Настоящее изобретение относится к серии новых соединений, которые являются ингибиторами фермента дипептидилпептидазы IV, к фармацевтическим композициям, включающим указанные ингибиторы, и к применению таких композиций при лечении заболеваний человека.
Предпосылки создания изобретения
Фермент дипептидилпептидаза IV, сокращенно называемый в настоящем описании как DP-IV (а также DAP-IV или DPP-IV), известный также по номенклатуре ферментов как ЕС.3.4.14.5, представляет собой сериновую протеазу, которая отщепляет N-концевой дипептид от пептидов, которые начинают последовательность Н-Хаа-Pro (где Хаа обозначает любую аминокислоту, хотя предпочтительно липофильную, и Pro обозначает пролин). Он также использует в качестве субстратов пептиды, которые начинаются с последовательности H-Xaa-Ala (где Ala обозначает аланин). DP-IV был вначале идентифицирован как связанный с мембраной фермент. Позже была идентифицирована растворимая форма.
Вначале интерес исследователей к DP-IV был связан с выяснением его роли в активации Т лимфоцитов. DP-IV идентичен Т клеточному белку CD26. Было высказано предположение о том, что ингибиторы DP-IV способны к модуляции Т-клеточной иммунной реакции и таким образом на их основе можно разработать новые иммуномодуляторы. Предполагалось также, что CD26 является необходимым дополнительным рецептором для ВИЧ и в этой связи, ингибиторы DP-IV могут быть полезными при лечении СПИДа.
Также акцент был сделан на изучении роли DP-IV за пределами иммунной системы. Известно, что DP-IV играет ключевую роль в деградации ряда пептидных гормонов, включая рилизинг-фактор ростового гормона (РФРГ) (GHRH) и глюкагон-подобный пептид-1 и пептид-2 (GLP-1 и GLP-2). Поскольку известно, что GLP-1 оказывает потенциирующий эффект на действие инсулина в регулировании уровня глюкозы в крови после приема пищи, ясно, что ингибиторы DP-IV могут также с успехом применяться при лечении диабета типа II и нарушенной толерантности к глюкозе. В настоящее время по меньшей мере два ингибитора DP-IV проходят клинические испытания с целью изучения указанной возможности.
Несколькими группами исследователей были раскрыты ингибиторы DP-IV. При этом, в то время, как некоторые из них были обнаружены в результате проведения случайных скрининг-программ, большая часть работ в данной области была направлена на исследование субстратных аналогов. Ингибиторы DP-IV, которые являются субстратными аналогами, раскрыты, например, в документах US 5462928, US 5543396, WO 95/15309 (эквивалентен US 5939560 и ЕР 0731789), WO 98/19998 (эквивалентен US 6011155), WO 99/46272 и WO 99/61431. Наиболее мощные ингибиторы относятся к аминоацилпирролидинбороновым кислотам, но они нестабильны и склонны к циклизации, тогда как более стабильные пирролидиновые и тиазолидиновые производные отличаются меньшей аффинностью к ферменту и, следовательно, при их клиническом использовании будет требоваться введение больших доз. Похоже, что пирролидиннитрилы представляют хороший компромисс, поскольку они обладают и высокой аффинностью к ферменту, и умеренно продолжительным полупериодом существования в растворе в виде свободного основания. Однако, при этом остается потребность в хороших ингибиторах DP-IV с улучшенными свойствами.
Краткое описание изобретения
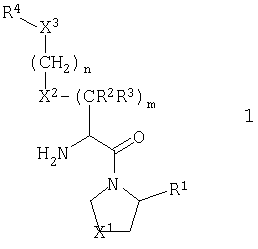
Настоящее изобретение относится к серии ингибиторов DP-IV с улучшенной аффинностью к ферменту. Соединения могут применяться при лечении множества заболеваний человека, включая нарушенную толерантность к глюкозе и диабет типа II. Соответственно, изобретение также относится к использованию указанных соединений при получении фармацевтических композиций, к самим композициям и к применению таких композиций при лечении людей. Соединения согласно настоящему изобретению описываются общей формулой 1.
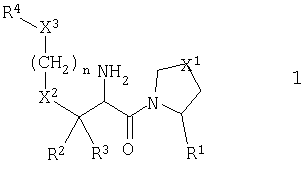
В общей формуле 1 X1 выбирают из -S-, -О-, -SO-, -SO2- и -СН2-; X2 выбирают из -О, -S-, -NH- и -СН2-; X3 обозначает или -NR5-, или >С=O или >C=S группу; R1 обозначает либо Н, либо -CN; R2 и R3 выбирают независимо из Н и низшего алкила, или вместе они могут представлять -(CH2)p-; R4 обозначает R4A, когда X3 обозначает -NR5-, и R4B, когда X3 обозначает >С=O или >C=S; R4A выбирают из R6R7NC(=O), R6R7NC(=S), R8(CH2)qC(=O), R8(CH2)qC(=S), R8(CH2)qSO2, R8(СН2)qOC(=S) и R8(CH2)qOC(=O); R4B обозначает R6R7N; R5 обозначает Н или низший алкил; R6 и R7 обозначают, каждый, независимо R8(CH2)q или вместе они образуют -(СН2)2-Z-(CH2)2-; R8 выбирают из Н, алкила, необязательно замещенного арила, необязательно замещенного ароила, необязательно замещенного арилсульфонила и необязательно замещенного гетероарила; Z выбирают из ковалентной связи, -(СН2)r-, -О-, -SOt- и -N((CH2)qR8)-; n обозначает 0-4; р обозначает 2-5; q обозначает 0-3; r обозначает 1 или 2; и t обозначает 0-2.
Подробное описание изобретения
В первом аспекте настоящее изобретение относится к серии новых соединений, которые являются ингибиторами фермента DP-IV и которые полезны при лечении некоторых заболеваний человека. Соединения описываются общей формулой 1:
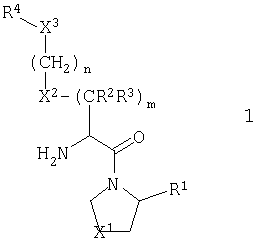
В общей формуле 1 Х1 обозначает двухвалентную группу, выбранную из атома серы (-S-), атома кислорода (-O-), сульфинильной группы (-SO-), сульфонильной группы (-SO2-) и метиленовой группы (-CH2-). X2 обозначает двухвалентную группу, выбранную из атома кислорода (-O-), атома серы (-S-) и метиленовой группы (-СН2-). X3 обозначает либо замещенную иминогруппу (-NR5-), либо карбонильную (>С=O) или тиокарбонильную группу (>С=S).
R1 обозначает либо атом водорода (Н), либо нитрильную группу (-CN).
R2 и R3 могут независимо друг от друга представлять атом водорода (Н) или низшую алкильную группу, или вместе они могут составлять цепь от двух до пяти метиленовых звеньев -(СН2)p-, где р принимает значения в диапазоне от 2 до 5, образуя вместе с атомом углерода, к которому они присоединяются, трех-, четырех-, пяти- или шестичленное кольцо. Параметр m может иметь значение 1, 2 или 3. В том случае, когда m больше 1, то каждое из звеньев CR2R3 может быть одинаковым или они могут различаться. Так, например, в том случае, когда m равно 2, то (CR2R3)2 может представлять СН2СН2, CH2C(Me)2, С(Ме)2СН2 и др.
Природа R4 зависит от значения параметра X3, при этом две группы соединяются амидной (CO-N), тиоамидной (CS-N) или сульфонамидной (SO2-N) связью. Так, в том случае, когда X3 обозначает замещенную иминогруппу (-NR5-), R4 обозначает R4A, где R4A выбирают из карбамоильных групп (R6R7NC(=O)), тиокарбамоильных групп (R6R7NC(=S)), необязательно модифицированных ацильных групп (R8(СН2)qC(=O)), необязательно модифицированных тиоацильных групп (R8(СН2)qC(=S)), сульфонильных групп (R8(CH2)qSO2), необязательно модифицированных (алкил или арилокси)карбонильных групп (R8(CH2)qOC(=O)) и необязательно модифицированных (алкил или арилокси)тиокарбонильных групп (R8(CH2)qOC(=S)). В контексте настоящего описания термин "необязательно модифицированный" используется для указания того, что некоторые варианты R8 выходят за рамки определения терминов "алкил", "ацил" и "арил". Область определения R4A задается областью определения R8. Альтернативно, в том случае, когда X3 обозначает карбонильную (>С=О) или тиокарбонильную (>С=S) группу, то R4 представляет собой R4B, где R4B обозначает замещенную аминогруппу (R6R7N).
R5 обозначает атом водорода (Н) или низшую алкильную группу. Предпочтительно R5 обозначает Н.
R6 и R7 могут, каждый, независимо друг от друга, представлять собой R8(CH2)q. Альтернативно, они могут вместе образовывать группу - (CH2)2-Z1-(CH2)2- или -CHR9-Z1-CH2-CR10-. В данном случае Z1 обозначает ковалентную связь, метиленовую или этилиденовую группу (-(СН2)r-, где r имеет значение 1 или 2), атом кислорода (-O-), атом серы или оксиленный атом серы (-SOt-, где t имеет значение нуль, 1 или 2) или замещенную иминогруппу (-N((CH2)qR8)-), так что группа NR6R7 представляет собой пирролидиновое, пиперидиновое, пергидроазепиновое, морфолиновое, не обязательно окисленное тиоморфолиновое или замещенное пиперазиновое кольцо. Z2 обозначает орто-фениленовую группу (-С6Н4-), так что группа NR6R7 представляет собой тетрагидроизохинолин.
R8 выбирают из атома водорода (Н), низшей алкильной группы, низшей циклоалкильной группы, конденсированной с бензольным кольцом (такой как инданильная группа), ацильной (низший алкил-СО) группы, ди(низший алкил)аминогруппы, ди(низший алкил)карбамоильной группы, N-(низший алкил)пиперидинильной группы, необязательно замещенной α-алкилбензильной группы, необязательно замещенной фенильной, нафтильной или гетероарильной группы и необязательно замещенной ароильной (арил-СО) или арилсульфонильной (арил-SO2) группы. В приведенном выше тексте подходящие необязательные заместители включают низший алкил, арил, которые могут быть далее замещены одной или более метильными или трифтометильными группами, гидрокси, низший алкилокси, низшую алкилсульфонильную, ацильную, перфторацильную, амино, низшую алкиламино, ди(низший алкил)амино, аминоалкиленовую, фтор-, хлор-, бром-, трифторметильную, нитро, циано, карбамоильную, карбокси и низшую алкилоксикарбонильную группы. Вдобавок два соседних заместителя могут соединяться с образованием кольца, конденсированного с родоначальным арильным или гетероарильным кольцом.
R9 и R10 независимо выбирают из водорода, карбамоильной, гидроксиметильной и цианометильной групп.
Параметр n обозначает целое число и выбирается из диапазона значений от нуля до 4, и q выбирают из диапазона значений от нуля до 3.
Некоторые соединения намеренно исключаются из области настоящего изобретения. Так, в том случае, когда X2 обозначает метилен, X3 обозначает NH и R4 обозначает R8(CH2)qO(CO), при значении q=1, R8 не может представлять собой незамещенный фенил или фенил, замещенный нитрогруппой. В целом, предпочтительно, что, когда X2 обозначает метилен, X3 обозначает NH и R4 обозначает R8(СН2)qО(СО) при значении q=1 и R8 обозначает замещенную фенильную группу, заместитель или заместители должны выбираться из хлор-, метокси и трифтометильной групп.
В контексте настоящего описания термин "низший алкил", сам по себе или в таких сочетаниях, как низший алкилокси, включает линейные, разветвленные и циклические насыщенные углеводородные группы с числом атомов углерода от одного до шести. Примеры низших алкильных групп включают, не ограничиваясь приведенным списком, метил, этил, изопропил, трет-бутил, неопентил, циклогексил, циклопентилметил, 2-(циклопропил)этил, 3,3-диметилциклобутил и бицикло[3.1.0]гексил.
Термин "гетероарил" включает моноциклические пяти- и шестичленные кольцевые ароматические группы с одним или двумя гетероатомами, которые выбирают из азота, кислорода и серы. Так, гетероарильные группы включают пиридил, пиридазинил, пиримидинил, пиразинил, пирролил, тиенил, фурил, имидазолил, пиразолил, тиазолил, изотиазолил, оксазолил и изоксазолил. Гетероарил также включает производные указанных колец, конденсированные с бензолом, такие как хинолинил, изохинолинил, хиноксалинил, хиназолинил, фталазинил, циннолинил, индолил, изоиндолил, бензотиазолил и др., а также бициклические группы, образованные конденсацией двух таких моноциклических гетероароматических групп.
Термин "арил" включает фенил, нафтил и гетероарил.
Соединения общей формулы 1 содержат по меньшей мере один стереогенный центр, так что они могут проявлять оптическую изомерию. Все такие изомеры, включая энантиомеры, диастереомеры и эпимеры, входят в область настоящего изобретения. Кроме того, изобретение включает такие соединения, как отдельные изомеры и их смеси, включая рацематы. Некоторые соединения общей формулы 1, в том числе содержащие гетероарильную группу с гидрокси или амино заместителем, могут существовать в виде таутомеров. Указанные таутомеры, либо отдельно, либо в виде смесей, также входят в область настоящего изобретения.
Соединения общей формулы 1 содержат по меньшей мере одну основную функциональную группу. В этой связи, они могут образовывать аддитивные соли кислот. Те аддитивные соли кислот, которые образуются с фармацевтически приемлемыми кислотами, входят в область настоящего изобретения. Примеры приемлемых кислот включают уксусную кислоту, трифторуксусную кислоту, лимонную кислоту, фумаровую кислоту, бензойную кислоту, памоевую кислоту, метансульфоновую кислоту, хлористоводородную кислоту, азотную кислоту, серную кислоту, фосфорную кислоту и др.
Некоторые соединения общей формулы 1 содержат кислотную группу и способны, в этой связи, образовывать соли с основаниями. Примеры таких солей включают соли натрия, калия и кальция, которые образуются при реакции кислоты с соответствующим гидроксидом, оксидом, карбонатом или бикарбонатом металла. Аналогично, тетраалкиламмониевые соли могут быть образованы при реакции кислоты с гидроксидом тетраалкиламмония. Первичные, вторичные и третичные амины, такие как триэтиламин, могут образовывать аддитивные соли с кислотой. Особый случай представляет образование внутренней аддитивной соли в результате реакции между кислотной группой и группой первичного амина в пределах одной и той же молекулы, которую называют также цвиттерионом. Все такие соли, в случае их фармацевтической приемлемости, включаются в область настоящего изобретения.
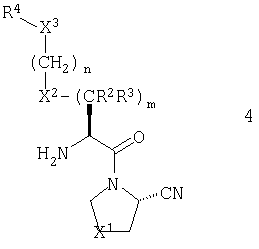
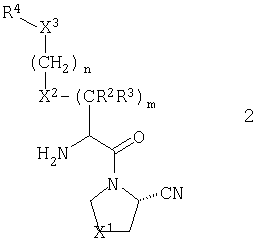
В предпочтительном варианте осуществления настоящего изобретения R1 обозначает нитрильную группу. В случае настоящего варианта, предпочтительно, чтобы стереохимия нитрильной группы соответствовала таковой, показанной для общей формулы 2:
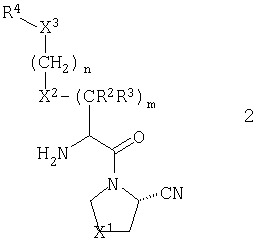
В соответствии со стандартной терминологией, имеет место S конфигурация, когда X1 обозначает метилен, и R конфигурация, когда X1 обозначает серу, кислород, сульфинил или сульфонил.
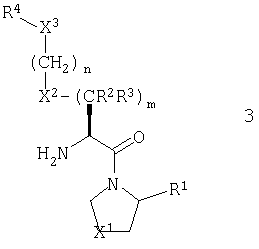
В другом предпочтительном варианте стереохимия в центре, соседствующем с первичным амином, соответствует представленной общей формулой 3. Так, имеет место S конфигурация, когда X2 обозначает атом кислорода или метиленовую или иминогруппу, и R конфигурация, когда X2 обозначает атом серы.
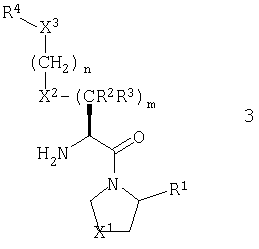
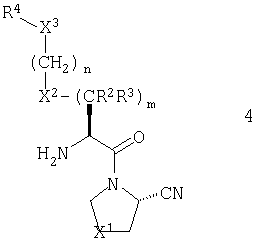
В рамках указанного варианта осуществления изобретения, R1 должен, более предпочтительно, представлять нитрильную группу и еще более предпочтительно, он должен иметь абсолютную конфигурацию, изображенную общей формулой 4.
В рамках другого предпочтительного варианта осуществления изобретения, m равно 1. Более предпочтительно, m равно 1 и R2 и R3 обозначают независимо атомы водорода или метильные группы. В том случае, когда X2 обозначает метиленовую группу, более предпочтительно, чтобы R2 и R3 оба были водородами. В том случае, когда X2 обозначает атом кислорода, более предпочтительно, чтобы один из R2 и R3 был водородом, а другой - метильной группой. В том случае, когда X2 обозначает атом серы, более предпочтительно, чтобы R2 и R3 оба были метальными групппами.
В другом предпочтительном варианте осуществления изобретения X1 обозначает либо S, либо метилен. Более предпочтительно, X1 обозначает S и R1 обозначает Н, или X1 обозначает метилен и R1 обозначает CN.
В еще одном предпочтительном варианте осуществления изобретения X3 обозначает NH. Более предпочтительно, X3 обозначает NH, m равно 1, R2 и R3, оба обозначают Н, X2 обозначает метилен и n имеет значение 1 или 2.
В еще одном предпочтительном варианте осуществления изобретения R4 обозначает R8NHCO или R8CO и R8 обозначает необязательно замещенную гетероарильную группу. Более предпочтительно, R8 обозначает незамещенную гетероарильную группу или гетероарильную группу, замещенную одной или двумя группами, выбранными из низшего алкила, низшего алкилокси, фтора, хлора и трифторметильных групп.
В другом предпочтительном варианте осуществления изобретения X3 обозначает СО и R4 обозначает R8NH. Более предпочтительно, R8 обозначает необязательно замещенную гетероарильную группу. Еще более предпочтительно, R8 обозначает незамещенную гетероарильную группу или гетероарильную группу, замещенную одной или двумя группами, выбранными из низшего алкила, низшего алкилокси, фтора, хлора и трифторметильных групп.
В другом предпочтительном варианте осуществления изобретения X3 обозначает NH и R4 выбирают из R6R7N(CO), R8(CH2)qCO и R8(CH2)qSO2.
Особенно предпочтительные соединения согласно настоящему изобретению включают:
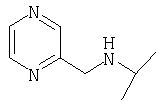
(2S)-1-[Nω-(пиразинил-2-карбонил)-L-орнитинил]пирролидин-2-карбонитрил,
(2S)-1-[Nω-(пиразинил-2-карбонил)-L-лизинил]пирролидин-2-карбонитрил,
(2S)-1-[(2',3)-2'-амино-4'-(пиразинил-2''-карбониламино)бутаноил]пирролидин-2-карбонитрил,
(4R)-3-[Nω-(пиразинил-2-карбонил)-L-лизинил]тиазолидин-4-карбонитрил,
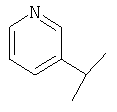
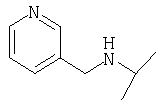
(2S)-1-[Nω-(пиридил-3-метил)-L-глютаминил]пирролидин-2-карбонитрил,
1-[Nω-(пиразинил-2-карбонил)-L-орнитинил]пирролидин,
(2S)-1-[S-(ацетиламинометил)-L-цистеинил]пирролидин-2-карбонитрил,
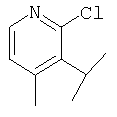
3-[Nω-(2-хлорпиридил-3-карбонил)-L-орнитинил]тиазолидин,
1-[Nω-(2-хлорпиридил-3-карбонил)-L-орнитинил]пирролидин и
(2S)-1-[Nω-(2-хлорпиридил-3-карбонил)-L-орнитинил]пирролидин-2-карбонитрил,
3-[Nω-(пиразинил-2-карбонил)-L-орнитинил]тиазолидин,
3-[Nω-(2-хиноксалоил)-L-лизинил]тиазолидин,
3-[Nω-(2-хиноксалоил)-L-орнитинил]тиаэолидин,
(2S)-1-[Nω-(2-хиноксалоил)-L-орнитинил]пирролидин-2-карбонитрил,
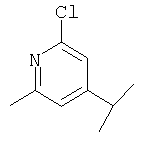
3-[Nω-(6-метилпиразинил-2-карбонил)-L-орнитинил]тиазолидин,
3-[Nω-(изохинолин-3-карбонил)-L-орнитинил]тиазолидин,
3-[Nω-(6-трифторметилникотиноил)-L-орнитинил]тиазолидин,
(2S)-1-[(2'R)-3'-(ацетиламинометилтио)-2'-амино-3'-метилбутаноил]-пирролидин-2-карбонитрил,
(2S)-1-[S-(3-пиколилкарбамоилметил)-L-цистеинил]пирролидин-2-карбонитрил,
3-[Nω-(3-пиридилоксикарбонил)-L-орнитинил]тиазолидин,
3-[О-(3-хлорбензилкарбамоил)серинил]тиазолидин и
3-[(2'S)-2'-амино-5'-оксо-5'-(1'',2'',3'',4''-тетрагидроизохинолин-2''-ил)пентаноил]тиазолидин.
Во втором аспекте настоящее изобретение относится к фармацевтической композиции для применения при лечении людей. Композиция отличается тем, что содержит, в качестве активного агента, по меньшей мере одно соединение из числа описанных в настоящем изобретении. Такая композиция полезна при лечении заболеваний человека. Композиция в основном включает одно или более дополнительных компонентов, выбранных из фармацевтически приемлемых наполнителей и фармацевтически активных агентов, отличных от таковых согласно настоящему изобретению.
Композиция может иметь вид твердой или жидкой формы, в зависимости от планируемого способа введения. Примеры твердых композиций включают пилюли, таблетки, капсулы и порошки для перорального введения, суппозитории для ректального или вагинального введения, порошки для назального или внутрилегочного введения и пластыри для чрескожного или чресслизистого (такого как трансбуккальное) введения. Примеры жидких композиций включают растворы и суспензии для внутривенной, подкожной или внутримышечной инъекции, а также для перорального, назального или внутрилегочного введения. Особенно предпочтительной формой композиции является таблетка для перорального введения. Другой предпочтительной формой, особенно в неотложных случаях и в при ведении больных в реанимации, является стерильный раствор для внутривенной инъекции.
Композиция включает по меньшей мере одно соединение согласно приведенному выше описанию. Композиция может содержать более чем одно такое соединение, но в основном предпочтительно, чтобы она включала только одно. Количество соединения, используемого в композиции, должно быть таким, чтобы общая дневная доза активного агента могла вводиться в виде одной - четырех удобных стандартных доз. Так, например, композиция может представлять собой таблетку, содержащую соединение, в количестве, равном общей необходимой дневной дозе, причем указанная таблетка может приниматься один раз в день. Альтернативно, таблетка может содержать половину (или одну треть или одну четверть) дневной дозы и принимается дважды (или три или четыре раза) в день. Такая таблетка может также иметь насечку для облегчения деления дозы, так чтобы, например, таблетка, содержащая полную дневную дозу, могла быть разломана на две половинки и введена в виде двух порций. Предпочтительно, таблетка или другая стандартная дозированная форма содержит от 0,1 мг до 1 г активного соединения. Более предпочтительно, она содержит от 1 мг до 250 мг.
Композиция в основном включает один или более наполнителей, выбранных из известных как фармацевтически приемлемые. Подходящие наполнители включают, не ограничиваясь приведенным списком, объемные наполнители, связующие вещества, разбавители, растворители, консерванты и вкусовые вещества. В контексте настоящего изобретения в качестве подходящих наполнителей также рассматриваются агенты, которые модифицируют показатели высвобождения композиции, такие как полимеры, которые селективно растворяются в кишечнике ("энтеросолюбильные покрытия").
Композиция может включать, в дополнение к соединению согласно настоящему изобретению, второй фармацевтически приемлемый активный агент. Так, например, композиция может включать противодиабетическое средство, рост-стимулирующее средство, противовоспалительное средство или противовирусное средство. Однако, в основном предпочтительно, чтобы композиция содержала только один активный агент.
В третьем аспекте изобретение относится к применению описанных выше соединений и композиций при лечении заболеваний человека. Указанный аспект можно также рассматривать как равнозначный способу лечения таких заболеваний. Заболевания, чувствительные к указанному лечению, представляют собой такие заболевания, при которых ингибирование DP-IV или CD26 дает клиническое улучшение, непосредственное или опосредованное. Непосредственные эффекты включают блокирование активации Т лимфоцитов. Опосредованные эффекты включают потенциирование активности пептидного гормона за счет предотвращения распада таких гормонов. Примеры указанных заболеваний включают, не ограничиваясь приведенным списком, аутоиммунные и воспалительные заболевания, такие как воспалительное заболевание кишечника и ревматоидный артрит, дефицит гормона роста, ведущий к низкому росту, синдром поликистоза яичников, нарушенная толерантность к глюкозе и диабет типа 2. Особенно предпочтительным вариантом является применение соединений и композиций при лечении нарушенной толерантности к глюкозе и диабета типа 2, а также в равной мере - способ лечения указанных заболеваний посредством введения эффективного количества соединения или композиции, описанных выше.
Точные детали лечения, включая определение режима дозирования, устанавливается лечащим врачом при учете общего состояние здоровья пациента и тяжести заболевания. При таких заболеваниях, как воспалительное заболевание кишечника, в случае которого имеются острые фазы активной болезни, разделенные латентными периодами, врач может выбрать относительно высокую дозу в острой фазе и более низкую поддерживающую дозу в латентном периоде. При хронических заболеваниях, таких как диабет типа 2 и нарушенная толерантность к глюкозе, может потребоваться поддержание дозы на одном уровне в течение длительного периода времени. В таких случаях может быть типичным режим дозирования, включающий употребление от одной до четырех таблеток в день, каждая из которых содержит от 0,1 мг до 1 г (и предпочтительно от 1 мг до 250 мг) активного соединения.
Соединения согласно настоящему изобретению могут быть получены с помощью известных в данной области химии методов. Выбираемый способ зависит от конкретной природы заместителей, имеющихся в целевой молекуле. В приведенном ниже описании обозначен путь синтеза для соединений, в которых m равно 1. Соединения, в которых m=2 или 3, могут быть в основном получены с помощью аналогичных методов.
Исходное вещество обычно представляет собой производное α,ω-диаминокислоты 5 или производное аминодикарбоновой кислоты 6.
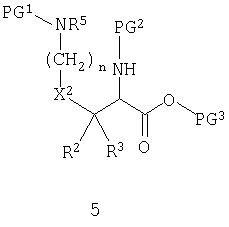
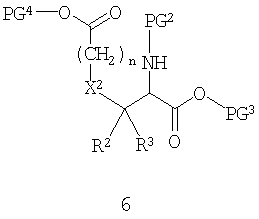
PG1 и PG2 представляют собой "ортогональные" защитные группы - группы, которые маскируют реакционную способность аминогрупп и каждая из которых может быть селективно удалена в присутствии другой. Подходящие группы хорошо известны из литературы. PG3 и PG4 представляют собой защитные группы для карбоновых кислот. Их выбирают таким образом, чтобы они были ортогональны друг другу и защитным группам для аминогрупп. Подходящие возможности для PG3 и PG4 также хорошо известны из литературы. Производные диаминокислот общей формулы 5 и производные аминодикарбоновых кислот общей формулы 6 представляют собой либо выпускаемые продукты, либо они могут быть получены с использованием методов, описанных в литературе. На практике, в зависимости от выбранной стратегии, исходное вещество содержит только две из трех присутствующих защитных групп. Либо будет отсутствовать PG3, давая возможность введения пирролидинового (или тиазолидинового или оксазолидинового) остатка, или будет отсутствовать PG1 или PG4, позволяя наращивать боковую цепь.
Схема А иллюстрирует введение пирролидиновой (или тиазолидиновой или оксазолидиновой) группы в качестве первой стадии в способе получения соединений согласно настоящему изобретению.
Схема А
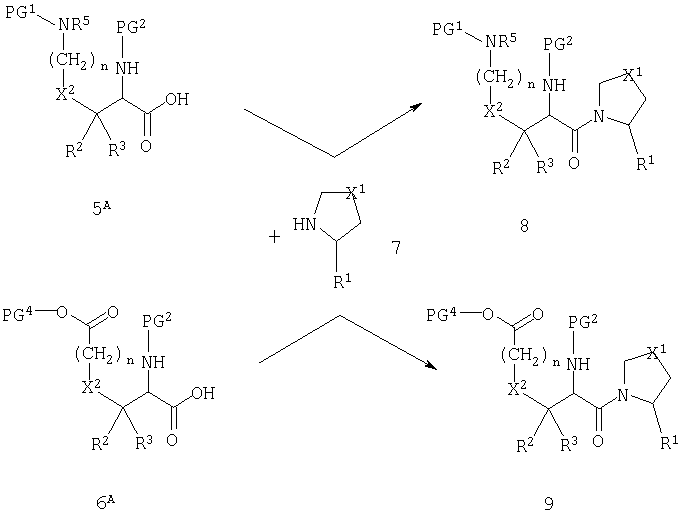
Соединения 5A и 6A соответствуют 5 и 6, когда PG3 означает атом водорода (т.е. без защитной группы). Свободная карбоновая кислота может быть подвергнута реакции с пирролидиновым производным 7 с образованием амида 8 или 9. Реакционные условия для достижения указанного превращения хорошо описаны в литературе. Подходящие реагенты включают карбодиимиды, фосфорные реагенты и алкилхлорформиаты, и реакция обычно катализируется третичным амином, таким как триэтиламин или диметиламинопиридин.
Реакция, изображенная на схеме А, доступна для всех комбинаций R1 и X1. Однако, в том случае, когда R1 обозначает нитрильную группу, или когда Х1 обозначает сульфинильную или сульфонильную группу, может быть удобно модифицировать стратегию так, как показано на схемах В и С.
Схема В
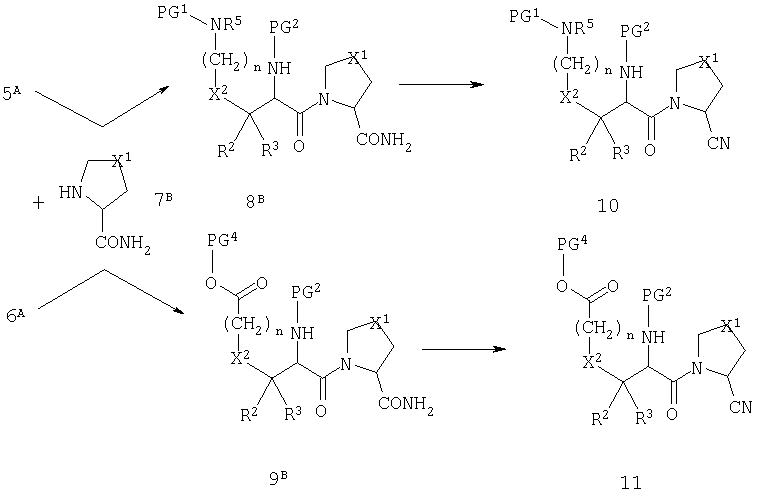
Схема С
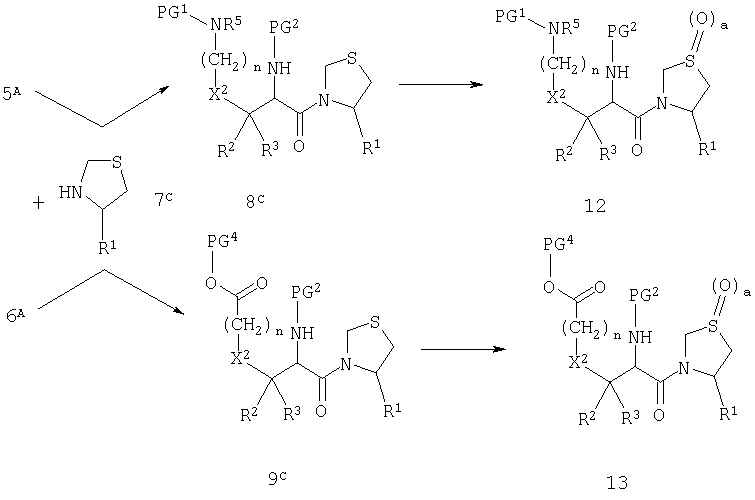
На схеме В группу R1 вводят в виде первичного амида и впоследствии превращают в нитрил при действии дегидратирующего агента, такого как трифторуксусный ангидрид. На схеме С группу X1 вводят в виде тиоэфира и впоследствии превращают в сульфоксид (а=1) или сульфон (а=2) при действии окислителя, такого как периодат натрия. Модификация стратегии, приведненной на схеме С, невозможна, если X2 обозначает атом серы.
Схема D
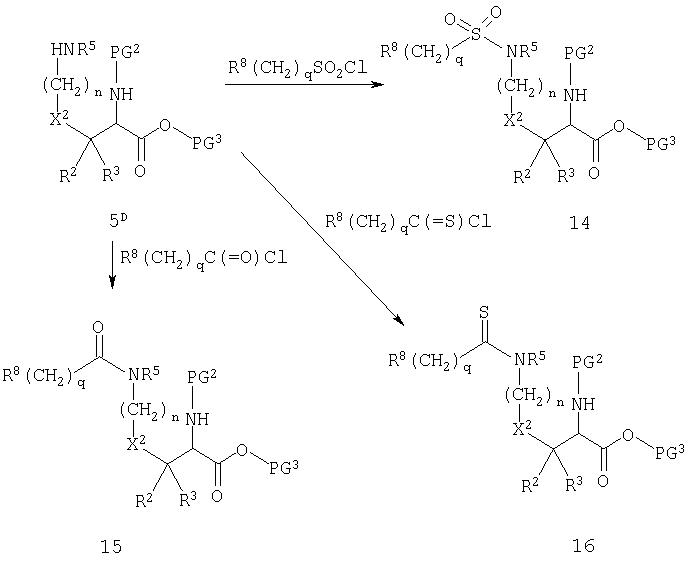
На схеме D соединение 5D представляет собой производное диаминокислоты 5, когда ω-защитная группа обозначает атом водорода. Свободная аминогруппа легко взаимодействует с сульфонилхлоридами, ацилхлоридами и тиоцилхлоридами, обычно в присутствии третичного амина, с образованием сульфонамидов 14, амидов 15 и тиоамидов 16, соответственно. Реагенты в основном либо доступны как таковые, либо могут быть получены из соответствующих кислот. Реакция, изображенная на схеме D, применима в основном ко всем вариациям группы R8(CH2)q, при условии, что для некоторых заместителей в фенильном и гетероарильном кольцах, которые являются вариантами значений R8, может потребоваться защита. Такие заместители и их соответствующая защита в основном очевидна для специалистов в данной области химии.
Схема Е
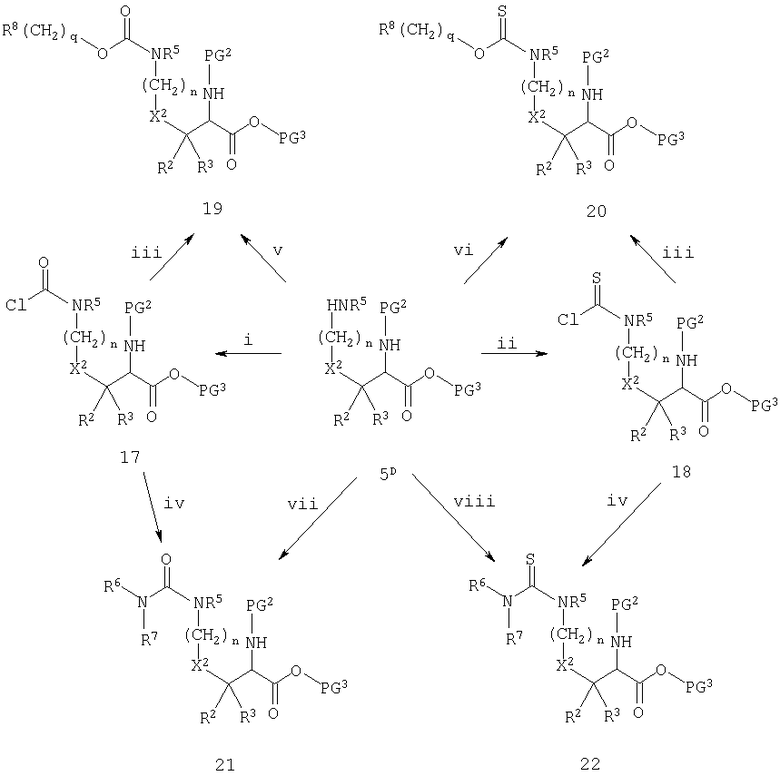
Реагенты: i) COCl2; ii) CSCl2; iii) R8(CH2)qOH; iv) R6R7NH; v) R8(CH2)qOCOCl; vi) R8(CH2)qOCSCl; vii) R6R7NCOCl; viii) R6R7NCSCl.
Схема Е иллюстрирует преобразование 5D до карбаматов и мочевин и их тиоаналогов. В том случае, когда R5 отличен от атома водорода, соединение 5D может быть превращено в соответствующий карбамоилхлорид 17 или тиокарбамоилхлорид 18 по реакции с фосгеном или тиофосгеном. Могут также использоваться другие реагенты, в отношении которых известно, что они функционально равноценны указанным токсичным реагентам. В том случае, когда R5 обозначает водород, образующийся промежуточный продукт представляет собой изоцианат или изотиоцианат, который, однако, действует эквивалентно соответствующему хлориду. Промежуточные продукты 17 и 18, как правило, в норме не выделяют, а подвергают непосредственной обработке спиртами с образованием карбаматов 19 и тиокарбаматов 20. Обработка тех же указанных промежуточных продуктов аминами ведет к образованию мочевин 21 и тиомочевин 22. Альтернативно, 5D может быть непосредственно подвергнуто реакции с хлорформиатом или хлортиоформиатом с получением карбамата или тиокарбамата, или, в том случае, когда ни R6, ни R7 не обозначают водород, с хлорформамидом или хлортиоформамидом с получением мочевины или тиомочевины. В том случае, когда R6 или R7 обозначают атом водорода, хлорформамид или хлортиоформамид может быть нестабильным, и в таком случае используют изоцианат (например, R6-NCO) или изотиоцианат (например, R6-NCS). Как отмечалось ранее при обсуждении схемы D, некоторые заместители в числе вариантов R8 могут потребовать соответствующей защиты.
Схема F
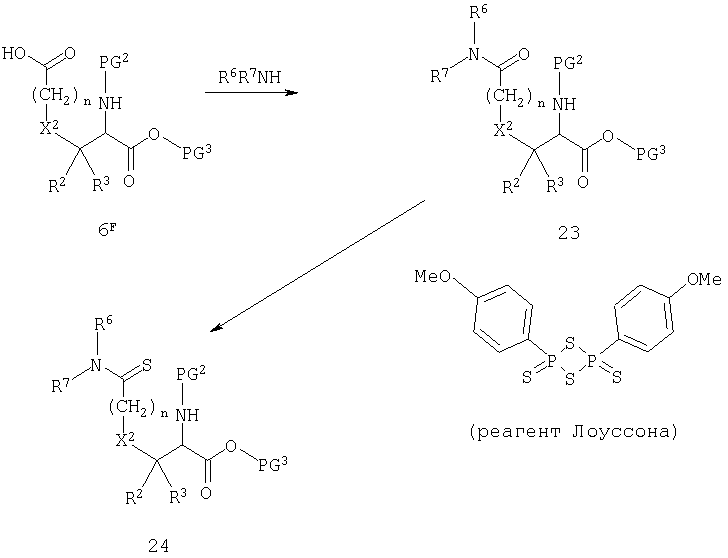
Схема F иллюстрирует преобразование боковой цепи серии аминодикарбоновой кислоты. Кислота 6F без ω-защищенной группы может быть в разнообразных условиях подвергнута реакции с амином с образованием амида 23. Конденсация может быть облегчена дегидратирующим реагентом, таким как карбодиимид или фосфорный реагент. Альтернативно, кислота может быть преобразована в более реакционноспособное производное, посредством такой реакции, как обработка оксалилхлоридом или тионилхлоридом, с образованием соответствующего хлорангидрида, который далее будет непосредственно взаимодействовать с амином. Тиоамид 24 может быть получен при обработке амида 23 реагентом Лоуссона (Lawesson's reagent).
После завершения преобразования всех групп удаляют конечную защитную группу, выделяют продукт и очищают его с использованием стандартных процедур.
Описанные основные методы далее иллюстрируются с помощью неограничивающих примеров.
ПРИМЕРЫ
Сокращения
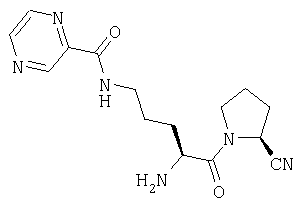
ПРИМЕР 1
Трифторацетат (2S)-1-[Nω-(пиразинил-2-карбонил)-L-орнитинил]пирролидин-2-карбонитрила
A. N-(2-нитробензолсульфенил)-L-пролин
L-пролин (25 г, 217 ммоль) растворяют в 2 М NaOH (110 мл, 220 ммоль) и диоксане (120 мл). В то же самое время, что и 2 М NaOH (110 мл, 220 ммоль) медленно добавляют раствор 2-нитробензолсульфенилхлорида (42 г, 222 ммоль) в диоксане (60 мл). После 2 часов выдерживания при комнатной температуре реакционную смесь вливают в воду (500 мл) и отфильтровывают твердое вещество. Доводят значение рН фильтрата до 3 добавлением 2 М HCl и раствор экстрагируют этилацетатом (3×500 мл). Объединенные органические экстракты промывают водой (4×200 мл).и насыщенным раствором соли (1×200 мл), сушат (Na2SO4) и выпаривают в вакууме с получением оранжевого твердого вещества, которое идентифицируют как N-(2-нитробензолсульфенил)-L-пролин (58,1 г, 217 ммоль, 100%).
В. Сукцинимидиловый сложный эфир N-(2-нитробензолсульфенил)-L-пролина
N-(2-нитробензолсульфенил)-L-пролин (57,9 г, 216 ммоль) растворяют в СН2Cl2/ДМФ (9:1, 500 мл). Добавляют N-гидроксисукцинимид (37,3 г, 324 ммоль) и водорастворимый карбодиимид (51,8 г, 260 ммоль). После 18 часов выдерживания при комнатной температуре растворитель удаляют в вакууме и остаток растворяют в этилацетате (1000 мл). Раствор промывают водой (4×200 мл) и насыщенным раствором соли (1×200 мл), сушат (Na2SO4) и выпаривают в вакууме с получением желтого твердого вещества, которое идентифицируют как сукцинимидиловый сложный эфир N-(2-нитробензолсульфенил)-L-пролина (78,9 г, 216 ммоль, 100%).
С. N-(2-нитробензолсульфенил)-L-пролинамид
Сукцинимидиловый сложный эфир N-(2-нитробензолсульфенил)-L-пролина (78,5 г, 215 ммоль) растворяют в диоксане (500 мл). Добавляют аммиак (35%, 100 мл). После перемешивания при комнатной температуре в течение 2 часов реакционную смесь вливают в воду (700 мл). Осадок отфильтровывают, промывают водой (200 мл), сушат над P2O5 и повторно кристаллизуют из этилацетата/петролейного эфира с получением желтого твердого вещества, которое идентифицируют как N-(2-нитробензолсульфенил)-L-пролинамид (49,6 г, 185 ммоль, 86%).
D. (2S)-N-(2-нитробензолсульфенил)пирролидин-2-карбонитрил
N-(2-нитробензолсульфенил)-L-пролинамид (49 г, 183 ммоль) растворяют в сухом ТГФ (300 мл). Раствор охлаждают до 0°С, добавляют триэтиламин (36,7 г, 367 ммоль) и затем медленно добавляют трифторуксусный ангидрид (77 г, 367 ммоль). Величину рН доводят до 9, добавляя триэтиламин. Через 30 минут реакционную смесь разбавляют этилацетатом (500 мл), промывают водой (1×200 мл) и насыщенным раствором соли (1×200 мл), сушат (Na2SO4) и выпаривают в вакууме с получением оранжевого масла, которое очищают флэш-хроматографией (элюент: 80% петр. эфир, 20% этилацетат) с получением желтого твердого вещества, которое идентифицируют как (2S)-N-(2-нитробензолсульфенил)пирролидин-2-карбонитрил (38,9 г, 150 ммоль, 82%).
Е. Гидрохлорид (2S)-пирролилин-2-карбонитрила
(2S)-N-(2-нитробензолсульфенил)пирролидин-2-карбонитрил (38,5 г, 149 ммоль) растворяют в диэтиловом эфире (200 мл). Медленно добавляют 4 М HCl/диоксан (150 мл, 600 ммоль). После 2 часов выдерживания при комнатной температуре реакционную смесь вливают в диэиловый эфир (1000 мл). Твердое вещество отфильтровывают, промывают диэтиловым эфиром (500 мл) и повторно кристаллизуют из метанола/диэтилового эфира с получением белого твердого вещества, которое идентифицируют как гидрохлорид (2S)-пирролидин-2-карбонитрила (18,9 г, 142,5 ммоль, 96%).
F. (2S)-1-[Nα-(трет-бутилоксикарбонил)-Nω-(пиразинил-2-карбонил)-L-оринитинил]пирролидин-2-карбонитрил
Nα-(трет-бутилоксикарбонил)-Nω-(пиразинил-2-карбонил)-L-оринитин (2,5 г, 7,4 ммоль) растворяют в СН2Cl2 (50 мл). Указанный раствор охлаждают до 0°С, добавляют гидрохлорид (2S)-пирролидин-2-карбонитрила (1,2 г, 9,1 ммоль) и PyBOP® (4,3 г, 8,23 ммоль) и доводят величину рН до 9, добавляя триэтиламин. После 18 часов выдерживания при температуре от 0°С до комнатной температуры растворитель удаляют в вакууме и остаток растворяют в этилацетате (200 мл). Раствор промывают 0,3 М KHSO4 (2×50 мл), насыщенным раствором NaHCO3 (2×50 мл), водой (2×50 мл) и насыщенным раствором соли (1×50 мл), сушат (Na2SO4) и выпаривают в вакууме с получением желтого масла. Указанное масло очищают флэш-хроматографией (элюент: 80% этилацетат, 20% петр. эфир) с получением бесцветного масла, которое идентифицируют как (2S)-1-[Nα-(трет-бутилоксикарбонил)-Nω-(пиразинил-2-карбонил)-L-оринитинил]пирролидин-2-карбонитрил (2,98 г, 7,16 ммоль, 97%).
G. Трифторацетат (2S)-1-[Nω-(пиразинил-2-карбонил)-L-оринитинил]пирролидин-2-карбонитрила
(2S)-1-[Nα-(трет-бутилоксикарбонил)-Nω-(пиразинил-2-карбонил)-L-оринитинил]пирролидин-2-карбонитрил (2,8 г, 6,7 ммоль) растворяют в трифторуксусной кислоте (5 мл). После 1 часа выдерживания при комнатной температуре растворитель удаляют в вакууме. Остаток очищают препаративной ВЭЖХ (Vydak С18, от 5 до 50% 0,1% ТФУ/ацетонитрил в 0,1% ТФУ/воде в течение 40 мин с объемным расходом 3 мл/мин). Фракции, содержащие продукт, лиофилизуют с получением бесцветного масла, которое идентифицируют как трифторацетат (2S)-1-[Nω-(пиразинил-2-карбонил)-L-оринитинил]пирролидин-2-карбонитрила (1,5 г, 3,48 ммоль, 52%).
[M+H]+=317,3.
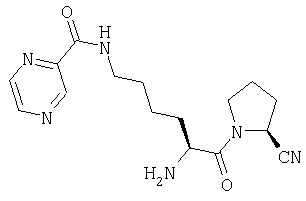
ПРИМЕР 2
Трифторацетат (2S)-1-[Nω-(пиразинил-2-карбонил)-L-лизинил]пирролидин-2-карбонитрила
А. (Nα-(трет-бутилоксикарбонил)-Nω-(9-флуоренилметилоксикарбонил)-L-лизинил)-L-пролинамид
Nα-(трет-бутилоксикарбонил)-Nω-(9-флуоренилметилоксикарбонил)-L-лизин (5 г, 10,7 ммоль) растворяют в CH2Cl2 (100 мл). Раствор охлаждают до 0°С, добавляют L-пролинамид (1,78 г, 11,7 ммоль) и PyBOP® (6,7 г, 12,8 ммоль) и величину рН доводят до 9, добавляя триэтиламин. После 18 часов выдерживания при температуре от 0°С до комнатной температуры растворитель удаляют в вакууме и остаток растворяют в этилацетате (200 мл). Раствор промывают 0,3 М KHSO4 (2×50 мл), насыщенным раствором NaHCO3 (2×50 мл), водой (2×50 мл) и насыщенным раствором соли (1×50 мл), сушат (Na2SO4) и выпаривают в вакууме. Остаток очищают флэш-хроматографией (элюент: 2% метанол, 98% хлороформ) с получением бесцветного масла, которое идентифицируют как (Nα-(трет-бутилоксикарбонил)-Nω-(9-флуоренилметилоксикарбонил)-L-лизинил)-L-пролинамид (4,05 г, 7,2 ммоль, 67%).
В. (2S)-1-(Nα-(трет-бутилоксикарбонил)-Nω-(9-флуоренилметилоксикарбонил)-L-лизинил)пирролидин-2-карбонитрил
(Nα-(трет-бутилоксикарбонил)-Nω-(9-флуоренилметилоксикарбонил)-L-лизинил)-L-пролинамид (3,95 г, 7,02 ммоль) растворяют в безводном ТГФ (100 мл). Раствор охлаждают при 0°С, добавляют триэтиламин (1,4 г, 14 ммоль) и затем медленно добавляют трифторуксусный ангидрид (2,97 г, 14,1 ммоль). Величину рН доводят до 9, добавляя триэтиламин. Через 30 мин реакционную смесь разбавляют этилацетатом (100 мл), промывают водой (1×50 мл) и насыщенным раствором соли (1×50 мл), сушат (Na2SO4) и выпаривают в вакууме с получением оранжевого масла. Остаток очищают флэш-хроматографией (элюент: 60% петр. эфир, 40% этилацетат) с получением бесцветного масла, которое идентифицируют как (2S)-1-(Nα-(трет-бутилоксикарбонил)-Nω-(9-флуоренилметилоксикарбонил)-L-лизинил)пирролидин-2-карбонитрил (3,3 г, 6,11 ммоль, 87%).
С. (2S)-1-(Nα-(трет-бутилоксикарбонил)-L-лизинил)пирролидин-2-карбонитрил
(2S)-1-(Nα-(трет-бутилоксикарбонил)-Nω-(9-флуоренилметилоксикарбонил)-L-лизинил)пирролидин-2-карбонитрил (3,1 г, 5,7 ммоль) растворяют в ТГФ (80 мл). Добавляют диэтиламин (20 мл). После 2 ч выдерживания при комнатной температуре растворитель удаляют в вакууме. Остаток очищают флэш-хроматографией (элюент: 90% хлороформ, 7% метанол, 3% триэтиламин) с получением бесцветного масла, которое идентифицируют как (2S)-1-(Nα-(трет-бутилоксикарбонил)-L-лизинил)пирролидин-2-карбонитрил (1,63 г, 5,03 ммоль, 89%).
D. (2S)-1-(Nα-(трет-бутилоксикарбонил)-Nω-(пиразинил-2-карбонил)-L-лизинил)пирролидин-2-карбонитрил
(2S)-1-(Nα-(трет-бутилоксикарбонил)-L-лизинил)пирролидин-2-карбонитрил (100 мг, 0,31 ммоль) растворяют в СН2Cl2/ДМФ (9:1, 20 мл). К указанному раствору при 0°С добавляют гидрат 1-гидроксибензотриазола (84 мг, 0,62 ммоль), водорастворимый карбодиимид (76 мг, 0,38 ммоль), 2-пиразинкарбоновую кислоту (43 мг, 0,35 ммоль) и триэтиламин (65 мг, 0,65 ммоль). После 18 ч выдерживания при комнатной температуре растворитель удаляют в вакууме и остаток растворяют в этилацетате (70 мл). Указанный раствор промывают 0,3 М KHSO4 (2×20 мл), насыщенным раствором NaHCO3 (2×20 мл), водой (2×20 мл) и насыщенным раствором соли (1×20 мл), сушат (Na2SO4) и выпаривают в вакууме с получением желтого масла. Остаток очищают флэш-хроматографией (элюент: 2% метанол, 98% хлороформ) с получением бесцветного масла, которое идентифицируют как (2S)-1-(Nα-(трет-бутилоксикарбонил)-Nω-(пиразинил-2-карбонил)-L-лизинил)пирролидин-2-карбонитрил (124 мг, 0,29 ммоль, 93%).
Е. Трифторацетат (2S)-1-[Nω-(пиразинил-2-карбонил)-L-лизинил]пирролидин-2-карбонитрила
(2S)-1-(Nα-(трет-бутилоксикарбонил)-Nω-(пиразинил-2-карбонил)-L-лизинил)пирролидин-2-карбонитрил (110 мг, 0,26 ммоль) растворяют в трифторуксусной кислоте (5 мл). После 1 часа выдерживания при комнатной температуре растворитель удаляют в вакууме. Остаток очищают препаративной ВЭЖХ (Vydac С18, от 5 до 50% 0,1% ТФУ/ацетонитрила в 0,1% ТФУ/воде в течение 40 мин с объемным расходом 3 мл/мин). Фракции, содержащие продукт, лиофилизуют с получением бесцветного масла, которое идентифицируют как Трифторацетат (2S)-1-[Nω-(пиразинил-2-карбонил)-L-лизинил]пирролидин-2-карбонитрила (66 мг).
[М+Н]+=331,1.
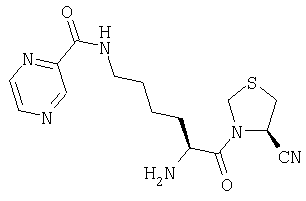
ПРИМЕР 3
Трифторацетат (4R)-3-[Nω-(пиразинил-2-карбонил)-L-лизинил]тиазолидин-4-карбонитрила
А. (4R)-3-(трет-бутилоксикарбонил)тиазолидин-4-карбоксамид
(4R)-3-(трет-бутилоксикарбонил)тиазолидин-4-карбоновую кислоту (12,5 г, 54,1 ммоль) растворяют в СН2Cl2/ДМФ (9:1, 150 мл). К указанному раствору при 0°С добавляют гидрат 1-гидроксибензотриазола (14,6 г, 108 ммоль) и водорастворимый карбодиимид (13,0 г, 65 ммоль). После 1 часа выдерживания при 0°С добавляют аммиак (35%, 50 мл). После 1 часа выдерживания при температуре от 0°С до комнатной температуры растворитель удаляют в вакууме и остаток растворяют в этилацетате (500 мл). Раствор промывают 0,3 М KHSO4 (2×100 мл), насыщенным раствором NaHCO3 (2×100 мл), водой (2×100 мл) и насыщенным раствором соли (1×100 мл), сушат (Na2SO4) и выпаривают в вакууме с получением желтого масла. Остаток очищают флэш-хроматографией (элюент: 2% метанол, 98% хлороформ) с получением бесцветного масла, которое идентифицируют как (4R)-3-(трет-бутилоксикарбонил)тиазолидин-4-карбоксамид (8,9 г, 38,4 ммоль, 71%).
В. Гидрохлорид (4R)-тиазолидин-4-карбоксамида
(4S)-3-(трет-бутилоксикарбонил)тиазолидин-4-карбоксамид (8,6 г, 37,1 ммоль) растворяют в 4 М HCl/диоксане (50 мл). После выдерживания в течение 1 часа при комнатной температуре растворитель выпаривают в вакууме с получением белого твердого вещества, которое идентифицируют как гидрохлорид (4R)-тиазолидин-4-карбоксамида (6,2 г, 36,8 ммоль, 99%).
С. (4R)-3-[Nα-(трет-бутилоксикарбонил)-Nω-(9-флуоренилметилоксикарбонил)-L-лизинил]тиазолидин-4-карбоксамид
Nα-(трет-бутилоксикарбонил)-Nω-(9-флуоренилметилоксикарбонил)-L-лизин (5 г, 10,7 ммоль) растворяют в CH2Cl2 (100 мл). Указанный раствор охлаждают до 0°С, добавляют гидрохлорид (4R)-тиазолидин-4-карбоксамида (1,78 г, 11,7 ммоль) и PyBOP® (6,7 г, 12,8 ммоль) и доводят триэтиламином значение рН до 9. После выдерживания в течение 18 часов при температуре от 0°С до комнатной температуры растворитель удаляют в вакууме и остаток растворяют в этилацетате (200 мл). Раствор промывают 0,3 М KHSO4 (2×50 мл), насыщенным раствором NaHCO3 (2×50 мл), водой (2×50 мл) и насыщенным раствором соли (1×50 мл), сушат (Na2SO4) и выпаривают в вакууме с получением желтого масла. Остаток очищают флэш-хроматографией (элюент: 2% метанол, 98% хлороформ) с получением бесцветного масла, которое идентифицируют как (4R)-3-[Nα-(трет-бутилоксикарбонил)-Nω-(9-флуоренилметилоксикарбонил)-L-лизинил]тиазолидин-4-карбоксамид (2,81 г, 4,8 ммоль, 44%).
D. (4R)-3-[Nα-(трет-бутомоксикарбонил)-Nω-(9-флуоренилметилоксикарбонил)-L-лизинил]тиазолидин-4-карбонитрил
(4R)-3-[Nα-(трет-бутилоксикарбонил)-Nω-(9-флуоренилметилоксикарбонил)-L-лизинил]тиазолидин-4-карбоксамид (2,7 г, 4,7 ммоль) растворяют в безводном ТГФ (100 мл). Раствор охлаждают до 0°С, добавляют триэтиламин (1,0 г, 10 ммоль) и затем медленно добавляют трифторуксусный ангидрид (2,0 г, 9,5 ммоль). Величину рН доводят до 9, добавляя триэтиламин. Через 30 мин реакционную смесь разбавляют этилацетатом (100 мл), промывают водой (1×50 мл) и насыщенным раствором соли (1×50 мл), сушат (Na2SO4) и выпаривают в вакууме. Остаток очищают флэш-хроматографией (элюент: 60% петр. эфир, 40% этилацетат) с получением бесцветного масла, которое идентифицируют как (4R)-3-[Nα-(трет-бутилоксикарбонил)-Nω-(9-флуоренилметилоксикарбонил)-L-лизинил]тиазолидин-4-карбонитрил (2,14 г, 3,81 ммоль, 82%).
Е. (4R)-3-[Nα-(трет-бутилоксикарбонил)-L-лизинил]тиазолидин-4-карбонитрил
(4R)-3-[Nα-(трет-бутилоксикарбонил)-Nω-(9-флуоренилметилоксикарбонил)-L-лизинил]тиазолидин-4-карбонитрил (1,9 г, 3,4 ммоль) растворяют в ТГФ (40 мл). Добавляют диэтиламин (10 мл). После 2 ч выдерживания при комнатной температуре растворитель удаляют в вакууме. Остаток очищают флэш-хроматографией (элюент: 90% хлороформ, 7% метанол, 3% триэтиламин) с получением бесцветного масла, которое идентифицируют как (4R)-3-[Nα-(трет-бутилоксикарбонил)-L-лизинил]тиазолидин-4-карбонитрил (863 мг, 2,5 ммоль, 75%).
F. (4R)-3-[Nα-(трет-бутилоксикарбонил)-Nω-(пиразинил-2-карбонил)-L-лизинил]тиазолидин-4-карбонитрил
(4R)-3-[N-(трет-бутилоксикарбонил)-L-лизинил]тиазолидин-4-карбонитрил (100 мг, 0,29 ммоль) растворяют в CH2Cl2 (20 мл). К указанному раствору при 0°С добавляют 2-пиразинкарбоновую кислоту (43 мг, 0,35 ммоль) и PyBOP® (170 мг, 0,33 ммоль) и доводят величину рН до 9, добавляя триэтиламин. После 18 ч выдерживания при комнатной температуре растворитель удаляют в вакууме и остаток растворяют в этилацетате (70 мл). Раствор промывают 0,3 М KHSO4 (2×20 мл), насыщенным раствором NaHCO3 (2×20 мл), водой (2×20 мл) и насыщенным раствором соли (1×20 мл), сушат (Na2SO4) и выпаривают в вакууме. Остаток очищают флэш-хроматографией (элюент: 2% метанол, 98% хлороформ) с получением бесцветного масла, которое идентифицируют как (4R)-3-[Nα-(трет-бутилоксикарбонил)-Nω-(пиразинил-2-карбонил)-L-лизинил]тиазолидин-4-карбонитрил (112 мг, 0,25 ммоль, 86%).
G. Трифторацетат (4R)-3-[Nω-(пиразинил-2-карбонил)-L-лизинил]тиазолидин-4-карбонитрила
(4R)-3-[Nα-(трет-бутилоксикарбонил)-Nω-(пиразинил-2-карбонил)-L-лизинил]тиазолидин-4-карбонитрил (110 мг, 0,26 ммоль) растворяют в трифторуксусной кислоте (5 мл). После выдерживания в течение 1 часа при комнатной температуре растворитель удаляют в вакууме. Остаток очищают препаративной ВЭЖХ (Vydac C18, от 5 до 50% 0,1% ТФУ/ацетонитрила в 0,1% ТФУ/воде в течение 40 мин с объемным расходом 3 мл/мин). Фракции, содержащие продукт, лиофилизуют с получением бесцветного масла, которое идентифицируют как трифторацетат (4R)-3-[Nω-(пиразинил-2-карбонил)-L-лизинил]тиазолидин-4-карбонитрила (57 мг).
[М+Н]+=349,1.
ПРИМЕР 4
Дигидрохлорид (2S)-1-[Nω-(пиридил-3-метил)-L-глютаминил]пирролидин-2-карбонитрила
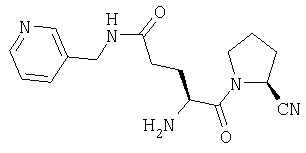
Д. (2S)-1-[N-(трет-бутилоксикарбонил)-Oω -метил-L-глютамил]пирролидин-2-карбонитрил
N-(трет-бутилоксикарбонил)-Oω-метил-L-глютаминовую кислоту (1,0 г, 3,83 ммоль) растворяют в СН2Cl2/ДМФ (9:1, 20 мл). К указанному раствору при 0°С добавляют гидрат 1-гидроксибензотриазола (788 мг, 5,84 ммоль), водорастворимый карбодиимид (877 мг, 4,38 ммоль), гидрохлорид (2S)-пирролидин-2-карбонитрила (609 мг, 4,6 ммоль) и триэтиламин (65 мг, 0,65 ммоль). После выдерживания в течение 18 ч при температуре от 0°С до комнатной температуры растворитель удаляют в вакууме и остаток растворяют в этилацетате (70 мл), затем указанный раствор промывают 0,3 М KHSO4 (2×20 мл), насыщенным раствором NaHCO3 (2×20 мл), водой (2×20 мл) и насыщенным раствором соли (1×20 мл), ушат (Na2SO4) и выпаривают в вакууме. Остаток очищают флэш-хроматографией (элюент: 50% этилацетат, 50% петр. эфир) с получением коричневого масла, которое идентифицируют как (2S)-1-[N-(трет-бутилоксикарбонил)-Oω-метил-L-глютамил]пирролидин-2-карбонитрил (290 мг, 0,86 ммоль, 22%).
В. (2S)-1-[N-(трет-бутилоксикарбонил)-L-глютамил]пирролидин-2-карбонитрил
(2S)-1-[N-(трет-бутилоксикарбонил)-Oω-метил-L-глютамил]пирролидин-2-карбонитрил (250 мг, 0,74 ммоль) растворяют в диоксане (5 мл). Добавляют 1 М гидроксид лития (1,1 мл, 1,1 ммоль). После выдерживания в течение 1 часа при комнатной температуре растворитель удаляют в вакууме и остаток растворяют в этилацетате (70 мл). Указанный раствор промывают 1 М KHSO4 (2×20 мл), водой (2×20 мл) и насыщенным раствором соли (1×20 мл), сушат (Na2SO4) и выпаривают в вакууме с получением бесцветного масла, которое идентифицируют как (2S)-1-[N-(трет-бутилоксикарбонил)-L-глютамил]пирролидин-2-карбонитрил (200 мг, 0,61 ммоль, 83%).
С. (2S)-1-[Nα-(трет-бутилоксикарбонил)-Nω-(пиридил-3-метил)-L-глютаминил]пирролидин-2-карбонитрил
(2S)-1-[N-(трет-бутилоксикарбонил)-L-глютамил]пирролидин-2-карбонитрил (30 мг, 0,093 ммоль) растворяют в СН2Cl2/ДМФ (9:1, 10 мл). К указанному раствору при 0°С добавляют гидрат 1-гидроксибензотриазола (21 мг, 0,16 ммоль), водорастворимый карбодиимид (21 мг, 0,105 ммоль), 3-(аминометил)пиридин (11 мг, 0,1 ммоль) и триэтиламин (20 мг, 0,2 ммоль). После выдерживания в течение 18 ч при температуре от 0°С до комнатной температуры растворитель удаляют в вакууме и остаток растворяют в этилацетате (70 мл). Раствор промывают 0,3 М KHSO4 (2×20 мл), насыщенным раствором NaHCO3 (2×20 мл), водой (2×20 мл) и насыщенным раствором соли (1×20 мл), сушат (Na2SO4) и выпаривают в вакууме с получением желтого масла. Остаток очищают флэш-хроматографией (элюент: 5% метанол, 97% хлороформ) с получением бесцветного масла, которое идентифицируют как (2S)-1-[Nα-(трет-бутилоксикарбонил)-Nω-(пиридил-3-метил)-L-глютаминил]пирролидин-2-карбонитрил (16,6 мг, 0,04 ммоль, 44%).
D. Дигидрохлорид (2S)-1-[Nω-(пиридил-3-метил)-L-глютаминил]пирролидин-2-карбонитрила
(2S)-1-[Nα-(трет-бутилоксикарбонил)-Nω-(пиридил-3-метил)-L-глютаминил]пирролидин-2-карбонитрил (17 мг, 0,04 ммоль) растворяют в 4 М HCl/диоксане (5 мл). После выдерживания в течение 1 часа при комнатной температуре растворитель удаляют в вакууме с получением белого твердого вещества, которое идентифицируют как дигидрохлорид (2S)-1-[Nω-(пиридил-3-метил)-L-глютаминил]пирролидин-2-карбонитрила (17 мг, 0,04 ммоль, 100%).
[М+Н]+=316,2.
ПРИМЕР 5
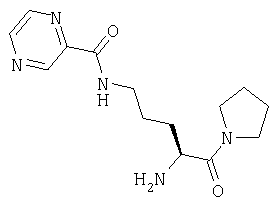
Трифторацетат 1-[Nω-(пиразинил-2-карбонил)-L-орнитинил]пирролидина
А. 1-[Nω-(бензилоксикарбонил)-Nα-(трет-бутилоксикарбонил)-L-орнитинил]пирролидин
Nω-(бензилоксикарбонил)-Nα-(трет-бутилоксикарбонил)-L-орнитин (5,49 г, 15 ммоль) растворяют в СН2Cl2/ДМФ (9:1, 100 мл). К указанному раствору при 0°С добавляют гидрат 1-гидроксибензотриазола (3,37 г, 22 ммоль), водорастворимый карбодиимид (3,46 г, 18 ммоль), пирролидин (1,28 г, 18 ммоль) и триэтиламин (200 мг, 20 ммоль). После выдерживания в течение 18 ч при температуре от 0°С до комнатной температуры растворитель удаляют в вакууме и остаток растворяют в этилацетате (200 мл). Раствор промывают 0,3 М KHSO4 (2×50 мл), насыщенным раствором NaHCO3 (2×50 мл), водой (2×50 мл) и насыщенным раствором соли (1×50 мл), сушат (Na2SO4) и выпаривают в вакууме. Остаток очищают флэш-хроматографией (элюент: 90% этилацетат, 10% петр. эфир) с получением бесцветного масла, которое идентифицируют как 1-[Nω-(бензилоксикарбонил)-Nα-(трет-бутилоксикарбонил)-L-орнитинил]пирролидин (5,15 г, 12,3 ммоль, 82%).
В. 1-[Nα-(трет-бутилоксикарбонил)-L-орнитинил]пирролидин
1-[Nω-(бензилоксикарбонил)-Nα-(трет-бутилоксикарбонил)-L-орнитинил]пирролидин (2,15 г, 5,13 ммоль) растворяют в метаноле (80 мл). Указанный раствор гидрируют над 10% Pd/C (400 мг). Через 2 часа катализатор отфильтровывают и промывают метанолом (50 мл). Объединенные фильтраты выпаривают в вакууме с получением не совсем белого твердого вещества, которое идентифицируют как 1-[Nα-(трет-бутилоксикарбонил)-L-орнитинил]пирролидин (1,35 г, 4,74 ммоль, 94%).
С. 1-[Nα-(трет-бутилоксикарбонил)-Nω-(пиразинил-2-карбонил)-L-орнитинил]пирролидин
1-[Nα-(трет-бутилоксикарбонил)-L-орнитинил]пирролидин (100 мг, 0,35 ммоль) растворяют в CH2Cl2 (20 мл). К указанному раствору при 0°С добавляют PyBrop® (195 мг, 0,04 ммоль), 2-пиразинкарбоновую кислоту (50 мг, 0,4 ммоль) и триэтиламин (100 мг, 1,0 ммоль). После выдерживания в течение 18 ч при температуре от 0°С до комнатной температуры растворитель удаляют в вакууме и остаток растворяют в этилацетате (70 мл). Раствор промывают 0,3 М KHSO4 (2×20 мл), насыщенным раствором NaHCO3 (2×20 мл), водой (2×20 мл) и насыщенным раствором соли (1×20 мл), сушат (Na2SO4) и выпаривают в вакууме. Остаток очищают флэш-хроматографией (элюент: 3% метанол, 97% хлороформ) с получением липкого белого твердого вещества, которое идентифицируют как 1-[Nα-(трет-бутилоксикарбонил)-Nω-(пиразинил-2-карбонил)-L-орнитинил]пирролидин (90 мг, 0,25 ммоль, 66%).
D. Трифторацетат 1-[Nω-(пиразинил-2-карбонил)-L-орнитинил]пирролидина
1-[Nα-(трет-бутилоксикарбонил)-Nω-(пиразинил-2-карбонил)-L-орнитинил]пирролидин (90 мг, 0,23 ммоль) растворяют в 4 М HCl/диоксане (15 мл). После выдерживания в течение 45 мин при комнатной температуре растворитель удаляют в вакууме. Остаток очищают методом препаративной ВЭЖХ (Vydac C18, от 5 до 50% 0,1% ТФУ/ацетонитрила в 0,1% ТФУ/воде в течение 40 мин с объемным расходом 3 мл/мин). Фракции, содержащие продукт, лиофилизуют с получением бесцветного масла, которое идентифицируют как трифторацетат 1-[Nω-(пиразинил-2-карбонил)-L-орнитинил]пирролидина (51 мг).
[М+Н]+=292,1.
ПРИМЕР 6
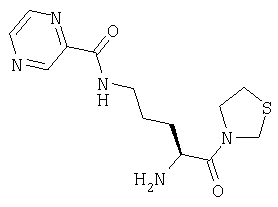
Трифторацетат 3-[Nω-(пиразинил-2-карбонил)-L-орнитинил]тиазолидина
А. 3-[Nα-(трет-бутилоксикарбонил)-Nω-(9-флуоренилметилоксикарбонил)-L-орнитинил]тиазолидин
Nα-(трет-бутилоксикарбонил)-Nω-(9-флуоренилметилоксикарбонил)-L-орнитин (2,73 г, 6 ммоль) растворяют в СН2Cl2/ДМФ (9:1, 100 мл). К указанному раствору при 0°C добавляют гидрат 1-гидроксибензотриазола (1,53 г, 10 ммоль), водорастворимый карбодиимид (1,34 г, 7 ммоль), тиазолидин (1,28 г, 18 ммоль) и триэтиламин (80 мг, 8 ммоль). После выдерживания в течение 18 ч при температуре от 0°С до комнатной температуры растворитель удаляют в вакууме и остаток растворяют в этилацетате (100 мл). Раствор промывают 0,3 М KHSO4 (2×25 мл), насыщенным раствором NaHCO3 (2×25 мл), водой (2×25 мл) и насыщенным раствором соли (1×25 мл), сушат (Na2SO4) и выпаривают в вакууме. Остаток очищают флэш-хроматографией (элюент: 75% этилацетат, 25% петр. эфир) с получением белого твердого вещества, которое идентифицируют как 3-[Nα-(трет-бутилоксикарбонил)-Nω-(9-флуоренилметилоксикарбонил)-L-орнитинил]тиазолидин (2,55 г, 4,85 ммоль, 81%).
В. 3-[Nα-(трет-бутилоксикарбонил)-L-орнитинил]тиазолидин
3-[Nα-(трет-бутилоксикарбонил)-Nω-(9-флуоренилметилоксикарбонил)-L-орнитинил]тиазолидин (1,15 г, 2,13 ммоль) растворяют в ацетонитриле (20 мл). Добавляют диэтиламин (5 мл). После выдерживания в течение 90 мин при комнатной температуре растворитель удаляют в вакууме и остаток очищают флэш-хроматографией (элюент: 90% хлороформ, 7% метанол, 3% триэтиламин) с получением слегка желтого масла, которое идентифицируют как 3-[Nα-(трет-бутилоксикарбонил)-L-орнитинил]тиазолидин (530 мг, 1,67 ммоль, 78%).
С. 3-[Nα-(трет-бутилоксикарбонил)-Nω-(пиразинил-2-карбонил)-L-орнитинил]тиазолидин
3-[Nα-(трет-бутилоксикарбонил)-L-орнитинил]тиазолидин (80 мг, 0,27 ммоль) растворяют в СН2Cl2 (20 мл). К указанному раствору при 0°С добавляют PyBroP® (146 мг, 0,3 ммоль), 2-пиразинкарбоновую кислоту (37 мг, 0,3 ммоль) и триэтиламин (90 мг, 0,9 ммоль). После выдерживания в течение 18 ч при температуре от 0°С до комнатной температуры растворитель удаляют в вакууме и остаток растворяют в этилацетате (70 мл). Раствор промывают 0,3 М KHSO4 (2×20 мл), насыщенным раствором NaHCO3 (2×20 мл), водой (2×20 мл) и насыщенным раствором соли (1×20 мл), сушат (Na2SO4) и выпаривают в вакууме. Остаток очищают флэш-хроматографией (элюент: 3% метанол, 97% хлороформ) с получением липкого белого твердого вещества, которое идентифицируют как 3-[Nα-(трет-бутилоксикарбонил)-Nω-(пиразинил-2-карбонил)-L-орнитинил]тиазолидин (45 мг, 0,11 ммоль, 41%).
D. Трифторацетат 3-[Nω-(пиразинил-2-карбонил)-L-орнитинил]тиазолидина
3-[Nα-(трет-бутилоксикарбонил)-Nω-(пиразинил-2-карбонил)-L-орнитинил]тиазолидин (45 мг, 0,11 ммоль) растворяют в 4 М HCl/диоксане (10 мл). После выдерживания в течение 45 мин при комнатной температуре растворитель удаляют в вакууме. Остаток очищают методом препаративной ВЭЖХ (Vydac C18, от 5 до 50% 0,1% ТФУ/ацетонитрила в 0,1% ТФУ/воде в течение 40 мин с объемным расходом 3 мл/мин). Фракции, содержащие продукт, лиофилизуют с получением бесцветного масла, которое идентифицируют как трифторацетат 3-[Nω-(пиразинил-2-карбонил)-L-орнитинил]тиазолидина (14 мг).
[М+Н]+=310,0.
ПРИМЕР 7
Трифторацетат (2S)-1-[S-(ацетиламинометил)-L-цистеинил]пирролидин-2-карбонитрила
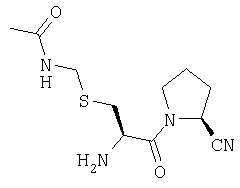
А. (2S)-1-[S-(ацетиламинометил)-N-(трет-бутилоксикарбонил)-L-цистеинил]пирролидин-2-карбонитрил
S-(ацетиламинометил)-N-(трет-бутилоксикарбонил)-L-цистеин (660 мг, 2,26 ммоль) растворяют в СН2Cl2 (30 мл). К указанному раствору при 0°С добавляют гидрохлорид (2S)-пирролидин-2-карбонитрила (250 мг, 1,89 ммоль) и PyBOP® (1,3 г, 2,49 ммоль) и доводят значение рН до 9, добавляя триэтиламин. После выдерживания в течение 18 ч при температуре от 0°С до комнатной температуры растворитель удаляют в вакууме и остаток растворяют в этилацетате (150 мл). Раствор промывают 0,3 М KHSO4 (2×30 мл), насыщенным раствором NaHCO3 (2×30 мл), водой (2×30 мл) и насыщенным раствором соли (1×30 мл), сушат (Na2SO4) и выпаривают в вакууме. Остаток очищают флэш-хроматографией (элюент: 75% этилацетат, 25% петр. эфир) с получением бесцветного масла, которое идентифицируют как (2S)-1-[S-(ацетиламинометил)-N-(трет-бутилоксикарбонил)-L-цистеинил]пирролидин-2-карбонитрил (650 мг, 1,76 ммоль, 78%).
В. Трифторацетат (2S)-1-[S-(ацетиламинометил)-L-цистеинил]пирролидин-2-карбонитрила
(2S)-1-[S-(ацетиламинометил)-N-(трет-бутилоксикарбонил)-L-цистеинил]пирролидин-2-карбонитрил (610 мг, 1,65 ммоль) растворяют в трифторуксусной кислоте (30 мл). После выдерживания в течение 1 часа при комнатной температуре растворитель удаляют в вакууме с получением бесцветного масла, которое идентифицируют как трифторацетат (2S)-1-[S-(ацетиламинометил)-L-цистеинил]пирролидин-2-карбонитрила (620 мг, 1,61 ммоль, 98%).
[М+Н]+=271,0.
ПРИМЕР 8
Трифторацетат (2S)-1-[(2'R)-3'-(ацетиламинометилтио)-2'-амино-3'-метилбутаноил]пирролидин-2-карбонитрила
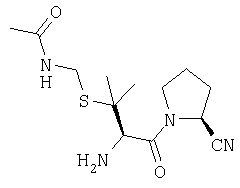
А. (2S)-1-[(2'R)-3'-(ацетиламинометилтио)-2'-(трет-бутилоксикарбониламино)-3'-метилбутаноил]пирролидин-2-карбонитрил
S-(ацетиламинометил)-N-(трет-бутилоксикарбонил)пеницилламин (720 мг, 2,25 ммоль) растворяют в CH2Cl2 (30 мл). К указанному раствору при 0°C добавляют гидрохлорид (2S)-пирролидин-2-карбонитрила (270 мг, 2,04 ммоль) и PyBOP® (1,3 г, 2,49 ммоль) и доводят значение рН до 9, добавляя триэтиламин. После выдерживания в течение 18 ч при температуре от 0°С до комнатной температуры растворитель удаляют в вакууме и остаток растворяют в этилацетате (150 мл). Раствор промывают 0,3 М KHSO4 (2×30 мл), насыщенным раствором NaHCO3 (2×30 мл), водой (2×30 мл) и насыщенным раствором соли (1×30 мл), сушат (Na2SO4) и выпаривают в вакууме. Остаток очищают флэш-хроматографией (элюент: 75% этилацетат, 25% петр. эфир) с получением бесцветного масла, которое идентифицируют как (2S)-1-[(2'R)-3'-(ацетиламинометилтио)-2'-(трет-бутилоксикарбониламино)-3'-метилбутаноил]пирролидин-2-карбонитрил (742 мг, 1,86 ммоль, 83%).
В. Трифторацетат (2S)-1-[(2'R)-3'-(ацетиламинометилтио)-2'-амино-3'-метилбутаноил]пирролидин-2-карбонитрила
(2S)-1-[(2'R)-3'-(ацетиламинометилтио)-2'-(трет-бутилоксикарбониламино)-3'-метилбутаноил]пирролидин-2-карбонитрил (710 мг, 1,78 ммоль) растворяют в трифторуксусной кислоте (30 мл). После выдерживания в течение 1 часа при комнатной температуре растворитель удаляют в вакууме с получением бесцветного масла, которое идентифицируют как трифторацетат (2S)-1-[(2'R)-3'-(ацетиламинометилтио)-2'-амино-3'-метилбутаноил]-пирролидин-2-карбонитрила (560 мг, 1,36 ммоль, 76%).
[M+H]+=299,1.
ПРИМЕР 9
Трифторацетат (2S)-1-[Nω-(2-хлорпиридил-3-карбонил)-L-орнитинил]пирролидин-2-карбонитрила
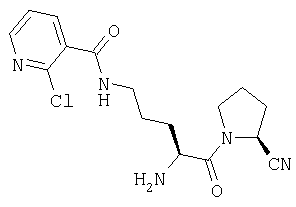
A. (2S)-1-(Nα-(трет-бутилоксикарбонил)-L-орнитил)пирролилин-2-карбонитрил
(2S)-1-(Nα-(трет-бутилоксикарбонил)-L-орнитил]пирролидин-2-карбонитрил получают по методу, описанному для производного лизина в примере 2.
В. (2S)-1-(Nα-(трет-бутилоксикарбонил)-Nω-(2-хлорпиридил-3-карбонил)-L-орнитил)иирролилин-2-карбонитрил
(2S)-1-(Nα-(трет-бутилоксикарбонил)-L-орнитил)пирролидин-2-карбонитрил (80 мг, 0,26 ммоль) растворяют в CH2Cl2 (20 мл). К указанному раствору добавляют 2-хлорпиридин-3-карбонилхлорид (55 мг, 0,32 ммоль) и доводят значение рН до 9, добавляя триэтиламин. После выдерживания в течение 18 ч при комнатной температуре растворитель удаляют в вакууме и остаток растворяют в этилацетате (70 мл). Раствор промывают 0,3 М KHSO4 (2×20 мл), насыщенным раствором NaHCO3 (2×20 мл), водой (2×20 мл) и насыщенным раствором соли (1×20 мл), сушат (Na2SO4) и выпаривают в вакууме. Остаток очищают флэш-хроматографией (элюент: 95% этилацетат, 5% петр. эфир) с получением бесцветного масла, которое идентифицируют как (2S)-1-(Nα-(трет-бутилоксикарбонил)-Nω-(2-хлорпиридил-3-карбонил)-L-орнитил)пирролидин-2-карбонитрил (60 мг, 0,14 ммоль, 53%).
С. Трифторацетат (2S)-1-[Nω-(2-хлорпиридил-3-карбонил)-L-орнитинил]пирролидин-2-карбонитрила
(2S)-1-[Nα-(трет-бутилоксикарбонил)-Nω-(2-хлорпиридил-3-карбонил)-L-орнитинил]пирролидин-2-карбонитрил (60 мг, 0,14 ммоль) растворяют в трифторуксусной кислоте (5 мл). После выдерживания в течение 1 часа при комнатной температуре растворитель удаляют в вакууме. Остаток очищают методом препаративной ВЭЖХ (Vydac C18, от 5 до 50% 0,1% ТФУ/ацетонитрила в 0,1% ТФУ/воде в течение 40 мин с объемным расходом 3 мл/мин). Фракции, содержащие продукт, лиофилизуют с получением белого твердого вещества, которое идентифицируют как Трифторацетат (2S)-1-[Nω-(2-хлорпиридил-3-карбонил)-L-орнитинил]пирролидин-2-карбонитрила (52 мг).
[M+H]+=350,1.
ПРИМЕР 10
Гидрохлорид 1-[Nω-(2-хлорпиридил-3-карбонил)-L-орнитинил]пирролидина
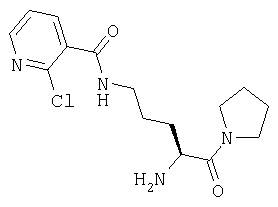
А. 1-(Nα-(трет-бутилоксикарбонил)-Nω-(2-хлоорпиридил-3-карбонил)-L-орнитил)пирролидин
1-(Nα-(трет-бутилоксикарбонил)-L-орнитил)пирролидин (20 мг, 0,069 ммоль) растворяют в CH2Cl2 (5 мл). К указанному раствору добавляют 2-хлорпиридин-3-карбонилхлорид (14 мг, 0,076 ммоль) и доводят значение рН до 9, добавляя триэтиламин. После выдерживания в течение 1 часа при комнатной температуре растворитель удаляют в вакууме и остаток растворяют в этилацетате (70 мл). Раствор промывают 0,3 М KHSO4 (2×20 мл), насыщенным раствором NaHCO3 (2×20 мл), водой (2×20 мл) и насыщенным раствором соли (1×20 мл), сушат (Na2SO4) и выпаривают в вакууме. Остаток очищают флэш-хроматографией (элюент: 10% метанол, 90% дихлорметан) с получением бесцветного масла, которое идентифицируют как 1-(Nα-трет-бутилоксикарбонил)-Nω-(2-хлорпиридил-3-карбонил)-L-орнитил)пирролидин (19 мг, 0,045 ммоль, 63%).
В. Гидрохлорид 1-[Nω-(2-хлорпиридил-3-карбонил)-L-орнитинил]пирролидина
1-[Nα-(трет-бутилоксикарбонил)-Nω-(2-хлорпиридил-3-карбонил)-L-орнитинил] пирролидин (19 мг, 0,045 ммоль) растворяют в 4 М HCl/диоксане (10 мл). После выдерживания в течение 45 мин при комнатной температуре растворитель удаляют в вакууме с получением белого твердого вещества, которое идентифицируют как гидрохлорид 1-[Nω-(2-хлорпиридил-3-карбонил)-L-орнитинил]пирролидина (15 мг).
[М+Н]+=325,1.
ПРИМЕР 11
Гидрохлорид 3-[Nω-(2-хлорпиридил-3-карбонил)-L-орнитинил]тиазолидина
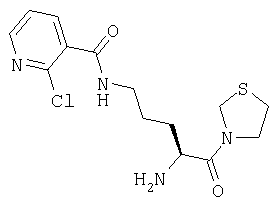
А. 3-(Nα-(трет-бутилоксикарбонил)-Nω-(2-хлорпиридил-3-карбонил)-L-орнитил)тиазолидин
3-(Nα-(трет-бутилоксикарбонил)-L-орнитил)тиазолидин (136 мг, 0,45 ммоль) растворяют в СН2Cl2 (10 мл). К указанному раствору добавляют 2-хлорпиридин-3-карбонилхлорид (88 мг, 0,5 ммоль) и доводят значение рН до 9, добавляя триэтиламин. После выдерживания в течение 1 часа при комнатной температуре растворитель удаляют в вакууме и остаток растворяют в этилацетате (70 мл). Раствор промывают 0,3 М KHSO4 (2×20 мл), насыщенным раствором NaHCO3 (2×20 мл), водой (2×20 мл) и насыщенным раствором соли (1×20 мл), сушат (Na2SO4) и выпаривают в вакууме. Остаток очищают флэш-хроматографией (элюент: 1,5% метанол, 98,5% дихлорметан) с получением бесцветного масла, которое идентифицируют как 3-(Nα-(трет-бутилоксикарбонил)-Nω-(2-хлорпиридил-3-карбонил)-L-орнитил)тиазолидин (30 мг, 0,068 ммоль, 15%).
В. Гидрохлорид 3-[Nω-(2-хлорпиридил-3-карбонил)-L-орнитинил]тиазолидина
3-[Nα-(трет-бутилоксикарбонил)-Nω-(2-хлорпиридил-3-карбонил)-L-орнитинил]тиазолидин (30 мг, 0,068 ммоль) растворяют в 4 М HCl/диоксане (10 мл). После выдерживания в течение 45 мин при комнатной температуре растворитель удаляют в вакууме с получением белого твердого вещества, которое идентифицируют как гидрохлорид 1-[Nω-(2-хлорпиридил-3-карбонил)-L-орнитинил]тиазолидина (25 мг).
[М+Н]+=342,1.
ПРИМЕР 12
Трифторацетат (2S)-1-[S-(3-пиколилкарбамоилметил)-L-цистеинил]пирролидин-2-карбонитрила
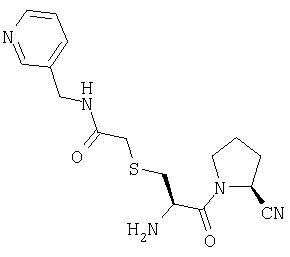
А. S-(бензилоксикарбонилметил)-N-(трет-бутилоксикарбонил)-L-цистеин
N-(трет-бутилоксикарбонил)-L-цистеин (3,5 г, 15,8 ммоль), бензил-2-бромацетат (3,7 г, 16,1 ммоль) и триэтиламин (1,8 г, 18,1 ммоль) растворяют в ТГФ (100 мл). После выдерживания в течение 18 ч при комнатной температуре реакционную смесь разбавляют этилацетатом (100 мл), промывают 0,3 М KHSO4, насыщенным раствором NaHCO3, водой и насыщенным раствором соли, сушат (Na2SO4) и выпаривают. Остаток очищают флэш-хроматографией (элюент: 95% хлороформ, 4% метанол, 1% уксусная кислота) с получением бесцветного масла, которое идентифицируют как S-(бензилоксикарбонилметил)-N-(трет-бутилоксикарбонил)-L-цистеин (5,2 г, 14,1 ммоль, 89%).
В. (2S)-1-[S-(бензилоксикарбонилметил)-N-(трет-бутилоксикарбонил)-L-цистеинил]пирролидин-2-карбонитрил
S-(бензилоксикарбонилметил)-N-(трет-бутилоксикарбонил)-L-цистеин (5,10 г, 13,8 ммоль) растворяют в СН2Cl2 (200 мл). Указанный раствор охлаждают до 0°С, добавляют гидрохлорид (2S)-пирролидин-2-карбонитрила (2,1 мг, 15,8 ммоль) и PyBOP (8,0 г, 15,3 ммоль) и доводят значение рН до 9, добавляя триэтиламин. После выдерживания в течение 18 ч при температуре от 0°С до комнатной температуры растворитель удаляют в вакууме и остаток растворяют в этилацетате (150 мл). Раствор промывают 0,3 М KHSO4 (1×50 мл), насыщенным раствором NaHCO3 (1×50 мл), водой (1×50 мл) и насыщенным раствором соли (1×50 мл), сушат (Na2SO4) и выпаривают в вакууме с получением желтого масла. Указанное масло очищают флэш-хроматографией (элюент: 40% этилацетат, 60% петр. эфир) с получением бесцветного масла, которое идентифицируют как (2S)-1-[S-(бензилоксикарбонилметил)-N-(трет-бутилоксикарбонил)-L-цистеинил]пирролидин-2-карбонитрил (5,82 г, 13,0 ммоль, 94%).
С. (2S)-1-[N-(трет-бутилоксикарбонил)-S-(карбоксиметил)-L-цистеинил]пирролидин-2-карбонитрил
(2S)-1-[S-(бензилоксикарбонилметил)-N-(трет-бутилоксикарбонил)-L-цистеинил]пирролидин-2-карбонитрил (1,31 г, 2,9 ммоль) растворяют в ТГФ (100 мл). Добавляют водный раствор гидроксида лития (1 М, 3,5 мл, 3,5 ммоль). После выдерживания в течение 3 часов при комнатной температуре реакционную смесь разбавляют этилацетатом (100 мл), промывают 1 М лимонной кислотой, водой и насыщенным раствором соли, сушат (Na2SO4) и выпаривают в вакууме с получением бесцветного масла. Указанное масло очищают флэш-хроматографией (элюент: 97% хлороформ, 2% метанол, 1% уксусная кислота) с получением бесцветного масла, которое идентифицируют как (2S)-1-[N-(трет-бутилоксикарбонил)-S-(карбоксиметил)-L-цистеинил]пирролидин-2-карбонитрил (860 мг, 2,4 ммоль, 82%).
D. (2S)-1-[N-(трет-бутилоксикарбонил)-S-(3-пиколилкарбамоилметил)-L-цистеинил]пирролидин-2-карбонитрил
(2S)-1-[N-(трет-бутилоксикарбонил)-S-(карбоксиметил)-L-цистеинил]пирролидин-2-карбонитрил (150 мг, 0,42 ммоль) растворяют в CH2Cl2 (20 мл). Указанный раствор охлаждают до 0°С, добавляют 3-(аминометил)пиридин (53 мг, 0,5 ммоль) и PyBOP (270 мг, 0,52 ммоль) и доводят значение рН до 9, добавляя триэтиламин. После выдерживания в течение 18 ч при температуре от 0°С до комнатной температуры растворитель удаляют в вакууме и остаток растворяют в этилацетате (70 мл). Далее указанный раствор промывают 0,3 М KHSO4 (1×20 мл), насыщенным раствором NaHCO3 (1×20 мл), водой (1×20 мл) и насыщенным раствором соли (1×20 мл), сушат (Na2SO4) и выпаривают в вакууме с получением желтого масла. Указанное масло очищают флэш-хроматографией (элюент: 96% хлороформ, 4% метанол) с получением бесцветного масла, которое идентифицируют как (2S)-1-[N-(трет-бутилоксикарбонил)-S-(3-пиколилкарбамоилметил)-L-цистеинил]пирролидин-2-карбонитрил (170 мг, 0,38 ммоль, 91%).
Е. Трифторацетат (2S)-1-[S-(3-пиколилкарбамоилметил)-L-цистеинил]пирролидин-2-карбонитрила
(2S)-1-[N-(трет-бутилоксикарбонил)-S-(3-пиколилкарбамоилметил)-L-цистеинил]пирролидин-2-карбонитрил (130 мг, 0,29 ммоль) растворяют в трифторуксусной кислоте (10 мл). После выдерживания в течение 1 часа при комнатной температуре растворитель удаляют в вакууме с получением белого твердого вещества, которое идентифицируют как трифторацетат (2S)-1-[S-(3-пиколилкарбамоилметил)-L-цистеинил]пирролидин-2-карбонитрила (116 мг, 0,25 ммоль, 86%).
[М+Н]+=348,2.
ПРИМЕР 13
Гидрохлорид 3-[Nω-(2-хиноксалоил)-L-лизинил]тиазолидина
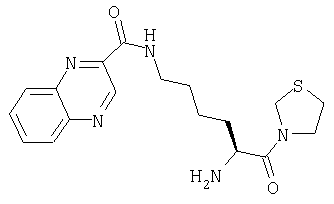
А. 3-[Nα-(трет-бутилоксикарбонил)-Nω-(2-хиноксалоил)-L-лизинил]тиазолидин
3-[Nα-(трет-бутилоксикарбонил)лизинил]тиазолидин (128 мг, 0,4 ммоль) растворяют в CH2Cl2 (10 мл). Добавляют 2-хиноксалоилхлорид (85 мг, 0,44 ммоль) и карбонат калия (45,8 мг, 0,3 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 18 ч и затем растворитель удаляют в вакууме. Остаток очищают флэш-хроматографией (элюент: 99,5% хлороформ, 0,5% метанол) с получением бесцветного масла, которое идентифицируют как 3-[Nα-(трет-бутилоксикарбонил)-Nω-(2-хиноксалоил)-L-лизинил]тиазолидин (140 мг, 0,296 ммоль, 74%).
В. Гидрохлорид 3-[Nω-(2-хиноксалоил)-L-лиаинил]тиазолидина
3-[Nα-(трет-бутилоксикарбонил)-Nω-(2-хиноксалоил)-L-лизинил]тиазолидин (140 мг, 0,296 ммоль) растворяют в 4 М HCl/диоксане (20 мл). После перемешивания в течение 1 часа при комнатной температуре растворитель удаляют в вакууме с получением белого твердого вещества, которое идентифицируют как гидрохлорид 3-[Nω-(2-хиноксалоил)-L-лизинил]тиазолидина (128 мг, 0,296 ммоль, 100%).
[М+Н]+=374,2.
ПРИМЕР 14
Гидрохлорид 3-[Nω-(3-пиридилоксикарбонил)-L-орнитинил]тиазолидина
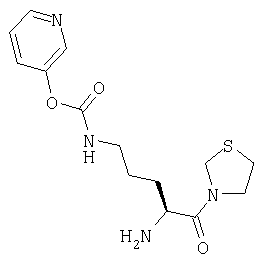
А. 3-[Nα-(трет-бутилоксикарбонил)-Nω-(3-пиридилоксикарбонил) L-орнитинил]тиазолидин
3-Гидроксипиридин (14,9 мг, 0,138 ммоль) растворяют в СН2Cl2 (20 мл). Добавляют при 0°С фосген (20% раствор в толуоле, 0,335 мл, 0,685 ммоль) и пиридин (14 мг, 0,182 ммоль). Через 90 мин растворитель удаляют в вакууме и остаток растворяют в CH2Cl2 (20 мл). Добавляют 3-[Nα-(трет-бутилоксикарбонил)орнитинил]тиазолидин (42 мг, 0,138 ммоль) и триэтиламин (28 мг, 0,28 ммоль). Реакционную смесь перемешивают в течение 18 часов и затем растворитель удаляют в вакууме. Остаток очищают флэш-хроматографией (элюент: 97% хлороформ, 3% метанол) с получением бесцветного масла, которое идентифицируют как 3-[Nα-(трет-бутилоксикарбонил)-Nω-(3-пиридилоксикарбонил)-L-орнитинил]тиазолидин (16 мг, 0,038 ммоль, 27%).
В. Гидрохлорид 3-[Nω-(3-пиридилоксикарбонил)-L-орнитинил]тиазолидина
3-[Nα-(трет-бутилоксикарбонил)-Nω-(3-пиридилоксикарбонил)-L-орнитинил] тиазолидин (16 мг, 0,038 ммоль) растворяют в 4 М HCl/диоксане (20 мл). После выдерживания в течение 1 часа при комнатной температуре растворитель удаляют в вакууме с получением белого твердого вещества, которое идентифицируют как гидрохлорид 3-[Nω-(3-пиридилоксикарбонил)-L-орнитинил]тиазолидина (14 мг, 0,038 ммоль, 100%).
[М+Н]+=325,1.
ПРИМЕР 15
Гидрохлорид 3-[О-(3-хлорбензилкарбамоил)серинил]тиазолидина
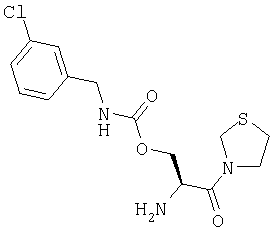
А. 3-[N-(трет-бутилоксикарбонил)-L-серинил]тиазолидин
N-(трет-бутилоксикарбонил)-L-серин (2,1 г, 10,2 ммоль) растворяют в СН2Cl2/ДМФ (9:1, 50 мл). Добавляют при 0°С тиазолидин (650 мг, 11,2 ммоль), гидроксибензотриазол (2,8 г, 20,7 ммоль) и водорастворимый карбодиимид (3,9 г, 19,5 ммоль). Значение рН доводят до 8, добавляя N-метилморфолин. Реакционную смесь перемешивают при комнатной температуре в течение 18 часов, растворитель удаляют в вакууме и остаток растворяют в этилацетате (150 мл). Раствор промывают 0,3 М KHSO4 (1×50 мл), насыщенным раствором NaHCO3 (1×50 мл), водой (1×50 мл) и насыщенным раствором соли (1×50 мл), сушат (Na2SO4) и выпаривают в вакууме с получением белого твердого вещества, которое идентифицируют как 3-[N-(трет-бутилоксикарбонил)-L-серинил]тиазолидин (2,15 г, 7,78 ммоль, 76%).
В. 3-[N-(трет-бутилоксикарбонил)-О-(3-хлорбензилкарбамоил)-L-серинил]тиазолидин
3-[N-(трет-бутилоксикарбонил)-L-серинил]тиазолидин (110 мг, 0,48 ммоль) растворяют в ДМФ (10 мл) и добавляют 1,1'-карбонилдиимидазол (71 мг, 0,43 ммоль). После выдерживания в течение 2 часов при комнатной температуре добавляют 3-хлорбензиламин (62 мг, 0,4 ммоль). По прошествии еще 18 часов добавляют EtOAc (200 мл). Указанный раствор промывают 0,3 М KHSO4 (1×50 мл), насыщенным раствором NaHCO3 (1×50 мл), водой (4×50 мл) и насыщенным раствором соли (1×50 мл), сушат (Na2SO4) и выпаривают в вакууме с получением желтого масла. Указанное масло очищают флэш-хроматографией (элюент: 40% этилацетат, 60% петр. эфир) с получением бесцветного масла, которое идентифицируют как 3-[N-(трет-бутилоксикарбонил)-О-(3-хлорбензилкарбамоил)-L-серинил]тиазолидин (158 мг, 0,36 ммоль, 90%).
С. Гидрохлорид 3-[О-(3-хлорбенэилкарбамоил)-L-серинил]тиазолидина
3-[N-(трет-бутилоксикарбонил)-О-(3-хлорбензилкарбамоил)-L-серинил]тиазолидин (140 мг, 0,32 ммоль) растворяют в 4 М HCl/диоксане (20 мл). После перемешивания в течение 1 часа при комнатной температуре растворитель удаляют в вакууме с получением белого твердого вещества, которое идентифицируют как гидрохлорид 3-[О-(3-хлорбензилкарбамоил)-L-серинил]тиазолидина (115 мг, 0,3 ммоль, 94%).
[М+H]+=344,1.
Соединения других примеров, которые указаны в приведенных ниже таблицах, получают в соответствии с описанными выше методами.
Примеры 16-162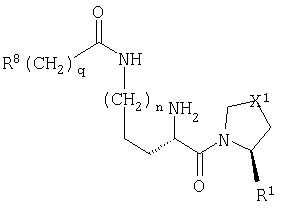

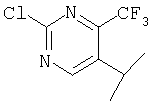
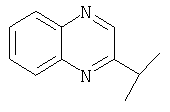
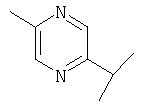
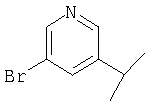
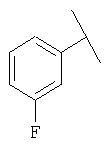
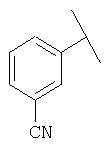
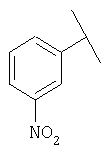
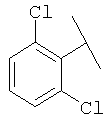
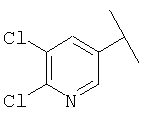
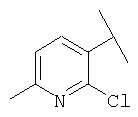

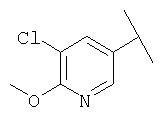
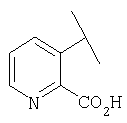
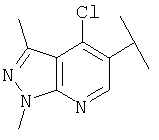
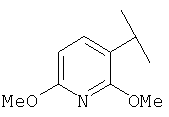
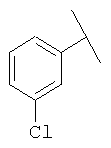
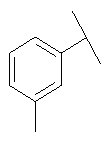


Примеры 163-250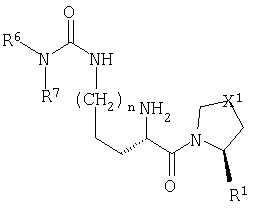


Примеры 251-266


Примеры 267-318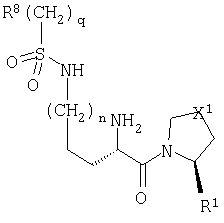










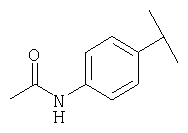

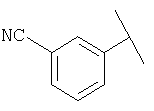
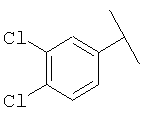




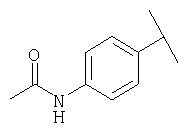
Примеры 319-378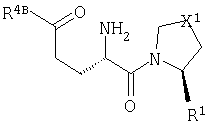
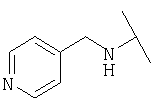
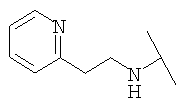
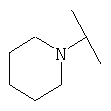
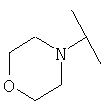


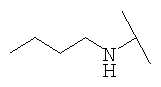




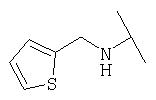
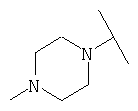
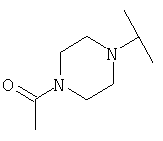
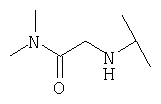

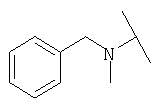



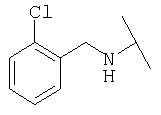
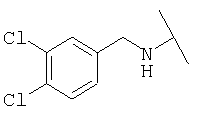
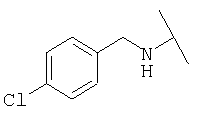
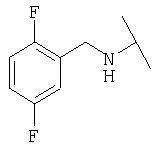
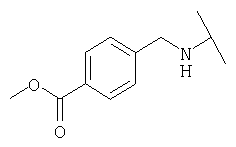
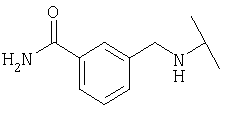
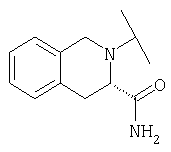

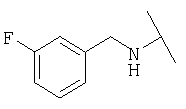
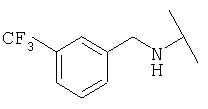

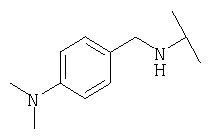
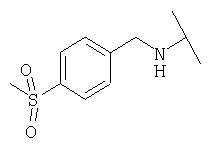
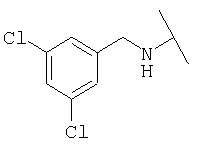
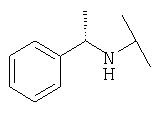
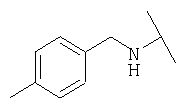





Примеры 379-418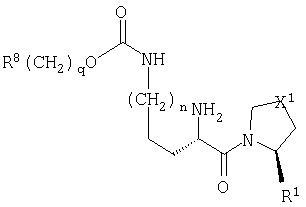

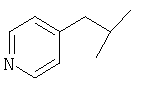
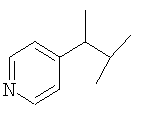
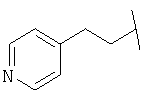
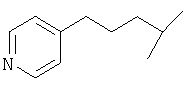
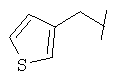
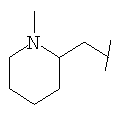
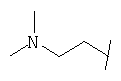
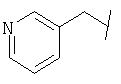
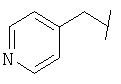

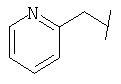
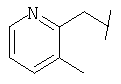
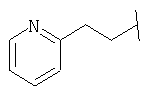



Примеры 419-438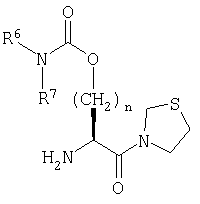
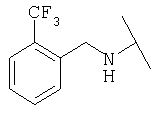
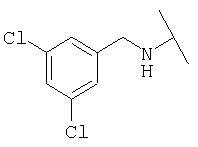


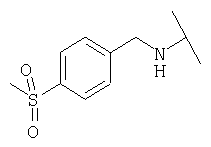



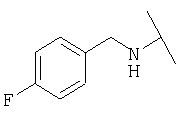

Примеры 439-450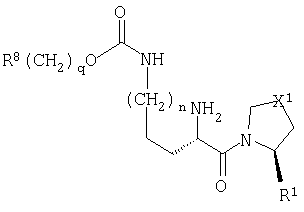

ПРИМЕР 451
Определение активности
Оценивают способность соединений ингибировать DP-IV, используя методы анализа, описанные в WO 95/15309. Все соединения, описанные в предыдущих примерах, являются конкурентными ингибиторами DP-IV со значениями Ki менее чем 300 нМ.
ПРИМЕР 452
Определение активности in vivo
Противодиабетическое действие выбранных соединений было показано на страдающих ожирением крысах Цукера (Zucker) с использованием стандартного перорального теста на толерантность к глюкозе. Контрольным крысам через зонд вводят раствор глюкозы и определяют в плазме уровень глюкозы. Указанные крысы демонстрируют выраженную гипергликемию. Соединения согласно настоящему изобретению растворяют в растворе глюкозы в разных концентрациях, так чтобы крысы могли получать различные дозы соединения одновременно с глюкозной провокацией. Гипергликемическое отклонение снижается зависимым от дозы образом у животных, получающих от 0,1 до 100 мг/кг ингибитора DP-IV.
ПРИМЕР 453
Фармацевтическая композиция
Таблетки, содержащие 100 мг соединения из примера 1 в качестве активного ингредиента, получают с использованием следующих компонентов:
Исходные компоненты смешивают и затем прессуют с получением 2000 таблеток по 250 мг, каждая из которых содержит 100 мг соединения из примера 1.
Из приведенного выше описания видно, что соединения согласно настоящему изобретению являются ингибиторами DP-IV, и, соответственно, следует ожидать, что они будут полезны в качестве лекарственных средств при лечении нарушенной толерантности к глюкозе, диабета типа II и других заболеваний, в случае которых ингибирование указанного фермента ведет к ослаблению соответствующей основной патологии или к снижению симптомов.
Настоящее изобретение определяет приведенная далее формула изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ИНГИБИТОРЫ ДИПЕПТИДИЛПЕПТИДАЗЫ IV | 2001 |
|
RU2280035C2 |
| НОВЫЕ АНТИДИАБЕТИЧЕСКИЕ АГЕНТЫ | 2000 |
|
RU2265012C2 |
| ПРОИЗВОДНЫЕ ПИРРОЛИДИНА ДЛЯ ПРИМЕНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ КАТЕПСИНА | 2011 |
|
RU2548684C2 |
| ЛИПОТЕТРАПЕПТИДЫ НА ОСНОВЕ ДИЭФИРОВ L-ГЛУТАМИНОВОЙ КИСЛОТЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2013 |
|
RU2533554C1 |
| НОВЫЕ КОНЪЮГАТЫ СВЯЗЫВАЮЩЕЕ СОЕДИНЕНИЕ - АКТИВНОЕ СОЕДИНЕНИЕ (ADC) И ИХ ПРИМЕНЕНИЕ | 2012 |
|
RU2610336C2 |
| ПЕПТИД, ОБЛАДАЮЩИЙ БИОЦИДНОЙ АКТИВНОСТЬЮ | 2000 |
|
RU2183643C1 |
| ПРОИЗВОДНЫЕ 1-ФЕНИЛ-2-ПИРИДИНИЛАЛКИЛЬНЫХ СПИРТОВ В КАЧЕСТВЕ ИНГИБИТОРОВ ФОСФОДИЭСТЕРАЗЫ | 2012 |
|
RU2626956C2 |
| ЗАМЕЩЕННЫЕ АМИНОМАСЛЯНЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ НЕПРИЛИЗИНА | 2012 |
|
RU2604522C2 |
| АГОНИСТЫ РЕЦЕПТОРА МЕЛАНОКОРТИНА | 2007 |
|
RU2411240C2 |
| ИЗОКСАЗОЛИНЫ И ИЗОКСАЗОЛЫ, СПОСОБ ПОДАВЛЕНИЯ АГРЕГАЦИИ ТРОМБОЦИТОВ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ПОДАВЛЯЮЩАЯ АГРЕГАЦИЮ ТРОМБОЦИТОВ | 1994 |
|
RU2149871C1 |
Предложены соединения общей формулы (1):
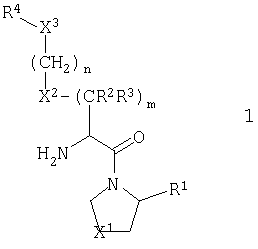
где Х1 выбирают из атома серы и метиленовой группы; Х2 выбирают из О, S и метилена; X3 обозначает либо NR5, либо карбонильную группу; R1 обозначает либо атом водорода, либо нитрильную группу; R2 и R3 выбирают независимо из Н и C1-С6 алкила; R4 обозначает R4A, когда X3 обозначает NR5, и R4B, когда X3 обозначает карбонильную группу; R4A выбирают из R6R7NC(=O), R6R7NC(=S), R8(CH2)qC(=O), R8(CH2)qC(=S), R8(CH2)qSO2 и R8(CH2)qOC(=O); R4B обозначает R6R7N; R5 обозначает Н; R6 и R7 выбирают независимо из R8(CH2)q или вместе они образуют -(CH2)2-Z1-(CH2)2- или -CHR9-Z2-CH2-CHR10-; R8 выбирают из Н, C1-C4 алкила, циклоалкила, конденсированного с бензольным кольцом, ацила, диалкилкарбамоила, диалкиламино, N-алкилпиперидила, необязательно замещенного арила, необязательно замещенного α-алкилбензила, необязательно замещенного ароила, необязательно замещенного арилсульфонила и необязательно замещенного гетероарила, представляющего собой моноциклическую пяти- и шестичленную кольцевую ароматическую группу с одним или двумя гетероатомами, которые выбирают из азота, кислорода и серы, и производные указанных колец, конденсированные с бензолом; R9 и R10 выбирают независимо из Н, карбамоила, гидроксиметила и цианометила; Z1 выбирают из -(СН2)r-, -О- и -N((CH2)qR8)-; Z2 обозначает необязательно замещенную орто-фениленовую группу; m обозначает 1-3; n обозначает 0-4; р обозначает 2-5; q обозначает 0-3; и r обозначает 1 или 3. Соединения являются ингибиторами дипептидилпептидазы IV и могут использоваться для приготовления фармацевтических композиций, предназначенных для лечения различных заболеваний, в том числе, диабета типа 2. 21 з.п. ф-лы, 8 табл.
где X1 выбирают из атома серы и метиленовой группы;
X2 выбирают из О, S и метилена;
X3 обозначает либо NR5, либо карбонильную группу;
R1 обозначает либо атом водорода, либо нитрильную группу;
R2 и R3 выбирают независимо из Н и C1-С6алкила;
R4 обозначает R4A, когда X3 обозначает NR5, и R4B, когда X3 обозначает карбонильную группу;
R4A выбирают из R6R7NC(=O), R6R7NC(=S), R8(CH2)qC(=O),
R8(CH2)qC(=S), R8(CH2)qSO2 и R8(CH2)qOC(=O);
R4B обозначает R6R7N;
R5 обозначает Н;
R6 и R7 выбирают независимо из R8(CH2)q или вместе они образуют
-(CH2)2-Z1-(CH2)2- или -CHR9-Z2-CH2-CHR10-;
R8 выбирают из Н, C1-C4алкила, циклоалкила, конденсированного с бензольным кольцом, ацила, диалкилкарбамоила, диалкиламино, N-алкилпиперидила, необязательно замещенного арила, необязательно замещенного α-алкилбензила, необязательно замещенного ароила, необязательно замещенного арилсульфонила и необязательно замещенного гетероарила, представляющего собой моноциклическую пяти- и шестичленную кольцевую ароматическую группу с одним или двумя гетероатомами, которые выбирают из азота, кислорода и серы, и производные указанных колец, конденсированные с бензолом;
R9 и R10 выбирают независимо из Н, карбамоила, гидроксиметила и цианометила;
Z1 выбирают из -(СН2)r-, -О- и -N((CH2)qR8)-;
Z2 обозначает необязательно замещенную ортофениленовую группу;
m обозначает 1-3;
n обозначает 0-4;
р обозначает 2-5;
q обозначает 0-3; и
r обозначает 1 или 3;
при условии, что когда X2 обозначает СН2, X3 обозначает NH и R4 обозначает R8CH2O(CO), то R8 не будет незамещенным фенилом или нитрофенилом; а также при условии, что когда Х1 обозначает CH2, R1 обозначает Н, Х2 обозначает СН2, X3 обозначает NH и R4 обозначает R8(CH2)qC(=O), то R8(CH2)q не будет метилом или этилом.
(2S)-1-[Nω-(пиразинил-2-карбонил)-L-орнитинил]пирролидин-2-карбонитрила,
(2S)-1-[Nω-(пиразинил-2-карбонил)-L-лизинил]пирролидин-2-карбонитрила,
(2S)-1-[(2'S)-2'-амино-4'-(пиразинил-2''-карбониламино)бутаноил]пирролидин-2-карбонитрила,
(4R)-3-[Nω-(пиразинил-2-карбонил)-L-лизинил]тиазолидин-4-карбонитрила,
(2S)-1-[Nω-(пиридил-3-метил)-L-глютаминил]пирролидин-2-карбонитрила,
1-[Nω-(пиразинил-3-карбонил)-L-орнитинил]пирролидина,
(2S)-1-[S-(ацетиламинометил)-L-цистеинил]пирролидин-2-карбонитрила,
3-[Nω-(2-хлорпиридил-3-карбонил)-L-орнитинил]тиазолидина,
1-[Nω-(2-хлорпиридил-3-карбонил)-L-орнитинил]пирролидина,
(2S)-1-[Nω-(2-хлорпиридил-3-карбонил)-L-орнитинил]пирролидин-2-карбонитрила,
3-[Nω-(пиразинил-2-карбонил)-L-орнитинил]тиазолидина,
3-[Nω-(2-хиноксалоил)-L-лизинил]тиазолидина,
3-[Nω-(2-хиноксалоил)-L-орнитинил]тиазолидина,
(2S)-1-[Nω-(2-хиноксалоил)-L-орнитинил]пирролидин-2-карбонитрила,
3-[Nω-(6-метилпиразинил-2-карбонил)-L-орнитинил]тиазолидина,
3-[Nω-(изохинолин-3-карбонил)-L-орнитинил]тиазолидина,
3-[Nω-(6-трифторметилникотиноил)-L-орнитинил]тиазолидина,
(2S)-1-[(2'R)-3'-(ацетиламинометилтио)-2'-амино-3'-метилбутаноил]пирролидин-2-карбонитрила,
(2S)-1-[S-(3-пиколилкарбамоилметил)-L-цистеинил]пирролидин-2-карбонитрила,
3-[Nω-(3-пиридилоксикарбонил)-L-орнитинил]тиазолидина,
3-[O-(3-хлорбензилкарбамоил)серинил]тиазолидина и
3-[(2'S)-2'-амино-5'-оксо-5'-(1'',2'',3'',4''-тетрагидроизохинолин-2''-ил)пентаноил]тиазолидина.
| RU 98107337 А, 27.01.2000 | |||
| US 5939560 А, 17.08.1999 | |||
| ЕР 0490379 А2, 17.06.1992 | |||
| WO 9961431 A1, 02.12.1999 | |||
| DEMUTH, H.-U., et al: "Desing of as aminodicarboxylic acid pyrrolidides as potent inhibitors of proline-specific peptidase", FEBS LETTERS, 1993, v.320, №1, р.23-27. |
Авторы
Даты
2006-09-10—Публикация
2001-04-26—Подача