Область изобретения
Изобретение касается новых изоксазолинов и изоксазолов, которые пригодны в качестве антагонистов гликопротеинового рецепторного комплекса IIb/IIIa фибриногена у тромбоцитов, фармацевтических композиций, содержащих такие соединения, процесса получения таких соединений и методов применения этих соединений, по отдельности или в сочетании с другими лекарственными препаратами, для подавления агрегации тромбоцитов, как тромболитики, и/или для лечения тромбоэмболических осложнений.
Предпосылки изобретения
Гемостаз - это нормальный физиологический процесс, при котором происходит остановка кровотечения из поврежденного кровеносного сосуда. Это динамичный и сложный процесс. В течение секунд с момента повреждения сосуда покоящиеся тромбоциты становятся активными и связываются с поверхностью поврежденного сосуда путем феномена, называемого прилипанием (адгезией) тромбоцитов. Активированные тромбоциты также связываются друг с другом в процессе, называемом агрегацией тромбоцитов, с образованием тромбоцитарной пробки. Тромбоцитарная пробка может быстро остановить кровотечение, но она должна быть усилена фибрином для того, чтобы обеспечивать остановку кровотечения до полного заживления сосуда.
Тромбоз может рассматриваться как патологическое состояние, при котором нарушение механизмов гемостаза приводит к образованию тромбов внутри сосуда. Активация тромбоцитов, последующая их агрегация и выделение тромбоцитарных факторов связаны с различными патофизиологическими состояниями, в том числе сердечно-сосудистыми и связанными с сосудами мозга тромбоэмболическими осложнениями, например тромбоэлическим осложнением, связанным с неустойчивой стенокардией, инфарктом миокарда, проходящим сердечным приступом, ударом, атеросклерозом и диабетом. Вклад тромбоцитов в эти патологические процессы проистекает из их способности образовывать агрегаты, или тромбоцитарные тромбы, особенно на стенке артерии в результате повреждения.
Тромбоциты активируются рядом агонистов, вызывающих изменение формы тромбоцита, секреции гранулированного содержимого и агрегации. Агрегация тромбоцитов служит очагом последующего образования сгустка за счет концентрации активированных факторов свертывания крови в месте повреждения. Идентифицированы некоторые эндогенные агонисты, в том числе аденозиндифосфат (АДФ), серотонин, арахидоновая кислота, тромбин и коллаген. Из-за участия нескольких эндогенных агонистов в активации тромбоцитов и их агрегации, ингибитор, который действовал против всех агонистов, представлял бы более эффективный антитромбоцитарный агент, чем имеющиеся в распоряжении в настоящее время лекарства, являющиеся агонист-специфичными.
Современные антитромбоцитарные лекарства эффективны только против одного типа агониста: к ним относятся аспирин, который действует против арахидоновой кислоты, тиклопидин, который действует против АДФ, ингибиторы тромбоксан A2 синтетазы или антагонисты рецепторы, которые действуют против тромбоксана A2, и хирудин, который действует против тромбина.
Недавно идентифицирован общий путь всех известных агонистов, а именно тромбоцитарный комплекс гликопротеин IIb/IIIa, являющийся мембранным белком, опосредующим агрегацию тромбоцитов. Последний обзор о ГПIIb/IIIa сделан Phillips et al. , Cell (1991) 65^ 359-362. Обнаружение антагонистов ГПIIb/IIIa представляет собой новый многообещающий подход антитромбоцитарной терапии.
У нестимулированных тромбоцитов ГПIIb/IIIa не связывается с растворимыми белками, но известно, что у активированных тромбоцитов ГПIIb/IIIa связывается с четырьмя растворимыми белками адгезии, а именно фибриногеном, фактором фон Виллебранда, фибронектином и витронектином. Связывание фибриногена и фактора фон Виллебранда с ГПIIb/IIIa вызывает агрегацию тромбоцитов. Связывание фибриногена опосредовано частично последовательностью узнавания Arg-Gly-Asp (РГД), которая является общей для белков адгезии, которые связываются с ГПIIb/IIIa.
Кроме ГПIIb/IIIa идентифицируют все большее количество других рецепторов клеточной поверхности, связывающихся с лигандами внеклеточного матрикса или лигандами адгезии других клеток, опосредуя таким образом процессы адгезии клетка-клетка и клетка-матрикс. Эти рецепторы принадлежат к подсемейству генов, называемых интегринами, и состоят из гетеродимерных трансмембранных гликопротеинов, содержащих альфа- и бета-субъединицы. Подсемейства интегринов содержат общую бета-субъединицу в сочетании с разными альфа-субъединицами, образуя рецепторы адгезии с уникальной специфичностью. К настоящему моменту клонированы гены восьми разных бета-субъединиц и определена их последовательность.
Два члена подсемейства β1,α4/β1 и α5/β1 вовлечены в различные воспалительные процессы. Антитела к α4 предотвращают прилипание лимфоцитов к синовиальным эндотелиальным клеткам in vitro, процесс, который может иметь большое значение при ревматоидных артритах (VanDinther-Janssen et al., J. Immunol., 1991, 147: 4207). Другие исследования с моноклональными антителами к α4β предоставляют доказательство того, что α4/β1 могут также играть роль при аллергии, астме и аутоиммунных заболеваниях (Walsh et al., J. Immunol., 1991. 146:3419; Bocher et al., J. Exp. Med., 1991, 173:1553; Yednock et al., Nature 1992, 356: 63). Антитела к α4 также блокируют миграцию лейкоцитов к месту воспаления (Issedutz et al., J. Immunol., 1991, 147:4178).
Гетеродимер αv/β3, обычно обозначаемый как рецептор витронектина, - еще один член подсемейства β3 интегринов, охарактеризован у тромбоцитов, эндотелиальных клеток, меланомы, клеток гладких мышц и на поверхности остеобластов (Horton and Davies, J. Bone Min. Res. 1989, 4:803-808; Davies et al., J. Cell. Biol. 1989, 109: 1817-1826: Horton, Int. J. Exp. Pathol., 1990, 71: 741-759). Подобно ГПIIb/IIIa рецептор витронектина связывается с рядом РГД-содержащих белков адгезии, таких как витронектин, фибронектин, ФВФ, фибриноген, остеопонтин, костный сиалобелок II и тромбоспонден, при участии РГД последовательности. Высказано предположение о возможных ролях αv/β3 в ангиогенезе, развитии опухоли и реваскуляризации (Brooks et al., Science, 1994, 264: 569-571). Прилипание остеокластов к матриксу кости является ключевым событием резорбции кости. Исследования с использованием моноклональных антител показали участие в этом процессе αv/β3 рецептора и предположили, что избирательный αv/β3 антагонист был бы полезен для блокирования процесса резорбции кости (Horton et al., J. Bone Miner. Res., 1993, 8:239-247; Helfrich et al., J. Bone Miner. Res., 1992, 7:335-343).
Было сообщение о некоторых РГД-пептидомиметических соединениях, которые блокируют связывание фибриногена и предотвращают образование тромбов.
Европейский Патент N 478363 касается соединений общей формулы
Европейский патент N 478328 касается соединений общей формулы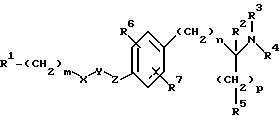
Европейский патент N 525626 (соответствует патенту Канады N 2074685) открывает соединения общей формулы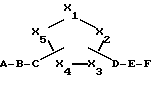
PCT патент 9307867 касается соединений общей формулы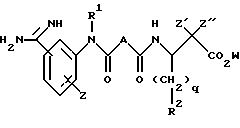
Европейский патент N 4512831 касается соединений общей формулы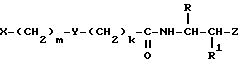
Ни одна из вышеуказанных ссылок не дает или не имеет в виду соединения настоящего изобретения, которые подробно описаны ниже.
Краткое описание изобретения
Настоящее изобретение обеспечивает новые соединения непептидной природы, которые связываются с интегринами, тем самым изменяя процессы адгезии клетка-клетка и клетка-матрикс. Соединения настоящего изобретения пригодны для лечения воспалительных процессов, резорбции костей, опухолей, метастазов, тромбозов, состояний, связанных с агрегацией клеток, у млекопитающих.
Один аспект этого изобретения обеспечивает новые соединения формулы I (описано ниже), которые пригодны в качестве антагонистов рецепторного гликопротеинового комплекса IIb/IIIa тромбоцитов. Соединения настоящего изобретения подавляют связывание фибриногена с тромбоцитарным гликопротеиновым комплексом IIb/IIIa и подавляют агрегацию тромбоцитов. Настоящее изобретение также включает фармацевтические композиции, содержащие такие соединения формулы I, и методы применения таких соединений в качестве тромболитиков для подавления агрегации тромбоцитов и/или для лечения тромбоэмболических осложнений.
Настоящее изобретение также включает методы лечения сердечно-сосудистого заболевания, тромбоза или опасной агрегации тромбоцитов, повторной закупорки после тромбоза, реперфузии повреждения или повторного стеноза введением соединения формулы I в отдельности или в сочетании с одним или более дополнительными лекарственными препаратами, выбранными из: противосвертывающих средств, таких как гепарин и варфарин; противотромбоцитарных средств, таких как аспирин, пироксикамин или тиклопидин; ингибиторов тромбина, таких как производные бороаргинина, хирудин или аргатробан; или тромболитиков, таких как активатор тканевого плазминогена, анистреплаза, урокиназа или стрептокиназа, или их сочетания.
Настоящее изобретение также обеспечивает новые соединения, фармацевтические композиции и методы, которые могут применяться в лечении или предупреждении заболеваний, при которых имеют место процессы адгезии клеток, включающие, но не ограниченные, ревматоидный артрит, астму, аллергии, дыхательную недостаточность взрослых, реакцию "трансплантант против хозяина", трансплантацию органов, септический шок, псориаз, экзему, контактный дерматит, остеопороз, остеоартрит, атеросклероз, метастазы, заживление ран, диабетическую ретинопатию, воспалительное заболевание кишечника и другие аутоиммунные заболевания.
Также включенными в настоящее изобретение являются фармацевтические наборы, состоящие из одного или более упаковок, содержащих фармацевтические единицы, дозы, включающие соединения формулы I, для лечения расстройств, связанных с агрегацией клеток, включая, но не ограничиваясь, тромбоэмболические осложнения.
Подробное описание изобретения
Настоящее изобретение обеспечивает новые соединения непептидной природы, которые связываются с интегринами, тем самым изменяя процессы адгезии клетка-клетка и клетка-матрикс. Соединения настоящего изобретения пригодны для лечения воспалительных процессов, резорбции костей, опухолей, метастазов, тромбозов, состояний, связанных с агрегацией клеток, у млекопитающих.
Один аспект этого изобретения обеспечивает новые соединения формулы I (описано ниже), которые пригодны в качестве антагонистов рецепторного гликопротеинового комплекса IIb/IIIa тромбоцитов. Соединения настоящего изобретения подавляют связывание фибриногена с тромбоцитарным гликопротеиновым комплексом IIb/IIIa и подавляют агрегацию тромбоцитов. Настоящее изобретение также включает фармацевтические композиции, содержащие такие соединения формулы I, и методы применения таких соединений в качестве тромболитиков для подавления агрегации тромбоцитов и/или - для лечения тромбоэмболических осложнений.
Это изобретение касается новых соединений формулы I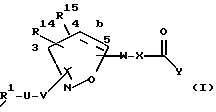
или фармацевтически приемлемых солей или пролекарств из них.
[1] Первое воплощение этого изобретения обеспечивает соединения формулы I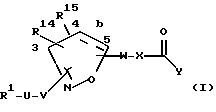
или фармацевтически приемлемые соли и пролекарства из них,
где b - это одинарная или двойная связь;
R1 выбирается из R2(R3)N(CH2)qZ-, R2(R3)N(R2N=)CN(R2)(CH2)qZ-,
пиперазинил-(CH2)qZ- или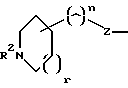
Z выбирается из O, S, S(=O) или S(=O)2;
R2 и R3 независимо выбирается из: H, C1-C10-алкил, C2-C6-алкенил, C3-C11-циклоалкил, C4-C11-циклоалкилалкил, C6-C10-арил, C7-C11-арилалкил,
C2-C7-алкилкарбонил, C6-C10-арилкарбонил, C2-C10-алкоксикарбонил, C4-C11-циклоалкоксикарбонил, C7-C11-бициклоалкоксикарбонил, C6-C10-арилоксикарбонил, арил(C1-C10-алкокси)карбонил, C1-C6-алкилкарбонилокси(C1-C4-алкокси)карбонил, C6-C10-арилкарбонил(C1-C4-алкокси)карбонил, C4-C11-циклоалкилкарбонилокси(C1-C4- алкокси)карбонил;
U выбирается из: одинарной связи (т. е. U не присутствует), -(C1-C7-алкил)-, -(C2-C7-алкенил)-, -(C2-C7-алкинил)-, -(арил)-замещенный 0-3 R6a или -(пиридил)-замещенный 0-3 R6a;
V выбирается из: одинарной связи (т. е. V не присутствует); -(C1-C7-алкил)-, замещенный 0-3 группами, независимо выбранными из R6 или R7; -(C2-C7-алкенил)-, замещенный 0-3 группами, независимо выбранными из R6 или R7; -(C2-C7-алкинил)-, замещенный 0-2 группами, независимо выбранными из R6 или R7; -(арил)-, замещенный 0-2 группами, независимо выбранными из R6 или R7; -(пиридил)-, замещенный 0-2 группами, независимо выбранными из R6 или R7; или -(пиридазинил)-, замещенный 0-2 группами, независимо выбранными из R6 или R7;
W выбирается из: одинарной связи (т. е. W не присутствует), -(C1-C7-алкил)-, -(C2-C7-алкенил)-, -(C2-C7-алкинил)-, или -(C(R5)2)nC(=O)N(R5a)-;
X выбирается из: одинарной связи (т. е. X не присутствует), -(C1-C7-алкил)-, замещенный 0-3 группами, независимо выбранными из R4, R8 или R14; -(C2-C7-алкенил)-, замещенный 0-3 группами, независимо выбранными из R4, R8 или R14; -(C2-C7-алкинил)-, замещенный 0-3 группами, независимо выбранными из R4, R8 или R14; или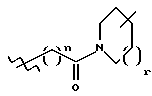
Y выбирается из гидрокси, C1-C10-алкокси, C3-C11-циклоалкокси, C6-C10-арилокси, C7-C11-аралкилокси, C3-C10-алкилкарбонилоксиалкилокси, C3-C10-алкоксикарбонилоксиалкилокси, C2-C10-алкоксикарбонилалкилокси, C5-C10-циклоалкилкарбонилоксиалкилокси, C5-C10-циклоалкоксикарбонилоксиалкилокси, C5-C10-циклоалкоксикарбонилалкилокси, C7-C11-арилоксикарбонилалкилокси, C8-C12-арилоксикарбонилоксиалкилокси, C8-C12-арилкарбонилоксиалкилокси, C5-C10-алкоксиалкилкарбонилоксиалкилокси, C5-C10(5-алкил-1,3-диокса-циклопентен-2-он-ил)метилокси, C10-C14(5-арил-1,3-диокса-циклопентен-2-он-ил)метилокси; или (R2)(R3)N-(C1-C10-алкокси)-:
R4 и Rb независимо выбирается из H, C1-C10-алкила, гидрокси, C1-C10-алкокси, нитро, C1-C10-алкилкарбонила или -N(R12)R13;
R5 выбирается из H, C1-C8-алкила, C2-C6-алкенила, C3-C11-циклоалкила, C4-C11-циклоалкилметила, C6-C10-арила, C7-C11-арилалкила или C1-C10-алкила, замещенного 0-2 R4b;
R5a выбирается из водорода, гидрокси, C1-C8-алкила, C2 до C6 алкенила, C3-C11-циклоалкила, C4-C11-циклоалкилметила, C1-C6-алкокси, бензилокси, от C6 до C10 арила, гетероарила, гетероарилалкила, от C7 до C11 арилалкила, адамантилметила или C1-C10-алкила, замещенный 0-2 R4b;
или же R5 и R5a могут соединяться вместе, являясь 3-азабициклононилом, 1-пиперидинилом, 1-морфолинилом или 1-пиперазинилом, каждый факультативно замещенный C1-C6-алкилом, C6-C10-арилом, гетероарилом, C7-C11-арилалкилом, C1-C6-алкилкарбонилом, C3-C7-циклоалкилкарбонилом, C1-C6-алкоксикарбонилом,
C7-C11-арилалкоксикарбонилом, C1-C6-алкилсульфонилом или C6-C10-арилсульфонилом;
R5b выбирается из C1-C8-алкила, C2-C6-алкенила, C3-C11-циклоалкила, C4-C11-циклоалкилметила, C6-C10-арила, C7-C11-арилалкила или C1-C10-алкила, замещенного 0-2 R4b;
R6 выбирается из H, C1-C10-алкила, гидрокси, C1-C10-алкокси, нитро, C1-C10-алкилкарбонила, -N(R12)R13, циано, гало, CF3, CHO, CO2R5, C(=O)R5a, CONR5R5a, OC(=O)R5a, OC(=O)OR5b, OR5a, OC(=O)NR5R5a, OCH2CO2R5, CO2CH2CO2R5, NO2, NR5aC(=O)R5a, NR5aC(=O)OR5b, NR5aC(=O)NR5R5a, NR5aSO2NR5R5a, NR5aSO2R5, S(O)pR5a, SO2NR5R5a, от C2 до C6 алкенила, от C3 до C11 циклоалкила, от C4 до C11 циклоалкилметила; от C6 до C10 арила, факультативно замещенного 1-3 группами, выбранными из галогена, C1-C6-алкокси, C1-C6-алкила, CF3, S(O)mMe или -NMe2; от C7 до C11 арилалкила, вышеуказанный арил факультативно замещен 1-3 группами, выбранными из галогена, C1-C6-алкокси, C1-C6-алкила, CF3, S(O)mMe или -NMe2; метилендиокси, когда R6 является заместителем на ариле; или 5-10-членного гетероциклического кольца, содержащего 1-3 гетероатома N, O или S, где указанное гетероциклическое кольцо может быть насыщенным, частично насыщенным или полностью ненасыщенным, указанное гетероциклическое кольцо замещено 0-2 R7;
R6a выбирается из C1-C4-алкила, C1-C4-алкокси, гало, CF3, NO2 или NR12R13;
R7 выбирается из H, C1-C10-алкила, гидрокси, C1-C10-алкокси, нитро, C1-C10-алкилкарбонила, -N(R12)R13, циано, гало, CF3, CHO, CO2R5, C(=O)R5a, CONR5R5a, OC(=O)R5a, OC(=O)OR5b, OR5a, OC(=O)NR5R5a, OCH2CO2R5, CO2CH2CO2R5, NO2, NR5aC(=O)R5a, NR5aC(=O)OR5b, NR5aC(=O)NR5R5a, NR5aSO2NR5R5a, NR5aSO2R5,
S(O)pR5a, SO2NR5R5a, от C2 до C6 алкенила, от C3 до C11 циклоалкила, от C4 до C11 циклоалкилметила, от C6 до C10 арила или от C7 до C11 арилалкила;
R8 выбирается из: H; R6; C1-C10-алкила, замещенного 0-3 R6; C2-C10-алкенила, замещенного 0-3 R6; C2-C10-алкинила, замещенного 0-3 R6; C3-C8-циклоалкила, замещенного 0-3 R6; C5-C6-циклоалкенила, замещенного 0-2 R6; арила, замещенного 0-2 R6; 5-10-членного гетероциклического кольца, содержащего 1-3 гетероатома N, O или S, где указанное гетероциклическое кольцо может быть насыщенным, частично насыщенным или полностью ненасыщенным, указанное гетероциклическое кольцо замещено 0-2 R6;
R12 и R13 независимо являются H, C1-C10-алкилом, C1-C10-алкоксикарбонилом, C1-C10-алкилкарбонилом, C1-C10-алкилсульфонилом,
арил(C1-C10-алкил)сульфонилом, арилсульфонилом, арилом, C2-C6-алкенилом, C3-C11-циклоалкилом, C4-C11-циклоалкилалкилом, C7-C11-арилалкилом, C2-C7-алкилкарбонилом, C7-C11-арилкарбонилом, C2-C10-алкоксикарбонилом, C4-C11-циклоалкоксикарбонилом, C7-C11-бициклоалкоксикарбонилом, C7-C11-арилкарбонилом, гетероарилкарбонилом, гетероарилалкилкарбонилом или арил(C1-C10-алкокси) карбонил;
R14 выбирается из H, C1-C10-алкила, C2-C10-алкенила, C2-C10-алкинила, C1-C10-алкокси, арила, гетероарила или C1-C10-алкоксикарбонила, CO2R5 или -C(=O)N(R5)R5a;
R15 выбирается из: H; R6; C1-C10-алкила, замещенного 0-8 R6; C2-C10-алкенила, замещенного 0-6 R6; C1-C10-алкокси, замещенного 0-6 R6; арила, замещенного 0-5 R6; 5-6-членного гетероциклического кольца, содержащего 1-2 гетероатома N, O или S, где указанное гетероциклическое кольцо может быть насыщенным, частично насыщенным или полностью ненасыщенным, указанное гетероциклическое кольцо замещено 0-5 R6; C1-C10-алкоксикарбонила, замещенного 0-8 R6; CO2R5 или -C(=O)N(R5)R5a;
n = 0-4;
q = 2-7;
r = 0-3;
при условии, что, когда b является двойной связью, присутствует только один из R14 или R15;
при условии, что n, q и r выбираются таким образом, что число атомов в цепи между R1 и
Y находится в интервале 8-18.
[2] Предпочтительными соединениями этого первого воплощения являются те соединения формулы II (где W являются одинарной связью (т.е. отсутствует) и U является одинарной связью (т.е. отсутствует))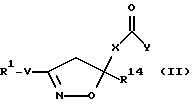
где R1 выбирается из R2HN(CH2)qO-, R2HN(R2N=)CNH(CH2)qO-, пиперазинил-(CH2)qO- или
и/или
R2 выбирается из H, арил(C1-C10-алкокси)карбонила, C1-C10-алкоксикарбонила; и/или
R8 выбирается из H, C1-C10-алкила, C2-C10-алкенил, C5-C6-циклоалкенила, C3-C8-циклоалкила, арила, 5-6-членного гетероциклического кольца, содержащего 1-2 гетероатома N, O или S, где указанное гетероциклическое кольцо может быть насыщенным, частично насыщенным или полностью ненасыщенным; и/или
R6 и R7 выбираются из H, C1-C10-алкила, гидрокси, C1-C10-алкокси, нитро, C1-C10-алкилкарбонила, -N(R12)R13, циано или гало.
[3] Более предпочтительными соединениями этого первого воплощения являются те соединения формулы II (где W является связью/отсутствует и U является связью/отсутствует)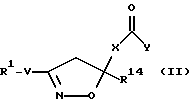
где X выбирается из: одинарной связи (т.е. X не присутствует); -(C1-C7 алкила)-, замещенного 0-2 группами, независимо выбранными из R4, R8 или R14; -(C2-C7-алкенила)-, замещенного 0-2 группами, независимо выбранными из R4, R8 или R14; -(C2-C7-алкинила)-, замещенного 0-2 группами, независимо выбранными из R4, R8 или R14; и/или
R8 выбирается из H, C1-C6-алкила, C2-C6-алкенил, C3-C8-циклоалкила, C3-C6-циклоалкенила, арила, 5-6-членного гетероциклического кольца, содержащего 1-2 гетероатома N, O или S, где указанное гетероциклическое кольцо может быть насыщенным, частично насыщенным или полностью ненасыщенным; и/или
[4] наиболее предпочтительными соединениями этого первого воплощения являются соединения формулы I, где R1 является
V является фениленом или пиридиленом;
n = 1 или 2;
X является -C1-C2-алкилом-, замещенным 0-2 R4;
Y выбирается из: гидрокси; от C1 до C10 алкокси; метилкарбонилоксиметокси-; этилкарбонилоксиметокси-; t-бутилкарбонилоксиметокси-; циклогексилкарбонилоксиметокси-; 1-(метилкарбонилокси)этокси-; 1-(этилкарбонилокси)этокси-; 1-(t-бутилкар6онилокси)этокси-; 1-(циклогексилкарбонилокси)этокси-; i-пропилоксикарбонилоксиметокси-; t-бутилоксикарбонилоксиметокси-; 1-(i-пропилоксикарбонилокси)этокси-; 1-(циклогексилоксикарбонилокси)этокси-; 1-(t-бутилоксикарбонилокси)этокси-; диметиламиноэтокси-; диэтиламиноэтокси-; (5-метил-1,3-диоксациклопентен-2-он-4-ил)метокси-; (5-(t-бутил)-1,3-диоксациклопентен-2-он-4-ил)метокси-; (1,3-диокса-5-фенил-циклопентен-2-он-4-ил)метокси-; 1-(2-(2-метоксипропил)карбонилокси)этокси-;
R4 является -NR12R13;
R12 является H, C1-C4-алкоксикарбонилом, C1-C4-алкилкарбонилом, C1-C4-алкилсульфонилом, арилалкилсульфанилом, арилсульфонилом, бензилом, бензоилом, феноксикарбонилом, бензилоксикарбонилом, арилалкилсульфанилом, пиридилкарбонилом или пиридилметилкарбонилом;
R13 является H.
[5] Особенно предпочтительными соединениями этого первого воплощения являются соединения или фармацевтически приемлемая соль или пролекарства из них, выбранные из:
5(R, S)-3-[[4-(2-пиперидин-4-ил)этоксифенил] изоксазолин-5-ил] уксусная кислота;
5(R, S)-N-(бутансульфонил)-L-{ 3-[4-(2-пиперидин-4- ил)этоксифенил]изоксазолин-5-ил}глицин;
5(R, S)-N-(a-толуолсульфонил)-L-{ 3-[4-(2-пиперидин-4- ил)этоксифенил] изоксазолин-5-ил}глицин;
5(R, S)-N-[(бензилокси)карбонил]-L-{3-[4-(2-пиперидин-4- ил)этоксифенил] изоксазолин-5-ил}глицин;
5(R, S)-N-(пентаноил)-L-{ 3-[4-(2-пиперидин-4-ил)этоксифенил] изоксазолин-5-ил}глицин;
5(R,S)-3-[4-(пиперидин-4-ил)метоксифенил]изоксазолин-5-ил}пропановая кислота;
2(R,S)-5(R,S)-N-(бутансульфонил)амино-{3-[4-(пиперидин-4- ил)метоксифенил]изоксазолин-5-ил}пропановая кислота;
2(R,S)-5(R,S)-N-(a-толуолсульфонил)амино-{3-[4-(пиперидин-4- ил)метоксифенил]изоксазолин-5-ил}пропановая кислота;
2(R, S)-5(R, S)-N-[(бензилокси)карбонил] амино-{ 3-[4-(пиперидин-4- ил)метоксифенил]изоксазолин-5-ил}пропановая кислота;
2(R, S)-5(R, S)-N-(пентаноил)амино-{ 3-[4-(пиперидин-4- ил)метоксифенил] изоксазолин-5-ил}пропановая кислота.
[6] Второе воплощение этого изобретения обеспечивает соединения формулы I: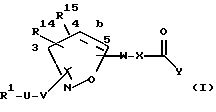
или фармацевтически приемлемую соль или пролекарства из него,
где b - одинарная или двойная связь;
R1 выбирается из R2aR3N-, R2(R3)N(R2N=)C-, R2a(R3)N(CH2)qZ-, R2(R3)N(R2N=)C(CH2)qZ-, R2(R3)N(R2N=)CN(R2)-,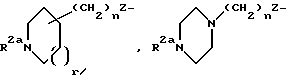
или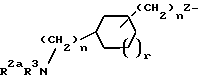
Z выбирается из связи (т.е. отсутствует), O, S, S(=O) или S(=O)2;
R2 и R3 независимо выбирается из: H, C1-C10-алкил, C3-C6-алкенил, C3-C11-циклоалкил, C4-C11-циклоалкилалкил, C6-C10-арил, C7-C11-арилалкил,
C2-C7-алкилкарбонил, C7-C11-арилкарбонил, C2-C10-алкоксикарбонил, C4-C11-циклоалкоксикарбонил, C7-C11-бициклоалкоксикарбонил, C7-C11-арилоксикарбонил, арил(C1-C10-алкокси) карбонил, C1-C6-арилкарбонилокси (C1-C4-алкокси)карбонил, C4-C11-циклоалкилкарбонилокси (C1-C4-алкокси)карбонил;
R2a выбирается из R2 или R2(R3)N(R2N)=C-;
U выбирается из: одинарной связи (т. е. U не присутствует), -(C1-C7-алкил)-, -(C2-C7-алкенил)-, -(C2-C7-алкинил)-, -(арил)-, замещенный 0-3 R6a или -(пиридил)-, замещенный 0-3 R6a;
V выбирается из: одинарной связи (т. е. V не присутствует); -(C1-C7-алкил)-, замещенный 0-3 группами, независимо выбранными из R6 или R7; -(C2-C7-алкенил)-, замещенный 0-3 группами, независимо выбранными из R6 или R7; -(C2-C7-алкинил)-, замещенный 0-3 группами, независимо выбранными из R6 или R7; -(фенил)-Q-, указанный фенил, замещенный 0-2 группами, независимо выбранными из R6 или R7; -(пиридил)-Q-, указанный пиридил, замещенный 0-2 группами, независимо выбранными из R6 или R7: или -(пиридазинил)-Q-, указанный пиридазинил, замещенный 0-2 группами, независимо выбранными из R6 или R7;
Q выбирается из: одинарной связи (т.е. Q не присутствует); -O-, -S(O)m-, -N(R12)-, -(CH2)m-, -C(= O), -N(R5a)C(=O)-, -C(=O)N(R5a)-, -CH2O-, -OCH2-, -CH2N(R12)-, -N(R12)CH2-, -CH2C(=O)-, -C(=O)CH2-, -CH2S(O)m- или -S(O)mCH2-, при условии, что, когда b является одинарной связью и R1-U-V- являются заместителем на C5 центрального 5-членного кольца формулы I, Q не является -O-, -S(O)m-, -N(R12)-, -C(=O)N(R5a)-, -CH2O-, -CH2N(R12)- или - CH2S(O)m-.
W выбирается из: -(C(R4)2)nC(=O)N(R5a)- или -C(=O)-N(R5a)-(C(R4)2)n-;
X выбирается из: одинарной связи (т.е. X не присутствует), -(C(R4)2)n-C(R4)(R8)- C(R4)(R4a), при условии, что, когда n равняется 0 или 1, по меньшей мере один из R4a или R8 не является H или метилом;
Y выбирается из гидрокси, C1-C10-алкилокси, C3-C11-циклоалкилокси, C6-C10-арилокси, C7-C11-аралкилокси, C3-C10-алкилкарбонилоксиалкилокси, C3-C10-алкоксикарбонилоксиалкилокси, C2-C10-алкоксикарбонилоксиалкилокси, C5-C10-циклоалкилкарбонилоксиалкилокси, C5-C10-циклоалкоксикарбонилоксиалкилокси, C5-C10-циклоалкоксикарбонилалкилокси, C7-C11- арилоксикарбонилалкилокси, C8-C12- арилоксикарбонилоксиалкилокси, C8-C12- арилкарбонилоксиалкилокси, C5-C10- алкоксиалкилкарбонилоксиалкилокси, C5-C10(5-алкил-1,3-диокса-циклопентен-2-он-ил)метилокси, C10-C14(5-арил-1,3-диокса-циклопентен-2-он-ил)метилокси; или (R2)(R3)N-(C1-C10-алкокси)-;
R4 выбирается из H, C1-C10-алкил, C1-C10-алкилкарбонил, арил, арилалкил, циклоалкил или циклоалкилалкил; или же, две R4 группы на соседних атомах углерода могут соединяться с образованием связи (т.е. двойной или тройной связи углерод-углерод);
R4a выбирается из H, гидрокси, нитро, C1-C10-алкокси, -N(R5)R5a; -N(R12)R13; -N(R16)R17; C1-C10-алкил, замещенный 0-3 R6; арил, замещенный 0-3 R6 гетероарил, замещенный 0-3 R6 или C1-C10- алкилкарбонил;
R4b выбирается из H, C1-C6-алкил, C2-C6-алкенил, C2-C6-алкинил, C3-C7-циклоалкил, C7-C14-бициклоалкил, гидрокси, C1-C6-алкокси, C1-C6-алкилтио, C1-C6-алкилсульфинил, C1-C6-алкилсульфонил, нитро, C1-C6-алкилкарбонил, C6-C10-арил, -N(R12)R13, гало, CF3, CN, C1-C6-алкоксикарбонил, карбокси, пиперидинил, морфолинил или пиридинил;
R5 выбирается из H, C1-C8-алкил, C3-C6-алкенил, C3-C11-циклоалкил, C4-C11-циклоалкилметил, C6-C10-арил, C7-C11-арилалкил или C1-C10-алкил, замещенный 0-2 R4b;
R5a выбирается из водорода, гидрокси, C1-C8-алкил, C3 до C6 алкенил, C3-C11-циклоалкила, C4-C11-циклоалкилметил, C1-C6-алкокси, бензилокси, C6-C10-арила, гетероарила, гетероарилалкила, C7-C11-арилалкила адамантилметила или C1-C10-алкила, замещенного 0-2 R4b;
или же R5 и R5a, оба являясь заместителями на одном и том же атоме азота (как в -NR5R5a), могут объединяться с атомом азота, к которому они прикреплены, с образованием 3-азабициклононила, 1,2,3,4-тетрагидро-1-хинолинила, 1,2,3,4-тетрагидро-2-изохинолинила, 1-пиперидинила, 1-морфолинила, 1-пирролидинила, тиаморфолинила, тиазолидинила или 1-пиперазинил, каждый факультативно замещенный C1-C6-алкилом, C6-C10-арилом, гетероарилом, C7-C11-арилалкилом, C1-C6-алкилкарбонилом, C3-C7- циклоалкилкарбонилом, C1-C6- алкоксикарбонилом, C7-C11- арилалкоксикарбонилом, C1-C6- алкилсульфонилом или C6-C10- арилсульфонилом;
R5b выбирается из C1-C8-алкила, C2-C6-алкенила, C3-C11-циклоалкила, C4-C11-циклоалкилметила, C6-C10-арила, C7-C11-арилалкила или C1-C10-алкила, замещенного 0-2 R4b;
R6 выбирается из H, C1-C10-алкила, гидрокси, C1-C10-алкокси, нитро, C1-C10-алкилкарбонила, -N(R12)R13, циано, гало, CF3, CHO, CO2R5, C(=O)R5a, CONR5R5a, OC(=O)R5a, OC(=O)OR5b, OR5a, OC(=O)NR5R5a, OCH2CO2R5, CO2CH2CO2R5, NO2, NR5aC(=O)R5a, NR5aC(=O)OR5b, NR5aC(=O)NR5R5a, NR5aSO2NR5R5a, NR5aSO2R5,
S(O)mR5a, SO2NR5R5a, от C2 до C6 алкенила, от C3 до C11 циклоалкила, от C4 до C11 циклоалкилметила; от C6 до C10 арил факультативно замещен 1-3 группами, выбранными из галогена, C1-C6-алкокси, C1-C6-алкила, CF3, S(O)mMe или -NMe2; от C7 до C11 арилалкил, вышеуказанный арил факультативно замещен 1-3 группами, выбранными из галогена, C1-C6-алкокси, C1-C6-алкил, CF3, S(O)mMe или -NMe2; метилендиокси, когда R6 является заместителем на ариле; или 5-10-членное гетероциклическое кольцо, содержащее 1-3 гетероатома N, O или S, где указанное гетероциклическое кольцо может быть насыщенным, частично насыщенным или полностью ненасыщенным, указанное гетероциклическое кольцо замещено 0-2 R7;
R6a выбирается из C1-C4-алкил, C1-C4-алкокси, гало, CF3, NO2 или NR12R13;
R7 выбирается из H, C1-C10-алкил, гидрокси, C1-C10-алкокси, нитро, C1-C10-алкилкарбонил, N(R12)R13, циано, гало, CF3, CHO, CO2R5, C(=O)R5a, CONR5R5a, OC(=O)R5a, OC(=O)OR5b, OR5a, OC(=O)NR5R5a, OCH2CO2R5, CO2CH2CO2R5, NO2, NR5aC(= O)R5a, NR5aC(= O)NR5R5a, NR5aSO2NR5R5a, NR5aSO2R5, S(O)mR5a, SO2NR5R5a, C2-C6-алкенил, C3-C11-циклоалкил, C4-C11-циклоалкилметил, C6-C10-арил или C7-C11-арилалкил;
R8 выбирается из: R6; C1-C10-алкила, замещенного 0-3 R6; C2-C10-алкенила, замещенного 0-3 R6; C2-C10-алкинила, замещенного 0-3 R6; C3-C8-циклоалкила, замещенного 0-3 R6; C5-C6-циклоалкенила, замещенного 0-3 R6; арила, замещенного 0-3 R6; 5-10-членного гетероциклического кольца, содержащего 1-3 гетероатома N, O или S, где указанное гетероциклическое кольцо может быть насыщенным, частично насыщенным или полностью ненасыщенным, указанное гетероциклическое кольцо замещено 0-2 R6;
R12 и R13 независимо являются H, C1-C10-алкилом, C1-C10- алкоксикарбонилом, C1-C10- алкилкарбонилом, C1-C10- алкилсульфонилом, арил(C1-C10- алкил)сульфонилом, арилсульфонилом, арил(C2-C10- алкенил)сульфонилом, гетероарилсульфонилом, арилом, C2-C6-алкенилом, C3-C11-циклоалкилом, C4-C11- циклоалкилалкилом, C7-C11-арилалкилом, C7-C11- арилкарбонилом, C4-C11- циклоалкоксикарбонилом, C7-C11- бициклоалкоксикарбонилом, C7-C11- арилоксикарбонилом, гетероарилкарбонилом, гетероарилалкилкарбонилом или арил(C1-C10- алкокси)карбонил, где указанные арилы выборочно замещены 0-3 заместителями, выбранными из группы, содержащей C1-C4-алкил, C1-C4-алкокси, гало, CF3 и NO2;
R14 выбирается из H, C1-C10-алкила, C2-C10-алкенила, C2-C10-алкинила, C1-C10-алкокси, арила, гетероарила или C1-C10- алкоксикарбонила, CO2R5 или -C(=O)N(R5)R5a;
R15 выбирается из: H; R6; -CO2R5; -C(=O)N(R5)R5a; C1-C10- алкоксикарбонила, замещенного 0-2 R6; C1-C10-алкила, замещенного 0-3 R6; C2-C10-алкенила, замещенного 0-3 R6; C1-C10-алкокси, замещенного 0-3 R6; арила, замещенного 0-3 R6; 5-10-членного гетероциклического кольца, содержащего 1-3 гетероатома N, O или S, где указанное гетероциклическое кольцо может быть насыщенным, частично насыщенным или полностью ненасыщенным, указанное гетероциклическое кольцо замещено 0-2 R6;
при условии, если b - двойная связь, присутствует только один из R14 или R15;
R16 выбирается из: -C(= O)-O-R18a; -C(=O)-R18b; -C(=O)N(R18b)2; -C(= O)NHSO2R18a; -C(=O)NHC(=O)R18b; -C(=O)NHC(=O)OR18a; -C(=O)NHSO2NHR18b; -C(= S)-NH-R18b; -NH-C(= O)-O-R18a; -NH-C(=O)-R18b; -NH-C(=O)-NH-R18b; -SO2-O-R18a; -SO2-R18a; -SO2-N(R18b)2; -SO2-NHC(= O)OR18b; -P(=S)(OR18a)2; -P(= O)(OR18a)2; -P(=S)(R18a)2; -P(=O)(R18a)2 или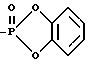
К17 выбирается из: H, C1-C10-алкила, C2-C6-алкенила, C3-C11-циклоалкила, C4-C15- циклоалкилалкила, арила, арил(C1-C10- алкила)-;
R18a выбирается из: C1-C8-алкила, замещенного 0-2 R19; C2-C8-алкенила, замещенного 0-2 R19; C2-C8-алкинила, замещенного 0-2 R19; C3-C8-циклоалкила, замещенного 0-2 R19; арила, замещенного 0-4 R19; арил(C1-C6- алкила), замещенного 0-4 R19; 5-6-членной гетероциклической системы, имеющей 1-3 гетероатома, выбранных независимо из O, S или N, указанного гетероциклического кольца, замещенного 0-4 R19; C1-C6-алкила, замещенного 5-10-членной гетероциклической системой, имеющей 1-3 гетероатома, выбранных независимо из O, S или N, указанного гетероциклического кольца, замещенного 0-4 R19;
R18b выбирается из R18a или H;
R19 выбирается из H, галогена, CF3, CN, NO2, NR12R13, C1-C8-алкила, C2-C6-алкенила, C2-C6-алкинила, C3-C11-циклоалкила, C4-C11- циклоалкилалкила, арила, арил(C1-C6- алкила)-, C1-C6-алкокси или C1-C4- алкоксикарбонила:
m = 0-2;
n = 0-4;
q = 1-7;
r = 0-3;
при условии, что n, q и r выбираются таким образом, что число атомов, связывающих R1 и
Y, находится в интервале 8-18.
[7] Предпочтительными соединениями этого второго воплощения являются те соединения формулы Ia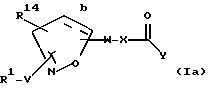
где Z выбирается из связи (т.е. отсутствует), O или S; и/или
R2 выбирается из H, арил(C1-C10- алкокси)карбонила, C1-C10- алкоксикарбонила; и/или
W - это -(CH2)nC(=O)N(R5a)-; и/или
X - это -(C(R4)2)n-C(R4)(R8)- CH(R4)-, при условии, что, когда n равняется 0 или 1, по меньшей мере один из R4a или R8 не является H или метилом; и/или
R5 выбирается из H или C1-C10-алкила, замещенного 0-6 R4b; и/или
R6 выбирается из H, C1-C10-алкила, гидрокси, C1-C10-алкокси, нитро, C1-C10-алкилкарбонила, -N(R12)R13, CO2R5, -NR5R5a, OR5, S(O)mR5a циано, гало; от C6 до C10 арила, факультативно замещенного 1-3 группами, выбранными из галогена, C1-C6-алкокси, C1-C6-алкила, CF3, S(O)mMe или -NMe2; от C7 до C11 арилалкила, вышеуказанного арила факультативно замещен 1-3 группами, выбранными из галогена, C1-C6-алкокси, C1-C6-алкил, CF3, S(O)mMe или -NMe2; метилендиокси, когда R6 является заместителем на ариле; или 5-10-членного гетероциклического кольца, содержащего 1-3 гетероатома N, O или S, где указанное гетероциклическое кольцо может быть насыщенным, частично насыщенным или полностью ненасыщенным, указанное гетероциклическое кольцо замещено 0-2 R7; и/или
R7 выбирается из H, C1-C10-алкила, гидрокси, C1-C10-алкокси, нитро, C1-C10- алкилкарбонила, N(R12)R13, циано или гало;
R8 выбирается из: -CONR5NR5a; -CO2R5; C1-C10-алкила, замещенного 0-3 R6; C2-C10-алкенила, замещенного 0-3 R6; C2-C10-алкинила, замещенного 0-3 R6; C3-C8-циклоалкила, замещенного 0-3 R6; C5-C6- циклоалкенила, замещенного 0-3 R6; арила, замещенного 0-3 R6; 5-10-членного гетероциклического кольца, содержащего 1-3 гетероатома N, O или S, где указанное гетероциклическое кольцо может быть насыщенным, частично насыщенным или полностью ненасыщенным, указанное гетероциклическое кольцо замещено 0-2 R6; и/или
R12 и R13 каждый независимо выбирается из H, C1-C10-алкила, C1-C10- алкоксикарбонила, C1-C10- алкилкарбонила, C1-C10- алкилсульфонила, арил(C1-C10- алкил)сульфонила, арилсульфонила, арила, гетероарилкарбонила или гетероарилалкилкарбонила, где указанные арилы выборочно замещены 0-3 заместителями, выбранными из группы, содержащей C1-C4-алкил, C1-C4-алкокси, гало, CF3 и NO2.
[8] Наиболее предпочтительными соединениями этого второго воплощения являются те соединения формулы Ia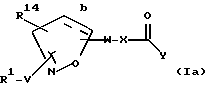
где Z выбирается из связи (т.е. отсутствует), O; и/или
W - это -(CH2)nC(=O)N(R12)-; и/или
X - это -C(R4)(R8)-C(R4)2-.
[9] Наиболее предпочтительными соединениями этого второго воплощения являются соединения формулы Ia, где R1 - это R2NHC(=NR2)- или R2NHC(=NR2)NH- и V - это фенилен или пиридилен, или R1
V является одинарной связью (т.е. V отсутствует);
n = 1 или 2;
X - это -CHR8CH2-;
Y выбирается из: гидрокси; C1-C10-алкокси; метилкарбонилоксиметокси-; этилкарбонилоксиметокси-; t-бутилкарбонилоксиметокси-; циклогексилкарбонилоксиметокси-; 1-(метилкарбонилокси)этокси-; 1-(этилкарбонилокси)этокси-; 1-(t-бутилкарбонилокси)этокси-; 1-(циклогексилкарбонилокси)этокси-; i-пропилоксикарбонилоксиметокси-; t-бутилоксикарбонилоксиметокси-; 1-(i- пропилоксикарбонилокси)этокси-; 1-(циклогексилоксикарбонилокси)этокси-; 1-(t- бутилоксикарбонилокси)этокси-; диметиламиноэтокси-; диэтиламиноэтокси-; (5-метил-1,3- диоксациклопентен-2-он-4-ил)метокси-; (5-(t-бутил)-1,3-диоксациклопентен -2-он-4-ил)метокси-; (1,3-диокса-5-фенил-циклопентен -2-он-4-ил)метокси-; 1-(2-(2-метоксипропил) карбонилокси)этокси-;
R6 выбирается из H, C1-C4-алкила, гидрокси, C1-C4-алкокси, нитро, C1-C10- алкилкарбонила, -N(R12)R13, CO2R5, -NR5R5a, OR5, S(O)mR5a, циано, гало; от C6 до C10 арила, факультативно замещенного 1-3 группами, выбранными из галогена, C1-C6-алкокси, C1-C6-алкила, CF3, S(O)mMe или -NMe2; метилендиокси, когда R6 является заместителем на ариле; или системы гетероциклических колец, выбранной из пиридинила, фуранила, тиазолила, тиенила, пирролила, пиразолила, триазолила, имидазолила, бензофуранила, индолила, индолинила, хинолинила, изохинолинила, бензимидазолила, пиперидинила, тетрагидрофуранила, пиранила, пиридинила, 3H-индолила, карбазолила, пирролидинила, пиперидинила, индолинила, изоксазолинила или морфолинила;
R8 выбирается из: -CONR5NR5a; -CO2R5; C1-C10-алкила, замещенного 0-3 R6; C2-C10-алкенила, замещенного 0-3 R6; C2-C10-алкинила, замещенного 0-3 R6; C3-C8-циклоалкила, замещенного 0-3 R6; арила, замещенного 0-2 R6; системы гетероциклических колец, выбранной из пиридинила, фуранила, тиазолила, тиенила, пирролила, пиразолила, триазолила, имидазолила, бензофуранила, индолила, индолинила, хинолинила, изохинолинила, изоксазолинила, бензимидазолила, пиперидинила, тетрагидрофуранила, пиранила, пиридинила, 3H-индолила, карбазолила, пирролидинила, пиперидинила, индолинила или морфолинила, указанного гетероциклического кольца, замещенного 0-2 R6;
R12 выбирается из H, C1-C6-алкила, C1-C4-алкоксикарбонила, C1-C6- алкилкарбонила, C1-C6- алкилсульфонила, арил(C1-C4- алкил)сульфонила, арилсульфонила, арила, пиридилкарбонила или пиридилметилкарбонила, где указанные арилы выборочно замещены 0-3 заместителями, выбранными из группы, содержащей C1-C4-алкил, C1-C4-алкокси, гало, CF3 и NO2; и
R13 - это H.
[10] Особенно предпочтительными соединениями этого второго воплощения являются соединения или фармацевтически приемлемые соли или пролекарства из них, выбранные из:
3(R,S)-{5(R,S)-N-[3-(4-амидинофенил)изоксазолин-5-илацетил]амино}- 3-фенилпропановая кислота;
3(R,S)-{5(R,S)-N-[3-(4-амидинофенил)изоксазолин-5-илацетил]амино}-3- пентановая кислота;
3(R)-{5(R,S)-N-[3-(4-амидинофенил)изоксазолин-5-илацетил]амино}-3- гептановая кислота;
3(R, S)-{ 5(R, S)-N-[3-(4-амидинофенил)изоксазолин-5-илацетил] амино}-4- (фенилтио)бутановая кислота;
3(R, S)-{ 5(R, S)-N-(3-(4-амидинофенил)изоксазолин-5-илацетил] амино}-4- (фенилсульфамидо)бутановая кислота;
3(R, S)-{ 5(R, S)-N-[3-(4-амидинофенил)изоксазолин-5-илацетил] амино}-4- (п-бутилсульфамидо)бутановая кислота;
3(S)-{ 5(R, S)-N-[3-(4-амидинофенил)изоксазолин-5-илацетил] амино} -3- (адамантилметиламинокарбонил)пропановая кислота;
3(S)-{5(R,S)-N-[3-(4-амидинофенил)изоксазолин-5-илацетил]амино}-3- (1-азабицикло[3.2.2]нонилкарбонил)пропановая кислота;
3(S)-{ 5(R, S)-N-[3-(4-амидинофенил)изоксазолин-5-илацетил] амино} -3- (фенетиламинокарбонил)пропановая кислота;
3(R)-{ 5(R,S)-N-[3-(4-амидинофенил)изоксазолин-5-илацетил]амино}-3- (3-пиридилэтил)пропановая кислота;
3(R)-{ 5(R,S)-N-[3-(4-амидинофенил)изоксазолин-5-илацетил]амино}-3- (2-пиридилэтил)пропановая кислота;
3(R)-{ 5(R, S)-N-[3-(4-амидинофенил)изоксазолин-5-илацетил] амино} -3- (фенилпропил)пропановая кислота.
[11] Также предпочтительными соединениями второго воплощения являются соединения формулы Iс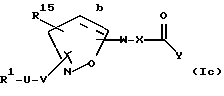
где b является одинарной или двойной связью;
R1 выбирается из R2a(R3)N-, R2(R3)N(R2N=)C-, R2a(R3)N(CH2)qZ-, R2(R3)N(R2N=)C(CH2)qZ-, R2(R3)N(R2N=)CN(R2)-,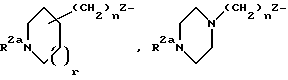
или
Z выбирается из связи (т.е. отсутствует), O или S;
R2 и R3 независимо выбираются из H, арил(C1-C10-алкокси) карбонила или C1-C10- алкоксикарбонила;
R2a - это R2 или R2(R3)N(R2N=)C;
U - это одинарная связь (т.е. U не присутствует);
V выбирается из: одинарной связи (т. е. V не присутствует); -(C1-C7-алкил)-, замещенного 0-3 группами, независимо выбранными из R6 или R7; -(C2-C7-алкенил)-, замещенного 0-3 группами, независимо выбранными из R6 или R7; -(C2-C7-алкил)-, замещенного 0-3 группами, независимо выбранными из R6 или R7; -(фенил)-Q-, указанный фенил, замещенный 0-2 группами, независимо выбранными из R6 или R7; -(пиридил)-Q-, указанный пиридил, замещенный 0-2 группами, независимо выбранными из R6 или R7, или -(пиридазинил)-Q-, указанный пиридазинил, замещенный 0-2 группами, независимо выбранными из R6 или R7;
Q выбирается из: одинарной связи (т.е. Q не присутствует); -O-, -S(O)m-, -N(R12)-, -(CH2)m-, -C(= O), -N(R5a)C(=O)-, -C(=O)N(R5a)-, -CH2O-, -OCH2-, -CH2N(R12)-, -N(R12)CH2-, -CH2C(=O)-, -C(=O)CH2-, -CH2S(O)m- или -S(O)mCH2-, при условии, что, когда b является одинарной связью и R1-U-V- - заместитель на C5 центрального 5-членного кольца формулы I, Q не является -O-, -S(O)m-, -N(R12)-, -C(=O)N(R5a)-, -CH2O-, CH2N(R12)- или -CH2S(O)m-;
W выбирается из: -(C(R4)2)-C(=O)-N(R5a)- или -C(=O)-N(R5a)-(C(R4)2)-;
X - это - C(R4)2-CHR4a-;
R4 выбирается из H, C1-C10-алкила, C1-C10-карбонила, арила, арилалкила, циклоалкила или циклоалкилалкила;
R4a выбирается из гидрокси, C1-C10-алкокси, нитро, -N(R5)R5a, -N(R12)R13 или -N(R16)R17, C1-C10-алкила, замещенного 0-3 R6, арила, замещенного 0-3 R6, гетероарила, замещенного 0-3 R6, или C1-C10- алкилкарбонила;
R4b выбирается из H, C1-C6-алкила, C2-C6-алкенила, C2-C6-алкинила, гидрокси, C1-C6-алкокси, C1-C6-алкилтио, C1-C6- алкилсульфинил, C1-C6- алкилсульфонил, нитро, C1-C6- алкилкарбонил, C6-C10-арил, -N(R17)R13, галоид, CF3, CN, C1-C6-алкоксикарбонил, карбокси, пиперидинил, морфолинил или пиридил;
R5 выбирается из H или C1-C10-алкила, замещенного 0-6 R4b;
R5a выбирается из водорода, гидрокси, C1-C8-алкила, C2-C6-алкенила, C3-C11- циклоалкила, C4-C11- циклоалкилметила, C1-C6-алкокси, бензилокси, C6-C10-арила, гетероарила, гетероарилалкила, C7-C11-арилалкила или адамантилметали, C1-C10-алкила, замещенного 0-2 R4b;
или же, R5 и R5a могут соединяться вместе, образуя 3-азабициклононил, 1,2,3,4-тетрагидро-1-хинолинил, 1,2,3,4-тетрагидро-2-изохинолинил, 1-пиперидинил, 1-морфолинил, 1-пирролидинил, тиаморфолинил, тиазолидинил или 1-пиперазинил, каждый выборочно замещенный C1-C6-алкилом, C6-C10-арилом, гетероарилом, C7-C11- арилалкилом, C1-C6- алкилкарбонилом, C3-C7- циклоалкилкарбонилом, C1-C6- алкоксикарбонилом или C7-C11- арилалкоксикарбонилом;
R5b выбирается из C1-C8-алкила, C2-C6-алкенила, C3-C11-циклоалкила, C4-C11- циклоалкилметил, C6-C10-арил, C7-C11-арилалкила или C1-C10-алкила, замещенного 0-2 R4b;
Y выбирается из гидрокси, C1-C10-алкокси, C3-C11- циклоалкилокси, C6-C10-арилокси, C7-C11- аралкилокси, C3-C10- алкилкарбонилоксиалкилокси, C3-C10- алкоксикарбонилоксиалкилокси, C2-C10- алкоксикарбонилалкилокси, C5-C10- циклоалкилкарбонилоксиалкилокси, C5-C10- циклоалкоксикарбонилоксиалкилокси, C5-C10- циклоалкоксикарбонилалкилокси, C7-C11-арилоксикарбонилалкилокси, C8-C12- арилоксикарбонилоксиалкилокси, C8-C12-арилкарбонилоксиалкилокси, C5-C10- алкоксиалкилкарбонилоксиалкилокси, C5-C10- (5-алкил-1,3-диокса-циклопентен-2-он-ил)метилокси или C10-C14- (5-арил-1,3-диокса-циклопентен-2-он-ил)метилокси;
R6 и R7 каждый независимо выбираются из H, C1-C10-алкила, гидрокси, C1-C10-алкокси, нитро, C1-C10- алкилкарбонила, N(R12)R13, циано или гало;
R12 и R13 каждый независимо выбираются из H, C1-C10-алкила, C1-C10- алкоксикарбонила, C1-C10- алкилкарбонила, C1-C10- алкилсульфонила, арил(C1-C10-алкил) сульфонила, арилсульфонила, гетероарилкарбонила, гетероарилалкилкарбонила или арила, где указанные арилы выборочно замещены 0-3 заместителями, выбранными из группы, состоящей из: C1-C4-алкила, C1-C4-алкокси, гало, CF3 и NO2;
R15 выбирается из H, C1-C10-алкила, C2-C10-алкенила, C2-C10-алкинила, C1-C10-алкокси, арила, гетероарила или C1-C10- алкоксикарбонила, CO2R5 или -C(=O)N(R5)R5a;
R16 выбирается из: -C(= O)-O-R18a; -C(= O)-R18b-; -C(=O)N(R18b)2; -SO2-R18a или SO2-N(R18b)2;
R17 выбирается из: H или C1-C4-алкила;
R18a выбирается из: C1-C8-алкила, замещенного 0-2 R19; C2-C8-алкенила, замещенного 0-2 R19; C2-C8-алкинила, замещенного 0-2 R19; C3-C8- циклоалкила, замещенного 0-2 R19; арила, замещенного 0-4 R19; арил(C1-C6- алкил)-, замещенного 0-4 R19; системы гетероциклических колец, выбранной из пиридинила, фуранила, тиазолила, тиенила, пирролила, пиразолила, триазолила, имидазолила, бензофуранила, индолила, индолинила, хинолинила, изохинолинила, изоксазолинила, бензимидазолила, пиперидинила, тетрагидрофуранила, пиранила, пиримидинила, 3H-индолила, карбазолила, пирролидинила, пиперидинила, индолинила или морфолинила, указанного гетероциклического кольца, замещенного 0-4 R19; C1-C6-алкила, замещенного системой гетероциклических колец, выбранной из пиридинила, фуранила, тиазолила, тиенила, пирролила, пиразолила, имидазолила, изоксазолинила, бензофуранила, индолила, индоленила, хинолинила, изохинолинила, бензимидазолила, пиперидинила, тетрагидрофуранила, пиранила, пиридинила, 3H-индолила, индолила, карбазола, пирролидинила, пиперидинила, индолинила или морфолинила, указанного гетероциклического кольца, замещенного 0-4 R19;
R18b выбирается из R18a или H;
R19 выбирается из H, галогена, CF3, CN, NO2, NR12R13, C1-C8-алкила, C2-C6-алкенила, C2-C6-алкинила, C1-C6-алкокси, C3-C11- циклоалкила, C4-C11- циклоалкилалкила, арила, гетероарила, арил(C1-C6-алкила)- или C1-C4- алкоксикарбонила;
n = 0-4;
q = 1-7;
r = 0-3;
при условии, что n, q, r выбираются таким образом, что число атомов между R1 и Y находится в интервале 8-17.
[12] Наиболее предпочтительными соединениями второго воплощения формулы Ic являются те соединения формулы Ib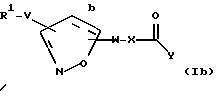
где R1 выбирается из R2(R3)N-, R2NH(R2N=)C-, R2NH(R2N=)CNH-, R2R3N(CH2)p'Z-, R2NH(R2N=)CNH(CH2)p''-Z- или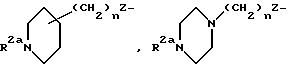
или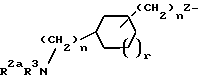
n = 0-1;
p' = 4-6;
p'' = 2-4;
Z выбирается из связи (т.е. отсутствует), O;
V - это одинарная связь (т. е. не присутствует), -(фенил)- или -(пиридил)-;
W выбирается из: -(C(R4)2)-C(=O)-N(R5a)- или -C(=O)-N(R5a)-(CH2)-;
X выбирается из: -CH2-CNH(R16)R17-, или -CH2-CHNR5R5a-;
Y выбирается из: гидрокси; C1-C10-алкокси; метилкарбонилоксиметокси-; этилкарбонилоксиметокси-; t-бутилкарбонилоксиметокси-; циклогексилкарбонилоксиметокси-; 1-(метилкарбонилокси)этокси-; 1-(этилкарбонилокси)этокси-; 1-(t-бутилкарбонилокси)этокси-; 1-(циклогексилкарбонилокси)этокси-; i-пропилоксикарбонилоксиметокси-; t-бутилоксикарбонилоксиметокси-; 1-(i-пропилоксикарбонилокси)этокси-; 1-(циклогексилоксикарбонилокси)этокси-; 1-(t-бутилоксикарбонилокси)этокси-; диметиламиноэтокси-; диэтиламиноэтокси-; (5-метил-1,3-диоксациклопентен-2-он-4-ил)метокси-; (5-(t-бутил)-1,3-диоксациклопентен-2-он-4-ил)метокси-; (1,3-диокса-5-фенил-циклопентен-2-он-4-ил)метокси-; 1-(2-(2-метоксипропил)карбонилокси)этокси-;
R16 выбирается из: -C(= O)-O-R18a; -C(= O)-R18b; -S(=O)2-R18a или -SO2-N(R18b)2;
R17 выбирается из H или C1-C5-алкила;
R18a выбирается из: C1-C8-алкила, замещенного 0-2 R19; C2-C8-алкенила, замещенного 0-2 R19; C2-C8-алкинила, замещенного 0-2 R19; C3-C8-циклоалкила, замещенного 0-2 R19; арила, замещенного 0-4 R19; арил(C1-C6-алкил)-, замещенного 0-4 R19; системы гетероциклических колец, выбранной из пиридинила, фуранила, тиазолила, тиенила, пирролила, пиразолила, триазолила, имидазолила, бензофуранила, индолила, индолинила, хинолинила, изохинолинила, изоксазолинила, бензимидазолила, пиперидинила, тетрагидрофуранила, пиранила, пиримидинила, 3H-индолила, карбазолила, пирролидинила, пиперидинила, индолинила или морфолинила, указанного гетероциклического кольца, замещенного 0-4 R19; C1-C6-алкила, замещенного системой гетероциклических колец, выбранной из пиридинила, фуранила, тиазолила, тиенила, пирролила, пиразолила, имидазолила, изоксазолинила, бензофуранила, индолила, индоленила, хинолинила, изохинолинила, бензимидазолила, пиперидинила, тетрагидрофуранила, пиранила, пиридинила, 3H-индолила, индолила, карбазола, пирролидинила, пиперидинила, индолинила или морфолинила, указанного гетероциклического кольца, замещенного 0-4 R19.
[13] Наиболее предпочтительными соединениями формулы Ib являются те соединениями, у которых: R1 - это R2NH(R2N=)C- или R2HN(R2N)CNH- и V - это фенилен или пиридилен или R1 - это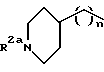
V является одинарной связью (т.е. V отсутствует);
n = 1 или 2;
R18a выбирается из: C1-C4-алкила, замещенного 0-2 R19; C2-C4-алкенила, замещенного 0-2 R19; C2-C4-алкинила, замещенного 0-2 R19; C3-C7-циклоалкила, замещенного 0-2 R19; арила, замещенного 0-4 R19; арил(C1-C6-алкил)-, замещенного 0-4 R19; системы гетероциклических колец, выбранной из пиридинила, фуранила, тиазолила, тиенила, пирролила, пиразолила, триазолила, имидазолила, бензофуранила, индолила, индолинила, хинолинила, изохинолинила, изоксазолинила, бензимидазолила, пиперидинила, тетрагидрофуранила, пиранила, пиримидинила, 3H-индолила, карбазолила, пирролидинила, пиперидинила, индолинила или морфолинила, указанного гетероциклического кольца, замещенного 0-4 R19; C1-C4-алкила, замещенного системой гетероциклических колец, выбранной из пиридинила, фуранила, тиазолила, тиенила, пирролила, пиразолила, имидазолила, изоксазолинила, бензофуранила, индолила, индоленила, хинолинила, изохинолинила, бензимидазолила, пиперидинила, тетрагидрофуранила, пиранила, пиридинила, 3H-индолила, индолила, карбазола, пирролидинила, пиперидинила, индолинила или морфолинила, указанного гетероциклического кольца, замещенного 0-4 R19.
[14] Особенно предпочтительными соединениями формулы Ib являются соединения или формы их фармацевтически приемлемых солей, выбранные из:
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5(R, S)-ил} - ацетил] -N2-(фенилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5(R, S)-ил} - ацетил]-N2-(4-метилфенилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5(R, S)-ил} - ацетил] -N2-(бутансульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5(R, S)-ил} - ацетил] -N2-(пропансульфонил)-2,3-(S)-диаминопропановая кислота:
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5(R, S)-ил} - ацетил] -N2-(этансульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5(R, S)-ил} - ацетил] -N2-(метилоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5(R, S)-ил} - ацетил] -N2-(этилоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5(R, S)-ил} - ацетил]-N2-(1-пропилоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5(R, S)-ил} - ацетил]-N2-(2-пропилоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5(R, S)-ил} - ацетил]-N2-(n-бутилоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5(R)-ил} - ацетил]-N2-(n-бутилоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5(S)-ил} - ацетил]-N2-(n-бутилоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5(R)-ил} - ацетил]-N2-(n-бутилоксикарбонил)-2,3-(R)-диаминопропановая кислота;
N3-[2-{ 3-(4-фоpмaмидинофенил)-изоксазолин-5(S)-ил} - ацетил]-N2-(n-бутилоксикарбонил)-2,3-(R)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5(R,S)-ил}- ацетил]-N2-(2-бутилоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5(R, S)-ил} - ацетил]-N2-(1-(2-метил)-пропилоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5(R, S)-ил} - ацетил]-N2-(2-(2-метил)-пропилоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5(R, S)-ил} - ацетил] -N2-(бензилоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5(R)-ил} - ацетил] -N2-(бензилоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изокcазолин-5(S)-ил} - ацетил] -N2-(бензилоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)-изоксазолин-5(R,S)-ил}- ацетил]-N2-(4-метилбензилоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)-изоксазолин-5(R,S)-ил}- ацетил]-N2-(4-метоксибензилоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)-изоксазолин-5(R,S)-ил}- ацетил]-N2-(4-хлорбензилоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)-изоксазолин-5(R,S)-ил}- ацетил]-N2-(4-бромбензилоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5(R, S)-ил} - ацетил] -N2-(фторбензилоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)-изоксазолин-5(R,S)-ил}- ацетил]-N2-(4-феноксибензилоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5(R, S)-ил} - ацетил]-N2-(2-(метилоксиэтил)-карбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)-изоксазолин-5(R,S)-ил}- ацетил]-N2-(2-пиридинилкарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)-изоксазолин-5(R,S)-ил}- ацетил]-N2-(3-пиридинилкарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)-изоксазолин-5(R,S)-ил}- ацетил]-N2-(4-пиридинил-карбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5(R, S)-ил} - ацетил]-N2-(2-(2-пиридинил)-ацетил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5(R, S)-ил} - ацетил]-N2-(2-(3-пиридинил)-ацетил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5(R, S)-ил} - ацетил]-N2-(2-(4-пиридинил)-ацетил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)-изоксазолин-5(R,S)-ил}- ацетил]-N2-(2-пиридил-метилоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)-изоксазолин-5(R,S)-ил}- ацетил]-N2-(3-пиридил-метилоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)-изоксазолин-5(R,S)-ил}- ацетил]-N2-(4-пиридил-метилоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)-изоксазолин-5(R,S)-ил}- ацетил]-N2-(4-бутилоксифенилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)-изоксазолин-5(R,S)-ил}- ацетил]-N2-(2-тиенилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5(R, S)-ил} - ацетил]-N2-(3-метилфенилсульфонил)-2,3-(R,S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5(R, S)-ил} - ацетил]-N2-(3-метилфенилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5(R, S)-ил} - ацетил]-N2-(3-метилфенилсульфонил)-2,3-(R)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5(R)-ил} - ацетил]-N2-(3-метилфенилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5(S)-ил} - ацетил]-N2-(3-метилфенилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5(S)-ил} - ацетил]-N2-(3-метилфенилсульфонил)-2,3-(R)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5(R)-ил} - ацетил]-N2-(3-метилфенилсульфонил)-2,3-(R)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5(R,S)-ил}- ацетил]-N2-(4-йодфенилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)-изоксазолин-5(R,S)-ил}- ацетил]-N2-(3-трифторметилфенилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)-изоксазолин-5(R,S)-ил}- ацетил]-N2-(3-хлорфенилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5(R,S)-ил}- ацетил]-N2-(3-2-метоксикарбонилфенилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5(R, S)-ил} - ацетил] -N2-(2,4,6-триметилфенилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)-изоксазолин-5(R,S)-ил}- ацетил]-N2-(2-хлорфенилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)-изоксазолин-5(R,S)-ил}- ацетил]-N2-(4-трифторметилфенилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)-изоксазолин-5(R,S)-ил}- ацетил]-N2-(2-трифторметилфенилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)-изоксазолин-5(R,S)-ил}- ацетил]-N2-(2-фторфенилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)-изоксазолин-5(R,S)-ил}- ацетил]-N2-(4-фторфенилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5(R,S)-ил}- ацетил]-N2-(4-метоксифенилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5(R, S)-ил} - ацетил] -N2-(2,3,5,6-тетраметилфенилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5(R, S)-ил} - ацетил]-N2-(4-цианофенилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)-изоксазолин-5(R,S)-ил}- ацетил]-N2-(4-хлорфенилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)-изоксазолин-5(R,S)-ил}- ацетил]-N2-(4-пропилфенилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5(R,S)-ил}- ацетил]-N2-(2-фенилэтилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)-изоксазолин-5(R,S)-ил}- ацетил]-N2-(4-изопропилфенилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5(R,S)-ил}- ацетил]-N2-(3-фенилпропилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5(R,S)-ил}- ацетил]-N2-(3-пиридилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5(R, S)-ил} - ацетил] -N2-(фениламиносульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5(R, S)-ил} - ацетил] -N2-(бензиламиносульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5(R, S)-ил} - ацетил] -N2-(диметиламиносульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(2-фтор-4-формамидинофенил)-изоксазолин-5(R, S)-ил}- ацетил]-N2-(3-метилфенилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(2-формамидино-5-пиридинил)-изоксазолин-5(R, S)-ил}- ацетил]-N2-(n-бутилоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(2-формамидино-5-пиридинил)-изоксазолин-5(R, S)-ил}- ацетил]-N2-(3-метилфенилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(3-формамидино-6-пиридинил)-изоксазолин-5(R, S)-ил}- ацетил]-N2-(n-бутилоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(3-формамидино-6-пиридинил)-изоксазолин-5(R, S)-ил}- ацетил]-N2-(3-метилфенилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5(R, S)-ил} - ацетил] -N2-(фениламинокарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5(R, S)-ил} - ацетил]-N2-(4-фторфениламинокарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5(R, S)-ил} - ацетил]-N2-(1-нафтиламинокарбонил))-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)изоксазолин-5(R, S)-ил} - ацетил] -N2-(бензиламинокарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5(R, S)-ил} - ацетил]-N2-(3-бром-2-тиенилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5(R, S)-ил} - ацетил]-N2-(3-метил-2-бензотиенилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5(R, S)-ил} - ацетил] -N2-(изобутилоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5(R)-ил} - ацетил] -N2-(изобутилоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5(S)-ил} - ацетил] -N2-(изобутилоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)-изоксазолин-5(R,S)-ил}- ацетил]-N2-(2-циклопропилэтоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5(R)-ил} - ацетил]-N2-(2-циклопропилэтоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5(S)-ил} - ацетил]-N2-(2-циклопропилэтоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-гуанидинофенил)-изоксазолин-5(R, S)-ил} - ацетил]-N2-(n-бутилоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-гуанидинофенил)-изоксазолин-5(R)-ил} - ацетил]-N2-(n-бутилоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-гуанидинофенил)-изоксазолин-5(R)-ил} - ацетил]-N2-(3-метилфенилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 5-(4-формамидинофенил)-изоксазолин-5(R,S)-ил}- ацетил]-N2-(n-бутилоксикарбонил)-2,3-(S)-диаминопропановая кислота.
[15] Также особенно предпочтительными являются сложные эфиры пролекарства особенно предпочтительных соединений формулы Ib, указанные эфиры, выбранные из группы, включающей: метил; этил; пропил; изопропил; метилкарбонилоксиметил; этилкарбонилоксиметил-; t-бутилкарбонилоксиметил-; циклогексилкарбонилоксиметил-; 1-(метилкарбонилокси)этил-; 1-(этилкарбонилокси)этил-; 1-(t-бутилкарбонилокси)этил-; 1 -(циклогексилкарбонилокси)этил-; i-пропилоксикарбонилоксиметил-; циклогексилкарбонилоксиметил-; t-бутилоксикарбонилоксиметил-; 1-(i-пропилоксикарбонилоксиметил)-; 1-(циклогексилоксикарбонилокси)этил-; 1-(t-бутилоксикарбонилокси)этил-; диметиламиноэтил-; диэтиламиноэтил-; (5-метил-1,3-диоксациклопентен-2-он-4-ил)метил-; (5-(t-бутил)-1,3-диоксациклопентен-2-он-4-ил)метил-; (1,3-диокса-5-фенил-циклопентен-2-он-4-ил)метил-; 1-(2-(2-метоксипропил)карбонилокси)этил-.
[16] Третье воплощение настоящего изобретения обеспечивает соединение формулы Id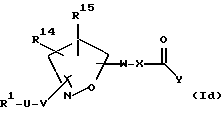
или фармацевтически приемлемую соль или пролекарство из него,
где R1 выбирается из R2(R3)N-, R2(R3)N(R2N=)C-, R2(R3)N(R2N=)CN(R2)-,
R2(R3)N(CH2)qZ-, R2(R3)N(R2N= )C(CH2)qZ-, R2(R3)N(R2N=)CN(R2)(CH2)qZ-,
пиперазинил-(CH2)qZ- или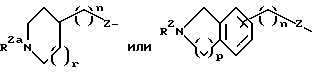
Z выбирается из связи (т.е. отсутствует), O, S, S(=O) или S(=O)2;
R2 и R3 независимо выбираются из: H, C1-C10-алкила, C2-C6-алкенила, C3-C11- циклоалкила, C4-C11- циклоалкилалкила, C6-C10-арила, C7-C11-арилалкила, C2-C7- алкилкарбонила, C7-C11- арилкарбонила, C2-C10- алкоксикарбонила, C4-C11- циклоалкоксикарбонила, C7-C11- бициклоалкоксикарбонила, C7-C11- арилоксикарбонила или арил(C1-C10-алкокси) карбонила, C1-C6- алкилкарбонилокси(C1-C4- алкокси)карбонила, C6-C10- арилкарбонилокси(C1-C4- алкокси)карбонила, C4-C11- циклоалкилкарбонилокси(C1-C4- алкокси)карбонила;
U выбирается из: одинарной связи (т.е. U отсутствует); C1-C7- алкилена; C2-C7- алкенилена; C2-C7-алкинилена; арилена, замещенного 0-3 R6a, пиридилена, замещенного 0-3 R6a;
V выбирается из: одинарной связи (т.е. V отсутствует); C1-C7- алкилена, замещенного 0-6 R6 или R7; C2-C7- алкенилена, замещенного 0-4 R6 или R7; C2-C7- алкинилена, замещенного 0-4 R6 или R7; фенилена, замещенного 0-4 R6 или R7; пиридилена, замещенного 0-3 R6 или R7; пиридазинилена, замещенного 0-3 R6 или R7;
X выбирается из: одинарной связи (т. е. X отсутствует); -(CH2)nC(= O)N(R12)-; C1-C7- алкилена, замещенного 0-6 R4, R8 или R15; C2-C7- алкенилена, замещенного 0-4 R4, R8 или R15; C2-C7- алкинилена, замещенного 0-4 R4, R8 или R15;
Y выбирается из: гидрокси, C1-C10-алкокси, C3-C11- циклоалкилокси, C6-C10-арилокси, C7-C11- аралкилокси, C3-C10- алкилкарбонилоксиалкилокси, C3-C10- алкоксикарбонилоксиалкилокси, C2-C10- алкоксикарбонилалкилокси, C5-C10- циклоалкилкарбонилоксиалкилокси, C5-C10- циклоалкоксикарбонилоксиалкилокси, C5-C10- циклоалкоксикарбонилалкилокси, C7-C11- арилоксикарбонилалкилокси, C8-C12- арилоксикарбонилоксиалкилокси, C8-C12- арилкарбонилоксиалкилокси, C5-C10- алкоксиалкилкарбонилоксиалкилокси, C5-C10- (5-алкил-1,3-диокса-циклопентен-2-он-ил)метилокси, C10-C14- (5-арил-1,3-диокса-циклопентен-2-он-ил)метилокси, (R2)(R3)N-(C1-C10-алкокси)-;
R14 и W прикрепляются к одному и тому же атому углерода и взятые вместе образуют спиро-конденсированное, 5-7-членное кольцо формулы
D, E, F и G каждый независимо выбирается из: C(R6a)2; карбонила; составляющей, содержащей гетероатом, выбранной из N, N(R12), O, при условии, что не более 2 из D, E, F и G являются N, N(R12), O, S или C(=O); или же, связь между D и E, E и F или F и G в таком спиро-конденсированном кольце может быть двойной связью углерод - азот или двойной связью углерод - углерод;
R4 выбирается из H, C1-C10-алкила, гидрокси, C1-C10-алкокси, нитро, C1-C10- алкилкарбонила или -N(R12)R13;
R6 и R7 каждый независимо выбираются из H, C1-C10-алкила, гидрокси, C1-C10-алкокси, нитро, C1-C10- алкилкарбонила, -N(R122)R13, циано, галоид, CF3, CHO, CO2R5a, C(=O)R5a, CONHR5a, CON(R12)2, OC(=O)R5a, OC(=O)OR5a, OR5a, OC(= O)N(R12)2, OCH2CO2R5a, CO2CH2CO2R5a, N(R12)2, NO2, NR12C(= O)R5a, NR12C(= O)OR5a, NR12C(= O)N(R12)2, NR12SO2N(R12)2, NR12SO2R5a, S(O)pR5a, SO2N(R12)2, C2-C6-алкенила, C3-C11-циклоалкила, C4-C11- циклоалкилметила; C6-C10-арила, выборочно замещенного 1-3 группами, выбранными из галогена, C1-C6-алкокси, C1-C6-алкила, CF3, S(O)mMe или -NMe2; C7-C11- арилалкила, указанного арила, факультативно замещенного 1-3 группами, выбранными из галогена, C1-C6-алкокси, C1-C6-алкила, CF3, S(O)mMe или -NMe2; метилендиокси, когда R6 является заместителем на ариле;
R6a выбирается из C1-C4-алкокси, C1-C4-алкила, галоид, CF3, NO2 или NR12R13;
R8 выбирается из: H; R6; C1-C10-алкила, замещенного 0-8 R6; C2-C10-алкенила, замещенного 0-6 R6; C2-C10-алкинила, замещенного 0-6 R6; C3-C8-циклоалкила, замещенного 0-6 R6; C5-C6-циклоалкенила, замещенного 0-5 R6; арила, замещенного 0-5 R6; 5-6-членного гетероциклического кольца, содержащего 1-2 гетероатома N, O или S, где указанный гетероцикл может быть насыщенным, частично насыщенным или полностью ненасыщенным, указанный гетероцикл замещен 0-5 R6;
R12 и R13 независимо являются H, C1-C10-алкил, C1-C10- алкоксикарбонил, C1-C10- алкилкарбонил, C1-C10- алкилсульфонил, арил(C1-C10- алкил)сульфонил, арилсульфонил, арил, C2-C6- алкенил, C3-C11- циклоалкил, C4-C11- циклоалкилалкил, C7-C11-арилалкил, C2-C7- алкилкарбонил, C7-C11- арилкарбонил, C2-C10- алкоксикарбонил, C4-C11- циклоалкоксикарбонил, C7-C11- бициклоалкоксикарбонил, C7-C11- арилоксикарбонил, гетероарилкарбонил, гетероарилалкилкарбонил или арил(C1-C10- алкокси)карбонил, где указанные арилы или гетероарилы факультативно замещены 0-3 заместителями, выбранными из группы, состоящей из: C1-C4- алкил, C1-C4-алкокси, галоид, CF3, NO2;
R5 и R5a независимо выбираются из H, C1-C8-алкил, C2-C6-алкенил, C3-C11-циклоалкил, C4-C11- циклоалкилметил, C6-C10-арил, C7-C11- арилалкил или C1-C10-алкил, замещенный 0-8 R4;
R15 выбирается из: H; R6; C1-C10-алкила, замещенного 0-8 R6; C2-C10-алкенила, замещенного 0-6 R6; C1-C10-алкокси, замещенного 0-6 R6; арила, замещенного 0-5 R6; 5-6-членного гетероциклического кольца, содержащего 1-2 гетероатома N, O или S, где указанное гетероциклическое кольцо может быть насыщенным, частично насыщенным или полностью ненасыщенным, указанное гетероциклическое кольцо замещено 0-8 R6; C1-C10- алкоксикарбонила, замещенного 0-8 R6; CO2R5; или -C(=O)N(R12)R13;
n = 0-4;
p = 1-3;
q = 1-7;
r = 0-3,
при условии, что n, p, q и r выбраны так, что число атомов между R1 и Y находится в интервале 8-17.
[17] Предпочтительными соединениями этого третьего воплощения являются соединения формулы III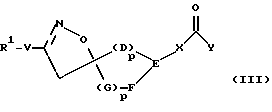
где R1 выбирается из R2NH-, H2N(R2N=)C-, H2N(R2N=)CNH-, R2HN(CH2)qO-, H2N(R2N=)CNH(CH2)qO-, пиперазинил-(CH2)qO-,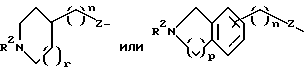
R2 выбирается из H, арил(C1-C10- алкокси)карбонила или C1-C10- алкоксикарбонила;
R4 выбирается из H, C1-C10- алкила, гидрокси, C1-C10- алкокси, нитро, C1-C10- алкилкарбонила или -N(R12)R13;
V выбирается из: одинарной связи (т.е. V отсутствует); C1-C7-алкилена, замещенного 0-6 R6 или R7; C2-C7- алкенилена, замещенного 0-4 R6 или R7; C2-C7- алкинилена, замещенного 0-4 R6 или R7; фенилена, замещенного 0-3 R6 или R7; пиридилена, замещенного 0-3 R6 или R7; пиридазинилена, замещенного 0-3 R6 или R7;
X выбирается из: -(CH2)nC(=O)N(R12)-; C1-C7-алкилена, замещенного 0-1 R4; C2-C7- алкенилена или C2-C7- алкинилена:
Y выбирается из: гидрокси, C1-C10-алкокси, C3-C11- циклоалкилокси, C6-C10-арилокси, C7-C11- аралкилокси, C3-C10- алкилкарбонилоксиалкилокси, C3-C10- алкоксикарбонилоксиалкилокси, C2-C10- алкоксикарбонилалкилокси, C5-C10- циклоалкилкарбонилоксиалкилокси, C5-C10 циклоалкоксикарбонилоксиалкилокси, C5-C10- циклоалкоксикарбонилалкилокси, C7-C11- арилоксикарбонилалкилокси, C8-C12- арилоксикарбонилоксиалкилокси, C8-C12- арилкарбонилоксиалкилокси, C5-C10- алкоксиалкилкарбонилоксиалкилокси, C5-C10- (5-алкил-1,3-диокса-циклопентен-2-он-ил)метилокси, C10-C14- (5-арил-1,3-диокса-циклопентен-2-он-ил)метилокси;
Z выбирается из O или CH2;
D, E, F и G каждый независимо выбирается из: CH2; карбонила; составляющей, содержащей гетероатом, выбранной из N, NH, O, при условии, что не более 2 из D, E, F и G являются N, NH, O или S; или же, связь между D и E, E и F или F и G в таком спиро-конденсированном кольце может быть двойной связью углерод - азот или двойной связью углерод - углерод;
R6 и R7 каждый независимо выбираются из H, C1-C10-алкила, гидрокси, C1-C10-алкокси, нитро, C1-C10- алкилкарбонила, -N(R12)R13, циано или галоид;
R12 и R13 независимо выбираются из H, C1-C10-алкила, C1-C10- алкоксикарбонила, C1-C10- алкилкарбонила, C1-C10- алкилсульфонила, арил(C1-C10- алкил)сульфонила, арилсульфонила, гетероарилкарбонила, гетероарилалкилкарбонила или арила;
n = 0-4;
p = 1-3;
q = 1-7;
r = 0-3,
при условии, что n, p, q и r выбраны так, что число атомов между R1 и Y находится в интервале 8-17.
[18] Более предпочтительными соединениями этого третьего воплощения являются соединения формулы II, где R1 - это R2NHC(=R2)- и V - это фенил или пиридил или R1 - это
V - это одинарная связь (т.е. V отсутствует);
n = 1 или 2;
X - это C1-C4-алкилен, замещенный 0-1 R4;
Y выбирается из:
гидрокси С1-С10-алкокси; метилкарбонилоксиметокси-; этилкарбонилоксиметокси-; t-бутилкарбонилоксиметокси-; циклогексилкарбонилоксиметокси-; 1 -(метилкарбонилокси)этокси-; 1 -(этилкарбонилокси)этокси-; 1 -(t-бутилкарбонилокси)этокси-; 1 -(циклогексилкарбонилокси)этокси-; i-пропилоксикарбонилоксиметокси-; t-бутилоксикарбонилоксиметокси-; 1-(i-пропилоксикарбонилокси)этокси-; 1 -(циклогексилоксикарбонилокси)этокси-; 1-(t- бутилоксикарбонилокси)этокси-; диметиламиноэтокси-; диэтиламиноэтокси-; (5-метил-1,3-диоксациклопентен -2-он-4-ил)метокси-; (5-(t-бутил)-1,3-диоксациклопентен -2-он-4-ил)метокси-; (1,3-диокса-5-фенил-циклопентен -2-он-4-ил)метокси-; 1 -(2-(2-метоксипропил) карбонилокси)этокси-;
R12 и R13 каждый независимо выбирается из H, C1-С6-алкила, C1-C4- алкоксикарбонила, C1-C4- алкилкарбонила, C1-C4- алкилсульфонила, арил (C1-C4- алкил)сульфонила, арилсульфонила, гетероарилкарбонила, гетероарилалкилкарбонила или арила; и
R13 - это H.
[19] Особенно предпочтительными соединениями этого третьего воплощения являются соединения или фармацевтически приемлемая соль или пролекарства из них, выбранные из:
5(R,S)-3-(4-амидинофенил)- 8-(2-карбоксиэтил)-1-окса-2,8-диазаспиро[4.4] нон-2- ен-7,9-дион;
5(R, S)-3-(4-амидинофенил)-8-(3-карбоксипропил)-1 -окса-2,8- диазаспиро[4.4]нон-2-ен-7,9-дион;
5(R,S)-3-(4-амидинофенил)-8-(2- карбоксиэтил)-1-окса-2,8-диазаспиро[4.4] нон-2- ен-5-он;
5(R, S)-3-(4-амидинофенил)-8-(3-карбоксипропил)-1 -окса-2,8- диазаспиро[4.4]нон-2-ен-5-он:
5(R,S)-3-(4-амидинофенил)-8-(2- карбоксиэтил)-1-окса-2-азаспиро[4.4]нона-2,8- диен-5-он;
5(R, S)-3- (4-амидинофенил)-8-(3-карбоксипропил)-1-окса-2-азаспиро[4.4] нона- 2,8-диен-5-он;
5(R,S)-3-(4-амидинофенил)-8-(2-карбоксиэтил)-1- окса-2,8-диазаспиро[4.4] дек-2- ен-7,9-дион;
5(R, S)-3-(4- амидинофенил)-8-(3-карбоксипропил)-1 -окса-2,8-диазаспиро[4.4]дек- 2-ен-7,9-дион;
5(R,S)-3-(4-амидинофенил)-8-(2-карбоксиэтил)-1- окса-2,8-диазаспиро[4.4] дек-2-ен-5-он;
5(R, S)-3-(4-амидинофенил)- 8-(3-карбоксипропил)-1 -окса-2,8-диазаспиро[4.4]дек-2-ен-5-он;
5(R,S)-3-(4-амидинофенил)-8-(2-карбоксиэтил)-1-окса-2- азаспиро[4.4]дека-2,8-диен-5-он;
5(R, S)-3-(4-амидинофенил)-8-(3-карбоксипропил)-1- окса-2-азаспиро[4.4] дека-2.8-диен-5-он;
5(R,S)-3-(4-амидинофенил)- 8-(2-карбоксиэтил)-1-окса-2,8-диазаспиро[4.4] ундек-2-ен-7,9-дион;
5(R, S)-3-(4-амидинофенил)-8-(3-карбоксипропил)-1 -окса-2,8- диазаспиро[4.4]ундек-2-ен-7,9-дион;
5(R,S)-3-(4-амидинофенил)-8- (2-карбоксиэтил)-1-окса-2,8-диазаспиро[4.4] ундек-2-ен-5-он;
5(R, S)-3-(4-амидинофенил)-8-(2-карбоксипропил)-1 -окса-2,8- диазаспиро[4.4]ундек-2-ен-5-он;
5(R,S)-3-(4-амидинофенил)-8-(2- карбоксиэтил)-1-окса-2-азаспиро[4.4]ундека-2,8-диен-5-он;
5(R, S)-3-(4-амидинофенил)-8-(3-карбоксипропил)-1-окса-2- азаспиро[4.4] ундека-2,8-диен-5-он;
5(R, S)-3-[2-(пиперидин-4- ил)этил] -8-(2-карбоксиэтил)-1-окса-2,8-диазаспиро[4.4]нон-2-ен- 7,9-дион;
5(R,S)-3-[2-(пиперидин-4-ил)этил]-8-(3-карбоксипропил)- 1-окса-2,8-диазаспиро[4.4]нон-2-ен-7,9-дион;
5(R, S)-3-[2-(пиперидин-4-ил)этил] -8-(2-карбоксиэтил)-1-окса-2,8- диазаспиро[4.4]нон-2-ен-5-он;
5(R, S)-3-[2-(пиперидин-4-ил)этил] -8- (3-карбоксипропил)-1-окса-2,8-диазаспиро[4.4]нон-2-ен-5-он;
5(R,S)-3-[2-(пиперидин-4-ил)этил]-8-(2-карбоксиэтил)-1- окса-2-азаспиро[4.4]нона-2,8-диен-5-он;
5(R, S)-3-[2-(пиперидин-4- ил)этил]-8-(3-карбоксипропил)-1-окса-2-азаспиро[4.4]нона-2,8- диен-5-он;
5(R,S)-3-[2-(пиперидин-4-ил)этил]-8-(2-карбоксиэтил)-1- окса-2,8-диазаспиро[4.4]дек-2-ен-7,9-дион;
5(R, S)-3-[2- (пиперидин-4-ил)этил] -8-(3-карбоксипропил)-1-окса-2,8- диазаспиро[4.4]дек-2-ен-7,9-дион;
5(R, S)-3-[2-(пиперидин-4- ил)этил] -8-(2-карбоксиэтил)-1-окса-2,8-диазаспиро[4.4]дек-2-ен-5- он;
5(R, S)-3-[2-(пиперидин-4-ил)этил] -8-(3-карбоксипропил)-1-окса- 2,8-диазаспиро[4.4]дек-2-ен-5-он;
5(R, S)-3-[2-(пиперидин-4- ил)этил]-8-(2-карбоксиэтил)-1-окса-2-азаспиро[4.4]дека-2,8-диен- 5-он;
5(R, S)-3-[2-(пиперидин-4-ил)этил] -8-(3-карбоксипропил)-1- окса-2-азаспиро[4.4]дека-2-ен-5-он;
5(R, S)-3-[2-(пиперидин-4- ил)этил] -8-(2-карбоксиэтил)-1-окса-2,8-диазаспиро[4.4]ундек-2-ен- 7,9-дион;
5(R,S)-3-[2-(пиперидин-4-ил)этил]-8-(3-карбоксипропил)- 1-окса-2,8-диазаспиро[4.4]ундек-2-ен-7.9-дион:
5(R, S)-3-[2- (пиперидин-4-ил)этил]-8-(2-карбоксиэтил)-1-окса-2,8- диазаспиро[4.4]ундек-2-ен-5-он;
5(R, S)-3-[2-(пиперидин-4-ил)этил] - 8-(3-карбоксипропил)-1-окса-2,8-диазаспиро[4.4]ундек-2-ен-5-он;
5(R, S)-3-[2-(пиперидин-4-ил)этил] -8-(2-карбоксиэтил)-1- окса-2-азаспиро[4.4]ундека-2,8-диен-5-он;
5(R, S)-3-[2-(пиперидин-4- ил)этил]-8-(3-карбоксипропил)-1-окса-2-азаспиро[4.4]ундека-2,8- диен-5-он:
5(R, S)-3-(4-амидинофенил)-8-[2- (бензилоксикарбониламино)-2-карбоксиэтил]-1-окса-2,8- диазаспиро[4.5]дек-2-ен.
[20] Четвертое воплощение этого изобретения обеспечивает соединения формулы 1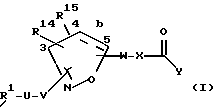
или фармацевтически приемлемую соль или пролекарства из них,
где R1 выбирается из: R2(R3)N(CH2)qZ-, R2(R3)N(R2N=)C(CH2)qZ-. R2(R3)N(R2N=)CN(R2)(CH2)qZ-, пиперазинил-(CH2)qZ- или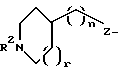
Z выбирается из O, S, S(=O), S(=O)2;
R2 и R3 независимо выбираются из: H, C1-C10-алкила, C2-C6-алкенила, C3-C11- циклоалкила, C4-C11- циклоалкилалкила, C6-C10-арила, C7-C11-арилалкил, C2-C7- алкилкарбонила, C7-C11- арилкарбонила, C2-C10- алкоксикарбонила, C4-C11- циклоалкоксикарбонила, C7-C11- бициклоалкоксикарбонила, C7-C11- арилоксикарбонила или арил(C1-C10- алкокси)карбонила, C1-C6- арилкарбонилокси(С1- C4- алкокси) карбонила, C4-C11- циклоалкилкарбонилокси(С1-С4- алкокси)карбонила;
U присутствует необязательно и выбирается из C1-C7-алкилена, C2-C7-алкенилена, C2-C7-алкинилена, арилена или пиридилена;
V выбирается из: одинарной связи (т.е. V отсутствует); C1-C7-алкилена, замещенного 0-6 R6 или R7; C2-C7-алкенилена, замещенного 0-4 R6 или R7; C2-C7- алкинилена, замещенного 0-4 R6 или R7; фенилена, замещенного 0-4 R6 или R7; пиридилена, замещенного 0-3 R6 или R7, пиридазинилена, замещенного 0-3 R6 или R7;
W - это -(арил)-Z1-, где указанный арил замещен 0-6 R6 или R7;
Z1 выбирается из одинарной связи (т.е. Z1 отсутствует), -CH2-, О или S;
X выбирается из: одинарной связи (т.е. X отсутствует); C1-C7- алкилена, замещенного 0-6 R4, R8 или R15; C2-C7- алкенилена, замещенного 0-4 R4, R8 или R15; C2-C7- алкинилена, замещенного 0-4 R4, R8 или R15;
Y выбирается из гидрокси, C1-C10- алкокси, С3-C11- циклоалкилокси, C6-C10-арилокси, C7-C11- аралкилокси, С3-C10- алкилкарбонилоксиалкилокси, С3-C10- алкоксикарбонилоксиалкилокси, C2-C10- алкоксикарбонилалкилокси, C5-C10- циклоалкилкарбонилоксиалкилокси, C5-C10- циклоалкоксикарбонилоксиалкилокси, C5-C10- циклоалкоксикарбонилалкилокси, C7-C11- арилоксикарбонилалкилокси, C8- C12- арилоксикарбонилоксиалкилокси, C8-C12- арилкарбонилоксиалкилокси, С5-C10- алкоксиалкилкарбонилоксиалкилокси, С5-С10- (5-алкил-1,3- диокса-циклопентен-2-он-ил) метилокси; C10-C14- (5-арил-1,3- диокса-циклопентен-2-он-ил) метилокси, (R2)(R3)N- (C1-C10- алкокси)-;
R4 выбирается из H, C1-C10-алкила, гидрокси, C1-C10-алкокси, нитро, C1-C10- алкилкарбонила или -N(R12)R13;
R6 и R7 каждый независимо выбираются из H, C1-C10 алкила, гидрокси, C1-C10- алкокси, нитро, C1-C10- алкилкарбонила, -N(R12)R13 циано, гало, CF3, CHO, CO2R5a, C(=O)R5a, CONHR5a, CON(R12)2, OC(=O)R5a, OC(=O)OR5a, OR5a, OC(= O)N(R12)2, OCH2CO2R5a, CO2CH2CO2R5a, N(R12)2, NO2, NR12C(=O)R5a, NR12C(= O)OR5a, NR12C(=O)N(R12)2, NR12SO2N(R12)2, NR12SO2R5a, S(O)pR5a SO2N(R12)2, C2-C6-алкенила, С3-C11- циклоалкила, C4-C11- циклоалкилметила; C6-C10-арила,
факультативно замещенного галогеном, алкокси, алкилом, CF3, S(O)mMe или -NMe2; или C7-C11-арилалкила, указанного арила, факультативно замещенного галогеном, алкокси, алкилом, CF3, S(O)mMe или -NMe2;
R8 выбирается из: H; R6; C1-C10-алкила, замещенного 0-8 R6; С2-С10- алкенила, замещенного 0-6 R6; С2-С10-алкинила, замещенного 0-6 R6; С3-С8- циклоалкила, замещенного 0-6 R6; C5-C6- циклоалкенила, замещенного 0-5 R6; арила, замещенного 0-5 R6; 5-6-членного гетероциклического кольца, содержащего 1-2 гетероатома N, О или S, где указанный гетероцикл может быть насыщенным, частично насыщенным или полностью ненасыщенным, указанный гетероцикл замещен 0-5 R6;
R12 и R13 независимо являются H, C1-C10-алкилом, C1-C10- алкоксикарбонилом, C1-C10- алкилкарбонилом, C1-C10- алкилсульфонилом, арил(C1-С10- алкил)сульфонилом, арилсульфонилом, арилом, C2-C6 алкенилом, С3-С11- циклоалкилом, C4-C11- циклоалкилалкилом, C7-C11- арилалкилом, C2-C7- алкилкарбонилом, C7-C11- арилкарбонилом, C2-C10- алкоксикарбонилом, C4-C11- циклоалкоксикарбонилом, C7-C11- бициклоалкоксикарбонилом, C7-C11- арилоксикарбонилом, гетероарилкарбонилом, гетероарилалкилкарбонилом или арил(C1-C10- алкокси)карбонилом;
R14 выбирается из H, C1-C10-алкила, C2-C10-алкенила, C2-C10- алкинила, C1-C10-алкокси, арила, гетероарила или C1-C10- алкоксикарбонила, CO2R5 или - C(=O)N(R12)R13;
R5 и R5a независимо выбираются из водорода, гидрокси, C1-C8-алкила, C2-C6- алкенила, С3-С11- циклоалкила, C4-C11- циклоалкилметила, C6-C10-арила, C7-С11- арилалкила или C1-C10- алкила, замещенного 0-8 R4;
R15 выбирается из: H; R6; C1-C10-алкила, замещенного 0-8 R6; C2-C10-алкенила, замещенного 0-6 R6; С1-C10-алкокси, замещенного 0-6 R6; арила, замещенного 0-5 R6; 5-6-членного гетероциклического кольца, содержащего 1-2 гетероатома N, О или S, где указанное гетероциклическое кольцо может быть насыщенным, частично насыщенным или полностью ненасыщенным, указанное гетероциклическое кольцо замещено 0-5 R6; C1-C10- алкоксикарбонила, замещенного 0-8 R6; CO2R5 или - C(=O)N(R12)R13;
n = 0-4;
q = 2-7;
r = 0-3;
при условии, что n, q и r выбраны так, что число атомов между R1 и Y примерно 8-17.
[21] Предпочтительными соединениями этого четвертого воплощения являются те соединения формулы IV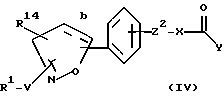
где R1 выбирается из R2HN(CH2)qO-, R2HN(R2N=)C(CH2)qZ-, пиперазинил-(CH2)qZ- или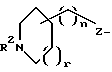
Z - это O;
R2 выбирается из: H, арил(С1-С10- алкокси)карбонила, C1-C10- алкоксикарбонила;
V выбирается из: одинарной связи (т.е. V отсутствует); C1-C7-алкилена, замещенного 0-6 R6 или R7; C2-C7- алкенилена, замещенного 0-4 R6 или R7; C2-C7-алкинилена, замещенного 0-4 R6 или R7; фенилена, замещенного 0-3 R6 или R7; пиридилена, замещенного 0-3 R6 или R7; пиридазинилена, замещенного 0-3 R6 или R7;
Z1 выбирается из одинарной связи (т.е. Z1 отсутствует), О или S;
X выбирается из: одинарной связи (т.е. X отсутствует): C1-C7-алкилена, замещенного 0-6 R4, R8 или R15; C2-C7- алкенилена, замещенного 0-4 R4, R8 или R15; C2-C7- алкинилена, замещенного 0-4 R4, R8 или R15;
Y выбирается из гидрокси, C1-C10-алкокси, С3-С11- циклоалкилокси, C6-C10- арилокси, C7-C11- аралкилокси, С3-С10- алкилкарбонилоксиалкилокси, С3-C10- алкоксикарбонилоксиалкилокси, C2-C10- алкоксикарбонилалкилокси, C5-C10- циклоалкилкарбонилоксиалкилокси, С5-C10- циклоалкоксикарбонилоксиалкилокси, C5-C10- циклоалкоксикарбонилалкилокси, C7-С11- арилоксикарбонилалкилокси, C8-C12- арилоксикарбонилоксиалкилокси, C8-C12- арилкарбонилоксиалкилокси, C5-C10- алкоксиалкилкарбонилоксиалкилокси, C5-C10- (5-алкил-1,3-диокса-циклопентен-2-он- ил)метилокси или C10-C14- (5-арил-1,3-диокса- циклопентен-2-он-ил)метилокси;
R4 выбирается из H, C1-C10-алкила, гидрокси, C1-C10-алкокси, нитро, C1-C10- алкилкарбонила или -N(R12)R13;
R6 и R7 каждый независимо выбираются из H, C1-C10-алкила, гидрокси, C1-C10-алкокси, нитро, C1-C10- алкилкарбонила, - N(R12)R13, циано, галоид;
R8 выбирается из: H; C1-C10-алкила, C2-C10-алкенила, C3-C8-циклоалкила, C5-C6- циклоалкенила, арила, 5-6-членного гетероциклического кольца, содержащего 1-2 гетероатома N, О или S, где указанный гетероцикл может быть насыщенным, частично насыщенным или полностью ненасыщенным;
R12 и R13 независимо выбираются из H, C1-C10-алкила, C1-C10- алкоксикарбонила, C1-C10- алкилкарбонила, C1-C10- алкилсульфонила, apил(C1-C10- алкил)сульфонила, арилсульфонила, гетероарилкарбонила, гетероарилалкилкарбонила или арила;
R14 выбирается из H, C1-C10-алкила, C2-C10-алкенила, C2-C10- алкинила, C1-C10-алкокси, арила, гетероарила или C1-C10- алкоксикарбонила, CO2R5 или - C(=O)N(R12)R13;
R5 выбирается из водорода или C1-C10, замещенного 0-6 R4;
n = 0-4;
q = 2-7;
при условии, что n и q выбраны так, что число атомов между R1 и Y находится в интервале 8-17.
[22] Более предпочтительными соединениями этого четвертого воплощения являются те соединения формулы IV,
где R1 - это R2HN(CH2)qO- или
V - это C1-С3-алкилена;
Z1 - одинарная связь (т.е. Z1 отсутствует) или О;
X - C1-С3-алкилена, замещенного 0-1 R4;
Y выбирается из: гидрокси; С1-С10-алкокси; метилкарбонилоксиметокси-; этилкарбонилоксиметокси-; t-бутилкарбонилоксиметокси-; циклогексилкарбонилоксиметокси-; 1- (метилкарбонилокси)этокси-; 1-(этилкарбонилокси)этокси-; 1-(t-бутилкарбонилокси)этокси-; 1 -(циклогексилкарбонилокси)этокси-; i- пропилоксикарбонилоксиметокси-; t-бутилоксикарбонилоксиметокси- ; 1-(i-пропилоксикарбонилокси)этокси-: 1 - (циклогексилоксикарбонилокси)этокси-; 1-(t- бутилоксикарбонилокси)этокси-; диметиламиноэтокси-; диэтиламиноэтокси-; (5-метил-1,3-диоксациклопентен -2-он-4- ил)метокси-: (5-(t-бутил)-1,3-диоксациклопентен -2-он-4- ил)метокси-; (1,3-диокса-5-фенил- циклопентен-2-он-4-ил)метокси-; 1-(2-(2-метоксипропил) карбонилокси)этокси-;
R12 и R13 независимо выбираются из H, C1-С6-алкила, С1-С4- алкоксикарбонила, C1-C4- алкилкарбонила, C1-С6- алкилсульфонила, арил(С1-С4- алкил)сульфонила, арилсульфонила, гетероарилкарбонила, гетероарилалкилкарбонила или арила;
R13 - H.
[23] Особенно предпочтительными соединениями этого четвертого воплощения являются соединения или фармацевтически приемлемая соль или пролекарства из них, выбранные из:
5(R, S)-4-[3-(пиперидин-4-ил)оксиметилизоксазолин-5-ил]гидрокоричная кислота;
5(R,S)-4-[3-(2-аминоэтоксиметил)изоксазолин-5- ил]гидрокоричная кислота:
5(R, S)-4-[3-(3- аминопропилоксиметил)изоксазолин-5-ил]гидрокоричная кислота:
5(R, S)-4-[3-(пиперидин-4-ил)оксиметилизоксазолин-5- ил]феноксиуксусная кислота;
5(R, S)-4-[3-(2- аминоэтоксиметил)изоксазолин-5-ил]феноксиуксусная кислота;
5(R, S)-4-[3-(3-аминопропилоксиметил)изоксазолин-5-ил] феноксиуксусная кислота.
[24] Пятое воплощение этого изобретения обеспечивает соединение формулы I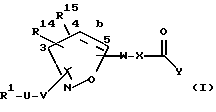
или фармацевтически приемлемую соль или пролекарство из него,
где b - это одинарная или двойная связь;
R1 выбирается из R2a(R3)N-, R2(R3)N(R2N=)C-, R2a(R3)N(CH2)qZ-, R2(R3)N(R2N=)C(CH2)qZ-,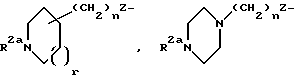
или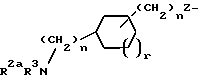
Z выбирается из связи (т.е. отсутствует), О, S, S(=O) или S(=O)2;
R2 и R3 независимо выбирается из: H, C1-C10-алкил, С2-С6-алкенил, С3-С11- циклоалкил, С4-С11- циклоалкилалкил, С6-С10- арил, С7-С11- арилалкил, С2-С7- алкилкарбонил, С7-С11- арилкарбонил, С2-С10- алкоксикарбонил, С4-С11- циклоалкоксикарбонил, С7-С11- бициклоалкоксикарбонил, С7-С11- арилоксикарбонил, apил(C1-C10- алкокси)карбонил, алкилкарбонилоксиалкоксикарбонил или алкоксикарбонилоксиалкоксикарбонил, C1-C6- арилкарбонилокси(С1-С4- алкокси)карбонил, С6-С10- арилкарбонилокси(С1-С4- алкокси)карбонил, C4-C11- циклоалкилкарбонилокси(С1-С4- алкокси)карбонил;
R2a - это R2 или R2(R3)N(R2N=)C;
U выбирается из: одинарной связи (т. е. U не присутствует), -(С1-C7-алкил)-, -(C2-C7-алкенил)-, -(C2-C7- алкинил)-, -(арил)-, замещенный 0-3 R6a или -(пиридил)-, замещенный 0-3 R6a;
V выбирается из: одинарной связи (т.е. V не присутствует); -(C1-C7- алкил)-, замещенный 0-3 группами, независимо выбранными из R6 или R7; -(C2-C7- алкенил)-, замещенный 0-3 группами, независимо выбранными из R6 или R7; (C2-C7- алкинил)-, замещенный 0-3 группами, независимо выбранными из R6 или R7; -(фенил)-, замещенный 0-2 группами, независимо выбранными из R6 или R7; -(пиридил)-, замещенный 0-2 группами, независимо выбранными из R6 или R7; или -(пиридазинил)-, замещенный 0-2 группами, независимо выбранными из R6 или R7;
W выбирается из: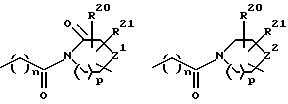
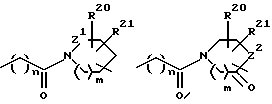
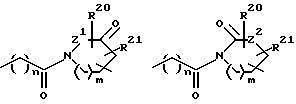
X выбирается из: одинарной связи (т.е. X не присутствует), -(C(R4)2)n-C(R4)(R8)-C(R4)(R4a)-, при условии, что, когда n равняется 0 или 1, по меньшей мере один из R4a или R8 не является H или метилом;
Y выбирается из гидрокси, С1-С10-алкилокси, С3-С11-циклоалкилокси, С6-С10-арилокси, C7-C11-аралкилокси, С3-С10- алкилкарбонилоксиалкилокси, C3-С10- алкоксикарбонилоксиалкилокси, C2-C10- алкоксикарбонилалкилокси, C5-C10- циклоалкилкарбонилоксиалкилокси, C5-C10- циклоалкоксикарбонилоксиалкилокси, C5-C10- циклоалкоксикарбонилалкилокси, C7-C11- арилоксикарбонилалкилокси, C8-C12- арилоксикарбонилоксиалкилокси, C8-C12- арилкарбонилоксиалкилокси, C5-C10- алкоксиалкилкарбонилоксиалкилокси, C5-C10- (5-алкил-1,3-диокса-циклопентен-2-он-ил)метилокси, C10-C14- (5-арил-1,3-диокса-циклопентен-2-он-ил)метилокси; (R2)(R3)N-(C1-C10-aлкокси)-;
Z' - это -C-, -О- или -NR22-;
Z2 - это -О- или -NR22;
R4 выбирается из H, C1-C10-алкила, C1-C10- алкилкарбонила, арила, арилалкиленциклоалкила или циклоалкилалкилена; или же, две группы R4 на соседних атомах углерода соединяются с образованием связи (т.е. двойная или тройная связь углерод - углерод);
R4a выбирается из H, гидрокси, C1-C10- алкокси, нитро, N(R5)R5a, - N(R12)R13, - N(R16)R17, C1-C10-алкила, замещенного 0-3 R6, арил, замещенного 0-3 R6 или C1-C10- алкилкарбонила;
R4b выбирается из H, C1-C6-алкила, C2-C6-алкенила, C2-C6-алкинила, гидрокси, C1-C6- алкокси, C1-C6- алкилтио, C1-C6- алкилсульфонила, C1-C6- алкилсульфинила, нитро, C1-C6- алкилкарбонила, C6-C10- арила, -N(R12)R13, галоид, CF3, CN, C1-C6- алкоксикарбонила, карбокси, пиперидинила или пиридила;
R5 выбирается из H, C1-C8-алкила, C2-C6-алкенила, C3-C11- циклоалкила, C4-C11- циклоалкилметила, C6-C10-арила, C7-C11- арилалкила или C1-C10-алкила, замещенного 0-2 R4b;
R5a выбирается из водорода, гидрокси, C1-C8-алкила, C2 до C6 алкенила, C3-C11-циклоалкила, C4-C11- циклоалкилметила, C1-C6-алкокси, бензилокси, от C6 до C10 арила, гетероарила, C7-C11- арилалкила или C1-C10-алкила, замещенного 0-2 R4b;
или же R5 и R5a, являясь заместителями на одном и том же атоме азота (как в - NR5R5a), могут соединяться с атомом азота, к которому они прикреплены, с образованием 3-азабициклононил, 1,2,3,4-тетрагидро-1- хинолинила, 1,2,3,4-тетрагидро-2-изохинолинила, 1-пиперидинила, 1- морфолинила или 1-пиперазинила, каждый факультативно имеющий заместитель C1-C6-алкил, C6-C10-арил, гетероарил, C7-C11- арилалкил, C1-С6- алкилкарбонил, С3-С7- циклоалкилкарбонил, C1-С6- алкоксикарбонил, C7-С11- арилалкоксикарбонил, C1-С6- алкилсульфонил или С6-С10- арилсульфонил;
R5b выбирается из C1-C8-алкила, C2-C6-алкенила, С3-С11- циклоалкила, С4-С11- циклоалкилметила, С6-С10-арила, C7-C11- арилалкила или C1-C10-алкила, замещенного 0-2 R4b;
R6 выбирается из H, C1-C10-алкила, гидрокси, C1-C10-алкокси, нитро, C1-C10- алкилкарбонила, - N(R12)R13, циано, галоид, CF3, CHO, CO2R5, C(= O)R5a, CONR5R5a, OC(= O) R5a, OC(= O)OR5b, OR5, OC(=O)NR5R5a, OCH2CO2R5, CO2CH2CO2R5, NO2, NR5aC(=O)OR5b, NR5aC(=O)R5a, NR5aC(=O)NR5R5a, NR5aSO2NR5R5a, NR5aSO2R5, S(O)pR5, SO2NR5R5a, от C2 до C6 алкенила, от С3 до С11 циклоалкила, от C4 до С11 циклоалкилметила; от C6 до С10 арила, факультативно замещенного 1-3 группами, выбранными из галогена, C1-C6-алкокси, C1-С6-алкила, CF3, S(O)mMe или -NMe2; от С7 до С11 арилалкила, вышеуказанный арил факультативно замещен 1-3 группами, выбранными из галогена, C1-С6-алкокси, C1-С6-алкила, CF3, S(O)mМе или -NMe2; метилендиокси, когда R6 является заместителем на ариле; или 5-10-членного гетероциклического кольца, содержащего 1-2 гетероатома N, О или S, где указанное гетероциклическое кольцо может быть насыщенным, частично насыщенным или полностью ненасыщенным, указанное гетероциклическое кольцо замещено 0-2 R7;
R6a выбирается из C1-C4-алкила, C1-C4-алкокси, галоид, CF3, NO2 или NR12R13;
R7 выбирается из H, C1-C10-алкила, гидрокси, C1-C10-алкокси, нитро, C1-C10- алкилкарбонила, -N(R12)R13, циано, галоид, CF3, CHO, CO2R5, C(= O)R5a, CONR5R5a, OC(= O)R5a, OC(= O)OR5b, OR5a, OC(=O)NR5R5a, OCH2CO2R5, CO2CH2CO2R5, NO2, NR5aC(=O)R5a, NR5aC(=O)OR5b, NR5aC(=O)NR5R5a, NR5aSO2NR5R5a, NR5aS02R5, S(O)mR5a, SO2NR5R5a, от C2 до C6 алкенила, от C3 до C11 циклоалкила, от C4 до C11 циклоалкилметила, от C6 до C10 арила или от C7 до C11 арилалкила;
R8 выбирается из: R6; C2-C10-алкила, замещенного 0-3 R6; C2-C10-алкенила, замещенного 0-3 R6; C2-C10-алкинила, замещенного 0-3 R6; C3-C8- циклоалкила, замещенного 0-3 R6; C5-C6- циклоалкенила, замещенного 0-2 R6; арила, замещенного 0-3 R6; 5-10-членного гетероциклического кольца, содержащего 1-2 гетероатома N, О или S, где указанное гетероциклическое кольцо может быть насыщенным, частично насыщенным или полностью ненасыщенным, указанное гетероциклическое кольцо замещено 0-2 R6;
R12 и R13 независимо являются H, C1-C10-алкилом, C1-C10- алкоксикарбонилом, C1-C10- алкилкарбонилом, C1-C10- алкилсульфонилом, apил(C1-C10- алкил)сульфонилом, арилсульфонилом, арилом, C2-C6- алкенилом, C3-C11- циклоалкилом, C4-C11- циклоалкилалкилом, C7-C11- арилалкилом, C7-C11- арилкарбонилом, C4-C11- циклоалкоксикарбонилом, C7-C11- бициклоалкоксикарбонилом, C7-C11- арилоксикарбонилом, или apил(C1-C10- алкокси)карбонилом, где указанные арилы факультативно замещены 0-3 заместителями, выбранными из группы, состоящей из: C1-C4-алкила, C1-C4-алкокси, галоид, CF3 и NO2;
R14 выбирается из H, C1-C10-алкила, C2-C10-алкенила, C2-C10-алкинила, C1-C10-алкокси, арила, гетероарила или C1-C10- алкоксикарбонила, CO2R5 или -C(=O)N(R5)R5a;
R15 выбирается из: H; R6; C1-C10-алкила, замещенного 0-3 R6; C2-C10-алкенила, замещенного 0-3 R6; C1-C10-алкокси, замещенного 0-3 R6; арила, замещенного 0-3 R6; 5-10-членного гетероциклического кольца, содержащего 1-2 гетероатома N, О или S, где указанное гетероциклическое кольцо может быть насыщенным, частично насыщенным или полностью ненасыщенным, указанное гетероциклическое кольцо замещено 0-2 R6; C1-C10- алкоксикарбонила, замещенного 0-2 R6; CO2R5 или -C(=O)N(R12)R13;
при условии, что, когда b - это двойная связь, присутствует только один из R14 или R15;
R16 выбирается из: -C(= O)-O-R18a; -C(=O)-R18b; -C(=O)N(R18b)2; -C(= O)NHSO2R18a; -C(=O)NHC(=O)R18b; -C(=O)NHC(=O)OR18a; -C(=O)NHSO2NHR18b; -C(= S)-NH-R18b; -NH-C(= O)-O-R18a; -NH-C(=O)-R18b; -NH-C(=O)-NH-R18b; -SO2-O-R18b; -SO2-R18a; -SO2-N(R18b)2; -SO2-NHC(= O)OR18b; -P(=S)(OR18b)2; -P(= O)(OR18a)2; -P(=S)(R18a)2; -P(=O)(R18a)2 или
R17 выбирается из: H, C1-C10-алкила, C2-C6-алкенила, C3-C11- циклоалкила, C4-C15- циклоалкилалкила, арила, арил(C1-C10-алкила)-;
R18a выбирается из: C1-C8-алкила, замещенного 0-2 R19; C2-C8-алкенила, замещенного 0-2 R19; C2-C8-алкинила, замещенного 0-2 R19; C3-C8- циклоалкила, замещенного 0-2 R19; арила, замещенного 0-4 R19; арил(C1-C6- алкила)-, замещенного 0-4 R19; 5-10-членной гетероциклической системы, имеющей 1-3 гетероатома, выбранные независимо из О, S или N, указанного гетероциклического кольца, замещенного 0-4 R19; C1-C6-алкила, замещенного 5-10-членной гетероциклической системой, имеющей 1-3 гетероатома, выбранные независимо из О, S или N, указанного гетероциклического кольца, замещенного 0-4 R19;
R18b выбирается из R18a или H;
R19 выбирается из H, галогена, CF3, CN, NO2, NR12R13, C1-C8-алкила, C2-C6-алкенила, C2-C6-алкинила, C3-C11- циклоалкила, C4-C11- циклоалкилалкила, арила, арил(C1-C6- алкила)-, C1-C6-алкокси или C1-C4- алкоксикарбонила;
R20 и R21 каждый независимо выбираются из H, C1-C10-алкила, CO2R5, C(= O)R5a CONR5R5a, NR5C(=O)R5a, NR12R13 C2-C6- алкенила, C3-C11- циклоалкила, C4-C11- циклоалкилметила, C6-C10-арила или C7-C11-арилалкила;
R22 выбирается из C1-C10-алкила, C2-C6-алкенила, C3-C11-циклоалкила, C4-C15- циклоалкилалкила, арила, apил(C1-C10- алкила)-; C(=O)R5a, CO2R5b, -C(=O)N(R5)R5a или связи к X;
m = 0-2;
n = 0-2;
p = 1-2;
q = 1-7;
r = 0-3;
при условии, что n, q и r выбираются таким образом, что число атомов, соединяющий R1 и
Y, находится в интервале 8-17.
[25] Предпочтительными соединениями этого воплощения являются те соединения формулы Iс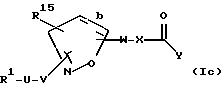
где Z выбирается из связи (т.е. отсутствует), О или S;
R2 выбирается из H, арил(C1-C10-алкокси)карбонила или C1-C10- алкоксикарбонила;
U - одинарная связь (т.е. U не присутствует);
X - это -CHR4a;
R5 выбирается из H или C1-C10-алкила, замещенного 0-6 R4b;
R6 и R7 каждый независимо выбираются из H, C1-C10-алкила, гидрокси, C1-C10-алкокси, нитро, C1-C10- алкилкарбонила, - N(R12)R13, циано или гало;
R12 и R13 независимо выбираются из H, C1-C10-алкила, C1-C10- алкоксикарбонила, C1-C10- алкилкарбонила, C1- C10- алкилсульфонила, apил(C1-C10- алкил)сульфонила, арилсульфонила или арила, где указанные арилы факультативно замещены 0-3 заместителями, выбранными из группы, состоящей из: C1-C4-алкила, C1-C4-алкокси, галоид, CF3 и NO2;
R15 выбирается из: H; C1-C10-алкила, C2-C10-алкенила, C2-C10-алкинила, C1-C10-алкокси, арила, гетероарила или C1-C10- алкоксикарбонила, CO2R5 или - C(=O)N(R5)R5a;
R16 выбирается из: -C(=O)-O-R18a; -C(=O)-R18b; -S(=O)2R18a;
R17 выбирается из: H или C1-C4-алкила;
R18a выбирается из: C1-C8-алкила; замещенного 0-2 R19; C2-C8-алкенила, замещенного 0-2 R19; C2-C8-алкинила, замещенного 0-2 R19; C3-C8-циклоалкила, замещенного 0-2 R19; арила, замещенного 0-4 R19; арил(C1-C6- алкила)-, замещенного 0-4 R19; гетероциклической системы, выбранной из пиридинила, фуранила, тиазолила, тиенила, пирролила, пиразолила, триазолила, имидазолила, бензофуранила, индолила, индолинила, хинолинила, изохинолинила, изоксазолинила, бензимидазолила, пиперидинила, тетрагидрофуранила, пиранила, пиридинила, 3H-индолила, карбазолила, пирролидинила, пиперидинила, индолинила или морфолинила, указанное гетероциклическое кольцо, замещено 0-2 R19; C1-C6-алкила, замещенного 5-10-членной гетероциклической системой, пиридинила, фуранила, тиазолила, тиенила, пирролила, пиразолила, имидазолила, бензофуранила, индолила, индолинила, хинолинила, изохинолинила, изоксазолинила, бензимидазолила, пиперидинила, тетрагидрофуранила, пиранила, пиридинила, 3H-индолила, карбазола, пирролидинила, пиперидинила, индолинила или морфолинила, указанное гетероциклическое кольцо замещено 0-2 R19.
[26] Более предпочтительными соединениями этого воплощения являются соединения формулы Ib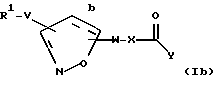
где R1 выбирается из R2(R3)N-, R2NH(R2N=)C-, R2R3N(CH2)p''-Z-, R2NH(R2N= )CNH(CH2)p'Z-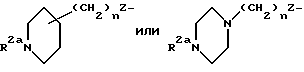
n = 0-1;
p' = 2-4;
p'' = 4-6;
Z выбирается из связи (т.е. отсутствует) или О;
R3 - это H или C1-C5-алкил;
V - одинарная связь (т.е. V отсутствует) или -(фенил)-;
X выбирается из: -CH2-, -CHN(R16)R17 или -CNHR5R5a;
Y выбирается: гидрокси; C1-C10-алкокси; метилкарбонилоксиметокси-; этилкарбонилоксиметокси-; t-бутилкарбонилоксиметокси-; циклогексилкарбонилоксиметокси-; 1-(метилкарбонилокси)этокси-; 1-(этилкарбонилокси)этокси-; 1-(t-бутилкарбонилокси)этокси-; 1-(циклогексилкарбонилокси)этокси-; i-пропилоксикарбонилоксиметокси-; t-бутилоксикарбонилоксиметокси-; 1-(i-пропилоксикарбонилокси)этокси-; 1 -(циклогексилоксикарбонилокси)этокси-; 1-(t-бутилоксикарбонилокси)этокси-; диметиламиноэтокси-; диэтиламиноэтокси-; (5-метил-1,3-диоксациклопентен-2-он-4-ил)метокси-; (5-(t-бутил)-1,3-диоксациклопентен-2-он-4-ил)метокси-; (1,3-диокса-5-фенил-циклопентен-2-он-4-ил)метокси-; 1-(2-(2- метоксипропил)карбонилокси)этокси-;
R18a выбирается из: C1-C4-алкила, замещенного 0-2 R19; C2-C4-алкенила, замещенного 0-2 R19; C2-C4-алкинила, замещенного 0-2 R19; C3-C4-циклоалкила, замешенного 0-2 R19; арила, замещенного 0-2 R19; арил(C1-C4- алкила)-, замещенного 0-2 R19; гетероциклической системы, выбранной из пиридинила, фуранила, тиазолила, тиенила, пирролила, пиразолила, триазолила, имидазолила, бензофуранила, индолила, индолинила, хинолинила, изохинолинила, изоксазолинила, бензимидазолила, пиперидинила, тетрагидрофуранила, пиранила, пиридинила, 3Н-индолила, карбазолила, пирролидинила, пиперидинила, индолинила или морфолинила, указанное гетероциклическое кольцо замещено 0-2 R19; C1-С6-алкила, замещенного 5-10-членной гетероциклической системой, пиридинила, фуранила, тиазолила, тиенила, пирролила, пиразолила, имидазолила, бензофуранила, индолила, индолинила, хинолинила, изохинолинила, изоксазолинила, бензимидазолила, пиперидинила, тетрагидрофуранила, пиранила, пиридинила, 3Н-индолила, индолила, карбазола, пирролидинила, пиперидинила, индолинила или морфолинила, указанное гетероциклическое кольцо замещено 0-2 R19.
[27] Более предпочтительными соединениями этого пятого воплощения являются соединения формулы Ib, где R1 - R2NH(R2N=)C- или R2NH(R2N=)CNH- и V - фенил или пиридил; или R1 - это
V - одинарная связь (т.е. V - отсутствует),
n = 1-2;
R3 - H или С1-C5-алкил;
X выбирается из: -CH2-, CHN(R16)R17 или -CHNR5R5a-;
W выбирается из
или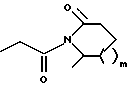
m = 1-3;
Y выбирается: гидрокси; C1-C10-алкокси; метилкарбонилоксиметокси-; этилкарбонилоксиметокси-; t-бутилкарбонилоксиметокси-; циклогексилкарбонилоксиметокси-; 1-(метилкарбонилокси)этокси-; 1-(этилкарбонилокси)этокси-; 1-(t-бутилкарбонилокси)этокси-; 1-(циклогексилкарбонилокси)этокси-; i-пропилоксикарбонилоксиметокси-; t-бутилоксикарбонилоксиметокси-; 1-(i-пропилоксикарбонилокси)этокси-; 1-(циклогексилоксикарбонилокси)этокси-; 1-(t-бутилоксикарбонилокси)этокси-; диметиламиноэтокси-; диэтиламиноэтокси-; (5-метил-1,3-диоксациклопентен-2-он-4-ил)метокси-; (5-(t-бутил)-1,3-диоксациклопентен-2-он-4-ил)метокси-; (1,3-диокса-5-фенил-циклопентен-2-он-4-ил)метокси-; 1-(2-(2-метоксипропил)карбонилокси)этокси-;
R19 - H, галоген, C1-C4-алкил, C3-C7-циклоалкил, циклопропилметил, арил или бензил;
R20 и R21 оба являются H;
R22 - это H, C1-C4-алкил или бензил.
[28] Особенно предпочтительными соединениями этого пятого воплощения являются соединения формулы 1b или формы их фармацевтически приемлемых солей, выбранные из:
2-(R, S)-2-карбоксиметил-1-{ 5-(R,S)-N-[3-(4-амидинофенил)изоксазолин-5- илацетил] пиперидин;
2-(R, S)-2-карбоксиметил-1-{ 5-(R,S)-N-[3- (4-амидинофенил)изоксазолин-5-илацетил]азепин;
2-(R, S)-2-карбоксиметил-1-{ 5-(R,S)-N-[3-(4-амидинофенил)изоксазолин-5- илацетил]пирролидин;
3-(R, S)-карбоксиметил-1-{ 5-(R, S)-N-[3-(4-амидинофенил)изоксазолин-5- илацетил]пиперазин-2-он;
6-(R, S)-карбоксиметил-1-{ 5-(R,S)-N-[3-(4- амидинофенил)изоксазолин-5-илацетил]пиперидин-2-он;
5-(R, S)-карбоксиметил-1-{ 5-(R,S)-N- [3-(4-амидинофенил)изоксазолин-5-илацетил]пирролидин-2-он;
7-(R, S)-карбоксиметил-1-{ 5-(R,S)-N-[3-(4- амидинофенил)изоксазолин-5-илацетил]азетидин-2-он;
2-(R, S)-карбоксиметил-1-{ 5-(R, S)-N-[3-(4-амидинофенил)изоксазолин-5- илацетил]пиразолидин;
3-(R, S)-карбоксиметил-4-{ 5-(R,S)-N-[3-(4- амидинофенил)изоксазолин-5-илацетил]морфолин.
В настоящем изобретении открыто, что вышеперечисленные соединения формулы I пригодны в качестве ингибиторов процессов адгезии между клеткой и матриксом и между клетками. Настоящее изобретение включает новые соединения формулы I и методы использования таких соединений для предотвращения или лечения заболеваний, развивающихся в результате ненормальной адгезии клеток с внеклеточным матриксом, включающие введение хозяину, нуждающемуся в таком лечении, терапевтически эффективного количества такого соединения формулы I.
В настоящем изобретении также открыто, что вышеперечисленные соединения формулы I пригодны в качестве ингибиторов гликопротеина IIb/IIIa (ГПIIb/IIIa). Соединения настоящего изобретения подавляют активацию и агрегацию тромбоцитов, вызываемую всему известными эндогенными агонистами тромбоцитов.
Настоящее изобретение также обеспечивает фармацевтические композиции, включающие соединение формулы I и фармацевтически приемлемый наполнитель.
Соединения формулы I настоящего изобретения пригодны для лечения (в том числе и предупреждения) тромбоэмболических осложнений. Используемый здесь
термин "тромбоэмболические осложнения" включает состояния, при которых происходит активация и агрегация тромбоцитов, такие как артериальные или венозные сердечно-сосудистые или связанные с сосудами мозга тромбоэмболические осложнения, в том числе, например, тромбоз, неустойчивая стенокардия, первый или повторяющиеся инфаркты миокарда, скоропостижная смерть от ишемической болезни, сердечный приступ, удар, атеросклероз, тромбофлебит, тромбоз вен, тромбоз глубокой вены, артериальная эмболия, тромбоз сердечной и мозговой артерий, инфаркт миокарда, церебральная эмболия, эмболия почек, эмболия легких или подобные заболевания, связанные c диабетом, включающие введение нуждающемуся в таком лечении млекопитающему терапевтически эффективного количества соединения формулы I, описанного выше.
Соединения формулы I настоящего изобретения могут быть пригодны для лечения или предупреждения других заболеваний, при которых протекают процессы слипания клеток, включая, но не ограничиваясь, воспалительный процесс, резорбцию кости, ревматоидный артрит, астму, аллергии, дыхательную недостаточность взрослых, реакцию "трансплантант против хозяина", отторжение пересаженных органов, септический шок, псориаз, экзему, контактный дерматит, остеопороз, остеоартрит, атеросклероз, опухоли, метастазы, диабетическую ретинопатию, воспалительное заболевание кишечника и другие аутоиммунные заболевания. Соединения формулы I настоящего изобретения также могут быть полезны при заживлении ран.
Соединения настоящего изобретения пригодны для подавления связывания фибриногена с тромбоцитами, подавления агрегации тромбоцитов, воздействия на образование тромба или эмбола или предупреждения образования тромба или эмбола у млекопитающих. Соединения этого изобретения могут использоваться как лекарства, блокирующие воздействие фибриногена на его рецепторы у млекопитающих.
Соединения настоящего изобретения могут вводиться больным, у которых необходимо предупредить тромбоз, подавляя связывание фибриногена с гликопротеиновым IIb/IIIa рецептором мембраны тромбоцитов. Они пригодны при хирургических операциях на периферических артериях (артериальный трансплантант, каротидная эндартектомия) и в сердечно-сосудистой хирургии, где коррекция артерий и органов и/или взаимодействие тромбоцитов с искусственными поверхностями приводит к агрегации тромбоцитов и истощению, и где агрегированные тромбоциты могут образовывать тромбы и тромбоэмболы. Соединения настоящего изобретения могут вводиться таким хирургическим больным для предупреждения образования тромбов и тромбоэмболов.
В сердечно-сосудистой хирургии для оксигенации крови обычно применяют экстракорпоральное кровообращение. Тромбоциты прилипают к поверхностям оборудования для экстракорпорального кровообращения. Адгезия зависит от взаимодействия между ГПIIb/IIIa на мембранах тромбоцитов и фибриногена, адсорбированного на поверхности оборудования. Тромбоциты, снятые с искусственных поверхностей, показывают нарушенную гомеостатическую функцию. Соединения этого изобретения могут вводиться для предотвращения такой агрегации in vivo.
Соединения настоящего изобретения могут использоваться для других in vivo применений для предотвращения адгезии клеток в биологических образцах.
Другие возможности применения этих соединений включают предупреждение тромбоцитарного тромбоза, тромбоэмболии и реокклюзии в процессе или после тромболитического лечения и предупреждения тромбоцитарного тромбоза, тромбоэмболии и реокклюзии после пластической операции на коронарной и других артериях и после шунтирования коронарной артерии. Соединения настоящего изобретения могут быть также использованы для предупреждения инфаркта миокарда. Соединения настоящего изобретения пригодны в качестве тромболитиков для лечения тромбоэмболических осложнений.
Соединения настоящего изобретения также могут вводиться в сочетании с одним или более дополнительным лекарственным препаратом, выбранным из: антикоагулянтов, или подавляющих коагуляцию соединений, таких как гепарин или варфарин; антитромбоцитарных, или подавляющих тромбоциты соединений, таких как аспирин, пироксикам или тиклопидин; ингибиторов тромбина, таких как боропептиды, хирудин или аргатробан; или тромболитических или фибринолитических соединений, таких как активаторы плазминогена, анистреплазы, урокиназы или стрептокиназы.
Соединения формулы I настоящего изобретения могут вводиться в сочетании с (одним или более из упомянутых выше) дополнительными лекарственными препаратами для того, чтобы уменьшить дозы каждого лекарственного препарата, требуемые для достижения желаемого терапевтического эффекта. Таким образом, комбинированное лечение настоящего изобретения позволяет применять более низкие дозы каждого компонента при уменьшении побочных токсических эффектов каждого компонента. Более низкая доза уменьшает вероятность побочных эффектов соединений, обеспечивая, таким образом, повышенный коэффициент безопасности по сравнению с коэффициентом безопасности каждого компонента при его использовании по отдельности. Такое комбинированное лечение может применяться для достижения синергических или аддитивных терапевтических эффектов при лечении тромбоэмболических осложнений.
Под "терапевтически эффективным количеством" подразумевается количество соединения формулы I, которое при введении по отдельности или в сочетании с дополнительным лекарственным препаратом в клетку или млекопитающему является эффективным для предупреждения или уменьшения интенсивности тромбоэмболического осложнения или прогрессирования заболевания.
Под "введенное в сочетании" или "комбинированное лечение" подразумевается, что соединение формулы I и один или более дополнительные лекарственные препараты вводятся совместно млекопитающему, которое подвергается лечению. При введении в сочетании каждый компонент может вводиться одновременно или последовательно в любом порядке в разные моменты времени. Таким образом, каждый компонент вводится отдельно, но достаточно близко по времени введения с тем, чтобы обеспечить желаемый терапевтический эффект.
Используемый здесь термин "противосвертывающие лекарственные средства" (или "подавляющие коагуляцию средства") обозначает средства, которые подавляют свертывание крови. Такие средства включают варфарин (доступный как Кумадин ТМ) и гепарин.
Используемый здесь термин "антитромбоцитарные средства" (или "подавляющие тромбоциты средства") обозначает препараты, подавляющие тромбоциты, а именно подавляющие агрегацию, адгезию или секрецию тромбоцитами гранулированного содержимого. К таким препаратам относятся различные известные нестероидные противовоспалительные препараты (НСПВП), а именно аспирин, ибупрофен, напроксен, сулиндак, индометацин, мефенамат, дроксикам, диклофенак, сульфинпиразон и пироксикам, включая фармацевтически приемлемые соли или их пролекарства. Из НСПВП аспирин (ацетилсалициловая кислота или АСК) и пироксикам. Пироксикам продается Pfizer Inc. (New York, NY) как Фелдан TM. Другие подходящие антитромбоцитарные препараты включают тиклопидин, в том числе фармацевтически приемлемые соли или его пролекарства. Тиклопидин также является предпочтительным соединением, поскольку известно, что он оказывает при использовании слабое воздействие на желудочно-кишечный тракт. Другие подходящие подавляющие тромбоциты препараты включают антагонисты рецептора тромбоксана А2 и ингибиторы тромбоксан А2-синтетазы, а также фармацевтически приемлемые соли или пролекарства из него.
Используемое здесь словосочетание "ингибиторы тромбина" (или противотромбинные препараты) обозначает ингибиторы сериновой протеазы тромбина. За счет подавления тромбина нарушаются различные опосредованные тромбином процессы, такие как вызываемая тромбином тромбоцитарная активация (т.е., например, агрегация тромбоцитов и/или секреция гранул ингибитора-1 активатора плазминогена и/или серотонина) и/или образование фибрина. К таким ингибиторам относятся производные бороаргинина и боропептиды, хирудин и аргатробан, включая фармацевтически приемлемые соли и пролекарства из них. Производные бороаргинина и боропептиды включают N-ацетил и пептидные производные борониевой кислоты, а именно С-концевые производные альфа-аминоборониевой кислоты, лизина, орнитина, аргинина, гомоаргинина, и соответствующие им изотиоурониевые аналоги. Используемый здесь термин хирудин включает соответствующие производные или аналоги хирудина, обозначенные здесь как хирулоги, а именно дисульфатохирудин. Боропептиды ингибиторов тромбина включают соединения, описанные Kettner et а1. в патенте США N 5187157 и Европейском патенте N 293881 А2, открытия которых включены в виде ссылок. Другие соответствующие производные бороаргинина и боропептиды-ингибиторы тромбина включают те, что открыты РСТ N 92/07869 и Европейским патентом N 471651 А2, открытия которых включены здесь в виде ссылок полностью.
Используемое здесь словосочетание "тромболитические (или фибринолитические) соединения" (или "тромболитики или фибринолитики") обозначает соединения, которые растворяют сгусток (тромб). Такие соединения включают тканевый активатор плазминогена, анистреплазу, урокиназу или стрептокиназу, в том числе фармацевтически приемлемые соли или пролекарства из них. Тканевый активатор плазминогена (ТАП) продается Genentech. Inc., South San Francisco, California. Используемый здесь термин "анистреплаза" относится к анизоилированному активирующему плазминоген стрептокиназному комплексу, как описано, например, в Европейском патенте N 028489, открытия которого сюда включены полностью в виде ссылок. Анистреплаза продается как ЭминазаТМ. Имеется в виду, что используемый здесь термин "урокиназа" обозначает урокиназу, имеющую как две, так и одну полипептидные цепи, последняя также обозначена здесь как проурокиназа.
Введение соединения формулы I этого изобретения в сочетании с таким дополнительным лекарственным препаратом может иметь преимущества в эффективности действия по сравнению с использованием соединений и препаратов по отдельности и может обеспечить это при использовании более низких доз каждого из препаратов. Более низкая доза уменьшает вероятность побочных эффектов, обеспечивая, таким образом, повышенный коэффициент безопасности.
Известно, что экспрессия ГПIIb/IIIa повышена в опухолевых клетках метастазов. Соединения или сочетание продуктов настоящего изобретения может быть также полезно в лечении, в том числе и предупреждении метастазирования при раке.
Соединения настоящего изобретения также пригодны в качестве стандартов или соединений для сравнения, например, как качественный стандарт или контроль в тестах или анализах, включающих связывание фибриногена с тромбоцитарным ГПIIb/IIIa. Такие соединения могут быть представлены в виде продажного набора, например, для использования в фармацевтическом исследовании с участием ГПIIb/IIIa. Соединения настоящего изобретения могут также использоваться в диагностических методах, включающих ГПIIb/IIIa.
Описанные здесь соединения могут иметь асимметричные центры. Если не указано иное, то все хиральные, диастереомерические и рацемические формы считаются включенными в настоящее изобретение. У описанных здесь соединений может существовать много геометрических изомеров олефинов, двойных связей C= N и т.п. Все такие стабильные изомеры предполагаются в данном изобретении. Следует учитывать, что соединения настоящего изобретения, содержащие асимметрически замещенные атомы углерода, могут быть выделены в оптически активной или рацемической формах. Хорошо известно, как получать оптически активные формы, а именно разделением рацемических смесей или синтезом из оптически активных исходных веществ. Предполагаются все хиральные, диастереомерические, рацемические формы и все геометрические структурные изомеры, если отдельно не указана специфическая стереохимия или форма изомера.
Если какая-либо переменная (например, но не ограничиваясь этим, R2, R4, R6, R7, R8, R12 и R14, n и т.д.) встречается более одного раза в каком-либо элементе или в какой-либо формуле, ее определение для каждого случая не зависит от ее определения для каждого другого случая. Так, например, если показано, что группа замещена 0-2 R4, то вышеуказанная группа может выборочно замещаться от 0 до 2 R4, и в каждом случае R4 выбирается независимо из определенного списка возможных R4. Также, к примеру для группы -N(R5a)2, каждый из двух заместителей R5a на N выбирается независимо из определенного списка возможных R5a. Также, к примеру для группы -C(R7)2-, каждый из двух заместителей R7 на C независимо выбирается из определенного списка возможных R7.
Когда показано, что связь к заместителю пересекает связь, соединяющую два атома в кольце, то такой заместитель может быть связан с любым атомом в кольце. Когда связь, соединяющая заместитель с другой группой, специально не показана или специально не указан атом, к которому присоединена другая группа, то такой заместитель может образовывать связь с любым атомом на такой другой группе.
Когда заместитель перечислен без указания атома, через который такой заместитель связан с остальной частью соединения формулы I, то такой заместитель может связываться через любой атом такого заместителя. Например, когда заместителем является пиперазинил, пиперидинил или тетразолил, если не оговорено иное, вышеуказанная пиперазинильная, пиперидинильная, тетразолильная группа может связываться с остальной частью соединения формулы I через любой атом в такой пиперазинильной, пиперидинильной, тетразолильной группе.
Сочетание заместителей и/или переменных допустимы только в том случае, если такие сочетания дают стабильные соединения. Под стабильным соединением или стабильной структурой здесь понимается соединение, которое достаточно прочно для того, чтобы выдержать выделение до подходящей степени чистоты из реакционной смеси и превращение в эффективный лекарственный препарат.
Используемый здесь термин "замещенный" обозначает, что какой-либо один или более атом водорода у обозначенного атома замещен по выбору указанной группой при условии, что не превышена обозначенная нормальная валентность атома и что замещение приводит к образованию стабильного соединения. Когда заместителем является кето (т.е. =O), то на атоме замещаются два атома водорода.
Имеется в виду, что используемый здесь термин "алкил" включает как разветвленные, так и неразветвленные насыщенные алифатические углеводородные радикалы, имеющие указанное количество атомов углерода (например, "C1-C10" обозначает алкил, имеющий от 1 до 10 атомов углерода); подразумевается, что "галоалкил" включает как разветвленные, так и неразветвленные насыщенные алифатические углеводородные радикалы с указанным количеством атомов углерода, замещенные одним или более атомом галогена (например, -CvFw, где v=1-3 и w= 1-(2v+1)); "алкокси" представляет собой алкильный радикал с указанным количеством атомов углерода, прикрепленный через кислородный мостик; имеется в виду, что "циклоалкил" включает насыщенные циклические радикалы, в том числе моно-, би- или полициклические системы колец, такие как циклопропил, циклобутил, циклопентил, циклогексил, циклооктил и адамантил; и имеется в виду, что "бициклоалкил" включает насыщенные бициклические радикалы, а именно [3.3.0] бициклооктан, [4.3.0] бициклононан, [4.4.0]бициклодекан (декалин), [2.2.2]бициклооктан и т.д. Имеется в виду, что "алкенил" включает либо разветвленные, либо неразветвленные углеводородные цепи с одной или более ненасыщенной связью углерод - углерод, которая может находиться в любой стабильной точке цепи, а именно этенил, пропенил и т.п.; и имеется в виду, что "алкинил" включает неразветвленные или разветвленные углеводородные цепи с одной или более тройными связями между атомами углерода, которые могут находиться в любой стабильной точке цепи, а именно этинил, пропинил и т.п.
Термины "алкилен", "алкенилен", "фенилен" и т.п. обозначают алкильные, алкенильные или фенильные радикалы соответственно, которые соединены двумя связями с остальной частью структуры формулы I. Такие "алкилен", "алкенилен", "фенилен" и т.п. могут поочередно и равнозначно обозначаться здесь как "-(алкил)-", "-(алкиенил)-" и "-(фенил)-" и т.п.
Используемые здесь "гало" или "галоген" относится к фтор-, хлор-, бром- и йод-; и "противоион" используется для обозначения небольших, отрицательно заряженных частиц, таких как хлорид, бромид, гидроксид, ацетата, сульфит и т.п.
Имеется в виду, что используемый здесь термин "арил", или "ароматический остаток", обозначает фенил или нафтил; "арилалкил" представляет собой арильный радикал, присоединенный через арильный мостик.
Имеется в виду, что используемый здесь термин "карбоцикл" или "карбоциклический радикал" обозначает любое стабильное 3-7-членное моноциклическое или бициклическое или 7-14-членное бициклическое или трициклическое или до 26-членное полициклическое углеродное кольцо, любое из которых может быть насыщенным, частично ненасыщенным или ароматическим. Примеры таких карбоциклов включают, но не ограничиваются, циклопропил, циклопентил, циклогексил, фенил, бифенил, нафтил, инданил, адамантил или тетрагидронафтил (тетралин).
Подразумевается, что используемый здесь термин "гетероцикл" или "гетероциклический" обозначает стабильное 5-7-членное моноциклическое или бициклическое или 7-10- членное бициклическое гетероциклическое кольцо, которое может быть насыщенным, частично ненасыщенным или ароматическим и которое состоит из атомов углерода и 1-4 гетероатомов, независимо выбранных из группы, состоящей из N, О и S, и где гетероатомы азота и серы могут быть выборочно окислены, и азот может по выбору иметь четыре связи, и включающее любой бициклический радикал, у которого любое из вышеопределенных гетероциклических колец конденсируется в бензольное кольцо. Гетероциклическое кольцо может прикрепляться к его дополнительной группе на любом гетероатоме или атоме углерода, что приводит к стабильной структуре. Описываемые здесь гетероциклические кольца могут быть замещены на атоме углерода или на атоме азота, если образующиеся соединения стабильны. Примеры таких гетероциклов включают, но не ограничиваются, пиридил (пиридинил), пиримидинил, фуранил (фурил), тиазолил, тиенил, пирролил, пиразолил, имидазолил, тетразолил, бензофуранил, бензотиофенил, индолил, индоленил, изоксазолинил, хинолинил, изохинолинил, бензимидазолил, пиперидинил, 4-пиперидонил, пирролидинил, 2-пирролидонил, пирролинил, тетрагидрофуранил, тетрагидрохинолинил, тетрагидроизохинолинил, декагидрозинолинил или октагидроизохинолинил, азоцинил, триазинил, 6H-1,2,5-тиадиазинил, 2H,6H-1,5,2-дитиазинил, тиантренил, пиранил, изобензофуранил, хроменил, ксантенил, феноксатиенил, 2H-пирролил, пирролил, имидазолил, пиразолил, изотиазолил, изоксазолил, оксазолил, пиридинил, пиразинил, пиримидинил, пиридазинил, индолизинил, изоиндолил, 3H-индолил, индолил, 1H-индазолил, пуринил, 4H-хинолизинил. изохинолинил, хинолинил, фталазинил, нафтиридинил, хиноксалинил, хиназолинил, циннолинил, птеридинил, 4аH-карбазол, карбазол, бета-карболинил, фенантридинил, акридинил, перимидинил, фенантролинил, феназинил, фенарсазинил, фенотиазинил, фуразанил, феноксазинил, изохроманил, хроманил, пирролидинил, пирролинил, имидазолидинил, имидазолинил, пиразолидинил, пиразолинил, пиперидинил, пиперазинил, индолинил, изоиндолинил, хинуклидинил, мофолинил или оксазолидинил. Включенными также являются конденсированное кольцо и спиросоединения, содержащие, например, вышеуказанные гетероциклы.
Используемый здесь термин "гетероарил" относится к ароматически гетероциклическим радикалам. Такие гетероарильные радикалы предпочтительно являются 5-6-членными моноциклическими радикалами или 8-10-членными конденсированными бициклическими радикалами. Примеры таких гетероарильных групп включают, но не ограничиваются, пиридил (пиридинил), пиримидинил, фуранил (фурил), тиазолил, тиенил, пирролил, пиразолил, имидазолил, индолил, изоксазолил, оксазолил, пиразинил, пиримидинил, пиридазинил, бензофуранил, бензотиенил, бензимидазолил, хинолинил или изохинолинил.
Используемый здесь термин "фармацевтически приемлемые соли" относится к производным открытых соединений, где исходное соединение формулы I модифицируется путем образования кислых или основных солей соединения формулы I. Примеры фармацевтически приемлемых солей включают, но не ограничиваются, солями неорганических или органических кислот основных остатков, таких как амины; щелочные или органические соли кислотных остатков, таких как карбоновые кислоты и т.п.
Предполагают, что "пролекарствами" являются любые ковалентно связанные наполнители, которые высвобождают активное исходное лекарство согласно формуле I in vivo при введении такого пролекарства млекопитающим. Пролекарства соединений формулы I готовят модифицируя функциональные группы соединений таким образом, чтобы модифицированные группы отщеплялись либо обычным способом, либо in vivo от исходных соединений. Пролекарства включают соединения формулы I, у которых гидроксильные, амино, сульфгидрильные или карбоксильные группы связаны с какой-либо группой, которая при введении млекопитающему отщепляется с образованием свободной гидроксильной, амино, сульфгидрильной или карбоксильной группы соответственно. Примеры пролекарств включают, но не ограничиваются, ацетаты, фомиаты, бензоаты спирта и функциональных аминогрупп соединений формулы I и т.п. Примеры типичных карбоксильных и амино пролекарств включены под определениями R2, R3 и Y.
Фармацевтически приемлемые соли соединений формулы I включают общепринятые нетоксичные соли или четвертичные соли аммония и соединения формулы I, образованные, например, с нетоксичными неорганическими или органическими кислотами. Например, такие общепринятые нетоксичные соли включают соли, полученные из неорганических кислот, таких как соляная, бромоводородная, серная, сульфаминовая, фосфорная, азотная и т.п., и соли, полученные из органических кислот, таких как уксусная, пропионовая, янтарная, гликолиевая, стеариновая, молочная, яблочная, винная, лимонная, аскорбиновая, памолевая, малеиновая, гидроксималеиновая, фенилуксусная, глутаминовая, бензойная, салициловая, сульфаниловая, 2-ацетоксибензойная, фумаровая, толуолсульфокислота, метансульфокислота, этансульфокислота, щавелевая, 2-оксиэтансульфокислота и т.д.
Фармацевтически приемлемые соли настоящего изобретения могут быть синтезированы из соединений формулы I, которые содержат основную или кислотную составляющую, общепринятыми химическими методами. Обычно соли получают взаимодействием свободного основания или кислоты со стехиометрическим количеством или с избытком желаемой солеобразующей неорганической или органической кислоты или основания в соответствующем растворителе или различных сочетаниях растворителей.
Фармацевтически приемлемые соли кислот формулы I с соответствующим количеством основания, а именно гидроксида щелочного или щелочно-земельного металла, например натрия, калия, лития, кальция или магния, или органического основания, а именно амино, например дибензилэтилендиамина, триметиламина, пиперидина, пирролидина, бензиламина и т.п., или четвертичного гидроксида аммония, а именно гидроксида тетраметиламмония.
Как обсуждалось выше, фармацевтически приемлемые соли соединений изобретения могут быть получены взаимодействием форм этих соединений в виде свободной кислоты или основания со стехиометрическим количеством соответствующего основания или кислоты, соответственно, в воде или в органическом растворителе или в их смеси; в основном, предпочтительна неводная среда, такая как эфир, этилацетат, этанол, изопропанол или ацетонитрил. Список соответствующих солей находится в Remington's Pharmaceutical Sciences, 17th ed., Mack Publishing Company, Easton, PA, 1985, p. 1418, включенном здесь в виде ссылки.
Все упоминаемые здесь источники включены полностью в виде ссылок.
Синтез
Соединения настоящего изобретения могут быть получены разными путями, известными специалистам в области органического синтеза. Соединения настоящего изобретения могут быть синтезированы описанными ниже методами, а также методами, известными в органическом синтезе или их разновидностями, известными специалистам в этой области. Предпочтительные методы включают, но не ограничиваются, описанные ниже методы. Все указанные здесь источники включены полностью в виде ссылок.
В тексте используются следующие сокращения:
β-Ala - 3-аминопропионовая кислота
Boc - трет-бутилоксикарбонил
Boc2O - ди-трет-бутилдикарбонат
BSTFA - N,O-биc(тpимeтилcилил)тpифтopмeтилaцeтaмид
Cbz - бензилоксикарбонил
DCC - 1,3-дициклогексилкарбодимид
DEAD - диэтилазодикарбоксилат
DEC - гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодимид
DIEA - диизопропилэтиламин
DCHA - дициклогексиламин
DCM - дихлорметан
DMAP - 4-диметиламинопиридин
DMF - N,N-димeтилфopмaмид
EtOAc - этилацетат
EtOH - этиловый спирт
HOBt - 1-гидроксибензотриазол
IBCF - изобутилхлороформиат
LAH - гидрид лития аллюминия
NCS - N-хлорсукцинимид
NMM - N-метилморфолин
PPh3 - трифенилфосфин
pyr - пиридин
TBTU - 2-(1 Н-бензотриазол-1 -ил)-1,1,3,3-тетраметилурония тетрафторборат
TFA - трифторуксусная кислота
THF - тетрагидрофуран
Традиционный метод синтеза соединений этого изобретения включает диполярное циклоприсоединение оксидов нитрила к соответствующим диполярофилам для получения изоксазолиновых колец, присутствующих в соединениях формулы I (для обзоров химии 1,3-диполярного циклоприсоединения см. 1,3-Dipolar Cycloaddition Chemistry (Padwa. ed. ), Wiley, New York. 1984; Kanemasa and Tsuge, Heterocycles 1190,30,719).
На схеме I (см. в конце описания) изображена последовательность синтеза соединений второго воплощения этого изобретения. Соответственно замещенный гидроксиламин обрабатывается NCS в DMF в соответствии с методом Liu et al. (J. Org. Chem. 1980, 45, 3916). Получающийся хлорид гидроксиминоила затем дигидрогалогенируют in situ, используя TEA для получения оксида нитрила, который подвергается 1,3-диполярному циклоприсоединению к соответственно замещенному алкену, давая изоксазолин. Или же оксим может быть окислительно хлорирован, дегидрохлорирован и получающийся оксид нитрила улавливают соответствующим алкеном в условиях переноса фаз в соответствии с методом Lee (Synthesis 1982, 508). Гидролиз эфира традиционными методами, известными специалистам в области органического синтеза, дает желаемые кислоты. У промежуточных соединений, содержащих чувствительные к щелочи функциональные группы, такие как нитрил, может отщепляться эфир с превосходной хемоизбирательностью при помощи триметилсиланолата натрия в соответствии с методом Laganis и Ehenard (Tetrahedron Lett. 1984, 25, 5831). Соединение получающихся кислот с соответственно замещенным альфа- или бета-аминоэфиром с использованием стандартных реагентов, таких как DCC/HOBt, для получения нитриламида. Затем нитрил превращается в амидин через имидат или тиоимидат при стандартных условиях с последующим омылением эфира (LiOH, THF/H2O).
Пример родственного метода получения соединений второго воплощения настоящего изобретения представлен на схеме Ia (см. в конце описания). Превращение 3-(4-цианофенил) -изоксазолин-5-ил-уксусной кислоты в соответствующий амидин с последующей защитой в виде Вос-производного и омылением дает 3-(4-Вос-амидинофенил)изоксазолин -5-ил-уксусную кислоту, которая соединяется, как показано, с эфиром бета-аминокислоты. Отделение протектора дает желаемые бета-аминоаланиновые эфиры изоксазолинилуксусной кислоты. Описанное омыление дает свободные кислоты.
Еще один пример синтеза соединений второго воплощения показан на схеме Iб (см. в конце описания). Циклоприсоединение продажных 4-цианостирола и t-бутилформилоксима по методу, описанному Gree et al. (Bioorganic and Med. Chem. Lett. , 1994, 253) дает t-бутил[5-(4-цианофенил)изоксазолин-3- ил] ацетат. Используя описанные методы, это промежуточное соединение превращают в соединение формулы I, где изоксазолиновое кольцо обратно ориентировано по отношению к соединениям, полученным по схемам I и Iа.
Другие изоксазолинилацетаты, пригодные в качестве исходных веществ для получения соединений формулы I, у которых V - это - (фенил)-Q- и Q не является одинарной связью, могут быть получены циклоприсоединением соответственно замещенного хлор- или бромоксима к эфиру винилуксусной кислоты, как показано на схеме Iв (см. в конце описания), используя описанные в литературе методы или их модификации (D.P. Curran & J. Chao, J. Org. Chem. 1988, 53, 5369-71; J.N. Kim & E.K. Ryu, Heterocycles, 1990, 31, 1693-97).
Соединения настоящего изобретения, где R2 или R3 является, например, алкоксикарбонилом, можно получать взаимодействием свободных амидинов, аминов или гуанидинов с активированным производным карбонила, таких как алкилхлорформиат. У соединений второго воплощения превращение свободных аминов, амидинов и гуанидинов в такие группы ацил-азот можно факультативно проводить до соединения изоксазолинуксусной кислоты с, например, бета-аминокислотами, что показано на схеме Iа.
Соединения настоящего изобретения, у которых Y - оксиалкокси радикал, например алкоксикарбонилоксиалкокси, можно получать взаимодействием соответственно замещенной карбоновой кислоты формулы I, например алкоксикарбонилоксиалкилхлоридом, в присутствии источника йода, такого как йодид тетрабутиламмония или йодида калия, и акцептора кислоты, такого как триэтиламин или карбонат калия, используя известные специалистам методы.
Соответственно замещенные рацемические бета-аминокислоты можно купить или, как показано на схеме II (см. в конце описания), метод 1, получить из соответствующего альдегида, малоновой кислоты и ацетата аммония в соответствии с методом Johnson и Livak (J. Am. Chem. Soc. 1936, 58, 299). Эфиры рацемических бета-замещенных-бета-аминокислот можно получать через взаимодействие диалкилкупратов или алкиллития с 4-бензоилокси-2-азетидином с последующей обработкой безводным этанолом (схема II, метод 2) или восстановительным аминированием бета-кетоэфиров, как описано в WO 9316038 (также см. Rico et al., J. Org. Chem. 1993, 58, 7948-51). Энантиомерически чистые бета-замещенные-бета-аминокислоты можно получать через оптическое расщепление смеси рацематов или их можно получать используя многочисленные методы, в том числе: получение гомологов соответствующих альфа-аминокислот по реакции Арндта-Айстерта (гомологизация Арндта-Айстерта), как показано на схеме II, метод 3 (см. Meier and Zeller, Angew. Chem. Int. Ed. Engl. 1975, 14, 32: Rodriquez et al. Tetrahedron Lett. 1990, 31, 5153; Greenlee, J. Med. Chem. 1985, 28, 434 и цитируемые в них источники); и через энантиоселективное гидрирование дегидроаминокислоты, как показано на схеме II, метод 4 (см. Asymmetric Synthesis. Vol. 5, (Morrison, ed.) Academic Press, New York 1985). Всестороннее исследование получения производных бета-аминокислот можно найти в заявке патента WO 9307867, открытие которого здесь включено в виде ссылки.
Синтез производных N2-замещенной диаминопропионовой кислоты можно проводить через перегруппировку Гофмана из разных производных аспарагина, как описано в Synthesis, 266-267 (1981).
Соответственно замещенные пирролидин-, пиперидин- и гексагидроазепин уксусных кислот можно получать используя большое количество методов. Пирролидины обычно получают реакцией Арндта-Айстерта из соответствующего пролина, как показано на схеме III (см. в конце описания), метод 1 (см. Meier and Zeller, Angew. Chem. Int. Ed. Engl. 1975, 14, 32; Rodriquez et al. Tetrahedron Lett. 1990, 31, 5153; Greenlee, J. Med. Chem. 1985, 28, 434 и цитируемые в них источники). Пиперидины можно получать восстановлением соответствующего пиридина, как показано на схеме III, метод 2. Гексагидроазепины получают восстановлением соответствующего винилогичного амида, используя цианоборогидрид натрия, как указано на схеме III, метод 3.
Многие дополнительные соответственно замещенные гетероциклы имеются в продаже или могут быть легко модифицированы известными специалистам методами. Соответственно замещенные морфолины могут быть получены из аминокислоты через последовательность шагов, указанных на схеме IIIа (см. в конце описания), метод 1 (см. Brown et аl., J. Chem. Soc. Perkin Trans I, 1987, 547; Bettoni et al. Tetrahedron 1980, 36, 409; Clarke, F.H. J. Org. Chem. 1962, 27, 3251 и цитируемые источники).
N-этоксикарбонилметил-1,2-диазогетероциклы получают конденсацией соответственно замещенных дибромидов с бензилгидразином с последующей реакцией Митсаноба с этилацетатом и отщеплением протектора, как показано на схеме IIIa, метод 2 (см. Kornet, et al. J. Pharm. Sci 1979, 68, 377; Barcza, et al. J. Org. Chem. 1976, 41, 1244 и цитируемые источники).
Общий протокол синтеза соединений первого воплощения этого изобретения изображен на схеме IV (см. в конце описания). Проводится соединение подходящего Вос-защищенного аминоспирта с соответственно замещенным фенолом в условиях Митсаноба (см. Mitsunobu, Synthesis 1981, 1), за которым следует оксимирование при участии солянокислотного гидроксиламина в этанол/пиридине (1: 1). Образование изоксазолина, омыление эфира и отщепление Boc (33% TFA/DCM) дает соединения этого изобретения с хорошим выходом.
Синтез спироконденсированных имидов изоксазолина третьего воплощения настоящего изобретения представлен общим протоколом, изображенным на схеме V (см. в конце описания).
Диполярное циклоприсоединение гидроксииминохлорида к альфа-метиленовому эфиру двухосновной кислоты дает изоксазолиновый диэфир, от которого отщепляют эфир, используя силанолат. Дегидратация до ангидрида по Ishihara et al. (Chem. Pharm. Bull. 1992, 40, 1177-85) с последующим образованием имида с использованием соответственно замещенного аминоэфира дает спироцикл. Или же имид можно получать непосредственно из диэфира изоксазолина согласно Culbertson et al. (J. Med. Chem. 1990, 33, 2270-75). Образование амидина или отщепление Boc с последующим омылением эфира дает соединения этого изобретения с хорошим выходом.
Синтез спироконденсированных изоксазолиновых амидов третьего воплощения настоящего изобретения представлен общим протоколом, изображенным на схеме VI (см. в конце описания). Диполярное циклоприсоединение гидроксиминохлорида к альфа-метиленлактону дает изоксазолинлактон, который взаимодействует с соответствующим аминоэфиром с образованием амида (см. The Chemistry of the Amides (Zabicky, ed. ), p. 96, Interscience, New York, 1970; Prelog et al. Hely. Chim. Acta. 1959, 42, 1310; Inubushi wr al., J. Chem. Soc., Chem. Commun. 1972, 1252). Образование амидина или отщепление Boc с последующим омылением эфира дает соединения этого изобретения с хорошим общим выходом.
Синтез спироконденсированных изоксазолиновых циклоалкенов третьего воплощения настоящего изобретения представлен общим протоколом, изображенным на схеме VII (см. в конце описания). Диполярное циклоприсоединение гидроксииминохлорида к соответственно замещенному альфа-метиленлактону дает изоксазолинлактон. Затем проводят взаимодействие лактона с соответствующим диметилалкилфосфонатом лития, за которым следует окисление PCC. Получающийся дикетофосфонат подвергается внутримолекулярной реакции Виттинга в присутствии K2CO3/18-крон-6 в соответствии с методом, описанным Lim и Marquez (Tetrahedron Lett. 1983, 24, 5559). Образование амидина или отщепление Вос с последующим омылением эфира дает соединения этого изобретения с хорошим общим выходом.
Диполярофилы, используемые для получения соединений настоящего изобретения, можно получать многочисленными методами. Эфир ω-алкеноловой кислоты, один из классов диполярофилов, можно купить или получить окислением соответствующих ω-алкенолов по методу Corey и Schmidt (Tetrahedron Lett. 1979, 399, схема VIII (см. в конце описания), метод 1). Альфа-метиленовый эфир двухосновной карбоновой кислоты и альфа-метиленлактон, другой класс диполярофилов, можно купить или получать различными способами из соответствующего эфира двухосновной кислоты (см. Osbond., J. Chem. Soc. 1951, 3464; Ames and Davey, J. Chem. Soc. 1958, 1794; Hiroi, J. Che. Soc., Chem. Commun. 1972, 1317, схема VIII, метод 2). 3-(стирол)пропионовый эфир можно получать катализируемым палладием перекрестным соединением соответственно замещенной бром- или йод-бета-фенилпропионовой кислоты с винилацетатом согласно методам, упоминаемым Mitchell (Synthesis 1992, 803) и Stille (Angew. Chem. Int. Ed. Engl. 1986, 25, 508, схема VIII, метод 3).
Соединения формулы I, у которых b - это двойная связь, можно получить используя один из путей, указанных на схеме IX (см. в конце описания). Бромирование с последующим дегидробромированием соответственно замещенного метил 3- (цианофенил)изоксазолин-5-илацетата, полученного как описано выше, используя метод Elkasaby & Salem (Indian J. Chem., 1980, 1913, 571-575), дает соответствующее промежуточное соединение изоксазола. Или же этот промежуточный продукт может быть получен 1,3-диполярным циклоприсоединением оксида цианофенилнитрила (полученного из соответствующего хлороксима, как описано на схеме I) к соответствующему алкину с образованием непосредственно изоксазола. Гидролиз эфира традиционными методами, известными специалистам в области органического синтеза, дает уксусные кислоты. Соединение образующихся кислот с соответственно замещенным альфа- или бета- аминоэфиром, используя стандартные реактивы, такие как TBTU, дает нитрил-амид. Затем нитрил превращают в имидин через имидат или тиоимидат при стандартных условиях с образованием эфиров пролекарств. Омыление приводит к образованию кислот.
Соединения формулы I, где R1 является (R2)(R3)N(R2N=)CN(R2)- и V является фениленом, получают как показано на схеме X (см. в конце описания). Циклоприсоединение соответственно N-замещенного аминофенилальдоксима к t-бутиловому эфиру
винилуксусной кислоты в условиях, описанных выше, дает t-бутил[3-(4-t- бутилоксикарбониламинофенил)изоксазолин -5-ил]ацетат. Гидролиз эфира гидроксидом лития дает свободную кислоту, которая может быть сцеплена с соответственно замещенным метил 3-аминопропионатом, как описано ранее. После отщепления защитной группы анилин превращается в соответствующий гуанидин по методу, описанному Kim et al. (Tetrahedrom Lett., 1993, 48, 7677). Окончательный этап отщепления Boc-группы дает гуанидиносоединения формулы I.
Соединения этого изобретения и их получение могут быть далее поняты из следующих методов и примеров, которые иллюстрируют, но не ограничивают рамки этого изобретения.
Пример 1
3-[4-(2-пиперидин-4-ил)этоксифенил] -(5R, S)- изоксазолин-5-ил-уксусная кислота, соль трифторуксусной кислоты
Часть А. Получение 2-(4-N-t-бутилоксикарбонилпиперидинил)этанола.
Это вещество получали из 4-пиперидин-2-этанола в соответствии с Европейской заявкой патента, номер публикации 478363 A2.
Часть Б. 4-[(2-N-t-бутилоксикарбонилпиперидин-4- ил) этокси]бензальдегид.
К раствору 2-(4-N-t-бутилоксикарбонилпиперидинил)этанола (7,71 г, 33,6 ммоль), 4-гидроксибензальдегида (4,11 г, 33,6 ммоль) и PPh3 (8,82 г, 33,6 ммоль) в THF (60 мл) при -20oC добавляли раствор DEAD (5,3 мл, 33,7 ммоль) в THF (30 мл) в течение 2 ч. В процессе добавления образовывался раствор насыщенного красного цвета, который менял окраску на золотую при нагревании в течение ночи (18 ч) до комнатной температуры. В этот момент раствор концентрировали и перерастворяли в EtOAc. Затем его промывали водой, 0,1 М HCl, 1 М NaOH, насыщенным NaCl и высушивали (MgSO4). Концентрирование давало твердый остаток (примерно 20 г), который очищали флэш-хроматографией (ступенчатый градиент 10-20-30-40-50% EtOAc/гексан), получая после достижения постоянной массы 7,82 г (70%) желаемого эфира; tпл 76,4 -79,7oC; 1H ЯМР (300 МГц, CDCl3) δ 9,88 (s, 1H), 7,83 (d, J=8,4 Гц, 2H), 6,98 (d, J=8,4 Гц, 2H), 4,10 (bd, J= 12,8 Гц, 2H), 4,04 (t, J=6,6 Гц, 2H), 2,69 (bt, 2H), 1,84 (m, 2H), 1,70 (bd J=14,3 Гц, 2H), 1,46 (s, 9H, перекрывание с m, 2H), 1,10 (m, 2H).
Часть В. 4-[(2-N-t-бутилоксикарбонилпиперидин-4- ил)этокси]бензальдоксим.
К раствору 4-[(2-N-t-бутилоксикарбонилпиперидин-4-ил)этокси]бензальдегида (3,16 г, 9,48 ммоль) в MeOH (20 мл) добавляли солянокислый гидроксиламин (1,27 г, 18,3 ммоль) и 2 М NaOH (7 мл, 14 ммоль). Получающуюся суспензию перемешивали ночь при комнатной температуре (18 ч). pH смеси доводили 1 М HCl до 4, затем смесь фильтровали и промывали водой. Кристаллы высушивали под вакуумом над P2O5, получая 2,88 г (87%); tпл 114,4-116,1oC; 1H ЯМР (300 МГц, CDCl3) δ 8,09 (s, 1H), 7,51 (d, J=8,8 Гц, 2H), 6,89 (d, J=8,8 Гц, 2H), 4,10 (b, 2H), 4,03 (t, J=6,2 Гц, 2H), 2,71 (bt, 2H), 1,73 (m, 4H), 1,46 (s, 9H), 1,19 (m, 2H).
Часть Г. 4-[(2-N-t-бутилоксикарбонилпиперидин-4-ил)этокси] бензальдоксиминоил хлорид.
К раствору 4-[(2-N-t- бутилоксикарбонилпиперидин-4-ил)этокси] бензальдоксима (955 мг, 2,74 ммоль) в DMF (5 мл) добавляли тремя порциями NCS (366 мг, 2,74 ммоль). Через 2 ч раствор разбавляли EtOAc и промывали водой, насыщенным NaCl, высушивали (MgSO4) и концентрировали. Получающийся твердый остаток перекристаллизовывали из эфир/гексана, получая 548 мг (52%) оксиминоилхлорида; tпл 119,3-119,9oC; 1H ЯМР (300 МГц, CDCl3) 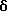 8,37 (bs, 1H), 7,77 (d, J= 8,8 Гц, 2H), 6,88 (d, J=8,8 Гц, 2H), 4,12 (bd,J=13,2 Гц, 2H), 4,04 (t, J= 6,2 Гц, 2H), 2,72 (bt, J=12,1 Гц, 2H), 1,70 (m, 5H), 1,46 (s, 9H), 1,10 (m, 2H).
8,37 (bs, 1H), 7,77 (d, J= 8,8 Гц, 2H), 6,88 (d, J=8,8 Гц, 2H), 4,12 (bd,J=13,2 Гц, 2H), 4,04 (t, J= 6,2 Гц, 2H), 2,72 (bt, J=12,1 Гц, 2H), 1,70 (m, 5H), 1,46 (s, 9H), 1,10 (m, 2H).
Часть Д. Метил 3-[4-{(2-N-t-бутилоксикарбонилпиперидин-4- ил)этокси}фенил]-(5R,S) -изоксазолин-5-илацетат.
К раствору 4-[(2-N-t-бутилоксикарбонилпиперидин-4-ил)этокси] бензальдоксиминоил хлорида (400 мг, 1,045 ммоль) и метил 3-бутеноата (200 мг, 2,00 ммоль) добавляли TEA (0,15 мл, 1,1 ммоль). Получающуюся суспензию нагревали с обратным холодильником 5 ч, охлаждали до комнатной температуры и разбавляли EtOAc. Затем промывали 0,1 М HCl, водой, насыщенным NaCl, высушивали (MgSO4) и концентрировали. Получающийся твердый остаток перекристаллизовывали из DCM/гексанов, получая 357 мг (77%) изоксазолина; tпл 139,1- 140,9oC; 1H ЯМР (300 МГц, CDCl3) δ 7,59 (d, J=8,8 Гц, 2H), 6,90 (d, J=8,8 Гц, 2H), 5,08 (m, 1H), 4,10 (bd, J=13,2 Гц, 2H), 4,04 (t, J=5,9 Гц, 2H), 3,73 (s, 3H), 3,53 (dd, J= 16,5, 10,1 Гц, 1H), 3,10 (dd, J=16,8, 7,1 Гц, 1H), 2,88 (dd, J= 16,1, 5,9 Гц, 1H), 2,71 (bt, J=12,8 Гц, 2H), 2,64 (dd, J=15,8, 7,7 Гц, 1H), 1,72 (m, 5H), 1,46 (s, 9H), 1,08 (m, 2H).
Часть Е. 3-[4-{(2-N-t-бутилоксикарбонилпиперидин -4- ил)этокси}фенил]-(5R,S) -изоксазолин-5-ил -уксусная кислота.
К раствору 3-[4-{(2-N-t-бутилоксикарбонилпиперидин-4-ил)этокси} фенил]- (5R, S)-изоксазолин-5-илацетата (47 мг, 0,105 ммоль) в THF (2 мл) добавляли 0,5 М LiOH (1 мл, 0,5 ммоль). Смесь перемешивали 5 ч при комнатной температуре, затем подкисляли до pH 3 0,1 М HCl. Смесь промывали DCM и объединенную органическую фракцию высушивали (MgSO4) и концентрировали. Получающийся твердый остаток перекристаллизовывали из EtOAc/гексанов. получая 34 мг (74%) карбоновой кислоты; tпл 169,1-170,6oC; 1H ЯМР (300 МГц, CDCl3) δ 7,60 (d, J= 8,8 Гц, 2H), 6,91 (d, J=8,8 Гц, 2H), 5,10 (m, 1H), 4,08 (bd, 2H, перекрывание с t, J=5,9 Гц, 2H), 3,55 (dd, J=16,5, 10,2 Гц, 1H), 3,11 (dd, J=16,8, 7,0 Гц, 1H), 2,93 (dd, J=16,1, 6,2 Гц, 1H), 2,71 (m, 3H), 2,00 (m, 2H), 1,72 (m, 5H), 1,46 (s, 9H).
Часть Ж. 3-[4-(2-пиперидин-4-ил) этоксифенил]-(5R,S)- изоксазолин -5-ил-уксусная кислота, соль трифторуксусной кислоты.
К раствору 3-[4-{(2-N-t-бутилоксикарбонилпиперидин-4- ил) этокси}фенил]- (5R, S)-изоксазолин-5-ил-уксусной кислоты (53 мг, 0,12 ммоль) в DCM (2 мл) добавляли TFA (1 мл, 13 ммоль). Через 1,5 ч продукт кристаллизовали добавлением эфира, получая 33 мг (60%) аминокислоты; tпл 142,4-143,1oC; 1H ЯМР (300 МГц, CDCl3) δ 7,59 (dd, J=8,8, 2,6 Гц, 2H), 6,96 (dd, J=8,8, 2,6 Гц, 2H), 5,03 (m, 1H), 4,10 (m, 2H), 3,55 (ddd, J=16,8, 10,3, 2,2 Гц, IH), 3,38 (bd, J= 12,4 Гц, 2H), 3,16 (ddd, J=17,2, 7,7, 2,2 Гц, IH), 2,98 (bt, J=13,2 Гц, 2H), 2,69 (m, 2H), 2,01 (bd, J=14,3 Гц, 2H), 1,91 (m, 1H), 1,80 (m, 2H), 1,46 (m, 2H).
Пример 4
(2S)-(5R, S)-[3-[4-{ (2-пиперидин-4- ил)этокси} фенил]изоксазолин-5- ил{ [(бензилокси)карбонил] амино}]ацетат, соль трифторуксусной кислоты
Часть А. Бензил-L-2-[[(бензилокси)карбонил] амино]-3-бутеноат.
Это соединение получали из альфа-бензилового эфира N-Cbz-L- глутаминовой кислоты согласно Krol et al. (J. Org. Chem. 1991, 728).
Часть Б. Бензил (2S)-(5R,S)-[3-[4-{(N-t- бутилоксикарбонилпиперидин-4- ил)этокси} фенил] изоксазолин-5- ил{[бензилокси)карбонил] амино}]ацетат.
К раствору 4-[(2-N-t- бутилоксикарбонилпиперидин-4 -ил)этокси]бензальдоксима (852 мг, 2,44 моль) и бензил L-2- [[бензилокси)карбонил]амино]-3-бутеноата (612 мг, 1,88 ммоль) в DCM (10 мл) добавляли 5% NaOCl (общепринятый бытовой отбеливатель, 4 мл, 2,8 ммоль). Смесь быстро перемешивали при комнатной температуре в течение 22 ч, после чего разбавляли водой и DCM. После разделения слоев водный слой промывали DCM (3х). Объединенные органические экстракты высушивали (MgSO4) и концентрировали in vacuo, получая 1,4 г. Последующая очистка флэш-хроматографией (10% EtOAc/гексаны - 30% EtOAc/гексаны) давала 886 мг (70%) маслянистого продукта в виде смеси 2,5:1 эритро- и трео-изомеров; 1H ЯМР (400 МГц, CDCl3) δ 7,50 (m, 2H), 7,34 (m, 5H), 7,23 (m, 5H), 6,87 (d, J=8,8 Гц, 2H), 5,47 (bd, 1H), 5,12 (m, 5H), 4,60 (m, 1H), 4,07 (m, перекрывание с 4,03 t, J=6,1 Гц, 4H), 3,36 (m, 2H), 2,71 (bt, J=12,7 Гц, 2H), 1,70 (m, 5H), 1,45 (s, 9H), 1,18 (m, 2H).
Вычислено для С38H45N3O8: С 67,93; H 6,76; N 6,26. Найдено: С 67,95; H 6,77; N 6,17.
Часть В. (2S)-(5R, S)-[3-[4-{ (2-N-t- бутилоксикарбонилпиперидин -4-ил)этокси} фенил] изоксазолин-5- ил{[(бензилокси)карбонил] амино}] уксусная кислота.
Раствор бензил (2S)-(5R, S)-[3-[4- {(N-t-бутилоксикарбонилпиперидин-4- ил)этокси}фенил] изоксазолин-5- ил{[бензилокси)карбонил] амино}]ацетата (875 мг, 1,302 ммоль) в THF (5 мл) омыляли в течение 5 ч 0,5 М LiOH (3,5 мл) согласно примеру 1, часть Ж. К неочищенному продукту добавляли метанол, вызывая кристаллизацию одного из диастереомеров. Фильтрация и откачивание до постоянной массы давали 295 мг (39%); tпл 216,1oC; 1H ЯМР (400 МГц, DMSO-d6, 80oC) δ 7,50 (d, J=8,9 Гц, 2H), 7,23 (s, 5H), 6,96 (d, J=8,9 Гц, 2H), 6,17 (bs, 1H), 4,99 (m, 3H), 4,07 (t, J=6,1 Гц, 2H), 3,90 (m, 3H), 3,35 (d, J=9,3 Гц, 2H), 2,72 (bt, J=12,4 Гц, 2H), 1,67 (m, 5H), 1,39 (s, 9H), 1,08 (m, 2H). Фильтрат концентрировали in vacuo и откачивали до достижения постоянной массы, получая 200 мг (26%) карбоновых кислот в виде смеси эритро- и трео-изомеров; ТСХ (силикагель 60; 20% MeOH/CHCl3) Rf= 0,23. Масс-спектр (ESI, e/z, относительное содержание) 582 (М+Н)+, 32%; 526 (M-С4H9 + H2)+, 100%; 482 (M-Boc + H2)+, 91%.
Часть Г. (2S)-(5R,S)-[3-[4- {(2-пиперидин-4- ил)этокси} фенил]изоксазолин-5- ил{[(бензилокси) карбонил]амино}] уксусная кислота (изомер А).
От (2S)-(5R, S)-[3-[4-{(2-N-t- бутилоксикарбонилпиперидин-4-ил) этокси} фенил] изоксазолин-5-ил{ [(бензилокси) карбонил]амино}]уксусной кислоты (23 мг, 0,039 ммоль) отщепляли Boc, используя 33% TFA/DCM согласно примеру 1, часть 3, получая 15 мг (79%); tпл 302oC (разложение); 1H ЯМР (400 МГц, DMSO-d6, 60oC) δ 7,57 (d, J=8,8 Гц, 2H), 7,30 (s, 5H), 6,99 (d, J=8,8 Гц, 2H), 5,05 (s, 2H, совпадает с m, 1H), 4,35 (d, J=4,9 Гц, 1H), 4,09 (t, J=6,l Гц, 2H), 3,52 (dd, J=17,3, 10,7 Гц, 1H), 3,26 (m, 3H), 2,88 (dt, J=12,7, 2,7 Гц, 2H), 1,88 (bd, J=14,4 Гц, 2H), 1,80 (m, 1H), 1,72 (m, 2H), 1,38 (m, 2H).
Часть Г'. (2S)-(5R,S)-[3- [4-{(2-пиперидин-4- ил)этокси} фенил]изоксазолин-5- ил{[(бензилокси) карбонил]амино}]уксусная кислота (изомер Б).
От (2S)-(5R, S)-[3-[4-{(2-N-t -бутилоксикарбонилпиперидин-4-ил) этокси} фенил] изоксазолин-5-ил{ [(бензилокси) карбонил]амино}]уксусной кислоты (23 мг, 0,039 ммоль) отщепляли Boc, используя 33% TFA/DCM согласно примеру 1, часть 3, получая 3 мг (2%) соли TFA; tпл > 400oC; 1H ЯМР (400 МГц, DMSO-d6, 60oC) δ 8,48 (bs, 0,5H), 8,15 (bs, 0,5H), 7,55 (d, J=8,9 Гц, 2H), 7,30 (m, 5H), 6,97 (d, J=8,9 Гц, 2H), 5,05 (s, 2H), 4,96 (m, 1H), 4,33 (m, 1H), 4,07 (t, J= 6,3 Гц, 2H), 3,38 (m, 2H), 3,26 (bd, J=12,0 Гц, 2H), 2,87 (m, 2H), 1,86 (bd, J= 14,2 Гц, 2H), 1,78 (m, 1H), 1,70 (кажущаяся q, J=6,3 Гц, 2H), 1,36 (bq, J= 13,2 Гц, 2H).
Пример 6
3-(3-[4-(пиперидин-4-илметокси) фенил] -(5R, S)- изоксазолин -5-ил)пропионовая кислота, соль трифторуксусной кислоты
Часть А. Этил-N-t-бутилоксикарбонилпиеридин-4-карбоксилат.
К перемешиваемому раствору этилизонипеконата (20,01 г, 0,1273 моль) в EtOAc (100 мл) при 0oC добавляли по каплям раствор Boc2О (27,76 г, 0,1272 моль) в EtOAc (50 мл). Смеси давали согреться до комнатной температуры в течение ночи. Через 20 ч смесь промывали водой, 0,1 М HCl, насыщенным NaHCO3, насыщенным NaCI и высушивали (MgSO4). Концентрирование и откачивание под вакуумом до достижения постоянной массы давало 32,54 г (99%) желаемого карбамата в виде маловязкого масла; 1H ЯМР (300 МГц, CDCl3) δ 4,13 (q, J=7,0 Гц, 2H), 4,03 (dm, J=13,6 Гц, 2H), 2,81 (m, 2H), 2,41 (m, 1H), 1,86 (dm, J= 13,6 Гц, 2H), 1,62 (m, 2H), 1,44 (s, 9H), 1,24 (t, J=7,0 Гц, 3H).
Часть Б. N-t-бутилоксикарбонилпиперидин-4-илметанол.
К раствору этил N-t-бутилоксикарбонилпиеридин-4-карбоксилата (32,34 г, 0,1257 моль) в THF (100 мл) добавляли по каплям при 0oC 1 M LAH в THF (87,9 мл, 0,0879 моль). Спустя 2 ч избыток гидрида гасили добавлением воды (3,2 мл), 2 М NaOH (3,2 мл) и воды (10 мл). Смесь фильтровали, промывали EtOAc и фильтрат промывали водой, насыщ. NaCl, высушивали (MgSO4) и концентрировали. Откачивание до постоянной массы давало 22,72 г (84%); tпл 79,2-81,1oC; 1H ЯМР (300 МГц, CDCl3) δ 4,12 (bd, J= 12,8 Гц, 2H), 3,49 (d, J=6,2 Гц, 2H), 2,68 (dt, J= 13,2 Гц, 2H), 1,69 (m, 3H), 1,44 (s, 9H перекрывание c m, 1H), 1,14 (m, 2H).
Часть В. 4-(N-t-бутилоксикарбонилпиперидин -4-илметокси)- бензальдегид.
К N-t-бутилоксикарбонилпиперидин -4-илметанолу (7,87 г, 36,5 ммоль), p-гидроксибензальдегиду (4,46 г, 36,5 ммоль) и PPh3 (9,59 г, 36,5 ммоль) в THF (100 мл) при -20oC добавляли DEAD (5,75 мл, 36,5 ммоль) в THF (50 мл) в соответствии с примером 1, часть Б, получая 8,14 г (70%); tпл 115,6-116,8oC; 1H ЯМР (300 МГц, CDCl3) δ 9,86 (s, 1H), 7,81 (d, J=8,8 Гц, 2H), 6,96 (d, J= 8.8 Гц, 2H), 4,15 (bd, J=13,2 Гц, 2H), 3,87 (d, J=6,6 Гц, 2H), 2,74 (dt, J= 12,4, 1,8 Гц, 2H), 1,97 (m, IH), 1,81 (bd, J=12,8 Гц, 2H), 1,45 (s, 9H), 1,27 (dq, J= 12,1, 4,0 Гц, 2H).
Часть Г. 4-(N-t-бутилоксикарбонилпиперидин -4- илметокси)бензальдоксим.
Смесь 4-(N-t-бутилоксикарбонилпиперидин-4- илметокси)-бензальдегида (3,16 г, 9,89 моль) и солянокислого гидроксиламина (1,27 г, 18,3 ммоль) в MeOH/пиридине (9: 1, 30 мл) нагревали с обратным холодильником 18 ч. Смесь охлаждали до комнатной температуры и концентрировали до сухого состояния. Остаток растворяли в EtOAc и промывали 0,1 М HCl (3х), водой, насыщенным CuSO4 (2х), водой, насыщенным NaCl, высушивали (MgSO4) и концентрировали, получая 3,19 г (96%) оксима; tпл 140,1-141,8oC; 1H ЯМР (300 МГц, CDCl3) δ 8,07 (s, 1H), 7,48 (d, J=8,8 Гц, 2H), 6,86 (d, J=8,8 Гц, 2H), 4,14 (bs, 2H), 3,80 (d, J=6,2 Гц, 2H), 2,71 (bt, J= 12,4, Гц, 2H), 1,95 (m, 1H), 1,80 (bd, J= 12,4 Гц, 2H), 1,45 (s, 9H), 1,26 (m, 2H).
Часть Д. 4-(N-t-бутилоксикарбонилпиперидин -4-илметокси) бензальдоксиминоила хлорид.
4-(N-t-бутилоксикарбонилпиперидин -4- илметокси)бензальдоксим (3,19 г, 9,54 ммоль) в DMF (10 мл) взаимодействовал с NCS (1,27 г, 9,51 ммоль) в течение 18 ч в соответствии с примером 1, часть Г, для получения гидроксиминоилхлорида (1,17 г, 33%); tпл 178,0-179,8oC; 1H ЯМР (300 МГц, CDCl3) δ 7,75 (d, J= 9,0 Гц, 2H), 6,86 (d, J=9,0 Гц, 2H), 4,17 (bd, J=12,4 Гц, 2H), 3,80 (d, J= 6,2 Гц, 2H), 1,95 (m, 1H), 1,81 (bd, J=12,1 Гц, 2H), 1,46 (s, 9H), 1,27 (dq, J=12,5, 4,0 Гц, 2H).
Часть Е. Метил 3-(3-[4-(N-t- бутилоксикарбонилпиперидин-4- илметокси)фенил] -(5R,S)-изоксазолин-5-ил)пропионат.
4-(N-t-бутилоксикарбонилпиперидин -4-илметокси)бензальдоксиминоила хлорид (738 мг, 2,00 ммоль), метил 4-пентеноат (230 мг, 2,02 ммоль) и TEA (0,28 мл, 2,0 ммоль) нагревали с обратным холодильником 1 ч в соответствии с примером 1, часть Д. Кристаллизация из эфира/гексанов давала 537 мг (60%); tпл 97,9-99,9oC; 1H ЯМР (300 МГц, CDCl3) δ 7,57 (d, J=9,0 Гц, 2H), 6,87 (d, J= 9,0 Гц, 2H), 4,74 (m, 1H), 4,15 (bd, J=13,2 Гц, 2H), 3,81 (d, J=6,2 Гц, 2H), 3,67 (s, 3H), 3,40 (dd, J=16,5, 10,2 Гц, 1H), 2,95 (dd, J=l6,5, 7,3 Гц, 1H), 2,73 (dt, J= 13,2, 1,1 Гц, 2H), 2,52 (t, J=7,3 Гц, 2H), 1,98 (q, J=7,0 Гц, 2H, перекрывание m, 1H), 1,81 (bd, J=12,8 Гц, 2H), 1,45 (s, 9H), 1,26 (dq, J=12,4, 3,7 Гц, 2H).
Часть Ж. 3-(3-[4-[N-t-бутилоксикарбонилпиперидин -4- илметокси) фенил] -(5R,S)-изоксазолин- 5-ил)пропионовая кислота.
Метил 3-(3-[4-(N-t-1- бутилоксикарбонилпиперидин-4- илметокси) фенил]-(5R, S)- изоксазолин-5-ил)пропионат (250 мг, 0,560 ммоль) омыляли, используя 0,5 M LiOH (2 мл, 1 ммоль) в THF (2 мл). Реакционную смесь перемешивали в течение 3 ч при комнатной температуре согласно примеру 1, часть Е. Получающийся твердый остаток перекристаллизовывали из DCM/гексанов, получая 163 мг (67%) карбоновой кислоты; tпл 146,5-147,7oC; 1H ЯМР (300 МГц, CDCl3) δ 7,57 (d, J=8,8 Гц, 2H), 6,88 (d, J=8,8 Гц, 2H), 4,75 (m, 1H), 3,81 (d, J=6,2 Гц, 2H), 3,41 (dd, J=16,5, 10,3 Гц, 1H), 2,95 (dd, J=16,5, 7,3 Гц, 1H), 2,75 (bt, J=12,4 Гц, 2H), 2,57 (t, J=7,3 Гц, 2H), 1,97 (m, 3H), 1,81 (bd, J= 12,1 Гц, 2H), 1,45 (s, 9H), 1,24 (m, 2H).
Часть З. 3-(3-[4-(пиперидин-4-илметокси) фенил]-(5R,S)- изоксазолин-5- ил)пропионовая кислота, соль трифторуксусной кислоты.
От 3-(3-[4-(N-t- бутилоксикарбонилпиперидин-4- илметокси) фенил]-(5R,S)- изоксазолин-5-ил)пропионовой кислоты (103 мг, 0,238 ммоль) отщепляли Boc, используя 33% TFA/DCM согласно примеру 1, часть Ж, получая 88 мг (83%) соли TFA; tпл 179,1- 181,8oC; 1H ЯМР (400 МГц, MeOH-d4) δ 7,60 (d, J=9,0 Гц, 2H), 6,97 (d, J=9,0 Гц, 2H), 4,73 (m, 1H), 3,94 (d, J=6,1 Гц, 2H), 3,46 (m, 3H), 3,06 (m, 3H), 2,45 (dt, J=7,3, 1,2 Гц, 2H), 2,16 (m, 1H), 2,08 (bd, J=15,4 Гц, 2H), 1,94 (q, J=6,6 Гц, IH), 1,64 (dq, J=14,2 Гц, 2H).
Пример 7
3-[4-(пиперидин-4-илметокси)фенил] -(5R,S)- изоксазолин-5-илуксусная кислота, соль трифторуксусной кислоты
Часть А. Метил 3-[4-((N-t- бутилоксикарбонилпиперидин-4- илметокси)фенил]- (5R,S)-изоксазолин-5-илацетат.
Хлорид 4-(N-t-бутилoкcикapбoнилпипepидин-4-илмeтoкcи) бензальдоксиминоила (412 мг, 1,12 ммоль), метил 3-бутеноат (200 мг, 2,00 ммоль) и TEA (0,18 мл, 1,3 ммоль) нагревали с обратным холодильником в течение 2 ч согласно примеру 1, часть Д. Кристаллизация из хлороформ/циклогексана давала 329 мг (68%); tпл 97,9-99,9oC; 1H ЯМР (300 МГц, CDCl3) δ 7,58 (d, J=8,8 Гц, 2H), 6,88 (d, J=8,8 Гц, 2H), 5,04 (m, 1H), 4,15 (bd, J=13,2 Гц, 2H), 3,81 (d, J= 6,2 Гц, 2H), 3,71 (s, 3H), 3,54 (dd, J=16,8, 10,3 Гц, 1H), 3,08 (dd, J= 16,8, 7,3 Гц, 1H), 2,86 (dd, J=16,l, 5,9 Гц, 1H), 2,73 (dt, J=12,8, 1,8 Гц, 2H), 2,62 (dd, J=15,8, 7,7 Гц, 1H), 1,95 (m, IH), 1,81 (bd, J=13,2 Гц, 2H), 1,45 (s, 9H), 1,25 (dq, J=12,8, 4,4 Гц, 2H).
Часть Б. 3-[4-(N-t-бутилоксикарбонилпиперидин -4- илметокси)фенил] -(5R, S)- изоксазолин-5-ил -уксусная кислота.
Метил 3-[4-((N-t- бутилоксикарбонилпиперидин-4-илметокси)фенил] -(5R,S)- изоксазолин-5-илацетат (329 мг, 0,762 ммоль) омыляли, используя 0,5 M LiOH (3 мл, 1,5 ммоль) в THF (5 мл). Реакционную смесь в течение 4 ч перемешивали с обратным холодильником согласно примеру 1, часть E, получая 72 мг (22%) карбоновой кислоты; tпл 164,0-164,8oC; 1H ЯМР (300 МГц, CDCl3) δ 7,58 (d, J= 8,8 Гц, 2H), 6,88 (d, J=8,8 Гц, 2H), 5,07 (m, 1H), 4,15 (bd, J=13,6 Гц, 2H), 3,82 (d, J= 6,2 Гц, 2H), 3,53 (dd, J=16,8, 10,3 Гц, 1H), 3,10 (dd, J=16,8, 7,0 Гц, 1H), 2,91 (dd, J=16,1, 5,9 Гц, 1H), 2,73 (dt, J=14,6, 1,8 Гц, 2H), 2,68 (dd, J=16,1, 7,3 Гц, 1H), 1,97 (m, 1H), 1,81 (bd, J=13,2 Гц, 2H), 1,45 (s, 9H), 1,26 (dq, J=12,8, 4,4 Гц, 2H).
Часть В. 3-[4-пиперидин- 4-илметокси) фенил]-(5R,S)- изоксазолин-5-илуксусная кислота, соль трифторуксусной кислоты.
От 3-[4-(N-t-бутилоксикарбонилпиперидин -4-илметокси)фенил] -(5R, S)- изоксазолин -5-ил-уксусной кислоты (72 мг, 0,172 ммоль) отщепляли Boc, используя 33% TFA/DCM согласно примеру 1, часть Ж, получая 64 мг (94%) соли TFA; tпл 220oC (разложение); 1H ЯМР (300 МГц, MeOH-d4) δ 7,61 (d, J=9,2 Гц, 2H), 6,97 (d, J=9,2 Гц, 2H), 5,04 (m, 1H), 3,95 (d, J=5,9 Гц, 2H), 3,56 (dd, J= 17,2, 10,2 Гц, 1H), 3,45 (bd, J=12,8 Гц, 2H), 3,18 (dd, J=17,2, 7,3 Гц, 1H), 3,04 (dt, J=10,2, 2,9 Гц, 2H), 2,69 (m, 2H), 2,18 (m, 1H), 2,08 (bd, J=14,6 Гц, 2H), 1,63 (bq, 2H).
Пример 8
3-[4-(2-пиперидин-4-ил)этоксифенил] -(5R,S)- изоксазолин-5-илпропионовая кислота, соль трифторуксусной кислоты
Это вещество получали по аналогии с примером 1, получая желаемое соединение; tпл 114,8-115,7oC; 1H ЯМР (300 МГц, CDCl3) δ 7,59 (d, J=8,4 Гц, 2H), 6,95 (d, J=8,4 Гц, 2H), 4,72 (m, 1H), 4,07 (t, J=5,9 Гц, 2H), 3,47 (dd, J= 16,8, 10,2 Гц, 1H), 3,37 (dd, J=16,8, 7,7 Гц, 1H), 2,98 (m, 2H), 2,44 (t, J= 7,3 Гц, 2H), 2,01 (bd, J=15,0 Гц, 2H), 1,93 (m, 3H), 1,80 (m, 2H), 1,44 (m, 2H).
Пример 9
Эритро- и трео-3-[3-[4-[(пиперидин-4- ил)метокси]фенил]изоксазолин-5-ил {[бутансульфонил] амино]пропионат, соль трифторуксусной кислоты
Часть А. Дициклогексиламмоний D,L-2-[(бутансульфонил)амино]- 4- пентеновая кислота.
К суспензии D, L-2-амино-4-пентеновой кислоты (2,54 г, 22,06 ммоль) в ацетонитриле (35 мл) добавляли BSTFA (7,3 мл, 27,5 ммоль). Суспензию нагревали 2 ч при 55oC, после чего получали раствор золотисто-желтого цвета. К этому раствору добавляли пиридин (2,2 мл, 27,2 ммоль) и n-бутансульфонилхлорид (3,0 мл, 23,1 ммоль). Смесь в течение 20 ч нагревали при 70oC, затем охлаждали до комнатной температуры. Концентрирование под вакуумом давало коричневое масло, к которому добавляли 15% KNSO4 (5 мл). Смесь перемешивали 1 ч и встряхивали с EtOAc (3х). Объединенные органические экстракты промывали насыщенным NaCl, высушивали (MgSO4), концентрировали и получающееся масло растворяли в эфире (5 мл). К этому раствору добавляли DCHA (4,38 мл, 22,0 ммоль), вызывая немедленное осаждение соли дициклогексиламмония. Твердый остаток собирали фильтрацией и откачивали до постоянной массы, получая 8,42 г (92%); tпл 207,1-208,6oCo; 1H ЯМР (300 МГц, MeOH-d4) δ 5,84 (m, 1H), 5,09 (dm, J=17,1 Гц, 1H), 5,04 (dm, J=10,2 Гц, 1H), 3,80 (dd, J=7,1, 5,1 Гц, 1H), 3,18 (m, 2H), 3,02 (m, 2H), 2,49 (m, 2H), 2,06 (m, 4H), 1,78 (m, 8H), 1,55 (m, 12H), 0,94 (t, J=7,3 Гц).
Часть Б. Метил D,L-2-[(бутансульфонил) амино]-4-пентеноат.
К раствору D, L-2-[(бутансульфонил) амино]-4-пентеноата дициклогексиламмония (8,36 г, 20,07 ммоль) в MeOH (50 мл) добавляли HCl, насыщенный MeOH (50 мл). Полученную суспензию перемешивали 18 ч при комнатной температуре, разбавляли эфиром и фильтровали. За концентрированием фильтрата под вакуумом следовало добавление эфира, вторая фильтрация и промывка фильтрата 0,1 М HCl, насыщенным NaHCO3, насыщенным NaCl. Раствор высушивали над безводным MgSO4, концентрировали и помещали под вакуум до достижения постоянной массы, получая 4,49 г (90%) желаемого эфира в виде светло-коричневого масла; 1H ЯМР (300 МГц, CDCl3) δ 5,68 (m, 1H), 5,19 (bd, J=l,5 Гц, 1H), 5,15 (m, 1H), 4,78 (bd, J= 8,4 Гц, 1H), 4,20 (dt, J=8,8, 5,8 Гц, 1H), 3,77 (s, 3H), 2,99 (m, 2H), 2,54 (t, J=6,6 Гц, 2H), 1,76 (m, 2H), 1,42 (секступлет, J=7,3 Гц, 2H), 0,93 (t, J=7,3 Гц, 3H).
Часть В. Метил эритро- и трео-3-(3-[4- {(бутилоксикарбонилпиперидин-4-ил) метокси}фенил]изоксазолин-5- ил{[бутансульфонил] амино})пропионат.
К раствору 4-[(N-t- бутилоксикарбонилпиперидин-4-ил)метокси]- бензальдоксима (2,680 г, 8,01 ммоль), метил D,L-[(бутансульфонил)амино]-4- пентеноата (2,000 г, 8,02 ммоль) и TEA (0,11 мл, 0,79 ммоль) в THF (10 мл) добавляли 5% раствор NaOCl (общепринятый бытовой отбеливатель, 15 мл, 10,5 ммоль). Полученную смесь интенсивно перемешивали при комнатной температуре в течение 20 ч. Смесь разбавляли EtOAc и водой и слои разделяли. Водную порцию промывали EtOAc и объединенные органические фракции промывали насыщ. NaCl и высушивали над MgSO4. Концентрирование in vacuo давало светло-коричневое масло (4,8 г), которое очищали флэш-хроматографией (0-50% EtOAc/гексаны в 5 этапов), получая четыре компонента. Наименее полярное из этих соединений (фракции 8-11) определено 1H ЯМР как исходный олефин (1,520 г, 76%). Следующий компонент, выделенный в порядке возрастания полярности (фракции 12-15), был определен 1H ЯМР как исходный оксим (1,423 г, 53%). Следующий компонент, сошедший с колонки (фракция 20), был определен как два диастереомера (317 мг). Это вещество сходило с колонки с примесью, имеющей 1H ЯМР профиль, сходный с исходным оксимом, и, вероятно, имеет примерно 50% чистоту. Наиболее полярный выделенный компонент (фракции 22-25) определен как второй диастереомер (395 мг, 8%); tпл 127,5-129,3oC; 1H ЯМР (300 МГц, CDCl3) δ 7,56 (d, J=8,6 Гц, 2H), 6,87 (d, J=8,6 Гц, 2H), 5,25 (d, J=9,5 Гц, 1H), 4,87 (m, 1H), 4,35 (dt, J= 9,2, 3,7 Гц, 1H), 4,15 (bs, 2H), 3,81 (d, J=6,2 Гц, 2H), 3,78 (s, 3H), 3,49 (dd, J= 16,5, 10,3 Гц, 1H), 3,05 (t, J=7,7 Гц, 2H), 2,97 (dd, J=16,5, 7,0 Гц, 1H), 2,73 (bt, J=12,1 Гц, 2H), 2,21 (m, 1H), 1,94 (m, 2H), 1,82 (m, 4H), 1,45 (s, 9H), 1,24 (m, 3H), 0,92 (t, J=7,3 Гц, 3H).
Часть Г. 3-(3-[4-{ (бутилоксикарбонилпиперидин -4-ил)метокси) фенил] изоксазолин-5-ил{ [бутансульфонил] амино})-пропионовая кислота (более полярный диастереомер).
Раствор более полярного диастереомера метил 3-(3-[4- { (бутилоксикарбонилпиперидин-4- ил)метокси}фенил]изоксазолин-5- ил{ [бутансульфонил] амино} )пропионата (200 мг, 0,344 ммоль) в THF (1 мл) омыляли, используя 0,5 M LiOH (1 мл, 0,5 ммоль) в течение 4 ч как в примере 1, часть Е. Неочищенную карбоновую кислоту перекристаллизовывали из EtOAc/гексанов, получая 77 мг (39%) желаемого соединения; tпл 137,3-139,0oC; 1H ЯМР (300 МГц, CDCl3) δ 7,55 (d, J=8,8 Гц, 2H), 6,87 (d, J=8,8 Гц, 2H), 5,45 (d, J= 9,5 Гц, 1H), 4,87 (m, 1H), 4,92 (m, 1H), 4,37 (m, 1H), 4,15 (b, 2H), 3,81 (d, J= 6,2 Гц, 2H), 3,47 (dd, J=16,5, 9,9 Гц, 1H), 3,08 (t, J=8,1 Гц, 2H), 3,01 (dd, J=16,5, 7,0 Гц, 1H), 2,74 (bt, J=12,1 Гц, 2H), 2,26 (m, 1H), 2,01 (m, 2H), 1,81 (m, 4H), 1,45 (s, 9H, перекрывание с m, 1H), 1,24 (m, 3H), 0,91 (t, J=7,3 Гц, 3H).
Часть Г'. 3-(3-[4-{ (бутилоксикарбонилпиперидин -4-ил) метокси}фенил] изоксазолин-5-ил{ [бутансульфонил] амино} )- пропионовая кислота (менее полярный диастереомер).
Раствор неочищенного менее полярного диастереомера метил 3-(3-[4- { (бутилоксикарбонилпиперидин-4-ил)метокси} фенил]изоксазолин-5- ил{ [бутансульфонил] амино})пропионата (309 мг) в THF (5 мл) омыляли, используя 0,5 М LiOH (2 мл, 1 ммоль) в течение 6 ч как в примере 1, часть Е. Hеочищенную карбоновую кислоту очищали флэш-хроматографией (CHCl3 - 5-15% MeOH/CHCl3 ступенчатый градиент), за которой следовала кристаллизация из ЕtOAc/гексанов, получая 169 мг желаемого соединения; tпл 155oC (разложение); 1H ЯМР (400 МГц, DMSO-d6) δ 7,56 (d, J=8,8 Гц, 2H), 6,98 (d, J=8,8 Гц, 2H), 4,80 (m, 1H), 3,96 (bd, J=13,2 Гц, 2H), 3,90 (d, J=6,3 Гц, 2H), 3,77 (bs, 3H), 3,52 (t, J=7,8 Гц, 1H), 3,38 (dd, J=14,4, 10,0 Гц, 1H), 2.98 (t, J=7,8 Гц, 2H), 2,76 (dt, J=12,2, 1,7 Гц, 2H), 1,95 (m, 2H), 1,75 (m, 4H), 1,41 (s, 9H), 1,38 (d, J=7,6 Гц, 1H), 1,25 (m, 4H), 0,88 (t, J=7,3 Гц, 3H).
Часть Д. 3-(3-[4-{ пиперидин -4-ил)метокси} фенил]изоксазолин- 5-ил { [бутансульфонил] амино} )пропионовая кислота, соль трифторуксусной кислоты (более полярный диастереомер).
От более полярного диастереомера 3-(3-[4-{(бутилоксикарбонилпиперидин-4- ил)метокси} фенил] изоксазолин-5-ил{ [бутансульфонил] амино} )- пропионовой кислоты (40 мг, 0,070 ммоль) отщепляли Boc, используя 33% TFA/DCM согласно примеру 1, часть Ж. Перекристаллизация из этанола давала 4 мг (10%) соли TFA: tпл 263,5oC (разложение).
Часть Д'. 3-(3-[4-{ пиперидин-4- ил)метокси} фенил]изоксазолин-5-ил) { [бутансульфонил] амино} )пропионовая кислота, соль трифторуксусной кислоты (менее полярный диастереомер).
От менее полярного диастереомера 3-(3-[4-{(бутилоксикарбонилпиперидин-4-ил) метокси} фенил]изоксазолин-5-ил{[бутансульфонил] амино})- пропионовой кислоты (98 мг, 0,173 ммоль) отщепляли Boc, используя 33% TFA/DCM согласно примеру 1, часть Ж, получая 40 мг соли TFA. Перекристаллизация из метанола давала 28 мг (29%) чистой аминокислоты; tпл 239,4-240,7oC.
Пример 33
4-карбоксиметил-3-[4-(2-пиперидин-4- ил)этоксифенил]-(5R,S)-изоксазолин-5-ил-уксусная кислота, соль трифторуксусной кислоты
Это вещество получали аналогично примеру 1, получая желаемое вещество; tпл 141,4oC (разложение); 1H ЯМР (400 МГц, CD3OD, 60oC) δ 7,60 (d, J=8,8 Гц, 2H), 6,96 (d, J=8,8 Гц, 2H), 3,84 (d, J=17,3 Гц, 2H), 3,66 (s, 3H), 3,59 (d, J=17,3 Гц, 1H), 3,38 (bd, J=12,9, Гц, 1H), 3,24 (t, J=1,7 Гц, 2H), 3,21 (dm, J= 20,3 Гц, 1H), 3,04 (d, J=1,5 Гц, 2H), 3,00 (dt, J=12,9, 2,9 Гц, 2H), 2,02 (bd, J=14,4 Гц, 2H), 1,95 (m, 1H), 1,81 (m, 2H), 1,48 (m, 2H).
Пример 43
3(R, S)-{ 5(R,S)-N-[3- (4-амидинофенил)изоксазолин- 5-илацетил] амино}-3-фенилпропановая кислота
Часть А. 4-цианобензальдоксим.
Это вещество получали из 4-цианобензальдегида согласно Kawase и Kikugawa (J. Chem. Soc. Perkin Trans 1 1979, 643).
Часть Б. Метил 3-(3-бутеноил)амино -3-фенилпропионат.
К раствору винилуксусной кислоты (861 мг, 10,0 ммоль), солянокислого метил 3-амино-3-фенилпропионата (2,37 г, 11,0 ммоль) и TEA (1,6 мл, 12 ммоль) в DCM (20 мл) при -10oC добавляли DEC (2,11 г, 11,0 ммоль). Полученную смесь перемешивали 15 ч при температуре -10oC. Затем смесь промывали водой, 0,1 М HCl, насыщенного NaHCO3, насыщенного NaCl и высушивали над безводным MgSO4. Концентрирование под вакуумом с последующим откачиванием до достижения постоянной массы давало 2,36 г (95%) желаемого амида в виде масла золотистого цвета соответствующей чистоты для следующей реакции; 1H ЯМР (300 МГц, CDCl3) δ 7,28 (m, 5H), 6,78 (bd, J=7,7 Гц, 1H), 5,95 (m, 1H), 5,43 (dt, J=8,4, 5,9 Гц, 1H), 5,25 (m, 2H), 3,61 (s, 3H), 3,04 (d, J=7,0 Гц, 2H), 2,88 (dq, J=15,0, 5,9 Гц, 2H).
Часть В. Метил 3(R,S)-{5(R,S)-N-[3- (4- цианофенил)изоксазолин-5- илацетил]амино} -3-фенилпропаноат.
Это вещество получали из метил 3-(3-бутеноил)амино-3-фенилпропионата (816 мг, 3,30 ммоль) и 4-цианобензальдоксима (438 мг, 3,00 ммоль) согласно примеру 4, часть Б. Неочищенный продукт очищали флэш-хроматографией (70% EtOAc/гексаны), получая 731 мг (62%) желаемых изоксазолинов в виде 1:1 смеси диастереомеров; 1H ЯМР (300 МГц, CDCl3) δ 7,74 (m, 8H), 7,29 (m, 10H), 6,92 (bm, 2H), 5,42 (m, 2H), 5,16 (m, 2H), 3,64 (s, 3H), 3,60 (s, 3H), 3,48 (m, 2H), 3,26 (dd, J=17,3, 7,7 Гц, 1H), 3,15 (dd, J=16,8, 8,1 Гц, 1H), 2,85 (m, 2H), 2,69 (m, 2H).
Часть Г. Метил 3(R,S)-{5(R,S)-N-[3-(4- амидинофенил) изоксазолин-5-илацетил] амино)-3-фенилпропаноат.
Через раствор метил 3(R,S)-{5(R,S)-N-[3- (4-цианофенил)изоксазолин-5- илацетил] амино} -3-фенилпропаноата (587 мг, 1,50 ммоль) в 10% DCM/метаноле (55 мл) пробулькивали сухой газообразный HCl в течение 2 ч. Смесь перемешивали 18 ч, затем концентрировали под вакуумом. Неочищенный имидат растворяли в метаноле (20 мл) и добавляли карбонат аммония. Полученную смесь перемешивали 18 ч, затем фильтровали. Фильтрат концентрировали под вакуумом и остаток очищали флэш-хроматографией (CHCl3-20% метанола/CHCl3). Концентрирование соответствующих фракций in vacuo с последующим помещением остатка под вакуум до достижения постоянной массы давало 193 мг (32%) желаемых амидинов; масс-спектр (NH3-DCI, e/z, относительное содержание) 409 (М+H)+, 100%.
Часть Д. 3(R,S)-{5(R,S)-N-[3-(4-амидинофенил) изоксазолин-5- илацетил] амино}-3-фенилпропановая кислота, соль трифторуксусной кислоты.
Метил 3(R, S)-{ 5(R, S)-N-[3- (4-амидинофенил)изоксазолин-5- илацетил] амино} -3-фенилпропаноат (45 мг, 0,113 ммоль) омыляли, используя 0,5 M LiOH (0,6 мл, 0,3 ммоль) согласно примеру 1, часть E, получая 28 мг (49%); масс-спектр (NH3-DCI, e/z, относительное содержание) 412 (М+H)+, 100%.
Пример 120а
Метил 3(R,S)-{5(R,S)-N-[3-(4- амидинофенил)изоксазолин-5-илацетил]амино} -3-этоксифенилпропаноат
Часть А. (Е)-метил-фенил-2-пентеноат.
Раствор гидрокоричного альдегида (13,42 г, 0,1 моль) и метил(трифенилфосфонанилиден)ацетата (33,44 г, 0,1 моль) в THF перемешивали с обратным холодильником 20 ч. Реакционную смесь концентрировали под вакуумом и остаток очищали флэш-хроматографией, используя гексан:EtOAc::9:1. Желаемое вещество получали в виде прозрачного бледно-желтого масла (8,0 г, 0,042 моль, 42%); 1H ЯМР (300 МГц, CDCl3) δ 7,3-7,2 (m, 2H), 7,2-7,1 (m, 3H), 7,1-6,9 (m, 1H), 5,85 (d, 1H, J=5,8 Гц), 3,75 (s, 3H), 2,8 (t, 2H, J=7,7 Гц), 2,55 (q, 2H, J=7,4 Гц); масс-спектр (NH3-DCI) 191 (М+H)+.
Часть Б. Метил 3-(R)-[N-(1-(R) -1-фенилэтил)амино]-5- фенилпентаноат.
Смесь (Е)-метил-5-фенил-2- пентеноата (5,70 г, 0,03 моль) и R-метилбензиламина (14,54 г, 0,12 моль) нагревали в течение 94 ч при 110oC. Охлажденную реакционную смесь очищали флэш-хроматографией, используя гексан:EtOAc::8:2 для получения 1,18 г (0,0038 моль, 12%) желаемого вещества в виде прозрачной жидкости; 1H ЯМР (300 МГц, CDCl3) δ 7,4-7,0 (m, 11H), 3,9 (q, 1H, J=6,5 Гц), 3,65 (s, 3H), 2,9-2,65 (m, 2H), 2,6-2,35 (m, 3H), 1,75-1,6 (m, 2H), 1,35 (d, 3H, J=6,2 Гц); масс-спектр (NH3-DCI) 312 (М+H)+.
Часть В. Метил 3-(R)-амино-5-фенилпентаноат, соль уксусной кислоты.
Смесь метил 3-(R)-[N-(1-(R)-1-фенилэтил) амино]-5- фенилпентаноат (0,72 г, 2,3 ммоль), 20% Pd(OH)2/C (0,38 г), циклогексена (8,2 мл), ледяной ускусной кислоты (0,13 мл, 2,3 ммоль) и MeOH (15 мл) нагревали с обратным холодильником в течение 20 ч в атмосфере азота. После охлаждения катализатор удаляли фильтрованием через пробку из целита, промывали MeOH и раствор концентрировали под вакуумом. Остаток растирали с гексаном для получения 0,46 г (96%) белого твердого остатка; tпл 73-75oC; 1H ЯМР (300 МГц, DMSO) δ 8,3 (bs, 2H), 7,35-7,15 (m, 5H), 3,65 (s, 3H), 3,45-3,35 (m, 1H), 2,8-2,6 (m, 4H), 2,0-1,7 (m, 2H); [α]
Часть Г. Метил 3(R)-{5(R,S)-N- [3-(4-цианофенил)изоксазолин- 5-илацетил] амино} гептаноат.
К суспензии 3-(4- цианофенил)изоксазолин -5-ил-уксусной кислоты (460 мг, 2,0 ммоль) в EtOAc (15 мл) добавляли соль уксусной кислоты метил 3-(R)-амино-5- фенилпентаноата (410 мг, 2,0 ммоль), TBTU (640 мг, 2,0 ммоль) и Et3N (0,56 мл, 400 мг, 4,0 ммоль). После перемешивания при комнатной температуре в течение 16 ч реакционную смесь концентрировали под вакуумом, затем очищали флэш-хроматографией, используя EtOAc, получая 690 мг (83%) бесцветного масла. 1H ЯМР (300 МГц, DMSO) δ 8,05 (brs, 1H), 7,95-7,9 (m, 2H), 7,85-7,8 (m, 2H), 7,3-7,25 (m, 2H), 7,2-7,1 (m, 2H), 5,15-5,0 (m, 2H), 4,15-4,0 (m, 1H), 3,6 (d, 3H, J= 9,9 Гц), 3,3 (d, 2H, J=6,9 Гц), 3,25-3,15 (m, 1H), 2,75-2,35 (m, 6H), 1,8-1,6 (m, 2H); MC (NH3-DCl) 420 (M+H)+.
Часть Д. Метил 3(R)-{5(R,S)-{[3- (4- амидинофенил) изоксазолин-5-илацетил] амино}-3- этоксифенилпропаноат.
Это соединение получали из метил 3(R)- { 5(R, S)-N-[3-(4- цианофенил)изоксазолин-5- илацетил] амино} гептаноата (670 мг, 1,6 ммоль) согласно примеру 43, часть Г. Неочищенный продукт растирали с охлажденным эфиром, получая 272 мг (39%) белого твердого остатка указанного соединения в виде смеси 1:1 диастереомеров; tпл 76-78oC; 1H ЯМР (300 МГц, DMSO) δ 8,1-8,0 (m, 1H), 8,0-7,8 (m, 4H), 7,95-7,85 (m, 5H), 7,35- 7,2 (m, 5H), 5,1-5,0 (m, 1H), 4,1-4,0 (m, 1H), 3,6 (s, 3H), 3,3- 3,15 (m, 2H), 2,7-2,4 (m, 6H), 1,8-1,7 (m, 2H); MC (NH3-ESI), 437 (M+H)+.
Пример 120б
Метил 3(S)-{ 5(R,S)-N-[3-(4- амидинофенил)изоксазолин-5-илацетил]амино} -3-этоксифенилпропаноат
Часть А. Метил 3(S)-[N-(1-(R)-1-фенилэтил)амино]-5- фенилпентаноат.
Смесь (Е)-метил-5-фенил-2-пентеноата (5,70 г, 0,03 моль) и R-метилбензиламина (14,54 г, 0,12 моль) нагревали в течение 94 ч при 110oC. Охлажденную реакционную смесь очищали флэш-хроматографией, используя гексан:EtOAc::8:2 для получения 1,20 г (0,0039 моль, 13%) желаемого соединения в виде прозрачной жидкости; 1H ЯМР (300 МГц, CDCl3) δ 7,35-7,0 (m, 11H), 3,9 (q, 1H, J=6,6 Гц), 3,65 (s, 3H), 2,95-2,8 (m, 1H), 2,75-2,5 (m, 2H), 2,45-2,35 (m, 2H), 1,9-1,65 (m, 2H), 1,3 (d, 3H, J=6,6 Гц); MC (NH3-DCI) 312 (M+H)+.
Часть Б. Метил 3-(S)-амино-5-фенилпентаноат, соль уксусной кислоты.
Метил 3(S)-[N-бензил -N-(1-R-1-фенилэтил) амино] гептаноат (0,93 г, 2,9 ммоль), 20% Pd(OH)2/C (0,47 г), циклогексен (10,1 мл), ледяную уксусную кислоту (0,17 мл, 2,9 ммоль) и MeOH (20 мл) нагревали с обратным холодильником в атмосфере азота в течение 48 ч. После охлаждения катализатор удаляли фильтрованием через пробку из целита, промывали MeOH и раствор концентрировали под вакуумом. Остаток растирали с гексаном, получая 0,65 г (80%) твердого остатка белого цвета; tпл 86-88oC; 1H ЯМР (300 МГц, CDCl3) δ 7,35-7,15 (m, 5H), 5,3 (brs, 2H), 3,65 (s, 3H), 3,35-3,2 (m, 1 Н), 2,8-2,55 (m, 3H), 2,5-2,4 (m, 1H), 2,0 (s, 3H), 1,8 (q, 2H, J=7,4 Гц); [α]
Часть В. Метил 3(S)-{5(R,S)-N- [3-(4-цианофенил)изоксазолин-5- илацетил] амино} гептаноат.
К суспензии 3-(4-цианофенил)изоксазолин- 5-ил-уксусной кислоты (700 мг, 2,6 ммоль) в EtOAc (15 мл) добавляли метил 3-(S)-амино-5-фенилпентаноата, соль уксусной кислоты, (600 мг, 2,6 ммоль), TBTU (830 мг, 2,6 ммоль) и Et3N (1,09 мл, 790 мг, 7,8 ммоль). После перемешивания в течение 16 ч при комнатной температуре реакционную смесь концентрировали под вакуумом, затем очищали флэш-хроматографией, используя EtOAc, получая 420 мг (38%) бесцветного масла. 1H ЯМР (300 МГц, CDCl3) δ 8,05-8,0 (m, 1H), 7,95-7,9 (m, 2H), 7,85-7,8 (m, 2Н), 7,3-7,2 (m, 2H), 7,2-7,1 (m, 3H), 5,15-5,0 (m, 1Н), 4,15-4,0 (m, 1H), 3,6-3,55 (m, 3H), 3,3-3,1 (m, 1H), 2,7- 2,4 (m, 6H), 1,8- 1,6 (m, 2H); MC (NH3-DCI) 420 (M+H)+.
Часть Г. Метил 3(S)-{5(R,S)-N-[3- (4- амидинофенил)изоксазолин-5- илацетил]амино}-3-этоксифенилпропаноат.
Это вещество получали из метил 3(S)-{5(R,S)-N-[3-(4- цианофенил)изоксазолин-5-илацетил]амино}-3-этоксифенилпропаноата (360 мг, 0,86 ммоль) согласно примеру 43, часть Г. Неочищенный продукт растирали с холодным эфиром, получая 230 мг (62%) указанного соединения в виде аморфного твердого остатка смеси диастереомеров, tпл 84-86oC; 1H ЯМР (300 МГц, DMSO) δ 8,1-8,0 (m, 1H), 8,0-7,8 (m, 4H), 7,75-7,7 (m, 1H), 7,3-7,1 (m, 6H), 5,1-5,0 (m, 1H), 4,15-4,0 (m, 1H), 3,65 (s, 3H), 3,3-3,1 (m, 1H), 2,7-2,6 (m, 3H), 2,5-2,4 (m, 3H), 1,8-1,65 (m, 2H), 1,1-1,0 (m, 2H); MC (NH3-ESI) 437 (M+H)+.
Пример 189
5(R, S)-(2-пиперидин-4-ил)этил-8-(2-карбоксиэтил)- 1 -окса-2,8-диазоспиро[4.4]нон-2-ен-7,9-дион
Часть А. 3-(N-t-бутилоксикарбонилпиперидин-4-ил)пропаналь.
К суспензии PCC (11,52 г, 53,44 ммоль) и ацетата натрия (4,38 г, 53,4 ммоль) в DCM (60 мл) добавляли раствор 3-(N-t- бутилоксикарбонилпиперидин-4-ил)пропанола (10,00 г, 41,09 ммоль) в DCM (20 мл). После стояния в течение 4 ч при комнатной температуре смесь разбавляли эфиром и пропускали через короткую колонку с флюорисилом (fluorisil (R)) с эфиром в качестве элюента. Элюат концентрировали in vacuo и помещали под вакуум до достижения постоянной массы, получая 8,32 г (84%) требуемого альдегида в виде бесцветного масла; 1H ЯМР (300 МГц, CDCl3) δ 9,76 (t, J=1,5 Гц, 1H), 4,05 (bs, 2H), 2,64 (bt, J= 11,7 Гц, 2H), 2,45 (dt, J=7,3, 1,5 Гц, 2H), 1,60 (m, 3H), 1,43 (s, 9H, перекрывалось с m, 2H), 1,08 (dq, J=12,1, 4,0 Гц, 2H).
Часть Б. Оксим (E,Z)-3-(N-t-бутилоксикарбонилпиперидин-4- ил)пропаналя.
К раствору 3-(N-t-бутилоксикарбонилпиперидин-4- ил)пропаналя (3,905 г, 16,18 ммоль) в этанол:пиридине=1:1 (20 мл) добавляли солянокислый гидроксиламин (1,701 г, 24,48 ммоль) и полученный раствор перемешивали 20 ч при комнатной температуре. Концентрация in vacuo давала масло, которое растворяли в EtOAc и промывали 0,1 М HCl (3х), водой, насыщенной CuSO4 (2х), водой и рассолом. Раствор высушивали над MgSO4, концентрировали in vacuo и помещали под вакуум до достижения постоянной массы, получая 4,071 г (98%) 1:1 смеси (E, Z)-оксима в виде бесцветного масла; 1H ЯМР (300 МГц, CDCl3) δ 7,42 (t, J=6,2 Гц, 0,5H), 6,70 (t, J=5,5 Гц, 0,5H), 4,06 (bs, 2H), 2,67 (bt, J=12,8 Гц, 2H), 2,41 (m, 1H), 2,23 (m, 1H), 1,66 (b, 2H), 1,45 (s, 9H, перекрывалось с m, 4H), 1,08 (m, 2H).
Часть В. Метил (5R,S)-3-{[2-(N-t- бутилоксикарбонилпиперидин-4-ил)этил] -5- карбоксиметилизоксазолин- 5-ил} ацетат
К раствору оксим (E,Z)-3-(N-t- бутилоксикарбонилпиперидин-4-ил)пропаналя (503 мг, 1,96 ммоль) и диметилитаконата (620 мг, 3,92 ммоль) в DCM (3 мл) добавляли 5% раствор гипохлорита натрия (обыкновенный бытовой отбеливатель, 3 мл, 2 ммоль). Полученную смесь перемешивали при комнатной температуре в течение ночи (19 ч). Разделяли слои и водный слой промывали DCM (2х). Объединенную DCM фракцию высушивали над MgSO4 и концентрировали в вакууме. Очистка флэш-хроматографией (гексан - 10% EtOAc/гексан - 50% EtOAc), последующее концентрирование и откачивание до постоянной массы давало желаемый изоксазолин (510 мг, 63%) в виде бесцветного масла; 1H ЯМР (300 МГц, CDCl3) δ 4,06 (bd, J=13,6 Гц, 2H), 3,78 (s, 3H), 3,67 (s, 3H), 3,57 (d, J=l7,6 Гц, 1H), 3,15 (d, J=16,5 Гц), 3,06 (d, J=17,6 Гц, 1H), 2,86 (d, J=16,5 Гц, 1H), 2,65 (bt, J= 12,1 Гц, 2H), 2,36 (m, 2H), 1,65 (m, 2H, перекрывалось с H2O, 2H), 1,43 (s, 9H), 1,07 (m, 2H).
Часть Г. 5(R,S)-{[2- (N-t-бутилоксикарбонилпиперидин-4- ил)этил]-5- карбоксиизоксазолин-5-ил} уксусная кислота.
Раствор метил (5R,S)-3-{[2-(N-t-бутилоксикарбонилпиперидин-4-ил)этил]-5- карбоксиметилазоксазолин-5-ил} ацетата (380 мг, 0,921 ммоль) в THF (5 мл) омыляли 0,5 M LiOH (5 мл, 2,5 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 5 ч согласно примеру 1, часть E, для получения 240 мг (68%) двухосновной кислоты; tпл 154,4-154,9oC; 1H ЯМР (300 МГц, MeOH-d4) 4,04 (bd, J=13,2 Гц, 2H), 3,52 (d, J=17,8 Гц, 1H), 3,18 (d, J= 17,8 Гц, 1H), 2,97 (AB квартет, Δ = 32,6, J=16,8 Гц, 2H), 2,72 (b, 2H), 2,39 (m, 2H), 1,71 (bd, J=13,2 Гц, 2H), 1,51 (m, 3H), 1,43 (s, 9H), 1,05 (m, 2H).
Часть Д. 5(R, S)-2-(N-t- бутилоксикарбонилпиперидин-4-ил)этил- 8-[(2-(1,1- диметилэтоксикарбонил) этил] -1-окса-2,8- диазаспиро[4,4]нон-2-ен-7,9-дион.
К раствору 5(R,S)-{[2-(N-t- бутилоксикарбонилпиперидин-4-ил)этил]-5-карбоксиизоксазолин-5-ил} уксусной кислоты (700 мг, 1,82 ммоль) в THF (5 мл) добавляли DCC (378 мг, 1,83 ммоль) и получающуюся суспензию перемешивали 30 мин при комнатной температуре. К этой смеси добавляли суспензию солянокислого t-бутилового эфира бета-аланина (372 мг, 2,05 ммоль) и TEA (300 мкл, 2,15 ммоль) в THF (5 мл). Смесь перемешивали ночь (18 ч) при комнатной температуре. После разбавления EtOAc, смесь фильтровали и фильтрат промывали 0,1 М HCl, насыщенным NaHCO3, насыщенным NaCl. Высушивали над безводным MgSO4, концентрировали и помещали под вакуум до достижения постоянной массы, получая 430 мг (46%) грязного амида. Часть этого вещества (420 мг, 0,821 ммоль) растворяли в THF (4 мл). К раствору добавляли HOSuc (100 мг, 0,869 ммоль) и затем DCC (180 мг, 0,872 ммоль). Полученную суспензию перемешивали при комнатной температуре 18 ч. Фильтрат высушивали над безводным MgSO4, концентрировали и помещали под вакуум до достижения постоянной массы, получая 430 мг (86%) неочищенного активного эфира. Часть этого вещества (402 мг, 0,660 ммоль) растворяли в DMF (5 мл) при 0oC. К этому раствору добавляли NaH (16 мг, 0,66 ммоль). Через 3 ч при 0oC реакцию останавливали HOAc. После разбавления EtOAc смесь промывали водой (4х), насыщенным NaHCO3, водой, 0,1 М HCl и насыщенным NaCl. Высушивали над безводным MgSO4, концентрировали и помещали под вакуум до достижения постоянной массы, получая 230 мг (70%) неочищенного имида. Неочищенное вещество очищали флэш-хроматографией (CHCl3 - 5% MeOH/CHCl3), получая 149 мг (46%) бесцветного масла после концентрирования соответствующих фракций и откачивания до достижения постоянной массы; 1H ЯМР (300 МГц, CDCl3) δ 4,09 (b, 2H), 3,82 (t, J=7,3 Гц, 2H), 3,54 (d, J=17,2 Гц, 1H), 3,12 (d, J=18,7 Гц, 1H), 2,98 (d, J=17,2 Гц, 1H), 2,83 (d, J=18,7 Гц, 1H), 2,69 (m, 2H), 2,57 (t, J=7,3 Гц, 2H), 2,42 (m, 2H), 1,68 (m, 2H), 1,57 (m, 2H), 1,45 (s, 9H, совпадает c m, 1H), 1,11 (m, 2H).
Часть E. 5(R, S)-(2-пиперидин-4-ил)этил -8-(2-карбоксиэтил)-1- окса-2,8-диазаспиро [4.4]нон-2-ен-7,9-дион.
К раствору 5(R,S)-2-(N- t-бутилоксикарбонилпиперидин-4-ил)этил-8-[(2-(1,1- диметилэтоксикарбонил)этил] -1 -окса-2,8-диазаспиро[4.4] нон-2-ен- 7,9-диона (75 мг, 0,152 ммоль) в DCM (1 мл) добавляли TFA (0,5 мл, 8 ммоль). Реакционную смесь перемешивали 2 ч при комнатной температуре, затем концентрировали in vacuo. Избыток TFA отгоняли на роторном испарителе с толуолом (2х). Кристаллизация из MeOH/эфира после откачивания до постоянной массы давала 10 мг (15%) желаемой аминокислоты; tпл 178,0-179,1oC; 1H ЯМР (300 МГц, DMSO-d6, 60oC) δ 12,15 (bs, 1H), 8,26 (bs, 2H), 3,64 (m, 2H), 3,39 (d, J= 17,8 Гц, 1H), 3,26 (m, 3H), 2,98 (AB, квартет, Δ =71,3, J=18,3 Гц, 2H), 2,85 (m, 2H), 2,50 (m, 1H, совпадает с DMSO-d5), 2,37 (t, J=7,6 Гц, 2H), 1,84 (bd, J= 11,7 Гц, 2H), 1,58 (m, 1H), 1,52 (t, J=7,6 Гц, 2H), 1,29 (m, 2H).
Пример 190
5(R,S)-(2-пиперидин-4-ил)этил-8-(3-карбоксипропил)-1-окса- 2,8-диазаспиро[4.4]нон-2-ен-7,9-дион
Это вещество получали способами, описанными в примере 189, получая указанное соединение; tпл 133,4-135,1oC; 1H ЯМР (400 МГц, CD3OD, 55oC) δ 3,59 (t,
J= 6,8 Гц, 2H), 3,50 (d, J=17,7 Гц, IH), 3,38 (bd, J=12,9 Гц, 2H), 3,18 (d, J= 17,7 Гц, 1H), 2,98 (m, 4H), 2,85 (m, 2H), 2,50 (m, 1H, совпадает с DMSO-d5), 2,45 (m, 2H), 2,31 (t, J=7,1 Гц, 2H), 2,00 (m, 2H), 1,98 (пентуплет, J=7,1 Гц, 2H), 1,40 (m, 2H).
Пример 275
N3-[3-(4-амидинофенил)изоксазолин-5(R, S)-илацетил]-L-2,3- t диаминопропионовая кислота, соль TFA
Часть А. 3-(4- цианофенил)изоксазолин - 5(R,S)-ил-уксусная кислота.
К раствору 4-цианобензальдоксима (см. пример 43, часть А) (312 г, 2,13 моль) в тетрагидрофуране (3000 мл) при комнатной температуре добавляли винилуксусную кислоту (552 г, 6,41 моль). Желтый раствор охлаждали на ледяной бане и добавляли по каплям в течение 2 ч раствор гипохлорита натрия (5200 мл). После перемешивания в течение ночи при комнатной температуре реакцию гасили 5% раствором лимонной кислоты и разбавляли 200 мл эфира. Разделяли слои и водный слой закисляли лимонной кислотой до pH 4. Кислый слой дважды промывали 200 мл эфира, эфирные слои объединяли и проводили экстракцию насыщенным раствором бикарбоната натрия. После закисления щелочного слоя лимонной кислотой продукт экстрагировали в 400 мл эфира. Органическую фазу 3 раза промывали 150 мл воды, один раз рассолом, высушивали (MgSO4) и концентрировали, получая 220 г 3-(4-цианофенил)изоксазолин-5-ил- уксусной кислоты в виде белого твердого остатка. Перекристаллизация из 25% раствора вода/этанол давала 165 г аналитически чистого вещества.
Вычислено для C12H10N2O3: C 62,61; H 4,38; N 12,16. Найдено: С 62,37; H 4,47; N 11,71.
1H ЯМР (300 МГц, CDCl3) δ 7,77-7,76 (d, 2H, J=1,8 Гц), 7,72-7,71 (d, 2H, H= 1,8 Гц), 5,22-5,14 (m, 1H), 3,63-3,54 (dd, 1H, J=10,6 Гц, 16,8 Гц), 3,19-3,11 (dd, 1H, J= 7,3 Гц, 16,8 Гц), 3,00-2,93 (dd, 1H, J=6,2 Гц, 16,5 Гц), 2,79-2,72 (dd, IH, J=7,3 Гц, 16,5 Гц); ИК-спектр (KBr осадок): 3202, 2244, 1736, 1610, 1432, 1194, 1152, 928, 840, 562 см-1.
Часть Б. Метил N2-Сbz-L-2,3-диаминопропионат, соль HCl.
N2-Cbz-L-2,3-диаминопропионовую кислоту (10 ммоль, 2,39 г) растворяли в 20 мл метанола и 20 мл 4 N HCl в диоксане и раствор перемешивали 4 ч и затем концентрировали до получения твердого остатка. Твердый остаток промывали несколько раз эфиром, получая 2,50 г (87%) продукта. ЯМР (DMSO-d6) δ 8,38 (b, 3H), 7,96 (d, 1H), 7,38 (m, 5H), 5,05 (s, 2H), 4,44 (m, 1H), 3,66 (s, 3H), 3,14 (m, 2H).
Часть В. Метил N2-Сbz-N3-[3-(4-цианофенил) изоксазолин- 5(R,S)-илацетил] -L-2,3-диаминопропионат.
К раствору 3-(4- цианофенил)изоксазолин -5(R,S)-ил-уксусной кислоты (19 ммоль, 4,37 г), метил N2-Сbz-L-2,3-диаминопропионата, соли HCl (20 ммоль, 5,76 г) и триэтиламина (60 ммоль, 8,36 мл) добавляли TBTU (20 ммоль, 6,42 г) и раствор перемешивали в течение 2 ч. Добавляли этилацетат и промывали раствор разбавленной лимонной кислотой, рассолом, NaHCO3 и рассолом, высушивали (MgSO4) и концентрировали. Кристаллизация из этилацетат/эфира давала 6,85 г (78%) 3 продукта. ЯМР (DMSO-d6) δ 8,16 (t, 1H), 7,92 (d, 2H), 7,82 (d, 2H), 7,68 (d, 1H), 7,36 (m, 5H), 5,04 (m, 3H), 4,20 (m, 1H), 3,64 (s, 3H), 3,50 (m, 2H), 3,26 (m, 2H), 2,50 (m, 2H).
Часть Г. Метил N3-[3-(4-aмидинoфeнил)изoкcaзoлин -5(R,S)- илaцeтил] -L-2,3- диаминопропионат, соль HCl.
Газообразный HCl пробулькивали через раствор метил N2-Cbz-N3-[3-(4-цианофенил) изоксазолин-5(R, S)-илацетил] -L-2,3-диаминопропионата (2,1 ммоль, 1,0 г) 1 ч, перемешивали раствор в течение ночи и концентрировали. Остаток растворяли в 30 мл 2 М аммиака в метаноле и раствор перемешивали ночь, концентрировали, получая 1,2 г неочищенного продукта.
Часть Е. N3-[3-(4-амидинофенил)изоксазолин -5(R,S)- илацетил]-L-2,3 -диаминопропионовая кислота, соль TFA.
Метил N3- [3-(4-aмидинoфeнил) изoкcaзoлин-5(R,S)-илaцeтил] -L-2,3- диаминопропионат, соль HCl (200 мг) омыляли 1 мл метанола и 1 мл 1 N NaOH в течение 1 ч и закисляли уксусной кислотой. Очистка обращенно-фазовой HPLC давала 40 мг продукта. ESI (М+Н)+: вычислено 334,2; найдено: 334,2.
Пример 276
N2-Cbz-N3-[3- (4-амидинофенил)изоксазолин -5(R,S)- илацетил]-L-2,3 -диаминопропионовая кислота, соль TFA
Часть А. Метил N2-Cbz-N3-[3- (4-амидинофенил)изоксазолин- 5(R,S)-илацетил] -L-2,3-диаминопропионат, соль TFA.
К раствору соединения примера 275, часть Д (1,0 ммоль, 385 мг) и бикарбоната натрия (5,0 ммоль, 400 мг) в 2 мл воды, 2 мл ацетонитрила и 1 мл DMF добавляли бензилхлорформиат (1 ммоль, 143 мкл) и смесь перемешивали 2 ч при комнатной температуре. Раствор фильтровали, подкисляли TFA и очищали обращенно-фазовой HPLC, получая 150 мг (25%) продукта. ЯМР (DMSO-d6) δ 9,40 (s, 2H), 9,20 (s, 2H), 8,18 (t, 1H), 7,86 (m, 4H), 7,68 (d, 1H), 7,35 (m, 5H), 5,02 (m, 3H), 4,20 (m, 1H), 3,64 (s, 3H), 3,52 (m, 2H), 3,26 (m, 2H), 2,50 (m, 2H).
Часть Б. N2-Cbz-N3-[3- (4-амидинофенил)изоксазолин-5(R,S)- илацетил]-L-2,3 -диаминопропионовая кислота, соль TFA.
Метил N2-Cbz-N3-[3- (4-амидинофенил)изоксазолин -5(R,S)-илацетил]-L-2,3 -диаминопропионат, соль TFA (0,12 ммоль, 70 мг) растворяли в 2 мл метанола и 1 мл 1 N NaOH и через 1 ч раствор закисляли уксусной кислотой. Очистка обращенно-фазовой HPLC давала 50 мг (74%) продукта. ESI (М+H)+: вычислено 468,2; найдено 468,2.
Пример 278
N2-n-бутилоксикарбонил-N3-[3-(4- амидинофенил) изоксазолин-5(R,S)-илацетил] -L-2,3-диаминопропионовая кислота, соль TFA
Часть А. Метил N2-n-бутилоксикарбонил-N3- [3-(4-амидинофенил) изоксазолин-5(R,S) -илацетил]-L-2,3-диаминопропионат, соль TFA.
К раствору соединения примера 275, часть E (1,0 ммоль, 385 мг) и бикарбоната натрия (2,5 ммоль, 200 мг) в 2 мл воды, 2 мл ацетонитрила и 1 мл DMF, охлаждаемому на ледяной бане, добавляли n-бутилхлорформиат (1 ммоль, 127 мкл). После перемешивания 1 ч раствор закисляли уксусной кислотой и очищали обращенно-фазовой HPLC, получая 150 мг (27%) продукта. ЯМР (DMSO-d6) δ 9,40 (s, 2H), 9,20 (s, 2H), 8,16 (t, 1H), 7,86 (m, 4H), 7,47 (d, 1H), 5,02 (m, 1H), 4,16 (m, 1H), 3,94 (t, 2H), 3,62 (s, 3H), 3,50 (m, 2H), 3,26 (m, 2H), 2,50 (m, 2H), 1,52 (m, 2H), 1,32 (m, 2H), 0,88 (t, 3H). ESI (M+H)+: вычислено 448,3; найдено 448,3.
Часть Б. N2-n-бутилoкcикapбoнил-N3- [3-(4- aмидинoфeнил)изoкcaзoлин -5(R,S)-илацетил]-(S)-2,3- диаминопропионовая кислота, соль TFA.
Метил N2-n-бутилоксикарбонил- N3-[3-(4-амидинофенил)изоксазолин -5(R, S)-илацетил] -L-2,3- диаминопропионат, соль TFA (0,107 ммоль, 60 мг) растворяли в 2 мл метанола и 2 мл 1 N NaOH и через 1 ч раствор закисляли уксусной кислотой. Очистка обращенно-фазовой HPLC давала 53 мг (89%) продукта. ESI (М+H)+: вычислено 434,3; найдено 434,3.
Пример 314А
Метил N2-n-бутилоксикарбонил-N3- [3-(4-амидинофенил)изоксазолин -5(S)-илацетил]-(S)-2,3-диаминопропионат, соль TFA
Часть А. Метил N2-Cbz-N3-Вос -L-2,3-диаминопропионат.
К раствору метил N2-Cbz-(S)-2,3-диаминопропионата, соли HCl (916,3 ммоль, 4,7 г) и ди-трет-бутилдикарбоната (16,3 ммоль, 3,56 г) в 30 мл хлороформа, охлаждаемого на ледяной бане, добавляли триэтиламин (34 ммоль, 4,7 мл) и раствор перемешивали 1 ч на ледяной бане и 3 ч при комнатной температуре и концентрировали. Остаток собирали этилацетатом и раствор промывали разбавленной лимонной кислотой, рассолом, NaHCO3 и рассолом, высушивали (MgSO4) и концентрировали. Кристаллизация из эфир/петролейного эфира давала 5,2 г (92%) конечного продукта. ЯМР (DMSO-d6) δ 7,60 (d, 1H), 7,35 (m, 5H), 6,88 (t, 1H), 5,02 (s, 2H), 4,14 (m, 1H), 3,60 (s, 3H), 3,28 (m, 2H), 1,37 (s, 9H), 0,88 (t, 3H).
Часть Б. Метил N3-Boc-(S)-2,3-диаминопропионат, соль HCO2H.
Смесь метил N2-Cbz-N3-Boc-(S)-2,3-диаминопропионата (14 ммоль, 5,0 г), муравьиной кислоты (42 ммоль, 1,6 мл) и 10% Pd/C (500 мг) в 40 мл метанола перемешивали при комнатной температуре 1 ч и фильтровали через целит. Фильтрат концентрировали и остаток растирали с эфир/петролейным эфиром, получая 3,7 г (100%) твердого продукта. ЯМР (DMSO-d6) δ 8,20 (s, 1H), 6,90 (t, 1H), 5,36 (b, 3H), 3,61 (s, 3H), 3,51 (t, 1H), 3,18 (t, 2H), 1,38 (s, 9H).
Часть В. Метил N2-n-бутилоксикарбонил -N3-Boc-(S)-2,3- диаминопропионат.
К смеси метил N3-Boc-(S)-2,3-диаминопропионата, соли HCO2H (14 ммоль, 3,7 г) и NaHCO3 (40 ммоль, 3,4 г) в 10 мл воды и 10 мл THF, охлаждаемой на ледяной бане, медленно в течение 15 мин добавляли бутилхлоформиат (16 ммоль, 2 мл). После перемешивания в течение 1 ч добавляли этилацетат и промывали раствор разбавленной лимонной кислотой, рассолом, NaHCO3 и рассолом, высушивали (MgSO4) и концентрировали, получая 4,4 г (100%) маслянистого продукта. ЯМР (DMSO-d6) 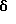 7,37 (d, 1H), 6,84 (t, 1H), 4,20 (m, 1H), 3,96 (t, 2H), 3,60 (s, 3H), 3,26 (m, 2H), 1,52 (m, 2H), 1,38 (s, 9H), 1,36 (m, 2H), 0,88 (t, 3H).
7,37 (d, 1H), 6,84 (t, 1H), 4,20 (m, 1H), 3,96 (t, 2H), 3,60 (s, 3H), 3,26 (m, 2H), 1,52 (m, 2H), 1,38 (s, 9H), 1,36 (m, 2H), 0,88 (t, 3H).
Часть Г. Метил N2-бутилоксикарбонил- (S)-2,3- диаминопропионат, соль TFA.
Метил N2-n-бутилоксикарбонил-N3-Boc-(S)- 2,3-диаминопропионат (13,9 ммоль, 4,4 г) растворяли в 25 мл дихлорметана и 35 мл TFA и спустя 1 ч раствор концентрировали, получая маслянистый продукт. Выход 4,8 г (100%). ЯМР (DMSO-d6) δ 8,02 (b, 3H), 7,68 (d, 2H), 4,38 (m, 1H), 3,99 (t, 2H), 3,68 (s, 3H), 3,22 (m, 1H), 3,06 (m, 1H), 1,55 (m, 2H), 1,34 (m, 2H), 0,89 (t, 3H).
Часть Д. Метил-N2-n-бутилоксикарбонил -N3-[3(4- цианофенил)изоксазолин-5(S)-илацетил] -(S)-2,3-диаминопропионат.
К раствору 3-(4-цианофенил)изоксазолин-5(S)-ил-уксусной кислоты (5,2 ммоль, 1,2 г) [хиральное исходное вещество получали из рацемического соединения примера 275, часть А, разделением на колонке Chiralpak AD, 50х2 см, используя 0,1% TFA/EtOH, при 10oC с выходом изомера А (сходит с колонки раньше) и изомера В (сходит позднее), или же изомеры разделяли кристаллизацией хинконидиновой соли 5-S изомера изоксазолина из ацетона, оставляя 5(R) изомер в маточном растворе; абсолютную стереохимию кристаллической соли определяли ренгеновской кристаллографией для выявления 5(S) изоксазолина] и метил N2-бутилоксикарбонил-(S)-2,3- диаминопропионата, соль TFA (6 ммоль, 1,53 г) в 20 мл DMF, охлаждаемой на ледяной бане, добавляли диизопропилэтиламин (20 ммоль, 3,5 мл), а затем ВОР (5,5 ммоль, 2,43 г). После перемешивания в течение 3 ч при комнатной температуре добавляли этилацетат и раствор промывали 0,5 N HCl, рассолом, NaHCO3 и рассолом, высушивали (MgSO4) и концентрировали, получая 1,9 г (87%) конечного продукта. ЯМР (DMSO-d6) δ 8,12 (t, 1H), 7,94 (d, 2H), 7,83 (d, 2H), 7,46 (d, 1H), 5,04 (m, 1H), 4,16 (m, 1H), 3,96 (t, 2H), 3,64 (s, 3H), 3,58 (dd, 1H), 3,40 (m, 2H), 3,20 (dd, 1H), 2,56 (dd, 1H), 2,43 (dd, 1H), 1,52 (m, 2H), 1,32 (m, 2H), 0,88 (t, 3H).
Часть Ж. Метил-N2-n-бутилоксикарбонил -N3-[3-(4-амидинофенил) изоксазолин-5(S)-илацетил] -(S)-2,3-диаминопропионат, соль TFA.
Через раствор метил-N2-n- бутилоксикарбонил-N3-[3(4-цианофенил) изоксазолин - 5(S)-илацетил]-(S)-2,3-диаминопропионата (4,4 ммоль, 1,9 г) в 50 мл метанола пробулькивали газообразный HCl при 0oC в течение 1 ч, раствор перемешивали в течение 5 ч при комнатной температуре и концентрировали. Остаток собирали 20 мл метанола и добавляли карбонат аммония (11 ммоль, 1,1 г). Смесь перемешивали ночь при комнатной температуре и концентрировали. Твердый остаток растворяли в смеси метанол/вода/TFA. Очистка обращенно-фазовой HPLC давала 1,0 г (40%) конечного продукта. ESI (М+Н)+: вычислено 448,3; найдено 448,3.
Пример 314Б
Метил N2-n-бутилоксикарбонил-N3- [3-(4- амидинофенил)изоксазолин -5(R)-илацетил]-(S)-2,3-диаминопропионат, соль TFA
Часть А. 3-(4-цианофенил)-5(R)-ил-уксусная кислота.
Это вещество отделяли от 3-(4-цианофенил)изоксазолин-5(R,S)-ил- уксусной кислоты как описано выше в методе примера 314А, часть Е.
Часть Б. Метил-N2-n-бутилоксикарбонил-N3- [3-(4- цианофенил)изоксазолин -5(R)-илацетил]-(S)-2,3-диаминопропионат.
Это вещество синтезировали из 3-(4-цианофенил)-5(R)-ил-уксусной кислоты (4,3 ммоль, 1,0 г), метил N2-бутилоксикарбонил-(S)-2,3- диаминопропионата, соли TFA (5 ммоль, 1,27 г), ВОР (4,5 ммоль, 2 г) и диизопропилэтиламина (16 ммоль, 2,8 мл), используя тот же метод, что и для XVII, выход 1,75 г (95%). ЯМР (DMSO-d6) δ 8,12 (t, 1H), 7,94 (d, 2H), 7,83 (d, 2H), 7,46 (d, 1H), 5,04 (m, 1H), 4,16 (m, 1H), 3,96 (t, 2H), 3,64 (s, 3H), 3,58 (dd, 1H), 3,40 (m, 2H), 3,20 (dd, 1H), 2,56 (dd, 1H), 2,43 (dd, 1H), 1,52 (m, 2H), 1,32 (m, 2H), 0,88 (t, 3H).
Часть В. Метил N2-n-бутилоксикарбонил -N3-[3-(4- амидинофенил)изоксазолин- 5(R)-илацетил]-(S) -2,3-диаминопропионат, соль TFA.
Это соединение синтезировали из метил-N2-n- бутилоксикарбонил-N3-[3-(4-цианофенил)изоксазолин-5(R)-илацетил]- (S)-2,3-диаминопропионата (4,0 ммоль, 1,7 г) тем же методом, что и в примере 314А, часть Ж. Выход - 1,0 г (45%). ESI (М+H)+: вычислено 448,3; найдено 448,3.
Пример 344
Метил 3(R)-{5(R,S)-N- [3-(4- амидинофенил)изоксазолин-5-илацетил] амино} гептаноат
Часть А. (Е)-метил 2-гептаноат.
К раствору диэтилметилфосфоноацетата (19 мл, 104 ммоль) в безводном THF (800 мл) при -4oC добавляли 64 мл n-Buli (1,6 M в гексане, 102 ммоль) по каплям в течение 45 мин. Полученный раствор перемешивали 1 ч при комнатной температуре. Добавляли валериановый альдегид (10,0 мл, 94 ммоль) и перемешивали 3,5 ч при комнатной температуре. Реакцию останавливали 25 мл насыщенным NH4Cl. Растворители отгоняли при атмосферном давлении и получающийся твердый остаток собирали EtOAc. экстрагировали водой и рассолом и высушивали над Na2SO4. Растворители еще раз отгоняли при атмосферном давлении и получающуюся желтую жидкость перегоняли в вакуумной установке с выходом 7,2 г прозрачной жидкости, интервал кипения в вакуумной установке 90-125oC. МС BP, e/z рассчитано (М+H)+: 143,1072; найдено 143,1070; ИК (пленка) 1728, 1658 см-1.
Часть Б. N-(l-(R)-1-фенилэтил)бензамид.
Раствор бензоилхлорида (22,5 мл, 0,19 моль) в дихлорметане (10 мл) добавляли по каплям в течение 1,5 ч к охлажденному до 0oC раствору (R)-(+)-α-метилбензиламина (25 мл, 0,19 ммоль), триэтиламина (31 мл, 0,22 моль) и 4-DMAP (100 мг) в дихлорметане. Через 1,75 ч при 0oC смесь концентрировали in vacuo, затем разбавляли EtOAc. Эту смесь экстрагировали водой, 1 М HCl, водой и рассолом, затем высушивали (MgSO4) и концентрировали с выходом 43,4 г бесцветного кристаллического твердого остатка; tпл 121,0-121,5oC; ИК-спектр (КВг) 3332, 1636 см-1; [α]
Вычислено для C15H15NO: С 79,97; H 6,71; N 6,22. Найдено: С 79,88; H 6,65; N 6,16.
Часть В. N-(1-(R)-1-фенилэтил)-N-бензиламин.
BH3/THF (1 М в THF, 220 мл, 220 ммоль) добавляли по каплям в течение 1 ч к охлажденному до 0oC раствору упомянутого выше бензамида (20 г, 89 ммоль) в безводном THF (200 мл). Удаляли ледяную баню и смесь нагревали с обратным холодильником 40 ч. Анализ ТСХ показал, что реакция полностью не прошла, поэтому добавляли еще BH3/THF (1 М в THF, 30 мл, 30 ммоль) и продолжали нагревание еще 22,5 ч. После охлаждения осторожно по каплям в течение 5 ч добавляли MeOH (250 мл). Полученную смесь кипятили 2 ч, затем охлаждали и концентрировали in vacuo. Повторное концентрирование из MeOH (2х500 мл) и сушка под высоким вакуумом давали 19,3 г масла, содержащего небольшое количество осадка. Этот неочищенный продукт перемешивали с горячей 2 М HCl (140 мл) до получения прозрачного раствора, затем медленно охлаждали до комнатной температуры и затем в ледяной бане до образования кристаллического твердого остатка, как описано Simpkins (Tetrahedron 1990, 46(2), 523). Твердый остаток собирали фильтрацией и промывали небольшим количеством воды. После высушивания на воздухе в течение 3 дней, получали 16,35 г солянокислой соли; tпл 178,5-179,5oC; [α]
Вычислено C15HN: С 85,26; H 8,11; N 6,63. Найдено: С 84,93; H 7,75; N 6,58.
Часть Г. Метил 3-(R)-[N-бензил-N-(1-(R)-1- фенилэтил) амино]гептаноат.
Согласно методу Davies асимметричного присоединения Михаэля (Tetrahedron: Asymmetry 1991, 2(3), 183), n-бутиллитий (1,6 М в гексане, 4,4 мл, 7,0 ммоль) добавляли по каплям в течение 3 мин к охлажденному до 0oС раствору N- (1-(R)-1-фенилэтил)-N- бензиламина (1,5 г, 7,0 ммоль) в безводном THF (35 мл). Через 30 мин полученный темный розовато-красный раствор охлаждали до -78oC и по каплям добавляли раствор метил 2-гептаноата (0,50 г, 3,5 ммоль) в THF (10 мл). Через 13 мин холодную реакционную смесь гасили насыщенным хлоридом аммония и рассолом, высушивали (MgSO4) и концентрировали in vacuo. Продукт очищали хроматографией на силикагеле, проводя элюцию 0-50% EtOAc в гексане. Фракции наиболее чистого основного продукта (отдельно от нескольких смешанных фракций) концентрировали in vacuo, получая 0,91 г светло-желтого масла, которое при ЯМР показывает присутствие одного диастереомера с заново полученным асимметричным центром, обозначенным как 3(R) по аналогии с Davies, ссылкой, указанной выше; 13С ЯМР (300 МГц, CDCl3) δ 173,31, 143,40, 141,78, 128,40, 128,27, 128,11, 128,00, 126,91, 126,67, 57,90, 54,22, 51,32, 50,05, 36,83, 33,28, 29,32, 22,72, 19,40, 14,12; [α]
Часть Д. Метил 3(R)-аминогептаноат, соль уксусной кислоты.
Метил 3-(R)-[N-бензил- N-(1-(R)-1-фенилэтил)амино]гептаноат (0,70 г, 2,0 ммоль), 20% Pd(OH)2/C (0,35 г), циклогексен (7 мл), ледяную уксусную кислоту (0,12 мл, 2,1 ммоль) и MeOH (14 мл) нагревали с обратным холодильником в атмосфере азота в течение 20,5 ч. После охлаждения катализатор удаляли фильтрацией через пробку из целита, промывали MeOH и раствор концентрировали in vacuo. Сушка в течение ночи под высоким вакуумом давала 0,43 г вязкого масла; 13С ЯМР (300 МГц, CDCl3) δ 177,64, 171,52, 51,97, 48,22, 37,24, 33,08, 27,50, 23,31, 22,29, 13,76; [α]
Часть Е. Метил 3(R)-{5(R,S)-N-[3-(4-цианосфенил)изоксазолин- 5-илацетил] амино}гептаноат.
К суспензии 3-(4-цианофенил)изоксазолин-5-илуксусной кислоты (300 мг, 1,3 ммоль) в EtOAc (10 мл) добавляли метил 3(R)-аминогептаноат, соль уксусной кислоты (287 мг, 1,3 ммоль), TBTU (420 мг, 1,3 ммоль) и Et3N (600 мкл, 4,3 ммоль). После 2,5 ч перемешивания при комнатной температуре реакционную смесь экстрагировали 5% KHSO4, насыщенный NaHCO3 и рассолом, затем высушивали Na2SO4. Выпаривание с последующей хроматографией на силикагеле в 50-100% EtOAc/гексаны давали 245 мг бесцветного стекла. МС (NH3-DCI). Рассчитано: (М+Н)+ 372; (M+NH4)+ 389. Найдено: 372, 389.
Часть Ж. Метил 3(R)-{5(R,S)-N-[3-(4-амидинофенил)изоксазолин- 5- илацетил]амино}гептаноат.
К раствору метил 3(R)-{5(R,S)-N-[3-(4- цианофенил)изоксазолин-5-илацетил] амино} гептаноата (179 мг, 0,48 ммоль) в 15 мл безводного MeOH при 0oC добавляли поток газообразного HCl, получаемого добавлением двух порций по 20 мл серной кислоты на твердый хлорид натрия, в течение 35 мин. После перемешивания в течение 20 ч при комнатной температуре растворитель удаляли быстрым потоком азота. Добавляли Et2O и удаляли быстрым потоком азота. Полученное масло с высоким содержанием смолистых веществ собирали в 15 мл безводного MeOH, к которому добавляли (NH4)2CO3 (1,1 г, 11,4 ммоль). После перемешивания в течение 19,5 ч при комнатной температуре растворитель удаляли быстрым потоком азота и получающийся белый твердый остаток очищали хроматографией на силикагеле, проводя элюцию 0-20% MeOH/CHCl3. Очищенный продукт собирали в 5% MeOH/CHCl3 и фильтровали, концентрирование фильтрата давало 100 мг твердого белого вещества. ИК (KBr) 3600-2800, 1734, 1676, 1640 см-1; MC BP, e/z вычислено (М+Н)+ 389,2189; найдено: 389,2192.
Пример 348
Этил 3(R)-{5(R,S)-N-[3-(4- амидинофенил)изоксазолин-5-илацетил]амино}-5-метилгексаноат, соль трифторуксусной кислоты
Часть А. (Е)-этил 5-метил-2-гексаноат.
Получали так же, как и метил 2-гептаноат, используя триэтилфосфоноацетат, перемешивая 17 ч при комнатной температуре перед добавлением изовалерианового альдегида. Отгонка в вакуумной установке давала 72% прозрачного масла, интервал кипения в вакуумной установке 80-130oC; ИК (пленка) 1724, 1656 см-1.
Часть Б. Этил 3-(R)-[N-бутил-N-(1-(R)-1-фенилэтил)амино]-5- метилгексаноат.
Получали аналогичным образом через асимметричное присоединение Михаэля пример 344, часть Г (см. выше). Выход вязкого светло-желтого масла (65%); 13C ЯМР (300 МГц, CDCl3) δ 172,83, 143,56, 142,71, 128,27, 128,21, 128,15, 128,03, 126,96, 126,60, 60,10, 58,56, 52,43, 50,09, 43,23, 36,72, 24,76, 23,48, 22,13, 20,20, 14,21; [α]
Часть В. Этил 3-(R)-амино-5-метилгексаноат, соль уксусной кислоты.
Получали как описано ранее, за исключением того, что в качестве растворителя использовали этанол. Выход воскообразного твердого остатка (94%); tпл 57-61oC; МС BP, e/z вычислено: (М+H)+ 174,1494; найдено: 174,1485.
Часть Г. Этил 3-(R)-амино-5-метилгексаноат, соль соляной кислоты.
Указанную выше соль уксусной кислоты (1,1 г, 4,7 ммоль) перемешивали 4 мин в 4 М HCl/диоксане (5,0 мл). Полученный раствор растирали Et2O, охлаждали и прозрачный раствор декантировали, оставляя оранжевое масло, которое затвердевало под высоким вакуумом с образованием 960 мг восковидного твердого остатка. 1H ЯМР (300 МГц, CDCl3) δ 8,49 (br, 3H), 4,20 (q, J=7,3, 2H), 3,70-3,65 (m, 1H), 2,86-2,80 (m, 2H), 1,83-1,80 (m, 2H), 1,58-1,54 (m, 1H), 1,30-1,26 (t, J=7,3, 3H), 0,99- 0,91 (m, 6H).
Часть Д. Этил 3(R)-{ 5(R, S)-N- [3-(4-(N-t- бутилоксикарбониламидино) фенил)изоксазолин-5-илацетил]амино}-5- метилгексаноат.
К суспензии 3-[4-(N-t-бутоксикарбониламидино) фенил]изоксазолин-5-ил-уксусной кислоты (78 мг, 0,22 ммоль) в EtOAc (5 мл) добавляли этил 3-(R)-амино-5-метилгексаноат, соль соляной кислоты (47 мг, 0,22 ммоль), TBTU (72 мг, 0,22 ммоль) и Et2N (100 мкл, 0,72 ммоль). После перемешивания в течение 6 ч при комнатной температуре, реакционную смесь экстрагировали буфером с pH 4 (гидрофталат калия), насыщенным NaHCO3 и рассолом, затем высушивали с Na2SO4. Выпаривание с последующей хроматографией на силикагеле с 100% EtOAc давали 33 мг бесцветного стекла; 1H ЯМР (300 МГц, CDCl3) δ 7,90 (d, J=8,4, 2H), 7,70 (dd, J= 8,5, J'=1,9, 2H), 6,32-6,28 (m, 1H), 5,13-5,11 (m, 1H), 4,34-4,33 (m, 1H), 4,17-4,09 (m, 2H), 3,56-3,47 (m, 1H), 3,25-3,17 (m, 1H), 2,71-2,46 (m, 4H), 1,66-1,47 (m, 2H), 1,56 (s, 9H), 1,31-1,23 (m, 4H), 0,92 (dd, J=6,6, J'=1,8, 3H), 0,84 (d, J=6,6, 3H).
Часть Г. Этил 3(R,S)-{5(R,S)-N-[3- (4- амидинофенил)изоксазолин -5-илацетил] амино}-5-метилгексаноат, соль трифторуксусной кислоты.
Продукт части Д (29 мг, 0,058 ммоль) растворяли в DCM (300 мкл), к которому добавляли TFA (100 мкл). Полученный раствор перемешивали при комнатной температуре с CaSO4 сушительной трубкой 3,5 ч и растирали с Et2O. Собирали фильтрацией 24 мг твердого белого остатка. 1H ЯМР (300 МГц, CDCl3) 9,4 (br, 1H), 9,0 (br, 1H), 7,8 (s, 4H), 5,0 (m, 1H), 4,2 (m, 1H), 4,0 (m, 2H), 3,6 (m, 1H), 3,3 (m, 2H), 2,4 (m, 3H), 1,6 (m, 1H), 1,4 (m, 1H), 1,2 (m, 4H), 0,8 (m, 6H); MC BP, e/z рассч.: (M+H)+ 403,2345; найдено: 403,2363.
Пример 350
Метил 3(R,S)- {5(R,S)-N-[3-(4-амидинофенил)изоксазолин-5-илацетил]амино} -4-(фенилтио)бутаноат, соль соляной кислоты
Часть А. Метилфенилтиоацетоацетат.
К раствору тиофенола (5,00 мл, 48,6 ммоль) в DMF (20 мл) добавляли карбонат калия (10,09 г, 73 ммоль) и метихлорацетоацетат (5,93 мл, 48,6 ммоль). Реакционную смесь перемешивали 6 ч при 50oC, разбавляли EtOAc и экстрагировали насыщенным Na2SO4, водой и рассолом, затем высушивали (Na2SO4) и концентрировали. Полученное масло хроматографировали с 20% EtOAc в гексане с выходом 9,40 г желтого масла; МС (CH4-DCI) вычислено: (М+Н)+ 224; найдено: 224; ИК-спектр (KBr) 2954, 1656, 1438, 626 см-1.
Часть Б. Метил-3(R,S)-амино-4-фенилтиобутаноат.
К раствору метилфенилтиоацетоацетата (1,00 г, 4,5 ммоль) в MeOH (20 мл) добавляли формиат аммония (4,26 г, 6,75 ммоль) и цианоборгидроид натрия (0,42 г, 6,7 ммоль). Реакционную смесь перемешивали при комнатной температуре 18 ч, затем разбавляли ЕtOАс и разделяли в 1 М HCl. Водный слой защелачивали до pH 8,0 NaOH. Желаемый продукт экстрагировали EtOAc, промывали водой и рассолом, высушивали над Na2SO4 и концентрировали, получая 0,61 г желтого масла; МС (NH3-CI/DDIP) вычислено: (М+Н)+ 226; найдено: 226; 1H ЯМР (300 МГц, CDCl3) δ 7,39 (d, J=7, 2H), 7,32-7,26 (m, 3H ), 7,22 (d, J=10, 1H), 3,74 (s, 3H), 3,39-3,31 (m, 1H), 3,13-3,07 (dd, J=13, J'=9, 1H), 2,91-2,83 (dd, J= 12, J'=6, 1H), 2,65-2,58 (dd, J=12, J'=6, 1H), 2,46-2,38 (dd, J=16, J'=8, 1H).
Часть В. Метил-3-(R,S)-{5(R,S)-N-[3-(4-цианофенил) изоксазолин-5- илацетил]амино}-4-((фенилтио)бутаноат.
К суспензии 3-(4-цианофенил)изоксазолин-5-ил-уксусной кислоты (0,50 г, 2 ммоль) в EtOAc (10 мл) добавляли метил-3-(R,S)амино-4- (фенилтио)бутаноат (0,51 г, 2 ммоль), TBTU (0,71 г, 2 ммоль) и Et3N (1,24 мл, 8,9 ммоль). Реакционную смесь перемешивали 2 ч при комнатной температуре, разбавляли EtOAc, промывали 5% лимонной кислотой, насыщенным NaHCO3 и рассолом, высушивали над Na2SO4, концентрировали и полученное масло хроматографировали на силикагеле в 100% EtOAc, получая 0,61 г желтого стекла; МС (NH3-CI/DDIP) рассчитано для (М+Н)+: 438,1; найдено: 438,1.
Вычислено для С32H23N3O4S1: С 63,31; H 5,30; N 9,60; S 7,33. Найдено: С 62,99; H 5,22; N 9,53; S 7,30.
Часть Г. Метил 3(R, S)-{ 5(R, S)-N-[3-(4- амидинофенил)изоксазолин-5- илацетил]амино} -4-(фенилтио)бутаноат. соль соляной кислоты.
Продукт части В (0,30 г, 0,68 ммоль) растворяли в безводном MeOH (20 мл) при 0oC. Через полученный раствор пропускали газообразый HCl от источника, описанного в примере 344, часть Ж, в течение 2 ч. Источник удаляли и реакционную смесь перемешивали при 0oC 18 ч, затем концентрировали и растирали с CHCl3. Получающийся осадок собирали фильтрацией и перерастворяли в безводном MeOH (20 мл). К этому раствору добавляли карбонат аммония (0,99 г, 10 ммоль) и перемешивали смесь 18 ч при комнатной температуре. Раствор концентрировали и перекристаллизовывали из DCM/MeOH с выходом 0,14 г белого твердого остатка; МС BP, e/z рассч. для (М+Н)+: 455,1753; найдено: 455,175. 1H ЯМР (300 МГц, d6-DMSO) 9,44 (br s, 1H), 9,18 (br s, 1H), 8,22 (d, J =10, 1H), 7,86 (m, 4H), 7,41-7,25 (m, 4H), 7,2 (m, 1H), 5,03 (m, 1H), 4,2 (m, 1H), 3,59 (s, 3H) 3,29-3,05 (m, 4H), 2,8-2,39 (m, 4H).
Пример 359
Метил 3(R,S)-{5(R,S)-N-[3-(4- амидинофенил)изоксазолин-5-илацетил]амино} -4- (фенилсульфонамидо)бутаноат, соль трифторуксусной кислоты
Часть А. Метил 3(R,S)-гидрокси-4-аминобутаноат, соль соляной кислоты.
Хлорметилсилан (100 мл, 0,79 моль) добавляли по каплям в течение 1,5 ч к перемешиваемой при 0oC суспензии 4-амино-3-(R,S)- гидроксимасляной кислоты (25 г, 0,21 моль) в MeOH (1 л). Получающемуся прозрачному раствору давали медленно согреться до комнатной температуры в течение ночи. Растворитель выпаривали in vacuo и получающийся остаток концентрировали еще раз из MeOH (2х500 мл). Сушка под высоким вакуумом давала 37 г вязкого масла. 13С ЯМР (300 МГц, d6-DMSO) δ 171,42, 90,14, 64,67, 51,89, 44,39.
Вычислено для C5H16ClNO3: С 35,41; H 7,13; N 8,26; Cl 20,90. Найдено: С 35,18; H 7,09; N 8,18; Cl 20,77.
Часть Б. Метил 3(R,S)-гидрокси-4-(фенилсульфонамидо)бутаноат.
Раствор бензолсульфонилхлорида (7,5 мл, 59 ммоль) в дихлорметане (10 мл) по каплям добавляли в течение 55 мин к охлажденному до 0oC растворе соли амина части А (10 г, 50 ммоль) и Et3N (17 мл, 120 ммоль) в дихлорметане (110 мл). Смеси давали медленно согреться до комнатной температуры и продолжали перемешивание в течение выходных. После удаления in vacuo растворителя смесь разбавляли EtOAc и экстрагировали водой, 0,1 М HCl и рассолом. Высушивание (MgSO4) и удаление in vacuo растворителя давали 14,6 г вязкого масла: 13С ЯМР (300 МГц, CDCl3) δ 172,67, 139,79, 132,78, 129,22, 127,02, 66,77, 52,01, 47,72, 38,31.
Вычислено для C11H15NO5S: С 48,34; H 5,53; N 5,13; S 11,73. Найдено: С 48,44; H 5,61; N 4,90; S 11,34.
Часть В. Метил 3-оксо-4-(фенилсульфонамидо)бутаноат.
Спирт Части Б (2,8 г, 10 ммоль) окисляли реактивом Джонса при стандартных условиях. Кетон очищали хроматографией на силикагеле, проводя элюцию 0-100% EtOAc в гексане, получая 1,11 г восковидного твердого остатка; tпл 94,5-95,5oC; 13С ЯМР (300 МГц, CDCl3) δ 197,08, 166,80, 139,17, 133,08, 129,29, 127,17, 52,71, 51,91, 46,15.
Вычислено для C11H13NO5S: С 48,70; H 4,83; N 5,16; S 11,82. Найдено: С 48,77; H 4,69; N 5,08; S 11,88.
Часть Г. Метил 3-(R,S)-3-амино-4-(фенилсульфонамидо)бутаноат.
При комнатной температуре к раствору кетона части В (0,71 г, 2,6 ммоль) в MeOH (7 мл) и THF (3 мл) добавляли формиат аммония (2,5 г, 39 ммоль) и цианоборгидрид натрия (0,25 г, 3,9 ммоль). Через 45,5 ч растворитель выпаривали и остаток разбавляли EtOAc (70 мл). Этот раствор экстрагировали 1,0 М NaOH, водой и рассолом. После концентрирования продукт очищали хроматографией на силикагеле, проводя элюцию 0-100% EtOAc в гексане, затем 1-20% MeOH в EtOAc, получая 0,16 г вязкого масла, которое со временем затвердевало; 1H ЯМР (300 МГц, CDCl3) δ 9,79 (br, 2H), 7,84 (d, 2H, J=8 Гц), 7,81 (br, 1H), 7,68-7,53 (m, 3H), 4,05-3,92 (m, 1H), 3,75 (s, 3H), 3,33-3,17 (m, 2H), 2,89-2,72 (m, 2H); MCBP e/z вычислено (M+H)+: 273,0909; найдено: 273,0916.
Часть Д. Метил 3-(R,S)-{5(R,S)-N-[3- (4-N-t- бутилоксикарбониламидино) фенил)изоксазолин-3-илацетил]амино}- (фенилсульфонамидо)бутаноат.
Это соединение получали по аналогии с примером 348, часть Д, перемешивая 24 ч в 5 мл EtOAc и 1 мл DMF. Хроматография в 5% MeOH/CHCl3 давала 80% оранжевого твердого остатка; ИК-спектр (KBr) 3296, 2338, 1736, 1660, 1618 см-1; MC BP, e/z вычислено для (М+Н)+: 602,2285; найдено: 602,2270.
Часть Е. Метил 3-(R,S)-{5(R,S)-N-[3- (4- амидинофенил)изоксазолин -5-илацетил] амино} -4- (фенилсульфонамидо)бутаноат, соль трифторуксусной кислоты.
От продукта части Д отщепляли защиту аналогично примеру 348, часть E, получая 86% розового твердого остатка; ИК-спектр (KBr) 3312, 3104, 1734, 1670; МС BP, e/z вычислено для (М+Н)+: 502,1760; найдено: 502,1761. Более активный диастереомер (на основе PRP анализа) выделяли из указанной выше смеси SFC HPLC, Chiralpak AD - 2х25 см, проводя элюцию 0,1% TFA/25% MeOH/75% CO2. При этих условиях более активный диастереомер элюировался последним.
Пример 362
Метил 3(R,S)-{5(R,S)-N-[3-(4- амидинофенил)изоксазолин-5-илацетил]амино} -4-(n- бутилсульфонамидо)бутаноат, соль трифтоуксусной кислоты
Часть А. Метил 3-(R,S)-гидрокси-4- (n- бутилсульфонамидо)бутаноата.
Это соединение получали точно так же, как и в примере 359, часть Б, используя n-бутилсульфонилхлорид. Бесцветный восковидный твердый остаток превосходной чистоты получали с 65% выходом без очистки; tпл 46-50oC; 13С ЯМР (300 МГц, CDCl3) δ 172,64, 67,29, 52,56, 51,99, 47,83, 38,40, 25,57, 21,52, 13,55.
Вычислено для C19H19NO5S: С 42,67; H 7,59; N 5,53; S 12,66. Найдено: С 42,69; H 7,59; N 5,36; S 12,78.
Часть Б. Метил-3-окса-4-(n-бутилсульфонамидо)бутаноат.
Полученный спирт немедленно окисляли как описано в примере 359, часть В, с образованием бесцветного твердого остатка (выход 57%); tпл 53-55oC.
Вычислено для C9H17NO5S: С 43,02; H 6,82; N 5,57; S 12,76. Найдено: С 42,68; H 7,03; N 5,74; S 13,06.
Часть В. Метил 3(R,S)-3-амино-4-(n- бутилсульфонамидо)бутаноат.
Соединение получали по аналогии с примером 350, часть Б, используя вышеуказанный продукт части Б (1,20 г, 4,8 ммоль), получая 0,26 г желтого масла; 1H ЯМР (300 МГц, CDCl3) δ 3,70 (s, 3H), 3,38 (m, 1H), 3,24-3,13 (m, 1H), 3,02 (m, 4H), 2,58-2,52 (dd, J=16, J'= 11, 1H), 1,79 (m, 2H), 1,24 (m, 2H), 0,95 (t, 3H); MC (NH4-DCI) вычислено для (M+H)+: 271; найдено: 271.
Часть Г. Метил-3(R,S)-{5(R,S)-N-[3-(4-N-t- бутоксикарбониламидин) фенил)изоксазолин-5-илацетил]амино}-4-(n- бутилсульфониламидо)бутаноат.
К раствору 3-[4-(N-t- бутоксикарбониламидин)фенил)изоксазолин-5-илуксусной кислоты (0,24 г, 0,83 ммоль) в DMF (20 мл) добавляли продукт Части В (0,29 г, 0,83 ммоль), TBTU (0,27 г, 0,83 ммоль) и Et3N (0,46 мл, 3,3 ммоль). После перемешивания в течение 4 ч при комнатной температуре реакционную смесь разбавляли EtOAc, экстрагировали буфером pH 4 (гидрофталат калия), насыщенным NaHCO3, рассолом, затем высушивали (NaSO4). Концентрирование с последующей хроматографией на силикагеле в 100% EtOAc давали 1,17 г белой пены; МС (NH3-DCI)вВычислено для (М+Н)+: 582,3; найдено: 582; ИК-спектр (KBr) 3312, 2338, 1620, 1144 см-1.
Часть Д. Метил 3(R,S)-{5(R,S)-N-[3-(4- амидинофенил)изоксазолин-5-илацетил] амино} -4-(n- бутилсульфонамидо)бутаноат, соль трифтоуксусной кислоты.
К раствору продукта части Г (0,22 г, 0,37 ммоль) в DCM (10 мл) добавляли трифторуксусную кислоту. Реакционную смесь перемешивали 2 ч при комнатной температуре, растирали с Et2O и получающийся осадок хроматографировали на силикалеге в 20% MeOH в CHCl3 с выходом 0,20 г белого твердого остатка; МС BP, e/z вычислено для (М+Н)+: 482,2073; найдено: 482,2090; tпл 178-184oC.
Пример 365
Метил { 5(R, S)-N-[3-(4-амидинофенил)изоксазолин-5- илацетил]амино}-4-(метоксикарбонил) бутаноата, соль трифторуксусной кислоты
Часть А. Диметил 3-аминоглутарат, соль соляной кислоты.
Этот продукт получали как описано в примере 359, часть А, из бета-глутаминовой кислоты, получая диэфир в виде бесцветной смолы с количественным выходом; МС BP, e/z вычислено для (М+Н)+: 176,0923; найдено: 176,0933.
Часть Б. Метил { 5(R, S)-N-[3-(4-(N-t- бутоксикарбониламидино) фенил)изоксазолин -5-илацетил]амино}-4- (метоксикарбонил)бутаноат.
Получали по аналогии с примером 359, часть Д, с выходом 32% белого твердого остатка; МС BP, e/z вычислено для (М+Н)+: 505,2298; найдено: 505,2283.
Часть В. Метил { 5(R,S)-N-[3-(4-амидинофенил)изоксазолин-5- илацетил] амино}-4-(метоксикарбонил)бутаноат, трифторуксусной кислоты.
Получали по аналогии с примером 348, часть E, с выходом 83% белого твердого остатка; ИК-спектр (KBr) 3316, 3102, 2340, 1736, 1670 см-1; МС BP, e/z рассч. для (М+Н)+: 405,1774; найдено: 405,1775.
Пример 368
Метил 3(R,S)-{5(R,S)-N-[3-(4- амидинофенил)изоксазолин-5-илацетил]амино} -4- (метоксикарбонил)пентаноат, трифторуксусной кислоты
Часть А. Диметил 3-(R,S)-аминоадипат, соль соляной кислоты.
Этот продукт получали как в Примере 359, Часть А, их бета-аминоадипиновой кислоты с образованием бесцветной смолы с количественным выходом; МС BP, e/z вычислено для (М+Н)+: 190,1079; найдено: 190,1080.
Часть Б. Метил-3(R,S)-{5(R,S)-N-[3-(4-N-t- бутоксикарбониламидин) фенил)изоксазолин-5-илацетил]амино}-4- (метоксикарбонил)пентаноат.
Это вещество получали по аналогии с примером 362, часть Г, используя вышеуказанное соединение части А (0,70 г, 3,1 ммоль) с выходом 1,17 г белой пены; МС BP, e/z вычислено для (М+Н)+: 519,2454; найдено: 519,2459.
Вычислено для С25H34N4O8: С 57,90; H 6,61; N 10,80. Найдено: С 57,73; H 6,51; N 10,86.
Часть В. Метил 3(R,S)-{5(R,S)-N-[3-(4- амидинофенил)изоксазолин-5-илацетил] амино}-4- (метоксикарбонил)пентаноат, трифторуксусной кислоты.
Этот продукт получали так же, как и в примере 362, часть Д, используя вышеуказанный продукт части В (1,00 г, 1,9 ммоль) с выходом 0,9 г белого твердого остатка; МС BP, e/z вычислено для (М+Н)+: 419,1930; найдено: 419,1921; tпл 214-215oС (разложение).
Пример 375
Получение 2-(R, S)-2-карбоксиметил-1-{ 5-(R, S)-N- [3-(4-амидинофенил) изоксазолин-5-илацетил]} пиперидин
Часть А. Получение 2-(метокси-2-оксоэтил)пиперидин.
Солянокислую пиридилуксусную кислоту (10,00 г, 57,6 ммоль) и оксид платины (IV) (1,00 г, 4,4 ммоль) встряхивали в смеси 75 мл уксусной кислоты, 75 мл метанола и 10 мл концентрированной HCl на Parr под 60 hsi водорода при комнатной температуре в течение ночи. Затем смесь фильтровали через Целит и фильтрат выпаривали при пониженном давлении с выходом 8,42 г (75,9%) названного выше соединения в виде не совсем белого твердого остатка. МС (NH3- CI/DDIP): m/e 158 (М+Н)+. 1H ЯМР (300 МГц, CDCl3) δ 1,50-1,96 (m, 6H), 2,80 (m, 2H), 3,20-3,60 (m, 3H), 3,76 (s, 3H). 13С ЯМР (60 МГц, d6-DMSO): 21,94, 28,05, 37,46, 40,49, 44,12, 57,33, 52,74, 170,39.
Часть Б. Получение 2-(R,S)-2-(метокси-2-оксоэтил) -1-{5- (R,S)-N-[3-(4-цианофенил)изоксазолин-5-илацетил)} пиперидин.
К 2,00 г (8,69 ммоль) 3-(4-цианофенил)-изоксазолин-5-илуксусной кислоты в безводном DMF добавляли 1,36 г (8,69 ммоль) 2-(метокси-2- оксоэтил)пиперидин, 2,80 г (8,69 ммоль) TBTU и 6,05 мл (34,7 ммоль) диизопропилэтиламина. После перемешивания в течение 6 ч реакционную смесь разбавляли этилацетатом и промывали 5% водным раствором лимонной кислоты, водой, 5% водным раствором NaHCO3 и насыщенным раствором NaCl. Органический слой высушивали над Na2SO4 и фильтровали. Фильтрат выпаривали при пониженном давлении, получая неочищенный продукт в виде желтой пены. Очистка колоночной флэш-хроматографией на силикагеле с 25-75% этилацетатом в гексане давала 1,54 г (48%) указанного соединения в виде желтой пены. Из смеси выделяли один диастереомер (рацемический). МС (NH3-CI/DDIP): m/e 370 (М+H)+. 1H ЯМР (300 МГц, CDCl3) δ 1,42-1,76 (m, 6H), 2,60 (m, 2H), 2,77-3,01 (m, 3H), 3,05-3,26 (m, 2H), 3,56-3,70 (m, 4H), 4,50 (m, 1H), 5,20 (m, 1H), 7,69 (d, J=8,4 Гц, 2H), 7,77 (d, J=8,4 Гц, 2H).
Часть В. Получение 2-(метокси-2-оксоэтил)-1-{N-[3-(4- амидинофенил) изоксазолин-5-илацетил]) пиперидин (рацемический диастереомер А).
Газообразный HCl пробулькивали через раствор 1,02 г (2,80 ммоль) продукта части Б в 30 мл безводного MeOH, охлаждаемого на ледяной бане, в течение 2 ч. Затем реакционную колбу запаивали тефлоновой лентой и согревали до комнатной температуры, перемешивая в течение ночи. Выпаривали MeOH при пониженном давлении и затем под вакуумом, получая промежуточный имидат в виде желтой пены. МС (ESI): m/e 402 (М+H)+. Затем его перемешивали с 8,07 г (84,0 ммоль) (NH4)2CO3 в 30 мл безводного EtOH ночь в запаянной реакционной колбе. После фильтрования фильтрат выпаривали при пониженном давлении, получая неочищенный продукт в виде желтой пены, который затем очищали флэш- хроматографией, используя 5-17% MeOH в CH2Cl2, получая 0,29 г (26,8%) указанного соединения в виде желтого твердого остатка. МС (ESI): m/e 387 (М+H)+. 1H ЯМР (300 МГц, d6-DMSO) δ 1,57-1,67 (br, 6H), 2,46-2,90 (m, 5H), 3,16 (m, 2H), 3,53-3,64 (m, 4H), 4,36 (br. m, 1H), 5,07 (br. m, 1H), 7,89 (m, 4H), 9,38 (br. s, 3H).
Часть Г. Получение 2-карбоксиметил-1-{N-[3-(4- амидинофенил)изоксазолин-5-илацетил)} пиперидин, (рацемический изомер А).
К раствору 0,08 г (0,2 ммоль) продукта, выделенного в части В, в 5 мл безводного THF при температуре окружающей среды добавляли 0,5 мл (0,5 ммоль) 1,0 М раствора NaOTMS в THF. После перемешивания в течение ночи растворитель выпаривали при пониженном давлении, получая желтый твердый остаток, который перекристаллизовывали из MeOH и Et2O, получая 0,05 г (64,9%) названного соединения в виде желтого порошка. МС (ESI): m/e 373 (М+H)+. 1H ЯМР (300 МГц, CD3OD) δ 1,68 (br., 6H), 2,56 (m, 2H), 2,72 (m, 3H), 2,94 (m, 2H), 3,57 (m, 4H), 4,46 (br., 1H), 5,18 (br., 1 H), 7,84 (m, 4H).
Пример 377
Получение 2-(R, S)-2-карбоксиметил-1-{ 5-(R, S)-N- [3-(4-амидинофенил) изоксазолин-5-илацетил]} азепина
Часть А. Получение 2-(R,S)-2-(этокси-2-оксоэтил)-1-{5-(R,S)- N-[3-(4-цианофенил)изоксазолин-5-илацетил]}азепина.
Получали 0,73 г (84,6%) указанного соединения из 0,50 г (2,17 ммоль) 3-(4- цианофенил)изоксазолин-5-илуксусной кислоты, используя 0,40 г (2,17 ммоль) 2-(этокси-2-оксоэтил)азепина, 0,70 г (2,17 ммоль) TBTU и 1,51 мл (8,70 ммоль) диизопропилэтиламина, согласно методу примера 375, часть Б. МС (NH3-CI/DDIP): m/e 398 (М+H)+. 1H ЯМР (300 МГц, CDCl3) δ 1,26 (m, 11H), 1,83 (br., 2H), 2,05 (m, 1H), 2,18-2,65 (m, 2H), 2,76-2,85 (m, 1H), 3,04 (m, 2H), 3,62 (s, 1H), 4,08 (m, 2H), 5,22 (m, 1H), 7,68 (d, J=8,4 Гц, 2H), 7,78 (d, J= 8,4 Гц, 2H).
Часть Б. Получение 2-(R,S)-2-(этокси-2-оксоэтил)-1-{5-(R,S)- N-[3-(4- амидинофенил) изоксазолин-5-илацетил]} азепина.
0,42 г (61,1%) названного соединения получали по методу примера 375, часть В, из 0,73 г (1,84 ммоль) 2-(R,S)-2-(этокси-2-оксоэтил)-1- {5-(R,S)-N-[3-(4-цианофенил)изоксазолин-5-илацетил] } азепина, используя в качестве растворителя EtOH. МС (NH3-CI/DDIP): m/e 415 (М+H)+. 1H ЯМР (300 МГц, d6-DMSO) δ 1,18 (m, 3H), 1,38 (m, 2H), 1,70 (m, 4H), 2,08 (br., 2H), 2,66 (m, 2H), 3,02-3,26 (m, 2H), 3,60 (br. m, 1H), 4,05 (m, 2H), 4,58 (m, 1H), 5,10 (m, 1H), 7,90 (m, 4H), 9,38 (br. s, 3H).
Часть В. Получение 2-(R,S)-2-карбоксиметил-1-{5-(R,S)-N-[3- (4-амидинофенил) изоксазолин-5-илацетил)} азепина.
0,12 г (82,9%) указанного соединения получали по методу примера 375, часть Г, из 0,16 г (0,35 ммоль) 2-(R,S)-2-(этокси-2-оксоэтил)-1-{5-(R,S)-N- [3-(4-амидинофенил) изоксазолин-5-илацетил] } азепина, используя 0,89 мл (0,89 ммоль) 1,0 М раствора NaOTMS в THF. МС (NH3-DCI): m/e 387 (М+Н)+.
Пример 400
Получение 3-(R,S)-(метокси-2-оксоэтил)-4-{5- (R,S)-N-[3-(4-амидинофенил) изоксазолин-5-илацетил]}пиперазин-2- она
Часть А. Получение 3-(R, S)-(этокси-2-оксоэтил)-4-{ 5-(R,S)-N- [3-(4- цианофенил) изоксазолин-5-илацетил]}пиперазин-2-она.
1,08 г (62,4%) указанного соединения получали по методу примера 375, часть Б, из 1,00 г (4,34 ммоль) 3-(4-цианофенил)изоксазолин-5-ил-уксусной кислоты, используя 0,81 г (4,34 ммоль) этил 2-пиперазин- 3-он ацетат, 1,39 (4,34 ммоль) TBTU и 3,02 мл (17,40 ммоль) диизопропилэтиламина. МС (NH3-CI/DDIP): m/e 399 (М+Н)+. 1H ЯМР (300 МГц, CDCl3) δ 1,26 (m, 3H), 2,71-3,65 (br., 9H), 3,87 (br., m, 1H), 4,16 (m, 2H), 5,01 & 5,09 (два t, J= 5,0, 5,1 Гц, 1H), 5,20 (m, 1H), 7,00 & 7,12 (два br, 1H), 7,77 (m, 4H).
Часть Б. Получение 3-(R, S)-(метокси-2-оксоэтил)-4-{ 5-(R,S)- -[3-(4- амидинофенил) изоксазолин-5-илацетил]} пиперазин-2-она.
0,30 г (27,6%) указанного соединения получали согласно примеру 375, часть В, из 1,08 г (2,71 ммоль) 3-(R,S)-(этокси-2-оксоэтил)- 4-{5-(R,S)-N-[3-(4-цианофенил)изоксазолин-5-илацетил]}пиперазин-2- она. МС (NH3-CI/DDIP): m/e 402 (М+H)+. 1H ЯМР (300 МГц, d6-DMSO) δ 2,70-3,67 (m, 12H), 3,91 (br., 1H), 4,87 & 4,64 (два m, 1H), 5,06 (m, 1H), 7,88 (m, 4H), 8,16 (br., 1H), 9,40 (br. s, 3H).
Пример 434
Получение (S)- Nα-[3-(4-aмидинoфeнил)изoкcaзoлин- 5-(R, S)-илaцeтил]- α-аспартат-N- (2-фенилэтил)амида, соль трифторуксусной кислоты
Часть А. Получение (S)- Nα-(бензилоксикарбонил)- β-(O-t-бутил)-α-аспартат -N-(2-фенилэтил)амида.
К раствору (S)-N-(бензилоксикарбонил)-β- (O-t-бутил)-аспарагиновой кислоты (BACHEM-Bioscience Inc) (3,20 г, 9,9 ммоль) в DCM (25 мл) добавляли этоксифениламин (1,34 г, 11,1 ммоль), затем добавляли DEC (2,10 г, 10,9 ммоль). Реакционную смесь перемешивали в течение ночи при комнатной температуре, получая светло-желтый раствор. Этот раствор промывали водой, 1 M HCl, 5% NaHCO3 и насыщенным NaCl, высушивали над безводным сульфатом магния, фильтровали и концентрировали под вакуумом, получая 4,28 г (100%) амида, который имел достаточную чистоту для использования на следующем этапе; 1H ЯМР (300 МГц, CDCl3) δ 7,35 (s, 5H), 7,17-7,35 (bm, 5H), 6,52 (bs, 1H), 5,93 (bd, J=8,1 Гц,
1H), 5,10 (s, 2H), 4,46 (bm, 1H), 3,50 (dd, J=13,9, 6,2 Гц, 2H), 2,92 (dd, J=17,0, 4,2 Гц, 2H), 2,57 (dd, J=17,0, 6,4 Гц, 1H), 1,42 (s, 9H); масс-спектр (NH3-DCl, e/z, относительное содержание) 444, (M+NH4)+, 100%; 427, (M+H)+, 4%.
Часть Б. Получение (S)-β-(O-t-бутил)-α- аспартат-N- (2- фенилэтил)амида.
Проводили реакцию гидрирования в растворе (S)-М-(бензилоксикарбонил)-β-(O-t-бутил)-α-аспартат-N-(2-фенилэтил)амида (4,09 г, 9,58 ммоль) в этиловом спирте (30 мл) при атмосферном давлении, используя в качестве катализатора 10% палладий на углероде (1,0 г) в течение 90 мин. Катализатор удаляли фильтрацией и фильтрат концентрировали под вакуумом с получением 2,80 г янтарного масла, которое очищали флэш-хроматографией (5% MeOH/DCM), получая 2,13 г (76%) свободного амина в виде твердого вещества; 1H ЯМР (300 МГц, CDCl3) δ 7,44 (bs, 1H), 7,20-7,35 (m, 5H), 3,61 (dd, J=8,4, 3,7 Гц, 1H), 3,52 (dd, J=13,2, 7,0 Гц, 1H), 2,80-2,90 (m, 3H), 2,46 (dd, J=16,7, 8,4 Гц, 1H), 1,58 (bs, 2H), 1,45 (s, 9H); масс-спектр (ESI, e/z, относительное содержание) 293, (М+Н)+, 37%; 237, (М+H-C4H8)+, 100%.
Часть В. Получение метил 3-(4-метоксиаминофенил)-(5R,S)- изоксазолин-5-илацетата, соль соляной кислоты.
Суспензию 3-(4-цианофенил)-(5R,S)-изоксазолин-5-илуксусной кислоты (23,1 г, 100 ммоль) в 200 мл безводного метанола охлаждали на ледяной бане и пробулькивали через реакционную смесь сухой газообразный HCl до образования прозрачного раствора. Общее время реакции присоединения примерно 3 ч. Реакционную колбу запаивали и давали реакционной смеси согреться до комнатной температуры при перемешивании в течение примерно 24 ч. После этого для осаждения продукта реакции метанольный раствор выливали в 600 мл безводного эфира и полученную кашицу охлаждали до -25oC 2,5 ч. Затем кашицу разбавляли еще 100 мл охлажденного безводного эфира. Осадок отфильтровывали, промывали двумя порциями по 100 мл охлажденного эфира и остаток высушивали в атмосфере азота, получая 23,3 г (73%) соли соляной кислоты; 1H ЯМР (300 МГц, CDCl3) δ 12,9 (bs, 1H), 12,2 (bs, 1H), 8,46 (d, J=8,8 Гц, 2H), 7,86 (d, J=8,8 Гц, 2H), 5,20 (bm, 1H), 4,59 (s, 3H), 3,74 (s, 3H), 3,53 (dd, J=16,8, 10,6 Гц, 1H), 3,15 (dd, J=16,8, 7,7 Гц, 1H), 2,90 (dd, J=16,l, 6,2 Гц, 1H), 2,70 (dd, J=16,l, 7,3 Гц, 1H), 1,77 (bs, 1H); масс-спектр (NH3-CI/DDIP, e/z, относительное содержание) 277, (М+H)+, 100%.
Часть Г. Получение метил 3-(4-амидинофенил)-(5R,S)- изоксазолин-5-илацетат, соль соляной кислоты.
Суспензию солянокислого метил 3-(4-метоксиминофенил)-(5R,S)-изоксазолин- 5- илацетата (22,9 г, 73,0 ммоль) в 500 мл 1 М аммиака в безводном метаноле перемешивали при комнатной температуре 14 ч, в течение которых твердый остаток полностью растворялся. Раствор концентрировали in vacuo, получая 22,1 г (100%) неочищенной соли соляной кислоты в виде рыжевато-коричневого твердого остатка; 1H ЯМР (300 МГц, CDCl3) δ 9,6-9,2 (b), 7,91 (d, J=8,8 Гц, 2H), 7,87 (d, J= 8,8 Гц, 2H), 5,08 (bm, 1H), 3,64 (s, 3H), 3,3-3,1 (m, 2H), 2,8 (m, 2H); масс-спектр (ESI, e/z, относительное содержание) 264, (М+H)+, 100%.
Часть Д. Получение метил 3-(4-N-Вос-амидинофенил)изоксазолин-5-илацетата.
К раствору 21,6 г (72,5 ммоль) метил 3-(4-амидинофенил)изоксазолин-5-илацетата (полученного согласно примеру 434, часть Д) в 350 мл DMF, охлаждаемому на ледяной бане, добавляли 20,2 мл (145 ммоль) триэтиламина и 17,4 г (79,8 ммоль) ди-трет-бутилдикарбоната. Смесь нагревали до комнатной температуры и перемешивали 16 ч. Реакционную смесь выливали в 1500 мл воды при перемешивании. После образования осадка смесь фильтровали и высушивали на фильтре в атмосфере азота, получая 19,6 г (74,8%) указанного соединения в виде твердого белого вещества. МС (ESI): m/e 362 (М+H)+; 306 (M+H-tBU)+. 1H ЯМР (300 МГц, d6-DMSO) δ 1,56 (s, 9H), 2,68 (dd, J=6,1, 6,1 Гц, 1H), 2,90 (dd, J= 6,1, 6,1 Гц, 1H), 3,14 (dd, J=6,8, 6,8 Гц, 1H), 3,74 (s, 3H), 5,14 (m, 1H), 7,70 (d, J=8,4 Гц, 2H), 7,90 (d, J=8,4 Гц, 2H). 13C ЯМР (60 МГц, d6-DMSO): 28,46; 39,31; 39,58; 51,98; 77,89; 78,35; 126,91; 128,51; 132,79; 136,24; 156,86; 164,04; 165,76; 170,93.
Часть E. Получение 3-(4-N-Boc-амидинофенил)изоксазолин-5- ил-уксусной кислоты.
К раствору 18,95 г (52,4 ммоль) метил 3-(4-N- Вос-амидинофенил)изоксазолин-5-илацетата (полученного согласно примеру 434, часть Д) в 500 мл метанола добавляли 2,42 г (57,7 ммоль) гидроксида лития (моногидрата) в 75 мл воды при 22oC. Смесь перемешивали 16 ч при 22oC и затем фильтровали: фильтрат выпаривали при пониженном давлении для удаления метанола. Оставшуюся водную фазу охлаждали на ледяной бане и закисляли 6 N и 1 N HCl до pH 4. Образовывался белый твердый осадок, который оставляли на ночь при -4oC. Осадок отфильтровывали и высушивали на фильтре в атмосфере азота, получая 17,74 г (97,4%) указанного соединения в виде не совсем белого порошка. МС (ESI): m/e 348 (М+H)+; 292 (М+H-tBU)+. 1H ЯМР (300 МГц, d6-DMSO) δ 1,50 (s, 9H), 2,68 (d, J=7,0 Гц, 2H), 3,22 (dd, J=7,2, 7,2 Гц, 1H), 3,62 (dd, J=6,8, 7,2 Гц, 1H), 5,04 (т, 1H), 7,78 (d, J=8,4 Гц, 2H), 7,94 (d, J=8,4 Гц, 2H). 13C ЯМР (60 МГц, d6-DMSO): 28,27; 39,30; 40,44; 78,39; 81,55; 126,87; 129,43; 132,78; 133,87; 156,76; 158,61; 165,58; 171,91.
Часть Ж. Получение (S)-Nα-[3-(4-N-Boc-амидинофенил) изоксазолин-5-(R,S) -илацетил]- (O-t-бутил)-α-аспартат -N-(2-фенилэтил)амида.
(O-t-бутил)-α-аспартат -N-(2-фенилэтил)амида.
К суспензии (S)-β-(O-t-бутил)-α-аспартат -N-(2-фенилэтил)амида (0,30 г, 1,0 ммоль), 3-(4-N-Вос-амидинофенил)-изоксазолин-5-ил-уксусной кислоты (0,35 г, 1,0 ммоль) и TBTU (0,32 г, 1,0 ммоль) в EtOAc (20 мл) добавляли триэтиламин (460 мкл, 0,33 г, 1,0 ммоль). Реакционную смесь перемешивали при комнатной температуре 4,5 ч. Смесь разбавляли EtOAc (20 мл) промывали буфером с pH 4, водой, 5% NaHCO3 и насыщенным NaCl, высушивали над безводным MgS04, фильтровали и концентрировали под вакуумом с получением 0,58 г твердого остатка. Hеочищенный продукт очищали флэш-хроматографией (100% EtOAc), получая 0,51 г (81%); 1H ЯМР (300 МГц, CDCl3) δ 7,89 (t, J=8,1 Гц, 2H), 7,69 (m, 2H), 7,25-7,3 (m, 3H), 7,15-7,25 (m, 4H), 7,04 (d, J=8,4 Гц, 1H), 6,65-6,80 (dt, 1H), 5,10 (bm, 1H), 4,71 (bm, 1H), 3,4-3,7 (bm, 3H), 3,1-3,3 (Октет, 1H), 2,75-2,95 (m, ЗH), 2,5-2,65 (m, 3H), 1,56 (s, 9H), 1,44 (d, 9H); масс-спектр (ESI, e/z, относительное содержание) 622, (М+H)+, 100%.
Пример 435
Получение (S)-Nα-[3-(4-амидинофенил) изоксазолин-5(R, S)-илацетил] -α-аспартат-N- (2-фенилэтил)амида, соль трифторуксусной кислоты
Раствор (S)-N-[3-(4-Nα-Вос-амидинофенил)изоксазолин -5-илацетил] -β-(O-t-бутил)- α-аспартат-N-(2-фенилэтил)амида (160 мг, 0,26 ммоль) в трифторуксусной кислоте (10 мл) и DCM (10 мл) перемешивали три дня при комнатной температуре. Раствор концентрировали под вакуумом, получая 150 мг продукта; 1H ЯМР (300 МГц, CDCl3) δ 9,40 (bs, 2H), 9,26 (bs, 2H), 8,33 (t, J=8,6 Гц, 1H), 7,85-8,0 (m, 1H), 7,88 (s, 4H), 7,3 (m, 1H), 7,28 (d, J=7,1 Гц, 2H), 7,20 (d, J=7,1 Гц, 2H), 5,07 (bm, 1H), 4,56 (bm, 1H), 3,5-3,6 (октет, 1H), 3,26 (bt, J=7,0, 2H), 3,2 (m, 1H), 2,70 (bt, J=7,0, 2H), 2,6-2,65 (bm, 2H), 2,4-2,5 (m, 2H); масс-спектр (ESI, e/z, относительное содержание) 466, (M+H)+, 100%.
Примеры 473А и 473Б
Разделение соли трифторуксусной кислоты метил N2-3-метилфенилсульфонил-N3-[3-(4-амидинофенил)-5S- илацетил]-S-2,3-диаминопропионата и соли соляной кислоты метил N2- 3-метилфенилсульфонил-N3-[3-(4-амидинофенил)-5S-илацетил] -R-2,3- диаминопропионата
Первоначально смесь очищали на колонке Pirkle DNBPG, используя в качестве элюента 10% HOAc/ 20% EtOH/ 70% гексан. Температуру колонки поддерживали на уровне 45oC, скорость 1,5 мл/мин и детектор был установлен на 280 нм. Диастереомеры затем разделяли на 25х2 см колонке с Chiralcel OD-25, используя в качестве элюента 0,l% TFA/ 20% MeOH/ 80% CO2. Температура колонки составляла 30oC, скорость тока 13 мл/мин, давление 175 атм и детектор был установлен на 280 нм. Нанесение было установлено на 23 мг образца. На две колонки в общем было нанесено 300 мг образца, получено 59 мг изомера R, пример 437А (МС ВР рассчитано для C23H27N5O6S: 502,176031; найдено: 502,175508), и 85 мг изомера S, пример 473Б (МС ВР рассчитано для C23H27N5O6S: 502,176031; найдено: 502,176358).
Пример 473В
N2-метилфенилсульфонил-N3-[3-(4-амидинофенил)-5S- илацетил]-S-2,3-диаминопропионовая кислота
Часть А. Meтил-N2-3-мeтилфeнилcульфoнил-N3-[3-(4- циaнoфeнил)-5S-илацетил]-S-2,3-диаминопропионат
К раствору 3-(4-цианофенил)изоксазолин-5-S-илуксусной кислоты (1,82 г, 7,90 ммоль, полученной как описано в примере 314А, часть Е) в DMF (50 мл) добавляли соль соляной кислоты метил-N2-3-метилфенилсульфонил- L-2,3-диаминопропионата (2,77 г, 7,90 ммоль), TBTU (2,53 г, 7,90 ммоль) и основание Хьюнигса (2,75 мл, 15,8 ммоль). После перемешивания при комнатной температуре в течение 16 ч реакционную смесь разбавляли EtOAc (500 мл) и промывали один раз водой (200 мл), один раз насыщенной NaHCO3 (200 мл), один раз 0,1 N HCl (200 мл), высушивали (MgS04), фильтровали и концентрировали, колоночная хроматография на силикагеле с 10% EtOAc/гексан в качестве элюента давала 1,99 г (52%) желаемого вещества в виде не совсем белой пены. 1H ЯМР (CDCl3) δ 7,81-7,78 (d, 2H, J=8,4 Гц), 7,16-7,67 (d, 2H, J=8,8 Гц), 7,61-7,58 (m, 2H), 7,39-7,37 (d, 2H, J=5,1 Гц), 6,35-6,30 (m, 1H), 5,54-5,52 (d, 1H, J=7,7 Гц), 5,18-5,17 (m, 1H), 4,00-3,96 (m, 1H), 3,62-3,50 (m, 3H), 3,57 (s, 3H), 3,27-3,19 (dd, 1H, J= 7,7, 17,0 Гц), 2,78-2,70 (dd, 1H, J=5,9, 14,8 Гц), 2,64-2,57 (dd, 1H, J=6,6, 14,6 Гц), 2,42 (s, 3H).
Часть Б. Солянокислый метил-N2-3-метилфенилсульфонил-N3-[3-(4- амидинофенил)-5S-илацетил] -S-2,3-диаминопропионат.
Метил-N2-3-метилфенилсульфонил-N3- [3-(4-цианофенил)-5S-илацетил]-S-2,3- диаминопропионат растворяли в 100 мл абсолютного этанола при 0oC и пропускали струю газообразного HCl в течение 2 ч. Реакционный сосуд запаивали и после перемешивания при комнатной температуре в течение 16 ч летучие компоненеты удаляли in vacuo. Остаток разбавляли 100 мл абсолютного этанола, добавляли карбонат аммония (9,6 г, 0,123 ммоль) и после перемешивания в течение 16 ч реакционную смесь фильтровали и концентрировали in vacuo. Колоночная хроматография на силикагеле градиентом элюции 5% MeOH/CH2Cl2-20% MeOH/CH2Cl2 давала 0,726 г (37%) желаемого амидина в виде белого твердого остатка. 1H ЯМР (CDCl3) δ 8,23-8,20 (m, 1H), 7,91-7,85 (m, 4H), 7,57-7,54 (m, 2H), 7,49- 7,46 (m, 2H), 5,00-4,94 (m, 1H), 4,08-3,86 (m, 1H), 3,59-3,49 (m, 1H), 3,39 (s, 3H), 3,38-3,29 (m, 3H), 2,49 (s, 3H), 2,50-2,45 (m, 2H). MC BP рассчитано для C23H27N5O6S: 502,176031; найдено: 502,175992. [α]D =+48,88oC (c= 0,180, MeOH).
Часть В. N2-3-метилфенилсульфонил-N3-[3-(4- амидинофенил)-5(S)-ил]ацетил-S-2,3-диаминопропионовая кислота.
Соединение примера 473В, часть Б (0,077 г, 0,14 ммоль) растворяли в MeOH (4 мл). К полученному раствору добавляли раствор гидроксида лития (0,0066 г, 0,158 ммоль) в воде (4 мл) и смесь перемешивали ночь при комнатной температуре. Метанол удаляли выпариванием под вакуумом и продукт из водной фазы выпадал в виде белого твердого остатка (0,026 г, 35%). MC BP рассчитано для C22H25N5O6S: 488,160381; найдено: 488,160827.
Пример 473Г
Солянокислый метил-N2-метилфенилсульфонил-N3-[3- (4-амидинофенил)-5R-илацетил]-S-2,3-диаминопропионат
Часть А. Метил-N2-метилфенилсульфонил-N3-[3-(4-цианофенил)-5R- илацетил] -S-2,3-диаминопропионат.
Это соединение синтезировали из 3-(4-цианофенил)изоксазолин-5-(R)-ил-уксусной кислоты (3,07 г, 0,011 ммоль), полученной как описано в примере 314Б, часть Б), используя тот же способ, что и в примере 473В, часть А. Выход 41%. Вычислено: C 57,02; H 4,99; N 11,56. Найдено: C 56,83; H 4,87; N 11,45.
Часть Б. Метил-N2-метилфенилсульфонил-N3-[3-(4-цианофенил)-5R-илацетил]- S-2,3-диаминопропионат.
Это соединение синтезировали из метил-N2-метилфенилсульфонил-N3-[3-(4-цианофенил)-5R-илацетил] -S- 2,3-диаминопропионата тем же способом, что и в примере 473В, часть Б. Выход 49%. MC BP рассчитано для C23H27N5O6S: 502,176031; найдено: 502,174103.
Пример 496
Метил-N2-(2,2-дифенил-1-этенсульфонил)-N3-[3-(4- амидинофенил)изоксазолин-5-(R,S)-илацетил]-(S)-2,3- диаминопропионат, соль трифторуксусной кислоты
Часть А. Метил-N2-(2,2-дифенил-1-этенсульфонил)-N3-Boc-(S)- 2,3-диаминопропионат.
К смеси метил N3-Boc-(S)-2,3-диаминопропионата (255 мг, 1,17 ммоль) и 2,2-дифенилэтиленсульфонил хлорида (Hasegawa and Hirooka, J. Chem.Soc.Japan 48, 1513-1518 (1975); 391 мг, 1,40 ммоль) в метиленхлориде (10 мл), охлажденной на ледяной бане, добавляли триэтиламин (0,25 мл, 1,76 ммоль). Через 22 ч смесь концентрировали и проводили флэш-хроматографию (6:4 толуол/этилацетет), получая 240 мг (46%) конечного продукта. ЯМР (CDCl3) δ 7,42-7,20 (10H), 6,81 (s, 1H), 5,24 (bd, 1H), 4,87 (bs, 1H), 3,95 (q, 1H), 3,72 (s, 3H), 3,50-3,42 (2H), 1,44 (s, 9H); масс-спектр (NH3-CI) m/z 466,54 (M+NH4 +, 100%).
Часть Б. Метил-N2-(2,2-дифенил-1-этенсульфонил)-(S)-2,3- диаминопропионат, соль TFA.
Продукт части А (210 мг, 0,468 ммоль) растворяли в 5 мл метиленхлорида и 3 мл TFA. Через 1 ч раствор концентрировали, получая маслянистый продукт (222 мг, 100%). ЯМР (CDCl3) δ 8,02 (bs, 3H), 7,40 (m, 5H), 7,23 (m, 4H), 7,00 (s, 1H), 4,26 (m, 1H), 3,71 (s, 3H), 3,20 (m, 1H), 2,98 (m, 1H); масс-спектр (NH3-CI) m/z.
Часть В. Метил-N2-(2,2-дифенил-1-этенсульфонил)-N3- [3-(4- N-Boc-aмидинoфeнил)изoкcaзoлин-5-(R,S)-илaцетил]-(S)-2,3- диaминoпpoпиoнaт.
Продукт части Б (220 мг, 0,46 ммоль) взаимодействовал с 3-(4-N-Boc-амидинофенил)изоксазолин-5-илуксусной кислотой (из примера 434, часть E; 0,46 ммоль) в соответствии с процедурой примера DGB-1, часть А, получая указанный продукт (215 мг, 68%). ЯМР (CDCl3) δ 7,84 (m, 2H), 7,64 (m, 2H), 7,40-7,18 (10H), 6,75 (s, 1H), 6,30 (m, 4H), 5,30 (m, 1H), 5,04 (m, 1H), 4,00 (1H), 3,78 (s, 3H), 3,62-3,40 (4H), 3,10 (m, 1H), 2,70-2,50 (2H), 2,04 (s, 1H), 1,58 (s, 9H); масс-спектр (ESI) m/z 690,2 (M+H+, 100%).
Часть Г. Метил-N2-(2,2-дифенил-1-этенсульфонил)-N3-[3-(4- амидинофенил)изоксазолин-5-(R, S)-илацетил]-(S)-2,3-диаминопропионат, соль трифторуксусной кислоты.
Продукт части В (210 мг, 0,30 ммоль) растворяли в метиленхлориде (3 мл) и добавляли трифторуксусную кислоту (1 мл) согласно примеру DGB-1, часть Б, получая указанный продукт (150 мг, 80%). ЯМР (CDCl3) δ 9,39 (bs, 2H), 9,05 (bs, 2H), 8,22 (m, 1H), 8,00 (m, 1H), 7,85 (s, 4H), 7,40 (m, 6H), 7,20 (m, 4H), 6,89 (s, 1H), 5,00 (m, 1H), 4,00 (m, 1H), 3,70-3,18 (5H), 3,62 (2s, 3H); масс-спектр (ESI) m/z 590,2 (M+H+, 100%).
Пример 511
Метил N2-(N,N-диметилсульфамоил)-N3-[3-(4- амидинофенил)изоксазолин-5-(R,S)-илацетил]-(S)-2,3- диаминопропионат, соль трифторуксусной кислоты
Часть А. Метил N2-(N,N-диметилсульфамоил)-N3-Boc-(S)-2,3- диаминопропионат.
К смеси метил N3-Вос-(S)-2,3-диаминопропионата (400 мг, 1,80 ммоль) и диметилсульфамоилхлорида (0,24 мл, 2,20 ммоль) в метиленхлориде (10 мл), охлажденному на ледяной бане, добавляли триэтиламин (0,38 мл, 2,20 ммоль). Через 18 ч смесь концентрировали и ставили флэш-хроматографию (6:4 толуол/этилацетат), получая 283 мг (49%) продукта. ЯМР (CDCl3) δ 5,23 (bd, 1H), 4,90 (m, 1H), 4,06 (m, 1H), 3,80 (s, 3H), 3,52 (bt, 2H), 2,80 (s, 6H), 1,42 (s, 9H); масс-спектр (NH3-CI) m/z 343,0 (M+NH4 +, 100%).
Часть Б. Метил-N2-(N,N-диметилсульфамоил)-(S)-2,3- диаминопропионат, соль TFA.
Продукт части А растворяли в 5 мл метиленхлорида и 3 мл TFA. Через 1 ч раствор концентрировали с получением маслянистого продукта (294 мг, 100%). ЯМР (DMSO-d6) δ 6,52 (bs, 2H), 4,4-3,9 (2H), 3,8 (bs, 3H), 2,93 (bs, 6H).
Часть В. Метил N2-(N, N-диметилсульфамоил)-N3-(4-N-Вос- амидинофенил)изоксазолин-5-(R,S)-илацетил]-L-2,3-диаминопропионат.
Продукт части Б (200 мг, 0,61 ммоль) взаимодействовал с 3-(4-N-Boc-амидинофенил)изоксазолин-5-илуксусной кислотой (из примера 434, часть E; 212 мг, 0,61 ммоль) согласно процедуре примера DGB-1, часть А, с образованием указанного продукта (203 мг, 61%). ЯМР (CDCl3) δ 7,78 (m, 2H), 7,42 (bt, 2H), 7,00 (m, 1H), 5,92 (m, 1H), 5,04 (m, 1H), 3,80 (2s, 3H), 3,64 (m, 2H), 3,40 (m, 1H), 3,05 (m, 1H), 2,80 (2s, 6H), 2,74 (m, 1H), 3,60 (m, 1H), 2,02 (s, 3H), 1,60 (s, 9H); масс-спектр (ESI) m/z 555,1 (M+H+ 100%).
Часть Г. Метил N2-(N, N-(диметилсульфамоил)-N3-[3-(4- амидинофенил)изоксазолин-5-(R, S)-илацетил] -L-2,3-диаминопропионат, соль трифторуксусной кислоты.
Продукт части В (183 мг, 0,329 ммоль) растворяли в метиленхлориде (3 мл) и обрабатывали трифторуксусной кислотой (1 мл) согласно процедуре примера DGB-1, часть А, получая указанный продукт (159 мг, 85%). ЯМР (DMSO-d6) δ 9,40 (bs, 2H), 9,00 (bs, 2H), 8,22 (m, 1H), 7,82 (s, 4H), 5,00 (m, 1H), 3,95 (m, 1H), 3,68 (2s, 3H), 3,60 (m, 2H), 3,20 (m, 4H), 2,80 (s, 6H); масс-спектр (ESI) m/z 455,1 (M+H+, 100%).
Пример 512
Метил N2-(m-толуолсульфонил)-N3- [3-(4-амидино-2-фторфенил)изоксазолин- 5-илацетил]-S-2,3-диаминопропионат, соль соляной кислоты
Часть А. 3-фтор-4-метилбензамид.
3-фтор-4-метилбензойную кислоту (10 г, 65 ммоль) кипятили в тионилхлориде (100 мл) с сушительной трубкой 2,5 ч. Избыток SOCl2 удаляли перегонкой. Маслянистый хлорид кислоты разбавляли CH2Cl2 (100 мл) и охлаждали на ледяной бане. Добавляли по каплям концентрированный водный раствор NH3 (20 мл) и продолжали перемешивание при 0oC в течение 0,5 ч, CH2Cl2 удаляли in vacuo, затем остаток разбавляли EtOAc. Смесь экстрагировали насыщенным водным Na2CO3 (2х), H2O и рассолом, высушивали (MgSO4) и концентрировали с получением 9,9 г светло-желтого твердого остатка; tпл 161-163oC; ИК-спектр (KBr) 3382, 1654 см-1. Аналитически рассчитано для C8H8FNO: C 62,74; H 5,27; N 9,15; F 12,40. Найдено: C 62,66; H 5,17; N 9,12; F 12,28.
Часть Б. 3-фтор-4-метилбензонитрил.
Раствор трихлорацетилхлорида (7,3 мл, 65 ммоль) в CH2Cl2 (20 мл) по каплям в течение 0,5 ч добавляли к раствору/суспензии амида части А (9,0 г, 59 ммоль) и Et3N (17 мл, 120 ммоль) в CH2Cl2 (80 мл) при 0oC. Через 40 мин смесь концентрировали in vacuo, затем разбавляли Et2O. Раствор экстрагировали 1 М HCl, насыщенным водным NaHCO3, H2O и рассолом, затем высушивали (MgSO4) и концентрировали с получением 7,8 г рыжевато-коричневого твердого остатка; tпл 45-47oC; ИК-спектр (KBr) 2232 см-1; MCBP, e/z рассчитано для (М+H)+: 135,0484; найдено: 135,0482.
Часть В. 2-фтор-4-цианобензилбромид.
N-бромсукцинимид (9,6 г, 54 ммоль) и вещество части Б (7,3 г, 54 ммоль) нагревали с обратным холодильником в CCl4 (100 мл) в атмосфере азота, облучая в течение 2 ч лампой дневного света с высокой интенсивностью. После охлаждения до температуры окружающей среды смесь фильтровали через целит и концентрировали под вакуумом. Неочищенный продукт перекристаллизовывали из горячего циклогексана (4х) с выходом 4,5 г не совсем белого игольчатого твердого остатка; tпл 75-55oC; ИК-спектр (KBr) 2236 см-1; MCBP, e/z рассчитано для (М+H)+: 213,9668; найдено: 213,9660.
Часть Г. 2-фтор-4-цианобензальдегид.
Бензилбромид части В (3,68 г, 17 ммоль), триметиламин-N-оксида дигидрат (7,6 г, 68 ммоль), CH2Cl2 (15 мл) и DMSO (30 мл) перемешивали несколько часов при 0oC, затем медленно согревали в течение ночи до температуры окружающей среды. Смесь разбавляли водой (30 мл) и рассолом (30 мл) и экстрагировали Et2O (4х). Объединенные органические фазы промывали рассолом, высушивали (MgSO4) и концентрировали с выходом 1,1 г желтого твердого остатка; ИК-спектр (KBr) 2238, 1706 см-1; MCBP, e/z рассчитано для (М+H)+: 150,0355; найдено: 150,0341.
Часть Д. 2-фтор-4-цианобензальдоксим.
Альдегид части Г (1,1 г, 7,4 ммоль), солянокислый гидроксиламин (1,0 г, 15 ммоль), K2CO3 (1,0 г, 7,4 ммоль), воду (1 мл) и MeOH (10 мл) нагревали с обратным холодильником 2,25 ч. После быстрого охлаждения смесь разбавляли водой и нерастворимый продукт собирали фильтрацией, затем промывали водой. Высушивание под высоким вакуумом давало 0,94 г светло-желтого аморфного твердого остатка; tпл 179-182oC; ИК-спектр (KBr) 3256, 2236, 1556 см-1; MCBP, e/z рассчитано для (М+H)+: 165,0464; найдено: 165,0455.
Часть Е. Метил 3-(4-циано-2-фторфенил)изоксазолин-5-илацетат.
Оксиму части Д давали провзаимодействовать с Хлорокс и метилвинилацетатом обычным способом с получением изоксазолина в виде желтого твердого остатка с выходом 32%; tпл 92-94oC; ИК-спектр (KBr) 2240, 1746 см-1: MCBP, e/z рассчитано для (М+H)+: 263,0832; найдено: 263,0818. Аналитически рассчитано для C13H11FN2O3: C 59,54; H 4,23; N 10,68; F 7,24. Найдено: C 59,84; H 4,31; N 10,53; F 7,26.
Часть Ж. Метил N2-(m-тoлуoлcульфoнил) -N3-[3-(4-aмидинo- 2-фторфенил)изоксазолин -5-илацетил]-S-2,3-диаминопропионат, соль соляной кислоты.
Промежуточное соединение части E превращали в указанное соединение через обычную последовательность шагов: синтез амидина Пиннера, Boc защита амидина, омыление эфира, конденсация с 2,3-диаминопропионатсульфонамидом и отщепление Boc с образованием желтой смолы; MCBP, e/z рассчитано для (М+H)+: 520,1666; найдено: 520,1675.
Пример 513
Метил N2-(n-бутилоксикарбонил)-N3-[3-(3- амидинопирид-6-ил)изоксазолин-5-илацетил]-S-2,3-диаминопропионат бис соль соляной кислоты
Получение по описанным в примере 514 методам давало порошок светло-желтого цвета; tпл 90-110oC (разложение); MCBP, e/z рассчитано для (M+H)+: 449,2149; найдено: 449,2140.
Пример 514
Метил N2-(m-толуолсульфонил)-N3-[3-(3-амидинопирид-6-ил)изоксазолин-5- илацетил]-S-2,3-диаминопропионат бис соль соляной кислоты
Часть А. 3-циано-6-пиридальдоксим.
5-циано-2-пиколин (25 мг, 0,21 моль) и I2 нагревали с обратным холодильником в DMSO (200 мл) 1 ч. После охлаждения до комнатной температуры добавляли солянокислый гидроксиламин (16 г, 0,23 моль), карбонат калия (29 г, 0,21 моль) и воду (21 мл). Полученную смесь нагревали до 80oC 2,5 ч, охлаждали, разбавляли водой (100 мл) и большим количеством ацетона и наносили на силикагель. Хроматография на силикагеле с элюцией 0-50% EtOAc в гексане давала 12,2 г рыжевато-коричневого твердого остатка; tпл 204-207oC (разложение); MCBP, e/z рассчитано для (М+H)+: 148,0511; найдено: 148,0516.
Часть Б. Метил 3-(3-цианопирид-6-ил)изоксазолин-5-илацетат.
Оксим примера 514, часть А превращали в изоксазолин как описано в примере 516, часть Б, с выходом 76% желтого твердого остатка; tпл 97-98oC; MCBP, e/z рассчитано для (М+H)+: 246,0879; найдено: 246,0881. Аналитически рассчитано для C12H11N3O3: C 58,77; H 4,52; N 17,13. Найдено: C 58,74; H 4,51; N 17,11.
Часть В. Метил 3-(3-t-бутилоксикарбониламидинопирид-6- ил)изоксазолин-5-илацетат.
Hитрил примера 514, части Б, превращали в амидин как описано в примере 516, части Г и Д (за исключением того, что требовалось 0,6 экв. NaOMe) и осуществляли присоединение Вос стандартным методом, получая после очистки желтый твердый продукт; tпл 143oC (выделение газа); MCBP, e/z рассчитано для (М+H)+: 363,1668; найдено: 363,1675. Аналитически рассчитано для C17H22N4O5: C 56,35; H 6,12; N 15,46. Найдено: C 56,35; H 6,10; N 15,39.
Часть Г. Литий 3-(3-t-бутилоксикарбониламидинопирид-6- ил)изоксазолин-5-илацетат.
Эфир примера 514, части В, омыляли и лиофилизировали как описано в методе примера 516, часть Е, получая количественно бесцветный аморфный твердый остаток; tпл> 230oC; MCBP, e/z рассчитано для конъюгата кислоты (М+H)+: 349,1512; найдено: 349,1527.
Часть Д. Метил N2-(m-толуолсульфонил-N3-[3-(3- амидинопирид-6-ил)изоксазолин-5-илацетил]-S-2,3-диаминопропионат бис соль соляной кислоты.
Карбоксилат лития части Г превращали в указанное соединение обработкой HCl в MeOH с получением желтого твердого остатка; tпл 90oC (разложение); MCBP, e/z рассчитано для (М+H)+: 503,1713; найдено: 507,1718.
Пример 515
Метил N2-(n-бутилоксикарбонил)-N3-[3-(2- амидинопирид-5-ил)изоксазолин-5-илацетил]-S-2,3-диаминопропионат бис соль соляной кислоты
Так же, как описано в примере 516, соединение примера 514, часть Д, соединялось с солянокислым метил N2-(n- бутилоксикарбонил)-2,3-диаминопропионатом в описанных выше условиях с последующим отщеплением Boc 4 М HCl/диоксан с образованием светло-желтого порошка; MCBP, e/z рассчитано для (М+H)+: 449,2149; найдено: 449,2154.
Пример 516
Метил N2-(m-толуолсульфонил)-N3-[3-(2-амидинопирид- 5-ил)изоксазолин-5-илацетил]-S-2,3-диаминопропионат бис соль соляной кислоты
Часть А. 2-хлор-5-пиридальдоксим.
2-хлор-5-формилпиридин (2,1 г, 15 ммоль) конденсировали с солянокислым гидроксиамином обычным способом для получения оксима, 1,5 г, в виде желтых кристаллов; tпл 171-175oC (разложение); MCBP, e/z рассчитано для (М+H)+: 157,0169; найдено: 157,0175.
Часть Б. Метил 3-(2-хлорпирид-5-ил)изоксазолин-5-илацетат.
Хлорокс (20 мл) по каплям добавляли в течение 1,75 ч к смеси оксима части А (1,13 г, 7,2 ммоль), метилвинилацетата (70% чистоты, 3,0 г, 21 ммоль), CH2Cl2 (40 мл) и DMF (4 мл), перемешивая при температуре окружающей среды. Удаляли CH2Cl2 выпариванием и разбавляли смесь EtOAc, экстрагировали водой (5х) и рассолом, затем высушивали (MgSO4), фильтровали и концентрировали. Хроматография на силикагеле, элюция 0-70% EtOAc в гексане, давала 1,4 г твердого остатка; tпл 94-96oC; MCBP, e/z рассчитано для (М+H)+: 255,0536; найдено: 255,0531.
Часть В. Метил 3-(2-цианопирид-5-ил)изоксазолин-5-илацетат.
Хлорпиридин части Б (0,51 г, 2,0 ммоль), цианид цинка (0,23 г, 2,0 ммоль), Pd(PPh3)4 (0,12 г, 0,10 ммоль) и DMF (2 мл) нагревали при 80oC в атмосфере азота в течение 3 дней. После охлаждения и концентрирования смесь наносили на силикагель, концентрируя из CHCl3. Хроматография на силикагеле с элюцией 0-90% EtOAc/гексан давала 0,28 г твердого остатка светло-желтого цвета; tпл 115- 116oC; MCBP, e/z рассчитано для (М+H)+: 246,0879; найдено: 246,0880. Аналитически рассчитано для C12H11N3O3: C 58,77; H 4,52; N 17,13. Найдено: C 58,68; H 4,48; N 16,90.
Часть Г. Метил 3-(2-амидинопирид-5-ил)изоксазолин-5-илацетат, соль муравьиной кислоты.
Цианопиридин части В (0,47 г, 1,9 ммоль) и метилат натрия (полученный in situ из металлического Na, 4 мг, 0,2 ммоль) перемешивали в безводном MeOH (6 мл) 16 ч при температуре окружающей среды, после чего 1H ЯМР анализ аликвот реакционной смеси показал полное образование метилимидата [9,25 (s, 1H) и 3,92 (s, 3H)] . К реакционной смеси добавляли формиат аммония (0,60 г, 9,5 ммоль) и продолжали перемешивание еще 7 ч. Смесь абсорбировали на силикагель концентрацией in vacuo. Хроматография на силикагеле при элюции 0-20% MeOH в CHCl3 и концентрирование давали 0,61 г амидина в виде не совсем белого твердого остатка; tпл 180-182oC (разложение); MCBP, e/z рассчитано для (М+H)+: 263,1144; найдено: 263,1148.
Часть Д. Метил 3-(2-t-бутилоксикарбониламидинопирид-5- ил)изоксазолин-5-илацетат.
К амидину части Д присоединяли Boc стандартным способом, получая после хроматографической очистки на силикагеле 41% бесцветной пены; MCBP, e/z рассчитано для (М+H)+: 363,1668; найдено: 363,1682.
Часть Е. Литий 3-(2-t-бутилоксикарбониламидинопиоид-5- ил)изоксазолин-5-илацетат.
Метиловый эфир части Д (0,37 г, 1,0 ммоль) омыляли, перемешивая с 0,5 М LiOH в MeOH при комнатной температуре. MeOH удаляли in vacuo, затем водный раствор замораживали и лиофилизировали, получая количественно светло-желтый твердый остаток; MCBP, e/z рассчитано для (М+H)+: 349,1512; найдено: 349,1531.
Часть Ж. Метил N2-(m-толуолсульфонил)-N3-[3-(2-амидинопирид-5- ил)изоксазолин-5-илацетил]-S-2,3-диаминопропионат бис соль соляной кислоты.
Карбоксилат лития части E конденсировали с солянокислым метил N2-(m-толуолсульфонил)-2,3-диаминопропионатом в описанных выше условиях, с последующим стандартным отщеплением Boc с 4 М HCl/диоксан, получая аморфный твердый остаток желтого цвета; MCBP, e/z рассчитано для (М+H)+: 503,1713; найдено: 503,1707.
Пример 548
Получение 3-бромтиофен-2-сульфонилхлорида
Раствор хлорсульфоновой кислоты (14,3 г, 0,12 моль) в 35 мл 1,2-дихлорэтана охлаждали до -10oC и защищали от поглощения влаги. Добавляли небольшими порциями пентахлорид фосфора (20,8 г, 0,1 моль), поддерживая температуру между -5 и -10oC. Полученную суспензию перемешивали при -10oC 30 мин. Затем добавляли по каплям в течение 45 мин 3-бромтиофен (16,3 г, 0,1 моль), поддерживая температуру между -5 и -10oC. При добавлении 3-бромтиофена происходило выделение хлороводорода; реакционная смесь становилась густой и пастообразной и с трудом перемешивалась. После полного добавления 3-бромтиофена температуру реакционной смеси поддерживали 0oC 2 ч. Затем смесь нагревали до 80oC и оставляли при этой температуре на 1 ч, в течение которого происходило растворение твердого остатка и выделение хлороводорода. Реакционную смесь охлаждали на ледяной бане, выливая на 250 г измельченного льда, и перемешивали один час до растворения льда. Полученную двухфазную систему разделяли и промывали водный слой три раза 125 мл хлороформа. Объединенные органические фазы высушивали над безводным сульфатом магния, фильтровали и концентрировали in vacuo, получая 24,1 г (92%) неочищенного продукта в виде масла темно-желтого цвета; 1H ЯМР (300 МГц, CDCl3) δ 7,22 (d, J=5,3, 1H), 7,73 (d, J= 5,3, 1H); масс-спектр (CH4-DCI/GC-MS, e/z, относительное содержание) 262,8, (M+H)+, 100%; 226,9, (M+H-HCl)+, 89,7%.
Пример 587A
N2-3-метилфенилсульфонил-N3-[3-(4-амидинофенил)-5S-илацетил] - S-2,3-диаминопропионовая кислота
Соединение примера 473В, часть Б (0,077 г, 0,14 ммоль) растворяли в MeOH (4 мл), LiOH (0,0066 г, 0,158 ммоль), добавляли воду (4 мл) и реакционную смесь перемешивали ночь. После выпаривания метанола продукт образовывал белый осадок в водной фазе (0,027 г, выход 35%). MCBP рассчитано для C22H25N5O6S: 488,160381; найдено: 488,160827.
Пример 602
Метил N2-n-бутилоксикарбонил-N3-[3-(4-гуанидинофенил)изоксазолин-5- (R, S)-илацетил]-(S)-2,3-диаминопропионта, соль трифторуксусной кислоты
Часть А. [3-[(4-t-бутилоксикарбониламино)фенил] изоксазолин- 5-ил]уксусная кислота.
Это соединение получали с выходом 49% из 4-t-бутилоксикарбониламинобензальдоксима и t-бутилвинилацетата по способу, описанному в примере 275, часть А. 1H ЯМР (CDCl3) δ 0,99 (t, 3H), 1,35 (m, 2H), 1,50 (s, 9H), 1,61 (m, 2H), 2,60 (dd, J=7,7 и 16,5 Гц, 1H), 2,84 (dd, J=5,9 и 16 Гц, 1H), 3,06 (dd, J= 7,4 & 16,9 Гц, 1H), 3,48 (dd, J= 10,3 & 16,5 Гц, 1H), 4,10 (t, 2H), 5,03 (m, 1H), 6,60 (широкий s, 1H), 7,38 (d, J=8,3 Гц, 2H), 7,58 (J=8,3 Гц, 2H); ИК (Kbr): 2966, 1734, 1740, 1610, 1578, 1528, 1508, 1458, 1442, 1412, 1392, 1368, 1234, 1160, 1058, 916, 878, 828, 772, 612 см-1; MCBP рассчитано для C20H28N2O5: 377,207647; найдено: 377,207278. Омыление LiOH в стандартных условиях давало соответствующую карбоновую кислоту в виде бесцветных кристаллов с выходом 88%. tпл 178-180oC; 1H ЯМР (CDCl3) δ 1,52 (s, 9H), 2,67 (dd, J=7,8 и 16 Гц, 1H), 2,89 (dd, J=8,3 & 16 Гц, 1H), 3,06 (dd, J=9,5 & 16,9 Гц, 1H), 3,48 (dd, J=10,3 & 16,5 Гц, 1H), 5,03 (m, 1H).
Часть Б. Метил N2-n-бутилоксикарбонил-N3-[3-[(4-t- бутилоксикарбониламино)фенил]изоксазолин-5-илацетил]-(S)-2,3- диаминопропионат.
Соединение примера 602, часть А, конденсировали с метил N2-tBoc-(S)-2,3-диаминопропионатом способом, описанным в примере 275, часть С, получая желаемый продукт, tпл 80-82oC; 1H ЯМР (CDCl3) δ 1,88 (t, 3H), 1,30 (m, 2H), 1,47 (sm, 20H), 2,50 (dd, 1H), 2,61 (dd, 1H), 3,07 (dd, 1H), 3,40 (dd, 1H), 3,63 (t, 2H), 3,74 (s, 3H), 4,00 (m, 2H), 4,38 (m, 1H), 5,00 (m, 1H), 5,88 (dd, 1H), 6,77 (t, 1H), 7,58 (d, 2H), 7,84 (d, 2H), 10,4 (s, 1H); ИК (KBr): 3286, 2964, 1722, 1646, 1546, 1414, 1368, 1340, 1312, 1294, 1240, 1156, 1122, 1100, 1058, 1030, 844, 776 см-1; MCBP (CI/NH4) 663 (M+H, 20), 563 (7), 549 (78), 506 (81), 463 (100).
Часть В. Метил N2-n-бутилоксикарбонил-N3-[3-(4- гуанидинофенил) изоксазолин -5-илацетил]-(S)-2,3-диаминопропионат.
Соединение примера 602, часть Б, обрабатывали TFA в дихлорметане, получая соответствующий анилин в виде соли TFA. Это промежуточное соединение превращали в соответствующее бис-Вос-защищенное гуанидиносоединение с выходом 59% в соответствии с методом Kim et al. (Tet. Lett. 1993, 48, 7677). Отщепление Boc в стандартных условиях (TFA/CH2Cl2) давало указанное соединение в виде соли TFA (90%). 1H ЯМР (DMSO-d6) δ 1,89 (t, 3H), 1,34 (m, 2H), 1,57 (m, 2H), 2,44 (dd, 1H), 2,58 (t, 2H), 2,64 (m, 1H), 3,17 (m, 1H), 3,40 (m, 2H), 3,65 (m, 1H), 3,70 (s, 3H), 4,00 (t, 2H), 4,31 (m, 1H), 5,02 (m, 1H), 6,80 (m, 1H), 7,28 (d, 2H), 7,64 (широкий s, 2H), 7,68 (d, 2H), 7,84 (широкий, 1H); масс-спектр (ES) m/z 463 (M+H, 100).
Пример 651
МетилN2-бензилоксикарбонил-N3-метил-N3-[3-(4-амидинофенил)изоксазолин-5-(R,S)-илацетил]-(S)2,3- диаминопропионат, соль трифторуксусной кислоты
Часть А. Получение метил N2-бензилоксикарбонил-N3-метил-[3- (4-N-Boc-амидинофенил)изоксазолин-5-(R,S)-илацетил]-(S)-2,3-диаминопропионата.
К смеси 3-(4-N-Boc-амидинофенил)изоксазолин-5-ил-уксусной кислоты (полученной в соответствии со способом примера 434, часть E; 189 мг, 0,54 ммоль), метил N3-метил-N2-Cbz-L-2,3-диаминопропионата (полученного согласно Sakai and Ohfune, J. Am. Chem. Soc. 114, 998 (1992); 145 мг, 0,54 ммоль) и TBTU (175 мг, 0,54 ммоль) в этилацетате (10 мл) добавляли триэтиламин (0,15 мл, 1,09 ммоль). После перемешивания в течение 26 ч смесь разбавляли этилацетатом, промывали буфером с pH 4, после этого насыщенным водным раствором бикарбонита, после этого насыщенным рассолом. Высушивали органическую фазу (MgSO4) и концентрировали. Остаток флэш-хроматографировали (этилацетат), получая продукт в виде бесцветного стекла (279 мг, 86%); ЯМР (CDCl3) δ 7,88 (m, 2H), 7,69 (m, 2H), 5,79 (bd, 1H), 5,09 (m, 3H), 4,58 (m, 1H), 3,86 (m, 1H), 3,77 (2s, 3H), 3,63 (m, 2H), 3,14 (dd, 1H), 3,01 (2s, 3H), 2,9 (m, 1H), 2,53 (m, 1H), 1,66 (b, 2H), 1,56 (s, 9H); масс-спектр (ESI) m/z 596,2 (M+H+ 100%).
Часть Б. Получение метил N2-бензилоксикарбонил-N3-метил- N3-[3-(4-амидинофенил)изоксазолин-5-(R, S)-илацетил] -(S)-2,3- диаминопропионата, соли трифторуксусной кислоты
Продукт части А (226 мг, 0,38 ммоль) растворяли в дихлорметане (3 мл) и обрабатывали трифторуксусной кислотой (1 мл). После перемешивания в течение 4 ч при комнатной температуре смесь разбавляли эфиром и перемешивали. Получающийся белый осадок собирали фильтрацией, получая указанный продукт в виде белого твердого остатка (201 мг, 87%); ЯМР (DMSO-d6) δ 9,39 (bs, 2H), 9,19 (bs, 2H), 7,87 (s, 4H), 7,79 (t, 1H), 7,32 (m, 5H), 5,03 (3H), 4,40 (m, 2H), 3,90 (m, 1H), 3,65 (2s, 3H), 2,95 и 2,82 (4s, 3H), 3,6-2,8-(4H); масс-спектр (ESI) m/z 496,3 (M+H+, 100%).
Пример 701
Метил N2-n-бутилоксикарбонил-N3-[3-(4- амидинофенил)изоксазолин-5-илацетил]-L-2,3-диаминопропионат, соль TFA
Часть А. Получение метил 3-(4-цианофенил)изоксазолин-5- илацетат.
К суспензии метил 3-(4-цианофенил)-5(R,S)-изоксазолин-5-илацетата (5,28 г, 21,62 ммоль) в хлороформе (150 мл) добавляли N-бромсукцинимид (4,23 г, 23,78 ммоль) и AIBN (100 мг) и смесь кипятили с обратным холодильником. Небольшие количества AIBN (100-200 мг) добавляли с интервалами в 1 ч до тех пор, пока ТСХ не показала полное прохождение реакции. Добавляли ацетат калия (17,3 г) и уксусную кислоту (6,5 мл) и кипятили реакционную смесь с обратным холодильником 1 ч, охлаждали, затем выливали в 1 N NaOH (325 мл). Отделяли органический слой, водный слой экстрагировали EtOAc (3х100 мл). Органические слои объединяли и промывали насыщ. NaCl, высушивали над Na2SO4, фильтровали и концентрировали in vacuo. Остаток хроматографировали на силикагеле (15-35% EtOAc в гексане), получая 2,2 г (42%) продукта в виде не совсем белого твердого остатка; 1H ЯМР (300 МГц, CDCl3) δ 7,93 (dd, 2H), 7,76 (dd, 2H), 6,67 (s, 1H), 3,92 (s, 2H), 3,8 (s, 3H).
Часть Б. Получение метил 3-(4-метоксииминофенил)изоксазо-5- илацетата, соли соляной кислоты.
Суспензию метил 3-(4-цианофенил)изоксазо-5-илацетата (2,19 г, 9,04 ммоль) в 100 мл безводного метанола охлаждали на ледяной бане и пробулькивали через реакционную смесь газообразный HCl до образования раствора. Время добавления - 2 ч. Реакционный сосуд закрывали и реакционной смеси давали согреться до комнатной температуры, при перемешивании в течение 24 ч. В этот момент времени метанольный раствор выливали в 500 мл безводного эфира, осаждая продукт, и полученную суспензию охлаждали 3 ч при -25oC. Осадок отфильтровывали, промывали двумя порциями по 100 мл охлажденного эфира и высушивали в атмосфере азота под вакуумом, получая 2,3 г (82%) соли соляной кислоты; 1H ЯМР (300 МГц, суспензия в CDCl3) δ 8,52 (d, J=8,06 Гц, 2H), 8,03 (d, J=8,4 Гц, 2H), 6,67 (s, 1H), 4,6 (s, 3H), 3,93 (s, 2H), 3,8 (s, 3H).
Часть В. Получение метил 3-(4-амидинофенил)изоксазо- илацетата, соли HCl.
Раствор метил 3-(4-метоксииминофенил)изоксазо- 5-илацетата, соли HCl (2,3 г, 7,4 ммоль) в 50 мл безводного метанола охлаждали на ледяной бане и добавляли 2 М аммиак в метаноле (18,5 мл, 37 ммоль). Реакционную колбу закрывали и реакционной смеси давали согреться до комнатной температуры при перемешивании в течение 24 ч. Янтарный раствор концентрировали in vacuo, получая 2,2 г (количественный выход) желтой пены; 1H ЯМР (300 МГц, d6-DMSO) δ 9,6-9,2 (b), 8,12 (d, J=8,4 Гц, 2H), 7,97 (d, J=8,4 Гц, 2H), 7,14 (s, 1H), 4,15 (s, 2H), 3,7 (s, 3H).
Часть Г. Получение метил 3-(4-N-Boc-амидинофенил)изоксазо- 5-илацетата.
К раствору метил 3-(4-амидинофенил)изоксазо-5-илацетат, соли HCl (2,2 г, 7,4 ммоль) в 30 мл DMF, охлаждаемому на ледяной бане, добавляли триэтиламин (2,06 мл, 14,8 ммоль) и ди-трет-бутилдикарбонат (1,78 г, 8,14 ммоль). Реакционную смесь согревали до комнатной температуры и перемешивали 64 ч. Затем реакционную смесь разделяли между EtOAc и водой. Водный слой промывали EtOAc. Органические слои объединяли и промывали водой, насыщ. NaCl, высушивали над Na2SO4, фильтровали и концентрировали in vacuo. Остаток хроматографировали на силикагеле (15%-25% EtOAc в гексане), получая 1,45 г (54% продукта); 1H ЯМР (300 МГц, CDCl3) δ 7,96 (d, J=8,4 Гц, 2H), 7,87 (d, J=8,4 Гц, 2H), 6,65 (s, 1H), 3,91 (s, 2H), 3,8 (s, 3H), 1,56 (s, 9H).
Часть Д. Получение 3-(4-N-Вос-амидинофенил)изоксазо-5-илуксусной кислоты/
К раствору метил 3-(4-N-Вос-амидинофенил)изоксазо-5-илацетата (1,45 г, 4,03 ммоль) в 30 мл метанола добавляли раствор гидроксида лития, моногидрата, (0,195 г, 4,64 ммоль) в воде (5 мл). Смесь перемешивали 16 ч при комнатной температуре. Затем реакционную смесь концентрировали in vacuo и остаток разбавляли водой и полученную смесь охлаждали на ледяной бане. Медленно добавляли 1 N HCl до pH 3-4 и полученную кислую водную смесь повторно экстрагировали EtOAc. Органические слои объединяли и промывали насыщенным NaCl, высушивали над Na2SO4, фильтровали и концентрировали un vacuo, получая 0,97 г (70%) продукта в виде не совсем белого порошкообразного твердого остатка; 1H ЯМР (300 МГц, d6- DMSO) δ 8,07 (d, J=8,79 Гц, 2H), 7,97 (d, J=8,4 Гц, 2H), 7,03 (s, 1H), 3,99 (s, 2H), 1,45 (s, 9H).
Часть Е. Получение метил N2-n-бутилоксикарбонил-N3-[3-(4-N- Вос-амидинофенил)изоксазо-5-илацетил]-L-2,3-диаминопропионата.
К раствору 3-(4-N-Вос-амидинофенил)изоксазо-5-илуксусной кислоты (0,262 г, 0,76 ммоль), метил N2-карбокси-n-бутил-L-2,3- диаминопропионата, соли HCl (0,193 г, 0,76 ммоль) и TBTU (0,256 г, 0,8 ммоль) в DMF (15 мл) добавляли триэтиламин (0,45 мл, 3,23 ммоль) и получающуюся реакционную смесь перемешивали при комнатной температуре 16 ч. Реакционную смесь разделяли между EtOAc и водой. Водный слой дважды промывали EtOAc. Органические слои объединяли и промывали водой, буфером с pH 4,5% NaHCO3 и насыщенным NaCl, высушивали на Na2SO4, фильтровали и выпаривали in vacuo. Остаток хроматографировали на силикагеле (100% EtOAc) с выходом 0,315 г (76%) светлой янтарной пены; 1H ЯМР (300 МГц, CDCl3) δ 7,93 (d, J= 8,42 Гц, 2H), 7,83 (d, J=8,42 Гц, 2H), 6,6 (s, 1H), 6,57 (bm, 1H), 5,66 (bm, 1H), 4,45 (bm, 1H), 4,05 (m, 2H), 3,77 (s, 5H), 3,7 (m, 2H), 1,57 (s, 9H), 1,56 (m, 2H), 1,35 (m, 2H), 0,9 (t, J= 7,32 Гц, 3H).
Часть Ж. Получение метил N2-n-бутилоксикарбонил-N3-[3-(4- амидинофенил)изоксазо-5-илацетил]-L-2,3-диаминопропионат, соль TFA.
Раствор метил N2-карбокси-n-бутил-N3-[3-(4-N-Вос- амидинофенил)изоксазо-5-илацетил]-L-2,3-диаминопропионата (0,215 г, 0,39 ммоль) в 1:1 метиленхлорид/трифторуксуной кислоте (общий объем 20 мл) перемешивали 16 ч при комнатной температуре. Затем реакционную смесь концентрировали in vacuo и остаток хроматографировали на силикагеле (10-30% метанола в хлороформе) с выходом 0,11 г (50%) белого твердого остатка; 1H ЯМР (300 МГц, d6-DMSO) δ 9,4 (bs, 2H), 9,15 (bs, 2H), 8,45 (t, 1H), 8,11 (d, J=8,42 Гц, 2H), 7,94 (d, J= 8,42 Гц, 2H), 7,53 (d, J=8,06 Гц, 1H), 7,01 (s, 1H), 4,21 (m, 1H), 3,95 (t, 2H), 3,81 (s, 2H), 3,62 (s, 3H), 3,55 (m, 1H), 3,34 (m, 1H), 1,5 (m, 2H), 1,3 (m, 2H), 0,87 (t, J=7,32 Гц, 3H); масс-спектр (ESI, e/z, относительное содержание) 446,5, (M+H)+, 100%.
Пример 829
Метил N2-n-бутилоксикарбонил-N3-[5-(4- формамидинофенил)изоксазолин-3-илацетил]-(2S)-2,3-диаминопропионат
Часть А. t-бутил{5-(4-цианофенил)изоксазолин-3-ил]ацетат.
Циклоприсоединение 4-цианофенилэтилена (MP&D chemical Co.) и трет-бутилформилоксима проводили согласно методу Gree et al. (Bioorganic&Medicinal Chemistry letters 1994, 253), получая желаемый изоксазолин с выходом 72%.
1H ЯМР (CDCl3) δ 1,40 (s, 9H), 3,00 (dd, J=8,3 и 17 Гц, 1H), 3,35 (dd (AB) J=18 и 8,3 Гц, 2H), 3,48 (m, 1H), 5,60 (dd, J=9 и 4,5 Гц, 1H), 7,47 (d, J= 8 Гц, 2H), 7,65 (d, J= 8 Гц, 2H); ИФ 2235, 1718, 1610 см-1. Масс-спектр m/z 287 (M+H, 100).
Часть Б. [5-(4-цианофенил)изоксазолин-3-ил]уксусная кислота.
Гидролиз соединения примера 829, часть А, с избытком TFA в дихлорметане давал кислоту с выходом 90%. 1H ЯМР (CDCl3) δ 3,00 (dd, J=8 и 17,2 Гц, 1H), 3,55 (s, 2H), 3,59 (m, 1H), 5,66 (dd, J=8 и 11 Гц, 1H), 7,45 (d, J= 8,4 Гц, 2H), 7,66 (d, J= 8,0 Гц, 2H); ИК 3325, 2235, 1718, 1605 см-1. Масс-спектр m/z 231 (M+H, 100).
Часть В. Метил [5-(4-Вос-амидинофенил)изоксазолин-3-ил]ацетат.
Соединение примера 829, часть Б, подвергали стандартной реакции Пиннера в условиях, описанных в примере 275, часть Г, для получения амидиносоединения, которое, без очистки, обрабатывали ди-трет-бутилдикарбонатом в диоксане/воде (9:1) и избытком триэтиламина, получая желаемое соединение с выходом 28%. 1H ЯМР (CDCl3) δ 1,54 (s, 9H), 2,98 (dd, J=8 и 17 Гц, 1H), 3,49 (s, 2H), 3,53 (m, 1H), 3,71 (s, 3H), 5,63 (dd, J=8 & 11,4 Гц, 1H), 7,38 (d, 8,2 Гц, 2H), 7,82 (d, 8,2 Гц, 2H); масс-спектр m/z 362 (M+H, 8), 306(18), 262 (M+H-Boc, 100).
Часть Г. [5-(4-Вос-амидинофенил)изоксазолин-3-ил]уксусная кислота.
Гидролиз эфира LiOH в стандартных условиях давал желаемую кислоту с выходом 5%. 1H ЯМР (CDCl3) δ 1,54 (s, 9H), 3,00 (dd, J=8 и 17 Гц, 1H), 3,51 (s, 2H), 3,53 (m, 1H), 5,63 (dd, J=8 & 11,4 Гц, 1H), 7,38 (d, 8,2 Гц, 2H), 7,82 (d, 8,2 Гц, 2H); масс-спектр m/z 348 (М+H, 12), 348 (M+H-Boc, 100).
Часть Д. Метил N2-n-бутилоксикарбонил-N3- [5-(4- формамидинофенил) изоксазолин-3-илацетил] -(2S)-2,3-диаминопропионат.
Соединение примера 829, часть Г связывали с метил-(S)-N2-n- бутилоксикарбонил-2,3-диаминопропионатом способом, описанным в примере 275, часть В, получая Boc-защищенное промежуточное соединение с выходом 80%. 1H ЯМР (CDCl3) δ 0,89 (t, 3H), 1,32 (m, 2H), 1,53 (s, 9H), 1,17 (m, 2H), 2,95 (dd, J= 8 и 17 Гц, 1H), 3,33 (s, 2H), 3,46 (m, 1H), 3,60 (m, 2H), 3,73 (s, 3H), 4,00 (m, 2H), 4,31 (m, 1H), 5,60 (dd, J=8 и 11,4 Гц, 1H), 5,70 (bd, 1H), 6,70 (широкий, 1H), 7,33 (d, 8,2 Гц, 2H), 7,89 (d, 8,2 Гц, 2H). Масс-спектр m/z 534 (М+H, 30), 434 (M+H-Boc, 100). Удаление защиты осуществляли обработкой вышеуказанного Boc-амидина избытком TFA в дихлорметане, получая указанное соединение в виде соли TFA.
1H ЯМР (CDCl3/DMSO-d6) δ 1,88 (t, 3H), 1,30 (m, 2H), 1,53 (m, 2H), 3,00 (dd, J= 8 и 17 Гц, 1H), 3,32 (s, 2H), 3,40-3,63 (m, 3H), 3,63 (d, 3H), 3,98 (t, 2H), 4,29 (m, 1H), 5,60 (dd, J=8 & 11 Гц, 1H), 6,80 (d, 1H), 7,50 (d, J= 8 Гц, 2H), 7,80 (d, J=8,2 Гц, 2H) 8,03 (широкий s, 1H), 9,05 (широкий s, 2H); ИК (KBr): 3388, 1718, 1664, 1620, 1528, 1456, 1436, 1384, 1366, 1280, 1254, 1168, 1144, 1074, 980, 882, 778 см-1; масс-спектр (ES) m/z 448 (М+H, 100).
Используя вышеуказанные методы и их вариации, известные специалистам в области органического синтеза, можно получить дополнительные примеры таблиц 1 - 15.
Применение
Соединения этого изобретения обладают антитромбоцитарной эффективностью, что доказывается их активностью в стандартных методах определения агрегации тромбоцитов или связывания фибриногена тромбоцитами, описанных ниже. Считают, что соединение является активным в этих исследованиях, если значение IC50 составляет менее 1 мМ. Ниже описаны методы определения агрегации тромбоцитов и связывания с фибриногеном, которые могут быть использованы для демонстрации антитромбоцитарной активности соединений изобретения.
Метод определения агрегации тромбоцитов. Венозную кровь получали из руки здорового донора, который в течение по меньшей мере двух недель до взятия крови не принимал лекарств и аспирина. Кровь собирали в 10 мл Vacuteiner пробирки с цитратом. Центрифугировали кровь 15 мин при 1500g при комнатной температуре и отбирали обогащенную тромбоцитами плазму (ПОТ). Оставшуюся кровь центрифугировали 15 мин при 1500g при комнатной температуре и отбирали не содержащую тромбоцитов плазму (ПБТ). Образцы промеряли на агрегометре (РАР-4 Platelet Aggregation Profiler), используя в качестве контроля ПБТ (100% прозрачность). В каждую микропробирку для тестирования добавляли по 200 мкл ПОТ и устанавливали 0% прозрачности. В каждую пробирку добавляли по 20 мкл различных агонистов (АДФ, коллаген, арахидонат, эпинефрин, тромбин) и строили кривые агрегации (% прозрачности относительно времени). Результаты выражаются как % подавления вызываемой агонистом агрегации тромбоцитов. Для определения IC50 тестируемые соединения добавляли в различных концентрациях до активации тромбоцитов.
Эфиры пролекарств предварительно инкубировали (10-3 М Ф.С) со 100 IU/мл эстеразы печени свиньи (Sigma Chemical Co., St. Louis, МО, #E-3128) 2 ч при 37oC. Аликвоты разбавляют 0,1 М Трис, pH 7,4 до требуемых концентраций. Аликвоты (20 мкл) обработанных эстеразой пролекарств добавляют к 200 мкл обогащенной тромбоцитами плазме человека. Образцы помещали в агрегометр на 8 мин при 37oC, затем добавляли 100 мкл аденозиндифосфата (Sigma Chemical Co., St. Louis, MO, # A- 6521) для того, чтобы вызвать агрегацию тромбоцитов. Процессу агрегации давали развиться в течение 5 мин. Процент подавления рассчитывают как процент агрегации в присутствии тестируемого соединения, деленный на процент агреации в контроле, умноженный на 100. Это значение вычитают из 100, получая процент подавления. Расчет IC50 проводится на Texas Instruments ТI59 по программе IC50.
Твердофазный иммуноферментный анализ (ELISA) связывания очищенного ГПIIb/IIIa с фибриногеном
В ELISA связывания ГПIIb/IIIa-фибриноген используют следующие реактивы:
- очищенный ГПIIb/IIIa (148,8 мкг/мл);
- биотинилированный фибриноген (примерно 1 мг/мл или 3000 нМ);
- конъюгит со щелочной фосфатазой к биотину (Sigma no. А7418);
- плоскодонные, 96-луночные планшеты с высоким связыванием (Costar Cat. no. 3590);
- субстрат для фосфатазы (Sigma 104) (40 мг капсулы);
- бычий сывороточный альбумин (БСА) (Sigma no. А3294);
- буфер для щелочной фосфатазы - 0,1 М глицин-HCl, 1 мМ MgCl2•6H2O, 1 мМ ZnCl2, pH 10,4;
- буфер для связывания - 20 мМ Трис-HCl, 150 мМ NaCl, 1 мМ CaCl2•2H2O, 0,02% NaN3, pH 7,0;
- буфер A - 50 мМ Трис-HCl, 100 мМ NaCl, 2 мМ CaCl2•2H2O, 0,02% NaN3, pH 7,4;
- буфер A + 3,5% БСА (буфер для забивки);
- буфер А +0,1% БСА (буфер для разбавления);
- 2 N NaOH.
В ELISA связывания ГПIIb/IIIa с фибриногеном используется следующая последовательность действий.
Планшеты насыщают ГПIIb/IIIa в буфере для связывания (125 нг/100 мкл на лунку) ночь при 4oC (оставляют первый ряд ненасыщенным для определения неспецифического связывания). Планшеты закрывают и замораживают при -70oC до использования. Размораживают планшету 1 ч при комнатной температуре или ночь при 4oC. Выливают насыщающий раствор и промывают 1 раз 200 мкл/лунку буфера для связывания. Забивку планшеты производят буфером А + 3,5% БСА (буфер для забивки) (200 цкл/лунку) 2 ч при комнатной температуре при встряхивании. Удаляют буфер для забивки и промывают один раз буфером А + 0,1% БСА (буфер для разбавления) (200 мкл/лунку). Вносят по 11 мкл тестируемого соединения (10x концентрация от той, что должна быть протестирована, в буфере для разбавления) на лунку (по две параллели). Вносят по 11 мкл буфера для разбавления в лунки с неспецифическим и общим связыванием. Затем в каждую лунку добавляют по 100 мкл биотинилированного фибриногена (1/133 в буфере для разбавления, конечная концентрация = 20 мМ). Инкубируют планшеты 3 ч при комнатной температуре на встряхивателе для планшет. Удаляют определяемый раствор и промывают каждую лунку два раза 300 мкл буфера для связывания. Добавляют в каждую лунку по 100 мкл конъюгата со щелочной фосфатазой к биотину (1/1500 в буфере для разбавления). Инкубируют планшеты 1 ч при комнатной температуре на встряхивателе для планшет. Удаляют конъюгат и промывают каждую лунку 300 мкл буфера для связывания. Добавляют по 100 мкл/лунку субстрата фосфатазы (1,5 мг/мл в буфере для щелочной фосфатазы). Инкубируют планшету при комнатной температуре на встряхивателе до развития окраски. Останавливают развитие окраски добавлением 25 мкл 2 N NaOH/лунку. Промеряют планшету при 405 нм. Контроль - лунка с неспецифическим связыванием (HCC). % подавления рассчитывается как
100-(поглощение с тестируемым соединением/общее поглощение)х100.
Метод определения связывания фибриногена с тромбоцитами. Связывание 125I-фибриногена с тромбоцитами проводили как описано Bennett et al. (1983) Proc. Natl. Acad. Sci. USA 80: 2417-2422, с некоторыми изменениями, описанными ниже. ПОТ человека (ч-ПОТ) наносили на колонку с сефарозой для очистки фракции тромбоцитов. Аликвоты тромбоцитов (5 х 108 клеток) вместе с 1 мМ хлоридом кальция добавляли в подвижные 96-луночные планшеты перед активацией очищенных на геле тромбоцитов (цГТП) человека. Активацию очищенных на геле тромбоцитов человека проводили, используя АДФ, коллаген, арахидонат, эпинефрина и/или тромбин в присутствии лиганда, 125I-фибриноген. Связанные с 125I-фибриногеном активированные тромбоциты отделяли от свободных тромбоцитов центрифугированием и затем просчитывали на гамма-счетчике. Для определения IC50 перед активацией тромбоцитов добавляли тестируемые соединения в разных концентрациях.
Соединения формулы I настоящего изобретения могут также обладать тромболитический эффективностью, т. е. они способны вызывать лизис уже сформированных обогащенных тромбоцитами кровяных сгустков фибрина и поэтому пригодны для лечения образования тромбов, что доказывается их активностью в описанных ниже тестах. Предпочтительные соединения настоящего изобретения для применения в тромболизисе включают те соединения, у которых значения IC50 (т.е. молярная концентрация, при которой достигается 50% лизис сгустков) менее 1 мкМ, более предпочтительно значение IC50 менее 0,1 мкМ.
Определение способности к тромболизису. Венозную кровь брали из руки здорового донора, который в течение по меньшей мере двух недель до взятия крови не принимал лекарств и аспирина, и помещали в 10 мл Vacuteiner пробирки с цитратом. Кровь центрифугировали 15 мин при l500xg при комнатной температуре и отбирали богатую тромбоцитами плазму (ПОТ). Затем к ПОТ добавляли 1•10-3 М агониста, а именно АДФ, эпинефрин, коллаген, арахидонат, серотонин или тромбин или их смеси, и инкубировали ПОТ 30 мин. Супернатант сливали, оставшиеся в пробирке тромбоциты ресуспендировали в не содержащей тромбоциты плазме (ПБТ), которая служила источником фибриногена. Суспензию исследовали на Coulter Counter (Coulter Electronics, Inc., Hialeah, FL) для определения количества тромбоцитов в момент времени 0. После получения нулевой отметки добавляли тестируемые соединения в различных концентрациях. Отбирали тестируемые образцы в различные моменты времени и считали тромбоциты на Coulter Counter. Для определения % лизиса счет тромбоцитов в момент времени после добавления тестируемого соединения вычитали из счета тромбоцитов в момент времени 0. Умножение этого результата на 100 давало процент лизиса сгустка данным тестируемым соединением. Для определения IC50 добавляли тестируемые соединения в различных концентрациях и рассчитывали % лизиса, вызываемого тестируемыми соединенными.
Соединения формулы I настоящего изобретения также подходят для введения в сочетании с противосвертывающими препаратами, такими как варфарин или гепарин, или антитромбоцитарными препаратами, такими как аспирин, пироксикам или тиклопидин, или ингибиторами тромбина, такими как боропептиды, хирудин или аргатробан, или тромболитическими препаратами, такими как тканевый активатор плазминогена, анстреплаза, урокиназа или стрептокиназа или их сочетания.
Соединения формулы I настоящего изобретения также могут быть полезны в качестве антагонистов других интегринов, таких как, например, 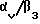 или рецептор витронектина,
или рецептор витронектина, 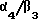 или
или 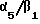 и, по существу, могут быть также полезны в лечении и диагностике остеопороза, метастазирования при раке, диабетической ретинопатии, ревматоидного артрита, воспалительного процесса и аутоиммунных заболеваний. Соединения формулы I настоящего изобретения могут применяться в лечении или предупреждении других заболеваний, которые включают процессы адгезии клеток, в том числе, но не ограничиваясь, воспаление, распад кости, ревматоидный артрит, астму, аллергии, дыхательную недостаточность взрослых, реакцию "трансплантант против хозяина", трансплантацию органов, септический шок, псориаз, экзему, контактный дерматит, остеопороз, остеоартрит, атеросклероз, метастазирование, заживление ран, диабетическая ретинопатия, воспалительное заболевание кишечника и другие аутоиммунные заболевания.
и, по существу, могут быть также полезны в лечении и диагностике остеопороза, метастазирования при раке, диабетической ретинопатии, ревматоидного артрита, воспалительного процесса и аутоиммунных заболеваний. Соединения формулы I настоящего изобретения могут применяться в лечении или предупреждении других заболеваний, которые включают процессы адгезии клеток, в том числе, но не ограничиваясь, воспаление, распад кости, ревматоидный артрит, астму, аллергии, дыхательную недостаточность взрослых, реакцию "трансплантант против хозяина", трансплантацию органов, септический шок, псориаз, экзему, контактный дерматит, остеопороз, остеоартрит, атеросклероз, метастазирование, заживление ран, диабетическая ретинопатия, воспалительное заболевание кишечника и другие аутоиммунные заболевания.
В таблице 16 представлена антитромбоцитарная активность характерных соединений настоящего изобретения. Указанные соединения проверяли на их способность подавлять агрегацию тромбоцитов (используя обогащенную тромбоцитами плазму (ПОТ)), показаны значения IC50 (концентрации антагониста, при которых агрегация тромбоцитов подавляется на 50% относительно контроля без антагониста). В таблице 16 значения IC50 обозначены следующим образом:
+++ = IC50 < 10 мкМ, ++ = IC50 10-50 мкМ, + = IC50 50-100 мкМ.
Дозы и технология приготовления лекарственных форм
Соединения настоящего изобретения могут вводиться в виде таких оральных лекарственных форм, как таблетки, капсулы (каждая из которых включает формы с непрерывным или ограниченным во времени высвобождением активного компонента), драже, порошки, гранулы, эликсиры, настойки, суспензии, сиропы и эмульсии. Они также могут вводиться внутривенно (шарик или вливание), внутрибрюшинно, подкожно или внутримышечно, используя лекарственные формы, известные специалистам в области фармакологии. Эффективное, но нетоксичное количество желаемого соединения может быть использовано как противоагрегационный лекарственный препарат.
Соединения этого изобретения могут вводиться любыми способами, которые создают контакт активного вещества с местом действия, гликопротеином IIb/IIIa (ГПIIb/IIIa), в теле млекопитающих. Они могут вводиться любыми традиционными способами, подходящими для применения вместе с фармацевтическими препаратами, либо в виде индивидуальных лекарственных препаратов, либо в сочетании с лекарственными препаратами, такими как второй антитромбоцитарный препарат, а именно аспирин или тиклопидин, являющимися агонист-специфичными. Они могут вводиться сами по себе, но в основном вводятся вместе с фармацевтическим носителем, выбранным на основании выбранного способа введения и общепринятой фармацевтической практики.
Схема приема соединений настоящего изобретения, конечно, будет варьировать в зависимости от известных факторов, таких как фармакодинамические характеристики определенного препарата и его форма и путь введения; вид, возраст, пол, состояние здоровья, медицинские условия и вес реципиента; природа и степень выраженности симптомов; разновидность сопутствующего лечения; частота лечения; путь введения, работа почек и печени больного и желаемый эффект. Обычно опытный терапевт или ветеринар могут легко определить и прописать эффективное количество требуемого для предупреждения, противодействия или остановки развития заболевания.
В качестве общего руководства ежедневная оральная доза каждого активного компонента при применении для достижения указанных эффектов будет варьировать от 0,001 до 1000 мг/кг веса тела, предпочтительно от 0,01 до 100 мг/кг веса тела в день и наиболее предпочтительно от примерно 1,0 до 20 мг/кг/день. Наиболее предпочтительные внутривенные дозы будут находиться в интервале от примерно 1 до примерно 10 мг/кг/мин при постоянной скорости вливания. Было бы лучше, если соединение настоящего изобретения вводилось бы в виде однократной ежедневной дозы или общая ежедневная доза вводилась бы в виде нескольких раздельных доз два, три или четыре раза в день.
Соединения настоящего изобретения могут вводиться через нос посредством соответствующих интраназальных носителей или трансдермальными путями, используя хорошо известные специалистам формы трансдермальных кожных пятен. При введении в виде трансдермальной системы введение будет непрерывным, а не прерывистым на протяжении всей схемы приема.
В методах настоящего изобретения подробно описанные соединения могут образовывать активный компонент и обычно вводятся в смеси с соответствующими фармацевтическими растворителями, наполнителями или носителями, обозначенными здесь под общим названием как вещества-наполнители, соответственно выбранными в зависимости от предполагаемой формы введения, т.е. оральные таблетки, капсулы, эликсиры, сиропы и т.п., и согласно общепринятой фармацевтической практике.
Например, при оральном введении в форме таблетки или капсулы активный компонент может комбинироваться с нетоксичным оральным, фармацевтически приемлемым, инертным наполнителем, таким как лактоза, крахмал, сахароза, глюкоза, метилцеллюлоза, стеарат магния, гидрофосфат калия, сульфат кальция, маннитол, сорбитол и т.п.; при оральном введении в виде жидкой лекарственной формы оральные лекарственные компоненты могут комбинироваться с любым нетоксичным оральным, фармацевтически приемлемым, инертным наполнителем, таким как этанол, глицерин, вода и т.п. Более того, при желании или в случае необходимости в смесь могут также быть включены соответствующие связывающие вещества, смазывающие вещества, диспергирующие соединения и красители. К подходящим связующим веществам относятся крахмал, желатин, природные сахара, а именно глюкоза или бета-лактоза, хлебные отдушки, натуральные или синтетические камеди, такие как акация, трагант или альгинат натрия, карбоксиметилцеллюлоза, полиэтиленгликоль, воски и т.п. Смазывающие вещества, используемые в этих лекарственных формах включают омат натрия, стеарат натрия, стеарат магния, бензоат натрия, ацетат натрия, хлорид натрия и т.п. Диспергирующие соединения включают, без ограничения, крахмал, метилцеллюлозу, агар, бентонит, ксантеновую смолу и т.п.
Соединения настоящего изобретения могут также вводиться в форме липосом, а именно небольших однослойных везикул, больших однослойных везикул и многослойных везикул. Липосомы могут быть образованы различными фосфолипидами, такими как холестерол, стеариламин или фосфатидилхолин.
Соединения настоящего изобретения также могут быть связаны с растворимыми полимерами, выступающими в качестве носителей лекарства, доставляющих его к месту действия. К таким полимерам относятся поливинилпирролидин, сополимер пирана, полигидроксипропилметакриламидфенол, полигидроксиэтиласпартамидофенол или полиэтиленоксид-полилизин, замещенный остатками польмитоила. Более того, соединения настоящего изобретения могут быть связаны с полимерами, разлагаемыми бактериями, что имеет значение при обеспечении контролируемого высвобождения лекарства, например, полиактиновой кислотой, полиортоэфиром, полиацеталями, полидигидрофураном, полицианоацилатами или сшитыми или амфипатическими блок-сополимерами гидрогелей.
Лекарственные формы (фармацевтические композиции), пригодные для введения, могут содержать от примерно 1 мг до примерно 100 мг активного компонента на единицу дозы. Активный компонент в этих фармацевтических композициях будет, как правило, присутствовать в количестве примерно 0,5-95% по весу от общего веса композиции.
Активный ингредиент может вводиться орально в твердой дозированной форме, такой как капсулы, таблетки и порошки, или в жидкой дозированной форме, такой как эликсиры, сиропы или суспензии. Он также может быть введен парентерально, в стерильной жидкой дозированной форме. Желатиновые капсулы могут содержать активный ингредиент и порошкообразные носители, такие как лактоза, крахмал, целлюлозные производные, стеарат магния, стеариновая кислота и другие. Подобные разбавители могут быть использованы при изготовлении таблеток. Таблетки и капсулы могут быть изготовлены таким образом, чтобы поддерживать освобождение продуктов, обеспечивающее высвобождение лекарства в определенный период времени. Таблетки могут иметь сахарное покрытие или пленочное, устраняющее неприятный вкус и предохраняющее таблетку от атмосферного воздействия, или кишечное покрытие для селективного разложения в желудочно-кишечном тракте. Жидкие дозированные формы для орального применения могут содержать цветовые или вкусовые добавки, улучшающие их прием пациентом. Для парентеральных растворов подходящими носителями являются вода, подходящее масло, соли, водная декстроза (глюкоза), подходящие растворы сахара и гликоли, такие как пропиленгликоль или полиэтиленгликоли.
Растворы для парентерального введения предпочтительно содержат в водном солевом растворе активный ингредиент, подходящие стабилизирующие агенты и, если необходимо, буферные субстанции. Противоокислительные агенты, также как бисульфит натрия, сульфит натрия или аскорбиновая кислота самостоятельно или в сочетании, являются подходящими стабилизирующими агентами. Лимонная кислота или ее соли и натрия этилендиаминтетраацетат также могут быть использованы. Дополнительно, парентеральные растворы могут содержать стабилизаторы, такие как бензальконхлорид, метил- или пропилпарабен или хлорбутанол. Подходящие фармацивтические носители описаны в Remington's Pharmaceutical Sciences, Mack Publishing Company, стандартная ссылка в этой области.
Характерные пригодные для употребления лекарственные формы введения соединений этого изобретения могут быть проиллюстрированы следующими примерами.
Капсулы
Капсулы получают заполнением стандартных жестких желатиновых капсул, состоящих из двух частей, каждой по 100 мг порошкообразного активного компонента, 150 мг лактозы, 50 мг целлюлозы и 6 мг стеарата магния.
Мягкие желатиновые капсулы
Готовят смесь активного компонента в пищевом масле, таком как соевое масло, хлопковое масло или оливковое масло и вводят ее с помощью поршневого насоса в желатин для формирования мягких желатиновых капсул, содержащих по 100 мг активного компонента. Капсулы промывают и высушивают.
Таблетки
Таблетки готовят традиционными способами таким образом, чтобы каждая единица дозы содержала по 100 мг активного компонента, 0,2 мг коллоидного диоксида кремния, 5 мг стеарата магния, 275 мг микрокристаллической целлюлозы, 11 мг крахмала и 98,8 мг лактозы. Для повышения вкусовых качеств или задержки всасывания могут быть нанесены соответствующие оболочки.
Инъекции
Парентеральный состав, подходящий для введения в виде уколов, готовят перемешиванием 1,5% по весу активного компонента в 10% по объему пропиленгликоле и воде. Раствор делают изотоническим с помощью хлорида натрия и стерилизуют.
Суспензии
Водную суспензию готовят для орального введения таким образом, чтобы каждые 5 мл содержали бы 100 мг тонко измельченного активного компонента, 200 мг карбоксиметилцеллюлозы, 5 мг бензоата натрия, 1,0 г раствора сорбитола, U.S.P. и 0,025 мл ванилина.
Соединения настоящего изобретения могут вводиться в сочетании со вторым лекарственным препаратом, выбранным из: противосвертывающего средства, такого как варфарин или гепарин; противотромбоцитарного препарата, такого как аспирин, пироксика или тиклопидин; ингибитора тромбина, такого как боропептид ингибитора тромбина или хирудин, или тромболитического препарата, такого как активаторы плазминогена, а именно тканевый активатор плазминогена, анистреплаза, урокиназа или стрептокиназа. Соединение формулы I и такой второй лекарственный препарат могут вводиться отдельно или в физической комбинации в одной единице дозы, в виде любой лекарственной формы и различными путями введения, описанными выше.
Соединение формулы I вместе со вторым лекарственным препаратом может входить в состав единицы однократной дозы (т.е. объединены вместе в одной капсуле, таблетке, порошке или жидкости и т.д.). В этом случае, если соединение формулы I и второй лекарственный препарат не входят в состав единицы дозы, соединение формулы I и второй лекарственный препарат (противосвертывающее средство, противотромбоцитарный препарат, ингибитор тромбина и/или тромболитический препарат) могут вводиться одновременно или в любом порядке; например соединение формулы I может вводиться первым с последующим введением второго препарата (противосвертывающего средства, противотромбоцитарного препарата, ингибитора тромбина и/или тромболитического препарата). Если препараты не вводятся одновременно, предпочтительно, чтобы введение соединения формулы I и второго лекарственного препарата проводилось с интервалом менее 1 ч.
Предпочтителен оральный путь введения соединения формулы I. Несмотря на то что предпочтительно введение соединения формулы I и второго лекарственного препарата (противосвертывающего средства, противотромбоцитарного препарата, ингибитора тромбина и/или тромболитического препарата) одним и тем же путем (т. е., например, оба препарата вводятся оральным путем), при желании они могут быть введены различными путями и в виде разных лекарственных форм (т. е. , например, один компонент комбинированного продукта может быть введен орально, а второй компонент может быть введен внутривенно).
Доза соединения формулы I при введении по отдельности или в сочетании со вторым лекарственным препаратом может варьировать в зависимости от различных факторов, а именно фармакодинамических характеристик отдельного препарата и его формы и способа введения, возраста, состояния здоровья и веса реципиента, природы и степени выраженности симптомов, вида сопутствующего лечения, частоты лечения и желаемого эффекта, как описано выше.
Несмотря на то что соответствующая доза соединения формулы I в том случае, если оно вводится в сочетании со вторым лекарственным препаратом, будет легко установлена специалистами, принимая во внимание настоящее открытие, в качестве общего руководства в тех случаях, когда соединения этого изобретения комбинируются с противосвертывающими препаратами, например, ежедневная доза может составлять примерно от 0,1 до 100 мг соединения формулы I и около 1-7,5 мг антикоагулянта на 1 кг веса тела больного. В таблетке новые соединения этого изобретения в основном могут присутствовать в количестве от около 1 до 10 мг на единицу дозы и антикоагулянт в количестве примерно 1-5 мг на единицу дозы.
В том случае, когда соединения формулы I вводятся в сочетании во вторым противотромбоцитаным препаратом, в качестве общей рекомендации, обычно ежедневная доза может составлять около 0,01-25 мг соединения формулы I и примерно 50-150 мг дополнительного противотромбоцитарного препарата, предпочтительно около 0,1-1 мг соединения формулы I и около 1-3 мг противотромбоцитарных препаратов на 1 кг веса тела больного.
Далее, в качестве общей рекомендации, в том случае, если соединения формулы I вводятся в сочетании с тромболитиком, ежедневная доза обычно может составлять примерно 0,1-1 мг соединения формулы I на 1 кг веса тела больного и для тромболитика обычная доза тромболитического препарата, вводимого отдельно, может быть уменьшена до примерно 70-80% в том случае, если он вводится вместе с соединением формулы I.
В том случае, если два и более указанных выше дополнительных лекарственных препарата вводятся вместе с соединением формулы I, обычно количество каждого компонента в обычной дневной дозе и обычной лекарственной форме может быть уменьшено относительно обычной дозы препарата, вводимой отдельно, с учетом аддитивного или синергетического эффекта лекарственных препаратов в том случае, если они вводятся в сочетании.
В случае одной единицы дозы может иметь место химическое взаимодействие между скомбинированными активными компонентами. По этой причине, если соединение формулы I и второй лекарственный препарат объединены в одной единице дозы, они готовятся таким образом, чтобы, несмотря на их присутствие в одной единице дозы, физический контакт между активными компонентами был сведен к минимуму. Например, один из активных компонентов может быть покрыт энтересолюбильной оболочкой. Энтеросолюбильная оболочка одного из активных компонентов позволяет не только уменьшить контакт между скомбинированными активными компонентами, но также дает возможность контролировать высвобождение одного из компонентов в желудочно-кишечном тракте таким образом, что один из этих компонентов не будет высвобождаться в желудке, а будет высвобождаться в тонком кишечнике. Один из активных компонентов может быть также покрыт веществом, контролирующим непрерывное выделение в желудочно-кишечном тракте, таким образом оно служит для уменьшения физического контакта между активными компонентами. Более того, непрерывно высвобождающийся компонент может быть дополнительно покрыт энтеросолюбильной оболочкой с тем, чтобы его высвобождение происходило только в кишечнике. Дополнительные достижения могут включать приготовление комбинированного продукта, в котором один из компонентов покрыт полимером, контролирующим непрерывное высвобождение и/или высвобождение в кишечнике, а второй компонент покрыт таким полимером, как гидроксипропилметилцеллюлоза с низкой вязкостью, или другим соответствующим материалом, известным специалистам, для дальнейшего разделения активных компонентов. Полимерное покрытие служит дополнительным барьером для взаимодействия с другим компонентом.
Эти, а также другие способы уменьшения контакта между компонентами комбинированного продукта настоящего изобретения, вводимых либо в одной единице дозы, либо в виде отдельных лекарственных форм, но одновременно одним и тем же способом, будут очевидны специалистам, имеющим настоящее открытие.
Настоящее изобретение также включает фармацевтические наборы, например, для подавления агрегации тромбоцитов, лечения кровяных сгустков и/или лечения тромбоэмболических осложнений, которые включают один или более контейнер, содержащий фармацевтическую композицию, содержащую терапевтически эффективное количество соединения формулы I. Такие наборы могут также включать при желании (один или более) различные традиционные компоненты фармацевтических наборов, а именно, например, контейнеры с одним или более фармацевтически приемлемым наполнителем, дополнительные контейнеры и т.д., что будет очевидно для специалистов. В набор могут также входить инструкции либо в виде вкладышей, либо надписей, содержащие указание на количество компонентов, которое должно быть введено, указания для применения и/или указания для смешивания компонентов.
В настоящем изобретении подразумевается, что указанные вещества и условия важны для внедрения изобретения, но что не исключаются неуказанные вещества и условия с тем, чтобы не предотвращать пользу изобретения от его реализации.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЦИКЛИЧЕСКИЕ МОЧЕВИНЫ, СПОСОБ ИНГИБИРОВАНИЯ РОСТА РЕТРОВИРУСОВ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1992 |
|
RU2131420C1 |
| ПРОИЗВОДНЫЕ АНТРАПИРАЗОЛОНОВ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И СПОСОБЫ ПОЛУЧЕНИЯ ИЗ НИХ АНТРАПИРАЗОЛОНОВ, ОБЛАДАЮЩИХ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 1994 |
|
RU2142456C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИМИДАЗОЛОВ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМОЙ СОЛИ | 1989 |
|
RU2028293C1 |
| ПОЛИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ, ИХ ПРОИЗВОДНЫЕ, ФАРМАЦЕВТИЧЕСКИЕ ПРЕПАРАТЫ КАК УСИЛИТЕЛИ И МЕТОД ЛЕЧЕНИЯ НАРУШЕНИЯ МЫСЛИТЕЛЬНОЙ ДЕЯТЕЛЬНОСТИ | 1994 |
|
RU2152944C1 |
| 1-N-АЛКИЛ-N-АРИЛПИРИМИДИНАМИНЫ, СПОСОБ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1994 |
|
RU2153494C2 |
| КАРБОЦИКЛИЧЕСКИЕ И ГЕТЕРОЦИКЛИЧЕСКИЕ КОНДЕНСИРОВАННЫЕ СОЕДИНЕНИЯ ХИНОЛИНКАРБОНОВОЙ КИСЛОТЫ, ПРИГОДНЫЕ В КАЧЕСТВЕ ИММУНОДЕПРЕССАНТОВ | 1994 |
|
RU2133740C1 |
| ЦИКЛИЧЕСКИЕ ПЕПТИДЫ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1992 |
|
RU2096415C1 |
| АНАЛОГИ Δ-ИЗОТАКСОЛА, ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ, СПОСОБ ПОЛУЧЕНИЯ ПРОМЕЖУТОЧНЫХ СОЕДИНЕНИЙ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1995 |
|
RU2142950C1 |
| АЗОТСОДЕРЖАЩИЕ ГЕТЕРОЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ ФЛУОРЕНА | 1992 |
|
RU2051151C1 |
| ЦИКЛИЧЕСКИЕ ПЕПТИДЫ, РАДИОФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ, ЦИКЛИЧЕСКИЕ ПЕПТИДЫ, ИМЕЮЩИЕ РАДИОАКТИВНУЮ МЕТКУ | 1994 |
|
RU2145608C1 |
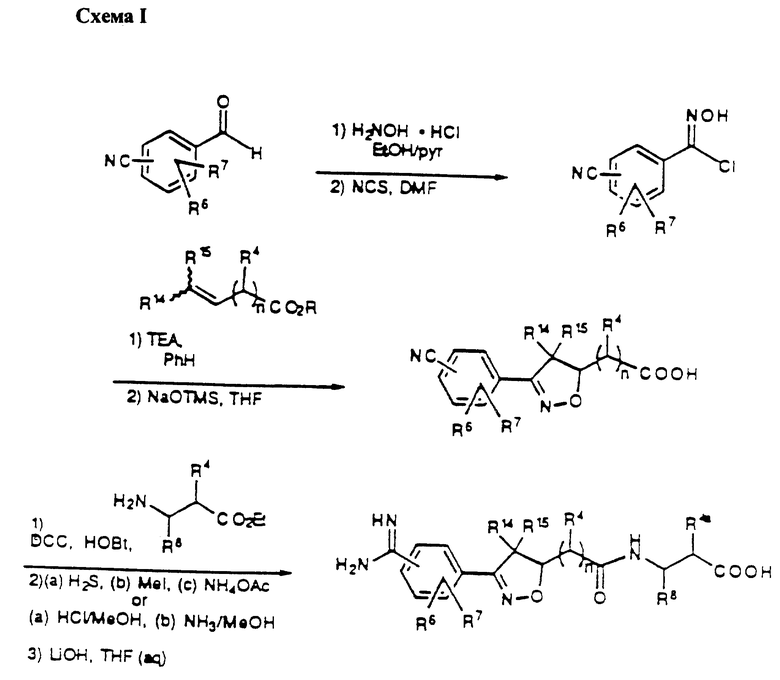
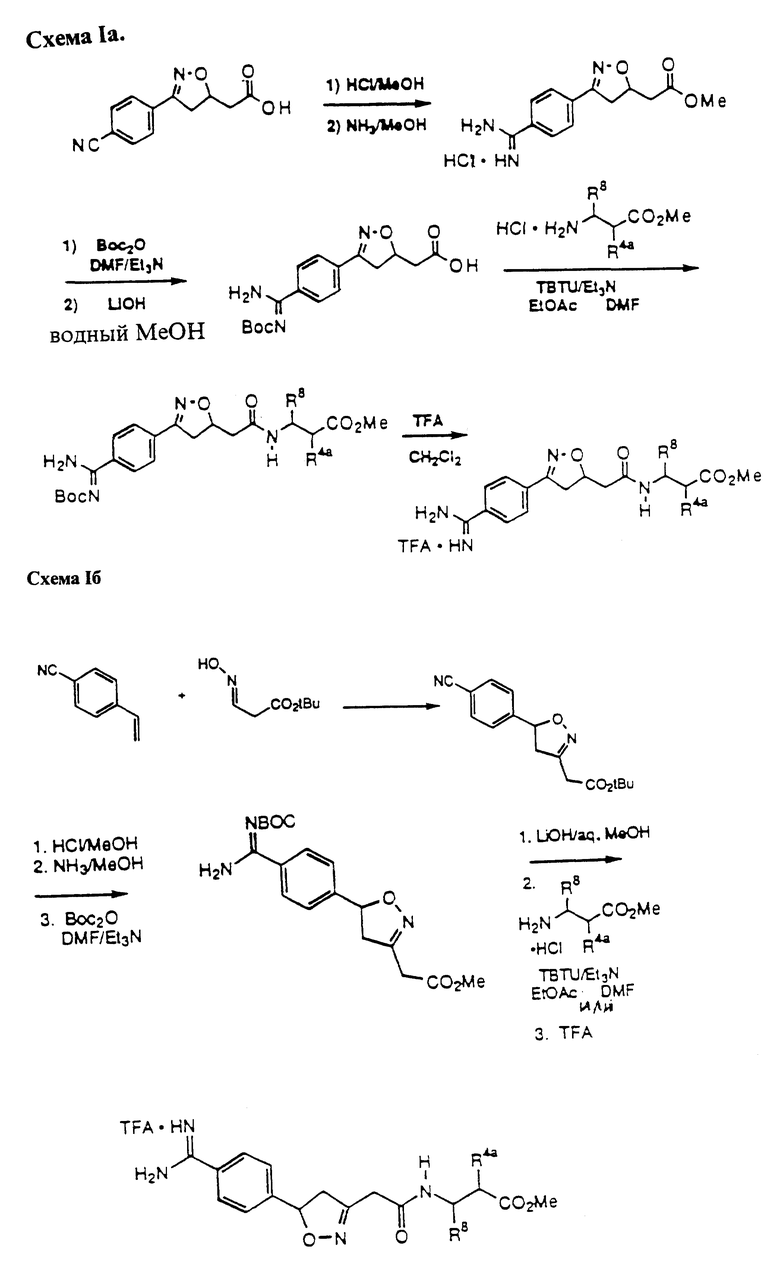
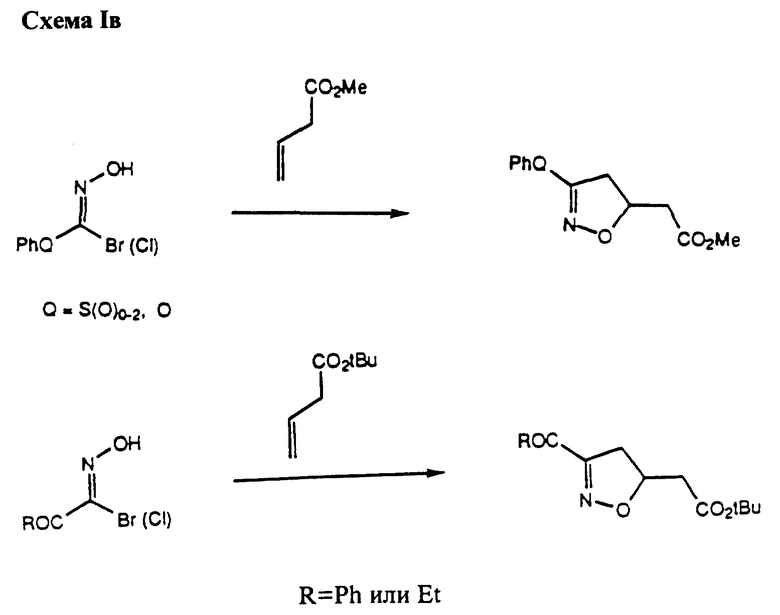
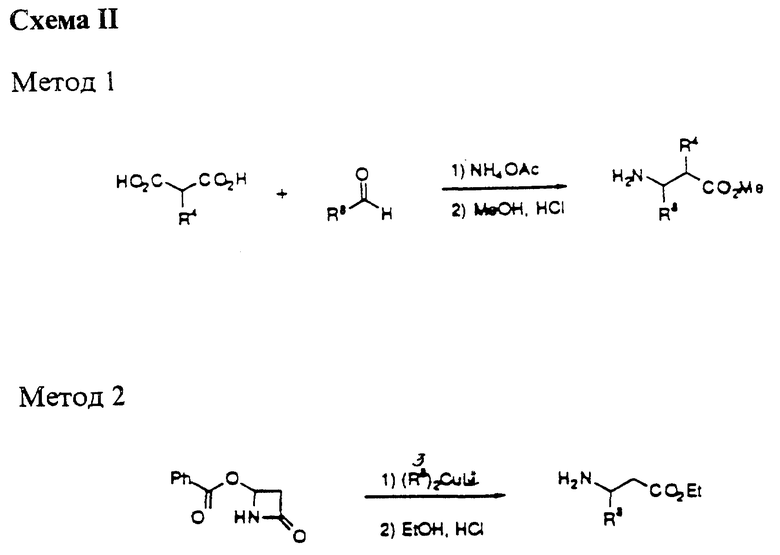

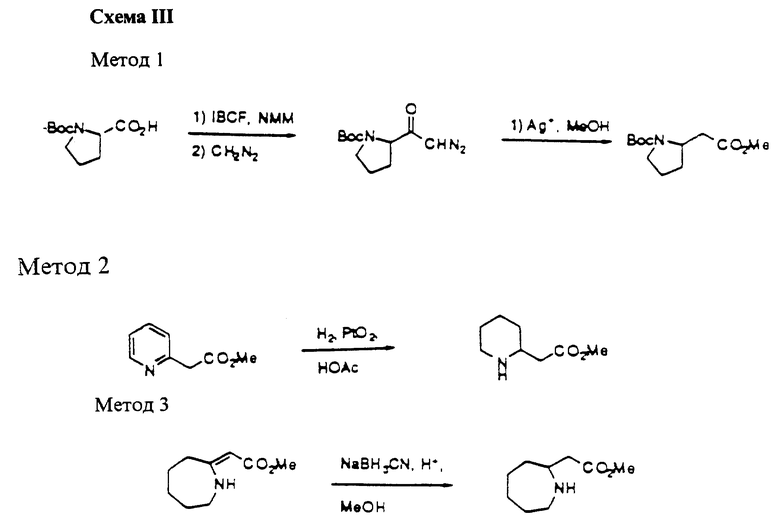
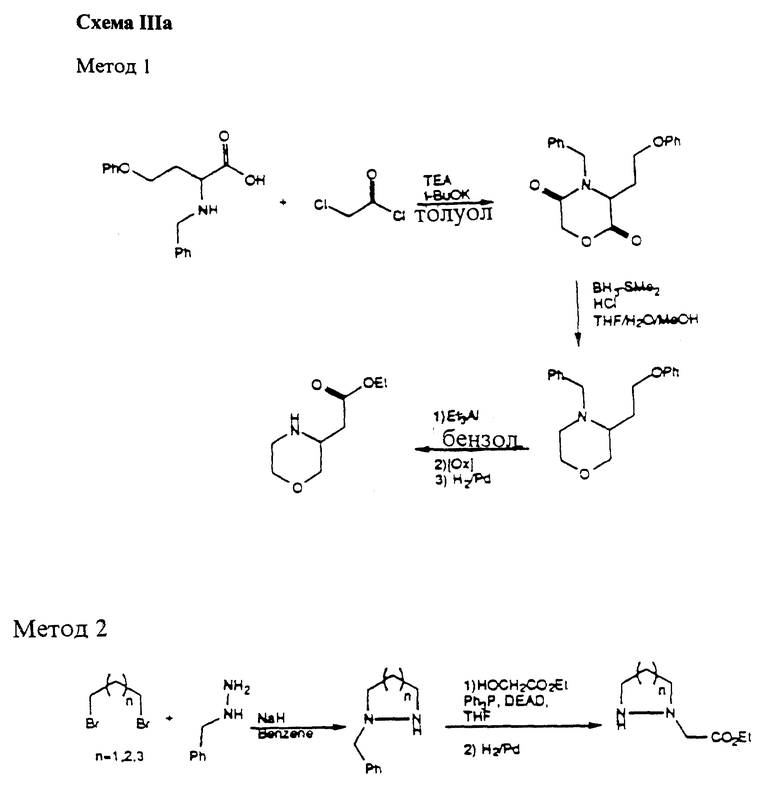
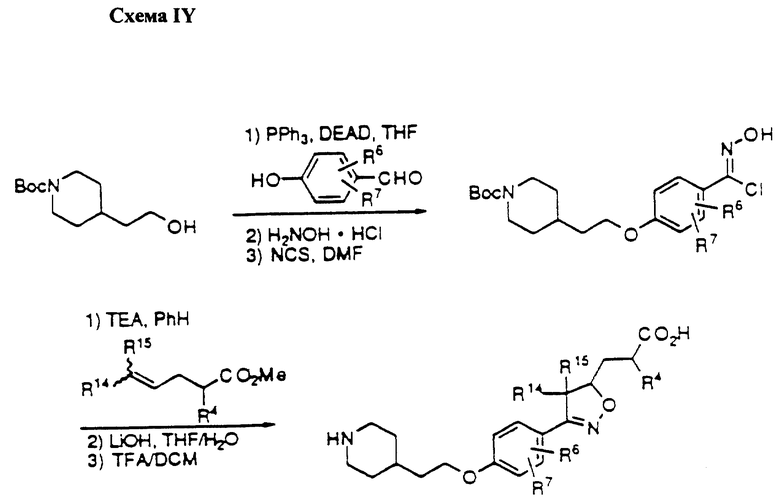
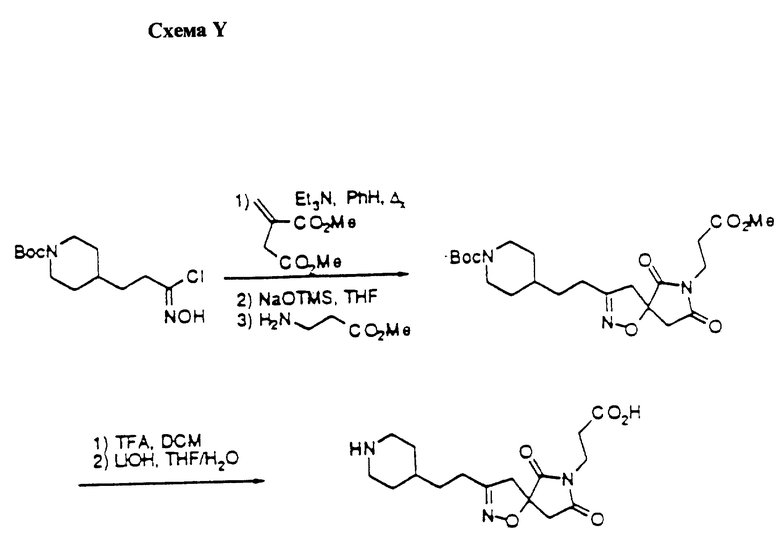
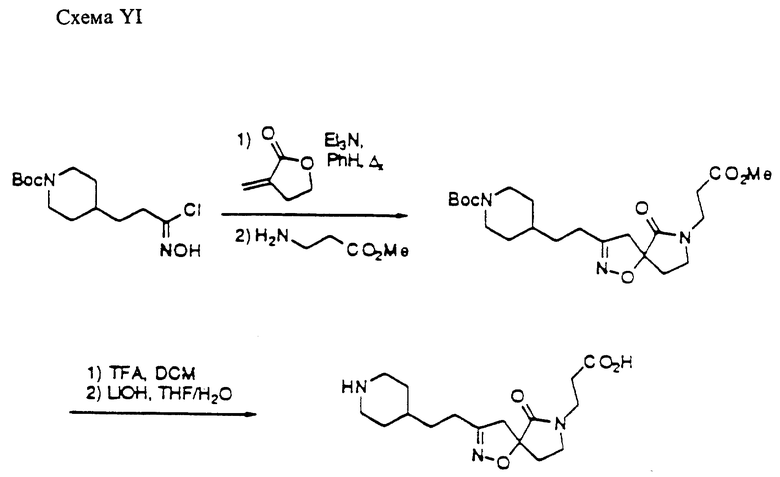
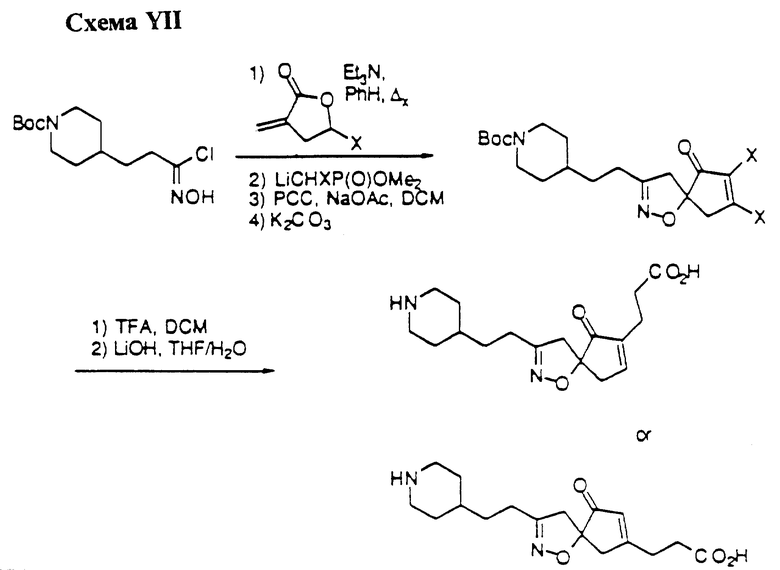
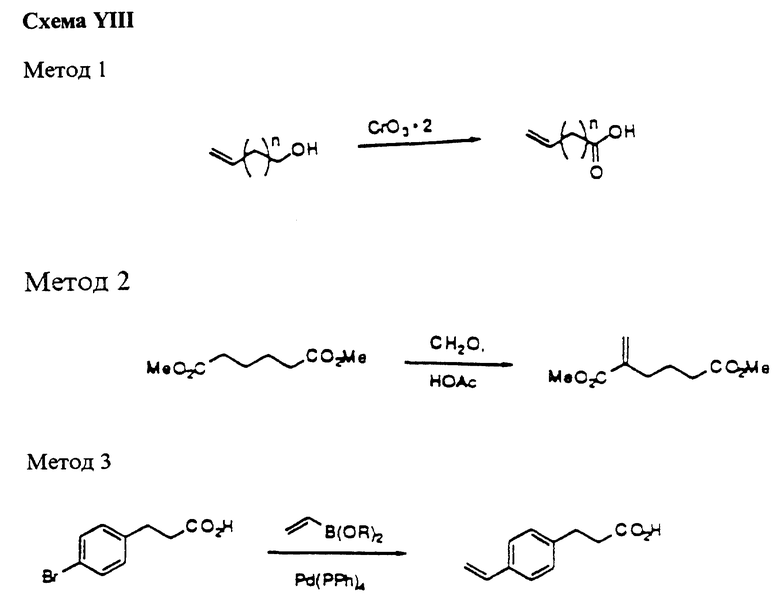
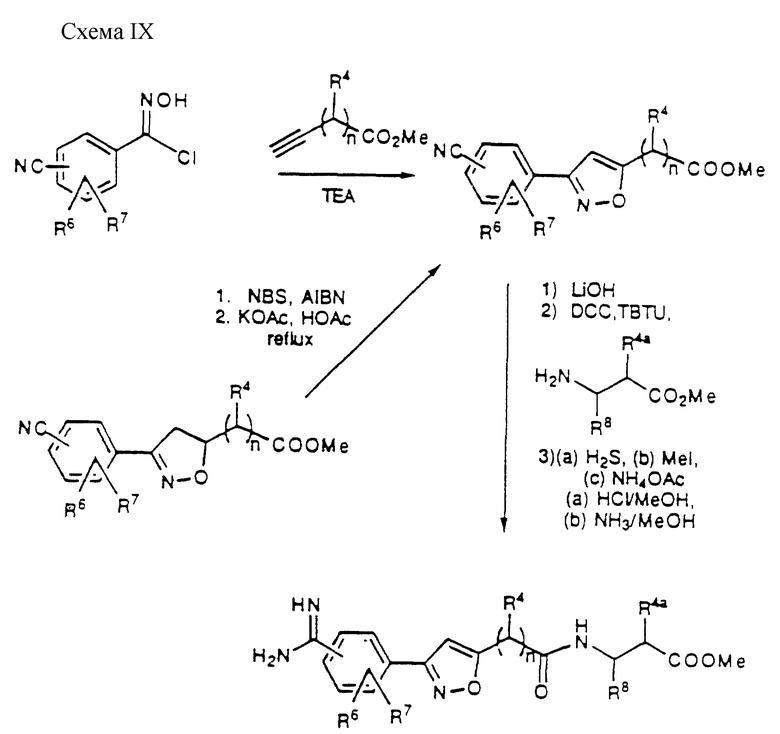
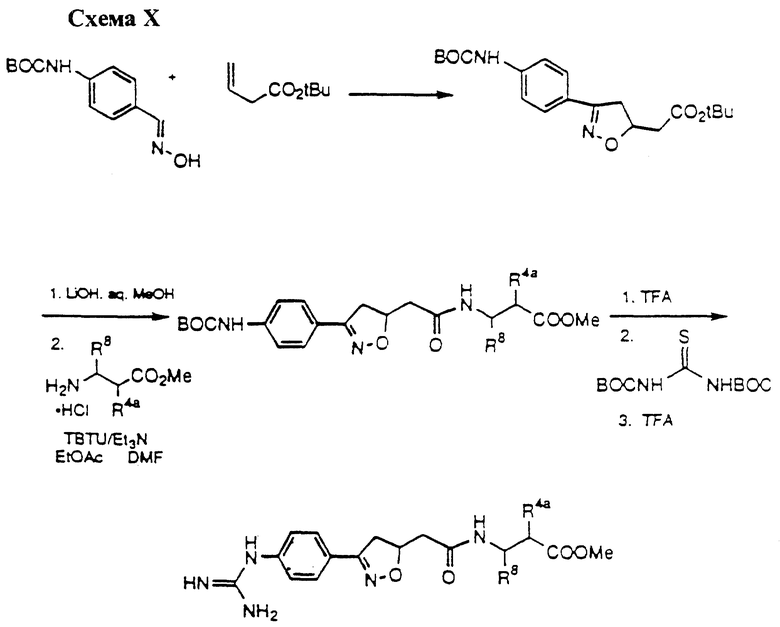
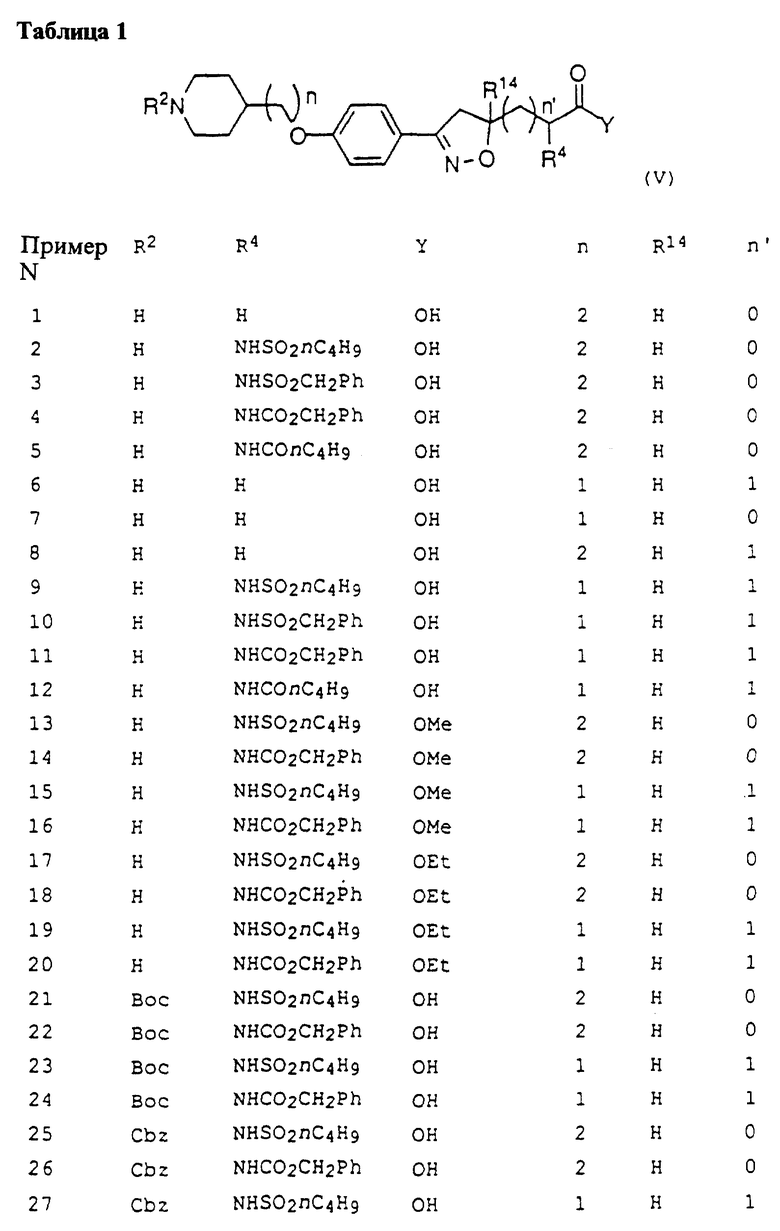
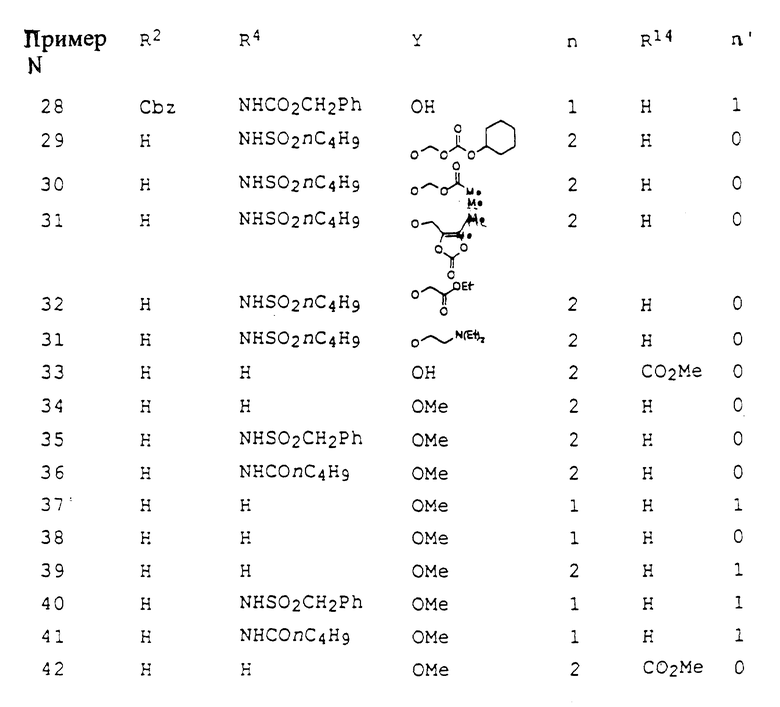
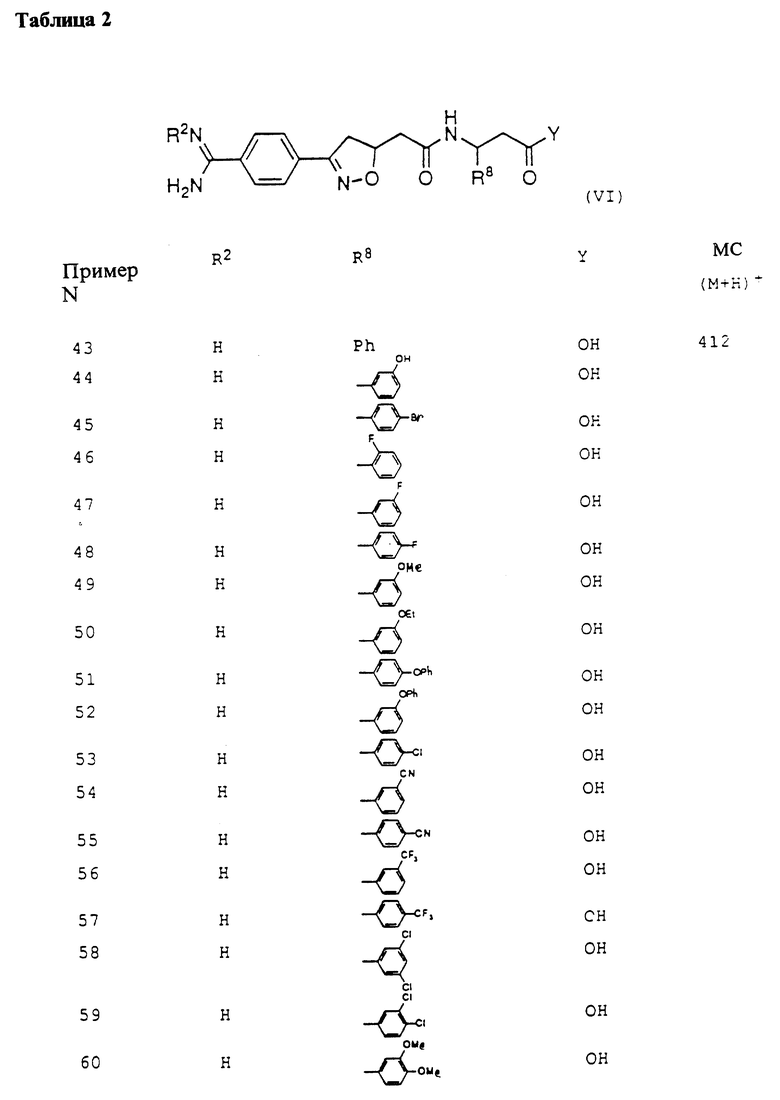
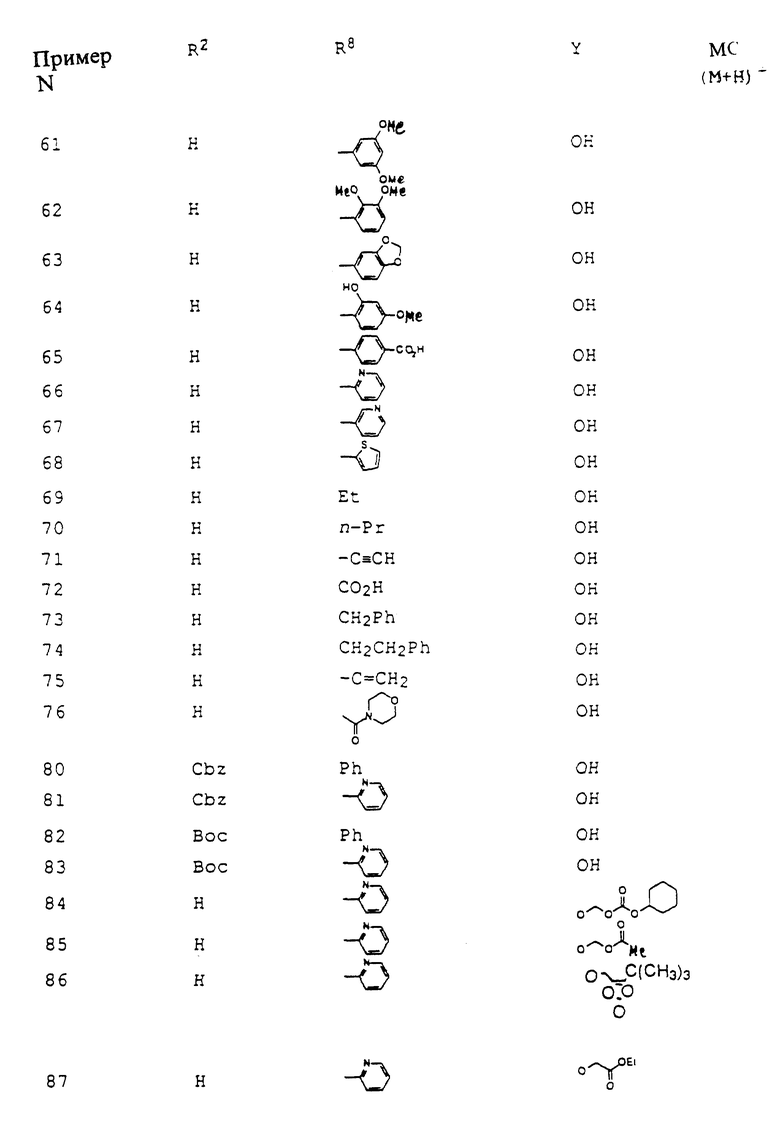


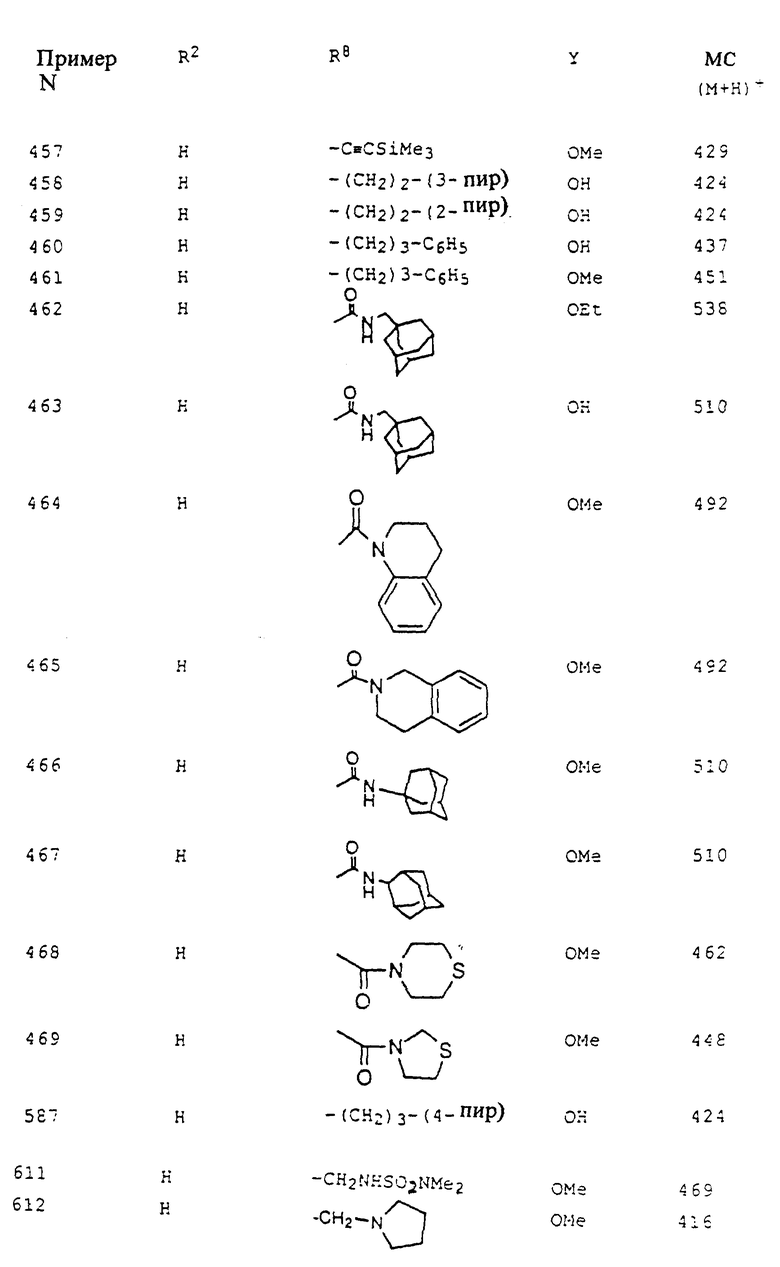
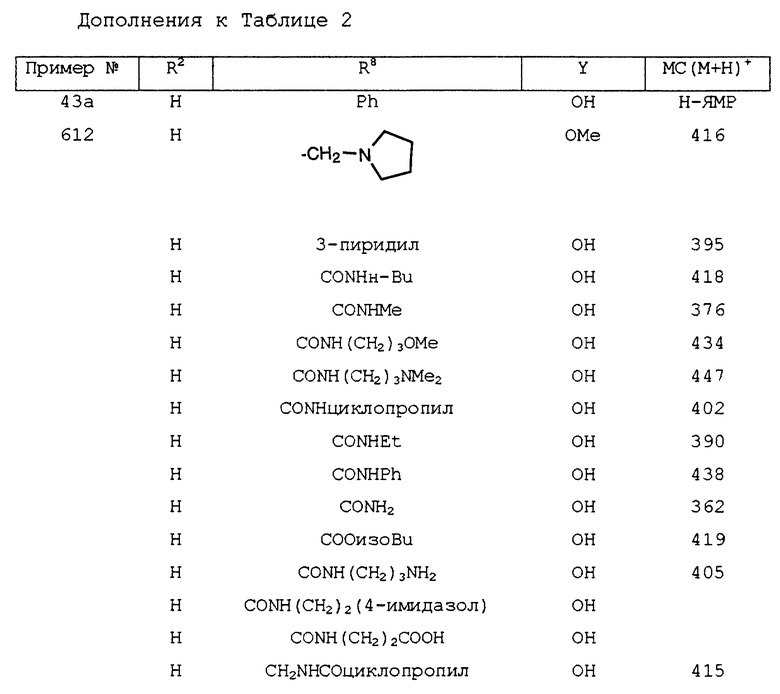
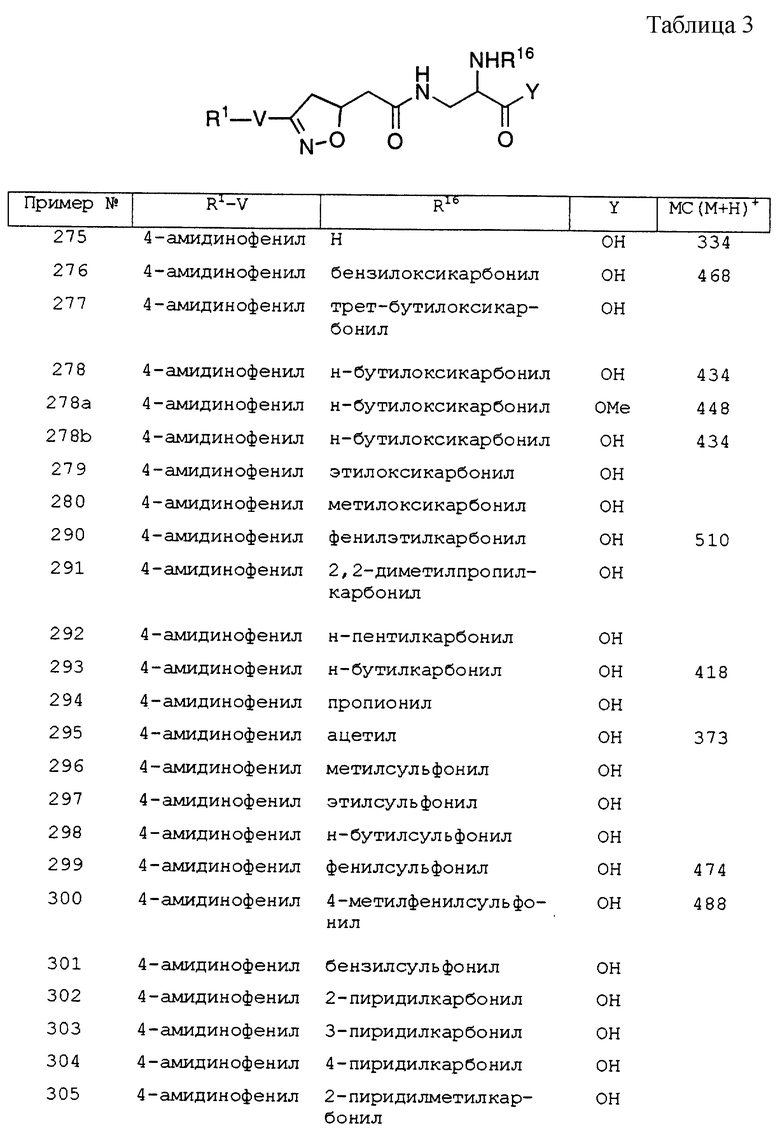


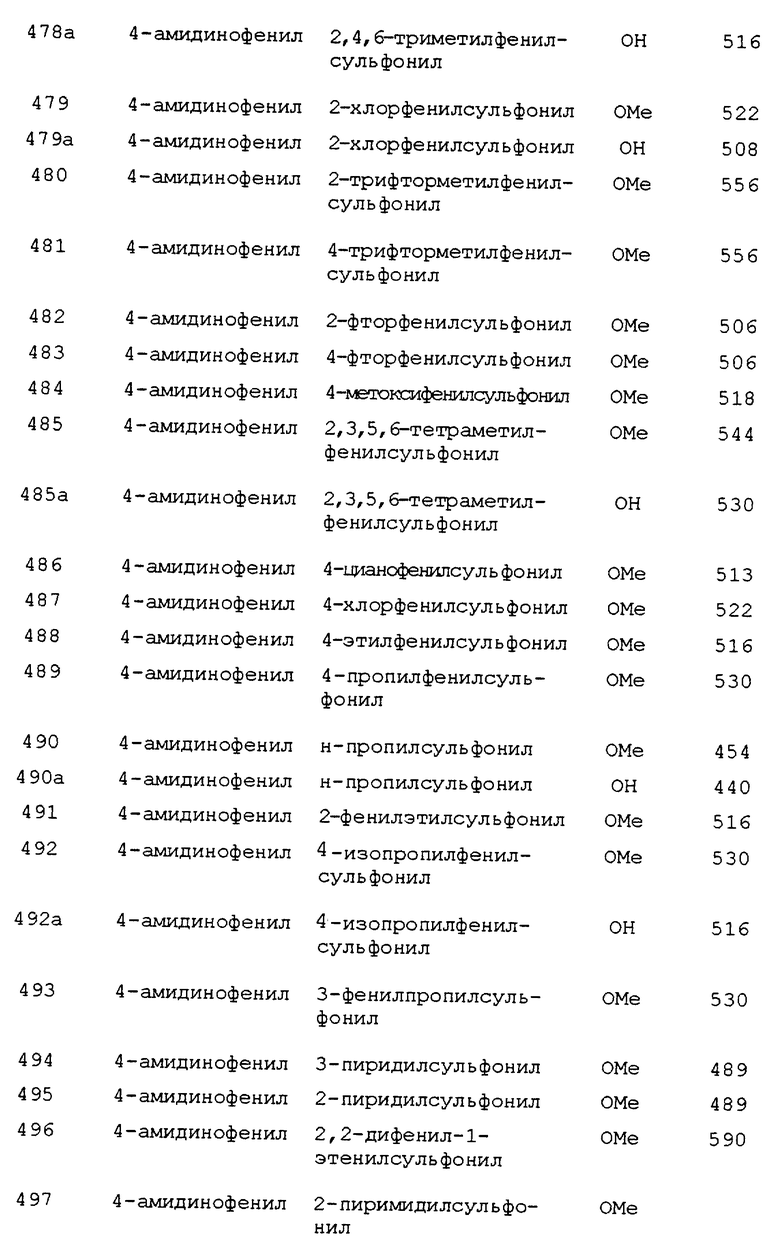









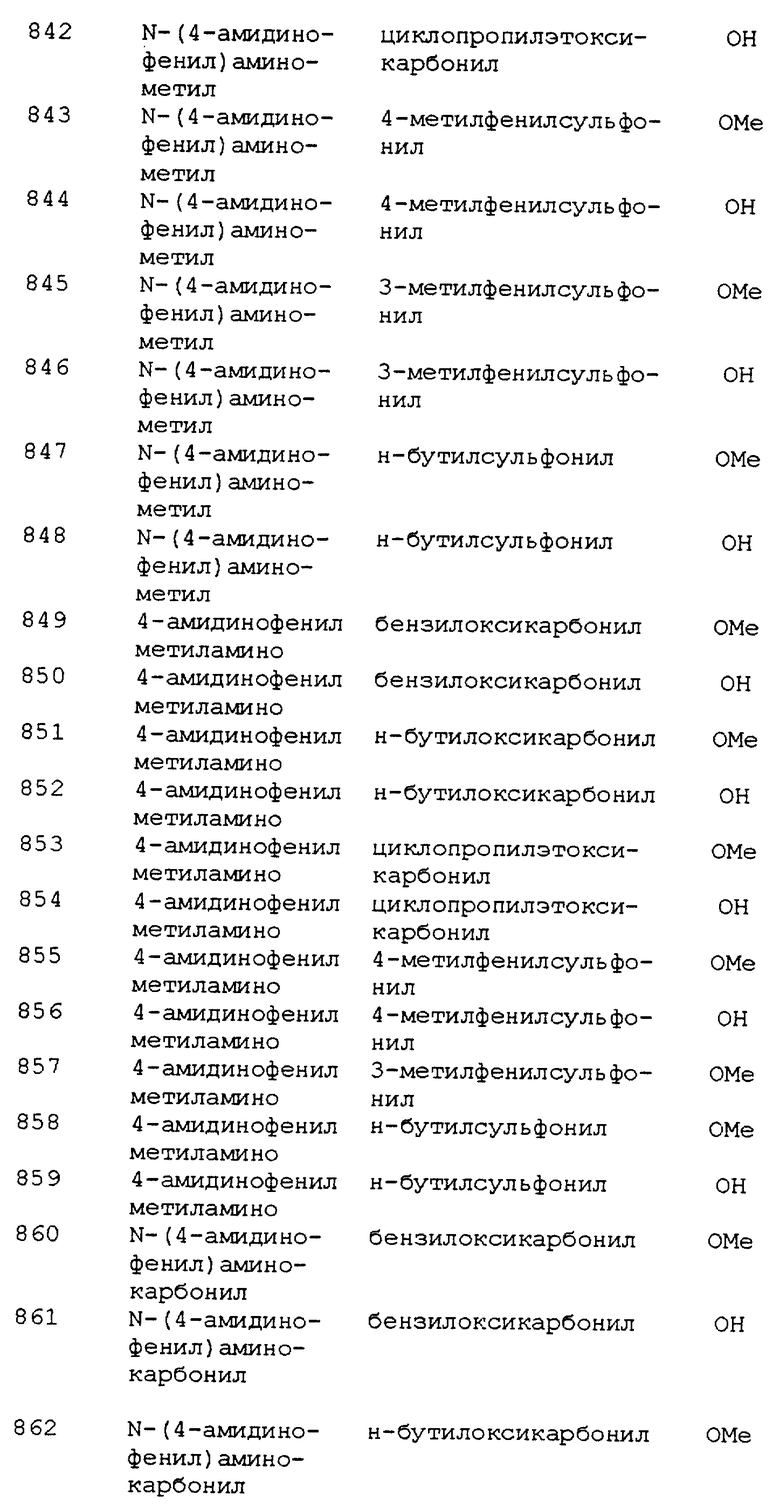


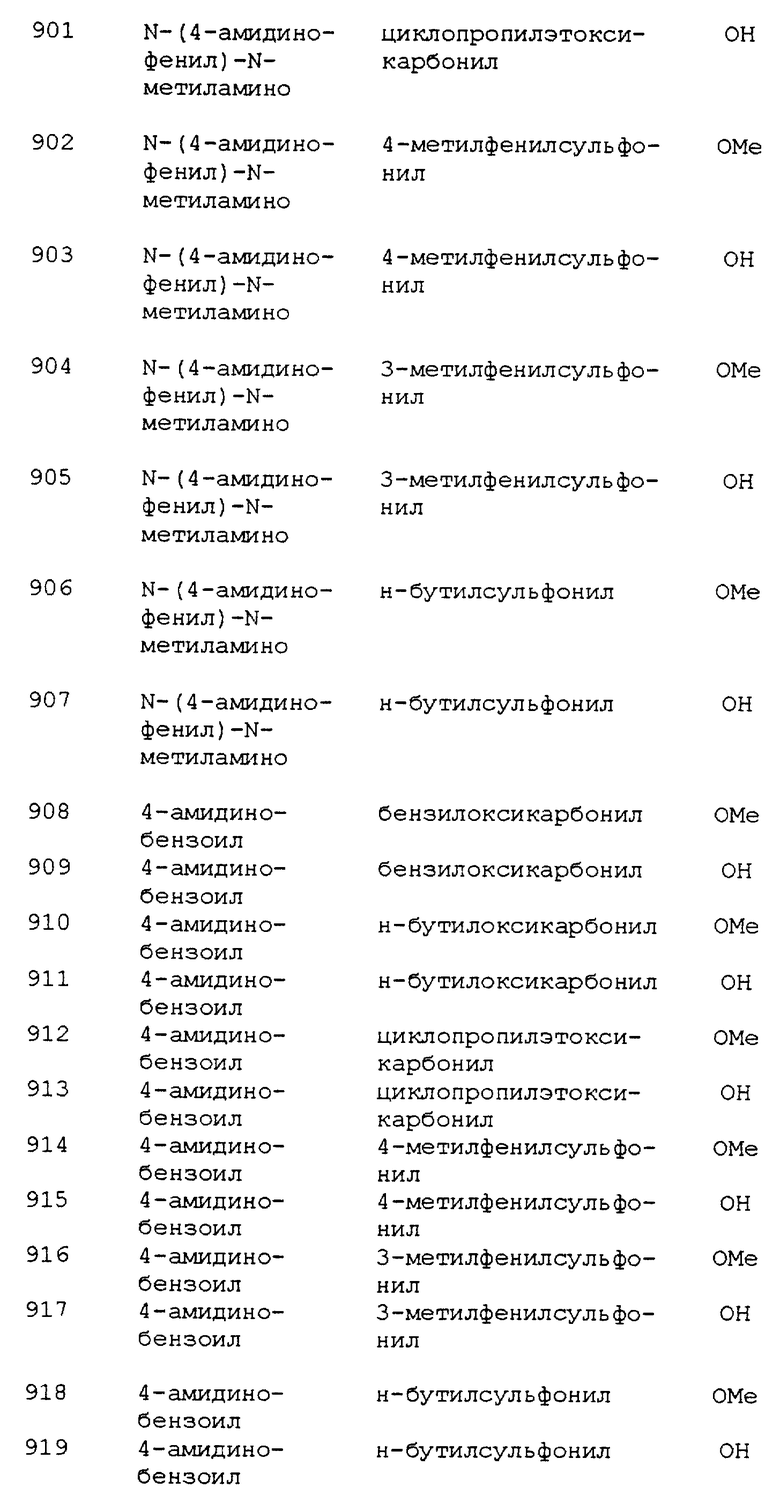
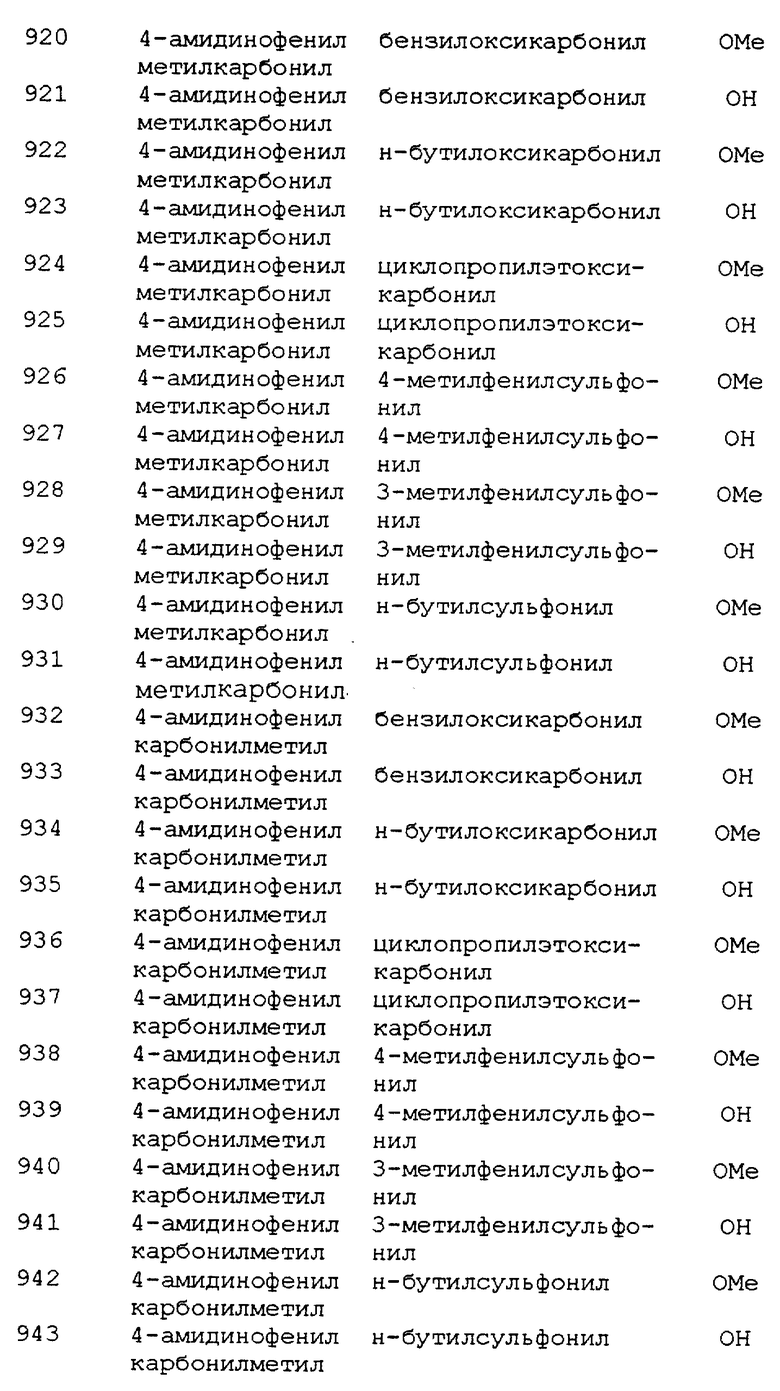

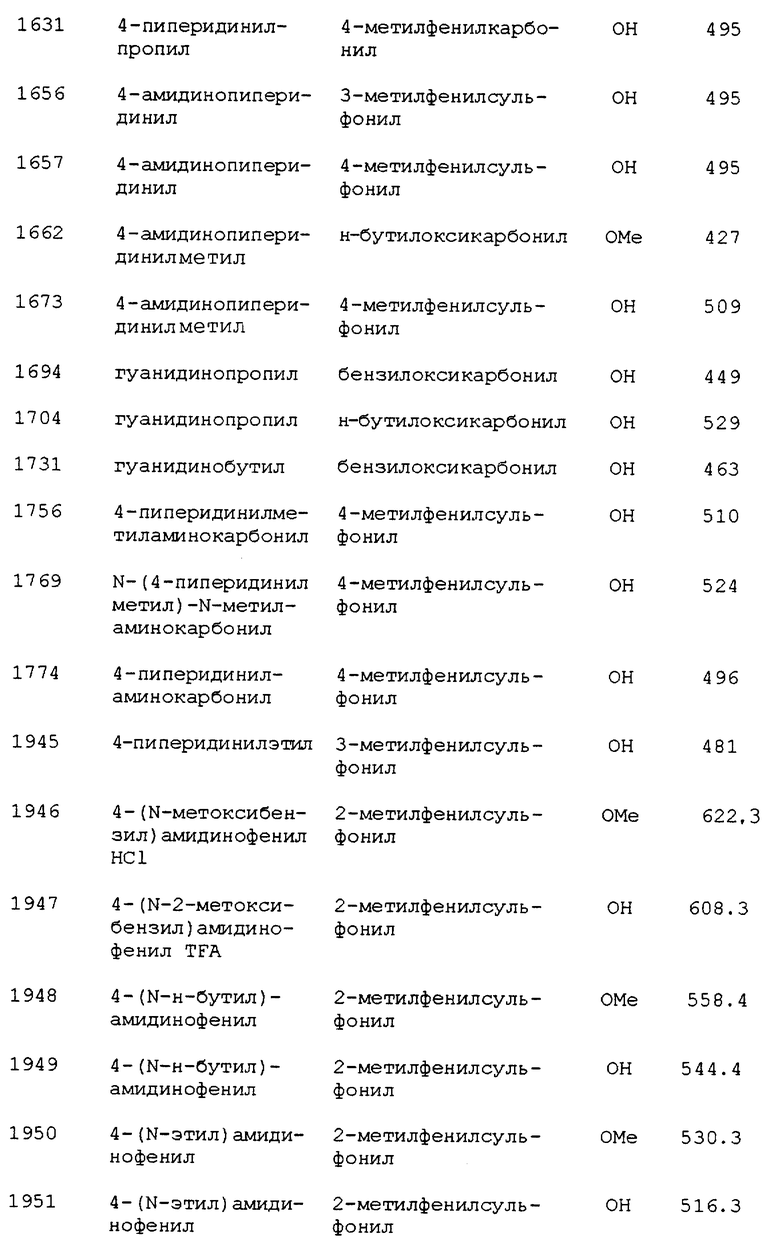


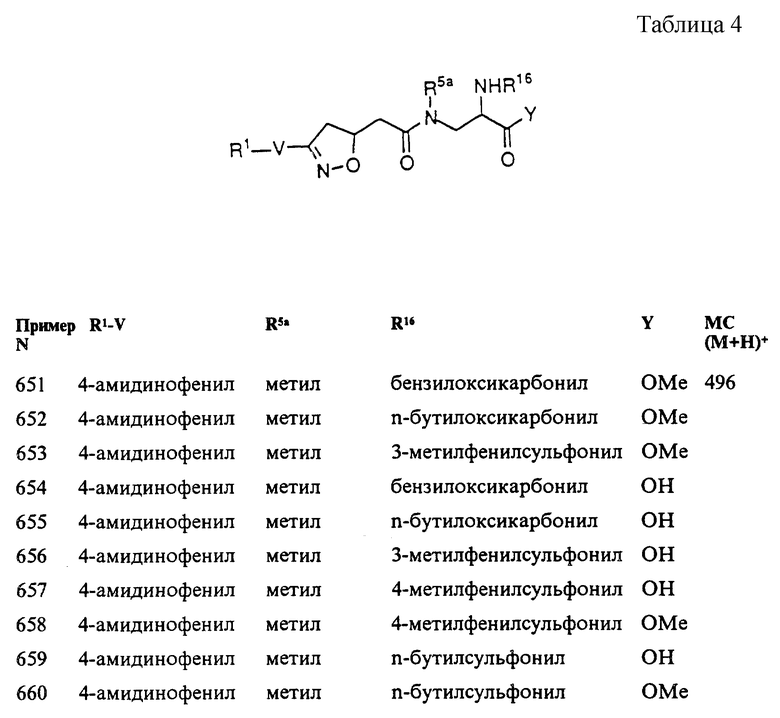
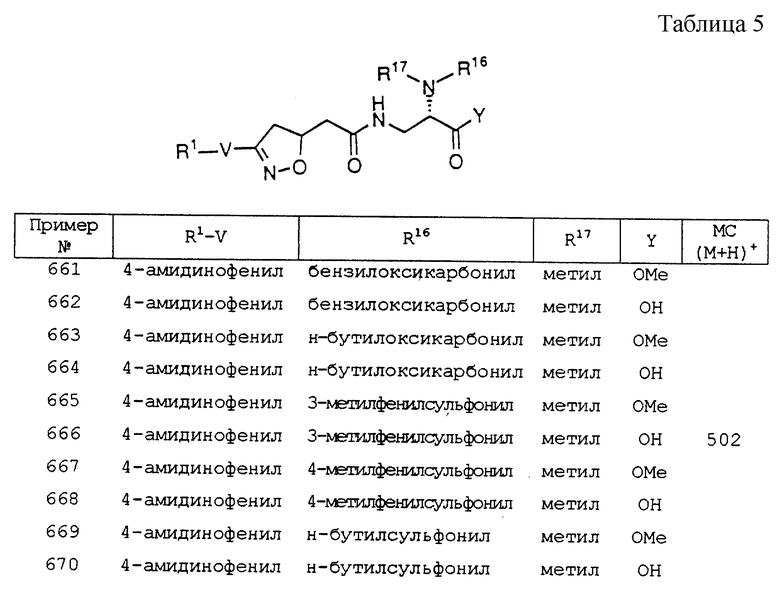
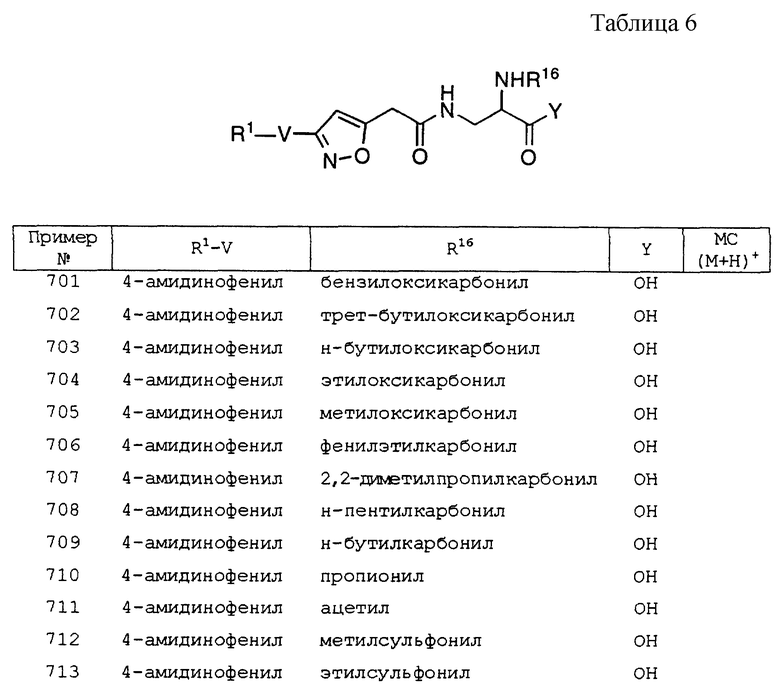



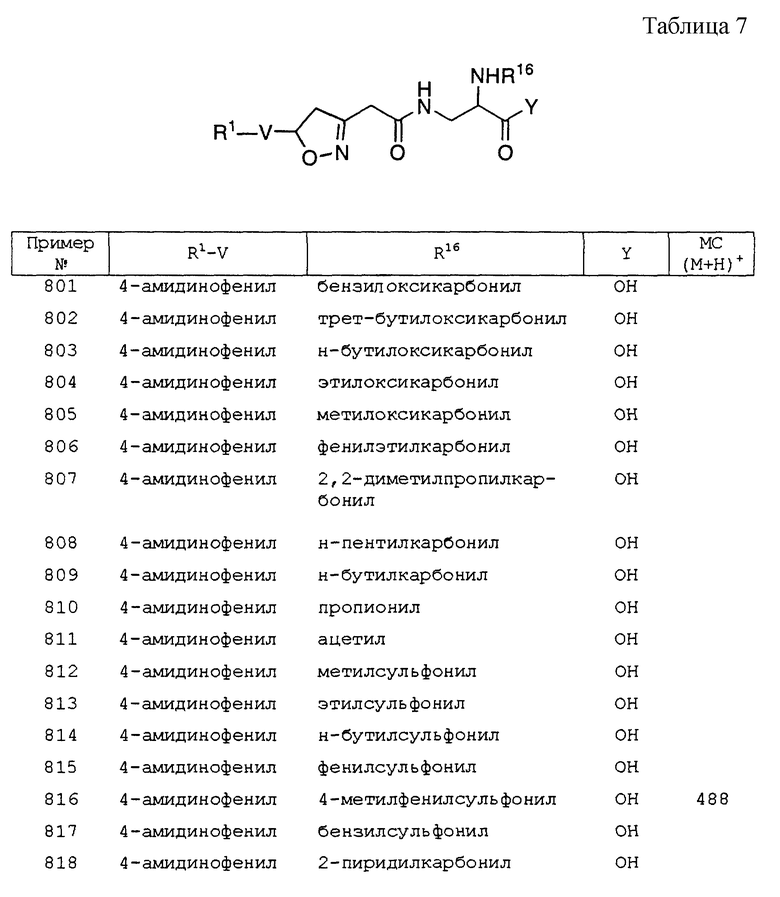



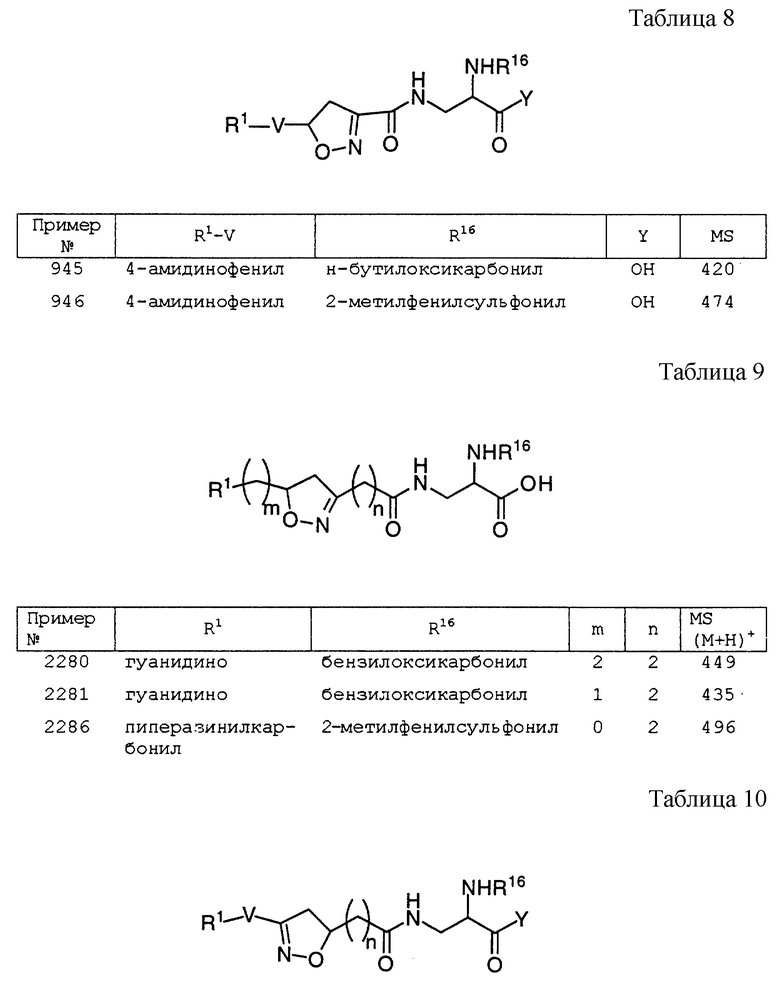




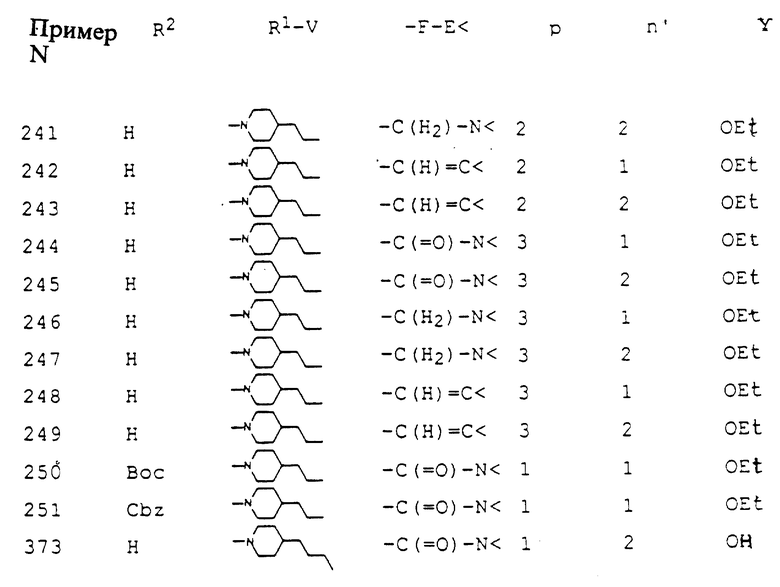
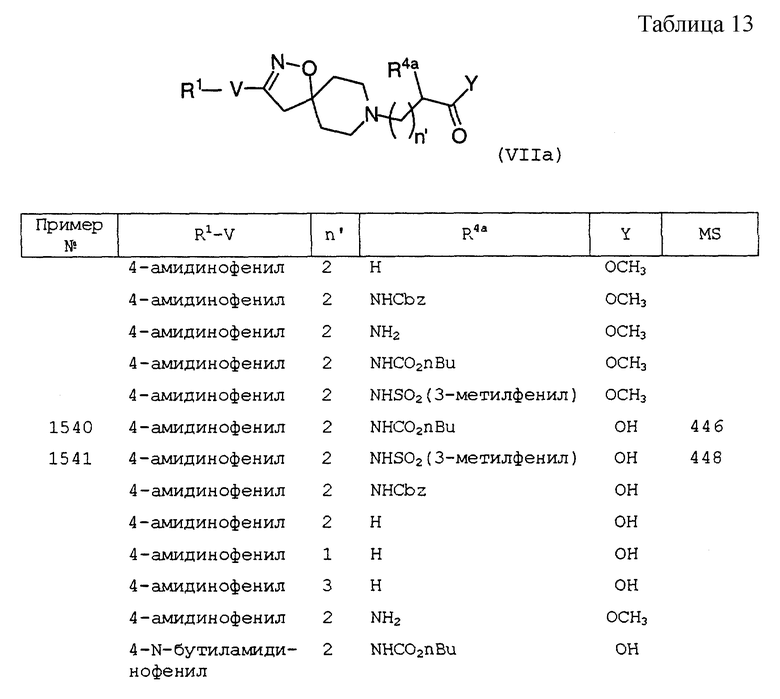

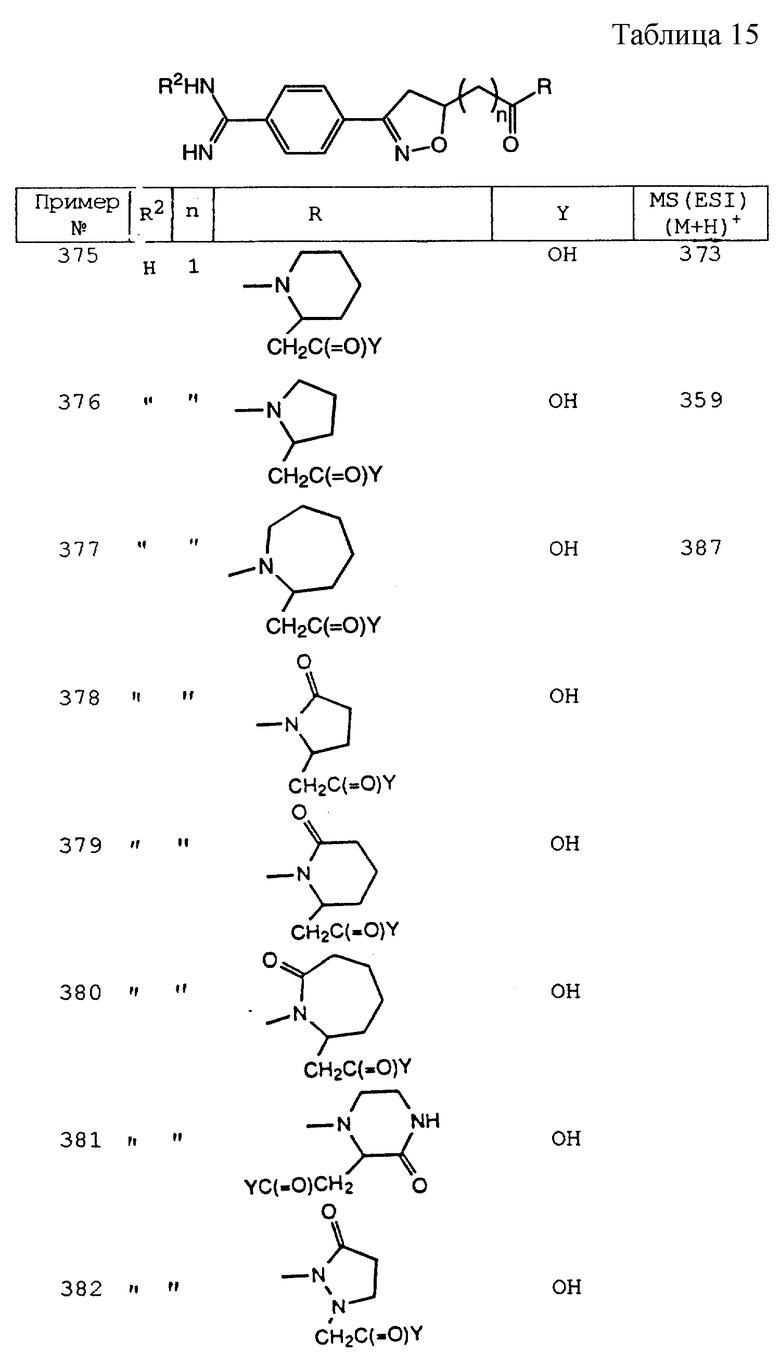
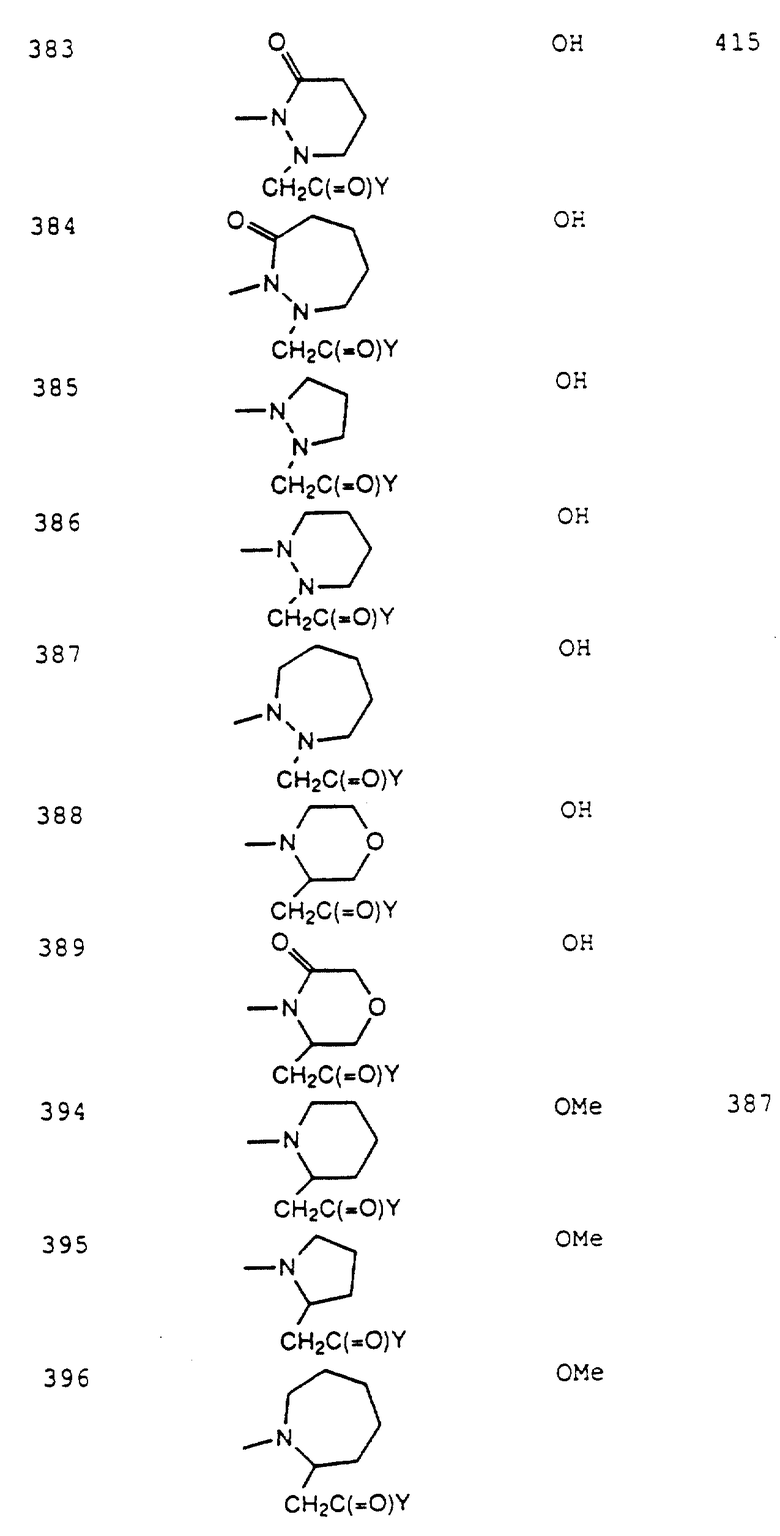
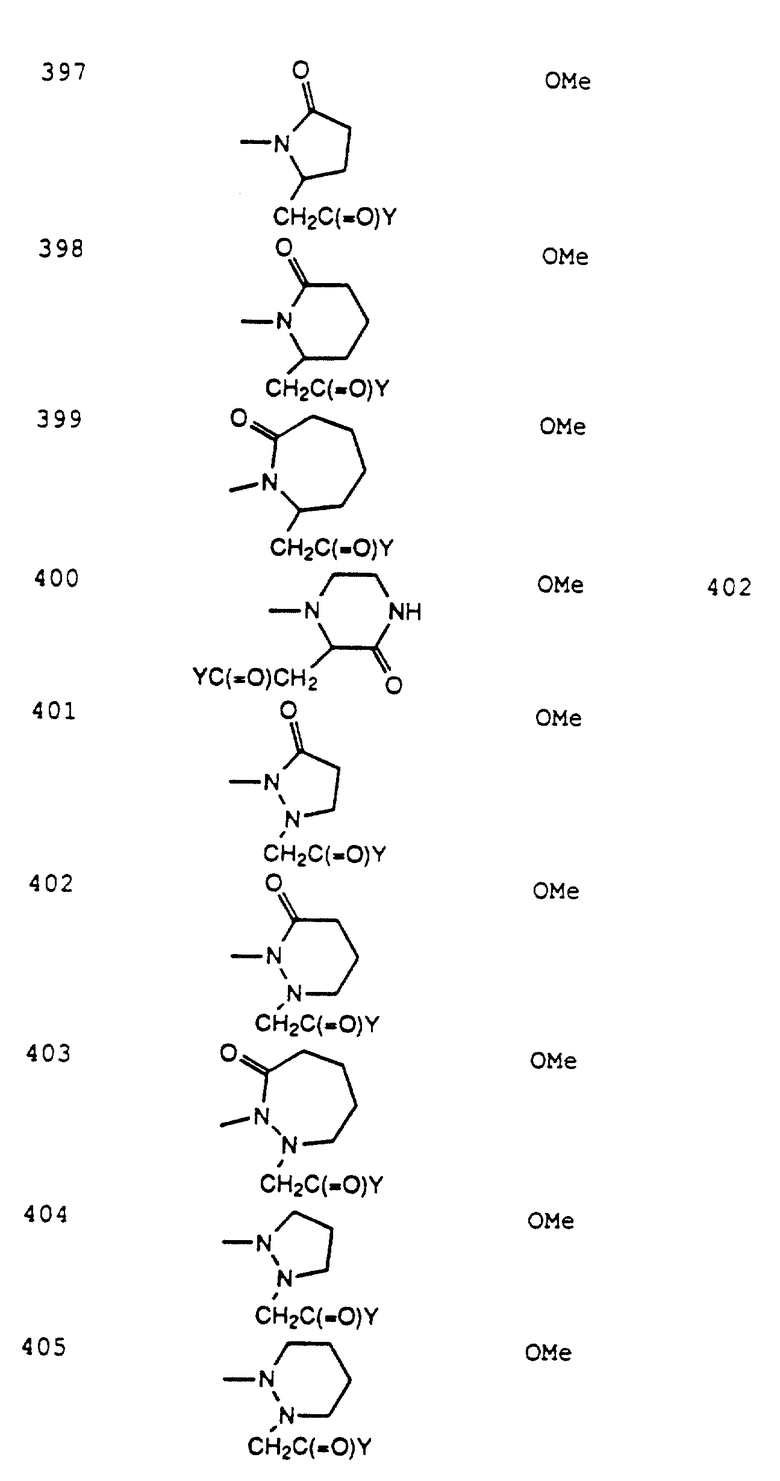
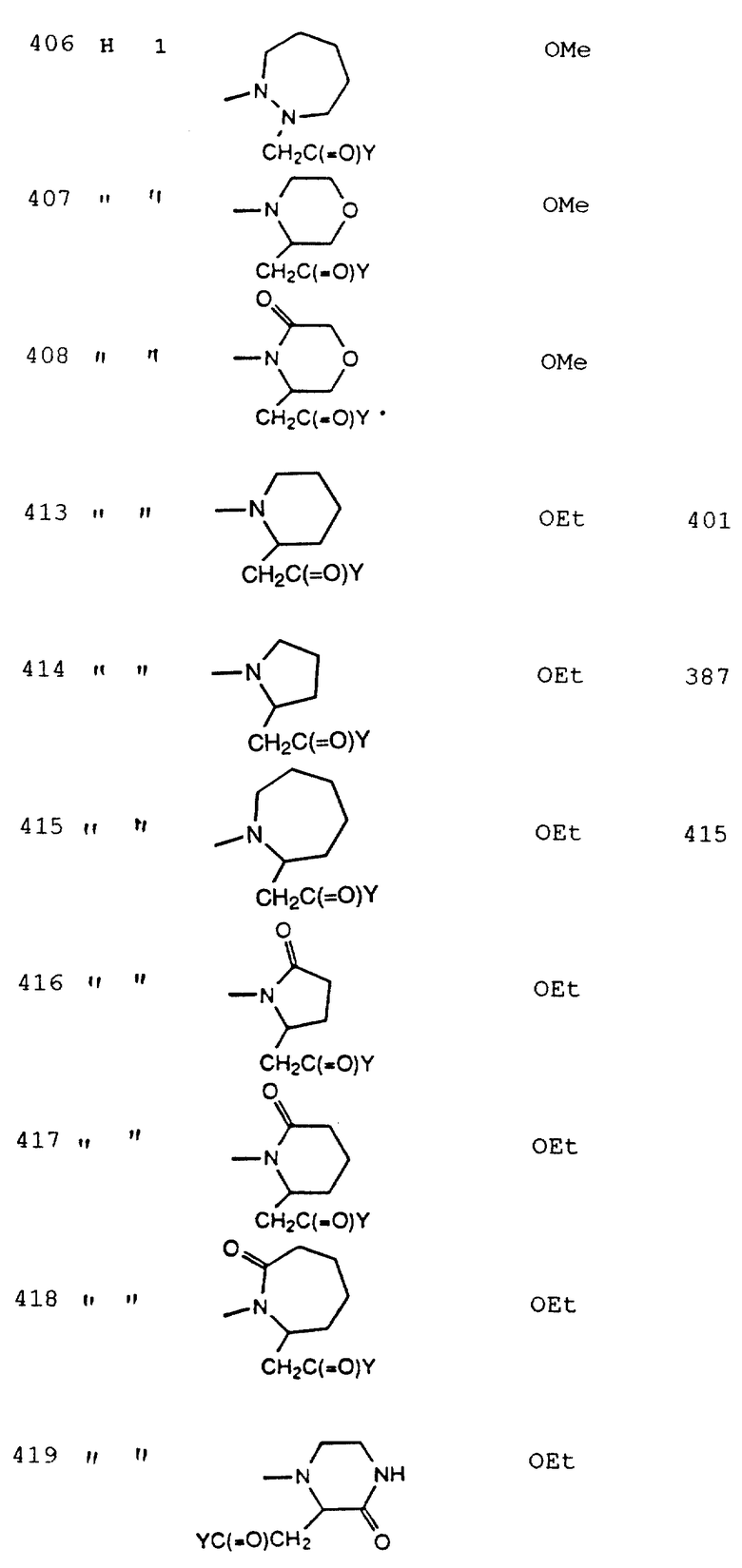
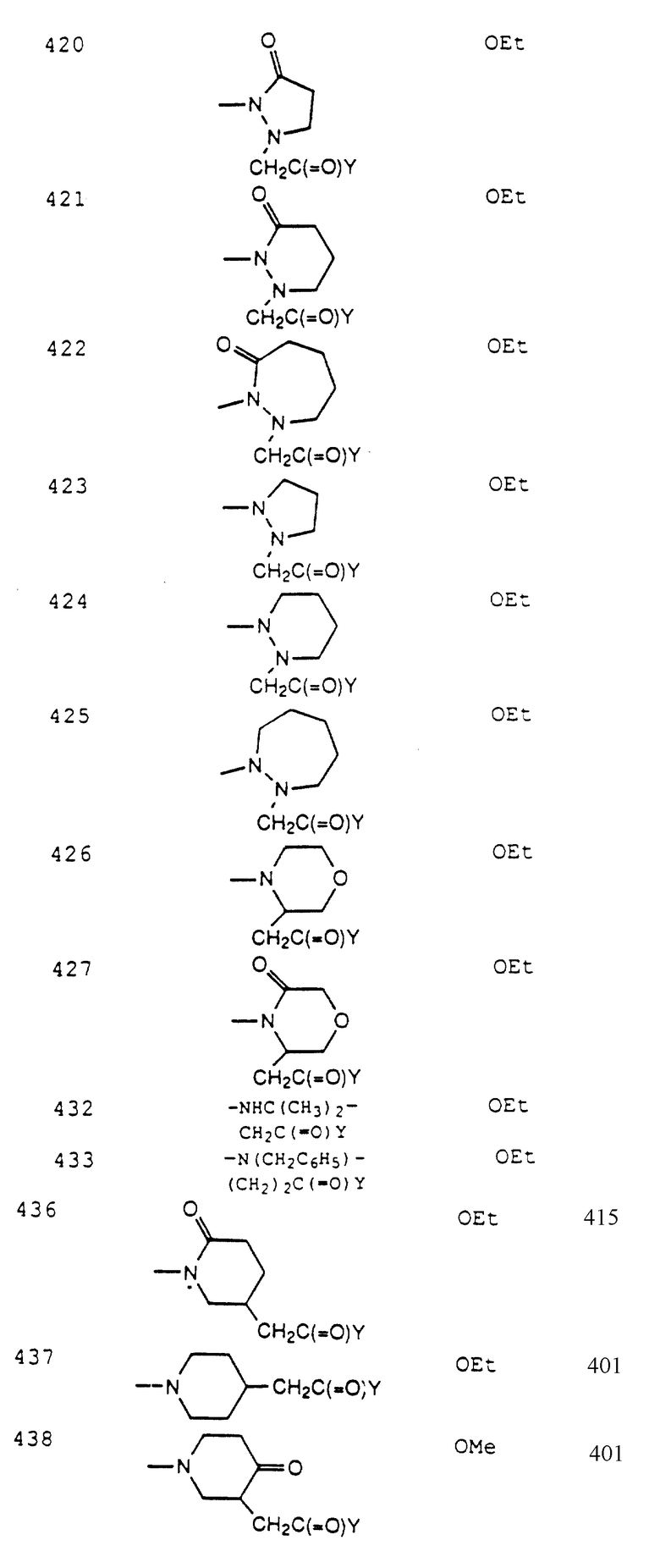
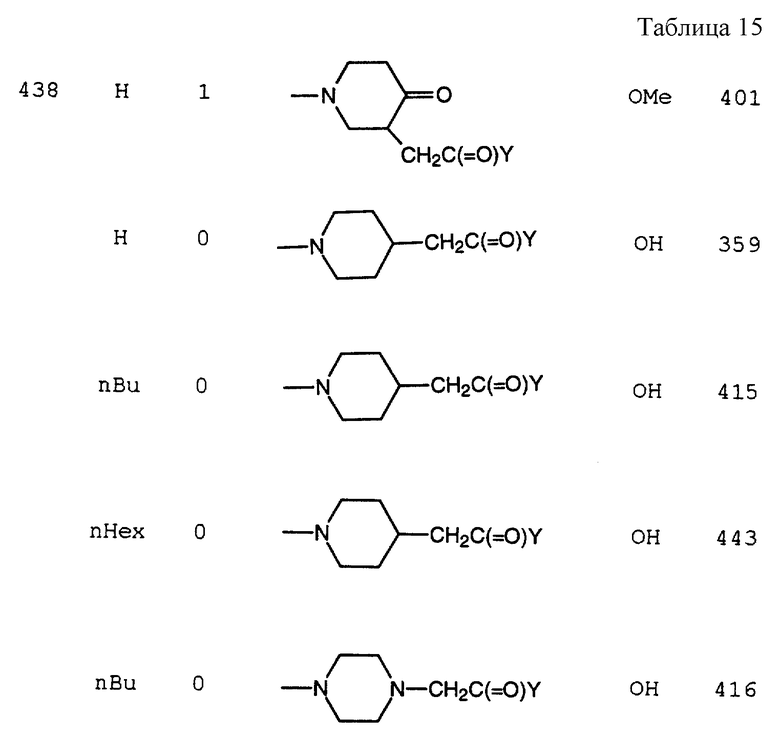






Изобретение касается новых изоксазолинов и изоксазолов формулы I, где R1, R14, R15, U, V, W, X, Y, b имеют значения, указанные в формуле изобретения, которые полезны в качестве антагонистов гликопротеинового рецептора фибриногена IIb/IIIa тромбоцитов, фармацевтических композиций, содержащих такие соединения, способа подавления агрегации тромбоцитов на основе этих соединений в качестве тромболитиков. 6 с. и 18 з.п.ф-лы, 16 табл.
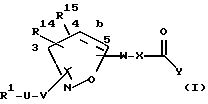
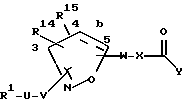
или их фармацевтически приемлемые соли,
где b - одинарная связь;
R1 представляет радикал формулы
Z обозначает O;
R2 выбирается из H и C2 - C10 алкоксикарбонила;
U представляет одинарную связь (т.е. U не присутствует);
V представляет фенил;
W представляет одинарную связь (т.е. W не присутствует)
X представляет -(C1 - C7 алкил)-, замещенный 0 - 3 группами R4;
Y выбирают из гидрокси или C1 - C10 алкокси;
R4 выбирают из H или -N(R12)R13;
R12 и R13 независимо являются H, C1 - C10 алкилкарбонилом, C1 - C10 алкилсульфонилом, фенил(C1 - C10 алкил)сульфонилом или фенил(C1 - C10 алкокси)карбонилом;
R14 выбирается из H или C1 - C10 алкоксикарбонила;
R15 представляет H;
n = 0 - 4;
r = 0 - 3.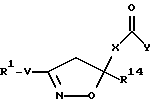
где R1 представляет радикал формулы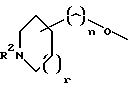
R2 выбирается из H и C2 - C10 алкоксикарбонила;
значения R14, X, V, Y, n и r указаны в п.1.
n = 1 или 2; X является (C1 - C2)-алкилом-, замещенным 0 - 2 R4; R4 является -NR12R13; R12 является H, C1 - C4 алкилкарбонилом, C1 - C4 алкилсульфонилом, фенил(C1 - C10)алкилсульфонилом или фенил(C1 - C10 алкокси)карбонилом; R13 является H.
5(R,S)-3-[[4-(2-пиперидин-4-ил)этоксифенил]изоксазолин-5-ил]уксусная кислота;
5(R, S)-N-(бутансульфонил)-L-{ 3-[4-(2-пиперидин-4-ил)этоксифенил] изоксазолин-5-ил}глицин;
5(R,S)-N-(α-толуолсульфонил)-L-{3-[4-(2-пиперидин-4-ил)этоксифенил]изоксазолин-5-ил}глицин;
5(R, S)-N-[(бензилокси)карбонил)-L-{ 3-[4-(2-пиперидин-4-ил)этоксифенил] изоксазолин-5-ил}глицин;
5(R, S)-N-(пентаноил)-L-{ 3-[4-(2-пиперидин-4-ил)этоксифенил] изоксазолин-5-ил}глицин;
5(R,S)-[4-(пиперидин-4-ил)метоксифенил]изоксазолин-5-ил}пропановая кислота;
2(R,S)-5(R,S)-N-(бутансульфонил)амино-{3-[4-(пиперидин-4-ил)метоксифенил]изоксазолин-5-ил}пропановая кислота;
2(R,S)-5(R,S)-N-(α-толуолсульфонил)амино{3-[4-(пиперидин-4-ил)метоксифенил]изоксазолин-5-ил}пропановая кислота;
2(R, S)-5(R, S)-N-[(бензилокси)карбонил] амино-{ 3-[4-(пиперидин-4-ил)метоксифенил]изоксазолин-5-ил}пропановая кислота;
2(R, S)-5(R, S)-N-(пентаноил)амино-{ 3-[4-(пиперидин-4-ил)метоксифенил] изоксазолин-5-ил}пропановая кислота;
5. Изоксазолины или изоксазолы формулы I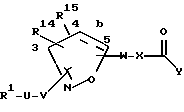
или его фармацевтически приемлемая соль,
где b - одинарная или двойная связь;
R1 представляет R2(R3)N(R2N=)C-, R2a(R3)N(CH2)qZ-, R2(R3)N(R2N=)CN(R2) или
Z выбирается из связи, O или S;
R2 и R3 независимо выбирается из H, C1 - C10 алкила, C3 - C11 циклоалкила, C7 - C11 арилалкила, C1 - C10 алкоксикарбонила или арил(C1 - C10алкокси)карбонила;
R2a выбирается из R2 или R2(R3)N(R2N=)C-;
U выбирается из одинарной связи и фенила;
V выбирается из одинарной связи; C1 - C7 алкила; фенила и (фенил)-Q, указанный фенил замещен 0 - 2 группами, независимо выбранными из R6 или R7; или -(пиридил)-Q;
Q выбирается из одинарной связи, -CH2-, -OCH2-;
W представляет -(C(R4)2)nC(=O)N(R5a)-;
X представляет -C(R4)(R8)-CHR4a-;
R4 представляет водород;
R4a представляет водород или -N(R16)R17;
Y выбирается из гидрокси или C1 - C10 алкилокси;
R8 выбирается из R6, C1 - C10 алкила, замещенного 0 - 3 R6, C2 - C10 алкинила, замещенного 0 - 3 R6, фенила или пиридила;
R6 выбирается из водорода, C1 - C10 алкила, галогена, -N(R12)R13, C1 - C10 алкокси, CO2R5, C(= O)R5a, CONR5R5a, NR5aSO2NR5R5a, NR5aSO2R5, SR5a, SiMe3, фенила, пирролидинила или пиридила;
R7 выбирается из H, C1 - C4 алкила, C1 - C10 алкокси и галогена;
R5 выбирается из H, C1 - C8 алкила, C3 - C11 циклоалкила, фенила, фенилэтила;
R5a выбирается из водорода, гидрокси, C1 - C8 алкила, фенила, фенилэтила, адамантилметила или C1 - C10 алкила, замещенного 0 - 2 R4b;
или же R5 и R5a, оба являясь заместителями на одном и том же атоме азота, могут объединяться с атомом азота, к которому они прикреплены, с образованием 3-азабициклононила, 1,2,3,4-тетрагидро-1-хинолинила, 1,2,3,4-тетрагидро-2-изохинолинила, 1-пирролидинила, тиаморфолинила, тиазолидинила или 1-пиперазинила, возможно замещенного фенилметилом;
R4b представляет метокси, NMe2, NH2 или COOH;
R12 и R13 независимо являются H, C1 - C10 алкилом или C1 - C10 алкилкарбонилом;
R14 выбирается из H или CO2R5, где R5 обозначает C1 - C8алкил;
R15 выбирается из H или OH;
R16 выбирается из -C(= O)-O-R18a, -C(= O)-R18b, -C(=O)-N(R18b)2, -SO2-R18a, -SO2-N(R18b)2;
R17 выбирается из H и C1 - C10 алкила;
R18a выбирается из: C1 - C8 алкила, замещенного 0 - 2 R19; C2 - C8 алкенила, замещенного 0 - 2 R19; C3 - C8 циклоалкила, замещенного 0 - 2 R19; арила, замещенного 0 - 4 R19; арил(C1 - C6 алкила), замещенного 0 - 4 R19; 5 - 10-членной гетероциклической системы, имеющей 1 - 3 гетероатома, выбранных независимо из O, S или N, указанного гетероциклического кольца, замещенного 0 - 4 R19;
R18b выбирается из R18a или H;
R19 выбирается из H, галогена, CF3, CN, NR12R13, C1 - C8 алкила, C3 - C11 циклоалкила, фенила, изоксалила, пиразолила, пиридинила, C1 - C6 алкокси или C1 - C4 алкоксикарбонила;
n = 0 - 4;
q = 1 - 7;
r = 0 - 3;
при условии, что n, q и r выбираются таким образом, что число атомов, связывающих R1 и Y находится в интервале 8 - 18.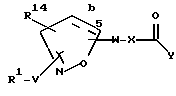
где b представляет собой одинарную связь;
R1 выбирается из R2(R3)N(R2N=)C-;
Z выбирается из связи, O или S;
R2 и R3 независимо выбираются из H или C1 - C10 алкоксикарбонила;
W представляет собой -(CH2)nC(=O)NH-;
X представляет собой C(R4)(R8)-CH2-;
Y является гидроксилом или C1 - C10 алкилокси;
R8 выбирается из R6; C1 - C10 алкила, замещенного 0 - 3 R6; C2 - C10 алкинила, замещенного 0 - 3 R6; фенила или пиридила;
R6 выбирается из C1 - C10 алкила, N(R12)R13, CO2R5, C(=O)R5a, CONR5R5a, NR5aSO2NR5R5a, NR5aSO2R5, SR5a, SiMe3, фенила, пирролидинила или пиридила;
R5 выбирается из H, C1 - C8 алкила, фенила или фенетила;
R5a выбирается из водорода, гидроксила, фенила, фенетила, адамантилметила или C1 - C10 алкила, замещенного 0 - 1 R4b;
или же R5 и R5a, когда они оба являются заместителями одного и того же атома азота (как в -NR5R5a), могут быть взяты вместе с атомом азота, к которому они присоединены, для образования 3-азабициклононила, 1,2,3,4-тетрагидро-1-хинолинила, 1,2,3,4-тетрагидро-2-изохинолинила, 1-пирролидинила, тиаморфолинила, тиазолидинила или 1-пиперазинила, необязательно замещенных фенилметилом;
R4b выбирается из метокси, NMe2, NH2, имидазола или COOH;
R12 и R13, каждый независимо, выбирается из H, C1 - C10 алкила, C1 - C10 алкилкарбонила.
3(R,S)-{5(R,S)-N-[3-(4-амидинофенил)изоксазолин-5-ил-ацетил]амино}-3-фенилпропановая кислота;
3(R,S)-{5(R,S)-N-[3-(4-амидинофенил)изоксазолин-5-ил-ацетил]амино}-пентановая кислота;
3(R,S)-{5(R,S)-N-[3-(4-амидинофенил)изоксазолин-5-ил-ацетил]амино}-гептановая кислота;
3(R, S)-{ 5(R,S)-N-[3-(4-амидинофенил)изоксазолин-5-ил-ацетил]амино}-4-(фенилтио)бутановая кислота;
3(R, S)-{ 5(R,S)-N-[3-(4-амидинофенил)изоксазолин-5-ил-ацетил]амино}-4-(фенилсульфонамидо)бутановая кислота;
3(R, S)-{ 5(R,S)-N-[3-(4-амидинофенил)изоксазолин-5-ил-ацетил]амино}-4-(н-бутилсульфонамидо)бутановая кислота;
3(S)-{ 5(R, S)-N-[3-(4-амидинофенил)изоксазолин-5-илацетил] амино} -3-(адамантилметиламинокарбонил)пропановая кислота;
3(S)-{5(R,S)-N-[3-(4-амидинофенил)изоксазолин-5-илацетил]амино}-3-(1-азабицикло[3.2.2]нонилкарбонил)пропановая кислота;
3(S)-{ 5(R, S)-N-[3-(4-амидинофенил)изоксазолин-5-илацетил] амино} -3-(фенетиламинокарбонил)пропановая кислота;
3(R)-{5(R,S)-N-[3-(4-амидинофенил)изоксазолин-5-илацетил]амино}-3-(3-пиридилэтил)пропановая кислота;
3(R)-{5(R,S)-N-[3-(4-амидинофенил)изоксазолин-5-илацетил]амино}-3-(2-пиридилэтил)пропановая кислота;
3(R)-{ 5(R, S)-N-[3-(4-амидинофенил)изоксазолин-5-илацетил] амино} -3-(фенилпропил)пропановая кислота.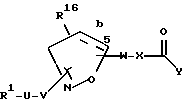
где b представляет собой одинарную или двойную связь;
R1 выбирается из R2(R3)N(R2N=)C-, R2(R3)N(R2N=)C(CH2)qZ-, R2(R3)N(R2N= )CN(R2)- или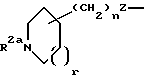
Z выбирается из связи или O;
R2 и R3, каждый независимо, выбираются из H, C1 - C10 алкила, C3 - C11 циклоалкила, C7 - C11 арилалкила, арил(C1 - C10 алкокси)карбонила или C1 - C10 алкоксикарбонила;
R2a представляет собой R2 или R2(R3)N(R2N=)C;
U представляет собой одинарную связь;
V выбирается из: одинарной связи, -C1 - C7 алкила-, -(фенил)-Q-, причем указанный фенил замещен 0 - 2 группами, независимо выбираемыми из R6 или R7, или (пиридил)-Q-;
Q выбирается из одинарной связи, -CH2-, -OCH2-;
W представляет собой (C(R4)2-C(=O)-N(R5a)-;
X представляет собой -C(R4)(R8)-CHR4a-;
R4 выбирается из H;
R4a представляет собой -N(R16)R17;
R5a выбирается из водорода или от C1 до C8 алкила;
Y выбирается из гидрокси, от C1 до C10 алкилокси;
R6 и R7 каждый независимо выбирается из H, галогена, метила или метоксила;
R12 или R13 каждый выбирается из H, C1 - C10 алкила или C1 - C10 алкилкарбонила;
R15 выбирается из H или OH;
R16 выбирается из: -C(=O)-O-R18a, -C(=O)-R18b, -C(=O)N(R18b)2, -SO2-R18a или -SO2-N(R18b)2;
R17 выбирается из H или метила;
R18a выбирается из: C1 - C8 алкила, замещенного 0 - 2 R19, C2 - C8 алкенила, замещенного 0 - 2 R19, C3 - C8 циклоалкила, фенила или нафтила, замещенных 0 - 4 R19, фенил(C1 - C6 алкил)-, замещенного 0 - 4 R19, системы гетероциклических колец, выбираемой из пиридинила, тиазолила, тиенила, пиразолила, имидазолила, хинолинила, изоксазолила, бензимидазолила, бензотиадиазолила и тиоимидазолила, причем указанное гетероциклическое кольцо замещается 0 - 4 R19;
R18b выбран из R18a или водорода;
R19 выбирается из H, галогена, CF3, CN, NR12R13, C1 - C8 алкила, C1 - C6 алкоксила, C3 - C11 циклоалкила, фенила, изоксалила, пиразолила, пиридинила или C1 - C4 алкоксикарбонила;
n = 0 - 4;
q = 1 - 7;
r = 0 - 3;
при условии, что n, q и r выбираются таким образом, чтобы число атомов в цепи между R1 и Y находилось в интервале 8 - 17.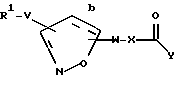
где R1 выбирается из R2NH(R2N=)C-, R2NH(R2N=)CNH или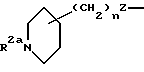
n = 0 - 1;
Z выбирается из связи, O;
V - это одинарная связь, -(фенил)- или -(пиридил)-;
R16 выбирается из -C(= O)-O-R18a, -C(= O)-R18b, -S(=O)2-R18a или -SO2-N(R18b)2.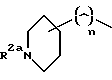
V является одинарной связью;
n = 1 или 2;
R18a выбирается из: C1 - C4 алкила, замещенного 0 - 2 R19, C2 - C4 алкенила, замещенного 0 - 2 R19, C3 - C7 циклоалкила, замещенного 0 - 2 R19, фенила или нафтила, замещенного 0 - 4 R19, фенил(C1 - C6 алкил)-, замещенного 0 - 4 R19, системы гетероциклических колец, выбранной из пиридинила, тиазолила, тиенила, пиразолила, имидазолила, хинолинила, бензимидазола, причем указанное гетероциклическое кольцо замещено 0 - 4 R19.
N3-[2-{ 3-(4-формамидинофенил)изоксазолин-5(R, S)-ил} ацетил] -N2-(фенилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)изоксазолин-5(R, S)-ил} ацетил] -N2-(4-метилфенилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)изоксазолин-5(R, S)-ил} ацетил] -N2-(бутансульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)изоксазолин-5(R, S)-ил} ацетил] -N2-(пропансульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)изоксазолин-5(R, S)-ил} ацетил] -N2-(этансульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)изоксазолин-5(R, S)-ил} ацетил] -N2-(метилоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)изоксазолин-5(R, S)-ил} ацетил] -N2-(этилоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)изоксазолин-5(R, S)-ил} ацетил]-N2-(1-пропилоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)изоксазолин-5(R, S)-ил} ацетил]-N2-(2-пропилоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)изоксазолин-5(R, S)-ил}ацетил]-N2-(н-бутилоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)изоксазолин-5(R)-ил} ацетил] -N2-(н-бутилоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)изоксазолин-5(S)-ил} ацетил] -N2-(н-бутилоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)изоксазолин-5(R)-ил} ацетил] -N2-(н-бутилоксикарбонил)-2,3-(R)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)изоксазолин-5(S)-ил} ацетил] -N2-(н-бутилоксикарбонил)-2,3-(R)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)изоксазолин-5(R, S)-ил}ацетил]-N2-(2-бутилоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)изоксазолин-5(R, S)-ил} ацетил]-N2-(1-(2-метил)пропилоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)изоксазолин-5(R, S)-ил} ацетил]-N2-(2-(2-метил)пропилоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)изоксазолин-5(R, S)-ил} ацетил] -N2-(бензилоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)изоксазолин-5(R)-ил}ацетил]-N2-(бензилоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)изоксазолин-5(S)-ил}ацетил]-N2-(бензилоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)изоксазолин-5(R,S)-ил}ацетил]-N2-(4-метилбензилоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)изоксазолин-5(R,S)-ил}ацетил]-N2-(4-метоксибензилоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)изоксазолин-5(R,S)-ил}ацетил]-N2-(4-хлорбензилоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)изоксазолин-5(R,S)-ил}ацетил]-N2-(4-бромбензилоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)изоксазолин-5(R,S)-ил}ацетил]-N2-(4-фторбензилоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)изоксазолин-5(R,S)-ил}ацетил]-N2-(4-феноксибензилоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)изоксазолин-5(R, S)-ил} ацетил] -N2-(2-(метилоксиэтил)оксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)изоксазолин-5(R,S)-ил}ацетил]-N2-(2-пиридинилкарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)изоксазолин-5(R,S)-ил}ацетил]-N2-(3-пиридинилкарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)изоксазолин-5(R,S)-ил}ацетил]-N2-(4-пиридинилкарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)изоксазолин-5(R,S)-ил}ацетил]-N2-(2-(2-пиридинил)ацетил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)изоксазолин-5(R,S)-ил}ацетил]-N2-(2-(3-пиридинил)ацетил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)изоксазолин-5(R,S)-ил}ацетил]-N2-(2-(4-пиридинил)ацетил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)изоксазолин-5(R,S)-ил}ацетил]-N2-(2-пиридил-метилоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)изоксазолин-5(R,S)-ил}ацетил]-N2-(3-пиридил-метилоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)изоксазолин-5(R, S)-ил}ацетил]-N2-(4-пиридил-метилоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)изоксазолин-5(R, S)-ил}ацетил]-N2-(4-бутилоксифенилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)изоксазолин-5(R, S)-ил} ацетил]-N2-(2-тиенилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)изоксазолин-5(R, S)-ил} ацетил] -N2-(3-метилфенилсульфонил)-2,3-(R,S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)изоксазолин-5(R, S)-ил} ацетил] -N2-(3-метилфенилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)изоксазолин-5(R, S)-ил} ацетил] -N2-(3-метилфенилсульфонил)-2,3-(R)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)изоксазолин-5(R)-ил} ацетил] -N2-(3-метилфенилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)изоксазолин-5(S)-ил} ацетил] -N2-(3-метилфенилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)изоксазолин-5(S)-ил} ацетил] -N2-(3-метилфенилсульфонил)-2,3-(R)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)изоксазолин-5(R)-ил} ацетил] -N2-(3-метилфенилсульфонил)-2,3-(R)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)изоксазолин-5(R,S)-ил}ацетил]-N2-(4-иодфенилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)изоксазолин-5(R,S)-ил}ацетил]-N2-(3-трифторметилфенилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)изоксазолин-5(R,S)-ил}ацетил]-N2-(3-хлорфенилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)изоксазолин-5(R,S)-ил}ацетил]-N2-(3-2-метоксикарбонилфенилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)изоксазолин-5(R, S)-ил}ацетил]-N2-(2,4,6-триметилфенилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)изоксазолин-5(R,S)-ил}ацетил]-N2-(2-хлорфенилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)изоксазолин-5(R,S)-ил}ацетил]-N2-(4-трифторметилфенилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)изоксазолин-5(R,S)-ил}ацетил]-N2-(2-трифторметилфенилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)изоксазолин-5(R,S)-ил}ацетил]-N2-(2-фторфенилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)изоксазолин-5(R,S)-ил}ацетил]-N2-(4-фторфенилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)изоксазолин-5(R,S)-ил}ацетил]-N2-(4-метоксифенилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)изоксазолин-5(R, S)-ил} ацетил] -N2-(2,3,5,6-тетраметилфенилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)изоксазолин-5(R,S)-ил}ацетил]-N2-(4-цианофенилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)изоксазолин-5(R,S)-ил}ацетил]-N2-(4-хлорфенилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)изоксазолин-5(R,S)-ил}ацетил]-N2-(4-пропилфенилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)изоксазолин-5(R,S)-ил}ацетил]-N2-(2-фенилэтилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)изоксазолин-5(R,S)-ил}ацетил]-N2-(4-изопропилфенилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)изоксазолин-5(R, S)-ил} ацетил] -N2-(3-фенилпропилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)изоксазолин-5(R, S)-ил}ацетил]-N2-(3-пиридилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)изоксазолин-5(R, S)-ил} ацетил] -N2-(фениламиносульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)изоксазолин-5(R, S)-ил} ацетил] -N2-(бензиламиносульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)изоксазолин-5(R, S)-ил} ацетил] -N2-(диметиламиносульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(2-фтор-4-формамидинофенил)изоксазолин-5(R, S)-ил}ацетил]-N2-(3-метилфенилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(2-формамидино-5-пиридинил)изоксазолин-5(R, S)-ил}ацетил]-N2-(н-бутилоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(2-формамидино-5-пиридинил)изоксазолин-5(R, S)-ил}ацетил]-N2-(3-метилфенилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(3-формамидино-6-пиридинил)изоксазолин-5(R, S)-ил}ацетил]-N2-(н-бутилоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(3-формамидино-6-пиридинил)изоксазолин-5(R, S)-ил}ацетил]-N2-(3-метилфенилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)изоксазолин-5(R, S)-ил} ацетил] -N2-(фениламинокарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)изоксазолин-5(R, S)-ил}ацетил]-N2-(4-фторфениламинокарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)изоксазолин-5(R, S)-ил} ацетил]-N2-(1-нафтиламинокарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)изоксазолин-5(R, S)-ил} ацетил] -N2-(бензиламинокарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)изоксазолин-5(R,S)-ил}ацетил]-N2-(3-бром-2-тиенилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)изоксазолин-5(R, S)-ил} ацетил] -N2-(3-метил-2-бензотиенилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)изоксазолин-5(R, S)-ил} ацетил] -N2-(изобутилоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)изоксазолин-5(R)-ил}ацетил]-N2-(изобутилоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)изоксазолин-5(S)-ил}ацетил]-N2-(изобутилоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)изоксазолин-5(R,S)-ил}ацетил]-N2-(2-циклопропилэтоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)изоксазолин-5(R)-ил} ацетил]-N2-(2-циклопропилэтоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)изоксазолин-5(S)-ил} ацетил]-N2-(2-циклопропилэтоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-гуанидинофенил)изоксазолин-5(R, S)-ил} ацетил] -N2-(н-бутилоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-гуанидинофенил)изоксазолин-5(R)-ил} ацетил] -N2-(н-бутилоксикарбонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 3-(4-гуанидинофенил)изоксазолин-5(R)-ил} ацетил] -N2-(3-метилфенилсульфонил)-2,3-(S)-диаминопропановая кислота;
N3-[2-{ 5-(4-формамидинофенил)изоксазолин-5(R, S)-ил}ацетил]-N2-(н-бутилоксикарбонил)-2,3-(S)-диаминопропановая кислота.
N3-[2-{3-(4-формамидинофенил)изоксазолин-5-ил}ацетил]-N2-(фенилсульфонил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)изоксазолин-5-ил} ацетил] -N2-(4-метилфенилсульфонил)-2,3-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)-изоксазолин-5-ил}-ацетил]-N2-(бутансульфонил)-2,3-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)-изоксазолин-5-ил}-ацетил]-N2-(пропансульфонил)-2,3-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)-изоксазолин-5-ил}-ацетил]-N2-(этансульфонил)-2,3-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)-изоксазолин-5-ил}-ацетил]-N2-(метилоксикарбонил)-2,3-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)-изоксазолин-5-ил}-ацетил]-N2-(этилоксикарбонил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5-ил} -ацетил] -N2-(1-пропилоксикарбонил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5-ил} -ацетил] -N2-(2-пропилоксикарбонил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5-ил} -ацетил]-N2-(n-бутилоксикарбонил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5-ил} -ацетил] -N2-(1-(2-метил)-пропилоксикарбонил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5-ил} -ацетил] -N2-(2-(2-метил)пропилоксикарбонил)-2,3-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)-изоксазолин-5-ил}-ацетил]-N2-(бензилоксикарбонил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5-ил} -ацетил] -N2-(4-метилбензилоксикарбонил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5-ил} -ацетил]-N2-(4-метоксибензилоксикарбонил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5-ил} -ацетил]-N2-(4-хлорбензилоксикарбонил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5-ил} -ацетил]-N2-(4-бромбензилоксикарбонил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5-ил} -ацетил]-N2-(4-фторбензилоксикарбонил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5-ил} -ацетил]-N2-(4-феноксибензилоксикарбонил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5-ил} -ацетил] -N2-(2-(метилоксиэтил)-оксикарбонил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5-ил} -ацетил] -N2-(2-пиридинилкарбонил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5-ил} -ацетил] -N2-(3-пиридинилкарбонил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5-ил} -ацетил] -N2-(4-пиридинилкарбонил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5-ил} -ацетил]-N2-(2-(2-пиридинил)-ацетил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5-ил} -ацетил]-N2-(2-(3-пиридинил)-ацетил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5-ил} -ацетил]-N2-(2-(4-пиридинил)-ацетил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5-ил} -ацетил]-N2-(2-пиридилметилоксикарбонил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5-ил} -ацетил]-N2-(3-пиридилметилоксикарбонил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5-ил} -ацетил]-N2-(4-пиридилметилоксикарбонил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5-ил} -ацетил]-N2-(4-бутилоксифенилсульфонил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5-ил} -ацетил] -N2-(2-тиенилсульфонил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5-ил} -ацетил]-N2-(3-метилфенилсульфонил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5-ил} -ацетил] -N2-(4-йодфенилсульфонил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5-ил} -ацетил]-N2-(3-трифторметилфенилсульфонил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5-ил} -ацетил] -N2-(3-хлорфенилсульфонил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5-ил} -ацетил]-N2-(3-2-метоксикарбонилфенилсульфонил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5-ил} -ацетил]-N2-(2,4,6-триметилфенилсульфонил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5-ил} -ацетил] -N2-(2-хлорфенилсульфонил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5-ил} -ацетил]-N2-(4-трифторметилфенилсульфонил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5-ил} -ацетил]-N2-(2-трифторметилфенилсульфонил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5-ил} -ацетил] -N2-(2-фторфенилсульфонил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5-ил} -ацетил] -N2-(4-фторфенилсульфонил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5-ил} -ацетил]-N2-(4-метоксифенилсульфонил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5-ил} -ацетил] -N2-(2,3,5,6-тетраметилфенилсульфонил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5-ил} -ацетил]-N2-(4-цианофенилсульфонил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5-ил} -ацетил] -N2-(4-хлорфенилсульфонил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5-ил} -ацетил] -N2-(4-пропилфенилсульфонил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5-ил} -ацетил] -N2-(2-фенилэтилсульфонил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5-ил} -ацетил] -N2-(4-изопропилфенилсульфонил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5-ил} -ацетил] -N2-(3-фенилпропилсульфонил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5-ил} -ацетил]-N2-(3-пиридилсульфонил)-2,3-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)-изоксазолин-5-ил}-ацетил]-N2-(фениламиносульфонил)-2,3-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)-изоксазолин-5-ил}-ацетил]-N2-(бензиламиносульфонил)-2,3-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)-изоксазолин-5-ил}-ацетил]-N2-(диметиламиносульфонил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(2-формамидинофенил)-изоксазолин-5-ил} -ацетил]-N2-(3-метилфенилсульфонил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(2-формамидино-5-пиридинил)-изоксазолин-5-ил} -ацетил]-N2-(n-бутилоксикарбонил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(2-формамидино-5-пиридинил)-изоксазолин-5-ил} -ацетил] -N2-(метилфенилсульфонил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(3-формамидино-6-пиридинил)-изоксазолин-5-ил} -ацетил]-N2-(n-бутилоксикарбонил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(3-формамидино-6-пиридинил)-изоксазолин-5-ил} -ацетил]-N2-(3-метилфенилсульфонил)-2,3-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)-изоксазолин-5-ил}-ацетил]-N2-(фениламинокарбонил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5-ил} -ацетил] -N2-(4-фторфениламинокарбонил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5-ил} -ацетил]-N2-(1-нафтиламинокарбонил)-2,3-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)-изоксазолин-5-ил}-ацетил]-N2-(бензиламинокарбонил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5-ил} -ацетил]-N2-(3-бром-2-тиенилсульфонил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5-ил}-ацетил]-N2-(3-метил-2-бензотиенилсульфонил)-2,3-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)-изоксазолин-5-ил}-ацетил]-N2-(изобутилоксикарбонил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5-ил} -ацетил] -N2-(2-циклопропилэтоксикарбонил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(4-гуанидинофенил)-изоксазолин-5-ил} -ацетил] -N2-(3-метилфенилсульфонил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(4-гуанидинофенил)-изоксазолин-5-ил} -ацетил]-N2-(n-бутилоксикарбонил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5-ил} -ацетил]-N2-(n-бутилоксикарбонил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5-ил} -ацетил] -N2-(2-бромфенилсульфонил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5-ил} -ацетил]-N2-(2-метилфенилсульфонил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(3-формамидино-6-пиридинил)-изоксазолин-5-ил} -ацетил]-N2-(3-метилфенилсульфонил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(2-формамидино-5-пиридинил)-изоксазолин-5-ил} -ацетил]-N2-(3-метилфенилсульфонил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(2-фтор-4-формамидинофенил)-изоксазолин-5-ил} -ацетил]-N2-(3-метилфенилсульфонил)-2,3-диаминопропановая кислота;
N3-[2-{ 3-(4-формамидинофенил)-изоксазолин-5-ил} -ацетил] -N2-(3-бромфенилсульфонил)-2,3-диаминопропановая кислота;
N3-[2-{3-(4-формамидинофенил)-изоксазолин-5-ил}-ацетил]-N2-(4-бромфенилсульфонил)-2,3-диаминопропановая кислота;
указанные энантио- и диастереомеры, выбранные из: (R,S), (R,S); (R), (R, S); (S), (R,S); (R), (R); (S), (R); (R), (S); (S), (S).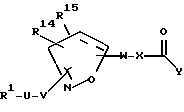
и его фармацевтически приемлемая соль,
где R1 представляет собой R2(R3)N(R2N=)C- или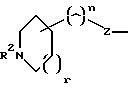
R3 представляет H или C1 - C10 алкил;
Z представляет собой одинарную связь;
R2 является H или C1 - C10 алкилом;
U представляет собой одинарную связь;
V представляет собой одинарную связь или фенил;
Y представляет собой гидрокси или от C1 до C10 алкокси;
R14 и W присоединены к одному и тому же углеродному атому и, взятые вместе, образуют спироконденсированное кольцо формулы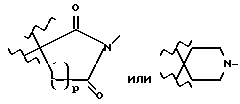
R15 представляет Н;
p = 1 или 2;
n = 0-4.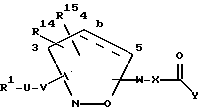
или его фармацевтически приемлемая соль,
где b - это одинарная связь;
R1 представляет R2(R3)N(R2N=)C-;
R2 и R3 независимо выбирается из Н или C1-C10 алкила;
U представляет собой одинарную связь;
V является фениленом;
X представляет собой -(С(R4)2)n-C(R4) (R4а)-;
R4 является водородом;
R4а является водородом;
W выбирается из: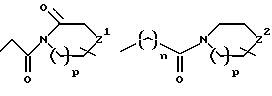
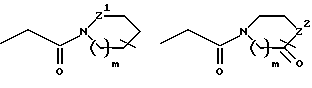
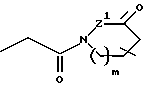
Y представляет собой гидрокси или от C1 до C10 алкокси;
Z1 является -С- или -NR22-;
Z2 является -NR22-; R14 и R15 - Н;
R22 представляет водород или связь с Х;
m = 0-2;
p = 1-2;
n = 0-2.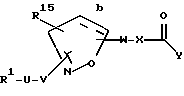
где R2 и R3 водород;
Х - это CHR4a, где R4a представляет водород.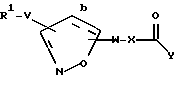
где R1 представляет R2NH(R2N=)C-;
R2 - это Н или C1-C5 алкил;
V - -(фенил)-;
X представляет -CH2-;
Y выбирается из гидрокси, C1-C10 алкокси.
m = 0-2;
Y выбирается из гидрокси, C1-C10 алкокси;
R22 - H.
2-(R, S)-2-карбоксиметил-1-(5-(R,S)-N-[3-(4-амидинофенил)изоксазолин-5-илацетил]пиперидин;
2-(R, S)-2-карбоксиметил-1-(5-(R,S)-N-[3-(4-амидинофенил)изоксазолин-5-илацетил]азепин;
2-(R, S)-2-карбоксиметил-1-(5-(R,S)-N-[3-(4-амидинофенил)изоксазолин-5-илацетил]пирролидин;
3-(R, S)-карбоксиметил-1-(5-(R, S)-N-[3-(4-амидинофенил)изоксазолин-5-илацетил]пиперазин-2-он;
6-(R, S)-карбоксиметил-1-(5-(R, S)-N-[3-(4-амидинофенил)изоксазолин-5-илацетил]пиперидин-2-он;
5-(R, S)-карбоксиметил-1-(5-(R, S)-N-[3-(4-амидинофенил)изоксазолин-5-илацетил]пирролидин-2-он;
7-(R, S)-карбоксиметил-1-(5-(R, S)-N-[3-(4-амидинофенил)изоксазолин-5-илацетил]азетидин-2-он;
2-(R, S)-карбоксиметил-1-(5-(R, S)-N-[3-(4-амидинофенил)изоксазолин-5-илацетил]пиразолидин;
3-(R, S)-карбоксиметил-4-(5-(R, S)-N-[3-(4-амидинофенил)изоксазолин-5-илацетил]морфолин.
Приоритет по пунктам и признакам:
24.11.93 по пп.1 - 24, где b представляет одинарную связь;
22.04.94 по пп.6, 10 - 13, 18 - 22, где b одинарная связь;
10.11.94 по пп.1 - 24, где b является двойной связью.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Способ получения 3-арил-5-алкил(арил) азо- @ -изоксазолинов | 1981 |
|
SU973533A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Способ получения производных гуанидина или их таутомеров или их солей | 1980 |
|
SU1003752A3 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Переставитель стеклоизделий | 1974 |
|
SU525629A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Устройство для моделирования стартстопной системы поэлементной синхронизации | 1973 |
|
SU478328A1 |
Авторы
Даты
2000-05-27—Публикация
1994-11-14—Подача