Изобретение относится к последовательностям нуклеиновых кислот, которые кодируют полипептид с активностью нитрилазы, к конструктам нуклеиновых кислот, содержащим последовательности нуклеиновых кислот, а также к векторам, содержащим последовательности нуклеиновых кислот или конструкты нуклеиновых кислот. Далее изобретение относится к последовательностям аминокислот, которые кодируются последовательностями нуклеиновых кислот, и к микроорганизмам, содержащим последовательности нуклеиновых кислот, или к конструктам нуклеиновых кислот или векторам, содержащим последовательности нуклеиновых кислот или конструкты нуклеиновых кислот.
Кроме того, изобретение относится к ферментативному способу получения карбоновых кислот из соответствующих нитрилов.
Алифатические, ароматические и гетероароматические карбоновые кислоты представляют собой важные соединения для органической химии синтеза. Они являются исходными продуктами для множества фармацевтических активных веществ или активных веществ для средств защиты растений.
Из литературы известен целый ряд различных ферментативных процессов синтеза для получения ахиральных или хиральных карбоновых кислот. Так например, ферментативным способом получают оптически активные аминокислоты. Недостатком при этом является то, что для каждой аминокислоты нужно разрабатывать свой способ. Чтобы можно было получать по возможности широкий спектр различных соединений, применяют химические или ферментативные способы. При химических способах недостатком является то, что стереоцентры должны быть построены, как правило, многостадийным, широко не применяемым, сложным синтезом.
Ферментативный синтез хиральных карбоновых кислот описан в целом ряде патентных заявок и патентов. Международная заявка WO 92/05275 описывает синтез энантиомерных α-гидрокси-α-алкил- или α-алкилкарбоновых кислот в присутствии оптически активного биологического материала. Другие синтезы оптически активных α-замещенных кислот микроорганизмами описываются в ЕР-В-0348901, ЕР-В-0332379, ЕР-А-0348901 или его эквиваленте, US 5283193, ЕР-А-0449648, ЕР-В-0473328, ЕР-В-0527553 или его эквиваленте, US 5296373, ЕР-А-0610048, ЕР-А-0610049, ЕР-А-0666320 или WO 97/32030.
Биотехнологические синтезы ахиральных карбоновых кислот микроорганизмами описываются, например, в ЕР-А-0187680, ЕР-А-0229042, WO 89/00193, JP 08173152, JP 06153968, FR 2694571, ЕР-А-0502476, ЕР-А-0444640 или ЕР-А-0319344.
Недостаток этих процессов состоит в том, что они часто приводят к продуктам с низкой оптической чистотой и/или что проходят с малым выходом по времени и пространству. Это приводит к экономически неинтересным процессам. Кроме того, недостатком является то, что ферменты, которые имеются в применяемых для синтеза ахиральных или хиральных карбоновых кислот микроорганизмах, как правило, имеют только органиченный спектр субстратов, т.е. микроорганизмами превращаются только определенные алифатические, ароматические или гетероароматические нитрилы. Особенно ароматические и гетероароматические нитрилы, как, например, цианотиофены или бензонитрилы, преобразуются микроорганизмами или плохо, или вообще не преобразуются в соответствующие карбоновые кислоты.
Задачей изобретения поэтому является разработка ферментативных способов получения ахиральных и/или хиральных карбоновых кислот, которые не имеют вышеприведенных недостатков и особенно доступны для получения ахиральных или хиральных карбоновых кислот из соответствующих нитрилов.
Эта задача решается выделенной по изобретению последовательностью нуклеиновых кислот, кодирующей полипептид с активностью нитрилазы, и выбранной из группы, включающей
а) последовательность нуклеиновых кислот с представленной в SEQ ID NO:1 последовательностью,
б) последовательности нуклеиновых кислот, которые как результат дегенерированного генетического кода отводятся от представленной в SEQ ID NO:1 последовательности нуклеиновых кислот,
в) производные представленной в SEQ ID NO:1 последовательности нуклеиновых кислот, кодирующие полипептиды с представленными в SEQ ID NO: 2 аминокислотными последовательностями и имеющие по меньшей мере 95% гомологию на аминокислотном уровне, без значительного снижения ферментативной активности полипептидов.
Под гомологией последовательности нуклеиновых кислот по изобретению с последовательностью SEQ ID NO:1 следует понимать, например, аллельные варианты, которые имеют 95%-ную гомологию на отведенном аминокислотном уровне, предпочтительно по меньшей мере 97% гомологию, особенно предпочтительно по меньшей мере 98% и чрезвычайно предпочтительно по меньшей мере 99% гомологию по всему участку последовательности. По частичному участку последовательностей гомология может лежать предпочтительно выше. Отведенная от SEQ ID NO:1 аминокислотная последовательность представлена в SEQ ID NO:2. Аллельные варианты охватывают, в частности, функциональные варианты, которые получаются делецией, инсерцией или замещением нуклеотидов из представленной в SEQ ID NO:1 последовательности, причем ферментативную активность отведенных синтезированных протеинов следует сохранять и незначительно снижать для внесения одного или нескольких генов в организм. Под незначительно сниженной активностью следует понимать ферментативную активность, которая имеет предпочтительно по меньшей мере 10%, предпочтительно 30%, особенно предпочтительно 50%, и с особой степени предпочтительно 70% ферментативной активности представленного в SEQ ID NO:2 фермента. Изобретение относится, таким образом, к аминокислотным последовательностям, которые кодируются вышеприведенными группами последовательностей нуклеиновых кислот. Предпочтительно изобретение относится к аминокислотным последовательностям, которые кодируются последовательностью SEQ ID NO:1.
Далее под гомологией последовательности SEQ ID NO:1 следует понимать, например, грибковые или бактериальные гомологи, сокращенные последовательности, однонитевые ДНК или РНК кодирующей и некодирующей ДНК-последовательности. Гомологи последовательности SEQ ID NO:1 имеют на уровне ДНК гомологию по меньшей мере 60%, предпочтительно по меньшей мере 70%, особенно предпочтительно по меньшей мере 80%, в особой степени предпочтительно по меньшей мере 90% по всему приведенному в SEQ ID NO:1 участку ДНК.
Кроме того, под гомологией SEQ ID NO:1 следует понимать производные, такие как, например, варианты промотеров. Промотеры, которые включены перед приведенными нуклеотидными кислотами, могут быть изменены посредством одной или нескольких замен нуклеотидов, посредством инерции (инерции) и/или делеции (делеций), без отрицательного воздействия на функциональность, соответственно эффективность промотеров. Далее промотеры могут быть повышены в их активности изменением их последовательности или же могут быть полностью заменены на более активные промотеры также и организмов другого вида.
Под производными следует также понимать варианты, последовательность нуклеотидов которых изменена в пределах от -1 до -200 пар оснований перед стартовым кодоном и от 0 до 1000 пар оснований после стопкодона таким образом, что изменяется экспрессия генов и/или экспрессия протеинов предпочтительно повышается.
Предпочтительно последовательность SEQ ID NO:1 или ее гомологи можно выделять из бактерий, предпочтительно из грамположительных бактерий, предпочтительно из видов Nocardia, Rhodococcus, Streptomyces, Mycobacterium, Corynebacterium, Micrococcus, Proactinomyces или Bacillus, особенно предпочтительно из бактерий вида Rhodococcus, Mycobacterium или Nocardia, чрезвычайно предпочтительно из бактерий вида Rhodococcus sp., Rhodococcus rhodochrous, Nocardia rhodochrous или Mycobacterium rhodochrous известными специалисту в данной области методами.
Последовательности SEQ ID No:1 или ее гомологи или части этих последовательностей могут быть выделены, например, обычными способами гибридизации или ПЦР-техники из других грибов или бактерий. Эти ДНК-последовательности гибридизируют при стандартных условиях с последовательностями по изобретению. Для гибридизации применяются предпочтительно короткие олигонуклеотиды консервированных участков, например из активного центра, которые могут быть определены посредством сравнения с другими нитрилазами и нитрилгидратазами известным специалисту образом. Однако для гибридизации могут применяться более длинные фрагменты нуклеиновых кислот по изобретению или полные последовательности. В зависимости от применяемых нуклеиновой кислоты, олигонуклеотида, более длинного фрагмента или полной последовательности и в зависимости от того, какой вид нуклеиновой кислоты ДНК или РНК применяется для гибридизации, варьируются эти стандартные условия. Так например, температура плавления для ДНК: ДНК-гибрида на прибл. на 10°С ниже, чем ДНК: РНК-гибридов такой же длины.
Под стандартными условиями следует понимать в зависимости от нуклеиновой кислоты температуры между 42 и 58°С в водном буферном растворе с концентрацией между 0,1 до 5 × SSC (причем 1 × SSC = 0,15 М NaCl, 15 мМ цитрата натрия, рН 7,2) или дополнительно в присутствии 50% формамида, например, 42°С in 5 × SSC, 50% формамида. Предпочтительно условия гибридизации составляют для ДНК:ДНК-гидрида 0,1 × SSC и температура между 20°С и 45°С, предпочтительно между 30°С и 45°С. Для ДНК:ДНК-гидрида условия гибридизации предпочтительно при 0,1 × SSC и температура между 30°С и 55°С, предпочтительно между 45°С и 55°С. Эти указанные температуры для гибридизации являются, например, рассчитанными значениями точки плавления для нуклеиновой кислоты длиной прибл. 100 нуклеотидов и с G + С-содержанием в 50% в присутствии формамида. Экспериментальные условия для гибридизации ДНК описаны в известных учебниках по генетике, как например в Sambrook и др., "Molecular Cloning", Cold Spring Harbor Laboratory, 1989, и могут быть рассчитаны по известным специалисту формулам, например, в зависимости от длины нуклеиновых кислот, вида гибридов или G + С-содержания. Дальнейшую информацию по гибридизации специалист может найти в следующей литературе: Ausubel et al. (eds), 1985, Current Protocols in Molecular Biology, John Wiley & Sons, New York; Hames and Higgins (eds), 1985, Nucleic Acids Hybridization: A Practical Approach, IRL Press at Oxford University Press, Oxford; Brown (ed), 1991, Essential Molecular Biology: A Practical Approach, IRL Press at Oxford University Press, Oxford.
Под конструктом нуклеиновой кислоты по изобретению следует понимать гены нитрилазы последовательности SEQ ID NO:1 и их гомологи, которые функционально связаны с одним или несколькими регуляторными сигналами, предпочтительно, для повышения экспрессии генов. При этих регуляторных последовательностях речь идет, например, о последовательностях, которые связываются с индукторами или репрессорами и таким образом регулируют экспрессию нуклеиновых кислот. Дополнительно к этим регуляторным последовательностям может еще иметься естественная регуляция этих последовательностей перед собственными структурными генами и, в случае необходимости, она может быть генетически изменена, так что естественная регуляция исключена и экспрессия генов повышена. Конструкт нуклеиновой кислоты может, однако, быть построен проще, т.е. дополнительные регуляторные сигналы перед последовательностью SEQ ID NO:1 или ее гомологами не инсерируются и естественный промотер со своей регуляцией не удален. Вместо этого естественную регуляцию мутируют таким образом, что больше не происходит регуляции и экспрессия генов повышается. Конструкт нуклеиновой кислоты может, кроме того, содержать также одну или несколько так называемых энхансерных последовательностей, функционально связанных с промотером, которые позволяют повышенную экспрессию последовательности нуклеиновых кислот. Также на 3′-конце ДНК-последовательности могут быть дополнительно инсерированы последовательности, такие как дальнейшие регуляторные элементы или терминаторы. Нуклеиновые кислоты по изобретению могут содержаться в одной или нескольких копиях в конструкте. В конструкте могут содержаться еще другие маркеры, такие как резистентные антибиотикам или комплементирующие ауксотропии гены, в случае необходимости, для селекции на конструкт.
Предпочтительные регуляторные последовательности для способа по изобретению содержатся, например, в таких промоторах, как cos-, tac-, trp-, tet-, trp-tet-, lpp-, lac-, lpp-lac-, laclq-, T7-, T5-, T3-, gal-, trc-, ara-, SP6-, λ-PR- или в λ-PL-промоторе, которые применяются предпочтительно в грамотрицательных бактериях. Другие регуляторные последовательности содержатся, например, в грамоположительных промотерах amy и SPO2, дрожжевых и грибных промотерах ADC1, MFa, AC, P-60, CYC1, GAPDH, TEF, rp28, ADH. В этой связи предпочтительны также и промотеры пируватдекарбоксилазы и метанолоксилазы, например, из Hansenula. Для регуляции могут также применяться искуственные промотеры.
Конструкт нуклеиновых кислот для экспрессии в организме-хозяине инсерируется, предпочтительно, в векторе, как, например, плазмиде, фаге или прочем ДНК, который обеспечивает оптимальную экспрессию генов. Эти векторы представляют собой дальнейший объект изобретения. Подходящие векторы имеются, например, в Е. coli pLG338, pACYC184, pBR322, pUC18, pUC19, рКСЗО, pRep4, pHS1, pHS2, pPLc236, pMBL24, pLG200, pUR290, pIN-III113-BI, lgt11 или pBdCI, в стрептомицетах рlJ101, plJ364, plJ702 или plJ361, в бациллах pUB110, pC194 или pBD214, в Corynebacterium pSA77 или pAJ667, в грибах pALS1, plL2 или рВВИб, в дрожжах 2μМ, pAG-1, YEp6, YEp13 или pEMBLYe23 или в растениях pLGV23, pGHIac+, pBIN19, pAK2004 или pDH151. Приведенные плазмиды представляют собой малый выбор возможных плазмид. Дальнейшие плазмиды известны специалисту в данной области и могут быть найдены, например, в книге Cloning Vectors (Eds. Pouwels P.Н. и др. Elsevier, Amsterdam-New York-Oxford, 1985, ISBN 0 444 904018).
Предпочтительно конструкт нуклеиновых кислот для экспрессии других имеющихся генов содержит дополнительно еще 3′ и/или 5′-концы регуляторных последовательностей для повышения экспрессии, которые в зависимости от выбранного организма-хозяина и гена или генов выбираются для оптимальной экспрессии.
Эти регуляторные последовательности должны позволять нацеленную экспрессию генов и экспрессию протеинов. Это может означать, в зависимости от организма-хозяина, то, что ген экспримируется или сверхэкспримируется только после индукции или, что он экспримируется и/или сверхэкспримируется сразу.
Регуляторные последовательности, соответственно факторы, могут предпочтительно положительно воздействовать на генную экспрессию внесенных генов и этим самым повышать ее. Усиление регуляторных элементов может предпочтительно осуществляться на температурном уровне, для чего применяются сильные транскрипционные сигналы и/или "энхасеры". Наряду с этим возможно также и усиление трансляции за счет того, что, например, улучшается стабильность мРНК.
При другой форме выполнения вектора содержащий конструкт нуклеиновой кислоты по изобретению или нуклеиновую кислоту по изобретению конструкт должен вводиться в организм-хозяин в форме линейной ДНК и через гетерологическую или гомологическую рекомбинацию интегрироваться в геном организма-хозяина. Линейная ДНК может состоять из линеаризированного вектора, такого как плазмид, или только из конструкта нуклеиновой кислоты или из нуклеиновой кислоты.
Для оптимальной экспрессии гетерологических генов в организме следует предпочтительно изменять последовательности нуклеиновых кислот в соответствии с примененным в организме специфичным "codon usage". Этот "codon usage" может легко определяться с помощью компьютерного сравнения других известных генов соответствующего организма.
В качестве организмов-хозяев для нуклеиновой кислоты по изобретению или конструкта нуклеиновой кислоты пригодны, в принципе, все прокариотические или эукариотические организмы. Предпочтительно в качестве организмов-хозяев применяют такие микроорганизмы, как бактерии, грибы или дрожжи. Предпочтительно применяют грамположительные или грамотрицательные бактерии семейства Enterobacteriaceae, Pseudomonadaceae, Streptomycetaceae, Mycobacteriaceae или Nocardiaceae, особенно препочтительно бактерии вида Escherichia, Pseudomonas, Nocardia, Mycobacterium, Streptomyces или Rhodococcus. В особой степени предпочтительны роды Escherichia coli, Rhodococcus rhodochrous, Nocardia rhodochrous, Mycobacterium rhodochrous или Streptomyces lividans.
Организм-хозяин согласно изобретению содержит при этом преимущественно по меньшей мере один протеинный агент для укладки синтезированных им полипептидов и, в частности, описываемых в настоящем изобретении последовательностей нуклеионовых кислот с активностью нитрилазы и/или кодирующие этот агент гены, причем этот агент имеется в количестве, которое больше, чем количество, соответствующее основному количеству рассматриваемого микроорганизма. Кодирующие этот агент гены содержатся в хромосоме или в экстрахромосомных элементах, таких как, например, плазмиды.
Другим объектом изобретения является способ получения хиральных или ахиральных карбоновых кислот, отличающийся тем, что нитрилы в присутствии кодируемой нуклеиновыми кислотами по изобретению аминокислотной последовательности и растущего, покоящегося или открытого вышеприведенного микроорганизма (= организма-хозяина), который содержит или последовательность нуклеиновых кислот по изобретению, или конструкт нуклеиновых кислот по изобретению, который держит нуклеиновую кислоту по изобретению связанной с одним или несколькими регуляторными сигналами, или вектор по изобретению, преобразуют в хиральные или ахиральные карбоновые кислоты.
Предпочтительная форма выполнения способа по изобретению заключается в превращении хиральных или ахиральных алифатических нитрилов в соответствующие карбоновые кислоты.
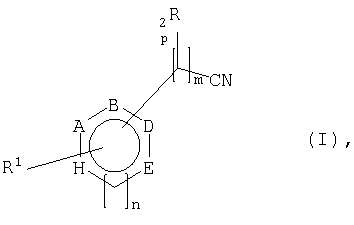
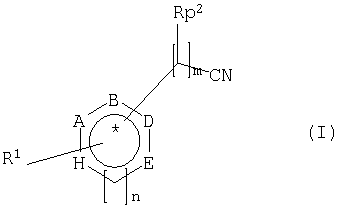
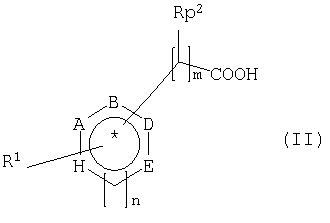
Другая форма выполнения способа получения хиральных или ахиральных карбоновых кислот отличается тем, что нитрилы общей формулы I
преобразуют в присутствии кодируемой нуклеиновые кислоты по изобретению аминокислотной последовательности или растущего, покоящегося или раскрытого вышеприведенного микроорганизма, который содержит или последовательность нуклеиновых кислот по изобретению, или конструкт нуклеиновых кислот по изобретению, который держит нуклеиновую кислоту по изобретению связанной с одним или несколькими регуляторными сигналами, или вектор по изобретению, в карбоновые кислоты общей формулы II
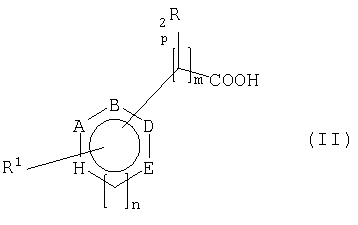
причем заместители в формулах I и II имеют следующее значение:
n = равно 0 или 1
m = равно 0, 1, 2 или 3, причем при m>2 между двумя смежными атомами углерода не обязательно имеется двойная связь,
р = равно 0 или 1
А, В, D и Е означают независимо друг от друга СН, N или CR3
Н = означает О, S, NR4, СН или CR3, если n=0, или СН, N или CR3, если n=1,
причем два смежных остатка А, В, D, Е или Н вместе могут образовывать другое замещенное или незамещенное, ароматическое, насыщенное или ненасыщенное кольцо, содержащее от 5 до 8 атомов в кольце, которое может содержать один или несколько гетероатомов, таких как О, N или S, и причем не больше трех остатков А, В, D, Е или Н представляют собой гетероатом,
R1 означает водород, замещенный или незамещенный, разветвленный или неразветвленный C1-C1-алкилили C1-С10алкокси-, замещенный или незамещенный арил- или гетарил-, гидрокси-, галоген-, С1-С10-алкиламино- или амино-,
R2 означает водород, замещенный или незамещенный, разветвленный или неразветвленный C1-С10алкил- или C1-С10алкокси-, замещенный или незамещенный арил- или гетарил-, гидрокси-, C1-С10алкиламино- или амино-,
R3 означает водород, замещенный или незамещенный, разветвленный или неразветвленный C1-С10алкил-, или C1-С10алкокси замещенный или незамещенный арил-, гетарил-, гидрокси-, галоген-, С1-С10алкиламино- или амино-,
R4 означает водород, замещенный или незамещенный, разветвленный или неразветвленный C1-С10алкил-.
R1 означает в соединениях формул I и II водород, замещенный или незамещенный, разветвленный или неразветвленный C1-С10алкил- или C1-С10-алкокси-, замещенный или незамещенный арил- или гетарил-, гидрокси-, галоген- как фтор, хлор или бром, C1-С10алкиламино- или амино-.
В качестве алкильных остатков следует привести замещенные или незамещенные, разветвленные или неразветвленные C1-С10алкильные остатки, как например, метил, этил, н-пропил, 1-метилэтил, н-бутил, 1-метилпропил-, 2-метилпропил, 1,1-диметилэтил, n-пентил, 1-метилбутил, 2-метилбутил, 3-метилбутил, 2,2-диметилпропил, 1-этилпропил, н-гексил, 1,1-диметилпропил, 1,2-диметилпропил, 1-метилпентил, 2-метилпентил, 3-метилпентил, 4-метилпентил, 1,1-диметилбутил, 1,2-диметилбутил, 1,3-диметилбутил, 2,2-диметилбутил, 2,3-диметилбутил, 3,3-диметилбутил, 1-этилбутил, 2-этилбутил, 1,1,2-триметилпропил, 1,2,2-триметилпропил, 1-этил-1-метил-пропил, 1-этил-2-метилпропил, н-гептил, н-октил, н-нонил или н-децил. Предпочтительны метил, этил, н-пропил, н-бутил, и-пропил или и-бутил.
В качестве алкоксиостатков следует привести замещенные или незамещенные, разветвленные или неразветвленные C1-С10алкокси-цепи, такие как, например, метокси, этокси, пропокси, 1-метилэтокси, бутокси, 1-метилпропокси, 2-метилпропокси, 1,1-диметилэтокси, пентокси, 1-метилбутокси, 2-метилбутокси, 3-метилбутокси, 1,1-диметилпропокси, 1,2-диметилпропокси, 2,2-диметилпропокси, 1-этилпропокси, гексокси, 1-метилпентокси, 2-метилпентокси, 3-метилпентокси, 4-метилпентокси, 1,1-диметилбутокси, 1,2-диметилбутокси, 1,3-диметилбутокси, 2,2-диметилбутокси, 2,3-диметилбутокси, 3,3-диметилбутокси, 1-этилбутокси, 2-этилбутокси, 1,1,2-триметилпропокси, 1,2,2-триметил-пропокси, 1-этил-1-метилпропокси, 1-этил-2-метилпропокси, гексилокси, гептилокси, оксилокси, нонилокси или децилокси и другие гомологи с разветвленными цепями.
В качестве арила- следует привести замещенные или незамещенные арильные остатки, которые содержат от 6 до 20 атомов углеродов. При этом речь идет о конденсированных друг к другу ароматических кольцах или о ароматических кольцах, которые связаны мостиками с помощью алкильных, алкилкарбонильных, алкенильных или алкенилкарбонильных цепей, карбонила, кислорода или азота. Арильные остатки могут быть соединены с основным скелетом еще через С1-С10алкильную, С3-С8алкенильную, С3-С6алкинильную или С3-С8-циклоалкильную цепь. Предпочтительны фенил или нафтил.
В качестве гетарила следует привести замещенные или незамещенные, разветвленные или неразветвленные кольцевые системы с одним или несколькими гетероароматическими, от 3- до 7-членными кольцами, которые могут содержать один или несколько гетероатомов, таких как N, О или S и, в случае необходимости, могут быть связаны через С1-С10-алкильные, С3-С8-алкенильные или С3-С8-циклоалкинильные цепи со скелетом. Примерами таких гетарильных остатков являются пиразол, имидазол, оксазол, изооксазол, тиазол, триазол, пиридин, хинолин, изохинолин, акридин, пиримидин, пиридазин, пиразин, феназин, пурин или птеридин. Гетарильные остатки могут быть связаны через гетероатомы или через различные атомы углерода в кольце или в кольцевой системе или через заместители со скелетом. Предпочтительны пиридин, имидпзол, пиримидин, пурин, пиразин или хинолин.
В качестве алкиламиноостатков следует привести замещенные или незамещенные, разветвленные или неразветвленные C1-С10алкиламиноцепи, такие как, например, метиламино, этиламино, n-пропиламино, 1-метилэтиламино, n-бутиламино, 1-метилпропиламиноамино-, 2-метилпропиламино, 1,1-диметилэтиламино, n-пентиламино, 1-метилбутиламино, 2-метилбутиламино, 3-метилбутиламино, 2,2-диметилпропиламино, 1-этилпропиламино, н-гексиламино, 1,1-диметилпропиламино, 1,2-диметилпропиламино, 1-метилпентиламино, 2-метилпентиламино, 3-метилпентиламино, 4-метилпентиламино, 1,1-диметилбутиламино, 1,2-диметилбутиламино, 1,3-диметилбутиламино, 2,2-диметилбутиламино, 2,3-диметилбутиламино, 3,3-диметилбутиламино, 1-этилбутиламино, 2-этилбутиламино, 1,1,2-триметилпропиламино, 1,2,2-триметилпропиламино, 1-этил-1-метилпропиламино, 1-этил-2-метилпропиламино, н-гептиламино, н-окстиламино, н-нониламино или н-дециламино. Предпочтительны метиламино, этиламино, н-пропиламино, н-бутиламино, и-пропиламино или и-бутиламино.
В качестве заместителей приведенных остатков для R1 пригодны, например, один или несколько таких заместителей, как галоген, такой, как фтор, хлор или бром, тио, циано, нитро, амино, гидрокси, алкил, алкокси, алкенил, алкенилокси, алкинил или другие ароматические или другие насыщенные или ненасыщенные неароматические кольца или кольцевые системы. Предпочтительны алкильные остатки, такие как С1-С6-алкил, например, метил, этил, пропил или бутил, арил, например, фенил, галоген, например, хлор, фтор или бром, гидрокси или амино.
R2 означает в соединениях формул I и II водород, замещенный или незамещенный, разветвленный или неразветвленный C1-С10-алкил- или C1-С10-алкокси-, замещенный или незамещенный арил- или гетарил-, гидрокси-, C1-С10-алкиламиноили амино-.
В качестве алкильных остатков следует привести замещенные или незамещенные, разветвленные или неразветвленные C1-С10алкильные цепи, как например, метил, этил, н-пропил, 1-метилэтил, н-бутил, 1-метилпропил-, 2-метилпропил, 1,1-диметилэтил, n-пентил, 1-метилбутил, 2-метилбутил, 3-метилбутил, 2,2-диметилпропил, 1-этилпропил, n-гексил, 1,1-диметилпропил, 1,2-диметилпропил, 1-метилпентил, 2-метилпентил, 3-метилпентил, 4-метилпентил, 1,1-диметилбутил, 1,2-диметилбутил, 1,3-диметилбутил, 2,2-диметилбутил, 2,3-диметилбутил, 3,3-диметилбутил, 1-этилбутил, 2-этилбутил, 1,1,2-триметилпропил, 1,2,2-триметилпропил, 1-этил-1-метилпропил, 1-этил-2-метилпропил, н-гептил, н-октил, н-нонил или н-децил. Предпочтение отдается метилу, этил, н-пропилу, н-бутилу, и-пропилу или и-бутилу.
В качестве алкоксиостатков следует привести замещенные или незамещенные, разветвленные или неразветвленные C1-С10алкоксицепи, как например, метокси, этокси, пропокси, 1-метилэтокси, бутокси, 1-метилпропокси, 2-метилпропокси, 1,1-диметилэтокси, пентокси, 1-метилбутокси, 2-метилбутокси, 3-метилбутокси, 1,1-диметилпропокси, 1,2-диметилпропокси, 2,2-диметилпропокси, 1-этилпропокси, гексокси, 1-метилпентокси, 2-метилпентокси, 3-метилпентокси, 4-метилпентокси, 1,1-диметилбутокси, 1,2-диметилбутокси, 1,3-диметилбутокси, 2,2-диметилбутокси, 2,3-диметилбутокси, 3,3-диметилбутокси, 1-этилбутокси, 2-этилбутокси, 1,1,2-триметилпропокси, 1,2,2-триметилпропокси, 1-этил-1-метилпропокси, 1-этил-2-метилпропокси, гексилокси, гептилокси, октилокси, нонилокси или децилокси их гомологи с разветвленными цепями.
В качестве арила- следует привести замещенные или незамещенные, арильные остатки, которые содержат от 6 до 20 атомов углерода в кольце или в кольцевой системе. При этом речь может идти о конденсированных друг к другу ароматических кольцах или об ароматических кольцах, которые связаны мостиком через алкильные, алкилкарбонильные, алкенильные или алкенилкарбонильные цепи, карбонил, кислород или азот. Арильные остатки могут, в случае необходимости, быть связаны еще через C1-С10-алкильную, С3-С8-алкенильную, С3-С8-алкинильную или С3-С8-циклоалкильную цепь со скелетом. Предпочтительны фенил или нафтил.
В качестве гетарила- следует привести замещенные или незамещенные, простые или конденсированные ароматические кольцевые системы с одним или несколькими гетероароматическими 3- до 7-членными кольцами, которые могут содержать один или несколько таких гетероатомов, как N, О или S, и, в случае необходимости, могут быть связаны со скелетом через C1-С10-алкильную, С3-С8-алкенильную или С3-С8-циклоалкильную цепь. Примерами таких гетарильных остатков являются пиразол, имидазол, оксазол, изоксазол, тиазол, триазол, пиридин, хинолин, изохинолин, ацидин, пиримидин, пиридазин, пиразин, феназин, пурин или птеридин. Гетарильные остатки могут быть связаны со скелетом через гетероатомы или через различные атомы углерода в кольце или кольцевой системе или через заместители. Предпочтительны пиридин, имидазол, пиримидин, пурин, пиразин или хинолин.
В качестве алкиламиноостатков следует привести замещенные или незамещенные, разветвленные или неразветвленные С1-С10алкиламиноцепи, как например, метиламино, этиламино, н-пропиламино, 1-метилэтиламино, n-бутиламино, 1-метилпропиламиноамино-, 2-метилпропиламино, 1,1-диметилэтиламино, н-пентиламино, 1-метилбутиламино, 2-метилбутиламино, 3-метилбутиламино, 2,2-диметилпропиламино, 1-этилпропиламино, н-гексиламино, 1,1-диметилпропиламино, 1,2-диметилпропиламино, 1-метилпентиламино, 2-метилпентиламино, 3-метилпентиламино, 4-метилпентиламино, 1,1-диметилбутиламино, 1,2-диметилбутиламино, 1,3-диметилбутиламино, 2,2-диметилбутиламино, 2,3-диметилбутиламино, 3,3-диметилбутиламино, 1-этилбутиламино, 2-этилбутиламино, 1,1,2-триметилпропиламино, 1,2,2-триметилпропиламино, 1-этил-1-метилпропиламино, 1-этил-2-метилпропиламино, н-гептиламино, н-октиламино, н-нониламино или н-дециламино. Предпочтительны метиламино, этиламино, н-пропиламино, н-бутиламино, и-пропиламино или и-бутиламино.
В качестве заместителей приведенных остатков для R2 пригодны, например, один или несколько таких заместителей, как галоген, например, фтор, хлор или бром, тио, нитро, амино, гидрокси, алкил, алкокси, алкенил, алкенилокси, алкинил или другие ароматические или другие насыщенные или ненасыщенные неароматические кольца или кольцевые системы. Предпочтительны при этом такие алкильные остатки, как C1-С6алкил, например, метил, этил, пропил или бутил, арил, например, фенил, галоген, например, хлор, фтор или бром, гидрокси или амино.
R3 означает в соединениях формул I и II водород, замещенный или незамещенный, разветвленный или неразветвленный C1-С10алкил- или C1-С10-алкокси-, замещенный или незамещенный арил- или гетарил-, гидрокси-, галоген, такой, как фтор, хлор или бром, C1-С10алкиламиноили амино-.
В качестве алкильных остатков следует привести замещенные или незамещенные, разветвленные или неразветвленные C1-С10алкильные цепи, как например, метил, этил, н-пропил, 1-метилэтил, н-бутил, 1-метилпропил-, 2-метилпропил, 1,1-диметилэтил, н-пентил, 1-метилбутил, 2-метилбутил, 3-метилбутил, 2,2-диметилпропил, 1-этилпропил, н-гексил, 1,1-диметилпропил, 1,2-диметилпропил, 1-метилпентил, 2-метилпентил, 3-метилпентил, 4-метилпентил, 1,1-диметилбутил, 1,2-диметилбутил, 1,3-диметилбутил, 2,2-диметилбутил, 2,3-диметилбутил, 3,3-диметилбутил, 1-этилбутил, 2-этилбутил, 1,1,2-триметилпропил, 1,2,2-триметилпропил, 1-этил-1-метилпропил, 1-этил-2-метилпропил, н-гептил, н-окстил, н-нонил или н-децил. Предпочтительны метил, этил, н-пропил, н-бутил, и-пропил или и-бутил.
В качестве алкоксиостатков следует привести замещенные или незамещенные, разветвленные или неразветвленные С1-С10-алкоксицепи, например, метокси, этокси, пропокси, 1-метилэтокси, бутокси, 1-метилпропокси, 2-метилпропокси, 1,1-диметилэтокси, пентокси, 1-метилбутокси, 2-метилбутокси, 3-метилбутокси, 1,1-диметилпропокси, 1,2-диметилпропокси, 2,2-диметилпропокси, 1-этилпропокси, гексокси, 1-метилпентокси, 2-метилпентокси, 3-метилпентокси, 4-метилпентокси, 1,1-диметилбутокси, 1,2-диметилбутокси, 1,3-диметилбутокси, 2,2-диметилбутокси, 2,3-диметилбутокси, 3,3-диметилбутокси, 1-этилбутокси, 2-этилбутокси, 1,1,2-триметилпропокси, 1,2,2-триметилпропокси, 1-этил-1-метилпропокси, 1-этил-2-метилпропокси, гексилокси, гептилокси, октилокси, нонилокси или децилокси и из гомологи с разветвленными цепями.
В качестве арила- следует привести замещенные или незамещенные, арильные остатки, которые содержат от 6 до 20 атомов углерода в кольце или кольцевой системе. При этом речь может идти о конденсированных друг к другу ароматических кольцах или о ароматических кольцах, которые через алкильные, алкилкарбонильные, алкенильные или алкенилкарбонильные цепи, карбонил, кислород или азот связаны мостиками. Арильные остатки, в случае необходимости, могут быть еще связаны со скелетом через C1-С10алкильную, С3-С8алкенильную, С3-С8алкинильную или С3-С8циклоалкильную цепь. Предпочтительны фенил или нафтил.
В качестве гетарила- следует привести замещенные или незамещенные, простые или конденсированные ароматические кольцевые системы с одним или несколькими гетероароматическими 3- до 7-членными кольцами, которые могут содержать один или несколько гетероатомов, таких как N, О или S и, в случае необходимости, через C1-С10алкильную, С3-С8алкенильную или С3-С8-циклоалкильную цепь могут быть связаны со скелетом. Примерами подобных гетарильных остатков являются пиразол, имидазол, оксазол, изооксазол, тиазол, триазол, пиридин, хинолин, изохинолин, акридин, пиримидин, пиридазин, пиразин, феназин, пурин или птеридин. Гетарильные остатки могут быть связаны со скелетом через гетероатомы или через различные атомы углерода в кольце или кольцевой системе или через заместители. Предпочтительны пиридин, иимдазол, пиримидин, пурин, пиразин или хинолин.
В качестве алкиламиноостатков следует назвать замещенные или незамещенные, разветвленные или неразветвленные C1-C10-алкиламиноцепи, такие как, например, метиламино, этиламино, н-пропиламино, 1-метилэтиламино, н-бутиламино, 1-метилпропиламиноамино-, 2-метилпропиламино, 1,1-диметилэтиламино, н-пентиламино, 1-метилбутиламино, 2-метилбутиламино, 3-метилбутиламино, 2,2-диметилпропиламино, 1-этилпропиламино, н-гексиламино, 1,1-диметилпропиламино, 1,2-диметилпропиламино, 1-метилпентиламино, 2-метилпентиламино, 3-метилпентиламино, 4-метилпентиламино, 1,1-диметилбутиламино, 1,2-диметилбутиламино, 1,3-диметилбутиламино, 2,2-диметилбутиламино, 2,3-диметилбутиламино, 3,3-диметилбутиламино, 1-этилбутиламино, 2-этилбутиламино, 1,1,2-триметилпропиламино, 1,2,2-триметилпропиламино, 1-этил-1-метилпропиламино, 1-этил-2-метилпропиламино, н-гептиламино, н-окстиламино, н-нониламино или н-дециламино. Предпочтительны метиламино, этиламино, н-пропиламино, н-бутиламино, и-пропиламино или и-бутиламино.
В качестве заместителей приведенных остатков для R3 пригодны, например, один или несколько таких заместителей, как галоген, например, фтор, хлор или бром, тио, нитро, амино, гидрокси, алкил, алкокси, алкенил, алкенилокси, алкинил или другие ароматические или другие насыщенные или ненасыщенные неароматические кольца или кольцевые системы. Предпочтительны такие алкильные остатки, как C1-C6-алкил, такой как метил, этил, пропил или бутил, арил, такой как фенил, галоген, такой как фтор, хлор, или бром, гидрокси или амино.
R4 означает в соединениях формул I и II водород или замещенный или незамещенный, разветвленный или неразветвленный C1-C10алкил-.
В качестве алкильных остатков следует привести замещенные или незамещенные, разветвленные или неразветвленные C1-C10алкильные цепи, как например, метил, этил, н-пропил, 1-метилэтил, н-бутил, 1-метилпропил-, 2-метилпропил, 1,1-диметилэтил, н-пентил, 1-метилбутил, 2-метилбутил, 3-метилбутил, 2,2-диметилпропил, 1-этилпропил, н-гексил, 1,1-диметилпропил, 1,2-диметилпропил, 1-метилпентил, 2-метилпентил, 3-метилпентил, 4-метилпентил, 1,1-диметилбутил, 1,2-диметилбутил, 1,3-диметилбутил, 2,2-диметилбутил, 2,3-диметилбутил, 3,3-диметилбутил, 1-этилбутил, 2-этилбутил, 1,1,2-триметилпропил, 1,2,2-триметилпропил, 1-этил-1-метилпропил, 1-этил-2-метилпропил, н-гептил, н-октил, н-нонил или н-децил. Предпочтительны метил, этил, н-пропил, н-бутил, и-пропил или и-бутил.
В качестве заместителей приведенных остатков для R4 пригодны, например, один или несколько таких заместителей, как галоген, такой как фтор, хлор или бром, тио, нитро, амино, гидрокси, алкил, алкокси, алкенил, алкенилокси, алкинил или другие ароматические или другие насыщенные или ненасыщенные неароматические кольца или кольцевые системы. Предпочтительны при этом такие алкильные остатки, как С1-С6алкил, такой как метил, этил, пропил или бутил, арил, такой как фенил, галоген, такой как хлор, фтор или бром, гидрокси или амино.
Также и алифатические, насыщенные или ненасыщенные динитрилы могут применяться в способе по изобретению.
Способ по изобретению проводится преимущественно при значении рН от 4 до 11, предпочтительно от 4 до 9.
Далее в способе применяют предпочтительно от 0,01 до 10 мас.%, предпочтительно от 0,1 до 10 мас.%, особенно предпочтительно от 0,5 до 5 мас. нитрила. В зависимости от вида нитрила могут применяться различные количества нитрила в реакции. Наименьшие количества нитрила применяются при нитрилах (циангидридах) (равно количествам между 0,01 до 5 мас.%), которые находятся в равновесии с соответствующими альдегидами и синильной кислотой, в связи с тем, что альдегиды, как правило, являются токсичными по отношению к микроорганизмам или ферментам. Нитрилы, которые являются легко летучими, применяются предпочтительно в количестве между 0,01 до 5 мас.%. При более высоких количествах циангидрина, соответственно нитрила, реакция проходит с замедлением. При нитрилах, которые имеют малые или слишком малые или почти никакие свойства растворителя, или нитрилы, которые растворяются только в очень малых количествах в водных средах, могут применяться в более высоких количествах, чем вышеприведенные. Для повышения конверсии и выхода реакцию предпочтительно проводят при постоянном добавлении нитрила. Продукт может после окончания реакции выделяться или может постоянно удаляться в байпассе (шунте).
Способ по изобретению проводят при температуре от 0°С до 80°С, предпочтительно от 10°С до 60°С, особенно предпочтительно от 15°С до 50°С.
Предпочтительно в способе по изобретению применяются ароматические или гетероароматические нитрилы, такие как 2-фенил-пропионитрил, нитрил 2-гидроксифенилуксусной кислоты, 2-амино-2-фенил-ацетонитрил, бензонитрил, фенилацетонитрил, нитрил транс.-коричной кислоты, 3-циантиофен или 3-цианометилтиофен.
Под хиральными нитрилами в способе по изобретению следует понимать нитрилы, которые состоят из смеси 50:50 чистого энантиомера или из любой другой смеси с обогащением одного из обоих энантиомеров в смеси. Примерами для таких нитрилов являются 2-фенил-пропионирил, нитрил 2-гидроксифенилуксусной кислоты, 2-амино-2-фенил-ацетатнитрил, 2-хлорпропионитрил или 2-гидроксипропионитрил.
Под хиральными карбоновыми кислотами в способе по изобретению следует понимать такие, которые проявляют обогащение энантиомерами. Предпочтительно в способе достигается чистота энантиомеров по меньшей мере 90%, предпочтительно мин. 95%, особенно предпочтительно мин. 98%, в особой степени предпочтительно мин. 99%.
Способ по изобретению позволяет преобразование большого количества хиральных или ахиральных нитрилов в соответствующие хиральные или ахиральные карбоновые кислоты. В способе можно преобразовывать по меньшей мере 25 ммоль нитрила/час × 1 мг протеина или по меньшей мере 25 моль нитрила/час × 1 г сухого веса микроорганизма, предпочтительно по меньшей мере 30 ммоль нитрила/час × 1 мг протеина или по меньшей мере 30 ммоль нитрила/час × 1 г сухого веса, предпочтительно по меньшей мере 40 ммоль нитрила/час × 1 мг протеина или по меньшей мере 40 ммоль нитрила/час × 1 г сухого веса. Особенно предпочтительно по меньшей мере 50 ммоль нитрила/час × 1 мг протеина или по меньшей мере 50 ммоль нитрила/час × 1 г сухого веса микроорганизма.
Для способа по изобретению могут применяться растущие клетки, которые содержат нуклеиновые кислоты по изобретению, конструкты нуклеиновых кислот по изобретению или векторы. Также могут применяться и покоящиеся или раскрытые клетки. Под раскрытыми клетками следует понимать, например, такие клетки, которые обработкой, например, растворителем делаются проницаемыми, или клетки, которые раскрываются ферментативной обработкой, механической обработкой (например, прессом или ультразвуком) или прочими методами. Полученные таким образом сырые экстракты пригодны для способа по изобретению. Также и очищенные ферменты могут применяться для способа по изобретению. Также пригодны иммобилизированные микроорганизмы или ферменты, которые предпочтительно могут найти применение в реакции.
Полученные способом по изобретению хиральные или ахиральные карбоновые кислоты могут быть выделены из водного реакционного раствора экстракцией или кристаллизацией или экстракцией и кристаллизацией. Для этого водный реакционный раствор подкисляют кислотой, например, минеральной кислотой (HCl или H2SO4) или органической кислотой до значения рН, предпочтительно ниже 2, и после этого экстрагируют органическим растворителем. Экстрагирование для повышения выхода может несколько раз повторяться. В качестве органического растворителя могут применяться в принципе все растворители, которые, в случае необходимости, после добавки солей образуют фазы с водой. Предпочтительными растворителями являются такие растворители, как толуол, бензол, гексан, метилтрет-бутиловый эфир или этилацетат. Также и очистка продукта может происходить предпочтительно путем связывания с ионообменником и последующего элюирования минеральной кислотой или такой карбоновой кислотой, как HCL, H2SO4, муравьиная кислота или уксусная кислота.
После концентрации водной или органической фазы продукты, как правило, могут выделяться с хорошей химической чистотой, т.е. более 90%. После экстракции органическую фазу с продуктом можно только частично концентрировать и продукт выкристаллизовывать. Для этого раствор охлаждают до температуры от 0°С до 10°С. Кристаллизация может осуществляться непосредственно из органического раствора. Выкристаллизованный продукт может быть загружен в тот же или в другой растворитель для повторной кристаллизации. Посредством последующей по меньшей мере одноразовой кристаллизации чистота энантиомеров продукта может быть еще повышена в зависимости от положения эвтектики.
Хиральные или ахиральные карбоновые кислоты, однако, сразу после подкисления кислотой на значение рН ниже 2 могут быть выкристаллизованы из водного реакционного раствора. Для этого преимущественно водную среду концентрируют при нагревании и снижают ее объем на 10 до 90%, предпочтительно 20 до 80%, особенно предпочтительно 30 до 70%. Кристаллизацию проводят при охлаждении. Для кристаллизации предпочтительны температуры от 0°С до 10°С. Из соображений экономии расходов предпочтение отдается непосредственной кристаллизации из водного раствора. Также предпочтительна обработка хиральных карбоновых кислот экстракцией и, в случае необходимости, последующей кристаллизации.
При предпочтительном виде обработки продукт, полученный способом по изобретению, выделяют с выходом от 60 до 100%, предпочтительно от 80 до 100%, особенно предпочтительно от 90 до 100% в пересчете на примененный в реакции нитрил. Выделенный продукт отличается высокой химической чистотой в >90%, предпочтительно в >95%, особенно предпочтительно в >98%. Далее продукт при хиральных нитрилах, соответственно хиральных карбоновых кислотах отличается высокой чистотой энантиомеров, которая может быть еще повышена кристаллизацией.
Полученный таким образом продукт пригоден в качестве исходного материала для органического синтеза при получении фармацевтических средств, агрохимикатов или для расщепления рацематов.
Примеры
Выделение и гетерологичная экспрессия nitA-гена из Rhodococcus rhodochrous NCIMB 11216
Пример 1: Выделение nitA-гена из Rhodococcus rhodochrous NCIMB 11216
Для выделения nitA-гена из Rhodococcus rhodochrous NCIMB 11216 выделяют клеточную ДНК, образовывают фаговый геномный банк и проверяют его с помощью олигонуклеотидного зонда.
1.1 Выделение ДНК из R.rhodochrous NCIMB 11216
Для выделения геномной ДНК из Rhodococcus rhodochrous NCIMB 11216 согласно авторам Sambrook и др., 1989, центрифугируют 2×100 мл культуры, которой дают стоять одну ночь (в среде dYT, Sambrook, J., Fritsch, E.F. and Maniatis, Т., 1989, Molecular cloning: a laboratory manual, 2nd edition, Cold Spring Harbor Laboratory Press. Cold Spring Harbor, New York.) и гранулы ресуспендируют в 8мл 25 мМ трис/HCl, 25 мМ ЭДТК, 10% сахарозы (вес/объем), рН 8,0. После обработки очищенных культур лизоцимом в течение 15 мин при 37°С (добавка 2 мл лизоцима, 100 мг/мл в 10 мМ трис/HCI, 0,1 мМ ЭДТК, рН 8,0) добавляют 2мл 10% (в/о) Na-лауроилсаркосцината и инкубируют при многократном перемешивании в течение 15 минут при 65°С. После этого подают CsCl с конечной концентрацией в 1 г/мл, растворяют при 65°С и после добавки бромида этидия с конечной концентрацией в 0,4 мг/мл проводят ультрацентрифугирование в роторе (Sorvall T1270, 83500 г, 48 ч, 17°С). Хромосомальную полосу ДНК снимают под УФ-светом, диализируют в течение 2 часов в ТЕ 10.1 (10 мМ трис/HCl, 1 мМ ЭДТК, рН 8,0) и 3 раза экстрагируют раствором фенола (насыщенным посредством 10 мМ трис/HCl, рН 8). После этого ДНК еще 3 раза диализируют в ТЕ 10.01 (10 мМ трис/HCl, 0,1 мМ ЭДТК, рН 8,0) и при хранят при 4°С. Таким образом получают прибл.1,5 мл раствора ДНК с концентрацией прибл. 500 мкг/мл.
1.2 Получение фагового банка генов из ДНК из R.rhodochrous NCIMB 11216
В качестве вектора для геномного банка применяют фаг I-RESIII: Этот вектор замещения содержит lux-оперон в качестве фрагмента гомогенотизации, что позволяет визуальный контроль фона посредством биолюминисценсии, а также интегрированный res("resolution") - сайт из Тn1721 и репликационных функций n pTW601-1, так что вектор может быть превращен в штамм с соответствующей транспозазой в автономно реплицирующий плазмид (Altenbuchner, 1993, A new I RES vector with a built-in Tn1721-encoded, excision system, Gene 123, 63-68).
1.2.1 Выделение 1-RESIII-DNA (согласно авторам Sambrook и др., 1989)
От продержанной ночь культуры Е.coliTAP90 (LB0, Sambrook и др., 1989, с 10 мМ MgSO4, 0,2% мальтозы (вес/об.)) центрифугируют 1010 клеток и гранулят ресуспендируют в 3 мл SM-фагового буфера (50 мМ трис/HCl, 100 мМ NaCl, 8 мМ MgSO4, 0,01% (вес/об.) желатины). После заражения посредством 1,5×108 - 1,5×109 бляшкообразующих единиц (pfu) I RESIII-лизата фаг в течение 20 минут при 37°С реакционную смесь подают в двухлитровую колбу Эрленмайера к 500 мл LB0, 10 мМ MgSO4, 0,2% мальтозы. В общем 4 таких реакционных смеси перемешивают в течение от 9 до 12 часов при 37°С до тех пор, пока лизис клеток не становятся видными, и для полного лизиса в каждую колбу подают 10 мл хлороформа, и перемешивают еще 30 минут при 37°С. Клеточные нуклеиновые кислоты переваривают посредство подачи ДН-азы и РН-азы (по 1 мкг/мл) в течение 30 минут при комнатной температуре. Потом к каждой реакционной смеси подают 29,2 г NaCI, растворяют, центрифугируют 10 минут при 8300 g и надосадочную жидкость смешивают с 10% PEG 6000. Для последующей препарации фагов реакционные смеси перемешивают в течение ночи при 4°С и затем центрифугируют в течение 15 минут при 14000 g. После сушки гранулята его загружают в 5 мл SM-буфера, смешивают с 5 мл хлороформа и центрифугируют 15 минут при 3000 g. Водные фазы с фагами собирают, смешивают с 0,75 г/мл CsCl и после полного растворения центрифугируют в течение 24 часов (ротор Sorvall T1270, 98400 g, 48 ч, 17°С). Видимую полосу фаг отделяют и диализируют два раз в 50 мМ трис/HCl, 10 мМ NaCl, 10 мМ MgCl2, pH 8,0. После добавки 20 мМ ЭДТК, 50 мкг/мл протеиназы К и 0,5%-го додецилсульфата натрия происходит инкубация в течение 1 часа при 65°С. Затем реакционную смесь экстрагируют по одному разу с помощью фенола (насыщенного 10 мМ трис/HCl, рН 8), по одному разу фенолом (насыщенным 10 мМ трис/HCl, рН 8) / хлороформом (50/50 об./об.) и по одному разу хлороформом. После этого ДНК диализируют 3 раза ТЕ 10.1 и один раз ТЕ 10.01, определяют в титре E.coliTAP 90 (см. 1.2.3) и хранят I-RESIII-ДНК при 4°С.
1.2.2 Клонирование ДНК в I-RESIII-векторы
Для клонирования геномного R.rhodochrous NCIMB 11216 ДНК-фрагмента сначала препарируют I-RESIII-фрагменты, при этом I-RESIII-ДНК в объеме 100 мкл 2 мкг переваривают с помощью 20 U BamHI в течение 5 часов при 37°С. После экстракции фенолом (насыщенным 10 мМ трис/HCI, рН 8) / хлороформом (50/50 об./об.), осаждения изопропанолом и промывания посредством 70% соотв. 100% этанола (предварительно охлажденного до 20°С) ДНК растворяют в ТЕ 10.01 и обрабатывают посредством 20 единиц Sall (5 часов при 37°С). Снова производят экстракцию фенолом/хлороформом, осаждение изопропанолом, промывание и растворение в ТЕ 10.01.
Для получения геномного ДНК-фрагмента - после запуска кинетики времени для применяемой партии ферментов - 10 мкг геномной ДНК частично переваривают в 100 мкл - смеси в течение 5 минут с помощью 0,5 ед.Sаu3Аl. После электрофорезного разделения посредством 0,8%-ного агарозного геля с низкой точкой плавления выделяют фрагментные участки от 8 до 14 тыс.п.о. и согласно Parker & Seed (1980) вымывают из геля. Геномный ДНК-фрагмент лигируют в течение ночи при 16°С с помощью I-RESIII-плечей.
После этого лигационную смесь упаковывают in vitro фаговыми экстрактами, которые до этого препарируют согласно "packaging extract donor" E.coli BHB 2688 ("freeze thaw lysate", FTL, Sambrook et al., 1989) и согласно "prehead donor" E.coli BHB 2690 ("sonicated extract", SE, Sambrook et al., 1989). Для упаковки 5 мкл лигационной смеси смешивают 7 мкл буфера А (20 мМ трис/HCl, 3 мМ MgCl2, 1 мМ ЭДТК, 0,05% β-меркаптоэтанола, рН 8,0), 7 мкл буфера М1 (6,7мmМ трис/HCl, 33 мМ спермидина, 100 мМ путресцина, 17,8 мМ АТР, 0,2% β-меркаптоэтанола, 20 мМ MgCl2, рН 8), 15 мкл SE и 10 мкл FTL и инкубируют в течение 1 часа при комнатной температуре. Затем добавляют 500 мкл SM-буфера и 1 каплю хлороформа, реакционную смесь перемешивают, центрифугируют и хранят при 4°С.
Для определения титра полученного фагового банка генов инфицируют штамм E.coli ТАР 90 (Patterson & Dean, 1987). Для этого логарифмически растущие клетки (выращивание в LB0, 10 мМ MgCl2, 0,5% мальтозы) инкубируют посредством 100 мкл различных разбавлении фагового или упаковочного лизата в SM-буфере в течение 30 минут при 37°С. Реакционные смеси смешивают затем с 3 мл нагретого до 42°C топ-агара (0,8% бакто-агара, мМ MgCl2, 0,5% мальтозы). Коротко перемешивают и накладывают на LB0-анарные пластинки с 10 мМ MgCl2 (предварительно нагретые до 37°С). После 12-16 часов инкубации при 37°С пересчитывают бляшки для определения титра. Титр полученного банка содержит около 4×105 бляшкообразующих единиц/мл.
1.2.3 Превращение рекомбинантных I-RESIII-фагов в плазмид
Полученные рекомбинантные I-RESIII-фаги превращают в штамме Е.coli HB 101 F′[::Тn1739lас], который несет транспосон Тn1739 с геном резольвазы под контролем fac-промотера (Altenbuchner, 1993, см. выше), в автономный реплицирующий плазмид. Этот штамм для инфекции выращивают в 5 мл LB0 с 10 мМ MgCl2 и 0,5% мальтозы до OD600 от 0,6 до 0,8 и 100 мкл от него инфицируют с подходящим количеством фагового лизата в течение 30 минут при комнатной температуре. Смесь укладывают в 5 мл предварительно нагретого dYT, 1 мМ изопропил-β-тиогалактопиранозида в течение 1 часа при 37°С центрифугируют, ресуспендируют в обратном потоке и клетки накладывают на агарные пластинки dYT с 100 мкг/мл канамицина и инкубируют в течение ночи при 37°С.
Для визуализирования клеток непревращенная I-RESIII-молекула еще содержит превоначальный фрагмент гомогенотизации с lux-опероном и вместе с этим не содержит геномный инсерт (фон банкагенов), пластинки индуцируют в течение 3 часов при 30°С и биолюминисцирующие клетки пересчитывают в темноте. Фон банка генов содержит долю люминисцирующих клеток в 13%.
1.3. Скриннинг гена нитрилазы nitA из R.rhodochrous NCIMB 11216
Рекомбинантные I-RESIII-фаги, которые содержат хромосомальные ДНК-фрагменты с геном нитрилазы из R.rhodochrous NCIMB 11216, идентифицируют посредством гибридизации фаговых бляшек олигонуклеотидными зондами
"nit1lower", с последовательностью: 5′-TGGAA(AG)TG(CT)TCCCA(AG)CA-3′, Kobayashi, M., Komeda, H., Yanaka, N., Nagasawa, T. and Yamada, H. (1992) Nitrilase from Rhodococcus rhodochrous J1. Kobayashi, M., Izui, H., Nagasawa, T. and Yamada, H. (1993) Nitrilase in biosynthesis of the plant hormone indole-3-acetic acid from indole-3-acetonitrile: Cloning of the Alcaligenes gene and site-directed mutagenesis of cysteine residues.
Последовательность олигонуклеотида идентифицируют из консервированного участка аминокислотной последовательности с предполагаемым каталитическим остатком (Kobayashi и др., J. Biol. Chem. 267, 1992, 20746-20751 und Proc. Natl. Acad. Sci. USA, 90, 1993, 247-251). Этот мотив можно было найти в уже известных ДНК-последовательностях гена нитрилазы из штаммов Rhodococcus rhodochrous J1 (GenBank Асе. # D11425) R.rhodochrous K22 (GenBank Асе. #D12583).
1.3.1 Трансфер ДНК и гибридизация
На 5 агарных пластинках в общей сложности с 2500 бляшками, которые получают как описано для определения титра в разделе 1.2.3, на 1 минуту накладывают нейлонные круглые мембраны. Мембраны кладут на 2×5 мин стороной бляшек вверх на фильтровальную бумагу с денатурирующим раствором (1,5 М NaCl, 0,5 М NaOH) и потом 2×5 мин на фильтровальную бумагу с денатурирующим раствором (0,5 М трис/HCl, 1,5 М NaCl, рН 7,5). После этого их коротко промывают в 50 мМ NaCl, сушат и ДНК фиксируют в течение 30 минут при 120°С.
Для гибридизации мембраны предварительно инкубируют посредством 50 мл гибридизирующего буфера в течение 2 часов при 37°С и потом в течение ночи гибридизируют в 12 мл гибридизирующего буфера при 37°С посредством 10 пмоль 32Р-маркированного олигонуклеотида. Олигонуклеотид маркируют в 30 мкл-смеси с 80 мкСi (g-32Р)-АТР посредством 10 ед. Т4-полинуклеотидкиназы и отделяют от избыточного (g-32Р)-АТР гель-фильтрацией с помощью Sephadex G-25.
После гибридизации нейлонные мембраны промывают 1×5 минут при комнатной температуре посредством 0,5 г/л NaCl, 8,8 г/л цитрата натрия (2 × SSC), 0,1% додецилсульфата натрия и 2×15 минут при 32°С посредством 0,125 г / 1 л NaCl, 2,2 г/л цитрата натрия (0,5×SSC), 0,1% додецилсульфата натрия и экспонируют в течение 5 дней в пленочной кассете с усиливающей пленкой с рентгеновской пленкой.
1.3.2 Идентификация и секвентирование nitA-гена
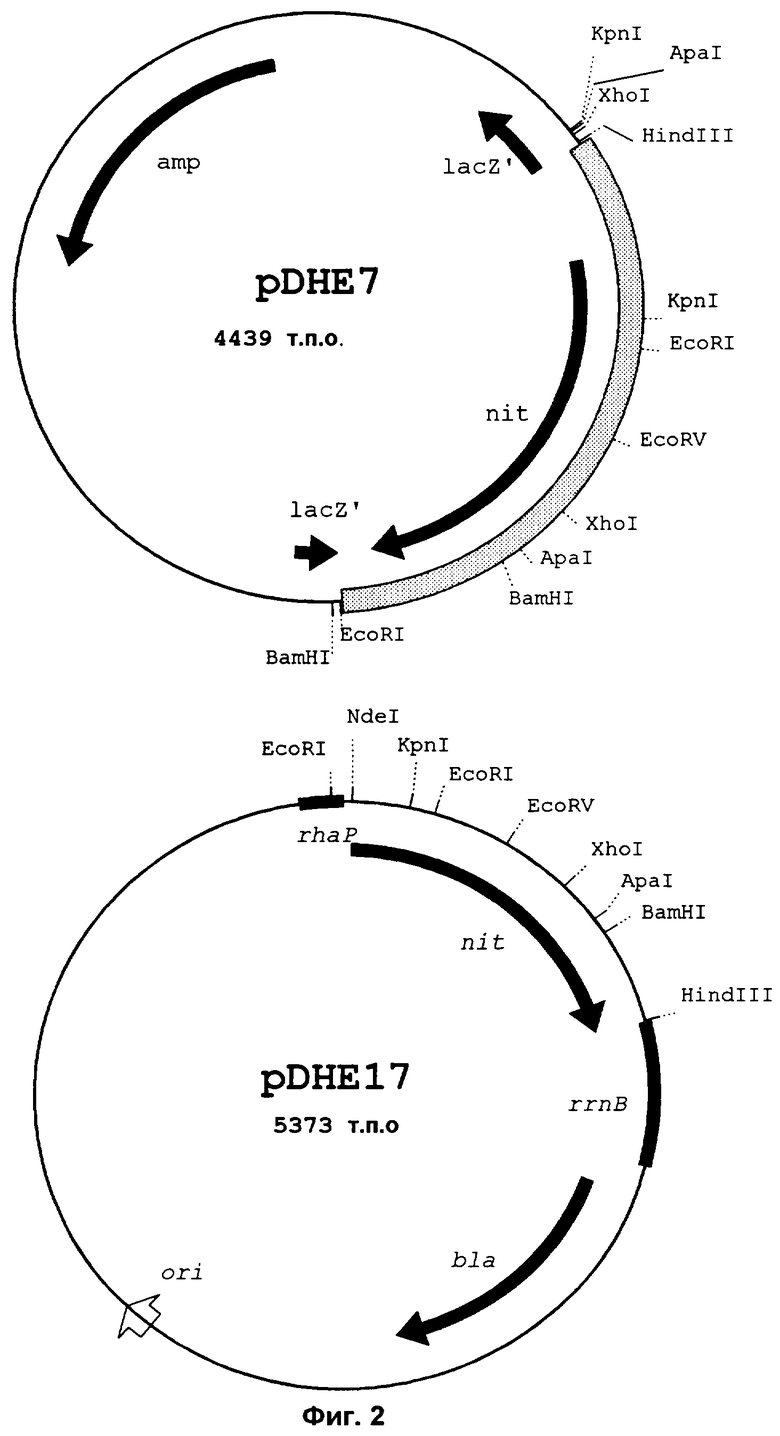
В общей сложности идентифицируют 3 положительных клона, из которых два имеют полный nitA-генный фрагмент и один имеет полный nitA-ген. Позитивные бляшки выделяют, инкубируют в течение 2 часов при комнатной температуре в 0,5 мл SM-буфера и после добавки 2 капель хлороформа хранят при 4°С. Результирующийся после превращения рекомбинантного I-RESIII-фага полным nitA-геном плазмид (см. 1.2.3) обозначают pDHE 6 (фиг.1 показывает pDHE 6 с 12 тыс. п.о.геномного фрагмента Rhodococcus rhodochrous NCIMB 11216 ) и рестрикционно картируют область nitA-гена с помощью Southern-габридизаций олигонуклкотидным зондом "nit1lower". Pvul-фрагмент с 1,5 тыс. п.о. с общим nitA-геном обрабатывают фрагментом Кленова и субклонируют обработанный в EcoRV pBluescriptSK + (pDHE 7 с Fvul-фрагментом в 1,5 тыс. п.о. из геномного фрагмента геномного банка в 12 тыс. п.о. из Rhodococcus rhodochrous NCIMB 11216 в pDHE6, фиг.2). После дальнейшего субклонирования перекрывающихся фрагментов pDHE 7 HindIII (вектор) IEcoRI, Kpnl/Xhol, EcoRV/BamHl и Apal/EcoRI (Vektor), соответствующим образом переваренный pBluescriptSK+ фрагмент PvuI секветрируют по методу авторов Sanger и др. (Proc. Natl. Acad. Sci. USA 74, 1977, 5463-5467) с помощью в двухнитевую последовательность. Реакция секвентирования проводится с помощью имеющегося в торговле набора секвентирования имеющимися также в продаже затравками "universal"и "reverse" (Vieira & Messing, Gene, 19, 1982: 259-268). Определенная для Pvul-фрагмента в 1,5 тыс. п.о. ДНК-последовательность представлена в SEQ ID NO:1. Отведенная аминокислотная последовательность представлена в SEQ ID NO:2.
2 Гетерологичная экспрессия nitA-гена из R.rhodochrous NCIMB 11216 в E.coli и очистка рекомбинантного протеина нитрилазы
Для клонирования в вектор экспрессии амплифицируют nitA-ген из R.rhodochrous NCIMB 11216 от кодона транслационного старта до кодона транслационного стопа. Для этого применяют затравки
"nit Ndel" (upper) с последовательностью
5′-TATATATCATATGGTCGAATACACAAACA-3′
и
"nit Hindlll" (lower) с последовательностью:
5′-TAATTAAGCTTCAGAGGGTGGCTGTCGC-3′
в которых на 5′-nitA-конце приведено перехлестывающееся с транслационным стартом Ndel-место резки и на 3′-nitA-конце, перехлестывающееся со стоп-кодоном Hindlll-место резки. Этой парой затравок амплифицируют nitA-ген из pDHE 7 с полимеразой Pwo в 40 мкл реакционной смеси из 8 нмоль затравки, 100 г pDHE 7-Template и 2,5 ед. Pwo в 10 мМ трис-HCl, рН 8.85, 25 мМ KCl, 5 мМ (NH4)SO4, 2 мМ MgSO4, 0,2 мМ dATP, 0,2 мМ dTTP, 0,2 мМ dGTP и 0,2 мМ dCTP при следующих условиях:
Денатурирование для 3′ при 94°С;
25 циклов с денатурированием для 1′ при 93°С, хранение затравки для 1′ 30′′ при 48°С и полимеризации для 1′ 30′′ при 72°С;
Заключительная полимеризация для 5′ при 72°С.
Полученный nit-ПЦР-фрагмент очищают, переваривают с помощью Ndel/HindIII, интегрируют в аналогично переваренные векторные молекулы pJOE 2702 (Volff и др., Mol. Microbiol., 21, 1996: 1037-1047) и результирующийся плазмид обозначают pDHE 17 (фиг.2: pDHE 17c nitA в идуцируемом L-рамнозой векторе экспресси pJOE 2702). Вследствие интеграции через Ndel/HindIII nitA-ген находится в плазмиде pDHE 17 под транскрипционным контролем полученного в pJOE 2702 промотера rhap, который происходит из оперона L-рамнозы rhaBAD в Е.coli (Egan & Schleif, Mol. Biol. 243, 1994: 821 - 829). Транскрипционная терминация nitA-гена и транслационная инициация транскриптов происходит также через векторную последовательность (см. Volff и др., 1996). После трансформации pDHE 17 в E.coli JM 109 nitA-ген из R.rhodochrous NCIMB 11216 может быть индуцирован посредством добавки L-рамнозы.
Для очистки рекомбинантного протеина нитрилазы с помощью имидазольной аффинной хроматографии nitA-ген, кроме того, сливают с 3′-последовательностью для С-концевого His6-мотива, причем для амплификации nitA-гена, которая осуществляется при вышеприведенных условиях, наряду с 5′-затравкой "nitNdel" (upper) применяют модифицированную 3′-затравку без стоп-кодона с последовательностью 5′-CGAGGGTGGCTGTCGCCCG-3′ и полученный ПЦР-фрагмент интегрируют в модифицированный pJOE 2702-вектор, который содержит позади BamHI-места резки последовательность [САТ]6ТСА. После BamHI-переваривания, обработки Кленова и Ndel-переваривания вектора Ndel-отрезанный nitA-Pwo-амплификант сливают лигацией на 3′-конце посредством "blunt ends" в рамках считывания с последовательностью His6-мотива и полученный плазмид обозначают pDHE 18.
Для гетерологичной экспрессии в лабораторном масштабе засевают JM 109 (pDHE 17) из культуры с температурой 37°С 1:200 в 50 мл dYT-среды (см. Sambrook и др., 1989) с помощью 0,2% L-рамнозы и культуру в течение 8 часов при 30°С культивируют в вибрационной водяной ванне при инкубации. После клетки промывают один раз в 50 мМ трис/HCl, рН 7,5 в соответствии с OD600 от 10 ресуспендируют в том же буфере и посредством ультразвуковой обработки раскрывают. Над JM 109 (pDHE 18) производят аналогичную процедуру. Протеин полученного ультразвуковой обработкой, осветленного центрифугированием сырого экстракта по сравнению с неиндуцированным контролем определяют SDS-полиакриламиноэлектрофорезом. При названных условиях индукции доля нитрилазы в общем протеине составляет для JM 109 (pDHE 17) и JM 109 (pDHE 18) для каждого по 30%.
Для очистки нитрилазы с His6-мотивом из JM 109 (pDHE 18) клетки промывают в 50 мМ трис/HCl, рН 7,5, ресуспендируют соответственно прибл.50 OD600/мл и получают экстракты прессом French-Press (2 × при 20000 кг/см2). После осветления экстракта центрифугированием в течение 30 минут при 15000 g осуществляют очистку с помощью QIAexpress-Ni2+-NTA (фирмы QIAGEN). На 1 мл сырого экстракта применяют 1 мл матрицы, которую приводят в равновесие с помощью 20 мМ трис/HCl, рН 7,5. После загрузки колонки промывают с помощью 5 объемов колонки 20 мМ трис/HCl, 300 мМ NaCl, 40 мМ имидазола, рН 7,0 и элюируют с помощью 20 мМ трис/HCl, 300 мМ NaCl, 300 мМ имидазола, рН 7,5. Чистота, определенная по гель-электрофорезному методу, полученного таким образом протеина нитрилазы составляет >90%. После двухкратного диализа в 50 мМ трис/HCl, 0,1 мМ DTT, 0,5 М (NH4)2SO4, рН 7,5 очищенную нитрилазу можно хранить при -20°С.
Для сырых экстрактов для превращения 2-бензонитрила в бензойную кислоту определяют 2 ед./мг и для очищенных посредством QIAexpress-Ni2+-NTA нитрилаз с His6-мотивом при концентрации ферментов в 50 млг/мл 11 ед./мг. Одна единица соответствует при этом производству 1 мкмоля бензойной кислоты при начальной концентрации бензонитрила в 10 мМ, 30°С и рН 7,5. Превращение 2-бензонитрила в бензойную кислоту посредством сырого экстракта нитрилазы происходит в 50 мМ трис/HCl, рН 7,5, превращение с помощью очищенной нитрилазы в 50 мМ трис/HCl, рН 7,5, 0,1 мМ дитиотреитола. Образование бензойной кислоты определяют с помощью ВСЖХ (колонна RP18, 250×4, растворитель 47% метанол, 0,3% Н3PO4,).
Аналогично описанному выше примеру подвергают взаимодействию целый ряд нитрилов и определяют конверсию.
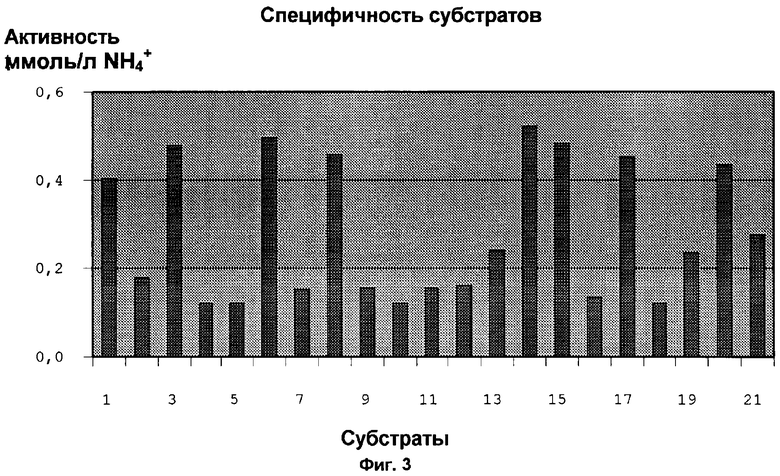
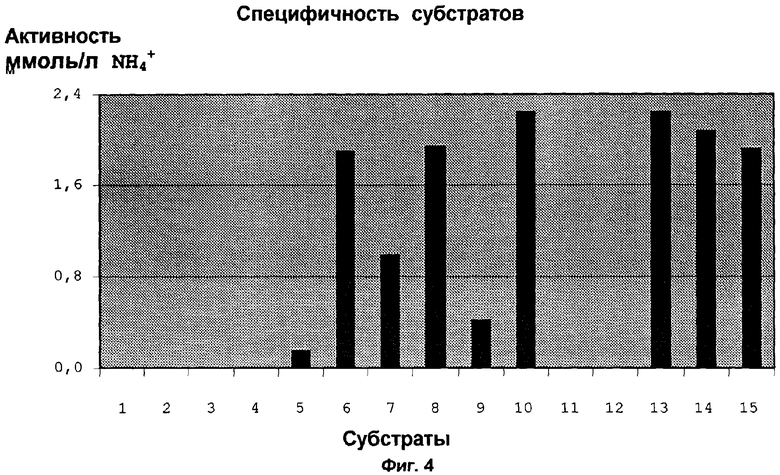
Штаммами Е.coli JM 109 (pDHE 17, соответственно pDHE 18) преобразуют различные нитрилы. Для этого клетки выращивают в 250 мл LB/Amp-среде + 2 г/л рамнозы при 30°С и 200 об/мин в течение 9 часов. Урожай клеток снимают центрифугированием (20 минут, 4°С, 5000 об/мин). Клетки ресуспендируют в 10 мМ фосфатного буфера с рН 7,2, так что концентрация биомассы составляет ок. 2 г биомассы/л. По 150 мкл клеточной суспензии помещают пипеткой в углубления микротитровой пластинки, пластинку после этого центрифугируют. Надосадочную жидкость отсасывают и клеточный гранулят промывают два раза с помощью Na2HPO4 (1,42 г/л в финаква, рН 7,2). После еще одной стадии центрифугирования клеточный гранулят ресуспендируют в субстратном растворе (150 мкл). Каждый 12 ряд микротитровой пластинки смешивают с субстратом. В качестве контроля берут ряд с субстратным раствором без клеток. Микротитровые пластинки инкубируют при 30°С и 200 об/мин в течение 1 часа в вибрационном инкубаторе. После этого клетки центрифугируют и в надосадочной жидкости определяют количество NH4-ионов с помощью прибора Biomek. Измерение производят при 620 нм относительно эталонной кривой, которая была построена с различными растворами NH4OH. В эксперименте 1 (см. фиг. 3, таблицу 1) в качестве субстрата применяют следующие субстраты: бензонитрил (=1), 3-гидроксипропионитрил (=2), 2-метилглютаронитрил (=3), 4-хлор-3-гидроксибутиронитрил (=4), малонодинитрил (=5), кротононитрил (=6), геранонитрил (=7), динитрил октандиевой кислоты (=8), пивалонитрил (=9), аминокапронитрил (=10), 3,4-дигидроксибензонитрил (=11), 3,5-дибром-4-гидроксибензонитрил (=12), 3-цианопиридин (=13), 4-бромбензилцианид (=14), 4-хлорбензилцианид (=15), 2-фенилбутиронитрил (=16), 2-хлорбензилцианид (=17), 2-пиридилацетонитрил (=18), 4-фторбензилцианид (=19), 4-метилбензонитрил (=20), бензилцианид (=21). В эксперименте 2 (см. фиг.4, таблицу 2), который проводят аналогично эксперименту 1, применяют следующие субстраты: 2-фенилпропионитрил (=1), манделонитрил (=2), 2-амино-2-фенилацетонитрил (=3), 2-гидроксипропионитрил (=4), 3,3-диметоксипропионитрил (=5), 3-циантиофен (=6), 3-цианметилтиофен (=7), бензонитрил (=8), пропионитрил (=9), нитрил транс-коричной кислоты (=10), 2-гидрокси-4-фенилбутиронитрил (=11), динитрил 3-фенилклютаровой кислоты (=12), фумаронитрил (=13), глютаронитрил (=14) валеронитрил (=15).




| название | год | авторы | номер документа |
|---|---|---|---|
| ГЕН ДЕСАТУРАЗЫ КИСЛОТЫ ЖИРНОГО РЯДА ИЗ РАСТЕНИЙ | 2000 |
|
RU2274657C2 |
| СПОСОБ ПОЛУЧЕНИЯ МОНОМЕРОВ И ИХ ПОЛИМЕРОВ | 2005 |
|
RU2390565C2 |
| ЦЕЛЬНОКЛЕТОЧНЫЙ БИОКАТАЛИЗАТОР | 2010 |
|
RU2534346C2 |
| ШТАММ БАКТЕРИЙ ALCALIGENES DENITRIFICANS - ПРОДУЦЕНТ НИТРИЛАЗЫ | 2007 |
|
RU2337954C1 |
| СРЕДСТВА И СПОСОБЫ ПОЛУЧЕНИЯ АМИДНЫХ СОЕДИНЕНИЙ С МЕНЬШИМ КОЛИЧЕСТВОМ АКРИЛОВОЙ КИСЛОТЫ | 2015 |
|
RU2730624C2 |
| СПОСОБ ПОЛУЧЕНИЯ КОМПОЗИЦИИ, ВКЛЮЧАЮЩЕЙ ПОЛИМЕР (МЕТ)АКРИЛАМИДА, И КОМПОЗИЦИЯ, ПОЛУЧЕННАЯ УКАЗАННЫМ СПОСОБОМ | 2004 |
|
RU2425886C2 |
| НИТРИЛГИДРАТАЗА ИЗ Rhodococcus | 2005 |
|
RU2385932C2 |
| НИТРИЛАЗА, ШТАММ RHODOCOCCUS RHODOCHROUS - ПРОДУЦЕНТ НИТРИЛАЗЫ (ВАРИАНТЫ), СПОСОБ ПОЛУЧЕНИЯ АКРИЛАТА АММОНИЯ, СПОСОБ ДЕТЕКТИРОВАНИЯ НИТРИЛА, СПОСОБ ОЧИСТКИ ПОЛИМЕРА | 1996 |
|
RU2188864C2 |
| Способ конструирования на основе бактерий рода Rhodococcus штамма-биокатализатора, обладающего нитрилазной активностью и повышенной операционной стабильностью, рекомбинантный штамм бактерий Rhodococcus rhodochrous, полученный таким способом, способ синтеза акриловой кислоты с использованием этого штамма в качестве биокатализатора | 2018 |
|
RU2731289C2 |
| НОВЫЕ ЦИТОХРОМ Р450-МОНООКСИГЕНАЗЫ И ИХ ПРИМЕНЕНИЕ ДЛЯ ОКИСЛЕНИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ | 2000 |
|
RU2285044C2 |
Изобретение относится к биотехнологии, в частности к выделенной последовательности нуклеиновых кислот, кодирующей полипептид с активностью нитрилазы. При этом в присутствии указанной нитрилазы нитрилы преобразуют в карбоновые кислоты. Заявленное изобретение позволяет получать хиральные карбоновые кислоты с высокой степенью эффективности и экономически более выгодно. 5 н. и 5 з.п. ф-лы, 4 ил., 2 табл.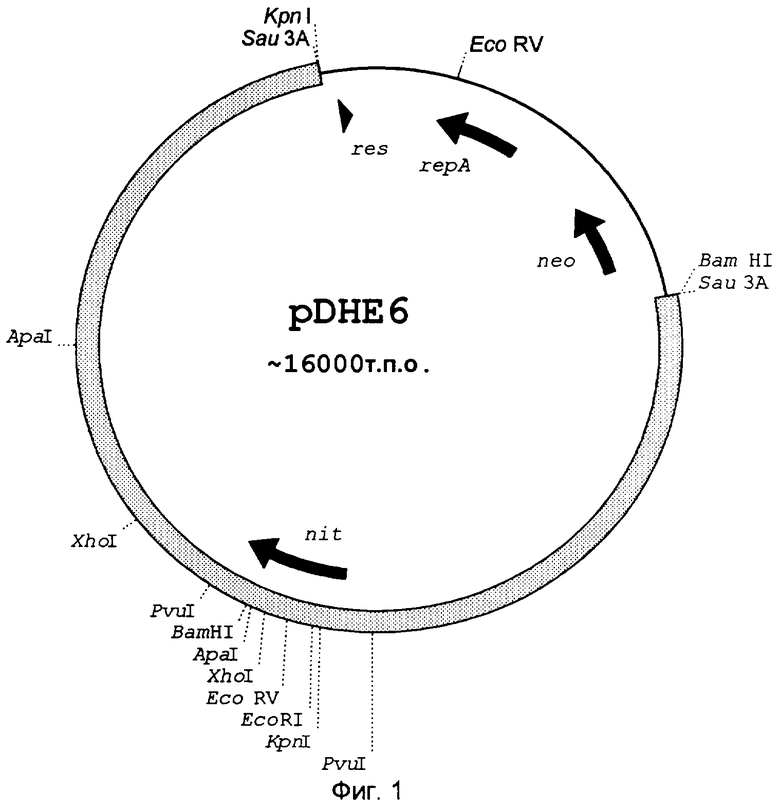
а) последовательность нуклеиновых кислот с представленной в SEQ ID N0:1 последовательностью,
б) последовательности нуклеиновых кислот, которые как результат дегенерированного генетического кода, производятся от представленной в SEQ ID NO:1 последовательности нуклеиновых кислот.
в присутствии аминокислотной последовательности по п.2 или 3 или растущего, покоящегося или раскрытого рекомбинантного микроорганизма, предпочтительно выбранного из группы, включающей бактерии вида Escherichia, Rhodococcus, Nocardia, Streptomyces или Mycobacterium, содержащего последовательность нуклеиновых кислот по п.1, конструкт нуклеиновых кислот по п.4 или вектор по п.5, преобразуют в карбоновые кислоты общей формулы II
причем преобразуют по меньшей мере 25 ммоль нитрила/ч·мг протеина или по меньшей мере 25 ммоль нитрила/ч·мг сухого веса и микроорганизма и причем заместители и переменные в формулах I и II имеют следующие значения:
n равно 0 или 1;
m равно 1, 2 или 3, причем при m>2 между двумя смежными аромами углерода может иметься одна двойная связь;
р равно 1;
А, В, D и Е означают независимо друг от друга СН, N или CR3;
Н означает О, S, NR4, СН или CR3, если n=0, или СН, N или CR3, если n=1;
причем два смежных остатка А, В, D, Е или Н вместе могут образовывать другое замещенное или незамещенное, ароматическое, насыщенное или частично насыщенное кольцо, содержащее от 5 до 8 атомов в кольце, которое может содержать один или несколько гетероатомов, таких как О, N или S, при этом не больше трех остатков А, В, D, Е или Н представляют собой гетероатом;
R1 означает водород, замещенные или незамещенные, разветвленный или неразветвленный С1-С1алкил, C1-С10алкокси, арил, гетарил или C1-С10алкиламино, гидроксил, галоген или амино;
R2 означает замещенные или незамещенные, разветвленный или неразветвленный С1-С1алкил, C1-С10алкокси, арил, гетарил или C1-С10алкиламино, гидроксил, амино;
R3 означает водород, замещенные или незамещенные, разветвленный или неразветвленный C1-С10алкил, C1-С10алкокси, арил, гетарил или С1-С10алкиламино, гидроксил, галоген или амино;
R4 означает водород, замещенный или незамещенный, разветвленный или неразветвленный С1-С10алкил.
| KOBAYASHI M et al | |||
| «Nitrilase from Phodococcus rhodochrous Jl», Journal of Biological Chemistry Bd 267 Nr 29, p.20746-20751 15.10.1992 | |||
| US 5135858, 04.08.1992 | |||
| ФРАГМЕНТ ДНК, КОДИРУЮЩИЙ ПОЛИПЕПТИД С АКТИВНОСТЬЮ НИТРИЛГИДРАТАЗЫ, РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК, КОДИРУЮЩАЯ ПОЛИПЕПТИД СО СВОЙСТВАМИ НИТРИЛГИДРАТАЗЫ, ШТАММ БАКТЕРИЙ ESHCERICHIA COLI - ПРОДУЦЕНТ ПОЛИПЕПТИДА СО СВОЙСТВАМИ НИТРИЛГИДРАТАЗЫ, СПОСОБ ПОЛУЧЕНИЯ ПОЛИПЕПТИДА СО СВОЙСТВАМИ НИТРИЛГИДРАТАЗЫ | 1991 |
|
RU2081173C1 |
Авторы
Даты
2006-09-20—Публикация
2001-02-27—Подача