Данное изобретение относится к новому применению соединений, разрушающих лиганд ИЛ-1β/рецептор ИЛ-1 (обозначаемых в данном контексте как "ИЛ-1β-соединения"), таких как маленькие молекулярные соединения, нарушающие взаимодействие лиганд ИЛ-1β - рецептор ИЛ-1, антитела к ИЛ-1β или антитела к рецептору ИЛ-1, например ИЛ-1β-связывающие молекулы, описанные в данном контексте, например антитела, раскрытые в данном контексте, например ИЛ-1β-связывающие соединения или рецептор ИЛ-1-связывающие соединения, и/или соединения РНК, снижающие уровни белков либо лигандов ИЛ-1β, либо рецептора ИЛ-1, для лечения и/или предупреждения аутовоспалительных синдромов, например синдрома ювенильного ревматоидного артрита или ревматоидного артрита взрослых, и к способам лечения и/или предупреждения аутовоспалительных синдромов, например синдрома ювенильного ревматоидного артрита или ревматоидного артрита взрослых, у млекопитающих, в частности у человека.
Интерлейкин-1β (ИЛ-1 бета, или ИЛ-1β, или Интерлейкин-1β имеет в данном контексте одинаковое значение) представляет собой сильный иммуномодулятор, который опосредует широкий круг иммунных и воспалительных ответов. Несоответствующая или избыточная продукция ИЛ-1β ассоциирована с патологией различных заболеваний и нарушений, таких как септицемия, септический или эндотоксический шок, аллергии, потеря костей, ишемия, инсульт, ревматоидный артрит и другие воспалительные нарушения. Антитела к ИЛ-1β предназначены для применения при лечении ИЛ-1-опосредованных заболеваний и нарушений; см., например, заявку WO 95/01997 и обсуждение во введении к ней и заявку WO 02/16436, содержание которых включено в виде ссылки.
В соответствии с настоящим изобретением в настоящее время обнаружено, что ИЛ-1β-соединения используют для предупреждения и лечения аутовоспалительных синдромов у пациентов, например у млекопитающих, особенно у человека. Аутовоспалительные синдромы согласно изобретению представляют собой, например, но без ограничения перечисленным, группу наследственных нарушений, характеризующихся рецидивирующими эпизодами воспаления, при которых, в противоположность аутоиммунным заболеваниям, отсутствуют высокие титры аутоантител или антиген-специфические Т-клетки. Кроме того, аутовоспалительные синдромы согласно изобретению показывают повышенный уровень секреции ИЛ-1β (утрата отрицательной регуляторной роли пирина, который, очевидно, мутирует при указанных заболеваниях), активацию NFkB и нарушенный апоптоз лейкоцитов. Аутовоспалительные синдромы согласно изобретению представляют собой синдромы Макла-Уэллса (MWS), семейный холодовый аутовоспалительный синдром (FCAS), мультисистемный воспалительный синдром новорожденных (NOMID), хронический детский неврологический, кожный, суставный (CINCA) синдром, семейную средиземноморскую лихорадку (FMF) и/или определенную форму ювенильного артрита, такую как системный идиопатический ювенильный артрит (SOIJA), определенную форму ювенильного ревматоидного артрита, такую как системный идиопатический ювенильный ревматоидный артрит, и/или определенную форму ревматоидного артрита взрослых. Предпочтительно, когда ИЛ-1β-соединения используют для предупреждения и лечения ювенильного ревматоидного артрита и ревматоидного артрита взрослых и/или синдрома Макла-Уэллса.
В соответствии с определенными фактами, обнаруженными в настоящем изобретении, представлены следующие варианты осуществления:
Настоящее изобретение относится к композициям и способам предупреждения и лечения аутовоспалительных синдромов у млекопитающих, в том числе человека. Соответственно ИЛ-1β-соединения используют также для получения лекарственных средств и лекарственных препаратов для лечения аутовоспалительных синдромов. В специальном аспекте данные лекарственные средства и лекарственные препараты включают терапевтически эффективное количество ИЛ-1β-соединений с фармацевтически приемлемым носителем.
В другом варианте осуществления изобретение представляет применение антитела, которое специфически связывается с любым из выше- или нижеописанных полипептидов, например лигандом ИЛ-1β или рецептором ИЛ-1β, предпочтительно лигандом ИЛ-1β, для предупреждения и/или лечения синдрома ювенильного ревматоидного артрита, ревматоидного артрита взрослых и/или других аутовоспалительных синдромов и синдрома Макла-Уэллса. Необязательно антитело представляет собой моноклональное антитело, гуманизированное антитело, фрагмент антитела или одноцепочечное антитело. В одном аспекте настоящее изобретение относится к выделенному антителу, которое связывает лиганд ИЛ-1β. В другом аспекте антитело ингибирует или нейтрализует активность лиганда ИЛ-1β (антагонистическое антитело). В другом аспекте антитело представляет собой моноклональное антитело, которое имеет либо остатки человеческого, либо нечеловеческого участка, определяющего комплементарность (CDR) и остатки человеческой каркасной области (FR). Антитело может быть меченым и может быть иммобилизованным на твердом носителе. В другом аспекте антитело представляет собой фрагмент антитела, моноклональное антитело, одноцепочечное антитело или антиидиотипическое антитело. В еще одном варианте осуществления настоящее изобретение представляет композицию, включающую антитело к лиганду ИЛ-1β или рецептору ИЛ-1β, предпочтительно антитело к лиганду ИЛ-1β, в смеси с фармацевтически приемлемым носителем. В одном аспекте композиция включает терапевтически эффективное количество антитела. Предпочтительно, когда композиция стерильна. Композицию можно ввести в форме жидкого фармацевтического препарата, в который может быть введен консервант с целью достижения более длительной стабильности при хранении. Альтернативно антитело представляет собой моноклональное антитело, фрагмент антитела, гуманизированное антитело или одноцепочечное антитело.
В другом варианте осуществления изобретение представляет собой применение ИЛ-1β-соединений, например антитела к ИЛ-1β, которое способно нарушать цепь положительной обратной связи ИЛ-1β in vivo, для предупреждения и/или лечения ювенильного ревматоидного артрита, или ревматоидного артрита взрослых, и/или других аутовоспалительных синдромов, и/или синдрома Макла-Уэллса. Данная положительная обратная связь in vivo приводит к самоподдерживающейся сверхпродукции ИЛ-1β у данных пациентов.
В другом варианте осуществления изобретение представляет применение ИЛ-1β-соединений, например антитела к ИЛ-1β, при заболеваниях, связанных с мутацией гена MEFV, находящегося на хромосоме 16р13 и кодирующего белок пирин (известный также как маренострин). Пирин экспрессируется в гранулоцитах, моноцитах и синовиальных фибробластах. Пирин включен в процессинг ИЛ-1β.
В следующем варианте осуществления изобретение относится к изделию, включающему: (а) представленную композицию, содержащую антитело к лиганду ИЛ-1β или рецептору ИЛ-1β, предпочтительно антитело к лиганду ИЛ-1β; (б) контейнер, содержащий композицию, и (в) этикетку, прикрепленную к указанному контейнеру, или вкладыш в упаковку, включенный в данный контейнер, относящийся к применению указанного антитела к лиганду ИЛ-1β или рецептору ИЛ-1β, предпочтительно антитела к лиганду ИЛ-1β, при лечении ювенильного ревматоидного артрита, или ревматоидного артрита взрослых, и/или других аутовоспалительных синдромов, и/или синдрома Макла-Уэллса. Композиция может включать терапевтически эффективное количество антитела к лиганду ИЛ-1β или рецептору ИЛ-1β, предпочтительно к лиганду ИЛ-1β.
В еще одном варианте осуществления изобретение представляет способ или применение, как определено выше, заключающиеся в совместном введении терапевтически эффективного количества ИЛ-1β-соединений в свободной форме или в форме соли, предпочтительно в фармацевтически приемлемой форме доставки, такой как внутривенная или подкожная, и второй лекарственной субстанции, причем вторая лекарственная субстанция представляет собой противовоспалительное соединение в свободной форме или в форме соли.
В еще одном следующем варианте осуществления ИЛ-1β-соединения, используемые согласно изобретению, представляют собой ИЛ-1β-связывающую молекулу, которая включает антигенсвязывающий центр, включающий по меньшей мере один вариабельный домен тяжелой цепи иммуноглобулина (VH), который включает следующие друг за другом гипервариабельные участки CDR1, CDR2 и CDR3, причем указанный CDR1 имеет последовательность аминокислот Val-Tyr-Gly-Met-Asn, указанный CDR2 имеет последовательность аминокислот Ile-Ile-Trp-Tyr-Asp-Gly-Asp-Asn-Gln-Tyr-Tyr-Ala-Asp-Ser-Val-Lys-Gly и указанный CDR3 имеет последовательность аминокислот Asp-Leu-Arg-Thr-Gly-Pro, и их непосредственные эквиваленты.
В еще одном варианте осуществления ИЛ-1β-соединение, используемое согласно изобретению, представляет собой ИЛ-1β-связывающую молекулу, которая включает по меньшей мере один вариабельный домен легкой цепи иммуноглобулина (VL), который включает следующие друг за другом гипервариабельные участки CDR1', CDR2' и CDR3', причем указанный CDR1' имеет последовательность аминокислот Arg-Ala-Ser-Gln-Ser-Ile-Gly-Ser-Ser-Leu-His, указанный CDR2' имеет последовательность аминокислот Ala-Ser-Gln-Ser-Phe-Ser и указанный CDR3' имеет последовательность аминокислот His-Gln-Ser-Ser-Ser-Leu-Pro, и их непосредственные эквиваленты.
В еще одном варианте осуществления, ИЛ-1β-соединение, используемое согласно изобретению, представляет собой однодоменную ИЛ-1β-связывающую молекулу, включающую выделенную тяжелую цепь иммуноглобулина, включающую вариабельный домен тяжелой цепи (VH), как определено выше, например, предназначенную для получения лекарственного препарата для лечения синдрома ювенильного ревматоидного артрита или ревматоидного артрита взрослых и/или аутовоспалительных синдромов, предпочтительно синдрома ювенильного ревматоидного артрита, или ревматоидного артрита взрослых, и/или синдрома Макла-Уэллса.
В еще одном варианте осуществления ИЛ-1β-соединение, используемое согласно изобретению, представляет собой ИЛ-1β-связывающую молекулу, включающую вариабельные домены как тяжелой (VH), так и легкой (VL) цепи, в которых указанная ИЛ-1β-связывающая молекула включает по меньшей мере один антигенсвязывающий центр, содержащий:
а) вариабельный домен тяжелой цепи иммуноглобулина (VH), который включает следующие друг за другом гипервариабельные участки CDR1, CDR2 и CDR3, причем указанный CDR1 имеет последовательность аминокислот Val-Tyr-Gly-Met-Asn, указанный CDR2 имеет последовательность аминокислот Ile-Ile-Trp-Tyr-Asp-Gly-Asp-Asn-Gln-Tyr-Tyr-Ala-Asp-Ser-Val-Lys-Gly и указанный CDR3 имеет последовательность аминокислот Asp-Leu-Arg-Thr-Gly-Pro, и
б) вариабельный домен легкой цепи иммуноглобулина (VL), который включает следующие друг за другом гипервариабельные участки CDR1', CDR2' и CDR3', причем указанный CDR1' имеет последовательность аминокислот Arg-Ala-Ser-Gln-Ser-Ile-Gly-Ser-Ser-Leu-His, указанный CDR2' имеет последовательность аминокислот Ala-Ser-Gln-Ser-Phe-Ser и указанный CDR3' имеет последовательность аминокислот His-Gln-Ser-Ser-Ser-Leu-Pro;
и их непосредственные эквиваленты.
Пока не указано иначе, любую полипептидную цепь в данном контексте описывают как имеющую последовательность аминокислот, начинающуюся с N-концевого края и заканчивающуюся С-концевым краем. Когда антигенсвязывающий центр включает оба, VH- и VL-домены, они могут находиться на одной и той же полипептидной молекуле или, предпочтительно, каждый домен может находиться на другой цепи, причем VH-домен является частью тяжелой цепи иммуноглобулина или ее фрагмента и VL является частью легкой цепи иммуноглобулина или ее фрагмента.
Под выражением "ИЛ-1β-связывающая молекула" подразумевают любую молекулу, способную связываться с лигандом ИЛ-1β либо в виде монокомпонента, либо в ассоциации с другими молекулами. Реакцию связывания можно показать стандартными методами (качественные анализы), включая, например, биоанализ, предназначенный для определения ингибирования связывания ИЛ-1β со своим рецептором или любого рода анализы связывания относительно отрицательного контрольного теста, в котором используют антитело неродственной специфичности, но того же самого изотипа, например антитело к CD25. Предпочтительно, когда связывание ИЛ-1β-связывающих молекул, представленных в изобретении, с ИЛ-1β можно показать в конкурентном анализе связывания.
Примеры антигенсвязывающих молекул включают антитела, как продуцируемые В-клетками или гибридомами, так и химерные, с привитым CDR, либо человеческие антитела или какой-либо их фрагмент, например F(ab')2 и фрагменты Fab, а также одноцепочечные или однодоменные антитела.
Одноцепочечное антитело состоит из вариабельных доменов тяжелой и легкой цепей антитела, ковалентно связанных пептидным линкером, обычно состоящим из 10-30 аминокислот, предпочтительно из 15-25 аминокислот. Вследствие этого данная структура не включает константную часть тяжелой и легкой цепей, и считают, что маленький пептидный спейсер является менее антигенным, чем целая константная часть. Под выражением "химерное антитело" подразумевают антитело, в котором константные области тяжелой и легкой цепей или обеих цепей имеют человеческую природу, тогда как вариабельные домены обеих, тяжелой и легкой цепей, имеют нечеловеческую (например, мышиную) природу или человеческую природу, но выделены из другого человеческого антитела. Под выражением "CDR-привитое антитело" подразумевают антитело, в котором гипервариабельные участки (CDR) выделены из донорного антитела, такого как нечеловеческое (например, мышиное) антитело, или другого человеческого антитела, тогда как все или в основном все другие части иммуноглобулина, например константные области и высококонсервативные части вариабельных доменов, т.е. каркасные области, выделены из акцепторного антитела человеческой природы. Однако CDR-привитое антитело может включать несколько аминокислот донорной последовательности в каркасных областях, например в частях каркасных областей, прилежащих к гипервариабельным участкам. Под термином "человеческое антитело" подразумевают антитело, в котором константная и вариабельная области обеих, тяжелой и легкой цепей, являются полностью человеческой природы или в существенной степени идентичны последовательностям человеческой природы, необязательно из одного и того же антитела, и он включает антитела, продуцируемые мышами, в которых гены вариабельной и константной частей мышиного иммуноглобулина заменены соответствующими человеческими аналогами, например, как в общих чертах описано в ЕР 0546073 B1, USP 5545806, USP 5569825, USP 5625126, USP 5633425, USP 5661016, USP 5770429, ЕР 0 438474 B1 и ЕР 0463151 B1.
Особенно предпочтительными ИЛ-1β-связывающими молекулами, представленными в изобретении, являются человеческие антитела, особенно антитело ACZ 885, как описано ниже в примерах и в заявке WO 02/16436.
Таким образом, в предпочтительных антителах, представленных в изобретении, вариабельные домены обеих, тяжелой и легкой цепей, имеют человеческую природу, например данные домены антитела ACZ 885, которые показаны в SEQ ID NO: 1 и SEQ ID NO: 2. Домены константных областей предпочтительно также включают подходящие домены человеческой константной области, например, как описано в работе "Sequences of Proteins of Immunological Interest", Kabat E.A. et al., Министерство здравоохранения и социального обеспечения США, Служба здравоохранения. Национальный институт здравоохранения.
Гипервариабельные участки могут быть связаны с любого рода каркасными участками, хотя предпочтительно имеют человеческую природу. Подходящие каркасные участки описаны в работе Kabat E.A. et al., там же. Предпочтительный каркас тяжелой цепи представляет собой каркас тяжелой цепи человека, например каркас антитела ACZ 885, который показан в SEQ ID NO: 1. Он состоит из последовательности участков FR1, FR2, FR3 и FR4. Аналогичный образом SEQ ID NO: 2 представляет предпочтительный каркас легкой цепи ACZ 885, который состоит из следующих друг за другом участков FR1', FR2', FR3' и FR4'.
Соответственно изобретение представляет также ИЛ-1β-связывающую молекулу, которая включает по меньшей мере один антигенсвязывающий центр, содержащий либо первый домен, имеющий последовательность аминокислот, в существенной степени идентичную показанной в SEQ ID NO: 1, начиная с аминокислоты в положении 1 и заканчивая аминокислотой в положении 118, либо первый домен, как описано выше, и второй домен, имеющий последовательность аминокислот в существенной степени идентичную показанной в SEQ ID NO: 2, начиная с аминокислоты в положении 1 и заканчивая аминокислотой в положении 107.
Моноклональные антитела, возникающие к белку, в естественных условиях обнаруживаемому у всех людей, как правило образуются в нечеловеческой системе, например у мышей, и в таком случае являются типично нечеловеческими белками. Как прямое следствие этого, ксеногенное антитело такое, как продуцируемое гибридомой, при введении человеку вызывает нежелательный иммунный ответ, который преимущественно опосредуется константной частью ксеногенного иммуноглобулина. Это явно ограничивает применение данных антител, поскольку их нельзя вводить в течение длительного периода времени. Вследствие этого особенно предпочтительным является применение одноцепочечных, однодоменных, химерных, CDR-привитых или в особенности человеческих антител, которые, вероятно, не будут вызывать существенный аллогенный ответ при введении человеку.
В свете вышеизложенного более предпочтительная ИЛ-1β-связывающая молекула, представленная в изобретении, выбрана из человеческого антитела к ИЛ-1β, которое включает по меньшей мере
а) тяжелую цепь иммуноглобулина или ее фрагмент, который включает (i) вариабельный домен, содержащий следующие друг за другом гипервариабельные участки CDR1, CDR2 и CDR3 и (ii) константную часть человеческой тяжелой цепи или ее фрагмент; причем указанный CDR1 имеет последовательность аминокислот Val-Tyr-Gly-Met-Asn, указанный CDR2 имеет последовательность аминокислот Ile-Ile-Trp-Tyr-Asp-Gly-Asp-Asn-Gln-Tyr-Tyr-Ala-Asp-Ser-Val-Lys-Gly и указанный CDR3 имеет последовательность аминокислот Asp-Leu-Arg-Thr-Gly-Pro, и
б) легкую цепь иммуноглобулина или ее фрагмент, который включает (i) вариабельный домен, содержащий следующие друг за другом гипервариабельные участки и константную часть человеческой легкой цепи или ее фрагмент; причем указанный CDR1' имеет последовательность аминокислот Arg-Ala-Ser-Gln-Ser-Ile-Gly-Ser-Ser-Leu-His, указанный CDR2' имеет последовательность аминокислот Ala-Ser-Gln-Ser-Phe-Ser и указанный CDR3' имеет последовательность аминокислот His-Gln-Ser-Ser-Ser-Leu-Pro,
и их непосредственные эквиваленты.
Альтернативно ИЛ-1β-связывающая молекула, представленная в изобретении, может быть выбрана из одноцепочечной связывающей молекулы, которая включает антигенсвязывающий центр, содержащий
а) первый домен, включающий следующие друг за другом гипервариабельные участки CDR1, CDR2 и CDR3, причем указанный CDR1 имеет последовательность аминокислот Val-Tyr-Gly-Met-Asn, указанный CDR2 имеет последовательность аминокислот Ile-Ile-Trp-Tyr-Asp-Gly-Asp-Asn-Gln-Tyr-Tyr-Ala-Asp-Ser-Val-Lys-Gly и указанный CDR3 имеет последовательность аминокислот Asp-Leu-Arg-Thr-Gly-Pro,
б) второй домен, включающий гипервариабельные участки CDR1', CDR2' и CDR3', причем указанный CDR1' имеет последовательность аминокислот Arg-Ala-Ser-Gln-Ser-Ile-Gly-Ser-Ser-Leu-His, указанный CDR2' имеет последовательность аминокислот Ala-Ser-Gln-Ser-Phe-Ser, и указанный CDR3' имеет последовательность аминокислот His-Gln-Ser-Ser-Ser-Leu-Pro и
в) пептидный линкер, который связан с N-концевым краем первого домена и с С-концевым краем второго домена либо с С-концевым краем первого домена и с N-концевым краем второго домена, и их непосредственные эквиваленты.
Как хорошо известно, минорные изменения в последовательности аминокислот, такие как делеция, добавление или замена одной, нескольких или даже ряда аминокислот, могут привести к образованию аллельной формы исходного белка, который имеет в существенной степени идентичные свойства.
Таким образом под термином "их непосредственные эквиваленты" подразумевают любую однодоменную ИЛ-1β-связывающую молекулу (молекулу X),
(i) в которой гипервариабельные участки CDR1, CDR2 и CDR3, взятые в целом, по меньшей мере на 80% гомологичны, предпочтительно по меньшей мере на 90% гомологичны, более предпочтительно по меньшей мере на 95% гомологичны гипервариабельным участкам, как показано выше, и
(ii) которая способна ингибировать связывание ИЛ-1β с его рецептором практически в той же самой степени, что эталонная молекула, имеющая каркасные участки, идентичные каркасным участкам молекулы X, но имеющая гипервариабельные участки CDR1, CDR2 и CDR3, идентичные приведенным выше,
или любую ИЛ-1β-связывающую молекулу, имеющую по меньшей мере два домена/центра связывания (молекула X')
(i) в которой гипервариабельные участки CDR1, CDR2, CDR3, CDR1', CDR2' и CDR3', взятые в целом, по меньшей мере на 80% гомологичны, предпочтительно по меньшей мере на 90% гомологичны, более предпочтительно по меньшей мере на 95% гомологичны гипервариабельным участкам, как показано выше, и
(ii) которая способна ингибировать связывание ИЛ-1β с его рецептором практически в той же самой степени, что эталонная молекула, имеющая каркасные участки и константные части, идентичные молекуле X, но имеющая гипервариабельные участки CDR1, CDR2, CDR3, CDR1', CDR2' и CDR3' идентичные приведенным выше.
В следующем аспекте изобретение представляет также ИЛ-1β-связывающую молекулу, включающую вариабельные домены как тяжелой (VH), так и легкой цепи (VL), в которых указанная ИЛ-1β-связывающая молекула включает по меньшей мере один антигенсвязывающий центр, содержащий:
а) вариабельный домен тяжелой цепи иммуноглобулина (VH), который включает следующие друг за другом гипервариабельные участки CDR1, CDR2 и CDR3, причем указанный CDR1 имеет последовательность аминокислот Ser-Tyr-Trp-Ile-Gly, указанный CDR2 имеет последовательность аминокислот Ile-Ile-Tyr-Pro-Ser-Asp-Ser-Asp-Thr-Arg-Tyr-Ser-Pro-Ser-Phe-Gln-Gly и указанный CDR3 имеет последовательность аминокислот Tyr-Thr-Asn-Trp-Asp-Ala-Phe-Asp-Ile, и
б) вариабельный домен легкой цепи иммуноглобулина (VL), который включает CDR3', гипервариабельный участок, имеющий последовательность аминокислот GIn-Gln-Arg-Ser-Asn-Trp-Met-Phe-Pro;
и его непосредственные эквиваленты.
В следующем аспекте изобретение представляет ИЛ-1β-связывающую молекулу, включающую вариабельные домены как тяжелой (VH), так и легкой (VL) цепи, где указанная ИЛ-1β-связывающая молекула включает по меньшей мере один антигенсвязывающий центр, содержащий:
а) вариабельный домен тяжелой цепи иммуноглобулина (VH), который включает следующие друг за другом гипервариабельные участки CDR1, CDR2 и CDR3, причем указанный CDR1 имеет последовательность аминокислот Ser-Tyr-Trp-Ile-Gly, указанный CDR2 имеет последовательность аминокислот Ile-Ile-Tyr-Pro-Ser-Asp-Ser-Asp-Thr-Arg-Tyr-Ser-Pro-Ser-Phe-Gln-Gly и указанный CDR3 имеет последовательность аминокислот Tyr-Thr-Asn-Trp-Asp-Ala-Phe-Asp-Ile, и
б) вариабельный домен легкой цепи иммуноглобулина (VL), который включает следующие друг за другом гипервариабельные участки CDR1', CDR2' и CDR3', причем указанный CDR1' имеет последовательность аминокислот Arg-Ala-Ser-Gln-Ser-Val-Ser-Ser-Tyr-Leu Ala, указанный CDR2' имеет последовательность аминокислот Asp-Ala-Ser-Asn-Arg-Ala-Thr и указанный CDR3' имеет последовательность аминокислот GIn-Gln-Arg-Ser-Asn-Trp-Met-Phe-Pro;
и его непосредственные эквиваленты.
В настоящем описании последовательности аминокислот по меньшей мере на 80% гомологичны друг другу, если они имеют по меньшей мере 80% идентичных остатков аминокислот в аналогичном положении при оптимальном выравнивании последовательностей, гэпы или инсерции в последовательностях аминокислот считают неидентичными остатками.
Ингибирование связывания ИЛ-1β с его рецептором можно удобно протестировать с помощью различных анализов, включая такие анализы, которые описаны в заявке WO 02/16436. Под термином "в той же степени" подразумевают, что эталонные и эквивалентные молекулы демонстрируют на статистической основе в основном идентичные кривые ингибирования связывания ИЛ-1β в одном из анализов, на которые ссылаются выше. Например, ИЛ-1β-связывающие молекулы, представленные в изобретении, как правило, имеют IC50 (50% ингибирующую концентрацию) связывания ИЛ-1β с его рецептором, которая лежит в интервале ±×5 от указанной величины, предпочтительно практически такую же, как IC50 соответствующей эталонной молекулы, которая проанализирована, как описано выше.
Например, используемый анализ может представлять собой анализ конкурентного ингибирования связывания ИЛ-1β растворимыми рецепторами ИЛ-1 и ИЛ-1β-связывающими молекулами, представленными в изобретении.
Наиболее предпочтительно, когда ИЛ-1β-связывающая молекула, предназначенная для применения согласно изобретению, представляет собой человеческое антитело к ИЛ-1, которое включает по меньшей мере
а) одну тяжелую цепь, которая включает вариабельный домен, имеющий последовательность аминокислот, в существенной степени идентичную показанной в SEQ ID NO: 1, начиная с аминокислоты в положении 1 и заканчивая аминокислотой в положении 118, и константную часть человеческой тяжелой цепи; и
б) одну легкую цепь, которая включает вариабельный домен, имеющий последовательность аминокислот, в существенной степени идентичную показанной в SEQ ID NO: 2, начиная с аминокислоты в положении 1 и заканчивая аминокислотой в положении 107 и константную часть человеческой легкой цепи.
Наиболее предпочтительно, когда ИЛ-1β-связывающая молекула, предназначенная для применения согласно изобретению, представляет собой ACZ885 (см. Пример).
Константная часть человеческой тяжелой цепи может представлять собой тип γ1, γ2, γ3, γ4, µ, α1, α2, δ или ε, предпочтительно тип γ, более предпочтительно тип γ1, тогда как константная часть человеческой легкой цепи может представлять собой тип к или λ (который включает подтипы λ1, λ2 и λ3), но предпочтительно представляет собой тип κ. Последовательности аминокислот всех данных константных частей приведены в работе Kabat et al., см. там же.
ИЛ-1β-связывающую молекулу, представленную в изобретении, можно продуцировать технологиями рекомбинантной ДНК, как, например, описано в заявке WO 02/16436.
В еще одном варианте осуществления изобретения ИЛ-1β-соединения могут представлять собой антитела, которые обладают специфичностью связывания в отношении антигенного эпитопа человеческого ИЛ-1β, который включает петлю, содержащую остаток Glu 64 зрелого человеческого ИЛ-1β (остаток Glu 64 зрелого человеческого ИЛ-1β соответствует остатку 180 предшественника человеческого ИЛ-1β). Данный эпитоп находится вне центра распознавания рецептора ИЛ-1β и, вследствие этого, наиболее удивительно, что антитела к данному эпитопу, например антитело ACZ 885, способны ингибировать связывание ИЛ-1β со своим рецептором. Таким образом, применение данных антител для лечения ювенильного ревматоидного артрита, и ревматоидного артрита взрослых, и/или аутовоспалительных синдромов, и/или синдрома Макла-Уэллса является новым и включено в объем настоящего изобретения.
Таким образом, в следующем аспекте изобретение включает применение антитела к ИЛ-1β, которое обладает антигенсвязывающей специфичностью в отношении антигенного эпитопа человеческого ИЛ-1β, который включает петлю, содержащую остаток Glu 64 зрелого человеческого ИЛ-1β, и который способен ингибировать связывание ИЛ-1β с его рецептором, для лечения ювенильного ревматоидного артрита, или ревматоидного артрита взрослых, и/или аутовоспалительных синдромов, и/или синдрома Макла-Уэллса.
В последующих аспектах изобретение включает:
i) применение антитела к ИЛ-1β, которое обладает антигенсвязывающей специфичностью в отношении антигенного эпитопа зрелого человеческого ИЛ-1β, которое включает петлю, содержащую остаток Glu 64, и который способно ингибировать связывание ИЛ-1β с его рецептором, для предупреждения и/или лечения ювенильного ревматоидного артрита, или ревматоидного артрита взрослых, и/или аутовоспалительных синдромов, и/или синдрома Макла-Уэллса,
ii) способ предупреждения и/или лечения ювенильного ревматоидного артрита, или ревматоидного артрита взрослых, и/или аутовоспалительных синдромов, и/или синдрома Макла-Уэллса у пациента, который заключается во введении пациенту эффективного количества антитела к ИЛ-1β, которое обладает антигенсвязывающей специфичностью в отношении антигенного эпитопа зрелого человеческого ИЛ-1β, которое включает петлю, содержащую остаток Glu 64, и которое способно ингибировать связывание ИЛ-1β с его рецептором;
iii) фармацевтическую композицию, включающую антитело к ИЛ-1β, которое обладает антигенсвязывающей специфичностью в отношении антигенного эпитопа зрелого человеческого ИЛ-1β, которое включает петлю, содержащую остаток Glu 64, и которое способно ингибировать связывание ИЛ-1β с его рецептором, в комбинации с фармацевтически приемлемым наполнителем, разбавителем или носителем, для лечения синдрома ювенильного ревматоидного артрита, или ревматоидного артрита взрослых, и/или аутовоспалительных синдромов, и/или синдрома Макла-Уэллса;
iv) применение антитела к ИЛ-1β, которое обладает антигенсвязывающей специфичностью в отношении антигенного эпитопа зрелого человеческого ИЛ-1β, которое включает петлю, содержащую остаток Glu 64, и которое способно ингибировать связывание ИЛ-1β с его рецептором, для получения лекарственного препарата для лечения синдрома ювенильного ревматоидного артрита, или ревматоидного артрита взрослых, и/или аутовоспалительных синдромов, и/или синдрома Макла-Уэллса. Для целей настоящего описания антитело "способно ингибировать связывание ИЛ-1β", если антитело способно ингибировать связывание ИЛ-1β со своим рецептором в существенной мере в той же степени, что антитело ACZ 885, т.е. имеет константу равновесия диссоциации (KD), измеренную, например, с помощью стандартного анализа BIAcore, как описано в примере, 10 нМ или ниже, например, 1 нМ или ниже, предпочтительно 100 пМ или ниже, более предпочтительно 50 пМ или ниже.
Таким образом в еще одном следующем аспекте изобретение представляет применение антитела к ИЛ-1β, которое имеет KD связывания с ИЛ-1β приблизительно 10 нМ, 1 нМ, предпочтительно 100 пМ, более предпочтительно 50 пМ или меньше, для лечения синдрома ювенильного ревматоидного артрита, или ревматоидного артрита взрослых, и/или аутовоспалительных синдромов. Данный аспект изобретения также включает применения способов и композиций таких высокоаффинных антител, как описано выше для антител к ИЛ-1β, имеющих специфичность связывания в отношении антигенной детерминанты зрелого человеческого ИЛ-1β, которая включает петлю, содержащую Glu 64.
В настоящем описании выражение "синдром ювенильного ревматоидного артрита, или ревматоидного артрита взрослых, и/или аутовоспалительные синдромы" охватывает все заболевания и медицинские состояния, которые являются частью синдрома ювенильного ревматоидного артрита, или ревматоидного артрита взрослых, и/или аутовоспалительных синдромов, как непосредственно, так и опосредованно, при заболевании или медицинском состоянии, включая этиологию, возникновение, развитие, устойчивость или патологию заболевания или состояния.
В настоящем описании выражение "синдром Макла-Уэллса" (также "MWS") охватывает все заболевания и медицинские состояния, которые являются частью "синдрома Макла-Уэллса", как непосредственно, так и опосредованно, при заболевании или медицинском состоянии, включая этиологию, возникновение, развитие, устойчивость или патологию заболевания или состояния.
Соединения формулы I можно вводить в виде единственного активного ингредиента или в сочетании, например в качестве вспомогательного компонента, с другими лекарственными препаратами, например с иммунодепрессантами, или иммуномодуляторами, или другими противовоспалительными агентами, например, для лечения или предупреждения острого или хронического отторжения алло- или ксенотрансплантата или воспалительных или аутоиммунных нарушений, либо с химиотерапевтическим агентом, например антипролиферативным агентом, действующим на злокачественные клетки. Например, антитела, соответствующие изобретению, можно использовать в комбинации с ингибитором кальцинейрина, например, циклоспорином А или FK 506; ингибитором mTOR, например, рапамицином, 40-O-(2-гидроксиэтил)-рапамицином, CCI779, АВТ578, АР23573, АР23464, АР23675, АР23841, TAFA-93, биолимусом-7 или биолимусом-9; аскомицином, обладающим иммунодепрессивными свойствами, например АВТ-281, ASM981 и т.п.; кортикосетроидами, циклофосфамидом, азатиопреном, метотрексатом, лейлуномидом, мизорибином, микофеноловой кислотой или солью; микофенолят мофетилом; 15-дезоксиспергуалином или его иммунодепрессивным гомологом, аналогом или производным; ингибитором РКС, например, как описано в заявках WO 02/38561 или WO 03/82859, например, соединением, представленным в примере 56 или 70; ингибитором киназы JAK3, например N-бензил-3,4-дигидрокси-бензилиден-цианоацетамид[-суапо-(3,4-дигидрокси)-]N-бензилциннамамидом (Тирфостином AG 490), продигиозином 25-С (PNU 156804), [4-(4'-гидроксифенил)-амино-6,7-диметоксихиназолином] (WHI-Р131), [4-(3'-бром-4'-гидроксифенил)-амино-6,7-диметоксихиназолином] (WHI-Р154), [4-(3',5'-дибром-4'-гидроксифенил)-амино-6,7-диметоксихиназолином] WHI-P97, KRX-211, 3-{(3R,4R)-4-метил-3-[метил-(7Н-пирроло[2,3-d]пиримидин-4-ил)-амино]-пиперидин-1-ил}-3-оксо-пропионитрилом, в свободной форме или в форме фармацевтически приемлемой соли, например, моноцитрата (называемого также СР-690550), или соединения, как описано в заявках WO 04/052359 или WO 05/066156; иммуносупрессивными моноклональными антителами, например моноклональными антителами к рецепторам лейкоцитов, например МНС, CD2, CD3, CD4, CD7, CD8, CD25, CD28, CD40, CD45, CD52, CD58, CD80, CD86 или их лигандам; другими иммуномодулирующими соединениями, например рекомбинантной связывающей молекулой, имеющей по меньшей мере часть внеклеточного домена CTLA4, или ее мутанта, например по меньшей мере внеклеточной части CTLA4 или ее мутанта, присоединенного к последовательности белка не-CTLA4, например CTLA4Ig (например, обозначенного АТСС 68629), или его мутанта, например LEA29Y; ингибиторами молекул адгезии, например антагонистами LFA-1, антагонистами ICAM-1 или -3, антагонистами VCAM-4 или антагонистами VLA-4, или химиотерапевтическим агентом, например паклитакселом, гемцитабином, цисплатином, доксорубицином или 5-фторурацилом; или противоинфекционным агентом. Иммуномодулирующие лекарственные препараты, которые, как предполагают, эффективны в комбинации с соединением, представленным в настоящем изобретении, включают, например
- медиаторы, например, ингибиторы активности mTOR, в том числе рапамицин формулы
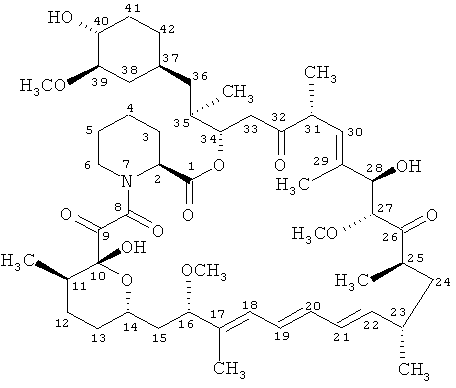
и производные рапамицина, например, включая
производные 40-O-алкил-рапамицина, такие как производные 40-O-гидроксиалкил-рапамицина, такие как 40-O-(2-гидрокси)-этил-рапамицин (эверолимус),
производные 32-дезоксо-рапамицина и производные 32-гидроксирапамицина, такие как 32-дезоксорапамицин, производные 16-O-замещенного рапамицина, такие как 16-пент-2-инилокси-32-дезоксорапамицин, 16-пент-2-инилокси-32-(S или R)-дигидро-рапамицин, 16-пент-2-инилокси-32-(S или R)-дигидро-40-O-(2-гидроксиэтил)-рапамицин,
производные рапамицина, которые ацилированы по группе кислорода в положении 40, например 40-[3-гидрокси-2-(гидроксиметил)-2-метилпропаноат]-рапамицин (известный также как CCI779), производные рапамицина, которые замещены в положении 40 гетероциклилом, например 40-эпи-(тетразолил)-рапамицином (известным также как АВТ578),
так называемые рапалоги, например, как описано в заявке WO9802441, WO0114387 и WO0364383, такие как АР23573, и
соединения, раскрытые под названием TAFA-93 и биолимус (биолимус А9).
В настоящем описании термины "лечение" или "лечить" относятся как к профилактическому или предупредительному лечению, так и излечивающему или модифицирующему болезнь лечению, в том числе лечению пациента из группы риска получить заболевание или предположительно получившего заболевание, а также пациентов, которые больны или у которых диагностировано заболевание или медицинское состояние, и включают подавление клинического рецидива. Успешное лечение согласно изобретению включает также ремиссии всех излечимых симптомов, но без ремиссий неизлечимых симптомов. Например, одним из симптомов Макла-Уэллса является прогрессирующая глухота, связанная с поражением слухового нерва, которая в норме неизлечима, и, таким образом, нельзя ожидать, что данный симптом можно вылечить. Однако другие излечимые симптомы Макла-Уэллса, такие как кожная сыпь, мышечная боль, повышенная температура, усталость и конъюнктивит, могут полностью исчезнуть при успешном лечении в соответствии с изобретением. Другой мерой успешного лечения является снижение уровней соответствующих биомаркеров для аутовоспалительных синдромов, например Макла-Уэллса, т.е. снижение уровня сывороточного амилоидного белка (SAA) и с-реактивного белка (CRP) до нормального интервала, т.е. <10 мг/л сыворотки у пациентов.
В настоящем описании болезнь "Макла-Уэллса" представлена среди прочих (молекулярная патология), определяемых согласно их клиническим симптомам, которые представляют собой острые лихорадочные воспалительные эпизоды артрита и крапивницы, прогрессирующую глухоту, связанную с поражением слухового нерва, и необязательно длительный множественный амилоидоз (приблизительно в 25% случаев). Молекулярную патологию вызывает одна или несколько мутаций в гене MEFV, находящемся на хромосоме 16р13, которая кодирует белок, называемый пирином.
ИЛ-1β-связывающие молекулы, как определено выше, в частности ИЛ-1β связывающие молекулы, соответствующие первому и второму аспектам изобретения, антитела, которые обладают специфичностью связывания в отношении антигенного эпитопа зрелого человеческого ИЛ-1β, который включает петлю, содержащую Glu 64, в частности антитела, которые способны ингибировать связывание ИЛ-1β со своим рецептором, и антитела к ИЛ-1β, которые имеют KD связывания с ИЛ-1β приблизительно 10 нМ, приблизительно 1 нМ, предпочтительно 100 пМ, более предпочтительно 50 пМ или меньше, в данном контексте обозначают как антитела, представленные в изобретении.
В еще одном варианте осуществления изобретения дальнейшие применения ИЛ-1β-соединений, например, антител, представленных в изобретении, являются следующими:
предупреждение и лечение воспалительной болезни кишки (IBD), ювенильного артрита, реактивного артрита, анкилозирующего спондилоартрита, коронарного синдрома, артериального рестеноза, кистозного фиброза, болезни Альцгеймера, множественной миеломы, артериосклероза, легочного фиброза, синдрома Макла-Уэллса и хронической обструктивной легочной болезни (COPD). Для всех показаний, описанных в данном контексте (показания, представленные в изобретениях), подходящая доза, конечно, будет варьировать в зависимости от, например, конкретных ИЛ-1β-соединений, например используемого антитела, соответствующего изобретению, хозяина, способа введения, а также природы и тяжести состояния, которое лечат. Однако в основном указывают, что при профилактическом применении удовлетворительные результаты получают при дозах от приблизительно 0,05 мг до приблизительно 10 мг/кг массы тела, чаще от приблизительно 0,1 мг до приблизительно 5 мг/кг массы тела. Антитело, представленное в изобретении, удобно вводить парентерально, внутривенно, например в предузелковую вену или другую периферическую вену, внутримышечно или подкожно.
В еще одном варианте осуществления изобретение относится к неожиданной частоте дозирования для терапевтического применения, т.е. схема лечения ИЛ-1β-соединениями, предпочтительно антителами к ИЛ-1β, более предпочтительно ACZ885 (в типичной дозе, например от приблизительно 0,1 мг до приблизительно 50 мг, более предпочтительно от 0,5 мг до 20 мг, даже более предпочтительно от 1 мг до 10 мг ACZ885/KF массы тела) может представлять собой ведение один раз каждую неделю или менее часто, более предпочтительно один раз каждые 2 недели или менее часто, более предпочтительно один раз каждые 3 недели или менее часто, более предпочтительно один раз каждый месяц или менее часто, более предпочтительно один раз каждые 2 месяца или менее часто, более предпочтительно один раз каждые 3 месяца или менее часто, даже более предпочтительно один раз каждые 4 месяца или менее часто, даже более предпочтительно один раз каждые 5 месяцев или менее часто или даже более предпочтительно один раз каждые 6 месяцев или менее часто. Наиболее предпочтительным является один раз каждый месяц.
Фармацевтические композиции, представленные в изобретении, можно изготовить принятым образом. Композицию, соответствующую изобретению, предпочтительно получают в лиофилизированной форме. Для незамедлительного введения ее растворяют в подходящем водном носителе, например в стерильной воде для инъекций или в стерильном буферном физиологическом солевом растворе. Если считают необходимым сделать раствор большего объема для введения путем инфузии, а не болюсной инъекции, благоприятно включить в солевой раствор во время приготовления человеческий сывороточный альбумин или собственную гепаринизированную кровь пациента. Присутствие избытка данного физиологически инертного белка предупреждает потерю антитела вследствие адсорбции на стенках контейнера и трубок, используемых с инфузионным раствором. При использовании альбумина подходящая концентрация составляет от 0,5 до 4,5% от массы солевого раствора.
Изобретение далее описывают посредством иллюстрации в последующих примерах.
Примеры
Пример LACZ885
Структура и получение ACZ885, например, описаны в заявке WO 02/16436. Вкратце, аминоконцевые последовательности вариабельных доменов тяжелой и легкой цепей и соответствующие последовательности ДНК приведены в SEQ ID NO:1 и SEQ ID NO:2 ниже, где CDR показаны курсивом и подчеркиванием.

Пример 2: Биохимические и биологические данные ACZ885
Обнаружено, что моноклональное антитело ACZ 885 нейтрализует активность интерлейкина-1β in vitro. Моноклональное антитело далее характеризуют по связыванию с рекомбинантным человеческим ИЛ-1β посредством анализа поверхностного плазменного резонанса. Способ нейтрализации оценивают исследованиями конкурентного связывания с растворимыми рецепторами ИЛ-1. Биологическую активность антитела ACZ 885 в отношении рекомбинантного и продуцируемого в естественных условиях ИЛ-1β определяют в первичных человеческих клетках, ответственных за стимуляцию посредством ИЛ-1β.
Определение константы равновесия диссоциации
Константы скорости ассоциации и диссоциации для связывания рекомбинантного человеческого ИЛ-1β с ACZ885 определяют с помощью анализа поверхностного плазменного разонанса. ACZ885 иммобилизуют и связывание рекомбинантного ИЛ-1β в интервале концентраций от 1 до 4 нМ измеряют с помощью поверхностного плазменного резонанса. Выбранный формат представляет одновалентное взаимодействие и, таким образом, позволяет обрабатывать событие связывания ИЛ-1β с ACZ885 согласно стехиометрии 1:1. Анализ данных проводят с использованием пакета программ BIAevaluation.
Заключение: ACZ885 связывается с рекомбинантным человеческим ИЛ-1β с очень высокой аффинностью.
Пример 3: Клиническое исследование с ACZ885
Для оценки приемлемости ИЛ-1β-соединения, например ACZ885, проводят одноцентровое исследование титрования дозы ACZ885 (человеческого моноклонального антитела к ИЛ-1β) с открытой этикеткой с целью оценки клинической эффективности, безопасности, фармакокинетики и фармакодинамики у пациентов с синдромом MW, характеризующимся мутациями NALP3.
Пациентов лечат однократной инфузией дозы ACZ885 (10 мг/кг внутривенно). Клиническую реакцию измеряют по улучшению симптомов (например, кожной сыпи, мышечной боли, повышения температуры, усталости) и по снижению белков острой фазы, белка амилоида (SAA) и с-реактивного белка (CRP). Кроме того, ответ на лечение оценивают по анализу мРНК, полученной из клеток периферической крови. Второй курс лечения (1 мг/кг внутривенно) осуществляют после повторного появления клинических симптомов.
Результаты: Клиническая ремиссия симптомов (повышения температуры, сыпи, конъюнктивита) в течение 3 дней и снижение CRP и SAA до нормального интервала (<10 мг/л) у пациентов. Клиническая ремиссия симптомов при первой инфузии продолжается по меньшей мере 134 дня, как правило, от 160 до 200 дней. При втором курсе лечения с использованием более низкой дозы пациенты отвечают улучшением симптомов и нормализацией уровня белков острой фазы.
Анализ мРНК, полученной из клеток периферической крови, демонстрирует понижающую регуляцию транскрипции ИЛ-1b и ИЛ-1b-индуцируемых генов в течение 24 часов после лечения ACZ885. Это позволяет предположить, что ACZ885 способно нарушать петлю положительной обратной связи in vivo, которая приводит к самоподдерживающейся сверхпродукции ИЛ-1b у данных пациентов. Данное утверждение поддерживается также исходной характеризацией эффектов PK/PD ACZ885, которое демонстрирует блокаду продукции ИЛ-1b при лечении ACZ885 у данных пациентов. Данная конкретная способность ACZ885 может делать вклад (быть причиной) в его длительный клинический эффект.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВОЕ ПРИМЕНЕНИЕ СОЕДИНЕНИЙ ИЛ-1β | 2012 |
|
RU2571563C2 |
| НОВЫЕ ПОКАЗАНИЯ К ПРИМЕНЕНИЮ ПРИ ЛЕЧЕНИИ АНТИТЕЛАМИ ПРОТИВ IL-1-БЕТА | 2019 |
|
RU2834722C2 |
| НОВЫЕ ПОКАЗАНИЯ К ПРИМЕНЕНИЮ ПРИ ЛЕЧЕНИИ АНТИТЕЛАМИ ПРОТИВ IL-1-БЕТА | 2014 |
|
RU2698208C2 |
| АНТИТЕЛА К ЧЕЛОВЕЧЕСКОМУ IL-1БЕТА | 2001 |
|
RU2286351C2 |
| РЕКОМБИНАНТНОЕ АНТИТЕЛО К ЧЕЛОВЕЧЕСКОМУ ИНТЕРЛЕЙКИНУ 1β | 2001 |
|
RU2264413C2 |
| АНТИТЕЛА К ЧЕЛОВЕЧЕСКОМУ МСР-1 | 2001 |
|
RU2314316C2 |
| СОСТАВЫ, СОДЕРЖАЩИЕ АНТИТЕЛА | 2009 |
|
RU2745601C2 |
| IL-18-СВЯЗЫВАЮЩИЕ БЕЛОК (IL-18BP) И АНТИТЕЛА ПРИ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЯХ | 2016 |
|
RU2755691C2 |
| IL-18-СВЯЗЫВАЮЩИЙ БЕЛОК (IL-18BP) И АНТИТЕЛА ПРИ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЯХ | 2016 |
|
RU2810206C1 |
| СПОСОБ ПОЛУЧЕНИЯ БИСПЕЦИФИЧЕСКИХ АНТИТЕЛ, БИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА И ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ ТАКИХ АНТИТЕЛ | 2018 |
|
RU2795240C2 |
Предложенная группа изобретений относится к области медицины. Предложено применение ИЛ-1β связывающего антитела для изготовления лекарственного препарата для лечения ювенильного ревматоидного артрита, у пациента, включающего по меньшей мере один антигенсвязывающий центр, который содержит первый домен, имеющий последовательность аминокислот, показанную в SEQ ID NO:1, и второй домен, имеющий последовательность аминокислот, показанную в SEQ ID NO:2. Предложена фармацевтическая композиция, включающая указанное антитело в комбинации с фармацевтически приемлемыми эксципиентами, растворителями или носителями, вводимая парентерально. Предложенная группа изобретений обеспечивает новое применение ИЛ-1β связывающего антитела для лечения ювенильного ревматоидного артрита, в частности, системного идиопатического ювенильного ревматоидного артрита у млекопитающих, в частности у человека. 2 н. и 8 з.п. ф-лы, 3 пр.
1. Применение ИЛ-1β связывающего антитела для изготовления лекарственного препарата для лечения ювенильного ревматоидного артрита у пациента, включающего по меньшей мере один антигенсвязывающий центр, который содержит первый домен, имеющий последовательность аминокислот, показанную в SEQ ID NO:1, и второй домен, имеющий последовательность аминокислот, показанную в SEQ ID NO:2.
2. Применение по п.1, при котором указанное антитело вводится парентерально в дозе 0,05-10 мг указанного антитела на кг веса тела пациента.
3. Применение по п.1, где ювенильным ревматоидным артритом является системный идиопатический ювенильный ревматоидный артрит.
4. Применение по п.1, где указанным антителом является ACZ885.
5. Применение по п.1, где указанное антитело вводится один раз в неделю или реже.
6. Применение по п.1, где указанное антитело вводится один раз каждый месяц или реже.
7. Применение по п.1, где указанное антитело вводится пациенту подкожно.
8. Применение по п.1, где указанное антитело вводится пациенту внутривенно.
9. Применение по п.1, при котором указанное антитело вводится в дозе 1-10 мг указанного антитела на кг веса тела пациента.
10. Фармацевтическая композиция, включающая антитело, которое определено в любом из пп.1-4, для применения для лечения системного идиопатического ювенильного ревматоидного артрита в комбинации с фармацевтически приемлемыми эксципиентами, растворителями или носителями, причем это антитело вводится парентерально.
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Прибор для очистки паром от сажи дымогарных трубок в паровозных котлах | 1913 |
|
SU95A1 |
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| HAWKINS P.N | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| FORSTER A | |||
| et al.: "Neue Studien an der Rheumaklinik: Patienten | |||
Авторы
Даты
2012-12-10—Публикация
2006-10-24—Подача