Настоящая заявка является выделенной из заявки №4894343/13, поданной 26 ноября 1990 г., с приоритетом от 27 мая 1988 г.
А. ИЛ-1
Интерлейкины-1 представляют собой класс белков, продуцируемых множеством типов клеток, включая моноциты и некоторые макрофаги. Данный класс включает, по меньшей мере, два белка с молекулярной массой 17-18 килодальтон, известных как интерлейкин-1 альфа и интерлейкин-1 бета. Эти белки оказывают важные физиологические воздействия на целый ряд различных целевых клеток, вовлеченных в воспалительные и иммунные реакции. Белки представляют собой ко-митагены (с фитогемаглутинином) для Т-лимфоцитов, побуждая фибробласты и хондроциты секретировать латентную коллагеназу и повышая поверхностные адгезионные силы эндотелиальных клеток для нейтрофилов. Кроме того, они воздействуют на гипоталамус как пирогены, они стимулируют катаболизм мышечного белка, и они заставляют гепатоциты синтезировать класс белков, известных как "острофазовые реагирующие вещества". Таким образом, интерлейкины-1 (ИЛ-1), очевидно, представляют собой важную часть реакции организма на заражение и повреждение.
В. Патологические Роли ИЛ-1
Тем не менее, несмотря на обычно благоприятные воздействия ИЛ-1, возникают случаи, когда их эффекты становятся отрицательными. Например, ИЛ-1 может повышать уровень содержания коллагенов в подагрическом суставе и вовлечен в качестве медиатора острой и хронической стадий иммунопатологии в ревматоидный артрит. ИЛ-1 может быть ответственным за изменение функции эндотелиальных клеток, направляя хемотаксис и миграцию лейкоцитов и лимфоцитов в синовиальную ткань, индуцируя капиллярную пролиферацию и стимулируя аккумуляцию макрофагов в синовиальную выстилку в течение острой фазы данного заболевания. В фазе разрыва тканей ИЛ-1 вовлечен в качестве медиатора при индуцировании тканевого разрыва, стимулируя высвобождение ферментов из фибробластов и хондроцитов.
Кроме того, избыточное производство ИЛ-1 продемонстрировано в коже пациентов с псориазом, и высокие уровни ИЛ-1 можно найти в синовиальной жидкости пациентов с псориатическим артритом. ИЛ-1, высвобождаемый клетками в воспалительной синовиальной оболочке при псориатическом артрите, может обусловливать разрыв тканей, стимулируя высвобождение ферментов из других клеток. Суставная патология синдрома Рейтера аналогична наблюдаемой при псориатичеоком артрите и ревматоидном артрите. Кроме того, ИЛ-1 можно обнаружить в синовиальной жидкости пациентов, страдающих остеоартритом. Высвобождение ИЛ-1 хондроцитами вовлечено в разрыв суставного хряща при данном заболевании.
ИЛ-1 также может повышать тяжесть аутоиммунных заболеваний. Например, пониженное производство ИЛ-1 описано из периферических кровяных клеток у пациентов, страдающих общей красной волчанкой. Кроме того, некоторые изменения в функции В-лимфоцитов могут быть связаны с нарушениями в производстве ИЛ-1 или пригодности ИЛ-1.
Избыточное производство ИЛ-1 продемонстрировано в периферических моноцитах пациентов, страдающих склеродермией, и ИЛ-1 вовлечен в качестве потенциального агента фиброза посредством стимуляции производства коллагенов фибробластами. Механизм повреждения тканей при дерматомикозе может также включать клеточно-опосредованный иммунитет, и поэтому ИЛ-1 может быть вовлечен в качестве медиатора в данный патофизиологический процесс.
Острая и хроническая коллагеновая легочная болезнь отличается избыточным производством коллагена легочными фибробластами, которые могут стимулироваться ИЛ-1. Недавние исследования на животной модели относительно легочной гипертензии показывают, что ИЛ-1 может быть ответственным за индукцию изменения эндотелиальных клеток, которые приводят к сужению легочных артерий. Именно такое сужение приводит к легочной гипертензии и дальнейшему вторичному нарушению. Таким образом, ингибиторы ИЛ-1 могли бы стать пригодными средствами при лечении этих легочных заболеваний.
Последние исследования показывают, что ИЛ-1 способен непосредственно повреждать бета-клетки в островках Лангерганса, которые отвечают за производство инсулина. Разрушение клеток при помощи ИЛ-1 в настоящее время рассматривается как первичное событие в острой фазе юношеского сахарного диабета.
Инфильтрация моноцитов и макрофагов в почках господствует во многих формах острого и хронического гломерулонефрита. Высвобождение ИЛ-1 этими клетками может привести к локальной аккумуляции других воспалительных клеток, приводя в конце концов к воспалительному разрушению и фиброзной раекции в почках.
Показано, что кристаллы, обнаруженные в тканях или жидкостях при подагре или псевдопадагре, могут непосредственно симулировать макрофаги к высвобождению ИЛ-1. Таким образом, ИЛ-1 может быть важным медиатором в воспалительном цикле при таких заболеваниях.
ИЛ-1 способен индуцировать потерю кальция из костей и может быть ответственным за остеопороз, который наблюдается при воспалительных заболеваниях суставов.
Кератиноциты от пациентов, страдающих псориазом, высвобождают большие количества ИЛ-1. Этот медиатор может отвечать за вторичную пролиферацию клеток, которая происходит в коже пациентов, страдающих данным заболеванием.
ИЛ-1 является одним из важных эндогенных пирогенов и может отвечать за индуцирование заметной степени лихорадочного состояния, наблюдаемого при некоторых инфекционных заболеваниях, таких как острые лихорадочные заболевания, вызванные бактериями или вирусами.
Саркоидоз характеризуется гранулематозными повреждениями во многих органах тела. Показано, что ИЛ-1 способен индуцировать образование гранулем in vitro и может быть вовлечен в данный процесс у пациентов, страдающих саркоидозом.
Избыточное производство ИЛ-1 продемонстрировано в периферических моноцитах от болезни Крона и неспецифического язвенного колита. Локальное высвобождение ИЛ-1 в кишечнике может стать важным медиатором в стимуляции воспалительного цикла при таких заболеваниях.
Некоторые лимфомы отличаются лихорадочным состоянием, остеопорозом и даже вторичным артритом. Избыточное производство ИЛ-1 продемонстрировано некоторыми клетками лимфомы in vitro и может отвечать за некоторые клинические проявления этих злокачественностей. Кроме того, ИЛ-1, продуцируемый некоторыми злокачественными лимфоцитами, может отвечать за определенные нарушения, такие как лихорадочное состояние, острофазовая реакция и общее истощение, которые наблюдаются при лейкемии.
Высвобождение ИЛ-1 астроцитами в мозге, как предполагают, отвечает за индуцирование фиброза, который может произойти в результате повреждения мозга от окклюзии сосудов.
С. Использование Ингибитора ИЛ-1
При таких и других обстоятельствах, когда ИЛ-1 имеет отрицательное воздействие, существует необходимость клинического использования ингибитора воздействия ИЛ-1. Поскольку ИЛ-1 представляет собой комитоген для Т-лимфоцитов, он имеет решающее значение для развития аутоиммунной и других иммунных заболеваний. Поэтому при системном введении ингибиторы ИЛ-1 могут стать полезными иммуно-супрессивными средствами. При локальном введении такие ингибиторы ИЛ-1 могут служить в деле предотвращения разрыва ткани в воспалительном суставе и других участках воспаления. На самом деле, для предотвращения деструкции тканей некоторые ингибиторы ИЛ-1 могли бы стать даже более эффективными, чем при введении в сочетании с ингибиторами коллагеназы.
Терапевтическое воздействие против влияния ИЛ-1 может стать возможным на уровне синтеза, секреции или связывания клеток-мишеней с белком. ИЛ-1 синтезируют моноцит/макрофагами и другими клетками в ответ на липополисахариды, фрагменты комплемента и вирусы. Любая молекула, которая блокирует связывание этих индуцирующих агентов с клетками продуцента или которая препятствует их влиянию на физиологию этих клеток, могла бы служить в качестве регулятора действия ИЛ-1. ИЛ-1 не секретируется традиционной системой секреции поскольку выделены мРНК, кодирующие по меньшей мере два предшественника белков С молекулярной массой 50 кД, но не содержащие гидрофобную сигнальную последовательность. Высвобождение активного белка из неактивного предшественника, по-видимому, требует осуществления протеолиза данного предшественника. Ингибитор высвобождения одного ИЛ-1 или нескольких ИЛ-1 из их предшественников теоритически мог бы регулировать действие ИЛ-1. По-видимому, ИЛ-1 воздействует на клетки-мишени посредством классического рецептор-опосредованного пути, хотя данный рецептор еще не выделен. Поэтому, вполне вероятно, что молекула, препятствующая связыванию ИЛ-1 с его рецепторами или регулирующая эти рецепторы, также может регулировать действие ИЛ-1. Кроме того, хотя все еще на вполне понятны внутриклеточные процессы после рецепторного связывания ИЛ-1, возможно, что существуют агенты, которые могут препятствовать клеточным реакциям на другие рецептор-опосредованные события, а посему могут блокировать действие ИЛ-1. По причинам, указанным выше, изыскиваются белки и малые молекулы, способные ингибировать ИЛ-1 одним или более из числа вышеприведенных способов. Заявитель неожиданно обнаружил, что существуют по меньшей мере два белка ингибиторов ИЛ-1 со свойствами ингибрования ИЛ-1. Эти молекулы получены в очищенной форме, которая позволяет специалисту в данной области знания определить их аминокислотную последовательность. Более того, охарактеризовано получение клеток, которые продуцируют эти белки, а также мРНК, которая приводит к их синтезу. Наконец, выявлены антисыворотки, которые облегчают задачу скрининга библиотек экспрессии кДНК для генов, кодирующих эти ингибиторы. Эти реагенты вместе позволяют кодировать кДНК, кодирующие ингибиторы ИЛ-1. В свою очередь, эти гены создают возможность крупномасштабного производства ингибиторов ИЛ-1, пригодных для использования в технологии приготовления лекарственных средств, полезных при лечении патофизиологических состояний, опосредованных ИЛ-1.
Настоящее изобретение относится к ингибиторам ИЛ-1 ("ИЛ-1и"), более конкретно, к ингибитору ИЛ-1, имеющему моноцитное происхождение. Кроме того, настоящее изобретение относится к биологически активным аналогам этих ингибиторов.
Целью настоящего изобретения является получение очищенных форм ингибиторов ИЛ-1, которые являются активными против ИЛ-1 альфа или ИЛ-1 бета или их комбинации. Другой целью настоящего изобретения является получение этих ингибиторов в очищенных формах с тем, чтобы способствовать определению их аминокислотной последовательности. Дополнительной целью настоящего изобретения является получение аминокислотных последовательностей определенных ингибиторов ИЛ-1. Кроме того, идентификация биологически активных аналогов таких ингибиторов ИЛ-1 с усовершенствованными или эквивалентными свойствами также является одной из целей настоящего изобретения.
Кроме того, цель настоящего изобретения состоит в получении системы рекомбинантных ДНК для производства ингибиторов ИЛ-1 в соответствии с предлагаемым изобретением. Другая цель настоящего изобретения заключается в создании очищенных форм ингибиторов ИЛ-1 которые были бы ценными фармацевтическими препаратами, проявляющими активность против ИЛ-1.
Дополнительные цели и преимущества настоящего изобретения будут представлены частично в описании, а частично будут понятны из данного описания или из практики изобретения. Цели и преимущества могут быть реализованы и получены при помощи средств и методов, указанных в прилагаемой формуле изобретения.
Для достижения целей в соответствии с настоящим изобретением раскрыты ингибиторы ИЛ-1, которые проявляют ингибирующую активность в отношении ИЛ-1. Предпочтительные ингибиторы выделены в очищенной форме из моноцит-кондиционированной среды с моноцитами, выращенными на чашках, покрытых иммуноглобулином Г (ИгГ).
Предпочтительными ингибиторами в соответствии с настоящим изобретением являются ингибиторы 1, 2 и 3. Ингибиторы 1 и 2 представляют собой белки, которыми манипулируют в положениях, характерных для белков с молекулярной массой 22-23 кД, при полиакриламидном гель-электрофорезе с додецил-сульфатом натрия, и которые элюируют при 52 мМ и 60 мМ NaCl, соответственно, из колонки жидкостной экспресс-хроматографии белков Mono Q при специфических условиях. Кроме того, для достижения целей в соответствии с настоящим изобретением заявитель раскрывает фармацевтические композиции, содержащие по крайней мере один из активных компонентов, ингибитор ИЛ-1 предлагаемого изобретения или его биологически активный аналог.
Более того, для достижения целей настоящего изобретения также раскрывается система рекомбинантных ДНК для создания этих ингибиторов ИЛ-1 и их аналогов. Предпочтительный вариант данной системы включает по меньшей мере один кДНК-клон или его синтетический эквивалент, кодирующий по крайней мере один ингибитор ИЛ-1, вместе с векторами и клетками, составляющими систему экспрессии, способную экспрессировать раскрываемые здесь ингибиторы ИЛ-1. Также предлагаются антисыворотки для использования при идентификации этих кДНК клонов. Помимо этого, предлагаются системы экспрессии для получения этих ингибиторов ИЛ-1 с использованием указанных кДНК-клонов, их аналоги или другие ДНК-последовательности, кодирующие эти ингибиторы.
Краткое описание чертежей
Фиг.1а и 1b изображают белковый профиль хроматографии Mono Q двух метаболически меченных моноцитных супернатантов. Клетки культивируют на чашках, покрытых ИгГ (1а) или фетальной телячьей сывороткой (1b).
Фиг.2а показывает окрашенные серебром гели фракций из областей, указанных на Фиг.1а и 1b.
Фиг.2b представляет собой авторадиограмму гелей, показанных на Фиг.2а.
Фиг.3а, b и с показывают данные относительно очищенного ингибитора ИЛ-1 Примера 1. Фиг.3а приводит данные хроматографии с рисунком радиоактивности. Фиг.3b представляет собой окрашенные серебром гели относительно образцов фракций, показанных на Фиг.3а, Фиг.3с показывает авторадиограммы гелей на Фиг.3b.
Фиг.4a и b отображают результаты гель-фильтрационных хроматограмм ингибитора ИЛ-1, очищенного на колонке Mono Q.
Фиг.5а и b показывают результаты Вестерн-анализа мышиных антисывороток.
Фиг.6 изображает конструирование плазмиды pSVXVPL 2-11-1i.
Фиг.7 изображает конструирование плазмиды рМК - SGE:IL-1i.
Фиг.8а-d изображают данные относительно IL-1i-α (ингибитора ИЛ-1-альфа), Фиг.8а и 8b отображают хромотографические данные. Фиг.8с изображает окрашенный серебром гель на образцах фракций, указанных на Фиг.8b. Фиг.8d изображает авторадиограмму.
Фиг.9а и 9 представляют данные относительно ингибитора ИЛ-1-бета (IL-1i-β). Фиг.9а отображает данные хроматографии. Фиг.9 отображает данные полиакриламидного гель-электрофореза с додецилсульфатом натрия.
Фиг.10 отображает данные относительно фракционирования пептицидов IL-1i-α.
Фиг.11 отражает данные относительно фракционирования пептидов IL-1i-α.
Фиг.12а представляет собой фотографию геля с GT10-IL 1i-2A, переваренного с применением EcoRI после электрофореза в соответствии с Примером 6.
Фиг.12b отражает данные авторадиограммы Саузерн-блоттинга геля, приведенного на Фиг.12а.
Фиг.13 изображает часть ДНК-последовательности протеинкодирующей области лямбда GT10-IL 1i-2А и предсказанной аминокислотной последовательности в соответствии с Примером 6.
Фиг.14 изображает нуклеотидную последовательность GT-10-IL 11i-2А.
Фиг.15 изображает пептид, включающий, inter alia, последовательность IL-1i и секреторную лидерную последовательность мономерных остатков.
Ниже приведены более подробно предпочтительные варианты изобретения, которые вместе с приводимыми примерами способствуют пояснению принципов настоящего изобретения.
А. Ингибитор из Человеческих Моноцитов
Как отмечается выше, настоящее изобретение относится к ингибиторам ИЛ-1, которые выделены в очищенной форме. Предпочтительно, ингибиторы ИЛ-1 настоящего изобретения получают из среды, кондиционированной человеческими моноцитами, в которой моноциты выращивают в сосудах, покрытых ИгГ. Кроме того, настоящее изобретение охватывает в основном очищенные ингибиторы ИЛ-1 любого происхождения, которые биологически эквивалентны ингибитору, полученному из человеческой моноцитсодержащей среды.
В описании изобретения и в ее формуле под термином "биологически эквивалентный" заявитель подразумевает композиции настоящего изобретения, способные предотвращать действие ИЛ-1 аналогично, однако необязательно в такой же степени, что и нативный ингибитор ИЛ-1, выделенный из моноцитов. Под термином "в основном гомологичный" в описании и формуле изобретения подразумевается степень гомологии к нативному ингибитору ИЛ-1, выделенному из моноцит-кондиционированной среды, превышающая ту степень гомологии, которая проявляется любыми ранее приведенными ингибиторами ИЛ-1. Предпочтительно, если степень гомологии превышает 70%, более предпочтительно - превышает 80% и наиболее предпочтительно - превышает 90%. Особенно предпочтительная группа ингибиторов имеет свыше 95% гомологии к нативному ингибитору. Процент гомологии вычисляют как процентное содержание аминокислотных остатков в наименьшей из двух последовательностей, которые располагаются на одном уровне с идентичными аминокислотными остатками в последовательности, сравниваемой тогда, когда можно ввести четыре промежутка в длину из 100 аминокислот с тем, чтобы способствовать данному расположению, как указано Дэйхоффом М. в Атласе Белковой Последовательности и Структуры, Том 5, стр.124 (1972), Национальная Организация по Биохимическим Исследованиям, Вашингтон, округ Колумбия, причем данная работа упоминается здесь в качестве отсылки.
Предпочтительные ингибиторы ИЛ-1 настоящего изобретения получают из моноцит-кондиционированной среды и они впервые выделены в очищенной форме. Для целей настоящей заявки "чистая форма" или "очищенная форма" относительно раскрываемых ингибиторов ИЛ-1 означает препарат, который является в значительной степени свободным от других белков, которые не есть белки ингибиторов ИЛ-1. Предпочтительно, ингибиторы ИЛ-1 настоящего изобретения имеют по меньшей мере 90% чистоты, более предпочтительно 95% чистоты.
По крайней мере, три очищенных ингибитора ИЛ-1 выделены методами Примера. Они включают ингибитор 1, ингибитор 2 и ингибитор 5. Ингибитор 1 проявляет себя как молекула с молекулярной массой 22-23 кД при полиакриламидном гель-электрофорезе с додецилсульфатом натрия с приближенной изоэлектрической точкой 4,8, и его элюируют из колонки жидкостной экспресс-хроматографии белков Mono Q при 52 мМ NaCl в Трис-буфере, рН 7,6. Ингибитор 2 также представляет собой белок с молекулярной массой 22-23 кД, изоэлектрической точкой 4,8, однако его элюируют из колонки Mono Q при 60 мМ NaCl. Ингибитор 3 представляет собой белок с молекулярной массой 20 кД и элюирует из колонки Mono Q при 48 мМ NaCl. Ингибиторы 1, 2 и 3 родственны иммунологически и функционально. Получение этих ингибиторов в очищенной форме позволяет заявителю создать их аминокислотные последовательности. С использованием очищенных ингибиторов, описанных впервые в настоящей заявке, и методов, таких, которые описаны здесь и в технических руководствах по Белковому Секвенатору ABI, можно вывести значительную часть аминокислотных последовательностей данных ингибиторов. Пример 3 показывает данные аминокислотной последовательности, полученные от трех видов ингибиторов ИЛ-1, а именно IL-1i-X, IL-1i-α и IL-1i-β.
Заявитель обнаружил по крайней мере одно антитело против ингибитора ИЛ-1. Другие поликлональные и моноклональные антитела против данного и других ингибиторов ИЛ-1 можно получить известными в данной области техники способами. Одно конкретное поликлональное антитело описано в Примере 4.
В. Рекомбинантный Ингибитор
1. Общее
В настоящее время раскрыт метод рекомбинантных ДНК для получения ингибитора ИЛ-1. В одном варианте изобретения активный сайт функционирует биологически эквивалентным образом относительно нативного ингибитора ИЛ-1, выделенного из человека. Последовательность натуральной или синтетической ДНК можно использовать для непосредственного получения ингибиторов ИЛ-1. Данный способ предусматривает:
(a) получение ДНК-последовательности, способной направлять клетку-хозяина к получению белка, имеющего активность ингибирования ИЛ-1,
(b) клонирование ДНК-последовательности в вектор, способный трансфецироваться и реплицироваться в клетке-хозяине, причем указанный вектор содержит операционные элементы, необходимые для экспрессии ДНК-последовательности,
(с) перенос вектора, содержащего синтетическую ДНК-последовательность и операционные элементы, в клетку-хозяина, способную экспрессировать ДНК, кодирующую ингибитор ИЛ-1,
(d) культивирование клеток-хозяев при условиях, подходящих для амплификации вектора и экспрессии ингибитора,
(е) сбор ингибитора и
(f) наделение ингибитора активной третичной структурой, посредством чего он обладает активностью ингибирования ИЛ-1.
2. Последовательности ДНК
Последовательности ДНК, предусмотренные для использования в данном способе, обсуждены частично в Примере 5 и частично в Примере 6. Предполагается, что эти последовательности включают синтетические и натуральные ДНК-последовательности. Натуральные последовательности, кроме того, включают сегменты кДНК или геномной ДНК.
Пример 6 предлагает молекулярный клон ДНК, кодирующей белок, идентичный выделенному в Примерах 1-3. В примере 6 бляшку GT10-IL 1i-2A выделяют из библиотеки GT10. Размножают фаг в пределах данной бляшки и ДНК выделяют и переваривают с помощью EcoRI. Фрагмент EcoRI величиной 1850 пар оснований несет кодирующую последовательность для ингибитора IL 1. Фиг.13 показывает частичную ДНК-последовательность фрагмента EcoRI.
С учетом приведенных здесь доктрин и методик специалист в данной области знания в состоянии получить другие синтетические полинуклеотидные последовательности. В качестве примера настоящего уровня техники, относящегося к полинуклеотидному синтезу, можно привести работы Matt euccl, М.Д. and Carutners, М.Н., J. Am. Chem. Soc. 103: 3185 (1981) и Beaucage, S.L. and Caruthers, М.Н., Tetrahedron lett. 22: 1859 (1981), а также инструкции, представленные с олигонуклеотидным синтезатором ABI.
Эти синтетические последовательности могут быть идентичными натуральным последовательностям, описанным более подробно ниже, или они могут содержать другие нуклеотиды. В одном варианте, если синтетические последовательности содержат нуклеотиды, отличающиеся от тех, которые обнаружены в натуральных ДНК-последовательностях настоящего изобретения, предполагается, что эти отличающиеся последовательности все же кодируют полипептид, который имеет ту же первичную структуру, что и ИЛ-1и, выделенный из моноцитов. В альтернативном варианте синтетическая последовательность, содержащая отличающиеся нуклеотиды, кодирует полипептид, который имеет такую же биологическую активность, что и ИЛ-1и, описываемый в данной заявке.
Кроме того, последовательностью ДНК может быть фрагмент натуральной последовательности, то есть фрагмент полинуклеотида, который встречается в природе и который выделен и очищен в первый раз настоящим заявителем. В одном варианте ДНК-последовательность представляет собой рестрикционной фрагмент, выделенный из кДНК-библиотеки.
В альтернативном варианте ДНК-последовательность выделяют из человеческой геномной библиотеки. Пример такой библиотеки, пригодной в данном варианте, приведен Lawn et al. Cell, 75: 1157-1174 (1978), и данная работа приведена здесь в качестве отсылки.
В предпочтительной версии, данного варианта предполагается, что натуральную ДНК-последовательность получают способом, который предполагает:
(a) получение человеческой кДНК-библиотеки из клеток, предпочтительно моноцитов, способных генерировать ингибитор ИЛ-1 в векторе и клетке, способных амплифицировать и экспрессировать всю или часть этой кДНК,
(b) зондирование библиотеки человеческой геномной ДНК, по меньшей мере, одним зондом, способным связываться с геном или его белковым продуктом ингибитора ИЛ-1,
(c) идентифицирование, по меньшей мере, одного клона, содержащего ген, кодирующий ингибитор, благодаря способности клона связывать по меньшей мере один зонд для гена или его белкового продукта,
(d) выделение гена или части гена, кодирующего ингибитор, из клона или клонов,
(е) связывание гена или его пригодных фрагментов с операционными элементами, необходимыми для поддержания и экспрессии гена в клетке-хозяине.
Натуральные ДНК-последовательности, пригодные в данном способе, также могут быть идентифицированы и выделены при помощи метода, который предусматривает:
(а) получение библиотеки человеческой геномной ДНК, предпочтительно размноженной в хозяине Е.coli recA recBC,
(b) зондирование библиотеки человеческой геномной ДНК, по меньшей мере, одним зондом, способным связываться с геном или его белковым продуктом ингибитора ИЛ-1,
(с) идентификацию, по меньшей мере, одного клона, содержащего ген, кодирующий ингибитор, благодаря способности клона связывать, по меньшей мере, один зон для гена или его белкового продукта,
(d) выделение гена, кодирующего ингибитор, из клона (клонов), который идентифицирован, и
(е) связывание гена или его пригодных фрагментов с операционными элементами, необходимыми для поддержания и экспрессии гена в клетке-хозяине.
При выделении натуральной ДНК-последовательности, пригодной для использования в вышеприведенном способе, предпочтительно идентифицировать два рестрикционных сайта, расположенных в пределах и в непосредственной близости к концевым частям соответствующего гена или секций гена. ДНК-сегмент, содержащий соответствующий ген, затем удаляют из оставшегося геномного материала с использованием соответствующих эндонуклеаз рестрикции. После иссечения 3' и 5' концы ДНК-последовательности и любые соединения экзона подвергают реконструкции с получением соответствующих ДНК-последовательностей способных кодировать N- и С-концы белка ингибитора ИЛ-1 и способных синтезировать ДНК-последовательность с ее операционными элементами.
3. Векторы
(а) Микроорганизмы, в частности, E.coli
Векторы, предусмотренные для использования в настоящем изобретении, включают любые векторы, в которые можно ввести обсуждаемую здесь ДНК-последовательность вместе с любыми предпочтительными или необходимыми операционными элементами, и которые затем можно последовательно перенести в клетку-хозяина и реплицировать в такой клетке. Предпочтительными векторами являются те, чьи рестрикционные сайты хорошо документированы и которые содержат операционные элементы, являющиеся предпочтительными или необходимыми для транскрипции ДНК последовательности. Тем не менее, предусматриваются некоторые варианты настоящего изобретения, которые используют нераскрытые к настоящему времени векторы, которые могли бы содержать одну или несколько кДНК-последовательностей, обсуждаемых в настоящей заявке. В частности, предпочтительно, чтобы все эти векторы имели некоторые или все следующие характеристики: (1) обладание минимальным числом последовательностей организма-хозяина, (2) устойчивое поддержание и размножение в желательном хозяине, (3) способность присутствовать в желательном хозяине с высоким числом копий, (4) обладание регулируемым промотором, расположенным так, чтобы промотировать транскрипцию искомого гена, (5) наличие, по меньшей мере, одной маркерной ДНК-последовательности, кодирующей селектируемый признак, присутствующий на части плазмиды отдельно от той части, куда инсерцируют ДНК-последовательность, (6) ДНК-последовательность, способную терминировать транскрипцию.
В различных предпочтительных вариантах изобретения эти клонирующие векторы, содержащие и способные экспрессировать ДНК-последовательности настоящего изобретения, содержат различные операционные элементы. Эти "операционные элементы", как они обсуждаются в данной заявке, включают по меньшей мере один промотор, по меньшей мере одну последовательность Shine - Dalgarno и инициаторный кодон, а также по меньшей мере один терминирующий кодон. Предпочтительно, если эти "операционные элементы" также включают по меньшей мере один оператор, одну лидерную последовательность для белков, экспортируемых из внутриклеточного пространства, по меньшей мере один ген для регуляторного белка, а также любые другие ДНК-последовательности, необходимые или предпочтительные для соответствующей транскрипции и последующей трансляции векторной ДНК.
Некоторые из этих операционных элементов могут присутствовать в каждом из предпочтительных векторов настоящего изобретения. Предполагается, что любые дополнительные операционные элементы могут быть включены в данные векторы с использованием методов, известных в данной области техники, в частности, в свете приведенных здесь положений.
На практике можно конструировать каждый из этих векторов таким образом, который позволяет осуществить беспрепятственное выделение, сборку и взаимозаменяемость. Это облегчает сборку многочисленных функциональных генов из комбинаций этих элементов и кодирующей области ДНК-последовательностей. Кроме того, многие из этих элементов могут использоваться в более чем одном хозяине. Предполагается также, что в определенных вариантах осуществления настоящего изобретения векторы могут содержать ДНК-последовательности, способные функционировать в качестве регуляторов ("операторов"), и другие ДНК-последовательности, способные кодировать регуляторные белки.
(I) Регуляторы
В одном варианте настоящего изобретения эти регуляторы служат целям предотвращения экспрессии ДНК-последовательности в присутствии определенных окружающих условий, позволяют осуществить транскрипцию и последующую экспрессию белка, кодируемого ДНК-последовательностью. В частности, предпочтительно, если регуляторные сегменты инсерцированы в вектор так, что не происходит экспрессия ДНК-последовательности, или происходит в значительной степени ограниченно в отсутствие, например, изопропилтио-бета-D-галактозида. В данной ситуации трансформированные микроорганизмы, содержащие ДНК-последовательность, можно выращивать до желательной плотности перед началом экспрессии ИЛ-1и. В данном варианте экспрессию желательного белка индуцируют путем прибавления вещества в микробную среду, которое способно вызывать экспрессию ДНК-последовательности после достижения желательной плотности.
(II) Промоторы
Векторы экспрессии должны содержать промоторы, которые могут быть использованы организмом-хозяином для экспрессии его собственных белков. Хотя обычно используют систему лактозных промоторов, выделены и охарактеризованы другие микробные промоторы, позволяющие специалистам использовать их для экспрессии рекомбинантного ИЛ-1и.
(III) Терминатор транскрипции
Предполагаемые терминаторы транскрипции обеспечивают стабилизацию вектора. В частности, последовательности, описанные в работе Rosenberg, М. and Court, Д., Ann. Rev. Genet. 13: 319-353 (1979), предполагается использовать в настоящем изобретении.
(IV) Нетранслированная последовательность
Следует отметить, что в предпочтительном варианте изобретения можно реконструировать 3' или 5' конец кодирующей области с тем, чтобы осуществить введение 3' или 5' нетранслированных последовательностей в генный транскрипт. Среди этих нетранслированных последовательностей можно отметить те, которые идентифицированы Schmeissner, U., McKenney, K., Rosenberg, M. and Court, D., J. Molec. Biol., 176: 39-53 (1984), причем данная работа введена в описание изобретения в качестве отсылки.
(V) Сайты рибосомного связывания
Микробная экспрессия инородных белков требует наличия определенных операционных элементов, которые, не ограничиваясь, включают сайты рибосомного связывания. Сайт рибосомного связывания представляет собой последовательность, которую рибосома распознает и привязывается к которой в начале белкового синтеза, как указано в работе Gold, L., et al., Ann. Rev. Microbio. 35: 557-580, или работе Marguis, D.M., et al., Genc 42: 175-183 (1986), которые введены в данное описание в качестве отсылок. Предпочтительным сайтом рибосомного связывания является GAGGGCGAAAAA (ATC).
(VI) Лидерная последовательность и Трансляционный линкер
Помимо этого, предпочтительно, если ДНК, кодирующая соответствующую секреторную лидерную (сигнальную) последовательность, присутствует у 5' конца ДНК-последовательности, как указано в работе Watson, M.E., Nucl. Acids. Res. 12: 5145-5163, которая введена в данное описание в качестве отсылки, если белок необходимо секретировать из цитоплазмы, ДНК для лидерной последовательности может быть в положении, которое обеспечивает производство гибридного белка, в котором лидерная последовательность непосредственно примыкает к ингибитору и ковалентно с ним связана, то есть между двумя ДНК-кодирующими последовательностями не должно быть сигналов транскрипционной или трансляционной терминации. Присутствие лидерной последовательности желательно частично по одной или более следующим причинам. Во-первых, присутствие лидерной последовательности может облегчить процессинг ингибитора ИЛ-1 со стороны хозяина. В частности, лидерная последовательность может направлять расщепление продукта начальной трансляции с помощью лидерной пептидазы, удаляя лидерную последовательность и оставляя полипептид с аминокислотной последовательностью, которая имеет потенциальную белковую активность. Во-вторых, присутствие лидерной последовательности может облегчать очистку ингибитора ИЛ-1 путем удаления белка из клеточной цитоплазмы. В некоторых видах микроорганизмов хозяина присутствие подходящей лидерной последовательности способствует транспортировке нативного белка в периплазматическое пространство, как в случае с некоторыми Е.coli. В случае с определенными Е.coli, Saccharomyces и штаммами Bacillus и Pseudomonas соответствующая лидерная последовательность способствует транспортировке белка через клеточную мембрану в экстрацеллюлярную среду. В данном случае белок может быть очищен от экстрацеллюлярного белка. В-третьих, в случае некоторых белков, полученных в соответствии с настоящим изобретением, присутствие лидерной последовательности может быть необходимым для расположения нативного белка в среде, в которой он может быть упорядочен с тем, чтобы принять его активную структуру, которая обладает соответствующей белковой активностью.
В одном предпочтительном варианте осуществления настоящего изобретения дополнительную ДНК-последовательность располагают непосредственно перед ДНК-последовательностью, которая кодирует ингибитор ИЛ-1. Дополнительная ДНК-последовательность способна функционировать как трансляционный линкер (сшивающий агент), то есть она представляет собой ДНК-последовательность, которая кодирует РНК, служащую для расположения рибосом в непосредственной близи от сайта рибосомного связывания РНК ингибитора, с которой она соприкасается. В одном варианте настоящего изобретения трансляционный линкер можно получить с использованием ДНК-последовательности TAACGAGGCGCAAAAAATGAAAAAGACAGCTATCGCGATCTTGGAGGATGATTAAATG и способов, известных в настоящее время специалистам в области, относящейся к трансляционным линкерам.
(VII) Трансляционный терминатор
Предполагаемые трансляционные терминаторы служат цели приращения трансляции мРНК. Они могут быть либо натуральными, как описано в работе Kohli, J., Mol. Gen. Genet. 182: 450-439, или синтетическими, как описано в работе Pettersson, R.F. Gene 24: 15-2 (1983), причем обе работы введены в данное описание в качестве отсылок.
(VIII) Селектируемый маркер
Предпочтительно, чтобы клонирующий вектор содержал селектируемый маркер, который вызывает экспрессию селектируемого признака микроорганизмом хозяина. В одном варианте настоящего изобретения в вектор включен ген, придающий устойчивость к ампициллину, тогда как в других плазмидах включен ген, придающий устойчивость к тетрациклину, или ген, придающий устойчивость к хлорамфениколу.
Такой селектируемый маркер или другой предназначен для частичного содействия в селекции трансформантов. Кроме того, присутствие такого селектируемого маркера в клонирующем векторе может найти применение в деле сохранения загрязняющих микроорганизмов в стороне от процесса размножения в культуральной среде. В данном варианте чистую культуру трансформированных микроорганизмов хозяина можно было бы получить культивированием микроорганизмов при условиях, которые требуют индуцированный фенотип для выживания.
Предлагаемые операционные элементы без труда выбирают специалисты в данной области техники в свете известного уровня знаний и содержащихся в данном описании положений. Основные примеры этих операционных элементов представлены в работе B.Lewin, Gene, Wiley Son., New York (1983), которая введена в данное описание в качестве отсылки. Различные примеры пригодных операционных элементов можно найти на вышеприведенных векторах и можно почерпнуть при обзоре публикаций, которые обсуждают основные характеристики вышеприведенных векторов.
После синтеза и выделения всех необходимых и желательных компонентов указанных векторов вектор собирают известными специалистам в данной области методами. Сборка таких векторов находится в пределах компетенции специалистов и может быть осуществлена без обременительных экспериментов. Например, аналогичные ДНК-последовательности лигируют в соответствующие клонирующие векторы, как указано в работе Maniatis et al., Molecular Cloning, Cold Spring Harbor Laboratories (1984), которая введена в данное описание в качестве отсылки.
При конструировании клонирующих векторов настоящего изобретения следует помнить о том, что в каждый вектор можно инсерцироватъ множество копий ДНК-последовательности и ее операционных элементов. В таком варианте организм-хозяин будет продуцировать более высокие количества желательного ингибитора ИЛ-1 на вектор. Количество множества копий ДНК-последовательности, которые можно инсерцировать в вектор, ограничено только способностью полученного вектора с учетом его размера, подлежащего переносу, а также репликации и транскрипции в соответствующей клетке-хозяине.
(b) Другие микроорганизмы
Векторы, пригодные для использования в микроорганизмах иных, нежели Е.coli, также рассматриваются настоящим изобретением. Такие векторы описаны в Таблице 1. Кроме того, ниже обсуждаются некоторые предпочтительные векторы.
отр A12
phos
B.amy альфа-амилаза22
B.subt субтилизин23
B.amy альфа-амилаза22
1. Backman, K., Ptasnne, M. and Gilbert, W. Proc. Natl. Acad. Sci. USA 73, 4174-4178 (1976).
2. de Boer, H.A., Comstock, L.J., and Vasser, M. Proc. Natl. Acad. Sci. USA 80, 21-25 (1983).
3. Shimatake, H. and Rosenberg, M. Nature 292, 128-132 (1981).
4. Derom, С., Gheysen, D. and Fiers, W. Gene 17, 15-51 (1982).
5. Hallewell R.A. and Entage, S. Gene 9, 27-47 (1980).
6. Grosius, J., Dull, T.J., Sleeter, D.D., and Noller, H.F., J. Mol. Biol. 148, 107-127 (1981).
7. Normanly, J. Ogden, R.C., Horvath, S. J. and Abelson, J. Nature 321, 213-219 (1986).
8. Belasco, J.G., Nilsson, G., von Gabain, A. and Conen, S.N. Cell 46, 245-251 (1986).
9. Schmelssner, W., McKenney, K., Rosenberg M. and Court, D.J. Mol. Biol. 176, 39-53 (1984).
10. Mott, J.E., Galloway, J.L. and Platt, T. EMBO J. 4, 1887-1891 (1985).
11. Koshland, D. and Botstein, D. Cell 20, 749-760 (1980).
12. Movva, N.R., Kakamura, K. and Inouye, M. J. Mol. Biol. 143, 317-328 (1980).
13. Surin, В.P., Jans, D.A., Fimmel, A.L., Shaw, D.C., Cox, G.B. and Rosenberg, M.J. Bacteriol. 157, 772-778 (1984).
14. Sutcliffe, J.G. Proc. Natl. Acad. Sci. USA 75, 3737-3741 (1978).
15. Peden K.W.C. Gene 22, 277-280 (1983).
16. Alton, N.K. and Vapnek, D. Nature 282, 864-869 (1979).
17. Yang, M., Galizzi, A., and Henner, D. Nuc. Acids Res. 11 (2), 237-248 (1983).
18. Wong, S.-L., Price, C.W., Goldfarb, D.S., and Doi, R.M. Proc. Natl. Acad. Sci. USA 81, 1184-1188 (1984).
19. Wang, P.-Z., and Doi, R.M. J. Biol. Chem. 259, 8619-3625, (1984).
20. Lin, С.-К., Quinn, L.A. Rodriquez, R.L. J. Cell. Biochem. Suppl. (98), p.198 (1985).
21. Vasantha, N., Thompson, L.D., Rhodes, C., Banner, C., Nagle, J., and Filpula, D. J. Bact. 159 (3), 811-319 (1984).
22. Palva, I., Sarvas, M., Lehtovaara, P., Sibazkov, M., and Kaariainen, L. Proc. Natl. Acad. Sci. USA 79, 5582-5586 (1982).
23. Wong, S.-L., Pricee, C.W., Goldfarb, D.S., and Doi, R.H. Proc. Natl. Acad. Sci. USA 81, 1184-1188 (1984).
24. Sullivan, M.A., Yasbin, R.E., and Young, F.E. Gene 29, 21-46 (1984).
25. Vasantha, N., Thompson, L.D., Rhodes, C., Banner, C. Nagle, J., and Filpula, D. J. Bact. 159 (3), 811-819 (1984).
26. Yansura, D.G. and Henner, D.J. PNAS 81, 439-443 (1984).
27. Gray, G.L., McKeown, К.A., Jones, A.J.S., Seeburg, P.H. and Heyneker, H.L. Biotechnology, 161-165 (1984).
28. Lory, S., and Tai, P.C. Gene 22, 95-101 (1983).
29. Liu, P.V. J. Infect. Dis. 130 (suppl), 594-599 (1974).
30. Wood, D.G., Hollinger, M.F., and Tindol, M.B. J. Bact. 145, 1448-1451 (1981).
31. St. John, Т.P. and Davis, R.W. J. Mol. Biol. 152, 285-315 (1981).
32. Hopper, J.E., and Rowe, L.B. J. Biol. Chem. 253, 7566-7569 (1978).
33. Denis, C.L., Ferguson, J. and Young, E.T. J. Biol. Chem. 258, 1165-1171 (1983).
34. Lutsdorf, L. and Megnet, R. Archs. Biochem. Biophys. 126, 933-944 (1968).
35. Meyhack, В., Bajwa, N., Rudolph, M. and Hinnen, A. EMBO. J. S, 675-680 (1982).
36. Watson, M.E. Nucleic Acid Research 12, 5145-5164 (1984).
37. Gerband, C. and Guerineau, М. Curr. Genet. 1, 219-225 (1-30).
38. Hinnen, A., Hicks, J.B. and Fink, G.R. Proc. Natl. Acad, Sci. USA 75, 1929-1933 (1978).
39. Jabbar, M.A., Sivasubramamian, N. and Nayak, D.P. Proc. Natl. Acad. Sci. USA 82, 2019-2023 (1985).
(I) Векторы Pseudomonas
Несколько векторных плазмид, автономно реплицирующихся в широком круге грамотрицательных бактерий, являются предпочтительными для использования в качестве систем организм-хозяин-клонирующий вектор в хозяевах рода Pseudomonas. Некоторые из них описаны Tait, R.C., Close, T.J., Lindquist, R.C., Hagiya, M., Redriquez, R.L. Kadoc в журнале Biotechnology, May, 1983, рр.269-275; Panopoulos, N.J., в журнале Genetic Engineering in the Plant Sciences, Praeger Publishers, New-York, pp.163-185 (1981), а также Sakagucki, K., Current Topic in Microbiology and Immunology 96: 31-45 (1982), причем каждая из упомянутых работ введена в данное описание в качестве отсылки.
Одна особенно предпочтительная конструкция включает плазмиду RSF 1010 и ее производные, как описано в работе Bagdasarian, M., Bagdasarian, M.M., Coleman, S., and Timmis, K.N. in Plasmids of Medical, Environmental and Commercial Importance, Timmis, K.N. and Puhler, A. eds., Elsivier/North Holland Biomedical Press (1979).
Преимущества плазмиды RSF 1010 заключается в том, что она относительно мала, имеет большое число копий, легко трансформируется и устойчиво сохраняется как в E.coli, так и в Pseudomonas. В данной системе предпочтительно использовать систему экспрессии Тас, как описано для Escherichia, поскольку оказывается, что trp-промотор E.coli без труда распознается РНК-полимеразой Pseudomonas, как приведено в работе Sakagucki, K. in Current Topics in Microbiology and Immunology, 96: 31-45 (1982) и работе Gray, G.L. McKeown, K.A., Jones, A.J.S., Seeburg, P.H., and Heyneker, K.L. in Biotechnology, Feb., 1984, рр.161-165, причем обе работы введены в данное описание в качестве отсылок. Транскрипционную активность можно дополнительно максимизировать путем замены промоторы, например, промотором trp E.coli или Р.aeruginosa. Кроме того, ген lac1 E.coli также будет включен в плазмиду для осуществления регуляции.
Трансляция может быть привязана к инициации трансляции для любых белков Pseudomonas, а также к сайтам инициации для любых высокоэкспрессированных белков того типа, который выбирают для осуществления внутриклеточной экспрессии ингибитора.
В тех случаях, когда рестрикционные минус-штаммы вида хозяина Pseudomonas нельзя получить, эффективность трансформации плазмидными конструкциями, выделенными из Е.Coli, является очень низкой. Следовательно, прохождение клонирующего вектора Pseudomonas через r-m + штамм другого вида является желательным перед трансформацией требуемого хозяина, как указано в работе Bagdasarian, M., et al., Plasmids of Medical, Environmental and Commercial Importance, pp.411-422, Timmis and Puhler eds., Elsevier/North Holland Biochemical Press (1979), которая введена в данное описание в качестве отсылки.
(II) Векторы Bacillus
Кроме того, предпочтительная система экспрессии в хозяевах рода Bacillus включает использование плазмиды pu В110 в качестве системы организм-хозяин-клонируемый вектор. Как и в другой системе векторов хозяина, есть возможность в Bacillus экспрессировать ингбитор ИЛ-1 настоящего изобретения в качестве или внутриклеточного, или секретируемого белка. Предлагаемые варианты настоящего изобретения включают обе системы. Векторы-челноки, которые реплицируются как в Bacillus, так и в Е.coli, приемлемы для конструирования и испытания различных генов, как описано в работе Dubnau, D., Gryezan, T., D, Contente, S., and Shivakumar, A.G., Genetic Engineering Vol.2, Setlov and Hollander eds., Plenum Press, New-York, New-York, pp.115-131 (1980), специфично введенной в данное описание в качестве отсылки. Для экспрессии и секреции ингибитора ИЛ-1 из B.sultilis сигнальную последовательность альфа-амилазы предпочтительно привязывают к кодирующей области относительно белка. Для синтеза внутриклеточного ингибитора портативную ДНК-последовательность трансляционно привязывают к сайту рибосомного связывания лидерной последовательности альфа-амилазы.
Транскрипцию любой из этих конструкций предпочтительно направляют альфа-амилаза-промотором или его производным. Это производное содержит последовательность распознавания РНК-полимеразы нативного альфа-амилаза-промотора, однако также включает lac-оператор-область. Аналогичные гибридные промоторы, сконструированные из промотора гена пенициллиназы и lac-оператора, функционируют в хозяевах Bacillus регулируемым образом, как указано в работе Yansura, D.G. and Honner, Genetics and Biotechnology of Bacilli, Ganesan, A.T. and Hoch, J.A., eds., Academic Press, рр.24-263 (1984), которая введена в данное описание в качестве отсылки. Ген lac1 E.coli также можно было бы включить в плазмиду для проведения регуляции.
(III) Векторы Clostridium
Одной предпочтительной конструкцией для экспрессии в Clostridium является плазмида pJU 12, описанная в работе Squires, C.H. et al., in Journal of Bacteriology 159: 465-471 (1984), которая специфически введена в данное описание в качестве отсылки. Данную плазмиду трансформируют в C.perfringens методом Hufner, D.L. et al., J. Bacteriol 159: 460-464 (1984), которая специфически введена в данное описание в качестве отсылки. Транскрипцию направляют промотором гена, придающего устойчивость к тетрациклину. Трансляцию связывают с последовательностями Shine-Dalgarno того же самого гена tetr точно в соответствии с методикой, приведенной выше в отношении векторов, пригодных для использования в других хозяевах.
(IV) Дрожжевые векторы
Сохранение чужеродной ДНК, интродуцированной в дрожжи, можно осуществить несколькими путями, как описано в работе Botstein, D. and Davis, R.W., The Molecular Biology of the Yeast Saccharomyces Cold Spring Harbor Laboratory, Stranthern, Jones& Broach, pp.607-656 (1982), которая введена в данное описание в качестве отсылки. Одна предпочтительная система экспрессии для использования с организмами-хозяевами рода Saecharomyces несет ген ингибитора ИЛ-1 на 2 мкм плазмиде. Преимуществами 2 мкм кольца являются относительно высокое число копий и стабильность при индуцировании в штаммы cir0. Эти векторы предпочтительно несут в себе начало репликации и по меньшей мере один маркер антибиотической устойчивости из плазмиды рВР522 для осуществления репликации и селекции в Е.coli. Кроме того, плазмида предпочтительно имеет 2 мкм последовательность и дрожжевой ген LEU2 для тех же целей в LEU2-дефицитных мутантах дрожжей.
Предполагается, что если рекомбинантные ингибиторы ИЛ-1 в конце концов будут экспрессированы в дрожжах, предпочтительно, чтобы клонирующий вектор сначала был перенесен в Escherichia coli, где вектору можно было бы реплицироваться и откуда вектор можно было бы получить и очистить после амплификации. Затем вектор можно было бы перенести в дрожжи для окончательной экспрессии ингибитора ИЛ-1.
(с) Клетки млекопитающих
кДНК для ингибитора ИЛ-1 служит в качестве гена для экспрессии ингибитора в млекопитающих клетках. кДНК должна иметь последовательность, которая была бы эффективной при связывании рибосом, как описано, например, в работе Kozak, Nucleic Acid Research 15: 8125-8132 (1987), которая специфически введена в данное описание в качестве отсылки, также должна иметь кодирующую емкость для лидерной последовательности (см. раздел 3 (а) (VI)) с тем, чтобы направлять зрелый белок из клетки в переработанной форме. ДНК-рестрикционный фрагмент, несущий полную кДНК-последовательность, может быть инсерцирован в вектор экспрессии, который имеет транскрипционный промотор и транскрипционный энхансер, как описано в работах Guarante, L., Cell 52:303-305 (1988) и Kadonaga, J.T., et al. Cell 51: 1079-1090 (1987), которые введены в данное описание в качестве отсылок. Промотор может быть регулируемым, как в плазмиде pMSG (Pharmacia Cat №27450601), если конститутивная экспрессия ингибитора является пагубной для клеточного роста. Вектор должен иметь полный сигнал полиаденилированния, как описано в работе Ausubel, F.M. et al., Current Protocols in Molecular Biology (1987), которая специфически введена в данное описание в качестве отсылки; с тем, чтобы можно было должным образом переработать мРНК, транскрибированную из данного вектора. Наконец, вектор должен иметь начало репликации и по меньшей мере один антибиотик-резистивный маркер из плазмиды рВР322 для осуществления репликации и селекции в E.Coli.
С целью отбора устойчивой линии клеток, которая продуцирует ингибитор ИЛ-1, экспрессирующий вектор может нести ген для селектируемого маркера, такого как маркер лекарственной устойчивости, или нести комплементарный ген для дефицитной линии клеток, такой как ген дигидрофолятредуктазы (dhfr) для трансформации линии клеток dhfr, как описано в работе Ausubel et al., выше. Альтернативно, отдельная плазмида, несущая селектируемый маркер, может быть совместно трансформирована вместе с экспрессирущим вектором.
4. Клетки-хозяева/Трансформация
Полученный таким образом вектор переносят в соответствующую клетку-хозяина. Этими клетками-хозяевами могут быть микроорганизмы или млекопитающие клетки.
(а) Микроорганизмы
Полагают, что любой микроорганизм, имеющий способность принимать экзогенную ДНК и экспрессировать эти гены и прилагаемые операционные элементы, может быть отобран для указанной цели. После отбора организма-хозяина вектор переносят в организм-хозяин с использованием методов, обычно известных специалистам в данной области техники. Примерами таких методов являются описания, представленные в работе Advanced Bacterial Genetics, R.W. Davis et al., Cold Spring Harbor Press, Cold Spring Harbor, New York (1980), которая специфически введена в данное описание в качестве отсылки. Предпочтительно, в одном варианте, чтобы трансформация происходила при низких температурах, поскольку температурная регуляция предполагается в качестве средства регуляции генной экспрессии при помощи операционных элементов, приведенных выше. В другом варианте, если в вектор инсерцированы осмолярные регуляторы, для гарантии осуществления должного управления чужеродными генами было бы необходимо регулировать солевые концентрации во время трансформации.
Предпочтительно, если микроорганизм-хозяин является факультативным анаэробом или аэробом. Хозяева, являющиеся предпочтительными для использования в данном методе, включают дрожжи и бактерии. Конкретные дрожжи включают дрожжи рода Saecharomyces, особенно, Saecharomyces cerevisiae. Конкретные бактерии включают бактерии родов Bacillus, Escherichia и Pseudomonas, особенно, Bacillus subtilis и Escherichia coli. Дополнительные клетки-хозяева приведены в Таблице 1, выше.
(b) Млекопитающие клетки
Вектор может быть интродуцирован в млекопитающие клетки в культуре при помощи нескольких способов, таких как кальций-фосфат: ДНК соосаждение, электропорация (т.е. электрошоковое открытие клеточных пор) или протопластное слияние. Предпочтительным способом является соосаждение с кальцийфосфатом, как описано Ausubel et al., выше.
Существует много типов устойчивых клеток, которые являются трансформируемыми и способными транскрибировать и транслировать кДНК-последовательность, перерабатывая предшественник ингибитора ИЛ-1 и секретируя зрелый белок. Однако типы клеток могут варьироваться в зависимости от гликозилирования секретированных белков и посттрансляционной модификации аминокислотных остатков. Таким образом, идеальными типами клеток являются такие, которые продуцируют рекомбинантный ингибитор ИЛ-1, являющийся идентичным натуральной молекуле.
5. Культивирование изготовленных клеток
Клетки-хозяева культивируют в условиях, подходящих для экспрессии ингибитора ИЛ-1. Эти условия в основном являются специфическими для клетки-хозяина, и они легко определяются специалистами в свете опубликованной литературы, относящейся к условиям выращивания таких клеток, а также в свете приведенных здесь положений. Например, Bergey's Manual of Determinative Bacteriology, 8th Ed., Williams & Wilkins Co., Baltimore, Maryland, которое введено в данное описание в качестве отсылки, содержит информацию относительно условий для культивирования бактерий. Аналогичную информацию относительно культивирования дрожжевых и млекопитающих клеток можно получить из Pollack, R. Mammalian Cell Culture, Cold Spring Harbor Laboratories (1975), введенной в данное описание в качестве отсылки.
При осуществлении работ на стадиях трансформации и культивирования могут быть отобраны любые условия, необходимые для регуляции экспрессии ДНК-последовательности, в зависимости от любых операционных элементов, инсерцированных в вектор или присутствующих в нем. В одном варианте осуществления изобретения клетки выращивают до высокой плотности в присутствии подходящих регуляторных условий, которые ингибируют экспрессию ДНК-последовательности. При достижении оптимальной плотности клеток окружающие условия изменяют на те, которые подходят для экспрессии ДНК-последовательности. Таким образом, предполагается, что производство ингибитора ИЛ-1 происходит во временном промежутке после роста клеток-хозяев почти до оптимальной плотности и что полученный ингибитор ИЛ-1 собирают на определенном этапе после индукции регуляторных условий, необходимых для его экспрессии.
6. Очистка
(а) Ингибитор Ил-1, полученный из микроорганизмов
В предпочтительном варианте осуществления настоящего изобретения рекомбинантный ингибитор ИЛ-1 очищают после его сбора и перед допущением его активной структуры. Данный вариант является предпочтительным, поскольку заявитель полагает, что извлечение высокого выхода повторно упорядоченного белка облегчается, если белок вначале очищен. Однако в одном предпочтительном, альтернативном варианте ингибитор ИЛ-1 может быть повторно упорядочен с принятием его активной структуры перед очисткой. В еще одном варианте, предпочтительном и альтернативном, ингибитор ИЛ-1 присутствует в его повторно упорядоченном, активном состоянии после извлечения из культуральной среды. При определенных обстоятельствах ингибитор ИЛ-1 будет принимать его должную, активную структуру после экспрессии в микроорганизме-хозяине и транспортировки белка через клеточную стенку или мембрану, или же в периплазматическое пространство. Это обычно происходит в том случае, если ДНК, кодирующая соответствующую лидерную последовательность, связана с ДНК, кодирующей рекомбинантный белок. Если ингибитор ИЛ-1 не принимает его должную, активную структуру, любые образованные дисульфидные связи и/или любые нековалентные взаимодействия будут разрушены агентами денатурации и восстановителями, например гуанидиний хлоридом и бета-меркаптоэтанолом, перед тем как ингибитор ИЛ-1 примет свою активную структуру после разбавления и окисления этих веществ в контролируемых условиях.
Для очистки перед и после повторного упорядочения предпочтительно использовать определенную комбинацию следующих операционных стадий: анионообменной хроматографии (Mono Q или ДЭАЭ-Сефароза), гель-фильтрации (супероза), хроматофокусирования (Mono P) и гидрофобной хроматографии (октил- или фенил-сефароза). Особую ценность приобретает хроматография по сродству к антителу с использованием ингибитор ИЛ-1-специфических моноклональных антител (описанных в Примере 5).
(b) Ингибитор ИЛ-1, полученный из клеток млекопитающих
Ингибитор ИЛ-1, полученный из млекопитающих клеток, очищают от кондиционированной среды комбинацией следующих стадий: ионообменная хроматография и иммуноаффинная хроматография, с использованием моноклональных антител, описанных в Примере 3. Специалист поймет, что в процессах и продуктах в соответствии с настоящим изобретением возможны различные модификации и вариации при условии, что все они составляют объем прилагаемой формулы изобретения.
Следует понять, что применение принципов настоящего изобретения находится в компетенции специалистов в данной области техники с учетом изложенных в данной заявке положений. Примеры продуктов настоящего изобретения и показательных способов их выделения и получения представлены ниже.
Следующие примеры иллюстрируют различные предпочтительные варианты настоящего изобретения. Публикации, приведенные в данных примерах, введены в качестве отсылок.
ПРИМЕРЫ
Пример 1 - Получение белков
А. Материалы
Сбалансированный солевой раствор Хенкса (HBSS) и RPMI поставляют из Медиатех, Вашингтон, округ Колумбия. Лимфопреп получают из Акъюрат Кемикал энд Сайентифик Корп., Уэстбери, Нью-Йорк. Человеческий иммуноглобулин Г (ИгГ), МТТ, кроличью антисыворотку к антипростагландину Е2, бикарбонат аммония, дитиотрейтол, полный и неполный стимуляторы Фрейнда, гипоксантин, аминоптерин и тимидин поставляют из Сигма Кемикал Ко., Сент-Луис, Миссури. Мыши С3Н/HeJ получают из Джаксон Лавз, Бар Нарбор, Мэн. Мыши BAL В/с и Р3 миелома-клетки получают из фондов Докторов Джона Каплера и Филиппы Маррак в Национальном Центре Джевиша по Изучению Иммунологии и Респираторной Медицины (NJ C/IPM), Денвер, Колорадо. Рекомбинантный человеческий ИЛ-1 получают из Цистрон Биотехнолоджи, Пайн Врук, Нью-Йорк. Очищенный фитогемагглютинин поставляется Уэлкам Дайагностикс, Рисерч Трайенгл Парк, Северная Каролина. Фибробласты из человеческой крайней плоти от первичных культур получают от Доктора Ричарда Кларка в NJ C/IPM, Денвер, Колорадо. Моноклональные мышиные противокроличьи ИгГ-антитела поставляются из реагентов AIA, Аврора, Колорадо. PPMI с низким содержанием метионина получают с использованием оборудования Селект-Амин из ГИВКО Лабораториез, Грэнд Айленд, Нью-Йорк. /35S/-метионин, дифенилоксазол и /14С/-иодоуксусную кислоту получают из ДюПон-NEN, Чикаго, Иллинойс. Околоплодную сыворотку теленка получают из ХайКлон Лабораториез, Логан, Юта. Колонки Mono Q и Супероза 12 поставляются Фармация, Инк., Пискэтуэй, Нью Джерси. Колонки с обращенной фазой C4 получают из Синхром, Инк., Лафайет, Индиана. Колонки с обращенными фазами С8 получают из Эпплайд Биосистемз, Инк., Фостер Сити, Калифорния. Ацетонитрил и полиэтиленгликоль 8000 поставляются Дж.Т.Бэйкер Кемикал Ко., Филлипсбург, Нью Джерси. Трифторуксусную кислоту и хлоргидрат гуанидина получают из Пиерс Кемикалз, Рокфорд, Иллинойс. Эндопротеиназу Lys С получают из Берингер Мангейм Биокемикалз, Индианаполис, Индиана. Титрационные микропланшеты, используемые для твердофазного иммуноферментного анализа РСЕ2 (РСЕ2 ELISA), представляют собой Нунк-Иммуно Плэйт 1, полученную из Интермаунтин Сайентифик Корпорейшн, Баунтифул, Юта. Чашки, используемые для получения гибридомы, получают из Костар, Кембридж, Массачусетс.
В. Генерация ингибитора ИЛ-1 моноцитов
Человеческие лейкоциты получают от нормальных доноров лейкофорезом, ресуспендируют в сбалансированном солевом растворе Хенкса (HBSS) при концентрации 1 часть уплотненных клеток на 1 часть HBSS, подслаивают Лимфопрепом и закручивают при 400 кг в течение 50 минут при комнатной температуре. Берут мононуклеарную фракцию (обычно 4-5 109 клеток получают от одного донора), промывают в HBSS без Ca++ или М++ суспендируют в бессывороточном RРМ1 и высевают на чашки Петри, покрытые нормальным человеческим ИгГ, который делают безлипополисахаридным хроматографией на колонке Сефадекс С200 (6×107 клеток в 10 мл на 100 мм чашку). Все реагенты содержат менее 10 пг/мл липополисахарида (ЛПС). Клетки культивируют в течение 24-48 часов, и полученная кондиционированная среда составляет неочищенный надосадочный слой ингибитора ИЛ-1 (ИЛ-1и). Обычно клетки от одного донора приводят к получению 700-900 мл неочищенного супернатанта ИЛ-1и.
С. Анализ ингибитора ИЛ-1
Обычно используют два анализа ИЛ-1 для определения ИЛ-1и. Тимоциты (1×106 клеток от 4-6-недельных мышей СЗН/HeJ) отвечают за 1,0 единицы/мл рекомбинантного человеческого ИЛ-1 плюс 1 мкг/мл фитогемагглютинина при полумаксимальной полиферации, как измерено введением 3H-тимидина или поглощением тетразолиевой соли МТТ (Mesmann, T., J. Immunol Method 65: 55-61 (1983)) через три дня после начала стимуляции. Неочищенный ИЛ-1и полностью ингибирует данную реакцию на пролиферацию при разведении 1/10. Человеческие дермальные фибробласты (1×105 клеток на лунку в 96-луночной чашке) как правило отвечают за 0,5 единицы/мл рекомбинантного человеческого ИЛ-1 при секретировании на 6 ч стимуляции, приблизительно 50000 пг/мл PCE2, которые можно измерить методом ELISA. Данный метод является таким же чувствительным к ИЛ-1и, что и анализ тимоцитов.
D. Метаболическое мечение ингибитора ИЛ-1
ИЛ-1и метаболически метят культивированием мононуклеарных лейкоцитов в течение 48 часов на ИгГ-покрытых планшетах (как описано в части В) в без сывороточном PPM1, содержащем только 0,75 мкг/мл холодного метионина (15 мкг/мл являются нормой), и к которому прибавляют 0,5 мкуб, дюйм 35S-метионина (1151 куб.дюйм/ммоль) на 107 клеток. Контрольные мечения осуществляют аналогичным образом за исключением того, что планшеты покрывают околоплодной сывороткой теленка, а не ИгГ. Анализ таких контрольных супернатантов показывает, что очень незначительное количество ИЛ-1и секретируется, когда клетки культивируют на планшетах, покрытых околоплодной сывороткой теленка.
Е. Очистка белка ингибитора ИЛ-1
Неочищенные супернататнты ИЛ-1и доводят до 1,0 М в хлориде натрия, инкубируют на льду в течение одного часа и центрифугируют при 10000 об/мин в течение 15 минут. Супернатанты, которые содержат всю ингибирующую активность, но только лишь 20% начального белка, затем интенсивно диализуют при температуре 4°С против 0,025 М Трис, рН 7,6, который содержит 0,1% сахарозу (буфер А), для градиентного фракционирования белков на анион с обменной колонке Mono Q. После диализа ингибиторсодержащие растворы повторно центрифугируют при 10000 об/мин в течение 15 минут и затем пропускают через найлоновые фильтры размером 0,22 мкм. Супернатанты обычно объединяют с 10 мл аналогичным образом приготовленного супернатанта от метаболического мечения и пропускают через колонки Mono Q-Супероза (жидкостная экспресс-хроматография белков (ЖЭХБ) на оборудовании Фармация)) с объемами слоев либо 1,0 мл, либо 8,0 мл, промывают буфером А до достижения значения OD280 отходящего потока, возвращенного к базисной линии, и тщательно хроматографируют с использованием линейного градиента хлорида натрия (0,025 М-0,10 М) в буфере А. Колоночные фракции собирают и анализируют на радиоактивность и биоактивность. Образцы каждой фракции также анализируют полиакриламидным гель-электрофорезом в 12,5% додецилсульфате натрия, окрашивают серебром, пропитывают дифенилок сазолом, сушат и кладут на пленку для получения ауторадиографических данных. Фиг.1а показывает белковый профиль Mono Q-хроматографии относительно 40 мл неочищенного супернатанта ИЛ-1и, смешанного с 5 мл метаболически меченного супернатанта ИЛ-1и. Добавлена величина радиоактивности, обнаруженной в 50 мкл каждой фракции, а также биоактивности ИЛ-1и, измеренной при анализе получения PGE2. Показаны два основных и один меньший вид радиоактивности, которые совершенно совпадают с тремя пиками биоактивности. Фиг.1b показывает сходную хроматографию 15 мл неочищенного супернатанта ИЛ-1и, смешанного с 5 мл супернатанта от моноцитов, метаболически меченных на планшетах, покрытых околоплодной сывороткой теленка (FCS), а не ИгГ. Уровни трех вышеупомянутых видов радиоактивности значительно снижены. Фиг.2а показывает гели, окрашенные серебром, на фракциях из участков хроматографии, приведенных на Фиг.1а и 1b. Следует отметить, что фракции пиковой радиоактивности и биоактивности на Фиг.1а (фракции 52 и 59) показывают основную полосу при 22 килодальтон (отмечена стрелками) при полиакриламидном гель-электрофорезе c додецилсульфатом натрия (ПААГ-ДДС Na). Третий вид (фракция 48 на Фиг.1a) показывает полосу при 20 кД во время ПААГ-ДДС Na). Гель-фильтрационные эксперименты относительно неочищенного ИЛ-1и показывают, что активная молекула имеет молекулярную массу 18-25 кД. Фиг.2b представляет собой авторадиограмму гелей, приведенных на Фиг.2а. Легко понять, что белковые полосы при 20 и 22 кД являются основными радиоактивными видами в этих фракциях.
Суммируя данные результаты, заявитель показывает на то, что метаболическое мечение моноцитов, высеянных на чашках Петри, покрытых ИгГ, приводит к получению радиоактивных видов, которые плохо продуцируются только тогда, когда клетки высевают на чашках, покрытых FCS. Эти индуцированные радиоактивные виды хорошо хроматографируются совместно с несколькими видами биоактивности ИЛ-1и на колонке Mono Q, причем гели и полученные авторадиограммы показывают, что три основные индуцированные молекулы представляют собой белки с прогнозируемой молекулярной массой для ИЛ-1и.
Молекулы ИЛ-1и подвергают дальнейшей очистке для секвенирования двумя способами. Во-первых, фракции Mono Q с пиковыми биоактивностью и радиоактивностью загружают в колонку С4 с обращенной фазой и элюируют Н2О/0,1% ТФА: градиент ацетонитрил/0,1% ТФА. Поскольку молекула ИЛ-1и метят изотопными индикаторами, образцы каждой фракции подвергают непосредственно подсчету степени радиоактивности, а также анализируют ПААГ-ДДС Na с последующей авторадиографией, Фиг.3а показывает такую хроматографию с внесенным рисунком радиоактивности. Окрашенные серебром гели испытывают относительно образцов из каждой фракции (Фиг.3b), и последующие авторадиограммы гелей (Фиг.5с) показывают, что молекула ИЛ-1и находится во фракциях 32-36. Эти фракции сушат и секвенируют. Альтернативно, пиковые фракции Mono Q сушат с помощью Speed Vac, ресуспендируют в 0,4 мл 0,05 М NH4HCO3 и непосредственно хроматографируют два раза на гель-фильтрационной колонке Супероза 12 (10×300 мм) (ЖЭХБ Фармация), уравновешенной в том же буферном растворе, как показано на Фиг.4а и 4. Фракции собирают и образцы каждой фракции испытывают на радиоактивность и тиоактивность, после чего анализируют окрашиванием серебром и авторадиографируют при ПААГ-ДДС Na. Соответствующие фракции затем сушат на Speed Vac и секвенируют.
Пример 2
Предлагаемое секвенирование ингибитора ИЛ-1
Перед секвенированием образцы растворяют в 6 М гуанидин-HCl, рН 8,6, восстанавливают в течение 4 часов при температуре 37°С под N2 100-кратным молярным избытком дитиотрейтола в сравнении с белком, после чего алкилируют в течение 1 часа 400-кратным избытком 14С-иодоуксусной кислотой. В данном случае реакционные смеси можно обессолить на колонке с обращенной фазой С8, элюировать и частично высушить, N-концевые последовательности определяют с использованием секвенатора белков Эпплайд Биосистемз. Для получения внутренних последовательностей восстановленные и алкированные образцы переваривают цианогенбромидом или протеолитическими ферментами с использованием известных способов. Реакционные смеси сушат, растворяют в 0,1% ТФА/H2O, и пептициды выделяют с использованием колонки с обращенной фазой С8.
Пример 3
Очистка и секвенирование видов ингибиторов ИЛ-1
А. Виды ИЛ-1и-X, ИЛ-1и-а и ИЛ-1и-b
Mono Q-очистка ИЛ-1и расщепляет биологическую активность на три основных вида, как показано на Фиг.1а и описано в Примере 1, где пиковыми фракциями относительно данной активности являются 48, 52 и 59. ПААГ-ДДС Na на образцах этих фракций, как показано на Фиг.2а, выявляет виды при 20 кД, 22 кД и 22 кД соответственно. Вестерн-анализ таких гелей с использованием мышиных антисывороток, который обсуждается в Примере 4 ниже, окрашивает все три вида. Когда ИЛ-1и получают из клеток, метаболически меченных 35S-метионином во время роста на планшетах, покрытых ИгГ, каждая из этих полос является радиоактивной (как показано на Фиг.2b, представляющем собой авторадиограмму вышеупомянутого геля). На основе доктрины, представленной в Примере 1, а именно, что параллельные клетки, инкубированные в неиндуцированных условиях, не продуцируют биоактивность ИЛ-1и и не продуцируют эти радиоактивные полосы, заявитель приходит к выводу, что эти три вида отвечают за биологическую активность. Заявитель назвал эти виды ИЛ-1и-X, ИЛ-1и-а, и ИЛ-1и-b соответственно.
В. Очистка и секвенирование ИЛ-1и-Х
Mono Q-фракции, содержащие ИЛ-1и-Х и/или ИЛ-1и-а, очищают от жидкостной хромотографией высокого давления с обращенной фазой на колонке Синхропак РР-4 (С4), и радиоактивные виды подвергают анализу секвенированием. Провалились многочисленные попытки непосредственного секвенирования ИЛ-1и-а и ИЛ-1И-b, очищенных ЖХДВ с обращенной фазой, что указывает на их химическую блокировку со стороны их N-концов. Однако один препарат ИЛ-1и-а (ИЛ-1и-аВ2р42) приводит к получению следующей последовательности:
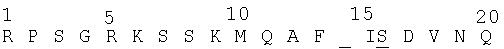
и последующие препараты ИЛ-1и-X, аналогично очищенные ЖХВД с обращенной фазой С4, продуцируют ту же последовательность:
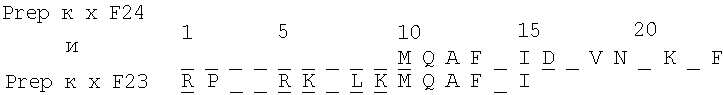
Они, несомненно, являются частью последовательности, обнаруженной при первоначальной попытке секвенировать ИЛ-1и-а. Заявитель приходит к выводу, что приведенные данные о последовательности являются N-концом 20 кД-вида, названного ИЛ-1и-Х. В этих и во всех последующих последовательностях подчеркнутое положение указывает или на неспособность идентифицировать остаток или на существование двусмысленности относительно идентифицированного остатка. Когда два или более остатков помещены в одном положении, это указывает на то, что обнаружено более чем одна аминокислота на стадии секвенирования, и более правильный остаток находится наверху.
С. Генерация, очистка и секвенирование пептидов ИЛ-1и-а и ИЛ-1и-b
Поскольку ИЛ-1и-а и ИЛ-1и-b химически блокированы со стороны их N-концов, пептиды каждого из них генерируют перевариванием эндопротеиназной. Конкретно, Mono Q-фракции, содержащие либо ИЛ-1и-a, либо ИЛ-1и-b, пропускают через колонку обращеннофазовой (C3) высокоэффективной жидкостной хроматографии размером 4,6×250 мм (Зорбакс Протеин Плюс), которая является альтернативной колонкам С-4, используемым во всех предыдущих экспериментах. Очень ступенчатые градиенты (0,2% ацетонитрил в минуту при 0,5 мл/мин) отщепляют ИЛ-1и-а (Фиг.8а, b) или ИЛ-1и-b (Фиг.9а) от основного загрязняющего радиоактивного вида, человеческого лизоцима. Идентичности очищенных видов подтверждаю присутствием одиночного, радиоактивного белка с молекулярной массой 22 кД на ПААГ-ДДС Na и последующих авторадиограммах (Фиг.8с, d и 9b). Белки собирают вручную в пробирки из кварцевого стекла, в каждую из которых прибавляют 25 мл 0,2% раствора Твин-20. ИЛ-1и-содержащие фракции затем приводят к объему 50 мкл на Speed Vac, доводят до 300 мкл прибавлением 1% NH4HCO3 с последующим прибавлением 1 мг эндопротеиназы. В случае с ИЛ-1и-а используют фермент Эндопротеиназа LysC (Бехрингер-Маннгейм), тогда как ИЛ-1и-b расщепляют Эндопротеиназной AspN (Бехрингер Маннгейм). Расщепление осуществляют при температуре 37°С в течение 16 часов, после чего объем реакционной смеси понижают до 50 мл на Speed Vac.
В случае с ИЛ-1и-а образец хроматогрфируют непосредственно, тогда как образец ИЛ-1и-b вначале восстанавливают путем прибавления 5 мл 50 мМ дитиотрейтола в 2 М Трис, рН 8,0, подвергают взаимодействию в течение 30 минут при температуре 37°С, после чего карбоксиметилируют путем прибавления 1,1 мкмоль 3H-иодоуксусной кислоты в 10 мл этанола (взаимодействуя в течение 30 минут при температуре 37°С в темноте). Сепарацию пептидов осуществляют на колонке узкого калибра Браунли Аквапор RP-300 (C8) размером 2,1×250 мм при скорости перемещения фронта растворителя 100 мкл/мин, используя ЖХВД Бекмана, снабженную микрокалибровочным оборудованием и микрокалибрсовместимыми насосами. Используют линейный градиент 200 мин, 0-100% (H2O/0,1% ТФА - ацетонитрил/0,1% ТФА). Пептидные выделения приведены на Фиг.10 и 11. Получена следующая информация относительно последовательностей:

Две пептидные последовательности, по-видимому, связаны по характеру с той, которая получена ранее от ИЛ-1и-X. Одна из них, RaLysC-41, является последовательностью ИЛ-1и-а, а другая, RbAspN-51, является последовательностью ИЛ-1и-b, что оспаривает утверждение, будто три вида ИЛ-1и являются по меньшей мере тесно связанными белками, если не химически и/или физически модифицированными формами единственной оригинальной молекулы ИЛ-1и. Если приведенные последовательности объединить, можно получить следующие составные последовательности:

Эти составные последовательности, по-видимому, не присутствуют ни в одном из иных известных полипептидов, представленных в недавно опубликованной Базе Данных Ресурса Идентифицированных Белков (PIR 16.0). Заявитель полагает, что эти последовательности или их менее значительные варианты представляют собой класс молекул, которые способны действовать как ингибиторы ИЛ-1.
Пример 4
Получение антител, специфических для ингибитора ИЛ-1
Мышам BaL В/с в возрасте десяти недель подкожно вводят ингибитор ИЛ-1, которые частично очищен (400-кратно) от сырых супернатантов с использованием Mono Q-хроматографии, диализован против ЗФГ (забуференного фосфатом физиологического раствора) и эмульгирован полным стимулятором Фрейнда. Каждая мышь получает ИЛ-1и, очищенный из 5 мл сырого надосадочного слоя. Мышей бустер-иммунизируют каждые две недели эквивалентным количеством ингибитора ИЛ-1, эмульгируемого неполным стимулятором Фрейнда, и сывороточные пробы отбирают из хвостов через семь дней после осуществления каждого бустера. Антисыворотки испытывают на противо-ИЛ-1и активность Вестерн-анализом трансблотов иммуногена, проводимым на полиакриламидном гель-электрофорезе с додецилсульфатом натрия, как показано на Фиг.5а. Фиг.5b показывает, что все мыши продуцируют антитела к ИЛ-1и после трех инъекций ингибитора ИЛ-1.
Поскольку моноклональные антитела будут иметь огромную ценность при клонировании гена ингибитора ИЛ-1 из библиотеки экспрессии, очистке рекомбинантного белка ингибитора ИЛ-1 и исследовании биологии молекулы, заявитель начал процесс изготовления батареи моноклональных антител, специфических для ингибитора ИЛ-1. Для получения гибридом клеток В вышеприведенных мышей инъецируют внутривенно с применением того же количества ингибитора ИЛ-1 в физиологическом растворе за 24 часа перед удалением селезенок. Спленоциты отпрепарируют от селезенок и помещают в холодный сбалансированный солевой раствор (BSS), промывают два раза BSS, смешивают с клетками миеломы РЗ при отношении 2×107 клеток РЗ на 108 селезеночных клеток В и закручивают. Клетки синтезируют путем покапельного прибавления 1 мл нагретого, загазированного (5% СО2) ПЭГ 6000 (40% полиэтиленгликоль 6000: 60% минимальная поддерживающая среда) до сухого осадка. Синтезированные клетки промывают BSS и ресуспендируют в 10 мл обогащенной среды (10% FBS), содержащей 2×105 перитонеальных клеток на 1 мл, и осадок осторожно диспергируют с использованием 10 мл пипетки. Объем доводят до 20 мл путем прибавления большего количества перитонеальных клеток в среду, и клетки высевают в 96-луночных планшетах при концентрации 0,1 мл/лунку. Планшеты помещают в газовый инкубатор и затем обрабатывают следующим образом:
1 день - прибавление 3×ГАТ (гипоксантин, аминоптерин, тимидин) в обогащенной среде до конечной концентрации 1×
5 день - смена среды путем замещения 200 мкл 1×ГАТ в обогащенной среде
10 день - начинают проверку на гибридный рост. Смена среды путем замещения 200 мкл 1×ГАТ в обогащенной среде, содержащей 1,5 х 106 перитонеальных клеток на 1 мл.
Когда гибридные клетки почти конфлуентны в лунке, надосадочные слои переносят для испытания и клетки осторожно собирают кончиком пипетки и переносят в лунки с 1 мл культуры, содержащие 1×ГАТ в обогащенной среде и 3×106 перитонеальных клеток на 1 мл. Надосадочные слои из конфлуентных лунок исследуют на активность против ингибитора ИЛ-1 с использованием иммуноферментного твердофазного анализа (ELISA), при котором частично очищенный ингибитор ИЛ-1 (Mono Q-очищенное вещество, являющееся идентичным тому, которое вводят мышам) привязывают к лункам на микротитровальном планшете. Сыворотки нормальных мышей и гипериммунные антисыворотки используют в качестве негативных и позитивных контрольных веществ соответственно. Позитивные надосадочные слои повторно исследуют методом ELISA на планшетах, покрытых гомогенно очищенным ингибитором ИЛ-1, а также методом иммунопреципитации очищенного метаболически меченного ингибитора ИЛ-1. Позитивные клетки затем клонируют, ограничивая разбавление, и вводят мышам, обработанным пристаном, для генерации асцитов. Большие количества ИЛ-1и-специфических антител можно получить тканевой культурой или массовой генерацией и сбором асцитической жидкости у мышей. Очистка этих антител и их присоединение к нерастворимым гранулам продуцируют адсорбенты сродства для очистки рекомбинантного белка ингибитора ИЛ-1.
Пример 5
Клонирование кДНК ингибитора ИЛ-1
Показано, что моноциты, высеянные на чашках Петри, покрытых иммуноглобулином Г, и культивированные в течение 24 часов в присутствии /35S/-метионина, продуцируют /35S/-ИЛ-1и, который можно идентифицировать по его хроматографическим свойствам на колонке Mono Q.
Для определения того, когда (в течение 24-часового периода) ИЛ-1и продуцируется с максимальной степенью, высеянные моноциты экспонируют к /35S/-метионину (импульсному) в течение короткого (2 часового) периода, и за это время прибавляют большой избыток немеченого метионина и инкубирование продолжают еще два часа. Затем среду собирают и анализируют на ингибитор ИЛ-1, меченный радиоактивной меткой. Данную методику используют в отношении моноцитов в различные временные интервалы после засева на планшетах, покрытых иммуноглобулином Г, и обнаружено, что моноциты, подвергшиеся воздействию /35S/-метионина на 15 ч после засева, продуцируют максимальное количество ингибитора ИЛ-1-/35S/, что говорит о том, что мРНК ингибитора ИЛ-1 в моноцитах имеет максимальный уровень через 15 часов после высева на иммуноглобулине Г.
Затем свежие моноциты высевают на иммуноглобулине Г, свободном от липополисахаридов, как в примере 1B. После инкубирования в средах RPM1 в течение 15 часов при температуре 37°С клетки промывают фосфатным буферным солевым раствором, затем лизируют 4 М тиоцианатом гуанидия, 25 мМ цитратом натрия, рН 7, 0,5% сарколизом, 0,1 М 2-меркаптоэтанолом. Затем полную РНК выделяют из данного лизата методом AGPC в соответствии с работой Р.Chomczynski and N.Sacchi, которая приведена в журнале Аналитическая Биохимия, Том 2, стр.156-159.
Поли А+ РНК выделяют хроматографией на олиго-dT целлюлозе методом Aviv, H. and Leader, P. (1972) Proc. Natl. Acad. Sci. (USA) 69: 1408-1412, осаждая этанолом и растворяя до концентрации 0,36 мкг/мкл. 1 мкг поли А+ РНК используют для получения кДНК в соответствии с работой Gubler, U. and Haffman (1983) Gene 25: 263-169.
кДНК инкорпорируют в библиотеку экспрессии лямбда gt11 с использованием линкеров Eco RI из каталожного номера 988448 Бехрингер Маннгейм или №1070 Нью Ингланд Био Лаб, а также инструкций, приведенных изготовителями.
Полученную библиотеку, которая содержит 106 самостоятельных клонов, подвергают скринингу на Е.coli Y1090rk- (Промега Биотек) с соответствующим поликлональным антителом к ингибитору ИЛ-1, как описано ранее, с использованием условий скрининга, описанных R.A.Young and R.W.Davis /(1983) PNAS 80: 1194-1198/. Положительные сигналы будут определяться с использованием биотинилированого второго антитела (такого, как козлиный антимышиный иммуноглобулин Г, Бефесда Рисерч Лабз), с последующим прибавлением конъюгата стрептавидинщелочная фосфатаза (Бефесда Рисерч Лабз), как описано Bayer, E.A. and Wilchek, M. (1979) в работе Methods in Biochemical, а также Guesdon, J.L.Ternynch. T. and Cevrameas, S. (1979) 27: 1151-1158, а также в соответствии с инструкциями изготовителей.
Пример 6
Получение и секвенирование гена, кодирующего ИЛ-1и
кДНК, полученную в соответствии с Примером 5, инкорпорируют в клонирующий вектор лямбда GT10. Данную кДНК сначала метилируют с использованием EcoRI-метилазы, применяя s-аденозил-метионин в качестве субстрата, линкеры EcoRI прикрепляют к реакции лигирования и избыточные линкеры удаляют путем переваривания эндонуклеазой ЕсоР и хроматографии на колонке CL6B-спин. Осуществляют реакцию лигирования, содержащую 0,124 мкг линкеров, отобранную по размерам кДНК и 1 мкг EcoRI-отрезанного и фосфатаза-обработанного вектора лямбда GT10, и продукты данной реакции лигирования уплотняют с использованием уплотнительных экстратов GIGAPACK GOLD (Стратаген). Получают библиотеку из 1×107 членов.
С целью скрининга данной библиотеки GT10 синтезируют олигонуклеотидные (антисмысловые) зонды на основе белковой и пептидной последовательности, представленной в Примере 3. Последовательности зондов и их соответствующая пептидная последовательность выглядят следующим образом:

Зонд № ИЛ1и1-3 32Р-фосфорилируют у его 5'-конца и используют для скрининга 3×105 бляшек библиотеки. Зонд гибридизирует репродуктивно к трем бляшкам, и одна из них также гибридизирует к зонду № ИЛ1и1-4. Данную бляшку, GT10-ИЛ1и-2А, культивируют и ДНК выделяют с использованием Lainbasorb (Промега) в соответствии с инструкциями изготовителя. GT10-ИЛ1и-2А депонирована в Американской Коллекции Типовых Культур (АТСС), Роквилл, Мэрилэнд, под депозитарным номером №40488. ДНК переваривают с использованием EcoRI, разделяют на пять равных аликвот и подвергают электрофорезу на 1%-ном агарозном геле.
После электрофореза данный гель окрашивают бромидом этидиума. Фотография данного геля показана на Фиг.12а. Дорожки 6, 8, 10, 12 и 14 содержат пять аликвот в результате переваривания EcoRI. Дорожка 5 содержит смесь лямбда-ДНК дикого типа, отрезанной с помощью Mind III, и X174 RF ДНК, отрезанной с помощью HaeIII (Нью Ингланд Биолабз), которые являются пригодными в качестве молекулярных маркеров, т.е,, маркеров молекулярной массы. Рис.12а показывает, что GТ10-ИЛ1и-2А содержит фрагмент EcoRI, имеющий длину 1850 пар оснований. С тем чтобы продемонстрировать более наглядно, что этот 1850 п.о. фрагмент несет кодирующую последовательность для ингибитора ИЛ-1, осуществляют Саузерн-блотирование следующим образом. ДНК-фрагменты в геле, показанном на Фиг.12а, блотируют на нитроцеллюлозе с использованием стандартных методов. Нитроцеллюлозу затем отрезают по длине на пять полосок так, чтобы каждая полоска содержала ДНК из дорожек 6, 8, 10, 12 и 14. Затем полоски отдельно гибридизируют к каждому из пяти олигонуклеотидных зондов (выше), которые метят с 5'-конца 32Р-фосфатом. Олигонуклеотидная концентрация составляет 1 пмоль/мл, а температура гибридизации выглядит следующим образом.
После промывки полоски выравнивают и связывают одна с другой для того, чтобы вновь образовать первоначальный нитроцеллюлозный лист. Лист авторадиографируют в присутствии усиливающего экрана при температуре -70°С в течение 24 часов. Фиг.12 является фотографией данной авторадиографии. Она показывает, что все зонды гибридизируют специфически к фрагменту длиной 1850 пар оснований, обеспечивая то, что данный фрагмент переносит существенную кодирующую последовательность для ингибитора ИЛ-1.
Для определения последовательности ДНК GT10-Ил1и-2А ДНК переваривают с EcoRI, подвергают электрофорезу на 1% агарозном геле и выделяют фрагмент размером 1850 пар оснований. Данный фрагмент лигируют с EcoRI-переваренным M13 mр19 и трансформируют в штамм Е.coli JM109. Трансформаторы подвергают скринингу, наблюдая за теми, которые не имеют бета-галактозидаза-активности. Выделяют пять таких трансформаторов, получают одноцепочную ДНК и секвенирование осуществляют в соответствии с методом Sanger et al. ДНК-последовательность трех трансформаторов соответствует 3'-концу мРНК, тогда как два трансформатора приводят к получению белок-кодирующей последовательности. На Фиг.13 показана последовательность ДНК, которую получают для белок-кодирующей области кДНК.
Фиг.13 также показывает предсказанную аминокислотную последовательность. Аминокислотная последовательность от первой аминокислоты Аланина до 29 аминокислоты Пролина и от 79 аминокислоты Изолейцина до конца является гипотетической аминокислотной последовательностью. Предсказанная аминокислотная последовательность от 30 аминокислоты Пролина до 78 аминокислоты Пролина согласуется с пептидными последовательностями, описанными в Примере 3.
Пример 7
Секвенирование GТ10-ИЛ-1и-2А и ИЛ-1и
Часть GТ10-ИЛ1и-2А секвенируют и показывают на Фиг.14. ДНК кодирует белок, содержащий аминокислотные последовательности, которые являются отличительными признаками ингибитора ИЛ-1 (нуклеотиды 99-557). Однако полагают, что перед секрецией белка в экстрацеллюлярную среду можно осуществить несколько его модификаций. Эти модификации могут или не могут быть существенными для белка с тем, чтобы он имел активность как ингибитор ИЛ-1.
GT10-ИЛ1и-2А кодирует, по крайней мере, 32 аминокислоты, N-концевых (нуклеотиды 3-98) к аминоконцу той формы ингибитора ИЛ-1, которая известна как X. Полагают, что в этих 32 аминокислотах находится секреторная лидерная последовательность, которая начинается у М, кодируемого нуклеотидами 24-26, направляет нарождающийся ингибитор ИЛ-1 в экстрацеллюлярную среду, после чего удаляется лидерной пептидазой, а возможно, и другими пептидазами. В настоящее время неизвестна степень, до которой данная последовательность удаляется в формах альфа- и бета ингибитора ИЛ-1, однако N-конец этих форм, как предполагают, близок к N-концу формы X. Удаление секреторной лидерной последовательности, вероятно, необходимо для того, чтобы белок имел эффективную активность ингибитора ИЛ-1.
Нуклеотиды 349-351 GT10-ИЛ1и-2А кодируют N-остаток, который является частью сайта согласованного N-гликозилирования. На основании их восприимчивости к перевариванию N-гликаназой полагают, что формы альфа и бета ингибитора ИЛ-1 являются гликозилированными. Поскольку форма X не является чувствительной к перевариванию данным ферментом, полагают, что она не гликозилирована, хотя остается возможность того, что так может произойти, и специалист без труда сможет показать это секвенированием белков с учетом приведенной здесь информации. Полагают, что гликозилирование в данном N-остатке не требуется для белка, проявляющего эффективную активность ингибитора ИЛ-1.
Нуклеотиды 99-101 GT10-ИЛ1и2А кодируют Р (см. Фиг.15), однако в данном положении (N-конец) формы Х ингибитора ИЛ-1 не обнаружено ни одного Р. Возможно, что этот остаток модифицирован в зрелом белке. Полагают, что модификация данного остатка не является существенным шагом в отношении эффективной активности ингибитора ИЛ-1.
Неизвестные в настоящее время остатки N-конца форм альфа и бета нельзя обнаружить полностью расщеплением по Эдману и, по всей вероятности, они модифицированы вслед за удалением некоторых из остатков N-конца белка, кодируемого GТ10-ИЛ1и-2А. Полагают, что данная модификация не является существенной для эффективной активности ингибитора ИЛ-1.
Пример 8
Экспрессия генов, кодирующих ингибитор интерлейкина 1 в животных клетках
Экспрессия животных клеток ингибитора ИЛ-1 предполагает выполнение следующих стадий:
а. Конструирование экспрессирующего вектора
. Выбор линии клеток-хозяев
с. Интродукция экспрессирующего вектора в клетки-хозяина
.Манипулирование рекомбинантными клетками-хозяевами с повышением уровней экспрессии ингибитора интерлейкина 1
1. Векторы экспрессии ингибитора ИЛ-1, предназначенные для использования в животных клетках, могут включать несколько типов, таких как сильные конститутивные экспрессирующие конструкции, индуцируемые генные конструкции, а также те, которые предназначены для экспрессии в определенных клеточных типах. Во всех случаях промоторы и другие генные регуляторные участки, например энхансеры (индуцируемые или нет) и сигналы полиаденилирования, помещают в соответственном положении относительно кДНК-последовательностей векторов на основе плазмид. Ниже приведены два примера таких конструкций: (1) Конструкция с использованием сильного конститутивного промотора должна быть изготовлена с применением сигналов управления геном вакуолизирующего вируса обезьяны 40 (OB-40) в таком порядке, который можно найти в плазмиде p SV2CAT, описанной Gorman et al., Mol. Cel. Biol 2: 1044-1051, 1982. Такой плазмидой необходимо манипулировать таким образом, чтобы заместить кДНК ингибитора ИЛ-1 кодирующими последовательностями хлорамфеникол-ацилтрансферазы (CAT) с использованием стандартных методик в области молекулярной биологии (Maniatis et al., выше), как показано на Фиг.6. (2) Конструкция индуцируемых генов должна быть изготовлена с использованием плазмиды РЖ, которая содержит область промотора мышиного металлотионеина (MT-1) (Brinster et al., Cell 27: 228-231, 1981). Данную плазмиду можно использовать в качестве исходного материала, и ею необходимо манипулировать, как показано на Фиг.7, с получением метал-индуцируемой генной конструкции.
2. Целый ряд линий животных клеток можно использовать для экспрессии ингибитора ИЛ-1 с применением векторов, описанных выше, для получения активного белка. Двумя потенциальными клеточными линиями, которые хорошо охарактеризованы по их способности промотировать экспрессию чужеродных генов, являются клетки мыши Ltk- и клетки dhfr яичника китайского хомячка (CHO), хотя экспрессия ингибитора ИЛ-1 не ограничивается этими клеточными линиями.
3. Векторную ДНК необходимо интродуцировать в эти клеточные линии с использованием целого ряда методик генного переноса. Используемый здесь метод включает методику кальций-фосфат-ДНК-преципитации, описанную S.L.Graham & A.S. van der Eb (Virology) 52: 456-4670 (1973), при которой экспрессирущий вектор для ингибитора ИЛ-1 соосаждают со вторым экспрессирующим вектором, кодирующим селектируемый маркер. В случае применения трансфекции клеток Ltk- селектируемым маркером является ген тимидинкиназы, а селекцию осуществляют так, как описано Wigler et al. (Cell 16: 777-785, 1979), а в случае применения клеток CHO dhfr- селектируемым маркером является дигидрофоля тредуктаза (DHFR), селекция которой описана в работе Ringold et al. J. Mol. Ap. Gen. 1: 155-175, 1981.
4. Клетки, экспрессирующие ген ингибитора ИЛ-1, следует выращивать в условиях, которые повышают уровни получения ингибитора ИЛ-1. Клетки, несущие конструкции металлотионеинового промотора, теперь можно выращивать в присутствии тяжелых металлов, таких как кадмий, которые приводят к 5-кратному повышению уровня используемого промотора MT-1 (Mayo et al., Cell 29: 99-108), впоследствии приводя к повышению уровней содержания белков ингибитора ИЛ-1. Клетки, содержащие векторы экспрессии ингибитора ИЛ-1 (либо ОВ-40, либо MT-1) вместе с вектором экспрессии DHFR могут быть взяты из протокола генной амплификации, описанного Ringold et al. (J. Mol. Appl. Genet 1: 165-175, 1981) с использованием мототрексата, конкурентного антагониста дигидрофолятредуктазы. Это приводит к большему числу копий генов DHFR присутствующих в клетках, а также повышенному числу копий генов ингибитора ИЛ-1, которые, в свою очередь, приводят к получению большего количества белка ингибитора ИЛ-1, продуцируемого клетками.
Пример 9
Очистка ингибитора ИЛ-1 из реномбинантных животных клеток
Поскольку ингибитор ИЛ-1 секретируется из клеток как натуральное вещество, ожидается, что методы, описанные выше для очистки натурального белка, позволяют осуществить аналогичную очистку и характеризацию рекомбинантного белка.
Пример 10
Последовательность ингибитора ИЛ-1
Аминоконцевой остаток ингибитора ИЛ-1 идентифицирован несколько раз путем непосредственного белкового секвенирования как аргинин. Результат такого секвенирования показан в Примере 3. В противоположность этому, аминоконцевой остаток ингибитора ИЛ-1, предсказанный последовательностью кДНК, представляет собой пролин (Р). Этот аминоконцевой остаток соответствует нуклеотидам 85-87 на Фиг.13 и окружен кольцом на Фиг.14 и 15. Это видимое несоответствие уезду кДНК-последовательностью и прямой белковой последовательностью можно разрешить путем предположения, что ошибка в кДНК-последовательности была инкорпорирована во время синтеза, катализируемого обратной транскриптазой из мРНК. То есть кодон CGA (аргинин), расположенный на мРНК, где он мог бы кодировать данный аминоконцевой остаток, мог быть изменен во время реакции обратной транскриптазы на кодон ССА (пролин) в кДНК. Данный тип проблемы относительно обратной транскриптазы изложен ранее в литературе, например в работе B.D.Clark et al., Nucleric Acids Research 14: 7897 (1986).
Заявитель полагает, что правильная аминокислотная последовательность белка - это та, которая предсказана кДНК, за исключением того, что аминоконцевой аминокислотой является аргинин вместо остатка пролина, указанного на Фиг.13-15. Заявитель предполагает, что обе ДНК-последовательности и их соответствующие пептидные последовательности подпадают в объем настоящего изобретения, хотя предпочтительной все же остается последовательность аминоконцевого аргинина.
Пример 11
В объем настоящего изобретения также включен белок, имеющий последовательность:

где X обозначает цистеин, серин или аланин, а Z обозначает аргинин или пролин.
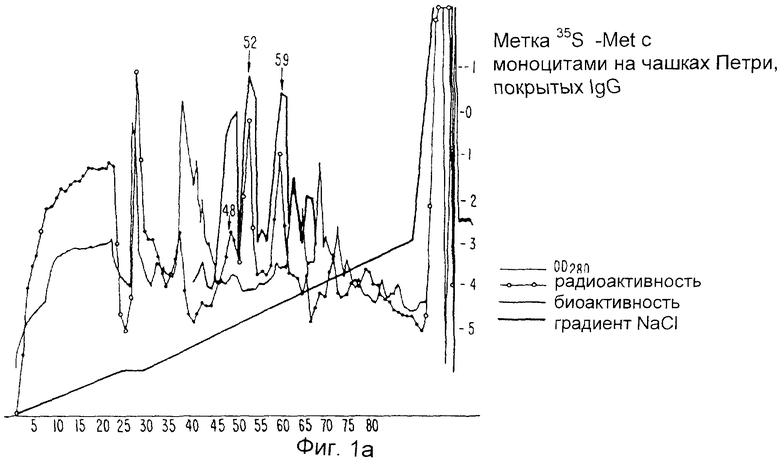
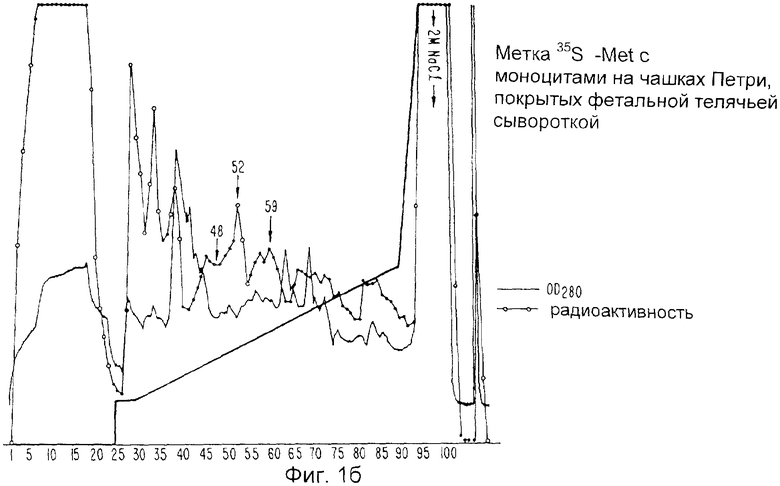
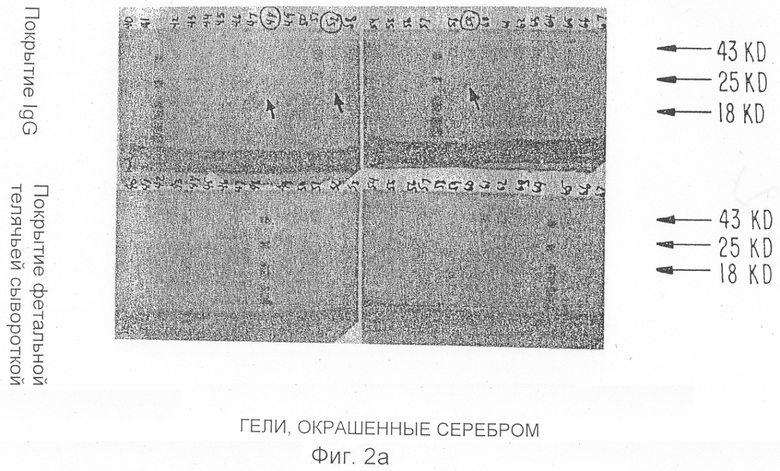
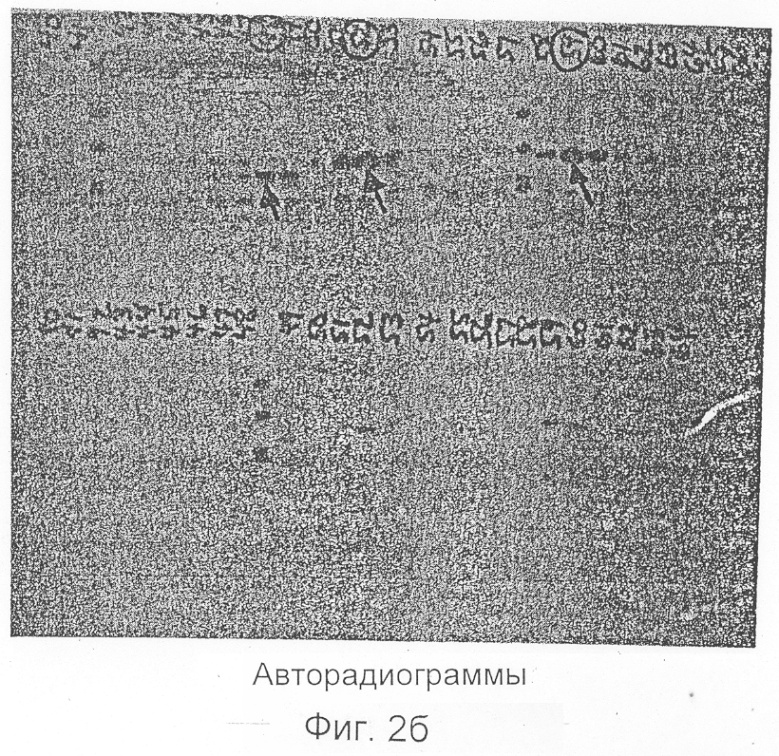
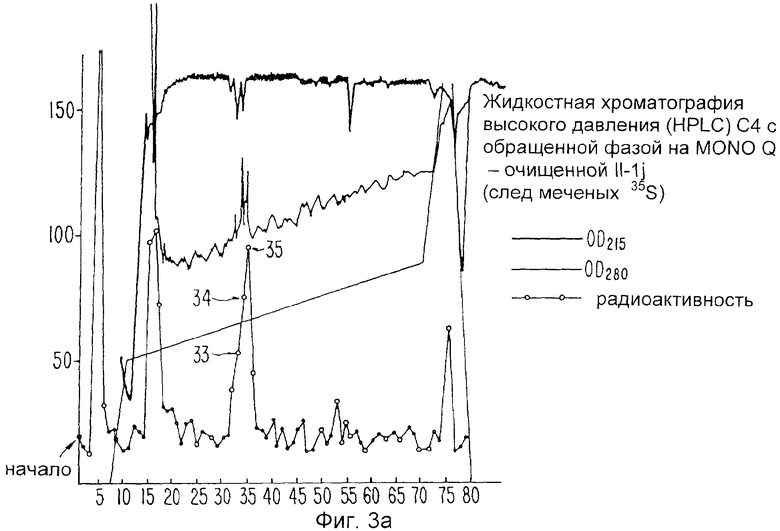
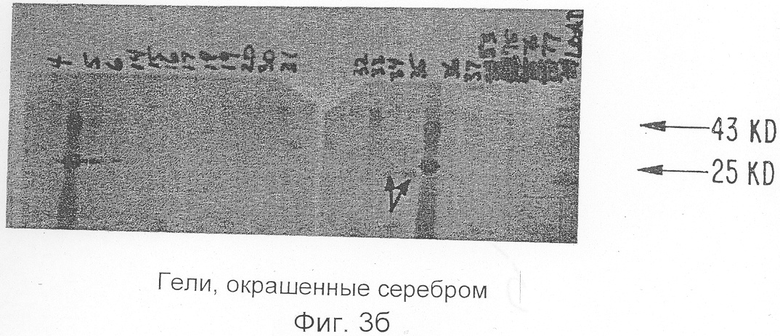

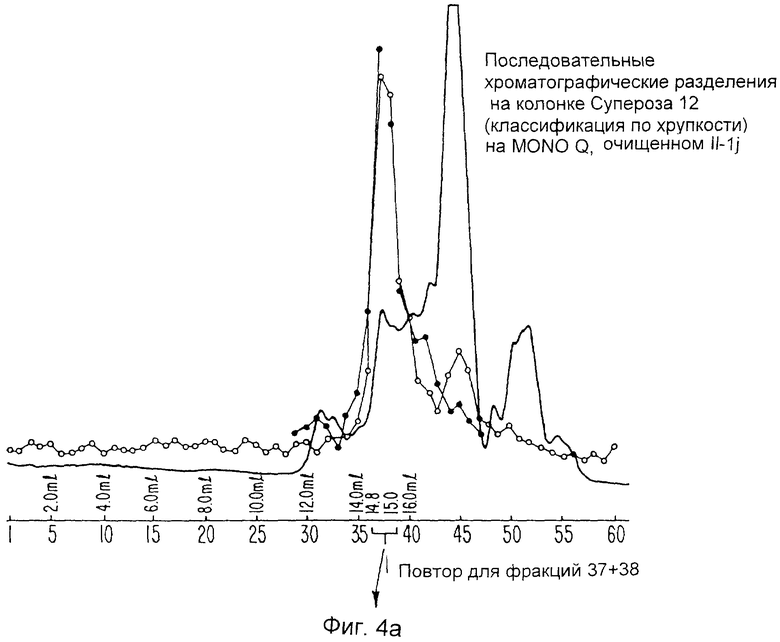

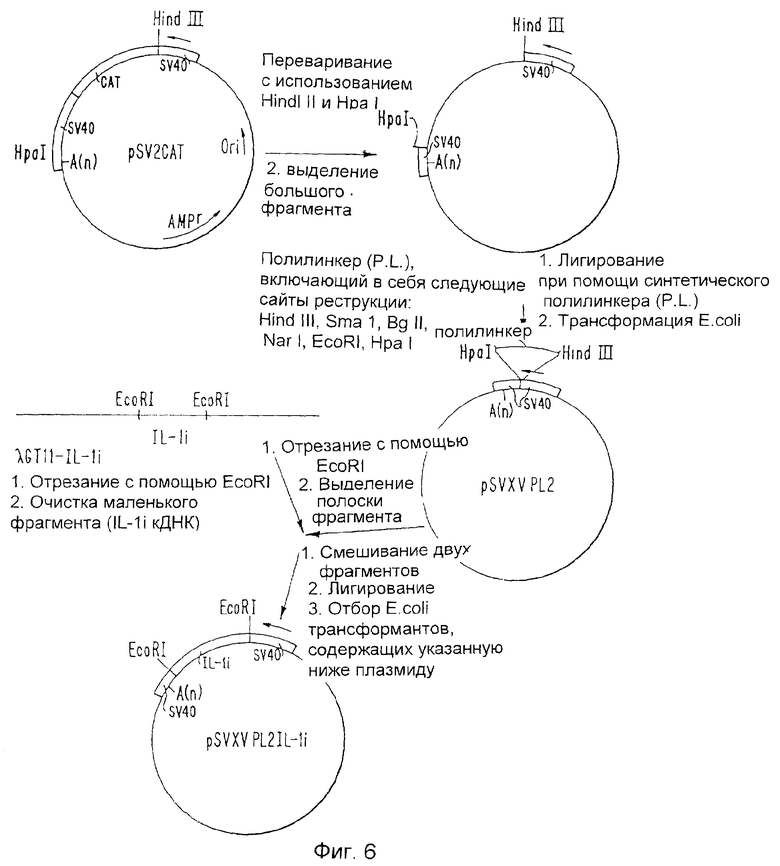
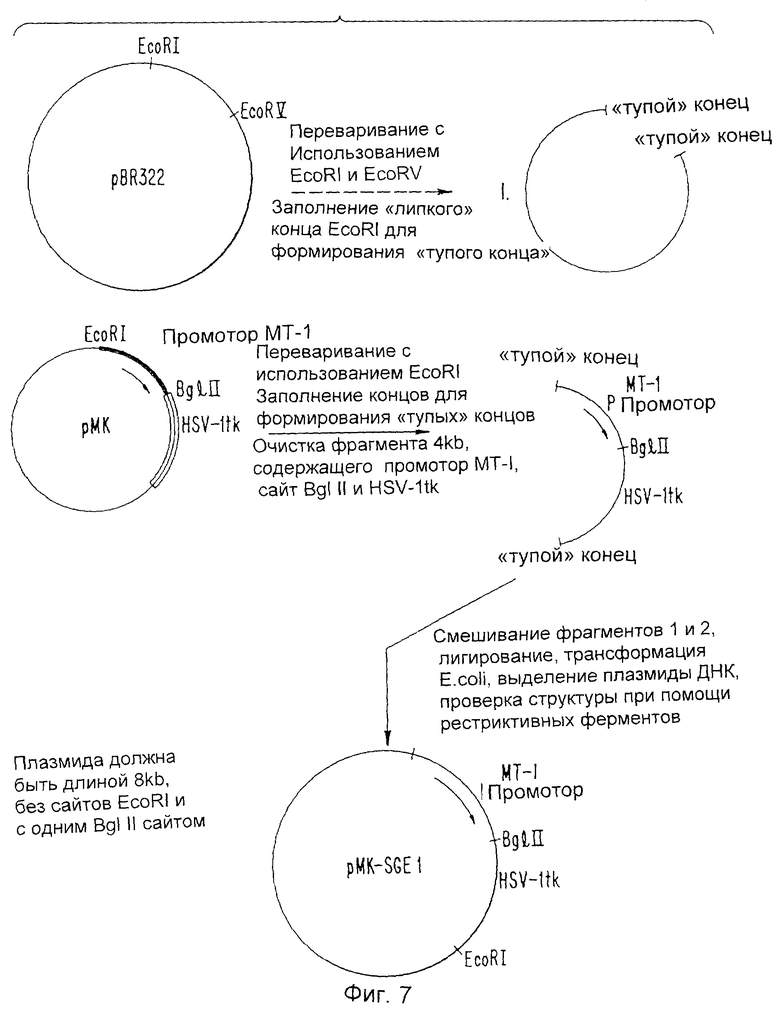
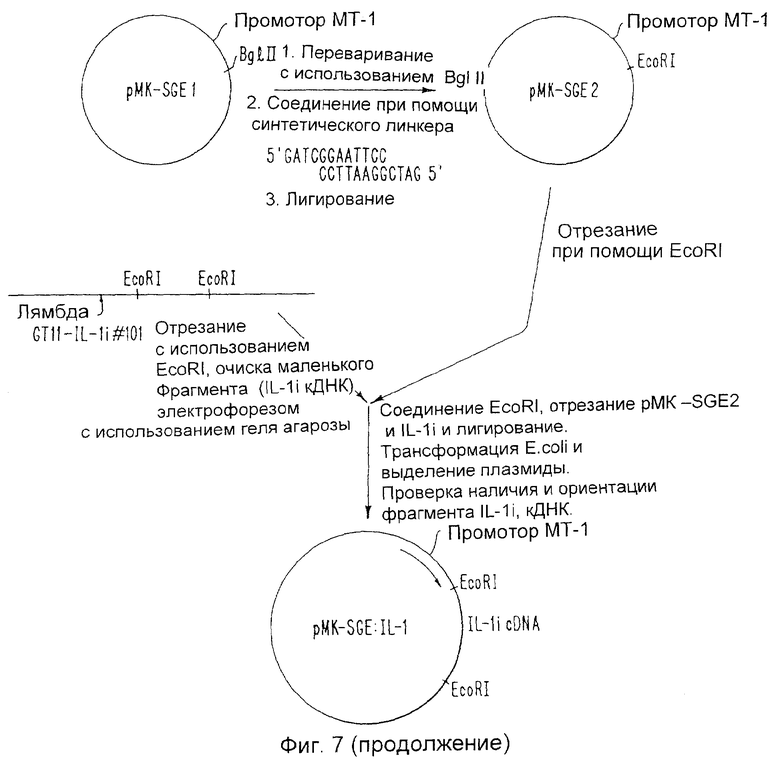
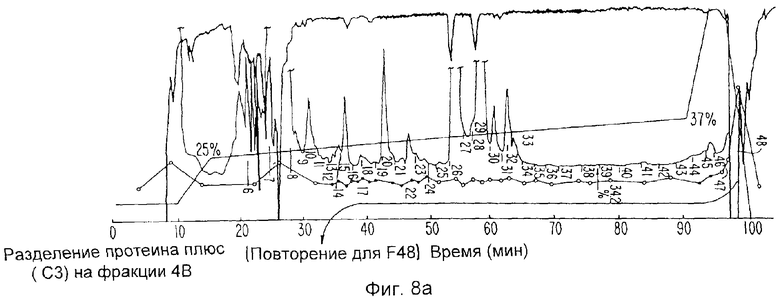
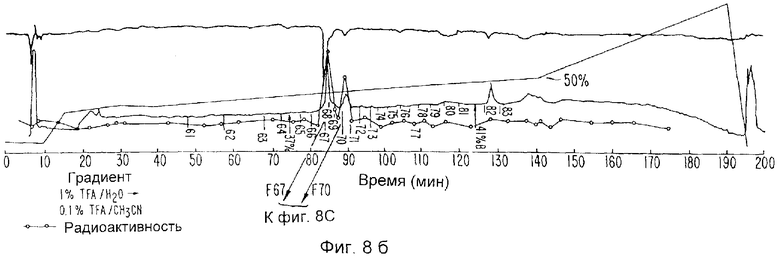


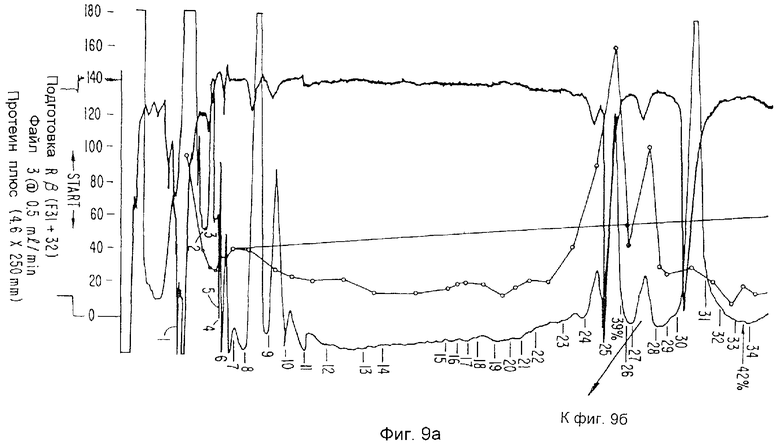
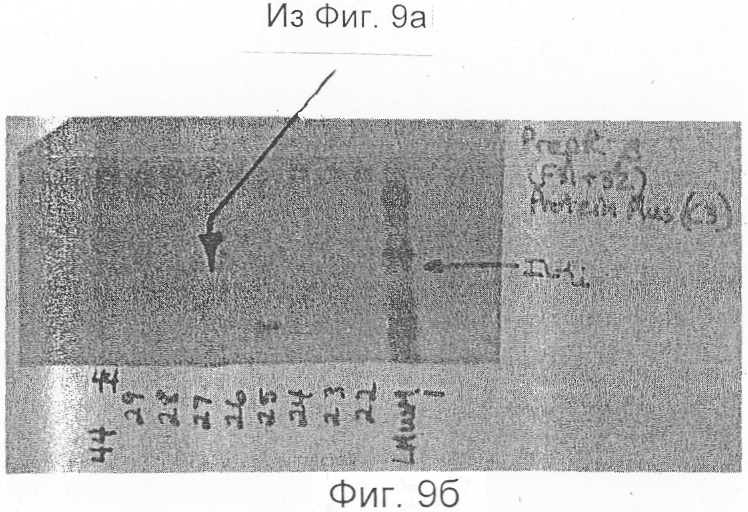
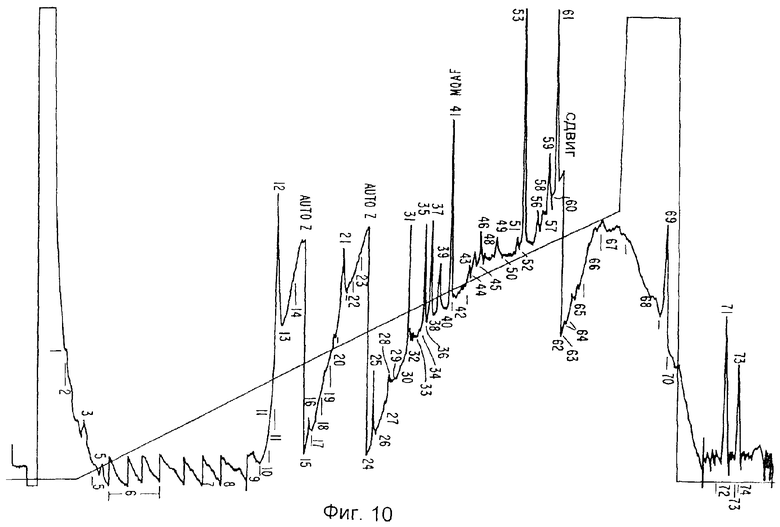
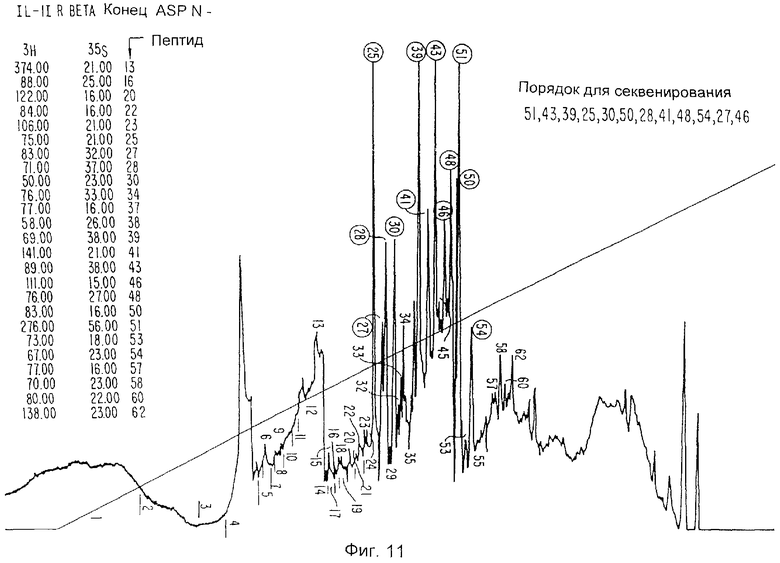
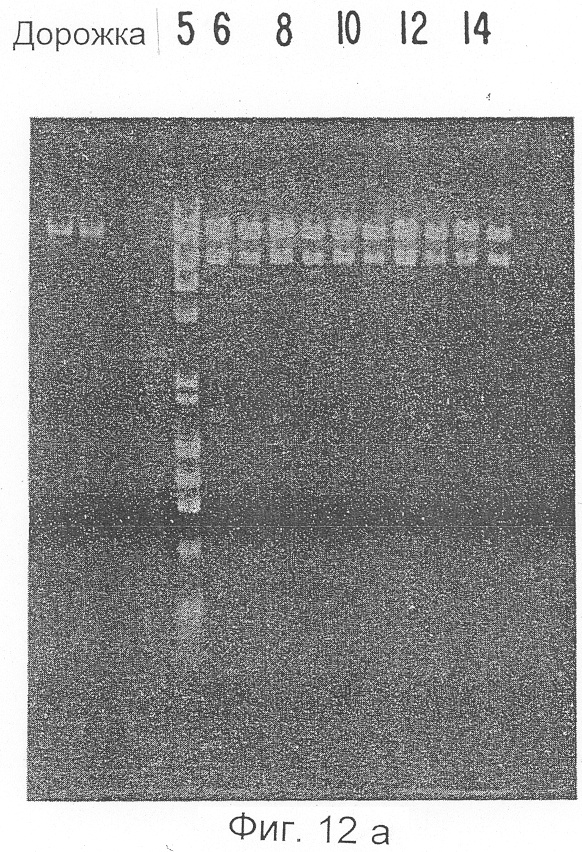



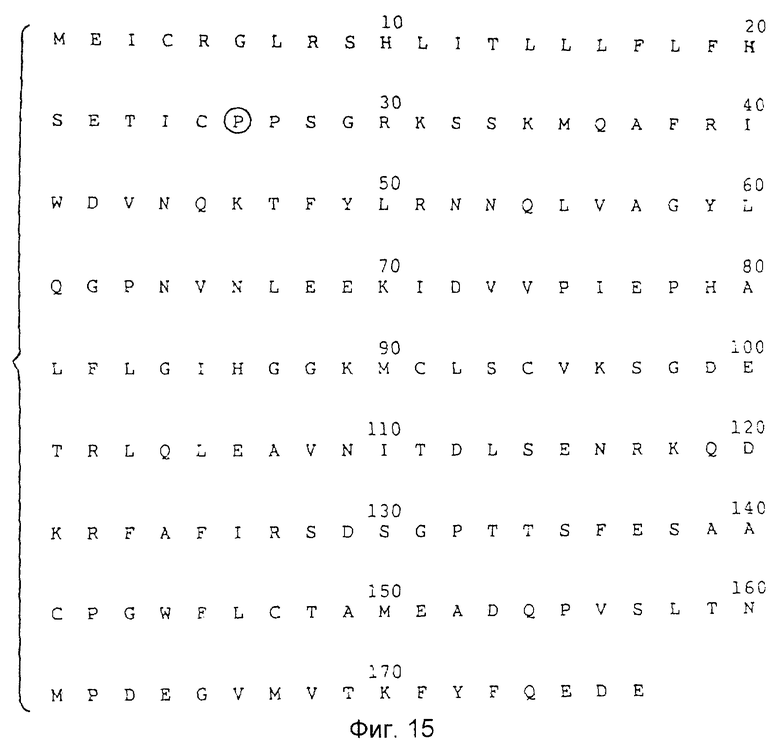
Изобретение относится к области биотехнологии, в частности генной инженерии, и может быть использовано в медико-биологической промышленности. С помощью технологии рекомбинантных ДНК получен полипептид (IL-li), проявляющий свойства ингибитора активности интерлейкина-1 альфа и интерлейкина-1 бета. Раскрыты последовательности ДНК, кодирующие предшественник и зрелую форму ингибитора; описано получение содержащих эти ДНК-последовательности векторных конструкций, а также трансформированных клеток, продуцирующих рекомбинантный IL-li. Применение изобретения позволяет масштабировать процесс получения ингибитора интерлейкина-1, пригодного для использования в медицине. 8 с. и 13 з.п. ф-лы, 26 ил.
(X) P S G R K S S K M Q A F R I W D V N Q K T F Y L R N
N Q L V A G Y L Q G P N V N L E E K I D V V P I E P H A
L F L G I H G G K M C L S C V K S G D E T R L Q L E A V
N I T D L S E N R K Q D K R F A F I R S D S G P T T S F
E S A A C P G W F L C T A M E A D Q P V S L T N M P D E
G V M V T K F Y F Q E D E,
где Х обозначает R или Р;
его фрагмент или гомолог, сохраняющий свойство ингибировать активность интерлейкина-1.
(X) P S G R K S S K M Q A F R I W D V N Q K T F Y L R N
N Q L V A G Y L Q G P N V N L E E K I D V V P I E P H A
L F L G I H G G K M C L S C V K S G D E T R L Q L E A V
N I T D L S E N R K Q D K R F A F I R S D S G P T T S F
E S A A C P G W F L C T A M E A D Q P V S L T N M P D E
G V M V T K F Y F Q E D E,
где Х обозначает R или Р.
а) трансформацию подходящей клетки-хозяина рекомбинантным экспрессирующим вектором по п.3;
б) выращивание трансформированной клетки в условиях, обеспечивающих экспрессию молекулы ДНК, содержащейся в векторе, и секрецию активного IL-li
и
в) выделение конечного продукта из культуральной среды.
(X) P S G R K S S K M Q A F R I W D V N Q K T F Y L R N
N Q L V A G Y L Q G P N V N L E E K I D V V P I E P H A
L F L G I H G G K M C L S C V K S G D E T R L Q L E A V
N I T D L S E N R K Q D K R F A F I R S D S G P T T S F
E S A A C P G W F L C T A M E A D Q P V S L T N M P D E
G V M V T K F Y F Q E D E,
где Х обозначает R или Р;
его фрагмент или гомолог, сохраняющий свойство ингибировать активность интерлейкина-1.
(X) P S G R K S S K M Q A F R I W D V N Q K T F Y L R N
N Q L V A G Y L Q G P N V N L E E K I D V V P I E P H A
L F L G I H G G K M C L S C V K S G D E T R L Q L E A V
N I T D L S E N R K Q D K R F A F I R S D S G P T T S F
E S A A C P G W F L C T A M E A D Q P V S L T N M P D E
G V M V T K F Y F Q E D E,
где Х обозначает R или Р.
(X) P S G R K S S K M Q A F R I W D V N Q K T F Y L R N
N Q L V A G Y L Q G P N V N L E E K I D V V P I E P H A
L F L G I H G G K M C L S C V K S G D E T R L Q L E A V
N I T D L S E N R K Q D K R F A F I R S D S G Р Т Т S F
E S A A C P G W F L C T A M E A D Q P V S L T N M P D E
G V M V T K F Y F Q E D E,
где Х обозначает R или Р.
| LIAO ЕТ AL., Journal of Immunology, 134, p.3882-3886, 1985 | |||
| ROBERTS ЕТ AL., Journal of Experimental Medicine, 163, p.511-519, 1986. |
Авторы
Даты
2006-10-27—Публикация
1999-02-11—Подача