УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к использованию вирусных векторов для экспрессии антигенов. Дополнительно описано использование слитых пептидов в качестве антигена.
Векторы на основе слитых пептидов упрощают режим дозирования и создают больше возможностей для гетерологичной бустер-иммунизации. Тем не менее, непредсказуемый характер процессинга слитых пептидов и презентации эпитопа и трудности в создании и репродукции аденовирусов, несущих большие вставки, препятствуют их широкомасштабному использованию.
Существует потребность в прогнозируемых способах создания вирусных векторов, эффективных для доставки генных продуктов.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к системе для получения вирусного вектора, несущего по меньшей мере две различные экспрессионные кассеты. В системе используется уникальный поливалентный плазмидный каркас, что позволяет эффективно детектировать и отбирать встроенные экспрессионные кассеты.
Также изобретение относится к способам получения поливалентных вирусных частиц с применением таких поливалентных каркасов по настоящему изобретению.
Ниже приводится более подробное описание этих и других вариантов осуществления и преимуществ настоящего изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На Фиг.1 показана сборка аденовирусных векторов ΔE1-ΔЕ3.
На Фиг.2 показано введение антигенов в локусы делеции Е1 и Е3 аденовирусных векторов.
На Фиг.3 представлена гистограмма, отображающая результаты сравнения in vivo экспрессии рекомбинантного аденовируса С9 шимпанзе, экспрессирующего этот же трансген (α1АТ) только из локуса Е1 (темные полосы), или из обоих локусов Е1 и Е3 (светлые полосы).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к системе создания вирусного вектора, несущего множественные экспрессионные кассеты к мишени. В системе используется молекула ДНК, несущая вирусный геном, содержащий кассеты клонирования, способные к переносу, несущие маркерные гены. Эту молекулу ДНК используют для создания вектора переноса, несущего вирусный геном, который содержит множество гетерологичных экспрессионных кассет, расположенных в различных локусах в пределах вирусного генома. Вирусный геном, несущий гетерологичные экспрессионные кассеты, высвобождается из вектора переноса по настоящему изобретению и упаковывается в подходящий вирусный капсид или белок оболочки с получением поливалентных вирусных векторов.
Используемую в настоящем изобретении молекулу ДНК и/или вектор переноса можно получить из любого генетического элемента, который может нести вирусный геном по настоящему изобретению и способного к переносу генома в клетку-хозяин. Можно выбрать любой подходящий генетический элемент (или каркас), включая, например, плазмиду, фаг, транспозон, космиду, эписому и тому подобное. В одном из вариантов осуществления генетический элемент подходит для экспрессии в прокариотических клетках, хотя можно использовать и другие системы клонирования.
Используемый в настоящем изобретении термин "различные локусы" указывает, что гетерологичная экспрессионная кассета первого выбранного продукта-мишени расположена в вирусном каркасе на участке, который не соприкасается со второй гетерологичной экспрессионной кассетой, то есть вирусные последовательности расположены между гетерологичными экспрессионными кассетами. Эти локусы могут находиться в разных областях гена или в разных открытых рамках считывания одной области гена. Альтернативно, в пределах одной открытой рамки считывания может находиться множество локусов, но не граничащих друг с другом, например разделенных спейсерами, нативными последовательностями, сайтами рестрикции или тому подобным.
Используемый в настоящем изобретении термин "экспрессионная кассета" содержит последовательность нуклеиновой кислоты, которая кодирует продукт, доставляемый в клетку-хозяин. Последовательность нуклеиновой кислоты, которая кодирует продукт, находится под контролем регуляторных последовательностей, которые регулируют экспрессию продукта в клетке-хозяине. Соответственно, экспрессионная кассета является гетерологичной для векторных последовательностей, которые фланкируют кассету. В одном из вариантов осуществления регуляторные элементы в каждой гетерологичной экспрессионной кассете отличаются от регуляторных элементов других гетерологичных экспрессионных кассет, что тем самым уменьшает (или устраняет) риск гомологичной рекомбинации в процессе клонирования вируса и при манипулировании в клетках. В одном из вариантов осуществления каждая гетерологичная экспрессионная кассета имеет различные промоторы и/или энхансеры, и/или polyA последовательности. Однако в других вариантах осуществления гетерологичная экспрессионная кассета в поливалентном векторе по настоящему изобретению может иметь один или несколько одинаковых регуляторных элементов с другой гетерологичной экспрессионной кассетой, находящейся в поливалентном векторе. В таком варианте осуществления регуляторный элемент, предпочтительно, представляет собой короткую последовательность, в которой не возможна рекомбинация.
Согласно настоящему описанию кодируемый продукт может быть мишенью для иммунной системы и стимулировать гуморальный и/или клеточный иммунный ответ, может быть адьювантом для другого кодируемого продукта, может оказывать эффект иммуномодуляции и/или терапевтический эффект. Согласно настоящему изобретению с помощью поливалентного вирусного вектора можно доставлять комбинацию таких продуктов.
Термин "функционально делетированный" или "функциональная делеция" означает, что достаточная часть гена удалена или иным образом повреждена, например мутацией или модификацией, так что часть гена больше не способна продуцировать функциональные продукты генной экспрессии. Если желательно, может быть удален весь ген. В настоящем документе описаны и другие подходящие участки повреждения или удаления гена.
I. ПОЛИВАЛЕНТНАЯ ВИРУСНАЯ КОНСТРУКЦИЯ
А. МОЛЕКУЛА ДНК, НЕСУЩАЯ ВИРУСНЫЙ ГЕНОМ И МНОЖЕСТВЕННЫЕ ГЕНЫ-РЕПОРТЕРЫ
В одном из аспектов настоящее изобретение относится к молекуле ДНК, несущей вирусные последовательности, которые будут упаковываться в поливалентный вирусный вектор. В одном из вариантов осуществления такая молекула ДНК является плазмидой. Тем не менее, может быть выбран другой подходящий генетический элемент, как определено выше. Введение вектора в клетку может осуществляться любыми способами, известными в данной области, или как описано в настоящей заявке, в том числе с помощью трансфекции.
Вирусные последовательности выбраны из такого типа вируса(ов), который желательно использовать в качестве носителя для доставки, и которые обладают достаточным пространством для размещения множественных экспрессионных кассет. Такие вирусные последовательности могут быть выбраны из вирусов с капсидным белком, например из аденовирусов или из оболочечных вирусов [например, ретровирусов, таких как вирус кошачьего лейкоза (FeLV), HTLVI и HTLVII], и лентивирусов [например, из вируса иммунодефицита человека (HIV), вируса иммунодефицита обезьяны (SIV), вируса кошачьего иммунодефицита (FIV), вируса инфекционной анемии лошадей и спумавируса], из поксвирусов [например, вируса оспы канареек] и других. Следует учитывать, что специалист в данной области без труда сможет выбрать и другие вирусы.
В одном из вариантов осуществления вирусные последовательности получают из аденовирусов. Соответственно, поливалентная молекула ДНК содержит последовательности нуклеиновых кислот генома аденовируса, который содержит по меньшей мере последовательности, необходимые для упаковки генома вируса в капсид. Обычно поливалентная молекула аденовируса содержит 5'-концевые цис-элементы аденовируса и 3'-концевые цис-элементы аденовируса на внешнем 5'-конце и на 3'-конце генома аденовируса соответственно. На 5'-конце аденовирусного генома содержатся 5'-цис-элементы, необходимые для упаковки и репликации; то есть, 5'-концевые последовательности инвертированного повтора (ITR) (которые действуют в качестве точки начала репликации) и 5'-концевые упаковывающие энхансерные домены (которые содержат последовательности, необходимые для укладки линейных геномов аденовирусов, и энхансерные элементы для E1-промотора). На 3'-конце гена аденовируса находятся 3'-цис-элементы (включая ITR), необходимые для укладки и капсидирования.
Кроме того, поливалентная молекула ДНК может содержать другие последовательности аденовируса или может быть по меньшей мере функционально делетирована в одной или нескольких областях гена аденовируса. В одном из вариантов осуществления аденовирусный вектор, используемый в настоящем изобретении, содержит область Е2 или ее функциональную часть (например, область, кодирующую Е2а и/или E2b) и один или несколько поздних генов, например L1, L2, L3, L4 и L5. В некоторых вариантах осуществления аденовирусные векторы, используемые в настоящем изобретении, могут содержать всю или часть области Е4 (например, ORF6 Е4).
Например, из аденовирусной последовательности, которая образует часть вектора, можно удалить весь или часть запаздывающего раннего гена Е3 аденовируса. Полагают, что функция обезьяньего гена Е3 не имеет отношения к функционированию и продукции рекомбинантных вирусных частиц.
Например, может быть сконструирован аденовирусный вектор с делецией Е1, по меньшей мере с делецией области ORF6 гена Е4, или, из-за избыточности функции этой области, с делецией всей области Е4. Вместе с тем другой вектор по настоящему изобретению содержит делецию в запаздывающем раннем гене Е2а. Соответственно, в этих векторах сохраняют поздние гены (т.е., L1, L2, L3, L4 и L5) и другие элементы, которые являются существенными для укладки аденовирусных векторов в вирусные частицы. Для некоторых целей делецию можно также осуществлять в промежуточных генах IX и IVA2. Делеции можно проводить в других структурных или неструктурных аденовирусных генах. Рассмотренная выше делеция может быть использована самостоятельно, то есть аденовирусная последовательность, используемая в настоящем изобретении, может содержать делецию только в этой одной области. Альтернативно, можно использовать любую комбинацию делеций всего гена или его частей, которая эффективно разрушает их биологическую активность. Например, в одном из примеров вектора в аденовирусной последовательности может быть делеция генов Е1 и гена Е4, или генов Е1, вместе с делецией или без делеций Е3, и тому подобное.
В другом варианте осуществления используют геном лентивируса. Обычно лентивирусная векторная плазмида содержит необходимые для вектора цис-действующие генетические последовательности для инфицирования клетки-мишени и для переноса гетерологичных экспрессионных кассет. Таким образом, удаляют исходные оболочечные белки и промотор для последовательности gag.
Вирусные последовательности в плазмидном каркасе не следует ограничивать последовательностями капсидного или оболочечного типа, в которые они ввведены. Таким образом, плазмидный каркас может содержать вирусные последовательности одного вирусного источника, которые капсидированы или упакованы в оболочку другого источника. Например, поливалентный вектор HIV может быть упакован в оболочку FIV; поливалентный вектор FIV может быть упакован в оболочку HIV; поливалентный аденовирусный вектор может быть упакован в капсид другого серотипа. При этом специалисту в данной области будут очевидны другие псевдотипичные вирусные векторы.
После того как вирусные последовательности клонируют в плазмиду с помощью технологий, известных специалистам в данной области, происходит изменение вирусного генома, и теперь он содержит первую способную к переносу кассету, расположенную в первом делетированном участке вирусного генома, и вторую способную к переносу кассету, расположенную во втором делетированном участке вирусного генома. Плазмида необязательно может содержать большое число способных к переносу кассет, каждая из которых расположена в разных локусах вирусного генома. Каждая способная к переносу кассета фланкирована уникальным набором сайтов рестрикции, что позволяет осуществлять их селективный перенос из плазмиды и быстрое встраивание гетерологичной экспрессионной кассеты.
Все способные к переносу кассеты, используемые в настоящем изобретении, содержат последовательности нуклеиновых кислот детектируемого гена-репортера, функционально связанные с последовательностями, которые регулируют их экспрессию в клетке-хозяине. Соответственно, каждая способная к переносу кассета содержит уникальный ген-репортер, который легко отличим от генов-репортеров других способных к переносу кассет, которые располагаются на плазмидном каркасе. В одном из вариантов осуществления гены-репортеры экспрессируют продукты, которые отличаются друг от друга по цвету.
Подходящие гены-репортеры включают такие продукты кодирования, которые можно отличить от других генов-репортеров, находящихся на поливалентном плазмидном каркасе по настоящему изобретению. Например, флуоресцентные белки различают по цвету после возбуждения их светом с соответствующей длиной волны, и к ним относятся, например, красный флуоресцентный белок, зеленый флуоресцентный белок, синий флуоресцентный белок, голубой флуоресцентный белок, желто-зеленый флуоресцентный белок. Подходящие флуоресцентные белки, которые можно использовать у выбранного типа клеток-хозяев, являются коммерчески доступными, например от компании ClonTech. При этом другие подходящие гены-репортеры, отличающиеся по цвету, включают в себя, например, gusA (синий); DsRed (красный); люциферазу (красный); бета-галактазидазу. Альтернативно, специалист в данной области техники может использовать другой ген-репортер, содержащий метку или таг, большое число которых известно специалистам в данной области.
Подходящие гены-репортеры выбирают в зависимости от системы клетки-хозяина, используемой для клонирования. Саму клетку-хозяин можно выбрать из любых биологических организмов, включая прокариотические клетки (например, бактериальные) и эукариотические клетки, включая клетки насекомых, дрожжевые клетки и клетки млекопитающих, как ниже описано более подробно.
В одном из предпочтительных вариантов осуществления используют прокариотическую систему. Кроме того, клетка-хозяин способна к трансфекции ДНК и к экспрессии трансфектной ДНК, и способна к экспрессии выбранного гена-репортера желательным образом, например колориметрическим способом.
Хорошо известны примеры подходящих прокариотических систем, включая бактериальные клетки. Например, подходящие бактериальные штаммы могут включать в себя, например, Escherichia coli C600-F-, е14, mcrA, thr-1 supE44, thi-1, leuB6, lacY1, tonA21, [[lambda]][-] [Huynh, Young, and Davis (1985) DNA Cloning, Vol.1, 56-110]; DH1-F[-], recA1, endA1, gyrA96, thi-1, hsdR17 (rk[-], mk[+], supE44, relA1, [[lambda]][-] [-Hanahan (1983) J.Mol.Biol. 166, 557-580; XL1Blue-MRF'-D(mcrA)182, D(mcrCB-hsdSMR-mrr)172, endAl, supE44, thi-1, recA, gyrA96, relAl, lac, l-, [F'proAB, lacI[q]ZDM15, Tn10(tet[r])]; SURE Cells [Stratagene]; е14(mcrA), D (mcrCB-hsdSMR-mrr)171, sbcC, recB, recJ, umuC::Tn5 (kan[r]), uvrC, supE44, lac, gyrA96, relA1, thi-1, end A1 [F'proAB, lacI[q]DM15, Tn10(tet[r])]; GM272-F[-], hsdR544 (rk[-], mk[-]), supE44, supF58, lacY1 или [[Delta]]lacIZY6, galK2, galT22, metB1m, trpR55, [[lambda]][-]; HB101-F[-], hsdS20 (rb[-], mb[-]), supE44, ara14, galK2, lacY1, proA2, rpsL20 (str[R]), xyl-5, mtl-1, [[лямбда]][-], recA13, mcrA(+), mcrB(-) [Raleigh and Wilson (1986) Proc. Natl. Acad. Sci. USA 83, 9070-9074]; JM101-supE, thi, [[дельта]](lac-proAB), [F', traD36, proAB, lacIqZ[[Delta]]M15], рестрикция: (rk[+], mk[+]), mcrA+ [Yanisch-Perron et al. (1985) Gene 33, 103-119]; XL-1 blue recA1, endA1, gyrA96, thi, hsdRl7 (rk[+], mk[+]), supE44, relA1, [[lambda]][-], lac, [F', proAB, lacIqZ[[Delta]]M15, Tn10 (tet[R])] [-Bullock, et al. (1987) BioTechniques 5, 376-379]; GM2929 [B.Bachman, Yale E.coli Genetic Stock Center (CSGC#7080)]; штамм M.Marinus; пол F[-]; (ara-14, leuB6, fhuA13, lacY1, tsx-78, supE44, [glnV44], galK2, galT22, 1[-], mcrA, dcm-6, hisG4, [Oc], rftD1, rpsL136, dam-13::Tn9, xyl-5, mtl-1, recF143, thi-1, mcrB, hsdR2); MC1000-(araD139, D[ara-leu]7679, galU, galK, D[lac] 174, rpsL, thi-1); ED8767 (F-, el4-[mcrA], supE44, supF58, hsdS3[rB[-]mB[-]], recA56, galK2, galT22, metBl, lac-3 или lac3Y1. Подходящие прокариотические клетки-хозяева доступны из Американской коллекции типовых культур (American Type Culture Collection), Manassas, VA, US, других общедоступных клеточных депозитариев, а также из различных институтов и коммерческих источников. Выбор подходящей системы клонирования или клеток не ограничивает объем настоящего изобретения.
Каждая способная к переносу кассета, используемая в конструкции по настоящему изобретению, фланкирована уникальным набором сайтов рестрикции крупнощепящих рестриктаз. Каждый набор сайтов рестрикции крупнощепящих рестриктаз имеет первый сайт рестрикции крупнощепящей рестриктазы на 5'-конце кассеты, способной к переносу, и второй сайт рестрикции крупнощепящей рестриктазы на 3'-м конце кассеты, способной к переносу. В одном из вариантов осуществления сайтов рестрикции крупнощепящих рестриктаз обеспечивает направленное клонирование экспрессионных кассет в локус. Однако настоящее изобретение не ограничено направлением вставок. Другими словами, способная к перемещению кассета и/или гетерологичная экспрессионная кассета может располагаться как от 5' к 3', так и от 3' к 5'-конца относительно ориентации рамки считывания прилегающего к ним вирусного генома. Кроме того, в некоторых вариантах осуществления набор сайтов рестрикции крупнощепящих рестриктаз может определить ненаправленное клонирование экспрессионной кассеты в выбранный локус.
В одном из примеров крупнощепящих рестриктаз I-SceI можно выбирать как для 5', так и для 3' сайтов рестрикции крупнощепящих рестриктаз, которые составляют общий набор. Этот фермент обеспечивает направленное клонирование даже при фланкировании обоих концов кассеты. В других вариантах осуществления I-SceI можно использовать в сочетании с другой крупнощепящей рестриктазой с образованием набора сайтов рестрикции крупнощепящих рестриктаз. Соответственно, каждый набор сайтов рестрикции крупнощепящих рестриктаз является уникальным, что обеспечивает расщепление единственного локуса и вставку гетерологичной экспрессионной кассеты в выбранный сайт-мишень.
В другом варианте осуществления крупнощепящую рестриктазу выбирают так, чтобы произошло расщепление только выбранного локуса (локусов) в вирусном геноме, то есть расщепление происходит только на 5' и на 3'-концах способной к переносу кассеты и/или гетерологичной экспрессионной кассеты, и чтобы ни один генетический элемент, несущий вирусный геном, или другие положения в вирусном геноме, расщеплены не были.
В настоящей заявке такую рестриктазу называют крупнощепящей рестриктазой. Примеры таких крупнощепящих рестриктаз включают рестриктазы, имеющие сайты распознавания из семи, восьми или большего числа оснований, включая, например, I-Ceu I, PI-See I, TevII, BmoI, DmoI, FseI, PacT, PmeI, PsrI, BcgI, BglI, BsabI, BstXI, DrdI, EcoNI, FseI, MaM I, Msl I, Mwo I, Psha I, Sfi I, Swa I, Xcm I, а также Xmn I и тому подобные. Подходящие рестриктазы можно идентифицировать с помощью информации, доступной специалистам в данной области из литературных источников и из различных интерактивных баз данных, например из базы данных REBASE™. Рестриктазы, подходящие для способа по настоящему изобретению, можно легко определить с помощью различных компьютерных программ и/или интерактивных баз данных. Подходящие рестриктазы доступны из различных коммерческих источников, включая, например, наряду с другими, England Biolabs, Obiogene, Lift Technology, Roche, BB Clontech, Stratagene, Amersham Pharmacia.
Таким образом, поливалентная плазмида по настоящему изобретению содержит по меньшей мере две способные к переносу кассеты, каждая из которых фланкирована уникальным набором сайтов рестрикции крупнощепящих рестриктаз, что обеспечивает селективную замену способных к переносу кассет на гетерологичную экспрессионную кассету. Такие поливалентные плазмиды трансфецируют в клетки-хозяева, что обеспечивает экспрессию маркерных генов, способных к переносу кассет.
В. ПОЛИВАЛЕНТНЫЙ ВЕКТОР ПЕРЕНОСА, НЕСУЩИЙ ГЕТЕРОЛОГИЧНУЮ ЭКСПРЕССИОННУЮ КАССЕТУ
После выбора соответствующей рестриктазы(рестриктаз) используют общепринятые методики расщепления и лигирования. Обычно плазмидную ДНК смешивают с рестриктазой(рестриктазами) и инкубируют в течение примерно от 12 до около 48 часов. После этого проводят обычную стадию экстракции фенолом/хлороформом. Например, можно использовать экстракцию фенолом/хлороформом, а затем преципитацию этанолом и растворение преципитата (например, в ТЕ (трис-ЭДТА) или другом подходящем буфере) для использования на оставшихся этапах способа. Например, см. руководство Sambrook, Molecular Cloning: A Laboratory Manual, 2nd Ed., 5.28-5.32, Appendix E.3-E.4 (Cold Spring Harbor Press, Cold Spring Harbor, New York, 1989). Другие подходящие способы могут быть предложены производителем или поставщиком используемой рестриктазы или могут быть известны специалистам в данной области из других источников.
Обычно для того чтобы обеспечить надлежащую вставку гетерологичной экспрессионной кассеты, гетерологичную экспрессионную кассету фланкируют на 5' и 3'-конце сайтами рестрикции, комплиментарными набору сайтов рестрикции, которые фланкируют способную к переносу кассету на сайте, в который вводят кассеты экспрессии.
Таким образом, обычно первую гетерологичную кассету экспрессии клонируют в сайт отрезанной способной к переносу кассеты. Предпочтительно, способ по настоящему изобретению позволяет быстро идентифицировать плазмиды, содержащие первую гетерологичную экспрессионную кассету. Такие плазмиды не экспрессируют продукт первого маркерного гена, но экспрессируют продукт второго маркерного гена (а также любой продукт другого присутствующего маркерного гена). Другими словами, если первая способная к переносу кассета экспрессирует зеленый флуоресцентный белок, то отсутствие зеленого цвета после расщепления и лигирования будет указывать на успешное удаление способной к переносу кассеты в сайте первого маркерного гена.
В одном из вариантов осуществления этапы расщепления и лигирования последовательно повторяют для каждой способной к переносу кассеты. Другими словами, для того чтобы ввести экспрессионную кассету в желательный локус, осуществляют первый этап расщепления, используя первый набор рестриктаз для удаления одной способной к переносу кассеты. После этого осуществляют второй этап расщепления, используя второй набор рестриктаз, являющийся уникальным для набора сайтов, фланкирующих вторую способную к переносу кассету. Вторая гетерологичная экспрессионная кассета, фланкированная сайтами рестрикции, соответствующими набору сайтов, фланкирующему вторую способную к переносу кассету, лигирована в каркас плазмиды, и выбирают клоны, которые не экспрессируют второй маркерный ген. Необязательно, осуществляют один или несколько дополнительных этапов расщепления для удаления одной или нескольких других способных к переносу кассет.
Таким образом, способ по настоящему изобретению позволяет эффективно получать поливалентный вектор переноса, который может использоваться для получения инфекционных вирусных частиц.
II. СПОСОБ ПОЛУЧЕНИЯ ПОЛИВАЛЕНТНОГО ВИРУСНОГО ВЕКТОРА
Для получения вирусных частиц с капсидом или оболочкой можно использовать поливалентный вектор переноса по настоящему изобретению, используя способы, известные специалистам в данной области. Такие способы включают хорошо известные способы клонирования кДНК, например способы, описанные в литературе [цитированном выше Sambrook et al.], использование перекрывающихся олигонуклеотидных последовательностей генома аденовируса, полимеразную цепную реакцию и любой подходящий способ, с помощью которого можно получить желательную нуклеотидную последовательность. Используют стандартную трансфекцию и методики одновременной трансфекции, например технологии преципитации CaPO4. Другие используемые известные способы включают гомологичную рекомбинацию вирусных геномов, плакирование вирусов на агаровое покрытие, способы измерения генерации сигнала и тому подобное.
Специалисту в данной области не составит труда подобрать подходящие клеточные линии продуценты. Например, подходящая клетка-хозяин может быть выбрана из любого биологического организма, включая прокариотические клетки (например, бактериальные) и эукариотические клетки, включая клетки насекомых, дрожжевые клетки и клетки млекопитающих. Клетки-хозяева могут быть выбраны из клеток любых видов млекопитающих, включая, но ими не ограничиваясь, такие как А549, WEHI, 3Т3, 10Т1/2, клетки НЕК 293 или PERC6 (каждый тип клеток экспрессирует функциональный Е1 аденовируса) [Fallaux, FJ et al (1998), Hum Gene Ther, 9: 1909-1917], Saos, C2C12, L-клетки, HT1080, HepG2 и первичные фибробласты, гепатоциты и миобластические клетки, полученные у млекопитающих, включая человека, обезьяну, мышь, крысу, кролика и хомяка. Объем настоящего изобретения не ограничен выбором вида млекопитающего, у которого получают клетки; а также не ограничен типом клеток млекопитающих, то есть фибробласт, гепатоцит, опухолевая клетка и тому подобное.
Как правило, при доставке поливалентного вектора переноса, содержащего гетерологичную экспрессионную кассету в клетку-хозяин, каркас берут в количестве от около 5 мкг до около 100 мкг ДНК, или от около 10 до около 50 мкг ДНК, от около 1×104 клеток до около 1×1013 клеток, или около 105 клеток. Однако можно регулировать количество плазмидной ДНК для клетки-хозяина, учитывая такие факторы, как выбранный вектор, способ доставки и выбранные клетки-хозяева.
Обычно поливалентные векторы переноса культивируют в клетках-хозяевах, которые экспрессируют капсидный белок и/или оболочечный белок. В клетках-хозяевах поливалентных вирусов геномы, экспрессирующие гетерологичную экспрессионную кассету, высвобождаются и упаковываются в капсидный белок или оболочечный белок с образованием инфекционной вирусной частицы.
А. Вирусные векторы с капсидными белками
В одном из вариантов осуществления настоящее изобретение относится к способу укладки поливалентного вирусного генома в инфекционный вирусный капсид.
В одном из вариантов осуществления вирусный капсид получают из аденовируса. Аденовирусная частица или вектор по настоящему изобретению состоит из инфекционного белкового капсида аденовируса, в который упакован поливалентный вирусный геном, содержащий две или более гетерологичных экспрессионных кассет, и каждая из этих кассет несет продукт, экспрессирующийся в клетке-хозяине. В другом варианте осуществления такие аденовирусные векторы дефектны по репликации и, таким образом, не реплицируются в клетке-хозяине.
Выбор серотипа аденовирусных последовательностей, присутствующих в векторе, не ограничивает объем настоящего изобретения. Различные аденовирусные штаммы являются доступными из American Type Culture Collection, Manassas, Virginia, или доступны по запросу из различных коммерческих источников и институтов. Кроме того, последовательности многих таких штаммов доступны из различных баз данных, включая, например, PubMed™ и GenBank™. Гомологичные аденовирусные векторы, полученные из аденовирусов обезьян или человека, описаны в опубликованной литературе [например, см. патент США 5240846]. Последовательности ДНК ряда аденовирусных типов, включая тип Ad5 [GenBank™ Accession No. M73260], доступны из GenBank. Аденовирусные последовательности могут быть получены из любого известного аденовирусного серотипа, например такого, как серотипы 2, 3, 4, 7, 12 и 40, и, дополнительно, из любого идентифицированного в настоящее время человеческого типа. Также в векторных конструкциях по настоящему изобретению можно использовать сходные аденовирусы, способные инфицировать животных нечеловеческого происхождения (например, обезьян). В одном из вариантов осуществления по меньшей мере один аденовирус, используемый в настоящем изобретении, получают у примата нечеловеческого происхождения. Примеры подходящих последовательностей примата нечеловеческого происхождения включают аденовирусы обезьян, такие как Pan5 (также С5), Pan6 (также С6), Pan7 (также С7), Pan9 (также С68) и С1. Описаны рекомбинантные аденовирусы для доставки молекул в клетки-хозяева. См. патент США 6083716, в котором описаны аденовирусные векторы, полученные из двух аденовирусов шимпанзе, С1 и С68 (также называемые Pan9), и международную патентную публикацию WO 02/33645 [векторы, полученные из Pan5, Pan6, Pan7]. Однако объем изобретения ими не ограничен.
Различные способы получения аденовирусных частиц хорошо известны специалистам в данной области. Выбор подходящих способов получения не ограничивает объем настоящего изобретения. См., например, патент США 6083716; международную патентную публикацию WO 02/33645; патентную заявку США 10/465302 и ее международную часть WO 2005/001103.
Кратко, поливалентный аденовирусный вектор переноса по настоящему изобретению, который не способен экспрессировать функциональный вариант любого важного генного продукта аденовируса (например, E1a, E1b, Е2а, E2b, и/или Е4 ORF6), можно культивировать в присутствии недостающих генных продуктов аденовируса, необходимых для вирусного инфицирования и размножения аденовирусной частицы. Эти вспомогательные функции можно обеспечивать путем культивирования каркаса в присутствии одной или нескольких хелперных конструкций (например, плазмиды или вируса) или упаковывающей клетки-хозяина. См., например, методики, описанные для получения "минимального" аденовирусного вектора человека в международной патентной публикации WO 96/13597, опубл. 9 мая 1996 года.
1. Хелперные вирусы
Таким образом, в зависимости от состава генов аденовируса в поливалентном векторе переноса, используемом в качестве носителя экспрессионных кассет, может быть необходим вспомогательный аденовирус или нереплицирующийся вирусный фрагмент для предоставления достаточных генных последовательностей аденовируса, необходимых для получения инфективной рекомбинантной вирусной частицы, содержащей кассету экспрессии. Хелперные вирусы, которые могут быть использованы, содержат выбранные генные последовательности аденовируса, отсутствующие в аденовирусной векторной конструкции и/или не экспрессирующиеся упаковывающей клеточной линией, в которую она трансфицирована. В одном из вариантов осуществления хелперный вирус дефектен по репликации и содержит различные гены аденовируса, кроме вышеописанных последовательностей. Такой хелперный вирус по желанию используется в сочетании с E1-экспрессирующей клеточной линией.
Хелперные вирусы могут быть также сформированы в поликатионные коньюгаты, как описано Wu et al, J. Biol Chem., 264: 16985-16987 (1989); К.J.Fisher and J.M.Wilson, Biochem. J., 299:49 (April 1, 1994). Хелперный вирус может необязательно содержать вторую репортерную экспрессионную кассету. В данной области известно большое число таких генов-репортеров. Наличие гена-репортера на хелперном вирусе, который отличается от генного продукта аденовирусного вектора, позволяет независимо контролировать как каркас аденовирусного вектора, так и хелперный вирус. Такой второй репортер используют для разделения получаемого рекомбинантного вируса и хелперного вируса при очистке.
2. Комплементационная клеточная линия
Для получения рекомбинантных аденовирусов, делетированных по любому из вышеописанных генов, функция делетированной области гена, если она важна для репликации и инфицирования вируса, должна быть восстановлена с помощью хелперного вируса или клегочной линии, то есть комплементационной клеточной линией или упаковывающей линией клеток. Во многих случаях можно использовать клеточную линию, экспрессирующую Е1 человека, для транс-комплементирования аденовирусного вектора шимпанзе. Это дает определенное преимущество, так как из-за различий между последовательностями аденовируса шимпанзе по настоящему изобретению и аденовирусными последовательностями Е1 человека, обнаруживаемыми в доступных в настоящее время упаковывающих клетках, использование E1-содержащих клеток настоящего человека по изобретению предотвращает образование способных к репликации аденовирусов в процессе репликации и продуцирования. Однако в некоторых случаях желательно использовать клеточную линию, которая экспрессирует генный продукт Е1 для получения делетированного по Е1 аденовируса обезьян. Такие клеточные линии описаны, например, см. в патенте США 6083716.
Если желательно, можно использовать описанные в настоящем описании последовательности для получения упаковывающей линии клеток или линии клеток, которая экспрессирует по меньшей мере E1-ген аденовируса под контролем промотора транскрипции для экспрессии выбранной линии клеток-предшественников. Для этой цели можно использовать индуцируемые или конститутивные промоторы. Примеры таких промоторов подробно описаны в настоящем описании. Клетку-предшественник выбирают для получения новой клеточной линии, экспрессирующей любой желательный ген аденовируса. Не ограничивая объем настоящего изобретения, такая предшествующая клеточная линия может, наряду с другими, представлять собой HeLa [АТСС Accession No. CCL 2], A549 [ATCC Accession No. CCL 185], НЕК 293, KB [CCL 17], Detroit [например, Detroit 510, CCL 72] и WI-38 [CCL 75]. Все указанные клеточные линии доступны из Американской коллекции типовых культур, American Type Culture Collection, 10801 University Boulevard, Manassas, Virginia 20110-2209. Другие подходящие предшествующие клеточные линии могут быть получены из других источников.
Такие E1-экспрессирующие клеточные линии являются удобными для получения рекомбинантных аденовирусных E1-делетированных векторов. Кроме того или альтернативно, изобретение относится к клеточным линиям, которые экспрессируют один или более генных продуктов аденовируса обезьян, например E1a, E1b, Е2а и/или Е4 ORF6, которые могут быть сконструированы, используя по существу те же методики, используемые для получения рекомбинантных вирусных векторов обезьян. Такие клеточные линии можно использовать для транс-комплементных аденовирусных векторов, делегированных по основным генам, которые кодируют эти продукты. Получение клетки-хозяина по настоящему изобретению включает методики, такие как сборка выбранных последовательностей ДНК. Такую сборку можно осуществлять с помощью обычных методик. Такие методики включают клонирование кДНК и геномное клонирование, которые хорошо известны и описаны в цитированных выше документах Sambrook et al., использование перекрывающихся олигонуклеотидных последовательностей аденовирусных геномов, в сочетании с полимеразной цепной реакцией, способами синтеза и любыми другими подходящими способами, которые обеспечивают желательную нуклеотидную последовательность.
Еще в одном альтернативном варианте основные генные продукты аденовируса получают транс-способом с помощью вектора и/или хелперного вируса. В этом случае подходящую клетку-хозяин можно выбрать из любых биологических организмов, включая прокариотические (например, бактериальные) и эукариотические клетки, включая клетки насекомых, дрожжевые клетки и клетки млекопитающих. Подходящие клетки-хозяева включают в себя клетки, известные специалисту в данной области, а также клетки, описанные в настоящем изобретении.
3. Сборка вирусной частицы и трансфекция клеточной линии
Один или более отсутствующих аденовирусных генов могут быть стабильно интегрированы в геном клетки-хозяина, стабильно экспрессироваться в виде эписом, или временно экспрессироваться. Все генные продукты могут временно экспрессироваться, экспрессироваться в виде эписомы или стабильно интегрироваться, или некоторые из генных продуктов могут стабильно экспрессироваться, а другие экспрессироваться временно.
Кроме того, для каждого аденовирусного гена можно выбрать промотор, независимо от конститутивного промотора, индуцируемого промотора или нативного аденовирусного промотора. Промоторы могут быть регулируемыми промоторами, например специфическим физиологическим состоянием организма или клетки (то есть статусом дифференциации или в реплицирующихся или в покоящихся клетках) или экзогенно-вводимыми факторами. Также можно осуществлять введение молекул (в виде плазмид или вирусов) в клетку-хозяин, используя методики, известные специалистам в данной области техники, и как описано в настоящем описании. В одном из вариантов осуществления используют технологии прямого клонирования. Такие технологии описаны [G.Gao et al., Gene Ther. 2003 Oct; 10 (22): 1926-1930; в опубл. патенте США 2003-0092161-А, 15 мая 2003 года; в международной патентной заявке PCT/US03/12405]. В другом варианте осуществления используют стандартные технологии трансфекции, например трансфекцию CaPO4 или электропорацию. Как сборка выбранных аденовирусных последовательностей ДНК (а также последовательностей, кодирующих продукт и другие векторные элементы) в различные промежуточные плазмиды, так и использование плазмид и векторов для получения рекомбинантной вирусной частицы, достигается путем использования общепринятых методик. Например, после конструирования и сборки желательного поливалентного вирусного вектора вектор in vitro трансфицируют в упаковывающую клеточную линию в присутствии хелперного вируса. Между хелперной и векторной последовательностями происходит гомологичная рекомбинация, которая позволяет реплицироваться последовательностям генов аденовируса в вектор и упаковаться в вирионные капсиды, что приводит к образованию рекомбинантных вирусных векторных частиц. Настоящий способ для создания таких вирусных частиц основан на трансфекции. Однако объем настоящего изобретения не ограничен этими способами.
Образующиеся рекомбинантные аденовирусы могут использоваться при переносе двух или более выбранных гетерологичных экспрессионных кассет в выбранную клетку.
В. Вирусные векторы с оболочечными белками
В другом варианте осуществления векторы переноса по настоящему изобретению используют для упаковки вирусного вектора в инфекционную частицу вируса, имеющего оболочечный белок, например лентивируса или поксвируса. Примеры подходящих лентивирусов включают, например, вирус иммунодефицита человека (HIV), вирус иммунодефицита обезьяны (SIV), вирус козьего артрита и энцефалита, вирус инфекционной анемии лошадей, вирус бычьего иммунодефицита, висна вирус и вирус кошачьего иммунодефицита (FIV). Представленные в настоящем изобретении примеры иллюстрируют использование минигенов, полученных из HIV и FIV. Вместе с тем также можно использовать другие лентивирусы человеческого или нечеловеческого происхождения. Последовательности, используемые в конструкциях по настоящему изобретению, могут быть получены из университетских, некоммерческих (например, из культур, American Type Culture Collection, Manassas, Virginia) или из коммерческих источников лентивирусов. Способы получения таких вирусных векторов хорошо известны специалистам в данной области.
Способы получения лентивирусных векторов описаны в литературе. См., например, публикацию JE Coleman, et al., Physiol Genomics. 2003 Feb 6; 12 (3): 221-8, где описано получение лентивирусной системы на основе HIV-1 с использованием самоинактивирующихся лентивирусных векторов. В одном из примеров лентивирусные векторы получают в системе временной трансфекции, в которой клеточная линия трансфицирована тремя отдельными плазмидными системами экспрессии. К ним относятся плазмида вектора переноса, которую получают в соответствии с настоящим изобретением и которая содержит участки выбранного лентивирусного провируса и гетерологичной кассеты экспрессии, упаковывающей плазмиды или конструкции, и плазмиды с лентивирусным оболочечным геном (ENV), который может представлять собой оболочечный белок того же лентивируса или отличного от него вируса [Amado and Chen, Lentiviral Vectors-the Promise of Gene Therapy Within Reach? Science. 285 (5428): 674-76 (1999)]. Три плазмидных компонента вектора помещены в упаковочную клетку, которую затем вводят в каркас лентивируса.
В одном из вариантов осуществления плазмида вектора переноса содержит цис-действующие генетические последовательности, необходимые для инфицирования вектором клетки-мишени и для переноса терапевтических (или репортерных) генов, и содержит сайты рестрикции для введения желательных генов. Удаляют 3' и 5'-конецевые длинные повторы (LTR), первичные оболочечные белки и промотор gag последовательности. Упаковывающая плазмида содержит элементы, необходимые для упаковки вектора, такие как структурные белки, гены HIV (кроме гена env, который определяет инфицирование Т-клеток, или вектора, способного инфицировать только эти клетки), и ферменты, которые продуцируют векторные частицы. Обычно сигналы укладки и смежные с ними сигналы удаляют, так что участки, отвечающие за укладку вирусной ДНК, отделяют от участков, которые их активируют. Таким образом, упаковывающие последовательности не будут встраиваться в геном вируса, а вирус не будет репродуцироваться после инфицирования клетки-хозяина.
Третий оболочечный ген плазмиды другого вируса определяет тип клетки-мишени и инфицирование вместо Т-клеток, например, гликопротеид вируса везикулярного стоматита, известный как VSV, MLV и другие. Обычно HIV могут инфицировать только Т-хелперные клетки, так как эти клетки используют их белок gp120 для связывания с рецептором CD4. Однако существует возможность генетического обмена белка, связывающегося с рецептором CD4, на другой белок, который является кодирующим для различных типов клеток, в отношении которых будет проводиться генная терапия. Это делает возможным использование широкого диапазона клеток-мишеней для лентивирусного вектора. Другие способы получения лентивирусов и векторных элементов описаны в опубликованном международном патенте WO 03/092582, который приведен в качестве ссылки.
Вместе с тем можно получать другие оболочечные вирусные векторы, используя способы поливалентных вирусных каркасов по настоящему изобретению. Например, см. "The Uses of Poxviruses as Vectors", Current Gene Therapy, vol. 3, no.6, pp.583-595 (December 2003); M.E.Perkus, et al, "Poxvirus-based vaccine candidates for cancer, AIDS, and other infectious diseases", Journal of Leukocyte Biology, Vol 58, Issue 11-13, (1995).
III. ИСПОЛЬЗОВАНИЕ ПОЛИВАЛЕНТНОГО ВИРУСНОГО ВЕКТОРА
Поливалентные вирусные векторы по настоящему изобретению вводят в состав композиции, содержащей физиологически совместимый носитель. Эти композиции могут использоваться для различных схем лечения и иммунизации. Преимуществом является тот факт, что экспрессия множества генных продуктов поливалентными вирусными векторами может уменьшить количество вектора, или другого лекарственного препарата, необходимого для доставки индивиду для достижения желательного биологического действия.
В одном из вариантов осуществления поливалентный вирусный вектор по настоящему изобретению содержит гетерологичную экспрессионную кассету, несущую терапевтический продукт. Такой поливалентный вирусный вектор может дополнительно нести один или более дополнительных терапевтических продуктов. Дополнительный терапевтический продукт может быть предназначен для лечения тех же состояний или симптомов, что и первый терапевтический продукт, или с лечением других симптомов. Если желательно, выбранный терапевтический генный продукт может быть доставлен для модулирования любого ответа на поливалентный вирусный вектор.
В другом варианте осуществления поливалентный вирусный вектор по настоящему изобретению содержит гетерологичную экспрессионную кассету, несущую продукт, который стимулирует гуморальный и/или цитотоксический иммунный ответ у мишени. Такой поливалентный вирусный вектор может дополнительно нести один или более таких дополнительных иммуногенных продуктов. Второй продукт может быть предназначен для стимуляции иммунного ответа у мишени или у перекрестно-реагирующей мишени. В другом варианте осуществления второй продукт может представлять собой терапевтический продукт, предназначенный для лечения симптомов, связанных с основным состоянием. Еще в одном варианте осуществления второй продукт может быть адьювантом другого генного продукта, доставляемого поливалентным вирусным вектором. Вместе с тем еще в одном варианте осуществления второй продукт представляет собой терапевтический продукт, доставляемый для модулирования любого ответа на поливалентный вирусный вектор.
Используемые в настоящем изобретении иммунные модуляторы включают в себя продукты, которые модулируют ответ иммунной системы, например на вирусный вектор. Примеры иммунных модуляторов включают, например, цитокины и интерлейкины.
Используемые в настоящем изобретении подходящие иммуномодулирующие соединения могут включать, например, иммуноглобулин CTLA4; анти-CD4 антитела; FK506; и интерлейкины (IL), включающие любые интерлейкины из IL1-21, например IL-2, IL-3, IL-4, IL-10, IL-12 и IL-18. Например, IL-10 может использоваться дли ингибирования местного противовоспалительного ответа; лиганд Fas может использоваться для ингибирования аденовирус-опосредованных ответов Т-клеток.
Вместе с тем специалистам в данной области из настоящего описания будут очевидны подходящие комбинации продуктов для доставки в поливалентном вирусном векторе по настоящему изобретению, в составе смеси, содержащей один или более поливалентных вирусных векторов по настоящему изобретению, или по схеме, включающей доставку одного или более поливалентных вирусных векторов по настоящему изобретению.
А. ДОСТАВКА ТЕРАПЕВТИЧЕСКИХ МОЛЕКУЛ, ОПОСРЕДОВАННАЯ ПОЛИВАЛЕНТНЫМ ВИРУСНЫМ ВЕКТОРОМ
В одном из вариантов осуществления поливалентные векторы вводят людям в соответствии с опубликованными способами генной терапии. Вирусный поливалентный вектор, несущий множественные гетерологичные экспрессионные регулирующие кассеты, можно вводить пациенту, предпочтительно, в виде суспензии в биологически совместимом растворе или в фармацевтически приемлемом носителе для доставки. Подходящий носитель включает стерильный физиологический раствор. В этих целях можно использовать другие водные и неводные изотонические стерильные растворы для инъекций, и водные и неводные стерильные суспензии, известные как фармацевтически приемлемые носители и известные специалистам в данной области техники.
Поливалентные векторы вводят в количествах, достаточных для трансдукции клетки-мишени и обеспечения достаточных уровней генного переноса и экспрессии, для получения терапевтического эффекта без нежелательных побочных эффектов или с приемлемыми с медицинской точки зрения физиологическими эффектами, которые может определить специалист в области медицины. Общепринятые и фармацевтически приемлемые пути введения включают, но ими не ограничиваются, прямое введение в сетчатку и другие способы внутриглазной доставки, прямое введение в печень, ингаляционный, интраназальный, внутривенный, внутримышечный, интратрахеальный, подкожный, внутрикожный, ректальный, пероральный и другие парентеральные пути введения. Если желательно, пути введения можно комбинировать или подбирать в зависимости от генного продукта или состояния. Прежде всего путь введения будет зависеть от характера состояния, на которое направлено лечение.
Доза вирусного вектора будут зависеть прежде всего от таких факторов, как состояние, на которое направлено лечение, возраст, вес и общее состояние пациента, и могут, таким образом, изменяться у различных пациентов. Например, терапевтически эффективная для взрослого человека или терапевтически эффективная ветеринарная доза вирусного вектора в целом находится в диапазоне от около 100 мкл до около 100 мл носителя, содержащего частицы в концентрации от около 1×106 до около 1×1015, от около 1×1011 до 1×1013 частиц, или от около 1×109 до 1×1012 вирусных частиц. Дозы могут изменяться в зависимости от размера животного и пути введения. Например, подходящая доза для человека или ветеринарная доза (для животного весом около 80 кг) для внутримышечного введения находится в диапазоне от около 1×109 до около 5×1012 частиц на мл, для одного участка. Необязательно доставку можно осуществлять в несколько участков локализации. В другом примере подходящая доза у человека или ветеринарная доза пероральных композиций может находиться в диапазоне от около 1×1011 до около 1×1015 частиц. Специалист в данной области техники сможет подобрать дозу в зависимости от пути введения и от целей их применения, терапии или иммунизации, для которых используют рекомбинантный вектор. Можно отслеживать уровни экспрессии терапевтического продукта или уровень циркулирующих антител для иммуногена для определения частоты введения дозы. При этом другие способы определения выбора времени частоты введения будут очевидны специалисту в данной области техники.
В одном из вариантов осуществления поливалентный вирусный вектор содержит гетерологичную экспрессионную кассету, кодирующую терапевтический продукт, и гетерологичную экспрессионную кассету, кодирующую иммуномодулятор. В настоящем изобретении выбранный иммуномодулятор определяют как средство, способное ингибировать образование нейтрализующих антител, направленных против рекомбинантного вектора по настоящему изобретению или способных ингибировать элиминацию цитолитических Т-лимфоцитов (CTL) из вектора. Иммуномодулятор может препятствовать взаимодействию субпопуляций Т-хелперов (TH1 или TH2) и В-клеток для ингибирования образования нейтрализующих антител. Альтернативно, иммуномодулятор может ингибировать взаимодействие между TH1-клетками и клетками CTL для уменьшения элиминации CTL из вектора. Различные эффективные иммуномодуляторы и дозы для их использования описаны, например, авторами Yang et al, J.Virol, 70 (9) (сентябрь, 1996 г.); в международном патенте WO 96/12406, опубл. 2 мая 1996 года; и в опубликованном международном патенте WO 96/26285.
1. Терапевтический продукт
Эффективные терапевтические продукты, кодируемые гетерологичной экспрессионной кассетой, включают гормоны и факторы роста и дифференцировки, включая, но ими не ограничиваясь, инсулин, глюкагон, гормон роста (ГР), паратиреоидный гормон (ПТГ), релизинг-фактор гормона роста (ФВГР), фолликулостимулирующий гормон (ФСГ), лютеинизирующий гормон (ЛГ), человеческий хорионический гонадотропин (чХГ), фактор роста эндотелиальных сосудов (ФРЭС), ангиопоэтины, ангиостатин, гранулоцитарный колониестимулирующий фактор (ГКСФ), эритропоэтин (ЭПО), фактор роста соединительный ткани (ФРСТ), основной фактор роста фибробластов (оФРФ), кислый фактор роста фибробластов (кФРФ), эпидермальный фактор роста (ЭФР), трансформирующий фактор роста α (TGFα), тромбоцитарный фактор роста (TGF), факторы роста I и II инсулина (ФРИ-I и ФРИ-II), любой член суперсемейства трансформирующего фактора роста, включая TGF, активины, ингибины, или любые костные морфогенетические белки (BMP) BMP 1-15, любой хереглуин/нейрегулин/ARIA/neu фактор дифференцировки (НДФ) семейства факторов роста, фактор роста нервов (ФРН), нейротрофический фактор головного мозга (BDNF), нейротрофины NT-3 и NT-4/5, цилиарный нейротрофический фактор (GDNF), нейротрофический фактор глиальной клеточной линии (ГЛНФ), нейртурин, агрин, любой член семейства семафоринов/коллапсинов, нетрин-1 и нетрин-2, фактор роста гепатоцитов (HGF), эфрины, ноггин, «звуковой ежик» и тирозингидроксилазу.
Другие генные продукты, которые могут использоваться, включают белки, которые регулируют иммунную систему, включая, но ими не ограничиваясь, цитокины и лимфокины, такие как тромбопоэтин (ТПО), интерлейкины (IL) от IL-1 до IL-25 (включая, например, IL-2, IL-4, IL-12 и IL-18), хемоаттрактант для моноцита, фактор, ингибирующий лейкоз, гранулоцитарно-макрофагальный колониестимулирующий фактор, лиганд Fas, фактор некроза опухоли и интерфероны, и фактор стволовой клетки, лиганд flk-2/flt3. Генные продукты, продуцируемые иммунной системой, также эффективны в соответствии с настоящим изобретением. К ним относятся, но ими не ограничиваются, иммуноглобулины IgG, IgM, IgA, IgD и IgE, гибридные иммуноглобулины, гуманизированные антитела, одноцепочечные антитела, рецепторы Т-клеток, рецепторы химерных Т-клеток, одноцепочечные рецепторы Т-клеток, молекулы главного комплекса гистосовместимости МНС класса I и класса II, а также иммуноглобулины и молекулы МНС, полученные методами генной инженерии. Генные продукты, которые могут также использоваться, включают комплементарные регуляторные белки, мембранные кофакторные белки (МСР), фактор распада (DAF), CR1, CF2 и CD59.
Вместе с тем другие генные продукты, которые могут использоваться, включают любой рецептор гормонов, факторов роста, цитокинов, лимфокинов, регуляторных белков и белков иммунной системы. Настоящее изобретение охватывает рецепторы для регуляции холестерина, включая рецепторы липопротеидов низкой плотности (ЛНП), рецепторы липопротеидов высокой плотности (ЛВП), рецепторы липопротеидов очень низкой плотности (ЛОНП) и фагоцитарный рецептор. Настоящее изобретение также относится к генным продуктам, таким как члены суперсемейства рецепторов стероидных гормонов, включая глюкокортикоидные рецепторы и рецепторы эстрогенов, рецепторы витамина D и другие ядерные рецепторы. Кроме того, генные продукты, которые могут использоваться включают факторы транскрипции, такие как jun, fos, max, mad, сывороточный фактор ответа (SRF) AP1, AP2, myb, MyoD и миогенин, белки, содержащие ETS-box, TFE3, E2F, ATF1, ATF2, ATF3, ATF4, ZF5, NFAT, CREB, HNF-4, C/EBP, SP1, белки, связывающие ССААТ-box, фактор регуляции интерферона (IRF-1), белок опухоли Вильмса, ETS-связывающий белок, STAT, GATA-бокс связывающие белки, например GATA-3, и семейство белков Forkhead со структурой типа «крылатой спирали».
Другие генные продукты, которые могут использоваться, включают карбамоилсинтетазу I, орнитинтранскарбамилазу, аргиносукцинатсинтетазу, аргиносукцинатлиазу, аргиназу, фумарилацетоацетатгидролазу, фенилаланингидроксилазу, альфа 1 антитрипсин, глюкозо-6-фосфатазу, порфиробилиногендеаминазу, фактор VIII, фактор IX, цистатион-бета-синтазу, разветвленную цепь кетоацидодекарбоксилазы, альбумин, изовалерил-СоА дегидрогеназу, пропионил СоА карбоксилазу, метилмалонил СоА мутазу, глутарил СоА дегидрогеназу, инсулин, бета-глюкозидазу, пируваткарбоксилат, печеночную фосфорилазу, фосфорилазу-киназу, глицин декарбоксилазу, Н-белок, Т-белок, последовательность трансмембранного регулятора кистозного фиброза (CFTR) и последовательность дистрофина кДНК.
Другие генные продукты, которые могут использоваться, включают неприродные полипептиды, такие как химерные или гибридные полипептиды, имеющие неприродные аминокислотные последовательности, содержащие вставки, делеции или аминокислотные замены. Например, у некоторых пациентов с иммунной недостаточностью могут быть эффективны одноцепочечные иммуноглобулины, полученные способами генной инженерии. Другие типы неприродных генных последовательностей включают антисмысловые молекулы и каталитические нуклеиновые кислоты, такие как рибозимы, которые можно использовать для уменьшения сверхэкспрессии мишени. Снижение и/или модуляция экспрессии гена является особенно желательной для лечения гиперпролиферативных состояний, характеризующихся гиперпролиферацией клеток, таких как рак и псориаз. Полипептиды-мишени включают такие полипептиды, которые продуцируются только в гиперпролиферативных клетках или уровень их экспрессии выше по сравнению с нормальными клетками. Антигены-мишени включают полипептиды, кодируемые такими онкогенами, как myb, myc, fyn, и генами транслокации bcr/abl, ras, src, P53, neu, trk и EGRF. Кроме онкогенных продуктов, таких как антигены-мишени, полипептиды-мишени для противоопухолевого лечения и защитных схем лечения включают вариабельные области антител, продуцируемых В-клеточными лимфомами, и вариабельные области Т-клеточных рецепторов Т-клеточных лимфом, которые, в некоторых вариантах осуществления, также можно использовать в качестве антигенов-мишеней для аутоиммунного заболевания. Другие опухолеспецифические полипептиды можно использовать в качестве полипептидов-мишеней, например полипептиды с более высоким уровнем в опухолевых клетках, включая полипептиды, распознаваемые моноклональным антителом 17-1А, и фолат-связывающие полипептиды.
Другие подходящие терапевтические полипептиды и белки включают полипептиды и белки, которые могут быть эффективны для лечения индивидуумов, страдающих аутоиммунными заболеваниями и расстройствами, путем передачи универсального защитного иммунного ответа против мишеней, связанных с аутоиммунитетом, включая клеточные рецепторы и клетки, которые продуцируют самонаправленные антитела. Опосредованные Т-клетками аутоиммунные болезни включают в себя ревматоидный артрит (РА), рассеянный склероз (PC), синдром Шегрена, саркоидоз, инсулинозависимый сахарный диабет (ИЗСД), аутоиммунный тиреоидит, реактивный артрит, анкилозирующий спондилит, склеродерму, полимиозит, дерматомиозит, псориаз, васкулит, грануломатоз Вегенера, болезнь Крона и язвенный колит.Каждое из этих заболеваний характеризуется Т-клеточными рецепторами (ТКР), которые связываются с эндогенными антигенами и инициируют воспалительный каскад, связыванный с аутоиммунными заболеваниями.
Поливалентные вирусные векторы по настоящему изобретению особенно эффективны для терапевтических схем, при которых желательна множественная вирус-опосредованная доставка генных продуктов, например в схемах, включая повторную доставку одного и того же продукта, или в комбинированных схемах, включающих в себя доставку других генных продуктов.
В. ПОЛИВАЛЕНТНАЯ ВИРУС-ОПОСРЕДОВАННАЯ ДОСТАВКА ИММУНОГЕННОГО ГЕННОГО ПРОДУКТА
Поливалентные вирусные векторы по настоящему изобретению также можно использовать в качестве иммуногенных композиций. Как используется в настоящем изобретении иммуногенная композиция, которая представляет собой композицию, в отношении которой индуцируется гуморальный (например, антитело) или клеточный (например, цитотоксическая Т-клетка) ответ на продукт, доставляемый иммуногенной композицией после введения млекопитающему и, предпочтительно, примату. Настоящее изобретение относится к поливалентному вирусному вектору, который в любой из делеций своей аденовирусной последовательности может содержать первую гетерологичную экспрессионную кассету, кодирующую желательный иммуноген. Поливалентный вирусный вектор может дополнительно содержать гетерологичную экспрессионную кассету, кодирующую адьювант для иммуногена, дополнительных иммуногенных продуктов, терапевтических продуктов или продукта, который ингибирует иммунный ответ на поливалентный вирусный вектор.
Если поливалентный вирусный вектор представляет собой поливалентный аденовирусный вектор, подходящий для использования в качестве живой рекомбинантной вирусной вакцины у различных видов животных по сравнению с аденовирусом человека, то он не ограничен только таким использованием. Рекомбинантные поливалентные вирусы можно использовать в качестве профилактических или терапевтических вакцин против любого патогена, для которого идентифицирован антиген(ы), значимый для индукции иммунного ответа и способный ограничивать распространение патогена, и для которого доступна кДНК.
Такие вакцинные (или другие иммуногенные) композиции входят в смесь с подходящим носителем для доставки, как описано выше. В целом, дозы для иммуногенных композиций находятся в диапазоне, определенном выше для терапевтических композиций. Можно контролировать уровни иммунности выбранного гена для определения необходимости в бустерных инъекциях, если таковые имеются. Могут быть желательны бустер-иммунизации после оценки титров антител в сыворотке.
Необязательно, состав вакцинной композиции по настоящему изобретению может содержать другие компоненты, включая, например, адьюванты, стабилизаторы, регуляторы рН, консерванты и тому подобное. Такие компоненты хорошо известны специалистам в области вакцинирования. Примеры подходящих адьювантов включают в себя, но ими не ограничиваются, липосомы, квасцы, монофосфорилированный липид А и любой биологически активный фактор, такой как цитокин, интерлейкин, хемокин, лиганды, и их оптимальные комбинации. Некоторые из этих биологически активных факторов могут экспрессироваться in vivo, например с помощью плазмиды или вирусного вектора. Например, такой адьювант можно вводить с примирующей вакциной ДНК, кодирующей антиген, усиливающий антиген-специфический иммунный ответ по сравнению с иммунным ответом, индуцируемым после примирования с ДНК вакциной, кодирующей только антиген.
Поливалентные вирусные векторы вводят в "иммуногенном количестве", то есть количество поливалентного вирусного вектора является эффективным для пути введения, трансфекции желательных клеток и достижения достаточного уровня экспрессии выбранного гена для индукции иммунного ответа. При обеспечении защитного иммунитета считается, что поливалентные вирусные векторы являются вакцинными композициями, эффективными для профилактики инфекции и/или рецидива болезни.
Альтернативно или дополнительно, векторы по настоящему изобретению могут содержать ген, кодирующий пептид, полипептид или белок, который индуцирует иммунный ответ на выбранный иммуноген. Вероятно, поливалентные аденовирусные векторы по настоящему изобретению будут высокоэффективными при индукции цитолитических Т-клеток и антител к встроенному гетерологичному антигенному белку, экспрессируемому вектором.
Например, иммуногены можно выбирать из различных семейств вирусов. Примеры семейств вирусов, против которых был бы желателен иммунный ответ, включают семейство пикорнавирусов, которое включает в себя род риновирусов, примерно в 50% случаев вызывающих насморк; род энтеровирусов, которые включают в себя полиовирусы, вирусы Коксаки, эховирусы и энтеровирусы человека, такие как вирус гепатита А; и род аптовирусов, которые отвечают за болезни ступней и рта, прежде всего у животных. В пределах пикорнавирусного семейства вирусов антигены-мишени включают в себя VP1, VP2, VP3, VP4 и VPG. Другое вирусное семейство включает в себя семейство кальцивирусов, которое охватывает группу вирусов Norwalk, значимых как возбудители эпидемии гастроэнтеритов. Вместе с тем другое вирусное семейство, которое может использоваться в качестве антигенов-мишеней для индукции иммунного ответа у людей и животных, представляет собой семейство тогавирусов, которое включает в себя род альфавирусов, включающих в себя вирусы Sindbis, вирус RossRiver, и вирусы венесуэльского, восточного и западного энцефалита лошадей, и рубивирус, включающий в себя вирус краснухи. Флавивирусное семейство включает в себя лихорадку, желтую лихорадку, японский энцефалит, энцефалит Св.Луи и передаваемые клещами вирусы энцефалита. Другие антигены-мишени можно получить из вируса гепатита С [см., например, опубликованную патентную заявку США 2003/190606 (9 октября 2003 года); заявку США 2002/081568 (27 июня 2002 года)] или семейства коронавирусов, к которым относится ряд нечеловеческих вирусов, таких как вирус инфекционного бронхита (домашняя птица), трансмиссионный вирус свиного гастроэнтерита (свинья), гемагглютинирующий вирус свиного энцефаломиелита (свинья), вирус кошачьего инфекционного перитонита (кошка), коронавирус кошачьего энтерита (кошка), собачий коронавирус (собака) и респираторный коронавирус человека, который может вызывать насморк и/или не-А, В или С гепатит, и предполагаемый возбудитель внезапного острого респираторного синдрома (SARS). В пределах семейства коронавирусов антигены-мишени включают Е1 (также называемый М или матричным белком), Е2 (также называемый S или спайк белок), Е3 (также называемый ГЭ или гемагглютин-эльтерозным) гликопротеидом (присутствующим не во всех коронавирусах) или N (нуклеокапсид). Вместе с тем другие антигены могут быть мишенями против семейства рабдовирусов, которое включает род везикуловирусов (например, вирус везикулярного стоматита) и род лиссавирусов (например, бешенство). В пределах семейства рабдовирусов можно получать подходящие антигены из G-белка или N-белка. Семейство филовирусов, которое включает вирусы геморрагической лихорадки, такие как вирус Марбурга и Эбола, может быть подходящим источником антигенов. Семейство парамиксовирусов включает вирус парагриппа типа 1, вирус парагриппа типа 3, бычий вирус парагриппа типа 3, рубулавирус (вирус свинки), вирус парагриппа типа 2, вирус парагриппа типа 4, вирус ньюкасльской болезни (цыплята), вирус чумы рогатого скота, морбилливирус, который включает в себя корь и собачью чумку и пневмовирус, включающий респираторно-синцитиальный вирус. Вирус гриппа классифицируется в пределах семейства ортомиксовирусов и представляет собой подходящий источник антигенов (например, НА белок, N1 белок). Семейство буньявирусов включает в себя род буньявирусов (калифорнийский энцефалит, Ла-Кросс), флебовирус (лихорадка долины Рифт), хантавирус (пуремала, являющаяся геморрагической вирусной лихорадой), найровирус (болезнь овец Найроби) и различные неопределенные буньявирусы. Семейство ареновирусов является источником антигенов против лимфоцитарного менингита ЛЦМ и вируса лихорадки Ласса. Семейство реовирусов включает в себя род реовирусов, ротавирусов (который вызывает острый гастроэнтерит у детей), орбивирусов и культивирусов (колорадская клещевая лихорадка, Лебомбо (люди), лошадиный энцефалоз, африканская катаральная лихорадка).
Семейство ретровирусов включает в себя подсемейство онкоривирусов, который охватывает такие болезни человека и животных, как вирус кошачьего лейкоза, HTLVI и HTLVII, лентивирус (который включает в себя вирус иммунодефицита человека (HIV), вирус иммунодефицита обезьяны (SIV), вирус кошачьего иммунодефицита (FIV), вирус инфекционной анемии лошадей и спумавирус). Среди лентивирусов было описано и можно легко отобрать много подходящих антигенов. Примеры подходящих HIV и SIV антигенов включают в себя, но ими не ограничиваются, gag, pol, Vif, Vpx, VPR, Env, Tat, Nef и Rev белки, а также их различные фрагменты. Например, подходящие фрагменты Env белка могут включать в себя любую его субъединицу, такую как gp120, gp160, gp41, или их меньшие фрагменты, например, по меньшей мере, длиной около 8 аминокислот. Сходным образом можно выбирать фрагменты tat белка. [См. патент США 5891994 и патент США 6193981.] См., также, HIV и SIV белки, описанные авторами D.Н.Barouch et al., J.Virol, 75 (5): 2462-2467 (март 2001 года), и R.R.Amara, et al., Science, 292: 69-1 (6 апреля 2001 года). В другом примере можно использовать иммуногенные белки или пептиды HIV и/или SIV для получения слитых белков или других иммуногенных молекул. См., например, слитые белки HIV-1 tat и/или Nef и схемы иммунизации, описанные в международной патентной публикации WO 01/54719, опубл. 2 августа 2001 года, и в международной патентной публикации WO 99/16884, опубл. 8 апреля 1999 года. Объем настоящего изобретения не ограничен раскрытыми в описании иммуногенными белками или пептидами HIV и/или SIV. Кроме того, были описаны различные модификации этих белков или они легко могли быть сделаны специалистом в данной области техники. См., например, в патенте США 5972596 описание модифицированного белка gag. Дополнительно, любые желательные иммуногены HIV и/или SIV можно доставлять самостоятельно или в комбинации. Такие комбинации могут включать экспрессию единственного вектора или множества векторов.
Необязательно, другая комбинация может включать в себя доставку одного или более экспрессируемых иммуногенов с доставкой одного или более иммуногенов в белковой форме. Такие комбинации более подробно рассмотрены ниже.
Семейство паповавирусов включает в себя подсемейство полиомавирусов (BKU и JCU вирусы) и подсемейство папилломавирусов (связанных с раковыми новообразованиями или злокачественным перерождением папилломы). Например, антигены папилломавирусов и их комбинации были описаны, см. например, опубликованную заявку США 2003/129199 (10 июля 2003 г.); опубликованную заявку США 2002/18221 (15 декабря 2002 г.); патент США 6342224.
Семейство аденовирусов включает в себя вирусы (EX, AD7, ARD, О.В.), которые вызывают респираторную болезнь и/или энтерит. Семейство парвовирусов включает кошачий парвовирус (кошачий энтерит), вирус кошачьей панлейкопении, собачий парвовирус и свиной парвовирус. Семейство герпесвирусов включает подсемейство альфагерпесвирусов, которое включает род симплексвирусов (HSVI, HSVII), варицелловирусов (псевдобешенство, ветряная оспа) и подсемейство бетагерпесвирусов, которое включает род цитомегаловирусов (HCMV, муромегаловирус) и подсемейство гаммагерпесвирусов, которое включает в себя род лимфокриптовирусов, EBV (лимфома Беркитта), инфекционный ринотрахеит, вирус болезни Марека и радиновирус. Семейство поксвирусов включает в себя подсемейство хордовирусов, которое охватывает роды ортопоксвирусов (вариола (оспа) и вакциния (коровья оспа)), парапоксвирусов, авипоксвирусов, каприпоксвирусов, лепорипоксвирусов, свипоксвирусов, и подсемейство энтомопоксвирусов. Семейство гепаднавирусов включает в себя вирус гепатита В. Один неклассифицированный вирус, который может быть подходящим источником антигенов, представляет собой дельтавирус гепатита. Вместе с тем другие вирусные источники могут включать в себя вирус птичьей инфекционной болезни фабрициевой сумки и вирус респираторного и репродуктивного синдрома свиней. Семейство альфавирусов включает в себя вирус лошадиного артрита и различные вирусы энцефалита.
Настоящее изобретение может также относится к иммуногенам, которые могут использоваться для иммунизации человека или животных против других патогенов, включая бактерии, грибы, микроорганизмы-паразиты или многоклеточные паразиты, которые заражают человека и других позвоночных, или против раковых клеток или опухолевых клеток. Примеры бактериальных патогенов включают в себя патогенные грам-положительные кокки, включающие в себя пневмококки, стафилококки и стрептококки. Патогенные грам-отрицательные кокки включают в себя менингококки, гонококки. Патогенные кишечные грам-отрицательные бациллы включают в себя enterobacteriaceae; pseudomonas, acinetobacteria и eikenella; melioidosis; salmonella; shigella; haemophilus; moraxella; H.ducreyi (которые вызывают шанкроид); brucella; Franisella tularensis (которые вызывают туляремию); yersinia (pasteurella); streptobacillus moniliformis и spirillum. Грам-положительные бациллы включают в себя listeria monocytogenes; erysipelothrix rhusiopathiae; Corynebacterium diphtheria (дифтерия); холера; В. anthracis (сибирская язва); donovanosis (паховая гранулема); и bartonellosis. Болезни, вызываемые патогенными анаэробными бактериями, включают в себя столбняк; ботулизм; другие клостридиальные инфекции; туберкулез; проказу; и другие инфекции, вызываемые микобактериями. Патогенные болезни, вызываемые спирохетами, включают в себя сифилис; трепонематоз: тропическую фрамбезию, пинту и эндемичный сифилис; и лептоспироз. Другие инфекции, вызываемые более высокопатогенными бактериями и патогенными грибами, включают в себя актиномикоз; нокардиоз; криптококкоз, бластомикоз, гистоплазмоз и коккцидиомикоз; кандидиаз, аспергиллез и мукоромикоз; споротрихоз; паракоккцидиомикоз, петриеллидиоз, торулопсидоз, мицетому и хромомикоз; и дерматофитоз. Риккеттсиальные инфекции включают в себя сыпной тиф, пятнистую лихорадку скалистых гор, лихорадку Ку и осповидный риккетсиоз. Примеры микоплазменных и хламидийных инфекций включают в себя: микоплазменную пневмонию; венерическую лимфогранулому; пситтакоз; и перинатальные хламидийные инфекции. Патогенные эукариоты охватывают патогенных простейших и гельминтов, и инфекции, вызываемые таким образом, включают в себя: амебиаз; малярию; лейшманиоз; трипаносомоз; токсоплазмоз; Pneumocystis carinii; Trichans; Toxoplasma gondii; бабезиоз; лямблиоз; трихиннелез; филяриоз; шистосомоз; и инфекции, которые вызывают нематоды; трематоды или сосальщики; и цестоды (ленточные черви).
Многие из этих организмов и/или токсинов, полученных таким образом, были идентифицированы Центрами контроля болезней, Centers for Disease Control [(CDC), Department of Heath and Human Services, USA], в качестве средств, обладающих потенциалом для использования при биологической атаке. Например, некоторые из этих биологических агентов, включающих в себя Bacillus anthracis (сибирская язва), Clostridium Botulinum и ее токсин (ботулизм), Yersinia pestis (чума), Variola major (оспа), Francisella tularensis (туляремия), и вирусные геморрагические лихорадки [филовирусы, например, Эбола, Марбург], и аренавирусы [например, Ласса, Мачупо], все из которых в настоящее время классифицируются как агенты категории A; Coxiella burnetti (лихорадка Ку); вид brucella (бруцеллез), Burkholderia mallei (сап), Burkholderia pseudomallei (мелоидоз), Ricinus communis и его токсин (рицинотоксин), Clostridium perfringens и его токсин (эпсилон-токсин), вид Staphylococcus и их токсины (энтеротоксин В), Chlamydia psittaci (пситтакоз), угрозы водной безопасности (например, Vibrio cholerae, Crytosporidium parvum), сыпной тиф (Richettsia powazekii), и вирусный энцефалит (альфавирусы, например, венесуэльский лошадиный энцефалит; восточный лошадиный энцефалит; западный лошадиный энцефалит); все из которых в настоящее время классифицируются как агенты категории В; и Nipan вирус и хантавирусы, которые в настоящее время классифицируются, как агенты категории С. Дополнительно, другие организмы, которые классифицируются таким образом, или классифицируются по-другому, можно идентифицировать и/или использовать для таких целей в будущем. Очевидно, что вирусные векторы и другие описанные в настоящем изобретении конструкции могут использоваться для доставки антигенов из этих организмов, вирусов, их токсинов или других побочных продуктов, которые служат для профилактики и/или лечения инфекции или других нежелательных реакций этих биологических агентов.
Введение векторов по настоящему изобретению для доставки иммуногенов против вариабельной области Т-клеток вызывает иммунный ответ, включающий цитотоксические Т-лимфоциты (CTL) для удаления этих Т-клеток. Получены характеристики нескольких специфичных вариабельных областей Т-клеточного рецептора (ТКР), которые вовлечены в болезнь при ревматоидном артрите (PA). Эти ТКР включают в себя V-3, V-14, V-17 и Vα-17. Таким образом, доставка последовательности нуклеиновой кислоты, которая кодирует по меньшей мере один из этих полипептидов, будет индуцировать иммунный ответ, мишенью которого являются Т-клетки, вовлеченные в РА. Получены характеристики нескольких специфичных вариабельных областей ТКР, которые вовлечены в развитие рассеянного склероза (PC). Эти ТКР включают в себя V-7 и Vα-10. Таким образом, доставка последовательности нуклеиновой кислоты, которая кодирует по меньшей мере один из этих полипептидов, вызовет иммунный ответ, мишенью которого будут Т-клетки, вовлеченные в PC. Получены характеристики нескольких специфичных вариабельных областей ТКР, которые вовлечены в развитие склеродермы. Эти ТКР включают в себя V-6, V-8, V-14 и Vα-16, Vα-3C, Vα-7, Vα-14, Vα-15, Vα-16, Vα-28 и Vα-12. Таким образом, доставка рекомбинантного аденовируса обезьяны, кодирующего по меньшей мере один из этих полипептидов, вызовет иммунный ответ, мишенью которого будут Т-клетки, вовлеченные в развитие склеродермы.
Следующие примеры иллюстрируют клонирование поливалентных аденовирусов и конструирование примеров поливалентных аденовирусных векторов по настоящему изобретению. Эти примеры приведены только в качестве иллюстрации и не ограничивают объем настоящего изобретения.
ПРИМЕРЫ
Как показано на Фиг.1 и 2, вектор на основе аденовируса шимпанзе Pan9 был сконструирован как поливалентный вектор переноса по настоящему изобретению.
А. КОНСТРУКЦИЯ МОЛЕКУЛЫ ДНК СО СПОСОБНЫМИ К ПЕРЕНОСУ КАССЕТАМИ
Согласно Фиг.1 был выбран плазмидный каркас, который несет вирусный геном аденовируса шимпанзе Pan9, имеющий кассету мутантного зеленого флуоресцентного белкового маркера (GFP) в сайте области Pan9 гена Е1, бычий гормон роста polyA и частичную делецию Е3. Более подробное описание этой плазмиды приводится в международной патентной публикации WO 2003/046124.
pPan9-pkGFP расщепляют с помощью AvrII (Фиг.1А) для удаления области Pan9 гена Е3, которую клонируют в pSL1180 [полученную коммерческим путем от компании Pharmacia] с образованием pSL1180-Pan9-Avr(II), который содержит ген устойчивости к ампициллину.
Плазмида RSV-Red2 содержит промотор RSV, промотор lac, несущий продукт AsRed2 (Lac-AsRed2), фланкированный сайтами I-SceI и PI-PspI, а также полиплазмиду SV40 А. Плазмиду pRSV-Red2 конструируют клонированием промотора RSV в плазмиду, конструированную из pUC19 и pkRFP (Clontech). Плазмиду pSL1180-Pan9-Avr(II) расщепляют с помощью Nrul (Фиг.1В) с высвобождением фрагмента Pan9 гена Е3, pRSV-Red2 расщепляют с помощью PvuII и HpaI (Фиг.1C) с высвобождением кассеты I-SceI-RSV-lac-AsRed2-PI-SceI и повторно лигируют с образованием плазмиды SL1180-Pan9-Avr(II) pkRFP, которая содержит ген устойчивости к ампициллину и кассету I-SceI-RSV-lac-AsRed2-PI-SceI в сайте Е3.
Получаемая также из AvrII-расщепленного pPan9-pkGFP, вышеописанная плазмида представляет собой плазмиду, содержащую вирусный геном Pan9 с делецией в области Е3 (Фиг.1D); после лигирования получаемую плазмиду обозначают как pPan9-pkGFP-Avr(II). Эту плазмиду и плазмиду pSL1180-Pan9-Avr(II)pkRFP расщепляют с помощью AvrII (Фиг.1Е) и лигируют с образованием единственной плазмиды, содержащей ген-репортер GFP (зеленого флуоресцентного белка) в E1-локусе и ген-репортер RFP (красного флуоресцентного белка) в Е3-локусе. Получаемую плазмиду обозначают как pPan9-(E1)-pkGFP-(Е3)pkRFP. При выборе для колоний, экспрессирующих желтый, для векторов выбирают экспрессию как зеленых, так и красных флуоресцентных белков.
Такое констуирование позволяет облегчить создание челнока в антигенных экспрессионные кассетах и сделать удобный выбор на основе цвета колоний рекомбинантов, которые будут подходить для высокопроизводительного создания вектора.
В. КОНСТРУИРОВАНИЕ ПОЛИВАЛЕНТНОГО ВЕКТОРА ПЕРЕНОСА
Для конструирования поливалентного вектора переноса по настоящему изобретению первую выбранную гетерологичную экспрессионную кассету клонируют в соответствующий локус в челночном векторе.
Согласно Фиг.2 это демонстрируется клонированием "антигена 1" в плазмиду, имеющую множественные сайты клонирования, выбором сайта, фланкированного сайтами рестрикции, соответствующими сайтам желательной области молекулы ДНК, созданной согласно вышеприведенной части А, то есть фланкированной сайтами I-CeuI и PI-SceI.
Вторую гетерологичную экспрессионную кассету (антиген 2) клонируют в подходящий вектор (например, pUC19-RSV), фланкированный сайтами I-SceI.
После расщепления подходящими ферментами, колориметрическими способами можно выбрать векторы, содержащие желательные гетерологичные экспрессионные кассеты. Более конкретно, колонии, экспрессирующие красный после возбуждения светом с подходящей длиной волны, указывают на присутствие векторов, в которых способная к переносу кассета, содержащая GFP, заменена на антиген 1, а способная к переносу кассета, содержащая RFP, сохранена. Колонии, экспрессирующие зеленый после возбуждения светом с подходящей длиной волны, указывают на присутствие векторов, в которых способная к переносу кассета, содержащая RFP, заменена на антиген 1, а способная к переносу кассета, содержащая GFP, сохранена. Колонии, которые оказываются белыми после возбуждения светом с подходящими длинами волн для GFP и RFP, указывают на векторы, в которых обе способные к переносу кассеты были заменены гетерологичными экспрессионными кассетами. Таким образом, осуществляя выбор белых колоний, можно быстро и точно выбирать поливалентные векторы переноса настоящего изобретения.
С. ИЗУЧЕНИЕ ВОЗДЕЙСТВИЯ ЛОКАЛИЗАЦИИ (E1 ИЛИ Е3) И ОРИЕНТАЦИИ ТРАНСГЕННЫХ КАССЕТ НА АНТИГЕННУЮ ЭКСПРЕССИЮ
Идентичные CMV-hA1AT экспрессионные кассеты раздельно клонировали в локус Е1 E1-делетированного вектора Pan9 (также называемого С9) ив локус Е3 E1/Е3-делетированного вектора С9. Продуцировали рекомбинантные вирусы С9, экспрессирующие А1АТ из различных локусов и вводили C57BL/6 мышам внутривенно в дозе 1×1011 ед./на мышь. У животных отбирали кровь на 3 и 7 день после переноса гена и для сравнения измеряли уровни hA1AT в сыворотке. Данные показали, что уровни hA1AT, экспрессируемые в Е3 локусе, были фактически по меньшей мере в 2 раза выше уровней в локусе Е1. (См. Фиг.3.)
Способ клонирования по настоящему изобретению имеет удобную систему выбора двойного цвета для рекомбинантов моно- или поливалентного вектора. Дополнительно, эти данные показывают отсутствие отрицательного локус-зависимого эффекта на экспрессию трансгена в обезьяньих аденовирусных векторах.
Все публикации, цитируемые в настоящем описании, и список последовательности включены в настоящее изобретение посредством ссылки. Поскольку в описании настоящего изобретения приведены ссылки на конкретные варианты осуществления, следует понимать, что можно осуществлять модификации без отхода от сущности настоящего изобретения. Такие модификации входят в объем прилагаемой формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ И КОМПОНЕНТЫ ИНДУКЦИИ ОПУХОЛЬ-СПЕЦИФИЧЕСКОЙ ЦИТОТОКСИЧНОСТИ | 1998 |
|
RU2214280C2 |
| КОМПОЗИЦИИ ПРОМОТОРОВ | 2014 |
|
RU2742435C2 |
| ОПТИМИЗИРОВАННЫЕ ГЕНЫ И ЭКСПРЕССИОННЫЕ КАССЕТЫ CLN1, И ИХ ПРИМЕНЕНИЕ | 2017 |
|
RU2764919C2 |
| ТЕРАПЕВТИЧЕСКИЕ СОЕДИНЕНИЯ ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНИ ХАНТИНГТОНА | 2015 |
|
RU2711147C2 |
| НЕТОКСИЧНЫЕ ВЕКТОРЫ НА ОСНОВЕ ВПГ ДЛЯ ПРИМЕНЕНИЙ В ЭФФЕКТИВНОЙ ДОСТАВКЕ ГЕНОВ И КОМПЛЕМЕНТИРУЮЩИЕ КЛЕТКИ ДЛЯ ИХ ПРОДУЦИРОВАНИЯ | 2014 |
|
RU2714259C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ НАРУШЕНИЙ И ЗАБОЛЕВАНИЙ, СВЯЗАННЫХ С RDH12 | 2017 |
|
RU2764920C2 |
| ПОСЛЕДОВАТЕЛЬНОСТЬ, РАСПОЛОЖЕННАЯ ВЫШЕ ГЕНА CARP, ВЕКТОР, СОДЕРЖАЩИЙ ЭТУ ПОСЛЕДОВАТЕЛЬНОСТЬ, И ИХ ИСПОЛЬЗОВАНИЕ | 2001 |
|
RU2283865C2 |
| ГЕННАЯ ТЕРАПИЯ ОФТАЛЬМОЛОГИЧЕСКИХ НАРУШЕНИЙ | 2016 |
|
RU2762747C2 |
| СПОСОБ СОЗДАНИЯ РЕКОМБИНАНТНОГО АДЕНОВИРУСА ПТИЦ ДЛЯ ВАКЦИНАЦИИ ПРОТИВ ВИРУСА ГРИППА ПТИЦ Н5N1 | 2006 |
|
RU2326943C1 |
| АДЕНОВИРУСНЫЙ/АЛЬФА-ВИРУСНЫЙ ГИБРИДНЫЙ ВЕКТОР ДЛЯ ЭФФЕКТИВНОГО ВВЕДЕНИЯ И ЭКСПРЕССИИ ТЕРАПЕВТИЧЕСКИХ ГЕНОВ В ОПУХОЛЕВЫЕ КЛЕТКИ | 2005 |
|
RU2394104C2 |
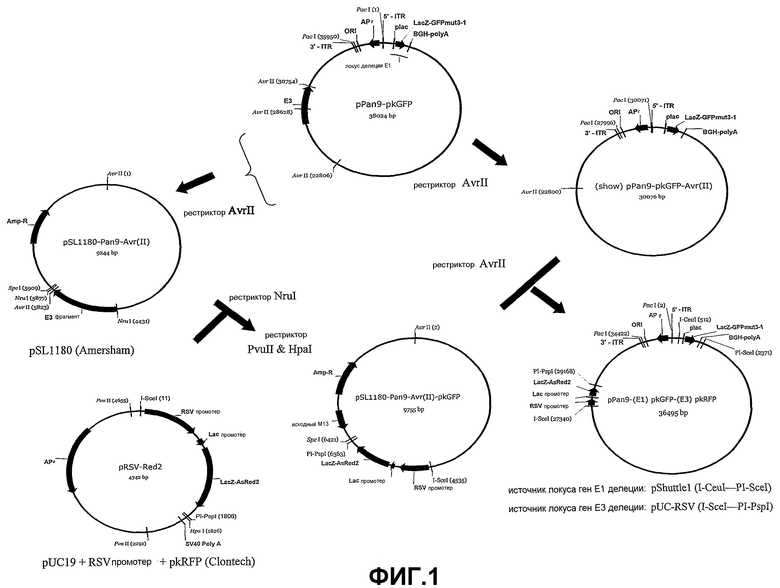
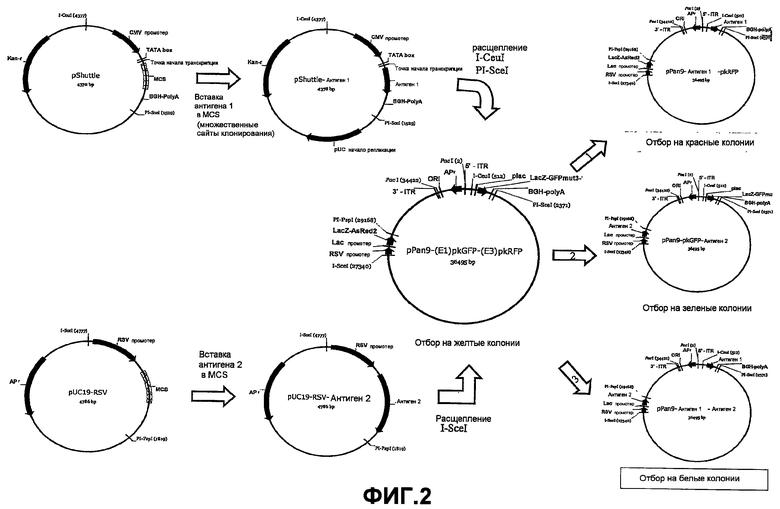
Изобретение относится к области биотехнологии и генной инженерии. Раскрывается плазмида для получения вирусного вектора, несущего множественные экспрессионные кассеты к мишени. Плазмида содержит нуклеотидные последовательности генома, упаковываемые в поливалентный капсид и несколько способных к переносу кассет. Описан также способ создания вирусного вектора, вирусный вектор и иммуногенная композиция. Предложенная группа изобретений может быть использована для широкомасштабной экспрессии целевых антигенов. 4 н. и 19 з.п. ф-лы, 3 ил.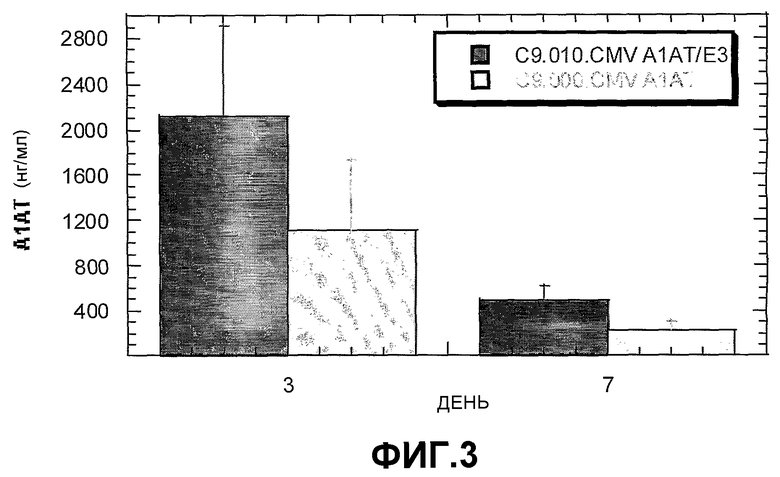
1. Плазмида для получения вирусного вектора, несущего множественные экспрессионные кассеты к мишени, содержащая нуклеотидные последовательности генома, упаковываемые в поливалентный аденовирусный капсид, и:
(a) первую способную к переносу кассету, расположенную в первом локусе последовательности аденовирусного генома, где указанная первая способная к переносу кассета содержит последовательности нуклеиновых кислот, содержащие первый ген-репортер, определяемый колориметрически, функционально связанный с последовательностями, которые регулируют его экспрессию, где указанная способная к переносу кассета фланкирована первым набором сайтов рестрикции крупнощепящих рестриктаз, состоящим из сайта рестрикции крупнощепящей рестриктазы на 5' конце первой способной к переносу кассеты и сайта рестрикции крупнощепящей рестриктазы на 3' конце первой способной к переносу кассеты; и
(b) вторую способную к переносу кассету, расположенную во втором локусе последовательности аденовирусного генома, не соприкасающемся с первым локусом, где указанная вторая способная к переносу кассета содержит последовательности нуклеиновых кислот, содержащие второй ген-репортер, определяемый колориметрически, функционально связанный с последовательностями, которые регулируют его экспрессию, где указанная способная к переносу кассета фланкирована вторым набором сайтов рестрикции крупнощепящих рестриктаз, состоящим из сайта рестрикции крупнощепящей рестриктазы на 5' конце второй способной к переносу кассеты и сайта рестрикции крупнощепящей рестриктазы на 3' конце второй способной к переносу кассеты;
причем продукт указанного первого детектируемого гена-репортера и второго детектируемого гена-репортера отличаются друг от друга по цвету, и
первый и второй набор сайтов рестрикции крупнощепящих рестриктаз отличаются друг от друга, при этом указанные сайты рестрикции крупнощепящих рестриктаз выбирают так, что соответствующая крупнощепящая рестриктаза расщепляет только эти сайты, не затрагивая генетический элемент, несущий вирусный геном, или другие сайты вирусного генома.
2. Плазмида по п.1, содержащая три или более способных к переносу кассет, фланкированных различными наборами сайтов рестрикции крупнощепящих рестриктаз.
3. Плазмида по п.1, в которой первый и второй локусы расположены в разных генах аденовирусного генома.
4. Плазмида по п.1, в которой первый и второй локусы расположены в разных открытых рамках считывания единственного гена аденовирусного генома.
5. Плазмида по п.1, в которой первый и второй локусы расположены в единственной открытой рамке считывания гена вирусного генома и не соприкасаются друг с другом.
6. Плазмида по п.1, в которой определяемые гены-репортеры независимо выбраны из группы, состоящей из зеленого флуоресцентного белка, красного флуоресцентного белка и бета-галактозидазы.
7. Плазмида по п.1, в которой сайты рестрикции крупнощепящих рестриктаз на 5' и 3' конце в первом наборе являются одинаковыми и независимо выбраны из группы, состоящей из I-Ceu I, PI-See I, TevII, BmoI и DmoI.
8. Плазмида по любому из пп.1-6, в которой сайты сайтов рестрикции крупнощепящих рестриктаз на 5' и 3' конце в первом наборе независимо выбраны из группы, состоящей из I-Ceu I, PI-See I, TevII, BmoI и DmoI, и отличаются друг от друга.
9. Плазмида по любому из пп.1-6, в которой сайты рестрикции крупнощепящих рестриктаз на 5' и 3' конце во втором наборе отличаются друг от друга.
10. Плазмида по любому из пп.1-6, в которой нуклеотидные последовательности аденовируса содержат 5'-концевую последовательность инвертированного повтора аденовируса, 5'-концевой упаковывающий энхансерный домен аденовируса, 3'-концевую последовательность инвертированного повтора аденовируса и один или несколько немедленно-ранних генов или поздних генов аденовируса.
11. Плазмида по любому из пп.1-6, где первая способная к переносу кассета расположена в области Е1 аденовируса.
12. Плазмида по любому из пп.1-6, где первая способная к переносу кассета расположена в области Е3 аденовируса.
13. Способ создания вирусного вектора, который включает стадии:
(а) смешивания в присутствии первого набора ферментов плазмид по любому из пп.1-12 и первой молекулы нуклеиновой кислоты, содержащей первую гетерологичную экспрессионную кассету, содержащую последовательность нуклеиновой кислоты, кодирующую продукт-мишень под контролем регуляторной последовательности, которая регулирует экспрессию продукта, причем указанная гетерологичная экспрессионная кассета фланкирована первым набором сайтов рестрикции;
(b) отбора на отсутствие первого определяемого репортера с получением плазмид, содержащих первую гетерологичную экспрессирующую кассету;
(c) смешивания в присутствии второго набора ферментов плазмид и второй молекулы нуклеиновой кислоты, содержащей вторую гетерологичную экспрессионную кассету, содержащую последовательность нуклеиновой кислоты, кодирующую продукт-мишень под контролем регуляторной последовательности, которая регулирует экспрессию продукта, причем указанная гетерологичная экспрессионная кассета фланкирована вторым набором сайтов рестрикции; и
(d) отбора на отсутствие второго определяемого репортера с получением плазмид, содержащих вторую гетерологичную экспрессионную кассету;
таким образом, получая вирусный вектор, содержащий поливалентный вирусный геном, содержащий первую экспрессионную кассету в первом локусе и вторую экспрессионную кассету во втором локусе;
(e) культивирования вирусного вектора в присутствии подходящих вирусных последовательностей для упаковки вирусного вектора в инфективный аденовирусный капсид.
14. Способ по п.13, в котором первый определяемый репортерный ген является зеленым флуоресцентным белком, а второй определяемый репортерный ген представляет собой красный флуоресцентный белок.
15. Способ по п.13, в котором первый набор ферментов представляет собой I-Ceu I и PI-See I.
16. Способ по любому из пп.13-15, в котором вирусный вектор содержит аденовирусные последовательности, в которых первая экспрессионная кассета расположена в области Е1 аденовируса.
17. Способ по любому из пп.13-15, в котором вирусный вектор содержит аденовирусные последовательности, в которых вторая экспрессионная кассета расположена в области Е3 аденовируса.
18. Вирусный вектор для доставки целевых нуклеиновых кислот, получаемый способом по любому из пп.10-17.
19. Иммуногенная композиция, содержащая:
(a) вирусный вектор, содержащий:
(i) первую гетерологичную экспрессионную кассету, содержащую последовательность нуклеиновой кислоты, кодирующую первый продукт-мишень под контролем регуляторной последовательности, которая регулирует экспрессию продукта; и
(ii) вторую гетерологичную экспрессионную кассету, содержащую последовательность нуклеиновой кислоты, кодирующую второй продукт-мишень под контролем регуляторной последовательности, которая регулирует экспрессию продукта;
в котором указанные первая и вторая экспрессионная кассета расположены в различных локусах вирусного векторного генома, и продукты-мишени экспрессируются независимо друг от друга; и
(b) физиологически совместимый носитель.
20. Композиция по п.18, в которой указанный первый и второй продукты независимо выбраны из группы, состоящей из антигена и цитокина.
21. Композиция по п.18, в которой первый или второй продукт представляет собой иммуномодулятор.
22. Композиция по п.21, в которой второй продукт представляет собой адъювант первого продукта.
23. Композиция по п.21, в которой первый или второй продукт является терапевтическим генным продуктом.
| WO 9943843 A1, 02.09.1999 | |||
| 0 |
|
SU155371A1 | |
| CONTRERAS J.L | |||
| et al., Double genetic modification of adenovirus fiber with RGD polylysine motifs significantly enhances gene transfer to isolated human pancreatic islets | |||
| Transplantation | |||
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
Авторы
Даты
2011-04-20—Публикация
2005-04-27—Подача