Предлагаемое изобретение относится к области химии природных соединений, биотехнологии, фармакологии и медицине и может быть использовано для терапии злокачественных новообразований.
Изобретение касается липосомной формы антиангиогенного препарата для терапии злокачественных новообразований, а именно для лечения первичных опухолей и метастазов у человека, для лечения злокачественных новообразований и других патологий, связанных с нарушениями ангиогенеза. Преимущество изобретения заключается в усилении антиангиогенной и противоопухолевой активности активного компонента препарата.
Ангиогенез представляет собой процесс формирования новых кровеносных сосудов из предсуществующих, играющий ключевую роль в широком спектре физиологических и патологических процессов. Прогрессия опухолей и течение онкологических заболеваний тесно связаны с ангиогенезом [Liotta L.A. et al., Cell 64: 327-336, 1991; Fidler I.J. and Ellis L.M., Cell 79: 185-188, 1994; Folkman J., N.Engl. J.Med. 333: 1757-1763, 1995]. Развивающаяся опухоль посредством секреции ангиогенных факторов привлекает к себе новые капилляры, развивающиеся из близлежащих сосудов. Дальнейшая прогрессия опухоли обусловлена тесной интеграцией опухолевых клеток и эндотелия кровеносных сосудов. Приносимые кровью кислород и нутриенты вызывают бурную прогрессию опухоли и инициацию процесса метастазирования. При использовании антиангиогенных агентов, вызывающих деструкцию опухолевой кровеносной сети, в модельных экспериментах на животных с привитыми опухолями рядом авторов наблюдался значительный терапевтический эффект от этих препаратов, выражающийся в подавлении роста опухоли и увеличении средней продолжительности жизни экспериментальных животных [O'Reilly M.S. et al., Cell 79: 315-328, 1994; O'Reilly M.S. et al., Nat. Med. 2: 689-692, 1996; Holmgren L. et al., Nat. Med. 1: 149-153, 1995; Mauceri H.J. et al., Nature 394: 287-291, 1998]. Таким образом, разрушение опухолевой кровеносной сети с помощью антиангиогенных агентов является перспективным подходом к терапии злокачественных новообразований.
Одним из наиболее сильных ингибиторов ангиогенеза является ангиостатин - протеолитический фрагмент плазминогена с мол. массой ˜ 40 кДа [O'Reilly M.S. et al., Cell 79: 315-328, 1994]. Воздействуя на эндотелиальные клетки кровеносных сосудов, ангиостатин подавляет рост как первичных опухолей, так и регионарных метастазов.
В настоящее время средствами генной инженерии получен биологически активный рекомбинантный ангиостатин, экспрессируемый в различных штаммах-продуцентах (Escherichia coli, Pichia pastoris и др.). Рекомбинантный ангиостатин вызывает апоптотическую гибель эндотелиальных клеток и эффективно подавляет рост опухолей легочной карциномы Льюис у мышей в ежедневных дозах 1-6 мг/кг [Wu Z. et al., Biochem. Biophys. Res. Commun. 236: 651-654, 1997]. Одной из важных особенностей ангиостатина является его способность подавлять рост опухолей без проявления токсических эффектов [O'Reilly M.S. et al., Nat. Med. 2: 689-692, 1996; Sim B.K. et al., Cancer Res. 57: 1329-1334, 1997; Lannutti B.J. et al., Cancer Res. 57: 5277-5280, 1997]. Даже при введении препарата в высоких дозах (˜100 мг/кг веса) не наблюдается каких-либо проявлений токсичности или развития лекарственной устойчивости опухолей к препарату [Sim B.K. et al., Cancer Res. 57: 1329-1334, 1997; Mauceri H.J. et al., Nature 394: 287-291, 1998; Drixler T.A. et al., Cancer Res. 60: 1761-1765, 2000].
Несмотря на очевидные преимущества и перспективы терапевтического применения ангиостатина, существенным недостатком препарата является его быстрое выведение из организма [Drixler T.A. et al., Cancer Res. 60: 1761-1765, 2000]. Кроме того, для достижения желаемого противоопухолевого эффекта необходимо длительное применение препарата. Таким образом, препарат вводится пациенту как минимум дважды в сутки в дозах от 20 до 100 мг/кг веса. Очевидно, что терапевтическое применение ангиостатина не только будет причинять неудобства пациентам в связи с необходимостью постоянных инъекций, но и потребует огромного количества препарата. Для того, чтобы избежать этого, необходимо снизить скорость выведения ангиостатина и увеличить эффективность его терапевтического действия.
Другим перспективным антиангиогенным препаратом, оказывающим влияние на выживание эндотелиальных клеток, является эндостатин - 20 кДа фрагмент коллагена XVIII, являющегося компонентом базальных мембран и внеклеточного матрикса [Muragaki Y. et al., Proc. Natl. Acad. Sci. USA, 92: 8763-8767, 1995]. Эндостатин специфически ингибирует пролиферацию и миграцию эндотелиальных клеток капилляров и может вызывать апоптоз пролиферирующих эндотелиальных клеток. Непосредственного эффекта на опухолевые клетки различных линий in vitro эндостатин не оказывает [O'Reilly M.S. et al., Cell: 88, 277-285, 1997]. In vivo эндостатин оказывает сильный ингибирующий эффект в отношении роста различных первичных опухолей и их метастазов. Пролонгированная терапия высокими дозами эндостатина вызывает практически полную блокаду опухолевого ангиогенеза и приводит к регрессии опухоли до микроскопических размеров [Boehm Т.et al., Nature: 390, 404-407, 1997]. В дальнейшем микроопухоли впадают в "дремлющее" состояние, в котором индекс пролиферации опухолевых клеток уравновешивается индексом их апоптоза. Даже после пролонгированной терапии не наблюдается возникновения резистентности к препарату или каких-либо токсических реакций [Sim B.K. et al., Cancer Metastasis Rev.: 19, 181-190, 2000]. Эндостатин может ингибировать индуцируемый ангиогенными факторами роста каскад внутриклеточной передачи сигналов, а также блокировать активацию и каталитическую активность матриксных металлопротеиназ.
Наиболее близкой по технической сущности являются ингибиторы ангиогенеза ангиостатин, эндостатин и их укороченные фрагменты для лечения злокачественных новообразований /Пат. РФ №2240328/. Недостатки этих ингибиторов указаны выше. Кроме того, авторы данного изобретения предлагают использование упомянутых ингибиторов ангиогенеза в виде гомодимерных белков, в которых молекула ингибитора связана с помощью полипептидного мостика с областью Fc иммуноглобулина гамма, что может дополнительно снижать биологическую активность целевого ингибитора ангиогенеза. Применение таких слитых белков также не решает проблемы высокой скорости выведения препаратов из организма пациента.
Цель изобретения - снижение скорости выведения активного соединения (ангиостатина и эндостатина) из организма и увеличение эффективности его терапевтического действия.
Поставленная цель решается путем создания ингибитора ангиогенеза, включающего активное соединение в форме липосом. При этом в качестве активного соединения используют ангиостатин или эндостатин, а также их укороченные пептидные фрагменты. Также предлагается антиангиогенная фармацевтическая композиция для лечения злокачественных новообразований и других патологий, связанных с нарушениями ангиогенеза, содержащая активное соединение (ангиостатин, эндостатин или их укороченные фрагменты) и фармацевтический носитель, где активное соединение содержится в липосомной форме в эффективном количестве, а в качестве фармацевтического носителя используются приемлемые растворы для инъекций.
Кроме того, предложен способ лечения злокачественных новообразований и других патологий, связанных с нарушениями ангиогенеза, заключающийся во введении нетоксичного терапевтически эффективного количества фармацевтической композиции как отдельно, так и в сочетании с адьювантной терапией другими противоопухолевыми препаратами, иммуномодуляторами или антиангиогенными агентами. В качестве противоопухолевого препарата для адьювантной терапии используют препарат, выбранный из группы: доксорубицин, карминомицин, мутамицин, новантрон, рубомицин, блеоцин, цисплатин, таксол, этопозид, винбластин, винкристин, гемзар, фторурацил, метотрексат, кселода, золадекс, дакарбазин, цисплатин, карбоплатин, тамоксифен. В качестве иммуномодулятора для адьювантной терапии используют препарат, выбранный из группы: интерферон-α, интерферон-γ, интерлейкин-2, интерлейкин-4, интерлейкин-6, интерлейкин-12. В качестве антиангиогенного агента для адьювантной терапии используют препарат, выбранный из группы: талидомид, витаксин, пентозан, сурамин, фумагиллин, скволамин, комбретастатин, приномастат, маримастат, неовастат.
Ангиостатин или эндостатин в составе липосом могут быть представлены различными формами, отличающимися длиной пептидной цепи - как целыми белками, так и их укороченными пептидными фрагментами, отличающимися от последовательности целого белка на одну и более концевую аминокислоту. Ангиостатин или эндостатин для липосомных композиций могут быть получены как из природных источников, так и с помощью генноинженерных технологий, а укороченные фрагменты этих белков - также с помощью генноинженерных способов или методом твердофазного пептидного синтеза.
Созданная липосомная форма ингибитора ангиогенеза отличается простотой и технологичностью получения, проявляет высокую биологическую активность и способна эффективно подавлять рост опухолевых сосудов и самих опухолей.
В основе изобретения лежит ингибитор ангиогенеза, находящийся в форме липосомы, который в экспериментах как in vitro, так и in vivo проявляет более высокую противоопухолевую активность, чем свободный активный компонент. Ингибитор в форме липосомы может быть легко получен с помощью стандартных биотехнологических и химических методов, отличается стабильностью и технологичностью получения. Липосомная форма антиангиогенного ингибитора может быть с успехом использована для лечения целого ряда патологий, связанных с нарушениями ангиогенеза. Таким образом, изобретение полностью соответствует критерию "изобретательский уровень".
Изобретение иллюстрируется следующими примерами.
Пример 1. Получение липосом, загруженных ангиостатином, или эндостатином, или их укороченными фрагментами.
На 1 мл липосомной дисперсии в круглодонную колбу помещают 20.5 мг яичного фосфатидилхолина (яФХ) и 4.5 мг холестерина (яФХ/холестерин 7/3 мольн.) в виде хлороформных растворов. Смесь растворов липидов упаривают на роторном испарителе до постоянного веса при 38°С. Остатки растворителя удаляют в вакууме масляного насоса в течение 2 ч. Полученную липидную пленку растворяют в 3 мл эфира и добавляют в колбу 1 мл раствора белка (ангиостатина, эндостатина или их фрагментов) (6 мг/мл) в фосфатно-солевом буфере (рН 7.4). Колбу продувают аргоном и озвучивают дисперсию на ультразвуковой бане 3 мин при 10°С. Осторожно упаривают эфир на роторном испарителе при комнатной температуре (200 об/мин). Полученную липидную дисперсию продавливают 19 раз через ядерный поликарбонатный фильтр с размером пор 100 нм. Получают 0.9 мл дисперсии липосом 100 нм (25 мг/мл липидов, 6 мг/мл белка). Эффективность включения белка составляет 14-26%. Липосомный ингибитор ангиогенеза лиофилизируют и хранят при 4°С.
Пример 2. Получение фармкомпозиции на основе липосомного ингибитора ангиогенеза.
Фармацевтические композиции для инъекций получают растворением эффективного количества лиофилизированного ингибитора ангиогенеза, полученного, как описано в примере 1, в физиологическом растворе или фосфатно-солевом растворе, приготовленном на воде для инъекций. рН растворов около 7,4. Концентрация активного вещества (по белку) в растворе составляет 5-10%.
Пример 3. Определение противоопухолевой активности липосомных ингибиторов ангиогенеза, включающих ангиостатин, эндостатин или их укороченные фрагменты, при индивидуальной терапии мышей с привитыми солидными опухолями меланомы В16.
Клетки меланомы линии В16 поддерживали путем еженедельной внутрибрюшинной перевивки мышам С57В1/6. Для индукции солидных опухолей мышам вводили подкожно клеточную суспензию (2·105 клеток в 0,1 мл физиологического раствора). Препараты вводили опытным животным внутривенно. Однократные дозы липосомной формы ингибитора ангиогенеза содержали: 90 мг/кг ангиостатина, эндостатина или их фрагментов. Препараты вводили внутривенно один раз неделю, всего три инъекции, начиная с 10-го дня после прививки опухоли. Каждая экспериментальная группа состояла из шести животных, контрольная - из десяти. Размер солидных опухолей измеряли один раз в 2-3 дня. Объем опухоли вычисляли по формуле 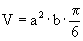 , где а - короткий, b - длинный диаметр опухоли. Относительный размер опухолей (ОРО) определяли по формуле:
, где а - короткий, b - длинный диаметр опухоли. Относительный размер опухолей (ОРО) определяли по формуле: 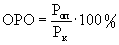 , где Роп - средний размер опухолей в опытной группе, Рк - средний размер опухолей у контрольных животных. Увеличение продолжительности жизни леченых животных по сравнению с контролем определяли по формуле:
, где Роп - средний размер опухолей в опытной группе, Рк - средний размер опухолей у контрольных животных. Увеличение продолжительности жизни леченых животных по сравнению с контролем определяли по формуле:  , где Т - средняя продолжительность жизни (СПЖ) леченых животных, дни, С - СПЖ контрольных животных, дни.
, где Т - средняя продолжительность жизни (СПЖ) леченых животных, дни, С - СПЖ контрольных животных, дни.
Результаты эксперимента приведены в табл.1. По сравнению со слабовыраженным эффектом от применения нелипосомных форм ангиостатина, эндостатина и их укороченных фрагментов, терапия липосомными формами приводила к значительному торможению роста опухолей как в период курса лечения, так и после его отмены и увеличению средней продолжительности жизни леченных животных.
Эффективность противоопухолевого действия липосомных ингибитор ангиогенеза в отношении меланомы В 16 у мышей в сравнении с нелипосомными формами.
Пример 4. Антиметастатическая активность липосомных ингибиторов ангиогенеза.
Для оценки антиметастатической активности липосомных антиангиогенных ингибиторов проводили эксперимент на мышах с подкожно привитой опухолью карциномы легкого Льюис (3LL) на фоне удаления первичного опухолевого узла.
Первичную опухоль удаляли на 8 день после перевивки. В качестве наркоза использовали гексенал. Опухолевый узел удаляли вместе с прилежащим участком кожного покрова, для предупреждения возможности рецидивирования. Дефект кожного покрова закрывали наложением шва, смазывали 5% спиртовым раствором йода. Первое введение исследуемых препаратов проводили за 12 часов перед проведением операции. Препараты вводили внутривенно в дозах 90 мг/кг 1 раз в 4 дня, всего 5 инъекций. Каждая экспериментальная группа состояла из 8 животных.
Антиметастатический эффект оценивали на момент начала гибели контрольных животных. Интенсивность метастазирования оценивали, сравнивая среднюю массу легких, пораженных метастазами, в контрольной и опытных группах животных. Одновременно использовали условные показатели интенсивности метастазирования - количество и площадь метастатических узлов в легочной ткани, частоту метастазирования опухоли. Статистическую обработку полученных результатов проводили по критериям Стьюдента.
Торможение роста метастазов вычисляли по формуле: 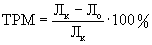 , где Лк - средняя масса легких с метастазами в контрольной группе, Ло - средняя масса легких с метастазами в группе леченых мышей.
, где Лк - средняя масса легких с метастазами в контрольной группе, Ло - средняя масса легких с метастазами в группе леченых мышей.
Результаты эксперимента представлены в табл.2. По сравнению с контрольными животными, у которых метастазы в легких выявлены в 100% случаев, в группах леченых животных наблюдались случаи отсутствия метастазов, а также была снижена интенсивность метастазирования. Таким образом, применение предлагаемых препаратов для предупреждения метастазирования представляется весьма перспективным.
Влияние липосомных ингибиторов ангиогенеза на интенсивность метастазирования подкожно привитой опухоли карциномы легкого Льюис (3LL) на фоне удаления первичного опухолевого узла.
1. Данные приведены на момент гибели животных.
2. В графе "Частота метастазирования" указано количество животных с метастазами/количество животных в группе.
3. В графе "Интенсивность метастазирования" (в квадратных скобках) - среднее количество метастатических колоний в легких на животное.
Пример 5. Эффективность действия антиангиогенных фармацевтических композиций, включающих ангиостатин, эндостатин или их укороченные фрагменты, в отношении меланомы мышей при их применении в режиме сочетанной терапии с противоопухолевыми препаратами, иммуномодуляторами и другими антиангиогенными агентами.
Антиангиогенные фармацевтические композиции вводили, как описано в примере 3, на фоне адьювантной терапии другими препаратами. Так, животным группы 1 дополнительно вводили противоопухолевый антибиотик доксорубицин (2 мг/кг) по той же схеме, что и липосомные препараты, группы 2 - интерферон-α ежедневно в течение 3 недель, группы 3 - антиангиогенный препарат талидомид. Результаты эксперимента приведены в табл.3. Как видно из приведенных данных, применение предлагаемых антиангиогенных фармацевтических композиций в режимах сочетанной терапии с другими препаратами существенно повышает эффективность их противоопухолевого действия.
Эффективность противоопухолевого действия антиангиогенных фармацевтических композиций в отношении меланомы линии В16 у мышей при их сочетанном применении с другими противоопухолевыми препаратами.
Аналогичные результаты были получены в экспериментах по изучению эффективности заявленной антиангиогенной фармацевтической композиции в режиме сочетанной терапии с другими противоопухолевыми препаратами - карминомицин, мутамицин, новантрон, рубомицин, блеоцин, цисплатин, таксол, этопозид, винбластин, винкристин, гемзар, фторурацил, метотрексат, кселода, золадекс, дакарбазин, цисплатин, карбоплатин, тамоксифен; иммуномодуляторами - интерферон-γ, интерлейкин-2, интерлейкин-4, интерлейкин-6, интерлейкин-12; антиангиогенными агентами - витаксин, пентозан, сурамин, фумагиллин, скволамин, комбретастатин, приномастат, маримастат, неовастат.
Предлагаемый заявителем подход лишен перечисленных выше недостатков аналогов и сочетает в себе простоту и технологичность получения липосомной формы антиангиогенных препаратов с высокой эффективностью противоопухолевого действия, обусловленной увеличением времени пребывания препарата в крови и его избирательным накоплением в области опухолевых кровеносных сосудов.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОНЪЮГАТ, ОБЛАДАЮЩИЙ ИЗБИРАТЕЛЬНЫМ ДЕЙСТВИЕМ ПО ОТНОШЕНИЮ К РАКОВЫМ ОПУХОЛЯМ | 2005 |
|
RU2303997C2 |
| СЛИТЫЙ БЕЛОК, ИМЕЮЩИЙ АКТИВНОСТЬ ИНГИБИТОРА АНГИОГЕНЕЗА | 2008 |
|
RU2372354C1 |
| АНТИАНГИОГЕННОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2009 |
|
RU2404783C1 |
| ПРЕПАРАТ ЧЕЛОВЕЧЕСКОГО ЭНДОСТАТИНА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2004 |
|
RU2278688C1 |
| РЕКОМБИНАНТНЫЙ ГИБРИДНЫЙ ПОЛИПЕПТИД, СПОСОБНЫЙ ИНГИБИРОВАТЬ ПРОЛИФЕРАЦИЮ ЭНДОТЕЛИАЛЬНЫХ КЛЕТОК ЧЕЛОВЕКА IN VITRO, И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2011 |
|
RU2465283C1 |
| ПРОТИВООПУХОЛЕВОЕ СРЕДСТВО | 2012 |
|
RU2503450C1 |
| СРЕДСТВО И СПОСОБ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2005 |
|
RU2283658C1 |
| РЕКОМБИНАНТНЫЙ ГИБРИДНЫЙ ИНГИБИТОР АНГИОГЕНЕЗА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2012 |
|
RU2499802C1 |
| ПРОТИВООПУХОЛЕВЫЙ ПЕПТИДНЫЙ ПРЕПАРАТ НА ОСНОВЕ ФРАГМЕНТА АЛЬФА-ФЕТОПРОТЕИНА, ЕГО КОНЪЮГАТ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ ГОРМОНЗАВИСИМЫХ ОПУХОЛЕЙ | 2005 |
|
RU2285537C1 |
| УСИЛЕНИЕ ИММУННЫХ ОТВЕТОВ, ОПОСРЕДОВАННЫХ БЕЛКАМИ, СЛИТЫМИ ИЗ АНТИТЕЛА И ЦИТОКИНА, ПОСРЕДСТВОМ СОВМЕСТНОГО ВВЕДЕНИЯ ИНГИБИТОРА АНГИОГЕНЕЗА | 1999 |
|
RU2229305C2 |
Предлагаемое изобретение относится к области химии природных соединений, биотехнологии, фармакологии и медицине и может быть использовано для ингибирования опухолевого роста и метастазирования злокачественных новообразований. Изобретение включает лекарственную форму ингибитора ангиогенеза, содержащую активное соединение в форме липосом, при этом в качестве активного соединения используют ангиостатин или эндостатин, а также их укороченные пептидные фрагменты, антиангиогенную фармацевтическую композицию для лечения. Кроме того, предложен способ ингибирования опухолевого роста и метастазирования злокачественных новообразований, связанных с нарушениями ангиогенеза, заключающийся во введении нетоксичного терапевтически эффективного количества фармацевтической композиции как отдельно, так и в сочетании с адьювантной терапией другими противоопухолевыми препаратами. Изобретение обеспечивает снижение скорости выведения активного соединения (ангиостатина, эндостатина или их укороченных фрагментов) из организма и увеличение эффективности его терапевтического действия. 3 н. и 4 з.п. ф-лы, 3 табл.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| RU 2002128751 А, 10.03.2004 | |||
| ТЕРАПЕВТИЧЕСКИЕ ПЕПТИДЫ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ | 1989 |
|
RU2088592C1 |
| US 6849757, 01.02.2005. | |||
Авторы
Даты
2006-11-20—Публикация
2005-03-01—Подача