Изобретение относится к области фармакологии и медицины, конкретно к новой нетоксичной высокоэффективной композиции для терапии заболеваний, сопровождающихся несбалансированной васкуляризацией.
Ангиогенез - процесс роста капилляров из кровеносных сосудов, в результате чего образуются новые сосудистые сети. В здоровом организме взрослого человека ангиогенез не встречается в большинстве органов и тканей, или его интенсивность пренебрежимо мала, кроме процессов тканевой регенерации, а также образования желтого тела, эндометрия и плаценты. Однако при экспрессии факторов роста (таких как, фактор роста эндотелия сосудов (VEGF), факторы роста фибробластов (FGF(s)) и др.), эндотелиальные клетки сосудов, находящиеся в покоящемся состоянии, могут вступать в клеточный цикл, пролиферировать, мигрировать и образовывать новые кровеносные сосуды. При этом патологический рост новых сосудов обуславливает прогрессию многих заболеваний, прежде всего рост и метастазирование солидных опухолей (Carmeliet and Jain, Nature, 407, 249-257, 2000). Специфически ингибируя ангиогенез, можно проводить терапию злокачественных новообразований и заболеваний, связанных с неоваскуляризацией сетчатки глаза, таких как диабетическая и серповидноклеточная ретинопатия и др. В связи с этим поиск новых ингибиторов ангиогенеза и разработка методов их получения в количествах, достаточных для проведения доклинических исследований, становится важной научно-прикладной задачей современной медицины.
Известны два активных ингибитора ангиогенеза: ангиостатин (O′Reilly et al., Cell, 79, 315, 1994; патенты США №№5733876, 5837682, 5885795) и эндостатин (O′Reilly et al., Cell, 88, 277, 1997; патент США №5854205). Было обнаружено, что они естественным способом продуцируются первичными опухолями. Оба белка специфически подавляют пролиферацию клеток эндотелия и ингибируют рост опухоли путем блокирования ангиогенеза - образования новых кровеносных сосудов, которые питают опухоль. Исследования показали, что эти ингибиторы ангиогенеза нетоксичны даже в очень высоких дозах и могут подавлять рост метастазов, а первичные опухоли могут регрессировать до размера, неразличимого под микроскопом. Оба ингибитора были идентифицированы как полученные протеолизом фрагменты намного больших интактных молекул. Было обнаружено, что ангиостатин является фрагментом плазминогена, а эндостатин - фрагментом коллагена XVIII.
Эти два белка привлекли пристальное внимание онкологов, так как было показано, что они подавляют у мышей рост многих различных типов опухолей, без видимых побочных эффектов или появления лекарственной устойчивости. Традиционная химиотерапия обычно приводит к приобретенной лекарственной зависимости, которая главным образом вызвана генетической нестабильностью раковых клеток. Терапия с использованием ингибиторов ангиогенеза действует на клетки опухолевого эндотелия, поражая лишь вновь образованные сосуды, которые поддерживают рост опухоли. Поскольку клетки эндотелия генетически стабильны, методы терапии с помощью ингибиторов ангиогенеза могут приводить к меньшей лекарственной устойчивости. Исследования показывают, что лекарственная устойчивость не развивалась у мышей, подвергавшихся длительной антиангиогенной терапии с помощью эндостатина. Более того, повторные циклы лечения мышей эндостатином приводили к длительной «спячке» опухолей, и после прекращения терапии рецидивы опухолей не наблюдались (Boehm et al., Nature, 390, 404, 1997).
Основным препятствием в использовании ангиостатина и эндостатина является то, что для достижения нужного клинического эффекта необходимо вводить большие количества белков в течение длительного срока, от нескольких недель до нескольких месяцев. Низкая продолжительность жизни этих белков в кровотоке требует поддержания их концентрации в крови путем частых (до нескольких раз в день) инъекций.
Одним из наиболее специфических маркеров, представленных на клеточной поверхности пролиферирующего эндотелия в зонах активной васкуляризации, являются αvβ3-интегрины (Hynes, Cell, 69, 11-25, 1992). (αvβ3-интегрины опосредуют взаимодействия эндотелиальных клеток с белками внеклеточного матрикса и являются важными регуляторными молекулами, участвующими в процессах адгезии, пролиферации и миграции эндотелиальных клеток. Специфичность экспрессии αvβ3-интегринов на поверхности эндотелиальных клеток капилляров, находящихся в зоне интенсивной васкуляризации, позволяет использовать их в качестве удобной мишени для направленной доставки лекарственных препаратов. Известно, что αvβ3-интегрины способны распознавать и эффективно связывать короткие полипептиды, содержащие аминокислотную последовательность аргинин - глицин - аспарагиновая кислота (RGD-последовательность). Подобные полипептиды способны самостоятельно выступать в качестве антагонистов αvβ3-интегринов и ингибировать ангиогенез в воспаленных тканях, опухоли и метастазах (заявка на изобретение РФ №2001124346, 2001; патент РФ №2162712, 2001).
Наиболее близкой по технической сущности является композиция, включающая слитый белок, имеющий активность ингибитора ангиогенеза и состоящий из ангиостатина и эндостатина или их фрагментов, связанных друг с другом (Пат. РФ №2240328). Авторы данного изобретения предлагают использование упомянутых ингибиторов ангиогенеза в виде гомодимерных белков, в которых молекула ингибитора связана с помощью полипептидного мостика, либо ковалентно, либо нековалентно с областью Fc иммуноглобулина гамма. Целью создания подобной конструкции являлось, с одной стороны, увеличение средней продолжительности жизни ингибиторов ангиогенеза в крови, а с другой - снижение иммуногенности полученного гомодимерного белка за счет Fc-компонента конструкции. Однако поскольку Fc фрагмент иммуноглобулина гамма имеет достаточно большие размеры, но не обладает самостоятельной антиангиогенной активностью, такое решение может привести к значительному снижению биологической активности целевых ингибиторов ангиогенеза. Кроме того, предлагаемая композиция не обладает селективностью (избирательностью) действия и будет ингибировать рост сосудов не только в зонах патологии, но и в здоровых нормальных тканях, что может привести к нежелательным побочным эффектам.
Цель данного изобретения состоит в том, чтобы получить новую композицию с активностью ингибитора ангиогенеза, сочетающую высокую эффективность терапевтического действия с низким уровнем побочных эффектов, достигаемым за счет способности композиции селективно накапливаться лишь на поверхности патологически пролиферирующего эндотелия.
Поставленная цель достигается за счет использования композиции, включающей слитый белок, имеющий активность ингибитора ангиогенеза и состоящий из ангиостатина и эндостатина или их биологически активных фрагментов, ковалентно связанных друг с другом. При этом слитый белок дополнительно содержит последовательность аминокислот (Арг-Гли-Асп)n (n=1-3), расположенную на С-, и/или N-конце полипептидной цепи, и/или между последовательностями ангиостатина и эндостатина, и/или их фрагментов.
На фиг.1 приведено схематическое изображение вариантов слитого белка. Анг - ангиостатин или его биологически активный фрагмент, Энд - эндостатин или его биологически активный фрагмент; (RGD) - последовательность (Арг-Гли-Асп).
Термин «биологически активные фрагменты» в применении к ангиостатину обозначает любой белковый фрагмент плазминогена или ангиостатина, который имеет по меньшей мере 30%, более предпочтительно по меньшей мере 70% и наиболее предпочтительно по меньшей мере 90% активности ангиостатина полной длины, определенной тестом в хориоаллантоисной мембране (ХАМ). Термин ««биологически активные фрагменты» в применении к эндостатину обозначает любой белковый фрагмент коллагена XVIII или эндостатина, который имеет по меньшей мере 30%, более предпочтительно по меньшей мере 70% и наиболее предпочтительно по меньшей мере 90% активности эндостатина полной длины, определенной тестом в ХАМ.
Композиция может быть получена как методом пептидного синтеза (Marglin and Merrifield, Annu Rev Biochem., 39, 841-866, 1970), так и генноинженерным способом с использованием плазмидной векторной ДНК, включающей последовательно встроенные в нее синтетические олигонуклеотидные последовательности, кодирующие биосинтез ангиостатина, эндостатина или их биологически активных фрагментов, а также оптимально от 1 до 3 олигонуклеотидных последовательностей, кодирующих пептид Арг-Гли-Асп. При этом слитый белок получают путем его экспрессии в клетках штамма-продуцента Е. coli, трансформированных плазмидным вектором, в который встроена кДНК, кодирующая биосинтез слитого белка (фиг.2). Клетки культивируют в жидкой среде до определенной мутности, после чего в среду добавляют индуктор и продолжают культивирование до накопления целевого продукта. Далее клетки подвергают воздействию ультразвука в присутствии деоксихолата натрия; растворение телец проводят в присутствии натрия N-лаурилсаркозина. Ренатурацию слитого белка проводят путем окисления кислородом воздуха. Полученный слитый целевой белок может быть затем очищен с использованием обычных методов очистки, хорошо известных и используемых в данной области, например методом гельфильтрационной хроматографии.
Изобретение иллюстрируется следующими примерами.
Пример 1. Антипролиферативная активность композиции в отношении эндотелиальных клеток in vivo.
Определение биологической активности композиции проводили путем оценки ее способности ингибировать пролиферацию эндотелиальных клеток человека in vitro. Эндотелиальные клетки пупочной вены человека (HUVEC) из монослоя трипсинизировали и ресуспендировали в среде M199, содержащей 5% фетальной бычьей сыворотки. Затем клетки рассеивали в 96-луночные планшеты, покрытые желатином, в плотности 5000 клеток в лунку. Через 24 часа добавляли исследуемые препараты в одинаковых концентрациях. По прошествии 20 минут культуры клеток обрабатывались 5 нг/мл раствором основного фактора роста фибробластов в присутствии гепарина. Выживаемость клеток в контрольной и в обработанных препаратами группах определяли с помощью МТТ-теста через 72 часа инкубации. МТТ-тест эффективно определяет метаболитическую активность митохондрий, и его результат прямо коррелирует с числом живых клеток. Результаты эксперимента приведены в табл.1. Как видно из табл.1, антипролиферативная активность композиции в отношении эндотелиальных клеток in vivo существенно превышает активность как свободных ангиостатина и эндостатина, так и слитого белка, сочетающих оба этих ингибитора, взятых в той же концентрации.
Пример 2. Влияние композиции на образование капилляров в матригеле.
Для исследования влияния композиции на процесс ангиогенеза использовали in vitro анализ развития капилляров в матригеле, имитирующем препарат внеклеточного матрикса. Данный метод достаточно полно отражает процесс неоваскуляризации, происходящий in vivo, и основан на наблюдении и подсчете количества капиллярных трубок, образующихся в матригеле под воздействием исследуемых препаратов. В табл.2 приведены сравнительные данные о влиянии композиции, входящих в ее состав антиангиогенных полипептидов и слитого белка, не содержащего дополнительных последовательностей, на процесс образования капиллярных трубок из клеток HUVEC в матригеле. Как видно из табл.2, композиция оказывает значительно более выраженное действие на исследуемый процесс.
Пример 3. Противоопухолевая активность композиции.
Клетки меланомы линии В16 поддерживали путем еженедельной внутрибрюшинной перевивки мышам С57В 1/6. Для индукции солидных опухолей мышам вводили подкожно клеточную суспензию (2·105 клеток в 0,1 мл физиологического раствора). Все исследуемые препараты вводили опытным животным внутривенно. Размер солидных опухолей измеряли один раз в 2-3 дня. Относительный размер опухолей (ОРО) определяли по формуле: 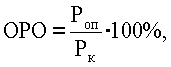 где
где 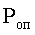 - средний размер опухолей в опытной группе, Рк - средний размер опухолей у контрольных животных. Увеличение продолжительности жизни леченых животных по сравнению с контролем определяли по формуле:
- средний размер опухолей в опытной группе, Рк - средний размер опухолей у контрольных животных. Увеличение продолжительности жизни леченых животных по сравнению с контролем определяли по формуле:  где Т - средняя продолжительность жизни (СПЖ) леченых животных, дни, С - СПЖ контрольных животных, дни.
где Т - средняя продолжительность жизни (СПЖ) леченых животных, дни, С - СПЖ контрольных животных, дни.
Результаты эксперимента приведены в табл.3. По сравнению со слабовыраженным эффектом от применения индивидуальных ангиостатина и эндостатина и недостаточным эффектом от применения слитого белка, не содержащего дополнительных последовательностей, терапия заявляемой композицией приводила к значительному торможению роста опухолей как в период курса лечения, так и после его отмены, и увеличению средней продолжительности жизни леченных животных.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОНЪЮГАТ, ОБЛАДАЮЩИЙ ИЗБИРАТЕЛЬНЫМ ДЕЙСТВИЕМ ПО ОТНОШЕНИЮ К РАКОВЫМ ОПУХОЛЯМ | 2005 |
|
RU2303997C2 |
| ИНГИБИТОР АНГИОГЕНЕЗА, АНТИАНГИОГЕННАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ И СПОСОБ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ | 2005 |
|
RU2287341C1 |
| РЕКОМБИНАНТНЫЙ ГИБРИДНЫЙ ИНГИБИТОР АНГИОГЕНЕЗА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2012 |
|
RU2499802C1 |
| РЕКОМБИНАНТНЫЙ ГИБРИДНЫЙ ПОЛИПЕПТИД, СПОСОБНЫЙ ИНГИБИРОВАТЬ ПРОЛИФЕРАЦИЮ ЭНДОТЕЛИАЛЬНЫХ КЛЕТОК ЧЕЛОВЕКА IN VITRO, И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2011 |
|
RU2465283C1 |
| УСИЛЕНИЕ ИММУННЫХ ОТВЕТОВ, ОПОСРЕДОВАННЫХ БЕЛКАМИ, СЛИТЫМИ ИЗ АНТИТЕЛА И ЦИТОКИНА, ПОСРЕДСТВОМ СОВМЕСТНОГО ВВЕДЕНИЯ ИНГИБИТОРА АНГИОГЕНЕЗА | 1999 |
|
RU2229305C2 |
| СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО АНТИАНГИОГЕННОГО ПОЛИПЕПТИДА | 2012 |
|
RU2488635C1 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ, ИСПОЛЬЗУЮЩАЯ АНТИАНГИОГЕННЫЕ СРЕДСТВА И TNF-α | 2002 |
|
RU2316337C2 |
| ГОМОДИМЕРНЫЙ СЛИТЫЙ БЕЛОК, ИМЕЮЩИЙ АКТИВНОСТЬ ИНГИБИТОРА АНГИОГЕНЕЗА (ВАРИАНТЫ), МОЛЕКУЛА ДНК, КОДИРУЮЩАЯ ГОМОДИМЕРНЫЙ СЛИТЫЙ БЕЛОК, ВЕКТОР ДЛЯ ЭКСПРЕССИИ ГОМОДИМЕРНОГО СЛИТОГО БЕЛКА, СПОСОБ ТРАНСФЕКЦИИ КЛЕТКИ МЛЕКОПИТАЮЩЕГО И СПОСОБ ПОЛУЧЕНИЯ ГОМОДИМЕРНОГО СЛИТОГО БЕЛКА | 1999 |
|
RU2240328C2 |
| МНОГОФУНКЦИОНАЛЬНЫЕ И ПОЛИВАЛЕНТНЫЕ ИНГИБИТОРЫ АНГИОГЕНЕЗА | 2005 |
|
RU2398878C2 |
| ПРЕПАРАТ ЧЕЛОВЕЧЕСКОГО ЭНДОСТАТИНА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2004 |
|
RU2278688C1 |
Изобретение относится к области биотехнологии, конкретно к получению соединений, обладающих активностью ингибиторов ангиогенеза, и может быть использовано в медицине для терапии заболеваний, сопровождающихся несбалансированной васкуляризацией. Получают слитый белок, состоящий из ангиостатина и эндостатина или биологически активных фрагментов ангиостатина и эндостатина, ковалентно связанных друг с другом и с последовательностью аминокислот (Арг-Гли-Асп)n, где n=1-3, расположенной на С-, и/или N-конце полипептидной цепи, и/или между последовательностями ангиостатина и эндостатина, и/или их фрагментов. Изобретение позволяет получить слитый белок с активностью ингибитора ангиогенеза, обладающий высокой терапевтической эффективностью и низким уровнем побочных эффектов. 2 ил., 3 табл.
Слитый белок, имеющий активность ингибитора ангиогенеза и состоящий из ангиостатина и эндостатина или биологически активных фрагментов ангиостатина и эндостатина, ковалентно связанных друг с другом, отличающийся тем, что слитый белок дополнительно содержит последовательность аминокислот (Арг-Гли-Асп)n, где n=1-3, расположенную на С-, и/или N-конце полипептидной цепи, и/или между последовательностями ангиостатина и эндостатина, и/или их фрагментов.
| ГОМОДИМЕРНЫЙ СЛИТЫЙ БЕЛОК, ИМЕЮЩИЙ АКТИВНОСТЬ ИНГИБИТОРА АНГИОГЕНЕЗА (ВАРИАНТЫ), МОЛЕКУЛА ДНК, КОДИРУЮЩАЯ ГОМОДИМЕРНЫЙ СЛИТЫЙ БЕЛОК, ВЕКТОР ДЛЯ ЭКСПРЕССИИ ГОМОДИМЕРНОГО СЛИТОГО БЕЛКА, СПОСОБ ТРАНСФЕКЦИИ КЛЕТКИ МЛЕКОПИТАЮЩЕГО И СПОСОБ ПОЛУЧЕНИЯ ГОМОДИМЕРНОГО СЛИТОГО БЕЛКА | 1999 |
|
RU2240328C2 |
| СПОСОБЫ И КОМПОЗИЦИИ, ПРИГОДНЫЕ ДЛЯ ИНГИБИРОВАНИЯ АНГИОГЕНЕЗА | 1995 |
|
RU2162712C2 |
| RU 2001124346 A, 27.06.2003 | |||
| WO 9952562 A2, 21.10.1999. | |||
Авторы
Даты
2009-11-10—Публикация
2008-02-28—Подача