Изобретение относится к области получения органических веществ и может быть использовано в производстве лекарственных или биологически активных соединений.
Известен способ получения 3-амино-5-ацетамидо-1,2,4-триазола нагреванием 1-ацетил-3,5-диамино-1,2,4-триазола при температуре 187-190°С (Певзнер М.С., Гладкова Н.В., Кравченко Т.А. 5-Амино-3-нитро-1,2,4-триазол и 5-нитрамино-3-нитро-1,2,4-триазол. // ЖОрХ. 1996. Т.32. Вып.8. С.1230-1233). Недостатком этого способа является возможность получения только 5-амино-3-N-ацетамидо-1,2,4-триазола.
Известен способ получения ацилпроизводных 3,5-диамино-1,2,4-триазола ацилированием 3,5-диамино-1,2,4-триазола (гуаназола) при кипячении с ангидридами или хлоран гидридами карбоновых кислот в бензоле или толуоле (Selassie С.D., Lien E.J., Khwaja Т.А. // J. Pharm. Sci. 1981. V.70. №11. Р.1281-1283). Недостатком этого способа является возможность получения только 5-амино-3-N-ациламино-1-R-1,2,4-триазолов, в которых R представляет собой водород, а также образование побочных продуктов - 3,5-диациламино-1,2,4-триазолов.
Наиболее близким по технической сущности и достигаемому результату является способ получения 3-ацетиламино-5-амино-1-фенил-1,2,4-триазола ацилированием 3,5-диамино-1-фенил-1,2,4-триазола при кипячении в уксусном ангидриде (Pellizzari, Rongagloloi // Gazz. chim. Ital. 1893. V.31, I. Р.478. / Belstein 1903. Bd IV. S.980). Основным недостатком данного способа является образование трудноразделимых смесей соединений при применении других ацилирующих агентов, кроме уксусного ангидрида. Это делает способ непригодным для получения 5-амино-3-N-ациламино-1-R-1,2,4-триазолов, в которых ацильная группа отличается от ацетильной.
Задачей изобретения является разработка способа получения 5-амино-3-N-ациламино-1-R-1,2,4-триазолов и 5-амино-3-N-сульфониламино-1-R-1,2,4-триазолов общей формулы (I), с высокой чистотой целевых продуктов, без образования побочных соединений и перерасхода реагентов.
Поставленная задача достигается за счет того, что в предлагаемом способе получения 5-амино-3-N-ациламино-1-R-1,2,4-триазолов и 5-амино-3-N-сульфониламино-1-R-1,2,4-триазолов общей формулы (I), включающем ацилирование 3,5-диамино-1-R-1,2,4-триазолов (II), к смеси 3,5-диамино-1-R-1,2,4-триазола формулы (II), апротонного растворителя и органического основания (III), которое представляет собой триэтиламин или другой третичный алифатический амин или пиридин или замещенный пиридин, прибавляют ацилирующий агент общей формулы (IV), при мольном соотношении (II):(III):(IV)=1.00:1.15-1.40:1.05-1.35, реакционную смесь перемешивают при температуре -10÷+120°С.
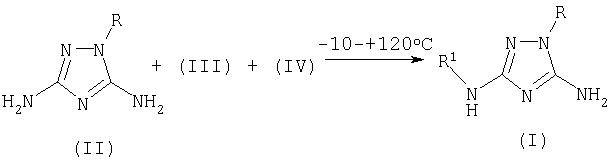
Проведенные исследования показали, что в предлагаемом способе можно использовать различные апротонные растворители, однако наилучшие результаты были получены при использовании ацетонитрила, диметилформамида, диметилсульфоксида, тетрагидрофурана и ацетона.
В качестве органических оснований можно использовать третичные алифатические амины или соединения пиридинового ряда, однако наиболее целесообразно использовать триэтиламин или пиридин, поскольку эти соединения являются наиболее дешевыми.
Мольное соотношение (II):(III):(IV)=1.00:1.15-1.40:1.05-1.35 является оптимальным. Изменение мольного соотношения приводит либо к образованию побочных соединений и низкой чистоте целевых продуктов (I), либо перерасходу реагентов, что экономически нецелесообразно.
Ацилирование должно проводиться в указанном температурном интервале. При температуре ниже -10°С значительно уменьшается скорость реакции и увеличивается продолжительность процесса, что технологически нецелесообразно. При температуре выше 120°С происходит уменьшение выхода целевых соединений (I) вследствие протекания побочных реакций.
Способ осуществляется следующим образом.
К смеси 3,5-диамино-1-R-1,2,4-триазола (II), апротонного растворителя и органического основания (III) прибавляют ацилирующий агент общей формулы (IV) при мольном соотношении (II):(III):(IV)=1.00:1.15-1.40:1.05-1.35, реакционную смесь перемешивают при температуре -10÷+120°С в течение 10-30 минут, выпавший осадок целевого продукта (I) отфильтровывают и перекристаллизовывают.
Пример 1
К смеси 1 г (5.7 ммоль) 3,5-диамино-1-фенил-1,2,4-триазола, 0.64 г (8.0 ммоль) пиридина и 5 мл ацетонитрила приливают при перемешивании 0.69 г (6.8 ммоль) уксусного ангидрида. Реакционную смесь перемешивают 10 мин при температуре 81-83°С, охлаждают до 20°С, выпавший осадок отфильтровывают. Получают 1.1 г (90%) 5-амино-3-ацетиламино-1-фенил-1,2,4-триазола. tпл=239-241°С (из воды).
Спектр ЯМР 1Н, δ, м.д. (DMSO d6) 2.05 с (3Н, СН3), 6.38 с (2Н, NH2), 7.30-7.55 м (5Н, аром.), 9.92 с (1Н, NH).
Найдено (%): С 55.30; Н 5.12; N 32.21.
C10H11N5O
Вычислено (%): С 55.29; Н 5.10; N 32.24.
Пример 2
К смеси 1 г (5.7 ммоль) 3,5-диамино-1-фенил-1,2,4-триазола, 0.64 г (8.0 ммоль) пиридина и 5 мл ацетонитрила приливают по каплям при перемешивании и температуре минус 10-0°С раствор 0.82 г (7.2 ммоль) трифторуксусного ангидрида в 3 мл ацетонитрила. Реакционную смесь перемешивают при температуре минус 10-0°С 20 минут, выпавший осадок отфильтровывают. Получают 0.94 г (61%) 5-амино-3-трифторацетиламино-1-фенил-1,2,4-триазола. tпл=213-214°C (этанол).
Спектр ЯМР 1Н, δ, м.д. (DMSO d6) 6.4 с (2Н, NH2), 7.25-7.40, 8.0 м (5Н, аром.), 12.5 c (1H, NH).
Найдено (%): С 44.30; Н 2.95; N 25.86.
C10H8F3N5О
Вычислено (%): С 44.29; Н 2.97; N 25.82.
Пример 3
К смеси 1 г (5.7 ммоль) 3,5-диамино-1-фенил-1,2,4-триазола, 0.64 г (8.0 ммоль) пиридина и 5 мл ацетонитрила приливают раствор 0.73 г (7.3 моль) янтарного ангидрида в 3 мл ацетонитрила. Реакционную смесь перемешивают 15 мин при температуре 81-83°С, охлаждают до 20°С, подкисляют 1 н. HCl до рН 4-5, выпавший осадок отфильтровывают. Получают 1.1 г (63%) 5-амино-3-сукциноиламино-1-фенил-1,2,4-триазола. tпл=206°C с разл. (этанол).
Спектр ЯМР 1Н, δ, м.д. (DMSO d6) 2.45 м (4Н, 2 CH2), 6.47 с (2Н, NH2), 7.3-7.55 м (5Н, аром.), 10.12 уш. с (1Н, NH), 12.5 уш. с (1Н, НО).
Найдено (%): С 52.38; Н 4.75; N 25.46.
C12H13N5O3
Вычислено (%): С 52.36; Н 4.76; N 25.44.
Пример 4
К смеси 1 г (5.7 ммоль) 3,5-диамино-1-фенил-1,2,4-триазола, 0.8 г (8.0 ммоль) триэтиламина и 5 мл ацетонитрила приливают по каплям 1.1 г (7 ммоль) пара-метилбензоилхлорида. Реакционную смесь перемешивают 10 мин при температуре 81-83°С, выпавший осадок отфильтровывают. Получают 1.31 г (71%) 5-амино-3-пара-метилбензоиламино-1-фенил-1,2,4-триазола. tпл=231-232°C (этанол).
Спектр ЯМР 1Н, δ, м.д. (DMSO d6) 2.4 с (3Н, СН3), 6.35 с (2Н, NH2), 7.21-7.88 м (9Н, аром.), 10.27 уш.с (1Н, NH).
Найдено (%): С 66.50, Н 5.17, N 23.85.
C16H15N5O
Вычислено (%): С 66.52, Н 5.15, N 23.88.
Пример 5
К смеси 1 г (5.7 ммоль) 3,5-диамино-1-фенил-1,2,4-триазола, 0.64 г (8.0 ммоль) пиридина и 5 мл ацетонитрила приливают по каплям раствор 1.37 г (7.2 ммоль) пара-толуолсульфохлорида в 3 мл ацетонитрила. Реакционную смесь перемешивают 25 мин при температуре 81-83°С, охлаждают до 20°С, выпавший осадок отфильтровывают. Получают 1.51 г (73%) 5-амино-3-пара-толуолсульфониламино-1-фенил-1,2,4-триазола. tпл=256-257°C (диметилформамид).
Спектр ЯМР 1Н, δ, м.д. (DMSO d6) 2.38 с (3Н, СН3), 6.4 с (2Н, NH2), 7.3-7.85 м (9Н, аром.), 10.65 уш.с (1Н, NH).
Найдено (%): С 54.72; Н 4.57; N 21.25.
C15H15N5O2S
Вычислено (%): С 54.70; Н 4.59; N 21.26.
Пример 6
К смеси 1 г (5 ммоль) 3,5-диамино-1-бензил-1,2,4-триазола, 0.64 г (8.0 ммоль) пиридина и 5 мл ацетонитрила приливают по каплям раствор 0.6 г (6.8 ммоль) уксусного ангидрида в 3 мл ацетонитрила. Реакционную смесь перемешивают 10 мин при температуре 81-83°С, выпавший осадок отфильтровывают. Получают 1 г (75%) 5-амино-3-ацетиламино-1-бензил-1,2,4-триазола. tпл=224-225°C (этанол).
Спектр ЯМР 1Н, δ, м.д. (DMSO d6) 2.05 с (3Н, СН3), 5.01 с (2Н, СН2), 6.25 с (2Н, NH2). 7.15-7.38 м (5Н, аром.), 9.80 уш. с (1H, NH).
Найдено (%): С 57.15; Н 5.68; N 30.25.
С11Н13N5O
Вычислено (%): С 57.13; Н 5.67; N 30.28.
Пример 7
К смеси 1 г (5 ммоль) 3,5-диамино-1-бензил-1,2,4-триазола, 0.62 г (7.8 ммоль) пиридина и 5 мл ацетонитрила приливают по каплям раствор 0.84 г (6.5 ммоль) бензоилхлорида в 3 мл ацетонитрила. Реакционную смесь перемешивают 10 мин при температуре 81-83°С, охлаждают до 20°С, выпавший осадок отфильтровывают. Получают 1.07 г (63%) 5-амино-3-бензоиламино-1-бензил-1,2,4-триазола. tпл=168-170°C (этанол).
Спектр ЯМР 1Н, δ, м.д. (DMSO d6) 5.07 с (2Н, СН2), 6.3 с (2Н, NH2), 7.25-7.5, 7.92 м (10Н, аром.), 10.15 уш.с (1Н, NH).
Найдено (%): С 65.53; Н 5.16; N 23.89.
C16H15N5O
Вычислено (%): С 65.52; Н 5.15; N 23.88.
Пример 8
К смеси 1 г (5 ммоль) 3,5-диамино-1-бензил-1,2,4-триазола, 0.65 г (8.2 ммоль) пиридина и 5 мл ацетонитрила приливают по каплям раствор 1.1 г (6.6 ммоль) пара-толуолсульфонилхлорида в 3 мл ацетонитрила. Реакционную смесь перемешивают 25 мин при температуре 81-83°С, охлаждают до 20°С, выпавший осадок отфильтровывают. Получают 1.29 г (65%) 5-амино-3-пара-толуолсульфониламино-1-бензил-1,2,4-триазола. tпл=271-273°С(этанол).
Спектр ЯМР 1Н, δ, м.д. (DMSO d6) 2.41 с (3Н, СН3), 4.93 с (2Н, CH2), 6.27 с (2Н, NH2), 7.09-7.28, 7.73 м (9Н, аром.), 10.40 уш. с (1Н, NH).
Найдено (%): С 55.94; Н 4.97; N 20.38.
C16H17N5O2S
Вычислено (%): 55.96; Н 4.99; N 20.39.
Пример 9
К смеси 1 г (3.8 ммоль) 3,5-диамино-1-[-4-метил-5-карбэтокситиазолил-2]-1,2,4-триазола, 0.7 г (7.0 ммоль) триэтиламина и 3 мл диметилформамида приливают по каплям раствор 0.97 г (5.1 ммоль) пара-толуолсульфонилхлорида в 2 мл диметилформамида. Реакционную смесь перемешивают 15 мин при температуре 115-120°С, охлаждают до 20°С, выпавший осадок отфильтровывают. Получают 0.83 г (53%) 5-амино-3-пара-толуолсульфониламино-1-[-4-метил-5-карбэтокситиазолил-2]-1,2,4-триазола. tпл=288-290°C (этанол).
Спектр ЯМР 1Н, δ, м.д. (DMSO d6) 1.38 м (3Н, СН3), 2.47 с (3Н, СН3), 2.59 с (3Н, СН3), 4.31 м (2Н, СН2), 7.29 м (2Н, аром.), 7.66 с (2Н, NH2), 7.85 м (2Н, аром.), 11.16 уш.с (1Н, NH).
Найдено (%): С 45.48; Н 4.27; N 19.90.
C16H18N6O4S2
Вычислено (%): 45.49; Н 4.29; N 19.89.
Пример 10
К смеси 1 г (3.8 ммоль) 3,5-диамино-1-[-4-метил-5-карбэтокситиазолил-2]-1,2,4-триазола, 0.54 г (6.8 ммоль) пиридина и 5 мл ацетонитрила приливают по каплям раствор 0.63 г (5.1 ммоль) бензоилхлорида в 3 мл ацетонитрила. Реакционную смесь перемешивают 10 мин при температуре 115-120°С, охлаждают до 20°С, выпавший осадок отфильтровывают. Получают 0.42 г (30%) 5-амино-3-бензоиламино-1-[-4-метил-5-карбэтокситиазолил-2]-1,2,4-триазола. tпл=258-260°С (этанол).
Спектр ЯМР 1Н, δ, м.д. (DMSO d6) 1.35 м (3Н, СН3), 2.65 с (3Н, СН3), 4.28 м (2Н, СН2), 7.41-7.52 м (3Н, аром.), 7.71 с (2Н, NH2), 7.98 м (2Н, аром.), 10.75 уш.с (1Н, NH).
Найдено (%): С 51.61; Н 4.32; N 22.56.
C16H16N6OS
Вычислено (%): С 51.60; Н 4.33; N 22.57.
Пример 11
К смеси 1 г (3.9 ммоль) 3,5-диамино-1-[-4-фенилтиазолил-2]-1,2,4-триазола, 0.47 г (6.0 ммоль) пиридина и 3 мл диметилформамида приливают по каплям раствор 0.53 г (5.2 ммоль) уксусного ангидрида. Реакционную смесь перемешивают 10 мин при температуре 115-120°С, охлаждают до 20°С, выпавший осадок отфильтровывают. Получают 0.92 г (65%) 5-амино-3-ацетиламино-1-[-4-фенилтиазолил-2]-1,2,4-триазола. tпл=294°С (этанол).
Спектр ЯМР 1Н, δ, м.д. (DMSO d6) 2.05 с (3Н, СН3), 7.42-7.61 м (3Н, аром.), 7.72 с (2Н, NH2), 7.84 с (1Н, СН), 8.02 м (2Н, аром.), 10.51 уш.с (1Н, NH).
Найдено (%): С 51.98; Н 4.02; N 27.99.
C13H12N6OS
Вычислено (%): С 51.99; Н 4.03; N 27.98.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ R-МЕТИЛПРОИЗВОДНЫХ 3,5-ДИАМИНО-1,2,4-ТРИАЗОЛА | 2005 |
|
RU2292340C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2-СУЛЬФОНИЛАМИНО-1,2,4,-ТРИАЗОЛО[1,5-a] ПИРИМИДИНОВ | 2007 |
|
RU2325390C1 |
| СПОСОБ ПОЛУЧЕНИЯ СУЛЬФОНИЛПРОИЗВОДНЫХ 3,5-ДИАМИНО-1,2,4-ТРИАЗОЛА | 2005 |
|
RU2277532C1 |
| СПОСОБ ПОЛУЧЕНИЯ 5-АМИНО-3-[N-АЦИЛ-N-АЛКИЛАМИНО]-1-ФЕНИЛ-1,2,4-ТРИАЗОЛОВ И 5-АМИНО-3-[N-СУЛЬФОНИЛ-N-АЛКИЛАМИНО]-1-ФЕНИЛ-1,2,4-ТРИАЗОЛОВ | 2004 |
|
RU2270195C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2-(3',5'-ДИАМИНО-1',2',4'-ТРИАЗОЛ-1'-ИЛ)-4-R-5-R-1,3-ТИАЗОЛОВ | 2005 |
|
RU2298553C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЭФИРОВ 5-АМИНО-1,2,4-ТРИАЗОЛ-3-ИЛКАРБОНОВОЙ КИСЛОТЫ ИЛИ 5-АМИНО-1,2,4-ТРИАЗОЛ-3-ИЛУКСУСНОЙ КИСЛОТЫ | 2004 |
|
RU2269521C1 |
| 5-АМИНО-3-(2-АМИНОПРОПИЛ)-[1,2,4]ТИАДИАЗОЛЫ | 2011 |
|
RU2449997C1 |
| СПОСОБ ПОЛУЧЕНИЯ АМИДОВ 5-АМИНО-1,2,4-ТРИАЗОЛ-3-ИЛКАРБОНОВЫХ КИСЛОТ | 2005 |
|
RU2292339C1 |
| СПОСОБ ПОЛУЧЕНИЯ 5-ЗАМЕЩЁННЫХ 1,2,4-ТРИАЗОЛ-3-КАРБОНОВЫХ КИСЛОТ И ИХ ПРОИЗВОДНЫХ ИЗ УНИВЕРСАЛЬНОГО ПРЕДШЕСТВЕННИКА | 2015 |
|
RU2605414C1 |
| СЕЛЕКТИВНЫЕ ПРОТИВОТУБЕРКУЛЕЗНЫЕ АГЕНТЫ, ПРЕДСТАВЛЯЮЩИЕ СОБОЙ ЗАМЕЩЕННЫЕ 7-АРИЛ(ГЕТЕРИЛ)-6-КАРБЭТОКСИ-4,7-ДИГИДРО-1,2,4-ТРИАЗОЛО[1,5-a]ПИРИМИДИНЫ ИЛИ ЗАМЕЩЕННЫЕ 7-АРИЛ(ГЕТЕРИЛ)-4,7-ДИГИДРО-6-НИТРО-1,2,4-ТРИАЗОЛО[1,5-a]ПИРИМИДИНЫ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ АДДИТИВНЫЕ СОЛИ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ 7-АРИЛ(ГЕТЕРИЛ)-6-КАРБЭТОКСИ-5-МЕТИЛ-4,7-ДИГИДРО-1,2,4-ТРИАЗОЛО[1,5-a]ПИРИМИДИНОВ | 2007 |
|
RU2360905C2 |
Описывается новый способ получения производных 1,2,4-триазола общей формулы I
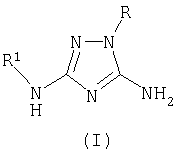
где R означает фенил, бензил, 4-фенилтиазол-2-ил или 4-метил-5-карбэтокситиазол-2-ил радикал;
R1 означает ацетил, трифторацетил, сукциноил, бензоил, метилбензоил или толуолсульфонил радикал, заключающийся в том, что к смеси 3,5-диамино-1-R-1,2,4-триазола общей формулы II
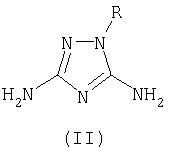
где R имеет указанные выше значения, апротонного растворителя, такого как ацетонитрил или диметилформамид, и органического основания (III), которое представляет собой триэтиламин или пиридин, прибавляют ацилирующий агент общей формулы IV,
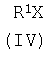
где R1 имеет указанные выше значения, а Х означает Cl или группу OR1, где R1 имеет указанные выше значения, и взаимодействие осуществляют при температуре -10÷+120°С и перемешивании, при мольном соотношении II:III:IV=1,00:1,15-1,40:1,05-1,35. Описываемый способ позволяет получить целевой продукт с высокой степенью чистоты и без перерасхода реагентов.
Способ получения 5-амино-3-N-R1-амино-1-R-1,2,4-триазолов общей формулы I
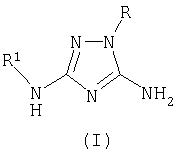
где R означает фенил, бензил, 4-фенилтиазол-2-ил или 4-метил-5-карбэтокситиазол-2-ил радикал;
R1 означает ацетил, трифторацетил, сукциноил, бензоил, метилбензоил или толуолсульфонил радикал,
заключающийся в том, что к смеси 3,5-диамино-1-R-1,2,4-триазола общей формулы II
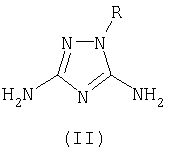
где R имеет указанные выше значения,
апротонного растворителя, такого, как ацетонитрил или диметилформамид, и органического основания (III), которое представляет собой триэтиламин или пиридин, прибавляют ацилирующий агент общей формулы IV
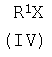
где R1 имеет указанные выше значения, а Х означает Cl или группу OR1, где R1 имеет указанные выше значения,
и взаимодействие осуществляют при температуре -10 - +120°С и перемешивании при мольном соотношении II:III:IV=1,00:1,15-1,40:1,05-1,35.
| Автоматизированный класс для обученияи КОНТРОля зНАНий ОбучАЕМыХ | 1979 |
|
SU836650A1 |
| Peiter J., Pong L., J | |||
| Het | |||
| Chem., V24, №1, p.127-142, 1987 | |||
| Selassia C.D | |||
| J | |||
| Pharm | |||
| Sci., v70, №11, p.1281-1283, 1981 | |||
| ПРОИЗВОДНЫЕ ДИПИРИДО-ДИАЗЕПИНА И ИХ ФАРМАКОЛОГИЧЕСКИ ПЕРЕНОСИМЫЕ СОЛИ, ОБЛАДАЮЩИЕ БИОЛОГИЧЕСКОЙ АКТИВНОСТЬЮ | 1992 |
|
RU2024522C1 |
| Летающий автоматический скребок | 1961 |
|
SU141119A1 |
Авторы
Даты
2006-12-27—Публикация
2005-02-15—Подача