Изобретение относится к области медицины и биотехнологии, а именно к средствам для стимуляции васкуляризации и восстановительных процессов в ишемизированных тканях, вызывающим усиление роста новых сосудов с целью лечения заболеваний, в основе которых лежит недостаточное кровоснабжения тканей, таких как критическая ишемия нижних конечностей (КИНК), ишемическая болезнь сердца (ИБС), диабетическая стопа, ишемический инсульт, боковой амиотрофический склероз, системная склеродермия, хронические незаживающие язвы, длительно незаживающие раны.
Заболевания человека, обусловленные нарушением кровообращения тканей и органов вследствие стенозирующего поражения сосудов, такие как ишемическая болезнь сердца, ишемический инсульт и ишемические заболевания нижних конечностей, в том числе обусловленные макроангиопатией при сахарном диабете, входят в ряд наиболее распространенных причин инвалидизации и смертности населения развитых стран трудоспособного возраста несмотря на внедрение в практику здравоохранения эффективных методов хирургической и эндоваскулярной реваскуляризации.
В России ИБС страдает около 10 миллионов человек трудоспособного возраста и более чем у трети из них имеется стабильная стенокардия. В 2000 г. заболеваемость ИБС в России составила 425,5 случая на 100 тыс. населения (В.И. Маколкин, Ф.Н. Зябрев "Почему надо снижать частоту сердечных сокращений при лечении стабильной стенокардии": Кардиология, 2006, т.46, с.88-91); при этом на долю ИБС в РФ приходится 48% всех сердечно-сосудистых заболеваний. По данным иностранных авторов, на долю больных с рефракторной стенокардией приходится около 15% от всех больных ИБС.
Стенозирующий атеросклероз сосудов нижних конечностей, приводящий к развитию тяжелой ишемии конечностей и в крайних случаях к развитию гангрены и ампутациям, ассоциирован с 3-6-кратным повышением сердечно-сосудистой заболеваемости и смертности населения. Наиболее тяжелое течение приобретают все вышеперечисленные заболевании при их сочетании с сахарным диабетом, который является огромной социально-экономической нагрузкой на общество: затраты составляют до 30% бюджета здравоохранения России (из них 90% - на осложнения диабета). Согласно материалам Европейской согласительной комиссии (European working group on chronic critical leg ischemia "Second European Consensus Document on chronic critical leg ischemia." Eur. J. Vasc. Surg. 1992 V.6 (Suppl. A), P.1-32), из миллиона больных сахарных диабетом КИНК ежегодно диагностируется у 500-1000 пациентов. Среди поздних осложнений сахарного диабета первое место по частоте занимают сосудистые макроангиопатии, являющиеся наиболее частой причиной инвалидизации и летальности. Следствие сосудистых макроангиопатии - синдром "диабетической стопы", проявляющийся в развитии трофических язв и гангрены конечности, наносит колоссальный экономический ущерб обществу. Частота нетравматических ампутаций у больных диабетом в России в 10-15 раз выше, чем в общей популяции, больничная летальность "высоких" ампутаций составляет до 45-50%, а 5-летняя выживаемость - около 50%.
Лечение ишемических заболеваний включает целый ряд мер медикаментозного характера, изменение образа жизни, коррекцию сопутствующей патологии, однако наиболее выраженный эффект дают хирургические и эндоваскулярные методы восстановления нарушенного кровотока - шунтирование, ангиопластика, атерэктомия, стентирование. Поскольку консервативные методы лечения неэффективны у значительной части тяжелых категорий этих больных, а существующие хирургические и эндоваскулярные методы применимы только для части больных, существует довольно значительная кагорта больных с множественными дистальными стенозами сосудов, для которых единственной альтернативой является терапия ангиогенными факторами роста, направленная на стимуляцию роста новых сосудов в зоне нарушенного кровоснабжения (ишемии), которая позволит без хирургического вмешательства улучшить кровоснабжение ткани, и остановить дегенеративные процессы, и таким образом восстановить ее функции. Однако клинические испытания препаратов на основе рекомбинантных факторов роста или их генов для лечения ишемической болезни сердца и критической ишемии нижних конечностей не показали достаточной эффективности (Rissanen TT, Yla-Herttuala S. Current status of cardiovascular gene therapy. Mol Ther. 2007; 15: 1233-47 // Gupta R, Losordo DW. Challenges in the translation of cardiovascular cell therapy. J Nucl Med. 2010 May 1; 51 Suppl 1:122S-127S. Review). Основной причиной этого является низкая эффективность трансфекции тканей при прямом введении генетических конструкций и побочные эффекты, связанные с использованием некоторых вирусных конструкций, что ограничивает возможность повторных введений.
Это диктует необходимость разработки инновационных методов лечения ишемических заболеваний, одним из которых является терапия стволовыми и прогениторными клетками - направление регенеративной медицины, активно развивающееся в последнее время.
Многочисленные исследования на моделях хронической ишемии сердца и инфаркта миокарда и ишемии конечностей у животных продемонстрировали возможность восстановления кровоснабжения сердца, его структуры и функции после инфаркта с помощью стволовых клеток, полученных из различных источников, включая клетки костного мозга и жировой ткани, периферической и пуповинной крови и пр. При этом известно использование в клинической практике аутологичных стволовых клеток в эффективном количестве от 106 до 1010 клеток на пациента (Stem cell treatment for acute myocardial infarction (Review). The Cochrane collaboration. Published by John Wiley&Sons, Ltd., published in The Cochrane Library 2012, Issue 2, http://www.thecochranelibrary.com).
Однако в клинических исследованиях эффективность клеточной терапии ишемических заболеваний с помощью аутологичных (полученных от больного) клеток оказалась не достаточно высокой (Kang S, et al. Effects of intracoronary autologous bone marrow cells on left ventricular function in acute myocardial infarction: a systematic review and meta-analysis for randomized controlled trials. Coron Artery Dis. 2008 Aug; 19 (5): 327-35. Review // Tongers J, Losordo DW, Landmesser U. Stem and progenitor cell-based therapy in ischaemic heart disease: promise, uncertainties, and challenges. Eur Heart J. 2011 May; 32 (10): 1197-206. Review).
Одной из основных причин недостаточной эффективности аутологической клеточной терапии является снижение регенеративного потенциала стволовых клеток под влиянием длительно существующего патологического процесса. Участие стволовых и прогениторных клеток в процессах восстановления поврежденных тканей и органов осуществляется за счет их функциональных особенностей: способности к направленной миграции в зону повреждения, к дифференцировке в клетки сосудов и сердечной мышцы и к продукции широкого спектра биологически активных молекул - факторов роста, цитокинов, ферментов. Причем последнее свойство считается основным механизмом их регенеративного действия. За счет секреции (продукции) биологически активных молекул стволовые клетки стимулируют рост сосудов и нервов в ишемизированной ткани, способствуют восстановлению поврежденных клеток и стимулируют собственные резидентные стволовые клетки ткани. Нарушение этих функций приводит к снижению регенеративных способностей стволовых и прогениторных клеток при их трансплантации. Так, эндотелиальные прогениторные клетки (ЭПК) костного мозга, полученные от больных ИБС, продуцируют меньше факторов роста, значительно хуже восстанавливают кровоснабжение ишемизированной конечности при введении иммунодефицитным мышам, чем ЭПК здоровых людей того же возраста (Heeschen С. Et al. Profoundly Reduced Neovascularization Capacity of Bone Marrow Mononuclear Cells Derived From Patients With Chronic Ischemic Heart Disease. Circulation 2004; 109; 1615-1622).
Поскольку продукция факторов роста и цитокинов стволовыми клетками при их трансплантации в поврежденные ткани является ключевым процессом, стимулирующим репарацию ткани, усиление этой продукции за счет генетической модификации может значительно повысить эффективность трансплантации стволовых клеток, было продемонстрировано в работе Yu YS, et al. AKT-modified autologous intracoronary mesenchymal stem cells prevent remodeling and repair in swine infarcted myocardium. Clin Med J. 2010 Jul; 123 (13): 1702-8, в которой модификация прогениторных клеток конструкциями с генами внутриклеточной сигнальной молекулы - Akt-киназы, регулирующей пролиферацию и апоптоз клеток, приводит к значительному повышению их способности восстанавливать миокард животных после инфаркта.
Генетическая модификация стволовых клеток генами факторов роста может решить проблему недостаточной эффективности генной и клеточной терапии. Клетки могут быть модифицированы in vitro вирусными конструкциями, что позволит избежать прямого введения этих конструкций в ткань. Продукция целевого белка - фактора роста - может быть измерена и необходимое количество клеток можно нарастить в культуре. Это дает возможность дозировать эффект, что практически невозможно при прямом введении генетических конструкций. Подбор генов для модификации клеток, так, чтобы их продукты обладали взаимодополняемым действием на патологический процесс, позволит усилить терапевтический эффект за счет использования смеси культур клеток, продуцирующих разные факторы роста. Ключевым моментом разработки такой технологии является выбор клеток, наиболее подходящих для генетической модификации и транплантации. Такие клетки должны быть относительно легко получаемы от пациента, должны хорошо модифицироваться наиболее безопасными вирусными конструкциями и должны благодаря своим свойствам усиливать эффекты тех факторов, которые они гиперпродуцируют.
Сегодня наибольшие перспективы в регенеративной медицине связываются с использованием мультипотентных мезенхимальных стромальных клеток (МСК) костного мозга и жировой ткани. Эти клетки способны дифференцироваться in vitro и in vivo в клетки сосудов, стимулировать рост сосудов и нервов за счет секреции широкого спектра факторов роста, цитокинов и протеаз. Эти клетки проявляют свойства перицитов, способствуя стабилизации кровеносных сосудов. Причем МСК из жировой ткани, обладая теми же свойствами, как и МСК из костного мозга, значительно легче получить из-за доступности жировой ткани в достаточно большом количестве при малоинвазивной и безболезненной процедуре ограниченной липосакции. Все эти свойства МСК жировой ткани делают их идеальным объектом для генетической модификации с целью повышения их секреторной активности и их регенеративных свойств.
Поскольку ключевым процессом восстановления структуры и функции тканей при ишемическом повреждении является восстановление их кровоснабжения за счет роста и ремоделирования сосудов, модификация различных прогениторных клеток конструкциями с геном основного фактора ангиогенеза - VEGF представляется наиболее предпочтительной для лечения ишемических повреждений тканей. Однако есть данные, показывающие, что гиперпродукция VEGF может приводить к развитию отеков тканей в результате формирования нестабильных незрелых «текучих» сосудов и в ряде случаев к развитию ангиом (Carmeliet P. VEGF gene therapy: stimulating angiogenesis or angioma-genesis. Nat Med. 2000; 6. - 1102-3).
Васкуляризация (рост сосудов) тканей - сложный многоступенчатый процесс, в котором участвуют многие факторы роста и типы клеток, и формирование зрелой функциональной сосудистой сети обеспечивается координированной экспрессией различных факторов. Так, при использовании прямой генной терапии плазмидой с геном тромбоцитарного фактора роста (PDGF-BB) в комбинации с FGF-2 удалось получить значительное усиление ангиогенного эффекта и формирования стабильных функциональных сосудов по сравнению с использованием только плазмиды с геном FGF-2 (Cao R, Brakenhielm E, Pawliuk R et al. Angiogenic synergism, vascular stability and improvement of hind-limb ischemia by a combination of PDGF-BB and FGF. Nat Med 2003; 9: 604-13).
Наиболее близким по технической сущности к заявляемым средству и способу является применение для стимуляции васкуляризации и репаративных процессов в миокарде после инфаркта с помощью генетически модифицированных МСК костного мозга, гиперэкспрессирующих VEGF, ген которого находится под гипоксическим промотером, то есть экспрессируется только в условиях гипоксии (Kim SH, et al. Hypoxia-inducible Vascular Endothelial Growth Factor-engineered Mesenchymal Stem Cells Prevent Myocardial Ischemic Injury. Mol Ther. 2011 Jan 18.) При этом симулировался рост сосудов и уменьшался размер инфаркта (некроза миокарда). Однако получение клеток из костного мозга сопряжено с болезненной и значительно более обременительной для больного процедурой пункции подвздошной кости, чем процедура ограниченной липосакции, которая используется для получения МСК из жировой ткани. Помимо этого значительное повышение продукции VEGF в микроокружении трансплантированных генетически модифицированных клеток может приводить к преимущественному развитию нестабильных незрелых и функционально неактивных сосудов, которые подвергаются обратному развитию, когда концентрация VEGF в ткани снижается (Ozawa CR, Banfi A, Glazer NL, et al. Microenvironmental VEGF concentration, not total dose, determines a threshold between normal and aberrant angiogenesis. J Clin Invest 2004; 113: 516-27). Это обусловливает недлительный временный эффект терапии, основанной на увеличении продукции только одного VEGF в ишемизированнх тканях (Kholova I, Koota S, Kaskenpää N, et al. Adenovirus-mediated gene transfer of human vascular endothelial growth factor-d induces transient angiogenic effects in mouse hind limb muscle. Hum Gene Ther. 2007 Mar; 18 (3): 232-44), а также может вызывать развитие отеков тканей, так как VEGF является наиболее мощным фактором, увеличивающим сосудистую проницаемость (Weis SM, Cheresh DA. Pathophysiological consequences of VEGF-induced vascular permeability. Nature. 2005 Sep 22; 437 (7058): 497-504). Все это диктует необходимость использования вместе с VEGF факторов, стабилизирующих сосуды, - снижающих сосудистую проницаемость и привлекающих перициты, гладко-мышечные клетки, образующие мышечный слой сосудистой стенки, и фибробласты. Поэтому сосуды остаются стабильными и после того, как концентрация VEGF в ткани уменьшается, что обеспечивает длительный эффект васкуляризации, приводящий к восстановлению структуры и функции тканей. Такими факторами являются ангиопоэтин-1, тромбоцитарный фактор роста-ВВ (PDFG-BB), факторы роста фибробластов (FGF), трансформирующий фактор роста-бета (TGF-beta). Все эти факторы по своему действию способствуют стабилизации сосудов, однако далеко не очевидным является то, что при увеличении их продукции в ишемизированных тканях вместе с увеличением продукции VEGF будет стимулироваться как рост сосудов, так и их стабилизация, так как некоторые их этих факторов в определенных условиях способны тормозить ангиогенез.
Задачей изобретения является разработка нового средства и способа лечения ишемических поражений тканей.
Технический результат заключается в ускорении васкуляризации и репарации ткани за счет создания комбинации генетически модифицированных клеток, гиперпродуцирующих два фактора роста, совместное действие которых приводит к формированию зрелой функциональной сосудистой сети, обеспечивающей более эффективное восстановление нарушенного кровоснабжения и структуры ткани, чем использование прямого введения немодифицированных клеток или модифицированных клеток, гиперпродуцирующих один фактор роста.
Поставленная задача решается тем, что средство для лечения ишемических поражений тканей представляет собой смесь из двух культур мезенхимальных стволовых клеток, одна из которых модифицирована генетической конструкцией, несущей ген фактора роста эндотелия сосудов (hVEGF), а другая - генетической конструкцией, несущей ген ангиопоэтина - 1 (ANGPT-1). В качестве генетической конструкции могут быть использованы рекомбинантный аденоассоциированный вирусный вектор или аденовирусный или лентивирусный вектор, а в качестве клеток - аутологичные или аллогенные клетки жировой ткани или костного мозга. Компоненты смеси взяты в соотношении 1÷0,5-3. Оптимальный результат достигается в случае, когда компоненты смеси взяты в соотношении 1÷1.
Поставленная задача также решается тем, что способ лечения ишемических поражений тканей включает введение в терапевтически приемлемом количестве в ишемизированные ткани средства, разведенного в растворе терапевтической культуральной среды, не содержащей сыворотки. При этом средство используют в концентрации от 3 до 100 млн клеток в 1 мл раствора среды путем обкалывания ишемизированной ткани.
Проведенные исследования показали, что наилучший результат достигается при использовании смеси культур модифицированных мезенхимальных стволовых (стромальных) клеток, гиперпродуцирующих ангиогенные факторы роста VEGF и ANGPT-1 в соотношениях 1:1, 1:2, 1:3, 2:1 и 3:1.
Способ лечения ишемических поражений тканей заключается во введении путем нескольких инъекций (обкалывания) прямо в ишемизированную ткань, например мышцы конечности или миокард, в культуральной среде, не содержащей сыворотки, смеси культур модифицированных мезенхимальных стволовых (стромальных) клеток, гиперпродуцирующих VEGF и ANGPT-1 в концентрациях от 3 до 100 млн клеток в 1 мл раствора, при этом количество точек для инъекций и используемое количество клеток зависит от размера ишемизированной области ткани.
Генетически модифицированные мезенхимальные стромальные клетки жировой ткани получали с помощью трансформации этих клеток рекомбинантным аденоассоциированным вирусным вектором 2 серотипа - AAV Helper-Free System (Stratagene, США), в который были встроены гены VEGF и ANGPT-1 человека.
Комплексное средство получали смешением культур клеток, продуцирующих VEGF и ANGPT-1, в соотношении количества клеток 1:1, 1:2, 1:3, 3:1, 2:1 и разведением в растворе стерильной терапевтической среды для мезенхимальных клеток до концентрации от 1 до 100 млн клеток в мл.
В качестве культуральной среды, в которой клетки будут вводиться в ткани, могут быть использованы коммерчески доступные терапевтические среды, не содержащие сыворотки, такие как AIM V® Serum Free Medium, INVITROGEN, USA; линейка терапевтических сред компании PAA_Therapeutics, USA; Advance STEM, HyClone, USA.
Изобретение поясняется чертежами.
На фиг.1 показано увеличение продукции VEGF и ANGPT-1 модифицированными клетками, оцененное по содержанию VEGF-165 и ANGPT-1 в кондиционированной среде интактных МСК жировой ткани (МСК ЖТ), МСК, модифицированных вирусом с геном маркерного белка GFP (GFP-MCK ЖТ) и МСК, модифицированных вирусом с геном VEGF-165 (VEGF-MCK ЖТ) (А) или с геном ANGPT-1 (ANGPT-1 - МСК ЖТ) (Б) (n=5). Данные показывают, что в модифицированных клетках продукция целевого белка - фактора роста - возрастает в десятки раз.
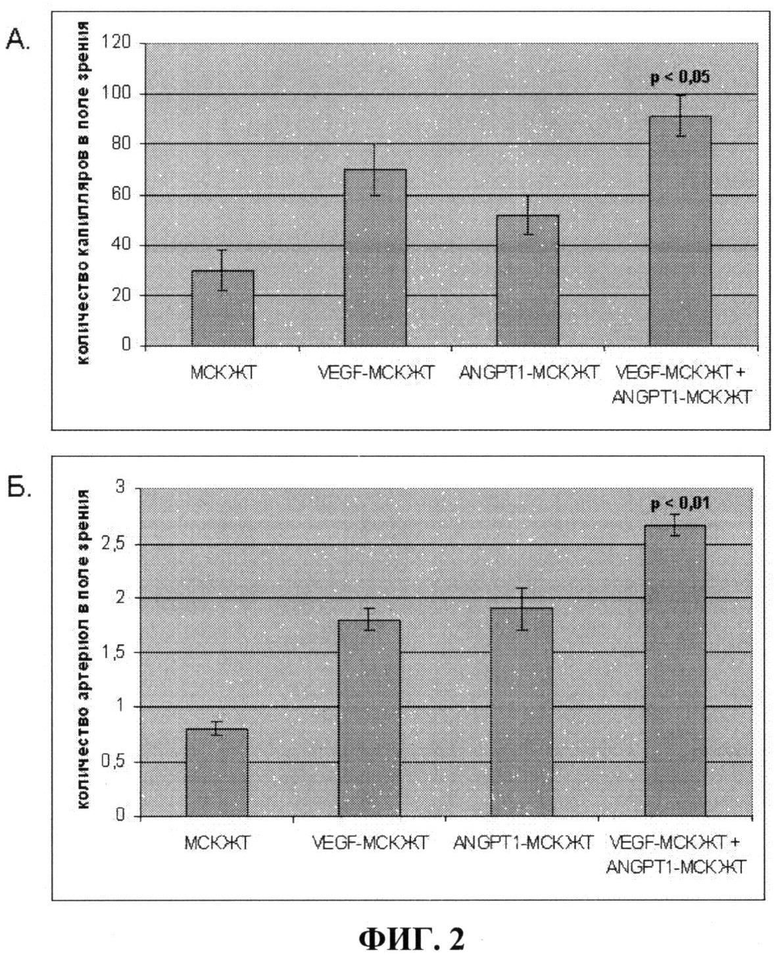
На фиг.2 показано количество капилляров (А) и артериол (Б) - зрелых сосудов, имеющих гладкомышечный слой, в имплантатах Матригеля под кожу мыши в случае введения: 1) Матригеля с немодифицированными клетками (МСК ЖТ); 2) Матригеля с клетками, гиперпродуцирующими VEGF (VEGF-MCK ЖТ); 3) Матригеля с клетками, гиперпродуцирующими ANGPT-1 (ANGPT-1 - МСК ЖТ); 4) Матригеля со смесью клеток, гиперпродуцирующих ANGPT -1 и VEGF (VEGF-MCK ЖТ+ANGPT-1 - МСК ЖТ). Из фиг.2 видно, что введение в подкожный имплантат Матригеля смеси клеток, гиперпродуцирующих VEGF и ANGPT-1 приводит к прорастанию в Матригель наибольшего количества сосудов, как капилляров, так и имеющих мышечную оболочку (стабильных сосудов) по сравнению с введением немодифицированных клеток и клеток, гиперпродуцирующих один из факторов (р<0,01), то есть наибольшая васкуляризация импланта Матригеля достигается за счет смеси клеток, продуцирующих VEGF и ANGPT 1.
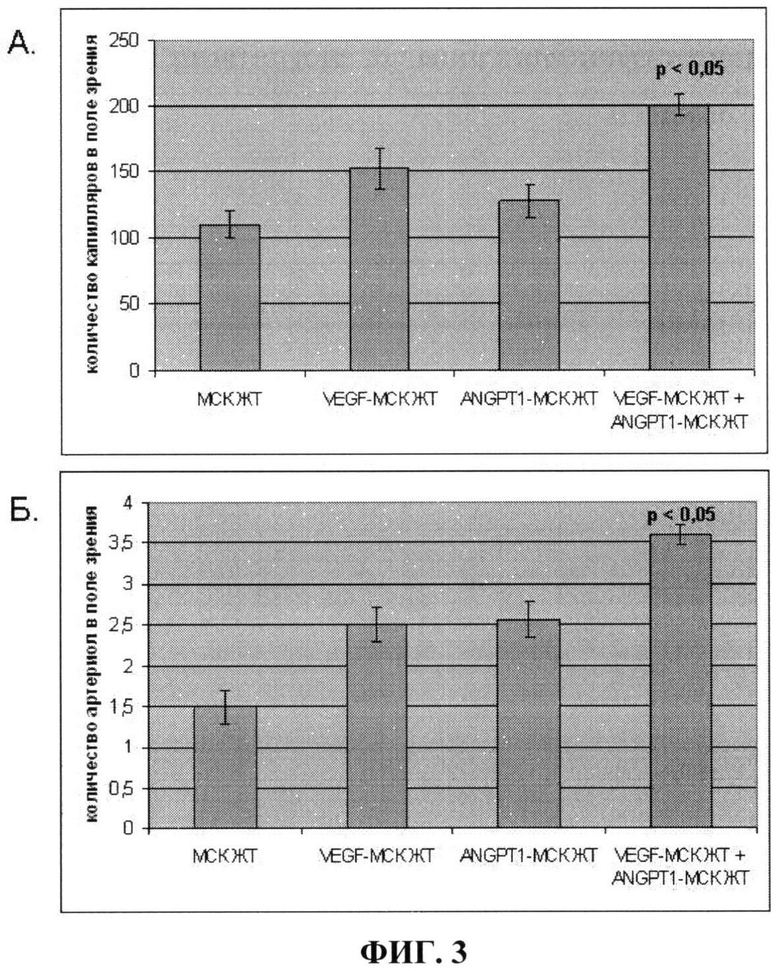
На фиг.3 показано количество капилляров (А) и артериол (Б) в мышцах ишемизированной задней конечности мыши после введения в них: 1) немодифицированных клеток (МСК ЖТ); 2) клеток, гиперпродуцирующих VEGF (VEGF-MCK ЖТ); 3) клеток, гиперпродуцирующих ANGPT-1 (ANGPT-1 - МСК ЖТ); 4) смеси в равных количествах клеток, гиперпродуцирующих ANGPT-1 и VEGF (VEGF-MCK ЖТ+ANGPT-1 - МСК ЖТ). Из фиг.3 видно, что внутримышечная трансплантация смеси клеток, гиперпродуцирующих VEGF и ANGPT-1, приводит к формированию большего количества стабильных сосудов, имеющих мышечную оболочку (р<0,05), чем трансплантация немодифицированных клеток или клеток, продуцирующих один из этих факторов.
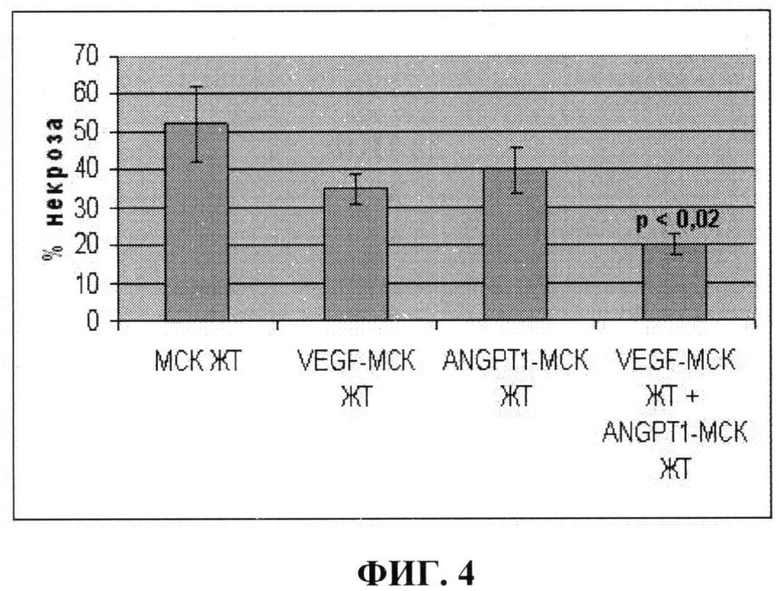
На фиг.4 показано уменьшение зоны некроза, отражающее репаративный процесс в ищемизированных мышцах задней конечности мыши, после введения: 1) немодифицированных клеток (МСК ЖТ); 2) клеток, гиперпродуцирующих VEGF (VEGF-МСК ЖТ); 3) клеток, гиперпродуцирующих ANGPT-1 (ANGPT-1 - МСК ЖТ); 4) смеси в равных количествах клеток, гиперпродуцирующих ANGPT -1 и VEGF (VEGF-MCK ЖТ+ANGPT-1 - МСК ЖТ). Из фиг.4 видно, что наиболее выраженное уменьшение зоны некроза в ишемизированной мышце задней конечности наблюдается при трансплантации смеси клеток, гиперпродуцирующих ANGPT-1 и VEGF (р<0,02). Увеличение эффективности восстановительных процессов достигается за счет использования смеси модифицированных клеток, продуцирующих ANGPT-1 и VEGF.
Методология проведения экспериментов и полученные результаты иллюстрируются следующими примерами.
Пример 1. Получение генетически модифицированных клеток и оценка продукции ими факторов роста. Для получения МСК ЖТ человека, гиперэкспрессирующих VEGF и ангиопоэтин-1, были созданы соответствующие аденоассоциированные вирусные векторы, кодирующие эти гены, для чего использовали векторную систему переноса генов на основе аденоассоциированного вируса 2-ого серотипа - AAV Helper-Free System (Stratagene, США). Продукцию рекомбинантных аденоассоциированных вирусов осуществляют в клетках линии НЕК-293Т, котрансфицированных плазмидами AAV-RC (кодирует вирусные гены, необходимые для репликации и инкапсидации вируса), pHelper (кодирует ген аденовируса) и векторной плазмидой pAAV-VEGF или pAAV-ANGPT-1 соответственно. Для получения векторных плазмид использовали оптимизированный ген VEGF 165 человека и оптимизированный ген ANGPT-1.
Для получения вируса, кодирующего маркерный ген зеленого флуоресцентного белка - GFP, клетки котрансфицировали плазмидами pAAV-RC, pHelper и pAAV-hrGFP (Stratagene). Для получения вируса, несущего ген VEGF 165 человека или ген ангиопоэтина-1 человека, вместо плазмиды pAAV-hrGFP использовали клонированные плазмиды pAAV-hVEGF и pAAV-hAng-1. Трансфекцию осуществляли при помощи кальций-фосфатного метода.
МСК человека выделяли из материала интактной подкожной жировой ткани, отсекаемой при проведении хирургических операций от пациентов старше 18 лет по модифицированной авторами методике Zuk et al. (Zuk, P.A., Zhu, M., Ashjian, P., et al. (2002) Human adipose tissue is a source of multipotent stem cells. Mol. Biol. Cell. 13, 4279-4295).
Для всех экспериментов используют МСК ЖТ не выше 4 пассажа. Для модификации МСК ЖТ рекомбинантным аденоассоциированным вирусом клетки 1-2 пассажа культивируют в среде AdvanceSTEM/10%GS. При достижении клетками 60-70% конфлюэнтного монослоя среду заменяют на AdvanceSTEM/1%GS, охлажденную до 4°С, и добавляют вирусный препарат из расчета 1-2 мл вирусного препарата на 400-600 тыс. клеток (одна чашка Петри диаметром 100 мм). Инкубируют клетки в течение 4-х часов при 37°С в СО2-инкубаторе, перемешивая среду каждые 30 мин. Далее к МСК ЖТ в среде AdvanceSTEM/1%GS/вирусный препарат добавляют равный объем среды AdvanceSTEM/20%GS и культивируют клетки без смены среды.
Эффективность модификации клеток конструкциями, несущими гены VEGF и ANGPT-1, оценивали по увеличению в кондиционированной среде продукта трансгена по сравнению с его содержанием в среде, кондиционированной немодифицированными клетками. Количественный анализ накопления продуктов трансгенов (VEGF и ангиопоэтина-1) в кондиционированных средах проводят методом иммуноферментного анализа с использованием соответствующих наборов реагентов Human VEGF Quantikine Kit (R&D Systems, США) и Human Angiopoetin-1 Quantikine Kit (R&D Systems, США) в строгом соответствии с протоколом производителей. При эффективной модификации МСК ЖТ вирусными конструкциями увеличение продукта трансгена в кондиционированной среде должно не менее чем в 10 раз превышать его содержание в кондиционированной среде немодифицированных клеток (фиг.1).
Пример 2. Анализ васкуляризации подкожного имплантата Матригеля (модель подкожного ангиогенеза). В данной работе использовали самцов иммунодефицитных мышей линии BALB/c NUDE (бестимусные мыши с дефицитом по Т-клеткам) в возрасте 8-10 недель. Все манипуляции с животными выполняли в соответствии с внутренними «Правилами проведения работ с использованием экспериментальных животных», утвержденными в ФГБУ «РКНПК» МЗ РФ в специальном чистом помещении под ламинаром. Для проведения эксперимента мышам линии BALB/c NUDE подкожно в область паха проводили инъекцию 400 мкл матригеля (Matrigel, BD Biosciences, США), смешанного со 100 мкл ФСБ или 100 мкл суспензии клеток (5×105 клеток). Через 14 дней после начала эксперимента извлекали имплантаты матригелей, помещали в кюветы со средой О.С.Т. Tissue-Tek (Sakura, Япония) и замораживали в жидком азоте.
Образцы имплантантов матригелей замораживали в жидком азоте в среде О.С.Т. Tissue-Tek (Sakura, Япония). Образцы хранили при температуре - 70°С. Гистологический анализ проводили на замороженных срезах толщиной 7-10 мкм. Для визуализации сосудов, прорастающих в Матригель, использовали окрашивание антителами против гладкомышечного актина мыши (SMA) (FITC-SMA, 1:100, Sigma-Aldrich, США) для визуализации сосудов с мышечной облочкой и немеченые крысиные антитела против CD31 мыши (анти-CD31, 1:100, BD Biosciences, США) для визуализации всех сосудов.
Препараты анализировали при помощи микроскопа Axiovert 200M (Zeiss, Германия). Документирование изображений и последующую их обработку производили с помощью цифровой видеокамеры Axiocam HRC (Zeiss, Германия) в программах Axiovision 3.1 (Zeiss, Германия), MetaMorph 7.1.0.0 (Universal Imaging Corporation, США). Для каждого среза образцов матригеля с помощью цифровой фотокамеры получали серию случайных снимков, охватывающих более 80% поверхности среза, на которых проводили морфомерические исследования с последующей статистической обработкой данных.
Полученные результаты приведены на фиг.2.
Пример 3. Модель ишемии задней конечности мыши. Для оценки терапевтического потенциала МСК ЖТ, гиперсекретирующих факторы роста и цитокины, использовали модель ишемии задней конечности мыши, описанную ранее в работе Couffinhal Т. с соавт. (Couffinhal Т., Silver M., Zheng L.P., et al. Mouse model of angiogenesis. Am J Pathol. 1998; 152 (6): 1667-79), разработанную для линии мышей C57b1. В экспериментах использовали линию мышей BALB/c Nude, признанную приемлемым объектом для изучения ангиогенного потенциала человеческих клеток при трансплантации. Однако эта линия мышей характеризуется слабым развитием коллатеральных сосудов по сравнению с линией C57b1 (Mac Gabhann F., Peirce S.M. Collateral capillary arterialization following arteriolar ligation in murine skeletal muscle. Microcirculation. 2010; 17 (5): 333-47; Chalothom D., Faber J.E. Strain-dependent variation in collateral circulatory function in mouse hindlimb. Physiol Genomics. 2010; 42 (3): 469-79), поэтому индуцированная иссечением бедренной артерии ишемия у BALB/c мышей приводит к обширному некрозу тканей и потере конечности. В связи с этим модель была модифицирована нами для BALB/c мышей путем замены иссечения a.Femoralis на ее перевязку, что позволило достаточно эффективно снизить кровоток в конечности, но не приводит к высоким ампутациям, в связи с чем стала возможна оценка пролиферации сосудов и доли некроза мышц. Мышей вводили в наркоз с помощью интраперитонеальной инъекции 300 мкл 2,5% раствора авертина. Операцию проводили под стереомикроскопом Olympus SZX16 (Olympus, Япония). В левой бедренной области мыши выполняли разрез по линии проекции a.femoralis. Бедренную артерию выделяли на протяжении ее дистальной части и перевязывали шелковой нитью 6-0 проксимальнее точки подколенной бифуркации с сохранением интактных v.femoralis и n.ischiadicus. Рану ушивали атравматической иглой (шелк 4-0) непрерывным швом, кожу стерилизовали 70% этанолом и помещали животное в отдельную клетку до полного выхода из наркоза.
Культуры клеток ресуспендировали в 0.15 мл фосфатно-солевого буфера или культуральной бессывороточной среды вводили в количестве 5×105 клеток на животное в 3 точки в ишемизированные мышцы конечности m.tibialis anterior, m.gastrocnemius и m.biceps femoris.
Образцы мышц выделяли на 21 день после операции и замораживали в жидком азоте в среде О.С.Т. Tissue-Tek (Sakura, Япония). Образцы хранили при температуре - 70С. Гистологический анализ проводили на замороженных срезах толщиной 7-10 мкм. Срезы мышечной ткани для визуализации сосудов используя первично-меченые антитела против гладкомышечного актина мыши (SMA) (FITC-SMA, 1:100, Sigma-Aldrich, США) и немеченые крысиные антитела против CD31 мыши (анти-CD31, 1:100, BD Biosciences, США). Ядра клеток окрашивали при помощи ядерного красителя DAPI в течение 10 мин, после чего препараты промывали буфером ФСБ, заключали в среду Aqua polymount (Polysciences inc, США) и накрывали покровными стеклами. Для визуализации области некроза срезы мышечной ткани окрашивали гематоксилином-эозином.
Препараты анализировали при помощи микроскопа Axiovert 200M (Zeiss, Германия). Документирование изображений и последующую их обработку производили с помощью цифровой видеокамеры Axiocam HRC (Zeiss, Германия) в программах Axiovision 3.1 (Zeiss, Германия), MetaMorph 7.1.0.0 (Universal Imaging Corporation, США). Для каждого среза m.tibialis anterior с помощью цифровой фотокамеры получали серию случайных снимков, охватывающих более 80% поверхности среза, на которых проводили морфометрические исследования с последующей статистической обработкой данных.
Результаты, представленные на фиг.3 и фиг.4, показывают, что введение в ишемизированные мышцы задней конечности мыши смеси клеток, продуцирующих VEGF и ANGPT-1, позволяет достичь лучшей васкуляризации ишемизированной ткани за счет большего количества образующихся стабильных сосудов, имеющих мышечный слой, чем введение немодифицированных клеток или клеток, продуцирующих один их этих факторов. При этом наблюдается наиболее значительное уменьшение зоны некроза мышц, что свидетельствует о более выраженных восстановительных процессах.
Данные представлены в формате среднее значение ± стандартное отклонение. Статистическую обработку результатов выполняли при помощи пакета Statsoft Statistica 6.0. Использовали t-критерий Стьюдента или U-критерий Манна-Уитни для выборок с Гауссовым или непараметрическим распределением величин соответственно. Значимыми считали отличия с р<0,05.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОЦЕНКИ АНГИОГЕННОГО ПОТЕНЦИАЛА ПРОГЕНИТОРНЫХ КЛЕТОК У БОЛЬНЫХ СЕРДЕЧНО-СОСУДИСТЫМИ ЗАБОЛЕВАНИЯМИ | 2011 |
|
RU2548801C2 |
| СПОСОБ СТИМУЛЯЦИИ РЕГЕНЕРАТИВНЫХ ПРОЦЕССОВ В ИШЕМИЗИРОВАННЫХ ТКАНЯХ | 2011 |
|
RU2497529C2 |
| СПОСОБ ПОВЫШЕНИЯ АНГИОГЕННОГО ПОТЕНЦИАЛА МЕЗЕНХИМАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК ЖИРОВОЙ ТКАНИ | 2010 |
|
RU2443778C1 |
| СПОСОБ ПОВЫШЕНИЯ АНГИОГЕННОЙ АКТИВНОСТИ СТРОМАЛЬНЫХ КЛЕТОК ЖИРОВОЙ ТКАНИ | 2011 |
|
RU2531502C2 |
| СПОСОБ ПОЛУЧЕНИЯ СРЕДСТВА ДЛЯ СТИМУЛЯЦИИ РЕГЕНЕРАЦИИ НА ОСНОВЕ ПРОДУКТОВ СЕКРЕЦИИ МУЛЬТИПОТЕНТНЫХ МЕЗЕНХИМНЫХ СТРОМАЛЬНЫХ КЛЕТОК ЧЕЛОВЕКА | 2015 |
|
RU2620167C1 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ОЖОГОВ И РАН НА ОСНОВЕ ЦИТОКИНОВ И ФАКТОРОВ РОСТА, СЕКРЕТИРУЕМЫХ МЕЗЕНХИМНЫМИ КЛЕТКАМИ ЧЕЛОВЕКА, СПОСОБ ПОЛУЧЕНИЯ СРЕДСТВА И СПОСОБ ЛЕЧЕНИЯ ОЖОГОВ И РАН | 2014 |
|
RU2574017C1 |
| КОСМЕТИЧЕСКОЕ СРЕДСТВО НА ОСНОВЕ ПРОДУКТОВ СЕКРЕЦИИ МЕЗЕНХИМНЫХ СТВОЛОВЫХ/СТРОМАЛЬНЫХ КЛЕТОК ЖИРОВОЙ ТКАНИ ЧЕЛОВЕКА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2016 |
|
RU2620342C1 |
| ЛЕЧЕНИЕ ЗАБОЛЕВАНИЯ ПЕРИФЕРИЧЕСКИХ СОСУДОВ ПРИ ПОМОЩИ КЛЕТОК, ПОЛУЧЕННЫХ ИЗ ТКАНИ ПУПОВИНЫ | 2011 |
|
RU2576836C2 |
| Способ оценки ранозаживляющего потенциала популяции мезенхимальных стволовых клеток и родственные способы отбора мезенхимальных стволовых клеток и идентификации ткани в качестве исходного материала для продуцирования популяции мезенхимальных стволовых клеток | 2020 |
|
RU2827447C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЛЕКАРСТВЕННОГО ПРЕПАРАТА НА ОСНОВЕ ВЕЗИКУЛ КЛЕТОК ЧЕЛОВЕКА | 2015 |
|
RU2605853C1 |
Изобретение относится к области биотехнологии, конкретно к средству для лечения ишемических поражений тканей, представляющему собой смесь с соотношением 1÷0,5-3 из двух культур мезенхимальных стволовых клеток, одна из которых модифицирована генетической конструкцией на основе вирусного вектора, обеспечивающего гиперпродукцию фактора роста эндотелия сосудов, а другая модифицирована генетической конструкцией на основе вирусного вектора, обеспечивающего гиперпродукцию ангиопоэтина, а также способу лечения ишемических поражений тканей посредством обкалывания ишемезированной ткани, и может быть использовано в медицине. Изобретение позволяет достичь эффективной васкуляризации и репарации ишемизированной ткани. 2 н. и 2 з.п. ф-лы, 4 ил., 3 пр.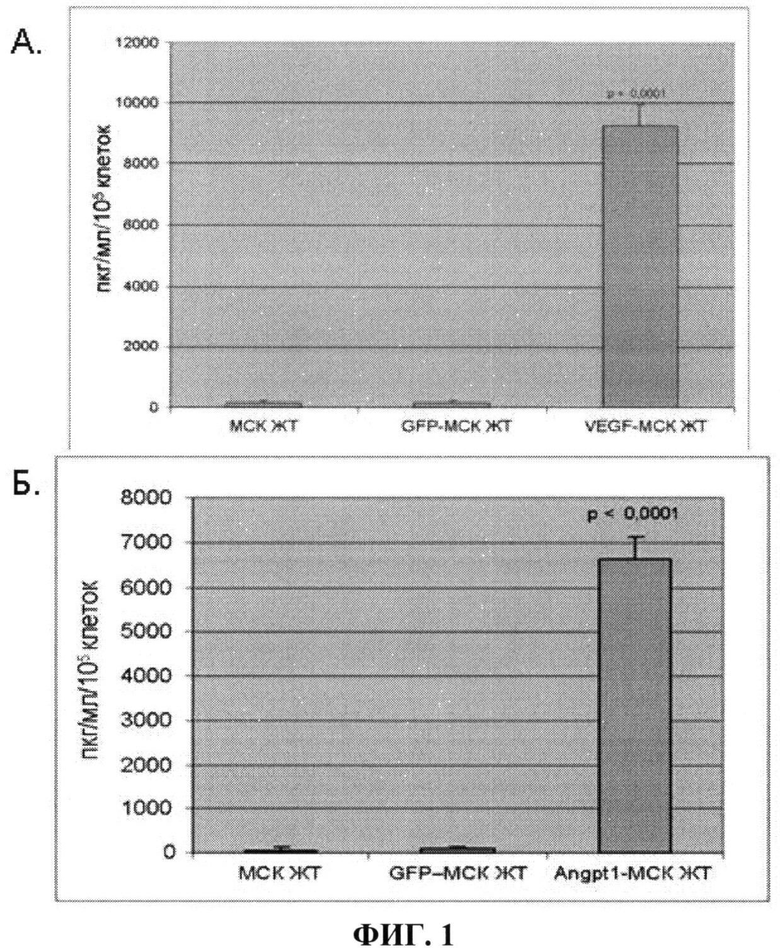
1. Средство для лечения ишемических поражений тканей, представляющее собой смесь из двух культур мезенхимальных стволовых клеток, одна из которых модифицирована генетической конструкцией на основе вирусного вектора, обеспечивающего гиперпродукцию фактора роста эндотелия сосудов, а другая - модифицирована генетической конструкцией на основе вирусного вектора, обеспечивающего гиперпродукцию ангиопоэтина, при этом компоненты смеси взяты в соотношении 1÷0,5-3 в эффективном количестве.
2. Средство по п.1, характеризующееся тем, что в качестве клеток использованы аутологичные или аллогенные мезенхимальные стволовые клетки жировой ткани или костного мозга.
3. Средство по п.1, характеризующееся тем, что компоненты смеси взяты в соотношении 1÷1.
4. Способ лечения ишемических поражений тканей, включающий введение в терапевтически приемлемом количестве в ишемизированные ткани средства по п.1, разведенного в растворе культуральной терапевтической среды, не содержащей сыворотки животных, при этом средство используют в концентрации от 3 до 100 млн клеток в 1 мл культуральной среды посредством обкалывания ишемизированной ткани.
| ПРИМЕНЕНИЕ КОМПОЗИЦИИ, СОСТОЯЩЕЙ ИЗ КОНЦЕНТРИРОВАННОЙ КЛЕТОЧНОЙ ПОПУЛЯЦИИ, ПРЕДСТАВЛЯЮЩЕЙ СОБОЙ СТВОЛОВЫЕ КЛЕТКИ И НЕДИФФЕРЕНЦИРОВАННЫЕ КЛЕТКИ-ПРЕДШЕСТВЕННИКИ | 2004 |
|
RU2372924C2 |
| RU 2009139207 A, 27.05.2011 | |||
| KIM S.H | |||
| et al., Hypoxia-inducible vascular endothelial growth factor-engineered mesenchymal stem cells prevent myocardial ischemic injury, Mol Ther., 2011, v.19,n.4,p | |||
| ПЕРЕДВИЖНОЕ ДРОВОПИЛЬНО-ДРОВОКОЛЬНОЕ УСТРОЙСТВО | 1923 |
|
SU741A1 |
| RUBINA K | |||
| ET AL., Adipose stromal cells stimulate angiogenesis via promoting progenitor cell differentiation, | |||
Авторы
Даты
2014-07-20—Публикация
2012-10-08—Подача