Изобретение относится к области микробиологической промышленности и представляет собой штамм-продуцент секретируемого фермента эндо-(1-4)-бета-ксиланазы Penicillium canescens (далее Р.canescens), сконструированный методами трансформации и генетической инженерии.
Эндоксиланазы расщепляют ксилан - основной компонент гемицеллюлез. В этой связи эндоксиланазы представляют большой интерес как в промышленном, так и прикладном биотехнологическом аспекте. Эндоксиланазы находят промышленное применение в бумажной индустрии в процессах отбеливания, в пищевой и кормовой промышленности и других сферах (FEMS Microbiology Reviews, 1999, v.23, p.411). Известны различные грибные продуценты эндоксиланаз: Trichoderma reesi, Trichoderma harzianum, (J Biotechnol, 1997, 57 (1-3):137.), Thermoascus auranticus, (патент США 4966850); Aspergillus tubigensis (патент США 5358864), Humicola insolens (патент США 5610048).
В качестве ближайшего аналога заявляемого изобретения рассмотрим штамм гриба Р.canescens ВКПМ F-832, являющийся продуцентом секретируемой эндо-(1-4)-бета-ксиланазы (патент РФ № 2197526).
Этот штамм накапливает до 770 единиц активности секретируемой эндо-(1-4)-бета-ксиланазы в 1 мл культуральной жидкости.
Недостатком штамма ВКПМ F-832 является наличие у него сателлитной целлюлолитической активности (1.4 ед/мл), которая сдерживает использование ферментного препарата ксиланазы на основе этого штамма.
Задача настоящего изобретения - получить штамм гриба Р.canescens - продуцент секретируемой эндо-(1-4)-бета-ксиланазы с пониженным уровнем целлюлолитической активности.
Для решения задачи сконструирован штамм гриба Р.canescens XYL-dEGL - продуцирующий секретируемую эндо-(1-4)-бета-ксиланазу, который имеет делеции по структурным генам egl2 (ген эндоглюканазы семейства А целлюлаз, семейства 5 гликозил гидролаз) и egl3 (ген эндоглюканазы семейства Н целлюлаз, семейства 12 гликозил гидролаз) эндоглюканаз - фермента, проявляющего целлюлолитическую активность. Штамм депонирован во Всероссийской коллекции промышленных микроорганизмов (ВКПМ) под номером ВКПМ F-912.
Заявляемый штамм Р.canescens ВКПМ F-912 имеет следующие характеристики.
Культурально-морфологические признаки на различных питательных средах после 10 суток роста при 30°С.
На сусло-агаре, имеющем состав (в мас.%): сусло - 40, агар - 2, вода - остальное, штамм образует колонии диаметром 6.5-7.5 см, обратная сторона которых оранжево-темно-коричневая; конидиеносцы размером 430-450×3.0-3.2 мкм, конидии 2.0-2.2 мкм, шаровидные, в молодом возрасте гладкие, в старом - шероховатые, образуются в цепочках, соединяются в колонки, со временем распадающиеся.
На агаризованной среде Роулена-Тома с сахарозой, имеющей состав (в мас.%): сахароза - 2, кукурузный экстракт - 1, KH2РО4 - 0.2, K2SO4 - 0.02, MgSO4×7H2O - 0.02, агар - 2, смесь микроэлементов: MnSO4×5H2O - 0.008, CuSO4×5H2O - 0.04, ZnSO4×7H2O - 0.0088, Со(NO3)2×6Н2O - 0.01, FeSO4×7H2O - 0.1, Н3ВО3 - 0.006, (NH4)2MoO×4H2O - 0.03, CaCl - 0.1, вода - остальное, диаметр колоний 3.8-4.8 см, колонии войлочные или слабопушистые в центре, слабовыпуклые, с радиальными бороздками, белого цвета, по краям окрашены в серо-голубоватый тон, края неровные, лопастные, обратная сторона серо-бежевого тона.
На агаризованной среде Чапека с глюкозой, имеющей состав (в мас.%): NaNO3 - 0.2, KH2PO4 - 0.1, MgSO4×7H2O - 0.05, KCl - 0.05, FeSO4 - 0.001, глюкоза - 2, агар - 2, вода - остальное, диаметр колоний 2.8-4.0 см, колонии серые, складчатые, с ровным краем, конидиеобразование интенсивное, цвет конидий светло-серый. Обратная сторона колоний с радиальными складками слабо-кремового тона.
Физиолого-биохимические признаки.
Мезофил, растет при 25-37°С, оптимальная температура роста 29°С. Оптимум роста при значениях рН среды 4.1-5.8. Желатину разжижает слабо.
Отношение к источникам углерода. Хорошо усваивает моно-, ди- и полисахариды, за исключением арабинозы, которую утилизирует слабо.
Отношение к источникам азота. Хорошо усваивает аммонийный и нитратный азот, пептон, мочевину.
Ферментативная активность. Заявляемый штамм накапливает до 800 единиц активности секретируемой эндо-(1-4)-бета-ксиланазы и не более 0,13 единиц целлюлазной активности в 1 мл культуральной жидкости.
Изобретение проиллюстрировано следующими фигурами графического изображения:
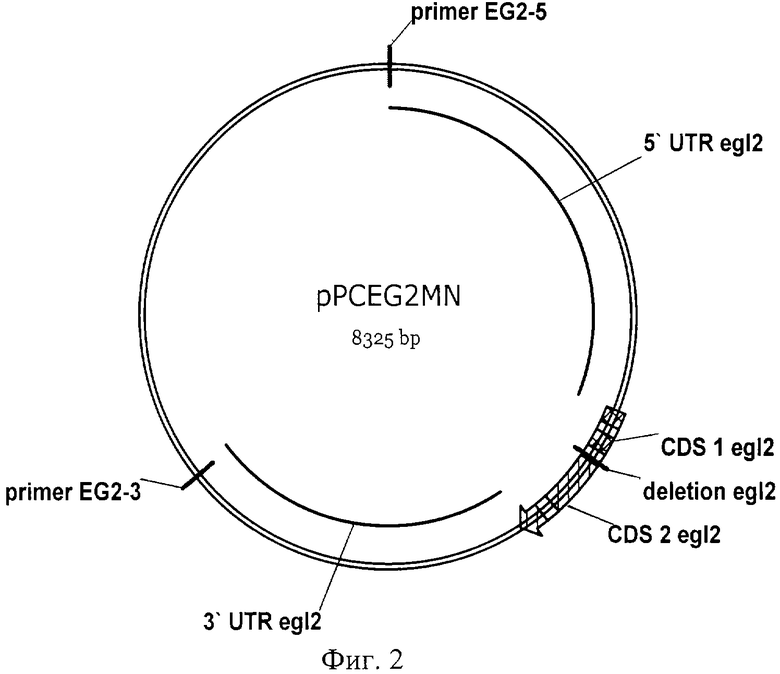
Фиг.1. Карта плазмиды pPCdelEG3niaD
Фиг.2. Карта плазмиды pPCEG2NM
Пример 1. Конструирование заявляемого штамма.
Штамм-реципиент Р.canescens PCA10 (Current Genetics, 1995, v.28, p.474) трансформируют (Биотехнология, 1999, N3, стр. 3-13) 1 мкг ДНК сконструированной нами плазмиды pPCdelEG3niaD (Фиг.1), содержащей 5'-нетранслируемую область гена egl3 P.canescens (5' UTP egl3), неполную кодурующую 5' область гена egl3 (CDS 1 egl3), ген нитратредуктазы (niaD) Aspergillus niger (Gene, 1992, v.111, p.149-155) в качестве селективного маркера, неполную кодурующую 3' область гена egl3 (CDS 2 egl3) и 3'-нетранслируемую область гена egl3 (3' UTP egl3) в плазмидном векторе pUC57 (Gene, 1985, v.33, p.103-119), линеаризованной по сайту рестрикции SmaI, и 10 мкг ДНК ПЦР-фрагмента сконструированной нами плазмиды pPCEG2NM (Фиг.2), включающей 5'-нетранслируемую область гена egl2 P.canescens (5' UTP egl2), неполную кодурующую 5' область гена egl2 (CDS I egl2), неполную кодирующую 3' область гена egl2 (CDS 2 egl2) и 3'-нетранслируемую область гена egl2 (3' UTP egl2) в плазмидном векторе pBluescript II KS(+) (Nucleic Acids Res., 1989, v.17, 9494), полученной с использованием пары праймеров:
EG2-5: 5'-TCATTTAAGCAGGGGTTGTCGGGTTTGTTAGATTC-3'
EG2-3: 5'-TCGGATTTCGAAATGCTTCCGTATGTATCATCAC-3'
Через 4-5 суток инкубации при 30°С проводят скрининг полученных котрансформантов на наличие делеций, используя ПЦР с конидий отдельных трансформантов.
Для идентификации штаммов с генотипом Δegl2 (делеция в гене egl2) проводят ПЦР с использованием пары праймеров:
EG2ID: 5'-ACCCTGAAAACCACTACAACTG-3';
EG2IR: 5'-GCTCTTGTATTTGGTCGCAA-3'.
Для идентификации штаммов с генотипом Δegl3 (делеция в гене egl3) проводят ПЦР с использованием пары праймеров:
EG3ID: 5'-TGGTCAAGGACAAAAGTCGA-3';
EG3IR: 5'-GGCGTACCAATCAAATACTGAG-3'
Анализ котрансформантов EG23-1 и EG23-5 с генотипом Δegl2, Δegl3 проводят, измеряя уровень ксиланазной и целлюлазной активности в культуральной жидкости при глубинном культивировании на среде со свекловичным жомом (как в примере 2). Результаты измерений представлены в Таблице 1.
Штамм EG23-1 выбран для дальнейших манипуляций, как имеющий меньшую целлюлазную активность при сохранении высокого уровня ксиланазной активности.
Для получения мутантов по гену нитратредуктазы (niaD), которые необходимы для амплификации структурного гена, кодирующего ксиланазу, 106 конидий штамма P.canescens EG23-1 обрабатывают нитрозогуанидином (0.4 мг/мл) 30 мин при 30°С и высевают на чашку с агаризованной минимальной средой (Биотехнология. 1999. N3. C.3-13), содержащей 0.45М хлората и в качестве единственного источника азота 10 мМ NH4Cl. Чашки инкубируют 4-5 суток при 30°С и выросшие колонии тестируют на чашках с агаризованной минимальной средой, с добавками в качестве единственного источника азота: а) - 10 мМ NaNO3; б) - 0.45М хлората, 10 мМ NH4Cl; в) - 5 мМ гипоксантина; г) - 10 мМ NH4Cl. У штаммов, отобранных по способности к росту на средах с хлоридом аммония, хлоратом и гипоксантином и отсутствию способности к росту на средах с NaNO3 определяют их ксиланазные и целлюлазные активности методом, приведенным в примере 2. Среди них селектируют штаммы с продуктивностью ксиланаз и целлюлаз, близкой к штамму EG23-1. В результате получают штамм EG23-1/niaD.
Заявляемый штаммм P.canescens ВКПМ F-912 - продуцент эндо-(1-4)-β-ксиланазы, содержащий делеции Δegl2, Δegl3, получают путем введения дополнительных копий гена xylA. эндо-(1-4)-β-ксиланазы P.canescens (Appl. Biochem. MicrobioL, 2002, v.38(5), p.495-501) в штамм EG23-1/niaD с помощью котрансформации плазмидой pPCXYLA (Патент РФ № 21197526), несущей ген xylA P.canescens, с трансформирующей плазмидой pSTA-10 (Gene, 1989, v.78, p.157), содержащей селективный ген нитратредуктазы niaD Aspergillus niger.
Пример 2. Оценка ферментативной активности заявляемого штамма.
Посевной материал получают путем культивирования штамма P.canescens ВКПМ F-912 на агаризованной среде Роулен-Тома (см. Пример 1) при 30°С в течение 5-7 суток. Затем водной суспензией полученных таким образом конидий (107 конидий/мл) инокулируют 100 мл пектинсодержащей среды следующего состава (мас.%): свекловичный жом - 3, пептон - 5, КН2PO4 - 2.5, вода - остальное.
Культивирование проводят на круговой качалке при 240-250 об/мин в качалочных колбах на 750 мл при 30°С в течение 120 часов. По окончании ферментации культуральную жидкость отделяют от мицелия и твердых остатков среды центрифугированием (10000 g, 15 мин) и в супернатанте определяют ксиланазную и целлюлазную активности.
Активность ксиланазы определяют по количеству восстанавливающих сахаров, выделяемых при гидролизе ксилана из лиственницы. Инкубацию субстрата и фермента проводят при 50°С в течение 10 мин. Проба включает 0.45 мл 1% раствора ксилана в 0.1 М ацетатном буферном растворе (рН 5.0) и 0.05 мл фермента в соответствующем разведении. За единицу активности принимают количество фермента, высвобождающее 1 мкмоль/мин восстанавливающих сахаров при указанных выше условиях. Восстанавливающие сахара определяют методом Шомоди-Нельсона (J.Biol.Chem. 1952. V.195. N1. P.19-28, J. Biol. Chem. 1944. V.153. P.375-380).
Для определения активности целлюлаз используют окрашенную карбоксиметилцеллюлозу (CMC ОС-41). Приготовляют 1% раствор CMC ОС-41 в 0.1 М ацетатном буфере, рН 4.5. К 0.25 мл этого раствора добавляют 0.15 мл 0.1М ацетатного буфера (рН 4.5), и прогрвают 5 мин при 40°С. Добавляют 0.1 мл прогретого 5 мин при 40°С, разведенного в том же буфере, образца. Инкубируют 10 мин при 40°С, затем добавляют 1 мл 1 М раствора CaCl в 80% этаноле. Суспензию центрифугируют (3000 g, 5 мин) и измеряют оптическую плотность надосадочной жидкости при 490 нм против "слепой" пробы. Приготовление "слепой" пробы осуществляют так же, как испытуемого образца, но пропускают инкубирование в течение 10 мин при 40°С.
Активность (ед/мл) = 0.611×OD490×5×R/t;
где:
0.611 - корреляционный коэффициент;
5 - разведение образца в реакционной смеси;
OD490 - оптическая плотность при 490 нм;
t - время инкубации;
R - первоначальное разведение образца.
Заявляемый штамм гриба P.canescens ВКПМ F-912 в описанных выше условиях проявляет ксиланазную активность 800 ед/мл и целлюлазную активность 0.13 ед/мл.
| название | год | авторы | номер документа |
|---|---|---|---|
| ГЕНЕТИЧЕСКАЯ КОНСТРУКЦИЯ ДЛЯ ОБЕСПЕЧЕНИЯ ЭКСПРЕССИИ ЦЕЛЕВЫХ ГОМОЛОГИЧНЫХ И ГЕТЕРОЛОГИЧНЫХ ГЕНОВ В КЛЕТКАХ МИЦЕЛИАЛЬНОГО ГРИБА PENICILLIUM VERRUCULOSUM, ИСПОЛЬЗУЕМОГО В КАЧЕСТВЕ ХОЗЯИНА, СПОСОБ ПОЛУЧЕНИЯ ШТАММА ГРИБА PENICILLIUM VERRUCULOSUM И СПОСОБ ПОЛУЧЕНИЯ ФЕРМЕНТНОГО ПРЕПАРАТА | 2008 |
|
RU2378372C2 |
| ФРАГМЕНТ ДНК МИЦЕЛИАЛЬНОГО ГРИБА PENICILLIUM VERRUCULOSUM, КОДИРУЮЩИЙ СИНТЕЗ СЕКРЕТИРУЕМОЙ ЭНДОГЛЮКАНАЗЫ III И ГРУППА ШТАММОВ PENICILLIUM CANESCENS, СИНТЕЗИРУЮЩИХ ЭНДОГЛЮКАНАЗУ III PENICILLIUM VERRUCULOSUM, СКОНСТРУИРОВАННЫХ МЕТОДАМИ ТРАНСФОРМАЦИИ И ГЕНЕТИЧЕСКОЙ ИНЖЕНЕРИИ НА ОСНОВЕ ЭТОГО ФРАГМЕНТА ДНК | 2001 |
|
RU2238974C2 |
| СПОСОБ ПОЛУЧЕНИЯ КОРМОВОГО КОМПЛЕКСНОГО ФЕРМЕНТНОГО ПРЕПАРАТА (ВАРИАНТЫ) И ШТАММ PENICILLIUM CANESCENS (ВАРИАНТЫ) | 2004 |
|
RU2288267C2 |
| ФРАГМЕНТ ДНК РСХ-302, КОДИРУЮЩИЙ СИНТЕЗ СЕКРЕТИРУЕМОЙ ЭНДО-(1-4)-БЕТА-КСИЛАНАЗЫ PENICILLIUM CANESCENS И ШТАММ ГРИБА PENICILLIUM CANESCENS - ПРОДУЦЕНТ СЕКРЕТИРУЕМОЙ ЭНДО-(1-4)-БЕТА-КСИЛАНАЗЫ | 2001 |
|
RU2197526C1 |
| ШТАММ ГРИБА Penicillium verruculosum B10 EGII ПРОДУЦЕНТ ЭНДО-1.3/1.4-β-ГЛЮКАНАЗЫ, ЦЕЛЛЮЛАЗЫ, β-ГЛЮКОЗИДАЗЫ И КСИЛАНАЗЫ И СПОСОБ ПОЛУЧЕНИЯ КОРМОВОГО КОМПЛЕКСНОГО ФЕРМЕНТНОГО ПРЕПАРАТА | 2012 |
|
RU2532840C2 |
| ШТАММ ГРИБА PENICILLIUM VERRUCULOSUM ПРОДУЦЕНТ КОМПЛЕКСА ФИТАЗЫ А И ЭНДО-1,4-β-ГЛЮКАНАЗЫ II И ФЕРМЕНТНЫЙ ПРЕПАРАТ НА ЕГО ОСНОВЕ ДЛЯ ИСПОЛЬЗОВАНИЯ В КАЧЕСТВЕ ДОБАВКИ В КОРМАХ | 2022 |
|
RU2810538C2 |
| ГЕНЕТИЧЕСКАЯ ФЬЮЖН-КОНСТРУКЦИЯ ДЛЯ ОБЕСПЕЧЕНИЯ ЭКСПРЕССИИ МУЛЬТИФЕРМЕНТНОГО КОМПЛЕКСА КАРБОГИДРАЗ В КЛЕТКАХ МИЦЕЛИАЛЬНОГО ГРИБА Penicillium verruculosum, ИСПОЛЬЗУЕМОГО В КАЧЕСТВЕ ХОЗЯИНА, СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО ШТАММА ГРИБА Penicillium verruculosum И СПОСОБ ПОЛУЧЕНИЯ ФЕРМЕНТНОГО ПРЕПАРАТА НА ЕГО ОСНОВЕ | 2013 |
|
RU2550044C2 |
| РЕКОМБИНАНТНЫЙ ШТАММ МИЦЕЛИАЛЬНОГО ГРИБА PENICILLIUM CANESCENS CL14, ПРОДУЦИРУЮЩИЙ КОМПОНЕНТ ЦЕЛЛЛЮЛОСОМЫ CLOSTRIDIUM THERMOCELLUM, И СПОСОБ ЕГО КУЛЬТИВИРОВАНИЯ | 2016 |
|
RU2646132C1 |
| КЛЕТКА МИЦЕЛИАЛЬНОГО ГРИБА Penicillium canescens - ПРОДУЦЕНТ КСИЛАНАЗЫ И ЛАККАЗЫ, СПОСОБ ПОЛУЧЕНИЯ КОМБИНИРОВАННОГО ФЕРМЕНТНОГО ПРЕПАРАТА КСИЛАНАЗЫ И ЛАККАЗЫ | 2012 |
|
RU2538149C2 |
| РЕКОМБИНАНТНЫЙ ШТАММ МИЦЕЛИАЛЬНОГО ГРИБА PENICILLIUM VERRUCULOSUM ( ВАРИАНТЫ) И СПОСОБ ПОЛУЧЕНИЯ ФЕРМЕНТНОГО ПРЕПАРАТА С ЕГО ИСПОЛЬЗОВАНИЕМ (ВАРИАНТЫ) | 2015 |
|
RU2646136C2 |
Изобретение относится к биотехнологии, в частности к генетической инженерии. Штамм гриба Penicillium canescens ВКПМ F-912 является продуцентом секретируемой эндо-(1-4)-бета-ксиланазы с удаленными генами эндоглюканаз. Данный штамм за 120-144 часов ферментации на средах со свекловичным жомом позволяет накапливать до 800 единиц активности секретируемой эндо-(1-4)-бета-ксиланазы и не более 0.13 единиц целлюлазной активности в 1 мл культуральной жидкости. 2 ил., 1 табл.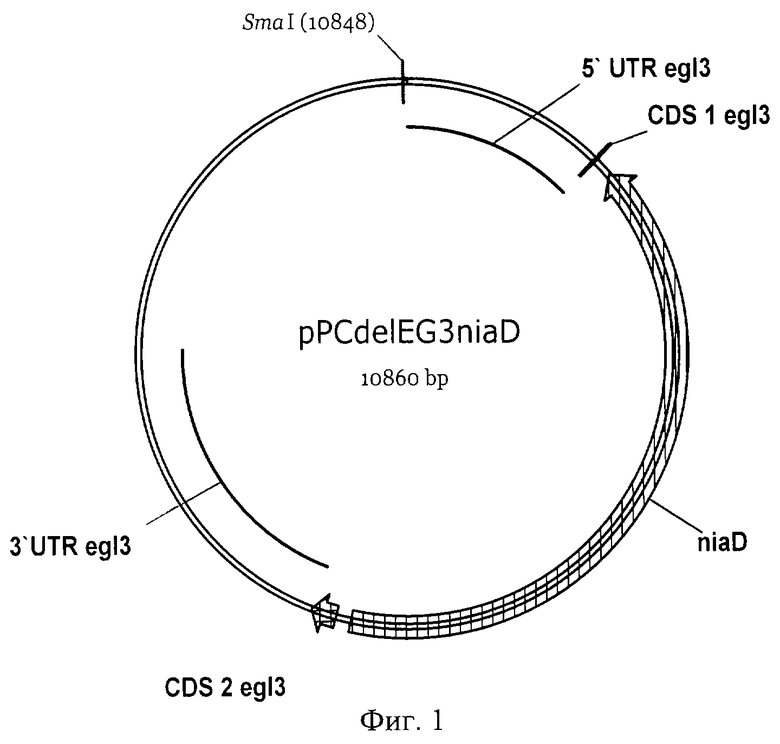
Штамм гриба Penicillium canescens ВКПМ F-912 - продуцент секретируемой эндо-(1-4)-бета-ксиланазы.
| ФРАГМЕНТ ДНК РСХ-302, КОДИРУЮЩИЙ СИНТЕЗ СЕКРЕТИРУЕМОЙ ЭНДО-(1-4)-БЕТА-КСИЛАНАЗЫ PENICILLIUM CANESCENS И ШТАММ ГРИБА PENICILLIUM CANESCENS - ПРОДУЦЕНТ СЕКРЕТИРУЕМОЙ ЭНДО-(1-4)-БЕТА-КСИЛАНАЗЫ | 2001 |
|
RU2197526C1 |
| ФРАГМЕНТ ДНК PCG 2,6, КОДИРУЮЩИЙ СИНТЕЗ СЕКРЕТИРУЕМОЙ БЕТА-ГАЛАКТОЗИДАЗЫ PENICILLIUM CANESCENS, И ШТАММ ГРИБА PENICILLIUM CANESCENS - ПРОДУЦЕНТ СЕКРЕТИРУЕМОЙ БЕТА-ГАЛАКТОЗИДАЗЫ | 1997 |
|
RU2126049C1 |
Авторы
Даты
2007-02-10—Публикация
2006-02-27—Подача