Изобретение относится к области биотехнологии и микробиологической промышленности, представляет собой способ получения кормового комплексного ферментного препарата с высокой эндо-1,3/1,4-β-глюканазной активностью путем культивирования рекомбинантного штамма Penicillium verruculosum - продуцента гомологичной эндо-1,3/1,4-β-глюканазы.
Эндо-1,3/1,4-β-глюканаза является одним из ключевых кормовых ферментов и гидролизует β-глюканы - некрахмальные полисахариды клеточной стенки зерна злаковых (ржи, овса, ячменя), за счет чего улучшается доступ пищеварительных ферментов животных и птиц к питательным компонентам корма. При этом уменьшается вязкость кормовой массы и облегчается ее прохождение через желудочно-кишечный тракт животных. Пищеварительные ферменты животных и птиц не содержат целлюлолитических ферментов, участвующих в расщеплении целлюлозы - основного некрахмального полисахарида растительной клеточной стенки. Наличие длинных неперевариваемых молекул целлюлозы значительно снижает питательную ценность кормов и ухудшает процессы всасывания в кишечнике. Некоторые грибные эндо-1,3-β-глюканазы расщепляют не только 1,3-β-, но и 4-β-глюкозидные связи, проявляя также и целлюлазную активность, и, следовательно, участвуют в расщеплении целлюлозы. В результате этого улучшается доступ пищеварительных ферментов сельскохозяйственных животных к основным питательным компонентам корма - крахмалу и белку, - и значительно повышается усвояемость кормов.
Современные кормовые ферментные препараты невозможно представить без наличия в них β-глюканазы, а также ксиланазы, пектинлиазы и других ферментов. Продуцентами этих ферментов являются, в основном, мицелиальные грибы. Известны патенты на различные виды и штаммы грибов, как природного происхождения, так и рекомбинантные штаммы, созданные с использованием генно-инженерных манипуляций. Природные штаммы не содержат чужеродной ДНК, не присущей изначально данному штамму, однако ферментный спектр у них не всегда идеальный для создания кормовых препаратов с заданными свойствами. Поэтому рекомбинантные штаммы грибов находят все большее применение в современной технологии производства кормовых добавок.
В последнее время повышенное внимание уделяется мультикопийным грибным продуцентам секретируемых ферментов, у которых продуктивность штаммов значительно повышалась за счет амплификации копий генов, кодирующих эти ферменты. Это относится и к кормовым ферментам. В качестве продуцентов β-глюканаз, используемых в качестве кормовых ферментов, заявлены культуры Trichoderma longibrachiatum (US Patent 5419778), Tr. reesei (WO Patent 94/28117), Humicola insolens (WO Patent 91/17243), Penicillium emersonii (US Patent 388072), Penicillium canescens (RU Патент 2288267), Penicillium funiculosum (RU Патент 2287570). Известны грибные продуценты ксиланаз - Aspergillus niger (US Patent 5358862), Tr. Reesei (Nevalainen et.al, US Patent 5298405), H.insolens (Schulein et al., 1997, US Patent 5610048).
Продуцентом целлюлаз и сопутствующих ферментов является штамм гриба Penicillium verruculosum, продуцирующий комплекс целлюлаз, ксиланаз и ксилоглюканаз для гидролиза целлюлозы и гемицеллюлозы (RU Patent 2361918).
Наиболее близкими по технической сущности к предлагаемому изобретению является патент RU №2378372 «Генетическая конструкция для обеспечения экспрессии целевых гомологичных и гетерологичных генов в клетках мицелиального гриба Penicillium verruculosum, используемого в качестве хозяина, способ получения штамма гриба Penicillium verruculosum и способ получения ферментного препарата».
Техническая задача, на решение которой направлено разработанное изобретение, - получение с помощью рекомбинантного штамма Penicillium verruculosum кормового комплексного ферментного препарата, обогащенного эндо-1,3/1,4-β-глюканазой и содержащего β-глюкозидазу, целлюлазу и ксиланазу.
Технический результат, который может быть получен при осуществлении изобретения, состоит в получении кормового комплексного ферментного препарата с высокой эндо-1,3/1,4-β-глюканазной активностью и содержащего также сопутствующие ферменты при культивировании нового мультикопийного штамма гриба Penicillium verruculosum продуцента гомологичной эндо-1,3/1,4-β-глюканазы.
Для получения указанного технического результата предлагается использовать новый мутантный штамм Penicillium verruculosum В10 с повышенной активностью β-1,4-глюкозидазы, синтезирующий также целлюлазы и ксиланазы, и генетическую конструкцию, обеспечивающую экспрессию гомологичного гена эндо-1,3/1,4-β-глюканазы в клетках грибного штамма Penicillium verruculosum В10, используемого в качестве хозяина.
Кроме того, для получения указанного технического результата предложено использовать способ получения ферментного препарата, обогащенного гомологичной эндо-1,3/1,4-β-глюканазой и содержащего сопутствующие ферменты β-глюкозидазу, целлюлазы и ксиланазы, путем культивирования указанного выше нового штамма гриба Penicillium verruculosum (B10 EGII), мультикопийного по гомологичному гену 1,3/1,4-β-глюканазы, на оптимизированной питательной среде в ферментерах с последующей фильтрацией, ультрафильтрацией и лиофилизацией культуральной жидкости.
Указанные варианты не исчерпывают возможности разработанного метода.
Разработка способа получения комплексного ферментного препарата, обогащенного эндо-1,3/1,4-β-глюканазой, осуществляется путем выполнения нескольких последовательных этапов.
Этап 1. Путем селекции и многоступенчатого мутагенеза из исходного штамма Penicillium verruculosum ВКМ F-3764D получают штамм В10 с повышенной активностью β-1,4-глюкозидазы и синтезирующий также внеклеточные целлюлазы, β-глюканазы и ксиланазы.
Этап 2. Методом мутагенеза Penicillium verruculosum В10 получают реципиентный штамм Penicillium verruculosum B10 NiaD-, ауксотрофный по гену нитратредуктазы (NiaD) и сохранивший способность к синтезу внеклеточных ферментов, включая β-глюкозидазу, β-глюканазы, целлюлазы и ксиланазы.
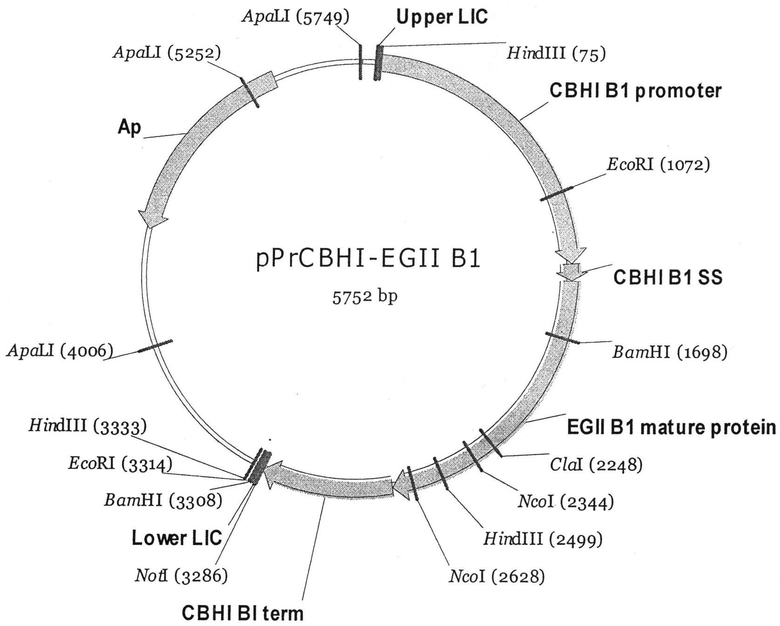
Этап 3. Путем клонирования в фаговом векторе выделяют фрагмент ДНК Penicillium verruculosum, кодирующий ген секретируемой эндо-1,3/1,4-β-глюканазы. Включают этот фрагмент ДНК в структуру векторной молекулы. Получают экспрессионную плазмиду pPrCBHI-EGII (рис.1), в которой нуклеотидная последовательность структурного гена эндо-1,3/1,4-β-глюканазы Penicillium verruculosum совмещена с нуклеотидной последовательностью промоторной области, сигнального пептида и терминатора гена cbhl целлобиогидролазы I Penicillium verruculosum.
Этап 4. Полученной экспрессионной плазмидой с включенным геном эндо-1,3/1,4-β-глюканазы проводят котрансформацию штамма Penicillium verruculosum B10 NiaD-, вместе с плазмидой, несущей последовательность NiaD гена, как маркера селекции, получают трансформанты Penicillium verruculosum B10 EGII и осуществляют отбор клонов, секретирующих в культуральную среду эндо-1,3/1,4-β-глюканазы. Проводят культивирование отобранных трансформантов и выбирают наиболее продуктивный клон.
Этап 5. Проводят процесс культивирования наиболее активного рекомбинантного штамма продуцента эндо-1,3/1,4-β-глюканазы на оптимизированной питательной среде в ферментерах и из культуральной жидкости с помощью фильтрации, ультрафильтрации и лиофилизации получают ферментные препараты.
Штаммы мицелиального гриба Penicillium verruculosum B10 EGII депонированы во Всероссийской коллекции микроорганизмов при Институте биохимии и физиологии микроорганизмов им. Г.К.Скрябина РАН под номером соответственно ВКМ F-4472D.
Изобретение иллюстрируется следующими примерами.
Пример 1. С помощью селекции и многоступенчатого мутагенеза из исходного штамма Penicillium verruculosum ВКМ F-3764D получают мутант с повышенной способностью к биосинтезу β-глюкозидазы при культивировании на твердых и в жидких средах. При этом сохраняется высокая активность других карбогидраз, целлюлазы (КМЦ-азы), β-глюканазы и ксиланазы. Кроме того, при культивировании на среде с глюкозой (1-2%) биосинтез карбогидраз у полученного мутанта снижается незначительно, т.е. он устойчив к катаболитной репрессии.
Далее получают посевной материал гриба на сусло- или СМ-агаре (29°С, 7 суток и при комнатной температуре 7 суток), затем суспензией спор, смытых с агара водой, содержащей 0,1% Твина 80, засевают в качалочные колбы Эрленмейера объемом 500 мл, содержащие 100 мл среды для культивирования следующего состава (в г/л): МКЦ - 40, пшеничные отруби - 10, дрожжевой экстракт - 10, (NH4)2SO4 - 5, КН2РО4 - 5, MgSO4×7H2O - 0,3, СаСl2×2Н2O - 0,3, рН 4,5. Колбы инкубируют на качалке (200 об/мин) при 30°С в течение 120-144 ч. После окончания культивирования в колбах β-глюкозидазная активность составляет 80-100 ед./мл, КМЦ-азная активность - 20-30 ед./мл, β-глюканазная активность - 15-20 ед./мл, и ксиланазная активность -40-50 ед./мл.
Затем проводят культивирование мутанта Penicillium verruculosum В10 в ферментерах (1- и 10-литровых с рабочим объемом 0,7 и 7,0 л соответственно и содержащих среду того же состава, что и качалочные колбы) при рН 4,5-5,0, температуре 30°С и оборотах мешалки 400 об/мин., время культивирования 120-144 час.Через 32 часа после начала ферментации (и до конца ферментации) осуществляют подпитку глюкозой в режиме fed batch. После окончания культивирования в ферментере β-глюкозидазная активность составляет 650-700 ед./мл, КМЦ-азная активность - 550-600 ед./мл, β-глюканазная активность - 600-650 ед./мл и ксиланазная активность -700-750 ед./мл.
После окончания ферментации культуральную жидкость, содержащую целлюлазный комплекс и сопутствующие ферменты, собирают и подвергают ультрафильтрации на полых волокнах (с пределом отсечения 10 кДа), ультраконцентрат лиофильно высушивают с получением сухого ферментного препарата.
β-глюкозидазная активность сухого ферментного препарата составляет 5200-5700 ед./г, КМЦ-азная активность - 4500-5000 ед./г, β-глюканазная активность - 4500-5000 ед./г, ксиланазная активность -5500-6000 ед./г.
Пример 2. Методом мутагенеза Penicillium verruculosum В10 получают реципиентный штамм Penicillium verruculosum В10 NiaD-, ауксотрофный по гену нитратредуктазы (NiaD) и сохранивший способность к синтезу внеклеточных ферментов, включая β-глюкозидазу, целлюлазы и ксиланазы.
С этой целью споровую суспензию гриба Penicillium verruculosum В10 подвергают облучению (УФ), затем проводят селекцию мутантов на среде с хлоратом натрия, отбирают колонии, которые растут на среде с NH4CI и усваивают другие формы азота, кроме NaNCb, и отбирают штамм Penicillium verruculosum В10-53 NiaD-, который не отличается от исходного штамма ни по биохимическим, ни по морфологическим и ни по биотехнологическим (продукция ферментов) признакам.
На заключительном этапе проводят трансформацию полученного мутанта Penicillium verruculosum В10-53 NiaD- плазмидой pSTA10, несущей ген нитратредуктазы (niaD+) Aspergillus niger, для возврата штамма к способности расти на среде с NaNO3. Она необходима для комплементации ауксотрофного признака NiaD- в штамме-реципиенте для возврата штамма к прототрофности, (в данном случае к способности расти на среде с NaNO3).
Далее проверяют аксотрофный мутант Penicillium verruculosum В10-53 NiaD- на способность к продукции карбогидраз при культивировании в колбах и в ферментере, как описано в примере 1. По продукции целевого (эндо-1,3/1,4-βглюканазы) и сопутствующих (целлюлазы, β-глюкозидазы и ксиланазы) ферментов реципиентный штамм не отличается от исходного Penicillium verruculosum В10.
Пример 3. Путем клонирования в фаговом векторе выделяют фрагмент ДНК Penicillium verruculosum, кодирующий ген секретируемой эндо-1,3/1,4-β-глюканазы. Включают этот фрагмент ДНК в структуру векторной молекулы. Получают экспрессионную плазмиду pPrCBHI-EGII (Фиг.1), в которой нуклеотидная последовательность структурного гена эндо-1,3/1,4-β-глюканазы Penicillium verruculosum совмещена с нуклеотидными последовательностями промоторной области, сигнального пептида и терминатора гена cbhI целлобиогидролазы I Penicillium verruculosum.
Карта кольцевой формы трансформационной плазмиды pPrCBHI-EGII, несущей целевой ген гомологичной эндо-1,3/1,4-β-глюканазы (EGII) Penicillium verruculosum, представлена на Фиг.1
Полученной экспрессионной плазмидой (10-20 мкг) с включенным геном эндо-1,3/1,4-β-глюканазы проводят котрансформацию штамма Penicillium verruculosum В10, вместе с плазмидой (1-3 мкг), несущей последовательность NiaD гена, как маркера селекции, получают NiaD- трансформанты Penicillium verruculosum BIO EGII и осуществляют отбор клонов, с повышенной секрецией эндо-1,3/1,4-β-глюканазы.
Сначала трансформанты пересевают на чашки с минимальной средой с NaNO3 в качестве источника азота, инкубируют 140 часов при температуре 30°С до образования спор. Затем трансформанты культивируют в качалочных колбах, как указано в примере №1. Далее отбирают трансформанты с увеличенной по сравнению с реципиентным штаммом эндо-1,3/1,4-β-глюканазной активностью. Эндо-1,3/1,4-β-глюканазную активность определяют по гидролизу β-глюкана ячменя.
При анализе культуральной жидкости отобранных трансформантов, проведенном с помощью ДДС-электрофореза в денатурирующих условиях, обнаружено увеличение количества белка полосы, соответствующего эндо-1,3/1,4-β-глюканазе (36 кДа).
На следующем этапе проводят ферментацию наиболее активных трансформантов в 1- и 10-литровых ферментерах, используя среду и условия культивирования, как описано в примере №1. После окончания культивирования в ферментере эндо-1,3/1,4-β-глюказная активность составляет 1200-1250 ед./мл, β-глюкозидазная активность - 350-400 ед./мл, КМЦ-азная активность - 1100-1200 ед./мл, ксиланазная активность -200-250 ед./мл.
После окончания ферментации культуральную жидкость, содержащую эндо-1,3/1,4-β-глюканазу и сопутствующие ферменты, собирают и подвергают ультрафильтрации на полых волокнах (с пределом отсечения 10 кДа), ультраконцентрат лиофильно высушивают с получением сухого ферментного препарата. Эндо-1,3/1,4-β-глюканазная активность сухого ферментного препарата составляет 17000-18000 ед./г, КМЦ-азная активность - 16000-17000 ед./г, β-глюкозидазная активность - 5400-5500 ед./г, ксиланазная активность -3200-3500 ед./г.
Пример 4. Сравнительный анализ удельной активности ферментного комплекса Penicillium verruculosum В10 EGII.
С этой целью активности эндо-1,3/1,4-β-глюканазы и сопутствующих ферментов, полученные, как указано выше, сравнивают с аналогичными ферментами коммерческих препаратов ферментов различных компаний, полученных с помощью штаммов-продуцентов мицелиальных грибов рода Trichoderma. При этом используют ферментативные препараты и методики, приведенные ниже.
Для анализа активности используют следующие коммерческие (промышленные) и лабораторные ферментные препараты: ферментные препараты Ксибетен-цел и Ксибетен-ксил (T.longibrachiatum) компании ООО «Промфермент» (Россия), препарат BioACE компании Dyadic International Ltd., США (T.longibrachiatum), препарат Celluclast 1.5L (T.reesei) компании Novozymes. Удельные активности ферментных препаратов (в ед./мг) приведены в таблице 1.
Из данных таблицы 1 очевидно, что наибольшую удельную активность эндо-1,3/1,4-β-глюканазаы проявляет ферментный препарат, полученный с помощью заявляемого штамма Penicillium verruculosum В10 EGII. При этом новый ферментный препарат сохраняет высокую активность целлюлазы (КМЦ-азы) и особенно β-глюкозидазы и ксиланазы.
Пример 5. Проверка сухих препаратов с помощью смоделированных лабораторных кормовых тестов. Эффективность полученных с помощью нового штамма-продуцента Penicillium verruculosum В10 EGII ферментных препаратов, обогащенных эндо-1,3/1,4-β-глюканазой, проверяют с помощью кормовых тестов. В качестве модельных кормовых субстратов использовали смесь пшеничной и ячменной муки (в соотношении 60:40 по весу) и пшеничные отруби. Методика оценки эффективности действия ферментных препаратов основана на измерении концентрации восстанавливающих сахаров (ВС), освобождающихся при гидролизе модельных кормов. При этом используют ферментные препараты и методики, описанные ниже.
Из данных таблицы 2 очевидно, что наибольшую активность при гидролизе обоих модельных субстратов проявляют ферментные препараты, полученные с помощью нового штамма-продуцента Penicillium verruculosum В10 EGII.
Методы определения активности. Эндо-1,3/1,4-β-глюканазную активность измеряют, проводя гидролиз 1%-ного раствора β-глюкана ячменя при рН 5,0 (0,1 М ацетатный буфер) и 50°С в течение 5 минут. За единицу β-глюканазной активности принимают такое количество фермента, которое в течение 1 минуты при температуре 50°С и рН 5,0 под действием на β-глюкан вызывает образование количества ВС, эквивалентного 1 микромолю глюкозы, определяемого методом Сомоджи-Нельсона (А.П.Синицын, А.В.Гусаков, И.М.Черноглазов. Биоконверсия лигноцеллюлозных материалов. Учебное пособие. М.: Изд-во МГУ, 1995, с.144-156).
Целлюлазную (КМЦ-азную) активность измеряют, проводя гидролиз водорастворимой Na-соли карбоксиметилцеллюлозы (5 мг/мл) при рН 5,0 (0,1 М ацетатный буфер) и 50°С в течение 10 минут. За единицу эндоглюканазной активности принимают такое количество фермента, которое в течение 1 минуты при температуре 50°С и рН 5,0 при гидролизе раствора КМЦ концентрацией 5 мг/мл приводит к образованию количества ВС, эквивалентного 1 микромолю глюкозы, определяемого методом Сомоджи-Нельсона (А.П.Синицын, А.В.Гусаков, И.М.Черноглазов. Биоконверсия лигноцеллюлозных материалов. Учебное пособие. М.: Изд-во МГУ, 1995, с.144-156).
6-Глюкозидазную активность измеряют, проводя гидролиз 0,5 мг/мл п-нитрофенил-β-D-глюкозида (пНФГ) при рН 5,0 (0,05 М ацетатный буфер) и 40°С в течение 10 минут. Реакцию останавливают 1 М Na2CO3, после чего измеряют оптическую плотность при 400 нм. За единицу β-глюкозидазной активности принимают такое количество фермента, которое в течение 1 минуты при рН 5,0 и 40°С приводит к образованию 1 микромоля п-нитрофенола.
Ксиланазную активность измеряют проводя гидролиз березового ксилана (5 мг/мл) при рН 5,0 (0,1 М ацетатный буфер) и 50°С в течение 10 минут. За единицу ксиланазной активности принимают такое количество фермента, которое в течение 1 минуты при температуре 50°С и рН 5,0 при гидролизе раствора ксилана концентрацией 5 мг/мл приводит к образованию количества ВС, эквивалентного 1 микромолю ксилозы, определяемого методом Сомоджи-Нельсона (А.П.Синицын, А.В.Гусаков, И.М.Черноглазов. Биоконверсия лигноцеллюлозных материалов. Учебное пособие. М.: Изд-во МГУ, 1995, с.144-156).
Лабораторные кормовые тесты. Методика оценки эффективности действия ферментных препаратов основана на измерении концентрации восстанавливающих сахаров методом Шомоди-Нельсона (А.П.Синицын, А.В.Гусаков, И.М.Черноглазов. Биоконверсия лигноцеллюлозных материалов. Учебное пособие. М.: Изд-во МГУ, 1995, с.144-156) при гидролизе модельных кормов. В качестве модельных кормовых субстратов использовали смесь пшеничной и ячменной муки (в соотношении 60:40 по весу) и пшеничные отруби. Перед использованием корма тщательно измельчают на механической мельнице и просеивают через сито с размером ячеек 0,14 мм. Концентрация кормов в реакционной смеси составляет 50 мг/мл. Гидролиз кормов проводят при 40°С, рН 5.0, 250 об/мин, в течение 3 часов. Сравнение эффективности действия различных ферментных препаратов на природные корма осуществляется при следующих нормировочных условиях: при равной дозе сухих препаратов по весу.
Таким образом, предлагаемое изобретение позволяет осущеставить получение с помощью культивирования нового рекомбинантного штамма Penicillium verruculosum, трансформированного фрагментами ДНК с клонированым гомологичным геном, кормовых комплексных ферментных препаратов, обогащенных эндо-1,3/1,4-β-глюканазную, содержащих β-глюкозидазу, целлюлазу и ксиланазу и гидролизующих некрахмальные полисахариды клеточной стенки зерна злаковых (ржи, овса, ячменя), за счет чего улучшается доступ пищеварительных ферментов животных и птиц к питательным компонентам корма.
| название | год | авторы | номер документа |
|---|---|---|---|
| Штамм мицелиального гриба TRICHODERMA LONGIBRACHIATUM TW-14-220 - продуцент целлюлаз, бета - глюканаз и ксиланаз для кормопроизводства и способ получения кормового комплексного ферментного препарата | 2017 |
|
RU2654564C1 |
| СПОСОБ ПОЛУЧЕНИЯ КОРМОВОГО КОМПЛЕКСНОГО ФЕРМЕНТНОГО ПРЕПАРАТА (ВАРИАНТЫ) И ШТАММ PENICILLIUM CANESCENS (ВАРИАНТЫ) | 2004 |
|
RU2288267C2 |
| РЕКОМБИНАНТНЫЙ ШТАММ МИЦЕЛИАЛЬНОГО ГРИБА PENICILLIUM VERRUCULOSUM ( ВАРИАНТЫ) И СПОСОБ ПОЛУЧЕНИЯ ФЕРМЕНТНОГО ПРЕПАРАТА С ЕГО ИСПОЛЬЗОВАНИЕМ (ВАРИАНТЫ) | 2015 |
|
RU2646136C2 |
| ШТАММ ГРИБА PENICILLIUM VERRUCULOSUM ПРОДУЦЕНТ КОМПЛЕКСА ФИТАЗЫ А И ЭНДО-1,4-β-ГЛЮКАНАЗЫ II И ФЕРМЕНТНЫЙ ПРЕПАРАТ НА ЕГО ОСНОВЕ ДЛЯ ИСПОЛЬЗОВАНИЯ В КАЧЕСТВЕ ДОБАВКИ В КОРМАХ | 2022 |
|
RU2810538C2 |
| ГЕНЕТИЧЕСКАЯ КОНСТРУКЦИЯ ДЛЯ ОБЕСПЕЧЕНИЯ ЭКСПРЕССИИ КОМПЛЕКСА ФЕРМЕНТОВ ЭНДОГЛЮКАНАЗ И КСИЛАНАЗ В КЛЕТКАХ ГРИБА PENICILLIUM VERRUCULOSUM И СПОСОБ ПОЛУЧЕНИЯ КОМПЛЕКСНЫХ ФЕРМЕНТНЫХ ПРЕПАРАТОВ НА ЕГО ОСНОВЕ, ПРЕДНАЗНАЧЕННЫХ ДЛЯ КОРМОПРОИЗВОДСТВА | 2017 |
|
RU2653429C1 |
| ШТАММ ГРИБА PENICILLIUM VERRUCULOSUM ЕЕ-105 ПРОДУЦЕНТ КОМПЛЕКСА ВЫСОКОЭФФЕКТИВНЫХ ЭНДОГЛЮКАНАЗ И ФЕРМЕНТНЫЙ ПРЕПАРАТ НА ЕГО ОСНОВЕ ДЛЯ ИСПОЛЬЗОВАНИЯ В КАЧЕСТВЕ КОРМОВОЙ ДОБАВКИ В ЗЕРНОВЫХ КОРМАХ | 2018 |
|
RU2696036C1 |
| ГЕНЕТИЧЕСКАЯ ФЬЮЖН-КОНСТРУКЦИЯ ДЛЯ ОБЕСПЕЧЕНИЯ ЭКСПРЕССИИ МУЛЬТИФЕРМЕНТНОГО КОМПЛЕКСА КАРБОГИДРАЗ В КЛЕТКАХ МИЦЕЛИАЛЬНОГО ГРИБА Penicillium verruculosum, ИСПОЛЬЗУЕМОГО В КАЧЕСТВЕ ХОЗЯИНА, СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО ШТАММА ГРИБА Penicillium verruculosum И СПОСОБ ПОЛУЧЕНИЯ ФЕРМЕНТНОГО ПРЕПАРАТА НА ЕГО ОСНОВЕ | 2013 |
|
RU2550044C2 |
| ГЕНЕТИЧЕСКАЯ КОНСТРУКЦИЯ ДЛЯ ОБЕСПЕЧЕНИЯ ЭКСПРЕССИИ ЦЕЛЕВЫХ ГОМОЛОГИЧНЫХ И ГЕТЕРОЛОГИЧНЫХ ГЕНОВ В КЛЕТКАХ МИЦЕЛИАЛЬНОГО ГРИБА PENICILLIUM VERRUCULOSUM, ИСПОЛЬЗУЕМОГО В КАЧЕСТВЕ ХОЗЯИНА, СПОСОБ ПОЛУЧЕНИЯ ШТАММА ГРИБА PENICILLIUM VERRUCULOSUM И СПОСОБ ПОЛУЧЕНИЯ ФЕРМЕНТНОГО ПРЕПАРАТА | 2008 |
|
RU2378372C2 |
| ШТАММ ГРИБА PENICILLIUM VERRUCULOSUM MX-73 ПРОДУЦЕНТ МОДИФИЦИРОВАННОЙ КСИЛАНАЗЫ Е С ПОВЫШЕННОЙ ТЕРМОСТАБИЛЬНОСТЬЮ, ФЕРМЕНТНЫЙ ПРЕПАРАТ НА ЕГО ОСНОВЕ ДЛЯ ИСПОЛЬЗОВАНИЯ В ПИЩЕВОЙ И КОРМОВОЙ ПРОМЫШЛЕННОСТИ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2018 |
|
RU2711578C1 |
| ШТАММ ГРИБА PENICILLIUM VERRUCULOSUM B6/PMO-BG-25 И СПОСОБ ПОЛУЧЕНИЯ КОМПЛЕКСНОГО ФЕРМЕНТНОГО ПРЕПАРАТА β-ГЛЮКОЗИДАЗЫ, ЦЕЛЛОБИОГИДРОЛАЗЫ И ПОЛИСАХАРИДМОНООКСИГЕНАЗЫ НА ЕГО ОСНОВЕ ДЛЯ БИОКОНВЕРСИИ ЦЕЛЛЮЛОЗОСОДЕРЖАЩИХ МАТЕРИАЛОВ | 2024 |
|
RU2836771C1 |
Изобретения касаются штамма гриба Penicillium verruculosum B10 EGII и способа получения кормового комплексного ферментного препарата. Представленный штамм является продуцентом эндо-1,3/1,4-β-глюканазы, целлюлазы, β-глюкозидазы и ксиланазы. Получен на основе штамма Penicillium verruculosum ВКМ F-3764D, путем трансформации его плазмидами pSTA10 и pPrCBHI-EGII. В плазмиде pPrCBHI-EGII нуклеотидная последовательность структурного гена эндо-1,3/1,4-β-глюканазы Penicillium verruculosum совмещена с нуклеотидными последовательностями промоторной области, сигнального пептида и терминатора гена cbhI целлобиогидролазы I Penicillium verruculosum. Способ получения препарата, содержащего эндо-1,3/1,4-β-глюканазу, целлюлазу, β-глюкозидазу и ксиланазу включает культивирование штамма гриба Penicillium verruculosum B10 EGII на оптимизированной питательной среде в ферментере и фильтрацию, ультрафильтрацию и лиофилизацию культуральной жидкости. Охарактеризованные изобретения могут быть использованы для получения кормового комплексного ферментного препарата, обогащенного эндоглюканазой. 2 н.п. ф-лы, 1 ил., 2 табл., 5 пр.
1. Штамм гриба Penicillium verruculosum B10 EGII продуцент эндо-1,3/1,4-β-глюканазы, целлюлазы, β-глюкозидазы и ксиланазы, полученный на основе штамма Penicillium verruculosum ВКМ F-3764D, путем трансформации его плазмидами pSTA10 и pPrCBHI-EGII, представленной на фиг.1, в которой нуклеотидная последовательность структурного гена эндо-1,3/1,4-β-глюканазы Penicillium verruculosum совмещена с нуклеотидными последовательностями промоторной области, сигнального пептида и терминатора гена cbhI целлобиогидролазы I Penicillium verruculosum.
2. Способ получения кормового комплексного ферментного препарата, содержащего эндо-1,3/1,4-β-глюканазу, целлюлазу, β-глюкозидазу и ксиланазу, путем культивирования штамма гриба Penicillium verruculosum B10 EGII по п.1 на оптимизированной питательной среде в ферментерах с последующей фильтрацией, ультрафильтрацией и лиофилизацией культуральной жидкости.
| ГЕНЕТИЧЕСКАЯ КОНСТРУКЦИЯ ДЛЯ ОБЕСПЕЧЕНИЯ ЭКСПРЕССИИ ЦЕЛЕВЫХ ГОМОЛОГИЧНЫХ И ГЕТЕРОЛОГИЧНЫХ ГЕНОВ В КЛЕТКАХ МИЦЕЛИАЛЬНОГО ГРИБА PENICILLIUM VERRUCULOSUM, ИСПОЛЬЗУЕМОГО В КАЧЕСТВЕ ХОЗЯИНА, СПОСОБ ПОЛУЧЕНИЯ ШТАММА ГРИБА PENICILLIUM VERRUCULOSUM И СПОСОБ ПОЛУЧЕНИЯ ФЕРМЕНТНОГО ПРЕПАРАТА | 2008 |
|
RU2378372C2 |
| ШТАММ МИЦЕЛИАЛЬНОГО ГРИБА PENICILLIUM VERRUCULOSUM - ПРОДУЦЕНТ КОМПЛЕКСА ЦЕЛЛЮЛАЗ, КСИЛАНАЗЫ И КСИЛОГЛЮКАНАЗЫ И СПОСОБ ПОЛУЧЕНИЯ ФЕРМЕНТНОГО ПРЕПАРАТА КОМПЛЕКСА ЦЕЛЛЮЛАЗ, КСИЛАНАЗЫ И КСИЛОГЛЮКАНАЗЫ ДЛЯ ГИДРОЛИЗА ЦЕЛЛЮЛОЗЫ И ГЕМИЦЕЛЛЮЛОЗЫ | 2008 |
|
RU2361918C1 |
| RU 2001124653 A, 27.07.2003 | |||
| Koch A et al., Cloning, sequencing, and heterologous expression of a cellulase-encoding cDNA (cbh1) from Penicillium janthinellum, Gene, 1993 Feb 14, Vol.124, No.1, p.p.57-65, abstr | |||
Авторы
Даты
2014-11-10—Публикация
2012-09-19—Подача