Изобретение относится к области микробиологической промышленности и представляет собой фрагмент ДНК мицелиального гриба Penicillium canescens, кодирующий синтез секретируемого фермента эндо-(1-4)-бета-ксиланазы и штамм-продуцент Penicillium canescens, сконструированный методами трансформации и генетической инженерии на основе этого фрагмента ДНК.
Эндоксиланазы расщепляют ксилан - основной компонент гемицеллюлоз. В этой связи эндоксиланазы представляют большой интерес как в промышленном, так и прикладном биотехнологическом аспекте. Эндоксиланазы находят промышленное применение в бумажной индустрии в процессах отбеливания, в пищевой и кормовой промышленности и других сферах (Kulkarni N., Shendye A., Rao M., FEMS Microbiology Reviews, 1999, v.23, p.411). Известны различные грибные продуценты эндоксиланаз: Trichoderma reesi, Trichoderma harzianum (Torronen A, Rouvmen. J. Biotechnol, 1997, 57(1-3): 137.), Thermoascus auranticus (патент США 4966850); Aspergillus tubigensis (патент США 5358864); Humicola insolens (патент США 5610048).
Наиболее активным продуцентом эндо-(1-4)-бета-ксиланазы является штамм Humicola insolens DSM1800 (патент США 5610048), активность которого на среде с крахмалом за 130 часов ферментации составляет 300 ед/мг секретируемого белка. Этот штамм выбран нами в качестве ближайшего аналога.
Задачей заявляемой группы изобретений является расширение спектра штаммов, используемых для получения секретируемой эндо-(1-4)-бета-ксиланазы.
Задачу решают получением фрагмента ДНК PCX-302, несущего полный ген секретируемой эндо-(1-4)-бета-ксиланазы Penicillium canescens ВКПМ F-178 и конструированием на его основе с помощью методов генетической инженерии штамма Penicillium canescens XYL-23, содержащего несколько копий этого гена. Этот штамм на средах с пектин-содержащим сырьем за 120-144 часов ферментации способен накапливать до 770 ед эндо-(1-4)-бета-ксиланазы в 1 мл культуральной жидкости.
Конструирование штамма включает несколько этапов:
Этап 1. Выделение путем клонирования в фаговом векторе фрагмента ДНК Penicillium canescens ВКПМ F-178 размером 15 тыс. пар нуклеотидов (т.п.н.), несущего полный ген секретируемой эндо-(1-4)-бета-ксиланазы, и получение из него фрагмента ДНК PCX-302 размером 4.5 т.п.н. со структурной частью гена секретируемой эндо-(1-4)-бета-ксиланазы Penicillium canescens ВКПМ F-178, кодирующей сигнальный пептид и зрелый белок, с протяженной 5'-нетранслируемой областью (промоторным районом) и с 3'-нетранслируемой частью (терминатором).
Этап 2. Включение фрагмента ДНК PCX-302 в структуру векторной молекулы pBluescript KS (+) (Short J.1988; Nucl.Acid Res., v.l6, p.7583) и получение экспрессионной плазмиды pPCXYLA.
Этап 3. Проведение трансформации штамма-реципиента Penicillium canescens PCA10 (niaD-) (Aleksenko A.Y. et al., 1995, Current Genetics, v.28, p.474) экспрессионной плазмидой pPCXYLA и плазмидой pSTA10 (Unkles S. et al., 1989, Gene, v.78, p.157) с гетерологичным геном нитратредуктазы из Aspergillus niger.
Этап 4. Селекция наиболее продуктивного штамма-продуцента эндо-(1-4)-бета-ксиланазы Penicillium canescens и характеристика секретируемого им фермента.
Полученный штамм Penicillium canescens XYL-23 депонирован во Всероссийской коллекции промышленных микроорганизмов под номером ВКПМ F-832.
Штамм Penicillium canescens XYL-23 характеризуется следующими культурально-морфологическими и физиолого-биохимическими признаками:
1. Культурально-морфологические признаки на различных питательных средах после 10 суток роста при 30oС:
Сусло-агар. Диаметр колоний 6.5-7.5 см. Обратная сторона оранжево-темно-коричневая. Конидиеносцы размером 430-450х3.0-3.2 мкм, конидии 2.0-2.2 мкм, шаровидные, в молодом возрасте гладкие, в старом - шероховатые, образуются в цепочках, соединяются в колонки, со временем распадающиеся.
Агаризованная среда Ролена-Тома с сахарозой. Диаметр колоний 3.8-4.8 см. Колонии войлочные или слабо пушистые в центре, слабовыпуклые, с радиальными бороздками, белого цвета, по краям окрашены в серо-голубоватый тон, края неровные, лопастные, обратная сторона серо-бежевого тона.
Агаризованная среда Чапека с глюкозой. Диаметр колоний 2.8-4.0 см. Колонии серые, складчатые, с ровным краем, конидиеобразование интенсивное, цвет конидий светло-серый. Обратная сторона колоний с радиальными складками слабо кремового тона.
2. Физиолого-биохимические признаки.
Мезофил, растет при 25-37oС, оптимальная температура роста 29oС. Оптимум роста при значениях рН среды 4.1-5.8. Желатину разжижает слабо.
Отношение к источникам углерода. Хорошо усваивает моно-, ди- и полисахариды, за исключением арабинозы, которую утилизирует слабо.
Отношение к источникам азота. Хорошо усваивает аммонийный и нитратный азот, пептон, мочевину.
3. Генотипические признаки. Основной генотипический признак заявляемого штамма заключается в увеличенном числе генов эндо-(1-4)-бета-ксиланазы. Штамм Penicillium canescens XYL-23 содержит мультикопийную плазмиду pPCXYLA и плазмиду pSTA10 с геном нитратредуктазы Aspergillus niger, интегрированные в геном.
У заявляемого штамма избирательно увеличена активность эндо-(1-4)-бета-ксиланазы. На средах с пектин-содержащим сырьем (свекловичный жом) штамм производит за 120-144 часов культивирования до 770 ед/мл эндо-(1-4)-бета-ксиланазы.
Изобретение иллюстрируется следующими фигурами графических изображений:
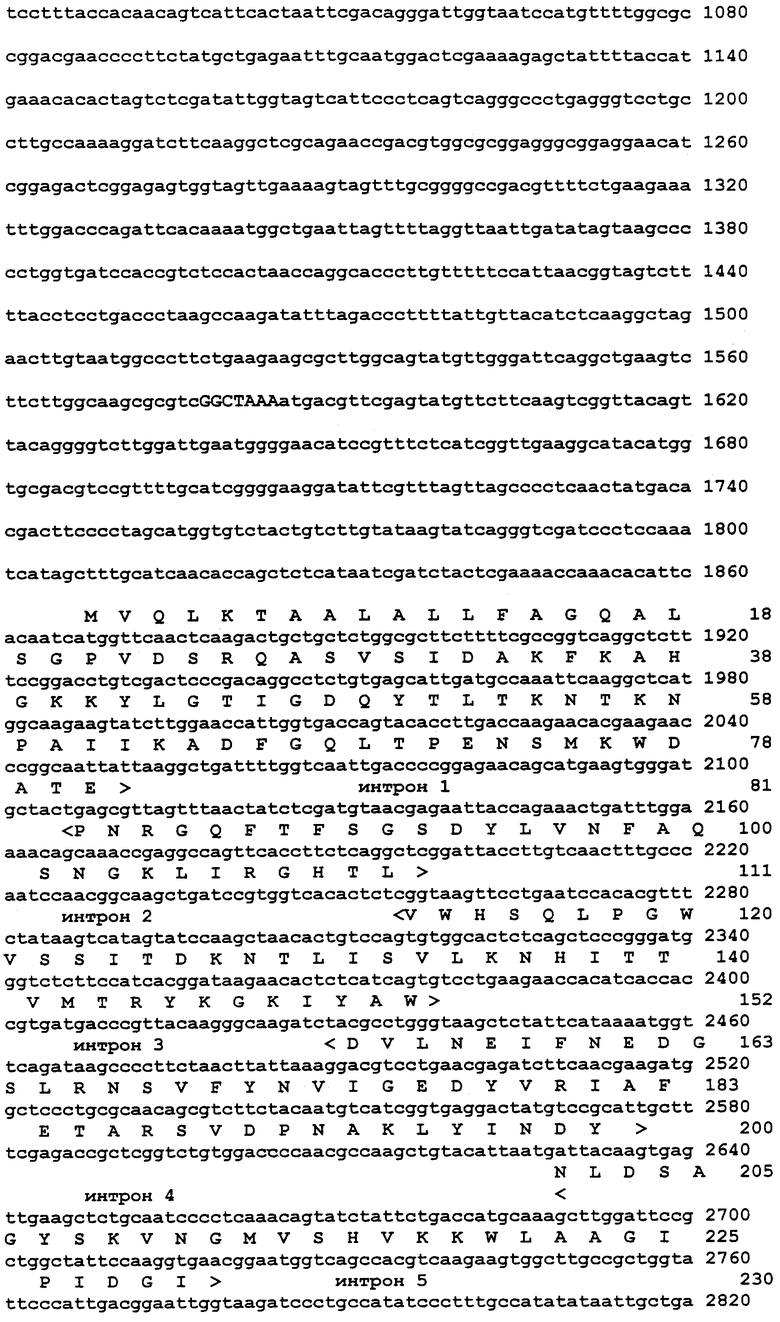
Фиг. 1 - карта плазмиды pPCXYLA.
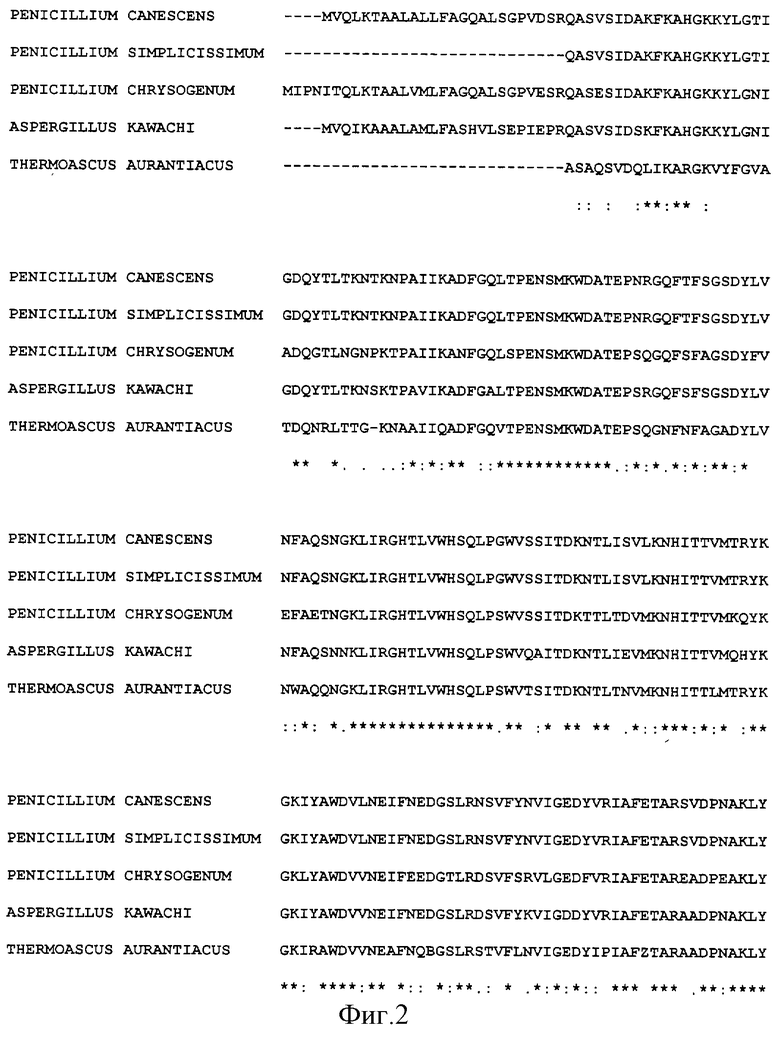
Фиг. 2 - сравнение аминокислотных последовательностей эндо-(1-4)-бета-ксиланаз различных грибов.
Изобретение иллюстрируется следующими примерами.
Пример 1. Получение фрагмента ДНК PCX-302, кодирующего синтез секретируемой эндо-(1-4)-бета-ксиланазы.
Для получения банка генов используют ДНК штамма Penicillium canescens ВКПМ F-178. ДНК этого штамма обрабатывают рестриктазой Sau3A в условиях неполного расщепления, фракционируют путем центрифугирования в градиенте плотности сахарозы, выделяя фрагменты ДНК размером 10-20 т.п.н., и включают путем лигирования в ДНК фагового вектора лямбда EMBL4. Далее готовят упаковочную смесь (белки фаговых головок и белки хвостов фага лямбда по отдельности), проводят упаковку при оптимальных соотношениях компонентов смеси и полученные фаговые частицы с рекомбинантными ДНК рассевают на чашки Петри с питательной средой и индикаторными бактериями (Т. Маниатис, Э. Фрич, Дж. Самбрук. "Молекулярное клонирование", 1984). Полученные негативные колонии (независимые клоны) в количестве 3•104 в совокупности представляют собой банк генов пеницилла.
Для селекции фагового клона с геном секретируемой эндо-(1-4)-бета-ксиланазы синтезируют радиоактивно-меченый фрагмент ДНК штамма Penicillium canescens ВКПМ F-178. Для синтеза фрагмента используют олигонуклеотидные праймеры с последовательностью:
1.5'- CATGAAGTGGGATGC(T/C)ACTGAGCGT - 3'
2.5' - CCACTTCTTGACTG(G/A)GT(C/T)GACCA - 3'
Последовательность нуклеотидов в праймерах вычисляют на основе консервативных нуклеотидных последовательностей грибных эндо-(1-4)-бета-ксиланаз, имеющихся в GenBank Database. Этот класс ксиланаз представлен ферментами с молекулярной массой порядка 33 кДа, что соответствует полученным электрофоретическим данным относительно размера секретируемой эндо-(1-4)-бета-ксиланазы. Реniсillium canescens ВКПМ F-178.
Далее с помощью ПЦР (полимеразной цепной реакции) синтезируют внутренний фрагмент ДНК гена эндоксиланазы размером 630 п.н.
ПЦР проводят при температуре отжига 56oС в объеме 50 мкл в буфере, содержащем 67 мМ Трис-HCl, 10 мМ 2-меркаптоэтанола, 16.7 мМ сульфата аммония, 2 мМ хлорида магния, 1 мМ dNTP и 5 ед. Tag-полимеразы. В качестве матрицы используют 0.3 мкг ДНК штамма Penicillium canescens ВКПМ F-178.
Далее определяют нуклеотидную последовательность этого фрагмента по методу Сенгера (Sanger et al., 1997, PNAS, v.74, p.5463) и метят до высокой специфической активности (1х1010 имп.мкг) с помощью ПЦР, в тех же условиях, используя вместо 1 мМ dNTP смесь, содержащую dCTP, dTTP, dGTP 1 мМ каждого, 5 мкКюри/мкл α32 pdATP, и добавляют в раствор для гибридизации (5х раствор Денхардта, 6xSSC, 0.5% SDS, 0.2 мг/мл ДНК спермы лосося) до конечной концентрации 106 имп.мин/мл. Фаговые негативные колонии переносят на нейлоновые фильтры для ДНК-ДНК гибридизации и инкубируют в указанном растворе в течение ночи при температуре с 65oС, после чего отмывают фильтры от неспецифически связавшейся метки в растворе 0.2хSSC при 65oС. Фильтры экспонируют с рентгеновской пленкой. При анализе геномной библиотеки гриба Penicillium canescens ВКПМ F-178 данным методом из 3•104 рекомбинантных фагов были выделены 30 клонов, из которых был выбран клон PCX-302, который нес фрагмент ДНК PCX-302 со структурной кодирующей частью гена секретируемой эндо-(1-4)-бета-ксиланазы, 3'-нетранслируемой частью и с протяженной 5'-нетранслируемой областью. Эта область содержит нуклеотидную последовательность ДНК, полностью обеспечивающую регуляторную функцию (специфическую индукцию арабинозой и углерод-катаболитную репрессию) гена секретируемой эндо-(1-4)-бета-ксиланазы Penicillium сanescens.
Таким образом, получен фрагмент ДНК PCX-302, кодирующий синтез секретируемой эндо-(1-4)-бета-ксиланазы Penicillium canescens ВКПМ F-178, включающий полный ген секретируемой эндо-( 1 -4)-бета-ксиланазы Penicillium сanescens ВКПМ F-178, который состоит из: регуляторной области, терминатора и нуклеотидных последовательностей, кодирующих сигнальный пептид, и зрелый белок секретируемой эндо-(1-4)-бета-ксиланазы Penicillium canescens (см. в конце описания).
Пример 2. Получение экспрессионной плазмиды pPCXYLA.
Получают плазмиду pPCXYLA, несущую фрагмент ДНК PCX-302, кодирующий эндо-(1-4)-бета-ксиланазу. 2 мкг ДНК клона PCX-302, содержащего фрагмент ДНК с геном эндо-(1-4)-бета-ксиланазы, обрабатывают рестриктазами SaI и KpnI (20 ед каждой) в течение 1 ч при 37oС и затем образовавшиеся фрагменты лигируют с 0.1 мкг ДНК плазмиды pBluescript KS (+), предварительно расщепленной теми же эндонуклеазами рестрикции. Лигирование проводят в течение ночи при 16oС, добавляя в пробу 2 ед ДНК-лигазы фага Т4. Клоны, содержащие фрагмент ДНК с данным геном, отбирают путем гибридизации с радиактивно-меченным ПЦР фрагментом, после чего проверяют ориентацию вставки в полученной плазмиде pPCXYLA (фиг. 1).
Далее определяют нуклеотидную последовательность гена ху1А и проводят анализ ее структуры. В кодирующей области выявляют восемь интронов. Далее проводят анализ 5'-нетранслируемой промоторной области с целью выявления консенсусных последовательностей (5'- SYGGGG - 3') связывания белка катаболитной репрессии CREA и последовательности связывания белка транскрипционного активатора 5'- GGCTAAA - 3'. В промоторном районе гена эндо-(1-4)-бета-ксиланазы Penicillium canescens активаторная последовательность имеется в единственном числе и находится в позиции -289. Сайты связывания белка катаболитной репрессии CREA были обнаружены в позициях -571, -1235, -1675.
Для определения места отщепления лидерного пептида от зрелого белка проводят сравнение аминокислотных последовательностей эндо-(1-4)-бета-ксиланаз этого семейства из различных грибов (фиг. 2). Обнаруживают, что 100% гомология у эндо-(1-4)-бета-ксиланазы Penicillium canescens наблюдается с эндо-(1-4)-бета-ксиланазой гриба Penicillium simplicissimum, а с эндо-(1-4)-бета-ксиланазами Aspergillus kawachi, Penicillium chrysogenum и Thermoascus aurantiacus гомология выражена в меньшей степени (78, 70 и 85% соответственно). У всех эндо-(1-4)-бета-ксиланаз, за исключением Thermoascus aurantiacus первой аминокислотой зрелого белка является глутамин. Зрелый белок эндо-(1-4)-бета-ксиланазы Penicillium canescens включает в себя 302 аминокислоты, последовательность лидерного пептида составлена из 25 аминокислот, как и у эндо-(1-4)-бета-ксиланаз аспергиллов.
Пример 3. Получение штамма Penicillium canescens XYL-23 с увеличенной активностью секретируемой эндо-(1-4)-бета-ксиланазы.
Штамм-реципиент Penicillium canescens PCA10 (Aleksenko A.Y. et al., 1995, Current Genetics, v.28, p.474) выращивают в течение 16 ч при 30oС на полной питательной среде с NH4Cl в качестве источника азота (Николаев И.В., Беккер О. Б. , Серебряный В.А., Чулкин А.М., Винецкий Ю.П., Биотехнология, 1999, N3, стр.3), переносят мицелий в раствор 1.2 М MgSО4 и 0.01 М NaH2PO4, pH 5.8 и добавляют лизирующие ферменты гриба Trichoderma harzianum (Sigma L2265) до концентрации 3 мг/мл. Протопластирование проводят в течение 1 ч при 30oС в условиях перемешивания. Протопласты собирают центрифугированием в ступенчатом градиенте плотности сорбитола, промывают 2 раза в стабилизирующем растворе, содержащем 1.2 М сорбитола, 0.01 М Трис, 0.01 М СаСl2, рН 7.5 и суспендируют в этом же растворе при концентрации 108 протопластов/мл. Трансформацию проводят следующим образом: к 100 мкл суспензии протопластов добавляют 1 мкг ДНК плазмиды pSTA10, несущей в качестве селективного маркера ген нитратредуктазы Aspergillus niger, и 10-20-кратный избыток плазмиды pPCXYLA с геном эндо-(1-4)-бета-ксиланазы Реniсillium canescens инкубируют при комнатной температуре 20 мин, после чего проводят осмотический шок в течение 5 мин в 50% полиэтиленгликоле и высевают протопласты на агаризованную питательную среду с 0.01 М NaNO3. Через 4-5 суток инкубации при 30oС проводят скрининг полученных котрансформантов, анализируя уровень эндо-(1-4)-бета-ксиланазной активности в культуральной жидкости при глубинном культивировании на среде со свекловичным жомом (см. пример 4). Наиболее продуктивным штаммом является XYL-23.
Пример 4. Культивирование штамма Penicillium canescens XYL-23 и оценка его продуктивности.
Для получения посевного материала культуру штамма Penicillium canescens XYL-23 выращивают на агаризованной среде Роулен-Тома при 30oС в течение 5-7 суток. Водной суспензией конидий (10 конидий/мл) инокулируют 100 мл пектин-содержащей среды следующего состава: свекловичный жом - 30 г/л, пептон - 50 г/л, КН2РO4 25 г/л, вода - остальное, рН 4.5.
Культивирование проводят на круговой качалке при 240-250 об/мин в качалочных колбах при 30oС в течение 120 часов. По окончании ферментации культуральную жидкость отделяют от мицелия и твердых остатков среды центрифугированием (10000 g, 15 мин) и в супернатанте определяют активности эндо-(1-4)-бета-ксиланазы и бета-галактозидазы.
Активность эндо-(1-4)-бета-ксиланазы определяют по количеству восстанавливающих сахаров, выделяемых при гидролизе ксилана из лиственницы. Инкубацию субстрата и фермента проводят при 50oС в течение 10 мин. При определении температурного оптимума инкубацию проводят в течение того же времени, но при разных температурах. Проба включает 0.45 мл 1% раствора ксилана в 0.1 М ацетатном буферном растворе, рН 5.0 и 0.05 мл фермента в соответствующем разведении. При определении рН-оптимума дополнительно используют 0.05 М имидазольный буферный раствор. За единицу активности принимают количество фермента, высвобождающее 1 мкмоль/мин восстанавливающих сахаров при указанных выше условиях. Восстанавливающие сахара определяют методом Шомоди-Нельсона. Электрофорез белков проводят в 12% ПААГ по методике Лэммли.
Для определения активности бета-галактозидазы реакционную смесь, содержащую 3 мг O-нитрофенил-бета-галактопиранозида (ОНФГ) в 1.9 мл 0.05 М Na-ацетатного буфера, рН 4.5, и 100 мкл культуральной жидкости соответствующего разведения инкубируют 15 мин при 30oС, затем добавляют 1 мл 1 М Na2CO3 и измеряют оптическую плотность раствора при 420 нм. За единицу активности бета-галактозидазы принимают количество фермента, которое освобождает из субстрата ОНФГ 1 мкмоль O-нитрофенола за 1 мин при данных условиях реакции.
Штамм Penicillium canescens XYL-23 на пектин-содержащей среде со свекловичным жомом продуцирует 770 ед эндо-(1-4)-бета-ксиланазы в 1 мл культуральной жидкости, что в 6-7 раз выше, чем у реципиентного штамма Penicillium canescens PCA10. Содержание бета-галактозидазы составляет 25 ед в 1 мл культуральной жидкости.
Увеличение эндоксиланазной активности у штамма Penicillium canescens XYL-23 сопровождается уменьшением уровня активности бета-галактозидазы в 2-3 раза по сравнению с реципиентным штаммом. Феномен уменьшения активности одного гена обычно происходит за счет титрования регуляторных белков и ферментов матричного синтеза избыточными копиями другого гена, если в механизме регуляции этих генов есть общие регуляторные белки.
Пример 5. Характеристика секретируемой эндо-(1-4)-бета-ксиланазы, полученной с помощью заявляемого штамма.
Для определения характеристик эндо-(1-4)-бета-ксиланазы в 12% полиакриламидном геле с додецилсульфатом натрия проводят электрофорез белков культуральной жидкости после культивирования реципиентного штамма Penicillium canescens PCA10 и мультикопийного штамма Penicillium canescens XYL-23 на среде со свекловичным жомом. В белках мультикопийного штамма отмечают значительное увеличение количества материала с молекулярной массой порядка 30 кДа в позиции полосы, соответствующей эндо-(1-4)-бета-ксиланазе. Кроме того, в белках штамма XYL-23 обнаруживают уменьшение доли бета-галактозидазы по сравнению с реципиентным штаммом. По результатам денситометрического сканирования геля у мультикопийного штамма Penicillium canescens XYL-23 секретируемая эндо-(1-4)-бета-ксиланаза составляет от 30 до 50% белка. Общее количество белка, секретируемое Penicillium canescens XYL-23 на среде со свекловичным жомом и пептоном, в среднем составляет 5 мг/мл. Тогда на долю эндо-(1-4)-бета-ксиланазы в культуральной жидкости приходится 1.5-2 мг/мл. Исходя из этой величины можно вычислить удельную активность эндо-(1-4)-бета-ксиланазы, которая составляет 385-500 ед/мг секретируемого белка. Этот показатель выше активности, продуцируемой рассмотренным аналогом - продуцентом эндо-(1-4)-бета-ксиланазы Humicila insolens, которая составляет 300 ед/мг.
Далее определяют температурный оптимум и рН-оптимум эндо-(1-4)-бета-ксиланазы штамма Penicillium canescens XYL-23, используя для этого культуральную жидкость. Температурный оптимум составляет 55oС, оптимум рН составляет 5.5.
Таким образом, заявляемый штамм Penicillium canescens XYL-23 расширяет спектр штаммов, продуцирующих секретируемую эндо-(1-4)-бета-ксиланазу. Штамм удобен в производстве ферментов благодаря тому, что он создан на основе гриба Penicillium canescens, среди штаммов которого имеются высокопродуктивные продуценты бета-галактозидазы, что позволяет использовать единый технологический процесс для получения этих ферментов.



Изобретение относится к области генетической инженерии и может быть использовано с целью получения фермента эндоксиланазы в промышленном масштабе. Путем выделения из фаговой библиотеки генов Penicillium canescens ВКПМ F-178 получен фрагмент ДНК (PCX-302), кодирующий синтез секретируемой эндо-(1-4)-бета-ксиланазы. На основе выделенного фрагмента ДНК сконструирована рекомбинантная плазмида pPCXYLA, которая использована для трансформации штамма-реципиента Penicillium canescens PCA10 (nia D-). В результате скрининга трансформантов получен мультикопийный штамм P.canescens XYL-23 (ВКПМ F-832) - продуцент секретируемой формы фермента. При культивировании полученного штамма на пектинсодержащей среде со свекловичным жомом может быть получено до 770 ед активности эндо-(1-4)-бета-ксиланазы на 1 мл культуральной среды, что в 6-7 раз больше, чем при использовании штамма-реципиента. 2 с.п ф-лы, 2 ил.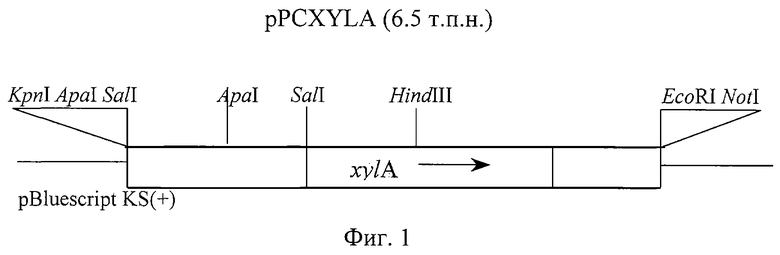
5'- CATGAAGTGGGATGC(T/C)ACTGAGCGT-3' и
5' -CACTTCTTGACTG(G/A)GT(C/T)GACCA-3',
включающий полный ген эндо-(1-4)-бета-ксиланазы Penicillium canescens ВКПМ F-178, который состоит из регуляторной области, терминатора и нуклеотидных последовательностей, кодирующих сигнальный пептид и зрелый белок секретируемой эндо-(1-4)-бета-ксиланазы Penicillium canescens и имеет последовательность, приведенную в описании.
| Штамм @ @ 20171-продуцент @ -галактозидазы | 1982 |
|
SU1065476A1 |
| ФРАГМЕНТ ДНК PCG 2,6, КОДИРУЮЩИЙ СИНТЕЗ СЕКРЕТИРУЕМОЙ БЕТА-ГАЛАКТОЗИДАЗЫ PENICILLIUM CANESCENS, И ШТАММ ГРИБА PENICILLIUM CANESCENS - ПРОДУЦЕНТ СЕКРЕТИРУЕМОЙ БЕТА-ГАЛАКТОЗИДАЗЫ | 1997 |
|
RU2126049C1 |
| US 5693518, 02.12.1997 | |||
| US 6197564 B1, 06.03.2001 | |||
| HAAS et al | |||
| Gene, 126, 237-242, 1993. | |||
Авторы
Даты
2003-01-27—Публикация
2001-07-23—Подача