ПЕРЕКРЕСТНЫЕ ССЛЫКИ НА СВЯЗАННЫЕ ЗАЯВКИ
Данная заявка притязает на приоритет предварительной заявки на выдачу патента США № 60/568656, поданной 5 мая 2004 г., содержание которой включено сюда в качестве ссылки.
ЗАЯВЛЕНИЕ В ОТНОШЕНИИ ПРАВ НА ИЗОБРЕТЕНИЯ, СДЕЛАННЫЕ ПРИ ИССЛЕДОВАНИЯХ И РАЗРАБОТКЕ, КОТОРЫЕ ФИНАНСИРУЮТСЯ ГОСУДАРСТВОМ
Не прилагается
ССЫЛКА НА «СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ», ТАБЛИЦУ, ИЛИ КОМПЬЮТЕРНУЮ ПРОГРАММУ, ПРЕДСТАВЛЯЕМЫЕ В ПРИЛОЖЕНИИ НА КОМПАКТ-ДИСКЕ.
Не прилагается
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Многие заболевания и нарушения вызваны неподходящей или избыточной активацией путей передачи сигнала, вызванной активацией рецепторов клеточной поверхности, например связыванием рецептор-специфичных лигандов. Рецепторы, вовлеченные в инициацию или прогрессию заболеваний или нарушений, таких как злокачественные опухоли или аутоиммунные нарушения, выдвинуты в качестве приоритетных мишеней для разработки терапевтических средств, которые снижают или предотвращают активацию рецепторов.
Примеры рецепторов-мишеней включают, например, рецептор эпидермального фактора роста («EGFR»), рецептор инсулиноподобного фактора роста 1 («IGF1-R») и рецептор фактора роста тромбоцитарного происхождения («PDGRF»), которые имеют тенденцию к избыточной экспрессии или отклоняющейся от нормы активации во многих патологических состояниях, таких как обычные солидные опухоли, включая немелкоклеточный рак легких и злокачественные опухоли молочной железы, предстательной железы и толстого кишечника, и при многих аутоиммунных заболеваниях, таких как миастения-гравис, системная красная волчанка и ревматоидный артрит. Активация рецептора приводит к аутофосфорилированию, которое направляет пути передачи сигнала, которые ведут к прогрессии заболевания.
Плодотворные исследования с использованием ингибиторов рецепторов четко показали, что путем предотвращения активации рецептора, ассоциированного с патологическим состоянием, развитие данного патологического состояния может быть изменено. В общем, однако, рецептор или рецепторы, ответственные за патологическое состояние, экспрессированы на многих различных клетках и тканях в дополнение к поврежденным клеткам или тканям. Хотя ингибиторы рецепторов, например герцептин®, мишенью которого является ErbB2 («HER-2»), становятся доступными для клинического применения, новые трудности включают идентификацию терапевтического средства, которое будет эффективно действовать на поврежденные клетки или ткани без направленного действия на незатронутые клетки и ткани.
Одним из подходов для направленного действия агентов специфично на пораженные клетки является применение биспецифических связывающих агентов, иногда обозначаемых здесь как «bsBA». Биспецифические связывающие агенты включают два связывающих домена, каждый из которых специфично распознает отдельную молекулу и связывается с ней (для удобства молекула, специфично связанная каждым соответствующим связывающим доменом, может обозначаться как «лиганд» для связанного домена). В разное время были сделаны попытки получения биспецифических связывающих агентов, примером чего служат Schmidt M, et al., "A bivalent single-chain antibody-toxin specific for ErbB-2 and the EGF receptor", Int J Cancer, 65 (4):538-46 (1996), Lu D, et al., "Simultaneous blockade of both the epidermal growth factor receptor and the insulin-like growth factor receptor signaling pathways in cancer cells with a fully human recombinant bispecific antibody", J Biol Chem. 279 (4):2856-65 and Francois C, et al., "Antibodies directed at mouse IL-2-R alpha and beta chains act in synergy to abolish T-cell proliferation in vitro and delayed type hypersensitivity reaction in vivo", Transpl Int. 9(1):46-50 (1996). Поскольку в bsBA часто используются антитела в качестве одного или обоих связывающих доменов, bsBA иногда включаются в класс агентов, обозначенных как иммунотерапевтические средства.
К сожалению, множество молекул, которые могут использоваться в качестве мишеней для bsBA, ограничено. Только относительно малое число молекул экспрессированы на патологических клетках, но не на нормальных клетках, и поэтому могут использоваться для направленного действия агентов исключительно на поврежденные клетки. Дополнительные молекулы экспрессированны в большем количестве на патологических клетках, чем на нормальных клетках. Данные молекулы могут позволить осуществление предпочтительной доставки агентов к патологическим клеткам по сравнению с нормальными клетками в зависимости от степени, в которой молекула избыточно экспрессирована в нормальных клетках.
Однако даже при существенной гиперэкспрессии молекулы-мишени на клетках-мишенях доставка направленных терапевтических средств часто сопровождается неблагоприятными побочными эффектами вследствие связывания агента с нормальными клетками, экспрессирующими молекулу-мишень. Например, рецептор HER2 (erbB2), представляющий собой мишень для одобренного FDA средства иммунотерапии герцептина®, повышенно экспрессируется в раковых клетках на уровне в 10-100 раз выше, чем экспрессия рецептора HER2 в нераковых клетках. Тем не менее, у некоторой доли пациентов развивается сердечная аритмия и другие неблагоприятные побочные эффекты вследствие связывания герцептина® с нормальными клетками.
Таким образом, необходимо расширить терапевтический диапазон средств для иммунотерапии путем разработки bsBA с улучшенной способностью связываться с клетками-мишенями без связывания с не относящимся к мишеням клетками.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новым композициям биспецифических связывающих агентов, а также к содержащим их наборам и способам и применению, относящимся к данным агентам.
В первой группе вариантов осуществления изобретение относится к способам модулирования биологической активности клетки-мишени с использованием биспецифического связывающего агента, (i) имеющего первый связывающий домен, характеризующийся Kd в отношении первой молекулы-мишени на поверхности указанной клетки, равной, по меньшей мере, 10-7 M, и второй связывающий домен, характеризующийся сродством в отношении второй молекулы-мишени на поверхности указанной клетки, (ii) причем вторая молекула-мишень отличается от указанной первой молекулы-мишени, (iii) где указанное сродство указанного второго связывающего домена в отношении второй молекулы-мишени, по меньшей мере, в 10 раз ниже, чем Kd указанного первого связывающего домена в отношении первой молекулы-мишени, и (iv), далее, где если молекула-мишень для указанного первого связывающего домена представляет собой ErbB2, молекула-мишень для указанного второго связывающего домена представляет собой не ErbB3, причем способы предусматривают контактирование биспецифического связывающего агента с клеткой-мишенью в условиях, которые позволяют первому и второму связывающим доменам связываться с первой и второй молекулами-мишенями соответственно, где связывание второго связывающего домена с второй молекулой-мишенью модулирует биологическую активность второй молекулы-мишени с модулированием за счет этого биологической активности клетки-мишени, и, далее, где связывание указанного первого связывающего домена с первой молекулой-мишенью не модулирует биологическую активность клетки-мишени. В некоторых вариантах осуществления биспецифический связывающий агент включает два антитела. В некоторых вариантах осуществления антитела представляют собой диатела, два одноцепочечных Fv, связанных непосредственно или посредством линкера, Fv со стабилизированными дисульфидами или их комбинации. В некоторых вариантах осуществления клетка-мишень представляет собой клетку злокачественной опухоли. В некоторых вариантах осуществления первая молекула-мишень представляет собой ассоциированный с опухолью антиген, цитокиновый рецептор или рецептор фактора роста. В некоторых вариантах осуществления ассоциированный с опухолью антиген выбран из группы, состоящей из MART-1, gp100 и MAGE-1. В некоторых вариантах осуществления первая молекула-мишень выбрана из группы, состоящей из ракового эмбрионального антигена (CEA), ErbB2, EGFR, Lewis Y, MUC-1, EpCAM, CA125, простатаспецифичного мембранного антигена (PSMA) и TAG72. В некоторых вариантах осуществления вторая молекула-мишень выбрана из группы, состоящей из ErbB3, ErbB4, любого из FGF-рецепторов 1-4, HGF-рецептора, IGF1-R, PDGF рецепторов альфа и бета и C-KIT. В некоторых вариантах осуществления клетка-мишень представляет собой клетку рака молочной железы, и молекула-мишень представляет собой рецепторную тирозинкиназу, выбранную из группы, состоящей из: рецептора эпидермального фактора роста (EGFR), ErbB2 (HER2/neu), ErbB3 (HER3) и ErbB4 (HER4). В некоторых вариантах осуществления Kd первого связывающего домена в отношении первой молекулы-мишени составляет от 10-8 до 10-12 М. В некоторых вариантах осуществления Kd второго связывающего домена в отношении второй молекулы-мишени, по меньшей мере, в 20 раз ниже, чем Kd первого связывающего домена в отношении первой молекулы-мишени.
Изобретение далее относится к способам модулирования биологической активности молекулы-мишени на клетке-мишени в организме, имеющем клетки-мишени и клетки, не относящиеся к мишеням, где клетки-мишени имеют первую молекулу-мишень на их внешней поверхности и вторую молекулу-мишень на их внешней поверхности и где (i) первая и вторая молекулы-мишени не имеют общего лиганда, (ii) первая молекула-мишень, по меньшей мере, в 10 раз больше представлена на поверхности клеток-мишеней, чем на поверхности клеток, не являющихся мишенями, которые также несут вторую молекулу-мишень, (iii) вторая молекула-мишень имеет биологическую активность, но первая молекула-мишень не имеет ее, и (iv) где молекула-мишень первого связывающего домена представляет собой ErbB2 (HER2), молекула-мишень второго связывающего домена не является ErbB3 (HER3), причем способы предусматривают применение биспецифического связывающего агента, имеющего первый связывающий домен, характеризующийся константой диссоциации (Kd) в отношении первой молекулы-мишени, равной, по меньшей мере, 10-7 M, и второй связывающий домен, характеризующейся Kd в отношении второй молекулы-мишени, которая, по меньшей мере, в 10 ниже Kd первого связывающего домена, и контактирование биспецифического связывающего агента с клеткой-мишенью в условиях, которые позволяют первому и второму связывающим доменам связываться с первой и второй молекулами-мишенями соответственно, где связывание указанного второго связывающего домена модулирует биологическую активность указанной второй молекулы-мишени на указанной клетке-мишени. В некоторых вариантах осуществления биспецифический связывающий агент включает два антитела. В некоторых вариантах осуществления антитела представляют собой диатела, два одноцепочечных Fv, связанных непосредственно или посредством линкера, Fv со стабилизированными дисульфидами или их комбинации. В некоторых вариантах осуществления клетка-мишень представляет собой клетку злокачественной опухоли. В некоторых вариантах осуществления первая молекула-мишень представляет собой ассоциированный с опухолью антиген, цитокиновый рецептор или рецептор фактора роста. В некоторых вариантах осуществления ассоциированный с опухолью антиген выбран из группы, состоящей из MART-1, gp100 и MAGE-1. В некоторых вариантах осуществления первая молекула-мишень выбрана из группы, состоящей из ракового эмбрионального антигена (CEA), ErbB2, EGFR, Lewis Y, MUC-1, EpCAM, CA125, простатаспецифичного мембранного антигена (PSMA) и TAG72. В некоторых вариантах осуществления вторая молекула-мишень выбрана из группы, состоящей из ErbB3, ErbB4, любого из FGF-рецепторов 1-4, HGF-рецептора, IGF1-R, PDGF рецепторов альфа и бета и C-KIT. В некоторых вариантах осуществления Kd первого связывающего домена в отношении первой молекулы-мишени составляет от 10-8 до 10-12 М. В некоторых вариантах осуществления Kd второго связывающего домена в отношении второй молекулы-мишени, по меньшей мере, в 20 раз ниже, чем Kd первого связывающего домена в отношении первой молекулы-мишени. В некоторых вариантах осуществления Kd второго связывающего домена в отношении второй молекулы-мишени, по меньшей мере, в 50 раз ниже, чем Kd первого связывающего домена в отношении первой молекулы-мишени. В некоторых вариантах осуществления модулирование представляет собой снижение активности рецепторной тирозинкиназы.
В другой группе вариантов осуществления изобретение относится к биспецифическим связывающим агентам (bsBA), включающим первый связывающий домен, характеризующийся константой диссоциации (Kd) в отношении первой молекулы-мишени на клетке-мишени, равной, по меньшей мере, 10-7 M, и второй связывающий домен, характеризующийся Kd в отношении второй молекулы-мишени на клетке-мишени, которая, по меньшей мере, в 10 раз ниже, чем Kd первого связывающего домена в отношении первой молекулы-мишени, где (i) первая и вторая молекулы-мишени не имеют одного и того же природного лиганда, (ii) вторая, но не первая молекула-мишень имеет биологическую активность и (iii) где молекула-мишень первого связывающего домена представляет собой ErbB2 (HER2), молекула-мишень второго связывающего домена не является ErbB3 (HER3) и, далее, где второй связывающий домен при связывании со второй молекулой-мишенью, модулирует биологическую активность второй молекулы-мишени. В некоторых вариантах осуществления Kd второго связывающего домена более чем в 50 раз ниже, чем Kd первого связывающего домена. В некоторых вариантах осуществления Kd второго связывающего домена в 100 или более раз ниже, чем Kd первого связывающего домена. В некоторых вариантах осуществления bsBA включает два антитела. В некоторых из данных вариантов осуществления антитела представляют собой диатела, два одноцепочечных Fv, связанных непосредственно или посредством линкера, Fv со стабилизированными дисульфидами или их комбинации. В некоторых вариантах осуществления первая молекула-мишень представляет собой ассоциированный с опухолью антиген, цитокиновый рецептор или рецептор фактора роста. В некоторых вариантах осуществления первая молекула-мишень выбрана из группы, состоящей из ракового эмбрионального антигена (CEA), ErbB2, EGFR, Lewis Y, MUC-1, EpCAM, CA125, простатаспецифичного мембранного антигена (PSMA) и TAG72. В некоторых вариантах осуществления вторая молекула-мишень выбрана из группы, состоящей из ErbB3, ErbB4, любого из FGF-рецепторов 1-4, HGF-рецептора, IGF1-R, PDGF рецепторов альфа и бета и C-KIT. В некоторых вариантах осуществления Kd первого связывающего домена составляет от 10-8 до 10-12 М. В некоторых вариантах осуществления первая молекула-мишень гиперэкспрессирована на клетке-мишени, по меньшей мере, в 10 раз по сравнению с ее экспрессией на нормальных клетках.
В другой группе вариантов осуществления изобретение относится к композициям (a) биспецифического связывающего агента (bsBA), содержащего первый связывающий домен, имеющий константу диссоциации (Kd) в отношении первой молекулы-мишени на клетке-мишени, равную, по меньшей мере 10-7 M, и второй связывающий домен, имеющий Kd в отношении второй молекулы-мишени на клетке-мишени, которая, по меньшей мере, в 10 раз ниже, чем Kd первого связывающего домена, где первая и вторая молекулы-мишени не имеют одного и того же природного лиганда и где (i) вторая, но не первая молекула-мишень имеет биологическую активность, (ii) где второй связывающий домен при связывании со второй молекулой-мишенью модулирует биологическую активность второй молекулы-мишени и (iii) когда молекула-мишень первого связывающего домена представляет собой ErbB2 (HER2), молекула-мишень второго связывающего домена не является ErbB3 (HER3), и (b) фармацевтически приемлемого носителя. В некоторых вариантах осуществления Kd второго связывающего домена в отношении второй молекулы-мишени, по меньшей мере, в 50 раз ниже, чем Kd первого связывающего домена. В некоторых вариантах осуществления Kd второго связывающего домена, по меньшей мере, в 100 или более раз ниже, чем Kd первого связывающего домена. В некоторых вариантах осуществления bsBA включает два антитела. В некоторых вариантах осуществления антитела представляют собой диатела, два одноцепочечных Fv, связанных непосредственно или посредством линкера, Fv со стабилизированными дисульфидами или их комбинации. В некоторых вариантах осуществления первая молекула-мишень представляет собой ассоциированный с опухолью антиген, цитокиновый рецептор или рецептор фактора роста. В некоторых вариантах осуществления первая молекула-мишень выбрана из группы, состоящей из ракового эмбрионального антигена (CEA), ErbB2, EGFR, Lewis Y, MUC-1, EpCAM, CA125, простатаспецифичного мембранного антигена (PSMA) и TAG72. В некоторых вариантах осуществления вторая молекула-мишень выбрана из группы, состоящей из ErbB3, ErbB4, любого из FGF-рецепторов 1-4, HGF-рецептора, IGF1-R, PDGF рецепторов альфа и бета и C-KIT. В некоторых вариантах осуществления первая молекула-мишень гиперэкспрессирована на клетках-мишенях, по меньшей мере, в 10 раз сильнее по сравнению с ее экспрессией на клетках, не относящихся к мишени, которые также несут вторую молекулу-мишень.
В другой группе вариантов осуществления изобретение относится к вариантам применения биспецифического связывающего агента (bsBA), содержащего первый связывающий домен, имеющий константу диссоциации (Kd) в отношении первой молекулы-мишени на клетке-мишени, равную, по меньшей мере 10-7 M, и второй связывающий домен, имеющий Kd в отношении второй молекулы-мишени, которая, по меньшей мере, в 10 раз ниже, чем Kd первого связывающего домена, где (i) первая и вторая молекулы-мишени не имеют одного и того же природного лиганда и где (ii) вторая, но не первая молекула-мишень имеет биологическую активность, (iii) где второй связывающий домен при связывании со второй молекулой-мишенью модулирует биологическую активность второй молекулы-мишени, и (iv) когда молекула-мишень первого связывающего домена представляет собой ErbB2 (HER2), молекула-мишень второго связывающего домена не является ErbB3 (HER3), для производства лекарственного средства. В некоторых вариантах осуществления Kd указанного второго связывающего домена, по меньшей мере, в 50 раз ниже, чем Kd первого связывающего домена. В некоторых вариантах осуществления Kd указанного второго связывающего домена, по меньшей мере, в 100 или более раз ниже, чем Kd первого связывающего домена. В некоторых вариантах осуществления bsBA включает два антитела. В некоторых вариантах осуществления антитела представляют собой диатела, два одноцепочечных Fv, связанных непосредственно или посредством линкера, Fv со стабилизированными дисульфидами или их комбинации. В некоторых вариантах осуществления молекулы-мишени, связываемые первым связывающим доменом и вторым связывающим доменом, независимо выбраны из группы, состоящей из ассоциированного с опухолью антигена, цитокинового рецептора и рецептора фактора роста, при условии что первый связывающий домен и второй связывающий домен не связываются с одним и тем же ассоциированным с опухолью антигеном, цитокиновым рецептором или рецептором фактора роста. В некоторых вариантах осуществления лекарственное средство предназначено для ингибирования пролиферации злокачественных клеток. В некоторых вариантах осуществления первая молекула-мишень гиперэкспрессирована на клетках-мишенях, по меньшей мере, в 10 раз сильнее по сравнению с ее экспрессией на клетках, не относящихся к мишени, каковые также несут вторую молекулу-мишень.
Далее изобретение относится к наборам, содержащим (a) контейнер, и (b) биспецифический связывающий агент (bsBA), содержащий первый связывающий домен, имеющий константу диссоциации (Kd) в отношении первой молекулы-мишени на клетке-мишени, равную, по меньшей мере 10-7 M, и второй связывающий домен, имеющий Kd в отношении второй молекулы-мишени на клетке-мишени, которая, по меньшей мере, в 10 раз ниже, чем Kd первого связывающего домена в отношении первой молекулы-мишени, где (i) первая и вторая молекулы-мишени не имеют одного и того же природного лиганда и где (ii) вторая, но не первая молекула-мишень имеет биологическую активность, (iii) где второй связывающий домен при связывании со второй молекулой-мишенью модулирует биологическую активность второй молекулы-мишени, и (iv) когда молекула-мишень первого связывающего домена представляет собой ErbB2 (HER2), молекула-мишень второго связывающего домена не является ErbB3 (HER3). В некоторых вариантах осуществления Kd второго связывающего домена более чем в 50 раз ниже, чем Kd первого связывающего домена. В некоторых вариантах осуществления Kd второго связывающего домена в 100 или более раз ниже, чем Kd первого связывающего домена. В некоторых вариантах осуществления bsBA включает два антитела. В некоторых вариантах осуществления антитела представляют собой диатела, два одноцепочечных Fv, связанных непосредственно или посредством линкера, Fv со стабилизированными дисульфидами или их комбинации. В некоторых вариантах осуществления первая молекула-мишень представляет собой ассоциированный с опухолью антиген, цитокиновый рецептор или рецептор фактора роста. В некоторых вариантах осуществления первая молекула-мишень выбрана из группы, состоящей из ракового эмбрионального антигена (CEA), ErbB2, EGFR, Lewis Y, MUC-1, EpCAM, CA125, простатаспецифичного мембранного антигена (PSMA) и TAG72. В некоторых вариантах осуществления вторая молекула-мишень выбрана из группы, состоящей из ErbB3, ErbB4, любого из FGF-рецепторов 1-4, HGF-рецептора, IGF1-R, PDGF рецепторов альфа и бета и C-KIT. В некоторых вариантах осуществления Kd первого связывающего домена составляет от 10-8 до 10-12 М. В некоторых вариантах осуществления первая молекула-мишень гиперэкспрессирована на клетке-мишени, по меньшей мере, в 10 раз по сравнению с ее экспрессией на нормальных клетках.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Введение
Одна из проблем современных средств иммунотерапии состоит в том, что их тенденция связываться с нормальными клетками, так же как и с поврежденными клетками вызывает неблагоприятные побочные эффекты. Таким образом, одной из целей научного сообщества является разработка иммунотерапевтических средств с улучшенной способностью к связыванию клеток-мишеней (например, патологических клеток) без связывания при этом не относящихся к мишени клеток (то есть нормальных клеток).
Настоящее изобретение относится к композициям и способам улучшения специфичности одного из классов иммунотерапевтических средств в плане связывания клеток-мишеней. Данные способы и композиции обеспечивают улучшенную способность модулировать биологическую активность клеток-мишеней без влияния на соответствующую активность клеток, не относящихся к мишеням. Неожиданно в настоящее время было открыто, что специфичность направленного действия на патологические клетки иммунотерапевтических средств, известных как биспецифические связывающие агенты («bsBA»), может быть увеличена путем контроля различия в сродстве связывания двух связывающих доменов bsBA. bsBA по изобретению, таким образом, могут использоваться для повышения или снижения биологической активности молекулы-мишени на клетках-мишенях и обеспечения таким образом улучшенной способности модулировать биологическую активность клеток-мишеней со сниженным, если вообще присутствующим воздействием на соответствующую активность клеток, не относящихся к мишени.
Как указано в их названии, bsBA имеют два связывающих домена, каждый из них специфичен для отдельной молекулы-мишени (для удобства молекула, специфично связываемая связывающим доменом, может обозначаться как «лиганд» для связывающего домена). Первый связывающий домен, в общем, используется для направленного действия bsBA на выбранную клетку, иногда обозначенную как «клетка-мишень». Таким образом, данный связывающий домен также обозначен здесь как «направляющий домен». В способах настоящего изобретения связывание направляющего домена со своей молекулой-мишенью не индуцирует значимого биологического эффекта в клетке-мишени. Второй связывающий домен связывается со второй молекулой-мишенью на клетке-мишени. Связывание второго связывающего домена со своим лигандом, как подразумевается, модулирует конкретный биологический эффект (то есть увеличение или ингибирование биологической активности). Связывающие домены со способностью модулировать виды биологической активности различными путями известны в данной области.
Часто виды биологической активности ингибируются связыванием связывающего домена со своей молекулой-мишенью. Например, если молекула, связанная со связывающим доменом, является частью цитокинового рецептора, связывание связывающего домена с таким рецептором может блокировать доступ цитокина к его рецептору, ингибируя таким образом биологическую активность, которая может в ином случае индуцироваться данным связыванием. Сходным образом, связывание связывающего домена с рецептором может предотвращать данный рецептор от образования гетеродимера, что требуется для полной активации некоторых цитокиновых рецепторов, например рецептора интерлейкина («IL»)-2. В ином случае связывание связывающего домена может изменить конформацию рецептора, так что он не может связывать свой природный лиганд и за счет этого активироваться. Связывающий домен может быть, наоборот, выбран по своей способности повышать биологическую активность путем связывания с рецептором. Например, связывание связывающего домена с рецептором может имитировать эффект природного лиганда данного рецептора, так что связывание активирует рецептор, или связывание связывающего домена может индуцировать конформационное изменение, которое делает низкоаффинный рецептор высокоаффинным в отношении его природного лиганда.
Как отмечалось, первый связывающий домен bsBA по изобретению служит для направленного действия bsBA на клетку-мишень, в то время как второй служит преимущественно для индукции эффекта на клетку-мишень. Поэтому для удобства различения двух доменов первый связывающий домен обозначается здесь как «направляющий домен», тогда как второй связывающий домен иногда обозначается здесь как «эффекторный домен». Сходным образом, для удобства различения молекул, связывающихся с данными двумя связывающими доменами, молекулы-мишени для эффекторного домена иногда обозначаются как «эффекторные молекулы-мишени», тогда как термин «молекула-мишень» сам по себе относится к мишени направляющего домена.
Предыдущие bsBA были обычно сконструированы с использованием связывающих доменов с наивысшим доступным сродством для каждой из соответствующих молекул-мишеней. Специалистам в данной области понятна малая вероятность того, что один домен будет иметь точно то же сродство в отношении соответствующей ему мишени, что и другой, и поэтому два связывающих домена обычно будут отличаться по сродству. Однако в предыдущих bsBA различия в сродстве обычно были невелики и могли быть значимыми в плане действительного эффекта связывания или незначимыми в этом плане.
Тем не менее, в способах и композициях по изобретению направляющий домен выбран так, что он имеет, по меньшей мере, на порядок большее сродство связывания, чем эффекторный домен в отношении своего лиганда. То есть направляющий домен имеет сродство, по меньшей мере, в 10 раз более высокое в отношении распознаваемой и связываемой им молекулы, чем эффекторный домен имеет в отношении распознаваемой и связываемой им молекулы. В некоторых вариантах осуществления сродство направляющего домена в отношении его лиганда составляет, по меньшей мере, в 15 раз выше, чем таковое эффекторного домена, в других вариантах оно выше в 20 раз или более, в других вариантах осуществления оно выше в 25 раз или более и в некоторых вариантах осуществления он имеет сродство выше в 30, 40, 50 или даже в 100 раз или более, чем сродство эффекторного домена в отношении его мишени, притом что каждое относительно более высокое сродство является более предпочтительным. Поскольку имеется различие по сродству связывания двух связывающих доменов bsBA по изобретению, по меньшей мере, на порядок, данные bsBA иногда обозначаются здесь как «hi-lo» bsBA.
Намеренная и существенная разница в сродстве связывания между направляющим связывающим доменом и эффекторным связывающим доменом предоставляет неожиданные и неизвестные ранее преимущества над известными ранее биспецифическими молекулами. Как отмечалось выше, известные ранее биспецифические агенты имели связывающие радикалы с максимально возможным сродством в отношении лиганда-мишени. Однако биспецифические молекулы со связывающими радикалами, которые имеют сходное сродство, ограничены молекулами, на которые они направлены, и ситуациями, в которых они могут использоваться, по сравнению с композициями и способами по изобретению. Некоторые из преимуществ изобретения могут рассматриваться ссылкой на гипотетический пример.
Рассмотрим случай раковой клетки, которая имеет два рецептора, рецептор A, гиперэкспрессированный на данной раковой клетке по сравнению нормальной клеткой, и рецептор B, который экспрессирован на нормальных клетках примерно в том же количестве копий, которое присутствует на раковой клетке. Биспецифический связывающий агент со связывающими доменами примерно с равным сродством в отношении обоих рецепторов будет иметь тенденцию по наличию примерно равных эффектов в отношении раковых клеток и нормальных, нераковых клеток. Это особенно верно в случае, когда достигаются высокие концентрации bsBA, поскольку bsBA будут стремиться насытить оба рецептора путем моновалентного связывания.
bsBA по изобретению, имеющие более направляющий домен с более высоким сродством, направленный на рецептор A, и эффекторный домен с более низким сродством, направленный на рецептор B, и имеющие преимущество в сродстве для рецептора А в 10, 20, 30 или более раз по сравнению с рецептором B, наоборот, будут преимущественно связываться с раковыми клетками и после обычных кинетических взаимодействий будут связываться в большем количестве с раковыми клетками по сравнению с нормальными клетками. Поэтому вместо неразборчивого связывания с клетками, несущими рецептор B, включающими существенные количества нормальных клеток, эффекторный домен будет избирательно доставляться к раковым клеткам. Так, изобретение обеспечивает более селективное направленное действие эффекторного домена на клетки-мишени.
Далее, связывание более высокоаффинного домена с рецептором А удерживает эффекторный домен вблизи клеточной поверхности, где он доступен для взаимодействия с рецептором B в течение некоторого времени. Это позволяет эффекторному домену связывать рецептор B даже несмотря на то, что его относительно низкого сродства к рецептору B обычно может быть недостаточно для удержания его на рецепторе, когда эффекторный домен представляется в виде «свободной», «моновалентной» (или «унивалентной») молекулы.
Специалистам в данной области понятно, что константа диссоциации («Kd») антитела или другого лиганда определяется kon и koff лиганда. То есть Kd представляет баланс между временем, в течение которого антитело или другой лиганд является связанным с молекулой-мишенью, и временем, когда оно не связано с ней. Поэтому низкоаффинный связывающий домен часто имеет низкое сродство именно из-за своей тенденции диссоциировать со своей молекулы-мишени. В течение периода, когда связывающий домен диссоциирует со своей молекулы-мишени, он может двигаться прочь за счет броуновского движения, тока жидкости или других кинетических сил, действующих на молекулу связывающего домена. Удержание низкоаффинного домена высокоаффинным доменом bsBA способствует поддержанию низкоаффинного домена вблизи рецептора, на который направлен низкоаффинный домен, и, таким образом, имеется тенденция повышения вероятности того, что в какой-либо момент времени низкоаффинный домен сможет связаться со своей молекулой-мишенью. Поскольку молекула-мишень низкоаффинного домена bsBA по изобретению в данном предположении является рецепторной киназой, имеется тенденция повышения способности bsBA связываться с данной рецепторной киназой-мишенью, и поэтому повышается его биологическое действие на клетки-мишени.
В предпочтительных вариантах осуществления два связывающих домена bsBA по изобретению связывают молекулы-мишени, которые обычно не связываются одним и тем же лигандом. Специалисты в данной области понимают, что некоторые лиганды, например интерлейкин IL-2, связываются двумя различными рецепторными цепями и что эти две цепи, связав IL-2, после этого взаимодействуют с образованием полностью биологически активной единицы. Когда bsBA, направленные на две рецепторные цепи, могут за счет этого предотвращать полную активацию такого рецептора, оба связывающих домена таких bsBA, конечно, направлены на один рецептор.
Наконец, образование тримера между bsBA и двумя молекулами-мишенями, связанными связывающими доменами, имеет дополнительное преимущество связывания молекул-мишеней в близости одной от другой и предотвращения их нормальной диффузии через липидный бислой клеточной мембраны. Перекрестное связывание различных рецепторов за счет bsBA само по себе, как полагают, вносит вклад в цитотоксические или цитостатические эффекты bsBA на клетки-мишени. Например, каскады передачи сигнала обычно активируются двумя белками, связывающимися друг с другом с образованием гетеродимера, или киназой, которая модулирует (обычно фосфорилированием) следующий белок в каскаде инициации. Перекрестное связывание различных рецепторов может препятствовать способности рецепторов образовывать их нормальные гетеродимеры или модулировать белок, которые обычно являются следующей стадией каскада инициации.
В одной группе вариантов осуществления направляющий домен bsBA связывается с рецептором клеточной поверхности, который преимущественно экспрессируется или избыточно экспрессируется на клетке-мишени, ассоциированной с заболеванием или нарушением (например, клетке рака молочной железы), а эффекторный домен связывается с рецептором клеточной поверхности, который экспрессирован повсеместно или везде на клетках-мишенях или клетках, не относящихся к мишени. Типовые рецепторы клеточной поверхности, на которые может действовать bsBA по изобретению, описаны ниже. В предпочтительных вариантах осуществления молекула, подлежащая связыванию направляющим доменом, экспрессируется на клетках-мишенях на уровне, более высоком по сравнению с уровнем молекулы, подлежащей связыванию эффекторным доменом. Так, bsBA и способы по изобретению особенно подходят для улучшения специфичной доставки эффекторных молекул к клеткам с молекулами-мишенями, которые могут связываться без различия обычными антителами или биспецифическими агентами или и тем, и тем. Специалистам в данной области понятно, что клетки различных злокачественных опухолей могут избыточно экспрессировать различные антигены или могут избыточно экспрессировать один и тот же антиген в различных степенях, как это делают клетки различных типов злокачественных опухолей. Таким образом, при конструировании bsBA по изобретению имеется в виду, что специалист-практик выберет направляющий домен, который направлен на рецептор клеточной поверхности, избыточно экспрессированный на конкретных клетках, подлежащих действию конкретного bsBA.
В некоторых вариантах осуществления направляющий домен bsBA связывается с первым рецептором клеточной поверхности, который преимущественно экспрессирован или избыточно экспрессирован на клетке-мишени, ассоциированной с заболеванием или нарушением (например, на раковой клетке), а эффекторный домен связывается со вторым рецептором клеточной поверхности, который избыточно экспрессирован на патологической клетке (например, на раковой клетке) по сравнению с нормальными клетками, но экспрессирован на более низком уровне, чем первый рецептор клеточной поверхности. В данных вариантах осуществления различие в уровне экспрессии между первым и вторым рецепторами клеточной поверхности опять улучшает специфичную доставку эффекторных молекул к клеткам с молекулами-мишенями.
Как отмечалось в описании предшествующего уровня техники, даже несмотря на то что HER2 избыточно экспрессирован в клетках рака молочной железы на уровнях в 10-100 раз выше, чем на нормальных клетках, у пациентов наблюдаются некоторые неблагоприятные побочные эффекты от связывания иммунотерапевтического средства герцептина® с нормальными клетками. Таким образом, даже существенной гиперэкспрессии молекулы-мишени не обязательно достаточно для удержания агентов с высоким сродством связывания от связывания с нормальными клетками с неблагоприятными побочными эффектами.
В отличие от таких агентов bsBA по изобретению имеют направляющий домен, который выбран так, что имеет сродство в отношении своей молекулы-мишени, которое, по меньшей мере, в 10 раз выше, и часто намного выше, чем таковое у эффекторного домена. Предпочтительно константа диссоциации направляющего домена для его молекулы-мишени находится в интервале от 10-8 до 10-12 M. Молекулу-мишень выбирают, поскольку она не присутствует на нормальных клетках или поскольку она в высокой степени гиперэкспрессирована на раковых клетках по сравнению с нормальными клетками, предпочтительно, по меньшей мере, в 20 раз и даже более предпочтительно в 100 раз больше, чем она экспрессирована на нормальных клетках. Как отмечалось, вследствие высокого сродства направляющего домена в отношении молекулы-мишени она имеет тенденцию связывать bsBA преимущественно на клетке-мишени. Так, ожидается, что эффекторный домен может действовать на молекулу-мишень, экспрессированную на нормальных клетках, и при этом достигается избирательное связывание, которое предоставляет терапевтическое окно больше того, которое имеет место с обычными bsBA.
Специалистам в данной области понятно, что раковые клетки, в частности, имеют тенденцию к позитивной регуляции экспрессии многих нормальных белков, включая многие белки с функцией поддержания гомеостаза в нормальных клетках. Таким образом, даже белки, которые обычно не считаются раковыми или опухолевыми антигенами, имеют тенденцию к позитивной регуляции на раковых клетках. Например, инсулиновый рецептор, который не считается опухолевым антигеном, часто положительно регулируется в 3-5 раз на опухолевых клетках по сравнению с нормальными клетками (см., например, Milazzo et al., Cancer Res. 52(14):3924-30 (1992)).
В качестве другого примера, рецептор ErbB3 в некоторой степени гиперэкспрессирован на некоторых раковых клетках по сравнению с его экспрессией на нормальных клетках. Однако он может использоваться в качестве эффекторной молекулы-мишени bsBA, когда направляющий домен направлен на молекулу-мишень, которая даже в большей степени гиперэкспрессирована. В примерах представлен типовой bsBA по изобретению, в которой направляющий домен направлен на EGFR, а эффекторный домен направлен на ErbB 3.
Требуется, чтобы направляющий домен был направлен на молекулу-мишень (например, раковый антиген), который гиперэкспрессирован на клетках-мишенях, в то время как эффекторный домен направлен на молекулу (например, рецепторную киназу), которая экспрессирована на более низком уровне, чем молекула-мишень для направляющего домена. Хотя необходимо только, чтобы данная молекула-мишень экспрессировалась на более высоком уровне, чем молекула-мишень для эффекторного домена, в общем, предпочтительно, чтобы имело место значимое различие между экспрессией молекулы-мишени и экспрессией эффекторной молекулы, поскольку эффекторные молекулы должны быть насыщены концентрациями bsBA, которые не превышают Kd направленного домена.
В общем предпочтительно, чтобы молекула-мишень направляющего домена гиперэкспрессировалась, по меньшей мере, в 10, 20, 50, 100 или более раз по сравнению с экспрессией данной молекулы на не относящихся к мишени клетках, причем каждое последующее повышение уровня экспрессии более предпочтительно. В общем, кроме того, предпочтительно, чтобы эффекторная молекула экспрессировалась на том же уровне, что и на нормальных клетках, или, если она гиперэкспрессирована, то в 2-5 раз выше, чем на не относящихся к мишени клетках. Иными словами, предпочтительно, чтобы направляющая молекула экспрессировалась (или гиперэкспрессировалась) на более высоком уровне относительно молекулы, связываемой эффекторным доменом.
Там, где клетка-мишень представляет собой патологическую клетку, такую, как раковая клетка, уровень экспрессии молекулы-мишени измеряют относительно экспрессии той же молекулы на нормальных клетках того же типа ткани, как тот, из которого происходит данная раковая клетка. То есть если патологическая клетка представляет собой клетку рака молочной железы, уровень экспрессии измеряют относительно нормальной клетки молочной железы, тогда как уровень экспрессии молекул клетки рака яичника измеряют относительно уровня экспрессии нормальных клеток яичника. Обычно используют популяцию клеток и определяют среднее значение уровня экспрессии (например, число экспрессированных молекул на клетку).
Далее, в некоторых предпочтительных вариантах осуществления выбирают антиген клеточной поверхности, распознаваемый и связываемый эффекторным доменом, имеющий биологическую активность, которую можно модулировать связыванием данного домена. Например, антиген клеточной поверхности, на который направлен эффекторный домен, может представлять собой рецептор цитокина или фактора роста, блокада которого данным доменом вносит вклад в возвращение клетки-мишени к нормальному фенотипу. Ожидается, что блокирование данного рецептора приведет к негативной регуляции пути, активируемого данными рецепторами, снижая скорость пролиферации данной клетки.
Как указывалось выше, также известны антитела, которые могут действовать как агонисты цитокиновых рецепторов и тому подобного; то есть они действуют по усилению активности молекулы-мишени. Таким образом, в зависимости от молекул-мишеней и связывающих агентов, выбранных специалистом, эффекторный домен bsBA по изобретению может ингибировать активность молекулы-мишени или может усиливать ее. Возможность выбирать связывающие домены, повышающие или снижающие активность молекулы-мишени эффекторного домена, обеспечивает специалисту значительную гибкость в конструировании bsBA, эффективных при разнообразных состояниях. Для указания того, что активность молекулы-мишени может быть усилена или снижена по выбору специалиста путем продуманного отбора связывающего агента, эффект bsBA на молекулу-мишень иногда именуется здесь как «модулирование» активности молекулы-мишени.
Например, некоторые злокачественные опухоли являются результатом мутации в гене, кодирующем рецептор, который действует как тирозинкиназа, где мутация приводит к тому, что рецептор становится конститутивно активным или гиперэкспрессированным, так что клетка пролиферирует сильнее, чем она делает это с нормальным рецептором или с рецептором, экспрессированным в нормальных количествах. Для снижения активности рецептора специалист может в данном случае выбрать связывающий агент, связывание которого, как известно, изменит конформацию конститутивно активного рецептора для снижения его активности или, в случае гиперэкспрессированного рецептора, просто блокирует его связывание природным лигандом, таким образом предотвращая гиперэкспрессию вследствие неподходящего повышения уровня передачи сигнала в клетке-мишени. Если, наоборот, молекула-мишень является той, активность которой требуется усилить, специалист может выбрать связывающий агент, связывание которого, как известно, действует как агонист активности.
Применения bsBA с одним высокоаффинным связывающим доменом достаточно для обеспечения специфичного связывания интересующих клеток. Исследования показали, что связывающие агенты с двумя высокоаффинными связывающими доменами, направленными на одну молекулу-мишень, лишь в три раза превышают по сродству молекулу-мишень по сравнению с одновалентным связывающим агентом с тем же связывающим доменом. Nielsen, U. et al., Cancer Res. 60 (22): 6434-40 (2000). Поэтому одновалентный связывающий агент обычно имеет Kd в наномолярном интервале. Поскольку терапевтические агенты обычно вводятся в количествах для обеспечения микромолярных концентраций, что в тысячи раз превышает Kd связывающего агента, высокие концентрации связывающего агента относительно Kd высокоаффинного направляющего домена, как ожидается, обеспечат связывание агента с клетками-мишенями, несущими молекулу-мишень. Таким образом, высокоаффинный направляющий домен bsBA по изобретению, как ожидается, обеспечивает специфичное связывание bsBA в условиях, в которых они будут введены.
Ожидается, что специалист может выбрать подходящие комбинации молекул-мишеней для направляющего домена и для эффекторного домена. В то время как некоторое количество предпочтительных молекул-мишеней и эффекторных молекул-мишеней описано ниже, оно может помочь в перечислении некоторых предпочтительных молекул-мишеней и эффекторных молекул-мишеней. Некоторые предпочтительные молекулы-мишени представляют собой EGFR и ErbB2. Некоторые предпочтительные эффекторные молекулы-мишени представляют собой: ErbB3, ErbB4, любой из рецепторов фактора роста фибробластов (FGF) 1-4, рецептор фактора роста гепатоцитов, рецептор инсулиноподобного фактора роста 1 (IGF1-R), инсулиновый рецептор, рецепторы фактора роста тромбоцитарного происхождения (PDGF) альфа и бета и C-KIT. Каждая из данных молекул известна в данной области и идентифицирована по своему инвентарному номеру в базе данных SWISS-PROT в последнем разделе.
Наконец, bsBA по изобретению не включают bsBA, которые связывают HER3 одним связывающим доменом и связывают HER2/neu вторым связывающим доменом.
Определения
Единицы, приставки и символы обозначены в их виде, принятом в Международной системе единиц (SI). Численные интервалы включают значения, определяющие интервал. Кроме обозначенных иначе случаев нуклеиновые кислоты прописаны слева направо в 5'-3'-ориентации; аминокислотные последовательности прописаны слева направо в ориентации от N-конца до C-конца. Представленные здесь заголовки не ограничивают различных аспектов осуществления изобретения, которые могут быть получены со ссылкой на данное описание в целом. В соответствии с этим термины, приведенные непосредственно ниже, более полно определяются со ссылкой на полное описание. Не определенные здесь термины имеют их обычное значение в понимании специалиста в данной области.
«Сродство» связывающего агента обычно формулируется в плане его константы диссоциации, или «Kd». Обычно подходящие связывающие агенты имеют Kd, выраженные в наномолярных концентрациях. Специалистам в данной области понятно, что антитело с Kd 10-8 M имеет сродство в 10 раз больше, чем таковое с Kd 10-7, и в 100 раз больше, чем антитело с Kd 10-6. Таким образом, агент с более высоким сродством имеет Kd с более низким значением (то есть 10-8 представляет собой меньшее значение, чем 10-6).
Для удобства ссылки используемый здесь термин «антитело» включает целые антитела, фрагменты антитела, которые сохраняют способность к распознаванию антигена и связывания, независимо от того, продуцированы ли они модификацией цельных антител или синтезируются de novo с использованием способов рекомбинантной ДНК, моноклональных антител, поликлональных антител и имитаций антител, кроме случаев, когда контекст требует иного. Антитело может представлять собой IgM, IgG (например, IgG1, IgG2, IgG3 или IgG4), IgD, IgA или IgE.
Термин «фрагменты антитела» означает молекулы, которые включают часть интактного антитела, в основном антигенсвязывающую или интактную область интактного антитела.
Примеры фрагментов антител включают Fab, Fab', F(ab')2, Fv-фрагменты; антитела со стабилизированными спиралями (см., например, Arndt et al., J Mol Biol 312: 221-228 (2001) ; диатела (см. ниже); одноцепочечные Fv («scFv», см., например, патент США № 5888773); антитела со стабилизированными дисульфидами («dsFv», см., например, патент США № 5747654), и доменные антитела («dAb», см., например, Holt et al., Trends Biotech 21 (11):484-490 Ghahroudi et al., FEBS Lett. 414: 521-526 (1997), Lauwereys et al., EMBO J 17: 3512-3520 (1998), Reiter et al., J. Mol. Biol. 290: 685-698 (1999), Davies and Riechmann, Biotechnology, 13:475-479 (2001)).
Термин «диатела» относится к малым фрагментам антитела с двумя антигенсвязывающими участками, причем данные фрагменты включают вариабельный тяжелый домен (VH), связанный с вариабельным легким доменом (VL) в одной полипептидной цепи (VH-VL) с использованием линкера, который слишком короток для образования пар между двумя доменами одной цепи, данные домены вынуждены образовывать пары с комплементарными доменами другой цепи с созданием двух антигенсвязывающих участков. Диатела более подробно описаны, например, в EP 404097; WO 93/11161; и Hollinger et al., Proc. Natl. Acad. Sci. USA, 90: 6444-6448 (1993).
Обычно иммуноглобулин имеет легкую и тяжелую цепи. Каждая из тяжелых и легких цепей содержит константную область и вариабельную область (данные области также известны как «домены»). Вариабельные области легких и тяжелых цепей содержат «каркасную» область, прерываемую тремя гипервариабельными областями, также называемыми «областями, определяющими комплементарность», или «CDR». Содержание каркасной области и CDR было определено, см. Kabat and Wu, infra. Последовательности каркасных областей различных легких или тяжелых цепей обычно консервативны в пределах вида. Каркасная область антитела, которая представляет собой объединенные каркасные области составляющих легких и тяжелых цепей, служит для позиционирования и выравнивания CDR в трехмерном пространстве.
CDR, в первую очередь, отвечают за связывание эпитопа антигена. CDR каждой цепи обычно обозначаются как CDR1, CDR2, и CDR3, нумеруются последовательно начиная с N-конца и также обычно идентифицируются цепью, в которой расположен конкретный CDR. Так, VH CDR3 расположен в вариабельном домене тяжелой цепи антитела, в котором он находится, в то время как VL CDR1 представляет собой CDR1 из вариабельного домена легкой цепи антитела, в котором он находится.
Ссылки на «VH» относятся к вариабельной области тяжелой цепи иммуноглобулина, включая Fv, scFv, dAb, dsFv или Fab. Ссылки на «VL» относятся к вариабельной области легкой цепи иммуноглобулина, включая Fv, scFv, dsFv, dAb или Fab.
Выражение «одноцепочечная Fv», или «scFv», относится к антителу, в котором вариабельные домены тяжелой цепи и легкой цепи традиционного двухцепочечного антитела объединены с образованием одной цепи. Необязательно между двумя цепями встроен линкер (обычно пептид), обеспечивающий надлежащее сворачивание и создание активного участка связывания.
«Биспецифические связывающие агенты», или «bsBA», представляют собой связывающие молекулы, способные к специфичному связыванию более чем одного типа молекулы-мишени одновременно.
«Связывающий агент» представляет собой любую молекулу, способную специфично связывать молекулу-мишень, и включает антитела, фрагменты антител, аптамеры, пептиды (например, Williams et al., J Biol Chem 266:5182-5190 (1991)), и имитации антитела, например те, которые могут быть созданы из десятого домена фибронектинового типа III (см., например, Xu, L., et al., Chem Biol. 9 (8):933-42, Koide et al., J Mol Biol 284: 1141-1151, Skerra, J Mol Recognit 13: 167-187 (2000), Main et al., Cell, 71: 671-678 (1992), и Dickinson et al., J Mol Biol, 236:1079-1092 (1994)), и могут включать природные белки и белки, модифицированные или сконструированные так, что они включают неприродные остатки. В некоторых вариантах осуществления «связывающий агент» может также относиться к природному лиганду для рецептора. Например, IL-13 может использоваться в качестве связывающего агента для рецептора IL-13.
«Аптамер», в общем, относится к олигонуклеотиду одной определенной последовательности или к смеси указанных олигонуклеотидов, где смесь сохраняет свойства связывания специфично в отношении молекулы-мишени. Таким образом, используемый здесь термин «аптамер» обозначает единственную или множественные последовательности олигонуклеотидов. Структурно аптамеры по изобретению являются специфично связывающими олигонуклеотидами. Олигонуклеотиды включают не только общепринятые основания, остатки сахаров и межнуклеотидные связи, но также те, которые содержат модификации любой или всех данных трех радикалов. В патенте США № 5756291, включенном сюда в качестве ссылки, предоставлено описание аптамеров, способов получения и тестирования аптамеров и варианты их применения.
Используемый здесь термин «молекула-мишень» означает молекулу, специфично связанную связывающим доменом биспецифичного связывающего агента по изобретению. Термины «первая молекула-мишень» и «вторая молекула-мишень» используются здесь для ссылки на молекулы двух различных молекулярных типов, а не на две молекулы одного молекулярного типа. Такие молекулярные типы могут быть, например, двумя различными рецепторными тирозинкиназами (например, рецептор основного фактора роста фибробластов 1 и рецептор фактора роста гепатоцитов). Некоторые цитокиновые рецепторы и другие рецепторы состоят из субъединиц, известных как «цепи», и рецептор в некоторых случаях становится полностью активированным за счет рекрутирования цепей при связывании лиганда для рецептора с одной из данных цепей. При использовании здесь, все цепи конкретного рецептора (например, рецептора IL-2) считаются одним молекулярным типом; поэтому, если цепь данного рецептора должна быть «первой молекулой-мишенью» для связывания с первым связывающим доменом bsBA по изобретению, «вторая молекула-мишень» не может быть второй цепью того же рецептора.
Используемый здесь термин «биологическая активность» относится к определенной известной активности, осуществляемой молекулой-мишенью. Чаще всего биологическая активность молекул, на которые действуют bsBA по изобретению, представляет собой трансдукцию сигнала. Например, в следующем ниже разделе данного описания перечислено некоторое количество рецепторов фактора роста в качестве молекул, которые могут быть молекулами-мишенями. Данные рецепторы обычно имеют лигандсвязывающий домен внеклеточной поверхности клеток, трансмембранный домен и цитозольный домен, который имеет ферментативную активность тирозинкиназы. Обычно активность тирозинкиназы активируется связыванием лиганда с лигандсвязывающим доменом. Затем киназная активность рецептора инициирует сигнальный каскад. Таким образом, биологическая активность данных молекул-мишеней представляет собой трансдукцию сигнала. Специалистам в данной области понятно, что биологическая активность молекулы-мишени в конечном счете оказывает действие на клетку, в которой расположена молекула-мишень. Например, каскад трансдукции сигнала, инициированный активацией рецептора фактора роста в раковой клетке, гиперэкспрессирующей данный рецептор, вероятно, повышает рост и пролиферацию клетки, причем ингибирование активности данного рецептора, вероятно, ингибирует или замедляет данную пролиферацию. Таким образом, термин «биологическая активность» может также использоваться здесь шире в связи с активностью клетки в отличие от активности молекулы-мишени. Какое значение подразумевается, будет ясно из контекста.
Как указано выше, некоторые молекулы, которые могут использоваться в качестве молекул-мишеней для bsBA по изобретению, по имеющимся сведениям, не имеют биологической активности. Определение того, имеет или нет биологическую активность данная молекула, находящаяся на поверхности клетки, для целей настоящего изобретения может проводиться следующими средствами. Культура человеческих клеток, несущих молекулы клеточной поверхности, может разделяться с образованием двух отдельных культур. Первая культура поддерживается в контакте со связывающим доменом, который специфично связывается с молекулой клеточной поверхности и который, как ожидается, блокирует связывание любого природного лиганда данной молекулы. Другая группа не подвергается такому воздействию. Затем две группы культивируют в идентичных в других отношениях условиях. Для целей настоящего изобретения молекула-мишень, как считается, не имеет «биологической активности», если связывание молекулы связывающим агентом не вызывает наблюдаемого отличия в пролиферации клеток, жизнеспособности клеток, апоптозе, активации нижележащих киназ, активации транскрипции, адгезии к поверхностям или способности выращивать колонии в мягком агаре. Анализы для наблюдения различий в данных характеристиках хорошо известны в данной области, и некоторые из них более подробно обсуждаются ниже.
Используемый здесь термин «модулирование» биологической активности относится к повышению или ингибированию биологической активности молекулы-мишени по намерению специалиста. Например, если молекула-мишень представляет собой рецептор, повышающий, как считается, пролиферацию раковых клеток (например, рецептор ErbB3), специалист может иметь намерение ингибировать активность рецептора с использованием связывающего домена для связывания рецептора, блокирующего связывание рецептора со своим природным лигандом. Часто данные молекулы-мишени представляют собой рецепторы, которые действуют как тирозинкиназы после связывания природного лиганда. Наоборот, если биологическая активность молекулы-мишени подлежит повышению по намерению специалиста, он может, например, использовать в качестве связывающего домена антитело, действующее, как известно в данной области, как агонист молекулы-мишени. Результат, как подразумевается, является благоприятным для лечения заболевания или патологического состояния; например, для лечения злокачественных опухолей и некоторых аутоиммунных заболеваний требуемый эффект обычно представляет ингибирование клеточного роста или индукцию апоптоза или он может представлять собой индукцию пролиферации определенного клеточного типа, например T-регуляторных T-клеток для лечения аутоиммунного заболевания.
Следует понимать, что рецепторы клеточной поверхности имеют лиганды, которые специфично связываются с данными рецепторами. Поэтому в отношении данного рецептора термин «природный лиганд» относится к молекуле, которая связывается с данным рецептором при нормальной физиологии. Например, интерлейкин («IL»)-13 является природным лигандом для рецептора IL-13, IL-2 представляет собой природный лиганд для рецептора IL-2, эпидермальный фактор роста представляет собой природный лиганд для рецептора EGF и так далее.
Термины «эффективное количество» или «терапевтически эффективное количество» включают ссылку на дозировку средства, достаточную для получения требуемого результата, такого как ингибирование синтеза белка в клетке, по меньшей мере, на 50% или уничтожение клетки.
«Эффекторные молекулы» определяются как рецепторы клеточной поверхности, которые могут использоваться для модулирования поведения клетки, например, путем передачи сигнала, фосфорилирования, индукции пролиферации или индукции клеточной гибели при контакте со связывающей молекулой, такой как эффекторный домен bsBA по изобретению.
«Kd» представляет собой отношение констант скорости обратной и прямой реакции типа:
A+B=AB.
В равновесных условиях константа равновесия (K) равна произведению концентраций реагентов, разделенных на концентрацию продукта, и имеет размерность концентрации.
Kd = (концентрация A × концентрация B)/(концентрация AB).
«Унивалентный связывающий агент» и «унивалентная связывающая композиция» определяются как связывающая молекула с единственным доменом для связывания маркера клеточной поверхности в отличие, наоборот, от интактной молекулы иммуноглобулина G, которая имеет два связывающих домена. Унивалентный связывающий агент обычно является выделенным фрагментом одного из двух связывающих доменов, который образует биспецифическое антитело, такое как scFv, Fab', однодоменное антитело и т.д.
«Клетка-мишень» представляет собой клетку, с которой, как подразумевается, преимущественно связывается биспецифический связывающий агент-антитело по изобретению за счет его высокоаффинного направляющего домена.
Термин «контактирование» включает ссылку на приведение в непосредственную физическую ассоциацию.
Клетки, как общеизвестно в данной области, окружены плазматической мембраной (обычно обозначаемой как «клеточная мембрана»), включающей липидный бислой, в котором расположены различные белки, такие как транспортеры, ионные каналы и цитокиновые рецепторы. См., в общем, Alberts et al., Molecular Biology of the Cell, Garland Publishing, Inc., New York (3rd Ed., 1994), Chapter 10. Клеточная мембрана, как можно считать, имеет поверхность, направленную на цитозоль, или внутрь клетки, и поверхность, направленную вне клетки, или во внеклеточное пространство. Трансмембранные белки часто являются амфипатичными, то есть они имеют гидрофобные области и гидрофильные области. Области, которые пронизывают мембрану, являются гидрофобными и взаимодействуют с гидрофобными цепями липидных молекул, образующими бислой. Гидрофильные области экспонированы в воду с цитозольной или внеклеточной стороны мембраны. Трансмембранный домен трансмембранных белков находится в составе альфа-спирали или множественных бета-складок. См., например, Lodish et al., Molecular Cell Biology, W. E. Freeman and Co., New York (4th Ed., 2000), в главе 3.
Под «цитокином» подразумевается общий термин для белков, высвобождаемых одной популяцией клеток, причем данные белки действуют на ту же клеточную популяцию (аутокринно) или другую клеточную популяцию (паракринно) как межклеточные медиаторы. Примерами таких цитокинов являются лимфокины и традиционные полипептидные гормоны. В цитокины включаются гормоны роста, такие как человеческий гормон роста, N-метионилированный человеческий гормон роста, и бычий гормон роста; паратиреоидный гормон; тироксин; инсулин; проинсулин; релаксин; прорелаксин; гормоны-гликопротеины, такие как фолликулостимулирующий гормон (ФСГ), тиреоидстимулирующий гормон (ТСГ), лютеинизирующий гормон (ЛГ); фактор роста гепатоцитов; фактор роста фибробластов; пролактин; плацентарный лактоген; фактор некроза опухоли α и β; мюллеровская ингибирующая субстанция; мышиный гонадотропин-ассоциированный пептид; ингибин; активин; фактор роста сосудистого эндотелия (VEGF); интегрин; тромбопоэтин (TPO); факторы роста нервов, такие как NGF-β; фактор роста тромбоцитарного происхождения (PDGF); трансформирующие факторы роста (TGF), такие как TGF-α и TGF-β; инсулиноподобный фактор роста (IGF), например IGF-I и IGF-II; эритропоэтин (EPO); остеоиндуктивные факторы; интерфероны, такие как интерферон-α, -β, и -γ; колониестимулирующие факторы (CSF), такие как макрофагальный CSF (M-CSF); гранулоцитарно-макрофагальный CSF (GM-CSF); и гранулоцитарный CSF (G-CSF); интерлейкины (IL), такие как IL-1, IL-1α, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL9, IL-11, IL-12; и другие полипептидные факторы, включая LIF и лиганд kit (KL, также известный как фактор steel).
Если не указано иначе, приведенные здесь ссылки на аминокислотные положения тяжелых и легких цепей антитела относятся к нумерации аминокислот по системе «Кабата и Ву». См., Kabat, E., et al., Sequences of Proteins of Immunological Interest, U.S. Government Printing Office, NIH Publication No. 91-3242 (1991), причем данная публикация включена сюда в качестве ссылки (база данных и система нумерации Кабата и Ву также называется здесь как система и нумерация «Кабата»). База данных Кабата и Ву является наиболее широко используемой в данной области системой для нумерации аминокислотных остатков антител и в настоящее время является слишком объемной для удобства печати. В настоящее время она поддерживается в виде онлайновой услуги по подписке, которая может быть найдена при входе на «http://» с последующим «immuno.bme.nwu.edu/». Число в соответствии с остатком по системе Кабата и Ву не обязательно соответствует числу, которое может быть получено для остатка в данной тяжелой или легкой цепи путем подсчета от N-конца данной цепи.
Термин «остаток», или «аминокислотный остаток», или «аминокислота» включает ссылку на аминокислоту, которая включена в белок, полипептид или пептид (все вместе «пептид»).
Аминокислота может быть встречающейся в природе аминокислотой и кроме иным образом ограниченного случая может охватывать аналоги природных аминокислот, которые могут функционировать как природные аминокислоты.
«Консервативная замена» при описании белка относится к изменению композиции аминокислот белка, которое, по существу, не меняет активность белка. Таким образом, «консервативно модифицированные вариации» конкретной аминокислотной последовательности относятся к аминокислотным заменам тех аминокислот, которые не критичны для активности белка, или к замене аминокислот другими аминокислотами, имеющими сходные свойства (например, кислые, основные, положительно или отрицательно заряженные, полярные или неполярные, и т.д.), так что данные замены даже критических аминокислот, по существу, не изменяют активности. Таблицы консервативных замен, предоставляющие функционально сходные аминокислоты, хорошо известны в данной области. Каждая из следующих шести групп в таблице A содержат аминокислоты, которые имеют консервативные замены одна на другую:
Таблица A
1) Аланин (A), серин (S), треонин (T);
2) аспарагиновая кислота (D), глутаминовая кислота (E);
3) аспарагин (N), глутамин (Q);
4) аргинин (R), лизин (K);
5) изолейцин (I), лейцин (L), метионин (M), валин (V); и
6) фенилаланин (F), тирозин (Y), триптофан (W).
См. также Creighton, Proteins, W. H. Freeman and Company, New York (1984).
Термины «избирательно реакционноспособный» и «избирательно связывается» в отношении антигена означают преимущественную ассоциацию антитела, целиком или частично, с клеткой или тканью, несущей данный антиген, и не с клеткой или тканью, лишенной данного антигена. Конечно, следует понимать, что в некоторой степени может произойти неспецифическое взаимодействие между молекулой и не являющейся мишенью клеткой или тканью. Тем не менее, избирательная реакционноспособность может отличаться тем, что она опосредуется специфичным распознаванием антигена. Хотя избирательно реакционноспособные антитела связывают антиген, они могут делать это с низким сродством. С другой стороны, специфическое связывание приводит к более сильной ассоциации между антителом и клетками, несущими антиген, чем между связанным антителом и клетками, лишенными антигена. Специфическое связывание обычно приводит к связыванию, превышающему более чем в 2 раза, предпочтительно более чем в 5 раз, более предпочтительно более чем в 10 раз и наиболее предпочтительно более чем в 100 раз по количеству связанного антитела (на единицу времени) с клеткой или тканью, несущей антиген или маркер-мишень, по сравнению с клеткой или тканью, лишенной данного антигена или маркера. Специфичное связывание с белком в таких условиях требует наличия антитела, которое выбрано за счет его специфичности в отношении конкретного белка. Различные форматы иммунного анализа подходят для селекции антител, специфично иммунореактивных в отношении конкретным белком. Например, твердофазные иммунные анализы ELISA рутинно используются для отбора моноклональных антител, специфично иммунологически реакционноспособных в отношении белка. См. Harlow & Lane, Antibodies, A Laboratory Manual, Cold Spring Harbor Publications, New York(1988), для описания формата и условий иммунных анализов и состояний, которые могут использоваться для определения специфичной иммунологической реакционной способности.
Термин «иммунологически реактивные условия» включает ссылки на условия, которые позволяют антителу, образованному против конкретного эпитопа, связываться с данным эпитопом в детектируемо более высокой степени по сравнению со связыванием, по существу, со всеми другими эпитопами и/или за исключением некоторых других эпитопов. Иммунологически реактивные условия зависят от формата реакции связывания антитела и обычно являются теми условиями, которые используются в протоколах иммунологического анализа, или теми условиями, которые встречаются in vivo. См. Harlow & Lane, supra, для описания форматов и условий иммунного анализа. Предпочтительно иммунологически реактивные условия, используемые в способах по настоящему изобретению, представляют собой «физиологические условия», которые включают ссылку на условия (например, температуру, осмолярность, pH), которые обычно находятся внутри живого вещества или клетки млекопитающих. Поскольку выяснено, что некоторые органы подвергаются экстремальным условиям, среда внутри организма или клетки обычно соответствует pH около 7 (т.е. от pH 6,0 до pH 8,0, чаще pH от 6,5 до 7,5), содержит воду в качестве доминирующего растворителя и существует при температуре выше 0°C и ниже 50°C. Осмолярность лежит в интервале, который поддерживает жизнеспособность и пролиферацию клеток.
Присоединение bsBA к терапевтическим средствам или меткам
Поскольку связывание bsBA с их лигандами, как подразумевается, само по себе модулирует биологическую активность клетки-мишени, например, путем блокирования доступа цитокинов к их рецепторам, действие bsBA на биологическую активность может повышаться присоединением к нему терапевтического средства. Поэтому в некоторых вариантах осуществления bsBA дериватизуются с введением функциональных групп, обеспечивающих присоединение терапевтического средства. bsBA может дериватизоваться с введением, например, боковых цепей, оканчивающихся гидразидом, гидразином, первичным амином или вторичными аминогруппами. Терапевтические средства могут конъюгироваться, например, посредством связи основания Шиффа, гидразоновой или ацилгидразоновой связью или гидразидным линкером (см., например, патент США № 5474765 и 5762918, каждый из которых специфично включен сюда полностью в качестве ссылки). В данной области известно некоторое количество других химических методов, подходящих для конъюгирования терапевтических средств с bsAB по изобретению, причем их примеры приведены в Hermanson, G., Bioconjugate Techniques, Academic Press, San Diego, CA (1996).
Терапевтические средства могут быть выбраны, например, из антинеопластических средств, антиметаболических средств, радиоактивных средств, цитотоксических средств и средств химиотерапии.
Цитотоксические средства включают противораковые средства, такие как следующие: гемцитабин; метотрексат; 5-FU; FUDR; FdUMP; гидроксимочевина; доцетаксел; дискодермолид; эпотилоны; винкристин; винбластин; винорельбин; мета-пак; иринотекан; SN-38; 10-ОH-кампто; топотекан; этопозид; адриамицин; флавопуридол; цисплатин; карбоплатин; блеомицин; митомицин С; митрамицин; капецитабин; цитарабин; 2-хлор-2'-дезоксиаденозин; митоксантрон; митозоломид; пентостатин; и ралтитрексед.
bsBA по изобретению могут далее модифицироваться или метиться для облегчения диагностических или терапевтических вариантов применения. Например, детектируемые метки, такие как радиоактивная, флуоресцентная, основанная на тяжелых металлах, или другая метка, могут конъюгироваться с bsBA по изобретению. Единичное, двойное или множественное мечение bsBA может быть предпочтительным. Например, bsBA может быть дважды меченным c наличием радиоактивного иода в одном или нескольких остатках и присоединения, например, 90Y посредством хелатирующей группы на аминосодержащих боковых группах или реакционноспособных группах. Данное комбинированное мечение может использоваться для специальных диагностических нужд, таких как идентификация широко распространившихся небольших клеточных масс неоплазии.
Радиоизотопы для радиоактивного мечения bsBA по изобретению включают любой радиоактивный изотоп, который может конъюгироваться или соединяться с остатком bsBA. Радиоактивные изотопы могут быть выбраны из радиоактивных изотопов, которые испускают бета- или гамма-радиацию, или альтернативно, пептидные агенты могут модифицироваться так, чтобы они содержали хелатирующую группу, которая, например, может ковалентно связываться с остатком(-ами) лизина в аналоге. Затем хелатирующие группы могут модифицироваться так, что они будут содержать любой из различных радиоизотопов, например галлий, индий, технеций, иттербий, рений или таллий (например, 125I, 67Ga, 111In, 99mTc, 169Yb, 186Re).
Хелатирующие группы могут использоваться для непрямого присоединения детектируемых меток или других молекул к bsBA по изобретению. Например, бифункциональный стабильный хелатор может присоединяться к одной или нескольким реакционноспособным группам концевых или внутренних аминокислот посредством изотиоцианат-бета-Ala или подходящего не относящегося к альфа-аминокислоте линкера, что предотвращает деградацию Эдмана. Примеры хелаторов, известных в данной области, включают, например, ининокарбоксильные и полиаминополикарбоксильные реакционноспособные группы, DTPA (N,N-бис-[2-[бис(карбоксиметил)амино]этил]глицин), и DOTA (1,4,7,10-тетраазациклодекан-1,4,7,10-тетрауксусную кислоту).
В отношении диагностики и лечения злокачественных опухолей bsBA по изобретению могут использоваться для получения диагностических композиций и композиций для визуализации и наборов, использующих данные bsBA в способах диагностики и визуализации (например, в способах диагностики in vivo и in vitro). Например, визуализация васкуляризованной опухоли может осуществляться с использованием диагностически эффективного количества bsBA, которое включает, по меньшей мере, первую связывающую молекулу, связывающуюся с доступным компонентом опухолевой клетки, сосудов опухоли или стромы опухоли, присоединенную к средству для диагностической визуализации in vivo.
В другом предпочтительном варианте осуществления, в котором заболевание или нарушение представляет собой злокачественную опухоль, предварительная визуализация перед лечением злокачественной опухоли может проводиться посредством: (a) введения животному или пациенту диагностически эффективного количества фармацевтической композиции, содержащей детектируемо меченный bsBA по изобретению, который содержит первую связывающую молекулу, связывающуюся с высоким сродством с гиперэкспрессированным рецептором, характерным для опухолевой клетки, или сосудов или стромы опухоли, и вторую связывающую молекулу, которая связывается с более низким, по меньшей мере, на порядок сродством со вторым убиквитарно экспрессированным рецептором (например, ErbB3 или ErbB4); (b) последующего выявления детектируемо меченного bsBA, связанного с опухолевыми клетками, кровеносными сосудами опухоли или стромой опухоли; за счет этого будет получено изображение опухоли, сосудов опухоли и/или стромы опухоли.
Без намерения связывать это явление с какой-либо теорией, bsBA может снижать, предотвращать или ингибировать передачу сигнала клетками путем конкуренции с природным лигандом за связывание с рецептором клеточной поверхности. В данной ситуации bsBA функционирует путем блокирования передачи сигнала в клетке после связывания лиганда. bsBA также может действовать путем индукции интернализации/отрицательной регуляции рецепторов клеточной поверхности. Снижение числа рецепторов клеточной поверхности, вызванное интернализацией/отрицательной регуляцией приводит к сниженной активации рецепторов, которая снижает или предотвращает передачу сигнала клетками по пути трансдукции сигнала для данных рецепторов. Наконец, в случаях, в которых димеризация рецептора требуется для передачи сигнала, bsBA может действовать путем предотвращения димеризации двух рецепторов клеточной поверхности.
Выбор клеточных маркеров для применения в качестве мишеней и в качестве эффекторов
Клеточные маркеры, используемые для действия bsBA, обычно экспрессированы на более высоком уровне на клетке-мишени, чем на не относящихся к мишени клетках, или не экспрессированы на клетках, не относящихся к мишеням. Например, единичный маркер может быть в высокой степени гиперэкспрессированным в конкретных злокачественных опухолях по сравнению с его экспрессией на не относящихся к мишени клетках, или он может не экспрессироваться клетками, которые не являются раковыми.
Клеточные маркеры, используемые в качестве эффекторов, обычно вовлечены в передачу сигнала в клетке, например, это факторы роста, цитокины или хемокиновые рецепторы, которые предпочтительны в плане модулирования в данных патологических условиях. Поскольку «hi-lo» bsBA по изобретению предоставляют избирательность, экспрессия маркера, связываемого эффекторным доменом bsBA, не обязательно определяется клеткой-мишенью и может экспрессироваться другими клетками организма.
Измерение K d
Сродство связывания связывающих молекул bsBA может определяться способами, известными в данной области, например, как описано в патенте США № 6703020, включенном сюда в качестве ссылки. Сродство связывания первой и второй молекул bsBA в отношении соответствующих им рецепторов-мишеней и скорость распада комплексов bsBA-рецептор могут определяться путем анализов конкурентного связывания. Одним из примеров анализа конкурентного связывания является радиоиммунный анализ, включающий инкубацию одного или нескольких рецепторов, меченных, например, 3H или 125I, с интересующим bsBA в присутствии возрастающих количеств немеченого рецептора, и выявление bsBA, связанного с меченым рецептором. Сродство интересующего bsBA в отношении конкретного рецептора и скорость распада комплекса могут определяться, например, из данных анализа с использованием графика Скетчарда. Kd может также определяться проточной цитометрией, как описано, например в Nielsen et al. (Cancer Res. 60 (22):6434-40 (2000)). Типовой анализ определения Kd приведен в примерах.
В предпочтительных способах сродство связывания рецептора с bsAb определяют по константам скоростей ассоциации и диссоциации, измеренных с использованием системы поверхностного плазмонного резонанса BIAcore (BIAcore, Inc., Piscataway, Нью-Джерси). Обычно сродство bsBA в отношении молекулы лиганда определяют иммобилизацией подходящего количества (например, 500 резонансных единиц) на биосенсорном чипе (BIAcore). Скорости прямой и обратной реакции связывания bsBA обычно измеряют в PBS путем инъекции 25 мкг/мл bsBA через поверхность чипа в течение 5 минут, позволяя затем связанному веществу диссоциировать в течение 5 минут промывки чипа буферным раствором. Кинетики связывания могут анализироваться, например, посредством программного обеспечения BIAevaluation 2.1 (BIAcore). С целью определения того, попадает ли конкретный bsBA в объем изобретения, значения сродства связывающих доменов bsBA определяют после образования bsBA (в противоположность измерению сродства доменов индивидуально перед их помещением в bsBA), так что может определяться относительное количество связывающих доменов.
Измерение требуемых биологических эффектов
bsBA по изобретению вначале предпочтительно тестируют in vitro на предмет требуемой терапевтической или профилактической активности. Например, анализы in vitro, которые могут использоваться для демонстрации терапевтического или профилактического применения bsBA, включают влияние bsBA на клеточную линию или образец ткани пациента.
Эффект bsBA в отношении клеточной линии и/или образца ткани может определяться с использованием способов, известных специалисту в данной области, включая, например, анализы пролиферации клеток, анализы жизнеспособности клеток, анализы фосфорилирования белков, активность протеинкиназ, анализы апоптозы и, среди прочих, исследования ингибирования синтеза белка. Микрочипы, основанные на антителах, могут использоваться для определения воздействия на множественные белки белкового пути. Такие анализы описаны, например, Nielsen et al. (Proc Natl Acad Sci U S A., 100 (16): 9330-5. (2003)) («Nielsen 2003»). Затем bsBA тестируют in vivo на предмет эффективности в не относящихся к человеку животных перед началом клинических испытаний на пациентах.
Создание одновалентных связывающих композиций
При создании bsBA путем химического перекрестного связывания фрагменты, не вступившие в перекрестное связывание, являются одновалентными связывающими фрагментами. В случае генетического связывания (то есть рекомбинантного экспрессирования) bsBA одновалентные связывающие композиции создают путем клонирования индивидуальных связывающих белков в векторы экспрессии, что позволяет экспрессировать и изолировать одновалентный связывающий белок. Сродство индивидуальных одновалентных связывающих композиций определяют затем, как описано выше.
Определение эквивалентной K d
Эквивалентную Kd определяли описанными выше способами с использованием одновалентных связывающих композиций.
Сравнение связывания bsBA и одновалентных связывающих композиций
Одновалентные связывающие композиции и bsBA подвергали анализам биологической активности, например, с целью выяснения их эффективности как терапевтических агентов и сравнения с эффективностью bsBA. Эти анализы известны в науке и зависят от целевого антигена. Примеры включают измерение AKT фосфорилирования с помощью ELISA или иммуноблоттинга с последующей активацией херегулином или другими факторами роста, анализы ингибирования роста (как описано, например, в WO 89/06692); или анализы апоптоза.
Для фосфорилирования использовали стандартный иммуноблоттинг для определения эффекта связывающих молекул, например, на активацию самой эффекторной молекулы или нижележащей киназы, или применяли чипы с антителами, как подробно описано выше в Nielsen 2003.
Для апоптоза фрагментацию ДНК определяли in vitro с использованием стандартного электрофореза или анализов TUNEL (terminal deoxynucleotidyl transferase dUTP nick end labeling), выявляющих одноцепочечные разрывы ДНК в апоптотических клетках. Когда клетки фиксированы, одноцепочечные разрывы ДНК определяли in situ с использованием терминальной дезоксинуклеотидилтрансферазы млекопитающих (TdT), которая ковалентно добавляет меченые нуклеотиды к 3'-гидроксильным концам этих фрагментов ДНК независимым от матрицы образом.
Жизнеспособность и пролиферация клеток могут быть отслежены с помощью различных химических и биологических реагентов, например, антител к маркерам, относящихся к клеточному циклу, или флюоресцентных анализов жизнеспособности и пролиферации клеток, таких как анализы с меченным тритием тимидином, анализы с освобождением трипана синего, анализа пролиферации клеток ATCCBioproducts™ MTT (American Type Culture Collection, Manassas, VA) или анализа жизнеспособности клеток CellTiter-Blue® (Promega, Madison, WI).
Использование bsBA для связывания рецепторов факторов роста
Большое количество молекул могут связываться эффекторным доменом bsBA по изобретению. В одной важной серии осуществлений эффекторный домен связывает рецептор фактора роста на поверхности клетки, такой как тирозинкиназный рецептор. Известно, что сверхэкспрессия или неадекватная активация большого числа важных рецепторов факторов роста и их лигандов, таких как принадлежащие к семействам эпидермальных факторов роста (EGF), факторов роста фибробластов (FGF), инсулин-подобных факторов роста (IGF-1), тромбоцитарных факторов роста (PDGF) и факторов роста эндотелия сосудов (VEGF), связана с или ответственна за начало и прогрессирование заболеваний и нарушений, таких как рак и аутоиммунные заболевания. Можно предположить, что эти факторы роста действуют аутокринным и/или паракринным способом для стимулирования выживания, пролиферации или миграции больных клеток. Связывание факторов роста с их рецепторами приводит к активации рецептора, например, путем димеризации рецептора, которая приводит к аутофосфорилированию рецептора и последующей передаче сигнала через ряд различных сигнальных молекул.
Воздействие на активность связывания фактора роста или активацию тирозинкиназных рецепторов у таких клеток может восстановить нераковый фенотип или уменьшить уровень пролиферации клеток, подвергшихся такому воздействию. То есть контакт рецептора bsBA по изобретению блокирует сигнал, образующийся при связывании лигандов, например факторов роста, с их рецепторами на поверхности клеток. BsBA предотвращает или уменьшает активацию пути передачи сигнала путем предотвращения или уменьшения связывания лиганда с рецептором или путем предотвращения или уменьшения димеризации рецептора, вызванной лигандом.
Примеры тирозинкиназных рецепторов (с альтернативными названиями, показанными в скобках), которые могут быть связаны эффекторным доменом bsBA для получения полезного результата в способах по изобретению, включают:
ALK (киназа анапластической лимфомы), тирозинкиназный рецептор, экспрессируемый как часть химерного белка NPM-ALK, в больших клетках анапластической лимфомы (ALCLs);
Рецептор с доменом дискоидина (DDR), рецепторная тирозинкиназа, отличающаяся уникальным внеклеточным доменом, гомологичным лектину дискоидину I (Дискоидиновая рецепторная тирозин киназа) (Тирозинпротеинкиназа CAK) (Киназа клеточной адгезии) (TRK E) (Протеинтирозинкиназа RTK 6) (CD 167a антиген);
Предшественник рецептора 2 с доменом дискоидина (Рецепторная протеинтирозинкиназа TKT) (Тирозинпротеинкиназа TYRO 10) (Нейротрофическая тирозинкиназа, связанная с рецептором 3);
Рецептор эпидермального фактора роста (Рецепторная протеинтирозинкиназа ErbB-1);
Рецепторная протеинтирозинкиназа erbB-2 (p185erbB2) (NEU прото-онкоген) (C-erbB-2);
Предшественник рецепторной протеинтирозинкиназы erbB-3 (c-erbB3) (Рецептор клеточной поверхности типа тирозинкиназы);
Рецепторная протеинтирозинкиназа erbB-4 (p180erbB4) (Рецептор клеточной поверхности типа тирозинкиназы);
Рецептор 1 основного фактора роста фибробластов (FGFR-1) (bFGF-R) (Fms-подобная тирозинкиназа-2) (c-fgr);
FL цитокиновый рецептор (Тирозинпротеинкиназный рецептор FLT3) (Тирозинкиназа 1 стволовых клеток) (STK-1) (CD135 антиген);
Рецептор фактора роста тучных/стволовых клеток (SCFR) (Прото-онкогенный тирозинпротеинкиназный набор) (c-kit) (CD117 антиген);
Тирозинкиназный рецептор лейкоцитов (Протеинтирозинкиназа-1);
Рецептор фактора роста гепатоцитов (Меt прото-онкогенная тирозинкиназа) (c-met) (HGF рецептор) (HGF-SF рецептор);
Протеинтирозинфосфатаза-эта (R-PTP-эта) (HPTP эта) (Протеинтирозинфосфатазный рецептор типа J) (Фосфатаза-1 повышенной плотности) (DEP-1) (CD148 антиген);
Прото-онкоген тирозинпротеинкиназный рецептор ret (C-ret);
Тирозинпротеинкиназный трансмембранный рецептор ROR1 (Нейротрофическая тирозинкиназа, связанная с рецептором 1);
Тирозинпротеин киназный трансмембранный рецептор ROR2 (Нейротрофическая тирозинкиназа, связанная с рецептором 2);
Тирозинпротеинкиназный рецептор Tie-1;
Рецептор ангиопоэтина 1 (Тирозинпротеинкиназный рецептор TIE-2) (Тирозинпротеинкиназный рецептор TEK) (P140 TEK) (Киназа внутренней мембраны эндотелиальных клеток) (CD202b антиген);
Высокоаффинный рецептор фактора роста нервов (TRK1 трансформирующий тирозинкиназный белок) (p140-TrkA) (Trk-A);
Рецептор факторов роста BDNF/NT-3 (TrkB тирозинкиназа) (GP145-TrkB) (Trk-B);
Рецептор фактора роста NT-3 (TrkC тирозинкиназа) (GP145-TrkC) (Trk-C);
Рецептор 1 сосудистого эндотелиального фактора роста (VEGFR-1) (Рецептор фактора проницаемости сосудов) (Тирозин-протеин киназный рецептор FLT) (Flt-1) (Тирозин-протеин киназа FRT) (Fms-подобная тирозин киназа 1);
Рецептор 2 сосудистого эндотелиального фактора роста (VEGFR-2) (Kinase insert domain receptor) (Протеинтирозинкиназный рецептор Flk-1);
Предшественник рецептора 3 сосудистого эндотелиального фактора роста (EC 2.7.1.112) (VEGFR-3) (Тирозинпротеинкиназный рецептор FLT4).
Приведенное ниже обсуждение содержит более специальную информацию о тирозинкиназных рецепторах, которые вполне применимы для связывания с эффекторным доменом, так же как и другие семейства рецепторов, которые могут успешно регулироваться с помощью способов по изобретению.
Рецептор эпидермального фактора роста (EGFR)/Рецептор ErbB
Семейство EGFR/ErbB, однократно пронизывающих мембрану тирозинкиназных рецепторов, состоит из четырех членов: рецептор эпидермального фактора роста (EGFR), ErbB2 (HER2/neu), ErbB3 (HER3) и ErbB4 (HER4). Идентифицировано большое количество лигандов, являющихся различными генными продуктами, которые связываются и активируют рецепторы ErbB. Эти рецепторы и лиганды играют ключевую роль в росте и дифференцировке нормальных клеток.
Нарушение сигнала и/или нерегулируемая активация рецепторных ErbB белков ведет к развитию и прогрессированию многих раковых заболеваний. Неконтролируемая клеточная пролиферация, опосредованная через дисфункциональные ErbB рецепторные пути, обнаруживается в широком спектре солидных опухолей эпителиального происхождения, и имеющиеся данные связывают экспрессию, избыточную экспрессию и/или нарушение регуляции опухолевых ErbB рецепторов с прогрессированием заболевания, появлением метастазов, устойчивостью к химиотерапии и с плохим прогнозом в целом. Более того, некоторые данные говорят об участии рецепторов ErbB в повышении инвазивности опухоли, подавлении клеточного апоптоза, повышении клеточной адгезии и ангиогенеза. В частности, повышенная экспрессия EGFR наблюдалась в более агрессивных карциномах молочной железы, мочевого пузыря, легких и желудка (Modjtahedi and Dean, Int. J. Oncol. 4:277-296, (1994)). Избыточная экспрессия человеческого ErbB2 ассоциирована с раком молочной железы и яичника (Slamon et al., Science 235:177- 182 (1987) and Slamon et al., Science 244:707-712 (1989)) и карциномами желудка, эндометрия, слюнных желез, легких, почек, кишечника и мочевого пузыря. Значительно повышенные уровни ErbB3 ассоциированы с определенными линиями человеческих опухолевых клеток молочной железы, показывая, что ErbB3, как ErbB и ErbB2, играют роль в развитии злокачественных опухолей у человека. В частности, обнаружена избыточная экспрессия ErbB3 при раке молочной железы (Lemoine et al., Br. J. Cancer 66:1116-1121, 1992), желудочно-кишечного тракта (Poller et al., J. Pathol. 168:275-280, 1992; Rajkumer et al., J. Pathol. 170:271-278, 1993; и Sanidas et al., Int. J. Cancer 54:935-940, 1993) и поджелудочной железы (Lemoine et al., J. Pathol. 168:269-273, 1992, и Friess et al., Clinical Cancer Research 1:1413-1420, 1995). Наконец, повышенная экспрессия ErbB4 также тесно коррелирует с карциномами человека, например карциномами эпителиального происхождения, включающими аденокарциномы молочной железы.
Передача сигнала, опосредованная белковыми рецепторами семейства ErbB, происходит во многих случаях через лиганд-индуцированную гетеродимеризацию рецепторов. "Рецепторное перекрестное взаимодействие", следующее за гетеродимеризацией, приводит к активации ErbB-рецепторного киназного домена и перекрестному фосфорилированию ErbB рецепторов, которое, как известно, происходит между, например, EGFR и ErbB2, ErbB2 и ErbB3, ErbB2 и ErbB4 (см., например, Wada et al., Cell 61:1339-1347 (1990); Plowman et al., Nature 336:473-475 (1993); Carraway and Cantley, Cell 78:5-8 (1994); Riese et al., Oncogene 12:345-353 (1996); Kokai et al., Cell 58:287-292 (1989); Stern et al., EMBO J. 7:995-1001 (1988); и King et al., Oncogene 4:13-18 (1989)).
Предпочтительные связывающие молекулы для использования в получении bsBA по изобретению описаны, например, в патентах США №№ 5183884, 5480968, 5968511, 5977322 и 6512097; Kraus et al., Proc. Natl. Acad. Sci. USA 86:9193-9197 (1989); заявке на выдачу Европейского патента № 444961A1; и Kraus et al., Proc. Natl. Acad. Sci. USA 90:2900-2904 (1993), каждый из которых включен здесь в качестве ссылки. Осуществления способа лечения включают болезненное состояние или состояния в дополнение к раку, такие как иммунологические нарушения, неврологические нарушения, такие как нейрофиброматоз и периферическая нейропатия, и кардиологические нарушения, такие как гипертрофия миокарда.
Рецептор инсулина (IR) и рецептор инсулин-подобного фактора роста (IGF-R)
Рецептор инсулина и IGF-1 рецепторы являются близко родственными белками, которые представляют собой важные мишени для развития новых способов лечения двух тяжелых заболеваний, диабета и рака. Диабет является глобальной проблемой здоровья повышенной важности. Это единственное неинфекционное заболевание, классифицированное Всемирной Организацией Здравоохранения как эпидемическое. Распространение диабета в мире составляет 2-3%, возрастая до 6% в США и других западных странах.
Нарастает число доказательств того, что рецепторы инсулин-подобного фактора роста (IGFRs) играют важную роль в развитии определенных видов рака и псориаза. Нарушение регуляции сигнализации с этих рецепторов связано с патогенезом, например, образования опухоли Уильма, гепатобластомы, гепатокарциномы, колоректального рака, рака молочной железы, аденокортикальной карциномы, множественной миеломы, лимфомы, лейкемии, рака предстательной железы и рака легких, с устойчивостью к радиотерапии и химиотерапии. Инсулиновые и IGF рецепторы тесно связаны с семейством рецепторов ErbB.
Рецепторы инсулин-подобного фактора роста (IGFRs) вовлечены в поддержание нормальной функции многих клеток организма. Рецептор IGF-II обычно экспрессируется опухолевыми клетками и может действовать как аутокринный фактор роста, иногда даже достигая тканей-мишеней и вызывая гипогликемию, индуцированную опухолью. Рецептор IGF-I обычно избыточно экспрессируется во многих раках, и многие недавние исследования идентифицировали новые сигнальные пути, исходящие от рецептора IGF-I, которые влияют на клеточную пролиферацию, адгезию, миграцию и гибель клеток; функции, которые являются критическими для выживания и метастазирования раковых клеток (см., например, LeRoith et al., Cancer Lett. 195:127-137 (2003)). Рецептор IGF-I не рассматривался как подходящая мишень для лечения рака, потому что многие нормальные клетки также экспрессируют этот рецептор. Научные данные свидетельствуют, что ингибирование рецептора IGF-I влияет на множество внутриклеточных сигналов, относящихся к клеточной пролиферации или развитию опухоли, и предоставляет возможные механизмы для объяснения, как ингибирование рецептора IGF-I может сделать опухолевые клетки более чувствительными к общепринятой химиотерапии или другим антираковым агентам. Вероятно, наиболее значимо, что ингибирование сигнализации с рецептора IGF-I подавляет рост опухоли, увеличивает продолжительность жизни пациента и повышает противоопухолевый эффект химиотерапии в клинически соответствующих мышиных моделях множественной миеломы и других гематологических злокачественных заболеваний. Таким образом, представляется, что bsBA, в котором связывающая молекула bsBA с низким сродством связывается с рецептором IGF-I, преодолеет недостатки ранее известных науке лекарств, которые преимущественно имели своей мишенью рецептор IGF-I (например, избегая ингибирования IGF-I-рецепторной сигнализации в не являющихся мишенью здоровых клетках). В этой связи предпочтительно, чтобы связывающая молекула bsBA с высоким сродством связывалась рецептором клеточной поверхности, который сделает больные клетки специфическими мишенями для bsBA (например, клетки, в которых требуется ингибирование избыточной стимуляции рецептора IGF-I). Имея преимущественной мишенью больные клетки, связывающая молекула bsBA с низким сродством может затем связаться с IGF-I и ингибировать чрезмерную клеточную сигнализацию, связанную с состоянием болезни.
Стратегии лечения пациентов с аденокарциномой молочной железы в развитой стадии часто включают использование цитотоксичной химиотерапии. Рецептор IGF-I, ключевой фактор в регуляции клеточного цикла, часто бывает избыточно экспрессирован при раках молочной железы высоких стадий и представляет собой первоочередную мишень при этих раках. Также было отмечено, что у пациентов, получавших лечение рака молочной железы с использованием анти-HER2/neu-рецепторных моноклональных антител (Трастузумаб, также известный как Герцептин®), которые ингибируют рост клеток рака молочной железы с избыточной экспрессией ErbB2, часто развивается устойчивость к антителам. Было отмечено, что инсулин-подобный фактор роста-I (IGF-I), который активирует сигналы выживания клеток, влияет на ингибирующее рост действие трастузумаба. Путем предотвращения, уменьшения или ингибирования клеточной сигнализации через рецептор IGF-I с использованием bsBA по изобретению, ингибирование роста, вызванное трастузумабом, может быть восстановлено (см., например, Lu et al., J. Natl. Cancer Inst. 93:1852-1857, 2001). Таким образом, одним из возможных путей применения bsBA по изобретению является использование IGF-I-рецепторной сигнализации в качестве мишени для предотвращения или прекращения развития устойчивости к трастузумабу или к другим существующим или будущим антираковым лекарствам.
Атипичные тератоидные/рабдоидные опухоли (ATT/RhT) центральной нервной системы (CNS) являются в педиатрии одними из самых злокачественных опухолей с наихудшим прогнозом и летальным исходом. В настоящее время нет объяснений их выраженной устойчивости к цитостатическим препаратам и радиотерапии. Рецептор IGF-I играет критическую роль в клеточном выживании, пролиферации, трансформации и регуляции апоптоза. Рецептор IGF-I защищает раковые клетки от апоптоза, индуцированного различными антираковыми препаратами и радиацией, но при его повреждении ингибиторами, такими как антисмысловые стратегии, доминантные негативные мутации или образование тройных спиралей, опухолевые клетки подвергаются массивному апоптозу, приводящему к подавлению образования опухолей и метастазов в экспериментальных животных моделях. bsBA по изобретению, мишенью которого является рецептор IGF-I, может быть использован для предотвращения или уменьшения передачи сигнала через активацию рецептора IGF-I и, таким образом, лечить болезненные состояния, такие как рак.
Перекрестное взаимодействие между сигнальными путями инсулин-подобного фактора роста (IGF) и эстрогенового рецептора (ER) приводит к синергичному росту. Эстроген усиливает сигнализацию IGF путем индуцирования экспрессии рецептора IGF-I и его нижележащих сигнальных молекул и инсулин-рецепторного субстрата (IRS)-1 и IRS-2. Индукция эстрогеном рецептора IGF-I и экспрессия IRS приводят к усилению фосфорилирования тирозина IRS-1 после стимуляции IGF-I с последующей усиленной митоген-активированной активации протеинкиназы. Это показывает, что активация рецептора IGF-I вовлечена в опосредованный эстрогеном рост и патогенез рака молочной железы (см., например, Lee et al., Mol. Endocrinol. 13:787-796, 1999). Таким образом, bsBA по изобретению, мишенью которого является рецептор IGF-I, может использоваться для предотвращения или уменьшения передачи сигнала через активацию рецептора IGF-I и, таким образом, лечить болезненные состояния эстроген-индуцированного рака молочной железы.
Рецептор фактора роста сосудистого эндотелия (VEGFR)
Фактор роста сосудистого эндотелия (VEGF) является многофункциональным цитокином, который индуцируется гипоксией и онкогенными мутациями. VEGF является первичным стимулирующим агентом развития и поддержания сосудистой сети в эмбриогенезе. Он функционирует как потенциальный индуцирующий проницаемость агент, агент хемотаксиса эндотелиальных клеток, фактор выживаемости эндотелиальных клеток и фактор пролиферации эндотелиальных клеток (Thomas, J. Biol. Chem. 271:603-606, 1996; и Neufeld et al., FASEB J. 13:9-22, 1999). VEGF является важным фактором, вызывающим ангиогенез и васкулогенез при большом количестве физиологических и патологических процессов, включающих заживление ран (Frank et al., 1995; Burke et al., 1995), диабетическую ретинопатию (Alon et al., 1995; Malecaze et al., 1994), псориаз (Detmar et al., 1994), атеросклероз (Inoue et al., 1998), ревматоидный артрит (Harada et al., 1998; Nagashima et al., 1999) и рост солидных опухолей (Plate et al., 1994; Claffey et al., 1996).
Разнообразные клетки и ткани вырабатывают VEGF. Димеры VEGF связываются с высоким сродством с двумя хорошо охарактеризованными рецепторами, VEGFR1 (FLT-1) and VEGFR2 (KDR/Flk-1), которые селективно экспрессируются на эндотелиальных клетках (Flt-1 и Flk-1 являются мышиными гомологами). Kd связывания VEGF с VEGFRI и VEGFR2 составляют 15-100 пM и 400-800 пM соответственно (Terman et al., 1994). Недавно идентифицированный третий белок клеточной поверхности, нейропилин-1, также связывает VEGF с высоким сродством (например, Soker et al., Cell. 92(6):735-45 (1998)).
VEGFRI и VEGFR2 являются членами семейства рецепторных тирозинкиназ типа III (RTK III), которое характеризуется семью внеклеточными IgG-подобными повторами однократно пронизывающих мембрану доменом и внутриклеточным разделенным доменом тирозинкиназы (Mustonen and Alitalo, J Cell Biol 129:895-898 (1995)). До совсем недавнего времени предполагали, что VEGFRI и VEGFR2 экспрессируются исключительно на эндотелиальных клетках (там же). Недавние исследования показали, что каждый из VEGF, VEGFRl и VEGFR2 необходимы для васкулогенеза, ангиогенеза и развития эмбриона. VEGFRI имеет более высокое сродство к VEGF, чем VEGFR2, но при этом имеет более низкую тирозинкиназную активность.
Связывание димера VEGF с рецептором VEGF, вероятно, вызывает димеризацию рецептора. Димеризация рецептора вызывает затем аутотрансфосфорилирование специфичных тирозиновых остатков, которое ведет к каскаду передачи сигнала. Происходящие далее внутриклеточные события, нижележащие в VEGF-индуцированной сигнализации, менее ясны, хотя ряд групп исследователей показали, что оксид азота (NO) образовывается после VEGF активации VEGFR2 (Kroll and Waltenberger, Biochem Biophys Res Commun. 252(3):743-6 (1998)). Также было показано, что активация VEGFR2, но не VEGFRl под действием VEGF вызывает активацию Src и Ras-MAP киназного каскада, включая MAP киназы, ERK 1 и 2 (Kroll and Waltenberger, J Biol Chem.272(51):32521-7 (1997)).
Предпочтительные связывающие молекулы для использования при получении bsBA по изобретению описаны, например, в патентах США №№ 5840301, 5874542, 6703020 и в WO 99/40118, каждый из которых приводится здесь в качестве ссылки. Предпочтительной связывающей молекулой для использования в получении bsBA является моноклональное антитело 2C3 (ATCC PTA 1595). Аптамеры РНК, антисмысловые молекулы и рибозимы против рецепторов VEGF также могут быть использованы как связывающие молекулы в bsBA. Предпочтительные антисмысловые молекулы РНК, аптамеры и рибозимы описаны, например, в Saleh et al., Cancer Res. 56(2):393-401 (1996); Cheng et al., Proc Natl Acad Sci U S A. 93(16):8502-7 (1996); Ke et al., Int J Oncol. 12(6):1391-6 (1998); и Parry et al., Nucleic Acids Res. 27(13):2569-77 (1999); каждый из которых приводится здесь в качестве ссылки.
Соединения и способы использования по настоящему изобретению предназначены, в частности, для использования у животных и пациентов (например, человека), которые имеют или которые подвержены риску развития, любую форму васкуляризированной опухоли; макулярную дегенерацию, включающую связанную с возрастом макулярную дегенерацию; артрит, включающий ревматоидный артрит; атеросклероз и атеросклеротические бляшки; диабетическую ретинопатию и другие ретинопатии; гиперплазию щитовидной железы, включающую диффузный токсический зоб; гемангиому; неоваскулярную глаукому и псориаз, которые связаны с неадекватной или избыточной активацией рецепторов VEGF.
Соединения и способы использования по изобретению предназначены, далее, для лечения животных и пациентов, которые имеют или подвержены риску развития, артериовенозные мальформации (AVM), менингиому и сосудистые рестенозы, включающие рестенозы после ангиопластики, состояния, которые также связаны с неадекватной или избыточной активацией рецепторов VEGF. Другими предполагаемыми мишенями терапевтических способов и применений являются животные и пациенты, которые имеют (или подвержены риску развития) следующие состояния, связанные с рецепторами VEGF: ангиофиброма, дерматит, эндометриоз, гемофилический гемартроз, гипертрофические рубцы, воспалительные заболевания или нарушения, пиогенная гранулема, склеродермия, синовиит, трахома и сосудистые адгезии.
Лечебные группы, приведенные выше, не являются исчерпывающими для состояний, когда может применяться лечение с помощью bsBAs по изобретению. Патент США № 5712291, приведенный здесь в качестве ссылки, раскрывает способ идентификации большого числа других состояний, которые могут эффективно лечиться с использованием bsBAs по изобретению, когда эффекторный домен направлен на один из рецепторов VEGF. Более того, дополнительные состояния, которые могут лечиться с использованием bsBAs по изобретению, который имеет эффекторный домен связывания VEGFR, могут быть найдены, например, в патенте США №. 6703020, приведенном здесь в качестве ссылки.
Рецептор фактора некроза опухолей (TNFR)
Факторы некроза опухолей (TNF) альфа и бета являются цитокинами, которые действуют через рецепторы TNF для регуляции многих биологических процессов, включающих защиту от инфекции, и индукцию шока и воспалительных заболеваний. Молекулы TNF принадлежат к надсемейству «TNF-лиганд» и действуют вместе со своими рецепторами или контр-лигандами, надсемейство «TNF-рецептор». В настоящее время идентифицировано девять членов надсемейства TNF-лиганд и охарактеризовано десять членов надсемейства TNF-рецептор.
Среди лигандов они включают TNF-, лимфотоксин- (LT-, также известный как TNF-β), LT-β (обнаруженный в комплексном гетеротримере LT-2-β), FasL, CD40L, CD27L, CD30L, 4-1BBL, OX40L и фактор роста нервов (NGF). Надсемейство TNF-рецепторов включает рецептор p55TNF, рецептор p75TNF, связанный с рецептором TNF белок, FAS антиген или APO-1, CD40, CD27, CD30, 4-1BB, OX40, p75 с низким сродством и NGF-рецептор (см., например, A. Meager, Biologicals 22:291-295, 1994).
Многие члены надсемейства TNF-лигандов экспрессируются активированными T-клетками, что позволяет предположить, что они необходимы для взаимодействия Т-клеток с другими типами клеток, которые лежат в основе клеточного онтогенеза и функций. (Meager 1994, выше). Значительный прогресс в понимании основных функций некоторых членов семейства TNF-рецепторов был достигнут после идентификации и создания мутантов, не экспрессирующих эти белки. Например, естественно возникающие мутации антигена FAS и его лиганда вызывают лимфопролиферативное заболевание (см., например, Watanabe-Fukunaga et al., Nature 356:314, 1992), возможно, отражая нарушение запрограммированной клеточной смерти. Мутации лиганда CD40 вызывают сцепленное с Х-хромосомой иммунодефицитное состояние, характеризующееся высокими уровнями иммуноглобулина М и низкими уровнями иммуноглобулина G в плазме, что показывает дефект Т-зависимой активации В-клеток (см., например, R. C. Allen et al., Science 259:990, 1993). Мутации, мишенями которых является рецептор фактора роста нервов с низким сродством, вызывают нарушение, характеризующееся дефектом чувствительной иннервации периферических структур (см., например, Lee et al., Cell 69:737, 1992).
Лиганды TNFR, TNF и LT-, способны связываться с двумя рецепторами TNF (55- и 75-kd рецепторы TNF). Большое количество биологических эффектов, вызванных TNF и LT-, действующих через свои рецепторы, включают геморрагический некроз трансплантированных опухолей, цитотоксичность, роль в эндотоксическом шоке, воспалении, иммунорегуляции, пролиферации и антивирусных ответах, а также защиту от повреждающего действия ионизирующей радиации. TNF и LT- вовлечены в патогенез широкого спектра заболеваний, включающего эндотоксический шок, церебральную малярию, опухоли, аутоиммунные заболевания, СПИД и отторжение трансплантат-хозяин (Beutler and Von Huffel, Science 264:667-668, 1994). Мутации рецептора p55 вызывают увеличение восприимчивости к микробной инфекции.
Другой TNFR, TNF-связанный апоптоз-индуцирующий лиганд или «TRAIL», экспрессируется во многих человеческих тканях (например, в селезенке, легких, предстательной железе, тимусе, яичниках, тонком кишечнике, толстом кишечнике, лимфоцитах периферической крови, плаценте, почках). Было показано, что TRAIL действует независимо от лиганда FAS и быстро активирует апоптоз примерно в тех же временных рамках, что и сигнал к смерти от Fas/Apo-1L, но гораздо быстрее, чем TNF-индуцированный апоптоз.
Известно, что семейство лигандов фактора некроза опухолей (TNF) относится к наиболее плейотропным цитокинам, вызывая большое количество клеточных ответов, включающих цитотоксичность, антивирусную активность, иммунорегуляторную активность и регуляцию транскрипции некоторых генов. Клеточный ответ на лиганды семейства TNF включает не только нормальные физиологические ответы, но также и заболевания, связанные с повышенным апоптозом или ингибированием апоптоза. Запрограммированная апоптозом клеточная гибель является физиологическим механизмом, вовлеченным в удаление периферических Т-лимфоцитов иммунной системы, и нарушение его регуляции может вести к большому числу различных патогенетических процессов. Заболевания, связанные с повышенной выживаемостью клеток или ингибированием апоптоза, включают рак, аутоиммунные нарушения, вирусные инфекции, воспаление, болезнь «трансплантат против хозяина», острое отторжение трансплантата и хроническое отторжение трансплантата. Заболевания, связанные с усилением апоптоза, включают СПИД, нейродегенеративные нарушения, миелодиспластические синдромы, ишемическое повреждение, индуцированное токсином заболевание печени, септический шок, кахексию и анорексию.
bsBA по изобретению может быть получен таким образом, что, по меньшей мере, один из двух связывающих доменов специфично связывается с TNFR. Такой bsBA может затем быть использован в способах лечения рака, аутоиммунных нарушений, вирусных инфекций, воспаления, болезни «трансплантат против хозяина», острого отторжения трансплантата и хронического отторжения трансплантата путем активации TNFR, например, через связывание TNFR, вызывая, таким образом, апоптоз и предотвращая или уменьшая неадекватный рост клеток (например, в случае рака). В предпочтительном варианте осуществления одна из связывающих молекул bsBA связывается с TNFR, а вторая связывающая молекула связывается со вторым рецептором, который, как известно, экспрессируется на клетке-мишени (например, со вторым, отличающимся от первого, TNFR или с рецептором, специфичным для заболевания). В случае рака предпочтительным вторым рецептором является рецептор семейства ErbB, такой как ErbB2. Предпочтительно связывающая молекула bsBA, которая связывается с TNFR, имеет меньшее сродство, чем сродство, которое вторая связывающая молекула имеет к этому рецептору.
Альтернативно, bsBA по изобретению может быть получен таким образом, что, по меньшей мере, одна из двух связывающих молекул bsBA специфично связывается с TNFR и предотвращает или уменьшает активацию TNFR, например, путем блокирования связывания лиганда с TNFR. Такой bsBA может затем быть использован в способах лечения СПИД, нейродегенеративных нарушений, миелодиспластических синдромов, ишемических повреждений, индуцированного токсином заболевания печени, септического шока, кахексии и анорексии путем предотвращения или уменьшения активации TNFR, например, путем предотвращения или уменьшения связывания лиганда с TNFR, таким образом, предотвращая или уменьшая апоптоз. Предпочтительно bsBA, в котором, по меньшей мере, одна из двух связывающих молекул bsBA специфично связывается с TNFR, используется для лечения заболевания, при котором наблюдается повышенный апоптоз (например, ишемического повреждения). В предпочтительном варианте осуществления домен bsBA направлен на антиген или на второй рецептор, который экспрессируется на клетке-мишени (например, на рецептор, отличный от TNFR) и который используется для направления bsBA на клетку-мишень.
Рецептор фактора роста фибробластов (FGFR)
Сигнальный путь фактора роста фибробластов (FGF) является важным участником нормального развития и заживления повреждений. FGF вызывают свои эффекты через рецепторы клеточной поверхности, которые являются членами семейства тирозинкиназ. У человека 4 различных рецептора фактора роста фибробластов (FGFR) были идентифицированы (FGFR1-FGFR4).
FGFR активируются аутофосфорилированием, следующим за димеризацией. Димеризация происходит после связывания лиганда в присутствии сульфата гепарана и приводит к фосфорилированию нескольких остатков тирозина с цитоплазматическим FGFR. Фосфорилирование FGFR активирует киназную активность и ведет к активации MAPK, PI3 киназы и Stat1/3 путей.
Мутации генов FGFR обычно приводят к мутациям усиления функции, результатом которых являются заболевания или нарушения, связанные с неадекватной активацией рецепторов. Мутации FGFR связаны с некоторыми нарушениями развития, включающими, например, синдром Пфейффера, синдром Джексона-Вайсса, синдром Кроузона, синдром Аперта, синдром чернеющего акантоза Бира-Стивенсона, акроцефалосиндактилию III типа, ахондроплазию, танатофорическую дисплазию, гипохондроплазию, синдром Муенке и тяжелую ахондроплазию с отставанием развития и дисплазией с чернеющим акантозом (SADDAN). Также обнаружена избыточная экспрессия FGFR в образцах многих опухолей в сравнении с нормальными тканями с применением иммуногистохимии. Например, избыточная экспрессия FGFR обнаружена при первичном колоректальном раке, раке поджелудочной железы, раке молочной железы и раке толстого кишечника. Молекулы FGF действуют как митогенные, ангиогенные и антиапоптотические факторы и, вероятно, вовлечены в канцерогенез.
bsBA по изобретению может быть получен таким образом, что, по меньшей мере, одна из двух связывающих молекул bsBA специфично связывается с FGFR и предотвращает или уменьшает активацию FGFR, например, путем блокирования связывания лиганда с FGFR или путем предотвращения или уменьшения димеризации FGFR. Такой bsBA может затем быть использован в способах лечения синдрома Пфейффера, синдрома Джексона-Вайсса, синдрома Кроузона, синдрома Аперта, синдрома чернеющего акантоза Бира-Стивенсона, акроцефалосиндактилии III типа, ахондроплазии, танатофорической дисплазии, гипохондроплазии, синдрома Муенке, тяжелой ахондроплазии с отставанием развития и дисплазией с чернеющим акантозом (SADDAN), первичного колоректального рака, рака поджелудочной железы, рака молочной железы и рака толстого кишечника путем предотвращения или уменьшения активации FGFR. В предпочтительном варианте осуществления домен bsBA направлен на второй рецептор, который экспрессируется на клетке-мишени (например, на рецептор, отличный от FGFR) и который используется для направления bsBA на клетку-мишень.
Рецептор тромбоцитарного фактора роста (PDGFR)
Семейство PDGFR активирует нижележащие сигнальные ферменты, которые стимулируют рост и подвижность клеток соединительной ткани, таких как сосудистые гладкомышечные клетки (VSMC), олигодендроциты (клетки ткани, покрывающей нервные волокна) и хондроциты (клетки хряща). Бета рецептор PDGF необходим для направления дифференцировки VSMC.
Избыточная экспрессия пути PDGFR приводит к различным серьезным заболеваниям, включающим атеросклероз и рак, которые связаны с неадекватной или повышенной активацией PDGFR. Альтернативно, может быть желательным усиление активации PDGFR для улучшения восстановления костей, периодонта, связок и хрящей.
bsBA по изобретению может быть получен таким образом, что, по меньшей мере, одна из двух связывающих молекул bsBA специфично связывается с PDGFR и предотвращает или уменьшает активацию PDGFR, например, путем блокирования связывания лиганда с PDGFR. Такой bsBA может затем быть использован в способах лечения, например, атеросклероза и рака путем предотвращения или уменьшения активации PDGFR. В предпочтительном варианте осуществления вторая связывающая молекула bsBA направлена на второй рецептор, который экспрессируется на клетке-мишени (например, на рецептор, отличный от PDGFR) и который используется для направления bsBA на клетку-мишень. Предпочтительно связывающая молекула bsBA, которая связывается с PDGFR, должна иметь меньшее сродство, чем сродство, которое вторая связывающая молекула имеет к этому рецептору.
Альтернативно, bsBA по изобретению может быть получен таким образом, что, по меньшей мере, одна из двух связывающих молекул bsBA специфично связывается с и активирует PDGFR. Такой bsBA может затем быть использован в способах для улучшения восстановления костей, периодонта, связок и хрящей путем активации PDGFR. В предпочтительном варианте осуществления эффекторный домен bsBA связывается с PDGFR, а домен, направленный на мишень, связывается с антигеном или со вторым рецептором, о котором известно, что он экспрессируется на клетке-мишени (например, со вторым, отличным от PDGFR, или с рецептором, специфичным для костей, периодонта, связок и хрящей).
Рецептор C-Kit (также известный как рецептор фактора Steel)
Прото-онкоген c-Kit является трансмембранным рецептором тирозинкиназного типа, необходимым для развития и пролиферации меланоцитов. Прото-онкоген c-Kit кодирует трансмембранный рецептор тирозинкиназного типа, относящийся к субсемейству рецепторов тромбоцитарного фактора роста PDGF/CSF-1(c-fms). Обнаружено, что с-Kit играет важную роль в нормальном росте и дифференцировке эмбриональных меланобластов. Злокачественная трансформация меланоцитов и прогрессирование меланомы человека связаны со снижением экспрессии прото-онкогена c-Kit. Экспрессия тирозинкиназного рецептора, кодируемого прото-онкогеном c- Kit, постепенно снижается в процессе роста опухоли и инвазии меланомы человека.
bsBA по изобретению может быть получен таким образом, что, по меньшей мере, одна из двух связывающих молекул bsBA специфично связывается с и активирует рецептор c-Kit. Такой bsBA может затем быть использован в способах лечения, например, меланомы. В предпочтительном варианте осуществления домен bsBA, направленный на мишень, направлен на антиген или на второй рецептор, который экспрессируется на клетке-мишени (например, на рецептор, отличный от рецептора c-Kit), который используется для направления bsBA на клетку-мишень.
Рецепторы Fc (FcR)
Рецепторы Fc являются специфичными рецепторами клеточной поверхности для комплексов антиген-антитело или агрегированных иммуноглобулинов, которые связываются с участком в Fc-области молекулы иммуноглобулина и могут проявлять специфичность к определенным классам иммуноглобулинов. FcR обнаружены на B-клетках, K-клетках, макрофагах, нейтрофилах и эозинофилах и в процессе некоторых стадий развития на T-клетках; рецепторы на K-клетках, макрофагах и нейтрофилах связываются с опсонизирующими антителами, связанными с антигенами, и запускают фагоцитоз антигена.
Известно, что человеческие FcR связаны с развитием или прогрессированием аутоиммунных заболеваний (например, системной красной волчанки, аутоиммунной тромбоцитопенической пурпурой, миастенией гравис, множественным склерозом, увеитом и офтальмопатией, связанной с тиреоидитом) и аллергических реакций на аллерген. Естественное ингибирование FcR ответственно за поддержание периферической толерантности, предотвращая, таким образом, развитие аутоиммунитета и аутоиммунных заболеваний. Напротив, недостаточная активация FcR приводит к формированию защитного фенотипа, разобщая аутоиммунитет от аутоиммунных заболеваний.
bsBA по изобретению может быть получен таким образом, что, по меньшей мере, одна из двух связывающих молекул bsBA специфично связывается с FcR и предотвращает или уменьшает активацию FcR, например, путем блокирования его связывания с молекулами Ig или иммунными клетками. Такой bsBA может затем быть использован в способах лечения, например, аутоиммунных заболеваний, таких как системная красная волчанка, аутоиммунная тромбоцитопеническая пурпура, миастения гравис, множественный склероз, увеит и офтальмопатия, связанная с тиреоидитом. Обычно домен bsBA, направленный на мишень, направлен на антиген или на второй рецептор, который экспрессируется на клетке-мишени (например, на рецептор, отличный от FcR), который используется для направления bsBA на клетку-мишень.
Использование bsBA для связывания цитокиновых рецепторов
В важной группе вариантов осуществления домен, направленный на мишень, или эффекторный домен могут быть использованы для связывания цитокинового рецептора на клеточной поверхности. В некоторых вариантах осуществления, которые несколько менее предпочтительны, связывающий агент может быть естественным лигандом для цитокинового рецептора (например, IL-13 может быть использован как связывающий агент для связывания рецептора IL-13) или фрагментом такого лиганда, сохранившим способность связывать рецептор.
Примеры цитокиновых рецепторов (с альтернативными названиями, приведенными в скобках), которые могут быть связаны, при необходимости, доменом, направленным на мишень, или эффекторным доменом bsBA для получения нужного результата в способах по изобретению, включают:
Общая гамма цепь цитокинового рецептора (Гамма-C) (Гамма цепь рецептора интерлейкина-2) (IL-2R гамма цепь) (P64) (CD 132 антиген);
Альфа цепь рецептора интерлейкина-10 (IL-10R-A) (IL-10R1);
Бета цепь рецептора интерлейкина-10 (IL-10R-B) (IL-lOR2) (Цитокиновый рецептор класс-11 CRF2-4);
Бета-1 цепь рецептора интерлейкина-12 (IL-12R-бета1) (Бета рецептора интерлейкина-12) (Бета компонент рецептора IL-12) (IL-12RB1);
Бета-2 цепь рецептора интерлейкина-12 (Бета-2 рецептора IL-12) (IL-12R-бета2);
Альфа-1 цепь рецептора интерлейкина-13 (IL-13R-альфа-1) (IL-13RA-1) (CD213a1 антиген);
Альфа-2 цепь рецептора интерлейкина-13 (Белок, связывающий интерлейкин-13);
Рецептор интерлейкина-17 (рецептор IL-17);
Рецептор интерлейкина-17В (рецептор IL-17B) (гомолог 1 рецептора IL-17) (IL-17Rh1) (IL17Rhl) (Цитокиновый рецептор CRL4) (UNQ2501/PRO19612);
Предшественник рецептора интерлейкина-21 (IL-21 R);
Рецептор интерлейкина-1, тип I (IL-1R-1) (IL-1R-альфа) (P80) (Антиген CD121a);
Рецептор интерлейкина-1, тип II (IL-1R-2) (IL-1R-бета) (Антиген CDw121b);
Белок-антагонист рецептора интерлейкина-1 (IL-Ira) (IRAP) (IL1 ингибитор) (IL-1RN) (ICIL- 1RA);
Альфа цепь рецептора интерлейкина-2 (Альфа субъединица рецептора IL-2) (P55) (TAC антиген) (CD25 антиген);
Бета цепь рецептора интерлейкина-2 (рецептор IL-2) (P70-75) (Бета субъединица рецептора IL-2 высокого сродства) (CD122 антиген);
Альфа цепь рецептора интерлейкина-3 (IL-3R-альфа) (CD123 антиген);
Альфа цепь рецептора интерлейкина-4 (IL-4R-альфа) (CD 124 антиген);
Альфа цепь рецептора интерлейкина-5 (IL-5R-альфа) (CD125 антиген);
Альфа цепь рецептора интерлейкина-6 (IL-6R-альфа) (IL-6R1) (CD 126 антиген);
Бета цепь рецептора интерлейкина-6 (IL-6R-бета) (Трансдуктор сигнала интерлейкина-6) (Мембранный гликопротеин 130) (gp130) (Рецептор онкостатина M) (CDw130) (CD130 антиген);
Альфа цепь рецептора интерлейкина-7 (IL-7R-альфа) (CDw127) (CD127 антиген);
Рецептор А интерлейкина-8 высокого сродства (IL-8R A) (Рецептор IL-8 типа 1) (CXCR-1) (CDwl28a);
Рецептор В интерлейкина-8 высокого сродства (IL-8R B) (CXCR-2) (Рецептор GRO/MGSA) (Рецептор IL-8 типа 2) (CDwl28b);
Рецептор интерлейкина-9 (IL-9R);
Рецептор 1 интерлейкина-18 (Белок, связанный с рецептором IL1) (IL-lRrp);
Предшественник, подобный рецептору 1 интерлейкина-1 (белок ST2);
Белок, подобный рецептору 2 интерлейкина-1 (IL-lRrp2) (Белок, подобный рецептору 2 интерлейкина-1) (IL1R- rp2);
Рецептор 1, подобный Toll (Белок, подобный рецептору Toll/интерлейкина-1) (TIL);
Рецептор 2, подобный Toll (Белок, подобный рецептору 4 Toll/интерлейкина-1);
Рецептор 5, подобный Toll (Белок, подобный рецептору 3 Toll/интерлейкина-1);
CX3C хемокиновый рецептор 1 (C-X3-C CKR-1) (CX3CR1) (рецептор фракталкина) (GPR13) (V28) (Бета хемокиновый белок, подобный рецептору 1) (CMK-BRL-1) (CMKBLR1);
C-X-C хемокиновый рецептор типа 3 (CXC-R3) (CXCR-3) (CKR-L2) (CD183 антиген);
C-X-C хемокиновый рецептор типа 4 (CXC-R4) (CXCR-4) (Рецептор фактора 1 клеток стромы) (SDF-1 рецептор) (Фузин) (Рецептор лейкоцитарного седьмого трансмембранного домена) (LESTR) (LCR1) (FB22) (NPYRL) (HM89) (CD184 антиген);
C-X-C хемокиновый рецептор типа 5 (CXC-R5) (CXCR-5) (Рецептор 1 лимфомы Беркитта) (Моноцитарный рецептор 15) (MDR15);
C-X-C хемокиновый рецептор типа 6 (CXC-R6) (CXCR-6) (Рецептор, связанный с белком G bonzo) (Рецептор STRL33, связанный с белком G);
Белок 2, связывающий хемокин (Белок D6, связывающий хемокин) (C-C хемокиновый рецептор D6) (Хемокиновый рецептор CCR-9) (CC-хемокиновый рецептор CCR10);
C-C хемокиновый рецептор типа 1 (C-C CKR-1) (CC-CKR-1)(CCR-1) (CCR1) (Альфа рецептор воспалительного белка-1 макрофагов) (MIP-1альфа-R) (RANTES-R) (HM145) (LD78 рецептор);
C-C хемокиновый рецептор типа 2 (C-C CKR-2) (CC-CKR-2) (CCR-2) (CCR2) (Рецептор белка 1 моноцитарного хемоаттрактанта) (MCP-1-R);
C-C хемокиновый рецептор типа 3 (C-C CKR-3) (CC-CKR-3) (CCR-3) (CCR3) (CKR3) (Рецептор эотаксина эозинофилов);
C-C хемокиновый рецептор типа 4 (C-C CKR-4) (CC-CKR-4) (CCR-4) (CCR4) (K5-5);
C-C хемокиновый рецептор типа 5 (C-C CKR-5) (CC-CKR-5) (CCR-5) (CCR5) (Корецептор слияния ВИЧ-1) (CHEMR13) (CD195 антиген);
C-C хемокиновый рецептор типа 6 (C-C CKR-6) (CC-CKR-6) (CCR-6) (LARC рецептор) (GPR- CY4) (GPRCY4) (Белок, подобный хемокиновому рецептору 3) (CKR-L3) (DRY6);
Предшественник C-C хемокинового рецептора типа 7 (C-C CKR-7) (CC-CKR-7) (CCR-7) (MIP-3 бета рецептор) (EBV-индуцируемый рецептор 1, связанный с белком G) (EBI1) (BLR2);
C-C хемокиновый рецептор типа 8 (C-C CKR-8) (CC-CKR-8) (CCR-8) (GPR-CY6) (GPRCY6)
(Белок, подобный хемокиновому рецептору 1)(CKR-LI) (TER1) (CMKBRL2) (CC-хемокиновый рецептор CHEMRI);
C-C хемокиновый рецептор типа 9 (C-C CKR-9) (CC-CKR-9) (CCR-9) (GPR-9-6);
C-C хемокиновый рецептор типа 10 (C-C CKR-10) (CC-CKR-10) (CCR-10) (Рецептор 2, связанный с белком G);
C-C хемокиновый рецептор типа 11 (C-C CKR-11)(CC-CKR-11) (CCR-11) (Белок, подобный хемокиновому рецептору 1) (CCRLl) (CCX CKR);
Белок, подобный хемокиновому рецептору 1 (Рецептор DEZ, связанный с белком G) (Рецептор ChemR23, связанный с белком G);
Белок, подобный хемокиновому рецептору 2 (IL8-связанный рецептор DRY12) (Индуцируемый потоком эндотелиальный рецептор, связанный с белком G) (FEG-1) (Рецептор GPR30, связанный с белком G) (GPCR-BR);
Рецептор 1 хемокина XC (XC хемокиновый рецептор 1) (Рецептор лимфотактина) (Рецептор 5, связанный с белком G).
Использование bsBAs для связывания ассоциированных с опухолью антигенов
В чрезвычайно важной группе вариантов осуществления домен bsBA, направленный на мишень, связывает ассоциированный с опухолью антиген. В соответствии с названием ассоциированные с опухолью антигены (TAA) являются типичными антигенами, которые экспрессируются на клетках именно опухолей, но при этом обычно не экспрессируются на нормальных клетках. Часто TAA являются антигенами, которые в норме экспрессируются на клетках только в определенных стадиях развития организма (таких как внутриутробный период) и которые оказываются неадекватно экспрессированными в организме на текущей стадии развития, или являются антигенами, которые нормальные ткани или клетки органа не экспрессируют, но в настоящее время начали экспрессировать. В число TAA, известных науке, входят MART-1, канцероэмбриональный антиген («CEA»), gp100, MAGE-1, HER-2 и антигены LewisY, а также антигены, идентифицированные, например, в патентах США №№ 5922566 и 6020478 и WO 2004/016643 A2.
Другие ассоциированные с опухолью антигены, пригодные быть мишенями для bsBA по изобретению, включают:
- антигены гематопоэтической дифференцировки - гликопротеины, обычно связанные с группами кластеров дифференцировки (CD), такие как CD5, CD19, CD20, CD22, CD33, CD45, CD52 и CD147;
- антигены дифференцировки клеточной поверхности, включающие гликопротеины, такие как канцероэмбриональный антиген (CEA, Swiss-Prot идентификационный № P06731), ассоциированный с опухолью гликопротеин (TAG-72, также идентифицированный как CA72-4, см., например, Hombach et al., Gastroenterology. 113(4):1163-70 (1997)), полиморфный эпителиальный муцин (PEM), молекула адгезии эпителиальных клеток (Ep-CAM), MUC-1, A33, G250, E-кадгерин, простата-специфичный мембранный антиген (PSMA, Swiss-Prot идентификационный № Q04609) и простата-специфичный антиген (PSA), гликолипиды, такие как ганглиозиды, например, GD2, GD3, GM2) и карбогидраты, такие как антигены, связанные с группами крови, включающие LEY и LEb (LEY - это "LewisY", также известный как «CD174»; это дифукозилированный тетрасахарид, обнаруженный на олигосахаридах гликолипидов и гликопротеинов группы крови 2);
- рецепторы факторов роста, включающие рецептор эпидермального фактора роста (EGFR, ErbB1, Swiss-Prot идентификационный № P00533) и их мутантные формы EGFRvIII, ErbB2 (HER-2/neu,Swiss-Prot идентификационный № P04626), ErbB3 (HER-3, Swiss-Prot идентификационный № P21860) и рецептор IL-2;
- антигены стромы и ангиогенеза, включающие белок активации фибробластов (FAP), рецептор эндотелиального фактора роста (VEGFR), танасцин и интегрин; и
- семейство рецепторов Frizzled (например, Fz-2).
В некоторых вариантах осуществления домен bsBA направлен на связывание мишени TAA, тогда как эффекторный домен связывается с рецептором фактора роста.
В некоторых предпочтительных вариантах осуществления домен bsBA направлен на молекулу, выбранную из CEA (Swiss-Prot идентификационный № P06731), ErbB2 (Swiss-Prot идентификационный № P04626), EGFR (Swiss-Prot идентификационный № P00533), LewisY, MUC-1 (Swiss-Prot идентификационный № P15941 ), EpCAM (мишень mAb17-lA (эдреколомаб, Panorex®, Glaxo Wellcome GmbH)), CA125 (Swiss- Prot идентификационный № Q96RK2), PSMA (Swiss-Prot идентификационный № Q04609), TAG72, CD20 (Swiss-Prot идентификационный № P11836), CD19 (Swiss-Prot идентификационный № P15391), CD22 (Swiss-Prot идентификационный № P20273), и CD36 (Swiss-Prot идентификационный № P16671). Нужно иметь в виду, что антигены CD, в частности, часто экспрессируются на нормальных клетках, но избыточно экспрессируются на некоторых раковых клетках или являются маркерами некоторых раков.
В некоторых предпочтительных вариантах осуществления эффекторный домен связывается с молекулой, выбранной из ErbB3 (Swiss-Prot идентификационный № P21860), ErbB4 (Swiss-Prot идентификационный № Q15303), рецепторов FGF 1-4 (Swiss-Prot идентификационные №№ P22455, Pl 1362, P21802, P22607), рецептора HGF (Swiss-Prot идентификационный № P08581), IGF1-R (Swiss-Prot идентификационный № P08069), рецептора инсулина (Swiss-Prot идентификационный № P06213), альфа и бета рецепторов PDGF (Swiss-Prot идентификационные №№ P16234, P09619 соответственно) и C-KIT (Swiss-Prot идентификационный № PI 0721). В некоторых особо предпочтительных вариантах осуществления домен, направленный на мишень, связывается с молекулой, как описано в предыдущем параграфе, а эффекторный домен связывается с молекулой, как описано в настоящем параграфе.
Аптамеры
bsBA, в которых одна или обе связывающие молекулы являются аптамерами, могут быть получены, как описано в патенте США № 5756291, включенного сюда в качестве ссылки. Аптамеры обычно получали с помощью способа "SELEX" (сокращенное «систематическая эволюция лигандов путем экспоненциального обогащения»). Этот многократный процесс использовали для идентификации аптамера к выбранной молекулярной мишени. Для начала создавали большую «библиотеку» молекул нуклеиновых кислот. На стадии селекции изолировали молекулы с наибольшим сродством к интересующей мишени.
Библиотеку нуклеотидных последовательностей экспонировали с белком клеточной поверхности и инкубировали определенное время. Молекулы из библиотеки со слабым или отсутствующим сродством к мишени отмывали, а молекулы, связавшиеся с мишенью, среди которых были аптамеры с высоким сродством, очищали от мишени и использовали для следующих стадий процесса SELEX.
Захваченные очищенные последовательности копировали ферментативно, или «амплифицировали», для создания новой библиотеки молекул, существенно обогащенной молекулами, способными связаться с мишенью. Обогащенную библиотеку использовали для начала нового цикла селекции, разделения и амплификации. После 5-15 циклов завершенного процесса библиотека молекул уменьшается от 1015 уникальных последовательностей до небольшого числа тех, которые плотно связываются с интересующим белком клеточной поверхности. Индивидуальные молекулы в смеси затем изолировали, определяли их нуклеотидные последовательности и измеряли их свойства, прежде всего сродство связывания, в целом так же, как для антител. Часто аптамеры в дальнейшем очищают для удаления любых нуклеотидов, которые не соответствуют мишени связывания или структуре аптамера. Аптамеры, процессированные до своих коровых связывающих доменов, обычно различаются по длине от 15 до 60 нуклеотидов. Два аптамера могут быть связаны нуклеотидным линкером или химической перекрестной связью с формированием биспецифических аптамеров, или один аптамер может быть сходным образом связан с антителом или фрагментом антитела с формированием химерной молекулы антитело-ДНК.
Создание биспецифических BA путем химического перекрестного взаимодействия
Две связывающие молекулы биспецифических блокирующих агентов, таких как биспецифические антитела, объединяли с использованием соответствующих способов конъюгации, известных специалистам в этой области науки, таких как описанные Hermanson, выше. В некоторых вариантах осуществления две связывающие молекулы bsBA объединяли с использованием химических связей. Пример биспецифических антител, полученных с использованием химических связей, ранее описан в Brennan et al., (Science, 229:81 (1985)) и также может быть использован для получения bsBA по настоящему изобретению. Интактные антитела расщепляли протеолитически для образования F(ab')2. Эти фрагменты редуцировали в присутствии арсенита натрия, агента, образующего дитиоловые комплексы, для стабилизации вицинальных дитиолов и предотвращения образования межмолекулярных дисульфидов. Образовавшиеся фрагменты Fab' затем конвертировали до производных тионитробензоата (TNB). Один из производных Fab'-TNB затем реконвертировали в Fab'-тиол путем редукции с меркаптоэтиламином и смешивали с эквимолярным количеством другого производного Fab'-TNB для формирования биспецифического антитела. Полученные биспецифические антитела могут использоваться как агенты для селективной иммобилизации ферментов.
Другое предпочтительное химическое связывание использует би-малеимидогексан или би-малеимидоэтан для перекрестного связывания. Фрагменты антител, содержащие SH-группы для перекрестного связывания, могут также быть получены рекомбинантно (например, Shalaby et al., J. Exp. Med., 175:217-225 (1992)), чтобы избежать протеолитического расщепления антител полной длины.
Создание bsBA с помощью рекомбинантных или синтетических способов
bsBA могут также быть получены с помощью рекомбинантных способов. Последовательности нуклеиновых кислот, кодирующие bsBA, могут быть получены любым подходящим способом, включающим, например, клонирование соответствующих последовательностей или прямой химический синтез такими способами, как фосфотриэфировый способ Narang, et al., Meth. Enzymol. 68:90-99 (1979); фосфодиэфировый способ Brown, et al., Meth. Enzymol. 68:109-151 (1979); диэтилфосфорамидитовый способ Beaucage, et al., Tetra. Lett. 22:1859-1862 (1981); твердофазный способ, основанный на триэфире фосфорамидита, описанный Beaucage & Caruthers, Tetra. Letts. 22 (20):1859-1862, например, с использованием автоматического синтезатора, как описано, например, в Needham-VanDevanter, et al. Nucl. Acids Res. 12:6159-6168 (1984); и способ на твердой основе, описанный в патенте США № 4458066. Химический синтез позволяет получить одноцепочечный олигонуклеотид. Он может быть превращен в двухцепочечную ДНК путем гибридизации с комплементарной последовательностью или путем полимеризации ДНК-полимеразой с использованием одной цепочки как матрицы. Специалист определит, что тогда как химический синтез ограничен последовательностью из 100 оснований, более длинные последовательности могут быть получены путем лигирования коротких последовательностей.
В предпочтительных вариантах осуществления последовательности нуклеиновых кислот, кодирующие bsBA, получали с помощью способов клонирования. Примеры соответствующих способов клонирования и сиквенса и инструкции, достаточные, чтобы провести специалиста через многочисленные стадии клонирования, находятся в Sambrook, et al., MOLECULAR CLONING: A LABORATORY MANUAL (2ND ED.), Vols.1-3, Cold Spring Harbor Laboratory (1989)), Berger and Kimmel (eds.), GUIDE TO MOLECULAR CLONING TECHNIQUES, Academic Press, Inc., San Diego CA(1987)), или Ausubel, et al. (eds.), CURRENT PROTOCOLS IN MOLECULAR BIOLOGY, Greene Publishing and John Wiley & Sons, Inc., (1987, 1995 Supplement) (Ausubel)). Информация от производителей биологических реагентов и экспериментального оборудования также содержит полезные сведения. Такие производители включают химическую компанию SIGMA (Saint Louis, MO), R&D systems (Minneapolis, MN), Pharmacia Amersham (Piscataway, NJ), CLONTECH Laboratories, Inc.*(Palo Alto, Калифорния), Chem Genes Corp., Aldrich Chemical Company (Milwaukee, WI), Glen Research, Inc., GIBCO BRL Life Technologies, Inc. (Gaithersburg, MD), Fluka Chemica-Biochemika Analytika (Fluka Chemie AG, Buchs, Швейцария), Invitrogen (San Diego, Калифорния), и Applied Biosystems (Foster City, Калифорния), а также многих других коммерческих источников, известных специалистам.
Когда нуклеиновые кислоты, кодирующие bsBA, клонированы, становится возможным экспрессировать желаемый белок в рекомбинантно сконструированной клетке, такой как бактериальная, растительная, дрожжевая клетка, или в клетках насекомых и млекопитающих. Желательно, чтобы специалист в этой области науки был ознакомлен с различными системами экспрессии, приемлемыми для экспрессии белков, включающими E. coli, другие бактериальные хозяева, дрожжи и различные высшие эукариотические клетки, такие как COS, CHO, HeLa и миеломные клеточные линии. Здесь не приводятся детальные описания различных способов, известных для экспрессии белков в клетках прокариот и эукариот.
Специалист в этой области науки сможет определить, какие модификации могут быть проведены нуклеиновой кислотой, кодирующей bsBA, без уменьшения его биологической активности. Некоторые модификации могут быть сделаны для облегчения клонирования, экспрессии или включения в белок слияния молекулы, направленной на мишень. Такие модификации хорошо известны специалистам в этой области науки и включают, например, терминальные кодоны, метионин, добавленный к аминоконцу для определения участка инициации, и дополнительные аминокислоты, помещаемые на любой конец для создания удобно расположенных участков рестрикции.
В дополнение к рекомбинантным способам, bsBA может быть получен полностью или частично с использованием стандартного пептидного синтеза. Твердофазный синтез полипептидов по настоящему изобретению, состоящих из менее чем 50 аминокислот, может быть выполнен путем прикрепления C-концевой аминокислоты последовательности к нерастворимой основе, после чего последовательно добавляются остальные аминокислоты последовательности. Способы твердофазного синтеза описаны в Barany & Merrifield, The Peptides: Analysis, Synthesis, Biology. Vol. 2: Special Methods in Peptide Synthesis, Part A. pp. 3-284; Merrifield, et al. J. Am. Chem. Soc. 85:2149-2156 (1963), и Stewart, et al., Solid Phase Peptide Synthesis, 2nd ed., Pierce Chem. Co., Rockford, Ill. (1984). Белки большей длины могут быть синтезированы соединением амино- и карбоксильных концов более коротких фрагментов. Способы образования пептидных связей путем активации С-концов (например, с использованием связывающего реагента N,N'-дициклогексилкарбодиимида) известны специалистам в этой области науки.
После экспрессирования рекомбинантный bsBA может быть очищен с использованием стандартных способов, известных в науке, включающих преципитацию сульфатом аммония, аффинные колонки, хроматографические колонки и подобные способы (см., в общем, R. Scopes, Protein Purification, Springer-Verlag, N.Y. (1982)). Предпочтительными являются тщательно очищенные соединения с однородностью, по меньшей мере, от 90 до 95%, а наиболее предпочтительными для фармацевтического использования являются соединения с однородностью от 98 до 99% или более. Будучи очищенными, частично или до желаемой степени однородности, если предстоит терапевтическое применение, полипептиды должны быть свободны от эндотоксинов.
Способы экспрессии одноцепочечных антител и/или рефолдинга в соответствующую активную форму, включая одноцепочечные антитела, из бактерий, таких как E. coli, описаны и хорошо известны и применимы к bsBA по этому изобретению, особенно те, которые используют антитела. См. Buchner, et al., Anal. Biochem. 205:263-270 (1992); Pluckthun, Biotechnology 9:545 (1991); Huse, et al., Science 246:1275 (1989) и Ward, et al., Nature 341:544 (1989), которые включены здесь в качестве ссылки.
Часто функциональные гетерологичные белки E. coli или других бактерий изолируют из внутриклеточных телец, и они требуют растворения с помощью сильных денатурантов с последующим рефолдингом. В процессе стадии растворения, как это хорошо известно в науке, должен присутствовать восстановитель для разделения дисульфидных связей. Примером буфера с восстановителем является: 0,1 M Tris pH 8, 6 M гуанидина, 2 мМ EDTA, 0,3 M DTE (дитиоэритритол). Реокисление дисульфидных связей может происходить в присутствии тиоловых реагентов с низким молекулярным весом в восстановленной и окисленной форме, как описано в Saxena, et al., Biochemistry 9:5015-5021 (1970), включенной здесь в качестве ссылки, и особенно, как описано в Buchner, et al., выше.
Ренатурацию обычно проводят путем разведения (например, 100-кратного) денатурированного и восстановленного белка в рефолдинговом буфере. Примером буфера является: 0,1 M Tris, pH 8,0, 0,5 M l-аргинина, 8 мМ окисленного глутатиона (GSSG), и 2 мМ EDTA.
Как модификация протокола очистки двухцепочечного антитела, участки тяжелой и легкой цепи растворяли раздельно, восстанавливали, а затем объединяли в рефолдинговом растворе. Наилучшего результата достигали, когда эти два белка смешивали в молярном соотношении таким образом, что превышение количества одного белка над другим не превышало 5-кратного. Желательно добавлять в рефолдинговый раствор избыток окисленного глутатиона или другого окисляющего соединения с низким молекулярным весом после того, как окислительно-восстановительный процесс завершен.
Терапевтические способы, основанные на bsBA
Далее настоящее изобретение относится к способам лечения, основанным на bsBA, которые включают введение bsBA по изобретению животным, преимущественно млекопитающим, а наиболее предпочтительно - человеку, для лечения одного или более описанных заболеваний или нарушений.
Терапевтические соединения по изобретению включают, но не ограничиваются ими, bsBA по изобретению. bsBA по изобретению могут использоваться для лечения, подавления или предотвращения заболеваний или нарушений описанных здесь, которые связаны с измененной экспрессией и/или активностью рецептора клеточной поверхности. Лечение и/или предотвращение заболеваний и нарушений, связанных с измененной экспрессией и/или активностью рецептора клеточной поверхности, включают, но не ограничиваются ими, облегчение симптомов, ассоциированных с такими заболеваниями и нарушениями. bsBA по изобретению может применяться в фармацевтически приемлемых соединениях, как это известно в науке или описано здесь. Применяя приведенные здесь указания, любой специалист в этой области науки сможет использовать bsBA по настоящему изобретению для диагностики, мониторинга или лечебного воздействия, без лишних экспериментов.
bsBA по изобретению может вводиться отдельно или в комбинации с другими типами лечения (например, радиационной терапией, химиотерапией, гормональной терапией, иммунотерапией и противоопухолевыми агентами).
Основанное на bsBA лечебное/профилактическое соединение и его введение
Изобретение относится к способам лечения, подавления и профилактики путем введения субъекту эффективного количества bsBA по изобретению, предпочтительно биспецифического антитела по изобретению. В предпочтительном аспекте bsBA тщательно очищен (например, тщательно очищен от субстанций, которые ограничивают его эффект или вызывают нежелательные побочные эффекты). Субъект является преимущественно животным, включая, но не ограничиваясь ими, таких животных, как коровы, свиньи, лошади, цыплята, кошки и собаки, и является преимущественно млекопитающим и наиболее предпочтительно - человеком.
Известны различные системы доставки, которые могут использоваться для введения bsBA по изобретению, например инкапсулирование в липосомах, микрочастицы, микрокапсулы, рекомбинантные клетки, способные экспрессировать bsBA, рецептор-опосредованный эндоцитоз (см., например, Wu and Wu, J. Biol. Chem. 262:4429-4432, 1987), конструкцию нуклеиновой кислоты как части ретровирусного или другого вектора и др. Способы введения включают, но не ограничиваются ими, внутрикожный, внутримышечный, интраперитонеальный, внутривенный, подкожный, интраназальный, эпидуральный и оральный пути. bsBA могут вводиться любым удобным путем, например через инфузию или болюсную инъекцию, путем абсорбции через эпителиальные или слизисто-кожные оболочки (например, слизистую полости рта, прямой кишки и тонкого кишечника, и др.), может вводиться вместе с другими биологически активными агентами. Введение может быть системным или местным. Кроме того, может быть желательным введение bsBA по изобретению в центральную нервную систему любым приемлемым путем, включающим интравентрикулярные и интратекальные инъекции. Интравентрикулярные инъекции могут осуществляться через интравентрикулярный катетер, например, подключенный к резервуару, такому как резервуар Ommaya. Введение через легкие также может применяться, например, путем использования ингалятора или распылителя в сочетании с аэрозольным агентом.
В особом варианте осуществления может быть желательным введение bsBAs по изобретению местно в область, нуждающуюся в лечении; это может быть достигнуто путем, и не только этим путем, например, местной инфузии во время оперативного лечения, местной аппликации, например, в сочетании с ушиванием раны после операции, путем инъекции, с помощью катетера, с помощью суппозитория или с помощью имплантата, который может быть пористым, непористым или изготовленным из желатиноподобного материала, включая мембраны, такие как сиаластичные мембраны, или нити. Предпочтительно при введении bsBA по изобретению, например, антитела, с осторожностью следует использовать материалы, которые не абсорбируют bsBA.
В другом варианте осуществления bsBA может доставляться в частицах, в частности в липосомах (см. Langer, Science 249:1527-1533, 1990; и Treat et al., in Liposomes in the Therapy of Infectious Disease and Cancer, Lopez-Berestein and Fidler (eds.), Liss, New York, pp. 353-365, 1989).
Еще в одном варианте осуществления bsBA может доставляться в системе с контролем высвобождения. В одном варианте осуществления может применяться насос (см. Langer, выше; Sefton, CRC Crit. Ref. Biomed. Eng. 14:201, 1987; Buchwald et al., Surgery 88:507, 1980; Saudek et al., N. Engl. J. Med. 321:574, 1989). В другом варианте осуществления могут применяться полимерные материалы (см. Medical Applications of Controlled Release, Langer and Wise (eds.), CRC Pres., Boca Raton, Fla. (1974); Controlled Drug Bioavailability, Drug Product Design and Performance, Smolen and Ball (eds.), Wiley, N. Y. (1984); Ranger and Peppas, J., 1983, Macromol. Sci. Rev. Macromol. Chem. 23:61; см. также Levy et al., 1985, Science 228:190; During et al., 1989, Ann. Neurol. 25:351; Howard et al., 1989, J. Neurosurg. 71:105). В другом варианте осуществления система с контролем высвобождения может быть расположена вблизи от терапевтической мишени, например органа тела, подвергающегося воздействию, такого как мозг, легкие, почки, печень, яичники, яички, кишечник, поджелудочная железа, грудь и кожа, таким образом требуя для введения только части системной дозы (см., например, Goodson, in Medical Applications of Controlled Release, выше, vol. 2, pp. 115-138 (1984)). Другие системы с контролем высвобождения обсуждаются в обзоре Langer (1990, Science 249:1527-1533).
Настоящее изобретение также относится к bsBA, представленному в фармацевтической композиции. Такие композиции содержат терапевтически эффективное количество bsBA и фармацевтически приемлемый носитель. В особом варианте осуществления термин «фармацевтически приемлемый» означает одобренный регулирующим агентством федерального правительства или правительства штата или упомянутый в Фармакопее США или других общепризнанных фармакопеях для использования у животных и, особенно, у человека. Термин «носитель» относится к растворителю, адъюванту, инертному наполнителю или переносчику, с которыми лекарство вводится. Такими фармацевтическими носителями могут быть стерильные растворы, такие как вода и масла, включающие масла including those of petroleum, животного, растительного или синтетического происхождения, такие как арахисовое масло, соевое масло, минеральное масло, кунжутное масло и им подобные. Вода является предпочтительным носителем, когда фармацевтическая композиция вводится внутривенно. Солевые растворы и водные растворы декстрозы и глицерина также могут использоваться как жидкие носители, в частности для инъекционных растворов. Фармацевтически приемлемые наполнители включают крахмал, глюкозу, лактозу, сахарозу, желатин, солод, рис, муку, мел, силикагель, стеарат натрия, моностеарат глицерина, тальк, хлорид натрия, сухое обезжиренное молоко, глицерин, пропилен, гликоль, воду, этанол и подобные им. Композиция, если необходимо, также может содержать небольшие количества увлажняющих или эмульгирующих агентов или рН буферных агентов. Эти композиции могут быть в форме растворов, суспензий, эмульсий, таблеток, пилюль, капсул, порошков, прописей с длительным высвобождением и подобных им. Композиция может быть выполнена в виде суппозитория с традиционными связывающими веществами и носителями, такими как триглицериды. Оральные прописи могут включать стандартные носители, такие как фармацевтически чистые маннитол, лактоза, крахмал, стеарат магния, сахарин натрия, целлюлоза, карбонат магния, и др. Примеры фармацевтически приемлемых носителей описаны в "Remington: The Science and Practice of Pharmacy, " A.R. Gennaro, ed. Lippincott Williams & Wilkins, Philadelphia, PA (20th Ed., 2003). Такие композиции должны содержать терапевтически эффективное количество соединения, предпочтительно в очищенной форме, а также приемлемое количество носителя для того, чтобы образовать форму для правильного введения пациенту. Пропись должна соответствовать способу введения.
В предпочтительном варианте осуществления композиция создается в соответствии с рутинными способами как фармацевтическая композиция для внутривенного введения человеку. Обычно композиции для внутривенного введения являются растворами в стерильном изотоническом водном буфере. При необходимости композиция может также содержать растворяющий агент и местный анестетик, такой как лигнокаин, для облегчения боли в месте инъекции.
В общем, ингредиенты поставляются или по отдельности, или в виде смеси в форме единицы дозирования, например, в виде сухого лиофилизованного порошка или обезвоженного концентрата в герметично закрытом контейнере, таком как ампула или саше, с указанием количества активного агента.
В случае если композиция будет вводиться путем инфузии, она может быть разведена в емкости для инфузии, содержащей стерильную фармацевтически чистую воду или солевой раствор. В случае если композиция будет вводиться путем инъекции, ампулу со стерильной водой или солевым раствором для инъекции применяют так, чтобы ингредиенты были смешаны перед инъекцией.
bsBA при включении в фармацевтическую композицию может быть представлен в нейтральной или солевой формах. Фармацевтически приемлемые соли включают анионные соли, такие как производные гидрохлорной, фосфорной, уксусной, щавелевой, винной кислот и др., и катионные соли, такие как производные натрия, калия, аммония, кальция, гидроксиды железа, изопропиламин, триэтиламин, 2-этиламино этанол, гистидин или прокаин.
Количество bsBA по изобретению, которое будет эффективным для лечения, подавления и предотвращения заболевания или нарушения, связанного с измененной экспрессией и/или активностью рецептора клеточной поверхности, может быть определено стандартными клиническими способами. В добавление, анализы in vitro при необходимости могут быть использованы для определения оптимальных дозировок.
Точная доза, используемая в прописи, будет также зависеть от пути введения и серьезности заболевания или нарушения и должна быть определена в соответствии с опытом лечащего врача и обстоятельствами каждого пациента. Эффективные дозы могут быть экстраполированы с кривых доза-ответ, полученных in vitro или на тестовых системах животных моделей.
Для bsBA вводимая пациенту доза обычно составляет от 0,1 мг/кг до 100 мг/кг веса тела пациента. Предпочтительно доза, вводимая пациенту, составляет от 0,1 мг/кг до 20 мг/кг веса тела пациента, более предпочтительно - от 1 мг/кг до 10 мг/кг веса тела пациента. В общем, человеческие антитела имеют более длительное время полужизни в человеческом организме, чем антитела от других животных в связи с иммунным ответом на чужеродные полипептиды. Следовательно, bsBA, происходящий из человеческих антител, могут вводиться в меньших дозах и в менее частом режиме введения. Далее, дозировка и частота введения bsBA по изобретению могут быть уменьшены повышением захвата и проникновения антител в ткани путем модификаций, таких как, например, липоидирование.
Наборы
Далее настоящее изобретение относится к наборам для использования в определении клеток, экспрессирующих или избыточно экспрессирующих молекулы-мишени in vivo или в биологических образцах. В некоторых предпочтительных вариантах осуществления наборы содержат bsBA, меченные биспецифическими антителами scFv. В зависимости от использования антитела могут быть функционализированы линкерами или комплексонами или обоими для связывания с эффектором (например, радиоактивным веществом, липосомой, цитотоксином, другим антителом, и др.), как здесь описано. Наборы при необходимости содержат буферы и композиции для использования в определении bsBA.
Наборы также могут включать инструкции, обучающие использованию антител для определения, например, раковых клеток, и/или обучающие комбинированию антител с функционализирующими реагентами, или обучающие использованию функционализирующих антител в диагностических и/или лечебных целях. В одном варианте осуществления bsBA is provided functionalized с линкером и/или комплексоном (в одном контейнере) с одним или более эффекторами, например цитотоксинами, радиоактивными метками (во втором контейнере) таким образом, что два компонента могут вводиться раздельно (например, с целью предварительного мечения) или таким образом, что два компонента могут вводиться непосредственно перед использованием.
Определенные инструкции будут содержать рекомендованные режимы дозирования, показатели подсчета и тому подобное. Так как инструкции обычно содержат письменные или печатные материалы, любой носитель, способный сохранить эти инструкции и доставить их конечному потребителю, предусмотрен по данному изобретению. Такие носители включают, но не ограничиваются ими, электронные носители информации (например, магнитные диски, ленты, картриджи, чипы), оптические носители (например, CD ROM) и тому подобное, или Интернет ресурс, содержащий инструкции. Изобретение также относится к фармацевтической упаковке или набору, содержащему один или несколько контейнеров, наполненных одним или более ингредиентами фармацевтической композиции по изобретению. При необходимости вместе с таким контейнером (контейнерами) может содержаться сообщение в форме, предписанной правительственным агентством, регулирующим производство, использование или продажу фармацевтических или биологических продуктов, которое содержит разрешение агентства производить, использовать или продавать для введения человеку.
ПРИМЕРЫ
Пример 1: Диатела и (scFv) 2
Образование диател изучали, например, в ЕР 404097; WO 93/11161; и Hollinger et al. (Proc. Natl. Acad. Sci. USA, 90:6444-6448 (1993)).
Диатела конструировали из фрагментов антител, обычно из двух scFv, с использованием линкера, слишком короткого для образования пары из двух доменов одной цепи; домены вынуждали образовывать пары с комплементарными доменами другой цепи и образовывать два места связывания антигенов. Альтернативно, два scFv могут быть связаны генетически кодированным линкером, который ковалентно связывает две молекулы, формируя таким образом (scFv)2, являющийся двухвалентным антителом.
Пример 2
Различные типы «димеризационных доменов» использовали для гетеродимеризации двух фрагментов антител. Например, путем генетического слияния биспецифического/дивалентного диатела с, через шарнирную область, N-концом домена СН(3) IgG (Lu et al. J Immunol Methods. 279(1-2):219-32 (2003)), создавали конструкцию, называемую «ди-диателом». Результатом являлся тетравалентный димер диатела, полученный при димеризации между шарнирной областью и доменами СН(3).
Естественный домен СН1 антитела может также использоваться для гетеродимеризации двух фрагментов антител путем генетического слияния одноцепочечного Fv (scFv) с С-концом легкой или тяжелой цепи фрагмента Fab различной антиген-связывающей специфичности (Lu et al. J Immunol Methods. 267(2):213-26 (2002)). Также может быть использован механизм естественной димеризации между легкой и тяжелой цепями IgG. Два одноцепочечных Fv (scFv) различной специфичности могут быть слиты с постоянным доменом человеческой каппа цепи (C(L)) и первым постоянным доменом человеческой тяжелой цепи (C(H1)) для образования двух полипептидов, (scFv)(1)-C(L) и (scFv)(2)-С(Н1)-С(Н2)-С(Н3) соответственно. Совместная экспрессия двух полипептидов в клетках млекопитающих вызывает образование ковалентно связанных IgG-подобных гетеротетрамеров, Bs(scFv)(4)-IgG, с двойной специфичностью (Zuo et al. Protein Eng. 13(5):361-7 (2000), Lu et al. J.Biol Chem. 23;279(4):2856-65 (2004)).
Образование гетеродимера из двух фрагментов антител может быть также проведено путем нековалентного взаимодействия в димеризационном домене, например, с гетеродимер-образующими лейциновыми застежками Fos и Jun, которые могут опосредовать образование биспецифического F(ab')2, когда они слиты по раздельности с двумя различными фрагментами Fab' (Tso et al. J Hematother. 4(5):389-94 (1995)).
Пример 3: Определение подходящих мишеней и эффекторных маркеров
Подходящие маркеры мишени определяли многими способами, такими как профилирование mRNA ткани-мишени и ткани, не являющейся мишенью, для идентификации молекул-мишеней, которые избыточно экспрессированы в ткани-мишени, или с помощью протеомных способов, таких как 2D-электрофорез клеток-мишеней или клеток, не являющихся мишенями, для сравнения уровней экспрессии белка и дальнейшей идентификации с помощью масс-спектроскопии. Например, для профилирования mRNA обычно использовали микрочипы Affymetrix и проводили его, как описано в Cao et al. (BMC Genomics. 27;5(1):26 (2004)), путем сравнения cRNA, полученных из ткани-мишени и ткани, не являющейся мишенью, (например, из опухоли и прилегающей нормальной ткани).
При использовании протеомных способов клетки-мишени и клетки, не являющиеся мишенями, обычно лизировали или гомогенизировали, а затем подвергали двумерному электрофорезу. Затем белки фиксировали в геле и окрашивали для визуализации. При анализе изображения на гелях из клеток-мишеней и клеток, не являющихся мишенями, выявляли белковые пятна, которые были экспрессированы различно. Эти пятна затем идентифицировали путем извлечения пятен, расщепления трипсином в геле и анализа на масс-спектрометре. Процесс описан, например, в Van Greevenbroek et al. 45, 1148-1154 (2004).
Подходящие эффекторные маркеры идентифицировали многими способами, такими как идентификация рецепторов с предполагаемыми местами фосфорилирования. Белковые или ДНК последовательности получали из GenBank или других открытых баз данных и потенциальные места фосфорилирования предсказывали с помощью общедоступных поисковых программ, таких как ScanSite (поиск on-line путем ввода «http://», и затем «scansite.mit.edu/») или NetPhos (поиск в сети путем ввода «www.», и затем «cbs.dtu.dk/services/NetPhos/»). Рецепторы с местами фосфорилирования с большой вероятностью являются хорошими эффекторными маркерами, так как они часто вовлечены в передачу сигнала. Альтернативно, подходящие эффекторные маркеры идентифицировали путем контактирования клеток-мишеней с антителами к маркерам на клетке с последующим изучением искомой биологической активности, как описано выше.
Пример 4: Изучение одновалентных и двухвалентных связывающих доменов
Для изучения одновалентного сродства связывающих доменов или биспецифических связывающих молекул получали bsBA, как описано выше. Для измерения кинетики связывания с помощью поверхностного плазмонного резонанса биосенсорный чип активировали для ковалентного связывания рецептора с использованием гидрохлорида N-этил-N'-(3диметиламинопропил)-карбодиимида (EDC) и N-гидроксисукцинимида (NHS) в соответствии с инструкциями производителя (BIAcore). Затем маркер связывали, например, путем инъекции в 10 мМ натрий-ацетатного буфера (рН 4,5) для получения сигнала, в идеале меньшего чем 400 единиц ответа (RU) иммобилизованного материала. Для измерений кинетики двукратные серийные разведения одновалентных или двухвалентных связывающих доменов наносили на антигенный чип в буфере PBS/Tween (0,05% Tween-20 в фосфатной буферной соли) при 25°С, используя скорость тока 20 мкл/мин. Показатели диссоциации затем вводили в модель с одним участком связывания для получения koff, рассчитывали константу псевдопервого порядка (ks) для каждой кривой связывания и представляли как функцию концентрации белка для получения kon ± стандартная ошибка.
Равновесная константа диссоциации Kd может быть затем рассчитана из измерений SPR в виде koff/kon. Отсутствие экспериментальных артефактов, таких как повторное связывание диссоциированного bsBA, должно быть определено проведением вышеуказанных измерений на нескольких поверхностях различной плотности, например 100, 200, и 400 RU.
Альтернативно, эти сродства могут быть также определены с помощью проточной цитометрии, как описано, например, в Nielsen et al. (Cancer Res. 60(22):6434-40 (2000)).
Пример 5: Измерение эффекторной функции в клетках
Эффекторную функцию связывающего домена определяли контактированием клеток-мишеней, выращенных в культуре, с доменом, связывающим рецептор, при разных концентрациях в течение, например, 30 минут. При этом клетки в некоторых случаях стимулировали экзогенным фактором роста для вызывания биологического эффекта, который молекула не могла изменить. Экстракты обработанных клеток, выращенных на 6- или 12-луночных культуральных плашках, получали 5-кратным пропусканием клеток через 27G шприц в лизирующем буфере (20 мМ Tris (рН 7,5), 150 мМ NaCl, 1 мМ EDTA, 1 мМ EGTA, 1% Triton X-100, 0,5% NP40, 10 мМ β-глицеринфосфата, 10 мМ NaF, 1 мМ Na3VO4, содержащем ингибиторы протеаз (1 мМ PMSF, 1 мкг/мл лейпептина, 1 мкг/мл пепстатина) на льду. Перед лизисом клетки промывали дважды холодным PBS. Лизаты затем анализировали, например, иммуноблоттингом с фосфо-специфическими антителами: экстракты общего клеточного белка (50 мкг общего белка/полоска) разделяли электрофорезом с использованием готовых 7,5% SDS-PAGE гелей (Invitrogen, Carlsbad, Калифорния), переносили на нитроцеллюлозные фильтры и инкубировали с антителами, которые определяли активацию маркера или снижение ассоциированных белков. Альтернативно, лизаты анализировали с помощью антительных микрочипов, как описано в Nielsen et al. (Proc Natl Acad Sci USA. 100(16):9330-5 (2003)).
Эффекторную функцию связывающего домена также определяли другими способами индикации изучаемой биологической функции, например анализами пролиферации клеток. Клетки-мишени высаживали в количестве 5×103 на лунку в 96-луночную плашку, содержащую DMEM и 5% FCS, и варьировали концентрации связывающего домена. Через 72 часа клетки лизировали и количество АТФ определяли люминесцентным анализом выживаемости клеток CellTiter-Glo (Promeda, Madison, WI), в соответствии с протоколом производителя.
Результаты анализов фосфорилирования и пролиферации представляли в виде графика со степенью ингибирования как логарифмической функции концентрации и IC50, определенной для эффектора и метящих доменов путем подставления в уравнение:
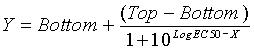
Пример 6: Изучение bsBA
Для изучения эффекта bsBA по его способности предотвращать, уменьшать или подавлять передачу сигнала в клетке, опосредованную рецепторами ErbB, раковые клетки, такие как А431 (клеточная линия эстроген-зависимого рака молочной железы, National Center for Biotechnology Information Accession GDS121), инкубировали с bsBA при различных концентрациях в течение 30 минут перед стимуляцией клеток факторами роста (например, херегулин или EGF) в течение двух часов. Затем клетки лизировали в буфере с добавлением Тритона, после чего обрабатывали ультразвуком. Затем лизаты анализировали на изменения в фосфорилировании или с помощью иммунноблоттинга или с использованием антительных микрочипов, чувствительных к фосфорилированию белков (см., например, Nielsen et al., 2003, PNAS 100:9330).
Например, с помощью компьютерного моделирования авторы изобретения предсказали, что bsBA с доменом, направленным на мишень, который связывается с антигеном клеточной поверхности, экспрессируемым в количестве 1 миллион копий на клетку, с сродством 1 нМ, и эффекторный домен, который связывается с ErbB3 (и, следовательно, конкурирует за связывание с херегулином) с сродством 1 мкМ, будут так же эффективны (при измерении IC50), как и bsBA с доменом, направленным на мишень, и эффекторный домен, которые оба связываются с сродством 1 нМ.
bsBA могут использоваться для ингибирования роста раковых клеток, которые экспрессируют соответствующие антигены. Эффект bsBA может быть усилен путем конъюгирования небольших молекул лекарств с bsBA. Такими лекарствами могут быть, например, стандартные цитотоксические агенты, такие как химиотерапевтические, или ингибиторы тирозинкиназы, такие как Gleevec® (мезилат иматиниба).
Пример 7: ErbB bsBA
Компьютерное симулирование херегулин (HRG)-индуцированной активации ERK и AKT в клетках А431 показало, что ErbB bsBA являются наиболее эффективными, если одна из молекул bsBA, связывающих рецептор ErbB, имеет меньшее сродство к его рецептору, чем другая молекула, связывающая ErbB, имеет к его рецептору.
Если молекула bsBA по изобретению с низким сродством связывания направлена на ErbB3 или ErbB4, а молекула bsBA с высоким сродством связывания направлена на другой рецептор ErbB (например, ErbB1 или ErbB2), bsBA снижает, предотвращает или ингибирует передачу клеточного сигнала, опосредованную рецепторами ErbB, через, как представляется вероятным, секвестрирование ErbB3 или ErbB4 в тримерный комплекс, состоящий из рецептора ErbB3 или ErbB4, bsBA и рецептора ErbB1 или ErbB2 (например, ErbB3/4:bsBA:ErbB1/2).
Связывающая молекула bsBA также может быть направлена на ErbB3 и ErbB4. В этом случае bsBA предположительно ингибирует димеризацию этих рецепторов ErbB с ErbB1 или ErbB2. Так как димеризация ErbB3 или ErbB4 с ErbB1 или ErbB2 необходима для передачи сигнала, bsBA эффективно предотвращает, снижает или ингибирует передачу клеточного сигнала путем блокирования образования димера. Преимущественно молекула этого bsBA с низким сродством связывания связывается с ErbB3.
Связывающие молекулы bsBA получали таким способом, что они связывались с ErbB1 и ErbB2, перекрестно реагируя, таким образом, с этими двумя рецепторами. Эта молекула bsBA вызывает снижение, предотвращение или подавление димеризации ErbB1 и ErbB2 с ErbB3 или ErbB4, которая, как обсуждалось выше, необходима для передачи сигнала. Преимущественно эта молекула с низким сродством связывания связывается с ErbB1.
Экземпляр bsBA включает молекулу с низким сродством связывания, которая связывается с ErbB3, с молекулой с высоким сродством связывания с EGFR или ErbB4. bsBA также может использоваться для направленной доставки цитотоксичных или химиотерапевтических агентов к клеткам, которые экспрессируют рецептор ErbB. Эти агенты содержат две связывающие молекулы, каждая из которых специфична для отдельного рецептора ErbB, и цитотоксичный или химиотерапевтический агент (например, сапорин, анти-интерферон-α, алкалоид барвинка, цепь А рицина, метотрексат или радиоактивный изотоп гаптена), конъюгированный с bsBA. bsBA получали в виде антител полной длины или фрагментов антител (например, F(ab')2 или (Fv)2 биспецифические антитела), диантител или аптамеров с двумя различными связывающими молекулами.
Модель тестировали с применением семейства рецепторов ErbB. Стимуляция рецепторов ErbB с помощью EGF или HRG приводила к одновременной активации путей, ведущих к фосфорилированию ERK и AKT, которые вызывают помехи на разных уровнях сигнального каскада. Чувствительность анализа позволила соотнести неточности выходных данных модели с различными источниками неточностей на входе модели. Так как опухолевые клетки характеризуются различными уровнями экспрессии рецепторов, авторы изобретения идентифицировали ErbB3 и ErbB4 как очень чувствительные мишени, если лигандом был HRG.
В общем, когда связывающими молекулами bsBA являются антитела или их фрагменты, эти связывающие молекулы могут быть хорошо характеризованы биохимически, так как их константы диссоциации или даже уровни ассоциации и диссоциации легко могут быть определены. Также и механизм действия антител легко может быть описан с использованием математической модели, и эффект применения известного антитела как ингибитора может быть протестирован in silico. Используя собственную компьютерную модель, авторы изобретения оценили идею применения биспецифических антител (например, антител, имеющих две различные связывающие молекулы, в которых каждый участок связывания связывает различный рецептор ErbB) для блокирования сигнального пути клеток ErbB. Результаты in silico подтвердили, что антитело, имеющее специфичность связывания с двумя различными рецепторами ErbB, в которых специфичное сродство для одного рецептора ErbB выше, чем специфичное сродство для другого рецептора ErbB, является идеальным для блокирования или предотвращения передачи клеточного сигнала через ErbB путь.
Используя способ in silico, авторы изобретения сравнили способность биспецифических антител, направленных на два различных рецептора ErbB, блокировать или предотвращать активацию сигнального пути ErbB в трех разных клеточных линиях, показывающих различную экспрессию рецепторов ErbB (Таблица 1), по сравнению со способностью условных ингибиторов, которые направлены только на один рецептор ErbB. Ингибирование сигнала в каждой клеточной линии моделировали in silico для биспецифических антител, так же как и для использующихся терапевтических моноспецифических антител. Модель авторов предсказывала, что ингибирование клеточной сигнализации биспецифическими антителами, имеющими разное сродство к двум разным рецепторам ErbB, будет значительно выше, чем ингибирование клеточной сигнализации, опосредованное традиционными ингибиторами одного рецептора. Данные, полученные с помощью компьютерного моделирования авторов, представлены в Таблице 2. В зависимости от соотношения рецепторов, имеющегося в опухоли, различные bsАb, имеющие связывающую молекулу с высоким сродством и связывающую молекулу с низким сродством, должны быть потенциально значительно более сильными ингибиторами, чем моноспецифические антитела или биспецифические антитела, в которых обе связывающие молекулы связываются со своими соответствующими антигенами с равным сродством.
Профили экспрессии рецепторов ErbB в разных клеточных линиях
Ингибирование с помощью bsBA в сравнении с традиционными моноспецифическими ингибиторами рецепторов
ERK|AKT
ERK|AKT
ERK|AKT
ERK|AKT
ERK|AKT
ERK|AKT
ERK|AKT
Авторы идентифицировали биспецифические антитела против ErbB1 (высокое сродство) или ErbB4 (низкое сродство), как наиболее эффективные блокирующие агенты для предотвращения клеточной сигнализации в связи с активацией ErbB-пути при всех стимулирующих условиях. ErbB1- ErbB2 bsAb также был вполне эффективен как агент, блокирующий ErbB клеточную сигнализацию при всех стимулирующих условиях. Когда в качестве активирующего агента использовали HRG, ErbB3- ErbB4 bsAb был весьма эффективен как агент, блокирующий ErbB-путь. Таким образом, предпочтительным bsAb является тот, у которого, по меньшей мере, одним из свойств блокирующего агента является способность метить рецептор ErbB3 или ErbB4 (с использованием связывающей молекулы с низким сродством). В общем, с помощью компьютерной модели авторы изобретения идентифицировали выраженные сигнальные возможности ErbB3/4. Перекрестное реагирование ErbB3/4 между собой или с более типичными раковыми антигенами, такими как ErbB1 или ErbB2, служит механизмом ингибирования ErbB3/4 сигнализации через одновременное ингибирование двух рецепторов или секвестрацию рецепторов.
Одним из преимуществ, связанных с использованием bsBA вместо традиционных моноспецифических блокирующих агентов, таких как моноспецифические антитела, является то, что биспецифические блокирующие агенты образуют стабильные тримеры (например, рецептор ErbB-биспецифический блокирующий агент-рецептор ErbB). Таким образом, эффективность bsBA значительно выше, чем у традиционного ингибитора единичного рецептора, как показано в Таблице 2.
Связываясь с двумя разными рецепторами ErbB, bsBA по изобретению не допускает взаимодействия рецептора ErbB с таким же или другим рецептором ErbB. bsBA образует очень стабильный (необратимый) комплекс, который предотвращает, уменьшает или ингибирует клеточную сигнальную активность связанных рецепторов ErbB с упомянутым рецептором ErbB ведет к образованию очень стабильного тримера. Альтернативно, первая стадия связывания bsBA с ErbB1, ErbB2, ErbB3 или ErbB4 может быть необратимой, а вторая стадия связывания - обратимой, позволяя, таким образом, bsBA формировать несколько различных тримерных комплексов. Образование тримера рецептор ErbB:bsBA:рецептор ErbB приводит к образованию комплекса, не способного индуцировать клеточную сигнализацию. Более того, через секвестрацию ErbB1, ErbB2, ErbB3 и ErbB4, bsBA предотвращает, уменьшает или ингибирует димеризацию этих рецепторов ErbB с такими же или отличными от них рецепторами ErbB. Преимущественно bsBA имеет высокое сродство к ErbB1 или ErbB2 и низкое сродство к ErbB3 или ErbB4, таким образом, когда один связывающий домен bsBA имеет высокое сродство к ErbB2, второй связывающий домен не связывается с ErbB3.
Образование неполного димера bsBA-рецептор ErbB, в котором задействована только одна из двух связывающих молекул bsBA, не приводит к образованию комплекса, нарушающего клеточную сигнализацию; только образование тримерного комплекса (например, рецептор ErbB:bsBA:рецептор ErbB) предотвращает клеточную сигнализацию. Кроме того, образование тримера невозможно между двумя рецепторами ErbB, связанными с bsBA.
Другие характеристики bsBA включают способность связывающего домена уменьшать, предотвращать или ингибировать клеточную сигнализацию путем конкуренции с естественным лигандом рецептора ErbB, таким как HRG.
Наши данные in silico показывают, что ErbB3-ErbB4 bsBA является более эффективным в блокировании клеточной сигнализации, чем моноспецифические ингибиторы ErbB3 или ErbB4. Моноспецифические ингибиторы, направленные исключительно на ErbB3 или ErbB4, не ингибируют АКТ фосфорилирование так эффективно, как ErbB3-ErbB4 bsBA, прежде всего в связи с высоким уровнем экспрессии ErbB3 и ErbB4 на клеточной поверхности. АКТ фосфорилирование предотвращается только в том случае, когда используются оба моноспецифических ингибитора, ErbB3 и ErbB4.
Так как bsBA не обладает ингибирующим эффектом в несвязанном состоянии или в виде димерного комплекса только с одним рецептором ErbB, увеличение концентрации ингибитора, когда рецепторы ErbB становятся насыщенными bsBA, приводит к снижению ингибирующего эффекта bsBA. Эффект может быть обратим при использовании bsBA, имеющего повышенное сродство к ErbB2, так что связывающее сродство bsBA выше для ErbB3, чем для ErbB4 (например, KdErbB3>ErbB4).
Обсуждавшийся выше bsBA частично эффективен в режиме доминирования HRG. В общем, bsBA эффективен в значительно меньших дозах по сравнению с ингибиторами рецептора ErbB, которые связываются только с одним рецептором.
Другое предпочтительное осуществление по настоящему изобретению - это bsBA, в котором одна связывающая молекула bsBA имеет связывающую специфичность к ErbB1 (высокое сродство связывания), а другая связывающая молекула имеет связывающую специфичность к ErbB3 или ErbB4 (низкое сродство связывания). В общем, опухолевые клетки экспрессируют высокие количества ErbB1 (например, обычно более 100000 рецепторов на клетку), тогда как экспрессия рецепторов ErbB3 и ErbB4 колеблется от 5000 до 20000 рецепторов на клетку. bsBA, который является антагонистом связывания лиганда, будет успешно ингибировать рецепторную сигнализацию, даже если уровни экспрессии рецептора различаются более чем в 10 раз.
Анализы авторов in silico подтвердили эффективность биспецифических ErbB1/ ErbB3 и ErbB1/ErbB4 bsBA. Ингибирование рецептора ErbB3 подавляет сигнализацию в режиме доминирования HRG.
На основе анализа in silico ErbB пути клеточной сигнализации авторы изобретения идентифицировали связывающую молекулу ErbB1 как высокоаффинный связывающий участок с низкой константой диссоциации Kd<1 нМ, но который является необратимым. Рецепторы ErbB3 и ErbB4 экспрессируются на значительно более низком уровне, чем рецепторы ErbB1. Так как bsBA связывается и с ErbB1 и с ErbB3/ErbB4 рецепторами и bsBA имеет высокое сродство к более распространенному рецептору ErbB1, bsBA эффективно блокирует клеточную сигнализацию, опосредованную димеризацией ErbB1 как с ErbB3, так и с ErbB4 при значительно более низкой концентрации, чем соответствующие моноспецифические ингибиторы ErbB. Высокое сродство bsBA к ErbB1 ведет к высокой эффективности низких концентраций bsBA.
Наш подход позволяет использовать преимущества компьютерного моделирования для идентификации оптимальных рецепторов для перекрестного связывания, так же как и желаемых аффинностей двух связывающих молекул. Различные аффинности двух связывающих молекул bsBA эффективно связывают bsBA с рецепторами, такими как ErbB3, которые вряд ли являются специфичными для раковых клеток. Перекрестное связывание ErbB3 с более типичным раковым антигеном, таким как ErbB1, придает смысл специфическому мечению раковых клеток и модулированию активности рецептора ErbB3 в этих клетках.
Используя собственную компьютерную модель, авторы изобретения идентифицировали необходимость различного сродства двух связывающих молекул bsBA. Различные сродства приводят к стабильности тримерного комплекса bsBA. Говоря в общем, активная связывающая молекула bsBA будет иметь более низкое сродство по сравнению с неактивной или менее активной связывающей молекулой. Если обе связывающие молекулы bsBA являются неактивными или менее активными, связывающая молекула, направленная на рецептор с более высокой экспрессией или более сильным сигналом, будет иметь более высокое сродство. Наличие разного сродства к одному из рецепторов приводит к следующему: если bsBA вводят в концентрации выше Kd взаимодействия с более высоким сродством (например, ErbB1), но ниже Kd взаимодействия с более низким сродством (например, ErbB3), bsBA будет накапливаться только на клетках, экспрессирующих антиген для взаимодействия с более высоким сродством. Другой конец bsBA способен взаимодействовать на этих клетках с антигеном с низким сродством для нарушения его биологической функции (например, ErbB3; для предотвращения снижения сигнала). Какой рецептор будет взаимодействовать с высоким или низким сродством, зависит от специфической силы сигнала рецептора (важности как мишени) и способа действия bsBA.
Следует понимать, что примеры и варианты осуществления, описанные здесь, приведены лишь с иллюстративными целями и что различные модификации или изменения в их свете могут быть предложены специалистами в данной области и должны быть включены в изобретение в соответствии с сущностью, областью применения и прилагаемой формулой изобретения. Все публикации, патенты и заявки на выдачу патентов, цитированные здесь, приведены здесь полностью в качестве ссылки для любых целей.
Изобретение относится к области медицины и касается биспецифических связывающих агентов для модулирования биологической активности. Сущность изобретения включает биспецифический связывающий агент, который способен направленно действовать на раковые клетки посредством связывающего домена с высоким сродством в отношении первого маркера клеточной поверхности, который не индуцирует значительный биологический эффект, и связывающего домена с низким сродством, который специфично связывается со вторым маркером клеточной поверхности, вызывающего значительный и требуемый биологический эффект. Также предоставлены фармацевтические композиции для лечения злокачественной опухоли, их применение для производства лекарственного средства и наборы для диагностики и визуализации опухоли. Преимущество изобретения заключается в усилении противоопухолевого действия. 10 н. и 27 з.п. ф-лы, 2 табл.
1. Способ модулирования биологической активности клетки-мишени, которая является раковой клеткой, экспрессирующей рецептор ErbB с использованием биспецифического связывающего агента,
(i) имеющего первый связывающий домен, характеризующийся Кd в отношении первой молекулы-мишени ЕrbВ2 на поверхности указанной клетки со сродством, равным, по меньшей мере, 10-7 М, и второй связывающий домен, характеризующийся Кd в отношении второй молекулы-мишени на поверхности указанной клетки,
(ii) причем вторая молекула-мишень отличается от указанной первой молекулы-мишени,
(iii) где указанное сродство указанного второго связывающего домена в отношении второй молекулы-мишени, по меньшей мере, в 10 раз ниже, чем сродство указанного первого связывающего домена в отношении указанной первой молекулы-мишени, и
(iv) при условии, что молекула-мишень для указанного второго связывающего домена не является ЕrbВ3, причем способ предусматривает контактирование биспецифического связывающего агента с клеткой-мишенью в условиях, которые позволяют первому и второму связывающим доменам связываться с первой и второй молекулами-мишенями соответственно, где связывание указанного второго связывающего домена с указанной второй молекулой-мишенью модулирует биологическую активность второй молекулы-мишени, тем самым модулируя биологическую активность клетки-мишени, и далее, где связывание указанного первого связывающего домена с указанной первой молекулой-мишенью не модулирует биологическую активность клетки-мишени.
2. Способ по п.1, в котором биспецифический связывающий агент включает два антитела.
3. Способ по п.2, в котором антитела представляют собой диатела, два одноцепочечных Fv, соединенных непосредственно или посредством линкера, Fv, стабилизированные дисульфидами или их комбинации.
4. Способ по п.1, в котором вторая молекула-мишень выбрана из группы, состоящей из ЕrbВ4, любого из FGF-рецепторов 1-4, HGF-рецептора, IGF1-R, PDGF рецепторов альфа и бета, и C-KIT.
5. Способ по п.1, в котором Kd первого связывающего домена в отношении первой молекулы-мишени составляет от 10-8 до 10-12 М.
6. Способ по п.1, в котором Kd второго связывающего домена в отношении второй молекулы-мишени, по меньшей мере, в 20 раз больше, чем Kd первого связывающего домена в отношении первой молекулы-мишени.
7. Способ модулирования биологической активности клетки-мишени, которая является раковой клеткой, экспрессирующей рецептор ErbB с использованием биспецифического связывающего агента,
(i) имеющего первый связывающий домен, характеризующийся Kd в отношении первой молекулы-мишени на поверхности указанной клетки со сродством, равным, по меньшей мере, 10-7 М, и второй связывающий домен, характеризующийся Kd в отношении второй молекулы-мишени ЕrbB3 на поверхности указанной клетки,
(ii) причем вторая молекула-мишень отличается от указанной первой молекулы-мишени,
(iii) где указанное сродство указанного второго связывающего домена в отношении второй молекулы-мишени, по меньшей мере, в 10 раз ниже, чем сродство указанного первого связывающего домена в отношении указанной первой молекулы-мишени, и
(iv) при условии, что молекула-мишень для указанного первого связывающего домена не является ЕrbВ2, причем способ предусматривает контактирование биспецифического связывающего агента с клеткой-мишенью в условиях, которые позволяют первому и второму связывающим доменам связываться с первой и второй молекулами-мишенями соответственно, где связывание указанного второго связывающего домена с указанной второй молекулой-мишенью модулирует биологическую активность второй молекулы-мишени, тем самым модулируя биологическую активность клетки-мишени, и, далее, где связывание указанного первого связывающего домена с указанной первой молекулой-мишенью не модулирует биологическую активность клетки-мишени.
8. Способ по п.7, в котором биспецифический связывающий агент включает два антитела.
9. Способ по п.8, в котором антитела представляют собой диатела, два одноцепочечных Fv, соединенных непосредственно или посредством линкера, Fv, стабилизированные дисульфидами или их комбинации.
10. Способ по п.7, в котором первая молекула-мишень представляет собой ассоциированный с опухолью антиген, цитокиновый рецептор или рецептор фактора роста.
11. Способ по п.10, в котором ассоциированный с опухолью антиген выбран из группы, состоящей из MART-1, gp100 и MAGE-1.
12. Способ по п.7, в котором указанная первая молекула-мишень выбрана из группы, состоящей из ракового эмбрионального антигена (СЕА), EGFR, LewisY, MUC-1, EpCAM, CA125, простатаспецифичного мембранного антигена (PSMA) и TAG72.
13. Способ по п.7, в котором Kd первого связывающего домена в отношении первой молекулы-мишени составляет от 10-8 до 10-12 М.
14. Способ по п.7, в котором Кd второго связывающего домена в отношении второй молекулы-мишени, по меньшей мере, в 20 раз больше, чем Kd первого связывающего домена в отношении первой молекулы-мишени.
15. Биспецифический связывающий агент (bsBA), содержащий первый связывающий домен, характеризующийся константой диссоциации (Кd) в отношении первой молекулы-мишени ЕrbВ2 на клетке-мишени со сродством, равным, по меньшей мере, 10-7 М, и второй связывающий домен, характеризующейся Кd в отношении второй молекулы-мишени на клетке-мишени со сродством, которое, по меньшей мере, в 10 раз ниже сродства первого связывающего домена в отношении первой молекулы-мишени, где
(i) указанные первая и вторая молекулы-мишени не имеют одного и того же природного лиганда,
(ii) указанная вторая, но не указанная первая молекула-мишень имеет биологическую активность, и
(iii) при условии, что молекула-мишень указанного второго связывающего домена не является ЕrbВ3 (HER3), и далее, где указанный второй связывающий домен при связывании с указанной второй молекулой-мишенью, модулирует биологическую активность второй молекулы-мишени,
где клетка-мишень является раковой клеткой, экспрессирующей рецептор ErbB.
16. Биспецифический связывающий агент по п.15, где указанная Кd указанного второго связывающего домена более чем в 50 раз больше, чем Kd первого связывающего домена.
17. Биспецифический связывающий агент по п.15, где указанная Кd указанного второго связывающего домена более чем в 100 раз больше, чем Кd первого связывающего домена.
18. Биспецифический связывающий агент по п.15, где указанный bsBA включает два антитела.
19. Биспецифический связывающий агент по п.18, где антитела представляют собой диатела, два одноцепочечных Fv, соединенных непосредственно или посредством линкера, Fv, стабилизированные дисульфидами или их комбинации.
20. Биспецифический связывающий агент по п.15, где вторая молекула-мишень выбрана из группы, состоящей из ЕrbВ4, любого из FGF-рецепторов 1-4, HGF-рецептора, IGF1-R, PDGF рецепторов альфа и бета, и C-KIT.
21. Биспецифический связывающий агент по п.15, где Кd первого связывающего домена составляет от 10-8 до 10-12 М.
22. Биспецифический связывающий агент по п.15, где указанная первая молекула-мишень гиперэкспрессирована, по меньшей мере, в 10 раз на клетках-мишенях по сравнению с ее экспрессией на нормальных клетках.
23. Биспецифический связывающий агент (bsBA), содержащий первый связывающий домен, характеризующийся константой диссоциации (Кd) в отношении первой молекулы-мишени на клетке-мишени со сродством, равным, по меньшей мере, 10-7 М, и второй связывающий домен, характеризующейся Кd в отношении второй молекулы-мишени ЕrbВ3 на клетке-мишени со сродством, которое, по меньшей мере, в 10 раз ниже сродства первого связывающего домена в отношении первой молекулы-мишени, где
(i) указанные первая и вторая молекулы-мишени не имеют одного и того же природного лиганда,
(ii) указанная вторая, но не указанная первая молекула-мишень имеет биологическую активность, и
(iii) при условии, что молекула-мишень указанного первого связывающего домена не является ЕrbВ2, и далее, где указанный второй связывающий домен при связывании с указанной второй молекулой-мишенью, модулирует биологическую активность второй молекулы-мишени,
где клетка-мишень является раковой клеткой, экспрессирующей рецептор ErbB.
24. Биспецифический связывающий агент по п.23, где указанная Кd указанного второго связывающего домена более чем в 50 раз больше, чем Kd первого связывающего домена.
25. Биспецифический связывающий агент по п.23, где указанная Кd указанного второго связывающего домена более чем в 100 раз больше, чем Кd первого связывающего домена.
26. Биспецифический связывающий агент по п.23, где указанный bsBA включает два антитела.
27. Биспецифический связывающий агент по п.26, где антитела представляют собой диатела, два одноцепочечных Fv, соединенных непосредственно или посредством линкера, Fv, стабилизированные дисульфидами или их комбинации.
28. Биспецифический связывающий агент по п.23, где первый связывающий домен связывается с ассоциированным с опухолью антигеном, цитокиновым рецептором или рецептором фактора роста.
29. Биспецифический связывающий агент по п.23, где указанная первая молекула-мишень выбрана из группы, состоящей из ракового эмбрионального антигена (СЕА), EGFR, LewisY, MUC-1, EpCAM, CA125, простатаспецифичного мембранного антигена (PSMA) и TAG72.
30. Биспецифический связывающий агент по п.23, где Kd первого связывающего домена составляет от 10-8 до 10-12 М.
31. Биспецифический связывающий агент по п.23, где указанная первая молекула-мишень гиперэкспрессирована, по меньшей мере, в 10 раз на клетках-мишенях по сравнению с ее экспрессией на нормальных клетках.
32. Фармацевтическая композиция для лечения злокачественной опухоли, содержащая а) терапевтически эффективное количество биспецифического связываюбщего агента (bsBA) по пп.15-22 и b) фармацевтически приемлемый носитель.
33. Фармацевтическая композиция для лечения злокачественной опухоли, содержащая а) терапевтически эффективное количество биспецифического связываюбщего агента (bsBA) по пп.23-31 и b) фармацевтически приемлемый носитель.
34. Применение биспецифического связывающего агента (bsBA) по пп.15-22 для производства лекарственного средства для ингибирования пролиферации раковых клеток, экпрессирующих рецептор ЕrbВ.
35. Применение биспецифического связывающего агента (bsBA) по пп.23-31 для производства лекарственного средства для ингибирования пролиферации раковых клеток, экпрессирующих рецептор ЕrbВ.
36. Набор для диагностики и визуализации опухоли, содержащий а) контейнер, и b) биспецифический связывающий агент bsBA по пп.15-22.
37. Набор для диагностики и визуализации опухоли, содержащий а) контейнер, и b) биспецифический связывающий агент (bsBA) по пп.23-31.
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| SCHMIDT M., WELS W | |||
| Targeted inhibition of tumor cell grouth dy bispesific single-chain toxin containing an antibody domain and TGFa, British Journal of Cancer, 1996, v.74, p.853-862 | |||
| LU DAN | |||
| et al., Complete inhibition of vascular endothelial growth factor (VEGF) activities with bifunctional biabody directed against | |||
Авторы
Даты
2011-11-20—Публикация
2005-05-05—Подача