Изобретение относится к биотехнологии и генной инженерии, а именно к технологии наработки и выделения препаративных количеств ДНК, и может быть использовано в медицине и фармацевтической промышленности.
Генная терапия (временный перенос генов и антисенс олигонуклеотидов в ткани биологических объектов с целью биокоррекции) предполагает лечить не следствие, а причину болезни. В этой связи актуальна проблема получения ДНК в достаточных количествах и высокой степени чистоты для разработки препартивных форм и методов лечения различных заболеваний.
Известен способ получения плазмидной ДНК (патент США №6503738, МПК С 12 N 5/00, А 61 К 35/00, опубл. 07.01.2003 г.), включающий культивирование рекомбинантных клеток E.coli в большеобъемных ферментерах емкостью до 50 л, разрушение бактериальных клеток, выделение и очистку ДНК.
Однако данная технология предполагает большие потери целевого продукта в процессе его получения. Это связано с тем, что в известном способе-аналоге наработка биомассы рекомбинантного штамма E.coli осуществляется в традиционном реакторе с механической мешалкой, которая способствует травмированию бактериальных клеток в процессе культивирования, что снижает количество ДНК, нарабатываемой рекомбинантной плазмидой в E.coli в процессе культивирования.
Наиболее близким техническим решением (прототипом) является способ культивирования рекомбинантных клеток E.coli и получения плазмидной ДНК (патент США №4962055, МПК С 12 N 15/00, опубл. 09.10.1990 г.), включающий суспензионное культивирование рекомбинантных клеток микроорганизмов в питательной среде типа LB при температуре 37°С, отделение клеток от питательной среды путем центрифугирования и отмывки, разрушение микробных клеток ферментами с последующим выделением и очисткой плазмидной ДНК высокоскоростным центрифугированием при скоростях центрифуги соответственно 6500, 17000 и 35000 об/мин и осаждением целевой фракции.
Однако известно, что природные бактериальные штаммы более устойчивы к различным внешним факторам, а искусственно модифицированные штаммы микроорганизмов менее жизнеспособны, требуют более щадящих условий культивирования. В известном способе-прототипе наработка биомассы рекомбинантного штамма E.coli осуществляется в традиционном реакторе с механической мешалкой, которая способствует травмированию бактериальных клеток в процессе культивирования, что снижает количество ДНК, нарабатываемой рекомбинантной плазмидой в E.coli в процессе культивирования. Кроме того, очистка ДНК производится с помощью высокоскоростных центрифуг (от 6500 до 35000 об/мин), производительность которых очень низкая, поскольку в стандартном исполнении эти центрифуги малогабаритные и, кроме того, весьма дорогостоящие, что удорожает процесс получения ДНК. Таким образом, оба эти фактора затрудняют использование высокоскоростных центрифуг для промышленного получения рекомбинантной ДНК.
Техническим результатом предлагаемого технического решения является создание такой технологии получения плазмидной ДНК, которая позволяет сократить потери целевого продукта на стадии культивирования, повысить ее производительность на стадии очистки, а также существенно удешевить процесс в целом.
Указанный технический результат достигается тем, что в способе получения препаративных количеств плазмидной ДНК из клеток рекомбинантных микроорганизмов, включающем суспензионное культивирование клеток рекомбинантных микроорганизмов в питательной среде типа LB при температуре 37°С, отделение клеток от питательной среды путем центрифугирования и отмывки, разрушение микробных клеток ферментами с последующим выделением и очисткой ДНК, согласно изобретению культивирование рекомбинантных клеток проводят в газовихревом биореакторе при объемном коэффициенте межфазного массобмена (kLa) не менее 5,0 1/час, до достижения оптической плотности (ОП) суспензии микроорганизмов не менее 1,4 единиц (λ=590 нм), а выделение и очистку плазмидной ДНК осуществляют путем инкубирования смеси, содержащей обработанные ферментами микробные клетки, щелочь и SDS с ацетатом щелочного металла, отделения образовавшегося осадка центрифугированием и получением целевого продукта из супернатанта путем осаждения хлоридом лития и этанолом, причем после каждой процедуры осаждения проводят центрифугирование, продолжительность каждой из указанных стадий инкубирования, осаждения и центрифугирования составляет не менее 20 минут, центрифугирование проводят на большероторных центрифугах при 5000 об/мин. В качестве большероторной центрифуги в заявленном способе используют крупногабаритную низкоскоростную центрифугу типа ОС-6М и/или Rotanta 46RSC Robotic (Hettich).
В качестве клеток рекомбинантных микроорганизмов - продуцентов плазмидной ДНК используют штаммы Е.coli JM 109 с клонированными генами ангиогенина человека.
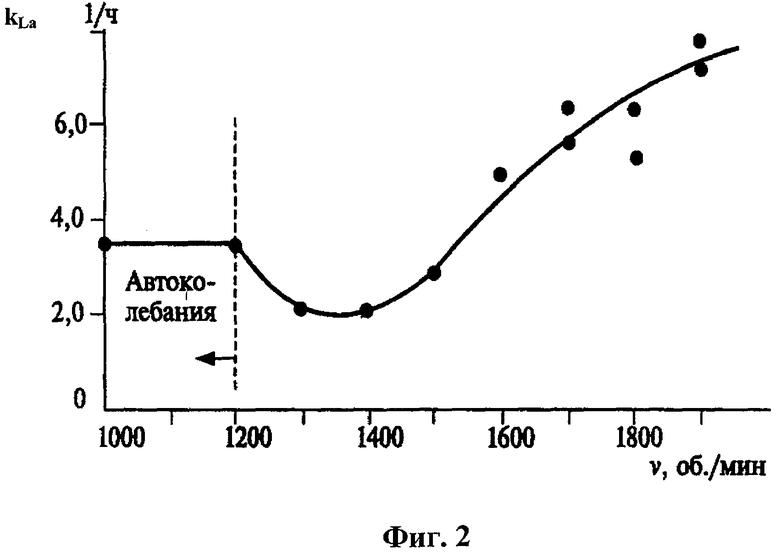
На чертежах на фиг.1 представлен график роста штаммов E.coli JM109, несущих различные рекомбинантные плазмиды ДНК с клонированными генами ангиогенина человека: 1 - плазмида pAng1 (вектор рС DNA3); 2 - плазмида pAng2 (вектор pCI-neo); 3 - плазмида pAng3 (вектор pCI), а на фиг.2 представлен график зависимости объемного коэффициента межфазного массообмена (kLa) (1/час) от скорости вращения активатора.
Ниже приведены примеры реализации заявляемого способа.
Пример 1. Технология культивирования рекомбинантных штаммов микроорганизмов
Для наработки препаративных количеств биомассы Е. coli, содержащей рекДНК, использован газовихревой биореактор "Биок" (Патент РФ №2135579, МПК С 12 М 1/04, опубл. 27.08.99). Биореактор можно использовать в биопроизводстве, он обладает удобством в обращении и экономичностью. Принцип действия биореактора "Биок" заключается в приведении во вращение водной фазы при помощи высокоскоростной (500-2500 об/мин) воздушной мешалки, вращающейся над поверхностью суспензии. Благодаря магнитному приводу обеспечивается полная стерильная изоляция внутренней среды ферментера от внешней. Его особенности следующие:
1. Возможность регуляции и изменения объема заполнения ферментера в процессе работы от 90% до 10% с сохранением заданных параметров.
2. Отсутствие травмирующих клетки микровихрей при интенсивном перемешивании (в связи с отсутствием механического активатора).
3. Трехмерное перемешивание по всему объему, обеспечивающее в 3-6 раз более интенсивный массообмен.
4. Гашение пены воздушным потоком.
5. Стерилизацию аппарата с присоединенными к основному модулю посредством гибких резиновых шлангов устройствами стерилизации подаваемого и выходящего воздуха осуществляют в аппарате "Коха" в течение 60 минут.
После стерилизации в аппарат, посредством принудительной подачи воздуха, закачивают стерильную среду (все операции состыковки резиновых патрубков ферментера и сосуда со средой, добавления в среду посевного материала и антибиотика производят в стерильных условиях).
Число оборотов механического активатора, генерирующего вихревое движение воздуха над поверхностью суспензии клеток, при запуске плавно наращивают в течение 3-х минут от 0 до 2500 об/мин. Объем питательной среды в биореактор изменяют от 3,5 до 5 литров.
Расход воздуха на аэрирование составляет 0,2 л/л среды в минуту.
Для наработки биомассы бактерий Е.coli, содержащей рекДНК, подращивают ночные посевные культуры в 100 мл среды LB, содержащей антибиотик ампициллин (50 мкг/мл), до оптической плотности 3,0 при λ=590 нм. Препаративные наработки биомассы проводят с подачей воздуха через стерилизующий ватно-марлевый и миллипоровый фильтры (поры 22 мкм).
Культивирование продуцентов рекомбинантных плазмид осуществляют на питательной среде LB. После приготовления питательную среду стерилизуют при 1 атм в течение 60 мин. В предварительно стерилизованный (1 атм в течение 60 мин) вихревой биореактор вводят: питательную среду, антибиотик ампициллин и посевной материал в количестве 200 мл. Затем аппарат подключают к сети и посредством электронного блока питания осуществляют его плавный запуск, регулировку и настройку параметров работы (температура, скорость оборотов двигателя, время работы), а также поддержание и регулирование режимов культивирования. Процесс культивирования проводят при температуре 37°С и скорости вращения активатора 1600-2000 об/мин, обеспечивавшего аэрирование и перемешивание культуральной среды. В процессе работы биореактора над поверхностью суспензии клеток формируется вихрь аэрирующего газа. За счет трения на границе газовой и жидкой фаз и разницы статического давления между периферией и центром газового вихря обеспечивается движение культуральной среды в виде вихревого кольца, вращающегося относительно оси биореактора, с одновременным нисходящим движением жидкости у стенок биореактора и восходящим в приосевой зоне. Таким образом, в указанной суспензии клеток формируется квазистационарное вращательное движение, генерируемое аэрирующим газом, подаваемым в биореактор над поверхностью суспензии клеток с одновременным его закручиванием в поток с полем скорости потенциального вихря на периферии биореактора и осевым противотоком в приосевой зоне при объемном коэффициенте межфазного массобмена (kLa) не менее 5,0 1/час. Аэрирующий газ взаимодействует с культуральной средой только через свободную поверхность последней, не смешиваясь с ней. В результате этого обеспечивается интенсификация массообмена за счет высокой разницы скорости аэрирующего газа и жидкости и равномерное перемешивание суспензии без застойных зон, снижение травмируемости клеток за счет исключения из объема жидкости областей с высоким уровнем турбулентности и отсутствия пенообразования.
В процессе работы ферментера через пробоотборники, снабженные зажимами и парубками, осуществляют отбор проб для определения рН (начальная рН культуральной среды 7,4) и контроль оптической плотности среды (590 нм). После окончания культивирования культуру сливают в сосуд, снабженный фильтром, и охлаждают в закрытом виде до +4°С.
Процесс культивирования представлен на графике (фиг.1). По оси абсцисс отложено время от начала культивирования, по оси ординат - оптическая плотность среды для каждой культуры при длине волны 590 нм. В конце культивирования при оптической плотности 1,4-2,4 культуру снимают и центрифугируют (оптимальной плотностью при получении биомассы культуры бактерий для целей наработки ДНК плазмид является оптическая плотность от 1,4 до 2,0 ед.).
Исследования показывают, что наиболее оптимальная скорость вращения активатора составляет 1600-2000 об/мин. При скорости активатора ниже 1600 об/мин снижается урожай клеток бактерий вследствие недостаточной интенсивности перемешивания. При скорости вращения активатора выше 2000 об/мин значительно уменьшается выход ДНК, что обусловлено неблагоприятными факторами (например, из-за неблагоприятного влияния центробежных сил на копийность плазмид в клетках), влияющими на процесс культивирования рекомбинантных бактериальных клеток.
Режим культивирования при скорости оборотов активатора 2300 об/мин характеризовался быстрым ростом культуры, изменением внешнего вида культуры (образование глобул), но малым конечным выходом рекДНК (1,06 г рекДНК из одного грамма биомассы).
Из графика на фиг.2 видно, что скорость вращения активатора 1600-2000 об/мин соответствует объемному коэффициенту межфазного массобмена (kLa) от 5,0 до 8,0 1/час, что является оптимальным диапазоном указанного параметра, при котором достигается максимальный выход рекомбинантной ДНК.
В Таблице 1 в последней строке каждого столбца указан вес сырой биомассы продуцента после центрифугирования (урожай). Разброс в величине полученной биомассы обусловлен вариацией числа оборотов активатора вихревого движения воздуха над поверхностью суспензии клеток.
Данные о наработке продуцентов плазмидной ДНК с клонированными генами ангиогенина человека в штаммах Е.coli JM 109
Ниже представлена таблица 2 наработки препаративных количеств рекДНК. Как видно из табл.2, выход рекДНК из 3,5 л среды составлял 18-19 мг. Выход рекДНК из V=5 л среды составлял 20 мг. При этом поддерживалась постоянная скорость вращения активатора 1600 об/мин (kLa=5,0 1/час). Среднее количество рекДНК, нарабатываемых в 1-ом литре среды в газовихревом ферментере «Биок», при достижении оптической плотности 1,4-2,0 (λ=590 нм) равнялось 5,1 мг/литр культуральной жидкости.
Данные о наработке препаратов рекомбинантных ДНК
Пример 2. Технология получения рекомбинантной ДНК из биомассы
Для получения целевого продукта полученную биомассу бактерий после культивирования предварительно охлаждают до +4°С и осаждают при 2500 об/мин на большероторной центрифуге в стаканах объемом 1 литр. В качестве большероторной центрифуги в заявленном способе используют крупногабаритную низкоскоростную центрифугу типа ОС-6М. Осадок бактерий после охлаждения до -20°С суспендируют в растворе следующего состава: 25 mM трис-HCl, рН 8,0, 10 mM ЭДТА, рН 8,0, 0,9% раствор глюкозы и 2 мг/мл лизоцима (объем раствора составляет 1/50 объема культуральной среды), инкубируют при +4°С 20 мин. В полученную смесь добавляют (2/50 от объема культуральной среды) раствор следующего состава: 0,2 М NaOH, 1% SDS (додецилсульфат натрия), перемешивают и инкубируют еще 10 мин при +4°С. В полученную смесь добавляют (0,03 от объема культуральной среды) 5 М ацетат К или ацетат Na, pH 4,8, перемешивают и инкубируют 1-1,2 часа при - 4°С, продукт осаждают в течение 25 мин, при 5000 об/мин. Полученный осадок отбрасывают, а супернатант переливают в другую пробирку, осаждают ДНК 96%-ным этанолом (2,5 объема супернатанта) 1 час при -20°С и центрифугируют 20 мин при 5000 об/мин, супернатант сливают, а осадок ополаскивают 96%-ным этанолом, подсушивают 20 мин и добавляют ТЕ буфер (1/100 от объема супернатанта). К полученному раствору добавляют 9 М LiCl (1/100 от объема супернатанта), выдерживают 40 мин при - 20°С, центрифугируют при 5000 об/мин 25-30 мин на большероторной центрифуге. Полученный супернатант переливают в другую пробирку (стакан ротора), добавляют 96% этанол (2,5 объема супернатанта), выдерживают 30 мин при -20°С, а затем центрифугируют при 5000 об/мин в течение 20 мин. Осадок промывают 70%-ным этанолом, подсушивают в течение 30 мин, растворяют в ТЕ буфере (1/300 объема супернатанта), переосаждают этанолом и полученный препарат ДНК помещают в 96%-й этанол для хранения и перевозки.
За счет увеличения времени инкубации очищаемого продукта с реагентами и времени центрифугирования не менее чем в 2 раза обеспечивается возможность использования в качестве большероторной центрифуги в заявленном способе крупногабаритной низкоскоростной центрифуги типа ОС-6М и/или Rotanta 46RSC Robotic (Hettich), что позволяет выделять рекДНК, наработанную в ферментере "Биок", за одну ферментацию. Таким образом, использование большероторной низкоскоростной центрифуги позволяет увеличивать объемы обрабатываемых для получения рекДНК биомасс, а значит, значительно удешевить производство препаратов для генотерапии.
Степень очистки плазмидной ДНК Ang1, Ang2 и Ang3 контролировали электрофорезом в 0,7%-ном агарозном геле после рестрикции по сайгу Eco RI. Вставки кДНК в плазмидах соответствовали искомым размерам. Из одного литра культуральной жидкости в среднем получают 5,1 мг плазмидной ДНК (табл.1), что также соответствовало 1,06-2,17 мг рекДНК на 1 г биомассы см. (табл.2). Во всех случаях количественную оценку ДНК производят денситометрически.
Пример 3. Результаты тестирования препаратов клонированного гена ангиогенина человека
Тестирование препаратов клонированного гена ангиогенина человека проводили на хориоаллантоисной мембране развивающихся куриных эмбрионов (ХАО РКЭ). Результаты представлены в табл.3.
При прямом подсчете сосудов на различных участках хориоаллантоисной оболочки куриного эмбриона получены следующие данные: в опытных образцах среднее число сосудов на площади 2 см2 составило 24,8±2,8, в контроле - 13,5±2,5. Таким образом, препарат №1 (ДНК pAng1) вызывал индукцию ангиогенеза в использованном нами тест-объекте. Значительные отличия от контроля наблюдались при испытании на ХАО развивающегося куриного эмбриона препаратов №2 и 3 (ДНК pAng2 - 30,3±2,7 и ДНК pAng3 - 35,3±2,9): в среднем наблюдалось двукратное превышение над контролем (контроль - 13,5±2,9) при прямом подсчете сосудов на участке ХАО (табл.3).
Результаты тестирования биологической активности рекДНК, содержащих ген ангиогенина человека (модель - хориоаллантоисная оболочка 9-суточного куриного эмбриона «Шавер 2000»).
На основании проведенного теста можно сделать заключение о ангиогенной активности препаратов рекДНК ангиогенина человека, полученных заявляемым способом.
Сравнительная оценка показывает, что выход ДНК по заявляемой технологии при одинаковой степени очистки продукта в 1,2-1,5 раза выше, чем в ближайших патентах-аналогах (патенты США №6503738 и №4962055).
Изобретение относится к биотехнологии и генной инженерии, а именно к технологии наработки и выделения препаративных количеств ДНК, и может быть использовано в медицине и фармацевтической промышленности. Способ получения препаративных количеств ДНК из рекомбинантных клеток микроорганизмов включает культивирование рекомбинантных клеток в газовихревом биореакторе, выделение и очистку плазмидной ДНК с использованием большероторных центрифуг. Использование изобретения позволяет увеличить выход целевого продукта. 2 з.п. ф-лы, 3 табл., 2 ил.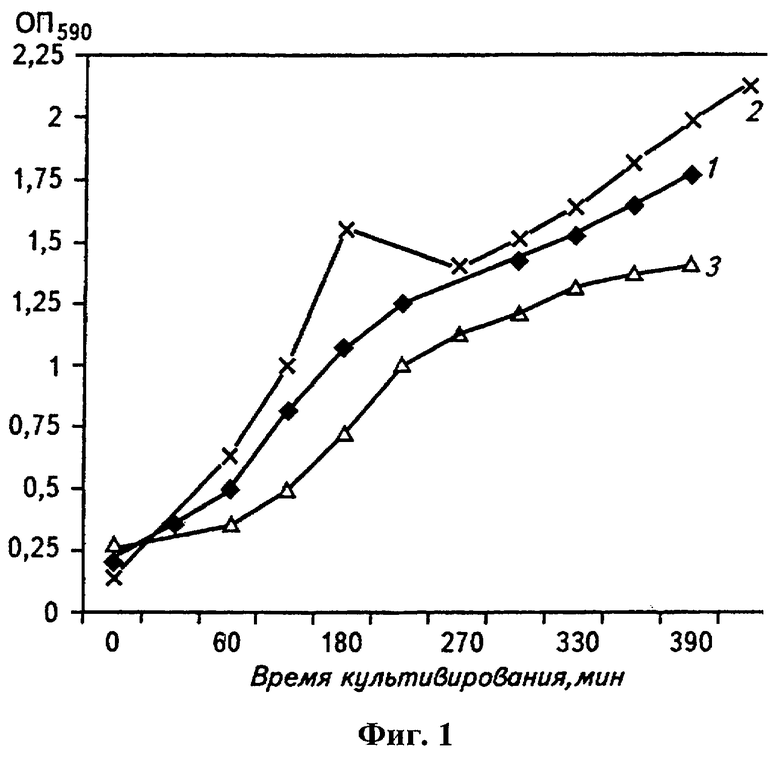
| АППАРАТ ДЛЯ СУСПЕНЗИОННОГО КУЛЬТИВИРОВАНИЯ КЛЕТОК ТКАНЕЙ И МИКРООРГАНИЗМОВ | 1998 |
|
RU2135579C1 |
| Способ выделения ДНК из селезенки крупного рогатого скота | 1986 |
|
SU1705301A1 |
| МАЗИН А.А | |||
| И ДР., Методы молекулярной генетики и генной инженерии, Новосибирск: Наука, 1990, стр.9. | |||
Авторы
Даты
2007-03-20—Публикация
2004-01-29—Подача