Изобретение относится к лекарственным средствам для коррекции метаболического сосудистого синдрома и заболеваний, сопровождающихся нарушением проницаемости сосудистой стенки и ломкостью капилляров, и может быть использовано как средство, повышающее резистентность капилляров.
Нарушение микроциркуляции крови в различных органах и тканях является одним из важнейших звеньев патогенеза большого числа заболеваний и патологических состояний. Известны средства, нормализующие проницаемость сосудов и улучшающие метаболические процессы в стенках сосудов. Среди препаратов необходимо отметить продектин, дицинон, доксиум, гливенол, эскузан (Большая Российская Энциклопедия лекарственных средств, М.: Издательство Ремедиум, т.2, 2002), применяемые для повышения устойчивости капилляров и нормализации их проницаемости при различных заболеваниях. Однако они характеризуются недостаточной эффективностью, наличием побочного действия и ограничением применения при нарушениях системы свертывания крови.
Это обусловливает необходимость разработки новых ангиопротекторных лекарственных препаратов.
Структурных аналогов, представленных в уровне техники, предлагаемый пептид не имеет.
Настоящим изобретением поставлена и решена задача получения нового пептида, обладающего биологической активностью, проявляющейся в повышении резистентности капилляров, и применения этого пептида для изготовления фармацевтической композиции, повышающей резистентность капилляров.
Технический результат изобретения заключается в создании нового пептида, повышающего резистентность капилляров, а также применении этого пептида в качестве активного начала в фармацевтической композиции, использование которой повышает резистентность капилляров и прочность стенок сосудов за счет нормализующего влияния на метаболические процессы в клетках стенок сосудов.
Указанный технический результат в отношении указанных объектов достигается за счет того, что предлагается пептид лизил-глутамил-аспарагиновая кислота общей формулы: H-Lys-Glu-Asp-OH последовательности 1 [SEQ ID NO:1].
Обнаружено, что пептид лизил-глутамил-аспарагиновая кислота общей формулы: H-Lys-Glu-Asp-OH последовательности 1 [SEQ ID NO:1] обладает биологической активностью, проявляющейся в повышении резистентности капилляров.
Предлагается применение пептида лизил-глутамил-аспарагиновая кислота общей формулы: H-Lys-Glu-Asp-OH последовательности 1 [SEQ ID NO:1] для приготовления лекарственного средства, повышающего резистентность капилляров.
Другой аспект настоящего изобретения касается фармацевтической композиции, повышающей резистентность капилляров, содержащей в качестве активного начала эффективное количество пептида лизил-глутамил-аспарагиновая кислота общей формулы: H-Lys-Glu-Asp-OH последовательности 1 [SEQ ID NO:1] и фармацевтически приемлемый носитель.
При этом фармацевтическая композиция находится в форме, подходящей для парентерального введения.
Следующий аспект настоящего изобретения касается способа профилактики и лечения нарушения микроциркуляции в органах и тканях, заключающегося в введении пациенту фармацевтической композиции, содержащей в качестве активного начала пептид лизил-глутамил-аспарагиновая кислота общей формулы: H-Lys-Glu-Asp-OH последовательности 1 [SEQ ID NO:1], в дозе 0,01-100 мкг/кг массы тела, по крайней мере, один раз в день в течение периода, необходимого для достижения терапевтического эффекта. При этом введение осуществляют парентерально.
Пептид глутамил-аспартил-аспарагиновая кислота общей формулы: H-Lys-Glu-Asp-OH получают классическим методом пептидного синтеза в растворе.
Регулирующее действие пептида H-Lys-Glu-Asp-OH на сосудистую стенку, то есть повышающее резистентность капилляров и прочность стенок сосудов, выявлено при его экспериментальном изучении.
Изучение биологической активности проводили на эксплантатах стенки сосудов, при экспериментальном парадонтите у крыс и у пациентов с поражением сосудов различной этиологии.
Понятие ″фармацевтическая композиция″ подразумевает различные лекарственные формы, содержащие пептид, которые могут найти лечебное применение в медицине в качестве средства, повышающего резистентность капилляров.
Для получения фармацевтических композиций, отвечающих изобретению, эффективное количество пептида H-Lys-Glu-Asp-OH как активное начало смешивают с фармацевтически приемлемым носителем согласно принятым в фармацевтике способам компаундирования.
Понятие "эффективное количество" подразумевает использование такого количества активного начала, которое в соответствии с его количественными показателями активности и токсичности, а также на основании знаний специалиста должно быть эффективным в данной лекарственной форме.
Носитель может иметь различные формы, которые зависят от лекарственной формы препарата, желаемой для введения в организм.
Для парентерального введения носитель обычно включает физиологический раствор или стерильную воду, хотя могут быть включены другие ингредиенты, способствующие стабильности, или для сохранения стерильности.
Сущность изобретения поясняется чертежом и таблицами.
В Таблице 1 показано влияние пептида H-Lys-Glu-Asp-OH на морфологические и биохимические показатели периферической крови морских свинок при изучении токсичности.
На чертеже показано влияние пептида H-Lys-Glu-Asp-OH на развитие эксплантатов сосудистой стенки.
В Таблице 2 показано влияние пептида H-Lys-Glu-Asp-OH на резистентность капилляров кожи пациентов с гиповитаминозом.
В Таблице 3 показано влияние пептида H-Lys-Glu-Asp-OH на показатели гемостаза у больных сенильной пурпурой.
Изобретение иллюстрируется примером синтеза пептида лизил-глутамил-аспарагиновая кислота общей формулы: H-Lys-Glu-Asp-OH (пример 1), примерами испытания токсичности и биологической активности пептида (примеры 2, 3, 4), а также примерами результатов клинического применения пептида, демонстрирующими его фармакологические свойства и подтверждающими возможность достижения профилактического и/или лечебного эффекта (примеры 5, 6).
Пример 1. Синтез пептида H-Lys-Glu-Asp-OH
1. Название соединения: лизил-глутамил-аспарагиновая кислота.
2. Структурная формула:
H-Lys-Glu-Asp-OH
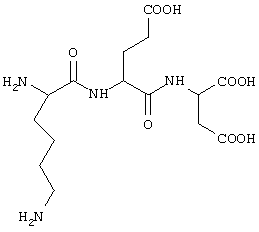
3. Брутто-формула без противоиона: C15H26N4O8.
4. Молекулярный вес без противоиона: 390,39.
5. Противоион: ацетат.
6. Внешний вид: белый аморфный порошок без запаха.
7. Способ синтеза: пептид получен классическим методом синтеза в растворе по схеме:

BOC - третбутилоксикарбонильная группа,
Z - бензилоксикарбонильная группа,
OSu - N-оксисукцинимидный эфир,
DCC - N,N'-дициклогексилкарбодиимид,
OBzl - бензиловый эфир,
TFA - трифторуксусная кислота.
8. Характеристики готового препарата:
- содержание основного вещества: 98,15% (по ВЭЖХ, 220 нм),
- ТСХ - индивидуален, Rf=0,65 (ацетонитрил-вода 1:3),
- содержание влаги: 6%,
- рН 0,01% раствора: 4,77,
- удельное оптическое вращение: [α]D 22: -31° (с=1, Н2O), ″Polamat A″, Carl Zeiss Jena.
Пример синтеза:
1) BOC-Glu(OBzl)-OSu, N-оксисукцинимидный эфир N-третбутилоксикарбонил-(γ-бензил)глутаминовой кислоты (I).
N-третбутилоксикарбонил-(γ-бензил)глутаминовую кислоту BOC-Glu(OBzl)-OH (33,7 г, 0,1 моль) растворяли в 50 мл N,N'-диметилформамида, охлаждали до температуры -10°С, добавляли при перемешивании охлажденные (4-6°С) растворы N,N'-дициклогексилкарбодиимида (23,0 г, 0,11 моль) в 30 мл N,N'-диметилформамида и N-гидроксисукцинимида (13,0 г, 0,11 моль) в 20 мл N,N'-диметилформамида. Реакционную смесь перемешивали в течение 12 ч при охлаждении льдом и далее в течение 1 суток при комнатной температуре. Выпавшую N,N'-дициклогексилмочевину отфильтровывали и полученный раствор активированного эфира использовали без выделения на следующей стадии.
2) BOC-Glu(OBzl)-Asp(OBzl)-OH, N-третбутилоксикарбонил-(γ-бензил)глутамил-(β-бензил)аспартат (II).
(β-Бензил)аспарагиновую кислоту H-Asp(OBzl)-OH (28,0 г, 0,12 моль) и 36 мл (0,12 моль) триэтиламина суспендировали в 50 мл N,N'-диметилформамида и перемешивали в течение 1 ч. Затем добавили порциями раствор активированного эфира BOC-Glu(OBzl)-OSu (I), полученный на предыдущей стадии. Реакционную смесь перемешивали при комнатной температуре в течение двух суток. Затем подкисляли 0,5 н серной кислотой до рН 2-3 и экстрагировали этилацетатом 4×50 мл. Вытяжки объединяли и последовательно промывали 0,5 н. H2SO4 3×50 мл, водой 2×50 мл, 5% раствором NaHCO3 2×50 мл, водой 2×50 мл, насыщенным раствором NaCl 2×50 мл. Органический слой сушили над Na2SO4, упаривали растворитель в вакууме, остаток кристаллизовали под гексаном. Получено 50 г продукта (92%). Rf=0,34 (бензол-ацетон 2:1).
3) TFA.H-Glu(OBzl)-Asp(OBzl)-OH (III), трифторацетат (γ-бензил)-глутамил-(β-бензил)аспартат.
N-третбутилоксикарбонил-(γ-бензил)глутамил-(β-бензил)аспартат (II) 5,68 г (≈0,01 моль) растворяют в 20 мл смеси дихлорметан-трифторуксусная кислота (3:1). Через 2 ч растворитель упаривали в вакууме при температуре 40°С, упаривание повторяли с новой порцией дихлорметана (2×10 мл), остаток сушат в вакууме над NaOH. Получено масло 5,80 г (≈100%).
Rf=0,63 (н-бутанол-пиридин-уксусная кислота-вода, 15:10:3:12).
4) Z-Lys(Z)-Glu(OBzl)-Asp(OBzl)-OH (IV), N,Nε-дибензилоксикарбониллизил-(γ-бензил) глутамил-(β-бензил)аспартат.
Трифторацетат (γ-бензил) глутамил-(β-бензил)аспартата (III) 5,65 г (0,01 моль) растворяют в 10 мл диметилформамида, добавляют триэтиламин 2,80 мл (0,02 моль) и N-оксисукцинимидный эфир N,Nε- дибензилоксикарбониллизина 6,64 г (0,013 моль). Смесь перемешивают 24 часа при комнатной температуре.
Продукт высаживают 0,5 н. раствором серной кислоты (150 мл), экстрагируют в этилацетат (3×30 мл), промывают 0,5 н. раствором серной кислоты (2×20 мл), водой, 5% раствором бикарбоната натрия (1×20 мл), водой, 0,5 н. раствором серной кислоты (2×20 мл), водой и сушат над безводным сульфатом натрия. Этилацетат фильтровали, упаривали в вакууме при температуре 40°С, остаток закристаллизовывали в системе этилацетат/гексан. Продукт отфильтровывали и сушили в вакууме над Р2O5. Выход 6,04 г (72%). Тпл.=142°С.
Rf=0,60 (бензол-ацетон, 1:1).
5) H-Lys-Glu-Asp-OH (V), лизил-глутамил-аспартат.
Защищенный трипептид Z-Lys(Z)-Glu(OBzl)-Asp(OBzl)-OH (IV) (0,90 г) растворяли в смеси метиловый спирт-вода (4:1) и гидрировали над катализатором Pd/C (5%) в течение 4 ч. Полноту прохождения реакции деблокирования контролировали по ТСХ в системе ацетонитрил-вода (1:3). Растворитель упаривали в вакууме, остаток сушили в вакууме над КОН.
Для очистки 300 мг препарата растворяли в 4 мл 0,01% трифторуксусной кислоты и подвергали высокоэффективной жидкостной хроматографии на колонке с обращенной фазой 50×250 мм Diasorb-130-C16T, 7mkm. Хроматограф Beckman System Gold, 126 Solvent Module, 168 Diode Array Detector Module. Условия хроматографирования А: 0,1% TFA; В: MeCN/0,1% TFA, градиент В 0→50% за 100 мин. Объем пробы 5 мл, детекция при 215 нм, сканирование 190-600 нм, скорость потока 10 мл/мин. Отбирали фракцию 42,0-47,0 мин. Растворитель упаривали в вакууме при температуре не выше 40°С, упаривание многократно (5 раз) повторяли с 10 мл 10% раствора уксусной кислоты.
Окончательно остаток растворяли в 20 мл деионизованной воды и лиофилизовывали. Получено 270 мг очищенного препарата в виде аморфного белого порошка без запаха.
6) Анализ готового препарата.
- Содержание основного вещества определяли методом ВЭЖХ на колонке Phenomenex С 18 LUNA 4,6×150 mm. A: 0,1% TFA, В: MeCN; grad. B 0-100% in 10 min. Скорость потока 1 мл/ мин. Детекция при 220 нм, сканирование 190-600 нм, проба 20 μl. Содержание основного вещества 98,15%.
- ТСХ: индивидуален, Rf=0,65 (ацетонитрил-вода 1:3, пластинки ПТСХ-П-В-УФ Sorbfil, силикагель СТХ-1ВЭ 8-12 мкм, проявление хлор/бензидин).
- Содержание влаги: 6% (гравиметрически по потере массы при сушке 20 мг при 100°С).
- рН 0,01% раствора: 4,77 (потенциометрически).
- Удельное оптическое вращение: [α]D 22: -31° (с=1, Н2O), "Polamat A", Carl Zeiss Jena.
Пример 2. Изучение токсичности пептида H-Lys-Glu-Asp-OH
Общетоксическое действие пептида H-Lys-Glu-Asp-OH исследовали в соответствии с требованиями ″Руководства по экспериментальному (доклиническому) изучению новых фармакологических веществ″ (2000): острой токсичности при однократном введении препарата, а также подострой и хронической токсичности при длительном введении пептида.
Исследование по изучению острой токсичности проведено на 66 белых беспородных мышах-самцах массой 20-23 г. Животные были рандомизированно разделены на 6 равных групп. Препарат вводили животным однократно внутримышечно в дозах 1 мг/кг, 2 мг/кг, 3 мг/кг, 4 мг/кг, 5 мг/кг в 0,25 мл стерильного 0,9% раствора NaCl. Животным контрольной группы в том же объеме вводили 0,9% раствор NaCl.
Исследование по изучению подострой токсичности проведено на 60 белых беспородных крысах-самцах массой 160-240 г. Ежедневно однократно животным подопытных групп вводили препарат внутримышечно в течение 90 дней в дозах 1 мкг/кг, 0,1 мг/кг, 1 мг/кг в 0,5 мл стерильного 0,9% раствора NaCl. Животным контрольной группы вводили в том же объеме стерильный 0,9% раствор NaCl. До введения препарата, на 30, 60 и 90 сутки после начала введения препарата у животных исследовали морфологический состав и свойства периферической крови. При завершении эксперимента исследовали биохимические и коагулологические показатели крови.
Исследования по изучению хронической токсичности проводили в течение 6 месяцев, исходя из длительности рекомендуемого клинического назначения препарата на 96 морских свинках-самцах массой 300-340 г. Животные подопытных групп получали ежедневно однократно внутримышечно пептид в течение 6 мес в дозах 1 мкг/кг, 0,1 мг/кг, 1 мг/кг в 0,5 мл стерильного 0,9% раствора NaCl. В контрольной группе животным вводили по аналогичной схеме стерильный 0,9% раствор NaCl в том же объеме. У животных в периферической крови общепринятыми методами определяли: количество эритроцитов, гемоглобина, ретикулоцитов, тромбоцитов, лейкоцитов, лейкоцитарную формулу, скорость оседания эритроцитов (СОЭ), резистентность эритроцитов. Наряду с этим определяли содержание в сыворотке крови общего белка по методу Лоури, калия и натрия методом плазменной спектрофотометрии. После завершения эксперимента проводили патоморфологическое исследование головного и спинного мозга, спинно-мозговых ганглиев, щитовидной железы, паращитовидных желез, надпочечников, семенников, гипофиза, сердца, легких, аорты, печени, почки, мочевого пузыря, поджелудочной железы, желудка, тонкой кишки, толстой кишки, тимуса, селезенки, лимфатических узлов, костного мозга.
При изучении острой токсичности установлено, что однократное введение исследуемого пептида животным в дозе, превышающей терапевтическую, рекомендованную для клинического применения, более чем в 5000 раз, не вызывает токсических реакций, что свидетельствует о большой терапевтической широте препарата.
Изучение подострой и хронической токсичности пептида свидетельствует об отсутствии побочных эффектов при длительном применении препарата в дозах, превышающих терапевтическую в 100-1000 раз. При исследовании влияния пептида на морфологический состав крови морских свинок установлено увеличение количества лейкоцитов через 3 и 6 месяцев после начала введения препарата (Таблица 1). Остальные показатели морфологического состава крови животных практически не изменялись. Не отмечено достоверного влияния препарата на СОЭ, резистентность эритроцитов и биохимические показатели сыворотки крови.
При оценке общего состояния животных, морфологических и биохимических показателей периферической крови, морфологического состояния внутренних органов, состояния сердечно-сосудистой и дыхательной систем, функции печени и почек патологические изменения в организме не обнаружены.
Отсутствие общетоксического действия позволяет рекомендовать фармацевтическую композицию, содержащую в качестве активного начала пептид Н-Lys-Glu-Asp-OH, для проведения клинических испытаний.
Пример 3. Влияние пептида H-Lys-Glu-Asp-OH на развитие эксплантатов сосудистой стенки
Эксперименты проведены на 32 фрагментах сосудистой стенки периферической артерии крыс линии ″Wistar″, массой тела 150-200 г. Питательная среда для культивирования эксплантатов состояла из 35% раствора Игла, 25% фетальной сыворотки теленка, 35% раствора Хенкса, 5% куриного эмбрионального экстракта, в среду добавляли глюкозу (0,6%), инсулин (0,5 ед./мл), пенициллин (100 ед./мл), глютамин (2 мМ). Фрагменты сосудистой стенки помещали в эту среду и культивировали в чашках Петри в термостате при 36,7°С в течение 2 суток. В экспериментальную среду добавляли пептид H-Lys-Glu-Asp-OH в концентрациях 1, 10, 100 и 200 нг/мл. Критерием биологической активности служил индекс площади (ИП) - соотношение площади всего эксплантата вместе с зоной роста к исходящей площади фрагмента сосудистой стенки. Значения ИП выражали в процентах, контрольное значение ИП принималось за 100%.
На чертеже показано влияние пептида H-Lys-Glu-Asp-OH на развитие эксплантатов сосудистой стенки.
Установлено, что через 1 сутки культивирования происходило распластывание эксплантатов на коллагеновой подложке и начиналось выселение пролиферирующих и мигрирующих клеток по периферии эксплантата. На 3-и сутки культивирования при концентрации пептида H-Lys-Glu-Asp-ОН 100 нг/мл наблюдалось достоверное повышение ИП эксплантатов на 24%, по сравнению с контрольными значениями ИП. При исследовании эксплантатов сосудистой стенки на более длительных сроках культивирования (7 дней) были выявлено аналогичное стимулирующее действие пептида H-Lys-Glu-Asp-OH в той же концентрации.
Таким образом, в отношении ткани сосудистой стенки пептид H-Lys-Glu-Asp-OH оказывал тканеспецифическое действие, проявляющееся в стимуляции роста эксплантатов.
Пример 4. Влияние пептида H-Lys-Glu-Asp-OH на микроциркуляцию у крыс с экспериментальным пародонтитом
Эксперименты проведены на 45 белых беспородных крысах обоего пола, с массой тела 180-200 г. Модель пародонтита легкой степени достигалась методикой дифференцированного кормления крыс с использованием стандартного гранулированного корма ПК-120 в течение 1,5 месяца. В ходе эксперимента животные были распределены на 3 группы по 15 крыс в каждой: 1 группа животных с экспериментальным пародонтитом, предоставленным собственному течению; 2 группа животных с экспериментальным пародонтитом, которым вводили 0,1 мл стерильного 0,9% раствора NaCl в слизистую переходной складки десны (контроль); 3 группа животных с экспериментальным пародонтитом, которым вводили пептид H-Lys-Glu-Asp-OH в течение 10 дней путем ежедневной однократной инъекции в дозе 2 мкг в 0,1 мл стерильного 0,9% раствора NaCl в слизистую переходной складки десны с одновременным втиранием раствора пептида.
Во всех сериях опытов под нембуталовым наркозом проводилась биомикроскопия слизистой оболочки десны у крыс с использованием контактных объективов, оценивалась скорость кровотока в капиллярах с помощью лазерного анализатора капиллярного кровотока ЛАКК-01. Исследования проводились в 3-х зонах десны; в свободной десне, в прикрепленной десне и переходной складке при увеличении 100. Клинические проявления пародонтита оценивали визуально.
При биомикроскопической оценке микроциркуляторного русла в тканях пародонта животных 1-ой группы обнаружено преобладание воспалительных изменений в микрососудах, особенно ярко выраженное в свободной десне. В данной области капилляры резко расширены, кровоток в них заметно замедлен. В венулярной части капилляры перегружены кровью за счет нарушения венозного оттока. Периваскулярная ткань отечная, фон мутный. По ходу капилляров отмечались диффузные периваскулярные геморрагии, что свидетельствует о значительном повышении проницаемости их стенок.
В зоне прикрепленной десны указанные признаки нарушения микроциркуляции сохраняются, но выражены в меньшей степени. В переходной складке десны признаки расстройства микроциркуляции носят более разнообразный характер: в поверхностном слое слизистой оболочки полости рта наблюдаются гиперемированные капилляры с адгезией лейкоцитов и диапедезными геморрагиями, особенно выраженными в посткапиллярном звене микроциркуляторного русла. В глубоких слоях слизистой оболочки на фоне отека тканей выявляются гиперемированные артериолы с деформированными контурами, а также гиперемированные венулы с замедленным зернистым кровотоком. Наибольший показатель индекса микроциркуляции (ИМ), характеризующего суммарную балльную оценку нарушения микроциркуляции, был выявлен при гингивите в свободной десне - 0,54±0,01, что более чем в 2 раза выше, чем в нормальном пародонте (0,21±0,30). Этот показатель в прикрепленной десне составил 0,31±0,08, а в области переходной складки - 0,27±0,04. Морфометрическое исследование показало увеличение диаметров капилляров во всех зонах десны: в свободной десне - 9,7±0,21 мкм, в прикрепленной десне - 8,9±0,25 мкм и в переходной складке - 8,7±0,11 мкм. Во всех исследуемых зонах наблюдалось повышение плотности капилляров на единицу площади по сравнению со здоровыми тканями пародонта в среднем до 40±1,2 мм2 (в норме 29,3±2,3 мм2). Лазерная допплерография показала повышение скорости кровотока во всех зонах десны: в свободной десне - 29±1,2 усл. ед.; в прикрепленной десне - 27±0,5 усл. ед.; в переходной складке - 22±1,0 усл. ед. (в норме - 18±1,3 усл. ед.). Осмотр слизистой оболочки десны крыс 2-й группы (контроль) обнаружил распространенное изменение ее окраски от бледно-розового до ярко-красного с синюшным оттенком цвета. Биомикроскопия слизистой оболочки выявила дальнейшее ухудшение трофического обеспечения тканей пародонта в виде прогрессирующего расстройства микроциркуляции. Так, кровоток в капиллярах и мелких венулах свободной и прикрепленной десны приобретал зернистый и замедленный характер с локальной агрегацией эритроцитов. Контуры сосудов приобретали извитой характер и были деформированы. Заметно нарастала проницаемость гистогематического барьера, о чем свидетельствует отечность интерстиция в виде помутнения фона и диффузные периваскулярные геморрагии. Как компенсаторная реакция на нарушение микроциркуляции на развивающуюся гипоксию тканей наблюдались признаки усиленной пролиферативной активности эндотелия, что выражается в нарастании извитости микрососудов и феномене дупликации капиллярных петель. Эти изменения наиболее отчетливо обнаруживались в прикрепленной десне и в поверхностных слоях переходной складки. В переходной складке на фоне заметного снижения скорости кровотока отмечалось уменьшение числа функционирующих капилляров, изменялась форма капиллярных петель в виде усиления их извитости, появления варикозных расширений и др. Капиллярный фон мутный, контуры капилляров нечеткие, что отражает нарушение барьерных возможностей их стенок с прогрессированием периваскулярных геморрагий. Следует подчеркнуть, что появлению признаков структурной перестройки микроциркуляторного русла предшествовала генерализация патологического процесса в тканях десны, что необходимо рассматривать как неблагоприятный прогностический признак. В данной группе экспериментов отмечалось дальнейшее увеличение степени нарушения микроциркуляции в тканях пародонта в виде роста ИМ: в свободной десне - до 0,75±0,03; в прикрепленной десне - до 0,63±0,04; в области переходной складки - до 0,39±0,02, Морфометрия диаметров микрососудов исследуемых зон слизистой оболочки десны в данной группе опытов показала их дальнейшее расширение (в свободной десне - 12,3±0,36; в прикрепленной десне - 9,8±0,35; в переходной складке - 9,1±0,09) на фоне определенного снижения плотности капилляров на единицу площади в среднем до 30±1,5 мм2. Лазерная допплерография выявила значительное снижение скорости капиллярного кровотока во всех зонах десны: в свободной десне - 15±1,5 усл. ед.; в прикрепленной десне - 17±0,7 усл. ед., в переходной складке - 19±1,2 усл. ед.
Осмотр слизистой оболочки десны крыс, получавших инъекции пептида H-Lys-Glu-Asp-OH, обнаружил изменение ее цвета на бледно-розовый и снижение отечно-воспалительной реакции, особенно в области переходной складки и прикрепленной десны. Биомикроскопия слизистой оболочки десны в целом выявила выраженную коррекцию признаков патологической перестройки микроциркуляторного русла и стихание признаков воспаления, отека тканей. Изменения микроциркуляции в большей мере сохраняются в свободной десне. Капилляры этой зоны несколько расширены, однако скорость кровотока в них резко возросла, кровоток стал гомогенным. Контуры капилляров относительно ровные, без признаков диапедеза эритроцитов, капилляроскопический фон вокруг них прозрачный, что свидетельствует о восстановлении нарушенной проницаемости гистогематического барьера. В зоне прикрепленной десны и переходной складки биомикроскопия слизистой оболочки десны показала полную коррекцию признаков нарушения микроциркуляции: заметно повысилось количество функционирующих капилляров, их контуры стали ровными, четкими, кровоток сохранял незначительную зернистость, нет признаков нарушения проницаемости и периваскуляркого отека тканей. В переходной складке, в глубоких слоях слизистой оболочки в единичных венулах сохранялся зернистый характер тока крови. Индекс ИМ в свободной десне снижался до уровня в нормальном пародонте - 0,29±0,15; а в прикрепленной десне и переходной складке, соответственно, - 0,22±0,05 и 0,20±0,18. При морфометрии выявлено уменьшение диаметров капилляров во всех зонах десны (в свободной десне - 8,2±0,1; в прикрепленной десне - 7,8±0,20 и в переходной складке - 6,57±0,1) на фоне повышенной плотности их на единицу площади, которая в среднем составила 34±2,7 мм2. Показатели лазерной допплерографии сосудов заметно снизились почти до нормы (в свободной десне - 20±0,9 усл. ед.; в прикрепленной десне - 20±1,1 усл. ед.; в переходной складке - 19±2,3 усл.ед.).
Таким образом, в результате экспериментальных исследований установлено, что применение пептида H-Lys-Glu-Asp-OH оказывает нормализующее влияние на состояние стенок капилляров, повышая их резистентность и проницаемость, а также на состояние микроциркуляторного русла слизистой оболочки десны и пародонта.
Пример 5. Влияние пептида H-Lys-Glu-Asp-OH на резистентность капилляров кожи у пациентов с гиповитаминозом
Исследование проведено на 25 пациентах в возрасте 19-35 лет с признаками гиповитаминоза в весенний период. Пациенты были рандомизированно разделены на две группы.
Основной группе больных фармацевтическую композицию, содержащую в качестве активного начала пептид H-Lys-Glu-Asp-OH, вводили в дозе 100 мкг в 1,0 мл физиологического раствора ежедневно однократно внутримышечно в течение 10 дней. Контрольная группа включала 18 пациентов, получавших инъекции физиологического раствора по аналогичной схеме. Пациенты обеих групп в этот период получали только сбалансированную витаминосодержащую диету.
Оценка влияния пептида H-Lys-Glu-Asp-OH на резистентность капилляров кожи проводилась с использованием манжеточной пробы Румпеля-Лееде-Кончаловского. Пациентам на верхнюю треть плеча накладывали манжету тонометра. В манжете создавали давление в 200 мм рт.ст. в течение 3 мин. Резистентность капилляров кожи оценивали на участке дозированной нагрузки на капилляры кожи (под манжетой). Кровоизлияния подсчитывали с помощью лупы.
Резистентность капилляров кожи оценивали по пятибалльной шкале:
I - до 5 мелких петехий,
II - от 6 до 15,
III - до 30,
IV - более 30 кровоизлияний,
V - число кровоизлияний не поддается подсчету, сливная реакция.
В результате проведенного исследования было установлено, что применение пептида H-Lys-Glu-Asp-OH способствует повышению резистентности капилляров кожи, выражавшемуся в достоверном уменьшении количества кровоизлияний в коже с 30-47, выявлявшихся у больных обеих групп до лечения, до 6-8 у больных основной группы после лечения, в то время как у пациентов контрольной группы количество кровоизлияний не изменилось (Таблица 2).
Таким образом, применение фармацевтической композиции, содержащей в качестве активного начала пептид H-Lys-Glu-Asp-OH, целесообразно в комплексной терапии пациентов с гиповитаминозами с целью повышения резистентности капилляров и предотвращения ломкости сосудов.
Пример 6. Эффективность применения пептида H-Lys-Glu-Asp-OH у больных с сенильной пурпурой
Исследование проведено на 23 больных сенильной пурпурой в возрасте 70-82 лет, которые предъявляли жалобы на частое спонтанное появление пятен кровоизлияний на лице, шее, предплечьях и кистях рук. У больных отмечалась прогрессирующая динамика развития заболевания.
Все больные ранее получали симптоматическую и патогенетическую терапию по поводу конкретных клинических проявлений сосудистой патологии.
Пациенты были рандомизированно разделены на 2 группы. Основную группу составили 12 больных, которым вводили фармацевтическую композицию, содержащую в качестве активного начала пептид H-Lys-Glu-Asp-OH, в дозе 100 мкг в 1,0 мл физиологического раствора ежедневно однократно внутримышечно в течение 10 дней. Контрольная группа включала 11 пациентов, получавших инъекции стерильного физиологического раствора по аналогичной схеме.
В динамике оценивали жалобы больных, проводили общеклиническое исследование крови и мочи, биохимическое изучение крови. С целью исследования гемостаза определяли коагулограмму крови и использовали пробу Гесса со жгутом.
В отличие от контрольной группы, у больных основной группы после применения фармацевтической композиции, содержащей в качестве активного начала пептид H-Lys-Glu-Asp-OH, наблюдалось более выраженное нормализующее воздействие пептида на изучаемые показатели гемостаза, которые практически приближались к показателям у здоровых лиц (время рекальцификации, протромбиновое время, активированное частичное тромбоплатиновое время, этаноловый тест); у пациентов контрольной группы отмечалось лишь небольшое недостоверное улучшение показателей гемостаза (Таблица 3).
В результате проведенного исследования установлено, что у больных сенильной пурпурой после применения фармацевтической композиции, содержащей в качестве активного начала пептид H-Lys-Glu-Asp-OH, наблюдались улучшение состояния кожи и повышение прочности стенок капилляров, о чем свидетельствуют результаты пробы Гесса, показывающие уменьшение количества кровоизлияний.
Таким образом, применение фармацевтической композиции, содержащей в качестве активного начала пептид H-Lys-Glu-Asp-OH, целесообразно для лечения больных сенильной пурпурой для повышения резистентности и прочности стенок капилляров и нормализации микроциркуляции крови.
** Р<0,05 по сравнению с показателем в контроле.
Изобретение относится к лекарственным средствам для коррекции метаболического сосудистого синдрома и заболеваний, сопровождающихся нарушением проницаемости сосудистой стенки и ломкостью капилляров, и может быть использовано как средство, повышающее резистентность капилляров. Предлагается пептид лизил-глутамил-аспарагиновая кислота общей формулы: H-Lys-Glu-Asp-OH последовательности 1 [SEQ ID NO:1], обладающий биологической активностью, проявляющейся в повышении резистентности капилляров. Предлагается фармацевтическая композиция, повышающая резистентность капилляров, содержащая в качестве активного начала эффективное количество пептида лизил-глутамил-аспарагиновая кислота общей формулы: H-Lys-Glu-Asp-OH последовательности 1 [SEQ ID NO:1] и фармацевтически приемлемый носитель. При этом фармацевтическая композиция находится в форме, подходящей для парентерального введения. Предлагается способ профилактики и/или лечения нарушения микроциркуляции в органах и тканях, заключающийся в введении пациенту фармацевтической композиции, содержащей в качестве активного начала эффективное количество пептида лизил-глутамил-аспарагиновая кислота общей формулы: H-Lys-Glu-Asp-OH последовательности 1 [SEQ ID NO:1], в дозе 0,01-100 мкг/кг массы тела, по крайней мере, один раз в день в течение периода, необходимого для достижения терапевтического эффекта. При этом введение осуществляют парентерально. Группа изобретений обеспечивает получение нового пептида, обладающего биологической активностью, проявляющейся в повышении резистентности капилляров, и применение этого пептида для изготовления фармацевтической композиции, повышающей резистентность капилляров. 4 н. и 3 з.п. ф-лы, 3 табл., 1 ил.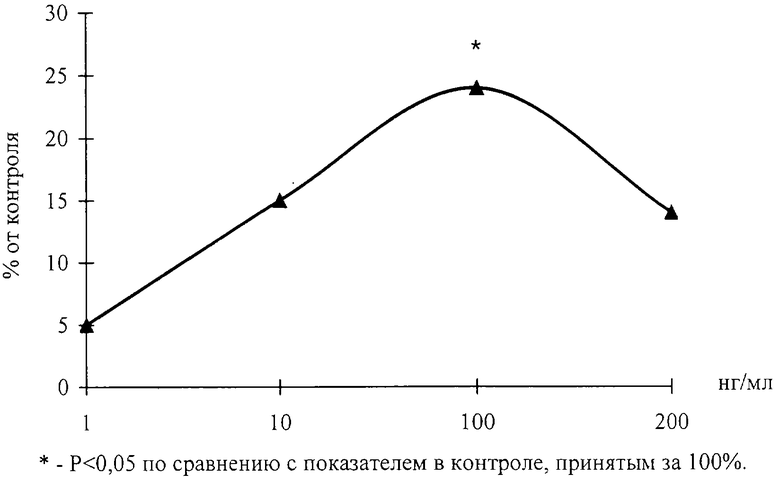
| US 6069129 А, 30.05 | |||
| ЩИТОВОЙ ДЛЯ ВОДОЕМОВ ЗАТВОР | 1922 |
|
SU2000A1 |
| US 2003130200 А, 10.07.2003 | |||
| US 2005101539 A, 12.05.12005 | |||
| RGD-СОДЕРЖАЩИЕ ПЕПТИДЫ | 2001 |
|
RU2214416C2 |
Авторы
Даты
2007-03-27—Публикация
2006-05-23—Подача