Настоящее изобретение относится к области парфюмерии. В особенности оно касается соединений, содержащих, по крайней мере, один β-окси или β-тиокарбонильный остаток, способный к высвобождению активной молекулы, такой как, например, α, β-ненасыщенный кетон, альдегид или эфир карбоновой кислоты. Настоящее изобретение касается также применения указанных соединений в парфюмерии, так же как ароматизирующих композиций или ароматизированных изделий, содержащих соединения по изобретению.
Уровень техники
Парфюмерная промышленность проявляет особый интерес к соединениям, которые способны к продлению эффекта воздействия активных ингредиентов в течение определенного периода времени, например, для того, чтобы преодолеть проблемы, с которыми сталкиваются при использовании ароматизаторов, являющихся слишком летучими или имеющими недостаточную устойчивость. Эти соединения могут быть использованы в различных областях применения, например, в тонкой или функциональной парфюмерии. Стирка изделий из текстиля является одной из конкретных областей, в которой ведутся постоянные разработки с целью обеспечить эффективность активных субстанций, в особенности ароматизаторов, которые действуют в течение определенного периода времени после стирки и сушки. Действительно, многие вещества, обладающие запахом и являющиеся особенно подходящими для этого типа применения, фактически известны как теряющие устойчивость при стирке или они не сохраняются после прополаскивания, в итоге их эффект как ароматизаторов продолжается не долго и не сильно. Учитывая важность этого типа применения для парфюмерной промышленности, было поддержано исследование в этой области, в особенности с целью обнаружения новых и более эффективных решений вышеупомянутых проблем.
Среди соединений по настоящему изобретению известны немногие из предшествующего уровня техники. Указанными соединениями являются 3-(фенилметокси)-1-(2,6,6-триметил-2-циклогексен-1-ил)-1-бутанон (Fehr С et al. in HeIv. Chim. Acta (1992), 75, 1023), 4-(фенилсульфонил)-4-(2,6,6-триметил-1,3-циклогексадиен-1-ил)-2-бутанон (Torii S. et al. in Bull. Chem. Soc. Jpn. (1978), 51, 949), 4-(фенилтио)-4-(2,6,6-триметил-1-циклогексен-1-ил)-2-бутанон (Kuwajima I. et al. in Synthesis (1976), 602), 4-(фенилсульфонил)-4-(2,6,6-триметил-1 или 2-циклогексен-1-ил)-2-бутанон (Torii S. et al. in Chem. Lett. (1975), 479), 2-метил-5-(1-метилэтенил)-3-[(4-метилфенил)сульфонил]-циклогексанон (Sayed A. et al. in Curr. Sci. (1999), 77, 818), 2-метил-5-(1-метилэтенил)-3-(фенилметокси)-циклогексанон (Hareau G. et al. in J.Am.Chem. Soc.(1999), 121, 3640), 2-метил-5-(1-метилэтенил)-3-(октилтио)-циклогексанон (Niyazymbetov M. et al. in Tetrahedron Lett. (1994), 35, 3037), 3,3'-тиобис[2-метил-5-(1-метилэтенил)-циклогексанон (Hargreaves M et al. in Z. Natwforsch., B: Anorg. Chem., Org. Chem. (1978), 33B, 1535), 2-метил-5-(1-метилэтенил)-3-(фенилтио)-циклогексанон и его оптические изомеры (например, Bakuzis P. et al. in J.Org.Chem. (1981), 46, 235), 4-(фенилсульфонил)-4-(2,5,6,6-тетраметил-1 или 2-циклогексен-1-ил)-2-бутанон и его оптические изомеры (Torii S. et al. in J.Org.Chem. (1980), 45, 16), бета-[(4-метилфенил)тио]-бензолпропаналь ( Manickam G. et al. Tetrahedron (1999), 55, 2721), бета-[4-(трифторметил)фенокси]-бензолпропаналь (in ES 2103680), бета-(фенилсульфонил)-бензолпропаналь (Vidal J. et al. in Tetrahedron Lett. (1986), 27, 3733), бета-(фенилметокси)-бензолпропаналь (Brickmann К. et al. in Chem. Ber. (1993), 126. 1227), бета-[[[3,5-бис(1,1-диметилэтил)-4-гидроксифенил]метил]тио]-бензолпропаналь (in EP 140298), бета-[(4-бром-3-метилфенил)тио]-бензолпропаналь (Loiseau P. et al. in Pharm. Acta HeIv. (1983), 58, 115), бета-[(4-хлорфенил)тио]-бензолпропаналь (in FR 2509725), бета-[(4-метилфенил)сульфонил]-бензолпропаналь (in WO 00/000198) и бета-(фенилтио)-бензолпропаналь (например, Tilak В. et al. in Indian J.Chem. (1969), 7, 191).
Однако все соединения, упомянутые выше, использовались как синтетические промежуточные соединения, а не как ароматизаторы. Кроме того, в документах, упомянутых выше, нет никакого упоминания или предложения по потенциальному использованию указанных соединений как ароматизаторов и более определенно по использованию указанных соединений для контролирования за высвобождением активных молекул, например молекул соединений, имеющих запах.
Раскрытие изобретения
Было обнаружено существование мономерных, олигомерных или даже полимерных соединений на подложке, содержащих, по крайней мере, один β-окси или β-тиокарбонильный остаток, способных к высвобождению активной молекулы, а именно енона. Под термином "активная молекула" в настоящем изобретении подразумевается любая молекула, способная принести выигрыш в запахе или оказать воздействие на окружающую ее среду и, в особенности, ароматическая молекула, то есть ароматизатор, такой как α, β-ненасыщенный кетон, альдегид или эфир карбоновой кислоты. Соединения настоящего изобретения имеют формулу
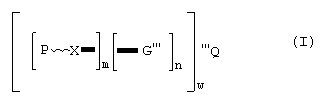
где а) w представляет собой целое число от 1 до 10000;
б) n имеет значение 1 или 0;
c) m представляет собой целое число от 1 до 4;
d) P представляет собой атом водорода или радикал, допускающий к образованию душистого α, β-ненасыщенного кетона, альдегида или эфира карбоновой кислоты и представлен формулой
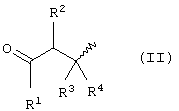
где волнистая линия означает положение связи между указанными Р и X;
R1 представляет собой атом водорода, C1-С6 алкоксильный радикал или C1-C15 линейный, циклический или разветвленный алкильный, алкенильный или алкадиенильный радикал, возможно замещенный C1-C4 алкильными группами;
R2, R3 и R4 представляют собой атом водорода, ароматическое кольцо или C1-C15 линейный, циклический или разветвленный алкильный, алкенильный или алкадиенильный радикал, возможно замещенный C1-C4 алкильными группами; или две или три группы R1-R4 связываются вместе, чтобы образовать насыщенное или ненасыщенное кольцо, имеющее от 6 до 20 атомов углерода, включая атом углерода, к которому присоединены указанные R1, R2, R3 или R4 группы, при этом это кольцо может быть замещенным C1-C8 линейными, разветвленными или циклическими алкильными или алкенильными группами; и при условии, что, по крайней мере, одна из Р групп имеет формулу (II) как определено выше;
е) Х представляет собой функциональную группу, выбранную из группы, включающей формулы от i) до xiii):

где в указанных формулах волнистые линии имеют те значения, как определено выше, и жирные линии показывают положение связи между указанными Х и G и R5 представляет собой атом водорода, С1-С22 насыщенную или ненасыщенную алкильную группу или арильную группу, возможно замещенную C1-С6 алкильной или алкоксильной группами или атомами галогена; и при условии, что Х может отсутствовать, когда Р представляет собой атом водорода;
f) G представляет собой поливалентный радикал (с m+1 валентностью) производный от арильного радикала, возможно замещенный, или двухвалентный циклический, линейный или разветвленный алкильный, алкенильный, алкадиенильный или алкилбензольный углеводородный радикал, имеющий от 6 до 22 атомов углерода или трех-, четырех или пятивалентный циклический, линейный или разветвленный алкильный, алкенильный, алкадиенильный или алкилбензольный углеводородный радикал, имеющий от 1 до 22 атомов углерода, указанный углеводородный радикал может быть замещенньм и содержащим от 1 до 10 функциональных групп, выбранных из групп, состоящих из простого эфира, сложного эфира, кетона, амина, четвертичных аминов и амидов; возможными заместителями G являются атомы галогена, NO2, OR6, NR6 2, COOR6 или R6 группы, R6 представляет собой C1-C15 алкильную или алкенильную группу;
g) Q представляет собой атом водорода (в этом случае w=1 и n=1) или представляет собой группу [[P-X]m[G]n] где Р, X, G, n и m являются теми, как определено выше (в этом случае w=1 или дендример, выбранный из группы, состоящей из полиалкилиминных дендримеров, аминокислотных (например, лизин) дендримеров, смешанных амино/эфирных дендримеров и смешанных амино/амидных дендримеров или полисахаридов, выбранных из группы, состоящей из целлюлозы, циклодекстринов и крахмалов или катионного квантернизированного силиконового полимера, такого как Abilquat® (источник: Goldsmith, USA) или еще полимерный скелет, производный от мономерного звена, выбранного из группы, включающей формулы от А) до Е) и их смеси:

где штриховые линии показывают положение связи между указанным мономерным звеном и G;
z представляет собой целое число от 1 до 5;
n определен выше;
R7 представляет собой одновременно или независимо атом водорода, C1-C15 алкильную или алкенильную группу, С4-С20 полиалкиленгликольную или ароматическую группу;
R8 представляет собой одновременно или независимо атом водорода или кислорода, C1-C5 алкил или гликоль или отсутствует;
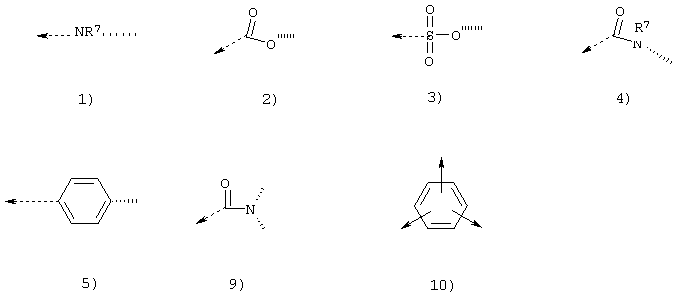
Z представляет собой функциональную группу, выбранную из группы, включающей формулы от 1) до 8), разветвленных звеньев формул от 9) до 11) и их смесей:

где значение штриховых линий определены выше, пунктирные стрелки показывают положение связи между указанным Z и остальной частью мономерного звена и стрелки показывают положение связи между указанным Z и либо G, либо оставшейся частью мономерного звена, R7 является тем, как определено выше; и при условии, что Z не является группой формул 1), 3) и 7), если мономерное звено имеет формулу В).
Под выражением "душистый α, β-ненасыщенный кетон, альдегид или эфир карбоновой кислоты", использованным в определении Р, подразумевают α, β-ненасыщенный кетон, альдегид или эфир карбоновой кислоты, который средним специалистом в данной области знаний определен как используемый в парфюмерии в качестве ароматизирующего ингредиента (отдушки). В общем случае указанный ароматизирующий α, β-ненасыщенный кетон, альдегид или эфир карбоновой кислоты является соединением, имеющим от 8 до 20 атомов углерода или даже более, предпочтительно от 10 до 15 атомов углерода. Предпочтительными соединениями формулы (I) являются те, в которых:
а) w представляет собой целое число от 1 до 10000;
б) n имеет значение 1 или 0;
c) m имеет значение 1 или 2;
d) Р представляет собой атом водорода или радикал формул от (Р-1) до (Р-11), в виде любого одного из его изомеров:

где волнистые линии имеют значения, обозначенные выше, и пунктирные линии представляют собой простую или двойную связь, R9 означает метильную или этильную группу и R10 представляет собой С6-С9 линейную или разветвленную алкильную, алкенильную или алкадиенильную группу; и при условии, что, по крайней мере, одна из Р групп имеет формулу от (Р-1) до (Р-11), как определено выше;
e) Х представляет собой функциональную группу, выбранную из группы, включающей формулы:

где жирные или волнистые линии имеют значения, обозначенные выше; и при условии, что Х может отсутствовать, когда Р представляет собой атом водорода;
f) G представляет собой двухвалентный или трехвалентный радикал, производный от арильного радикала, возможно замещенный или двухвалентный циклический, линейный или разветвленный алкильный, алкенильный, алкадиенильный или алкилбензольный углеводородный радикал, имеющий от 8 до 22 атомов углерода или трехвалентный циклический, линейный или разветвленный алкильный или алкенильный углеводородный радикал, имеющий от 1 до 22 атомов углерода, указанный углеводородный радикал может быть замещенным и содержащим от 1 до 5 функциональных групп, выбранных из группы, состоящей из простого эфира, сложного эфира, кетона, амина, четвертичных аминов и амидов; возможными заместителями G являются атомы галогена, NO2, OR6, NR6 2, COOR6 или R6 группы, R6 представляет собой C1-C15 алкильную или алкенильную группу;
g) Q представляет собой атом водорода (в этом случае w=1 и n=1) или представляет собой группу [[P-X]m[G]n], где Р, X, G, n и m являются теми, как определено выше (в этом случае w=1) или полимерный скелет, производный от мономерного звена, выбранный из группы, включающей формулы А), С), D), Е) и их смесей:
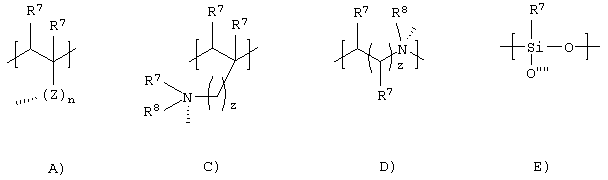
где штриховые линии, z и n являются теми, как определено выше;
R7 представляет собой одновременно или независимо атом водорода, C1-С10 алкильную группу или C4-C14 полиалкиленгликольную группу;
R8 представляет собой одновременно или независимо атом водорода или кислорода, C1-C4 алкил или гликоль или отсутствует;
Z представляет собой функциональную группу, выбранную из групп, включающих формулы от 1) до 5), 7), разветвленных звеньев формул от 9) и 10) и их смесей:

где штриховые линии, пунктирные стрелки и стрелки определены выше, R7 имеют значения, как определено выше.
В наиболее предпочтительном воплощении изобретения соединениями формулы (I) являются те, в которых:
а) w представляет собой целое число от 1 до 10000;
б) n имеет значение 1 или 0;
c) m имеет значение 1 или 2;
d) Р представляет собой радикал формул от (Р-1) до (Р-11), как определен выше;
e) Х представляет собой функциональную группу, выбранную из группы, включающей формулы

где значения жирных или волнистых линий определены выше;
f) G представляет собой двухвалентный или трехвалентный радикал, производный от арильного радикала, возможно замещенный, или линейный, или разветвленный алкильный, алкенильный, алкадиенильный или алкилбензольный углеводородный радикал, имеющий от 8 до 22 атомов углерода, указанный углеводородный радикал может быть замещенным и содержащим от 1 до 5 функциональных групп, выбранных из групп, состоящих из простого эфира, кетона и амина; возможными заместителями G групп являются атомы галогена, NO2, OR6, NR6 2, COOR6 или R6 группы, R6 представляет собой C1-С6 алкильную или алкенильную группу;
g) Q представляет собой атом водорода (в этом случае w=1 и n=1) или представляет собой группу [[P-X]m[G]], где Р, X, G, n и m являются теми, как определено выше (в этом случае w=1) или полимерный скелет, производный от мономерного звена, выбранного из группы, включающей формулы от А), С), Е) и их смесей:
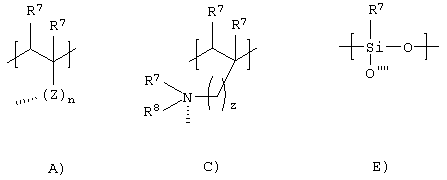
где штриховые линии, z и n являются теми, как определено выше;
R7 представляет собой одновременно или независимо атом водорода, C1-C5 алкильную группу или С4-С10 полиалкиленгликольную группу;
R8 представляет собой одновременно или независимо атом водорода или кислорода, C1-C4 алкил или гликоль или отсутствует;
Z представляет собой функциональную группу, выбранную из групп, включающих формулы от 1) до 5), разветвленных звеньев формул от 9) и 10) и их смесей:
где штриховые линии, пунктирные стрелки и стрелки определены выше, R7 определен выше.
Альтернативно, в указанном наиболее предпочтительном воплощении изобретения, m представляет собой 2, Х представляет собой функциональную группу формулы iii), как определено выше, и G представляет собой трехвалентный линейный или разветвленный алкильный или алкенильный углеводородный радикал, имеющий от 1 до 7 атомов углерода, указанный углеводородный радикал возможно содержит от 1 до 5 функциональных групп, выбранных из группы, состоящей из простого эфира, кетона и амина.
В другом указанном альтернативном наиболее предпочтительном воплощении изобретения m имеет значение 1 или 2, Х представляет собой функциональную группу, выбранную из группы, состоящей из формул

где значения жирных или волнистых линий определены выше; и G представляет собой двухвалентный радикал, производный от линейного или разветвленного алкильного или алкенильного углеводородного радикала, имеющего от 8 до 20 атомов углерода, указанный углеводородный радикал может быть замещенным и содержащим от 1 до 5 функциональных групп, выбранных из групп, состоящих из простого эфира, кетона и амина; возможными заместителями G группы являются атомы галогена, NO2, OR6, NR6 2, COOR6 или R6 группы, R6 представляет собой C1-С6 алкильную или алкенильную группу.
Должно быть понятно, что когда m или w в соединении формулы (I) представляет собой целое число больше, чем 1, тогда каждый из различных Р может быть одинаковым или различным, так же как каждый из Х или G.
В еще более предпочтительном воплощении настоящее изобретение представлено соединением формулы (I'):

где m имеет значение 1 или 2;
Q представляет собой атом водорода;
Р представляет собой радикал формул от (Р-1) до (Р-7), в форме любого одного из его изомеров:
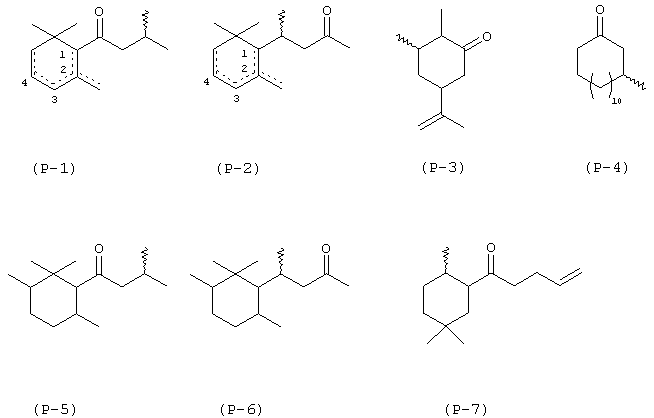
где значения волнистых линий и пунктирных линий являются теми, как определено выше;
Х представляет собой функциональную группу, выбранную из группы, состоящей из формул
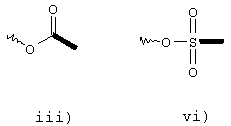
где значения жирных или волнистых линий определены выше; и G представляет собой двухвалентный или трехвалентный ареновый радикал, возможно замещенный атомами галогена, NO2, OR6, NR6 2, COOR6 и R6 группу, R6 представляет собой C1-С6алкильную или алкенильную группу. Альтернативно, указанными соединениями формулы (I') являются те, в которых

где Р, m и Q являются теми, как определено выше;
Х представляет собой функциональную группу формулы iii) или х), как определено выше и
G представляет собой двухвалентный радикал, производный от линейного или разветвленного алкильного или алкенильного углеводородного радикала, имеющего от 8 до 15 атомов углерода; или G представляет собой трехвалентный радикал, производный от линейного или разветвленного алкильного углеводородного радикала, имеющего от 2 до 10 атомов углерода.
Еще одна альтернатива представлена соединением формулы (I'):

где Р, m и Q являются теми, как определено выше;
Х представляет собой функциональную группу, выбранную из группы, включающей формулы ii), viii) или ix), как определено выше;
G представляет собой двухвалентный или трехвалентный радикал, производный от линейного или разветвленного алкильного или алкенильного углеводородного радикала, имеющего от 8 до 15 атомов углерода.
Соединение формулы (I") представляет собой даже более предпочтительное воплощение изобретения:
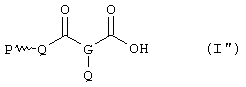
где Q и Р имеют значения, приведенные в формуле (I'); и G представляет собой трехвалентный радикал, производный от линейного или разветвленного алкильного или алкенильного углеводородного радикала, имеющего от 3 до 6 атомов углерода.
Когда m в формуле (I') имеет значение 2, тогда каждый из различных Р может быть одинаковым или различным, так же как каждый из X.
Соединения формулы (I) могут быть синтезированы из коммерчески доступных соединений с помощью обычных способов. В общем случае соединения по изобретению получают с помощью реакции присоединения [1, 4] между душистым α, β-ненасыщенным кетоном, альдегидом или карбоновым эфиром формулы (II')

где конфигурация углерод-углеродной двойной связи может быть Е или Z типа и R1, R2, R3 и R4 имеют значения, представленные в формуле (I); и соединением формулы Q[(-G-)n[-X-H]m]w, где все символы имеют значения, приведенные в формуле (I). Для практических целей и в соответствии с природой и нуклеофильностью функциональной группы X соединения по изобретению могут быть получены более преимущественно реакцией между соединением формулы (II'), которое представляет собой альдольное производное душистого соединения формулы (II'),

где R1, R2, R3 и R4 имеют значения, представленные в формуле (I); и производного Q[(-G-)n[-X-H]m]w, такого как хлорангидрид кислоты, сульфонилхлорид или алкилхлорформиатное производное.
Использование альдольного производного представляет особый интерес для синтеза всех соединений формулы (I), в котором Х представляет собой, например, карбоксильную, сульфонатную, сульфатную, карбонатную, фосфатную, боратную и силикатную функциональную группу. С другой стороны, прямое использование душистой молекулы в качестве исходного продукта представляет особый интерес для синтеза всех соединений формул (I), где Х представляет собой, например, эфирное, тиоэфирное или еще тиокарбоксильное производное.
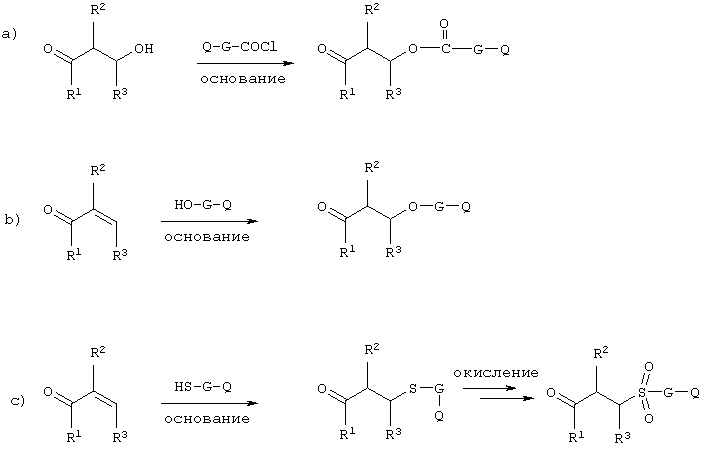
Полимерные продукты могут быть также получены путем полимеризации одного из мономеров, на которые остаток (-G-)n[-X-P]m заранее привит. Указанная полимеризация может быть также осуществлена в присутствии других мономерных звеньев, несущих различный (-G-)n[-X-P]m остаток.
Общие примеры такого подхода представлены на следующей схеме для конкретных случаев получения соединений формулы (I):
Хотя отсутствует возможность представить исчерпывающий список соединений формулы Q[(-G-)n[-X-H]m]w, которые могут быть использованы для синтеза соединений по изобретению, можно определить следующие предпочтительные примеры: бензойная кислота, 4- или 3-метилбензойная кислота, 3- или 4-(N,N-диметиламино)-бензойная кислота, тозиловая кислота, бензолсульфоновая кислота, изофталевая кислота, фталевая кислота, терефталевая кислота, бензол-1,2,3-трикарбоновая кислота, этилендиамин-тетрауксусная кислота, нитрилтриуксусная кислота, алкилиминодиуксусная кислота (где алкил представляет собой C1-С10 алкильную группу), 10-ундеценовая кислота, ундекановая кислота, щавелевая кислота, малоновая кислота, янтарная кислота, глутаровая кислота, адипиновая кислота, додекандионовая кислота, 1-октадекантиол и СН3(СН2)11S(O)аН (где а представляет собой 0, 1 или 2). В качестве полимерных соединений формулы Q[(-G-)n[-X-H]m]w могут быть приведены также различные полимеры или сополимеры на основе полиметакрилатов или полистиролов. В качестве производных соединений формулы Q[(-G-)n[-X-H]m]w могут быть приведены его щелочные соли, хлорангидриды кислоты (если Х=СОО), сульфонилхлорид и сульфатхлорид (если Х=SO2 или SO4) и хлорформиатные производные (если Х=ОСОО).
Аналогично, также невозможно привести исчерпывающий список известных в настоящее время душистых соединений формулы (II'), которые могут быть использованы в синтезе соединений по изобретению, а затем высвобождены. Тем не менее, могут быть названы следующие соединения в качестве предпочтительных примеров: α-дамаскон, β-дамаскон, γ-дамаскон, Δ-дамаскон, α-ионон, β-ионон, γ-ионон, Δ-ионон, β-дамаскенон, 3-метил-5-пропил-2-циклогексен-1-он, 1(6), 8-Р-ментадиен-2-он, 2,5-диметил-5-фенил-1-гексен-3-он, 1-(5,5-диметил-1-циклогексен-1-ил)-4-пентен-1-он, 8 или 10-метил-альфа-ионон, 2-октеналь, 1-(2,2,3,6-тетраметил-1-циклогексил)-2-бутен-1-он, 4-(2,2,3,6-тетраметил-1-циклогексил)-3-бутен-2-он, 2-циклопентадецен-1-он, нооткатон, коричный альдегид, 2,6,6-триметилбицикло[3.1.1]гептан-3-спиро-2'-циклогексен-4'-он, этил-2,4-декадиеноат, этил-2-октеноат, метил-2-ноненоат, этил-2,4-андекадиеноат и метил-5,9-диметил-2,4,8- декатриеноат. Несомненно, альдольные производные формулы (II") последних соединений являются также полезными для синтеза соединений по изобретению.
Среди душистых соединений, приведенных в указанном выше списке, предпочтительными являются: дамасконы, иононы, бета-дамаскенон, 1-(5,5-диметил-1-циклогексен-1-ил)-4-пентен-1-он, 1(6),8-Р-ментадиен-2-он, 2-циклопентадецен-1-он, 1-(2,2,3,6-тетраметил-1-циклогексил)-2-бутен-1-он, 4-(2,2,3,6-тетраметил-1-циклогексил)-3-бутен-2-он и 2-циклопентадецен-1-он.
Как можно заметить из формулы (I), соединения по изобретению состоят из трех основных частей, именно высвобождающего остатка Р-Х, фрагмента G и концевой группы Q.
Характерная черта изобретения связана со структурой высвобождающего остатка Р-Х. Благодаря особой химической структуре указанного остатка соединения формулы (I) обладают возможностью высвобождаться через реакцию разложения остатка и душистой молекулы, такой как, например, α, β-ненасыщенный кетон, альдегид или эфир карбоновой кислоты формулы (II').
Пример указанной реакции разложения представлен на следующей схеме:

Соединение Q[(-G-)n[-X-H]m]w, которое также является остатком, полученным в реакции разложения, само может и быть не имеющим запаха соединением или ароматизирующим ингредиентом; предпочтительно указанный остаток представляет собой соединение, не имеющее запаха. Аналогично, соединение формулы (I) является предпочтительно соединением без запаха.
Природа Х играет важную роль в кинетике высвобождения имеющих запах душистых молекул. Соответственно, с помощью тщательного подбора природы X представляется возможным настроить свойства соединений формулы (I), связанные с высвобождением запаха.
Вторая часть соединений по изобретению представляет собой фрагмент G. Помимо его роли в качестве связующего между звеном высвобождения Р-Х и Q, указанный G остаток может также оказывать влияние на свойства соединений формулы (I), связанные с высвобождением. Несомненно, тщательный выбор химической природы указанного фрагмента, например электронодонорно/акцепторные или гидрофобно/гидрофильные фрагменты, могут позволить улучшить гармонизацию свойств, связанных с высвобождением запаха.
Третьим компонентом соединения по изобретению является концевая группа Q. Поскольку Q не является водородом или группой [[Р-Х]m[G]n], указанная концевая группа может играть роль носителя, к которому могут присоединяться несколько высвободившихся звеньев Р-Х. Более того, в зависимости от ее специфической природы она может также играть важную роль в эффективном отложении и поверхностном нахождении молекул соединений по изобретению на поверхности, которую используют для применения, особенно на тканях и волосах. Указанная роль носителя в эффективном отложении является хорошо известной специалистам в данной области знаний.
Реакция разложения, которая приводит к высвобождению душистых или ароматизирующих молекул, как оказывается, подвержена влиянию со стороны изменения рН или нагревания, но может вызываться и другими типами механизма.
Поскольку соединения по изобретению являются полезными ингредиентами для ароматизации различных изделий, настоящее изобретение касается также всех различных форм соединений по изобретению, которые могут успешно использованы в парфюмерии. Такие формы включают композицию, состоящую из соединений формулы (I) и растворителя, обычно используемого в парфюмерии. В качестве примеров указанных растворителей, вообще говоря, можно определить соединения типа дипропиленгликоля, диэтилфталата, изопропилмиристата, бензилбензоата, 2-(2-этоксиэтокси)-1-этанола или этилцитрата, которые в основном используют.
Кроме того, настоящее изобретение касается ароматизирующей композиции, содержащей, по крайней мере, одно соединение формулы (I). В общем случае, под "ароматизирующей композицией" подразумевается смесь, содержащая, по крайней мере, два ароматизирующих ингредиента в любой из его форм и, возможно, один или более растворителей, обычно используемых в парфюмерных композициях. Следовательно, ароматизирующие композиции в соответствии с изобретением содержат, по крайней мере, одно из соединений по изобретению вместе с одним или более ароматизирующими соингредиентами и, возможно, одним или более растворителями.
Природа и тип указанных ароматизирующих соингредиентов не требуют более детального описания в настоящем изобретении, которое в любом случае не было бы исчерпывающим, средний специалист в данной области способен выбрать их на основе общих знаний и согласно природе продукта, который является ароматизатором, и в зависимости от желаемого эффекта. В общем случае эти ароматизирующие соингредиенты принадлежат к химическим классам, таким как различные спирты, альдегиды, кетоны, сложные эфиры, простые эфиры, ацетаты, нитрилы, терпеновые углеводороды, азот или серосодержащие гетероциклические соединения и эфирные масла природного или синтетического происхождения. Многие из этих ингредиентов, в любом случае, перечислены в книге, которая является ссылкой на S.Arctander, Perfume and Flavor Chemicals, 1969, Montclair, New Jersey, USA или его более недавние переиздания, или в других работах подобного характера, так же как в различной доступной литературе в области парфюмерии.
Точно так же детальное описание природы и типа растворителей, обычно используемых в ароматизирующих композициях, не может быть исчерпывающим. Средней специалист в данной области способен выбрать их исходя из природы продукта, который должен ароматизировать. Однако, как неограничивающие примеры таких растворителей, можно процитировать, в дополнение к растворителям, упомянутым выше, также этиловый спирт, смеси воды/этилового спирта, лимонен или другие терпены, изопарафины, известные под торговой маркой Isopar® (происхождение: Exxon Chemical) или гликолевые эфиры и сложные эфиры гликолевого эфира, известные под торговой маркой Dowanol® (происхождение: Dow Chemical Company).
Как упомянуто выше, соединение формулы (I), в любой из его форм, или ароматизирующая композиция, содержащая указанное соединение формулы (I), является полезным ароматизирующим ингредиентом, который может с успехом использоваться во всех областях современной парфюмерии, типа тонкой парфюмерии или функциональной парфюмерии, поскольку он способен регулировать высвобождение душистых молекул.
Действительно, соединения по изобретению могут с успехом использоваться в тонкой или функциональной парфюмерии, чтобы достигнуть более контролируемого осаждения и затем высвобождения душистого соединения. Например, ароматизирующие ингредиенты, присутствующие как таковые в моющих или ароматизирующих композициях, могут иметь небольшую силу удержания на поверхности и, следовательно, могут часто отщепляться, например, при полоскании в воде или при высыхании указанной поверхности. Эта проблема может быть решена, используя соединение формулы (I), которое, как может быть показано, обладает удивительной стабильностью при хранении и силой удерживания или устойчивостью на поверхностях, таких как текстильные ткани. Поэтому соединения по изобретению, вследствие их хорошей устойчивости, низкой летучести и контролируемого высвобождения душистых молекул, могут быть включены в любое применение, нуждающееся в быстром или пролонгированном высвобождении ароматизирующего компонента, как определено выше, и, кроме того, могут придать запах и свежесть обработанной поверхности, которые будут сохраняться после полоскания и/или сушки. Подходящими поверхностями являются, в частности, текстили, твердые поверхности, волосы и кожа.
Таким образом, в парфюмерии одним из главных преимуществ изобретения является то, что соединения формулы (I) придают интенсивный запах обработанной поверхности, что обеспечивается душистой молекулой, которая не была бы обнаружена на указанной поверхности за достаточно длительный период, если бы использовалось ароматизирующее α, β-ненасыщенное карбонильное производное как таковое без предшественника.
Такое поведение делает соединения формулы (I) особенно подходящими для использования в качестве предшественников ароматизирующих ингредиентов для областей применения, связанных с функциональной или тонкой парфюмерией. Следовательно, использование соединений по изобретению в качестве ароматизирующего ингредиента является еще одной задачей настоящего изобретения. Более того, ароматизированные изделия, содержащие, по крайней мере, одно соединение по изобретению, в любой из его форм или ароматизирующую композицию, содержащую указанное соединение формулы (I), являются также объектом настоящего изобретения.
Подходящие ароматизированные изделия включают твердые или жидкие моющие средства и мягчители ткани, так же как все другие изделия, обычные для парфюмерии, а именно духи, одеколоны или лосьоны после бритья, ароматизированные мыла, ароматические соли для ванны или душа, пены, масла или гели или средства гигиены или средства для ухода за волосами типа шампуней, средства ухода за телом, дезодоранты или антиперспиранты, освежители воздуха, а также косметические препараты. В качестве моющих средств предназначены для применения, такие как моющие композиции или чистящие изделия для стирки или для чистки различных поверхностей, например предназначенные для ткани, посуды или обработки твердой поверхности, в любом случае они предназначены для домашнего или промышленного применения. Другие ароматизированные изделия являются освежителями ткани, водой для глажения, бумагой, стеклоочистители или отбеливателями.
Предпочтительными ароматизирующими композициями или ароматизирующими изделиями являются духи, моющие средства для ткани или основания для мягчения.
Типичные примеры моющих средств для ткани или смягчающих композиций, в которых могут быть включены соединения по изобретению, описаны в WO 97/34986 или в US 4137180 и 5236615 или ЕР 799885. Другие типичные моющие средства и смягчающие композиции, которые могут использоваться, описаны в работах, таких как Ullman's Encyclopedia of Industrial Chemistry, vol.A8, pages 315- 448 (1987) and vol.A25, pages 747-817 (1994); Flick, Advanced Cleaning Product Formulations, Noye Publication, Park Ridge, New Jersey (1989); Showell, in Surfactant Science Series, vol.71: Powdered Detergents, Marcel Dekker, New York (1988); Proceedings World Conference on Detergents (4th, 1998, Montreux, Switzerland), AOCS print.
Некоторые из вышеупомянутых изделий могут представлять агрессивную среду для соединения по изобретению, таким образом, необходимо, чтобы имелась возможность защитить их от преждевременного разложения, например, с помощью капсулирования.
Для ясности должно быть упомянуто, что под "ароматизирующим изделием" подразумевается в настоящем изобретении готовый для потребления продукт или часть указанного продукта для потребления, способный усиливать ароматизирующее действие. Таким образом, ароматизированное изделие в соответствии с изобретением, включает, по крайней мере, часть всей композиции, соответствующей желаемому изделию, например моющему средству, или часть его и, по крайней мере, соединение по изобретению возможно вместе с одним или большим количеством ароматизирующих соингредиентов и, возможно, одним или большим количеством растворителей.
Природа и тип составных частей изделия не обсуждается более детально в настоящем изобретении, которое в любом случае не может быть исчерпывающим, средней специалист в данной области способен выбрать их на основе общих знаний и согласно природе и желательному эффекту по отношению к указанному изделию.
Пропорции, в которых соединения по изобретению могут быть включены в различные вышеупомянутые изделия или композиции, изменяются в широких пределах значений. Эти величины зависят от природы изделия или продукта, который должен быть ароматизирован, и в зависимости от обонятельного эффекта, так же как от природы соингредиентов в данной композиции, когда соединения по изобретению смешивают с ароматизирующими соингредиентами, растворителями или добавками, обычно используемыми в данной области.
Например, типичные концентрации находятся в пределах от 0,001 до 5% по массе или даже больше соединения по изобретению в расчете на массу композиции, в которую они включены. Могут использоваться концентрации ниже, чем порядка от 0,01% до 1% по массе, когда эти соединения применяют непосредственно для ароматизации различных продуктов потребления, упомянутых выше.
Другим объектом настоящего изобретения является способ ароматизации поверхности или способ усиления или продления эффекта диффузии характерного запаха ароматизатора на поверхности, заключающийся в том, что указанную поверхность обрабатывают в присутствии соединения формулы (I). Подходящие поверхности представляют собой, в частности, текстиль, твердые поверхности, волосы и кожу.
Изобретение далее описывается в подробностях с помощью следующих примеров, в которых сокращения имеют обычное значение в данном уровне техники, температуры обозначены в градусах по шкале Цельсия (°С); ЯМР спектральные данные регистрируют в CDCl3 (если не заявлено иначе) с частотой 360 или 400 МГц для 1Н и 13С, химсдвиг δ опознают в частях на миллион относительно TMS, как стандарт константа связывания J выражена в Гц. Гельпроникающую хроматографию выполняют на колонке Macherey-Nagel Nucleogel GPC 500-5 (300×7,7 мм диаметр в дюймах), элюирование ТГФ при 0,5 мл/минут и калиброванный с коммерчески доступными стандартами (происхождение: Fluka).
Пример 1
Синтез соединений формулы (I), при использовании альдольного производного α-дамаскона в качестве исходного продукта
Исходный продукт, а именно 3-гидрокси-1-(2,6,6-триметил-2-циклогексен-1-ил)-1-бутанон, полученный в соответствии с К.H.Schulte-Elte et al. в Helv. Chim. Acta 1973, 56, 310.
а) Синтез 1-метил-3-оксо-3-(2,6,6-триметил-2-циклогексен-1-ил)пропилбензоата
К раствору 3-гидрокси-1-(2,6,6-триметил-2-циклогексен-1-ил)-1-бутанона (4,00 г, с чистотой 92%, 17,5 ммоль), NEt3 (3,2 мл, 22,85 ммоль) и диметиламинопиридина (ДМАП) (400 мг) в CH2Cl2 (100 мл) добавляют бензоилхлорид (2,43 мл, 20,94 ммоль). Реакционную массу перемешивают в течение 65 часов при комнатной температуре. Затем смесь подкисляют с помощью 5% раствора HCl и экстрагируют дважды эфиром и промывают водой, насыщенным раствором NaHCO3, а затем насыщенным раствором Nad. Наконец, органические фазы высушивают над Na2SO4, концентрируют при 50-60°/0,03 мбар) и очищают с помощью флеш хроматографии над SiO2 (циклогексан/AcOEt=97:3). Соответственно получают 4,25 г продукта (выход: 73%). МС: 192 (52), 123 (22), 105 (100), 81 (13), 77 (20), 69 (45).
1H-ЯМР: 0.92/0.93/0.94 (3 с, 6Н); 1.12-1.23 (м, 1Н); 1.39/1.42 (д, J=6; 3Н); 1.59 (с, 3Н); 1.65-1.80 (м, 1Н); 1.95-2.20 (м, 2Н); 2.60-2.83 (м, 2Н); 3.02-3.20 (м, 1Н); 5.50-5.63 (м, 2Н), 7.36-7.45 (м, 2 Н), 7.48-7.57 (м, 1Н), 7.96-8.04 (м, 2 Н).
13С-ЯМР: 210.1 (с); 165.7 (с); 132.8 (д); 130.5 (с); 129.9 (с); 129.5 (2 д); 128.2 (2 д); 123.8 (д); 67.4/6 (д); 63.6/8 (д); 51.1 (т); 32.5 (с); 30.7/8 (т); 27.9 (кв); 27.8 (кв); 23.5 (кв); 22.6 (т); 20.0/1 (кв).
b) Синтез 1-метил-3-оксо-3-(2,6,6-триметил-2-циклогексен-1-ил)пропил 3-(диметил-амино)бензоата
К раствору 3-гидрокси-1-(2,6,6-триметил-2-циклогексен-1-ил)-1-бутанона (4,00 г, 92% чистота, 17,5 ммоль), 3-N,N-диметиламинобензойной кислоты (3,13 г, 19,0 ммоль) и ДМАП (1,85 г, 15,2 ммоль) в CH2Cl2 (50 мл) добавляют N,N-дициклогексилкарбодиимин (DCC) (4,31 г, 20,9 ммоль) в CH2Cl2 (15 мл). Реакционную массу перемешивают при комнатной температуре в течение 70 часов. Затем смесь подкисляют с помощью концентрированной HCl и экстрагируют дважды эфиром и промывают водой, насыщенным раствором NaHCO3 и затем насыщенным раствором NaCl. Наконец, органические фазы высушивают над Na2SO4, концентрируют при (50-60°/0,03 мбар) и очищают с помощью флеш хроматографии над SiO2 (циклогексан/AcOEt=97:3). Соответственно получают 4,20 г продукта (выход: 68%).
МС: 357 (М+, 19), 218 (8), 203 (28), 192 (13), 185 (10), 165 (19), 148 (100); 69 (36), 57 (19), 40 (51).
1Н-ЯМР: 0.92/0.93/0.94 (3 с, 6Н); 1.12-1.23 (м, 1Н); 1.38/1.40 (д, J=6; 3Н); 1.60 (с, 3Н); 1.65-1.80 (м, 1Н); 1.95-2.20 (м, 2Н); 2.60-2.80 (м, 2Н); 2.97 (с, 6Н); 3.01-3.20 (м, 1Н); 5.49-5.62 (м, 2Н), 6.85-6.91 (м, 1Н); 7.21-7.27 (м, 1Н), 7.30-7.38 (м, 2Н).
13С-ЯМР: 210.0/2 (с); 166.3 (с); 150.4 (с); 131.1 (с); 129.9 (с); 128.9 (д); 123.8 (д); 117.5 (д); 116.7 (д); 113.3 (д); 67.3/5 (д); 63.6/8 (д); 51.1/2 (т); 40.6 (2 кв); 32.4 (с); 30.7/8 (т); 28.0 (кв); 27.8 (кв; 23.5 (кв); 22.6 (т); 20.0/1 (кв).
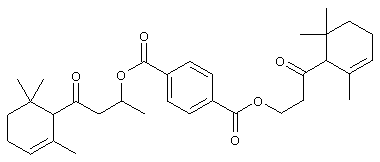
c) Синтез бис[1-метил-3-оксо-3-(2,6,6-триметил-2-циклогексен-1-ил)пропил]терефталата
Раствор 3-гидрокси-1-(2,6,6-триметил-2-циклогексен-1-ил)-1-бутанона (3,55 г, 92% чистота, 15,5 ммоль) в CH2Cl2 (10 мл) добавляют к раствору терефталоилхлорида (1,99 г, 9,80 ммоль) и NEt3 (2,12 г, 21,1 ммоль) в СН2Cl2 (15 мл). Реакционную массу нагревают при температуре кипения в течение 3 часов. Затем смесь подкисляют с помощью 5% раствора HCl и экстрагируют дважды эфиром и промывают водой, 5% раствором NaOH, снова водой, а затем насыщенным раствором NaCl. Наконец, органические фазы высушивают над Na2SO4, концентрируют при (50-60°/0,03 мбар) и очищают с помощью флеш-хроматографии над SiO2 (циклогексан/AcOEt=9:1). Соответственно получают 2,54 г продукта (выход: 60%).
1Н-ЯМР: 0.91/0.94 (2 с, 12Н); 1.12-1.23 (м, 2Н); 1.40/1.43 (д, J=6; 6Н); 1.58 (с, 6Н); 1.65-1.80 (м, 2Н); 1.95-2.20 (м, 4Н); 2.63-2.84 (м, 4Н); 3.02-3.23 (м. 2Н); 5.53-5.64 (м, 4Н); 8.02 (с, 4 Н).
13С-ЯМР: 209.9/210.0 (с); 164.9 (с); 134.2 (с); 129.7/8 (с); 129.4 (2 д); 123.9 (д); 67.9/68.1 (д); 63.6/8 (д); 51.0 (т); 32.5 (с); 30.7/8 (т); 28.0 (кв); 27.8 (кв); 23.5 (кв); 22.6 (т); 20.0/1 (кв).
d) Синтез 1-метил-3-оксо-3-(2,6,6-триметил-2-циклогексен-]-ил)пропил 4-метилбензолсульфоната
К раствору 3-гидрокси-1-(2,6,6-триметил-2-циклогексен-1-ил)-1-бутанона (1,00 г, 92% чистота, 4,38 ммоль), ДМАП (100 мг) и NEt3 (1,0 мл, 7,2 ммоль) в CH2Cl2 (20 мл) добавляют, при температуре 0°С, тозилхлорид (2.02 г, 10.56 ммоль). Реакционную массу перемешивают при комнатной температуре в течение 4 дней. Затем смесь подкисляют с помощью концентрированной HCl и экстрагируют дважды эфиром и промывают водой, насыщенным раствором NaHCO3, а затем насыщенным раствором NaCl. Наконец, органические фазы высушивают над Na2SO4, концентрируют при (50-60°/0,03 мбар). Соответственно получают 0,76 г продукта (выход: 50%). МС (электроспрей): 365 (M++1, 100), 353 (20), 279 (5), 228 (19), 193 (22).
1Н-ЯМР: 0.75/0.79/0.86/0.87 (4 с, 6Н); 1.06-1.18 (м, 1Н); 1.27/1.33 (д, J=6; 3Н); 1.49 (уширенный, 3Н); 1.52-1.65 (м, 1Н); 1.93-2.15 (м, 2Н); 2.43 (с, 3Н); 2.55-3.08 (м, 3Н); 4.92-5.05 (м, 1Н), 5.56 (уширенный, 1Н), 7.33 (д, J=8; 2Н), 7.77 (д, J=8; 2Н).
13С-ЯМР: 209.5/6 (с); 144.6/7 (с); 133.6 (с); 129.7/8 (д); 129.4/6 (с); 127.9 (2 д); 124.0/1 (д); 75.6 (д); 63.5/8 (д); 51.3/6 (т); 32.3/4 (с); 30.6 (т); 27.7/8 (кв); 27.7 (кв); 23.3 (кв); 22.5 (т); 21.6 (кв); 21.0/1 (кв).
e) Синтез 1-метил-3-оксо-3-(2,6,6-триметил-2-циклогексен-1-ил)пропилдоцеканоата
Используя аналогичную экспериментальную методику, как описано в примере 1.a), и используя додеканоилхлорид вместо бензоилхлорида. Соединение получают с 68% выходом.
1Н-ЯМР: 0.82-0.95 (м, 9Н); 1.17 (м, 1Н); 1.20-1.35 (м, 19Н); 1.59 (м, 5Н); 1.79 (м, 1Н); 1.95-2.18 (м, 2Н); 2.22 (т, J=7,2Н); 2.46-2.66 (м, 1Н); 2.70 (м, 1Н); 2.83-3.03 (м, 1Н); 5.32 (м, 1Н); 5.59 (б, 1 Н).
13С-ЯМР: 210.0 (с); 173.0 (с); 129.9 (с); 123.8 (д); 66.6 (д); 63.7 (д); 50.9 (т); 34.6 (т); 32.5 (с); 31.9 (т); 30.7 (т); 29.1-29.6 (несколько т); 27.8/9 (кв); 25.0 (т); 23.4 (кв); 22.6/7 (т); 19.9/20.0 (кв); 14.1 (кв).
f) Синтез бис-[1-метил-3-оксо-3-(2,6,6-триметил-2-циклогексен-1-ил)пропил]сукцината
Используя аналогичную экспериментальную методику, как описано в примере 1.b), и используя янтарную кислоту вместо 3-N,N-диметиламинобензойной кислоты. Соединение получают с 51% выходом.
1Н-ЯМР: 0.85-0.95 (м, 6Н); 1.17 (м, 1Н); 1.27 (т, J=8, 3Н); 1.58 (с, 3Н); 1.70 (м, 1Н); 1.95-2.20 (м, 2Н); 2.22 (т, J=7, 2Н); 2.44-2.68 (м, 1Н); 2.53 (с, 2Н); 2.73 (б, 1Н); 2.84-3.04 (м, 1Н); 5.32 (м, 1Н); 5.60 (б, 1 Н).
13С-ЯМР: 210.1 (с); 171.4 (с); 129.8 (с); 123.8 (д); 66.2 (д); 63.7 (д); 50.8 (т); 32.4 (с); 30.7 (т); 29.8 (т); 27.8 (кв); 23.4 (кв); 22.6 (т); 19.9 (кв).
g) 1-Метил-3-оксо-3-(2,6,6-триметил-2-циклогексен-1-ил)пропил 10-ундеценоата
Используя аналогичную экспериментальную методику, как описано в примере 1.b), и используя 10-ундеценоилхлорид вместо 3-N,N-диметиламинобензойной кислоты. Соединение получают с 64% выходом.
1Н-ЯМР: 0.83-0.96 (4 с, 6Н); 1.17 (м, 1Н); 1.20-1.45 (м, 15Н); 1.58 (б, 3Н); 1.70 (м, 1Н); 1.95-2.17 (м, 4Н); 2.22 (т, J=7; 2Н); 2.45-2.65 (м, 1Н); 2.72 (м, 1Н); 2.83-3.03 (м, 1Н); 4.92 (м, 1Н); 4.97 (м, 1Н); 5.30 (м, 1Н); 5.59 (м, 1Н); 5.80 (м, 1 Н).
13С-ЯМР: 210.0 (с); 172.9 (с); 139.2 (д); 129.8 (с); 123.8 (д); 114.1 (т); 66.6 (д); 63.7 (д); 50.95 (т); 34.5 (т); 33.8 (т); 32.4 (с); 30.7 (т); 28.9-29.3 (несколько т); 27.9 (кв); 27.8 (кв); 24.9 (т); 23.4 (кв); 22.6 (т); 19.95 (кв).
Пример 2
Синтез соединений формулы (I) при использовании α-дамаскона в качестве исходного продукта
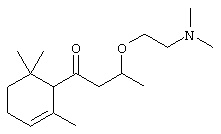
a) Синтез 3-[2-(диметиламино)этокси]-1-(2,6,6-триметил-2-циклогексен-1-ил)-1-бутанона
Раствор α-дамаскона (6,44 г; 33,5 ммоль), N,N-диметиламиноэтанола (30,25 мл; 301 ммоль) и тетраметилгуанидин (TMG) (0,77 г; 6,70 ммоль) нагревают при температуре 70°C в течение 15 часов. Затем избыток N,N-диметиламиноэтанола перегоняют при температуре приблизительно 60°С/при давлении от 10 до 2 мбар. Сырой продукт разбавляют в диэтиловом эфире (Et2O) и полученную смесь экстрагируют с помощью 5% раствора HCl, промывают водой и насыщенным раствором NaCl. Объединенные водные фазы подщелачивают, используя водный раствор NaOH и экстрагируют дважды эфиром, чтобы вновь получить сырой продукт в органических фазах. Указанные органические фазы еще раз промывают водой и рассолом, затем высушивают над Na2SO4 и концентрируют. Дистилляция из колбы в колбу сырого продукта (100-125°С/0,05 мбар) дает 2,94 г продукта желаемой чистоты (выход: 32%). МС: 281 (М+, 3), 192 (2), 123 (7), 73 (17), 72 (17), 58 (100).
1Н-ЯМР: 0.90/0.92/0.93 (3 с, 6Н); 1.10-1.20 (м, 1Н); 1.15/1.18 (д, J=6; 3Н); 1.58 (с, 3Н); 1.65-1.77 (м, 1Н); 1.95-2.20 (м, 2Н); 2.23 (с, 6Н); 2.37-2.56 (м. 3Н); 2.70/2.75 (уширенный, 1Н); 2.82-3.00 (м, 1Н); 3.40-3.50 (м, 1Н); 3.55-3.64 (м, 1Н); 3.86-3.99 (м, 1Н); 5.58 (уширенный, 1Н).
13С-ЯМР: 211.7/212.0 (с); 130.2 (с); 123.6 (д); 71.4/8 (д); 66.8/9 (т); 64.0/1 (д); 59.2 (т); 52.4/6 (т); 45.9 (2 кв); 32.4 (с); 30.7/9 (т); 28.0 (кв); 27.9 (кв); 23.4/5 (кв); 22.7 (т); 19.6/8 (кв).
b) Синтез 3-(октадецилтио)-1-(2,6,6-трилметил-2-циклогексен-1-ил)-1-бутанона
Раствор α-дамаскона (1,00 г; 5,20 ммоль), н-октадецилмеркаптана (0,76 г; 2,66 ммоль) и TMG (0,65 мл; 5,20 ммоль) в ТГФ (20 мл) перемешивают при комнатной температуре в течение 5 дней. Затем реакционную массу обрабатывают 5% водным раствором HCl, экстрагируют дважды эфиром и промывают водой, 5% водным раствором NaOH, а затем рассолом. Наконец, органические фазы высушивают над Na2SO4, концентрируют при температуре/давлении 90°С/0,04 мбар. Соответственно получают 1,30 г сырого продукта (выход: 100%, в расчете на н-октадецилмеркаптана). МС (электроспрей): 479 (М++1, 100), 401 (27), 356 (17), 313 (19).
1Н-ЯМР: 0.84-0.95 (4 пика, 9Н); 1.10-1.40 (м, приблизительно 34Н); 1.50-1.62 (м, 5Н); 1.67-1.80 (м, 1Н); 1.95-2.18 (м, 2Н); 2.48-2.95 (м, 5Н); 3.27 (м, 1Н); 5.59 (уширенный, 1Н).
13С-ЯМР: 211.1/3 (с); 130.0 (с); 123.7 (д); 63.6/7 (д); 53.1/4 (т); 34.3/5 (д); 32.4/7 (с); 31.9 (т); 30.9/40.0 (т); 29.1-29.7 (много т); 27.8/28.0 (кв); 27.8 (кв); 23.5 (кв); 22.6/7 (т); 21.6 (кв); 14.1 (кв).
Пример 3
Синтез соединений формулы (I) при использовании альдольного производного δ-дамаскона в качестве исходного продукта
Исходный продукт, а именно 3-гидрокси-1-(2,6,6-триметил-3-циклогексен-1-ил)-1-бутанон, получают соответствии с US 4334098.
Общая методика: раствор 3-гидрокси-1-(2,6,6,-триметил-3-циклогексен-1-ил)-1-бутанона (124 ммоль), NEt3 (16,26 г (22,40 мл), 161 ммоль) и ДМАП (2 г) в CH2Cl2 (200 мл) обрабатывают при комнатной температуре производным хлорангидрида карбоновой кислоты (136 ммоль). Реакционный раствор перемешивают в течение 15 часов, обрабатывают с помощью 5% раствора HCl и экстрагируют дважды эфиром, промывают H2O, насыщенным раствором NaHCO3, затем рассолом, высушивают над Na2SO4 и концентрируют при температуре/давлении 65-75°/0,01 мбар. Масло очищают с помощью флеш-хроматографии (циклогексан/AcOEt=95:5), используя SiO2 (500 г).
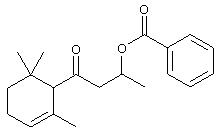
a) 1-Метил-3-оксо-3-(2,6,6-триметил-3-циклогексен-1-ил)пропилбензоата
Из бензоилхлорида, с 76% выходом. МС: 192 (42), 122 (33), 105 (90), 77 (45), 69 (100).
1H-ЯМР: 0.90 (2 д, 3Н); 0.93-1.05 (4 с, 6Н); 1.42 (2 д, 3Н); 1.65-1.75 (м, 1Н); 1.95-2.02 (2 б, 1Н); 2.22-2.30 (м, 1Н); 2.52 (м, 1Н); 2.60-2.83 (м, 1Н); 2.95-3.20 (м, 1Н); 5.40-5.61 (м, 3Н), 7.38-7.45 (м, 2Н), 7.53 (м, 1Н), 7.96-8.04 (м, 2Н).
13С-ЯМР: 211.4 (с); 165.7 (с); 132.8 (д); 131.7 (д); 130.5-(с); 129.5 (2д); 128.3 (2д); 124.1 (д); 67.3 (д); 63.0 (д); 53.3 (т); 41.7 (т); 33.1 (с); 31.6 (д); 29.8 (кв); 20.7 (кв); 20.1 (кв); 19.9 (кв).
b) 1-Метил-3-оксо-3-(2,6,6-триметил-3-циклогексен-1-ил)пропил 10-ундеценоата
Из 10-ундеценоилхлорида, с 63% выходом.
1Н-ЯМР: 0.88 (2 д, 3Н); 0.98 (4 с, 6Н); 1.22-1.42 (м, 13Н); 1.58 (м, 2Н); 1.65-1.75 (м, 1Н); 1.92-2.05 (м, 3Н); 2.22 (м, 3Н); 2.50 (м, 1Н); 2.42-2.58 (м, 1Н); 2.78-3.02 (м, 1Н); 4.92 (м, 1Н); 4.97 (м, 1Н); 5.33 (м, 1Н); 5.45 (м, 1Н); 5.53 (м, 1Н); 5.80 (м, 1Н).
13С-ЯМР: 211.4 (с); 172.9 (с); 139.2 (д); 131.7 (д); 124.1 (д); 114.1 (т); 66.3 (д); 63.0 (д); 53.2 (т); 41.7 (т); 31.6-28.9 (совокупность сигналов); 20.7 (кв); 20.0 (кв); 19.8 (кв).
c) Трис-[1-Метил-3-оксо-3-(2,6,6-триметил-3-циклогексен-1-ил)пропил]1,3,5-бензолтрикарбоксилата
Из 1,3,5-бензолтрикарбонилтрихлорида, используя ClCH2CH2Cl в качестве растворителя, с 54% выходом
1Н-ЯМР (количество Н: ×3): 0.87-1.10 (4 с +2 д, 9Н); 1.38-1.4.7. (м, 3Н); 1.65-1.75 (м, 1Н); 1.93-2.04 (м, 1Н); 2.28 (м, 1Н); 2.52 (м, 1Н); 2.60-2.88 (м, 1Н); 2.95-3.23 (м, 1Н); 5.45 (м, 1Н); 5.54 (м, 1Н), 5.66 (м, 1Н); 8.72-8.78 (м, 1Н).
13С-ЯМР: 211.3 (с); 164.1 (с); 134.3 (д); 131.6 (д); 131.4 (с); 124.2 (д); 68.2 (д); 63.1 (д); 53.2 (т); 41.7 (т); 33.1 (с); 31.6 (д); 29.8 (кв); 20.1 (кв); 20.0 (кв); 19.9 (кв).
d) Бис-[1-Метил-3-оксо-3-(2,6,6-триметил-3-циклогексен-1-ил)пропил]оксалата
Из оксалилхлорида, с 80% выходом.
1Н-ЯМР (количество Н: ×2): 0.90 (д, J=7, 3Н); 0.90-1.06 (4 с, 6Н); 1.36 (2 д, 3Н); 1.64-1.74 (м, 1Н); 1.92-2.02 (2 б, 1Н); 2.22 (м, 1Н); 2.51 (м, 1Н); 2.52-2.62 (м, 1Н); 2.85-3.15 (м, 1Н); 5.40-5.58 (м, 3Н).
13С-ЯМР: 210.7-211.1 (5 сигналов, с); 156.9 (с); 131.6 (д); 124.1 (д); 69.95 (д); 63.1 (д); 52.7 (т); 41.6 (т); 33.1 (с); 31.6 (д); 29.7 (кв); 20.7 (кв); 19.8 (кв); 19.5 (кв).
e) Бис-[1-Метил-3-оксо-3-(2,6,6-триметил-3-циклогексен-1-ил)пропил]додекандиоата
Из хлорангидрида дикислоты додекандиоата, с 59% выходом.
1Н-ЯМР (количество Н: ×2): 0.87/0.90 (д, J=7, 3Н); 0.92-1.03 (4 с, 6Н); 1.27 (м, 9Н); 1.58 (м, 2Н); 1.70 (м, 1Н); 1.96 (2 б, 1Н); 2.22 (м, 3Н); 2.43-3.02 (м, 3Н); 5.34 (м, 1Н); 5.45 (м, 1Н); 5.53 (м, 1Н).
13С-ЯМР: 211.4 (с); 172.9 (с); 131.7 (д); 124.1 (д); 66.3 (д); 63.0 (д); 53.2 (т); 41.7 (т); 34.5 (т); 33.0 (с); 31.5 (д); 29.7 (кв); 29.1-29.4 (несколько т); 25.0 (т); 20.7 (кв); 19.9 (кв); 19.8 (кв).
f) Этил-1-метил-3-оксо-3-(2,6,6-триметил-3-циклогексен-1-ил)пропилкарбоната
Раствор 3-гидрокси-1-(2,6,6-триметил-3-циклогексен-1-ил)-1-бутанона (8,0 ммоль) в пиридине (1,85 г, 23,4 ммоль) обрабатывают при температуре 0°С этилхлорформиатом (1,24 г, 23,4 ммоль). Реакционный раствор перемешивают при комнатной температуре в течение 36 часов, обрабатывают с помощью 5% раствора HCl и экстрагируют дважды эфиром, промывают (Н2O, насыщенным раствором NaHCO3, затем рассолом), высушивают над Na2SO4 и концентрируют. Масло (2,38 г) очищают с помощью флеш-хроматографии (циклогексан/AcOEt=98:2), используя SiO2 (100 г). Выход: 2,06 г (78%). МС: 192(47); 177(10); 151(11); 123(55); 122(41); 107(45); 91(11); 81(22); 69(100).
1Н-ЯМР: 0.89 (д, J=7, 3Н); 0.92-1.03 (4 с, 6Н); 1.23-1.37 (м, 6Н); 1.70 (м, 1Н); 1.96 (м, 1Н); 2.18-2.28 (м, 1Н); 2.50 (м, 1.5Н); 2.67 (м, 0.5Н); 2.87 (м, 0.5Н); 3.03 (м, 0.5Н); 4.18 (м, 2Н); 5.21 (м, 1Н); 5.42-5.48 (м, 1Н); 5.54 (м, 1Н).
13С-ЯМР: 211.4 (с); 154.4 (с); 131.7 (д); 124.2 (д); 70.5 (д); 63.8 (т); 63.1 (д); 53.1 (т); 41.7 (т); 33.1 (с); 31.6 (д); 29.7 (кв); 20.7 (кв); 20.0 (кв); 19.8 (кв); 14.3 (кв).
Пример 4
Синтез соединений формулы (I) при использовании δ-дамаскона в качестве исходного продукта
a) Синтез 3-(додецилтио)-1-(2,6,6-триметил-3-циклогексен-1-ил)-1-бутанона
Раствор δ-дамаскона (10,0 г; 52,1 ммоль) и 1-додекантиола (8,42 г, 41,7 ммоль) в ТГФ (150 мл) обрабатывают с помощью DBU (7,92 г; 52,1 ммоль) и перемешивают при температуре 45°С в течение 90 минут. Реакционный раствор обрабатывают с помощью 5% раствора HCl, экстрагируют дважды эфиром, промывают Н2О, насыщенным раствором NaHCO3, затем рассолом, высушивают над Na2SO4 и концентрируют при температуре/давлении 70°С/0,01 мбар. Выход сырого продукта: 16,2 г (99%).
1Н-ЯМР: 0.84-0.92 (м, 6Н); 0.93-1.02 (4 с, 6Н); 1.26 (м, 16Н); 1.29 (м, 3Н); 1.36 (м, 2Н); 1.58 (м, 2Н); 1.69 (м, 1Н); 1.96 (2 б, 1Н); 2.22 (м, 1Н); 2.50 (м, 3.5Н); 2.70 (м, 1Н); 2.90 (м, 0.5Н); 3.30 (м, 1Н); 5.43 (м, 1Н); 5.53 (м, 1Н).
13С-ЯМР: 212.4/5 (с); 131.8/9 (д); 124.1/2 (д); 62.9/63.0 (д); 55.2/3 (т); 41.7 (т); 34.1 (д); 33.0/2 (с); 31.9 (т); 31.6/8 (д); 30.9 (т); 29.8 (кв); 29.0-29.8 (несколько т); 22.7 (т); 21.6/8 (кв); 20.7 (кв); 19.9 (кв); 14.1 (кв).
b) Синтез 3-(додецилсульфинил)-1-(2,6,6-триметил-3-циклогексен-1-ил)-1-бутанона
Раствор 3-(додецилтио)-1-(2,6,6-триметил-3-циклогексен-1-ил)-1-бутанона (2,00 г; 5,10 ммоль) в МеОН (20 мл) добавляют при температуре 0°С к раствору NaJO4 (1,14 г, 5,30 ммоль) в H2O (11 мл). Температуру доводят до комнатной температуры и добавляют EtOH (30 мл). Суспензию перемешивают в течение 15 часов и названное соединение экстрагируют (эфиром/рассолом). Органическую фазу промывают растворами NaHCO3, Н2О, насыщенным раствором NaHCO3, затем рассолом, высушивают над Na2SO4 и концентрируют (16,2 г). Флеш-хроматография (циклогексан/этилацетат =7:3, затем 1:1) на SiO2 (40 г) дает 803 мг названное соединение (38%).
1H-ЯМР: 0.85-0.94 (м, 6Н); 0.95-1.03 (4 с, 6Н); 1.25 (м, 19Н); 1.45 (м, 2Н); 1.65-1.83 (м, 3Н); 1.97 (2 б, 1Н); 2.28 (м, 1Н); 2.46-2.62 (м. 2.5Н); 2.67 (м, 1Н); 2.78 (м, 0.5Н); 2.98 (м, 0.5Н); 3.15-3.27 (м. 1.5Н); 5.45 (м, 1Н); 5.54 (м, 1Н).
13С-ЯМР: 211.8 (с); 131.5 (д); 124.3 (д); 62.9 (д); 49.1 (т); 48.0 (д); 41.6 (т); 33.2 (с); 31.9 (т); 31.8 (д); 29.8 (кв); 29.0-29.8 (несколько т); 23.2 (т); 22.7 (т); 21.7 (кв); 20.7 (кв); 19.9 (кв); 14.1 (кв); 10.3/4 (кв).
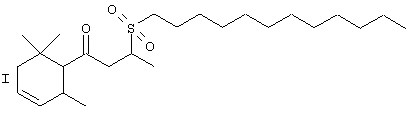
с) Синтез 3-(додецилсульфонил)-1-(2,6,6-триметил-3-циклогексен-1-ил)-1-бутанона
Раствор KHSO4 (62,1 ммоль) в Н2О (50 мл) добавляют к охлажденному льдом раствору 3-(додецилтио)-1-(2,6,6-триметил-3-циклогексен-1-ил)-1-бутанона (5,00 г; 12,7 ммоль) в МеОН (100 мл). Температуре дают возможность достигнуть 40°С. Суспензию перемешивают в течение 2 часов и названное соединение экстрагируют смесью эфира/рассола. Органическую фазу промывают Н2О, насыщенным раствором NaHCO3, затем рассолом, высушивают над Na2SO4 и концентрируют. Флеш-хроматография (циклогексан/этилацетат =95:5) на SiO2 (130 г) дает 2,59 г продукта (48%).
1Н-ЯМР: 0.84-0.92 (м, 6Н); 0.95-1.02 (3 с, 6Н); 1.26 (м, 16Н); 1.38 (м, 3Н); 1.43 (м, 2Н); 1.72 (м, 1Н); 1.85 (м, 2Н); 1.98 (2 б, 1Н); 2.29 (м, 1Н); 2.52 (м, 1Н); 2.60 (м, 0.5Н); 2.83 (м, 0.5Н); 2.95 (т, J=8, 2Н); 3.12 (м, 0.5Н); 3.35 (м, 0.5Н); 3.63 (м, 1Н); 5.46 (м, 1Н); 5.55 (м, 1 Н).
13С-ЯМР: 210.7 (с); 131.4 (д); 124.4 (д); 63.1 (д); 52.1 (д); 50.2 (т); 45.8 (т); 41.6 (т); 33.2 (с); 28.6-32.1 (несколько сигналов); 22.7 (т); 21.6 (т); 20.7 (кв); 19.9 (кв); 14.5/6 (кв); 14.1 (кв).
Пример 5
Синтез соединений формулы (I) при использовании других ароматизирующих ингредиентов в качестве исходного продукта
а) Синтез цис-4,4-диметил-2-(4-пентеноил)циклогексил бензоата
Этилвиниловый эфир (10,5 г) медленно и по каплям добавляют к 50 мл Et2O, содержащему 6-карбометокси-4,4-диметилциклогексан-1-ол (25 г) при температуре 0°С в атмосфере азота. Через 30 минут смесь промывают насыщенным раствором NaHCO3. После перегонки (температура кипения/барометрическое давление 110-120° С/10 торр; 1 торр =1 мм рт.ст.) получают 34 г 2-карбометокси-4,4-диметил-1-(2-метил-1,3-диоксапент-1-ил)пиклогексан (выход 98%)
1Н-ЯМР: 0.87-2.10 (18Н); 2.35-2.80 (1Н); 3.20-3.80 (5Н); 4.00-4.30 (1Н); 4.50-4.90 (1Н).
Раствор 2-карбометокси-4,4-диметил-1-(2-метил-1,3-диоксапент-1-ил) циклогексана (5,16 г) в 10 мл ТГФ добавляют по каплям в течение более 15 минут к раствору винилмагнийбромида (1,2 г) и винилбромиду (5,35 г) в 20 мл ТГФ при температуре 65°С. Через 4 часа смесь охлаждают и выливают в охлажденный 20% раствор HCl (40 мл). Экстракция смеси Et2O, удаление растворителей и хроматография на SiO2 (CH2Cl2/AcOEt) обеспечивает получение чистого 1-(2-гидрокси-5,5-диметил-1-циклогексил)-4-пентен-1-29 она (выход 60%).
1H-ЯМР: 0.96 (6Н); 1.00-1.95 (6Н); 2.20-2.80 (5Н); 3.36 (1H); 4.19 (1H); 4.83-5.20 (2Н); 5.83 (м, 1H)
Бензоилхлорид (12,8 г, 91 ммолей) добавляют по каплям к перемешиваемому раствору 1-(2-гидрокси-5,5-диметил-1-циклогексил)-4-пентен-1-она (16 г, 75 ммолей), Et3N (10 г, 99 ммолей) и ДМАП (1,8 г, 15 ммолей) в CH2Cl2 (380 мл) при температуре 20°С и в атмосфере азота. Раствор нагревают при температуре 45°С в течение 22 часов, охлаждают до комнатной температуры и промывают последовательно 5% раствором HCl, 10% раствором Na2CO3 и снова водой. Органическую фазу высушивают над Na2SO4 и концентрируют, чтобы получить масло коричневого цвета. Хроматография (SiO2, AcOEt/циклогексан 1:9) и дает 6,7 г названное соединение (выход =28%). МС (электроспрей): 314 (M++1,1), 259 (5), 192 (14), 137 (39), 105 (100).
1Н-ЯМР: 0.96 (с, 3Н); 1.06 (с, 3Н); 1.25 (м, 1H); 1.50 (м, 2Н); 1.82 (м, 1Н); 1.90 (д.д., J=15.2 гц, 1H); 2.05 (м, 1H); 2.27 (м, 2Н); 2.59 (м, 2Н); 2.74 (м, 1Н); 4.86 (уширенный д., J=10 гц, 1H); 4.95 (уширенный д., J=17 гц, 1H); 5.68-5.78 (2Н); 7.40 (м, 2Н); 7.55 (м, JH); 7.97 (м, 2Н).
13С-ЯМР: 209.1 (с); 165.6 (с); 137.1 (д); 133.0 (д); 130.3 (с); 129.6 (д); 128.4 (д); 115.2 (т); 69.5 (д); 49.5 (д); 39.6 (т); 34.8 (т); 33.0 (кв); 32.8 (т); 29.9 (с); 27.6 (т); 26.7 (т); 23.9 (кв).
b) Синтез 1-метил-2-оксо-3-(2,2, С-3, Т-6-тетраметил-R-1-циклогексил)пропилбензоата
3-(Бензилокси)-1-(2,2, С-3, Т-6-тетраметил-R-1-циклогексил)-1-бутанон получают в соответствии с известной методикой (С. Fehr, О. Guntem, Helv. Chim. Acta 1992, 75,1023), с 56% выходом. МС: 210 (30). 167 (27), 139 (55), 124 (76), 91 (100), 83 (69), 69 (35).
1H-ЯМР: 0.70-1.04 (м, 13Н); 1.15-1.45 (м, 5Н); 1.67 (м, 1H); 1.84 (м, 1 Н), 2.02 (м, 1Н); 2.37 (м, 0.5Н); 2.62 (м, 0.5Н); 2.82 (м, 0.5Н); 3.00 (м, 0.5Н); 3.05 (c, 1H); 4.10 (м, 1Н); 4.52 (м, 2 H); 7.20-7.38 (м, 5 H).
Обработанную суспензию бензилового эфира 82% чистоты (2,82 г, 7,30 ммоль) и 10% Pd/C (282 мг) в EtOH (23 мл) встряхивают в Н2-атмосфере. После 5 часов реакционную смесь отфильтровывают на целите и концентрируют. 3-Гидрокси-1-(2,2, С-3, Т-6-тетраметил-R-1-циклогексил)-1-бутанон очищают с помощью флеш хроматографии (циклогексан/AcOEt =98:2, затем 9:1), используя SiO2 (80 г). Выход: 969 мг (56%). МС: 226 (5), 167 (18), 139 (57), 124 (28), 87 (25), 83 (100), 69 (55), 55 (26), 43 (26).
1Н-ЯМР: 0.73-1.04 (м, 13H); 1.15-1.45 (м, 6H); 1.70 (м, 1H); 1.85 (м, 1H), 2.03 (м, 1Н); 2.41 (м, 0.5Н); 2.53 (м, 0.5Н); 2.64 (м, 0.5Н); 2.74 (м, 0.5Н); 3.30-3.65 (м, 1Н); 4.22 (м, 1H).
Названное соединение получают из 3-гидрокси-1-(2,2, С-3, Т-6-тетраметил-R-1-циклогексил)-1-бутанона и бензоилхлорида, используя аналогичную экспериментальную методику, как описано в примере 1.а) с 51% выходом. МС: 208 (18), 191 (17); 167 (32), 124 (44), 105 (100), 83 (81), 77 (28), 69 (84), 55 (23).
1Н-ЯМР: 0.73-0.86 (м, 9Н); 0.93 (с, 3Н); 0.93-1.05 (м, 1Н); 1.15-1.35 (м, 2Н); 1.41 (м, 4Н); 1.66 (м, 1H); 1.84 (м, 1 Н), 2.05 (м, 1Н); 2.79 (м, 1Н); 2.96 (м, 1Н); 5.57 (м, 1Н); 7.40 (м, 2Н); 7.53 (м, 1Н); 8.00 (м, 2 Н).
с) Синтез 3-оксоциклопентадецилбензоата
Используя аналогичную экспериментальную методику, как описано в примере 1.а), 3-оксоциклопентадецилбензоат получают из 3-гидроксициклопентадеканона и бензоилхлорида с 80% выходом. МС: 344 (след). 239 (7), 222 (47), 122 (36), 105 (100), 96 (26), 77 (34).
1Н-ЯМР: 1.18-1.48 (м, 18Н); 1.55-1.88 (м, 4Н); 2.50 (м, 2Н); 2.86 (м, 2Н); 5.48 (м, 1H); 7.43 (м, 2Н); 7.55 (м, 1Н); 8.03 (м, 2 Н)
13С-ЯМР: 208.4 (с); 133.0 (д); 130.4 (с); 129.6 (2 д); 128.4 (2 д); 70.8 (д); 47.2 (т); 42.4 (т); 32.6 (т); 27.7 (т); 26.2-26.8 (т); 23.1 (т); 23.0 (т).
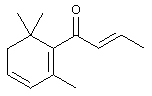
d) Синтез 1-метил-3-оксо-3-(2,6,6-триметил-1,3-циклогексадиен-1-ил)пропилбензоата
Используя аналогичную экспериментальную методику, как описано в примере 1.а), названное соединение получают из 3-гидрокси-1-(2,6,6-триметил-1,3-циклогексадиен-1-ил)-1-бутанона и бензоилхлорида с 60% выходом.
1H-ЯМР: 1.08 (2 с, 6Н); 1.45 (д, 3Н); 1.75 (с, 3Н); 2.08 (м, 2Н); 2.79 (м, 1Н); 3.20 (м, 1Н); 5.66 (м, 1Н); 5.79 (м, 1Н); 5.84 (м, 1Н); 7.42 (м, 2 Н), 7.53 (м, 1 Н), 8.02 (м, 2Н).
13С-ЯМР: 206.4 (с); 165.7 (с); 141.5 (с); 132.8 (д); 130.5 (с); 129.5 (2 д); 128.3 (2 д); 128.1 (д); 127.9 (д); 127.8 (д); 67.5 (д); 51.2 (т); 39.7 (т); 33.9 (с); 26.2 (кв); 26.1 (кв); 20.2 (кв); 19.1 (кв).
Пример 6
Синтез полимеров соединений формулы (I) при использовании производных δ-дамаскона в качестве исходного продукта
а) Синтез 1-метил-3-оксо-3-(2,6,6-триметил-3-циклогексен-1-ил)пропил-4-винилбензоата
Раствор DCC (3,60 г, 17,5 ммоль) в 10 мл СН2Cl2 добавляют к охлажденному льдом раствору 4-винилбензойной кислоты (2,35 г, 15,9 ммоль), ДМАП (1,55 г, 12,7 ммоль) и 3-гидрокси-1-(2,6,6-триметил-3-циклогексен-1-ил)-1-бутанона (4,00 г, 19,1 ммоль) в 30 мл СН2Cl2. Реакционную смесь перемешивают при комнатной температуре в течение 5 дней. Осадок отфильтровывают и фильтрат помещают в CH2Cl2, промывают дважды 10% раствором HCl, насыщенным раствором Na2CO3 и насыщенным раствором NaCl. Органические фазы высушивают над Na2SO4 и концентрируют. Флеш-хроматография над SiO2 (гептан/эфир 9:1) дает 4,02 г желаемое соединение (выход: 74%). МС: 193 (11), 192 (72), 177 (10), 149 (6), 148 (12), 135 (5), 132 (10), 131 (100), 124 (5), 123 (29), 122 (24), 121 (5), 108 (6), 107 (23), 103 (19), 102 (5), 91 (6), 81 (13), 79 (5), 77 (15), 69 (52), 41 (7).
1Н-ЯМР: 0.89 (д, J=7, 3Н); 0.93 (с, 3Н); 1.02 (с, 3Н); 1.41 (2 д, J=7, 6, 3Н); 1.70 (м, 1Н); 1.98 (м, 1Н); 2.27 (т, J=10, 1Н); 2.50 (м, 1Н); 2.63/3.00 (дд, J=18, 6, 1Н); 2.79/3.15 (дд, J=18, 7,1Н); 5.37 (д, J=10, 1Н); 5.44 (м, 1Н); 5.55 (м, 2Н); 5.85 (д, J=17, 1Н); 6.74 (дд. J=18, 11, 1Н); 7.44 (д, J=9, 2Н); 7.95 (д, J=8, 2Н).
13С-ЯМР: 211.5 (с); 165.4 (с); 141.8 (с); 136.0 (д); 131.8 (д); 129.8 (д); 129.7 (с); 126.0 (д); 124.2 (д); 116.4 (т); 67.4/2 (д); 63.0 (д); 53.3 (т); 41.7 (2 т); 33.1 (2 с); 31.6 (2 д); 29.8 (кв); 20.7 (кв); 20.1 (кв); 19.9 (кв).
b) Синтез статистического сополимера 1-метил-3-оксо-3-(2,6,6-триметил-3-циклогексен-1-ил)пропил-4-винилбензоата и 4-винилбензойной кислоты (приблизительно 1:3)
Раствор 1-метил-3-оксо-3-(2,6,6-триметил-3-циклогексен-1-ил)пропил-4-винилбензоата (1,00 г, 2,9 ммоль), 4-винилбензойной кислоты (1,30 г, 8,8 ммоль) и 2,2'-азобисизобутиронитрила (AIBN) (0.10 г, 0.6 ммоль) в 20 мл сухого ТГФ нагревают в атмосфере N2 при температуре 80°С в течение 2 дней добавляют дополнительно 0,10 г AIBN и через 2 дня реакционную смесь концентрируют, сырой продукт повторно растворяют в 3 мл ТГФ и осаждают с помощью 4 мл гептана (3х). Сушка в атмосфере высокого вакуума (0,3 мбар) дает 1,93 г желаемого соединения (выход: 84%).
Средняя величина молекулярного веса (гельпроникающая хроматография): приблизительно 1700 г/моль
ИК(чистый): 2925m (уширенный), 2870в, 2644в (уширенный), 2537в (уширенный), 1685с, 1606с, 1573м, 1508в, 1448в, 1419м, 1368м, 1311м, 1271с (уширенный)5 1176с, 1101м, 1046м, 1016м, 936в, 882в, 854м, 800м, 774с, 705с, 684в, 670в.
13С-ЯМР в ТГФ-D8: 211.6 (с, уширенный); 167.6 (с, уширенный); 165.7 (с, уширенный); 150.6 (с, уширенный); 132.7 (д); 130.6 (д, уширенный); 129.8 (с, уширенный); 128.4 (д, уширенный); 125.0 (д); 124.9 (д); 63.3 (д); 54.0 (т); 44.5 (т, уширенный); 42.5 (т); 41.7 (д, уширенный); 33.7 (с); 32.6 (д); 30.0 (кв); 21.1 (кв); 20.2 (кв, уширенный).
с) Синтез 2-[2-(2-метоксиэтокси)этокси]этил-4-винилбензоата
Как описано в примере 6а), соединение получают путем совместной реакции DCC (3.1 г, 14.9 ммоль), 4-винилбензойной кислоты (2,0 г, 13,5 ммоль), ДМАП (1,3 г, 10,8 ммоль) и 2-[2-(2-метоксиэтокси)этокси]этанола (3,3 г, 20,3 ммоль) в течение 2 дней. Флеш-хроматография над SiO2 (гептан/эфир градиент) и высушивание в атмосфере высокого вакуума дает 3,1 г масла желтоватого цвета (выход: 78%). МС: 176 (8), 175 (63), 174 (5), 148 (13), 132 (11), 131 (100), 103 (26), 102 (8), 89 (7), 87 (7), 77 (16), 59 (24), 58 (15). 45 (7).
1H-ЯМР: 3.36 (с, 3Н); 3.53 (м, 2Н); 3.66 (м, 4Н); 3.71 (м, 2Н); 3.83 (м, 2Н); 4.48 (м, 2Н); 5.38 (д, J=11, 1Н); 5.86 (д, J=17, 1Н); 6.75 (дд, J=11, 18, 1Н); 7.45 (д, J=9, 2Н); 8.01 (д, J=8, 2Н).
13С-ЯМР: 166.3 (с); 142.0 (с); 136.0 (д); 130.0 (д); 129.3 (с); 126.1 (д); 116.5 (т); 71.9 (т); 70.7 (т); 70.6 (т); 70.6 (т); 69.2 (т); 64.1 (т); 59.0 (кв).
d) Синтез статистического сополимера 1-метил-3-оксо-3-(2,6,6-триметил-3-циклогексен-1-ил)пропил-4-винилбензоата и 2-[2-(2-метоксиэтокси)этокси]этил-4-винилбензоата (приблизительно 1:2)
Раствор 1-метил-3-оксо-3-(2,6,6-триметил-3-циклогексен-1-ил)пропил-4-винилбензоата (0,29 г, 0,85 ммоль) и 2-[2-(2-метоксиэтокси)этокси]этил 4-винилбензоата (0,50 г, 1,7 ммоль) в 5 мл сухого ТГФ быстро добавляют к перемешиваемому раствору 0,05 г (0,3 ммоль) AIBN в 5 мл сухого ТГФ в атмосфере N2. Реакционную смесь нагревают при температуре 80°С в течение 90 часов. После остывания до комнатной температуры добавляют 1 мл метанола и смесь концентрируют. Сырой продукт помещают в 2 мл ТГФ и экстрагируют 4-6 мл гептана. Фазу гексана декантируют и процесс повторяют дважды. Концентрирование гептановой фазы и высушивание в атмосфере высокого вакуума дает 0,53 г очень вязкого масла (выход: 67%). Средняя величина молекулярного веса (GPC): приблизительно 8000 г/моль.
ИК (чистый): 3013w, 2922m, 2870m, 1710s, 1651w, 1607m, 1573w. 1507w, 1451m, 1418т, 1374т, 1365т, 1352т, 1307т, 1270s, 1197m, 1179m, 1135m, 1098s, 1029m, 1016т, 999w, 986w, 940m, 826w, 852m, 771m, 707s, 682m.
13С-ЯМР: 211.7 (с, уширенный); 166.1 (с); 165.3 (с); 149.2 (с, уширенный); 131.7 (д); 129.6 (д, уширенный); 128.6 (д, уширенный); 128.1 (д, уширенный); 127.4 (д, уширенный); 124.3 (д); 124.2 (д); 71.9 (т); 70.6 (т); 70.6 (т); 69.2 (т); 67.3 (д, уширенный); 64.0 (т); 62.9 (д); 59.0 (кв); 53.3 (т); 41.7 (т); 40.7 (д, уширенный); 33.1 (с); 31.6 (д); 29.8 (кв); 20.7 (кв); 20.1 (кв); 19.9 (кв).
е) Синтез статистического сополимера 1-метил-3-оксо-3-(2,6,6-триметил-3-циклогексен-1-ил)пропил-4-винилбензоата и 2-[2-(2-метоксиэтокси)этокси]этил-4-винилбензоата (приблизительно 1:3)
Как описано в примере 6с), полимер получают путем совместной реакции 0,19 г (0,57 ммоль) 1-метил-3-оксо-3-(2,6,6-триметил-3-циклогексен-1-ил)пропил-4-винилбензоата, 2-[2-(2-метоксиэтокси)этокси]этил-4-винилбензоата (0,50 г, 1,7 ммоль) и AIBN (0,3 ммоль), что дает 0,39 г очень вязкого масла (выход: 56%). Средняя величина молекулярного веса (GPC): приблизительно 6100 г/моль
ИК (чистый): 2927m, 2869m, 1711s, 1650w, 1607m, 1573w, 1507w, 1451m, 1418m, 1373m, 1366m, 1352m, 1307m, 1270s, 1197m, 1179m, 1098s, 1029m, 1016m, 998 w, 985 w, 940m, 853m, 772m, 707m, 683m.
13С-ЯМР: 166.1 (с); 165.3 (с); 149.3 (с, уширенный); 131.7 (д); 129.6 (д, уширенный); 128.2 (д, уширенный); 124.3 (д); 71.9 (т); 70.6 (т); 70.6 (т); 69.2 (т); 68.0 (т); 64.0 (т); 62.9 (д); 59.0 (кв); 53.3 (т); 41.7 (т); 40.7 (д, уширенный); 33.1 (с); 21.6 (д); 29.8 (кв); 20.7 (кв); 20.1(кв); 19,9 (кв).
Пример 7
Высвобождение ароматизирующего ингредиента из водного буферного раствора, содержащего не ионное поверхностно-активное вещество и полимер в соответствии с изобретением
Щелочной буферный раствор, содержащий 1% веса неионного поверхностно-активного вещества получают путем растворения двух таблеток боратного буфера рН 9,2 и 2,24 г Triton® X100 (происхождение: Union Carbide) в смеси 160 мл воды и 40 мл ацетонитрила. Для определения точного значения рН конечного реакционного раствора 10 мл буфера разбавляют 2 мл ацетонитрила (что дает смесь вода/ацетонитрил 2:1) и значение рН определяют как 10.5.
50 мкл 0,25 М раствора тестируемого соединения в ТГФ добавляют к 5 мл упомянутого выше щелочного буфера (вода/ацетонитрил 4:1) и разбавляют 1 мл ацетонитрила (что дает конечную смесь вода/ацетонитрил 2:1). Образцу дают возможность перемешиваться при комнатной температуре в течение 3 дней, затем экстрагируют 1 мл гептана и оставляют для декантирования в течение 30 минут. Гептановую фазу (0,5 мкл) впрыскивают трижды в газовый хроматограф Carlo Erba MFC 500, оснащенный Fisons В AS 800 автосемплером и J&W Scientific DB1 капиллярной колонкой (30 м, 0,32 мм диаметр в дюймах) при температуре 70°С в течение 10 минут, а затем до температуры 260°С (10°С/минут), давление гелия 50 кПа, температура инъекции 250°С, детектор температуры 280°С. Количество выщеленного дамаскона определяют с помощью поверхностной стандартной калибровки из пяти различных концентраций в гептане, используя среднюю величину из пяти вспрыскиваний для каждой калибровочной точки. Результаты суммированы в следующей таблице:
Несмотря на то, что как определили, соединения, внесенные в таблицу, являются стабильными в кислой среде, δ-дамаскон выделялся во всех экспериментах в щелочных условиях. Результаты показывают, что скорость высвобождения дамаскона может быть адаптирована для конкретных нужд конечного применения путем небольших изменений предшествующей структуры, таких как увеличение количества гидрофильного сомономера, включенного в основной полимер.
Пример 8
Основание для смягчения ткани, содержащее соединение формулы (I)
Основание для смягчения ткани получают путем перемешивания следующих ингредиентов:
Тестируемое соединение добавляют к 35 г основания для смягчения ткани, приготовленное выше взятое в количестве, в находящееся пределах между 0,15 и 1 ммоль.
После энергичного перемешивания смесь выливают в отделение для смягчителя ткани Miele Novotronic W900-79 СН стиральной машины. Затем стирают при температуре 40°С 17 небольших махровых полотенец (18×18 см, около 30 г каждый) и 2,3 кг больших хлопковых полотенец (11 полотенец 50×70 см), используя программу короткого цикла и 136 г Henkel "ECE Colour fastness Test Detergent 77" моющего средства без отдушки (ароматизаторов).
В конце стирки 17 небольших махровых полотенец высушивают в сушильной комнате в течение 24 часов, а затем свободно упаковывают в алюминиевую фольгу и определяют качество в течение 24 часов, 3 дней и 7 дней после стирки с помощью 20 экспертов.
Каждого эксперта просили оценить различные тестируемые хлопковые полотенца в масштабе интенсивности 1 к 7 (1: отсутствие аромата, 2: слабый аромат, 3: слегка слабый аромат, 4: средний аромат, 5: слегка сильный аромат, 6: сильный аромат, 7: очень сильный аромат).
В качестве рекомендации использовали основание для смягчения ткани, содержащее 1 ммоль чистого альфа-дамаскона, тестируемого через тот же процесс.
Результаты суммированы в следующих таблицах для различных ароматизирующих енонов:
1) α-дамаскон в сравнении с его производными формулы (I):

ссылка
0.2
0.365
2.7
0.30
0.15
0.334
0.167
4.4
4.1



2) миллимоли добавляют в 35 г основания для смягчения ткани
3) средняя интенсивность аромата сухой ткани в период, находящийся в пределах о
одного дня до семи дней после стирки
2) δ-дамаскон в сравнении с его производными формулы (I)

ссылка

3) Dynascone® (происхождение: Firmenich SA, Швейцария) в сравнении с производным формулы (I):

ссылка
4) 1-(2,2,3,6-тетраметил-1-циклогексил)-2-бутен-1-он (происхождение: Firmenich SA, Швейцария) в сравнении с производным формулы (I):

Ссылка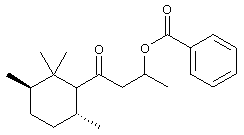
5) 1-(2,2,3-триметил-1,3-циклогексадиен-1 ил)-2-бутен-1-он в сравнении с производным формулы(I):
Ссылка
Пример 9
Гранулированное поверхностно-активное основание для ткани, содержащее соединение формулы (I)
2 ммолей тестируемого соединения (или 0,001 моль терефталевого производного) добавляют к 100 г Henkel "ECE Colour fastness Test Detergent 77" моющего средства без отдушки (ароматизатора). После смешивания новое поверхностно-активное основание наливают в отделение для порошка Miele Novotronic W900-79 СН стиральной машины. Мягчитель для ткани не используют. Затем стирают при температуре 40°С 17 небольших махровых полотенец (18 см ×18 см, около 30 г каждое) и 2,3 кг больших хлопковых полотенец (11 полотенец 50×70 см) используя программу короткого цикла стирки, складируют и оценку аромата выполняют как описано в примере 8), результаты суммируют в следующих таблицах:
1) α-дамаскон в сравнении с его производными формулы (I):




2) миллимоли добавляют в 35 г поверхностного-активного основания для ткани
3) средняя интенсивность аромата сухой ткани в период, лежащий в пределах от одного дня до семи дней после стирки
2) δ-дамаскон в сравнении с его производными формулы (I):



Дополнительные примеры соединений формулы (I):
а) функциональная группа формулы iv) в значении X:
Приготовление транс-S-[1-метил-3-оксо-3-(2,6,6-триметил-3-циклогексил-1-ил)пропил]бензолкарботиоата

Раствор δ-дамаскона (2,00 г; 10,4 ммоль) и тиобензойной кислоты (7,18 г, 52,0 ммоль) нагревают при 85°С в течение 15 час. Реакционный раствор выливают в насыщенный водный NaHCO3 и экстрагируют (простой эфир). Промывают (Н2О, затем насыщенным водным NaCl), сушат (Na2SO4) и концентрируют, получая 3.74 г сырого продукта, который очищают с помощью флэш-хроматографии (циклогексан/AcOEt=9:1), используя SiO2 (200 и). Выход: 1,70 г (50%) масло розового цвета.
MS: 207 (5), 192 (19), 123 (16), 105 (100), 77 (27), 69 (17).
1H-NMR: 0.89/0.93 (2 d, J=7, 3H); 0.95-1.03 (3 s, 6H); 1.45 (2 d, 3H); 1.69 (m, 1H); 1.95 (2 b, 1H); 2.23 (m, 1H); 2.53 (m, 1H); 2.65-3.15 (m, 2H); 4.18 (m, 1H); 5.45 (m, 1H); 5.53 (m. 1H), 7.43 (m, 2H); 7,54 (m, 1H); 7.94 (m, 2H).
13C-NMR: 211.9 (s); 191.6 (s); 137.2 (s); 133.3 (d); 131.8/9 (d); 128.5 (2 d); 127.1 (2 d); 124.1/3 (d); 62.6/7 (d); 53.9 (t); 41.7 (t); 34.1/2 (d); 33.1/2 (s); 31.7/8 (d); 29.7 (q); 20.7 (q); 20.5 (q); 19.9(q).
b) «возможные заместители G являются NO2, OR6, NR6 2, COOR6 или R6 группы, R6 представляет собой C1-C15 алкил или алкенильную группу» в определении значения G в пункте 1:
заместитель NO2:
Приготовление транс-1-метил-3-оксо-3-(2,6,6-триметил-3-циклогексен-1-ил)пропил-4-нитробензола
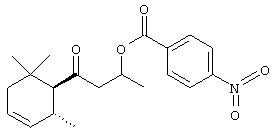
Раствор 6,09 г 80% чистого транс-3-гидрокси-1-(2,6,6-триметил-3-циклогесен-1-ил)-1-бутанона (23,2 ммоль) и NEt3 (5,38 мл, 38 ммоль) в CH2Cl2 (40 мл) обрабатывают при 0° п-нитробензоилхлоридом (5,92 г, 32 ммоль) в CH2Cl2 (10 мл). Реакционный раствор перемешивают при комнатной температуре 5 часов, обрабатывают 5% HCl и экстрагируют эфиром (2х), промывают (Н2О, насыщенным водным NaHCO3, затем насыщенным водным NaCl), сушат (Na2SO4) и концентрируют при 65-7570.01 мбар. Полученное масло (7,70 г) очищают с помощью флэш-хроматографии (циклогексан/AcOEt=95:5), используя SiO2 (100 г). Выход: 6,55 г (79%).
1H-NMR: 0,85-1.08 (9H); 1.40-1.48 (3Н); 1.72 (m, 1H); 1.98 (2 b, 1H); 2.27 (m, 1H); 2.51 (m, 1H); 2.62-3.22 (m, 2H); 5.45 (m, 1H); 5.54 (m, 1H); 5.66 (m, 1); 8.16 (m, 2H); 8.27 (m, 2H).
13C-NMR: 211.0/3 (s); 163.8 (s); 150.5 (s); 136.0 (s); 131.6 (d); 130.6 (2 d); 124.2 (d); 123.5 (2d); 68.4/5 (d); 63.0/1 (d); 53.1 (t); 41.7 (t); 33.1/2 (s); 31.6/7 (d); 29.8 (q); 20.7 (q); 20.0 (q); 19.9(q).
заместитель OR6:
Приготовление rac-1-метил-3-оксо-3-(2,2, С-3, T-6-тетраметил-R-1-циклогексил)пропил-4-метоксибензоата:
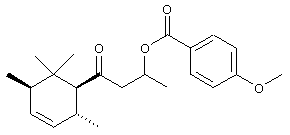
Раствор пара-анизоилхлорида (1,67 г 9,8 ммоль) в CH2Cl2 (2 мл) по каплям добавляют при 20° в раствор 3-гидрокси-1-(2,2,С-3, Т-6-тетраметил-R-1-циклогексил)-1-бутанона (2,0 г, 8,9 моль) и Et3N (0,99 г, 9,8 ммоль) в СН2Cl2 (20 мл). После 40 мин добавляют DMAP (76 мг, 0,62 ммоль). После 72 часов при 20°С эту смесь экстрагируют Н2О, водную фазу промывают СН2Cl2 (3×30 мл). Органическую фазу сушат (Na2SO4), концентрируют и очищают с помощью флэш-хроматографии (SiO2, толуол/AcOEt 9:1) и получают чистый rac-1-метил-3-оксо-3-(2,2, С-3, Т-6-тетраметил-R-1-циклогексил)пропил-4-метоксибензоат в виде смеси стереоизомеров 3:1.
1R: 2914, 1777, 1705, 1604, 1510, 1457, 1376, 1314, 1250, 1220, 1165, 1139, 1100, 1026, 845, 770.
1H-NMR: 0.79 (d, J=7, 3Н); 0.80 (s, 3Н); 0.85 (d, J=7, 3Н); 0,90 (m, 1H); 0.99 (s, 3Н); 1.25 (m, 3H); 1.39 (d, J=7, 3Н); 1.68 (m, 1H); 1.88 (m, 1H); 2.04 (m, 1H); 2.58 (dd, J - 7, 16, 1H); 3.14 (dd, J - 7. 16, 1H); 3.82 (s, 3Н); 5.55 (m, 1H); 6.9 (d, J - 8, 2H); 7.98 (d, J - 8, 3H).
13C-NMR; 14.2q, 15.6q, 20.2q, 20.8q, 28.0q, 30.4t, 30.8d, 35.2t, 37.1s, 42.0d, 54,0t, 55.4q, 66.9d, 67.6d, 113.52d, 123.0s, 131.5 2d, 163.2s, 165.4s, 211.7s.
заместитель COOR6:
Приготовление транс-1-метил-3-оксо-3-(2,6,6-триметил-3-циклогексен-1-ил)пропил-2-(СООМе)-бензоата

Фталат (R=H; основной диаст.):
Раствор транс-3-гидрокси-1-(2,6,6-триметил-3-циклогексан-1-ил)-1-бутанона (5,00 г, 23,8 ммоль) в СН2Cl2 (40 мл) обрабатывают при комнатной температуре фталевым ангидридом (3,17 г, 21,4 ммоль), N(iPr)2Et (8,30 мл, 47,6 ммоль) и DMAP (диметиламинопиридин) (0,29 г). Этот реакционный раствор перемешивают в течение 15 ч, обрабатывают 5% HCl и экстрагируют эфиром, промывают (Н2О, затем насыщенным водным NaCl), сушат (Na2SO4) и концентрируют при 70°/0,01 мбар. Выход твердого вещества: 7,54 г (98%).
1H-NMR: 0.85 (d, J=7, 3H); 0.94 (s, 3H); 0.96 (s, 3H); 1.42 (d, J - 6.5, 3H); 1.68 (m, 1H); 1.93 (2 b, 1H); 2.26 (d, J - 10, 1H); 2.50 (m, 1H); 2.78 (dd, J - 7, 18, 1H); 3.01 (dd, J - 5.5, 18, 1H); 5.42 (m, 1H); 5.52 (m, 1H), 5.59 (m, 1H); 7.50-7.66 (m, 3H); 7.93 (m, 1H); 8.50-9.50 (b, 1H).
13C-NMR: 211.7 (s); 172.0 (s); 167.4 (s); 134.1 (s); 132.4-128.7 (6d); 129.4 (s); 68.6 (d); 63.0 (d); 52.9 (t); 41.6 (t); 33.1 (s); 31.7 (d); 29.7 (q); 20.5 (q); 19.8 (q); 19.5 (q).
Фталат (R=Me: основной диаст.):
Суспензию указанной выше кислоты (1,80 г, 5,0 ммоль), K2СО3 (828 мг, 6,0 ммоль), и MeI (0,374 мл, 6,0 ммоль) в DMF (25 мл) осторожно перемешивают при 25° в течение 2 ч, обрабатывают 5% HCl и экстрагируют пентаном (2х), промывают (Н2О, насыщенным водным NaHCO3, затем насыщенным водным NaCl), сушат (Na2SO4) и концентрируют при 70°/0,01 мбар. Выход отвердеваемого масла: 1,29 г (69%).
1H-NMR: 0.85 (d, J=7, 3H); 0.95 (s, 3H); 0.98 (s, 3H); 1.42 (d, J=6.5, 3H); 1.70 (m, 1H); 1.96 (2 b, 1H); 2.25 (d, J=10, 1 H); 2.50 (m, 1H); 2.77 (dd, J=7, 18, 1H); 2.97 (dd, J - 5.5, 18, 1H); 3.91 (s, 3H); 5.43 (m, 1H); 5.52 (m, 1H), 5.55 (m, 1H); 7.50 (m, 2H); 7.65 (m, 1H); 7.72 (m, 1H).
13C-NMR: 211.5 (s); 167.9 (s); 166.8 (s); 132.7 (s); 131.8-128.6 (5d); 131.5 (s); 124.1 (d); 68.3 (d); 63.1 (d); 53.0 (t); 52.5 (q); 41.7 (t); 33.1 (s); 31.6 (d); 29.7 (q); 20,7 (q); 19.8 (2q).
G представляет собой тривалентный радикал, Q - атом водорода, Р одна группа формулы Р и один атом водорода

Раствор транс-3-гидрокси-1-(2,6,6-триметил-3-циклогексен-1-ил)-1-бутанона (5,00 г, 23,8 ммоль) в CH2Cl2 (40 мл) обрабатывают при комнатной температуре глутаровым ангидридом (2,43 г, 21,4 ммоль), N(iPr)2Et (8,30 мл, 47,6 ммоль) и DMAP (диметиламинопиридин) (0,29 г). Этот реакционный раствор перемешивают 15 ч., обрабатывают 5% HCl и экстрагируют эфиром, промывают (Н2О, затем насыщенным водным NaCl), сушат (Na2SO4) и концентрируют при 70°/0,01 мбар. Выход твердого вещества: 6,74 г (97%).
1H-NMR; 0.89 (d, J=7, 3H); 0.94 (s, 3H); 0.97 (s, 3H); 1.26 (d, J - 6.5. 3H); 1.70 (m, 1H); 1.88-2.04 (m, 3H); 2.20-2.55 (m, 6H); 2.66 (dd, J=6, 18, 1H); 2.82 (dd, J=6.5, 18, 1H); 5.34 (m, 1H); 5.45 (m, 1H), 5.53 (m, 1H).
13C-NMR: 211.6 (s); 178.7 (s); 172,0 (s); 131.8 (d); 124.2 (d); 66.9 (d); 63.3 (d); 53.1 (t); 41.7 (t); 33.4 (t); 33.2 (s); 33.1 (t); 32.9 (t); 31.7 (d); 29.7 (q); 20.7 (q); 20.0 (q); 19.8 (q).
R1 представляет собой C1-С6;

Раствор этил-3-гидрокси-3-фенилпропаноата (3,00 г, 15,5 ммоль) (M. W. Rathke, A. Lindert, J. Org. Chem. 1970, 35, 3966) в CH2Cl2 (30 мл) обрабатывают при 0° Net3 (2,40 мл, 17,1 ммоль) и DMAP (диметиламинопиридин) (0,19 г) и бензоилхлоридом (2,25 г, 15,5 ммоль) в СН2Cl2 (10 мл). Этот реакционный раствор перемешивают при комнатной температуре в течение 15 ч, обрабатывают 5% HCl и экстрагируют эфиром, промывают (H2O, насыщенным водным NaHCO3, затем насыщенным водным NaCl), сушат (Na2SO4) и концентрируют при 50°/0,01 мбар. Выход: 4,50 г (97%).
1H.NMR: 1.17 (t, J - 7, 3Н); 2.88 (dd. J=15. 4, 1H); 3.12 (dd, J - 15, 9, 1H); 4.12(q, J=7, 2Н); 6.42 (dd, J - 9,4, 1H); 7.25-7.48 (m, 8H); 8.05 (d, J=7, 2H).
13C-NMR: 169.7 (s); 165.3 (s); 139.3 (s); 133.1 (d); 130,0 (s); 129.7-128.4 (4 d); 126.5 (d); 72.9 (d); 60.8 (t); 41.8 (t); 14,1 (q).
R1 является атомом водорода;
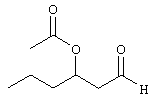
Свежеперерегнанную тиоацетиловую кислоту (11,4 г) по каплям добавляют к (£)-2-гексеналу (9,8 г, 0,1 моль) при 7°С в течение 30 мин. Этот раствор перемешивают в течение 16 ч. При комнатной температуре. Эту неочищенную смесь экстрагируют пентаном (3×100 мл) и промывают раствором насыщенного водного NaHCO3. Органическую фазу высушивают над MgSO4, фильтруют и концентрируют под вакуумом, неочищенное масло дистиллируют (очищают) на колонке Vigreux, при 0,5 мбар. 57-62°С, и пролучают 15,3 г целевого продукта (выход 88%).
1H-NMR: 9,7 (t, J=0.8. 1H), 3.90-4.00 (m, 1H); 2,70-2.75 (m, 2H); 2,31 (s. 3H); 1.59-1,65 (m, 2H), 1.30-1.50 (m, 2H); 0.91 (t, 7=7, 3H).
13C-NMR; 200 (d), 195 (s), 48 (t), 38 (d), 36 (t), 31 (q), 20 (t), 14 (q),)
Пример сополимера (±)-1-Метил-3-оксо-3-(транс-2,6,6-триметил-3-циклогексен-1-ил)пропил 2-метакрилата и метакриловой кислоты (са. 1:5) (3а):
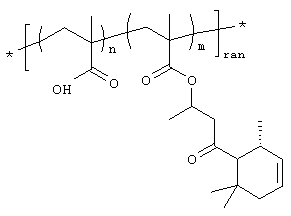
стадия а): Приготовление (±)-1-метил-1-3-оксо-3-(транс-2,6,6-триметил-3-циклогексен-1-ил)пропилl 2-метакрилата (1):
Предварительно охлажденный до 0°С раствор свежеперегнанной метакриловой кислоты (2,87 г, 33,3 ммоль), 4-диметиламинопиридина (ОМАР, 3,25 г, 26,6 ммоль) и (±)-транс-3-гидрокси-1-(2,6,6-триметил-3-циклогексен-1-ил)-1-бутанона (7,00 г, 33,3 ммоль) в СН2Cl2 (35 мл) каплями в течение 20 мин добавляют в раствор N,N'-дициклогексилкарбодиимида (DCC, 7,54 г, 36,6 ммоль) в СН2Cl2 (15 мл). Эту реакционную смесь перемешивают при комнатной температуре в течение 5 дней. Сформировавшийся осадок отфильтровывают, а фильтрат помещают в СН2Cl2, промывают HCl (10%, 2х), насыщенным раствором Na2CO3 (2x) и насыщенным раствором Nad (2x, рН около 7). Органический слой сушат (Na2SO4) и концентрируют. После многослойной колоночной хроматографии (SiO2, гептан/эфир 9:1)получают 4,67 г (63%) слабо желтое масло.
IR (neat): 3017w, 2956m, 2929m, 2872m, 2829w, 1709s, 1652w, 1636m, 1451m, 1399m, 1375s, 1352m, 1317s, 1296s, 1266w, 1250w, 1225w, 1211w, 1164s, 1136s, 1115m, 1077m, 1062m, 1030s, 1008m, 998m, 987w, 937s, 911m, 900w, 885w, 862m, 848m, 813m, 787m, 752m, 699s, 682s.
1H-NMR: 6.06-6.02 (m, 1H); 5.58-5.49 (m, 2H); 5.48-5.35 (m, 2H); 3.05 and 2.89 (dd, J - 17.9, 6.7, 1H); 2.71 and 2.54 (dd, J - 17.9, 6.1, 1H); 2,58-2.46 (m, 1H); 2.29-2.21 (m, 1H); 2.02-1.93 (m, 1H); 1.92 (m, 3H); 1.75-1.66 (m, 1H); 1.32 (d (2x), J=6.1, 3H); 1.02 and 0.99 (s, 3H); 0.95 and 0.93 (s, 3H); 0.89 and 0.88 (d, J=7.2 and 6.7, 3H).
13C-NMR:211.50 (s); 211.20 (s); 166.55 (s); 136.63 (s); 136.60 (s); 131.80 (d); 131,73 (d); 125.15 (t); 125.10 (t); 124.19 (d); 124.13 (d); 67.03 (d); 66.79 (d); 63.04 (d); 62.87 (d); 53.21 (t); 41.75 (I); 41.71 (t); 33,12 (s); 33.09 (s); 31.63 (d); 31.53 (d); 29.75 (q); 20.69 (q); 19.96 (q); 19.93 (q); 19.84 (q); 18.34 (q); 18.31 (q).
MS (E1): 193 (6), 192 (40), 177 (7), 155 (5), 149 (3), 135 (5), 124 (5), 123 (34), 122 (24), 121
(5), 109 (4), 108 (8), 107 (31), 95 (5), 93 (5), 91 (7), 87 (3), 83 (5), 82 (3), 81 (17), 79 (6), 77 (4), 70 (5), 69 (100), 67 (6), 55 (5), 53 (3), 43 (7), 42 (3), 41 (21), 39 (6).
стадия b): приготовление сополимера (±)-1-метил-3-оксо-3-(транс-2,6,6-триметил-3-циклогексен-1-ил)пропил-2-метакрилата и трет-бутилметакриалата (ca. 1:5) (2а);
трет-Бутилметакрилат (0,90 г, 6,3 ммоль) и 1 (0,35 г, 1,3 ммоль) растворяют в безводном анизоле (4 мл), затем к раствору в атмосфере N2 по каплям добавляют 2,2'-азобисизобутиронитрил (AIBN, 12,4 мг, 0,08 ммоль). Эту смесь дегазируют в течение 6 ч с помощью двух циклов заморозки и нагревания до 90°С. Полученный полимер растворяют в TMF и осаждают холодным метанолом (дважды), получая 0,95 г (76%) белого твердого продукта.
IR (neat); 2975w, 2933w, 2873w, 2830w, 1717m, 1474w, 1457w, 1391w, 1366m, 1248m, 1133s, 1029w, 967w, 874w, 846m, 751m, 699w, 682w, 667w.
1H-NMR: 5,53 (m, 1H); 5.45 (m, 1H); 5.10 (m, 1H); 3.06 (m, 1H); 2.86 (m, 1H); 2.72 (m, 1H); 2,50 (m, 3H); 2.36 (m, 1H); 2.30-1.65 (m, 16H); 1.42 (m, 45H); 1.31 (m, 6H); 1.20-0.74 (m, 25H).
13C-NMR:211.32 (s, br.); 177.47 (s, br.); 176.66 (s, br.); 131.73 (d, br.); 124.28 (d, br.); 80.91 (s, br.); 80.82 (s, br.); 67,84 (d, br); 63.05 (d, br.); 52.89 (t, br.); 46.23 (s, br.); 45.34 (s, br.); 41.72 (t); 33.05 (s, br.); 31.65 (d, br.); 29.76 (q, br.); 27.81 (d); 20.73 (q, br.); 19.89 (q, br.); 19.62 (q, br.); 17.82 (q, br.); 17.63 (q, br.).
Средний молекулярный вес (SEC, PMMA): Mw - 47000 Да, Мn=18000 Да.
стадия с): приготовление сополимера (±)-1-метил-1-3-оксо-3-(транс-2,6,6-триметил-3-циклогексен-1-ил)пропил-2-метакрилата и метакриловой кислоты (са. 1:5) (3а):
Трифторацетиловую кислоту (TFA, 15 мл) добавляют в раствор 2а (0,90 г, 0,91 ммоль) в CH2Cl2 (15 мл) и эту реакционную смесь перемешивают при комнатной температуре в течение 1 часа. Среда приобретает оранжевый цвет. Осаждение в холодном диэтиле дает 0,55 г (86%) белого твердого вещества.
IR (neat): 3700-2400w (br.), 2982m, 2969m, 2956m, 2935m, 2900m, 2838m, 1697s, 1474m, 1449m, 1387m, 1369m, 1252m, 1151s, 1065m, 1029w, 999w, 961m, 933m, 832w, 793w, 750w, 700w, 683w, 668w, 632w, 625w, 617w, 605w.
1H-NMR (MeOD): 5.58 (m, 1H); 5.49 (m, 1H); 5.11 (m, 1H); 3.14 (m, 1H); 2.90 (m, 1H); 2.67 (m, 1H); 2.50 (m, 1H); 2.32 (m, 1H); 2.20-1.78 (m, 19H); 1.75 (m, 2H); 1.52 (m, 2H); 1.45 (m, 4H); 1.30 (m, 7H); 1.11-0,73 (m, 32H).
13C-NMR (MeOD): 213.50 (s, br.); 183.69 (s, br.); 182.53 (s, br.); 182.24 (s, br.); 181.34 (s, br.); 179.15 (s, br.); 132.81 (d, br.); 125.50 (d, br,); 69.33 (d, br.); 64.03 (d, br.); 55.69 (t, br.); 54.18 (t, br.); 53.20 (t, br.); 52.90 (t, br.); 47.53 (s, br.); 46.32 (s, br.); 45.94 (s. br.); 42,81 (t); 34.19 (s, br.); 32.92 (d. br.); 30.51 (q. br.); 28.24 (q, br.); 21.50 (q, br.); 20.33 (q, br.); 19.93 (q, br.); 19.28 (q, br.); 30.51 (q, br.); 17.36 (q, br.); 17.02 (q.br.).
| название | год | авторы | номер документа |
|---|---|---|---|
| Макрогетероциклические нуклеозидные производные и их аналоги, получение и применение | 2017 |
|
RU2731385C1 |
| 3'-ЗАМЕЩАЕМЫЕ ПРОИЗВОДНЫЕ АБСЦИЗОВОЙ КИСЛОТЫ | 2015 |
|
RU2688347C2 |
| КОНЪЮГАТЫ VAR2CSA-ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2014 |
|
RU2714933C2 |
| СОЕДИНЕНИЯ ПИРИДАЗИНАМИДА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ТИРОЗИНКИНАЗЫ СЕЛЕЗЕНКИ (SYK) | 2013 |
|
RU2627661C2 |
| C-3 и C-17 модифицированные тритерпеноиды в качестве ингибиторов ВИЧ-1 | 2017 |
|
RU2716502C2 |
| ЭНАНТИОМЕРНО ЧИСТЫЕ ОСНОВНЫЕ ЭФИРЫ АРИЛ-ЦИКЛОАЛКИЛГИДРОКСИКАРБОНОВЫХ КИСЛОТ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ В ЛЕКАРСТВЕННЫХ СРЕДСТВАХ | 1997 |
|
RU2238936C2 |
| НОВЫЕ СОЕДИНЕНИЯ КОНДЕНСИРОВАННОГО ИМИДАЗОЛА, ОБЛАДАЮЩИЕ СВОЙСТВАМИ АГОНИСТОВ РЕЦЕПТОРА СВ2 | 2002 |
|
RU2312864C2 |
| Полусинтетические производные гелиомицина, ингибирующие опухолевый рост | 2016 |
|
RU2644780C2 |
| СПОСОБ ПОЛУЧЕНИЯ РЕТИНАЛЯ ИЛИ АДДУКТА (ПОЛНОСТЬЮ-Е)-РЕТИНАЛЯ С ГИДРОХИНОНОМ И ПРОМЕЖУТОЧНЫЕ ПРОДУКТЫ | 2002 |
|
RU2318805C2 |
| ПРОИЗВОДНЫЕ ТРИЦИКЛИЧЕСКОГО ТРИАЗОЛОБЕНЗАЗЕПИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ АЛЛЕРГИЧЕСКИХ ЗАБОЛЕВАНИЙ, ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 1998 |
|
RU2198885C2 |
Настоящее изобретение относится к области парфюмерии. В особенности оно относится к ароматизирующей композиции, содержащей в качестве активного ингредиента, по крайней мере, соединение формулы

где значения для w, m, P, X, G, Q, n определены в п.1 формулы, и один или более ароматизирующий соингредиент. Изобретение также относится к способу улучшения, усиления или модификации запаха, способу ароматизирования поверхности, способу усиления или продления диффузионного эффекта ингредиента на поверхности, к новым соединениям формулы (I), за исключением соединений, перечисленных в п.10 формулы, и к ароматизированному изделию с использованием соединений формулы (I). 6 н. и 7 з.п. ф-лы.

где w представляет собой целое число от 1 до 10000;
m представляет собой целое число от 1 до 4;
Р представляет собой атом водорода или радикал, допускающий образование душистого α,β-ненасыщенного кетона, альдегида или эфира карбоновой кислоты, и представлен формулой

в которой волнистая линия означает положение связи между указанными Р и X;
R1 представляет собой атом водорода, C1-C6 алкоксильный радикал или C1-C15 линейный, циклический или разветвленный алкильный, алкенильный или алкадиенильный радикал, возможно замещенный С1-С4 алкильными группами;
R2, R3 и R4 представляют собой атом водорода, ароматическое кольцо или C1-C15 линейный, циклический или разветвленный алкильный, алкенильный или алкадиенильный радикал, возможно замещенный C1-C4 алкильными группами; или две или три R1-R4 группы связываются вместе, чтобы образовать насыщенное или ненасыщенное кольцо, имеющее от 6 до 20 атомов углерода, включая атом углерода, к которому указанные R1, R2, R3 или R4 группы присоединены, это кольцо может быть замещенным C1-C8 линейными, разветвленными или циклическими алкильными или алкенильными группами; и при условии, что, по крайней мере, одна из Р групп имеет формулу (II) как определено выше;
е) Х представляет собой функциональную группу, выбранную из группы, включающей формулы i)-vi) и viii-x):

где волнистые линии являются теми, как определено выше, и жирные линии показывают положение связи между указанными Х и G, при условии, что Х может отсутствовать, когда Р представляет собой атом водорода;
G представляет собой поливалентный радикал (с m+1 валентностью) арильный радикал, возможно замещенный или двухвалентный циклический, линейный или разветвленный алкильный, алкенильный углеводородный радикал, имеющий от 6 до 22 атомов углерода или трех, четырех или пятивалентный циклический, линейный или разветвленный алкильный углеводородный радикал, имеющий от 1 до 22 атомов углерода, указанный углеводородный радикал может быть замещенным и содержащим от 1 до 10 функциональных групп, выбранных из группы, включающей простой эфир; возможными заместителями G являются NO2, OR6, NR6 2, COOR6 или R6 группы, R6 представляет собой C1-C15 алкильную или алкенильную группу;
Q представляет собой атом водорода (в этом случае w=1 и n=1) или представляет собой группу [[P-X]m[G]n], где Р, X, G и m являются теми, как определено выше (в этом случае w=1, a n=0 или 1) или полимерный скелет из мономерных единиц формулы А) (в этом случае n=1 или 0);

где штриховые линии показывают положение связи между указанным мономерным звеном и G;
n равен 1 или 0;
R7 представляет собой одновременно или независимо атом водорода;
Z представляет собой функциональную группу, выбранную из группы, включающей формулы от 2) и 5):

где штриховые линии определены выше, пунктирные стрелки показывают положение связи между указанным Z и оставшейся частью мономерного звена, причем указанная композиция содержит в качестве активного ингредиента, по меньшей мере одно соединение формулы (I) и один или более ароматизирующий соингредиент.
w представляет собой целое число от 1 до 10000; m имеет значение 1 или 2; Р представляет собой атом водорода или радикал формул от (Р-1) до (Р-11), в форме одного любого из его изомеров:

где волнистые линии имеют значения, обозначенные выше, и пунктирные линии представляют собой простую или двойную связь, R9 обозначает метильную или этильную группу и R10 представляет собой С6-С9 линейную или разветвленную алкильную, алкенильную или алкадиенильную группу; и при условии, что, по крайней мере, одна из Р групп имеет формулы от (Р-1) до (Р-11), как определено выше;
Х представляет собой функциональную группу, выбранную из группы, включающей формулы:
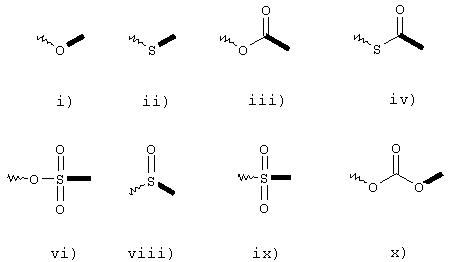
где значения жирных или волнистых линий имеют значения, обозначенные выше; и при условии, что Х может отсутствовать, когда Р представляет собой атом водорода;
G представляет собой двухвалентный или трехвалентный радикал арильный радикал, возможно замещенный или двухвалентный циклический, линейный или разветвленный алкильный, алкенильный углеводородный радикал, имеющий от 8 до 22 атомов углерода или трехвалентный циклический, линейный или разветвленный алкильный углеводородный радикал, имеющий от 1 до 22 атомов углерода, указанный углеводородный радикал может быть замещенным и содержащим от 1 до 5 функциональных групп, выбранных из группы, включающей простой эфир; причем возможными заместителями G являются, NO2, OR6, NR6 2, COOR6 или R6 группы, R6 представляет собой C1-C15 алкильную или алкенильную группу; и
Q представляет собой атом водорода (в этом случае w=1 и n=1) или представляет собой группу [[P-X]m[G]n], где Р, X, G, и m являются теми, как определено выше (в этом случае w=1, а n=0 или 1), или полимерным скелетом, производным от мономерного звена, формулы А):

где штриховые линии и n являются теми, как определено выше в п.1;
R7 представляет собой одновременно или независимо атом водорода;
Z представляет собой функциональную группу, выбранную из групп, включающей формулы 2) и 5);

где штриховые линии, пунктирные стрелки и стрелки определены выше в п.1.
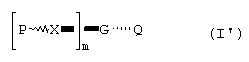
где m имеет значение 1 или 2;
Q представляет собой атом водорода;
Р представляет собой радикал формул от (Р-1) до (Р-7), в форме любого одного из его изомеров:

где волнистые линии и пунктирные линии являются теми, как определено выше; Х представляет собой функциональную группу, выбранную из группы, состоящей из формул

где жирные или волнистые линии определены выше; G представляет собой двухвалентный или трехвалентный ареновый радикал, возможно замещенный с помощью NO2, OR6, NR6 2, COOR6 и R6 группу, R6 представляет собой C1-С6 алкильную или алкенильную группу.
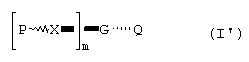
где Р, m и Q являются теми, как определено в п.3;
Х представляет собой функциональную группу формул, включающую iii) или х), как определено в п.1,и
G представляет собой двухвалентный радикал, производный от линейного или разветвленного алкильного или алкенильного, углеводородного радикала, имеющего от 8 до 15 атомов углерода; или G представляет собой трехвалентный радикал, производный от линейного или разветвленного алкильного углеводородного радикала, имеющего от 2 до 10 атомов углерода.
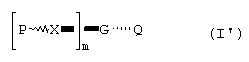
где Р, m и Q являются теми, как определено в п.3;
Х представляет собой функциональную группу, выбранную из группы, включающую формулы ii), viii) или ix), как определено выше;
G представляет собой двухвалентный или трехвалентный радикал, производный от линейного или разветвленного алкильного или алкенильного углеводородного радикала, имеющего от 8 до 15 атомов углерода.

где Q и Р имеют значения, приведенные в п.3;
G представляет собой трехвалентный радикал, производный от линейного или разветвленного алкильного или алкенильного, углеводородного радикала, имеющего от 3 до 6 атомов углерода,
| Ароматизирующая композиция | 1978 |
|
SU814283A3 |
| Устройство для пакетирования | 1987 |
|
SU1602747A1 |
| DE 3307869 А, 06.09.1984 | |||
| DE 3228289 А, 09.02.1984 | |||
| US 3900520 А, 19.08.1975 | |||
| US 3883572 А, 13.05.1975 | |||
| US 3819712 А, 25.06.1974 | |||
| Композиция синтетических и натуральных душистых веществ | 1977 |
|
SU861398A1 |
| ПИЩЕВОЙ АРОМАТИЗАТОР СО ВКУСОМ И АРОМАТОМ ТРОПИЧЕСКИХ ПЛОДОВ | 1995 |
|
RU2113133C1 |
| Композиция душистых веществ,обладающих запахом розы | 1968 |
|
SU258504A1 |
| Композиция душистых веществ, обладающая запахом ириса | 1974 |
|
SU526656A1 |
| Композиция душистых веществ | 1979 |
|
SU850653A1 |
| Способ получения ароматического продукта с запахом розы | 1988 |
|
SU1698276A1 |
| JP 11255629 А, | |||
Авторы
Даты
2007-03-27—Публикация
2002-12-11—Подача