Бромид 1-гексадецил-R(-)-3-окси-1-азониабицикло[2.2.2.]октана (далее вещество I) относится к кватернатам оптически активных бициклических аминоспиртов и может быть использован: в медицине в качестве химио- и радиопротектора в сочетании с химио- и лучевой терапией для улучшения качества жизни больных и уменьшения интервалов между курсами специфического лечения рака, при хирургическом лечении химиорезистентных форм рака (рак легкого, пищевода, желудка и т.д.) в качестве стимулятора противоопухолевого иммунитета у больных в послеоперационном периоде; для профилактики онкологических заболеваний у лиц с высоким фактором риска (генетическая предрасположенность к раку, профессиональные факторы и т.д.) на фоне мониторинга противоопухолевых составляющих иммунитета; при лечении иммунодефицитов и хронических инфекций различной природы; в качестве антикоагулянта у больных с повышенной свертываемостью крови для профилактики тромбообразования; в лабораторной практике: в качестве активатора натуральных киллеров и индуктора цитокинов (интерлейкинов, фактора некроза опухолей, интерферонов и т.д.)
В качестве аналогов вещества I могут рассматриваться иммуномодуляторы цитокиновой природы с противоопухолевой активностью. К таким соединениям относятся препараты интерлейкина-2 (Ронколейкин, Россия и Пролейкин, Голландия) и интерферона (Реоферон, Россия, Интрон-А, США). Эти препараты при воздействии в терапевтических дозах могут вызывать побочные реакции в виде лихорадки, снижения уровня артериального давления, почечной и дыхательной недостаточности (Биологические методы лечения онкологических заболеваний: Пер. с англ. /Под ред. В.Т.ДеВита, С.Хеллмана, С.А.Розенберга. - М.: Медицина, 2002. - Д.Дж.Шварцентрубер. Биологические методы лечения интерлейкином-2: клиническое применение, - с.247-262; К.А.Фун Биологические методы лечения интерфероном-α и -β: клиническое применение - с.382-390; X.Р.Кесада. Биологические методы лечения интерфероном-γ, с.452-460). Побочные эффекты этих рекомбинантных пептидов требуют проведения длительных (до 18 ч) инфузий или подкожных введений, при которых происходит потеря до 30% активности действующего начала (Справочник для иммунотерапии для практического врача./ Под ред. А.С.Симбирцева. - С.-П.: Диалог, 2002. - В.К.Козлов Ронколейкин: биологическая активность, иммунокорригирующая эффективность и клиническое применение). Кроме того, эти препараты при длительном применении вызывают образование антител, что снижает их эффективность (G. Sama at al. A comparative study of intravenous versus intralymphatic interleukin-2, with assessment of effects of interleukin-2 on both peripheral blood and thoracic-duct lymph. J. Immunother, 1994. - №15 - P.140-146). Рекомбинантные цитокины требуют особых условий хранения и транспортирования и не могут храниться в водных растворах. Известны также иммуномодуляторы не белковой природы (ликопид, полиоксидоний, иммунофан, неовир), которые используются для коррекции иммунного статуса у онкологических больных, однако их противоопухолевое действие не установлено (Добрица В.П., Ботерашвили Н.М., Добрица Е.В. Современные иммуномодуляторы для клинического применения: Руководство для врачей. -С.-П.: Политехника, 2001. - 251 с.; Справочник для иммунотерапии для практического врача. /Под ред. А.С.Симбирцева. - С.-П.: Диалог, 2002. - А.А.Старченко. Общая характеристика иммунотропных препаратов - с.100-151).
Вещество I в отличие от рекомбинантных цитокиновых противоопухолевых препаратов характеризуется низкой токсичностью и в дозах, в тысячи раз превышающих терапевтические, не оказывает токсического действия на системы жизнеобеспечения у лабораторных животных. Вещество I не вызывает гипертермических реакций у животных, не оказывает аллергезирующего действия и не обладает кумулятивным эффектом. Препарат высоко стабилен в водных растворах, не требует особых условий транспортирования и хранения, сохраняет свою биологическую активность в растворах не менее 3 лет. Вещество I наряду с иммуномодулирующим действием обладает противоопухолевой и бактериостатической активностью. Вещество I хотя и является синтетическим соединением с низкой молекулярной массой, наиболее близким по спектру биологической активности для него является рекомбинантный пептид ИЛ-2, который может рассматриваться в качестве его прототипа.
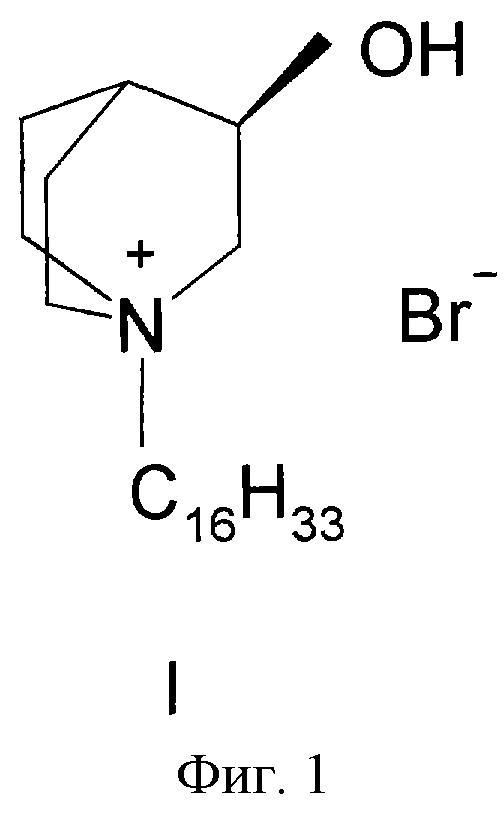
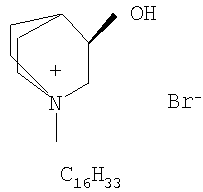
Препарат представляет собой индивидуальное органическое вещество - бромид 1-гексадецил-R(-)-3-окси-1-азониабицикло[2.2.2.]октана, см. фиг.1.
Способ получения. Бромид 1-гексадецил-R(-)-3-окси-1-азониабицикло[2.2.2.]октана (I) получают кватернизацией R(-)-1-азабицикло[2.2.2]октан-3-ола (II) бромистым гексадецилом (III) по схеме 1 при нагревании в органическом растворителе, например, этаноле или изопропаноле. По окончании реакции продукт I отфильтровывают и очищают перекристаллизацией.
Схема 1
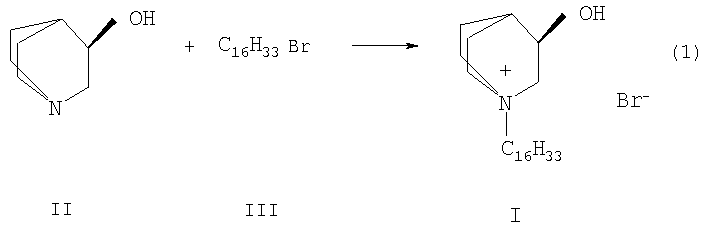
Бромид 1-гексадецил-R(-)-3-окси-1-азониабицикло[2.2.2.]октан (I) имеет R- абсолютную конфигурацию хирального центра, и поэтому исходным веществом для его получения по схеме 1 является R(-)-1-азабицикло[2.2.2.]октан-3-ол (II).
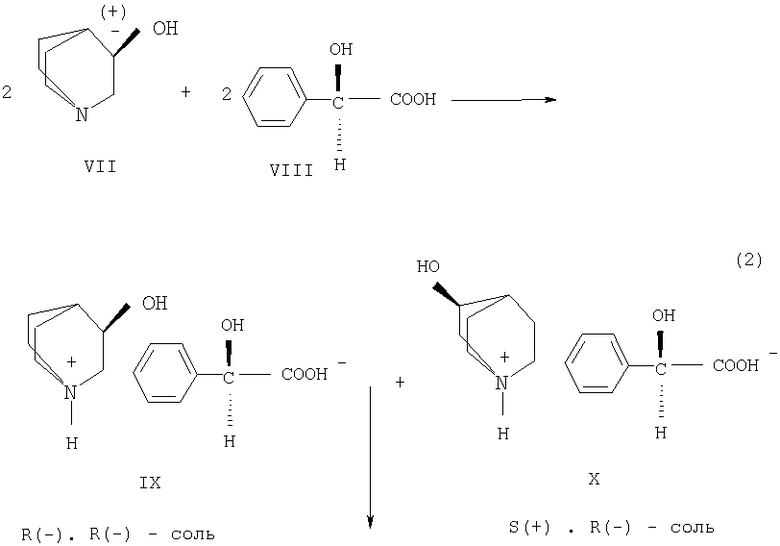
Исходное вещество - R(-)-1-азабицикло[2.2.2.]октан-3-ол (II) выделяют при расщеплении RS(±)-1-азабицикло[2.2.2]октан-3-ола (VII) через диастереомерные соли с хиральной кислотой (например, с R(-)- или S(+)-энантиомерами миндальной кислоты) в органическом растворителе(например, в ацетоне или метилэтилкетоне). При использовании для расщепления RS(±)-1-азабицикло[2.2.2]октан-3-ола (VII) в качестве хирального расщепляющего реагента кислого характера R(-)- миндальной кислоты (VIII) по схеме 2 происходит преимущественная кристаллизация R(-)•R(-) - диастереомерной соли (IX), которую отфильтровывают и очищают от второй S(+)•R(-)-диастереомерной соли кристаллизацией.
Схема 2
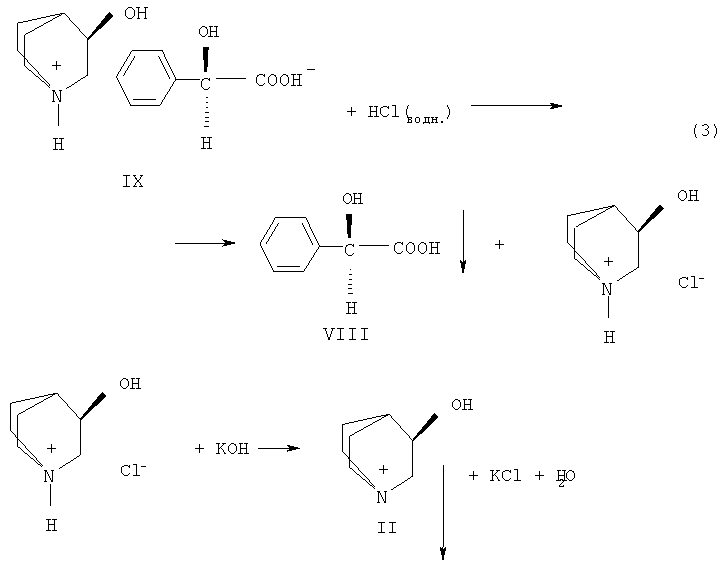
Разложение диастереомерных солей производится в следующем порядке (схема 3). В начале из водного раствора диастереоизомерной соли действием разбавленной соляной кислоты регенерируют хиральный реагент (УТЛ), извлекая его эфиром. Затем из водного кислого раствора действием твердого едкого кали выделяют энантиомер 1-азабицикло[2.2.2.]октан-3-ола (II), который отфильтровывают и очищают перекристаллизацией.
Схема 3
Используемые для получения бромида 1-гексадецил-R(-)-3-окси-1-азониабицикло[2.2.2]октана (I) PS(±)-1-азабицикло[2.2.2]октан-3-ола, бромистый гексадецил и R(-)- и S(+)-миндальные кислоты являются доступными реагентами для органического синтеза.
Бромид 1-гексадецил-R(-)-3-окси-1-азониабицикло[2.2.2]октана (I) представляет собой мелкокристаллическое химически и оптически стабильное вещество с температурой плавления Тпл.=228-230°С и удельным вращением 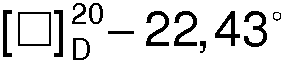 (с 1.5, 50% С2Н5OH),
(с 1.5, 50% С2Н5OH), 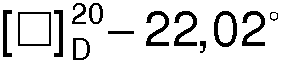 (с 1.5, C5H5N-CH3OH, 1:1). Вещество растворимо в воде, метаноле, этаноле, хлороформе, пиридине, диметилсульфоксиде.
(с 1.5, C5H5N-CH3OH, 1:1). Вещество растворимо в воде, метаноле, этаноле, хлороформе, пиридине, диметилсульфоксиде.
Пример 1. Бромид 1-гексадецил-R(-)-3-окси-1-азониабицикло[2.2.2]октана.
Раствор 12,7 г (0,1 моля) R(-)-1-азабицикло[2.2.2]октан-3-ола и 33,6 мл (33,6 г, 0,11 моля) бромистого гексадецила в 50 мл изопропанола нагревают в колбе с обратным холодильником в течение 16 ч. Осадок отфильтровывают, промывают изопропанолом и сушат. Перекристаллизовывают из изопропанола. Получают 39,5 г. (91,3%) бромида 1-гексацедил-R(-)-3-окси-1-азониабицикло[2.2.2.]октана в виде мелкокристаллического вещества с Тпл. 229,2°С, 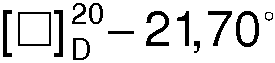 (с 1.5, 96% С2Н5OH),
(с 1.5, 96% С2Н5OH), 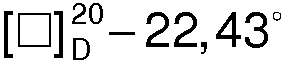 (с 1.5, 50% С2Н5OH),
(с 1.5, 50% С2Н5OH), 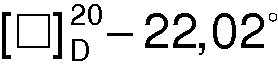 (с 1.5, 50% C5H5N- СН3ОН, 1:1)
(с 1.5, 50% C5H5N- СН3ОН, 1:1)
Найдено, %: С64,18; Н 10,97; N 3,18; Br 18,60.
С23Н46BrNO
Вычислено, %: С 63,87; Н 10,72; N 3.24; Br 18,47.
Пример 2.
R(-)- и S(+) - энантиомеры 1-азабицикло[2.2.2]октан-3-ола (расщепление RS (±)-1-азабицикло[2.2.2]октан-3-ола R(-)- и S (+) - миндальными кислотами).
К раствору 30,4 г (0,2 моля) R(-)- миндальной кислоты в 800 мл ацетона при перемешивании добавляют небольшими порциями 25,4 г (0,2 моля) RS(±)-1-азабицикло[2.2.2]октан-3-ола. Перемешивание продолжают до полного растворения 1-азабицикло[2.2.2]октан-3-ола. Через 12 ч образовавшийся осадок отфильтровывают, промывают ацетоном (2×30 мл) и сушат. Получают 27,8г кристаллов с Тпл. 111,8-112,3°С и 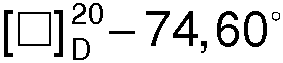 (с 3, Н2О), которые растирают в порошок и перекристаллизовывают из 1200 мл ацетона. Через 12 ч отфильтровывают 21,4 г (-)•(-) - соли с
(с 3, Н2О), которые растирают в порошок и перекристаллизовывают из 1200 мл ацетона. Через 12 ч отфильтровывают 21,4 г (-)•(-) - соли с 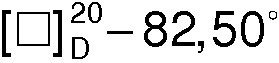 (с 3, Н2О). Вторую кристаллизацию проводят из 1000 мл ацетона. Через 12 ч выделяют 19,0 г (68,0%) R(-)-манделата R(-)-1-азабицикло[2.2.2]октан-3-ола, Тпл.=120,8°С,
(с 3, Н2О). Вторую кристаллизацию проводят из 1000 мл ацетона. Через 12 ч выделяют 19,0 г (68,0%) R(-)-манделата R(-)-1-азабицикло[2.2.2]октан-3-ола, Тпл.=120,8°С, 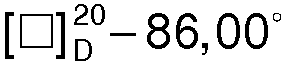 (с 3, Н2О). Последующая кристаллизация не приводит к изменению Тпл. и
(с 3, Н2О). Последующая кристаллизация не приводит к изменению Тпл. и  соли.
соли.
Найдено, %: С 65,11; Н 7,52; N 4,89. С7H13NO•C7Н8О3.
Вычислено, %: С 64,54; Н 7,58; N 5.05.
К 50, 4 мл 6%-ной соляной кислоты (0,085 моля) при перемешивании и охлаждении ледяной водой небольшими порциями добавляют 19,0 г (0,068 моля) R(-)-манделата R(-)-1-азабицикло[2.2.2]октан-3-ола. После полного растворения соли R(-) - миндальную кислоту экстрагируют эфиром (5×30 мл). Эфирные экстракты промывают насыщенным раствором хлорида натрия (2×10 мл). Эфир отгоняют. Остаток перекристаллизовывают из смеси гептан- ацетон (5:1). Получают 9,8 г R(-) - миндальной кислоты (регенерированный хиральный реагент), Тпл.=133,2°С,  (c 3, Н2О).
(c 3, Н2О).
К водному слою, оставшемуся после отделения R(-)- миндальной кислоты, при перемешивании и охлаждении ледяной водой небольшими порциями добавляют 24,7 г (0,44 моля) твердого едкого кали. Всплывший осадок отфильтровывают, сушат и перекристаллизовывают из толуола. Получают 7,9 г (91,3%) R(-)-1-азабицикло[2.2.2]октан-3-ола, Тпл=222.3°С, 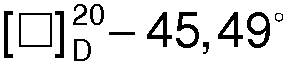 (с 2, 1 н. СН3СО2Н).
(с 2, 1 н. СН3СО2Н).
Первый ацетоновый маточный раствор, полученный после отделения 27,8 г (-)•(-)-соли, упаривают на водяной бане, и из остатка действием 6%-ной соляной кислоты выделяют 14,4 г R(-)- миндальной кислоты (регенерированный хиральный реагент), Тпл.=133,4°С (из смеси гептан- ацетон (5:1)), 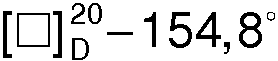 (с 3, Н2О), а затем действием едкого кали - 11,6 г 1-азабицикло[2.2.2]октан-3-ола, обогащенного S(+) - энантиомером, Тпл.=222,5°С (из толуола),
(с 3, Н2О), а затем действием едкого кали - 11,6 г 1-азабицикло[2.2.2]октан-3-ола, обогащенного S(+) - энантиомером, Тпл.=222,5°С (из толуола), 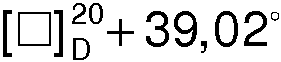 (с 2, 1 н. СН3CO2Н, о. ч. 85,7%).
(с 2, 1 н. СН3CO2Н, о. ч. 85,7%).
К раствору 13,9 г (0,091 моля) S(+) - миндальной кислоты в 800 мл ацетона при перемешивании добавляют небольшими порциями 11,6 г (0,091 моля 1-азабицикло[2.2.2]октан-3-ола, обогащенного S(+)-энантиомером с 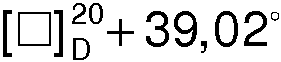 (с 2, 1 н. СН3СО2Н). Через 12 ч образовавшийся осадок отфильтровывают, промывают ацетоном (2×20 мл) и сушат. Получают 21,9 г (+)•(+)- соли с
(с 2, 1 н. СН3СО2Н). Через 12 ч образовавшийся осадок отфильтровывают, промывают ацетоном (2×20 мл) и сушат. Получают 21,9 г (+)•(+)- соли с 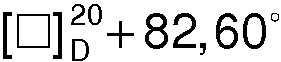 (с 3, Н2О). Последующая кристаллизация приводит к 19,4 г (82,0%) S(+) - манделата S(+)-1-азабицикло[2.2.2]октан-3-ола, Тпл=121,0°С,
(с 3, Н2О). Последующая кристаллизация приводит к 19,4 г (82,0%) S(+) - манделата S(+)-1-азабицикло[2.2.2]октан-3-ола, Тпл=121,0°С, 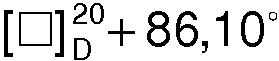 (c 3, Н2О).
(c 3, Н2О).
К 51,5 мл 6%-ой соляной кислоты (0,087 моля) при перемешивании и охлаждении ледяной водой небольшими порциями добавляют 19,4 г (0,069 моля) S(+) - манделата S(+)-1-азабицикло[2.2.2]октан-3-ола, S(+) - миндальную кислоту экстрагируют эфиром (5×30 мл). Экстракт промывают насыщенным раствором хлорида натрия (2×10 мл). Эфир отгоняют. Остаток перекристаллизовывают из смеси гептан- ацетон (5:1). Получают 10,0 г S(+) - миндальной кислоты (регенерированный хиральный реагент), Тпл.=131,1°С, 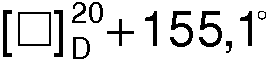 (c 3, H2O).
(c 3, H2O).
К водному слою, оставшемуся после отделения S(+) - миндальной кислоты, при перемешивании и охлаждении ледяной водой небольшими порциями добавляют 25,2 г (0,45 моля) твердого едкого кали. Всплывшее вещество отфильтровывают, сушат и перекристаллизовывают из толуола.
Получают 8,1 г (91,7%) S(+)-1-азабицикло[2.2.2.]октан-3-ола, Тпл=222,4°С, 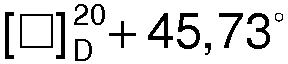 (с 2, 1 н. СН3СО2Н).
(с 2, 1 н. СН3СО2Н).
Таким образом, при расщеплении 25,4 г RS(±)-1-азабицикло[2.2.2]октан-3-ола получают 7,9 г (62,2%) R(-)-1-азабицикло[2.2.2]октан-3-ола и 8,1 г (63,8%) S(+)-1-азабицикло[2.2.2]октан-3-ола.
Цель патентуемой разработки: создание нового синтетического низкомолекулярного препарата, обладающего выраженным стимулирующим действием на систему противоопухолевого иммунитета, не уступающего, а по возможности превосходящего по эффективности современные отечественные и зарубежные препараты - иммуномодуляторы, которые являются природными высокомолекулярными биологически активными веществами, полученными с помощью методов генной инженерии.
Была проведена оценка токсической и биологической активности вещества I.
Оценка испытаний вещества I на острую токсичность.
Результаты проведенных испытаний показали отсутствие половых различий в чувствительности животных к токсическому действию вещества I. Категории доз острой токсичности препарата для мышей и крыс представлены в таблице 1.
В соответствии с табуляцией классов токсичности (Саноцкий И.В. Методы определения токсичности и опасности химических веществ (токсикометрия), М., 1970, стр.16) вещество I относится к классу «малотоксичных» веществ.
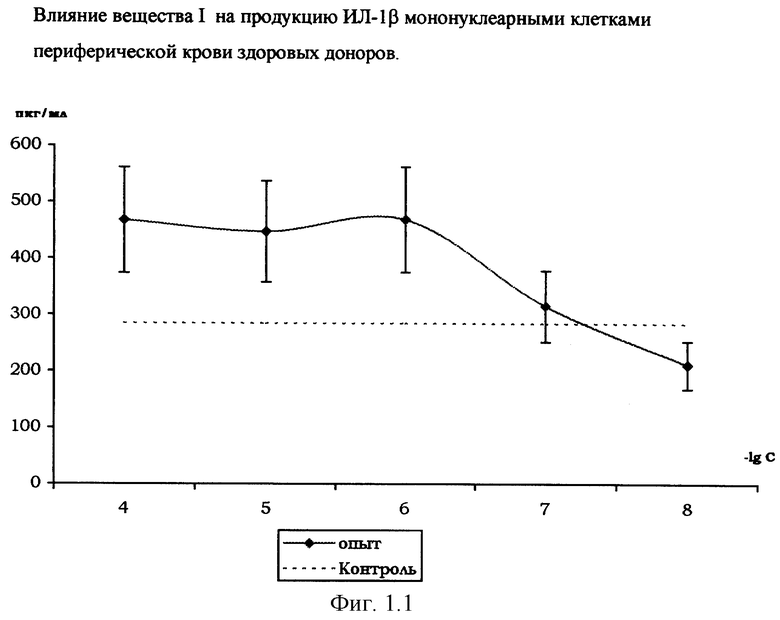
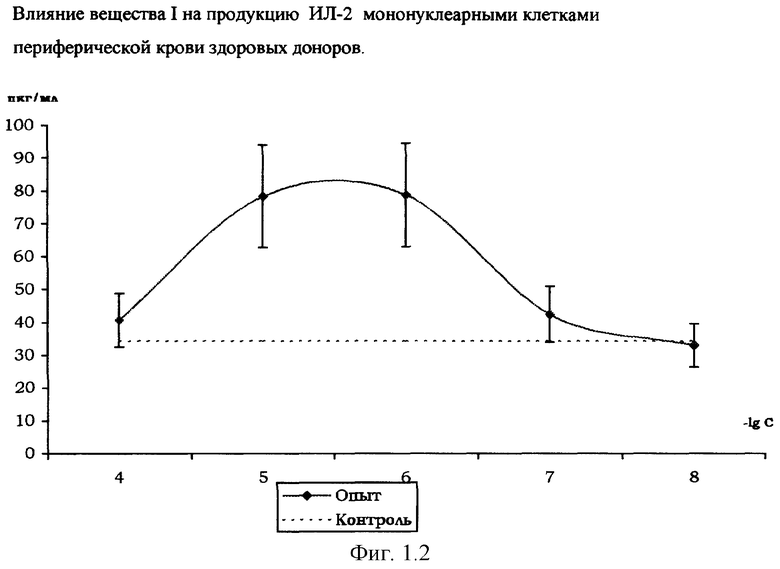
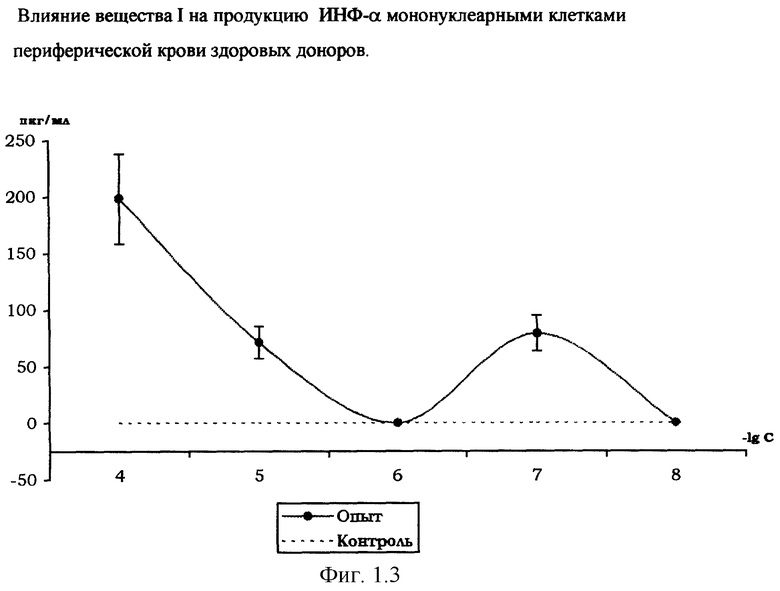
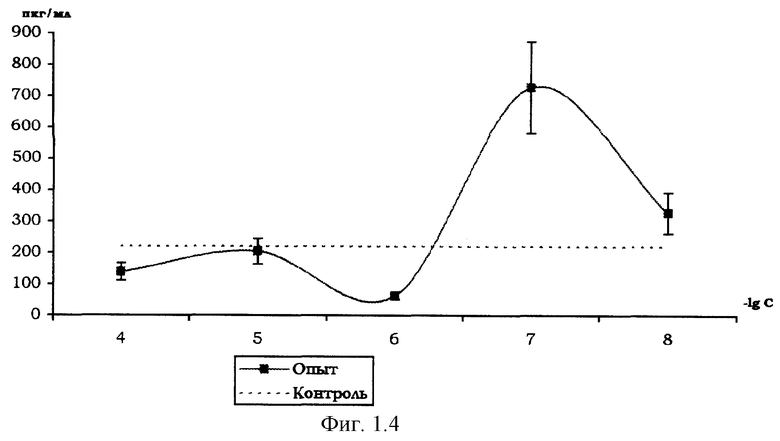
Влияние вещества I на продукцию цитокинов мононуклеарными клетками периферической крови здоровых доноров.
На фиг. 1.1., 1.2, 1.3 и 1.4 показано стимулирующее действие вещества I на продукцию цитокинов интерлейкина-1β (ИЛ-1β), интерферона-α (ИФН-α), интерлейкина-2 (ИЛ-2), фактора некроза опухоли (ФНО-α) мононуклеарными клетками здоровых доноров, выделенных из периферической крови согласно методике [Справочник. Лабораторные методы исследования в клинике. /Под ред. В.В.Меньшикова: Д.В.Белокриницкий «Методы клинической иммунологии». - М.: «Медицина», 1987. - с.307].
Количественное определение цитокинов в супернатанте мононуклеарных клеток, инкубированных с растворами вещества I (диапазон концентраций 10-4-10-8 М), по методике [Шпакова А.С., Павлова К.С., Булычева Т.И., ж. «Клиническая лабораторная диагностика», №2, 2000. - с.20-23], проводили с использованием твердофазного иммуноферментного метода с применением пероксидазы хрена в качестве индикаторного фермента [«Иммунология» под ред. У.Пола в 3-х т. - М., «Мир», 1989, т.3, гл. 28, с.260, Ed.W.Paul «Fundamental Immunology» - Raven Press, N.Y., 1984 ].
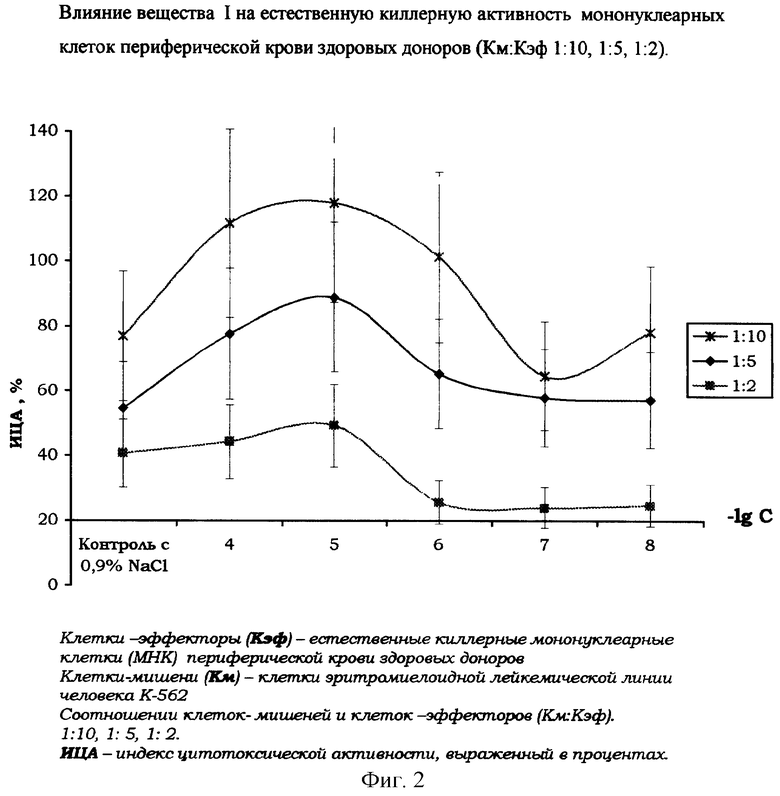
Соотношение клеток - мишеней и клеток - эффекторов 1:10, контроль - с добавлением физиологического раствора хлорида натрия (0,9% NaCl).
Количество выживших мышей с привитой опухолью Эрлиха.
Динамика роста опухоли у животных, леченных препаратом Пролейкин и веществом I, была достоверно меньше по сравнению с контрольной группой.
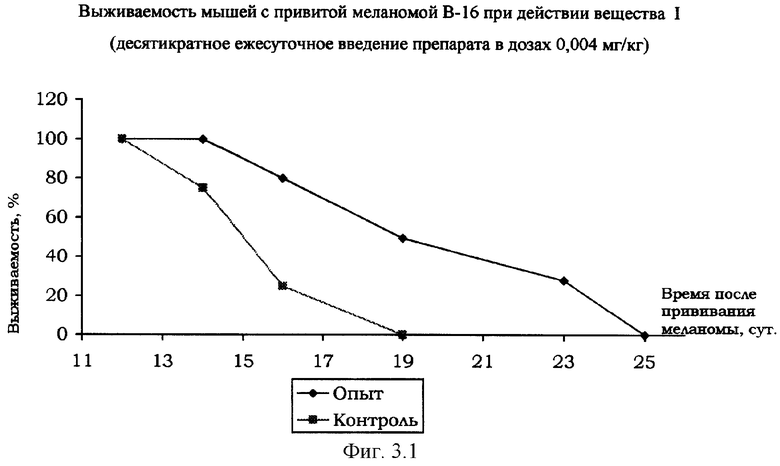
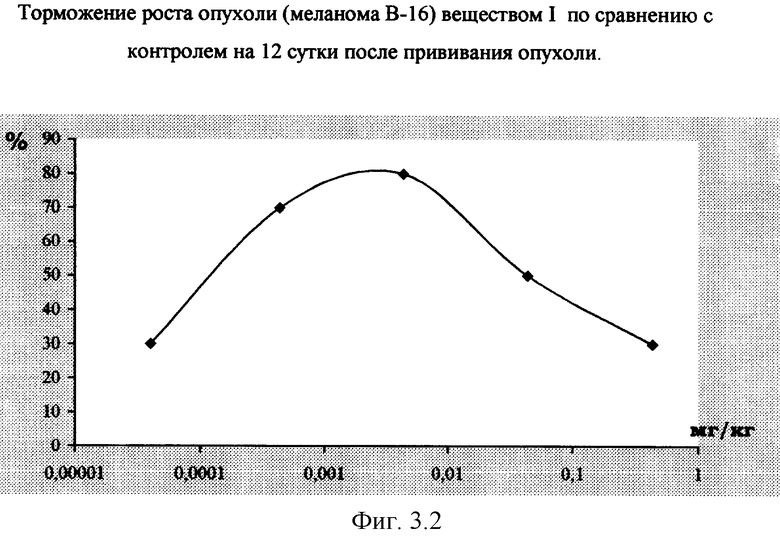
Вещество I оказывало тормозящее влияние на динамику роста опухоли меланомы В-16 у мышей гибридов F1 и увеличивал продолжительность их жизни. В частности, в дозе 0,005 мг/кг отмечено торможение опухолевого роста на 80%. Гибель животных в контрольной группе наступала на 19 сут., в то время как мыши, получавшие вещество I в указанной дозе, оставались живы до 25 сут. (см. фиг.3.1 и 3.2).
Таким образом, вещество I в дозах 0,05-0,005 мг/кг оказывает сходное цитостатическое действие по сравнению с препаратом Пролейкин при испытании на мышах с привитыми опухолями и вызывает стимуляцию противоопухолевого иммунитета.
Противоопухолевую активность также изучали на мышах-самцах линии СВА, которым подкожно перевивали аденокарциному яичников СаО-1. Опухоль была получена на потомстве мышей-самок линии СВА, которым во время беременности вводили эстрогены. Опухоль по гистологическому строению, клиническому течению и даже антигенному строению близка к раку яичника человека (БЭБиМ. - 2000 г., №129, стр.456-459). Опухолевые клетки перевивали в количестве 1 млн. клеток/ мышь.
Лечение осуществляли по схеме:
Мышам (30 штук) через 24 часа после перевивки опухолевых клеток начинали вводить разведенный в физиологическом растворе вещество I подкожно в 0.2 мл в нечетные дни (1-й, 3-й, 5-й и т.д.). Всего 7 введений. В контрольной группе животным вводили в этом же режиме физиологический раствор (растворитель препарата) (20 штук). Препарат вводили в трех дозах: 0,005 мг/кг, 0,05 мг/кг, 0,5 мг/кг.
Оценку действия препарата на рост опухоли проводили по регистрации различий в скорости роста опухоли. Расчет объема опухоли осуществляли по формуле:
V=ав2 (усл.ед).
Объем опухоли измеряли на 10,12 и 15 дни после перевивки. Результаты исследований представлены в таблице 3.
Общие характеристики животных и влияния вещества I на рост аденокарциномы яичников СаО-1.
раствор.
и 31.2
Вещество I замедляет рост аденокарциномы яичников СаО-1.
Торможение роста опухоли на 10-й день измерения составило 42%, 45%, 52%, на 12-й день 43%, 49%, 45%, а на 15-й день 32%, 42%, 40% для режимов 0,005 мг/кг, 0,05 мг/кг, 0,5 мг/кг соответственно. Данный эффект является пограничным эффектом для цитостатиков. Токсического действия препарата не обнаружено.
Приведенные выше примеры свидетельствуют о выраженной противоопухолевой активности вещества I
Изучение влияния вещества I на фагоцитарную активность нейтрофильных лейкоцитов крови здоровых доноров.
Данное исследование проводилось в 2 этапа: изучение влияния препарата на бактерицидную активность нейтрофилов и воздействие вещества I на способность нейтрофилов к захвату частиц латекса.
Для выделения нейтрофилов из венозной крови здорового донора получали лейкоконцентрат по методике [Медицинские лабораторные технологии и диагностика: Справочник. Медицинские лабораторные технологии/Под редакцией профессора А.И.Карпищенко. - Санкт-Петербург: Интермедика, 2002. - 408 с.]. Его разводили физиологическим раствором рН 7,2 до концентрации 5×104 лейкоцитарных клеток в 1 мкл. Полученную суспензию по 180 мкл разливали в лунки 24-х луночной плашки Falcon, получая, таким образом, 4 параллельных ряда по 6 лунок. Затем в лунки добавляли вещество I в различной концентрации действующего вещества (10-3-10-7 М) по 20 мкл, в последние в ряду лунки вносили 0,9% р-р хлорида натрия в качестве контроля.
Для изучения бактерицидной активности клеток вносили во все лунки по 10 мкл взвеси суточной агаровой дрожжевой культуры Saccharomyces cerevisiae (2×1011 кл/мл). Описанные манипуляции проводились с соблюдением условий стерильности.
Планшет с клетками термостатировали в течение 6 часов при 37°С. Далее удаляли пипеткой супернатант из лунок, из осадка готовили тонкие мазки, которые фиксировали в смеси Никифорова (5-10 мин) и окрашивали по Романовскому - Гимзе [В.С.Ронин, Г.М.Старобинец, Н.Л.Утевский/Руководство к практическим занятиям по методам клинических лабораторных исследований. - М.: Медицина, 1977, 335 с.].
Учет результатов проводили следующим образом: при микроскопировании окрашенных мазков учитывают 100 нейтрофилов, в которых подсчитывают количество клеток с признаками фагоцитоза.
Поглотительную способность фагоцитов оценивают с помощью фагоцитарного показателя. Фагоцитарный показатель (ФП) - процент фагоцитов из числа сосчитанных нейтрофилов.
Результаты исследований приведены в таблице 4.
Влияние на бактерицидную активность нейтрофилов крови человека вещества i
Из данных таблицы 4 следует, что совместная инкубация лейкоцитов с веществом I достоверно повышает способность нейтрофилов к поглощению микроорганизмов по сравнению с контролем.
Кроме того, было проведено исследование влияния изучаемого препарата на способность нейтрофилов к захвату опсонизированных частиц латекса. Для этого в лунки с фагоцитами, активированными изучаемым препаратом, вносили по 10 мкл взвеси опсонизированных частиц латекса в физиологическом растворе (концентрация частиц составляла 5000 в 1 мл). Фагоциты инкубировали с латексом в течение 8 ч. Результаты проведенного теста представлены в таблице 5.
Влияние вещества I на способность нейтрофилов фагоцитировать частицы латекса.
Из данных статистической обработки результатов таблиц 4 и 5 следует, что совместная инкубация лейкоцитов с веществом I в действующих концентрациях 10-4-10-5 М достоверно повышает фагоцитарную активность нейтрофилов, увеличивая ФП по сравнению с контролем.
Бактериостатическая активность вещества I
В проведенной серии экспериментов была исследована чувствительность к веществу I штаммов микроорганизмов, выделенных из патологического материала от больных (экссудат, транссудат, кровь, моча, содержимое толстого кишечника, раневое отделяемое, слизь из зева) в послеоперационный период, и с предметов, окружающих больного в этот период - из воздуха, с предметов ухода за больными, с перевязочного материала, смывы с рук (санитарная группа микроорганизмов).
Видовой состав используемых штаммов бактериальных культур определялся исходя из того, что до недавнего времени основной причиной возникновения инфекций у больных являлись грамотрицательные бактерии, в частности псевдомонады, кишечная палочка, а в настоящее время все возрастающую отрицательную роль играют грамположительные бактерии (мецитиллинрезистентные штаммы золотистого стафилококка, энтерококки и др.). Эти бактериальные штаммы характеризуются антибиотикорезистентностью к широкому спектру химиопрепаратов.
Бактериостатическое воздействие вещества I на рост штаммов микроорганизмов определяли согласно луночно - диффузной методике [В.S.Reisner, Gl. Woods, R.В.Thomson - Specium Processing in Manual of Clinical Microbiology - Washington, 1999, 64-104; Сидоренко С.В., Колупаев В.Е. - Антибиотикограмма: Диско-диффузионный метод. Интерпретация результатов. - 1999]
Бактериостатическая активность вещества I по отношению к микроорганизмам - возбудителям внутрибольничных инфекций (ВБИ) и микроорганизмам санитарной группы.
Вещество I характеризуется высокой бактериостатической активностью и широким спектром действия по отношению к большинству исследованных штаммов микроорганизмов.
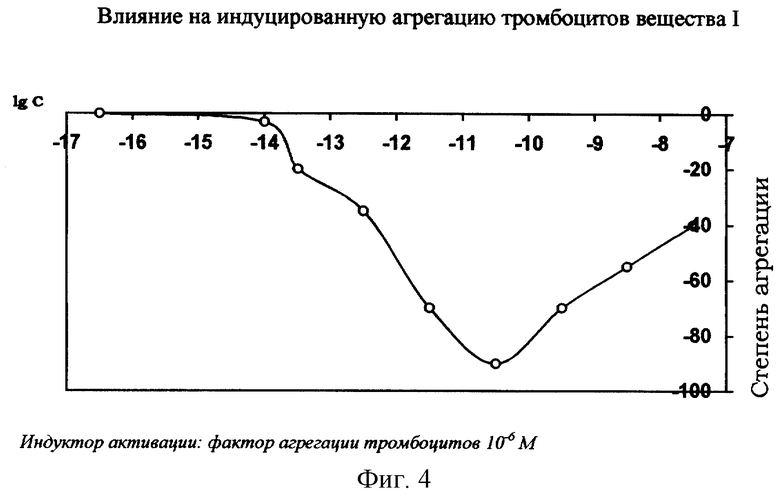
Антитромбоцитагрегирующее действие вещества I
Вещество I оказывает активное антитромбоцитагрегирующее действие. Оно снижает агрегацию, вызываемую адреналином, АДФ и практически на 100% тормозит агрегацию, индуцируемую фактором агрегации тромбоцитов (ФАТ) и тромбином (см. фиг.4). Индекс антитромбоцитагрегирующей активности вещества I по тромбину и ФАТ равен 1×10-11 М, что относит препарат к разряду активных антагонистов ФАТ.
Таким образом, к преимуществам вещества I можно отнести: высокую иммуномодулирующую и противоопухолевую активность, бактерицидное и антиагрегантное действие, низкую токсичность, высокую стабильность в водных растворах, простую технологию получения.
Результаты, представленные на фиг.1.1,1.2,1.3,1.4, свидетельствуют о стимулирующем влиянии вещества I на продукцию мононуклеарными клетками цитокинов ИЛ-1β, ИЛ-2, ИФН-α и ФНО-α, обладающих иммуномодулирующими и противоопухолевыми свойствами. Этот эффект выражен наиболее ярко при действующей концентрации вещества I в супернатанте в диапазоне 10-4-10-7 М.
Влияние вещества I на естественную киллерную активность мононуклеарных клеток периферической крови здоровых доноров.
На фиг. 2 показано стимулирующее влияние вещества I на естественную киллерную активность мононуклеарных клеток периферической крови здоровых доноров, выделенных согласно методике [«Справочник. Лабораторные методы исследования в клинике.» под ред. В.В.Меньшикова: Д.В.Белокриницкий «Методы клинической иммунологии». - М., «Медицина», 1987, с.307].
Количественное определение цитотоксической активности естественных киллерных клеток, инкубированных с растворами вещества I (диапазон концентраций 10-4-10-8 М) (контроль - с 0,9% NaCl), проводили с использованием МТТ-колориметрического теста по методике [Шпакова А.С., Павлова К.С., Булычева Т.И., ж. «Клиническая лабораторная диагностика», №2, 2000, с.20-23].
Наиболее оптимальные соотношения «опухолевая клетка/естественная киллерная клетка» - 1:10 и 1:5, при которых цитотоксическая активность МНК совместно инкубированных с тестируемым препаратом достигает наибольшего значения.
Максимальный, стабильно воспроизводимый эффект повышения противоопухолевой активности естественных киллеров отмечается при воздействии на МНК вещества I в диапазоне концентраций 10-4-10-6М.
Вещество I не оказывает прямого цитотоксического воздействия на изолированные мононуклеарные клетки крови и опухолевые клетки.
Изучение противоопухолевой активности вещества I
Исследование противоопухолевого эффекта проводили на мышах линии СВА и гибридах F1 весом 20-25 г. Животные содержались согласно «Правилам доклинических испытаний фармакологических препаратов» (PD 64-126-91).
Клетки опухоли Эрлиха вводили внутрибрюшинно (ip), а меланомы В 16 - подкожно (sc) в дозе 2 млн./мышь. Опытные и контрольные группы состояли из 6-10 животных. Контрольной группе вводили физиологический раствор. Действие тестируемых образцов сравнивали с эффектом препарата Пролейкин, Голландия (ИЛ-2). Наблюдение осуществлялось в течение 1 мес после трансплантации опухоли. Оценку состояния животных производили визуально. Динамику роста опухолевой массы оценивали по весу животных.
Изучение противоопухолевой активности вещества I в отношении опухоли Эрлиха проводили на мышах линии СВА в дозе 0,05 мг/кг, а Пролейкин в дозе 10000 МЕ/ мышь. Тестируемые вещества вводили за 3-е сут. до и на 1, 3, 5, 7, 10, 12, 14, 15, 17, 18 и 20 сут после трансплантации опухоли. В контрольной группе на 15-е сут осталась жива одна особь из 6. В группе мышей, получавших вещество I в указанной дозе, погибло 3 из 7 мышей. Среди животных, получавших Пролейкин к 20 сут. погибло 2 из 6 особей.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ БРОМИДА 1-ГЕКСАДЕЦИЛ-R(-)-3-ОКСИ-1-АЗОНИАБИЦИКЛО[2.2.2]ОКТАНА-ИММУНОМОДУЛЯТОРА С ПРОТИВООПУХОЛЕВЫМИ, БАКТЕРИОСТАТИЧЕСКИМИ И АНТИАГРЕГАНТНЫМИ СВОЙСТВАМИ | 2005 |
|
RU2321589C2 |
| ХИНУКЛИДИНОВЫЕ ПРОИЗВОДНЫЕ (ГЕТЕРО)АРИЛЦИКЛОГЕПТАНКАРБОНОВОЙ КИСЛОТЫ В КАЧЕСТВЕ АНТАГОНИСТОВ МУСКАРИНОВЫХ РЕЦЕПТОРОВ | 2007 |
|
RU2456286C2 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ ВИРУЛИЦИДНЫМ, БАКТЕРИЦИДНЫМ И ДЕЗИНФИЦИРУЮЩИМ ДЕЙСТВИЕМ | 2009 |
|
RU2403042C1 |
| КАРБАМАТЫ ХИНУКЛИДИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 2001 |
|
RU2296762C2 |
| АЗА-КОЛЬЦЕВОЕ СОЕДИНЕНИЕ С ВНУТРЕННИМ МОСТИКОМ | 2008 |
|
RU2441868C2 |
| ГЕМИНАПАДИЗИЛАТ 5-(2-{[6-(2,2-ДИФТОР-2-ФЕНИЛЭТОКСИ)ГЕКСИЛ]АМИНО}-1-ГИДРОКСИЭТИЛ)-8-ГИДРОКСИХИНОЛИН-2(1H)-ОНА КАК АГОНИСТ β2 АДРЕНЕРГИЧЕСКОГО РЕЦЕПТОРА | 2008 |
|
RU2495029C2 |
| (2S,3R)-N-(2-((3-ПИРИДИНИЛ)МЕТИЛ)-1-АЗАБИЦИКЛО[2.2.2]ОКТ-3-ИЛ)БЕНЗОФУРАН-2-КАРБОКСАМИД, НОВЫЕ СОЛЕВЫЕ ФОРМЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2008 |
|
RU2476220C2 |
| Хинуклидиновые эфиры 1-азагетероциклилуксусной кислоты в качестве антимускариновых средств, способ их получения и их лекарственные композиции | 2012 |
|
RU2628082C2 |
| Натриевая соль 4-{ 2-[2-(4-гидрокси-3-метоксифенил)-винил]-6-этил-4-оксо-5-фенил-4H-пиримидин-1-ил} -бензсульфамида, обладающая противоопухолевым действием | 2021 |
|
RU2763899C1 |
| КОМБИНАЦИИ, ВКЛЮЧАЮЩИЕ АНТИМУСКАРИНОВЫЕ АГЕНТЫ И КОРТИКОСТЕРОИДЫ | 2005 |
|
RU2385721C2 |
Изобретение относится к области фармакологии, медицины и органической химии и касается средства, проявляющего иммуномодулирующие, противоопухолевые, бактериостатические и антиагрегантные свойства, представляющего собой бромид 1-гексадецил-R-(-)-3-окси-1-азониабицикло[2.2.2]октана, и способа его получения путем кватернизации R-(-)-1-азабицикло [2.2.2]октан-3-ола бромистым гексадецилом при нагревании в органическом растворителе. Средство обладает низкой токсичностью, высокой эффективностью, не оказывает аллергезирующего действия и не обладает кумулятивным эффектом. 2 н.п. ф-лы, 4 ил., 6 табл.
| БРОМИД L-(-)-ЭНАНТИОМЕРА(ЭНДО,СИН)-(-)-3-(3-ОКСИ-1-ОКСО-2-ФЕНИЛПРОПОКСИ)-8-МЕТИЛ- 8-(1-МЕТИЛЭТИЛ)-8-АЗОНИ-АБИЦИКЛО[3.2.1]ОКТАНА С ЧИСТОТОЙ 90-100% И ИНГАЛЯЦИОННЫЙ ПРЕПАРАТ ДЛЯ ИНГИБИРОВАНИЯ БРОНХОСПАЗМА, ВЫЗВАННОГО АЦЕТИЛХОЛИНОМ | 1996 |
|
RU2171258C2 |
| ИММУНОМОДУЛЯТОР | 1993 |
|
RU2108100C1 |
| СПОСОБ ПОЛУЧЕНИЯ 3-ХИНУКЛИДИНИЛПРОПАНОАТОВ | 1990 |
|
RU2005721C1 |
Авторы
Даты
2007-04-10—Публикация
2005-04-28—Подача