Область техники, к которой относится изобретение
Настоящее изобретение относится к медицине и связано с мембраносвязанными рецепторами и их функцией; с расстройством познавательной способности и родственными состояниями; с их лечением; и с составами для применения в таком лечении. Более конкретно, но не эксклюзивно, изобретение связано с лечением состояний, которые характеризуются недостаточностью числа или функции мембраносвязанных рецепторов. В дальнейшем настоящее изобретение будет описываться в основном со ссылкой на лечение болезни Альцгеймера (AD) и старческого слабоумия по типу болезни Альцгеймера (SDAT), при которых была продемострирована недостаточность количества рецепторов. Однако следует понимать, что настоящее изобретение относится, как правило, к лечению состояний, отнесенных к наследственным патологическим состояниям, и/или к состояниям, вызванным неблагоприятным воздействием окружающей среды, причем эти состояния характеризуются недостаточностью числа или функции мембраносвязанных рецепторов или недостаточностью передачи сигнала на стыках между нейронами либо на стыках нейронов и эффекторных клеток.
Состояния упомянутого выше типа включают болезнь Паркинсона, слабоумие Lewi body, постуральную гипотензию, аутизм, синдром хронической усталости, тяжелую миастению, болезнь Ламберта Итона, заболевания и проблемы, связанные с синдромом войны в Заливе, профессиональным контактом с фосфорорганическими соединениями и проблемы, связанные со старением.
Уровень техники
Болезнь Альцгеймера (AD) и старческое слабоумие по типу болезни Альцгеймера (SDAT) являются серьезной и все возрастающей проблемой всех обществ, в которых благодаря увеличивающейся продолжительности жизни и контролю за приобретенными заболеваниями демографический показатель все больше сдвигается в направлении более старой популяции. Агенты, которые могут лечить или помогать в ведении AD и SDAT, крайне необходимы.
Нарушение памяти, связанное с возрастом (AAMI), характерно для пациентов старческого возраста, которые, будучи психологически и физически нормальными, жалуются на потерю памяти. Это плохо выявляемый синдром, однако агенты, которые являются эффективными в лечении AD и SDAT, могут также оказаться полезными для этих пациентов.
Исследования по AD и SDAT проводятся с помощью традиционных и общеизвестных методов медицинских исследований. В традиционной медицине существует несколько подходов к лечению AD и SDAT. Известно, что биохимические процессы в коре головного мозга, содействующие запоминанию, являются (по крайней мере, частично) холинергически опосредованными. Специалисты в этой области знают, что "холинергически опосредованные" механизмы могут быть отнесены непосредственно к действию ацетилхолина на рецепторы, и в этом случае эффекты являются прямыми. Другие полезные с клинической точки зрения эффекты могут также быть вызваны путем модуляции высвобождения ацетилхолина из пресинаптических нервных окончаний или ингибирования ферментов, которые разрушают ацетилхолин. Эти модулирующие факторы могут действовать через нейроны, где медиатор не является холинергическим; в этом случае эффекты считаются непрямыми. Некоторые попытки лечения были сосредоточены на роли других медиаторов, таких, как 5-гидрокситриптамин, который является медиатором в другой области мозга, такой, как ядра среднего мозга. Однако поскольку нервные волокна из этих областей выходят в кору головного мозга, где первичным переносчиком является ацетилхолин, то в ходе поиска соответствующих терапевтических агентов внимание было сосредоточено на ведении именно этого медиатора.
Холинергические стратегии лечения AD и SDAT направлены на несколько точек наряду с метаболическим путем образования, высвобождения из синапсов и удаления высвобожденного ацетилхолина.
Один подход включает лечение высокими дозами лецитина и других предшественников ацетилхолина. Это имеет ограниченное применение в достижении устойчивых улучшений познавательного процесса.
Другой подход включает применение растительных препаратов, таких, как экстракт корня Polygalae, который, как было показано, усиливает в мозге холин-ацетилхолинтрансферазную (CAT) активность и секрецию фактора роста нерва (NGF). Пероральное введение NGF не оказывает эффекта на нейроны центральной нервной системы потому, что он представляет собой белок с высокой молекулярной массой, который не проходит через гемато-энцефалический барьер. Однако для улучшения памяти были предложены агенты, которые могут проникать через гемато-энцефалический барьер и оказывают стимулирующее воздействие на синтез NGF в центральной нервной системе.
Результаты третьего клинического подхода, при котором используют ингибиторы холинэстеразы, такие, как гидрохлорид такрина, были лишь минимально более позитивны, чем описаные выше. Вещества, полученные из растений, применяемых в китайской и западной медицине, например хуперзин, галантамин и физостигмин, как было показано, все приносят некоторую, хотя и ограниченную, пользу при лечении AD и SDAT в ходе клинических испытаний, а также на лабораторных моделях. Все эти вещества являются ингибиторами ацетилхолинэстеразы (AChE). У пациентов с AD и SDAT может быть снижен синтез ацетилхолина (ACh), снижена эффективность высвобождения ACh из пресинаптических отложений и снижены число или функция постсинаптических рецепторов (M1). Показано также снижение в пресинаптических рецепторах М2. Полезный эффект ингибиторов ацетилхолинэстеразы связан с повышением уровней ацетилхолина в синапсах мозга путем замедления деструкции секретированного переносчика.
Известно, что составы, которые модулируют холинергическую функцию, воздействуют на запоминание и воспроизведение. Например, никотин стимулирует никотиновые ацетилхолиновые рецепторы, и считается, что эффекты усиления короткой памяти при курении сигареты связаны с действием никотина. Скополамин, антагонист ацетилхолина, будет приводить к амнезии и нарушенной познавательной функции в психомоторных тестах в виде удлинения времени простого ответа, возможно, в результате нарушенного внимания и применяется для этой цели в качестве вспомогательной анальгезирующей обработки. При амнезическом эффекте скополамина антагонистом может служить никотин.
Существуют два семейства подтипов никотиновых рецепторов (α и β), и каждый включает четыре подгруппы, которые отличаются по лигандной специфичности. Роль никотиновых рецепторов в центральной нервной системе (CNS) на молекулярном уровне выяснена недостаточно. Возможно, что агенты, связывающиеся с никотиновыми рецепторами, могут модифицировать скорость обращения на сайтах мускариновых рецепторов мозга. Никотиновые рецепторы являются закрытыми для лиганда ионными каналами, и их активация вызывает быстрое (миллисекундное) усиление клеточной проницаемости ионов натрия и кальция, деполяризации и возбуждения.
Другой класс холинергических рецепторов может стимулироваться мускарином. Такие мускариновые рецепторы (M) представляют собой рецепторы, сопряженные с G-белком. Ответ мускариновых рецепторов замедлен; они могут быть возбудительными или ингибиторными. Они необязательно связаны с изменениями в ионной проницаемости.
Пять типов мускариновых рецепторов были определены путем клонирования холинергического рецептора и обозначены как m1-m5. Фармакологические эффекты связывают с четырьмя из клонированных рецепторов, и в зависимости от фармакологической специфичности они обозначаются как M1-M4.
Используя специфические рецепторные белки и моноклональные антитела, стало возможным осуществить дальнейшую локализацию мускариновых рецепторов мозга в виде m1 (постсинаптический) и m2 (пресинаптический). В сердце рецепторы М2 являются постсинаптическими. Считается, что пресинаптические мускариновые рецепторы являются ингибиторными, причем связывание ацетилхолина с этими рецепторами ослабляет дальнейшее высвобождение ацетилхолина, обеспечивая механизм отрицательной обратной связи для его высвобождения. Поэтому селективные антагонисты рецептора M2, локализованные преимущественно в мозге, могут применяться для лечения болезни Альцгеймера.
Известно, что при болезненных состояниях, таких, как AD и SDAT, наблюдается генерализованная потеря нейронов и недостаточность холинергической функции нерва. Было высказано предположение о том, что в оставшихся холинергических нервных клетках связывающие сайты с высоким сродством к никотину в ходе лечения таких заболеваний могут быть превращены в связывающие сайты с низким сродством, поддерживая тем самым секрецию переносчика. При снижении сродства никотиновых связывающих сайтов процесс быстрой десенсибилизации исключается.
Агонистическая активация никотиновых рецепторов мозга имеет быстрое начало и окончание. Пониженное сродство никотиновых рецепторов будет ослаблять процесс десенсибилизации. Schwarz R,D. и др. [J. Neurochem., 42, 1495-1498 (1984)] показали, что никотиновые связывающие сайты локализованы пресинаптически на холинергических (и также 5-гидрокситриптаминергических и катехоламинергических) окончаниях аксонов.
Изменение в сайтах с высоким сродством при AD и SDAT может также вызвать изменение модулирующего эффекта, который никотиновые связывающие сайты могут оказывать на системы других переносчиков.
Пресинаптические холинергические механизмы находятся также под ингибиторным контролем GABA(γ-аминомасляная кислота)ергических нейронов, и считается, что это ингибирование усиливается при AD и SDAT. Исключение или снижение этого ингибирования повышает пресинаптическую кортикальную холинергическую активность и усиливает познавательную способность.
Взаимодействие межнейронных волокон, иннервированых никотином (снижение связывающего сродства), и дезингибирование GABAергических волокон, - оба имеют пресинаптический локус.
Это упрощенная модель центрального пути передачи, но она обеспечивает основу для понимания попыток, которые были сделаны для того, чтобы повысить эффективную концентрацию ацетилхолина в центральных синапсах. Это дополнительно иллюстрирует концепцию прямого и непрямого действия. Имеются недостатки, связанные с тремя упомянутыми выше общеизвестными терапевтическими подходами к лечению AD и SDAT: добавление ацетилхолинового предшественника, замена агониста и ингибирование ацетилхолинэстеразы. Такая терапия может привести к кратковременному повышению доступности ацетилхолина, который может активировать механизмы обратной связи, приводящие к десенсибилизации постсинаптических рецепторов. На основании теории долгосрочный положительный эффект непредсказуем, а после прекращения лечения все положительные эффекты в ведении AD, SDAT и AAMI исчезают и состояние может даже ухудшиться.
Было показано, что соединение с агонистической активностью в отношении M1 и антагонистической активностью в отношении М2/М3 улучшает познавательную способность у пациентов с SDAT (Sramak et al. Life Science, 2, No. 3, 195-202, 1997). Однако это соединение вызывает неприемлемые холинергические побочные эффекты, такие, как утомляемость, диаррея и рвота.
Более радикальный подход к AD, SDAT и AAMI направлен на увеличение в мозге числа постсинаптических рецепторов (M1). Из данных патента Китая 1096031 А следует, что сарсасапогенин (SaG) способен увеличивать уровень холинергических рецепторов (MI) и также уменьшать (т.е. сдвигать в сторону нормальных уровней) уровень β-адренергических рецепторов, число которых может патологически увеличиваться при AD и SDAT.
Сущность изобретения
Заявители нашли ряд сапонинов и сапогенинов, которые обладают способностью регулировать рецепторы. Таким образом, в соответствии с одним аспектом изобретения обеспечивается применение одного или нескольких соединений из группы, состоящей из смилагенина, анзурогенина D и астрагалозида, в производстве препарата для лечения состояния, характеризующегося недостаточностью числа или функции постсинаптических мембраносвязанных рецепторов.
Специалисты будут отдавать себе отчет о взаимосвязи между сапонинами и соответствующими сапогенинами и о том, что желаемые эффекты сапогенинов могут быть достигнуты у пациентов путем введения соответствующих сапонинов или их смесей. В желудочно-кишечном тракте происходит гидролиз, по меньшей мере, части сапонина. Специалист будет также иметь в виду эпимеризацию некоторых сапогенинов в условиях кислотного гидролиза.
Не все сапонины и/или их агликоны пригодны для лечения AD и SDAT, a некоторые, такие, как сапонины и сапогенины из дигиталиса, оказывают сильное инотропное действие на миокард. Эта группа сапонинов, по-видимому, не оказывает воздействия на центральную нервную систему (CNS), которое служило бы прогностическим показателем для терапевтического применения при AD и SDAT; их эффективность и токсичность при высоких дозах также исключают это.
Некоторые из основных сапогенинов имеют следующую общую формулу:
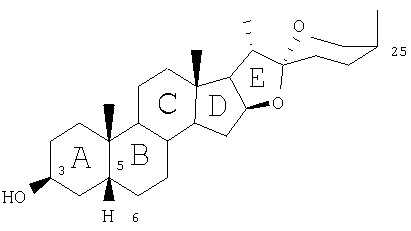
Со ссылкой на эту формулу структура некоторых сапогенинов приведена ниже в таблице 1.
Отличие в фармакологических свойствах и фармакодинамических характеристиках различных типов сапогенинов усиливает необходимость отбора тех агентов, которые наиболее полезны в лечении AD и SDAT. Открытие новых данных о действии SaG позволило определить, какое из веществ наиболее полезно в лечении AD и SDAT и подобных им состояний.
Сапонины и сапогенины, представляющие основной интерес по некоторым аспектам настоящего изобретения, существуют в природе в разнообразных образцах растений, особенно видов Smilax, Asparagus, Anemarrhena. Yucca и Agave. Образцы, представляющие в настоящее время самый большой интерес, включают Smilax regelii от Kilip & Morton, общеизвестна как гондурасская сарсапарель; Smilax aristolochiaefolia от Miller, общеизвестна как мексиканская сарсапарель; Smilax ornata от Hooker, общеизвестна как ямайская сарсапарель; Smilax aspera, общеизвестна как испанская сарсапарель; Smilax glabra от Roxburgh; Smilax febrifuga от Kunth, общеизвестна как эквадорская или перуанская сарсапарель; Anemarrhena asphodeloides от Bunge; Yucca schidigera от Roezi & Ortgies; и Yucca brevifolia от Engelm. Сапонины и сапогенины, которые могут представить интерес, существуют в природе и в других видах, например, Dioscorea, Trillium, Solanum, Strophanthus. Digitalis и Trigonella. Как указано выше, некоторые сапонины и сапогенины из этих источников обладают нежелательными свойствами и поэтому не рекомендуются для применения по изобретению.
В соответствии с дальнейшим аспектом настоящего изобретения обеспечивается фармацевтический состав, обладающий свойствами улучшения познавательной способности и включающий эффективное количество сапонина или сапогенина. Сапонин или сапогенин является предпочтительно стероидным сапонином или сапогенином. Такой состав предпочтительно включает эффективное количество неэстрогенного сапонина или сапогенина.
В другом аспекте настоящее изобретение обеспечивает фармацевтический состав, обладающий свойствами улучшения познавательной способности и включающий эффективное количество сапонина или сапогенина (предпочтительно неэстрогенного сапонина или сапогенина) в виде экстракта, полученного из растений видов Smilax. Asparagus, Anemarrhena, Yucca или Agave.
Изобретение обеспечивает дополнительно применение экстракта растения видов Smilax, Asparagus. Anemarrhena, Yucca или Agave при получении препарата, обладающего свойством улучшать познавательную способность.
Будет признано, что изобретение охватывает область применения составов, описанную выше. Так, в соответствии с пятым аспектом настоящее изобретение обеспечивает способ улучшения познавательной способности, который включает введение человеку или животному эффективной дозы состава по изобретению.
Изобретение обеспечивает также способ улучшения познавательной способности у человека и иного, чем человек, млекопитающего, который включает введение эффективной дозы сапонина или сапогенина, предпочтительно неэстрогенного сапонина или сапогенина.
Термин "познавательная способность", как он использован в данном изобретении, означает такие функции, как мышление, обоснование, вспоминание, воображение и обучаемость.
Таким образом, в седьмом аспекте изобретения обеспечивается применение одного или нескольких веществ из группы, состоящей из смилагенина, празеригенина, астрагалозида, тигогенина, рускогенина, гекогенина и диосгенина, в производстве препарата для лечения состояния, характеризующегося недостаточностью числа или функции постсинаптических мембраносвязанных рецепторов.
Заявители также нашли, что при сочетании сарсасапогенина с некоторыми другими сапогенинами наблюдается синергизм.
Таким образом, в восьмом аспекте изобретения обеспечивается состав для лечения состояния, характеризующегося недостаточностью числа или функции постсинаптических мембраносвязанных рецепторов, состав, включающий, по меньшей мере, два вещества из группы, состоящей из смилагенина, празеригенина, астрагалозида, тигогенина, рускогенина, гекогенина и диосгенина.
Вещества, используемые по седьмому и восьмому аспектам изобретения, не должны обладать выраженной эстрогенной, и/или андрогенной, и/или анаболической активностью у пациентов. Тем не менее, в некоторых вариантах осуществления изобретения дополнительно наблюдается низкий уровень эстрогенной и/или андрогенной активности.
В соответствии с девятым аспектом настоящего изобретения обеспечивается способ лечения состояния, которое характеризуется недостаточностью числа или функции мембраносвязанных рецепторов в ткани, органе, типе клеток или органелл, способ, включающий: модуляцию, прямую или непрямую, действия цитозольного, ядерного или мембраносвязанного белка или рецептора, которая, когда рецептор активируется путем связывания с его агонистом или когда активность рецептора промотируется путем дезактивации его антагониста, регулирует с повышением и/или нормализует число и/или оборот мембраносвязанных рецепторов в той самой ткани, органе, типе клеток или органелл.
Неожиданно заявители обнаружили, что радиоактивно меченный SaG концентрируется в ядрах клеток мозга, выделенных от крыс, и что уровни мРНК рецептора М повышаются у крыс, обработанных SaG. Не углубляясь в теорию, заявители полагают, что SaG проявляет эффекты, описанные в патенте Китая 1096031 А, модулируя экспрессию ДНК.
Одно из возможных объяснений по данному изобретению состоит в том, что SaG является внутриклеточным агонистом стероидного рецептора, возможно эстрогенного рецептора, или фактором транскрипции либо промотором. Имеются сходства в химической структуре стероидов и SaG, и поэтому возможно, что механизм транспорта из цитоплазмы в ядро для SaG такой же, как и для стероидов. Таким образом, после прохождения через клеточную мембрану SaG связывается со стероидным рецептором, присутствующим в цитоплазме, и промотирует конформационное превращение рецептора таким образом, что ядерный комплекс, обладающий высоким сродством, доставляется в сайт ответа на комплексе ДНК-белок. Там он усиливает транскрипцию мРНК, которая мигрирует из ядра в рибосому, что приводит к усиленному образованию мускариновых рецепторов.
Вторая возможность состоит в том, что SaG является агонистом неизвестного рецептора, действие которого вызывает усиление экспрессии мРНК путем связывания с комплексом ДНК-белок в ядре и выполнения функции промотора.
В другом варианте связывание комплекса SaG-рецептор с ДНК может вызывать усиление экспрессии мРНК, которая кодирует холинергические рецепторы, допаминергические рецепторы или адренергические рецепторы либо мембраносвязанные рецепторы.
В качестве альтернативы связывание комплекса SaG-рецептор с ДНК может вызывать усиление образования сцепленных белков, таких, как G-белок; или препятствовать их деградации; или более позднее образование связи между такими белками и ассоциированными рецепторами, вызывая тем самым вторичные изменения числа рецепторов.
Эффекты SaG могут быть опосредованы через увеличение уровней одного или нескольких нейротропных факторов, например, фактора роста нерва (NGF).
Известно также, что, помимо нервных и холинергически опосредованных синаптических механизмов существует вероятность, что такие вещества, как оксид азота (NO) и нехолинергические агонисты, могут оказывать модулирующее действие на холинергическую передачу.
Какова бы ни была точная природа компонента клетки, с которым связывается SaG для того, чтобы проявить свои эффекты, это обеспечивает новое направление, на которое может быть нацелено потенциальное лечение AD, SDAT, AAMI и подобных заболеваний.
Было показано, что SaG повышает уровни мРНК мембраносвязанного рецептора, в частности, мРНК рецептора m1. Поэтому возможно, что цитозольный или ядерный рецептор или промотор при активации усиливает образование мРНК, которая кодирует мембраносвязанные рецепторы, в ткани, органе, типе клеток или органелл или уменьшает распад мРНК, которая кодирует мембраносвязанные рецепторы, в ткани, органе, типе клеток или органелл.
Цитозольный или ядерный рецептор при активации может также усилить транскрипцию мРНК, которая кодирует мембраносвязанные рецепторы, в ткани, органе, типе клеток и органелл.
Как упомянуто выше, никотиновые рецепторы могут модулировать число и/или оборот мембраносвязанных рецепторов. Соответственно в одном из воплощений изобретения действие цитозольного или ядерного рецептора модулируют путем введения вещества, которое является, по меньшей мере, частичным агонистом никотиновых рецепторов.
В настоящее время предпочтительно, чтобы действие цитозольного или ядерного рецептора модулировалось путем введения вещества, которое является, по меньшей мере, их частичным агонистом.
Агонистом может быть сапонин или сапогенин, предпочтительно один или несколько, из группы, включающей сарасасапогенин, смилагенин, празеригенин, астрагалозид, тигогенин, рускогенин, гекогенин и диосгенин. Эти соединения не должны иметь выраженной эстрогенной и/или андрогенной и/или анаболической активности у пациентов. Низкий уровень дополнительной эстрогенной и/или андрогенной активности может оказаться полезным в способе по девятому аспекту настоящего изобретения.
Рецептор может находиться в цитозоле клеток ткани, органа, группы клеток или органелл и при активации путем связывания агониста мигрировать в ядра клеток. Возможно также, что рецептор находится в ядрах клеток ткани, органа, группы клеток или органелл, причем агонист диффундирует в ядра или переносится в них с помощью другого механизма.
В способе по первому аспекту настоящего изобретения для введенного вещества несущественно, действует ли оно непосредственно на цитозоль или на сам рецептор. Взамен действие может происходить или против хода, или по ходу включения цитозольного или ядерного рецептора или промотора в метаболический путь. Таким образом, действие цитозольного или ядерного рецептора может модулироваться путем введения вещества, которое усиливает экспрессию мРНК, которая кодирует мембраносвязанные рецепторы, в ткани, органе, группе клеток или органелл.
Роль эстрогенов и родственных соединений в возможном лечении SDAT вызвала значительный интерес. В исследованиях, проводимых с целью изучения влияния холинэстеразного ингибитора такрина на познавательную способность у пациентов с SDAT вторичный анализ, позволил предположить, что все улучшения наблюдались у пациентов женского пола, которые получали также гормональную (эстрогенную) заместительную терапию (ERT). На основании эпидемиологических данных предполагается также, что ERT может защищать от развития SDAT. Проводится интенсивное исследование на крысах, которое позволяет предположить, что овариэктомия приводит к снижению познавательной способности и что этот эффект может быть обращен, по меньшей мере, у части животных путем введения эстрогена. Эффекты эстрогена на этой модели могут усилить усвоение холина в некоторых областях мозга с высоким сродством к нему, улучшая тем самым холинергическую передачу. На той же самой модели с использованием соответствующей методики гибридизации in situ (Singh, 1995) было показано, что введение эстрогена повышает уровни мРНК для полученного из мозга нейротропного фактора (BDNF).
Возможные механизмы после воздействия эстрогена были исследованы в экспериментах in vitro. Эти исследования проведены с использованием линии клеток нейробластомы и ответа клеток на исключение сыворотки или эффекты β-амилодных (ВА) фракций. Считается, что последний раздражитель является особенно актуальным из-за заметных амилоидных бляшек на поздних стадиях SDAT. Как исключение сыворотки, так и ВА индуцируют гибель клеток. Было показано, что 17β-эстрадиол защищает клетки от гибели, индуцированной исключением сыворотки и ВА. Защитный эффект не исчезал, когда Прэстрадиол тестировали в присутствии эстрогенового антагониста тамоксифена. Неэстрогенный энантиомер 17α-эстрадиол был также эффективен в подавлении гибели клеток. Последующее исследование позволило допустить, что защитные эффекты этих соединений зависят от присутствия полностью ненасыщенного фенольного кольца А и свободной гидроксильной группы в третьем положении (Simpkins, 1997; Green, 1997). Было показано, что в культурах клеток нейробластомы эстрогены усиливают секрецию фактора роста нерва. Связь этих фактов с эффектами эстрогенов при SDAT остается неясной.
Опубликованы заявки на патенты, которые раскрывают применимость ряда стероидных сапогенинов, имеющих спиростановую, фуроспиростановую, спиросолановую или соланидиновую структуру, для лечения заболеваний, включая SDAT. Две патентных публикации особенно важны для данного изобретения: патент Китая 1096031 А заявляет применение спиростанового сапогенина, сарсасапогенина для лечения SDAT. Однако документ раскрывает это в краткой форме. Другим важным документом является публикация патента Германии 4303214 А1, который раскрывает применение самых разнообразных сапонинов и сапогенинов для лечения широкого спектра заболеваний, которые, по мнению заявителей, имеют вирусное происхождение. Однако такое раскрытие имеет сомнительную ценность, поскольку хорошо известно, что в очень большом количестве состояний, характеризующихся недостаточностью синаптической передачи, нет никакого элемента инфекционности, и, следовательно основная предпосылка заявленного изобретения ошибочна. Кроме того, в нем не представлены никакие данные, позволяющие специалисту выбрать предпочтительное соединение из большого числа заявленных.
При идентификации соединений, которые могли бы оказаться полезными в лечении SDAT и других заболеваний, характеризующихся снижением числа рецепторов или синаптической передачи, заявители учитывали необходимость идентификации таких соединений, которые могли бы оказать желаемое воздействие, но при этом были бы лишены каких-либо эстрогенных свойств, поскольку они были бы неприемлемы, особенно в случае пациентов мужского пола. Ряд соединений, заявленных как активные в публикации патента Германии 43032140 А1, имеют выраженную эстрогенную активность и поэтому являются неприемлемыми. Эти данные представлены ниже в таблице 2.
Кроме того, эти соединения тестировались на других стероидных рецепторах, поскольку считалось, что для применения в клинике соединения не должны действовать на другие стероидные рецепторы. Ни одно из соединений не проявило никакой активности ни на одном из следующих рецепторов: прогестероновые, глюкокортикоидные, тестостероновые. Таким образом, было показано, что соединения, не действующие на эстрогенные рецепторы, не действовали также и на другие важные стероидные рецепторы.
Активность отобранных соединений изучена также в ряде тестов in vitro. Анализы/эксперименты, которые рассматривались как имеющие ключевое значение при определении возможной активности в отношении увеличения числа мембраносвязанных рецепторов, были следующие.
1. Клетки яичника китайского хомяка (СНО), трансфицированные фрагментом ДНК, кодирующим мускариновый рецептор. Клеточная линия, использованная в большинстве экспериментов, экспрессировала рецептор m2.
2. Эффекты экспрессии мускаринового рецептора исследовали в культивированной клеточной линии, происходящей от нервных клеток.
3. Культивированные клетки сердечной мышцы, полученные от новорожденных крыс линии Sprague Dawley. Клетки сердечной мышцы экспрессировали мускариновые рецепторы, обычно m2. Уровень этих рецепторов падает на продленной культуре, в связи с чем исследовали влияние соединений, представляющих интерес, на предотвращение уменьшения числа рецепторов.
Методы и результаты этих экспериментов описываются теперь по порядку.
1. Эксперименты с линией клеток СНО
Исследовали влияние различных соединений на экспрессию рецепторов m2 в клетках СНО, трансфицированных ДНК для рецепторов m2. Количество рецепторов анализировали, используя меченный тритием QNB (3-хинуклидинилбензилат) и вычитая величину, характеризующую неспецифическое связывание. Соединения растворяли в DMSO (диметилсульфоксиде) и в качестве контроля использовали тот же растворитель. Соединения тестировали в интервале конечных концентраций. Соединения тестировали также в присутствии и в отсутствие тамоксифена для того, чтобы выделить механизм, опосредованный эстрогеновым рецептором. Результаты суммированы ниже в таблице 3.
NS - нет значительного эффекта
Таким образом, эксперименты показывают, что некоторые из соединений способны увеличить число мускариновых рецепторов, экспрессируемых на поверхности клеток СНО, культивированных in vitro. Эффект не был антагонистическим по отношению к тамоксифену, свидетельствуя о том, что действующий механизм не включал эстрогеновый рецептор. В отличие от работы, опубликованной Simpkin и др., было найдено, что присутствие интактного фенольного кольца А не является необходимым. Также ряд соединений, являющихся стероидными сапогенинами, были лишены активности. Кроме того, дополнительные эксперименты указывали на то, что β-эстрадиол оказывал подобное действие на усиление экспрессии рецепторов при введении в концентрации 10-5 М.
2. Влияние соединений на выживаемость клеток
Для выявления различия между активными и неактивными соединениями использовали другие методы анализа in vitro. В частности, различные линии клеток нейробластомы, включая клетки SKN-SN и SH-SY5Y, а также клеточные линии феохромоцитомы, культивировали in vitro в присутствии β-амилоидных фрагментов или в отстутствие сыворотки. Для демонстрации эффективности соединений в защите клеточных линий исследовали ряд методик. Эти методики включали исключение трипанового синего, хемилюминисценцию и секрецию лактатдегидрогеназы. Наибольший интерес представило наблюдение того факта, что при инкубации клеток, в частности клеток PC 12, с β-амилоидом уменьшалось число мускариновых рецепторов, измеренное с помощью методики связывания меченного радиоактивным изотопом лиганда. Было обнаружено, что это снижение числа рецепторов уменьшалось в присутствии активных соединений.
3. Влияние соединений на культивированные клетки сердечной мышцы
Клетки сердечной мышцы выделяли из вентрикулярной мышцы новорожденных крыс линии Sprague Dawley, используя стандартные методики. Клетки культивировали in vitro, и количество мускариновых рецепторов, экспрессированных на клеточных поверхностях мембранных фрагментов, после гомогенизации выращенных клеток в различные промежутки времени определяли с использованием специфического связывания меченного тритием QNB. Предварительные эксперименты показали, что количество экспрессированных рецепторов имеет тенденцию к снижению после 10 дней культивирования. Поэтому эксперименты проводили таким образом, чтобы исследовать влияние различных соединений на подавление этого снижения числа рецепторов. Результаты этих экспериментов суммированы в таблице 4.
Таблица 4
Влияние различных соединений на экспрессию мускариновых рецепторов в культивированных клетках сердечной мышцы
NS - нет значительного эффекта
Неожиданно заявители обнаружили, что сапогенины концентрируются предпочтительно в ядрах клеток, культивированных in vitro. Это вызывает удивление, поскольку, как обсуждалось выше, сарсасапогенин (SaG) и некоторые другие соединения, которые, как было показано, увеличивают число мускариновых рецепторов, не связываются с известными стероидными рецепторами. Кроме того, вызывает удивление, что SaG поглощается предпочтительно ядрами, поскольку эффекты этих соединений могут проявляться в аналитических системах in vitro, которые экспрессируют мускариновый рецептор, но в которых ДНК рецептора трансфицирована в цитоплазму и, следовательно, не находится под контролем нормального ядерного механизма.
Было показано, что SaG и другие соединения, которые исследовались и, как оказалось, регулируют уровни рецепторов в сторону увеличения, не связываются непосредственно ни с одним из большинства известных классов мембраносвязанных рецепторов. Таким образом, было предположено, что наблюдаемые эффекты, вероятно, не объясняются, например, действием на никотиновый рецептор и логически вытекающим отсюда увеличением числа мускариновых рецепторов. Это объяснение, по-видимому, даже менее правдоподобно (хотя и не может быть исключено), если учесть, что некоторые из соединений, как также было показано заявителями, увеличивают число β-адренергических рецепторов, экспрессированных на лимфоцитах периферической крови. Таким образом, потенциальным механизмом является такой, который обеспечивает более общее воздействие на регуляцию мембраносвязанных рецепторов.
Предполагается, что эффект активных соединений, заявленных в данном патенте, может проявляться через воздействие на G-белок и что влияние на уровень рецепторов является вторичным по отношению к воздействию на G-белок. Когда мембраносвязанный сцепленный с G-белком рецептор стимулируется, происходят два вида событий: эффекторный ответ и интернализация (поглощение) рецептора. Последующий переход рецептора в состояние, когда он снова становится частью клеточной поверхности или другой мембранной поверхности, где он может взаимодействовать с другим рецепторным лигандом, по-видимому, зависит от множества факторов. Некоторые из этих факторов или механизмов, по-видимому, сопряжены с G-белком. Существует доказательство, что активация рецепторов m3 может оказать влияние на экспрессию или уровни G-белка. Предполагается, что действия соединений, описанных в данном патенте, могут объясняться участием в процессах регенерации рецепторов, сцепления G-белка или гомеостаза G-белка.
Альтернативная гипотеза состоит в том, что соединения усиливают синтез или секрецию либо сниженную скорость деградации нейротропных факторов, таких, как фактор роста мозга и/или фактор роста нерва. Эти воздействия на факторы роста могут объясняться влиянием соединения на цитозольный или ядерный рецептор или на связывание соединения с промоторным участком с последующим действием непосредственно на скорость образования мРНК для фактора роста, или как следствие усиливающегося образования другого материального фактора, такого, как G-белок, или, наконец, эффекты могут быть вторичными по отношению к влиянию на рецептор или G-белок.
Усиленная экспрессия и/или аномальный процессинг белка амилоидного предшественника (АРР) связан с образованием амилоидных бляшек и цереброваскулярных амилоидных отложений, которые являются основными морфологическими признаками болезни Альцгеймера. Особый интерес представляют процессы, регулирующие протеолитическое расщепление АРР на амилоидогенный и неамилоидогенный фрагменты. Расщепление АРР с помощью фермента α-секретазы внутри β-амилоидной последовательности белка приводит к образованию неамилоидогенного С-концевого фрагмента и растворимого фрагмента  этот последний фрагмент, как было показано, обладает нейротропной и нейрозащитной активностью, а также улучшает память у мышей при интрацеребровентрикулярной (ICV) инъекции. В противоположность этому процессинг АРР с помощью β-секретазы раскрывает N-концы β-амилоида, который высвобождается с помощью расщепления γ-секретазой по вариабильным С-концам. Было показано, что образующиеся β-амилоидные пептиды, которые содержат 39-43 аминокислоты, являются нейротоксичными и накапливаются в бляшках, которые препятствуют соединению между нейронами.
этот последний фрагмент, как было показано, обладает нейротропной и нейрозащитной активностью, а также улучшает память у мышей при интрацеребровентрикулярной (ICV) инъекции. В противоположность этому процессинг АРР с помощью β-секретазы раскрывает N-концы β-амилоида, который высвобождается с помощью расщепления γ-секретазой по вариабильным С-концам. Было показано, что образующиеся β-амилоидные пептиды, которые содержат 39-43 аминокислоты, являются нейротоксичными и накапливаются в бляшках, которые препятствуют соединению между нейронами.
Ряд исследований показали, что стимуляция сцепленных с протеинкиназой С (РКС) мускариновых рецепторов M1 и М3 приводит к усилению активности α-секретазы. Как следствие усиливается процесинг АРР в APPs-α с его нейрозащитными эффектами. Параллельно снижается процессинг АРР с помощью β- и γ-секретазы и наблюдается логически вытекающее отсюда уменьшение р-амилоида. Другие переносчики, такие, как фактор роста нерва (NGF) и происходящий из мозга нейротропный фактор (BDNF), а также брадикинин и вазопрессин, могут проявлять подобные эффекты увеличения доли АРР, превращенной в APPs-α. Ряд факторов могут быть вовлечены в эффекты NGF, которые могут включать связывание фактора с рецептором тирозинкиназы (TrkA) и стимуляцию фосфолипазы Сγ с последующим фосфорилированием и активацией протеинкиназы С (РКС) и повышать относительную активность α-секретазы.
В связи с этим можно ожидать, что любая терапия, которая избирательно повышает активность протеинкиназы С в мозге, будет полезной для ведения болезни Альцгеймера. До недавнего времени селективные агонисты рецептора M1 не были доступны. Можно было ожидать, что неселективные агонисты стимулируют пресинаптические рецепторы М2, вызывая отрицательную обратную связь, и, следовательно, в дальнейшем тяжелые нарушения мускариновой передачи. Селективные агонисты рецептора M1 в настоящее время становятся доступными (талсаклидин), и такие агенты проходят испытания при лечении AD. Однако существует значительная опасность того, что по мере постоянного введения любого агониста рецептора наблюдаемые клинические преимущества будут существенно ограничиваться, с точки зрения приносимой пользы - снижением числа рецепторов и чувствительности, и с точки зрения побочных эффектов - потерей специфичности рецепторов. Таким образом, описанные в данном изобретении соединения, которые избирательно повышают число мускариновых рецепторов M1 и оказывают слабое влияние или совсем не влияют на число мускариновых рецепторов М2 в мозге, не будут вызывать проблем при применении, наблюдаемых в случае мускаринового агониста, и, следовательно, имеют особую полезность. Действительно, можно наблюдать три группы следующих преимуществ.
1. Избирательное увеличение числа рецепторов M1, приводящее к усилению синаптической передачи. Постоянное введение селективного агониста, по меньшей мере, не будет оказывать нежелательного воздействия на передачу.
2. Вторичное по отношению к увеличению числа рецепторов усиление стимуляции РКС с последующим усилением активности α-секретазы, приводящее:
2.1. к сниженному образованию β-амилоида и последующего образования бляшек и утраты нейронов;
2.2. к увеличению APPsα и последующему улучшению церебральной функции, подтверждаемому улучшением короткой и длинной памяти.
Наконец, выше были обсуждены эффекты систем GABA в модуляции передачи. Хорошо известно, что на рецепторе GABA имеется сайт связывания стероидов. который отличается от сайтов связывания бензодиазепина, хлорида и GABA. Известен ряд терапевтических соединений, которые связываются с этим сайтом и использовались с целью усиления или снижения уровня сознания. Предполагается, что постоянное введение частичного агониста этого сайта может привести к усилению передачи.
Изобретение в дальнейшем будет описываться с помощью следующих примеров.
Пример 1.
Исследование уровней мРНК с применением гибридизации in situ
Крыс-самцов чистой линии Sprague Dawley двадцатинедельного возраста делили произвольно на 2 группы. Одна группа получала в среднем 3 мг смешанного с кормом сарсасапогенина на крысу в день. Контрольная группа получала обычный корм и воду. Через четыре месяца мозг животных использовали в экспериментах по методу гибридизации, в качестве молодой контрольной группы использовали мозг крыс возрастом 4-6 месяцев. Другие условия кормления обеих групп были идентичны.
Синтезировали цепи кДНК, которые в указанном порядке соответствовали мРНК как m1, так и m2. Рецептор m1 соответствует аминокислотной последовательности 3-18 рецепторного белка, т.е. TGGTGCCAAGACAGTGATGTTGGGACTGACAGCAGGGG-GCACTGAGGT, рецептор m2 - аминокислотной последовательности 1-16, т.е. ATGAATAACTCAACAAACTCCTCGAACAATGGCTTGGCTATTACCAGT. Метили кДНК, используя набор реагентов для 3′-концевой метки с 35S-dATP (8.9 ТБк/ммоль) в качестве материала для метки. По окончании реакции смесь очищали на нуклеотидной колонке. Специфическую активность пробы определяли как (16.67-33.34)×108 МБк/мкг. Набор реагентов для 3′-концевой метки, 35S-dATP и нуклеотидную колонку получали от фирмы Du Pont Co., США.
Из каждой группы кадый раз брали по одной крысе и проводили параллельные эксперименты. Крыс умерщвляли декапитацией, мозг удаляли интактным. Коронарные срезы толщиной 15 мкм готовили при постоянном замораживании в криомикротоме (марки AS-600, фирмы Anglia Scientific Co, Великобритания). Срезы готовили из различных областей мозга (идентичные области для каждой крысы) и помещали на предметное стекло с нанесенным полилизином, сушили током холодного воздуха, фиксировали в 4% параформальдегиде [содержащем 1х забуференный фосфатом физиологический раствор (PBS), рН 7.0] в течение 5 минут перед двукратной промывкой в PBS. Затем помещали срезы в раствор 0.25% уксусного ангидрида (содержащего 0.1 М гидрохлорида триэтаноламина с рН 8.0 и 0.9% хлорида натрия) на 10 минут, обезвоживали в 70%, 80%, 95% и 100% этиловом спирте в течение 1 минуты, обезжиривали в хлороформе в течение 5 минут и в заключение обрабатывали последовательно в 100% и 95% этиловом спирте в течение 1 минуты.
Срезы, использованные для отрицательного контроля, обезвоживали в этиловом спирте и т.д., как подробно описано выше, но заблаговременно обрабатывали 100 мг/мл РНКазы и раствором 2х SSC (раствором соли и цитрата натрия, содержащим 300 ммоль/л хлорида натрия и 45 ммоль/л цитрата натрия) в течение 2 часов при 37°С.
Для гибридизации жидкую матрицу нагружали свежедеионизированным 50% формамидом, 4х SSC, 10% сульфатом декстрана, 250 мкг/мкл дрожжевой тРНК, 5х раствором Денхарда, 500 мкг/мл осажденной протамином ДНК, 10 ммоль/л дитиотреита. В заключение прибавляли олигонуклеотидный зонд [(16.67-33.34)×10 МБк/50 мкл], меченный с 35S, и перемешивали. На каждый срез прикапывали 50 мкл матрицы и осторожно накрывали силикатным стеклом, не допуская попадания воздуха. Затем срезы помещали в гибридизационную камеру, содержащую на дне 2х SSC для поддержания влажности, и инкубировали при 37°С в течение 18-24 часов.
После гибридизации срезы вымачивали в 1х растворе SSC и осторожно встряхивали, чтобы удалить стеклянное покрытие. Быстро промывали 1х раствором SSC, затем осторожно встряхивали в 2х SSC, содержащем 50% формамид, при 37°С в течение 20 минут, меняя раствор четыре раза, после чего переносили в раствор 1х SSC для встряхивания при комнатной температуре в течение 30 минут (повторяли дважды). В заключение срезы промывали бидистиллированной водой, обезвоживали с 70%, затем с 95% этиловым спиртом и сушили на воздухе.
Ауторадиограммы получали в темной комнате, причем образец и пленку Hyperfilm Beta Мах прижимали друг к другу с использованием контактного метода и помещали в кассету с осушителем, экспонированную при 4°С в течение 2-3 недель. Затем проявляли (D196) и фиксировали (F5). В заключение анализировали ауторадиограммы, используя снабженный компьютером видеоанализатор (марки VIDAS от фирмы Kontron, Германия).
В случае m2-зонда не обнаружено какой-либо локализованной области активности. В случае m1-зонда обнаружена активность в зубчатых ядрах, коре головного мозга и полосатом теле. Сравнение этих трех областей для различных групп животных показано в таблице 5.
Наблюдалось значительное снижение экспрессии мРНК для рецепторов m1 в стратуме у взрослых крыс по сравнению с молодыми контрольными. Введение SaG привело к значительному увеличению экспрессии мРНК для рецепторов m1 в той же самой области мозга при сопоставлении обработанных животных со взрослыми необработанными контрольными животными.
Пример 2.
В этом исследовании изучали способность смилагенина, сарсасапогенина, эписарсасапогенина и эписмилагенина к предотвращению МРР9+-индуцированного апоптоза в дофаминергических нейронах крыс.
Повреждения, вызываемые нейротоксином МРР+, метаболитом 1-метил-4-фенил-1,2,3,6-тетрагидропиридина (МРТР), напоминают дегенерацию дофаминергических нейронов нигростриатума при нейродегенеративных заболеваниях, таких как болезнь Паркинсона (Mytinlineou et al. Science. 225, 529-531, 1984). Наиболее заметные биохимические изменения, вызываемые этим токсином, включают снижение уровня дофамина и его метаболитов в substantia nigra pars compacta и в хвостатом ядре (Burns et al., Proc. Nat. Acad. Sci. USA. 80, 4546-4550, 1983) и уменьшение захвата дофамина в препаратах синаптосом из нигростриатума (Heikkila et al., J. Neurochem. 44, 310-313, 1985).
Предварительная обработка в течение 24 часов дофаминовых нейронов среднего мозга крыс сарсасапогенином, смилагенином, эписарсасапогенином и эписмилагенином значительно повышала выживаемость нейронов, подвергнутых воздействию одного МРР+, что свидетельствует о существенном нейрозащитном действии (табл.6).
Таблица 6. Влияние предварительной обработки сарсасапогенином и смилагенином на дофаминергические нейроны после воздействия МРР+ (2 мкМ) (среднее±SE)
Результаты этих опытов были получены в виде микрофотоснимков, а также проведен дополнительный опыт по проверке соединения эписмилагенина катилата. Эти микрофотоснимки приведены в конце данной Справки. Наблюдается впечатляющая сохранность роста нейритов при использовании исследованных соединений по сравнению с контролем и с опытами без обработки.
Это исследование показало, что сарсасапогенин, смилагенин, эписарсасапогенин и эписмилагенин предотвращают вызванное МРР+ повреждение нейронов у первичных дофаминовых нейронов среднего мозга, то есть на in vitro модели болезни Паркинсона.
Пример 3.
В этом исследовании изучали способность смилагенина и сарсасапогенина к предотвращению МРР+-индуцированного апоптоза в дофаминергических нейронах крыс.
Обработка нейронов среднего мозга крыс МРР+ (2 мкМ, 24 часа) вела к повреждению нейронов при измерении через 48 часов (табл.7).
После обработки МРР+ внесение сарсасапогенина и смилагенина на 48 часов приводило к значительному уменьшению повреждений нейронов по сравнению с нейронами, обработанными одним МРР+, что свидетельствует о существенном нейрозащитном действии (табл.7).
Таблица 7. Влияние обработки сарсасапогенином и смилагенином на дофаминергические нейроны после воздействия МРР+ (2 мкМ) (среднее±SE)
Обработка МРР+ также значительно снижала процент нейронов, имеющих нейриты (табл.8). После воздействия МРР+ сарсасапогенин и смилагенин значительно уменьшали снижение числа нейронов, имеющих нейриты.
Таблица 8. Влияние сарсасапогенина и смилагенина на процент дофаминергических нейронов, имеющих нейриты после воздействия МРР+ (2 мкМ) (среднее±SE)
Из этих результатов следует ожидать, что данные соединения будут предотвращать повреждение нейронов аддуктами наркотических соединений.
| название | год | авторы | номер документа |
|---|---|---|---|
| СТЕРОИДНЫЕ САПОГЕНИНЫ И ИХ ПРОИЗВОДНЫЕ ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНИ АЛЬЦГЕЙМЕРА | 1999 |
|
RU2242978C2 |
| ПРОИЗВОДНЫЕ 5БЕТА-САПОГЕНИНА И ПСЕВДОСАПОГЕНИНА И ИХ ПРИМЕНЕНИЕ ПРИ ЛЕЧЕНИИ ДЕМЕНЦИИ | 2000 |
|
RU2325396C2 |
| ПРОИЗВОДНЫЕ САПОГЕНИНА, ИХ СИНТЕЗ, ПРИМЕНЕНИЕ И СПОСОБЫ, ОСНОВАННЫЕ НА ИХ ПРИМЕНЕНИИ | 2002 |
|
RU2311423C2 |
| ПРОИЗВОДНЫЕ АЗОТСОДЕРЖАЩИХ ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ И ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ НА ИХ ОСНОВЕ | 1999 |
|
RU2278111C2 |
| ПРОИЗВОДНЫЕ АЗОТСОДЕРЖАЩИХ ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1999 |
|
RU2230740C2 |
| ТЕРАПЕВТИЧЕСКИЕ СПОСОБЫ И ПРИМЕНЕНИЯ САПОГЕНИНОВ И ИХ ПРОИЗВОДНЫХ | 2003 |
|
RU2332999C2 |
| ПРИМЕНЕНИЕ N-ДЕСМЕТИЛКЛОЗАПИНА ДЛЯ ЛЕЧЕНИЯ НЕЙРОПСИХИАТРИЧЕСКИХ ЗАБОЛЕВАНИЙ У ЛЮДЕЙ | 2004 |
|
RU2336879C2 |
| СОЕДИНЕНИЯ-АГОНИСТЫ РЕЦЕПТОРА 5-НТ ДЛЯ ЛЕЧЕНИЯ РАССТРОЙСТВ ПОЗНАВАТЕЛЬНОЙ СПОСОБНОСТИ | 2010 |
|
RU2569056C2 |
| Способ лечения синдрома гиперактивного мочевого пузыря | 2022 |
|
RU2792534C1 |
| АГОНИСТЫ АЛЬФА-2В ИЛИ 2В/2С АДРЕНОРЕЦЕПТОРОВ ДЛЯ ЛЕЧЕНИЯ НЕЙРОДЕГЕНЕРАТИВНЫХ ЗАБОЛЕВАНИЙ | 2003 |
|
RU2330649C2 |
Изобретение относится к области медицины, а именно к фармакологии и психиатрии. Предложено использование сарсасапогенина, в случае необходимости с одним или несколькими соединениями из группы, состоящей из смилагена и анзурогенина-D, для приготовления композиции для лечения болезни Паркинсона или для лечения постуральной гипотензии, аутизма, синдрома хронической усталости, тяжелой миастении Грависа, болезни Ламберта Итона, синдрома войны в Заливе и синдрома, связанного с профессиональным контактом с фосфорорганичекими соединениями. Сарсасапогенин избирательно увеличивает активность мускариновых рецепторов M1, приводящих к усилению синаптической передачи, и не влияет на активность М2 рецепторов (которые вызывают отрицательную обратную связь и нарушают мускариновую передачу). 2 н. и 1 з.п. ф-лы, 8 табл.
| DE 4303214 A1, 11.08.1994 | |||
| РАСТИТЕЛЬНЫЙ ЭКСТРАКТ, ОБЛАДАЮЩИЙ ДОПАМИНЕРГИЧЕСКОЙ АКТИВНОСТЬЮ | 1992 |
|
RU2072859C1 |
| Шиберный затвор для отсечки металла при литье под давлением | 1979 |
|
SU1096031A1 |
| Руководство по медицине «THE MERCK MANUAL» | |||
| - M.: Мир, 1997, т.1, с.1014-1015 | |||
| НЕВРОЛОГИЯ | |||
| /Под ред | |||
| М.Самуэльса | |||
| - M.: Практикум, 1997, с.67, 523-533. | |||
Авторы
Даты
2007-04-20—Публикация
2004-07-29—Подача