Область, к которой относится изобретение
Настоящее изобретение относится к антителу, способному специфически связываться с одним типом рецептора лиганда (далее обозначаемого "TRAIL"), индуцирующего апоптоз, ассоциированный с фактором некроза опухоли (далее обозначаемым TNF), а более конкретно, к моноклональному антителу, индуцирующему апоптоз клеток in vivo и in vitro, экспрессирующих указанный один тип рецептора, и к терапии, основанной на использовании этого антитела.
Предпосылки создания изобретения
TRAIL является членом семейства белков TNF, которое также включает TNF-α и Fas-лиганд [1]. Эти белки являются сильными индукторами апоптоза. В настоящее время идентифицированы пять рецепторов для TRAIL, два из которых, DR4 (TRAIL-R1) и DR5 (TRAIL-R2)[2-7], способны к передаче сигналов апоптоза, тогда как три других рецептора DcR1 (TRAIL-R3), DcR2 (TRAIL-R4) и остеопротегрин (OPG) не являются медиаторами передачи сигнала апоптоза [8-12]. Все пять рецепторов для TRAIL имеют общую значительную гомологию в своих внеклеточных лиганд-связывающих доменах. Аналогично рецептору Fas и рецептору TNF I (далее называемому "TNFRI"), внутриклеточные сегменты DR4 и DR5 содержат домен гибели и передают сигнал апоптоза по пути, в котором участвует Fas-ассоциированный белок, содержащий домен гибели (далее обозначаемый "FADD") и каспаза 8 [6,7]. Помимо передачи сигнала апоптоза рецепторы DR4 и DR5 могут также активировать каскад реакций с участием NFkb [6,7].
Было продемонстрировано, что биологические функции TRAIL включают его способность селективно индуцировать апоптоз трансформированных опухолевых клеток, при этом нормальные клетки являются относительно резистентными к TRAIL-опосредованному апоптозу [13-15]. Такая селективность дает основание предполагать, что в отличие от лиганда Fas введение TRAIL ассоциируется с очень низкими уровнями токсичности, как было продемонстрировано путем системного введения TRAIL животному-модели, и не вызывает значительного индуцирования токсичности [13]. Таким образом, было предположено, что TRAIL является сильным индуктором апоптоза и может быть использован в качестве терапевтического средства для лечения злокачественных опухолей и других заболеваний, ассоциированных с аномальной пролиферацией клеток. Также было предположено, что TRAIL является сильным индуктором апоптоза, который может быть использован для лечения аутоиммунных и воспалительных заболеваний. Было продемонстрировано, что TRAIL-опосредованный апоптоз участвует в гибели Т-клеток, индуцируемой активацией, а поэтому действует по альтернативному механизму, отличающемуся от механизма действия лиганда Fas [16,17]. TRAIL-опосредованный апоптоз может также функционировать как индуктор апоптоза Т-клеток и других воспалительных клеток [18], и играет определенную роль в цитолитической активности клеток NK (19-21) и в иммуномодуляторной функции дендритных клеток [22,23]. Таким образом, TRAIL-опосредованный апоптоз может также участвовать в определении иммунной предпочтительности и осуществлении иммунологического надзора.
Система рецепторов TRAIL является комплексной и включает, по крайней мере, два рецептора гибели, DR4 и DR5, и, по крайней мере, два неапоптотических рецептора, DcR1 и DcR2. Все эти рецепторы не только имеют высокую степень гомологии аминокислотных последовательностей, но также обладают аналогичной аффинностью связывания с TRAIL [2-12]. Способность рецепторов DcR1 и DcR2 конкурировать за связывание с TRAIL без индуцирования апоптоза дает основание предполагать, что они могут действовать как рецепторы-ловушки, которые блокируют или модулируют активность лиганда TRAIL. Кроме того, сообщалось, что нетрансформированные клетки экспрессируют более высокие уровни рецепторов-ловушек, чем трансформированные клетки. Таким образом, предполагается, что дифференциальная модуляция экспрессии рецепторов гибели и рецепторов-ловушек может представлять собой ключевой регуляторный механизм, который определяет чувствительность клеток к TRAIL-опосредуемому апоптозу, но при отсутствии рецептор-специфических антител [2]. Хотя были проведены интенсивные исследования экспрессии и функции DR4 и DR5, однако прогресса в этой области пока не наблюдается из-за отсутствия рецептор-специфических моноклональных антител. Пока не были представлены какие-либо данные относительно экспрессии DR5 на клеточной поверхности. Сообщалось, что была генерирована панель антител против рецепторов TRAIL, способных индуцировать апоптоз клеток меланомы in vitro, но только после иммобилизации этих антител для стимуляции перекрестного связывания, а в некоторых случаях требовалось культивирование этих клеток с актиномицином D [24]. Было генерировано несколько антител против DR-5 [24]. Однако эти ранее генерированные моноклональные антитела против DR-5 обладают низкой апопотоз-индуцирующей антивностью in vitro, даже в условиях перекрестного связывания. О какой-либо in vivo-активности не сообщалось. Эти антитела не были использованы для оценки экспрессии рецепторов TRAIL на клеточной поверхности [24]. Таким образом, необходимо получить моноклональное антитело, которое является селективным по отношению к каждому специфическому рецептору TRAIL и которое не только способно связываться с рецептором клеточной поверхности, но также способно сильно индуцировать как in vivo, так и in vitro, апоптоз аномальных клеток различных типов, включая опухолевые клетки, без перекрестного связывания или иммобилизации. Такое антитело должно служить не только потенциальным терапевтическим агентом, но также и диагностическим инструментом для функционального анализа рецептора TRAIL. Существует крайняя необходимость в продуцировании антитела против каждого из рецепторов DR4 и DR5, индуцирующих гибель клеток.
При развитии или прогрессировании многих заболеваний часто случается, что клетки не элиминируются. При многих аутоиммунных заболеваниях и воспалительных состояниях, выжившие активированные клетки атакуют нормальные ткани или клетки. Кроме того, прогрессирование онкогенеза и развитие пролиферативного паннуса ревматоидного артрита характеризуется неконтролируемой пролиферацией клеток. Таким образом, недостаточный апоптоз приводит к развитию заболевания, а использование апоптоз-индуцирующего лиганда или агонистического моноклонального антитела для усиления апоптоза рассматривается как возможная терапевтическая стратегия для элиминации этих нежелательных клеток.
Так, например, ревматоидный артрит (далее обозначаемый "РА") является распространенным аутоиммунным заболеванием человека. Современное представление о патофизиологии РА заключается в том, что аутоиммунные Т-клетки и В-клетки инициируют воспалительный ответ в суставах, который приводит к гиперпролиферации синовиоцитов. Гиперпролиферация синовиальных клеток приводит к сверхпродуцированию металлопротеиназ (далее обозначаемых "ММР"), что вызывает эрозивную деструкцию хряща и кости, которая характерна для РА [25]. Таким образом, регуляция гиперпролиферации воспалительных синовиальных клеток является ключевой стадией лечения РА. Молекулярные механизмы, приводящие к гиперпролиферации синовиальных клеток, пока неизвестны. Хотя гиперпролиферативные синовиальные клетки не являются злокачественными и не трансформируются, однако многие исследования дают основание предполагать, что они имеют некоторые общие признаки с трансформированными клетками [46]. Эти клетки, так называемые "появившиеся трансформированные синовиоциты", характеризуются плотным шероховатым эндоплазматическим ретикулом, множеством ядер неправильной формы и изменениями в нормальной веретенообразной форме цитоскелета. Было высказано предположение, что включение онкогенов и вирусных генов может быть главной причиной появления трансформированных синовиальных клеток РА [46].
По крайней мере, два аспекта РА позволяют предположить, что нарушение регуляции апоптоза может вносить свой вклад в патологический процесс и что терапевтическая стимуляция апоптоза может оказаться эффективным лечением: т.е., неспособность активированных Т-клеток к элиминации позволяет предположить, что в данном случае имеет место индуцированная недостаточной активацией гибель этих Т-клеток, которая представляет собой процесс с участием Fas-опосредованного апоптоза и TRAIL-опосредованного апоптоза, а гиперпролиферативная природа синовиальных клеток РА является стимулирующим фактором на более поздних стадиях патофизиологии РА. Действительно, было показано, что введение антитела против Fas в воспаленный сустав ингибирует развитие хронического артрита у tax-трансгенных мышей, которые служат моделью человеческого РА [26]. Кроме того, локализованная трансдукция гена лиганда fas аденовирусным вектором является эффективной для предупреждения коллаген-индуцированного артрита [27]. В обоих случаях наблюдается ингибирование пролиферации воспалительных синовиальных клеток путем усиления Fas-индуцированного апоптоза. Хотя лиганд Fas является сильным индуктором апоптоза в синовиальных клетках РА, однако применение опосредованного лигандом Fas апоптоза в качестве терапевтического средства для лечения человека ограничено его летальной токсичностью для печени. Таким образом, индуцированный TRAIL-рецептором апоптоз представляет собой более безопасное и более эффективное терапевтическое средство для лечения РА, чем апоптоз, индуцированный лигандом Fas.
Индуцированный TRAIL-рецептором апоптоз также представляет собой более безопасное и более эффективное терапевтическое средство для лечения злокачественных опухолей, чем апоптоз, индуцированный лигандом Fas. Известно, что TRAIL-опосредованный апоптоз специфически индуцирует апоптоз трансформированных опухолевых клеток и не оказывает негативного влияния на нормальные клетки. Было показано, что системное введение тримеризованного растворимого TRAIL не вызывает токсикоза у экспериментальных животных и даже может индуцировать регрессию имплантированных опухолей [13,28]. Возможность его применения в качестве дополнительной терапии при традиционном лечении была появилась благодаря недавнему обнаружению того факта, что экспрессия DR5 и чувствительность TRAIL-опосредованного апоптоза клеток злокачественной опухоли молочной железы усиливается при облучении, что дает основание предположить, что при противораковой терапии в комбинации с облучением эффективность TRAIL должна повышаться.
Кроме того, ген, кодирующий TRAIL-рецептор DR5, был картирован на хромосоме 8р21-22, то есть в локусе с высокой частотой мутации в некоторых злокачественных клетках [30]. Сообщалось, что по крайней мере, у двух видов опухолевых клеток, мелкоклеточной злокачественной опухоли легких [31] и злокачественных опухолей головы и шеи [32] обнаруживались мутации в гене домена гибели DR5. Таким образом, исследования злокачественных опухолей в целях определения влияния, которое оказывает изменение эпитопа рецептора на развитие и прогрессирование злокачественных опухолей, привели к необходимости продуцировать антитело против DR5. Кроме того, функциональность мутаций TRAIL-рецептора должна подтвердить эффективность такого клинического диагностического инструмента при его использовании в сочетании с другими биомаркерами для обнаружения злокачественных опухолей на ранней стадии, а также в качестве прогностического фактора агрессивности опухоли.
Краткое описание изобретения
Описано антитело, которое распознает TRAIL-рецептор DR5 и которое индуцирует апоптоз в DR5-экспрессирующей клетке in vivo. Кроме того, описано антитело, которое распознает DR5, но не DR4, DcR1 и DcR2. Особенно подробно описано моноклональное антитело, продуцированное гибридомой.
Способ настоящего изобретения позволяет ингибировать пролиферацию клеток путем обработки клетки терапевтическим количеством антитела, способного связываться с DR5. Также описана фармакологическая композиция, включающая терапевтическое количество моноклонального антитела против DR5, фармацевтически приемлемый носитель и контейнер, включающий указанное антитело и указанный носитель. Кроме того, настоящее изобретение относится к использованию DR5-распознающего антитела в целях изготовления терапевтического средства для селективного апоптоза аномальных или разрегулированных клеток.
Антитело настоящего изобретения взаимодействует с рецептором лиганда фактора некроза опухоли, таким как DR4, DR5, DcR1, DcR2 и OPG, индуцирующим апоптоз клетки, экспрессирующей указанный рецептор. Описано антитело настоящего изобретения, способное селективно связываться с эпитопом агонистического или антагонистического рецептора лиганда фактора некроза опухоли. Настоящее изобретение относится к лечению ассоциированного с апоптозом заболевания способом, предусматривающим обработку нужной ткани, подверженной ассоциированному с апоптозом заболеванию, терапевтическим количеством антитела настоящего изобретения.
Кроме того, описан гибридный белок, который включает аминокислотную последовательность антигенного рецептора TRAIL, имеющую, по крайней мере, десять оснований, присоединенных к белку иммуноглобулина или к его фрагменту, способному вырабатывать иммунный ответ у индивидуума.
Настоящее изобретение относится к способу генной терапии, в котором клетку-мишень трансфицируют нуклеиновокислотной последовательностью рецептора TRAIL, присутствующей в экспрессирующем векторе так, чтобы указанный рецептор TRAIL экспрессировался на указанной клетке-мишени. Затем указанную клетку-мишень обрабатывают антителом, которое селективно связывается с указанным рецептором TRAIL.
Описаны аминокислотные последовательности и последовательности нуклеиновой кислоты, кодирующие тяжелую и легкую иммуноглобулиновые цепи антитела, обладающего селективностью по отношению к DR5. Также подробно описаны векторы, включающие последовательность нуклеиновой кислоты настоящего изобретения, и клетки-хозяева, трансформированные вектором настоящего изобретения.
Настоящее изобретение относится к клетке-хозяину, продуцирующей гуманизированное антитело TRA-8.
Описан способ продуцирования гуманизированного антитела против DR5, предусматривающий трансформацию хозяина последовательностями нуклеиновой кислоты, кодирующими легкую цепь гуманизированного иммуноглобулина и тяжелую цепь гуманизированного иммуноглобулина, и последующее инкубирование трансформированного хозяина в течение заранее определенного интервала времени.
Также описан способ ингибирования пролиферации клеток, предусматривающий контактирование клетки-мишени с фармацевтически эффективным количеством гуманизированного антитела против DR5.
Также рассматривается коммерчески доступный набор для индуцирования клеточной гибели, который включает гуманизированное селективное антитело против DR5 и который упакован в соответствующий контейнер с инструкциями по использованию.
Краткое описание графического материала
Фигура 1. Характеризация TRA-8
(а). Специфическое связывание TRA-8: Вестерн-блот-анализ (верхняя панель): рекомбинантные гибридные белки семейства TNFR, зондированные антителом TRA-8 или антителом против IgG человека. Дорожка 1: гибридный белок DR5/hIgG1 (иммуноген); дорожка 2: DR4/hIgG1 (TRAIL-R1); дорожка 3: DR5/hIgG1; дорожка 4: TRAIL-R3 (DcR-1)/hIgG1; дорожка 5: TRAIL-R4 (DcR-2)/hIgG1; дорожка 6: СD95/hIgG1; дорожка 7: растворимый TNFRI. ELISA-анализ (нижняя панель): номера лунок совпадают с номерами лунок для Вестерн-блот-анализа за исключением лунки 8, которая относится к мышиному гибридному белку DR5/hIgG1.
(b). Активность связывания растворимого TRAI и TRA-8 с DR5 и DR4: ELISA-планшеты покрывают DR5/hIgG1 (левая панель) или DR4/hIgG1 (средняя панель), а затем инкубируют с TRAIL или TRA-8.
(с). Проточный цитометрический анализ экспрессии DR5 на клеточной поверхности. Клетки Cos-7 трансфицировали экспрессирующим вектором pcDNA3, содержащим полноразмерную кДНК DR5 (захтрихованная гистограмма) или кДНК DR4 (незаштрихованная гистограмма, сплошная линия), либо пустым вектором (незаштрихо-ванная гистограмма, пунктирная линия). Через сорок восемь часов после трансфекции клетки окрашивали TRA-8, а затем ФЭ-конъюгированным антителом против мышиного IgG1.
(d). Иммуногистохимическая реактивность in situ для DR5: Через 48 часов после трансфекции предметные стекла с клетками Cos-7, трансфицированными DR5-экспрессирующим или контрольным вектором, окрашенным TRA-8, подвергали центрифугированию в цитоцентрифуге. Цитолитическая активность TRA-8: клетки Jurkat инкубировали с указанными концентрациями TRA-8. После культивирования в течение ночи определяли жизнеспособность клеток с помощью эксклюзионных анализов ATPLIite, МТТ и PI. Результаты анализов ATPLIite и МТТ выражены в процентах от контроля (среда), а результат анализа PI выражен в процентах PI-негативных клеток.
(f). Вестерн-блот-анализ на активацию каспазы: клетки Jurkat инкубировали с 500 нг/мл TRA-8 в течение указанного интервала времени. Клеточные лизаты разделяли с помощью электрофореза в 15% ПААГ с ДСН, подвергали блот-анализу и зондировали антителами против каспазы. Стрелки указывают на расщепленные субъединицы каждой каспазы.
g. Анализ на ингибирование каспазы: клетки Jurkat инкубировали с 50 нг/мл TRA-8 в течение ночи в присутствии различных концентраций указанных ингибиторов каспазы. Жизнеспособность клеток определяли с помощью анализа ATPLite.
Фигура 2. Экспрессия DR5 на клеточной поверхности и восприимчивость к DR5-опосредованному апоптозу. Нормальные Т- и В-клетки, только что выделенные из периферической крови, Т-клетки (а и а'), клетки глиомы (b и b'), раковые клетки предстательной железы (с) и В-клетки (d) инкубировали с антителом TRA-8 или с контрольным антителом против мышиного изотипа IgG1, а затем с ФЭ-конъюгированным козьим антителом против мышиного IgG1. Незаштрихованные гистограммы представляют изотип контрольного антитела, а сплошные гистограммы представляют TRA-8-окрашивание. Апоптоз определяли с помощью анализа ATPLite после инкубирования в течение ночи с растворимым TRAIL (незаштрихованные кружки) или с TRA-8 (заштрихованные кружки), как показано в а, b' и d.
Фигура 3а'. Т-клеточную линию U937 инкубировали с TRA-8 или с контрольным мышиным антителом изотипа IgG1. Апоптоз определяли с помощью анализа ATPLite после инкубирования в течение ночи с растворимым TRAIL (незаштрихованные кружки) или с TRA-8 (заштрихованные кружки).
Фигура 3. Клеточные линии глиомы (b) и злокачественной опухоли предстательной железы (с) инкубировали с TRA-8 или с контрольным мышиным антителом изотипа IgG1. Апоптоз определяли с помощью анализа ATPLite после инкубирования в течение ночи с растворимым TRAIL (незаштрихованные кружки) или с TRA-8 (заштрихованные кружки).
Фигура 4 представляет собой серию графиков, иллюстрирующих жизнеспособность человеческих клеток Jurkat после обработки указанными концентрациями (А) антитела видов TRA-1, -8 и -10, и (В) TRAIL в присутствии фиксированной концентрации антител настоящего изобретения типов, указанных на фиг.4А;
Фигура 5. Экспрессия DR5 в нормальных и злокачественных тканях: гомогенаты нормальных и злокачественных тканей зондировали антителом TRA-8 и оценивали на развитие хемилюминесценции. (а). Вестерн-блот-анализ белка DR5 в нормальных тканях: дорожка 1: печень, дорожка 2: головной мозг, дорожка 3: легкие, дорожка 4: почки, дорожка 5: селезенка, дорожка 6: яички, дорожка 7: яичник, дорожка 8: сердце, дорожка 9: поджелудочная железа. b. Вестерн-блот-анализ белка DR5 в злокачественных тканях. Блот раковой ткани, содержащий раковые клетки яичника (дорожка 1), легкого (дорожка 2), печени (дорожка 3), прямой кишки (дорожка 4), шейки матки (дорожка 5), кожи (дорожка 6), яичек (дорожка 7), щитовидной железы (дорожка 8), матки (дорожка 10), желудка (дорожка 11), носоглотки (дорожка 12) и поджелудочной железы (дорожка 13), зондировали. Иммуногистохимический анализ in situ нормальных тканей (с) и злокачественных тканей (d) человека. Замороженные срезы подвергали иммуноокрашиванию TRA-8.
Фигура 6. Тумороцидная активность TRA-8. Мышей SCID подкожно инокулировали клетками 1321N1. Мышам внутривенно вводили одну дозу 100 мкг TRA-8 на второй день после инокуляции опухоли (а), или три дозы 100 мкг TRA-8 начиная с 7-го дня после инокуляции опухоли (b). Рост опухоли определяли по ее массе и гистологически оценивали по окрашиванию Н&E. Фотографии указывают на рост жизнеспособных опухолевых клеток у контрольных мышей, но не у TRA-8-обработанных мышей (с., верхняя панель), и на Н&E-окрашивание опухоли (с, нижняя панель). Мышам SCID внутривенно инъецировали 106 клеток Jurkat и этих мышей обрабатывали одной дозой TRA-8 на второй день после инъекции. Через 7 дней клетки селезенки собирали, окрашивали антителом против человеческого CD3 и анализировали с помощью проточной цитометрии (d) или иммуногистохимии (е).
На фигуре 7 проиллюстрирована экспрессия DR5 на поверхности синовиальных клеток при РА (А) и ОА (В). 1 х 106 первичных культивированных синовиальных клеток окрашивали аффинноочищенным TRA-8, а затем ФЭ-конъюгированным козьим антителом против мышиных IgG1. 10000 жизнеспособных клеток анализировали с использованием программы FACSvantage.
Фигура 8 представляет собой серию графиков, иллюстрирующих жизнеспособность клеток и выражающих зависимость концентрации TRAIL и TRA-8, индуцирующей апоптоз репрезентативных штаммов синовиальных клеток РА (А) и ОА (В), от различных концентраций рекомбинантного растворимого TRAIL (незаштрихованные кружки) или аффинноочищенного TRA-8 (заштрихованные кружки). Жизнеспособность клеток выражали в процентах им./мин обработанных клеток по отношению к им./мин необработанных клеток.
Фигура 9 представляет собой серию графиков, иллюстрирующих зависимость DR5-опосредованного апоптоза синовиальных клеток РА от каспазы. Синовиальные клетки РА (RA512) инкубировали с 50 нг/мл растворимого лиганда Fas (незаштрихованные квадраты), с анти-Fas антителом (СН-11) (заштрихованные квадраты), с растворимым TRAIL (незаштрихованные кружки) или с анти-DR5 антителом (TRA-8) (заштрихованные кружки) в присутствии различных концентраций ингибиторов каспазы. После культивирования в течение ночи жизнеспособность клеток определяли с помощью ATPLite.
Фигура 10А иллюстрирует анализ электрофоретического сдвига в геле, указывающий на активацию NFkb. Клетки RA1016 инкубировали с 20 нг/мл TNF-α, 50 нг/мл растворимого TRAIL или с 50 нг/мл TRA-8 в течение указанных промежутков времени, а затем подвергали электрофорезу. Фигуры 10В и С представляют собой графики, иллюстрирующие продуцирование ММР-1 и ММР-3. 1 х 106/мл указанных синовиальных клеток РА инкубировали с указанными концентрациями TNF-а (незаштрихованные кружки), TRAIL (незаштрихованные треугольники) или TRA-8 (заштрихованные кружки). После культивирования в течение ночи собирали супернатанты культуры. Уровни ММР в супернатантах культуры определяли с помощью ELISA.
Фигура 11. TRA-8 не индуцирует гепатоцеллюлярную токсичность. (а). Нормальные ткани печени не экспрессируют DR5. Парафиновые срезы двух нормальных тканей печени, одной ткани гепатоцеллюлярной карциномы и центрифугированный препарат клеток НерG2 получали для Н&E-окрашивания и соответствующие замороженные срезы окрашивали TRA-8. (b). Оценка экспрессии DR5 на клеточной поверхности методом проточный цитометрии. Гепатоциты, выделенные из двух нормальных тканей печени и из ткани гепатоцеллюлярной карциномы, и клетки НерG2 окрашивали TRA-8, анти-Fas антителом (DХ2) или контрольным антителом определенного изотипа. Заштрихованные гистограммы указывают на TRA-8- или DХ2-окрашивание, а незаштрихованные гистограммы соответствуют контрольным изотипам.
Фигура 12. TRAIL, но не TRA-8 индуцируют гепатоцеллюлярную токсичность. Свежие нормальные гепатоциты человека выдерживали в среде для культивирования гепатоцитов.
(а). Апоптоз гепатоцитов индуцировали с использованием 1 мкг/мл растворимого TRAIL и перекрестносвязывающего агента или TRA-8 в указанное время. Жизнеспособность клеток определяли с помощью ATPLite. Результаты представлены как процент жизнеспособных клеток по отношению к контролю (среда). Заштрихованные столбцы относятся к TRAIL, а черные столбцы относятся к TRA-8.
(b). Конденсированные ядра гепатоцитов окрашивали Hoechst 33352 и анализировали с помощью проточной цитометрии.
(с). Влияние циклогексимида на апоптоз гепатоцитов. Гепатоциты культивировали в контрольной среде или с 1 мкг/мл TRAIL или TRA-8 в отсутствие (незаштрихованные столбцы) или в присутствии (заштрихованные столбцы) 1 мкг/мл циклогексимида в течение 8 часов. Жизнеспособность клеток определяли с помощью ATPLite. Результаты представлены как среднее значение ± ср.кв.ош. для культур, полученных с тремя повторностями в двух экспериментах.
(d). Сравнение чувствительности нормальных гепатоцитов к DR5- и Fas-опосредован-ному апоптозу. Свежевыделенные гепатоциты инкубировали с указанными концентрациями растворимого TRAIL, TRA-8, растворимого FasL или анти-Fas mAb СН11 в течение 6 часов. Жизнеспособность клеток определяли с помощью ATPLite. Результаты представлены как процент жизнеспособных клеток по отношению к контролю (среда). Для нормальных гепатоцитов представлены средние значения ± ср.кв.ош. для четырех нормальных индивидуумов. Результаты для клеток гепатоцеллюлярной карциномы, взятых от одного пациента, и для клеток НерG2 представлены как средние значения для культур, полученных с тремя повторностями.
Фигура 13. TRAIL индуцирует гепатит. Мышей В6 внутривенно инокулировали 109 б.о.е. аденовиросного вектора, кодирующего полноразмерный TRAIL человека под контролем транскрипционного элемента "Tet-on". Экспрессию TRAIL индуцировали указанной дозой тетрациклина.
(а). Нозерн-блот-анализ экспрессии человеческого TRAIL в печени. Через 24 часа после инокуляции вектора и индуцирования тетрациклином, полноразмерную РНК выделяли из печени и зондировали с использованием кДНА человечекого TRAIL или β-актина.
(b). Сывороточные уровни AST. Через 24 часа после трансдукции TRAIL определяли сывороточные уровни AST.
(с). TRAIL-опосредованная гибель гепатоцитов, инфицированных аденовирусным вектором: мышей В6 внутривенно инокулировали тетрациклин-индуцибельным аденовирусным вектором. Через 48 часов после инокуляции гепатоциты от инокулированных и неинокулированных контрольных мышей выделяли и инкубировали с указанными концентрациями TRAIL в течение 8 часов (левая панель). Жизнеспособность гепатоцитов определяли с помощью ATPLite. Затем, через 48 часов, мышам, инокулированным вышеупомянутым аденовирусным вектором, внутривенно инъецировали 10 мкг растворимого человеческого TRAIL. Через 24 часа после инъекции TRAIL определяли сывороточные уровни AST (правая панель).
(d и е). Гистологический анализ на повреждение печени, индуцированное TRAIL. Через 24 часа (d) или на 7-й день (е) после инъекции TRAIL печень вырезали. Парафиновые срезы окрашивали Н&E и фотографировали при 100х (верхняя панель) и 400х (нижняя панель).
Фигура 14 представляет серию графиков, на которых показано, что активированные Т-клетки и В-клетки, выделенные из человеческих МКПК, экспрессируют повышенные уровни DR5, как было определено с помощью проточной цитометрии для покоящихся (незаштрихованные) и активированных (заштрихованные) клеток.
Фигура 15 представляет графики жизнеспособности, выражающие зависимость от концентрации TRA-8 для очищенных Т-клеток и В-клеток, представленных на фиг.14, которые были стимулированы анти-CD3 или анти-μ антителом в течение 48 часов, бластные клетки, собранные при различной плотности Фиколл-Пак. Жизнеспособность клеток определяли с помощью анализа ATPLite.
Фигура 16 представляет собой гистограмму и графики проточной цитометрии, иллюстрирующие экспрессию CD3 в популяции лимфоцитах, отобранных в клеточном сортере с дискриминационным окном, для мышей NOD/SCID с дефицитом NK-клеток, которым были инъецированы МКПК и TRA-8 или IgG (контроль).
Фигура 17 иллюстрирует CD3- и TUNEL-окрашенные макрофаги для ткани мышиной селезенки, как подробно описано в примере 13.
Фигура 18 представляет график цитотоксичности для клеток хронического лимфолейкоза (ХЛЛ) и для нормальных В-клеток человека в присутствии TRA-8, BISVIII и их комбинации.
Подробное описание изобретения
Неспособность клеток к элиминации обусловлена нарушениями в апоптоз-индуцирующей системе, которая ассоциируется с дефектами, включая, например, нарушение экспрессии или функции лиганда, рецептора или внутриклеточных регуляторных или эффекторных молекул. Настоящее изобретение относится к способу коррекции дефицитной апоптоз-индуцирующей системы, а также выявления конкретных дефектов, присущих данной дефицитной апоптоз-индуцирующей системе.
Настоящее изобретение относится к новому классу моноклональных антител, которые обладают селективной in vivo и in vitro апоптоз-индуцирующей активностью против специфических TRAIL-рецепторов, включая DR5, DR4, DcR1 и DcR2. Антитело настоящего изобретения может быть использовано в качестве реагента для исследования передачи сигнала апоптоза, а также в качестве терапевтически эффективного реагента против клеток, экспрессирующих TRAIL-рецепторы, включая, например, широкий класс злокачественных клеток, систему нарушения регуляции апоптоза и аномально пролиферирующие синовиальные клетки, ассоциированные с аутоиммунными заболеваниями. Антитела настоящего изобретения специфически связываются с конкретными типами TRAIL-рецепторов независимо от гомологии между ними. Антитела настоящего изобретения направлены на апоптоз только тех клеток, которые экспрессируют целевой TRAIL-рецептор, или альтернативно, эти антитела блокируют TRAIL-апоптоз клеток, экспрессирующих рецептор-мишень.
Моноклональное антитело против DR5 настоящего изобретения служит сильным индуктором апоптоза клеток, экспрессирующих DR5 in vitro, и сильным индуктором апоптоза in vivo. гуманизированные фрагментарные CDR-последовательности, привитые к каркасам гуманизированного антитела и гибридный белок антител против DR5 настоящего изобретения обладают аналогичными апоптотическими свойствами.
До настоящего времени не было получено моноклонального антитела, которое связывается с DR5 клеточной поверхности и индуцирует апоптоз клеток, экспрессирующих DR5 как in vitro, так и in vivo в отсутствие перекрестносвязывающего агента. Настоящее изобретение относится к анти-DR5 антителу, действующему как терапевтический агент у животных с моделью заболевания, таких как животные с ксенотрансплантатом, или in vivo. Было показано, что хотя растворимый TRAIL эффективно индуцирует апоптоз опухолевых клеток in vivo, однако его цитолитическая активность является очень низкой, а поэтому часто необходимо вводить большие и повторные дозы [13]. TRA-8, который является одним из серии анти-DR5 антител настоящего изобретения, является фармацевтически эффективным у животных, несущих трансген человеческого DR5, и может быть использован для создания модели в целях изучения роли DR5 и TRAIL.
Антитело настоящего изобретения, вырабатываемое против TRAIL-рецептора, выделяют из экспериментального животного в соответствии с настоящим изобретением. Благодаря гуманизации антитела настоящего изобретения, при котором сохраняется связывающая активность рецептора и в то же время вырабатывается ослабленный и терапевтически толерантный иммунный ответ в организме человека, такое гуманизированное антитело против TRAIL-рецептора настоящего изобретения может быть использовано в качестве терапевтического агониста или антагониста для данного TRAIL-рецептора. Антитело настоящего изобретения может действовать как терапевтический агент in vivo, поскольку в данном случае не требуется "второго" перекрестносвязывающего антитела против TRAIL-рецептора.
Настоящее изобретение не ограничивается лишь одним антителом против TRAIL-рецептора, обладающим агонистическим или антагонистическим апоптотическим действием. Наоборот, предпочтительно, чтобы два или несколько антител против TRAIL-рецептора контактировали с клеточной культурой in vivo или тканью организма индивидуума in vivo для достижения синергического терапевтического действия. Так, например, клеточная линия глиомы U87 и гемопоэтические клеточные линии U937 и Molt-4 чувствительны к синергическому действию агонистических анти-DR4 и анти-DR5 антител, тогда как их обработка только агонистическим анти-DR5 антителом дает лишь ограниченный эффект в индуцировании апоптоза.
Кроме того, антагонистические антитела против TRAIL-рецептора настоящего изобретения особенно эффективны в том случае, когда это антитело специфически связывается с одним из рецепторов-ловушек DcR1, DcR2 или OPG. Селективное блокирование рецептора-ловушки антителом настоящего изобретения эффективно в клетках таких типов, которые экспрессируют рецепторы-ловушки со сдвигом равновесия TRAIL-связывания в сторону тех TRAIL-рецепторов, которые способны передавать сигнал апоптоза клеток. Таким образом, в другой комбинированной терапии настоящего изобретения антитело, связывающееся с рецептором-ловушкой, сенсибилизирует экспрессирующую клетку в отношении агонистического связывания с TRAIL-рецептором, передающим сигнал апоптоза.
В другом варианте своего осуществления настоящее изобретение относится к способу выявления агонистических и антагонистических эпитопов данного TRAIL-рецептора. Кроме того, в соответствии с настоящим изобретением с использованием панели моноклональных антител, каждое из которых имеет отличающуюся вариабельную или CDR-область, может быть выявлен полиморфизм между индивидуумами, ассоциированный с данным TRAIL-рецептором. Охарактеризованная панель моноклональных антител позволяет определить агонистические и антиагонистические эпитопы и полиморфизм. Таким образом, панель моноклональных антител настоящего изобретения может быть использована для получения лекарственного средства и/или для выявления индивидуума с предрасположенностью к заболеванию.
В другом варианте осуществления изобретения настоящее изобретение относится к гибридным белкам, включающим антигенный фрагмент TRAIL-рецептора, связанного с белком иммуноглобулина, его полипептидом или фрагментом. "Фрагмент TRAIL-рецептора" означает фрагмент, содержащий достаточное число оснований для вырабатывания иммуногенного ответа к нативному TRAIL-рецептору, экспрессируемому на поверхности клеток индивидуума. Фрагмент гибридного TRAIL-рецептора включает, по крайней мере, десять аминокислот. "Гибридный белок иммуноглобулина или его фрагмент" означает нативный или синтетический сегмент белка или полипептида, имеющий определенное число аминокислотных оснований, достаточное для активации каскада реакций иммуногенного ответа у индивидуума. Иммуноген настоящего изобретения, включающий гибрид фрагмента TRAIL-рецептора, связанного с иммуноглобулиновым фрагментом, может быть использован в качестве in vivo-терапевтического средства для вырабатывания антитела против TRAIL-рецептора in situ у индивидуума.
В еще одном варианте осуществления изобретения настоящее изобретение относится к генной терапии. В генной терапии как аспекте настоящего изобретения клетки-мишени трансфицируют вектором, несущим экспрессируемую последовательность, соответствующую TRAIL-рецептору. При этом используется стандартный вектор, который выбирают исходя из чувствительности клеток-мишеней к данному вектору. Векторами для генной терапии является, например, аденовирус, pAdCMV5. После экспрессии клетками-мишенями или тканями трансфицированного TRAIL-рецептора эти клетки или ткани обрабатывают антителом настоящего изобретения, специфичным к связыванию с указанным трансфицированным TRAIL-рецептором. Следует отметить, что антитело против TRAIL-рецептора является либо агонистом, либо антагонистом в зависимости от нужного терапевтического результата.
Антитела настоящего изобретения могут также действовать в сочетании с сенсибилизатором. Используемый здесь термин "сенсибилизатор" означает любой стимулятор, который индуцирует апоптоз, включая ультрафиолетовый свет, органические молекулы, включая конкретно класс бисиндолмалеимидов, тяжелые металлы и молекулы свободных радикалов.
Что касается терапии злокачественных опухолей, то антитело TRA-8 способно индуцировать апоптоз большинства TRAIL-чувствительных опухолевых клеток каспазо-зависимым способом в отсутствие "второго" перекрестносвязывающего агента. TRA-8 обладает сильной тумороцидной активностью in vivo. Способность TRA-8 индуцировать апоптоз большинства TRAIL-чувствительных клеток подтверждает, что для стимуляции апоптоза достаточно одного DR5. Большинство подробно описанных здесь опухолевых клеток экспрессируют DR5 на своей поверхности и их чувствительность к TRA-8-индуцированной клеточной гибели коррелирует с их чувствительностью к TRAIL, что указывает на то, что DR5 является главным рецептором гибели для TRAIL-опосредованного апоптоза у большинства опухолевых клеток. Таким образом, дифференциальная экспрессия DR5 нормальными и раковыми клетками играет определенную роль в селективности TRAIL-опосредованного апоптоза. TRA-8 "обходит" рецепторы-ловушки, индуцирующие TRAIL-опосредованный апоптоз. Лишь незначительное количество TRAIL-резистентных опухолевых клеток являются чувствительными к TRA-8, однако это сидетельствует о том, что указанные рецепторы-ловушки, очевидно, не играют главной роли в резистентности опухолевых клеток к TRAIL-опосредованному апоптозу.
Хотя предварительные исследования показали, что системное введение животным растворимой формы TRAIL индуцирует регрессию опухоли, не оказывая, при этом токсического действия [3,4,22], однако мембрано-ассоциированная форма человеческого TRAIL вызывает повреждение печени у мышей, как показано в настоящем описании. Однако токсичность TRAIL для печени является гораздо менее сильной, чем токсичность Fas-лиганда, на что указывала меньшая чувствительность нормальных гепатоцитов к TRAIL-индуцированному поражению по сравнению с лигандом Fas и отсутствие летального воздействия TRAIL in vivo. Таким образом, титрование TRAIL может быть использовано в противораковой терапии.
В настоящей заявке было подробно показано отсутствие значительных уровней экспрессии белка DR5 нормальными гепатоцитами и такое отсутствие ассоциируется с резистентностью гепатоцитов к TRA-8-индуцированному апоптозу. Перекрестное связывание DR5 с моноклональным антителом недостаточно для образования гомополимерных форм рецептора гибели, способного стимулировать апоптоз. Эксперименты на обезьянах-ингрунках не обнаружили токсического воздействия TRA-8 на печень при его введении. Таким образом, агонистическое моноклональное антитело против DR5, вероятно, является более селективным и более безопасным в качестве терапевтического агента, чем растворимый TRAIL.
Настоящее изобретение может быть с успехом использовано в скринирующем анализе для детекции небольших скоплений злокачественных клеток, которые еще могут иметь нормальную клеточную морфологию. Окрашивание in situ клеточных срезов злокачественных опухолей человека, включая рак легких, предстательной железы и печени, мечеными антителами настоящего изобретения позволяет легко идентифицировать раковые клетки. Наблюдалось, что эти раковые клетки экспрессируют очень высокие уровни DR5 по сравнению с нормальными клетками того же типа. Таким образом, настоящее изобретение может быть использовано в качестве чувствительного метода скрининга для обнаружения злокачественных опухолей на ранней стадии в тканях, включая, по крайней мере, легкие, предстательную железу и печень. Терапевтический способ, подробно описанный в настоящей заявке, направлен на ингибирование пролиферации аномальных клеток, ассоциированной с такими заболеваниями, как, например, рак и лимфолейкоз.
Подробно описанное здесь изобретение, в частности, относится к моноклональному антителу против DR5 человека, обозначенному TRA-8 и депонированному в АТСС под регистрационным номером РТА-1428. Следует отметить, что подробно описанные здесь способы и результаты, относящиеся к агонистическому моноклональному антителу против DR5 человека, TRA-8, в целом, могут иметь отношение и применение к антагонистическим антителам DR5, а также к антителам, вырабатываемые против DR4, DcR1 и DcR2, действующим как агонисты, так и антагонисты.
Уровни экспрессии рецептора апоптоза, такого как Fas, необязательно должно коррелировать с чувствительностью клеток к апопотозу. Предполагается, что в случае TRAIL-опосредованного апоптоза экспрессия рецепторов-ловушек для TRAIL влияет на чувствительность этих клеток. Кроме того, было высказано предположение, что DR5 должен быть ассоциирован с DR4 для эффективной передачи сигнала апоптоза по пути, в котором участвует FADD и каспаза 8. Присутствие агонистического моноклонального антитела против DR5 позволяет оценить регуляцию передачи сигнала DR5 и его относительную роль в TRAIL-опосредованном апоптозе. Сравнение чувствительности этих клеток к TRA-8-опосредованному апоптозу с их чувствительностью к TRAIL-опосредованному апоптозу позволяет понять роль DR5 в TRAIL-опосредованном апоптозе и механизмы, которые могут влиять на чувствительность клеток.
Таким преимуществом обладают в основном гуманизированные антитела против DR5 настоящего изобретения. Молекулярный клон антитела против DR5 получают известными методами, подробно описанными в нижеследующих примерах. Для конструирования последовательностей нуклеиновой кислоты, кодирующих молекулу моноклонального антитела или его антигенсвязывающую область, используется описанная здесь техника рекомбинантных ДНК [33].
Настоящее изобретение позволяет конструировать гуманизированные антитела против TRAIL-рецептора, которые, по всей вероятности, не индуцируют ответ в виде вырабатывания человеческого антитела против мышиного иммуноглобулина (называемого далее НАМА) [34], но которые при этом обладают эффективной эффекторной функцией антитела. Применяемые здесь термины "человеческие" и гуманизированные, относятся к любому антителу, которое, как предполагается, продуцирует слабый терапевтически допустимый иммуногенный ответ у человека.
Настоящее изобретение относится к анти-DR5 антителу, гуманизированному антителу против DR5, к тяжелой и легкой цепи иммуноглобулинов TRA-8 и к тяжелой и легкой цепи гуманизированных иммуноглобулинов. Некторые усеченные варианты этих белков или генов осуществляют регуляторную или ферментную функцию белка или гена с полноразмерной последовательностью. Так, например, последовательности нуклеиновой кислоты, кодирующие эти белки, могут быть модифицированы путем замен, добавлений, делеций или мультимерной экспрессии, которая обеспечивает функциональность эквивалентных белков или генов. Вследствие вырожденности кодирующих последовательностей нуклеиновой кислоты для осуществления настоящего изобретения могут быть использованы другие последовательности, которые кодируют аминокислотные последовательности, в основном аналогичные аминокислотным последовательностям природных белков. Такими последовательностями являются, но не ограничиваются ими, последовательности нуклеиновой кислоты, включающие всю последовательность нуклеиновой кислоты или ее части, кодирующие вышеуказанные полипетиды, которые являются модифицированными вследствие замены различных кодонов, кодирующих функционально эквивалентный аминокислотный остаток в данной последовательности, в результате чего продуцируется молчащая мутация. Следует отметить, что нуклеотидная последовательность иммуноглобулина настоящего изобретения допускает изменение гомологии последовательности вплоть до 25%, как было вычислено стандартными методами ("Current Methods in Sequence Comparison and Analysis", Macromolecule Sequencing and Synthesis, Selected Methods and Applications, pp. 127-149, 1998, Alan R. Liss, Inc.), при условии, что такой вариант образует функциональное антитело, которое распознает TRAIL-рецептор DR5. Так, например, один или несколько аминокислотных остатков в полипептидной последовательности могут быть заменены другой аминокислотой с аналогичной полярностью, которая действует как функциональный эквивалент, в результате чего образуется молчащая альтерация. Аминокислоты для замены в данной последовательности могут быть выбраны из других членов класса, к которому принадлежит данная аминокислота. Так, например, неполярными (гидрофобными) аминокислотами являются аланин, лейцин, изолейцин, валин, пролин, фенилаланин, триптофан и метионин. Полярными нейтральными аминокислотами являются глицин, серин, треонин, цистеин, тирозин, аспарагин и глутамин. Положительно заряженными (основными) аминокислотами являются аргинин, лизин и гистидин. Отрицательно заряженными (кислотными) аминокислотами являются аспарагиновая кислота и глутаминовая кислота. В объем настоящего изобретения входят также белки или их фрагменты или производные, которые дифференциально модифицируются во время или после трансляции, например, путем гликозилирования, протеолитического расщепления, связывания с молекулой антитела или с другими клеточными лигандами и т.п. Кроме того, рекомбинантный вектор, содержащий последовательности нуклеиновой кислоты, кодирующие анти-DR5 антитела настоящего изобретения, могут быть сконструированы так, чтобы это приводило к модификации процессинга или экспрессии вектора.
Кроме того, для облегчения последующей in vitro-модификации последовательность нуклеиновой кислоты, кодирующая ингибитор, может быть мутирована in vitro или in vivo для создания и/или разрушения сайтов трансляции, инициации и/или терминации, или для создания модификаций в кодирующих областях, и/или образования новых сайтов рестриктирующих эндонуклеаз, или для разрушения уже имеющихся сайтов. Для этого могут быть использованы любые методы мутагенеза, известные впециалистам, включая, но не ограничиваясь ими, сайт-направленный мутагенез in vitro, J.Bio.Chem. 253:6551, использование линкеров Tab (Pharmacia) и т.п.
Данные рентгеновского кристаллографического анализа показали, что укладка цепи иммуноглобулина обычно образует длинную цилиндрическую структуру, включающую два слоя антипараллельных β-складок, каждая из которых состоит из трех или четырех β-цепей. В вариабельной области три петли от каждого из V-доменов кластера Н- и L-цепей вместе образуют антиген-связывающий центр. Каждая из этих петель завершается гипервариабельным участком (CDR - определяющим комплементарность участком). CDR имеют наиболее высокую степень вариабельности в аминокислотной последовательности антитела. Участки вариабельной области, которые не являются частью CDR, называются "каркасными участками" ("FR"-участки) и обычно играют определенную роль в сохранении структуры CDR. В целях сохранения связывающей области для области эпитопа TRAIL-рецептора предпочтительно, чтобы все CDR от данного антитела были привиты к акцепторному антителу. Следует отметить, что в данном случае часть от общего количества CDR переносят донору. Следует отметить, что такой перенос в основном позволяет осуществлять замену одного остатка на другой, одной аминокислоты или ее области на другую. Однако иногда, а особенно при переносе определенной области один или несколько остатков могут быть добавлены, либо делетированы, либо заменены другим остатком, если это необходимо, и такие делеции и инсерции, а также соответствующие замены и инверсии являются очевидными для каждого специалиста. Антитело настоящего изобретения получают, например, путем встраивания каждой CDR-области субъединицы L-цепи и Н-цепи моноклонального антитела против TRAIL-рецептора в соответствующую CDR-область человеческого антитела, что приводит к гуманизации мышиного моноклонального антитела, эффективного по отношению к TRAIL-рецептору.
Фрагменты антитела, которые содержат идиотип указанной молекулы, также генерируют и применяют в настоящем изобретении с использованием известной техники. Так, например, указанными фрагментами являются: (АВ')2-фрагмент против TRAIL-рецептора, который может быть продуцирован путем гидролиза молекулы антитела пепсином; АВ'-фрагменты антитела против TRAIL-рецептора, генерированные путем восстановления дисульфидных мостиков (АВ')2-фрагмента против TRAIL-рецептора; и фрагмент антитела, который генерируют путем обработки указанной молекулы антитела папаином и восстановителем.
В частности, моноклональное антитело TRA-8 против DR5 может быть получено путем культивирования гибридомы, которая в свою очередь может быть получена путем иммунизации мыши человеческим DR5, а затем путем слияния клеток селезенки или клеток лимфоузлов, взятых у мыши, с клетками мышиной миеломы.
Получение моноклонального антитела включает, например, следующие стадии:
а) очистка биологической макромолекулы для использования в качестве иммунизирующего антигена;
b) получение антитело-продуцирующих клеток после первой иммунизации соответствующего животного путем его инфицирования антигеном с последующим взятием крови у этого животного и анализом на титр антитела, для того чтобы определить, когда нужно удалять селезенку;
с) получение клеток миеломы;
d) слияние антитело-продуцирующих клеток с миеломными клетками;
е) отбор гибридомы, продуцирующей нужное антитело;
f) получение единого клеточного клона (клонирование);
g) необязательно культивирование гибридомных клеток или выращивание животных, которым были трансплантированы гибридомные клетки, для крупномасштабного продуцирования моноклонального антитела; и
h) тестирование полученного таким образом моноклонального антитела на биологическую активность и специфичность либо проведение анализа на свойства агента-маркера.
Общая процедура получения моноклонального анти-DR5 антитела более подробно описана ниже в соответствии с каждой из вышеуказанных стадий. Этот метод получения антитела настоящего изобретения приводится лишь для иллюстрации способов получения антитела и не является ограничивающим. При этом могут быть использованы и другие известные процедуры или нижеследующий модифицированный метод, где, например, вместо клеток селезенки и миеломы используются антитело-продуцирующие клетки.
а) Получение антигена
Рекомбинантный белок (называемый далее "рекомбинантным человеческим DR5"), который является эффективным в качестве антигена, получают путем трансфекции клеток QBI-293А экспрессирующим вектором pAdDR5-IgG для гибридного белка, содержащего внеклеточный домен человеческого DR5 и Fc-область человеческого антитела IgG1 (далее обозначаемого "IgG") (см. РТА-1428) в целях его экспрессии с использованием набора ADENO-Quest (Quantum Biotechnologies Inc., Canada) с последующим сбором и частичной очисткой продукта экспрессии. Плазмиду pAdDR5-IgG конструируют путем инсерции ДНК, кодирующей гибридный белок, содержащий человеческий DR5 и человеческий IgG, в pAdСМV5, которая является экспрессирующим вектором для клеток животных. В данной работе могут быть использованы и другие материалы, такие как ДНК, кодирующая DR5, вектор и клетка-хозяин.
Гибридный белок "DR5 и IgG человека", продуцированный в супернатанте культуры клеток QBI-293А, трансфицированных вектором pAdDR5-IgG, может быть частично очищен аффинной хроматографией на белок А-сефарозе, аффинной хроматографией на белок G-сефарозе или ионообменной хроматографией на колонке с Resource Q (торговый знак: Pharmacia).
Альтернативно очищенный DR5, полученный из мембран клеточной линии человека, используется в качестве антигена. Кроме того, поскольку первичная структура DR5 известна (см., РТА-1428), то пептид, содержащий аминокислотную последовательность SEQ ID No:1, может быть химически синтезирован известным методом, таким как метод Сэнгера, и использован в качестве антигена.
b) Получение антитело-продуцирующих клеток
Мышь иммунизируют иммуногеном, продуцированным в стадии (а) и смешанным с адъювантом, таким как полный или неполный адъювант Фрейнда или квасцы. Другими подходящими экспериментальными животными являются, например, крысы, морские свинки, кролики, собаки, куры, лошади, свиньи, коровы и овцы.
Подходящими способами введения иммуногена для иммунизации экспериментального животного являются подкожная, внутрибрюшинная, внутривенная, чрескожная и внутримышечная инъекция, при этом предпочтительной является подкожная и внутрибрюшинная инъекция.
Иммунизация может быть проведена путем введения разовой дозы или нескольких многократных доз через соответствующие интервалы времени (предпочтительно 1-5 недель). Затем проводят мониторинг мммунизированных животных на титр антитела в их сыворотке и животное с достаточно высоким титром антител отбирают в качестве источника антитело-продуцирующих клеток. Отбор животного с высоким титром антител делает последующий процесс более эффективным. Клетки для последующего слияния обычно собирают от животного через 3-5 дней после последней иммунизации.
Методы анализа на титр антител представляют собой хорошо известную технику, такую как радиоиммуноанализ (далее обозначаемый "RIA"), твердофазный иммуноферментный анализ (далее обозначаемый "ELISA"), флуоресцентный анализ с использованием антитела и анализ на пассивную гемагглютинацию, при этом предпочтительными являются RIA и ELISA благодаря их детектирующей чувствительности, быстроте, точности и возможности автоматизации.
Определение титра антител может быть осуществлено, например, с помощью ELISA следующим образом. Сначала очищенный или частично очищенный DR5 адсорбируют на твердофазной поверхности, такой как 96-луночный планшет для ELISA, а затем остальную поверхность, с которой DR5 не связывается, блокируют белком, не являющимся родственным антигену, таким как альбумин бычьей сыворотки (BSA). После промывки для осуществления связывания анти-DR5 антитела в образцах с антигеном поверхность лунок подвергают контакту с серийно разведенными образцами мышиной сыворотки. Для связывания с мышиным антителом добавляют меченное ферментом антитело против мышиного иммуноглобулина в качестве "второго" антитела. После промывки добавляют субстрат для фермента и титр антитела оценивают путем определения изменения оптической плотности вследствие развития окраски, вызываемой изменением субстрата или т.п.
с) Получение миеломных клеток
В качестве источника миеломных клеток служат клетки от полученных мышиных клеточных линий, включая, например, 8-азагуанин-резистентную мышь, происходящую от миеломных штаммов BALB/c, Р3Х63Аg8U.1 (P3-U1) [35], P3/NSI/1-Ag4-1 (NS-1) [36], Sp2/O-Ag14(SP-2) [37], Р3Х63Аg8.653 (653) [38] и Р3Х63Аg8 (X63) [39]. Выбранную клеточную линию серийно переносят в соответствующую среду, такую как 8-азагуаниновая среда. 8-азагуаниновая среда включает среду Дульбекко, модифицированную по способу Исков (обозначаемую далее "IMDM") или модифицированную по способу Дульбекко среду Игла (обозначаемую далее "DMEM"). В среду RPMI-1640 были добавлены глутамин, 2-меркаптоэтанол, гентамицин, фетальная телячья сыворотка (далее обозначаемая "FCS") и 8-азагуанин. А затем, за 3-4 дня до слияния, для обеспечения в день слияния полотности, по крайней мере, 2 х 107 клеток эти клетки переносят в нормальную среду, такую как среда ASF104 (Ajinomoto, К.К.), содержащая 10% FCS.
(d) Слияние клеток
Для продуцирования антитела в качестве клеток-предшественников клеток используют лимфоциты или клетки плазмы, полученные из любой подходящей части организма животного. Такими источниками лимфоцитов или клеток плазмы являются, например, селезенка, лимфатические узлы, периферическая кровь или любая их подходящая комбинация, при этом чаще всего используют клетки селезенки.
После последней бустер-инъекции для получения антитело-продуцирующих клеток у мыши, имеющей предварительно определенный титр антител, удаляют ткань, в которой присутствуют антитело-продуцирующие клетки. В современной предпочтительной технике слияния клеток селезенки с клетками миеломы, полученными, как описано в стадии (с), используют полиэтиленгликоль.
Указанная техника слияния предусматривает промывку клеток селезенки и миеломы бессывороточной средой (такой как RPMI-1640) или забуференным фосфатом физиологическим раствором (обозначаемым далее "PBS") и их смешивание, так чтобы отношение клеток селезенки к клеткам миеломы составляло приблизительно 5:1 - 10:1, после чего клетки центрифугируют. Затем супернатант отбрасывают и осажденные клетки в достаточной степени разрыхляют, после чего, перемешивая, по каплям добавляют 1 мл, бессывороточной среды, содержащей 50% (мас./об.) полиэтиленгликоля (Mw 1000 - 4000). Затем медленно добавляют 10 мл бессывороточной среды, после чего смесь центрифугируют. Супернатант снова отбрасывают, а осажденные клетки суспендируют в соответствующем количестве среды НАТ, содержащей раствор гипоксантина, аминоптерина и тимидина (обозначаемый далее "НАТ") и мышиный интерлейкин-2 (обозначаемый далее "IL-2"). Затем суспензию распределяют по лункам планшетов для культивирования (называемых далее просто "планшетами") и инкубируют в присутствии 5% об./об. СО2 при 37оС, примерно в течение 2 недель с добавлением, если необходимо, среды НАТ.
е) Отбор гибридом
Если используемый штамм миеломы является резистентным к 8-азагуанину, то есть если он является дефицитным по ферменту гипоксантин-гуанин-фосфорибозилтрансферазе (HGPRT), то любые неслитые миеломные клетки и любые гибриды миелома-миелома неспособны выживать в среде НАТ. С другой стороны, гибриды антитело-образующих клеток, образуемых друг с другом, а также гибридомы, образованные антитело-продуцирующими клетками и миеломными клетками, могут выживать в этой среде, причем первые имеют лишь ограниченное время жизни. В соответствии с этим продолжительное инкубирование в среде НАТ приводит к отбору лишь нужных гибридом.
Затем полученные гибридомы выращивают до образования колоний, которые затем переносят в среду НАТ, не содержащей аминоптерина (среда НТ). Затем берут аликвоты супернатанта культуры для определения титра антитела против Fas, например, с помощью ELISA. Если в качестве ELISA-антигена используют вышеуказанный рекомбинантный гибридный белок, то необходимо также удалить клоны, продуцирующие антитело, которое специфически связывается с Fc-областью IgG1 человека. Присутствие или отсутствие такого клона может быть проверено, например, с помощью ELISA с использованием Fas-IgG1 или IgG1 в качестве антигена.
f) Клонирование
Гибридомы, которые продуцируют специфические антитела, как было показано с использованием метода, аналогичного описанному в стадии (b) для определения титра антитела, затем переносят на другой планшет для клонирования. Подходящими методами клонирования являются: метод предельных разведений, в котором гибридомы разводят так, чтобы на одну лунку планшета приходилась одна клетка, а затем культивируют; метод с использованием мягкого агара, в котором колонии выделяют после культивирования с среде с мягким агаром; метод с использованием микроманипулятора для выделения одиночной клетки для культивирования; и "сортировка клона", в котором одиночные клетки разделяют на клеточном сортере.
Процедуру клонирования, осуществляемую, например, методом лимитирующих разведений, повторяют 2-4 раза для каждой лунки, обнаруживающей определенный титр антител; и клоны, имеющие стабильные титры антител, отбирают в качестве гибридом, продуцирующих моноклональное анти-DR5 антитело. Гибридомы, продуцирующие антитело против мышиного DR5, отбирают аналогичным способом для получения клеточной линии, продуцирующей моноклональное антитело против DR5.
Гибридома "мышь-мышь" TRA-8, на основе которой получают антитела настоящего изобретения, была депонирована 1 марта 2000 г. в Американской коллекции типовых культур под регистрационным номером РТА-1428. В соответствии с этим получение антитела с использованием гибридомы "мышь-мышь" TRA-8 или любой другой полученной гибридомы может быть достигнуто в соответствии с процедурой, описанной ниже в стадии (g), без осуществления стадий (а) -(f).
g) Культивирование гибридомы для получения моноклонального антитела
Гибридому, полученную путем клонирования, затем культивировали не в среде НТ, а в нормальной среде. Крупномасштабное культивирование осуществляют в культуральных роллер-флаконах с использованием либо культуральных флаконов больших размеров, либо центрифуги для культивирования. Затем супернатант от крупномасштабной культуры собирают и очищают подходящим методом, таким как гель-фильтрация, хорошо известным специалистам, в целях получения моноклонального антитела против DR5, которое было взято за основу для получения антител настоящего изобретения. Гибридома может быть также выращена внутрибрюшинно в сингенной мыши, такой как мышь BALB/c или "голая" ("nu/nu", т.е. бестимусная) мышь, для получения асцитной жидкости, содержащей моноклональное анти-DR5 антитело в больших количествах. Для очистки собранных антител обычно используются имеющиеся в продаже готовые наборы для очистки моноклональных антител (например, MAbTrap GII Kit; Pharmacia).
Моноклональные антитела, полученные как описано выше, обладают высокой специфичностью по отношению к человеческому DR5.
(h) Анализ моноклонального антитела
Подходящими методами идентификации изотипа и подкласса моноклонального антитела являются метод Ухтерлони, ELISA и RIA. Для идентификации предпочтительно использовать коммерческий набор, такой как Mouse Typer Kit (торговый знак; BioRad).
Количественная оценка белка может быть осуществлена, например, методом Folin-Lowry, или путем вычисления исходя из оптической плотности при 280 нм (1,4 (OD280) = 1 мг/мл иммуноглобулина).
Идентификация эпитопа, распознаваемого моноклональным антителом, может быть осуществлена следующим образом. Сначала получают различные частичные структуры молекулы, распознаваемые моноклональным антителом. Эти частичные структуры получают методом, в котором различные отдельные пептиды данной молекулы получают синтетически известными методами олигонуклеотидного синтеза или методом, в котором ДНК, кодирующую нужный полипептидный фрагмент, встаривают в подходящую экспрессирующую плазмиду и экспрессируют в подходящем хозяине, таком как E.coli, с получением пептидов. Обычно для осуществления вышеуказанной цели эти оба метода часто используются в комбинации друг с другом. Так, например, серии полипептидов, имеющих соответственно уменьшенные длины и "функционирующих" от С- или N-концов антигенного белка, могут быть получены стандартными методами генной инженерии. Путем установления, какие именно из фрагментов реагируют с антителом, может быть получено приблизительное представление о локализации эпитопа.
Этот эпитоп может быть более точно идентифицирован путем синтеза ряда более мелких олигопептидов, соответствующих данному пептиду или мутантам этого пептида с использованием стандартных методов олигопептидного синтеза в целях определения способности связывания указанных пептидов с моноклональным антителом против DR5, которое было взято за основу для получения антитела настоящего изобретения, или пептидов, и оценки конкурентного ингибирования связывания данного пептида для антигена с моноклональным антителом. Для получения широкого ряда олигопептидов, могут быть использованы коммерчески доступные наборы, такие как SPOTs Kit (Genosys Biotechnologies, Inc.) и серии наборов для синтеза пептида мультипина, основанного на методе синтеза мультипина (Chiron Corp.).
Антитело настоящего изобретения имеет различные функциональные свойства (а)-(f), описанные ниже, каждое из которых может быть подтверждено, например, методом описанным ниже.
а) Специфическое связывание TRA-8 с клетками, экспрессирующими DR5 человека
Отличительным признаком настоящего изобретения является способность DR5 связываться с клеточной поверхностью. Это было продемонстрировано в анализе клеток, экспрессирующих DR5, методом проточной цитометрии. Во-первых, специфическое связывание клеточной поверхности с DR5 было подтверждено на клетках Cos-7, трансфицированных полноразмерной кДНК, кодирующей DR5 человека. В частности, TRA-8 распознает лишь клетки Cos-7, трансфицированные рецептором DR5, но не пустым контрольным вектором или вектором, кодирующим DR4. Во-вторых, были протестированы три различных источника: гемопоэтические клетки, клетки глиомы и злакачесвтенные опухолевые клетки злокачественной опухоли предстательной железы человека. Большинство из указанных трансформированных опухолевых клеток экспрессировали значительные уровни DR5 клеточной поверхности, хотя эти уровни экспрессии значительно варьировались. И в-третьих, были оценены две панели первичных синовиальных клеток фибробластов человека, взятых у пациентов с РА и ОА. Все синовиальные клетки РА экспрессировали значительно более высокие уровни DR5, чем клетки ОА.
b) Индуцирование апоптоза злокачественнывх опухолевых клеток человека in vitro в отсутствие перекрестносвязывающего агента
Способность антител, продуцированных в соответствии с настоящим изобретением, распознавать TRAIL-рецептор и непосредственно индуцировать апоптоз злокачественных опухолевых клеток человека определяют с помощью анализа на жизнеспособность клеток (ATPLite) в процессе in vitro-культивирования клеток с различными концентрациями антитела, а в частности, TRA-8. Большинство опухолевых клеток чувствительны к TRA-8-индуцированному апопотозу. У некоторых клеток TRA-8 обнаруживает сильную апоптоз-индуцирующую активность, например, TRA-8 обладает способностью индуцировать апоптоз человеческих клеток Jurkat на пг/мл-уровнях. Важно отметить, что TRA-8-индуцированный апоптоз не требует перекрестного связывания, а у большинства клеток TRA-8 обнаруживает более сильную апопотоз-индуцирующую активность, чем рекомбинантный растворимый TRAIL в присутствии энхансера.
с) Туморицидная активность TRA-8 in vivo
Туморицидную активность TRA-8 оценивали для двух SCID-моделях с опухолевыми клетками человека. Сначала мышей SCID внутривенно инокулировали клетками человеческого лейкоза Jurkat и обработывали одной дозой (100 мкг) TRA-8. Результаты показали, что при обработке TRA-8 большинство имплантированных клеток Jurkat были элиминированы из периферической крови и селезенки, как было определено в анализе методом проточной цитометрии и путем иммуногистохимического окрашивания in situ клеток Jurkat. Затем мышам SCID подкожно инокулировали клетки астроцитомы человека, 1321N1, и мышей с опухолью обрабатывали одной дозой TRA-8. Рост имплантированных клеток 1321N1 значительно ингибировался у TRA-8-обработанных мышей, как было определено по размеру опухоли и в гистологическом анализе.
d) Идентификация синовиальных клеток РА с использованием TRA-8
Первичные синовиальные клетки, выделенные у 8 пациентов с РА и у 4 пациентов с ОА, тестировали на экспрессию DR5 на клеточной поверхности. TRA-8 давал положительный результат для всех штаммов клеток РА, но отрицательный результат для всех штаммов клеток ОА. Таким образом, РА отличался от ОА по экспрессии на DR5 клеточной поверхности, как было определено с помощью TRA-8.
е) Индуцирование апоптоза в синовиальных клетках фибробластов РА с помощью TRA-8 Способность TRA-8 индуцировать апоптоз синовиальных клеток РА определяют с помощью анализа на жизнеспособность клеток в процессе in vitro-культивирования в присутствии различных концентраций TRA-8. Все клетки РА обнаруживали от высоких до промежуточных уровней чувствительности к 100 нг/мл TRA-8. В противоположность этому все клетки ОА были в основном резистентными к TRA-8-индуцированному апоптозу. Важно отметить, что TRA-8 обнаруживало лучшую апоптоз-индуцирующую активность по отношению к синовиальным клеткам РА, чем растворимый TRAIL с энхансером. Более того, по сравнению с анти-Fas антителом (CH-11) антитело TRA-8 обнаруживало лучшую селективность по отношению к синовиальным клеткам РА.
f) TRA-8 не индуцирует продуцирование ММР в синовиальных клетках РА
Поскольку антитело TRA-8 способно индуцировать активацию NF-kb в синовиальных клетках РА, как и TNF-а, то было оценено влияние TRA-8 на продуцирование ММР1 и ММР3 в синовиальных клетках. Хотя TNF-α индуцирует дозозависимое увеличение ММР, однако TRA-8 не способно индуцировать какое-либо продуцирование ММР, а при определенных концентрациях TRA-8 способствует небольшому снижению продуцирования ММР в синовиальных клетках РА.
g) TRA-8 индуцирует активацию многих каспаз
Поскольку каспазы играют решающую роль в индуцировании апопотоза, то была оценена способность TRA-8 индуцировать активацию касапазы в человеческих клетках Jurkat. При инкубировании клеток Jurkat с низкой дозой (50 нг/мл) TRA-8 активация каспазы 8, каспазы 9 и каспазы 3 наблюдалась, по меньшей мере, через 15 минут после начала инкубирования, как было продемонстрировано в Вестерн-блот-анализе и в анализе на расщепление каспазы. По таким параметрам, как время, количество и сила активации каспазы, антитела настоящего изобретения, включая репрезентативное антитело TRA-8, обнаруживают гораздо большую активность, чем любые другие апоптоз-индуцирующие антитела, такие как антитело против человеческого Fas (СН-11).
Таким образом, антитело настоящего изобретения представляет собой вещество, обладающее способностью селективно индуцировать апоптоз в патогенных клетках, как показано пунктах (а) и (g). В соответствии с этим оно может быть использовано в качестве профилактического и терапевтического средства для лечения заболеваний, ассоциированных с выживанием нежелательных клеток или с нежелательной пролиферацией клеток, таких как клетки, которым свойственна разрегуляция системы апоптоза, включая систему Fas/лиганда Fas.
Способность антител настоящего изобретения индуцировать апопотоз была подтверждена культивированием клеток, таких как клеточная линия человеческого лейкоза Jurkat (Американская коллекция типовых культур No TID-152) и клеточная линия астроцитомы 1321N1, в среде, в которую был добавлен тестируемый образец, и определением уровня выживаемости этих клеток, например, с помощью анализа ATPLite.
Антитело настоящего изобретения, а в частности антитела против DR5, обладающие почти такой же иммуногенностью для человека, как и человеческие антитела, используется в качестве средства для профилактики или лечения заболеваний, ассоциированных с нежелательным выживанием клеток или с нежелательной пролиферацией клеток, включая клетки, которым свойственна разрегуляция системы апоптоза при аутоиммунных заболеваниях, например, таких как системная красная волчанка, болезнь Хасимото, ревматоидный артрит, реакция "трансплантат против хозяина", синдром Шегрена, пернициозная анемия, болезнь Адиссона, склеродермия, синдром Гудпасчера, болезнь Крона, аутоиммунная гемолитическая анемия, бесплодие, тяжелая псевдопаралитическая миастения, рассеянный склероз, базедова болезнь, тромбоцитопеническая пурпура, инсулинзависимый сахарный диабет; аллергия; атопическая болезнь; артериосклероз; миокардит; кардиомиопатия; гломерулярный нефрит; гипопластическая анемия; отторжение трансплантированного органа и множественные злокачественные опухоли легких, предстательной железы, печени, яичника, лимфатических узлов и молочной железы.
Такое профилактическое или терапевтическое средство может быть введено в различных формах. Подходящими способами введения является пероральное введение лекарственных форм, таких, как таблетки, капсулы, гранулы, порошки и сиропы; или парентеральное введение, например, путем инъекции, капельной инъекции и в виде суппозитории.
Антитело или терапевтическое средство настоящего изобретения могут быть введены перорально, ректально, интрацистернально, интравентрикулярно, интракриниально, интратекально, интравагинально, парентерально (внутривенно, внутримышечно или подкожно), местно (в виде порошков, мазей или капель), внутрибрюшинно, чрескожно, путем ингаляции или в виде буккального или назального спрея. Требуемое точное количество антитела или терапевтического агента может варьироваться для различных индивидуумов в зависимости от возраста, массы тела и общего состояния пациента, от тяжести заболевания, подвергаемого лечению, от локализации и размера опухоли, от конкретно используемых соединений, от способа введения и т.п. Подходящее количество может быть определено самим специалистом путем лишь рутинного экспериментирования. Обычно разовая доза антитела варьируется в пределах от 0,1 мг до 10000 микрограммов, а предпочтительно от 0,1 мг до 100 микрограммов. Типичные концентрации антитела в носителе составляют в пределах от 0,2 до 2000 нанограммов на миллилитр носителя.
В зависимости от предусматриваемого способа введения антитело или терапевтический агент может присутствовать в фармацевтических композициях, изготовленных в виде твердых, полутвердых или жидких лекарственных форм, таких как, например, таблетки, суппозитории, драже, капсулы, порошки, жидкости или суспензии, предпочтительно в виде разовой лекарственной формы, подходящей для однократного введения точной дозы. Такие композиции включают эффективное количество выбранного субстрата в комбинации с фармацевтически приемлемым носителем и, кроме того, они могут включать другие лекарственные средства, фармацевтические агенты, носители или разбавители. Термин "фармацевтически приемлемый" относится к материалу, который не является биологически, или в каком-либо ином отношении, нежелательным и который может быть введен вместе с выбранным субстратом и при этом не оказывает нежелательного биологического действия или не взаимодействует каким-либо иным нежелательным образом с любым из других компонентов фармацевтической композиции, в которой он содержится.
Композиции, подходящие для парентерального введения, могут включать физиологически приемлемые стерильные водные или безводные растворы, дисперсии, суспензии или эмульсии и стерильные порошки для получения стерильных растворов или дисперсий для инъекций. Примерами подходящих водных и безводных носителей, разбавителей, растворителей или носителей являются вода, этанол, полиолы (пропиленгликоль, полиэтиленгликоль, глицерин и т.п.), их подходящие смеси, растительные масла (такие как оливковое масло) и пригодные для инъекций органические сложные эфиры, такие как этилолеат. Присущая им текучесть может быть сохранена, например, путем использования вещества для покрытий, такого как лецитин, путем поддерживания нужного размера частиц в случае дисперсий и путем использования поверхностно-активных веществ.
Указанные композиции могут также содержать адъюванты, такие как консерванты, смачивающие вещества, эмульгаторы и диспергирующие агенты. Для предупреждения воздействия микроорганизмов могут быть использованы различные антибактериальные и противогрибковые агенты, например, парабены, хлорбутанол, фенол, сорбиновая кислота и т.п. Желательно также включать изотонические агенты, например, сахара, хлорид натрия и т.п. Пролонгированная абсорбция фармацевтической формы для инъекций может быть достигнута путем использования веществ, замедляющих абсорбцию, например, моностеарат алюминия и желатин.
Твердыми лекарственными формами для перорального введения являются капсулы, таблетки, драже, порошки и гранулы. В таких твердых лекарственных формах, активное соединение смешано, по крайней мере, с одним инертным стандартным наполнителем (или носителем), таким как цитрат натрия или бифосфат кальция, или (а) с наполнителями или сухими разбавителями, такими как, например, крахмалы, лактоза, сахароза, глюкоза, маннит и кремневая кислота, (b) со связующими веществами, таким как, например, карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и аравийская камедь, (с) с увлажнителями, такими как, например, глицерин, (d) с дезинтеграторами, такими как, например, агар-агар, карбонат кальция, картофельный крахмал или крахмал тапиоки, альгиновая кислота, некоторые комплексные силикаты и карбонат натрия, (е) с замедлителями растворения, такими как, например, парафин, (f) с ускорителями абсорбции, такими как, например, четвертичные аммониевые соединения, (g) со смачивающими агентами, такими как, например, цетиловый спирт, и моностеарат глицерина, (h) с адсорбентами, такими как, например, каолин и бентонит и (i) с замасливателями, такими как, например, тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия или их смеси. В случае использования капсул, таблеток и драже указанные лекарственные формы могут также содержать забуферивающие агенты.
Твердые композиции аналогичного типа могут быть также использованы как наполнители в мягких и твердых желатиновых капсулах с применением таких как наполнителей, как лактоза или молочный сахар, а также высокомолекулярные полиэтиленгликоли и т.п.
Твердые лекарственные формы, такие как таблетки, драже, капсулы, пилюли и гранулы, могут иметь покрытия и оболочки, такие как энтеросолюбильные покрытия и другие покрытия, хорошо известные специалистам. Они могут содержать агент, придающий непрозрачность, а также могут представлять собой такую композицию, которая обеспечивает пролонгированное высвобождение активного соединения или соединений в определенной части желудочно-кишечного тракта. Примерами используемых заливочных композиций являются полимерные вещества и воски. Активные соединения могут также присутствовать в микроинкапсулированной форме, если это необходимо, вместе с одним или несколькими из вышеупомянутых наполнителей.
Жидкими лекарственными формами для перорального введения являются фармацевтически приемлемые эмульсии, растворы, суспензии, сиропы и эликсиры. Помимо активных соединений жидкие лекарственные формы могут содержать инертные разбавители, обычно используемые специалистами, такие как вода или другие растворители, солюбилизирующие агенты и эмульгаторы, такие как, например, этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, диметилформамид, масла, а в частности, масло из семян хлопчатника, арахисовое масло, масло из проросших семян кукурузы, оливковое масло, касторовое масло и кунжутное масло, глицерин, тетрагидрофурфуриловый спирт, полиэтиленгликоли и сложные эфиры жирных кислот и сорбитана, или смеси этих веществ и т.п.
Помимо указанных инертных разбавителей указанная композиция может также включать адъюванты, такие как смачивающие агенты, эмульгаторы и суспендирующие агенты, подслащивающие агенты, отдушки и ароматизаторы.
Суспензии помимо активных соединений могут содержать суспендирующие агенты, такие как, например, этоксилированные изостеариловые спирты, сложные эфиры полиоксиэтиленсорбита и сорбитана, микрокристаллическая целлюлоза, метагидроксид алюминия, бентонит, агар-агар и трагакантовая камедь или смеси указанных веществ и т.п.
Композициями для ректального введения предпочтительно являются суппозитории, которые могут быть получены путем смешивания соединений настоящего изобретения с подходящими нераздражающими наполнителями или носителями, такими как масло какао, полиэтиленгликоль или воск для суппозиториев, которые являются твердыми при нормальных температурах, но жидкими при температуре тела, а поэтому они расплавляются в прямой кишке или влагалище и высвобождают активный компонент.
Лекарственными формами для местного применения соединений настоящего изобретения являются мази, порошки, спреи и ингаляторы. Активный компонент смешивают в стерильных условиях с фармацевтически приемлемым носителем и с любыми консервантами, буферами или пропеллентами, которые могут потребоваться для этих целей. В объем настоящего изобретения также входят офтальмические композиции, глазные мази, порошки и раствор.
Используемый здесь термин "фармацевтически приемлемые соли, сложные эфиры, амиды и пролекарства" означает соли карбоновых кислот, соли присоединения аминокислот, сложные эфиры, амиды и пролекарства соединений настоящего изобретения, которые исходя из тщательной оценки специалистов-медиков являются подходящими для использования при контактировании с тканями пациентов, не вызывают чрезмерной токсичности, раздражения, аллергической реакции и т.п. и соответствуют приемлемому отношению "польза/риск", а также являются эффективными для целевого применения, причем указанный термин также означает цвиттерионные формы соединений настоящего изобретения, если они существуют. Термин "соли" означает относительно нетоксичные соли присоединения неорганических и органических кислот соединений настоящего изобретения. Эти соли могут быть получены in situ во время конечного выделения и очистки соединений или посредством взаимодействия отдельного очищенного соединения в его свободной форме с подходящей органической или неорганической кислотой и выделения полученной таким образом соли. Типичными солями являются гидробромид, гидрохлорид, сульфат, бисульфат, нитрат, ацетат, оксалат, валерат, олеат, пальмитат, стеарат, лаурат, борат, бензоат, лактат, фосфат, тозилат, цитрат, малеат, фумарат, сукцинат, тартрат, нафтилат, мезилат, глюкогептонат, лактобионат, метансульфонат и лаурилсульфонат, и т.п. Такими солями могут быть катионы на основе щелочных и щелочноземельных металлов, таких как натрий, литий, калий, кальций, магний и т.п., а также катионы нетоксичного аммония, четвертичного аммония и амина, включая, но не ограничиваясь ими, аммоний, триметиламмоний, тетраэтиламмоний, метиламин, диметиламин, триметиламин, триэтиламин, этиламин и т.п. (см, например, работу S.M. Barge et al., "Pharmaceutical Salts", J. Pharm. Sci., 1977, 66:1-19, которая вводится в настоящее описание посредством ссылки).
Термин "пролекарство" означает соединение, которое быстро преобразовывается in vivo в исходные соединения вышеуказанной формулы, например, посредством гидролиза в кровотоке. Подробное обсуждение приводится в работе T. Higuchi & V. Stella, "Pro-drugs as Novel Delivery Systems", Vol. 14 of the A.C.S. Symposium Series, и в работе Bioreversible Carriers in Drug Design, ed. Edward B. Roche, American Pharmaceutical Association and Pergamon Press, 1987.
Клеткой-мишенью является клетка животного, включая, например, человека, примата, не являющегося человеком, крысу, мышь, морскую свинку, кролика, козу, овцу, корову, лошадь, курицу, свинью, обезьяну-игрунку и хорька.
Кроме того, антитело или терапевтическое средство настоящего изобретения могут присутствовать в несольватированной, а также в сольватированной форме с фармацевтически приемлемыми растворителями, такими как вода, этанол и т.п. В основном для осуществления настоящего изобретения сольватированные формы рассматриваются как эквиваленты несольватированных форм.
Молекулы антител очищают известными методами, включая, например, аминоабсорбционную или аминоаффинную хроматографию, и хроматографическую технику, такую как жидкостная хроматография высокого давления или их комбинации.
В другом своем аспекте настоящее изобретение относится к фармацевтическому продукту для доставки позвоночному биологически активного антитела против TRAIL-рецептора или гуманизированного антитела против TRAIL-рецептора. Фармацевтический продукт включает фармацевтически эффективное количество антитела против TRAIL-рецептора или его фрагмента, фармацевтически приемлемый носитель и контейнер, включающий носитель и антитело в стерильной форме.
В предпочтительном варианте осуществления изобретения фармацевтически эффективное количество антитела против DR5 ингибирует пролиферацию клеток путем контактирования с клеткой-мишенью. Фармацевтически эффективным количеством антитела, распознающего DR5 или гуманизированного антитела, распознающего DR5, является количество, вводимое индивидууму, которое является достаточным для достижения нужного эффекта. Нужными эффектами введения фармацевтически эффективного количества DR5-распознающих антител являются гибель клетки-мишени, ингибирование роста клетки-мишени, стимуляция DR5, связывание с DR5 и увеличение уровней или активности NFkB в клетке-мишени. Клека-мишень представляет собой клетку, которая экспрессирует DR5, и такими клетками являются, например, клетки с аномальным ростом и опухоли, такие как папилломы и бородавки; рак молочной железы, рак толстой кишки, гепатомы, лейкоз, рак легких, меланома, миеломы, остеосаркомы, рак яичника, рак поджелудочной железы, рак предстательной железы, рак головы и шеи, рак щитовидной железы, рак матки и опухоли головного мозга, такие как астроцитомы. In vivo, такой клеткой-мишенью является клетка индивидуума, страдающего патологическим состоянием, включая состояние, при котором пролиферация клеток является аномальной или разрегулированной, например, доброкачественные или злокачественные опухоли и ревматоидный артрит.
В другом предпочтительном варианте осуществления изобретения клетка-мишень также контактирует с терапевтическим средством.
Терапевтическое средство представляет собой соединение или композицию, эффективную для облегчения патологического состояния. Иллюстративным примером терапевтического средства является противораковое соединение.
Противораковое соединение представляет собой соединение или композицию, эффективную для ингибирования или прекращения роста аномально растущих клеток. Фармацевтически приемлемым количеством противоракового соединения является вводимое индивидууму количество, достаточное для стимуляции ингибирования или прекращения роста аномально растущих клеток. Иллюстративными примерами противоопухолевых соединений являются блеомицин, карбоплатин, хлорамбуцил, цисплатин, колхицин, циклофосфамид, даунорубицин, дактиномицин, диэтилстилбестрол, доксорубицин, этопозид, 5-фторурацил, флоксуредин, мелфалан, метотрексат, митомицин, 6-меркаптопурин, тенипозид, 6-тиогуанин, винкристин и винбластин. Другие примеры противоопухолевых соединений и терапевтических средств можно найти в работах Merck Manual of Diagnosis and Therapy, 15th Ed., Berkow et al., eds., 1987, Rahway, N.J. и Sladek et al., Metabolism and Action of Anti-Cancer Drugs, 1987, Powis et al., eds., Taylor & Francis, New York, N.Y.
При лечении злокачественных опухолей применение антитела настоящего изобретения может быть также объединено с другими терапевтическими методами терапии, такими как химиотерапия и лучевая терапия, а терапевтическая эффективность может быть усилена апоптоз-индуцирующими соединениями, такими как бисиндолилмалеимид VIII.
По сравнению с ранее описанным в литературе антителом против DR5 [24], апоптоз-индуцирующиая активность репрезентативного антитела TRA-8 настоящего изобретения является очень высокой, способна индуцировать апоптоз клеток Jurkat на пг/мл-уровне in vitro, и является превосходной онкогенной in vivo-активностью по сравнению с активностью ранее описанного растворимого TRAIL. Внутривенное введение одной дозы TRA-8 является достаточным для ингибирования роста как клеток твердой опухоли, так и гемопоэтических опухолевых клеток, тогда как для индуцирования регрессии опухолей in vivo растворимым TRAIL требуются гораздо более высокие дозы (500 мкг ежедневно в течение 10 дней). Антитела против TRAIL-рецептора настоящего изобретения являются, очевидно, безопасными, как и растворимый TRAIL, поскольку рассматриваемое антитело TRA-8 не индуцирует апоптоз нетрансформированных фибробластов.
Векторами настоящего изобретения являются последовательность нуклеиновой кислоты, кодирующая тяжелую или легкую иммуноглобулиновую цепь анти-DR5 антитела, функционально связанную с регуляторным элементом, таким как промотор или энхансер. Термин "функционально связанный" относится к такой организации нуклеотидных последовательностей, конфигурация которых позволяет осуществлять их обычные функции. Таким образом, регуляторный элемент, функционально связанный с нуклеотидной последовательностью, кодирующей полипептид, способен регулировать транскрипцию, репликацию и/или трансляцию полипептида. Для каждого специалиста очевидно, что один вектор необязательно должен включать кодирующие последовательности тяжелой и легкой иммуноглобулиновых цепей анти-D5 антитела.
Нижеследующие примеры иллюстрируют способы и результаты настоящего изобретения. Эти примеры не ставят своей целью рассмотрение всех аспектов настоящего изобретения, а лишь иллюстрируют его репрезентативные методы и результаты. Указанные примеры не исключают возможные эквиваленты и модификации настоящего изобретения, которые являются очевидными для каждого специалиста.
Пример 1. Получение антигена DR5
1.1. Клонирование кДНК DR5
ДНК, кодирующую человеческий белок DR5, клонировали нижеописанным ОФ-ПЦР-методом, где используются:
а) Матрица
Полноразмерную РНК клеток HeLa экстрагировали с использованием реагента TRIzol (GIBCO BRL). В качестве матрицы для ПЦР-реакции была использована кДНК, которую получали с помощью набора для синтеза первой цепи кДНК (Amersham Pharmacia Biotech) в соответствии с инструкциями, прилагаемыми к данному набору.
b) ПЦР-праймеры
Были синтезированы следующие олигонуклеотидные праймеры для ПЦР:
5'-gacgatgcccgatctactttaaggg-3' (DR5р1:SEQ ID NO:1)
5'-ccactgggtgatgttggatggg-3' (DR5р2:SEQ ID NO:2)
Если это не оговорено особо, все олигонуклеотиды в этих примерах синтезировали методом с использованием Lifetechno-logies. Все олигонуклеотиды после растворения в дистиллированной воде хранили при -20°С.
с) ПЦР-реакция
Состав ПЦР-реакционного раствора:
кДНК-матрица, 5 мкл от всей 33 мкл реакционной смеси;
праймер DR5р1, 10 пмоль;
праймер DR5р2, 10 пмоль;
10х концентрированный ПЦР-буфер (поставляется с набором), 10 мкл;
dNTP (каждый 2,5 мМ), 4 мкл; и
Полимераза Taq (Promega), 5 единиц.
К этому раствору добавляли стерильную дистиллированную воду до полного объема 100 мкл. Если это не оговорено особо, dNTP получали в виде эквимолярной смеси dATP, dCTP, dGTP, и dTTP (каждого 2,5 мМ).
ПЦР-реакцию проводили следующим образом. Раствор сначала нагревали при 94оС в течение 2 минут, после чего 40 раз повторяли цикл нагревания до 94оС в течение 30 с, 52оС в течение 1 минуты, и при 72оС в течение 3 минут. После завершения этой процедуры реакционный раствор нагревали при 72оС в течение 10 минут.
Полученные таким образом амплифицированные ДНК-фрагменты разделяли на 1% агарозном геле, содержащем 0,25 мкг/мл этидийбромида. Полосы, которые, как было обнаружено, содержали нужные ДНК-фрагменты, вырезали острием бритвы и выделяли ДНК с использованием набора Gene Clean (BIO101). ДНК-фрагмент клонировали с использованием набора для клонирования ТА (Invitrogen, СА). Это осуществляли следующим образом.
ДНК-фрагмент, выделенный из ПЦР-реакционного раствора вместе с 50 нг вектора рCR2.1, который поставляется с набором для клонирования ТА, смешивали с 1 мкл 10 х буфера для лигазной реакции (6 мМ Трис-HCI (pH 7,5), 6 мМ хлорида магния, 5 мМ хлорида натрия, 7 мМ β-меркаптоэтанола, 0,1 мМ АТР, 2 мМ DTT, 1 мМ спермидина и 0,1 мг/мл альбумина бычьей сыворотки), к которому добавляли 4 единицы ДНК-лигазы Т4 (1 мкл). Полный объем смеси доводили до 10 мкл путем добавления стерильной деионизованной воды и полученный лигазный раствор инкубировали в течение 15 часов при 14оС. По истечении этого времени 2 мкл лигазного реакционного раствора добавляли к 50 мкл компетентного штамма TOP10F' E.coli, который поставлялся с набором для клонирования ТА и был доведен до состояния компетентности в соответствии с инструкциями, прилагаемыми к набору, и к которому добавляли 2 мкл 0,5 М β-меркаптоэтанола, и полученную смесь выдерживали на льду в течение 30 минут, затем при 42оС в течение 30 секунд, а затем снова выдерживали на льду в течение 5 минут. После этого к культуре добавляли 500 мкл среды, содержащей 2% об./об. триптона, 0,5% мас./об. дрожжевого экстракта, 0,05% мас./об. хлорида натрия, 2,5 мМ хлорида калия, 1 мМ хлорида магния и 20 мМ глюкозы (обозначаемой далее "SOC") и смесь инкубировали в течение одного часа при 37оС при встряхивании. По истечении этого времени культуру высевали на чашку агара с L-бульоном (1% об./об. триптона, 0,5% мас./об. дрожжевого экстракта, 0,5% мас./об. хлорида натрия, 0,1% мас./об. глюкозы, и 0,6% мас./об. бакто-агара (Difco), содержащую 100 мкг/мл ампициллина, и инкубировали при 37оС в течение ночи. Появившиеся на чашке резистентные к ампициллину колонии отбирали и соскабливали при помощи платиновой трансфер-петли, а затем культивировали в течение ночи при 37оС, в среде с L-бульоном, содержащей 100 мкг/мл ампициллина, встряхивая при 200 об/мин. После инкубирования, клетки собирали путем центрифугирования, в результате чего была получена ДНК-плазмида с использованием щелочного метода. EcoRI-EcoRI-фрагмент DR5cDNA из полученной таким образом плазмиды субклонировали в плазмиду pcDNA3 (Invitrogen, СА). Полноразмерный ген DR5 в pcDNA3 секвенировали и сопоставляли с опубликованной последовательностью. Полученную таким образом плазмиду обозначали pcDNA3-DR5.
1.2 Конструирование экспрессирующего вектора DR5-IgG
Для получения растворимой формы человеческого DR5, не содержащего трансмембранного домена, конструировали экспрессирующий плазмидный вектор. Этот вектор конструировали так, чтобы он кодировал гибридный белок, включающий внеклеточный домен человеческого DR5, присоединенный к ДНК Fc-фрагмента IgG человека [41]. ДНК, кодирующую человеческий DR5, не содержащий трансмембранный домен, получали с помощью нижеследующей ПЦР-реакции.
а) Матрица
В качестве матрицы для ПЦР-реакции использовали pcDNA3-DR5.
b) ПЦР-праймеры
Были синтезированы следующие олигонуклеотидные праймеры для ПЦР:
5'-gacgatgcccgatctactttaaggg-3' (DR5р1:SEQ ID NO:1)
5'-ggatccgtggacacattcgatgtc-3' (DR5р3:SEQ ID NO:3)
Если это не оговорено особо, все олигонуклеотиды в этих примерах синтезировали методом с использованием Lifetech-nologies. Все олигонуклеотиды после растворения в дистиллированной воде хранили при -20°С.
с) ПЦР-реакция
Проводили ПЦР-реакцию и амплифицированную ДНК выделяли, как описано в примере 1.1(с).
Полученную таким образом плазмиду обозначали pCR-ΔDR5. BamHI-EcoRI-фрагмент, кодирующий человеческий Fc-фрагмент, который был выделен из pmFas-hIgG1Fc, субклонировали в BamHI- и EcoRI-сайты множественного клонирования pcDNA3. Полученную таким образом плазмиду обозначали pcDNAFc. Затем BamHI-BamHI-фрагмент, кодирующий область растворимого человеческого DR5, который выделяли из pCR-ΔDR5, субклонировали в BamHI-сайт плазмиды pcDNAFc. Полученную таким образом плазмиду обозначали pcDNAΔDR5-Fc. EcoRI-фрагмент, кодирующий область "растворимый человеческий DR5 - Fc человеческого IgG", который выделяли из плазмиды pcDNAΔDR5-Fc, затупляли по концам с использованием ДНК-полимеразы, фрагмента Кленова (GIBCO BRL), а затем субклонировали в челночный вектор pAdCMV5 (Quantum Biotechnologies Inc., Canada), который затупляли по концам после разрезания ферментом BamHI. Полученную таким образом плазмиду обозначали pAdΔDR5-Fc.
1.3 Экспрессия и очистка гибридного белка "человеческий DR5-IgG1"
Клетки QBI-293A (поставляемые в наборе ADENO-Quest) ко-трансфицировали pAdΔDR5-Fc и QBI-вирусной ДНК (поставляемой в наборе ADENO-Quest) с использованием набора ADENO-Quest (Quantum Biotechnologies Inc., Canada) в соответствии с инструкциями. Рекомбинантные вирусные бляшки культивировали и скринировали на экспрессию гибридного белка "DR5-IgG" с помощью ELISA-анализа супернатанта. Позитивные бляшки амплифицировали в клетках QBI-293A и хранили при -80°С в качестве исходного вирусного штамма. Пятьдесят чашек (150 мм) с клетками QBI-293A трансфицировали рекомбинантным вирусом pAdΔDR5-Fc при 10 m.o.i (множественность заражения). Культуральные среды собирали после трансфекции в течение 48 часов.
Трансфицированные клетки, имеющие ген DR5-IgG, культивировали до плотности 1 х 106 клеток/мл путем инкубирования в 500 мл среды DMEM (GIBCO), содержащей 10% об/об FCS при 37оС в атмосфере 5% об/об CO2 в течение 2 дней. Затем культуру центрифугировали (1000 об/мин, 5 минут) и супернатант собирали. Выделение DR5-IgG из супернатанта осуществляли с помощью аффинной хроматографии на белке А-сефарозе CL-4В (Pharmacia) при следующих условиях: Колонка: колонка с белком А-сефарозой CL-4В (размер колонки 2 мл; Pharmacia);
Элюирующий буфер: 0,1 М глицин (рН 2,4), 0,15 М NaCl;
Нейтрализующий буфер: 1 М Трис-HCI (pH 8,5);
После нанесения всего супернатанта на колонку ее три раза промывали 20 мл PBS, а затем добавляли 10×1 мл элюирующего буфера. После этого измеряли оптическую плотность каждой проэлюированной фракции (1 мл). Фракции 2-5 (с OD280≥0,1) собирали и после добавления 100 мкл нейтрализующего буфера элюаты отдельно помещали в трубку для диализа и диализовали против 1 литра PBS (рН 7,5) при 4°С. Буфер для диализа меняли два раза.
Затем элюаты анализировали на экспрессию продукта гена DR5-IgG посредством ELISA. Сначала 100 мкл каждой фракции отдельно помещали отдельно в лунки 96-луночного микропланшета (Costar) и инкубировали в течение 1 часа при температуре 37оС. По истечении этого времени раствор в лунках удаляли и планшет три раза промывали 100 мкл/лунку PBS, содержащим 0,1% об/об Твина 20 (далее обозначаемым "PBS-Твин"). После промывки добавляли PBS, содержащий 2% (мас./об.) альбумина бычьей сыворотки (обозначаемого далее "BSA"), в количестве 100 мкл/лун., а затем планшет инкубировали при 37оС в течение 1 часа. По истечении этого времени лунки промывали еще 3 раза 100 мкл/лунку PBS-Твина, а затем в каждую лунку добавляли 100 мкл/лунку раствора моноклонального антитела против человеческого IgG1, 1000-кратно разведенного PBS-Твином, и планшет снова инкубировали при температуре 37оС в течение 1 часа. Затем лунки 3 раза промывали 100 мкл/лунку PBS-Твина. После этого добавляли систему "3,3',5,5'-тетраметилбензидин (далее обозначаемый "ТВМ")- жидкий субстрат" (Sigma) в количестве 100 мкл/лунку и планшет оставляли на 5 минут при комнатной температуре, а затем реакцию гасили добавлением 100 мкл/лунку 0,2 н Н2SO4. Для оценки концентрации связанного антитела оптическую плотность каждой лунки считывали при 450 нм с использованием в качестве контрольного считывания оптической плотности при 650 нм. Оптическую плотность измеряли на микропланшет-ридере (Molecular Devices). Продуцирование DR5-IgG1 подтверждали с помощью указанного ELISA-метода. Молекулярную массу экспрессированного гибридного белка DR5-IgG1 определяли с помощью Вестерн-блот-анализа, в котором использовали mAb против человеческого IgG1 (Sigma) для детекции антитела на геле. Молекулярная масса экспрессированного гибридного белка DR5-IgG1 составляла приблизительно 50 кДа. При этом была достигнута чистота более чем 90%, как было оценено с помощью анализа на ДСН-ПААГ и детекции белка путем окрашивания кумасси синим.
Пример 2. Генерирование моноклональных антител против человеческого DR5
2.1 Иммунизация
6-8-недельных самок мышей Balb/с (Jackson Laboratory, Bar Harbor, ME) иммунизировали аффинно очищенным гибридным белком "человеческий DR5/hIgG1". Для первоначальной иммунизации в подушечку лапы гибридный белок (50 мкг) эмульгировали в полном адъюванте Фрейнда (Difco, Detroit, MI). Мышам через день вводили четыре бустер-инъекции 50 мкг гибридного белка, не содержащего адъюванта. Через три дня после последней инъекции лимфоциты из локальных лимфоузлов подвергали слиянию с клетками миеломы NS-1 и гибридомы культивировали в среде F104, в которую была добавлена 10% фетальная телячья сыворотка. Позитивные гибридомы отбирали с помощью ELISA, при котором планшеты покрывали либо 1 мкг/мл DR5/hIgG1, либо тем же количеством Fas/hIgG1 в качестве контроля. Изотип гибридом определяли с помощью ELISA с использованием панели козьих антител, специфичных к мышиному изотипу Ig (Southern Biotechnology, Birmingham, AL). Моноклональные антитела очищали аффинной хроматографией с использованием иммобилизованного антитела против мышиного IgG1 или белка G (Sigma).
2.2 Слияние клеток
На третий день после бустер-инъекции у мыши удаляли локальные лимфоузлы и помещали в 10 мл бессывороточной среды RPMI 1640 (GIBCO BRL), содержащей 50 ед./мл пенициллина, 50 мкг/мл стрептомицина и 300 мкг/мл L-глутаминовой кислоты, а затем лимфоузлы измельчали путем их пропускания через сито (Cell Strainer; Falcon) с использованием шпателя. Полученную клеточную суспензию центрифугировали для осаждения клеток локальных лимфоузлов, которые затем дважды промывали бессывороточной средой RPMI. Затем промытые клетки ресуспендировали в бессывороточной среде RPMI и подсчитывали.
Одновременно клетки миеломы NS1 (Американская коллекция типовых культур TIB-18) культивировали до клеточной плотности, не превышающей 1×108 клеток/мл, в среде ASF104 (Ajinomoto, K.K.), содержащей 10% об./об. FCS (Gibco BRL)("среда ASF с сывороткой") при 37оС в атмосфере 5% об./об. СО2, а затем аналогичным образом измельчали, промывали, ресуспендировали и подсчитывали.
Определенное количество клеточной суспензии NS1, которое, как было вычислено, составляло 3×107 клеток, смешивали с определенным количеством суспензии клеток селезенки, которое, как было вычислено, составляло 3×108 клеток. Полученную смесь центрифугировали, а супернатант отбрасывали. Затем проводили стадии слияния клеток, выдерживая все это время пластиковую пробирку, содержащую осадок, при 37оС в химическом стакане с теплой водой.
Затем один миллилитр 50% (мас./об.) полиэтиленгликоля 1500 (Boehringer Manheim) медленно добавляли в пробирку и осадок все время перемешивали кончиком пипетки. После этого двумя порциями медленно добавляли 1 мл бессывороточной среды RPMI, предварительно нагретой до 37оС, а затем добавляли еще 7 мл бессывороточной RPMI. Полученную смесь центрифугировали, супернатант отбрасывали и добавляли при мягком перемешивании кончиком пипетки 10 мл среды НАТ, содержащей 10% об./об. FCS. После добавления еще 20 мл среды HAT, содержащей 10% об./об. FCS, суспензию разливали по 96-луночным микропланшетам для культивирования клеток при концентрации 100 мкл/лунку и инкубировали при 37оС в атмосфере 5% (об./об.) СО2. Через 7 или 8 дней во всех лунках среду с желтоватым оттенком заменяли на 100 мкл/лунку свежеприготовленной среды HAT. Гибридные клетки из этих лунок клонировали путем лимитирующего разведения, как описано ниже.
2.3 Клонирование путем лимитирующего разведения
Тимусы от 4-10 недельных самок мышей BALB/c (от Japan SLC, Inc.) удаляли, измельчали на сите (CeII Strainer; Falcon), как описано выше, и полученные дезинтегрированные клетки дважды промывали средой НТ, содержащей 10% об./об. FCS. Количество тимусных клеток, соответствующее количеству клеток от одной мыши, суспендировали в 30 мл среды HT, содержащей 10% об./об. FCS, и получали суспензию клеток-фидеров. Препарат гибридных клеток, полученный, как описано выше в примере 2.2, 10-100-кратно разводили этой суспензией клеток-фидеров, а затем серийно разводили указанной суспензией клеток-фидеров, и получали суспензии, имеющие плотности гибридных клеток, составляющие 5, 1 и 0,5 клеток/мл. Полученные таким образом образцы распределяли по лункам 96-луночных микропланшетов для культивирования клеток при концентрации 100 мкл/лунку и инкубировали в течение 5 дней при 37оС в атмосфере 5% об./об. СО2.
2.4 Скрининг
Супернатанты культуры от растущих гибридом скринировали посредством ELISA с использованием планшетов, покрытых либо 1 мкг/мл DR5/hIgG1, либо тем же количеством Fas/hIgG1 с использованием в качестве контроля [41]. Связанные антитела детектировали с использованием конъюгированного с пероксидазой хрена (ПХ) антитела против мышиных иммуноглобулинов (Southern Biotech-nology, Birmingham, AL) и с использованием ТМВ (Sigma, St. Louis, MI) в качестве субстрата. Очищенный DR5-IgG1 в концентрации 1 мкг/мл или то же самое количесто Fas/hIgG1 вводили в лунку 96-луночного планшета ELISA/RIA STRIP PLATE (Costar, NY). Планшет выдерживали в течение ночи при 4°С для адсорбции белка на поверхности лунки. По истечении этого времени раствор из лунок удаляли и каждую лунку 3 раза промывали PBS-твином. Затем в каждую лунку добавляли 100 мкл PBS, содержащего 1% (мас./об.) альбумина бычьей сыворотки (А3803; (Sigma Chemical Co.), и планшет инкубировали при 37оС в течение 1 часа. Затем лунки еще 3 раза промывали PBS-твином, после чего в каждую лунку добавляли 50 мкл супернатанта каждой культуры от растущих гибридом. Затем планшет инкубировали при 37оС в течение 1 часа и лунки снова 4 раза промывали PBS-Твином. После промывки добавляли 50 мкл/лунку меченного пероксидазой хрена козьего антитела против мышиного иммуноглобулина (Southern Biotechnology, Birmingham, AL), 1000-кратно разведенного PBS, и планшет снова инкубировали при 37оС в течение 1 часа, после чего лунки 4 раза промывали PBS-твином. После этого добавляли систему "3,3',5,5'-тетраметилбензидин (ТМВ)- жидкий субстрат" (Sigma) в количестве 100 мкл/лунку и планшет оставляли на 5 минут при комнатной температуре, после чего реакцию прекращали добавлением 100 мкл/лунку 0,2 н. Н2SO4. Оптическую плотность каждой лунки при 450 нм (контроль 650 нм) измеряли на микропланшет-ридере (Molecular Devices) и гибридные клетки отбирали из образца, который имел оптическую плотность (450-650 нм, величины OD; >0,5), явно превышающую плотность образца, к которому не был добавлен супернатант от гибридных клеток (величины OD; ≈0,03). Затем супернатанты культуры от растущих гибридом также скринировали на функциональность путем измерения апоптоз-индуцирующей активности с использованием клеток Jurkat. 50 мкл среды RPMI, содержащей клетки Jurkat (100 клеток на лунку) и 5 мкМ бисиндолилмалеимида VIII (Bis VIII, Alexis, San Diego, CA) добавляли в 96-луночные планшеты, в которых присутствовали 50 мкл супернатантов культуры растущих гибридом. Клетки культивировали в инкубаторе в повышенной влажностью в течение ночи при 37оС. Апоптоз определяли по жизнеспособности клеток с использованием набора ATPLite в соответствии с инструкциями производителей (Packard Instruments) и образцы считывали на счетчике TopCounter (Packard Instruments).
2.5 ELISA-связывание TRAIL и TRA-8 с рецепторами
ELISA-планшеты сенсибилизировали 2 мкг/мл гибридного белка DR4-Ig или DR5-Ig в течение ночи. После блокирования 3%-ным BSA добавляли растворимый TRAIL-FLAG или TRA-8 в указанных концентрациях и инкубировали при 37°С в течение одного часа. Связывание TRAIL или TRA-8 детектировали с использованием ПХ-конъюгированного антитела против Flag (Alexis) или ПХ-конъюгированного антитела против мышиного IgG1 (Southern Biotechnology) соответственно. Реакции проявляли ТМВ-субстратным буфером и измеряли на микропланшет-ридере Benchmark Microplate Reader (BioRad). Величины Kd оценивали с помощью односайтовой модели связывания с нелинейной регрессией с использованием программы GraphPad Prism (GraphPad Software, San Diego, CA). Для осуществления конкурентного ELISA добавляли 100 нг/мл TRAIL-FLAG и инкубировали в присутствии различных концентраций TRA-8. Уровень связывания TRAIL определяли, как описано выше.
2.6. Клонирование
Стадии, описанные выше в примерах 2.3 и 2.4, повторяли 5 раз для клеток, отобранных в стадии 2.4, что позволило отобрать несколько клонов гибридомы, каждая из которых продуцирует одно антитело, связывающееся с DR5-IgG, но не связывающееся с Fas-IgG. В результате этой процедуры отбора, получали гибридому "мышь-мышь", обозначенную TRA-8 и продуцирующую антитело, связывающееся с DR5-IgG, но не с Fas-IgG. Эта гибридома TRA-8 была депонирована в Американской коллекции типовых культур 1 марта 2000 года под регистрационным номером РТА-1428.
После тестирования с использованием набора для определения изотипа моноклонального антитела (Pierce) было выявлено, что подклассом антитела TRA-8, продуцируемого гибридомой "мышь-мышь" (обозначаемой далее просто как "TRA-8"), является IgG1.
С использованием гибридного белка "человеческий DR5-IgG1" настоящего изобретения в качестве иммуногена было получено путем предварительного ELISA-скрининга семь клонов гибридом, каждый из которых был в высокой степени положительным в отношении гибридного белка DR5-IgG1, но не в отношении Fas-IgG, что указывает на то, что полученные гибридомы продуцируют антитела, распознающие внеклеточную часть DR5, но не Fc-часть IgG1 (данные не приводятся).
2.7 Вестерн-блот-анализ
Фильтры для Вестерн-блот-анализа гомогенатов нормальных и злокачественных тканей человека были закуплены у Geno Technology (St Louis, MO). Каждую дорожку загружали равным количеством белка, определенного с помощью антитела против β-актина. Блоты зондировали 1 мкг/мл TRA-8 в течение ночи, а затем ПХ-конъюгированным козьим антителом против мышиного IgG1 (Southern Biotechnology) при комнатной температуре в течение одного часа, и проявляли хемилюминисценцией.
2.8. In situ-иммуногистохимия
Человеческие ткани получали из Центра по поставке тканевых матриалов (Tissue Procurement Center of UAB). Замороженные срезы фиксировали в 70% этаноле, блокировали 10% лошадиной сывороткой в PBS, а затем инкубировали с 10 мкг/мл аффинно очищенного TRA-8 при комнатной температуре в течение 60 минут. Для визуализации реактивности использовали набор с АВС против мышиного IgG с диаминобензидином (Vector, Burlingame, CA) в качестве колориметрического субстрата.
2.9. Анализ активации каспазы
Клетки Jurkat (1 x 106/мл) инкубировали с 500 нг/мл TRA-8. Аликвоты (30 мкг белка) клеточного лизата разделяли с помощью электрофореза в 15% ПААГ с ДСН, подвергали блот-анализу на найлоновой мембране и полученные блоты зондировали антителами против каспазы 8, 9 и 3 (BD Pharmingen, San Diego, CA), а затем ПХ-конъюгированным "вторым" антителом, после чего продукты расщепления визуализировали посредством хемилюминисценции. Набор ингибиторов каспазы закупали у R&D Systems (Minneapolis, MN). Каждый ингибитор каспазы добавляли в культуру в указанных концентрациях.
Пример 3. Очистка моноклонального антитела TRA-8
Гибридому "мышь-мышь", TRA-8, культивировали до плотности клеток 1 х 106 клеток/мл путем инкубирования в 500 мл среды ASF, содержащей 10% (об./об.) FCS при 37оС в присутствии 5% об./об. СО2 в течение 5 дней. Затем культуру центрифугировали (1000 об/мин, 5 минут) и супернатант собирали. Выделение TRA-8 из супернатанта осуществляли с помощью аффинной хроматографии на белке G-сефароза CL-4В (Pharmacia) при следующих условиях:
Колонка: колонка с белком G-сефарозой CL-4В (размер колонки 2 мл; Pharmacia);
Элюирующий буфер: 0,1 М глицин (рН 2,4), 0,15 М NaCl;
Нейтрализующий буфер: 1 М Трис-HCI (pH 8,5);
После нанесения всего супернатанта на колонку, ее три раза промывали 20 мл PBS, а затем добавляли 10×1 мл элюирующего буфера. После этого измеряли оптическую плотность каждой проэлюированной фракции (1 мл). Фракции №2-5 (с OD280>0,1) собирали отдельно.
После добавления 100 мкл нейтрализующего буфера элюаты отдельно помещали в трубку для диализа и элюаты диализовали против 1 литра PBS (рН 7,5) при 4°С. Буфер для диализа меняли два раза. Этот образец анализировали на активность антитела против DR5 с помощью ELISA и с использованием гибридного белка "человеческий DR5-IgG1", полученного методом, описанным выше.
Пример 4. Получение антигена DR4, DR4-IgG1-экспрессирующего вектора и моноклонального антитела против DR4
Для получения антигена DR4, который был использован, как описано в примерах 1.2-3 для продуцирования моноклонального антитела против DR4, повторяли процедуры примеров 1-3 с использованием кДНК-матрицы DR4 и праймеров вместо тех, которые были использованы в Примере 1.
Пример 5. Моноклональные антитела против DcR1 и DcR2
Моноклональные антитела против рецепторов-ловушек DcR1 и DcR2 продуцировали для получения соответствующих антигенов путем замены соответствующих кДНК и праймеров, как описано в примере 1. Экспрессирующие векторы для DcR1- или DcR2-гибридов с иммуноглобулином G и очищенные моноклональные антитела получали, как описано в Примерах 2 и 3.
Пример 6. Специфичность моноклонального антитела
Поскольку все рецепторы TRAIL и другие белки семейства TNFR имеют значительную гомологию, то специфичность рассматриваемого антитела TRA-8 против DR5 определяли с помощью Вестерн-блот-анализа с использованием двух различных гибридных белков "человеческий DR5-IgG" и растворимых рекомбинантных форм других родственных белков. Первый гибридный белок DR5-Ig конструировали путем лигирования кДНК, кодирующей остатки 1-180 внеклеточной области DR5, и кДНК, кодирующей константную область челевеческого IgG1. Гибридную кДНК клонировали в рекомбинантный аденовирусный вектор (Quantum Biotechnologies Inc., Montreal, Canada). Экспрессированный гибридный белок DR5/hIgG1, который имел относительную молекулярную массу 50 кДа, очищали с использованием аффинной колонки с антителом против человеческого IgG (Sigma, St. Louis, MO). Для проведения Вестерн-блот-анализа на специфичность второй гибридный рекомбинантный белок "человеческий DR5-IgG1" (аминокислоты 52-212), а также гибридный белки TRAIL-R1, R3 и R4 закупали у Alexis. Растворимые формы человеческого Fas и TNFR1 были любезно предоставлены Dr.Carl Edwards of Amgen, Inc., Thousands Oaks, CA, USA. Используемые растворимые рекомбинантные молекулы человеческих DR4, DcR1, DcR2, TNFR1, R4 и Fas представляют собой белки-гибриды с человеческим IgG1. 0,5 мкг каждого белка разделяли с помощью электрофореза в 10% ПААГ с ДСН и подвергали блоттингу на нитроцеллюлозной мембране. Блоты блокировали 5% сухим молоком в PBS при комнатной температуре в течение одного часа и зондировали 1 мкг/мл очищенного моноклонального антитела против DR5 (клон: TRA-8) или 0,1 мкг/мл ПХ-конъюгированного козьего антитела против человеческого IgG в течение ночи при 4°С. Конъюгированное с пероксидазой хрена (ПХ) козье антитело против человеческого IgG использовали в качестве "второго" антитела для детекции связанного TRA-8. Блоты проявляли посредством хемилюминесценции.
Клетки Cos-7, трансфицированные вектором pcDNA3 (Clontech, Palo Alto, CA), содержащим полноразмерный DR5 или DR4, или пустым вектором, использовали для анализа методом проточной цитометирии. Полноразмерную кДНК, кодирующую человеческий TRAIL или мышиный Fas-лиганд, клонировали в вектор pTRE ниже от регулируемого тетрациклином промотора (Clontech). Затем XhoI-HindIII-фрагменты pTRE-hTRAIL или pTRE-mFasL клонировали в аденовирусный челночный вектор pAdBN (Quantum Biotechnologies, Inc.). Клетки-хозяева 293 ко-трансфицировали линеаризованным pAd-pTRE-hTRAIL или pAd-pTRE-mFasL и большим фрагментом ДНК аденовируса. Экспрессию функционального человеческого TRAIL или мышиного Fas-лиганда из рекомбинантных вирусных бляшек скринировали с помощью анализа на высвобождение 51Cr клетками Jurkat, используемыми в качестве мишеней.
TRA-8 сильно реагировал с гибридным белком DR5-IgG1 (˜50 кДа), который использовали для иммунизации, как показано на фиг.1а, DR5, #1, и слабо реагировал со вторым гибридным белком DR5-IgG1 (˜60 кДа), как показано на фиг.1а, DR5, #2. Какого-либо значительного связывания TRA-8 с DR4, DcR1, DcR2, Fas (CD95) или TNFR1 не наблюдалось. Эти результаты показали, что TRA-8 распознает эпитопы, которые являются специфичными для DR5, но не для других членов этого семейства.
TRA-8 не реагировал с другими членами суперсемейства TNF-рецепторов, такими как Fas (CD95) и TNF-рецептор I, а также не обнаруживал перекрестной реакции с мышиным гомологом DR5, на что указывают отношения оптической плотности при 450 нм и 650 нм, где нижняя панель пронумерована 1-7 (фиг.1а, столбец 8 нижней панели). Растворимые TRAIL и TRA-8 показали сравнимое связывание с иммобилизованным DR5 (фиг.1b, левая панель). В противополжность этому TRAIL связывался с DR4, а TRA-8 не обнаруживал какой-либо связывающей активности с DR4 (фиг.1b, средняя панель). Величины Kd для связывания TRAIL и TRA-8 с DR5 оценивали при 59 нМ и 3 нМ соответственно. Важно отметить, что TRA-8 эффективно конкурирует с TRAIL за связывание с DR5, но не за связывание с DR4, как было показано в конкурентном ELISA (фиг.1b, правая панель). Эти результаты подтверждают специфичность TRA-8 по отношению к человеческому DR5.
TRA-8 способен детектировать экспрессию DR5 на клеточной поверхности, причем анализ, проводимый методом проточной цитометрии, указывал на специфическое связывание с поверхностью клеток Cos-7, трансфицированных полноразмерным человеческим DR5, но не с поверхностью клеток Cos-7, трансфицированных DR4 или пустым вектором (фиг.1с). Аналогичным образом иммуногистохимия in situ с использованием TRA-8 продемонстрировала реактивность с клетками Cos-7, трансфицированными ДНК DR5, но не с клетками, трансфицированными контрольным вектором (фиг.1d). TRA-8 не индуцирует апоптоз нетрансфицированных клеток Cos-7, а ОТ-ПЦР РНК от клеток Cos-7, проводимая с использованием парных праймеров, кодирующих человеческий DR5, указывала на отсутствие специфичных ПЦР-продуктов. Последующий функциональный анализ с использованием человеческих клеток Jurkat в качестве мишеней показал, что в отсутствие перекрестного связывания TRA-8 сильно индуцирует гибель клеток, как было продемонстрировано в трех различных анализах на жизнеспособность клеток, включая эксклюзионные анализы ATPLite, МТТ и PI (фиг.1е). Более чем 50% клеток Jurkat погибали под действием нанограммовых уровней TRA-8, как показал анализ ATPLite. Киллерная активность антитела TRA-8 была специфичной по отношению к DR5, поскольку она могла блокироваться гибридным белком DR5-Ig, но не гибридным белком DR5-Ig (данные не приводятся). Расщепление каспаз 8, 9 и 3 может быть детектировано с помощью Вестерн-блот-анализа, по крайней мере, через 30 минут после TRA-8-обработки клеток Jurkat (фиг.1f), а гибель клеток Jurkat полностью ингибировалась общим ингибитором каспаз (Z-VAD)(фиг.1g). Ингибиторы отдельных каспаз, специфичные для каспаз 8, 3, 9 и 10, частично ингибировали гибель клеток, что дополнительно указывало на то, что TRA-8-опосредованная гибель клеток происходит, главным образом, по механизму каспазозависимого апоптоза.
Пример 7. Проточный цитометрический анализ на экспрессию DR5 клеточной поверхности: главный рецептор гибели присутствует на многих опухолевых клетках, но не присутствует на нормальных клетках
Способность TRA-8 к связыванию с DR5, экспрессированным на клеточной поверхности, и специфичность этой реакции оценивали с использованием клеток COS-7 (Американская коллекция типовых культур № CRL-1651), трансфицированных экспрессирующим вектором, содержащим полноразмерную кДНК человеческого DR5 или DR4, или пустым вектором, используемом в качестве контроля. Конъюгированное с фикоэритрином (ФЭ) антитело против мышиного IgG1 (Pharmingen) использовали в качестве "второго" антитела для детекции связанного TRA-8. Флуоресценцию 1 х 104 клеток измеряли на проточном цитометре (FACSVantage) при следующих условиях:
Длина волны возбуждения: 488 нм;
Длина волны детекции: 600 нм.
Проточный цитометрический анализ показал, что TRA-8 окрашивало приблизительно 30% клеток COS-7, трансфицированных DR5-вектором, на что указывала заштрихованная гистограмма на фиг.1с. Этот процент соответствует эффективности трансфекции, определенной с помощью анализа на трансфекцию, проводимого с использованием белка, флуоресцирующего в зеленом диапазоне спектра (GFP)(данные не приводятся). TRA-8 не давало значительного окрашивания клеток, трансфицированных либо DR4 (незаштри-хованная гистограмма), либо контрольным вектором (пунктирная гистограмма), что указывало на то, что TRA-8 является специфичным для DR5 клеточной поверхности. Несмотря на широкие исследования экспрессии DR5 в опухолевых клетках на мРНК-уровне (Rieger J. et al. 1:FEBS Lett 1998 May 1; 427(1):124-8) механизм поверхностной экспрессии DR5 точно неизвестен. Gibson S.B. et al.,1:Mol.Cell.Biol.2000 Jan; 20(1):205-12; Kim K. et al. 1:Clin.Cancer.Res. 2000 Feb; 6(2):335-46. Таким образом, наличие моноклонального DR5-антиантитела позволило авторам изобретения оценить уровни экспрессии DR5 на клеточной поверхности и выявить корреляцию экспрессии с чувствительностью клеток к TRAIL-опосредованному апоптозу. Нижеследующую панель клеток (1×106) инкубировали с 10 мкг/мл аффинноочищенного TRA-8 при комнатной температуре в течение 30 минут, а затем окрашивали ФЭ-конъюгированным антителом против мышиного IgG1 (Pharmingen) в течение еще 30 минут. 10000 жизнеспособных клеток анализировали на проточном цитометре FACSVantage при следующих условиях:
Длина волны возбуждения: 488 нм;
Длина волны детекции: 600 нм.
Было протестировано пять гемопоэтических клеточных линий: Jurkat, СЕМ-6, Molt-4, Н-9 и U937. Экспрессия DR5 наблюдалась на поверхности клеток Jurkat, СЕМ-6, Н-9 и U937, но почти не обнаруживалась на клетках Molt-4, как показано на фиг.2а и 2а'. Хотя высокие уровни экспрессии РНК DR5 были описаны ранее [43], однако FACS-анализ показал, что эти клетки не экспрессируют высоких уровней поверхностного DR5. Эти результаты показали, что экспрессия DR5 на клеточной поверхности не коррелирует с транскрипционной экспрессией DR5, что не является неожиданным для данного рецептора. Уровень экспрессии DR5 на клеточной поверхности может быть специфическим в отношении клеточных линий дифференцировки, поскольку большинство клеток гемопоэтического происхождения экспрессировали низкие уровни DR5, тогда как большинство клеток глиомы и предстательной железы экспрессировали высокие уровни DR5.
Моноклональное антитело TRA-8 использовали для определения роли DR5 в индуцировании TRAIL-опосредованного апоптоза путем оценки панели различных типов опухолевых клеток человека на его экспрессию на клеточной поверхности, а также на чувствительность этих клеток к TRAIL- и TRA-8-опосредованному апоптозу. Первичные Т-клетки периферической крови не экспрессировали значительных уровней DR5 на своей клеточной поверхности и были резистентными к TRAIL- и TRA-8-опосредованному апоптозу (фиг.2а, 2а' и 3а'). Хотя все пять протестированных клеточных линий Т-клеточного лейкоза человека экспрессировали детектируемые, но относительно низкие уровни DR5 клеточной поверхности, однако две из них (Jurkat и СЕМ-6) оказались в высокой степени восприимчивыми к TRAIL- и TRA-8-опосредованному апоптозу, что свидетельствовало о том, что для индуцирования апопотоза этих клеток достаточно одного DR5. Клетки Molt-4 и U937 были частично восприимчивыми к TRAIL-опосредованному апоптозу, но относительно резистентными к TRA-8-опосредованному апоптозу, что позволяет предположить, что другие TRAIL-рецепторы могут участвовать в передаче сигнала апоптоза. Клетки Н-9 являются резистентными к TRAIL- и TRA-8-опосредованному апоптозу, что позволяет сделать вывод о блокировании, опосредуемом внутриклеточным антиапоптотическим механизмом.
Панель клеток включала клеточные линии злокачественной глиомы человека, Hs683, U251MG, D37MG, D54MG, U373MG, СН235MG, U87 и нормальные астроциты человека, которые были предоставлены Dr. Yancey Gillespie of the Neurosurgery Department of the University of Alabama at Birmingham. Клеточные линии злокачественной опухоли предстательной железы человека, Du154, PC3 и LnCap, были предоставлены Dr. William Grizzle of the Pathology Department of the University of Alabama at Birmingham, который получал указанные клеточные линии из Американской коллекции типовых культур. Т-клеточные линии лейкоза человека, В-клеточной лимфомы, клетки Jurkat НерG2 (Американская коллекция типовых культур TIB-152) и CCRF-CEM СЕМ-6 (Американская коллекция типовых культур № CRL-119); моноцитарные клеточные линии, U937 (Американская коллекция типовых культур № CRL-2376) закупали в Американской коллекции типовых культур. Все вышеуказанные клеточные линии культивировали в среде RPMI 1640, в которую была добавлена 10% FCS. Клеточная линия астроцитомы человека, 1321N1, была любезно предоставлена Dr. Richard Jope of Psychiatry Department of the University of Alabama at Birmingham и была культивирована в среде DMEM с добавлением 5% FCS.
Растворимый рекомбинантный человеческий TRAIL, закупленный у Alexis Corporation (San Diego, CA), представляет собой гибридный белок, состоящий из внеклеточного домена человеческого TRAIL (аминокислотные остатки 95-281), присоединенного у N-конца к FLAG-метке, и линкерного пептида из 8 аминокислот. В отличие от ранее описанного His-меченного TRAIL, этот препарат из одного TRAIL не индуцирует сильный апоптотический ответ в клетках Jurkat, и для усиления апопотоза требуется присутствие антитела против FLAG в качестве перекрестносвязывающего агента. Антитело против FLAG также закупали у Alexis.
Все 10 протестированных злокачественных клеток глиомы человека экспрессировали детектируемые уровни DR5 на клеточной поверхности. Большинство из них экспрессировали от промежуточных до высоких уровней DR5, как показано на фиг.2b. Три линии, D-54MG, U373MG и СН-235MG экспрессировали высокие уровни DR5, тогда как шесть линий Hs-683, U251-MG, D37-MG, U87, SМК1 и 1321N1 экспрессировали промежуточные уровни DR5. Только одна клеточная линия, Н-465, экспрессировала низкие уровни DR5. Все три клеточные линии злокачественной опухоли предстательной железы экспрессировали высокие уровни DR5, как показано на фиг.2с.
Как и нормальные первичные Т-клетки, первичные В-клетки не экспрессировали значительных уровней DR5 и не подвергались апоптозу после обработки TRAIL или TRA-8 (фиг.2d). Три (SКW6.4, EB-3 и Raji) из четырех клеточных линий В-лимфомы экспрессировали относительно высокие уровни DR5 и были очень чувствительными к TRAIL- и TRA-8-опосредованному апоптозу. Четвертая клеточная линия, Daudi, экспрессировала очень низкие уровни DR5 и была гораздо менее чувствительна к TRAIL- и TRA-8-опосредованному апоптозу. Хотя первичные астроциты не экспрессировали детектируемых уровней DR5 клеточной поверхности (фиг.2b'), однако все четыре протестированные глиомные клеточные линии экспрессировали высокие уровни DR5. Более высокий уровень экспрессии DR5 на глиомных клетках в отличие от В- и Т-клеток не сопровождался значительно более высокой чувствительностью к TRAIL- и DR5-опосредованному апоптозу, что давало основание предположить, что уровень экспрессии DR5 на клеточной поверхности необязательно должен коррелировать с уровнем апоптоза опухолевых клеток. ОТ-ПЦР, проводимая для определения уровней переноса DR4, DR5 и DcR1, обнаруживала перенос этих рецепторов во все протестированные клетки (таблица 1). Однако в основном первичные нормальные клетки экспрессировали относительно низкие уровни DR5 по сравнению с трансформированными опухолевыми клетками.
* Полноразмерную РНК выделяли из клеток и ОТ-ПЦР осуществляли, как описано в Методах. ПЦР-продукты разделяли на 3% агарозном геле и анализировали с использованием системы Fluor-S MAX MiltiImager System (BioRad). Величины представлены как отношения к значению для β-актина.
Пример 8. Индуцирование апопотоза in vitro в злокачественных клетках
Для того чтобы определить, индуцирует ли TRA-8 апоптоз в трансформированных клетках in vitro, все DR5-положительные опухолевые клетки оценивали на их чувствительность к апопотозу, индуцированному TRA-8 или TRAIL.
Клетки-мишени (1 х 103 на лунку) культивировали в 96-луночных планшетах в присутствии указанных концентраций растворимого TRAIL вместе с перекрестносвязывающим агентом (Alexis) или TRA-8 при 37°С в течение ночи. Жизнеспособность клеток определяли с использованием (1) набора ATPLite в соответствии с инструкциями производителей (Packard Instruments, Meriden, CT); (2) набора для оценки пролиферации/жизнеспособности клеток МТТ (Sigma); или (3) PI-окрашивания погибших клеток, и клетки анализировали с помощью проточной цитометрии. После завершения культивирования клетки окрашивали 10 мкг/мл PI и PI-негативные клетки отсортировывали как жизнеспособные клетки. Для анализа конденсированных ядер гепатоцитов клетки окрашивали 10 нг/мл Hoechst 33352 (Molecular Probes) и анализировали с помощью проточной цитометрии.
Антитело TRA-8 оказалось способным индуцировать апоптоз у большинства злокачественных глиомных клеточных линий человека (9/10), у 2 из 3 злокачественных клеточных линий предстательной железы и у 2 из 4 DR5-положительных гемопоэтических клеточных линий. Это антитело не индуцировало апоптоз клеточной линии Molt-4, которая экспрессирует на своей поверхности почти недетектируемые уровни DR5. Однако среди указанных клеточных линий уровни чувствительности клеток к TRA-8-опосредованнному апоптозу значительно варьируются.
Вариабильность чувствительности указанных клеток к индуцированному антителом TRA-8 апоптозу дает основание предположить, что хотя для такой чувствительности требуется минимальный уровень экспрессии DR5 на клеточной поверхности, однако этот уровень экспрессии DR5 на клеточной поверхности необязательно является главным определяющим фактором чувствительности и на этот процесс влияют другие факторы. Нсмотря на то что все клетки глиомы в основном экспрессировали значительно более высокие уровни поверхностного DR5, чем гемопоэтические клетки, чувствительность глиомных клеток к TRA-8-индуцированному апоптозу в отличие от гемопоэтических клеток не увеличивалась пропорционально. Чувствительность пяти клеточных линий глиомы D-37MG, D-54MG, U373-MG, СН235-MG и 1321N1 к TRA-8-опосредованному апоптозу является высокой и эквивалентна их чувствительности к TRAIL-опосредованному апоптозу, как показано на фиг.3b. Две глиомные клеточные линии, Н-456 и SМК1, гораздо менее восприимчивы к апоптозу, индуцированному TRA-8. В случае клеток Н-456 экспрессия поверхностного DR5 является низкой; однако у более чувствительных клеточных линий, экспрессия DR5 на поверхности SМК1 является аналогичной, что позволяет предположить, что в определении чувствительности к TRAIL-опосредованному апоптозу могут играть определенную роль и другие механизмы. Хотя все три клеточные линии злокачественной опухоли предстательной железы экспрессировали высокие уровни DR5, однако клетки Du145 являются наиболее чувствительными к TRA-8-опосредованному апоптозу, клетки РС3 являются частично чувствительными, а клетки LnCAP являются полностью резистентными к апоптозу, как показано на фиг.3с. Было обнаружено, что среди гемопоэтических клеток клетки Jurkat и СЕМ-6 являются очень восприимчивыми к TRA-8-апоптозу, как показано на фиг.2а, хотя обе эти клеточные линии, как было обнаружено, экспрессировали низкие уровни DR5. Несмотря на то что DR5 был детектирован на клетках U937 эти клетки оказались резистентными к TRA-8-опосредованному апоптозу. Аналогичным образом хотя клетки Н-9 экспрессировали детектируемые уровни DR5, однако клетки Н-9 были резистентными к TRA-8-опосредованному апоптозу. Эти результаты подтвердили существование регуляторных механизмов, влияющих на DR5-опосредованный апоптоз.
Дополнительные антитела против DR5, связывающиеся с поверхностью клеток, были продуцированы, как описано в процедурах примеров 1-3. Два дополнительных антитела против DR5, обозначенных TRA-1 и TRA-10, исследовали вместе с TRA-8 для определения их относительной способности индуцировать апоптоз, и для того чтобы установить, действуют ли они как агонисты или, наоборот, блокируют TRAIL-опосредованный апоптоз, то есть действуют как антагонисты. Человеческие клетки Jurkat были использованы в качестве мишени для определения агонистической и/или антагонистической активности трех антител против DR5, обозначенных TRA-1, TRA-8 и TRA-10. Как показано на Фиг.4, после инкубирования в течение ночи с 2,5 мкг на мл, жизнеспособность клеток составляла примерно 90, 70 и 20% для TRA-10, TRA-1 и TRA-8 соответственно. Антитело TRA-8 индуцировало сильный апоптотический дозозависимый ответ, TRA-1 индуцировало лишь умеренный апоптотический ответ, а TRA-10 индуцировало лишь слабый ответ. Поэтому TRA-8 было классифицировано как антитело-агонист против DR5. На фиг.4 жизнеспособность человеческих клеток Jurkat показана как дозозависимая функция TRAIL-индуцированного апоптоза. В исследовании апоптоза, индуцированного низкими дозами TRAIL, TRA-10 в значительной степени блокировало апоптоз человеческих клеток Jurkat. Таким образом, TRA-10 было классифицировано как антитело-антагонист против DR5. TRA-1 было депонировано в Американской коллекции типовых культур под регистрационным номером РТА-1741. TRA-10 было депонировано в Американской коллекции типовых культур под регистрационным номером РТА-1742.
Чувствительность пяти глиомных клеточных линий, D-37MG, D-54MG, U373-MG, СН235-MG и 1321N1 к TRA-8-индуцированному апоптозу эквивалента их чувствительности к TRAIL-опосредованному апоптозу, как показано на фиг.3b, что указывало на то, что TRAIL-индуцированный апоптоз в этих клетках опосредуется, главным образом, DR5. Кроме того, две глиомные клеточные линии, Hs683 и U251-MG, являются резистентными к TRAIL-индуцированному апоптозу, но частично чувствительными к TRA-8- индуцированному апоптозу, что указывает на то, что в этих клетках функционируют рецепторы-ловушки и что использование антитела TRA-8 позволяет "обходить" этот регуляторный механизм. В клеточных линиях злокачественной опухоли предстательной железы несмотря на их варьирующуюся чувствительность к TRA-8-индуцированному апоптозу эта чувствительность коррелирует с чувствительностью клеток к апоптозу, индуцированному TRAIL, что снова позволяет предположить, что DR5 играет главную роль в TRAIL-опосредованном апоптозе злокачественных клеток предстательной железы. Было обнаружено, что из гемопоэтических клеток клетки Jurkat и СЕМ-6 являются очень чувствительными к TRA-8- и TRAIL-опосредованному апоптозу. Уровень апоптоза, индуцированного TRA-8, аналогичен уровню апоптоза, индуцированному TRAIL, как показано на фиг.2а и 3а'. Лишь одна глиомная клеточная линия, U87, и две гемопоэтические клеточные линии, U937 и Molt-4, обнаруживали чувствительность к TRAIL-индуцированному апоптозу, но при этом они были менее чувствительными или вообще резистентными к TRA-8-индуцированному апоптозу. Одна клеточная линия, Н-9, экспрессировала детектируемые уровни DR5, но была резистентной к апоптозу, индуцированному TRA-8 или TRAIL. Хотя для TRA-8-индуцированного апоптоза требуются минимальные уровни экспрессии DR5, однако уровень экспрессии DR5 не обязательно является показателем чувствительности клеток к TRA-8-опосредованному апоптозу, поскольку в некоторых клетках в модуляции TRAIL-опосредованного апоптоза определенную роль играют рецепторы-ловушки, но не очевидно, что они играют главную роль в большинстве тестируемых ранее клеток, а поэтому, как и ожидалось, использование антитела TRA-8 позволяет "обходить" действие этих рецепторов-ловушек; при этом в трансформированных клетках могут присутствовать функциональные мутации рецептора DR5; и наконец, внутриклеточные регуляторные механизмы могут иметь важное или даже более весомое значение для определения чувствительности клеток к TRAIL- и DR5-опосредованному апоптозу, чем рецепторы-ловушки.
Проведенные ранее исследования показали, что мРНК DR5 имеет широкое распределение в нормальных тканях [7]. Для оценки экспрессии DR5 на белковом уровне панель гомогенатов нормальной ткани человека (Geno Technology, St. Louis, MO) зондировали антителом TRA-8 в Вестерн-блот-анализе. Из девяти нормальных человеческих тканей ткань головного мозга была слабо положительной (фиг.5а, дорожка 2). Реактивность TRA-8 не обнаруживала белок DR5 в печени (дорожка 1), легком (дорожка 3), почках (дорожка 4), селезенке (дорожка 5), яичках (дорожка 6), яичниках (дорожка 7), сердце (дорожка 8) или в поджелудочной железе (дорожка 9). В противоположность этому все тринадцать злокачественных тканей человека были позитивно окрашены TRA-8 (фиг.5b), включая раковые ткани яичника (дорожка 1), легкого (дорожка 2), печени (дорожка 3), прямой кишки (дорожка 4), шейки матки (дорожка 5), кожи (дорожка 6), яичек (дорожка 7), щитовидной железы (дорожка 8), матки (дорожка 10), желудка (дорожка 11), носоглотки (дорожка 12) и поджелудочной железы (дорожка 13). Кроме того, иммуногистохимический анализ in situ нормальных и злокачественных тканей с использованием TRA-8 подтвердил, что за исключением нескольких разрозненных положительных клеток в селезенке экспрессия DR5 в нормальных тканях молочной железы, легких и селезенки не детектировалась (фиг.5с). Соответствующие раковые ткани, включая инфильтрирующую дуктальную карциному молочной железы, мелкоклеточный рак легких и лимфому, положительно реагировали с TRA-8 (фиг.5d). Из всех протестированных 22 злокачественных тканей 5 из 6 тканей злокачественной опухоли молочной железы, 2 из 2 тканей злокачественной опухоли шейки матки, 4 из 5 тканей злокачественной опухоли печени, 5 из 8 лимфом, 2 из 2 тканей злокачественной опухоли легких и 2 из 2 тканей злокачественной опухоли поджелудочной железы положительно реагировали с TRA-8. Эти результаты совпадают с результатами, полученными в проточном цитометрическом анализе, и указывают на то, что раковые ткани экспрессируют более высокие уровни DR5, чем нормальные ткани.
Пример 9. Тумороцидная активность TRA-8 in vivo
По различным причинам многие агенты, которые давали обещающие результаты в in vitro исследованиях, не обнаруживали эффективности in vivo. Поэтому важно проанализировать эффективность TRA-8 на модели животного in vivo. Для этого антитело TRA-8 против человеческого DR5 вводили мышам, несущим ксенотрансплантаты человека, которые экспрессируют молекулу человеческого DR5. В этих целях использовали 6-8-недельных мышей NOD/SCID (Jackson Laboratory), которым подкожно инъецировали клетки астроцитомы человека 1321N1 (1 х 107), либо внутривенно инъецировали клетки лейкоза Jurkat человека (1 х 106). На 2-ой день после инокуляции опухолью мышам внутривенно инъецировали TRA-8 (100 мкг). Через пять дней после TRA-8-обработки рост опухолевых клеток 1321N1 определяли по размеру и массе опухоли. Рост клеток Jurkat определяли по массе селезенки и по проценту CD-3-положительных человеческих клеток Jurkat в селезенке инокулированных животных. Затем брали биопсию опухолевых тканей и проводили гистологический анализ.
Ранняя обработка одной внутривенной дозой 100 мкг TRA-8 через один день после инокуляции опухолью приводила к полному ингибированию клеток 1321N1 в образовавшейся твердой опухоли (фиг.6а). Поздняя обработка тремя дозами 100 мкг TRA-8 через одну неделю после инокуляции опухолью приводила к 4-кратному или более уменьшению массы опухоли (фиг.6b). Образование опухоли не наблюдалось у животных, рано обработанных TRA-8 (фиг.6с, верхняя панель). Гистологический анализ выявил резкую дегенерацию опухолевой ткани у животных, обработанных TRA-8 (фиг.6с, нижняя панель). Аналогичным образом TRA-8-обработка ингибировала заселение селезенки клетками Jurkat, на что указывал дефицит CD3-положительных клеток Jurkat в селезенке (фиг.6d, 6е). Гистологический анализ имплантированной опухоли выявил несколько разрозненных опухолевых клеток мягкой ткани TRA-8-обработанных животных, тогда как у контрольных животных обнаруживалось образование твердой опухоли, как показано на фиг.6с. В модельных клетках Jurkat число клеток Jurkat в селезенке у TRA-8-обработанных животных составляло менее чем 2 % в отличие от почти 10%-ного их содержания в селезенке контрольных животных, как было продемонстрировано в проточном цитометрическом анализе, проиллюстрированном на фиг.6а, и при in situ CD3-окрашивании, как показано на фиг.6с.
Эти результаты подтверждают недавно полученные данные, указывающие на то, что системное введение перекрестно-связанного рекомбинантного TRAIL приводит к ингибированию роста опухоли in vivo [13]. Эти результаты показали, что одна доза TRA-8 является в высокой степени эффективной в элиминации опухолевых клеток in vivo.
Поскольку в мышиной модели использовали античеловеческое антитело, то в оценке токсичности TRA-8-обработки не было необходимости. Однако исследование введения TRAIL in vivo показали, что указанная обработка не ассоциируется с какой-либо значительной токсичностью [13].
Пример 10. Синовиальные клетки RA являются чувствительными в TRAIL- и TRA-8-индуцированному апоптозу
Большинство предшествующих исследований по TRAIL-опосредованному апоптозу было направлено на злокачественные клетки. В соответствии с настоящим изобретением TRAIL-опосредованный апоптоз имеет также терапевтический эффект при аутоиммунных и воспалительных состояниях, таких как РА.
10.1. Проточный цитометрический анализ экспрессии DR5 на клеточной поверхности синовиальных клеток при РА
Экспрессию DR5 на панели из восьми первичных культивированных синовиальных клеток у пациентов с РА сравнивали с экспрессией DR5 на панели из восьми первичных культивированных синовиальных клеток у пациентов с остеоартритом (обозначаемым далее "ОА"). Восемь клеточных культур первичных синовиальных клеток RA: RA-1014, RA-1016, RA-512, RA-707, RA-811, RA-716 и RA-929 были любезно предоставлены Dr. M. Ohtsuki (Sankyo Co. Ltd., Tokyo, Japan) и культивированы в DMEM, в которую были добавлены 10% FCS, пенициллин, стрептомицин и глутамин. Семь первичных клеточных культур синовиальных клеток ОА выделяли из синовиальных тканей пациентов с ОА стандартным методом с использованием коллагеназы и культивировали в тех же условиях. Число пассажей всех первичных клеток составляло 10. Экспрессию DR5 определяли с помощью FACS-анализа, как описано в примере 5.
Все первичные культуры клеток RA экспрессировали высокие уровни поверхностного DR5, и у этих синовиальных клеток, выделенных у различных пациентов, как показано на фиг.7а, наблюдалось небольшое различие в уровнях экспрессии. В противоположность этому экспрессия DR5 на поверхности синовиальных клеток, выделенных у пациентов с ОА, была либо очень низкой, либо вообще не детектировалась, как показано на фиг.7b. Было обнаружено, что SV40-трансформированные клетки экспрессировали высокие уровни DR5, сравнимые с уровнями, экспрессируемыми клетками RA. В противоположность этому нетрансформированные клетки фибробластов экспрессировали низкие уровни DR5, сравнимые с уровнями, экспрессируемыми клетками ОА, как показано на фиг.7b.
10.2. Чувствительность синовиальных клеток РА к апоптозу, опосредованному TRA-8 или TRAIL
В основном все синовиальные клетки, выделенные у пациентов с РА, были чувствительными к апоптозу, индуцированному TRAIL и антителом против DR5, а все клетки ОА были резистентными к апоптозу, индуцированному TRAIL и антителом против DR5, как показано на Фиг.8а,b. Эти исследования показали, что антитело TRA-8 нацелено преимущественно на измененные клетки, а не на нормальные клетки. Кроме того, картина чувствительности или резистентности к апоптозу, индуцированному TRAIL, коррелирует с картиной чувствительности или резистентности к апоптозу, индуцированному антителом против DR5, что свидетельствует о том, что для запуска TRAIL-апоптоза синовиальные клетки используют, главным образом, DR5.
Как и у злокачественных клеток, у синовиальных клеток RA чувствительность к апоптозу, индуцированному TRAIL или антителом против DR5, варьируется, хотя они экспрессируют аналогичные уровни DR5. RA-512 и RA-707 являются наиболее чувствительными, поскольку свыше 80% клеток уничтожались концентрациями TRAIL или TRA-8, составляющими менее 20 нг/мл. RA-1014, RA-811, RA-716 и RA-929 являются клетками с промежуточной чувствительностью к TRAIL или TRA-8, при этом почти 100%-ная гибель клеток наблюдалась в присутствии высоких концентраций (>50 мг/мл) TRAIL или TRA-8. Что касается клеток RA-1016 и RA-1021, то несмотря на то что большинство из них (свыше 60%) погибали при низкой дозе TRAIL или TRA-8, часть клеток выживала в присутствии высоких концентраций TRAIL или TRA-8, что свидетельствовало о том, что субпопуляция этих клеток была резистентной к TRAIL-опосредованному апоптозу. В противоположность этому все клетки ОА были гораздо менее чувствительными к TRAIL- и TRA-8-индуцированному апоптозу. При этом даже в присутствии высокой концентрации TRAIL или TRA-8 погибало не более чем 60% клеток ОА52F и ОА69F. Клетки ОА 72М были полностью резистентными к TRAIL- и TRA-8-индуцированному апоптозу. SV40-трансформированные синовиальные клетки также были чувствительными к TRAIL- и TRA-8-индуцированному апоптозу (данные не приводятся). В противоположность этому нетрансформированные клетки фибробластов являются, очевидно, резистентными в TRAIL и TRA-8.
Ранее было показано, что для запуска апоптоза DR5 использует путь, в котором участвует FADD/каспаза 8 [44]. Для определения каспазозависимого DR5-опосредованного апоптоза синовиальных клеток RA клетки RA культивировали с TRAIL или антителом против DR5 в присутствии специфических ингибиторов каспазы. Из восьми протестированных ингибиторов каспазы ингибиторы каспазы 6, 8 и 10 обладали способностью ингибировать апоптоз синовиальных клеток RA, индуцированный TRAIL и DR5, как показано на фиг.9, что указывало на то, что эти три каспазы участвуют в DR5-опосредованном апоптозе.
10.3 TRA-8 или TRAIL индуцируют активацию NF-kb в синовиальных клетках RA, не приводящую к повышенному высвобождению ММР
Имеется значительное количество данных, подтверждающих идею о том, что существует тесная связь между передачей сигнала апоптоза и передачей сигнала пролиферации [45]. Было установлено, что DR5 помимо передачи сигнала апоптоза способен активировать NF-kb-путь, и что активация NF-kb может способствовать передаче антиапоптотического сигнала. Поэтому был проведен анализ на сдвиг в геле. Клетки стимулировали 50 нг/мл рекомбинантного растворимого TRAIL, Fas-лиганда, в присутствии 1 мг/мл энхансера или 50 нг/мл TRA-8 в течение указанного времени. Получали ядерные экстракты и эти экстракты инкубировали с [32Р]-меченным олиго-ДНК-зондом, подвергнутым двойному окрашиванию. Результаты анализировали с использованием люминофора Cyclone (TopCount NXT, Packard Instrument Company, CT). После инкубирования синовиальных клеток RA с TNF-α или TRAIL клетки NF-kb активировались в зависимости от времени инкубирования. Антитело TRA-8 способствовало сильной активации NF-kb. В противоположность этому Fas-лиганд оказался неспособным индуцировать активацию NF-kb, как показано на фиг.10а.
Таким образом, хотя TRAIL и антитело TRA-8 индуцируют сильный апоптотический ответ в синовиальных клетках RA, однако они также активируют NF-kb, а активация NF-kb, как известно, усиливает провоспалительное действие TNF-α при ревматоидном артрите РА. Таким образом, возможно, что TRAIL, так же как и TRA-8, может служить в качестве провоспалительного цитокина. Для того чтобы определить, имеет ли TRAIL- и TNF-α-индуцированная активация NF-kb аналогичное биологическое действие, определяли продуцирование ММР с помощью ELISA. Синовиальные клетки культивировали лишь в одной среде: либо в среде с 50 нг/мг интерлейкина 1b, 10 нг/мл TNF-α, 50 нг/мг TRAIL или 50 нг/мл TRA-8 в течение ночи. Уровни ММР1 и ММР-3 в супернатантах культуры определяли с использованием ELISA-наборов.
При инкубировании синовиальных клеток RA с провоспалительным цитокином, TNF-α или IL-1b продуцирование ММР-1, 3 и 13 увеличивалось по сравнению с контролем, где использовалась среда, как показано на фиг.10 b,c. В противоположность этому обработка TRAIL или антителом против DR5 не ассоциировалась с повышенным высвобождением указанных ММР.
Пример 11А. Отсутствие гепатоцеллюлярной токсичности
Для 24-часовых анализов на жизнеспособность клеток свежие нормальные гепатоциты человека в 96-луночных планшетах закупали у In Vitro Technology (Baltimore, MD). Гепатоциты культивировали в среде для культивирования гепатоцитов, содержащей 1 мкг/мл растворимого TRAIL или TRA-8. Для проведения 6-часовых анализов на жизнеспособность клеток нормальные гепатоциты или гепатоцеллюлярные раковые клетки выделяли из свежих хирургических образцов, взятых в Центре по поставке тканевого материала (UAB Tissue Procurement Center). Все реагенты для выделения гепатоцитов человека, включая буфер для перфузии гепатоцитов, среду для гидролиза, промывочную среду и среду для связывания, закупали у Gibco. Ткань на предметных стеклах гидролизовали в среде для гидролиза гепатоцитов при 37°С и со встряхиванием (50 об/мин) в течение одного часа. Выделенные гепатоциты собирали путем центрифугирования при низкой скорости (50 g, 3 мин) и 6 раз промывали средой для промывки гепатоцитов. Моноклеточную суспензию гепатоцитов культивировали в среде для связывания, содержащей 10% FCS, в 96-луночных планшетах Matrigel (BD) в течение шести часов. Несвязанные гепатоциты удаляли путем двойной промывки предварительно нагретой средой для связывания. Затем связанные гепатоциты инкубировали с различными концентрациями растворимого TRAIL или FasL в присутствии перекрестно-связывающего агента, TRA-8 или СН11 в течение 6 часов.
TRAIL имеет, по крайней мере, два рецептора (DR4 и DR5), способных индуцировать апоптоз. TRA-8 использовали для того, чтобы определить, достаточно ли одного перекрестного связывания DR5 для индуцирования апоптоза нормальных гепатоцитов. Экспрессию DR5 на белковом уровне оценивали в пяти нормальных тканях печени человека и в пяти злокачественных тканях печени человека посредством иммуногистохимического анализа in situ с использованием TRA-8. Срезы нормальных тканей печени обнаруживали нормальную архитектуру и морфологию клетки после окрашивания H&E (Фиг.11а, левые верхние панели) в отсутствие положительной реакции с антителом TRA-8 против DR5 (Фиг.11а, левые нижние панели). В противоположность этому гепатоцеллюлярная ткань карциномы человека положительно реагировала с TRA-8, причем, картина этой реакции соответствовала присутствию DR5 на клеточной мембране и в цитоплазме злокачественных клеток. Клеточная линия человеческой гепатоцеллюларной карциномы человека НерG2 также была DR5-положительной. Эти результаты совпадали с результатами, полученными для пяти нормальных тканей печени, и лишь одна из пяти злокачественных тканей печени (аденома печени) оказалась DR5-отрицательной. Эти результаты совпадают с данными Вестерн-блот-анализа, представленными на фиг.5а и указывающими на то, что, как и в случае других нормальных тканей, нормальная ткань печени человека не экспрессировала значительных уровней белка DR5. Кроме того, Вестерн-блот-анализ выделенных нормальных гепатоцитов человека, зондированных TRA-8, не выявил детектируемых уровней DR5.
Экспрессия DR5 на поверхности гепатоцитов человека, обнаруженная в проточном цитометрическом анализе, показала, что свежеприготовленные нормальные гепатоциты не экспрессировали детектируемых уровней DR5 на клеточной поверхности (фиг.11b, верхние левые панели). DR5 не был детектирован на нормальных гепатоцитах человека, которые были подвергнуты криоконсервации или помещены в кратковременную культуру. В противоположность этому свежевыделенные клетки гепатоцеллюлярной карциномы, как и клетки НерG2, экспрессировали DR5 на своей поверхности. При использовании Fas для сравнения было выявлено, что все нормальные гепатоциты, гепатоцеллюлярные клетки карциномы и клетки НерG2, все экспрессировали эквивалентные уровни Fas (фиг.11b, нижние панели). Эти результаты совпадают с результатами, полученными в иммуногистохимическом анализе in situ и в Вестерн-блот-анализе, и указывают на то, что DR5 в высокой степени экспрессируется на поверхности злокачественных клеток печени, но не на поверхности нормальных гепатоцитов. Присутствие мРНК-уровней для DR4, DR5, DcR1 и DcR2 в человеческих гепатоцитах, как было продемонстрировано с помощью ОТ-ПЦР [23], позволяет предположить, что гепатоциты человека могут экспрессировать очень низкие уровни белка DR5, которые составляют ниже пороговых уровней для детекции TRA-8.
Для того чтобы определить, индуцирует ли TRA-8 гепатоцеллюлярную токсичность, оценивали чувствительность нормальных гепатоцитов человека к апоптозу, индуцированному TRA-8 и растворимым TRAIL вместе с перекрестносвязывающим агентом. При культивировании нормальных гепатоцитов в присутствии высокой концентрации TRAIL наблюдалось зависимое от времени снижение жизнеспособности клеток, как было определено с помощью анализов ATPLite (фиг.12а) и МТТ. TRAIL-опосредованная гибель нормальных гепатоцитов могла наблюдаться уже через четыре часа после добавления TRAIL. После завершения 24-часового культивирования более чем 80% гепатоцитов погибали под действием TRAIL. В противоположность этому за аналогичный период культивирования TRA-8 не индуцировало значительной гибели нормальных гепатоцитов. Число конденсированных ядер, окрашенных Hoechst и являющихся индикаторами апоптоза, увеличивалось у TRAIL-обработанных гепатоцитов, но не у TRA-8-обработанных гепатоцитов (фиг.12b). Число апоптотических гепатоцитов явно коррелировало со снижением жизнеспособности клеток, как было определено в анализе ATPLite, что дает основание предположить, что TRAIL-индуцированная гибель гепатоцитов опосредована апоптозом. Это было подтверждено способностью Z-VAD ингибировать TRAIL-опосредованную токсичность гепатоцитов. Поскольку циклогексимид является сильным стимулятором апоптоза, то было проведено исследование действия этого соединения на TRAIL- и TRA-8-обработанные гепатоциты. Во время 4-часового культивирования циклогексимид значительно усиливал гибель гепатоцитов, индуцированную TRAIL, при этом более чем 70% гепатоцитов погибали под действием TRAIL в присутствии циклогексимида (фиг.12с). Однако обработка циклогексимидом не приводила к увеличению TRA-8-опосредованной гибели гепатоцитов. Для сравнения характеристик TRA-8-индуцированного апоптоза гепатоцитов с TRAIL-индуцированным апоптозом нормальные гепатоциты, а также раковые клетки инкубировали с различными концентрациями растворимого TRAIL вместе с перекрестносвязывающим агентом или с TRA-8. Во время 6-часового культивирования TRAIL индуцировал умеренный апопототический ответ у нормальных гепатоцитов. Свыше 20% гепатоцитов погибали в присутствии 500 нг/мл TRAIL (фиг.12d, верхняя левая панель). TRA-8-обработка нормальных гепатоцитов за тот же самый промежуток времени не приводила к какой-либо значительной клеточной гибели. В противоположность нормальным гепатоцитам первичные гепатоцеллюлярные клетки карциномы (фиг.12d, верхняя средняя панель) и клетки НерG2 (фиг.12d, верхняя правая панель) были в высокой степени чувствительны к апоптозу, опосредованному TRAIL или TRA-8. Свыше 80% гепатоцеллюлярных клеток карциномы и почти 100% клеток НерG2 погибали в течение 8-часового периода культивирования. Эти результаты показали, что нормальные гепатоциты являются полностью резистентными к TRA-8-опосредованному апоптозу и гораздо менее чувствительными к TRAIL-опосредованному апоптозу, чем раковые клетки печени. При использовании Fas-лиганда и антитела против Fas (СН-11) какого-либо значительного различия в чувствительности к Fas-опосредованному апоптозу нормальных гепатоцитов, гепатоцеллюлярных клеток карциномы и клеток НерG2 не наблюдалось (фиг.12d, нижние панели).
Сравнительный пример 11В. Индуцирование гепатита in vivo мембрано-ассоциированным TRAIL человека
8-10-недельным самкам мышей В6 внутривенно инъецировали 109 б.о.е. Ad/hTRAIL с равным количеством Ad/Tet-on. Сразу после инокуляции аденовирусными векторами мышам давали питьевую воду с различными концентрациями тетрациклина. Поражение печени определяли по уровням AST в сыворотке с использованием диагностического набора AST (Sigma). Экспрессию TRAIL определяли с помощью Нозерн-блот-анализа.
Для того чтобы определить, индуцирует ли мембраноассоциированная форма TRAIL поражение печени in vivo, конструировали рекомбинантный аденовирусный вектор, кодирующий полноразмерный человеческий TRAIL (Ad/hTRAIL), экспрессия которого находится под контролем тетрациклин-индуцибельного промотора. Через 24 часа после внутривенной Ad/hTRAIL-инокуляции мышей В6 наблюдалась дозозависимая индуцированная тетрациклином экспрессия человеческого TRAIL человека в печени, как было продемонстрировано с помощью Нозерн-блот-анализа (фиг.13а). Уровни экспрессии TRAIL явно коррелировали с поражением печени, на что указывало тетрациклинзависимое, а также дозозависимое увеличение уровней трансаминаз в сыворотке (фиг.13b). Поскольку инокуляция аденовирусным вектором per se приводила к увеличению чувствительности гепатоцитов к TRAIL-опосредованному апоптозу, то гепатоциты мышей, инокулированных Ad/TRAIL, выделяли и тестировали на TRAIL-опосредованную клеточную гибель. Какого-либо значительно увеличения клеточной гибели Ad/TRAIL-инфицированных гепатоцитов по сравнению с контрольными мышами не наблюдалось (фиг.13с, левая панель). Более того, после внутривенной инъекции растворимого человеческого TRAIL у мышей, инокулированных Ad/TRAIL, не неблюдалось увеличения поражения печени. Из этого также следует, что гепатит, индуцированный Ad/TRAIL, опосредован высокими уровнями экспрессии TRAIL в мембранной форме. Гистологический анализ срезов печени выявил, что поражение гепатоцитов заметно уже через 24 часа после инокуляции вектором (Фиг.13d) и сохраняется, по крайней мере, в течение 7 дней (Фиг.13е). Эти патологические изменения в печени также зависят от тетрациклина и от дозы. На ранней стадии, через 24 часа после обработки, TRAIL-индуцированное поражение печени характеризовалась наличием очагов некроза. Инфильтрация воспалительных клеток не наблюдалась на этой стадии, но имело место геморрагия. На 7-й день после инокуляции наблюдались диффузные поражения печени с заметной дольковой неупорядоченностью, тяжелая дегенерация гепатоцитов с неравномерно комковатой структурой цитоплазмы и большими прозрачными областями, а также с явно выраженными апоптозом и некрозом. Характерным признаком этой стадии был обширный инфильтрат мононуклеарных клеток. Эти результаты показали, что человеческий TRAIL в его мембрано-ассоциированной форме способен индуцировать разрушение печени in vivo. Несмотря на способность человеческого TRAIL вызывать тяжелый гепатит у мышей, он не индуцировал летальный ответ. В противоположность этому у мышей, инокулированных аналогичными тетрациклин-регулируемыми векторами, кодирующими Fas-лиганд, развивался молниеносный гепатит с массивным апоптозом и некроз гепатоцитов сопровождался тяжелой геморрагией и смертью животных в зависимости от дозы тетрациклина через 72 часа после инокуляции. В подгруппе, получавшей 3 мг/мл или более тетрациклина, смертность достигала 100% через 48 часов после инокуляции. В противоположность этому все мыши, получавшие Ad/hTRAIL независимо от дозы тетрациклина были еще живы через четыре недели после инокуляции. Из этого следует, что in vivo, TRAIL в своей мембрано-ассоциированной форме является менее сильным индуктором гепатоцеллюлярных повреждений, чем Fas-лиганд. Кроме того, это позволяет предположить, что TRAIL может индуцировать поражение печени по механизму, который отличается от механизма, вызывающего токсичность Fas-лиганда.
Пример 12. Активированные Т- и В-клетки экспрессируют повышенные уровни DR5
Для того чтобы определить, играет ли DR5 какую-либо роль в TRAIL-опосредованном апоптозе активированных Т-клеток и В-клеток, оценивали экспрессию DR5 на поверхности покоящихся и активированных Т-клеток и В-клеток. Нестимулированные человеческие Т-клетки в МКПК не экспрессировали повышенных уровней DR5 (фиг.14). Через 48 часов после стимуляции либо антителом против CD3, либо Con-A экспрессия DR5 на клеточной поверхности заметно увеличивалась. Аналогичным образом нестимулированные В-клетки экспрессировали очень низкие уровни DR5. Стимуляцию анти-μ антителом, но не LPS, приводила к увеличению экспрессии DR5 на клеточной поверхности. Эти результаты показали, что объединенные органические слои активированные Т- и В-клетки экспрессируют более высокие уровни DR5 на своей поверхности. Клетки окрашивали 20 мкг/мл TRA-8 и ФЭ-конъюгированным антителом против мышиного IgG1.
Пример 13. Активированные Т- и В-клетки становятся чувствительными к TRA-8-опосредованному апоптозу
Для того чтобы определить, являются ли активированные Т- и В-клетки чувствительными к TRA-8-опосредованному апоптозу, Т-клетки и В-клетки из МКПК человека стимулировали in vitro анти-CD3 или анти-μ антителом в течение 48 часов соответственно. Жизнеспособные клетки и пролиферирующие бластные клетки собирали градиентным центрифугированием и инкубировали с различными концентрациями TRA-8. Нестимулированные Т-клетки и В-клетки были не чувствительны к TRA-8-опосредованному апоптозу (фиг.15). Все стимулированные Т- и В-клетки обнаруживали умеренное повышение чувствительности к TRA-8-опосредованному апоптозу, при этом 20% клеток погибали под действием TRA-8 после культивирования в течение ночи. В высокой степени пролиферирующие бластные Т-клетки были еще более чувствительны к TRA-8-опосредованному апоптозу. Более чем 70% бластных Т-клеток погибали под действием TRA-8. Бластные В-клетки по сравнению с другими клетками также были чувствительны к TRA-8-опосредованному апоптозу. Эти результаты показали, что активированные Т- и В-клетки были чувствительны к DR5-опосредованному апоптозу.
Пример 14. TRA-8 способствуют снижению числа активированных Т-клеток у человека/мыши SCID
Для определения in vivo анти-Т-клеточной эффективности TRA-8 мышам NOD/SCID внутривенно инъецировали 1 х 108 человеческих МКПК. Обычно Т-клетки человека у мышей SCID быстро активируются в ответ на ксеногенную стимуляцию. Мышам SCID с человеческими МКПК внутрибрюшинно инъецировали 100 мкг TRA-8 или контрольный IgG1 ежедневно в течение трех дней начиная с дня переноса. Через пять дней после переноса мононуклеарные клетки выделяли из селезенки и окрашивали антителом против человеческого CD3, после чего популяцию лимфоцитов отбирали с помощью проточного цитометрического анализа и анализировали на CD3-положительные Т-клетки человека. Приблизительно 30% лимфоцитов селезенки представляли собой Т-клетки человека, как было определено с помощью окрашивания антителом против человеческого CD3 у контрольных мышей. Однако среди лимфоцитов селезенки у TRA-8-обработанных мышей имелось лишь несколько человеческих Т-клеток (менее 3%) (фиг.16). Гистологическое исследование in situ в селезенке контрольных мышей выявило, что, Т-клетки человека снова заселялись в селезенку, причем было обнаружено только несколько апоптотических клеток, на что указывало окрашивание TUNEL. В противоположность этому у TRA-8-обработанных мышей повторное заселение жизнеспособными человеческими Т-клетками не наблюдалось, а вместо этого наблюдалось большое количество апоптотических клеток (фиг.17). Эти результаты показали, что TRA-8 обладают анти Т-клеточной активностью in vivo, а поэтому антитела настоящего изобретения могут быть использованы для лечения заболевания, ассоциированного с реакцией "трансплантат против хозяина".
Пример 15. Противораковая терапевтическая активность TRA-8
15.1 Экспрессия и функция DR5 в злокачественных тканях и клеточных линиях человека
i) Экспрессия DR5 в злокачественных тканях человека, обнаруживаемая при окрашивании in situ антителом TRA-8.
Для того чтобы определить, происходит ли дифференциальная экспрессия повышенных уровней DR5 в злокачественных клетках и тканях, панель злокачественных тканей человека, включающую свыше 20 злокачественных тканей молочной железы, 6 злокачественных тканей яичника, 5 злокачественных тканей толстой кишки и 5 злокачественных тканей предстательной железы окрашивали TRA-8 для иммуногистохимического анализа. Большинство этих злокачественных тканей экспрессировали детектируемый DR5. Уровни экспрессии DR5 в этих злокачественных тканях варьировались. В основном раковые ткани экспрессировали более высокие уровни DR5, чем ткани, не вовлеченные в патологический процесс. Кроме того, экспрессия DR5, очевидно, не коррелирует с мутацией р53.
ii) Экспрессия и функция DR5 в злокачественных клеточных линиях человека (Таблица 2). Десять клеточных линий злокачественной опухоли молочной железы человека, три клеточные линии злокачественной опухоли яичника человека, три клеточные линии злокачественной опухоли толстой кишки человека и три клеточные линии злокачественной опухоли предстательной железы человека оценивали in vitro на экспрессию DR5 на клеточной поверхности и чувствительность к TRAIL- и TRA-8-индуцированному апоптозу. 7 из 9 клеточных линий злокачественной опухоли молочной железы человека, 3 из 3 клеточных линий злокачественной опухоли яичника, 3 из 3 клеточных линий злокачественной опухоли толстой кишки и 3 из 3 клеточных линий злокачественной опухоли предстательной железы экспрессировали различные уровни DR5 на клеточной поверхности. Из 9 клеточных линий злокачественной опухоли молочной железы три оказались очень чувствительными к TRA-8-опосредованному апоптозу, три имели промежуточную чувствительность, а три были резистентными к TRA-8-опосредованному апоптозу. Все три клеточные линии злокачественной опухоли яичника имели очень высокую чувствительность. Одна из трех клеточных линий злокачественной опухоли толстой кишки имела очень высокую чувствительность, а две другие имели промежуточную чувствительность. Две из трех клеточных линий злокачественной опухоли предстательной железы имели промежуточную чувствительность, а одна оказалась резистентной.
Примечания: 1 определяли методом проточной цитометрии, клетки окрашивали 20 мкг/мл TRA-8 и сравнивали с контрольным антителом. 2 определяли с помощью анализа ATPLite. ++++: погибало свыше 80% клеток; +++: погибало 60-80% клеток; ++: погибало 40-60% клеток; +: погибало 20-40% клеток; - клетки не погибали.
iii) Общая цитотоксичность TRA-8 и адриамицина. В некоторых клеточных линия злокачественной опухоли молочной железы оценивали действие адриамицина на TRA-8-индуцированный апоптоз. Высокие дозы адриамицина давали дополнительный эффект. Однако в некоторых TRA-8-резистентных Т-клеточных линиях низкие дозы адриамицина синергически усиливали TRA-8-индуцированный апоптоз.
iv) In vitro и in vivo активность связывания TRA-8 с раковыми клетками человека. Использование меченного радиоизотопом TRA-8. Активность связывания TRA-8 с клеточной линией злокачественной опухоли молочной железы оценивали in vitro и in vivo у мышей SCID с имплантированной опухолью. In vitro активность связывания с раковыми клетками оценивали как величину Kd=3 нм, которая, по предварительным оценкам авторов изобретения с помощью ELISA, является постоянной и, по крайней мере, в 50 раз превышает величину для растворимого TRAIL. In vivo, TRA-8 локализовалось в имплантированных опухолевых тканях.
15.2. Терапия хронического лимфолейкоза у мышей NOD/SCID с использованием TRA-8
Хронический лимфолейкоз (ХЛЛ) представляет собой наиболее распространенную форму В-клеточных злокачественных опухолей. Большинство злокачественных клеток при ХЛЛ имеют зрелый фенотип и являются резистентными к большинству стимуляторов апоптоза. Была оценена экспрессия и функция DR5 в В-клетках у пяти пациентов с ХЛЛ. Все пациенты имели большое число периферических В-клеток, на что указывало более чем 95% CD19+-В-клеток среди МКПК. По сравнению с нормальными первичными В-клетками В-клетки у всех пациентов с ХЛЛ имели более высокие уровни DR5 на клеточной поверхности и были более чувствительными к TRA-8-индуцирован-ному апоптозу in vitro. Интересно отметить, что В-клетки ХЛЛ также были чувствительными к цитотоксичности, индуцированной бисиндолмалеимидом VIII (BisVIII). После комбинированной обработки TRA-8 и BisVIII, почти 50% В-клеток ХЛЛ погибали, тогда как нормальные В-клетки оказались нечувствительными (фиг.18). Через пять дней после переноса ХЛЛ-В-клеток мышам NOD/SCID наблюдалось повторное заселение примерно 25%-30% CD19+-В-клеток в селезенку мышей-реципиентов. Однако обработка тремя дозами 100 мкг TRA-8 приводила к полной элиминации ХЛЛ-В-клеток в селезенке у четырех из пяти мышей-реципиентов SCID. Таким образом, TRA-8, взятое отдельно или в сочетании с другими веществами, является активным в качестве терапевтического средства для лечения хронического лимфолейкоза.
Пример 16. Клонирование кДНК
(1) Определение N-концевых аминокислотных последовательностей тяжелой и легкой цепей TRA-8
Для получения кДНК тяжелой и легкой цепей TRA-8 N-концевые аминокислотные последовательности тяжелой и легкой цепей TRA-8 и гены клонированных TRA-8 определяли известными методами.
Десять микрограммов раствора, содержащего антитело TRA-8 против человеческого DR5, подвергали электрофорезу в полиакриламидном геле с ДСН ("ДСН-ПААГ") при концентрации геля 12% (мас./об.) и постоянном напряжении 100 В в течение 120 минут. После электрофореза гель погружали на 5 минут в буфер для переноса, содержащий 25 мМ Трис-HCI (pH 9,5), 20% метанол, 0,02% об./об. ДСН. По истечении этого времени белок, содержащийся в геле, переносили на 14 часов на поливинилидендифторидную мембрану ("PVDF-мембрана"; размер пор 0,45 мкм; Millipore, Japan), предварительно смоченную в буфере для переноса, с использованием устройства для блоттинга (KS-8451; Marysol) при постоянном напряжении 10 В и при 4оС.
По истечении этого времени PVDF-мембрану промывали буфером для промывки, 25 мМ NaCl, 10 мМ боратно-натриевый буфер (pH 8,0), а затем окрашивали в окрашивающем растворе (50% об./об. метанола, 20% об./об. уксусной кислоты, и 0,05% мас./об. кумасси бриллиантового голубого) в течение 5 минут для обнаружения полос белка. Затем PVDF-мембрану обесцвечивали путем добавления 90% об./об. водного раствора метанола и полосу, соответствующую тяжелой цепи, т.е. полосу с более низкой подвижностью, и полосу, соответствующую легкой цепи, т.е. полосу с более высокой подвижностью, предварительно локализованные на PVDF-мембране, вырезали и промывали деионизированной водой.
N-концевые аминокислотные последовательности тяжелой и легкой цепи определяли автоматическим методом Эдмана (см. Edman, P., et al., (1967), Eur. J. Biochem., 1, 80) с использованием газофазового секвенатора белка (PPSQ-10; Shimadzu Seisakusyo, K. K.).
Было определено, что N-концевая аминокислотная последовательность полосы, соответствующей тяжелой цепи, представляет собой:
Glu-Val-Met-Leu-Val-Glu-Ser-Gly-Gly-Gly-Leu-Val-Lys-Pro-Gly-Gly-Ser-Leu-Lys-Leu (SEQ ID No:4 в Списке последовательностей);
а N-концевая аминокислотная последовательность полосы, соответствующей легкой цепи, представляет собой:
Asp-Ile-Val-Met-Thr-Gln-Ser-His-Lys-Phe-Met-Ser-Thr-Ser-Val-Gly-Asp-Arg-Val-Ser (SEQ ID No:5 в Списке последовательностей).
Сравнение этих аминокислотных последовательностей с данными аминокислотных последовательностей антител, полученных, как описано Kabat et al. (См. Kabat E.A.., et al.,(1991), в "Sequnces of Proteins of Immunological Interest Vol.11,", U.S. Department of Health and Human Services), выявило, что тяжелая цепь (γ1-цепь) и легкая цепь (k-цепь) TRA-8 принадлежат к подтипам 3d и 1 соответственно.
(2) Клонирование кДНК
На основании вышеуказанных результатов были синтезированы олигонуклеотидные праймеры, которые как ожидалось, должны гибридизироваться с частями 5′-нетранслируемых областей и с теми же самыми концами 3′-нетранслируемых областей генов, принадлежащих к этим мышиным подтипам. Затем кДНК, кодирующие тяжелую и легкую цепи TRA-8, клонировали с использованием нижеследующей комбинации обратной транскрипции и ПЦР (ОТ-ПЦР):
а) Матрица
Полноразмерную РНК гибридомы TRA-8 (АТСС №РТА-1428) экстрагировали с использованием реагента TRIzol (GIBCO BRL). В качестве матрицы для ПЦР-реакции использовали кДНК, которую получали с помощью набора для синтеза первой цепи кДНК (Amersham Pharmacia Biotech) в соответствии с инструкциями, прилагаемыми к данному набору.
b) ПЦР-праймеры
Были синтезированы следующие олигонуклеотидные праймеры для ПЦР:
5'-cagcactgaa cacggacccc-3' (H5NCS1: SEQ ID 6 Списка последовательностей);
5'-aaaggtaatt tattgagaag-3' (H5NCS2: SEQ ID No. 7 Списка последовательностей);
5'-cctcaccatg aacttcgggc-3' (H5SS1: SEQ ID No. 8 Списка последовательностей);
5'-ctgttgtatg cacatgagac-3' (H5SS2: SEQ ID) No. 9 Списка последовательностей);
5'-gaagtgatgc tggtggagtc-3' (H5CS1: SEQ ID No. 10 Списка последовательностей);
5'-agtgtgaagt gatgctggtg-3' (H5CS2: SEQ ID No. 11 Списка последовательностей);
5'-tttaccagga gagtgggaga g-3' (H3CR: SEQ ID No. 12 Списка последовательностей);
5'-tgcagagaca gtgaccagag-3' (H3VR: SEQ ID No. 13 Списка последовательностей);
5'-tgttcaggac cagcatgggc-3' (L5NCS1: SEQ ID No. 14 Списка последовательностей);
5'-aagacatttt ggattctaac-3' (L5NCS2: SEQ ID No. 15 Списка последовательностей);
5'-tatcatgaag tctttgtatg-3' (L5SS1: SEQ ID No. 16 Списка последовательностей);
5'-gatggagaca cattctcagg-3' (L5SS2: SEQ ID No. 17 Списка последовательностей);
5'-gacattgtga tgacccagtc-3' (L5CS: SEQ ID No. 18 Списка последовательностей);
5'-ttaacactca ttcctgttga-3' (L3CR: SEQ ID No. 19 Списка последовательностей); и
5'-gactgggtca tcacaatgto-3' (LCSR: SEQ ID No. 20 Списка последовательностей).
Если это не оговорено особо, то все олигонуклеотиды в этих примерах синтезировали методом с использованием Pharmacia Biotech. Все олигонуклеотиды после растворения в дистиллированной воде хранили при -20°С.
с) ПЦР-реакция
Состав ПЦР-реакционного раствора:
кДНК-матрица, 5 мкл от всей 33 мкл реакционной смеси;
праймер 1, 10 пмоль;
праймер 2, 10 пмоль;
10х концентрированный ПЦР-буфер (поставляется с набором), 10 мкл;
dNTP (каждый 2,5 мМ), 4 мкл; и
полимераза Taq (Promega), 5 единиц.
К этому раствору добавляли стерильную дистиллированную воду до полного объема 100 мкл. Если это не оговорено особо, dNTP получали в виде эквимолярной смеси dATP, dCTP, dGTP и dTTP (каждого 2,5 мМ).
ПЦР-реакцию проводили следующим образом. Раствор сначала нагревали при 94оС в течение 2 минут, после чего 40 раз повторяли цикл нагревания при 94оС, 30 сек, при 52оС, 1 мин и при 72оС, 3 мин. После завершения этой процедуры реакционный раствор нагревали при 72оС в течение 10 минут.
Полученные таким образом амплифицированные ДНК-фрагменты разделяли на 1% агарозном геле, содержащем 0,25 мкг/мл этидийбромида. Полосы, которые, как было установлено, содержали нужные ДНК-фрагменты, вырезали острием бритвы и выделяли ДНК с использованием набора Gene Clean (BIO101). ДНК-фрагмент клонировали с использованием вектора pGEM-Т Easy (Promega). Это осуществляли следующим образом.
ДНК-фрагмент, выделенный из ПЦР-реакционного раствора вместе с 50 нг вектора pGEM-Т Easy (поставляется с набором), смешивали в 1 мкл 10× буфера для лигазной реакции (6 мМ Трис-HCI (pH 7,5), 6 мМ хлорида магния, 5 мМ хлорида натрия, 7 мМ β-меркаптоэтанола, 0,1 мМ АТР, 2 мМ DTT, 1 мМ спермидина и 0,1 мг/мл альбумина бычьей сыворотки), к которому добавляли 4 единицы ДНК-лигазы Т4 (1 мкл). Полный объем смеси доводили до 10 мкл путем добавления стерильной деионизованной воды и полученный лигазный раствор инкубировали в течение 15 часов при 14оС. По истечении этого времени 2 мкл лигазного реакционного раствора добавляли к 50 мкл компетентного штамма JM109 E.coli (поставляемого с набором и доведенного до состояния компетентности в соответствии с инструкциями, прилагаемыми к набору), после чего к этому раствору добавляли 2 мкл 0,5 М β-меркаптоэтанола и полученную смесь выдерживали на льду в течение 30 минут, затем при 42оС в течение 30 секунд, а затем снова на льду в течение 5 минут. После этого к культуре добавляли 500 мкл среды, содержащей 2% об./об. триптона, 0,5% мас./об. дрожжевого экстракта, 0,05% мас./об. хлорида натрия, 2,5 мМ хлорида калия, 1 мМ хлорида магния и 20 мМ глюкозы, (называемой далее средой "SOC"), и смесь инкубировали в течение одного часа при 37оС со встряхиванием. По истечении этого времени культуру высевали на чашку с L-агаровым бульоном (1% об./об. триптона, 0,5% мас./об. дрожжевого экстракта, 0,5% мас./об. хлорида натрия, 0,1% мас./об. глюкозы, и 0,6% мас./об. бакто-агара (Difco)), содержащим 100 мкг/мл ампициллина). Появившиеся на чашке резистентные к ампициллину колонии отбирали и соскабливали при помощи платиновой трансфер-петли, а затем культивировали в течение ночи при 37оС в среде с L-бульоном, содержащей 100 мкг/мл ампициллина, встряхивая при 200 об/мин. После инкубирования клетки собирали центрифугированием, в результате чего получали ДНК-плазмиду щелочным методом. Плазмиду, полученную для тяжелой цепи TRA-8, обозначали рН62, а плазмиду, полученную для легкой цепи TRA-8, обозначали рL28. Штаммы-трансформанты E.coli, содержащие эти плазмиды и обозначенные JM109/рН62 E.coli и JM109/ рL28 E.coli, были депонированы 20 апреля 2001 г в Международном депозитарии патентуемых микроорганизмов, Национальный институт промышленных наук и передовых технологий, 1-1, Higashi 1 chome Tsukuba-shi, Ibaraki-ken, 305-5466, Japan, в соответствии с Будапештским договором о депонировании микроорганизмов, и имеют регистрационные номера FERM BP-7560 и FERM BP-7561. Нуклеотидные последовательности обеих ДНК, кодирующих тяжелую цепь и легкую цепь TRA-8, определяли дидезокси-методом (Sanger, F.S., et al., (1997), Proc. Natl. Acad. Sci. USA, 74:5463-5467) с использованием ДНК-анализатора 3700 (ABI PRISM; Perkin Elmer Applied Biosystems, Japan).
Нуклеотидные последовательности тяжелой и легкой цепей TRA-8 представлены как SEQ ID No:21 и 22 соответственно в Списке последовательностей. Аминокислотные последовательности тяжелой и легкой цепей TRA-8 представлены как SEQ ID No:23 и 24 в Списке последовательностей соответственно. N-концевые аминокислотные последовательности тяжелой и легкой цепей TRA-8, определенные выше, точно соответствуют указанным последовательностям. Кроме того, при сравнении аминокислотных последовательностей тяжелой и легкой цепей с базой данных для аминокислотных последовательностей антител, было установлено, что для тяжелой цепи нуклеотиды 58-414 в SEQ ID NO:21, соответствуют вариабельной области, а нуклеотиды 415-1392 в SEQ ID NO:21 соответствуют константной области. Для легкой цепи нуклеотиды 64-387 в SEQ ID NO:22, соответствуют вариабельной области, а нуклеотиды 388-702 в SEQ ID NO:22 соответствуют константной области. Локализация и последовательности CDR также были выявлены по определению их гомологии с последовательностями в базе данных. Аминокислотные последовательности CDR1, CDR2 и CDR3 тяжелой цепи TRA-8 представлены в SEQ ID NO:25, 26 и 27 соответственно. Аминокислотные последовательности CDR1, CDR2 и CDR3 легкой цепи TRA-8 представлены в SEQ ID NO:28, 29 и 30 соответственно.
Пример 17. Конструирование гуманизированного варианта антитела TRA-8
(1) Молекулярное моделирование вариабельной области TRA-8
Молекулярное моделирование вариабельной области TRA-8 проводили методом, в основном известным как гомологичное моделирование (Methods in Enzymology, 203, 121-153, (1991)). Первичные последовательности вариабельных областей человеческого иммуноглобулина, которые были зарегистрированы в Банке данных белков (Nuc. Acid Res. 28, 235-242 (2000)) и для которых была осуществлена рентгеновская кристаллография трехмерной структуры, сравнивали с каркасными областями TRA-8, определенными выше. В результате были отобраны 1NCD и 1HIL, которые имели наиболее высокую степень гомологии с каркасными участками для легкой и тяжелой цепей TRA-8 соответственно. Трехмерные структуры каркасных участков генерировали путем комбинирования координат 1NCD и 1HIL, которые соответствовали легкой и тяжелой цепям TRA-8, в результате чего получали "каркасную модель". С использованием классификации, описанной Chothia и др., CDR антитела TRA-8 были классифицированы следующим образом: CDRL1, CDRL2, CDRH1 и CDRH2 принадлежат к каноническим классам 2,1,1,3 соответственно, а CDRL3 не принадлежит к какому-либо конкретному каноническому классу. CDR-петли CDRL1, CDRL2, CDRH1 и CDRH2 были приписаны конфирмациям, присущим их соответствующим каноническим классам, и интегрированы в каркасную модель. CDRL1 был приписан конформации кластера 8А в соответствии с классификацией Thornton et al., (см., J. Mol. Biol., 263, 800-815, (1996)), а CDRH3 отнесен к классу k(8)C в соответствии с правилом Н3 (FEBS Letter 455, 188-197 (1999)). Затем репрезентативные конформации для CDRL3 и CDRH3 интегрировали в каркасную модель.
И наконец, для исключения нежелательного контакта между атомами проводили вычисления энергии для того, чтобы получить вероятную энергетическую молекулярную модель вариабельной области TRA-8. Вышеуказанную процедуру осуществляли с использованием коммерчески доступной системы молекулярного моделирования, АВМ (Oxford Molecular Limited, Inc.). Для получения молекулярной модели точность данной структуры может быть затем оценена с использованием программного обеспечения PROCHECK (J.Appl. Cryst., (1993), 26, 283-291).
(2) Конструирование аминокислотных последовательностей для гуманизированного TRA-8
Конструирование гуманизированных антител TRA-8 осуществляли методом, в основном известным как CDR-прививка (Proc.Natl. Acad. Sci., USA, 86, 10029-10033 (1989)). Антитело-акцептор выбирали исходя из гомологии аминокислот в каркасной области. Последовательности каркасной области в TRA-8 сравнивали со всеми человеческими каркасными последовательностями в базе данных аминокислотных последовательностей антител Kabat (Nuc. Acid Res. 29, 205-206 (2001)). В результате в качестве акцептора выбирали антитело mAb58'CL из-за наиболее высокой гомологии, т.е. 80%, его каркасной области. Аминокислотные остатки в каркасной области mAb58'CL сопоставляли с каркасной областью TRA-8 и идентифицировали положения с различными аминокислотами. Локализацию этих остатков анализировали с использованием трехмерной модели TRA-8, сконструированной, как описано выше, а донорные остатки, которые должны быть привиты к акцептору, выбирали в соответствии с критерием Queen et al. (Proc.Natl. Acad. Sci., USA, 86, 10029-10033 (1989)). Гуманизированные последовательности TRA-8 конструировали, как описано в нижеследующем примере, путем переноса нескольких донорных остатков в антитело-акцептор mAb58'CL.
Пример 18. Конструирование экспрессирующего вектора для тяжелой цепи гуманизированного антитела
(1) Конструирование плазмиды, несущей ДНК вариабельной области тяжелой цепи гуманизированного TRA-8
Для определения активности гуманизированного TRA-8 плазмиду, несущую тяжелую цепь гуманизированного TRA-8, конструировали описанным ниже способом. Однако следует отметить, что способ гуманизирования TRA-8 не ограничивается этими примерами.
Как показано в SEQ ID NO:31 списка последовательностей, гуманизирование аминокислотных последовательностей тяжелой цепи мышиного антитела TRA-8 против человеческого DR5 осуществляли путем замены 13-й аминокислоты (лизина), 19-й аминокислоты (лизина), 40-й аминокислоты (треонина), 42-й аминокислоты (глутаминовой кислоты), 44-й аминокислоты (аргинина), 84-й аминокислоты (серина), 88-й аминокислоты (серина), 93-й аминокислоты (метионина), 114-й аминокислоты (треонина) и 115-й аминокислоты (лейцина) глутамином, аргинином, аланином, глицином, глицином, аспарагином, аланином, валином, лейцином и валином соответственно.
Плазмиду, несущую ДНК, кодирующую вариабельную область тяжелой цепи гуманизированного TRA-8 (SEQ ID NO:31 в списке последовательностей) конструировали нижеописанным способом.
Для конструирования нижеследующих ДНК-последовательностей, каждая из которых содержала вышеописанные замены, использовали ПЦР.
Были синтезированы следующие 12 олигонуклеотидов:
5'- ttggataagc ttggcttgac ctcaccatgg gatggagctg tatcatcctc ttcttggtag caacagctac aggtgtccac -3' (A; SEQ ID No. 32);
5'- tctgaagtaa tgctggtgga gtctggggga ggcttagtac agcctggagg gtccctgaga ctctcctgtg cagcctctgg -3' (В; SEQ ID No. 33);
5'- attcactttc agtagttatg taatgtcttg ggttcggcag gcaccaggga agggtotgga gtgggttgca accattagta -3' (С; SEQ ID No. 34);
5'- gtggtggtag ttacacctac tatccagaca gtgtgaaggg ccgattcacc atctccagag acaatgccaa gaacaccctg -3' (D; SEQ ID No. 35);
5'- tatctgcaaa tgaacagtct gagagcagag gacacggctg tttattactg tgcaagaagg ggtgactcta tgattacgac -3' (E; SEQ ID No. 36);
5'- ggactactgg ggccaaggga ccctggtcac agtctcctca gcctccacc aagggcccat cggte-3' (F;SEQ ID No.37);
5'- ctaccaagaa gaggatgata cagctccatc ccatggtgag gtcaagccaa gcttatccaa -3' (G;SEQ ID No.38);
5'- tctcagggac cctccaggct gtactaagcc tcccccagac tccaccagca ttacttcaga gtggacacct gtagctgttg -3' (H; SEQ ID No. 39);
5'- tccagaccct tccctggtgc ctgccgaacc caagacatta cataactact gaaagtgaat ccagaggctg cacaggagag -3' (I; SEQ ID No. 40);
5'- ctctggagat ggtgaatcgg cccttcacac tgtctggata gtaggtgtaa ctaccaccac tactaatggt tgcaacccac -3' (J; SEQ ID No. 41);
5'- ccttcttgca cagtaataaa cagccgtgtc ctctgctctc agactgttca tttgcagata cagggtgttc ttggcattgt -3' (К; SEQ ID No. 42); и
5'- gaccgatggg cccttggtgg aggctgagga gactgtgacc agggtccctt ggccccagta gtccgtcgta atcatagagt cacc -3' (L; SEQ ID No. 43).
Нижеследующие 2 ПЦР-праймера были синтезированы, как описано выше:
5'-ttggataagc ttggcttgac-3' (Р1; SEQ ID NO:44) и
5'-gaccgatggg cccttggtgg a-3' (Р2; SEQ ID NO:45).
Синтез ДНК, кодирующей полипептидную цепь, содержащую секреторную сигнальную последовательность, вариабельную область тяжелой цепи гуманизированной" TRA-8 и 8 аминокислотных остатков у N-конца области IgG-CH1, осуществляли с использованием комбинированной ПЦР соответственно.
ДНК-фрагмент получали нижеописанным способом.
Состав ПЦР-реакционного раствора:
олигонуклеотид А, 10 пмоль;
олигонуклеотид В, 10 пмоль;
олигонуклеотид С, 10 пмоль;
олигонуклеотид D, 10 пмоль;
олигонуклеотид Е, 10 пмоль;
олигонуклеотид F, 10 пмоль;
олигонуклеотид G, 10 пмоль;
олигонуклеотид H, 10 пмоль;
олигонуклеотид I, 10 пмоль;
олигонуклеотид J, 10 пмоль;
олигонуклеотид К, 10 пмоль;
олигонуклеотид L, 10 пмоль;
олигонуклеотидный праймер Р1, 2 мкМ;
олигонуклеотидный праймер Р2, 2 мкМ;
10 × буфер Pyrobest II, 10 мкл;
смесь dNTP, 8 мкл;
ДНК-полимераза Pyrobest, 0,5 мкл; и
бидистиллированная вода до конечного объема 50 мкл.
ПЦР-реакцию проводили следующим образом. Сначала раствор нагревали при 94°С в течение 5 минут, а затем проводили 7 циклов нагревания до 98°С в течение 10 секунд, при 55°С в течение 30 секунд и при 72°С в течение 1 минуты. После завершения этой процедуры реакционный раствор нагревали при 72°С в течение 15 минут.
К 200 мкл каждого из ПЦР-продуктов добавляли равный объем фенола-хлороформа (50% об./об. фенола, насыщенного водой, 48% об./об. хлороформа, 2% об./об. изоамилового спирта) и смесь интенсивно перемешивали в течение 1 минуты. По истечении этого времени смесь центрифугировали при 10000 х g и водный слой выделяли и смешивали с равным объемом смеси хлороформа-изоамилового спирта (96% об./об. хлороформа и 4% об./об. изоамилового спирта), которую снова интенсивно центрифугировали при 10000 х g, и водный слой выделяли. Серия стадий, описанных в этом параграфе, далее будет называться "экстракция фенолом".
Затем выделенный водный слой осаждали этанолом. Используемый в этом описании термин "осаждение этанолом" означает добавление при смешивании одной десятой объема 3М ацетата натрия (рН 5,2) и 2,5 объема 100% этанола к обрабатываемому раствору с последующим замораживанием этой смеси с использованием сухого льда. Затем полученную смесь центрифугировали при 10000 × g и выделяли ДНК в виде осадка.
После экстракции фенолом и осаждения этанолом полученный ДНК-осадок сушили в вакууме, растворяли в минимальном количестве бидистиллированной воды и разделяли с помощью электрофореза на 3% агарозном геле. После электрофореза гель окрашивали 1 мкг/мл водного раствора бромида этидия для обнаружения ДНК при УФ-излучении. ДНК-полосы, соответствующие ДНК гуманизированного TRA-8, вырезали лезвием бритвы и элюировали из геля с использованием набора Geneclean Spin (Bio 101, CA, USA). После экстракции фенолом проэлюированную ДНК концентрировали путем центрифугирования при 7500 х g, осаждали этанолом и, наконец, растворяли в 5 мкл дистиллированной воды.
Каждую из экстрагированных ДНК клонировали с использованием вектора pGEM-Т Easy (Promega) следующим образом:
ДНК-фрагмент, полученный в ПЦР-реакции, 5 мкл;
10 х Taq-полимеразный буфер, 1 мкл;
смесь dNTP, 1 мкл;
полимераза Taq (5 ед./мл), 1 мкл; и
бидистиллированная вода до конечного объема 10 мкл.
После проведения реакции каждого вышеуказанного раствора при 70°С в течение 30 минут каждый ДНК-раствор и вектор pGEM-Т Easy лигировали с использованием набора для лигирования ДНК, Версия 2.0 (Takara Shuzo Co, Ltd.) в соответствии с инструкциями производителей.
После 4-часового инкубирования при 15°С 2 мкл инкубированного реакционного раствора смешивали со 100 мкл компетентного штамма JM109 E.coli при плотности клеток 1-2 х 109 клеток/мл (Takara Shuzo Co, Ltd.) и смесь выдерживали на льду в течение 30 минут, затем при 42оС в течение 30 секунд, а затем снова выдерживали на льду в течение 1 минуты. После этого к смеси добавляли 500 мкл среды SOC (2% об./об. триптона, 0,5% мас./об. дрожжевого экстракта, 0,05% мас./об. хлорида натрия, 2,5 мМ хлорида калия, 1 мМ хлорида магния и 20 мМ глюкозы) и смесь инкубировали еще один час при встряхивании. Затем выделяли штаммы-трансформанты и из этих штаммов получали плазмидную ДНК, как описано в "Molecular cloning A Laboratory Manual". Нуклеотидные последовательности этих ДНК, кодирующих тяжелую цепь гуманизированного TRA-8, подтверждали дидезокси-методом (Sanger, F.S., et al., (1997), Proc. Natl. Acad. Sci. USA, 74:5463-5467) с использованием ДНК-анализатора 3700 (ABI PRISM; Perkin Elmer Applied Biosystems, Japan).
Полученные плазмиды обозначали рНВ14 (плазмида, несущая кДНК, кодирующую тяжелую цепь гуманизированного TRA-8). Штамм-трансформант E.coli, содержащий эти плазмиды и обозначенный JM109/рН14 E.coli, был депонирован 20 апреля 2001 г. в Международном депозитарии патентуемых микроорганизмов, Национальный институт промышленных наук и передовых технологий, 1-1, Higashi 1 chome Tsukuba-shi, Ibaraki-ken, 305-5466, Japan, в соответствии с Будапештским договором о депонировании микроорганизмов, и имеет регистрационный номер FERM BP-7556.
(2) Конструирование экспрессирующих плазмид, несущих вариабельную область ДНК тяжелой цепи гуманизированного TRA-8
Рекомбинантные экспрессирующие векторы для клеток животных конструировали путем встраивания ДНК, кодирующей тяжелую цепь гуманизированного TRA-8 (клонированную, как описано выше) следующим образом.
Один микрограмм плазмиды pSRННН3 (Европейская патентная заявка ЕР 0909816-А1), несущей ДНК человеческой вариабельной области тяжелой цепи гуманизированного моноклонального антитела НFE7A против Fas и константной области человеческого IgG1, гидролизовали рестриктирующими ферментами HindIII и ApaI и выделяли с помощью электрофореза на 3% агарозом геле. После электрофореза гель окрашивали 1 мкг/мл водного раствора бромида этидия для обнаружения ДНК при УФ-излучении. Полосы векторной ДНК, содержащей геномную ДНК константной области человеческого IgG1 без вариабельной области тяжелой цепи гуманизированного НFE7A, вырезали лезвием бритвы и элюировали из геля с использованием набора Geneclean Spin (Bio 101, CA, USA). После экстракции фенолом проэлюированную ДНК концентрировали путем центрифугирования при 7500 × g, а затем осаждали этанолом и, наконец, растворяли в 5 мкл дистиллированной воды, после чего дефосфорилировали с использованием CIP. Полученную гидролизованную дефосфорилированную плазмидную ДНК (100 нг) лигировали с 1 мкг ДНК-фрагмента рНВ14, содержащего ДНК, кодирующую вариабельную область тяжелой цепи гуманизированного TRA-8, которая также была гидролизована ферментами HindIII и Apal, с использованием набора для лигирования ДНК Version 2.0 (Takara Shuzo Co., Ltd.). Затем лигированную смесь использовали для трансформации клеток JM109 E.coli, которые после этого засевали в чашки с LB-агаром, содержащие 50 мкг/мл ампициллина.
Полученные таким способом трансформанты культивировали в 2 мл жидкой LB-среды, содержащей 50 мкг/мл ампициллина при 37оС в течение ночи, после чего плазмидную ДНК экстрагировали из полученной культуры с использованием щелочного ДСН.
Экстрагированную плазмидную ДНК гидролизовали HindIII и Apal и подвергали электрофорезу на 3% (мас./об.) агарозном геле для подтверждения присутствия или отсутствия нужной вставки ДНК, кодирующей вариабельную область тяжелой цепи гуманизированного TRA-8. Инсерция и ориентация нужного ДНК-фрагмента в данном векторе были подтверждены секвенированием ДНК с использованием анализатора генных последовательностей (ABI Prism 3700 DNA Analyzer; Applied Biosystems). Полученные экспрессирующие плазмиды, несущие кДНК, кодирующую тяжелую цепь гуманизированного TRA-8, обозначали рНВ14-1.
Пример 19. Конструирование экспрессирующего вектора для легкой цепи гуманизированного антитела
(1) Конструирование векторов для легких цепей гуманизированных вариантов антитела TRA-8
Как показано в SEQ ID NO:46 списка последовательностей, в гуманизированной аминокислотной последовательности легкой цепи мышиного антитела TRA-8 против человеческого DR5, 8-я аминокислота (гистидин), 9-я аминокислота (лизин), 10-я аминокислота (фенилаланин), 11-я аминокислота (метионин), 13-я аминокислота (треонин), 20-я аминокислота (серин), 42-я аминокислота (глутамин), 43-я аминокислота (серин), 60-я аминокислота (аспарагиновая кислота), 63-я аминокислота (треонин), 77-я аминокислота (аспарагин), 78-я аминокислота (валин), 80-я аминокислота (серин), 83-я аминокислота (лейцин), 85-я аминокислота (аспарагиновая кислота), 87-я аминокислота (фенилаланин), 99-я аминокислота (глицин), 103-я аминокислота (лейцин) и 108-я аминокислота (аланин) у N-конца аминокислотной последовательности легкой цепи TRA-8 заменены пролином, серином, серином, лейцином, аланином, треонином, лизином, аланином, серином, серином, серином, лейцином, пролином, фенилаланином, треонином, тирозином, глутамином, валином и треонином соответственно. Полученная последовательность была обозначена LМ2.
Экспрессирующие плазмижы, несущие указанный тип аминокислотных последовательностей гуманизированной легкой цепи антитела TRA-8 против человеческого DR5, конструировали как описано ниже.
1) Синтез праймеров для получения вариабельных и константных областей легкой цепи гуманизированного TRA-8
ДНК, кодирующую полипептидную цепь LМ2 (SEQ ID NO:46 в списке последовательностей), каждая из которых представляет собой гибрид вариабельной области легкой цепи гуманизированного анти-DR5 антитела TRA-8 и константной области легкой цепи человеческгоо Ig (к-цепь), синтезировали соответствующим образом с использованием комбинации ПЦР.
Помимо 7ALIP (SEQ ID NO:47) и 7ALCN (SEQ ID NO:48) были синтезированы нижеследующие олигонуклеотидные праймеры для ПЦР: 5'- gtcccccaca gatgcagaca aagaacttgg agattgggtc atcacaatgt caccagtgga -3' (HKSPR11; SEQ ID No. 49);
5'- ccaagttctt tgtctgcatc agtaggasac agggtcacca tcacctgc -3' (HKCDF11; SEQ ID No. 50);
5'- agtgtgccgg gtggatgccc agtaaatcag tagtttagga gctttccctg gtttctg -3' (HKCDR12; SEQ ID No.51);
5'- tgggcatcca cccggcacac tggggtccca agcaggttta gtgscagt -3' (HKCDF22; SEQ ID No. 52);
5'- ataactacta tattgctgac agtaataegt tgcaaaatcc tccggctgca gactagagat ggt -3' (HKCDR22; SEQ ID No. 53); и
5' - cagcaatata gcagctatcg gacgttcggt caaggcacca aggtggaaat caaacggact gtg -3' (HKCF12; SEQ ID No. 54).
2) Конструирование плазмиды рCR3.1/М2-1 (клонирующей легкую цепь гуманизированного TRA-8)
LМ2-ДНК-фрагмент, определенный в SEQ ID NO:55 в списке последовательностей и кодирующей аминокислотную последовательность, определенную в SEQ ID NO:46 в том же списке последовательностей, получали путем проведения 2-стадийной ПЦР, встраивали в плазмидный вектор и клонировали в E.coli.
а) Первая стадия ПЦР
LМ2-F1-ДНК-фрагмент, кодирующий секреторную сигнальную последовательность и часть FRL1-области с сайтом рестриктирующего фермента HindIII у 5′-конца, получали при следующих условиях. Матричные плазмиды рHSGHM17 и pSRPDHH получали в соответствии с описанием в Европейской пантентной заявке ЕР 0 909816 А1.
Состав реакционного раствора: ДНК плазмиды рHSGHM17 (Европейская пантентная заявка ЕР 0 909816 А1) 25 нг;
олигонуклеотидный праймер 7AL1P, 50 пмоль;
олигонуклеотидный праймер НКSRP11, 50 пмоль;
dNTP-смесь, 5 мкл;
10 × ПЦР-буфер, 5 мкл;
ДНК-полимераза ampliTaq (Perkin-Elmer), 2,5 единиц.
Реакционный раствор, имеющий вышеуказанный состав, доводили до конечного объема 50 мкл путем добавления бидистиллированной воды и использовали в ПЦР.
Температурные условия ПЦР: осуществляли нагревание при 94°С в течение 2 минут, после чего 30 раз повторяли цикл нагревания при 94°С в течение 1 минуты, при 55°С в течение 1 минуты и при 72°С в течение 2 минут, а затем нагревали при 72°С в течение 10 минут.
LМ2-F2-ДНК-фрагмент, кодирующий часть FRL1, CDRL1, FRL2 и CDRL2, получали при нижеследующих условиях.
Состав ПЦР-реакционного раствора:
ДНК плазмиды pL28, 25 нг;
олигонуклеотидный праймер НКСDF11, 50 пмоль;
олигонуклеотидный праймер НКCDR12, 50 пмоль;
dNTP-смесь, 5 мкл;
10 х ПЦР-буфер, 5 мкл;
ДНК-полимераза ampliTaq, 2,5 единиц.
Реакционный раствор, имеющий вышеуказанный состав, доводили до конечного объема 50 мкл путем добавления бидистиллированной воды и использовали в ПЦР.
Температурные условия ПЦР: нагревание при 94°С в течение 2 минут, после чего 30-кратное повторение цикла нагревания при 94°С в течение 1 минуты, при 55°С в течение 1 минуты и при 72°С в течение 2 минут, а затем нагревание при 72°С в течение 10 минут.
LМ2-F3-ДНК-фрагмент, кодирующий CDRL2, FRL3 и часть CDRL3 получали при нижеследующих условиях.
Состав реакционного раствора:
ДНК плазмиды pHSRPDHH (Европейская пантентная заявка ЕР 0 909816 А1) 25 нг;
олигонуклеотидный праймер НКСDF22, 50 пмоль;
олигонуклеотидный праймер НКCDR22, 50 пмоль;
dNTP-смесь, 5 мкл;
10 × ПЦР-буфер, 5 мкл;
ДНК-полимераза ampliTaq, 2,5 единиц.
Реакционный раствор, имеющий вышеуказанный состав, доводили до конечного объема 50 мкл путем добавления бидистиллированной воды и использовали в ПЦР.
Температурные условия ПЦР: нагревание при 94°С в течение 2 минут, после чего 30-кратное повторение цикла нагревания при 94°С в течение 1 минуты, при 55°С в течение 1 минуты и при 72°С в течение 2 минут, а затем нагревание при 72°С в течение 10 минут.
LМ2-F4-ДНК-фрагмент, кодирующий CDRL3, FRL4 и константную область с добавленным у 3'-конца сайтом расщепления рестриктирующего фермента EcoRI, получали при нижеследующих условиях.
Состав реакционного раствора:
ДНК плазмиды pHSRPDHH, 25 нг;
олигонуклеотидный праймер НКСF12, 50 пмоль;
олигонуклеотидный праймер 7ALCN, 50 пмоль;
dNTP-смесь, 5 мкл;
10 × ПЦР-буфер, 5 мкл;
ДНК-полимераза ampliTaq, 2,5 единиц.
Реакционный раствор, имеющий вышеуказанный состав, доводили до конечного объема 50 мкл путем добавления бидистиллированной воды и использовали в ПЦР.
Температурные условия ПЦР: нагревание при 94°С в течение 2 минут, после чего 30-кратное повторение цикла нагревания при 94°С в течение 1 минуты, при 55°С в течение 1 минуты и при 72°С в течение 2 минут, а затем нагревание при 72°С в течение 10 минут.
Амплифицированные ДНК-фрагменты, полученные после ПЦР, выделяли с помощью электрофореза в 5% полиакриламидном геле. После электрофореза, гель окрашивали 1 мкг/мл этидийбромида для детекции продуцированной ДНК при УФ-излучении. Детектированные таким образом, соответствующие ДНК-полосы вырезали лезвием бритвы.
b) Вторая стадия ПЦР
LМ2-ДНК, в которой были лигированы вышеописанные LМ2-F1-ДНК, LМ2-F2-ДНК, LМ2-F3-ДНК и LМ2-F4-ДНК-фрагменты, получали при следующих условиях.
Состав ПЦР-реакционного раствора:
Фрагмент геля с LМ2-F1-ДНК, полученный в первой стадии ПЦР,
Фрагмент геля с LМ2-F2-ДНК, полученный в первой стадии ПЦР,
Фрагмент геля с LМ2-F3-ДНК, полученный в первой стадии ПЦР,
Фрагмент геля с LМ2-F4-ДНК, полученный в первой стадии ПЦР,
олигонуклеотидный праймер 7AL1P, 50 пмоль;
олигонуклеотидный праймер 7ALCN, 50 пмоль;
dNTP-смесь, 5,0 мкл;
10 × ПЦР-буфер, 5,0 мкл;
ДНК-полимераза ampliTaq, 2,5 единиц.
Реакционный раствор, имеющий вышеуказанный состав, доводили до конечного объема 50 мкл путем добавления бидистиллированной воды и использовали в ПЦР.
Температурные условия ПЦР: нагревание при 94°С в течение 2 минут, после чего 30-кратное повторение цикла нагревания при 94°С в течение 1 минуты, при 55°С в течение 1 минуты и при 72°С в течение 2 минут, а затем нагревание при 72°С в течение 10 минут.
Полученный таким образом LМ2-ДНК-фрагмент встраивали в плазмиду рCR3.1DNA с использованием набора для клонирования эукариотического ТА (Invitrogen) в соответствии с инструкциями производителей и вводили в компетентный штамм TOP10F' E.coli, поставляемый с набором. Нуклеотидные последовательности этих ДНК, кодирующих легкую цепь гуманизированного TRA-8, были подтверждены дидезокси-методом (Sanger, F.S., et al., (1997), Proc. Natl. Acad. Sci. USA, 74:5463-5467) с использованием ДНК-анализатора 3700 (ABI PRISM; Perkin Elmer Applied Biosystems, Japan).
Полученные плазмиды обозначали рCR3.1/М2-1 (плазмида, несущая кДНК, кодирующую вариабельную область легкой цепи гуманизированного TRA-8 и константную область легкой цепи человеческого Ig).
Один микрограмм ДНК клонирующей плазмиды рНSG399 гидролизовали рестриктирующими ферментами HindIII и EcoRI, а затем дефосфорилировали с использованием CIP. Полученную таким образом дефосфорилированную рНSG399-ДНК и LМ2-ДНК-фрагмент, который был также гидролизован рестриктирующими ферментами HindIII и EcoRI, лигировали с использованием набора для лигирования ДНК Version 2.0 (Takara Shuzo Co., Ltd.). Затем DH5α E.coli трансформировали лигированной ДНК и высевали на LB-агаровую среду, содержащую 0,1 мМ IPTG, 0,1% Х-Gal и 50 мкг/мл хлорамфеникола (конечные концентрации). Полученные белые трансформанты культивировали в жидкой LB-среды, содержащей 50 мкг/мл хлорамфеникола, и плазмидную ДНК экстрагировали из полученной культуры и с использованием щелочного ДСН. Экстрагированную плазмидную ДНК гидролизовали ферментами HindIII и EcoRI, а затем клон, несущий LM2-ДНК-фрагмент, отбирали при помощи электрофореза на 1% агарозном геле.
В соответствии с вышеописанной процедурой получали плазмиду pHSG/М2-1-4, несущую гибридный фрагмент вариабельной области гуманизированной легкой цепи LМ2-TRA-8 и константной области цепи человеческого Igκ. Штамм-трансформант E.coli, содержащий эти плазмиды и обозначенный E.coli DH5α/pHSG/М2-1-4, был депонирован 20 апреля 2001, в Международном депозитарии патентуемых микроорганизмов, Национальный институт промышленных наук и передовых технологий, 1-1, Higashi 1 chome Tsukuba-shi, Ibaraki-ken, 305-5466, Japan, в соответствии с Будапештским договором о депонировании микроорганизмов, и имеет регистрационный номер FERM BP-7563.
3) Конструирование плазмиды pSR/М2-1 (экспрессирующая плазмида для гуманизированной легкой цепи LМ2-TRA-8
Полученную плазмиду pHSG/М2-1-4, несущую гибридный фрагмент вариабельной области легкой цепи гуманизированного LМ2-TRA-8 и константной области цепи человеческого Igκ, гидролизовали рестриктирующими ферментами HindIII и EcoRI.
Один микрограмм плазмиды pSRPDHH (Европейская патентная заявка ЕР 0909816-А1) гидролизовали рестриктирующими ферментами HindIII и EcoRI, а затем дефосфорилировали с использованием CIP. Полученную дефосфорилированную ДНК плазмиды pSRPDHH и HindIII- EcoRI-ДНК-фрагмент, полученный из pHSG/М2-1-4, лигировали с использованием набора для лигирования ДНК Version 2.0 (Takara Shuzo Co., Ltd.). Затем DH5α E.coli трансформировали лигированной ДНК и высевали на LB-агар. Полученные трансформанты культивировали в жидкой LB-среде, содержащей 100 мкг/мл ампициллина, и из полученной культуры экстрагировали плазмидную ДНК с использованием щелочного ДСН. Инсерция и ориентация нужного ДНК-фрагмента в векторе pSRPDHH были подтверждены секвенированием ДНК с использованием анализатора генных последовательностей (ABI Prism 3700 DNA Analyzer; Applied Biosystems). Полученную экспрессирующую плазмиду, несущую кДНК, кодирующую легкую цепь гуманизированного TRA-8, обозначали pSR/М2-1.
Пример 20. Продуцирование гуманизированного антитела
Трансфекцию клеток COS-7 (то есть клеточной линии, происходящей от почек обезьяны) экспрессирующими плазмидами для тяжелой цепи гуманизированного TRA-8 и легкой цепи гуманизированного TRA-8, полученными, как описано выше, осуществляли методами с использованием трансфицирующего реагента FUGENE6 (Boehringer Mannhiem Biochemica) в соответствии с инструкциями, прилагаемыми к данному набору.
Клетки COS-7 (Американская коллекция типовых культур № CRL-1651) культивировали до полуконфлюентности (3×106 клеток на чашку) в культуральной чашке (площадь культуры: 57 см3; Sumitomo Bakelite, K.K.), содержащей модифицированную по способу Дульбекко среду Игла (обозначаемую далее "DMEM"; Gibco BRL), в которую была добавлена 10% фетальная телячья сыворотка (обозначаемая далее "FCS"; Moregate).
Одновременно 10 мкг/чашку (всего 5 чашек) ДНК тяжелой цепи гуманизированного DR5 в экспрессирующей плазмиде (рНА15-1) и 10 мкг/чашку ДНК легкой цепи гуманизированного DR5 в экспрессирующей плазмиде, полученных с использованием щелочного ДСН и центрифугированием в градиенте плотности хлорида цезия, смешивали, осаждали этанолом, а затем суспендированием в 5 мкл/чашку dH2O.
После смешивания 15 мкл/чашку трансфицирующего реагента FUGENE6 с 180 мкл/чашку D-MEM без FCS этот раствор FUGENE6 (185 мкл/чашку) смешивали с 5 мкл/чашку ДНК-раствора, содержащего 10 мкг/чашку ДНК тяжелой цепи гуманизированного DR5 в экспрессирующей плазмиде и 10 мкг/чашку ДНК легкой цепи гуманизированного DR5 в экспрессирующей плазмиде. После инкубирования в течение 15 минут при комнатной температуре полученную плазмидную суспензию (200 мкл) добавляли в предварительно приготовленные планшеты с COS-7. После инкубирования в 5% CO2 при 37оС в течение 24 часов культуральную среду заменяли средой D-MEM без FCS. После инкубирования в 5% CO2 при 37оС в течение 72 часов, супернатант культуры выделяли для очистки продуктов экспрессии в надосадочных жидкостях. Методом, описанным выше, клетки COS-7 трансфицировали каждой из нижеследующих плазмидных комбинаций:
(А) без плазмидной ДНК;
(В) котрансфекция рHВ14-1 и pSR/M2-1.
Затем культуру центрифугировали (1000 об/мин, 5 минут) и супернатант собирали. Супернатант снова центрифугировали (9800 об/мин, 15 минут) и фильтровали через 0,45 мкм-фильтр (ADVANTEC TOYO DISMIC-25cs, cat.# 25CS045 AS). Выделение IgG из фильтратов осуществляли посредством аффинной хроматографии с использованием белка G-POROS (Applied Biosystems) при следующих условиях:
ВЭЖХ: BioCAD 700E (Applied Biosystems).
Колонка: сенсорная кассета с белком G-ID (размер колонки: 2,1 мм ID x 30 мм LD, объем слоя: 0,1 мл; cat.#№ 2-1002-00, Applied Biosystems)
Элюирующий буфер: 0,1 М глицин-HCl (рН 2,5);
Нейтрализующий буфер: 1 М Трис-HCI (pH 8,5);
Детекция: 280 нм
Скорость потока: 1 мл/мин
Размер фракции: 0,5 мл/0,5 мин
Пробирка для фракционирования: полипропиленовая 1,5 мл-микропробирка.
Температура: 4°С.
После нанесения всех фильтратов на колонку для промывки колонки использовали 30 мл PBS (Sigma, cat.# 1003-3). После нанесения элюирующего буфера начинали сбор фракций. Каждая микропробирка для фракционирования содержала 55 мкл 1М NaCl, 110 мкл нейтрализующего буфера и 74 мкл 2 мг/мл альбумина бычьей сыворотки (Sigma, cat.# А-7030) в PBS. Фракции № 8-№ 10 собирали и диализовали против 1 литра PBS (рН 7,5) при 4°С в течение 1 дня с использованием анализатора Slide Analyzer (Pierce, cat.# 66450). Буфер для диализа меняли дважды.
Подтверждение экспрессии гуманизированных антител и количественный анализ полученных продуктов экспрессии в надосадочных жидкостях культуры осуществляли с помощью ELISA с использованием антитела против IgG человека.
В каждую лунку 96-луночного планшета (MaxiSorp, Nunc) добавляли 100 мкл козьего Fc-специфического поликлонального антитела против IgG (Kappel), растворенного в конечной концентрации 0,5 мкг/мл в буфере для адсорбции (0,05М бикарбонат натрия, 0,02% азида натрия, рН 9,6), и планшет инкубировали при 37°С в течение 2 часов для стимуляции адсорбции антитела. Затем планшет пять раз промывали 350 мкл PBS(-), содержащим 0,05% Твина-20 (BioRad) (далее называемого "PBS-T"). После промывки к лункам добавляли супернатант культуры, разведенный в D-MEM, содержащей 10% FCS, и инкубировали при 37°С в течение 2 часов. После повторной промывки PBS-T в каждую лунку добавляли 100 мкл меченного щелочной фосфатазой Fc-специфического козьего поликлонального антитела против человеческого IgG (Jackson Immuno Research Lab), 10000-кратно разведенного PBS-T, и инкубировали при 37°С в течение 2 часов. После повторной промывки PBS-T добавляли субстратный раствор п-нитрофенилфосфата, поставляемый с набором, содержащим субстрат щелочной фосфатазы (BioRad) в соответствии с инструкциями, прилагаемыми к набору. После инкубирования при 37°С в течение 0,5-1 часа измеряли оптическую плотность при 450 нм. В экспериментах настоящего изобретения иммуноглобулин подкласса G плазмы человека (IgG1) (Biopure AG), разведенный в DMEM, содержащей 10% FCS до определенных концентраций, исользовали как образцы с эталонной концентрацией для гуманизированных анти-DR5 антител, содержащихся в надосадочных жидкостях культуры.
В результате этого экспрессию и очищенные продукты в надосадочных жидкостях культур специфически детектировали с использованием антитела против человеческого IgG. Количество антитела против человеческого IgG составляло 8,96 мкг (800 мкл).
Пример 21. Апоптоз-индуцирующая активность гуманизированного антитела
Для оценки апоптоз-индуцирующей активности очищенного гуманизированного антитела TRA-8 использовали клетки Jurkat (АТСС №TIB-152).
Клетки Jurkat, культивированые в среде RPMI 1640 с 10% FSC (Gibco BRL) при 37оС в течение 3 дней в присутствии 5% СО2, добавляли в каждую лунку 96-луночного микропланшета (Sumitomo Bakelite) в количестве 50 мкл на лунку. Гуманизированное антитело TRA-8, полученное, как описано в Примере 20, доводили до концентрации конечного нужного продукта 100 нг/мл в среде RPMI 1640, содержащей 10% FSC, путем оценки их концентраций в жидкостях методом, описанным в примере 20. Каждый из полученных растворов продуктов экспрессии, доведенных до 100 мг/мл, использовали для приготовления серийных разведений путем 2-кратного разведения средой RPMI 1640, содержащей 10% FSC. Каждое из полученных разведений гуманизированного антитела TRA-8 добавляли в каждую лунку при концентрации 50 мкл на лунку. После проведения реакции при 37оС в течение 12 часов добавляли 50 мкл 25 мкМ PMS (метосульфат феназина; Sigma Chemical Co.), содержащие 1 мг/мл ХТТ (2,3-бис[2-метокси-4-нитро-5-сульфофенил]-2Н-тетра-золий-5-карбоксианилида; внутренняя соль Sigma Chemical Co.) (конечные концентрации 250 мкг/мл для ХТТ и 5 мкМ для PMS). После инкубирования в течение 3 часов измеряли оптическую плотность каждой лунки при 450 нм, после чего определяли жизнеспособность клеток с использованием восстанавливающей способности митохондрий в качестве индикатора.
Жизнеспособность клеток в каждой лунке вычисляли по следующей формуле:
Жизнеспособность (%)=100×(а-b)/(c-b)
где а представляет значение для тестируемой лунки, b представляет значение для лунки без клеток и с представляет значение для лунки, в которую не было добавлено антитело.
В результате было продемонстрировано, что продукт экспрессии, полученный, как описано в примере 20 (гуманизированное антитело TRA-8), индуцирует апоптоз в Т-клеточной лимфоме, экспрессирующей антиген DR5 человека.
Пример 22. Реактивность TRA-8 с различными молекулами DR5
Для определения реактивности TRA-8 с различными молекулами DR5 реактивность TRA-8 оценивали с использованием активированных лимфоцитов, как описано ниже.
Сначала образцы периферической крови брали у человека (30 мл), у обезьяны игрунки (3 мл) и у собакоподобной обезьяны (20 мл). К этим образцам добавляли 1 мл гепарина (Novoheparin; Novo), а затем, образцы медленно наносили на равный объем раствора Фиколл-Пак+ (Ficoll-Paque PLUS, Amersham Pharmacia Biotech.), удельный вес для всех обезьян составлял 1,077 за исключением собакоподобной обезьяны, удельный вес образцов которой составлял 1,072) и центрифугировали при 1700 об/мин в течение 30 минут с получением фракции мононуклеарных клеток периферической крови. Эту фракцию мононуклеарных клеток дважды промывали сбалансированным солевым раствором Хэнкса, а затем суспендировали в среде RPMI 1640 с 10% об./об. FCS до клеточной плотности 1 х 106 клеток/мл. К полученной суспензии добавляли фитогемаглютинин-Р (РНА-Р, Sigma Chemicals, Co.) до конечной концентрации 5 мкг/мл и образец инкубировали при 37оС в течение 24 часов в присутствии 5% об./об. СО2. По истечении этого времени клетки выделяли путем центрифугирования, промывали и ресуспендировали в среде RPMI 1640, содержащей 10% об./об. FCS. После этого для активации выделенных клеток к суспензии добавляли интерлейкин-2 (Amersham Pharmacia Biotech.) до конечной концентрации 10 единиц/мл и эту суспензию инкубировали при 37оС в течение 72 часов в присутствии 5% об./об. СО2.
Определенное количество активированного препарата, которое, как было вычислено, содержало 1×106 активированных лимфоцитов, помещали в тест-пробирку и суспендировали либо в 50 мкл 0,5; 1; 5; 10 мкг/мл TRA-8 в PBS, либо в 50 мкл одного PBS. Полученную суспензию выдерживали на льду в течение 1 часа, после чего клетки 3 раза промывали аликвотами 500 мкл PBS, а затем суспендировали в 50 мкл 20 мкг/мл FITC-меченного антитела против мышиных IgG (Bioresource) в PBS. С использованием клеток, суспендированных в 500 мкл PBS, в качестве контроля измеряли интенсивность флуоресценции на проточном цитометре (FASCCalibur; Becton Dickinson).
Распределение численности клеток определяли по интенсивности флуоресценции и подсчитывали соотношения числа окрашенных клеток к полному числу клеток. Затем, с использованием концентрации TRA-8, вычисляли каждую величину Kd и отношения числа окрашенных клеток к общему числу клеток. Способности клеток реагировать с активированными лимфоцитами человека, обезьяны-игрунки и собакоподобной обезьяны были почти одинаковыми. В соответствии с этим, было установлено, что антитело TRA-8 способно связываться с DR5 приматов разных видов, включая человека, против клеток которого было первоначально продуцировано TRA-8.
Пример 23. Исследование возрастающей дозы TRA-8 у обезьян-игрунок
Предварительное исследование относительной токсичности возрастающих доз TRA-8 осуществляли с использованием 1 самца и 1 самки игрунки. Для этого внутривенно вводили три серии разовых доз и это введение проводили с 7-дневным интервалом. Эти дозы TRA-8 составляли 50, 250 и 1250 мкг/массу тела. Через 48 часов после каждой обработки из бедренной вены брали кровь и получали плазму. Активности аспартат-аминотрансферазы и аланин-аминотрансферазы измеряли с использованием анализатора (FUJI DRI-CHEM: Fuji Film Medical Co., Ltd.). Все пробы крови брали без анестезии. В результате после каждой обработки биохимический анализ плазмы не выявил каких-либо поражений печени.
Пример 24. In vitro и in vivo фармакологические исследования действия TRA-8 против злокачественных клеток
Для того чтобы определить, обладает ли TRA-8 терапевтической противораковой активностью, оценивали in vitro киллерную активность TRA-8 с использованием различных злокачественных клеточных линий.
Различные раковые клетки (2-8×103 клеток/50 мкл), культивированые в среде RPMI 1640 (для Jurkat), в среде DMEM (для НСТ-116), МЕМ-R (для WiDr) или DMEM-F12 (для COL2-Jck) и полученные от Gibco BRL с 10% об./об. FCS (Gibco BRL) при 37оС в присутствии 5 % СО2, добавляли в каждую лунку 96-луночного микропланшета (Sumitomo Bakelite). TRA-8 доводили до конечной концентрации нужного продукта 100 нг/мл в среде, содержащей 10% FSC. Раствор TRA-8 (100 нг/мл) использовали для приготовления серийных разведений путем 2-кратного серийного разведения средой, содержащей 10% FSC. Каждое из полученных разведений раствора TRA-8 добавляли в каждую лунку при концентрации 50 мкл на лунку и инкубировали при 37оС. После проведения реакции при 37оС в течение 72 часов, добавляли 50 мкл 25 мкМ PMS (метосульфат феназина; Sigma Chemical Co.), содержащие 1 мг/мл ХТТ) (конечная концентрация 250 мкг/мл для ХТТ и 5 мкМ для PMS). После инкубирования в течение 3 часов измеряли оптическую плотность каждой лунки при 450 нм, после чего определяли жизнеспособность клеток с использованием восстанавливающей способности митохондрий в качестве индикатора.
Жизнеспособность клеток в каждой лунке вычисляли по следующей формуле:
Жизнеспособность (%)=100×(а-b)/(c-b)
где а представляет значение для тестируемой лунки, b представляет значение для лунки без клеток и с представляет значение для лунки, в которую не было добавлено антитело.
Результаты представлены ниже в таблице 3.
Антитело TRA-8 сильно индуцировало апоптоз различных злокачественных клеточных линий в in vitro условиях.
Кроме того, оценивали противоопухолевое действие in vivo TRA-8 у "голых" (бестимусных) мышей с имплантированными клетками WiDr, поскольку TRA-8 не вступает в перекрестную реакцию с мышиным DR5.
Антитела TRA-8 против человеческого DR5 вводили "голым" мышам, несущим человеческие ксенотрансплантаты, которые экспрессируют молекулу человеческого DR5. Для этого использовали 6-недельных "голых" мышей BALB/c (самок, от Clea Japan Inc.), которым имплантировали человеческие клеточные линии злокачественной опухоли толстой кишки WiDr (5 мм3). Через день после имплантации опухоли этим мышам с трансплантатом ежедневно внутрисуставно вводили инъекцию TRA-8 (5 мкг/массу тела) до 14 раз. Рост опухоли WiDr ежедневно оценивали по размеру опухолевой массы. Результаты представлены ниже в таблице 4.
В этой модели все необработанные животные обнаруживали заметный рост опухоли, а опухолевый рост у TRA-8-обработанных животных ингибировался, на что указывал размер опухоли. Этот результат показал, что TRA-8 является эффективным средством для элиминации опухолевых клеток in vivo.
Пример 25. Комбинированное исследование TRA-8
Клеточную линию злокачественной опухоли предстательной железы человека РС-3 получали из Американской коллекции тканевых культур (АТСС) и выдерживали в питательной смеси F12-К (21127-022, Gibco BRL), содержащей 10% фетальную бычью сыворотку (FBS, Hyclone), 1% L-глутамина-200 мМ (25030-149, Gibco BRL) и 0,5% раствор пенициллина и стрептомицина (Р-7539, Sigma). Среду RPMI 1640 (MED-008, IWAKI), в которую было добавлено 10% FBS и 0,5% раствор пенициллина и стрептомицина, использовали в описанном ниже эксперименте. Экспоненциально растущие клетки РС-3 собирали путем трипсинизации и дважды промывали свежей средой. Затем, за день до начала эксперимента, клетки подсчитывали, ресуспендировали в свежей среде при плотности 5 х 104 клеток/мл и распределяли с тремя повторностями по плоскодонным 96-луночным планшетам (3598, Corning-Coster) в полном объеме 100 мкл/лунку. Репрезентативное противораковое лекарственное средство, паклитаксел (169-18611, Wако), растворенное в диметилсульфоксиде (10 мг/мл), разводили в свежей среде, а затем добавляли в 96-луночные планшеты, содержащие клетки при концентрации 50 мкл/лунку. Конечные концентрации диметилсульфоксида составляли менее чем 0,1%. После инкубирования в течение 24 часов при 37оС в атмосфере 5% CO2, в лунки добавляли TRA-8, разведенное в свежей среде. После инкубирования в течение еще 24 часов, в лунки добавляли 50 мкл минимальной поддерживающей среды (11095-098, Gibco BRL), содержащей 1 мг/мл ХТТ и 25 мМ PMS и планшеты инкубировали в течение 6 ч. Затем измеряли OD450 на приборе SPECTRA MAX 250 (Molecular Devices) и жизнеспособность клеток определяли следующим образом.
Жизнеспособность клеток (%)=(OD450 для лунок, содержащих клетки, обработанные таксолом и/или TRA-8 (агент(ы))-OD450 для лунок, не содержащих ни клеток, ни агента) × 100/(OD450 для лунок, содержащих клетки, но не содержащих агента - OD450 для лунок, не содержащих ни клеток, ни агента). Результаты вышеописанного анализа для антитела TRA-8, используемого вместе с репрезентативным противораковым лекарственным средством, паклитакселом, представлены ниже. Пактитаксел снижают жизнеспособность клеток РС-3, но более, чем 40% сигналов, указывало на то, что при концентрациях вплоть до 200 нМ еще оставались жизнеспособные раковые клетки. При этом добавление 0,1 нг/мл TRA-8 значительно снижало жизнеспособность злокачественных клеток, вплоть до 10%, хотя после разового введения TRA-8 при этой концентрации не наблюдалось какого-либо снижения жизнеспособности клеток. Этот результат явно свидетельствовал о том, что TRA-8 обнаруживал противораковую синергическую активность при его объединении с другими противораковыми лекарственными средствами.
Пример 26. Анализ гуманизированных антител TRA-8 другого типа
(1) Конструирование гуманизированных антител
Конструирование гуманизированной версии TRA-8 осуществляли методом, в основном известным как CDR-прививка. В качестве антитела-акцептора использовали антитело mAb58'CL, как описано в сравнительном примере 2, и к этому акцептору присоединяли CDR-области антитела TRA-8. В каркасной области к акцептору присоединяли некоторые аминокислоты из TRA-8 или из человеческих "консенсусных" последовательностей в соответствии с критерием Queen et al. (Proc.Natl. Acad. Sci., USA, 86, 10029-10033 (1989)) и гуманизированные последовательности TRA-8 конструировали, как описано ниже.
(2) Конструирование плазмиды, несущей ДНК вариабельной области тяжелой цепи гуманизированного или мышиного TRA-8 других типов
Как показано на SEQ ID NO:56 списка последовательностей, гуманизацию Н1-типа аминокислотных последовательностей тяжелой цепи мышиного антитела TRA-8 против человеческого DR5 осуществляли путем замены 3-й аминокислоты (метионина), 13-й аминокислоты (лизина), 19-й аминокислоты (лизина), 40-й аминокислоты (треонина), 42-й аминокислоты (глутаминовой кислоты), 44-й аминокислоты (аргинина), 84-й аминокислоты (серина), 88-й аминокислоты (серина), 93-й аминокислоты (метионина), 114-й аминокислоты (треонина) и 115-й аминокислоты (лейцина) глутамином, глутамином, аргинином, аланином, глицином, глицином, аспарагином, аланином, валином, лейцином и валином соответственно.
Как показано на SEQ ID NO:59 списка последовательностей, гуманизацию Н3-типа аминокислотных последовательностей тяжелой цепи мышиного антитела TRA-8 против человеческого DR5, осуществляли путем замены 13-й аминокислоты (лизина), 19-й аминокислоты (лизина), 40-й аминокислоты (треонина), 42-й аминокислоты (глутаминовой кислоты), 44-й аминокислоты (аргинина), 88-й аминокислоты (серина), 93-й аминокислоты (метионина), 114-й аминокислоты (треонина) и 115-й аминокислоты (лейцина) глутамином, аргинином, аланином, глицином, глицином, аланином, валином, лейцином и валином соответственно.
Как показано на SEQ ID NO:60 списка последовательностей, гуманизацию Н4-типа аминокислотных последовательностей тяжелой цепи мышиного антитела TRA-8 против человеческого DR5 осуществляли путем замены 13-й аминокислоты (лизина), 19-й аминокислоты (лизина), 88-й аминокислоты (серина), 93-й аминокислоты (метионина), 114-й аминокислоты (треонина) и 115-й аминокислоты (лейцина) глутамином, аргинином, аланином, валином, лейцином и валином соответственно.
Как показано на SEQ ID NO:61 списка последовательностей, плазмиду, несущую ДНК вариабельной области тяжелой цепи химерного TRA-8, обозначали как "М-тип". Кроме того, гуманизированное TRA-8, описанное в примере 17 и 18, обозначали "Н2-тип".
Плазмиду, несущую ДНК, кодирующую вариабельную область тяжелой цепи гуманизированного или химерного TRA-8 конструировали нижеописанным способом.
Для конструирования нижеследующих ДНК-последовательностей, каждая из которых содержала вышеописанные (замены), использовали ПЦР.
Были синтезированы следующие 24 олигонуклеотида:
5'- ttggataagc ttggcttgac ctcaccatgg gatggagctg tatcatcctc ttcttggtag caacagctac aggtgtccac -3' (A; SEQ ID No. 32);
5'- tctgaagtaa tgctggtgga gtctggggga ggcttagtac agcctggagg gtccctgaga ctctcctgtg cagcctotgg -3' (В; SEQ ID No. 33);
5'- tctgaagtac agctggtgga gtctggggga ggcttagtac agcctggagg gtccctgaga ctctcctgtg cagcctotgg -3' (B2; SEQ ID No. 57);
5'- tctgaagtaa tgctggtgga gtctggggga ggcttagtaa agcctggagg gtccctgaaa ctctcctgtg cagcctotgg -3' (B3; SEQ ID No. 66);
5'- attcactttc agtasttatg taatstcttg ggttcggcag gcaccaggga agggtctgga gtgggttgca accattagta -3' (С; SEQ ID No. 34);
5'- attcactttc agtagttatg taatgtcttg ggttcggcag actccagaga agaggctgga gtgggttgca accattagta -3' (C2; SEQ ID No. 64);
5'- gtggtggtag ttacacctac tatccagaca gtgtgaaggg ccgattcacc atctccagag acaatgccaa gaacaccctg -3' (D; SEQ ID No. 35);
5'- tatctgcaaa tgaacagtct gagagcagag sacacggctg tttattactg tgcaagaagg ggtgactcta tgattacgac -3' (E; SEQ ID No. 36);
5'- tatctgcaaa tgagcagtct gagagcagag gacacggctg tttattactg tgcaagaagg ggtgactcta tgattacgac -3' (E2; SEQ ID No. 62);
5'- tatctgcaaa tgagcagtct gagatctgag gacacggcta tgtattactg tgcaagaagg ggtgactcta tgattacgac -3' (E3; SEQ ID No. 67);
5'- ggactactgg ggccaaggga ccctggtcac agtctcctca gcctccacc aagggcccat cggtc -3' (F; SEQ ID No. 37);
5'- ggactactgg ggccaaggga ccactctcac agtctcctca gcctccacc aagggcccat cggtc -3' (F2; SEQ ID No. 68);
5'- ctaccaagaa gaggatgata cagctccatc ccatggtgag gtcaagccaa gcttatccaa -3' (G; SEQ ID No. 38);
5'- tetcagggac cctccaggct gtactaagcc tcccccagac tccaccagca ttacttcaga gtggacacct gtagctgttg -3' (H; SEQ ID No. 39);
5'- tetcagggac cctccaggct gtactaagcc tcccccagac tccaccagct gtacttcaga gtggacacct gtagctgttg -3' (H2; SEQ ID No. 58);
5'- tttcagggac cctccaggct ttactaagcc tcccccagac tccaccagca ttacttcaga gtggacacct gtagctgttg -3' (H3; SEQ ID No. 69);
5'- tccagaccct tccctggtgc ctgccgaacc caagacatta cataactact gaaagtgaat ccagaggctg cacaggagag -3' (I; SEQ ID No. 40);
5'- tccagcctct tctctggagt ctgccgaacc caagacatta cataactact gaaagtgaat ccagaggctg cacaggagag -3' (12; SEQ ID No. 65);
5'- ctctggagat ggtgaatcgg cccttcacac tgtctggata gtaggtgtaa ctaccaccac tactaatggt tgcaacccac -3' (J; SEQ ID No. 41);
5'- ccttcttgca cagtaataaa cagccgtgtc ctctgctctc agactgttca tttgcagata cagggtgttc ttggcattgt -3' (К; SEQ ID No. 42);
5'- ccttcttgca cagtaataaa cagccgtgtc ctctgctctc agactgttca tttgcagata cagggtgttc ttggcattgt -3' (K2; SEQ ID No. 63);
5'- ccttcttgca cagtaataca tagccgtgtc ctcagatctc agactgctca tttgcagata cagggtgttc ttggcattgt -3' (КЗ; SEQ ID No. 70);
5'- gaccgatggg cccttggtgg aggctgagga gactgtgacc agggtccctt ggccccagta gtccgtcgta atcatagagt cacc -3' (L; SEQ ID No. 43) и
5'- gaccgatggg cccttsgtgg agsctgagga gactgtgaga gtggtccctt ggccccagta gtccstggta atcatagagt cacc -3' (L2; SEQ ID No. 71).
Нижеследующие 2 ПЦР-праймера были синтезированы, как описано выше:
5'-ttggataagc ttggcttgac-3' (Р1; SEQ ID NO:44) и
5'-gaccgatggg cccttggtgg a-3' (Р2; SEQ ID NO:45).
Синтез ДНК Н1-типа, кодирующей полипептидную цепь, содержащую секреторную сигнальную последовательность, вариабельную область тяжелой цепи гуманизированного TRA-8 и 8 аминокислотных остатков у N-конца области IgG-CH1, осуществляли с использованием комбинированной ПЦР соответственно.
ДНК-фрагмент Н1-типа получали нижеописанным способом.
Состав ПЦР-реакционного раствора:
олигонуклеотид А, 10 пмоль;
олигонуклеотид В2, 10 пмоль;
олигонуклеотид С, 10 пмоль;
олигонуклеотид D, 10 пмоль;
олигонуклеотид Е, 10 пмоль;
олигонуклеотид F, 10 пмоль;
олигонуклеотид G, 10 пмоль;
олигонуклеотид H2, 10 пмоль;
олигонуклеотид I, 10 пмоль;
олигонуклеотид J, 10 пмоль;
олигонуклеотид К, 10 пмоль;
олигонуклеотид L, 10 пмоль;
олигонуклеотидный праймер Р1, 2 мкМ;
олигонуклеотидный праймер Р2, 2 мкМ;
10 х буфер Pyrobest II, 10 мкл;
смесь dNTP, 8 мкл;
ДНК-полимераза Pyrobest, 0,5 мкл; и бидистиллированная вода до конечного объема 50 мкл.
ПЦР-реакцию проводили следующим образом. Сначала раствор нагревали при 94°С в течение 5 минут, а затем проводили 7 циклов нагревания при 98°С в течение 10 секунд, при 55°С в течение 30 секунд и при 72°С в течение 1 минуты. После завершения этой процедуры реакционный раствор нагревали при 72°С в течение 15 минут.
После экстракции фенолом и осаждения этанолом полученный ДНК-осадок сушили в вакууме, растворяли в минимальном количестве бидистиллированной воды и разделяли с помощью электрофореза на 3% агарозном геле. После электрофореза гель окрашивали 1 мкг/мл водного раствора этидийбромида для обнаружения ДНК при УФ-излучении. ДНК-полосы, соответствующие ДНК Н1-типа, вырезали лезвием бритвы и элюировали из геля с использованием набора Geneclean Spin (Bio 101, CA, USA). После экстракции фенолом проэлюированную ДНК концентрировали путем центрифугирования при 7500 х g, затем осаждали этанолом и, наконец, растворяли в 5 мкл дистиллированной воды.
Синтез ДНК Н3-типа, кодирующей полипептидную цепь, содержащую секреторную сигнальную последовательность, вариабельную область тяжелой цепи геманизированного TRA-8 и 8 аминокислотных остатков у N-конца области IgG-CH1, осуществляли с использованием комбинированной ПЦР соответственно.
ДНК-фрагмент Н3-типа получали нижеописанным способом.
Состав ПЦР-реакционного раствора:
олигонуклеотид А, 10 пмоль; олигонуклеотид В, 10 пмоль;
олигонуклеотид С, 10 пмоль;
олигонуклеотид D, 10 пмоль;
олигонуклеотид Е2, 10 пмоль;
олигонуклеотид F, 10 пмоль;
олигонуклеотид G, 10 пмоль;
олигонуклеотид H, 10 пмоль;
олигонуклеотид I, 10 пмоль;
олигонуклеотид J, 10 пмоль;
олигонуклеотид К2, 10 пмоль;
олигонуклеотид L, 10 пмоль;
олигонуклеотидный праймер Р1, 2 мкМ;
олигонуклеотидный праймер Р2, 2 мкМ;
10 × буфер Pyrobest II, 10 мкл;
смесь dNTP, 8 мкл;
ДНК-полимераза Pyrobest, 0,5 мкл; и
бидистиллированная вода до конечного объема 50 мкл.
ПЦР-реакцию проводили следующим образом. Сначала раствор нагревали при 94°С в течение 5 минут, а затем проводили 7 циклов нагревания при 98°С в течение 10 секунд, при 55°С в течение 30 секунд и при 72°С в течение 1 минуты. После завершения этой процедуры реакционный раствор нагревали при 72°С в течение 15 минут.
После экстракции фенолом и осаждения этанолом полученный ДНК-осадок сушили в вакууме, растворяли в минимальном количестве бидистиллированной воды и разделяли с помощью электрофореза на 3% агарозном геле. После электрофореза гель окрашивали 1 мкг/мл водного раствора этидийбромида для обнаружения ДНК при УФ-излучении. ДНК-полосы, соответствующие ДНК Н3-типа, вырезали лезвием бритвы и элюировали из геля с использованием набора Geneclean Spin. После экстракции фенолом проэлюированную ДНК концентрировали путем центрифугирования при 7500 х g, осаждали этанолом и, наконец, растворяли в 5 мкл дистиллированной воды.
Синтез ДНК Н4-типа, кодирующей полипептидную цепь, содержащую секреторную сигнальную последовательность, вариабельную область тяжелой цепи гуманизированного TRA-8 и 8 аминокислотных остатков у N-конца области IgG-CH1, осуществляли с использованием комбинированной ПЦР соответственно.
ДНК-фрагмент Н3-типа получали нижеописанным способом.
Состав ПЦР-реакционного раствора:
олигонуклеотид А, 10 пмоль;
олигонуклеотид В, 10 пмоль;
олигонуклеотид С2, 10 пмоль;
олигонуклеотид D, 10 пмоль;
олигонуклеотид Е2, 10 пмоль;
олигонуклеотид F, 10 пмоль;
олигонуклеотид G, 10 пмоль;
олигонуклеотид H, 10 пмоль;
олигонуклеотид I2, 10 пмоль;
олигонуклеотид J, 10 пмоль;
олигонуклеотид К2, 10 пмоль;
олигонуклеотид L, 10 пмоль;
олигонуклеотидный праймер Р1, 2 мкМ;
олигонуклеотидный праймер Р2, 2 мкМ;
10 × буфер Pyrobest II, 10 мкл;
смесь dNTP, 8 мкл;
ДНК-полимераза Pyrobest, 0,5 мкл; и
бидистиллированная вода до конечного объема 50 мкл.
ПЦР-реакцию проводили следующим образом. Сначала раствор нагревали при 94°С в течение 5 минут, а затем проводили 7 циклов нагревания при 98°С в течение 10 секунд, при 55°С в течение 30 секунд и при 72°С в течение 1 минуты. После завершения этой процедуры реакционный раствор нагревали при 72°С в течение 15 минут.
После экстракции фенолом и осаждения этанолом полученный ДНК-осадок сушили в вакууме, растворяли в минимальном количестве бидистиллированной воды и разделяли с помощью электрофореза на 3% агарозном геле. После электрофореза гель окрашивали 1 мкг/мл водного раствора этидийбромида для обнаружения ДНК при УФ-излучении. ДНК-полосы, соответствующие ДНК Н4-типа, вырезали лезвием бритвы и элюировали из геля с использованием набора Geneclean Spin. После экстракции фенолом проэлюированную ДНК концентрировали путем центрифугирования при 7500 х g, осаждали этанолом и, наконец, растворяли в 5 мкл дистиллированной воды.
Синтез ДНК М-типа, кодирующей полипептидную цепь, содержащую секреторную сигнальную последовательность, вариабельную область тяжелой цепи химерного TRA-8 и 8 аминокислотных остатков у N-конца области IgG-CH1, осуществляли с использованием комбинированной ПЦР соответственно.
ДНК-фрагмент М-типа получали нижеописанным способом.
Состав ПЦР-реакционного раствора:
олигонуклеотид А, 10 пмоль;
олигонуклеотид В3, 10 пмоль;
олигонуклеотид С2, 10 пмоль;
олигонуклеотид D, 10 пмоль;
олигонуклеотид Е3, 10 пмоль;
олигонуклеотид F2, 10 пмоль;
олигонуклеотид G, 10 пмоль;
олигонуклеотид H3, 10 пмоль;
олигонуклеотид I2, 10 пмоль;
олигонуклеотид J, 10 пмоль;
олигонуклеотид К3, 10 пмоль;
олигонуклеотид L2, 10 пмоль;
олигонуклеотидный праймер Р1, 2 мкМ;
олигонуклеотидный праймер Р2, 2 мкМ;
10 х буфер Pyrobest II, 10 мкл;
смесь dNTP, 8 мкл;
ДНК-полимераза Pyrobest, 0,5 мкл; и
бидистиллированная вода до конечного объема 50 мкл.
ПЦР-реакцию проводили следующим образом. Сначала раствор нагревали при 94°С в течение 5 минут, а затем проводили 7 циклов нагревания при 98°С в течение 10 секунд, при 55°С в течение 30 секунд и при 72°С в течение 1 минуты. После завершения этой процедуры реакционный раствор нагревали при 72°С в течение 15 минут.
После экстракции фенолом и осаждения этанолом полученный ДНК-осадок сушили в вакууме, растворяли в минимальном количестве бидистиллированной воды и разделяли с помощью электрофореза на 3% агарозном геле. После электрофореза гель окрашивали 1 мкг/мл водного раствора этидийбромида для обнаружения ДНК при УФ-излучении. ДНК-полосы, соответствующие ДНК М-типа, вырезали лезвием бритвы и элюировали из геля с использованием набора Geneclean Spin. После экстракции фенолом проэлюированную ДНК концентрировали путем центрифугирования при 7500 × g, осаждали этанолом и, наконец, растворяли в 5 мкл дистиллированной воды.
Каждую полученную экстрагированную ДНК (Н1-типа, Н3-типа, Н4-типа и М-типа) клонировали с использованием вектора pGEM-Т Easy (Promega) следующим образом:
ДНК-фрагмент, полученный в результате ПЦР-реакции (Н1, Н3, Н4 или М), 5 мкл;
10 × Taq-полимеразный буфер, 1 мкл;
смесь dNTP, 1 мкл;
Полимераза Taq (5 ед./мл), 1 мкл; и
бидистиллированная вода до конечного объема 10 мкл.
После проведения реакции каждого вышеуказанного раствора при 70°С в течение 30 минут каждый ДНК-раствор и вектор pGEM-Т Easy лигировали с использованием набора для лигирования ДНК, Версия 2.0 (Takara Shuzo Co, Ltd.) в соответствии с инструкциями производителей.
После 4-часового инкубирования при 15°С 2 мкл инкубированного реакционного раствора смешивали со 100 мкл компетентного штамма JM109 E.coli при плотности клеток 1-2 × 109 клеток/мл (Takara Shuzo Co, Ltd.) и смесь выдерживали на льду в течение 30 минут, затем при 42оС в течение 30 секунд, а затем снова выдерживали на льду в течение 1 минуты. После этого к смеси добавляли 500 мкл среды SOC (2% об./об. триптона, 0,5% мас./об. дрожжевого экстракта, 0,05% мас./об. хлорида натрия, 2,5 мМ хлорида калия, 1 мМ хлорида магния и 20 мМ глюкозы) и смесь инкубировали еще один час при встряхивании. Затем выделяли штаммы-трансформанты и из этих штаммов получали плазмидную ДНК, как описано в "Molecular cloning A Laboratory Manual". Нуклеотидные последовательности этих ДНК, кодирующих тяжелую цепь и легкую цепь TRA-8, определяли дидезокси-методом соответственно (Sanger, F.S., et al., (1997), Proc. Natl. Acad. Sci. USA, 74:5463-5467] с использованием ДНК-анализатора 3700 (ABI PRISM; Perkin Elmer Applied Biosystems, Japan).
Полученные плазмиды обозначали рНА15 (плазмида, несущая кДНК, кодирующую тяжелую цепь гуманизированного TRA-8 Н1-типа), рНС10 (плазмида, несущая кДНК, кодирующую тяжелую цепь гуманизированного TRA-8 Н4-типа), рНD21 (плазмида, несущая кДНК, кодирующую тяжелую цепь гуманизированного TRA-8 Н4-типа) и рМ11 (плазмида, несущая кДНК, кодирующую тяжелую цепь химерного TRA-8). Штаммы-трансформанты E.coli, содержащие эти плазмиды и обозначенные E.coli JM109/рНА15, E.coli JM109/рНС10, E.coli JM109/рНD21 и E.coli JM109/рМ11, были депонированы 20 апреля 2001 г в Международном депозитарии патентуемых микроорганизмов, Национальный институт промышленных наук и передовых технологий, 1-1, Higashi 1 chome Tsukuba-shi, Ibaraki-ken, 305-5466, Japan, в соответствии с Будапештским договором о депонировании микроорганизмов, и имеют регистрационный номер FERM BP-7555, FERM BP-7557, FERM BP-7558 и FERM BP-7559 соответственно.
(3) Конструирование экспрессирующих плазмид, несущих ДНК вариабельной области тяжелой цепи гуманизированного или мышиного TRA-8 нескольких типов
Рекомбинантный экспрессирующий вектор для клеток животных конструировали путем встраивания ДНК, кодирующей тяжелую цепь гуманизированного TRA-8 Н1-типа, Н3-типа и Н4-типа или химерного TRA-8 М-типа (клонированную, как описано выше) следующим образом.
Один микрограмм плазмиды pSRННН3 (Европейская патентная заявка ЕР 0-909816-А1), несущей геномную ДНК человеческой вариабельной области тяжелой цепи гуманизированного моноклонального антитела НFE7A против Fas и константной области человеческого IgG1, т.е., экспрессирующего вектора для клеток млекопитающих, гидролизовали рестриктирующими ферментами HindIII и ApaI и выделяли с помощью электрофореза на 3% агарозом геле. После электрофореза гель окрашивали 1 мкг/мл водного раствора бромида этидия для обнаружения ДНК при УФ-излучении. Полосы векторной ДНК, содержащие геномную ДНК константной области человеческого IgG1 без вариабельной области тяжелой цепи гуманизированного НFE7A, вырезали лезвием бритвы и элюировали из геля с использованием набора Geneclean Spin. После экстракции фенолом проэлюированную ДНК концентрировали путем центрифугирования при 7500 × g, а затем осаждали этанолом и, наконец, растворяли в 5 мкл дистиллированной воды, а затем дефосфорилировали с использованием CIP. Полученную гидролизованную дефосфорилированную плазмиду (100 нг) лигировали с 1 мкг ДНК-фрагмента рНА15, рНС10, рНD21 или рМ11, содержащего ДНК, кодирующую вариабельную область тяжелой цепи гуманизированного или химерного TRA-8, которое также было гидролизовано ферментами HindIII и Apal с использованием набора для лигирования ДНК Version 2.0 (Takara Shuzo Co., Ltd.). Затем лигированную смесь использовали для трансформации клеток JM109 E.coli, которые после этого высевали в чашки с LB-агаром, содержащие 50 мкг/мл ампициллина.
Полученные таким способом трансформанты культивировали в 2 мл жидкой LB-среды, содержащей 50 мкг/мл ампициллина, в течение ночи при 37оС, и плазмидную ДНК экстрагировали из полученной культуры с использованием щелочного ДСН.
Экстрагированную плазмидную ДНК гидролизовали ферментами HindIII и Apal и подвергали электрофорезу на 3% (мас./об) агарозном геле для подтверждения присутствия или отсутствия нужной вставки ДНК, кодирующей вариабельную область тяжелой цепи гуманизированного или химерного TRA-8. Инсерция и ориентация нужного ДНК-фрагмента в данном векторе были подтверждены секвенированием ДНК с использованием анализатора генных последовательностей (ABI Prism 3700 DNA Analyzer; Applied Biosystems). Полученные экспрессирующие плазмиды, несущие кДНК, кодирующую тяжелую цепь гуманизированного или химерного TRA-8, обозначали рНА15-1, рНС10-3, рНD21-1 или рМ11-1 соответственно.
(4) Конструирование векторов для гуманизированных легких цепей
(4.1) Конструирование экспрессирующего вектора для легкой цепи гуманизированного антитела (LМ1-типа)
Как показано в SEQ ID NO:72 списка последовательностей, гуманизацию другого типа (LМ1-типа) аминокислотных последовательностей легкой цепи мышиного антитела TRA-8 против человеческого DR5 осуществляли путем замены 3-й аминокислоты (валина), 8-й аминокислоты (гистидина), 9-й аминокислоты (лизина), 10-й аминокислоты (фенилаланина), 11-й аминокислоты (метионина), 13-й аминокислоты (треонина), 20-й аминокислоты (серина), 42-й аминокислоты (глутамина), 43-й аминокислоты (серина), 60-й аминокислоты (аспарагиновой кислоты), 63-й аминокислоты (треонина), 77-й аминокислоты (аспарагина), 78-й аминокислоты (валина), 80-й аминокислоты (серина), 83-й аминокислоты (лейцина), 85-й аминокислоты (аспарагиновой кислоты), 87-й аминокислоты (фенилаланина), 99-й аминокислоты (глицина), 103-й аминокислоты (лейцина) и 108-й аминокислоты (аланина) у N-конца аминокислотной последовательности легкой цепи TRA-8 глутамином, пролином, серином, серином, лейцином, аланином, треонином, лизином, аланином, серином, серином, серином, лейцином, пролином, фенилаланином, треонином, тирозином, глутамином, валином и треонином соответственно. Полученная последовательность была обозначена LМ1.
Экспрессирующие плазмиды, несущие указанный тип аминокислотных последовательностей гуманизированной легкой цепи антитела TRA-8 против человеческого DR5 (LМ1-типа, SEQ ID NO:72 в списке последовательностей), конструировали, как описано ниже. 1) Синтез праймеров для получения вариабельных и константных областей легкой цепи гуманизированного TRA-8 (LМ1-типа)
ДНК, кодирующую полипептидную цепь LМ1 (SEQ ID NO:72 в списке последовательностей), каждая из которых представляет собой гибрид вариабельной области легкой цепи гуманизированного анти-DR5 антитела TRA-8 (LМ1-типа) и константной области легкой цепи человеческого Ig (к-цепь), синтезировали соответствующим образом с использованием комбинации ПЦР.
Помимо 7ALIP (SEQ ID NO:47) и 7ALCN (SEQ ID NO:48) были синтезированы HKCDF11 (SEQ ID NO:50), HKCDR12 (SEQ ID NO:51), HKCDF22 (SEQ ID NO:52), HKCDR22 (SEQ ID NO:53) и HKCDF12 (SEQ ID NO:54).
Нижеследующий олигонуклеотидный праймер синтезировали для ПЦР:
5'-gtcccccaca gatgcagaca aagaacttgg agattgggtc atctgaatgt caccagtgga-3' (HKCPR12 (SEQ ID NO:77).
2) Конструирование плазмиды рCR3.1/LМ1-2 (клонирующей легкую цепь гуманизированного TRA-8 LМ1-типа)
LМ1-ДНК-фрагмент, кодирующий аминокислотную последовательность, определенную в SEQ ID NO:72 в списке последовательностей, получали путем проведения 2-стадийной ПЦР, встраивали в плазмидный вектор и клонировали в E.coli.
а) Первая стадия ПЦР
LМ1-F1-ДНК-фрагмент, кодирующий секреторную сигнальную последовательность и часть FRL1-области с сайтом расщепления рестриктирующим ферментом HindIII у 5′-конца, получали при следующих условиях. Матричные плазмиды рHSGHM17 и pSRPDHH получали в соответствии с описанием в Европейской патентной заявке ЕР 0 909816 А1.
Состав реакционного раствора:
ДНК плазмиды рHSGHM17, 25 нг;
олигонуклеотидный праймер 7AL1P, 50 пмоль;
олигонуклеотидный праймер НКSPR12, 50 пмоль;
dNTP-смесь, 5 мкл;
10 × ПЦР-буфер, 5 мкл;
ДНК-полимераза ampliTaq (Perkin-Elmer), 2,5 единиц.
Реакционный раствор, имеющий вышеуказанный состав, доводили до конечного объема 50 мкл путем добавления бидистиллированной воды и использовали в ПЦР.
Температурные условия ПЦР: нагревание при 94°С в течение 2 минут, затем 30-кратное повторение цикла нагревания при 94°С в течение 1 минуты, при 55°С в течение 1 минуты и при 72°С в течение 2 минут с последующим нагреванием при 72°С в течение 10 минут.
LМ1-F2-ДНК-фрагмент, кодирующий часть FRL1, CDRL1, FRL2 и CDRL2, получали при нижеследующих условиях.
Состав ПЦР-реакционного раствора:
ДНК плазмиды pL28, 25 нг;
олигонуклеотидный праймер НКСDF11, 50 пмоль;
олигонуклеотидный праймер НКCDR12, 50 пмоль;
dNTP-смесь, 5 мкл;
10 х ПЦР-буфер, 5 мкл;
ДНК-полимераза ampliTaq, 2,5 единиц.
Реакционный раствор, имеющий вышеуказанный состав, доводили до конечного объема 50 мкл путем добавления бидистиллированной воды и использовали в ПЦР.
Температурные условия ПЦР: нагревание при 94°С в течение 2 минут, затем 30-кратное повторение цикла нагревания при 94°С в течение 1 минуты, при 55°С в течение 1 минуты и при 72°С в течение 2 минут с последующим нагреванием при 72°С в течение 10 минут.
LМ1-F3-ДНК-фрагмент, кодирующий CDRL2, FRL3 и часть CDRL3, получали при нижеследующих условиях.
Состав реакционного раствора:
ДНК плазмиды pSRPDHH, 25 нг;
олигонуклеотидный праймер НКСDF22, 50 пмоль;
олигонуклеотидный праймер НКCDR22, 50 пмоль;
dNTP-смесь, 5 мкл;
10 × ПЦР-буфер, 5 мкл;
ДНК-полимераза ampliTaq, 2,5 единиц.
Реакционный раствор, имеющий вышеуказанный состав, доводили до конечного объема 50 мкл путем добавления бидистиллированной воды и использовали в ПЦР.
Температурные условия ПЦР: нагревание при 94°С в течение 2 минут, затем 30-кратное повторение цикла нагревания при 94°С в течение 1 минуты, при 55°С в течение 1 минуты и при 72°С в течение 2 минут с последующим нагреванием при 72°С в течение 10 минут.
LМ1-F4-ДНК-фрагмент, кодирующий CDRL3, FRL4 и константную область с добавленным сайтом расщепления рестриктирующего фермента EcoRI у 3'-конца, получали при нижеследующих условиях.
Состав реакционного раствора:
ДНК плазмиды pHSRPDHH, 25 нг;
олигонуклеотидный праймер НКСF12, 50 пмоль;
олигонуклеотидный праймер 7ALCN, 50 пмоль;
dNTP-смесь, 5 мкл;
10 × ПЦР-буфер, 5 мкл;
ДНК-полимераза ampliTaq, 2,5 единиц.
Реакционный раствор, имеющий вышеуказанный состав, доводили до конечного объема 50 мкл путем добавления бидистиллированной воды и использовали в ПЦР.
Температурные условия ПЦР: нагревание при 94°С в течение 2 минут, затем 30-кратное повторение цикла нагревания при 94°С в течение 1 минуты, при 55°С в течение 1 минуты и при 72°С в течение 2 минут с последующим нагреванием при 72°С в течение 10 минут.
Амплифицированные ДНК-фрагменты, полученные в результате ПЦР, выделяли с помощью электрофореза в 5% полиакриламидном геле. После электрофореза гель окрашивали 1 мкг/мл этидийбромида для детекции продуцированной ДНК при УФ-излучении. Детектированные таким образом соответствующие ДНК-полосы вырезали лезвием бритвы.
b) Вторая стадия ПЦР
LМ1-ДНК, в которой были лигированы вышеописанные LМ1-F1-ДНК, LМ1-F2-ДНК, LМ1-F3-ДНК и LМ1-F4-ДНК-фрагменты, получали при следующих условиях.
Состав ПЦР-реакционного раствора:
Фрагмент геля с LМ1-F1-ДНК, полученный в первой стадии ПЦР,
Фрагмент геля с LМ1-F2-ДНК, полученный в первой стадии ПЦР,
Фрагмент геля с LМ1-F3-ДНК, полученный в первой стадии ПЦР,
Фрагмент геля с LМ1-F4-ДНК, полученный в первой стадии ПЦР,
олигонуклеотидный праймер 7AL1P, 50 пмоль;
олигонуклеотидный праймер 7ALCN, 50 пмоль;
dNTP-смесь, 5,0 мкл;
10 × ПЦР-буфер, 5,0 мкл;
ДНК-полимераза ampliTaq, 2,5 единиц.
Реакционный раствор, имеющий вышеуказанный состав, доводили до конечного объема 50 мкл путем добавления бидистиллированной воды и использовали в ПЦР.
Температурные условия ПЦР: нагревание при 94°С в течение 2 минут, затем 30-кратное повторение цикла нагревания при 94°С в течение 1 минуты, при 55°С в течение 1 минуты и при 72°С в течение 2 минут с последующим нагреванием при 72°С в течение 10 минут.
Полученный таким образом LМ1-ДНК-фрагмент встраивали в плазмиду рCR3.1DNA с использованием набора для клонирования эукариотического ТА (Invitrogen) в соответствии с инструкциями производителей и вводили в компетентный штамм TOP10F' E.coli, поставляемый с набором. Нуклеотидные последовательности этих ДНК, кодирующих легкую цепь гуманизированного TRA-8 (LМ1-типа), подтверждали дидезокси-методом (Sanger, F.S., et al., (1997), Proc. Natl. Acad. Sci. USA, 74:5463-5467) с использованием ДНК-анализатора 3700 (ABI PRISM; Perkin Elmer Applied Biosystems, Japan).
Полученные плазмиды обозначали рCR3.1/LМ1-2 (плазмида, несущая кДНК, кодирующую вариабельную область легкой цепи гуманизированного TRA-8 (LМ1-типа) и константную область легкой цепи человеческого Ig).
Полученную плазмиду рCR3.1/LМ1-2, содержащую LМ1-ДНК-фрагмент, гидролизовали рестриктирующими ферментами HindIII и EcoRI.
Один микрограмм ДНК клонирующей плазмиды рНSG399 гидролизовали рестриктирующими ферментами HindIII и EcoRI, а затем дефосфорилировали с использованием CIP. Полученную таким образом дефосфорилированную рНSG399-плазмидную ДНК и LМ1-ДНК-фрагмент, который был также гидролизован рестриктирующими ферментами HindIII и EcoRI, лигировали с использованием набора для лигирования ДНК Version 2.0 (Takara Shuzo Co., Ltd.). После этого DH5α E.coli трансформировали лигированной ДНК и высевали на LB-агаровую среду, содержащую 0,1 мМ IPTG, 0,1% Х-Gal и 50 мкг/мл хлорамфеникола (конечные концентрации). Полученные белые трансформанты культивировали в жидкой LB-среде, содержащей 50 мкг/мл хлорамфеникола, и плазмидную ДНК экстрагировали из полученной культуры методом с использованием щелочного ДСН. Экстрагированную плазмидную ДНК гидролизовали ферментами HindIII и EcoRI, а затем, клон, содержащий LM1-ДНК-фрагмент, отбирали посредством электрофореза на 1% агарозном геле.
С использованием вышеописанной процедуры получали плазмиду pHSG/М1-2-2, несущую гибридный фрагмент вариабельной области легкой цепи гуманизированного LМ1-TRA-8 и константной области цепи человеческого Igκ. Штамм-трансформант E.coli, содержащий эти плазмиды и обозначенный E.coli DH5α/pHSG/М1-2-2, был депонирован 20 апреля 2001 г в Международном депозитарии патентуемых микроорганизмов, Национальный институт промышленных наук и передовых технологий, 1-1, Higashi 1 chome Tsukuba-shi, Ibaraki-ken, 305-5466, Japan, в соответствии с Будапештским договором о депонировании микроорганизмов, и имеет регистрационный номер FERM BP-7562.
3) Конструирование плазмиды pSR/LМ1-2 (экспрессирующая плазмида для гуманизированной легкой цепи LМ1-TRA-8
Полученную плазмиду pHSG/М1-2-2, несущую гибридный фрагмент вариабельной области легкой цепи гуманизированного LМ1-TRA-8 и константной области цепи человеческого Igκ, гидролизовали рестриктирующими ферментами HindIII и EcoRI.
Один микрограмм ДНК клонирующей плазмиды pSRPDHH (Европейская патентная заявка ЕР 0 909816 А1) гидролизовали рестриктирующими ферментами HindIII и EcoRI, а затем дефосфорилировали с использованием CIP. Полученную дефосфорилированную ДНК плазмиды pSRPDHH и HindIII-EcoRI-ДНК-фрагмент, полученный из pHSG/М1-2-2, лигировали с использованием набора для лигирования ДНК Version 2.0 (Takara Shuzo Co., Ltd.). Затем DH5α E.coli трансформировали лигированной ДНК и высевали на LB-агар. Полученные трансформанты культивировали в жидкой LB-среде, содержащей 100 мкг/мл ампициллина, и плазмидную ДНК экстрагировали из полученной культуры с использованием щелочного ДСН. Инсерция и ориентация нужного ДНК-фрагмента в векторе pSRPDHH были подтверждены секвенированием ДНК с использованием анализатора генных последовательностей.
Полученную экспрессирующую плазмиду, несущую кДНК, кодирующую легкую цепь гуманизированного TRA-8 LМ1-типа, обозначали pSR/LМ1-2.
(4.2) Конструирование экспрессирующего вектора для легкой цепи гуманизированного антитела (LМ3-типа)
Как показано в SEQ ID NO:73 списка последовательностей, гуманизацию другого типа (LМ3-типа) аминокислотных последовательностей легкой цепи мышиного антитела TRA-8 против человеческого DR5, осуществляли путем замены 8-й аминокислоты (гистидина), 9-й аминокислоты (лизина), 10-й аминокислоты (фенилаланина), 11-й аминокислоты (метионина), 13-й аминокислоты (треонина), 20-й аминокислоты (серина), 42-й аминокислоты (глутамина), 43-й аминокислоты (серина), 77-й аминокислоты (аспарагина), 78-й аминокислоты (валина), 80-й аминокислоты (серина), 83-й аминокислоты (лейцина), 85-й аминокислоты (аспарагиновой кислоты), 87-й аминокислоты (фенилаланина), 99-й аминокислоты (глицина), 103-й аминокислоты (лейцина) и 108-й аминокислоты (аланина) у N-конца аминокислотной последовательности легкой цепи TRA-8 пролином, серином, серином, лейцином, аланином, треонином, лизином, аланином, серином, лейцином, пролином, фенилаланином, треонином, тирозином, глутамином, валином и треонином соответственно. Полученная последовательность была обозначена LМ3.
Экспрессирующие плазмиды, несущие указанный тип аминокислотных последовательностей гуманизированной легкой цепи антитела TRA-8 против человеческого DR5 (LМ3-типа, SEQ ID NO:73 в списке последовательностей), конструировали, как описано ниже.
1) Синтез праймеров для получения вариабельных и константных областей легкой цепи гуманизированного TRA-8 LМ3-типа
ДНК, кодирующую полипептидную цепь LМ3 (SEQ ID NO:73 в списке последовательностей), каждая из которых представляет собой гибрид вариабельной области легкой цепи гуманизированного анти-DR5 антитела TRA-8 и константной области легкой цепи человеческого Ig (к-цепь), синтезировали соответствующим образом с использованием комбинации ПЦР.
Помимо 7ALIP (SEQ ID NO:47) и 7ALCN (SEQ ID NO:48) были синтезированы нижеследующие олигонуклеотидные праймеры для ПЦР:
5'- atctagttct cagagatgga gacagacaca atcctgctat gggtgctgct gctctgggtt ccagg -3' (MOD1F1; SEQ ID No. 78);
5'- cagcacccat agcaggattg tgtctgtctc catctctgag aactagatga gaggatgctt cttaagctt -3' (MOD1R1; SEQ ID No. 79);
5'- ctccactggt gacattgtga tgacccaatc tccaagttct ttgtctgcat ctgtggggga cagggtc -3' (MOD1F22; SEQ ID No. 80);
5'- acttggagat tgggtcatca caatgtcacc agtggagcct ggaacccaga gcag-3' (MOD1R22; SEQ ID No. 81);
5'-accatcacct gcaaggccag tcaggatgtg ggtactgctg tagcctggta ccaacasaaa ccaggaa -3' (MOD1F3; SEQ ID No. 82);
5'- tacagcagta cccacatcct gactggcctt gcaggtgatg gtgaccctgt cccccacaga tgcagacaaaga-3' (MOD1R3;SEQ ID No.83);
5'- aagcacccaa actcctcatc tattgggcat ccacccggca cactggggtc ccagataggt ttacaggcag t -3' (MOD1F42; SEQ ID No. 84);
5'- cccagtetgc cgggtggatg cccaatagat gaggagtttg ggtgcttttc ctggtttctg ttggtaccag gc -3' (MOD1R4; SEQ ID No. 85);
5'- gggtctggga cagacttcac cctcaccatc tctagtctgc agccggagga ttttgcaacc tat -3' (MOD1F5; SEQ ID No. 86);
5'- actagagatg gtgagggtga agtctgtccc agacccactg cctgtaaacc tatctgggac -3' (MOD1R52; SEQ ID No. 87);
5'- tactgtcagc aatatagcag ctatcggacg ttoggtcaag ecaccaaegt ggaaatc -3' (MOD1F6; SEQ ID No. 88);
5'- cgtccgatag ctgctatatt gctgacagta ataggttgca aaatcctccg gctgcac -3' (MOD1R6; SEQ ID No. 89);
5'- aaacggactg tggctgcacc atctgtcttc atcttcecgc catctgatga g -3' (MOD1F7; SEQ ID No. 90);
5'- gaagatgaag acagatggtg cagccacagt ccgtttgatt tccaccttgg tgccttgacc gaa -3' (MOD1R7; SEQ ID No. 91); и
5'- agatttcaac tgctcatcag atggcgggaa (LR17; SEQ ID No. 101).
2) Конструирование плазмиды рCR3.1/LМ3-3-44 (клонирующей легкую цепь гуманизированного TRA-8 LМ3-типа)
LМ3-ДНК-фрагмент, кодирующий аминокислотную последовательность, определенную в SEQ ID NO:73 в списке последовательностей, получали путем проведения 2-стадийной ПЦР, встраивали в плазмидный вектор и клонировали в E.coli.
а) Первая стадия ПЦР
LМ3-F31В-ДНК-фрагмент, кодирующий секреторную сигнальную последовательность с сайтом расщепления рестриктирующим ферментом HindIII у 5′-конца, FRL1, CDRL1, FRL2 и CDRL2, FRL3, CDRL3, FRL4 и часть константной области, получали при следующих условиях.
Состав реакционного раствора:
олигонуклеотидый праймер МОD1F1, 5 пмоль,
олигонуклеотидый праймер МОD1R1, 5 пмоль,
олигонуклеотидый праймер МОD1F22, 5 пмоль,
олигонуклеотидый праймер МОD1R22, 5 пмоль,
олигонуклеотидый праймер МОD1F3, 5 пмоль,
олигонуклеотидый праймер МОD1R3, 5 пмоль,
олигонуклеотидый праймер МОD1F42, 5 пмоль,
олигонуклеотидый праймер МОD1R4, 5 пмоль,
олигонуклеотидый праймер МОD1F5, 5 пмоль,
олигонуклеотидый праймер МОD1R52, 5 пмоль,
олигонуклеотидый праймер МОD1F6, 5 пмоль,
олигонуклеотидый праймер МОD1R6, 5 пмоль,
олигонуклеотидый праймер МОD1F7, 50 пмоль,
олигонуклеотидый праймер МОD1R7, 5 пмоль,
олигонуклеотидный праймер 7AL1P, 50 пмоль;
олигонуклеотидный праймер LR17, 50 пмоль;
dNTP-смесь, 5 мкл;
10 х ПЦР-буфер, 5 мкл;
ДНК-полимераза ampliTaq, 2,5 единиц.
Реакционный раствор, имеющий вышеуказанный состав, доводили до конечного объема 50 мкл путем добавления бидистиллированной воды и использовали в ПЦР.
Температурные условия ПЦР: нагревание при 94°С в течение 2 минут, затем 30-кратное повторение цикла нагревания при 94°С в течение 1 минуты, при 55°С в течение 1 минуты и при 72°С в течение 2 минут с последующим нагреванием при 72°С в течение 10 минут.
LМ3-F31С-ДНК-фрагмент, кодирующий часть константной области с добавленным сайтом расщепления рестриктирующего фермента EcoRI у 3'-конца, получали при нижеследующих условиях.
Матричную плазмиду pSRPDHH получали, как описано в Европейской патентной заявке ЕР 0 909 816 А1.
Состав реакционного раствора:
ДНК плазмиды pSRPDHH, 25 нг;
олигонуклеотидный праймер MOD1F7, 50 пмоль;
олигонуклеотидный праймер 7ALCN, 50 пмоль;
dNTP-смесь, 5 мкл;
10 × ПЦР-буфер, 5 мкл;
ДНК-полимераза ampliTaq, 2,5 единиц.
Реакционный раствор, имеющий вышеуказанный состав, доводили до конечного объема 50 мкл путем добавления бидистиллированной воды и использовали в ПЦР.
Температурные условия ПЦР: нагревание при 94°С в течение 2 минут, затем 30-кратное повторение цикла нагревания при 94°С в течение 1 минуты, при 55°С в течение 1 минуты и при 72°С в течение 2 минут с последующим нагреванием при 72°С в течение 10 минут.
После ПЦР амплифицированные ДНК-фрагменты выделяли с помощью электрофореза в 5% полиакриламидном геле. После электрофореза гель окрашивали 1 мкг/мл этидийбромида для детекции продуцированной ДНК при УФ-излучении. Детектированные таким образом соответствующие ДНК-полосы вырезали лезвием бритвы.
b) Вторая стадия ПЦР
LМ3-ДНК, в которой были лигированы вышеописанные LМ3-F31В-ДНК и LМ3-F31С-ДНК-фрагменты, получали при следующих условиях.
Состав ПЦР-реакционного раствора:
Фрагмент геля с LМ3-F31В-ДНК, полученный в первой стадии ПЦР,
Фрагмент геля с LМ3-F31С-ДНК, полученный в первой стадии ПЦР,
олигонуклеотидный праймер 7AL1P, 50 пмоль;
олигонуклеотидный праймер 7ALCN, 50 пмоль;
dNTP-смесь, 5,0 мкл;
10 × ПЦР-буфер, 5,0 мкл;
ДНК-полимераза ampliTaq, 2,5 единиц.
Реакционный раствор, имеющий вышеуказанный состав, доводили до конечного объема 50 мкл путем добавления бидистиллированной воды и использовали в ПЦР.
Температурные условия ПЦР: нагревание при 94°С в течение 2 минут, затем 30-кратное повторение цикла нагревания при 94°С в течение 1 минуты, при 55°С в течение 1 минуты и при 72°С в течение 2 минут с последующим нагреванием при 72°С в течение 10 минут.
Полученный таким образом LМ3-ДНК-фрагмент встраивали в плазмиду рCR3.1DNA с использованием набора для клонирования эукариотического ТА (Invitrogen) в соответствии с инструкциями производителей и вводили в компетентный штамм TOP10F' E.coli, поставляемый с набором. Нуклеотидные последовательности этих ДНК, кодирующих легкую цепь гуманизированного TRA-8 (LМ1-типа), подтверждали дидезокси-методом (Sanger, F.S., et al., (1997), Proc. Natl. Acad. Sci. USA, 74:5463-5467] с использованием ДНК-анализатора 3700 (ABI PRISM; Perkin Elmer Applied Biosystems, Japan).
Полученные плазмиды обозначали рCR3.1/LМ3-3-44 (плазмида, несущая кДНК, кодирующую вариабельную область легкой цепи гуманизированного TRA-8 LМ3-типа и константную область легкой цепи человеческого Ig).
Полученную плазмиду рCR3.1/LМ3-3-44, содержащую LМ3-ДНК-фрагмент, гидролизовали рестриктирующими ферментами HindIII и EcoRI.
Один микрограмм ДНК клонирующей плазмиды рНSG399 гидролизовали рестриктирующими ферментами HindIII и EcoRI, а затем дефосфорилировали с использованием CIP. Полученную таким образом дефосфорилированную рНSG399-плазмидную ДНК и LМ1-ДНК-фрагмент, который был также гидролизован рестриктирующими ферментами HindIII и EcoRI, лигировали с использованием набора для лигирования ДНК Version 2.0 (Takara Shuzo Co., Ltd.). Затем DH5α E.coli трансформировали лигированной ДНК и высевали на LB-агаровую среду, содержащую 0,1 мМ IPTG, 0,1% Х-Gal и 50 мкг/мл хлорамфеникола (конечные концентрации). Полученные белые трансформанты культивировали в жидкой LB-среде, содержащей 50 мкг/мл хлорамфеникола, и плазмидную ДНК экстрагировали из полученной культуры методом с использованием щелочного ДСН. Экстрагированную плазмидную ДНК гидролизовали ферментами HindIII и EcoRI, а затем клон, несущий LM1-ДНК-фрагмент, отбирали при помощи электрофореза на 1% агарозном геле.
С использованием вышеописанной процедуры получали плазмиду pHSG/М3-3-22, несущую гибридный фрагмент вариабельной области легкой цепи гуманизированного LМ1-TRA-8 и константной области цепи человеческого Igκ. Штамм-трансформант E.coli, содержащий эти плазмиды и обозначенный E.coli DH5α/pHSG/М3-3-22, был депонирован 20 апреля 2001 г. в Международном депозитарии патентуемых микроорганизмов, Национальный институт промышленных наук и передовых технологий, 1-1, Higashi 1 chome Tsukuba-shi, Ibaraki-ken, 305-5466, Japan, в соответствии с Будапештским договором о депонировании микроорганизмов, и имеет регистрационный номер FERM BP-7564.
3) Конструирование плазмиды pSR/LМ3-3-44-10 (экспрессирующая плазмида для гуманизированной легкой цепи LМ3-TRA-8)
Полученную плазмиду pHSG/М3-3-22, несущую гибридный фрагмент вариабельной области легкой цепи гуманизированного LМ3-TRA-8 и константной области цепи человеческого Igκ, гидролизовали рестриктирующими ферментами HindIII и EcoRI.
Один микрограмм ДНК клонирующей плазмиды pSRPDHH (Европейская патентная заявка ЕР 0 909816 А1) гидролизовали рестриктирующими ферментами HindIII и EcoRI, а затем дефосфорилировали с использованием CIP. Полученную дефосфорилированную ДНК плазмиды pSRPDHH и HindIII-EcoRI-ДНК-фрагмент, полученный из pHSG/М3-3-22, лигировали с использованием набора для лигирования ДНК Version 2.0 (Takara Shuzo Co., Ltd.). Затем DH5α E.coli трансформировали лигированной ДНК и высевали на LB-агар. Полученные трансформанты культивировали в жидкой LB-среде, содержащей 100 мкг/мл ампициллина, и плазмидную ДНК экстрагировали из полученной культуры методом с использованием щелочного ДСН. Инсерция и ориентация нужного ДНК-фрагмента в векторе pSRPDHH были подтверждены секвенированием ДНК с использованием анализатора генных последовательностей (ABI Prism 3700 DNA Analyzer; Applied Biosystems).
Полученную экспрессирующую плазмиду, несущую кДНК, кодирующую легкую цепь гуманизированного TRA-8 LМ3-типа, обозначали pSR/LМ3-3-44-10.
(4.3) Конструирование экспрессирующего вектора для легкой цепи гуманизированного антитела (LМ4-типа)
Как показано в SEQ ID NO:74 списка последовательностей, гуманизацию другого типа (LМ4-типа) аминокислотных последовательностей легкой цепи мышиного антитела TRA-8 против человеческого DR5 осуществляли путем замены 8-й аминокислоты (гистидина), 9-й аминокислоты (лизина), 10-й аминокислоты (фенилаланина), 11-й аминокислоты (метионина), 13-й аминокислоты (треонина), 20-й аминокислоты (серина), 42-й аминокислоты (глутамина), 43-й аминокислоты (серина), 77-й аминокислоты (аспарагина), 78-й аминокислоты (валина), 80-й аминокислоты (серина), 83-й аминокислоты (лейцина), 85-й аминокислоты (аспарагиновой кислоты), 99-й аминокислоты (глицина), 103-й аминокислоты (лейцина) и 108-й аминокислоты (аланина) у N-конца аминокислотной последовательности легкой цепи TRA-8 пролином, серином, серином, лейцином, аланином, треонином, лизином, аланином, серином, лейцином, пролином, фенилаланином, треонином, глутамином, валином и треонином соответственно. Полученная последовательность была обозначена LМ4.
Экспрессирующие плазмиды, содрежащие указанный тип аминокислотных последовательностей гуманизированной легкой цепи антитела TRA-8 против человеческого DR5 (LМ4-типа, SEQ ID NO: 74 в списке последовательностей), конструировали, как описано ниже.
1) Синтез праймеров для получения вариабельных и константных областей легкой цепи гуманизированного TRA-8 LМ4-типа
ДНК, кодирующую полипептидную цепь LМ4 (SEQ ID NO:74 в списке последовательностей), каждая из которых представляет собой гибрид вариабельной области легкой цепи гуманизированного анти-DR5 антитела TRA-8 и константной области легкой цепи человеческого Ig (к-цепь), синтезировали соответствующим образом с использованием комбинации ПЦР.
Помимо 7ALIP (SEQ ID NO:47) и 7ALCN (SEQ ID NO:48) MOD1F1 (SEQ ID NO:78), MOD1R1 (SEQ ID NO:79), MOD1F22 (SEQ ID NO:80), MOD1R22 (SEQ ID NO:81), MOD1F3 (SEQ ID NO:82), MOD1R3 (SEQ ID NO:83), MOD1F42 (SEQ ID NO:84), MOD1R4 (SEQ ID NO:85), MOD1F5 (SEQ ID NO:86), MOD1R52 (SEQ ID NO:87), MOD1F7 (SEQ ID NO:90), MOD1R7 (SEQ ID NO:91) и LR17 (SEQ ID NO:101), для ПЦР были синтезированы следующие олигонуклеотидные праймеры:
5'-ttctgtcagc aatatagcag ctatcggacg ttctcggtcaag gcaccaaggt ggaaatc-3' (MOD1F62, SEQ ID NO:92),
5'-cgtccgatag ctgctatatt gctgacagaa ataggttgca aaatcctccg gctgcag-3' (MOD1R62, SEQ ID NO:93)
2) Конструирование плазмиды рCR3.1/LМ4-5-3 (клонирующей легкую цепь гуманизированного TRA-8 LМ4-типа)
LМ4-ДНК-фрагмент, кодирующий аминокислотную последовательность, определенную в SEQ ID NO:74 в списке последовательностей, получали путем проведения 2-стадийной ПЦР, встраивали в плазмидный вектор и клонировали в E.coli.
а) Первая стадия ПЦР
LМ4-F41В-ДНК-фрагмент, кодирующий секреторную сигнальную последовательность с сайтом расщепления рестриктирующим ферментом HindIII у 5′-конца, FRL1, CDRL1, FRL2 и CDRL2, FRL3, CDRL3, FRL4 и часть константной области, получали при следующих условиях.
Состав реакционного раствора:
олигонуклеотидый праймер МОD1F1, 5 пмоль,
олигонуклеотидый праймер МОD1R1, 5 пмоль,
олигонуклеотидый праймер МОD1F22, 5 пмоль,
олигонуклеотидый праймер МОD1R22, 5 пмоль,
олигонуклеотидый праймер МОD1F3, 5 пмоль,
олигонуклеотидый праймер МОD1R3, 5 пмоль,
олигонуклеотидый праймер МОD1F42, 5 пмоль,
олигонуклеотидый праймер МОD1R4, 5 пмоль,
олигонуклеотидый праймер МОD1F5, 5 пмоль,
олигонуклеотидый праймер МОD1R52, 5 пмоль,
олигонуклеотидый праймер МОD1F62, 5 пмоль,
олигонуклеотидый праймер МОD1R62, 5 пмоль,
олигонуклеотидый праймер МОD1F7, 50 пмоль,
олигонуклеотидый праймер МОD1R7, 5 пмоль,
олигонуклеотидный праймер 7AL1P, 50 пмоль;
олигонуклеотидный праймер LR17, 50 пмоль;
dNTP-смесь, 5 мкл;
10 х ПЦР-буфер, 5 мкл;
ДНК-полимераза ampliTaq, 2,5 единиц.
Реакционный раствор, имеющий вышеуказанный состав, доводили до конечного объема 50 мкл путем добавления бидистиллированной воды и использовали в ПЦР.
Температурные условия ПЦР: нагревание при 94°С в течение 2 минут, затем 30-кратное повторение цикла нагревания при 94°С в течение 1 минуты, при 55°С в течение 1 минуты и при 72°С в течение 2 минут с последующим нагреванием при 72°С в течение 10 минут.
LМ4-F41С-ДНК-фрагмент, кодирующий часть константной области с добавленным сайтом расщепления рестриктирующего фермента EcoRI у 3'-конца получали при нижеследующих условиях.
Матричную плазмиду pSRPDHH получали, как описано в Европейской патентной заявке ЕР 0 909 816 А1.
Состав реакционного раствора:
ДНК плазмиды pSRPDHH, 25 нг;
олигонуклеотидный праймер MOD1F7, 50 пмоль;
олигонуклеотидный праймер 7ALCN, 50 пмоль;
dNTP-смесь, 5 мкл;
10 х ПЦР-буфер, 5 мкл;
ДНК-полимераза ampliTaq, 2,5 единиц.
Реакционный раствор, имеющий вышеуказанный состав, доводили до конечного объема 50 мкл путем добавления бидистиллированной воды и использовали в ПЦР.
Температурные условия ПЦР: осуществляли нагревание при 94°С в течение 2 минут, после чего 30 раз повторяли цикл нагревания при 94°С в течение 1 минуты, при 55°С в течение 1 минуты и при 72°С в течение 2 минут, а затем нагревали при 72°С в течение 10 минут.
После ПЦР амплифицированные ДНК-фрагменты выделяли с помощью электрофореза в 5% полиакриламидном геле. После электрофореза гель окрашивали 1 мкг/мл этидийбромида для детекции продуцированной ДНК при УФ-излучении. Детектированные таким образом соответствующие ДНК-полосы вырезали лезвием бритвы.
b) Вторая стадия ПЦР
LМ4-ДНК, в которой были лигированы вышеописанные LМ4- F41В-ДНК и LМ4-F41С-ДНК-фрагменты, получали при следующих условиях.
Состав ПЦР-реакционного раствора:
Фрагмент геля с LМ4-F41В-ДНК, полученный в первой стадии ПЦР,
Фрагмент геля с LМ4-F41С-ДНК, полученный в первой стадии ПЦР,
олигонуклеотидный праймер 7AL1P, 50 пмоль;
олигонуклеотидный праймер 7ALCN, 50 пмоль;
dNTP-смесь, 5,0 мкл;
10 × ПЦР-буфер, 5,0 мкл;
ДНК-полимераза ampliTaq, 2,5 единиц.
Реакционный раствор, имеющий вышеуказанный состав, доводили до конечного объема 50 мкл путем добавления бидистиллированной воды и использовали в ПЦР.
Температурные условия ПЦР: нагревание при 94°С в течение 2 минут, затем 30-кратное повторение цикла нагревания при 94°С в течение 1 минуты, при 55°С в течение 1 минуты и при 72°С в течение 2 минут с последующим нагреванием при 72°С в течение 10 минут.
Полученный таким образом LМ4-ДНК-фрагмент встраивали в плазмиду рCR3.1DNA с использованием набора для клонирования эукариотического ТА (Invitrogen) в соответствии с инструкциями производителей и вводили в компетентный штамм TOP10F' E.coli, поставляемый с набором. Нуклеотидные последовательности этих ДНК, кодирующих легкую цепь гуманизированного TRA-8 LМ4-типа, подтверждали дидезокси-методом (Sanger, F.S., et al., (1997), Proc. Natl. Acad. Sci. USA, 74:5463-5467) с использованием ДНК-анализатора 3700 (ABI PRISM; Perkin Elmer Applied Biosystems, Japan).
Полученные плазмиды обозначали рCR3.1/LМ4-5-3 (плазмида, несущая кДНК, кодирующую вариабельную область легкой цепи гуманизированного TRA-8 LМ4-типа и константную область легкой цепи человеческого Ig).
Полученную плазмиду рCR3.1/LМ4-5-3, содержащую LМ4-ДНК-фрагмент, гидролизовали рестриктирующими ферментами HindIII и EcoRI.
Один микрограмм ДНК клонирующей плазмиды рНSG399 гидролизовали рестриктирующими ферментами HindIII и EcoRI, а затем дефосфорилировали с использованием CIP. Полученную таким образом дефосфорилированную рНSG399-плазмидную ДНК и LМ4-ДНК-фрагмент, который был также гидролизован рестриктирующими ферментами HindIII и EcoRI, лигировали с использованием набора для лигирования ДНК Version 2.0 (Takara Shuzo Co., Ltd.). Затем DH5α E.coli трансформировали лигированной ДНК и высевали на LB-агаровую среду, содержащую 0,1 мМ IPTG, 0,1% Х-Gal и 50 мкг/мл хлорамфеникола (конечные концентрации). Полученные белые трансформанты культивировали в жидкой LB-среде, содержащей 50 мкг/мл хлорамфеникола, и плазмидную ДНК экстрагировали из полученной культуры методом с использованием щелочного ДСН. Экстрагированную плазмидную ДНК гидролизовали ферментами HindIII и EcoRI, а затем клон, несущий LM4-ДНК-фрагмент, отбирали при помощи электрофореза на 1% агарозном геле.
С использованием вышеописанной процедуры получали плазмиду pHSG/М4-5-3-1, несущую гибридный фрагмент вариабельной области легкой цепи гуманизированного LМ4-TRA-8 и константной области цепи человеческого Igκ. Штамм-трансформант E.coli, содержащий эти плазмиды и обозначенный E.coli DH5α/pHSG/М4-5-3-1, был депонирован 20 апреля 2001 г в Международном депозитарии патентуемых микроорганизмов, Национальный институт промышленных наук и передовых технологий, 1-1, Higashi 1 chome Tsukuba-shi, Ibaraki-ken, 305-5466, Japan, в соответствии с Будапештским договором о депонировании микроорганизмов, и имеет регистрационный номер FERM BP-7565.
3) Конструирование плазмиды pSR/LМ4-5-3-3 (экспрессирующая плазмида для гуманизированной легкой цепи LМ4-TRA-8)
Полученную плазмиду pHSG/М4-5-3-1, несущую гибридный фрагмент вариабельной области легкой цепи гуманизированного LМ4-TRA-8 и константной области цепи человеческого Igκ, гидролизовали рестриктирующими ферментами HindIII и EcoRI.
Один микрограмм ДНК клонирующей плазмиды pSRPDHH (Европейская патентная заявка ЕР 0 909816 А1) гидролизовали рестриктирующими ферментами HindIII и EcoRI, а затем дефосфорилировали с использованием CIP. Полученную дефосфорилированную ДНК плазмиды pSRPDHH и HindIII-EcoRI-ДНК-фрагмент, полученный из pHSG/М4-5-3-1, лигировали с использованием набора для лигирования ДНК Version 2.0 (Takara Shuzo Co., Ltd.). Затем DH5α E.coli трансформировали лигированной ДНК и высевали на LB-агар. Полученные трансформанты культивировали в жидкой LB-среде, содержащей 100 мкг/мл ампициллина, и плазмидную ДНК экстрагировали из полученной культуры методом с использованием щелочного ДСН. Инсерция и ориентация нужного ДНК-фрагмента в векторе pSRPDHH были подтверждены секвенированием ДНК с использованием анализатора генных последовательностей (ABI Prism 3700 DNA Analyzer; Applied Biosystems).
Полученную экспрессирующую плазмиду, несущую кДНК, кодирующую легкую цепь гуманизированного TRA-8 LМ4-типа, обозначали pSR/LМ3-5-3-3.
(4.4) Конструирование экспрессирующего вектора для легкой цепи гуманизированного антитела (LМ5-типа)
Как показано в SEQ ID NO:76 списка последовательностей, гуманизацию другого типа (LМ5-типа) аминокислотных последовательностей легкой цепи мышиного антитела TRA-8 против человеческого DR5 осуществляли путем замены 8-й аминокислоты (гистидина), 9-й аминокислоты (лизина), 10-й аминокислоты (фенилаланина), 11-й аминокислоты (метионина), 13-й аминокислоты (треонина), 20-й аминокислоты (серина), 42-й аминокислоты (глутамина), 43-й аминокислоты (серина), 77-й аминокислоты (аспарагина), 78-й аминокислоты (валина), 80-й аминокислоты (серина), 83-й аминокислоты (лейцина), 103-й аминокислоты (лейцина) и 108-й аминокислоты (аланина) у N-конца аминокислотной последовательности легкой цепи TRA-8 пролином, серином, серином, лейцином, аланином, треонином, лизином, аланином, серином, лейцином, пролином, фенилаланином, валином и треонином соответственно. Полученная последовательность была обозначена LМ5.
Экспрессирующие плазмиды, несущие указанный тип аминокислотных последовательностей гуманизированной легкой цепи антитела TRA-8 против человеческого DR5 (LМ5-типа, SEQ ID NO:75 в списке последовательностей), конструировали, как описано ниже.
1) Синтез праймеров для получения вариабельных и константных областей легкой цепи гуманизированного TRA-8 LМ5-типа
ДНК, кодирующую полипептидную цепь LМ5 (SEQ ID NO:75 в списке последовательностей), каждая из которых представляет собой гибрид вариабельной области легкой цепи гуманизированного анти-DR5 антитела TRA-8 и константной области легкой цепи человеческого Ig (к-цепь), синтезировали соответствующим образом с использованием комбинации ПЦР.
Помимо 7ALIP (SEQ ID NO:47) и 7ALCN (SEQ ID NO:48) MOD1F1 (SEQ ID NO:78), MOD1R1 (SEQ ID NO:79), MOD1F22 (SEQ ID NO:80), MOD1R22 (SEQ ID NO:81), MOD1F3 (SEQ ID NO:82), MOD1R3 (SEQ ID NO:83), MOD1F42 (SEQ ID NO:84), MOD1R4 (SEQ ID NO:85), MOD1F5 (SEQ ID NO:86), MOD1R52 (SEQ ID NO:87), MOD1F7 (SEQ ID NO:90), и LR17 (SEQ ID NO:101), для ПЦР были синтезированы следующие олигонуклеотидные праймеры:
5'- gggtctggga cagacttcac cctcaccatc tctagtctgc agccggagga ttttgcagat tat -3' (MOD1F52; SEQ ID No. 94);
5'- ttctgfcagc aatatagcag ctatcggacg ttcggtggag gcaccaaggt ggaaatc -3' (MOD1F63; SEQ ID No. 95);
5'- cgtccgatag ctgctatatt gctgacagaa ataatctgca aaatcctccg gctgcag -3' (MOD1R63; SEQ ID No. 96);
5'- gaagatgaag acagatsgtg cagccacagt ccgtttgatt tecaccttgg tgcctccacc gaa-3' (MOD1R72; SEQ ID No. 102)
2) Конструирование плазмиды рCR3.1/LМ5-3-42 (клонирующей легкую цепь гуманизированного TRA-8 LМ5-типа)
LМ5-ДНК-фрагмент, кодирующий аминокислотную последовательность, определенную в SEQ ID NO:74 в списке последовательностей, получали путем проведения 2-стадийной ПЦР, встраивали в плазмидный вектор и клонировали в E.coli.
а) Первая стадия ПЦР
LМ5-F51В-ДНК-фрагмент, кодирующий область секреторной сигнальной последовательностм с сайтом рестриктирующего фермента HindIII у 5′-конца, FRL1, CDRL1, FRL2, CDRL2, FRL3, CDRL3, FRL4 и часть константной области, получали при следующих условиях.
Состав реакционного раствора:
олигонуклеотидый праймер МОD1F1, 5 пмоль,
олигонуклеотидый праймер МОD1R1, 5 пмоль, олигонуклеотидый праймер МОD1F22, 5 пмоль,
олигонуклеотидый праймер МОD1R22, 5 пмоль,
олигонуклеотидый праймер МОD1F3, 5 пмоль,
олигонуклеотидый праймер МОD1R3, 5 пмоль,
олигонуклеотидый праймер МОD1F42, 5 пмоль,
олигонуклеотидый праймер МОD1R4, 5 пмоль,
олигонуклеотидый праймер МОD1F52, 5 пмоль,
олигонуклеотидый праймер МОD1R52, 5 пмоль,
олигонуклеотидый праймер МОD1F63, 5 пмоль,
олигонуклеотидый праймер МОD1R63, 5 пмоль,
олигонуклеотидый праймер МОD1F7, 50 пмоль,
олигонуклеотидый праймер МОD1R72, 5 пмоль,
олигонуклеотидный праймер 7AL1P, 50 пмоль;
олигонуклеотидный праймер LR17, 50 пмоль;
dNTP-смесь, 5 мкл;
10 × ПЦР-буфер, 5 мкл;
ДНК-полимераза ampliTaq, 2,5 единиц.
Реакционный раствор, имеющий вышеуказанный состав, доводили до конечного объема 50 мкл путем добавления бидистиллированной воды и использовали в ПЦР.
Температурные условия ПЦР: нагревание при 94°С в течение 2 минут, затем 30-кратное повторение цикла нагревания при 94°С в течение 1 минуты, при 55°С в течение 1 минуты и при 72°С в течение 2 минут с последующим нагреванием при 72°С в течение 10 минут.
LМ5-F51С-ДНК-фрагмент, кодирующий часть константной области с добавленным сайтом рестриктирующего фермента EcoRI у 3'-конца получали при нижеследующих условиях. Матричную плазмиду pSRPDHH получали как описано в Европейской патентной заявке ЕР 0 909 816 А1.
Состав реакционного раствора:
ДНК плазмиды pSRPDHH, 25 нг;
олигонуклеотидный праймер MOD1F7, 50 пмоль;
олигонуклеотидный праймер 7ALCN, 50 пмоль;
dNTP-смесь, 5 мкл;
10 × ПЦР-буфер, 5 мкл;
ДНК-полимераза ampliTaq, 2,5 единиц.
Реакционный раствор, имеющий вышеуказанный состав, доводили до конечного объема 50 мкл путем добавления бидистиллированной воды и использовали в ПЦР.
Температурные условия ПЦР: нагревание при 94°С в течение 2 минут, затем 30-кратное повторение цикла нагревания при 94°С в течение 1 минуты, при 55°С в течение 1 минуты и при 72°С в течение 2 минут с последующим нагреванием при 72°С в течение 10 минут.
После ПЦР амплифицированные ДНК-фрагменты выделяли с помощью электрофореза в 5% полиакриламидном геле. После электрофореза гель окрашивали 1 мкг/мл этидийбромида для детекции продуцированной ДНК при УФ-излучении. Детектированные таким образом соответствующие ДНК-полосы вырезали лезвием бритвы.
b) Вторая стадия ПЦР
LМ5-ДНК, в которой были лигированы вышеописанные LМ5- F51В-ДНК и LМ5-F51С-ДНК-фрагменты, получали при следующих условиях.
Состав ПЦР-реакционного раствора:
Фрагмент геля с LМ5-F51В-ДНК, полученный в первой стадии ПЦР,
Фрагмент геля с LМ5-F51С-ДНК, полученный в первой стадии ПЦР,
олигонуклеотидный праймер 7AL1P, 50 пмоль;
олигонуклеотидный праймер 7ALCN, 50 пмоль;
dNTP-смесь, 5,0 мкл;
10 × ПЦР-буфер, 5,0 мкл;
ДНК-полимераза ampliTaq, 2,5 единиц.
Реакционный раствор, имеющий вышеуказанный состав, доводили до конечного объема 50 мкл путем добавления бидистиллированной воды и использовали в ПЦР.
Температурные условия ПЦР: нагревание при 94°С в течение 2 минут, затем 30-кратное повторение цикла нагревания при 94°С в течение 1 минуты, при 55°С в течение 1 минуты и при 72°С в течение 2 минут с последующим нагреванием при 72°С в течение 10 минут.
Полученный таким образом LМ5-ДНК-фрагмент встраивали в плазмиду рCR3.1DNA с использованием набора для клонирования эукариотического ТА (Invitrogen) в соответствии с инструкциями производителей и вводили в компетентный штамм TOP10F' E.coli, поставляемый с набором. Нуклеотидные последовательности этих ДНК, кодирующих легкую цепь гуманизированного TRA-8 LМ5-типа, подтверждали дидезокси-методом (Sanger, F.S., et al., (1997), Proc. Natl. Acad. Sci. USA, 74:5463-5467) с использованием ДНК-анализатора 3700 (ABI PRISM; Perkin Elmer Applied Biosystems, Japan).
Полученные плазмиды обозначали рCR3.1/LМ5-3-42 (плазмида, несущая кДНК, кодирующую вариабельную область легкой цепи гуманизированного TRA-8 LМ5-типа и константную область легкой цепи человеческого Ig).
Полученную плазмиду рCR3.1/LМ5-3-42, содержащую LМ5-ДНК-фрагмент, гидролизовали рестриктирующими ферментами HindIII и EcoRI.
Один микрограмм ДНК клонирующей плазмиды рНSG399 гидролизовали рестриктирующими ферментами HindIII и EcoRI, а затем дефосфорилировали с использованием CIP. Полученную таким образом дефосфорилированную рНSG399-плазмидную ДНК и LМ5-ДНК-фрагмент, который был также гидролизован рестриктирующими ферментами HindIII и EcoRI, лигировали с использованием набора для лигирования ДНК Version 2.0 (Takara Shuzo Co., Ltd.). Затем DH5α E.coli трансформировали лигированной ДНК и высевали на LB-агаровую среду, содержащую 0,1 мМ IPTG, 0,1% Х-Gal и 50 мкг/мл хлорамфеникола (конечные концентрации). Полученные белые трансформанты культивировали в жидкой LB-среде, содержащей 50 мкг/мл хлорамфеникола, и плазмидную ДНК экстрагировали из полученной культуры методом с использованием щелочного ДСН. Экстрагированную плазмидную ДНК гидролизовали ферментами HindIII и EcoRI, а затем клон, несущий LM5-ДНК-фрагмент, отбирали при помощи электрофореза на 1% агарозном геле.
С использованием вышеописанной процедуры получали плазмиду pHSG/М5-3-27, несущую гибридный фрагмент вариабельной области легкой цепи гуманизированного LМ5-TRA-8 и константной области цепи человеческого Igκ.
3) Конструирование плазмиды pSR/LМ5-3-27-1 (экспрессирующей плазмида для гуманизированной легкой цепи LМ5-TRA-8)
Полученную плазмиду pHSG/М5-3-27, несущую гибридный фрагмент вариабельной области легкой цепи гуманизированного LМ5-TRA-8 и константной области цепи человеческого Igκ, гидролизовали рестриктирующими ферментами HindIII и EcoRI.
Один микрограмм ДНК клонирующей плазмиды pSRPDHH (Европейская патентная заявка ЕР 0 909816 А1) гидролизовали рестриктирующими ферментами HindIII и EcoRI, а затем дефосфорилировали с использованием CIP. Полученную дефосфорилированную ДНК плазмиды pSRPDHH и HindIII-EcoRI-ДНК-фрагмент, полученный из pHSG/М5-3-27, лигировали с использованием набора для лигирования ДНК Version 2.0 (Takara Shuzo Co., Ltd.). Затем DH5α E.coli трансформировали лигированной ДНК и высевали на LB-агар. Полученные трансформанты культивировали в жидкой LB-среде, содержащей 100 мкг/мл ампициллина, и плазмидную ДНК экстрагировали из полученной культуры с использованием щелочного ДСН. Инсерция и ориентация нужного ДНК-фрагмента в векторе pSRPDHH были подтверждены секвенированием ДНК с использованием анализатора генных последовательностей (ABI Prism 3700 DNA Analyzer; Applied Biosystems).
Полученную экспрессирующую плазмиду, несущую кДНК, кодирующую легкую цепь гуманизированного TRA-8 LМ5-типа, обозначали pSR/LМ5-3-27-1.
(4.5) Конструирование экспрессирующего вектора для легкой цепи гуманизированного антитела (химерного типа)
Последовательность, показанную в SEQ ID NO:76 списка последовательностей, т.е. аминокислотную последовательность легкой цепи TRA-8 химерного типа обозначали LМ6.
Экспрессирующие плазмиды, несущие указанный тип аминокислотных последовательностей гуманизированной легкой цепи антитела TRA-8 против человеческого DR5 (LМ6-типа) (SEQ ID NO:75 в списке последовательностей), конструировали, как описано ниже.
1) Синтез праймеров для получения вариабельных и константных областей легкой цепи гуманизированного TRA-8 LМ6-типа
ДНК, кодирующую полипептидную цепь LМ6 (SEQ ID NO:75 в списке последовательностей), каждая из которых представляет собой гибрид вариабельной области легкой цепи мышиного анти-DR5 антитела TRA-8 (LМ6-типа) и константной области легкой цепи человеческого Ig (к-цепи), синтезировали соответствующим образом с использованием комбинаций ПЦР.
Помимо 7ALIP (SEQ ID NO:47) и 7ALCN (SEQ ID NO:48) были синтезированы следующие олигонуклеотидные праймеры для ПЦР:
5'- tgatgtggac atgaatttgt gagactgggt catcacaatg tcaccagtgg a -3' (HKSPR13; SEQ ID No. 97);
5'- tgggttccag gctocactgg tgacattgtg atgacccagt cteacaaatt с -3' (MVF11; SEQ ID No. 98);
5'- aagacagatg gtgcagccac agcccgtttg atttccagct tggtgcctc -3' (MVR11; SEQ ID No. 99); и
5'- aagctggaaa tcaaacgggc tgtggctgca ccatctgtct tcatc -3' (MCF11; SEQ ID No. 100).
2) Конструирование плазмиды рCR3.1/LМ6-1-16 (клонирующей легкую цепь гуманизированного TRA-8 LМ6-типа)
LМ6-ДНК-фрагмент, кодирующий аминокислотную последовательность, определенную в SEQ ID NO:75 в списке последовательностей, получали путем проведения 2-стадийной ПЦР, встраивали в плазмидный вектор и клонировали в E.coli.
а) Первая стадия ПЦР
LМ6-F1-ДНК-фрагмент, кодирующий секреторную сигнальную последовательность и часть FRL1 с добавленным сайтом рестриктирующго фермента HindIII у 5′-конца получали при нижеследующих условиях. Матричные плазмиды pHSGHM17 и pSRPDHH получали, как описано в Европейской патентной заявке ЕР 0909816 А1.
Состав реакционного раствора:
ДНК плазмиды pHSGHM17, 25 нг;
олигонуклеотидный праймер 7AL1P, 50 пмоль;
олигонуклеотидный праймер HKSPR13, 50 пмоль;
dNTP-смесь, 5 мкл;
10 × ПЦР-буфер, 5 мкл;
ДНК-полимераза ampliTaq (PerkinElmer), 2,5 единиц.
Реакционный раствор, имеющий вышеуказанный состав, доводили до конечного объема 50 мкл путем добавления бидистиллированной воды и использовали в ПЦР.
Температурные условия ПЦР: нагревание при 94°С в течение 2 мин, затем 30-кратное повторение цикла нагревания при 94°С в течение 1 мин, при 55°С в течение 1 мин и при 72°С в течение 2 минут с последующим нагреванием при 72°С в течение 10 минут.
LМ6-F2-ДНК-фрагмент, кодирующий часть FRL1, CDRL1, FRL2 и CDRL2, FRL3, CDRL3, FRL4 и часть константной области получали при нижеследующих условиях.
Состав реакционного раствора:
ДНК плазмиды рL28, 25 нг;
олигонуклеотидный праймер MVF11, 50 пмоль;
олигонуклеотидный праймер MVR12, 50 пмоль;
dNTP-смесь, 5 мкл;
10 × ПЦР-буфер, 5 мкл;
ДНК-полимераза ampliTaq, 2,5 единиц.
Реакционный раствор, имеющий вышеуказанный состав, доводили до конечного объема 50 мкл путем добавления бидистиллированной воды и использовали в ПЦР.
Температурные условия ПЦР: нагревание при 94°С в течение 2 мин, затем 30-кратное повторение цикла нагревания при 94°С в течение 1 мин, при 55°С в течение 1 мин и при 72°С в течение 2 минут с последующим нагреванием при 72°С в течение 10 минут.
LМ6-F3-ДНК-фрагмент, кодирующий часть FRL4 и константную область с добавленным сайтом рестриктирующего фермента EcoRI у 3'-конца, получали при нижеследующих условиях.
Состав реакционного раствора:
ДНК плазмиды pSRPDHH, 25 нг;
олигонуклеотидный праймер MСF11, 50 пмоль;
олигонуклеотидный праймер 7ALCN, 50 пмоль;
dNTP-смесь, 5 мкл;
10 × ПЦР-буфер, 5 мкл;
ДНК-полимераза ampliTaq, 2,5 единиц.
Реакционный раствор, имеющий вышеуказанный состав, доводили до конечного объема 50 мкл путем добавления бидистиллированной воды и использовали в ПЦР.
Температурные условия ПЦР: нагревание при 94°С в течение 2 мин, затем 30-кратное повторение цикла нагревания при 94°С в течение 1 мин, при 55°С в течение 1 мин и при 72°С в течение 2 минут с последующим нагреванием при 72°С в течение 10 минут.
После ПЦР, амплифицированные ДНК-фрагменты, выделяли с помощью электрофореза в 5% полиакриламидном геле. После электрофореза гель окрашивали 1 мкг/мл этидийбромида для детекции продуцированной ДНК при УФ-излучении. Детектированные таким образом, соответствующие ДНК-полосы вырезали лезвием бритвы.
b) Вторая стадия ПЦР
LМ6-ДНК, в которой были лигированы вышеописанные LМ6-F1-ДНК, LМ6-F2-ДНК и LМ6-F3-ДНК-фрагменты получали при следующих условиях.
Состав ПЦР-реакционного раствора:
фрагмент геля с LМ6-F1-ДНК, полученный в первой стадии ПЦР,
фрагмент геля с LМ6-F2-ДНК, полученный в первой стадии ПЦР,
фрагмент геля с LМ6-F3-ДНК, полученный в первой стадии ПЦР,
олигонуклеотидный праймер 7AL1P, 50 пмоль;
олигонуклеотидный праймер 7ALCN, 50 пмоль;
dNTP-смесь, 5,0 мкл;
10 × ПЦР-буфер, 5,0 мкл;
ДНК-полимераза ampliTaq, 2,5 единиц.
Реакционный раствор, имеющий вышеуказанный состав, доводили до конечного объема 50 мкл путем добавления бидистиллированной воды и использовали в ПЦР.
Температурные условия ПЦР: нагревание при 94°С в течение 2 мин, затем 30-кратное повторение цикла нагревания при 94°С в течение 1 минуты, при 55°С в течение 1 минуты и при 72°С в течение 2 минут с последующим нагреванием при 72°С в течение 10 минут.
Полученный таким образом LМ6-ДНК-фрагмент встраивали в плазмиду рCR3.1DNA с использованием набора для клонирования эукариотического ТА (Invitrogen) в соответствии с инструкциями производителей и вводили в компетентный штамм TOP10F' E.coli, поставляемый с набором. Нуклеотидные последовательности этих ДНК, кодирующих легкую цепь гуманизированного TRA-8, подтверждали дидезокси-методом с использованием ДНК-анализатора.
Полученные плазмиды обозначали рCR3.1/LМ6-1-16 (плазмида, несущая кДНК, кодирующую вариабельную область легкой цепи мышиного TRA-8 и константную область легкой цепи человеческого Ig).
Полученную плазмиду рCR3.1/LМ6-1-16, содержащую LМ6-ДНК-фрагмент, гидролизовали рестриктирующими ферментами HindIII и EcoRI.
Один микрограмм ДНК клонирующей плазмиды рНSG399 гидролизовали рестриктирующими ферментами HindIII и EcoRI, а затем дефосфорилировали с использованием CIP. Полученную таким образом дефосфорилированную рНSG399-плазмидную ДНК и LМ6-ДНК-фрагмент, который был также гидролизован рестриктирующими ферментами HindIII и EcoRI, лигировали с использованием набора для лигирования ДНК Version 2.0 (Takara Shuzo Co., Ltd.). Затем DH5α E.coli трансформировали лигированной ДНК и высевали на LB-агаровую среду, содержащую 0,1 мМ IPTG, 0,1% Х-Gal и 50 мкг/мл хлорамфеникола (конечные концентрации). Полученные белые трансформанты культивировали в жидкой LB-среде, содержащей 50 мкг/мл хлорамфеникола, и плазмидную ДНК экстрагировали из полученной культуры методом с использованием щелочного ДСН. Экстрагированную плазмидную ДНК гидролизовали ферментами HindIII и EcoRI, а затем клон, несущий LM5-ДНК-фрагмент, отбирали при помощи электрофореза на 1% агарозном геле.
С использованием вышеописанной процедуры получали плазмиду pHSG/М6-1-4-1, несущую гибридный фрагмент вариабельной области легкой цепи мышиного TRA-8 и константной области цепи человеческого Igκ. Штамм-трансформант E.coli, содержащий эти плазмиды и обозначенный E.coli DH5α/pHSG/М6-1-4-1, был депонирован 20 апреля 2001 г в Международном депозитарии патентуемых микроорганизмов, Национальный институт промышленных наук и передовых технологий, 1-1, Higashi 1 chome Tsukuba-shi, Ibaraki-ken, 305-5466, Japan, в соответствии с Будапештским договором о депонировании микроорганизмов, и имеет регистрационный номер FERM BP-7566.
3) Конструирование плазмиды pSR/LМ6-1-4-6 (экспрессирующая плазмида для легкой цепи LМ6-TRA-8 химерного типа)
Полученную плазмиду pHSG/М6-1-4-1, несущую гибридный фрагмент вариабельной области легкой цепи мышиного TRA-8 и константной области цепи человеческого Igκ, гидролизовали рестриктирующими ферментами HindIII и EcoRI.
Один микрограмм ДНК клонирующей плазмиды pSRPDHH гидролизовали рестриктирующими ферментами HindIII и EcoRI, а затем дефосфорилировали с использованием CIP. Полученную дефосфорилированную ДНК плазмиды pSRPDHH и HindIII-EcoRI-ДНК-фрагмент, полученный из pHSG/М6-1-4-1, лигировали с использованием набора для лигирования ДНК Version 2.0 (Takara Shuzo Co., Ltd.). Затем DH5α E.coli трансформировали лигированной ДНК и высевали на LB-агар. Полученные трансформанты культивировали в жидкой LB-среде, содержащей 100 мкг/мл ампициллина, и плазмидную ДНК экстрагировали из полученной культуры с использованием щелочного ДСН. Инсерция и ориентация нужного ДНК-фрагмента в указанном векторе были подтверждены секвенированием ДНК с использованием анализатора генных последовательностей.
Полученную экспрессирующую плазмиду, несущую кДНК, кодирующую легкую цепь TRA-8 химерного типа, обозначали pSR/LМ6-1-4-6.
(5) Продуцирование гуманизированного или химерного антитела TRA-8 нескольких типов
Трансфекцию клеток COS-7 осуществляли методами с использованием трансфицирующего реагента FUGENE6 (Boehringer Mannhiem Biochemica) в соответствии с инструкциями, прилагаемыми к данному набору.
Клетки COS-7 (Американская коллекция типовых культур № CRL-1651) культивировали до полуконфлюентности (3 × 106 клеток на чашку) в культуральной чашке (площадь культуры: 57 см3; Sumitomo Bakelite, K.K.), содержащей модифицированную по способу Дульбекко среду Игла (обозначаемую далее "DMEM"; Gibco BRL), в которую была добавлена 10% фетальная телячья сыворотка (обозначаемая далее "FCS"; Moregate).
Одновременно 10 мкг/чашку (всего 5 чашек) ДНК тяжелой цепи гуманизированного DR5 в экспрессирующей плазмиде (рНА15-1) и 10 мкг/чашку ДНК легкой цепи гуманизированного DR5 в экспрессирующей плазмиде, полученных с использованием щелочного ДСН и центрифугированием в градиенте плотности хлорида цезия, смешивали, а затем осаждали этанолом и суспендировали в 5 мкл/чашку dH2O.
После смешивания 15 мкл/чашку трансфицирующего реагента FUGENE6 с 180 мкл/чашку D-MEM без FCS этот раствор FUGENE6 (185 мкл/чашку) смешивали с 5 мкл/чашку ДНК-раствора, содержащего 10 мкг/чашку ДНК тяжелой цепи гуманизированного DR5 в экспрессирующей плазмиде и 10 мкг/чашку ДНК легкой цепи гуманизированного DR5 в экспрессирующей плазмиде. После инкубирования в течение 15 минут при комнатной температуре полученную плазмидную суспензию (200 мкл) добавляли в предварительно приготовленные планшеты с COS-7. После инкубирования в 5% CO2 при 37оС в течение 24 часов культуральную среду заменяли средой D-MEM без FCS. После инкубирования в 5% CO2 при 37оС в течение 72 часов, супернатант культуры выделяли для очистки продуктов экспрессии в надосадочных жидкостях. Методом, описанным выше, клетки COS-7 трансфицировали каждой из нижеследующих плазмидных комбинаций:
(А) котрансфекция рHА15-1 и pSR/LM1-2 (H1L1)
(В) котрансфекция рHВ14-1 и pSR/M2-1 (H2L2).
(С) котрансфекция рHB14-1 и pSR/LM3-3-44-10 (H2L3).
(D) котрансфекция рHB14-1 и pSR/LM4-5-3-3 (H2L4).
(E) котрансфекция рHB10-3 и pSR/M2-1 (H3L2).
(F) котрансфекция рHC10-3 и pSR/LM3-3-44-10 (H3L3).
(G) котрансфекция рHC10-3 и pSR/LM4-5-3-3 (H3L4).
(H) котрансфекция рHD21-1 и pSR/LM5-3-27-1 (H4L5).
(I) котрансфекция рM11-1 и pSR/LM6-1-4-6 (химера).
Затем культуру центрифугировали (3500 об/мин, 15 минут) и супернатант собирали. Супернатант фильтровали через 0,45 мкм-фильтр (ADVANTEC TOYO DISMIC-25cs, cat.# 25CS045 AS). Выделение IgG из фильтратов осуществляли аффинной хроматографией с белком G-POROS (Applied Biosystems) при следующих условиях:
ВЭЖХ-система: BioCAD 700E (Applied Biosystems)
колонка: сенсорная кассета с белком G-ID (размер колонки: 2,1 мм ID x 30 мм LD, объем слоя 0,1 мл; Applied Biosystems)
элюирующий буфер: 0,1 М глицин-HCl (рН 2,5);
нейтрализующий буфер: 1 М Трис-HCI (pH 8,5);
детекция: 280 нм
скорость потока: 1 мл/мин
размер фракции: 0,5 мл/0,5 мин
пробирка для фракций: полипропиленовая 1,5 мл-микропробирка
температура: 4°С.
После нанесения всех фильтратов на колонку для промывки колонки использовали 30 мл PBS (Sigma, Cat.# 1003-3). После нанесения элюирующего буфера начинали сбор фракций. Каждая микропробирка для фракционирования содержала 55 мкл 1М NaCl, 110 мкл нейтрализующего буфера и 74 мкл 2 мг/мл альбумина бычьей сыворотки (Sigma, Cat.# А-7030) в PBS. Фракции №7-№8 собирали.
Подтверждение экспрессии гуманизированных антител и количественный анализ полученных продуктов экспрессии в надосадочных жидкостях культуры осуществляли с помощью ELISA с использованием антитела против IgG человека.
В каждую лунку 96-луночного планшета (MaxiSorp, Nunc) добавляли 100 мкл козьего Fc-специфического поликлонального антитела против IgG (Kappel), растворенного в конечной концентрации 0,5 мкг/мл в буфере для адсорбции (0,05М бикарбонат натрия, 0,02% азида натрия, рН 9,6), и планшет инкубировали при 37°С в течение 2 часов для стимуляции адсорбции антитела. Затем планшет пять раз промывали 350 мкл PBS-Т. После промывки к лункам добавляли супернатант культуры, разведенный средой DMEM, содержащей 10% FCS, и инкубировали при 37°С в течение 2 часов. После повторной промывки PBS-T в каждую лунку добавляли 100 мкл меченного щелочной фосфатазой Fc-специфического козьего поликлонального антитела против человеческого IgG (Jackson Immuno Research Lab), 10000-кратно разведенного PBS-T, и инкубировали при 37°С в течение 2 часов. После повторной промывки PBS-T добавляли субстратный раствор п-нитрофенилфосфата, поставляемого с набором, содержащим субстрат щелочной фосфатазы (BioRad), в соответствии с инструкциями, прилагаемыми к набору. После инкубирования при 37°С в течение 0,5-1 часа измеряли оптическую плотность при 450 нм. В экспериментах настоящего изобретения иммуноглобулин плазмы человека подкласса G (IgG1) (Biopure AG), разведенный DMEM, содержащей 10% FCS, до определенных концентраций, использовали как образцы с эталонной концентрацией для гуманизированных анти-DR5 антител, содержащихся в надосадочных жидкостях культуры.
В результате этого экспрессию и очищенные продукты в супернатанте культуры специфически детектировали с использованием антитела против человеческого IgG. Конечная концентрация антитела против человеческого IgG составляло 44,03 мкг/мл (Н1L1), 39,8 мкг/мл (Н2L2), 26,7 мкг/мл (Н2L3), 41,0 мкг/мл (Н2L4), 39,3 мкг/мл (Н3L2), 24,7 мкг/мл (Н3L3), 21,5 мкг/мл (Н3L4), 16,7 мкг/мл (Н4L5) и 18,3 мкг/мл (химера) соответственно.
(6). Апоптоз-индуцирующая активность гуманизированного антитела нескольких типов или химерного антитела
Для оценки апоптоз-индуцирующей активности очищенного гуманизированного антитела TRA-8 использовали клетки Jurkat (АТСС № TIB-152).
Клетки Jurkat, культивированые в среде RPMI 1640 с 10% об./об. FSC (Gibco BRL) в течение 3 дней при 37оС в присутствии 5% СО2, добавляли в каждую лунку 96-луночного микропланшета (Sumitomo Bakelite) в количестве 50 мкл на лунку, гуманизированное антитело TRA-8, полученное как описано в Примере 26, доводили до концентрации конечного нужного продукта 100 нг/мл в среде RPMI 1640, содержащей 10% FSC, путем оценки их концентраций в жидкостях методом, описанным в примере 26. Каждый из полученных растворов продуктов экспрессии, доведенных до 100 мг/мл, использовали для приготовления серийных разведений путем 2-кратного разведения средой RPMI 1640, содержащей 10% FSC. Каждый из растворов разведенного гуманизированного антитела TRA-8 (Н1L1, Н2L2, Н2L3, Н2L4, Н3L3, Н3L4 или Н3L5) добавляли в каждую лунку при концентрации 50 мкл на лунку. После проведения реакции при 37оС в течение 12 часов, добавляли 50 мкл 25 мкМ PMS, содержащего 1 мг/мл ХТТ (конечные концентрации 250 мкг/мл для ХТТ и 5 мкМ для PMS). После инкубирования в течение 3 часов измеряли оптическую плотность каждой лунки при 450 нм, а затем определяли жизнеспособность клеток с использованием восстанавливающей способности митохондрий в качестве индикатора.
Жизнеспособность клеток в каждой лунке вычисляли по следующей формуле:
Жизнеспособность (%)=100×(а-b)/(c-b)
где а представляет значение для тестируемой лунки, b представляет значение для лунки без клеток и с представляет значение для лунки, в которую не было добавлено антитело.
В результате было продемонстрировано, что протестированные гуманизированные антитела индуцируют апоптоз в Т-клеточной лимфоме, экспрессирующей антиген DR5 человека.
Кроме того, апоптоз-индуцирующую активность гуманизированного TRA-8 по отношению к клеткам РС-3 оценивали путем добавления таксола методом, описанным в примере 25.
Клеточную линию злокачественной опухоли предстательной железы человека РС-3 (АТСС №CRL-1435) получали из Американской коллекции тканевых культур (АТСС) и выдерживали в питательной смеси F12-К (21127-022, Gibco BRL), содержащей 10% фетальную бычью сыворотку (FBS, Hyclone), 1% L-глутамина-200 мМ (25030-149, Gibco BRL) и 0,5% раствор пенициллина и стрептомицина (Р-7539, Sigma). Среду RPMI 1640 (MED-008, IWAKI), в которую были добавлены 10% FBS и 0,5% раствор пенициллина и стрептомицина, использовали в описанном ниже эксперименте. Экспоненциально растущие клетки РС-3 собирали путем трипсинизации и дважды промывали свежей средой. Затем, за день до начала эксперимента, клетки подсчитывали, ресуспендировали в свежей среде при плотности 5×104 клеток/мл и распределяли с тремя повторностями по плоскодонным 96-луночным планшетам (3598, Corning-Coster) в полном объеме 100 мкл/лунку. Репрезентативное противораковое лекарственное средство, паклитаксел (169-18611, Wако), растворенное в диметилсульфоксиде (10 мг/мл), разводили в свежей среде, а затем добавляли в 96-луночные планшеты, содержащие клетки при концентрации 50 мкл/лунку. Конечная концентрация диметилсульфоксида составляла менее чем 0,1%. После инкубирования в течение 24 часов при 37оС в атмосфере 5% CO2, в лунки добавляли гуманизированное антитело TRA-8 (Н1L1, Н2L2, Н2L3, Н2L4, Н3L2, Н3L3, Н3L4 или Н4L5), разведенное в свежей среде. После инкубирования в течение еще 24 часов в лунки добавляли 50 мкл минимальной поддерживающей среды (11095-098, Gibco BRL), содержащей 1 мг/мл ХТТ и 25 мМ PMS, и планшеты инкубировали в течение 6 ч. Затем измеряли OD450 на счетчике ARVO HTS 1420 Multilabel Counter (Wallac Berthold) и жизнеспособность клеток определяли следующим образом.
Жизнеспособность клеток (%)= (OD450 для лунок, содержащих клетки, обработанные таксолом и/или гуманизированного TRA-8 (агент(ы)) - OD450 для лунок, не содержащих ни клеток, ни агента) × 100/(OD450 для лунок, содержащих клетки, но не содержащих агента - OD450 для лунок, не содержащих ни клеток, ни агента).
В результате было продемонстрировано, что протестированные гуманизированные антитела индуцируют апоптоз клеток злокачественной опухоли предстательной железы, экспрессирующих антиген DR5 человека.
Все патенты и публикации, упомянутые в данной заявке, характеризуют предшествующий уровень техники в области, к которой относится настоящее изобретение. Эти патенты и публикации вводятся в настоящее описание посредством ссылки так, как если бы каждая отдельная публикация была введена посредством ссылки.
Настоящее изобретение не ограничено вышеуказанным депозитом или вариантами его осуществления, описанными в примерах, которые лишь иллюстрируют несколько аспектов настоящего изобретения, и в объем настоящего изобретения входят любые варианты, которые являются функциональными эквивалентами настоящего изобретения. Помимо описанных и упомянутых здесь вариантов, в настоящее изобретение могут быть внесены различные модификации, очевидные для каждого специалиста и не выходящие за рамки прилагаемой формулы изобретения.




| название | год | авторы | номер документа |
|---|---|---|---|
| КОМБИНАЦИИ АНТИТЕЛ, ОБЛАДАЮЩИХ СЕЛЕКТИВНОСТЬЮ ПО ОТНОШЕНИЮ К РЕЦЕПТОРУ ЛИГАНДА, ИНДУЦИРУЮЩЕМУ АПОПТОЗ, АССОЦИИРОВАННЫЙ С ФАКТОРОМ НЕКРОЗА ОПУХОЛИ, И ДРУГИХ ТЕРАПЕВТИЧЕСКИХ СРЕДСТВ | 2002 |
|
RU2313368C2 |
| АНТИТЕЛО, СЕЛЕКТИВНОЕ В ОТНОШЕНИИ РЕЦЕПТОРА ЛИГАНДА, ИНДУЦИРУЮЩЕГО АПОПТОЗ И СВЯЗАННОГО С ФАКТОРОМ НЕКРОЗА ОПУХОЛИ, И ЕГО ПРИМЕНЕНИЕ | 2002 |
|
RU2313537C2 |
| ДЕГРАДИРОВАННОЕ АНТИТЕЛО, ЯВЛЯЮЩЕЕСЯ АГОНИСТОМ TPO | 2001 |
|
RU2287534C2 |
| МОДИФИЦИРОВАННОЕ АГОНИСТИЧЕСКОЕ АНТИТЕЛО | 2001 |
|
RU2295537C2 |
| НОВОЕ АНТИТЕЛО ПРОТИВ DR5 | 2011 |
|
RU2644678C1 |
| НОВОЕ АНТИТЕЛО ПРОТИВ DR5 | 2011 |
|
RU2590711C2 |
| АНТИ-DR5-АНТИТЕЛО И ЕГО ПРИМЕНЕНИЕ | 2018 |
|
RU2735956C1 |
| АНТИТЕЛА | 2005 |
|
RU2482131C2 |
| АПОПТОТИЧЕСКАЯ ЧУВСТВИТЕЛЬНОСТЬ К Apo2L/TRAIL ПУТЕМ ТЕСТИРОВАНИЯ ЭКСПРЕССИИ GalNac-T14 В КЛЕТКАХ/ТКАНЯХ | 2006 |
|
RU2416097C2 |
| АНАЛИЗЫ И СПОСОБЫ, ИСПОЛЬЗУЮЩИЕ БИОМАРКЕРЫ | 2005 |
|
RU2410438C2 |







































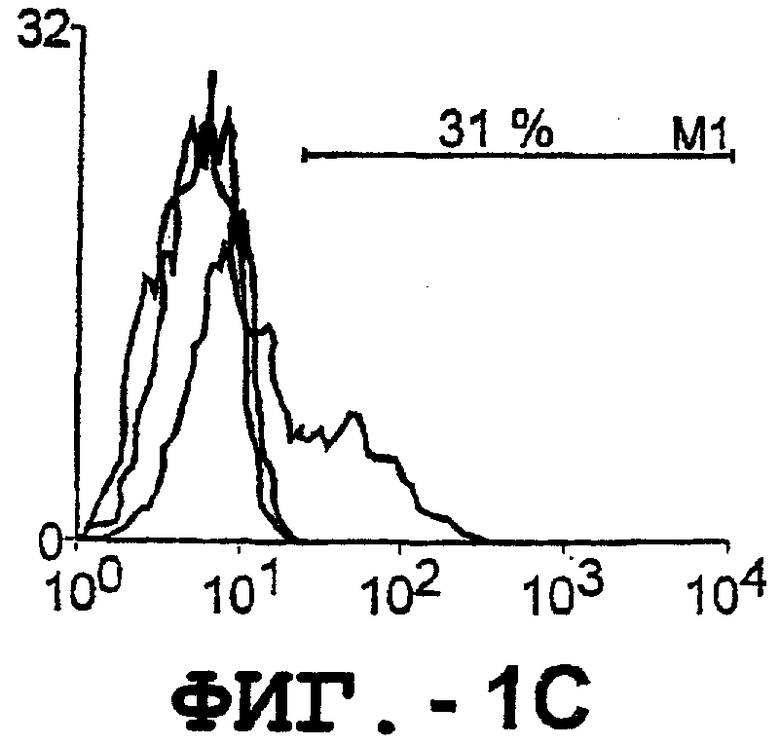


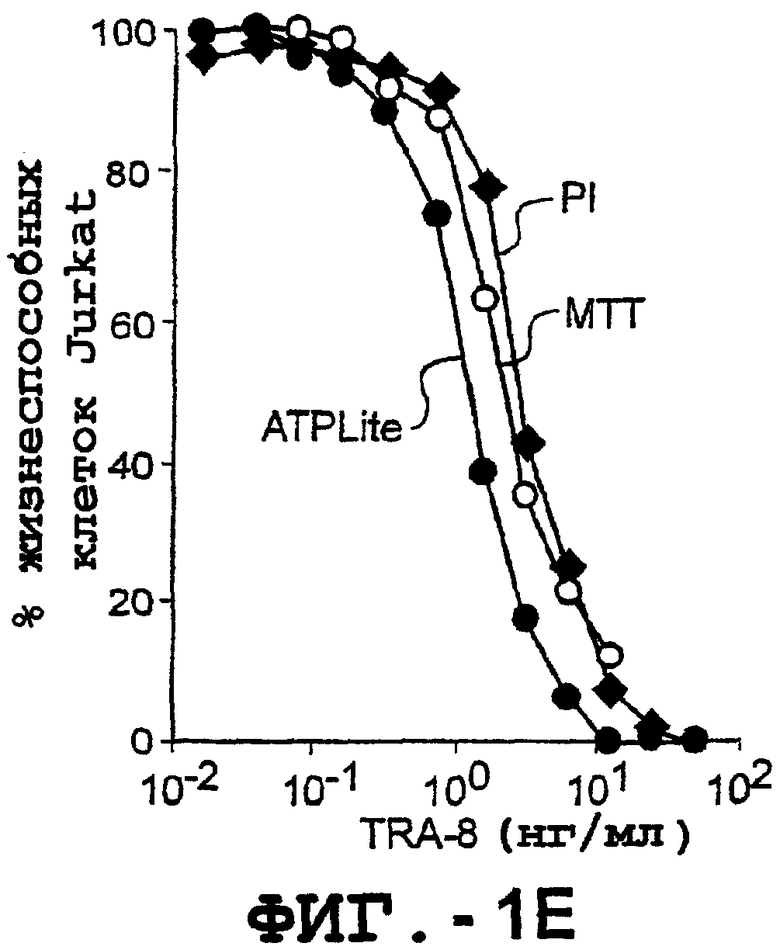
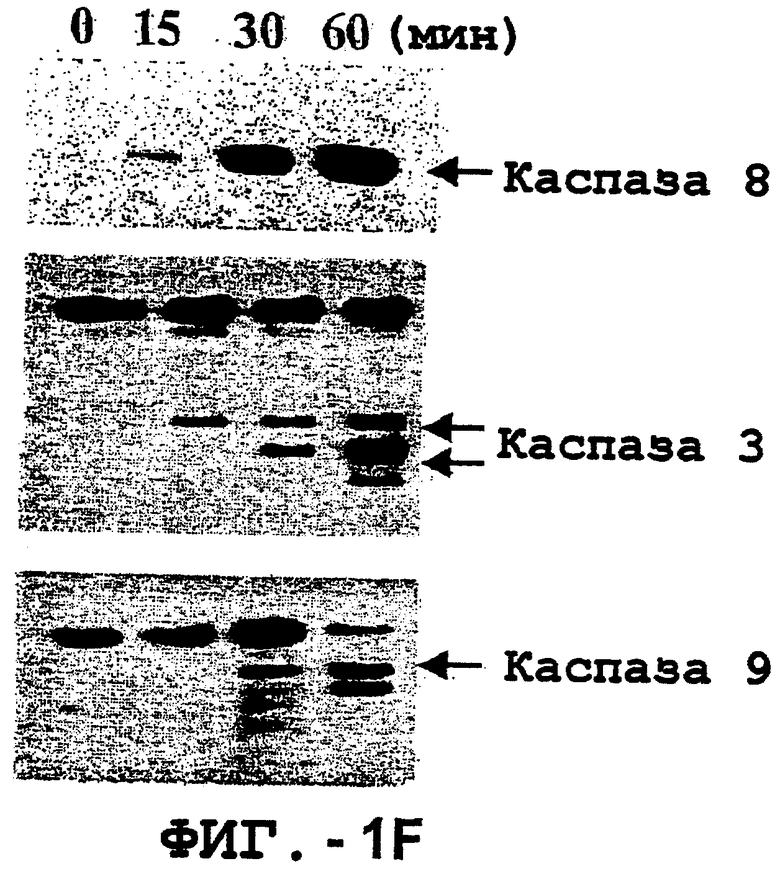
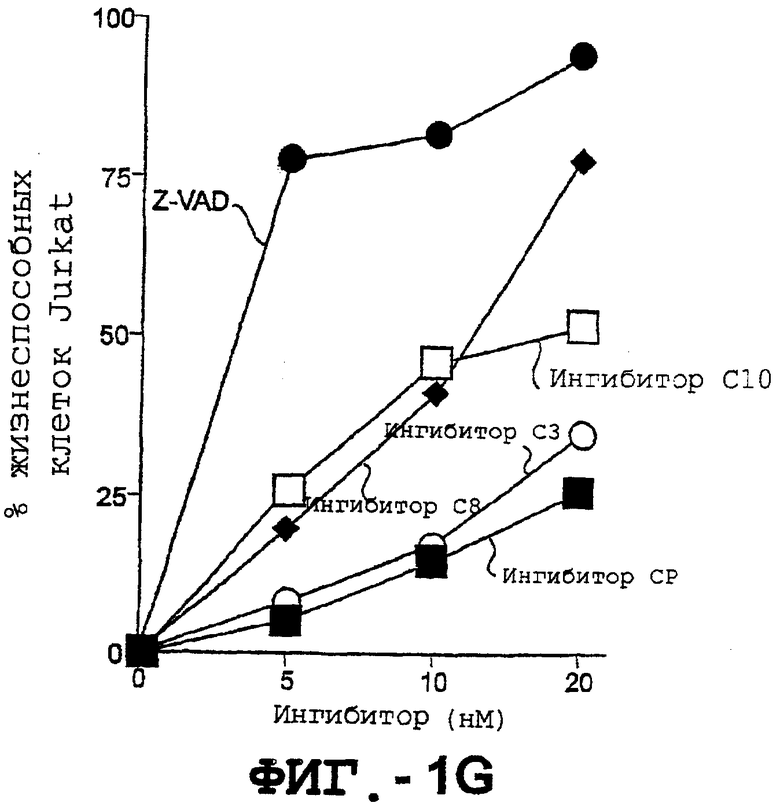
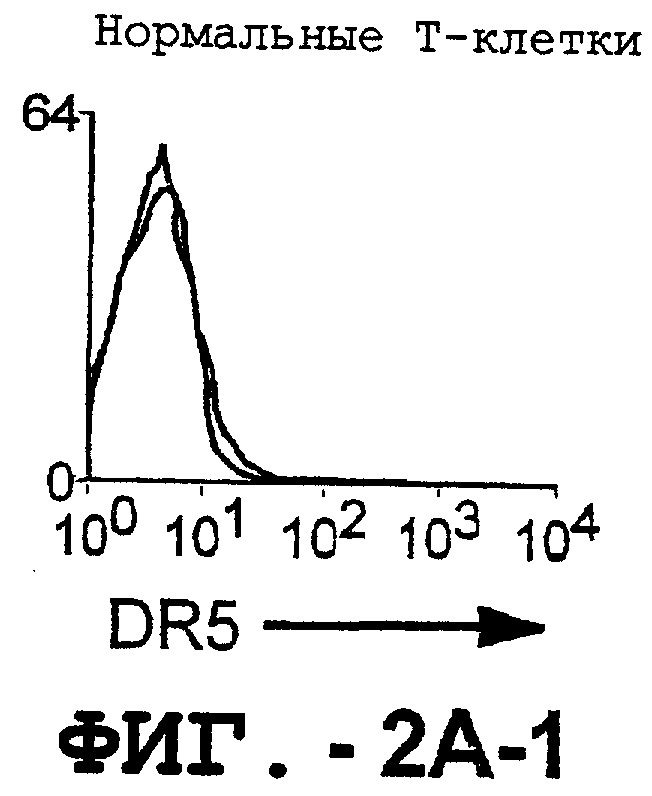


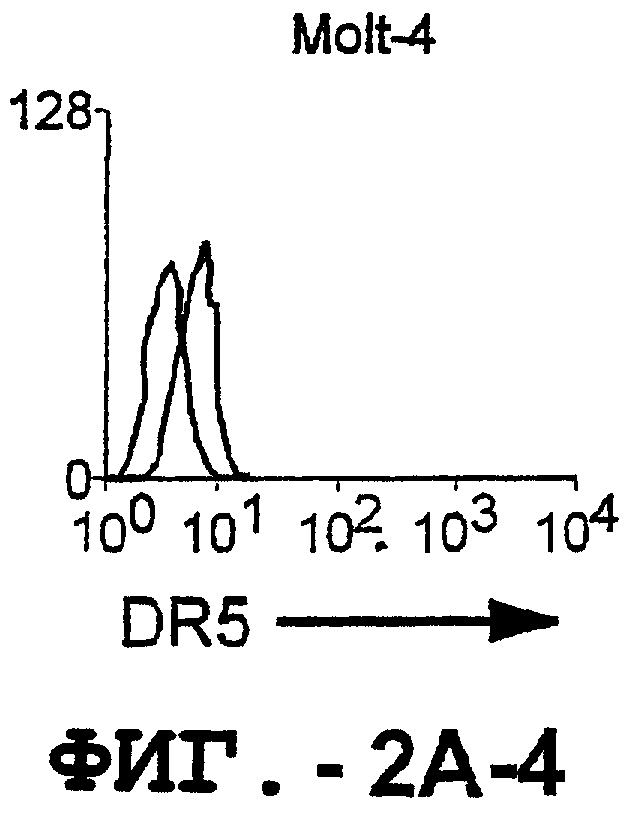
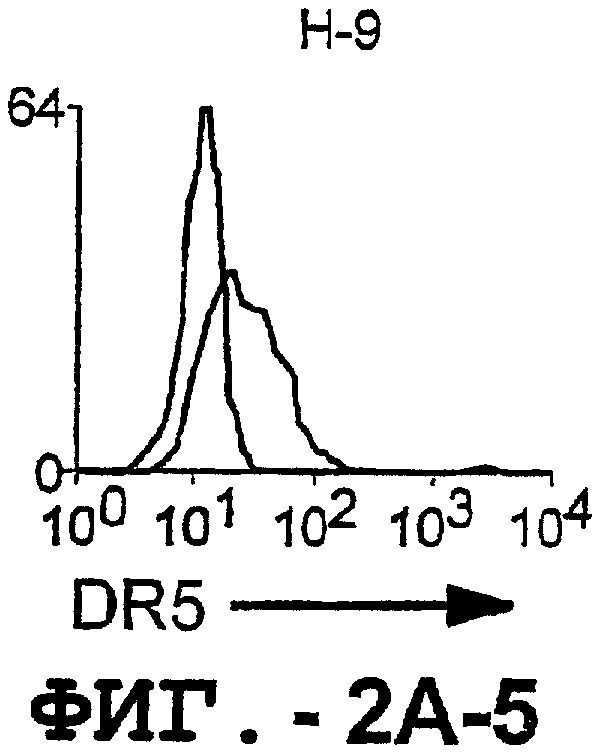
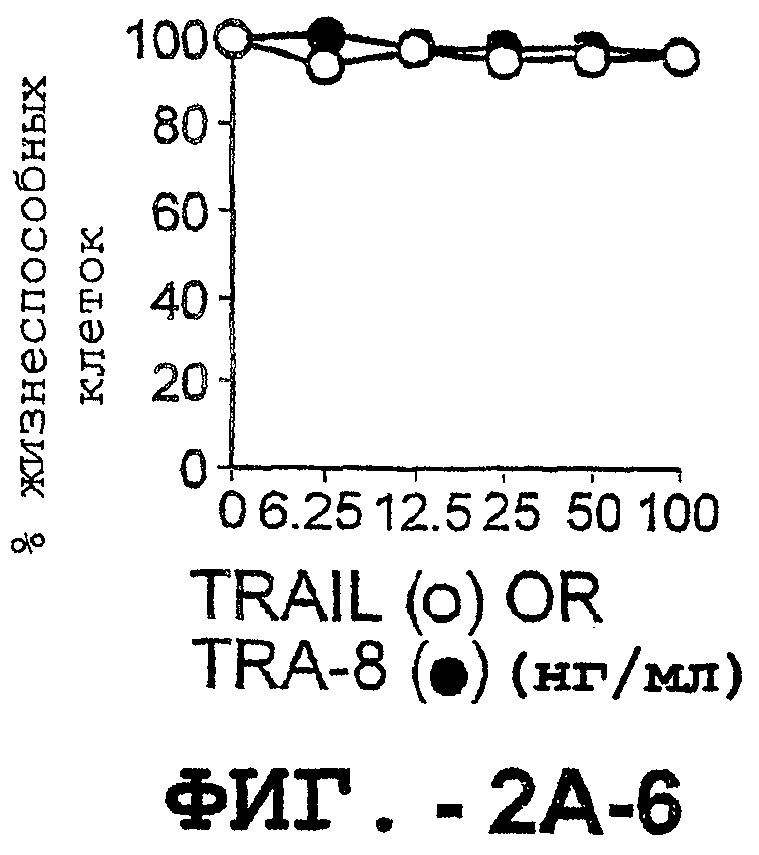

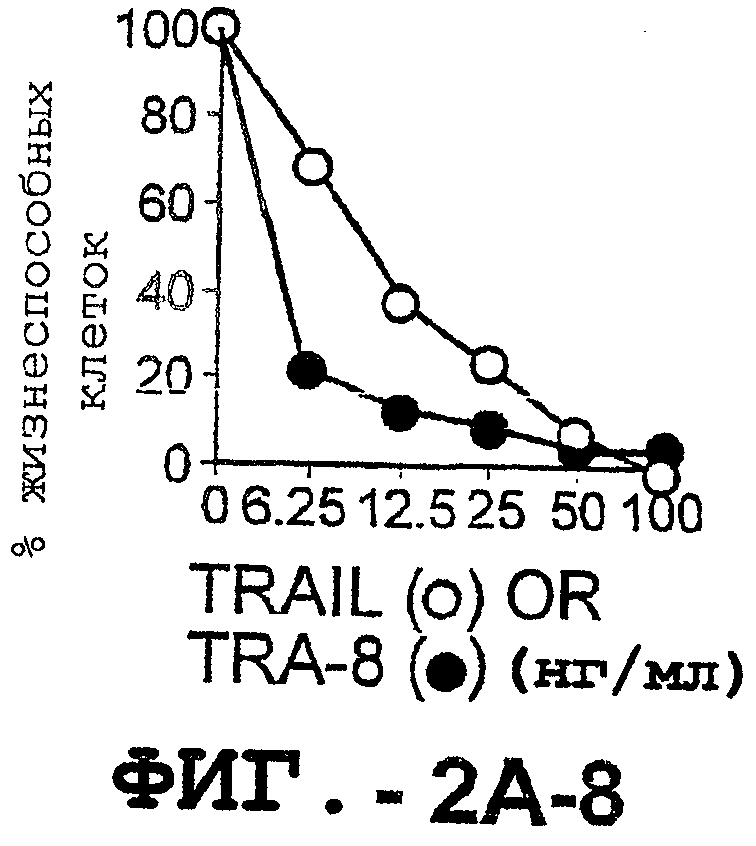


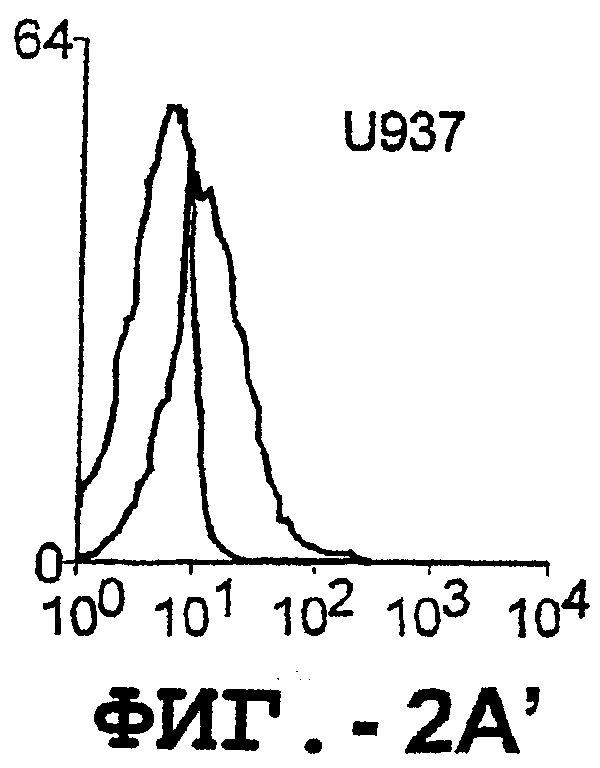
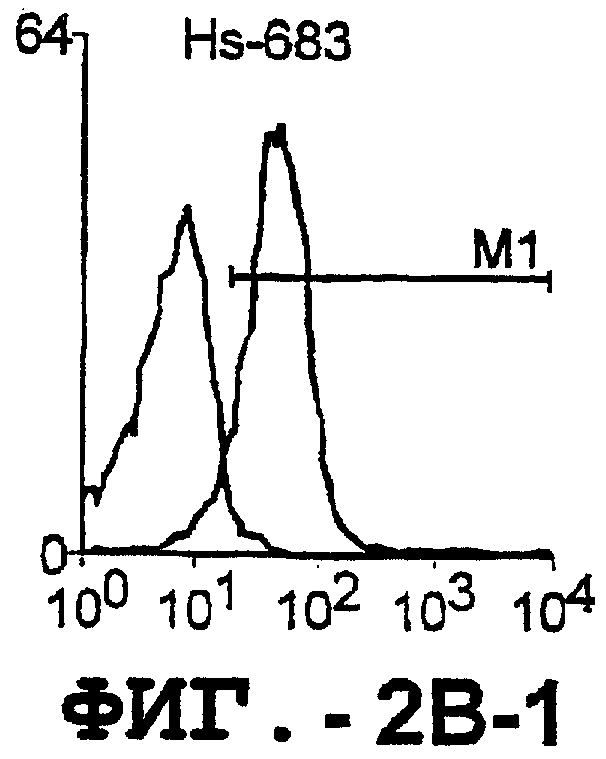

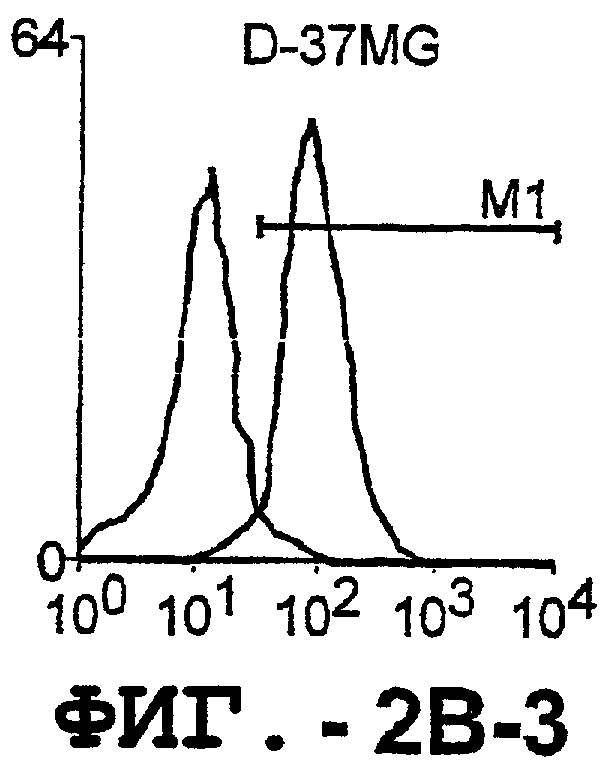
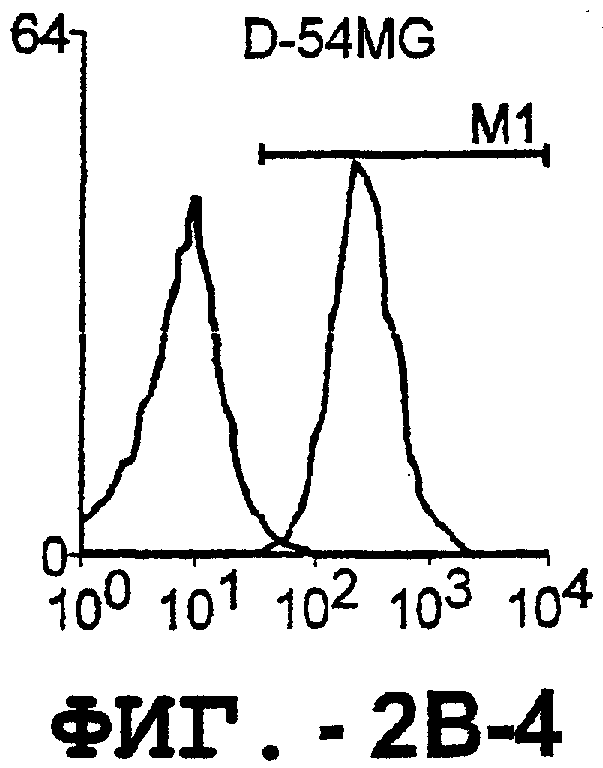
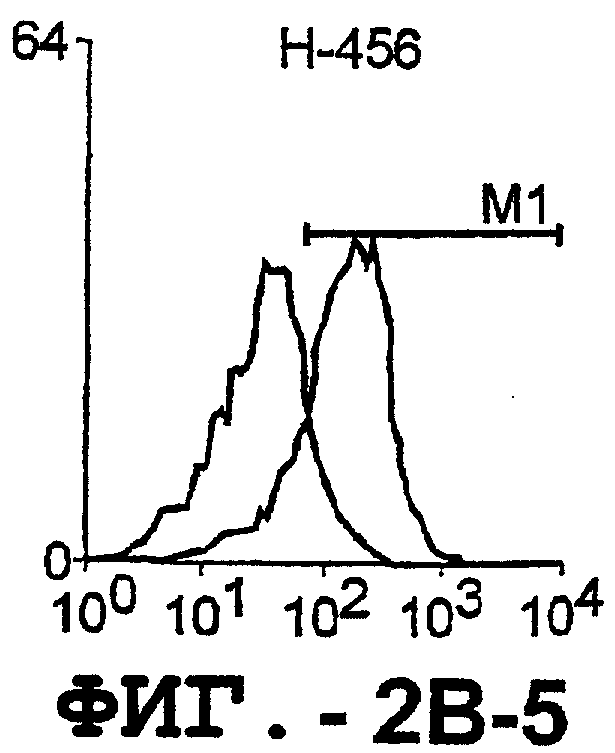
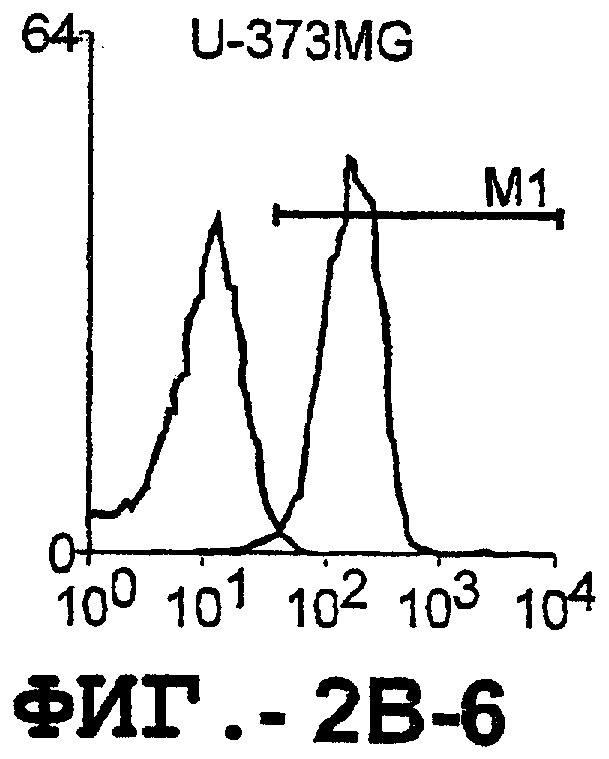
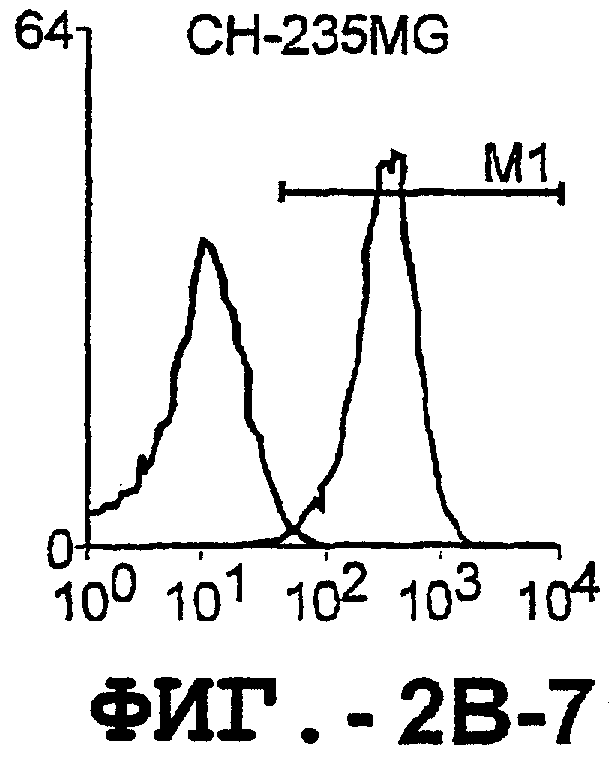
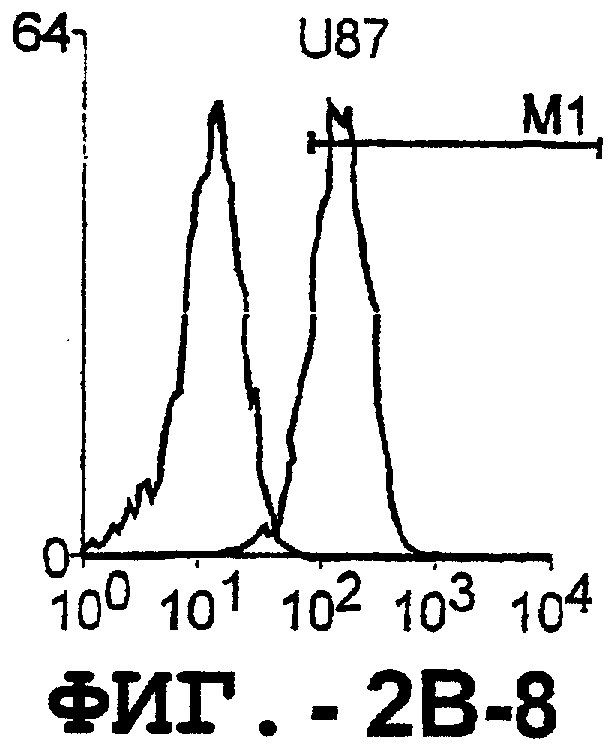
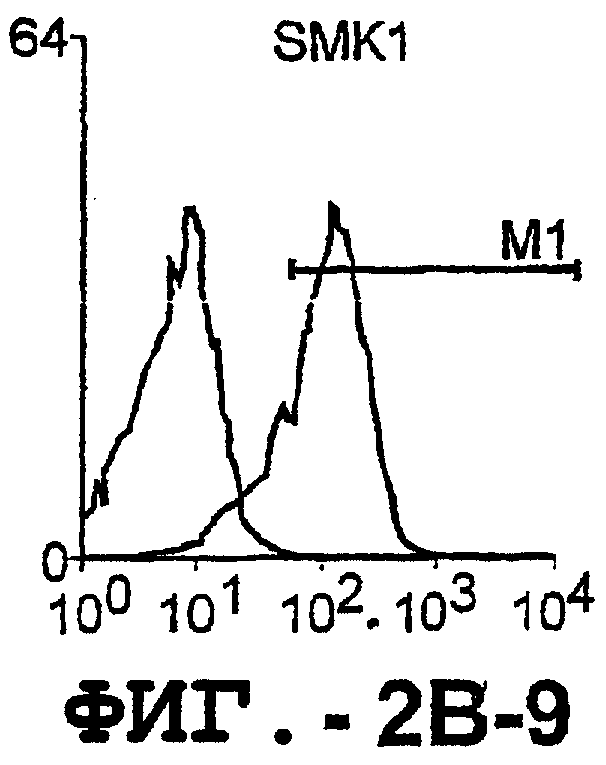
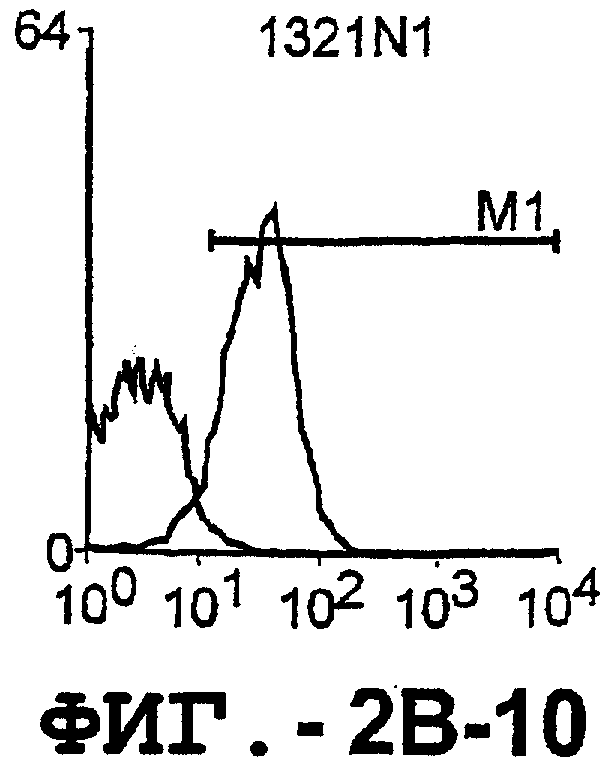
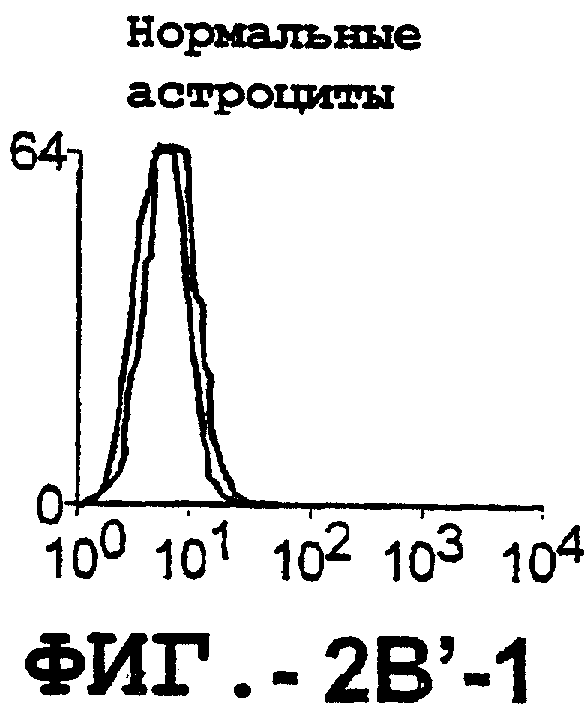
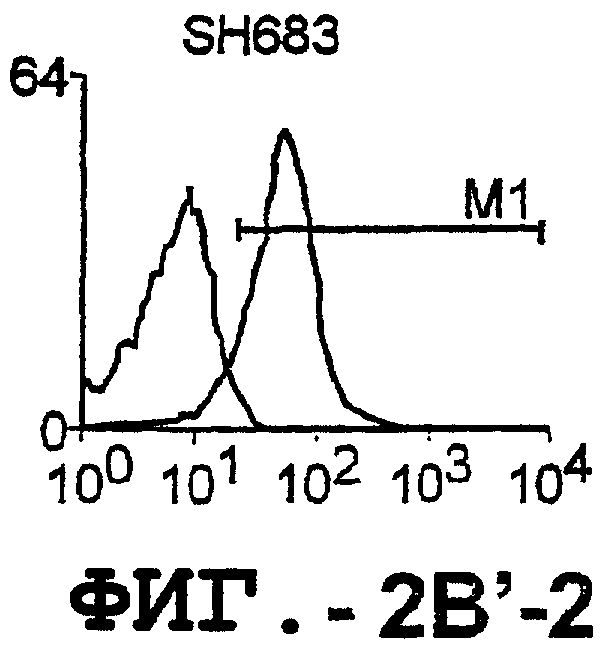
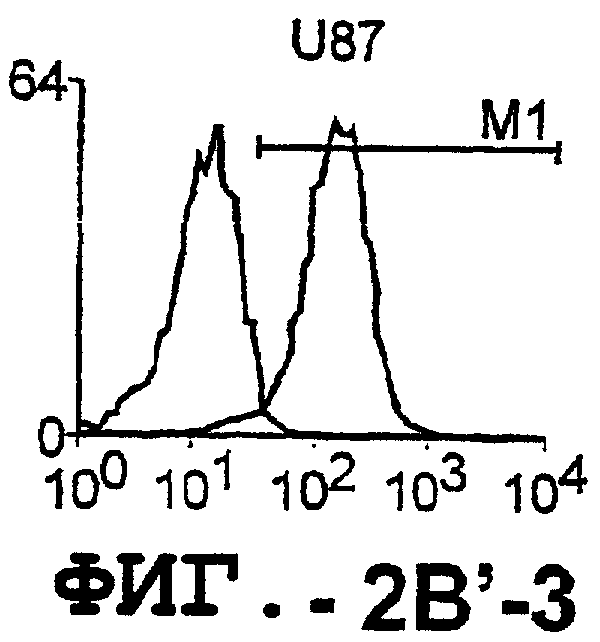
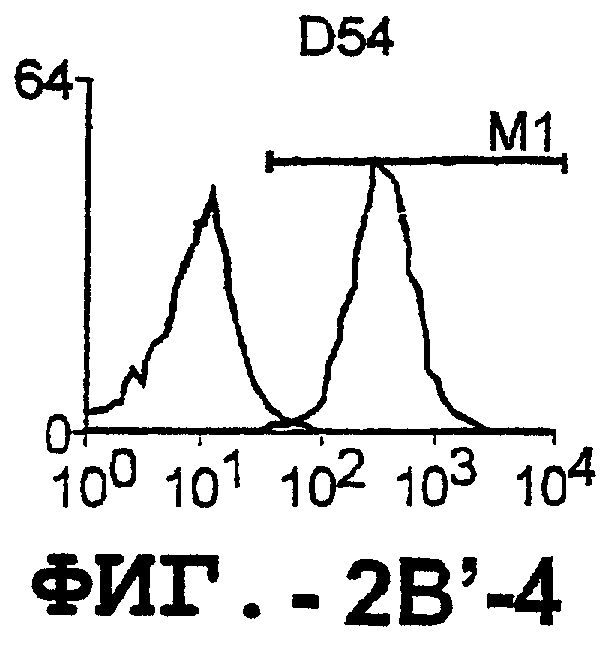
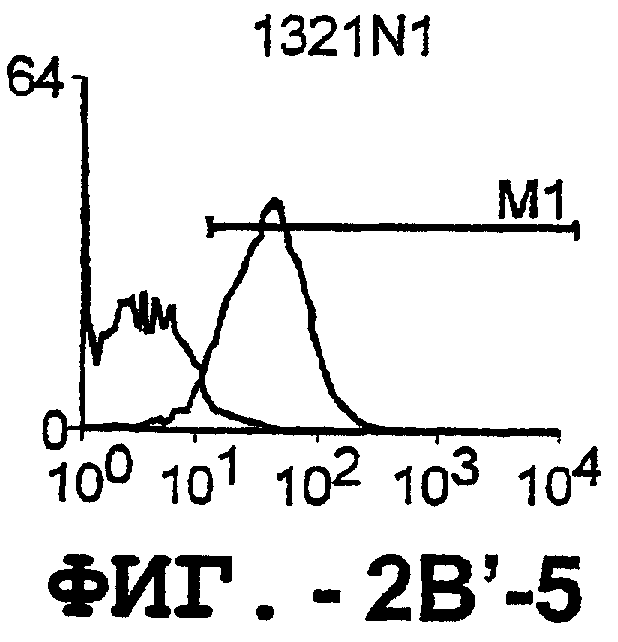

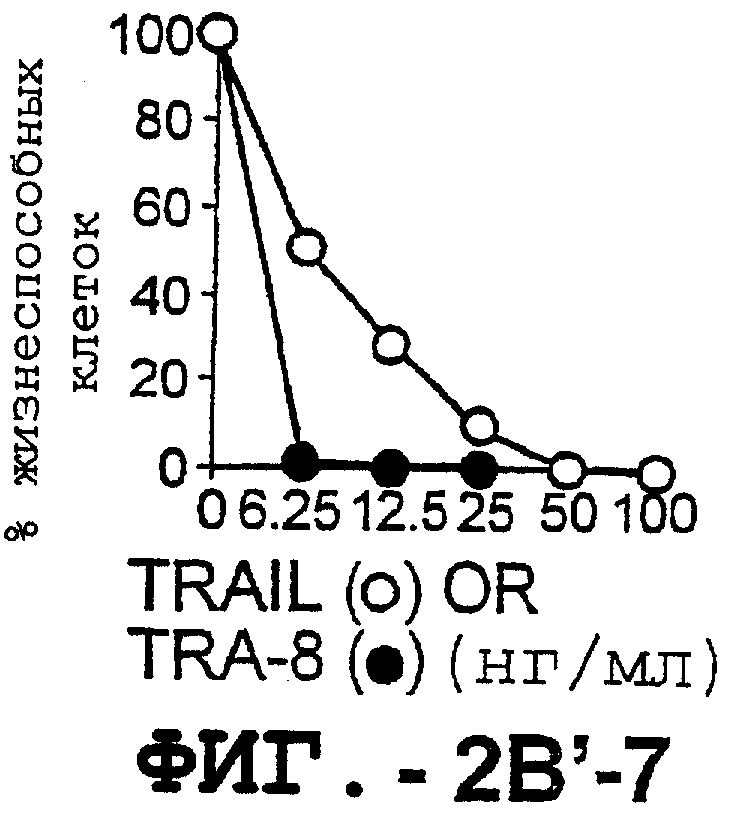
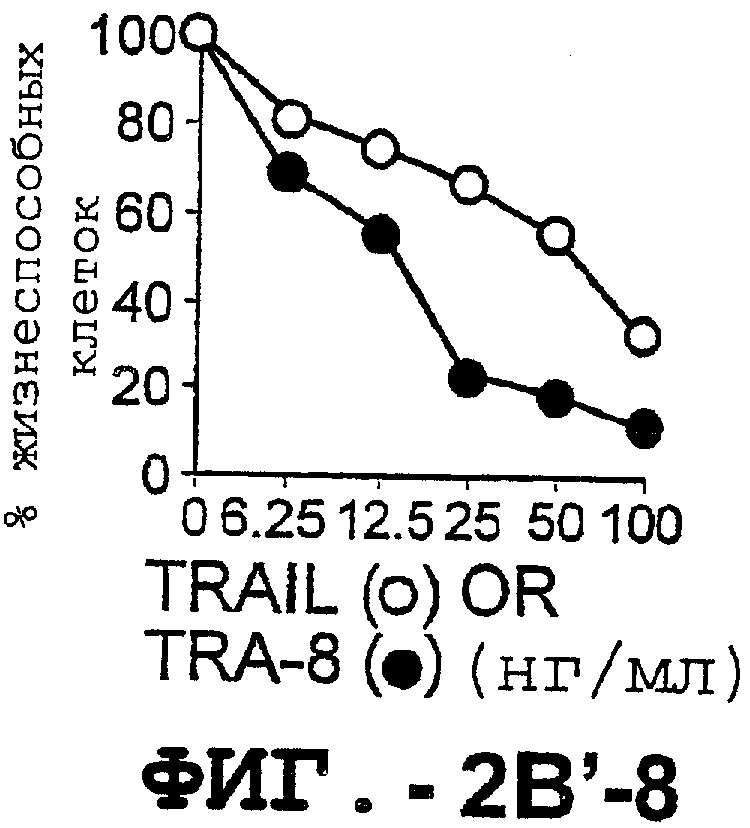


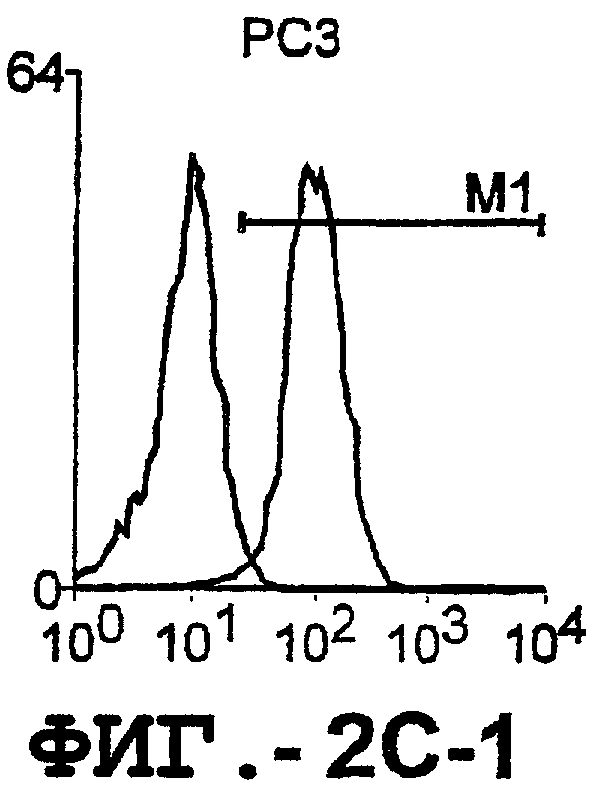
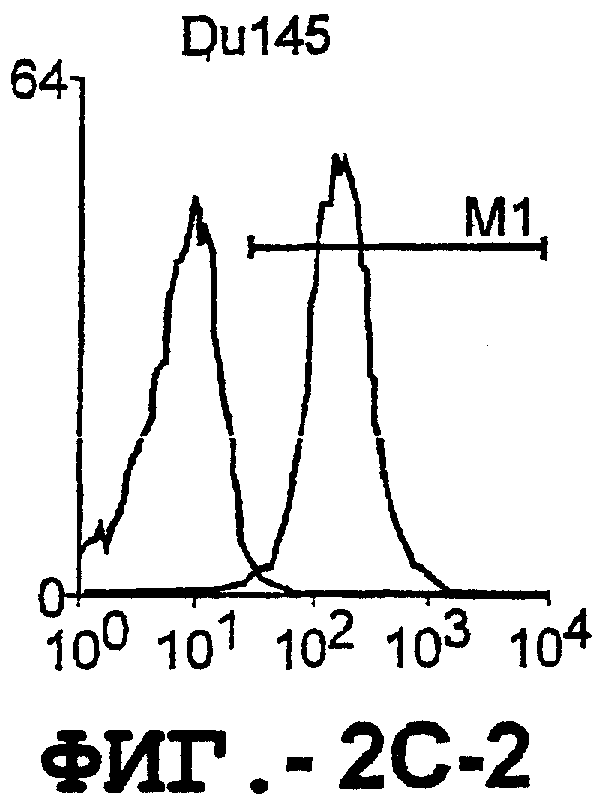
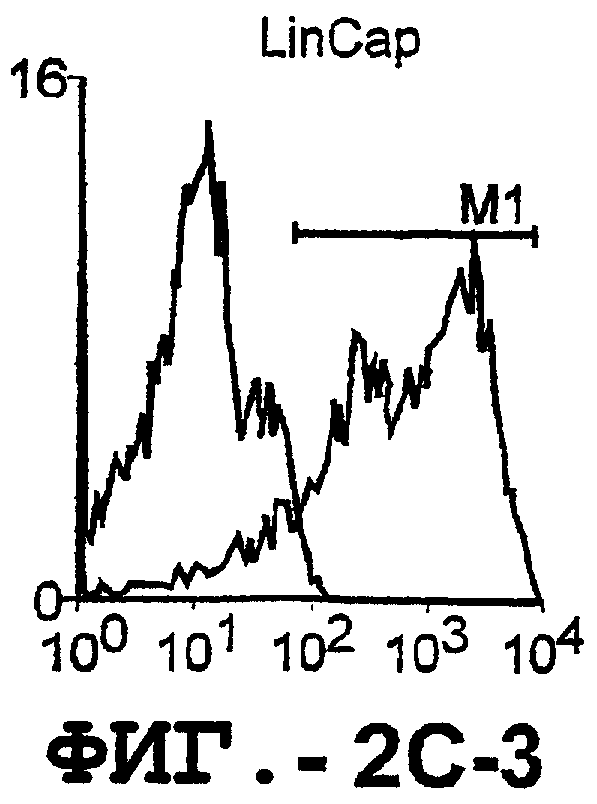
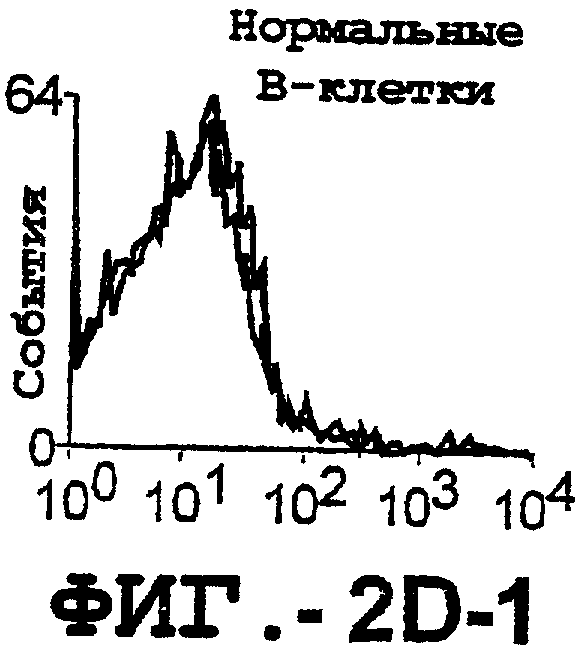
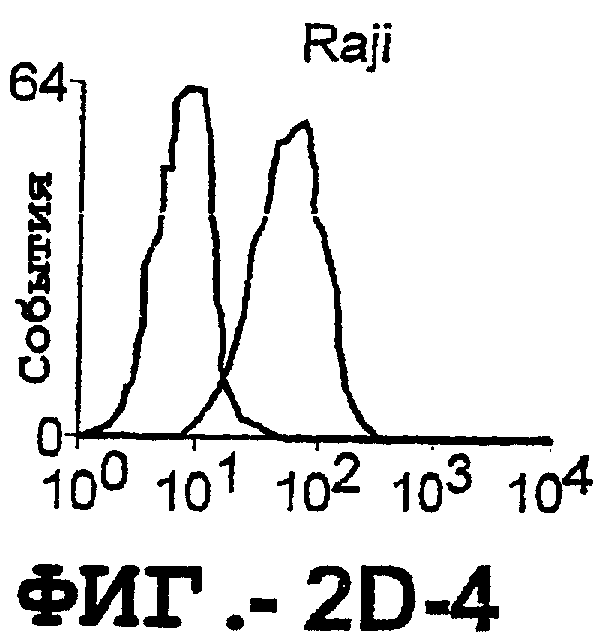
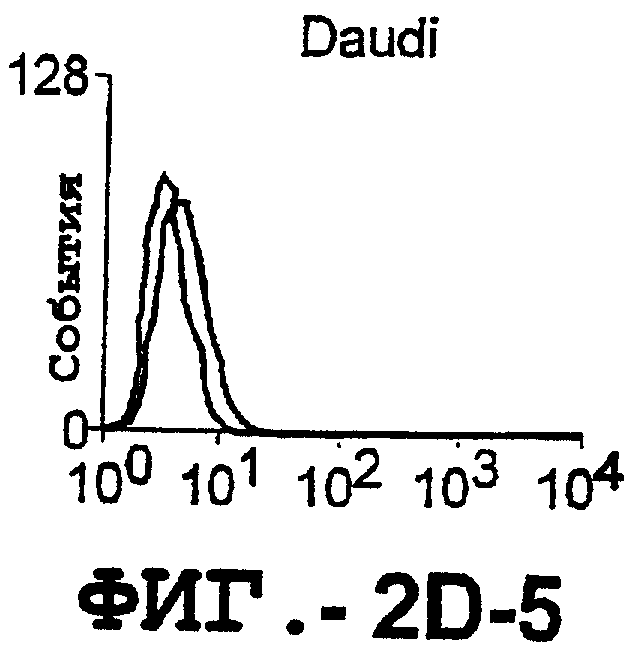

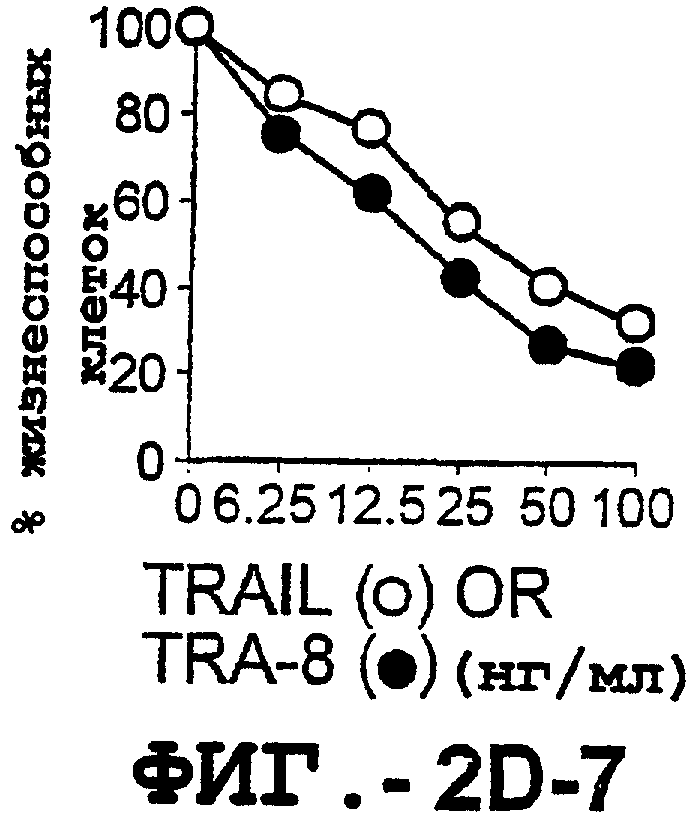
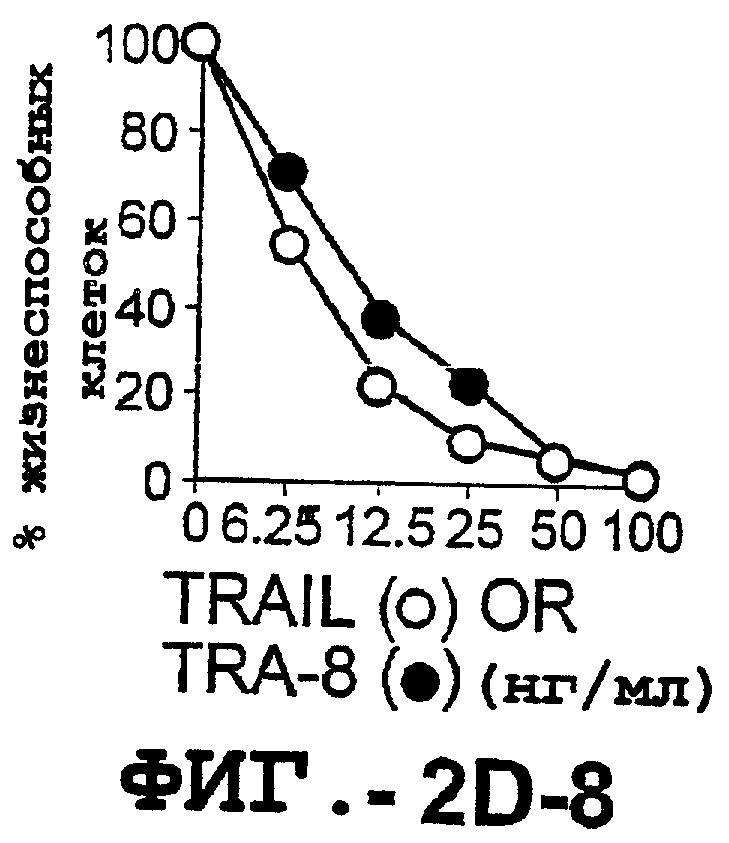

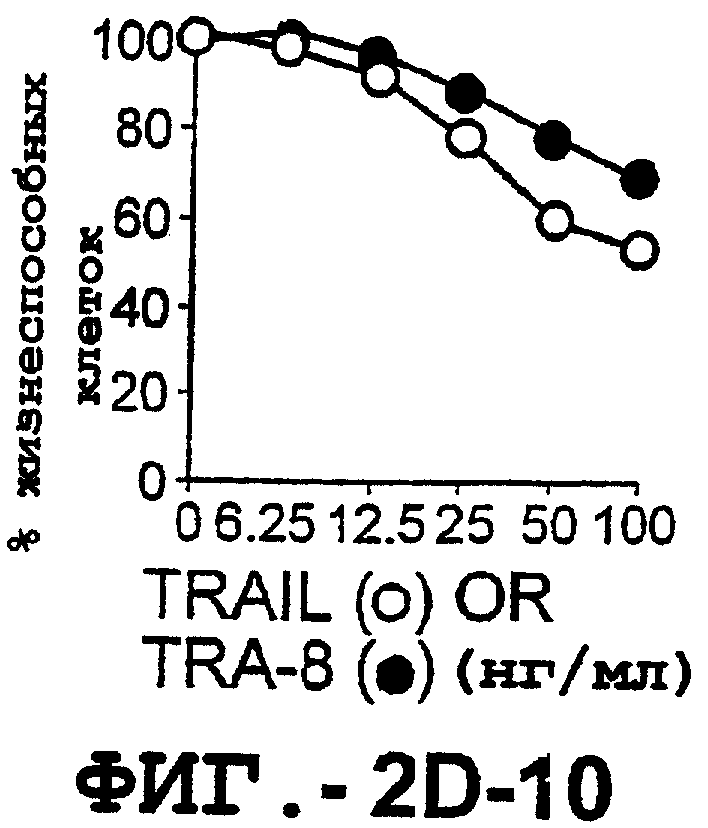
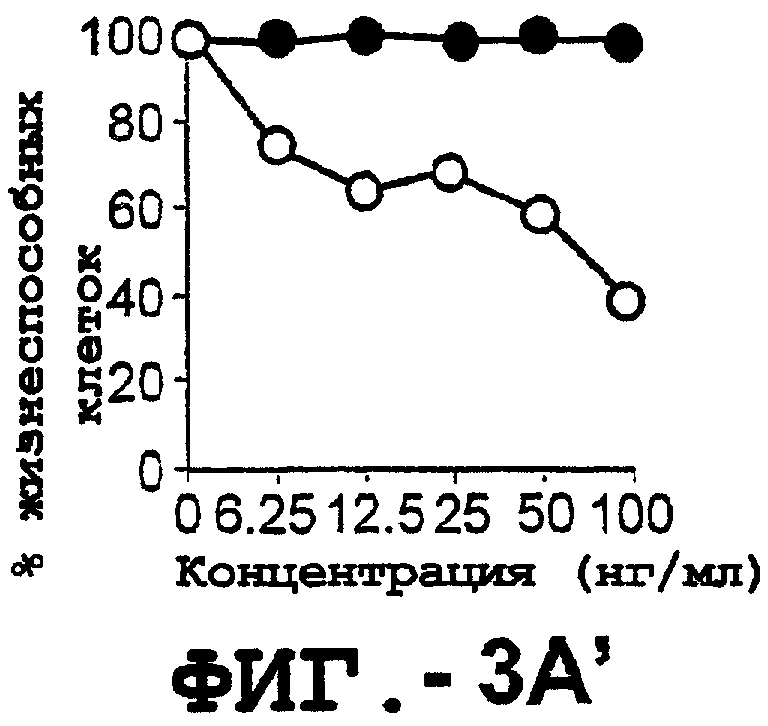

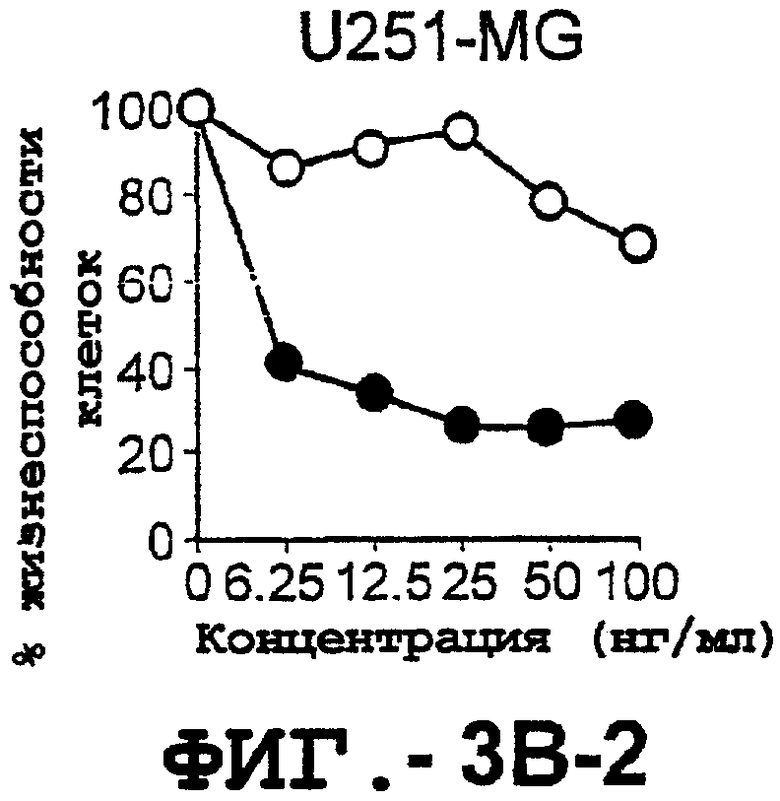

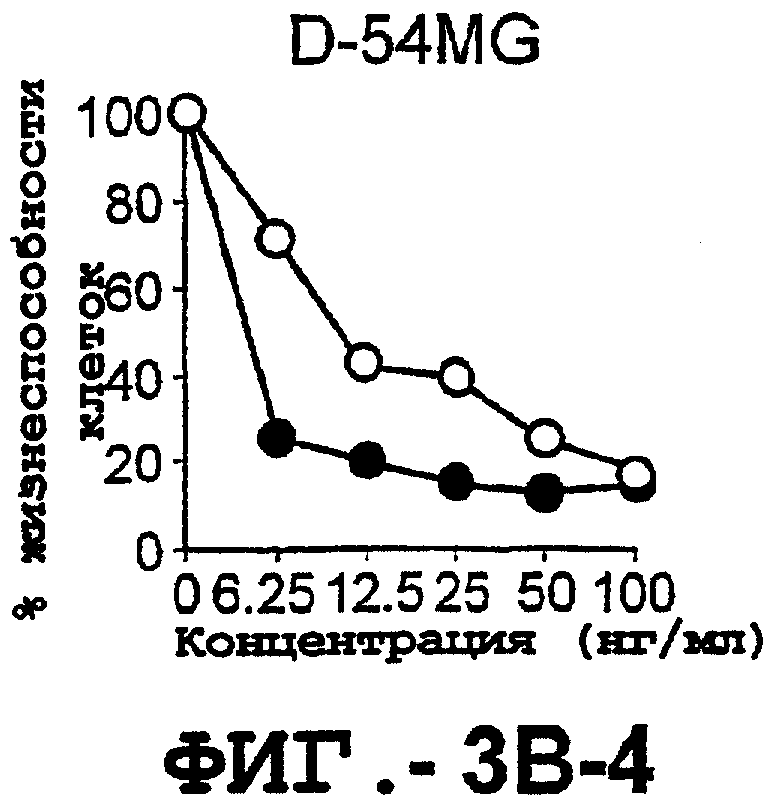

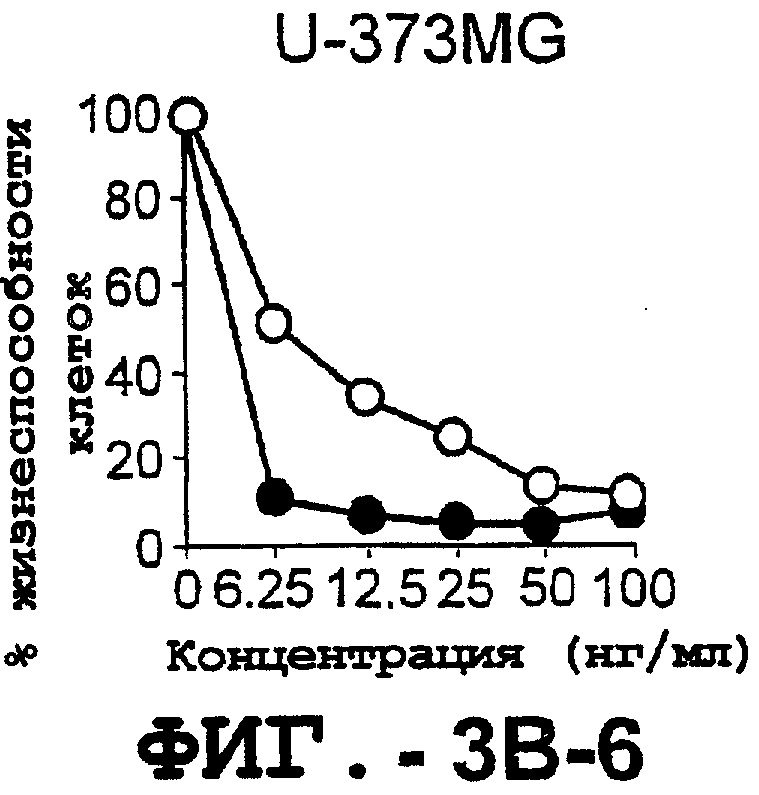
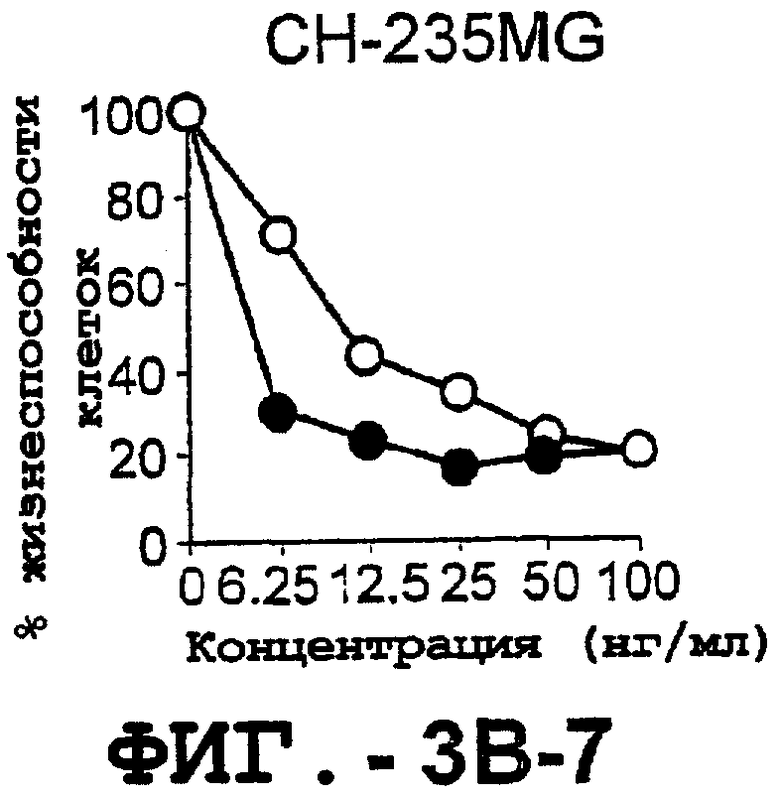
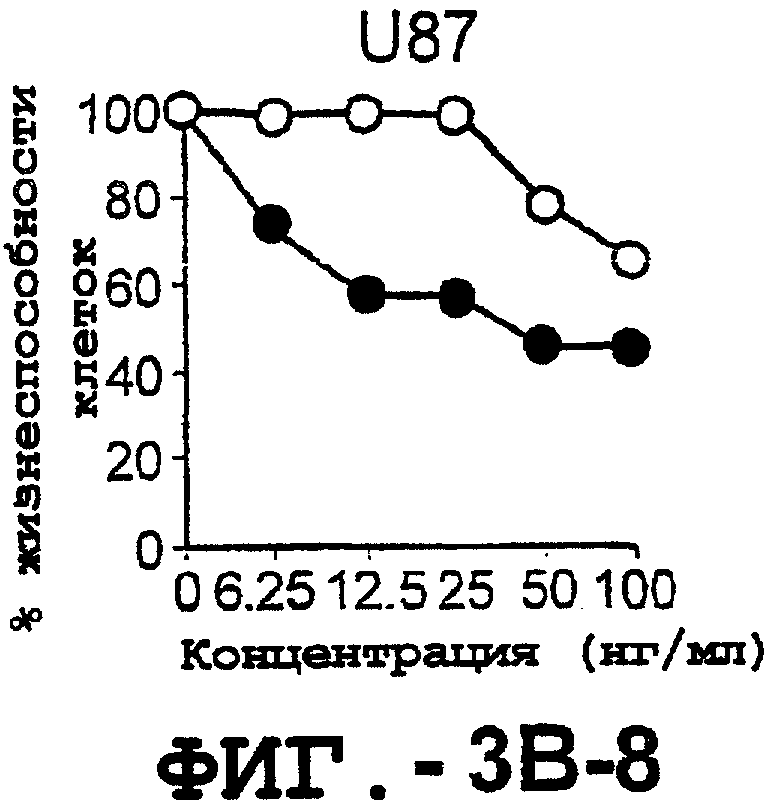

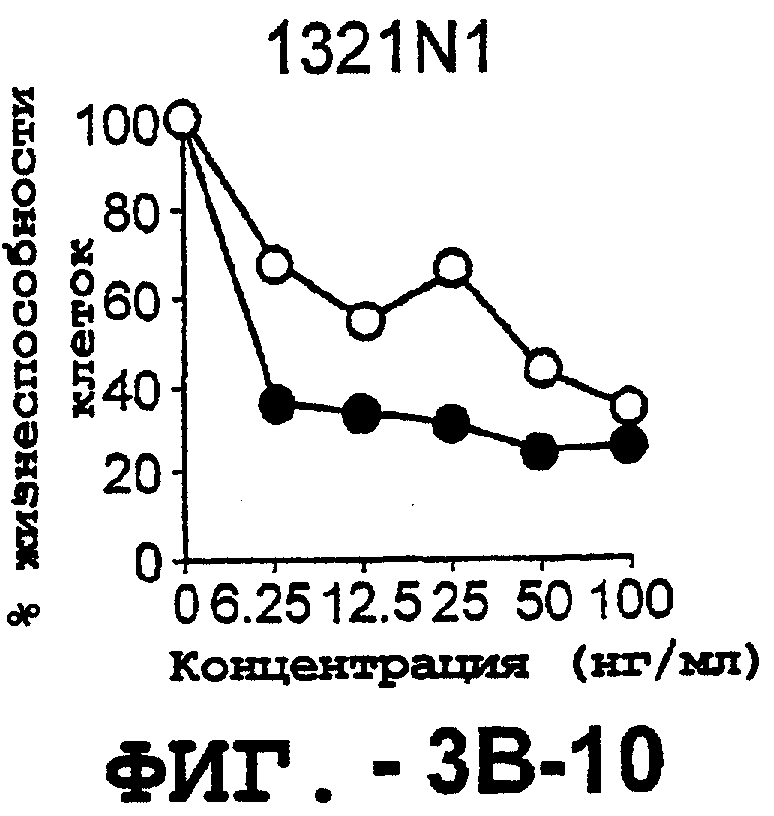
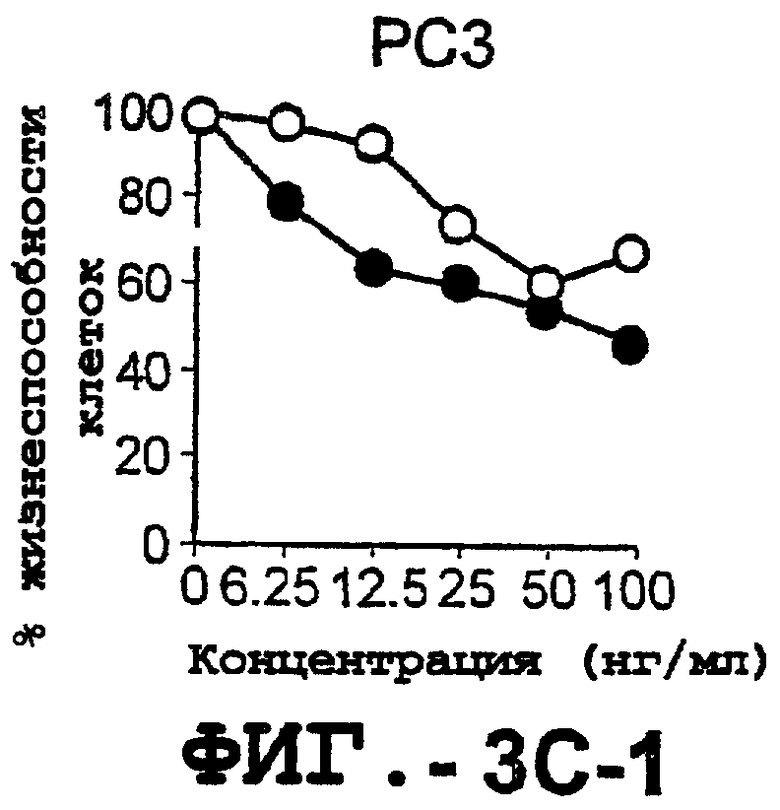

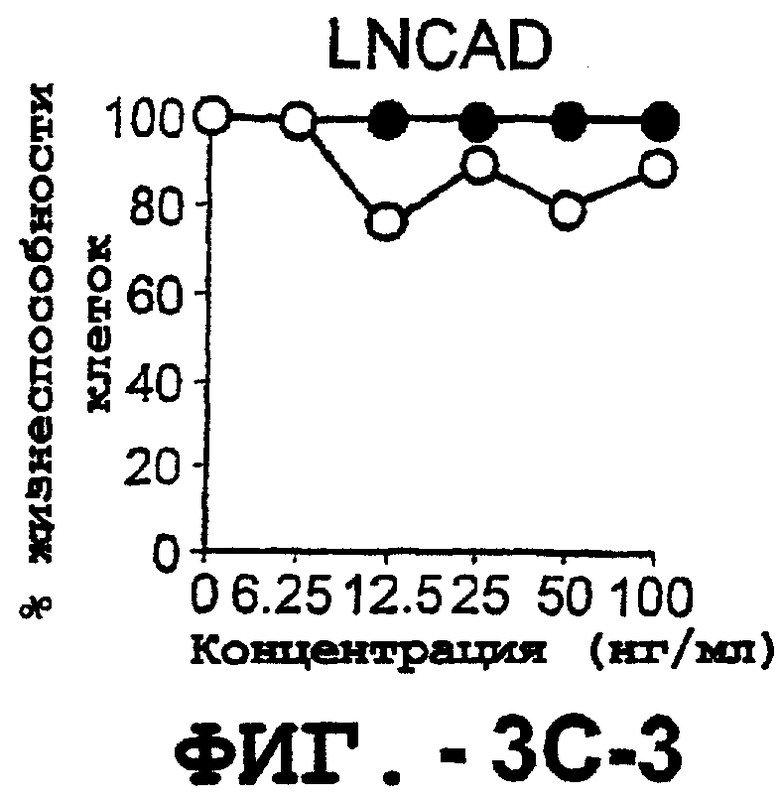
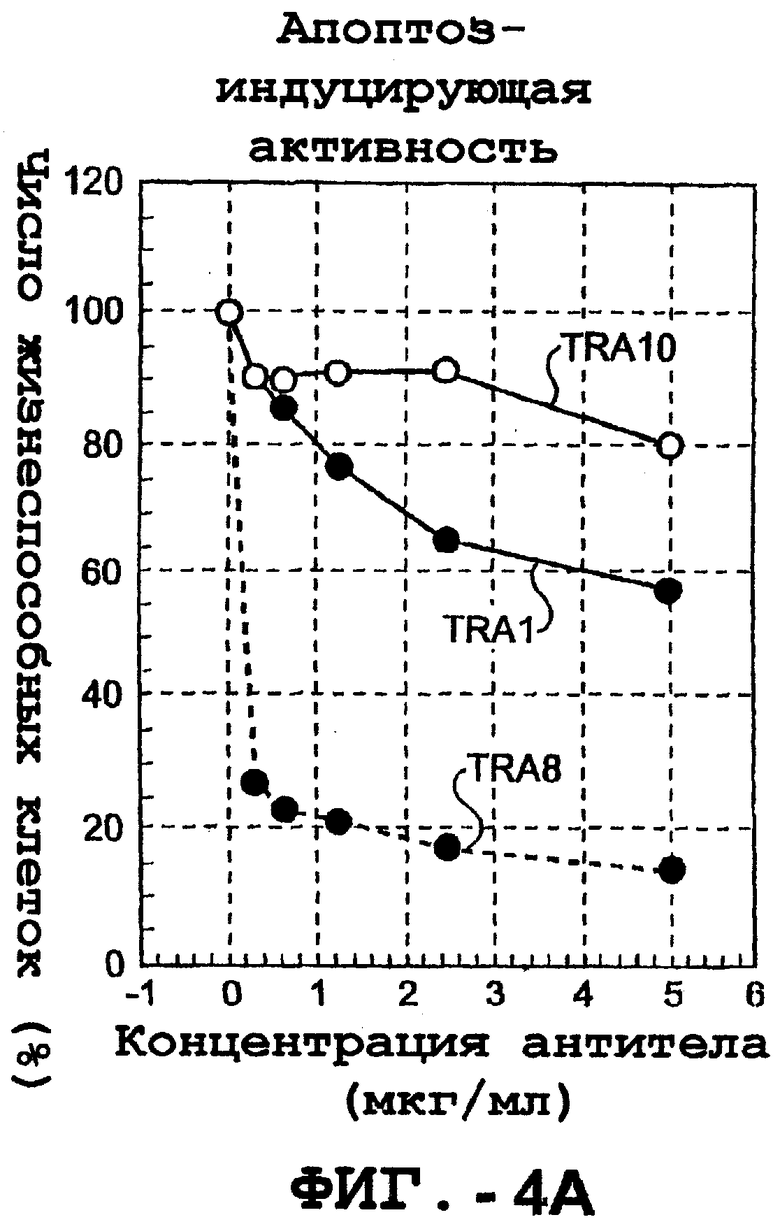




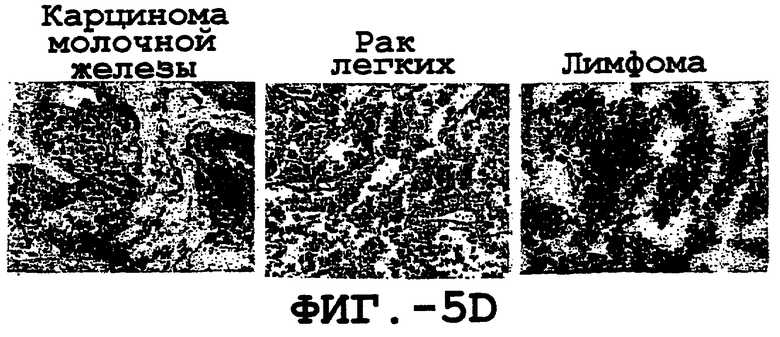

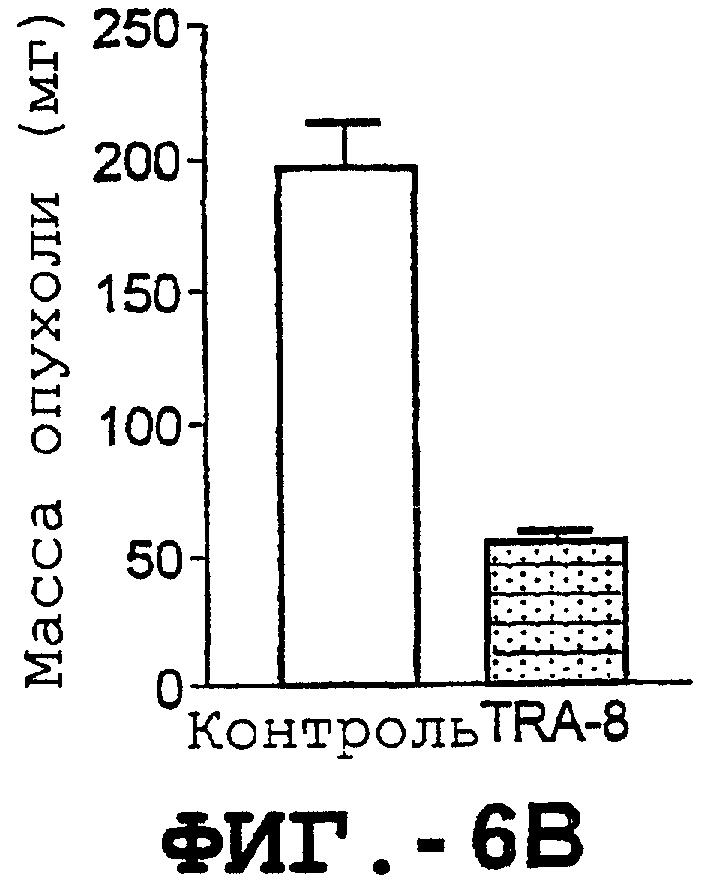
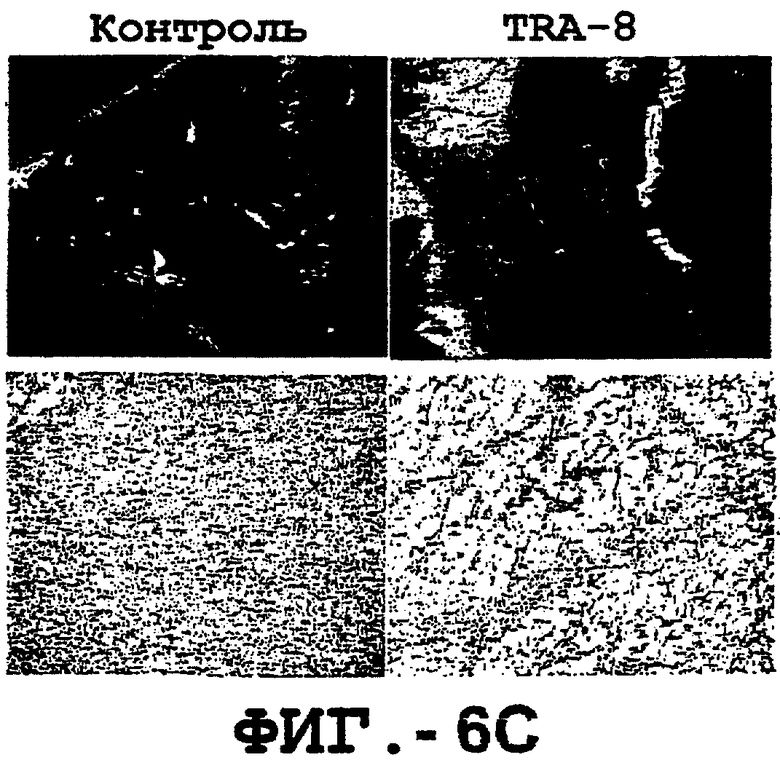


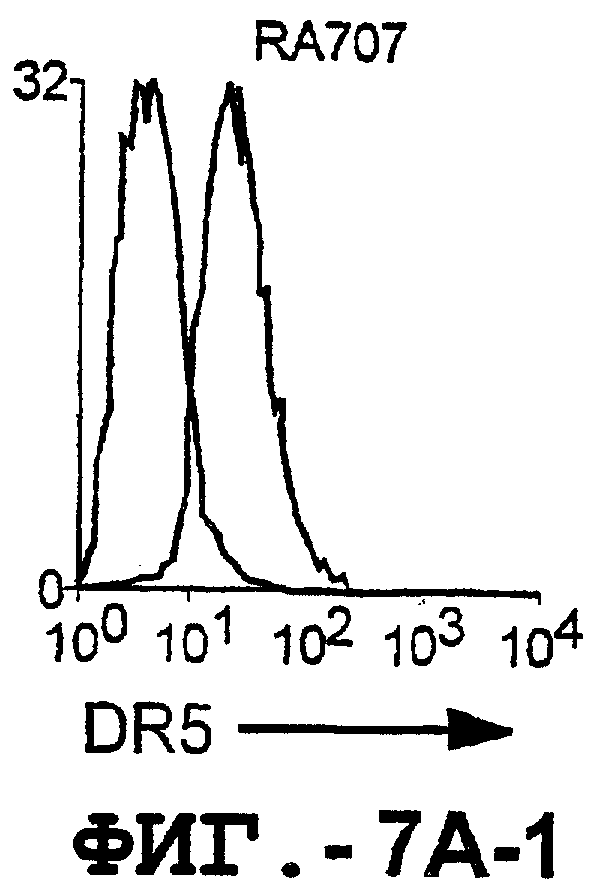


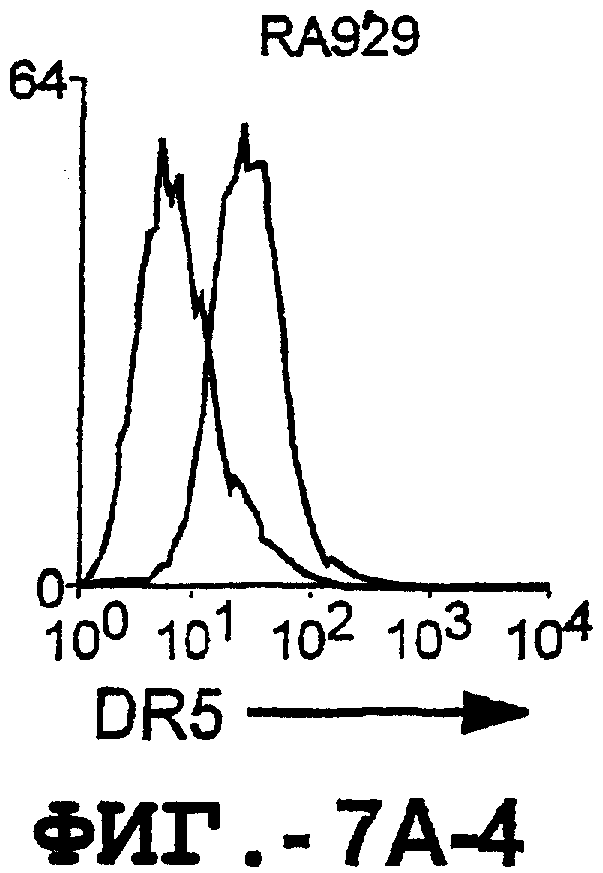
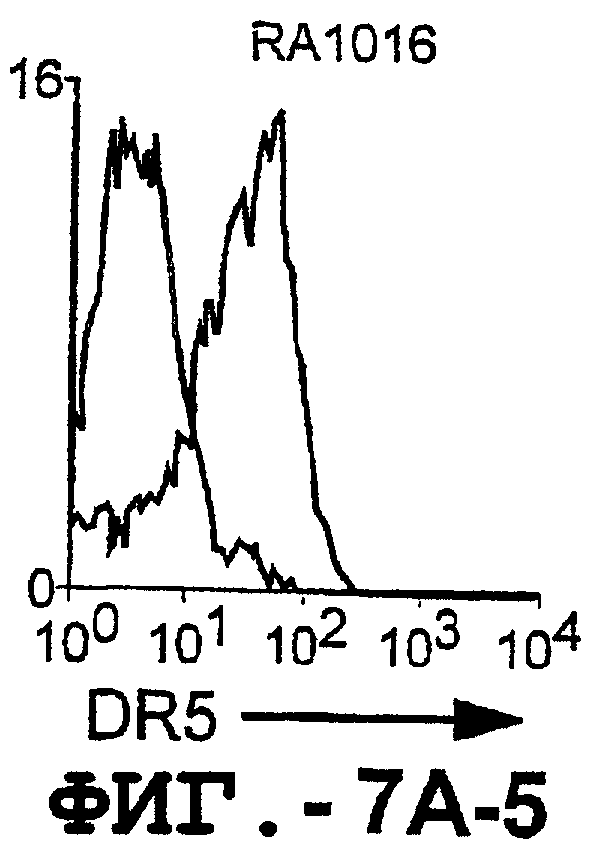
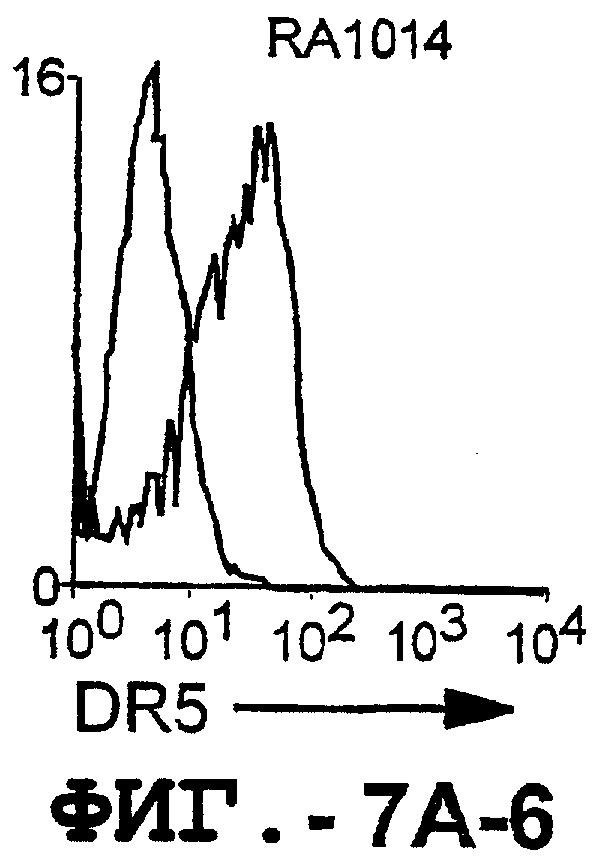
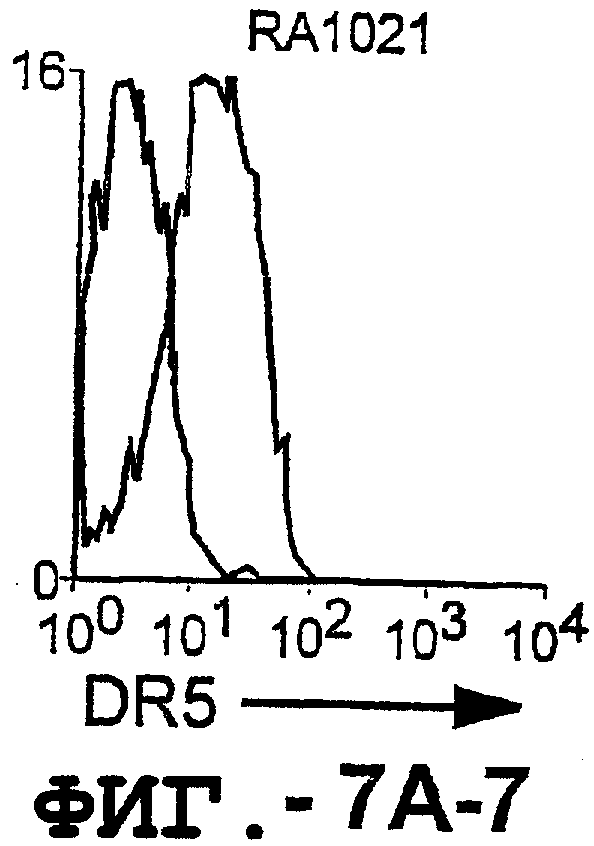
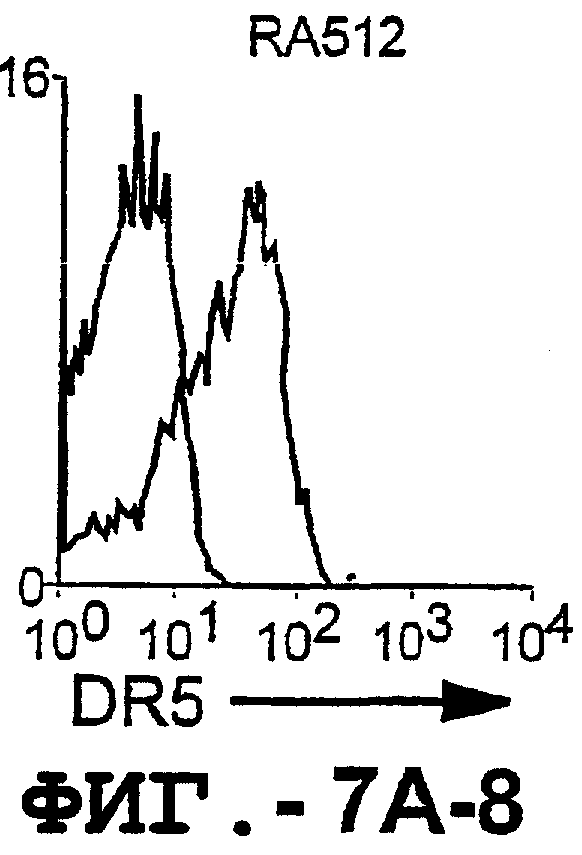

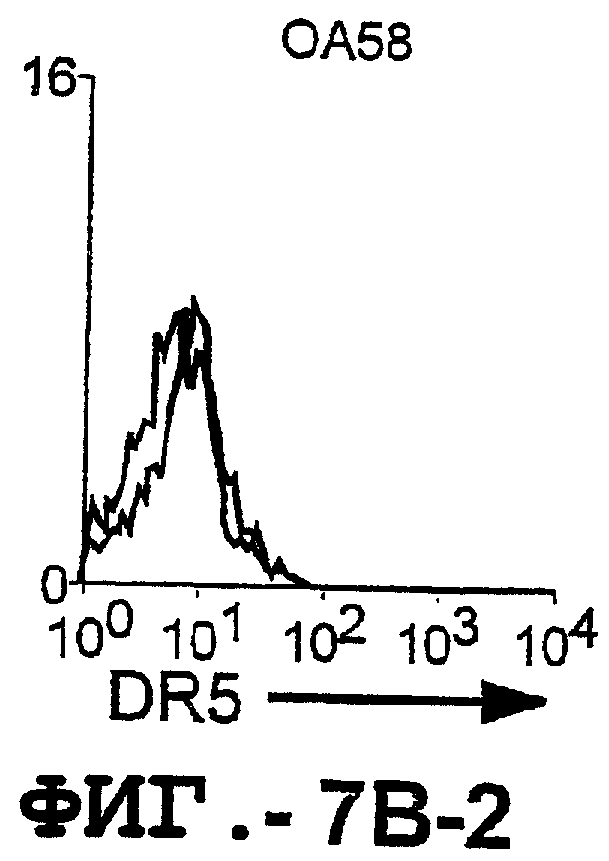
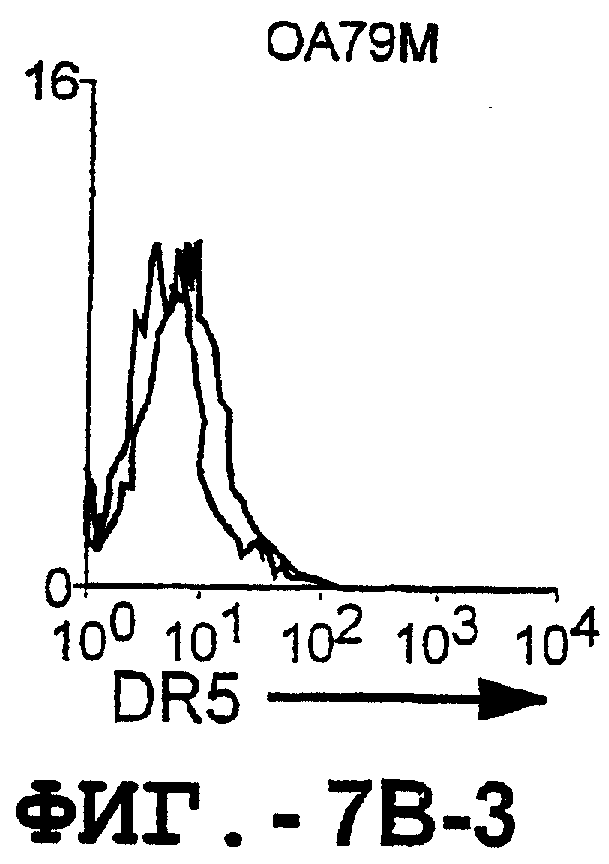

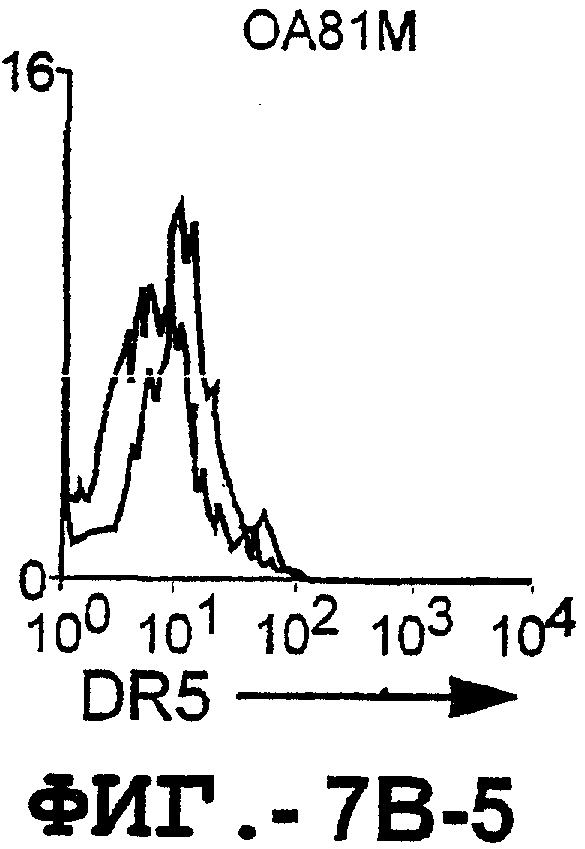
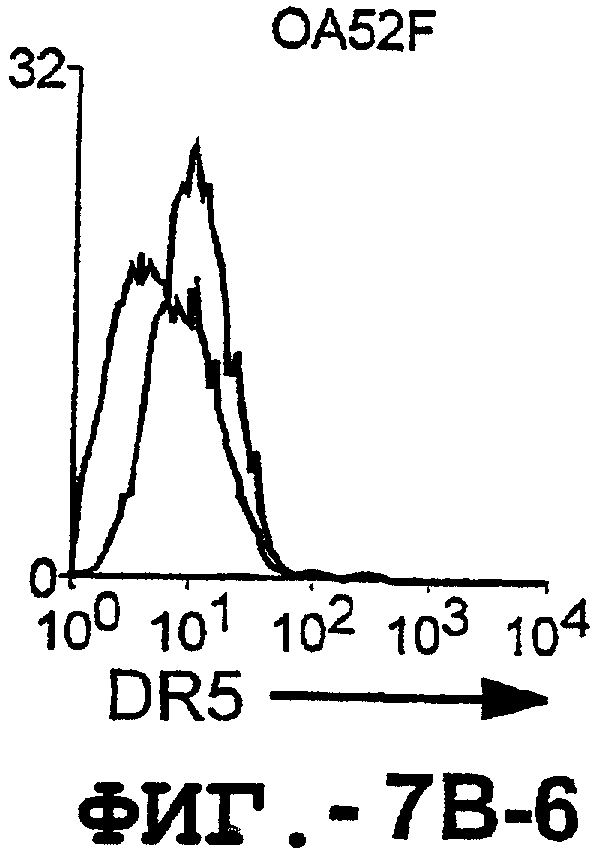


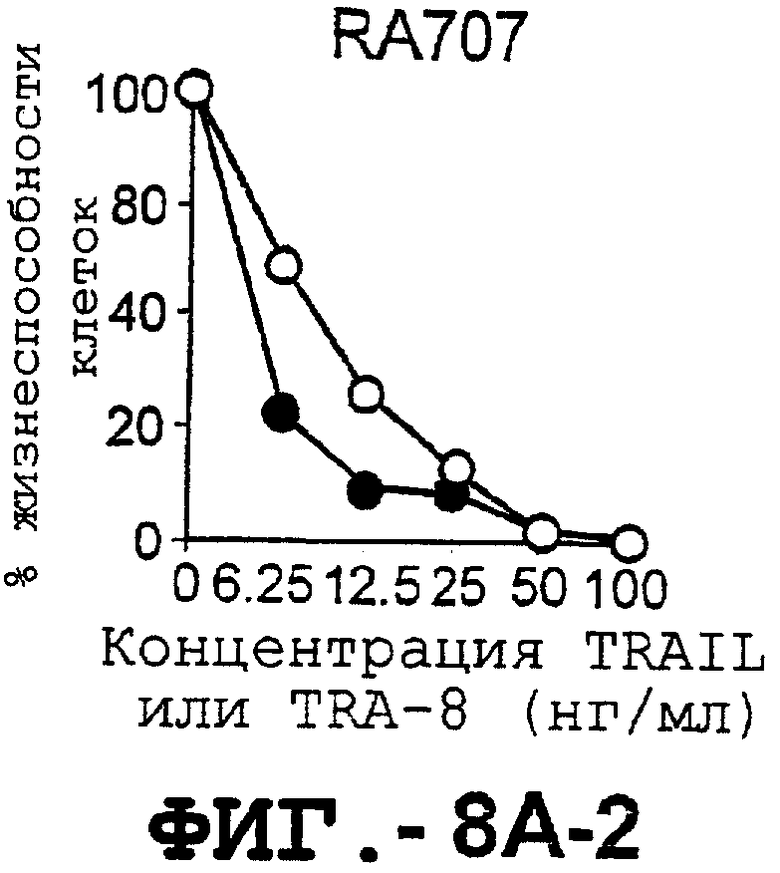


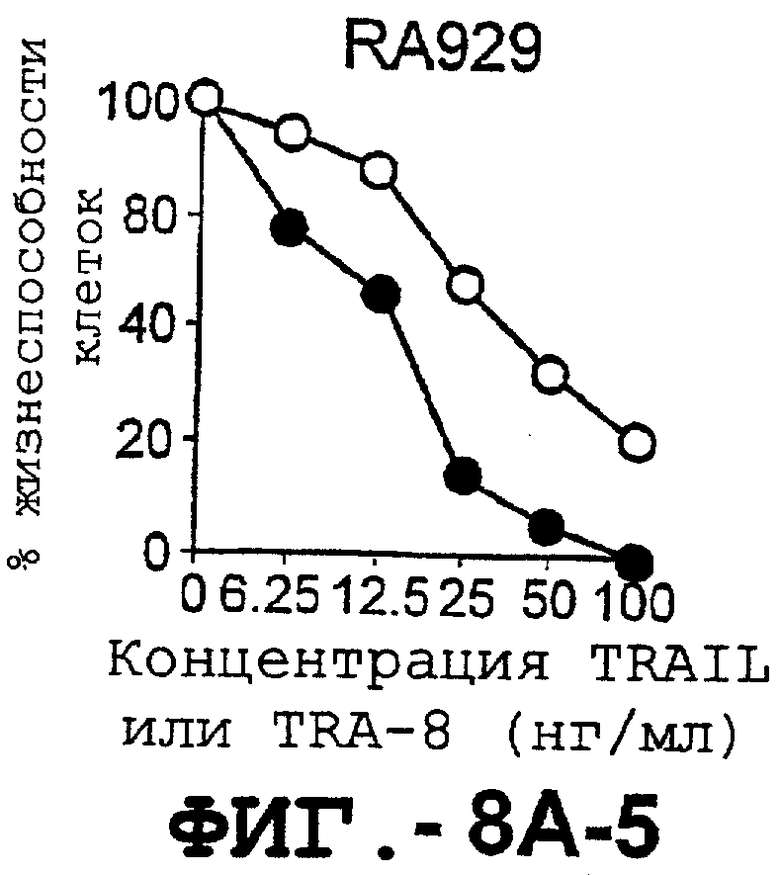
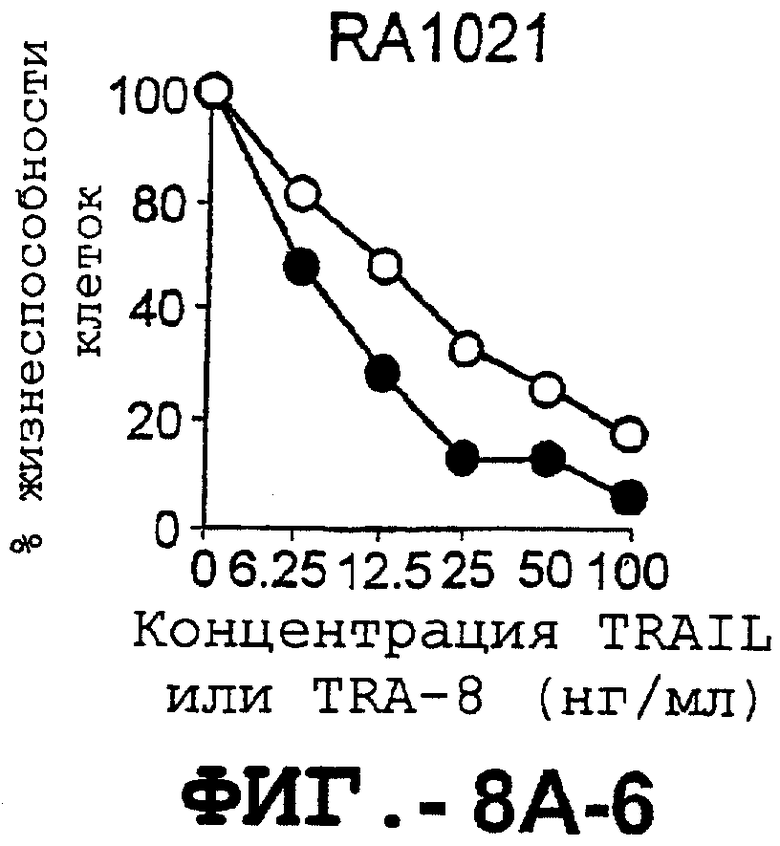
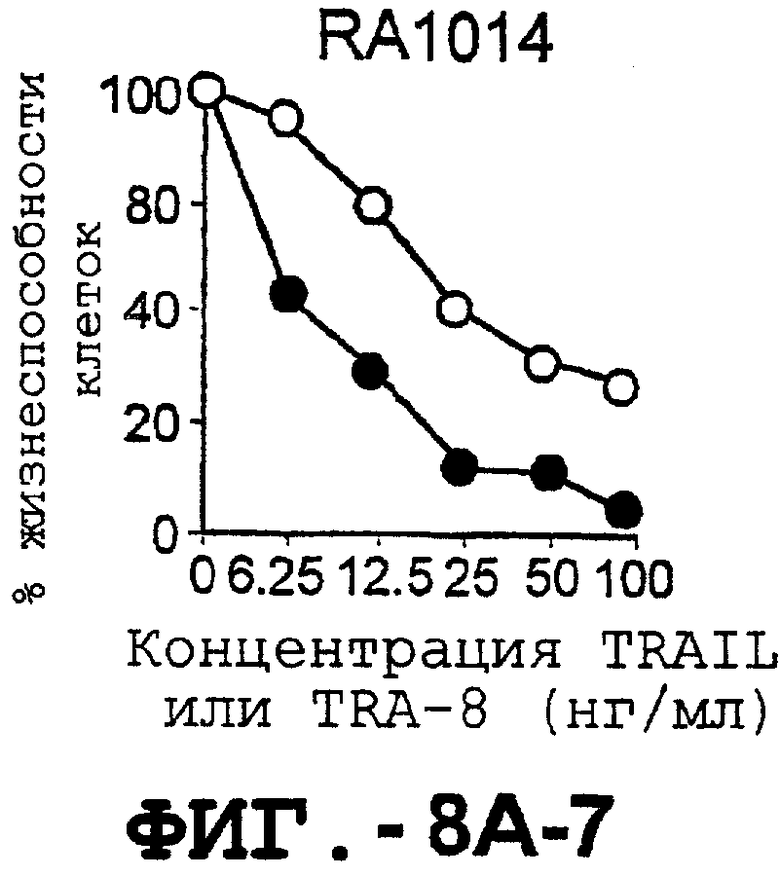
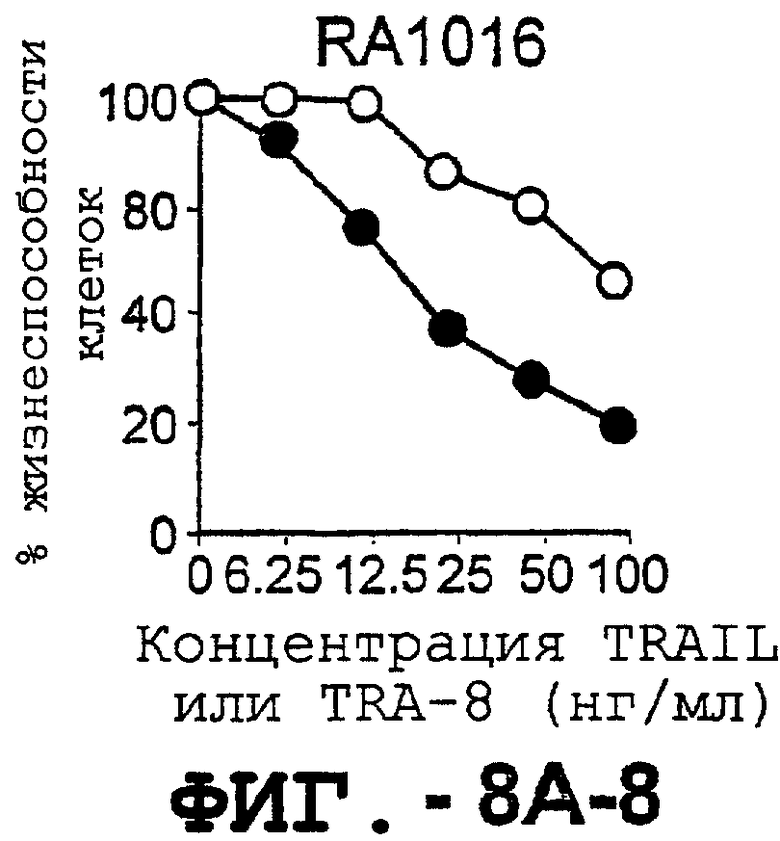
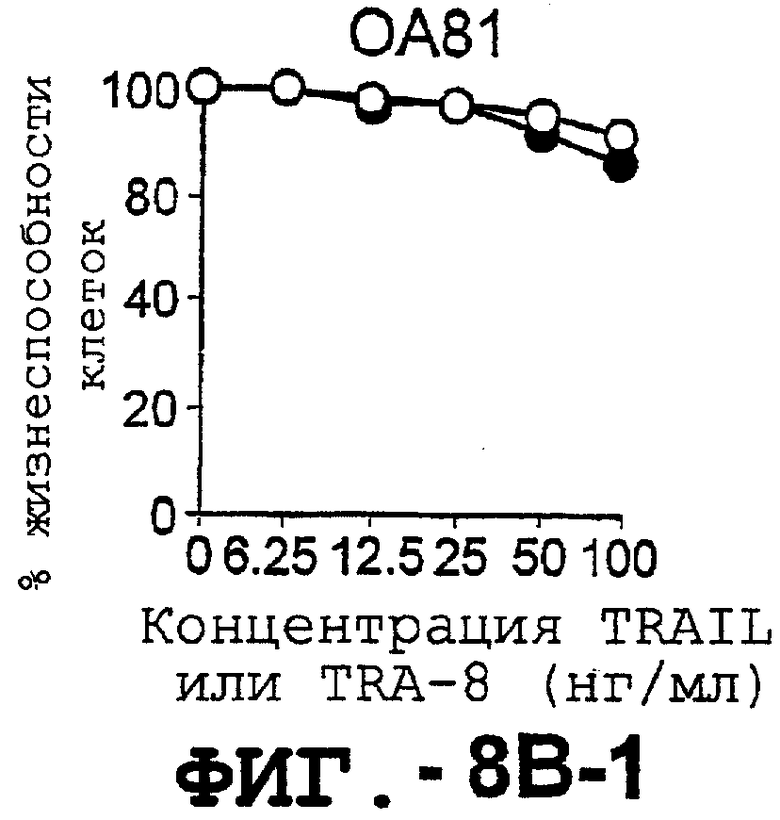

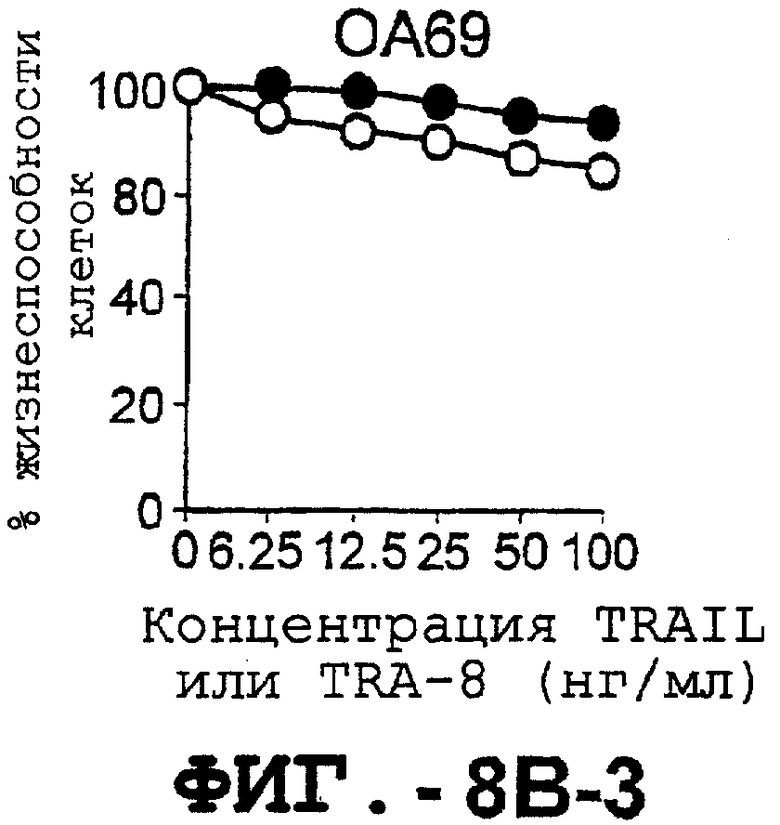


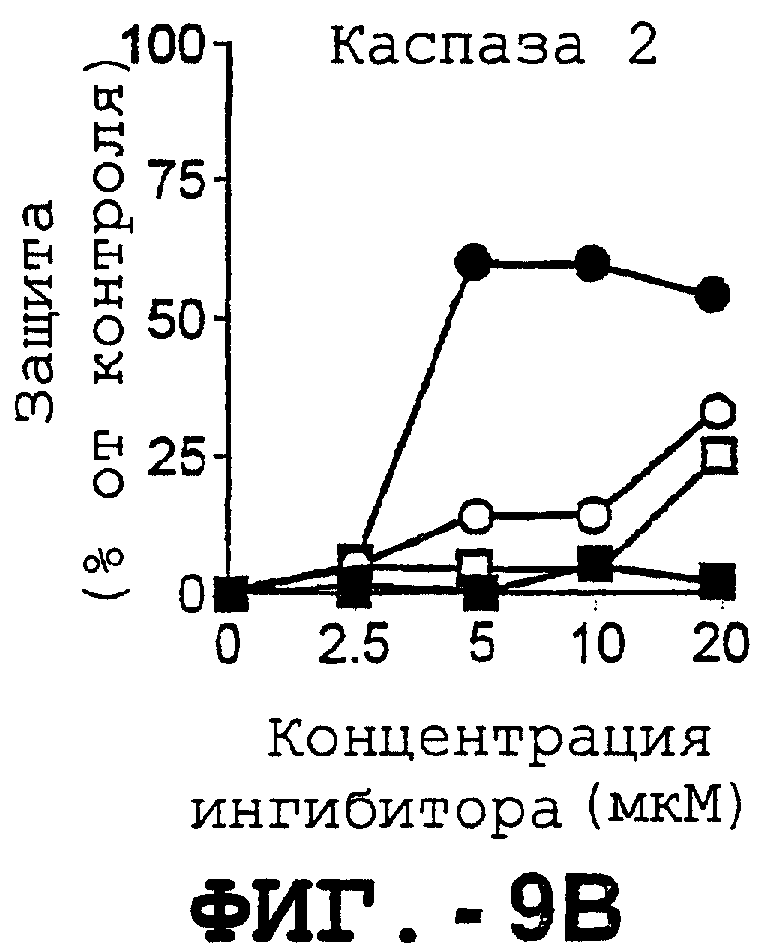

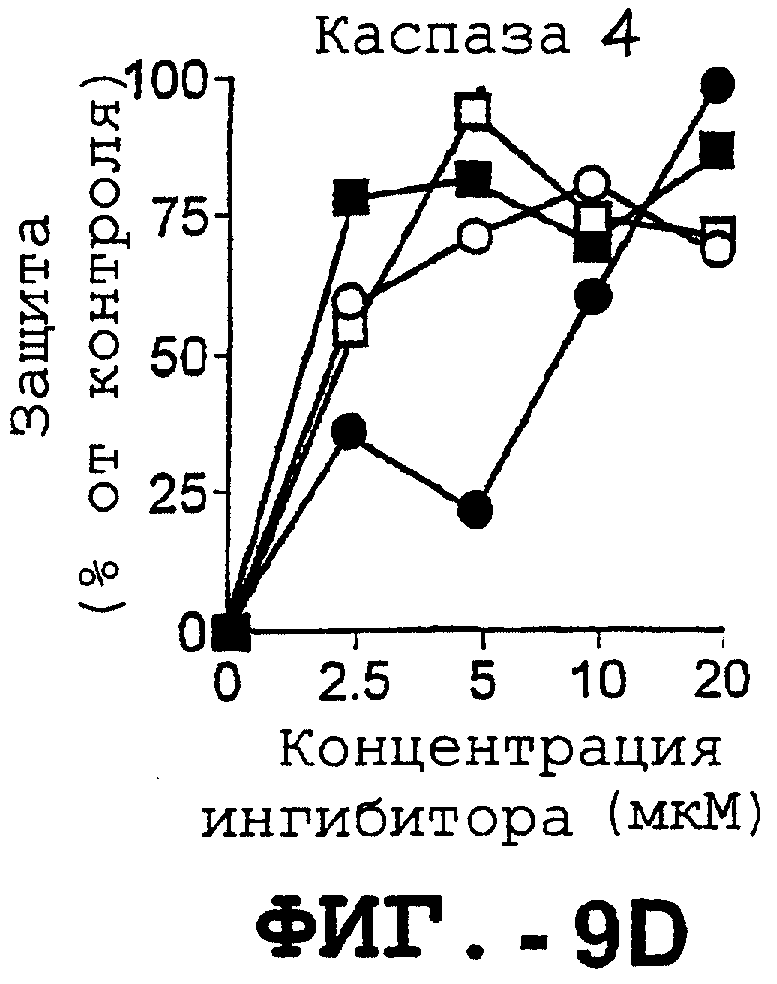


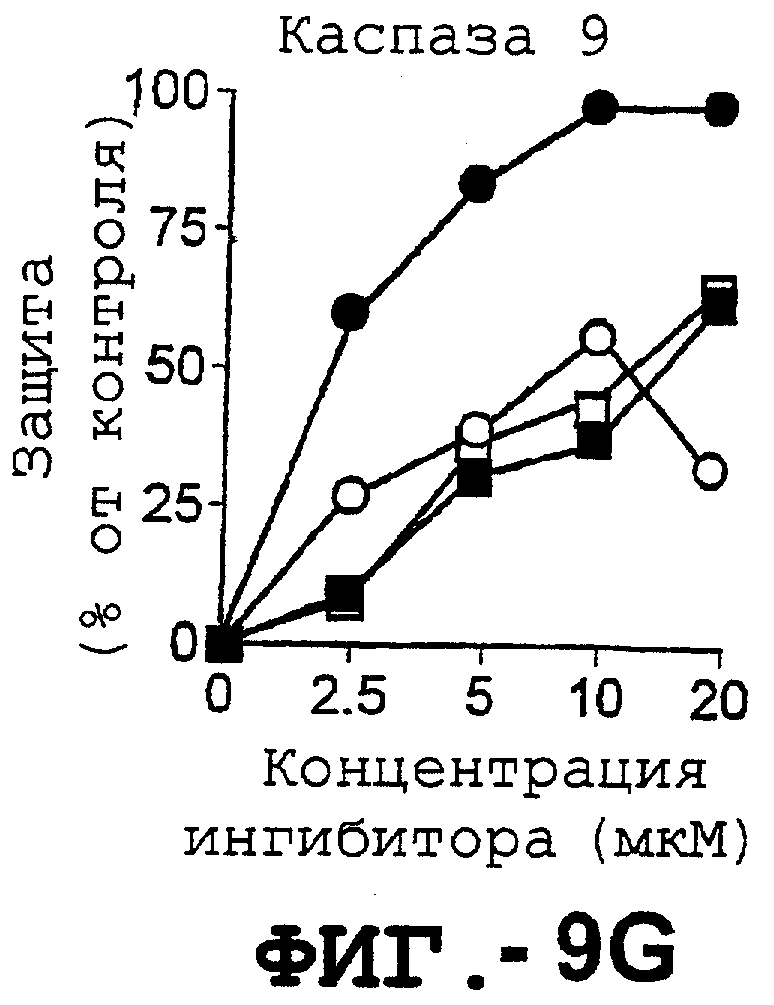
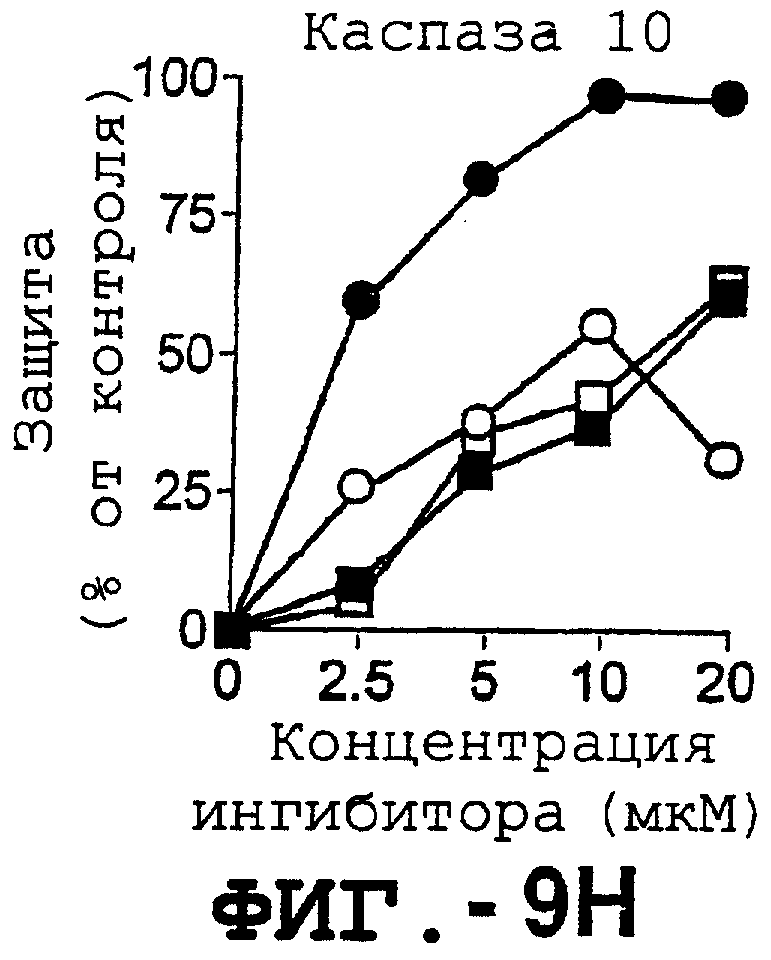
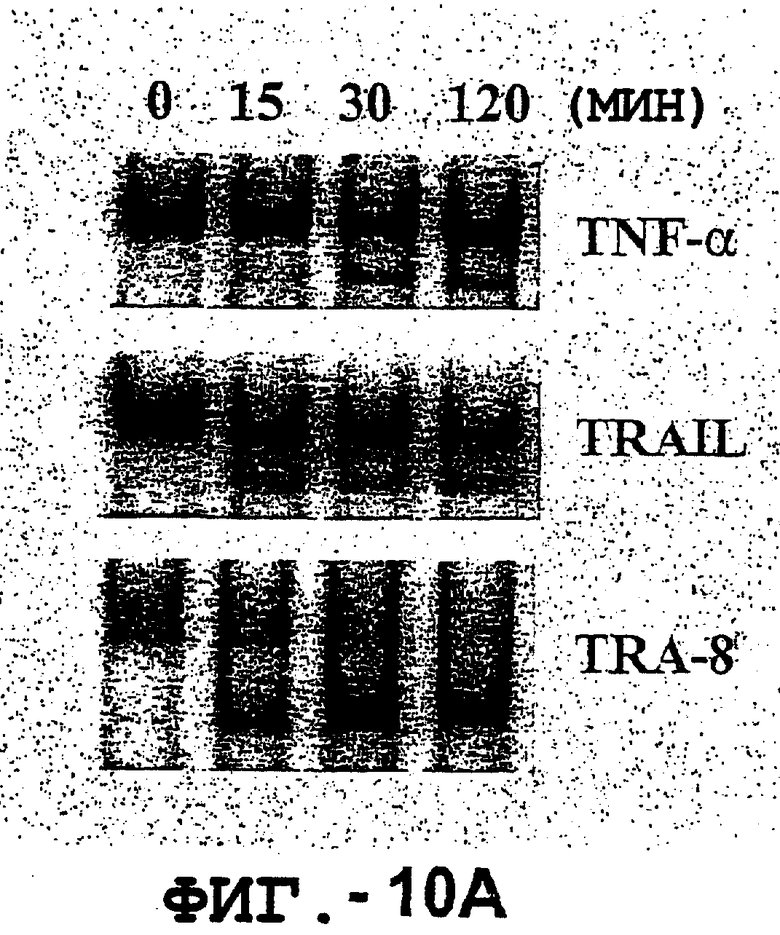
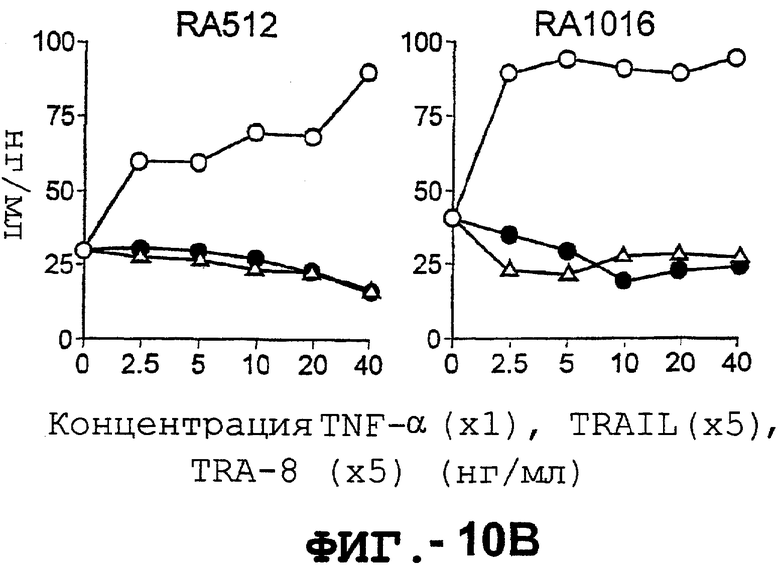
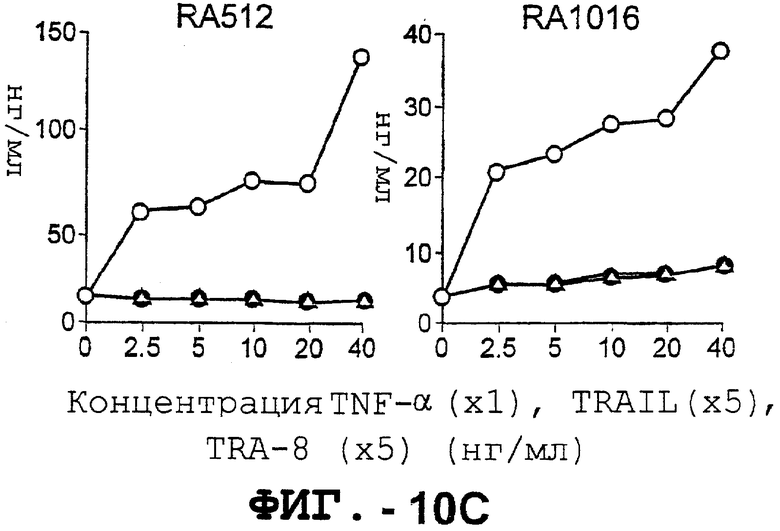
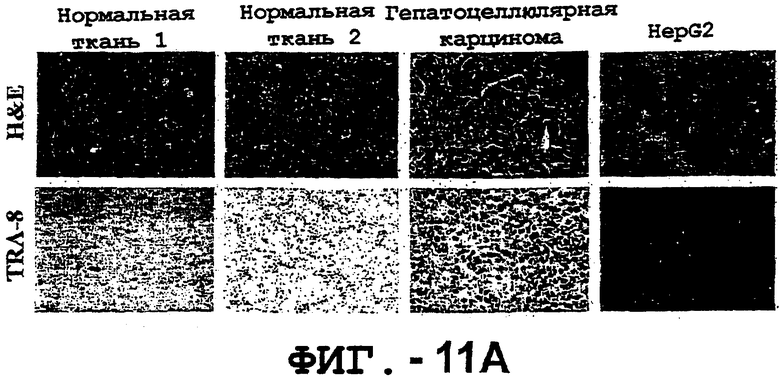
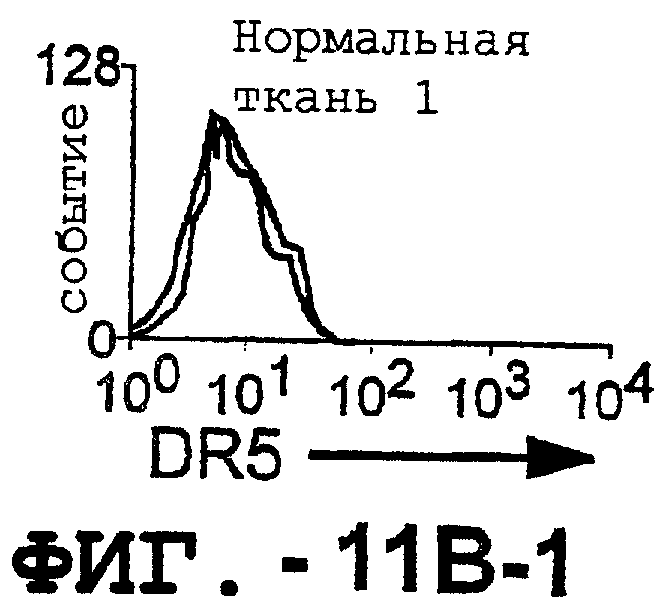

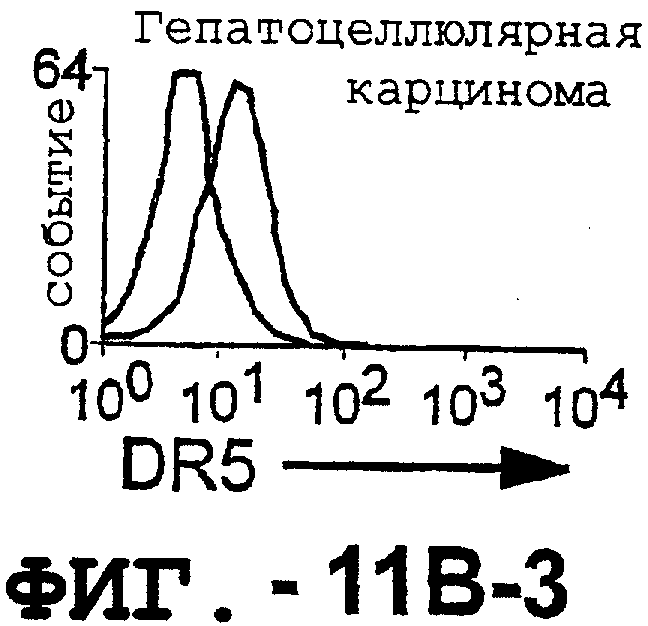

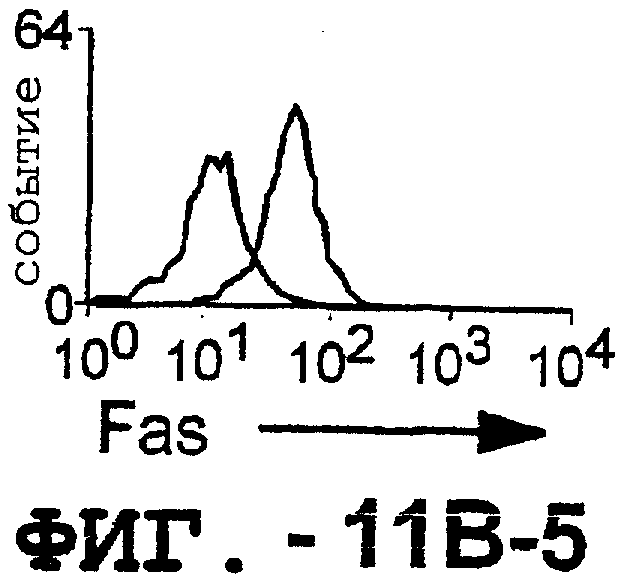
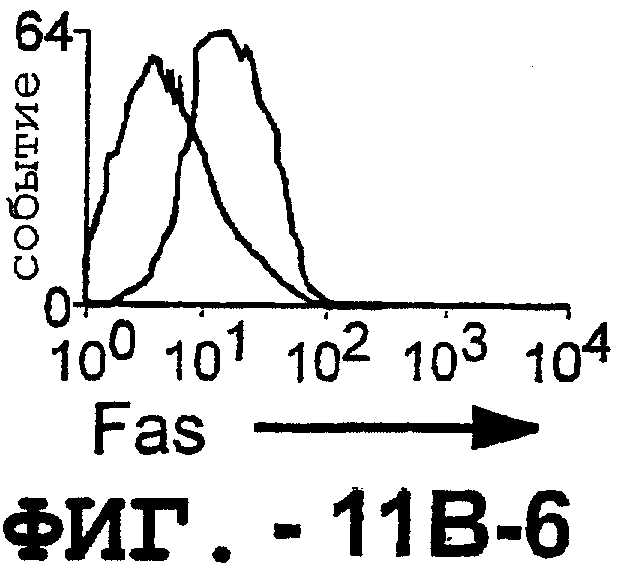
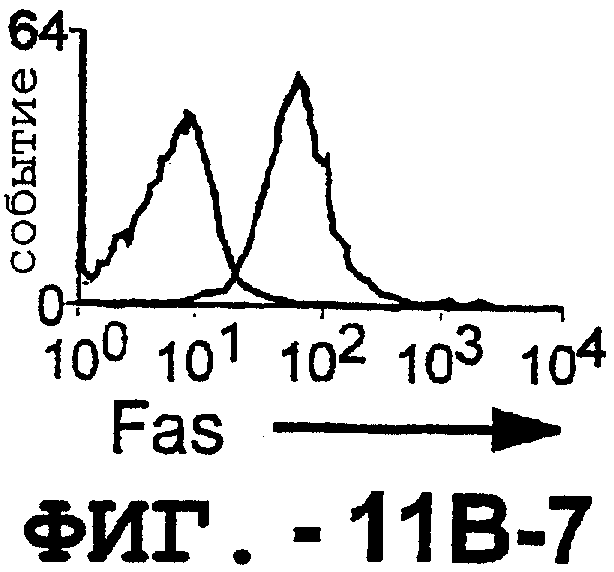
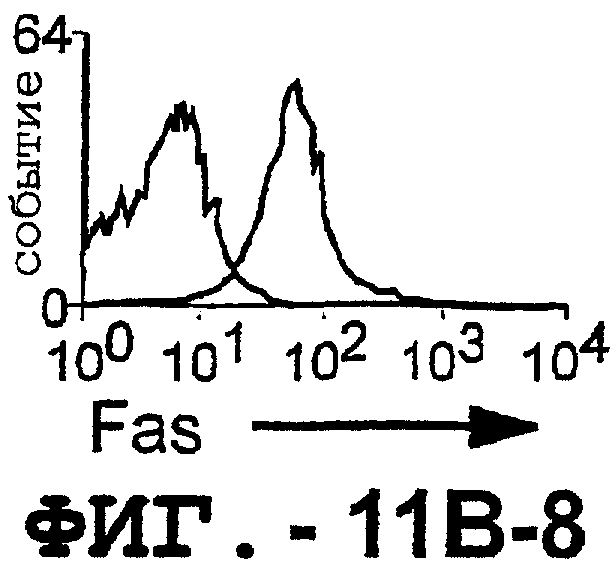

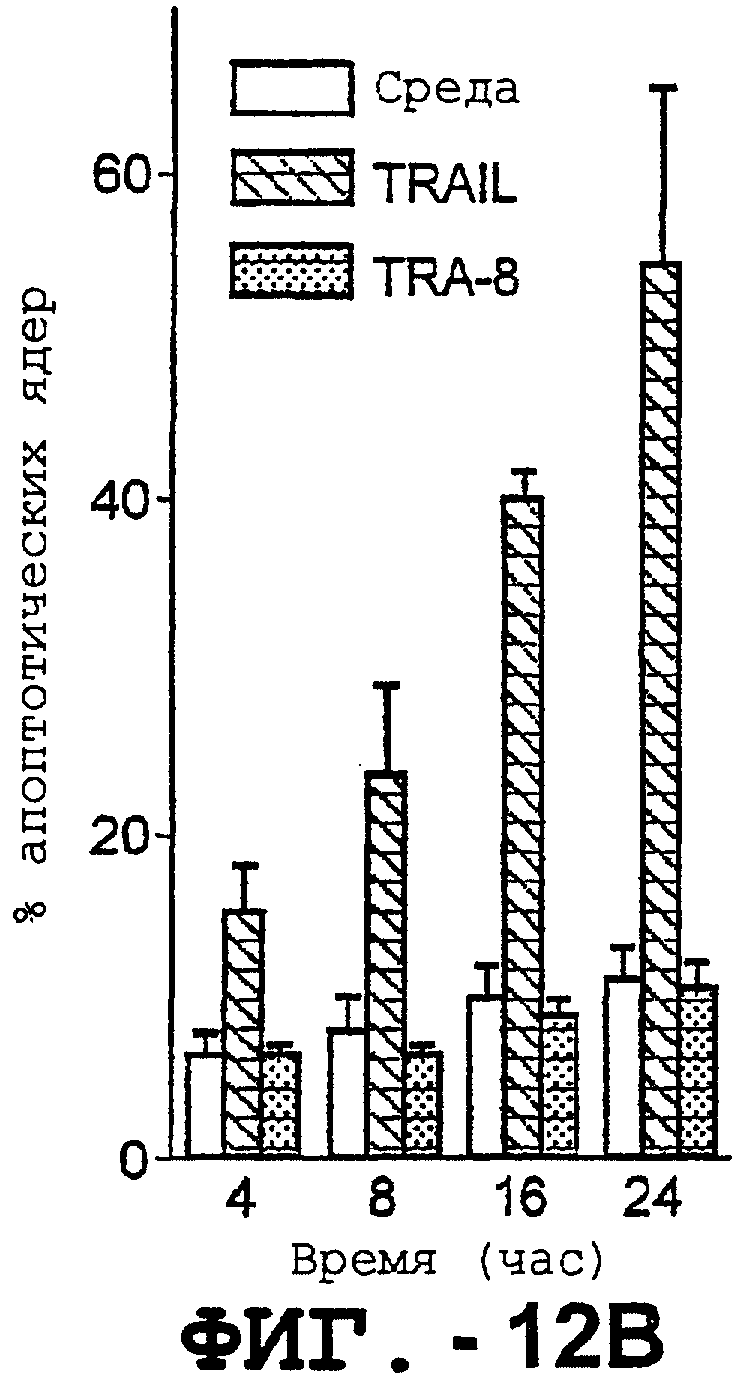
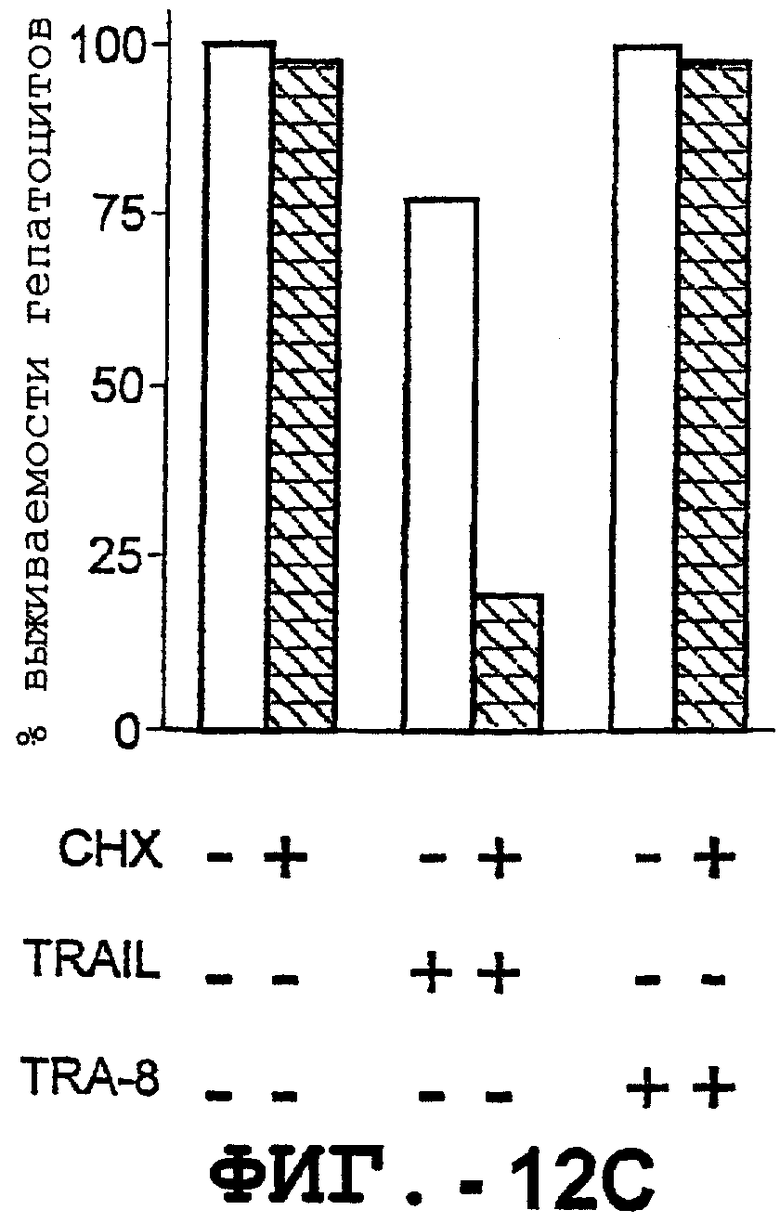
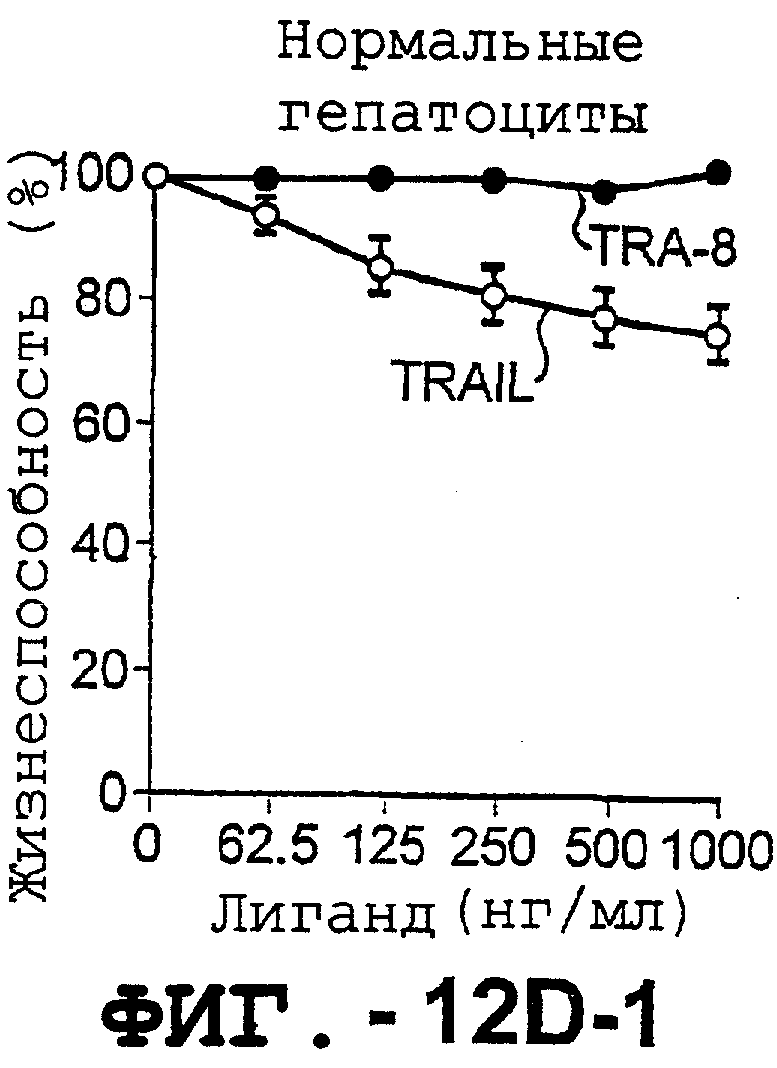
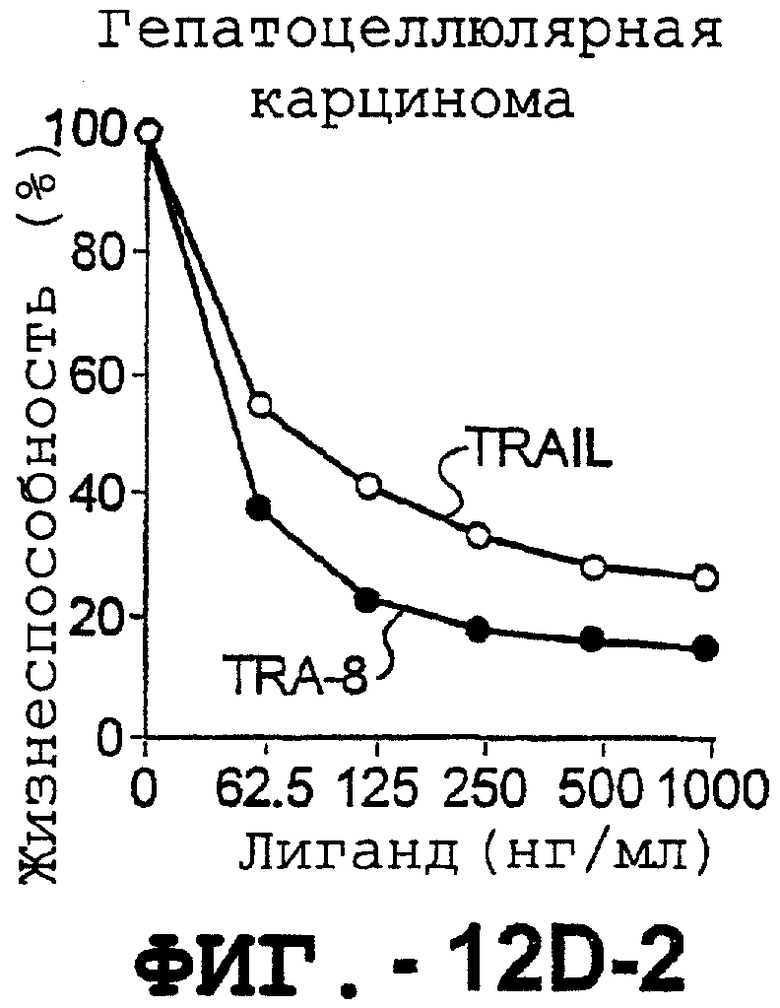
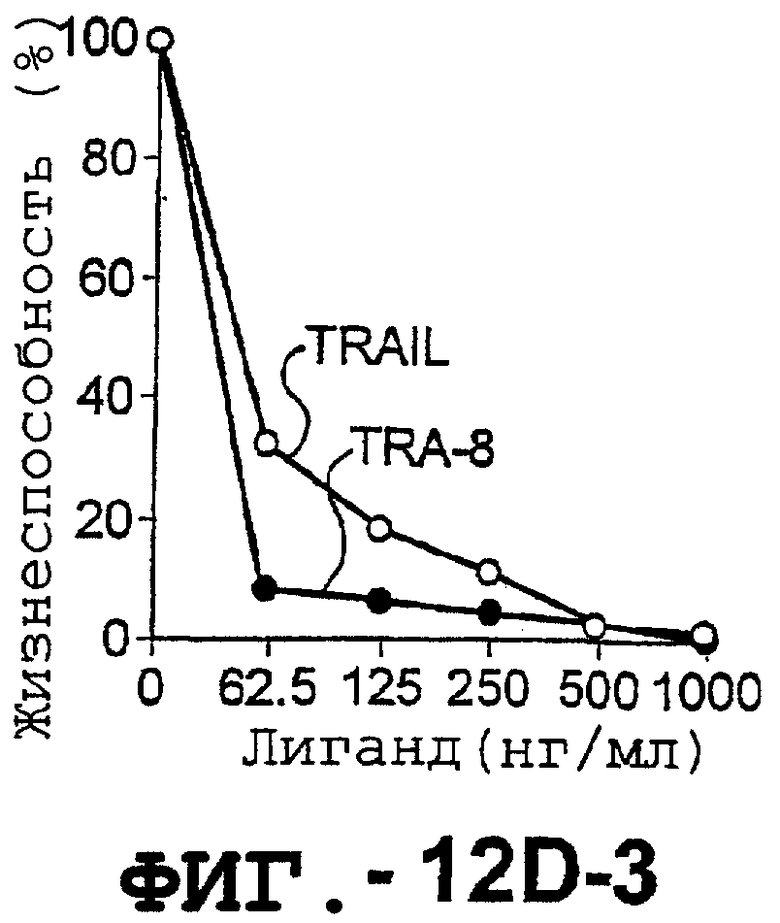

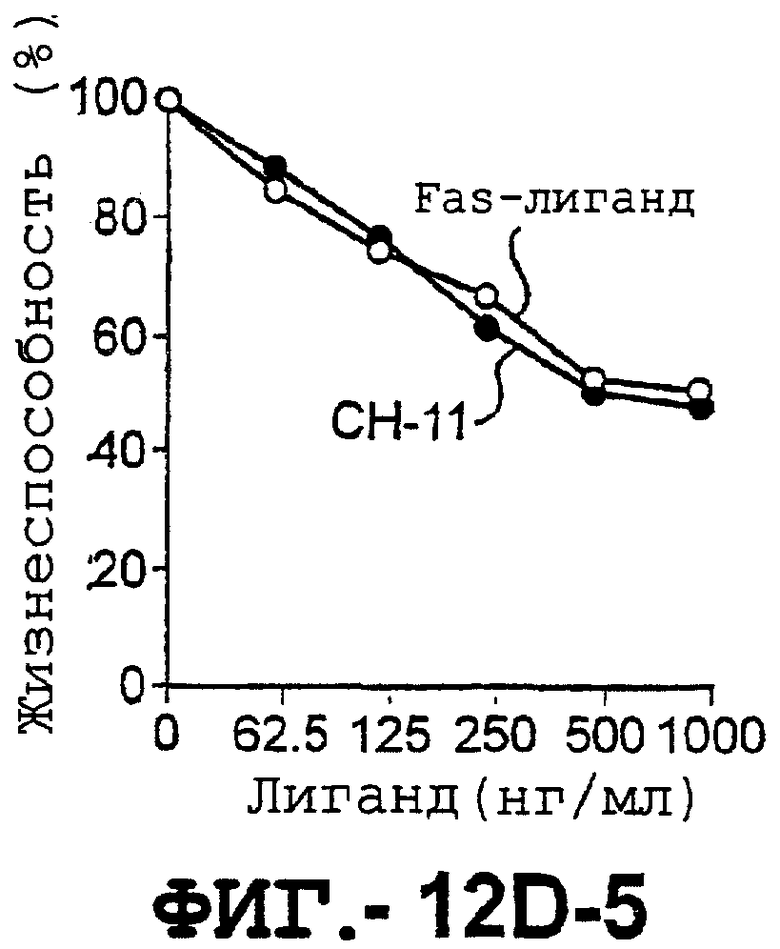
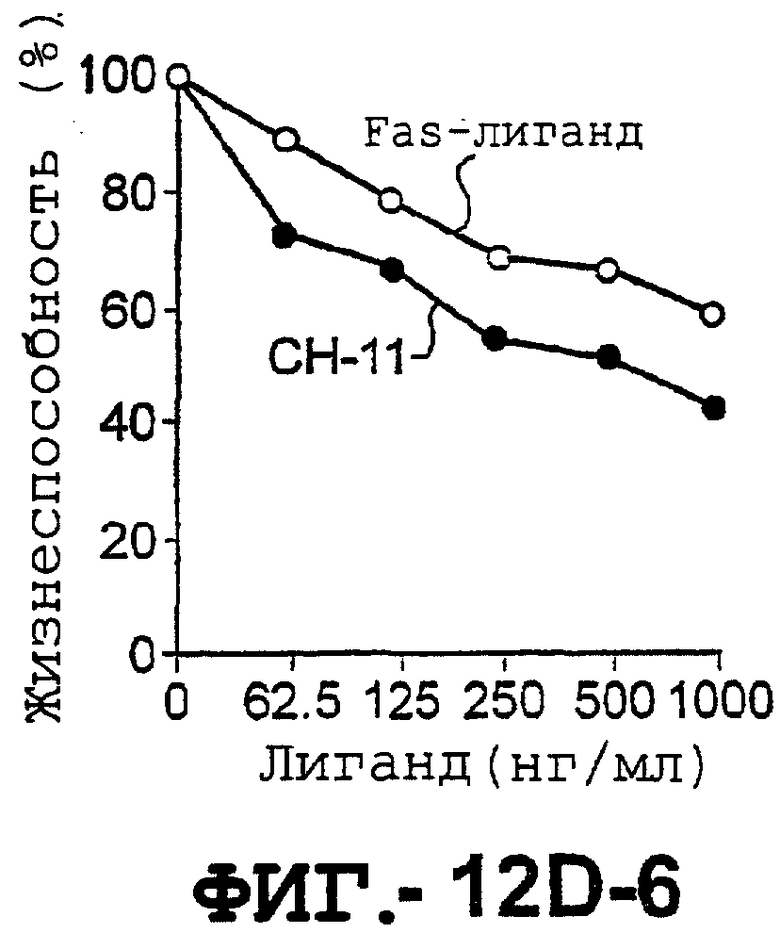
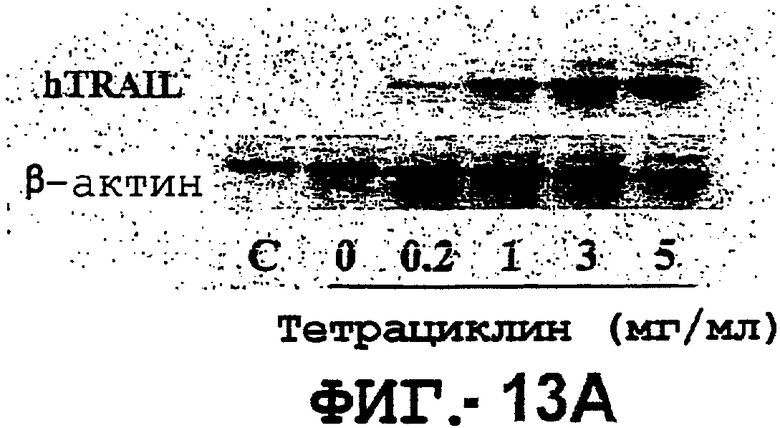
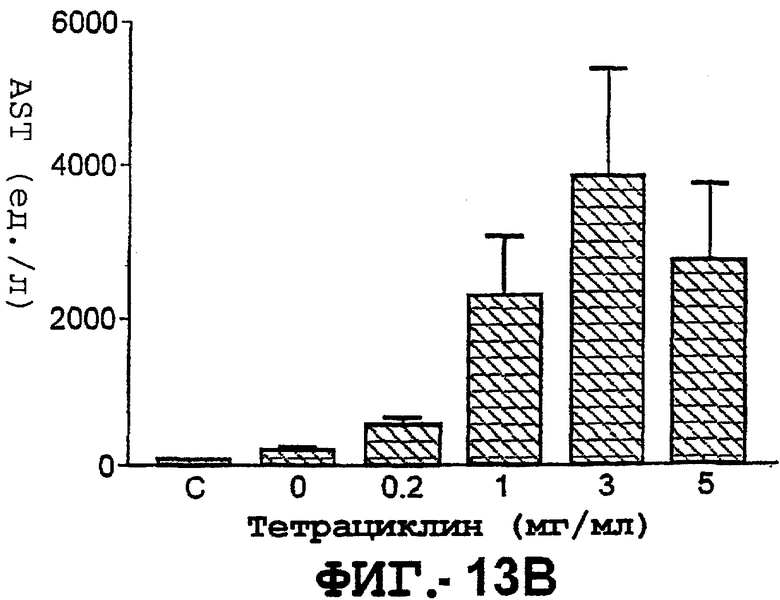
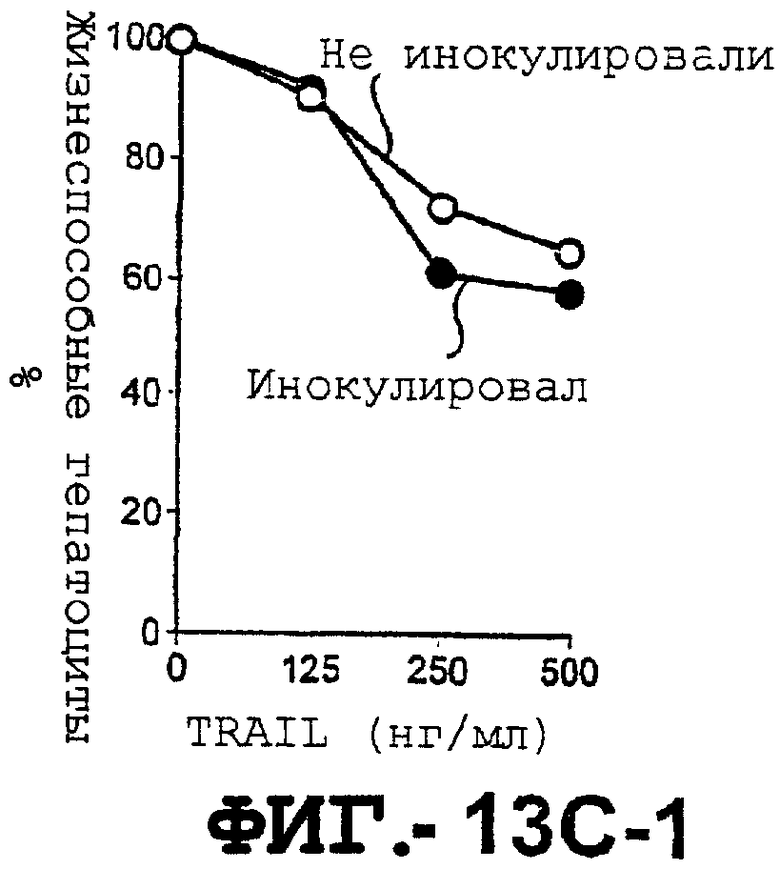
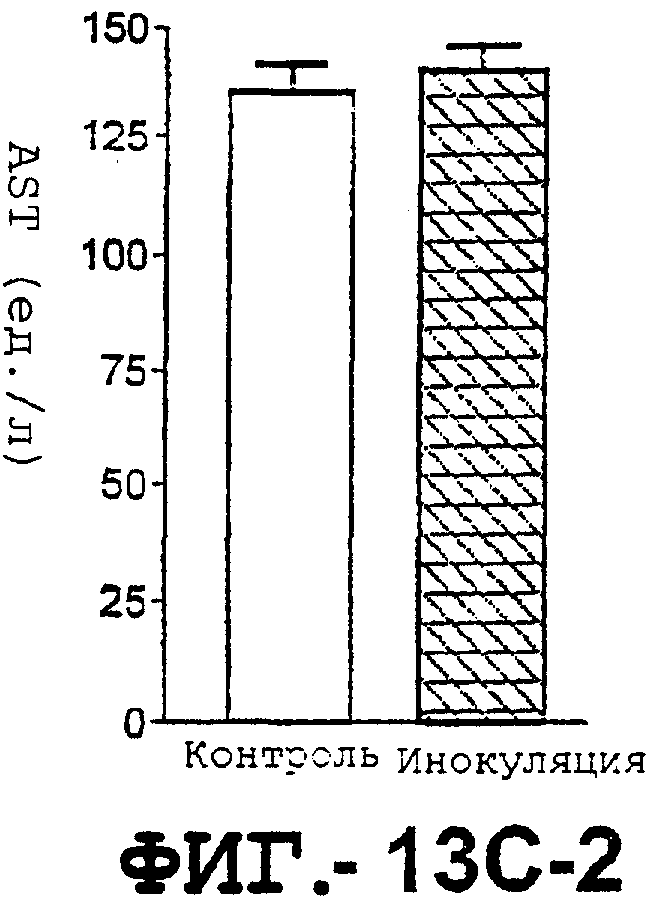
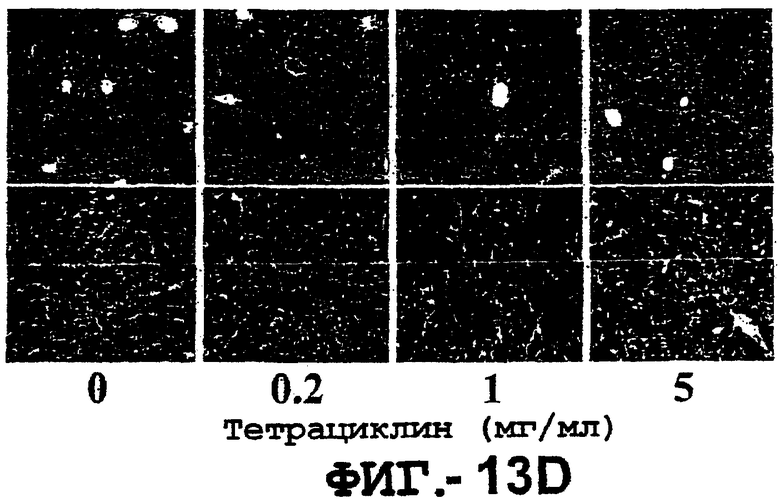
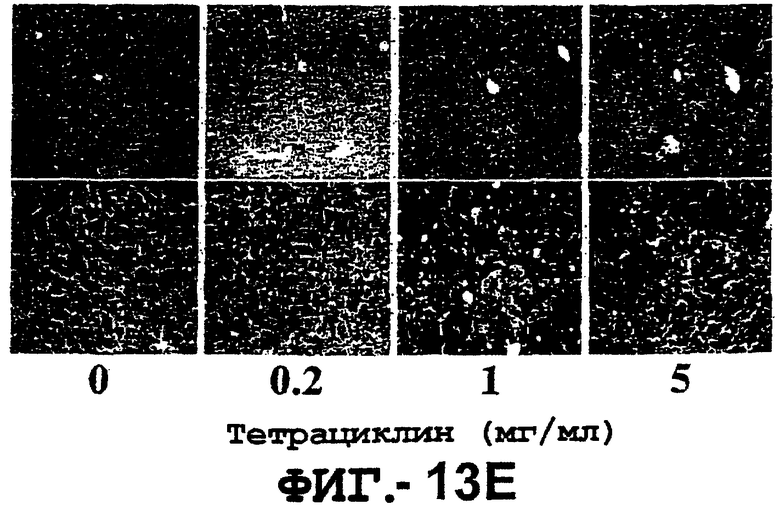

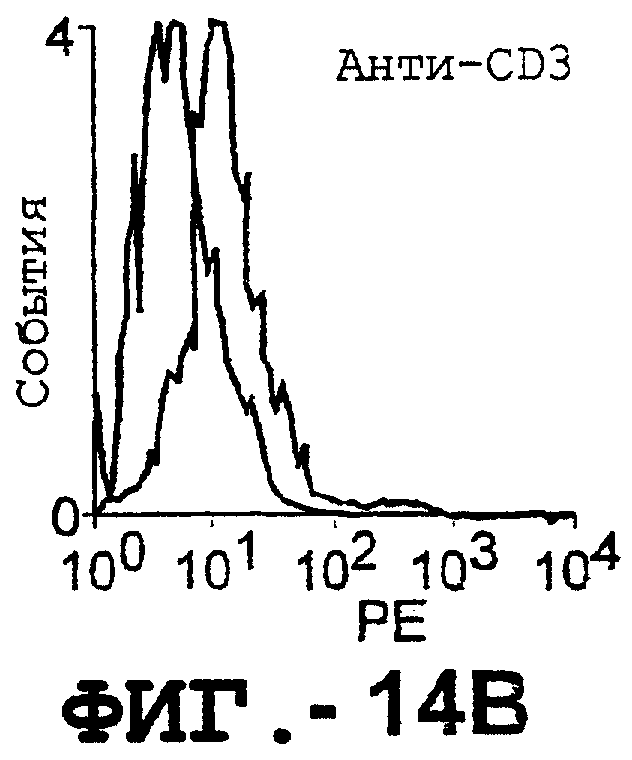
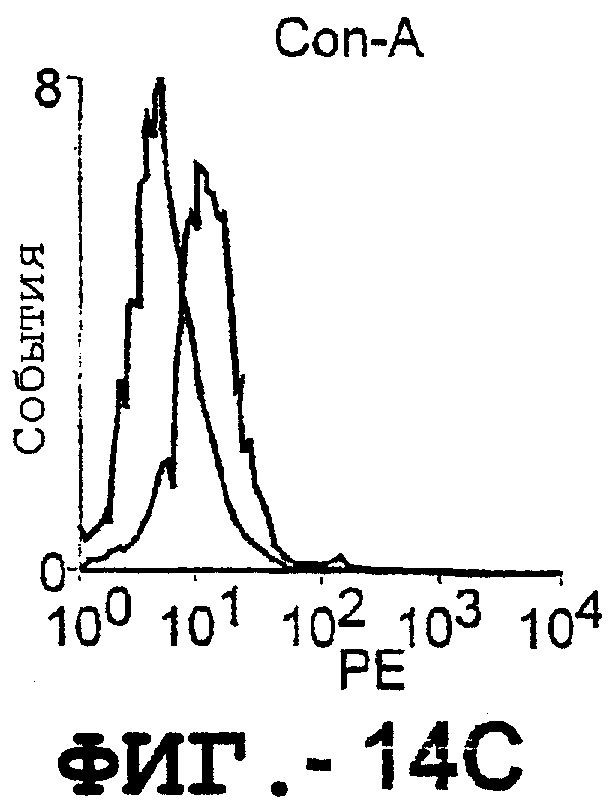

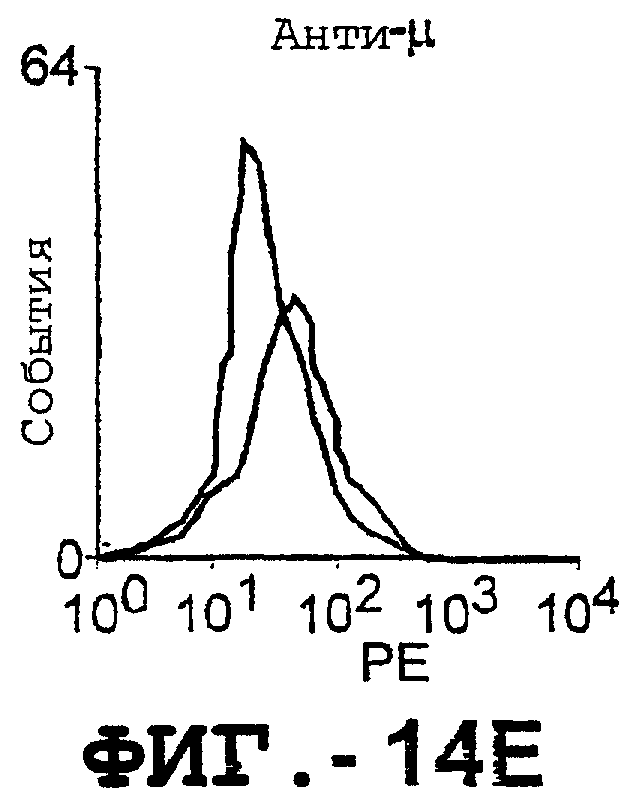
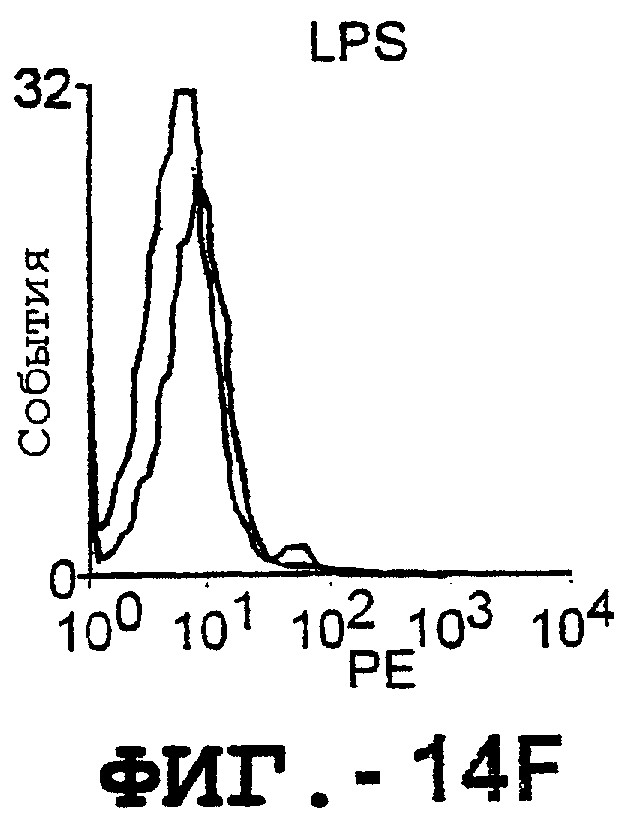
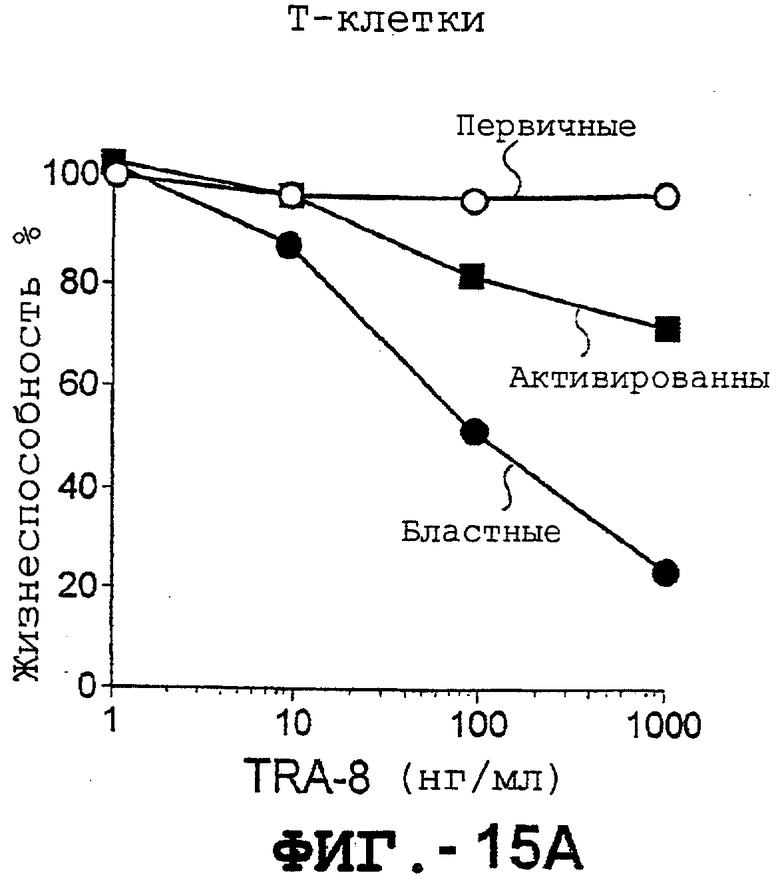
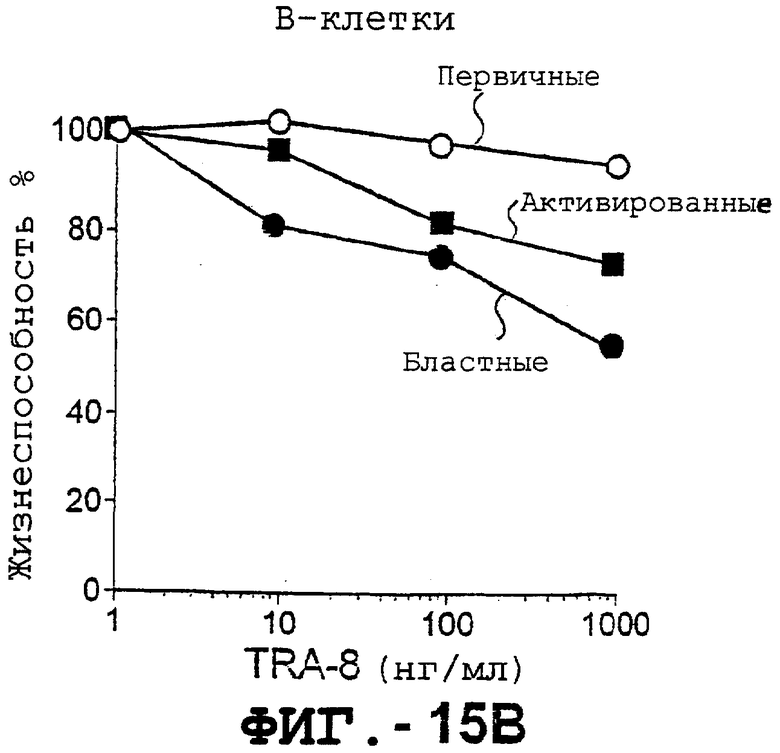
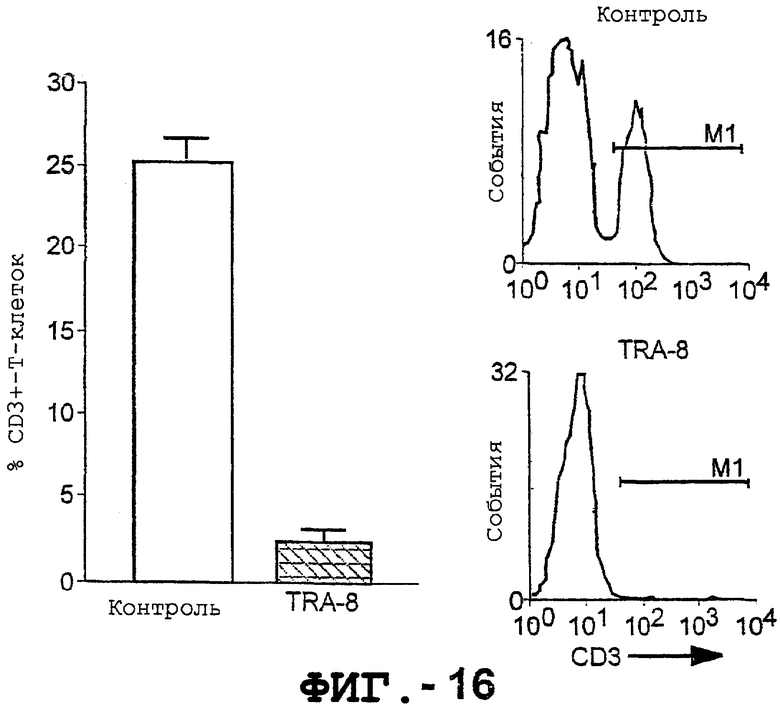
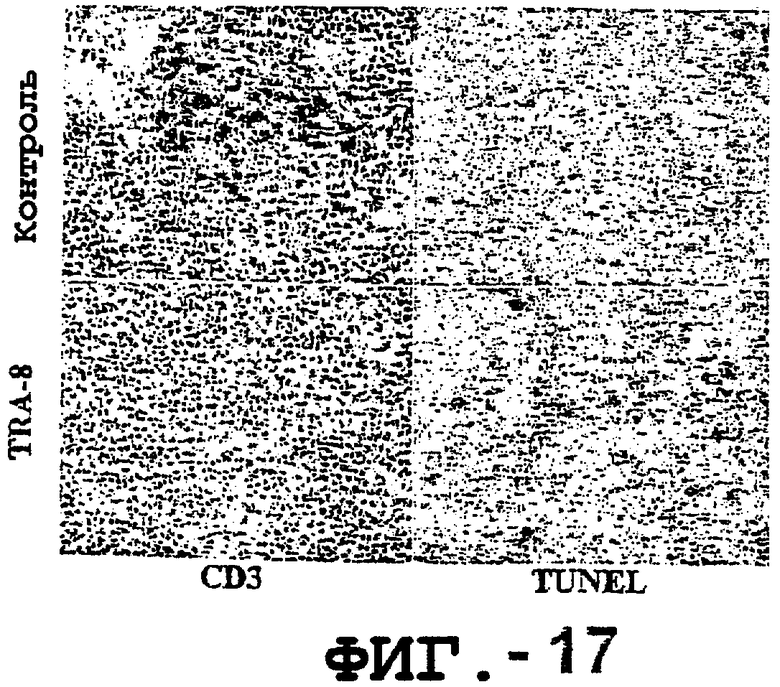
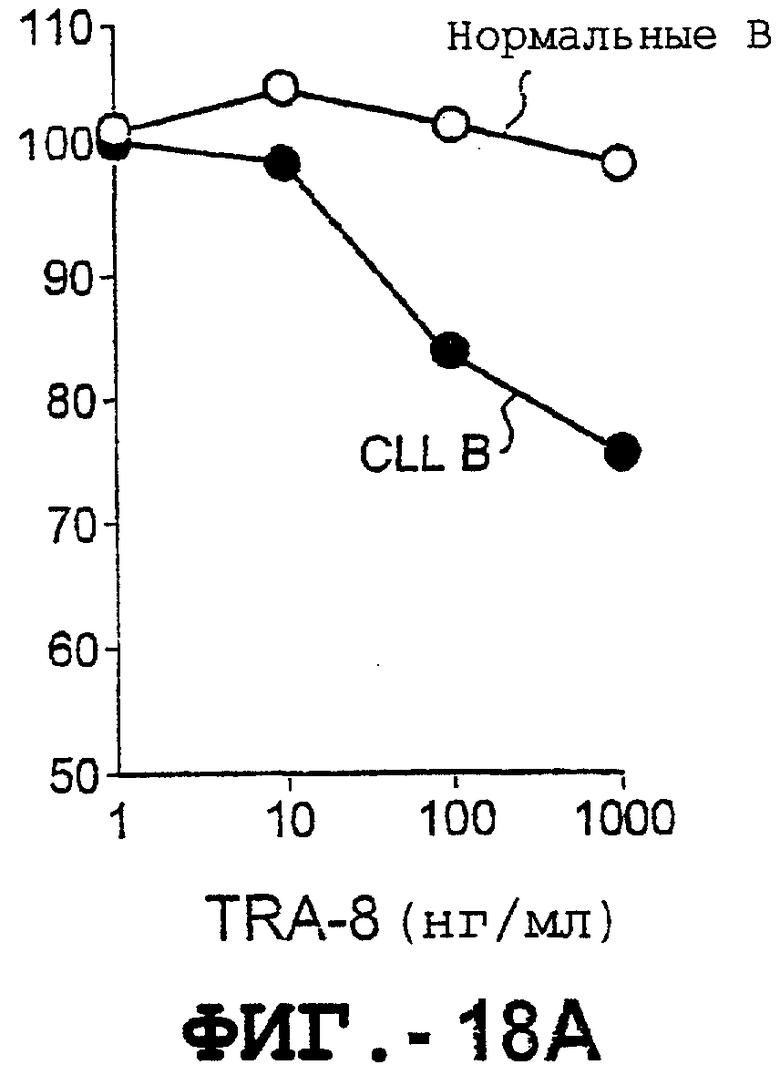
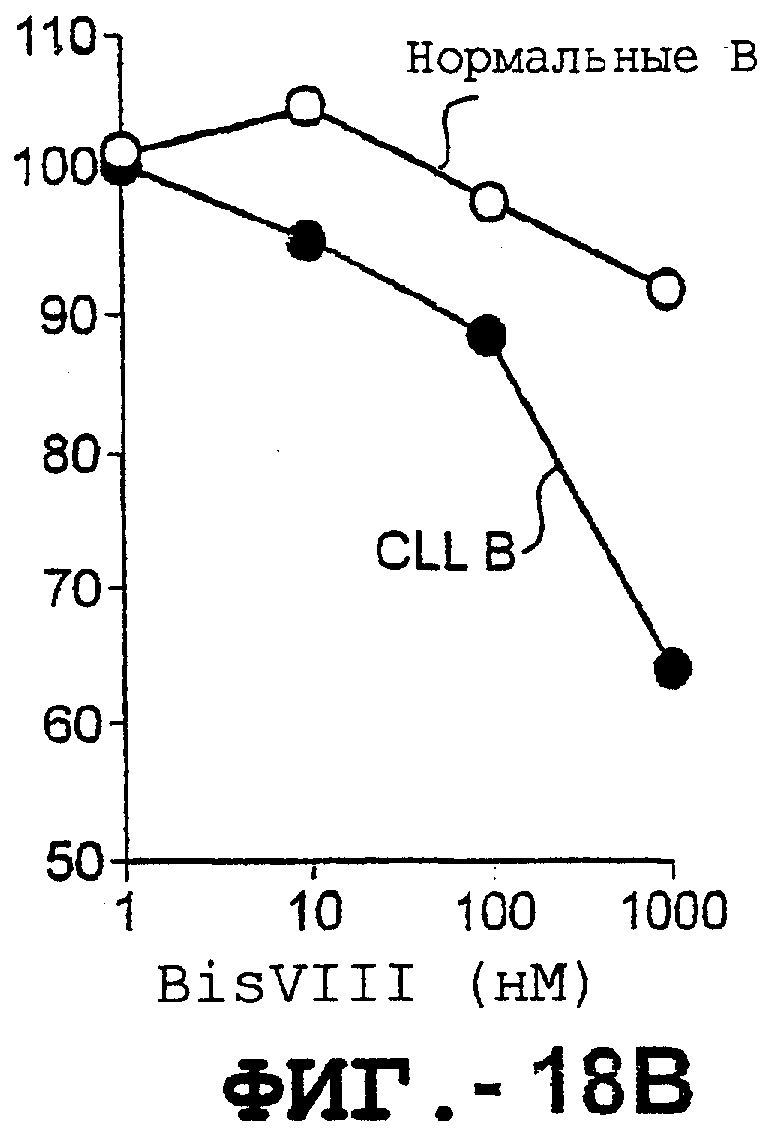

Изобретение относится к области биотехнологии, конкретно к получению моноклональных антител, и может быть использовано в медицинских и диагностических целях. С помощью гибридомной технологии получено моноклональное антитело, которое селективно связывается с TRAIL-рецептором DR5 и не связывается с TRAIL-рецептором DR4, DcR1 или DcR2. Антитело выявили при тестировании в системах in vitro - по способности индуцировать в растворимой форме при концентрациях менее 1 мкг/мл, гибель клеток-мишеней, экспрессирующих DR5, и in vivo - по способности проявлять туморицидную активность в отношении опухолевых клеток, экспрессирующих DR5. Моноклональное антитело воспроизводят путем трансгенных технологий, включающих культивирование рекомбинантных штаммов-продуцентов Е.coli. Антитело в терапевтических количествах используют в терапии воспалительных, аутоиммунных и связанных с апоптозом заболеваний, а также в комплексном лечении онкологических больных. Полученное моноклональное антитело в концентрациях менее 1 мкг/мл позволяет селективно индуцировать гибель или ингибировать пролиферацию клеток-мишеней, экспрессирующих DR5, 43 н. и 72 з.п. ф-лы, 18 ил., 4 табл.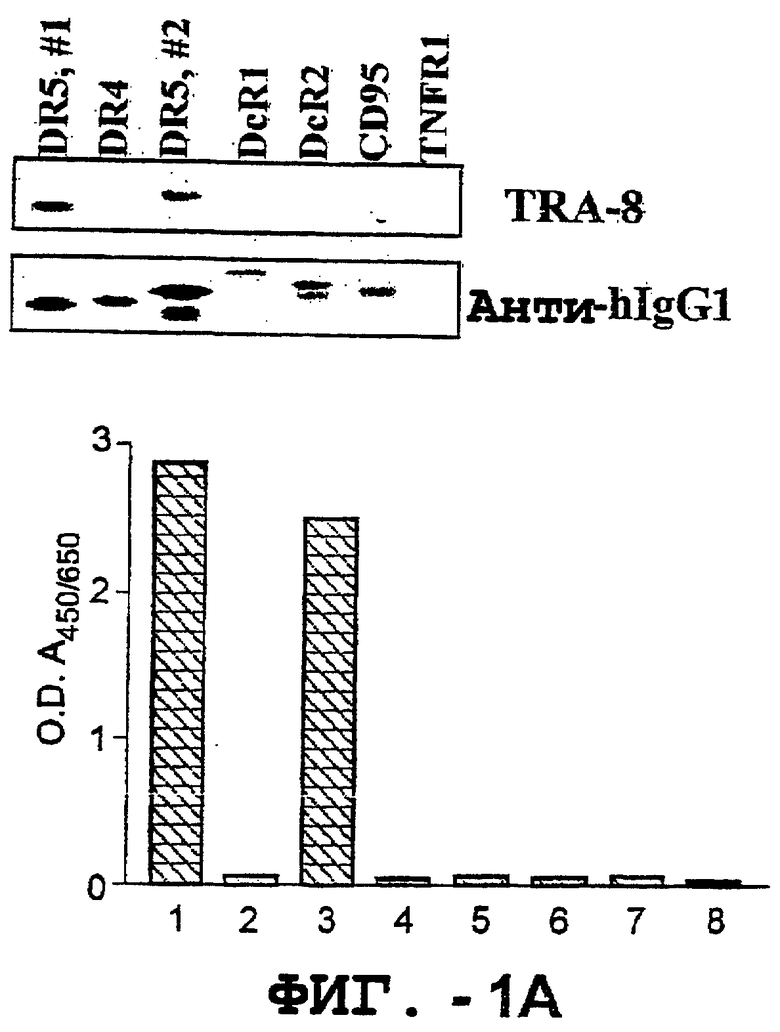
(a) тяжелую цепь, которая содержит константную и вариабельную области, при этом вариабельная область выбрана из группы, состоящей из
аминокислотных остатков 1-119 SEQ ID NO:31 или их функциональных эквивалентов;
аминокислотных остатков 1-119 SEQ ID NO:56 или их функциональных эквивалентов;
аминокислотных остатков 1-119 SEQ ID NO:59 или их функциональных эквивалентов;
аминокислотных остатков 1-119 SEQ ID NO:60 или их функциональных эквивалентов;
аминокислотных остатков 1-119 SEQ ID NO:61 или их функциональных эквивалентов, и
(b) легкую цепь, которая содержит константную и вариабельную области, при этом вариабельная область выбрана из группы, состоящей из
аминокислотных остатков 1-108 SEQ ID NO:46 или их функциональных эквивалентов;
аминокислотных остатков 1-108 SEQ ID NO:72 или их функциональных эквивалентов;
аминокислотных остатков 1-108 SEQ ID NO:73 или их функциональных эквивалентов;
аминокислотных остатков 1-108 SEQ ID NO:74 или их функциональных эквивалентов;
аминокислотных остатков 1-108 SEQ ID NO:75 или их функциональных эквивалентов и
аминокислотных остатков 1-108 SEQ ID NO:76 или их функциональных эквивалентов.
(a) тяжелую цепь, которая содержит вариабельную область, выбранную из группы, состоящей из
вариабельной области, кодируемой нуклеотидной последовательностью вставки вектора, содержащегося в E.coli JM109/pHB14 (FERM BP-7556), или ее функционального эквивалента;
вариабельной области, кодируемой нуклеотидной последовательностью вставки вектора, содержащегося в E.coli JM109/pHA15 (FERM BP-7555), или ее функционального эквивалента;
вариабельной области, кодируемой нуклеотидной последовательностью вставки вектора, содержащегося в E.coli JM109/pHC10 (FERM BP-7557), или ее функционального эквивалента;
вариабельной области, кодируемой нуклеотидной последовательностью вставки вектора, содержащегося в E.coli JM109/pHD21 (FERM ВР-7558), или ее функционального эквивалента;
вариабельной области, кодируемой нуклеотидной последовательностью вставки вектора, содержащегося в E.coli JM109/pHM11 (FERM BP-7559), или ее функционального эквивалента,
и
(b) легкой цепи, которая содержит вариабельную область, связанную с константной областью, выбранной из группы, состоящей из
вариабельной области, связанной с константной областью, кодируемой нуклеотидной последовательностью вставки вектора, содержащегося в E.coli DH5α/pHSG/M2-1-4 (FERM BP-7563), или ее функционального эквивалента;
вариабельной области, связанной с константной областью, кодируемой нуклеотидной последовательностью вставки вектора, содержащегося в E.coli DH5α/pHSG/M1-2-2 (FERM BP-7562), или ее функционального эквивалента;
вариабельной области, связанной с константной областью, кодируемой нуклеотидной последовательностью вставки вектора, содержащегося в E.coli DH5α/pHSG/M3-3-22 (FERM BP-7564), или ее функционального эквивалента;
вариабельной области, связанной с константной областью, кодируемой нуклеотидной последовательностью вставки вектора, содержащегося в E.coli DH5α/pHSG/M4-5-3-1 (FERM BP-7565), или ее функционального эквивалента;
вариабельной области, связанной с константной областью, кодируемой нуклеотидной последовательностью вставки вектора, содержащегося в E.coli DH5α/pHSG/M6-1-4-1 (FERM BP-7566), или ее функционального эквивалента.
(а) тяжелую цепь иммуноглобулина, которая содержит вариабельную область, имеющую общую формулу каркасный участок 1 - CDR1 - каркасный участок 2 - СВР2-карасный участок 3 - CDR3 - каркасный участок 4, где
CDR1 состоит из аминокислотных остатков 1-5 SEQ ID NO:25,
CDR2 состоит из аминокислотных остатков 1-17 SEQ ID NO:26,
CDR3 состоит из аминокислотных остатков 1-10 SEQ ID NO:27,
и
(b) легкую цепь иммуноглобулина, которая содержит вариабельную область, имеющую общую формулу каркасный участок 5 - CDR4 - каркасный участок 6 - CDR5 - каркасный участок 7 - CDR6 - каркасный участок 8, где
CDR4 состоит из аминокислотных остатков 1-11 SEQ ID NO:28,
CDR5 состоит из аминокислотных остатков 1-7 SEQ ID NO:29,
и
CDR6 состоит из аминокислотных остатков 1-8 SEQ ID NO:30.
(a) трансфекции клеток-мишеней вектором, содержащим экспрессируемую нуклеиновую кислоту, кодирующую TRAIL-рецептор DR5;
(b) экспрессии на указанных клетках TRAIL-рецептора DR5 и
(c) контактирования указанных клеток с индуцирующим клеточную гибель антителом по п.1.
(a) трансфекции клеток-мишеней вектором, содержащим экспрессируемую нуклеиновую кислоту, кодирующую TRAIL-рецептор DR5;
(b) экспрессии на указанных клетках TRAIL-рецептор DR5 и
(c) контактирования указанных клеток с антителом по п.13.
(a) вариабельной области, состоящей из аминокислотных остатков 1-119 SEQ ID NO:31, или ее функционального эквивалента;
(b) вариабельной области, состоящей из аминокислотных остатков 1-119 SEQ ID NO:56, или ее функционального эквивалента;
(c) вариабельной области, состоящей из аминокислотных остатков 1-119 SEQ ID NO:59, или ее функционального эквивалента;
(d) вариабельной области, состоящей из аминокислотных остатков 1-119 SEQ ID NO:60, или ее функционального эквивалента;
(e) вариабельной области, состоящей из аминокислотных остатков 1-119 SEQ ID NO:61, или ее функционального эквивалента.
(a) вариабельной области, кодируемой нуклеотидной последовательностью вставки вектора, содержащегося в E.coli JM109/pHB14 (FERM ВР-7556), или ее функционального эквивалента;
(b) вариабельной области, кодируемой нуклеотидной последовательностью вставки вектора, содержащегося в E.coli JM109/pHA15 (FERM BP-7555), или ее функционального эквивалента;
(c) вариабельной области, кодируемой нуклеотидной последовательностью вставки вектора, содержащегося в E.coli JM109/pHC10 (FERM BP-7557), или ее функционального эквивалента;
(d) вариабельной области, кодируемой нуклеотидной последовательностью вставки вектора, содержащегося в E.coli JM109/pHD21 (PERM BP-7558), или ее функционального эквивалента;
(e) вариабельной области, кодируемой нуклеотидной последовательностью вставки вектора, содержащегося в E.coli JM109/pHM11 (FERM BP-7559), или ее функционального эквивалента.
(a) вариабельной области, состоящей из аминокислотных остатков 1-119 SEQ ID NO:31, или ее функционального эквивалента;
(b) вариабельной области, состоящей из аминокислотных остатков 1-119 SEQ ID NO:56, или ее функционального эквивалента;
(c) вариабельной области, состоящей из аминокислотных остатков 1-119 SEQ ID NO:59, или ее функционального эквивалента;
(d) вариабельной области, состоящей из аминокислотных остатков 1-119 SEQ ID NO:60, или ее функционального эквивалента;
(e) вариабельной области, состоящей из аминокислотных остатков 1-119 SEQ ID NO:61, или ее функционального эквивалента.
(a) вариабельной области, кодируемой нуклеотидной последовательностью вставки вектора, содержащегося в E.coli JM109/pHB14 (FERM BP-7556), или ее функционального эквивалента;
(b) вариабельной области, кодируемой нуклеотидной последовательностью вставки вектора, содержащегося в E.coli JM109/pHA15 (FERM BP-7555), или ее функционального эквивалента;
(c) вариабельной области, кодируемой нуклеотидной последовательностью вставки вектора, содержащегося в E.coli JM109/pHC10 (FERM ВР-7557), или ее функционального эквивалента;
(d) вариабельной области, кодируемой нуклеотидной последовательностью вставки вектора, содержащегося в E.coli JM109/pHD21 (FERM BP-7558), или ее функционального эквивалента;
(e) вариабельной области, кодируемом нуклеотидной последовательностью вставки вектора, содержащегося в E.coli JM109/pHM11 (FERM BP-7559), или ее функционального эквивалента.
(a) вариабельной области, состоящей из аминокислотных остатков 1-108 SEQ ID NO:46, или ее функционального эквивалента;
(b) вариабельной области, состоящей из аминокислотных остатков 1-108 SEQ ID NO:72, или ее функционального эквивалента;
(c) вариабельной области, состоящей из аминокислотных остатков 1-108 SEQ ID NO:73, или ее функционального эквивалента;
(d) вариабельной области, состоящей из аминокислотных остатков 1-108 SEQ ID NO:74, или ее функционального эквивалента;
(e) вариабельной области, состоящей из аминокислотных остатков 1-108 SEQ ID NO:75, или ее функционального эквивалента;
(f) вариабельной области, состоящей из аминокислотных остатков 1-108 SEQ ID NO:76, или ее функционального эквивалента.
(а) вариабельной области, связанной с константной областью, кодируемой нуклеотидной последовательностью вставки вектора, содержащегося в E.coli DH5α/pHSG/M2-1-4 (FERM ВР-7563), или ее функционального эквивалента;
(b) вариабельной области, связанной с константной областью, кодируемой нуклеотидной последовательностью вставки вектора, содержащегося в E.coli DH5α/pHSG/M1-2-2 (FERM BP-7562), или ее функционального эквивалента;
(c) вариабельной области, связанной с константной областью, кодируемой нуклеотидной последовательностью вставки вектора, содержащегося в E.coli DH5α/pHSG/M3-3-22 (FERM ВР-7564), или ее функционального эквивалента;
(d) вариабельной области, связанной с константной областью, кодируемой нуклеотидной последовательностью вставки вектора, содержащегося в E.coli DH5α/pHSG/M4-5-3-1 (FERM BP-7565), или ее функционального эквивалента;
(e) вариабельной области, связанной с константной областью, кодируемой нуклеотидной последовательностью вставки вектора, содержащегося в E.coli DH5α/pHSG/M6-1-4-1 (FERM BP-7566), или ее функционального эквивалента.
(a) вариабельной области, состоящей из аминокислотных остатков 1-108 SEQ ID NO:46, или ее функционального эквивалента;
(b) вариабельной области, состоящей из аминокислотных остатков 1-108 SEQ ID NO:72, или ее функционального эквивалента;
(c) вариабельной области, состоящей из аминокислотных остатков 1-108 SEQ ID NO:73, или ее функционального эквивалента;
(d) вариабельной области, состоящей из аминокислотных остатков 1-108 SEQ ID NO:74, или ее функционального эквивалента;
(e) вариабельной области, состоящей из аминокислотных остатков 1-108 SEQ ID NO:75, или ее функционального эквивалента;
(f) вариабельной области, состоящей из аминокислотных остатков 1-108 SEQ ID NO:76, или ее функционального эквивалента.
(a) вариабельной области, связанной с константной областью, кодируемой нуклеотидной последовательностью вставки вектора, содержащегося в E.coli DH5α/pHSG/M2-1-4 (FERM BP-7563), или ее функционального эквивалента;
(b) вариабельной области, связанной с константной областью, кодируемой нуклеотидной последовательностью вставки вектора, содержащегося в E.coli DH5α/pHSG/M1-2-2 (FERM BP-7562), или ее функционального эквивалента;
(c) вариабельной области, связанной с константной областью, кодируемой нуклеотидной последовательностью вставки вектора, содержащегося в E.coli DH5α/pHSG/M3-3-22 (FERM ВР-7564), или ее функционального эквивалента;
(d) вариабельной области, связанной с константной областью, кодируемой нуклеотидной последовательностью вставки вектора, содержащегося в E.coli DH5α/pHSG/M4-5-3-1 (FERM BP-7565), или ее функционального эквивалента;
(e) вариабельной области, связанной с константной областью, кодируемой нуклеотидной последовательностью вставки вектора, содержащегося в E.coli DH5α/pHSG/M6-1-4-1 (FERM BP-7566), или ее функционального эквивалента.
(a) трансформации клеток млекопитающих по меньшей мере одним вектором, содержащим нуклеиновую кислоту, кодирующую легкую цепь иммуноглобулина указанного антитела, тяжелую цепь иммуноглобулина указанного антитела или обе эти цепи;
(b) инкубирования трансформированных клеток млекопитающего в условиях, обеспечивающих экспрессию легкой цепи иммуноглобулина или тяжелой цепи иммуноглобулина указанного антитела; и
(c) выделения указанного антитела из клеток млекопитающего или из среды указанных клеток млекопитающего.
| GRIFFITH T.S | |||
| et al., Functional analysis of TRAIL receptors using monoclonal antibodies, 1999, J | |||
| Immunol., v.162, n.5, p.2597-2605 | |||
| МОНОКЛОНАЛЬНОЕ АНТИТЕЛО, ПРОДУЦИРУЕМОЕ ШТАММОМ ГИБРИДНЫХ КУЛЬТИВИРУЕМЫХ КЛЕТОК МЫШИ MUS MUSCULUS L. ЕСАСС N 90110707, F(AB)-ФРАГМЕНТ МОНОКЛОНАЛЬНОГО АНТИТЕЛА, ПРОДУЦИРУЕМОГО ШТАММОМ ГИБРИДНЫХ КУЛЬТИВИРУЕМЫХ КЛЕТОК МЫШИ MUS MUSCULUS L. ЕСАСС N 90110707, F(AB)*002-ФРАГМЕНТ МОНОКЛОНАЛЬНОГО АНТИТЕЛА, ПРОДУЦИРУЕМОГО ШТАММОМ ГИБРИДНЫХ КУЛЬТИВИРУЕМЫХ КЛЕТОК МЫШИ MUS MUSCULUS L. ЕСАСС N 90110707, ШТАММ ГИБРИДНЫХ КУЛЬТИВИРУЕМЫХ КЛЕТОК МЫШИ MUS MUSCULUS L., ПРОДУЦИРУЮЩИЙ МОНОКЛОНАЛЬНОЕ АНТИТЕЛО И СПОСОБ ПОЛУЧЕНИЯ ШТАММА ГИБРИДНЫХ КУЛЬТИВИРУЕМЫХ КЛЕТОК МЫШИ MUS MUSCULUS L. ЕСАСС N 90110707 | 1991 |
|
RU2073722C1 |
Авторы
Даты
2007-04-27—Публикация
2001-05-02—Подача