Область техники
Настоящее описание изобретение относится к антителу, специфически связывающемуся с рецептором смерти 5 (DR5) и выполняющему функцию уничтожения раковых клеток, а именно, к анти-DR5-антителу или его антигенсвязывающему фрагменту, а также к применению антитела или антигенсвязывающего фрагмента в профилактике или лечении рака.
Предшествующий уровень техники
Путь клеточного апоптоза через ФНО-связанный апоптоз-индуцирующий лиганд (TRAIL или Apo2L) и рецептор смерти 5 (DR5), являющегося одним из его рецепторов, индуцирует избирательный по отношению к раковым клеткам апоптоз, не затрагивая нормальные клетки, и считается важной целью разработки препаратов для лечения онкологических заболеваний (Ashkenazi et al., Nat Rev Cancer 2: 420,2002).
В настоящее время рекомбинантный TRAIL и антитела, специфичные к рецептору смерти, нацеленные на DR5, разрабатываются в качестве препаратов для воздействия на раковые клетки.
В отношении TRAIL проблема с этим заключается в низкой селективности DR5, поскольку лиганд связывается не только с DR4 (рецептор смерти 4, TRAIL-рецептор 1) и DR5 (рецептор смерти 5, TRAIL-рецептор 2), передающими апоптотические сигналы, но и с DcR1 (рецептор-ловушка 1, TRAIL-рецептор 3) и DcR2 (рецептор-ловушка 1, TRAIL-рецептор 4), не способными передавать апоптотические сигналы. Кроме того, рекомбинантный TRAIL отличается низкой стабильностью и индуцирует апоптоз в нормальных клетках, включая астроциты, гепатоциты, кератиноциты и т.п. (Jo et al., Nature Medicine 6, 564-567, 2000). Таким образом, к настоящему времени выполнены исследования по разработке анти-DR4- и анти-DR5-антител, инициирующих селективный апоптоз раковых клеток и обладающих малым количеством побочных эффектов.
В отношении антител, специфичных к рецептору смерти, были выполнены клинические испытания, направленные на оценку цитотоксической активности анти-DR5-антитела, разработанного компаниями Genentech Incorporated (США) и Amgen (США). Компания Human Genome Sciences (США) завершила вторую фазу клинических испытаний анти-DR5-антитела HGS-ETR2 и анти-DR4-антитела HGS-ETR1, после чего прекратила разработку. Кроме того, была прекращена разработка таких анти-DR5-антител, как «Апомаб», «Конатумумаб», «Тигатузумаб» и др.
По существу, выделяют два основных механизма клеточного апоптоза: внешний путь апоптоза и собственный путь апоптоза. Большинство химиотерапевтических средств и лучевая терапия индуцируют гибель опухолевых клеток через p53-опосредованный собственный путь апоптоза, в то время как DR5-опосредованный апоптоз индуцируется p53-независимым внешним путем апоптоза и собственным путем апоптоза (Takeda et al., Oncogene, 26, 3745-3757, 2007). Внешний путь апоптоза предусматривает связывание TRAIL или антител с DR5 с образованием сигнального комплекса, индуцирующего смерть клеток (DISC), который посредством адаптерного белка (FADD) активирует апоптоз-инициирующие протеазы: каспазу-8 и каспазу-10. После этого каспаза-8 активирует нижестоящие протеазы каспазу-3 и каспазу-7, одновременно индуцируя собственный апоптоз по митохондриальному пути (Ohtsuka et al., Oncogene, 22, 2034-2044, 2003).
Учитывая растущую значимость TRAIL как мишени в терапии онкологических заболеваний, необходимо разработать более эффективные и мощные TRAIL-направленные препараты.
Подробное описание изобретения
Техническая задача
Задачей настоящего изобретения является разработка анти-DR5-антитела, специфически взаимодействующего с рецептором смерти 5 (DR5) с целью эффективного уничтожения различных опухолевых клеток, а также разработка способа применения такого антитела.
Первый аспект изобретения относится к анти-DR5-антителу или его антигенсвязывающему фрагменту.
Следующий аспект относится к фармацевтической композиции для профилактики или лечения онкологических заболеваний, при этом композиция содержит анти-DR5-антитело и / или антигенсвязывающий фрагмент.
Следующий аспект относится к способу профилактики или лечения онкологических заболеваний, при этом способ содержит этап введения анти-DR5-антитела и / или антигенсвязывающего фрагмента нуждающемуся в этом субъекту.
Следующий аспект относится к применению анти-DR5-антитела и / или антигенсвязывающего фрагмента для профилактики или лечения онкологических заболеваний или для получения противоопухолевого препарата.
Следующий аспект относится к полинуклеотидной молекуле, кодирующей анти-DR5-антитело или антигенсвязывающий фрагмент, рекомбинантному вектору, несущему полинуклеотид, и рекомбинантной клетке, содержащей рекомбинантный вектор.
Следующий аспект относится к способу получения анти-DR5-антитела или его антигенсвязывающего фрагмента, при этом способ содержит этап экспрессии полинуклеотидной молекулы.
Техническое решение
Предложено анти-DR5-антитело, специфически связывающееся с рецептором смерти 5 (DR5) в целях эффективной индукции гибели различных опухолевых клеток, и содержащая его фармацевтическая композиция, предназначенная для профилактики или лечения опухолевых заболеваний.
Заявленное антитело представляет собой TRAIL-неконкурентное антитело, сохраняющее постоянный уровень антигенсвязывающей активности независимо от концентрации TRAIL (ФНО-связанного апоптоз-индуцирующего лиганда). Следовательно, антитело можно эффективно использовать для разработки инновационных лекарственных средств на основе антител или диагностических средств, эффективность которых превышает ранее разработанные лекарственные средства на основе антител.
Рецептор смерти 5 (DR5), также известный как TRAIL-рецептор 2 (TRAILR2) или член суперсемейства рецепторов фактора некроза опухолей 10B (TNFRSF10B), представляет собой рецептор клеточной поверхности суперсемейства рецепторов ФНО, связывающийся с TRAIL и способствует апоптозу путем передачи сигнала апоптоза. Показано, что DR5 взаимодействует с каспазой 8, каспазой 10, FADD (белком, взаимодействующим с доменом смерти Fas-рецептора) и TRAIL. DR5 может быть получен от млекопитающих и может представлять собой, например, человеческий DR5 (например, производства Национального центра биотехнологической информации (NCBI) за номером Q6FH58 по базе UniProtKB / Swiss-Prot).
Одним из аспектов изобретения предложен полипептид, специфически распознающий и / или связывающий DR5. Полипептид может быть выбран из группы, состоящей из аминокислотных последовательностей с идентификаторами SEQ ID NOS: 1-16. Точнее говоря, аминокислотная последовательность полипептида может быть выбрана из группы, состоящей из последовательностей с идентификаторами SEQ ID NOS: 1, 2, 4 и 7-16.
В настоящем документе под «белком, полипептидом или полинуклеотидом, содержащим аминокислотную или нуклеотидную последовательность» подразумевают любые случаи, в которых белок, полипептид или полинуклеотид содержит последовательность, по существу состоит из последовательности или состоит из последовательности.
Такие полипептиды можно использовать в качестве определяющих комплементарность областей (CDR) анти-DR5-антитела.
Полипептиды и их применимые определяющие комплементарность области перечислены в таблице 1 (см. ниже):
Таблица 1
DAGSGCGSGGWTGACIDT
DAGSPCGSGGWTGACIDT
DAGSPCGKGGWTGACIDT
7
8
9
NNNNRPS
NNNNLMP
NNNNKAK
10
11
12
GSRDSSYVGI
GSRDSAGMGA
GSRDSDGGGR
GSRDSSGAGG
13
14
15
16
(В данной таблице 1 VH-CDR1, VH-CDR2 и VH-CDR3 представляют области, определяющие комплементарность тяжелой цепи, а VL-CDR1, VL-CDR2 и VL-CDR3 представляют области, определяющие комплементарность легкой цепи)
Другим аспектом предложена DR5-направленная полипептидная молекула, содержащая, по меньшей мере, одну молекулу, выбранную из группы, в которую входят перечисленные выше полипептиды. DR5-направленная полипептидная молекула способна действовать, инициируя гибель опухолевых клеток (например, апоптоз опухолевых клеток), не конкурируя с DR5-лигандом TRAIL.
DR5-направленная полипептидная молекула может содержать вышеупомянутые области анти-DR5-антитела, определяющие комплементарность тяжелой цепи, или области анти-DR5-антитела, определяющие комплементарность легкой цепи; или их комбинацию, или вариабельный участок тяжелой цепи, содержащий область, определяющую комплементарность тяжелой цепи, вариабельный участок легкой цепи, содержащий область, определяющую комплементарность легкой цепи, или их комбинацию.
DR5-направленная полипептидная молекула может функционировать, но не ограничиваясь этим, в качестве анти-DR5-антитела, антигенсвязывающего фрагмента антитела или аналога анти-DR5-антитела (структуры, имеющей сходный каркас и действующей в качестве антитела; например, "пептид-ассоциированного антитела, наноантитела и т.п.), а также в качестве прекурсора или компонента (например, определяющей комплементарность области) мультиспецифического антитела.
В настоящем документе под «пептид-ассоциированным антителом» понимают гибридный белок (пептид + антитело), имитирующий антитело с точки зрения структуры и функции, в котором пептид соединен с частичной или полной константной областью антитела, например, Fc. В этом контексте один или несколько пептидов, как было описано выше, могут служить антигенсвязывающим фрагментом (определяющая комплементарность область или вариабельный участок тяжелой и / или легкой цепи).
В настоящем документе под «наноантителом», также называемым однодоменным антителом, понимают фрагмент антитела, содержащий мономерный единичный вариабельный домен антитела и проявляющий селективность в отношении определенных антигенов подобно полноразмерному антителу. Его молекулярная масса составляет, как правило, примерно 12-15 кДа, что намного меньше значения (примерно 150-160 кДа) полноразмерного антитела (включая две тяжелые и две легкие цепи), а в некоторых случаях даже меньше значений фрагмента Fab или scFv.
В данном документе под «мультиспецифическим антителом» (включая биспецифическое антитело) понимают антитело, распознающее и / или связывающее два (и более) различных антигена, или распознающее и / или связывающее различные сайты одного антигена, причем один из антигенсвязывающих сайтов мультиспецифического антитела может содержать описанный выше полипептид.
Один из аспектов относится к анти-DR5-антителу, содержащему в качестве определяющей комплементарность области, по меньшей мере, один полипептид из группы, в которую входят описанные выше полипептиды, или его антигенсвязывающий фрагмент. Заявленное анти-DR5-антитело, обладающее эффектом агониста DR5, воздействует на кластеризацию молекул DR5, существующих отдельно на поверхности клетки, с целью генерации и трансдукции сигнала апоптоза в клетке, индуцируя тем самым гибель клетки.
Анти-DR5-антитело или его антигенсвязывающий фрагмент могут содержать в качестве определяющей комплементарность области тяжелой цепи, по меньшей мере, одну из областей следующей группы:
полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 1 (VH-CDR1),
полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 2 (VH-CDR2), и
полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 3 (VH-CDR3).
Аминокислотная последовательность с идентификатором SEQ ID NO: 3 совпадает с последовательностью следующей общей формулы 1:
[общая формула 1] ( SEQ ID NO: 3)
D-A-G-S-X1-C-G-X2-G-G-W-T-G-A-C-I-D-T
в которой
X1 = G или P, и
X2 = S или K.
В одном варианте осуществления полипептид с идентификатором SEQ ID NO: 3, используемый в качестве CDR3 тяжелой цепи анти-DR5-антитела или его антигенсвязывающего фрагмента, может содержать, по меньшей мере, одну аминокислотную последовательность из группы, в которую входят, например, последовательности с идентификаторами SEQ ID NOS: 7, 8 и 9 (в следующих аминокислотных последовательностях выделенные жирным шрифтом и подчеркнутые буквы обозначают аминокислотные остатки, модифицированные из аминокислотной последовательности с идентификатором SEQ ID NO: 7):
идентификатор SEQ ID NO: 7: DAGSGCGSGGWTGACIDT
идентификатор SEQ ID NO: 8: DAGSPCGSGGWTGACIDT
идентификатор SEQ ID NO: 9: DAGSPCGKGGWTGACIDT
В другом варианте осуществления анти-DR5-антитело или его антигенсвязывающий фрагмент могут содержать в качестве определяющей комплементарность области легкой цепи, по меньшей мере, одну из областей следующей группы:
полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 4 (VL-CDR1),
полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 5 (VL-CDR2), и
полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 6 (VL-CDR3).
Аминокислотные последовательности с идентификаторами SEQ ID NOS: 5 и 6 совпадают с последовательностями следующих общих формул 2 и 3, соответственно.
[общая формула 2] (SEQ ID NO: 5)
N-N-N-N-X3-X4-X5
в которой
X3 = R, L или K,
X4 = P, M или A и
X5 = S, P или K;
[общая формула 3] (идентификатор 6)
G-S-R-D-S-X6-X7-X8-G-X9
в которой
X6 = S, A или D,
X7 = Y или G,
X8 = V, M, G или A, и
X9 = I, A, R или G.
В одном варианте осуществления полипептид с идентификатором SEQ ID NO: 5, применимый в качестве CDR2 тяжелой цепи анти-DR5-антитела или его антигенсвязывающего фрагмента, может содержать, по меньшей мере, одну аминокислотную последовательность из группы, в которую входят последовательности с идентификаторами SEQ ID NOS: 10, 11 и 12 (в следующих аминокислотных последовательностях выделенные жирным шрифтом и подчеркнутые буквы обозначают аминокислотные остатки, модифицированные из аминокислотной последовательности с идентификатором SEQ ID NO: 10):
идентификатор SEQ ID NO: 10: NNNNRPS
идентификатор SEQ ID NO: 11: NNNNLMP
идентификатор SEQ ID NO: 12: NNNNKAK
В одном варианте осуществления полипептид с идентификатором SEQ ID NO: 6, используемый в качестве CDR3 легкой цепи анти-DR5-антитела или его антигенсвязывающего фрагмента, может содержать, по меньшей мере, одну аминокислотную последовательность из группы, в которую входят последовательности с идентификаторами SEQ ID NOS: 13, 14, 15 и 16 (в следующих аминокислотных последовательностях выделенные жирным шрифтом и подчеркнутые буквы обозначают аминокислотные остатки, модифицированные из аминокислотной последовательности с идентификатором SEQ ID NO: 13):
идентификатор SEQ ID NO:13: GSRDSSYVGI
идентификатор SEQ ID NO: 14: GSRDSAGMGA
идентификатор SEQ ID NO: 15: GSRDSDGGGR
идентификатор SEQ ID NO: 16: GSRDSSGAGG
В одном варианте осуществления анти-DR5-антитело или его антигенсвязывающий фрагмент может содержать:
по меньшей мере, одну определяющую комплементарность область тяжелой цепи, выбранную из группы, в которую входит полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 1 (VH-CDR1), полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 2 (VH-CDR2), и полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 3 (VH-CDR3), или вариабельный участок тяжелой цепи, содержащий, по меньшей мере, одну определяющую комплементарность область тяжелой цепи, описанную выше;
по меньшей мере, одну определяющую комплементарность область легкой цепи, выбранную из группы, в которую входит полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 4 (VL-CDR1), полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 5 (VL-CDR2), и полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 6 (VL-CDR3), или вариабельный участок легкой цепи, содержащий, по меньшей мере, одну определяющую комплементарность область легкой цепи, описанную выше;
комбинацию определяющей комплементарность области тяжелой цепи и определяющей комплементарность области легкой цепи, описанных выше; или
комбинацию вариабельного участка тяжелой цепи и вариабельного участка легкой цепи, описанных выше.
Точнее говоря, анти-DR5-антитело или его антигенсвязывающий фрагмент может содержать:
по меньшей мере, одну определяющую комплементарность область тяжелой цепи, выбранную из группы, в которую входит полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 1 (VH-CDR1), полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 2 (VH-CDR2), и полипептид, содержащий аминокислотную последовательность из группы, в которую входят последовательности с идентификаторами SEQ ID NOS: 7- 9 (VH-CDR3), или вариабельный участок тяжелой цепи, содержащий, по меньшей мере, одну определяющую комплементарность область тяжелой цепи, описанную выше;
по меньшей мере, одну определяющую комплементарность область легкой цепи, выбранную из группы, в которую входит полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 4 (VL-CDR1), полипептид, содержащий аминокислотную последовательность из группы, в которую входят последовательности с идентификаторами SEQ ID NOS: 10-12 (VL-CDR2), и полипептид, содержащий аминокислотную последовательность из группы, в которую входят последовательности с идентификаторами SEQ ID NOS: 13-16 (VL-CDR3), или вариабельный участок легкой цепи, содержащий, по меньшей мере, одну определяющую комплементарность область легкой цепи, описанную выше;
комбинацию определяющей комплементарность области тяжелой цепи и определяющей комплементарность области легкой цепи, описанных выше; или
комбинацию вариабельного участка тяжелой цепи и вариабельного участка легкой цепи, описанных выше.
В одном варианте осуществления анти-DR5-антитело или антигенсвязывающий фрагмент может содержать:
вариабельный участок тяжелой цепи, выбранный из группы, содержащей полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 1 (VH-CDR1), полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 2 (VH-CDR2), и полипептид, содержащий аминокислотную последовательность из группы, в которую входят последовательности с идентификаторами SEQ ID NOS: 7-9 (VH-CDR3); и
вариабельный участок легкой цепи, состоящий из полипептида, содержащего аминокислотную последовательность с идентификатором SEQ ID NO: 4 (VL-CDR1), полипептида, содержащего аминокислотную последовательность из группы, в которую входят последовательности с идентификаторами SEQ ID NOS: 10-12 (VL-CDR2), и полипептида, содержащего аминокислотную последовательность из группы, в которую входят последовательности с идентификаторами SEQ ID NOS: 13-16 (VL-CDR3).
В одном варианте осуществления анти-DR5-антитело или его антигенсвязывающий фрагмент может содержать комбинацию вариабельных участков тяжелой цепи и вариабельных участков легкой цепи, которые перечислены в нижеприведенных таблицах 2 и 3.
ТАБЛИЦА 2
Последовательности определяющей комплементарность области (CDR) тяжелой цепи
ТАБЛИЦА 3
Последовательности определяющей комплементарность области (CDR) легкой цепи
Следующим аспектом предложен вариабельный участок тяжелой цепи, содержащий определяющую комплементарность область тяжелой цепи, вариабельный участок легкой цепи, содержащий определяющую комплементарность область легкой цепи, или их комбинацию. Например, вариабельный участок тяжелой цепи может содержать аминокислотную последовательность, выбранную из группы, содержащей последовательности с идентификаторами SEQ ID NOS: 17-37, а вариабельный участок легкой цепи может содержать аминокислотную последовательность, выбранную из группы, в которую входят последовательности с идентификаторами SEQ ID NOS: 38-49.
Таким образом, анти-DR5-антитело или его антигенсвязывающий фрагмент может содержать:
вариабельный участок тяжелой цепи, содержащий аминокислотную последовательность из группы, в которую входят последовательности с идентификаторами SEQ ID NOS: 17-37;
вариабельный участок легкой цепи, содержащий аминокислотную последовательность из группы, в которую входят последовательности с идентификаторами SEQ ID NOS: 38-49; или
их комбинацию.
В одном варианте осуществления анти-DR5-антитело может представлять собой антитело животного происхождения (например, антитело мыши), химерное антитело (например, химерное антитело мыши-человека) или гуманизированное антитело. Антитело или антигенсвязывающий фрагмент могут быть выделены из живого организма или иметь неприродное происхождение. Антитело или его антигенсвязывающий фрагмент может быть рекомбинантным или синтетическим.
В другом варианте осуществления антитело может быть получено (выделено) от любого животного организма, в частности, млекопитающих, включая людей, птиц и т.д. Например, антитело может представлять собой антитело человека, антитело мыши, антитело осла, антитело овцы, антитело кролика, антитело козы, антитело морской свинки, антитело верблюда, антитело лошади или антитело курицы. В данном случае под антителом человека понимают антитело, содержащее аминокислотную последовательность человеческого иммуноглобулина, и включает антитело, выделенное из базы человеческих иммуноглобулинов или из животного организма, являвшегося трансгенным, по меньшей мере, для одного человеческого иммуноглобулина, и не включает эндогенных иммуноглобулинов.
Анти-DR5-антитело может быть моноклональным или поликлональным, например моноклональным антителом. Моноклональное антитело может быть получено с использованием известного из уровня техники метода, например технологией фагового дисплея. В альтернативном варианте анти-DR5-антитело может быть получено в виде выделенного из мыши моноклонального антитела.
За исключением участков CDR тяжелой цепи и CDR легкой цепи или вариабельных участков тяжелой цепи и легкой цепи, как было указано выше, анти-DR5-антитело или его антигенсвязывающий фрагмент могут быть получены из любого подтипа иммуноглобулина (например, IgA, IgD, IgE, IgG (IgG1, IgG2, IgG3, IgG4), IgM и т.п.), например, из каркасной части и / или константной области легкой цепи и / или константной области тяжелой цепи.
Полноразмерное антитело (например, типа IgG) имеет структуру с двумя легкими цепями полной длины и двумя тяжелыми цепями полной длины, в которой каждая легкая цепь связана с соответствующей тяжелой цепью посредством дисульфидной связи. Константную область антитела разделяют на константную область тяжелой цепи и константную область легкой цепи, а константную область тяжелой цепи классифицируют по типу (гамма (γ), мю (μ), альфа (α), дельта (δ) и эпсилон (ε)) и подклассу (гамма1 (γ1), гамма2 (γ2), гамма3 (γ3), гамма4 (γ4), альфа1 (α1) и альфа2 (α2)). Константная область легкой цепи имеет тип каппа (κ) или лямбда (λ).
В настоящем документе под «тяжелой цепью» понимают полноразмерные тяжелые цепи и их фрагменты, причем полноразмерная тяжелая цепь содержит вариабельный участок VH, в состав которого входят аминокислотные последовательности, достаточные для обеспечения специфичности к антигенам, три константные области CH1, CH2 и CH3 и шарнирный участок. В настоящем документе под «легкой цепью» понимают полноразмерные легкие цепи и их фрагменты, причем полноразмерная легкая цепь содержит вариабельный участок VL, в состав которого входят аминокислотные последовательности, достаточные для обеспечения специфичности к антигенам, и константная область CL.
Под термином «определяющая комплементарность область (complementarity determining region - CDR)» понимают аминокислотную последовательность, обнаруженную в гипервариабельном участке тяжелой или легкой цепи иммуноглобулина. Тяжелые и легкие цепи могут содержать, соответственно, три CDR (CDRH1, CDRH2 и CDRH3; и CDRL1, CDRL2 и CDRL3). CDR может образовывать контактные остатки, играющие важную роль для связывания антител с антигенами или эпитопами. В настоящем документе термины «специфически связывающий» и «специфически распознающий» имеют общее значение, известное специалисту в данной области, и указывают на специфическое взаимодействие антитела и антигена друг с другом, следствием которого становится иммунологическая реакция.
В настоящем документе термин «антигенсвязывающий фрагмент» относится к фрагментам интактного иммуноглобулина, включая часть полипептида, образующую антигенсвязывающий сайт. Антигенсвязывающий фрагмент может представлять собой, scFv, (scFv)2, scFvFc, Fab, Fab′ или F(ab′)2, но не ограничиваясь этим.
Среди антигенсвязывающих фрагментов Fab, содержащий вариабельные участки легкой цепи и тяжелой цепи, константную область легкой цепи и первую константную область CH1 тяжелой цепи, имеет один антигенсвязывающий сайт.
Fab' отличается от Fab тем, что Fab' включает шарнирный участок, по меньшей мере, с одним цистеиновым остатком на С-конце CH1.
Антитело F(ab′)2 образуется дисульфидным мостиком цистеиновых остатков на шарнирном участке Fab'. Fv представляет собой минимальный фрагмент антитела, состоящий только из вариабельного участка тяжелой цепи и вариабельного участка легкой цепи. Технология рекомбинации для получения фрагмента Fv широко известна в уровне техники.
Двухцепочечный Fv содержит вариабельный участок тяжелой цепи и участок легкой цепи, соединенные друг с другом нековалентной связью. Одноцепочечный Fv обычно содержит вариабельный участок тяжелой цепи и вариабельный участок легкой цепи, соединенные друг с другом ковалентной связью через пептидный линкер или связью на С-концах с получением димерной структуры, подобной двухцепочечному Fv.
Антигенсвязывающие фрагменты могут быть получены из протеазы (например, Fab можно получать ограниченным расщеплением целого антитела папаином, а фрагмент F(ab′)2 можно получать расщеплением пепсином) или методом генетической рекомбинации.
В настоящем документе под «шарнирным участком» понимают область между доменами СН1 и СН2 в тяжелой цепи антитела, обеспечивающую гибкость антигенсвязывающего сайта.
Следующим аспектом предложена фармацевтическая композиция, содержащая анти-DR5-антитело или его антигенсвязывающий фрагмент в качестве эффективного компонента для профилактики и / или лечения онкологических заболеваний.
Следующим аспектом предложен способ профилактики и / или лечения онкологических заболеваний, содержащий этап введения фармацевтически эффективного количества анти-DR5-антитела или его антигенсвязывающего фрагмента нуждающемуся в этом субъекту. Способ профилактики и / или лечения онкологических заболеваний может дополнительно содержать этап идентификации пациента, нуждающегося в профилактике и / или лечении онкологического заболевания (например, диагностику или выбор субъекта для проведения терапии) перед этапом введения.
Анти-DR5-антитело может выгодным образом применяться для профилактики или лечения онкологических заболеваний. Поскольку, как было описано выше, заявленное анти-DR5-антитело в данном случае действует как агонист DR5, может быть предпочтителен вариант, в котором раковые клетки будут экспрессировать DR5 для того, чтобы нацеленное на них анти-DR5-антитело проявляло достаточную эффективность (например, противоопухолевую эффективность, в частности, индукцию гибели раковых клеток). Кроме того, онкологическое заболевание может быть чувствительно или устойчиво к TRAIL. В одном варианте осуществления онкологическим заболеванием может быть, в том числе, рак крови, рак легких, рак желудка, рак печени, рак костей, рак поджелудочной железы, рак кожи, рак головы и шеи, меланома кожи, рак матки, рак яичников, рак прямой кишки, рак ободочной и прямой кишки, рак толстой кишки, рак молочной железы, саркома матки, рак маточной трубы, рак эндометрия, рак шейки матки, рак влагалища, рак вульвы, рак пищевода, рак гортани, рак тонкой кишки, рак щитовидной железы, рак паращитовидных желез, саркома мягких тканей, рак уретры, рак полового члена, рак предстательной железы, хронический или острый лейкоз, солидные опухоли в ювенильной стадии, дифференцированная лимфома, рак мочевого пузыря, рак почки, почечноклеточный рак, рак почечной лоханки, первичная лимфома центральной нервной системы, опухоли позвоночника, глиома ствола головного мозга, и аденома гипофиза.
В одном варианте осуществления применение анти-DR5-антитела или его антигенсвязывающего фрагмента в комбинации с TRAIL вызывает синергетический эффект по сравнению с применением анти-DR5-антитела или его антигенсвязывающего фрагмента по отдельности и имеет противораковый эффект при терапии как TRAIL резистентного, так и чувствительного к TRAIL рака (см. пример 13).
Таким образом, фармацевтическая композиция может содержать TRAIL (ФНО-связанный апоптоз-индуцирующий лиганд) дополнительно к анти-DR5-антителу или его антигенсвязывающему фрагменту.
Таким образом, фармацевтическая композиция в качестве эффективных компонентов может содержать:
(1) анти-DR5-антитело или его антигенсвязывающий фрагмент; и
(2) TRAIL.
Фармацевтическая композиция может содержать (1) анти-DR5-антитело или его антигенсвязывающий фрагмент и (2) TRAIL в одной консолидированной лекарственной форме или в соответствующих лекарственных формах.
Кроме того, способ профилактики и / или лечения онкологических заболеваний может содержать этап введения фармацевтически эффективного количества TRAIL дополнительно к этапу введения анти-DR5-антитела или его антигенсвязывающего фрагмента.
Таким образом, способ профилактики и / или лечения онкологических заболеваний может содержать этап введения комбинации (1) фармацевтически эффективного количества анти-DR5-антитела или его антигенсвязывающего фрагмента и (2) фармацевтически эффективного количества TRAIL пациенту, нуждающемуся в профилактике и / или лечении онкологического заболевания.
Этап комбинированного введения может предусматривать введение (1) фармацевтически эффективного количества анти-DR5-антитела или его антигенсвязывающего фрагмента и (2) фармацевтически эффективного количества TRAIL в одной лекарственной форме одновременно, или (1) фармацевтически эффективное количество анти-DR5-антитела или его антигенсвязывающего фрагмента и (2) фармацевтически эффективного количества TRAIL в соответствующих лекарственных формах одновременно или последовательно в любом порядке.
TRAIL (ФНО-связанный апоптоз-индуцирующий лиганд), также обозначенный CD253 (кластер дифференцировки 253) или TNFSF10 (член 10 суперсемейства фактора некроза опухоли (лиганд)), представляет собой действующий в качестве лиганда белок, индуцирующий процесс гибели клеток (апоптоз). TRAIL представляет собой цитокин, широко продуцируемый и секретируемый клетками здоровой ткани. В одном варианте осуществления TRAIL может иметь, но не ограничиваясь этим, человеческое происхождение, например, производства NCBI за номером NP_001177871.1, NP_003801.1, и т.п.
Анти-DR5-антитело или его антигенсвязывающий фрагмент (в том числе в комбинации с TRAIL), использующий преимущества пути апоптоза, можно применять в сочетании, по меньшей мере, с одним препаратом для химиотерапии, в частности карбоплатином или паклитакселом (Recka et al., Lung Cancer, 82, 441-448, 2013), гемцитабином (Torres et al., Cancer Medicine, 2(6), 925-932, 2013) и т.п., усиливая тем самым противораковое / противоопухолевое действие (см. пример 15).
В целях оказания профилактического и / или терапевтического воздействия на онкологические заболевания анти-DR5-антитело, или его антигенсвязывающий фрагмент, или содержащую его фармацевтическую композицию можно вводить отдельно или в сочетании с хирургическим вмешательством, гормональной терапией, фармакотерапией и / или модификатором биологического отклика.
В одном варианте осуществления фармацевтическая композиция может содержать, по меньшей мере, один хорошо известный действующий компонент, обладающий противоопухолевым действием (химиотерапевтический препарат), дополнительно к анти-DR5-антителу или его антигенсвязывающему фрагменту (в том числе в комбинации с TRAIL). Кроме того, способ профилактики и / или лечения онкологических заболеваний может содержать в себе этап введения, по меньшей мере, одного хорошо известного действующего компонента, обладающего противоопухолевым действием (химиотерапевтический препарат), дополнительно к анти-DR5-антителу или его антигенсвязывающему фрагменту (в том числе в комбинации с TRAIL).
Химиотерапевтический препарат, который можно использовать с анти-DR5-антителом или его антигенсвязывающим фрагментом, может представлять собой, по меньшей мере, один член группы, в которую входят, в том числе: алкилирующие противоопухолевые средства, в частности карбоплатин, паклитаксел (Recka et al., Lung Cancer, 82, 441-448, 2013) и т.п.; противоопухолевые агенты на основе антагонистов метаболизма, в частности гемцитабин (Torres et al., Cancer Medicine, 2(6), 925-932, 2013) и т.п.; противоопухолевые средства на основе антрациклина, в частности доксорубицин (HM Amm et al., Mol Cancer Res April, 9; 403, 2011) и т.п.; и противоопухолевые средства на основе ингибитора протеасом, в частности, бортезомиб (Shanker A et al., J Natl Cancer Inst, May 7; 100(9): 649-62, 2008) и т.п.
Для правильного введения действующих компонентов, в частности анти-DR5-антитела, антигенсвязывающего средства и т.п. по меньшей мере, один фармацевтически приемлемый носитель может быть включен в фармацевтическую композицию или может вводиться вместе с действующими компонентами. В качестве фармацевтически приемлемого носителя можно использовать, в том числе, физиологический раствор, стерилизованную воду, раствор Рингера, забуференный физиологический раствор, раствор декстрозы, раствор мальтодекстрина, глицерин, этанол и смесь одного или нескольких из вышеперечисленных компонентов. При необходимости можно добавить прочие традиционные вспомогательные вещества, в частности антиоксиданты, буферы или бактериостатики. Кроме того, фармацевтическая композиция может быть выполнена в виде инъекционных лекарственных форм, в частности водного раствора, суспензии или эмульсии; или пилюли, капсулы, гранулы или таблетки путем добавления разбавителя, диспергирующего средства, поверхностно-активного вещества, связующего вещества или смазывающего вещества. Кроме того, фармацевтическая композиция может быть составлена в надлежащем соответствии с заболеваниями или компонентами, используя метод из данной области техники или метод, раскрытый в Remington's Pharmaceutical Science (последнее издание), Mack Publishing Company, Easton PA.
Действующий компонент, в частности, анти-DR5-антитело, антигенсвязывающий фрагмент и т.п. или фармацевтическую композицию можно вводить перорально или парентерально. Парентеральное введение может быть реализовано путем внутривенной, подкожной, внутримышечной или внутрибрюшинной инъекции, эндотелиального, местного, интраназального, внутрилегочного и ректального введения. Поскольку пероральное введение приводит к расщеплению белков или пептидов, активный компонент в композициях для перорального введения может быть покрыт оболочкой или составлен таким образом, чтобы предотвратить расщепление в желудке. Кроме того, композицию можно вводить с использованием дополнительного устройства, позволяющего доставлять активный компонент в клетки-мишени.
Фармацевтически эффективное количество анти-DR5-антитела или его антигенсвязывающего фрагмента может назначаться в различных количествах в зависимости от способа приготовления (состава), способа введения, возраста пациента, массы тела, пола, патологических состояний и диеты, времени и интервала введения, пути введения, скорости выведения и чувствительности реакции. Например, суточная доза анти-DR5-антитела или его антигенсвязывающего фрагмента может находиться в диапазоне от 0,001 до 1000 мг/кг, в частности от 0,01 до 100 мг/кг, более конкретно от 0,1 до 50 мг/кг, или даже более конкретно от 0,1 до 20 мг/кг, но не ограничиваясь этим. Суточная доза может быть изготовлена в виде единого препарата в единичной лекарственной форме, в виде раздельных лекарственных форм или в виде упаковки лекарственных средств для многократного приема. Фармацевтическую композицию можно вводить в сочетании с другими лекарственными средствами, причем в зависимости от состояния пациентов можно надлежащим образом подбирать дозировку, способ введения и виды других лекарственных средств.
Фармацевтическая композиция может быть выполнена в виде масляного или водного раствора, суспензии, сиропа, эмульсии, экстракта, порошка, гранул, таблетки или капсулы, а также может дополнительно содержать диспергирующее или стабилизирующее средство.
В частности, фармацевтическая композиция, содержащая анти-DR5-антитело или его антигенсвязывающий фрагмент, может быть составлена в форме иммунолипосомы, содержащей антитело или антигенсвязывающий фрагмент. Липосома, несущая антитело, может быть получена любым из способов, известных в данной области техники. Иммунолипосома может представлять собой липидную композицию, содержащую фосфатидилхолин, холестерин и полученный из полиэтиленгликоля фосфатидилэтаноламин, и может быть получена с помощью выпаривание в обращенной фазе. Например, Fab'-фрагменты антитела могут быть конъюгированы с липосомой посредством реакции дисульфидного обмена.
При этом, поскольку анти-DR5-антитело или его антигенсвязывающий фрагмент специфически связывает DR5, антитело или фрагмент можно использовать для обнаружения DR5 (то есть наличия и / или уровня (концентрации)) и / или для диагностики связанных с DR5 заболеваний (то есть наличия или изменения уровней DR5 (для заболеваний, характеризующихся повышенным или аномальным уровнем по сравнению с нормальным состоянием)).
Соответственно, в одном варианте осуществления предусмотрена композиция для обнаружения DR5, содержащая анти-DR5-антитело или его антигенсвязывающий фрагмент. Следующим аспектом предложен способ обнаружения DR5, содержащий следующие этапы: обработка биологического образца анти-DR5-антителом или его антигенсвязывающим фрагментом; и выявление присутствия реакции антиген-антитело. Если реакция антиген-антитело выявлена, биологический образец может быть классифицирован как содержащий DR5, а уровень (концентрацию) DR5 можно измерить посредством измерения степени реакции антиген-антитело в биологическом образце.
Биологический образец может быть выбран из группы, в которую входят клетки, ткани и биологические жидкости, полученные от пациентов (например, млекопитающих, в частности, людей), и культуры из них. Здоровый образец может быть выбран из группы, в которую входят клетки, ткани и биологические жидкости, полученные от здоровых субъектов (например, млекопитающих, в частности, людей), не страдающих от связанного с DR5 заболевания, и культур из них.
Этап выявления реакции антиген-антитело или этап измерения степени реакции антиген-антитело может быть осуществлен различными способами, известными в данной области. В качестве примера, реакция антиген-антитело может быть подтверждена с помощью обычной ферментативной реакции, флуоресцентного, люминесцентного и / или радиоактивного детектирования и, в частности, может быть измерена одним из методов группы, в которую входит, в частности, иммунохроматография, иммуногистохимия, твердофазный иммуноферментный анализ (ELISA), радиоиммунологический анализ (RIA), иммуноферментный анализ (EIA), иммунофлуоресцентный анализ (FIA), иммунолюминесцентный анализ (LIA), иммуноблоттинг и т.п.
Следующим аспектом предложен:
полинуклеотид, кодирующий определяющую комплементарность область тяжелой цепи, полинуклеотид, кодирующий определяющую комплементарность область легкой цепи или их комбинация; полинуклеотид, кодирующий вариабельный участок тяжелой цепи, полинуклеотид, кодирующий вариабельный участок легкой цепи или их комбинация; или полинуклеотид, кодирующий тяжелую цепь, полинуклеотид, кодирующий легкую цепь или их комбинация, причем определяющие комплементарность области, вариабельные участки тяжелой и легкой цепи, а также тяжелая и легкая цепь соответствуют вышеприведенному описанию для анти-DR5-антитела;
рекомбинантный вектор, несущий полинуклеотиды или их комбинацию; а также
рекомбинантную клетку, несущую рекомбинантный вектор.
В одном варианте осуществления вышеописанный рекомбинантный вектор может содержать полинуклеотиды, кодирующие определяющую комплементарность область тяжелой цепи и определяющую комплементарность область легкой цепи; вариабельный участок тяжелой цепи и вариабельный участок легкой цепи; или тяжелую цепь и легкую цепь в анти-DR5-антителе, соответственно, в одном или нескольких векторах, несущих каждый из полинуклеотидов.
Под «вектором» понимают средство для экспрессии гена-мишени в клетке-хозяине, например плазмидный, космидный или вирусный вектор, в частности, вектор на основе бактериофага, аденовирусный вектор, ретровирусный вектор и аденоассоциированный вирусный вектор. Рекомбинантный вектор может быть получен из плазмид, часто используемых в данной области (например, pSC101, pGV1106, pACYC177, ColE1, pKT230, pME290, pBR322, pUC8/9, pUC6, pBD9, pHC79, pIJ61, pLAFR1, pHV14, серии pGEX, серии pET и pUC19), фагов (например, λgt4λB, λ-Charon, λΔz1 и M13), или путем манипулирования вирусами (например, SV40 и т. д.).
В рекомбинантном векторе полинуклеотид может быть функционально связан с промотором. Под термином «функционально связанный» понимают функциональную связь между искомой нуклеотидной последовательностью и регуляторной последовательностью экспрессии (например, промоторной последовательностью). Будучи «функционально связанным», регуляторный элемент может управлять транскрипцией и / или трансляцией искомого нуклеотида.
Рекомбинантный вектор обычно может представлять собой клонирующий или экспрессионный вектор. Для рекомбинантных экспрессионных векторов можно использовать вектор, обычно доступный в данной области для экспрессии чужеродного белка в клетках растений, животных или микробов. Различные методы, хорошо известные в данной области, могут использоваться для конструирования рекомбинантных векторов.
Для использования в носителях, в частности, прокариотических или эукариотических клетках, рекомбинантный вектор может быть сконструирован соответствующим образом. Например, если вектор конструируется как экспрессионный вектор для использования в прокариотическом носителе, вектор обычно содержит сильный промотор транскрипции (например, промотор pLκλ, промотор ЦМВ, промотор trp, промотор lac, промотор tac промотор T7 и т.д.), сайт связывания рибосом для инициации трансляции и последовательности терминации транскрипции / трансляции. С другой стороны, экспрессионный вектор для использования в эукариотическом носителе содержит, в том числе, точку начала репликации, действующую в эукариотической клетке, в частности, точку начала репликации f1, точку начала репликации SV40, точку начала репликации pMB1, точку начала репликации аденовирусной ДНК, точку начала репликации AAV и точку начала репликации BBV. Кроме того, экспрессионный вектор обычно содержит промотор, полученный из геномов клеток млекопитающих (например, промотор металлотионеина) или вирусов млекопитающих (например, позднего промотора аденовируса, промотора 7.5K вируса коровьей оспы, промотора SV40, промотора ЦМВ и промотора tk ВПГ), и последовательность полиаденилирования в качестве последовательности терминации транскрипции.
Рекомбинантная клетка может быть получена путем введения рекомбинантного вектора в подходящую клетку-хозяин. При условии стабильного последовательного клонирования и экспрессии рекомбинантного вектора любую клетку-хозяина, известную в данной области, можно использовать в настоящем изобретении. В качестве примера прокариотической клетки-хозяина, доступной для настоящего изобретения, можно назвать E. coli, разновидности бацилл, в частности, Bacillus subtilis и Bacillus thuringiensis, и штаммы энтеробактерий, в частности, Salmonella typhimurium, Serratia marcescens и различные виды Pseudomonas. К эукариотическим клеткам-хозяевам, доступным для трансформации, относятся, но не ограничиваясь этим, Saccharomyce cerevisiae, клетки насекомых и животных, в частности, Sp2/0, CHO (яичник китайского хомячка) K1, CHO DG44, PER.C6, W138, BHK, COS-7, 293, HepG2, Huh7, 3T3, RIN и MDCK.
Молекула нуклеиновой кислоты или несущий ее рекомбинантный вектор может быть введен (трансфицирован) в клетку-хозяина методом, хорошо известным в данной области. Такая трансфекция может быть осуществлена методом CaCl2 или электропорации, если клетка-хозяин является прокариотической. Для эукариотических клеток-хозяев генетический перенос может быть достигнут, в частности, методом микроинъекции, осаждения фосфата кальция, электропорации, опосредованной липосомами трансфекции или бомбардировки частицами.
Для выбора трансформированной клетки-хозяина выгодным образом можно использовать фенотип, связанный с маркером отбора, одним из хорошо известных в данной области способов. Например, если маркер отбора представляет собой ген, придающий резистентность к определенному антибиотику, клетки-хозяева можно выращивать в присутствии антибиотика в среде для выбора искомого трансформанта.
Следующий аспект относится к способу получения анти-DR5-антитела или его антигенсвязывающего фрагмента, содержащему этап экспрессии полинуклеотида или рекомбинантного вектора в подходящей клетке-хозяине. В одном варианте осуществления способ получения может содержать этап культивирования рекомбинантной клетки, содержащей полинуклеотид или рекомбинантный вектор, а также, при необходимости, этап выделения и / или очистки антитела из питательной среды.
Полезные эффекты изобретения
Настоящее изобретение относится к анти-DR5-антителу для прицельной терапии заболеваний, связанных с экспрессией DR5. Антитело согласно настоящему описанию изобретения представляет собой TRAIL-неконкурентное антитело, сохраняющее постоянный уровень антигенсвязывающей способности независимо от концентрации TRAIL. Следовательно, антитело можно эффективно использовать для разработки инновационных лекарственных средств на основе антител или диагностических средств, эффективность которых превышает ранее разработанные лекарственные средства на основе антител.
Краткое описание чертежей
На ФИГ. 1 изображена сенсограмма ассоциации и диссоциации, отражающая скорости ассоциации и диссоциации антитела D0.
На ФИГ. 2a-2f изображены графики, сравнивающие антитела D0 и DA1-DA35 с контрольным антителом AP в отношении активности связывания DR5.
На ФИГ. 3a и 3b показаны результаты электрофореза типичных антител в полиакриламидном геле в присутствии додецилсульфата натрия (ДНС-ПААГ) в соответствии с настоящим изобретением.
На ФИГ. 4a-4h изображены гель-фильтрационные хроматограммы (SEC) типичных антител согласно настоящему изобретению.
На ФИГ. 5 изображен фармакокинетический профиль антител согласно настоящему изобретению.
На ФИГ. 6a-6r показано, что антитела согласно настоящему изобретению обладают цитотоксической активностью в опухолевых клетках.
На ФИГ. 7a и 7b показаны результаты ингибирования роста опухоли антителами согласно настоящему изобретению на ксенотрансплантатных моделях опухоли у животных.
На ФИГ. 8a и 8b показано, что антитела согласно настоящему изобретению не конкурируют с TRAIL за связывание DR5.
На ФИГ. 9a и 9b изображены графики, показывающие синергетические эффекты антител согласно настоящему изобретению и TRAIL в анализах индукции гибели клеток.
На ФИГ. 10a-10c изображены графики, показывающие, что антитела согласно настоящему изобретению индуцируют гибель клеток посредством апоптоза.
На ФИГ. 11a и 11b показана цитотоксическая активность антител согласно настоящему изобретению при применении в сочетании с гемцитабином в определенных концентрациях.
Вариант осуществления изобретения
Настоящее изобретение будет детально описано ниже со ссылкой на примеры. Эти примеры предназначены только для иллюстрации настоящего изобретения и, что очевидно специалистам в данной области техники, что объем настоящего изобретения не ограничивается этими примерами.
ПРИМЕР 1. Иммунизация DR5 и создание библиотеки кДНК
Для выбора антител, специфически связывающих DR5, были созданы библиотеки иммунизированных антител животного происхождения. Библиотеки составлены путем получения мРНК из иммунных клеток животных, иммунизированных антигеном, ПЦР-амплификации гена антитела с использованием комбинации праймеров для гена антитела и клонирования гена антитела в векторы фагового дисплея.
По существу, человеческий DR5 (R&D systems, США) в смеси с полным и неполным адъювантом Фрейнда (Sigma, США) подкожно вводили трем цыплятам породы белый леггорн пять раз с интервалом в три недели. Сыворотки иммунизированных животных перед сохранением разводили в концентрации 1:100, 1:500, 1:2500 и 1:12500 в PBSB (3% альбумина бычьей сыворотки в забуференном фосфатом физиологическом растворе). Твердофазный иммуноферментный анализ был выполнено для проверки связывания сывороткой человеческого DR5. Планшеты для твердофазного ИФА покрывали на ночь 1 мкг/мл человеческого DR5 (R&D systems, США) при 4ºC с последующей реакцией с разбавленной сывороткой в течение 2 часов. Планшеты трижды промывали PBST (0,1% Tween-20 в фосфатно-солевом буфере), после чего инкубировали с куриным анти-иммуноглобулином-HRP (пероксидаза хрена) (1:3000) в течение одного часа. После трех циклов промывки в PBST проявление цвета выполнялось в течение 20 минут с помощью ABTS (Thermo, США). Абсорбцию при 405 нм определяли по считывающему устройству для микропланшетов. Перед иммунизацией сыворотки не связывали DR5. Были отобраны животные, сыворотки которых характеризовались сильным связыванием с человеческим DR5.
Через пять дней после последней инъекции были взяты образцы костного мозга, селезенки и фабрициевой сумки у выбранной курицы. Ткани смешивали с 10 мл реагента TRI (Молекулярный исследовательский центр, США) и гомогенизировали в гомогенизаторе. После добавления 20 мл реагента TRI было выполнено центрифугирование. Полученный таким образом супернатант смешивали с 3 мл 1-бром-3-хлорпропана (BCP) и центрифугировали для получения супернатанта. Суммарную РНК осаждали добавлением 15 мл изопропанола. Обратную транскрипцию проводили с использованием системы транскрипции SuperScript (Invitrogen, США) со случайными гексамерами в качестве праймеров (5 минут при 65°C; 5 минут при 4°C; 50 минут при 50°C; 5 минут при 85°C; и 4°C). 5 мкл реакционной смеси обратной транскрипции, содержащей полученную кДНК, загрузили в 1% агарозный гель и подвергали электрофорезу для обнаружения полос кДНК различной длины.
ПРИМЕР 2. Составление библиотеки антител
(2-1) Амплификация гена иммунного антитела
Для амплификации вариабельных участков тяжелой и легкой цепи VH и VL антитела цыпленка полимеразная цепная реакция (ПЦР) была выполнена следующим образом. Матрицей для проведения ПЦР послужила кДНК, полученная в примере 1, причем использовались комбинации праймеров, разработанных для вариабельных участков тяжелой цепи, вариабельных участков легкой цепи и scFv (одноцепочечного Fv), связывающего вариабельные участки тяжелой и легкой цепи, как показано в таблице 4 (см. ниже). 0,5 мкл каждой из библиотек кДНК VH и VL, 30 пмоль прямого праймера, 30 пмоль обратного праймера, 10-кратный буфер ПЦР, 200 мкмоль дНТФ и 0,5 мкл ДНК-полимеразы Taq смешивали и доводили до конечного объема 50 мкл, после чего подвергли ПЦР, начав с денатурации при 94°C в течение 5 минут с последующим выполнением 30 циклов при 94°C в течение 15 секунд, при 56°C в течение 30 секунд и при 72°C в течение 90 секунд. ПЦР-амплифицированные антитела ДНК разделяли по размеру электрофорезом в 1% агарозном геле и очищали с помощью набора для экстракции геля (Qiagen, США).
Для получения ДНК scFv использовали матрицу из 50 нг очищенной ДНК VH и 50 нг очищенной ДНК VL, смешанных с 30 пмоль прямого праймера, 30 пмоль обратного праймера, 10-кратным буфером ПЦР, 200 мкмоль дНТФ и 0,5 мкл ДНК-полимеразы Taq, с доведением до конечного объема 50 мкл. ПЦР выполняли денатурацией при 94°C в течение 5 минут, затем выполняли 20 циклов при 94°C в течение 30 секунд, при 56°C в течение 30 минут и при 72°C в течение 2 минут. ПЦР-амплифицированную ДНК разделяли в соответствии с размером электрофорезом в 1% агарозном геле и очищали с помощью набора для экстракции геля (Qiagen, США).
Праймеры, использовавшиеся в ПЦР, перечислены в таблице 4 (см. ниже).
[Таблица 4]
Праймеры, используемые в ПЦР
(2-2) Расщепление ДНК антитела рестрикционным ферментом
Полученный выше scFV и фагмидный вектор pComb3X (Научно-исследовательский институт Scripps, Калифорния, США) расщепляли рестрикционным ферментом SfiI (Roche, США). Смесь из 10 мкг фрагмента ПЦР, кодирующего scFv, 360 единиц SfiI (Roche, США) и 20 мкл 10-кратного буфера довели до конечного объема 200 мкл и оставили на реакцию в течение ночи при 50°C. Кроме того, смесь из 20 мкг вектора pComb3X, 120 единиц SfiI и 20 мкл 10-кратного буфера довели по объему до 200 мкл и оставили реагировать на ночь при 50°C. Каждый из полученных лизатов подвергали электрофорезу в агарозном геле и очищали с помощью набора для экстракции геля (Qiagen, США).
(2-3) Лигатирование ДНК антитела и составление библиотеки
Для введения фрагментов scFv в pComb3X смесь из 700 нг фрагментов ПЦР, кодирующих scFV и расщепленных рестрикционным ферментом SfiI на (2-2), и 1,4 мкг pComb3X подвергли реакции в течение ночи при 16°C в присутствии ДНК-лигазы Т4 (Invitrogen, США). Полученную таким образом смесь для лигатирования очищали спиртовым осаждением и трансформировали в E. coli ER2738 (New England Biolab, США) электропорацией. Е. coli культивировали в присутствии 46 мкг/мл карбенициллина и 70 мкг/мл канамицина для получения библиотеки сложностью 5×109.
ПРИМЕР 3. Выбор фагового клона, несущего анти-DR5 scFv
Из библиотеки, полученной в примере 2 и содержащей рандомизированные тяжелые и легкие цепи в форме scFV, были выбраны антитела, связывающиеся с человеческим DR5, с использованием твердофазного иммобилизованного DR5.
(3-1) Выбор антитела, связывающего DR5
Сначала 10 мкг человеческого DR5 (R&D systems, США) были конъюгированы с магнитными микроносителями. Библиотеку ДНК антител составили путем слияния антител типа scFv, полученных в примере 2, с белком оболочки фага PIII, что позволило обеспечить экспрессию антител на поверхности фага. После трансформации методом электропорации с использованием библиотеки ДНК антител E. coli ER2738 (New England Biolab) культивировали при 37°C, после чего инкубировали в течение ночи с фагом-помощником VCSM13 (Stratagene, США) в присутствии 46 мкг/мл карбенициллина и 70 мкг/мл канамицина в среде SB (30 г/л триптона, 20 г/л дрожжевого экстракта и 10 гл 3-(N-морфолин) пропансульфониевой кислоты (MOPS), pH 7,0). Полученную бульонную культуру, содержащую E. coli и фаги, центрифугировали для осаждения и удаления E. coli. Супернатант выделяли и центрифугировали после добавления 40 мг/мл полиэтиленгликоля 8000 и 30 мг/мл NaCl. Осажденные полиэтиленгликолем фаги собирали и ресуспендировали в фосфатно-солевой буферный раствор. Фаги вступали в реакцию с человеческим DR5, конъюгированным с магнитными микроносителями, при комнатной температуре в течение 2 часов с целью захвата фагов, имеющих сродство к DR5. После этого микроносители промывали 0,5% Tween 20 в фосфатно-солевом буферном растворе, а связанные фаги элюировали 0,1 моль глицина (рН 2,2) и нейтрализовали 2 моль тригидроксиметиламинометана. Элюированными фагами инфицировали E. coli ER2738, после чего культуру оставляли на ночь для следующего цикла пэннинга. Такую процедуру пэннинга повторяли четыре раза. Повторные циклы пэннинга давали скопление фагов с высокой аффинностью связывания. Отдельные клоны, отобранные из чашек четвертого пэннинга, инкубировали в течение ночи с фагом-помощником VCSM13 (1:1000) при 37°C в присутствии 100 мкг/мл карбенициллина и 70 мкг/мл канамицина в планшетах с 96 глубокими лунками с целью индуцирования амплификации фагов, экспрессирующих антитело. После центрифугирования полученной бульонной культуры фаги в супернатанте предварительно связывали с TRAIL, после чего высевали в планшеты для твердофазного ИФА, покрытые DR5. После инкубации при 37°C в течение 2 часов проводили твердофазный ИФА с использованием HRP-конъюгированного анти-М13-антитела с целью идентификации связывающих DR5 антител.
(3-2) Секвенирование выбранного антитела
E. coli ER2738, содержащий, как было показано выше, DR5-реактивные клоны в условиях отбора примера (3-1), культивировали в течение ночи в среде SB и собирали центрифугированием. Плазмидную ДНК получали с помощью набора DNA min-prep (GeneAll, Корея), после чего секвенировали. Для секвенирования использовали праймеры секвенирования, перечисленные в таблице 5 (см. ниже).
ТАБЛИЦА 5
Праймеры, используемые в ПЦР
ПРИМЕР 4. Оптимизация антител - гуманизация и повышение аффинности
Из группы клонов антител, полученных из библиотек иммунизированных антител животного происхождения, был выбран исходный клон D0 (химерное антитело) с высокой аффинностью и активностью. Каркас антитела был перенесен в каркас антитела человека (Nishibori et al., Molecular Immunology, 43 (2006)). Для повышения аффинности была составлена новая библиотека фагов со случайными мутациями последовательностей CDR в областях тяжелой и легкой цепи. Библиотека фагов была получена аналогично примеру 2, после реагирования в течение 2 часов при комнатной температуре с 10 мкг человеческого DR5, иммобилизованного на магнитных микроносителях, с последующей пятикратной промывкой 0,5% Tween 20 в фосфатно-солевом буферном растворе. После этого связанные фаги элюировали 0,1 моль глицина (рН 2,2) и нейтрализовали 2 моль раствора тригидроксиметиламинометана. Для повышения давления отбора 1 мкг человеческого DR5 иммобилизовали на магнитных микроносителях и промывали 10 раз средством Tween 20 в фосфатно-солевом буферном растворе во втором цикле пэннинга, а 0,1 мкг человеческого DR5 иммобилизовали и промывали 20 раз средством Tween 20 в фосфатно-солевом буферном растворе в третьем цикле пэннинга. В дополнение к вышеописанным методам гуманизации и повышения аффинности были сконструированы деиммунизированные варианты, полученные заменой аминокислот в вариабельных участках каркасных последовательностях исходных клонов и обладающие, как было предсказано, высокой иммуногенностью в иммунных клетках. Гуманизированные или деиммунизированные варианты исходного клона, полученные вышеописанным способом, получили обозначения «DA1-DA35».
Последовательности определяющих комплементарность областей и вариабельных участков, полученных из клонов D0 и DA1-DA35, собраны в таблицы 6-9 (см. ниже):
[Таблица 6]
Последовательности CDR тяжелой цепи
[Таблица 7]
Последовательности CDR легкой цепи
[Таблица 8]
Последовательности вариабельных участков тяжелой цепи
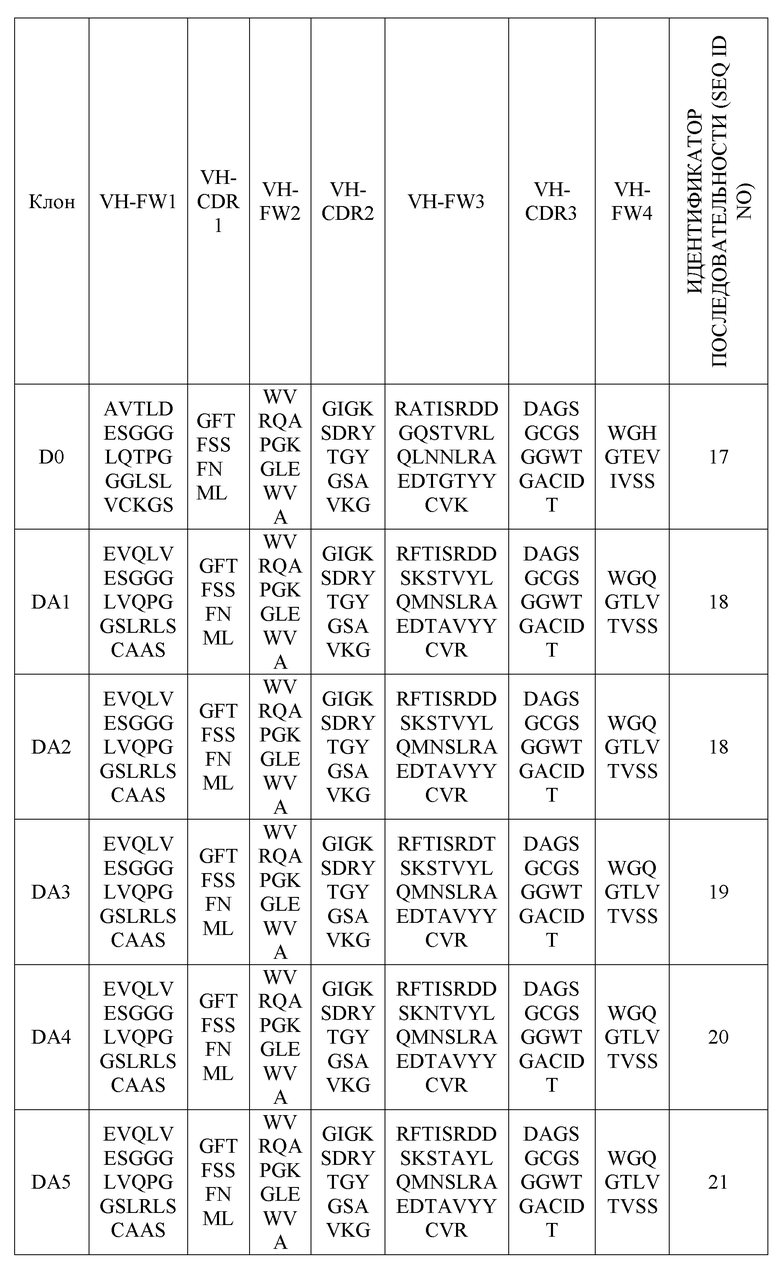
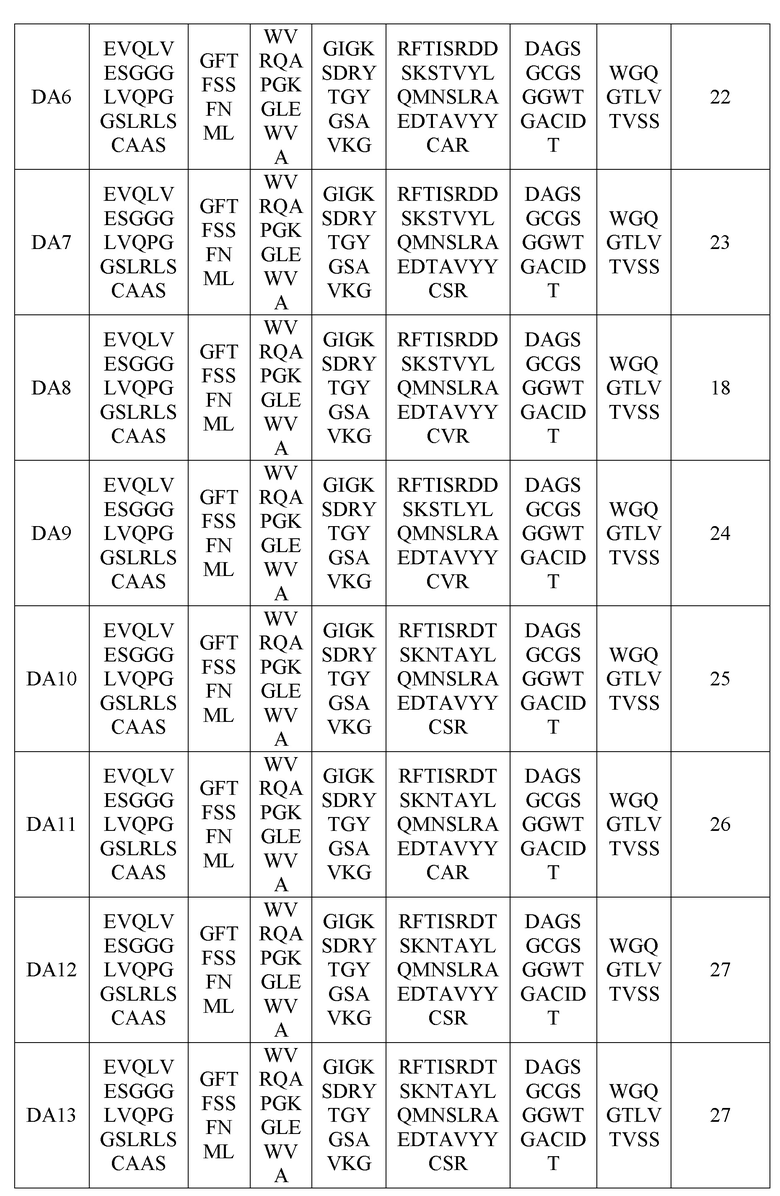
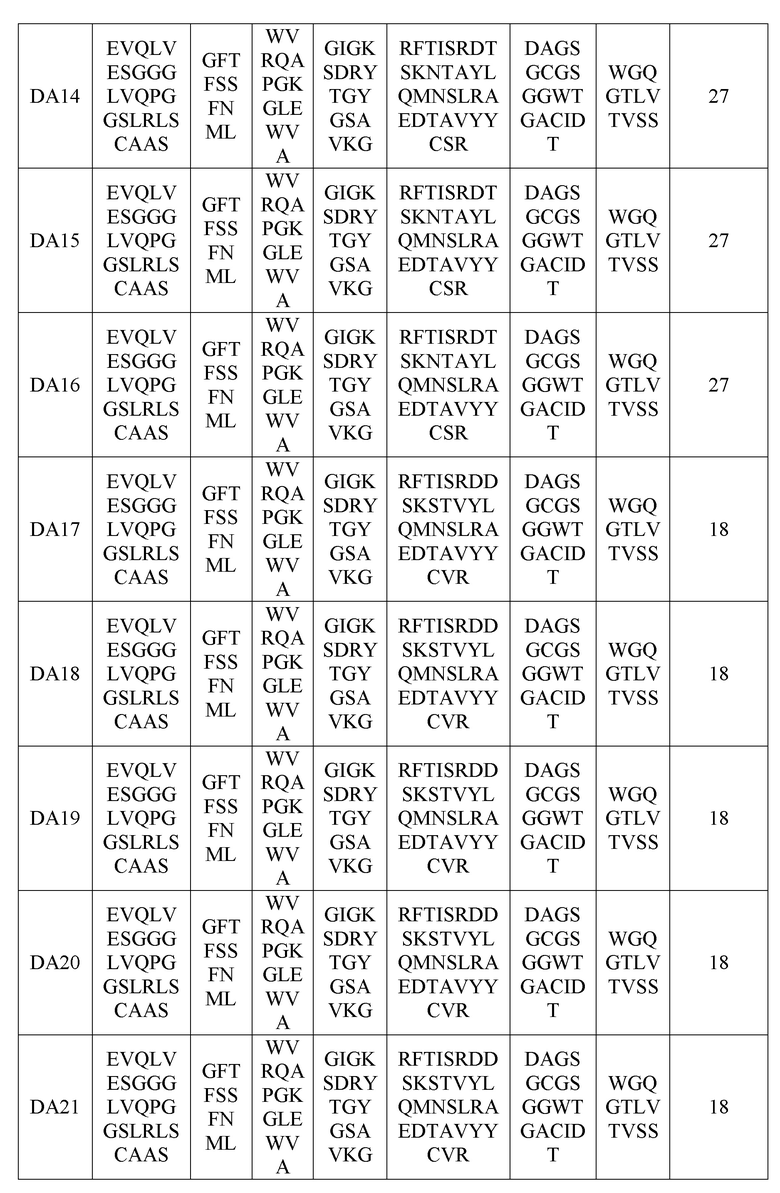
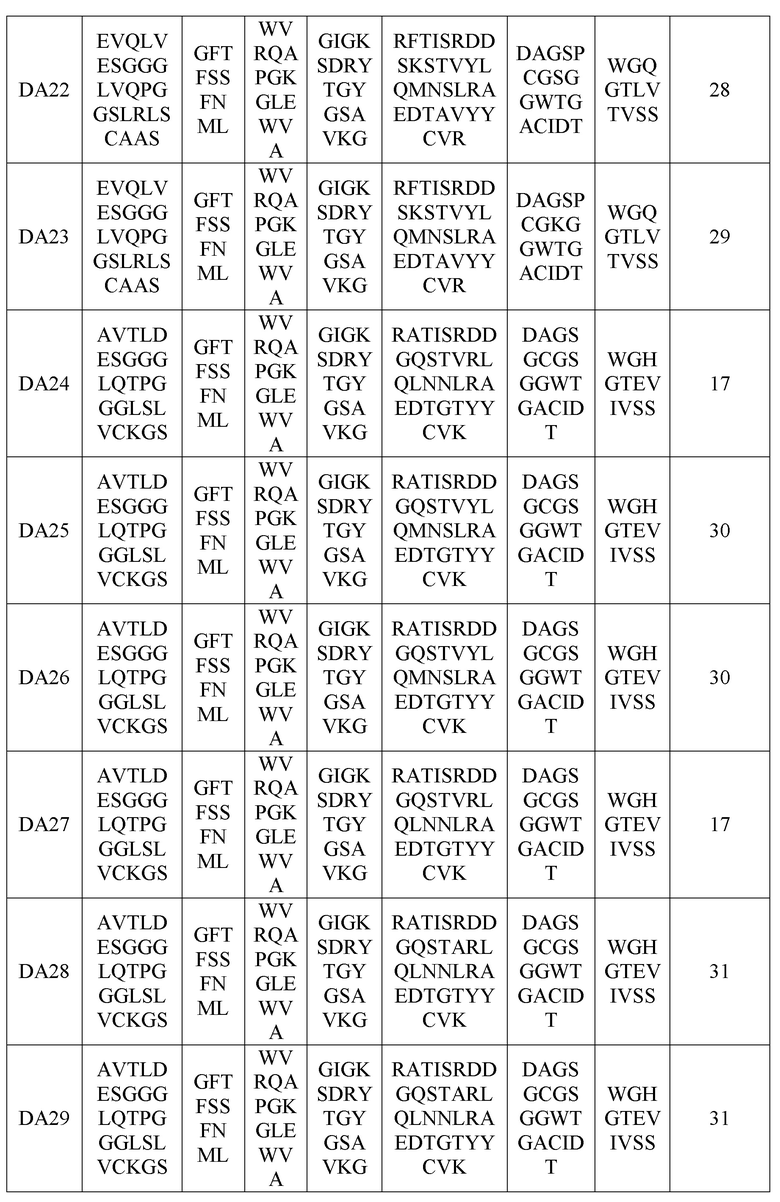
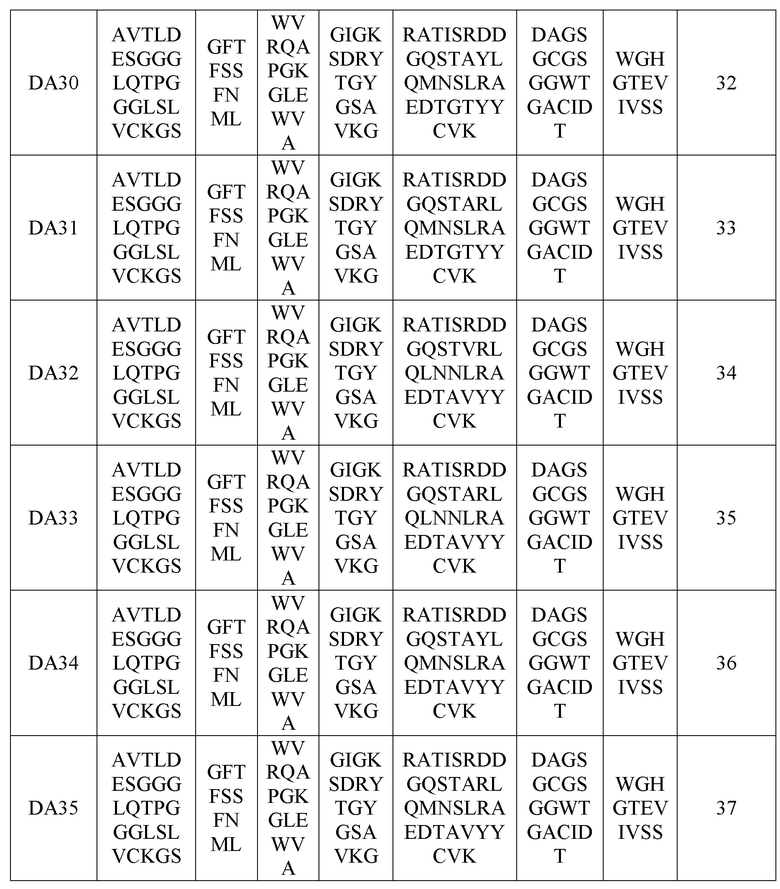
(В вышеприведенной таблице 8 VH-FW1, VH-FW2 и VH-FW3 представляют собой каркасы вариабельного участка тяжелой цепи)
[Таблица 9]
Последовательности вариабельных участков легкой цепи
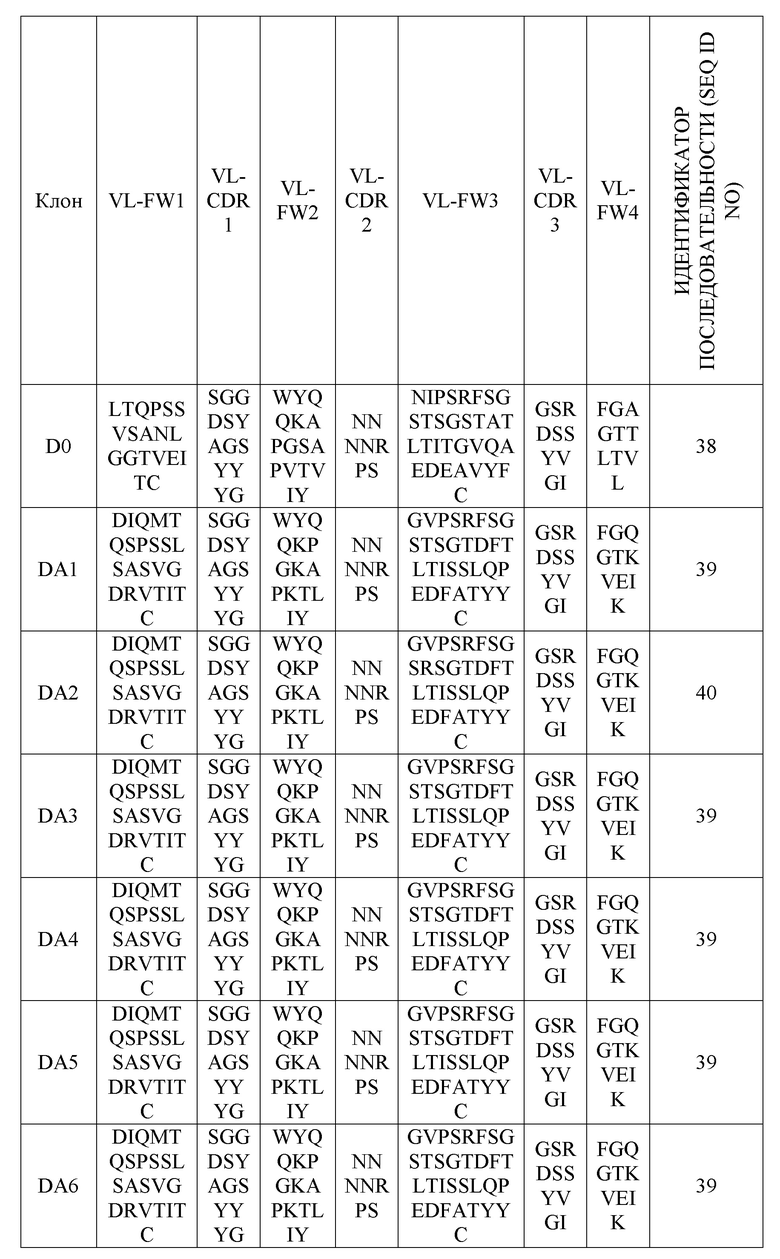
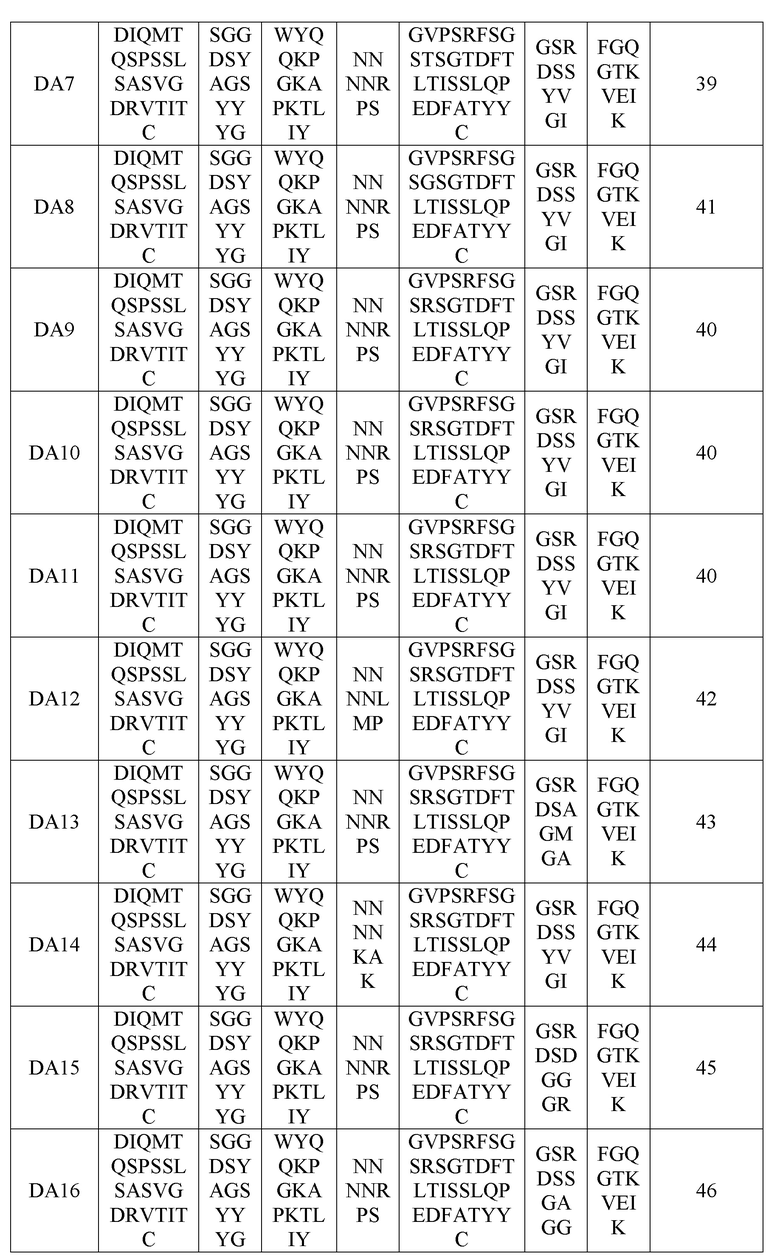
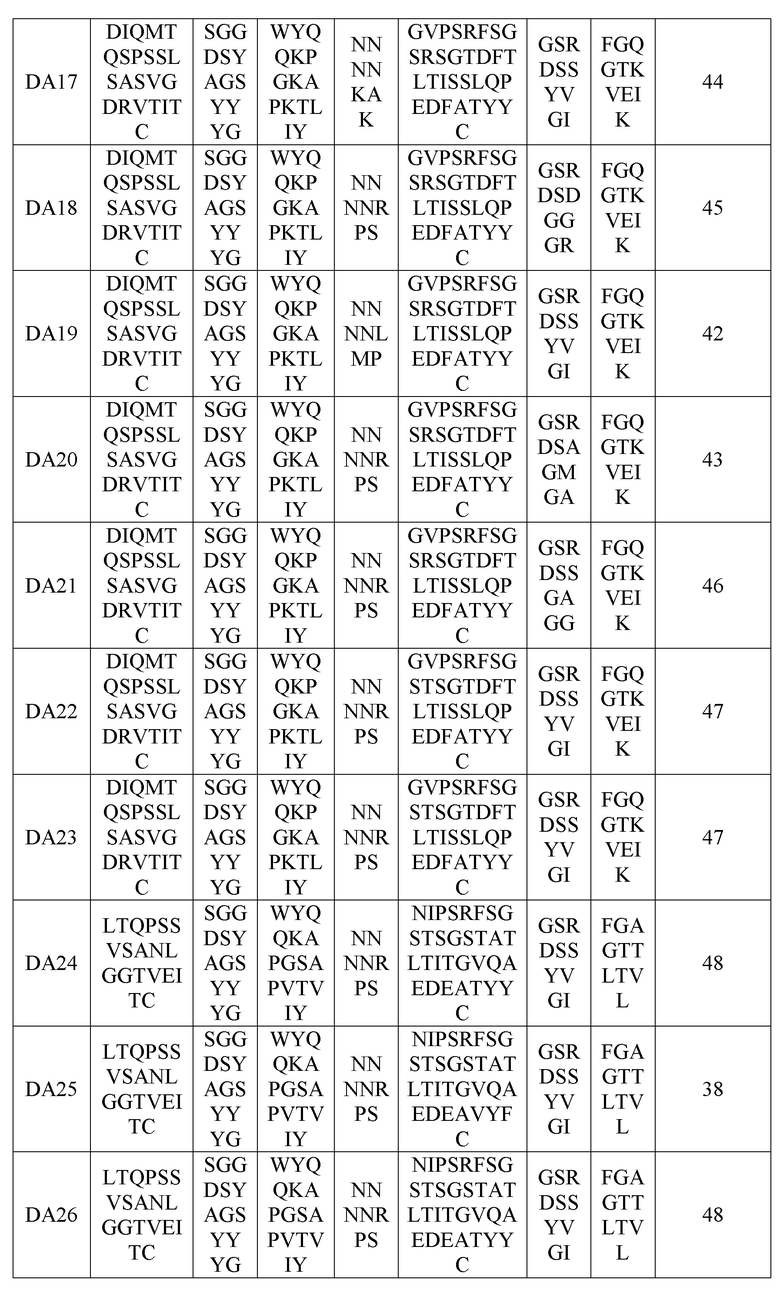
(В таблице 9 VL-FW1, VL-FW2 и VL-FW3 представляют собой каркасы вариабельного участка легкой цепи)
ПРИМЕР 5. Получение антитела
Для использования в анализе аффинности и активности ранее полученных антител были получены иммуноглобулиновые (IgG) белки. Из pComb3x, несущего нуклеотид scFv, были получены фрагменты вариабельных и константных участков тяжелой и легкой цепи посредством ПЦР с использованием комбинаций праймеров, перечисленных в таблице 10, в условиях примера 2.
Гены вариабельных участков (от VH до VL) и константных участков (от CH до Ck) в тяжелых и легких цепях амплифицировали полимеразно-цепной реакцией (ПЦР) с использованием комбинаций праймеров HC и LC (см. таблицу 10) и вводили в плазмиды экспрессии клеток млекопитающих с использованием наборов для клонирования pcDNATM3.3-TOPO®TA и pOptiTMVEC-TOPO®TA (Invitrogen, США). 1 мкл каждого вектора (вектор pcDNATM3.3-TOPO® и вектор pOptiTM VEC-TOPO®) и фрагменты добавляли в буфер, содержащий 200 ммоль NaCl и 10 ммоль MgCl2, до конечного объема 6 мкл и оставляли на 5 мин для реакции при комнатной температуре. Векторы были трансформированы в компетентные клетки E. coli DH5α путем теплового шока. Полученные колонии массово культивировали для получения плазмид. Полученные выше плазмиды трансфицировали в клетки HEK293F (Invitrogen, США), которые затем культивировали в течение 7 дней для экспрессии антител. Антитела очищали в колонке с белком А (GE, США). Супернатанты клеточных культур загружали в колонку для связывания антител (IgG) с белком А с последующим элюированием 20 ммоль буфера цитрата натрия (рН 3,0). Анализом ДНС-ПААГ была подтверждена высокая чистота антител, а также соответствие молекулярной массы легкой и тяжелой цепи теоретическим величинам.
ТАБЛИЦА 10
ПРИМЕР 6. Анализ аффинности связывания антитела с DR5 человека
Для измерения аффинности человеческий DR5 связывали с карбоксилированными декстрановыми биосенсорными чипами (CM5, GE) в соответствии с инструкцией производителя. Скорость ассоциации и диссоциации оценивали путем введения белков IgG, серийно разведенных в 2 раза до 5 нмоль, 2,5 нмоль, 1,25 нмоль, 0,625 нмоль, 0,313 нмоль и 0,156 нмоль.
Скорости ассоциации и диссоциации отражены на сенсограммах ассоциации и диссоциации и рассчитаны по простой модели связывания Ленгмюра 1:1 (BIAcore X100 Evaluation Software, версия 2.0). Было подтверждено нахождение равновесных констант диссоциации (KD), выражающих отношение константы диссоциации (Kd) к константе ассоциации (Ka), в субнаномолярном диапазоне. Измерения связывания антител D0 и DA1-DA35, описываемых настоящим изобретением, с DR5 сведены в нижеприведенную таблицу 11 (названия антител указаны как названия клонов, из которых были получены антитела). Типичная сенсограмма для D0 изображена на ФИГ. 1.
[Таблица 11]
ПРИМЕР 7. Анализ активности связывания антител с человеческим DR5
Активность связывания антител согласно настоящему изобретению с человеческим DR5 подтверждена твердофазным иммуноферментным анализом. Человеческий белок DR5 в концентрации 10 нг/мл высевали в объеме 150 мкл на лунку на 96-луночные иммунные планшеты (Nunc, США) и адсорбировали при комнатной температуре в течение одного часа. После трехкратного промывания планшетов буферным раствором в лунки добавляли серийные разведения (0,1-2000 нг/мл) антител в объеме 150 мкл на лунку и инкубировали при комнатной температуре в течение 1-2 часов. После этого планшеты повторно промывали буферным раствором. Затем конъюгированное HRP (пероксидазой хрена) антитело (Serotec, США) разводили относительно Fc-антитела иммуноглобулина человека в пропорции 1:20000 и высевали в объеме 150 мкл на лунку с последующей инкубацией при комнатной температуре в течение 1 часа. После промывки добавляли раствор 3,3',5,5'-тетраметилбензидина (TMB; Sigma, США) в количестве 100 мкл на лунку и инкубировали в течение 3-10 минут для проявления цвета. После достижения определенного уровня проявления цвета реакцию прекращали введением 1 н. серной кислоты (H2SO4). Абсорбцию при 450 нм считывали с использованием спектрофотометра (Molecular Device, США); результаты представлены на ФИГ. 2a-2f. При выполнении этого анализа антитело АР синтезировали в соответствии с последовательностью анти-DR5-антитела, раскрытой в PCT/US 2006/03577 (WO 2006/083971), и использовали в качестве контрольного антитела. Как показано на ФИГ. 2a-2f, обнаружилось, что антитела D0 и DA1-DA35 обладают более высокой антигенсвязывающей активностью по сравнению с контрольным антителом АР.
ПРИМЕР 8. Анализ физико-химических свойств
[8-1] Подтверждение размера антитела
Размеры антител по настоящему изобретению анализировали с помощью ДНС-ПААГ с использованием геля NuPAGE 4-12% бис-трис (Invitrogen, США). Полученные анти-DR5-антитела (D0, DA1, DA4, DA16, DA18, DA20, DA23, DA26 и DA29) подвергали электрофорезу в SDS-полиакриламидном геле (ДНС-ПААГ) в восстановительных условиях после обработки дитиотреитолом (ДТТ) (Invitrogen, США) для удаления дисульфидных связей и в невосстановительных условиях без обработки ДТТ для выявления легких и тяжелых цепей полного антитела. Результаты представлены на ФИГ. 3a (невосстановительные условия) и 3b (восстановительные условия). Как показано на ФИГ. 3a, в образцах, проанализированных в невосстановительных условиях, обнаружена полоса в положении между маркерами размера 98 кДа и 188 кДа, что соответствует размеру полного антитела. Как показано на ФИГ. 3b, в образцах, проанализированных в восстановительных условиях, обнаружено две полосы в области маркеров размера 49 кДа и 28 кДа, относящиеся к тяжелой и легкой цепи антител, соответственно. Таким образом, полосы, соответствующие полному антителу, тяжелой цепи и легкой цепи, были детектированы электрофорезом в SDS-полиакриламидном геле.
[8-2] Подтверждение чистоты антитела
Чистоту антител и (растворимые) агрегаты анализировали методом гель-фильтрационной хроматографии (SEC) с использованием колонки TSKgel G3000SWxl (Tosoh, Япония). Результаты представлены на ФИГ. 4a (контрольное антитело AP), 4b (D0), 4c (DA1), 4d (DA4), 4e (DA15), 4f (DA23), 4g (DA26) и 4h (DA29). Гель-фильтрационная хроматография выполнена с изократическим элюированием с использованием 100 ммоль фосфатного буфера (рН 6,6) в качестве подвижной фазы и измерением поглощения при 280 нм. По существу, подтверждена чистота выше 94%, причем мономеры составляли 94% и более от общей площади пиков, а агрегированные пики составляли менее 6%.
ПРИМЕР 9. Фармакокинетика антитела
Для исследования in vivo кинетики полученных ранее антител время полужизни в крови было оценено на мышах. Антитела вводили голым мышам внутривенно в дозах 1-10 мг/кг. Кровь забирали из глазничной вены через 5-14 дней после инъекции. Забор крови выполнялся посредством гепаринизированных капиллярных трубок. Плазму, полученную центрифугированием образцов крови, разбавляли в определенных соотношениях и использовали в качестве образцов для твердофазного ИФА. Человеческий DR5, разведенный до концентрации 10 нг/мл, высевали в объеме 100 мкл на лунку на 96-луночные иммунные планшеты (Nunc, США) и адсорбировали в лунках в течение 12-14 часов. Планшеты трижды промывали буферным раствором, содержащим 0,1% Tween 20, и блокировали буферным раствором, содержащим альбумин бычьей сыворотки (Sigma, США) при комнатной температуре в течение 1 часа. После трех циклов промывки буферным раствором планшеты инкубировали с каждым из разведений плазмы мышей и серийным разведением стандартного вещества при комнатной температуре в течение 2-3 часов. После трех промывок буферным раствором добавляли разведение 1:20000 конъюгированного HRP Fc-антитела иммуноглобулина человека (Fc-HRP) (Bethyl, США) в объеме 100 мкл на лунку и инкубировали при комнатной температуре в течение 1 часа. После трехкратной промывки в каждую лунку добавляли 100 мкл раствора триметилбензидина (Sigma, США) и оставляли для проведения реакции. После достижения определенного уровня проявления цвета реакцию прекращали введением 0.2 н. раствора серной кислоты. Оптическую плотность при 450 нм измеряли спектрофотометром (Molecular Device, США). Концентрацию антител в каждом образце плазмы рассчитывали на основании измеренной оптической плотности (OD), а фармакокинетические параметры оценивали с помощью программы WinNonLin верс. 6.2.0.495. Результаты представлены на ФИГ. 5 и в таблице 12 (см. ниже).
[Таблица12]
Как показано на ФИГ. 5 и в таблице 12, антитела (D0, DA22 и DA23) показали время полужизни в крови участвующих в исследовании мышей от 6,68 до 8,37 дней.
ПРИМЕР 10. Подтверждение цитотоксичности антитела в опухолевых клетках
Биологическую активность полученных антител определяли с использованием анализов гибели клеток in vitro. Для этого анализа использовали клеточную линию рака ободочной и прямой кишки человека Colo205 (ATCC, США), клеточную линию рака поджелудочной железы человека Miapaca-2 (ATCC, США) и клеточную линию рака легкого человека H2122 (ATCC, США).
Каждую линию опухолевых клеток суспендировали с плотностью 1×105 клеток/мл, высевали в объеме 50 мкл на лунку в 96-луночные планшеты для культивирования клеток и культивировали в течение 16-24 часов в камере с постоянной температурой и влажностью. Антитела в определенной концентрации (0,06-66000 пмоль) применяли отдельно (только антитело) или в комбинации с поперечно-сшитым антителом (Fc-антитело человека) (Serotec, США) (сцепленное антитело), после чего инкубировали в течение 48 часов. 10 мкл раствора резазурина (Invitrogen, США) добавляли в каждую лунку и инкубировали в течение 1-2 часов в камере с постоянной температурой и влажностью. После этого спектрофотометром (Molecular Device) определяли флуоресценцию при 590 нм. Жизнеспособность клеток рассчитывали как отношение процента относительных единиц флуоресценции (RFU) группы, обработанной испытуемым веществом (обработанных RFU), к относительным единицам флуоресценции группы, обработанной средой (необработанных RFU) (жизнеспособность клеток (%) = обработанные RFU / необработанные RFU х 100). Результаты представлены на ФИГ. 6a-6r. В целях сравнения вышеописанный анализ выполняли на контрольном антителе АР.
Как показано на ФИГ. 6a-6r, полученные ранее антитела отличались высокой активностью гибели клеток во всех трех линиях опухолевых клеток человека.
ПРИМЕР 11. Оценка противоопухолевой активности в ксенотрансплантатных моделях
Противоопухолевую активность оценивали путем введения антител голым мышам, которым были привиты линии опухолевых клеток человека. Для линий опухолевых клеток, экспрессирующих DR5 человека, использовали клеточную линию рака легкого человека H2122 (ATCC, США) и клеточную линию рака поджелудочной железы человека Miapaca-2 (ATCC, США). От двух до пяти миллионов опухолевых клеток прививали к латеральным подкожным участкам самок голых мышей BALB/c в возрасте 6-8 недель (OrientBio), после чего измеряли объем опухолей штангенциркулем. После того, как опухоли выросли до среднего объема 100-300 мм3, мышей разделили на группы, и соответствующим группам ввели полученные ранее антитела (контрольное антитело АР и антитело D0). Антитела вводили в виде трех еженедельных внутрибрюшинных инъекций (в день разделения на группы, на 7-й и 14-й день) в дозах 0,05-2 мг/кг. Объем опухолей измеряли два раза в неделю в течение периода от 28-го до 50-го дня после первой инъекции. Буферный раствор (PBS) вводили в качестве отрицательного контроля.
Результаты представлены на ФИГ. 7a (мыши с введенным H2122) и 7b (мыши с введенным Miapaca-2). Как показано на ФИГ. 7a и 7b, противоопухолевая активность антитела D0 превышала активность контрольного антитела АР.
ПРИМЕР 12. TRAIL-неконкурентное связывание
Для исследования антигенсвязывающих характеристик антител, отобранных в примере 3, был проведен TRAIL-конкурентный твердофазный иммуноферментный анализ. Планшеты для твердофазного ИФА были покрыты человеческим DR5 в концентрации 0,1 мкг/мл (R&D systems, США) при 4°C. После этого планшеты инкубировали 0,01-1440 нмоль антител (D0, DA20, DA21, DA21, DA22 и DA23) вместе с 0,01-400 нмоль белка TRAIL в течение 2 часов. После трехкратной промывки планшетов PBST (0,1% альбумина бычьей сыворотки и Tween-20 в фосфатно-солевом буферном растворе) в каждую лунку добавляли конъюгированное HRP (пероксидазой хрена) Fc-антитело иммуноглобулина человека и инкубировали в течение 1 часа. После трех промывок в PBST проявление цвета выполнялось в течение 20 минут с помощью ABTS (Thermo, США). После достижения определенного уровня проявления цвета реакцию прекращали введением 1 н. серной кислоты. Абсорбцию при 405 нм измеряли спектрофотометром (Molecular Device, США); результаты представлены на ФИГ. 8a-8b. Антитело АР, описанное в примере (7-1), использовали в качестве контрольного.
На ФИГ. 8a и 8b связывание антигена контрольного антитела АР снижалось в зависимости от дозы TRAIL, в то время как антитела D0, DA20, DA21, DA21, DA22 и DA23 сохраняли определенный уровень связывания антигена независимо от концентрации TRAIL; таким образом, подразумевается, что антитела согласно настоящему изобретению не конкурируют с TRAIL за связывание DR5.
ПРИМЕР 13. Влияние антитела в сочетании с TRAIL
Свойства антител в соответствии с эпитопами анализировали в отношении активности гибели клеток при совместной обработке с сконструированными антителами и TRAIL. Для этого анализа использовали клеточную линию рака ободочной и прямой кишки человека Colo205 (ATCC, США) и клеточную линию рака поджелудочной железы человека Miapaca-2 (ATCC, США). Опухолевые клетки суспендировали в концентрации 1×105 клеток/мл, после чего суспензию высевали в объеме 50 мкл на лунку в 96-луночные планшеты для культивирования с последующей инкубацией в течение 16-24 часов в камере с постоянной температурой и влажностью. Серийные разведения антител (0,1-10000 нг/мл) и белка TRAIL в определенных концентрациях (0,5, 1, 10 нг/мл) совместно помещали в 96-луночные планшеты. После инкубации в течение 48-72 часов при постоянной температуре во влажных условиях добавляли раствор резазурина (Invitrogen, США) в объеме 10 мкл на лунку. После достижения определенного уровня реакции через 1-2 часа флуоресценцию считывали спектрофотометром при 590 нм (Molecular Device). Жизнеспособность клеток рассчитывали как отношение процента относительных единиц флуоресценции (RFU) группы, обработанной испытуемым веществом (обработанных RFU), к относительным единицам флуоресценции культуры группы, обработанной средой (необработанных RFU) (жизнеспособность клеток (%) = обработанные RFU / необработанные RFU х 100).
Репрезентативные результаты представлены на ФИГ. 9a (Colo205) и 9b (Miapaca-2). Для сравнения вышеописанное антитело AP использовали в качестве контроля, основываясь на описанных в литературе наблюдениях (Cell Death and Differentiation, 15, 751-761, 2008), согласно которым данное антитело AP обладает связывающим участком, аналогичным белку TRAIL.
Как показано на ФИГ. 9a и 9b, при применении антитела D0 или DA23 в концентрациях до 10 нг/мл в сочетании с определенными концентрациями TRAIL была обнаружена более высокая активность гибели клеток по сравнению с применением одного антитела, в то время как для контрольного антитела AP такого повышения активности не наблюдалось.
ПРИМЕР 14. Анализ внутриклеточной активности каспазы
В целях исследования присущего ей механизма клеточной гибели сконструированные антитела анализировали на каспазную активность. Активность каспазы-3/7 измеряли с использованием набора для анализа гомогенной каспазы-3/7 Apo-ONE®. (Promega, США). Для этого анализа использовали клеточную линию рака ободочной и прямой кишки человека Colo205 (ATCC, США), клеточную линию рака поджелудочной железы человека Miapaca-2 (ATCC, СШ А) и клеточную линию рака легкого H2122 (ATCC, СШ А). Суспензию каждой линии опухолевых клеток в концентрации 1×105 клеток/мл, высевали в объеме 50 мкл на лунку в 96-луночные планшеты для культивирования клеток и культивировали в течение 16-24 часов в камере с постоянной температурой и влажностью. Клетки обрабатывались применявшимися отдельно антителами (только антитело) в предварительно определенной концентрации (0,01-10000 пмоль) или в комбинации с поперечно-сшитым антителом (Fc-антитело человека) (Serotec, США) (сцепленное антитело), после чего культивировали в течение 4 часов. После этого клетки инкубировали в течение 3-16 часов с добавлением 100 мкл реагента Каспаза 3/7 Apo-ONE® (Promega, США) в каждую лунку в камере с постоянной температурой и влажностью. Когда реакция достигала предварительно определенного уровня, флуоресценцию считывали спектрофотометром при 520 нм (Molecular Device). Каспазную активность рассчитывали как кратное увеличение относительных единиц флуоресценции (RFU) группы, обработанной тестовым веществом (обработанных RFU) сверх относительных единиц флуоресценции культуры группы, обработанной средой (необработанных RFU) (каспазная активность = обработанные RFU / необработанные RFU).
Репрезентативные результаты представлены на ФИГ. 10a (Colo205), 10b (H2122) и 10c (Miapaca-2). В целях сравнения антитело АР обрабатывали таким же образом.
Как показано на ФИГ. 10a и 10c, применение антитела D0 или DA29 к линиям раковых клеток вызывало увеличение активности каспазы-3/7, подразумевая, что механизм гибели клеток, присущий антителу согласно настоящему изобретению, включает в себя путь апоптоза.
ПРИМЕР 15. Эффект сочетания антител и лекарства
Эффекты, полученные в результате совместной обработки полученным ранее антителом и гемцитабином, оценивали с помощью анализа гибели опухолевых клеток in vitro. Этот анализ основан на описанных в литературе (J Gastrointest Surg. 2006 Nov; 10(9):1291-300) наблюдениях, согласно которым совместная обработка раковых клеток поджелудочной железы гемцитабином и анти-DR5-антителом приводила к большей гибели опухолевых клеток и каспазной активности.
Клеточные линии рака поджелудочной железы человека Miapaca-2 (ATCC, США) и Panc-1 (ATCC, США) были суспендированы с плотностью 1×105 клеток/мл. Суспензии добавляли в объеме 50 мкл в каждую лунку 96-луночного планшета для культивирования клеток и инкубировали в течение 16-24 часов в камере с постоянной температурой и влажностью. Линии раковых клеток обрабатывали анти-DR5-антителами согласно настоящему изобретению, включая D0, в сочетании с определенными концентрациями (3-300 нмоль) гемцитабина, и культивировали в течение 48-72 часов. Далее клетки инкубировали в течение 1-3 часов после добавления 10 мкл раствора ресазурина (Invitrogen, США) в каждую лунку. Когда реакция достигала предварительно определенного уровня, флуоресценцию считывали спектрофотометром при 590 нм (Molecular Device). Жизнеспособность клеток рассчитывали как отношение процента относительных единиц флуоресценции (RFU) группы, обработанной тестовым веществом (обработанных RFU), к относительным единицам флуоресценции культуры группы, обработанной средой (необработанных RFU) (жизнеспособность клеток (%) = обработанные RFU / необработанные RFU х 100). Результаты представлены на ФИГ. 6a-6r. Репрезентативные результаты представлены на ФИГ. 11a (Miapaca-2) и 11b (Panc-1). В целях сравнения контрольное антитело АР обрабатывали аналогичным образом.
Как показано на фиг. 11a и 11b, при совместной обработке антителом D0 или DA29 и гемцитабином была обнаружена повышенная апоптотическая активность по сравнению с обработкой каждым из этих веществ по отдельности.
Специалистам в данной области техники будет очевидно, что концепции и варианты осуществления, раскрытые в предыдущем описании, можно легко использовать в качестве основы для модификации или разработки других вариантов осуществления изобретения в целях достижения тех же целей настоящего изобретения. Специалистам в данной области также очевидно, что подобные эквивалентные варианты осуществления остаются в рамках сути и объема изобретения согласно прилагаемой формуле изобретения.
--->
<110> ТОН-А СТ КО., ЛТД.
<120> АНТИ-DR5-АНТИТЕЛО И ЕГО ПРИМЕНЕНИЕ
<130> OPP20180344KR
<150> KR 10-2017-0035623
<151> 2017-03-21
<160> 69
<170> KopatentIn 3.0
<210> 1
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> VH-CDR1
<400> 1
Gly Phe Thr Phe Ser Ser Phe Asn Met Leu
1 5 10
<210> 2
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> VH-CDR2
<400> 2
Gly Ile Gly Lys Ser Asp Arg Tyr Thr Gly Tyr Gly Ser Ala Val Lys
1 5 10 15
Gly
<210> 3
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> VH-CDR3
<220>
<221> MOD_RES
<222> (5)
<223> Xaa is Gly or Pro
<220>
<221> MOD_RES
<222> (8)
<223> Xaa is Ser or Lys
<400> 3
Asp Ala Gly Ser Xaa Cys Gly Xaa Gly Gly Trp Thr Gly Ala Cys Ile
1 5 10 15
Asp Thr
<210> 4
<211> 13
<212> PRT
<213> Artificial Sequence
<220>
<223> VL-CDR1
<400> 4
Ser Gly Gly Asp Ser Tyr Ala Gly Ser Tyr Tyr Tyr Gly
1 5 10
<210> 5
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> VL-CDR2
<220>
<221> MOD_RES
<222> (5)
<223> Xaa is Arg, Leu, or Lys
<220>
<221> MOD_RES
<222> (6)
<223> Xaa is Pro, Met, or Ala
<220>
<221> MOD_RES
<222> (7)
<223> Xaa is Ser, Pro, or Lys
<400> 5
Asn Asn Asn Asn Xaa Xaa Xaa
1 5
<210> 6
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> VL-CDR3
<220>
<221> MOD_RES
<222> (6)
<223> Xaa is Ser, Ala, or Asp
<220>
<221> MOD_RES
<222> (7)
<223> Xaa is Tyr or Gly
<220>
<221> MOD_RES
<222> (8)
<223> Xaa is Val, Met, Gly, or Ala
<220>
<221> MOD_RES
<222> (10)
<223> Xaa is Ile, Ala, Arg, or Gly
<400> 6
Gly Ser Arg Asp Ser Xaa Xaa Xaa Gly Xaa
1 5 10
<210> 7
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> VH-CDR3
<400> 7
Asp Ala Gly Ser Gly Cys Gly Ser Gly Gly Trp Thr Gly Ala Cys Ile
1 5 10 15
Asp Thr
<210> 8
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> VH-CDR3
<400> 8
Asp Ala Gly Ser Pro Cys Gly Ser Gly Gly Trp Thr Gly Ala Cys Ile
1 5 10 15
Asp Thr
<210> 9
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> VH-CDR3
<400> 9
Asp Ala Gly Ser Pro Cys Gly Lys Gly Gly Trp Thr Gly Ala Cys Ile
1 5 10 15
Asp Thr
<210> 10
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> VL-CDR2
<400> 10
Asn Asn Asn Asn Arg Pro Ser
1 5
<210> 11
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> VL-CDR2
<400> 11
Asn Asn Asn Asn Leu Met Pro
1 5
<210> 12
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> VL-CDR2
<400> 12
Asn Asn Asn Asn Lys Ala Lys
1 5
<210> 13
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> VL-CDR3
<400> 13
Gly Ser Arg Asp Ser Ser Tyr Val Gly Ile
1 5 10
<210> 14
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> VL-CDR3
<400> 14
Gly Ser Arg Asp Ser Ala Gly Met Gly Ala
1 5 10
<210> 15
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> VL-CDR3
<400> 15
Gly Ser Arg Asp Ser Asp Gly Gly Gly Arg
1 5 10
<210> 16
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> VL-CDR3
<400> 16
Gly Ser Arg Asp Ser Ser Gly Ala Gly Gly
1 5 10
<210> 17
<211> 127
<212> PRT
<213> Artificial Sequence
<220>
<223> Heavy chain variable region
<400> 17
Ala Val Thr Leu Asp Glu Ser Gly Gly Gly Leu Gln Thr Pro Gly Gly
1 5 10 15
Gly Leu Ser Leu Val Cys Lys Gly Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Asn Met Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Gly Ile Gly Lys Ser Asp Arg Tyr Thr Gly Tyr Gly Ser Ala Val
50 55 60
Lys Gly Arg Ala Thr Ile Ser Arg Asp Asp Gly Gln Ser Thr Val Arg
65 70 75 80
Leu Gln Leu Asn Asn Leu Arg Ala Glu Asp Thr Gly Thr Tyr Tyr Cys
85 90 95
Val Lys Asp Ala Gly Ser Gly Cys Gly Ser Gly Gly Trp Thr Gly Ala
100 105 110
Cys Ile Asp Thr Trp Gly His Gly Thr Glu Val Ile Val Ser Ser
115 120 125
<210> 18
<211> 127
<212> PRT
<213> Artificial Sequence
<220>
<223> Heavy chain variable region
<400> 18
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Asn Met Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Gly Ile Gly Lys Ser Asp Arg Tyr Thr Gly Tyr Gly Ser Ala Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Thr Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Arg Asp Ala Gly Ser Gly Cys Gly Ser Gly Gly Trp Thr Gly Ala
100 105 110
Cys Ile Asp Thr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 19
<211> 127
<212> PRT
<213> Artificial Sequence
<220>
<223> Heavy chain variable region
<400> 19
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Asn Met Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Gly Ile Gly Lys Ser Asp Arg Tyr Thr Gly Tyr Gly Ser Ala Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Thr Ser Lys Ser Thr Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Arg Asp Ala Gly Ser Gly Cys Gly Ser Gly Gly Trp Thr Gly Ala
100 105 110
Cys Ile Asp Thr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 20
<211> 127
<212> PRT
<213> Artificial Sequence
<220>
<223> Heavy chain variable region
<400> 20
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Asn Met Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Gly Ile Gly Lys Ser Asp Arg Tyr Thr Gly Tyr Gly Ser Ala Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Arg Asp Ala Gly Ser Gly Cys Gly Ser Gly Gly Trp Thr Gly Ala
100 105 110
Cys Ile Asp Thr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 21
<211> 127
<212> PRT
<213> Artificial Sequence
<220>
<223> Heavy chain variable region
<400> 21
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Asn Met Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Gly Ile Gly Lys Ser Asp Arg Tyr Thr Gly Tyr Gly Ser Ala Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Arg Asp Ala Gly Ser Gly Cys Gly Ser Gly Gly Trp Thr Gly Ala
100 105 110
Cys Ile Asp Thr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 22
<211> 127
<212> PRT
<213> Artificial Sequence
<220>
<223> Heavy chain variable region
<400> 22
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Asn Met Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Gly Ile Gly Lys Ser Asp Arg Tyr Thr Gly Tyr Gly Ser Ala Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Thr Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Ala Gly Ser Gly Cys Gly Ser Gly Gly Trp Thr Gly Ala
100 105 110
Cys Ile Asp Thr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 23
<211> 127
<212> PRT
<213> Artificial Sequence
<220>
<223> Heavy chain variable region
<400> 23
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Asn Met Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Gly Ile Gly Lys Ser Asp Arg Tyr Thr Gly Tyr Gly Ser Ala Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Thr Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Asp Ala Gly Ser Gly Cys Gly Ser Gly Gly Trp Thr Gly Ala
100 105 110
Cys Ile Asp Thr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 24
<211> 127
<212> PRT
<213> Artificial Sequence
<220>
<223> Heavy chain variable region
<400> 24
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Asn Met Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Gly Ile Gly Lys Ser Asp Arg Tyr Thr Gly Tyr Gly Ser Ala Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Arg Asp Ala Gly Ser Gly Cys Gly Ser Gly Gly Trp Thr Gly Ala
100 105 110
Cys Ile Asp Thr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 25
<211> 127
<212> PRT
<213> Artificial Sequence
<220>
<223> Heavy chain variable region
<400> 25
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Asn Met Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Gly Ile Gly Lys Ser Asp Arg Tyr Thr Gly Tyr Gly Ser Ala Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Asp Ala Gly Ser Gly Cys Gly Ser Gly Gly Trp Thr Gly Ala
100 105 110
Cys Ile Asp Thr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 26
<211> 127
<212> PRT
<213> Artificial Sequence
<220>
<223> Heavy chain variable region
<400> 26
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Asn Met Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Gly Ile Gly Lys Ser Asp Arg Tyr Thr Gly Tyr Gly Ser Ala Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Ala Gly Ser Gly Cys Gly Ser Gly Gly Trp Thr Gly Ala
100 105 110
Cys Ile Asp Thr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 27
<211> 127
<212> PRT
<213> Artificial Sequence
<220>
<223> Heavy chain variable region
<400> 27
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Asn Met Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Gly Ile Gly Lys Ser Asp Arg Tyr Thr Gly Tyr Gly Ser Ala Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Asp Ala Gly Ser Gly Cys Gly Ser Gly Gly Trp Thr Gly Ala
100 105 110
Cys Ile Asp Thr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 28
<211> 127
<212> PRT
<213> Artificial Sequence
<220>
<223> Heavy chain variable region
<400> 28
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Asn Met Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Gly Ile Gly Lys Ser Asp Arg Tyr Thr Gly Tyr Gly Ser Ala Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Thr Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Arg Asp Ala Gly Ser Pro Cys Gly Ser Gly Gly Trp Thr Gly Ala
100 105 110
Cys Ile Asp Thr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 29
<211> 127
<212> PRT
<213> Artificial Sequence
<220>
<223> Heavy chain variable region
<400> 29
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Asn Met Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Gly Ile Gly Lys Ser Asp Arg Tyr Thr Gly Tyr Gly Ser Ala Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Thr Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Arg Asp Ala Gly Ser Pro Cys Gly Lys Gly Gly Trp Thr Gly Ala
100 105 110
Cys Ile Asp Thr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 30
<211> 127
<212> PRT
<213> Artificial Sequence
<220>
<223> Heavy chain variable region
<400> 30
Ala Val Thr Leu Asp Glu Ser Gly Gly Gly Leu Gln Thr Pro Gly Gly
1 5 10 15
Gly Leu Ser Leu Val Cys Lys Gly Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Asn Met Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Gly Ile Gly Lys Ser Asp Arg Tyr Thr Gly Tyr Gly Ser Ala Val
50 55 60
Lys Gly Arg Ala Thr Ile Ser Arg Asp Asp Gly Gln Ser Thr Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Gly Thr Tyr Tyr Cys
85 90 95
Val Lys Asp Ala Gly Ser Gly Cys Gly Ser Gly Gly Trp Thr Gly Ala
100 105 110
Cys Ile Asp Thr Trp Gly His Gly Thr Glu Val Ile Val Ser Ser
115 120 125
<210> 31
<211> 127
<212> PRT
<213> Artificial Sequence
<220>
<223> Heavy chain variable region
<400> 31
Ala Val Thr Leu Asp Glu Ser Gly Gly Gly Leu Gln Thr Pro Gly Gly
1 5 10 15
Gly Leu Ser Leu Val Cys Lys Gly Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Asn Met Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Gly Ile Gly Lys Ser Asp Arg Tyr Thr Gly Tyr Gly Ser Ala Val
50 55 60
Lys Gly Arg Ala Thr Ile Ser Arg Asp Asp Gly Gln Ser Thr Ala Arg
65 70 75 80
Leu Gln Leu Asn Asn Leu Arg Ala Glu Asp Thr Gly Thr Tyr Tyr Cys
85 90 95
Val Lys Asp Ala Gly Ser Gly Cys Gly Ser Gly Gly Trp Thr Gly Ala
100 105 110
Cys Ile Asp Thr Trp Gly His Gly Thr Glu Val Ile Val Ser Ser
115 120 125
<210> 32
<211> 127
<212> PRT
<213> Artificial Sequence
<220>
<223> Heavy chain variable region
<400> 32
Ala Val Thr Leu Asp Glu Ser Gly Gly Gly Leu Gln Thr Pro Gly Gly
1 5 10 15
Gly Leu Ser Leu Val Cys Lys Gly Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Asn Met Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Gly Ile Gly Lys Ser Asp Arg Tyr Thr Gly Tyr Gly Ser Ala Val
50 55 60
Lys Gly Arg Ala Thr Ile Ser Arg Asp Asp Gly Gln Ser Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Gly Thr Tyr Tyr Cys
85 90 95
Val Lys Asp Ala Gly Ser Gly Cys Gly Ser Gly Gly Trp Thr Gly Ala
100 105 110
Cys Ile Asp Thr Trp Gly His Gly Thr Glu Val Ile Val Ser Ser
115 120 125
<210> 33
<211> 127
<212> PRT
<213> Artificial Sequence
<220>
<223> Heavy chain variable region
<400> 33
Ala Val Thr Leu Asp Glu Ser Gly Gly Gly Leu Gln Thr Pro Gly Gly
1 5 10 15
Gly Leu Ser Leu Val Cys Lys Gly Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Asn Met Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Gly Ile Gly Lys Ser Asp Arg Tyr Thr Gly Tyr Gly Ser Ala Val
50 55 60
Lys Gly Arg Ala Thr Ile Ser Arg Asp Asp Gly Gln Ser Thr Ala Arg
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Gly Thr Tyr Tyr Cys
85 90 95
Val Lys Asp Ala Gly Ser Gly Cys Gly Ser Gly Gly Trp Thr Gly Ala
100 105 110
Cys Ile Asp Thr Trp Gly His Gly Thr Glu Val Ile Val Ser Ser
115 120 125
<210> 34
<211> 127
<212> PRT
<213> Artificial Sequence
<220>
<223> Heavy chain variable region
<400> 34
Ala Val Thr Leu Asp Glu Ser Gly Gly Gly Leu Gln Thr Pro Gly Gly
1 5 10 15
Gly Leu Ser Leu Val Cys Lys Gly Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Asn Met Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Gly Ile Gly Lys Ser Asp Arg Tyr Thr Gly Tyr Gly Ser Ala Val
50 55 60
Lys Gly Arg Ala Thr Ile Ser Arg Asp Asp Gly Gln Ser Thr Val Arg
65 70 75 80
Leu Gln Leu Asn Asn Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Lys Asp Ala Gly Ser Gly Cys Gly Ser Gly Gly Trp Thr Gly Ala
100 105 110
Cys Ile Asp Thr Trp Gly His Gly Thr Glu Val Ile Val Ser Ser
115 120 125
<210> 35
<211> 127
<212> PRT
<213> Artificial Sequence
<220>
<223> Heavy chain variable region
<400> 35
Ala Val Thr Leu Asp Glu Ser Gly Gly Gly Leu Gln Thr Pro Gly Gly
1 5 10 15
Gly Leu Ser Leu Val Cys Lys Gly Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Asn Met Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Gly Ile Gly Lys Ser Asp Arg Tyr Thr Gly Tyr Gly Ser Ala Val
50 55 60
Lys Gly Arg Ala Thr Ile Ser Arg Asp Asp Gly Gln Ser Thr Ala Arg
65 70 75 80
Leu Gln Leu Asn Asn Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Lys Asp Ala Gly Ser Gly Cys Gly Ser Gly Gly Trp Thr Gly Ala
100 105 110
Cys Ile Asp Thr Trp Gly His Gly Thr Glu Val Ile Val Ser Ser
115 120 125
<210> 36
<211> 127
<212> PRT
<213> Artificial Sequence
<220>
<223> Heavy chain variable region
<400> 36
Ala Val Thr Leu Asp Glu Ser Gly Gly Gly Leu Gln Thr Pro Gly Gly
1 5 10 15
Gly Leu Ser Leu Val Cys Lys Gly Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Asn Met Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Gly Ile Gly Lys Ser Asp Arg Tyr Thr Gly Tyr Gly Ser Ala Val
50 55 60
Lys Gly Arg Ala Thr Ile Ser Arg Asp Asp Gly Gln Ser Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Lys Asp Ala Gly Ser Gly Cys Gly Ser Gly Gly Trp Thr Gly Ala
100 105 110
Cys Ile Asp Thr Trp Gly His Gly Thr Glu Val Ile Val Ser Ser
115 120 125
<210> 37
<211> 127
<212> PRT
<213> Artificial Sequence
<220>
<223> Heavy chain variable region
<400> 37
Ala Val Thr Leu Asp Glu Ser Gly Gly Gly Leu Gln Thr Pro Gly Gly
1 5 10 15
Gly Leu Ser Leu Val Cys Lys Gly Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Asn Met Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Gly Ile Gly Lys Ser Asp Arg Tyr Thr Gly Tyr Gly Ser Ala Val
50 55 60
Lys Gly Arg Ala Thr Ile Ser Arg Asp Asp Gly Gln Ser Thr Ala Arg
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Lys Asp Ala Gly Ser Gly Cys Gly Ser Gly Gly Trp Thr Gly Ala
100 105 110
Cys Ile Asp Thr Trp Gly His Gly Thr Glu Val Ile Val Ser Ser
115 120 125
<210> 38
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Light chain variable region
<400> 38
Leu Thr Gln Pro Ser Ser Val Ser Ala Asn Leu Gly Gly Thr Val Glu
1 5 10 15
Ile Thr Cys Ser Gly Gly Asp Ser Tyr Ala Gly Ser Tyr Tyr Tyr Gly
20 25 30
Trp Tyr Gln Gln Lys Ala Pro Gly Ser Ala Pro Val Thr Val Ile Tyr
35 40 45
Asn Asn Asn Asn Arg Pro Ser Asn Ile Pro Ser Arg Phe Ser Gly Ser
50 55 60
Thr Ser Gly Ser Thr Ala Thr Leu Thr Ile Thr Gly Val Gln Ala Glu
65 70 75 80
Asp Glu Ala Val Tyr Phe Cys Gly Ser Arg Asp Ser Ser Tyr Val Gly
85 90 95
Ile Phe Gly Ala Gly Thr Thr Leu Thr Val Leu
100 105
<210> 39
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<223> Light chain variable region
<400> 39
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Ser Gly Gly Asp Ser Tyr Ala Gly Ser
20 25 30
Tyr Tyr Tyr Gly Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Thr
35 40 45
Leu Ile Tyr Asn Asn Asn Asn Arg Pro Ser Gly Val Pro Ser Arg Phe
50 55 60
Ser Gly Ser Thr Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu
65 70 75 80
Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gly Ser Arg Asp Ser Ser
85 90 95
Tyr Val Gly Ile Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 40
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<223> Light chain variable region
<400> 40
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Ser Gly Gly Asp Ser Tyr Ala Gly Ser
20 25 30
Tyr Tyr Tyr Gly Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Thr
35 40 45
Leu Ile Tyr Asn Asn Asn Asn Arg Pro Ser Gly Val Pro Ser Arg Phe
50 55 60
Ser Gly Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu
65 70 75 80
Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gly Ser Arg Asp Ser Ser
85 90 95
Tyr Val Gly Ile Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 41
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<223> Light chain variable region
<400> 41
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Ser Gly Gly Asp Ser Tyr Ala Gly Ser
20 25 30
Tyr Tyr Tyr Gly Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Thr
35 40 45
Leu Ile Tyr Asn Asn Asn Asn Arg Pro Ser Gly Val Pro Ser Arg Phe
50 55 60
Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu
65 70 75 80
Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gly Ser Arg Asp Ser Ser
85 90 95
Tyr Val Gly Ile Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 42
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<223> Light chain variable region
<400> 42
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Ser Gly Gly Asp Ser Tyr Ala Gly Ser
20 25 30
Tyr Tyr Tyr Gly Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Thr
35 40 45
Leu Ile Tyr Asn Asn Asn Asn Leu Met Pro Gly Val Pro Ser Arg Phe
50 55 60
Ser Gly Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu
65 70 75 80
Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gly Ser Arg Asp Ser Ser
85 90 95
Tyr Val Gly Ile Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 43
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<223> Light chain variable region
<400> 43
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Ser Gly Gly Asp Ser Tyr Ala Gly Ser
20 25 30
Tyr Tyr Tyr Gly Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Thr
35 40 45
Leu Ile Tyr Asn Asn Asn Asn Arg Pro Ser Gly Val Pro Ser Arg Phe
50 55 60
Ser Gly Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu
65 70 75 80
Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gly Ser Arg Asp Ser Ala
85 90 95
Gly Met Gly Ala Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 44
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<223> Light chain variable region
<400> 44
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Ser Gly Gly Asp Ser Tyr Ala Gly Ser
20 25 30
Tyr Tyr Tyr Gly Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Thr
35 40 45
Leu Ile Tyr Asn Asn Asn Asn Lys Ala Lys Gly Val Pro Ser Arg Phe
50 55 60
Ser Gly Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu
65 70 75 80
Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gly Ser Arg Asp Ser Ser
85 90 95
Tyr Val Gly Ile Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 45
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<223> Light chain variable region
<400> 45
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Ser Gly Gly Asp Ser Tyr Ala Gly Ser
20 25 30
Tyr Tyr Tyr Gly Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Thr
35 40 45
Leu Ile Tyr Asn Asn Asn Asn Arg Pro Ser Gly Val Pro Ser Arg Phe
50 55 60
Ser Gly Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu
65 70 75 80
Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gly Ser Arg Asp Ser Asp
85 90 95
Gly Gly Gly Arg Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 46
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<223> Light chain variable region
<400> 46
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Ser Gly Gly Asp Ser Tyr Ala Gly Ser
20 25 30
Tyr Tyr Tyr Gly Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Thr
35 40 45
Leu Ile Tyr Asn Asn Asn Asn Arg Pro Ser Gly Val Pro Ser Arg Phe
50 55 60
Ser Gly Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu
65 70 75 80
Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gly Ser Arg Asp Ser Ser
85 90 95
Gly Ala Gly Gly Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 47
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<223> Light chain variable region
<400> 47
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Ser Gly Gly Asp Ser Tyr Ala Gly Ser
20 25 30
Tyr Tyr Tyr Gly Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Thr
35 40 45
Leu Ile Tyr Asn Asn Asn Asn Arg Pro Ser Gly Val Pro Ser Arg Phe
50 55 60
Ser Gly Ser Thr Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu
65 70 75 80
Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gly Ser Arg Asp Ser Ser
85 90 95
Tyr Val Gly Ile Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 48
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Light chain variable region
<400> 48
Leu Thr Gln Pro Ser Ser Val Ser Ala Asn Leu Gly Gly Thr Val Glu
1 5 10 15
Ile Thr Cys Ser Gly Gly Asp Ser Tyr Ala Gly Ser Tyr Tyr Tyr Gly
20 25 30
Trp Tyr Gln Gln Lys Ala Pro Gly Ser Ala Pro Val Thr Val Ile Tyr
35 40 45
Asn Asn Asn Asn Arg Pro Ser Asn Ile Pro Ser Arg Phe Ser Gly Ser
50 55 60
Thr Ser Gly Ser Thr Ala Thr Leu Thr Ile Thr Gly Val Gln Ala Glu
65 70 75 80
Asp Glu Ala Thr Tyr Tyr Cys Gly Ser Arg Asp Ser Ser Tyr Val Gly
85 90 95
Ile Phe Gly Ala Gly Thr Thr Leu Thr Val Leu
100 105
<210> 49
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Light chain variable region
<400> 49
Leu Thr Gln Pro Ser Ser Val Ser Ala Asn Leu Gly Gly Thr Val Glu
1 5 10 15
Ile Thr Cys Ser Gly Gly Asp Ser Tyr Ala Gly Ser Tyr Tyr Tyr Gly
20 25 30
Trp Tyr Gln Gln Lys Ala Pro Gly Ser Ala Pro Val Thr Val Ile Tyr
35 40 45
Asn Asn Asn Asn Arg Pro Ser Asn Ile Pro Ser Arg Phe Ser Gly Ser
50 55 60
Thr Ser Gly Ser Thr Ala Thr Leu Thr Ile Thr Gly Val Gln Ala Glu
65 70 75 80
Asp Glu Ala Thr Tyr Phe Cys Gly Ser Arg Asp Ser Ser Tyr Val Gly
85 90 95
Ile Phe Gly Ala Gly Thr Thr Leu Thr Val Leu
100 105
<210> 50
<211> 72
<212> DNA
<213> Artificial Sequence
<220>
<223> forward primer for heavy chain variable region
<400> 50
ggtcagtcct ctagatcttc cggcggtggt ggcagctccg gtggtggcgg ttccgccgtg 60
acgttggacg ag 72
<210> 51
<211> 44
<212> DNA
<213> Artificial Sequence
<220>
<223> reverse primer for heavy chain variable region
<400> 51
ctggccggcc tggccactag tggaggagac gatgacttcg gtcc 44
<210> 52
<211> 38
<212> DNA
<213> Artificial Sequence
<220>
<223> forward primer for light chain variable region
<400> 52
gtggcccagg cggccctgac tcagccgtcc tcggtgtc 38
<210> 53
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> reverse primer for light chain variable region
<400> 53
ggaagatcta gaggactgac ctaggacggt cagg 34
<210> 54
<211> 42
<212> DNA
<213> Artificial Sequence
<220>
<223> forward primer for scFv
<400> 54
gaggaggagg aggaggaggt ggcccaggcg gccctgactc ag 42
<210> 55
<211> 47
<212> DNA
<213> Artificial Sequence
<220>
<223> reverse primer for scFv
<400> 55
gaggaggagg aggaggagga gctggccggc ctggccacta gtggagg 47
<210> 56
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> sequencing primer (forward)
<400> 56
acactttatg cttccggctc 20
<210> 57
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> sequencing primer (reverse)
<400> 57
caaaatcacc ggaaccagag 20
<210> 58
<211> 19
<212> DNA
<213> Artificial Sequence
<220>
<223> forward primer for heavy chain variable region
<400> 58
gctagccgcc accatgggc 19
<210> 59
<211> 37
<212> DNA
<213> Artificial Sequence
<220>
<223> reverse primer for heavy chain variable region
<400> 59
aggggccctt ggtggaggcc tggccggcct ggccact 37
<210> 60
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> forward primer for heavy chain constant region
<400> 60
gcctccacca agggcccctc 20
<210> 61
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> reverse primer for heavy chain constant region
<400> 61
cgggatccct tgccggccgt 20
<210> 62
<211> 19
<212> DNA
<213> Artificial Sequence
<220>
<223> forward primer for heavy chain
<400> 62
gctagccgcc accatgggc 19
<210> 63
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> reverse primer for heavy chain
<400> 63
cgggatccct tgccggccgt 20
<210> 64
<211> 18
<212> DNA
<213> Artificial Sequence
<220>
<223> forward primer for light chain variable region
<400> 64
aagcttgccg ccaccatg 18
<210> 65
<211> 37
<212> DNA
<213> Artificial Sequence
<220>
<223> reverse primer for light chain variable region
<400> 65
agggggcggc cacggtccgg gaagatctag aggactg 37
<210> 66
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> forward primer for light chain constant region (kappa)
<400> 66
cggaccgtgg ccgccccctc 20
<210> 67
<211> 19
<212> DNA
<213> Artificial Sequence
<220>
<223> reverse primer for light chain constant region (kappa)
<400> 67
gctctagact agcactcgc 19
<210> 68
<211> 18
<212> DNA
<213> Artificial Sequence
<220>
<223> forward primer for light chain
<400> 68
aagcttgccg ccaccatg 18
<210> 69
<211> 19
<212> DNA
<213> Artificial Sequence
<220>
<223> reverse primer for light chain
<400> 69
gctctagact agcactcgc 19
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| СЛИТЫЙ БЕЛОК, ВКЛЮЧАЮЩИЙ IL-12 И АНТИТЕЛО ПРОТИВ FAP, И ЕГО ПРИМЕНЕНИЕ | 2021 |
|
RU2831612C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ АНТИТЕЛО, СПЕЦИФИЧНО СВЯЗЫВАЮЩЕЕСЯ С N-КОНЦОМ ЛИЗИЛ-тРНК-СИНТЕТАЗЫ, В КАЧЕСТВЕ ЭФФЕКТИВНОГО ИНГРЕДИЕНТА ДЛЯ ПРОФИЛАКТИКИ ИЛИ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЯ, ОБУСЛОВЛЕННОГО МИГРАЦИЕЙ КЛЕТОК | 2018 |
|
RU2749591C1 |
| АНТИ-LILRB1 АНТИТЕЛО И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2801535C1 |
| Биспецифическое антитело анти-HER2/анти-4-1BB и его применение | 2020 |
|
RU2831838C2 |
| БИСПЕЦИФИЧЕСКОЕ АНТИТЕЛО АНТИ-EGFR/АНТИ-4-1ВВ И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2831836C2 |
| АНТИТЕЛО ПРОТИВ LILRB1 И ЕГО ПРИМЕНЕНИЯ | 2021 |
|
RU2813373C1 |
| МУЛЬТИВАЛЕНТНЫЕ И МУЛЬТИСПЕЦИФИЧЕСКИЕ ГИБРИДНЫЕ БЕЛКИ, СВЯЗЫВАЮЩИЕСЯ С DR5 | 2016 |
|
RU2748620C2 |
| АНТИТЕЛО ДЛЯ СПЕЦИФИЧЕСКОГО СВЯЗЫВАНИЯ С N-КОНЦЕВЫМ ДОМЕНОМ ЛИЗИЛ-ТРНК-СИНТЕТАЗЫ, ЭКСПОНИРОВАННЫМ НА ВНЕКЛЕТОЧНОЙ МЕМБРАНЕ | 2019 |
|
RU2781304C1 |
| Эпитоп тиоредоксина-1, специфично связывающийся с моноклональным антителом | 2018 |
|
RU2804772C2 |
| Эпитоп тиоредоксина-1 и моноклональное антитело, специфически связывающееся с ним | 2018 |
|
RU2797266C2 |
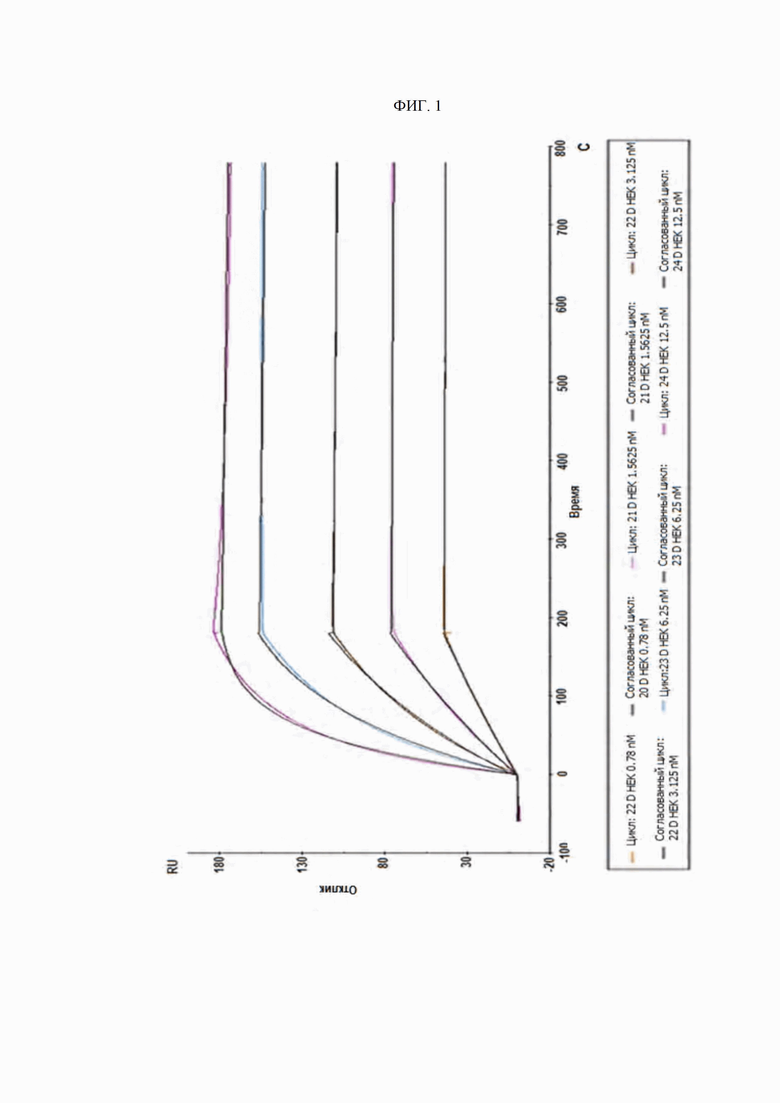
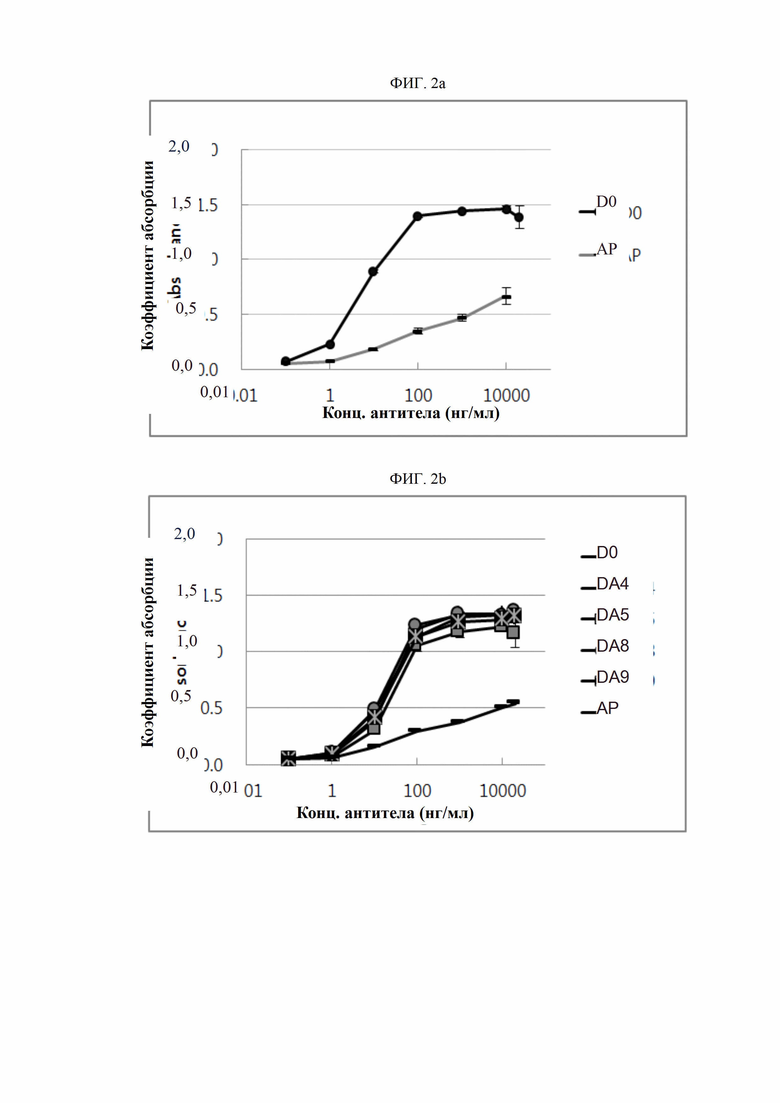
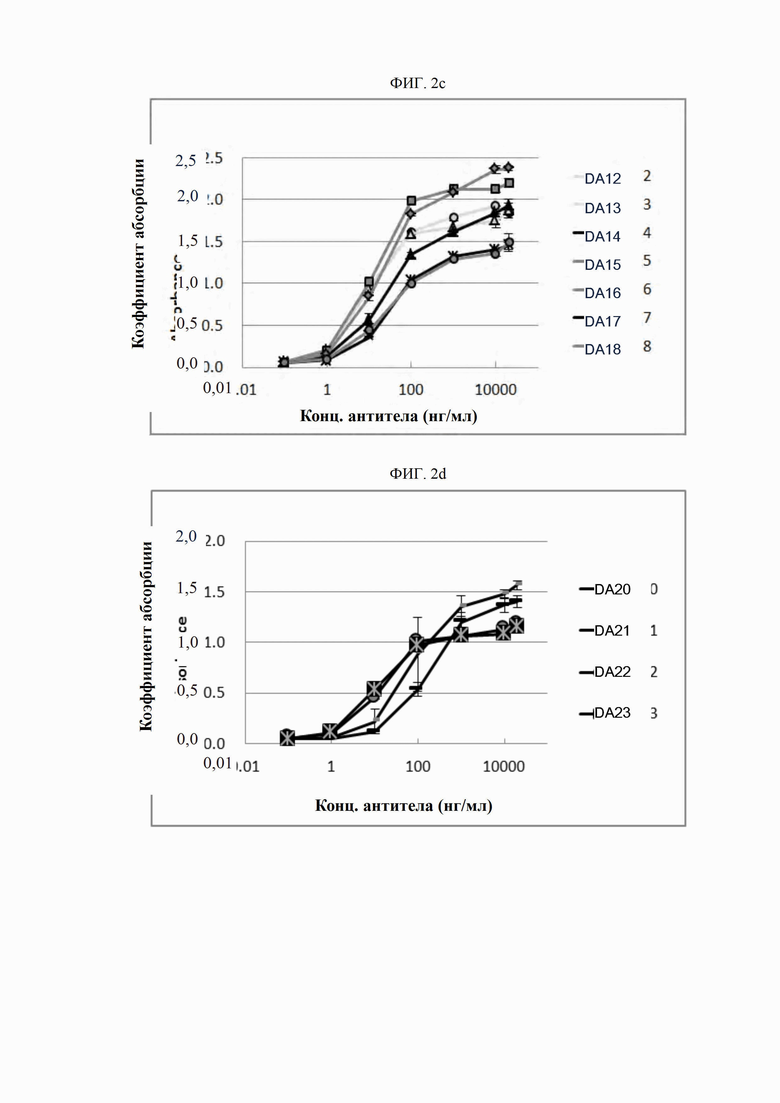
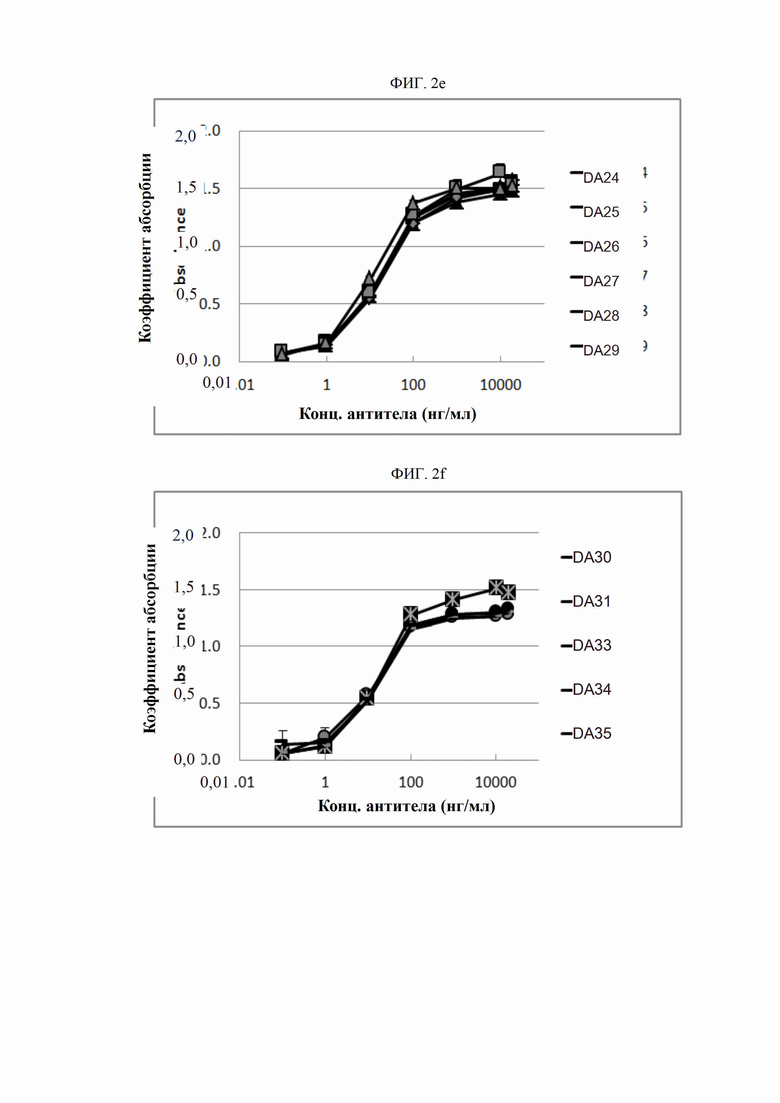


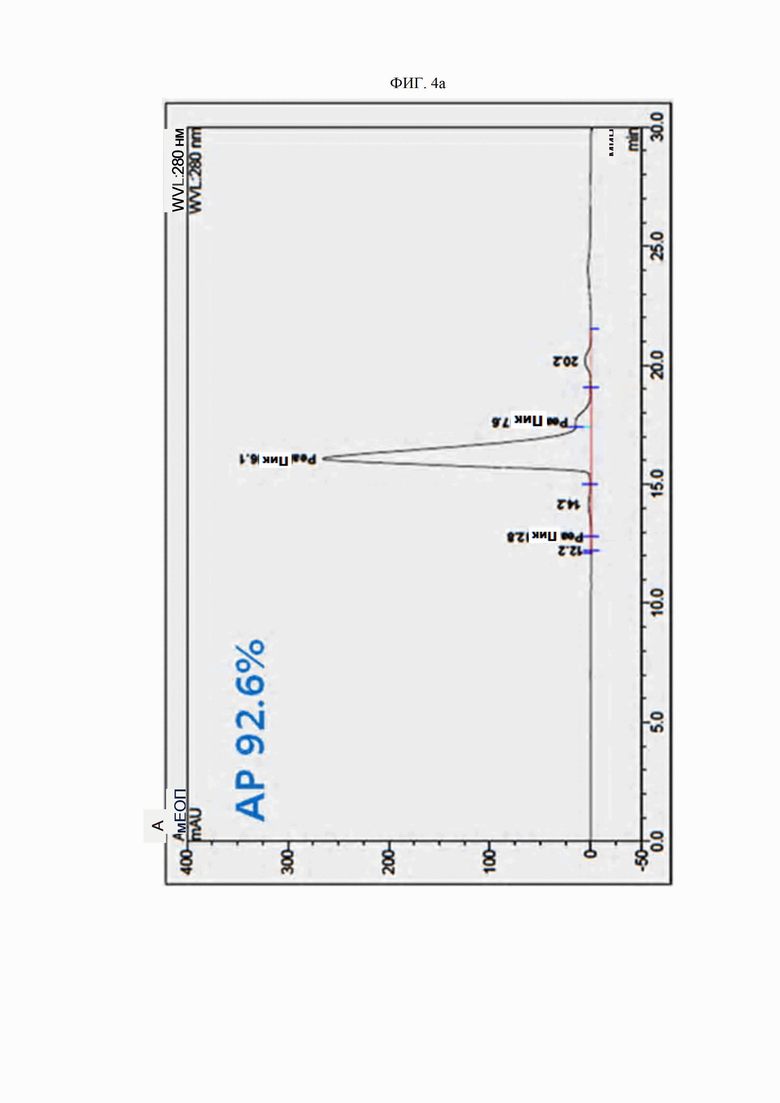

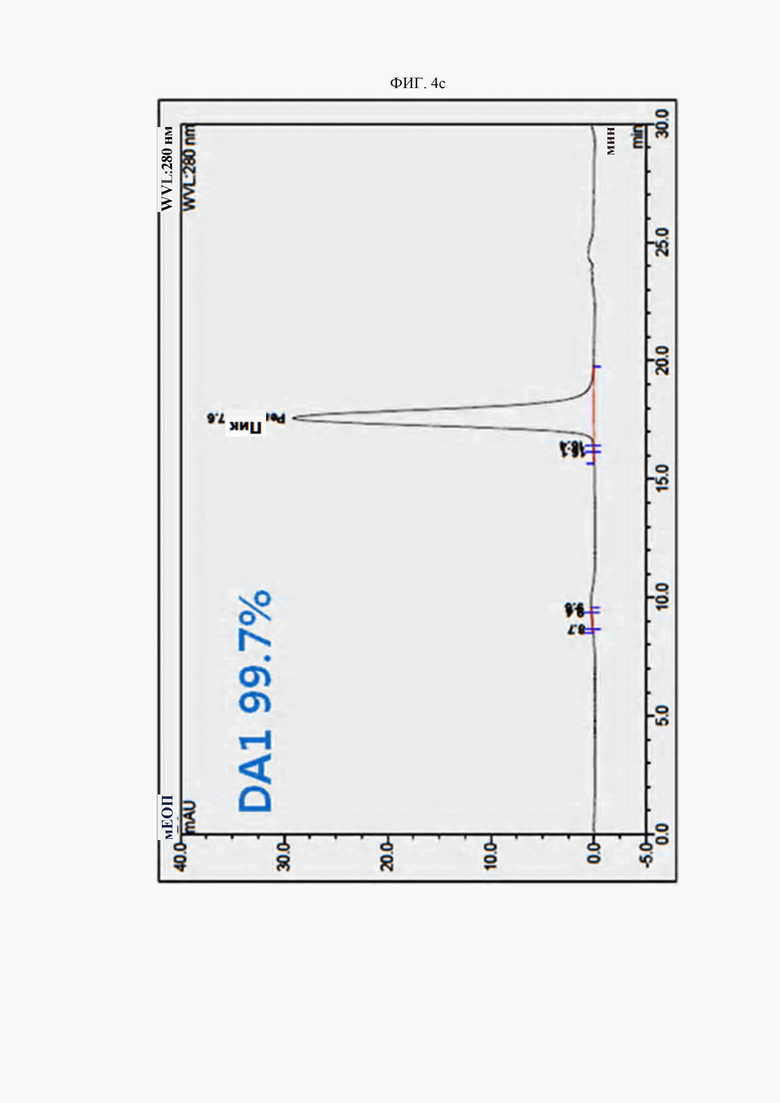



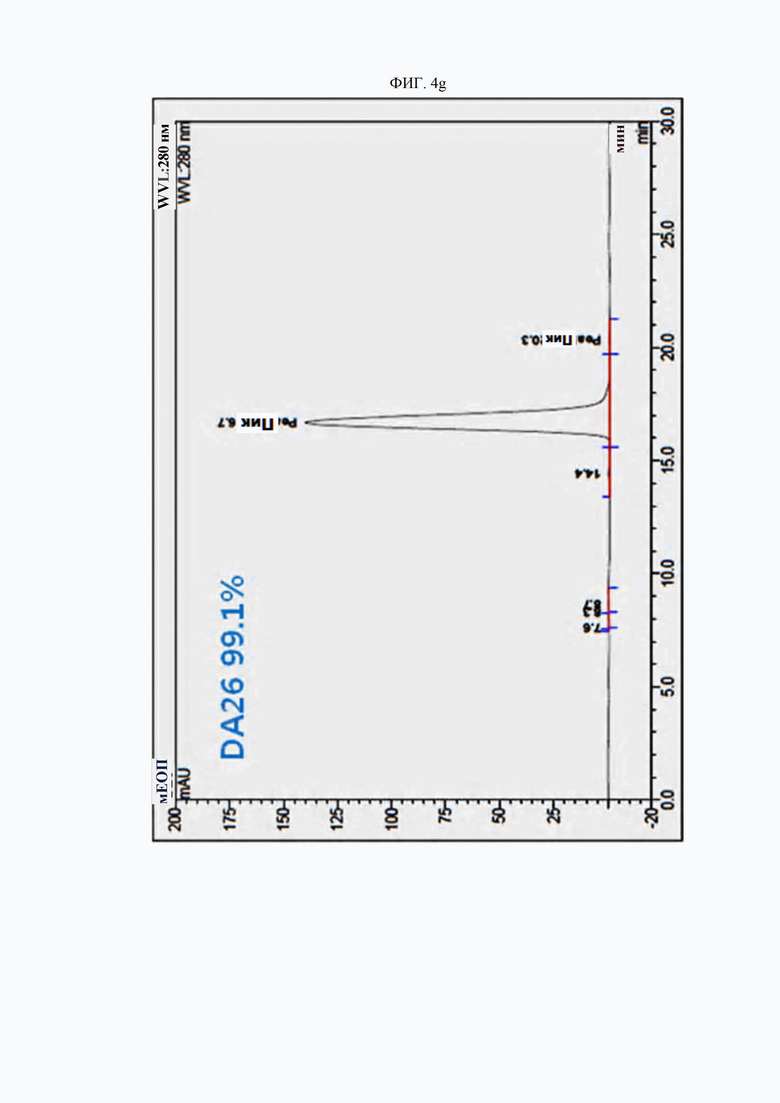

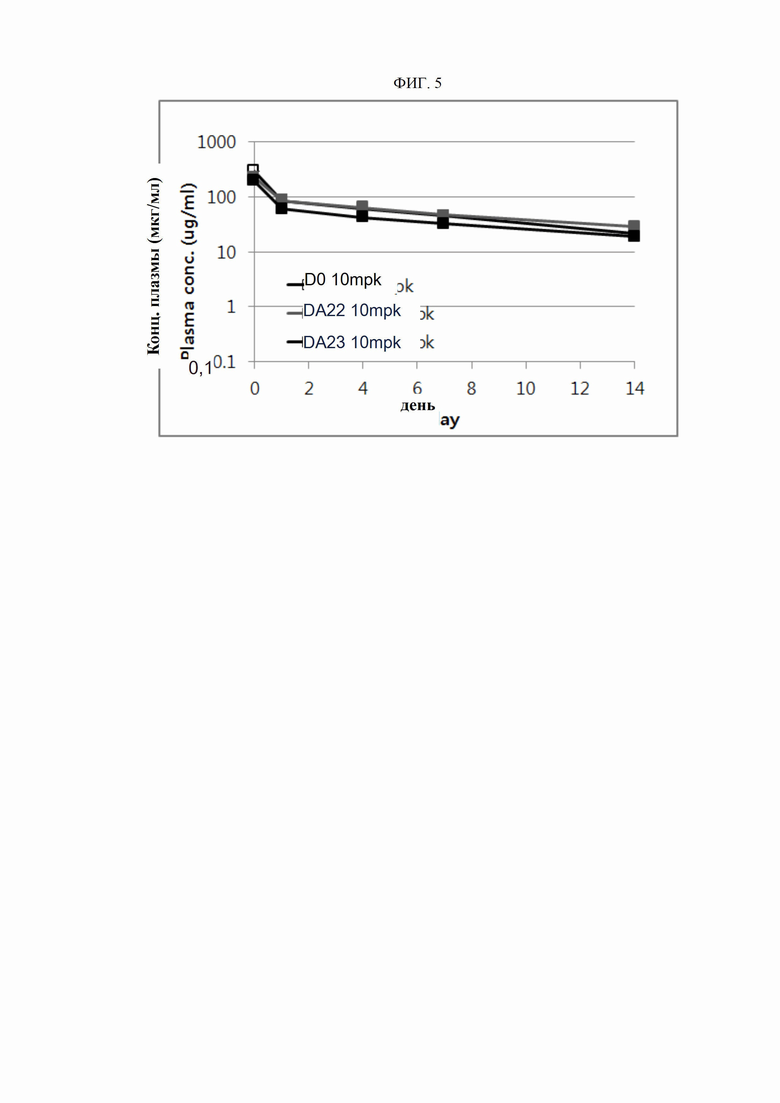
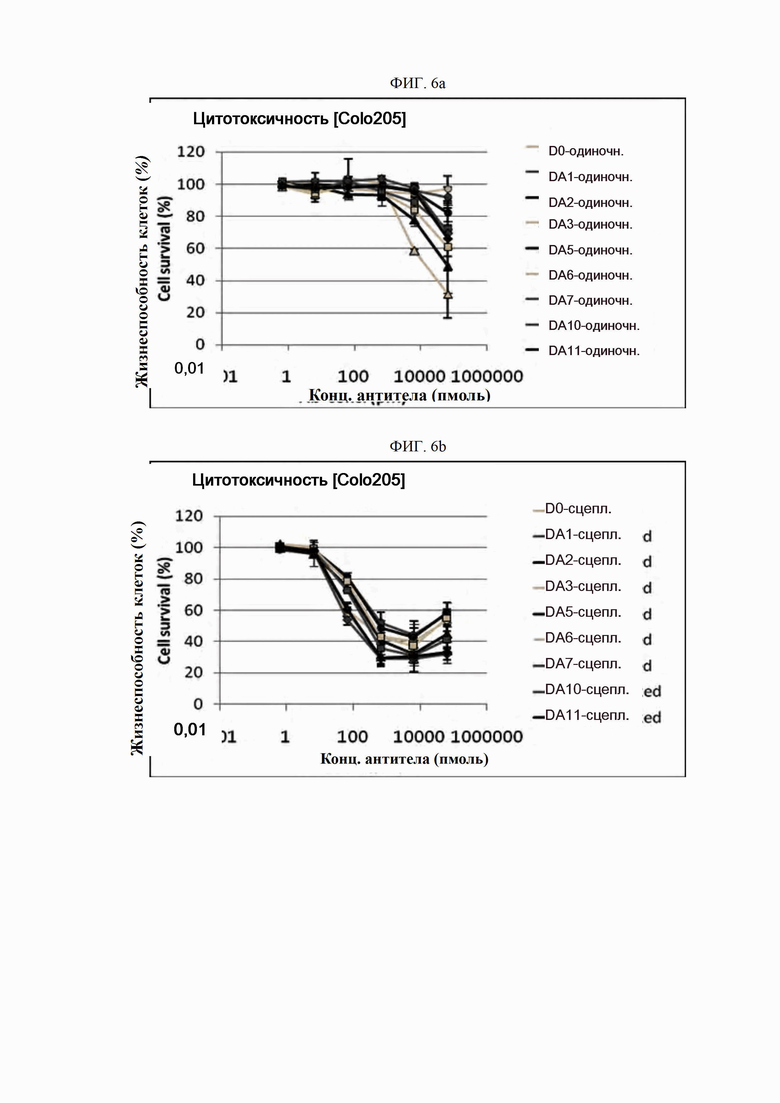
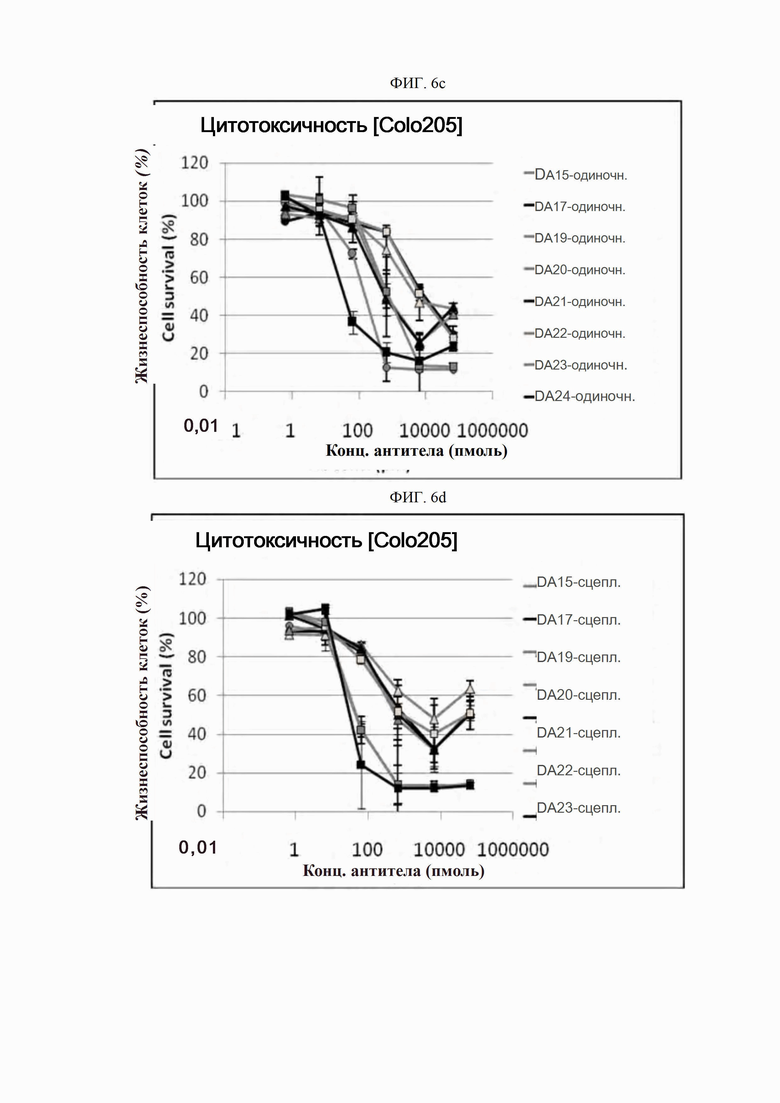
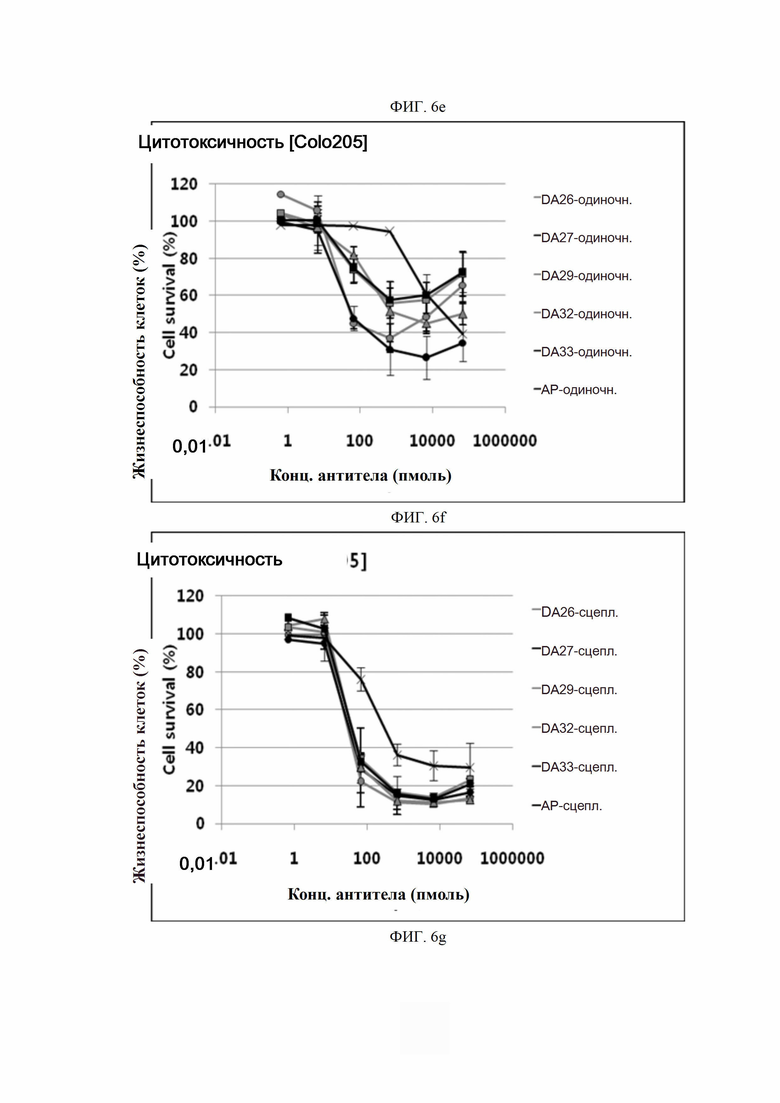
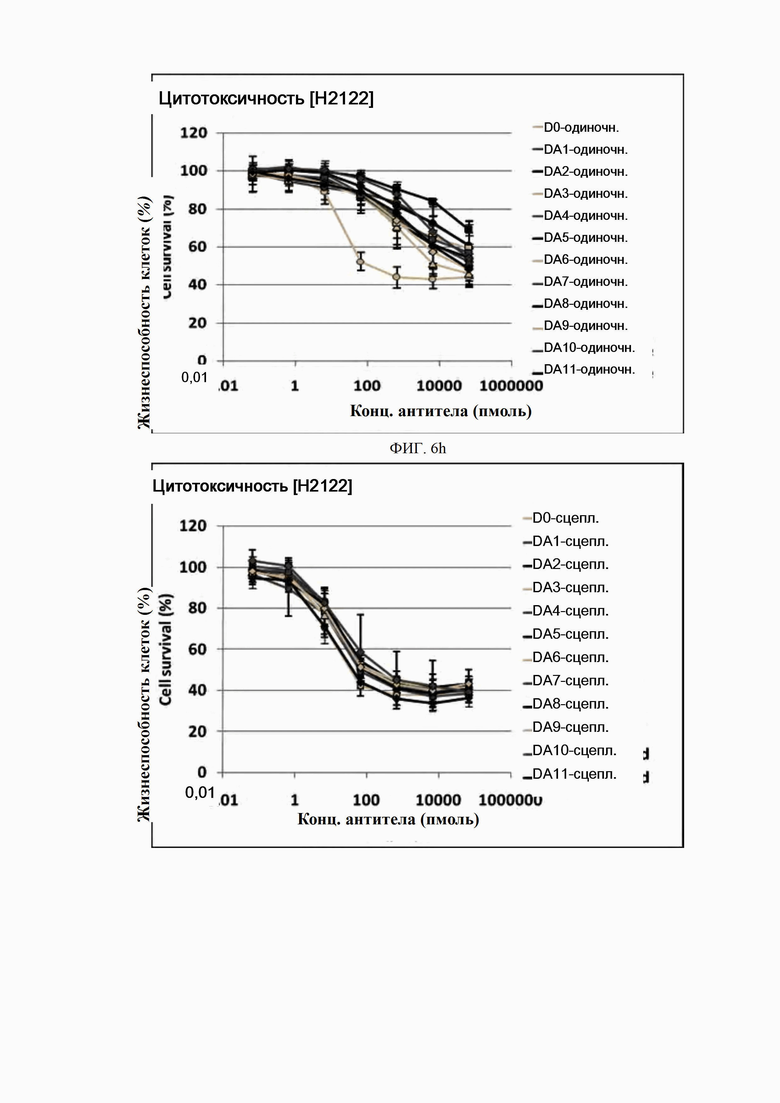
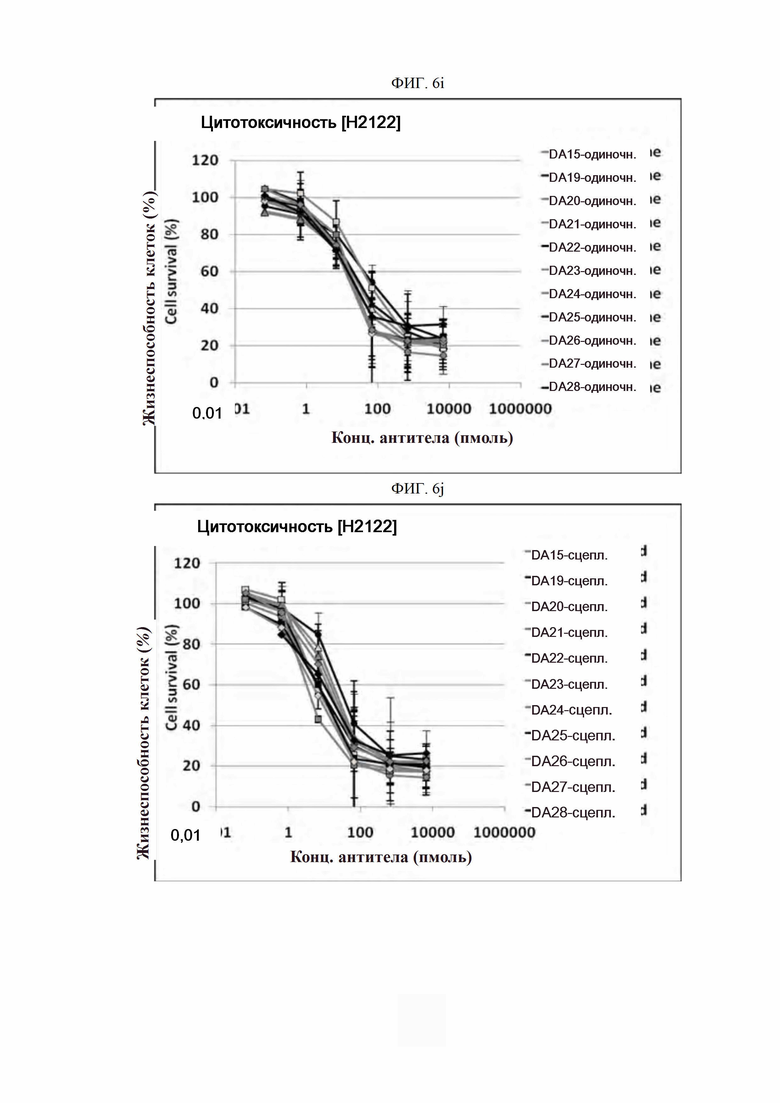
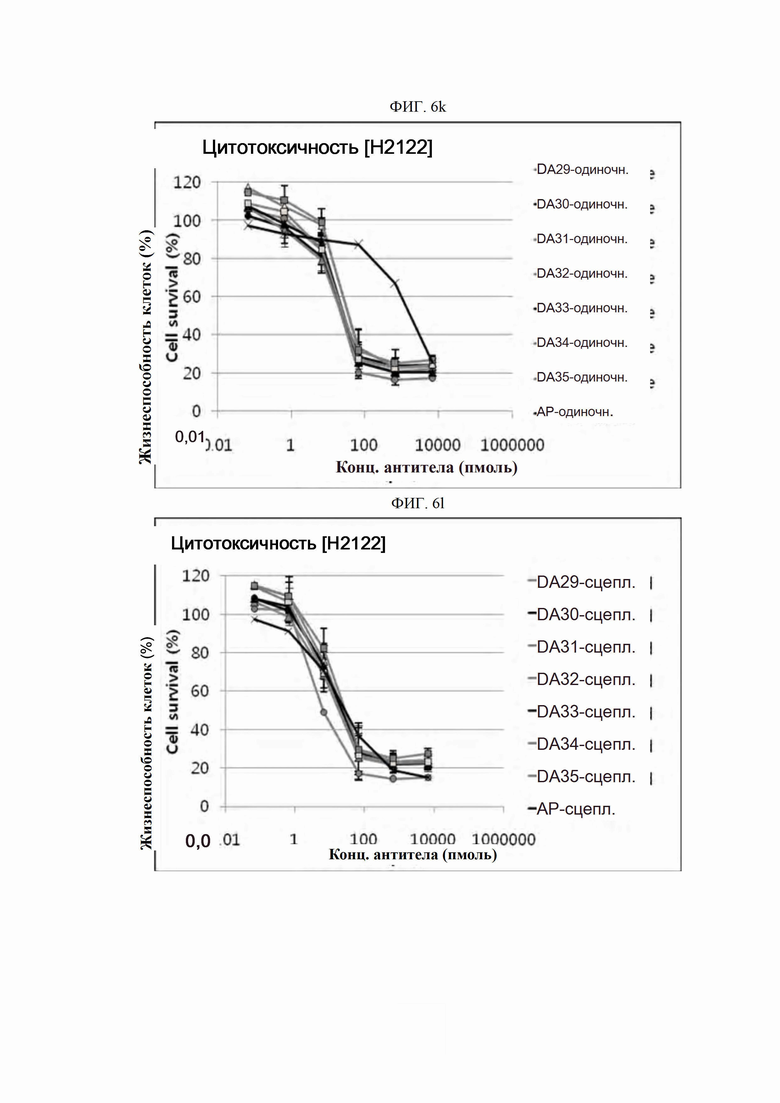
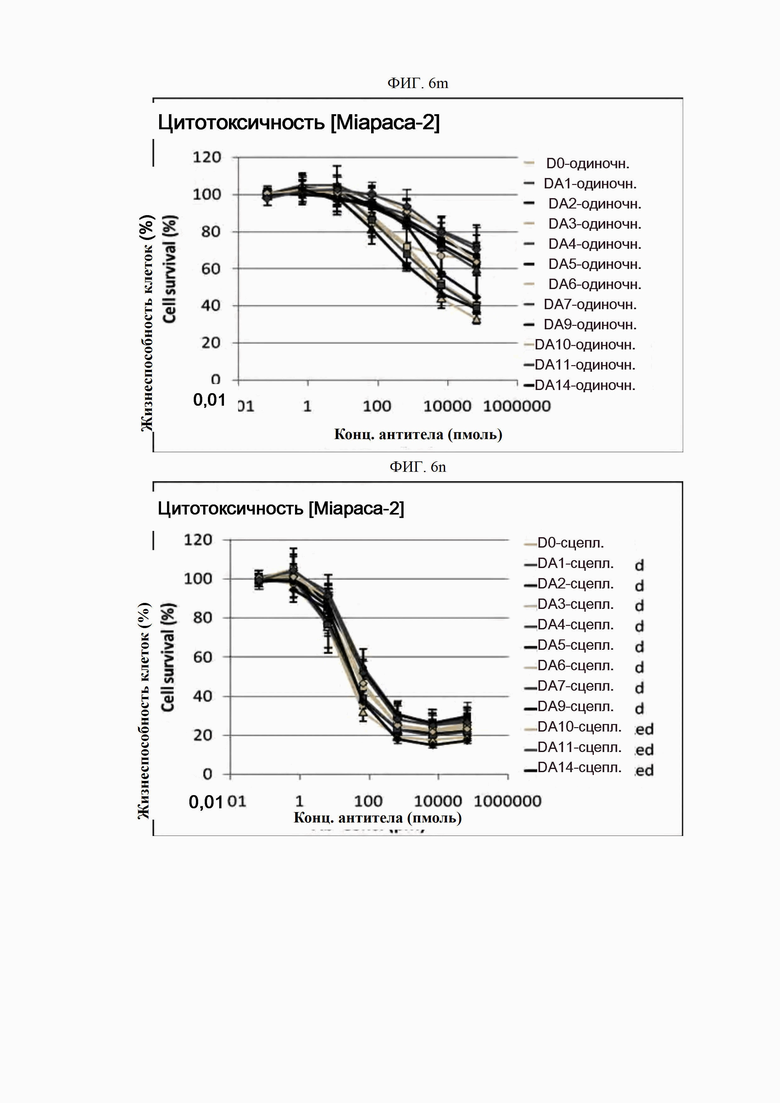
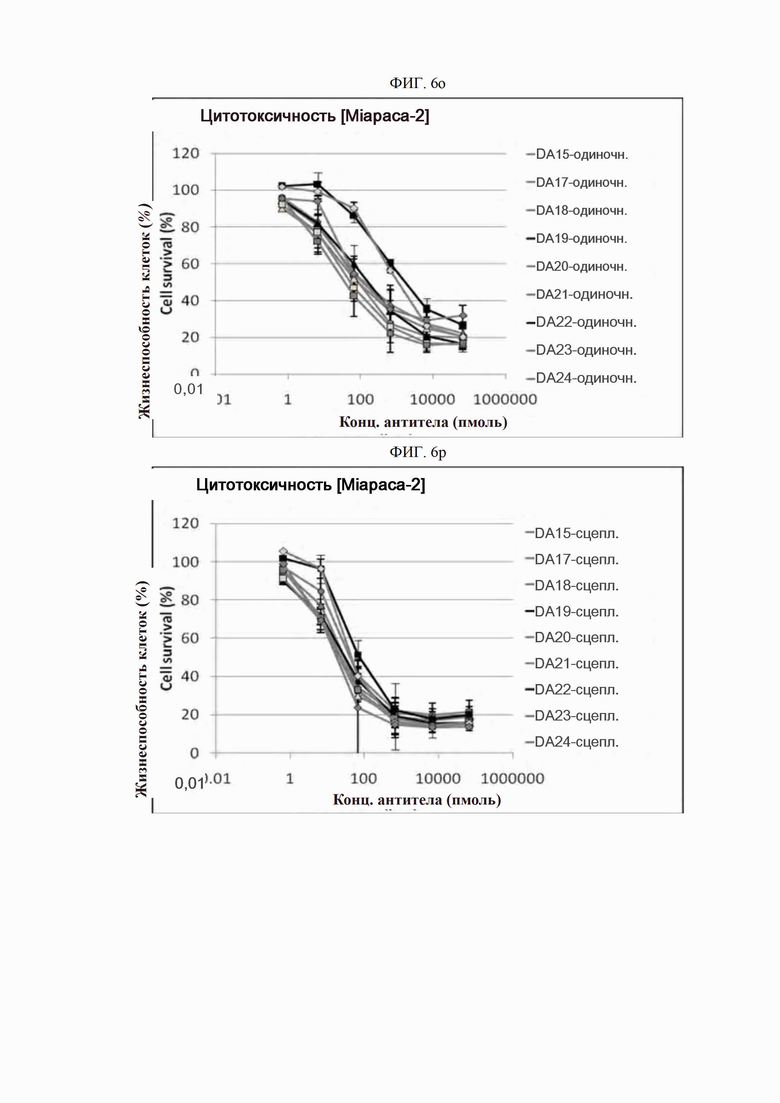
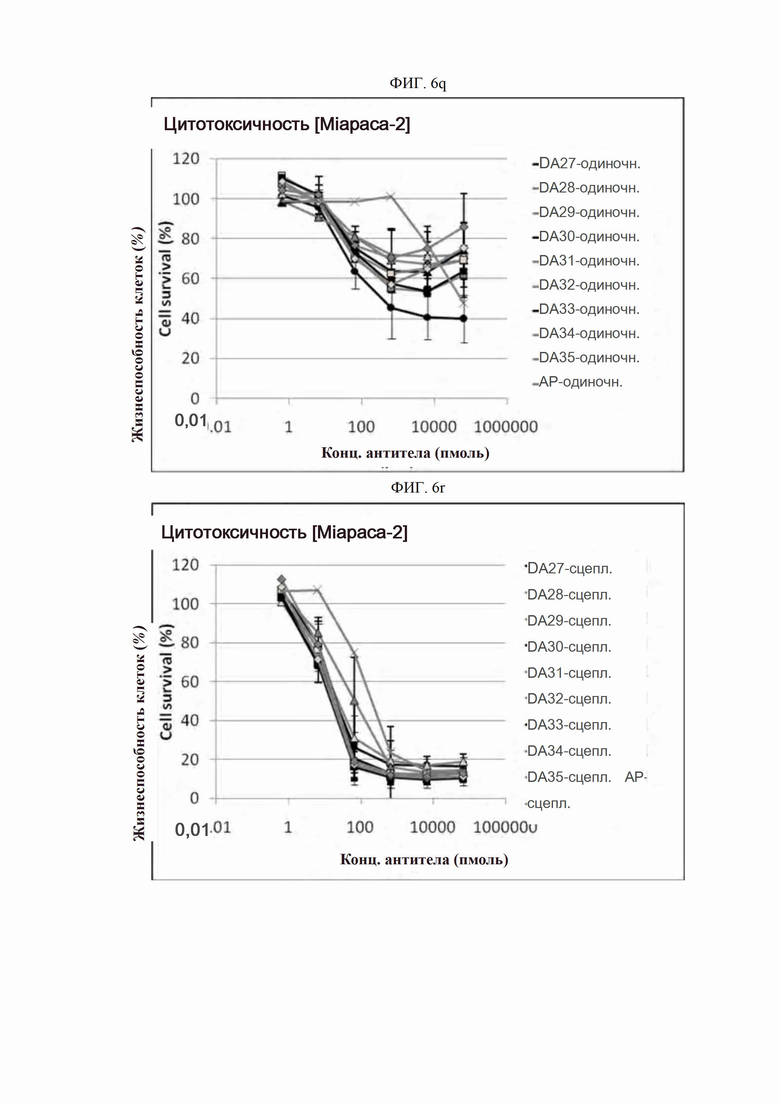
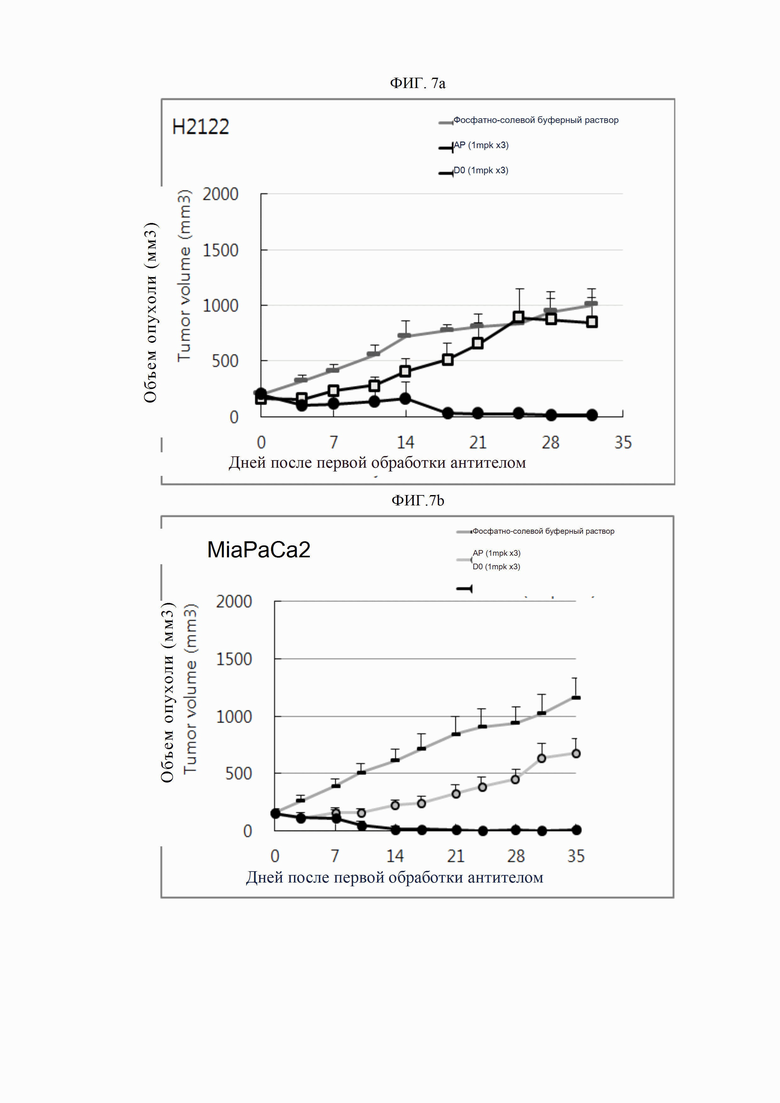
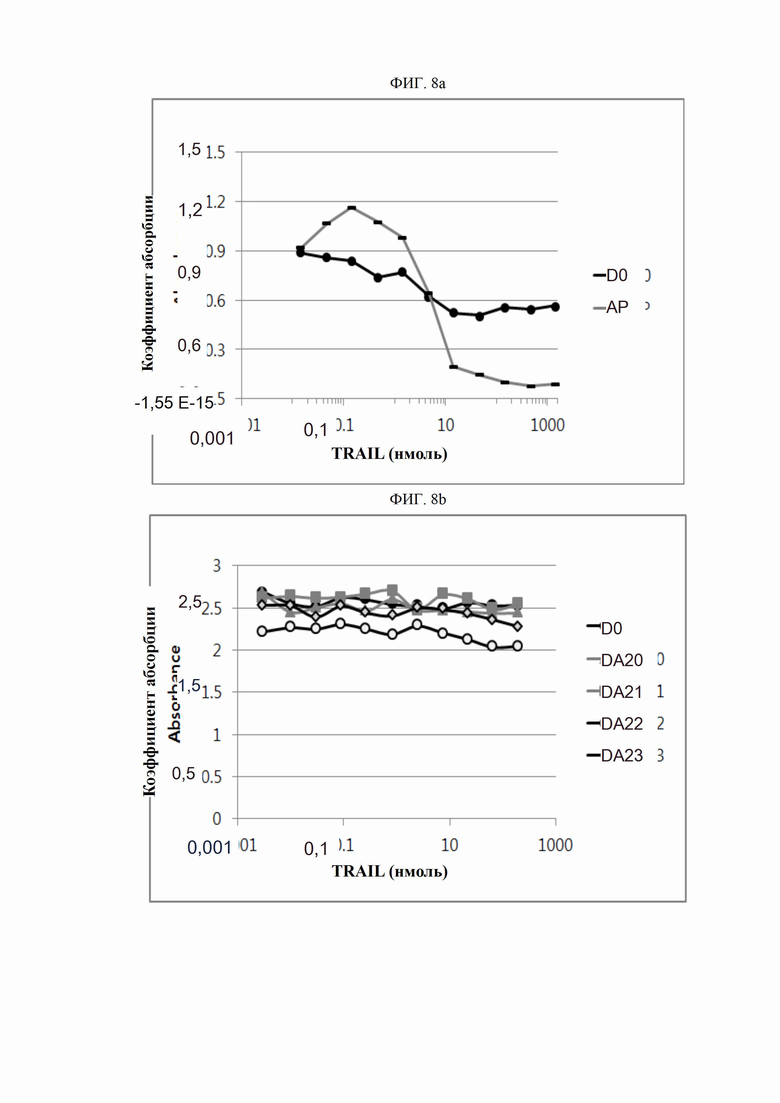
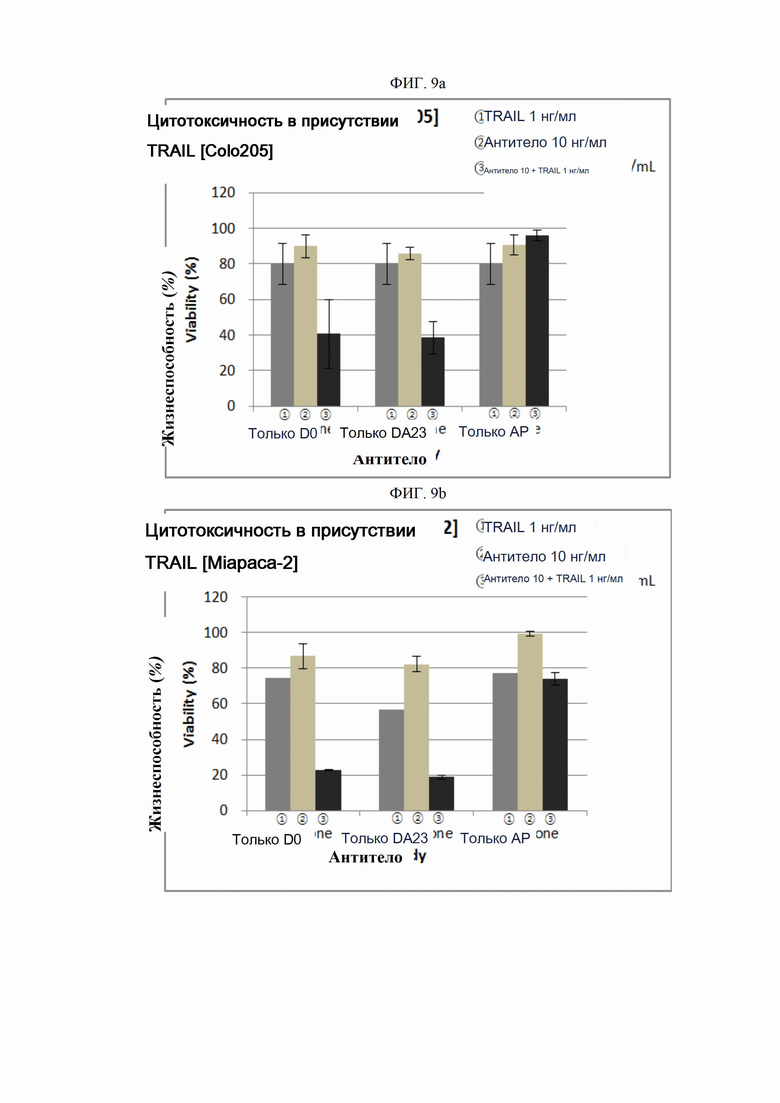
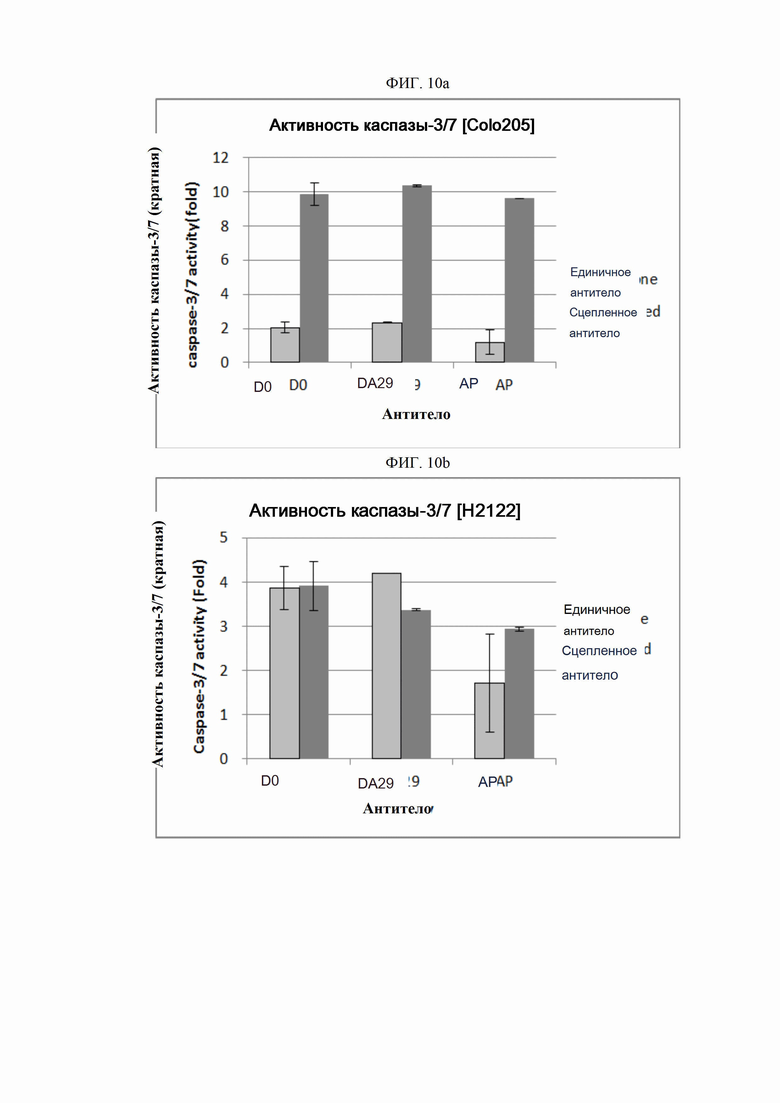
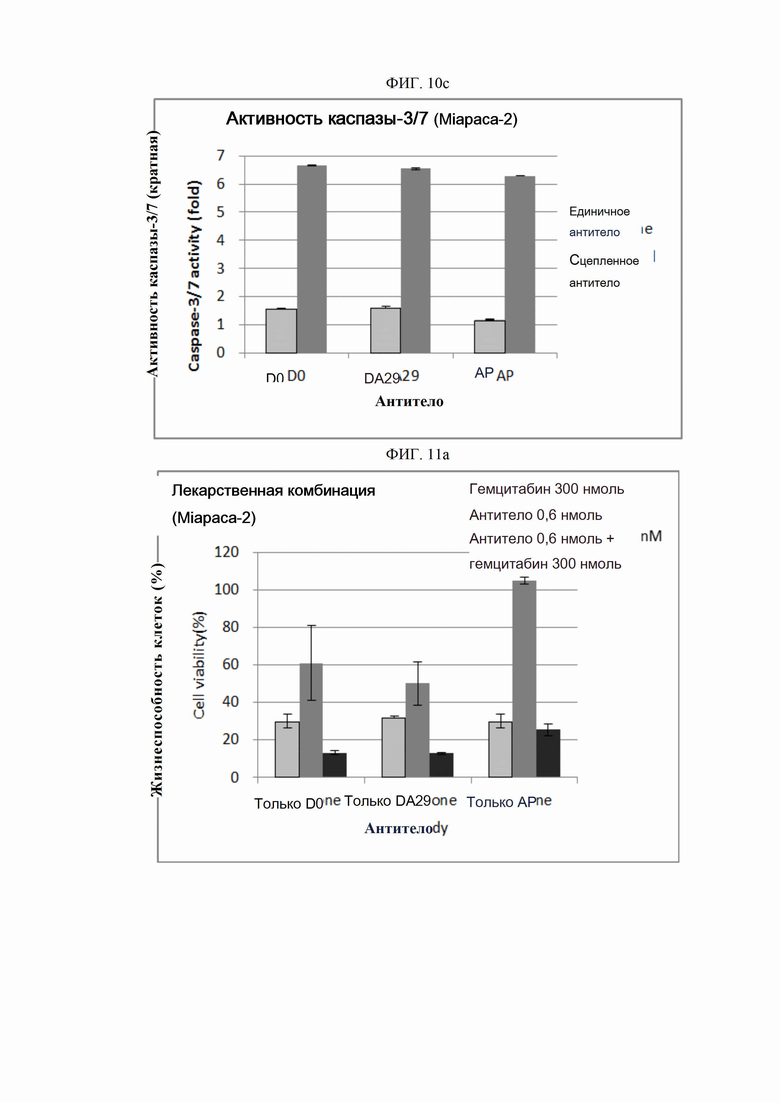
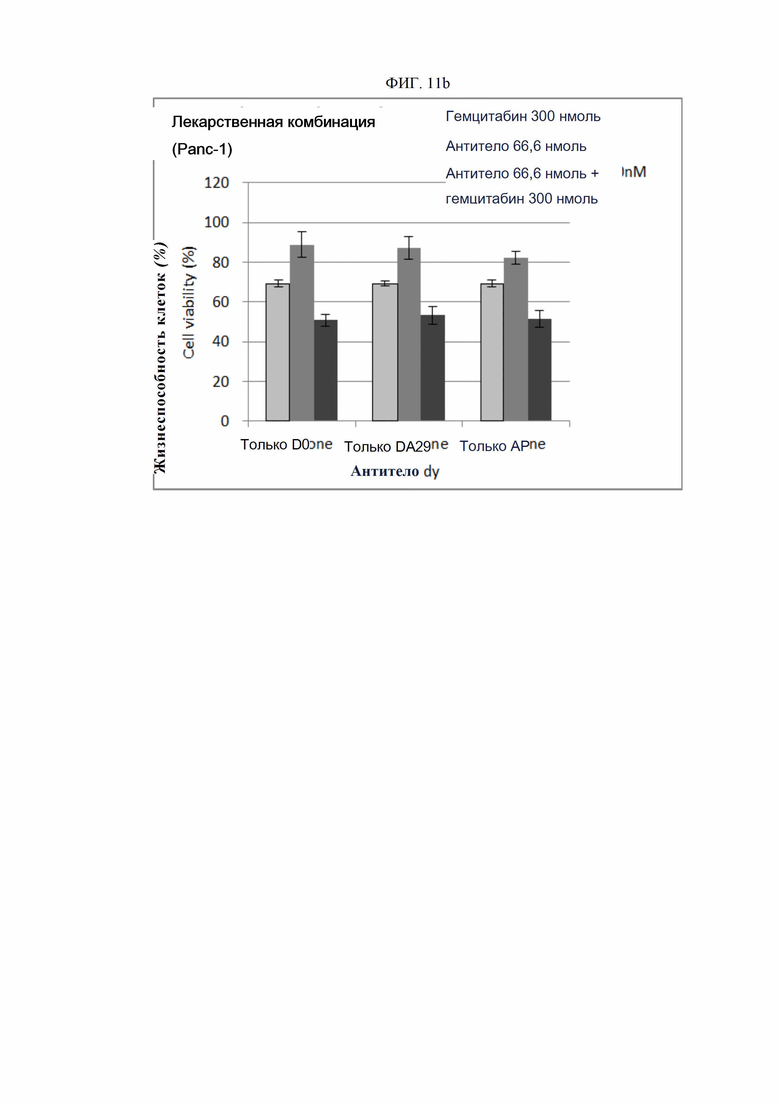
Изобретение относится к области биохимии, в частности к антителу против рецептора смерти 5 (DR5) или его антигенсвязывающему фрагменту, а также к фармацевтической композиции, его содержащей. Кроме того раскрыта полинуклеотидная молекула, кодирующая вышеуказанное антитело или его фрагмент, а также вектор и клетка, содержащие вышеуказанную молекулу. Изобретение также относится к способу получения анти-DR5-антитела или его антигенсвязывающего фрагмента, содержащему этап культивирования вышеуказанной клетки. Изобретение позволяет эффективно осуществлять профилактику или лечение онкологических заболеваний. 6 н. и 10 з.п. ф-лы, 12 табл., 15 пр., 11 ил.
1. Антитело против рецептора смерти 5 (DR5) или его антигенсвязывающий фрагмент, при этом антитело специфически связывающееся с DR5 и содержащее:
(1) полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 1 (VH-CDR1),
полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 2 (VH-CDR2),
полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 3 (VH-CDR3),
полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 4 (VL-CDR1),
полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 10 (VL-CDR2), и
полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 13 (VL-CDR3);
(2) полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 1 (VH-CDR1),
полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 2 (VH-CDR2),
полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 7 (VH-CDR3),
полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 4 (VL-CDR1),
полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 11 (VL-CDR2), и
полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 13 (VL-CDR3);
(3) полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 1 (VH-CDR1),
полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 2 (VH-CDR2),
полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 7 (VH-CDR3),
полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 4 (VL-CDR1),
полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 10 (VL-CDR2), и
полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 14 (VL-CDR3);
(4) полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 1 (VH-CDR1),
полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 2 (VH-CDR2),
полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 7 (VH-CDR3),
полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 4 (VL-CDR1),
полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 12 (VL-CDR2), и
полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 13 (VL-CDR3);
(5) полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 1 (VH-CDR1),
полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 2 (VH-CDR2),
полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 7 (VH-CDR3),
полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 4 (VL-CDR1),
полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 10 (VL-CDR2), и
полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 15 (VL-CDR3);
(6) полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 1 (VH-CDR1),
полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 2 (VH-CDR2),
полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 7 (VH-CDR3),
полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 4 (VL-CDR1),
полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 10 (VL-CDR2), и
полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 16 (VL-CDR3);
(7) полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 1 (VH-CDR1),
полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 2 (VH-CDR2),
полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 8 (VH-CDR3),
полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 4 (VL-CDR1),
полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 10 (VL-CDR2), и
полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 13 (VL-CDR3); или
(8) полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 1 (VH-CDR1),
полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 2 (VH-CDR2),
полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 9 (VH-CDR3),
полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 4 (VL-CDR1),
полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 10 (VL-CDR2), и
полипептид, содержащий аминокислотную последовательность с идентификатором SEQ ID NO: 13 (VL-CDR3).
2. Анти-DR5-антитело или его антигенсвязывающий фрагмент по п. 1, в котором анти-DR5-антитело или его антигенсвязывающий фрагмент содержит:
вариабельный участок тяжелой цепи, содержащий аминокислотную последовательность, выбранную из группы, включающей последовательности с идентификаторами, начиная с SEQ ID NO: 17 по SEQ ID NO: 37; и
вариабельный участок легкой цепи, содержащий аминокислотную последовательность, выбранную из группы, включающей последовательности с идентификаторами, начиная с SEQ ID NO: 38 SEQ ID NO: 49.
3. Анти-DR5-антитело или его антигенсвязывающий фрагмент по п. 1, в котором анти-DR5-антитело или его антигенсвязывающий фрагмент обладает способностью к индукции апоптоза в чувствительных к ФНО-связанному апоптоз-индуцирующему лиганду опухолевых клетках, экспрессирующих DR5, или резистентных к ФНО-связанному апоптоз-индуцирующему лиганду опухолевых клетках, экспрессирующих DR5.
4. Анти-DR5-антитело или его антигенсвязывающий фрагмент по п. 1, в котором анти-DR5-антитело представляет собой моноклональное антитело.
5. Анти-DR5-антитело или его антигенсвязывающий фрагмент по п. 1, в котором антигенсвязывающий фрагмент выбран из группы, в которую входят scFv, (scFv)2, Fab, Fab' и F(ab')2 анти-DR5-антитела.
6. Анти-DR5-антитело или его антигенсвязывающий фрагмент по п. 1, в котором анти-DR5-антитело представляет собой антитело мыши, химерное антитело мышь-человек, гуманизированное антитело или антитело человека.
7. Фармацевтическая композиция для профилактики или лечения онкологических заболеваний, содержащая эффективное количество анти-DR5-антитела или антигенсвязывающего фрагмента по одному из пп. 1 - 6.
8. Фармацевтическая композиция по п. 7, в котором онкологическое заболевание является выбранным из группы, включающей рак крови, рак легких, рак желудка, рак печени, рак костей, рак поджелудочной железы, рак кожи, рак головы и шеи, меланому кожи, рак матки, рак яичников, рак прямой кишки, рак ободочной и прямой кишки, рак толстой кишки, рак молочной железы, саркому матки, рак маточной трубы, рак эндометрия, рак шейки матки, рак влагалища, рак вульвы, рак пищевода, рак гортани, рак тонкой кишки, рак щитовидной железы, рак паращитовидных желез, саркому мягких тканей, рак уретры, рак полового члена, рак предстательной железы, хронический или острый лейкоз, солидные опухоли в ювенильной стадии, дифференцированную лимфому, рак мочевого пузыря, рак почки, почечноклеточный рак, рак почечной лоханки, первичную лимфому центральной нервной системы, опухоли позвоночника, глиому ствола головного мозга и аденому гипофиза.
9. Фармацевтическая композиция по п. 7, дополнительно содержащая ФНО-связанный апоптоз-индуцирующий лиганд.
10. Фармацевтическая композиция по п. 9, в которой композиция содержит анти-DR5-антитело или его антигенсвязывающий фрагмент и ФНО-связанный апоптоз-индуцирующий лиганд в одной консолидированной лекарственной форме или в соответствующих лекарственных формах.
11. Фармацевтическая композиция по п. 7, дополнительно содержащая, по меньшей мере, одно противоопухолевое средство, выбранное из группы, включающей алкилирующее противоопухолевое средство, противоопухолевое средство на основе антагониста метаболизма, противоопухолевое средство на основе антрациклина и противоопухолевое средство на основе ингибитора протеасом.
12. Фармацевтическая композиция по п. 11, в которой противоопухолевое средство представляет собой, по меньшей мере, одно выбранное из группы, включающей карбоплатин, паклитаксел, гемцитабин, доксорубицин и бортезомиб.
13. Полинуклеотидная молекула, кодирующая анти-DR5-антитело или антигенсвязывающий фрагмент по любому из пп. 1 – 6.
14. Рекомбинантный экспрессионный вектор, несущий полинуклеотидную молекулу по п. 13.
15. Рекомбинантная клетка, содержащая рекомбинантный экспрессионный вектор по п. 14.
16. Способ получения анти-DR5-антитела или его антигенсвязывающего фрагмента, содержащий этап культивирования рекомбинантной клетки по п. 15.
| WO 2010047509 A2, 29.04.2010 | |||
| US 2008248037 A1, 09.10.2008 | |||
| US 2012070432 A1, 22.03.2012 | |||
| АНТИТЕЛА К DR5 И ИХ ПРИМЕНЕНИЯ | 2006 |
|
RU2458072C2 |
Авторы
Даты
2020-11-11—Публикация
2018-02-08—Подача