ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к растениям, характеризующимся уменьшенным периодом покоя, и, более конкретно, к растениям, характеризующимся уменьшенным периодом покоя и повышенной урожайностью.
Кроме того, настоящее изобретение также относится к способам продукции растений, характеризующихся уменьшенным периодом покоя, и, более конкретно, к способам продукции растений, характеризующихся уменьшенным периодом покоя и характеризующихся повышенной урожайностью.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Состоянием покоя обозначают состояние, в котором живое растение не дает почек или ростков, даже если условия окружающей среды, такие как влажность, температура и т.д., благоприятны для прорастания семян или образования из них побегов. Состояние покоя обычно для семян, луковиц, листопадных плодовых деревьев и тому подобного. Состояние покоя считается важной функцией защиты растений от неблагоприятных условий среды и сохранения их семян. Однако в современном сельском хозяйстве условия культуры улучшены с распространением культивирования в теплицах или мультикультивирования и, таким образом, это состояние покоя может сильно препятствовать культивированию. В этой связи, активно культивировали виды растений с коротким периодом покоя или без периода покоя и так получали отличные результаты.
Кроме того, разработан способ нарушения состояния покоя растений путем искусственной обработки. Считается, что состояние покоя главным образом вызвано накоплением ингибиторов прорастания, таких как абсцизиновая кислота. Считается, что для прерывания состояния покоя необходимо снижение количества ингибитора прорастания или повышение количества гиббереллина, который обладает действием антагониста ингибиторов прорастания. Поэтому при обработке растений гиббереллином ожидаются эффекты прерывания состояния покоя.
Фактически, гиббереллин проявляет эффект индуцирования прорастания покоящихся семян овса, латука, и т.д. и покоящихся почек томата, персика, камелии и т.д. (Tomokazu Koshiba and Yuji Kamiya, "Science of new plant hormone", Kodansha Ltd., 2002). И было признано, что он имеет заметный эффект по улучшению прорастания семян риса, семейства пшеницы, рами, арахиса, Bromus catharticus, Bromus inermis Leyss., японского хрена, Brassica, латука, баклажана, печеночницы, глоксинии, каланхоэ, Primula, Nigella damascene и т.д., и также клубники, Aralia cordata Thunberg и т.д. (Vegetable horticulture great dictionary, Yokendo, 1977). Лук, лук-шалот, шпинат, луковичные цветы также считаются представителями растений, характеризующимися состоянием покоя, хотя корреляция между гиббереллином и созреванием семян не выяснена.
Картофель также является растением, характеризующимся состоянием покоя, и прорастание картофеля может не наблюдаться в течение примерно 3 месяцев после сбора урожая. Однако, как описано выше, имеются сообщения о том, что период покоя может быть укорочен обработкой гиббереллином (Tokushima Test and Research Report of Agriculture, vol. 36, pp. 7-17, 2000), и картофель считается подходящим материалом для оценки корреляции между регуляторами состояния покоя и содержанием эндогенного гиббереллина.
Картофель культивируют примерно на 20 миллионах га (гектар) и его средняя урожайность составляет 1,48 тонн на 10 а (ар), его общий урожай составляет примерно триста миллионов тонн. Максимальные посевные площади находятся в России, затем следуют Китай и Польша, и общий урожай на этих территориях также подобного порядка величины. Посевная площадь картофеля в Японии составляет примерно 130 тысяч га и его урожай составляет примерно 4 миллиона тонн. Его потребление распределяется по 44% на сырьевой крахмал, 21% на сырую пищу и 13% на обработанную пищу. Однако, поскольку либерализация импорта кукурузы и пшеницы стала эффективной, стал доступен импорт дешевого крахмала. Поэтому для победы в этой жесткой ценовой конкуренции требуется гарантировать систему продукции, имеющей высокое качество и одновременно большое количество, путем дальнейшего улучшения культивирования картофеля. Конкретно, считается необходимым увеличивать среднее количество крахмала с 13% до 18% и увеличивать средний выход продукции на 10 ар с 4 до 7 тонн и далее снижать стоимость продукции наполовину.
Содержание крахмала на начальной стадии утолщения клубня после образования клубня составляет примерно 0,8% и после этого это содержание возрастает по мере утолщения клубня. В соответствии с этим, для повышения содержания крахмала в клубнях важно предоставить достаточно времени для их утолщения. Кроме того, так как содержание крахмала быстро снижается при понижении температуры почвы, оптимальной температурой почвы (на глубине 10 см) является температура от 17 до 22°C. Ввиду этого требуется так подстраивать время культивирования, чтобы температура во время цветения, которое инициирует образование клубня, составляла примерно 18°C, и, более конкретно, рекомендуется, чтобы весенняя посадка осуществлялась за 7-10 суток до того, как температура воздуха достигнет 10°C, и осенняя посадка должна осуществляться за 10 суток до достижения средней температуры 23°C.
С другой стороны, для урожая клубней предпочтительно подбирать достаточный период утолщения клубней, и урожай картофеля возрастает примерно на 60-70 кг в сутки на 10 ар во время периода утолщения, и требуется осуществлять посадку на сельскохозяйственные поля как можно раньше в плане температуры, оптимальной для содержания крахмала.
Кроме того, в общем, время от клубней до проросших побегов (период прорастания) варьирует, и вариации, равные 15 суткам, не являются необычными. В общем, по сравнению с урожайностью побегов, проросших раньше, урожайность побегов, проросших позже снижается, поскольку для утолщения клубней недостаточно времени. Если прорастание задерживается на 15 суток, урожай в пересчете на растение, по оценкам, снижается максимум на 24%. Таким образом, вариация периода прорастания считается важным фактором снижения урожайности. Поэтому быстрое и одновременное прорастание из клубней, то есть малая вариация роста, является существенным фактором увеличения урожайности (Potato encyclopedia, Minoru Yoshida, Rural Culture Association, 1988).
Гиббереллин, как считается, синтезируется двумя путями: один из них является путем мевалоновой кислоты, в котором гиббереллин синтезируется из происходящей из уксусной кислоты мевалоновой кислоты через изопентенилдифосфат, а другой представляет собой не связанный с мевалоновой кислотой путь, в котором гиббереллин синтезируется из изопентенилдифосфата, продуцируемого из происходящих из глюкозы пировиноградной кислоты и глицеральдегид-3-фосфата. Изопентенилдифосфат преобразуется в тетрациклический углеводород энт-каурен через геранилдифосфат, геранилгеранилдифосфат, и энт-копалилдифосфат. Затем энт-каурен подвергается трем последовательным окислениям с образованием энт-кауреновой кислоты, и энт-кауреновая кислота подвергается трем последовательным окислением с синтезом GA12. Биосинтез после синтеза GA12 катализируется диоксигеназой, которая использует в качестве совместного субстрата 2-оксоглутарат. В настоящее время зарегистрировано 100 или более разновидностей свободных гиббереллинов, но активные гиббереллины, обладающие физиологической активностью, составляют лишь часть их (GA1, GA3, GA4, и т.д.).
С целью изучения физиологического эффекта гиббереллина сделана попытка введения в растение генов, ответственных за синтез гиббереллина. Huang et al. продуцировали трансформированное растение путем введения гена 20-оксидазы, выделенного из Arabidopsis, в Arabidopsis в смысловом направлении, где этот ген был гиперэкспрессирован. Сообщалось, что это трансформированное растение характеризовалось повышенным содержанием GA1, GA9, и GA20, продленным периодом цветения, и сниженным периодом покоя семян по сравнению с нетрансформированными растениями, но также сообщалось, что имела место заметная морфологическая аномалия растения, в котором наблюдалось вытяжение гипокотилей и стеблей (Plant Physiology, 118: 773-781, 1998). Более того, Carrera et al. выделили из картофеля ген, кодирующий GA20-оксидазу (StGA20ox1), и ввели его в картофель в смысловом направлении и в антисмысловом направлении. Сообщалось, что при его введении в смысловом направлении и гиперэкспрессии длина междоузлия возрастала и время прорастания из клубней продлевалось (Plant Journal, 22: 247-256, 2000). Однако в трансформированном растении, в которое был введен ген, кодирующий GA20-оксидазу, в антисмысловом положении, уменьшался период покоя, и число и масса клубней сильно уменьшались, и таким образом, улучшение урожайности не достигалось. Далее, поскольку не наблюдалось различий между временем прорастания клубней картофеля, куда был введен ген, кодирующий GA20-оксидазу, в антисмысловом положении, и временем прорастания клубней нетрансформированного растения, авторы заключили, что между GA20-оксидазой и состоянием покоя нет корреляции.
С другой стороны, независимо от описанного выше исследования было получено трансгенное растение с введением в него гена глутаматдегидрогеназы (GDH), и происходящий из E. coli ген NADP-зависимой GDH (gdhA) вводили в табак и кукурузу с целью достижения устойчивости к гербициду - фосфоноглицину. На основе этих исследований сообщалось, что сухой вес растений, общее содержание аминокислот и содержание водорастворимых углеводов существенно возрастало (Lightfoot et al., Canada, CA2180786, 1996). Сходным образом, Tian et al. (патент Китая, CN00109779.2) сообщают, что табак характеризовался хорошими ростовыми результатами при введении в него происходящего из Neurospora гена NADP-зависимой GDH, по сравнению с табаком, в который не был введен указанный ген. Более того, сообщалось, что происходящий из Aspergillus nidulans ген NADP-зависимой GDH вводили в томаты с повышением, таким образом, содержания свободных аминокислот в плоде (Japanese Unexamined Patent Publication No. 2001-238556, Kisaka et al.), и тот же ген вводили в картофель с повышением, таким образом, массы и числа клубней (JP2000-404322). Однако ни в одном из этих отчетов не описано изменений в содержании гиббереллина, и в них не проводили исследования состояния покоя.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Целью настоящего изобретения является получение растения, характеризующегося уменьшенным периодом покоя.
Далее, другой целью настоящего изобретения является разработка способа продукции растений, характеризующихся уменьшенным периодом покоя.
Кроме того, другой целью настоящего изобретения является разработка способа уменьшения периода покоя у растений.
В частности, целью настоящего изобретения является получение растений, характеризующихся уменьшенным периодом покоя и одновременными сроками образования побегов или прорастания.
Более того, еще одной целью настоящего изобретения является разработка способа продукции растений, характеризующихся уменьшенным периодом покоя и одновременными сроками образования побегов или прорастания.
Кроме того, другой целью настоящего изобретения является разработка способа уменьшения периода покоя у растений и продукции растений, характеризующихся уменьшенным периодом покоя и одновременными сроками образования побегов или прорастания.
В частности, другой целью настоящего изобретения является получение растений, характеризующихся сниженным периодом покоя и одновременными сроками образования побегов или прорастания и, следовательно, характеризующихся повышенной урожайностью.
Кроме того, целью настоящего изобретения является разработка способа продукции растений, характеризующихся сниженным периодом покоя и одновременными сроками образования побегов или прорастания и, следовательно, характеризующихся повышенной урожайностью.
Авторами настоящего изобретения уже обнаружено, что внутриклеточное содержание 2-OG повышается путем повышенной экспрессии гена глутаматдегидрогеназы (здесь и далее обозначается как GDH) в растительных клетках (Kisaka et al., заявка на выдачу патента Японии № 2003-198559). GDH катализирует обратимую реакцию введения аминогруппы в 2-OG с образованием глутаминовой кислоты, и обратимо высвобождает аммиак из глутаминовой кислоты с образованием 2-OG. Однако, в общем считается, что GDH разлагает глутаминовую кислоту на 2-OG и аммиак, а не включает аминогруппу в состав 2-OG с образованием глутаминовой кислоты в клетках, поскольку GDH имеет высокое значение Km для аммиака, и в результате повышается содержание 2-OG.
С другой стороны, по настоящему изобретению считается, что период покоя может быть снижен путем увеличения активности эндогенного гиббереллина в растении, что приводит к улучшению сроков созревания, с получением таким образом сорта, обладающего синхронностью роста, и так может быть повышена урожайность. Более конкретно, авторами настоящего изобретения обнаружено, что поскольку биосинтез после синтеза GA12 катализируется диоксигеназой, которая использует в качестве совместного субстрата 2-оксоглутаровую кислоту (2-OG), стабильно обеспечивается избыточная подача 2-OG путем гиперэкспрессии гена глутаматдегидрогеназы (GDH) растения, и активность гиббереллина в клубнях может возрастать, и что в результате действительно могут быть получены штаммы, характеризующиеся сниженным периодом покоя, улучшенными сроками образования побегов или прорастания и одновременными сроками образования побегов или прорастания, и поэтому могут быть получены штаммы, характеризующиеся синхронным ростом. Авторами настоящего изобретения также обнаружено, что урожайность увеличилась.
Иными словами, настоящее изобретение относится к растению, характеризующемуся повышенным уровнем внутриклеточного 2-OG и уменьшенным периодом покоя, по сравнению с таковым во встречающихся в природе растениях того же вида, и к способу продукции растения, характеризующегося уменьшенным периодом покоя, по сравнению с таковым во встречающихся в природе растениях того же вида, путем повышения в указанном растении внутриклеточного содержания 2-OG.
Кроме того, настоящее изобретение относится к растению, характеризующемуся повышенным внутриклеточным содержанием 2-OG, уменьшенным периодом покоя, по сравнению с таковым во встречающихся в природе растениях того же вида, и характеризующемуся одновременными сроками образования побегов или прорастания; и к способу продукции растения, характеризующегося уменьшенным периодом покоя, по сравнению с таковым во встречающихся в природе растениях того же вида, и характеризующегося одновременными сроками образования побегов или прорастания, путем повышения в указанном растении внутриклеточного содержания 2-OG.
Настоящее изобретение относится к растению, характеризующемуся уменьшенным периодом покоя, по сравнению с таковым во встречающихся в природе растениях того же вида, за счет гиперэкспрессии внутриклеточного гена GDH, и к способу продукции растения, характеризующегося уменьшенным периодом покоя, по сравнению с таковым во встречающихся в природе растениях того же вида, путем гиперэкспрессии в указанном растении внутриклеточного гена GDH.
Далее, настоящее изобретение относится к растению, характеризующемуся уменьшенным периодом покоя, по сравнению с таковым во встречающихся в природе растениях того же вида, и характеризующемуся одновременными сроками образования побегов и/или прорастания, за счет гиперэкспрессии внутриклеточного гена GDH, и к способу продукции растения, характеризующегося уменьшенным периодом покоя, по сравнению с таковым во встречающихся в природе растениях того же вида, и характеризующегося одновременными сроками образования побегов и/или прорастания, путем гиперэкспрессии в указанном растении внутриклеточного гена GDH. Растение по настоящему изобретению и растение, продуцированное способом по настоящему изобретению, характеризуется уменьшенным периодом покоя и одновременными сроками образования побегов и/или прорастания, и в результате они обладают синхронностью роста, и, таким образом, характеризуются повышенной урожайностью.
В частности, настоящее изобретение относится к растению, в которое введена конструкция нуклеиновой кислоты, способная усиливать экспрессию гена GDH, и которая может гиперэкспрессировать ген GDH в клетках, причем указанное растение характеризуется сниженным периодом покоя по сравнению с таковым во встречающихся в природе растениях того же вида. Кроме того, настоящее изобретение относится к способу продукции растения, характеризующегося сниженным периодом покоя, по сравнению с таковым во встречающихся в природе растениях того же вида, путем введения в указанное растение конструкции нуклеиновой кислоты, способной усиливать экспрессию гена GDH для гиперэкспрессии гена GDH в растительных клетках.
В частности, настоящее изобретение относится к описанному выше способу или растению, в котором конструкция нуклеиновой кислоты содержит молекулу нуклеиновой кислоты, кодирующую полипептид, характеризующийся аминокислотной последовательностью, описанной в SEQ ID NO: 2 или SEQ ID NO: 4. Кроме того, настоящее изобретение относится к описанному выше способу или растению, где нуклеиновая конструкция содержит конструкцию нуклеиновой кислоты, способной гибридизоваться с молекулой нуклеиновой кислоты, характеризующейся последовательностью, описанной в SEQ ID NO: 1 или SEQ ID NO: 3 в жестких условиях, и указанная нуклеиновая конструкция кодирует полипептид, характеризующийся активностью GDH.
Конкретно, настоящее изобретение относится к описанному выше растению и способу продукции растения, где указанное растение представляет собой картофель, и растение, продуцируемое указанным способом, представляет собой картофель.
Состояние покоя растения не только ограничивает сроки культивирования, но также представляет собой препятствие, определяющее рост и урожайность растения. Поэтому по настоящему изобретению путем снижения периода покоя растения без индукции значительных нарушений ограничения по времени культивирования могут быть сняты, и это обеспечит улучшение сроков образования побегов или прорастания, что приводит к одновременным срокам образования побегов или прорастания. Поэтому настоящее изобретение может обеспечивать одновременный рост растения и, следовательно, может обеспечивать простое культивирование и высокий урожай, рост и качество.
Фиг. 1 представляет собой схематичную иллюстрацию сконструированного плазмидного вектора.
Nos-Pro: промотор нопалинсинтазы
NPTII: неомицинфосфотрансфераза
Nos-Ter: терминатор нопалинсинтазы
35S-Pro: промотор 35S вируса мозаики цветной капусты
Mtd-AN-GDH: происходящая из Aspergillus nidulans глутаматдегидрогеназа, содержащая пептид митохондриального транспорта
HPT: гидромицинфосфотрансфераза
H: HindIII, B: BamHI, X: XbaI, Sp: SpeI, E: EcoRI,
LB: левая граница, RB: правая граница
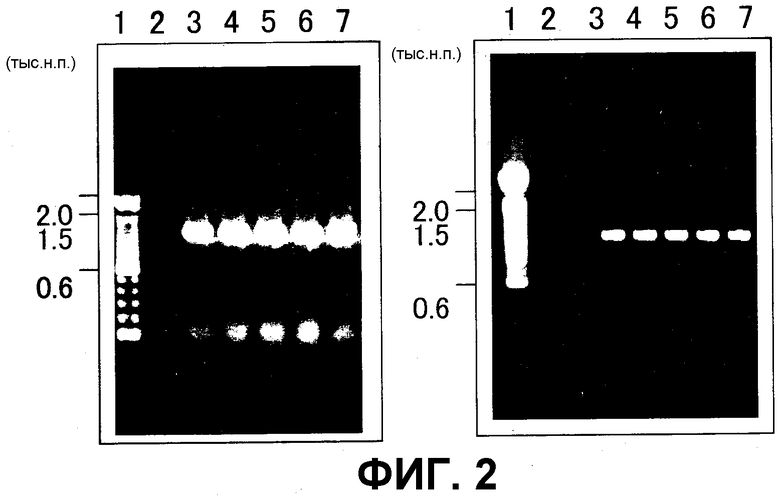
На фиг. 2 показаны результаты PCR трансгенного картофеля, где использовали праймер, специфичный для гена An-GDH (A), праймер, специфичный для гена NPTII (B). Дорожка 1: маркер размером 100 н.п., дорожка 2: нетрасгенный картофель, дорожка 3: трансгенный картофель Mtd 1, дорожка 4: трансгенный картофель Mtd 2, дорожка 5: трансгенный картофель Mtd 3, дорожка 6: трансгенный картофель Mtd 5 и дорожка 7: трансгенный картофель Mtd 8.
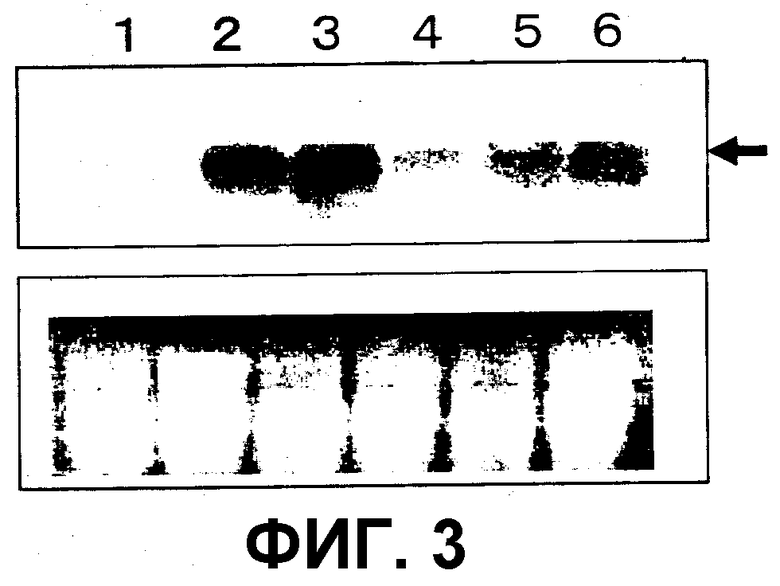
На фиг. 3 показаны результаты нозерн-блоттинга на трансгенном картофеле. Общее количество РНК, равное 10 мкг, выделенное из клубней, подвергали электрофорезу и окрашивали этидий-бромидом. Полноразмерный ген An-GDH применяли в качестве зонда. Дорожка 1: нетрасгенный картофель, дорожка 2: трансгенный картофель Mtd 1, дорожка 3: трансгенный картофель Mtd 2, дорожка 4: трансгенный картофель Mtd 3, дорожка 5: трансгенный картофель Mtd 5 и дорожка 6: трансгенный картофель Mtd 8.
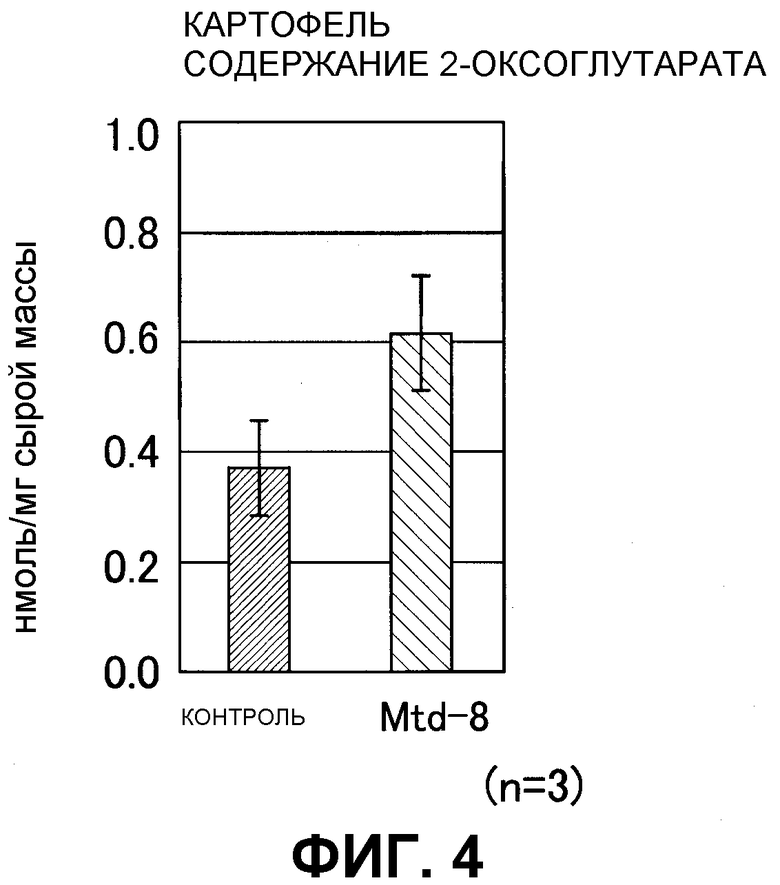
На фиг. 4 показано содержание 2-оксоглутарата (2-OG) в трансгенном по GDH картофеле (n=3). Контроль: нетрансгенный картофель, и Mtd8: трансгенный картофель.
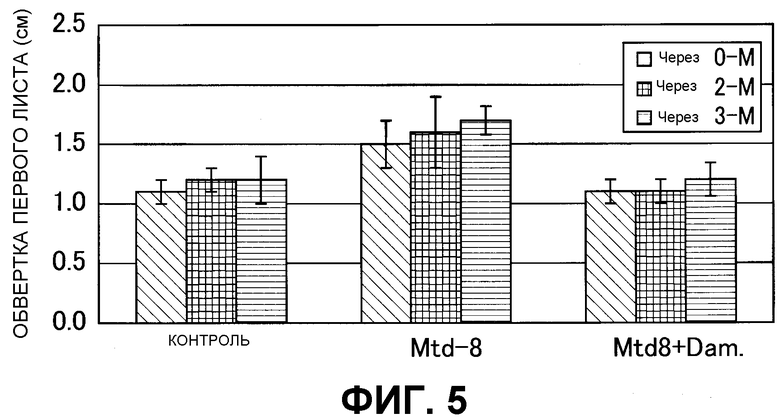
На фиг. 5 показаны результаты анализа на гиббереллин из клубня трансгенного по GDH картофеля. Контроль: раствор образца из клубня нетрансгенного картофеля, Mtd8: раствор образца из клубня нетрансгенного картофеля, Mtd8+Dami: раствор образца из клубня трансгенного картофеля + раствор даминозида. После 0-M: клубень непосредственно после сбора, после 2-M: клубень через 2 месяца после сбора, и после 3-M: клубень через 3 месяца после сбора.
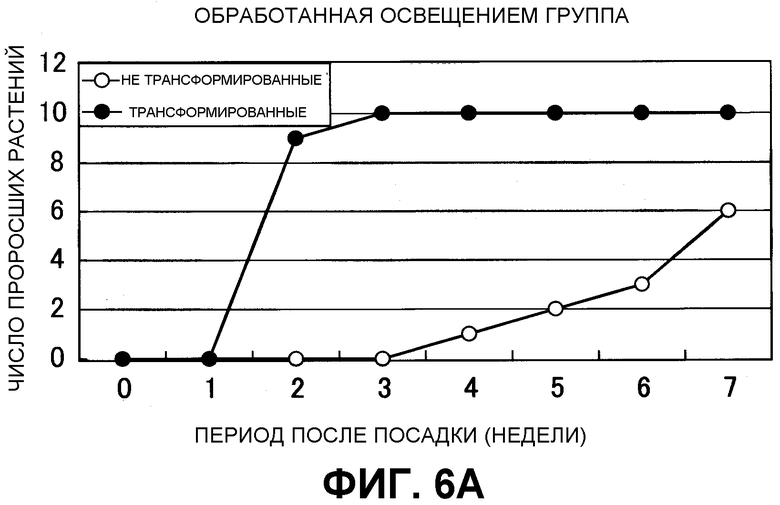
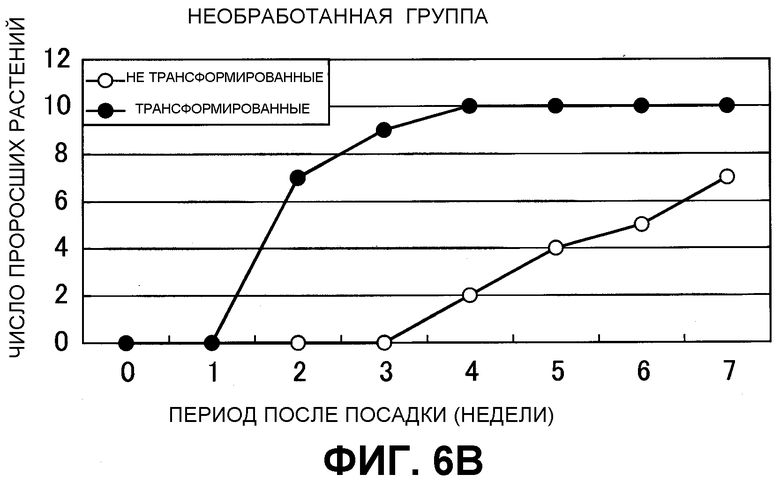
На фиг. 6 показаны результаты теста на прорастание трансгенного по GDH клубня картофеля. (A) Световая обработка: в течение 3 суток при 24°C в теплице и затем пересадка на вермикулит; (B) Без обработки: пересадка на вермикулит без тепловой обработки.
ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Как описано выше, настоящее изобретение относится к растению (включая его потомство), характеризующемуся уменьшенным периодом покоя по сравнению с таковым во встречающихся в природе растениях того же вида, за счет гиперэкспрессии гена GDH в растительных клетках, и к способу продукции этого растения.
Далее, настоящее изобретение относится к растению (включая его потомство), способному к гиперэкспрессии гена глутаматдегидрогеназы (GDH) в растительных клетках, характеризующемуся уменьшенным периодом покоя по сравнению с таковым во встречающихся в природе растениях того же вида и характеризующемуся одновременными сроками образования побегов или прорастания, и также к способу продукции растения, характеризующегося уменьшенным периодом покоя по сравнению с таковым во встречающихся в природе растениях того же вида и характеризующегося одновременными сроками образования побегов или прорастания, путем гиперэкспрессии гена GDH в растительных клетках.
В настоящем описании «встречающееся в природе растение того же вида» относится к растению, которое принадлежит к тому же виду, что и продуцируемое по настоящему изобретению, и наблюдается в природе, и которое, как было подтверждено, не подвергалось искусственным манипуляциям или не было получено в результате искусственных манипуляций.
Более конкретно, в одном из вариантов осуществления по настоящему изобретению может быть получено растение, которое может избыточно экспрессировать ген GDH и характеризуется уменьшенным периодом покоя по сравнению с встречающимися в природе растениями того же вида, путем введения гена, способного усиливать экспрессию гена GDH в растении.
В одном из вариантов осуществления настоящего изобретения путем введения конструкции нуклеиновой кислоты, содержащей GDH, в растение, GDH экспрессируется в полученном в результате трансформированном растении с повышением содержания 2-OG, и затем повышается активность гиббереллина. В результате может быть получено растение, которое характеризуется уменьшенным периодом покоя и однородными сроками образования побегов или прорастания. GDH катализирует реакцию окислительного дезаминирования глутаминовой кислоты с образованием аммиака, а также обратную реакцию образования глутаминовой кислоты путем конденсации 2-OG и аммиака. Однако в основном считается, что GDH in vivo преимущественно катализирует распад глутаминовой кислоты, то есть реакцию продукции 2-OG и аммиака, поскольку уровень Km для аммиака высок. В общем, избыточное количество внутриклеточного гиббереллина или быстрое повышение уровня внутриклеточного гиббереллина может иметь вредное влияние на рост или урожайность. Однако по настоящему изобретению гиббереллин получают не извне клетки, а, наоборот, увеличивается уровень внутриклеточного гиббереллина за счет увеличения уровня 2-OG вследствие гиперэкспрессии гена GDH. Поэтому по настоящему изобретению активность эндогенного гиббереллина будет подниматься медленно путем повышения 2-OG, что приводит к снижению периода покоя и синхронизации сроков образования побегов или прорастания без индукции значимых вредных эффектов, таких как морфологические аномалии. Обычно культуры собирают одновременно для всех растений, культивируемых, по существу, в одинаковых условиях в течение предварительно определенного периода, что приводит к задержке и разнобою в сроках образования побегов или прорастании, что может непосредственно вызвать низкий выход урожайности. Поэтому по настоящему изобретению может достигаться дальнейшее стабильное улучшение выхода.
По настоящему изобретению для увеличения содержания 2-OG в растении и, в результате, для повышения активности гиббереллина способ не ограничен только введением гена GDH, но ген фермента, который может отличаться от GDH, также может использоваться, причем этот фермент может генерировать 2-OG. В растении, куда введен такой ген, содержание 2-OG повысится и в результате возрастет активность гиббереллина. Например, такие ферменты могут включать аспартатаминотрансферазу или аланинаминотрансферазу или тому подобное.
Хотя источник ферментов, которые могут повышать содержание 2-OG, например GDH, используемый согласно изобретению, конкретно не ограничен, фермент из организма рода Aspergillus, например GDH из организма рода Aspergillus, может быть более предпочтительным. Более предпочтительно, фермент представляет собой GDH из Aspergillus nidulans или Aspergillus awamorii. Кроме того, модифицированный фермент или его ген, содержащий делецию 1 или нескольких аминокислот, замену и вставку, например модифицированная GDH и модифицированный ген GDH, может использоваться по настоящему изобретению при условии, что модифицированный фермент имеет описанную выше ферментативную активность, например активность GDH.
Для гиперэкспрессии 1 или нескольких из этих генов экспрессия эндогенных генов растений может усиливаться вместо прямого введения конструкции нуклеиновой кислоты, которая может экспрессировать указанные гены. Например, такие процедуры включают в себя введение действующей в цис-направлении конструкции нуклеиновой кислоты, которая повышает экспрессию эндогенного гена, включая мощный промотор и/или энхансер, и введение действующего в транс-направлении фактора, который может усиливать экспрессию этих генов.
Более того, локализация GDH во внутриклеточной органелле растительной клетки не ограничивается цитоплазмой, но возможно применение GDH, локализованной в митохондрии, хлоропласте, пероксисоме и т.д. Кроме того, GDH с сигнальным или транспортным пептидом, который присоединен к N-концу или С-концу для транспорта белка-фермента в этих внутриклеточных органеллах, также может использоваться согласно изобретению.
Эти гены или кДНК могут легко продуцироваться специалистами в данной области по опубликованным SEQ ID NO. Например, нуклеотидная последовательность кДНК гена GDH Aspergillus nidulans опубликована в GenBank под инвентарным № X16121. Последовательность нуклеотидов (последовательность кДНК) происходящего из Aspergillus nidulans гена GDH показана в SEQ ID NO: 1, а аминокислотная последовательность GDH - в SEQ ID NO: 2. На основе данных последовательностей может быть легко получена кДНК GDH путем синтеза PCR-праймера, с помощью которого можно амплифицировать фрагмент ДНК, кодирующий последовательность белка, и провести RT-PCR с использованием в качестве матрицы РНК, выделенной из культуры Aspergillus nidulans. Aspergillus nidulans может быть получена в American Type Culture Collection, в том числе те штаммы, которые зарегистрированы как ATCC10074 или ATCC11267 или подобные им. Кроме того, последовательность кДНК GDH Aspergillus awamorii также опубликована в GenBank под инвентарным № Y15784. Aspergillus awamorii зарегистрирована в American Type Culture Collection как ATCC10548 или ATCC11358 или подобные им, и кДНК GDH может быть получена способом, описанным выше с использованием полученных штаммов. Нуклеотидная последовательность (последовательность кДНК) гена GDH, происходящего из Aspergillus awamorii, обозначена как SEQ ID NO:3, а аминокислотная последовательность GDH показана в SEQ ID NO:4.
По настоящему изобретению может использоваться конструкция нуклеиновой кислоты, содержащая молекулы нуклеиновой кислоты, кодирующей полипептид с аминокислотной последовательностью, описанной в SEQ ID NO: 2 или 4. Более того, также возможно применять конструкцию нуклеиновой кислоты, содержащую молекулы нуклеиновой кислоты, которые характеризуются гомологией, составляющей по меньшей мере 70% или более, предпочтительно 80% или более, более предпочтительно 90% или более, в отношении SEQ ID NO: 1 или 3, где конструкция нуклеиновой кислоты кодирует полипептид, характеризующийся активностью GDH. Эта гомология может рассчитываться с использованием программы, хорошо известной в данной области, например FASTA, со стандартными параметрами. Например, такие программы, как FASTA, и т.д., предоставляются Center for Information Biology and DNA Data Bank of Japan, National Institute of Genetics (DDBJ/CIB) (http://www.ddbj.nig.ac.jp/Welcome-j.html) (например, ее можно использовать с коэффициентом 100 и выравниванием 100). Другой алгоритм и программа для рассчета гомологии среди 2 или более последовательностей хорошо известны в данной области вместе со стандартными параметрами для них. Эти молекулы нуклеиновой кислоты также могут пониматься как молекула нуклеиновой кислоты, способная гибридизоваться с указанными последовательностями в «жестких условиях», в частности с последовательностями, показанными в SEQ ID NO: 1 или 3. Используемый здесь термин «жесткие условия» относится к условиям, в которых образуются так называемые специфичные гибриды и не образуются неспецифичные гибриды. Трудно выразить эти условия численно, но, например, можно определить их как условия, в которых способны преимущественно гибридизоваться молекулы ДНК, характеризующиеся гомологией 70% или более, а другие ДНК, характеризующиеся гомологией 70% или менее, значимо не гибридизуются. Более конкретно, их можно определить, как условия, в которых гибридизация может происходить при условиях отмывки, которые соответствуют нормальным условиям отмывки для саузерн-гибридизации, представляющим собой 50°C, 2 × SSC и 0,1% SDS, предпочтительно 1 × SSC, и 0,1% SDS, и более предпочтительно 0,1 × SSC и 0,1% SDS. Более того, любые эквивалентные условия могут быть понятны специалистам в данной области (например, Sambrook et al., Molecular Cloning: A Laboratory Manual, 2nd Edition, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York, 1989; Ausubel et al., Current Protocols in Molecular Biology, John Wiley & Sons, Inc., 1994). Хотя ген, способный гибридизоваться в таких условиях, может содержать стоп-кодон(-ы) внутри себя или может иметь в своем активном центре мутацию, вызывающую потерю активности, такой ген может быть легко удален путем определения ферментативной активности после его присоединения к коммерчески доступному экспрессирующему вектору.
SEQ ID NO: 1 и SEQ ID NO: 3 характеризуются гомологией 66%, рассчитанной посредством Genetyx Ver 3.2. Сходным образом, SEQ ID NO: 2 и 4, как показано, характеризуются гомологией 87%.
Активность GDH может, например, измеряться способом Ameziane et al. (Plant and Soil, 221: 47-57, 2000). Более конкретно, растительные ткани, например лист, подвергают криообработке для сохранения жидким азотом, измельчают в ступке и смешивают с буфером для экстракции {200 мМ Tris (pH 8,0), 14 мМ β-меркаптоэтанола, 10 мМ L-цистеин-HCl и 0,5 мМ PMSF} в 5-кратном объеме относительно массы образца ткани. Полученную в результате смесь переносят в центрифужную пробирку, центрифугируют в течение 30 минут при 12000 об./мин при 4°C и надосадочную жидкость подвергают ультрафильтрации (Millipore, фильтровальное устройство Ultrafree 0,5, Biomax-10) и остаток несколько раз промывают буфером для экстракции. Полученный в результате экстрагированный раствор фермента добавляют к раствору, содержащему 100 мМ Tris (pH 8,5), 20 мМ 2-оксоглутаровой кислоты, 10 мМ CaCl2, 0,2 мМ NADH и 200 мМ NH4Cl. Затем активность GDH можно определить путем измерения снижения поглощения при 340 нм. Концентрацию белка в экстрагированном растворе неочищенного фермента можно измерить хорошо известным способом, таким как метод Брэдфорд, с использованием в качестве стандарта, например, бычьего сывороточного альбумина (BSA).
Кроме того, по настоящему изобретению способ повышения активности гиббереллина путем увеличения содержания 2-OG не ограничен введением гена GDH. Растение, характеризующееся высокой активностью гиббереллина вследствие повышения содержания 2-OG, также может продуцироваться путем введения фермента, который продуцирует 2-OG из глутаминовой кислоты и который может отличаться от GDH. Примеры таких ферментов включают в себя аспартатаминотрансферазу или аланинаминотрансферазу или подобные им.
Конструкция нуклеиновой кислоты, используемая по настоящему изобретению, может быть получена способами, хорошо известными специалистам в данной области. Способы молекулярной биологии, включающие в себя выделение и определение последовательности конструкции нуклеиновой кислоты, указаны в публикациях, таких как Sambrook et al., Molecular Cloning-Laboratory Manual, the 2nd edition, Cold Spring Harbor Laboratory Press). Альтернативно, способ амплификации генов, такой как PCR, может потребоваться для продукции конструкции нуклеиновой кислоты, которая может использоваться по настоящему изобретению. Эти способы также указаны в таких публикациях, как F.M. Ausubel et al. (Current Protocols in Molecular Biology, John Wiley & Sons, Inc. (1994)).
Конструкция нуклеиновой кислоты, кодирующая GDH или описанные выше ферменты, может, в основном, содержать подходящий промотор растительных клеток, например промотор гена нопалинсинтазы, 35S-промотор вируса мозаики цветной капусты (CaMV35S) или подходящие терминаторы, такие как терминаторы гена нопалинсинтазы, и другие требуемые или предпочтительные последовательности для экспрессии, такие как энхансер и маркерный ген для скрининга трансформантов, например ген устойчивости к лекарственному средству, включая ген устойчивости к канамицину, ген устойчивости к G418 и ген устойчивости к гидромицину.
Промотор, используемый в такой конструкции нуклеиновой кислоты, может представлять собой конститутивный промотор, тканеспецифический промотор, или специфичный для стадии роста промотор, который может быть выбран в зависимости от используемого промотора, в зависимости от хозяина, требуемого уровня экспрессии, органа-мишени экспрессии или стадии роста. В предпочтительном варианте осуществления настоящего изобретения могут использоваться сильные промоторы, которые не специфичны в отношении ткани и стадии роста, включая, например, промотор CaMV35S. Тканеспецифические промоторы включают в себя, например, промотор гена фазеолина или промотор гена пататина или подобные тому. В наиболее предпочтительном осуществлении настоящего изобретения используют конструкцию нуклеиновой кислоты, где ген GDH направляется сильным конститутивным промотором, таким как промотор CaMV35S.
Способ переноса генов по настоящему изобретению конкретно не ограничен, и возможно адаптировать подходящий способ переноса генов к растительным клеткам, известный специалистам в данной области, в зависимости от хозяина. Например, в одном из осуществлений настоящего изобретения используют способ переноса генов с применением Agrobacteruim. В такой системе трансформации предпочтительно использовать бинарный вектор. В случае применения Agrobacterium, конструкция нуклеиновой кислоты, применяемая при трансформации, далее включает в себя область Т-ДНК, фланкирующую подлежащую введению последовательность ДНК. В предпочтительном варианте осуществления настоящего изобретения введенную последовательность встраивают между левой и правой пограничными T-ДНК-последовательностями. Подходящий дизайн и конструкция такого трансформирующего вектора, основанного на T-ДНК, хорошо известны специалистам в данной области. Кроме того, условия трансфекции растения Agrobacterium, несущей такую конструкцию нуклеиновой кислоты, также хорошо известны специалистам в данной области.
В настоящем изобретении могут быть также использованы другие способы переноса генов. Примеры способов переноса генов включают способ введения ДНК в протопласт с использованием полиэтиленгликоля или кальция, процедуры трансформации протопласта электропорацией, способ с использованием обстрела частицами и т.п.
Растительные клетки и подобные им, с которыми манипулировали, как описано выше, могут подвергаться отбору на предмет трансформации. Этот отбор может проводиться, например, на основе экспрессии маркерного гена, присутствующего в конструкции нуклеиновой кислоты, использованной для трансформации. Например, когда маркерный ген представляет собой ген устойчивости к лекарственному средству, их можно отбирать путем культивирования или выращивания растительных клеток в культуральной среде, содержащей антибиотики или гербицид, или подобное им, в умеренной концентрации. Альтернативно, когда маркерный ген представляет собой ген β-глюкуронидазы или ген люциферазы, трансформированные клетки могут отбираться путем скрининга на активность маркерного гена. Если эти идентифицированные трансформированные клетки отличаются от растительного организма, такого как протопласты, каллусы, эксплантаты, и тому подобное, из них можно регенерировать целое растение. Для этой регенерации может использоваться любой способ, известный специалистам в данной области, в зависимости от подлежащих использованию растений-хозяев.
Полученное таким образом растение может культивироваться любым обычным способом, то есть в тех же условиях, что используются для нетрансформированных клеток, и для идентификации трансгенного растения, содержащего конструкцию нуклеиновой кислоты по изобретению, могут использоваться различные способы молекулярной биологии в дополнение к отбору, основанному на маркерном гене, описанному выше. Например, для детекции наличия или отсутствия вставки рекомбинантной ДНК и ее структуры. Возможно применять нозерн-гибридизацию или RT-PCR, или подобные способы для детекции или измерения РНК-транскрипта, происходящего от ДНК введенной конструкции нуклеиновой кислоты.
Экспрессию введенного гена полученного трансформанта можно затем оценивать путем определения количества белка, мРНК, или ферментативной активности, например, белка GDH. Например, количество белка может оцениваться способом вестерн-блота или подобным ему, а количество мРНК может оцениваться способом нозерн-блота или способом количественной RT-PCR. Кроме того, описанная выше ферментативная активность в растительных экстрактах может измеряться обычным способом. Например, активность GDH может измеряться способом Ameziane et al. (Ameziane R., Bernhard K., and Lightfood D., Plant and Soil, 221: 47-57, 2000).
В соответствии с этим, содержание 2-OG может далее оцениваться для трансформированного растения, в котором подтверждена экспрессия введенного гена, например экспрессия гена GDH. Содержание 2-OG может измеряться, например, ферментативным способом, где целое трансформированное растение или его часть может осаждаться, и получают экстрагированный раствор. Получение растительного экстракта и количественный анализ 2-OG может проводиться способом Usuda (Usuda H., Plant Physiol, 78: 859-864, 1985). Более конкретно, образцы могут быть получены из растения подходящим способом. Например, 20 мкл экстрагированного образца можно добавить к 475 мкл реакционного раствора {0,1 M Tris-HCl (pH 8,5), 1,0 мМ CaCl2, 0,2 мМ NADPH и 0,2 M NH4Cl}, поглощение полученного в результате раствора можно измерить при 340 нм, затем 5 мкл (10 единиц) GDH можно добавлять к раствору и полученный в результате раствор можно оставить для взаимодействия в течение 10 минут при 37°C. После этого можно опять измерять поглощение при 340 нм. Содержание 2-OG может быть рассчитано из разницы между поглощением, измеренным после добавления раствора фермента, и тем, что измерено до добавления раствора фермента. В обычных условиях культивирования считается, что содержание 2-OG повышено, когда содержание 2-OG в надземной части (лист, стебель, оба они, орган цветка или часть плода) или в подземной части (корень или клубень) возрастает в 1,2 раза или более по сравнению с таковым в исходном сорте того же вида, использованного для введения гена (нетрансформированное растение).
При количественном анализе гиббереллина рассматриваются два случая. В одном из них тип гиббереллина для анализа предварительно определяется. В данном случае, после проведения необходимой очистки, может проводиться инструментальный анализ, такой как способ GC/MS. В другом случае тип(-ы) и содержание гиббереллина(-ов) в образце неизвестен(-ы). В данном случае после очистки и/или фракционировании образца может проводиться биоанализ (биологический анализ), например, по способу Chen et al. Для биоанализа в основном используется капельный способ с применением карликового мутанта риса Tanginbozu, который чувствительно отвечает на гиббереллин. В кратком изложении, лущенные неполированные рисовые семена стерилизовали путем обработки их 70% этанолом в течение 1 минуты и 2% гипохлоритом натрия в течение 15 минут с последующей промывкой стерилизованной водой, и их погружали в стерилизованную воду и инкубировали в течение 2 суток при 30°C. Затем пророщенные семена опять стерилизовали тем же способом, высевали на агаровую среду (0,6% агар), и инкубировали при 25°C в течение 5 суток при дневном свете в течение 16 часов. Выбирали только пророщенные семена, характеризующиеся синхронным ростом, и 2 мкл раствора образца раскапывали между 1-м листом и колеоптилем. После культивирования в течение дополнительных 5 суток в тех же условиях содержание гиббереллина можно определять путем измерения длины обвертки 2-го листа. Количественный анализ гиббереллина можно проводить путем инструментального анализа или путем биоанализа. Если содержание активного гиббереллина возрастает по сравнению с контролем, что определено путем инструментального анализа, или длина междоузлий возрастает статистически значимо (например, уровень значимости 5%) по сравнению с контролем, что определено путем биоанализа, возможно определить, что активность гиббереллина возрастает.
В соответствии с этим, как только определено трансгенное растение, которое характеризуется уменьшенным периодом покоя вследствие повышения содержания эндогенного 2-OG и активности гиббереллина по сравнению с нетрансформированными растениями в качестве контроля, могут быть тестированы их свойства на предмет того, являются ли они генетически стабильными. Для этого растения могут выращиваться и культивироваться в обычных условиях для получения их семян или для получения клубней, например, в случае картофеля, и для них может анализироваться расщепление потомства. Наличие или отсутствие введенной конструкции нуклеиновой кислоты, ее расположения, экспрессии, и тому подобного в потомстве может также анализироваться сходным способом, как и для первого поколения трансформантов (поколение T1).
Хотя трансгенные растения могут быть гемизиготными или гомозиготными относительно конструкции нуклеиновой кислоты, введенной в геном, путем их скрещивания в потомстве можно получить и гемизиготы, и гомозиготы, если это требуется. Последовательность, происходящая из конструкции нуклеиновой кислоты, которая интегрирована в геном, в потомстве будет характеризоваться менделевским расщеплением. Поэтому для получения растений-потомков и их семян, характеризующихся стабильными признаками, предпочтительно использовать гомозиготные растения.
Кроме того, в большинстве трансформантов чужеродный ген встроен в один локус, но нередки случаи, когда трансформанты представляют собой мультикопийные трансформанты, где чужеродный ген встроен во многие генные локусы. Для целей стабильности введенного гена и т.д. более предпочтительными по настоящему изобретению являются однокопийные трансформанты.
В соответствии с этим, полученные таким образом трансгенные растения оценивают на предмет периода покоя. Уменьшение периода покоя может оцениваться путем сравнения периода покоя растения каждого из сортов растения по настоящему изобретению с периодом покоя стандартного вида растений или путем сравнения периода покоя растения каждого из сортов растения, продуцированных по настоящему изобретению, с периодами покоя стандартного растения, где оценка может проводиться с использованием уровня значимости, равного 5%. В общем, данный «стандартный вид растения» представляет собой «встречающееся в природе растение того же вида», описанное ранее.
Например, в случае трансгенных растений, после сбора, их хранили при комнатной температуре (от 15 до 25°C) или при низкой температуре (от 4 до 8°C) примерно в течение 3 месяцев при обычных условиях, и затем посевной картофель высевали в культуральную почву. Затем долю проросших картофелин сравнивали с таковой для нетрансгенного картофеля (например, исходное растение, использованное для введения генетической конструкции по настоящему изобретению, включая встречающееся в природе растение того же вида) для оценки уменьшения периода покоя. Действительное число суток, требуемое для прорастания (роста рассады) может изменяться в зависимости от условий хранения, разновидности, условий культивирования и тому подобного, но, например, если трансгенное растение и нетрансгенное растение, происходящие от May Queen, хранят при комнатной температуре, 70% или более картофеля по настоящему изобретению или картофеля, продуцированного по настоящему изобретению, характеризуются уменьшением периода, требуемого для ускорения прорастания, на 1-8 недель. Поэтому в случае картофеля, в кратком изложении, когда период, требуемый для ускорения прорастания, для 70% или более картофеля при условиях, описанных выше, снижен на 1-8 недель по сравнению с встречающимся в природе картофелем того же вида, также можно считать, что период покоя уменьшен.
В соответствии с этим, поскольку трансгенные растения характеризуются ранними сроками образования побегов или прорастания и синхронизированным образованием побегов или прорастанием по сравнению с нетрансформированным растением, возможно заметно улучшить рост или урожайность. Более того, от продуцированного таким образом трансгенного растения можно получить семена. Семена можно легко продуцировать тем же способом, что и для нетрансформированного растения того же вида. Если необходимо, семена могут сохраняться, стерилизоваться, подвергаться дезинсектизации и тому подобному общепринятыми способами, известными специалистам в данной области.
В дополнение к введению конкретной конструкции нуклеиновой кислоты, период покоя может быть изменен путем увеличения в растении внутриклеточного содержания 2-OG путем мутагенеза за счет радиации, ультрафиолетовых лучей, и/или мутагена (например, алкилирующими средствами, такими как этиленимин или этилметансульфонат), необязательно, с последующей селекцией. В частности, независимо от введения конструкции нуклеиновой кислоты, период покоя растения может укорачиваться путем повышения путем увеличения внутриклеточного содержания 2-OG за счет усиления экспрессии гена GDH, аспартаталанинтрансферазы и аминотрансферазы. Общий способ мутагенеза и реагенты, относящиеся к данному способу, хорошо известны специалистам в данной области и они могут использоваться по настоящему изобретению. Оценка способа культивирования, содержания 2-OG, степени экспрессии каждого из описанных выше генов, и/или уменьшенного периода покоя растения, продуцированного таким образом, может проводиться способом и в манере, сходной с той, которая описана для трансгенного растения.
Как может быть понятно из приведенного выше описания по настоящему изобретению, период покоя растения может, в общем, быть уменьшен по сравнению с нетрансформированным растением, например встречающимися в природе растениями того же вида. Настоящее изобретение может применяться в отношении растения, у которого гиббереллин эффективен в плане прерывания состояния покоя. Такие растения включают в себя овес, латук, картофель, персик, камелию, растения риса, растения семейства пшеницы, рами, арахис, Bromus catharticus, Bromus inermis Leyss., редис, Brassica, латук, баклажан, печеночницу, глоксинию, каланхоэ, Nigella damascena, клубнику и Aralia cordata Thunberg, но они не ограничены данными видами. Конкретным предпочтительным примером растения, характеризующегося сниженным периодом покоя, по настоящему изобретению, и растения, продуцируемого по настоящему изобретению, является картофель.
Настоящее изобретение будет описано конкретно и подробно следующими осуществлениями, относящимися к способу продукции растения, имеющего повышенное содержание 2-OG, в частности растения, с которым проведены манипуляции по гиперэкспрессии гена GDH, измерению содержания 2-OG, анализу гиббереллина, теста прорастания и теста урожайности.
ПРИМЕРЫ
Пример 1
Выделение гена NADP-зависимой GDH из Aspergillus nidulans (A. nidulans) и конструирование плазмидного вектора Ti
(1) Выделение гена NADP-зависимой GDH из Aspergillus nidulans (An-GDH)
A.nidulans инокулировали на агаровой среде с декстрозой картофеля, культивировали при 30°C в течение ночи и полученные в результате колонии далее культивировали в жидкой декстрозной среде в течение 2 суток. Общую РНК получали изданных пролиферирующих бактерий.
мРНК очищали из общей РНК с использованием набора для быстрого выделения мРНК, основанного на поли(А), Poly (A) Quick mRNA Isolation Kit (Stratagene Co.), и затем синтезировали первую цепь кДНК с использованием набора для синтеза первой цепи кДНК First-strand cDNA Synthesis Kit (Amersham Bioscience Co.). Реакцию PCR проводили на синтезированной первой цепи кДНК в качестве матрицы. Реакцию PCR проводили с использованием PCR System 2400 производства PerkinElmer следующим образом: 94°C - 3 мин; 94°C - 45 с, 59°C - 30 с, 72°C - 90 с, и 35 циклов; 72°C - 10 мин. Использованные праймеры представляли собой 5'-TCT AGA ATG TCT AAC CTT CCC GTT GAG-3' (SEQ ID NO: 5) и 5'-GAG CTC TCA CCA CCA GTC ACC CTG GTC-3' (SEQ ID NO: 6). В результате обнаруживали полосу размером примерно 1,4 тыс.н.п., которая соответствовала ожидаемому размеру требуемого гена. Полученные продукты PCR клонировали использованием набора для клонирования TA-Cloning-Kit (Invitrogen Co.). Нуклеотидную последовательность полученного клона определяли с использованием секвенатора (377A от ABI Co.). Данная нуклеотидная последовательность показана в SEQ ID NO: 1, а аминокислотная последовательность кодируемого белка показана в SEQ ID NO: 2.
Данная последовательность соответствовала известной нуклеотидной последовательности NADP-зависимого гена GDH от A. nidulans, который обозначали как An-GDH.
(2) Конструирование плазмидного вектора Ti
Таким образом, полученные гены объединяли с нуклеотидной последовательностью, кодирующей пептид митохондриального транспорта. Нуклеотидный фрагмент, кодирующий пептид митохондриального транспорта, получали, проводя PCR с использованием в качестве матрицы 5'-части гена NAD-зависимой GDH из томатов. Праймеры, использованные для реакции PCR, представляли собой 5'-CTG CAG ATG AAT GCT TTA GCA GCA AC-3'(SEQ ID NO: 7) и 5'-TCT AGA TAA ACC AAG AAG CCT AGC TG-3'(SEQ ID NO: 8). Объединение гена An-GDH и нуклеотидной последовательности, кодирующей пептид митохондриального транспорта, проводили путем PCR с геном An-GDH и геном транспортного пептида в качестве матриц. Четыре праймера, использованные в реакции PCR, представляли собой 5'-TCT AGA ATG AAT GCT TTA GCA GCA AC-3'(SEQ ID NO: 9), 5'-GGG AAG GTT TAG ACA TTA AAC CAA GAA GCC T-3'(SEQ ID NO: 10), 5'-AGG CTT CTT GGT TTA ATG TCT AAC CTT CCC-3'(SEQ ID NO: 11) и 5'-GAG CTC TTA CGC CTC CCA TCC TCG AA-3' (SEQ ID NO: 12). К полученному гену GDH добавляли последовательность транспортного пептида для митохондрий и это обозначали как Mtd-An-GDH. Ген Mtd-An-GDH включали в состав pIG121-Hm путем замещения части GUS pIG121-Hm, вектора, Ti-плазмиды для опосредованной Agrobacterium трансформации (фиг.1). Полученную Ti-плазмиду вводили в Agrobacterium tumefaciens EHA101, подлежащую применению для трансформации картофеля.
Пример 2
Продукция трансгенного картофеля
Трансформацию картофеля (May Queen) проводили способом Gordon et al. (Plant Cell Reports, 12: 324-327, 1993). Индуцированные в стерильных условиях микроклубни разрезали с образованием клубневых дисков и кусочки помещали на агаровую среду MS, содержащую 2 мг/л зеатина и 0,1 мг/л индолуксусной кислоты. Кусочки культивировали при 25°C в течение 24 часов, в то время как время дневного освещения поддерживали на уровне 16 часов. Среду YEP (10 г/л бактотриптона, 10 г/л дрожжевого экстракта и 1 г/л глюкозы), содержащую 50 мг/л канамицина и 50 мг/л гидромицина, инокулировали Agrobacterium, содержащей конструированные молекулы нуклеиновой кислоты, и культивировали в течение ночи при 28°C и встряхивании. Суспензию Agrobacterium добавляли на клубневые диски, культивируемые в течение 24 часов, чтобы вызвать инфицирование. Через 10 минут избыток суспензии Agrobacterium удаляли с использованием стерилизованной фильтровальной бумаги, переносили на чашку Петри, содержащую описанную выше среду, и культивировали в течение 24 часов при тех же условиях. Затем клубневые диски переносили на агаровую среду MS, содержащую 50 мг/л канамицина, 300 мг/л цефотаксима гидрохлорида, 2 мг/л зеатина и 0,1 мг/л индолуксусной кислоты, для отбора трансформантов. Регенерировавший побег далее переносили на описанную выше среду и подтверждали ее устойчивость. Побег, характеризующийся явной устойчивостью к канамицину, затем переносили на агаровую корневую среду MS, содержащую 50 мг/л канамицина и 300 мг/л цефотаксима гидрохлорида, для индукции дифференцировки корня. Верхнюю часть побега отрезали от повторно дифференцировавшегося укоренившегося растения, по меньшей мере, три раза и переносили на среду регенерации-селекции для подтверждения устойчивости к канамицину, исключая таким образом химеры. Всего 5 индивидуальных растений, полученных таким образом, акклиматизировали на почве для получения клубней.
Пример 3
Подтверждение наличия введенного гена
ДНК выделяли из 5 выбранных индивидуальных сортов, характеризовавшихся устойчивостью к канамицину, и из неинфицированных растений. ДНК экстрагировали способом Honda et al. (Honda and Hirai, Jpn. J Breed 40: 339-348, 1990). PCR-анализ проводили с экстрагированной ДНК в качестве матрицы, со специфичными для гена An-GDH праймерами 5'-TCT AGA ATG TCT AAC CTT CCC GTT GAG-3'(SEQ ID NO: 5) и 5'-GAG CTC TCA CCA CCA GTC ACC CTG GTC-3'(SEQ ID NO: 6), и праймерами для амплификации гена NPTII в вектор 5'-CCC CTC GGT ATC CAA TTA GAG-3'(SEQ ID NO: 13) и 5'-CGG GGG GTG GGC GAA GAA CTC CAG-3' (SEQ ID NO: 14). Реакцию PCR проводили с использованием системы PCR System 2400 производства PerkinElmer Co. следующим образом: 94°C - 3 мин; 94°C - 45 с, 55°C - 30 с, 72°C - 90 с, 35 циклов; 72°C - 10 мин. Продукт PCR подвергали электрофорезу в 1%-ном агарозном геле и затем с этидий-бромидом для оценки наличия или отсутствия продукта амплификации и его размера. В результате наблюдали специфичные полосы для гена An-GDH (примерно 1,5 тыс.н.п.) и гена NPTII (примерно 1,1 тыс.н.п.) в отобранных трансгенных сортах картофеля (фиг. 2), и данные полосы не наблюдали в неинфицированных растениях. В результате подтверждали, что область T-ДНК, включающая ген An-GDH, была введена в трансформированный картофель.
Пример 4
Подтверждение экспрессии введенного гена (анализ путем нозерн-блота)
Экспрессию вводимого гена подтверждали путем проведения нозерн-блот-анализа с использованием трангенного картофеля, в котором было подтверждено введение гена An-GDH.
РНК экстрагировали из клубней трансформированных сортов картофеля способом с использованием SDS-фенола. Экстрагированную ДНК подвергали электрофорезу в 1,2%-ном агарозном геле, содержащем 18% формальдегида, и затем окрашивали этидий-бромидом. После ее блоттинга на нейлоновую мембрану (Hybond N+), ее фиксировали с использованием УФ и проводили гибридизацию с зондом, содержащим полноразмерный ген An-GDH. Набор DIG-High Prime DNA Labeling and Detection Starter Kit II и набор PCR DIG Probe Synthesis Kit производства Roche Diagnostics K.K. использовали для нозерн-блота и получения зонда.
В результате, для клубней трансгенных сортов картофеля подтверждали специфичную для An-GDH полосу (фиг.3). Экспрессия введенного гена была показана в тканях листа и клубнях трансгенных сортов картофеля. Данная специфичная для An-GDH полоса не наблюдалась в нетрансформированном картофеле.
Пример 5
Экспрессия введенного гена (активность NADP-GDH)
Активность NADP-GDH определяли для подтверждения экспрессии введенного гена с использованием трансформированных сортов картофеля, в которых подтверждали введение гена An-GDH.
Измерение активности проводили способом Ameziane et al. (Plant and Soil, 221: 47-57, 2000). Ткани листа (около 0,2 г) трансгенных сортов картофеля замораживали в жидком азоте и затем растирали в ступке. К образцу добавляли буфер для экстракции {200 мМ Tris (pH 8,0), 14 мМ β-меркаптоэтанол, 10 мМ L-цистеин-HCl и 0,5 мМ PMSF} в количестве 5 объемов образца ткани. Полученную суспензию переносили в центрифужную пробирку и центрифугировали при 12000 об./мин при 4°C в течение 30 минут. Надосадочную жидкость подвергали ультрафильтрации (Millipore, фильтровальное устройство Ultrafree 0,5, Biomax-10) и промывали три раза буфером для экстракции для восстановления осадка на фильтре и получения раствора неочищенного фермента.
Активность измеряли путем добавления ранее экстрагированного неочищенного раствора фермента к раствору, содержащему 100 мМ Tris (pH 8,5), 20 мМ 2-оксоглутаровой кислоты, 10 мМ CaCl2, 0,2 мМ NADH, и 200 мМ NH4Cl, и измеряли поглощение при 340 нм. Концентрацию белка в экстрагированном растворе неочищенного фермента измеряли методом Брэдфорд с использованием в качестве стандарта бычьего сывороточного альбумина (BSA).
В результате в образце трансгенных сортов картофеля наблюдали активность, в 20-50 раз большую по сравнению с нетрансгенными сортами картофеля (таблица 1). Данную активность считали активностью вследствие экспрессии введенного гена An-GDH, поскольку в образцах из нетрансгенных сортов картофеля было мало активности NADP-GDH.
Активность NADP-GDH в трансгенном картофеле и нетрансгенном картофеле
Пример 6
Определение содержания 2-оксоглутарата (2-OG) картофеля с введенным геном GDH
Определяли содержание 2-OG в тканях листа трансгенного картофеля (Mtd 8). Картофель культивировали в течение 1 месяца в смешанной почве из 500 г Power Soil и 500 г вермикулита, с получением здоровых растущих растений и ткань листа использовали в качестве тестируемого материала. Экстракцию проводили способом Agarei et al. (Plant Science, 162: 257-265, 2002). После того как ткань листа (примерно 0,1 г) разрушали жидким азотом, к ней добавляли 200 мкл 3% HCO4 и хорошо смешивали. После центрифугирования при 12000 об./мин в течение 10 минут, надосадочную жидкость переносили в другую пробирку. К оставшемуся осадку добавляли 200 мкл 3% HCO4 и хорошо перемешивали. После центрифугирования при 12000 об./мин в течение 10 минут, надосадочную жидкость переносили в первую пробирку. Затем к полученной надосадочной жидкости добавляли от 50 мкл до 70 мкл 5 M K2CO3 для нейтрализации раствора. После подтверждения того, что pH раствора был нейтральным, с использованием лакмусовой бумаги, стерилизованную воду добавляли к раствору для доведения объема до 600 мкл, полученный в результате раствор использовали в качестве тестируемого образца. Определение содержания 2-OG проводили по модифицированному способу Usuda et al (ссылка: приведена ранее). Экстрагированный образец объемом 20 мкл добавляли к 475 мкл реакционного раствора {0,1 M Tris-HCl (pH 8,5), 1,0 мМ CaCl2, 0,2 мМ NADPH и 0,2 M NH4Cl}. После измерения поглощения при 340 нм туда добавляли 5 мкл (10 единиц) глутаматдегидрогеназы (GDH), и затем полученный в результате раствор взаимодействовал при 37°C в течение 10 минут. Поглощение при 340 нм измеряли опять и содержание 2-OG рассчитывали путем использования разницы между значением поглощения, рассчитанным после добавления раствора фермента, и тем, что было измерено до добавления раствора фермента.
В результате в трансформированном картофеле содержание 2-OG возрастало в 1,7 раза по сравнению с нетрансформированным картофелем (фиг. 4).
Пример 7
Биоанализ на гиббереллин для клубней картофеля с введенным геном GDH
Карликовый мутант риса Tanginbozu использовали в анализе. Способ анализа был основан на способе Chen et al. (Plant Cell and Environment, 24: 469-476, 2001). Лущеные неполированные рисовые семена стерилизовали путем обработки их 70% этанолом в течение 1 минуты и 2% гипохлоритом натрия в течение 15 минут с последующей трехкратной промывкой стерилизованной водой и их погружали в стерилизованную воду и инкубировали в течение 2 суток при 30°C. Пророщенные семена опять стерилизовали тем же способом. После того как 0,6% агаровые чашки добавляли в дистиллированную воду и стерилизовали путем автоклавирования, пророщенные семена помещали в тестовые пробирки диаметром 3 см, каждая из которых была заполнена 25 мл агаровой среды. Семена культивировали при 25°C в течение 5 суток при интервале дневного освещения, равном 16 часов. Выбирали только пророщенные семена, характеризующиеся синхронным ростом, и 2 мкл раствора образца раскапывали между 1-м листом и колеоптилем. После культивирования в течение дополнительных 5 суток в тех же условиях содержание гиббереллина можно определять путем измерения длины обвертки 2-го листа.
Для анализа клубни помещали на -80°C немедленно после сбора, использовали клубни через 2 месяца после сбора и через 3 месяца после сбора. Собранные клубни хранили в помещении. Все клубни разрушали с использованием жидкого азота и экстрагировали путем добавления 80% ацетона в объеме, 3-кратно превышающем сырую массу. После удаления примесей центрифугированием надосадочную жидкость сушили вымораживанием. 20% ацентон добавляли к высушенному замораживанием образцу с получением сырой массы 100 мкл/г. Для оценки специфичности гиббереллина использовали 1 мг/л даминозида, антагониста гиббереллина. Подготавливали следующие 3 группы: группу тестируемого раствора из клубней трансгенного картофеля, группу тестируемого раствора из нетрансгенных клубней картофеля и группу, в которой добавляли сходное количество даминозида к тестируемому раствору из трансгенных клубней картофеля.
В результате подтверждали, что в случае раскапывания тестируемого раствора, экстрагированного из клубней трансгенного картофеля, длина вытяжения обертки 2-го листа усиливалась по сравнению с введением того раствора, который был экстрагирован из клубней нетрансгенного картофеля. Это указывало на то, что содержание активного гиббереллина в тестируемом растворе из клубней трансгенного картофеля увеличилось по сравнению с таковым из клубней нетрансгенного картофеля. Более того, поскольку эффекты усиления вытяжения обертки 2-го листа ингибировались добавлением даминозида, вытяжение обертки 2-го листа считалось специфичным для гиббереллина эффектом (фиг.5). Кроме того, поскольку вытяжение длины обертки 2-го листа, как оказалось, усилено при повышении периода хранения картофеля, считалось, что состояние покоя будет прервано за счет постепенного возрастания активности гиббереллина в клубнях во время долгосрочного хранения.
Пример 8
Исследование прорастания трансформированного картофеля
Было исследовано прорастание из трансгенных клубней картофеля и нетрансгенных клубней картофеля через 3 месяца после сбора. Много проросших клубней обнаруживали для трансгенного картофеля (40 из 42 клубней), но для нетрансгенного картофеля проросших клубней не наблюдали (0 из 30 клубней). Более того, после световой обработки проводили обработку по проращиванию 10 клубней трансгенного картофеля и 10 клубней нетрансгенного картофеля при комнатной температуре 25°C в течение 3 суток, одну из групп переносили на почву, состоящую только из вермикулита, и другую группу, характеризующуюся тем же числом клубней держали в тех условиях, что и ранее. Затем определяли число ростков. Перенесенные клубни культивировали в теплице закрытой системы с поддержанием 24°C в течение дня и 18°C в течение ночи и каждую неделю измеряли число картофелин, характеризующихся прорастанием побегов из грунта.
В результате прорастание клубней трансгенного картофеля наблюдали через 2 недели после пересадки, и все клубни прорастали через 3 недели после пересадки в группе клубней трансгенного картофеля. В нетрансгенном картофеле, наоборот, некоторое прорастание наблюдали на 4-й неделе, но прорастание из всех клубней не наблюдали даже после 7-й недели (фиг. 6). Эти исследования подтверждали, что время прорастания клубней трансгенного картофеля было улучшено, и ростки образовывались одновременно.
Пример 9
Исследование выхода трансформированного картофеля
Исследовали урожайность с использованием клубней трансгенного картофеля и нетрансгенного картофеля. Power Soil (Kureha Chemical Industry Co.) в количестве 0,3 кг и вермикулит в количестве 1 кг добавляли в горшок №7 и в каждый горшок помещали один клубень. В данном исследовании культивировали 8 клубней трансгенного картофеля и 8 клубней нетрансгенного картофеля и измеряли сырую массу надземных частей, количество клубней и массу клубней. Во время культивирования число стеблей нормализовали, так что оно становилось по одному на клубень, и поливали только водой без дополнительных удобрений.
В результате масса надземных частей, масса клубней и число клубней трансгенного картофеля возрастало в 1,13, 1,35, и 1,24 раза, соответственно, по сравнению с данными характеристиками нетрансгенного картофеля (таблица 2).
Исследование урожая трансформированного картофеля, содержащего введенный ген GDH
ССЫЛКИ
1. Патент Канады, CA2180786.
2. Патент Китая, CN00109779.2.
3. Нерассмотренная публикация заявки на выдачу патента Японии № 2001-238556.
4. Tomokazu Koshiba and Yuji Kamiya, "Science of new plant hormone", Kodansha Ltd., 2002.
5. Vegetable horticulture great dictionary, Yokendo, 1977.
6. Tokushima Test and Research Report of Agriculture, vol. 36, pp. 7-17 (2000).
7. Minoru Yoshida, Potato encyclopedia, Rural Culture Association, 1988.
8. Plant Physiology, vol.118, pp. 773-781 (1998).
9. Plant Journal, vol. 22, pp. 247-256 (2000).




















| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ ПОЛУЧЕНИЯ РАСТЕНИЙ С УЛУЧШЕННЫМ РОСТОМ В УСЛОВИЯХ ОГРАНИЧЕНИЯ УРОВНЯ АЗОТА | 2004 |
|
RU2333245C2 |
| РАСТЕНИЯ, ХАРАКТЕРИЗУЮЩИЕСЯ ПОВЫШЕННОЙ УРОЖАЙНОСТЬЮ, И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2006 |
|
RU2463351C2 |
| ПРОДУЦИРОВАНИЕ ТРЕГАЛОЗЫ В РАСТЕНИЯХ | 1994 |
|
RU2143496C1 |
| БЕЛКИ, ИНДУЦИРУЮЩИЕ МНОЖЕСТВЕННУЮ УСТОЙЧИВОСТЬ РАСТЕНИЙ К ФИТОПАТОГЕНАМ И ВРЕДИТЕЛЯМ | 2004 |
|
RU2333220C2 |
| СПОСОБЫ УВЕЛИЧЕНИЯ УРОЖАЯ И СТРЕССОУСТОЙЧИВОСТИ У РАСТЕНИЯ | 2012 |
|
RU2632569C2 |
| МОЛЕКУЛЯРНЫЙ КОНТРОЛЬ СЕГРЕГАЦИИ ТРАНСГЕНОВ И ИХ УТЕЧКИ С ИСПОЛЬЗОВАНИЕМ СИСТЕМЫ ВОЗМЕЩАЕМОГО БЛОКИРОВАНИЯ ФУНКЦИИ | 2001 |
|
RU2270866C2 |
| ПИЩЕВЫЕ ПРОДУКТЫ С НИЗКИМ СОДЕРЖАНИЕМ АКРИЛАМИДА | 2006 |
|
RU2458133C2 |
| КАРТОФЕЛЬ С ПОВЫШЕННЫМ ВЫХОДОМ КРАХМАЛА В ПЕРЕСЧЕТЕ НА ОТДЕЛЬНОЕ РАСТЕНИЕ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2004 |
|
RU2289914C2 |
| КАРТОФЕЛЬ С ПОВЫШЕННЫМ ВЫХОДОМ КРАХМАЛА В ПЕРЕСЧЕТЕ НА ОТДЕЛЬНОЕ РАСТЕНИЕ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2006 |
|
RU2326527C2 |
| РАСТЕНИЯ С ПОВЫШЕННОЙ УРОЖАЙНОСТЬЮ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2005 |
|
RU2384621C2 |
Изобретение относится к генной инженерии растений и может быть использовано для получения растений с высокой урожайностью. В клетки растения вводят конструкцию нуклеиновой кислоты, обеспечивающую повышенную экспрессию гена GDH. Повышенная экспрессия гена GDH приводит к уменьшению периода покоя растения и однородным срокам образования у него побегов или его прорастания. 2 н. и 14 з.п. ф-лы, 7 ил., 2 табл.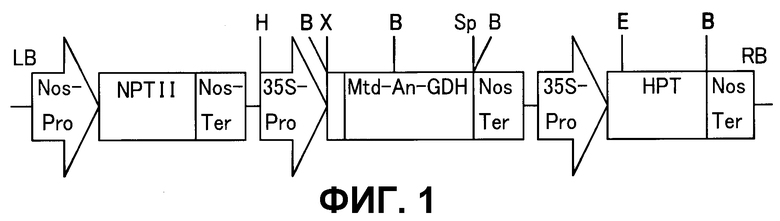
| СПОСОБ ПРОИЗВОДСТВА МЯСОРАСТИТЕЛЬНЫХ КОНСЕРВОВ | 2000 |
|
RU2180786C1 |
| JP 2001238556 А, 04.09.2001. | |||
Авторы
Даты
2007-04-27—Публикация
2005-02-17—Подача