Настоящее изобретение относится к новым соединениям циклического амина, которые оказывают ингибирующее действие как на клеточную адгезию, так и на клеточную инфильтрацию, и полезны в качестве противоастматических средств, противоаллергических средств, противоревматических средств, противоартериосклеротических средств, противовоспалительных средств, средств против синдрома Шегрена и т.п., и к лекарственным средствам, содержащим такие соединения.
Описание предшествующего уровня техники
При различных воспалительных заболеваниях наблюдается инфильтрация лейкоцитов в воспаленные участки. Например, описана инфильтрация эозинофилов в бронхи при астме (Ohkawara Y. et al., Am. J. Respir. Cell Mol. Biol., 12, 4-12 (1995)), инфильтрация макрофагов и Т-клеток в аорту при артериосклерозе (Sakai A. et al., Arterioscler. Thromb. Vasc. Biol., 17, 310-316 (1997)), инфильтрация Т-клеток и эозинофилов в кожу при атопическом дерматите (Wakita H. et al., J. Cutan. Pathol., 21, 33-39 (1994)) или контактном дерматите (Satoh T. et al., Eur. J. Immunol., 27, 85-91 (1997)), а также инфильтрация различных лейкоцитов в ревматоидную синовиальную ткань (Tak PP. et al., Clin. Immunol. Immunopathol., 77, 236-242 (1995)).
Синдром Шегрена у людей представляет собой органоспецифическое аутоиммунное заболевание, характеризующееся инфильтрацией лейкоцитов в слюнные и слезные железы, вызывающей разрушение гландулярной системы и появление таких симптомов, как сухость во рту и сухость в глазах в результате недостаточной секреции желез (Fox RI. et al. "Sjogren's syndrome: proposed criteria for classification", Arthritis Rheum., 1986, 29: 577-585).
Инфильтрация таких лейкоцитов вызвана цитокинами, хемокинами, липидами и комплементами, продуцируемыми на воспаленных участках (Albeda SM. et al., FASEB J., 8, 504-512 (1994)). Активированные лейкоциты в крови прилипают к васкулярным эндотелиальным клеткам в результате взаимодействия, называемого "вращением" или "связыванием" с эндотелиальными клетками, активированными подобным образом. Затем лейкоциты трансмигрируют через эндотелий, проникая в воспаленные участки (Springer TA., Annu. Rev. Physiol., 57, 827-872 (1995)). При адгезии лейкоцитов к васкулярным эндотелиальным клеткам во время данного процесса важную роль играют различные клеточные адгезионные молекулы, такие как надсемейство иммуноглобулинов (ICAM-1, VCAM-1 и т.п.), семейство селектинов (Е-селектин и т.п.), семейство интегринов (LFA-1, VLA-4 и т.п.) и CD44, индуцируемые на поверхности клеток в результате стимуляции цитокинами и т.п. ("Rinsho Meneki (Clinical Immune)", 30, Supple. 18 (1998)), при этом отмечается связь между нарушенным состоянием и аберрантной экспрессией молекул клеточной адгезии.
Соответственно, средство, способное ингибировать клеточную адгезию или клеточную инфильтрацию, может быть полезно в качестве средства для предотвращения и лечения аллергических заболеваний, таких как бронхиальная астма, дерматит, ринит и конъюнктивит; аутоиммунных заболеваний, таких как ревматоидный артрит, нефрит, синдром Шегрена, воспалительные заболевания кишечника, диабет и артериосклероз, а также хронических воспалительных заболеваний. Фактически, имеются сообщения о том, что антитела против молекул клеточной адгезии на лейкоцитах, таких как LFA-1, Mac-1 и VLA-4, либо антитела против ICAM-1, VCAM-1, P-селектина, Е-селектина и т.п. на васкулярных эндотелиальных клетках, которые становятся их лигандами, ингибируют инфильтрацию лейкоцитов в воспалительные участки на животных моделях. Например, нейтрализующие антитела против VCAM-1 и VLA-4, представляющие собой их считывающие рецепторы, способны замедлить развитие диабета в мышиной модели NOD, спонтанно вызывающей диабет (Michie SA. et al., Curr. Top. Microbiol. Immunol., 231, 65-83 (1998)). Было также установлено, что антитело против VLA-4 или ICAM-1 и его считывающего рецептора LFA-1 ингибирует инфильтрацию эозинофилов на модели аллергического конъюнктивита у морских свинок и мышей (Ebihara et al., Current Eye Res., 19, 20-25 (1999); Whitcup, SM. et al., Clin. Immuniol., 93, 107-113 (1999)), а моноклональное тело против VCAM-1 ингибирует инфильтрацию лейкоцитов на модели DSS-индуцированного колита у мышей, ослабляя его (Soriano A. et al., Lab. Invest., 80, 1541-1551 (2000)). Кроме того, анти-VLA-4 антитело и анти-CD44 антитело снижают частоту возникновения симптомов заболевания на модели коллаген-индуцированного артрита у мышей (Zeidler A. et al., Autoimmunity, 21, 245-252 (1995)). Даже у мышей с дефицитом молекул клеточной адгезии наблюдается ингибирование инфильтрации лейкоцитов в воспаленные ткани, подобным образом, как в моделях воспаления (Bendjelloul F. et al., Clin. Exp. Immunol., 119, 57-63 (2000); Wolyniec, WW. et al., Am. J. Respir. Cell Mol. Biol., 18, 777-785 (1998); Bullard DC. et al., J. Immunol., 157, 3153-3158 (1996)).
Однако разработка лекарственных средств на основе антител затруднительна, поскольку они представляют собой полипептиды и их пероральное введение затруднительно. Более того, проблемой также является возможное побочное действие, вызываемое антигенностью и аллергическими реакциями.
С другой стороны, проводились различные исследования низкомолекулярных соединений, оказывающих ингибирующее действие на клеточную адгезию, с целью обеспечения возможности перорального введения. Такие соединения включают производные бензотиофена (Boschelli DH. et al., J. Med. Chem., 38, 4597-4614 (1995)), производные нафталина (выложенная патентная заявка Японии № 10-147568), производные гидроксибензойной кислоты (выложенная патентная заявка Японии № 10-182550), лигнаны (выложенная патентная заявка Японии № 10-67656), производные 2-замещенных бензотиазолов (выложенная патентная заявка Японии № 2000-086641), конденсированные соединения пиразина (выложенная патентная заявка Японии № 2000-319277, поданная как РСТ), 2,6-диалкил-4-силилфенол (выложенная патентная заявка Японии № 2000-509070) и т.п. Однако в указанных случаях цель зачастую так и не была достигнута. Циклические соединения диамина, описанные в выложенных патентных заявках Японии №№ 9-143075, 11-92382 и WO 02/20477, не оказывают достаточного ингибирующего действия на клеточную адгезию, поэтому необходимо дальнейшее усиление их активности.
Целью настоящего изобретения является разработка вещества, оказывающего ингибирующее действие как на клеточную адгезию, так и на клеточную инфильтрацию, плюс сильное противоастматическое действие, противоаллергическое действие, противоревматическое действие, противоартериосклеротическое действие, противовоспалительное действие и действие против синдрома Шегрена.
Сущность изобретения
С учетом вышеизложенных обстоятельств авторы данного изобретения провели широкие исследования по разработке вещества, ингибирующего клеточную адгезию и клеточную инфильтрацию. В результате было обнаружено, что соединения, представленные общей формулой (1), имеющие фенилпиридильные или бифенильные группы на обоих концах циклического амина, обладают сильным действием по ингибированию клеточной адгезии и клеточной инфильтрации и полезны в качестве противоаллергических средств, противоастматических средств, противоревматических средств, противоартериосклеротических средств, противовоспалительных средств или средств против синдрома Шегрена.
Настоящее изобретение предусматривает соединение циклического амина, представленное следующей общей формулой (1):
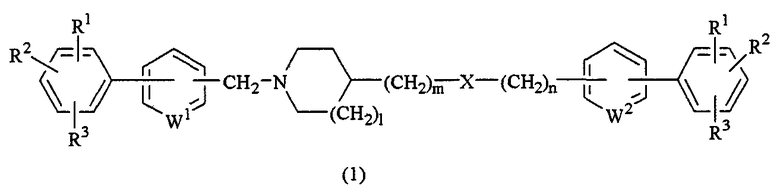
где каждый из R1, R2 и R3 независимо представляет собой атом водорода, атом галогена либо гидрокси, алкил, галогензамещенный алкил, алкокси, алкилтио, карбоксил, алкоксикарбонил или алканоил;
каждый из W1 и W2 независимо представляет собой N или СН;
Х представляет собой О, NR4, CONR4 или NR4CO;
каждый из R4 независимо представляет собой атом водорода либо алкил, алкенил, алкинил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный аралкил, замещенный или незамещенный гетероаралкил и каждый из l, m и n представляет собой число 0 или 1,
либо его кислотно-аддитивную соль или его гидрат.
В соответствии с настоящим изобретением также предусматривается лекарственное средство, содержащее в качестве активного ингредиента вышеуказанное соединение циклического амина, его кислотно-аддитивную соль или его гидрат.
В соответствии с настоящим изобретением также предусматривается фармацевтическая композиция, содержащая вышеуказанное соединение циклического амина, его кислотно-аддитивную соль или его гидрат и фармацевтически приемлемый носитель.
В соответствии с настоящим изобретением также предусматривается применение вышеуказанного соединения циклического амина, его кислотно-аддитивной соли или его гидрата для изготовления лекарственного средства.
В соответствии с настоящим изобретением также предусматривается способ лечения заболевания, вызванного клеточной адгезией и/или клеточной инфильтрацией, включающий введение эффективного количества вышеуказанного соединения циклического амина, его соли или его гидрата пациенту, нуждающемуся в таком лечении.
Предпочтительные варианты осуществления изобретения
Соединение настоящего изобретения отличается тем, что циклический амин имеет на обоих своих концах две фенилпиридильные или бифенильные группы. До настоящего времени было неизвестно, что соединения, имеющие такую структуру, оказывают сильное действие по ингибированию как клеточной адгезии, так и клеточной инфильтрации.
В общей формуле (1) атомы галогена для R1, R2 и R3 включают атомы фтора, хлора, брома и йода.
Алкильная группа для R1, R2, R3 и R4 обычно включает прямые, разветвленные или циклические С1-С8алкильные группы, такие как прямые, разветвленные или циклические С1-С8алкильные группы, например метил, этил, пропил, бутил, пентил, гексил, гептил и октильные группы, и С3-С8циклоалкильные группы, например циклопропил, циклобутил, циклопентил, циклогексил, циклогексилметил и циклогексилэтил. Среди них особенно предпочтительными являются С1-С6алкильные группы, такие как метил, этил, н-пропил, изопропил, н-бутил и т.п.
Галогензамещенная алкильная группа для R1, R2 и R3 обычно включает С1-С8алкильные группы, замещенные 1-3 атомами галогена. Среди них особенно предпочтительными являются С1-С6алкильные группы, замещенные 1-3 атомами галогена, такие как трифторметил, 2,2,2-трифторэтил и т.д.
Алкоксигруппа обычно включает прямые, разветвленные или циклические С1-С8алкоксигруппы, такие как прямые, разветвленные или циклические С1-С8алкоксигруппы, например метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, втор-бутокси, трет-бутокси, пентилокси и гексилоксигруппы, а также С3-С8циклоалкилоксигруппы, например циклопропилокси, циклобутилокси, циклопентилокси, циклогексилокси, циклогексилметилокси и циклогексилэтилоксигруппы. Среди них особенно предпочтительными являются С1-С6алкоксигруппы, такие как метокси, этокси, н-пропокси, изопропокси и н-бутилоксигруппы.
Алкилтиогруппа обычно включает С1-С8алкилтиогруппы и предпочтительно представляет собой С1-С6алкилтиогруппу, такую как, например, метилтио, этилтио, н-пропилтио, изопропилтио и т.п.
Алкоксикарбонильная группа обычно включает С1-С6алкоксикарбонильные группы и предпочтительно представляет собой С1-С4алкоксикарбонильную группу, такую как метоксикарбонил, этоксикарбонил, трет-бутоксикарбонил и т.п.
Алканоильная группа обычно включает С1-С6алканоильные группы и предпочтительно представляет собой С1-С4алканоильную группу, такую как ацетил, пропионил, бутирил, изобутирил и т.п.
Алкенильная группа для R4 обычно включает С3-С8алкенильные группы и предпочтительно представляет собой С3-С6алкенильную группу, такую как 2-пропенил, 3-бутенил и т.п. Алкинильная группа обычно включает С3-С8алкинильные группы и предпочтительно представляет собой С3-С6алкинильную группу, такую как 2-пропинил, 3-бутинил и т.п.
Арильная группа для R4 обычно включает С6-С14арильные группы и предпочтительно представляет собой фенил, нафтил, антрил, инденил, инданил, 5,6,7,8-тетрагидронафтил и т.п.
Гетероарильная группа для R4 обычно включает гетероарильные группы с 5- или 6-членным кольцом, содержащие 1-4 атома азота в кольце, и предпочтительно представляет собой имидазолил, пиридил, пиримидинил и т.п.
Аралкильная группа обычно включает С6-С14арилС1-С6алкильные группы, такие как фенил С1-С6алкильные группы и нафтилС1-С6алкильные группы, например бензил, нафтилметил, фенилэтил, фенилпропил и т.д. Гетероаралкильная группа для R4 обычно включает гетероарилС1-С6алкильные группы с 5- или 6-членным кольцом, содержащим 1-4 атома азота кольца, такие как имидазолил-С1-С6алкил, пиридилС1-С6алкил, пиримидинилС1-С6алкил и т.д.
Группы, которые могут замещать вышеуказанные арил, гетероарил, аралкил или гетероаралкил, включают 1-3 группы или атома, выбранных из алкила, алкокси, галогензамещенного алкокси, алкилтио, алкилсульфинила, алкилсульфонила, галогена, нитро, амино, ацетиламино, трифторметила и алкилендиокси, где указанные алкил, алкокси и алкилтио включают значения, проиллюстрированные для R1˜R3. Алкильная группа, содержащаяся в алкилсульфинильных и алкилсульфонильных группах, включает С1-С3алкильные группы, такие как метил, этил, н-пропил и изопропильные группы. Галогензамещенный алкокси включает С1-С8алкоксигруппы, замещенные 1-3 атомами галогена, и предпочтительно представляет собой С1-С4алкоксигруппу, замещенную 1-3 атомами галогена, такую как трифторметокси или 2,2,2-трифторэтокси. Алкилендиоксигруппа обычно включает С1-С3алкилендиоксигруппы, такие как метилендиокси, этилендиокси и пропилендиоксигруппы.
Х предпочтительно представляет собой NR4. Более предпочтительно Х представляет собой NR4, где R4 представляет собой замещенную или незамещенную С6-С14арильную группу или замещенную или незамещенную гетероарильную группу с 5- или 6-членным кольцом, содержащую 1-4 атома азота в кольце. Как показано ниже в примере испытаний 1, соединения формулы (1), в которой Х представляет собой NR4, оказывают особенно сильное действие по ингибированию клеточной адгезии.
R1, R2 и R3 предпочтительно присоединены к фенильной группе в положениях 3, 4 и 5. В данном случае особенно предпочтительно, чтобы R1 и R3 (в положениях 3 и 5 фенильного кольца) представляли собой алкоксигруппу или галоген. Также предпочтительно, чтобы R2 (в положении 4 фенильного кольца) представлял собой атом водорода, атом галогена либо гидрокси, алкил, галогензамещенный алкил, алкокси, алкилтио, карбокси, алкоксикарбонил или алканоил.
l означает 0 или 1, предпочтительно 1.
W1 предпочтительно представляет собой N.
W2 предпочтительно представляет собой N.
Предпочтительные соединения включают соединения формулы (1), в которой Х представляет собой NR4, где R4 представляет замещенную или незамещенную С6-С14арильную группу либо замещенную или незамещенную гетероарильную группу с 5- или 6-членным кольцом, содержащую 1-4 атома азота в кольце. Особенно предпочтительно R4 представляет фенильную или пиридильную группу, которая может быть замещена одной или двумя группами либо одним или двумя атомами, выбранными из галогена, алкила, алкокси, алкилтио, трифторметила и алкилендиокси.
Кислотно-аддитивные соли соединений (1) в соответствии с данным изобретением не имеют особых ограничений, при условии, что они представляют собой фармацевтически приемлемые соли. Примеры таких солей включают кислотно-аддитивные соли минеральных кислот, такие как гидрохлориды, гидробромиды, гидройодиды, сульфаты и фосфаты, а также кислотно-аддитивные соли органических кислот, такие как бензоаты, метансульфонаты, этансульфонаты, бензолсульфонаты, п-толуолсульфонаты, оксалаты, малеаты, фумараты, тартраты, цитраты и ацетаты.
Соединения формулы (1) могут присутствовать в виде сольватов, примером которых являются гидраты, при этом такие сольваты входят в объем настоящего изобретения.
Соединения формулы (1) могут быть получены в соответствии со следующими способами А˜L.
Способ А: получение соединения формулы (1), в которой l=1, m=0, n=1 и Х=CONR4
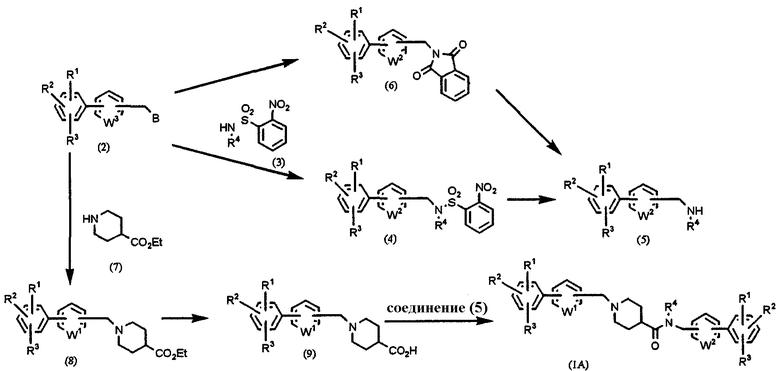
где W1, W2, R1, R2, R3 и R4 имеют значения, указанные выше, W3 имеет такие же значения, как W1 или W2, и В означает удаляемую группу, такую как атом галогена, либо метансульфонилокси или п-толуолсульфонилоксигруппа.
Соединение (2) и производное N-(2-нитробензолсульфониламина (3) подвергают взаимодействию, получая соединение (4). Полученное соединение (4) обрабатывают тиофенолом в присутствии основания, такого как карбонат калия, для удаления 2-нитробензолсульфонильной группы, получая в результате соединение амина (5). Альтернативно, если R4 представляет собой Н, то соединение (2) может быть подвергнуто взаимодействию с фталимидом калия и затем полученное производное фталимида (6) может быть подвергнуто обработке гидразином с получением соответствующего соединения амина (5).
С другой стороны, соединение (2) подвергают взаимодействию с этилизонипекотатом (7) в растворителе, таком как ацетонитрил, N,N-диметилформамид (ДМФА), диметилсульфоксид (ДМСО), тетрагидрофуран (ТГФ), диоксан, толуол, бензол и т.д., в присутствии основания, такого как карбонат калия и т.п., при температуре от 0°С до температуры образования флегмы в течение периода времени от нескольких часов до нескольких дней, предпочтительно при комнатной температуре в течение ночи, получая соединение (8). Соединение (8) подвергают обычному щелочному гидролизу с получением соответствующего соединения карбоновой кислоты (9).
Соединение карбоновой кислоты (9) подвергают взаимодействию с соединением амина (5), используя дегидратирующий конденсирующий агент, такой как гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (растворимый в воде карбодиимид), гексафторфосфат 2-(1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония (HBTU) и т.п., в растворителе, таком как хлороформ, дихлорэтан, ТГФ, диоксан, ацетонитрил и т.д., при температуре от 0°С до температуры образования флегмы в течение периода времени от нескольких часов до нескольких дней, предпочтительно при комнатной температуре в течение 12 часов, получая конечный продукт (1А).
Способ В: получение соединения формулы (1), в которой l=1, m=0, n=1, и Х=O
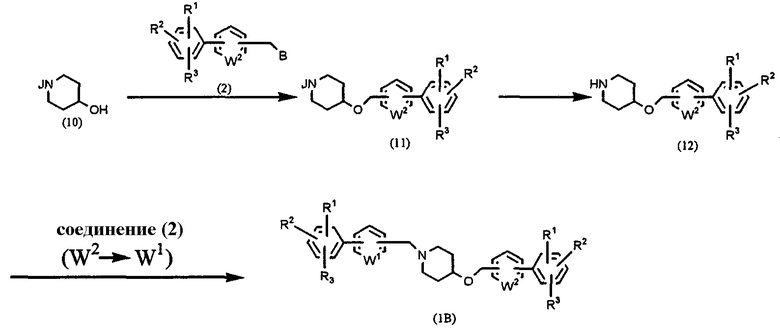
где В, W1, W2, R1, R2 и R3 имеют значения, указанные выше, и J означает защитную группу, такую как бензилоксикарбонил, трет-бутоксикарбонил, ацетил, бензоил или бензил.
Между прочим, в реакционных схемах, представленных выше и ниже, выражение "(W2→W1)" означает, что W2 в формуле, представляющей соединение (2), заменено W1. То же самое касается реакционных схем, представленных ниже.
Соединение 4-гидроксипиперидина (10) с защищенной аминогруппой подвергают взаимодействию с соединением (2) в присутствии гидрида натрия или йодида калия в растворителе, таком как ДМФА, ДМСО и т.д., при температуре от 0°С до температуры образования флегмы в течение периода времени от нескольких часов до нескольких дней, предпочтительно при комнатной температуре в течение 2 дней, получая соединение (11). Защитную группу в соединении (11) удаляют известным способом. Полученное соединение (12) подвергают взаимодействию с соединением (2) в присутствии основания, такого как карбонат калия, в растворителе, таком как ацетонитрил, ДМФА, ДМСО, ТГФ, диоксан и т.д., при температуре от 0°С до температуры образования флегмы в течение периода времени от нескольких часов до нескольких дней, предпочтительно при комнатной температуре в течение 4 часов, получая конечный продукт (1В).
Способ С: получение соединения формулы (1), в которой l=1, m=0, n=0, Х=NR4CO, где R4=Н или Ме
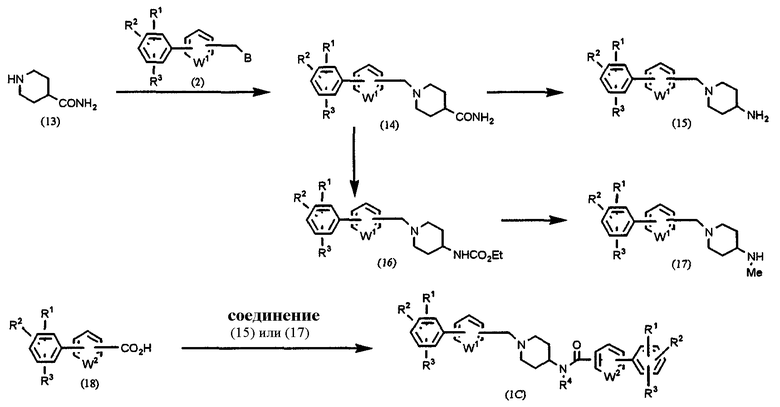
где В, W1, W2, R1, R2 и R3 имеют значения, указанные выше, и R4 означает атом водорода или метил.
Изонипекотамид (13) подвергают взаимодействию с соединением (2) в присутствии основания, такого как карбонат калия, карбонат натрия и т.п., в растворителе, таком как ацетонитрил, ДМФА, ДМСО, ТГФ, диоксан и т.д., при температуре от 0°С до температуры образования флегмы в течение периода времени от нескольких часов до нескольких дней, предпочтительно при комнатной температуре в течение 4 часов, получая соединение (14). Соединение (14) подвергают реакции перегруппировки Хофмана, получая соединение амина (15).
С другой стороны, подвергая соединение (14) реакции перегруппировки Хофмана в этаноле, получают соединение карбамата (16). Затем, подвергая соединение (16) реакции восстановления с использованием литийалюминийгидрида, получают соединение метиламина (17).
В результате взаимодействия соединения карбоновой кислоты (18) с соединением амина (15) или соединением метиламина (17) подобно реакции конденсации в Способе А получают конечное соединение (1С).
Способ D: получение соединения формулы (1), в которой l=1, m=0, n=1 и Х=NR4
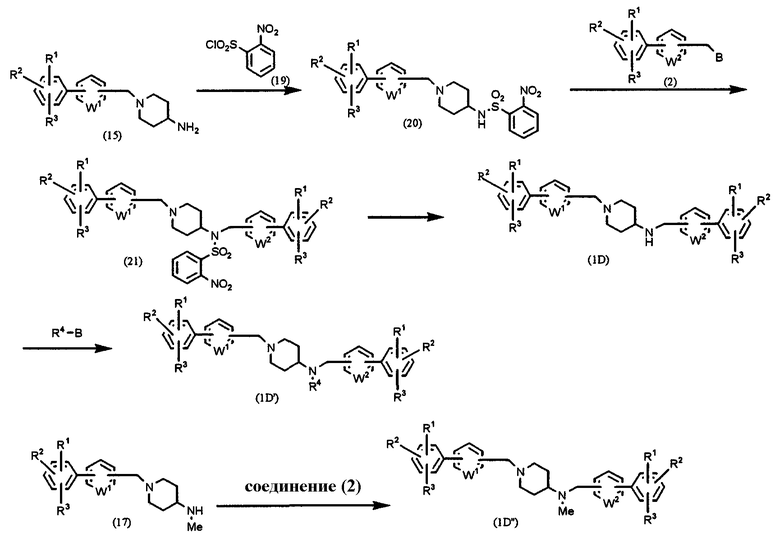
где В, W1, W2, R1, R2 и R3 имеют значения, указанные выше и R4 означает алкил, алкенил, алкинил, аралкил или гетероаралкил.
Приведенное выше соединение амина (15) подвергают взаимодействию с 2-нитробензолсульфонилхлоридом (19) в соответствии с известным способом, получая соединение (20). Соединение (20) подвергают взаимодействию с соединением (2) в присутствии основания, такого как карбонат калия, в растворителе, таком как ацетонитрил, ДМФА, ДМСО, ТГФ, диоксан и т.д., при температуре от 0°С до температуры образования флегмы в течение периода времени от нескольких часов до нескольких дней, предпочтительно при комнатной температуре в течение 4 часов, получая соединение (21). Бензолсульфонильную группу соединения (21) удаляют согласно методике, применяемой для соединения (4) в Способе А, получая конечное соединение (1D) (R4=H). Соединение (1D) подвергают взаимодействию с R4-B в присутствии основания, такого как карбонат натрия, бикарбонат натрия, карбонат калия, карбонат цезия и т.п., в растворителе, таком как ацетонитрил, ТГФ, диоксан, хлороформ, дихлорметан, ДМФА, ДМСО и т.д., при температуре от 0°С до температуры образования флегмы в течение периода времени от нескольких часов до нескольких дней, предпочтительно при 80°С в течение 12 часов, получая соединение (1D').
С другой стороны, соединение метиламина (17) подвергают взаимодействию с соединением (2) в присутствии основания, такого как карбонат калия, в растворителе, таком как ацетонитрил, ДМФА, ДМСО, ТГФ, диоксан и т.д., при температуре от 0°С до температуры образования флегмы в течение периода времени от нескольких часов до нескольких дней, предпочтительно при комнатной температуре в течение 4 часов, получая соединение (1D") (R4=Me).
Способ Е: получение соединения формулы (1), в которой l=1, m=0 или 1, n=1 и Х=NR4
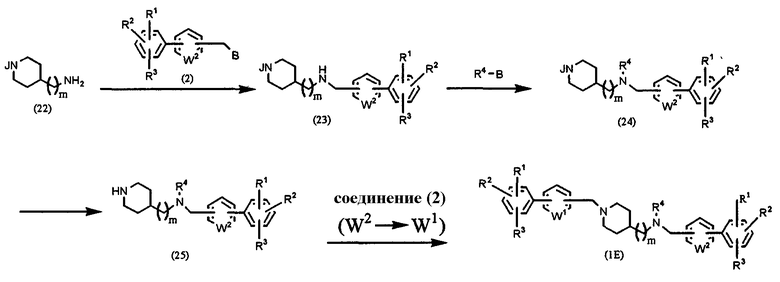
где В, J, W1, W2, R1, R2 и R3 имеют значения, указанные выше, и R4 означает алкил, алкенил, алкинил, аралкил или гетероаралкил.
Производное аминопиперидина формулы (22), в которой аминогруппа в кольце защищена, подвергают взаимодействию с соединением (2) в присутствии основания, такого как карбонат калия, в растворителе, таком как ацетонитрил, ДМФА, ДМСО, ТГФ, диоксан и т.д., при температуре от 0°С до температуры образования флегмы в течение периода времени от нескольких часов до нескольких дней, предпочтительно при комнатной температуре в течение 4 часов, получая соединение (23). Соединение (23) подвергают взаимодействию с R4-B в присутствии основания, такого как карбонат натрия, бикарбонат натрия, карбонат калия, карбонат цезия и т.п., в растворителе, таком как ацетонитрил, ТГФ, диоксан, хлороформ, дихлорэтан, ДМФА, ДМСО и т.д., при температуре от 0°С до температуры образования флегмы в течение периода времени от нескольких часов до нескольких дней, предпочтительно при 80°С в течение 12 часов, получая соединение (24). После удаления защитной группы в соединении (24) полученное соединение подвергают взаимодействию с соединением (2) в присутствии основания, такого как карбонат калия, в растворителе, таком как ацетонитрил, ДМФА, ДМСО, ТГФ, диоксан и т.д., при температуре от 0°С до температуры образования флегмы в течение периода времени от нескольких часов до нескольких дней, предпочтительно при комнатной температуре в течение 4 часов, получая соединение (1Е).
Способ F: получение соединения формулы (1), в которой l=1, m=0, n=1 и Х=NR4
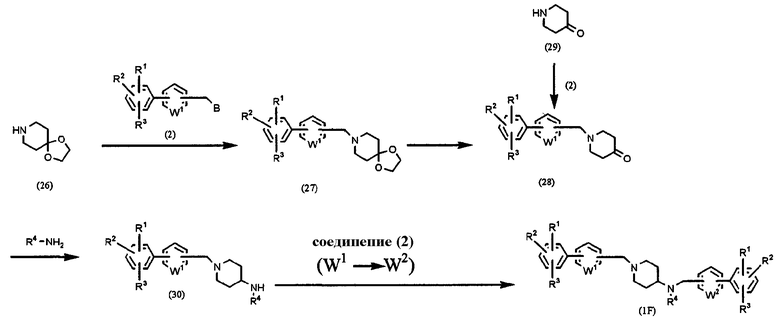
где В, J, W1, W2, R1, R2 и R3 имеют значения, указанные выше, и R4 означает алкил, алкенил, алкинил, аралкил, гетероаралкил, арил или гетероарил.
4-Пиперидонэтиленкеталь (26) подвергают взаимодействию с соединением (2) в присутствии основания, такого как карбонат калия, в растворителе, таком как ацетонитрил, ДМФА, ДМСО, ТГФ, диоксан и т.д., при температуре от 0°С до температуры образования флегмы в течение периода времени от нескольких часов до нескольких дней, предпочтительно при комнатной температуре в течение 4 часов, получая соединение (27), которое, в свою очередь, подвергают декетализации, используя кислоту, с получением соединения кетона (28).
С другой стороны, 4-пиперидон (29) подвергают взаимодействию с соединением (2) в присутствии основания, такого как карбонат калия, в растворителе, таком как ацетонитрил, ДМФА, ДМСО, ТГФ, диоксан и т.п., при температуре от 0°С до температуры образования флегмы в течение периода времени от нескольких часов до нескольких дней, предпочтительно при комнатной температуре в течение 4 часов, получая соединение (28). В результате применения соединения (28) в соответствии с любым из следующих двух способов синтеза может быть получено соединение амина (30).
Способ синтеза 1: Соединение (28) подвергают взаимодействию с соединением амина формулы R4-NH2 в присутствии молекулярных сит в толуоле или бензоле при температуре от 0°С до температуры образования флегмы в течение периода времени от нескольких часов до нескольких дней, предпочтительно при температуре образования флегмы в течение 12 часов, с последующим взаимодействием с восстановителем, таким как борогидрид натрия или цианборогидрид натрия, при температуре от 0°С до температуры образования флегмы в течение периода времени от нескольких минут до нескольких дней, предпочтительно при комнатной температуре в течение 1 часа, с получением соединения амина (30).
Способ синтеза 2: Соединение (28) подвергают взаимодействию с соединением амина формулы R4-NH2 в присутствии восстановителя, такого как триацетоксиборогидрид натрия, в растворителе, таком как дихлорметан, 1,2-дихлорэтан, метанол, этанол и т.д., при температуре от 0°С до температуры образования флегмы в течение периода времени от нескольких минут до нескольких дней, предпочтительно при комнатной температуре в течение 4 часов, для получения соединения амина (30).
Полученное соединение (30) подвергают взаимодействию с соединением (2) в растворителе, таком как ацетонитрил, ДМФА, ДМСО, ТГФ, диоксан и т.д., при температуре от 0°С до температуры образования флегмы в течение периода времени от нескольких часов до нескольких дней, предпочтительно при комнатной температуре в течение 4 часов, для получения конечного продукта (IF).
Способ G: получение соединения формулы (1), в которой l=1, m=0, n=1 и Х=NR4
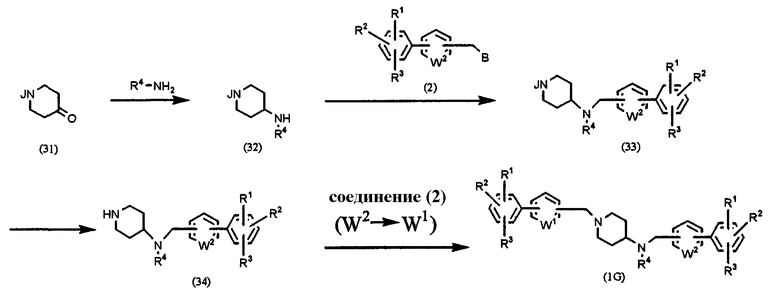
где В, J, W1, W2, R1, R2 и R3 имеют значения, указанные выше, и R4 означает алкил, алкенил, алкинил, аралкил, гетероаралкил, арил или гетероарил.
Производное 4-пиперидона формулы (31), в которой аминогруппа защищена, подвергают взаимодействию с соединением амина R4-NH2, аналогично методике получения соединения (30) Способа F, для получения соединения (32). Соединение (32) подвергают взаимодействию с соединением (2) в присутствии основания, такого как карбонат калия, в растворителе, таком как ацетонитрил, ДМФА, ДМСО, ТГФ, диоксан и т.д., при температуре от 0°С до температуры образования флегмы в течение периода времени от нескольких часов до нескольких дней, предпочтительно при комнатной температуре в течение 4 часов, получая соединение (33). После удаления защитной группы из соединения (33) полученное соединение (34) подвергают взаимодействию с соединением (2) в присутствии основания, такого как карбонат калия, в растворителе, таком как ацетонитрил, ДМФА, ДМСО, ТГФ, диоксан и т.п., при температуре от 0°С до температуры образования флегмы в течение периода времени от нескольких часов до нескольких дней, предпочтительно при комнатной температуре в течение 4 часов, получая конечный продукт (1G).
Способ Н: получение соединения формулы (1), в которой l=0, m=0, n=1 и Х=NH
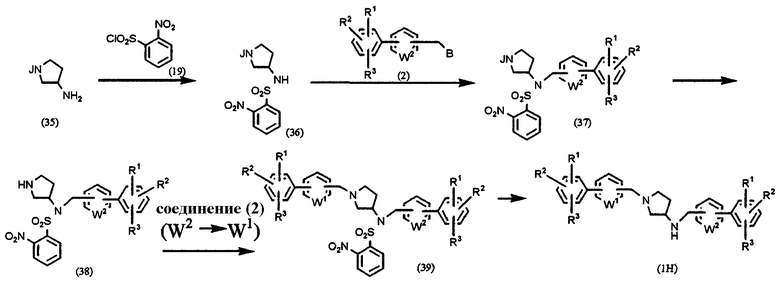
где В, J, W1, W2, R1, R2 и R3 имеют значения, указанные выше.
Производное 3-аминопирролидина (35) с защищенной аминогруппой в кольце подвергают взаимодействию с 2-нитробензолсульфонилхлоридом (19) в обычных условиях, получая производное бензолсульфонила (36). Производное (36) подвергают взаимодействию с соединением (2) в присутствии основания, такого как карбонат калия, в растворителе, таком как ацетонитрил, ДМФА, ДМСО, ТГФ, диоксан и т.д., при температуре от 0°С до температуры образования флегмы в течение периода времени от нескольких часов до нескольких дней, предпочтительно при комнатной температуре в течение 4 часов, получая соединение (37). Защитную группу аминогруппы удаляют из соединения (37), получая соединение (38), которое, в свою очередь, подвергают взаимодействию с соединением (2) в присутствии основания, такого как карбонат калия, в растворителе, таком как ацетонитрил, ДМФА, ДМСО, ТГФ, диоксан и т.п., при температуре от 0°С до температуры образования флегмы в течение периода времени от нескольких часов до нескольких дней, предпочтительно при комнатной температуре в течение 4 часов, с получением соединения (39). Подвергая соединение (39) взаимодействию, подобно получению соединения (5), описанному в Способе А, получают конечный продукт (1Н).
Способ I: получение соединения формулы (1), в которой l=0, m=0, n=1 и Х=NR4
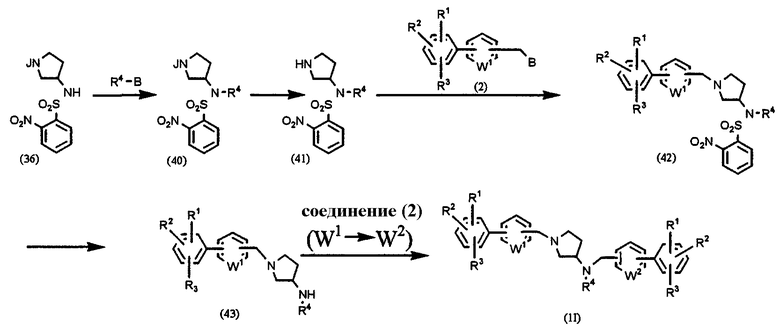
где В, J, W1, W2, R1, R2 и R3 имеют значения, указанные выше, и R4 означает алкил, алкенил, алкинил или аралкил.
Соединение (36) подвергают взаимодействию с R4-В в присутствии основания, такого как карбонат натрия, карбонат калия и т.д., в растворителе, таком как ацетонитрил, ТГФ, диоксан, хлороформ, дихлорэтан, ДМФА, ДМСО и т.д., при температуре от 0°С до температуры образования флегмы в течение периода времени от нескольких часов до нескольких дней, предпочтительно при 80°С в течение 12 часов, получая соединение (40). Аминозащитную группу удаляют из соединения (40) и полученное соединение (41) подвергают взаимодействию с соединением (2) в присутствии основания, такого как карбонат калия, в растворителе, таком как ацетонитрил, ДМФА, ДМСО, ТГФ, диоксан и т.п., при температуре от 0°С до температуры образования флегмы в течение периода времени от нескольких часов до нескольких дней, предпочтительно при комнатной температуре в течение 4 часов, получая конечный продукт (42). Подвергая соединение (42) взаимодействию, подобно получению соединения (5), описанному в Способе А, получают соединение (43). Соединение (43) подвергают взаимодействию с соединением (2) в присутствии основания, такого как карбонат калия, в растворителе, таком как ацетонитрил, ДМФА, ДМСО, ТГФ, диоксан и т.д., при температуре от 0°С до температуры образования флегмы в течение периода времени от нескольких часов до нескольких дней, предпочтительно при комнатной температуре в течение 4 часов для получения конечного продукта (1I).
Способ J: получение соединения формулы (1), в которой R2=ОН
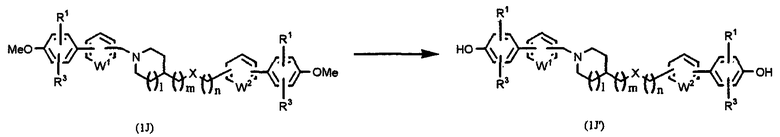
где Х, W1, W2, R1, R3, l, m и n имеют значения, указанные выше.
В результате взаимодействия метоксисоединения (1J) с иодтриметилсиланом в растворителе, таком как толуол, хлороформ, дихлорметан и т.д., при температуре от -25°С до температуры образования флегмы в течение периода времени от нескольких часов до нескольких дней, предпочтительно при 0°С в течение 2 часов, может быть получен конечный продукт (1J').
Способ К: получение соединения формулы (1), в которой l=1, m=0, n=0 и Х=NR4СО
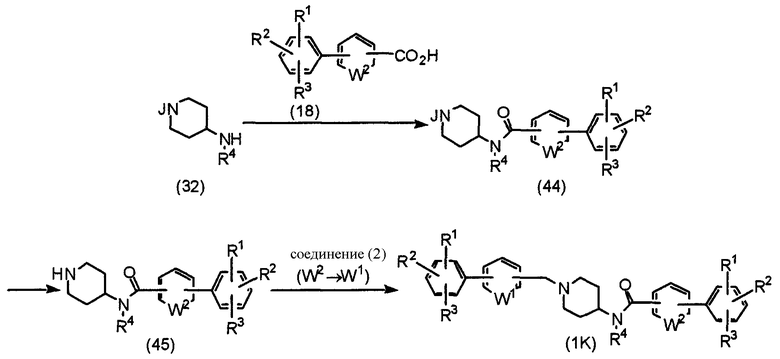
где В, J, W1, W2, R1, R2 и R3 имеют значения, указанные выше, и R4 означает алкил, алкенил, алкинил, аралкил, гетероаралкил, арил или гетероарил.
Соединение (32), описанное в Способе G, подвергают взаимодействию с соединением (18) в соответствии с методикой получения соединения (1А), описанной в Способе А, для получения соединения (44). После удаления защитной группы из соединения (44) полученное соединение (45) подвергают взаимодействию с соединением (2) в присутствии основания, такого как карбонат калия, в растворителе, таком как ацетонитрил, ДМФА, ДМСО, ТГФ, диоксан и т.д., при температуре от 0°С до температуры образования флегмы в течение периода времени от нескольких часов до нескольких дней, предпочтительно при комнатной температуре в течение 4 часов, получая конечный продукт (1К).
Способ L: получение соединения формулы (1), в которой l=1, m=0, n=1 и Х=алкилсульфонилфениламиногруппа
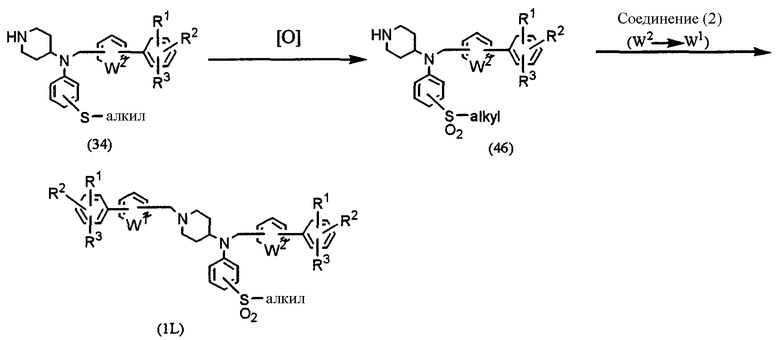
где В, W1, W2, R1, R2 и R3 имеют значения, указанные выше.
Соединение (34), синтезированное в соответствии со Способом G, в котором Х представляет собой алкилтиофениламиногруппу, подвергают взаимодействию с окислителем, таким как 3-хлорпербензойная кислота, перуксусная кислота или перекись водорода, в соответствии с известным способом, с получением производного алкилсульфоксида (46). Соединение (46) подвергают взаимодействию с соединением (2) в присутствии основания, такого как карбонат калия, в растворителе, таком как ацетонитрил, ДМФА, ДМСО, ТГФ или диоксан, при температуре от 0°С до температуры образования флегмы в течение периода времени от нескольких часов до нескольких дней, предпочтительно при 70°С на протяжении ночи, получая конечный продукт (1L).
Соединения (1) в соответствии с настоящим изобретением могут быть получены любым из описанных выше способов и при необходимости подвергнуты дополнительной очистке с использованием обычных способов очистки, таких как перекристаллизация или колоночная хроматография. При необходимости полученные соединения также могут быть превращены в нужные соли или сольваты способом, известным в данной области техники per se.
В том случае, когда соединения (1) включают асимметричный атом углерода, настоящее изобретение включает любые конфигурации изомеров.
Соединения (1) в соответствии с настоящим изобретением, полученные таким образом, либо их соли или сольваты, как описано ниже в примере испытания 1, оказывают сильное ингибирующее действие на клеточную адгезию и полезны в качестве лекарственных средств для лечения и профилактики заболеваний животных, включая людей, вызываемых клеточной адгезией или клеточной инфильтрацией, например астмы, аллергии, ревматизма, артериосклероза, воспаления, синдрома Шегрена и т.д.
Лекарственное средство в соответствии с настоящим изобретением включает соединение (1), его соль или его сольват в качестве активного ингредиента. Форма введения может быть при необходимости соответствующим образом выбрана для предполагаемого терапевтического назначения без каких-либо конкретных ограничений, включая препараты для перорального введения, инъекции, суппозитории, мази, лекарственные формы для ингаляции, глазные капли, капли в нос и пластыри. Композиция, подходящая для применения в указанных формах введения, может быть получена смешиванием фармацевтически приемлемого носителя в соответствии с традиционным способом получения, хорошо известным специалистам в данной области техники.
При получении твердого препарата для перорального введения к соединению (1) добавляют эксципиент и необязательно связующее, дезинтегратор, лубрикант, краситель, вкусовое вещество, ароматизирующее вещество и т.п., при этом полученная композиция может быть составлена в виде таблеток, гранул, порошков, капсул и т.д. в соответствии со способами, известными в данной области техники. В качестве описанных выше добавок могут быть использованы любые добавки, обычно используемые в фармакологической области. Примеры включают эксципиенты, такие как лактоза, сахароза, хлорид натрия, глюкоза, крахмал, карбонат кальция, каолин, микрокристаллическая целлюлоза и кремниевая кислота; связующие, такие как вода, этанол, пропанол, простой сироп, раствор глюкозы, раствор крахмала, раствор желатина, карбоксиметилцеллюлоза, гидроксипропилцеллюлоза, гидроксипропиловый крахмал, метилцеллюлоза, этилцеллюлоза, шеллак, фосфат кальция и поливинилпирролидон; дезинтеграторы, такие как сухой крахмал, альгинат натрия, порошок агара, гидрокарбонат натрия, карбонат кальция, лаурилсульфат натрия, моноглицерилстеарат и лактоза; лубриканты, такие как очищенный тальк, соли стеариновой кислоты, тетраборат натрия и полиэтиленгликоль, а также вкусовые вещества, такие как сахароза, кожура апельсинов, лимонная кислота и винная кислота.
При получении жидкого препарата для перорального введения к соединению (1) добавляют вкусовое вещество, буфер, стабилизатор, ароматизирующее вещество и/или т.п., при этом полученная композиция может быть приготовлена в виде жидких препаратов для внутреннего применения, сиропов, эликсиров и т.д. в соответствии со способами, известными в данной области техники. В данном случае ванилин может быть использован в качестве вкусового вещества в соответствии с приведенным выше описанием. В качестве буфера может быть приведен цитрат натрия. В качестве примеров стабилизатора могут быть приведены трагакант, гуммиарабик и желатин.
При получении раствора для инъекции к соединению (1) в соответствии с настоящим изобретением могут быть добавлены регулятор рН, буфер, стабилизатор, изотонический агент, местный анестетик и т.п., при этом полученная композиция может быть приготовлена в виде растворов для подкожных, внутримышечных и внутривенных инъекций в соответствии со способами, известными в данной области техники. Примеры регулятора рН и буфера в данном случае включают цитрат натрия, ацетат натрия и фосфат натрия. Примеры стабилизатора включают пиросульфит натрия, ЭДТА, тиогликолевую кислоту и тиомолочную кислоту. Примеры местного анестетика включают прокаингидрохлорид и лидокаингидрохлорид. Примеры изотонического агента включают хлорид натрия и глюкозу.
При получении суппозитория к соединению (1) добавляют соответствующий носитель, известный в данной области техники, например полиэтиленгликоль, ланолин, масло какао, триглицерид жирной кислоты и т.п., и необязательно поверхностно-активное вещество, такое как "Твин" (зарегистрированный товарный знак) и т.п., при этом полученная композиция может быть приготовлена в виде суппозиториев в соответствии со способами, известными в данной области техники.
При получении мази обычно применяемые материал основы, стабилизатор, увлажняющее средство, консервант и т.п. смешивают с соединением (1) соответствующим образом и полученную смесь перемешивают и приготавливают в виде мазей в соответствии с известным способом. Примеры материала основы включают жидкий парафин, белый вазелин, отбеленный пчелиный воск, октилдодециловый спирт и парафин. Примеры консервантов включают метил-п-гидроксибензоат, этил-п-гидроксибензоат и пропил-п-гидроксибензоат.
Помимо вышеуказанных препаратов, лекарственные формы для ингаляции, глазные капли и капли для носа также могут быть приготовлены в соответствии с известными способами.
Доза лекарственного средства в соответствии с настоящим изобретением варьируется в соответствии с возрастом, массой и состоянием подвергаемого лечению пациента, способом введения, числом введений и т.п. Однако в целом предпочтительно пероральное или парентеральное введение данного лекарственного средства за один или несколько раз в дозе от 1 до 1000 мг в сутки соединения (1) для взрослого человека.
Примеры
Далее следует более подробное описание настоящего изобретения при помощи примеров. Однако настоящее изобретение не ограничено указанными примерами.
Пример получения 1
Синтез этил-2-(3,4,5-триметоксифенил)изоникотината
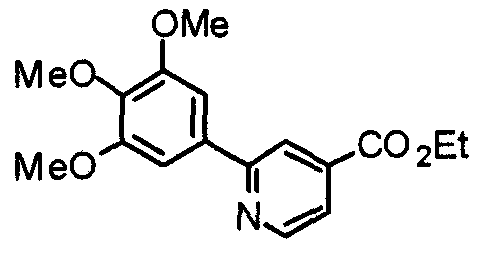
3,4,5-Триметоксифенилбороновую кислоту (20,10 г) и этил-2-хлоризоникотинат (18,56 г) суспендируют в смешанном растворителе из толуола (200 мл) и ТГФ (100 мл) и к суспензии добавляют 2 М карбонат натрия (200 мл) и тетракис(трифенилфосфин)палладий(0) (5,78 г). Смесь перемешивают при 90°С в течение ночи в атмосфере аргона. С целью экстрагирования к реакционной смеси добавляют этилацетат и органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле, используя смесь гексан/этилацетат (5:1), с получением указанного в заголовке соединения.
Выход 27,99 г (88%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,45 (т, 3H, J=7,0 Гц), 3,92 (с, 3H), 3,99 (с, 6H), 4,46 (кв, 2H, J=7,0 Гц), 7,30 (с, 2H), 7,76 (дд, 1H, J=5,1 Гц, 1,6 Гц), 8,24 (дд, 1H, J=1,6 Гц, 0,8 Гц), 8,81 (дд, 1H, J=5,1 Гц, 0,8 Гц).
Пример получения 2
Синтез 4-гидроксиметил-2-(3,4,5-триметоксифенил)пиридина
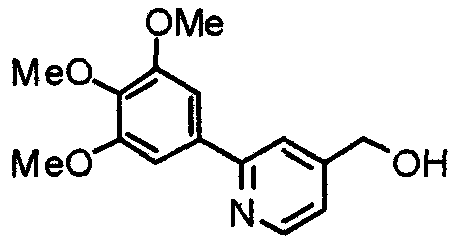
Этил-2-(3,4,5-триметоксифенил)изоникотинат (24,57 г) растворяют в сухом ТГФ (200 мл) и к раствору добавляют литийалюминийгидрид (2,94 г) при 0°С в атмосфере аргона. В таком состоянии смесь перемешивают при 0°С в течение часа. К реакционной смеси добавляют небольшое количество воды и затем сульфата натрия, после чего нерастворимые вещества отфильтровывают через целит. Фильтрат концентрируют при пониженном давлении и полученные необработанные кристаллы перекристаллизовывают из смеси этилацетат/гексан, получая указанное в заголовке соединение.
Выход 17,53 г (82%).
1H-ЯМР (400 МГц, CDCl3) δ: 3,90 (с, 3H), 3,95 (с, 6H), 4,79 (с, 2H), 7,19 (д, 1H, J=5,1 Гц), 7,21 (с, 2H), 7,66 (с, 1H), 8,60 (д, 1H, J=5,1 Гц).
Пример получения 3
Синтез 4-хлорметил-2-(3,4,5-триметоксифенил)пиридина
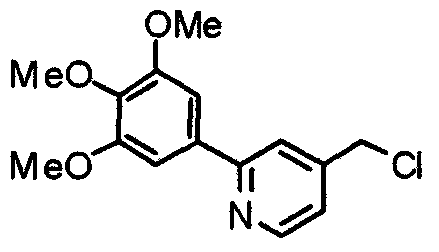
4-Гидроксиметил-2-(3,4,5-триметоксифенил)пиридин (19,18 г) растворяют в хлороформе (100 мл) и к раствору при 0°С медленно добавляют хлорид. Через 30 минут смесь нагревают до комнатной температуры и перемешивают в течение 4 часов. Реакционную смесь промывают водным насыщенным гидрокарбонатом натрия и насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Кристаллический остаток затем перекристаллизовывают из смеси этилацетат/гексан, получая указанное в заголовке соединения в виде бледно-желтого кристаллического порошка.
Выход 18,24 г (89%).
1H-ЯМР (400 МГц, CDCl3) δ: 3,91 (с, 3H), 3,97 (с, 6H), 4,61 (с, 2H), 7,24 (с, 2H), 7,26 (д, 1H, J=5,1 Гц), 7,68 (с, 1H), 8,67 (д, 1H, J=5,1 Гц).
Пример получения 4
Синтез N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]фталимида
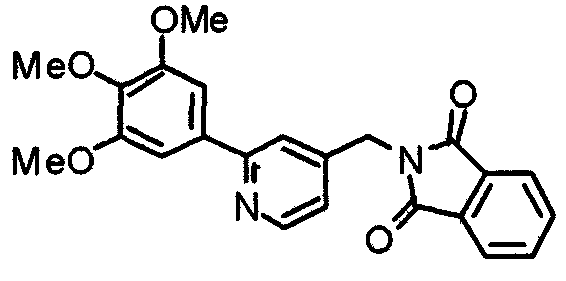
К раствору 4-хлорметил-2-(3,4,5-триметоксифенил)пиридина (881 мг) в хлороформе (10 мл) добавляют фталимид калия (556 мг). Смесь перемешивают при комнатной температуре в течение ночи и добавляют воду. После отделения органического слоя водный слой экстрагируют хлороформом. Органические слои объединяют, сушат над безводным сульфатом магния и концентрируют при пониженном давлении, получая указанное в заголовке соединение в виде белого порошка.
Выход 1,16 г (96%).
Пример получения 5
Синтез 4-аминометил-2-(3,4,5-триметоксифенил)пиридина
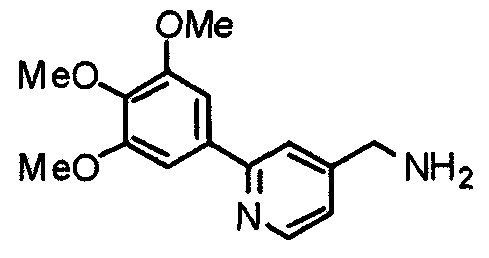
К суспензии N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]фталимида (1,16 г) в этаноле (30 мл) добавляют моногидрат гидразина (1 мл). Смесь кипятят с обратным холодильником в течение 3 часов. После охлаждения нерастворимые вещества отфильтровывают. Фильтрат концентрируют при пониженном давлении и остаток растворяют в хлороформе. Раствор промывают насыщенным водным гидрокарбонатом натрия и насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют при пониженном давлении, получая указанное в заголовке соединение в виде бледно-желтого масла.
Выход 418 мг (53%).
Пример получения 6
Синтез этил-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидин-4-карбоксилата
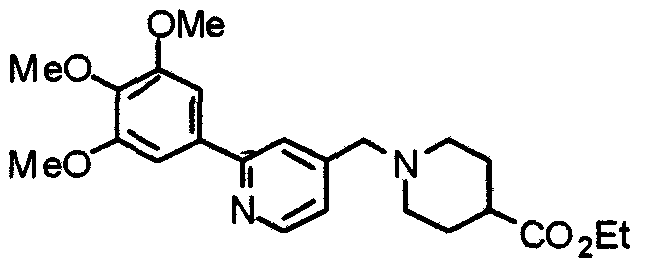
Этилпиперидин-4-карбоксилат (514 мг), 4-хлорметил-2-(3,4,5-триметоксифенил)пиридин (969 мг) и карбонат калия (452 мг) суспендируют в ацетонитриле (20 мл). Суспензию перемешивают при комнатной температуре в течение 4 часов. Реакционную смесь концентрируют при пониженном давлении и затем добавляют хлороформ и воду для отделения органического слоя. Водный слой экстрагируют хлороформом. Органические слои объединяют и сушат над безводным сульфатом магния. После концентрирования при пониженном давлении остаток очищают колоночной хроматографией на силикагеле, элюируя смесью гексан/этилацетат (1:1) и затем смесью метанол/хлороформ (40:1), с получением указанного в заголовке соединения в виде белых призм.
Выход 1,20 г (88%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,25 (т, 3H, J=7,0 Гц), 1,72-1,93 (м, 4H), 2,10 (т, 2H, J=9,8 Гц), 2,27-2,35 (м, 1H), 2,86 (д, 2H, J=11,3 Гц), 3,55 (с, 2H), 3,91 (с, 3H), 3,98 (с, 6H), 4,14 (кв, 2H, J=7,0 Гц), 7,21 (д, 1H, J=4,9 Гц), 7,24 (с, 2H), 7,63 (с, 1H), 8,59 (д, 1H, J=5,1 Гц).
Пример получения 7
Синтез 1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидин-4-карбоновой кислоты
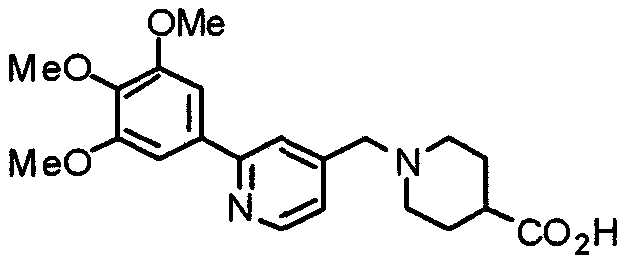
К раствору этил-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]пиперидин-4-карбоксилата (760 мг) в этаноле (10 мл) добавляют 1 М гидроксид натрия (10 мл). Смесь перемешивают при комнатной температуре в течение 4 часов и этанол отгоняют при пониженном давлении. К остатку добавляют воду (20 мл) и затем постепенно добавляют 5% водный бисульфат калия до тех пор, пока pH раствора не достигнет 7. Осажденные кристаллы собирают фильтрованием и продукт используют на следующих стадиях без дальнейшей очистки.
Выход 779 мг (теоретическое количество).
Пример 1
Синтез малеата 1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]-4-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метиламинокарбонил]пиперидина
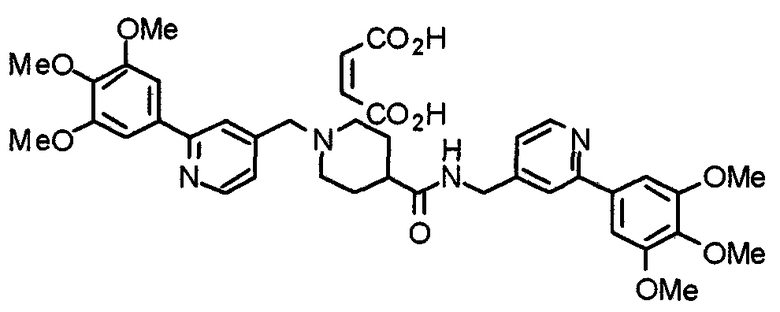
К раствору 1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидин-4-карбоновой кислоты (97 мг) и 4-аминометил-2-(3,4,5-триметоксифенил)пиридина (68 мг) в ацетонитриле (5 мл) добавляют гексафторфосфат 2-(1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония (95 мг). Смесь перемешивают при комнатной температуре в течение 12 часов и концентрируют при пониженном давлении. Остаток растворяют в хлороформе, промывают насыщенным раствором водного гидрокарбоната натрия и насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, элюируя смесью хлороформ/метанол (40:1˜20:1). Указанное в заголовке соединение получают в виде свободного основания. Затем добавлением малеиновой кислоты свободное основание превращают в малеат.
Выход 93 мг (49%).
1H-ЯМР (400 МГц, определяемый как малеат, ДМСО-d6) δ: 1,87-2,01 (м, 4H), 2,48-2,56 (м, 1H), 2,78-2,86 (м, 2H), 3,26-3,31 (м, 2H), 3,78 (с, 3H), 3,79 (с, 3H), 3,87 (с, 6H), 3,90 (с, 6H), 4,15 (с, 2H), 4,39 (д, 2H, J=5,9 Гц), 6,16 (с, 2H), 7,16 (д, 1H, J=5,9 Гц), 7,35 (с, 2H), 7,39 (д, 1H, J=5,9 Гц), 7,39 (с, 2H), 7,73 (с, 1H), 7,95 (с, 1H), 8,15 (д, 1H, J=5,9 Гц), 8,54 (д, 1H, J=4,9 Гц), 8,68 (д, 1H, J=4,9 Гц).
Пример получения 8
Синтез 1-(бензилоксикарбонил)-4[[2-(3,4,5-триметоксифенил-4-ил]метилокси]пиперидина
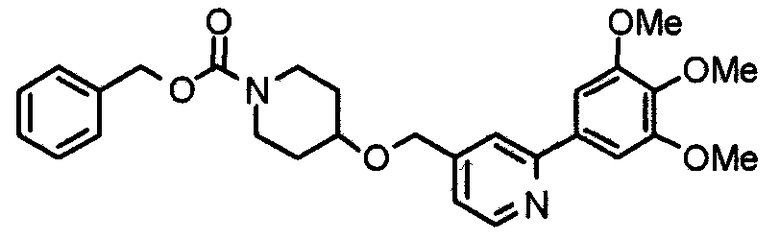
К раствору 1-(бензилоксикарбонил)-4-гидроксипиперидина (1,0 г) в ДМФА (20 мг) добавляют гидрид натрия (55% дисперсия в минеральном масле, 222 мг). Смесь перемешивают при комнатной температуре в течение часа и затем добавляют 4-хлорметил-2-(3,4,5-триметоксифенил)пиридин (1,37 г) и йодид калия (755 мг). Смесь перемешивают при 70°С в течение ночи, добавляют воду и затем экстрагируют хлороформом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле, используя смесь хлороформ/метанол (99:1) в качестве элюента, с получением указанного в заголовке соединения.
Выход 213 мг (10%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,63 (шир, 2H), 1,89 (шир, 2H), 3,20-3,35 (м, 2H), 3,57-3,68 (м, 1H), 3,84-3,92 (м, 5H), 3,94 (с, 6H), 4,62 (с, 2H), 5,11 (с, 2H), 7,21-7,35 (м, 8H), 7,61 (с, 1H), 8,61 (д, 1H, J=5,0 Гц).
Пример получения 9
Синтез 4-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метилокси]пиперидина
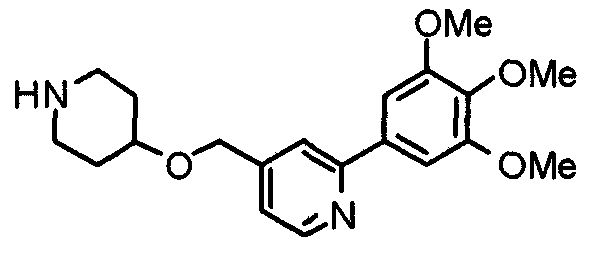
К раствору 1-(бензилоксикарбонил)-4-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метилокси]пиперидина (213 мг) в метаноле (10 мл) добавляют 40% водный гидроксид калия (10 мл). Смесь перемешивают при 100°С в течение 3 часов. После концентрирования при пониженном давлении к остатку добавляют воду и экстрагируют хлороформом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле, элюируя смесью хлороформ/насыщенный метанолом аммиак (20:1), с получением указанного в заголовке соединения.
Выход 93 мг (60%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,55-1,68 (м, 2H), 2,01 (шир, 2H), 2,67-2,72 (м, 2H), 3,13-3,18 (м, 2H), 3,50-3,60 (м, 1H), 3,91 (с, 3H), 3,97 (с, 6H), 4,64 (с, 2H), 7,22 (д, 1H, J=4,3 Гц), 7,24 (с, 2H), 7,64 (с, 1H), 8,63 (д, 1H, J=5,1 Гц).
Пример 2
Синтез тригидрохлорида 1-[2-[(3,4,5-триметоксифенил)пиридин-4-ил]метил]-4-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метилокси]пиперидина
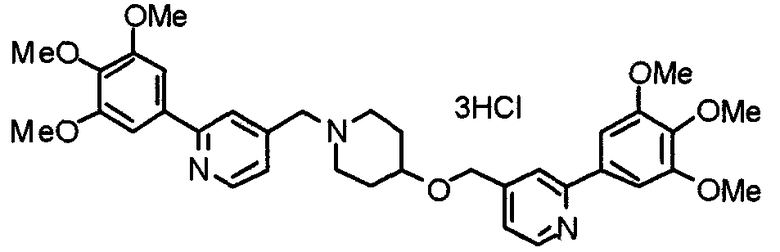
4-[[2-[(3,4,5-Триметоксифенил)пиридин-4-ил]метилокси]пиперидин (70 мг), 4-хлорометил-2-(3,4,5-триметоксифенил)пиридин (22 мг), карбонат калия (56 мг) и йодид калия (40 мг) суспендируют в ацетонитриле (5 мл). Смесь перемешивают при комнатной температуре в течение 5 часов и концентрируют при пониженном давлении. К остатку добавляют хлороформ и воду и органический слой отделяют. Водный слой затем экстрагируют хлороформом, органические слои объединяют, сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле, используя смесь хлороформ/метанол (40:1) в качестве элюента. Полученное свободное основание превращают в тригидрохлорид в соответствии с традиционным способом.
Выход 42 мг (39%).
1H-ЯМР (400 МГц, определяемый как свободное основание, CDCl3) δ: 1,53-2,42 (м, 6H), 2,80 (шир, 2H), 3,57 (шир, 3H), 3,88 (с, 6H), 3,94 (с, 6H), 3,95 (с, 6H), 4,60 (с, 2H), 7,18-7,24 (м, 6H), 7,61 (с, 2H), 8,58-8,61 (м, 2H).
Пример получения 10
Синтез (3S)-1-(трет-бутоксикарбонил)-3-[(2-нитробензол)сульфониламино]пирролидина
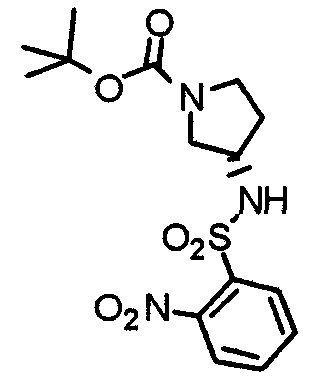
К охлажденному льдом раствору (3S)-3-амино-1-(трет -бутоксикарбонил)пирролидина (404 мг) и триэтиламина (220 мг) в ТГФ (5 мл) добавляют 2-нитробензолсульфонилхлорид (481 мг). Смесь перемешивают при комнатной температуре в течение 30 минут и концентрируют при пониженном давлении. К остатку добавляют этилацетат. Раствор промывают водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и концентрируют при пониженным давлении. Остаток очищают колоночной хроматографией на силикагеле, используя смесь хлороформ/метанол (20:1) в качестве элюента, с получением указанного в заголовке соединения в виде бледно-желтого аморфного вещества.
Выход 597 мг (74%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,44 (с, 9H), 1,80-2,12 (м, 2H), 3,14-3,44 (м, 4H), 4,02 (шир, 1H), 5,48 (д, 1H, J=7,2 Гц), 7,77 (т, 2H, J=4,4 Гц), 7,87-7,90 (м, 1H), 8,17-8,19 (м, 1H).
Пример получения 11
Синтез (3S)-1-(трет-бутоксикарбонил)-3-[N-метил-N-(2-нитробензолсульфонил)амино]пирролидина
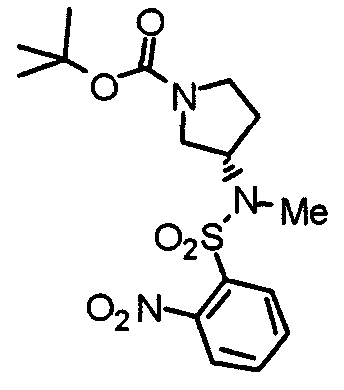
К суспензии (3S)-1-(трет-бутоксикарбонил)-3-[2-нитробензол)сульфониламино]пирролидина (371 мг) и карбоната калия (138 мг) в ацетонитриле (10 мл) добавляют метилйодид (141 мг). Смесь перемешивают при 60°С в течение 2 часов и концентрируют при пониженном давлении. К смеси добавляют этилацетат. Раствор промывают насыщенным водным гидрокарбонатом натрия и насыщенным раствором соли, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток используют для колоночной хроматографии на силикагеле, используя смесь гексан/этилацетат (2:1) в качестве элюента для очистки, с получением указанного в заголовке соединения в виде желтого масла.
Выход 365 мг (95%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,44 (с, 9H), 1,95 (шир, 1H), 2,09 (шир, 1H), 2,87 (с, 3H), 3,20-3,31 (м, 2H), 3,53 (шир, 2H), 4,58 (шир, 1H), 7,65 (шир, 1H), 7,71 (шир, 2H), 8,04 (шир, 1H).
Пример получения 12
Синтез (3S)-3-[N-метил-N-(2-нитробензолсульфонил)амино]пирролидина
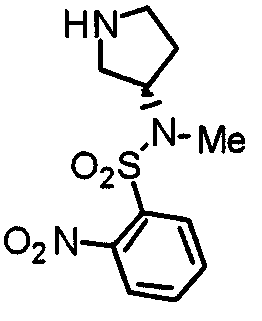
К раствору (3S)-1-(трет-бутоксикарбонил)-3-[N-метил-N-(2-нитробензолсульфонил)амино]пирролидина (365 мг) в дихлорометане (25 мл) при 0°С добавляют трифторуксусную кислоту (1 мл).Смесь перемешивают при комнатной температуре в течение 3 часов, концентрируют при пониженном давлении и добавляют к хлороформу. Раствор промывают насыщенным водным раствором гидрокарбоната натрия и насыщенным раствором соли, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении, получая указанное в заголовке соединение в виде желтого масла.
Выход 135 мг (50%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,69-1,74 (м, 1H), 1,87 (шир, 1H), 1,95-2,02 (м, 1H), 2,80 (дд, 1H, J=11,7 Гц, 5,7 Гц), 2,84-2,91 (м, 4H), 2,96-3,05 (м, 1H), 3,10 (дд, 1H, J=11,7 Гц, 8,2 Гц), 4,48-4,56 (м, 1H), 7,61-7,63 (м, 1H), 7,66-7,73 (м, 2H), 8,01-8,04 (м, 1H).
Пример получения 13
Синтез (3S)-3-[N-метил-N-(2-нитробензолсульфонил)амино]-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пирролидина
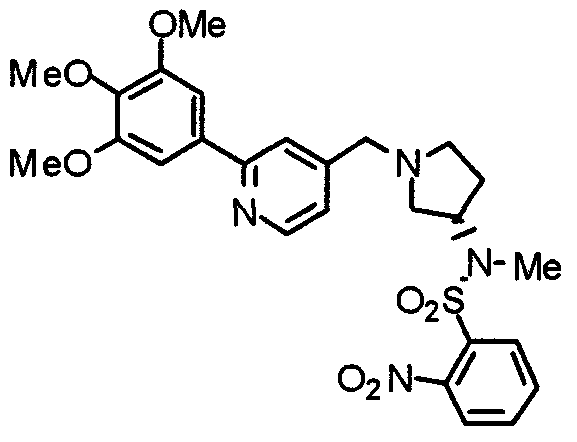
(3S)-3-[N-Метил-N-(2-нитробензолсульфонил)амино]пирролидин (135 мг) и 4-хлорметил-2-(3,4,5-триметоксифенил)пиридин (139 мг) обрабатывают по методике, аналогично описанной в примере 2, получая указанное в заголовке соединение в виде желтого аморфного вещества.
Выход 247 мг (96%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,80-1,87 (м, 1H), 2,15-2,30 (м, 2H), 2,52 (дд, 1H, J=10,5 Гц, 8,2 Гц), 2,71 (дд, 1H, J=10,5 Гц, 8,2 Гц), 2,90 (дт, 1H, J=8,8 Гц, 2,9 Гц), 2,96 (с, 3H), 3,53 (д, 1H, J=13,9 Гц), 3,68 (д, 1H, J=13,9 Гц), 3,90 (с, 3H), 3,96 (с, 6H), 4,61-4,68 (м, 1H), 7,16 (дд, 1H, J=4,9 Гц, 1,2 Гц), 7,21 (с, 2H), 7,58-7,60 (м, 2H), 7,64-7,69 (м, 2H), 7,99-8,02 (м, 1H), 8,58 (д, 1H, J=4,9 Гц).
Пример получения 14
Синтез (3S)-3-метиламино-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пирролидина
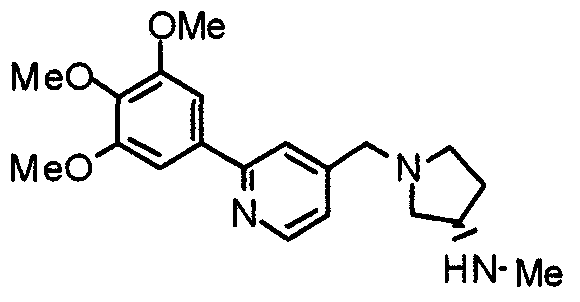
К раствору (3S)-3-[N-метил-N-(2-нитробензолсульфонил)амино]-1-[2-(3,4,5-триметоксифенил)пиридин-4-ил]пирролидина (242 мг) в ацетонитриле (5 мл) добавляют карбонат калия (94 мг) и тиофенол (75 мг). Смесь перемешивают при 80°С в течение часа. После охлаждения к смеси добавляют этилацетат и раствор промывают насыщенным водным раствором гидрокарбоната натрия, водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают препаративной ТСХ, используя раствор хлороформ/метанол (20:1) в качестве элюента, с получением указанного в заголовке соединения в виде желтого масла.
Выход 104 мг (64%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,32 (шир, 1H), 1,56-1,64 (м, 1H), 2,11-2,17 (м, 1H), 2,38 (с, 3H), 2,44 (дд, 1H, J=7,4 Гц, 4,5 Гц), 2,50-2,55 (м, 1H), 2,66-2,75 (м, 2H), 3,20-3,26 (м, 1H), 3,66 (с, 2H), 3,90 (с, 3H), 3,97 (с, 6H), 7,21 (д, 1H, J=4,1 Гц), 7,25 (с, 2H), 7,64 (с, 1H), 8,59 (д, 1H, J=4,9 Гц).
Пример 3
Синтез тетрагидрохлорида (3S)-3-[N-метил-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пирролидина
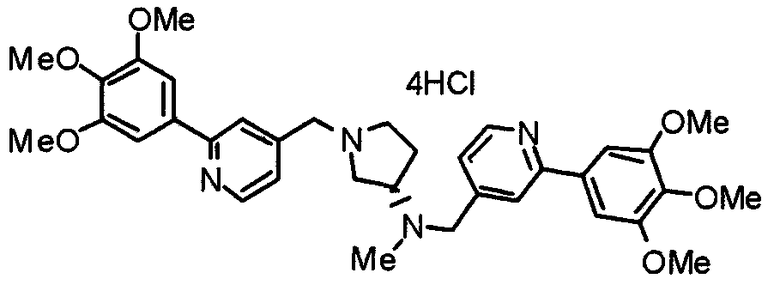
(3S)-3-Метиламино-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пирролидин (104 мг) и 4-хлорометил-2-(3,4,5-триметоксифенил)пиридин (85 мг) подвергают взаимодействию по методике, аналогично описанной в примере 2. Полученный в результате продукт превращают в тетрагидрохлорид, получая указанное в заголовке соединения в виде желтого порошка.
Выход 151 мг (68%).
1H-ЯМР (400 МГц, определяемый как свободное основание, CDCl3) δ: 1,89-1,92 (м, 1H), 2,04-2,08 (м, 1H), 2,18 (с, 3H), 2,60-2,76 (м, 4H), 3,25-3,29 (м, 1H), 3,53 (д, 1H, J=14,3 Гц), 3,62 (д, 1H, J=14,3 Гц), 3,64 (д, 1H, J=13,9 Гц), 3,73 (д, 1H, J=13,9 Гц), 3,89 (с, 6H), 3,95 (с, 6H), 3,96 (с, 6H), 7,20-7,21 (м, 2H), 7,23 (с, 2H), 7,24 (с, 2H), 7,61 (с, 1H), 7,65 (с, 1H), 8,59 (д, 1H, J=5,7 Гц), 8,60 (д, 1H, J=5,3 Гц).
Пример получения 15
Синтез 1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидин-4-карбоксамида
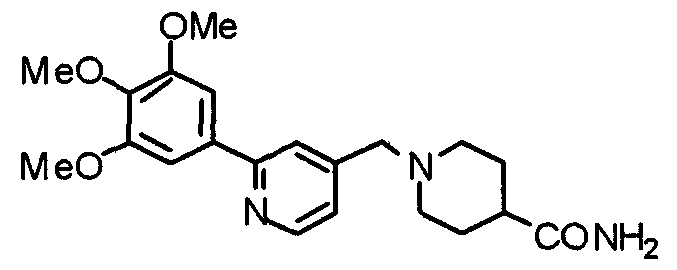
Пиперидин-4-карбоксамид (385 мг) и 4-хлорметил-2-(3,4,5-триметоксифенил)пиридин (881 мг) подвергают взаимодействию по методике, аналогично описанной в примере 2, получая указанное в заголовке соединение в виде белых игл.
Выход 1,01 г (87%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,70-1,88 (м, 4H), 2,01-2,23 (м, 3H), 2,95 (д, 2H, J=11,0 Гц), 3,56 (с, 2H), 3,90 (с, 3H), 3,98 (с, 6H), 5,46 (д, 2H, J=16,3 Гц), 7,21 (д, 1H, J=5,0 Гц), 7,24 (с, 2H), 7,64 (с, 1H), 8,59 (д, 1H, J=5,0 Гц).
Пример получения 16
Синтез тригидрохлорида 4-амино-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
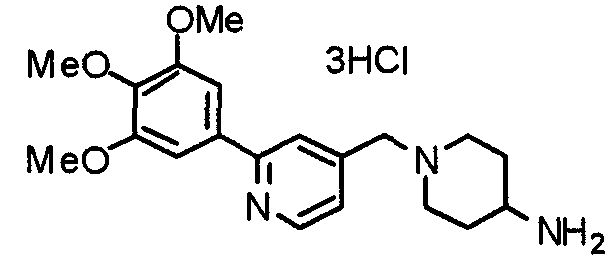
К раствору 1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидин-4-карбоксамида (192 мг) в смешанном растворителе из воды (50 мл) и ацетонитрила (50 мл) добавляют [бис(трифторацетокси)йод]бензол (323 мг). Смесь перемешивают при комнатной температуре в течение ночи и концентрируют при пониженном давлении. К остатку добавляют насыщенный водный гидрокарбонат натрия для подщелачивания и остаток экстрагируют хлороформом. Слой хлороформа промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Полученное таким образом желтое масло затем превращают в гидрохлорид, который дает желтый порошок. Указанное в заголовке соединение используют на следующей стадии без дальнейшей очистки.
Выход 201 мг (теоретическое количество).
Пример получения 17
Синтез 2-(3,4,5-триметоксифенил)изоникотиновой кислоты
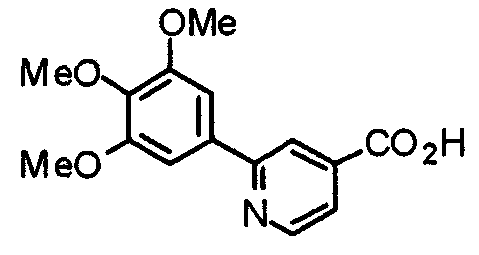
К раствору этил-2-(3,4,5-триметоксифенил)изоникотината (3,17 г) в этаноле (40 мл) добавляют 10% гидроксид калия (2,42 г). Смесь перемешивают при комнатной температуре в течение 5 часов и концентрируют при пониженном давлении. К остатку добавляют воду и доводят рН до 7. Полученный белый осадок фильтруют. Полученное указанное в заголовке соединение используют на следующих стадиях без дальнейшей очистки.
Выход 2,60 г (90%).
Пример 4
Синтез малеата 1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]-4-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]карбониламино]пиперидина
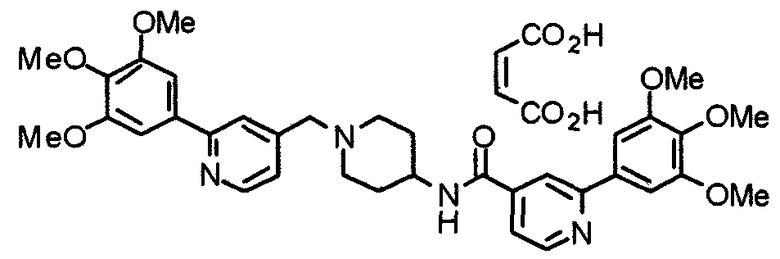
2-(3,4,5-Триметоксифенил)пиридин-4-карбоновую кислоту (72 мг) и 4-амино-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидин (117 мг) подвергают взаимодействию по методике, аналогично описанной в примере 1. Полученный в результате продукт превращают в малеат, получая указанное в заголовке соединение.
Выход 173 мг (93%).
1H-ЯМР (400 МГц, определяемый как малеат, ДМСО-d6) δ: 1,82-1,94 (м, 2H), 2,03-2,08 (м, 2H), 2,77-2,83 (м, 2H), 3,20-3,27 (м, 2H), 3,79 (с, 6H), 3,90 (с, 12H), 4,00 (шир, 1H), 4,06 (с, 2H), 6,15 (с, 2H), 7,36-7,38 (м, 1H), 7,39 (с, 2H), 7,41 (с, 2H), 7,61-7,63 (м, 1H), 7,90 (с, 1H), 8,12 (с, 1H), 8,27-8,32 (м, 1H), 8,67 (д, 1H, J=4,9 Гц), 8,74 (д, 1H, J=5,1 Гц).
Пример получения 18
Синтез 4-[(2-нитробензолсульфонил)амино]-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
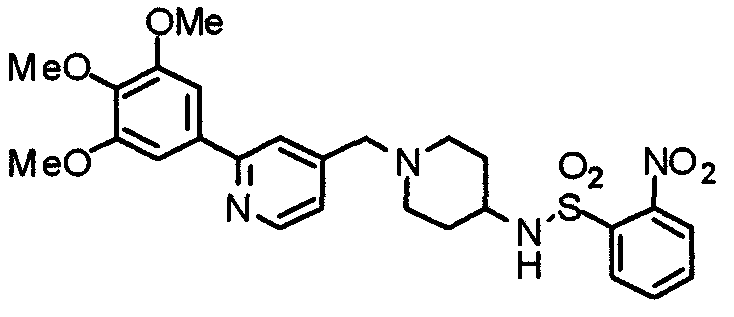
4-Амино-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидин (467 мг) и 2-нитробензолсульфонилхлорид (244 мг) подвергают взаимодействию по методике, аналогично описанной в примере получения 10, получая указанное в заголовке соединение.
Выход 494 мг (91%).
Пример получения 19
Синтез 4-[N-(2-нитробензолсульфонил)-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
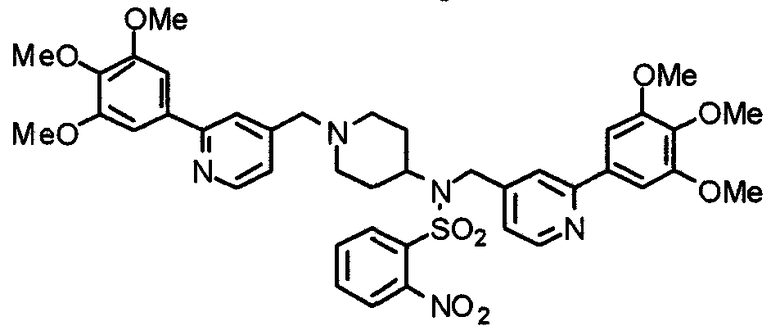
4-[(2-Нитробензол)сульфониламино]-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидин (494 мг) и 4-хлорметил-2-(3,4,5-триметоксифенил)пиридин (267 мг) подвергают взаимодействию по методике, аналогично описанной в примере получения 2, получая указанное в заголовке соединение.
Выход 443 мг (61%).
Пример 5
Синтез дифумалата 1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]-4-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метиламино]пиперидина
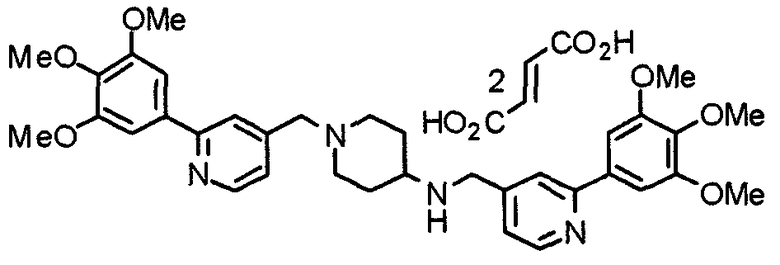
4-[N-(2-Нитробензолсульфонил)-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидин (443 мг) обрабатывают по методике, аналогично описанной в примере получения 14. Указанное в заголовке соединение получают в виде дифумалата.
Выход 103 мг (24%).
1H-ЯМР (400 МГц, определяемый как свободное основание, CDCl3) δ: 1,44-1,53 (м, 2H), 1,87-1,91 (м, 2H), 2,15 (т, 2H, J=1,1 Гц), 2,57-2,64 (м, 1H), 2,82-2,85 (м, 2H), 3,59 (с, 2H), 3,78 (с, 6H), 3,89 (с, 12H), 3,90 (с, 2H), 6,63 (с, 4H), 7,24 (д, 1H, J=4,9 Гц), 7,29 (д, 1H, J=4,9 Гц), 7,35 (с, 2H), 7,37 (с, 2H), 7,76 (с, 1H), 7,85 (с, 1H), 8,53-8,56 (м, 2H).
Пример получения 20
Синтез 4-(этоксикарбониламино)-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
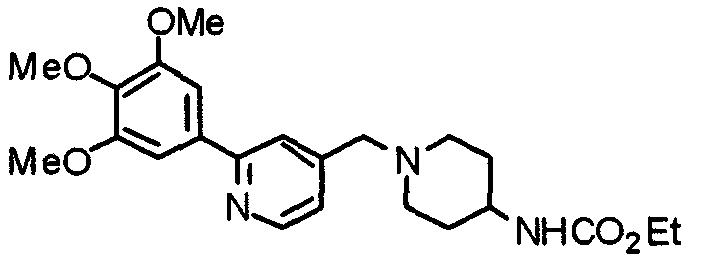
К раствору 1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидин-4-карбоксамида (528 мг) в смешанном растворителе из этанола (10 мл) и ацетонитрила (10 мл) добавляют [бис(трифторацетокси)йод]бензол (884 мг). Смесь перемешивают при комнатной температуре в течение ночи. После концентрирования при пониженном давлении в смесь вводят насыщенный водный гидрокарбонат натрия и экстрагируют хлороформом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле, используя смесь хлороформ/метанол (20:1) в качестве элюента, с получением указанного в заголовке соединения.
Выход 566 мг (96%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,21 (т, 3H, J=7,0 Гц), 1,40-1,51 (м, 2H), 1,92 (д, 2H, J=10,9 Гц), 2,15 (т, 2H, J=10,9 Гц), 2,78 (д, 2H, J=11,6 Гц), 3,52 (шир, 3H), 3,87 (с, 3H), 3,94 (с, 6H), 4,07 (кв, 2H, J=7,0 Гц), 4,56 (шир, 1H), 7,17 (д, 1H, J=4,9 Гц), 7,21 (с, 2H), 7,59 (с, 1H), 8,56 (д, 1H, J=5,1 Гц).
Пример получения 21
Синтез 4-(метиламино)-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
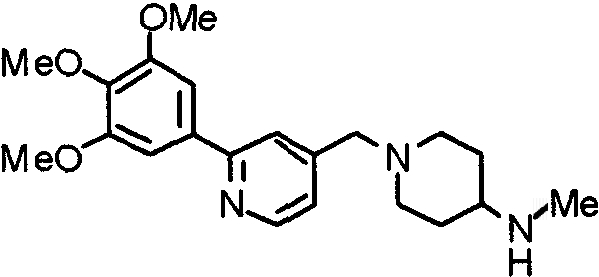
К суспензии литийалюминийгидрида (100 мг) в сухом ТГФ (50 мл) постепенно добавляют раствор 4-(этоксикарбониламино)-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина (566 мг) в сухом ТГФ (50 мл) в атмосфере аргона. Затем смесь кипятят с обратным холодильником в течение ночи и после этого охлаждают. К смеси добавляют насыщенный водный раствор хлорида аммония и полученную смесь, после окончания выделения пузырьков, экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле, используя смесь хлороформ/насыщенный аммиаком метанол (9:1), с получением указанного в заголовке соединения в виде желтого масла.
Выход 379 мг (78%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,36-1,46 (м, 2H), 1,89 (д, 2H, J=12,5 Гц), 2,10 (дт, 2H, J=11,5 Гц, 1,1 Гц), 2,35-2,43 (м, 1H), 2,43 (с, 3H), 2,86 (д, 2H, J=11,6 Гц), 3,56 (с, 2H), 3,90 (с, 3H), 3,97 (с, 6H), 7,21 (д, 1H, J=5,1 Гц), 7,24 (с, 2H), 7,64 (с, 1H), 8,59 (д, 1H, J=4,9 Гц).
Пример получения 22
Синтез этиленкеталя 1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]-4-пиперидона
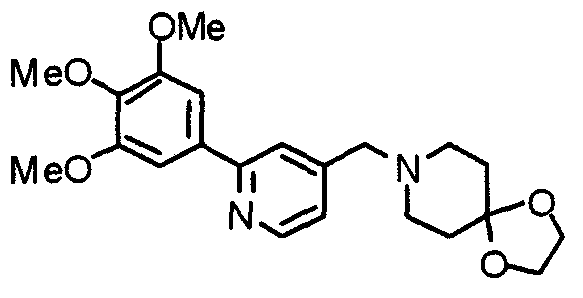
4-Пиперидонэтиленкеталь (12,0 г) и 4-хлорметил-2-(3,4,5-триметоксифенил)пиридин (12,3 г) подвергают взаимодействию по методике, аналогично описанной в примере 2, получая указанное в заголовке соединение.
Выход 19,0 г (теоретическое количество).
1H-ЯМР (400 МГц, CDCl3) δ: 1,68 (т, 4H, J=5,6 Гц), 2,48 (шир, 4H), 3,50 (с, 2H), 3,82 (с, 3H), 3,86 (с, 4H), 3,88 (с, 6H), 7,13 (д, 1H, J=4,9 Гц), 7,17 (с, 2H), 7,57 (с, 1H), 8,51 (д, 1H, J=4,9 Гц).
Пример получения 23
Синтез 1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]-4-пиперидона
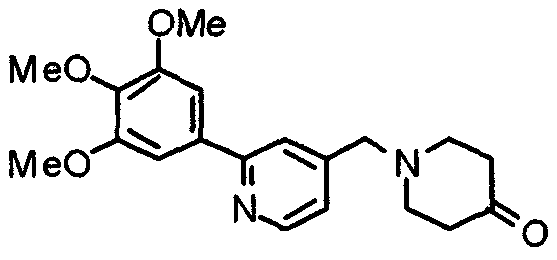
К раствору этиленкеталя 1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]-4-пиперидона (19,0 г) в ТГФ (200 мл) добавляют 1 М хлористоводородную кислоту (200 мл). Смесь перемешивают при 90°С в течение ночи, затем нейтрализуют 2 М гидроксидом натрия и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле, используя смесь хлороформ/метанол (40:1) в качестве элюента, с получением указанного в заголовке соединения.
Выход 15,0 г (75%).
1H-ЯМР (400 МГц, CDCl3) δ: 2,48 (т, 4H, J=6,1 Гц), 2,79 (т, 4H, J=6,0 Гц), 3,69 (с, 2H), 3,89 (с, 3H), 3,96 (с, 6H), 7,24 (с, 2H), 7,26 (д, 1H, J=4,9 Гц), 7,66 (с, 1H), 8,62 (д, 1H, J=4,9 Гц).
Пример получения 24
Синтез 1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]-4-пиперидона
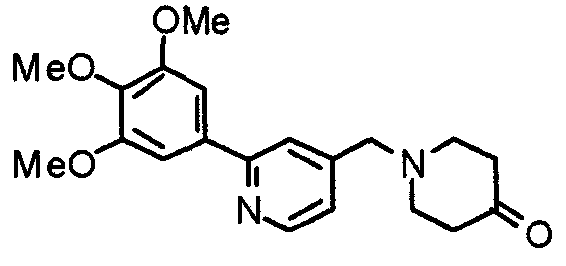
Моногидрат 4-пиперидонгидрохлорида (3,07 г) и 4-хлорометил-2-(3,4,5-триметоксифенил)пиридин (2,94 г) подвергают взаимодействию по методике, аналогично описанной в примере 2, с получением указанного в заголовке соединения.
Выход 3,55 г (99%).
Пример получения 25
Синтез 4-(метиламино)1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина

К раствору 1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]-4-пиперидона (1,00 г) в 1,2-дихлорэтане (60 мл) добавляют 30% раствор метиламина в этаноле (750 г) и триацетоксиборогидрид натрия (1,66 г). Смесь перемешивают при комнатной температуре в течение 3 часов, вводят воду и концентрируют при пониженном давлении. После добавления воды остаток экстрагируют хлороформом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле, используя смесь хлороформ/метанол (40:1) в качестве элюента, с получением указанного в заголовке соединения.
Выход 640 мг (62%).
Пример получения 26
Синтез этил-3-(3,4,5-триметоксифенил)бензоата
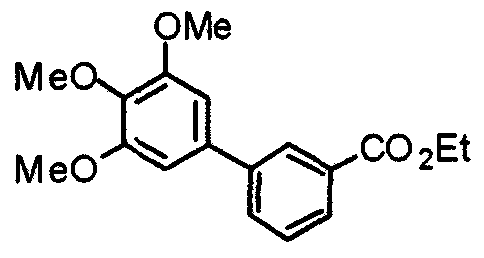
3,4,5-Триметоксифенилбороновую кислоту (3,7 г) и этил-3-бромбензоат (4,02 г) подвергают взаимодействию по методике, аналогично описанной в примере получения 1, получая указанное в заголовке соединение.
Выход 5,09 г (92%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,42 (т, 3H, J=7,1 Гц), 3,90 (с, 3H), 3,94 (с, 6H), 4,41 (кв, 2H, J=7,1 Гц), 6,79 (с, 2H), 7,50 (т, 1H, J=7,8 Гц), 7,73 (дт, 1H, J=7,1 Гц, 1,5 Гц), 8,01 (дт, 1H, J=7,8 Гц, 1,4 Гц), 8,23 (т, 1H, J=1,8 Гц).
Пример получения 27
Синтез 3-(3,4,5-триметоксифенил)бензойной кислоты
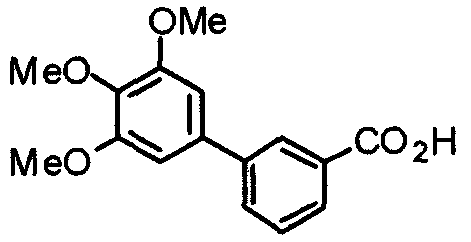
Этил-3-(3,4,5-триметоксифенил)бензоат (1,19 г) обрабатывают по методике, аналогично описанной в примере получения 17, получая указанное в заголовке соединение.
Выход 986 мг (91%).
Пример 6
Синтез дигидрохлорида 4-[N-метил-N-[3-(3,4,5-триметоксифенил)бензоил]амино]-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
3-(3,4,5-Триметоксифенил)бензойную кислоту (1,03 г) и 4-(метиламино)-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина (1,32 г) подвергают взаимодействию по методике, аналогично описанной в примере 1, получая указанное в заголовке соединение в виде дигидрохлорида.
Выход 1,44 г (57%).
1H-ЯМР (400 МГц, определяемый как дигидрохлорид, ДМСО-d6) δ: 1,89 (д, 2H, J=11,7 Гц), 2,54-2,62 (м, 2H), 2,89 (с, 3H), 3,09 (т, 2H, J=12,7 Гц), 3,43 (д, 2H, J=14,4 Гц), 3,76 (с, 3H), 3,78 (с, 3H), 3,88 (с, 6H), 3,91 (с, 6H), 4,34 (шир, 3H), 6,91 (с, 2H), 7,33 (д, 1H, J=7,6 Гц), 7,47-7,51 (м, 2H), 7,54 (с, 2H), 7,60 (с, 1H), 7,71 (д, 1H, J=7,8 Гц), 8,55 (с, 1H), 8,68 (д, 1H, J=5,1 Гц).
Пример 7
Синтез дифумарата 4-[N-метил-N-[[3-(3,4,5-триметоксифенил)пиридин-5-ил]метил]амино-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
4-Метиламино-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидин (135 мг) и 5-хлорметил-3-(3,4,5-триметоксифенил)пиридин (107 мг) подвергают взаимодействию по методике, аналогично описанной в примере 2, получая указанное в заголовке соединение в виде дифумарата.
Выход 180 мг (58%).
1H-ЯМР (400 МГц, определяемый как свободное основание, CDCl3) δ: 1,69-1,73 (м, 2H), 1,82-1,85 (м, 2H), 2,03-2,08 (м, 2H), 2,25 (с, 3H), 2,48-2,51 (м, 1H), 2,97-2,99 (м, 2H), 3,56 (с, 2H), 3,67 (с, 2H), 3,90 (с, 3H), 3,91 (с, 3H), 3,94 (с, 6H), 3,98 (с, 6H), 6,76 (с, 2H), 7,22 (д, 1H, J=5,1 Гц), 7,24 (с, 2H), 7,62 (с, 1H), 7,80 (с, 1H), 8,50 (д, 1H, J=2,0 Гц), 8,60 (д, 1H, J=4,3 Гц), 8,69 (д, 1H, J=5,1 Гц).
Пример получения 28
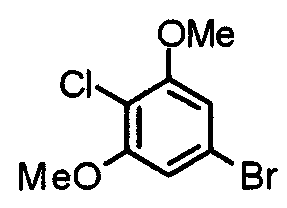
Синтез 1-бром-4-хлор-3,5-диметоксибензола
Раствор нитрита натрия (97 мг) в воде по каплям добавляют к охлажденной льдом суспензии 4-бром-2,6-диметоксианилина (232 мг) в 6,0 М хлористводородной кислоте (2,5 мл) после добавления к последней измельченного льда. После перемешивания смеси на ледяной бане в течение 30 минут к смеси добавляют раствор хлорида меди (II) (495 мг) в концентрированной хлористводородной кислоте (2,0 мл). Реакционную смесь перемешивают при комнатной температуре в течение 30 минут, затем при 100°С в течение 2 часов и экстрагируют этилацетатом. Органический слой промывают насыщенным водным гидрокарбонатом натрия и водой, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле, используя смесь гексан/этилацетат (10:1) в качестве элюента, с получением указанного в заголовке соединения в виде белого порошка.
Выход 230 мг (92%).
Пример получения 29
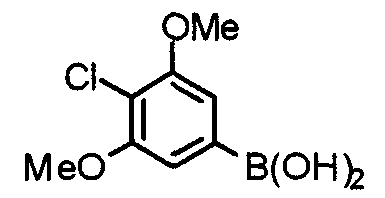
Синтез 4-хлор-3,5-диметоксифенилбороновой кислоты
В атмосфере аргона к сухому ТГФ (2 мл), охлажденному на бане сухой лед/метанол, постепенно добавляют 1,57 М раствор н-бутиллития в гексане (0,8 мл) с последующим добавлением по каплям раствора 1-бром-4-хлор-3,5-диметоксибензола (160 мг) в сухом ТГФ (2 мл). После перемешивания смеси в течение 20 минут на бане сухой лед/метанол добавляют триизопропилборат (0,18 мл) и смесь дополнительно перемешивают еще в течение 20 минут. Реакционную смесь затем перемешивают при комнатной температуре в течение часа и рН смеси доводят до 3, используя 4 М хлористводородную кислоту. Смесь перемешивают при 0°С в течение часа и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток перекристаллизовывают из смеси этилацетат/гексан, получая указанное в заголовке соединение в виде белого порошка.
Выход 90 мг (66%).
Пример получения 30
Синтез этил-2-(4-хлор-3,5-диметоксифенил)изоникотината
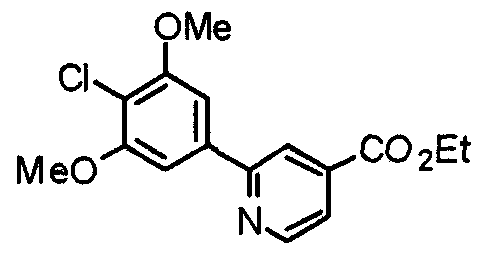
4-Хлор-3,5-диметоксифенилбороновую кислоту (7,45 г) и этил-2-хлоризоникотинат (6,39 г) обрабатывают по методике, аналогично описанной в примере получения 1, получая указанное в заголовке соединение.
Выход 8,55 г (77%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,45 (т, 3H, J=7,3 Гц), 4,03 (с, 6H), 4,45 (кв, 2H, J=7,3 Гц), 7,32 (с, 2H), 7,80 (д, 1H, J=5,1 Гц), 8,27 (с, 1H), 8,83 (д, 1H, J=5,0 Гц).
Пример получения 31
Синтез 2-(4-хлор-3,5-диметоксифенил)изоникотиновой кислоты
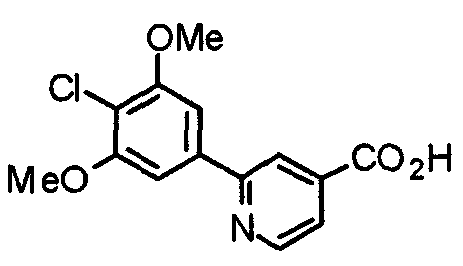
К раствору этил-2-(4-хлор-3,5-диметоксифенил)изоникотината (8,55 г) в этаноле (80 мл) добавляют 2 М гидроксид натрия (100 мл). Смесь перемешивают при кипячении с обратным холодильником в течение 30 минут и этанол отгоняют при пониженном давлении. Смесь нейтрализуют добавлением 1 М хлористводородной кислоты. Полученный осадок растворяют в смешанном растворителе этилацетат/ТГФ (3:1), сушат над безводным сульфатом натрия и концентрируют при пониженном давлении, получая указанное в заголовке соединение.
Выход 7,20 г (92%).
1H-ЯМР (400 МГц, CDCl3) δ: 4,02 (с, 6H), 7,34 (с, 2H), 7,83 (д, 1H, J=4,9 Гц), 7,84 (с, 1H), 8,82 (д, 1H, J=4,9 Гц).
Пример получения 32
Синтез 2-(4-хлор-3,5-диметоксифенил)-4-гидроксиметилпиридина
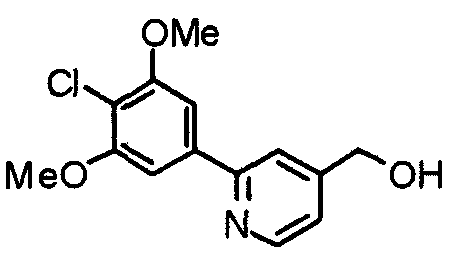
К раствору 2-(4-хлор-3,5-диметоксифенил)изоникотиновой кислоты (7,20 г) и триэтиламина (5,6 мл) в ТГФ (70 мл) при 0°С добавляют этилхлорформиат (2,8 мл). Смесь перемешивают при комнатной температуре в течение часа и нерастворимые вещества отфильтровывают. К фильтрату затем добавляют раствор борогидрида натрия (1,25 г) в воде (4 мл). Смесь перемешивают при комнатной температуре в течение еще одного часа и концентрируют при пониженном давлении. После добавления воды остаток экстрагируют хлороформом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле, используя смесь хлороформ/метанол (20:1˜15:1), с получением указанного в заголовке соединения.
Выход 4,10 г (60%).
1H-ЯМР (400 МГц, CDCl3+ДМСО-d6) δ: 4,01 (с, 6H), 4,76 (с, 2H), 7,20-7,35 (м, 3H), 7,78 (с, 1H), 8,62 (с, 1H).
Пример получения 33
Синтез 2-(4-хлор-3,5-диметоксифенил)-4-хлорметилпиридина
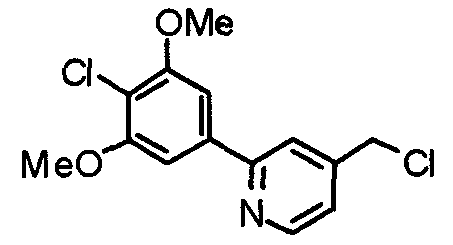
2-(4-Хлор-3,5-диметоксифенил)-4-гидрометилпиридин (4,10 г) растворяют в хлороформе (20 мл), вводят тионилхлорид (5,2 мл) и перемешивают при 70°С в течение часа. После концентрирования смеси при пониженном давлении полученный остаток нейтрализуют насыщенным водным раствором гидрокарбоната натрия и экстрагируют этилацетатом. Органический слой промывают водой и насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют при пониженном давлении, получая указанное в заголовке соединение.
Выход 4,20 г (96%).
1H-ЯМР (400 МГц, CDCl3) δ: 4,02 (с, 6H), 4,63 (с, 2H), 7,26 (с, 2H), 7,29 (д, 1H, J=4,9 Гц), 7,72 (с, 1H), 8,69 (д, 1H, J=4,9 Гц).
Пример получения 34
Синтез 1-[[2-(4-хлор-3,5-диметоксифенил)пиридин-4-ил]метил]пиперидин-4-карбоксамида
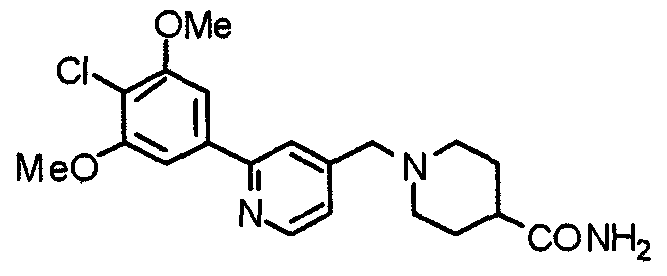
Пиперидин-4-карбоксамид (301 мг) и 2-(4-хлор-3,5-диметоксифенил)-4-хлорметилпиридин (600 мг) подвергают взаимодействию по методике, аналогично описанной в примере 2, получая указанное в заголовке соединение.
Выход 743 мг (95%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,75-1,90 (м, 4H), 2,07-2,25 (м, 3H), 2,94 (д, 2H, J=11,6 Гц), 3,57 (с, 2H), 4,02 (с, 6H), 7,24-7,31 (м, 3H), 7,67 (с, 1H), 8,61 (д, 1H, J=5,1 Гц).
Пример получения 35
Синтез 1-[[2-(4-хлор-3,5-диметоксифенил)пиридин-4-ил]метил]-4-(этоксикарбониламино)пиперидина
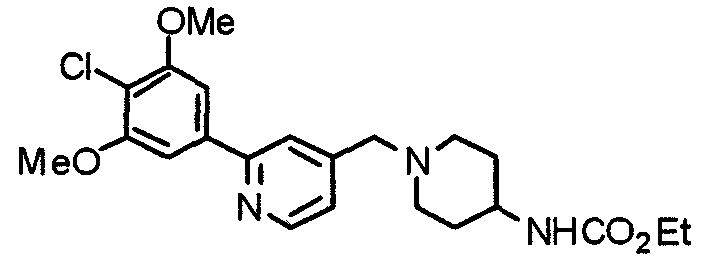
1-[[2-(4-Хлор-3,5-диметоксифенил)пиридин-4-ил]метил]пиперидин-4-карбоксамид (743 мг) обрабатывают по методике, аналогично описанной в примере получения 20, получая указанное в заголовке соединение.
Выход 887 мг (теоретическое количество).
1H-ЯМР (400 МГц, CDCl3) δ: 1,24 (т, 3H, J=7,1 Гц), 1,43-1,59 (м, 2H), 1,96 (д, 2H, J=11,4 Гц), 2,19 (т, 2H, J=11,0 Гц), 2,82 (д, 2H, J=11,5 Гц), 3,56 (с, 2H), 4,02 (с, 6H), 4,10 (кв, 2H, J=7,1 Гц), 7,26 (с, 2H), 7,66 (с, 1H), 7,71 (дд, 1H, J=5,6 Гц, 1,0 Гц), 8,6 (дд, 1H, J=4,9 Гц, 0,5 Гц).
Пример получения 36
Синтез 1-[[2-(4-хлор-3,5-диметоксифенил)пиридин-4-ил]метил]-4-метиламинопиперидина
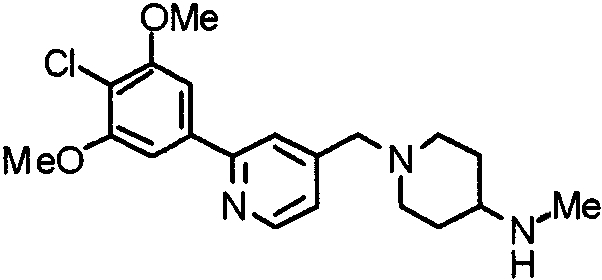
1-[[2-(4-Хлор-3,5-диметоксифенил)пиридин-4-ил]метил]-4-этоксикарбониламино)пиперидин (887 мг) обрабатывают по методике, аналогично описанной в примере получения 21, получая указанное в заголовке соединение.
Выход 195 мг (27%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,35-1,49 (м, 2H), 1,89 (д, 2H, J=12,3 Гц), 2,11 (т, 2H, J=9,4 Гц), 2,38-2,45 (м, 1H), 2,44 (с, 3H), 2,87 (д, 2H, J=10,7 Гц), 3,57 (с, 2H), 4,02 (с, 6H), 7,23-7,29 (м, 3H), 7,68 (с, 1H), 8,61 (д, 1H, J=4,9 Гц).
Пример 8
Синтез тетрагидрохлорида 1-[[2-(4-хлор-3,5-диметоксифенил)пиридин-4-ил]метил]-4-[N-[[2-(4-хлор-3,5-диметоксифенил)пиридин-4-ил]метил]-N-метиламино]пиперидина
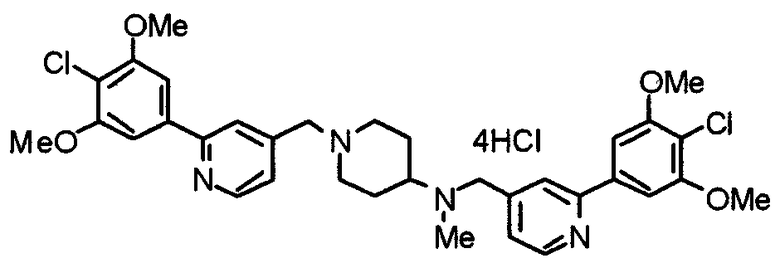
1-[[2-(4-Хлор-3,5-диметоксифенил)пиридин-4-ил]метил]-4-метиламинопиперидин (195 мг) и 2-(4-хлор-3,5-диметоксифенил)-4-хлорметилпиридин (152 мг) подвергают взаимодействию по методике, аналогично описанной в примере 2. Полученное таким образом свободное основание превращают в тетрагидрохлорид, получая указанное в заголовке соединение в виде желтого порошка.
Выход 300 мг (75%).
1H-ЯМР (400 МГц, определяемый как свободное основание, CDCl3) δ: 1,60-1,90 (м, 4H), 2,06 (т, 2H, J=11,7 Гц), 2,26 (с, 3H), 2,45-2,55 (м, 1H), 2,97 (д, 2H, J=11,3 Гц), 3,57 (с, 2H), 3,67 (с, 2H), 4,01 (с, 6H), 4,02 (с, 6H), 7,24-7,28 (м, 6H), 7,65 (с, 1H), 7,67 (с, 1H), 8,61 (д, 1H, J=5,4 Гц), 8,62 (д, 1H, J=5,4 Гц).
Пример получения 37
Синтез 4-(п-анизидино)-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
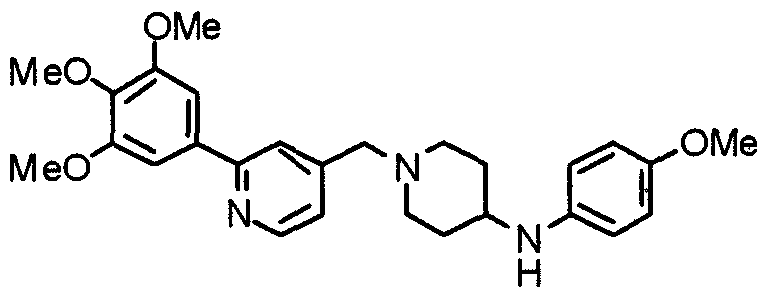
К раствору 1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]-4-пиперидона (2,17 г) в толуоле (40 мл) добавляют п-анизидин (900 мг) и молекулярные сита 4Å (6,0 г). Смесь кипятят с обратным холодильником в течение ночи, затем молекулярные сита отфильтровывают и фильтрат упаривают. Остаток растворяют в этаноле (40 мл) и добавляют борогидрид (276 мг) натрия. Смесь перемешивают при комнатной температуре в течение 2 часов перед концентрированием в вакууме. В остаток вводят воду и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле, используя смесь хлороформ/метанол (50:1), с получением указанного в заголовке соединения.
Выход 1,56 г (55%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,48 (шир, 2H), 2,05 (шир, 2H), 2,20 (шир, 2H), 2,86 (шир, 2H), 3,23 (с, 1H), 3,58 (с, 2H), 3,74 (с, 3H), 3,91 (с, 3H), 3,97 (с, 6H), 6,58 (д, 2H, J=8,8 Гц), 6,77 (д, 2H, J=9,0 Гц), 7,22 (д, 1H, J=5,1 Гц), 7,26 (с, 2H), 7,64 (с, 1H), 8,59 (д, 1H, J=4,9 Гц).
Пример получения 38
Синтез этил-2-(3,4,5-триметоксифенил)никотината
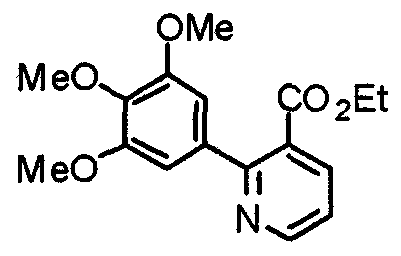
3,4,5-Триметоксифенилбороновую кислоту (694 мг) и этил-2-хлорникотината (608 мг) подвергают взаимодействию по методике, аналогично описанной в примере получения 1, получая указанное в заголовке соединение.
Выход 799 мг (77%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,10 (т, 3H, J=7,2 Гц), 3,89 (с, 9H), 4,19 (кв, 2H, J=7,2 Гц), 6,79 (с, 2H), 7,34 (дд, 1H, J=7,8 Гц, 4,8 Гц), 8,06 (дд, 1H, J=7,8 Гц, 1,7 Гц), 8,75 (дд, 1H, J=4,8 Гц, 1,7 Гц).
Пример получения 39
Синтез 3-гидроксиметил-2-(3,4,5-триметоксифенил)пиридина
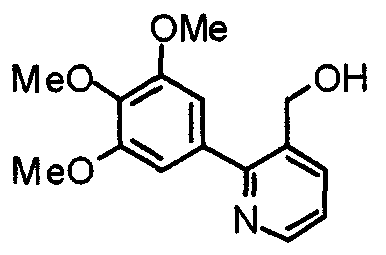
Этил-2-(3,4,5-триметоксифенил)никотинат (468 мг) обрабатывают по методике, аналогично описанной в примере получения 2, получая указанное в заголовке соединение.
Выход 293 мг (72%).
1H-ЯМР (400 МГц, CDCl3) δ: 3,90 (с, 9H), 4,72 (с, 2H), 6,83 (с, 2H), 7,32 (дд, 1H, J=7,9 Гц, 4,8 Гц), 7,92 (дд, 1H, J=7,9 Гц, 1,7 Гц), 8,62 (дд, 1H, J=4,8 Гц, 1,7 Гц).
Пример получения 40
Синтез 3-хлорметил-2-(3,4,5-триметоксифенил)пиридина
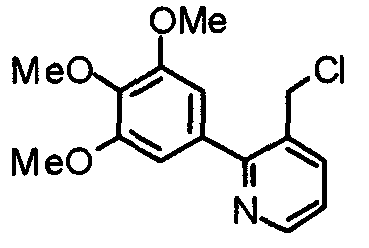
3-Гидроксиметил-2-(3,4,5-триметоксифенил)пиридин (293 мг) обрабатывают по методике, аналогично описанной в примере получения 3, получая указанное в заголовке соединение.
Пример 9
Синтез тригидрохлорида 4-[N-(4-метоксифенил)-N-[[2-(3,4,5-триметоксифенил)пиридин-3-ил]метил]амино]-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
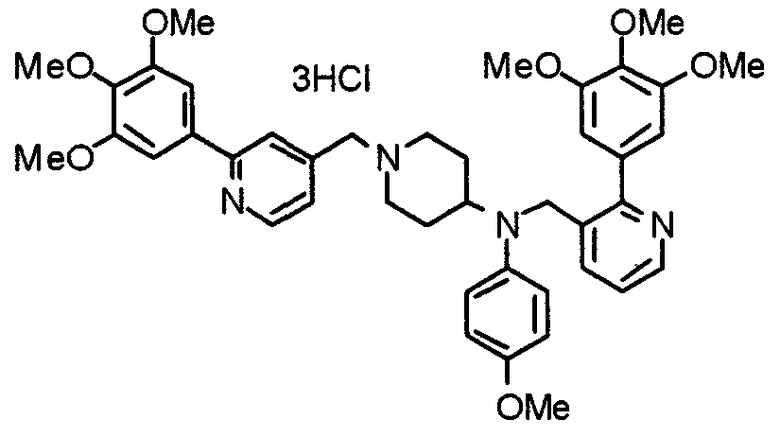
К раствору 4-(п-анизидино)-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина (139 мг) и 3-хлорметил-2-(3,4,5-триметоксифенил)пиридина (114 мг) в ацетонитриле (5 мл) добавляют карбонат калия (83 мг) и йодид калия (63 мг). Смесь перемешивают при 70°С в течение ночи и концентрируют при пониженном давлении. Остаток растворяют в хлороформе, промывают водой и насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле, используя смесь эфир/метанол (20:1) в качестве элюента. Полученное таким образом свободное основание превращают в тригидрохлорид, получая указанное в заголовке соединение в виде желтого порошка.
Выход 16 мг (8%).
1H-ЯМР (400 МГц, определяемый как свободное основание, CDCl3) δ: 1,60 (шир, 2H), 1,77 (шир, 2H), 2,09 (шир, 2H), 2,93 (шир, 2H), 3,45 (шир, 1H), 3,54 (с, 2H), 3,73 (с, 3H), 3,90 (с, 6H), 3,91 (с, 6H), 3,96 (с, 6H), 4,34 (с, 2H), 6,65 (д, 2H, J=9,0 Гц), 6,71 (с, 2H), 6,74 (д, 2H, J=9,0 Гц), 7,16-7,19 (м, 2H), 7,22 (с, 2H), 7,55 (с, 1H), 7,79 (д, 1H, J=7,0 Гц), 8,50 (шир, 1H), 8,58 (д, 1H, J=4,9 Гц).
Пример 10
Синтез тригидрохлорида 4-[N-(4-метоксифенил)-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
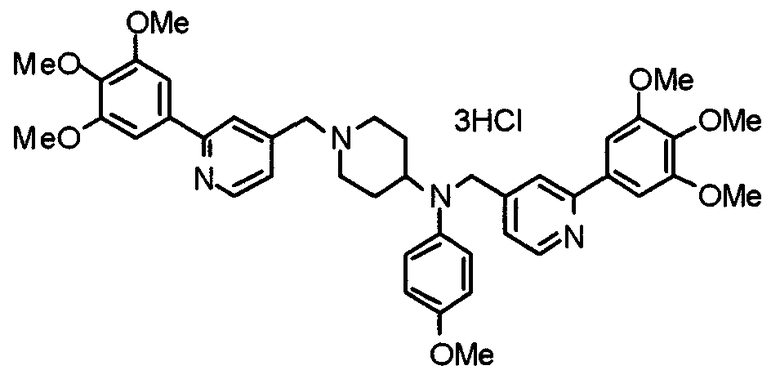
4-(п-Анизидино)-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидин (1,56 г) и 4-хлорметил-2-(3,4,5-триметоксифенил)пиридин (1,08 г) подвергают взаимодействию по методике, аналогично описанной в примере 9. Полученное свободное основание превращают в тригидрохлорид, получая указанное в заголовке соединение в виде желтого порошка.
Выход 1,17 г (40%).
1H-ЯМР (400 МГц, определяемый как свободное основание, CDCl3) δ: 1,68-1,97 (м, 4H), 2,09-2,23 (м, 2H), 2,98 (шир, 2H), 3 54-3,66 (м, 3H), 3,73 (с, 3H), 3,89 (с, 3H), 3,90 (с, 3H), 3,93 (с, 6H), 3,96 (с, 6H), 4,45 (с, 2H), 6,74 (д, 2H, J=9,2 Гц), 6,79 (д, 2H, J=9,2 Гц), 7,15 (с, 2H), 7,16-7,21 (м, 2H), 7,23 (с, 2H), 7,57 (с, 1H), 7,60 (с, 1H), 8,54 (д, 1H, J=5,1 Гц), 8,59 (д, 1H, J=4,9 Гц).
Пример получения 41
Синтез 3-(3,4,5-триметоксифенил)бензилового спирта
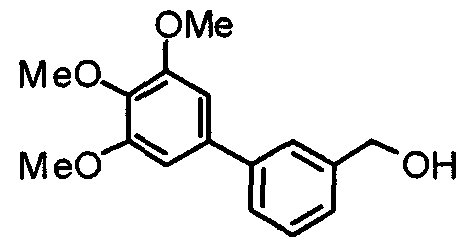
Этил-3-(3,4,5-триметоксифенил)бензоат (5,09 г) обрабатывают по методике, аналогично описанной в примере получения 2, получая указанное в заголовке соединение.
Выход 4,25 г (97%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,87 (т, 1H, J=6 0 Гц), 3,89 (с, 3H), 3,92 (с, 6H), 4,76 (д, 1H, J=5,6 Гц), 6,77 (с, 2H), 7,34 (д, 1H, J=7,4 Гц), 7,42 (т, 1H, J=7,5 Гц), 7,48 (д, 1H, J=7,6 Гц), 7,55 (с, 1H).
Пример получения 42
Синтез 3-(3,4,5-триметоксифенил)бензилхлорида
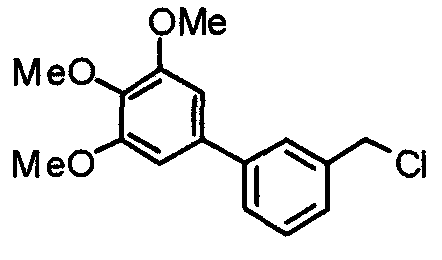
3-(3,4,5-Триметоксифенил)бензиловый спирт (1,21 г) обрабатывают по методике, аналогично описанной в примере получения 3, получая указанное в заголовке соединение.
Выход 893 мг (69%).
1H-ЯМР (400 МГц, CDCl3) δ: 3,87 (с, 3H), 3,90 (с, 6H), 4,62 (с, 2H), 6,75 (с, 2H), 7,33 (д, 1H, J=7,6 Гц), 7,39 (т, 1H, J=7,7 Гц), 7,48 (д, 1H, J=7,6 Гц), 7,54 (с, 1H).
Пример 11
Синтез дигидрохлорида 4-[N-(4-метоксифенил)-N-[3-(3,4,5-триметоксифенил)бензил]амино]-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
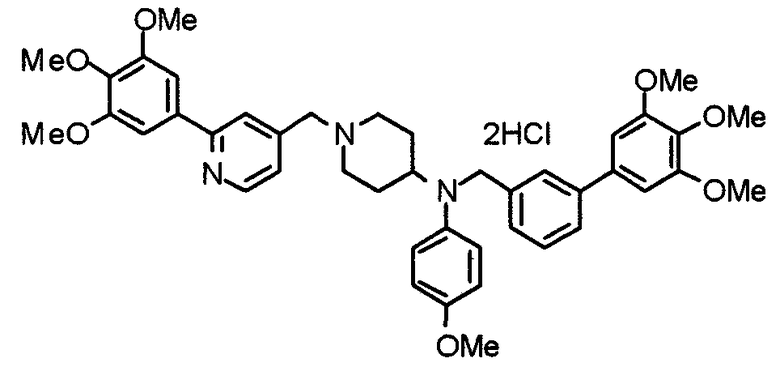
4-(п-Анизидино)-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидин (139 мг) и 3-(3,4,5-триметоксифенил)бензилхлорид (114 мг) подвергают взаимодействию по методике, аналогично описанной в примере 9. Полученное свободное основание превращают в дигидрохлорид, получая указанное в заголовке соединение в виде желтого порошка.
Выход 52 мг (22%).
1H-ЯМР (400 МГц, определяемый как свободное основание, CDCl3) δ: 1,77-1,92 (м, 5H), 2,14-2,20 (м, 2H), 2,95-3,00 (м, 5H), 2,14-2,20 (м, 2H), 2,95-3,00 (м, 2H), 3,58 (с, 2H), 3,72 (с, 3H), 3,88 (с, 3H), 3,89 (с, 6H), 3,90 (с, 3H), 3,96 (с, 6H), 4,47 (с, 2H), 6,70 (с, 2H), 6,74-6,83 (м, 4H), 7,20 (д, 1H, J=7,4 Гц), 7,23 (с, 2H), 7,25-7,27 (м, 1H), 7,33 (т, 1H, J=7,4 Гц), 7,38 (д, 1H, J=8,7 Гц), 7,43 (с, 1H), 7,62 (с, 1H), 8,59 (д, 1H, J=5,1 Гц).
Пример получения 43
Синтез этил-6-(3,4,5-триметоксифенил)никотината
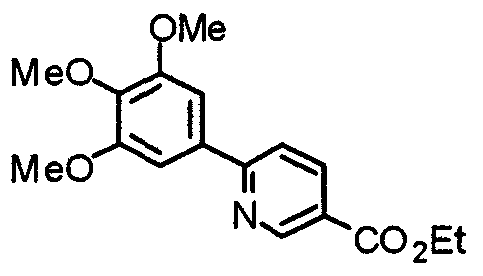
3,4,5-Триметоксифенилбороновую кислоту (1,16 г) и этил-6-хлорникотинат (1,02 г) подвергают взаимодействию по методике, аналогично описанной в примере получения 1, получая указанное в заголовке соединение.
Выход 1,42 г (82%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,43 (т, 3H, J=7,2 Гц), 3,92 (с, 3H), 3,98 (с, 6H), 4,44 (кв, 2H, J=7,2 Гц), 7,32 (с, 2H), 7,76 (д, 1H, J=8,3 Гц), 8,33 (дд, 1H, J=8,2 Гц, 2,2 Гц), 9,26 (д, 1H, J=2,2 Гц).
Пример получения 44
Синтез 5-гидроксиметил-2-(3,4,5-триметоксифенил)пиридина
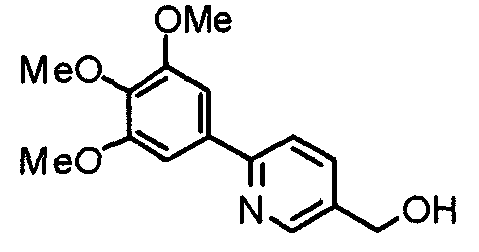
Этил-6-(3,4,5-триметоксифенил)никотинат (658 мг) обрабатывают по методике, аналогично описанной в примере получения 2, получая указанное в заголовке соединение.
Выход 482 мг (85%).
1H-ЯМР (400 МГц, CDCl3) δ: 3,91 (с, 3H), 3,97 (с, 6H), 4,76 (с, 2H), 7,23 (с, 2H), 7,68 (д, 1H, J=7,4 Гц), 7,78 (дд, 1H, J=7,4 Гц, 2,3 Гц), 8,63 (д, 1H, J=2,3 Гц).
Пример получения 45
Синтез 5-хлорметил-2-(3,4,5-триметоксифенил)пиридина
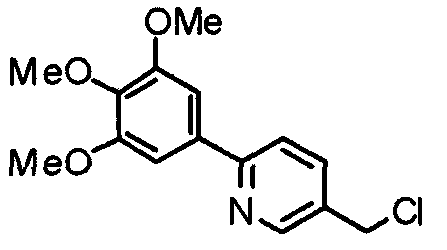
5-Гидроксиметил-2-(3,4,5-триметоксифенил)пиридин (685 мг) обрабатывают по методике, аналогично описанной в примере получения 3, получая указанное в заголовке соединение.
Выход 717 мг (теоретическое количество).
Пример 12
Синтез тригидрохлорида 4-[N-(4-метоксифенил)-N-[[2-(3,4,5-триметоксифенил)пиридин-5-ил]метил]амино]-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
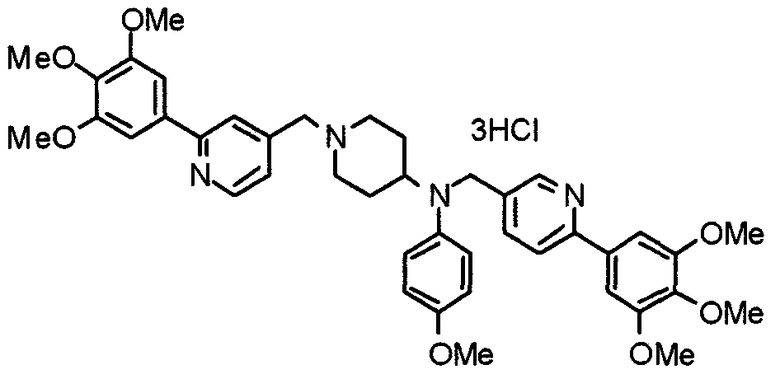
4-(п-Анизидино)-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидин (139 мг) и 5-хлорметил-2-(3,4,5-триметоксифенил)пиридин (114 мг) подвергают взаимодействию по методике, аналогично описанной в примере 9. Полученное свободное основание превращают в тригидрохлорид, получая указанное в заголовке соединение в виде желтого порошка.
Выход 13 мг (5%).
1H-ЯМР (400 МГц, определяемый как свободное основание, CDCl3) δ: 1,76 (шир, 2H), 1,88 (шир, 2H), 2,14 (шир, 2H), 2,97 (шир, 2H), 3,51 (шир, 1H), 3,57 (с, 2H), 3,73 (с, 3H), 3,89 (с, 3H), 3,90 (с, 3H), 3,94 (с, 6H), 3,96 (с, 6H), 4,42 (с, 2H), 6,78 (шир, 4H), 7,20 (шир, 3H), 7,23 (с, 2H), 7,57-7,70 (м, 3H), 8,58-8,60 (м, 2H).
Пример получения 46
Синтез этил-5-(3,4,5-триметоксифенил)никотината
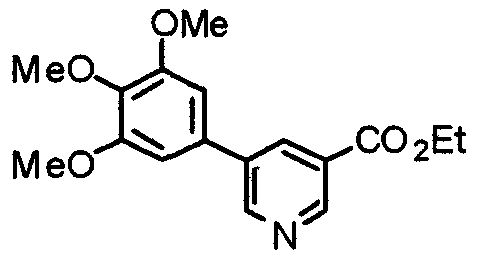
3,4,5-Триметоксифенилбороновую кислоту (6,36 г) и этил-5-бромникотинат (6,90 г) подвергают взаимодействию по методике, аналогично описанной в примере получения 1, получая указанное в заголовке соединение.
Выход 7,19 г (76%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,44 (т, 3H, J=7,1 Гц), 3,91 (с, 3H), 3,95 (с, 6H), 4,46 (кв, 2H, J=7,1 Гц), 6,79 (с, 2H), 8,44 (т, 1H, J=2,1 Гц), 8,96 (д, 1H, J=2,1 Гц), 9,18 (д, 1H, J=1,8 Гц).
Пример получения 47
Синтез 3-гидроксиметил-5-(3,4,5-триметоксифенил)пиридина
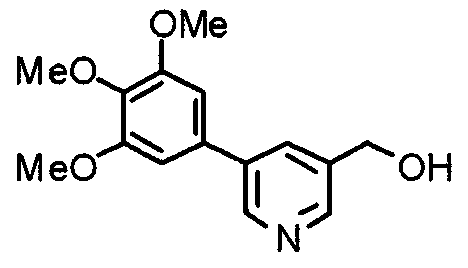
Этил-5-(3,4,5-триметоксифенил)никотинат (7,19 г) обрабатывают по методике, аналогично описанной в примере получения 2, получая указанное в заголовке соединение.
Выход 3,83 г (61%).
1H-ЯМР (400 МГц, CDCl3) δ: 3,88 (с, 3H), 3,89 (с, 6H), 4,39 (шир, 1H), 4,80 (с, 2H), 6,72 (с, 2H), 7,89 (т, 1H, J=1,2 Гц), 8,47 (д, 1H, J=2,1 Гц), 8,63 (д, 1H, J=2,2 Гц).
Пример получения 48
Синтез 3-хлорметил-5-(3,4,5-триметоксифенил)пиридина
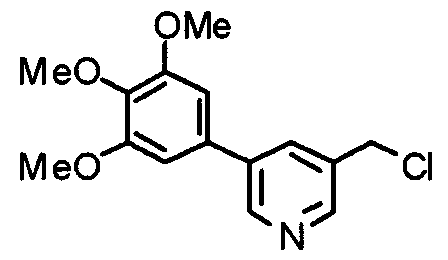
3-Гидроксиметил-5-(3,4,5-триметоксифенил)пиридин (2,85 г) обрабатывают по методике, аналогично описанной в примере получения 3, получая указанное в заголовке соединение.
Выход 1,97 г (65%).
1H-ЯМР (400 МГц, CDCl3) δ: 3,90 (с, 3H), 3,94 (с, 6H), 4,67 (с, 2H), 6,75 (с, 2H), 7,87 (т, 1H, J=2,1 Гц), 8,59 (д, 1H, J=2,0 Гц), 8,76 (д, 1H, J=2,1 Гц).
Пример 13
Синтез тригидрохлорида 4-[N-(4-метоксифенил)-N-[[5-(3,4,5-триметоксифенил)пиридин-3-ил]метил]амино]-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
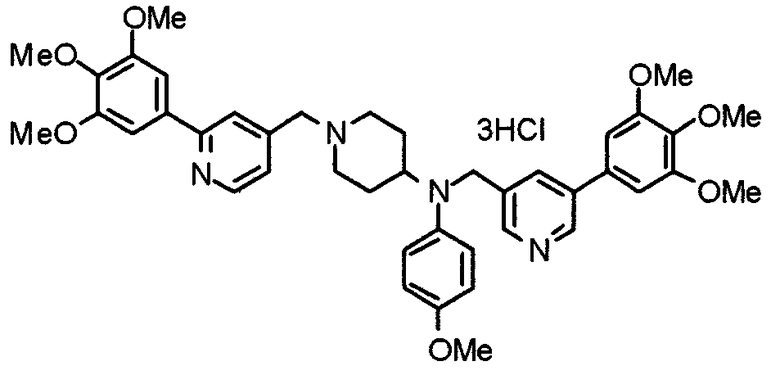
4-(п-Анизидино)-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидин (139 мг) и 3-хлорметил-5-(3,4,5-триметоксифенил)пиридин (114 мг) подвергают взаимодействию по методике, аналогично описанной в примере 9. Полученное свободное основание превращают в тригидрохлорид, получая указанное в заголовке соединение в виде желтого порошка.
Выход 14 мг (5%).
1H-ЯМР (400 МГц, определяемый как свободное основание, CDCl3) δ: 1,73-1,75 (м, 2H), 1,88 (д, 2H, J=11,3 Гц), 2,13 (т, 2H, J=11,3 Гц), 2,96 (д, 2H, J=11,5 Гц), 3,50 (шир, 1H), 3,55 (с, 2H), 3,72 (с, 3H), 3,88 (с, 3H), 3,89 (с, 9H), 3,96 (с, 6H), 4,45 (с, 2H), 6,65 (с, 2H), 6,76 (д, 2H, J=9,6 Гц), 6,80 (д, 2H, J=9,4 Гц), 7,20 (д, 1H, J=5,3 Гц), 7,22 (с, 2H), 7,59 (с, 1H), 7,67 (с, 1H), 8,50 (с, 1H), 8,59 (д, 1H, J=4,7 Гц), 8,62 (с, 1H).
Пример получения 49
Синтез 4-йод-2,6-диметоксифенола
К раствору 5-йод-1,2,3-триметоксибензола (3,2 г) в 1,2-дихлорэтане (40 мл) добавляют хлорид алюминия (1,6 г). Смесь перемешивают при 60°С в течение 4 часов и концентрируют при пониженном давлении. Остаток растворяют в 1 М водном растворе гидроксида натрия и промывают эфиром. Водный слой затем подкисляют и экстрагируют хлороформом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют при пониженном давлении, получая указанное в заголовке соединение в виде белого кристаллического порошка.
Выход 1,0 г (31%).
Пример получения 50
Синтез 1,3-диметокси-5-йод-2-изопропоксибензола
К суспензии 2,6-диметокси-4-йодфенола (1,0 г) и карбоната калия (938 мг) в ДМФА (10 мл) добавляют 2-йодпропан (507 мл). Смесь перемешивают при 60°С в течение 3 часов и концентрируют при пониженном давлении. К остатку добавляют этилацетат и воду, органический слой удаляют, промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле, используя смесь гексан/этилацетат (5:1) в качестве элюента, получая указанное в заголовке соединение.
Выход 788 мг (72%).
Пример получения 51
Синтез 3,5-диметокси-4-изопропоксифенилбороновой кислоты
1,3-Диметокси-5-йод-2-изопропоксибензол (2,25 г) обрабатывают по методике, аналогично описанной в примере получения 29, получая указанное в заголовке соединение.
Выход 1,23 г (74%).
Пример получения 52
Синтез этил-2-(3,4,5-диметокси-4-изопропоксифенил)изоникотината
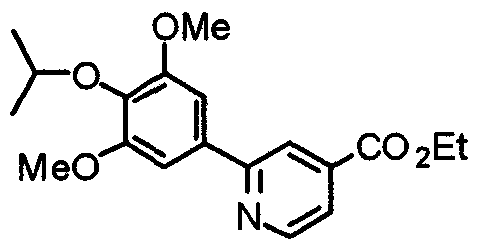
3,5-Диметокси-4-изопропоксифенилбороновую кислоту (1,23 г) и этил-2-хлоризоникотинат (0,95 г) подвергают взаимодействию по методике, аналогично описанной в примере получения 1, получая указанное в заголовке соединение.
Выход 1,57 г (89%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,33 (д, 6H, J=4,9 Гц), 1,44 (т, 3H, J=7,1 Гц), 3,95 (с, 6H), 4,42-4,49 (м, 3H), 7,29 (с, 2H), 7,75 (дд, 1H, J=4,9 Гц, 1,4 Гц), 8,24 (с, 1H), 8,80 (д, 1H, J=4,9 Гц).
Пример получения 53
Синтез 2-(3,5-диметокси-4-изопропоксифенил)-4-гидроксиметилпиридина
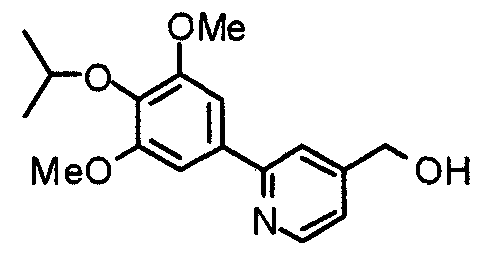
К суспензии литийалюминийгидрида (190 мг) в ТГФ (20 мл) по каплям добавляют раствор 2-(4-изопропокси-3,5-диметоксифенил)изоникотината (1,57 г) в ТГФ (30 мл) при охлаждении льдом в атмосфере аргона. Смесь перемешивают при 0°С в течение 30 минут и добавляют насыщенный водный хлорид аммония. После экстрагирования смеси этилацетатом органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле, элюируя смесью гексан/этилацетат (3:1) и затем смесью хлороформ/метанол (15:1), с получением указанного в заголовке соединения.
Выход 1,31 г (95%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,32 (д, 6H, J=6,1 Гц), 3,93 (с, 6H), 4,45 (квинтет, 1H, J=6,1 Гц), 4,81 (с, 2H), 7,20 (д, 1H, J=5,1 Гц), 7,23 (с, 2H), 7,68 (с, 1H), 8,62 (д, 1H, J=5,1 Гц).
Пример получения 54
Синтез 4-хлорметил-2-(3,5-диметокси-4-изопропоксифенил)пиридина
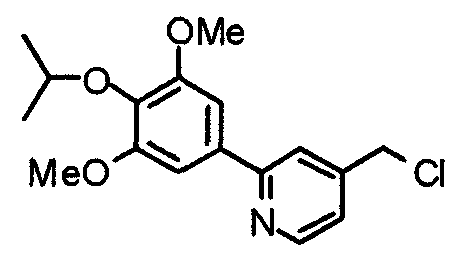
2-(3,5-Диметокси-4-изопропоксифенил)-4-гидроксиметилпиридин (1,49 г) обрабатывают по методике, аналогично описанной в примере получения 3, получая указанное в заголовке соединение.
Выход 1,33 г (84%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,32 (д, 6H, J=6,2 Гц), 3,94 (с, 6H), 4,45 (квинтет, 1H, J=6,1 Гц), 4,61 (с, 2H), 7,23-7,26 (м, 3H), 7,69 (с, 1H), 8,66 (д, 1H, J=5,1 Гц).
Пример получения 55
Синтез этиленкеталя 1-[[2-(3,5-диметокси-4-изопропоксифенил)пиридин-4-ил]метил]-4-пиперидона
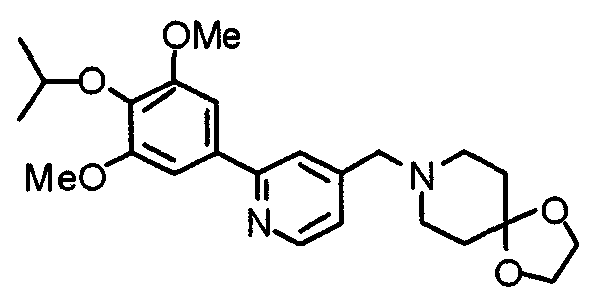
4-Хлорметил-2-(3,5-диметокси-4-изопропоксифенил)пиридин (643 мг) и этиленкеталь 4-пиперидона (287 мг) подвергают взаимодействию по методике, аналогично описанной в примере 2, получая указанное в заголовке соединение.
Выход 818 мг (95%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,32 (д, 6H, J=6,1 Гц), 1,78 (т, 4H, J=5,7 Гц), 2,57 (шир, 4H), 3,49 (с, 4H), 3,59 (с, 2H), 3,94 (с, 6H), 4,44 (квинтет, 1H, J=6,1 Гц), 7,21 (д, 1H, J=5,1 Гц), 7,23 (с, 2H), 7,65 (с, 1H), 8,59 (д, 1H, J=5,1 Гц).
Пример получения 56
Синтез 1-[[2-(3,5-диметокси-4-изопропоксифенил)пиридин-4-ил]метил]-4-пиперидона
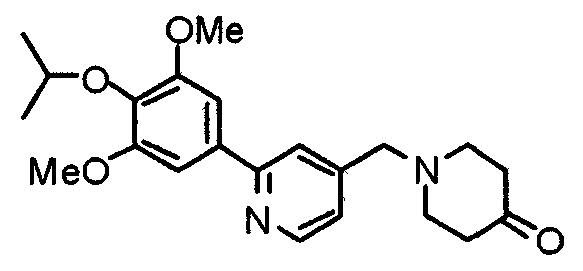
Этиленкеталь 1-[[2-(3,5-диметокси-4-изопропоксифенил)пиридин-4-ил]метил]-4-пиперидона (818 мг) обрабатывают по методике, аналогично описанной в примере получения 23, получая указанное в заголовке соединение.
Выход 717 мг (98%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,32 (д, 6H, J=6,2 Гц), 2,50 (т, 4H, J=6,1 Гц), 2,81 (т, 4H, J=6,1 Гц), 3,69 (с, 2H), 3,95 (с, 6H), 4,45 (квинтет, 1H, J=6,2 Гц), 7,24 (с, 2H), 7,25-7,27 (м, 1H), 7,68 (с, 1H), 8,63 (д, 1H, J=5,1 Гц).
Пример получения 57
Синтез 4-(п-анизидино)-1-[[2-(3,5-диметокси-4-изопропоксифенил)пиридин-4-ил]метил]пиперидина
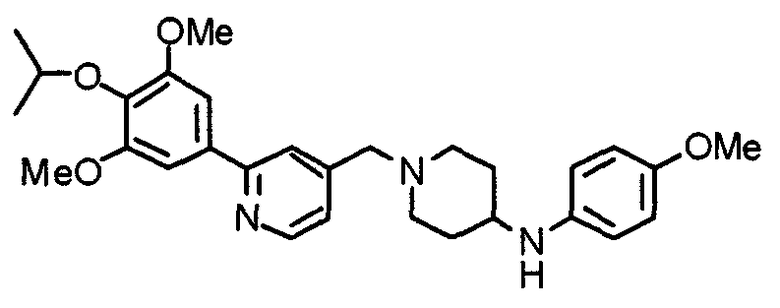
1-[[2-(3,5-Диметокси-4-изопропоксифенил)пиридин-4-ил]метил]-4-пиперидон (350 мг) и п-анизидин (123 мг) обрабатывают по методике, аналогично описанной в примере получения 37, получая указанное в заголовке соединение.
Выход 307 мг (69%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,32 (д, 6H, J=6,3 Гц), 1,46-1,52 (м, 2H), 2,00-2,24 (м, 2H), 2,22 (т, 2H, J=11,1 Гц), 2,86 (д, 2H, J=12,1 Гц), 3,18-3,28 (м, 1H), 3,58 (с, 2H), 3,74 (с, 3H), 3,94 (с, 6H), 4,40 (квинтет, 1H, J=6,3 Гц), 6,58 (д, 2H, J=6,6 Гц), 6,78 (д, 2H, J=6,6 Гц), 7,20 (д, 1H, J=5,1 Гц), 7,24 (с, 2H), 7,64 (с, 1H), 8,59 (д, 1H, J=5,1 Гц).
Пример 14
Синтез тригидрохлорида 1-[[2-(4-изопропокси-3,5-диметоксифенил)пиридин-4-ил]метил]-4-[N-[[2-(4-изопропокси-3,5-диметоксифенил)пиридин-4-ил]метил]-N-(4-метоксифенил)аминопиперидина
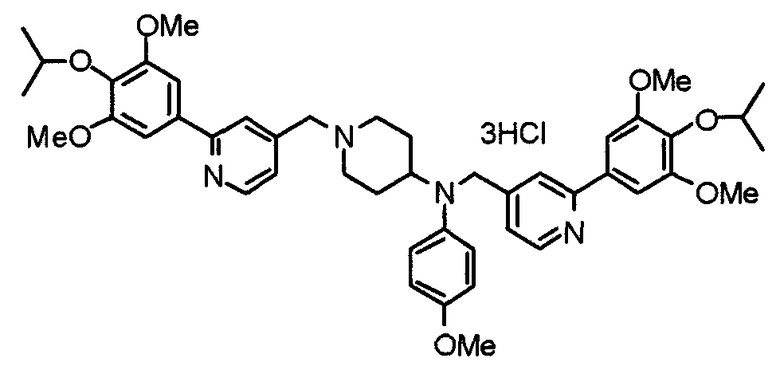
4-(п-Анизидино)-1-[[2-(3,5-диметокси-4-изопропоксифенил)пиридин-4-ил]метил]пиперидин (307 мг) и 4-хлорметил-2-(3,5-диметокси-4-изопропоксифенил)пиридин (201 мг) подвергают взаимодействию по методике, аналогично описанной в примере 9. Полученное свободное основание превращают в тригидрохлорид, получая указанное в заголовке соединение в виде желтого порошка.
Выход 230 мг (46%).
1H-ЯМР (400 МГц, определяемый как свободное основание, CDCl3) δ: 1,31 (д, 6H, J=3,3 Гц), 1,32 (д, 6H, J=6,8 Гц), 1,70-1,92 (м, 4H), 2,10-2,20 (м, 2H), 2,92-3,01 (м, 2H), 3,56 (с, 2H), 3,73 (с, 3H), 3,85-3,95 (м, 1H), 3,90 (с, 6H), 3,93 (с, 6H), 4,39-4,49 (м, 4H), 6,73 (д, 2H, J=4,8 Гц), 6,78 (д, 2H, J=4,8 Гц), 7,14 (с, 2H), 7,15-7,20 (м, 2H), 7,23 (с, 2H), 7,58 (с, 1H), 7,60 (с, 1H), 8,53 (д, 1H, J=5,1 Гц), 8,58 (д, 1H, J=5,1 Гц).
Пример получения 58
Синтез 4-бензиламино-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
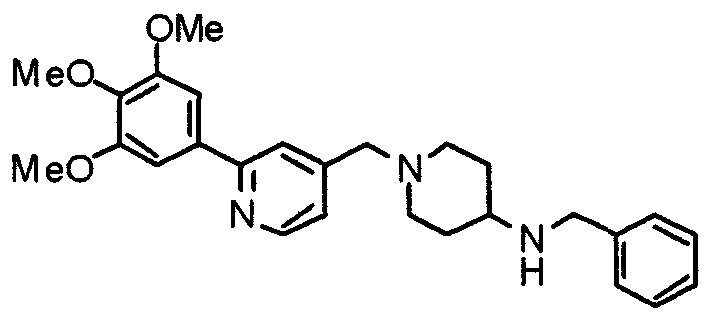
1-[[2-(3,4,5-Триметоксифенил)пиридин-4-ил]метил-4-пиперидон (1,40 г) и бензиламин (0,51 г) подвергают взаимодействию по методике, аналогично описанной в примере получения 37, получая указанное в заголовке соединение в виде желтого аморфного вещества.
Выход 1,20 г (68%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,40-1,60 (м, 2H), 1,88-2,09 (м, 5H), 2,54 (шир, 1H), 2,82-2,85 (м, 2H), 3,52 (с, 2H), 3,80 (с, 2H), 3,89 (с, 2H), 3,95 (с, 6H), 7,18-7,31 (м, 8H), 7,64 (с, 1H), 8,57 (д, 1H, J=5,1 Гц).
Пример 15
Синтез тетрагидрохлорида 4-[N-бензил-N-[[2-(3,4,5-триметоксифенил)пиридин-3-ил]метил]амино]-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
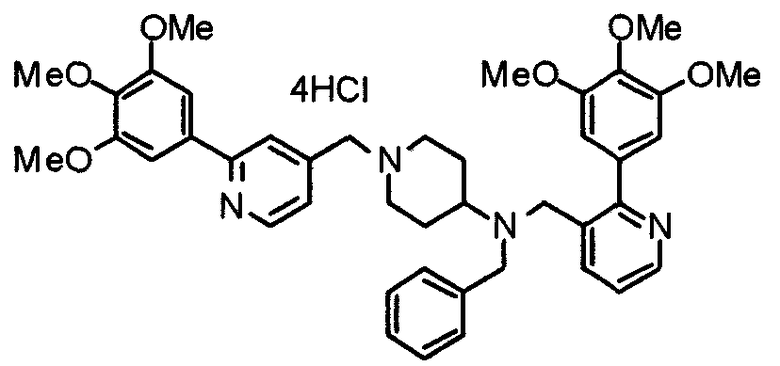
4-Бензиламино-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидин (134 мг) и 3-хлорметил-2-(3,4,5-триметоксифенил)пиридин (114 мг) подвергают взаимодействию по методике, аналогично описанной в примере 9. Полученное свободное основание превращают в тетрагидрохлорид, получая указанное в заголовке соединение в виде желтого порошка.
Выход 43 мг (17%).
1H-ЯМР (400 МГц, определяемый как свободное основание, CDCl3) δ: 1,63 (шир, 4H), 1,87 (шир, 2H), 2,39 (шир, 1H), 2,88 (шир, 2H), 3,49 (с, 2H), 3,57 (с, 2H), 3,68 (с, 2H), 3,86 (с, 6H), 3,88 (с, 3H), 3,90 (с, 3H), 3,96 (с, 6H), 6,60 (с, 2H), 7,17 (д, 1H, J=5,1 Гц), 7,22-7,29 (м, 8H), 7,56 (с, 1H), 8,02 (д, 1H, J=8,0 Гц), 8,50 (д, 1H, J=6,4 Гц), 8,58 (д, 1H, J=5,1 Гц).
Пример 16
Синтез тетрагидрохлорида 4-[N-бензил-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
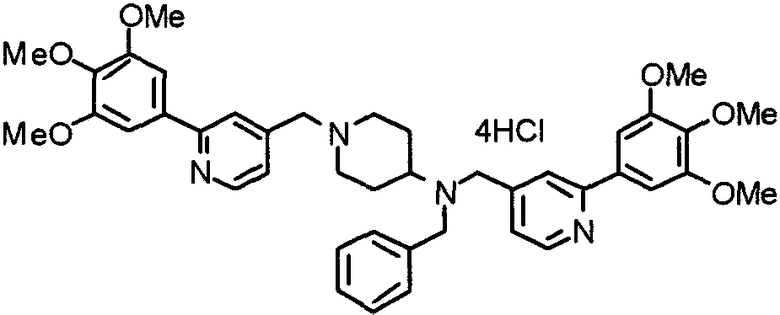
4-Бензиламино-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидин (230 мг) и 4-хлорметил-2-(3,4,5-триметоксифенил)пиридин (158 мг) подвергают взаимодействию по методике, аналогично описанной в примере 9. Полученное свободное основание превращают в тетрагидрохлорид, получая в результате указанное в заголовке соединение в виде желтого порошка.
Выход 172 мг (47%).
1H-ЯМР (400 МГц, определяемый как свободное основание, CDCl3) δ: 1,69-1,85 (м, 4H), 1,93-1,99 (м, 2H), 2,56 (шир, 1H), 2,93-3,00 (м, 2H), 3,51 (с, 2H), 3,71 (с, 2H), 3,74 (с, 2H), 3,90 (с, 6H), 3,96 (с, 6H), 3,96 (с, 6H), 7,18-7,32 (м, 9H), 7,38 (д, 2H, J=7,1 Гц), 7,59 (с, 1H), 7,68 (с, 1H), 8,56 (д, 1H, J=5,1 Гц), 8,60 (д, 1H, J=5,1 Гц).
Пример 17
Синтез тригидрохлорида 4-[N-бензил-N-[3-(3,4,5-триметоксифенил)бензил]амино]-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
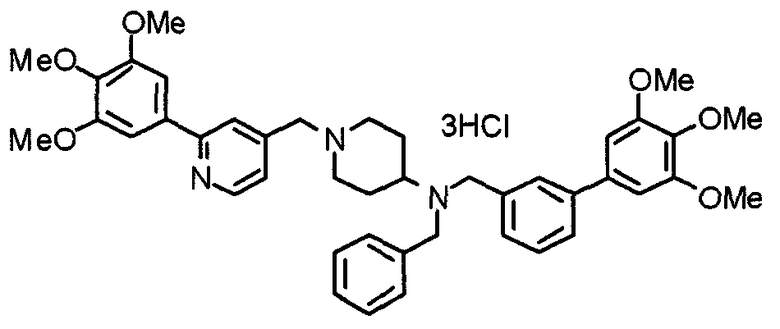
4-Бензиламино-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидин (134 мг) и 3-(3,4,5-триметоксифенил)бензилхлорид (114 мг) подвергают взаимодействию по методике, аналогично описанной в примере 9. Полученное свободное основание превращают в тригидрохлорид, получая указанное в заголовке соединение в виде желтого порошка.
Выход 47 мг (18%).
1H-ЯМР (400 МГц, определяемый как свободное основание, CDCl3) δ: 1,70-1,86 (м, 4H), 1,96 (шир, 2H), 2,59 (шир, 1H), 2,94 (шир, 2H), 3,51 (с, 2H), 3,70 (с, 2H), 3,74 (с, 2H), 3,89 (с, 3H), 3,90 (с, 3H), 3,92 (с, 6H), 3,96 (с, 6H), 6,75 (с, 2H), 7,18-7,30 (м, 6H), 7,35-7,40 (м, 5H), 7,56 (с, 1H), 7,60 (с, 1H), 8,58 (д, 1H, J=5,1 Гц).
Пример 18
Синтез тетрагидрохлорида 4-[N-бензил-N-[[2-(3,4,5-триметоксифенил)пиридин-5-ил]метил]амино]-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
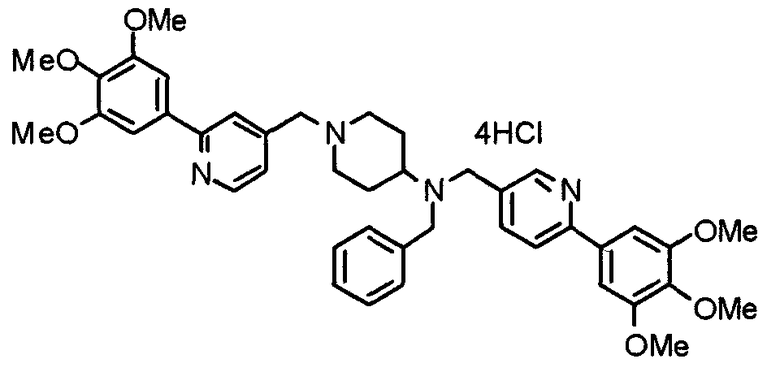
4-Бензиламино-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидин (134 мг) и 5-хлорметил-2-(3,4,5-триметоксифенил)пиридин (114 мг) подвергают взаимодействию по методике, аналогично описанной в примере 9. Полученное свободное основание превращают в тетрагидрохлорид, получая в результате указанное в заголовке соединение в виде желтого порошка.
Выход 44 мг (17%).
1H-ЯМР (400 МГц, определяемый как свободное основание, CDCl3) δ: 1,81 (шир, 4H), 1,96 (шир, 2H), 2,55 (шир, 1H), 2,96 (шир, 2H), 3,52 (с, 2H), 3,69 (с, 4H), 3,89 (с, 6H), 3,95 (с, 6H), 3,96 (с, 6H), 7,19-7,32 (м, 8H), 7,36-7,38 (м, 2H), 7,61 (д, 2H, J=7,6 Гц), 7,69-7,73 (м, 1H), 8,59 (д, 1H, J=4,9 Гц), 8,63 (с, 1H).
Пример 19
Синтез тетрагидрохлорида 4-[N-бензил-N-[[5-(3,4,5-триметоксифенил)пиридин-3-ил]метил]амино]-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
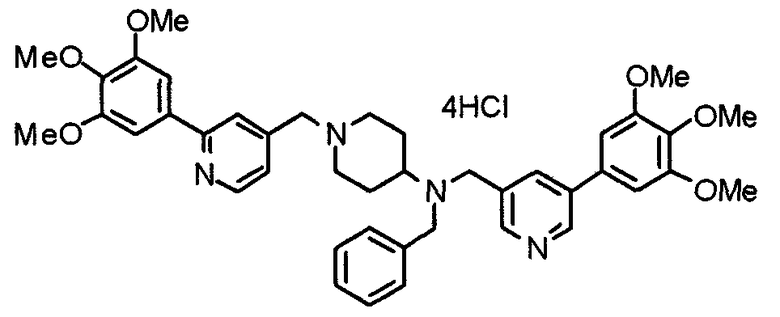
4-Бензиламино-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидин (134 мг) и 3-хлорметил-5-(3,4,5-триметоксифенил)пиридин (114 мг) подвергают взаимодействию по методике, аналогично описанной в примере 9. Полученное свободное основание превращают в тетрагидрохлорид, получая в результате указанное в заголовке соединение в виде желтого порошка.
Выход 26 мг (10%).
1H-ЯМР (400 МГц, определяемый как свободное основание, CDCl3) δ: 1,83 (шир, 4H), 1,97 (шир, 2H), 2,58 (шир, 1H), 2,95 (шир, 2H), 3,53 (с, 2H), 3,71 (с, 2H), 3,75 (с, 2H), 3,90 (с, 6H), 3,93 (с, 6H), 3,96 (с, 6H), 6,74 (с, 2H), 7,19-7,30 (м, 6H), 7,36 (д, 2H, J=6,8 Гц), 7,60 (с, 1H), 7,79 (с, 1H), 8,54 (с, 1H), 8,59 (д, 1H, J=5,1 Гц), 8,64 (с, 1H).
Пример получения 59
Синтез 1-(трет-бутоксикарбонил)-4-[N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]аминоэтил]пиперидина
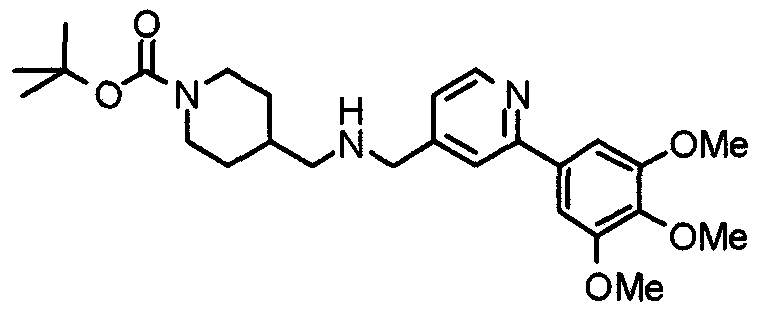
1-(трет-Бутоксикарбонил)-4-аминометилпиперидин (200 мг) и 4-хлорметил-2-(3,4,5-триметоксифенил)пиридин (183 мг) подвергают взаимодействию по методике, аналогично описанной в примере 2, получая указанное в заголовке соединение в виде желтого масла.
Выход 264 мг (90%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,12-1,27 (м, 3H), 1,45 (с, 9H), 1,60 (шир, 1H), 1,74 (д, 2H, J=12,9 Гц), 2,54 (д, 2H, J=6,6 Гц), 2,69 (шир, 2H), 3,87 (с, 2H), 3,90 (с, 3H), 3,97 (с, 6H), 4,03-4,14 (м, 2H), 7,20 (д, 1H, J=3,9 Гц), 7,24 (с, 2H), 7,65 (с, 1H), 8,60 (д, 1H, J=4,9 Гц).
Пример получения 60
Синтез 1-(трет-бутоксикарбонил)-4-[N-метил-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]аминометил]пиперидина
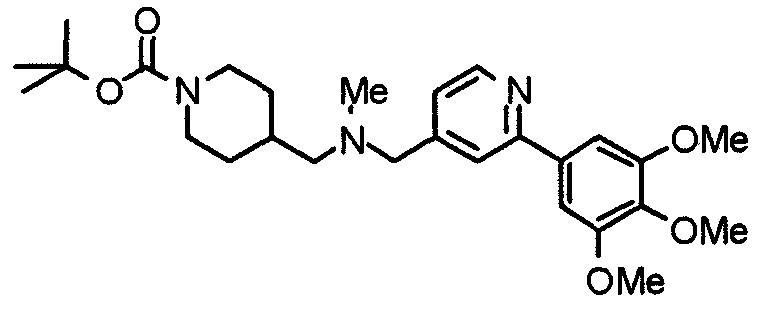
1-(трет-Бутоксикарбонил)-4-[N-[[3,4,5-триметоксифенил)пиридин-4-ил]метил]аминоэтил]пиперидин (264 мг) обрабатывают по методике, аналогично описанной в примере получения 11, получая указанное в заголовке соединение в виде желтого масла.
Выход 157 мг (58%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,00-1,09 (м, 2H), 1,43 (с, 9H), 1,65-1,70 (м, 1H), 1,79 (д, 2H, J=12,7 Гц), 2,21 (д, 2H, J=7,4 Гц), 2,23 (с, 3H), 2,69 (шир, 2H), 3,52 (с, 2H), 3,89 (с, 3H), 3,96 (с, 6H), 4,07-4,13 (м, 2H), 7,20 (д, 1H, J=4,9 Гц), 7,24 (с, 2H), 7,64 (с, 1H), 8,58 (д, 1H, J=5,1 Гц).
Пример получения 61
Синтез 4-[N-метил-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]аминометил]пиперидина
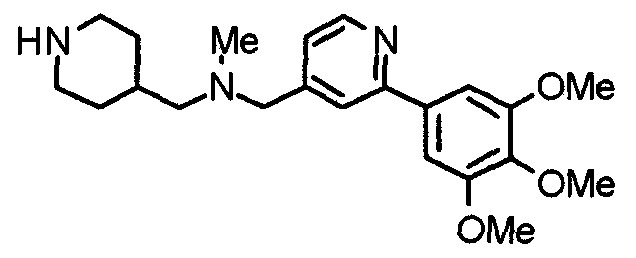
1-(трет-Бутоксикарбонил)-4-[N-метил-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]аминометил]пиперидин (152 мг) обрабатывают по методике, аналогично описанной в примере получения 12, получая указанное в заголовке соединение в виде желтых кристаллов.
Выход 105 мг (88%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,00-1,10 (м, 2H), 1,60-1,68 (м, 1H), 1,80 (д, 2H, J=12,5 Гц), 2,03 (шир, 1H), 2,20 (д, 2H, J=8,4 Гц), 2,21 (с, 3H), 2,58 (дт, 2H, J=12,1 Гц, 2,1 Гц), 3,05 (д, 2H, J=12,1 Гц), 3,51 (с, 2H), 3,89 (с, 3H), 3,95 (с, 6H), 7,20 (д, 1H, J=5,1 Гц), 7,24 (с, 2H), 7,65 (с, 1H), 8,57 (д, 1H, J=5,9 Гц).
Пример 20
Синтез диоксалата 4-[N-метил-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]аминометил]-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
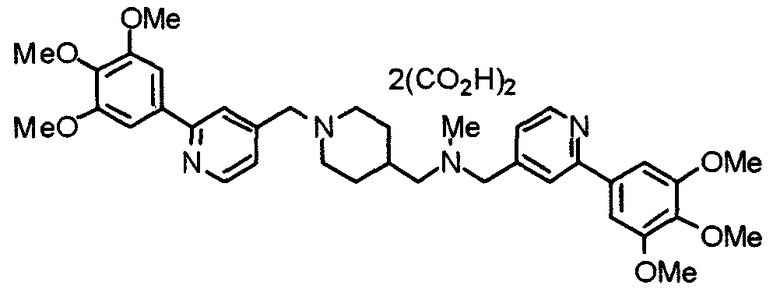
4-[N-Метил-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]аминометил]пиперидин (96 мг) и 4-хлорметил-2-(3,4,5-триметоксифенил)пиридин (73 мг) подвергают взаимодействию по методике, аналогично описанной в примере 2. После превращения полученного продукта в диоксалат получают указанное в заголовке соединение в виде белого порошка.
Выход 109 мг (40%).
1H-ЯМР (400 МГц, определяемый как свободное основание, CDCl3) δ: 1,19-1,27 (м, 2H), 1,56 (шир, 1H), 1,81 (д, 2H, J=11,1 Гц), 1,99-2,04 (м, 2H), 2,23 (с, 5H), 2,88 (д, 2H, J=11,1 Гц), 3,53 (с, 4H), 3,89 (с, 3H), 3,90 (с, 3H), 3,94 (с, 6H), 3,96 (с, 6H), 7,20 (шир, 2H), 7,23 (с, 4H), 7,61 (с, 1H), 7,64 (с, 1H), 8,58 (д, 2H, J=4,9 Гц).
Пример получения 62
Синтез 4-(3,5-диметоксифениламино)-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
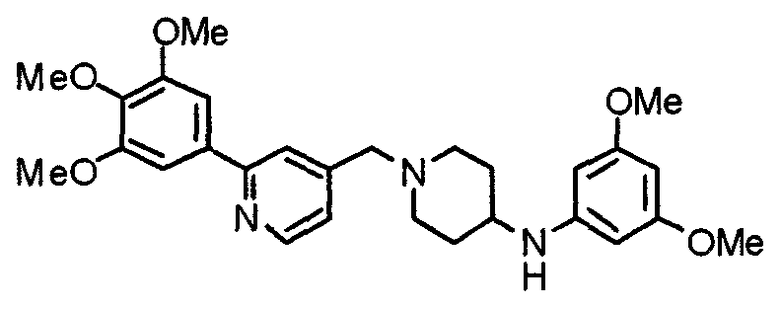
1-[[2-(3,4,5-Триметоксифенил)пиридин-4-ил]метил]-4-пиперидон (1,40 г) и 3,5-диметоксианилин (722 мг) подвергают взаимодействию по методике, аналогично описанной в примере получения 37, получая указанное в заголовке соединение.
Выход 800 мг (41%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,40-1,90 (м, 2H), 1,95-2,50 (м, 4H), 2,93 (шир, 2H), 3,31 (шир, 1H), 3,65 (шир, 2H), 3,72 (с, 6H), 3,88 (с, 3H), 3,96 (с, 6H), 5,76 (с, 2H), 5,85 (с, 1H), 7,20-7,35 (м, 3H), 7,73 (шир, 1H), 8,60 (д, 1H, J=4,9 Гц).
Пример 21
Синтез тригидрохлорида 4-[N-(3,5-диметоксифенил)-N-[[2-(3,4,5-триметоксифенил)пиридин-3-ил]метил]амино]-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
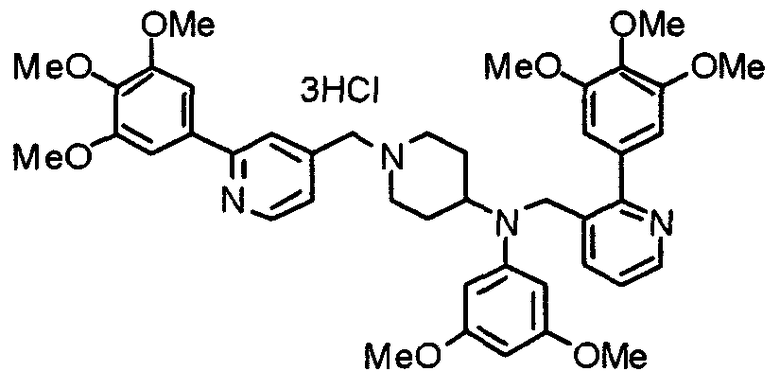
4-(3,5-Диметоксифениламино)-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидин (148 мг) и 3-хлорметил-2-(3,4,5-триметоксифенил)пиридин (114 мг) подвергают взаимодействию по методике, аналогично описанной в примере 9. Полученное свободное основание превращают в тригидрохлорид, получая указанное в заголовке соединение в виде желтого порошка.
Выход 29 мг (11%).
1H-ЯМР (400 МГц, определяемый как свободное основание, CDCl3) δ: 1,60-1,63 (м, 2H), 1,79 (д, 2H, J=11,7 Гц), 2,13 (т, 2H, J=11,4 Гц), 2,94 (д, 2H, J=11,3 Гц), 3,54 (с, 2H), 3,71 (с, 6H), 3,78-3,84 (м, 1H), 3,90 (с, 3H), 3,91 (с, 6H), 3,92 (с, 3H), 3,96 (с, 6H), 4,41 (с, 2H), 5,84 (с, 2H), 6,72 (с, 2H), 7,09-7,24 (м, 5H), 7,53 (с, 1H), 7,71 (д, 1H, J=6,6 Гц), 8,51 (дд, 1H, J=4,7 Гц, 1,6 Гц), 8,59 (д, 1H, J=4,9 Гц).
Пример получения 63
Синтез этил-2-(3,4,5-триметоксифенил)бензоата
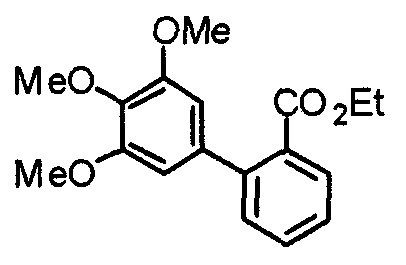
3,4,5-Триметоксифенилбороновую кислоту (649 мг) и этил-2-бромбензоат (479 мг) подвергают взаимодействию по методике, аналогично описанной в примере получения 1, получая указанное в заголовке соединение.
Выход 655 мг (69%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,04 (т, 3H, J=7,2 Гц), 3,86 (с, 6H), 3,89 (с, 3H), 4,12 (кв, 2H, J=7,2 Гц), 6,54 (с, 2H), 7,40-7,42 (м, 2H), 7,51 (т, 1H, J=7,8 Гц), 7,77 (д, 1H, J=6,8 Гц).
Пример получения 64
Синтез 2-(3,4,5-триметоксифенил)бензилового спирта
Этил-2-(3,4,5-триметоксифенил)бензоат (655 мг) обрабатывают по методике, аналогично описанной в примере получения 2, получая указанное в заголовке соединение.
Выход 630 мг (теоретическое количество).
1H-ЯМР (400 МГц, CDCl3) δ: 3,85 (с, 6H), 3,90 (с, 3H), 4,61 (с, 2H), 6,61 (с, 2H), 7,26-7,39 (м, 3H), 7,53 (д, 1H, J=6,8 Гц).
Пример получения 65
Синтез 2-(3,4,5-триметоксифенил)бензилхлорида
2-(3,4,5-Триметоксифенил)бензиловый спирт (630 мг) обрабатывают по методике, аналогично описанной в примере получения 3, получая указанное в заголовке соединение.
Выход 615 мг (теоретическое количество).
1H-ЯМР (400 МГц, CDCl3) δ: 3,87 (с, 6H), 3,90 (с, 3H), 4,53 (с, 2H), 6,66 (с, 2H), 7,29-7,32 (м, 1H), 7,34-7,39 (м, 2H), 7,50-7,52 (м, 1H).
Пример 22
Синтез дигидрохлорида 4-[N-(3,5-диметоксифенил)-N-[2-(3,4,5-триметоксифенил)бензил]амино]-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
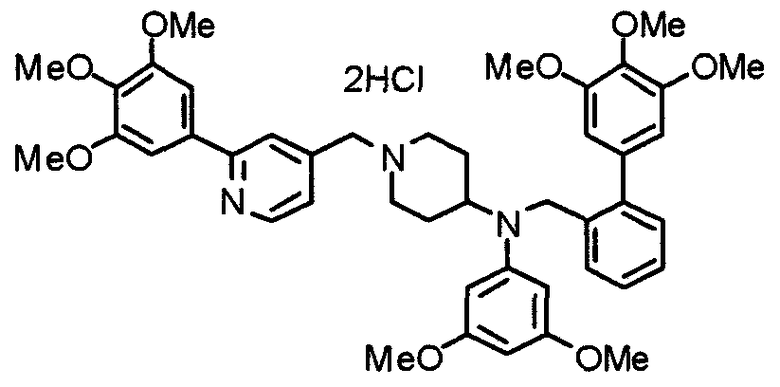
4-(3,5-Диметоксифениламино)-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидин (148 мг) и 2-(3,4,5-триметоксифенил)бензилхлорид (114 мг) подвергают взаимодействию по методике, аналогично описанной в примере 9. Полученное свободное основание превращают в дигидрохлорид, получая указанное в заголовке соединение в виде желтого порошка.
Выход 20 мг (8%).
1H-ЯМР (400 МГц, определяемый как свободное основание, CDCl3) δ: 1,50-1,90 (м, 4H), 2,05-2,20 (м, 2H), 2,92 (шир, 2H), 3,52 (шир, 3H), 3,68 (с, 6H), 3,85 (с, 6H), 3,88 (с, 3H), 3,89 (с, 3H), 3,94 (с, 6H), 4,31 (с, 2H), 5,85 (шир, 3H), 6,52 (с, 2H), 7,05-7,27 (м, 6H), 7,34 (с, 1H), 7,51 (с, 1H), 8,56 (с, 1H).
Пример 23
Синтез тригидрохлорида 4-[N-(3,5-диметоксифенил)-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
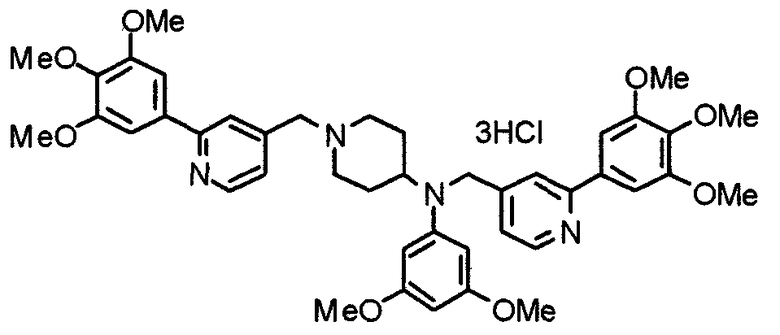
4-(3,5-Диметоксифениламино)-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидин (148 мг) и 4-хлорметил-2-(3,4,5-триметоксифенил)пиридин (114 мг) подвергают взаимодействию по методике, аналогично описанной в примере 9. Полученное свободное основание превращают в тригидрохлорид, получая указанное в заголовке соединение в виде желтого порошка.
Выход 40 мг (18%).
1H-ЯМР (400 МГц, определяемый как свободное основание, CDCl3) δ: 1,68-1,90 (м, 4H), 2,12-2,22 (м, 2H), 2,94-3,02 (м, 2H), 3,57 (с, 2H), 3,71 (с, 6H), 3,81-3,83 (м, 1H), 3,89 (с, 3H), 3,90 (с, 3H), 3,93 (с, 6H), 3,96 (с, 6H), 4,52 (с, 2H), 5,89-5,94 (м, 3H), 7,14 (д, 1H, J=5,3 Гц), 7,16 (с, 2H), 7,20 (д, 1H, J=3,7 Гц), 7,22 (с, 2H), 7,54-7,60 (м, 2H), 8,55 (д, 1H, J=5,1 Гц), 8,59 (д, 1H, J=5,1 Гц).
Пример 24
Синтез дигидрохлорида 4-[N-(3,5-диметоксифенил)-N-[3-(3,4,5-триметоксифенил)бензил]амино]-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
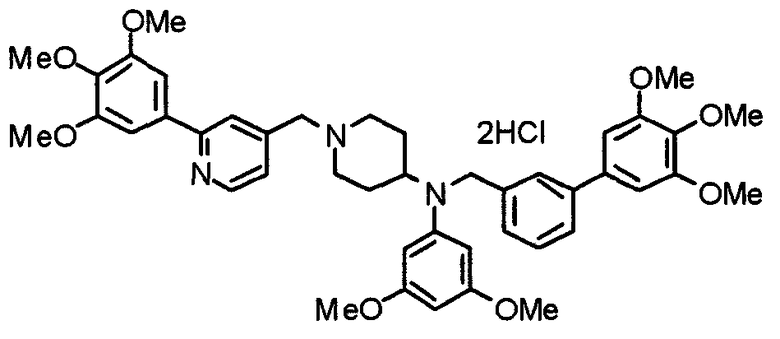
4-(3,5-Диметоксифениламино)-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидин (148 мг) и 3-(3,4,5-триметоксифенил)бензилхлорид (114 мг) подвергают взаимодействию по методике, аналогично описанной в примере 9. Полученное свободное основание превращают в дигидрохлорид, получая указанное в заголовке соединение в виде желтого порошка.
Выход 41 мг (16%).
1H-ЯМР (400 МГц, определяемый как свободное основание, CDCl3) δ: 1,78-1,88 (м, 4H), 2,16 (т, 2H, J=10,7 Гц), 2,96 (д, 2H, J=11,3 Гц), 3,56 (с, 2H), 3,70 (с, 6H), 3,73-3,84 (м, 1H), 3,87 (с, 3H), 3,89 (с, 6H), 3,90 (с, 3H), 3,95 (с, 6H), 4,54 (с, 2H), 5,95 (с, 2H), 6,71 (с, 2H), 7,19-7,26 (м, 4H), 7,31-7,39 (м, 3H), 7,42 (с, 1H), 7,59 (с, 1H), 8,58 (д, 1H, J=4,9 Гц).
Пример 25
Синтез тригидрохлорида 4-[N-(3,5-диметоксифенил)-N-[[2-(3,4,5-триметоксифенил)пиридин-5-ил]метил]амино]-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
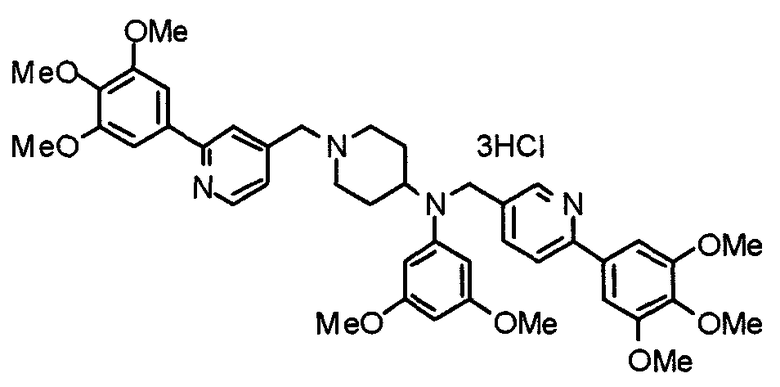
4-(3,5-Диметоксифениламино)-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидин (148 мг) и 5-хлорметил-2-(3,4,5-триметоксифенил)пиридин (114 мг) подвергают взаимодействию по методике, аналогично описанной в примере 9. Полученное свободное основание превращают в тригидрохлорид, получая указанное в заголовке соединение в виде желтого порошка.
Выход 23 мг (10%).
1H-ЯМР (400 МГц, определяемый как свободное основание, CDCl3) δ: 1,64 (шир, 2H), 1,82 (шир, 2H), 2,10 (шир, 2H), 2,94 (шир, 2H), 3,48-3,60 (м, 3H), 3,64 (с, 6H), 3,82 (с, 3H), 3,83 (с, 3H), 3,87 (с, 6H), 3,90 (с, 6H), 4,46 (с, 2H), 5,85 (шир, 3H), 7,05-7,24 (м, 6H), 7,53-7,54 (м, 2H), 8,51 (с, 1H), 8,54 (шир, 1H).
Пример получения 66
Синтез этил-4-(3,4,5-триметоксифенил)бензоата
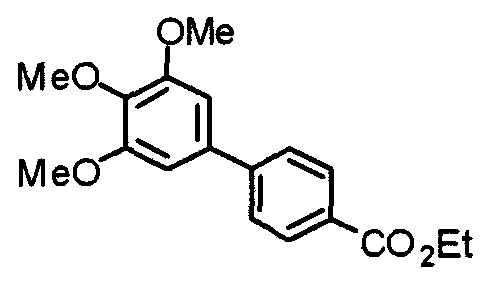
3,4,5-Триметоксифенилбороновую кислоту (2,01 г) и этил-4-бромбензоат (2,29 г) подвергают взаимодействию по методике, аналогично описанной в примере получения 1, получая указанное в заголовке соединение.
Выход 2,99 г (95%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,42 (т, 3H, J=7,2 Гц), 3,90 (с, 3H), 3,94 (с, 6H), 4,38 (кв, 2H, J=7,2 Гц), 6,81 (с, 2H), 7,62 (д, 2H, J=8,2 Гц), 8,10 (д, 2H, J=8,2 Гц).
Пример получения 67
Синтез 4-(3,4,5-триметоксифенил)бензилового спирта
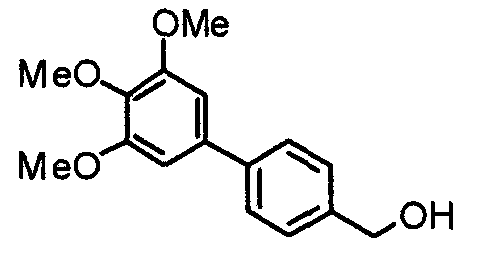
Этил-4-(3,4,5-триметоксифенил)бензоат (2,99 г) обрабатывают по методике, аналогично описанной в примере получения 2, получая указанное в заголовке соединение.
Выход 1,83 г (71%).
Пример получения 68
Синтез 2-(3,4,5-триметоксифенил)бензилхлорида
4-(3,4,5-Триметоксифенил)бензиловый спирт (1,83 г) обрабатывают по методике, аналогично описанной в примере получения 3, получая указанное в заголовке соединение.
Выход 1,65 г (84%).
1H-ЯМР (400 МГц, CDCl3) δ: 3,90 (с, 3H), 3,93 (с, 6H), 4,65 (с, 2H), 6,77 (с, 2H), 7,46 (д, 2H, J=8,0 Гц), 7,55 (д, 2H, J=8,0 Гц).
Пример 26
Синтез дигидрохлорида 4-[N-(3,5-диметоксифенил)-N-[[4-(3,4,5-триметоксифенил)бензил]амино]-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
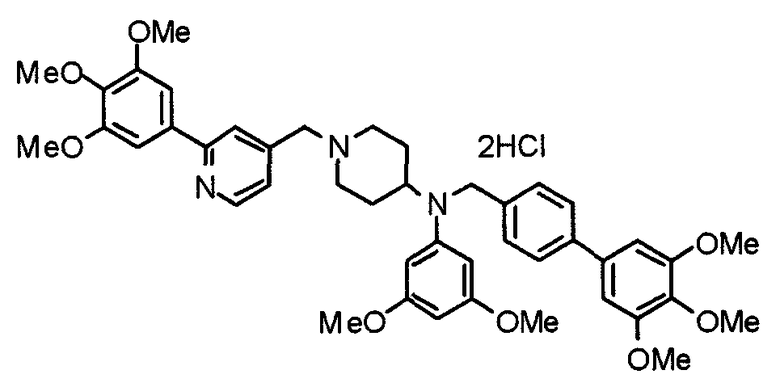
4-(3,5-Диметоксифениламино)-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидин (148 мг) и 4-(3,4,5-триметоксифенил)бензилхлорид (114 мг) подвергают взаимодействию по методике, аналогично описанной в примере 9. Полученное свободное основание превращают в дигидрохлорид, получая указанное в заголовке соединение в виде желтого порошка.
Выход 35 мг (14%).
1H-ЯМР (400 МГц, определяемый как свободное основание, CDCl3) δ: 1,80-1,89 (м, 4H), 2,17 (шир, 2H), 2,97 (д, 2H, J=10,5 Гц), 3,57 (с, 2H), 3,70 (с, 6H), 3,77-3,84 (м, 1H), 3,87 (с, 3H), 3,90 (с, 3H), 3,91 (с, 6H), 3,96 (с, 6H), 4,52 (с, 2H), 5,93 (с, 2H), 6,74 (с, 2H), 7,19-7,22 (м, 4H), 7,31 (д, 2H, J=8,2 Гц), 7,46 (д, 2H, J=8,2 Гц), 7,60 (с, 1H), 8,59 (д, 1H, J=5,1 Гц).
Пример получения 69
Синтез 4-(3,4-метилендиоксифениламино)-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
1-[[2-(3,4,5-Триметоксифенил)пиридин-4-ил]метил]-4-пиперидон (1,40 г) и 3,4-метилендиоксианилин (646 мг) подвергают взаимодействию по методике, аналогично описанной в примере получения 37, получая указанное в заголовке соединение.
Выход 810 мг (43%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,63 (шир, 2H), 2,02-2,60 (м, 4H), 2,80-3,15 (м, 2H), 3,25 (шир, 1H), 3,70 (шир, 2H), 3,88 (с, 3H), 3,96 (с, 6H), 5,83 (с, 2H), 6,02 (д, 1H, J=8,3 Гц), 6,22 (с, 1H), 6,61 (д, 1H, J=8,3 Гц), 7,18-7,28 (м, 3H), 7,64 (шир, 1H), 8,60 (д, 1H, J=4,9 Гц).
Пример 27
Синтез тригидрохлорида 4-[N-(3,4-метилендиоксифенил)-N-[[2-(3,4,5-триметоксифенил)пиридин-3-ил]метил]амино]-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
4-(3,4-Метилендиоксифениламино)-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидин (119 мг) и 3-хлорметил-2-(3,4,5-триметоксифенил)пиридин (114 мг) подвергают взаимодействию по методике, аналогично описанной в примере 9. Полученное свободное основание превращают в тригидрохлорид, получая указанное в заголовке соединение в виде желтого порошка.
Выход 30 мг (14%).
1H-ЯМР (400 МГц, определяемый как свободное основание, CDCl3) δ: 1,45-2,25 (м, 6H), 2,90 (шир, 2H), 3,40 (шир, 1H), 3,55 (шир, 2H), 3,87 (с, 3H), 3,88 (с, 9H), 3,93 (с, 6H), 4,28 (с, 2H), 5,82 (с, 2H), 6,10 (шир, 1H), 6,28 (с, 1H), 6,58 (д, 1H, J=8,4 Гц), 6,67 (с, 2H), 7,12-7,30 (м, 4H), 7,52 (шир, 1H), 7,75 (шир, 1H), 8,51 (шир, 1H), 8,57 (шир, 1H).
Пример 28
Синтез дигидрохлорида 4-[N-(3,4-метилендиоксифенил)-N-[2-(3,4,5-триметоксифенил)бензил]амино]-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
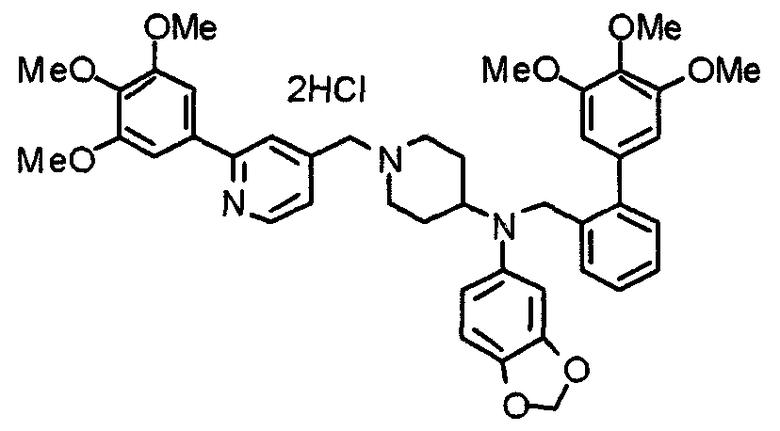
4-(3,4-Метилендиоксифениламино)-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидин (119 мг) и 2-(3,4,5-триметоксифенил)бензилхлорид (114 мг) подвергают взаимодействию по методике, аналогично описанной в примере 9. Полученное свободное основание превращают в дигидрохлорид, получая указанное в заголовке соединение в виде желтого порошка.
Выход 13 мг (6%).
1H-ЯМР (400 МГц, определяемый как свободное основание, CDCl3) δ: 1,61 (шир, 2H), 1,78 (шир, 2H), 2,10 (шир, 2H), 2,91 (шир, 2H), 3,50-3,54 (м, 3H), 3,87 (с, 6H), 3,90 (с, 3H), 3,92 (с, 3H), 3,99 (с, 6H), 4,26 (с, 2H), 5,82 (с, 2H), 6,12 (д, 1H, J=8,6 Гц), 6,32 (с, 1H), 6,53 (с, 2H), 6,62 (д, 1H, J=8,6 Гц), 7,17-7,26 (м, 6H), 7,42 (шир, 1H), 7,55 (с, 1H), 8,58 (д, 1H, J=4,9 Гц).
Пример 29
Синтез тригидрохлорида 4-[N-(3,4-метилендиоксифенил)-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
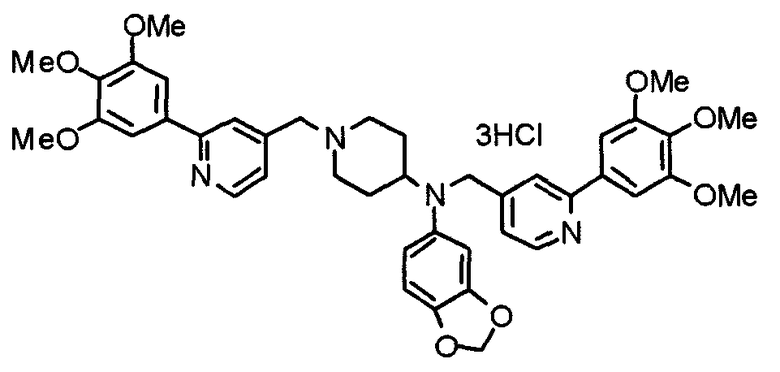
4-(3,4-Метилендиоксифениламино)-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидин (119 мг) и 4-хлорметил-2-(3,4,5-триметоксифенил)пиридин (114 мг) подвергают взаимодействию по методике, аналогично описанной в примере 9. Полученное свободное основание превращают в тригидрохлорид, получая указанное в заголовке соединение в виде желтого порошка.
Выход 52 мг (25%).
1H-ЯМР (400 МГц, определяемый как свободное основание, CDCl3) δ: 1,60-1,95 (м, 4H), 2,20 (шир, 2H), 3,00 (шир, 2H), 3,58 (шир, 3H), 3,86 (с, 3H), 3,87 (с, 3H), 3,91 (с, 6H), 3,94 (с, 6H), 4,41 (с, 2H), 5,82 (с, 2H), 6,17 (д, 1H, J=8,4 Гц), 6,39 (с, 1H), 6,62 (д, 1H, J=8,4 Гц), 7,12-7,13 (м, 3H), 7,18 (д, 1H, J=4,1 Гц), 7,23 (шир, 2H), 7,54 (шир, 2H), 8,51 (д, 1H, J=5,1 Гц), 8,57 (д, 1H, J=4,9 Гц).
Пример 30
Синтез дигидрохлорида 4-[N-(3,4-метилендиоксифенил)-N-[3-(3,4,5-триметоксифенил)бензил]амино]-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
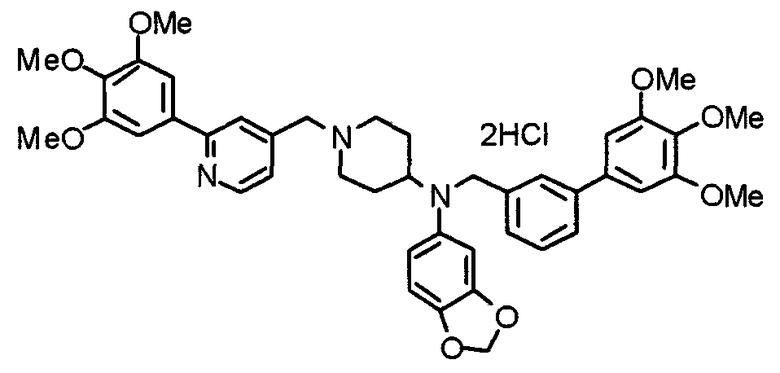
4-(3,4-Метилендиоксифениламино)-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидин (119 мг) и 3-(3,4,5-триметоксифенил)бензилхлорид (114 мг) подвергают взаимодействию по методике, аналогично описанной в примере 9. Полученное свободное основание превращают в дигидрохлорид, получая указанное в заголовке соединение в виде желтого порошка.
Выход 58 мг (29%).
1H-ЯМР (400 МГц, определяемый как свободное основание, CDCl3) δ: 1,60-1,97 (м, 4H), 2,15 (шир, 2H), 3,00 (шир, 2H), 3,58 (шир, 3H), 3,86 (с, 3H), 3,88 (с, 9H), 3,94 (с, 6H), 4,43 (с, 2H), 5,81 (с, 2H), 6,21 (шир, 1H), 6,42 (с, 1H), 6,62 (д, 1H, J=8,4 Гц), 6,69 (с, 2H), 7,18 (д, 1H, J=4,9 Гц), 7,22-7,39 (м, 6H), 7,60 (шир, 1H), 8,57 (д, 1H, J=4,9 Гц).
Пример 31
Синтез тригидрохлорида 4-[N-(3,4-метилендиоксифенил)-N-[[2-(3,4,5-триметоксифенил)пиридин-5-ил]метил]амино]-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
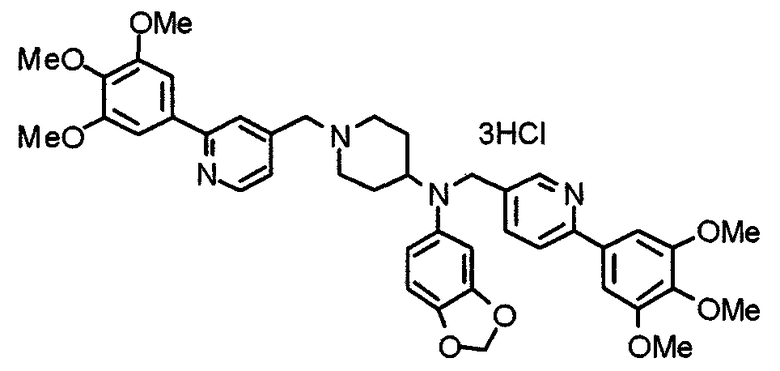
4-(3,4-Метилендиоксифениламино)-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидин (119 мг) и 5-хлорметил-2-(3,4,5-триметоксифенил)пиридин (114 мг) подвергают взаимодействию по методике, аналогично описанной в примере 9. Полученное свободное основание превращают в тригидрохлорид, получая указанное в заголовке соединение в виде желтого порошка.
Выход 69 мг (27%).
1H-ЯМР (400 МГц, определяемый как свободное основание, CDCl3) δ: 1,71-1,88 (м, 4H), 2,14 (д, 2H, J=11,2 Гц), 2,97 (д, 2H, J=11,5 Гц), 3,45-3,52 (м, 1H), 3,56 (с, 2H), 3,89 (с, 3H), 3,90 (с, 3H), 3,94 (с, 6H), 3,96 (с, 6H), 4,12 (с, 2H), 5,85 (с, 2H), 6,24 (дд, 1H, J=8,5 Гц, 2,5 Гц), 6,45 (д, 1H, J=2,4 Гц), 6,64 (д, 1H, J=8,5 Гц), 7,20-7,21 (м, 1H), 7,21 (с, 2H), 7,23 (с, 2H), 7,58-7,65 (м, 3H), 8,57 (д, 1H, J=1,5 Гц), 8,59 (д, 1H, J=4,9 Гц).
Пример 32
Синтез дигидрохлорида 4-[N-(3,4-метилендиоксифенил)-N-[4-(3,4,5-триметоксифенил)бензил]амино]-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
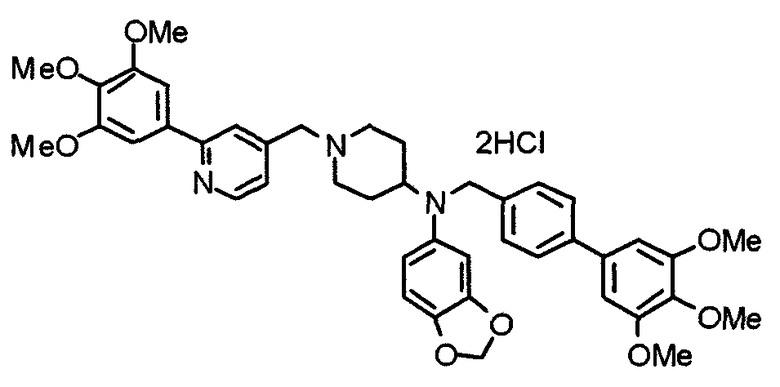
4-(3,4-Метилендиоксифениламино)-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидин (119 мг) и 4-(3,4,5-триметоксифенил)бензилхлорид (114 мг) подвергают взаимодействию по методике, аналогично описанной в примере 9. Полученное свободное основание превращают в дигидрохлорид, получая указанное в заголовке соединение в виде желтого порошка.
Выход 29 мг (14%).
1H-ЯМР (400 МГц, определяемый как свободное основание, CDCl3) δ: 1,62-2,00 (м, 4H), 2,20 (шир, 2H), 2,99 (шир, 2H), 3,58 (шир, 3H), 3,86 (с, 3H), 3,87 (с, 3H), 3,88 (с, 6H), 3,89 (с, 6H), 4,41 (с, 2H), 5,82 (с, 2H), 6,19 (д, 1H, J=8,6 Гц), 6,39 (с, 1H), 6,63 (д, 1H, J=8,4 Гц), 6,72 (с, 2H), 7,18 (д, 1H, J=5,1 Гц), 7,23 (с, 2H), 7,29 (д, 2H, J=8,0 Гц), 7,43 (д, 2H, J=8,2 Гц), 7,60 (шир, 1H), 8,57 (д, 1H, J=4,9 Гц).
Пример получения 70
Синтез 4-[N-метил-N-[(2-нитробензол)сульфонил]аминометил]-2-(3,4,5-триметоксифенил)пиридина
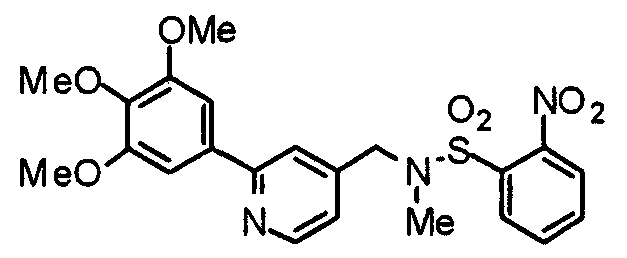
4-Хлорметил-2-(3,4,5-триметоксифенил)пиридин (232 мг), N-метил-2-нитробензолсульфонамид (171 мг) и карбонат калия (138 мг) суспендируют в ацетонитриле (10 мл). Смесь перемешивают при комнатной температуре в течение ночи и концентрируют при пониженном давлении. Остаток растворяют в хлороформе, промывают насыщенным водным гидрокарбонатом натрия и насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют при пониженном давлении, получая указанное в заголовке соединение.
Выход 362 мг (97,0%).
Пример получения 71
Синтез 4-(метиламинометил)-2-(3,4,5-триметоксифенил)пиридина
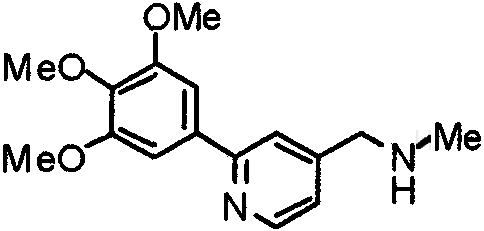
К суспензии 4-[N-метил-N-[(2-нитробензол) сульфонил] аминометил]-2-(3,4,5-триметоксифенил)пиридина (691 мг) и карбоната калия (203 мг) в ацетонитриле (20 мл) добавляют тиофенол (228 мкл). Смесь перемешивают при температуре 50°С в течение ночи и концентрируют при пониженном давлении. Остаток растворяют в хлороформе, промывают насыщенным водным гидрокарбонатом натрия и насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле с использованием смеси хлороформ/метанол (40:1˜10:1) в качестве элюентов, получая указанное в заголовке соединение.
Выход 356 мг (84%).
Пример 33
Синтез малеата 4-[N-метил-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]аминокарбонил]-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
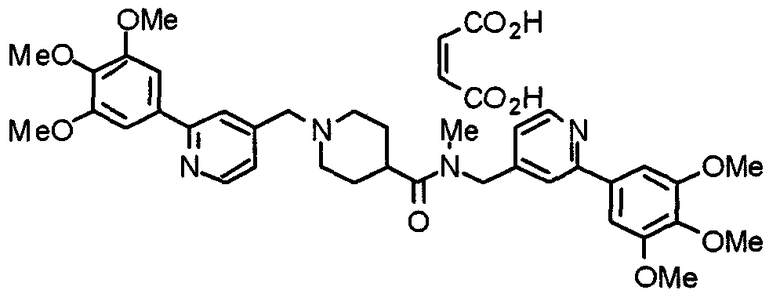
1-[[2-(3,4,5-Триметоксифенил)пиридин-4-ил]метил]пиперидин-4-карбоновую кислоту (98 мг) и 4-(метиламинометил)-2-(3,4,5-триметоксифенил)пиридин (73 мг) обрабатывают по методике, аналогично описанной в примере 1, получая малеат указанного в заголовке соединения.
Выход 145 мг (75%).
1H-ЯМР (400 МГц, определяемый как малеат, ДМСО-d6) δ: 1,89-1,97 (м, 4H), 2,75-2,96 (м, 3H), 3,03 (с, 3H), 3,27 (д, 2H, J=12,0 Гц), 3,78 (с, 3H), 3,79 (с, 3H), 3,87 (с, 6H), 3,90 (с, 6H), 4,09 (с, 2H), 4,64 (с, 2H), 6,14 (с, 2H), 7,09 (д, 1H, J=5,0 Гц), 7,33 (с, 2H), 7,37 (д, 1H, J=5,0 Гц), 7,38 (с, 2H), 7,65 (с, 1H), 7,90 (с, 1H), 8,57 (д, 1H, J=5,0 Гц), 8,67 (д, 1H, J=5,0 Гц).
Пример получения 72
Синтез (3S)-1-(трет-бутоксикарбонил)-3-[N-[(2-нитробензол)сульфонил]-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]пирролидина
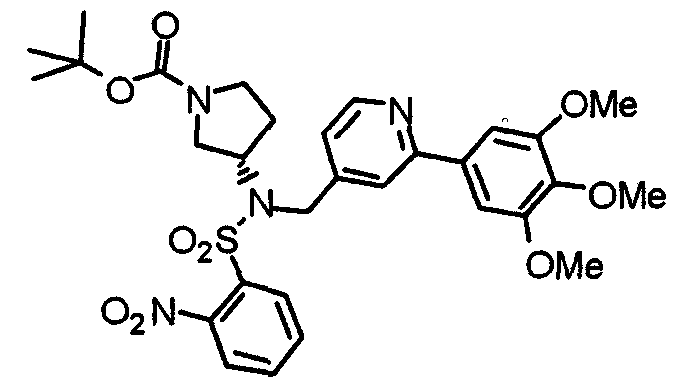
(3S)-1-(трет-Бутоксикарбонил)-3-[(2-нитробензол)сульфониламино]пирролидин (72 мг) и 4-хлорметил-2-(3,4,5-триметоксифенил)пиридин (57 мг) подвергают взаимодействию по методике, аналогично описанной в примере получения 2, получая указанное в заголовке соединение в виде бесцветного аморфного вещества.
Выход 103 мг (85%).
Пример получения 73
Синтез (3S)-3-[N-[(2-нитробензол)сульфонил]-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]пирролидина

(3S)-1-(трет-Бутоксикарбонил)-3-[N-[(2-нитробензол)сульфонил]-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]пирролидин (103 мг) обрабатывают по методике, аналогично описанной в примере получения 12, получая указанное в заголовке соединение в виде желтого аморфного вещества.
Выход 72 мг (84%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,66-1,75 (м, 1H), 2,03-2,05 (м, 1H), 2,78-2,85 (м, 2H), 3,00-3,10 (м, 2H), 3,39 (шир, 1H), 3,90 (с, 3H), 3,96 (с, 6H), 4,59-4,67 (м, 1H), 4,70 (с, 2H), 7,13-7,18 (м, 1H), 7,20 (с, 2H), 7,52-7,64 (м, 4H), 7,95 (дд, 1H, J=7,9 Гц, 1,1 Гц), 8,52 (д, 1H, J=5,1 Гц).
Пример получения 74
Синтез (3S)-3-[N-[(2-нитробензол)сульфонил]-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пирролидина
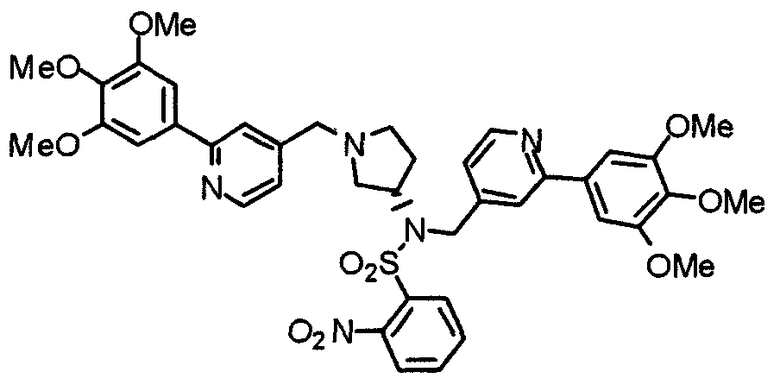
(3S)-3-[N-[(2-Нитробензол)сульфонил]-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]пирролидин (72 мг) и 4-хлорметил-2-(3,4,5-триметоксифенил)пиридин (40 мг) подвергают взаимодействию по методике, аналогично описанной в примере 2, получая указанное в заголовке соединение в виде желтого аморфного вещества.
Выход 97 мг (91%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,59 (шир, 1H), 1,80-1,90 (м, 1H), 2,20-2,30 (м, 2H), 2,55 (дд, 1H, J=10,5 Гц, 8,2 Гц), 2,78 (дд, 1H, J=10,6 Гц, 3,2 Гц), 2,87 (т, 1H, J=7,2 Гц), 3,50 (д, 1H, J=13,7 Гц), 3,64 (д, 1H, J=13,7 Гц), 3,89 (с, 3H), 3,90 (с, 3H), 3,92 (с, 6H), 3,93 (с, 6H), 4,83 (д, 2H, J=4,5 Гц), 7,07 (д, 1H, J=5,1 Гц), 7,10 (д, 1H, J=4,9 Гц), 7,15 (с, 2H), 7,17 (с, 2H), 7,41-7,45 (м, 1H), 7,50-7,55 (м, 3H), 7,61 (с, 1H), 7,81 (д, 1H, J=7,4 Гц), 8,45 (д, 1H, J=4,9 Гц), 8,51 (д, 1H, J=5,1 Гц).
Пример 34
Синтез тригидрохлорида (3S)-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]-3-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метиламино]пирролидина
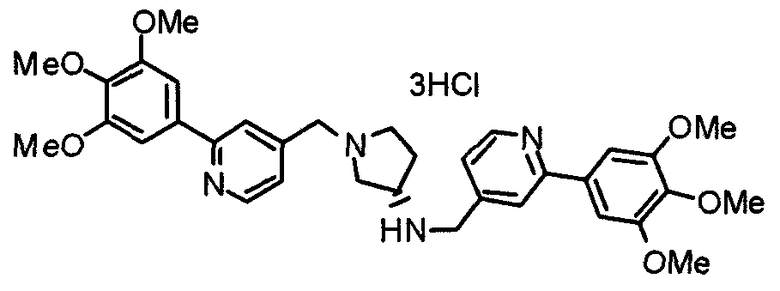
(3S)-3-[N-[(2-Нитробензолсульфонил]-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пирролидин (97 мг) обрабатывают по методике, аналогично описанной в примере получения 14. Продукт превращают в тригидрохлорид в соответствии с известным способом, получая указанное в заголовке соединение в виде желтого порошка.
Выход 80 мг (89%).
1H-ЯМР (400 МГц, определяемый как свободное основание, CDCl3) δ: 1,71 (шир, 2H), 2,19-2,21 (м, 1H), 2,52-2,55 (м, 2H), 2,73-2,77 (м, 2H), 3,39 (шир, 1H), 3,66 (д, 1H, J=13,7 Гц), 3,71 (д, 1H, J=13,7 Гц), 3,82 (с, 2H), 3,90 (с, 6H), 3,95 (с, 12H), 7,18-7,21 (м, 2H), 7,23 (с, 2H), 7,24 (с, 2H), 7,63 (с, 2H), 8,59 (д, 1H, J=4,3 Гц), 8,60 (д, 1H, J=4,3 Гц).
Пример 35
Синтез малеата 4-[3-(3,4,5-триметоксифенил)бензоиламино]-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
3-(3,4,5-Триметоксифенил)бензойную кислоту (69 мг) и 4-амино-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидин (114 мг) подвергают взаимодействию по методике, аналогично описанной в примере 1. После превращения продукта в малеат получают указанное в заголовке соединение.
Выход 100 мг (56%).
1H-ЯМР (400 МГц, определяемый как малеат, ДМСО-d6) δ: 1,85-2,10 (м, 4H), 2,77-2,93 (м, 2H), 3,20-3,31 (м, 2H), 3,77 (с, 3H, 3,79 (с, 3H), 3,89 (с, 6H), 3,91 (с, 6H), 3,98-4,07 (м, 1H), 4,13 (с, 2H), 6,15 (с, 2H), 6,94 (с, 2H), 7,40-7,52 (м, 4H), 7,73-7,80 (м, 2H), 8,02-8,10 (м, 3H), 8,67-8,68 (м, 1H).
Пример 36
Синтез тетрагидрохлорида 4-[N-метил-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
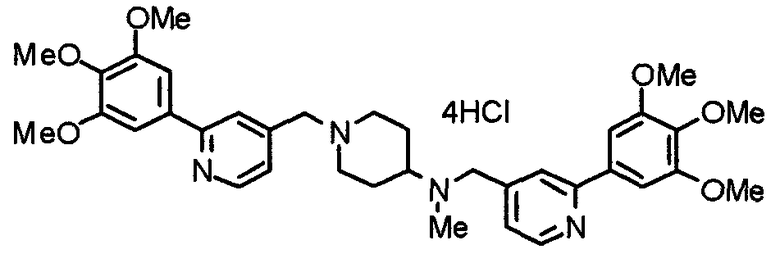
4-(Метиламино)-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидин (2,67 г) и 4-хлорметил-2-(3,4,5-триметоксифенил)пиридин (2,12 г) подвергают взаимодействию по методике, аналогично описанной в примере 2. После превращения продукта в тетрагидрохлорид получают указанное в заголовке соединение.
Выход 2,55 г (46%).
1H-ЯМР (400 МГц, определяемый как свободное основание, CDCl3) δ: 1,66-1,74 (м, 2H), 1,82 (д, 2H, J=10,7 Гц), 2,04 (т, 2H, J=11,0 Гц), 2,25 (с, 3H), 2,45-2,51 (м, 1H), 2,98 (д, 2H, J=11,7 Гц), 3,55 (с, 2H), 3,66 (с, 2H), 3,90 (с, 3H), 3,91 (с, 3H), 3,96 (с, 6H), 3,97 (с, 6H), 7,21-7,23 (м, 2H), 7,24 (с, 2H), 7,25 (с, 2H), 7,62 (с, 1H), 7,63 (с, 1H), 8,59 (д, 1H, J=5,1 Гц), 8,60 (д, 1H, J=5,3 Гц).
Пример получения 75
Синтез 1-(этоксикарбонил)-4-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метиламино]пиперидина
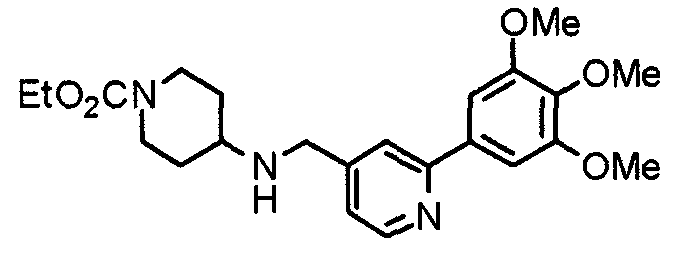
1-(Этоксикарбонил)пиперидин (341 мг) и 4-хлорметил-2-(3,4,5-триметоксифенил)пиридин (300 мг) подвергают взаимодействию по методике, аналогично описанной в примере получения 2, получая указанное в заголовке соединение.
Выход 438 мг (теоретический выход).
1H-ЯМР (400 МГц, CDCl3) δ: 1,25 (т, 3H, J=7,1 Гц), 1,27-1,34 (м, 2H), 1,60 (шир, 1H), 1,90 (д, 2H, J=10,9 Гц), 2,67-2,72 (м, 1H), 2,87 (т, 2H, J=11,5 Гц), 3,90 (с, 3H), 3,91 (шир, 2H), 3,96 (с, 6H), 4,09 (шир, 2H), 4,12 (кв, 2H, J=7,0 Гц), 7,21 (д, 1H, J=3,5 Гц), 7,24 (с, 2H), 7,65 (с, 1H), 8,59 (д, 1H, J=4,9 Гц).
Пример получения 76
Синтез 1-(этоксикарбонил)-4-[N-метил-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]пиперидина
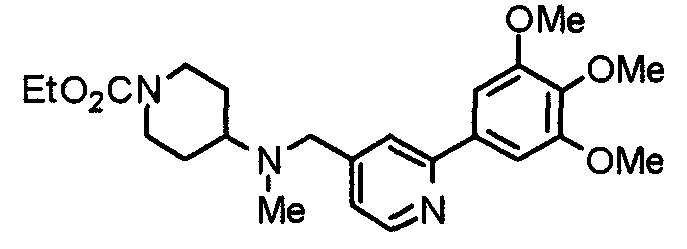
1-(Этоксикарбонил)-4-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метиламино]пиперидин (438 мг) обрабатывают по методике, аналогично описанной в примере получения 11, получая указанное в заголовке соединение в виде желтого масла.
Выход 235 мг (52%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,26 (т, 3H, J=7,1 Гц), 1,42-1,57 (м, 2H), 1,82 (д, 2H, J=11,9 Гц), 2,24 (с, 3H), 2,59-2,65 (м, 1H), 2,75 (т, 2H, J=12,0 Гц), 3,65 (с, 2H), 3,90 (с, 3H), 3,97 (с, 6H), 4,13 (кв, 2H, J=7,0 Гц), 4,23 (шир, 2H), 7,22 (дд, 1H, J=5,0 Гц, 1,3 Гц), 7,24 (с, 2H), 7,63 (с, 1H), 8,59 (д, 1H, J=4,5 Гц).
Пример получения 77
Синтез 4-[N-метил-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]пиперидина
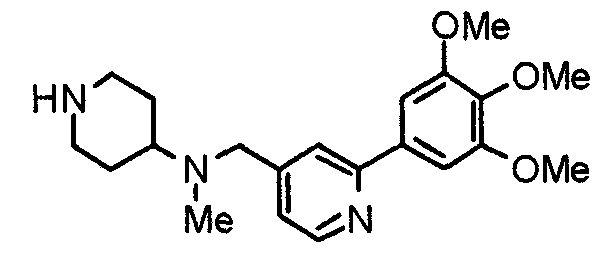
К раствору 1-(этоксикарбонил)-4-[N-метил-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]пиперидина (100 мг) в этаноле (2 мл) добавляют 4 М гидроксид натрия (8 мл). Смесь перемешивают в течение ночи и экстрагируют хлороформом. Экстракт промывают водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле, используя смесь хлороформ/метанол (20:1), с получением указанного в заголовке соединения в виде желтого масла.
Выход 73 мг (88%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,50-1,55 (м, 2H), 1,84 (д, 2H, J=12,0 Гц), 1,99 (шир, 1H), 2,25 (с, 3H), 2,55-2,63 (м, 3H), 3,16 (д, 2H, J=12,2 Гц), 3,65 (с, 2H), 3,90 (с, 3H), 3,97 (с, 6H), 7,22 (д, 1H, J=6,1 Гц), 7,24 (с, 2H), 7,64 (с, 1H), 8,58 (д, 1H, J=5,1 Гц).
Пример 37
Синтез тетрагидрохлорида 4-[N-метил-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
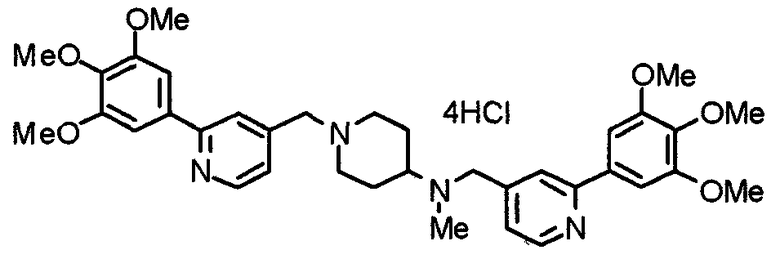
4-[N-Метил-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]пиперидин (73 мг) и 4-хлорметил-2-(3,4,5-триметоксифенил)пиридин (58 мг) подвергают взаимодействию по методике, аналогично описанной в примере 2. После превращения продукта в тетрагидрохлорид получают указанное в заголовке соединение.
Выход 126 мг (84%).
Пример 38
Синтез дифумарата 4-[N-метил-N-[3-(3,4,5-триметоксифенил)бензил]амино]-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
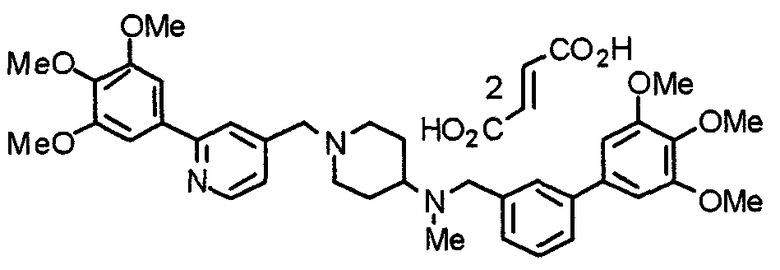
4-(Метиламино)-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидин (111 мг) и 3-(3,4,5-триметоксифенил)бензилхлорид (88 мг) подвергают взаимодействию по методике, аналогично описанной в примере 2. После превращения продукта в дифумарат получают указанное в заголовке соединение в виде белого порошка.
Выход 59 мг (23%).
1H-ЯМР (400 МГц, определяемый как свободное основание, CDCl3) δ: 1,70-1,77 (м, 2H), 1,85-1,87 (м, 2H), 2,03-2,08 (м, 2H), 2,27 (с, 3H), 2,55-2,59 (м, 1H), 2,98 (д, 2H, J=11,3 Гц), 3,56 (с, 2H), 3,69 (с, 2H), 3,89 (с, 3H), 3,90 (с, 3H), 3,93 (с, 6H), 3,98 (с, 6H), 6,79 (с, 2H), 7,22 (д, 1H, J=4,9 Гц), 7,28 (с, 2H), 7,31 (д, 1H, J=7,6 Гц), 7,38 (т, 1H, J=7,4 Гц), 7,45 (д, 1H, J=7,6 Гц), 7,51 (с, 1H), 7,63 (с, 1H), 8,60 (д, 1H, J=5,1 Гц).
Пример 39
Синтез тетрагидрохлорида 1-[[2-(4-гидрокси-3,5-диметоксифенил)пиридин-4-ил]метил]-4-[N-[[2-(4-гидрокси-3,5-диметоксифенил)пиридин-4-ил]метил]-N-метиламино]пиперидина
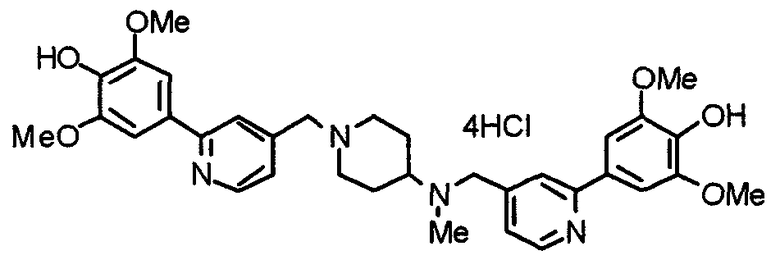
К раствору 4-[N-метил-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина (100 мг) в дихлорметане (5 мл) при 0°С добавляют йодтриметилсилан (173 мкл). Смесь перемешивают при 0°С в течение 2 часов и затем при комнатной температуре в течение ночи. К смеси при 0°С добавляют небольшое количество воды, этилацетат и насыщенный водный гидрокарбонат натрия, после чего отделяют органический слой. Органический слой промывают насыщенным раствором соли, сушат над сульфатом магния и концентрируют при пониженном давлении. Остаток очищают препаративной ТСХ на силикагеле, используя смесь хлороформ/насыщенный метанолом аммиак (15:1), и превращают в тетрагидрохлорид известным способом, получая указанное в заголовке соединение.
Выход 50 мг (52,3%).
1H-ЯМР (400 МГц, определяемый как свободное основание, CDCl3) δ: 1,68-1,89 (м, 4H), 2,03-2,12 (м, 2H), 2,26 (с, 3H), 2,48-2,60 (м, 1H), 2,98-3,05 (м, 2H), 3,57 (с, 2H), 3,65 (с, 2H), 3,94 (с, 6H), 3,95 (с, 6H), 7,16-7,19 (м, 2H), 7,26 (с, 2H), 7,27 (с, 2H), 7,62-7,68 (м, 2H), 8,56 (д, 1H, J=5,3 Гц), 8,58 (д, 1H, J=5,2 Гц).
Пример получения 78
Синтез 1-(этоксикарбонил)-4-[N-этил-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]пиперидина
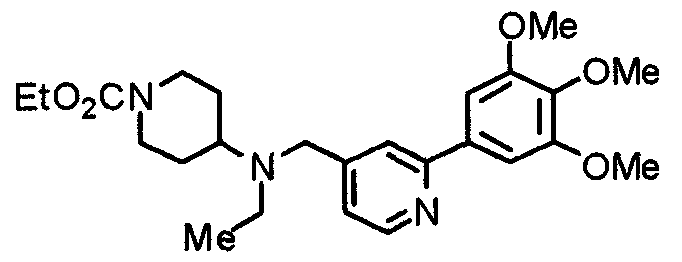
К раствору 1-(этоксикарбонил)-4-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метиламино]пиперидина (400 мг) в ацетонитриле (5 мл) добавляют карбонат калия (13 мг) и йодэтан (145 мг). Смесь помещают в закупоренный сосуд и перемешивают при 80°С в течение 2 часов. После концентрирования реакционной жидкости в вакууме в остаток вводят этилацетат, промывают его водой и насыщенным раствором соли, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле, используя в качестве элюента смесь хлороформ/метанол (30:1), с получением указанного в заголовке соединения в виде желтого масла.
Выход 242 мг (57%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,04 (т, 3H, J=7,1 Гц), 1,25 (т, 3H, J=7,1 Гц), 1,43-1,52 (м, 2H), 1,79 (д, 2H, J=11,5 Гц), 2,60 (кв, 2H, J=7,0 Гц), 2,66-2,76 (м, 3H), 3,70 (с, 2H), 3,90 (с, 3H), 3,97 (с, 6H), 4,12 (кв, 2H, J=7,0 Гц), 4,20 (шир, 2H), 7,23 (с, 2H), 7,26 (д, 1H, J=5,7 Гц), 7,67 (с, 1H), 8,58 (д, 1H, J=4,9 Гц).
Пример получения 79
Синтез 4-[N-этил-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]пиперидина
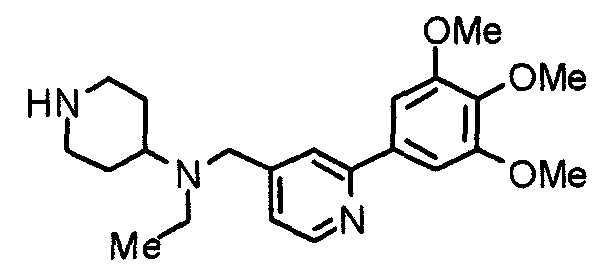
1-(Этоксикарбонил)-4-[N-этил-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]пиперидин (242 мг) обрабатывают по методике, аналогично описанной в примере получения 77, получая указанное в заголовке соединение в виде желтого масла.
Выход 150 мг (74%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,03 (т, 3H, J=7,0 Гц), 1,43-1,52 (м, 2H), 1,70 (шир, 1H), 1,79 (д, 2H, J=12,3 Гц), 2,53-2,67 (м, 5H), 3,13 (д, 2H, J=11,9 Гц), 3,71 (с, 2H), 3,90 (с, 3H), 3,97 (с, 6H), 7,24 (с, 2H), 7,27 (д, 1H, J=5,1 Гц), 7,68 (с, 1H), 8,57 (д, 1H, J=4,3 Гц).
Пример 40
Синтез тетрагидрохлорида 4-[N-этил-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
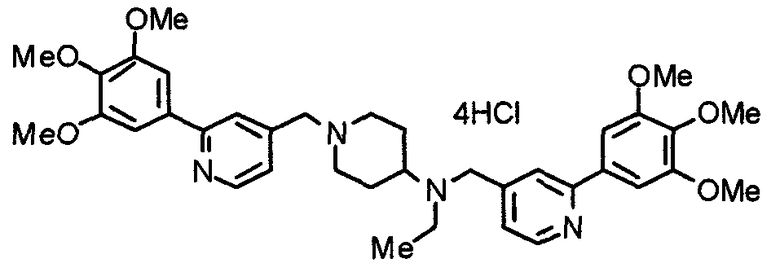
4-[N-Этил-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]пиперидин (65 мг) подвергают взаимодействию с 4-хлорметил-2-(3,4,5-триметоксифенил)пиридином (50 мг) по методике, аналогично описанной в примере 2. После превращения продукта в тетрагидрохлорид получают указанное в заголовке соединение.
Выход 121 мг (90%).
1H-ЯМР (400 МГц, определяемый как свободное основание, CDCl3) δ: 1,03 (т, 3H, J=7,1 Гц), 1,64-1,69 (м, 2H), 1,77 (д, 2H, J=10,7 Гц), 2,01 (т, 2H, J=10,8 Гц), 2,55-2,64 (м, 3H), 2,95 (д, 2H, J=11,1 Гц), 3,53 (с, 2H), 3,71 (с, 2H), 3,90 (с, 6H), 3,97 (с, 12H), 7,20-7,27 (м, 6H), 7,60 (с, 1H), 7,68 (с, 1H), 8,57 (д, 1H, J=4,9 Гц), 8,59 (д, 1H, J=5,1 Гц).
Пример получения 80
Синтез 4-(циклогексиламино)-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
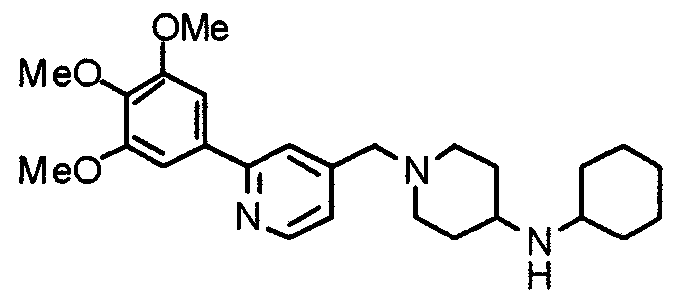
1-[[2-(3,4,5-Триметоксифенил)пиридин-4-ил]метил]-4-пиперидон (400 мг) и циклогексиламин (134 мг) подвергают взаимодействию по методике, аналогично описанной в примере получения 37, получая указанное в заголовке соединение.
Выход 342 мг (69%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,05-1,30 (м, 6H), 1,38-1,52 (м, 2H), 1,53-1,80 (м, 3H), 1,87 (шир, 4H), 2,07 (т, 2H, J=10,7 Гц), 2,59 (шир, 2H), 2,86 (шир, 2H), 3,54 (с, 2H), 3,90 (с, 3H), 3,97 (с, 6H), 7,19 (д, 1H, J=4,9 Гц), 7,24 (с, 2H), 7,64 (с, 1H), 8,58 (д, 1H, J=4,9 Гц).
Пример 41
Синтез тетрагидрохлорида 4-[N-циклогексил-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
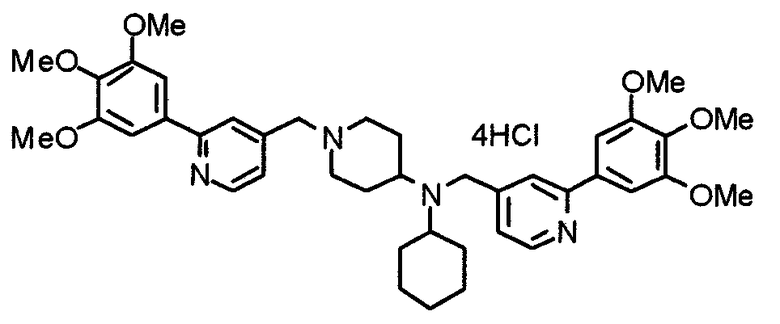
4-(Циклогексиламин)-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидин (342 мг) подвергают взаимодействию с 4-хлорметил-2-(3,4,5-триметоксифенил)пиридином (252 мг) по методике, аналогично описанной в примере получения 9. После превращения продукта в тетрагидрохлорид получают указанное в заголовке соединение.
Выход 55 мг (8%).
1H-ЯМР (400 МГц, определяемый как свободное основание, CDCl3) δ: 1,00-1,39 (м, 6H), 1,58-1,88 (м, 8H), 2,07 (шир, 2H), 2,61 (шир, 2H), 2,96 (шир, 2H), 3,57 (шир, 2H), 3,85 (с, 2H), 3,90 (с, 3H), 3,91 (с, 3H), 3,97 (с, 12H), 7,19-7,28 (м, 6H), 7,70 (шир, 2H), 8,56 (д, 1H, J=5,1 Гц), 8,60 (д, 1H, J=5,1 Гц).
Пример получения 81
Синтез 4-анилино-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
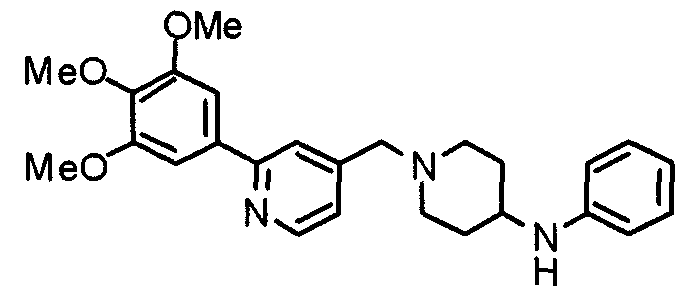
1-[[2-(3,4,5-Триметоксифенил)пиридин-4-ил]метил]-4-пиперидон (1,1 г) и анилин (344 мг) подвергают взаимодействию по методике, аналогично описанной в примере получения 37, получая указанное в заголовке соединение.
Выход 1,09 г (81%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,53 (шир, 2H), 2,02-2,13 (м, 2H), 2,16-2,32 (м, 2H), 2,86 (шир, 2H), 3,32 (шир, 1H), 3,59 (с, 2H), 3,88 (с, 3H), 3,95 (с, 6H), 6,57 (д, 2H, J=8,6 Гц), 6,66 (т, 1H, J=7,3 Гц), 7,14 (т, 2H, J=7,9 Гц), 7,20-7,24 (м, 5H), 7,65 (шир, 1H), 8,59 (д, 1H, J=5,1 Гц).
Пример 42
Синтез тригидрохлорида 4-[N-фенил-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
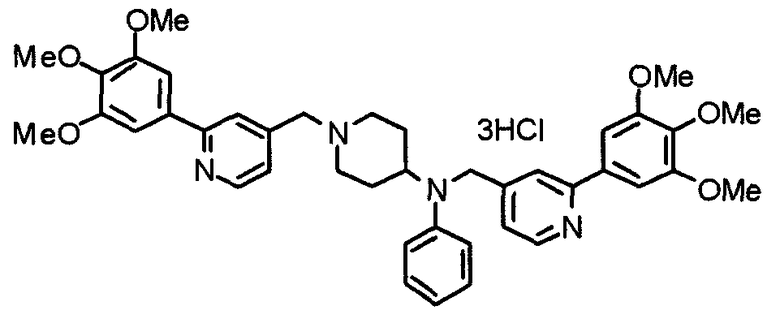
4-Анилино-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидин (1,64 г) и 4-хлорметил-2-(3,4,5-триметоксифенил)пиридин (1,33 г) подвергают взаимодействию по методике, аналогично описанной в примере получения 9. После превращения продукта в тригидрохлорид получают указанное в заголовке соединение.
Выход 635 мг (20%).
1H-ЯМР (400 МГц, определяемый как свободное основание, CDCl3) δ: 1,60-2,00 (м, 4H), 2,10-2,35 (м, 2H), 2,99 (шир, 2H), 3,58 (шир, 3H), 3,86 (с, 3H), 3,88 (с, 3H), 3,90 (с, 6H), 3,94 (с, 6H), 4,52 (с, 2H), 6,66-6,78 (м, 3H), 7,13-7,28 (м, 8H), 7,54 (шир, 2H), 8,53 (д, 1H, J=5,1 Гц), 8,58 (д, 1H, J=4,9 Гц).
Пример получения 82
Синтез этиленкеталя 1-[[2-(4-хлор-3,5-диметоксифенил)пиридин-4-ил]метил]-4-пиперидона
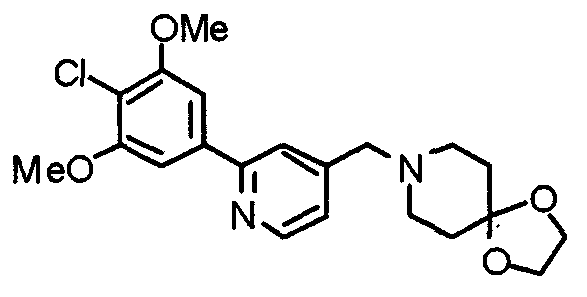
Этиленкеталь 4-пиперидона (573 мг) подвергают взаимодействию с 2-(4-хлор-3,5-диметоксифенил)-4-хлорметилпиридином (1,19 г) по методике, аналогично описанной в примере 2, получая указанное в заголовке соединение.
Выход 1,67 г (теоретическое количество).
1H-ЯМР (400 МГц, CDCl3) δ: 1,78 (т, 4H, J=5,6 Гц), 2,58 (шир, 4H), 3,61 (с, 2H), 3,67 (с, 4H), 4,02 (с, 6H), 7,25-7,29 (м, 3H), 7,68 (с, 1H), 8,61 (д, 1H, J=4,9 Гц).
Пример получения 83
Синтез 1-[[2-(4-хлор-3,5-триметоксифенил)пиридин-4-ил]метил]-4-пиперидона
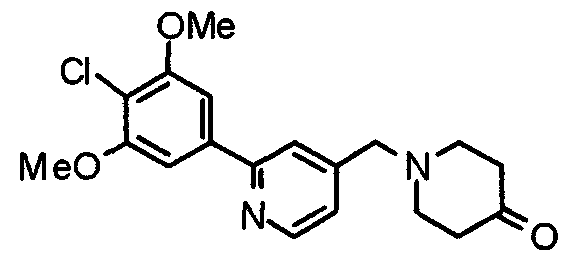
Этиленкеталь 1-[[2-(4-Хлор-3,5-диметоксифенил)пиридин-4-ил]метил]-4-пиперидона (1,67 г) обрабатывают по методике, аналогично описанной в примере получения 23, получая указанное в заголовке соединение.
Выход 1,29 г (89%).
1H-ЯМР (400 МГц, CDCl3) δ: 2,50 (т, 4H, J=5,8 Гц), 2,81 (т, 4H, J=5,8 Гц), 3,71 (с, 2H), 4,02 (с, 6H), 7,26 (с, 2H), 7,33 (д, 1H, J=4,3 Гц), 7,70 (с, 1H), 8,66 (д, 1H, J=4,9 Гц).
Пример получения 84
Синтез 4-анилино-1-[[2-(4-хлор-3,5-диметоксифенил)пиридин-4-ил]метил]пиперидина
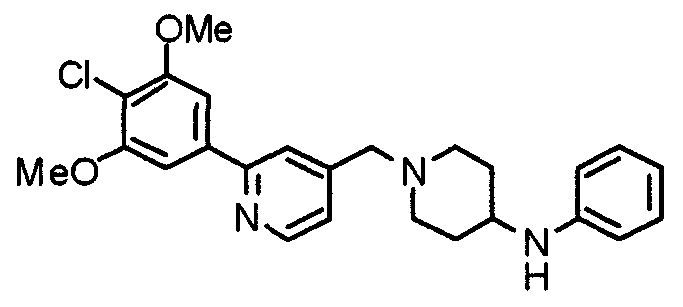
1-[[2-(4-Хлор-3,5-диметоксифенил)пиридин-4-ил]метил]-4-пиперидон (600 мг) и анилин (0,18 мл) обрабатывают по методике, аналогично описанной в примере получения 37, получая указанное в заголовке соединение.
Выход 465 мг (63%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,49-1,69 (м, 2H), 2,08 (д, 2H, J=7,8 Гц), 2,23 (т, 2H, J=9,3 Гц), 2,87 (д, 2H, J=7,8 Гц), 3,34 (шир, 1H), 3,60 (с, 2H), 4,02 (с, 6H), 6,60 (д, 2H, J=7,6 Гц), 6,69 (т, 1H, J=7,3 Гц), 7,10-7,20 (м, 2H), 7,20-7,30 (м, 3H), 7,67 (с, 1H), 8,62 (д, 1H, J=5,2 Гц).
Пример 43
Синтез тригидрохлорида 1-[[2-(4-хлор-3,5-диметоксифенил)пиридин-4-ил]метил]-4-[N-[[2-(4-хлор-3,5-диметоксифенил)пиридин-4-ил]метил]-N-фениламино]пиперидина
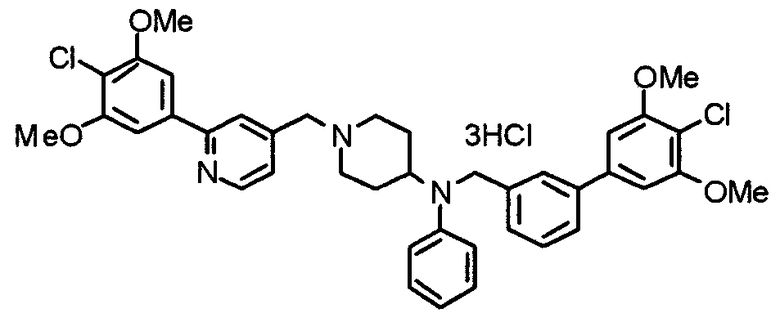
4-Анилино-1-[[2-(4-хлор-3,5-диметоксифенил)пиридин-4-ил]метил]пиперидин (230 мг) подвергают взаимодействию с 2-(4-хлор-3,5-диметоксифенил)-4-хлорметилпиридином (157 мг) по методике, аналогично описанной в примере 9. После превращения продукта в тригидрохлорид получают указанное в заголовке соединение в виде желтого порошка.
Выход 104 мг (24%).
1H-ЯМР (400 МГц, определяемый как свободное основание, CDCl3) δ: 1,70-1,85 (м, 4H), 2,20 (т, 2H, J=2,3 Гц), 3,00 (д, 2H, J=1,3 Гц), 3,59 (с, 2H), 3,96 (с, 6H), 4,00 (с, 6H), 4,56 (с, 2H), 6,65-6,78 (м, 3H), 7,16 (с, 2H), 7,18-7,28 (м, 6H), 7,59 (с, 1H), 7,62 (с, 1H), 8,57 (д, 1H, J=5,1 Гц), 8,57 (д, 1H, J=4,8 Гц).
Пример получения 85
Синтез 4-(п-анизидино)-1-[[2-(4-хлор-3,5-диметоксифенил)пиридин-4-ил]метил]пиперидина
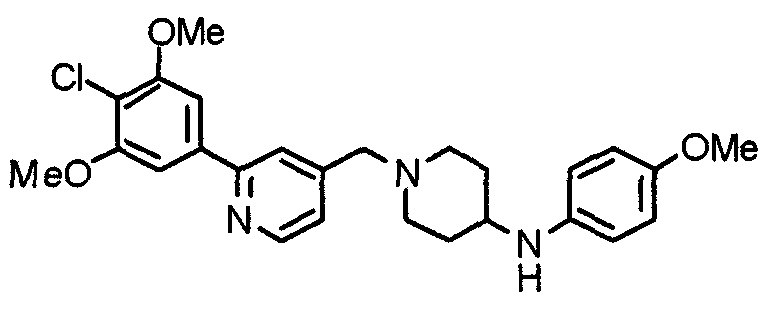
1-[[2-(4-Хлор-3,5-диметоксифенил)пиридин-4-ил]метил]-4-пиперидон (690 мг) и п-анизидин (283 мг) обрабатывают по методике, аналогично описанной в примере получения 37, получая указанное в заголовке соединение.
Выход 646 мг (72%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,45-1,55 (м, 2H), 2,05 (д, 2H, J=11,7 Гц), 2,20 (т, 2H, J=11,2 Гц), 2,87 (д, 2H, J=11,7 Гц), 3,20-3,35 (м, 1H), 3,59 (с, 2H), 3,74 (с, 3H), 4,02 (с, 6H), 6,58 (д, 2H, J=8,7 Гц), 6,77 (д, 2H, J=8,7 Гц), 7,25-7,28 (м, 3H), 7,67 (с, 1H), 8,62 (д, 1H, J=4,9 Гц).
Пример 44
Синтез тригидрохлорида 1-[[2-(4-хлор-3,5-диметоксифенил)пиридин-4-ил]метил]-4-[N-[[2-(4-хлор-3,5-диметоксифенил)пиридин-4-ил]метил]-N-(4-метоксифенил)амино]пиперидина
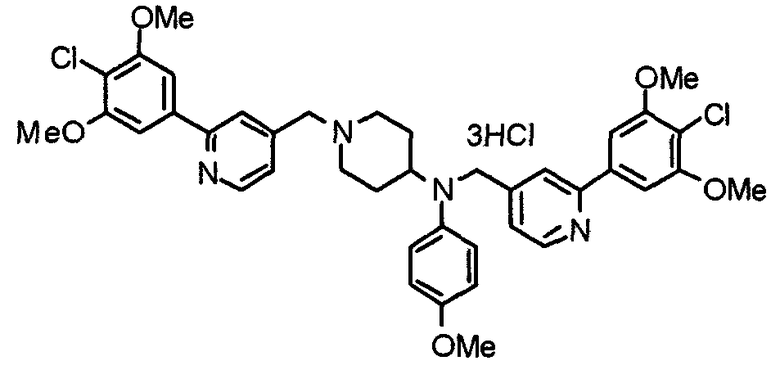
4-(п-Анизидино-1-[[2-(4-хлор-3,5-диметоксифенил)пиридин-4-ил]метил]пиперидин (271 мг) подвергают взаимодействию с 2-(4-хлор-3,5-диметоксифенил)-4-хлорметилпиридином (173 мг) по методике, аналогично описанной в примере 9. После превращения продукта в тригидрохлорид получают указанное в заголовке соединение в виде желтого порошка.
Выход 324 мг (67%).
1H-ЯМР (400 МГц, определяемый как свободное основание, CDCl3) δ: 1,65-1,90 (м, 4H), 2,16 (т, 2H, J=10,4 Гц), 2,97 (д, 2H, J=7,5 Гц), 3,54-3,60 (м, 1H), 3,58 (с, 2H), 3,73 (с, 3H), 3,97 (с, 6H), 4,00 (с, 6H), 4,46 (с, 2H), 6,74 (д, 2H, J=9,4 Гц), 6,79 (д, 2H, J=9,4 Гц), 7,16 (с, 2H), 7,20-7,29 (м, 4H), 7,59 (с, 1H), 7,62 (с, 1H), 8,56 (д, 1H, J=4,8 Гц), 8,60 (д, 1H, J=4,8 Гц).
Пример получения 86
Синтез 4-(3-метиланилино)-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
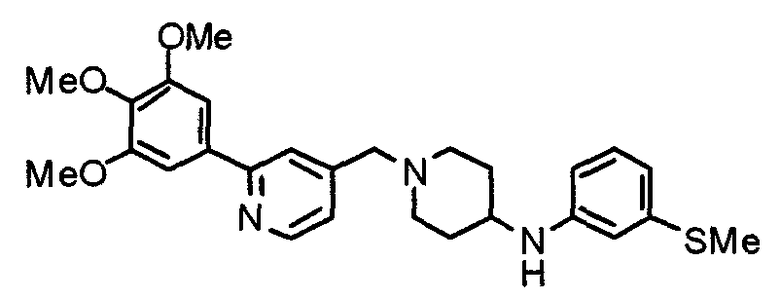
1-[[2-(3,4,5-Триметоксифенил)пиридин-4-ил]метил]-4-пиперидон (1,40 г) и 3-метилтиоанилин (655 мг) обрабатывают по методике, аналогично описанной в примере получения 37, получая указанное в заголовке соединение.
Выход 1,01 г (54%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,44-1,60 (м, 2H), 1,98-2,10 (м, 2H), 2,23 (шир, 2H), 2,42 (с, 3H), 2,88 (шир, 2H), 3,30 (шир, 1H), 3,59 (с, 2H), 3,88 (с, 3H), 3,95 (с, 6H), 6,35 (д, 1H, J=7,6 Гц), 6,47 (с, 1H), 6,55 (д, 1H, J=8,6 Гц), 7,05 (т, 1H, J=7,9 Гц), 7,20 (д, 1H, J=4,9 Гц), 7,24 (с, 2H), 7,68 (шир, 1H), 8,58 (д, 1H, J=4,9 Гц).
Пример 45
Синтез тригидрохлорида 4-[N-(3-метилтиофенил)-N-[[2-(3,4,5-триметоксифенил)пиридин-3-ил]метил]амино]-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
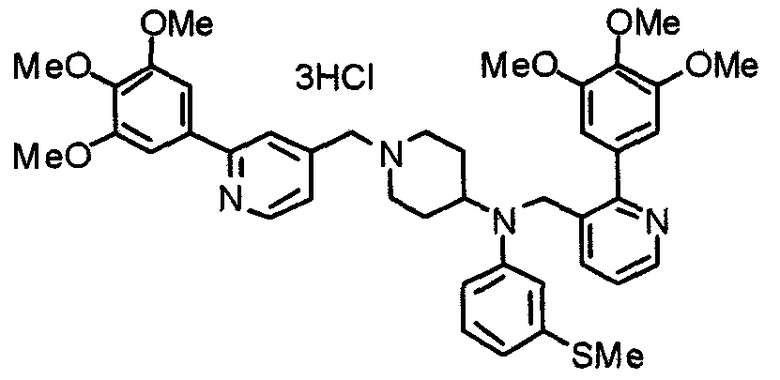
4-(3-Метилтиоанилино-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидин (143 мг) подвергают взаимодействию с 3-хлорметил-2-(3,4,5-триметоксифенил)пиридином (114 мг) по методике, аналогично описанной в примере 9. После превращения продукта в тригидрохлорид получают указанное в заголовке соединение в виде желтого порошка.
Выход 45 мг (18%).
1H-ЯМР (400 МГц, определяемый как свободное основание, CDCl3) δ: 1,58-1,71 (с, 2H), 1,79 (д, 2H, J=10,7 Гц), 2,16 (т, 2H, J=11,2 Гц), 2,38 (с, 3H), 2,96 (д, 2H, J=11,2 Гц), 3,56 (с, 3H), 3,68-3,97 (м, 1H), 3,90 (с, 3H), 3,92 (с, 9H), 3,96 (с, 9H), 4,42 (с, 2H), 6,45 (д, 1H, J=8,3 Гц), 6,52 (с, 1H), 6,61 (д, 1H, J=7,3 Гц), 6,74 (с, 2H), 7,11 (т, 1H, J=8,1 Гц), 7,15-7,26 (м, 4H), 7,54 (с, 1H), 7,68 (д, 1H, J=7,8 Гц), 8,53 (д, 1H, J=3,2 Гц), 8,59 (д, 1H, J=4,8 Гц).
Пример 46
Синтез дигидрохлорида 4-[N-(3-метилтиофенил)-N-[[2-(3,4,5-триметоксифенил)бензил]амино]-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
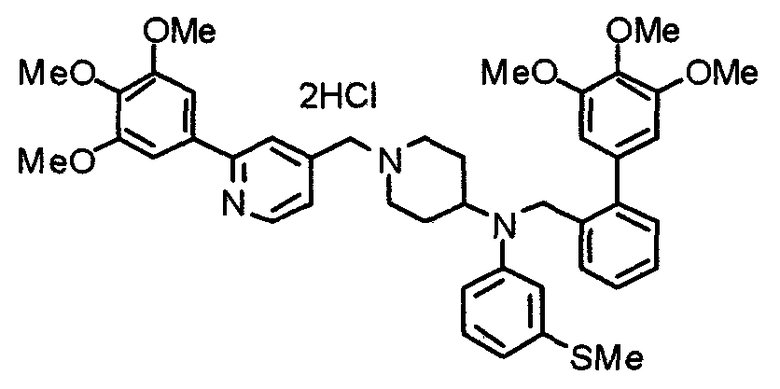
4-(3-Метилтиоанилино-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидин (143 мг) подвергают взаимодействию с 2-(3,4,5-триметоксифенил)бензилхлоридом (114 мг) по методике, аналогично описанной в примере 9. После превращения продукта в дигидрохлорид получают указанное в заголовке соединение в виде желтого порошка.
Выход 51 мг (23%).
1H-ЯМР (400 МГц, определяемый как свободное основание, CDCl3) δ: 1,56-1,73 (м, 2H), 1,78-1,87 (м, 2H), 2,10-2,20 (м, 2H), 2,38 (с, 3H), 2,91-2,98 (м, 2H), 3,55 (с, 2H), 3,70-3,80 (м, 1H), 3,88 (с, 6H), 3,90 (с, 3H), 3,92 (с, 3H), 3,96 (с, 6H), 4,35 (с, 2H), 6,47 (д, 1H, J=8,2 Гц), 6,53-6,62 (м, 5H), 7,09 (т, 1H, J=8,0 Гц), 7,18-7,40 (м, 6H), 7,54 (с, 1H), 8,58 (д, 1H, J=4,7 Гц).
Пример 47
Синтез фумарата 4-[N-(3-метилтиофенил)-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
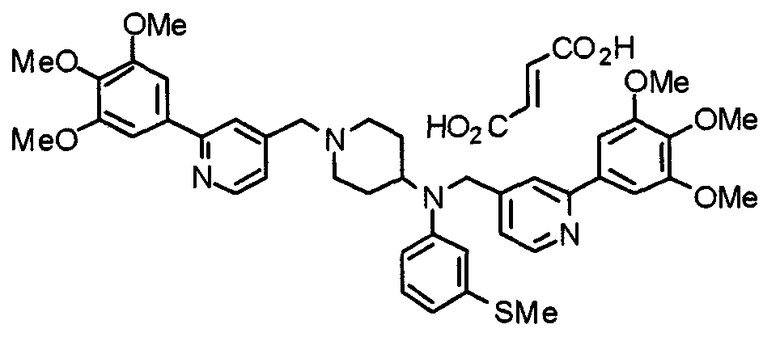
4-(3-Метилтиоанилино-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидин (143 мг) подвергают взаимодействию с 4-хлорметил-2-(3,4,5-триметоксифенил)пиридином (114 мг) по методике, аналогично описанной в примере 9. После превращения продукта в фумарат получают указанное в заголовке соединение в виде белого порошка.
Выход 14 мг (5%).
1H-ЯМР (400 МГц, определяемый как свободное основание, CDCl3) δ: 1,76-1,86 (м, 5H), 2,17-2,23 (м, 2H), 2,39 (с, 3H), 2,97-3,00 (м, 2H), 3,58 (с, 2H), 3,89 (с, 3H), 3,90 (с, 3H), 3,93 (с, 6H), 3,96 (с, 6H), 4,54 (с, 2H), 6,47-6,50 (м, 1H), 6,63 (с, 1H), 6,64 (с, 1H), 7,10-7,15 (м, 2H), 7,15 (с, 2H), 7,20-7,21 (м, 1H), 7,22 (с, 2H), 7,55 (с, 1H), 7,59 (с, 1H), 8,56 (д, 1H, J=5,1 Гц), 8,59 (д, 1H, J=5,1 Гц).
Пример 48
Синтез дигидрохлорида 4-[N-(3-метилтиофенил)-N-[[3-(3,4,5-триметоксифенил)бензил]амино]-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
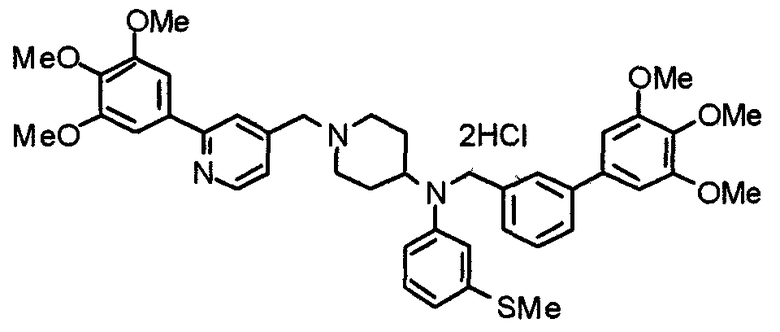
4-(3-Метилтиоанилино-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидин (143 мг) подвергают взаимодействию с 3-(3,4,5-триметоксифенил)бензилхлоридом (114 мг) по методике, аналогично описанной в примере 9. После превращения продукта в дигидрохлорид получают указанное в заголовке соединение в виде желтого порошка.
Выход 60 мг (24%).
1H-ЯМР (400 МГц, определяемый как свободное основание, CDCl3) δ: 1,65-1,91 (м, 4H), 2,18 (т, 2H, J=10,5 Гц), 2,33 (с, 3H), 2,97 (д, 2H, J=10,9 Гц), 3,58 (с, 2H), 3,70-3,85 (м, 1H), 3,88 (с, 3H), 3,89 (с, 6H), 3,90 (с, 3H), 3,96 (с, 6H), 4,56 (с, 2H), 6,52 (д, 1H, J=8,4 Гц), 6,59 (д, 1H, J=7,6 Гц), 6,65 (с, 1H), 6,72 (с, 2H), 7,10 (т, 2H, J=8,0 Гц), 7,19-7,25 (м, 4H), 7,31-7,42 (м, 3H), 7,60 (с, 1H), 8,59 (д, 1H, J=7,8 Гц).
Пример 49
Синтез тригидрохлорида 4-[N-(3-метилтиофенил)-N-[[2-(3,4,5-триметоксифенил)пиридин-5-ил]метил]амино]-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
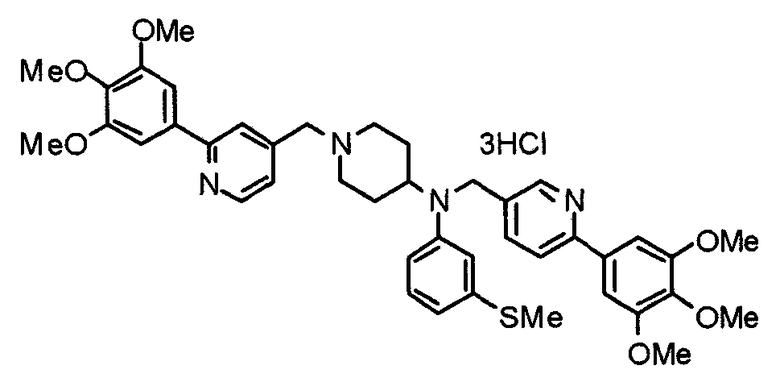
4-(3-Метилтиоанилино-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидин (143 мг) подвергают взаимодействию с 5-хлорметил-2-(3,4,5-триметоксифенил)пиридином (114 мг) по методике, аналогично описанной в примере 9. После превращения продукта в тригидрохлорид получают указанное в заголовке соединение в виде желтого порошка.
Выход 22 мг (9%).
1H-ЯМР (400 МГц, определяемый как свободное основание, CDCl3) δ: 1,50-2,05 (м, 4H), 2,20 (шир, 2H), 2,37 (с, 3H), 3,05 (шир, 2H), 3,50-3,70 (шир, 3H), 3,86 (с, 3H), 3,87 (с, 3H), 3,92 (с, 6H), 3,95 (с, 6H), 4,52 (с, 2H), 6,49 (д, 1H, J=8,3 Гц), 6,62 (шир, 2H), 7,09 (т, 1H, J=8,2 Гц), 7,18-7,30 (м, 6H), 7,58 (с, 2H), 8,54 (шир, 1H), 8,60 (шир, 1H).
Пример 50
Синтез дигидрохлорида 4-[N-(3-метилтиофенил)-N-[[4-(3,4,5-триметоксифенил)бензил]амино]-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
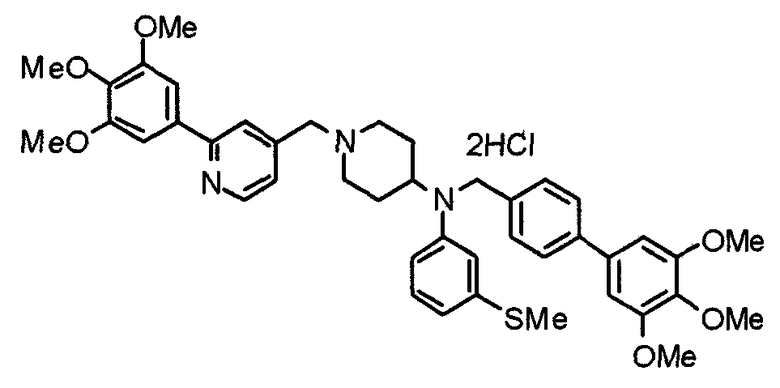
4-(3-Метилтиоанилин-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидин (143 мг) подвергают взаимодействию с 4-(3,4,5-триметоксифенил)бензилхлоридом (114 мг) по методике, аналогично описанной в примере 9. После превращения продукта в дигидрохлорид получают указанное в заголовке соединение в виде желтого порошка.
Выход 57 мг (22%).
1H-ЯМР (400 МГц, определяемый как свободное основание, CDCl3) δ: 1,58-1,83 (м, 4H), 2,20 (т, 2H, J=11,3 Гц), 2,39 (с, 3H), 2,98 (д, 2H, J=11,1 Гц), 3,58 (с, 2H), 3,88 (с, 3H), 3,90 (с, 3H), 3,91 (с, 6H), 3,96 (с, 6H), 4,53 (с, 2H), 6,51 (дд, 1H, J=8,4 Гц, 2,4 Гц), 6,60 (д, 1H, J=8,0 Гц), 6,64 (с, 1H), 6,75 (с, 2H), 7,10 (т, 1H, J=8,1 Гц), 7,24-7,33 (м, 4H), 7,47 (д, 2H, J=8,0 Гц), 7,61 (с, 1H), 8,59 (д, 1H, J=5,0 Гц).
Пример получения 87
Синтез 4-пропаргиламино-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
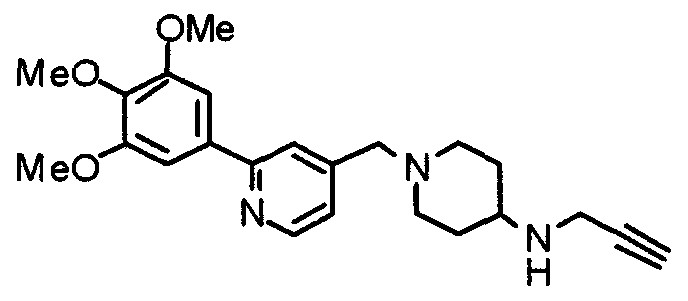
1-[[2-(3,4,5-Триметоксифенил)пиридин-4-ил]метил]-4-пиперидон (400 мг) и пропаргиламин (80 мг) обрабатывают по методике, аналогично описанной в примере получения 25, получая указанное в заголовке соединение.
Выход 227 мг (63%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,38-1,51 (м, 2H), 1,83-1,86 (м, 3H), 2,10-2,15 (м, 2H), 2,21 (с, 1H), 2,74 (шир, 1H), 2,83-2,87 (м, 2H), 3,45 (с, 2H), 3,56 (с, 2H), 3,89 (с, 3H), 3,96 (с, 6H), 7,19 (д, 1H, J=4,9 Гц), 7,24 (с, 2H), 7,65 (с, 1H), 8,58 (д, 1H, J=4,9 Гц).
Пример 51
Синтез тетрагидрохлорида 4-[N-пропаргил-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
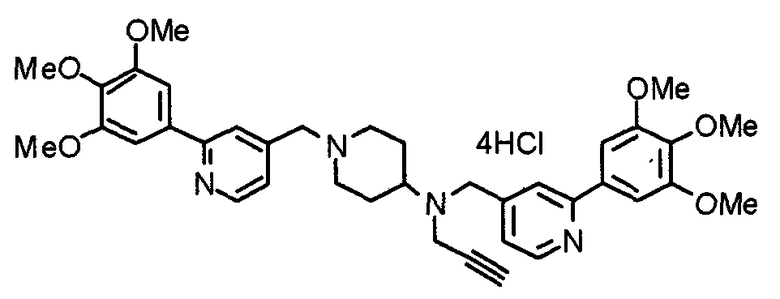
4-Пропаргиламин-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидин (227 мг) подвергают взаимодействию с 4-хлорметил-2-(3,4,5-триметоксифенил)пиридином (226 мг) по методике, аналогично описанной в примере 9. После превращения продукта в тетрагидрохлорид получают указанное в заголовке соединение в виде желтого порошка.
Выход 128 мг (23%).
1H-ЯМР (400 МГц, определяемый как свободное основание, CDCl3) δ: 1,48-2,40 (м, 7H), 2,72 (шир, 1H), 3,02 (шир, 2H), 3,39 (с, 2H), 3,64 (шир, 2H), 3,84 (с, 2H), 3,91 (с, 6H), 3,98 (с, 6H), 3,99 (с, 6H), 7,22-7,29 (м, 6H), 7,66 (шир, 2H), 8,60 (д, 1H, J=4,9 Гц), 8,62 (д, 1H, J=4,9 Гц).
Пример получения 88
Синтез 4-(5-инданиламино)-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
1-[[2-(3,4,5-Триметоксифенил)пиридин-4-ил]метил]-4-пиперидон (1,40 г) и 5-аминоиндан (680 мг) обрабатывают по методике, аналогично описанной в примере получения 37, получая указанное в заголовке соединение.
Выход 1,22 г (59%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,40-1,57 (м, 2H), 2,00-2,15 (м, 5H), 2,19-2,25 (м, 2H), 2,77-2,93 (м, 6H), 3,30 (шир, 1H), 3,58 (с, 2H), 3,91 (с, 3H), 3,97 (с, 6H), 6,41 (д, 1H, J=8,0 Гц), 6,52 (с, 1H), 7,01 (д, 1H, J=8,0 Гц), 7,21-7,26 (м, 3H), 7,64 (с, 1H), 8,60 (д, 1H, J=4,9 Гц).
Пример 52
Синтез тригидрохлорида 4-[N-(индан-5-ил)-N-[[2-(3,4,5-триметоксифенил)пиридин-3-ил]метил]амино]-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина

4-(5-Инданиламино)-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидин (142 мг) подвергают взаимодействию с 3-хлорметил-2-(3,4,5-триметоксифенил)пиридином (114 мг) по методике, аналогично описанной в примере 9. После превращения продукта в тригидрохлорид получают указанное в заголовке соединение в виде желтого порошка.
Выход 90 мг (41%).
1H-ЯМР (400 МГц, определяемый как свободное основание, CDCl3) δ: 1,54-1,67 (м, 2H), 1,74-1,83 (м, 2H), 1,98-2,07 (м, 2H), 2,09-2,98 (м, 2H), 3,55 (с, 2H), 3,64-3,74 (м, 1H), 3,90 (с, 3H), 3,91 (с, 6H), 3,92 (с, 3H), 3,96 (с, 6H), 4,41 (с, 2H), 6,49 (дд, 1H, J=8,2 Гц, 2,4 Гц), 6,59 (с, 1H), 6,74 (с, 2H), 7,04 (д, 1H, J=8,2 Гц), 7,15-7,20 (м, 2H), 7,22 (с, 2H), 7,54 (с, 1H), 7,77 (дд, 1H, J=7,8 Гц, 1,4 Гц), 8,52 (дд, 1H, J=4,7 Гц, 1,8 Гц), 8,59 (д, 1H, J=5,1 Гц).
Пример 53
Синтез дигидрохлорида 4-[N-(индан-5-ил)-N-[[2-(3,4,5-триметоксифенил)бензил]амино]-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
4-(5-Инданиламино)-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидин (142 мг) подвергают взаимодействию с 2-(3,4,5-триметоксифенил)бензилхлоридом (114 мг) по методике, аналогично описанной в примере 9. После превращения продукта в дигидрохлорид получают указанное в заголовке соединение в виде желтого порошка.
Выход 115 мг (47%).
1H-ЯМР (400 МГц, определяемый как свободное основание, CDCl3) δ: 1,56-1,66 (м, 2H), 1,80-1,83 (м, 2H), 2,00-2,05 (м, 2H), 2,11-2,18 (м, 2H), 2,77-2,83 (м, 4H), 2,92-2,95 (м, 2H), 3,55 (с, 2H), 3,72 (шир, 1H), 3,87 (с, 6H), 3,90 (с, 3H), 3,92 (с, 3H), 3,96 (с, 6H), 4,34 (с, 2H), 6,49 (д, 1H, J=8,3 Гц), 6,56 (с, 2H), 6,60 (с, 1H), 7,02 (д, 1H, J=8,3 Гц), 7,17-7,27 (м, 5H), 7,42-7,45 (м, 1H), 7,54 (с, 1H), 8,58 (д, 1H, J=4,9 Гц).
Пример 54
Синтез тригидрохлорида 4-[N-(индан-5-ил)-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
4-(5-Инданиламино)-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидин (142 мг) подвергают взаимодействию с 4-хлорметил-2-(3,4,5-триметоксифенил)пиридином (114 мг) по методике, аналогично описанной в примере 9. После превращения продукта в тригидрохлорид получают указанное в заголовке соединение в виде белого порошка.
Выход 23 мг (9%).
1H-ЯМР (400 МГц, определяемый как свободное основание, CDCl3) δ: 1,60-1,95 (м, 4H), 2,00 (квинтет, 2H, J=7,3 Гц), 2,20 (шир, 2H), 2,75-2,81 (м, 4H), 2,99 (шир, 2H), 3,58 (шир, 2H), 3,77 (с, 1H), 3,86 (с, 3H), 3,87 (с, 3H), 3,91 (с, 6H), 3,94 (с, 6H), 4,49 (с, 2H), 6,51 (д, 1H, J=8,3 Гц), 6,62 (с, 1H), 7,02 (д, 1H, J=8,0 Гц), 7,16 (с, 2H), 7,18-7,22 (м, 4H), 7,57 (шир, 2H), 8,52 (д, 1H, J=4,9 Гц), 8,57 (д, 1H, J=4,9 Гц).
Пример 55
Синтез дигидрохлорида 4-[N-(индан-5-ил)-N-[[3-(3,4,5-триметоксифенил)бензил]амино]-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
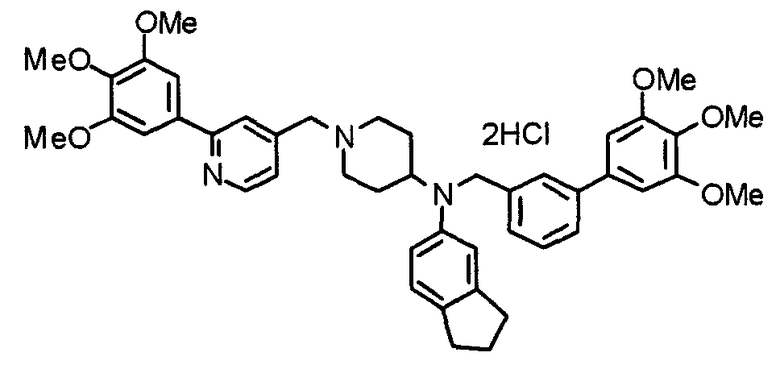
4-(5-Инданиламино)-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидин (60 мг) подвергают взаимодействию с 3-(3,4,5-триметоксифенил)бензилхлоридом (114 мг) по методике, аналогично описанной в примере 9. После превращения продукта в дигидрохлорид получают указанное в заголовке соединение в виде желтого порошка.
Выход 18 мг (19%).
1H-ЯМР (400 МГц, определяемый как свободное основание, CDCl3) δ: 1,60-1,95 (м, 4H), 2,00 (квинтет, 2H, J=7,2 Гц), 2,20 (шир, 2H), 2,75-2,81 (м, 4H), 2,95 (шир, 2H), 3,60 (шир, 2H), 3,85 (шир, 1H), 3,86 (с, 3H), 3,87 (с, 6H), 3,88 (с, 3H), 3,94 (с, 6H), 4,51 (с, 2H), 6,54 (д, 1H, J=8,2 Гц), 6,66 (с, 1H), 6,70 (с, 2H), 7,01 (д, 1H, J=8,4 Гц), 7,19 (д, 1H, J=4,9 Гц), 7,19-7,42 (м, 6H), 7,60 (шир, 1H), 8,59 (шир, 1H).
Пример 56
Синтез тригидрохлорида 4-[N-(индан-5-ил)-N-[[2-(3,4,5-триметоксифенил)пиридин-5-ил]метил]амино]-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
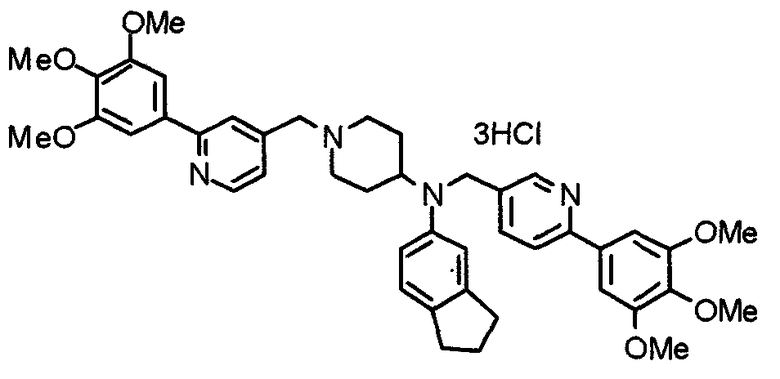
4-(5-Инданиламино)-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидин (143 мг) подвергают взаимодействию с 5-хлорметил-2-(3,4,5-триметоксифенил)пиридином (114 мг) по методике, аналогично описанной в примере 9. После превращения продукта в тригидрохлорид получают указанное в заголовке соединение в виде белого порошка.
Выход 138 мг (63%).
1H-ЯМР (400 МГц, определяемый как свободное основание, CDCl3) δ: 1,71-1,91 (м, 4H), 1,98-2,06 (м, 2H), 2,13-2,22 (м, 2H), 2,76-2,84 (м, 4H), 2,94-3,05 (м, 2H), 3,57 (с, 2H), 3,69-3,78 (м, 1H), 3,89 (с, 3H), 3,90 (с, 3H), 3,94 (с, 6H), 3,96 (с, 6H), 4,50 (с, 2H), 6,57 (дд, 1H, J=8,2 Гц, 2,3 Гц), 6,67 (с, 1H), 7,04 (д, 1H, J=8,4 Гц), 7,20-7,22 (м, 1H), 7,22 (с, 2H), 7,23 (с, 2H), 7,57-7,62 (м, 1H), 7,60 (с, 1H), 7,65 (дд, 1H, J=8,2 Гц, 2,2 Гц), 8,58-8,62 (м, 2H).
Пример 57
Синтез дигидрохлорида 4-[N-(индан-5-ил)-N-[[4-(3,4,5-триметоксифенил)бензил]амино]-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
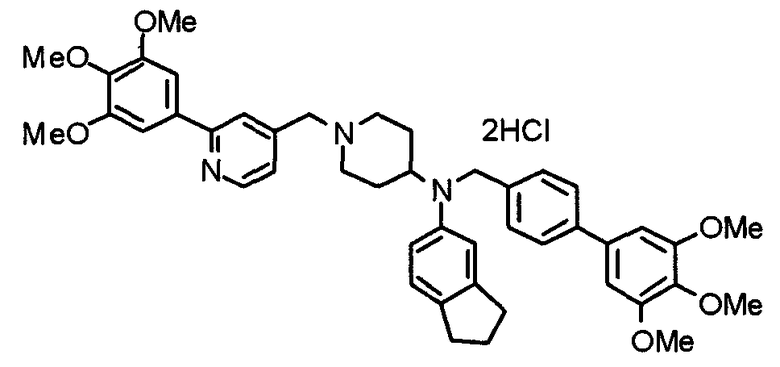
4-(5-Инданиламино)-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидин (143 мг) подвергают взаимодействию с 4-(3,4,5-триметоксифенил)бензилхлоридом (114 мг) по методике, аналогично описанной в примере 9. После превращения продукта в дигидрохлорид получают указанное в заголовке соединение в виде желтого порошка.
Выход 95 мг (39%).
1H-ЯМР (400 МГц, определяемый как свободное основание, CDCl3) δ: 1,74-1,90 (м, 4H), 2,01-2,06 (м, 2H), 2,16-2,22 (м, 2H), 2,78-2,84 (м, 4H), 2,96-2,99 (м, 2H), 3,58 (с, 2H), 3,72 (шир, 1H), 3,88 (с, 3H), 3,90 (с, 3H), 3,91 (с, 6H), 3,96 (с, 6H), 4,51 (с, 2H), 6,55 (д, 1H, J=8,3 Гц), 6,67 (с, 1H), 6,72 (с, 2H), 7,04 (д, 1H, J=8,3 Гц), 7,20 (д, 1H, J=5,1 Гц), 7,23 (с, 2H), 7,35 (д, 2H, J=8,1 Гц), 7,47 (д, 2H, J=8,1 Гц), 7,61 (с, 1H), 8,59 (д, 1H, J=4,9 Гц).
Пример получения 89
Синтез 4-(4-бутиланилино)-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
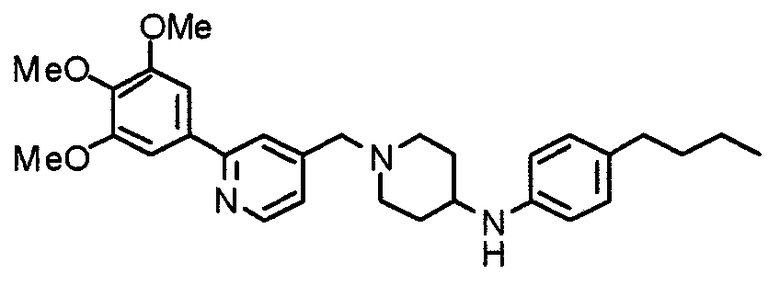
1-[[2-(3,4,5-Триметоксифенил)пиридин-4-ил]метил]-4-пиперидон (1,24 г) и 4-бутиланилин (149 мг) обрабатывают в соответствии со способом, описанном в примере получения 37, получая указанное в заголовке соединение.
Выход 1,23 г (72%).
1H-ЯМР (400 МГц, CDCl3) δ: 0,82 (т, 3H, J=7,3 Гц), 1,20-1,30 (м, 2H), 1,38-1,50 (м, 4H), 1,92-2,25 (м, 4H), 2,40 (т, 2H, J=7,7 Гц), 2,77 (шир, 2H), 3,21 (шир, 1H), 3,50 (с, 2H), 3,82 (с, 3H), 3,89 (с, 6H), 6,45 (д, 2H, J=7,8 Гц), 6,89 (д, 2H, J=8,0 Гц), 7,13 (д, 1H, J=4,9 Гц), 7,18 (с, 2H), 7,58 (с, 1H), 8,52 (д, 1H, J=4,9 Гц).
Пример 58
Синтез тригидрохлорида 4-[N-(4-бутилфенил)-N-[[2-(3,4,5-триметоксифенил)пиридин-3-ил]метил]амино]-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
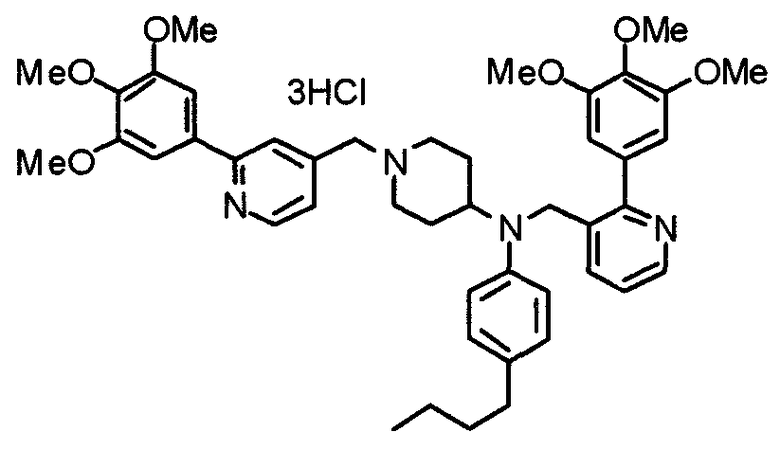
4-(4-Бутиланилино)-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидин (147 мг) подвергают взаимодействию с 3-хлорметил-2-(3,4,5-триметоксифенил)пиридином (114 мг) по методике, аналогично описанной в примере 9. После превращения продукта в тригидрохлорид получают указанное в заголовке соединение в виде желтого порошка.
Выход 58 мг (27%).
1H-ЯМР (400 МГц, определяемый как свободное основание, CDCl3) δ: 0,91 (т, 3H, J=7,3 Гц), 1,32-1,35 (м, 2H), 1,50-1,70 (м, 4H), 1,75 (шир, 2H), 2,10-2,20 (м, 2H), 2,49 (т, 2H, J=7,6 Гц), 2,95 (шир, 2H), 3,55 (с, 2H), 3,70 (шир, 1H), 3,90 (с, 3H), 3,91 (с, 6H), 3,92 (с, 3H), 3,96 (с, 6H), 4,41 (с, 2H), 6,59 (д, 2H, J=8,8 Гц), 6,74 (с, 2H), 7,00 (д, 2H, J=8,6 Гц), 7,16-7,17 (м, 1H), 7,19 (д, 1H, J=4,9 Гц), 7,22 (с, 2H), 7,54 (с, 1H), 8,59 (д, 1H, J=7,5 Гц), 8,52 (шир, 1H), 8,59 (д, 1H, J=4,9 Гц).
Пример 59
Синтез дигидрохлорида 4-[N-(4-бутилфенил)-N-[2-(3,4,5-триметоксифенил)бензил]амино]-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
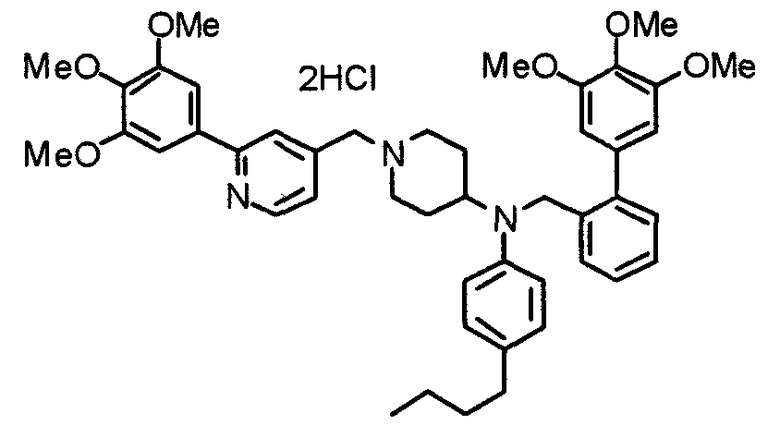
4-(4-Бутиланилино)-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидин (147 мг) подвергают взаимодействию с 2-(3,4,5-триметоксифенил)бензилхлоридом (114 мг) по методике, аналогично описанной в примере 9. После превращения продукта в дигидрохлорид получают указанное в заголовке соединение в виде желтого порошка.
Выход 59 мг (24%).
1H-ЯМР (400 МГц, определяемый как свободное основание, CDCl3) δ: 0,90 (т, 3H, J=7,4 Гц), 1,25-1,41 (м, 2H), 1,48-1,75 (м, 4H), 1,81 (д, 2H, J=11,7 Гц), 2,13 (т, 2H, J=11,2 Гц), 2,48 (т, 2H, J=7,5 Гц), 2,93 (д, 2H, J=11,2 Гц), 3,55 (с, 2H), 3,65-3,80 (м, 1H), 3,87 (с, 6H), 3,90 (с, 3H), 3,92 (с, 1H), 3,96 (с, 6H), 4,33 (с, 2H), 6,56 (с, 2H), 6,60 (д, 2H, J=8,5 Гц), 6,98 (д, 2H, J=8,5 Гц), 7,18 (д, 1H, J=4,9 Гц), 7,21 (с, 2H), 7,20-7,37 (м, 3H), 7,41 (шир, 1H), 7,54 (с, 1H), 8,58 (д, 1H, J=4,9 Гц).
Пример 60
Синтез тригидрохлорида 4-[N-(4-бутилфенил)-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
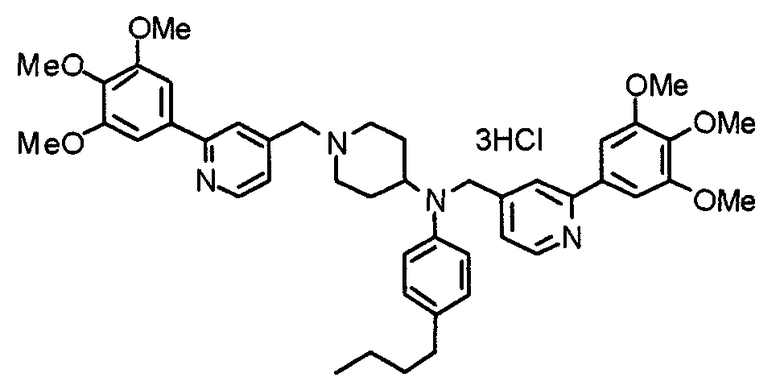
4-(4-Бутиланилино)-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидин (196 мг) подвергают взаимодействию с 4-хлорметил-2-(3,4,5-триметоксифенил)пиридином (129 мг) по методике, аналогично описанной в примере 9. После превращения продукта в тригидрохлорид получают указанное в заголовке соединение в виде белого порошка.
Выход 20 мг (6%).
1H-ЯМР (400 МГц, определяемый как свободное основание, CDCl3) δ: 0,88 (т, 3H, J=7,3 Гц), 1,20-1,35 (м, 2H), 1,49-1,60 (м, 2H), 1,62-2,02 (м, 4H), 2,20 (шир, 2H), 2,46 (т, 2H, J=7,3 Гц), 3,05 (шир, 2H), 3,60 (шир, 3H), 3,87 (с, 3H), 3,88 (с, 3H), 3,90 (с, 6H), 3,94 (с, 6H), 4,49 (с, 2H), 6,62 (д, 2H, J=8,3 Гц), 6,98 (д, 2H, J=8,3 Гц), 7,13 (с, 2H), 7,15-7,40 (м, 4H), 7,55 (шир, 2H), 8,52 (д, 1H, J=4,9 Гц), 8,60 (шир, 1H).
Пример 61
Синтез дигидрохлорида 4-[N-(4-бутилфенил)-N-[3-(3,4,5-триметоксифенил)бензил]амино]-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
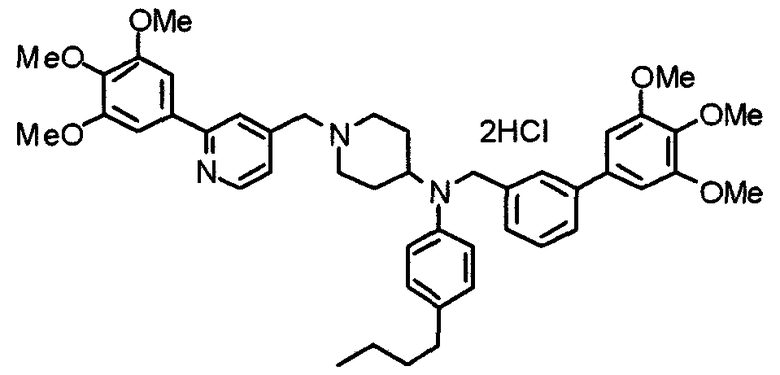
4-(4-Бутиланилино)-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидин (147 мг) подвергают взаимодействию с 3-(3,4,5-триметоксифенил)бензилхлоридом (114 мг) по методике, аналогично описанной в примере 9. После превращения продукта в дигидрохлорид получают указанное в заголовке соединение в виде желтого порошка.
Выход 102 мг (42%).
1H-ЯМР (400 МГц, определяемый как свободное основание, CDCl3) δ: 0,90 (т, 3H, J=7,4 Гц), 1,30-1,36 (м, 2H), 1,48-1,56 (м, 2H), 1,76-1,89 (м, 4H), 2,19 (шир, 2H), 2,48 (т, 2H, J=7,8 Гц), 2,97 (шир, 2H), 3,58 (с, 2H), 3,86 (шир, 1H), 3,88 (с, 3H), 3,58 (с, 2H), 3,86 (шир, 1H), 3,88 (с, 3H), 3,90 (с, 3H), 3,95 (с, 6H), 4,54 (с, 2H), 6,68 (д, 2H, J=8,6 Гц), 6,72 (с, 2H), 7,00 (д, 2H, J=8,6 Гц), 7,20-7,27 (м, 2H), 7,23 (с, 2H), 7,32-7,40 (м, 2H), 7,44 (с, 1H), 7,62 (с, 1H), 8,59 (д, 1H, J=5,1 Гц).
Пример 62
Синтез тригидрохлорида 4-[N-(4-бутилфенил)-N-[[2-(3,4,5-триметоксифенил)пиридин-5-ил]метил]амино]-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
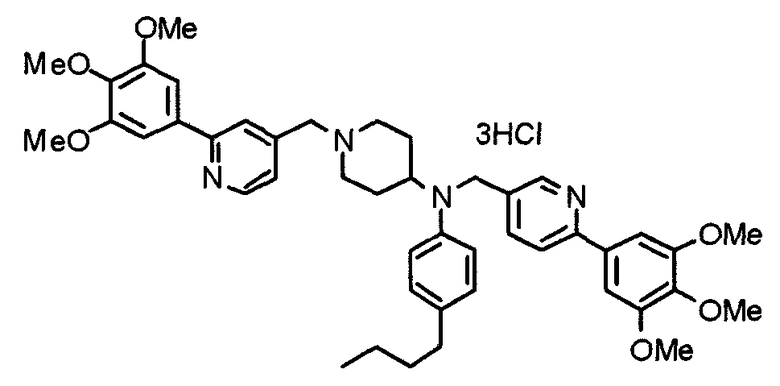
4-(4-Бутиланилино)-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидин (147 мг) подвергают взаимодействию с 5-хлорметил-2-(3,4,5-триметоксифенил)пиридином (114 мг) по методике, аналогично описанной в примере 9. После превращения продукта в тригидрохлорид получают указанное в заголовке соединение в виде белого порошка.
Выход 65 мг (21%).
1H-ЯМР (400 МГц, определяемый как свободное основание, CDCl3) δ: 0,90 (т, 3H, J=7,3 Гц), 1,32-1,36 (м, 2H), 1,50-1,54 (м, 2H), 1,70-1,95 (м, 4H), 2,17 (шир, 2H), 2,49 (т, 2H, J=7,7 Гц), 2,96 (шир, 2H), 3,58 (с, 2H), 3,75 (шир, 1H), 3,89 (с, 3H), 3,90 (с, 3H), 3,94 (с, 6H), 3,96 (с, 6H), 4,50 (с, 2H), 6,68 (д, 2H, J=8,6 Гц), 7,00 (д, 2H, J=8,6 Гц), 7,20-7,22 (м, 3H), 7,23 (с, 2H), 7,58-7,66 (м, 3H), 8,59 (шир, 1H), 8,60 (шир, 1H).
Пример 63
Синтез дигидрохлорида 4-[N-(4-бутилфенил)-N-[4-(3,4,5-триметоксифенил)бензил]амино]-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
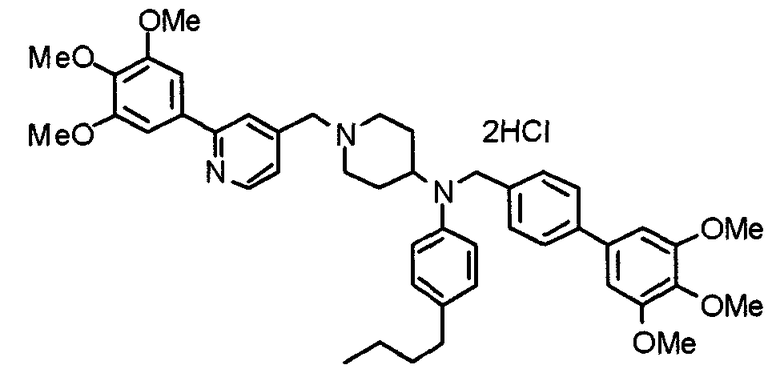
4-(4-Бутиланилино)-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидин (147 мг) подвергают взаимодействию с 4-(3,4,5-триметоксифенил)бензилхлоридом (114 мг) по методике, аналогично описанной в примере 9. После превращения продукта в дигидрохлорид получают указанное в заголовке соединение в виде желтого порошка.
Выход 82 мг (33%).
1H-ЯМР (400 МГц, определяемый как свободное основание, CDCl3) δ: 0,90 (т, 3H, J=7,3 Гц), 1,30-1,36 (м, 2H), 1,51-1,55 (м, 2H), 1,79-1,90 (м, 4H), 2,18 (шир, 2H), 2,48 (т, 2H, J=7,7 Гц), 2,98 (д, 2H, J=10,7 Гц), 3,57 (с, 2H), 3,72-3,85 (м, 1H), 3,88 (с, 3H), 3,90 (с, 3H), 3,91 (с, 6H), 3,96 (с, 6H), 4,50 (с, 2H), 6,66 (д, 2H, J=8,8 Гц), 6,75 (с, 2H), 7,00 (д, 2H, J=8,8 Гц), 7,20 (д, 1H, J=4,9 Гц), 7,22 (с, 2H), 7,33 (д, 2H, J=8,2 Гц), 7,47 (д, 2H, J=8,2 Гц), 7,61 (с, 1H), 8,59 (д, 1H, J=5,1 Гц).
Пример получения 90
Синтез 1-(4-пиколил)-4-пиперидона
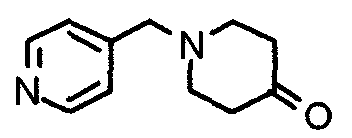
Моногидрат гидрохлорида 4-пиперидона (922 мг) и гидрохлорид 4-пиколилхлорида (820 мг) подвергают взаимодействию в соответствии со способом, описанном в примере 2, получая указанное в заголовке соединение.
Выход 870 мг (92%).
1H-ЯМР (400 МГц, CDCl3) δ: 2,46 (т, 4H, J=5,9 Гц), 2,74 (т, 4H, J=6,2 Гц), 3,61 (с, 2H), 7,29 (д, 2H, J=6,2 Гц), 8,55 (дд, 2H, J=6,2 Гц, 1,1 Гц).
Пример получения 91
Синтез тетрагидрохлорида 1-(4-пиколил)-4-(4-пиколиламино)пиперидина
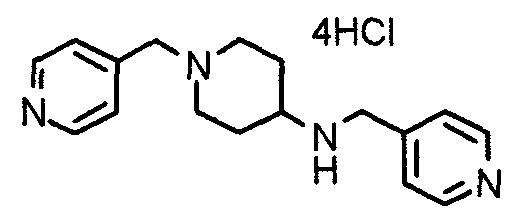
1-(4-Пиколил)-4-пиперидон (870 мг) подвергают взаимодействию с 4-пиколиламином (497 мг) по методике, аналогично описанной в примере получения 37. Целевое соединение получают в виде бледно-коричневого тетрагидрохлорида.
Выход 363 мг (19%).
1H-ЯМР (400 МГц, определяемый как свободное основание, CDCl3) δ: 1,37-1,51 (м, 2H), 1,82-1,90 (м, 2H), 2,04 (дт, 2H, J=11,6 Гц, 2,7 Гц), 2,44-2,55 (м, 1H), 2,76-2,82 (м, 2H), 3,47 (с, 2H), 3,82 (с, 2H), 7,23-7,26 (м, 4H), 8,50-8,53 (м, 4H).
Пример получения 92
Синтез 4-(п-анизидино)-1-(трет-бутоксикарбонил)пиперидина
1-(трет-Бутоксикарбонил)-4-пиперидон (116 г) подвергают взаимодействию с п-анизидином (68,3 г) по методике, аналогично описанной в примере получения 37, получая указанное в заголовке соединение.
Выход 125 г (74%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,23-1,35 (м, 2H), 1,46 (с, 9H), 1,96-2,06 (м, 2H), 2,83-2,96 (м, 2H), 3,27-3,38 (м, 1H), 3,74 (с, 9H), 3,94-4,12 (м, 2H), 6,58 (д, 2H, J=9,0 Гц), 6,77 (д, 2H, J=9,0 Гц).
Пример получения 93
Синтез 1-(трет-бутоксикарбонил)-4-[N-(4-метоксифенил)-N-[3-(3,4,5-триметоксифенил)бензоиламино]пиперидина
4-(п-Анизидино)-1-(трет-бутоксикарбонил)пиперидин (613 мг) подвергают взаимодействию с 3-(3,4,5-триметоксифенил)бензойной кислотой (577 мг) по методике, аналогично описанной в примере 1, получая указанное в заголовке соединение.
Выход 416 мг (36%).
Пример получения 94
Синтез гидрохлорида 4-[N-(4-метоксифенил)-N-[3-(3,4,5-триметоксифенил)бензоил]амино]пиперидина
К раствору 1-(трет-бутоксикарбонил)-4-[N-(4-метоксифенил)-N-[3-(3,4,5-триметоксифенил)бензоиламино]пиперидина (416 мг) в этилацетате (5 мл) добавляют 4 М раствор хлористого водорода в этилацетате (5 мл). Смесь перемешивают при комнатной температуре в течение 4 часов, полученные осадки фильтруют, промывают этилацетатом с помощью воронки и сушат, получая указанное в заголовке соединение.
Выход 315 мг (85%).
Примеры 64-66
Указанные соединения получают взаимодействием гидрохлорида 4-[N-(4-метоксифенил)-N-[3-(3,4,5-триметоксифенил)бензоил]амино]пиперидина с производными хлорида, полученными в примерах получения 3, 42 и 48. Полученные свободные основания затем превращают в соответствующие гидрохлориды. Выходы и данные ЯМР их свободных оснований указаны ниже.
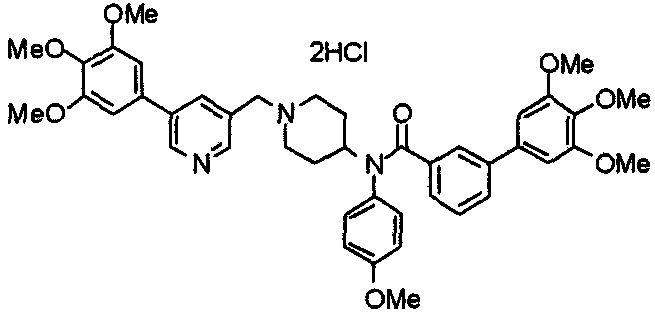
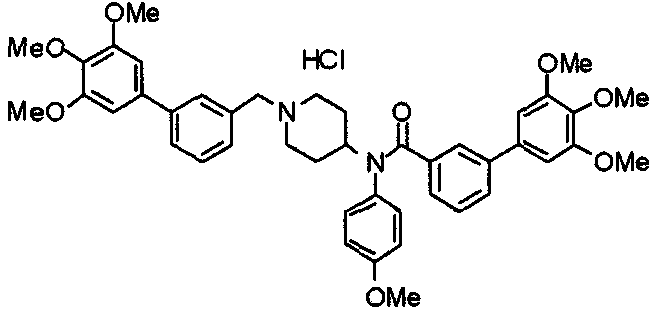
Пример получения 95
Синтез 1-(трет-бутоксикарбонил)-4-[N-(4-метоксифенил)-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]пиперидина
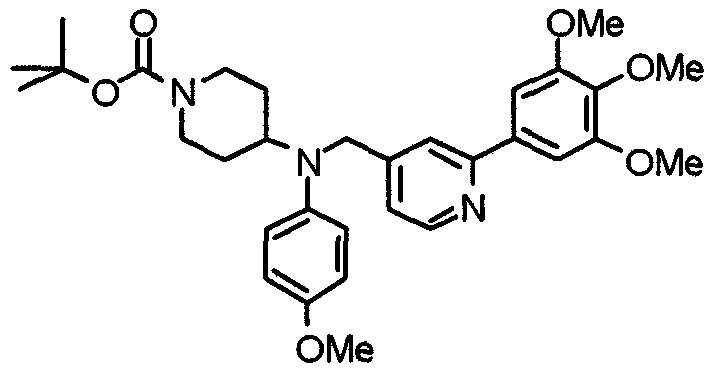
4-(п-Анизидино)-1-(трет-бутоксикарбонил)пиперидин (2,21 г) подвергают взаимодействию с 4-хлорметил-2-(3,4,5-триметоксифенил)пиридином (2,12 г) по методике, аналогично описанной в примере 9, получая указанное в заголовке соединение.
Выход 3,76 г (93%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,40-1,64 (м, 2H), 1,44 (с, 9H), 1,82-1,91 (м, 2H), 2,71-2,84 (м, 2H), 3,62-3,73 (м, 1H), 3,74 (с, 3H), 3,89 (с, 3H), 3,94 (с, 6H), 4,10-4,30 (м, 2H), 4,40 (с, 2H), 6,76 (д, 2H, J=9,4 Гц), 6,79 (д, 2H, J=9,8 Гц), 7,14-7,19 (м, 3H), 7,56 (с, 1H), 8,55 (д, 1H, J=5,1 Гц).
Пример получения 96
Синтез дигидрохлорида 4-[N-(4-метоксифенил)-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]пиперидина
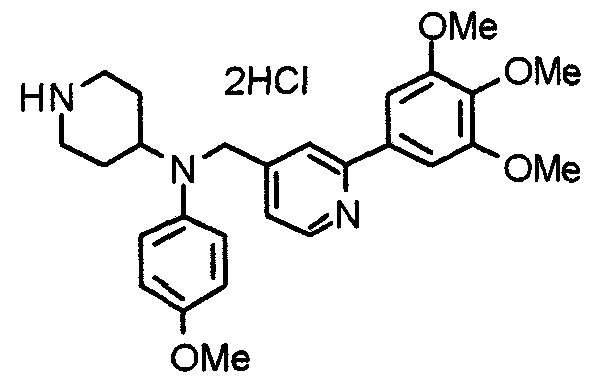
1-(трет-Бутоксикарбонил)-4-[N-(4-метоксифенил)-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]пиперидин (3,76 г) обрабатывают по методике, аналогично описанной в примере получения 94, получая указанное в заголовке соединение.
Выход 3,77 г (теоретический выход).
Пример получения 97
Синтез 1-(трет-бутоксикарбонил)-4-[N-(4-метоксифенил)-N-[[3-(3,4,5-триметоксифенил)пиридин-5-ил]метил]амино]пиперидина
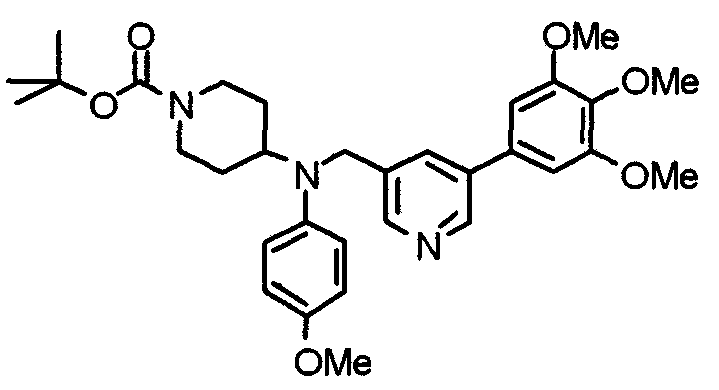
4-(п-Анизидино)-1-(трет-бутоксикарбонил)пиперидин (613 мг) подвергают взаимодействию с 5-хлорметил-3-(3,4,5-триметоксифенил)пиридином (588 мг) по методике, аналогично описанной в примере получения 9, получая указанное в заголовке соединение в виде желтого аморфного вещества.
Выход 159 мг (14%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,44 (с, 9H), 1,50-1,65 (м, 2H), 1,83-1,91 (м, 2H), 2,70-2,84 (м, 2H), 3,53-3,62 (м, 1H), 3,73 (с, 3H), 3,89 (с, 3H), 3,91 (с, 6H), 4,10-4,29 (м, 2H), 4,41 (с, 2H), 6,66 (с, 2H), 6,76-6,84 (м, 4H), 7,70 (с, 1H), 8,49 (с, 1H), 8,63 (д, 1H, J=2,1 Гц).
Пример получения 98
Синтез дигидрохлорида 4-[N-(4-метоксифенил)-N-[[3-(3,4,5-триметоксифенил)пиридин-5-ил]метил]амино]пиперидина
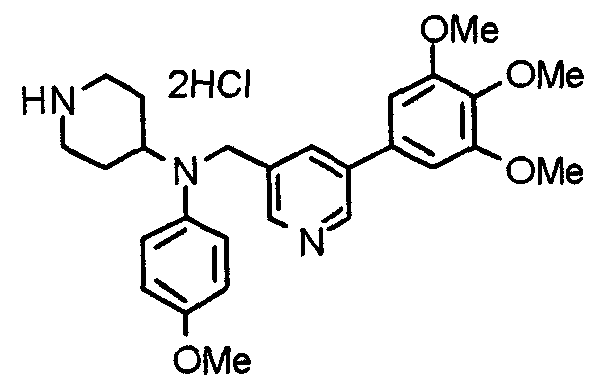
1-(трет-Бутоксикарбонил)-4-[N-(4-метоксифенил)-N-[[3-(3,4,5-триметоксифенил)пиридин-5-ил]метил]амино]пиперидин (159 мг) обрабатывают по методике, аналогично описанной в примере получения 94, получая указанное в заголовке соединение в виде желтого порошка.
Выход 142 мг (94%).
Пример получения 99
Синтез 1-(трет-бутоксикарбонил)-4-[N-(4-метоксифенил)-N-[3-(3,4,5-триметоксифенил)бензил]амино]пиперидина
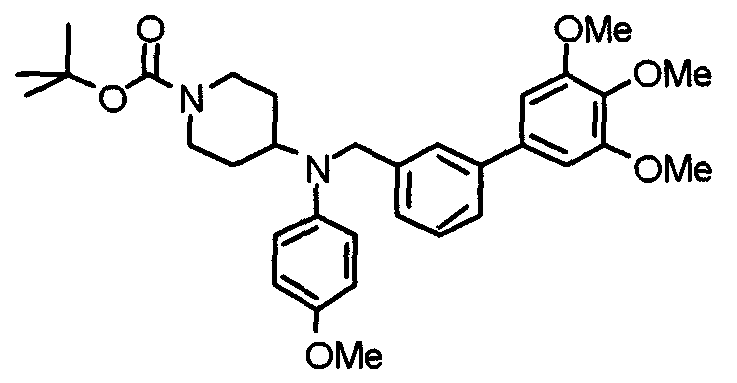
4-(п-Анизидино)-1-(трет-бутоксикарбонил)пиперидин (613 мг) и 3-(3,4,5-триметоксифенил)бензилхлорид (586 мг) обрабатывают по методике, аналогично описанной в примере 9, получая указанное в заголовке соединение в виде желтого аморфного вещества.
Выход 1,12 г (90%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,44 (с, 9H), 1,50-1,63 (м, 2H), 1,82-1,91 (м, 2H), 2,71-2,83 (м, 2H), 3,69 (тт, 1H, J=11,5 Гц, 3,5 Гц), 3,73 (с, 3H), 3,88 (с, 3H), 3,90 (с, 6H), 4,10-4,28 (м, 2H), 4,42 (с, 2H), 6,71 (с, 2H), 6,78 (с, 4H), 7,24-7,28 (м, 1H), 7,31-7,40 (м, 2H), 7,42 (с, 1H).
Пример получения 100
Синтез гидрохлорида 4-[N-(4-метоксифенил)-N-[3-(3,4,5-триметоксифенил)бензил]амино]пиперидина
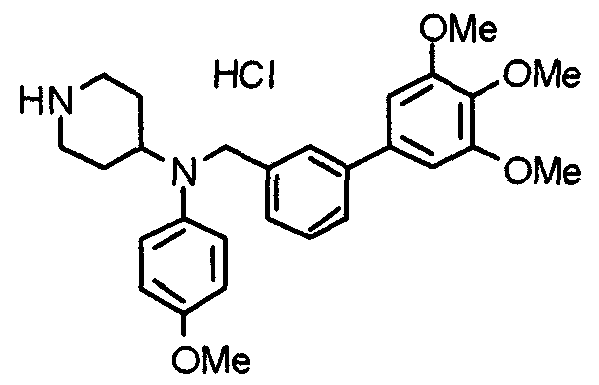
1-(трет-Бутоксикарбонил)-4-[N-(4-метоксифенил)-N-[3-(3,4,5-триметоксифенил)бензил]амино]пиперидин (1,12 г) обрабатывают по методике, аналогично описанной в примере получения 94, получая указанное в заголовке соединение в виде желтого порошка.
Выход 980 мг (99%).
Примеры 67-71
Указанные соединения получают взаимодействием аминов, полученных в примерах получения 96, 98 и 100, с производными хлорида, полученными в примерах получения 42 и 48. Полученные свободные основания затем превращают в соответствующие гидрохлориды. Выходы и данные ЯМР их свободных оснований указаны ниже.
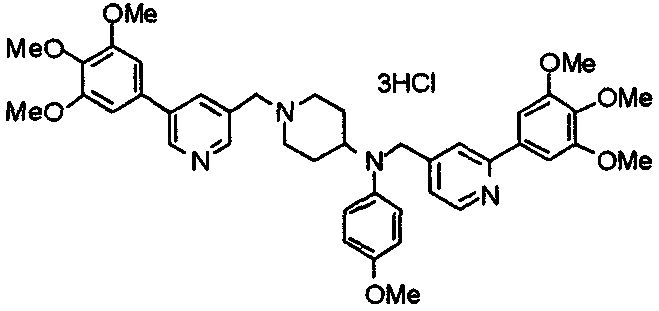
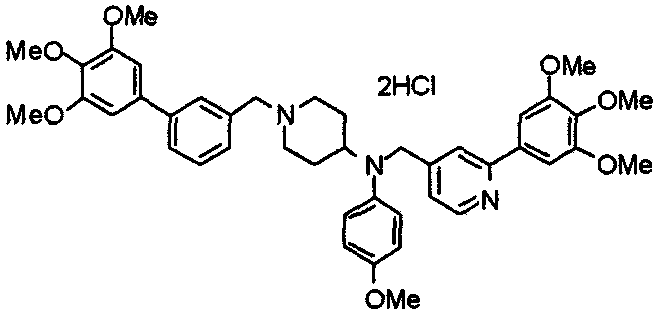
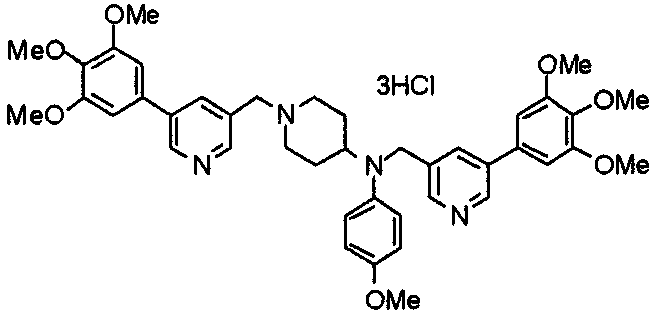
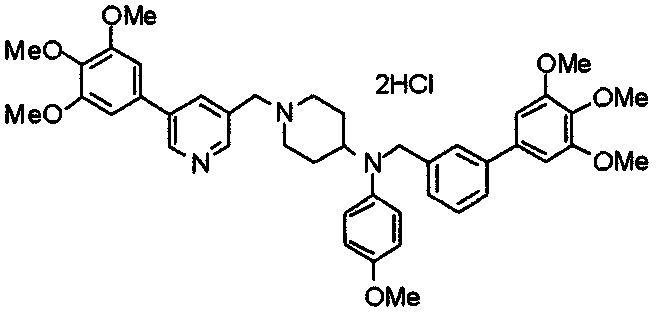
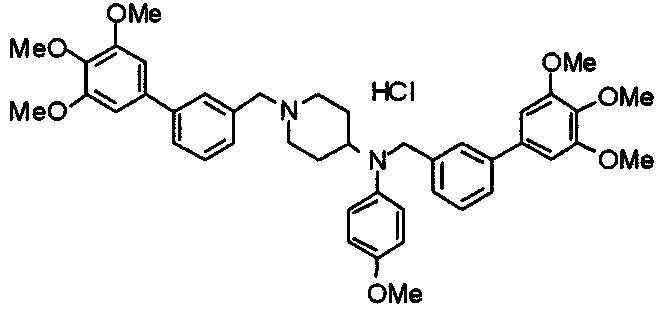
Пример получения 101
Синтез 1-(трет-бутоксикарбонил)-4-(4-этоксифениламино)пиперидина
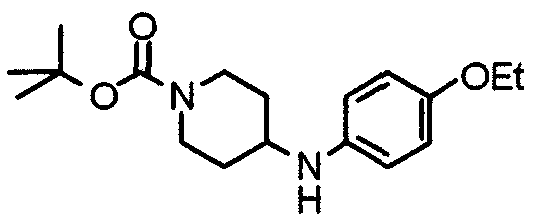
1-(трет-Бутоксикарбонил)-4-пиперидинон (5,00 г) подвергают взаимодействию с п-фенитидином (3,28 г) по методике, аналогично описанной в примере получения 37, получая указанное в заголовке соединение в виде коричневого порошка.
Выход 7,00 г (91%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,21-1,31 (м, 2H), 1,37 (т, 3H, J=7,0 Гц), 1,46 (с, 9H), 1,97-2,05 (м, 2H), 2,84-2,95 (м, 2H), 3,28-3,37 (м, 1H), 3,96 (кв, 2H, J=7,0 Гц), 3,99-4,10 (м, 2H), 6,57 (д, 2H, J=8,8 Гц), 6,77 (д, 2H, J=9,0 Гц).
Пример получения 102
Синтез 1-(трет-бутоксикарбонил)-4-[N-(4-этоксифенил)-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]пиперидина
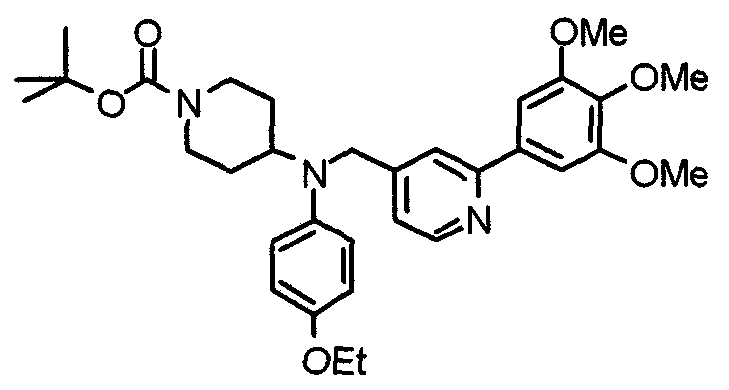
1-(трет-Бутоксикарбонил)-4-[(4-этоксифенил)амино]пиперидин (641 мг) подвергают взаимодействию с 4-хлорметил-2-(3,4,5-триметоксифенил)пиридином (588 мг) по методике, аналогично описанной в примере 9, получая указанное в заголовке соединение в виде желтого аморфного вещества.
Выход 2,08 г (94%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,36 (т, 3H, J=7,9 Гц), 1,44 (с, 9H), 1,49-1,58 (м, 2H), 1,82-1,92 (м, 2H), 2,70-2,85 (м, 2H), 3,62-3,72 (м, 1H), 3,89 (с, 3H), 3,94 (с, 6H), 4,12-4,29 (м, 2H), 4,39 (с, 2H), 6,75 (д, 2H, J=9,2 Гц), 6,78 (д, 2H, J=9,6 Гц), 7,14-7,18 (м, 3H), 7,55 (с, 1H), 8,54 (д, 1H, J=5,1 Гц).
Пример получения 103
Синтез дигидрохлорида 4-[N-(4-этоксифенил)-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]пиперидина
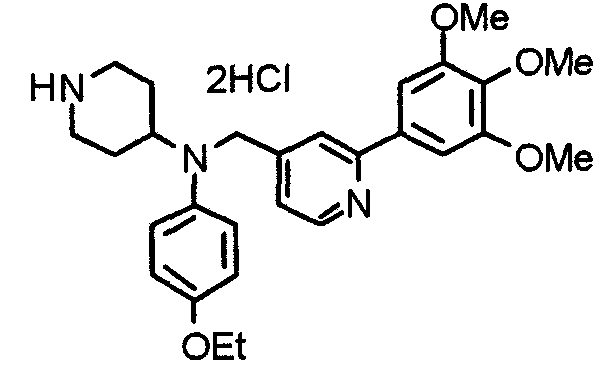
1-(трет-Бутоксикарбонил)-4-[N-(4-этоксифенил)-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]пиперидин (1,08 г) обрабатывают по методике, аналогично описанной в примере получения 94, получая указанное в заголовке соединение в виде бледно-желтого порошка.
Выход 1,01 г (98%).
Пример получения 104
Синтез 1-(трет-бутоксикарбонил)-4-[N-(4-этоксифенил)-N-[[3-(3,4,5-триметоксифенил)пиридин-5-ил]метил]амино]пиперидина
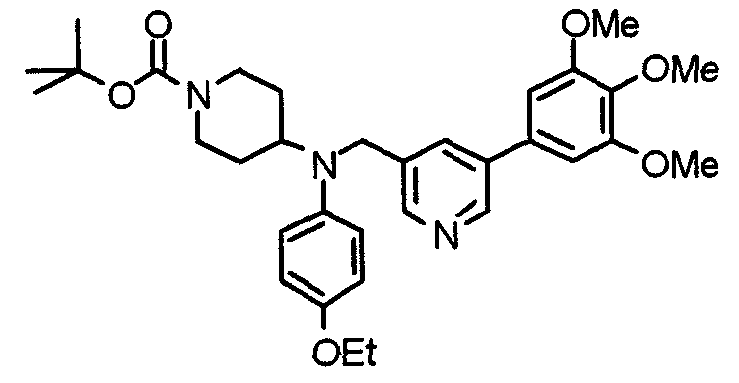
1-(трет-Бутоксикарбонил)-4-[(4-этоксифенил)амино]пиперидин (641 мг) подвергают взаимодействию с 5-хлорметил-3-(3,4,5-триметоксифенил)пиридином (588 мг) по методике, аналогично описанной в примере 9, получая указанное в заголовке соединение в виде желтого аморфного вещества.
Выход 452 мг (39%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,36 (т, 3H, J=6,8 Гц), 1,44 (с, 9H), 1,50-1,60 (м, 2H) 1,82-1,90 (м, 1H), 2,68-2,82 (м, 2H), 3,52-3,61 (м, 1H), 3,88 (с, 3H), 3,90 (с, 6H), 3,94 (кв, 2H, J=7,0 Гц), 4,10-4,25 (м, 2H), 4,40 (с, 2H), 6,66 (с, 2H), 6,77 (д, 2H, J=9,2 Гц), 6,81 (д, 2H, J=9,2 Гц), 7,67 (с, 1H), 8,49 (д, 1H, J=2,0 Гц), 8,62 (д, 1H, J=2,1 Гц).
Пример получения 105
Синтез дигидрохлорида 4-[N-(4-этоксифенил)-N-[[3-(3,4,5-триметоксифенил)пиридин-5-ил]метил]амино]пиперидина
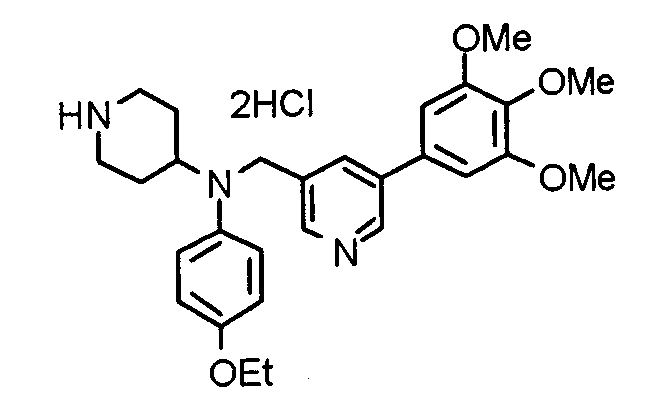
1-(трет-Бутоксикарбонил)-4-[N-(4-этоксифенил)-N-[[3-(3,4,5-триметоксифенил)пиридин-5-ил]метил]амино]пиперидин (452 мг) обрабатывают по методике, аналогично описанной в примере получения 94, получая указанное в заголовке соединение в виде светло-желтого порошка.
Выход 380 мг (88%).
Пример получения 106
Синтез 1-(трет-бутоксикарбонил)-4-[N-(4-этоксифенил)-N-[[3-(3,4,5-триметоксифенил)бензил]амино]пиперидина
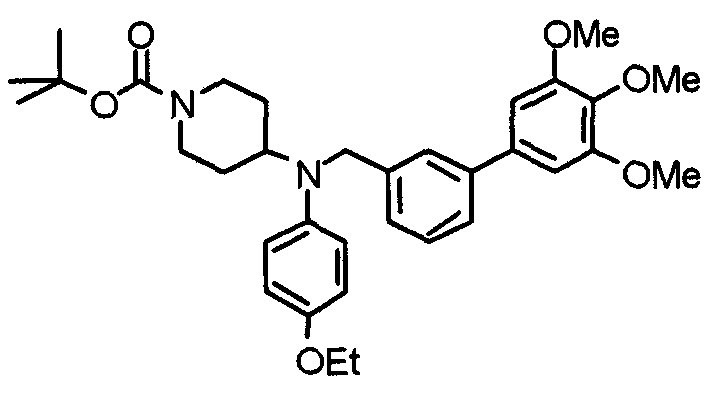
1-(трет-Бутоксикарбонил)-4-[(4-этоксифенил)амино]пиперидин (641 мг) подвергают взаимодействию 3-(3,4,5-триметоксифенил)бензилхлоридом (586 мг) по методике, аналогично описанной в примере 9, получая указанное в заголовке соединение в виде бледно-желтого аморфного вещества.
Выход 1,06 г (92%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,36 (т, 3H, J=7,0 Гц), 1,44 (с, 9H), 1,53-1,59 (м, 2H), 1,83-1,91 (м, 2H), 2,70-2,83 (м, 2H), 3,64-3,73 (м, 1H), 3,88 (с, 3H), 3,90 (с, 6H), 3,94 (кв, 2H, J=7,0 Гц), 4,10-4,29 (м, 2H), 4,41 (с, 2H), 6,71 (с, 2H), 6,76 (с, 4H), 7,26 (д, 1H, J=7,9 Гц), 7,33 (дд, 1H, J=7,4 Гц, 7,4 Гц), 7,38 (д, 1H, J=7,6 Гц), 7,42 (с, 1H).
Пример получения 107
Синтез гидрохлорида 4-[N-(4-этоксифенил)-N-[3-(3,4,5-триметоксифенил)бензил]амино]пиперидина
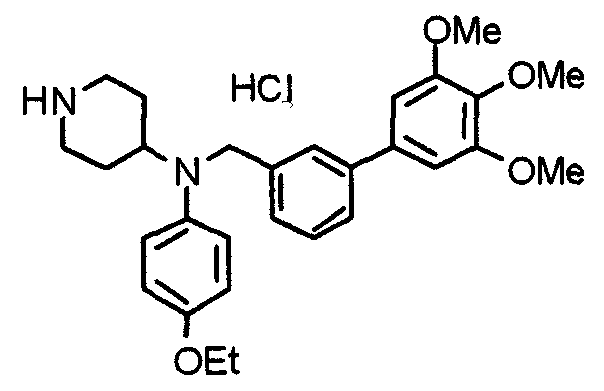
1-(трет-Бутоксикарбонил)-4-[N-(4-этоксифенил)-N-[3-(3,4,5-триметоксифенил)бензил]амино]пиперидин (1,06 г) обрабатывают по методике, аналогично описанной в примере получения 94, получая указанное в заголовке соединение в виде светло-желтого порошка.
Выход 913 мг (97%).
Примеры 72-79
Указанные соединения получают взаимодействием аминов, полученных в примерах получения 103, 105 и 107, с производными хлорида, полученными в примерах получения 3, 42 и 48. Полученные свободные основания затем превращают в соответствующие гидрохлориды. Выходы и данные ЯМР их свободных оснований указаны ниже.
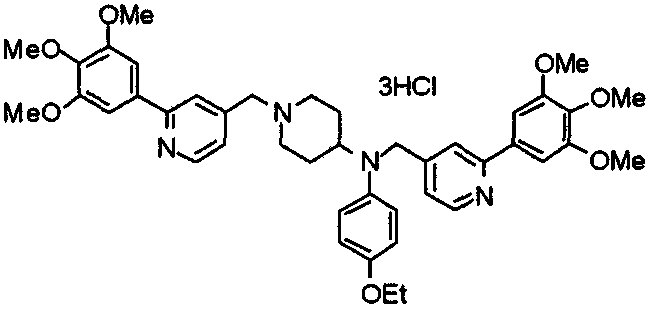
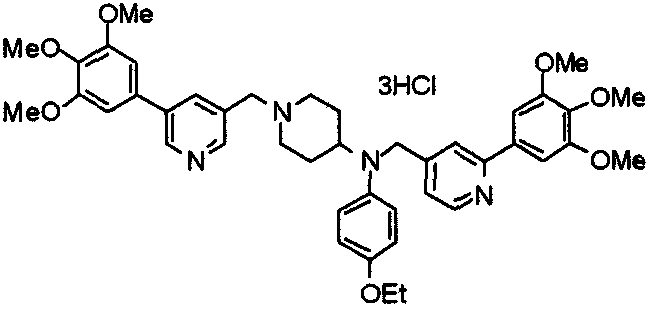
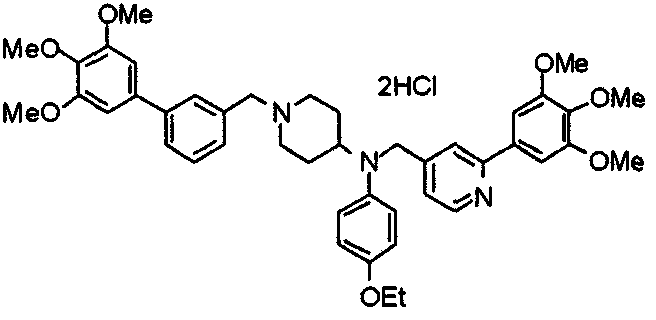
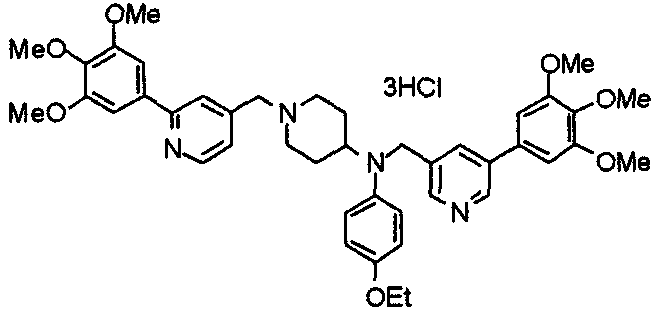
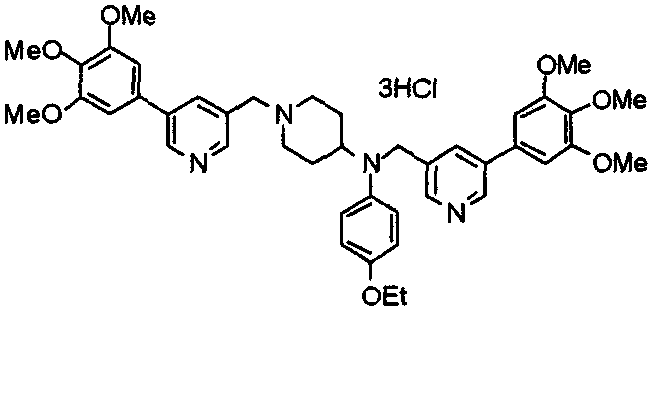
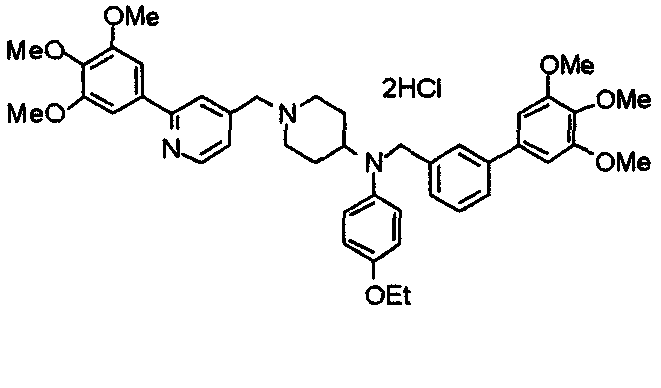
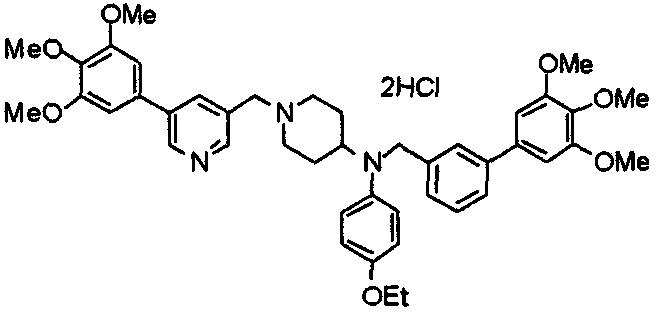
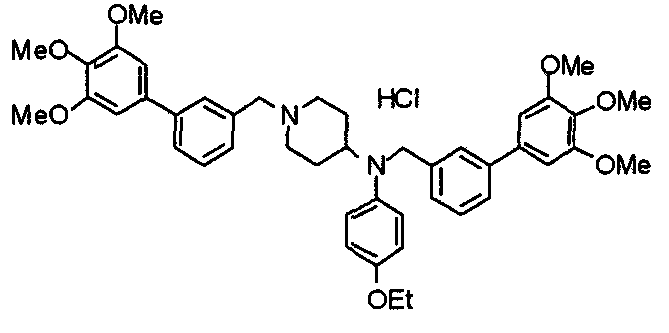
Пример получения 108
Синтез 1-(трет-бутоксикарбонил)-4-(4-бутоксифениламино)пиперидина
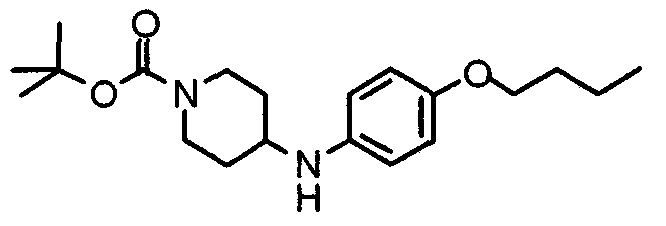
1-(трет-Бутоксикарбонил)-4-пиперидинон (5,00 г) подвергают взаимодействию с 4-бутоксианилином (3,95 г) в соответствии со способом, описанным в примере получения 37, получая указанное в заголовке соединение в виде коричневого порошка.
Выход 6,91 г (83%).
1H-ЯМР (400 МГц, CDCl3) δ: 0,96 (т, 3H, J=7,2 Гц), 1,23-1,35 (м, 2H), 1,42-1,53 (м, 2H), 1,46 (с, 9H), 1,68-1,76 (м, 2H), 1,97-2,05 (м, 2H), 2,84-2,95 (м, 2H), 3,28-3,37 (м, 1H), 3,88 (т, 2H, J=6,6 Гц), 3,96-4,12 (м, 2H), 6,57 (д, 2H, J=9,0 Гц), 6,77 (д, 2H, J=8,8 Гц).
Пример получения 109
Синтез 1-(трет-бутоксикарбонил)-4-[N-(4-бутоксифенил)-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]пиперидина
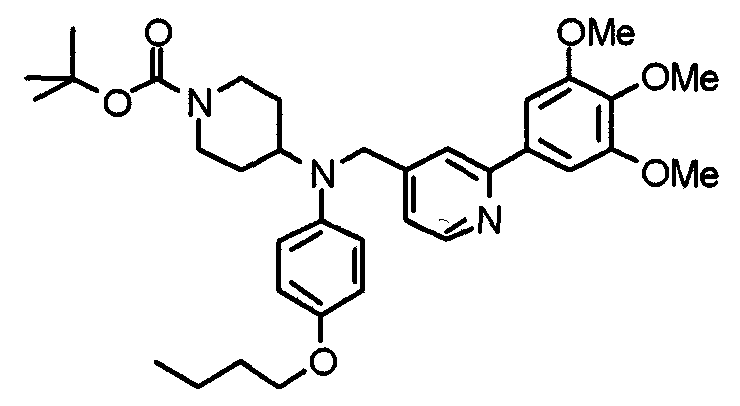
1-(трет-Бутоксикарбонил)-4-[(4-бутоксифенил)амино]пиперидин (696 мг) подвергают взаимодействию с 4-хлорметил-2-(3,4,5-триметоксифенил)пиридином (588 мг) по методике, аналогично описанной в примере 9, получая указанное в заголовке соединение в виде светло-желтого аморфного вещества.
Выход 980 мг (81%).
1H-ЯМР (400 МГц, CDCl3) δ: 0,95 (т, 3H, J=7,4 Гц), 1,40-1,50 (м, 2H), 1,44 (с, 9H), 1,67-1,76 (м, 2H), 1,82-1,90 (м, 2H), 1,82-1,90 (м, 2H), 2,70-2,82 (м, 2H), 3,61-3,71 (м, 1H), 3,84-3,90 (м, 5H), 3,94 (с, 6H), 4,10-4,28 (м, 2H), 4,39 (с, 2H), 6,74 (д, 2H, J=9,4 Гц), 6,78 (д, 2H, J=9,4 Гц), 7,14-7,18 (м, 3H), 7,56 (с, 1H), 8,54 (д, 1H, J=5,1 Гц).
Пример получения 110
Синтез дигидрохлорида 4-[N-(4-бутоксифенил)-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]пиперидина
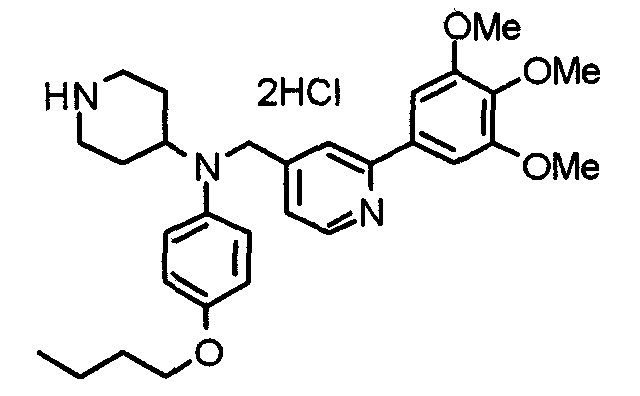
1-(трет-Бутоксикарбонил)-4-[N-(4-бутоксифенил)-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]пиперидин (980 мг) обрабатывают по методике, аналогично описанной в примере получения 94, получая указанное в заголовке соединение в виде желтого порошка.
Выход 926 мг (99%).
Пример получения 111
Синтез 1-(трет-бутоксикарбонил)-4-[N-(4-бутоксифенил)-N-[[3-(3,4,5-триметоксифенил)пиридин-5-ил]метил]амино]пиперидина
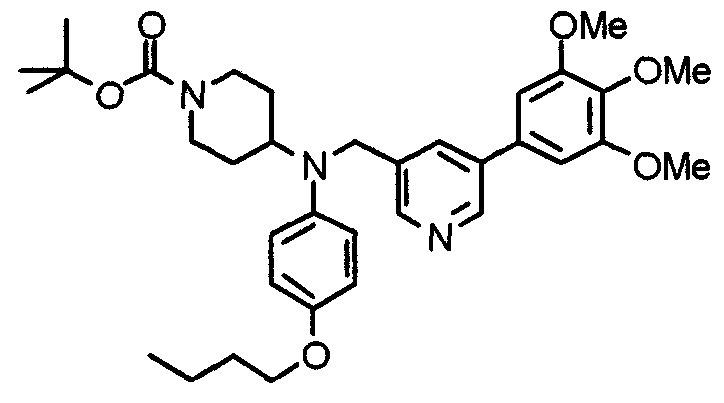
1-(трет-Бутоксикарбонил)-4-[(4-бутоксифенил)амино]пиперидин (697 мг) подвергают взаимодействию с 5-хлорметил-3-(3,4,5-триметоксифенил)пиридином (588 мг) по методике, аналогично описанной в примере 9, получая указанное в заголовке соединение в виде светло-желтого аморфного вещества.
Выход 485 мг (40%).
1H-ЯМР (400 МГц, CDCl3) δ: 0,95 (т, 3H, J=7,4 Гц), 1,40-1,57 (м, 2H), 1,44 (с, 9H), 1,67-1,75 (м, 2H), 1,82-1,90 (м, 2H), 2,69-2,81 (м, 2H), 3,51-3,60 (м, 1H), 3,87 (кв, 2H, J=6,6 Гц), 3,88 (с, 3H), 3,90 (с, 6H), 4,06-4,23 (м, 2H), 4,39 (с, 2H), 6,66 (с, 2H), 6,77 (д, 2H, J=9,2 Гц), 6,81 (д, 2H, J=9,2 Гц), 6,81 (д, 2H, J=9,4 Гц), 7,67 (с, 1H), 8,49 (д, 1H, J=1,8 Гц), 8,62 (д, 1H, J=2,2 Гц).
Пример получения 112
Синтез дигидрохлорида 4-[N-(4-бутоксифенил)-N-[[3-(3,4,5-триметоксифенил)пиридин-5-ил]метил]амино]пиперидина
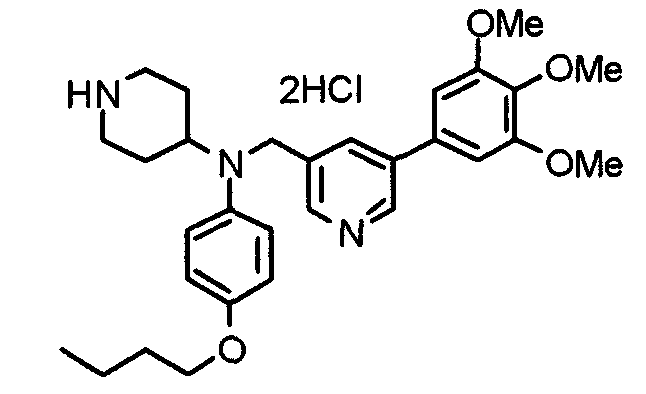
1-(трет-Бутоксикарбонил)-4-[N-(4-бутоксифенил)-N-[[3-(3,4,5-триметоксифенил)пиридин-5-ил]метил]амино]пиперидин (485 мг) обрабатывают по методике, аналогично описанной в примере получения 94, получая указанное в заголовке соединение в виде светло-желтого порошка.
Выход 456 мг (98%).
Пример получения 113
Синтез 1-(трет-бутоксикарбонил)-4-[N-(4-бутоксифенил)-N-[3-(3,4,5-триметоксифенил)бензил]амино]пиперидина
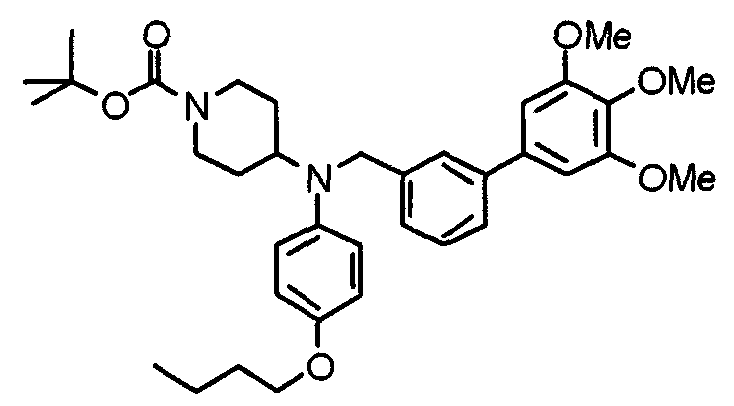
1-(трет-Бутоксикарбонил)-4-[(4-бутоксифенил)амино]пиперидин (697 мг) подвергают взаимодействию с 3-(3,4,5-триметоксифенил)бензилхлоридом (586 мг) по методике, аналогично описанной в примере 9, получая указанное в заголовке соединение в виде светло-желтого аморфного вещества.
Выход 1,17 г (97%).
1H-ЯМР (400 МГц, CDCl3) δ: 0,95 (т, 3H, J=7,3 Гц), 1,40-1,61 (м, 4H), 1,44 (с, 9H), 1,67-1,75 (м, 2H), 1,83-1,90 (м, 2H), 2,70-2,83 (м, 2H), 3,63-3,72 (м, 2H), 3,87 (кв, 2H, J=6,6 Гц), 3,88 (с, 3H), 3,90 (с, 6H), 4,09-4,28 (м, 2H), 4,41 (с, 2H), 6,70 (с, 2H), 6,76 (с, 4H), 7,26 (д, 2H, J=8,0 Гц), 7,33 (т, 1H, J=7,6 Гц), 7,38 (д, 1H, J=7,3 Гц), 7,42 (с, 1H).
Пример получения 114
Синтез дигидрохлорида 4-[N-(4-бутоксифенил)-N-[3-(3,4,5-триметоксифенил)бензил]амино]пиперидина
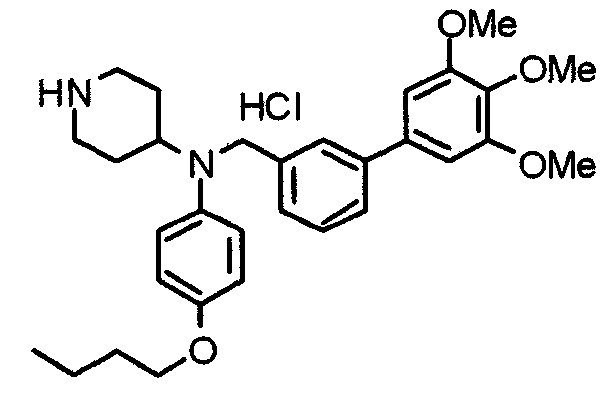
1-(трет-Бутоксикарбонил)-4-[N-(4-бутоксифенил)-N-[3-(3,4,5-триметоксифенил)бензил]амино]пиперидин (1,17 г) обрабатывают по методике, аналогично описанной в примере получения 94, получая указанное в заголовке соединение в виде светло-желтого порошка.
Выход 1,02 г (98%).
Примеры 80-87
Указанные соединения получают взаимодействием аминов, полученных в примерах получения 110, 112 и 114, с производными хлорида, полученными в примерах получения 3, 42 и 48. Полученные свободные основания затем превращают в соответствующие гидрохлориды. Выходы и данные ЯМР их свободных оснований указаны ниже.
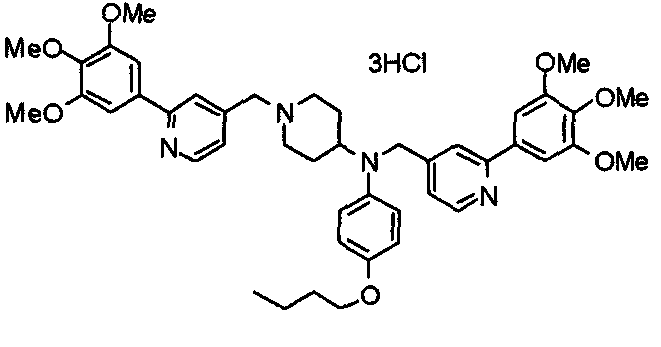
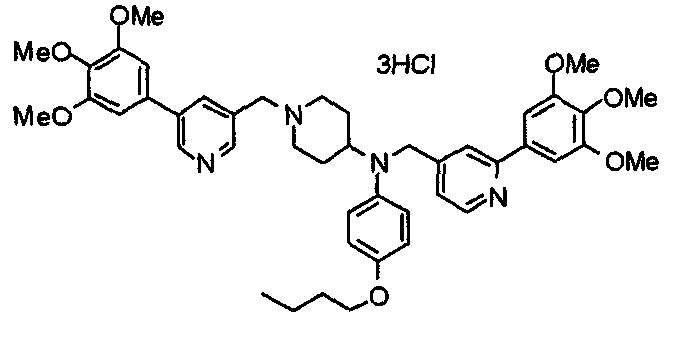
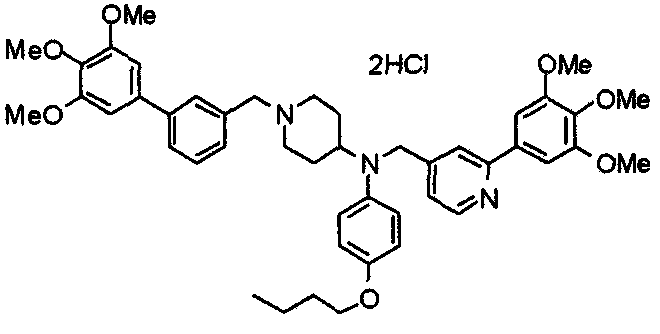
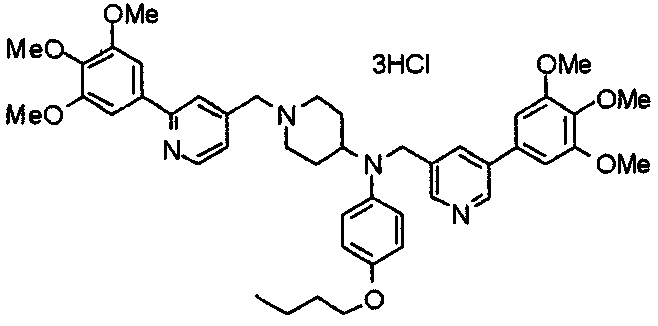
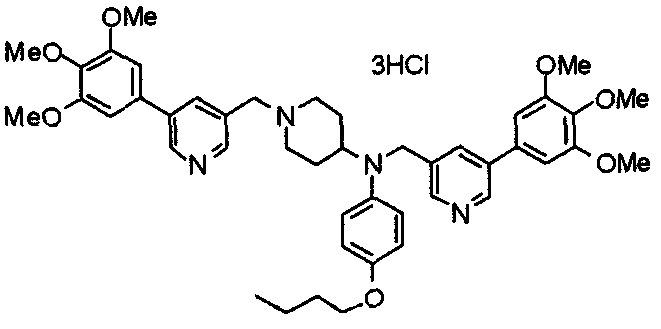
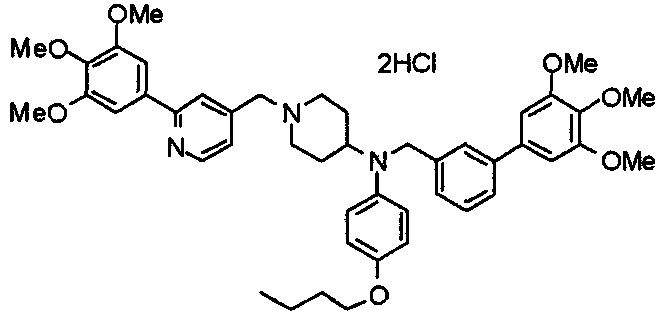
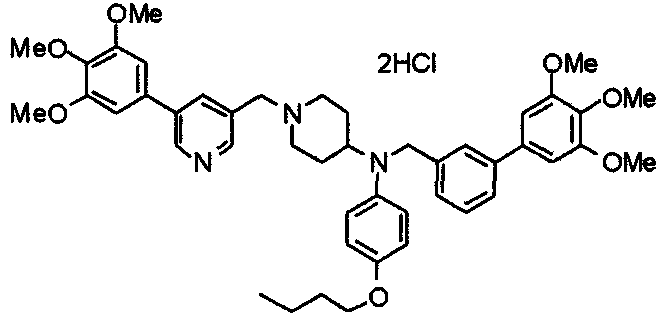
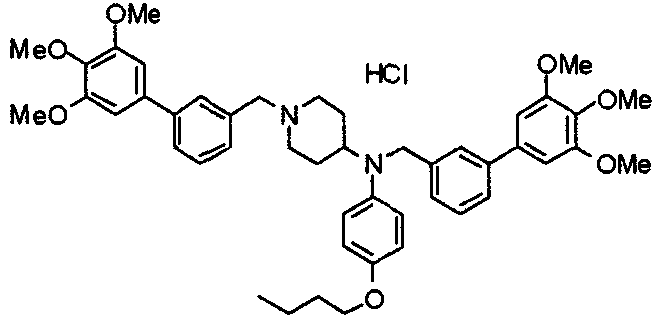
Пример получения 115
Синтез 4-(м-анизидино)-1-(трет-бутоксикарбонил)пиперидина
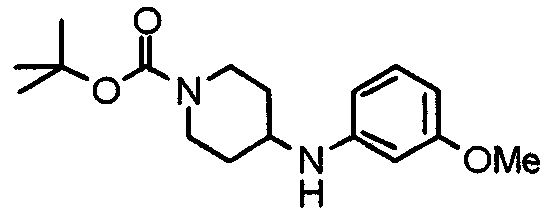
1-(трет-Бутоксикарбонил)-4-пиперидинон (4,78 г) подвергают взаимодействию с м-анизидином (2,96 г) в соответствии со способом, описанным в примере получения 37, получая указанное в заголовке соединение.
Выход 4,83 г (66%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,20-1,39 (м, 2H), 1,44 (с, 9H), 1,99-2,05 (м, 2H), 2,89 (дт, 2H, J=13,5 Гц, 2,2 Гц), 3,33-3,44 (м, 1H), 3,75 (с, 3H), 3,96-4,07 (м, 2H), 6,14 (т, 1H, J=2,2 Гц), 6,18-6,29 (м, 2H), 7,05 (т, 1H, J=8,1 Гц).
Пример получения 116
Синтез 1-(трет-бутоксикарбонил)-4-[N-(3-метоксифенил)-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]пиперидина
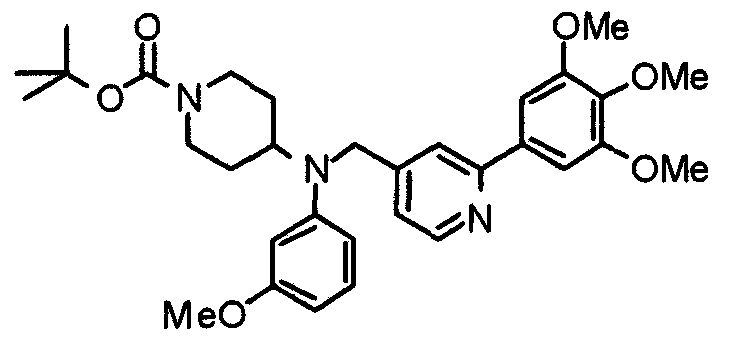
4-(м-Анизидино)-1-(трет-бутоксикарбонил)пиперидин (613 мг) подвергают взаимодействию с 4-хлорметил-2-(3,4,5-триметоксифенил)пиридином (588 мг) по методике, аналогично описанной в примере 9, получая указанное в заголовке соединение в виде светло-желтого аморфного вещества.
Выход 789 мг (70%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,45 (с, 9H), 1,50-1,67 (м, 2H), 1,82-1,91 (м, 2H), 2,74-2,87 (м, 2H), 3,74 (с, 3H), 3,88-3,98 (м, 1H), 3,89 (с, 3H), 3,94 (с, 6H), 4,14-4,32 (м, 2H), 4,48 (с, 2H), 6,28 (дд, 1H, J=2,2 Гц, 2,2 Гц), 6,31-6,37 (м, 2H), 7,10-7,15 (м, 2H), 7,16 (с, 2H), 7,55 (с, 1H), 8,56 (д, 1H, J=5,1 Гц).
Пример получения 117
Синтез дигидрохлорида 4-[N-(3-метоксифенил)-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]пиперидина
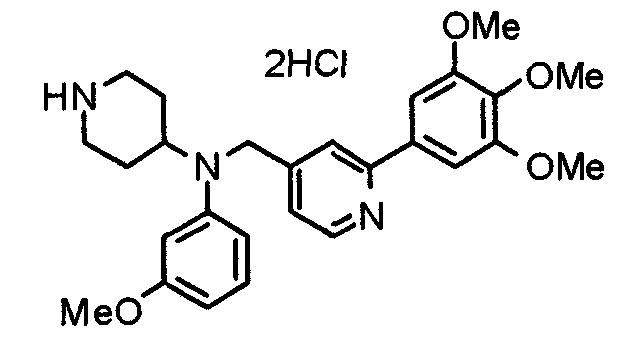
1-(трет-Бутоксикарбонил)-4-[N-(3-метоксифенил)-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]пиперидин (789 мг) обрабатывают по методике, аналогично описанной в примере получения 94, получая указанное в заголовке соединение в виде светло-желтого порошка.
Выход 710 мг (95%).
Пример получения 118
Синтез 1-(трет-бутоксикарбонил)-4-[N-(3-метоксифенил)-N-[[3-(3,4,5-триметоксифенил)пиридин-5-ил]метил]амино]пиперидина
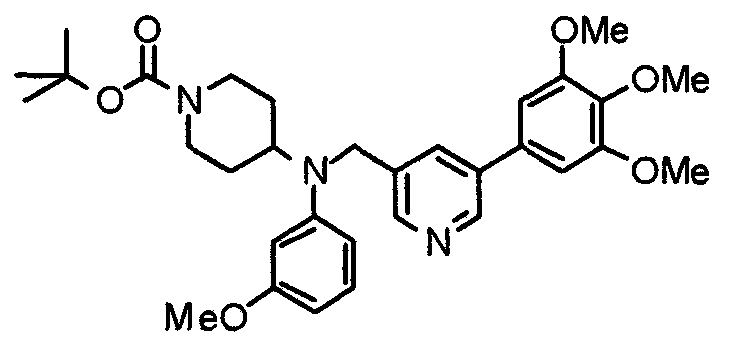
4-(м-Анизидино)-1-(трет-бутоксикарбонил)пиперидин (613 мг) подвергают взаимодействию с 5-хлорметил-3-(3,4,5-триметоксифенил)пиридином (588 мг) по методике, аналогично описанной в примере 9, получая указанное в заголовке соединение в виде светло-желтого аморфного вещества.
Выход 396 мг (35%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,45 (с, 9H), 1,54-1,66 (м, 2H), 1,81-1,91 (м, 2H), 2,73-2,87 (м, 2H), 3,74 (с, 3H), 3,87-3,93 (м, 1H), 3,88 (с, 3H), 3,90 (с, 6H), 4,14-4,29 (м, 2H), 4,51 (с, 2H), 6,30-6,35 (м, 2H), 6,38 (д, 1H, J=7,2 Гц), 6,68 (с, 2H), 7,12 (дд, 1H, J=8,8 Гц, 8,88 Гц), 7,66 (с, 1H), 8,49 (д, 1H, J=2,0 Гц), 8,66 (д, 1H, J=2,2 Гц).
Пример получения 119
Синтез дигидрохлорида 4-[N-(3-метоксифенил)-N-[[3-(3,4,5-триметоксифенил)пиридин-5-ил]метил]амино]пиперидина
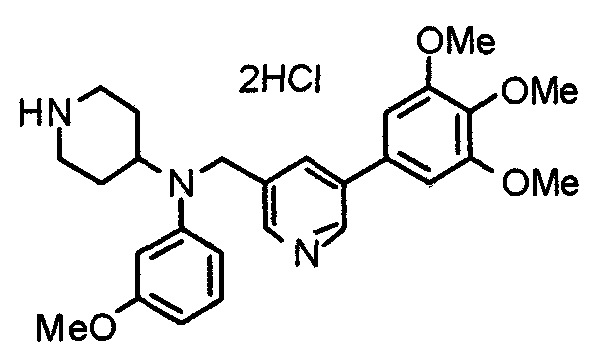
1-(трет-Бутоксикарбонил)-4-[N-(3-метоксифенил)-N-[[3-(3,4,5-триметоксифенил)пиридин-5-ил]метил]амино]пиперидин (396 мг) обрабатывают по методике, аналогично описанной в примере получения 94, получая указанное в заголовке соединение в виде светло-желтого порошка.
Выход 348 мг (92%).
Пример получения 120
Синтез 1-(трет-бутоксикарбонил)-4-[N-(3-метоксифенил)-N-[3-(3,4,5-триметоксифенил)бензил]амино]пиперидина
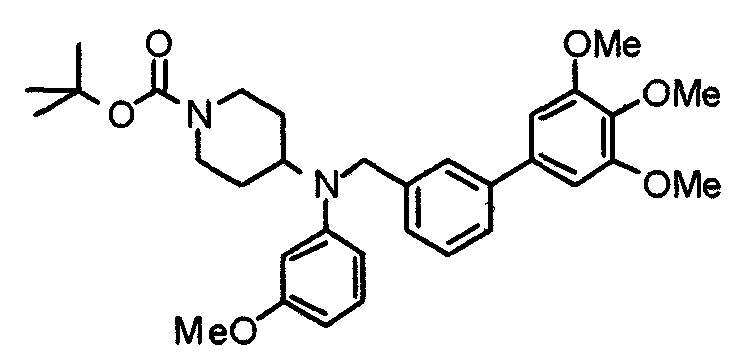
4-(м-Анизидино)-1-(трет-бутоксикарбонил)пиперидин (613 мг) подвергают взаимодействию с 3-(3,4,5-триметоксифенил)бензилхлоридом (586 мг) по методике, аналогично описанной в примере 9, получая указанное в заголовке соединение в виде светло-желтого аморфного вещества.
Выход 1,01 г (90%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,44 (с, 9H), 1,56-1,67 (м, 2H), 1,83-1,91 (м, 2H), 2,72-2,86 (м, 2H), 3,73 (с, 3H), 3,85-3,98 (м, 1H), 3,88 (с, 3H), 3,90 (с, 6H), 4,12-4,30 (м, 2H), 4,50 (с, 2H), 6,27-6,34 (м, 2H), 6,38 (дд, 1H, J=8,2 Гц, 2,4 Гц), 6,72 (с, 2H), 7,10 (дд, 1H, J=8,2 Гц, 8,2 Гц), 7,21-7,27 (м, 1H), 7,32-7,43 (м, 3H).
Пример получения 121
Синтез гидрохлорида 4-[N-(3-метоксифенил)-N-[3-(3,4,5-триметоксифенил)бензил]амино]пиперидина
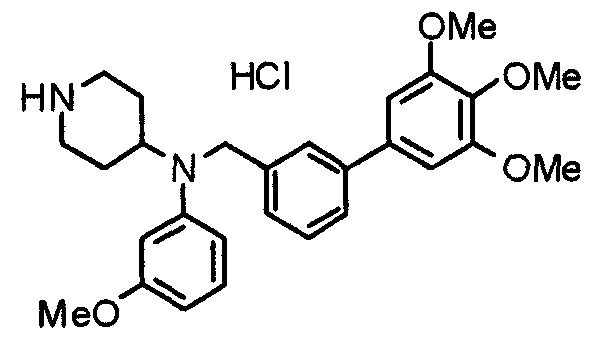
1-(трет-Бутоксикарбонил)-4-[N-(3-метоксифенил)-N-[3-(3,4,5-триметоксифенил)бензил]амино]пиперидин (1,01 г) обрабатывают по методике, аналогично описанной в примере получения 94, получая указанное в заголовке соединение в виде светло-желтого порошка.
Выход 820 мг (92%).
Примеры 88-95
Указанные соединения получают взаимодействием аминов, полученных в примерах получения 117, 119 и 121, с производными хлорида, полученными в примерах получения 3, 42 и 48. Полученные свободные основания затем превращают в соответствующие гидрохлориды. Выходы и данные ЯМР их свободных оснований указаны ниже.
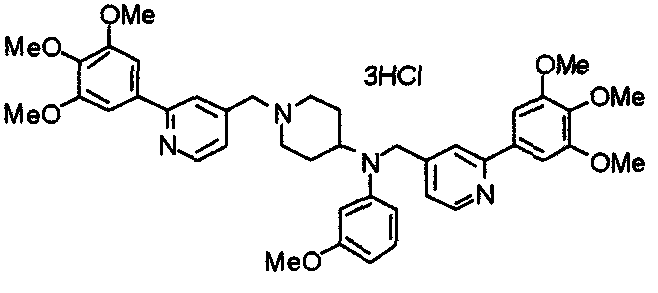
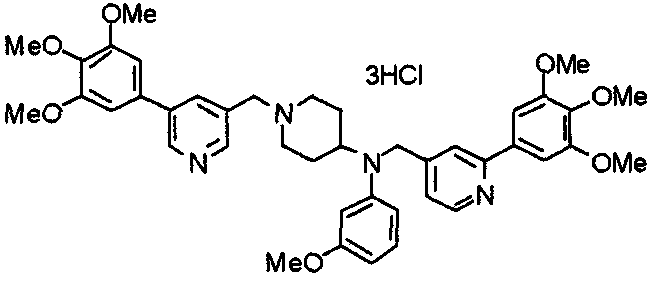
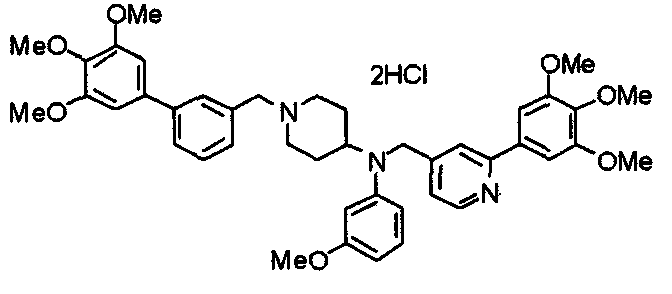
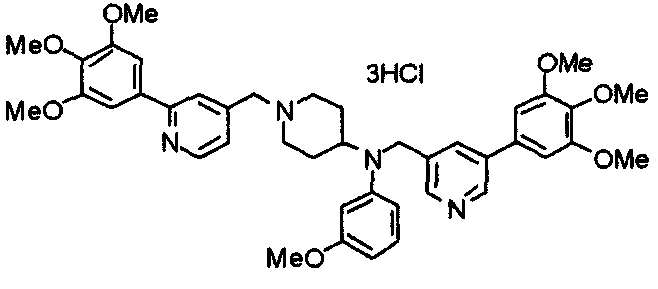
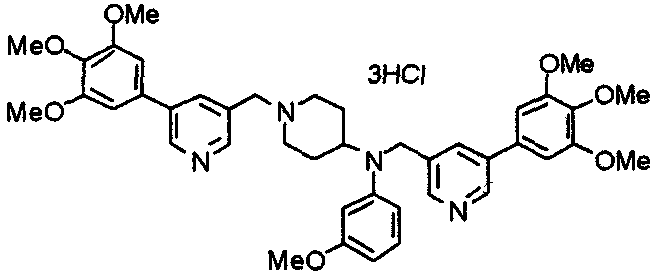
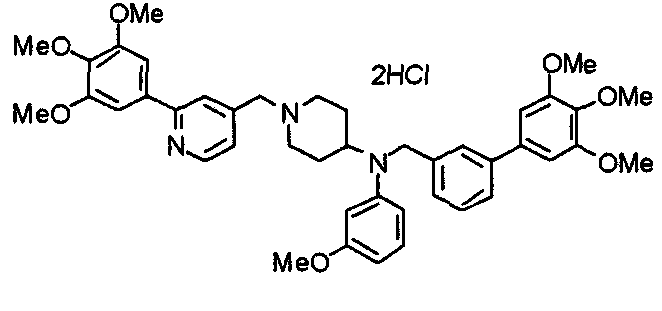
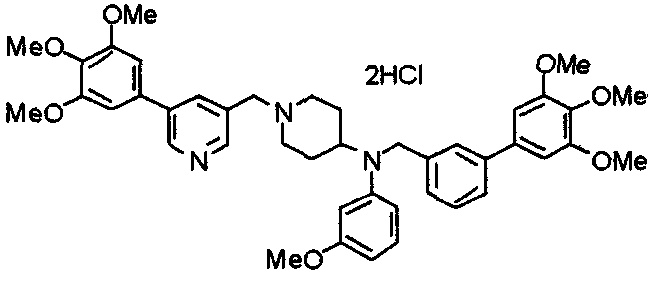
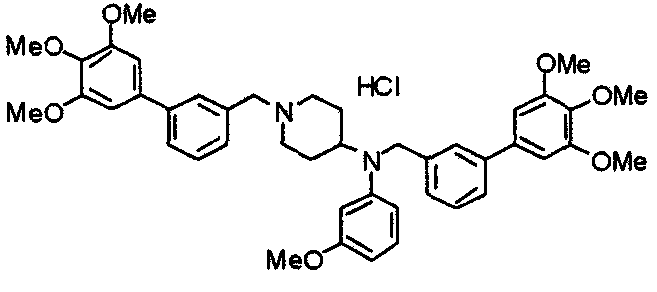
Пример получения 122
Синтез 4-(o-анизидино)-1-(трет-бутоксикарбонил)пиперидина
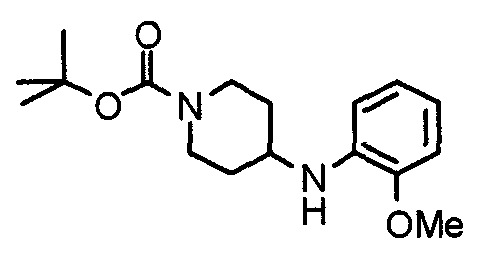
1-(трет-Бутоксикарбонил)-4-пиперидон (4,78 г) подвергают взаимодействию с o-анизидином (2,96 г) по методике, аналогично описанной в примере получения 37, получая указанное в заголовке соединение.
Выход 2,61 г (36%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,31-1,41 (м, 2H), 1,47 (с, 9H), 2,00-2,08 (м, 2H), 2,90-3,01 (м, 2H), 3,38-3,47 (м, 1H), 3,83 (с, 3H), 4,00-4,21 (м, 2H), 6,60-6,69 (м, 2H),6,76-6,89 (м, 2H).
Пример получения 123
Синтез 1-(трет-бутоксикарбонил)-4-[N-(2-метоксифенил)-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]пиперидина
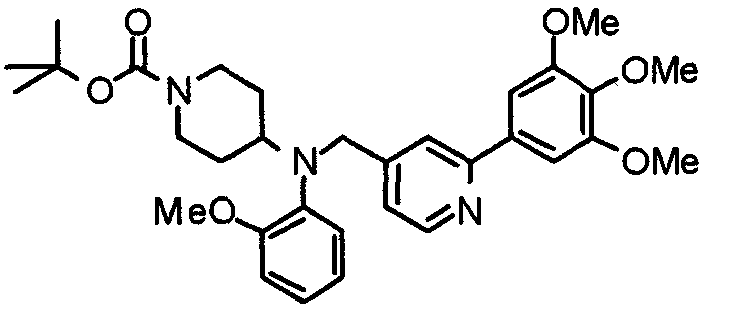
4-(o-Анизидино)-1-(трет-бутоксикарбонил)пиперидин (613 мг) подвергают взаимодействию с 4-хлорметил-2-(3,4,5-триметоксифенил)пиридином (588 мг) по методике, аналогично описанной в примере 9, получая указанное в заголовке соединение в виде светло-желтого аморфного вещества.
Выход 763 мг (68%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,41-1,58 (м, 2H), 1,44 (с, 9H), 1,81-1,91 (м, 2H), 2,62-2,78 (м, 2H), 3,29 (тт, 1H, J=7,6 Гц, 3,7 Гц), 3,86 (с, 3H), 3,89 (с, 3H), 3,95 (с, 6H), 4,06-4,16 (м, 2H), 4,37 (с, 2H), 6,80 (ддд, 1H, J=7,6 Гц, 7,6 Гц, 1,2 Гц), 6,87 (дд, 1H, J=8,5 Гц, 1,0 Гц), 7,00-7,06 (м, 2H), 7,14 (с, 2H), 7,20 (дд, 1H, J=4,9 Гц, 1,0 Гц), 7,61 (с, 1H), 8,49 (д, 1H, J=4,9 Гц).
Пример получения 124
Синтез дигидрохлорида 4-[N-(2-метоксифенил)-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]пиперидина
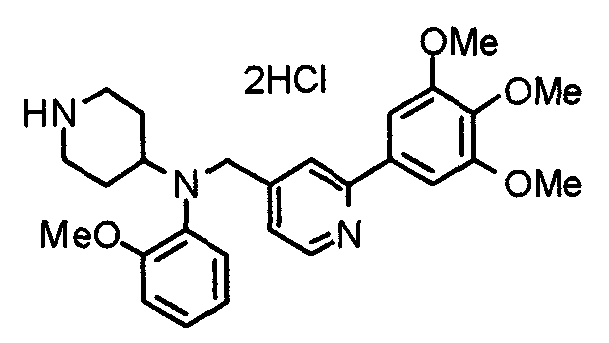
1-(трет-Бутоксикарбонил)-4-[N-(2-метоксифенил)-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]пиперидин (763 мг) обрабатывают по методике, аналогично описанной в примере получения 94, получая указанное в заголовке соединение в виде светло-желтого порошка.
Выход 701 мг (97%).
Пример получения 125
Синтез 1-(трет-бутоксикарбонил)-4-[N-(2-метоксифенил)-N-[[3-(3,4,5-триметоксифенил)пиридин-5-ил]метил]амино]пиперидина
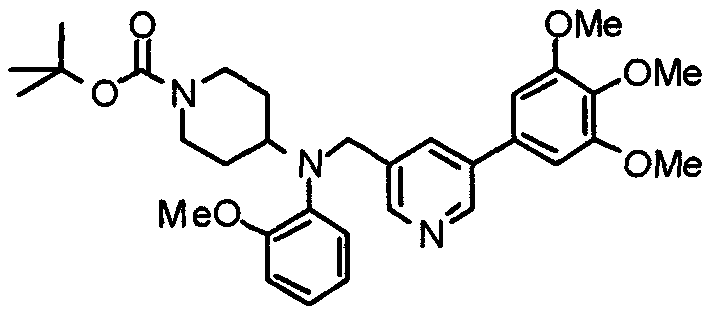
4-(о-Анизидино)-1-(трет-бутоксикарбонил)пиперидин (613 мг) подвергают взаимодействию с 5-хлорметил-3-(3,4,5-триметоксифенил)пиридином (588 мг) по методике, аналогично описанной в примере 9, получая указанное в заголовке соединение в виде светло-желтого аморфного вещества.
Выход 353 мг (31%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,44 (с, 9H), 1,46-1,53 (м, 2H), 1,82-1,91 (м, 2H), 2,62-2,78 (м, 2H), 3,24-3,33 (м, 1H), 3,83 (с, 3H), 3,89 (с, 3H), 3,91 (с, 6H), 4,03-4,16 (м, 2H), 4,37 (с, 2H), 6,64 (с, 2H), 6,79 (ддд, 1H, J=7,6 Гц, 7,6 Гц, 1,2 Гц), 6,84 (дд, 1H, J=7,0 Гц, 1,2 Гц), 6,97-7,06 (м, 2H), 7,68 (дд, 1H, J=1,3 Гц, 1,3 Гц), 8,49 (д, 1H, J=2,0 Гц), 8,56 (д, 1H, J=2,2 Гц).
Пример получения 126
Синтез дигидрохлорида 4-[N-(2-метоксифенил)-N-[[3-(3,4,5-триметоксифенил)пиридин-5-ил]метил]амино]пиперидина
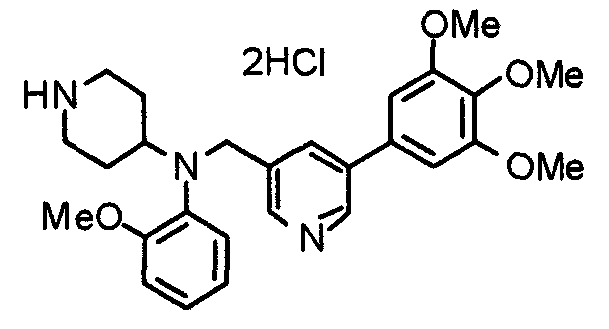
1-(трет-Бутоксикарбонил)-4-[N-(2-метоксифенил)-N-[[3-(3,4,5-триметоксифенил)пиридин-5-ил]метил]амино]пиперидин (353 мг) обрабатывают по методике, аналогично описанной в примере получения 94, получая указанное в заголовке соединение в виде светло-желтого порошка.
Выход 312 мг (93%).
Пример получения 127
Синтез 1-(трет-бутоксикарбонил)-4-[N-(2-метоксифенил)-N-[3-(3,4,5-триметоксифенил)бензил]амино]пиперидина
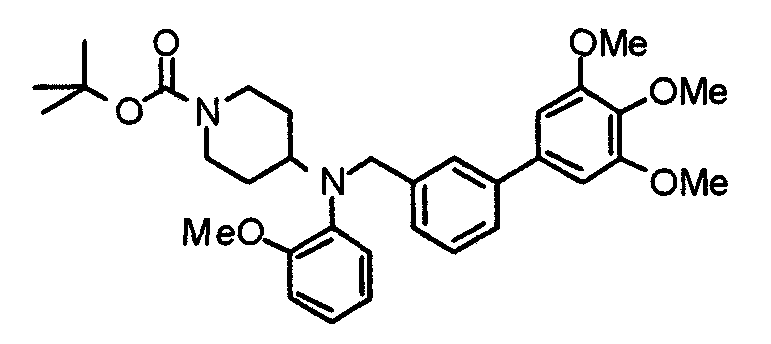
4-(o-Анизидино)-1-(трет-бутоксикарбонил)пиперидин (613 мг) подвергают взаимодействию с 3-(3,4,5-триметоксифенил)бензилхлоридом (586 мг) по методике, аналогично описанной в примере 9, получая указанное в заголовке соединение в виде светло-желтого аморфного вещества.
Выход 1,12 г (100%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,43 (с, 9H), 1,46-1,57 (м, 2H), 1,81-1,90 (м, 2H), 2,62-2,76 (м, 2H), 3,31 (тт, 1H, J=11,1 Гц, 3,3 Гц), 3,84 (с, 3H), 3,88 (с, 3H), 3,91 (с, 6H), 4,00-4,16 (м, 2H), 4,36 (с, 2H), 6,67 (с, 2H), 6,78 (т, 1H, J=7,3 Гц), 6,85 (д, 1H, J=7,9 Гц), 6,96-7,03 (м, 2H), 7,24-7,34 (м, 3H), 7,43 (с, 1H).
Пример получения 128
Синтез гидрохлорида 4-[N-(2-метоксифенил)-N-[3-(3,4,5-триметоксифенил)бензил]амино]пиперидина
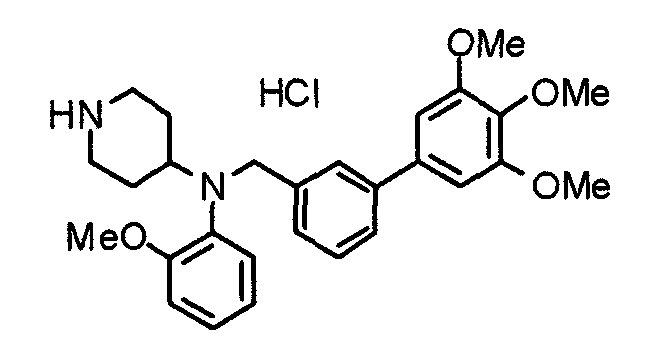
1-(трет-Бутоксикарбонил)-4-[N-(2-метоксифенил)-N-[3-(3,4,5-триметоксифенил)бензил]амино]пиперидин (1,12 г) обрабатывают по методике, аналогично описанной в примере получения 94, получая указанное в заголовке соединение в виде светло-желтого порошка.
Выход 987 мг (99%).
Примеры 96-101
Указанные соединения получают взаимодействием аминов, полученных в примерах получения 124, 126 и 128, с производными хлорида, полученными в примерах получения 3 и 48. Полученные свободные основания затем превращают в соответствующие гидрохлориды. Выходы и данные ЯМР их свободных оснований указаны ниже.
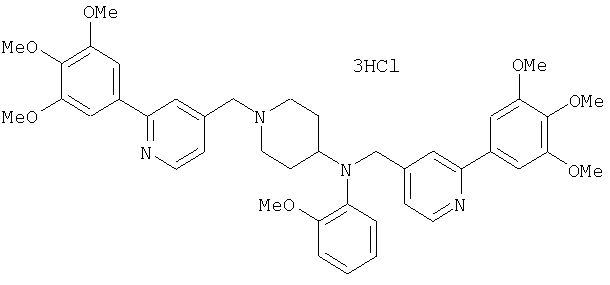
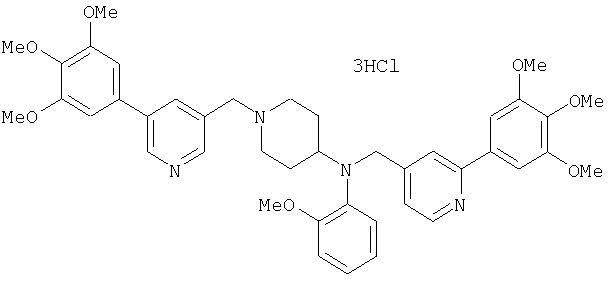
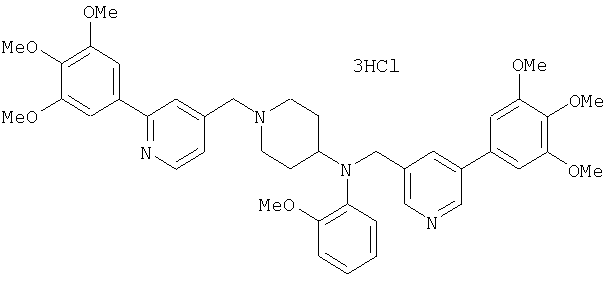
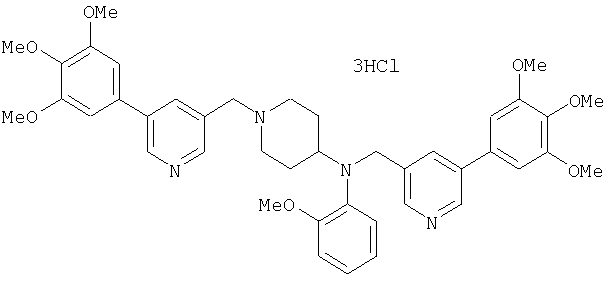
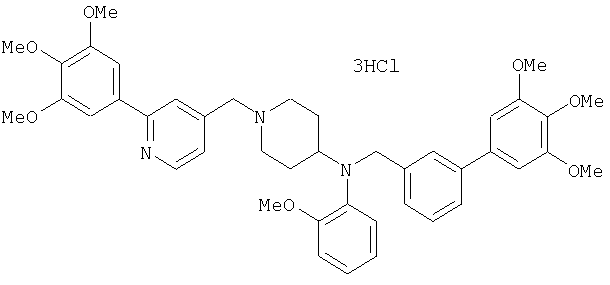

Пример получения 129
Синтез 1-(трет-бутоксикарбонил)-4-(2,3-диметоксифениламино)пиперидина
1-(трет-Бутоксикарбонил)-4-пиперидинон (4,78 г) подвергают взаимодействию с 2,3-диметоксианилином (3,68 г) в соответствии со способом, описанным в примере получения 37, получая указанное в заголовке соединение.
Выход 3,18 г (39%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,29-1,42 (м, 2H), 1,45 (с, 9H), 1,97-2,03 (м, 2H), 2,92 (дт, 2H, J=13,5 Гц, 2,2 Гц), 3,38 (дт, 1H, J=13,8 Гц, 4,1 Гц), 3,77 (с, 3H), 3,82 (с, 3H), 3,99-4,03 (м, 2H), 4,17 (м, 1H), 6,27-6,32 (м, 2H), 6,88 (т, 1H, J=8,4 Гц).
Пример получения 130
Синтез 1-(трет-бутоксикарбонил)-4-[N-(2,3-диметоксифенил)-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]пиперидина
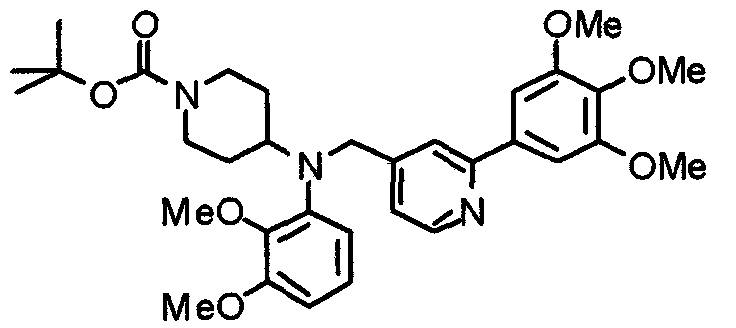
1-(трет-Бутоксикарбонил)-4-(2,3-диметоксифениламино)пиперидин (673 мг) подвергают взаимодействию с 4-хлорметил-2-(3,4,5-триметоксифенил)пиридином (588 мг) по методике, аналогично описанной в примере 9, получая указанное в заголовке соединение в виде светло-желтого аморфного вещества.
Выход 613 мг (52%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,45 (с, 9H), 1,56-1,70 (м, 2H), 1,84-1,91 (м, 2H), 2,62-2,76 (м, 2H), 3,58 (тт, 1H, J=11,8 Гц, 3,6 Гц), 3,83 (с, 3H), 3,89 (с, 6H), 3,93 (с, 6H), 4,08-4,25 (м, 2H), 4,35 (с, 2H), 6,56-6,63 (м, 2H), 6,86 (т, 1H, J=8,3 Гц), 7,14 (с, 2H), 7,17 (дд, 1H, J=5,1 Гц, 1,2 Гц), 7,62 (с, 1H), 8,50 (д, 1H, J=5,1 Гц).
Пример получения 131
Синтез дигидрохлорида 4-[N-(2,3-диметоксифенил)-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]пиперидина
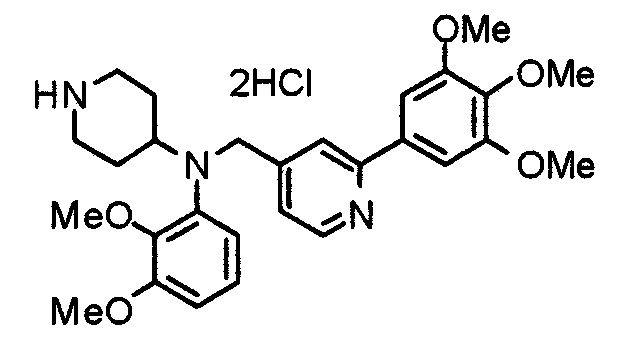
1-(трет-Бутоксикарбонил)-4-[N-(2,3-диметоксифенил)-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]пиперидин (613 мг) обрабатывают по методике, аналогично описанной в примере получения 94, получая указанное в заголовке соединение в виде светло-желтого порошка.
Выход 512 мг (88%).
Пример 102
Синтез тригидрохлорида 4-[N-(2,3-диметоксифенил)-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]-1-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
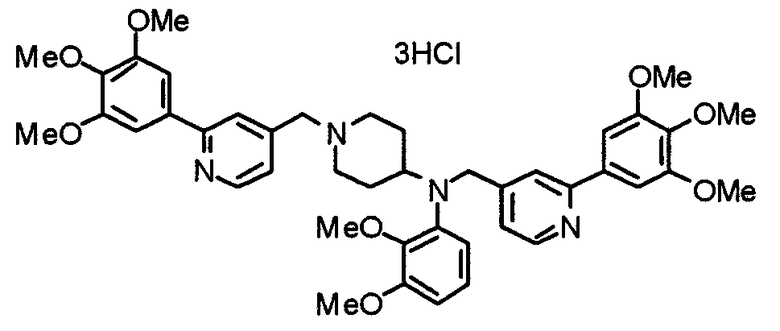
Дигидрохлорид 4-[N-(2,3-диметоксифенил)-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина (113 мг) подвергают взаимодействию с 4-хлорметил-2-(3,4,5-триметоксифенил)пиридином (59 мг) по методике, аналогично описанной в примере 2. После превращения продукта в гидрохлорид получают указанное в заголовке соединение в виде светло-желтого порошка.
Выход 21 мг (12%).
1H-ЯМР (400 МГц, определяемый как свободное основание, CDCl3) δ: 1,76-1,96 (м, 4H), 2,00-2,13 (м, 2H), 2,86-3,00 (м, 2H), 3,42-3,60 (м, 1H), 3,54 (с, 2H), 3,82 (с, 3H), 3,88 (с, 3H), 3,90 (с, 3H), 3,97 (с, 6H), 4,41 (с, 2H), 6,57 (д, 1H, J=8,0 Гц), 6,62 (д, 1H, J=8,2 Гц), 6,85 (дд, 1H, J=8,4 Гц, 8,4 Гц), 7,11-7,29 (м, 6H), 7,59 (с, 1H), 7,63 (с, 1H), 8,50 (д, 1H, J=4,9 Гц), 8,59 (д, 1H, J=4,9 Гц).
Пример получения 132
Синтез 1-(трет-бутоксикарбонил)-4-[4-[(трифторметокси)фенил]амино]пиперидина
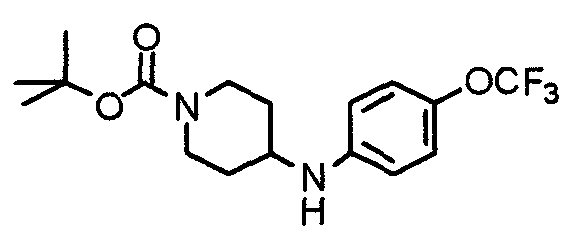
1-(трет-Бутоксикарбонил)-4-пиперидон (5,00 г) подвергают взаимодействию с 4-(фторметокси)анилином (4,23 г) по методике, аналогично описанной в примере получения 37, получая указанное в заголовке соединение в виде белого порошка.
Выход 5,22 г (60%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,25-1,40 (м, 2H), 1,47 (с, 9H), 1,98-2,08 (м, 2H), 2,83-2,98 (м, 2H), 3,34-3,43 (м, 1H), 3,97-4,12 (м, 2H), 6,58 (д, 2H, J=8,8 Гц), 7,03 (д, 2H, J=8,8 Гц).
Пример получения 133
Синтез 1-(трет-бутоксикарбонил)-4-[N-[4-(трифторметокси)фенил]-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]пиперидина
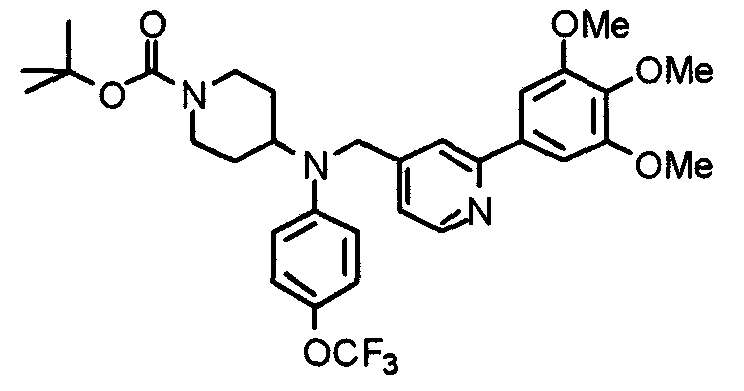
1-(трет-Бутоксикарбонил)-4-[4-[(трифторметокси)фенил]амино]пиперидин (721 мг) подвергают взаимодействию с 4-хлорметил-2-(3,4,5-триметоксифенил)пиридином (588 мг) по методике, аналогично описанной в примере 9, получая указанное в заголовке соединение в виде светло-желтого аморфного вещества.
Выход 543 мг (44%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,45 (с, 9H), 1,52-1,66 (м, 2H), 1,81-1,91 (м, 2H), 2,73-2,88 (м, 2H), 3,88-3,99 (м, 1H), 3,89 (с, 3H), 3,93 (с, 6H), 4,15-4,34 (м, 2H), 4,48 (с, 2H), 6,68 (д, 2H, J=9,2 Гц), 7,07 (д, 2H, J=8,6 Гц), 7,12 (дд, 1H, J=5,2 Гц, 1,3 Гц), 7,15 (с, 2H), 7,52 (с, 1H), 8,58 (д, 1H, J=5,2 Гц).
Пример получения 134
Синтез дигидрохлорида 4-[N-[4-(трифторметокси)фенил]-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]пиперидина
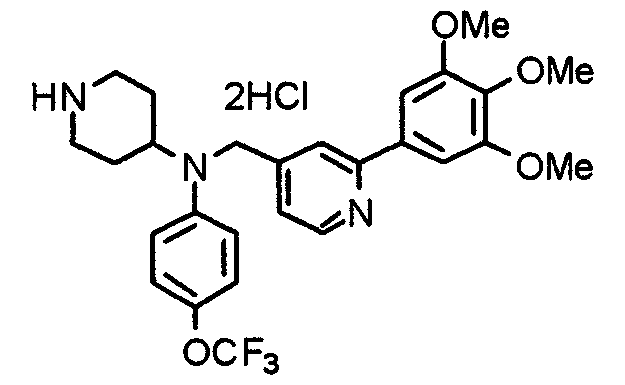
1-(трет-Бутоксикарбонил)-4-[N-[4-(трифторметокси)фенил]-N-[[2-(3,4,5-трифторметоксифенил)пиридин-4-ил]метил]амино]пиперидин (543 мг) обрабатывают по методике, аналогично описанной в примере получения 94, получая указанное в заголовке соединение в виде светло-желтого порошка.
Выход 481 мг (93%).
Пример получения 135
Синтез 1-(трет-бутоксикарбонил)-4-[N-(4-(трифторметокси)фенил)-N-[3-(3,4,5-триметоксифенил)пиридин-5-ил]метил]амино]пиперидина
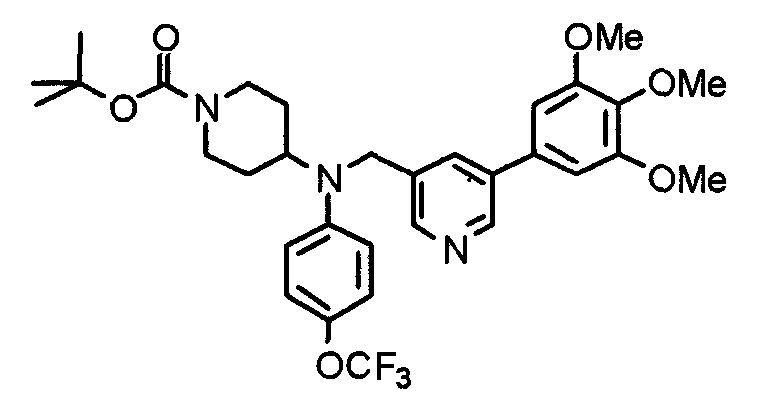
1-(трет-Бутоксикарбонил)-4-[4-[(трифторметокси)фенил]амино]пиперидин (721 мг) 5-хлорметил-3-(3,4,5-триметоксифенил)пиридином (588 мг) обрабатывают по методике, аналогично описанной в примере 9, получая указанное в заголовке соединение в виде светло-желтого аморфного вещества.
Выход 201 мг (16%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,45 (с, 9H), 1,54-1,67 (м, 2H), 1,82-1,90 (м, 2H), 2,74-2,86 (м, 2H), 3,84-3,91 (м, 1H), 3,88 (с, 3H), 3,89 (с, 6H), 4,16-4,30 (м, 2H), 4,52 (с, 2H), 6,67 (с, 2H), 6,72 (д, 2H, J=9,4 Гц), 7,06 (д, 2H, J=8,4 Гц), 7,64 (т, 1H, J=2,1 Гц), 8,49 (д, 1H, J=2,2 Гц), 8,68 (д, 1H, J=2,1 Гц).
Пример получения 136
Синтез дигидрохлорида 4-[N-(4-(трифторметокси)фенил]-N-[3-(3,4,5-триметоксифенил)пиридин-5-ил]метил]амино]пиперидина
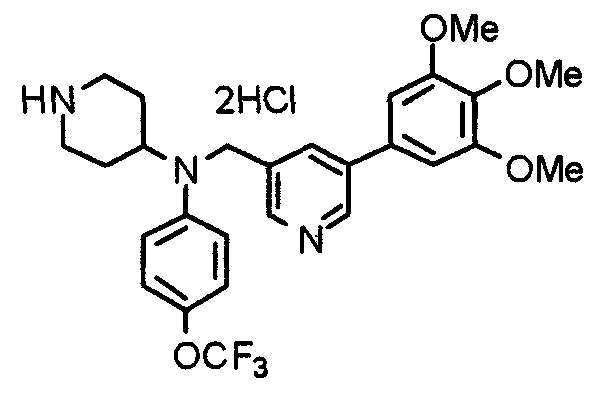
1-(трет-Бутоксикарбонил)-4-[N-[4-(трифторметокси)фенил]-N-[[3-(3,4,5-триметоксифенил)пиридин-5-ил]бензил]амино]пиперидин (201 мг) обрабатывают по методике, аналогично описанной в примере получения 94, получая указанное в заголовке соединение в виде светло-желтого порошка.
Выход 185 мг (96%).
Пример получения 137
Синтез 1-(трет-бутоксикарбонил)-4-[N-[(4-(трифторметокси)фенил)-N-[3-(3,4,5-триметоксифенил)бензил]амино]пиперидина
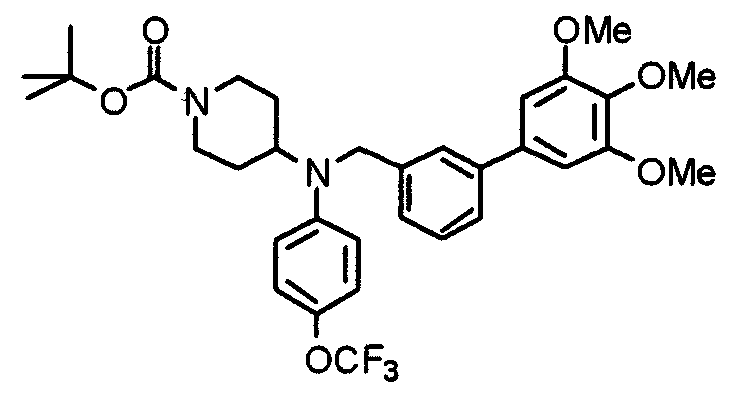
1-(трет-Бутоксикарбонил)-4-[4-[(трифторметокси)фенил]амино]пиперидин (721 мг) подвергают взаимодействию с 3-(3,4,5-триметоксифенил)бензилхлоридом (586 мг) по методике, аналогично описанной в примере 9, получая указанное в заголовке соединение в виде светло-желтого аморфного вещества.
Выход 1,06 г (86%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,45 (с, 9H), 1,56-1,68 (м, 2H), 1,83-1,90 (м, 2H), 2,71-2,86 (м, 2H), 3,87-3,90 (м, 1H), 3,88 (с, 3H), 3,89 (с, 6H), 4,16-4,29 (м, 2H), 4,51 (с, 2H), 6,70 (д, 2H, J=9,3 Гц), 6,70 (с, 2H), 7,04 (д, 2H, J=8,5 Гц), 7,22 (д, 1H, J=7,8 Гц), 7,34-7,44 (м, 3H).
Пример получения 138
Синтез гидрохлорида 4-[N-[4-(трифторметокси)фенил]-N-[3-(3,4,5-триметоксифенил)бензил]амино]пиперидина
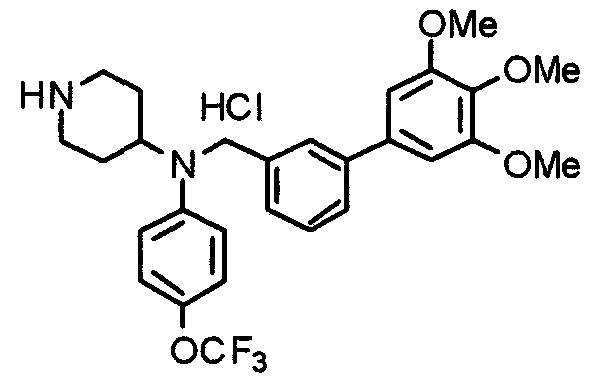
1-(трет-Бутоксикарбонил)-4-[N-[(4-трифторметокси)фенил]-N-[3-(3,4,5-триметоксифенил)бензил]амино]пиперидин (1,06 г) обрабатывают по методике, аналогично описанной в примере получения 94, получая указанное в заголовке соединение в виде светло-желтого порошка.
Выход 795 мг (84%).
Примеры 103-110
Указанные соединения получают взаимодействием аминов, полученных в примерах получения 134, 136 и 138, с производными хлорида, полученными в примерах получения 3, 42 и 48. Полученные свободные основания затем превращают в соответствующие гидрохлориды. Выходы и данные ЯМР их свободных оснований указаны ниже.
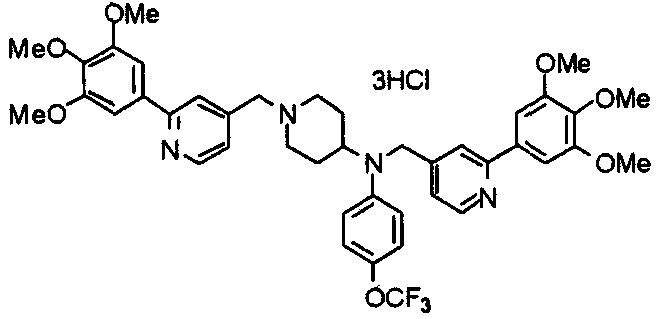
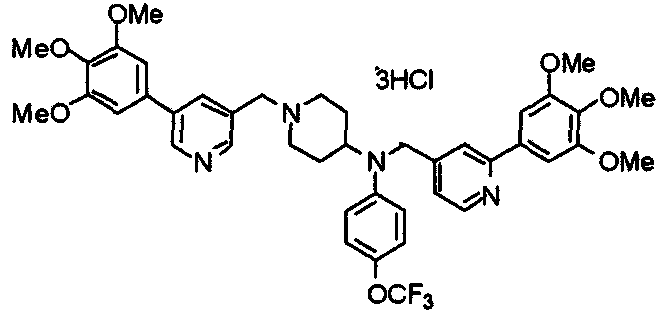
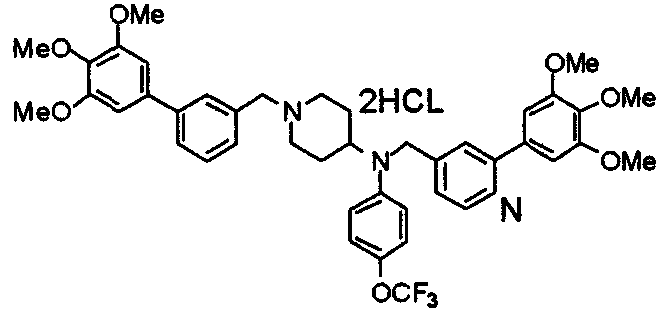
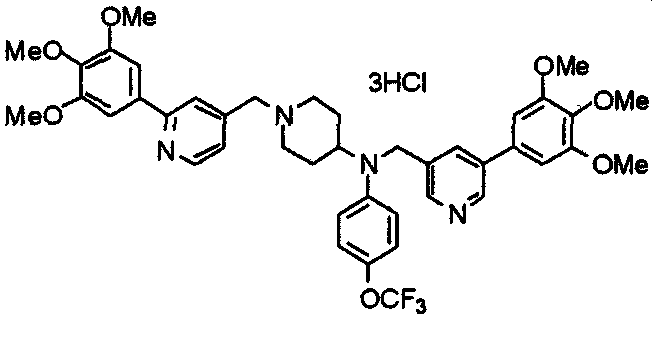
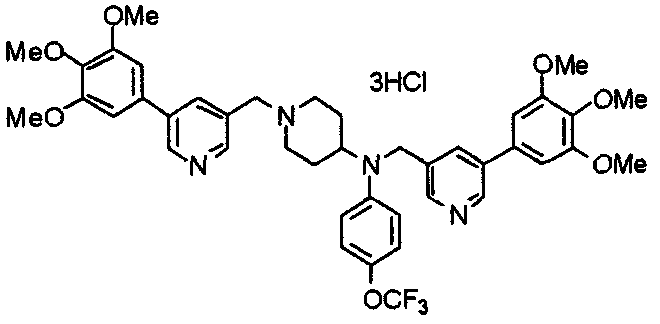
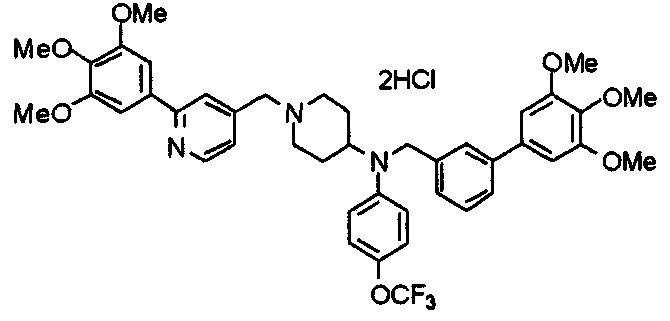
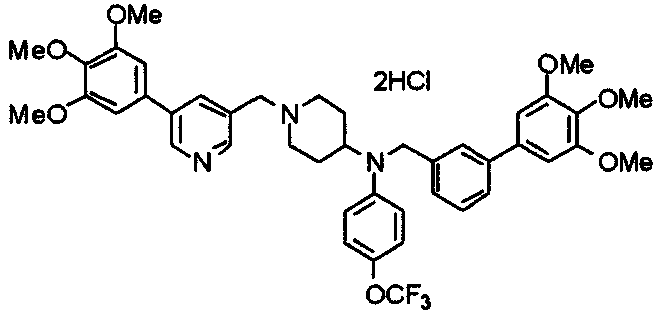
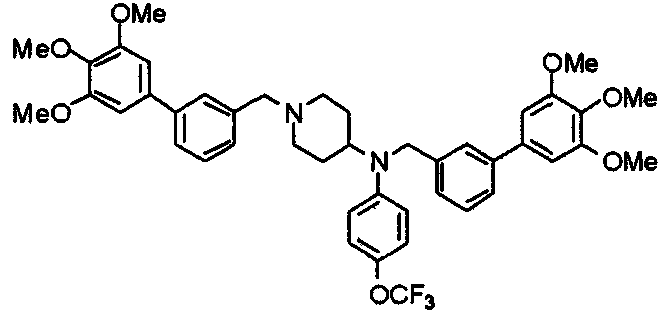
Пример получения 139
Синтез 1-(трет-бутоксикарбонил)-4-[[4-(метилтио)фенил]амино]пиперидина
1-(трет-Бутоксикарбонил)-4-пиперидон (5,00 г) подвергают взаимодействию с 4-(метилтио)анилином (3,33 г) в соответствии со способом, описанным в примере получения 37, получая указанное в заголовке соединение в виде белого порошка.
Выход 3,80 г (49%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,26-1,38 (м, 2H), 1,46 (с, 9H), 1,98-2,06 (м, 2H), 2,41 (с, 3H), 2,88-2,97 (м, 2H), 3,36-3,45 (м, 2H), 3,48-3,56 (шир, 1H), 3,96-4,12 (м, 2H), 6,55 (д, 2H, J=8,8 Гц), 7,21 (д, 2H, J=8,8 Гц).
Пример получения 140
Синтез 1-(трет-бутоксикарбонил)-4-[N-[4-(метилтио)фенил]-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]пиперидина
1-(трет-Бутоксикарбонил)-4-[[4-(метилтио)фенил]амино]пиперидин (644 мг) и 4-хлорметил-2-(3,4,5-триметоксифенил)пиридин (588 мг) обрабатывают по методике, аналогично описанной в примере 9, получая указанное в заголовке соединение в виде светло-желтого аморфного вещества.
Выход 671 мг (58%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,45 (с, 9H), 1,50-1,66 (м, 2H), 1,81-1,89 (м, 2H), 2,40 (с, 3H), 2,74-2,87 (м, 2H), 3,88-3,94 (м, 1H), 3,90 (с, 3H), 3,94 (с, 6H), 4,15-4,29 (м, 2H), 4,48 (с, 2H), 6,67 (д, 2H, J=9,0 Гц), 7,11-7,18 (м, 1H), 7,16 (с, 2H), 7,22 (д, 2H, J=6,6 Гц), 7,54 (с, 1H), 8,57 (д, 1H, J=5,1 Гц).
Пример получения 141
Синтез дигидрохлорида 4-[N-[4-(метилтио)фенил]-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]пиперидина
1-(трет-Бутоксикарбонил)-4-[N-[4-(метилтио)фенил]-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]пиперидин (671 мг) обрабатывают по методике, аналогично описанной в примере получения 94, получая указанное в заголовке соединение в виде светло-желтого порошка.
Выход 602 мг (94%).
Пример получения 142
Синтез 1-(трет-бутоксикарбонил)-4-[N-(4-(метилтио)фенил]-N-[[3-(3,4,5-триметоксифенил)пиридин-5-ил]метил]амино]пиперидина
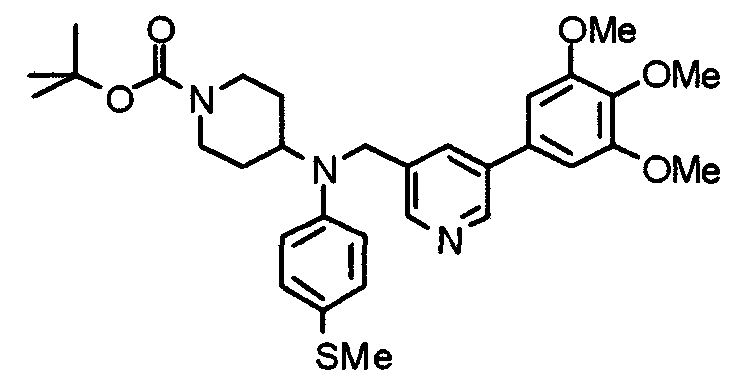
1-(трет-Бутоксикарбонил)-4-[[4-(метилтио)фенил]амино]пиперидин (645 мг) и 5-хлорметил-3-(3,4,5-триметоксифенил)пиридин (588 мг) обрабатывают по методике, аналогично описанной в примере 9, получая указанное в заголовке соединение в виде светло-желтого аморфного вещества.
Выход 312 мг (27%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,45 (с, 9H), 1,53-1,63 (м, 2H), 1,83-1,89 (м, 2H), 2,40 (с, 3H), 2,73-2,85 (м, 2H), 3,87-3,91 (м, 1H), 3,88 (с, 3H), 3,90 (с, 6H), 4,16-4,30 (м, 2H), 4,50 (с, 2H), 6,67 (с, 2H), 6,71 (д, 2H, J=9,0 Гц), 7,21 (д, 2H, J=9,0 Гц), 7,64 (с, 1H), 8,48 (д, 1H, J=2,2 Гц), 8,66 (д, 1H, J=2,1 Гц).
Пример получения 143
Синтез дигидрохлорида 4-[N-[4-(метилтио)фенил]-N-[[3-(3,4,5-триметоксифенил)пиридин-5-ил]метил]амино]пиперидина
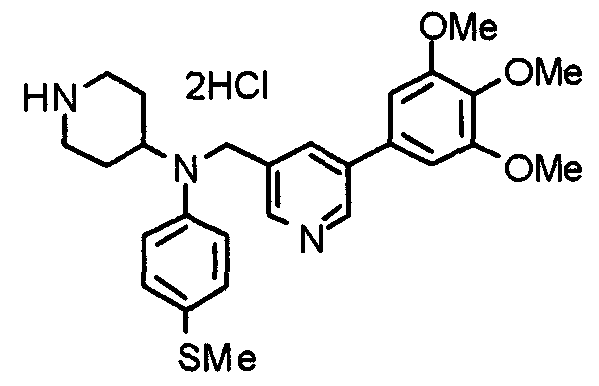
1-(трет-Бутоксикарбонил)-4-[N-[4-(метилтио)фенил]-N-[[3-(3,4,5-триметоксифенил)пиридин-5-ил]метил]амино]пиперидин (312 мг) обрабатывают по методике, аналогично описанной в примере получения 94, получая указанное в заголовке соединение в виде светло-желтого порошка.
Выход 251 мг (84%).
Пример получения 144
Синтез 1-(трет-бутоксикарбонил)-4-[N-[(4-метилтио)фенил]-N-[3-(3,4,5-триметоксифенил)бензил]амино]пиперидина
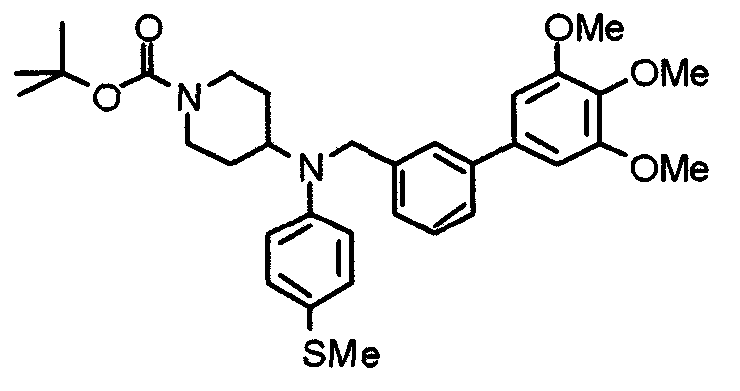
1-(трет-Бутоксикарбонил)-4-[N-[(4-метилтио)фенил]амино]пиперидин (645 мг) подвергают взаимодействию с 3-(3,4,5-триметоксифенил)бензилхлоридом (586 мг) по методике, аналогично описанной в примере 9, получая указанное в заголовке соединение в виде светло-желтого аморфного вещества.
Выход 1,10 г (95%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,45 (с, 9H), 1,55-1,68 (м, 2H), 1,81-1,90 (м, 2H), 2,39 (с, 3H), 2,73-2,86 (м, 2H), 3,87-3,91 (м, 1H), 3,88 (с, 3H), 3,89 (с, 6H), 4,15-4,29 (м, 2H), 4,50 (с, 2H), 6,68-6,73 (м, 4H), 7,19-7,24 (м, 3H), 7,33-7,43 (м, 3H).
Пример получения 145
Синтез гидрохлорида 4-[N-[4-(метилтио)фенил]-N-[[3-(3,4,5-триметоксифенил)бензил]амино]пиперидина
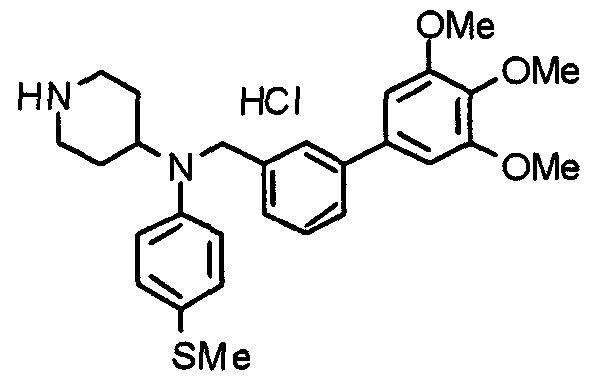
1-(трет-Бутоксикарбонил)-4-[N-[4-(метилтио)фенил]-N-[3-(3,4,5-трифторметоксифенил)бензил]амино]пиперидин (1,10 г) обрабатывают по методике, аналогично описанной в примере получения 94, получая указанное в заголовке соединение в виде светло-желтого порошка.
Выход 866 мг (89%).
Примеры 111-118
Указанные соединения получают взаимодействием аминов, полученных в примерах получения 141, 143 и 145, с производными хлорида, полученными в примерах получения 3, 42 и 48. Полученные свободные основания затем превращают в соответствующие гидрохлориды. Выходы и данные ЯМР их свободных оснований указаны ниже.
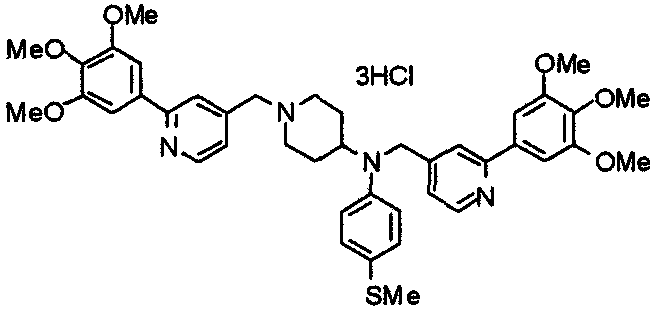
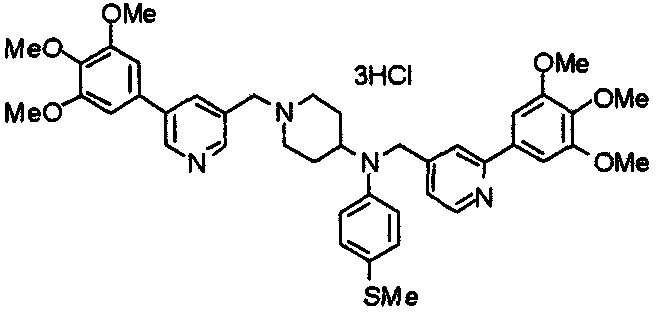
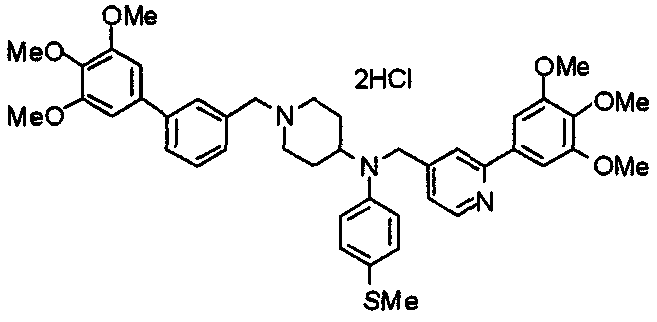
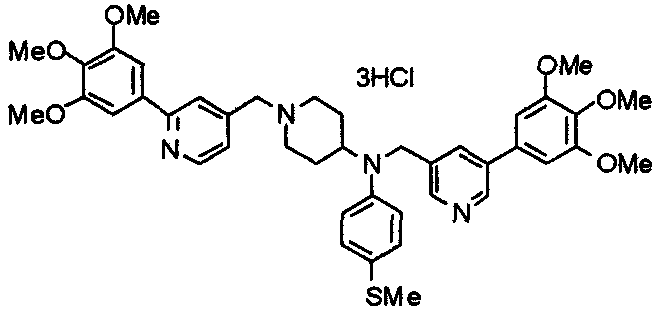
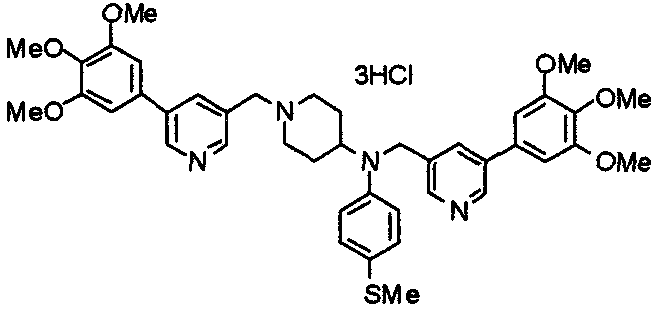
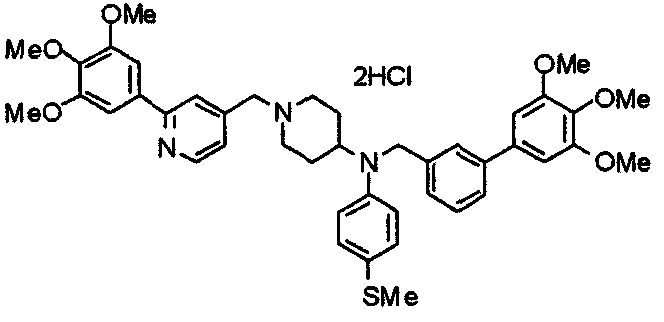
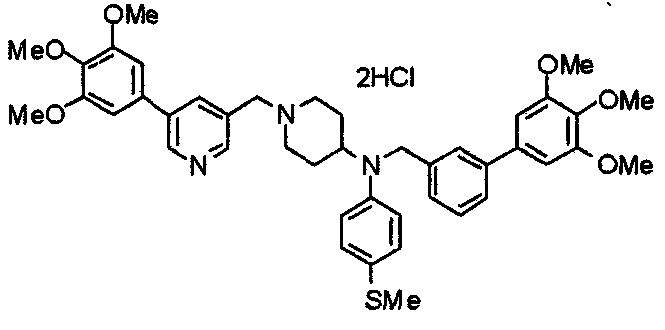
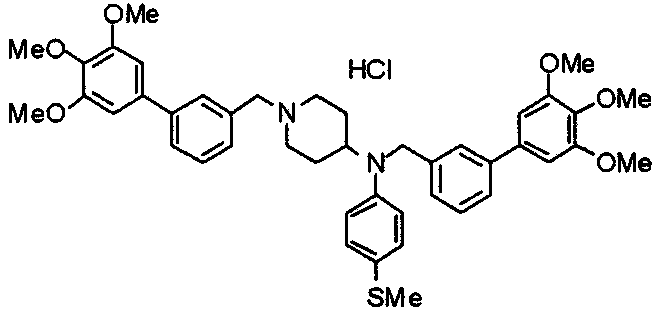
Пример получения 146
Синтез 1-(трет-бутоксикарбонил)-4-[(4-метилфенил)амино]пиперидина
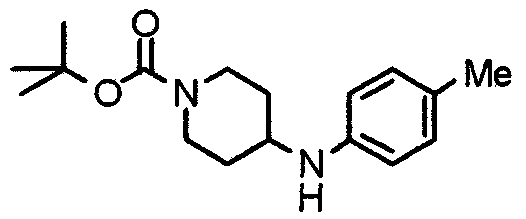
1-(трет-Бутоксикарбонил)-4-пиперидон (5,00 г) и п-толуидин (2,56 г) обрабатывают по методике, аналогично описанной в примере получения 37, получая указанное в заголовке соединение в виде белого порошка.
Выход 5,79 г (83%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,25-1,36 (м, 2H), 1,46 (с, 9H), 1,99-2,06 (м, 2H), 2,23 (с, 3H), 2,86-2,96 (м, 2H), 3,30-3,43 (м, 2H), 3,96-4,10 (м, 2H), 6,53 (д, 2H, J=8,4 Гц), 6,98 (д, 2H, J=8,0 Гц).
Пример получения 147
Синтез 1-(трет-бутоксикарбонил)-4-[N-(4-метилфенил)-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]пиперидина
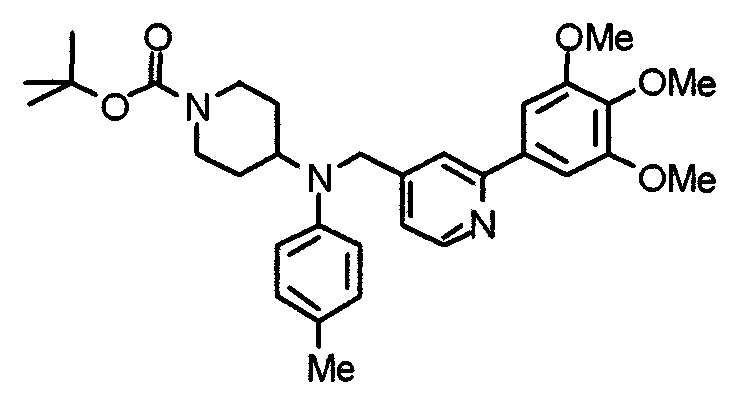
1-(трет-Бутоксикарбонил)-4-[N-(4-метилфенил)амино]пиперидин (581 мг) и 4-хлорметил-2-(3,4,5-триметоксифенил)пиридин (588 мг) обрабатывают по методике, аналогично описанной в примере 9, получая указанное в заголовке соединение в виде светло-желтого аморфного вещества.
Выход 1,00 г (91%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,45 (с, 9H), 1,55-1,59 (м, 2H), 1,81-1,90 (м, 2H), 2,23 (с, 3H), 2,72-2,86 (м, 2H), 3,81-3,94 (м, 1H), 3,89 (с, 3H), 3,93 (с, 6H), 4,14-4,30 (м, 2H), 4,45 (с, 2H), 6,66 (д, 2H, J=8,6 Гц), 7,02 (д, 2H, J=8,2 Гц), 7,13-7,16 (м, 3H), 7,55 (с, 1H), 8,55 (д, 1H, J=8,1 Гц).
Пример получения 148
Синтез дигидрохлорида 4-[N-(4-метилфенил)-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]пиперидина
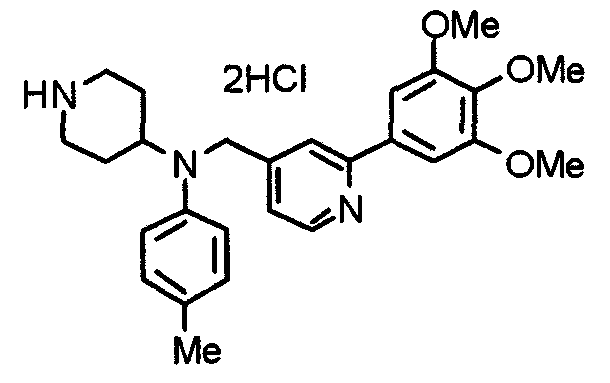
1-(трет-Бутоксикарбонил)-4-[N-(4-метилфенил)-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]бензил]метил]пиперидин (1,00 г) обрабатывают по методике, аналогично описанной в примере получения 94, получая указанное в заголовке соединение в виде светло-желтого порошка.
Выход 924 мг (97%).
Пример получения 149
Синтез 1-(трет-бутоксикарбонил)-4-[N-(4-метилфенил)-N-[[3-(3,4,5-триметоксифенил)пиридин-5-ил]метил]амино]пиперидина
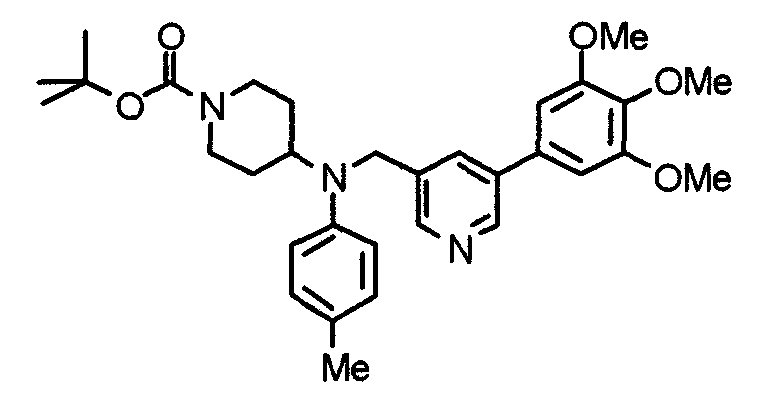
1-(трет-Бутоксикарбонил)-4-[(4-метилфенил)амино]пиперидин (581 мг) и 5-хлорметил-3-(3,4,5-триметоксифенил)пиридин (588 мг) обрабатывают по методике, аналогично описанной в примере 9, получая указанное в заголовке соединение в виде светло-желтого аморфного вещества.
Выход 426 мг (39%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,45 (с, 9H), 1,52-1,70 (м, 2H), 1,82-1,90 (м, 2H), 2,23 (с, 3H), 2,72-2,86 (м, 2H), 3,77-3,86 (м, 1H), 3,88 (с, 3H), 3,90 (с, 6H), 4,10-4,28 (м, 2H), 4,47 (с, 2H), 6,67 (с, 2H), 6,70 (д, 2H, J=8,6 Гц), 7,01 (д, 2H, J=8,2 Гц), 7,67 (дд, 1H, J=2,1 Гц, 2,1 Гц), 8,50 (д, 1H, J=2,0 Гц), 8,64 (д, 1H, J=2,2 Гц).
Пример получения 150
Синтез дигидрохлорида 4-[N-(4-метилфенил)-N-[[3-(3,4,5-триметоксифенил)пиридин-5-ил]метил]амино]пиперидина
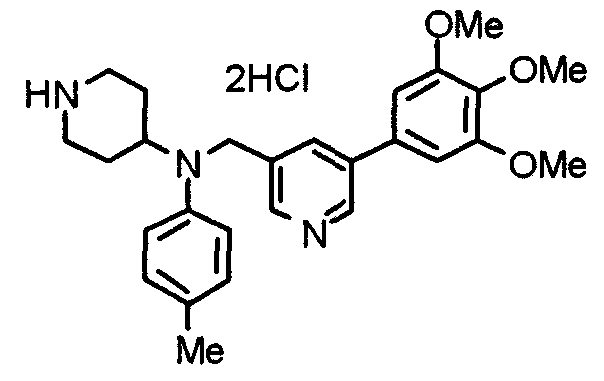
1-(трет-Бутоксикарбонил)-4-[N-(4-метилфенил)-N-[[3-(3,4,5-триметоксифенил)пиридин-5-ил]метил]амино]пиперидин (426 мг) обрабатывают по методике, аналогично описанной в примере получения 94, получая указанное в заголовке соединение в виде светло-желтого порошка.
Выход 400 мг (99%).
Пример получения 151
Синтез 1-(трет-бутоксикарбонил)-4-[N-(4-метилфенил)-N-[3-(3,4,5-триметоксифенил)бензил]амино]пиперидина
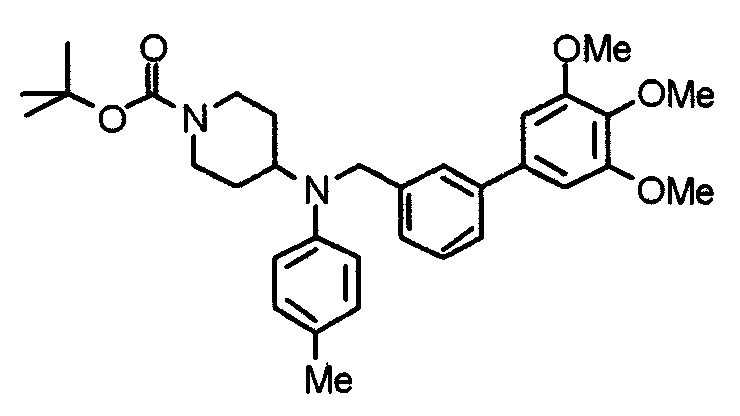
1-(трет-Бутоксикарбонил)-4-[(4-метилфенил)амино]пиперидин (581 мг) подвергают взаимодействию с 3-(3,4,5-триметоксифенил)бензилхлоридом (586 мг) по методике, аналогично описанной в примере 9, получая указанное в заголовке соединение в виде светло-желтого аморфного вещества.
Выход 1,03 г (94%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,44 (с, 9H), 1,50-1,66 (м, 2H), 1,83-1,90 (м, 2H), 2,23 (с, 3H), 2,72-2,85 (м, 2H), 3,82-3,92 (м, 1H), 3,88 (с, 3H), 3,89 (с, 6H), 4,11-4,30 (м, 2H), 4,47 (с, 2H), 6,68 (д, 2H, J=8,6 Гц), 6,71 (с, 2H), 7,00 (д, 2H, J=8,8 Гц), 7,23-7,27 (м, 1H), 7,32-7,44 (м, 3H).
Пример получения 152
Синтез гидрохлорида 4-[N-(4-метилфенил)-N-[3-(3,4,5-триметоксифенил)бензил]амино]пиперидина
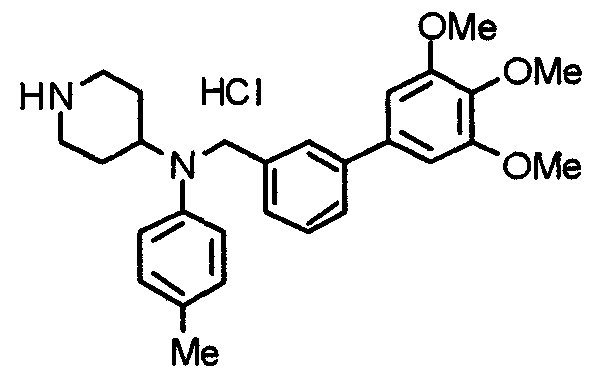
1-(трет-Бутоксикарбонил)-4-[N-(4-метилфенил)-N-[3-(3,4,5-триметоксифенил)бензил]амино]пиперидин (1,03 г) обрабатывают по методике, аналогично описанной в примере получения 94, получая указанное в заголовке соединение в виде светло-желтого порошка.
Выход 882 мг (97%).
Примеры 119-126
Указанные соединения получают взаимодействием аминов, полученных в примерах получения 148, 150 и 152, с производными хлорида, полученными в примерах получения 3, 42 и 48. Полученные свободные основания затем превращают в соответствующие гидрохлориды. Выходы и данные ЯМР их свободных оснований указаны ниже.
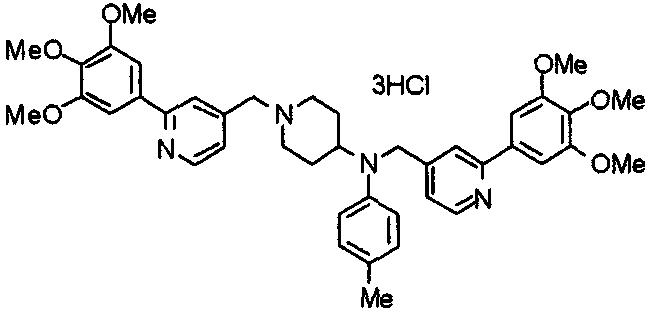
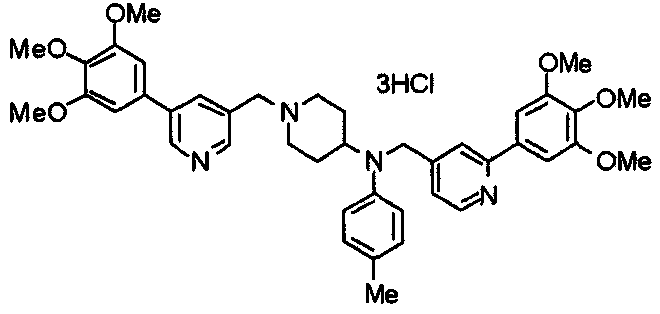
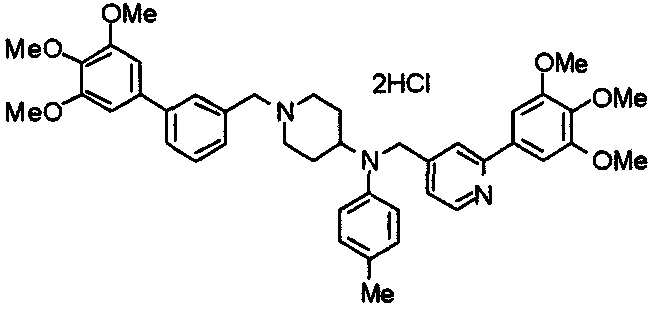
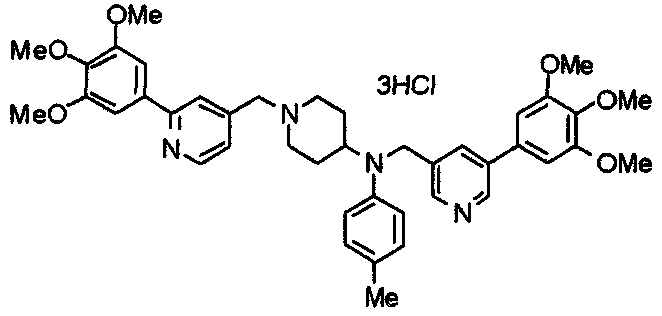
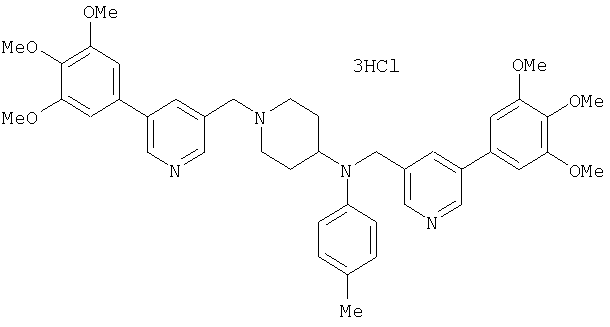
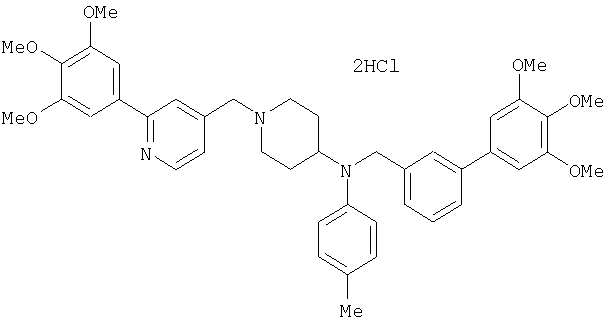
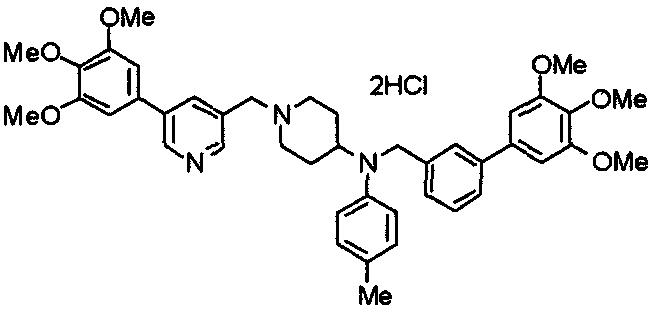
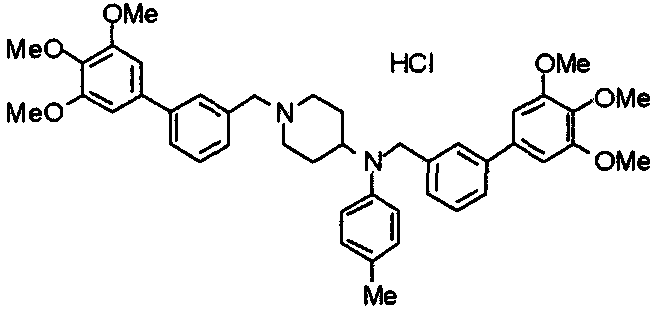
Пример получения 153
Синтез 1-(трет-бутоксикарбонил)-4-[[4-(триметилфенил)фенил]амино]пиперидина
1-(трет-Бутоксикарбонил)-4-пиперидон (5,00 г) подвергают взаимодействию с 4-(трифтор)анилином (3,85 г) по методике, аналогично описанной в примере получения 37, получая указанное в заголовке соединение в виде белого порошка.
Выход 3,30 г (40%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,30-1,41 (м, 2H), 1,47 (с, 9H), 2,00-2,07 (м, 2H), 2,88-2,99 (м, 2H), 3,32-3,52 (м, 1H), 3,83-3,89 (м, 1H), 4,00-4,14 (м, 2H), 6,59 (д, 2H, J=8,4 Гц), 7,39 (д, 2H, J=8,4 Гц).
Пример получения 154
Синтез 1-(трет-бутоксикарбонил)-4-[N-[4-(трифторметил)фенил]-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]пиперидина
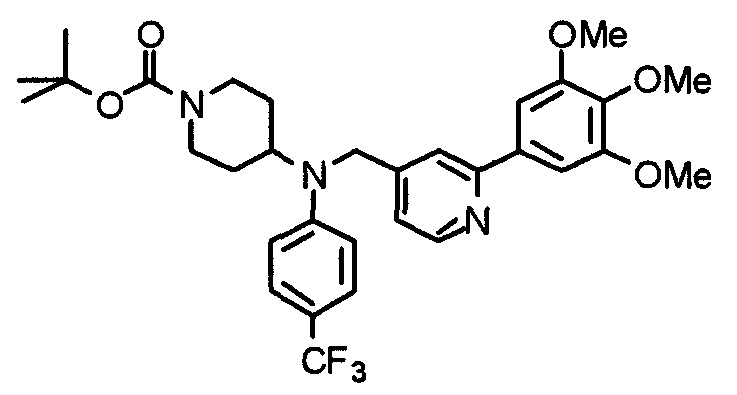
1-(трет-Бутоксикарбонил)-4-[[4-(трифторметил)фенил]амино]пиперидин (688 мг) и 4-хлорметил-2-(3,4,5-триметоксифенил)пиридин (588 мг) обрабатывают по методике, аналогично описанной в примере 9, получая указанное в заголовке соединение в виде светло-желтого аморфного вещества.
Выход 412 мг (34%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,45 (с, 9H), 1,54-1,68 (м, 2H), 1,81-1,90 (м, 2H), 2,77-2,90 (м, 2H), 3,89 (с, 3H), 3,92 (с, 6H), 3,98-4,07 (м, 1H), 4,18-4,33 (м, 2H), 4,55 (с, 2H), 6,73 (д, 2H, J=8,8 Гц), 7,09 (д, 1H, J=3,7 Гц), 7,13 (с, 2H), 7,44 (д, 2H, J=8,8 Гц), 7,49 (с, 1H), 8,58 (д, 1H, J=5,1 Гц).
Пример получения 155
Синтез дигидрохлорида 4-[N-[4-(трифторметил)фенил]-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]пиперидина
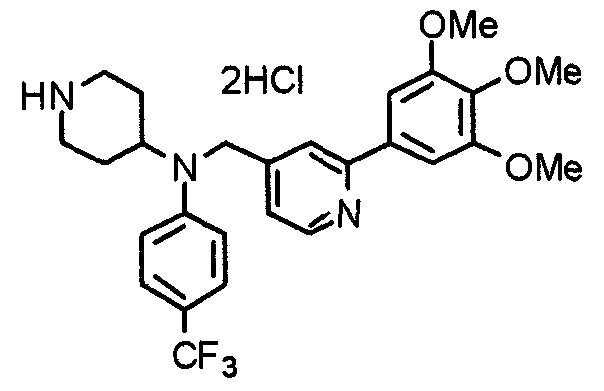
1-(трет-Бутоксикарбонил)-4-[N-[4-(трифторметил)фенил]-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]пиперидин (412 мг) обрабатывают по методике, аналогично описанной в примере получения 94, получая указанное в заголовке соединение в виде светло-желтого порошка.
Выход 359 мг (91%).
Пример получения 156
Синтез 1-(трет-бутоксикарбонил)-4-[N-[(4-(трифторметил)фенил)-N-[3-(3,4,5-триметоксифенил)бензил]амино]пиперидина
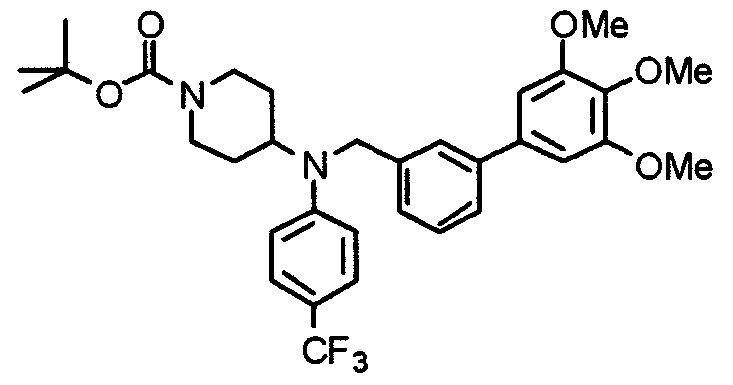
1-(трет-Бутоксикарбонил)-4-[[4-(трифторметил)фенил]амино]пиперидин (689 мг) подвергают взаимодействию с 3-(3,4,5-триметоксифенил)бензилхлоридом (586 мг) по методике, аналогично описанной в примере 9, получая указанное в заголовке соединение в виде светло-желтого аморфного вещества.
Выход 522 мг (44%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,45 (с, 9H), 1,58-1,70 (м, 2H), 1,83-1,90 (м, 2H), 2,76-2,87 (м, 2H), 3,87 (с, 6H), 3,88 (с, 3H), 3,96-4,06 (м, 1H), 4,15-4,30 (м, 2H), 4,58 (с, 2H), 6,68 (с, 2H), 6,76 (д, 2H, J=8,8 Гц), 7,19 (с, 1H, J=7,4 Гц), 7,33-7,44 (м, 5H).
Пример получения 157
Синтез гидрохлорида 4-[N-[4-(трифторметил)фенил]-N-[[3-(3,4,5-триметоксифенил)бензил]амино]пиперидина
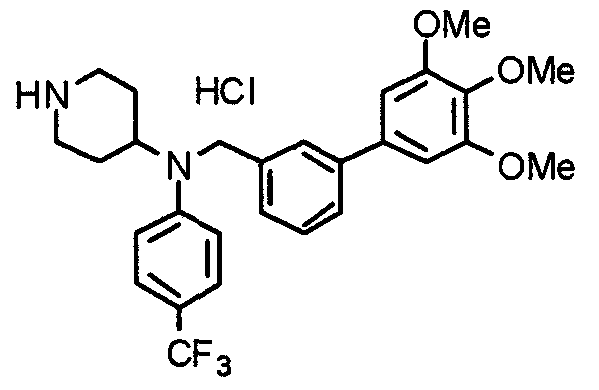
1-(трет-Бутоксикарбонил)-4-[N-[4-(трифторметил)фенил]-N-[[3-(3,4,5-триметоксифенил)бензил]амино]пиперидин (522 мг) обрабатывают по методике, аналогично описанной в примере получения 94, получая указанное в заголовке соединение в виде светло-желтого порошка.
Выход 460 мг (99%).
Примеры 127-132
Указанные соединения получают взаимодействием аминов, полученных в примерах получения 155 и 157, с производными хлорида, полученными в примерах получения 3, 42 и 48. Полученные свободные основания затем превращают в соответствующие гидрохлориды. Выходы и данные ЯМР их свободных оснований указаны ниже.
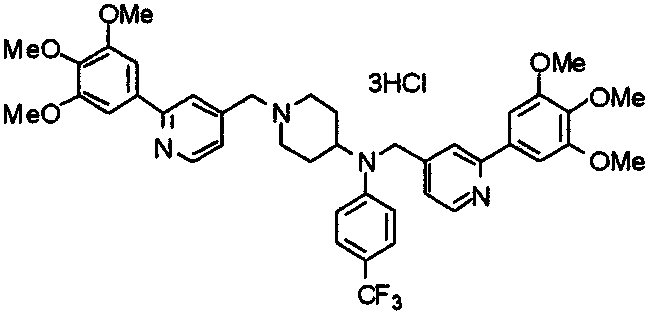
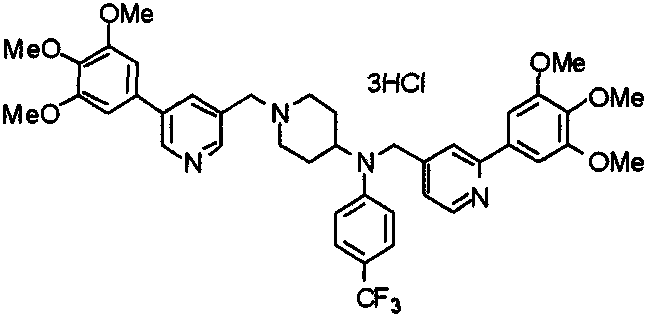
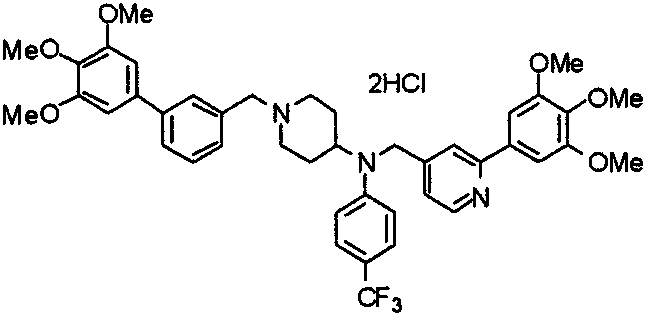
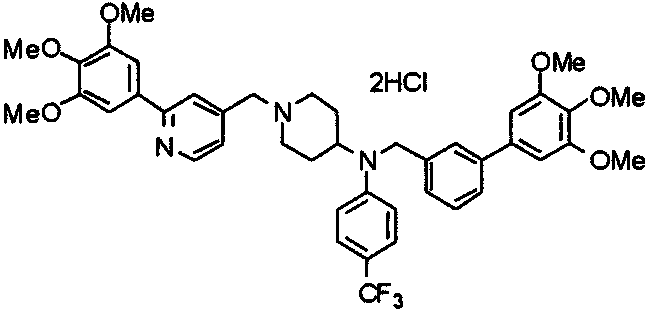
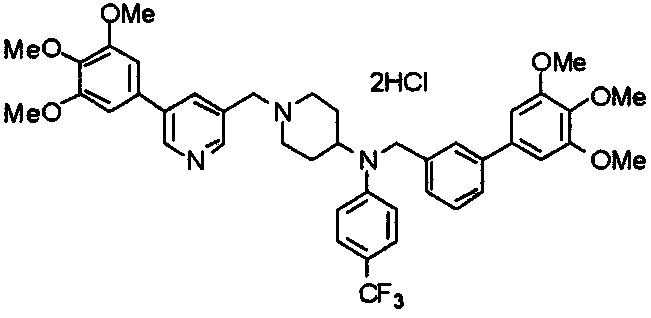
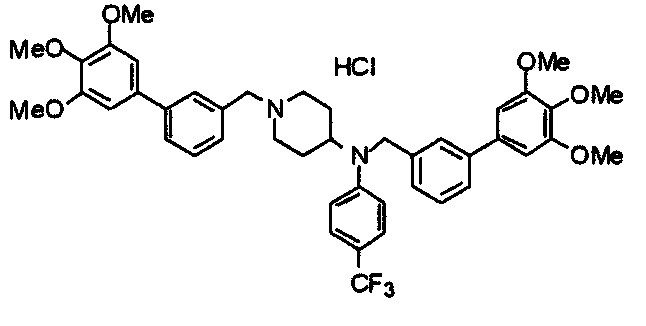
Пример получения 158
Синтез 1-(трет-бутоксикарбонил)-4-(4-бромфенил)аминопиперидина
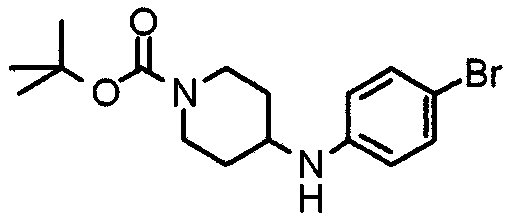
1-(трет-Бутоксикарбонил)-4-пиперидон (5,00 г) подвергают взаимодействию с 4-броманилином (4,11 г) по методике, аналогично описанной в примере получения 37, получая указанное в заголовке соединение в виде белого порошка.
Выход 3,09 г (36%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,25-1,37 (м, 2H), 1,46 (с, 9H), 1,97-2,05 (м, 2H), 2,86-2,96 (м, 2H), 3,33-3,42 (м, 2H), 3,47-3,57 (м, 1H), 3,96-4,12 (м, 2H), 6,47 (д, 2H, J=8,8 Гц), 7,24 (д, 2H, J=9,0 Гц).
Пример получения 159
Синтез 1-(трет-бутоксикарбонил)-4-[N-(4-бромфенил)-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]пиперидина
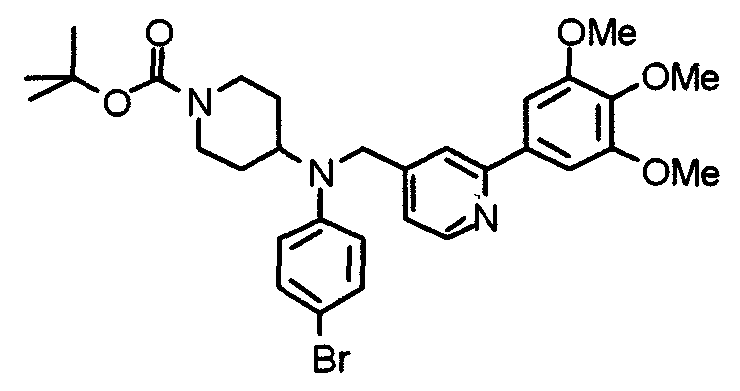
1-(трет-Бутоксикарбонил)-4-(4-бромфенил)аминопиперидин (711 мг) и 4-хлорметил-2-(3,4,5-триметоксифенил)пиридин (588 мг) обрабатывают по методике, аналогично описанной в примере 9, получая указанное в заголовке соединение в виде светло-желтого аморфного вещества.
Выход 607 мг (50%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,45 (с, 9H), 1,50-1,64 (м, 2H), 1,81-1,88 (м, 2H), 2,74-2,88 (м, 2H), 3,86-3,94 (м, 1H), 3,89 (с, 3H), 3,93 (с, 6H), 4,14-4,32 (м, 2H), 4,46 (с, 2H), 6,59 (д, 2H, J=9,1 Гц), 7,10 (д, 1H, J=5,2 Гц), 7,14 (с, 2H), 7,28 (д, 2H, J=9,1 Гц), 7,50 (с, 1H), 8,57 (д, 1H, J=5,0 Гц).
Пример получения 160
Синтез дигидрохлорида 4-[N-(4-бромфенил)-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]пиперидина

1-(трет-Бутоксикарбонил)-4-[N-(4-бромфенил)-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]пиперидин (607 мг) обрабатывают по методике, аналогично описанной в примере получения 94, получая указанное в заголовке соединение в виде светло-желтого порошка.
Выход 541 мг (93%).
Пример получения 161
Синтез 1-(трет-бутоксикарбонил)-4-[N-(4-бромфенил)-N-[[3-(3,4,5-триметоксифенил)пиридин-5-ил]метил]амино]пиперидина
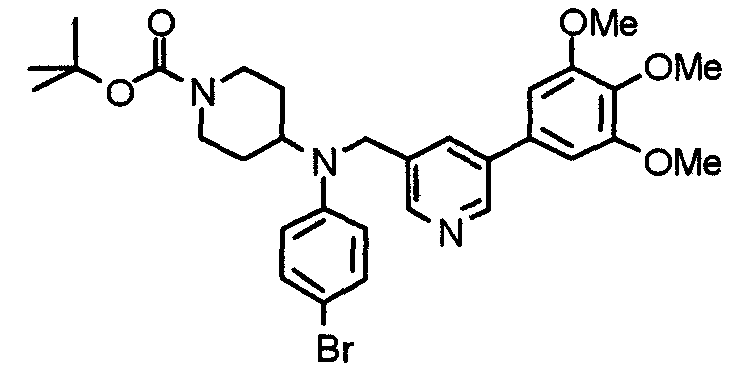
1-(трет-Бутоксикарбонил)-4-(4-бромфенил)аминопиперидин (711 мг) и 5-хлорметил-3-(3,4,5-триметоксифенил)пиридин (588 мг) по методике, аналогично описанной в примере 9, получая указанное в заголовке соединение в виде светло-желтого аморфного вещества.
Выход 347 мг (28%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,45 (с, 9H), 1,52-1,67 (м, 2H), 1,80-1,89 (м, 2H), 2,72-2,87 (м, 2H), 3,82-3,92 (м, 1H), 3,89 (с, 3H), 3,90 (с, 6H), 4,14-4,33 (м, 2H), 4,50 (с, 2H), 6,63 (д, 2H, J=9,2 Гц), 6,65 (с, 2H), 7,28 (д, 2H, J=9,4 Гц), 7,61 (с, 1H), 8,47 (д, 1H, J=2,0 Гц), 8,67 (д, 1H, J=2,2 Гц).
Пример получения 162
Синтез дигидрохлорида 4-[N-(4-бромфенил)-N-[[3-(3,4,5-триметоксифенил)пиридин-5-ил]метил]амино]пиперидина
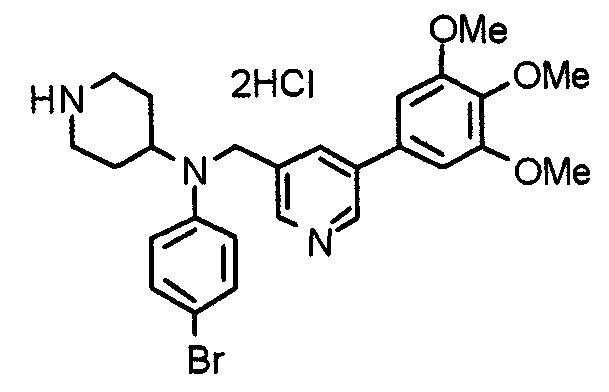
1-(трет-Бутоксикарбонил)-4-[N-(4-бромфенил)-N-[[3-(3,4,5-триметоксифенил)пиридин-5-ил]метил]амино]пиперидин (347 мг) обрабатывают по методике, аналогично описанной в примере получения 94, получая указанное в заголовке соединение в виде светло-желтого порошка.
Выход 302 мг (91%).
Пример получения 163
Синтез 1-(трет-бутоксикарбонил)-4-[N-(4-бромфенил)-N-[3-(3,4,5-триметоксифенил)бензил]амино]пиперидина
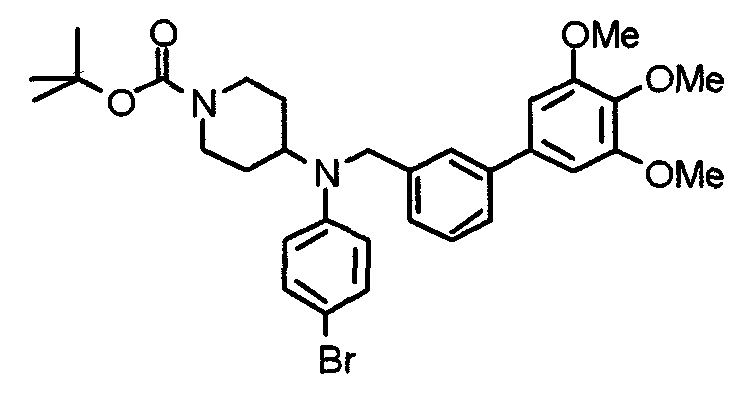
1-(трет-Бутоксикарбонил)-4-(4-бромфенил)аминопиперидин (711 мг) подвергают взаимодействию с 3-(3,4,5-триметоксифенил)бензилхлоридом (586 мг) по методике, аналогично описанной в примере 9, получая указанное в заголовке соединение в виде светло-желтого аморфного вещества.
Выход 1,14 г (93%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,45 (с, 9H), 1,52-1,67 (м, 2H), 1,80-1,89 (м, 2H), 2,72-2,86 (м, 2H), 3,84-3,91 (м, 1H), 3,88 (с, 3H), 3,89 (с, 6H), 4,11-4,32 (м, 2H), 4,49 (с, 2H), 6,62 (д, 2H, J=9,2 Гц), 6,69 (с, 2H), 7,19 (д, 1H, J=7,6 Гц), 7,25 (д, 2H, J=5,5 Гц), 7,32-7,42 (м, 3H).
Пример получения 164
Синтез гидрохлорида 4-[N-(4-бромфенил)-N-[3-(3,4,5-триметоксифенил)бензил]амино]пиперидина
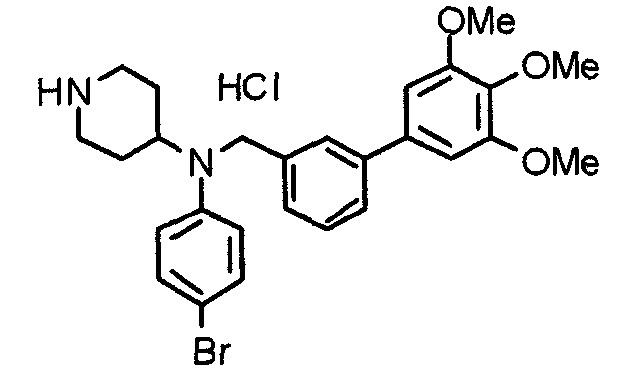
1-(трет-Бутоксикарбонил)-4-[N-(4-бромфенил)-N-[3-(3,4,5-триметоксифенил)бензил]амино]пиперидин (1,03 г) обрабатывают по методике, аналогично описанной в примере получения 94, получая указанное в заголовке соединение в виде светло-желтого порошка.
Выход 973 мг (84%).
Примеры 133-140
Указанные соединения получают взаимодействием аминов, полученных в примерах получения 160, 162 и 164, с производными хлорида, полученными в примерах получения 3, 42 и 48. Полученные свободные основания затем превращают в соответствующие гидрохлориды. Выходы и данные ЯМР их свободных оснований указаны ниже.
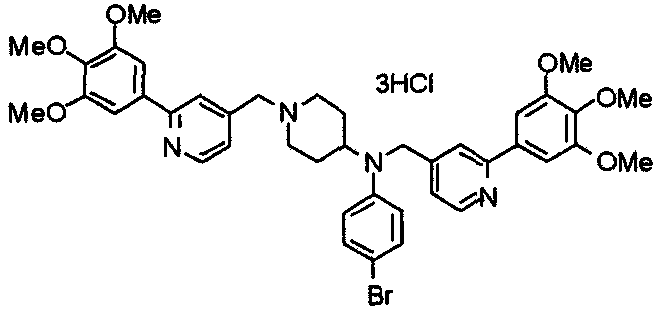
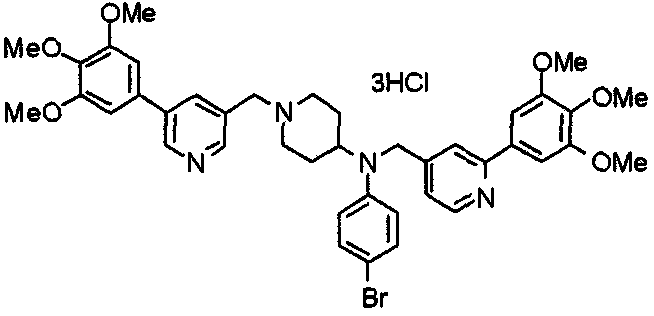
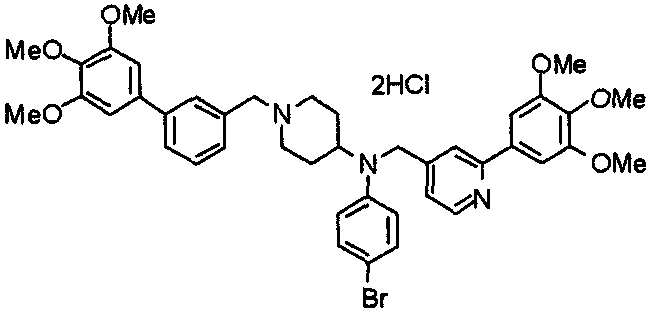
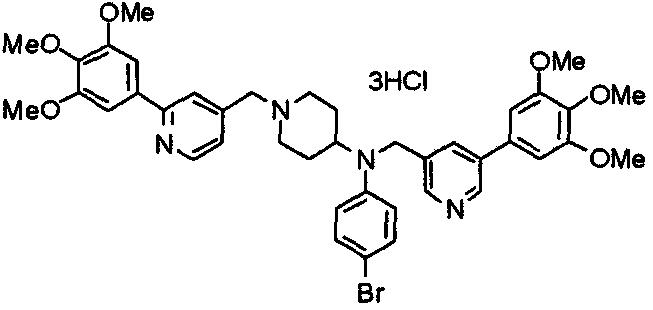
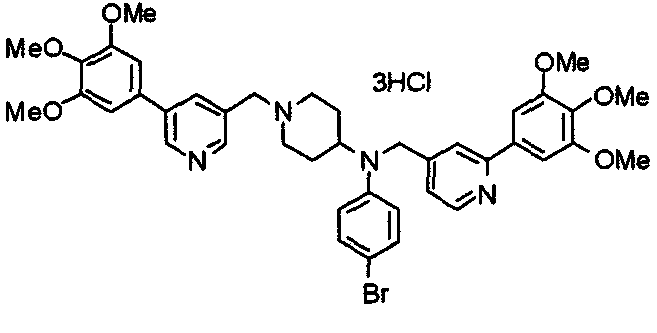
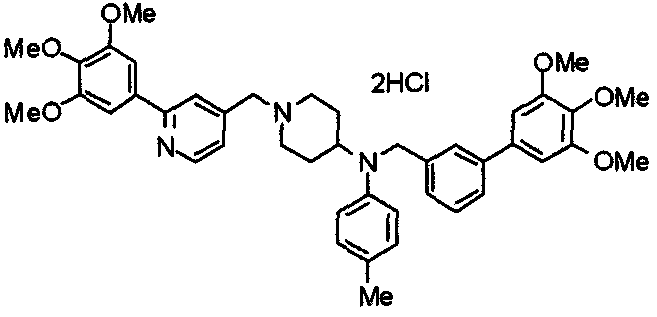
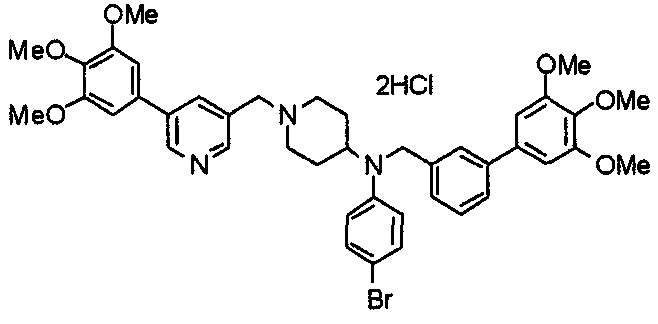
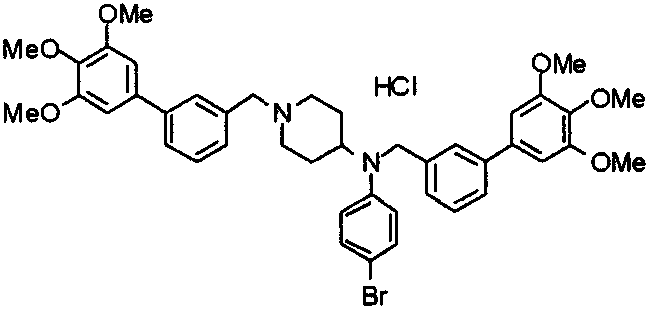
Пример получения 165
Синтез 1-(трет-бутоксикарбонил)-4-[(4-хлорфенил)амино]пиперидина
1-(трет-Бутоксикарбонил)-4-пиперидон (5,00 г) подвергают взаимодействию с 4-хлоранилином (3,05 г) по методике, аналогично описанной в примере получения 37, получая указанное в заголовке соединение в виде белого порошка.
Выход 3,80 г (49%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,24-1,38 (м, 2H), 1,46 (с, 9H), 1,97-2,05 (м, 2H), 2,86-2,96 (м, 2H), 3,32-3,42 (м, 2H), 3,51 (шир, 1H), 6,52 (д, 2H, J=9,0 Гц), 7,11 (д, 2H, J=9,0 Гц).
Пример получения 166
Синтез 1-(трет-бутоксикарбонил)-4-[N-(4-хлорфенил)-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]пиперидина
1-(трет-Бутоксикарбонил)-4-[(4-хлорфенил)амино]пиперидин (621 мг) и 4-хлорметил-2-(3,4,5-триметоксифенил)пиридин (588 мг) обрабатывают по методике, аналогично описанной в примере 9, получая указанное в заголовке соединение в виде светло-желтого аморфного вещества.
Выход 789 мг (69%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,45 (с, 9H), 1,51-1,68 (м, 2H), 1,80-1,89 (м, 2H), 2,72-2,86 (м, 2H), 3,87-3,90 (м, 1H), 3,89 (с, 3H), 3,93 (с, 6H), 4,64 (с, 2H), 6,64 (д, 2H, J=9,0 Гц), 7,14 (д, 1H, J=5,3 Гц), 7,15 (д, 2H, J=9,0 Гц), 7,51 (с, 2H), 8,57 (д, 2H, J=5,1 Гц).
Пример получения 167
Синтез дигидрохлорида 4-[N-(4-бромфенил)-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]пиперидина
1-(трет-Бутоксикарбонил)-4-[N-(4-бромфенил)-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]пиперидин (789 мг) обрабатывают по методике, аналогично описанной в примере получения 94, получая указанное в заголовке соединение в виде светло-желтого порошка.
Выход 673 мг (90%).
Пример получения 168
Синтез 1-(трет-бутоксикарбонил)-4-[N-(4-хлорфенил)-N-[[3-(3,4,5-триметоксифенил)пиридин-5-ил]метил]амино]пиперидина
1-(трет-Бутоксикарбонил)-4-[(4-хлорфенил)амино]пиперидин (621 мг) и 5-хлорметил-3-(3,4,5-триметоксифенил)пиридин (588 мг) по методике, аналогично описанной в примере 9, получая указанное в заголовке соединение в виде светло-желтого аморфного вещества.
Выход 268 мг (24%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,45 (с, 9H), 1,56-1,76 (м, 2H), 1,80-1,90 (м, 2H), 2,76-2,83 (м, 2H), 3,86-3,90 (м, 1H), 3,89 (с, 3H), 3,90 (с, 6H), 4,15-4,30 (м, 2H), 4,50 (с, 2H), 6,66 (с, 2H), 6,68 (д, 2H, J=9,2 Гц), 7,15 (д, 2H, J=9,0 Гц), 7,63 (с, 1H), 8,47 (д, 1H, J=2,0 Гц), 8,66 (д, 1H, J=2,0 Гц).
Пример получения 169
Синтез дигидрохлорида 4-[N-(4-бромфенил)-N-[[3-(3,4,5-триметоксифенил)пиридин-5-ил]метил]амино]пиперидина
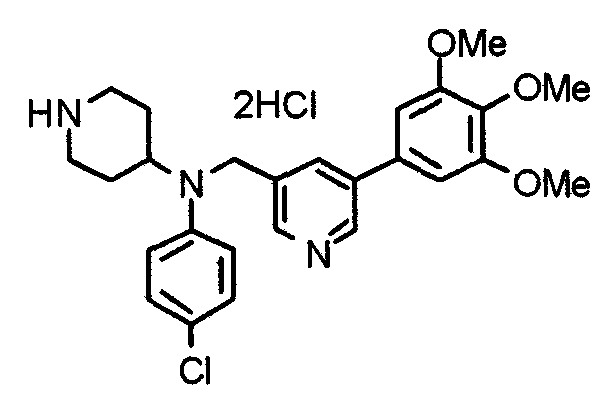
1-(трет-Бутоксикарбонил)-4-[N-(4-бромфенил)-N-[[3-(3,4,5-триметоксифенил)пиридин-5-ил]метил]амино]пиперидин (268 мг) обрабатывают по методике, аналогично описанной в примере получения 94, получая указанное в заголовке соединение в виде светло-желтого порошка.
Выход 233 мг (91%).
Пример получения 170
Синтез 1-(трет-бутоксикарбонил)-4-[N-(4-хлорфенил)-N-[3-(3,4,5-триметоксифенил)бензил]амино]пиперидина
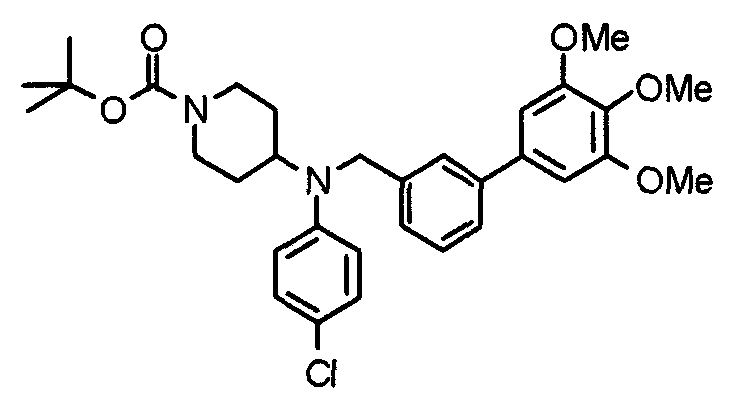
1-(трет-Бутоксикарбонил)-4-[4-хлорфенил)амино]пиперидин (622 мг) подвергают взаимодействию с 3-(3,4,5-триметоксифенил)бензилхлоридом (586 мг) по методике, аналогично описанной в примере 9, получая указанное в заголовке соединение в виде светло-желтого аморфного вещества.
Выход 1,04 г (92%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,45 (с, 9H), 1,58-1,67 (м, 2H), 1,82-1,91 (м, 2H), 2,74-2,86 (м, 2H), 3,85-3,92 (м, 1H), 3,88 (с, 3H), 3,89 (с, 6H), 4,35-4,31 (м, 2H), 4,49 (с, 2H), 6,66 (д, 2H, J=9,2 Гц), 6,70 (с, 2H), 7,12 (д, 2H, J=9,0 Гц), 7,20 (д, 2H, J=7,3 Гц), 7,33-7,43 (м, 3H).
Пример получения 171
Синтез гидрохлорида 4-[N-(4-хлорфенил)-N-[3-(3,4,5-триметоксифенил)бензил]амино]пиперидина
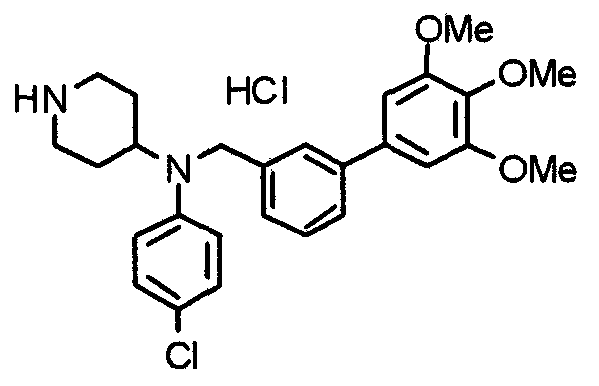
1-(трет-Бутоксикарбонил)-4-[N-(4-бромфенил)-N-[3-(3,4,5-триметоксифенил)бензил]амино]пиперидин (1,04 г) обрабатывают по методике, аналогично описанной в примере получения 94, получая указанное в заголовке соединение в виде светло-желтого порошка.
Выход 899 мг (97%).
Примеры 141-148
Указанные соединения получают взаимодействием аминов, полученных в примерах получения 167, 169 и 171, с производными хлорида, полученными в примерах получения 3, 42 и 48. Полученные свободные основания затем превращают в соответствующие гидрохлориды. Выходы и данные ЯМР их свободных оснований указаны ниже.
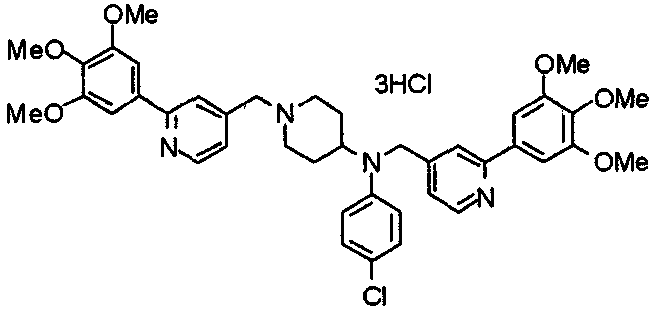
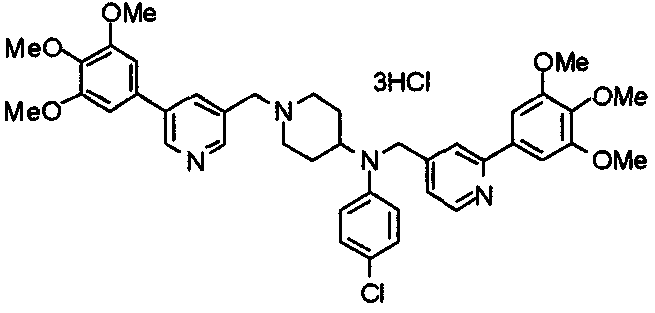
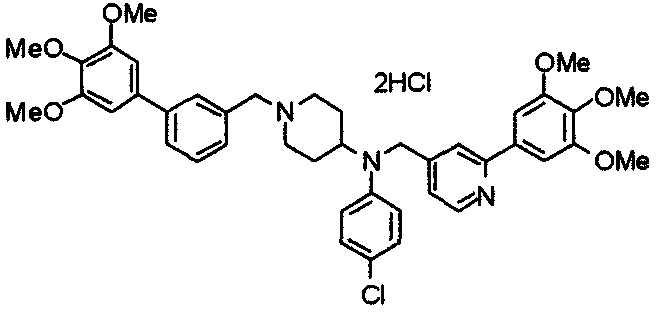
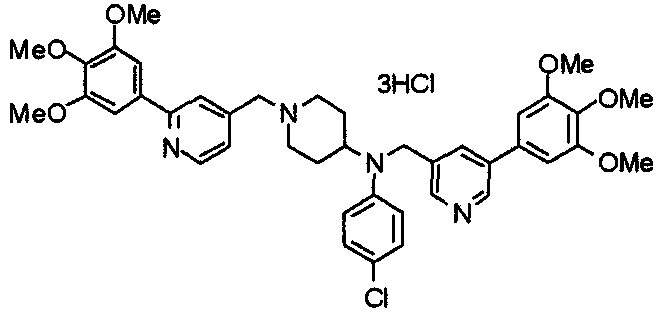
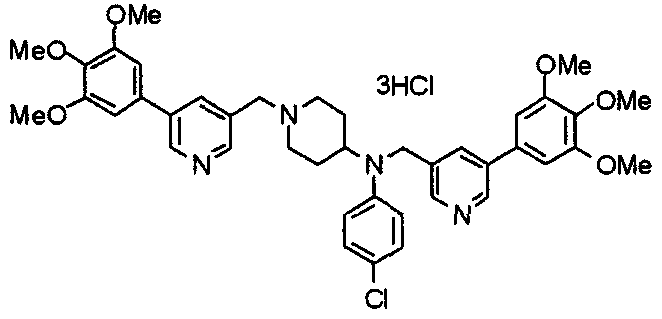
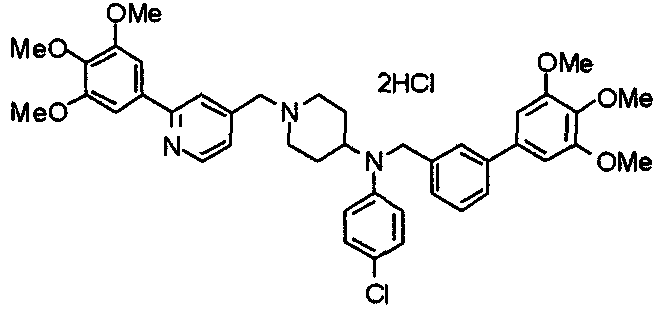
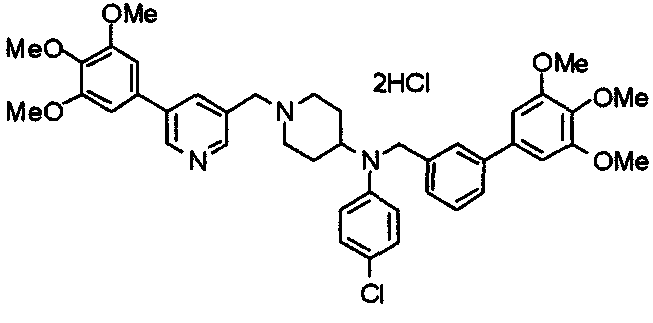
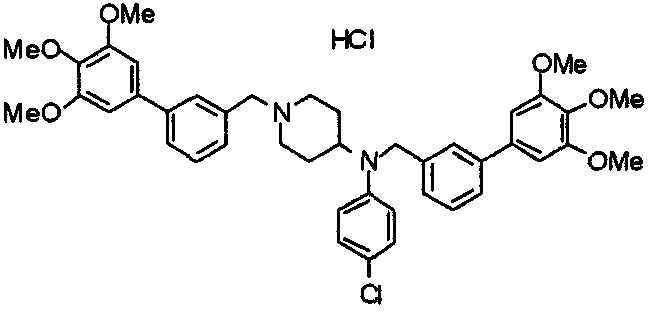
Пример получения 172
Синтез 1-(трет-бутоксикарбонил)-4-[(3,4-дифторфенил)амино]пиперидина
1-(трет-Бутоксикарбонил)-4-пиперидон (5,00 г) подвергают взаимодействию с 3,4-дифторанилином (3,09 г) по методике, аналогично описанной в примере получения 37, получая указанное в заголовке соединение в виде белого порошка.
Выход 4,66 г (62%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,24-1,37 (м, 2H), 1,46 (с, 9H), 1,97-2,05 (м, 2H), 2,85-2,96 (м, 2H), 3,26-3,36 (м, 1H), 3,38-3,52 (м, 1H), 3,96-4,14 (м, 2H), 6,22-6,28 (м, 1H), 6,38 (ддд, 1H, J=12,7 Гц, 6,6 Гц, 2,9 Гц), 6,94 (дд, 1H, J=19,1 Гц, 9,0 Гц).
Пример получения 173
Синтез 1-(трет-бутоксикарбонил)-4-[N-(3,4-дифторфенил)-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]пиперидина
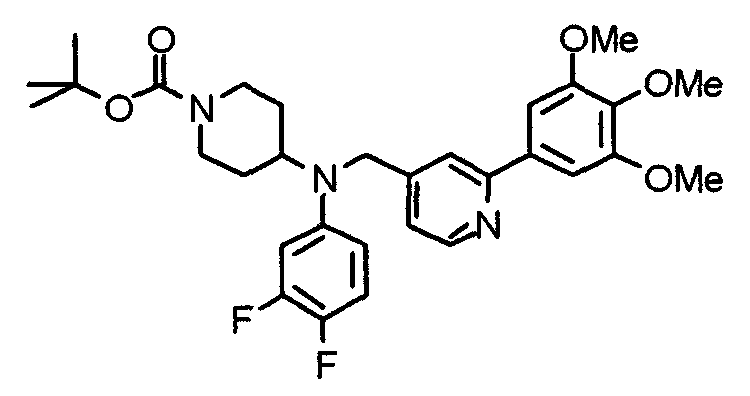
1-(трет-Бутоксикарбонил)-4-[(3,4-дифторфенил)амино]пиперидин (625 мг) и 4-хлорметил-2-(3,4,5-триметоксифенил)пиридин (588 мг) обрабатывают по методике, аналогично описанной в примере 9, получая указанное в заголовке соединение в виде светло-желтого аморфного вещества.
Выход 534 мг (47%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,45 (с, 9H), 1,50-1,70 (м, 2H), 1,82-1,90 (м, 2H), 2,73-2,88 (м, 2H), 3,90 (с, 3H), 3,94 (с, 6H), 4,15-4,30 (м, 2H), 4,43 (с, 2H), 6,33-6,39 (м, 1H), 6,52 (ддд, 1H, J=13,6 Гц, 6,4 Гц, 3,1 Гц), 6,98 (дд, 1H, J=19,1 Гц, 9,2 Гц), 7,11 (дд, 1H, J=5,0 Гц, 1,3 Гц), 7,16 (с, 2H), 7,51 (с, 1H), 8,58 (д, 1H, J=5,1 Гц).
Пример получения 174
Синтез дигидрохлорида 4-[N-(3,4-дифторфенил)-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]пиперидина
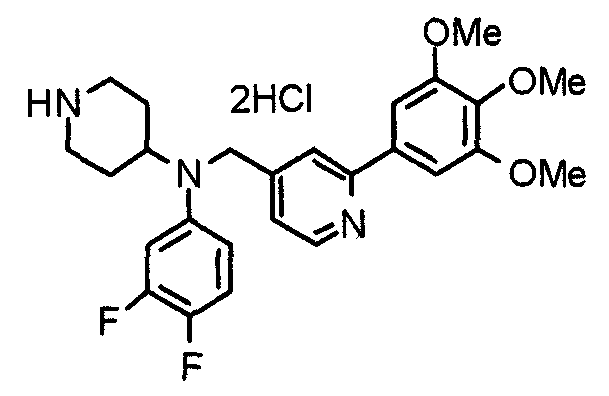
1-(трет-Бутоксикарбонил)-4-[N-(3,4-дифторфенил)-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]пиперидин (534 мг) обрабатывают по методике, аналогично описанной в примере получения 94, получая указанное в заголовке соединение в виде светло-желтого порошка.
Выход 442 мг (87%).
Пример получения 175
Синтез 1-(трет-бутоксикарбонил)-4-[N-(3,4-дифторфенил)-N-[[3-(3,4,5-триметоксифенил)пиридин-5-ил]метил]амино]пиперидина
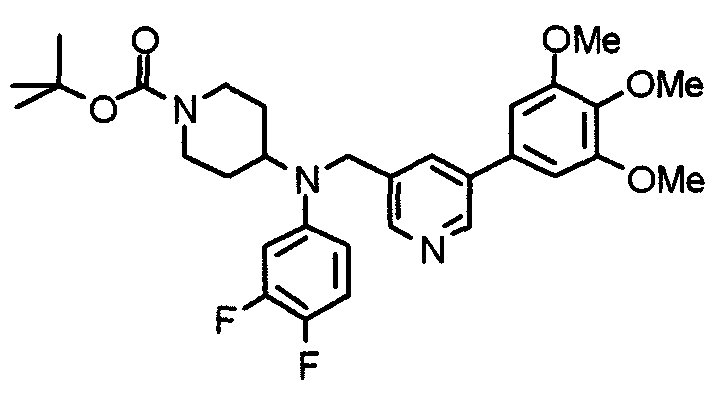
1-(трет-Бутоксикарбонил)-4-[(3,4-дифторфенил)амино]пиперидин (625 мг) и 5-хлорметил-3-(3,4,5-триметоксифенил)пиридин (588 мг) обрабатывают по методике, аналогично описанной в примере 9, получая указанное в заголовке соединение в виде светло-желтого аморфного вещества.
Выход 350 мг (31%).
Пример получения 176
Синтез дигидрохлорида 4-[N-(3,4-дифторфенил)-N-[[3-(3,4,5-триметоксифенил)пиридин-5-ил]метил]амино]пиперидина
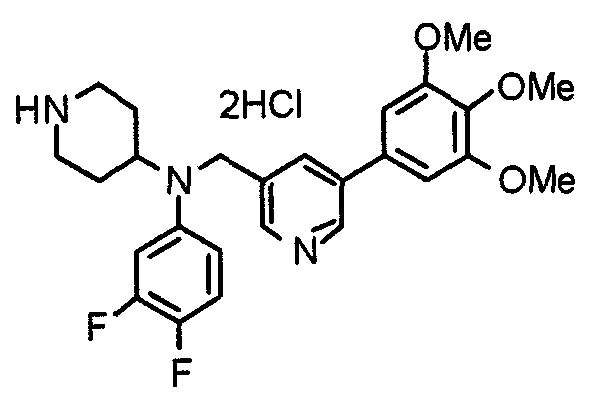
1-(трет-Бутоксикарбонил)-4-[N-(3,4-дифторфенил)-N-[[3-(3,4,5-триметоксифенил)пиридин-5-ил]метил]амино]пиперидин (350 мг) обрабатывают по методике, аналогично описанной в примере получения 94, получая указанное в заголовке соединение в виде светло-желтого порошка.
Выход 305 мг (92%).
Пример получения 177
Синтез 1-(трет-бутоксикарбонил)-4-[N-(3,4-дифторфенил)-N-[3-(3,4,5-триметоксифенил)бензил]амино]пиперидина
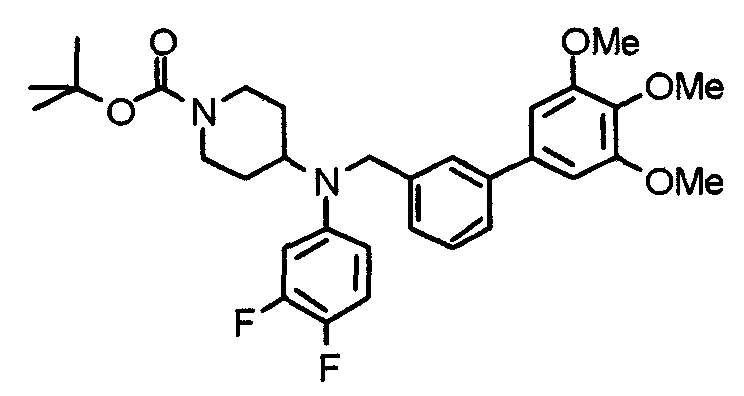
1-(трет-Бутоксикарбонил)-4-[(3,4-дифторфенил)амино]пиперидин (625 мг) подвергают взаимодействию с 3-(3,4,5-триметоксифенил)бензилхлоридом (586 мг) по методике, аналогично описанной в примере 9, получая указанное в заголовке соединение в виде светло-желтого аморфного вещества.
Выход 1,04 г (92%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,45 (с, 9H), 1,52-1,66 (м, 2H), 1,81-1,89 (м, 2H), 2,72-2,85 (м, 2H), 3,78 (тт, 1H, J=11,8 Гц, 3,8 Гц), 3,88 (с, 3H), 3,90 (с, 6H), 4,12-4,30 (м, 2H), 4,45 (с, 2H), 6,36-6,42 (м, 1H), 6,54 (ддд, 1H, J=13,9 Гц, 6,8 Гц, 2,9 Гц), 6,71 (с, 2H), 6,95 (дд, 1H, J=19,2 Гц, 9,2 Гц), 7,20 (д, 1H, J=7,4 Гц), 7,36-7,43 (м, 3H).
Пример получения 178
Синтез гидрохлорида 4-[N-(3,4-дифторфенил)-N-[3-(3,4,5-триметоксифенил)бензил]амино]пиперидина
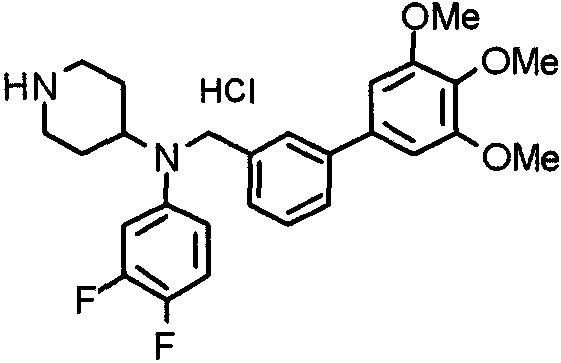
1-(трет-Бутоксикарбонил)-4-[(3,4-дифторфенил)-N-[3-(3,4,5-триметоксифенил)бензил]амино]пиперидин (980 мг) обрабатывают по методике, аналогично описанной в примере получения 94, получая указанное в заголовке соединение в виде светло-желтого порошка.
Выход 819 мг (94%).
Примеры 149-156
Указанные соединения получают взаимодействием аминов, полученных в примерах получения 174, 176 и 178, с производными хлорида, полученными в примерах получения 3, 42 и 48. Полученные свободные основания затем превращают в соответствующие гидрохлориды. Выходы и данные ЯМР их свободных оснований указаны ниже.
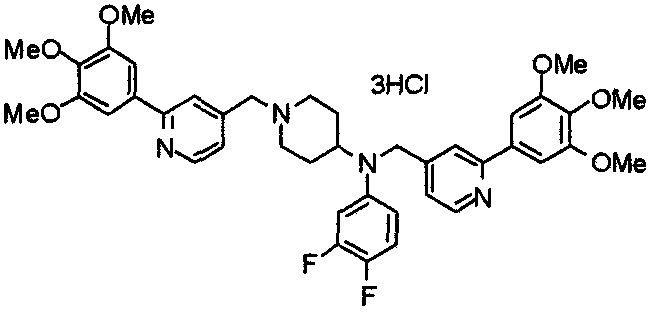
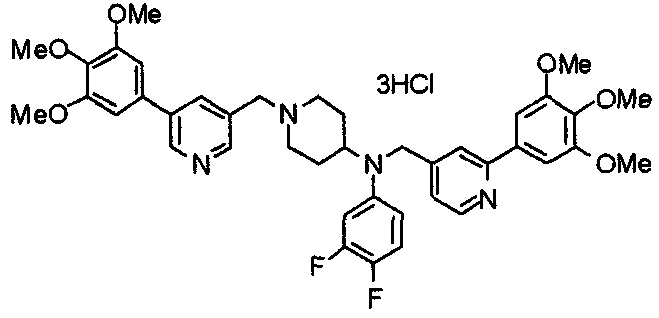
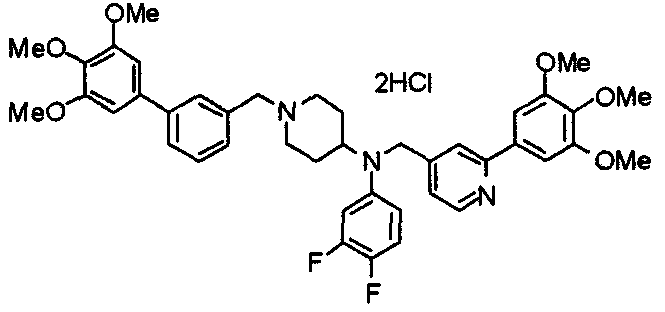
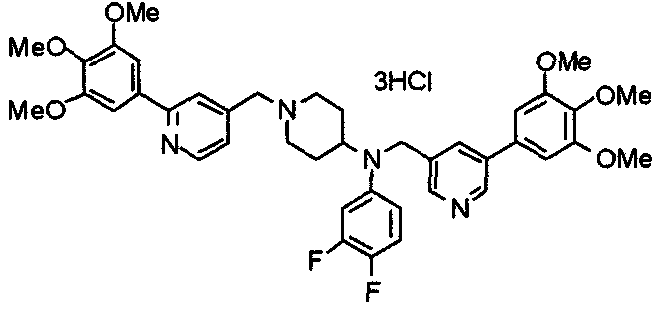
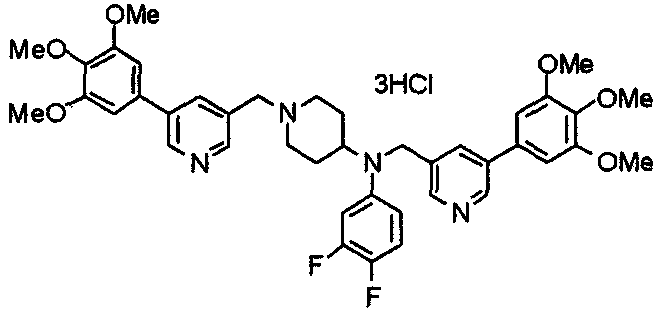
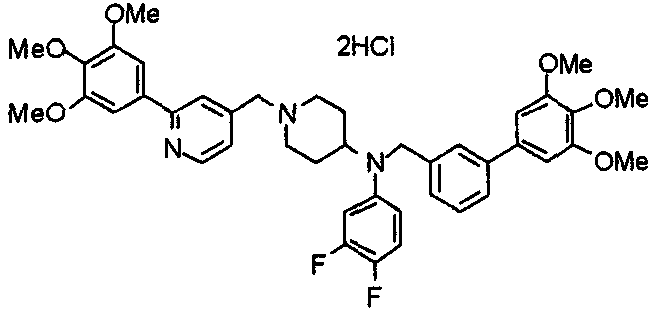
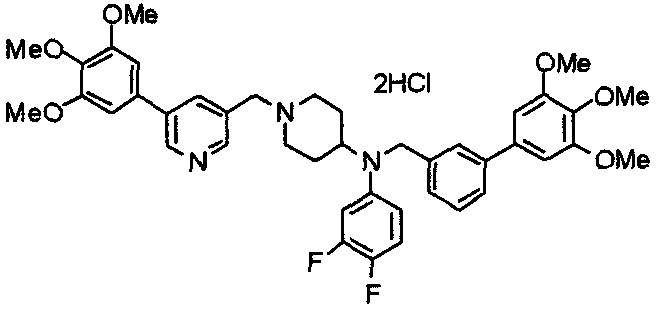
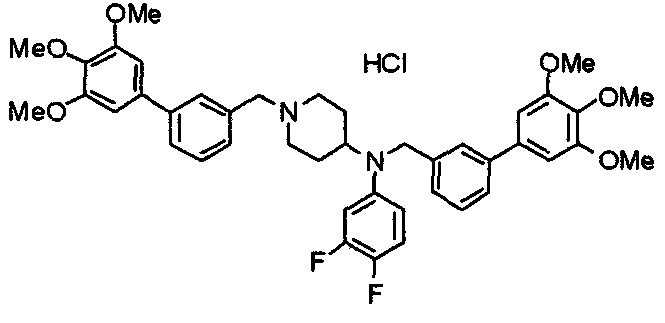
Пример получения 179
Синтез 1-(трет-бутоксикарбонил)-4-[(4-фторфенил)амино]пиперидина
1-(трет-Бутоксикарбонил)-4-пиперидон (5,00 г) подвергают взаимодействию с 4-фторанилином (2,66 г) по методике, аналогично описанной в примере получения 37, получая указанное в заголовке соединение в виде белого порошка.
Выход 4,99 г (71%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,23-1,36 (м, 2H), 1,46 (с, 9H), 1,97-2,05 (м, 2H), 2,84-2,96 (м, 2H), 3,30-3,39 (м, 2H), 3,96-4,14 (м, 2H), 6,51-6,57 (м, 2H), 6,84-6,91 (м, 2H).
Пример получения 180
Синтез 1-(трет-бутоксикарбонил)-4-[N-(4-фторфенил)-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]пиперидина
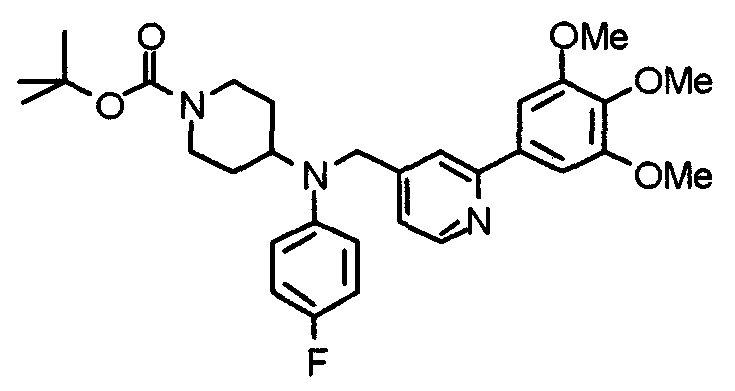
1-(трет-Бутоксикарбонил)-4-[(4-фторфенил)амино]пиперидин (589 мг) и 4-хлорметил-2-(3,4,5-триметоксифенил)пиридин (588 мг) обрабатывают по методике, аналогично описанной в примере 9, получая указанное в заголовке соединение в виде светло-желтого аморфного вещества.
Выход 702 мг (64%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,45 (с, 9H), 1,48-1,64 (м, 2H), 1,81-1,90 (м, 2H), 2,72-2,85 (м, 2H), 3,69-3,98 (м, 1H), 3,89 (м, 3H), 3,94 (м, 6H), 4,16-4,28 (м, 2H), 4,43 (с, 2H), 6,66-6,73 (м, 2H), 6,91 (дд, 2H, J=9,2 Гц, 9,2 Гц), 7,12-7,16 (м, 3H), 7,53 (с, 1H).
Пример получения 181
Синтез дигидрохлорида 4-[N-(4-фторфенил)-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]пиперидина
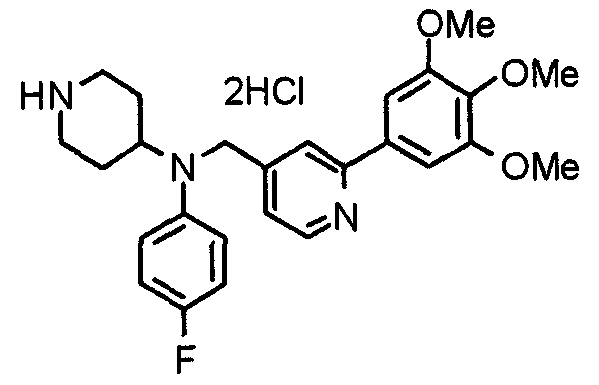
1-(трет-Бутоксикарбонил)-4-[N-(4-фторфенил)-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]пиперидин (702 мг) обрабатывают по методике, аналогично описанной в примере получения 94, получая указанное в заголовке соединение в виде светло-желтого порошка.
Выход 561 мг (84%).
Пример получения 182
Синтез 1-(трет-бутоксикарбонил)-4-[N-(4-фторфенил)-N-[[3-(3,4,5-триметоксифенил)пиридин-5-ил]метил]амино]пиперидина
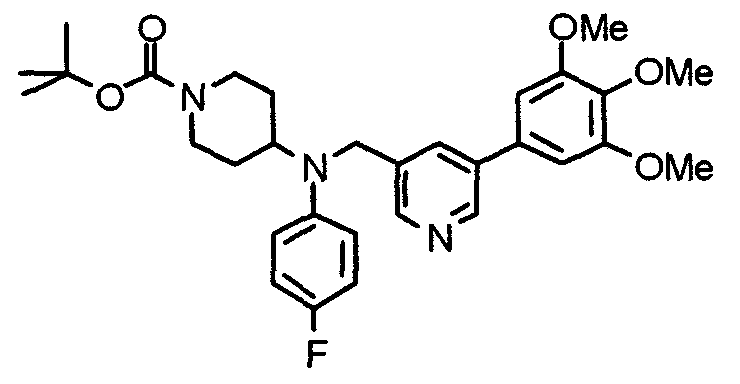
1-(трет-Бутоксикарбонил)-4-[(4-фторфенил)амино]пиперидин (589 мг) и 5-хлорметил-3-(3,4,5-триметоксифенил)пиридин (588 мг) обрабатывают по методике, аналогично описанной в примере 9, получая указанное в заголовке соединение в виде светло-желтого аморфного вещества.
Выход 190 мг (17%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,45 (с, 9H), 1,50-1,73 (м, 2H), 1,82-1,90 (м, 2H), 2,71-2,85 (м, 2H), 3,71 (тт, 1H, J=11,7 Гц, 3,1 Гц), 3,89 (с, 3H), 3,90 (с, 6H), 4,12-4,30 (м, 2H), 4,45 (с, 2H), 6,66 (с, 2H), 6,73-6,78 (м, 2H), 6,91 (дд, 2H, J=9,2 Гц, 8,2 Гц), 7,65 (с, 1H), 8,49 (д, 1H, J=2,0 Гц), 8,65 (д, 1H, J=2,0 Гц).
Пример получения 183
Синтез дигидрохлорида 4-[N-(4-фторфенил)-N-[[3-(3,4,5-триметоксифенил)пиридин-5-ил]метил]амино]пиперидина
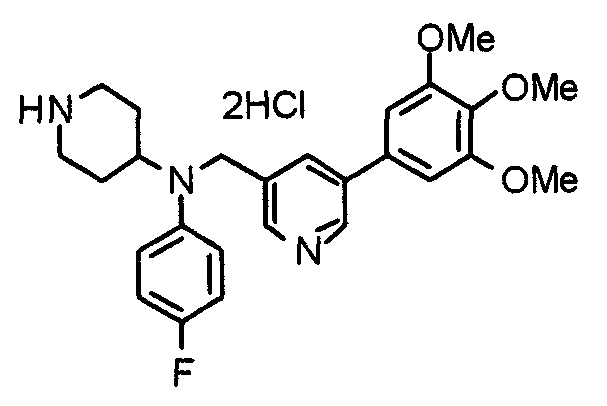
1-(трет-Бутоксикарбонил)-4-[N-(4-фторфенил)-N-[[3-(3,4,5-триметоксифенил)пиридин-5-ил]метил]амино]пиперидин (190 мг) обрабатывают по методике, аналогично описанной в примере получения 94, получая указанное в заголовке соединение в виде светло-желтого порошка.
Выход 165 мг (91%).
Пример получения 184
Синтез 1-(трет-бутоксикарбонил)-4-[N-(4-фторфенил)-N-[3-(3,4,5-триметоксифенил)бензил]амино]пиперидина

1-(трет-Бутоксикарбонил)-4-[(4-фторфенил)амино]пиперидин (589 мг) подвергают взаимодействию с 3-(3,4,5-триметоксифенил)бензилхлоридом (586 мг) по методике, аналогично описанной в примере 9, получая указанное в заголовке соединение в виде светло-желтого аморфного вещества.
Выход 1,01 г (92%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,44 (с, 9H), 1,51-1,65 (м, 2H), 1,82-1,90 (м, 2H), 2,82-2,84 (м, 2H), 3,78 (тт, 1H, J=11,7 Гц, 3,5 Гц), 3,88 (с, 3H), 3,90 (с, 6H), 4,10-4,30 (м, 2H), 4,45 (с, 2H), 6,68-6,73 (м, 4H), 6,89 (дд, 2H, J=9,2 Гц, 8,2 Гц), 7,21-7,25 (м, 1H), 7,32-7,41 (м, 3H).
Пример получения 185
Синтез гидрохлорида 4-[N-(4-фторфенил)-N-[3-(3,4,5-триметоксифенил)бензил]амино]пиперидина
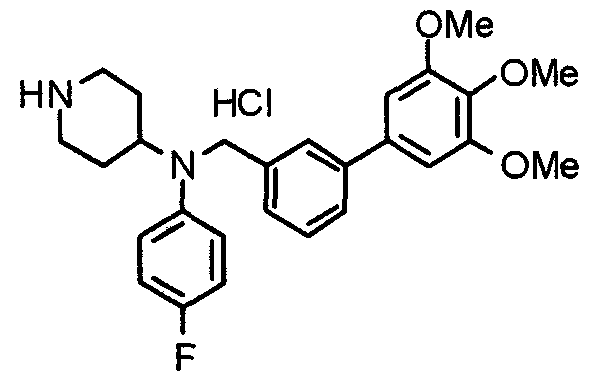
1-(трет-Бутоксикарбонил)-4-[N-(4-фторфенил)-N-[3-(3,4,5-триметоксифенил)бензил]амино]пиперидин (1,01 г) обрабатывают по методике, аналогично описанной в примере получения 94, получая указанное в заголовке соединение в виде светло-желтого порошка.
Выход 790 мг (88%).
Примеры 157-164
Указанные соединения получают взаимодействием аминов, полученных в примерах получения 181, 183 и 185, с производными хлорида, полученными в примерах получения 3, 42 и 48. Полученные свободные основания затем превращают в соответствующие гидрохлориды. Выходы и данные ЯМР их свободных оснований указаны ниже.
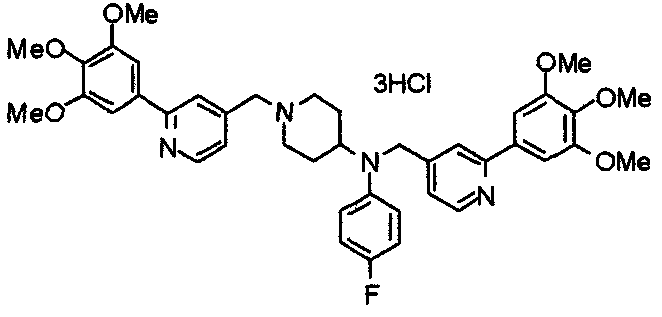
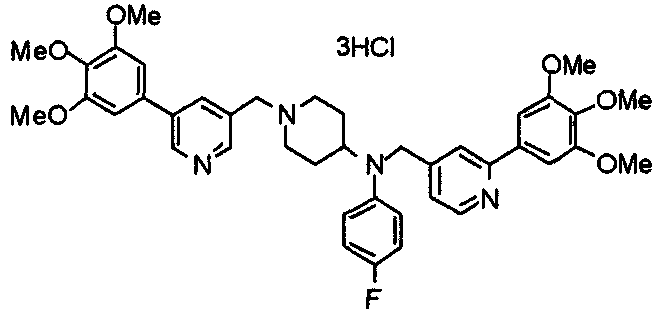
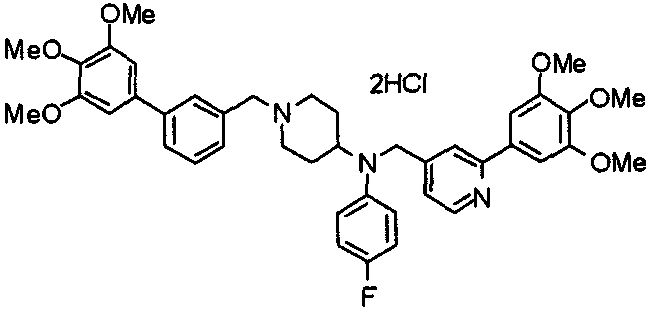
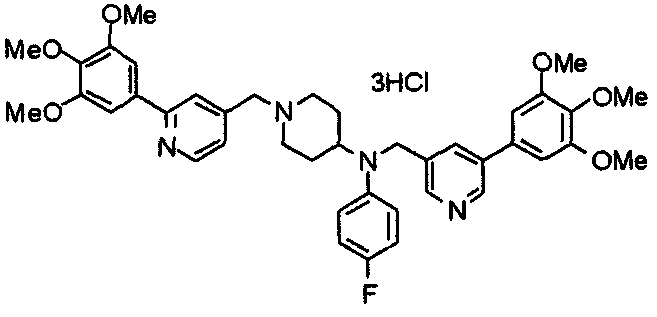
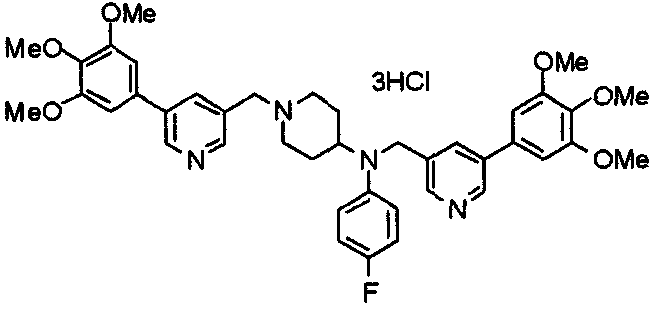
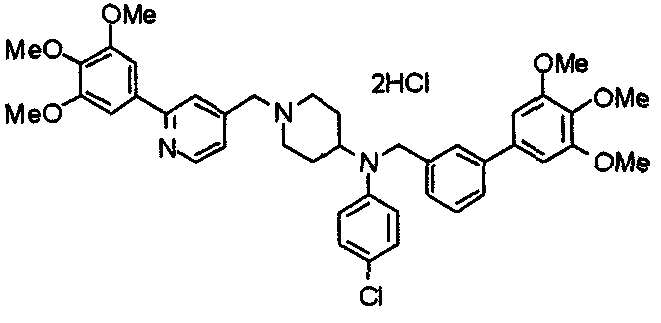
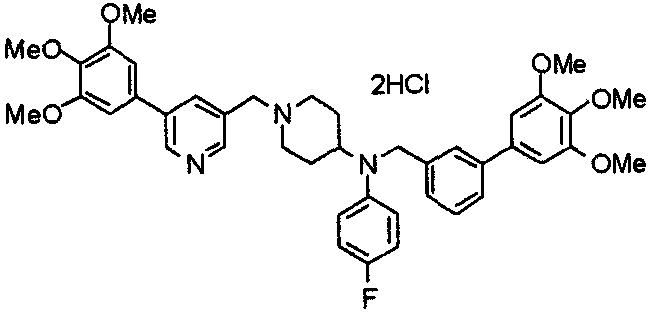
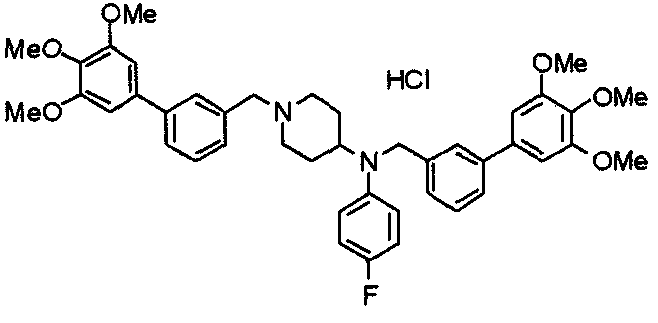
Пример получения 186
Синтез 1-(трет-бутоксикарбонил)-4-фениламинопиперидина
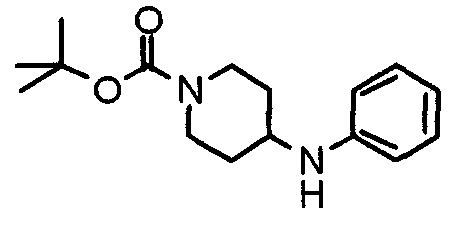
1-(трет-Бутоксикарбонил)-4-пиперидон (5,00 г) подвергают взаимодействию с анилином (2,23 г) по методике, аналогично описанной в примере получения 37, получая указанное в заголовке соединение в виде белого порошка.
Выход 3,77 г (57%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,25-1,38 (м, 2H), 1,47 (с, 9H), 2,00-2,07 (м, 2H), 2,87-2,97 (м, 2H), 3,38-3,53 (м, 2H), 3,96-4,14 (м, 2H), 6,57-6,52 (м, 2H), 6,70 (тт, 1H, J=6,2 Гц, 1,0 Гц), 7,17 (дд, 2H, J=8,6 Гц, 7,2 Гц).
Пример получения 187
Синтез 1-(трет-бутоксикарбонил)-4-[N-фенил-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]пиперидина
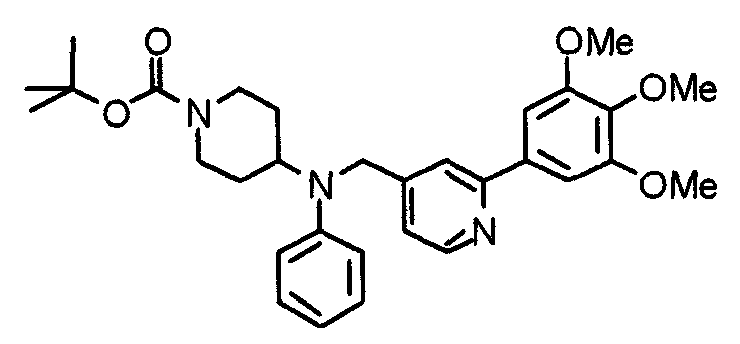
1-(трет-Бутоксикарбонил)-4-фениламинопиперидин (553 мг) и 4-хлорметил-2-(3,4,5-триметоксифенил)пиридин (588 мг) обрабатывают по методике, аналогично описанной в примере 9, получая указанное в заголовке соединение в виде светло-желтого аморфного вещества.
Выход 760 мг (71%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,45 (с, 9H), 1,53-1,63 (м, 2H), 1,83-1,91 (м, 2H), 2,76-2,90 (м, 2H), 3,86-3,97 (м, 1H), 3,89 (с, 3H), 3,93 (с, 6H), 4,14-4,32 (м, 2H), 4,49 (с, 2H), 6,71-6,78 (м, 3H), 7,14 (с, 1H), 7,15 (с, 2H), 7,21 (дд, 2H, J=8,8 Гц, 7,4 Гц), 7,55 (с, 1H), 8,56 (д, 1H, J=5,1 Гц).
Пример получения 188
Синтез дигидрохлорида 4-[N-фенил]-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]пиперидина
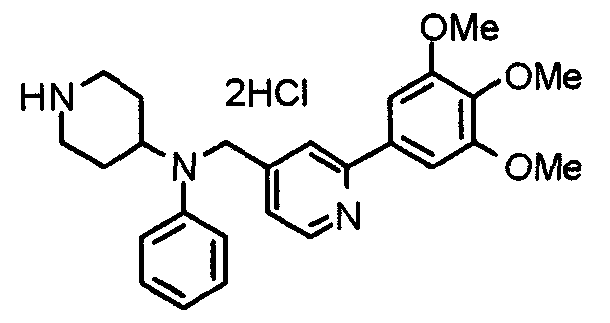
1-(трет-Бутоксикарбонил)-4-[N-фенил-N-[[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]амино]пиперидин (760 мг) обрабатывают по методике, аналогично описанной в примере получения 94, получая указанное в заголовке соединение в виде светло-желтого порошка.
Выход 652 мг (90%).
Пример получения 189
Синтез 1-(трет-бутоксикарбонил)-4-[N-фенил-N-[[3-(3,4,5-триметоксифенил)пиридин-5-ил]метил]амино]пиперидина
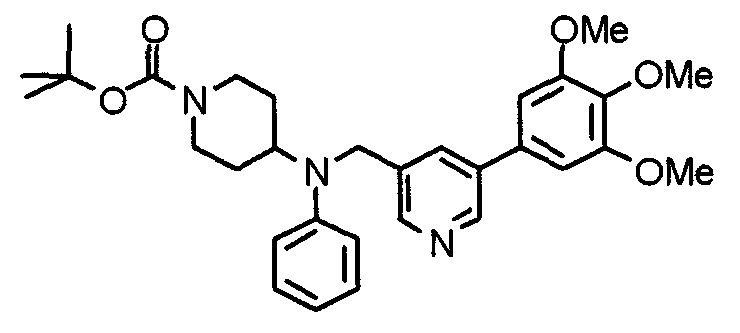
1-(трет-Бутоксикарбонил)-4-N-фениламинопиперидин (553 мг) и 5-хлорметил-3-(3,4,5-триметоксифенил)пиридин (588 мг) обрабатывают по методике, аналогично описанной в примере 9, получая указанное в заголовке соединение в виде светло-желтого аморфного вещества.
Выход 222 мг (21%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,45 (с, 9H), 1,52-1,67 (м, 2H), 1,82-1,91 (м, 2H), 2,74-2,87 (м, 2H), 3,88-3,90 (м, 1H), 3,88 (с, 3H), 3,89 (с, 6H), 4,14-4,31 (м, 2H), 4,53 (с, 2H), 6,67 (с, 2H), 6,74-6,80 (м, 3H), 7,21 (дд, 2H, J=8,8 Гц, 7,2 Гц), 7,67 (с, 1H), 8,50 (д, 1H, J=5,3 Гц, 2,2 Гц), 8,66 (д, 1H, J=2,1 Гц).
Пример получения 190
Синтез дигидрохлорида 4-[N-фенил-N-[[3-(3,4,5-триметоксифенил)пиридин-5-ил]метил]амино]пиперидин
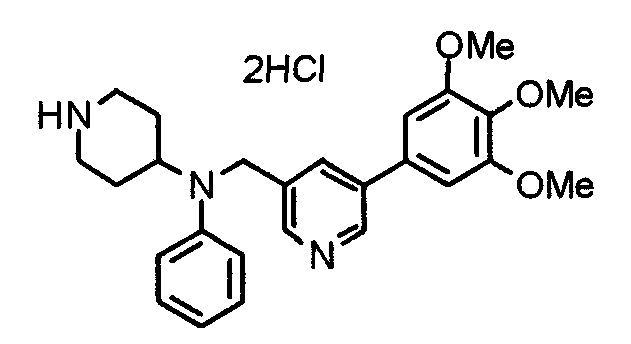
1-(трет-Бутоксикарбонил)-4-[N-фенил-N-[[3-(3,4,5-триметоксифенил)пиридин-5-ил]метил]амино]пиперидин (222 мг) обрабатывают по методике, аналогично описанной в примере получения 94, получая указанное в заголовке соединение в виде светло-желтого порошка.
Выход 197 мг (94%).
Пример получения 191
Синтез 1-(трет-бутоксикарбонил)-4-[N-фенил-N-[3-(3,4,5-триметоксифенил)бензил]амино]пиперидина
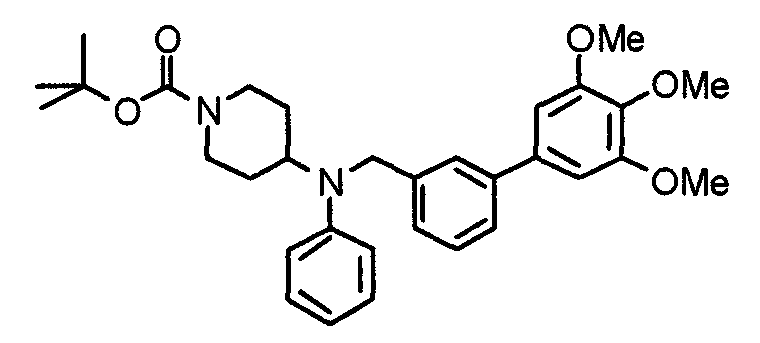
1-(трет-Бутоксикарбонил)-4-фениламинопиперидин (553 мг) подвергают взаимодействию с 3-(3,4,5-триметоксифенил)бензилхлоридом (586 мг) по методике, аналогично описанной в примере 9, получая указанное в заголовке соединение в виде светло-желтого аморфного вещества.
Выход 1,06 г (100%).
1H-ЯМР (400 МГц, CDCl3) δ: 1,45 (с, 9H), 1,52-1,68 (м, 2H), 1,83-1,92 (м, 2H), 2,73-2,86 (м, 2H), 3,88 (с, 3H), 3,89 (с, 6H), 3,94 (тт, 1H, J=11,7 Гц, 3,3 Гц), 4,14-4,30 (м, 2H), 4,52 (с, 2H), 6,69-6,78 (м, 6H), 7,17-7,27 (м, 2H), 7,32-7,42 (м, 3H).
Пример получения 192
Синтез гидрохлорида 4-[N-фенил-N-[3-(3,4,5-триметоксифенил)бензил]амино]пиперидина
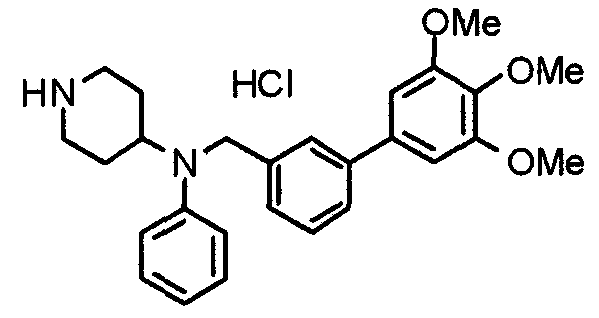
1-(трет-Бутоксикарбонил)-4-[N-фенил-N-[3-(3,4,5-триметоксифенил)бензил]амино]пиперидин (1,06 г) обрабатывают по методике, аналогично описанной в примере получения 94, получая указанное в заголовке соединение в виде светло-желтого порошка.
Выход 909 мг (97%).
Примеры 165-169
Указанные соединения получают взаимодействием аминов, полученных в примерах получения 188, 190 и 192, с производными хлорида, полученными в примерах получения 3 и 48. Полученные свободные основания затем превращают в соответствующие гидрохлориды. Выходы и данные ЯМР их свободных оснований указаны ниже.
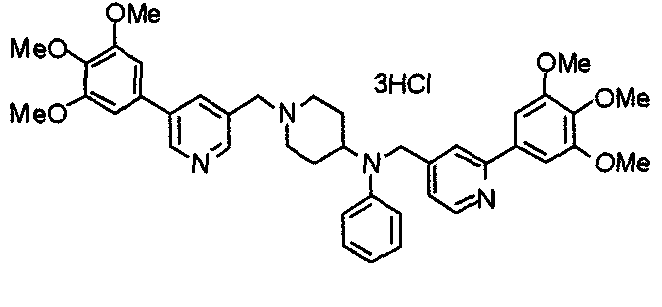
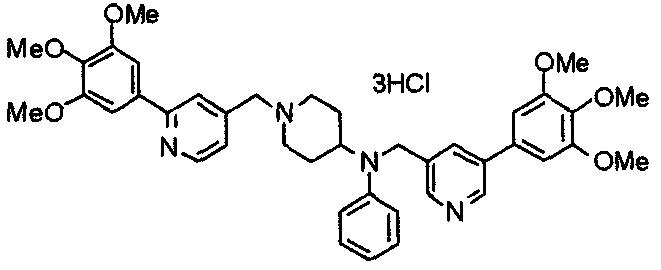
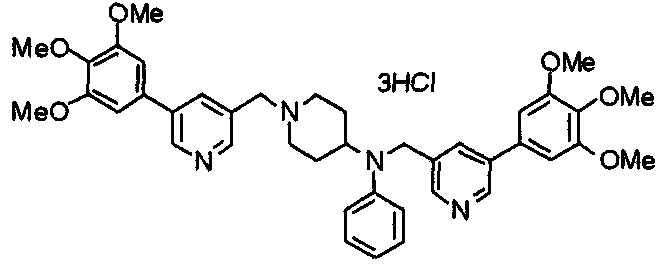
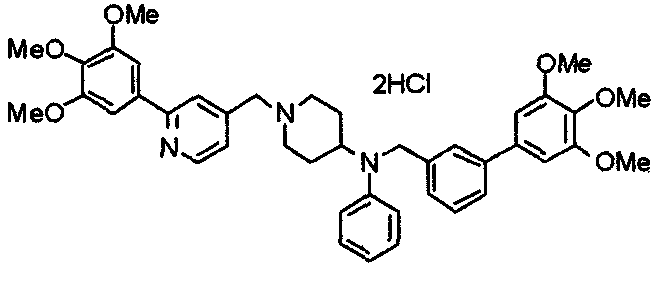
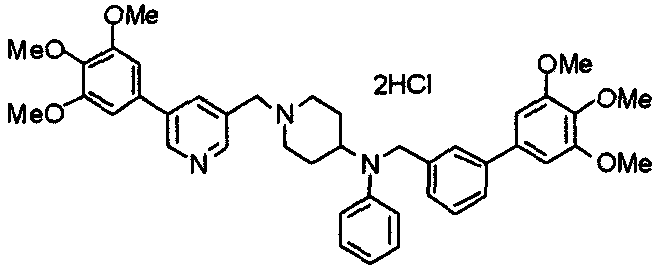
Примеры получения 193-203
Указанные соединения получают, используя методику, описанную в примерах получения 1-3. Структуры и данные ЯМР указаны ниже.
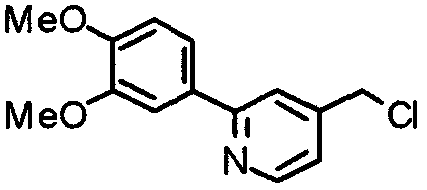
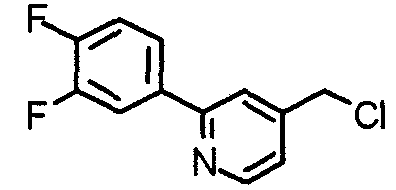
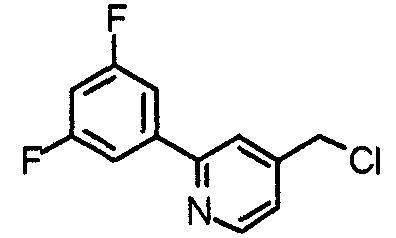
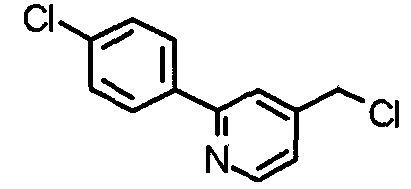
Пример получения 204
Синтез 1-(трет-бутоксикарбонил)-4-[N-(4-метоксифенил)-N-[(2-фенилпиридин-4-ил)метил]амино]пиперидина
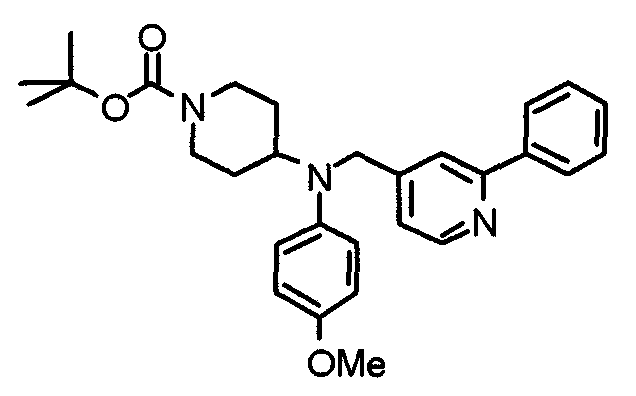
4-(п-Анизидино)-1-(трет-бутоксикарбонил)пиперидин (612 мг) подвергают взаимодействию с 4-хлорметил-2-фенилпиридином (204 мг) по методике, аналогично описанной в примере 9, получая указанное в заголовке соединение.
Выход 407 мг (43%).
Пример получения 205
Синтез дигидрохлорида 4-[N-(4-метоксифенил)-N-[(2-фенилпиридин-4-ил)метил]амино]пиперидина
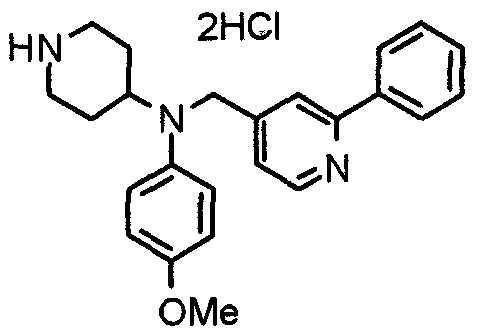
1-(трет-Бутоксикарбонил)-4-[N-(4-метоксифенил)-N-[(2-фенилпиридин-4-ил]метил]амино]пиперидин (407 мг) обрабатывают по методике, аналогично описанной в примере получения 94, получая указанное в заголовке соединение.
Выход 365 мг (95%).
Пример получения 206
Синтез 1-(трет-бутоксикарбонил)-4-[N-(4-метоксифенил)-N-[[2-(2-метоксифенил)пиридин-4-ил]метил]амино]пиперидина
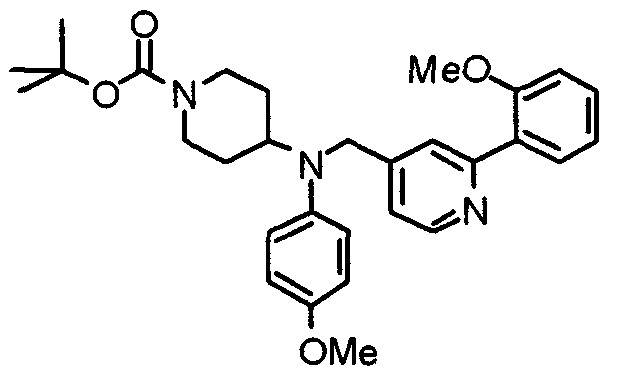
4-(п-Анизидино)-1-(трет-бутоксикарбонил)пиперидин (306 мг) подвергают взаимодействию с 4-хлорметил-2-(2-метоксифенил)пиридином (234 мг) по методике, аналогично описанной в примере 9, получая указанное в заголовке соединение.
Выход 237 мг (72%).
Пример получения 207
Синтез дигидрохлорида 4-[N-(4-метоксифенил)-N-[[2-(2-метоксифенил)пиридин-4-ил]метил]амино]пиперидина
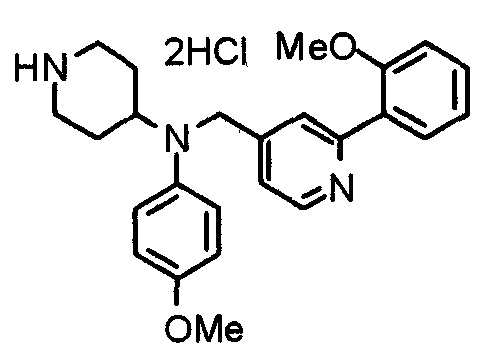
1-(трет-Бутоксикарбонил)-4-[N-(4-метоксифенил)-N-[[2-(2-метоксифенил)пиридин-4-ил]метил]амино]пиперидин (360 мг) обрабатывают по методике, аналогично описанной в примере получения 94, получая указанное в заголовке соединение.
Выход 365 мг (65%).
Пример получения 208
Синтез 1-(трет-бутоксикарбонил)-4-[N-(4-метоксифенил)-N-[[2-(3-метоксифенил)пиридин-4-ил]метил]амино]пиперидина
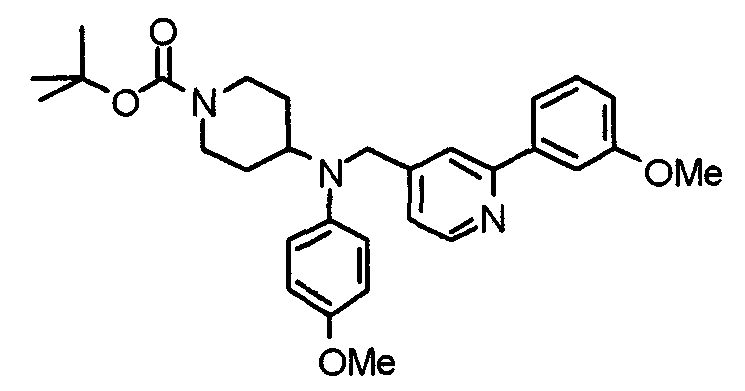
4-(п-Анизидино)-1-(трет-бутоксикарбонил)пиперидин (306 мг) подвергают взаимодействию с 4-хлорметил-2-(3-метоксифенил)пиридином (234 мг) и затем конденсируют по методике, аналогично описанной в примере 9, получая указанное в заголовке соединение.
Выход 550 мг (теоретический выход).
Пример получения 209
Синтез дигидрохлорида 4-[N-(4-метоксифенил)-N-[[2-(3-метоксифенил)пиридин-4-ил]метил]амино]пиперидина
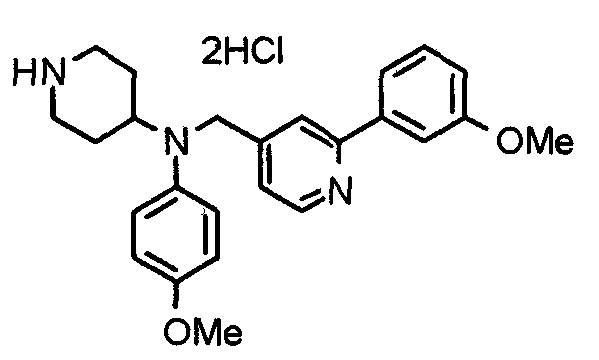
1-(трет-Бутоксикарбонил)-4-[N-(4-метоксифенил)-N-[[2-(3-метоксифенил)пиридин-4-ил]метил]амино]пиперидин (550 мг) обрабатывают по методике, аналогично описанной в примере получения 94, получая указанное в заголовке соединение.
Выход 436 г (85%).
Пример получения 210
Синтез 1-(трет-бутоксикарбонил)-4-[N-[[2-(4-этоксифенил)пиридин-4-ил]метил]-N-(4-метоксифенил)амино]пиперидина
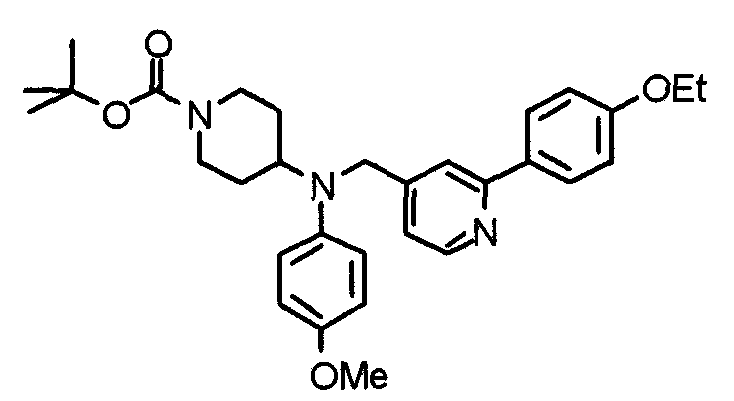
4-(п-Анизидино)-1-(трет-бутоксикарбонил)пиперидин (306 мг) подвергают взаимодействию с 4-хлорметил-2-(4-этоксифенил)пиридином (248 мг) по методике, аналогично описанной в примере 9, получая указанное в заголовке соединение.
Выход 515 мг (99%).
Пример получения 211
Синтез дигидрохлорида 4-[N-[[2-(4-этоксифенил)пиридин-4-ил]метил]-N-(4-метоксифенил)амино]пиперидина
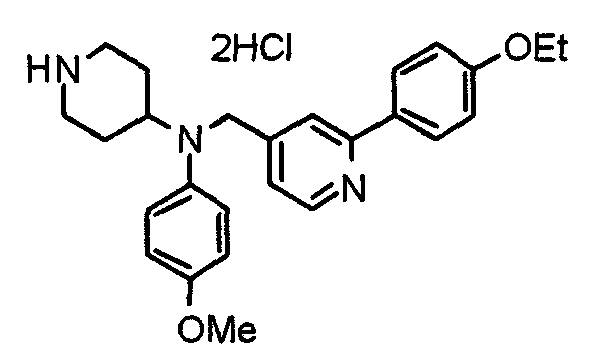
1-(трет-Бутоксикарбонил)-4-[N-[2-(4-этоксифенил)пиридин-4-ил]метил-N-(4-метоксифенил)амино]пиперидин (515 мг) обрабатывают по методике, аналогично описанной в примере получения 94, получая указанное в заголовке соединение.
Выход 418 мг (80%).
Пример получения 212
Синтез 1-(трет-бутоксикарбонил)-4-[N-[[2-(3,4-диметоксифенил)пиридин-4-ил]метил]-[N-(4-метоксифенил)амино]пиперидина
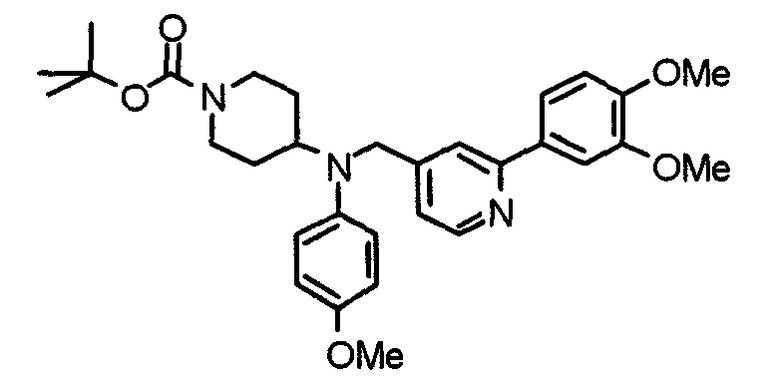
4-(п-Анизидино)-1-(трет-бутоксикарбонил)пиперидин (306 мг) подвергают взаимодействию с 4-хлорметил-2-(3,4-диметоксифенил)пиридином (264 мг) по методике, аналогично описанной в примере 9, получая указанное в заголовке соединение.
Выход 600 мг (теоретический выход).
Пример получения 213
Синтез дигидрохлорида 4-[N-[[2-(3,4-диметоксифенил)пиридин-4-ил]метил]-N-(4-метоксифенил)амино]пиперидина
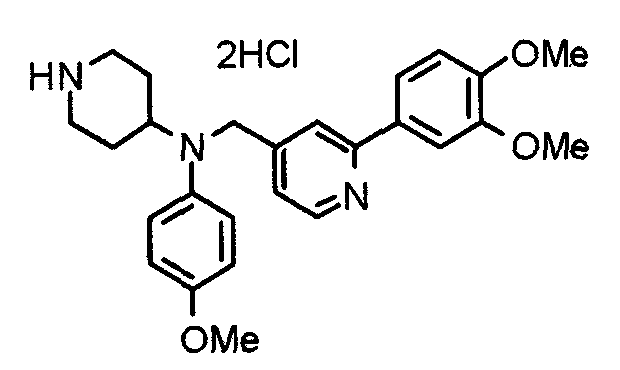
1-(трет-Бутоксикарбонил)-4-[N-[[2-(3,4-диметоксифенил)пиридин-4-ил]метил]-N-(4-метоксифенил)амино]пиперидин (600 мг) обрабатывают по методике, аналогично описанной в примере получения 94, получая указанное в заголовке соединение.
Выход 416 мг (77%).
Пример получения 214
Синтез 1-(трет-бутоксикарбонил)-4-[N-[[2-(2-фторфенил)пиридин-4-ил]метил]-[N-(4-метоксифенил)амино]пиперидина
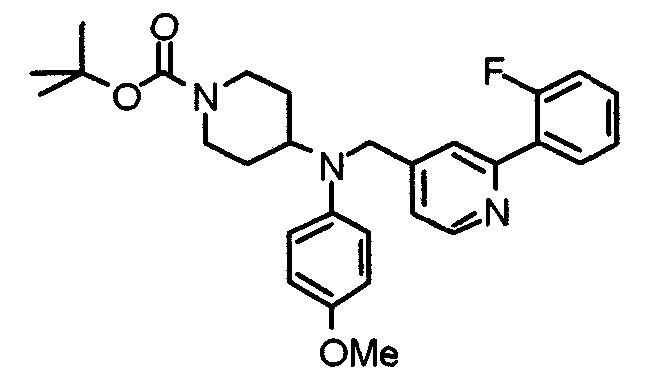
4-(п-Анизидино)-(трет-бутоксикарбонил)пиперидин (306 мг) подвергают взаимодействию с 4-хлорметил-2-(2-фторфенил)пиридином (222 мг) по методике, аналогично описанной в примере 9, получая указанное в заголовке соединение.
Выход 530 мг (теоретический выход).
Пример получения 215
Синтез дигидрохлорида 4-[N-[[2-(2-фторфенил)пиридин-4-ил]метил]-N-(4-метоксифенил)амино]пиперидина
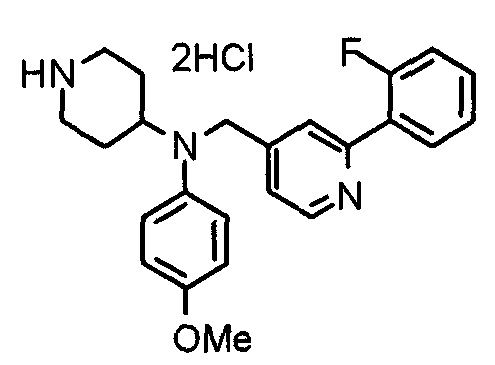
1-(трет-Бутоксикарбонил)-4-[N-[[2-(2-фторфенил)пиридин-4-ил]метил]-N-(4-метоксифенил)амино]пиперидин (530 мг) обрабатывают по методике, аналогично описанной в примере получения 94, получая указанное в заголовке соединение.
Выход 423 мг (85%).
Пример получения 216
Синтез 1-(трет-бутоксикарбонил)-4-[N-[[2-(3-фторфенил)пиридин-4-ил]метил]-N-(4-метоксифенил)амино]пиперидина
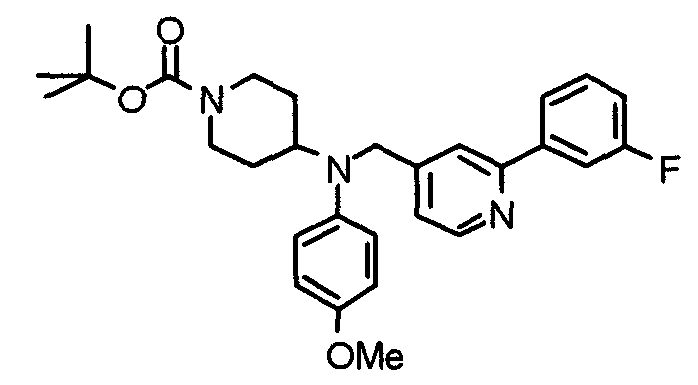
4-(п-Анизидино)-1-(трет-бутоксикарбонил)пиперидин (153 мг) подвергают взаимодействию с 4-хлорметил-2-(3-фторфенил)пиридином (111 мг) по методике, аналогично описанной в примере 9, получая указанное в заголовке соединение.
Выход 270 мг (теоретический выход).
Пример получения 217
Синтез дигидрохлорида 4-[N-[[2-(3-фторфенил)пиридин-4-ил]метил]-N-(4-метоксифенил)амино]пиперидина
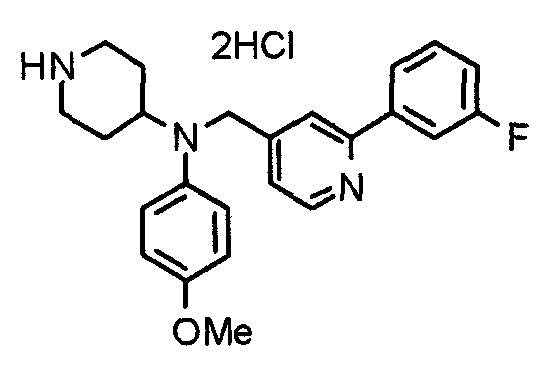
1-(трет-Бутоксикарбонил)-4-[N-[[2-(3-фторфенил)пиридин-4-ил]метил]-N-(4-метоксифенил)амино]пиперидин (270 мг) обрабатывают по методике, аналогично описанной в примере получения 94, получая указанное в заголовке соединение.
Выход 193 мг (70%).
Пример получения 218
Синтез 1-(трет-бутоксикарбонил)-4-[N-[[2-(4-фторфенил)пиридин-4-ил]метил]-N-(4-метоксифенил)амино]пиперидина
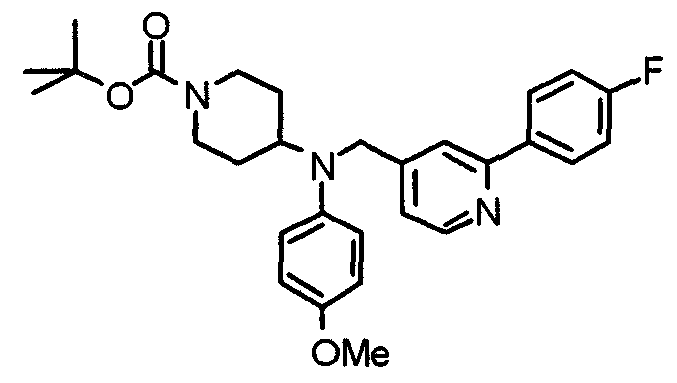
4-(п-Анизидино)-1-(трет-бутоксикарбонил)пиперидин (306 мг) подвергают взаимодействию с 4-хлорметил-2-(4-фторфенил)пиридином (222 мг) по методике, аналогично описанной в примере 9, получая указанное в заголовке соединение.
Выход 550 мг (теоретический выход).
Пример получения 219
Синтез дигидрохлорида 4-[N-[[2-(4-фторфенил)пиридин-4-ил]метил]-N-(4-метоксифенил)амино]пиперидина
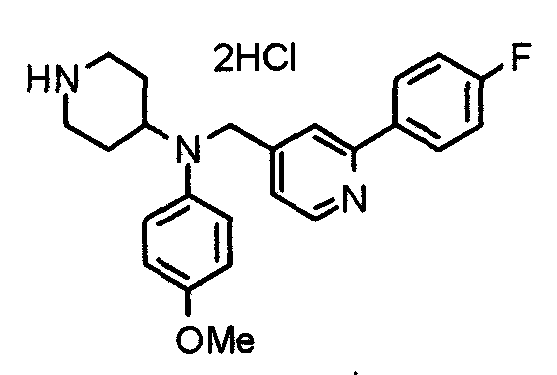
1-(трет-Бутоксикарбонил)-4-[N-[[2-(4-фторфенил)пиридин-4-ил]метил]-N-(4-метоксифенил)амино]пиперидин (550 мг) обрабатывают по методике, аналогично описанной в примере получения 94, получая указанное в заголовке соединение.
Выход 439 мг (88%).
Пример получения 220
Синтез 1-(трет-бутоксикарбонил)-4-[N-[[2-(3,4-дифторфенил)пиридин-4-ил]метил]-N-(4-метоксифенил)амино]пиперидина
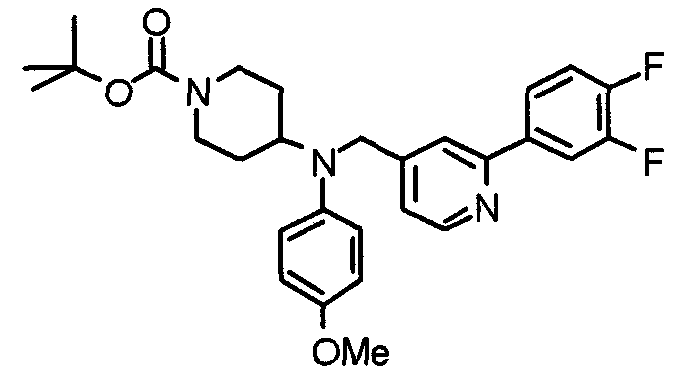
4-(п-Анизидино)-1-(трет-бутоксикарбонил)пиперидин (306 мг) подвергают взаимодействию с 4-хлорметил-2-(3,4-дифторфенил)пиридином (240 мг) по методике, аналогично описанной в примере 9, получая указанное в заголовке соединение.
Выход 590 мг (теоретический выход).
Пример получения 221
Синтез дигидрохлорида 4-[N-[[2-(3,4-дифторфенил)пиридин-4-ил]метил]-N-(4-метоксифенил)амино]пиперидина
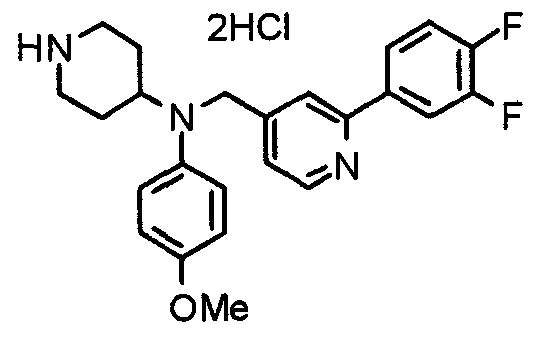
1-(трет-Бутоксикарбонил)-4-[N-[[2-(3,4-дифторфенил)пиридин-4-ил]метил]-N-(4-метоксифенил)амино]пиперидин (590 мг) обрабатывают по методике, аналогично описанной в примере получения 94, получая указанное в заголовке соединение.
Выход 483 мг (93%).
Пример получения 222
Синтез 1-(трет-бутоксикарбонил)-4-[N-[[2-(3,5-дифторфенил)пиридин-4-ил]метил]-N-(4-метоксифенил)амино]пиперидина
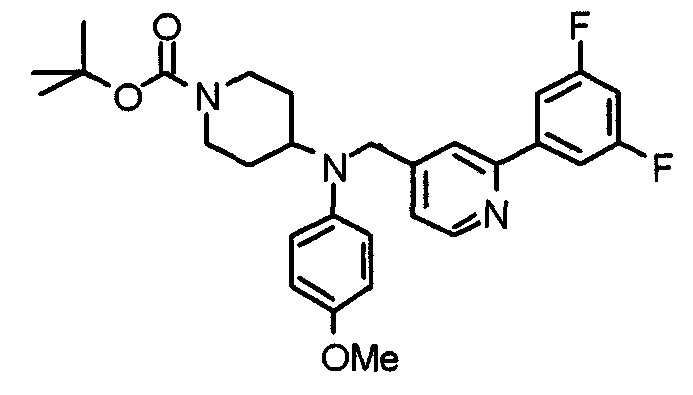
4-(п-Анизидино)-1-(трет-бутоксикарбонил)пиперидин (306 мг) подвергают взаимодействию с 4-хлорметил-2-(3,5-дифторфенил)пиридином (240 мг) по методике, аналогично описанной в примере 9, получая указанное в заголовке соединение.
Выход 530 мг (теоретический выход).
Пример получения 223
Синтез дигидрохлорида 4-[N-[[2-(3,5-дифторфенил)пиридин-4-ил]метил]-N-(4-метоксифенил)амино]пиперидина
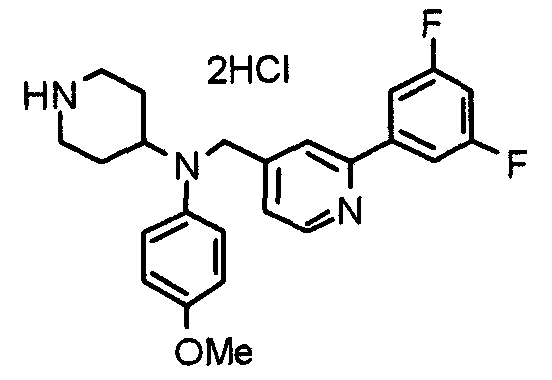
1-(трет-Бутоксикарбонил)-4-[N-[[2-(3,5-дифторфенил)пиридин-4-ил]метил]-N-(4-метоксифенил)амино]пиперидин (530 мг) обрабатывают по методике, аналогично описанной в примере получения 94, получая указанное в заголовке соединение.
Выход 418 мг (81%).
Пример получения 224
Синтез 1-(трет-бутоксикарбонил)-4-[N-[[2-(4-хлорфенил)пиридин-4-ил]метил]-[N-(4-метоксифенил)амино]пиперидина
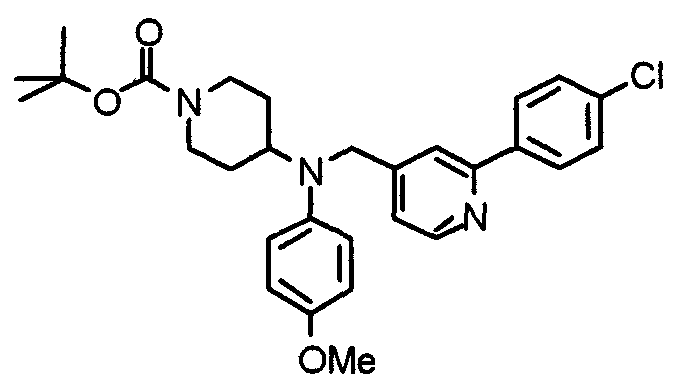
4-(п-Анизидино)-1-(трет-бутоксикарбонил)пиперидин (306 мг) подвергают взаимодействию с 4-хлорметил-2-(4-хлорфенил)пиридином (238 мг) по методике, аналогично описанной в примере 9, получая указанное в заголовке соединение.
Выход 600 мг (теоретический выход).
Пример получения 225
Синтез дигидрохлорида 4-[N-[[2-(4-хлорфенил)пиридин-4-ил]метил]-N-(4-метоксифенил)амино]пиперидина
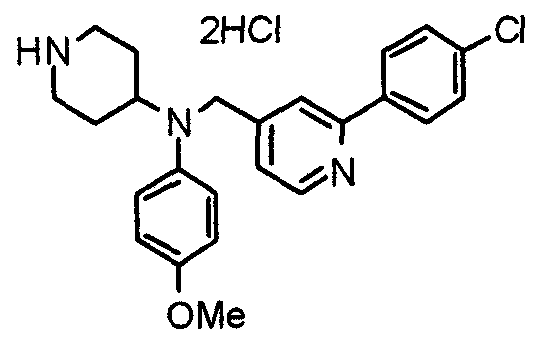
1-(трет-Бутоксикарбонил)-4-[N-[[2-(4-хлорфенил)пиридин-4-ил]метил]-N-(4-метоксифенил)амино]пиперидин (600 мг) обрабатывают по методике, аналогично описанной в примере получения 94, получая указанное в заголовке соединение.
Выход 447 мг (86%).
Примеры 170-202
Указанные соединения получают взаимодействием аминов, полученных в примерах получения 96, 205, 207, 209, 211, 213, 215, 217, 219, 221, 223 и 225, с производными хлорида, полученными в примерах получения 3, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202 и 203. Полученные свободные основания затем превращают в соответствующие гидрохлориды. Выходы и данные ЯМР их свободных оснований указаны ниже.
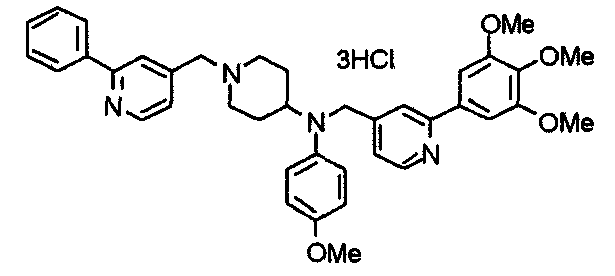
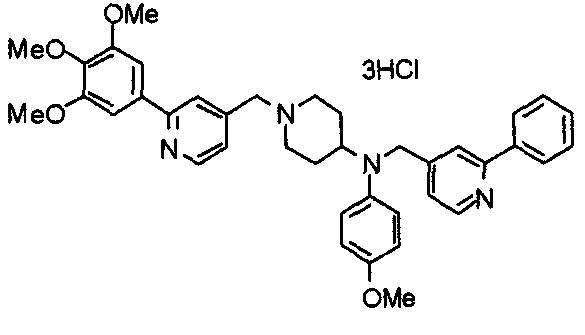
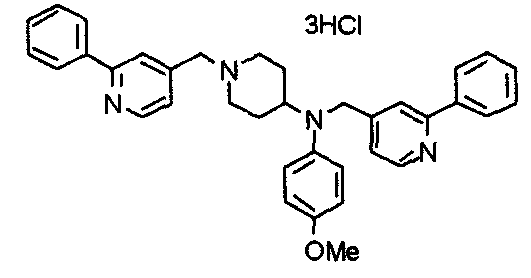

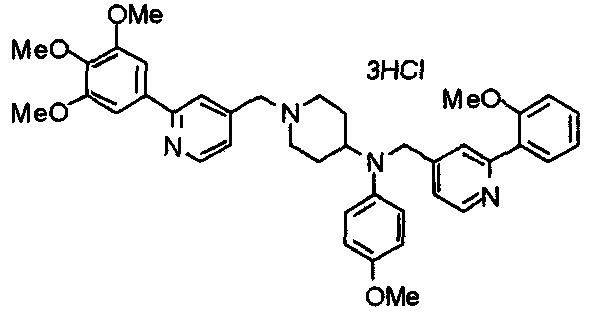
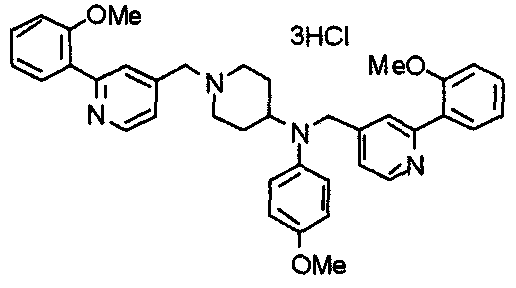
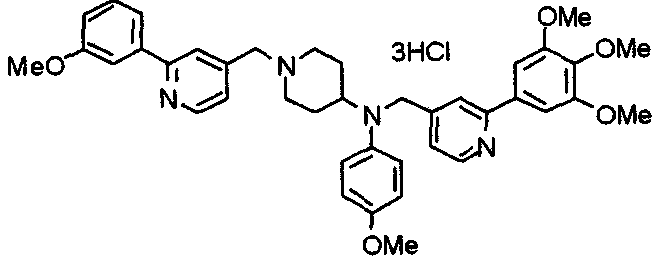
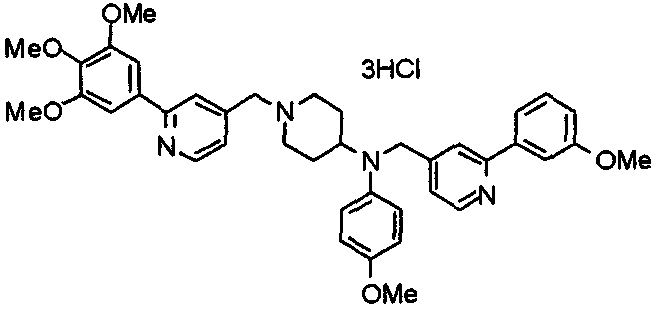
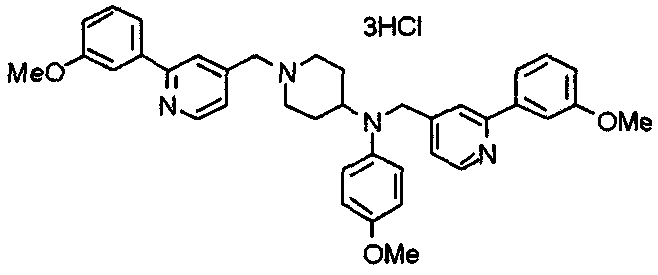
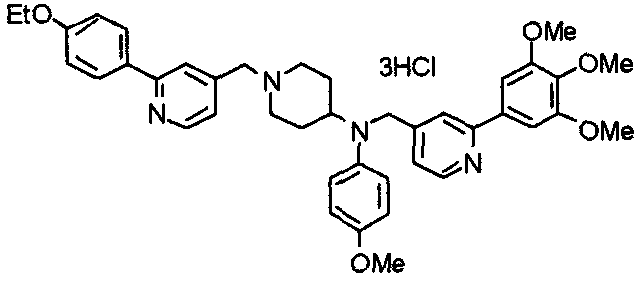
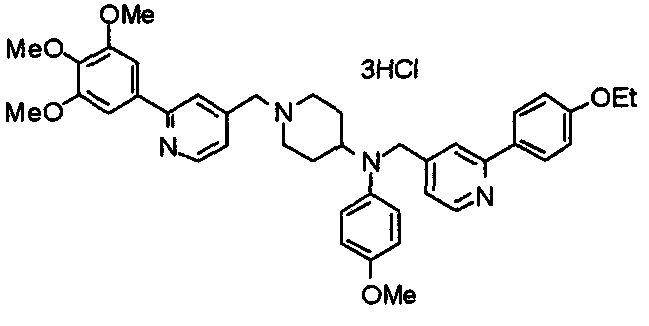

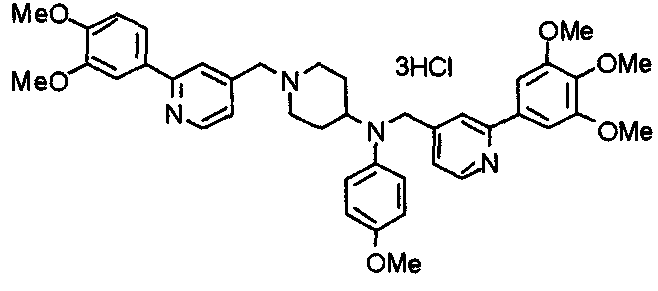
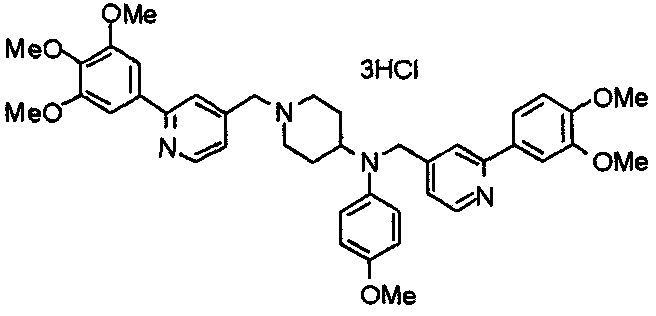
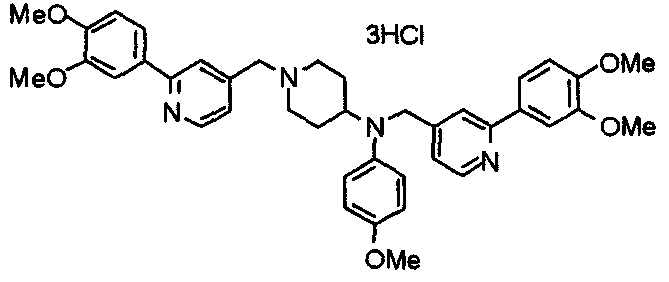
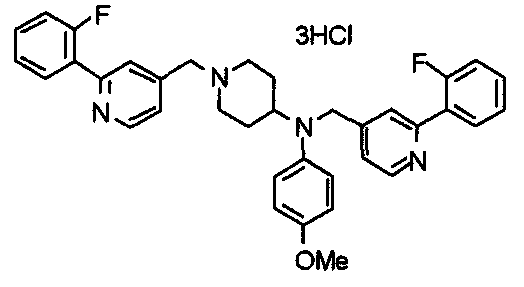
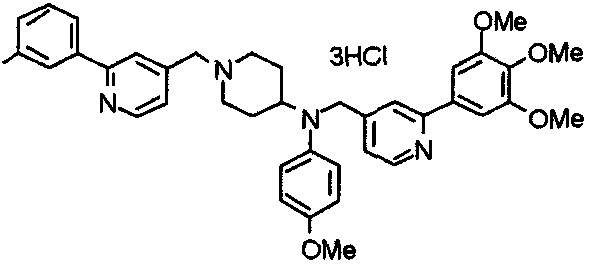
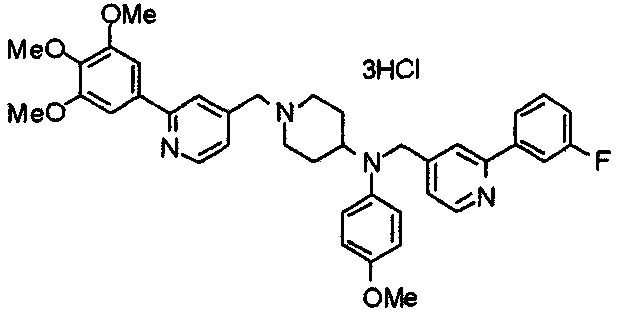
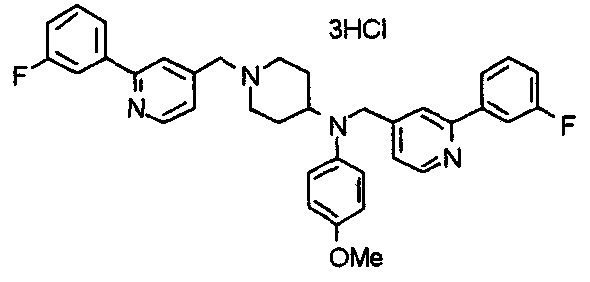
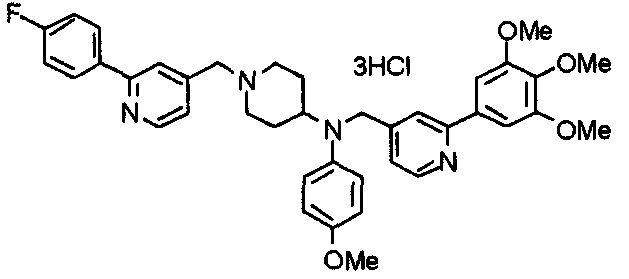
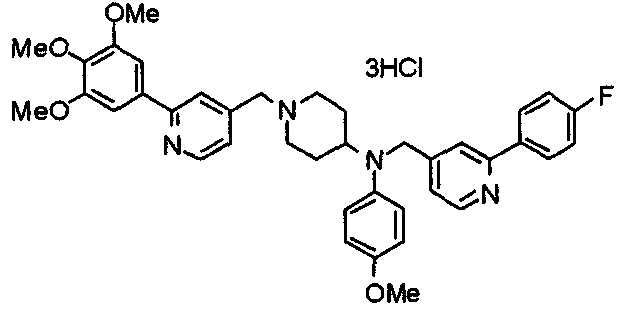
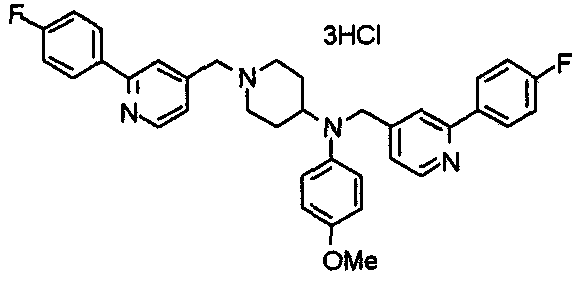
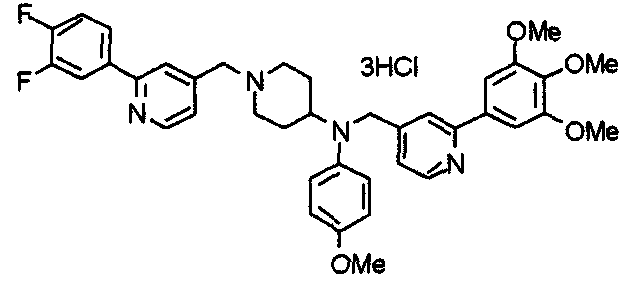
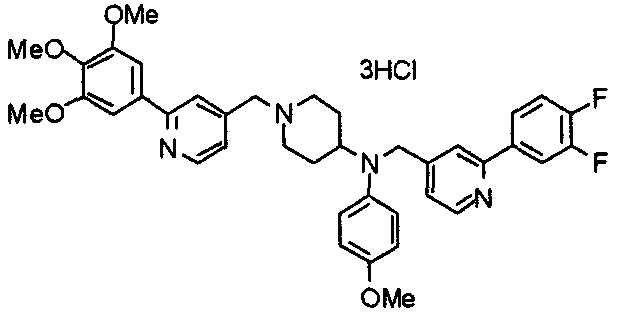
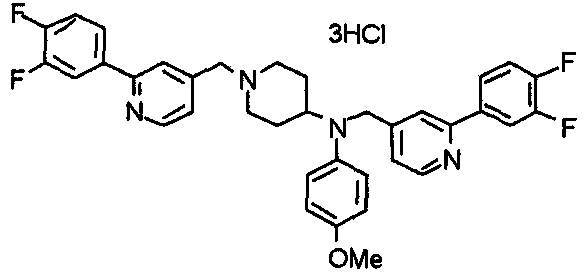
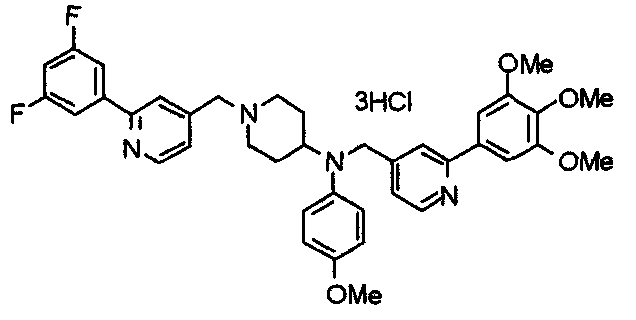
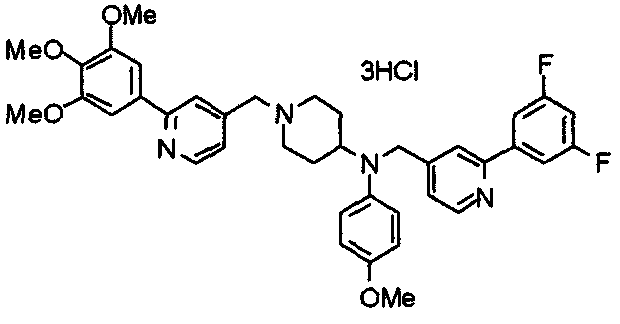
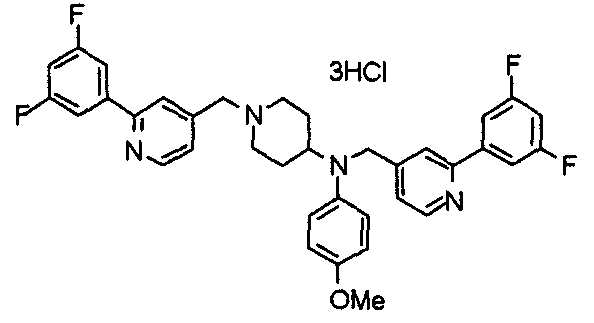
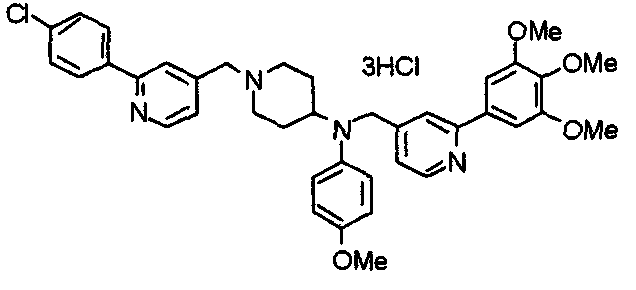
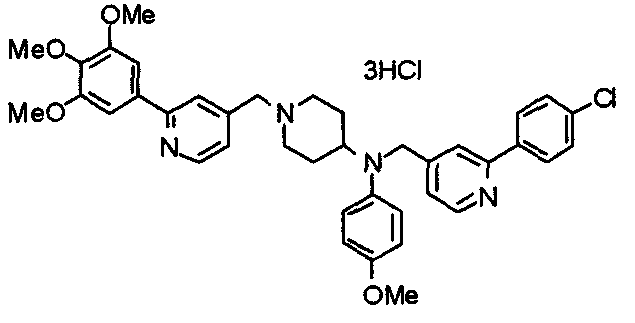
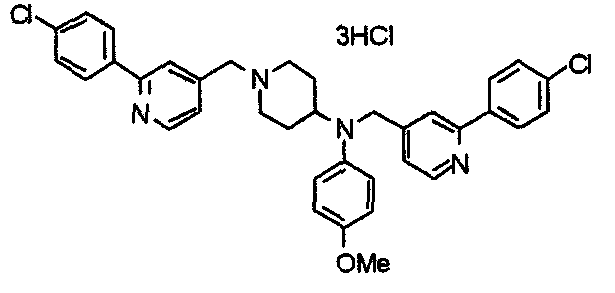
Пример получения 226
Синтез 4-[N-[3-(3,4,5-триметоксифенил)бензил]-N-[4-(метилсульфонил)фенил]амино]пиперидина
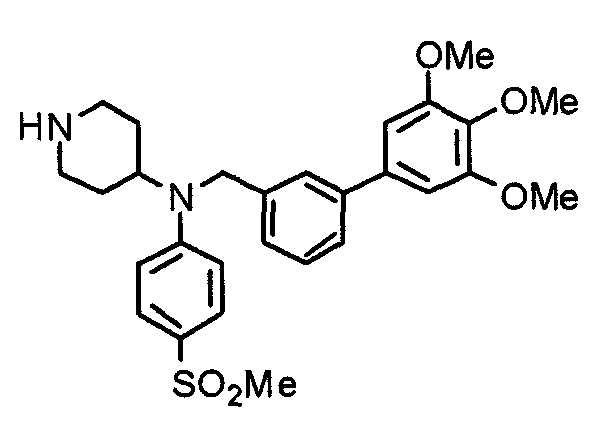
Гидрохлорид 4-[N-[3-(3,4,5-триметоксифенил)бензил]-N-[4-(метилтио)фенил]амино]пиперидина (52 мг, получен в примере получения 145) растворяют в дихлорметане (1 мл) и к полученному раствору при 0°С добавляют 3-хлорпербензойную кислоту (69 мг). После того как смеси дают нагреться до комнатной температуры и 3-часового перемешивания, добавляют насыщенный раствор гидрокарбоната натрия. После отделения органического слоя водный слой экстрагируют хлороформом. Объединенные органические слои промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Полученное бледно-желтое масло используют на следующей стадии без очистки.
Пример 203
Синтез дигидрохлорида 4-[N-[3-(3,4,5-триметоксифенил)бензил]-N-[4-(метилсульфонил)фенил]амино]-1-[2-(3,4,5-триметоксифенил)пиридин-4-ил]метил]пиперидина
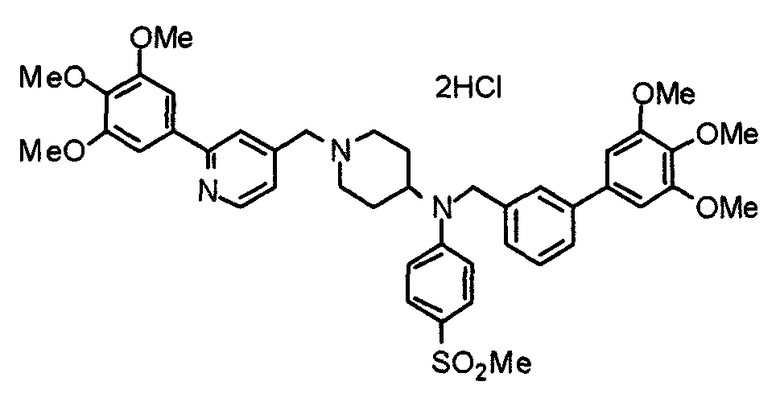
Неочищенный 4-[N-[3-(3,4,5-триметоксифенил)бензил]-N-[4-(метилсульфонил)фенил]амино]пиперидин, полученный в примере получения 226, подвергают взаимодействию с 4-хлорметил-2-(3,4,5-триметоксифенил)пиридином (29 мг) по методике, аналогично описанной в примере 2. После превращения полученного свободного основания в соответствующий дигидрохлорид получают указанное в заголовке соединение в виде бледно-желтого порошка.
Выход 23 мг (26% за две стадии).
1H-ЯМР (400 МГц, определяемое как свободное основание, CDCl3) δ: 1,70-1,97 (м, 4H), 2,16-2,28 (м, 2H), 2,95-3,04 (м, 2H), 2,99 (с, 3H), 3,59 (с, 2H), 3,82 (с, 3H), 3,87-3,97 (м, 1H), 3,90 (с, 3H), 3,91 (с, 3H), 3,92 (с, 3H), 3,96 (с, 9H), 4,65 (с, 2H), 6,59 (с, 1H), 6,75 (д, 2H, J=9,3 Гц), 7,19-7,30 (м, 7H), 7,39 (дд, 1H, J=7,6 Гц, 7,6 Гц), 7,60 (с, 1H), 7,68 (д, 2H, J=9,0 Гц), 8,60 (д, 1H, J=4,9 Гц).
Пример 204
Синтез тригидрохлорида 4-[N-(4-метоксифенил)-N-[[3-(3,4,5-триметоксифенил)пиридин-5-ил]метил]амино]-1-[[2-(3-метоксифенил)пиридин-4-ил]метил]пиперидина
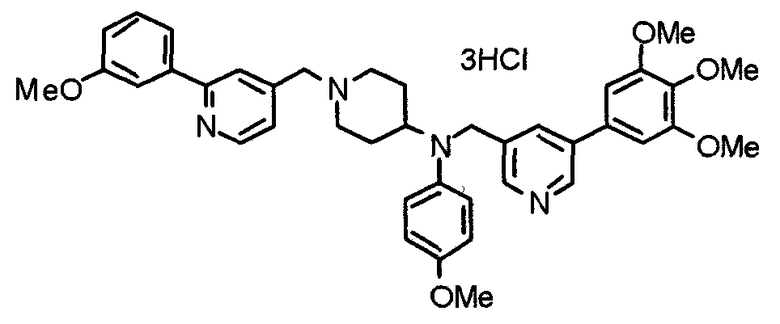
Дигидрохлорид 4-[N-(4-метоксифенил)-N-[[3-(3,4,5-триметоксифенил)пиридин-5-ил]метил]амино]пиперидина (139 мг, см. пример получения 98) подвергают взаимодействию с 4-хлорметил-2-(3-метоксифенил)пиридином (70 мг, см. пример получения 195) по методике, аналогично описанной в примере 2, получая указанное в заголовке соединение в виде тригидрохлорида.
Выход 131 мг (66%).
1H-ЯМР (400 МГц, определяемое как свободное основание, CDCl3) δ: 1,70-1,95 (м, 4H), 2,05-2,25 (м, 2H), 2,90-3,08 (м, 2H), 3,45-3,68 (м, 3H), 3,72 (с, 3H), 3,88 (с, 3), 3,90 (с, 9H), 4,46 (с, 2H), 6,70-6,85 (м, 4H), 6,96 (д, 1H, J=8,3 Гц), 7,21 (шир, 1H), 7,38 (т, 1H, J=7,8 Гц), 7,55 (т, 1H, J=7,8 Гц), 7,59 (с, 1H), 7,63-7,75 (м, 2H), 8,50 (с, 1H), 8,62 (шир, 1H).
Пример 205
Синтез 4-[N-(4-метоксифенил)-N-[[3-(3,4,5-триметоксифенил)пиридин-5-ил]амино]-1-[[2-(3,4-диметоксифенил)пиридин-4-ил]метил]пиперидина
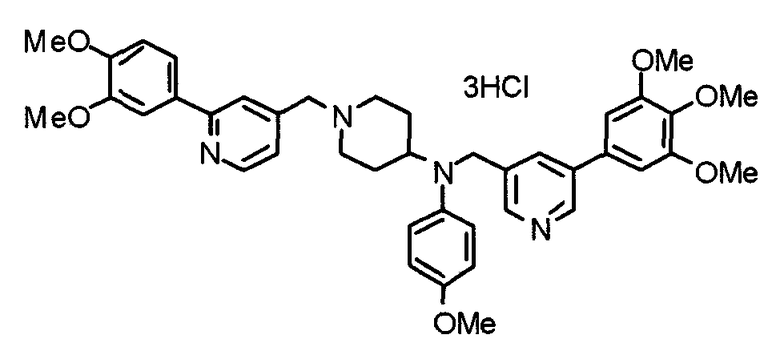
Дигидрохлорид 4-[N-(4-метоксифенил)-N-[[3-(3,4,5-триметоксифенил)пиридин-5-ил]метил]амино]пиперидина (139 мг, см. пример получения 98) подвергают взаимодействию с 4-хлорметил-2-(3,4-диметоксифенил)пиридином (80 мг, см. пример получения 197) по методике, аналогично описанной в примере 2, получая указанное в заголовке соединение в виде тригидрохлорида.
Выход 139 мг (67%).
1H-ЯМР (400 МГц, определяемое как свободное основание, CDCl3) δ: 1,70-1,95 (м, 4H), 2,05-2,20 (м, 2H), 2,90-3,05 (м, 2H), 3,45-3,60 (м, 3H), 3,73 (с, 3H), 3,88 (с, 3H), 3,89 (с, 6H), 3,94 (с, 3H), 4,00 (с, 3H), 4,46 (с, 2H), 6,65 (с, 2H), 6,74-6,82 (м, 4H), 6,94 (д, 1H, J=8,3 Гц), 7,15 (шир, 1H), 7,52 (шир, 1H), 7,58-7,71 (м, 3H), 8,50 (с, 1H), 8,57 (д, 1H, J=5,2 Гц), 8,62 (шир, 1H).
Пример 206
Синтез тригидрохлорида 4-[N-(4-фторфенил)-N-[[3-(3,4,5-триметоксифенил)пиридин-5-ил]метил]амино]-1-[[2-(3-метоксифенил)пиридин-4-ил]метил]пиперидина
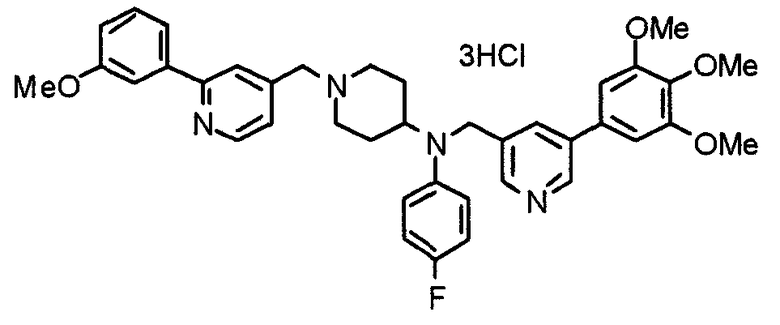
Дигидрохлорид 4-[N-(4-фторфенил)-N-[[3-(3,4,5-триметоксифенил)пиридин-5-ил]метил]амино]пиперидина (135 мг, см. пример получения 183) подвергают взаимодействию с 4-хлорметил-2-(3-метоксифенил)пиридином (70 мг, см. пример получения 195) по методике, аналогично описанной в примере 2, получая указанное в заголовке соединение в виде тригидрохлорида.
Выход 178 мг (92%).
1H-ЯМР (400 МГц, определяемое как свободное основание, CDCl3) δ: 1,73-1,95 (м, 4H), 2,10-2,25 (м, 2H), 2,93-3,05 (м, 2H), 3,57 (с, 2H), 3,64 (шир, 1H), 3,88 (с, 3H), 3,89 (с, 9H), 4,51 (с, 2H), 6,66 (с, 2H), 6,70-6,76 (м, 2H), 6,90 (т, 2H, J=8,3 Гц), 6,96 (д, 1H, J=8,3 Гц), 7,21 (шир, 1H), 7,38 (т, 1H, J=8,0 Гц), 7,54 (д, 1H, J=7,8 Гц), 7,58 (с, 1H), 7,65 (с, 1H), 7,74 (шир, 1H), 8,50 (с, 1H), 8,61 (д, 1H, J=5,1 Гц), 8,65 (шир, 1H).
Пример 207
Синтез тригидрохлорида 4-[N-(4-фторфенил)-N-[[3-(3,4,5-триметоксифенил)пиридин-5-ил]метил]амино]-1-[[2-(3,4-диметоксифенил)пиридин-4-ил]метил]пиперидина
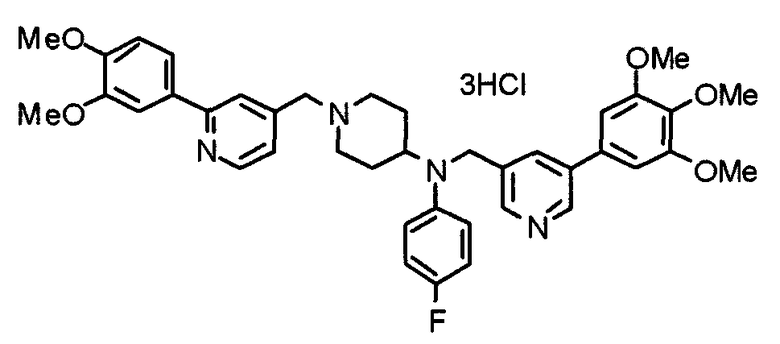
Дигидрохлорид 4-[N-(4-фторфенил)-N-[[3-(3,4,5-триметоксифенил)пиридин-5-ил]метил]амино]пиперидина (135 мг, см. пример получения 183) подвергают взаимодействию с 4-хлорметил-2-(3,4-диметоксифенил)пиридином (80 мг, см. пример получения 197) по методике, аналогично описанной в примере 2, получая указанное в заголовке соединение в виде тригидрохлорида.
Выход 195 мг (96%).
1H-ЯМР (400 МГц, определяемое как свободное основание, CDCl3) δ: 1,70-1,95 (м, 4H), 2,10-2,24 (м, 2H), 2,94-3,09 (м, 2H), 3,57 (с, 2H), 3,64 (шир, 1H), 3,88 (с, 3H), 3,89 (с, 6H), 3,94 (с, 3H), 4,00 (с, 3H), 4,51 (с, 2H), 6,65 (с, 2H), 6,69-6,78 (м, 2H), 6,86-6,97 (м, 3H), 7,16 (д, 1H, J=4,9 Гц), 7,51 (д, 1H, J=8,5 Гц), 7,60-7,70 (м, 3H), 8,50 (с, 1H), 8,58 (д, 1H, J=4,9 Гц), 8,65 (с, 1H).
Пример 208
Синтез тригидрохлорида 4-[N-(3,4-дифторфенил)-N-[[3-(3,4,5-триметоксифенил)пиридин-5-ил]метил]амино]-1-[[2-(3-метоксифенил)пиридин-4-ил]метил]пиперидина
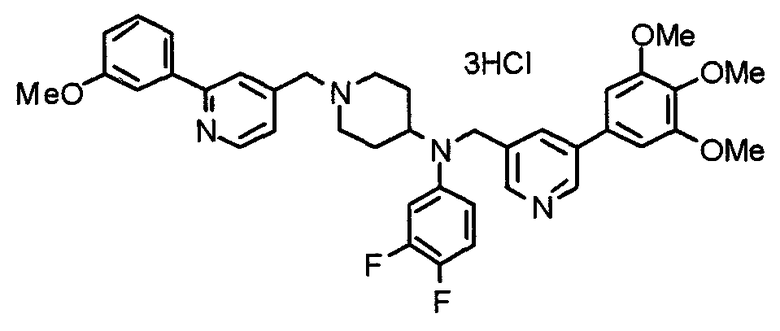
Дигидрохлорид 4-[N-(3,4-дифторфенил)-N-[[3-(3,4,5-триметоксифенил)пиридин-5-ил]метил]амино]пиперидина (160 мг, см. пример получения 176) подвергают взаимодействию с 4-хлорметил-2-(3-метоксифенил)пиридином (80 мг, см. пример получения 195) по методике, аналогично описанной в примере 2, получая указанное в заголовке соединение в виде тригидрохлорида.
Выход 130 мг (57%).
1H-ЯМР (400 МГц, определяемое как свободное основание, CDCl3) δ: 1,73-1,90 (м, 4H), 2,01-2,24 (м, 2H), 2,92-3,05 (м, 2H), 3,57 (с, 2H), 3,67 (шир, 1H), 3,88 (с, 3H), 3,89 (с, 3H), 3,90 (с, 6H), 4,52 (с, 2H), 6,36-6,42 (м, 1H), 6,50-6,58 (м, 1H), 6,67 (с, 2H), 6,93-7,01 (м, 2H), 7,20 (шир, 1H), 7,38 (т, 1H, J=7,8 Гц), 7,52-7,62 (м, 2H), 7,62-7,72 (м, 2H), 8,48 (шир, 1H), 8,61 (шир, 1H), 8,66 (д, 1H, J=2,0 Гц).
Пример 209
Синтез 4-[N-(4-метилтиофенил)-N-[[3-(3,4,5-триметоксифенил)пиридин-5-ил]метил]амино]-1-[[2-(3-метоксифенил)пиридин-4-ил]метил]пиперидина
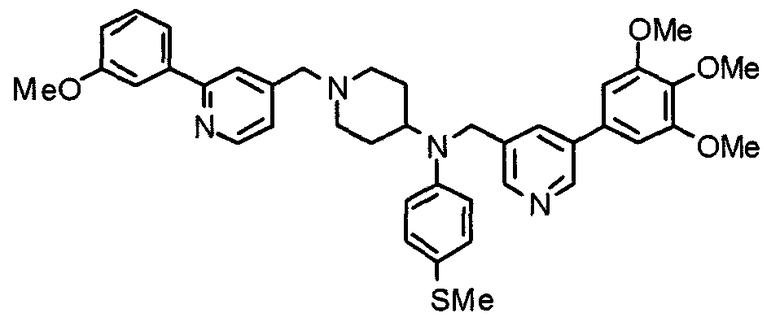
Дигидрохлорид 4-[N-(4-метилтиофенил)-N-[[3-(3,4,5-триметоксифенил)пиридин-5-ил]метил]амино]пиперидина (121 мг, см. пример получения 143) подвергают взаимодействию с 4-хлорметил-2-(3-метоксифенил)пиридином (55 мг, см. пример получения 195) по методике, аналогично описанной в примере 2, получая указанное в заголовке соединение.
Выход 71 мг (44%).
1H-ЯМР (400 МГц, определяемое как свободное основание, CDCl3) δ: 1,72-1,83 (м, 4H), 2,12-2,20 (м, 2H), 2,37 (с, 3H), 2,97 (д, 2H, J=10,8 Гц), 3,56 (с, 2H), 3,75-3,81 (м, 1H), 3,86 (с, 3H), 3,87 (с, 6H), 4,54 (с, 2H), 6,64-6,69 (м, 3H), 6,94 (дд, 1H, J=7,8 Гц, 1,9 Гц), 7,17-7,26 (м, 4H), 7,35 (т, 1H, J=7,8 Гц), 7,51-7,66 (м, 4H), 8,47 (с, 1H), 8,59 (д, 1H, J=4,6 Гц), 8,63 (с, 1H).
Пример испытаний 1
(ингибирующее действие на клеточную адгезию)
Тест проводят по методике, аналогично описанной Ross et al. (J. Biol. Chem., 267, 8537-8543 (1992)). Более конкретно, после культивирования в 48-луночном планшете эндотелиальных клеток пупочной вены человека (HUVEC) до конфлюэнтного роста к ним добавляют TNFα. Через 5 часов после указанного добавления добавляют U937, представляющий собой моноцитарный/гистоцитарный лейкоцит, флуоресцентно меченный РКН2 (продукт Sigma-Aldrich Co., Ltd.), в количестве 1×106 клеток на лунку. После пребывания планшета в покое при комнатной температуре в течение часа не прилипшие U937 вымывают и лизируют в 1% Triton X-100 для измерения оставшейся интенсивности флуоресценции (длина волны возбуждения 480 нм; длина волны измерения 530 нм). HUVEC и U937 культивируют в EGM-2 (продукт Sanko Junyaku K.K.) и RPMI1640, содержащем 10% FCS (фетальную телячью сыворотку) соответственно. Каждый исследуемый агент добавляют к HUVEC после добавления TNFα и к U937 за 24 часа до начала теста на клеточную адгезию. Степень ингибирования определяют в соответствии с уравнением (А-С)/(А-В)×100(%), где А равно количеству клеток U937, прилипших к HUVEC, стимулированных TNF без добавления исследуемого агента, В равно количеству клеток U937, прилипших к HUVEC, не стимулированных TNFα без добавления исследуемого агента, и С равно количеству клеток U937, прилипших к HUVEC, стимулированных TNFα с добавлением исследуемого агента. Полученные результаты представлены в таблице. В качестве контрольных соединений одновременно оценивали исследуемое соединение 1, описанное в выложенной патентной заявке Японии № 9-143075, и дилазеп, описанный в выложенной патентной заявке Японии № 11-92382.
Как указано выше, соединение настоящего изобретения отличается тем, что циклический амин содержит фенилпиридильные или бифенильные группы на обоих концах молекулы.
Ингибирующее действие на клеточную адгезию соединения циклического амина, содержащего пиридильные группы на его обоих концах, полученного в примере получения 91, определяют в соответствии с вышеописанной методикой. В результате данное соединение не проявило ингибирующего действия по клеточной адгезии даже при такой высокой концентрации, как 10 мкМ.
Ниже представлены примеры конкретных композиций.
Вышеуказанные ингредиенты смешивают согласно способу, известному в данной области per se, и затем помещают в желатиновые капсулы, получая препараты в виде капсул.
Вышеуказанные ингредиенты смешивают согласно способу, известному в данной области per se, получая препараты в виде таблеток.
Пример композиции 3 (препарат в виде инъекций)
Соединение, полученное в примере 13 (100 мг) и хлорид натрия (900 мг) растворяют в дистиллированной воде (около 80 мл) для инъекций и к полученному раствору добавляют дистиллированную воду до общего количества 100 мл. Полученный разведенный раствор стерилизуют фильтрованием и затем разделяют на дозы и помещают в 10 ампул, после чего ампулы запаивают, получая препараты для инъекций.
Промышленная применимость
Как указано выше, соединения (1) в соответствии с настоящим изобретением проявляют ингибирующее действие как против клеточной адгезии, так и клеточной инфильтрации, и могут быть полезны в качестве лекарственных средств для профилактики или лечения аллергии, астмы, ревматизма, артериосклероза, воспалительных заболеваний, синдрома Шегрена и т.д.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНОЕ ПИРАЗОЛОПИРИМИДИНА | 2007 |
|
RU2420530C2 |
| ЦИКЛОАЛКИЛ-ЗАМЕЩЕННОЕ ПРОИЗВОДНОЕ ИМИДАЗОЛА, ОБЛАДАЮЩЕЕ ИНГИБИРУЮЩЕЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ TAFIa | 2011 |
|
RU2572814C2 |
| ПРОИЗВОДНЫЕ ПИПЕРАЗИНА | 1994 |
|
RU2124511C1 |
| ПРОИЗВОДНЫЕ ПИРИМИДИНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ БОЛЕЗНИ | 1996 |
|
RU2170734C2 |
| 1-ГЕТЕРОЦИКЛИЛСУЛЬФОНИЛ, 2-АМИНОМЕТИЛ, 5-(ГЕТЕРО-)АРИЛ ЗАМЕЩЕННЫЕ 1-Н-ПИРРОЛ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ СЕКРЕЦИИ КИСЛОТЫ | 2006 |
|
RU2415838C2 |
| ПРОИЗВОДНЫЕ 4-АМИНО-5-ЦИАНОПИРИМИДИНА | 2005 |
|
RU2386628C2 |
| ПРОИЗВОДНЫЕ ДИАМИНА | 2002 |
|
RU2314303C2 |
| ПРОИЗВОДНЫЕ ДИАМИНОВ | 2002 |
|
RU2319699C2 |
| ПРОИЗВОДНЫЕ КАРБОНОВЫХ КИСЛОТ И ФАРМАЦЕВТИЧЕСКОЕ СРЕДСТВО, СОДЕРЖАЩЕЕ ИХ В КАЧЕСТВЕ АКТИВНОГО ИНГРЕДИЕНТА | 2002 |
|
RU2315746C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ ЦИКЛИЧЕСКОГО АМИДА | 2001 |
|
RU2257384C2 |
Изобретение относится к новым соединениям циклического амина, представленным общей формулой (1), их фармацевтически приемлемым солям или гидратам, обладающим ингибирующим действием на клеточную адгезию и/или клеточную инфильтрацию, к лекарственному средству и фармацевтической композиции на их основе.
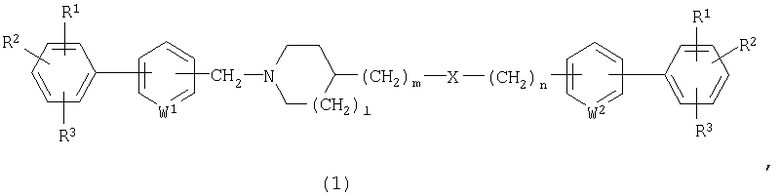
где каждый из R1, R2 и R3 независимо представляет собой атом водорода, атом галогена, гидроксигруппу, С1-С8алкоксигруппу; каждый из W1 и W2 независимо представляет собой N или СН; Х представляет собой О, NR4, CONR4 или NR4CO; R4 представляет собой атом водорода, С1-С8алкил, С3-С6алкинил, замещенный или незамещенный фенил, незамещенный бензил, незамещенный инданил, где заместитель(и) фенила представляет(ют) собой 1-3 группы или атома, выбранных из С1-С8алкила, C1-C8алкокси, С1-С8алкокси, замещенного 1-3 атомами галогена, C1-C8-алкилтиогруппы, С1-С8алкилсульфонила, атома галогена, трифторметильной группы и C1-С3алкилендиоксигруппы; каждый из l, m и n представляет собой число 0 или 1. 3 н. и 3 з.п. ф-лы, 18 табл.
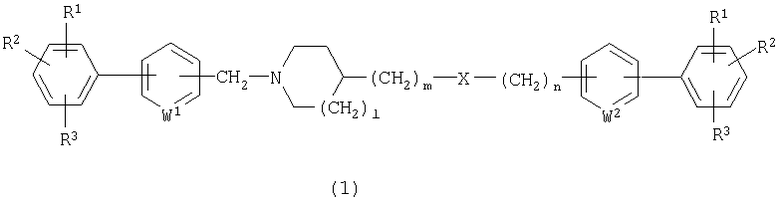
где каждый из R1, R2 и R3 независимо представляет собой атом водорода, атом галогена, гидроксигруппу, С1-С8алкоксигруппу;
каждый из W1 и W2 независимо представляет собой N или СН;
Х представляет собой О, NR4, CONR4 или NR4CO;
R4 представляет собой атом водорода, С1-С8алкил, С3-С6алкинил, незамещенный или замещенный фенил, незамещенный бензил, незамещенный инданил, где заместитель(и) фенила представляет(ют) собой 1-3 группы или атома, выбранных из C1-С8алкила, С1-С8алкокси, С1-С8алкокси, замещенного 1-3 атомами галогена, C1-C8-алкилтиогруппы, С1-С8алкилсульфонила, атома галогена, трифторметильной группы и C1-С3алкилендиоксигруппы; и
каждый из l, m и n представляет собой число 0 или 1, его фармацевтически приемлемая соль или гидрат.
Приоритет по пунктам и признакам:
| ПРОИЗВОДНЫЕ ФЕНОКСИ- ИЛИ ФЕНОКСИАЛКИЛПИПЕРИДИНА И АНТИВИРУСНАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1993 |
|
RU2125565C1 |
| ЕР 774257 А2, 21.05.1997 | |||
| Разборный с внутренней печью кипятильник | 1922 |
|
SU9A1 |
| FR 1575591 A, 25.07.1969 | |||
| ЕР 1254904 А1, 18.01.2001 | |||
| Прибор, замыкающий сигнальную цепь при повышении температуры | 1918 |
|
SU99A1 |
Авторы
Даты
2007-05-20—Публикация
2002-08-28—Подача