Область техники, к которой относится изобретение
Изобретение относится к лекарственному препарату, пригодному в качестве агониста рецептора аденозина А2а, содержащему производное 4-амино-5-цианопиримидина или его фармацевтически приемлемую соль, и фармацевтической композиции, содержащей данные соединения.
Уровень техники
Аденозин представляет соединение, которое может проявлять различные физиологические эффекты, когда оно связывается с рецептором на поверхности клеток. Рецепторы аденозина на поверхности клеток относятся к семейству сопряженных с G-белком рецепторов, и их подразделяют на А1, А2а, А2b и А3. Среди них рецепторы аденозина А1 и аденозина А3 сопряжены с Gi-белком, и их активация приводит к снижению внутриклеточной концентрации цАМФ. Кроме того, рецепторы аденозина А2а и аденозина А2b сопряжены с Gs-белком, и их активация приводит к повышению внутриклеточной концентрации цАМФ. Клонированы 4 вида подтипов аденозиновых рецепторов.
Имеются сообщения о результатах различных исследований по агонистам и антагонистам, которые касаются каждого из подтипов вышеуказанных рецепторов аденозина. Было установлено, что данные агонисты и антагонисты могут использоваться в качестве лекарственных препаратов для лечения сердечно-сосудистых нарушений, нарушений кровообращения в результате ишемии, воспаления, болезни Паркинсона, шизофрении и тому подобное. В частности, сообщалось о ряде производных аденозина, использованных в качестве активного соединения агониста рецептора аденозина А2а (см. WO 01/027131 А1, WO 00/077018 А1, WO 00/078776 А1, WO 00/078777 А1, WO 00/078778 А1, WO 00/078779 А1, WO 00/072799 А1, WO 00/023457 А1, WO 99/67266 А1, WO 99/67265 А1, WO 99/67264 А1, WO 99/67263 А1, WO 99/41267 А1, WO 99/38877 А1, WO 98/28319 А1, патент США № 5877180, WO 00/044763 А1, WO 93/22328 А1, JP-B-1-33477, JP-B-1-2774169, патент США № 4968697, JP-А-63-201196, JP-А-2003-055395 и JP-А-2002-173427).
Кроме того, также сообщалось о соединениях, которые в структурном отношении отличаются от производных аденозина и не обладают структурой аденина, в качестве активного соединения агониста рецептора аденозина А1 или А2. Примеры соединений включают производные дицианопиридина (см. WO 00/125210 А1, WO 02/070484 А1, WO 02/070485 А1, WO 02/070520 А1, WO 02/079195 А1, WO 02/079196 А1, WO 03/008384 А1 и WO 03/053441 А1). Однако не были известны производные цианопиримидина, обладающие свойством активировать рецептор аденозина А2а.
С другой стороны, глаукома представляет собой трудноизлечимую офтальмопатию, которой страдает большинство видов млекопитающих, включая приматов. Наблюдаемыми симптомами являются расплывчатое зрение и боль в глазах, или потеря зрения, и нарушение глазного нерва может оказывать влияние на область зрения, в некоторых случаях, приводя к слепоте. Глаукому можно подразделить на два типа: глаукому в результате глазной гипертензии, которая характеризуется увеличением внутриглазного давления (повышением внутриглазного давления), и глаукому с нормальным давлением без повышения внутриглазного давления. Повышение внутриглазного давления при глаукоме может возникать в результате потери баланса между скоростью притока внутриглазной жидкости, которая секретируется цилиарным эпителием в заднюю камеру глазного яблока, и скоростью оттока внутриглазной жидкости, которая выделяется из передней камеры глазного яблока в основном через шлеммов канал. Полагают, что данная потеря баланса возникает в результате повышенной резистентности потока внутриглазной жидкости в основном за счет блокирования оттока внутриглазной жидкости. Глаукома представляет серьезное заболевание, количество страдающих ею пациентов возрастает год за годом в любой развитой стране по мере старения общества, и все более возрастает социальная необходимость в разработке лекарственного препарата для его лечения.
В настоящее время при лечении глаукомы регуляция внутриглазного давления, которое является самым критическим фактором, представляет наиболее важную проблему, и лекарственные препараты, применяемые при ее лечении, включают такие β-блокаторы, как картеолол и тимолол, такие производные простагландинов, как латанопрост и изопропил унопростон, такие ингибиторы карбоангидразы, как дорзоламид. Данные лекарственные препараты могут модулировать образование или отток внутриглазной жидкости со снижением внутриглазного давления.
Сообщалось, что агонисты рецептора аденозина А2а не только проявляют сильное гипотензивное действие и пригодны в качестве таких вышеуказанных препаратов, как гипотензивный препарат, лекарственный препарат для лечения/профилактики ишемического заболевания сердца и мозга и препарат против артериосклероза, но также проявляют гипотензивное действие для глаз (смотрите J. Pharmacol. Exp. Ther. 320-326, 273 (1995) и Eur. J. Pharmacol. 307-316, 486 (2004)).
Кроме того, имелся частичный прогресс в исследовании и разработке в отношении производных аденозина, обладающих способностью снижать внутриглазное давление (см. JP-А-2003-055395 и JP-А-2002-173427).
Однако применение данных производных аденозина может сопровождаться развитием некоторого побочного действия на центральную нервную и сердечно-сосудистую системы, когда они применяются в качестве лекарственного препарата для лечения глаукомы.
Как уже указывалось выше, полагают, что производные аденозина, имеющие структуру аденина, проявляют действие в качестве агониста рецептора аденозина А2а, особенно в качестве лекарственного препарата для лечения глаукомы и тому подобное в результате их способности снижать внутриглазное давление, но способности снижать внутриглазное давление недостаточно, более того, данные соединения обладают существенным недостатком, проявляющимся в побочном действии для центральной нервной и сердечно-сосудистой систем, например, сильным гипотензивным действием в результате потенциальной агонистической активности по отношению к рецептору аденозина А2а за счет их структуры аденина. Следовательно, в данной области имеется необходимость в разработке соединения, которое может оказывать требуемое снижение внутриглазного давления в качестве агониста рецептора аденозина А2а, в частности, лекарственного препарата для лечения глаукомы и тому подобное, и более безопасного, по сравнению с вышеуказанными соединениями.
Целью настоящего изобретения является обеспечение соединения, обладающего безопасной и высокой агонистической активностью по отношению к рецептору аденозина А2а, и обеспечение агониста рецептора аденозина А2а, средства для снижения внутриглазного давления, лекарственного препарата для лечения глаукомы и т.д., включающих соединение в качестве активного ингредиента.
Заявители настоящего изобретения провели интенсивные исследования и получили некоторые виды производных 4-амино-5-цианопиримидина и также установили, что эти соединения проявляли высокое агонистическое действие в отношении рецептора аденозина А2а. Настоящее изобретение было завершено дополнительными исследованиями, основанными на обнаруженных фактах.
Настоящее изобретение относится к соединениям, представленным в последующих пунктах 1-13, и их фармацевтическим композициям.
1. Производное 4-амино-5-цианопиримидина формулы (1):
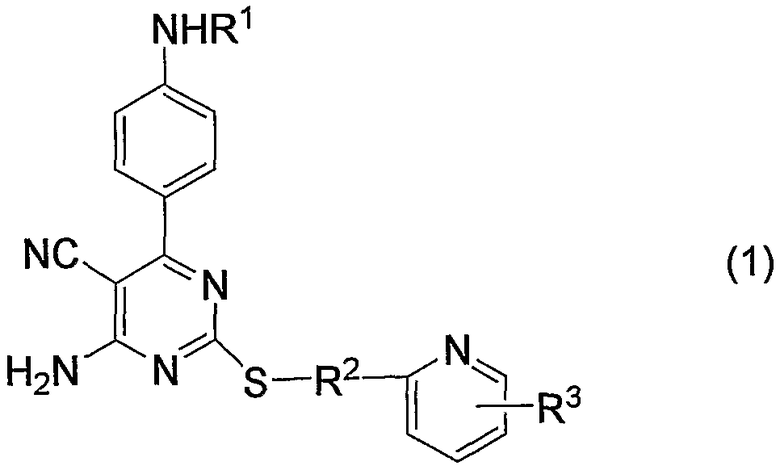
или его фармацевтически приемлемая соль,
в которой:
R1 представляет атом водорода, низший алкилкарбонил, низший алкенилкарбонил, фенилкарбонил или низший алкоксикарбонил;
R2 представляет низший алкилен;
R3 представляет любое из (1) атома водорода, (2) низшего алкила или любую из следующих групп (3)-(12):
группа (3) 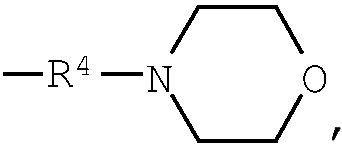 группа (4)
группа (4) 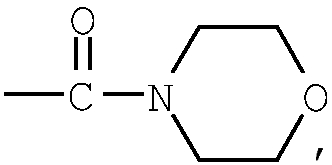 группа (5)
группа (5) 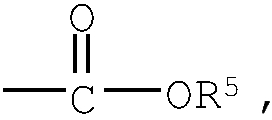 группа (6)
группа (6) 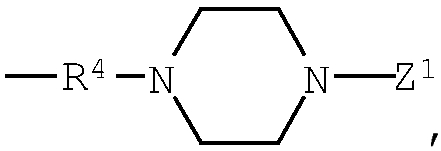 группа (7)
группа (7) 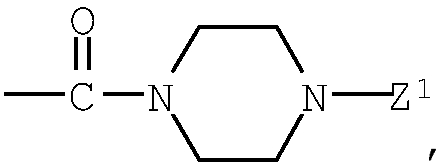 группа (8)
группа (8) 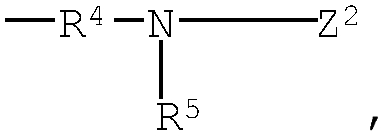 группа (9)
группа (9) 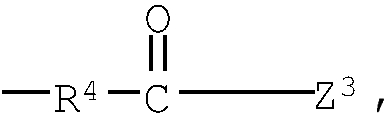 группа (10)
группа (10) 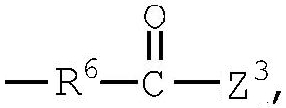 группа (11)
группа (11) 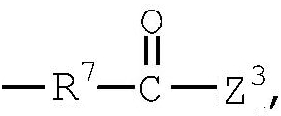 группа (12)
группа (12) 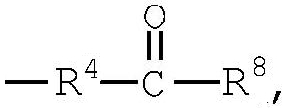
в которых:
R4 представляет низший алкилен, R5 является атомом водорода или низшим алкилом, R6 представляет низший алкенилен, R7 представляет низший алкинилен и R8 представляет низший алкил;
Z1, Z2 и Z3 выбраны соответственно из групп (а1)-(а38), (b1)-(b8) и (с1)-(с22), имеющих значения, определенные ниже:
Z1: (а1) низший алкил, (а2) арил-низший алкил, (а3) аминоарил-низший алкил, (а4) арил-низший алкенил, (а5) гетероарил-низший алкил, (а6) гетероарил-низший алкенил, (а7) гетероариларил-низший алкил, (а8) гидрокси-низший алкил, (а9) арилокси-низший алкил, (а10) амино-низший алкил, (а11) аминокарбонил-низший алкил, (а12) низший алкилкарбонил, (а13) низший алкокси-низший алкилкарбонил, (а14) амино-низший алкилкарбонил, (а15) арилкарбонил, (а16) арил-низший алкилкарбонил, (а17) арил-низший алкенилкарбонил, (а18) арилокси-низший алкилкарбонил, (а19) гетероарилкарбонил, (а20) гетероарил-низший алкилкарбонил, (а21) гетероарил-низший алкенилкарбонил, (а22) гетероарилокси-низший алкилкарбонил, (а23) гетероарилсульфанил-низший алкилкарбонил, (а24) гетероариларилкарбонил, (а25) арилсульфанил-низший алкилкарбонил, (а26) арилкарбонил-низший алкилкарбонил, (а27) ариламино-низший алкилкарбонил, (а28) низший алкоксикарбонил, (а29) низший алкилсульфонил, (а30) арилсульфонил, (а31) гетероарилсульфонил, (а32) атом водорода, (а33) низший алкил, содержащий насыщенный гетероцикл, (а34) карбонил-низший алкил, содержащий насыщенный гетероцикл, (а35) арил-низший алкил, содержащий насыщенный гетероцикл, (а36) карбонил, содержащий насыщенный гетероцикл, (а37) низший алкилкарбонил, содержащий насыщенный гетероцикл, или (а38) арилкарбонил, содержащий насыщенный гетероцикл;
аминогруппа, входящая в состав групп (а3), (а10), (а11) и (а14), представленных выше, может быть необязательно замещена 1 или 2 заместителями, выбранными из группы, состоящей из низшего алкила, карбонила и низшего алкилкарбонила;
арильная группа, входящая в состав групп (а2), (а15), (а16), (а17), (а18), (а30) и (а35), представленных выше, может быть необязательно замещена 1-3 заместителями, выбранными из группы, состоящей из атома галогена, гидрокси, низшего алкила, низшего алкокси, галоген-низшего алкокси, арила, арилокси, метилендиокси, дигалогенметилендиокси, карбоксила, низшего алкоксикарбонила, низшего алкилкарбонилокси, нитро, низшего алкиламино, низшего алкилкарбониламино и аминосульфонила;
гетероарильная группа, входящая в состав групп (а5), (а19)-(а24) и (а31), представленных выше, может быть необязательно замещена 1-3 заместителями, выбранными из группы, состоящей из атома галогена, гидрокси, низшего алкила, гидрокси-низшего алкила, галоген-низшего алкила, арила, галогенарила, низшего алкилсульфанила, аминокарбонила и карбоксила; и
насыщенный гетероцикл, входящий в состав групп (а33)-(а38), представленных выше, может представлять 5-7-членную насыщенную азотсодержащую гетероциклическую группу или указанную гетероциклическую группу, сконденсированную с 1-2 бензольными кольцами, необязательно содержащую низший алкил или низший алкилкарбонил в атоме азота кольцевой системы, или необязательно содержащую 1 или 2 оксогруппы в атомах углерода кольцевой системы;
Z2: (b1) атом водорода, (b2) низший алкоксикарбонил, (b3) амино-низший алкилкарбонил, (b4) низший алкенилкарбонил, (b5) низший алкилкарбонил, содержащий насыщенный гетероцикл, (b6) пиперидино-низший алкилкарбонил, содержащий насыщенный гетероцикл, (b7) карбонил, содержащий насыщенный гетероцикл, (b8) низший алкилсульфонил;
аминогруппа, входящая в состав группы (b3), представленной выше, может быть необязательно замещена 1 или 2 низшими алкилами;
насыщенный гетероцикл, входящий в состав групп (b5)-(b7), представленных выше, может представлять 5-7-членную насыщенную азотсодержащую гетероциклическую группу, необязательно содержащую низший алкил в атоме азота кольцевой системы;
Z3: (с1) гидрокси, (с2) низший алкокси, (с3) амино, (с4) амино-низший алкиламино, (с5) пиперазино, (с6) амино-низший алкилпиперазино, (с7) аминокарбонил-низший алкилпиперазино, (с8) 1,4-диазепан-1-ил, (с9) амино-низший алкил-1,4-диазепан-1-ил, (с10) пиперидино, (с11) аминопиперидино, (с12) амино-низший алкиламинопиперидино, (с13) амино-низший алкилпиперидино, (с14) пирролидино, (с15) амино, содержащий насыщенный гетероцикл, (с16) низший алкиламино, содержащий насыщенный гетероцикл, (с17) пиперазино, содержащий насыщенный гетероцикл, (с18) низший алкилпиперазино, содержащий насыщенный гетероцикл, (с19) карбонил-низший алкилпиперазино, содержащий насыщенный гетероцикл, (с20) низший алкил-1,4-диазепан-1-ил, содержащий насыщенный гетероцикл, (с21) пиперидино, содержащий насыщенный гетероцикл, или (с22) низший алкилморфолино, содержащий насыщенный гетероцикл;
аминогруппа в группе (с3), представленной выше, или аминогруппа, входящая в состав групп (с4), (с6), (с7), (с9), (с11), (с12), (с13), (с15) и (с16), представленных выше, может быть необязательно замещена 1 или 2 заместителями, выбранными из группы, состоящей низшего алкила, гидрокси-низшего алкила, арила, гетероарила, арил-низшего алкила, алкоксиарил-низшего алкила, гетероарил-низшего алкила и низшего алкоксикарбонила;
аминогруппа, входящая в состав группы (с11), представленной выше, может быть необязательно замещена арил-низшим алкилкарбонилом;
пиперазино в группе (с5), представленной выше, и 1,4-диазепан-1-ил в группе (с8), представленной выше, могут быть замещены любым из заместителей, выбранных из группы, состоящей из низшего алкила, гидрокси-низшего алкила, низший алкокси-низшего алкила, арила, низшего алкиларила, гидроксиарила, цианоарила, галогенарила, арил-низшего алкила, низший алкоксиарил-низшего алкила, галогенарилокси-низшего алкила, гетероарила, низшего алкилгетероарила, галоген-низшего алкилгетероарила, цианогетероарила, гетероарил-низшего алкила, низшего алкоксикарбонила и низшего алкилкарбонила в положении 4 кольцевой системы; дополнительно
насыщенный гетероцикл, входящий в состав групп (с15)-(с22), представленных выше, может представлять 5-7-членную насыщенную азотсодержащую гетероциклическую группу или указанную гетероциклическую группу, сконденсированную с 1-2 бензольными кольцами, необязательно содержащую любой из заместителей, выбранных из группы, состоящей из низшего алкила, арила, цианоарила, низшего алкилкарбонила, галоген-низшего алкиларила и арил-низшего алкила в атоме азота кольцевой системы; и дополнительно
пиперазино в группе (с5), представленной выше, пиперидино в группе (с10), представленной выше, и насыщенный гетероцикл, входящий в состав групп (с15)-(с22), представленных выше, могут быть замещены любым из заместителей, выбранным из группы, состоящей из гидрокси, оксо, низшего алкила, гидрокси-низшего алкила, арила, арил-низшего алкила, аминокарбонила и низшего алкиламино по атому углерода кольцевой системы.
2. Производное 4-амино-5-цианопиримидина по п.1, представленное выше, или его фармацевтически приемлемая соль, в котором R2 представляет метилен, R3 является атомом водорода или низшим алкилом.
3. Производное 4-амино-5-цианопиримидина по п.1, представленное выше, или его фармацевтически приемлемая соль, в котором R1 представляет низший алкилкарбонил, R2 является метиленом и R3 представляет группу (3) или группу (6).
4. Производное 4-амино-5-цианопиримидина по п.3, представленное выше, или его фармацевтически приемлемая соль, в котором R4 представляет низший алкилен и Z1 является любым из заместителей, выбранных из группы, состоящей из (а2), (а14), (а15), (а28), (а32) и (а37).
5. Производное 4-амино-5-цианопиримидина по п.1, представленное выше, или его фармацевтически приемлемая соль, в котором R1 представляет низший алкилкарбонил, R2 является метиленом и R3 представляет группу (4), группу (5) или группу (7), в которых Z1 представляет низший алкоксикарбонил или атом водорода.
6. Производное 4-амино-5-цианопиримидина по п.1, представленное выше, или его фармацевтически приемлемая соль, в котором R1 представляет низший алкилкарбонил, R2 является метиленом и R3 представляет группу (8).
7. Производное 4-амино-5-цианопиримидина по п.1, представленное выше, или его фармацевтически приемлемая соль, в котором R1 представляет атом водорода или низший алкилкарбонил, R2 является метиленом и R3 представляет группу (9), группу (10) или группу (11).
8. Производное 4-амино-5-цианопиримидина по п.1, представленное выше, или его фармацевтически приемлемая соль, в котором R1 представляет атом водорода или низший алкилкарбонил, R2 является метиленом и R3 представляет группу (9), группу (10) или группу (11), в которых Z3 представляет (с1), (с2), (с4), (с5), (с6), (с7), (с8), (с10), (с11), (с15), (с16), (с18), (с21) или (с22).
9. Производное 4-амино-5-цианопиримидина по п.1, представленное выше, или его фармацевтически приемлемая соль, в котором R1 представляет ацетил, R2 является метиленом и R3 представляет группу (9), в которой Z3 представляет (с4), (с5), (с6), (с10), (с11), (с16), (с18), (с21) или (с22).
10. Производное 4-амино-5-цианопиримидина по пп.1-9, представленное выше, или его фармацевтически приемлемая соль, где соединение выбрано из группы, состоящей из следующих соединений 1-19:
1) N-{4-[6-амино-5-циано-2-(пиридин-2-илметилсульфанил)пиримидин-4-ил]фенил}ацетамид,
2) N-{4-[6-амино-5-циано-2-(6-метилпиридин-2-илметилсульфанил)пиримидин-4-ил]фенил}ацетамид,
3) N-{4-[6-амино-5-циано-2-(6-{4-[2-(4-метилпиперазин-1-ил)ацетил]пиперазин-1-илметил}пиридин-2-илметилсульфанил)пиримидин-4-ил]фенил}ацетамид,
4) N-[4-(6-амино-5-циано-2-{6-[3-(4-метилпиперазин-1-ил)-3-оксопропил]пиридин-2-илметилсульфанил}пиримидин-4-ил)фенил]ацетамид,
5) 3-{6-[4-(4-ацетиламинофенил)-6-амино-5-цианопиримидин-2-илсульфанилметил]пиридин-2-ил}-N-(2-диметиламиноэтил)пропионамид,
6) 3-{6-[4-(4-ацетиламинофенил)-6-амино-5-цианопиримидин-2-илсульфанилметил]пиридин-2-ил}-N-(2-диметиламиноэтил)-N-метилпропионамид,
7) 3-{6-[4-(4-ацетиламинофенил)-6-амино-5-цианопиримидин-2-илсульфанилметил]пиридин-2-ил}-N-(2-диметиламинопропил)-N-метилпропионамид,
8) 3-{6-[4-(4-ацетиламинофенил)-6-амино-5-цианопиримидин-2-илсульфанилметил]пиридин-2-ил}-N-(2-метилпиперидин-1-илэтил)пропионамид,
9) 3-{6-[4-(4-ацетиламинофенил)-6-амино-5-цианопиримидин-2-илсульфанилметил]пиридин-2-ил}-N-(2-диэтиламиноэтил)пропионамид,
10) 3-{6-[4-(4-ацетиламинофенил)-6-амино-5-цианопиримидин-2-илсульфанилметил]пиридин-2-ил}-N-метил-N-(1-метилпиперидин-4-ил)пропионамид,
11) N-(4-{6-амино-2-[6-(3-[1,4']бипиперидинил-1'-ил-3-оксопропил)пиридин-2-илметилсульфанил]-5-цианопиримидин-4-ил}фенил)ацетамид,
12) N-[4-(6-амино-5-циано-2-{6-[3-оксо-3-(2-пиперидин-1-илметилморфолин-4-ил)пропил]пиридин-2-илметилсульфанил}пиримидин-4-ил)фенил]ацетамид,
13) N-{4-[6-амино-5-циано-2-(6-{3-[2-(4-этилпиперазин-1-илметил)морфолин-4-ил]-3-оксопропил}пиридин-2-илметилсульфанил)пиримидин-4-ил]фенил}ацетамид,
14) N-{4-[6-амино-5-циано-2-(6-{3-[4-(2-диэтиламиноэтил)пиперазин-1-ил]-3-оксопропил}пиридин-2-илметилсульфанил)пиримидин-4-ил]фенил}ацетамид,
15) N-{4-[6-амино-5-циано-2-(6-{3-[4-(2-диизопропиламиноэтил)пиперазин-1-ил]-3-оксопропил}пиридин-2-илметилсульфанил)пиримидин-4-ил]фенил}ацетамид,
16) N-{4-[6-амино-5-циано-2-(6-{3-оксо-3-[4-(2-пирролидин-1-илэтил)пиперазин-1-ил]пропил}пиридин-2-илметилсульфанил)пиримидин-4-ил]фенил}ацетамид,
17) N-{4-[6-амино-5-циано-2-(6-{3-[4-(2-морфолин-4-илэтил)пиперазин-1-ил]-3-оксопропил}пиридин-2-илметилсульфанил)пиримидин-4-ил]фенил}ацетамид,
18) N-{4-[6-амино-5-циано-2-(6-{3-[4-(2-диэтиламиноэтил)пиперазин-1-ил]-3-оксопропил}пиридин-2-илметилсульфанил)пиримидин-4-ил]фенил}ацетамид и
19) N-[4-(6-амино-5-циано-2-{6-[3-(4-метил-[1,4]диазепан-1-ил)-3-оксопропил]пиридин-2-илметилсульфанил}пиримидин-4-ил)фенил]ацетамид.
11. Агонист рецептора аденозина А2а, содержащий любое из производных 4-амино-5-цианопиримидина по пп.1-10, представленных выше, или его фармацевтически приемлемую соль в качестве активного ингредиента.
12. Средство для снижения внутриглазного давления, содержащее любое из производных 4-амино-5-цианопиримидина по пп.1-10, представленных выше, или его фармацевтически приемлемую соль в качестве активного ингредиента.
13. Лекарственный препарат для лечения глазной гипертензии или глаукомы, содержащий любое из производных 4-амино-5-цианопиримидина по пп.1-10, представленных выше, или его фармацевтически приемлемую соль в качестве активного ингредиента.
Производное 4-амино-5-цианопиримидина по настоящему изобретению обладает следующим структурным свойством, т.е. оно имеет структуру пиримидина и фенольное кольцо, содержащее определенный заместитель, замещенный в положении 6 пиримидинового кольца, и пиримидиновое кольцо замещено в положении 2 пиримидинового кольца через сульфанилалкиленовую цепь, или дополнительно пиримидиновое кольцо имеет определенный заместитель. Основываясь на данном структурном свойстве, соединения по изобретению обладают свойством активировать рецептор аденозина А2а, т.е. замечательным фармакологическим свойством агонистического действия по отношению к рецептору аденозина А2а. До настоящего времени соединения, обладающие таким оригинальным структурным свойством, были неизвестны, и было невозможно предположить, что соединения могут проявлять какое-либо фармакологическое действие из предшествующего уровня.
Термин «низший алкил», в том смысле, в котором он используется в настоящем описании, означает алкил с прямой или разветвленной цепью, содержащий 1-6 атомов углерода, т.е. С1-6 прямой или разветвленный алкил.
Термины «низший алкокси» и «низший алкилен» также означают соответственно алкокси и алкилен с прямой или разветвленной цепью, содержащий 1-6 атомов углерода.
Термины «низший алкенил», «низший алкенилен» и «низший алкинилен» означают соответственно алкенил, алкенилен и алкинилен с прямой или разветвленной цепью, содержащие 2-6 атомов углерода, т.е. С2-6 прямой или разветвленный алкенил, алкенилен и алкинилен.
Термин «арил» означает одновалентную группу, содержащую моноциклический или полициклический ароматический углеводород, включая, например, фенил и нафтил.
Термин «гетероарил» означает одновалентную группу, содержащую 5-6-членную ароматическую гетеромоноциклическую группу, содержащую один или более, в частности, 1-3, одинаковых или различных гетероатомов, выбранных из группы, состоящей из атомов азота, кислорода или серы, или ароматическую гетероциклическую группу, состоящую из указанной гетеромоноциклической группы, сконденсированной с арилом, такие как фурил, тиенил, тиазолил, имидазолил, пиразолил, бензофурил, индолил, бензотиазолил, пиридил, пиразинил и тому подобное.
Термин «насыщенный гетероцикл» означает 5-7-членный насыщенный гетероцикл, содержащий один или более, в частности, 1-3, одинаковых или различных гетероатомов, выбранных из группы, состоящей из атомов азота, кислорода или серы. Насыщенный гетероцикл содержится в виде одновалентного насыщенного гетероцикла в любом заместителе, в частности, примерами являются пирролидинил, пирролидино, пиперидил, пиперидино, пиперазинил, пиперазино, 1,4-диазепан-1-ил, тетрагидрофурил, 1,3-диоксоланил, тетрагидротиенил, морфолинил, морфолино, тетрагидроимидазолил и тому подобное. Например, в случае низшего алкила, содержащего насыщенный гетероцикл, низший алкил означает низший алкил, замещенный насыщенным гетероциклом, указанным выше. В низшем алкиле, замещенном насыщенным гетероциклом, связывание не ограничивается, т.е. он может быть связан с низшим алкилом по атому азота, который представляет гетероатом, входящий в гетероцикл, или по его атому углерода. Кроме того, указанная выше 5-7-членная насыщенная гетероциклическая группа может быть сконденсирована с дополнительным 1 или 2 бензольными кольцами. Такие сконденсированные кольцевые группы включают, например, дигидроиндолил, дигидроизоиндолил, тетрагидрохинолил, тетрагидрохинолино, бензоморфолинил, бензоморфолино и тому подобное.
Ниже каждая группа, входящая в соединения по изобретению, представленные указанной общей формулой (1), показана отдельно. Определения каждой группы, представленные ниже, адаптированы не только к соединениям, представленным формулой (1), но также и к другим соединениям.
Примеры низшего алкилкарбонила, представленного как R1, включают ацетил, пропаноил, бутаноил, бутилкарбонил, пентилкарбонил, гексилкарбонил, изопропилкарбонил и тому подобное, предпочтительно ацетил и пропаноил.
Примеры низшего алкенилкарбонила, представленного как R1, включают акрилоил, метакрилоил, кротоноил, изокротоноил и тому подобное, предпочтительно акрилоил.
Примеры низшего алкоксикарбонила, представленного как R1, включают метоксикарбонил, этоксикарбонил, трет-бутоксикарбонил, н-бутоксикарбонил и тому подобное, предпочтительно метоксикарбонил.
Примеры низшего алкилена, представленного как R2, включают метилен, этилен, триметилен, тетраметилен, пентаметилен и гексаметилен, а также такие их структурные изомеры, как 1-метилэтилен. Среди них метилен является предпочтительным.
Примеры низшего алкила, представленного как R3, включают метил, этил, пропил, бутил, пентил и гексил, а также такие их структурные изомеры, как изопропил. Среди них метил является предпочтительным.
Примеры низшего алкилена, представленного как R4, включают метилен, этилен, триметилен, тетраметилен, гептаметилен и гексаметилен, а также такие их структурные изомеры, как 1-метилэтилен. Низший алкилен, представленный как R4, предпочтительно представляет метилен или этилен, когда R3 является группой (3); низший алкилен, представленный как R4, предпочтительно представляет метилен, когда R3 является группой (6) или группой (8); низший алкилен, представленный как R4, предпочтительно представляет этилен или тетраметилен, когда R3 является группой (9).
Примеры низшего алкила, представленного как R5, включают метил, этил, пропил, бутил, пентил и гексил, а также такие их структурные изомеры, как изопропил. Среди них метил является предпочтительным.
Примеры низшего алкенилена, представленного как R6, включают такой низший алкенилен с прямой цепью, как этенилен, пропенилен, бутенилен, пентенилен, гексенилен и бутандиенилен, и такие их структурные изомеры, как 2-метилпропенилен. Среди них этенилен является предпочтительным.
Примеры низшего алкинилена, представленного как R7, включают такой низший алкинилен с прямой цепью, как этинилен, пропинилен, бутинилен, пентинилен, гексинилен и бутандиинилен, и такие их структурные изомеры, как 3-метилбутинилен. Среди них бутинилен является предпочтительным.
Примеры низшего алкила, представленного как R8, включают метил, этил, пропил, бутил, пентил и гексил, а также такие их структурные изомеры, как изопропил. Среди них этил является предпочтительным.
Примеры низшего алкила (а1), представленного как Z1, включают такой низший алкил с прямой цепью, как метил, этил, пропил, бутил, пентил и гексил, а также такие их структурные изомеры, как изопропил. Среди них С1-4 алкил является предпочтительным.
Арил-низший алкил (а2), представленный как Z1, означает низший алкил, замещенный арилом. Примеры включают бензил, фенэтил, фенилпропил, нафтиметил и тому подобное. Среди них бензил или фенэтил являются предпочтительными.
Аминоарил-низший алкил (а3), представленный как Z1, означает арил-низший алкил, содержащий аминогруппу в его арильной группе. Примерами являются аминобензил, аминофенэтил, аминофенилпропил, аминонафтилметил и тому подобное. Среди них аминобензил или аминофенэтил являются предпочтительными.
Арил-низший алкенил (а4), представленный как Z1, означает низший алкенил, замещенный арилом. Примерами являются фенилэтенил, фенилпропенил, фенилбутенил и тому подобное. Среди них фенилпропенил является предпочтительным.
Гетероарил-низший алкил (а5), представленный как Z1, означает низший алкил, замещенный гетероарилом. Примерами являются фурилметил, пиразолилэтил, имидазолилпропил, пиридилметил и тому подобное. Среди них фурилметил или пиридилметил являются предпочтительными.
Гетероарил-низший алкенил (а6), представленный как Z1, означает низший алкенил, замещенный гетероарилом. Примерами являются пиридилэтенил, пиридилпропенил, фурилпропенил и тому подобное. Среди них пиридилпропенил или фурилпропенил являются предпочтительными.
Гетероариларил-низший алкил (а7), представленный как Z1, означает арил-низший алкил, содержащий гетероарил в его арильной группе. Примерами являются фурилфенилметил, тиенилфенилэтил, пиридилфенилпропил, триазолилфенилметил, имидазолилфенилметил и тому подобное. Среди них триазолилфенилметил или имидазолилфенилметил являются предпочтительными.
Примеры гидрокси-низшего алкила (а8), представленного как Z1, включают гидроксиметил, 1-гидроксиэтил, 2-гидроксиэтил, 1-гидроксипропил, 2-гидроксипропил, 3-гидроксипропил, 4-гидроксибутил и тому подобное, предпочтительно 3-гидроксипропил и 4-гидроксибутил.
Примеры арилокси-низшего алкила (а9), представленного как Z1, включают феноксиметил, 1-феноксиэтил, 2-феноксиэтил, 1-феноксипропил, 2-феноксипропил, 3-феноксипропил и тому подобное, предпочтительно 3-феноксипропил.
Примеры амино-низшего алкила (а10), представленного как Z1, включают аминометил, 1-аминоэтил, 2-аминоэтил, 1-аминопропил, 2-аминопропил, 3-аминопропил и тому подобное, предпочтительно 2-аминоэтил и 3-аминопропил.
Примеры аминокарбонил-низшего алкила (а11), представленного как Z1, включают аминокарбонилметил, 1-аминокарбонилэтил, 2-аминокарбонилэтил, 1-аминокарбонилпропил, 2-аминокарбонилпропил, 3-аминокарбонилпропил и тому подобное, предпочтительно аминокарбонилметил.
Низший алкилкарбонил (а12), представленный как Z1, включает ацетил, пропаноил, пропилкарбонил, бутилкарбонил, пентилкарбонил, гексилкарбонил, изопропилкарбонил и тому подобное, предпочтительно ацетил и пропаноил.
Примеры низшего алкокси-низшего алкилкарбонила (а13), представленного как Z1, включают метоксиметилкарбонил, метоксиэтилкарбонил, этоксиэтилкарбонил и тому подобное, предпочтительно метоксиметилкарбонил.
Примеры амино-низшего алкилкарбонила ((а14) и (b3)), представленного как Z1 и Z2, включают аминометилкарбонил, аминоэтилкарбонил, аминопропилкарбонил, аминобутилкарбонил и тому подобное, предпочтительно аминометилкарбонил и аминоэтилкарбонил.
Примеры арилкарбонила (а15), представленного как Z1, включают бензоил, нафтилкарбонил и тому подобное, предпочтительно бензоил.
Примеры арил-низшего алкилкарбонила (а16), представленного как Z1, включают бензилкарбонил, нафтилметилкарбонил, фенэтилкарбонил, фенилпропилкарбонил, фенилбутилкарбонил и тому подобное, предпочтительно бензилкарбонил и фенэтилкарбонил.
Примеры арил-низшего алкенилкарбонила (а17), представленного как Z1, включают фенилэтенилкарбонил, фенилпропенилкарбонил, фенилбутенилкарбонил и тому подобное, предпочтительно фенилэтенилкарбонил.
Примеры арилокси-низшего алкилкарбонила (а18), представленного как Z1, включают феноксиметилкарбонил, феноксиэтилкарбонил, феноксипропилкарбонил, феноксибутилкарбонил и тому подобное, предпочтительно феноксиметилкарбонил и феноксиэтилкарбонил.
Примеры гетероарилкарбонила (а19), представленного как Z1, включают фурилкарбонил, тиенилкарбонил, имидазолилкарбонил, тиазолилкарбонил, пиридилкарбонил, хинолилкарбонил и тому подобное, предпочтительно пиридилкарбонил, фурилкарбонил и тиенилкарбонил.
Примеры гетероарил-низшего алкилкарбонила (а20), представленного как Z1, включают фурилметилкарбонил, фурилэтилкарбонил, тиенилметилкарбонил, пиридилметилкарбонил, пиридилэтилкарбонил, пиридилпропилкарбонил и тому подобное, предпочтительно тиенилметилкарбонил и пиридилметилкарбонил.
Примеры гетероарил-низшего алкенилкарбонила (а21), представленного как Z1, включают пиридилакрилоил, имидазолилакрилоил и тому подобное, предпочтительно пиридилакрилоил.
Примеры гетероарилокси-низшего алкилкарбонила (а22), представленного как Z1, включают пиридилоксиметилкарбонил, хинолилоксиэтилкарбонил, тетрагидрохинолинонилоксиметилкарбонил, тетрагидрохинолинонилоксипропилкарбонил и тому подобное, предпочтительно тетрагидрохинолинонилоксиметилкарбонил и тетрагидрохинолинонилоксипропилкарбонил.
Примеры гетероарилсульфанил-низшего алкилкарбонила (а23), представленного как Z1, включают фурилсульфанилметилкарбонил, пиридилсульфанилэтилкарбонил, хинолилсульфанилпропилкарбонил и тому подобное, предпочтительно пиридилсульфанилметилкарбонил.
Примеры гетероариларилкарбонила (а24), представленного как Z1, включают пирролилфенилкарбонил, пиразолилфенилкарбонил, имидазолилфенилкарбонил, триазолилфенилкарбонил, тиенилфенилкарбонил, фурилфенилкарбонил, пиридилфенилкарбонил и тому подобное, предпочтительно пирролилфенилкарбонил, пиразолилфенилкарбонил и имидазолилфенилкарбонил, триазолилфенилкарбонил.
Примеры арилсульфанил-низшего алкилкарбонила (а25), представленного как Z1, включают фенилсульфанилметилкарбонил, фенилсульфанилэтилкарбонил, фенилсульфанилпропилкарбонил и тому подобное, предпочтительно фенилсульфанилметилкарбонил.
Примеры арилкарбонил-низшего алкилкарбонила (а26), представленного как Z1, включают бензоилметилкарбонил, бензоилэтилкарбонил, бензоилпропилкарбонил и тому подобное, предпочтительно бензоилэтилкарбонил.
Примеры ариламино-низшего алкилкарбонила (а27), представленного как Z1, включают фениламинометилкарбонил, фениламиноэтилкарбонил, фениламинопропилкарбонил и тому подобное, предпочтительно фениламинометилкарбонил.
Примеры низшего алкоксикарбонила ((а28) и (b2)), представленного как Z1 и Z2, включают метоксикарбонил, этоксикарбонил, пропоксикарбонил, бутоксикарбонил, пентилоксикарбонил, гексилоксикарбонил, изопропоксикарбонил и тому подобное. Среди них предпочтительными являются метоксикарбонил и трет-бутоксикарбонил.
Примеры низшего алкилсульфонила ((а29) и (b8)), представленного как Z1 и Z2, включают метилсульфонил, этилсульфонил, пропилсульфонил, бутилсульфонил и тому подобное. Среди них предпочтительным низшим алкилсульфонилом (а29), представленным как Z1, являются метилсульфонил или этилсульфонил; и предпочтительным низшим алкилсульфонилом (b8), представленным как Z2, являются этилсульфонил или пропилсульфонил.
Примеры арилсульфонила (а30), представленного как Z1, включают фенилсульфонил, толуолсульфонил, нафталинсульфонил и тому подобное, предпочтительно фенилсульфонил.
Примеры гетероарилсульфонила (а31), представленного как Z1, включают фурилсульфонил, тиенилсульфонил, пиридилсульфонил, имидазолилсульфонил и тому подобное, предпочтительно имидазолилсульфонил.
Низший алкил, содержащий насыщенный гетероцикл (а33), представленный как Z1, означает низший алкил, замещенный насыщенной гетероциклической группой. Примерами являются пирролидиноэтил, пиперидиноэтил, пиперидилэтил, морфолиноэтил, морфолинилметил и тому подобное, предпочтительно пиперидиноэтил и морфолиноэтил.
Карбонил-низший алкил, содержащий насыщенный гетероцикл (а34), представленный как Z1, означает карбонил-низший алкил, замещенный насыщенной гетероциклической группой. Примерами являются пирролидинокарбонилэтил, пиперидинокарбонилэтил, пиперидилкарбонилэтил, морфолинокарбонилэтил, морфолинилкарбонилэтил и тому подобное, предпочтительно пиперидинокарбонилметил.
Арил-низший алкил, содержащий насыщенный гетероцикл (а35), представленный как Z1, означает арил-низший алкил, содержащий насыщенную гетероциклическую группу в арильном кольце. Примерами являются пирролидинофенилэтил, пиперидинофенилметил, пиперидилфенилэтил, морфолинофенилэтил, морфолинилфенилметил, пиперазинофенилметил и тому подобное, предпочтительно пиперазинофенилметил.
Примеры карбонила, содержащего насыщенный гетероцикл ((а36) и (b7)), представленного как Z1 и Z2, включают пирролидинокарбонил, пиперидинокарбонил, пиперидилкарбонил, морфолинокарбонил, морфолинилкарбонил, пиперазинокарбонил, пиперазинилкарбонил, тиазолилкарбонил, пирролилкарбонил и тому подобное, предпочтительно пиперазинокарбонил, тиазолилкарбонил и пирролилкарбонил.
Примеры низшего алкилкарбонила, содержащего насыщенный гетероцикл ((а37) и (b5)), представленного как Z1 и Z2, включают пирролидиноэтилкарбонил, пиперидинометилкарбонил, пиперидиноэтилкарбонил, пиперидилметилкарбонил, морфолиноэтилкарбонил, морфолинилметилкарбонил, пиперазинометилкарбонил, пиперазинилпропилкарбонил, тиазолилметилкарбонил и тому подобное, предпочтительно пиперазинометилкарбонил, пиперидинометилкарбонил и пиперидиноэтилкарбонил.
Примеры арилкарбонила, содержащего насыщенный гетероцикл (а38), представленного как Z1, включают пирролидинофенилкарбонил, пиперидинофенилкарбонил, пиперидилфенилкарбонил, морфолинофенилкарбонил, морфолинилфенилкарбонил, тиоморфолинофенилкарбонил, пиперазинофенилкарбонил и тому подобное, предпочтительно пирролидинофенилкарбонил, морфолинилфенилкарбонил и тиоморфолинофенилкарбонил.
Примеры необязательного заместителя, включенного в каждую группу в качестве фрагмента группы, представленной выше как Z1, указаны как следующие.
Примеры низшего алкила включают метил, этил, пропил, бутил, пентил, гексил, изопропил, изобутил и тому подобное. Среди них предпочтительными являются метил, этил и изопропил.
Примеры низшего алкилкарбонила включают ацетил, пропаноил, бутаноил, бутилкарбонил, пентилкарбонил и тому подобное, предпочтительно ацетил.
Примеры атома галогена включают атомы фтора, хлора, брома и йода, предпочтительно атомы фтора и хлора.
Примеры низшего алкокси включают метокси, этокси, пропокси, бутокси, пентилокси, гексилокси, изопропокси и тому подобное. Среди них С1-4 алкокси является предпочтительным.
Примеры галоген-низшего алкокси включают хлорметокси, дихлорметокси, трихлорметокси, трифторметокси, 2,2,2-трифторэтокси и тому подобное, предпочтительно трифторметокси.
Примеры арила включают фенил, нафтил и тому подобное, предпочтительно фенил.
Примеры арилокси включают фенокси, нафтокси и тому подобное, предпочтительно фенокси.
Примеры дигалогенметилендиокси включают дифторметилендиокси, дихлорметилендиокси и тому подобное, предпочтительно дифторметилендиокси.
Примеры низшего алкоксикарбонила включают метоксикарбонил, этоксикарбонил, трет-бутоксикарбонил и тому подобное, предпочтительно метоксикарбонил.
Примеры низшего алкилкарбонилокси включают ацетокси, пропилкарбонилокси и тому подобное, предпочтительно ацетокси.
Примеры низшего алкиламино включают такой моно- или ди(низший алкил)амино, как метиламино, диметиламино, диэтиламино, диизопропиламино и тому подобное, предпочтительно диметиламино.
Примеры низшего алкилкарбониламино включают ацетиламино, пропиониламино и тому подобное, предпочтительно ацетиламино.
Примеры гидрокси-низшего алкила включают такой низший алкил, содержащий одну гидроксильную группу, как гидроксиметил, 1-гидроксиэтил, 2-гидроксиэтил, 1-гидроксипропил, 2-гидроксипропил, 3-гидроксипропил, 2-гидрокси-2-метилэтил и тому подобное, предпочтительно гидроксиметил или 2-гидроксиэтил.
Примеры галоген-низшего алкила включают такой низший алкил, содержащий 1-5 атомов галогена, как хлорэтил, дихлорметил, трифторметил, пентафторэтил и тому подобное, предпочтительно трифторметил.
Примеры галогенарила включают хлорфенил, дихлорфенил, фторфенил, дифторфенил, пентафторфенил, бромфенил, йодфенил, хлорнафтил и тому подобное, предпочтительно хлорфенил.
Примеры низшего алкилсульфанила включают метилсульфанил, этилсульфанил, пропилсульфанил и тому подобное, предпочтительно метилсульфанил.
Примеры аминогруппы, замещенной 1 или 2 низшими алкилами, входящей в состав аминоарил-низшего алкила (а3), амино-низшего алкила (а10), аминокарбонил-низшего алкила (а11) или амино-низшего алкилкарбонила (а14), включают диметиламинофенилэтил, диметиламиноэтил, диэтиламиноэтил, диизопропиламиноэтил, диметиламинокарбонилметил, диэтиламинометилкарбонил, диэтиламиноэтилкарбонил и тому подобное. Кроме того, примеры указанной аминогруппы, замещенной одним карбонилом, включают N-формиламинометилкарбонил, и примеры указанной аминогруппы, замещенной одним низшим алкилкарбонилом, включают ацетиламинометилкарбонил.
Примеры арила, замещенного атомом(-ами) галогена, где арил входит в состав арил-низшего алкила (а2), арилкарбонила (а15), арил-низшего алкилкарбонила (а16), арил-низшего алкенилкарбонила (а17), арилокси-низшего алкилкарбонила (а18), арилсульфонила (а30) и арил-низшего алкила, содержащего насыщенный гетероцикл (а35), включают хлорфенилкарбонил, дихлор(аминосульфонил)фенилкарбонил, хлорфенилметилкарбонил и фтор(4-метилпиперазино)фенилметил. Примеры арила, замещенного гидроксигруппой(-ами), включают гидроксифенилметил. Примеры арила, замещенного низшим алкилом(-ами), включают метилфенилкарбонил, метилфенилметилкарбонил, метилфеноксиметилкарбонил и метилфенилсульфонил. Примеры арила, замещенного низшей алкоксигруппой(-ами), включают метоксифенилметил, триметоксифенилметил, бутоксифенилметил, этоксифенилметил, метоксифенилкарбонил, метоксифенилметилкарбонил, метоксифеноксиметилкарбонил и метоксифенилсульфонил. Примеры арила, замещенного галоген-низшей алкоксигруппой(-ами), включают трифторметоксифенилметилкарбонил. Примеры арила, замещенного другим арилом(-ами), включают бифенил. Примеры арила, замещенного арилоксигруппой(-ами), включают феноксифенилметил и феноксифенилкарбонил. Примеры арила, замещенного метилендиоксигруппой(-ами), включают метилендиоксифенилметил и метилендиоксифенилкарбонил. Примеры арила, замещенного дигалогенметилендиоксигруппой(-ами), включают дифторметилендиоксифенилметил. Примеры арила, замещенного карбоксилом(-ами), включают гидроксикарбонилфенилметил. Примеры арила, замещенного низшим алкоксикарбонилом(-ами), включают метоксикарбонилфенилметил и метоксикарбонилфенилкарбонил. Примеры арила, замещенного низшей алкилкарбонилоксигруппой(-ами), включают метилкарбонилоксиметил и метилкарбонилоксифенилкарбонил. Примеры арила, замещенного нитрогруппой(-ами), включают нитрофенилкарбонил. Примеры арила, замещенного низшей алкиламиногруппой(-ами), включают диметиламинофенилкарбонил и диметиламинофенилэтенилкарбонил. Примеры арила, замещенного низшей алкилкарбониламиногруппой(-ами), включают ацетиламинофенилкарбонил. Примеры арила, замещенного аминосульфонилом(-ами), включают дихлор(аминосульфонил)фенилкарбонил.
Примеры гетероарила, замещенного атомом(-ами) галогена, где гетероарил входит в состав гетероарил-низшего алкила (а5), гетероарилкарбонила (а19), гетероарил-низшего алкилкарбонила (а20), гетероарил-низшего алкенилкарбонила (а21), гетероарилокси-низшего алкенилкарбонила (а22), гетероарилсульфанил-низшего алкилкарбонила (а23), гетероариларилкарбонила (а24) и гетероарилсульфонила (а31), включают хлортиенилметил, дихлоримидазолилметил и хлор(гидрокси)пиридилкарбонил. Примеры гетероарила, замещенного гидроксигруппой(-ами), включают гидроксипиридилкарбонил и хлор(гидрокси)пиридилкарбонил. Примеры гетероарила, замещенного низшим алкилом(-ами), включают метилтиазолилметил, н-гексилтетразолилметил, метилизоксазолилметил и метилимидазолилметил. Примеры гетероарила, замещенного гидрокси-низшим алкилом(-ами), включают гидроксиметилпиридилметил. Примеры гетероарила, замещенного галоген-низшим алкилом(-ами), включают трифторметилбензофуранилметил. Примеры гетероарила, замещенного арилом(-ами), включают фенилтиазолилметил и фенилимидазолилметил. Примеры гетероарила, замещенного галогенарилом(-ами), включают хлорфенилпирролилметил. Примеры гетероарила, замещенного низшим алкилсульфанилом(-ами), включают метилсульфанилпиридилкарбонил. Примеры гетероарила, замещенного аминокарбонилом(-ами), включают аминокарбонилпиразолилкарбонил. Примеры гетероарила, замещенного карбоксилом(-ами), включают гидроксикарбонилфурилметил и гидроксикарбонилтиенилметил.
Насыщенный гетероцикл, входящий в состав групп (а33)-(а38), может содержать определенный заместитель в атоме азота или атоме углерода (низший алкил или низший алкоксикарбонил в качестве заместителя по атому азота или оксогруппа в качестве заместителя по атому углерода). Среди них примерами предпочтительных групп являются следующие.
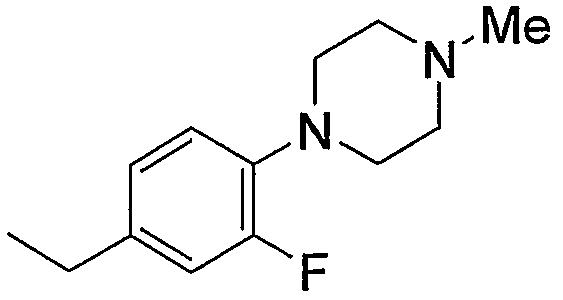
Примерами низшего алкила, содержащего насыщенный гетероцикл (а33), который дополнительно имеет низший алкил в атоме азота гетероцикла, являются
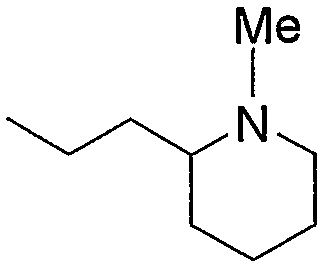
и тому подобное, в которых Ме означает метил, то же самое ниже.
Примерами арил-низшего алкила, содержащего насыщенный гетероцикл (а35), который дополнительно имеет один низший алкил в атоме азота гетероцикла, являются
и тому подобное.
Примерами карбонила, содержащего насыщенный гетероцикл (а36), который дополнительно имеет низший алкилкарбонил в атоме азота гетероцикла, являются
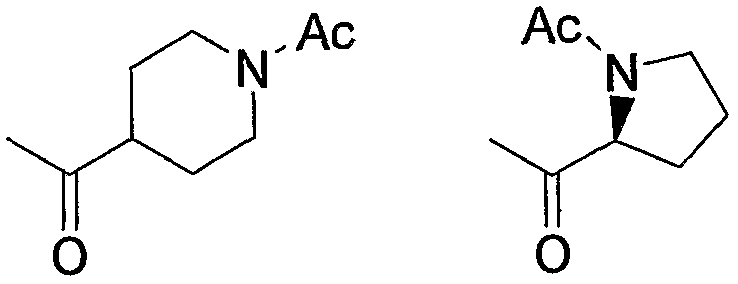
и тому подобное, в которых Ас означает ацетил, то же самое ниже.
Примерами карбонила, содержащего насыщенный гетероцикл (а36), который дополнительно имеет оксогруппу в атоме углерода гетероцикла, являются
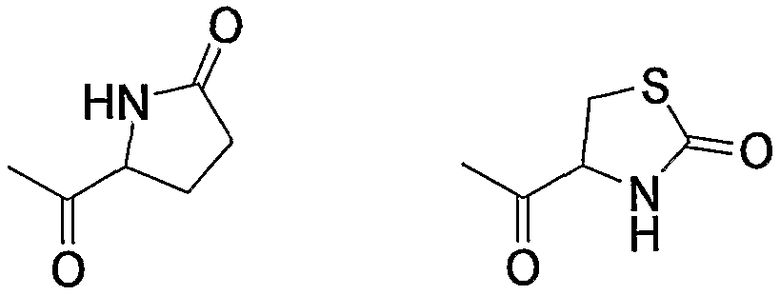
и тому подобное.
Примерами низшего алкилкарбонила, содержащего насыщенный гетероцикл (а37), который дополнительно имеет один низший алкил в атоме азота гетероцикла, являются
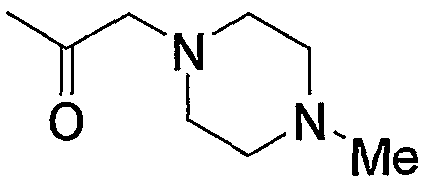
и тому подобное.
Примерами низшего алкилкарбонила, содержащего насыщенный гетероцикл (а37), который дополнительно имеет две оксогруппы в атоме углерода гетероцикла, являются
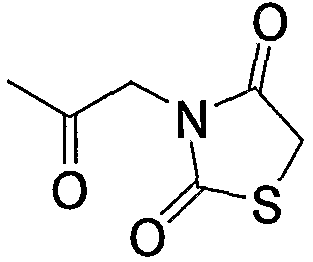
и тому подобное.
Примерами арилкарбонила, содержащего насыщенный гетероцикл (а38), который дополнительно имеет одну оксогруппу в атоме углерода гетероцикла, являются
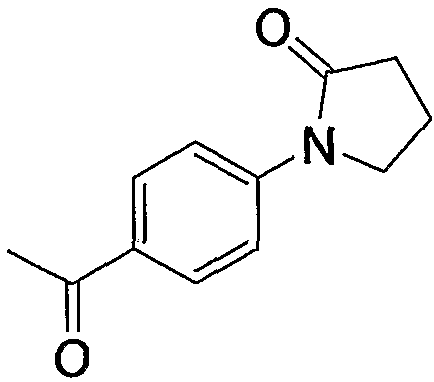
и тому подобное.
Среди каждой группы из (b1)-(b7), представленных как Z2, (b2), (b3), (b5) и (b7) уже были упомянуты выше.
Примеры низшего алкенилкарбонила (b4), представленного как Z2, включают акрилоил, метакрилоил, кротоноил, изокротоноил и тому подобное, предпочтительно акрилоил.
Примеры пиперидино-низшего алкилкарбонила, содержащего насыщенный гетероцикл (b6), представленного как Z2, включают пирролидинопиперидинометилкарбонил, пирролидинилпиперидиноэтилкарбонил, пиперидинопиперидинометилкарбонил, пиперидилпиперидиноэтилкарбонил, морфолинопиперидиноэтилкарбонил, пиперазинопиперидинопропилкарбонил и тому подобное, предпочтительно

Примеры низшего алкила, который необязательно замещен по аминогруппе, входящей в состав группы (b3), представленной как Z2, включают метил, этил, пропил, бутил, пентил или гексил, и такие их структурные изомеры, как изопропил. Среди них метил, этил и изопропил являются предпочтительными. Кроме того, примеры низшего алкила, который необязательно замещен по атому азота насыщенного гетероцикла, входящего в состав каждой группы (b5)-(b7), также являются теми же, что представлены выше. Предпочтительные примеры аминогруппы, содержащей указанный низший алкил, и группы, содержащей насыщенный гетероцикл, который имеет указанный низший алкил в атоме азота, соответственно представляют диметиламинометилкарбонил и 4-метилпиперазинокарбонил.
Примеры низшего алкокси (с2), представленного как Z3, включают метокси, этокси, трет-бутокси, н-бутокси и тому подобное, предпочтительно этокси и трет-бутокси.
Примеры амино-низшего алкиламино (с4), представленного как Z3, включают аминометиламино, аминоэтиламино, аминопропиламино, аминобутиламино и тому подобное, предпочтительно аминоэтиламино и аминопропиламино.
Примеры амино-низшего алкилпиперазино (с6), представленного как Z3, включают аминометилпиперазино, аминоэтилпиперазино, аминопропилпиперазино, аминобутилпиперазино и тому подобное, предпочтительно аминоэтилпиперазино и аминопропилпиперазино.
Примеры аминокарбонил-низшего алкилпиперазино (с7), представленного как Z3, включают аминокарбонилметилпиперазино, аминокарбонилэтилпиперазино, аминокарбонилпропилпиперазино, аминокарбонилбутилпиперазино и тому подобное, предпочтительно аминокарбонилметилпиперазино.
Примеры амино-низший алкил-1,4-диазепан-1-ила (с9), представленного как Z3, включают аминометил-1,4-диазепан-1-ил, аминоэтил-1,4-диазепан-1-ил, аминопропил-1,4-диазепан-1-ил, аминобутил-1,4-диазепан-1-ил и тому подобное, предпочтительно аминопропил-1,4-диазепан-1-ил.
Примеры амино-низшего алкиламинопиперидино (с12), представленного как Z3, включают аминометиламинопиперидино, аминоэтиламинопиперидино, аминопропиламинопиперидино, аминобутиламинопиперидино и тому подобное, предпочтительно аминоэтиламинопиперидино.
Примеры амино-низшего алкилпиперидино (с13), представленного как Z3, включают аминометилпиперидино, аминоэтилпиперидино, аминопропилпиперидино, аминобутилпиперидино и тому подобное, предпочтительно аминоэтилпиперидино.
Примеры аминогруппы, содержащей насыщенный гетероцикл (с15), представленного как Z3, включают пиперидиноамино, пиперидиламино, пиперазиноамино, пиперазиниламино, пирролидиниламино, морфолиниламино и тому подобное, предпочтительно пиперидиноамино и пиперазиноамино.
Примеры низшей алкиламиногруппы, содержащей насыщенный гетероцикл (с16), представленного как Z3, включают пиперидиноэтиламино, пиперидилметиламино, пирролидиноэтиламино, морфолинопропиламино, пиперазинопропиламино и тому подобное, предпочтительно пиперидиноэтиламино.
Примеры пиперазино, содержащего насыщенный гетероцикл (с17), представленного как Z3, включают пиперидилпиперазино, морфолинилпиперазино и тому подобное, предпочтительно пиперидилпиперазино.
Низший алкилпиперазино, содержащий насыщенный гетероцикл (с18), представленный как Z3, означает низший алкилпиперазино, замещенный насыщенным гетероциклом по его низшему алкилу. Примеры включают пирролидиноэтилпиперазино, морфолиноэтилпиперазино, пиперидиноэтилпиперазино, пиперидилэтилпиперазино, пиперидилметилпиперазино, 1,3-диоксоланилметилпиперазино, тетрагидрофурилметилпиперазино и тому подобное, предпочтительно пирролидиноэтилпиперазино, морфолиноэтилпиперазино, пиперидиноэтилпиперазино, пиперидилметилпиперазино.
Примеры карбонил-низшего алкилпиперазино, содержащего насыщенный гетероцикл (с19), представленного как Z3, включают пирролидинокарбонилметилпиперазино, пиперидинокарбонилэтилпиперазино и тому подобное, предпочтительно пирролидинокарбонилметилпиперазино.
Примеры низшего алкил-1,4-диазепан-1-ила, содержащего насыщенный гетероцикл (с20), представленного как Z3, включают морфолинопропил-1,4-диазепан-1-ил, пиперидиноэтил-1,4-диазепан-1-ил и тому подобное, предпочтительно морфолинопропил-1,4-диазепан-1-ил.
Примеры пиперидино, содержащего насыщенный гетероцикл (с21), представленного как Z3, включают пиперидинопиперидино, пиперазинопиперидино, морфолинопиперидино, морфолинилпиперидино и тому подобное, предпочтительно пиперидинопиперидино и пиперазинопиперидино.
Примеры низшего алкилморфолино, содержащего насыщенный гетероцикл (с22), представленного как Z3, включают пиперидинометилморфолино, пиперазинометилморфолино, 1,4-диазепан-1-илметилморфолино и тому подобное, предпочтительно пиперидинометилморфолино и пиперазинометилморфолино.
Предпочтительные примеры аминогруппы (с3) и аминогрупп, входящих в состав амино-низшего алкиламино (с4), амино-низшего алкилпиперазино (с6), аминокарбонил-низшего алкилпиперазино (с7), амино-низшего алкил-1,4-диазепан-1-ила (с9), аминопиперидино (с11), амино-низшего алкиламинопиперидино (с12), амино-низшего алкилпиперидино (с13), амино, содержащего насыщенный гетероцикл (с15), и низшего алкиламино, содержащего насыщенный гетероцикл (с16), которые замещены 1-2 заместителями, выбранными из группы, состоящей из низшего алкила, гидрокси-низшего алкила, арила, гетероарила, арил-низшего алкила, алкоксиарил-низшего алкила, гетероарил-низшего алкила, низшего алкилкарбонила и низшего алкоксикарбонила, приведены ниже.

В приведенных в качестве примера группах, представленных выше, Ph означает фенил, Вос означает трет-бутоксикарбонил, i-Pr означает изопропил, n-Pr означает н-пропил, и Et означает этил (тоже самое ниже).
Предпочтительные примеры аминогруппы, входящей в состав аминопиперидино (с11), которая замещена арил-низшим алкилкарбонилом, приведены ниже.
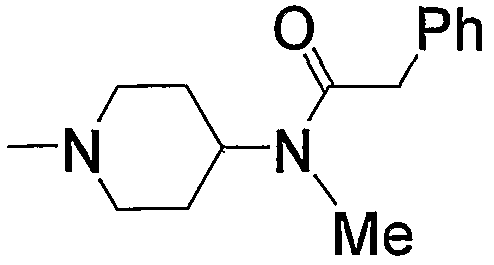
Предпочтительные примеры пиперазино (с5) и 1,4-диазепан-1-ила (с8), которые содержат любой из заместителей, выбранных из группы, состоящей из низшего алкила, гидрокси-низшего алкила, низший алкокси-низшего алкила, арила, низшего алкиларила, гидроксиарила, цианоарила, галогенарила, арил-низшего алкила, низший алкоксиарил-низшего алкила, галогенарилокси-низшего алкила, гетероарила, низшего алкилгетероарила, галоген-низшего алкилгетероарила, цианогетероарила, гетероарил-низшего алкила, низшего алкоксикарбонила и низшего алкилкарбонила, в положении 4 колец, приведены ниже.


В приведенных в качестве примера группах, представленных выше, ОМе означает метокси и O-t-Bu означает трет-бутокси (тоже самое ниже).
Предпочтительные примеры насыщенного гетероцикла, входящего в состав групп (с15)-(с22), который содержит любой из заместителей, выбранных из группы, состоящей из низшего алкила, арила, цианоарила, низшего алкилкарбонила, галоген-низшего алкиларила и арил-низшего алкила, в атоме азота в кольце, приведены ниже.
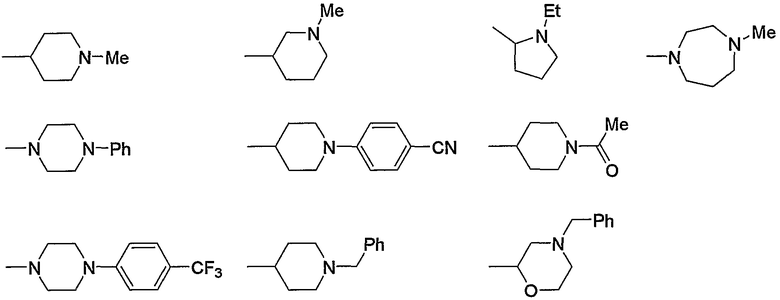
Предпочтительные примеры пиперазино (с5), пиперидино (с10) и насыщенного гетероцикла, входящих в состав групп (с15)-(с22), которые содержат любой из заместителей, выбранных из группы, состоящей из гидрокси, оксо, низшего алкила, гидрокси-низшего алкила, арила, арил-низшего алкила, аминокарбонила и низшего алкиламино, в атоме углерода кольца, приведены ниже.
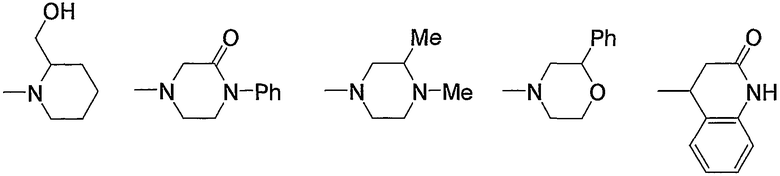
Предпочтительные примеры группы, содержащей заместитель(-и), выбранный из группы, состоящей из низшего алкила, арила, цианоарила, низшего алкилкарбонила, галоген-низшего алкиларила и арил-низшего алкила, в атоме азота насыщенного гетероцикла, входящего в состав групп (с15)-(с22), и предпочтительные примеры групп, содержащих заместители, выбранные из группы, состоящей из гидрокси, оксо, низшего алкила, гидрокси-низшего алкила, арила, арил-низшего алкила, аминокарбонила и низшего алкиламино, в атоме углерода насыщенного гетероцикла, приведены ниже.
Примеры амино, содержащего насыщенный гетероцикл (с15), который имеет заместитель в гетероцикле, включают
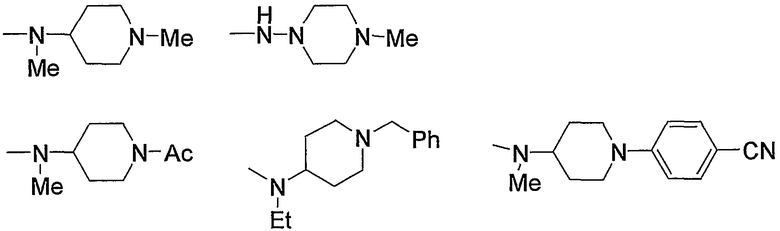
Примеры низшего алкиламино, содержащего насыщенный гетероцикл (с16), который имеет заместитель в гетероцикле, включают
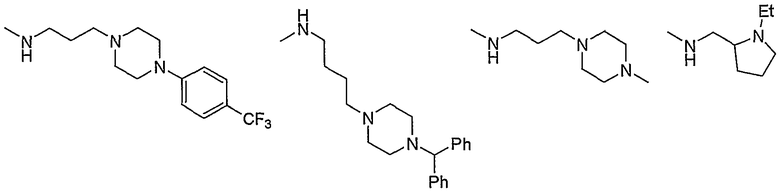
и тому подобное.
Примеры пиперазино, содержащего насыщенный гетероцикл (с17), который имеет заместитель в гетероцикле, включают
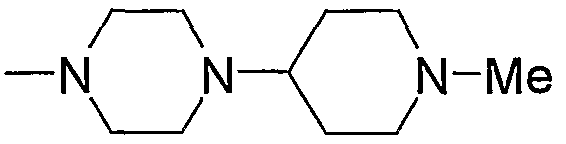
и тому подобное.
Примеры низшего алкилпиперазино, содержащего насыщенный гетероцикл (с18), который имеет заместитель в гетероцикле, включают
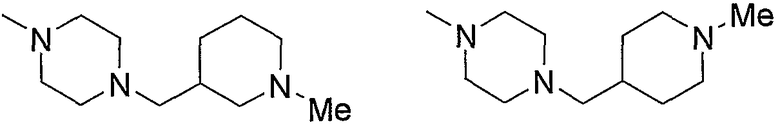
и тому подобное.
Примеры пиперидино, содержащего насыщенный гетероцикл (с21), который имеет заместитель в гетероцикле, включают
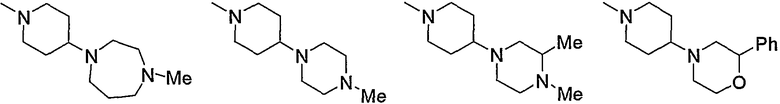
и тому подобное.
Примеры низшего алкилморфолино, содержащего насыщенный гетероцикл (с22), включают
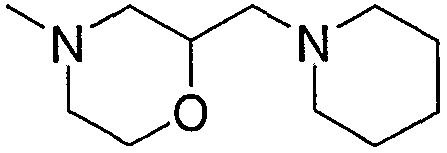
и тому подобное, и дополнительно примеры, имеющие заместитель в атоме азота гетероцикла, включают
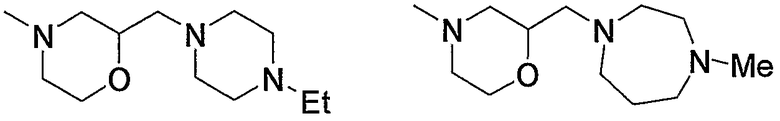
и тому подобное.
Предпочтительные соединения по изобретению, представленные указанной общей формулой (1), могут включать соединение, в котором R2 представляет метилен и R3 является атомом водорода или низшим алкилом.
Вторые предпочтительные соединения могут включать соединение, в котором R1 представляет низший алкилкарбонил, R2 является метиленом и R3 представляет группу (3) или группу (6). Среди таких соединений более предпочтительные соединения могут включать соединение, в котором R4 представляет низший алкилен и Z1 является любой группой, выбранной из (а2), (а14), (а15), (а28), (а32) и (а37).
Третьи предпочтительные соединения могут включать соединение, в котором R1 представляет низший алкилкарбонил, R2 является метиленом и R3 представляет группу (4), группу (5) или группу (7), при условии, что Z1 представляет низший алкоксикарбонил или атом водорода.
Четвертые предпочтительные соединения могут включать соединение, в котором R1 представляет низший алкилкарбонил, R2 является метиленом и R3 представляет группу (8).
Пятые предпочтительные соединения могут включать соединение, в котором R1 представляет атом водорода или низший алкилкарбонил, R2 является метиленом и R3 представляет группу (9), группу (10) или группу (11).
Шестые предпочтительные соединения могут включать соединение, в котором R1 представляет атом водорода или низший алкилкарбонил, R2 является метиленом и R3 представляет группу (9), группу (10) или группу (11), при условии, что Z3 представляет (с1), (с2), (с4), (с5), (с6), (с7), (с8), (с10), (с11), (с15), (с16), (с18), (с21) или (с22).
Седьмые предпочтительные соединения могут включать соединение, в котором R1 представляет ацетил, R2 является метиленом и R3 представляет группу (9), при условии, что Z3 представляет (с4), (с5), (с6), (с10), (с11), (с16), (с18), (с21) или (с22).
Примеры предпочтительных соединений по изобретению включают следующие соединения, приведенные в пп.1-19:
1) N-{4-[6-амино-5-циано-2-(пиридин-2-илметилсульфанил)пиримидин-4-ил]фенил}ацетамид,
2) N-{4-[6-амино-5-циано-2-(6-метилпиридин-2-илметилсульфанил)пиримидин-4-ил]фенил}ацетамид,
3) N-{4-[6-амино-5-циано-2-(6-{4-[2-(4-метилпиперазин-1-ил)ацетил]пиперазин-1-илметил}пиридин-2-илметилсульфанил)пиримидин-4-ил]фенил}ацетамид,
4) N-[4-(6-амино-5-циано-2-{6-[3-(4-метилпиперазин-1-ил)-3-оксопропил]пиридин-2-илметилсульфанил}пиримидин-4-ил)фенил]ацетамид,
5) 3-{6-[4-(4-ацетиламинофенил)-6-амино-5-цианопиримидин-2-илсульфанилметил]пиридин-2-ил}-N-(2-диметиламиноэтил)пропионамид,
6) 3-{6-[4-(4-ацетиламинофенил)-6-амино-5-цианопиримидин-2-илсульфанилметил]пиридин-2-ил}-N-(2-диметиламиноэтил)-N-метилпропионамид,
7) 3-{6-[4-(4-ацетиламинофенил)-6-амино-5-цианопиримидин-2-илсульфанилметил]пиридин-2-ил}-N-(2-диметиламинопропил)-N-метилпропионамид,
8) 3-{6-[4-(4-ацетиламинофенил)-6-амино-5-цианопиримидин-2-илсульфанилметил]пиридин-2-ил}-N-(2-метилпиперидин-1-илэтил)пропионамид,
9) 3-{6-[4-(4-ацетиламинофенил)-6-амино-5-цианопиримидин-2-илсульфанилметил]пиридин-2-ил}-N-(2-диэтиламиноэтил)пропионамид,
10) 3-{6-[4-(4-ацетиламинофенил)-6-амино-5-цианопиримидин-2-илсульфанилметил]пиридин-2-ил}-N-метил-N-(1-метилпиперидин-4-ил)пропионамид,
11) N-(4-{6-амино-2-[6-(3-[1,4']бипиперидинил-1'-ил-3-оксопропил)пиридин-2-илметилсульфанил]-5-цианопиримидин-4-ил}фенил)ацетамид,
12) N-[4-(6-амино-5-циано-2-{6-[3-оксо-3-(2-пиперидин-1-илметилморфолин-4-ил)пропил]пиридин-2-илметилсульфанил}пиримидин-4-ил)фенил]ацетамид,
13) N-{4-[6-амино-5-циано-2-(6-{3-[2-(4-этилпиперазин-1-илметил)морфолин-4-ил]-3-оксопропил}пиридин-2-илметилсульфанил)пиримидин-4-ил]фенил}ацетамид,
14) N-{4-[6-амино-5-циано-2-(6-{3-[4-(2-диэтиламиноэтил)пиперазин-1-ил]-3-оксопропил}пиридин-2-илметилсульфанил)пиримидин-4-ил]фенил}ацетамид,
15) N-{4-[6-амино-5-циано-2-(6-{3-[4-(2-диизопропиламиноэтил)пиперазин-1-ил]-3-оксопропил}пиридин-2-илметилсульфанил)пиримидин-4-ил]фенил}ацетамид,
16) N-{4-[6-амино-5-циано-2-(6-{3-оксо-3-[4-(2-пирролидин-1-илэтил)пиперазин-1-ил]пропил}пиридин-2-илметилсульфанил)пиримидин-4-ил]фенил}ацетамид,
17) N-{4-[6-амино-5-циано-2-(6-{3-[4-(2-морфолин-4-илэтил)пиперазин-1-ил]-3-оксопропил}пиридин-2-илметилсульфанил)пиримидин-4-ил]фенил}ацетамид,
18) N-{4-[6-амино-5-циано-2-(6-{3-[4-(2-диэтиламиноэтил)пиперазин-1-ил]-3-оксопропил}пиридин-2-илметилсульфанил)пиримидин-4-ил]фенил}ацетамид и
19) N-[4-(6-амино-5-циано-2-{6-[3-(4-метил-[1,4]диазепан-1-ил)-3-оксопропил]пиридин-2-илметилсульфанил}пиримидин-4-ил)фенил]ацетамид.
Некоторые соединения по изобретению могут иметь геометрические изомеры или таутомеры за счет присутствия заместителя, двойной связи, амидной связи и т.д. Настоящее изобретение включает все их отдельные изомеры и их смеси.
Кроме того, некоторые соединения по изобретению могут содержать асимметричные атомы углерода, следовательно, они могут иметь оптические изомеры за счет присутствия асимметричных атомов углерода. Настоящее изобретение включает все смеси оптических изомеров и отдельные изомеры.
Кроме того, настоящее изобретение включает меченное радиоактивным изотопом производное вышеуказанных соединений по изобретению.
Кроме того, соединения по изобретению включают их фармакологически приемлемые пролекарства. «Фармакологически приемлемое пролекарство» относится к соединению, содержащему группу (защитную группу), которую можно превратить в группу соединений по изобретению в результате сольволиза или физиологического действия и тому подобное. Группы, которые можно включить в пролекарства, известны (смотрите, например, Prog. Med., 5, 2157-2161, 1985; и «Pharmaceutical Research and Development», Vol. 7, p. 163-196, 1990 by Hirokawa Publishing Company). Такие группы можно превратить в такие функциональные группы, как -NH2, -OH и -СООН в результате упомянутого сольволиза и тому подобное. Например, такие соединения по изобретению, имеющие форму сложного этилового эфира, как соединение примера 43, можно превратить в соединение по изобретению, имеющее форму карбоновой кислоты, т.е. соединение примера 45, в условиях in vivo под действием эстеразы.
Кроме того, соединение по изобретению можно превратить в соль с использованием кислоты или основания с учетом типа заместителя. Настоящее изобретение включает такую соль, в частности, соль с фармацевтически приемлемой кислотой и основанием. Аддитивные соли кислоты включают, например, соли с такой неорганической кислотой, как соляная кислота, бромистоводородная кислота, йодистоводородная кислота, серная кислота, азотная кислота и фосфорная кислота; соли с такой органической кислотой, как муравьиная кислота, уксусная кислота, пропионовая кислота, щавелевая кислота, малоновая кислота, янтарная кислота, фумаровая кислота, малеиновая кислота, молочная кислота, яблочная кислота, лимонная кислота, винная кислота, угольная кислота, пикриновая кислота, метансульфоновая кислота, этансульфоновая кислота и глутаминовая кислота. Кроме того, примеры основания для образования соли включают такое неорганическое основание, как натрий, калий, магний, кальций и алюминий; такое органическое основание, как метиламин, этиламин, меглумин и этаноламин; и такую основную аминокислоту, как лизин, аргинин и орнитин. Соли с основанием также включают соли аммония. Такие соли можно получить обычными методиками.
Кроме того, настоящее изобретение также включает гидрат, сольват и полиморфную форму соединения по изобретению и его фармацевтически приемлемую соль.
Ниже подробно описано получение соединений по изобретению, включая их фармацевтически приемлемые соли (далее относятся к «соединению(-ям) по изобретению», если не указано иначе.
Соединения по изобретению можно получить различными известными способами с использованием соответствующих исходных соединений с учетом их основной структуры или типа заместителей. Затем в зависимости от типа функциональной группы в требуемом соединении может быть необходимым при производственном способе, чтобы функциональная группа в исходном соединении (или промежуточном соединении) была замещена на подходящую защитную группу, которая представляет группу, легко преобразуемую в функциональную группу. Такие функциональные группы включают -NH2, -OH, -СООН и тому подобное. Примеры защитных групп приводятся в руководстве Greene and Wuts, «Protective Groups in Organic Synthesis», 3rd edition, 1999 by John Wiley & Sons Inc. Реакцию замещения защитной группы можно определить в зависимости от типа защитной группы и согласно условиям реакции, описанным в руководстве. Кроме того, с использованием обычных способов, например, способов, описанных в руководстве, указанном выше, защитную группу, введенную реакцией замещения, представленной выше, можно удалить из соединения после получения требуемого соединения подходящей реакцией.
Соединения по изобретению можно получить способом, представленным на последующей схеме реакций 1.
Схема реакций 1
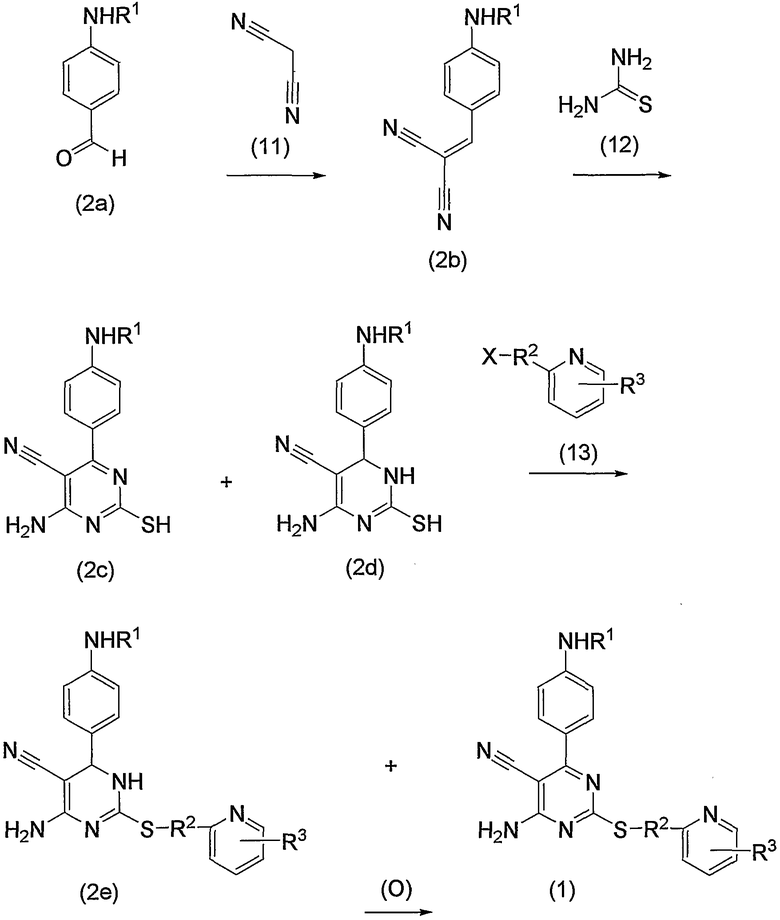
на которой R1, R2 и R3 имеют значения, определенные выше, при условии, что R1 не является атомом водорода. Х представляет атом галогена, алкилсульфонилокси или арилсульфонилокси.
Соединения (1) по изобретению можно получить из производного альдегида (соединение (2а)) через производное дицианоэтилена (соединение (2b)) и производное 2-меркаптопиримидина (соединение (2с)) или производное 2-меркаптодигидропиримидина (соединение (2d)).
Соединение (2а), используемое в настоящем описании в качестве исходного соединения, является известным соединением.
Кроме того, соединение (2d) включает изомер, который содержит двойную связь, различно расположенную в кольце.
Каждую из реакций, представленных на схеме реакций 1, можно провести способами, описанными в каждом источнике. Подробно последующий способ может быть возможным для проведения.
Прежде всего, соединение (2а) и малононитрил (11) можно подвергнуть взаимодействию по способу, описанному в источнике (например, смотрите W. S. Emerson, T. M. Patrick, J. Org. Chem., 790, 14, 1949). Т.е. соединение (2а) можно подвергнуть взаимодействию с эквимолярным или избыточным молярным количеством малононитрила (11) без растворителя или в таком инертном растворителе, как вода, диметилформамид (ДМФА), диметилсульфоксид (ДМСО), диэтиловый эфир, тетрагидрофуран (ТГФ), диоксан, ацетон, метилэтилкетон (МЭК), метанол, этанол, метиленхлорид, дихлорэтан и хлороформ, с получением соединения (2b). Предпочтительно указанную реакцию проводить в инертном растворителе, в частности, этаноле. Несмотря на то, что вышеуказанную реакцию можно проводить без какого-либо катализатора, предпочтительно можно использовать каталитическое или эквимолярное количество катализатора на один моль соединения (2а). Примеры катализатора включают такое органическое основание, как пиперидин или его соль, такую аминокислоту, как глицин, и соль аммония, такую как ацетат аммония. Среди них особенно предпочтительным основанием является пиперидин. Температура при проведении вышеуказанной реакции может быть от комнатной температуры до повышенной температуры, несмотря на то, используется какой-либо растворитель и катализатор или нет. В частности, комнатная температура является предпочтительной.
Затем соединение (2b) из вышеуказанной реакции можно превратить в соединение (2с) или соединение (2d), или их смесь взаимодействием с тиомочевиной (12). Данную реакцию можно провести способом, описанным в источнике (например, смотрите Daboun H.A.; El-Reedy A.M.; Z. Naturforsch., 1983, 38 (12), 1686). Подробнее реакцию можно проводить с эквимолярным или избыточным молярным количеством тиомочевины (12) на один моль соединения (2b) без растворителя или в таком инертном растворителе, как вода, ДМФА, ДМСО, диэтиловый эфир, ТГФ, диоксан, ацетон, МЭК, метанол, этанол, ацетонитрил, метиленхлорид, дихлорметан и хлороформ. В реакционную среду можно необязательно добавить такое основание, как карбонат калия, гидроксид натрия, ацетат натрия, метилат натрия, этилат натрия и триэтиламин. Предпочтительно указанную реакцию можно проводить в этаноле в присутствии этилата натрия. Температура при проведении вышеуказанной реакции может быть от комнатной температуры до повышенной температуры, предпочтительно температурой кипения растворителя.
Затем по схеме реакций 1 соединение (2с) или соединение (2d), или их смесь, которую получают из вышеуказанной реакции, можно подвергнуть взаимодействию с соединением (13) (т.е. замещенным пиридил-низшим алкилом, содержащим такую уходящую группу, как атом галогена, арилсульфонилокси, алкилсульфонилокси) с получением соединений по изобретению (1) или дигидропроизводного (2е), или их смеси. Данную реакцию можно проводить с использованием эквимолярного или избыточного молярного количества соединения (13) на один моль соединения (2с) или соединения (2d), или их смеси. Реакцию можно проводить без растворителя или в таком инертном растворителе, как ДМФА, ДМСО, диэтиловый эфир, ТГФ, диоксан, ацетон, МЭК, метанол, этанол, ацетонитрил, метиленхлорид, дихлорэтан и хлороформ. В реакционную среду, когда необходимо, можно дополнительно добавить такое основание, как карбонат калия, бикарбонат натрия, гидроксид натрия, ацетат натрия, метилат натрия, этилат натрия и триэтиламин. Среди указанных условий особенно предпочтительно проводить реакцию с использованием ДМФА в качестве реакционного растворителя и в присутствии бикарбоната натрия в качестве основания. Реакцию можно проводить при комнатной температуре или повышенной температуре, предпочтительно при комнатной температуре.
Соединение (13), которое используют в вышеуказанной реакции, включает новое соединение за счет типа группы R2 и группы R3. Такие новые соединения будут описаны ниже.
Кроме того, дигидропроизводное (2е) по изобретению, полученное из вышеуказанной реакции, может дать соединение (1) по изобретению окислением. Данную реакцию можно проводить без растворителя или в таком инертном растворителе, как ДМФА, ДМСО, диэтиловый эфир, ТГФ, диоксан, ацетон, МЭК, метанол, этанол, ацетонитрил, этилацетат, метиленхлорид, дихлорэтан и хлороформ, с использованием каталитического или избыточного молярного количества окислителя на один моль дигидропроизводного (2е), такого как DDQ (2,3-дихлор-5,6-дициано-п-бензохинон) и NBS (N-бромсукцинимид). Таким образом, можно получить соединения (1) по изобретению. Среди указанных условий особенно предпочтительно проводить реакцию с использованием этанола в качестве реакционного растворителя и в присутствии NBS, или с использованием диоксана в качестве реакционного растворителя и в присутствии DDQ. Реакцию можно проводить при температуре от комнатной до повышенной температуры, предпочтительно при температуре кипения растворителя.
Соединения по изобретению также можно получить способом, представленным на последующей схеме реакций 2.
Схема реакций 2
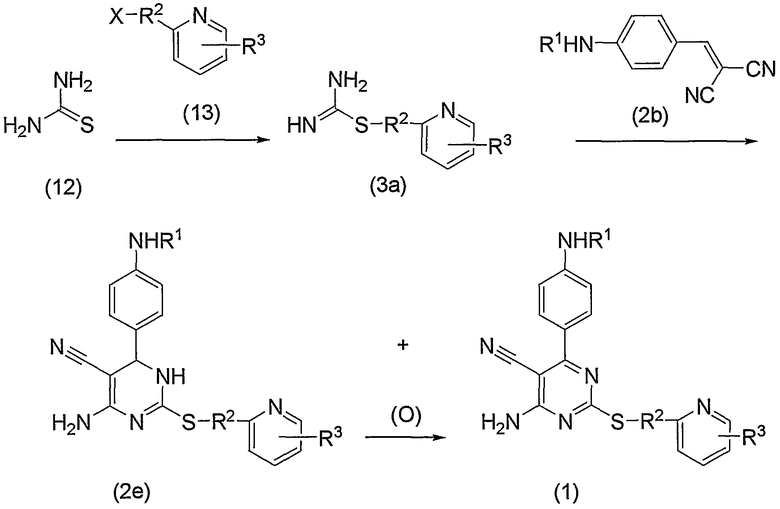
на которой R1, R2, R3 и Х имеют те же значения, определенные для схемы реакций 1, представленной выше, при условии, что R1 не является атомом водорода.
По схеме реакций 2 соединение (1) по изобретению можно получить взаимодействием соединения (3а), полученного в результате взаимодействия тиомочевины (12) и соединения (13), и соединения (2b) через соединение (2е). Следовательно, соединение (1) по изобретению можно получить в виде смеси с соединением (2е) через соединение (2е) (производное дигидропиримидина) вышеуказанной реакцией.
Соединение (13), используемое в настоящем описании в качестве исходного соединения, включает как известное соединение, так и новое соединение, представленное выше на схеме реакций 1. Такие новые соединения будут описаны ниже.
Кроме того, соединение (2b) можно получить взаимодействием соединения (2а) и соединения (11), представленного выше на схеме реакций 1.
Соединение (2е) включает изомер, имеющий двойную связь, различно расположенную в кольце.
В способе, представленном на схеме реакций 2, прежде всего, подвергают взаимодействию соединение (13) в эквимолярном или избыточном молярном количестве на один моль тиомочевины (12) без растворителя или в таком инертном растворителе, как вода, ДМФА, ДМСО, диэтиловый эфир, ТГФ, диоксан, ацетон, МЭК, метанол, этанол, ацетонитрил, метиленхлорид, дихлорэтан и хлороформ. Данную реакцию можно проводить способом синтеза с S-алкилизотиомочевинами, описанным Urquhart, G.G.; Gates, J. W. Jr.; Connor, R.; Org. Synth., 1941, 21, 36. В реакционную среду можно необязательно добавить такое основание, как карбонат калия, бикарбонат натрия, гидроксид натрия, ацетат натрия, метилат натрия, этилат натрия и триэтиламин, или такую минеральную кислоту, как соляная кислота или серная кислота, или такую органическую кислоту, как уксусная кислота. Предпочтительно реакционным растворителем является этанол. Реакцию можно проводить при температуре от комнатной до повышенной температуры, предпочтительно при повышенной температуре (в частности, примерно 60°С). Таким образом, можно получить соединение (3а) в виде свободного основания или соли.
Затем к полученному соединению (3а) (оно может быть в виде свободного основания или соли) добавляют соединение (2b) в эквимолярном или избыточном молярном количестве без растворителя или в таком инертном растворителе, как ДМФА, ДМСО, диэтиловый эфир, ТГФ, диоксан, ацетон, МЭК, метанол, этанол, ацетонитрил, метиленхлорид, дихлорэтан и хлороформ, и необязательно добавить эквимолярное или избыточное молярное количество такого основания, как карбонат калия, бикарбонат натрия, гидроксид натрия, ацетат натрия, метилат натрия, этилат натрия, триэтиламин и диизопропилэтиламин, в реакционную смесь для протекания реакции. Данную реакцию можно проводить способом, представленным в источнике (El-Sharabsy S.A.; Abdel Gawad S.M.; Hussain S.M.; J. Prakt. Chem., 1989, 331 (2), 207). В данной реакции этанол может быть примером предпочтительного растворителя. Кроме того, также предпочтительно добавить бикарбонат натрия в реакционную среду. Реакцию можно проводить при температуре от комнатной до повышенной температуры, предпочтительно при температуре кипения растворителя. Таким образом, можно получить соединение (1) по изобретению или дигидропроизводное (2е), или их смесь.
Дигидропроизводное (2е) по изобретению, полученное выше, можно превратить в соединения (1) по изобретению окислением, представленным выше на схеме реакций 1.
В способе схемы реакций 2 соединение (3а) получают из тиомочевины (12) и указанное соединение выделяют и затем данное соединение подвергают взаимодействию с соединением (2b). Однако без выделения соединения (3а) реакция, в которой соединение (2b) добавляют в реакционную среду в тех же условиях, может дать соединение (1) по изобретению или дигидропроизводное (2е), или их смесь.
Соединение по изобретению можно также получить способом, представленным на последующей схеме реакций 3.
Схема реакций 3
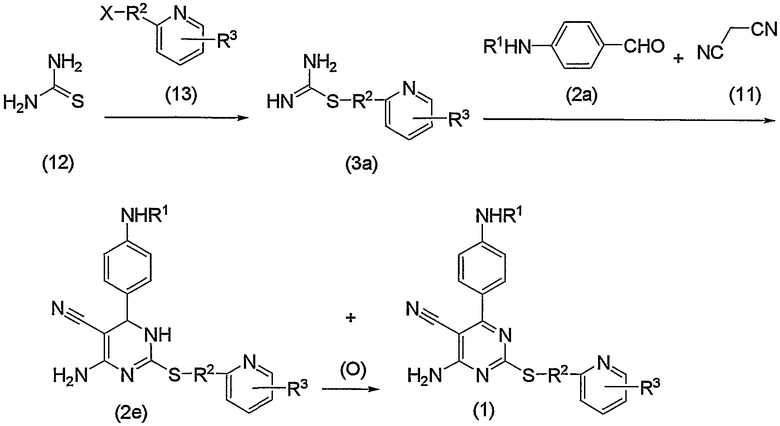
на которой R1, R2, R3 и Х имеют те же значения, определенные для схемы реакций 1, представленной выше, при условии, что R1 не является атомом водорода.
По схеме реакций 3, с или без выделения соединения (3а), полученного взаимодействием тиомочевины (12) и соединения (13), соединение (1) по изобретению или дигидропроизводное (2е), или их смесь можно получить одновременным взаимодействием соединения (3а) с соединением (2а) и малононитрилом (11).
Способ получения соединения (3а) представлен выше на схеме реакций 2. Взаимодействие соединения (3а) с соединением (2а) и малононитрилом (11) можно проводить следующим образом: соединение (3а) (оно может быть в виде свободного основания или соли) подвергают взаимодействию с эквимолярным или избыточным молярным количеством соединения (2а) и эквимолярным или избыточным молярным количеством малононитрила (11) в тех же условиях реакции, представленных выше на схеме реакций 2, с получением соединения (1) по изобретению или его дигидропроизводного (2е), или их смеси.
Дигидропроизводное (2е) по изобретению, полученное выше, можно превратить в соединение (1) по изобретению окислением, представленным выше на схеме реакций 1.
Кроме того, соединения по изобретению можно получить известными способами из соединений, полученных различными способами, представленными выше, в качестве исходных соединений, как описано ниже.
Соединение (13), которое используют в качестве исходного вещества, на вышеуказанных схеме реакций 1 - схеме реакций 3, включает новое соединение за счет типа группы R2 и группы R3. Например, данные соединения можно получить способами, представленными на последующих схеме реакций 4 - схеме реакций 9.
Схема реакций 4
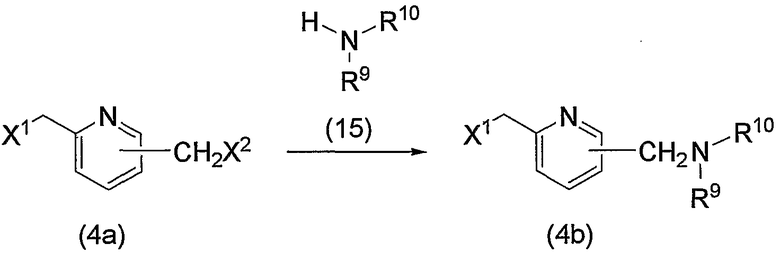
на которой Х1 и Х2 означают такие уходящие группы, как атом галогена, арилсульфонилокси, алкилсульфонилокси. Кроме того, -NR9R10 означает
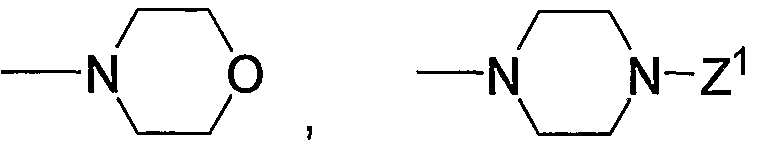 или
или 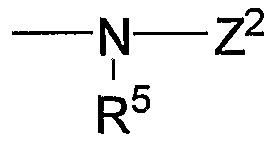
(в каждой группе Z1, Z2 и R5 имеют те же значения, определенные выше для общей формулы (1)).
По схеме 4 исходное соединение (соединение (4b)) по изобретению, в котором R2 представляет метилен, R3 является группой (3), группой (6) или группой (8), можно получить взаимодействием известного соединения (4а) и соединения (15).
При взаимодействии соединение (15), как правило, используют в эквимолярном или избыточном молярном количестве на один моль соединения (4а). Взаимодействие можно проводить без растворителя или в инертном растворителе, таком как ДМФА, ДМСО, диэтиловый эфир, ТГФ, диоксан, ацетон, МЭК, метанол, этанол, ацетонитрил, метиленхлорид, дихлорэтан и хлороформ. Необязательно реакционная среда может включать эквимолярное или избыточное молярное количество основания на один моль соединения (4а), такого как карбонат калия, бикарбонат натрия, гидроксид натрия, ацетат натрия, метилат натрия, этилат натрия, триэтиламин и диизопропилэтиламин. Таким образом, можно получить соединение (4b). Предпочтительно проводить данную реакцию с использованием этанола в качестве растворителя и с использованием молярного избытка соединения (15) на один моль соединения (4а) и при отсутствии основания. Температура реакции может быть от комнатной до повышенной температуры, предпочтительно это комнатная температура.
Схема реакций 5
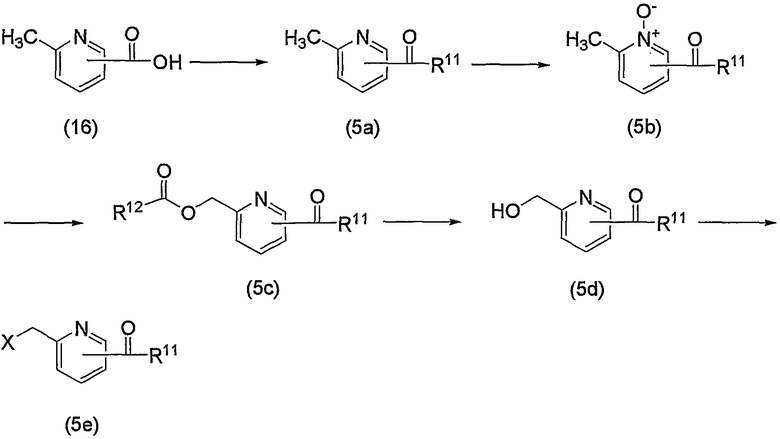
на которой R11 означает
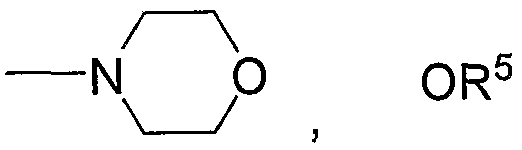 или
или 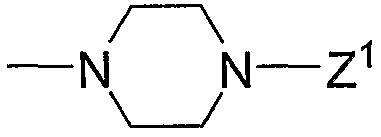
(в каждой группе R5 и Z1 имеют те же значения, определенные для общей формулы (1)), R12 представляет низший алкил, арил или галоген-низший алкил, и Х имеет то же значение, определенное для схемы реакций 1, представленной выше.
По схеме реакций 5 можно получить исходное соединение (соединение (5е)) по изобретению, в котором R2 представляет метилен, R3 является группой (4), группой (5) или группой (7). Каждую реакцию, представленную в данном способе, можно провести следующим образом. Т.е. соединение (5а), которое получают обычным способом из 6-метил-2-пиколиновой кислоты (16) (или 6-метил-3-пиколиновой кислоты, 6-метил-4-пиколиновой кислоты, 6-метил-5-пиколиновой кислоты) можно подвергнуть взаимодействию с эквимолярным или избыточным молярным количеством окислителя, такого как м-хлорпербензойная кислота (m-CPBA) или перекись водорода, в таком инертном растворителе, как диэтиловый эфир, ТГФ, диоксан, ацетонитрил, метиленхлорид, дихлорэтан и хлороформ с получением соединения (5b). Температура реакции может быть от 0°С до температуры кипения растворителя. В частности, предпочтительно проводить данную реакцию с использованием избыточного количества окислителя, такого как m-CPBA, в хлороформе, при комнатной температуре.
Затем к полученному соединению (5b) можно добавить эквимолярное или избыточное молярное количество такого ангидрида органической кислоты, как уксусный ангидрид, без растворителя или в таком инертном растворителе, как ДМФА, ДМСО, диэтиловый эфир, ТГФ, диоксан, ацетон, МЭК, метанол, этанол, ацетонитрил, метиленхлорид, дихлорэтан и хлороформ, и смесь можно подвергнуть взаимодействию при комнатной температуре или при нагревании с получением соединения (5с).
Кроме того, полученное соединение (5с) гидролизуют в таком инертном растворителе, как вода, диэтиловый эфир, ТГФ, диоксан, ацетон, МЭК, метанол, этанол, ацетонитрил, метиленхлорид, дихлорэтан и хлороформ, в присутствии эквимолярного или избыточного молярного количества такого основания, как гидроксид натрия, гидроксид калия, карбонат калия, бикарбонат натрия, ацетат натрия, метилат натрия и этилат натрия, при комнатной температуре или при нагревании, с получением соединения (5d). В частности, предпочтительно проводить данную реакцию в метаноле, с избытком гидроксида калия, при нагревании до кипения. Кроме того, соединение (5d), полученное в данной реакции, можно также получить непосредственно в одну стадию из соединения (5b). В данной реакции соединение (5b) можно подвергнуть взаимодействию с эквимолярным или избыточным молярным количеством трифторуксусного ангидрида в таком инертном растворителе, как диэтиловый эфир, ТГФ, диоксан, ацетон, МЭК, ацетонитрил, метиленхлорид, дихлорэтан и хлороформ, или без растворителя, и затем гидролизовать водой, метанолом, этанолом и тому подобное. Предпочтительно данную реакцию проводят с избытком трифторуксусного ангидрида, без растворителя, и затем добавляют метанол и смесь перемешивают.
В заключение взаимодействие соединения (5d) с соединением (5е) можно проводить тремя следующими способами.
Способ 1): соединение (5d) подвергают взаимодействию с эквимолярным или избыточным молярным количеством такого галогенирующего агента, как тионилхлорид, тионилбромид и оксалилхлорид, без растворителя или в таком инертном растворителе, как диэтиловый эфир, ТГФ, диоксан, ацетон, МЭК, ацетонитрил, метиленхлорид, дихлорэтан и хлороформ.
Способ 2): соединение (5d) подвергают взаимодействию с эквимолярным или избыточным молярным количеством такого алкилсульфонилхлорида, как метансульфонилхлорид, без растворителя или в таком инертном растворителе, как диэтиловый эфир, ТГФ, диоксан, ацетон, МЭК, ацетонитрил, метиленхлорид, дихлорэтан и хлороформ, в присутствии эквимолярного или избыточного молярного количества такого основания, как карбонат калия, бикарбонат натрия, гидроксид натрия, ацетат натрия, метилат натрия, этилат натрия, триэтиламин и диизопропилэтиламин.
Способ 3): соединение (5d) подвергают взаимодействию с эквимолярным или избыточным молярным количеством такого галогеналкила, как четыреххлористый углерод, хлороформ и четырехбромистый углерод, в присутствии эквимолярного или избыточного молярного количества такого лиганда фосфина, как трифенилфосфин и три(н-бутил)фосфин, в таком инертном растворителе, как диэтиловый эфир, ТГФ, диоксан, ацетон, МЭК, ацетонитрил, метиленхлорид, дихлорэтан и хлороформ.
Схема реакций 6
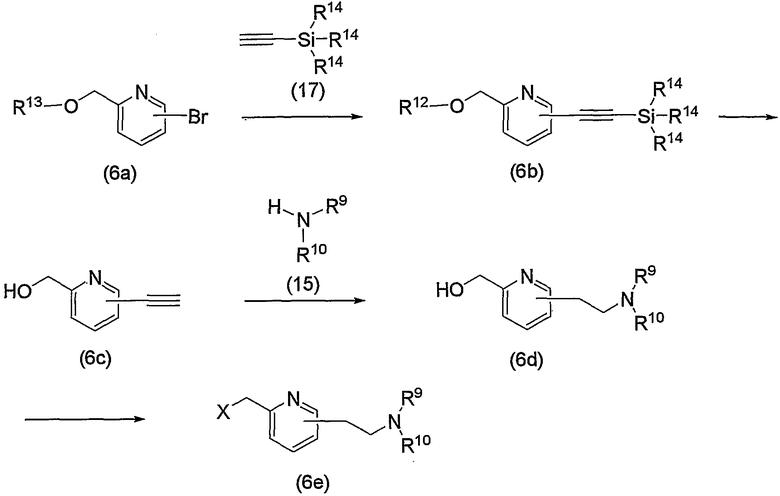
на которой R13 означает атом водорода или защитную группу, R14 является низшим алкилом. Х имеет те же значения, определенные для схемы реакций 1, представленной выше. R9 и R10 имеют те же значения, определенные для схемы реакций 4, представленной выше.
Защитная группа, упомянутая выше, которая представлена как R13, включает такую обычную защитную группу для спиртовой гидроксильной группы, как ацетил, метоксиметил и тетрагидропиранил.
По схеме реакций 6 можно получить соединение (6е), которое представляет исходное соединение по изобретению, в котором R4 представляет этилен, R3 является любой из группы (3), группы (6) и группы (8). Каждую реакцию, представленную в данном способе, можно проводить следующим образом, т.е. вначале соединение (6а) с или без защитной группы для гидроксильной группы сочетают с эквимолярным или избыточным молярным количеством триалкилсилилацетилена (17) в таком основании, как триэтиламин, в присутствии каталитического количества такого металлоорганического катализатора, как бис(трифенилфосфин)палладий(II) хлорид, и такого активатора, как йодид меди(I). Данная реакция может дать соединение (6b).
Затем соединение (6b) можно десилилировать в таком инертном растворителе, как ДМФА, ДМСО, диэтиловый эфир, ТГФ, диоксан, ацетон, МЭК, метанол, этанол, ацетонитрил, метиленхлорид, дихлорэтан и хлороформ, в присутствии эквимолярного или избыточного молярного количества такого основания, как карбонат калия и гидроксид натрия, с получением соединения (6с). В некотором случае защитную группу невозможно отщепить за счет отличия защитной группы R12. В данном случае защитную группу можно отщепить любым обычным способом.
Затем к полученному соединению (6с) добавляют эквимолярное или избыточное молярное количество соединения (15), без растворителя или в таком инертном растворителе, как ДМФА, ДМСО, диэтиловый эфир, ТГФ, диоксан, ацетон, МЭК, метанол, этанол, ацетонитрил, метиленхлорид, дихлорэтан и хлороформ, и смесь можно подвергнуть взаимодействию при температуре от 0°С до температуры кипения растворителя, необязательно в присутствии эквимолярного или избыточного молярного количества такого основания, как карбонат калия, бикарбонат натрия, гидроксид натрия, ацетат натрия, метилат натрия, этилат натрия, триэтиламин и диизопропилэтиламин, с получением соединения (6d). Предпочтительно проводить нагревание до кипения с молярным избытком соединения (15) в этаноле.
Наконец, соединение (6d) можно подвергнуть взаимодействию по тому же способу синтеза с соединением (5е), как представлено выше на схеме реакций 5, с получением соединения (6е).
Схема реакций 7
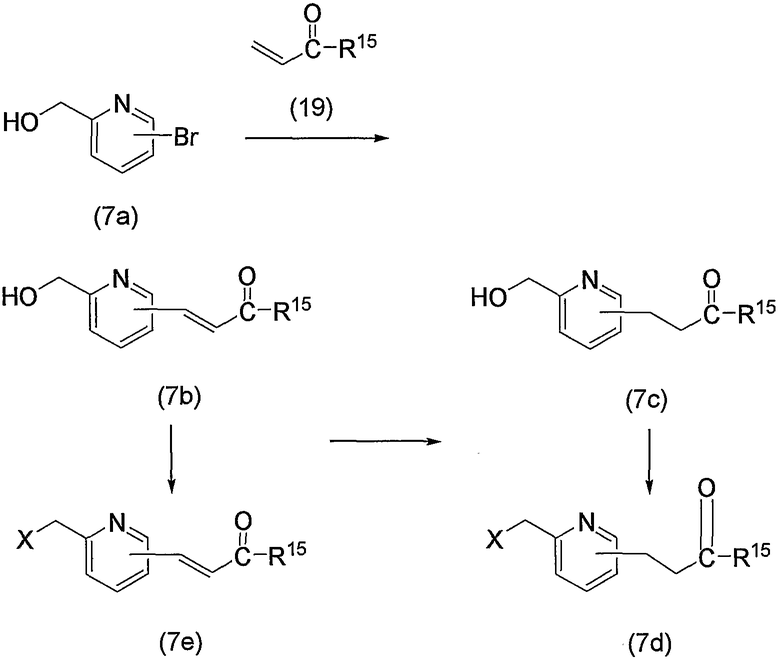
на которой R15 означает низший алкокси. Х имеет те же значения, определенные для схемы реакций 1, представленной выше.
По схеме реакций 7 можно синтезировать исходное соединение (соединение (7d)) по изобретению, в котором R2 представляет метилен, R3 представляет группу (9) и Z3 является (с2) низшим алкокси; и исходное соединение (соединение (7е)) по изобретению, в котором R2 представляет метилен, R3 представляет группу (10) и Z3 является (с2) низшим алкокси.
В данном способе, подробно представленном ниже, вначале соединение (7а) подвергают взаимодействию с эквимолярным или избыточным молярным количеством низшего алкилакрилата (19) с получением соединения (7b). Реакцию можно проводить двумя следующими способами.
Т.е. соединение (7а) подвергают взаимодействию с соединением (19), без растворителя или в таком инертном растворителе, как ДМФА, ДМСО, диэтиловый эфир, ТГФ, диоксан, ацетон, МЭК, метанол, этанол, ацетонитрил, метиленхлорид, дихлорэтан и хлороформ, необязательно в атмосфере такого инертного газа, как аргон и азот, в присутствии эквимолярного или избыточного молярного количества такого основания, как триэтиламин и диизопропилэтиламин, в присутствии каталитического или эквимолярного количества такого металлорганического катализатора, как ацетат палладия(II) и бис(трифенилфосфин)палладий хлорид, и в присутствии эквимолярного или избыточного молярного количества такого лиганда фосфина, как трифенилфосфин и три(о-толил)фосфин, и при комнатной температуре или при нагревании (реакция Хека) (способ 1).
Соединение (7а) подвергают взаимодействию с соединением (19) без растворителя или в таком инертном растворителе, как ДМФА, ДМСО, диэтиловый эфир, ТГФ, диоксан, ацетон, МЭК, метанол, этанол, ацетонитрил, метиленхлорид, дихлорэтан и хлороформ, необязательно в атмосфере такого инертного газа, как аргон и азот, в присутствии эквимолярного или избыточного молярного количества такого основания, как карбонат калия, бикарбонат натрия, гидроксид натрия, ацетат натрия, метилат натрия, этилат натрия, триэтиламин и диизопропилэтиламин, в присутствии эквимолярного или избыточного молярного количества такого межфазного катализатора, как хлорид тетра-(н-бутил)аммония и хлорид тетраметиламмония, в присутствии каталитического количества или эквимолярного количества такого металлоорганического катализатора, как ацетат палладия(II) и бис(трифенилфосфин)палладий хлорид, и необязательно в присутствии такого макродополнительного обезвоживающего реагента, как молярные сита, и при комнатной температуре или при нагревании (реакция Хека, условия Джеффри) (способ 2).
Среди них предпочтительным является способ 2, особенно реакция в атмосфере аргона в ДМФА, в присутствии эквимолярного количества хлорида тетра(н-бутил)аммония, молярного избытка бикарбоната натрия, молярного избытка молярных сит (например, «3А 1/16», смотрите Showa Kagaku Chemical Database) и каталитического количества ацетата палладия(II) при 80°С.
Затем полученное соединение (7b) можно подвергнуть взаимодействию с газообразным водородом при нормальном или повышенном давлении, в таком инертном растворителе, как ДМФА, ДМСО, диэтиловый эфир, ТГФ, диоксан, метанол, этанол, ацетонитрил и метиленхлорид, при комнатной температуре или при нагревании, в присутствии каталитического количества такого катализатора для гидрирования, как диоксид платины или палладий на угле, с получением соединения (7с). Среди данных реакций особенно предпочтительной является реакция с энергичным перемешиванием с газообразным водородом при нормальном или повышенном давлении (1-3 кгс/см2), в метаноле или этаноле, при комнатной температуре, в присутствии каталитического количества диоксида платины.
Соединение (7с), полученное выше, можно превратить в требуемое соединение (7d) тем же способом, каким получают соединение (5е) из соединения (5d), как представлено выше на схеме реакций 5.
Кроме того, указанное соединение (7b) можно подвергнуть взаимодействию тем же способом, каким получают соединение (5е) из соединения (5d), как представлено выше на схеме реакций 5, с получением соединения (7е).
Можно синтезировать исходное соединение по изобретению, в котором R2 представляет низший алкилен и R3 является группой (9), группой (10) или группой (12), когда используют соответствующее исходное соединение в способе, представленном на схеме реакций 7.
Схема реакций 8
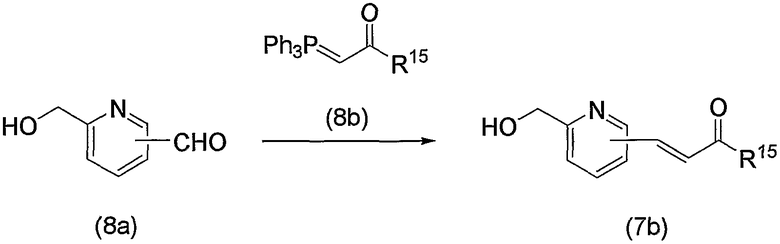
на которой R15 имеет те же значения, определенные для схемы реакций 7, представленной выше. Ph означает фенил.
Как представлено выше на схеме реакций 8, соединение (7b), приведенное на схеме реакций 7, можно также получить с использованием известного соединения (8а) в качестве исходного соединения реакцией Виттига (A. Maercher, OR, 14, 270 (1965) B.E. Maryanoff et al., CRV, 89, 863 (1989)) или реакцией Виттига-Хорнера (в реакции используется сложный эфир фосфоновой кислоты вместо соли фосфония в реакции Виттига).
В случае реакции Виттига требуемое соединение (7b) можно получить, когда соединение (8а) подвергают взаимодействию с эквимолярным или избыточным молярным количеством соединения (8b), без растворителя или в таком инертном растворителе, как ДМФА, диэтиловый эфир, ТГФ, диоксан, метанол, этанол, ацетонитрил, метиленхлорид, дихлорэтан и хлороформ, необязательно в такой инертной атмосфере, как аргон и азот, при 0°С, при комнатной температуре или при нагревании. Особенно предпочтительной является реакция с молярным избытком соединения (8b) в ДМФА. Реакцию Виттига-Хорнера можно проводить таким же образом с использованием соответствующего сложного фосфонатного эфира соединения (8b) вместо соединения (8b) и такого соответствующего основания, как метилат натрия.
Исходное соединение для соединения по изобретению, в котором R2 представляет низший алкилен и R3 является группой (9), группой (10) или группой (12), можно синтезировать, когда используют соответствующее исходное соединение в способе, представленном на схеме реакций 8.
Схема реакций 9
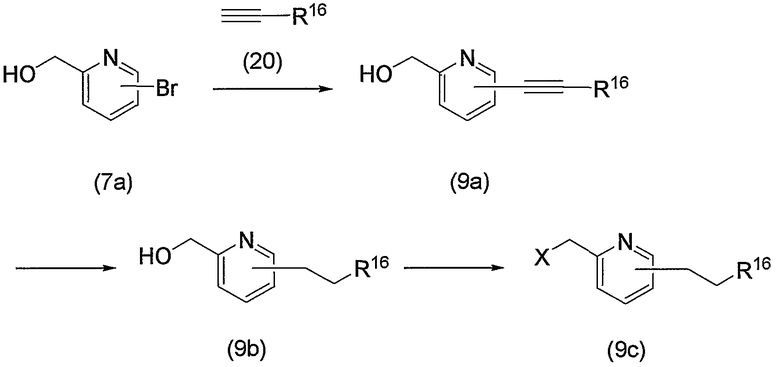
на которой R16 представляет атом водорода, или
в которых R17 представляет низший алкил.
Исходное соединение (соединение (9b)) для соединения по изобретению, в котором R2 представляет метилен и R3 является группой (2) низшим алкилом; исходное соединение (соединение (9а)) для соединения по изобретению, в котором R2 представляет метилен и R3 является группой (9), при условии, что Z3 представляет низший алкокси (с2); и исходное соединение (соединение (9с)) для соединения по изобретению, в котором R2 представляет метилен и R3 является группой (11), при условии, что Z3 представляет группу (с5), содержащую низший алкил в положении 4, можно получить способом, представленным на схеме реакций 9.
В данном способе вначале соединение (7а) сочетают с эквимолярным или избыточным молярным количеством производного алкина (20) с получением соединения (9а). Данную реакцию можно проводить в таком инертном растворителе, как ДМФА, ДМСО, диэтиловый эфир, ТГФ, диоксан, ацетон, МЭК, метанол, этанол, ацетонитрил, метиленхлорид, дихлорэтан и хлороформ, в присутствии эквимолярного или избыточного молярного количества такого основания, как триэтиламин, диизопропилэтиламин и трет-бутиламин, в присутствии каталитического количества такого металлоорганического катализатора, как тетракис(трифенилфосфин)палладий(0) и палладия(II) хлорид, и в присутствии такого активатора, как йодид меди(I), необязательно в атмосфере такого инертного газа, как аргон и азот, в присутствии такого антиоксиданта, как BHT (бутилгидрокситолуол). Особенно предпочтительной является реакция в атмосфере аргона в ДМФА, в присутствии молярного избытка трет-бутиламина, каталитического количества тетракис(трифенилфосфин)палладия(0), йодида меди(I) и BHT при 80°С.
Затем полученное соединение (9а) можно подвергнуть взаимодействию таким же способом, что использовали для превращения соединения (7b) в соединение (7с), как представлено выше на схеме реакций 7, с получением соединения (9b).
Далее, соединение (9b) подвергают взаимодействию таким же способом, что использовали для превращения соединения (5d) в соединение (5е), как представлено выше на схеме реакций 5, с получением требуемого соединения (9с).
Некоторые соединения по изобретению можно также получить различными известными способами синтеза из других соединений по изобретению, полученных вышеуказанными способами, в качестве исходного соединения, с использованием свойств, основанных на основной структуре и типе заместителя. Ниже способы получения соединений по изобретению, с помощью которых можно преобразовать настоящее соединение по изобретению в другое соединение по изобретению, представлены на последующих схемах.
Схема реакций 10
на которой R2 и R3 имеют те же значения, определенные для общей формулы (1). R1а означает низший алкилкарбонил. R1b представляет низший алкилкарбонил, низший алкенилкарбонил или фенилкарбонил.
Как представлено на схеме реакций 10, соединение по изобретению (соединение 1В), в котором R1 представляет атом водорода в общей формуле (1), можно получить, когда соединение (1А) по изобретению, в котором R1 представляет такой алкилкарбонил, как ацетил, подвергают взаимодействию с эквимолярным или избыточным молярным количеством такого основания, как карбонат калия, бикарбонат натрия, ацетат натрия, гидроксид натрия, гидроксид калия, метилат натрия и этилат натрия, или такой кислоты, как соляная кислота, серная кислота, уксусная кислота и лимонная кислота, в таком инертном растворителе, как вода, ДМФА, ДМСО, диэтиловый эфир, ТГФ, диоксан, ацетон, МЭК, метанол, этанол, ацетонитрил, метиленхлорид, дихлорэтан и хлороформ, и подвергают гидролизу. Реакцию гидролиза можно проводить при температуре от комнатной до повышенной. В частности, предпочтительно реакцию гидролиза проводить при перемешивании в смеси этанол-вода, с водным раствором соляной кислоты, при 80°С.
Соединение (1С) по изобретению, в котором R1 представляет низший алкилкарбонил, низший алкенилкарбонил и фенилкарбонил, можно синтезировать, когда соединение (1В) по изобретению, в котором R1 представляет атом водорода, подвергают взаимодействию с эквимолярным или избыточным молярным количеством такого ацилирующего агента, как хлорангидрид кислоты и сложный активный эфир, в таком инертном растворителе, как ДМСО, диэтиловый эфир, ТГФ, диоксан, ацетон, МЭК, ацетонитрил, метиленхлорид, дихлорэтан и хлороформ, в присутствии эквимолярного или избыточного молярного количества такого основания, как карбонат калия, бикарбонат натрия, ацетат натрия, гидроксид натрия, гидроксид калия, триэтиламин и диизопропилэтиламин, при 0°С, при комнатной температуре или при повышенной температуре.
В частности, предпочтительно проводить данную реакцию взаимодействием молярного избытка хлорангидрида кислоты в присутствии молярного избытка триэтиламина в ацетонитриле, при комнатной температуре.
Схема реакций 11
на которой R1, R2 и R4 имеют те же значения, определенные для общей формулы (1). Z1а означает (а12) низший алкилкарбонил или (а28) низший алкоксикарбонил. И Z1b имеет те же значения, определенные для Z1 в общей формуле (1), за исключением атома водорода, т.е. он представляет любую из групп, выбранных из (а1)-(а31) и (а33)-(а38) в общей формуле (1).
Как представлено на схеме реакций 11, соединение (1Е) по изобретению, в котором R3 представляет группу (6) и Z1 является (а32) атомом водорода в общей формуле (1), можно синтезировать, когда уходящая группа отщепляется от соединения (1D) по изобретению, в котором R3 представляет группу (6) и Z1 является группой (а12) или (а28), т.е. соединение содержит группу, которая отщепляется. Как уже подробно указывалось выше, соединение (1Е) можно получить, когда соединение (1D) по изобретению подвергают взаимодействию с эквимолярным или избыточным молярным количеством такого основания, как карбонат калия, бикарбонат натрия, ацетат натрия, гидроксид натрия, гидроксид калия, метилат натрия и этилат натрия, или такой минеральной кислоты, как соляная кислота и серная кислота, или такой органической кислоты, как уксусная кислота, трифторуксусная кислота и лимонная кислота, в таком инертном растворителе, как вода, ДМФА, ДМСО, диэтиловый эфир, ТГФ, диоксан, ацетон, МЭК, метанол, этанол, ацетонитрил, метиленхлорид, дихлорэтан и хлороформ, или без растворителя и подвергают гидролизу. Реакцию гидролиза можно проводить при 0°С, комнатной температуре или повышенной температуре. В частности, предпочтительно, чтобы соединение по изобретению, в котором Z1а представляет группу ВОС (трет-бутоксикарбонил), перемешивали в избытке трифторуксусной кислоты, при комнатной температуре, без растворителя.
Как представлено на схеме реакций 11, соединение (1F) по изобретению, в котором R3 представляет группу (6) и Z1 является любой из групп, выбранных из (а1)-(а31) и (а33)-(а38) в общей формуле (1), можно синтезировать из соединения (1Е) по изобретению, в котором R3 представляет группу (6) и Z1 является (а32) атомом водорода в общей формуле (1), согласно типу Z1, как следует.
Т.е. соединение (1Е) можно подвергнуть взаимодействию с эквимолярным или избыточным молярным количеством такого ацилирующего агента, как алкилкарбонилхлорид, арилкарбонилхлорид и сложный активный эфир, в таком инертном растворителе, как ДМФА, ДМСО, диэтиловый эфир, ТГФ, диоксан, ацетон, МЭК, ацетонитрил, метиленхлорид, дихлорэтан и хлороформ, в присутствии эквимолярного или избыточного молярного количества такого основания, как карбонат калия, бикарбонат натрия, ацетат натрия, гидроксид натрия, гидроксид калия, триэтиламин и диизопропилэтиламин, при 0°С, комнатной температуре или повышенной температуре, с получением соединения по изобретению, в котором Z1 представляет замещенную карбонильную группу (а12)-(а28) или (а36)-(а38). Предпочтительно проводить реакцию с молярным избытком замещенного карбонилхлорида в ацетонитриле, в присутствии триэтиламина.
Соединение (1Е) можно подвергнуть взаимодействию с эквимолярным или избыточным молярным количеством карбоновой кислоты, содержащей различные заместители, в таком инертном растворителе, как ДМСО, диэтиловый эфир, ТГФ, диоксан, ацетон, МЭК, ацетонитрил, метиленхлорид, дихлорэтан и хлороформ, в присутствии эквимолярного или избыточного молярного количества конденсирующего реагента, такого как DCC, WSC, BOP и DEPC, необязательно в присутствии эквимолярного или избыточного молярного количества активирующего агента, такого как HOSu, HOBt и HOOBt, с получением соединения по изобретению, в котором Z1 представляет замещенную карбонильную группу (а12)-(а28) или (а36)-(а38). Реакцию можно проводить при любой температуре, включая 0°С, комнатную температуру или повышенную температуру. В частности, предпочтительно проводить реакцию в присутствии WSC и HOBt, при комнатной температуре.
Соединение (1Е) можно подвергнуть взаимодействию с эквимолярным или избыточным молярным количеством такого сульфонилирующего реагента, как алкилсульфонилхлорид и арилсульфонилхлорид, в присутствии эквимолярного или избыточного молярного количества такого основания, как карбонат калия, бикарбонат натрия, ацетат натрия, гидроксид натрия, гидроксид калия, триэтиламин и диизопропилэтиламин, в таком инертном растворителе, как ДМФА, ДМСО, диэтиловый эфир, ТГФ, диоксан, ацетон, МЭК, ацетонитрил, метиленхлорид, дихлорэтан и хлороформ, с получением соединения по изобретению, в котором Z1 представляет любую из групп, выбранных из (а29)-(а31). Реакцию можно проводить при любой температуре, включая 0°С, комнатную температуру или повышенную температуру. В частности, предпочтительно проводить реакцию в присутствии молярного избытка диизопропилэтиламина в ДМФА, при комнатной температуре.
Соединение (1Е) можно подвергнуть взаимодействию с эквимолярным или избыточным молярным количеством такого алкилирующего реагента, как алкилгалогенид (например, алкилхлорид) и алкилметансульфонат, в присутствии эквимолярного или избыточного молярного количества такого основания, как карбонат калия, бикарбонат натрия, ацетат натрия, гидроксид натрия, гидроксид калия, триэтиламин и диизопропилэтиламин, в таком инертном растворителе, как ДМФА, ДМСО, диэтиловый эфир, ТГФ, диоксан, ацетон, МЭК, ацетонитрил, метиленхлорид, дихлорэтан и хлороформ, с получением соединения по изобретению, в котором Z1 представляет любую из групп, выбранных из (а1)-(а11) и (а33)-(а35). Реакцию можно проводить при любой температуре, включая 0°С, комнатную температуру или повышенную температуру. В частности, предпочтительно проводить реакцию в присутствии молярного избытка алкилирующего реагента, предпочтительно алкилгалогенида, в присутствии молярного избытка карбоната калия в ДМФА, при комнатной температуре.
Соединение (1Е) можно подвергнуть взаимодействию с эквимолярным или избыточным молярным количеством альдегида, содержащего соответствующий заместитель, в таком инертном растворителе, как ДМФА, ДМСО, диэтиловый эфир, ТГФ, диоксан, ацетонитрил, метиленхлорид, дихлорэтан, хлороформ, метанол и этанол, необязательно в присутствии каталитического количества или избыточного молярного количества такого катализатора, как уксусная кислота, с получением выделенного или невыделенного производного имина. И производное имина можно подвергнуть взаимодействию с эквимолярным или избыточным молярным количеством восстановителя на один моль такого соединения (1Е), как боргидрид натрия, цианоборгидрид натрия и диборан, с получением соединения по изобретению, в котором Z1 представляет любую из групп, выбранных из (а1)-(а11) и (а33)-(а35) (восстановительное алкилирование). Реакцию можно проводить при любой температуре, включая 0°С, комнатную температуру или повышенную температуру. Предпочтительно, чтобы соединение (1Е) подвергали взаимодействию с молярным избытком альдегида в присутствии 5-кратного количества уксусной кислоты и молярного избытка цианоборгидрида натрия в ДМФА, при комнатной температуре.
Соединение по изобретению, в котором R3 представляет группу (7) и Z1 является (а32) атомом водорода в общей формуле (1), и соединение по изобретению, в котором R3 представляет группу (8) и Z1 является (b1) атомом водорода в общей формуле (1), также можно синтезировать из соединения по изобретению, в котором R3 представляет группу (7) и Z1 является любой группой из (а12) и (а28) в общей формуле (1), и из соединения по изобретению, в котором R3 представляет группу (8) и Z2 является группой (b2) в общей формуле (1), в качестве исходного соединения, как аналогичная реакция для получения соединения (1Е) из соединения (1D), как представлено на схеме реакций 11.
Кроме того, соединение по изобретению, в котором R3 представляет группу (7) и Z1 является любой группой из (а1)-(а32) или (а33)-(а38) в общей формуле (1), и соединение по изобретению, в котором R3 представляет группу (8) и Z2 является любой группой из (b2)-(b8) в общей формуле (1), можно получить из соединения по изобретению, в котором R3 представляет группу (7) и Z1 является (а32) атомом водорода в общей формуле (1), и из соединения по изобретению, в котором R3 представляет группу (8) и Z2 является (b1) атомом водорода в общей формуле (1), в качестве исходного соединения, как аналогичная реакция для получения соединения (1F) из соединения (1E), как представлено на схеме реакций 11.
Схема реакций 12
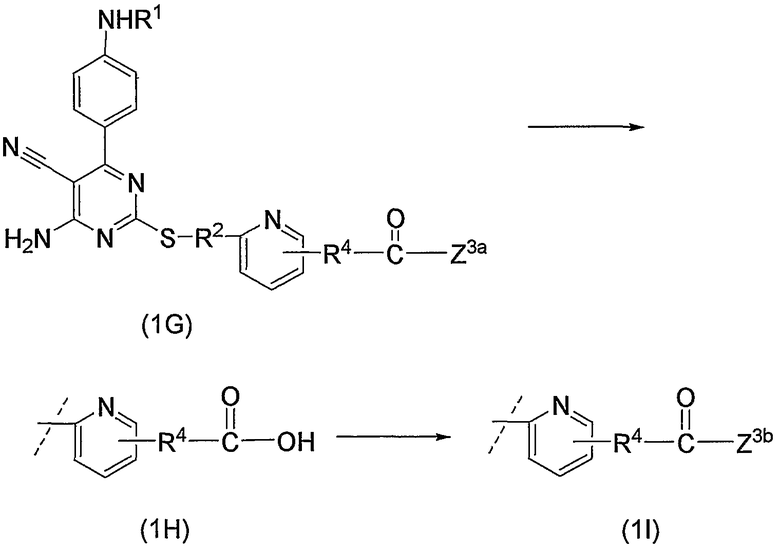
на которой R1, R2 и R4 имеют те же значения, определенные для общей формулы (1). Z3а означает (с2) низший алкокси. Z3b представляет группу Z3 в общей формуле (1), за исключением гидрокси и низшего алкокси, т.е. любую из групп (с3)-(с22) в общей формуле (1).
Как представлено на схеме реакций 12, соединение по изобретению (1Н), в котором R3 представляет группу (9) и Z3 является (с1) гидрокси, можно синтезировать из соединения (1G) по изобретению, в котором R3 представляет группу (9) и Z3 является низшим алкокси. Данную реакцию можно проводить, например, когда соединение (1G) по изобретению подвергают взаимодействию с эквимолярным или избыточным молярным количеством такого основания, как карбонат калия, бикарбонат натрия, ацетат натрия, гидроксид натрия, гидроксид калия, метилат натрия и этилат натрия, или такой минеральной кислоты, как соляная кислота и серная кислота, или такой органической кислоты, как уксусная кислота, трифторуксусная кислота и лимонная кислота, в таком инертном растворителе, как вода, ДМФА, ДМСО, диэтиловый эфир, ТГФ, диоксан, ацетон, МЭК, метанол, этанол, ацетонитрил, метиленхлорид, дихлорэтан и хлороформ, или без растворителя и подвергают гидролизу. Реакцию гидролиза можно проводить при 0°С, комнатной температуре или повышенной температуре. В частности, предпочтительно, чтобы соединение по изобретению, в котором Z3а представляет трет-бутокси, перемешивали в избытке трифторуксусной кислоты, при комнатной температуре, без растворителя.
Кроме того, как представлено на схеме реакций 12, соединение (1I) по изобретению, в котором R3 представляет группу (9) и Z3 является группой, выбранной из (с3)-(с22) в общей формуле (1), можно синтезировать из соединения (1Н) по изобретению, в котором R3 представляет группу (9) и Z3 является (с1) гидрокси. Как подробно указывалось выше, данный способ проводят, когда соединение (1Н) по изобретению подвергают взаимодействию с эквимолярным или избыточным молярным количеством амина или алифатического азотсодержащего гетероциклического соединения, содержащего подходящий заместитель, соответствующий требуемому Z3, в таком инертном растворителе, как ДМФА, ДМСО, диэтиловый эфир, ТГФ, диоксан, ацетон, МЭК, ацетонитрил, метиленхлорид, дихлорэтан и хлороформ, в присутствии эквимолярного или избыточного молярного количества такого конденсирующего реагента, как DCC, WSC, BOP и DEPC, необязательно в присутствии эквимолярного или избыточного молярного количества такого активирующего агента, как HOSu, HOBt и HOOBt. Таким образом, можно получить соединение (1I) по изобретению, в котором Z3 представляет группу, выбранную из (с3)-(с20). Реакцию можно проводить при любой температуре, включая 0°С, комнатную температуру или повышенную температуру. В частности, предпочтительно проводить реакцию в ДМФА или ацетонитриле, в присутствии BOP или WSC и HOBt, при комнатной температуре.
Соединение по изобретению, в котором R3 представляет группу (10) и Z3 является (с1) гидрокси в общей формуле (1), и соединение по изобретению, в котором R3 представляет группу (11) и Z3 является (с1) гидрокси в общей формуле (1), также можно синтезировать из соединения по изобретению, в котором R3 представляет группу (12) и Z3 является (с2) низшим алкокси в общей формуле (1), и соединения по изобретению, в котором R3 представляет группу (11) и Z3 является (с2) низшим алкокси в общей формуле (1), в качестве исходного соединения, как в аналогичной реакции для получения соединения (1Н) из соединения (1G), как представлено выше на схеме реакций 12.
Кроме того, соединение по изобретению, в котором R3 представляет группу (10) и Z3 является любой группой из (с3)-(с22) в общей формуле (1), и соединение по изобретению, в котором R3 представляет группу (11) и Z3 является любой группой из (с3)-(с22) в общей формуле (1), можно получить из соединения по изобретению, в котором R3 представляет группу (10) и Z3 является (с1) гидрокси в общей формуле (1), и соединения по изобретению, в котором R3 представляет группу (11) и Z3 является (с1) гидрокси в общей формуле (1), в качестве исходного соединения, как в аналогичной реакции для получения соединения (1I) из соединения (1H), как представлено выше на схеме реакций 12.
Требуемые соединения каждого способа, представленного выше на каждой схеме, и соединения по изобретению можно выделить или очистить в свободной форме или соли обычным способом. Способы такого выделения и очистки включают такие химические операции, как экстракция, концентрирование, перегонка, кристаллизация, фильтрование, перекристаллизация и различные типы хроматографии.
Когда соединение по изобретению представляет смесь изомеров, как указывалось выше, то каждый изомер можно выделить обычным способом с использованием различных физических свойств изомеров. Более подробно выделение стереохимически чистого изомера из рацемической смеси можно проводить обычным разделением рацемической смеси, в котором рацемические производные превращают в диастереоизомерные соли с помощью такой обычной оптически активной кислоты, как винная кислота, и затем разделить. Выделение изомера из диастереоизомерной смеси можно провести, например, фракционированной кристаллизацией и хроматографией. Кроме того, оптически активные соединения по изобретению можно также получить с использованием оптически активного исходного соединения.
Фармацевтические композиции по изобретению
Соединения по изобретению и их соли обладают агонистической активностью по отношению к рецептору аденозина А2а, и таким образом, они являются пригодными в качестве агониста рецептора аденозина А2а для млекопитающих, включая людей. Следовательно, настоящее изобретение также относится к фармацевтическим композициям в качестве лекарственного препарата, такого как агонист рецептора аденозина А2а.
Настоящую фармацевтическую композицию можно получить в виде обычной фармацевтической формы, включающей эффективное количество одного или более соединений, выбранных из группы, состоящей из соединений по изобретению и их солей, и некоторых фармацевтически приемлемых носителей. Фармацевтически приемлемые носители, используемые в фармацевтической композиции по изобретению, могут быть такими твердыми, как наполнитель, или такими жидкими, как разбавитель. Примеры данных носителей включают лактозу, стеарат магния, крахмал, тальк, желатин, агар, пектин, аравийскую камедь, оливковое масло, кунжутное масло, какао-масло, этиленгликоль и тому подобное.
Кроме того, фармацевтическую композицию можно получить в виде разовой лекарственной формы, пригодной для введения. Примеры включают твердую или жидкую форму для перорального введения, такую как таблетка, пилюля, капсула, гранула, порошок и жидкость, а также форму для парентерального введения, такую как инъекционный препарат (инъекционный препарат для внутривенного введения, инъекционный препарат для внутримышечного введения и т.д.), глазные капли, глазная мазь, суппозиторий, средство для всасывания через кожу и тому подобное. В частности, предпочтительной фармацевтической композицией являются глазные капли, поскольку предусматривается, что фармацевтическую композицию по изобретению можно использовать в качестве средства для снижения внутриглазного давления, лекарственного препарата для лечения глаукомы и тому подобное, основываясь на его агонистической активности по отношению к рецептору аденозина А2а.
Глазные капли можно приготовить обычным способом, например, при необязательном добавлении такого изотонического вещества, как хлорид натрия, глицерин; такого стабилизатора, как эдетат натрия; такого антисептика, как бензалкония хлорид и парабены; такого вещества для доведения рН, как динатрийфосфат, мононатрийфосфат, борная кислота, тетраборат натрия (боракс), соляная кислота и гидроксид натрия, к соединению по изобретению (включая его соль, то же самое ниже).
Такой твердый лекарственный препарат по настоящему изобретению для приема внутрь, как таблетка, порошок и гранула, можно приготовить смешением соединения по изобретению, по меньшей мере, с одним таким инертным носителем, как лактоза, маннит, глюкоза, гидроксипропилцеллюлоза, микрокристаллическая целлюлоза, крахмал, поливинилпирролидон, мета-кремниевая кислота и алюминат магния, и формированием смеси обычным способом. В препарат могут быть включены другие подходящие добавки, например, такое скользящее вещество, как стеарат магния; такой разрыхлитель, как кальциевая соль кармеллозы; такой стабилизатор, как лактоза; такое солюбилизирующее вещество, как глутаминовая кислота и аспарагиновая кислота; и тому подобное. Дополнительно можно включить подсластитель, вкусовое вещество, ароматизатор, антисептик и тому подобное. Таблетку или пилюлю можно покрыть оболочкой из такого сахара, как сахароза, желатин, гидроксипропилцеллюлоза и гидроксипропилметилцеллюлоза фталат, или оболочкой из внутрижелудочного или кишечного материала, когда это необходимо.
Такой жидкий лекарственный препарат по настоящему изобретению для приема внутрь, как эмульсия, раствор, суспензия, сироп и эликсир, можно приготовить растворением или распределением соединения по изобретению в таком в основном используемом инертном разбавителе, как очищенная вода и этанол. Жидкий лекарственный препарат может также содержать такое вспомогательное вещество, как смачивающее вещество и суспендирующее вещество, подсластитель, вкусовое вещество, ароматизатор, антисептик и тому подобное.
Инъекционный препарат для парентерального введения включает асептический водный или неводный раствор, суспензию, эмульсию и тому подобное, и водный раствор или суспензию можно приготовить обычным способом, например, с использованием дистиллированной воды для инъекций и физиологического раствора в качестве разбавителя. Неводный раствор или суспензию можно приготовить обычным способом, например, с использованием пропиленгликоля, полиэтиленгликоля или такого растительного масла, как оливковое масло; таких спиртов, как этанол; такого разбавителя или носителя, как полисорбат 80. Раствор или суспензия могут дополнительно содержать такое вспомогательное вещество, как антисептик, смачивающее вещество, эмульгатор, диспергирующее вещество, стабилизатор (например, лактоза) и солюбилизирующее средство (например, глутаминовая кислота и аспарагиновая кислота). Инъекционный препарат стерилизуют обычным способом, например, фильтрованием через фильтр для удаления бактерий, добавлением противобактериального препарата или облучением, например, гамма-лучами. Кроме того, инъекционный препарат можно также приготовить в виде препарата, который готовится непосредственно перед применением, когда приготовленный асептический твердый лекарственный препарат растворяют в асептической воде или асептическом растворителе для инъекций перед применением.
Дозировки фармацевтической композиции по настоящему изобретению в каждой лекарственной форме будут определяться в каждом случае в зависимости от состояния пациентов, которым вводят фармацевтическую композицию (субъекты для введения), возраста, пола и тому подобное. Как правило, дозу глазных капель, которые включают фармацевтическую композицию по настоящему изобретению, можно определить, как такое количество, чтобы глазные капли, содержащие активное соединение в концентрации 0,0001-10% (масс./об.), закапывали или наносили от одного до нескольких раз в сутки. Количество глазных капель для одного применения обычно составляет примерно 0,001-1 мл для взрослого человека.
В случае лекарственного препарата для приема внутрь или инъекционного препарата фармацевтической композиции по изобретению дозу можно определить таким образом, чтобы соединение по изобретению вводили в количестве 0,001-1000 мг в сутки для взрослого человека. Суточную дозу можно вводить один раз в день, но предпочтительно разделить ее на несколько введений. Вышеуказанная доза является только указанием, и следовательно, ее можно увеличить или снизить. Как уже указывалось выше, является полезным определять используемую дозировку каждый раз в зависимости от различных состояний. Следовательно, в зависимости от состояний, пониженная доза может по-прежнему обеспечивать достаточные эффекты.
Промышленная применимость
Соединения по изобретению проявляют активирующее действие в отношении рецептора аденозина А2а (т.е. агонистическую активность по отношению к рецептору аденозина А2а) и являются пригодными для профилактики и/или лечения глаукомы и глазной гипертензии за счет его снижающего внутриглазное давление действия.
Ниже настоящее изобретение проиллюстрировано ссылочными примерами для получения исходных соединений и примерами для получения соединений по изобретению, а также опытами фармакологических тестов, но их не следует рассматривать в качестве ограничивающих.
Спектры ядерно-магнитного резонанса (ЯМР) в примерах, приведенных ниже, определяли в следующих условиях. Сокращенные обозначения определены следующим образом.
Аппаратура: JNM-AL300 (JEOL)
Внутренний стандарт: TMС
с: синглет, д: дублет, т: триплет, кв: квартет, квинт: квинтет, секст: секстет
В примерах использованы следующие сокращения:
IPE: изопропиловый эфир
WSC: 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорид
LiAlH4: алюмогидрид лития
ТГФ: тетрагидрофуран
TBAF: тетрабутиламмоний фторид
Раствор TBAF/ТГФ: смесь тетрабутиламмония фторида и тетрагидрофурана
ДМФА: N,N-диметилформамид
HOBt: 1-гидроксибензотриазол
m-CPBA: м-хлорпербензойная кислота
EtOH: этанол
NBS: N-бромсукцинимид
DDQ: 2,3-дихлор-5,6-дициано-п-бензохинон
ДМСО: диметилсульфоксид
BOP и реагент BOP: бензотриазол-1-илокситрис(диметиламино)фосфоний гексафторфосфат
ТФА: трифторуксусная кислота.
Ссылочный пример 1
Метил (4-формилфенил)карбамат (560 мг) и малононитрил (206 мг) растворяли в 10 мл этанола и к полученному раствору добавляли одну каплю пиперидина, и затем смесь перемешивали при комнатной температуре в течение 3 часов. К реакционной смеси добавляли IPE (10 мл) и выпавшие в осадок кристаллы отфильтровывали с получением 441 мг метил [4-(2,2-дициановинил)фенил]карбамата в виде порошка желтого цвета.
1Н-ЯМР (CDCl3) δ: 7,90 (2Н, д, J=8,7 Гц), 7,65 (1Н, с), 7,56 (2Н, д, J=8,7 Гц), 6,92 (1Н, шир. с), 3,83 (3Н, с).
Ссылочный пример 2
К 20 мл абсолютного этанола добавляли небольшими порциями 250 мг металлического натрия. После полного растворения к указанному раствору добавляли 760 мг тиомочевины и смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли 2,11 г N-[4-(2,2-дициановинил)фенил]ацетамида и смесь кипятили с обратным холодильником в течение 3 часов. Затем растворитель удаляли при пониженном давлении из реакционной смеси, остаток растворяли в 30 мл воды. Кроме того, смесь подкисляли добавлением уксусной кислоты небольшими порциями, к этому добавляли 30 мл этилацетата и затем раствор перемешивали в течение ночи. Отфильтровывание выпавшего в осадок вещества давало 1,2 г N-[4-(6-амино-5-циано-2-меркапто-2,3-дигидропиримидин-4-ил)фенил]ацетамида в виде порошка белого цвета.
1Н-ЯМР (ДМСО-d6) δ: 9,98 (1Н, с), 9,65 (1Н, шир. с), 7,56 (2Н, д, J=8,7 Гц), 7,14 (2Н, д, J=8,7 Гц), 6,16 (2Н, с), 4,92 (1Н, с), 2,08 (3Н, с).
Ссылочный пример 3
2,6-бис(бромметил)пиридин (265 мг) суспендировали в 2 мл этанола, к полученной смеси добавляли 87 мг морфолина при 0°С и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении и остаток очищали хроматографией на силикагеле (смесь метиленхлорид-этанол-триэтиламин = 400:20:1 (об./об., то же самое ниже)) с получением 90 мг 4-(6-бромметилпиридин-2-илметил)морфолина в виде порошка белого цвета.
1Н-ЯМР (CDCl3) δ: 10,0 (1H, с), 7,54-7,48 (2H, м), 7,42 (1H, с), 7,24 (1H, с), 4,08 (2H, т, J=6,0 Гц), 3,56 (2H, т, J=4,5 Гц), 2,49 (2H, т, J=7,2 Гц), 2,42-2,34 (4H, м), 1,89 (2H, квинт, J=6,6 Гц).
Ссылочный пример 4
1) В круглодонную колбу добавляли 2,3 г 6-бромпиридин-2-илметилацетата, 1,18 г триметилсилилацетилена, 210 мг бис(трифенилфосфин)палладия(II) хлорида, 114 мг йодида меди(I) и 12 мл триэтиламина, и затем смесь кипятили с обратным холодильником в атмосфере аргона в течение 5 часов. После охлаждения смесь концентрировали досуха при пониженном давлении, к полученному остатку добавляли воду и смесь экстрагировали этилацетатом. Органический слой концентрировали при пониженном давлении, к остатку добавляли 7 мл метанола и 30 мл 1 н. водного раствора гидроксида калия и смесь перемешивали в течение 1 часа. Реакционную смесь подкисляли 1 н. раствором соляной кислоты и концентрировали при пониженном давлении. Сконцентрированный раствор подщелачивали карбонатом калия и экстрагировали этилацетатом. Органический слой промывали насыщенным раствором соли, высушивали над безводным сульфатом магния и затем растворитель удаляли при пониженном давлении. Продукт очищали хроматографией на силикагеле (смесь гексан-этилацетат = 4:1) с получением 212 мг (6-этинилпиридин-2-ил)метанола в виде порошка белого цвета.
1Н-ЯМР (CDCl3) δ: 7,67 (1H, т, J=7,8 Гц), 7,40 (1H, д, J=7,8 Гц), 7,28 (1H, д, J=7,8 Гц), 4,76 (2H, д, J=5,1 Гц), 3,38 (1H, т, J=5,1 Гц), 3,18 (1H, с).
2) (6-этинилпиридин-2-ил)метанол (320 мг) и морфолин (1 г) растворяли в 3 мл этанола, и раствор кипятили с обратным холодильником в атмосфере аргона в течение 24 часов. После охлаждения реакционной смеси этанол удаляли при пониженном давлении и остаток подщелачивали водным раствором гидроксида натрия и экстрагировали хлороформом. Органический слой промывали насыщенным раствором соли, высушивали над безводным сульфатом магния и растворитель удаляли. Остаток очищали хроматографией на силикагеле (смесь хлороформ-метанол-водный аммиак = 200:10:1) с получением 122 мг [6-(2-морфолин-4-илэтил)пиридин-2-ил]метанола в виде масла желтого цвета.
1Н-ЯМР (CDCl3) δ: 7,60 (1H, т, J=7,8 Гц), 7,08 (1H, д, J=7,8 Гц), 7,03 (1H, д, J=7,8 Гц), 4,72 (2H, с), 3,73 (4H, т, J=4,5 Гц), 3,00 (2H, дд, J=10, 8,7 Гц), 2,77 (2H, дд, J=10, 8,7 Гц), 2,53 (4H, т, J=4,5 Гц).
3) [6-(2-морфолин-4-илэтил)пиридин-2-ил]метанол (122 мг) и диизопропилэтиламин (104 мг) растворяли в 2,5 мл дихлорметана и к раствору добавляли по каплям 47 мкл метансульфонилхлорида при 0°С и затем смесь перемешивали при комнатной температуре в течение ночи. После удаления растворителя из реакционной смеси при пониженном давлении, остаток очищали хроматографией на силикагеле (смесь хлороформ-метанол-водный аммиак = 300:10:1) с получением 80 мг 4-[2-(6-хлорметилпиридин-2-ил)этил]морфолина в виде масла желтого цвета.
1Н-ЯМР (CDCl3) δ: 7,62 (1H, т, J=7,8 Гц), 7,30 (1H, д, J=7,8 Гц), 7,12 (1H, д, J=7,8 Гц), 4,64 (2H, с), 3,72 (4H, т, J=4,8 Гц), 2,98 (2H, дд, J=10, 8,7 Гц), 2,74 (2H, дд, J=10, 8,7 Гц), 2,53 (4H, т, J=4,8 Гц).
Ссылочный пример 5
1) 6-(трет-бутилдиметилсиланилоксиметил)пиридин-2-карбоксальдегид (4,29 г) растворяли в 50 мл ДМФА и к раствору добавляли 7,14 г (карбетоксиметилен)трифенилфосфорана и затем смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь выливали в ледяную воду и экстрагировали этилацетатом. Органический слой промывали водой, высушивали над безводным сульфатом магния и концентрировали досуха при пониженном давлении. К остатку добавляли 100 мл смеси гексан-этилацетат (5:1), нерастворенное вещество отфильтровывали и фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле (смесь гексан-этилацетат = 10:1) с получением 5,45 г этил 3-[6-(трет-бутилдиметилсиланилоксиметил)пиридин-2-ил]акрилата в виде масла светло-желтого цвета.
1Н-ЯМР (CDCl3) δ: 7,72 (1H, т, J=7,5 Гц), 7,66 (1H, д, J=15,6 Гц), 7,49 (1H, д, J=7,5 Гц), 7,29 (1H, д, J=7,5 Гц), 6,88 (1H, д, J=15,6 Гц), 4,83 (2H, с), 4,27 (2H, кв, J=7,2 Гц), 1,33 (3H, т, J=7,2 Гц), 0,97 (9H, с), 0,13 (6H, с).
2) Этил 3-[6-(трет-бутилдиметилсиланилоксиметил)пиридин-2-ил]акрилат (5,45 г) растворяли в 100 мл этанола и к раствору добавляли 200 мг диоксида платины, и затем смесь перемешивали при нормальном давлении водорода при комнатной температуре в течение 5 часов. После продувки азотом катализатор отфильтровывали и растворитель удаляли с получением 5,07 г этил 3-[6-(трет-бутилдиметилсиланилоксиметил)пиридин-2-ил]пропионата в виде масла бледно-желтого цвета.
1Н-ЯМР (CDCl3) δ: 7,60 (1H, т, J=7,5 Гц), 7,33 (1H, д, J=7,5 Гц), 7,03 (1H, д, J=7,5 Гц), 4,79 (2H, с), 4,12 (2H, кв, J=7,2 Гц), 3,07 (2H, т, J=7,5 Гц), 2,75 (2H, т, J=7,5 Гц), 1,23 (3H, т, J=7,2 Гц), 0,96 (9H, с), 0,11 (6H, с).
3) Этил 3-[6-(трет-бутилдиметилсиланилоксиметил)пиридин-2-ил]пропионат (5,07 г) растворяли в 100 мл этанола и к раствору добавляли 23,5 м 1 н. водного раствора гидроксида натрия, и затем смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь концентрировали до примерно половины объема при пониженном давлении, после добавления ледяной воды, раствор подкисляли соляной кислотой и экстрагировали этилацетатом. Органический слой промывали насыщенным раствором соли, высушивали над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле (смесь хлороформ-метанол = 10:1) с получением 2,77 г 3-[6-(трет-бутилдиметилсиланилоксиметил)пиридин-2-ил]пропионовой кислоты в виде бесцветного порошка.
1Н-ЯМР (CDCl3) δ: 7,77 (1H, т, J=7,5 Гц), 7,47 (1H, д, J=7,5 Гц), 7,13 (1H, д, J=7,5 Гц), 4,84 (2H, с), 3,15 (2H, т, J=6,0 Гц), 2,82 (2H, т, J=6,0 Гц), 0,96 (9H, с), 0,14 (6H, с).
4) 3-[6-(трет-бутилдиметилсиланилоксиметил)пиридин-2-ил]пропионовую кислоту (1,65 г) растворяли в 20 мл метиленхлорида и к раствору добавляли 584 мкл морфолина, 1,6 г WSC и 1,56 мл триэтиламина, и затем смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли хлороформом, переносили в делительную воронку и промывали водой. Органический слой высушивали над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле (смесь хлороформ-метанол = 30:1) с получением 1,91 г 3-[6-(трет-бутилдиметилсиланилоксиметил)пиридин-2-ил]-1-морфолин-4-илпропан-1-она в виде масла желтого цвета.
1Н-ЯМР (CDCl3) δ: 7,60 (1H, т, J=7,5 Гц), 7,33 (1H, д, J=7,5 Гц), 7,08 (1H, д, J=7,5 Гц), 4,79 (2H, с), 3,62-3,43 (8H, м), 3,11 (2H, т, J=7,5 Гц), 2,77 (2H, т, J=7,5 Гц), 0,96 (9H, с), 0,12 (6H, с).
5) К суспензии 420 мг LiAlH4 в 20 мл ТГФ добавляли по каплям раствор 1,9 г 3-[6-(трет-бутилдиметилсиланилоксиметил)пиридин-2-ил]-1-морфолин-4-илпропан-1-она в 30 мл ТГФ при 0°С. Затем реакционную смесь перемешивали при комнатной температуре в течение 3 часов, избыток LiAlH4 гасили водой и раствор фильтровали через Hyflo Super-Cel (Nacalai Tesque) и разделяли. Органический слой промывали насыщенным раствором соли и высушивали над безводным сульфатом магния. После удаления растворителя при пониженном давлении остаток очищали хроматографией на силикагеле (смесь метиленхлорид-этанол = 40:1) с получением 760 мг 4-{3-[6-(трет-бутилдиметилсиланилоксиметил)пиридин-2-ил]пропил}морфолина.
Затем к раствору 760 мг 4-{3-[6-(трет-бутилдиметилсиланилоксиметил)пиридин-2-ил]пропил}морфолина в 4 мл ТГФ при 0°С добавляли по каплям 4,34 мл раствора TBAF/ТГФ (1 моль/л). После перемешивания раствора при комнатной температуре в течение 2 часов растворитель удаляли и остаток очищали хроматографией на силикагеле (смесь метиленхлорид-этанол = 40:1) с получением 495 мг [6-(3-морфолин-4-илпропил)пиридин-2-ил]метанола.
Дополнительно к раствору 495 мг полученного [6-(3-морфолин-4-илпропил)пиридин-2-ил]метанола и 104 мг диизопропилэтиламина в 20 мл метиленхлорида при 0°С добавляли по каплям 0,18 мл метансульфонилхлорида и смесь перемешивали при комнатной температуре в течение ночи. После удаления растворителя остаток очищали хроматографией на силикагеле (смесь метиленхлорид-этанол = 40:1) с получением 290 мг 4-[3-(6-хлорметилпиридин-2-ил)пропил]морфолина в виде порошка желтого цвета.
1Н-ЯМР (CDCl3) δ: 7,57 (1H, т, J=7,8 Гц), 7,05 (1H, д, J=7,8 Гц), 7,02 (1H, д, J=7,8 Гц), 4,65 (2H, с), 3,72 (4H, т, J=4,8 Гц), 2,83 (2H, т, J=7,8 Гц), 2,47-2,23 (6H, м), 1,96 (2H, квинт, J=7,8 Гц).
Ссылочный пример 6
2,6-бис(хлорметил)пиридин (352 мг) суспендировали в 4 мл этанола и к суспензии добавляли 372 мг N-(трет-бутоксикарбонил)пиперазина при 0°С и затем суспензию перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении, остаток добавляли к воде и экстрагировали хлороформом. Органический слой промывали насыщенным раствором соли, высушивали над безводным сульфатом магния и растворитель удаляли. Остаток очищали хроматографией на силикагеле (смесь метиленхлорид-этанол = 30:1) с получением 250 мг трет-бутил 4-(6-хлорметилпиридин-2-илметил)пиперазин-1-карбоксилата в виде бесцветного масла.
1Н-ЯМР (CDCl3) δ: 7,69 (1H, т, J=7,8 Гц), 7,37 (1H, дд, J=7,8, 2,1 Гц), 4,66 (2H, с), 3,67 (2H, с), 3,45 (4H, т, J=5,1 Гц), 2,45 (4H, т, J=5,1 Гц), 1,48 (9H, с).
Ссылочный пример 7
1) 6-метилпиколиновую кислоту (1,37 г) и морфолин (870 мг) растворяли в 30 мл ДМФА и к полученной смеси добавляли при перемешивании при 0°С 1,6 г HOBt. После перемешивания смеси при той же температуре в течение 15 минут дополнительно добавляли 2,3 г WSC и раствор перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении и к остатку добавляли воду, и затем полученную смесь экстрагировали этилацетатом. Органический слой промывали насыщенным раствором соли, высушивали над безводным сульфатом магния и затем растворитель удаляли. Полученный остаток очищали хроматографией на силикагеле (смесь метиленхлорид-метанол-триэтиламин = 900:30:1) с получением 1,71 г (6-метилпиридин-2-ил)морфолин-4-илметанона в виде бесцветного масла.
1Н-ЯМР (CDCl3) δ: 7,67 (1Н, т, J=7,8 Гц), 7,41 (1Н, д, J=7,8 Гц), 7,20 (1Н, д, J=7,8 Гц), 3,80 (4Н, шир. с), 3,67-3,58 (4Н, м), 2,57 (3Н, с).
2) (6-метилпиридин-2-ил)морфолин-4-илметанон (1,38 г) растворяли в 10 мл хлороформа и к раствору добавляли по каплям 1,77 г m-CPBA в 23 мл хлороформа и смесь перемешивали при комнатной температуре в течение 1 суток. К реакционной смеси добавляли 15 мл 10% водного раствора сульфита натрия и смесь разделяли. Органический слой промывали насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли, высушивали над безводным сульфатом магния и растворитель удаляли. Полученный остаток очищали хроматографией на силикагеле (смесь метиленхлорид-метанол-триэтиламин = 1000:25:1) с получением 1,26 г (6-метил-1-оксипиридин-2-ил)морфолин-4-илметанона в виде порошка белого цвета.
1Н-ЯМР (CDCl3) δ: 7,31-7,18 (3Н, м), 3,94-3,64 (6Н, м), 3,30-3,20 (1Н, м), 3,18-3,12 (1Н, м), 2,52 (3Н, с).
3) К 1,26 г (6-метил-1-оксипиридин-2-ил)морфолин-4-илметанона добавляли 0,53 мл уксусного ангидрида и смесь перемешивали при 100°С в течение 1 часа. К реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия и полученную смесь экстрагировали этилацетатом. Органический слой промывали насыщенным раствором соли, высушивали над безводным сульфатом магния и растворитель удаляли. Полученный остаток очищали хроматографией на силикагеле (смесь метиленхлорид-метанол-триэтиламин = 1000:25:1) с получением 1,13 г 6-(морфолин-4-карбонил)пиридин-2-илметилацетата в виде масла желтого цвета.
1Н-ЯМР (CDCl3) δ: 7,82 (1H, т, J=7,8 Гц), 7,61 (1H, д, J=7,8 Гц), 7,42 (1H, д, J=7,8 Гц), 5,22 (2H, с), 3,82 (4H, шир. с), 3,67-3,65 (4H, м), 2,17 (3H, с).
4) К 1,13 г 6-(морфолин-4-карбонил)пиридин-2-илметилацетата добавляли 233 мг гидроксида калия и 1,5 мл этанола, и смесь кипятили с обратным холодильником в течение 4 часов. Реакционную смесь концентрировали при пониженном давлении, к остатку добавляли воду и экстрагировали хлороформом. Органический слой промывали насыщенным раствором соли, высушивали над безводным сульфатом магния и растворитель удаляли в вакууме. Остаток очищали хроматографией на силикагеле (смесь хлороформ-метанол-триэтиламин = 500:25:1) с получением 530 мг (6-гидроксиметилпиридин-2-ил)морфолин-4-илметанона в виде порошка белого цвета.
1Н-ЯМР (CDCl3) δ: 7,81 (1H, т, J=7,8 Гц), 7,57 (1H, д, J=7,8 Гц), 7,33 (1H, д, J=7,8 Гц), 4,79 (2H, с), 3,82 (4H, шир. с), 3,68 (2H, т, J=4,8 Гц), 3,58 (2H, т, J=4,8 Гц).
5) К раствору 530 мг (6-гидроксиметилпиридин-2-ил)морфолин-4-илметанона и 614 мг диизопропилэтиламина в 10 мл метиленхлорида при 0°С добавляли по каплям 0,28 мл метансульфонилхлорида и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении и остаток очищали хроматографией на силикагеле (смесь метиленхлорид-этанол = 50:1) с получением 570 мг (6-хлорметилпиридин-2-ил)морфолин-4-илметанона в виде масла желтого цвета.
1Н-ЯМР (CDCl3) δ: 7,84 (1H, т, J=7,8 Гц), 7,70 (1H, д, J=7,8 Гц), 7,52 (1H, д, J=7,8 Гц), 4,65 (2H, с), 3,82 (4H, шир. с), 3,69-3,65 (4H, м).
Ссылочный пример 8
1) Трет-бутил 6-метилпиридин-2-карбоксилат (3,03 г) растворяли в 30 мл хлороформа и раствор 3,96 г m-CPBA в 45 мл хлороформа добавляли по каплям к вышеуказанной смеси и полученную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь переносили в делительную воронку, в которую добавляли 35 мл 10% раствора Na2SO3 и полученную смесь разделяли. Органический слой промывали насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли, высушивали над безводным сульфатом магния и затем растворитель удаляли. Остаток очищали хроматографией на силикагеле (смесь метиленхлорид-этанол = 30:1) с получением 3,28 г трет-бутил 6-метил-1-оксипиридин-2-карбоксилата в виде бесцветного масла.
1Н-ЯМР (CDCl3) δ: 7,29-7,13 (3Н, м), 2,66 (3Н, с), 1,63 (9Н, с).
2) К 3,28 г трет-бутил 6-метил-1-оксипиридин-2-карбоксилата добавляли 1,5 мл уксусного ангидрида и смесь перемешивали при 100°С в течение 1 часа. Реакционную смесь нейтрализовали насыщенным водным раствором бикарбоната натрия и экстрагировали хлороформом. Органический слой промывали насыщенным раствором соли, высушивали над безводным сульфатом магния и растворитель удаляли. Остаток очищали хроматографией на силикагеле (смесь метиленхлорид-этанол = 30:1) с получением трет-бутил 6-ацетоксиметилпиридин-2-карбоксилата в виде масла желтого цвета.
1Н-ЯМР (CDCl3) δ: 7,94 (1Н, д, J=7,5 Гц), 7,80 (1Н, т, J=7,5 Гц), 7,50 (1Н, д, J=7,5 Гц), 5,32 (2Н, с), 2,17 (3Н, с), 1,58 (9Н, с).
3) К 3,0 г трет-бутил 6-ацетоксиметилпиридин-2-карбоксилата добавляли 330 мг карбоната калия, 20 мл метанола и 20 мл воды, и смесь перемешивали при комнатной температуре в течение 3 часов. Метанол удаляли при пониженном давлении, затем остаток экстрагировали хлороформом. Органический слой промывали насыщенным раствором соли, высушивали над безводным сульфатом магния и растворитель удаляли. Остаток очищали хроматографией на силикагеле (смесь хлороформ-этанол = 50:1) с получением трет-бутил 6-гидроксиметилпиридин-2-карбоксилата в виде порошка желтого цвета.
1Н-ЯМР (CDCl3) δ: 7,95 (1H, д, J=7,5 Гц), 7,80 (1H, т, J=7,5 Гц), 7,43 (1H, д, J=7,5 Гц), 4,83 (2H, д, J=5,1 Гц), 3,68 (1H, т, J=5,1 Гц), 1,59 (9H, с).
4) Трет-бутил 6-гидроксиметилпиридин-2-карбоксилат (1,34 г) и диизопропилэтиламин (1,24 г) растворяли в 30 мл метиленхлорида, к полученной смеси добавляли по каплям 0,54 мл метансульфонилхлорида при 0°С и смесь перемешивали при комнатной температуре в течение ночи. Растворитель удаляли из реакционной смеси и затем остаток очищали хроматографией на силикагеле (смесь гексан-этилацетат = 5:1) с получением трет-бутил 6-хлорметилпиридин-2-карбоксилата в виде порошка желтого цвета.
1Н-ЯМР (CDCl3) δ: 7,96 (1H, д, J=7,5 Гц), 7,83 (1H, т, J=7,5 Гц), 7,67 (1H, д, J=7,5 Гц), 4,80 (2H, с), 1,59 (9H, с).
Ссылочный пример 9
1) 6-метилпиколиновую кислоту (2,15 г) и трет-бутил пиперазин-1-карбоксилат (3,21 г) растворяли в 45 мл ДМФА и к раствору добавляли 4,24 г HOBt при 0°С. После перемешивания в течение 15 минут дополнительно добавляли 3,0 г WSC и смесь перемешивали при комнатной температуре в течение ночи. После удаления растворителя при пониженном давлении из реакционной смеси добавляли воду к остатку и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным раствором соли, высушивали над безводным сульфатом магния, затем растворитель удаляли при пониженном давлении. Остаток очищали хроматографией на силикагеле (смесь метиленхлорид-этанол = 30:1) с получением 4,57 г трет-бутил 4-(6-метилпиридин-2-карбонил)пиперазин-1-карбоксилата в виде бесцветного масла.
1Н-ЯМР (CDCl3) δ: 7,67 (1H, т, J=7,8 Гц), 7,35 (1H, д, J=7,8 Гц), 7,21 (1H, д, J=7,8 Гц), 3,77 (2H, т, J=4,8 Гц), 3,55 (4H, т, J=4,8 Гц), 3,46 (2H, т, J=4,8 Гц), 2,57 (3H, с), 1,47 (9H, с).
2) Трет-бутил 4-(6-метилпиридин-2-карбонил)пиперазин-1-карбоксилат (4,57 г) растворяли в 30 мл хлороформа, к полученному раствору медленно добавляли по каплям раствор 3,9 г m-CPBA в 40 мл хлороформа. После этого смесь перемешивали при комнатной температуре в течение 1 суток, затем к реакционной смеси добавляли 10% водный раствор сульфита натрия (35 мл) и смесь разделяли. Органический слой промывали насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли, высушивали над безводным сульфатом магния и затем растворитель удаляли. Остаток очищали хроматографией на силикагеле (смесь метиленхлорид-этанол = 40:1) с получением 4,2 г трет-бутил 4-(6-метил-1-оксипиридин-2-карбонил)пиперазин-1-карбоксилата в виде порошка белого цвета.
1Н-ЯМР (CDCl3) δ: 7,31-7,17 (3H, м), 3,91 (1H, шир. с), 3,62-3,56 (4H, м), 3,45 (1H, шир. с), 3,26 (1H, шир. с), 3,13 (1H, шир. с), 2,51 (3H, с), 1,47 (9H, с).
3) К трет-бутил 4-(6-метил-1-оксипиридин-2-карбонил)пиперазин-1-карбоксилату (4,2 г) добавляли 1,2 мл уксусного ангидрида и смесь перемешивали при 100°С в течение 1 часа. После охлаждения реакционный раствор нейтрализовали насыщенным водным раствором бикарбоната натрия и экстрагировали хлороформом. Органический слой промывали насыщенным раствором соли, высушивали над безводным сульфатом магния и растворитель удаляли при пониженном давлении. Остаток очищали хроматографией на силикагеле (смесь метиленхлорид-этанол = 40:1) с получением 3,7 г трет-бутил 4-(6-ацетоксиметилпиридин-2-карбонил)пиперазин-1-карбоксилата в виде бесцветного масла.
1Н-ЯМР (CDCl3) δ: 7,82 (1H, т, J=7,8 Гц), 7,60 (1H, д, J=7,8 Гц), 7,40 (1H, д, J=7,8 Гц), 5,22 (2H, с), 3,77 (2H, т, J=4,8 Гц), 3,59-3,56 (4H, шир.), 3,69 (2H, т, J=4,8 Гц), 2,17 (3H, с), 1,47 (9H, с).
4) К раствору 3,7 г трет-бутил 4-(6-ацетоксиметилпиридин-2-карбонил)пиперазин-1-карбоксилата в 10 мл метанола добавляли 840 мг гидроксида калия и смесь кипятили с обратным холодильником в течение 4 часов. После удаления растворителя к раствору добавляли воду и смесь экстрагировали хлороформом. Органический слой промывали насыщенным раствором соли, высушивали над безводным сульфатом магния, затем растворитель удаляли при пониженном давлении. Остаток очищали хроматографией на силикагеле (смесь метиленхлорид-этанол = 50:1) с получением 1,26 г трет-бутил 4-(6-гидроксиметилпиридин-2-карбонил)пиперазин-1-карбоксилата в виде бесцветного масла.
1Н-ЯМР (CDCl3) δ: 7,81 (1H, т, J=7,8 Гц), 7,55 (1H, д, J=7,8 Гц), 7,34 (1H, д, J=7,8 Гц), 4,79 (2H, с), 3,79 (2H, т, J=4,8 Гц), 3,58-3,45 (6H, шир.), 1,47 (9H, с).
5) Трет-бутил 4-(6-гидроксиметилпиридин-2-карбонил)пиперазин-1-карбоксилат (1,26 г) и диизопропилэтиламин (1,0 г) растворяли в 20 мл метиленхлорида, в вышеуказанный раствор добавляли по каплям 0,1 мл метансульфонилхлорида при 0°С и смесь перемешивали при комнатной температуре в течение ночи. После удаления растворителя при пониженном давлении из реакционной смеси остаток очищали хроматографией на силикагеле (смесь метиленхлорид-этанол = 40:1) с получением 1,07 г трет-бутил 4-(6-хлорметилпиридин-2-карбонил)пиперазин-1-карбоксилата в виде бесцветного масла.
1Н-ЯМР (CDCl3) δ: 7,84 (1H, т, J=7,8 Гц), 7,60 (1H, д, J=7,8 Гц), 7,54 (1H, д, J=7,8 Гц), 4,66 (2H, с), 3,76 (2H, шир.), 3,57-3,48 (6H, шир.), 1,47 (9H, с).
Ссылочный пример 10
1) 6-гидроксиметилпиридин-2-карбальдегид (15,3 г) растворяли в 250 мл сухого ДМФА и к вышеуказанному раствору добавляли 50 г (трет-бутоксикарбонилметилен)трифенилфосфорана и затем смесь перемешивали при комнатной температуре в течение 30 минут. Реакционную смесь выливали в ледяную воду и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным раствором соли, высушивали над безводным сульфатом магния и концентрировали при пониженном давлении. К остатку добавляли 300 мл смеси гексан-этилацетат (2:1), нерастворимое вещество отфильтровывали. Фильтрат концентрировали при пониженном давлении, остаток очищали хроматографией на силикагеле (смесь гексан-этилацетат = 2:1) с получением 16,86 г трет-бутил 3-(6-гидроксиметилпиридин-2-ил)-транс-акрилата и 5,69 г трет-бутил 3-(6-гидроксиметилпиридин-2-ил)-цис-акрилата.
Транс-форма: бесцветное масло
1Н-ЯМР (CDCl3) δ: 7,70 (1H, т, J=7,5 Гц), 7,58 (1H, д, J=15,6 Гц), 7,31 (1H, д, J=7,5 Гц), 7,18 (1H, д, J=7,5 Гц), 6,88 (1H, д, J=15,6 Гц), 4,77 (2H, д, J=4,8 Гц), 3,88 (1H, т, J=4,8 Гц), 1,54 (9H, с).
Цис-форма: бесцветное масло
1Н-ЯМР (CDCl3) δ: 7,67 (1H, т, J=7,8 Гц), 7,51 (1H, д, J=7,8 Гц), 7,14 (1H, д, J=7,8 Гц), 6,86 (1H, д, J=12,6 Гц), 6,07 (1H, д, J=12,6 Гц), 4,74 (2H, д, J=4,8 Гц), 3,77 (1H, т, J=4,8 Гц), 1,46 (9H, с).
2) Трет-бутил 3-(6-гидроксиметилпиридин-2-ил)-транс-акрилат (транс-форма) (16,86 г) растворяли в 200 мл этанола и к раствору добавляли 0,5 г диоксида платины и затем смесь перемешивали при нормальном давлении водорода, при комнатной температуре в течение 5 часов. После чего катализатор отфильтровывали, добавляли еще диоксид платины (0,5 г) и затем смесь перемешивали при нормальном давлении водорода, при комнатной температуре в течение 6 часов. Катализатор отфильтровывали из реакционной смеси и растворитель удаляли при пониженном давлении с получением 16,13 г трет-бутил 3-(6-гидроксиметилпиридин-2-ил)пропионата в виде масла светло-желтого цвета.
1Н-ЯМР (CDCl3) δ: 7,58 (1H, т, J=7,5 Гц), 7,08 (1H, д, J=7,5 Гц), 7,03 (1H, д, J=7,5 Гц), 4,70 (2H, с), 3,10 (2H, т, J=7,5 Гц), 2,72 (2H, т, J=7,5 Гц), 1,42 (9H, с).
3) Трет-бутил 3-(6-гидроксиметилпиридин-2-ил)пропионат (16,13 г) растворяли в 200 мл сухого метиленхлорида и к вышеуказанному раствору добавляли 33,8 г четырехбромистого углерода, дополнительно к полученной смеси добавляли 21,5 г трифенилфосфина небольшими порциями при перемешивании, при 0°С и затем смесь перемешивали при той же температуре в течение 30 минут. Реакционную смесь переносили в делительную воронку, промывали насыщенным водным раствором бикарбоната натрия, затем насыщенным раствором соли, высушивали над безводным сульфатом магния и концентрировали при пониженном давлении. К остатку добавляли 200 мл смеси гексан-этилацетат (2:1), выпавшее в осадок нерастворимое вещество отфильтровывали и фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на на силикагеле (смесь гексан-этилацетат = 5:1) с получением 14,12 г трет-бутил 3-(6-бромметилпиридин-2-ил)пропионата в виде масла светло-желтого цвета.
1Н-ЯМР (CDCl3) δ: 7,58 (1H, т, J=7,5 Гц), 7,26 (1H, д, J=7,5 Гц), 7,09 (1H, д, J=7,5 Гц), 4,51 (2H, с), 3,06 (2H, т, J=7,5 Гц), 2,70 (2H, т, J=7,5 Гц), 1,42 (9H, с).
Ссылочный пример 11
1) 2-бромпиридин-6-метанол (2 г) растворяли в 10 мл сухого ДМФА и к вышеуказанному раствору добавляли 1,73 мл этилакрилата, 2,95 г тетра(н-бутил)аммония хлорида, 1,78 г бикарбоната натрия и 2 г молярных сит (молярные сита 3Å (1/16)), дополнительно в атмосфере аргона добавляли 119 мг ацетата палладия(II) и затем смесь перемешивали при 80°С в течение 5 часов. После охлаждения нерастворимое вещество отфильтровывали и добавляли воду, и затем смесь экстрагировали этилацетатом. Органический слой промывали насыщенным раствором соли, высушивали над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле (смесь гексан-этилацетат = 2:1) с получением 1,39 г этил 3-(6-гидроксиметилпиридин-2-ил)-транс-акрилата в виде масла светло-желтого цвета.
1Н-ЯМР (CDCl3) δ: 7,71 (1H, т, J=7,5 Гц), 7,66 (1H, д, J=15,6 Гц), 7,32 (1H, д, J=7,5 Гц), 7,20 (1H, д, J=7,5 Гц), 6,96 (1H, д, J=15,6 Гц), 4,78 (2H, д, J=4,8 Гц), 4,29 (2H, кв, J=7,2 Гц), 3,85 (1H, т, J=4,8 Гц), 1,35 (3H, т, J=7,2 Гц).
2) По той же методике, описанной в ссылочном примере 10-(2), этил 3-(6-гидроксиметилпиридин-2-ил)-транс-акрилат восстанавливали с получением этил 3-(6-гидроксиметилпиридин-2-ил)пропионата в виде масла светло-желтого цвета.
1Н-ЯМР (CDCl3) δ: 7,58 (1H, т, J=7,5 Гц), 7,08 (1H, д, J=7,5 Гц), 7,02 (1H, д, J,=7,5 Гц), 4,71 (2H, д, J=4,5 Гц), 4,14 (2H, кв, J=7,2 Гц), 4,01 (1H, т, J=4,5 Гц), 3,15 (2H, т, J=7,5 Гц), 2,80 (2H, т, J=7,5 Гц), 1,24 (3H, т, J=7,2 Гц).
Ссылочный пример 12
1) По той же методике, описанной в ссылочном примере 1, использование метилакрилата давало метил 3-(6-гидроксиметилпиридин-2-ил)-транс-акрилат в виде порошка светло-желтого цвета.
1Н-ЯМР (CDCl3) δ: 7,72 (1H, т, J=7,5 Гц), 7,68 (1H, д, J=15,6 Гц), 7,32 (1H, д, J=7,5 Гц), 7,21 (1H, д, J=7,5 Гц), 6,97 (1H, д, J=15,6 Гц), 4,78 (2H, д, J=4,2 Гц), 3,85 (1H, т, J=4,2 Гц), 3,83 (3H, с).
2) По той же методике, описанной в ссылочном примере 10-(2), метил 3-(6-гидроксиметилпиридин-2-ил)-транс-акрилат восстанавливали с получением метил 3-(6-гидроксиметилпиридин-2-ил)пропионата в виде масла светло-коричневого цвета.
1Н-ЯМР (CDCl3) δ: 7,58 (1H, т, J=7,5 Гц), 7,09 (1H, д, J=7,5 Гц), 7,03 (1H, д, J=7,5 Гц), 4,71 (2H, с), 4,01 (1H, шир. с), 3,69 (3H, с), 3,15 (2H, т, J=7,2 Гц), 2,81 (2H, т, J=7,2 Гц).
Вышеуказанное соединение также получали следующим образом: к раствору 50,02 г метил 3-(6-гидроксиметилпиридин-2-ил)-транс-акрилата в 502 мл IPA добавляли 2,51 г 5% палладия на угле (содержащего 50% воды) в атмосфере аргона, реакционную смесь перемешивали при давлении водорода 1-4 атм при 50°С в течение 2,5 часа. После охлаждения катализатор отфильтровывали и растворитель удаляли при пониженном давлении из реакционной смеси, что давало 50 г метил 3-(6-гидроксиметилпиридин-2-ил)пропионата в виде масла коричневого цвета.
Ссылочный пример 13
1) 6-гидроксиметилпиридин-2-карбальдегид (2,95 г) и триэтил 2-фосфонопропионат (5,12 г) растворяли в 20 мл сухого ДМФА и к раствору добавляли по каплям раствор 1,30 г метилата натрия в 10 мл метанола и смесь перемешивали при комнатной температуре в течение 20 минут. Реакционную смесь выливали в ледяную воду и экстрагировали этилацетатом. Органический слой промывали насыщенным раствором соли, высушивали над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле (смесь гексан-этилацетат = 1:1) с получением 2,42 г этил (Е)-3-(6-гидроксиметилпиридин-2-ил)-2-метилакрилата в виде бесцветного масла.
1Н-ЯМР (CDCl3) δ: 7,71 (1H, т, J=7,8 Гц), 7,63 (1H, кв, J=1,5 Гц), 7,29 (1H, д, J=7,8 Гц), 7,14 (1H, д, J=7,8 Гц), 4,79 (2H, д, J=4,8 Гц), 4,29 (2H, кв, J=7,2 Гц), 3,84 (1H, т, J=4,8 Гц), 2,35 (3H, д, J=1,5 Гц), 1,36 (3H, т, J=7,2 Гц).
2) По той же методике, описанной в ссылочном примере 10-(2), этил (Е)-3-(6-гидроксиметилпиридин-2-ил)-2-метилакрилат восстанавливали с получением этил 3-(6-гидроксиметилпиридин-2-ил)-2-метилпропионата в виде бесцветного масла.
1Н-ЯМР (CDCl3) δ: 7,57 (1H, т, J=7,5 Гц), 7,04 (1H, д, J=7,5 Гц), 7,02 (1H, д, J=7,5 Гц), 4,70 (2H, шир. с), 4,11 (2H, кв, J=7,2 Гц), 3,22 (1H, дд, J=14,1, 7,8 Гц), 3,05 (1H, секст, J=6,3 Гц), 2,88 (1H, дд, J=14,1, 6,3 Гц), 1,27-1,16 (6H, м).
Ссылочный пример 14
К раствору, полученному с трет-бутил 3-(6-гидроксиметилпиридин-2-ил)-транс-акрилатом (транс-формой, 2 г), описанным в ссылочном примере 10-(1), и четырехбромистому углероду (4,23 г), в метиленхлориде (20 мл) при 0°С добавляли небольшими порциями трифенилфосфин (2,68 г) и смесь перемешивали при той же температуре в течение 15 минут. Реакционный раствор переносили в делительную воронку, разбавляли хлороформом, промывали насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли, высушивали над безводным сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле (смесь гексан-этилацетат = 10:1) с получением 2,23 г трет-бутил 3-(6-бромметилпиридин-2-ил)-транс-акрилата в виде порошка светло-желтого цвета.
1Н-ЯМР (CDCl3) δ: 7,70 (1H, т, J=7,8 Гц), 7,56 (1H, д, J=15,6 Гц), 7,41 (1H, д, J=7,8 Гц), 7,32 (1H, д, J=7,8 Гц), 6,87 (1H, д, J=15,6 Гц), 4,54 (2H, с), 1,53 (9H, с).
Ссылочный пример 15
1) 4-пентиновую кислоту (1,03 г) и N-метилпиперазин (1,0 г) растворяли в 30 мл ДМФА, к раствору добавляли 1,6 г HOBt при 0°С, при перемешивании. После перемешивания смеси при той же температуре в течение 15 минут дополнительно добавляли 2,3 г WSC и раствор перемешивали при комнатной температуре в течение ночи. ДМФА удаляли при пониженном давлении из реакционной смеси, затем к остатку добавляли воду и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным раствором соли, высушивали над безводным сульфатом магния и затем растворитель удаляли. Остаток очищали хроматографией на силикагеле (смесь метиленхлорид-метанол-триэтиламин = 600:20:1) с получением 510 мг 1-(4-метилпиперазин-1-ил)пент-4-ин-1-она в виде бесцветного масла.
1Н-ЯМР (CDCl3) δ: 3,64 (2H, т, J=5,1 Гц), 3,48 (2H, т, J=5,1 Гц), 2,59-2,52 (4H, м), 2,41-2,35 (4H, м), 2,30 (3H, с), 1,97 (1H, с).
2) В круглодонную колбу емкостью 50 мл вносили 484 мг 2-бромпиридин-6-метанола, 510 мг 1-(4-метилпиперазин-1-ил)пент-4-ин-1-она, 20 мг BHT, 162 мг йодида меди(I), 118 мг тетракис(трифенилфосфин)палладия(0), 375 мг трет-бутиламина и 7,5 мл ДМФА и смесь перемешивали в атмосфере аргона при 80°С в течение 6 часов. ДМФА удаляли при пониженном давлении, затем добавляли насыщенный водный раствор бикарбоната натрия и смесь экстрагировали хлороформом. Органический слой промывали насыщенным раствором соли, высушивали над безводным сульфатом магния и затем растворитель удаляли. Остаток очищали хроматографией на силикагеле (смесь метиленхлорид-метанол-триэтиламин = 600:20:1) с получением 540 мг 5-(6-гидроксиметилпиридин-2-ил)-1-(4-метилпиперазин-1-ил)пент-4-ин-1-она в виде масла желтого цвета.
1Н-ЯМР (CDCl3) δ: 7,62 (1H, т, J=7,8 Гц), 7,27 (1H, д, J=7,8 Гц), 7,18 (1H, д, J=7,8 Гц), 4,73 (2H, с), 3,67 (2H, т, J=6,6 Гц), 3,53 (2H, т, J=6,6 Гц), 2,84-2,78 (2H, м), 2,72-2,67 (2H, м), 2,43-2,38 (4H, м), 2,30 (3H, с).
Ссылочный пример 16
1) В круглодонную колбу емкостью 200 мл вносили 3,49 г 2-бромпиридин-6-метанола, 3,0 г трет-бутил 4-пентиноата, 190 мг BHT, 1,17 г йодида меди(I), 877 мг тетракис(трифенилфосфин)палладия(0), 2,72 г трет-бутиламина и 56 мл ДМФА и смесь перемешивали в атмосфере аргона при 80°С в течение 6 часов. После удаления ДМФА при пониженном давлении из реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным раствором соли, высушивали над безводным сульфатом магния и затем растворитель удаляли. Остаток очищали хроматографией на силикагеле (смесь н-гексан-этилацетат = 2:1) с получением 2,76 г трет-бутил 5-(6-гидроксиметилпиридин-2-ил)пент-4-иноата в виде масла желтого цвета.
1Н-ЯМР (CDCl3) δ: 7,61 (1H, т, J=7,8 Гц), 7,28 (1H, д, J=7,8 Гц), 7,17 (1H, д, J=7,8 Гц), 4,72 (2H, д, J=5,1 Гц), 3,32 (1H, т, J=5,1 Гц), 2,75 (2H, т, J=7,2 Гц), 2,57 (2H, т, J=7,2 Гц), 1,45 (12H, с).
2) В круглодонную колбу емкостью 200 мл вносили 2,76 г трет-бутил 5-(6-гидроксиметилпиридин-2-ил)пент-4-иноата, 50 мг диоксида платины и 25 мл EtOH, смесь перемешивали при нормальном давлении водорода, при комнатной температуре в течение 8 часов. Нерастворимое вещество удаляли и затем фильтрат концентрировали с получением 2,78 г трет-бутил 5-(6-гидроксиметилпиридин-2-ил)пентаноата в виде масла желтого цвета.
1Н-ЯМР (CDCl3) δ: 7,57 (1H, т, J=7,8 Гц), 7,02 (2H, т, J=7,8 Гц), 4,71 (2H, с), 2,80 (2H, т, J=7,2 Гц), 2,56 (2H, т, J=7,2 Гц), 1,82-1,60 (4H, м), 1,42 (12H, с).
3) В круглодонную колбу емкостью 200 мл вносили 50 мл дихлорметана, 2,78 г трет-бутил 5-(6-гидроксиметилпиридин-2-ил)пентаноата и 2,0 г диизопропилэтиламина, и смесь перемешивали при 0°С в течение 10 минут. К реакционной смеси добавляли по каплям 0,89 мл метансульфонилхлорида и смесь перемешивали при комнатной температуре в течение 3 часов. К реакционной смеси добавляли воду и смесь разделяли. Органический слой промывали насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли, высушивали над безводным сульфатом магния и затем растворитель удаляли. Остаток очищали хроматографией на силикагеле (смесь н-гексан-этилацетат = 3:1) с получением 2,28 г трет-бутил 5-(6-метансульфонилоксиметилпиридин-2-ил)пентаноата в виде масла желтого цвета.
1Н-ЯМР (CDCl3) δ: 7,65 (1H, т, J=7,8 Гц), 7,30 (1H, д, J=7,8 Гц), 7,13 (1H, д, J=7,8 Гц), 5,29 (2H, с), 3,08 (3H, с), 2,80 (2H, т, J=7,2 Гц), 2,25 (2H, т, J=7,2 Гц), 1,75-1,50 (4H, м), 1,44 (12H, с).
Ссылочный пример 17
1) По той же методике, описанной в ссылочном примере 11, использование этилвинилкетона вместо этилакрилата давало (Е)-1-(6-гидроксиметилпиридин-2-ил)пент-1-ен-3-он в виде бесцветного масла.
1Н-ЯМР (CDCl3) δ: 7,72 (1H, т, J=7,5 Гц), 7,55 (1H, д, J=15,6 Гц), 7,36 (1H, д, J=7,5 Гц), 7,23 (1H, д, J=15,6 Гц), 7,22 (1H, д, J=7,5 Гц), 4,79 (2H, д, J=4,5 Гц), 3,84 (1H, шир. т, J=4,5 Гц), 2,74 (2H, кв, J=7,2 Гц), 1,18 (3H, т, J=7,2 Гц).
2) По той же методике, описанной в ссылочном примере 10-(2), (Е)-1-(6-гидроксиметилпиридин-2-ил)пент-1-ен-3-он восстанавливали с получением 1-(6-гидроксиметилпиридин-2-ил)пентан-3-она в виде масла светло-коричневого цвета.
1Н-ЯМР (CDCl3) δ: 7,57 (1H, т, J=7,8 Гц), 7,09 (1H, д, J=7,8 Гц), 7,02 (1H, д, J=7,8 Гц), 4,70 (2H, с), 3,94 (1H, шир. с), 3,09 (2H, т, J=6,9 Гц), 2,92 (2H, т, J=6,9 Гц), 2,47 (2H, кв, J=7,2 Гц), 1,06 (3H, т, J=7,2 Гц).
Формулы каждого соединения, полученного в ссылочных примерах 1-17-(2), приведенных выше, представлены в последующей таблице 1. Сокращенные обозначения в таблицах представлены ниже. Обозначения, использованные в других таблицах, имеют те же значения.
МеО и ОМе: метокси,
Ме: метил,
Et: этил,
АсО и ОАс: ацетилокси,
TBDMS: трет-бутилдиметилсилил,
OEt и EtO: этокси,
OtBu и tBuO: трет-бутилокси,
Ас: ацетил,
tBu и t-Bu: трет-бутил,
n-Pr: н-пропил,
iPr и i-Pr: изопропил,
Ph: фенил,
n-Bu: н-бутил,
i-Bu: 2-метилпропил.
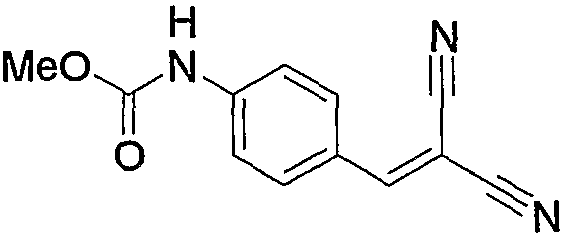
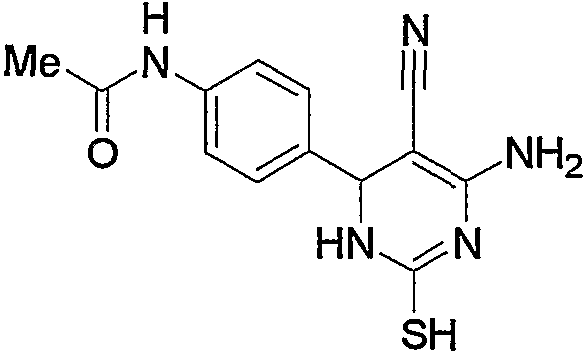
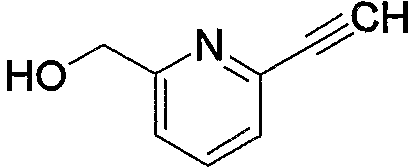
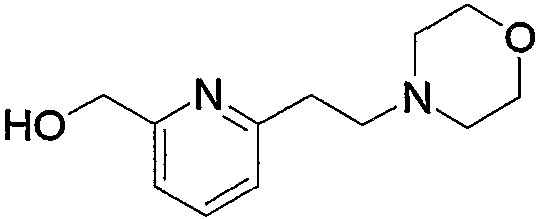
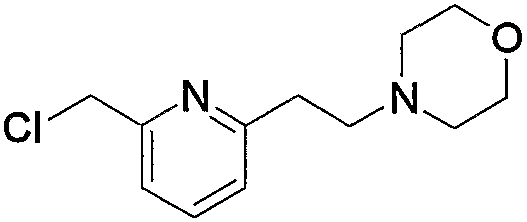
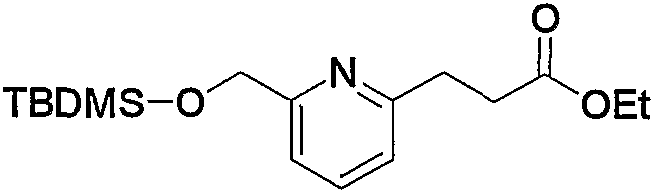
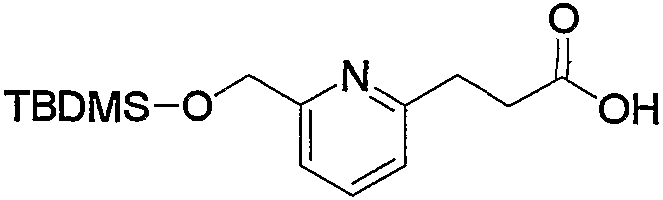
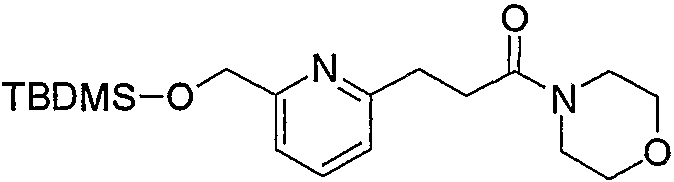
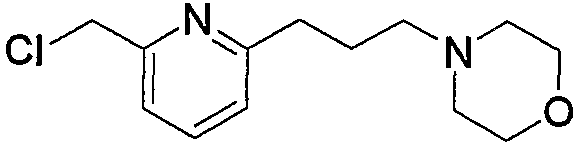
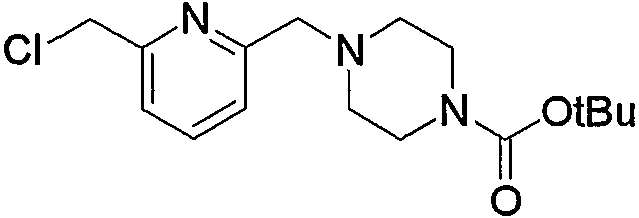

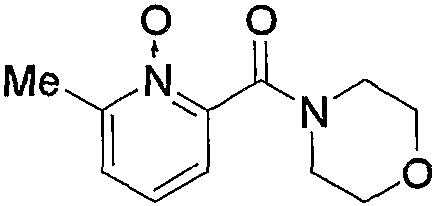
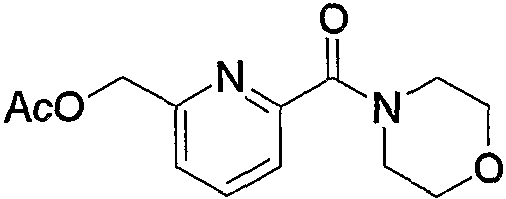

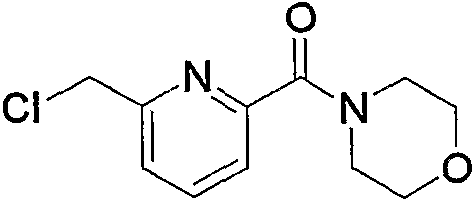
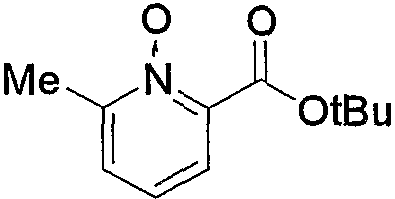
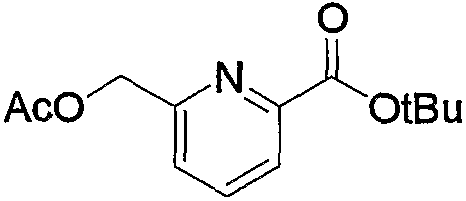
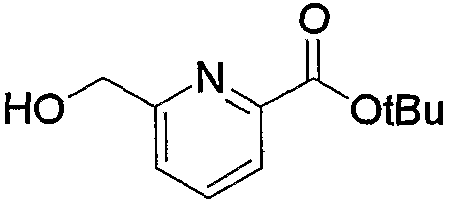
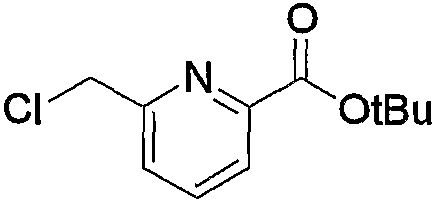
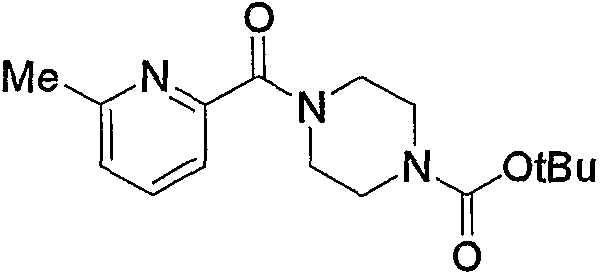
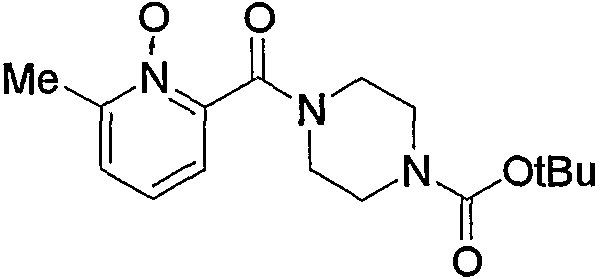
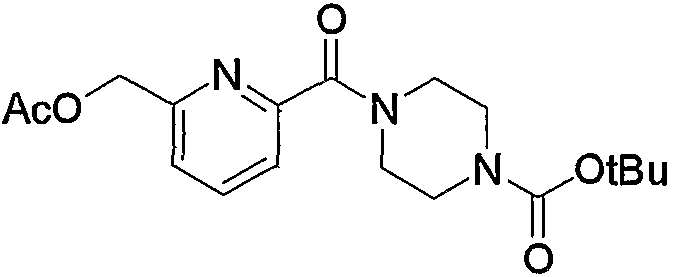
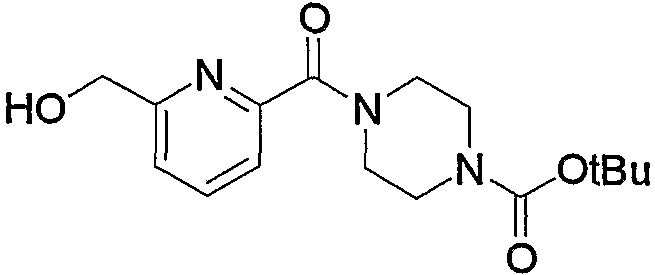
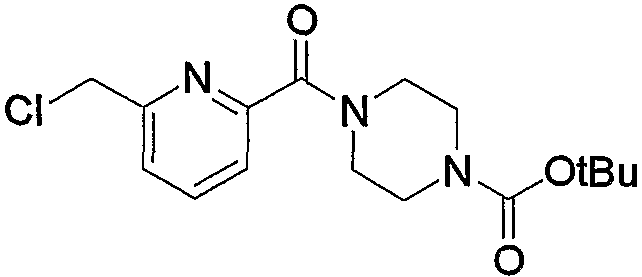
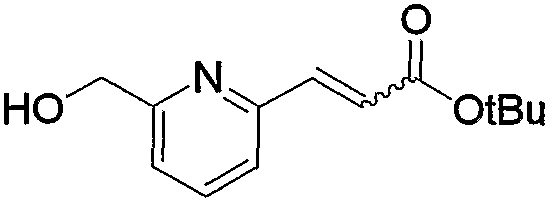
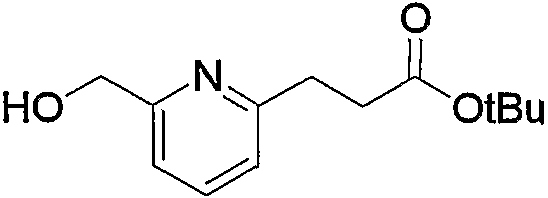
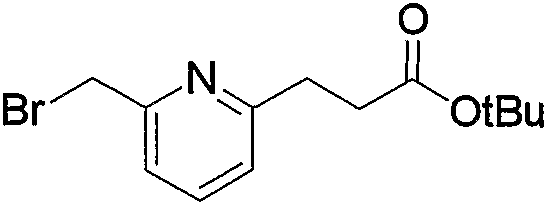
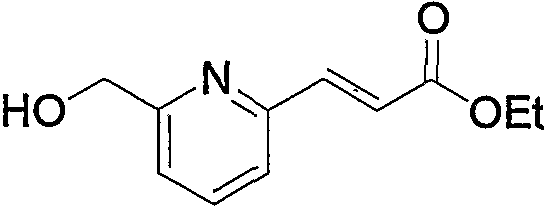
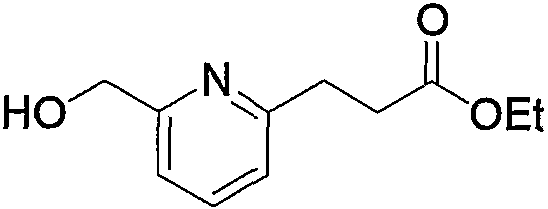
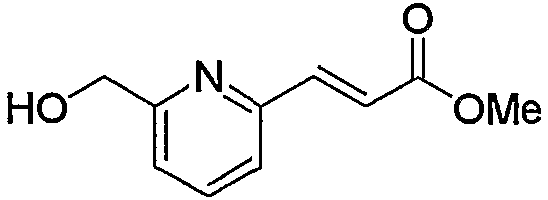
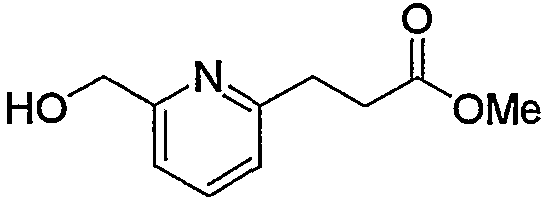
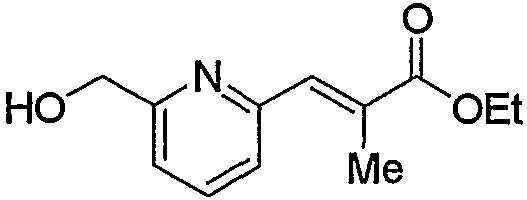
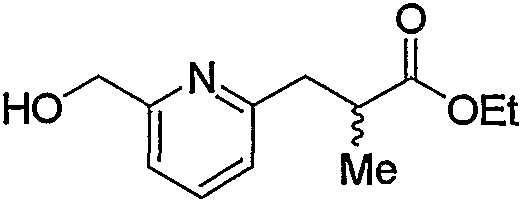
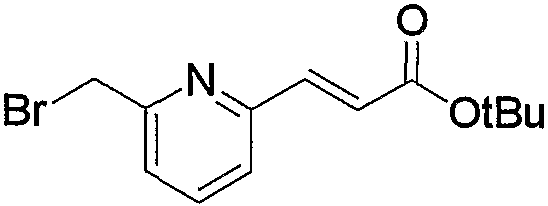
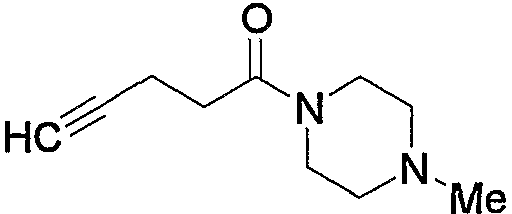
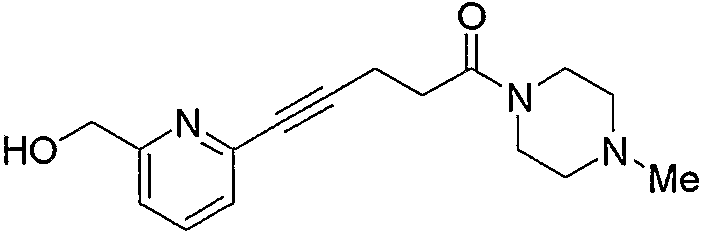
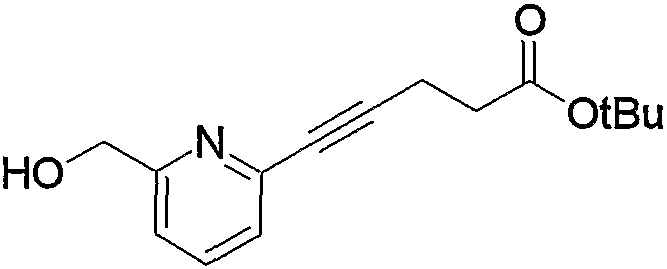
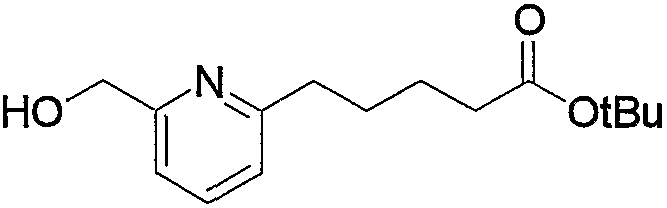
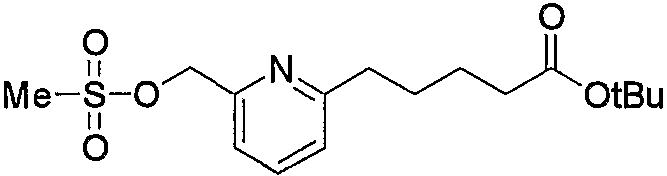
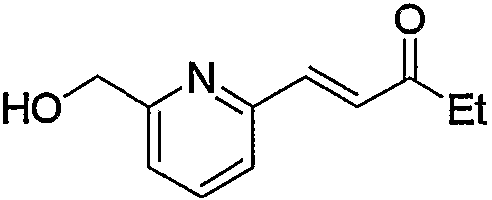
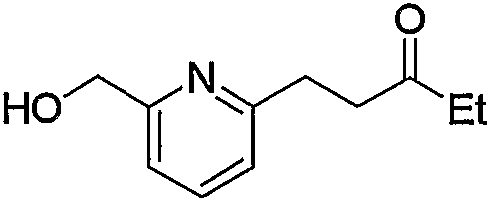
Пример 1
К ДМФА (3 мл) добавляли 285 мг соединения ссылочного примера 2, 172 мг 2-(хлорметил)пиридина гидрохлорида, 184 мг бикарбоната натрия и 157 мг йодида натрия и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду, смесь экстрагировали этилацетатом. Органический слой промывали насыщенным раствором соли, высушивали над безводным сульфатом магния и растворитель удаляли при пониженном давлении. Остаток очищали хроматографией на силикагеле (смесь метиленхлорид-этанол = 40:1) с получением 31 мг N-{4-[6-амино-5-циано-2-(пиридин-2-илметилсульфанил)пиримидин-4-ил]фенил}ацетамида в виде порошка белого цвета.
1Н-ЯМР (ДМСО-d6) δ: 10,2 (1H, с), 8,51 (1H, д, J=4,8 Гц), 7,83 (2H, д, J=8,4 Гц), 7,75-7,70 (3H, м), 7,54 (1H, д, J=7,8 Гц), 7,26 (1H, дд, J=6,6, 4,8 Гц), 4,50 (2H, с), 2,08 (3H, с).
Пример 2
6-метил-2-пиридинметанол (5 г) растворяли в 50 мл метиленхлорида и к раствору добавляли 10,6 мл диизопропилэтиламина, и затем добавляли по каплям 3,5 мл метансульфонилхлорида при перемешивании, при 0°С. После перемешивания при 0°С в течение 1 часа к реакционному раствору добавляли воду и органический слой промывали водой (2×) и насыщенным раствором соли (1×). Органический слой высушивали над сульфатом магния и затем растворитель удаляли с получением 6,98 г коричневого масла.
Часть полученного масла (4,56 г) растворяли в 50 мл этанола, к раствору добавляли 1,72 г тиомочевины и смесь кипятили с обратным холодильником в течение 1 часа. Затем к реакционному раствору добавляли 20 мл этанола и раствор охлаждали и затем добавляли 4,79 г N-[4-(2,2-дициановинил)фенил]ацетамида и 3 г бикарбоната натрия, и затем смесь кипятили с обратным холодильником в течение 1,5 часа. После охлаждения реакционного раствора добавляли 2,02 г NBS к раствору, и смесь кипятили с обратным холодильником в течение 30 минут. После охлаждения реакционного раствора дополнительно добавляли диизопропиловый эфир и выпавшее в осадок неорганическое вещество отфильтровывали, затем фильтрат вновь концентрировали и растворяли в этаноле. Насыщенный водный раствор бикарбоната натрия добавляли к раствору и полученные кристаллы отфильтровывали, промывали водой и этанолом, и затем высушивали при пониженном давлении с получением 3,2 г N-{4-[6-амино-5-циано-2-(6-метилпиридин-2-илметилсульфанил)пиримидин-4-ил]фенил}ацетамида в виде порошка белого цвета.
1Н-ЯМР (ДМСО-d6) δ: 10,2 (1H, с), 7,83 (2H, д, J=8,7 Гц), 7,72 (2H, д, J=8,7 Гц), 7,60 (1H, т, J=7,5 Гц), 7,33 (1H, д, J=7,5 Гц), 7,12 (1H, д, J=7,5 Гц), 4,44 (2H, с), 2,45 (3H, с), 2,09 (3H, с).
Пример 3
По той же методике, описанной в примере 2, использование 5-метил-2-пиридинметанола вместо 6-метил-2-пиридинметанола давало N-{4-[6-амино-5-циано-2-(5-метилпиридин-2-илметилсульфанил)пиримидин-4-ил]фенил}ацетамид в виде порошка белого цвета.
1Н-ЯМР (ДМСО-d6) δ: 10,23 (1H, c), 8,34 (1H, c), 7,60-8,20 (2H, шир. c), 7,84 (2H, д, J=8,7 Гц), 7,72 (2H, д, J=8,7 Гц), 7,54 (1H, д, J=7,8 Гц), 7,43 (1H, д, J=7,8 Гц), 4,46 (2H, c), 2,26 (3H, c), 2,09 (3H, c).
Пример 4
По той же методике, описанной в примере 2, использование 4-метил-2-пиридинметанола вместо 6-метил-2-пиридинметанола давало N-{4-[6-амино-5-циано-2-(4-метилпиридин-2-илметилсульфанил)пиримидин-4-ил]фенил}ацетамид в виде порошка светло-желтого цвета.
1Н-ЯМР (ДМСО-d6) δ: 10,24 (1H, с), 8,62 (1H, с), 7,65-8,25 (2H, шир. с), 7,84 (2H, д, J=8,7 Гц), 7,73 (2H, д, J=8,7 Гц), 7,36 (1H, с), 7,00 (1H, д, J=7,8 Гц), 4,56 (2H, c), 2,26 (3H, c), 2,09 (3H, c).
Пример 5
По той же методике, описанной в примере 2, использование 3-метил-2-пиридинметанола вместо 6-метил-2-пиридинметанола давало N-{4-[6-амино-5-циано-2-(3-метилпиридин-2-илметилсульфанил)пиримидин-4-ил]фенил}ацетамид в виде порошка белого цвета.
1Н-ЯМР (ДМСО-d6) δ: 10,24 (1H, с), 8,34 (1H, д, J=4,8 Гц), 7,70-8,25 (2H, шир. с), 7,87 (2H, д, J=8,7 Гц), 7,73 (2H, д, J=8,7 Гц), 7,60 (1H, д, J=7,5 Гц), 7,19-7,24 (1H, м), 4,61 (2H, с), 2,36 (3H, с), 2,09 (3H, с).
Пример 6
По той же методике, описанной в примере 2, использование 1-(6-метилпиридин-2-ил)этанола вместо 6-метил-2-пиридинметанола давало N-(4-{6-амино-5-циано-2-[1-(6-метилпиридин-2-ил)этилсульфанил]пиримидин-4-ил}фенил)ацетамид в виде порошка белого цвета.
1Н-ЯМР (CDCl3) δ: 10,25 (1H, шир. с), 7,83 (2H, д, J=7 Гц), 7,73 (2H, д, J=6 Гц), 7,62 (1H, т, J=6 Гц), 7,32 (1H, д, J=6 Гц), 7,13 (1H, д, J=6 Гц), 5,10 (1H, кв, J=6 Гц), 2,47 (3H, с), 2,09 (3H, с), 1,69 (3H, д, J=6 Гц).
Пример 7
По той же методике, описанной в примере 2, использование 1-(6-метилпиридин-2-ил)пентан-1-ола вместо 6-метил-2-пиридинметанола давало N-(4-{6-амино-5-циано-2-[1-(6-метилпиридин-2-ил)пентилсульфанил]пиримидин-4-ил}фенил)ацетамид в виде порошка белого цвета.
1Н-ЯМР (CDCl3) δ: 8,40 (1H, шир. с), 7,94 (2H, д, J=6 Гц), 7,63 (2H, д, J=6 Гц), 7,52 (1H, т, J=6 Гц), 7,22 (1Н, д, J=6 Гц), 7,00 (1H, д, J=6 Гц), 5,79 (1H, шир. с), 5,03 (1H, т, J=6 Гц), 2,55 (3H, с), 2,21 (3H, с), 2,00-2,15 (2H, м), 1,20-1,45 (4H, м), 0,86 (3H, т, J=6 Гц).
Пример 8
Соединение (5,5 г) примера 2 суспендировали в смеси 50 мл этанола и 50 мл воды, и к суспензии добавляли 50 мл 5 н. соляной кислоты, и полученную смесь кипятили с обратным холодильником при 80°С в течение 5 часов при перемешивании. После охлаждения реакционной смеси этанол удаляли при пониженном давлении и остаток нейтрализовали 5 н. водным раствором гидроксида натрия при 0°С. Полученные кристаллы отфильтровывали и перекристаллизовывали из этанола с получением 2,3 г 4-амино-6-(4-аминофенил)-2-(6-метилпиридин-2-илметилсульфанил)пиримидин-5-карбонитрила в виде порошка светло-желтого цвета.
1Н-ЯМР (ДМСО-d6) δ: 7,48-7,98 (2H, шир. с), 7,74 (2H, д, J=8,7 Гц), 7,60 (1H, т, J=7,8 Гц), 7,32 (1H, д, J=7,8 Гц), 7,12 (1H, д, J=7,8 Гц), 6,61 (2H, д, J=8,7 Гц), 5,90 (2H, с), 4,44 (2H, с), 2,45 (3H, с).
Пример 9
Соединение примера 8 (170 мг) и триэтиламин (0,2 мл) добавляли к 10 мл ацетонитрила, к раствору добавляли по каплям 0,12 г пропионилхлорида и затем смесь перемешивали при комнатной температуре в течение ночи. Полученные кристаллы отфильтровывали, промывали диэтиловым эфиром и затем высушивали при пониженном давлении с получением 85 мг N-{4-[6-амино-5-циано-2-(6-метилпиридин-2-илметилсульфанил)пиримидин-4-ил]фенил}пропионамида в виде порошка белого цвета.
1Н-ЯМР (ДМСО-d6) δ: 10,16 (1H, с), 7,84 (2H, д, J=8,7 Гц), 7,74 (2H, д, J=8,7 Гц), 7,61 (1H, т, J=7,8 Гц), 7,33 (1H, д, J=7,8 Гц), 7,12 (1H, д, J=7,8 Гц), 4,45 (2H, с), 2,45 (3H, с), 2,37 (2H, кв, J=8,7 Гц), 1,10 (3H, т, J=7,5 Гц).
Пример 10
По той же методике, описанной в примере 9, использование акрилоилхлорида вместо пропионилхлорида давало N-{4-[6-амино-5-циано-2-(6-метилпиридин-2-илметилсульфанил)пиримидин-4-ил]фенил}акриламид в виде порошка белого цвета.
1Н-ЯМР (ДМСО-d6) δ: 10,43 (1H, с), 7,79-7,89 (4H, м), 7,61 (1H, т, J=7,8 Гц), 7,33 (1H, д, J=7,8 Гц), 7,12 (1H, д, J=7,8 Гц), 6,42-6,52 (1H, м), 6,31 (1H, дд, J=16,8, 2,1 Гц), 5,81 (1H, дд, J=9,9, 2,1 Гц), 4,45 (2H, с), 2,45 (3H, с).
Пример 11
По той же методике, описанной в примере 9, использование бутирилхлорида вместо пропионилхлорида давало N-{4-[6-амино-5-циано-2-(6-метилпиридин-2-илметилсульфанил)пиримидин-4-ил]фенил}бутиламид в виде порошка белого цвета.
1Н-ЯМР (ДМСО-d6) δ: 10,17 (1H, с), 7,65-8,20 (2H, шир. с), 7,83 (2H, д, J=8,7 Гц), 7,74 (2H, д, J=8,7 Гц), 7,61 (1H, т, J=7,8 Гц), 7,33 (1H, д, J=7,8 Гц), 7,12 (1H, д, J=7,8 Гц), 4,45 (2H, с), 2,45 (3H, с), 2,33 (2H, т, J=7,5 Гц), 1,63 (3H, секст, J=7,5 Гц), 0,93 (3H, т, J=7,5 Гц).
Пример 12
По той же методике, описанной в примере 9, использование бензоилхлорида вместо пропионилхлорида давало N-{4-[6-амино-5-циано-2-(6-метилпиридин-2-илметилсульфанил)пиримидин-4-ил]фенил}бензамид в виде порошка белого цвета.
1Н-ЯМР (ДМСО-d6) δ: 10,53 (1H, с), 7,80-8,01 (6H, м), 7,51-7,70 (4H, м), 7,35 (1H, д, J=7,5 Гц), 7,13 (1H, д, J=7,5 Гц), 4,47 (2H, с), 2,46 (3H, с).
Пример 13
По той же методике, описанной в примере 2, использование 6-метил-2-пиридинметанола, тиомочевины и соединения ссылочного примера 1 давало метил {4-[6-амино-5-циано-2-(6-метилпиридин-2-илметилсульфанил)пиримидин-4-ил]фенил}карбамат в виде порошка желтого цвета.
1Н-ЯМР (ДМСО-d6) δ: 10,01 (1H, с), 7,83 (2H, д, J=8,7 Гц), 7,61 (1H, т, J=7,5 Гц), 7,60 (2H, д, J=8,7 Гц), 7,33 (1H, д, J=7,5 Гц), 7,12 (1H, д, J=7,5 Гц), 4,45 (2H, с), 3,70 (3H, с), 2,45 (3H, с).
Формулы каждого соединения, полученного в примерах 1-13, приведенных выше, представлены в последующей таблице 2.
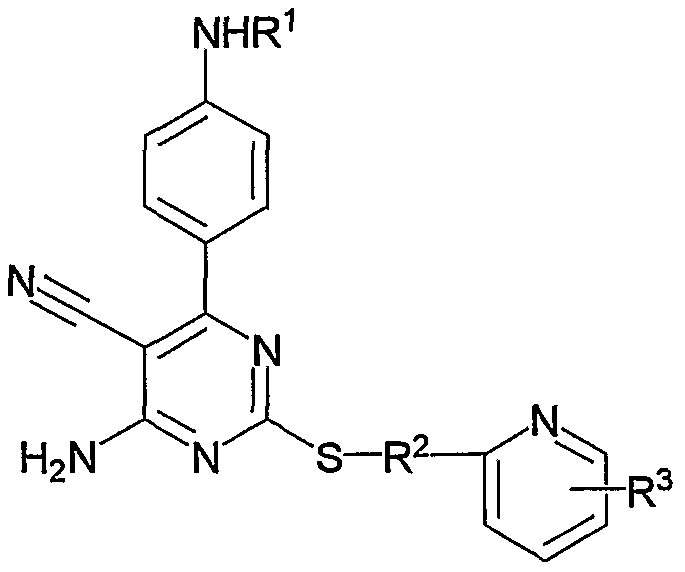
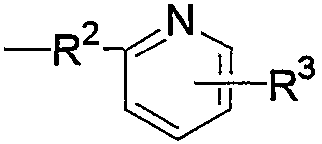
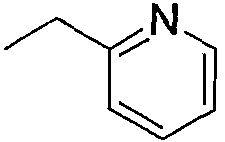
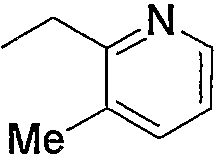






Пример 14
Соединение ссылочного примера 2 (10 г), соединение ссылочного примера 3 (9,8 г), бикарбонат натрия (3,52 г) и йодид натрия (5,40 г) добавляли к 100 мл ДМФА и полученную смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным раствором соли, высушивали над безводным сульфатом магния и растворитель удаляли при пониженном давлении. Остаток очищали хроматографией на силикагеле (смесь метиленхлорид-этанол-триэтиламин = 800:40:1) с получением 1,67 г N-{4-[6-амино-5-циано-2-(6-морфолин-4-илметилпиридин-2-илметилсульфанил)-2,3-дигидропиримидин-4-ил]фенил}ацетамида.
Настоящее соединение (600 мг) растворяли в 12 мл 1,4-диоксана, к раствору добавляли 290 мг DDQ и смесь кипятили с обратным холодильником в течение 2 часов. После удаления растворителя к остатку добавляли воду, затем добавляли 1 н. раствор соляной кислоты для подкисления раствора. Полученный раствор промывали этилацетатом, водный слой подщелачивали 1 н. водным раствором гидроксида натрия и экстрагировали этилацетатом. Органический слой промывали насыщенным раствором соли, высушивали над безводным сульфатом магния и затем растворитель удаляли при пониженном давлении. Остаток перекристаллизовывали из этанола с получением 290 мг N-{4-[6-амино-5-циано-2-(6-морфолин-4-илметилпиридин-2-илметилсульфанил) пиримидин-4-ил]фенил}ацетамида.
Весь указанный продукт растворяли в этаноле, к полученному раствору добавляли 1 моль/л соляной кислоты в этаноле (0,61 мл) и смесь выпаривали досуха при пониженном давлении с получением вышеуказанного соединения в виде гидрохлорида, в виде порошка белого цвета.
1Н-ЯМР (ДМСО-d6) δ: 10,2 (1H, с), 7,82 (2H, д, J=8,7 Гц), 7,72-7,67 (3H, м), 7,40 (1H, д, J=7,8 Гц), 7,31 (1H, д, J=7,8 Гц), 4,47 (2H, с), 3,57 (4H, шир. т), 2,39 (4H, шир. т), 2,08 (3H, с).
Пример 15
К раствору соединения ссылочного примера 2 (287 мг) в 3 мл ДМФА добавляли соединение ссылочного примера 4 (260 мг), бикарбонат натрия (100 мг) и йодид натрия (150 мг) и смесь перемешивали при комнатной температуре в течение ночи. После добавления к реакционной смеси воды смесь экстрагировали этилацетатом и органический слой промывали насыщенным раствором соли, высушивали над безводным сульфатом магния и затем растворитель удаляли при пониженном давлении. К остатку добавляли 1 мл ацетонитрила и 7,3 мг NBS и смесь кипятили с обратным холодильником в течение 30 минут. После охлаждения к реакционной смеси добавляли воду и полученную смесь экстрагировали этилацетатом. Органический слой промывали насыщенным раствором соли, высушивали над безводным сульфатом магния и затем растворитель удаляли при пониженном давлении. Остаток перекристаллизовывали из этанола с получением 35 мг N-(4-{6-амино-5-циано-2-[6-(2-морфолин-4-илэтил)пиридин-2-илметилсульфанил]пиримидин-4-ил}фенил)
ацетамида. Все полученное соединение растворяли в этаноле, добавляли 1 моль/л соляной кислоты в этаноле (0,14 мл) и смесь выпаривали досуха при пониженном давлении с получением 40 мг требуемого соединения в виде гидрохлорида, в виде порошка белого цвета.
1Н-ЯМР (ДМСО-d6) δ: 10,2 (1H, с), 7,83 (2H, д, J=8,7 Гц), 7,71 (2H, д, J=8,7 Гц), 7,66 (1H, т, J=7,2 Гц), 7,33 (1H, д, J=7,2 Гц), 7,15 (1H, д, J=7,2 Гц), 4,46 (2H, с), 3,55-3,52 (4H, м), 2,86 (2H, т, J=7,2 Гц), 2,60 (2H, т, J=7,2 Гц), 2,39 (4Н, шир. т), 2,03 (3Н, с).
Пример 16
Тиомочевину (86 мг) и соединение ссылочного примера 5 (290 мг) суспендировали в 50 мл этанола и полученную суспензию перемешивали при 60°С в течение 1 часа. После охлаждения к раствору добавляли 240 мг N-[4-(2,2-дициановинил)фенил]ацетамида и 287 мг бикарбоната натрия и кипятили с обратным холодильником в течение 5 часов. После охлаждения дополнительно добавляли 200 мг NBS и смесь кипятили с обратным холодильником в течение 1 часа. К реакционному раствору добавляли воду и смесь экстрагировали хлороформом. Органический слой промывали насыщенным раствором соли, высушивали над безводным сульфатом магния и затем растворитель удаляли при пониженном давлении. Остаток очищали хроматографией на силикагеле (смесь хлороформ-метанол-водный аммиак = 300:10:1) с получением 85 мг N-(4-{6-амино-5-циано-2-[6-(3-морфолин-4-илпропил)пиридин-2-илметилсульфанил]пиримидин-4-ил}фенил)ацетамида. Все полученное соединение растворяли в этаноле, добавляли 1 моль/л соляной кислоты в этаноле (0,38 мл) и затем растворитель удаляли с получением 110 мг требуемого соединения в виде гидрохлорида, в виде порошка желтого цвета.
1Н-ЯМР (ДМСО-d6) δ: 10,2 (1H, с), 7,83 (2H, д, J=8,7 Гц), 7,71 (2H, д, J=8,7 Гц), 7,61 (1H, т, J=7,5 Гц), 7,32 (1H, д, J=7,5 Гц), 7,12 (1H, д, J=7,5 Гц), 4,40 (2H, с), 3,64-3,50 (4H, м), 2,70 (2H, т, J=7,5 Гц), 2,40-2,24 (6H, м), 2,08 (3H, с), 2,49-2,45 (2H, м).
Пример 17
Соединение ссылочного примера 6 (15 г) и тиомочевину (3,8 г) суспендировали в 200 мл этанола и суспензию перемешивали при 60°С в течение 1 часа. К реакционной смеси добавляли 9,72 г N-[4-(2,2-дициановинил)фенил]ацетамида и смесь кипятили с обратным холодильником в течение ночи. После удаления растворителя при пониженном давлении к остатку добавляли воду, смесь экстрагировали хлороформом. Органический слой промывали насыщенным раствором соли, высушивали над безводным сульфатом магния и затем концентрировали досуха при пониженном давлении. Остаток очищали хроматографией на силикагеле (смесь метиленхлорид-метанол-водный аммиак = 300:10:1) с получением 10,3 г трет-бутил 4-{6-[4-(4-ацетиламинофенил)-6-амино-5-цианопиримидин-2-илсульфанилметил]пиридин-2-илметил}пиперазин-1-карбоксилата в виде порошка белого цвета.
1Н-ЯМР (ДМСО-d6) δ: 10,2 (1H, c), 7,83 (2H, д, J=8,7 Гц), 7,72-7,70 (3H, м), 7,40 (1H, д, J=7,5 Гц), 7,32 (1H, д, J=7,5 Гц), 4,47 (2H, c), 3,57 (2H, c), 2,50-2,35 (8H, м), 2,20 (3H, c), 1,38 (9H, c).
Пример 18
Соединение примера 17 (123 мг) вносили в круглодонную колбу, к этому соединению добавляли при 0°С 0,35 мл трифторуксусной кислоты. Смесь перемешивали при комнатной температуре в течение 1 часа и затем трифторуксусную кислоту удаляли при пониженном давлении. К остатку добавляли 0,1 моль/л соляной кислоты в 6 мл этанола и растворитель выпаривали досуха. Оставшееся твердое вещество перекристаллизовывали из этанола с получением 80 мг N-{4-[6-амино-5-циано-2-(6-пиперазин-1-илметилпиридин-2-илметилсульфанил)пиримидин-4-ил]фенил}ацетамида гидрохлорида в виде порошка белого цвета.
1Н-ЯМР (ДМСО-d6) δ: 10,3 (1H, с), 9,42 (1H, шир. с), 7,89-7,81 (3H, м), 7,73 (2H, д, J=8,7 Гц), 7,63 (1H, д, J=7,5 Гц), 7,52 (1H, д, J=7,5 Гц), 4,55 (2H, c), 3,37-3,25 (10H, м), 2,03 (3H, c).
Пример 19
Соединение примера 18 (292 мг), бензойную кислоту (61 мг) и триэтиламин (0,2 мл) растворяли в 3 мл ДМФА, к вышеуказанному раствору добавляли 80 мг HOBt при перемешивании, при 0°С. После перемешивания смеси при той же температуре в течение 15 минут добавляли 115 мг WSC и смесь перемешивали при комнатной температуре в течение ночи. Реакционный раствор упаривали досуха при пониженном давлении и к полученному остатку добавляли ледяную воду и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным раствором соли, высушивали над безводным сульфатом магния и затем концентрировали досуха при пониженном давлении. Остаток очищали хроматографией на силикагеле (смесь метиленхлорид-метанол-триэтиламин = 300:10:1) с получением 261 мг N-(4-{6-амино-2-[6-(4-бензоилпиперазин-1-илметил)пиридин-2-илметилсульфанил]-5-цианопиримидин-4-ил}фенил)ацетамида в виде порошка белого цвета.
1Н-ЯМР (ДМСО-d6) δ: 10,2 (1H, с), 7,83 (2H, д, J=8,7 Гц), 7,72-7,70 (3H, м), 7,44-7,32 (7H, м), 4,48 (2H, с), 3,60 (2H, с), 2,08 (3H, с).
Пример 20
Соединение примера 18 (146 мг), бензальдегид (28 мг) и триэтиламин (75 мг) растворяли в смеси 1 мл ДМФА и 2 мл метанола, полученную смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси при 0°С добавляли 30 мг цианоборгидрида натрия и смесь перемешивали при той же температуре в течение 1 часа. Реакционный раствор упаривали досуха при пониженном давлении, к остатку добавляли ледяную воду и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным раствором соли, высушивали над безводным сульфатом магния и затем концентрировали досуха при пониженном давлении. Остаток очищали хроматографией на силикагеле (смесь метиленхлорид-метанол-триэтиламин = 600:20:1) с получением 60 мг N-(4-{6-амино-2-[6-(4-бензилпиперазин-1-илметил)пиридин-2-илметилсульфанил]-5-цианопиримидин-4-ил}фенил)ацетамида в виде порошка белого цвета.
1Н-ЯМР (ДМСО-d6) δ: 7,98 (2H, д, J=8,7 Гц), 7,64 (2H, д, J=8,7 Гц), 7,58 (1H, т, J=7,5 Гц), 7,53-7,50 (2H, м), 7,42-7,29 (5H, м), 4,54 (2H, с), 3,75 (2H, с), 2,61-2,48 (10H, м), 2,20 (3H, с).
Пример 21
По той же методике, описанной в примере 19, использование (4-метилпиперазин-1-ил)уксусной кислоты вместо бензойной кислоты давало N-{4-[6-амино-5-циано-2-(6-{4-[2-(4-метилпиперазин-1-ил)ацетил]пиперазин-1-илметил}пиридин-2-илметилсульфанил)пиримидин-4-ил]фенил}ацетамида гидрохлорида в виде порошка белого цвета.
1Н-ЯМР (ДМСО-d6) δ: 10,2 (1H, с), 7,83 (2H, д, J=8,7 Гц), 7,73-7,70 (3H, м), 7,40 (1H, д, J=7,5 Гц), 7,32 (1H, д, J=7,5 Гц), 4,48 (2H, с), 3,59 (2H, с), 3,43 (2H, шир. т), 3,36-3,33 (4H, м), 3,08 (2H, с), 2,49-2,27 (10H, м), 2,12 (3H, с), 2,08 (3H, с).
Пример 22
По той же методике, описанной в примере 19, использование п-метоксибензойной кислоты вместо бензойной кислоты давало N-[4-(6-амино-5-циано-2-{6-[4-(4-метоксибензоил)пиперазин-1-илметил]пиридин-2-илметилсульфанил}пиримидин-4-ил)фенил]ацетамида гидрохлорида в виде порошка белого цвета.
1Н-ЯМР (ДМСО-d6) δ: 10,2 (1H, с), 7,97 (1H, д, J=8,4 Гц), 7,83 (2H, д, J=8,7 Гц), 7,73-7,68 (3H, м), 7,53 (1H, т, J=7,2 Гц), 7,43-7,32 (3H, м), 6,96 (1H, д, J=8,7 Гц), 4,47 (2H, с), 3,78 (3H, с), 3,62 (3H, с), 3,48-3,32 (2H, м), 2,49-2,45 (4H, м), 2,08 (3H, с).
Пример 23
По той же методике, описанной в примере 19, использование N,N-диметилглицина вместо бензойной кислоты давало N-[4-(6-амино-5-циано-2-{6-[4-(2-диметиламиноацетил)пиперазин-1-илметил]пиридин-2-илметилсульфанил}пиримидин-4-ил)фенил]ацетамид гидрохлорид в виде порошка белого цвета.
1Н-ЯМР (ДМСО-d6) δ: 10,2 (1H, с), 7,83 (2H, д, J=9,0 Гц), 7,72-7,68 (3H, м), 7,42 (1H, д, J=7,5 Гц), 7,33 (1H, д, J=7,5 Гц), 4,48 (2H, с), 3,59 (2H, с), 3,49-3,41 (4H, м), 3,15 (2H, шир. с), 2,48-2,42 (4H, м), 2,21 (6H, с), 2,08 (3H, с).
Пример 24
По той же методике, описанной в примере 19, использование пиперидин-1-пропионовой кислоты вместо бензойной кислоты давало N-[4-(6-амино-5-циано-2-{6-[4-(3-пиперидин-1-илпропионил)пиперазин-1-илметил]пиридин-2-илметилсульфанил}пиримидин-4-ил)фенил]ацетамид гидрохлорид в виде порошка белого цвета.
1Н-ЯМР (ДМСО-d6) δ: 10,2 (1H, с), 7,83 (2H, д, J=8,7 Гц), 7,74-7,68 (3H, м), 7,43 (1H, т, J=7,5 Гц), 7,33 (1H, д, J=7,5 Гц), 4,47 (2H, с), 3,60 (2H, с), 3,44-3,34 (4H, м), 2,51-2,50 (4H, м), 2,43-2,37 (4H, м), 2,09 (3H, с), 1,58 (4H, шир. с), 1,43 (2H, шир. т).
Пример 25
По той же методике, описанной в примере 19, использование пиперидин-1-илуксусной кислоты вместо бензойной кислоты давало N-[4-(6-амино-5-циано-2-{6-[4-(2-пиперидин-1-илацетил)пиперазин-1-илметил]пиридин-2-илметилсульфанил}пиримидин-4-ил)фенил]ацетамид гидрохлорид в виде порошка белого цвета.
1Н-ЯМР (CD3OD) δ: 7,90-7,81 (3H, м), 7,73 (2H, д, J=8,7 Гц), 7,69 (2H, д, J=7,8 Гц), 7,43 (1H, т, J=7,8 Гц), 4,64 (2H, с), 4,55 (2H, с), 4,42 (2H, с), 3,92 (1H, шир. с), 3,77-3,72 (3H, м), 3,58-3,51 (2H, м), 3,44-3,31 (2H, м), 3,29-3,14 (2H, м), 2,16 (3H, с), 2,10-2,06 (2H, м), 1,36-1,31 (2H, м).
Формулы каждого соединения, полученного в примерах 14-25, приведенных выше, представлены в последующей таблице 3.
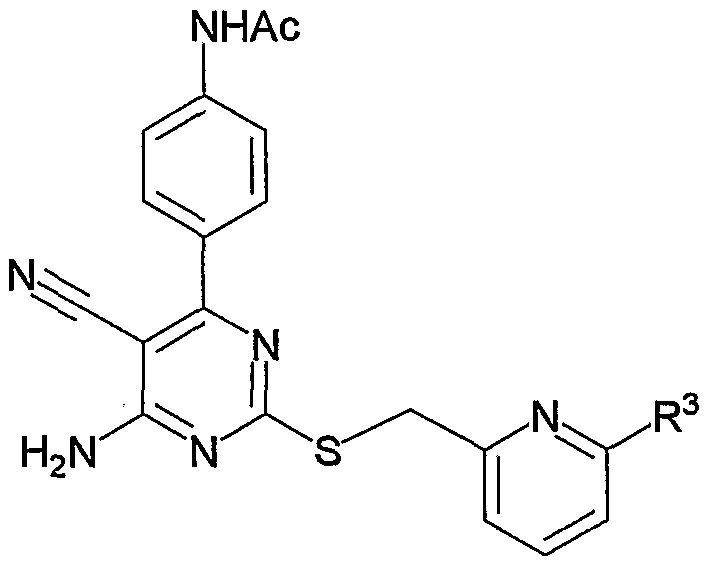
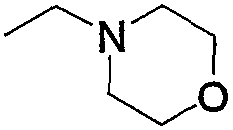
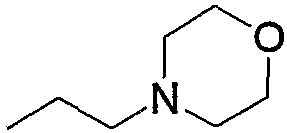
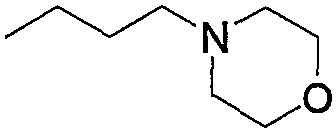
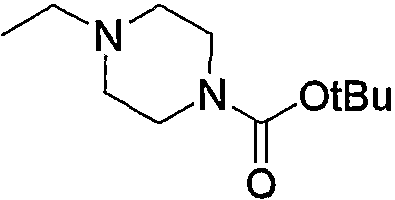
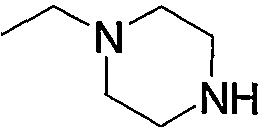
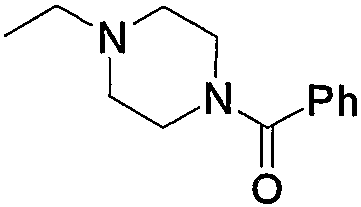
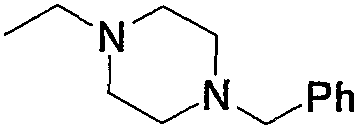
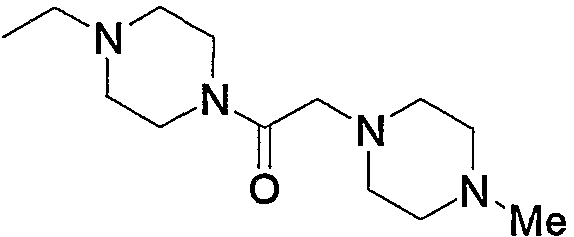
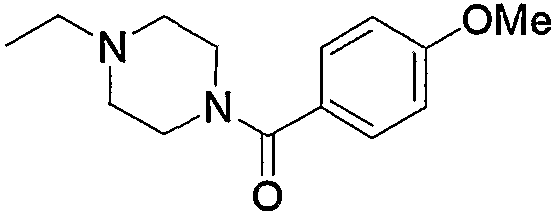
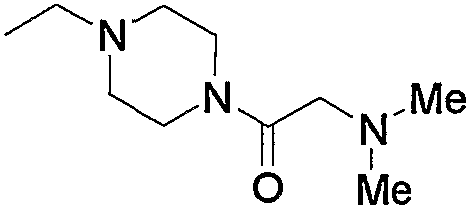
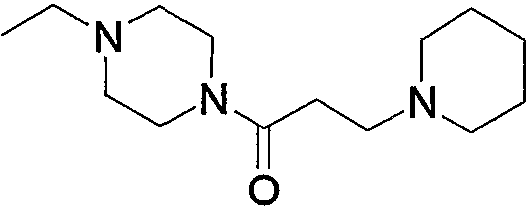
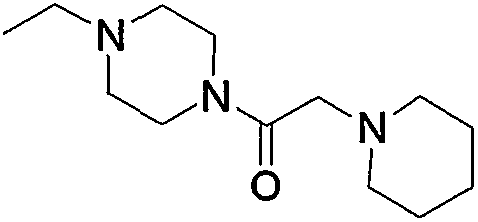
Пример 26
Соединение ссылочного примера 7 (571 мг) и тиомочевину (180 мг) растворяли в 20 мл этанола и раствор кипятили с обратным холодильником в течение 1 часа. После охлаждения к реакционной смеси добавляли 500 мг N-[4-(2,2-дициановинил)фенил]ацетамида и 600 мг бикарбоната натрия и полученную смесь кипятили с обратным холодильником в течение 4 часов. После охлаждения к реакционной смеси добавляли 356 мг NBS и полученную смесь кипятили с обратным холодильником в течение 1 часа. После охлаждения также добавляли 5 мл насыщенного водного раствора бикарбоната натрия и 10 мл воды, и осадок отфильтровывали, промывали водой и высушивали при пониженном давлении с получением 380 мг N-(4-{6-амино-5-циано-2-[6-(морфолин-4-карбонил)пиридин-2-илметилсульфанил]пиримидин-4-ил}фенил)ацетамида гидрохлорида в виде порошка белого цвета.
1Н-ЯМР (ДМСО-d6) δ: 10,2 (1H, с), 7,86 (1H, т, J=7,8 Гц), 7,79 (2H, д, J=9,0 Гц), 7,70 (2H, д, J=9,0 Гц), 7,62 (1H, д, J=7,8 Гц), 7,47 (1H, д, J=7,8 Гц), 4,53 (2H, с), 3,63 (4H, шир. т), 3,49-3,44 (2H, м), 2,08 (3H, с).
Пример 27
По той же методике, описанной в примере 26, использование соединения ссылочного примера 8 вместо соединения ссылочного примера 7 давало трет-бутил 6-[4-(4-ацетиламинофенил)-6-амино-5-цианопиримидин-2-илсульфанилметил]пиридин-2-карбоксилат в виде порошка белого цвета.
1Н-ЯМР (ДМСО-d6) δ: 7,82-7,72 (7H, м), 4,55 (2H, с), 2,08 (3H, с), 1,54 (9H, с).
Пример 28
По той же методике, описанной в примере 26, использование соединения ссылочного примера 9 вместо соединения ссылочного примера 7 давало трет-бутил 4-{6-[4-(4-ацетиламинофенил)-6-амино-5-цианопиримидин-2-илсульфанилметил]пиридин-2-карбонил}пиперазин-1-карбоксилат в виде порошка белого цвета.
1Н-ЯМР (ДМСО-d6) δ: 10,2 (1H, с), 7,89 (1H, т, J=7,8 Гц), 7,83 (2H, д, J=8,7 Гц), 7,75 (2H, д, J=8,7 Гц), 7,63 (1H, д, J=7,8 Гц), 7,47 (1H, д, J=7,8 Гц), 4,53 (2H, с), 3,60-3,56 (2H, шир.), 3,45-3,31 (6H, шир.), 2,09 (3H, с), 1,40 (12H, с).
Пример 29
К соединению примера 28 (600 мг) при 0°С добавляли 2 мл ТФА и смесь перемешивали при комнатной температуре в течение 1 часа. Остаточное количество ТФА удаляли при пониженном давлении и к остатку добавляли 20 мл 0,1 моль/л соляной кислоты в этаноле и смесь перемешивали. Полученные кристаллы отфильтровывали с получением 80 мг N-(4-{6-амино-5-циано-2-[6-(пиперазин-1-карбонил)пиридин-2-илметилсульфанил]пиримидин-4-ил}фенил)ацетамида гидрохлорида в виде порошка белого цвета.
1Н-ЯМР (ДМСО-d6) δ: 10,2 (1H, с), 9,16 (2H, шир.), 7,90 (1H, т, J=7,8 Гц), 7,80 (2H, д, J=8,7 Гц), 7,72 (2H, д, J=8,7 Гц), 7,69 (1H, д, J=7,8 Гц), 7,55 (1H, д, J=7,8 Гц), 4,54 (2H, с), 3,86 (2H, шир.), 3,70 (2H, шир.), 3,20-3,10 (4H, шир.), 2,09 (3H, с).
Формулы каждого соединения, полученного в примерах 26-29, приведенных выше, представлены в последующей таблице 4.
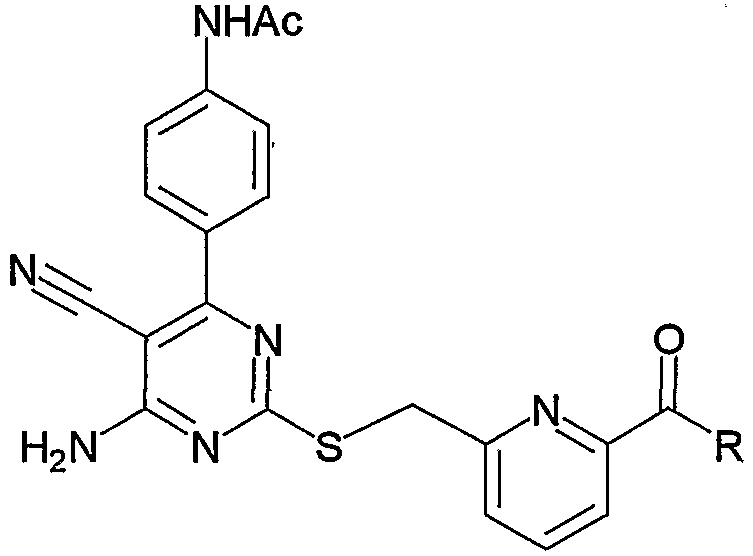

Пример 30
Трет-бутил (6-гидроксиметилпиридин-2-илметил)карбамат (1 г) и диизопропилэтиламин (1,1 мл) растворяли в 20 мл дихлорметана, к раствору по каплям добавляли 0,33 мл метансульфонилхлорида при комнатной температуре и смесь перемешивали в течение 1 часа при той же температуре. К реакционному раствору добавляли воду, органический слой промывали водой (дважды) и насыщенным раствором соли (один раз) и высушивали над безводным сульфатом магния. Растворитель удаляли при пониженном давлении, полученное масло растворяли в 25 мл этанола вместе с 0,32 г тиомочевины и затем кипятили с обратным холодильником в течение 1 часа. К реакционной смеси добавляли 0,4 г NBS и смесь кипятили с обратным холодильником в течение 5 минут. После охлаждения растворитель удаляли. Остаток растворяли в хлороформе, промывали водой (дважды) и насыщенным раствором соли (один раз) и затем высушивали над безводным сульфатом магния. Растворитель удаляли при пониженном давлении и остаток очищали хроматографией на силикагеле (смесь метиленхлорид-метанол-водный аммиак = 90:10:1). Полученные сырые кристаллы очищали перекристаллизацией из смеси этилацетат-гексан с получением 0,97 г трет-бутил {6-[4-(4-ацетиламинофенил)-6-амино-5-цианопиримидин-2-илсульфанилметил]пиридин-2-илметил}карбамата в виде порошка белого цвета.
1H-ЯМР (ДМСО-d6) δ: 10,25 (1H, с), 8,25-7,49 (2H, шир. с), 7,98 (1H, т, J=7,5 Гц), 7,83 (2H, д, J=8,7 Гц), 7,73 (2H, д, J=8,7 Гц), 7,64 (1H, д, J=7,5 Гц), 7,53 (1H, шир. с), 7,33 (1H, д, J=7,5 Гц), 4,54 (2H, с), 4,29 (2H, д, J=5,7 Гц), 2,09 (3H, с), 1,40 (9H, с).
Пример 31
К 0,2 г соединения примера 30 добавляли 1 мл трифторуксусной кислоты и смесь перемешивали в течение 30 минут при комнатной температуре, и затем трифторуксусную кислоту удаляли. К остатку добавляли 2 мл триэтиламина, смесь перемешивали при комнатной температуре и затем добавляли 0,19 г WSC, 0,14 г HOBt и 41 мг N,N-диметилглицина и затем смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и полученные кристаллы отфильтровывали, промывали этанолом и затем высушивали с получением 76 мг N-{6-[4-(4-ацетиламинофенил)-6-амино-5-цианопиримидин-2-илсульфанилметил]пиридин-2-илметил}-2-диметиламиноацетамида.
Весь продукт растворяли в 2 мл этанола, к раствору добавляли 1 мл 1 моль/л соляной кислоты в этаноле и затем этанол удаляли при пониженном давлении с получением требуемого соединения в виде гидрохлорида в виде порошка белого цвета.
1H-ЯМР (ДМСО-d6) δ: 10,24 (1H, с), 8,36 (1H, т, J=6,0 Гц), 8,25-7,65 (2H, шир. с), 7,85 (2H, д, J=8,7 Гц), 7,72-7,66 (3H, м), 7,41 (1H, д, J=7,5 Гц), 7,14 (1H, д, J=7,5 Гц), 4,48 (2H, с), 4,38 (2H, д, J=6,0 Гц), 2,94 (2H, с), 2,24 (6H, с), 2,09 (3H, с).
Пример 32
К 0,3 г соединения примера 30 добавляли 2 мл трифторуксусной кислоты и смесь перемешивали при комнатной температуре в течение 1 часа. Затем трифторуксусную кислоту удаляли при пониженном давлении из реакционной смеси, остаток растворяли в 2 мл ацетонитрила. К полученному раствору добавляли 4 мл 28% водного раствора аммиака и полученные кристаллы отфильтровывали с получением 0,2 г N-{4-[6-амино-2-(6-аминометилпиридин-2-илметилсульфанил)-5-цианопиримидин-4-ил]фенил}ацетамида в виде порошка белого цвета.
1H-ЯМР (ДМСО-d6) δ: 10,25 (1H, с), 8,25-7,65 (2H, шир. с), 7,84 (2H, д, J=8,7 Гц), 7,75-7,65 (3H, м), 7,29-7,40 (2H, м), 4,47 (2H, с), 3,78 (2H, с), 2,09 (3H, с).
Пример 33
Соединение примера 32 (0,2 г) и триэтиламин (0,5 мл) растворяли в 2 мл ДМФА. К раствору добавляли 0,1 г 4-пирролидин-1-илмасляной кислоты гидрохлорида, 0,07 г HOBt и 0,1 г WSC, и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и полученные кристаллы отфильтровывали. Сырые кристаллы перекристаллизовывали из этанола с получением 43 мг N-{6-[4-(4-ацетиламинофенил)-6-амино-5-цианопиримидин-2-илсульфанилметил]пиридин-2-илметил}-4-пирролидин-1-илбутиламида.
Весь продукт растворяли в 2 мл этанола, к раствору добавляли 1 мл 1 моль/л соляной кислоты в этаноле и затем этанол удаляли при пониженном давлении с получением требуемого соединения в виде гидрохлорида, в виде порошка белого цвета.
1H-ЯМР (ДМСО-d6) δ: 10,24 (1H, с), 8,40 (1H, т, J=6,0 Гц), 8,25-7,65 (2H, шир. с), 7,85 (1H, д, J=8,7 Гц), 7,74-7,66 (3H, м), 7,41 (1H, д, J=7,5 Гц), 7,12 (1H, д, J=7,5 Гц), 4,47 (2H, с), 4,31 (2H, д, J=6,0 Гц), 2,32-2,38 (6H, м), 2,20 (2H, т, J=7,2 Гц), 2,09 (3H, с), 1,75-1,57 (6H, м).
Пример 34
Трет-бутил (6-гидроксиметилпиридин-2-илметил)метилкарбамат (0,76 г) и диизопропилэтиламин (0,78 мл) растворяли в 10 мл метиленхлорида, к полученному раствору добавляли 0,23 мл метансульфонилхлорида при комнатной температуре и смесь перемешивали в течение 1 часа. К реакционной смеси добавляли воду, органический слой промывали насыщенным раствором соли, высушивали над безводным сульфатом магния и затем растворитель удаляли при пониженном давлении. Полученное масло растворяли в 20 мл этанола, добавляли 0,23 г тиомочевины и смесь кипятили с обратным холодильником в течение 1 часа. После охлаждения реакционной смеси растворитель удаляли при пониженном давлении и остаток промывали диэтиловым эфиром с получением 0,9 г масла светло-коричневого цвета. Весь продукт и 0,63 г N-[4-(2,2-дициановинил)фенил]ацетамида растворяли в 20 мл этанола и раствор кипятили с обратным холодильником в течение 2 часов. К реакционной смеси добавляли 0,32 г NBS и смесь кипятили с обратным холодильником еще в течение 5 минут. После охлаждения смеси растворитель удаляли при пониженном давлении. Остаток растворяли в хлороформе, промывали водой (дважды) и насыщенным раствором соли (один раз) и затем высушивали над безводным сульфатом магния. Растворитель удаляли при пониженном давлении, полученное масло очищали хроматографией на силикагеле (смесь метиленхлорид-метанол-водный аммиак = 90:10:1). Сырые кристаллы перекристаллизовывали из смеси этилацетат-гексан с получением 0,51 г трет-бутил {6-[4-(4-ацетиламинофенил)-6-амино-5-цианопиримидин-2-илсульфанилметил]пиридин-2-илметил}метилкарбамата в виде порошка белого цвета.
1H-ЯМР (ДМСО-d6) δ: 10,24 (1H, с), 7,84 (2H, д, J=8,4 Гц), 7,75-7,69 (3H, м), 7,43 (1H, д, J=7,5 Гц), 7,05 (1H, д, J=7,5 Гц), 4,48 (3H, с), 4,43 (2H, с), 2,85 (3H, с), 2,09 (3H, с), 1,51-1,25 (9H, м).
Пример 35
По той же методике, описанной в примере 32, использование соединения примера 34 вместо соединения примера 30 в качестве исходного соединения давало N-{4-[6-амино-5-циано-2-(6-метиламинометилпиридин-2-илметилсульфанил)пиримидин-4-ил]фенил}ацетамид в виде порошка белого цвета.
1H-ЯМР (ДМСО-d6) δ: 10,24 (1H, с), 7,65-8,25 (2H, шир. с), 7,84 (2H, д, J=8,7 Гц), 7,72-7,66 (3H, м), 7,41 (1H, д, J=7,8 Гц), 7,30 (1H, д, J=7,8 Гц), 4,48 (2H, с), 3,74 (2H, с), 2,31 (3H, с), 2,09 (3H, с).
Пример 36
По той же методике, описанной в примере 33, использование соединения примера 35 вместо соединения примера 32 давало N-{6-[4-(4-ацетиламинофенил)-6-амино-5-цианопиримидин-2-илсульфанилметил]пиридин-2-илметил}-N-метил-4-пирролидин-1-илбутиламид гидрохлорид в виде порошка белого цвета.
1H-ЯМР (ДМСО-d6) δ: 10,23 (1H, с), 8,22-7,66 (2H, шир. с), 7,86-7,65 (5H, м), 7,47-7,39 (1H, м), 7,13-7,01 (1H, м), 4,71-4,42 (4H, м), 3,05-2,78 (3H, м), 2,45-2,20 (8H, м), 2,09 (3H, с), 1,75-1,55 (6H, м).
Пример 37
Соединение примера 32 (0,5 г) и триэтиламин (0,3 мл) растворяли в 5 мл ДМСО, к раствору при 0°С добавляли 0,17 г 3-бромпропионилхлорида и смесь перемешивали в течение 30 минут. Реакционную смесь разбавляли хлороформом, промывали водой (дважды) и насыщенным раствором соли (один раз) и органический слой высушивали над безводным сульфатом магния. Растворитель удаляли и полученные сырые кристаллы промывали диэтиловым эфиром с получением 0,12 г N-{6-[4-(4-ацетиламинофенил)-6-амино-5-цианопиримидин-2-илсульфанилметил]пиридин-2-илметил}акриламида в виде порошка белого цвета.
1H-ЯМР (ДМСО-d6) δ: 10,29 (1H, с), 8,73-8,65 (1H, м), 8,25-7,65 (2H, шир. с), 7,84 (2H, д, J=9 Гц), 7,81-7,70 (3H, м), 7,50-7,45 (1H, м), 7,23-7,11 (1H, м), 6,20-5,79 (3H, м), 4,51-4,32 (4H, м), 2,10 (3H, с).
Пример 38
Соединение примера 37 (0,11 г) и 4-пиперидинопиперидин (0,1 г) растворяли в 2 мл ДМСО и раствор перемешивали при комнатной температуре в течение ночи. К реакционному раствору добавляли хлороформ и воду, и органический слой промывали водой (дважды), затем насыщенным раствором соли (один раз), и органический слой высушивали над безводным сульфатом магния. После удаления растворителя остаток очищали хроматографией на силикагеле (смесь метиленхлорид-метанол-28% водный аммиак = 90:10:1) с получением 50 мг N-{6-[4-(4-ацетиламинофенил)-6-амино-5-цианопиримидин-2-илсульфанилметил]пиридин-2-илметил}-3-[1,4']бипиперидинил-1'-илпропионамида. Данный продукт превращали в его гидрохлорид (масло светло-желтого цвета) по методике, описанной в примере 31.
1H-ЯМР (ДМСО-d6) δ: 10,2 (1H, с), 7,83 (2H, д, J=8,7 Гц), 7,71 (2H, д, J=8,7 Гц), 7,66 (1H, т, J=7,2 Гц), 7,33 (1H, д, J=7,2 Гц), 7,15 (1H, д, J=7,2 Гц), 4,46 (2H, с), 3,55-3,52 (4H, м), 2,86 (2H, т, J=7,2 Гц), 2,60 (2H, т, J=7,2 Гц), 2,39 (4H, шир. т), 2,03 (3H, с).
Пример 39
К 0,2 г соединения примера 30 добавляли 1 мл трифторуксусной кислоты, смесь перемешивали при комнатной температуре в течение 30 минут и затем реакционную смесь концентрировали досуха при пониженном давлении. Остаток растворяли в 5 мл ацетонитрила и к раствору добавляли 2 мл триэтиламина и смесь перемешивали при комнатной температуре. Затем добавляли 63 мг 4-метилпиперазин-1-карбонилхлорида гидрохлорида и смесь перемешивали при комнатной температуре в течение ночи. К реакционному раствору добавляли воду и полученные кристаллы отфильтровывали, промывали этанолом и затем высушивали с получением 35 мг {6-[4-(4-ацетиламинофенил)-6-амино-5-цианопиримидин-2-илсульфанилметил]пиридин-2-илметил}амида 4-метилпиперазин-1-карбоновой кислоты. Полученный продукт превращали в гидрохлорид (порошок белого цвета) по методике, описанной в примере 31.
1H-ЯМР (ДМСО-d6) δ: 10,24 (1H, с), 8,25-7,65 (2H, шир. с), 7,86 (2H, д, J=8,7 Гц), 7,74-7,65 (3H, м), 7,38 (1H, д, J=7,5 Гц), 7,17-7,10 (2H, м), 4,47 (2H, с), 4,31 (2H, д, J=6,0 Гц), 3,35-3,30 (4H, м), 2,31-2,24 (4H, м), 2,37 (3H, с), 2,10 (3H, с).
Пример 40
К суспензии 0,1 г соединения примера 32 в 5 мл ДМСО добавляли 0,25 мл диизопропилэтиламина и добавляли по каплям 0,04 мл 1-пропансульфонилхлорида при перемешивании. Через 30 минут к реакционной смеси добавляли воду и полученные кристаллы отфильтровывали и высушивали при пониженном давлении с получением 80 мг N-[4-(6-амино-5-циано-2-{6-[(пропан-1-сульфониламино)метил]пиридин-2-илметилсульфанил}пиримидин-4-ил)фенил]ацетамида в виде порошка белого цвета.
1H-ЯМР (ДМСО-d6) δ: 10,23 (1H, с), 7,65-8,20 (5H, м), 7,46 (1H, д, J=7,8 Гц), 7,33 (1H, д, J=7,8 Гц), 4,48 (2H, с), 4,22 (2H, д, J=6,3 Гц), 2,94-3,01 (2H, м), 2,09 (3H, с), 1,55-1,70 (2H, м), 0,89 (3H, т, J=7,5 Гц).
Пример 41
К суспензии 0,1 г соединения примера 35 в 5 мл ацетонитрила добавляли 0,25 мл диизопропилэтиламина, добавляли по каплям 0,04 мл 1-пропансульфонилхлорида при перемешивании. Через 1 час к реакционной смеси добавляли воду и полученные кристаллы отфильтровывали и высушивали при пониженном давлении с получением 80 мг N-{4-[6-амино-5-циано-2-(6-{[метил(пропан-1-сульфонил)амино]метил}пиридин-2-илметилсульфанил)пиримидин-4-ил]фенил}ацетамида в виде порошка белого цвета.
1H-ЯМР (ДМСО-d6) δ: 10,23 (1H, с), 7,65-8,20 (5H, м), 7,49 (1H, д, J=7,8 Гц), 7,27 (1H, д, J=7,8 Гц), 4,50 (2H, с), 4,40 (2H, с), 2,77-3,32 (2H, м), 2,79 (3H, с), 2,09 (3H, с), 1,61-1,76 (3H, м), 0,96 (3H, т, J=7,2 Гц).
Формулы каждого соединения, полученного в примерах 30-41, представлены в последующей таблице 5.
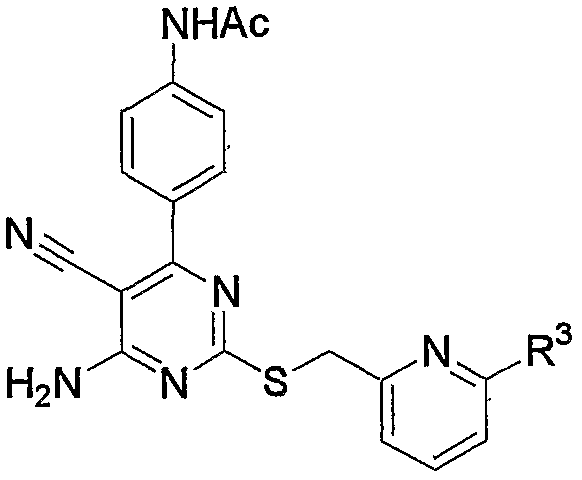
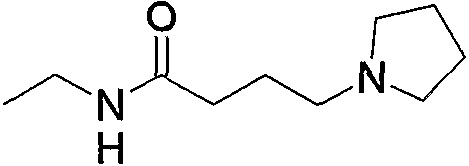
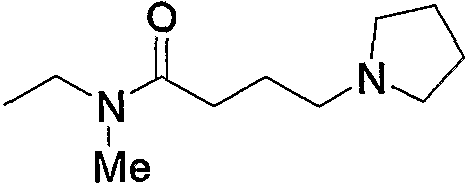
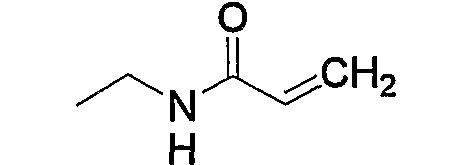
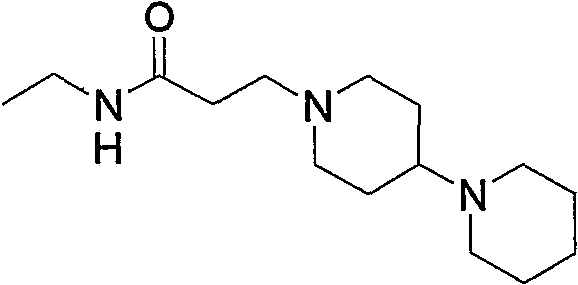
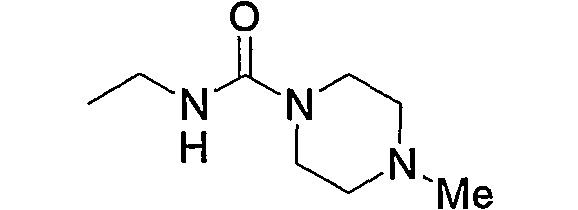
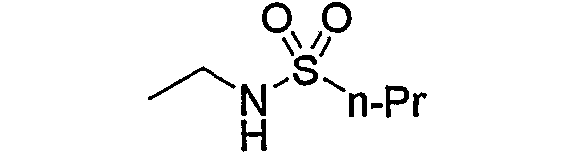
Пример 42
Тиомочевину (5,33 г) растворяли в 70 мл этанола при 60°С, к раствору добавляли 19,21 г соединения ссылочного примера 10 в 50 мл этанола и смесь перемешивали при той же температуре в течение 2 часов. После охлаждения к реакционной смеси добавляли 14,7 г бикарбоната натрия и смесь перемешивали при комнатной температуре в течение 10 минут. Дополнительно к смеси добавляли 14,8 г N-[4-(2,2-дициановинил)фенил]ацетамида и 50 мл этанола и смесь кипятили с обратным холодильником в течение ночи. Реакционную смесь выливали в ледяную воду и экстрагировали этилацетатом. Органический слой промывали насыщенным раствором соли, высушивали над безводным сульфатом магния и концентрировали досуха при пониженном давлении. Остаток растворяли в 200 мл этанола и при кипячении с обратным холодильником каждый час добавляли по 2 г NBS, и в целом это составляло 4 раза. После охлаждения реакционную смесь выливали в насыщенный водный раствор бикарбоната натрия и экстрагировали этилацетатом. Органический слой промывали насыщенным раствором соли, высушивали над безводным сульфатом магния и концентрировали досуха при пониженном давлении. Остаток очищали хроматографией на силикагеле (смесь хлороформ-метанол = 10:1) и перекристаллизовывали из смеси ацетон-IPE с получением 16,19 г трет-бутил 3-{6-[4-(4-ацетиламинофенил)-6-амино-5-цианопиримидин-2-илсульфанилметил]пиридин-2-илметил}пропионата в виде порошка светло-желтого цвета.
1H-ЯМР (ДМСО-d6) δ: 7,83 (2H, д, J=8,7 Гц), 7,72 (2H, д, J=8,7 Гц), 7,63 (1H, т, J=7,5 Гц), 7,35 (1H, д, J=7,5 Гц), 7,14 (1H, д, J=7,5 Гц), 4,45 (2H, с), 2,94 (2H, т, J=7,5 Гц), 2,61 (2H, т, J=7,5 Гц), 2,09 (3H, с), 1,34 (9H, с).
Пример 43
Соединение ссылочного примера 11 (3 г) растворяли в 50 мл дихлорметана, добавляли 4 мл диизопропилэтиламина, добавляли по каплям 1,3 мл метансульфонилхлорида при 0°С и смесь перемешивали в течение 1 часа. К реакционной смеси добавляли воду, органический слой промывали водой и насыщенным раствором соли, высушивали над сульфатом магния и затем растворитель удаляли при пониженном давлении. Полученное масло коричневого цвета растворяли в 50 мл этанола, добавляли 1,0 г тиомочевины и смесь кипятили с обратным холодильником в течение 1 часа. После охлаждения реакционного раствора, добавляли 2,5 г N-[4-(2,2-дициановинил)фенил]ацетамида, 5 мл диизопропилэтиламина и одну каплю DBU и смесь перемешивали при комнатной температуре в течение ночи. После удаления реакционного растворителя при пониженном давлении остаток растворяли в 50 мл этилацетата, добавляли 1,8 г NBS при 0°С, при перемешивании и смесь перемешивали в течение 30 минут. К реакционной смеси добавляли воду, органический слой промывали водой и насыщенным раствором соли. Органический слой высушивали над безводным сульфатом магния и затем растворитель удаляли при пониженном давлении. Полученное масло белого цвета кристаллизовали из 2-пропанола, дополнительно перекристаллизовывали из 2-пропанола с получением 2,3 г этил 3-{6-[4-(4-ацетиламинофенил)-6-амино-5-цианопиримидин-2-илсульфанилметил]пиридин-2-ил}пропионата в виде порошка белого цвета.
1H-ЯМР (ДМСО-d6) δ: 10,23 (1H, с), 7,26-8,20 (2H, шир. с) 7,83 (2H, д, J=8,7 Гц), 7,72 (2H, д, J=8,7 Гц), 7,63 (1H, т, J=7,8 Гц), 7,35 (1H, д, J=7,8 Гц) 7,15 (1H, д, J=7,8 Гц), 4,45 (2H, с), 4,03 (2H, кв, J=7,2 Гц), 2,98 (2H, т, J=7,2 Гц), 2,70 (2H, т, J=7,2 Гц), 2,09 (3H, с), 1,14 (3H, т, J=7,2 Гц).
Пример 44
По той же методике, описанной в примере 43, использование соединения ссылочного примера 12 вместо соединения ссылочного примера 11, тиомочевины и N-[4-(2,2-дициановинил)фенил]ацетамида, давало метил 3-{6-[4-(4-ацетиламинофенил)-6-амино-5-цианопиримидин-2-илсульфанилметил]пиридин-2-ил}пропионат в виде порошка белого цвета.
1H-ЯМР (ДМСО-d6) δ: 10,23 (1H, с), 8,20-7,60 (2H, шир. с), 7,83 (2H, д, J=8,7 Гц), 7,72 (2H, д, J=8,7 Гц), 7,63 (1H, т, J=7,8, 7,8 Гц), 7,35 (1H, д, J=7,8 Гц), 7,15 (1H, д, J=7,8 Гц), 4,45 (2H, с), 3,57 (3H, с), 2,96 (2H, т, J=7,2 Гц), 2,74 (2H, т, J=7,2 Гц), 2,09 (3H, с).
Пример 45
Соединение примера 42 (8,21 г) охлаждали при 0°С, добавляли 30 мл ТФА и смесь перемешивали при комнатной температуре в течение 1,5 часа. ТФА удаляли при пониженном давлении, затем к остатку добавляли 100 мл хлороформа и вновь упаривали при пониженном давлении. Остаток растворяли в ацетоне, добавляли 18 мл 1 н. соляной кислоты и смесь концентрировали досуха при пониженном давлении. Остаток распределяли в ацетоне и фильтровали с получением 6,82 г 3-{6-[4-(4-ацетиламинофенил)-6-амино-5-цианопиримидин-2-илсульфанилметил]пиридин-2-ил}пропионовой кислоты гидрохлорида в виде порошка светло-желтого цвета.
1H-ЯМР (CD3OD) δ: 8,38 (1H, т, J=7,8 Гц), 8,05 (1H, д, J=7,8 Гц), 7,82 (2H, д, J=9,0 Гц), 7,81 (1H, д, J=7,8 Гц), 7,72 (2H, д, J=9,0 Гц), 4,69 (2H, с), 3,15 (2H, т, J=6,9 Гц), 2,84 (2H, т, J=6,9 Гц), 2,16 (3H, с).
Пример 46
Соединение примера 45 (100 мг) суспендировали в 2 мл метиленхлорида. К суспензии добавляли 34 мкл N-метилпиперазина, 79 мг WSC и 72 мкл диизопропилэтиламина и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли насыщенный раствор соли, смесь экстрагировали этилацетатом. Органический слой промывали насыщенным раствором соли, высушивали над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле (смесь хлороформ-метанол-28% водный аммиак = 100:10:1) с получением 95 мг N-[4-(6-амино-5-циано-2-{6-[3-(4-метилпиперазин-1-ил)-3-оксопропил]пиридин-2-илметилсульфанил}пиримидин-4-ил)фенил]ацетамида.
Соединение (69 мг) растворяли в метаноле и добавляли 0,29 мл 1 н. соляной кислоты и смесь концентрировали досуха при пониженном давлении. Остаток перекристаллизовывали из смеси метанол-IPE с получением 67 мг гидрохлорида вышеуказанного соединения (порошок светло-желтого цвета).
Характеристики данного гидрохлорида представляют следующее:
1H-ЯМР (CD3OD) δ: 8,39 (1H, т, J=7,8 Гц), 8,04 (1H, д, J=7,8 Гц), 7,83 (1H, д, J=7,8 Гц), 7,82 (2H, д, J=8,7 Гц), 7,72 (2H, д, J=8,7 Гц), 4,72 (2H, с), 3,65-3,40 (4H, м), 3,26-2,99 (8H, м), 2,91 (3H, с), 2,16 (3H, с).
Пример 47
По той же методике, описанной в примере 42, использование соединения ссылочного примера 14 вместо соединения ссылочного примера 10 давало трет-бутил 3-{6-[4-(4-ацетиламинофенил)-6-амино-5-цианопиримидин-2-илсульфанилметил]пиридин-2-ил}акрилат в виде порошка светло-коричневого цвета.
1H-ЯМР (ДМСО-d6) δ: 10,22 (1H, с), 7,82 (2H, д, J=8,7 Гц), 7,79 (1H, т, J=7,5 Гц), 7,70 (2H, д, J=8,7 Гц), 7,60 (1H, д, J=7,5 Гц), 7,55 (1H, д, J=7,5 Гц), 7,53 (1H, д, J=15,9 Гц), 6,78 (1H, д, J=15,9 Гц), 4,53 (2H, с), 2,08 (3H, с), 1,48 (9H, с).
Пример 48
В круглодонную колбу вносили 251 мг соединения примера 47. После охлаждения колбы при 0°С также вносили 0,5 мл ТФА и смесь перемешивали при комнатной температуре в течение 1 часа. После удаления ТФА при пониженном давлении к маслянистому остатку добавляли 5 мл ацетонитрила, дополнительно добавляли по каплям 5 мл триэтиламина при перемешивании. Дополнительно добавляли 50 мг N-метилпиперазина и 455 мг реагента BOP и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении, очищали хроматографией на силикагеле (смесь хлороформ-метанол-водный аммиак = 200:10:1) с получением 40 мг N-[4-(6-амино-5-циано-2-{6-[3-(4-метилпиперазин-1-ил)-3-оксопропенил]пиридин-2-илметилсульфанил}пиримидин-4-ил)фенил]ацетамида. Весь продукт растворяли в этаноле, к указанному раствору добавляли 0,15 мл 1 моль/л соляной кислоты в этаноле и затем растворитель удаляли с получением 48 мг вышеуказанного соединения в виде гидрохлорида (порошок белого цвета).
Характеристики данного гидрохлорида представляют следующее:
1H-ЯМР (ДМСО-d6) δ: 10,2 (1H, с), 7,82 (2H, д, J=9,0 Гц), 7,76 (1H, д, J=7,8 Гц), 7,70 (2H, д, J=9,0 Гц), 7,61 (1H, д, J=7,8 Гц), 7,51 (1H, д, J=7,8 Гц), 7,46 (2H, с), 4,53 (2H, с), 3,57 (4H, шир. т), 2,31 (4H, шир. т), 2,19 (3H, с), 2,08 (3H, с).
Пример 49
По той же методике, описанной в примере 43, использование соединения ссылочного примера 13 вместо соединения ссылочного примера 11 давало этил 3-{6-[4-(4-ацетиламинофенил)-6-амино-5-цианопиримидин-2-илсульфанилметил]пиридин-2-ил}-2-метилпропионат в виде порошка светло-желтого цвета.
1H-ЯМР (CDCl3) δ: 7,99 (2H, д, J=9,0 Гц), 7,64 (2H, д, J=9,0 Гц), 7,50 (1H, т, J=7,5 Гц), 7,28 (1H, д, J=7,5 Гц), 6,99 (1H, д, J=7,5 Гц), 5,82 (2H, шир. с), 4,52 (1H, д, J=14,4 Гц), 4,44 (1H, д, J=14,4 Гц), 4,13 (2H, кв, J=7,2 Гц), 3,17 (1H, дд, J=13,8, 7,8 Гц), 3,08-3,00 (1H, м), 2,87 (1H, дд, J=13,8, 6,0 Гц), 2,21 (3H, с), 1,26-1,12 (6H, м).
Пример 50
Соединение примера 49 (1,13 г) растворяли в 30 мл этанола, добавляли 7,5 мл 1 н. водного раствора гидроксида натрия и смесь перемешивали при комнатной температуре в течение ночи. Растворитель удаляли при пониженном давлении и остаток нейтрализовали 2% водным раствором лимонной кислоты и распределяли, и затем нерастворимое вещество отфильтровывали. Полученный сырой продукт очищали хроматографией на силикагеле (смесь метиленхлорид-метанол = 10:1) с получением 597 мг 3-{6-[4-(4-ацетиламинофенил)-6-амино-5-цианопиримидин-2-илсульфанилметил]пиридин-2-ил}-2-метилпропионовой кислоты в виде бесцветного порошка.
1H-ЯМР (ДМСО-d6) δ: 10,23 (1H, с), 7,83 (2H, д, J=9,0 Гц), 7,71 (2H, д, J=9,0 Гц), 7,63 (1H, т, J=7,5 Гц), 7,36 (1H, д, J=7,5 Гц), 7,12 (1H, д, J=7,5 Гц), 4,47 (2H, с), 3,05 (1H, дд, J=13,8, 6,9 Гц), 2,86 (1H, сeкст, J=6,9 Гц), 2,71 (1H, дд, J=13,8, 7,2 Гц), 2,09 (3H, с), 1,04 (3H, д, J=6,9 Гц).
Пример 51
По той же методике, описанной в примере 46, использование соединения примера 50 вместо соединения примера 45, давало N-[4-(6-амино-5-циано-2-{6-[2-метил-3-(4-метилпиперазин-1-ил)-3-оксопропил]пиридин-2-илметилсульфанил}пиримидин-4-ил)фенил]ацетамид в виде порошка светло-желтого цвета.
1H-ЯМР (ДМСО-d6) δ: 10,24 (1H, с), 7,84 (2H, д, J=9,0 Гц), 7,72 (2H, д, J=9,0 Гц), 7,60 (1H, т, J=7,5 Гц), 7,35 (1H, д, J=7,5 Гц), 7,04 (1H, д, J=7,5 Гц), 4,49 (1H, д, J=13,8 Гц), 4,42 (1H, д, J=13,8 Гц), 3,35-3,25 (5H, м), 2,97 (1H, дд, J=17,1, 8,4 Гц), 2,69 (1H, дд, J=17,1, 6,0 Гц), 2,54-1,91 (4H, м), 2,09 (6H, с), 1,04 (3H, д, J=6,0 Гц).
Пример 52
К 9 мл дихлорметана добавляли соединение ссылочного примера 15 (540 мг) и диизопропилэтиламин (244 мг). После перемешивания смеси при 0°С в течение 10 минут, к смеси добавляли по каплям 0,16 мл метансульфонилхлорида и затем смесь перемешивали при комнатной температуре в течение 1 часа. Полученный раствор мезилата добавляли по каплям в раствор 142 мг тиомочевины в 2 мл этанола при 60°С и смесь перемешивали при той же температуре в течение 1 часа. После удаления растворителя из реакционной смеси к остатку добавляли 9 мл этанола, 396 мг N-[4-(2,2-дициановинил)фенил]ацетамида и 473 мг бикарбоната натрия и смесь кипятили с обратным холодильником в течение 2 часов. После охлаждения реакционной смеси добавляли 270 мг NBS и смесь кипятили с обратным холодильником в течение 30 минут. После удаления растворителя при пониженном давлении к остатку добавляли насыщенный водный раствор бикарбоната натрия. Смесь экстрагировали хлороформом, органический слой промывали насыщенным раствором соли, высушивали над безводным сульфатом магния и затем растворитель удаляли при пониженном давлении. Остаток очищали хроматографией на силикагеле (смесь метиленхлорид-метанол-триэтиламин = 600:20:1), затем перекристаллизовывали из этанола с получением 190 мг N-[4-(6-амино-5-циано-2-{6-[5-(4-метилпиперазин-1-ил)-5-оксопент-1-инил]пиридин-2-илметилсульфанил}пиримидин-4-ил)фенил]ацетамида в виде порошка белого цвета.
1H-ЯМР (ДМСО-d6) δ: 10,2 (1H, с), 7,83 (2H, д, J=8,7 Гц), 7,73-7,67 (3H, м), 7,49 (1H, д, J=7,5 Гц), 7,30 (1H, д, J=7,5 Гц), 4,45 (2H, с), 3,38-3,32 (4H, м), 2,62 (4H, с), 2,29-2,21 (4H, м), 2,14 (3H, с), 2,09 (3H, с).
Пример 53
К 7 мл этанола добавляли соединение ссылочного примера 16 (2,28 г) и тиомочевину (545 мг) и смесь перемешивали при 60°С в течение 1,5 часа. После охлаждения смеси добавляли к смеси 1,40 г N-[4-(2,2-дициановинил)фенил]ацетамида и 1,46 г триэтиламина и смесь перемешивали при 60°С в течение 4 часов. Полученный реакционный раствор охлаждали при 0°С, добавляли 827 мг NBS и смесь перемешивали при той же температуре в течение 30 минут. Из реакционной смеси удаляли растворитель при пониженном давлении. К остатку добавляли воду и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным раствором соли, высушивали над безводным сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле (смесь метиленхлорид-этанол = 30:1) с получением 1,86 г трет-бутил 5-{6-[4-(4-ацетиламинофенил)-6-амино-5-цианопиримидин-2-илсульфанилметил]пиридин-2-ил}пентаноата в виде порошка белого цвета.
1H-ЯМР (ДМСО-d6) δ: 10,2 (1H, с), 7,83 (2H, д, J=8,4 Гц), 7,70 (2H, д, J=8,4 Гц), 7,62 (1H, т, J=7,5 Гц), 7,34 (1H, д, J=7,5 Гц), 7,10 (1H, д, J=7,5 Гц), 4,45 (2H, с), 2,69 (2H, т, J=7,5 Гц), 2,19 (2H, т, J=7,5 Гц), 2,08 (3H, с), 1,66-1,47 (4H, м), 1,37 (9H, с).
Пример 54
Соединение примера 53 (1,06 г) охлаждали при 0°С, добавляли по каплям 2 мл ТФА и смесь перемешивали при комнатной температуре в течение 1,5 часа. Оставшуюся ТФА удаляли при пониженном давлении, остаток растворяли в 20 мл ДМФА. Раствор нейтрализовали 3 мл триэтиламина при 0°С и перемешивали в течение 15 минут после добавления затем 1,8 г HOBt. К реакционной смеси добавляли 200 мг N-метилпиперазина и 764 мг WSC и смесь перемешивали при комнатной температуре в течение ночи. Полученную реакционную смесь упаривали при пониженном давлении, добавляли бикарбонат натрия и смесь экстрагировали хлороформом. Органический слой промывали насыщенным раствором соли, высушивали над безводным сульфатом магния и затем растворитель удаляли. Остаток очищали хроматографией на силикагеле (смесь метиленхлорид-метанол-триэтиламин = 300:10:1) с получением 1,0 г N-[4-(6-амино-5-циано-2-{6-[5-(4-метилпиперазин-1-ил)-5-оксопентил]пиридин-2-илметилсульфанил}пиримидин-4-ил)фенил]ацетамида в виде порошка белого цвета.
1H-ЯМР (CDCl3) δ: 8,34 (1H, с), 7,90 (2H, д, J=8,4 Гц), 7,67 (2H, д, J=8,4 Гц), 7,52 (1H, т, J=7,5 Гц), 7,31 (1H, д, J=7,5 Гц), 7,01 (1H, д, J=7,5 Гц), 5,71 (2H, с), 4,50 (2H, с), 3,62 (2H, т, J=5,1 Гц), 3,50 (2H, т, J=5,1 Гц), 2,82 (2H, т, J=7,5 Гц), 2,44-2,34 (6H, м), 2,30 (3H, с), 2,20 (3H, с), 1,86-1,73 (4H, м).
Пример 55
По той же методике, описанной в примере 54, использование 1-(2-диэтиламиноэтил)пиперазина вместо N-метилпиперазина давало N-{4-[6-амино-5-циано-2-(6-{5-[4-(2-диэтиламиноэтил)пиперазин-1-ил]-5-оксопентил}пиридин-2-илметилсульфанил)пиримидин-4-ил]фенил}ацетамид гидрохлорид в виде порошка белого цвета.
1H-ЯМР (ДМСО-d6) δ: 10,2 (1H, с), 7,83 (2H, т, J=8,7 Гц), 7,72 (2H, д, J=8,7 Гц), 7,64 (1H, т, J=7,8 Гц), 7,34 (1H, д, J=7,8 Гц), 7,12 (1H, д, J=7,8 Гц), 4,46 (2H, с), 2,70 (2H, т, J=7,5 Гц), 2,31-2,26 (8H, м), 2,09 (3H, с), 1,65-1,63 (2H, м), 1,52-1,49 (2H, м), 0,97-0,90 (6H, м).
Пример 56
Соединение примера 46 (1 г) суспендировали в смешанном растворителе из 10 мл этанола и 10 мл воды. К суспензии добавляли 10 мл 5 н. соляной кислоты и смесь перемешивали в течение 4 часов при нагревании при 60°С. После удаления этанола из реакционной смеси при пониженном давлении смесь нейтрализовали 5 н. водным раствором гидроксида натрия при 0°С. Полученные кристаллы отфильтровывали, промывали диэтиловым эфиром и затем высушивали при пониженном давлении с получением 0,85 г 4-амино-6-(4-аминофенил)-2-{6-[3-(4-метилпиперазин-1-ил)-3-оксопропил]пиридин-2-илметилсульфанил}пиримидин-5-карбонитрила в виде порошка белого цвета.
1H-ЯМР (ДМСО-d6) δ: 7,73 (2H, д, J=8,7 Гц), 7,80-7,55 (2H, шир. с), 7,61 (1H, т, J=7,8 Гц), 7,33 (1H, д, J=7,8 Гц), 7,14 (1H, д, J=7,8 Гц), 6,61 (2H, д, J=8,7 Гц), 5,90 (2H, с), 4,45 (2H, с), 3,40-3,34 (4H, м), 2,94 (2H, т, J=7,2 Гц), 2,70 (2H, т, J=7,2 Гц), 2,25-2,19 (4H, м), 2,12 (3H, с).
Пример 57
Соединение примера 56 (150 мг) и триэтиламин (0,5 мл) растворяли в 10 мл ацетонитрила и к смеси добавляли по каплям 0,1 г пропионилхлорида и смесь перемешивали при комнатной температуре в течение 30 минут. После удаления растворителя остаток растворяли в хлороформе. К полученному раствору добавляли воду, органический слой промывали водой (дважды), затем насыщенным раствором соли (один раз) и высушивали над сульфатом магния. После удаления растворителя при пониженном давлении полученное масло очищали хроматографией на силикагеле (смесь метиленхлорид-метанол-водный аммиак = 90:10:1) с получением 50 мг N-[4-(6-амино-5-циано-2-{6-[3-(4-метилпиперазин-1-ил)-3-оксопропил]пиридин-2-илметилсульфанил}пиримидин-4-ил)фенил]пропионамида в виде порошка светло-желтого цвета.
1H-ЯМР (ДМСО-d6) δ: 10,16 (1H, с), 8,20-7,64 (2H, шир. с), 7,84 (2H, д, J=8,7 Гц), 7,74 (2H, д, J=8,7 Гц), 7,62 (1H, т, J=7,8 Гц), 7,34 (1H, д, J=7,8 Гц) 7,14 (1H, д, J=7,8 Гц), 4,46 (2H, с), 3,42-3,35 (4H, м), 2,94 (2H, т, J=7,2 Гц), 2,70 (2H, т, J=7,2 Гц), 2,37 (2H, кв, J=7,5 Гц), 2,20-2,16 (4H, м), 2,12 (3H, с), 1,10 (3H, т, J=7,5 Гц).
Пример 58
По той же методике, описанной в примере 57, использование бутирилхлорида вместо пропионилхлорида давало N-[4-(6-амино-5-циано-2-{6-[3-(4-метилпиперазин-1-ил)-3-оксопропил]пиридин-2-илметилсульфанил}пиримидин-4-ил)фенил]бутиламид в виде порошка белого цвета.
1H-ЯМР (ДМСО-d6) δ: 10,24 (1H, с), 7,83 (2H, д, J=8,7 Гц), 7,73 (2H, д, J=8,7 Гц), 7,62 (1H, т, J=7,2 Гц), 7,34 (1H, д, J=7,2 Гц), 7,14 (1H, д, J=7,2 Гц), 4,46 (2H, с), 3,40-3,35 (4H, м), 2,94 (2H, т, J=7,5 Гц), 2,70 (2H, т, J=7,5 Гц), 2,20-2,16 (4H, м), 2,12 (3H, с), 1,63 (2H, сeкстет, J=7,5 Гц), 0,93 (3H, т, J=7,5 Гц).
Пример 59
По той же методике, описанной в примере 46, использование N-(трет-бутоксикарбонил)этилендиамина вместо N-метилпиперазина давало трет-бутил [2-(3-{6-[4-(4-ацетиламинофенил)-6-амино-5-цианопиримидин-2-илсульфанилметил]пиридин-2-ил}пропиониламино)этил]карбамат в виде бесцветного порошка.
1H-ЯМР (ДМСО-d6) δ: 10,24 (1H, с), 7,88 (1H, шир. т, J=7,5 Гц), 7,83 (2H, д, J=8,4 Гц), 7,72 (2H, д, J=8,4 Гц), 7,62 (1H, т, J=7,5 Гц), 7,35 (1H, д, J=7,5 Гц), 7,12 (1H, д, J=7,5 Гц), 6,77 (1H, шир. т, J=7,5 Гц), 4,46 (2H, с), 3,05 (2H, кв, J=7,5 Гц), 2,98-2,90 (4H, м), 2,46 (2H, т, J=7,5 Гц), 2,09 (3H, с).
Пример 60
К 100 мг соединения примера 59 при 0°С добавляли 1 мл ТФА и смесь перемешивали в течение 30 минут. Реакционный раствор упаривали досуха при пониженном давлении и растворяли в 10 мл этанола. К раствору добавляли 0,37 мл 1 н. соляной кислоты и смесь концентрировали досуха при пониженном давлении. Полученное твердое вещество перекристаллизовывали из смеси метанол-IPE с получением 90 мг 3-{6-[4-(4-ацетиламинофенил)-6-амино-5-цианопиримидин-2-илсульфанилметил]пиридин-2-ил}-N-(2-аминоэтил)пропионамида гидрохлорида в виде порошка светло-желтого цвета.
1H-ЯМР (ДМСО-d6) δ: 10,23 (1H, с), 8,12 (1H, шир. т, J=7,5 Гц), 7,85 (2H, шир. с), 7,82 (2H, д, J=8,7 Гц), 7,72 (2H, д, J=8,7 Гц), 7,57 (1H, шир. д, J=7,5 Гц), 7,34 (1H, шир. д, J=7,5 Гц), 4,56 (2H, с), 3,29 (2H, кв, J=6,0 Гц), 3,07 (2H, т, J=7,5 Гц), 2,85 (2H, кв, J=6,0 Гц), 2,59 (2H, т, J=7,5 Гц), 2,09 (3H, с).
Пример 61
Соединение примера 45 (200 мг) растворяли в 3 мл ДМФА. К полученному раствору добавляли 54 мг N,N-диметилэтилендиамина, 365 мг BOP и 172 мкл триэтиламина и смесь перемешивали при комнатной температуре в течение ночи. Из реакционной смеси удаляли растворитель при пониженном давлении, остаток очищали хроматографией на силикагеле (смесь хлороформ-метанол-водный аммиак = 50:10:1).
Соединение, полученное на вышеуказанной стадии в свободной форме (187 мг), растворяли в метаноле, к этому добавляли 0,721 мл 1 н. соляной кислоты и смесь упаривали досуха при пониженном давлении. Полученное твердое вещество перекристаллизовывали из смеси метанол-ацетон-IPE с получением 186 мг 3-{6-[4-(4-ацетиламинофенил)-6-амино-5-цианопиримидин-2-илсульфанилметил]пиридин-2-ил}-N-(2-диметиламиноэтил)пропионамида гидрохлорида в виде порошка светло-желтого цвета.
Характеристики данного гидрохлорида представляют следующее:
1H-ЯМР (CD3OD) δ: 8,38 (1H, т, J=7,8 Гц), 8,05 (1H, д, J=7,8 Гц), 7,83 (2H, д, J=9,0 Гц), 7,82 (1H, д, J=7,8 Гц), 7,72 (2H, д, J=9,0 Гц), 4,73 (2H, с), 3,53 (2H, т, J=6,0 Гц), 3,27-3,22 (4H, м), 2,90 (6H, с), 2,82 (2H, т, J=6,0 Гц), 2,16 (3H, с).
Пример 62
По той же методике, описанной в примере 61, использование N,N,N'-триметилэтилендиамина вместо N,N-диметилэтилендиамина давало 3-{6-[4-(4-ацетиламинофенил)-6-амино-5-цианопиримидин-2-илсульфанилметил]пиридин-2-ил}-N-(2-диметиламиноэтил)-N-метилпропионамид гидрохлорид в виде порошка светло-желтого цвета.
1H-ЯМР (CD3OD) δ: 8,37 (1H, т, J=8,1 Гц), 8,03 (1H, д, J=8,1 Гц), 7,84 (1H, д, J=8,1 Гц), 7,83 (2H, д, J=9,0 Гц), 7,72 (2H, д, J=9,0 Гц), 4,73 (2H, с), 3,72 (2H, т, J=5,4 Гц), 3,32-3,21 (4H, м), 3,07 (3H, с), 3,02 (2H, т, J=5,4 Гц), 2,92 (6H, с), 2,16 (3H, с).
Пример 63
По той же методике, описанной в примере 61, использование 39 мкл 3-диметиламинопропиламина вместо N,N-диметилэтилендиамина давало 3-{6-[4-(4-ацетиламинофенил)-6-амино-5-цианопиримидин-2-илсульфанилметил]пиридин-2-ил}-N-(2-диметиламинопропил)пропионамид гидрохлорид в виде порошка светло-желтого цвета.
1H-ЯМР (CD3OD) δ: 8,38 (1H, т, J=7,8 Гц), 8,05 (1H, д, J=7,8 Гц), 7,83 (2H, д, J=9,0 Гц), 7,80 (1H, д, J=7,8 Гц), 7,72 (2H, д, J=9,0 Гц), 4,73 (2H, с), 3,23 (2H, т, J=6,9 Гц), 3,10 (2H, т, J=6,9 Гц), 2,87 (2H, т, J=6,9 Гц), 2,85 (6H, с), 2,79 (2H, т, J=6,9 Гц), 2,16 (3H, с), 1,89 (2H, квинт, J=6,9 Гц).
Пример 64
По той же методике, описанной в примере 61, использование N,N,N'-триметил-1,3-пропандиамина вместо N,N-диметилэтилендиамина давало 3-{6-[4-(4-ацетиламинофенил)-6-амино-5-цианопиримидин-2-илсульфанилметил]пиридин-2-ил}-N-(2-диметиламинопропил)-N-метилпропионамид гидрохлорид в виде порошка светло-желтого цвета.
1H-ЯМР (CD3OD) δ: 8,36 (1H, т, J=7,8 Гц), 8,01 (1H, д, J=7,8 Гц), 7,84 (2H, д, J=9,0 Гц), 7,82 (1H, д, J=7,8 Гц), 7,72 (2H, д, J=9,0 Гц), 4,72 (2H, с), 3,40 (2H, т, J=6,9 Гц), 3,22 (2H, т, J=6,9 Гц), 3,06 (3H, с), 3,06-2,98 (4H, м), 2,82 (6H, с), 2,16 (3H, с).
Пример 65
По той же методике, описанной в примере 46, использование 1-(2-аминоэтил)пиперидина вместо N-метилпиперазина давало 3-{6-[4-(4-ацетиламинофенил)-6-амино-5-цианопиримидин-2-илсульфанилметил]пиридин-2-ил}-N-(2-метилпиперидин-1-илэтил)пропионамид гидрохлорид.
1H-ЯМР (ДМСО-d6) δ: 10,24 (1H, с), 8,25-7,61 (3H, м), 7,83 (2H, д, J=8,7 Гц), 7,72 (2H, д, J=8,7 Гц), 7,62 (1H, т, J=7,8 Гц), 7,35 (1H, д, J=7,5 Гц), 7,12 (1H, д, J=7,5 Гц), 4,46 (2H, с) 3,17-3,12 (2H, м), 2,98-2,89 (2H, м), 2,49-2,45 (2H, м), 2,40-2,22 (6H, м), 2,09 (3H, с), 1,30-2,01 (6H, м).
Пример 66
По той же методике, описанной в примере 61, использование N,N-диэтилэтилендиамина вместо N,N-диметилэтилендиамина давало 3-{6-[4-(4-ацетиламинофенил)-6-амино-5-цианопиримидин-2-илсульфанилметил]пиридин-2-ил}-N-(2-диэтиламиноэтил)пропионамид гидрохлорид в виде порошка светло-желтого цвета.
1H-ЯМР (CD3OD) δ: 8,39 (1H, т, J=8,1 Гц), 8,06 (1H, д, J=8,1 Гц), 7,83 (2H, д, J=9,0 Гц), 7,81 (1H, д, J=8,1 Гц), 7,72 (2H, д, J=9,0 Гц), 4,73 (2H, с), 3,51 (2H, т, J=6,3 Гц), 3,30-3,19 (8H, м), 2,82 (2H, т, J=6,3 Гц), 2,17 (3H, с), 1,29 (6H, т, J=9,0 Гц).
Пример 67
По той же методике, описанной в примере 61, использование 1-метил-4-(метиламино)пиперидина вместо N,N-диметилэтилендиамина давало 3-{6-[4-(4-ацетиламинофенил)-6-амино-5-цианопиримидин-2-илсульфанилметил]пиридин-2-ил}-N-метил-N-(1-метилпиперидин-4-ил)пропионамид гидрохлорид в виде порошка желтого цвета.
1H-ЯМР (CD3OD) δ: 8,39 (1H, т, J=7,8 Гц), 8,03 (1H, д, J=7,8 Гц), 7,86 (2H, д, J=9,0 Гц), 7,83 (1H, д, J=7,8 Гц), 7,73 (2H, д, J=9,0 Гц), 4,80 (2H, с), 3,64-3,47 (2H, м), 3,24 (2H, т, J=6,3 Гц), 3,17-3,12 (1H, м), 2,99 (2H, т, J=6,3 Гц), 2,98-2,89 (2H, м), 2,91 (3H, с), 2,79 (3H, с), 2,16 (3H, с), 2,10-1,76 (4H, м).
Пример 68
По той же методике, описанной в примере 61, использование 4-(диэтиламино)пиперидина вместо N,N-диметилэтилендиамина давало N-[4-(6-амино-5-циано-2-{6-[3-(4-диэтиламинопиперидин-1-ил)-3-оксопропил]пиридин-2-илметилсульфанил}пиримидин-4-ил)фенил]ацетамид гидрохлорид в виде бесцветного порошка.
1H-ЯМР (CD3OD) δ: 8,39 (1H, т, J=7,2 Гц), 8,03 (1H, д, J=7,2 Гц), 7,84 (2H, д, J=8,7 Гц), 7,83 (1H, д, J=7,2 Гц), 7,72 (2H, д, J=8,7 Гц), 4,73 (2H, с), 4,58 (1H, шир. д, J=12,6 Гц), 4,06 (1H, шир. д, J=12,6 Гц), 3,64-3,53 (1H, м), 3,33-2,62 (8H, м), 2,16 (3H, с), 2,16-1,56 (4H, м), 1,35 (6H, т, J=7,2 Гц).
Пример 69
По той же методике, описанной в примере 46, использование 4-пиперидинопиперидина вместо N-метилпиперазина давало N-(4-{6-амино-2-[6-(3-[1,4']бипиперидинил-1'-ил-3-оксопропил)пиридин-2-илметилсульфанил]-5-цианопиримидин-4-ил}фенил)ацетамид гидрохлорид в виде порошка светло-желтого цвета.
1H-ЯМР (ДМСО-d6) δ: 10,45 (1H, с), 8,27 (1H, т, J=7,5 Гц), 7,93 (1H, т, J=7,5 Гц), 7,81 (2H, д, J=9,0 Гц), 7,76 (2H, д, J=9,0 Гц), 7,74 (1H, д, J=7,5 Гц), 4,76 (2H, с), 4,46 (1H, шир. д, J=13,2 Гц), 4,00 (1H, шир. д, J=13,2 Гц), 3,35-3,17 (6H, м), 3,05-2,84 (4H, м), 2,56-2,48 (1H, м), 2,15-2,07 (2H, м), 2,10 (3H, с), 1,97-1,35 (8H, м).
Пример 70
По той же методике, описанной в примере 46, использование 2-пиперидинметанола вместо N-метилпиперазина давало N-[4-(6-амино-5-циано-2-{6-[3-(2-гидроксиметилпиперидин-1-ил)-3-оксопропил]пиридин-2-илметилсульфанил}пиримидин-4-ил)фенил]ацетамид гидрохлорид в виде порошка белого цвета.
1H-ЯМР (ДМСО-d6) δ: 10,24 (1H, с), 8,25-7,50 (2H, шир. с), 7,84 (2H, д, J=8,7 Гц), 7,72 (2H, д, J=8,7 Гц), 7,62 (1H, т, J=7,8 Гц), 7,34 (1H, д, J=7,8 Гц), 7,15 (1H, д, J=7,8 Гц), 4,47 (2H, с), 3,85-4,70 (5H, м), 3,70-3,35 (1H, м), 3,01-2,62 (4H, м), 2,09 (3H, с), 1,80-1,05 (6H, м).
Пример 71
По той же методике, описанной в примере 46, использование 2-пиперидин-1-илметилморфолина вместо N-метилпиперазина давало N-[4-(6-амино-5-циано-2-{6-[3-оксо-3-(2-пиперидин-1-илметилморфолин-4-ил)пропил]пиридин-2-илметилсульфанил}пиримидин-4-ил)фенил]ацетамид гидрохлорид в виде порошка белого цвета.
1H-ЯМР (ДМСО-d6) δ: 10,2 (1H, с), 7,83 (2H, д, J=8,4 Гц), 7,71 (2H, д, J=8,4 Гц), 7,62 (1H, т, J=7,8 Гц), 7,34 (1H, д, J=7,8 Гц), 7,15 (1H, д, J=7,8 Гц), 4,45 (2H, с), 4,25-3,75 (3H, м), 2,94 (4H, м), 2,80-2,73 (2H, м), 2,48-2,20 (8H, м), 2,08 (3H, с), 1,42-1,32 (6H, м).
Пример 72
По той же методике, описанной в примере 46, использование 2-(4-этилпиперазин-1-илметил)морфолина вместо N-метилпиперазина давало N-{4-[6-амино-5-циано-2-(6-{3-[2-(4-этилпиперазин-1-илметил)морфолин-4-ил]-3-оксопропил}пиридин-2-илметилсульфанил)пиримидин-4-ил]фенил}ацетамид гидрохлорид в виде порошка белого цвета.
1H-ЯМР (ДМСО-d6) δ: 10,2 (1H, с), 7,83 (2H, д, J=8,4 Гц), 7,71 (2H, д, J=8,4 Гц), 7,62 (1H, т, J=7,8 Гц), 7,34 (1H, д, J=7,8 Гц), 7,16 (1H, д, J=7,8 Гц), 4,46 (2H, с), 4,25-3,75 (3H, м), 2,94-2,73 (4H, м), 2,48-2,20 (13H, м), 2,08 (3H, с), 0,93 (3H, шир. т).
Пример 73
По той же методике, описанной в примере 61, использование 1-трет-бутоксикарбонилпиперазина вместо N,N-диметилэтилендиамина давало трет-бутил 4-(3-{6-[4-(4-ацетиламинофенил)-6-амино-5-цианопиримидин-2-илсульфанилметил]пиридин-2-ил}пропионил)пиперазин-1-карбоксилат в виде порошка белого цвета.
1H-ЯМР (ДМСО-d6) δ: 10,23 (1H, с), 7,83 (2H, д, J=8,7 Гц), 7,71 (2H, д, J=8,7 Гц), 7,62 (1H, т, J=7,8 Гц), 7,34 (1H, д, J=7,8 Гц), 7,16 (1H, д, J=7,8 Гц), 4,46 (2H, с), 3,41-3,38 (4H, м), 3,30-3,25 (4H, м), 2,95 (2H, т, J=7,5 Гц), 2,73 (2H, т, J=7,5 Гц), 2,09 (3H, с), 1,39 (9H, с).
Пример 74
По той же методике, описанной в примере 60, использование соединения примера 73 давало N-(4-{6-амино-5-циано-2-[6-(3-оксо-3-пиперазин-1-илпропил)пиридин-2-илметилсульфанил]пиримидин-4-ил}фенил)ацетамид гидрохлорид в виде порошка светло-желтого цвета.
1H-ЯМР (CD3OD) δ: 8,34 (1H, т, J=7,8 Гц), 8,00 (1H, д, J=7,8 Гц), 7,83 (2H, д, J=8,7 Гц), 7,79 (1H, д, J=7,8 Гц), 7,71 (2H, д, J=8,7 Гц), 4,70 (2H, с), 3,77-3,74 (4H, м), 3,29-3,16 (6H, м), 3,04 (2H, т, J=6,6 Гц), 2,16 (3H, с).
Пример 75
По той же методике, описанной в примере 61, использование 1-(2-диэтиламиноэтил)пиперазина вместо N,N-диметилэтилендиамина давало N-{4-[6-амино-5-циано-2-(6-{3-[4-(2-диэтиламиноэтил)пиперазин-1-ил]-3-оксопропил}пиридин-2-илметилсульфанил)пиримидин-4-ил]фенил}ацетамид гидрохлорид в виде бесцветного порошка.
1H-ЯМР (CD3OD) δ: 8,39 (1H, т, J=7,8 Гц), 8,05 (1H, д, J=7,8 Гц), 7,86 (1H, д, J=7,8 Гц), 7,83 (2H, д, J=9,0 Гц), 7,73 (2H, д, J=9,0 Гц), 4,73 (2H, с), 3,69-3,07 (20H, м), 2,17 (3H, с), 1,38 (6H, т, J=7,2 Гц).
Пример 76
По той же методике, описанной в примере 46, использование 1-(2-диизопропиламиноэтил)пиперазина вместо N-метилпиперазина давало N-{4-[6-амино-5-циано-2-(6-{3-[4-(2-диизопропиламиноэтил)пиперазин-1-ил]-3-оксопропил}пиридин-2-илметилсульфанил)пиримидин-4-ил]фенил}ацетамид гидрохлорид в виде бесцветного порошка.
1H-ЯМР (ДМСО-d6) δ: 10,23 (1H, с), 7,65-8,20 (2H, шир. с), 7,84 (2H, д, J=8,7 Гц), 7,72 (2H, д, J=8,7 Гц), 7,62 (1H, т, J=7,8 Гц), 7,34 (1H, д, J=7,8 Гц), 7,14 (1H, д, J=7,8 Гц), 4,47 (2H, с), 3,40-3,29 (4H, м), 2,97-2,71 (4H, м), 2,69-2,51 (2H, м), 2,49-2,42 (2H, м), 2,30-2,18 (6H, м), 2,09 (3H, с), 0,92 (12H, д, J=6,3 Гц).
Пример 77
По той же методике, описанной в примере 61, использование 1-[2-(пирролидин-1-ил)этил]пиперазина вместо N,N-диметилэтилендиамина давало N-{4-[6-амино-5-циано-2-(6-{3-оксо-3-[4-(2-пирролидин-1-илэтил)пиперазин-1-ил]пропил}пиридин-2-илметилсульфанил)пиримидин-4-ил]фенил}ацетамид гидрохлорид в виде порошка светло-желтого цвета.
1H-ЯМР (ДМСО-d6+D2O) δ: 8,09 (1H, т, J=7,8 Гц), 7,80 (2H, д, J=9,0 Гц), 7,77 (1H, д, J=7,8 Гц), 7,72 (2H, д, J=9,0 Гц), 7,57 (1H, д, J=7,8 Гц), 4,62 (2H, с), 3,58 (2H, т, J=7,2 Гц), 3,65-3,11 (16H, м), 2,91 (2H, т, J=7,2 Гц), 2,11 (3H, с), 1,99 (4H, шир. с).
Пример 78
По той же методике, описанной в примере 61, использование 1-[2-(морфолин-4-ил)этил]пиперазина вместо N,N-диметилэтилендиамина давало N-{4-[6-амино-5-циано-2-(6-{3-[4-(2-морфолин-4-илэтил)пиперазин-1-ил]-3-оксопропил}пиридин-2-илметилсульфанил)пиримидин-4-ил]фенил}ацетамид гидрохлорид в виде порошка светло-желтого цвета.
1H-ЯМР (CD3OD) δ: 8,39 (1H, т, J=8,1 Гц), 8,05 (1H, д, J=8,1 Гц), 7,85 (1H, д, J=8,1 Гц), 7,83 (2H, д, J=8,7 Гц), 7,72 (2H, д, J=8,7 Гц), 4,73 (2H, с), 4,00 (4H, шир. с), 3,72 (4H, шир. с), 3,66-3,27 (14H, м), 3,09 (2H, шир. с), 2,17 (3H, с).
Пример 79
По той же методике, описанной в примере 61, использование 1-(N-метилпиперидин-4-илметил)пиперазина вместо N,N-диметилэтилендиамина давало N-{4-[6-амино-5-циано-2-(6-{3-[4-(2-диэтиламиноэтил)пиперазин-1-ил]-3-оксопропил}пиридин-2-илметилсульфанил)пиримидин-4-ил]фенил}ацетамид гидрохлорид в виде порошка светло-желтого цвета.
1H-ЯМР (CD3OD) δ: 8,39 (1H, т, J=8,1 Гц), 8,03 (1H, д, J=8,1 Гц), 7,84 (3H, шир. д, J=9,0 Гц), 7,72 (2H, д, J=9,0 Гц), 4,74 (2H, с), 3,58-2,92 (18H, м), 2,88 (3H, с), 2,28-1,57 (5H, м), 2,17 (3H, с).
Пример 80
По той же методике, описанной в примере 61, использование 1-метилгомопиперазина вместо N,N-диметилэтилендиамина давало N-[4-(6-амино-5-циано-2-{6-[3-(4-метил[1,4]диазепан-1-ил)-3-оксопропил]пиридин-2-илметилсульфанил}пиримидин-4-ил)фенил]ацетамид гидрохлорид в виде порошка светло-желтого цвета.
1H-ЯМР (CD3OD) δ: 8,38 (1H, т, J=7,8 Гц), 8,02 (1H, д, J=7,8 Гц), 7,84 (2H, д, J=9,0 Гц), 7,84 (1H, д, J=7,8 Гц), 7,72 (2H, д, J=9,0 Гц), 4,72 (2H, с), 4,03-3,05 (12H, м), 2,89 (3H, с), 2,23-2,06 (2H, м), 2,16 (3H, с).
Пример 81
По той же методике, описанной в примере 61, использование 1-амино-4-метилпиперазина вместо N,N-диметилэтилендиамина давало 3-{6-[4-(4-ацетиламинофенил)-6-амино-5-цианопиримидин-2-илсульфанилметил]пиридин-2-ил}-N-(4-метилпиперазин-1-ил)пропионамид гидрохлорид в виде порошка светло-желтого цвета.
1H-ЯМР (CD3OD) δ: 8,40 (1H, т, J=8,1 Гц), 8,08 (1H, д, J=8,1 Гц), 7,83 (2H, д, J=8,7 Гц), 7,82 (1H, д, J=8,1 Гц), 7,72 (2H, д, J=8,7 Гц), 4,72 (2H, с), 3,48-2,70 (12H, м), 2,85 (3H, с), 2,16 (3H, с).
Пример 82
По той же методике, описанной в примере 43, использование соединения ссылочного примера 17 вместо соединения ссылочного примера 11 давало N-(4-{6-амино-5-циано-2-[6-(3-оксопентил)пиридин-2-илметилсульфанил]пиримидин-4-ил}фенил)ацетамид в виде бесцветного порошка.
1H-ЯМР (ДМСО-d6) δ: 10,23 (1H, с), 7,83 (2H, д, J=9,0 Гц), 7,72 (2H, д, J=9,0 Гц), 7,61 (1H, т, J=7,5 Гц), 7,33 (1H, д, J=7,5 Гц), 7,13 (1H, д, J=7,5 Гц), 4,45 (2H, с), 2,93 (2H, т, J=6,9 Гц), 2,81 (2H, т, J=6,9 Гц), 2,46 (2H, кв, J=7,2 Гц), 2,09 (3H, с), 0,90 (3H, т, J=7,2 Гц).
Формулы каждого соединения, полученного в примерах 42-82, представлены в последующей таблице 6.
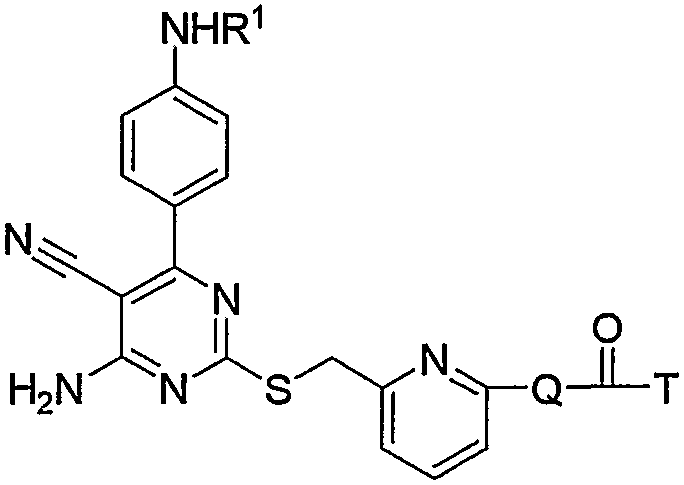
Q означает R4, R6 или R7, и Т означает Z3 или R8.







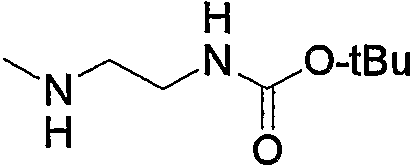
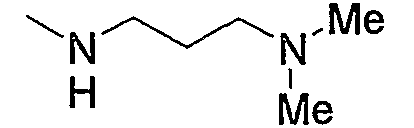
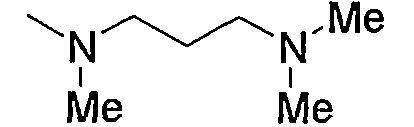
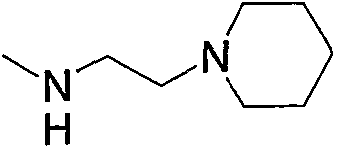
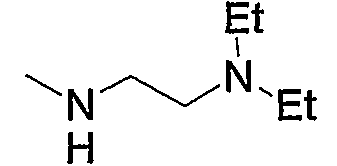
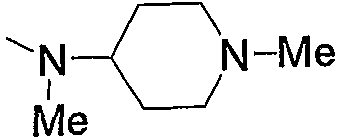
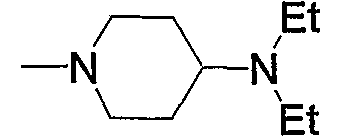
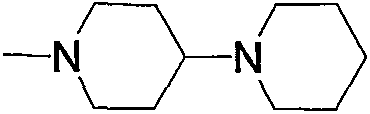
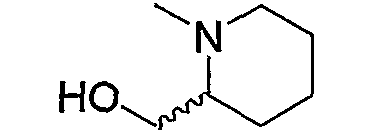
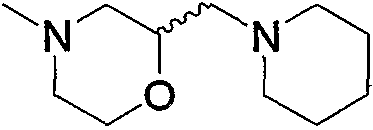
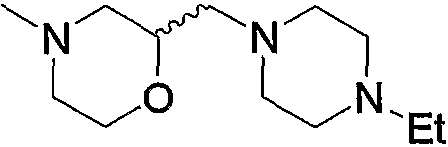
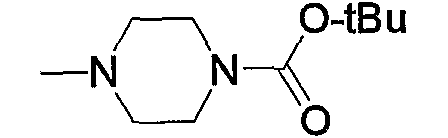
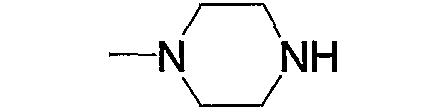
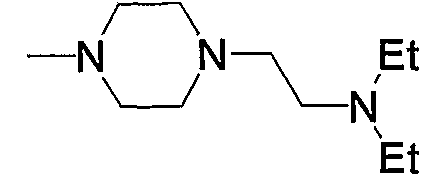
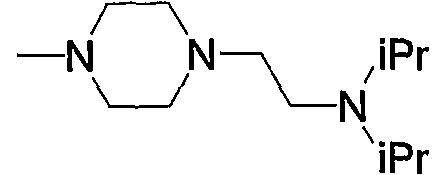
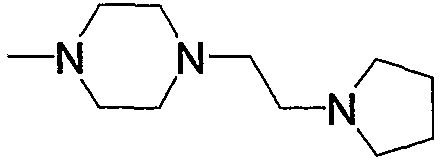
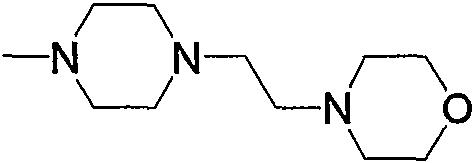
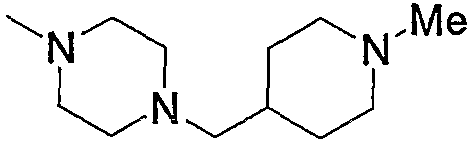
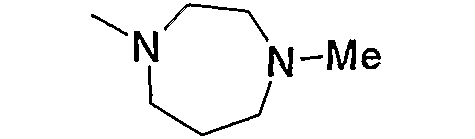
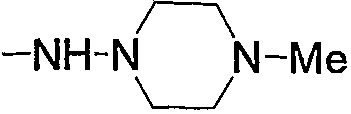
Примеры 83-193
Соединение, полученное в примере 18 (в виде гидрохлорида, 20 мг, 25 мкМ), соответствующую карбоновую кислоту (30 мкМ), МР-карбонат (25 мкМ, производства Argonaut Company, макропористая полистироловая анионообменная смола) и HOBt-H2O (4,5 мг, 29 мкМ) добавляли к смеси метиленхлорид/ДМФА (0,5 мл/0,1 мл) и полученную суспензию встряхивали при комнатной температуре в течение 1 часа. Затем к реакционной смеси добавляли PS-карбодиимид (33 мкМ, производства Argonaut Company, N-циклогексилкарбодиимид-N'-пропилоксиметилполистирол) и смесь встряхивали при комнатной температуре в течение ночи (примерно 18 часов). К реакционному раствору добавляли PS-изоцианат (75 мкМ, производства Argonaut Company, полистиролметилизоцианат) и смесь встряхивали при комнатной температуре в течение 3 часов и затем непрореагировавшее исходное соединение удаляли. Затем МР-карбонат отфильтровывали и промывали 0,2 мл метиленхлорида и 0,2 мл ДМФА. Из смеси фильтрата и промывного раствора выпаривали метиленхлорид продуванием газообразного азота и остаток очищали разделением ВЭЖХ в следующих условиях с получением продукта. После очистки фракцию раствора лиофилизовали и лиофилизованный продукт взвешивали и структуру определяли ЖХ/МС в следующих условиях.
Условия ВЭЖХ
Колонка: CAPCELL PAK C18 (UG 120 S-5, 20 мм × 50 мм) (для очистки)
CAPCELL PAK C18 (UG 120 S-3, 3,0 мм × 50 мм) (для анализа)
Элюент: смесь 0,05% ТФА-MeCN, 0,05% ТФА-H2O (необязательно с изменением соотношения)
Скорость элюента: 36 мл/мин (для очистки)
1,8 мл/мин (для анализа)
Условия анализа ЖХ/МС
Система: Waters Alliance 2795, Waters ZQ
Детектор МС: положительное электрораспыление.
По вышеуказанной методике синтезировали каждое соединение, представленное в таблице 7. В каждой таблице рассчитанное массовое число и наблюдаемые результаты ЖХ/МС ([M+H]) представлены вместе.

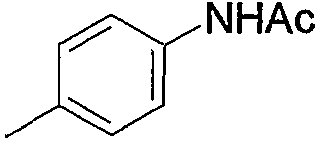
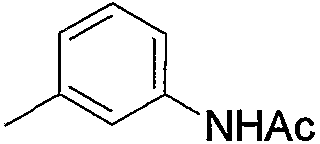
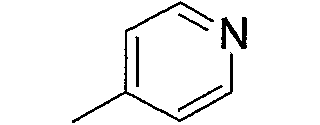
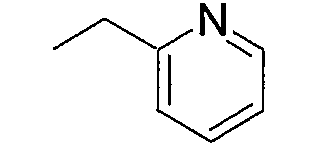
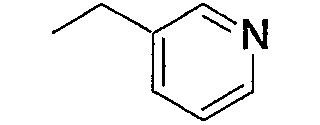
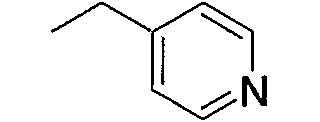
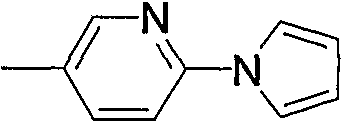



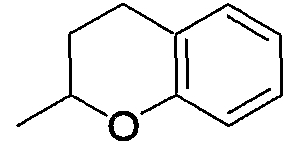
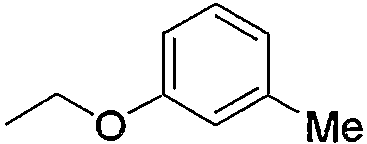
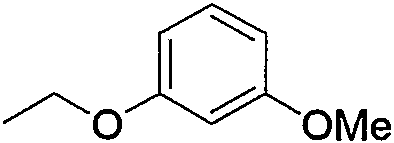
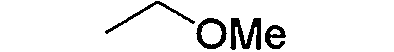
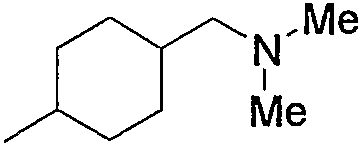
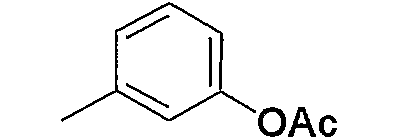
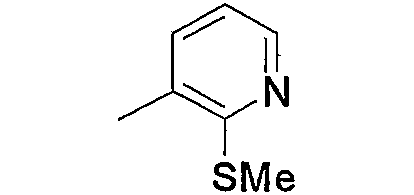
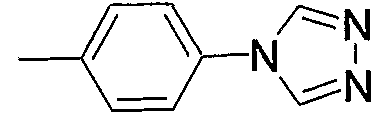
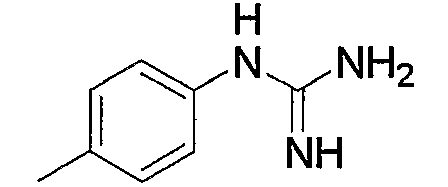
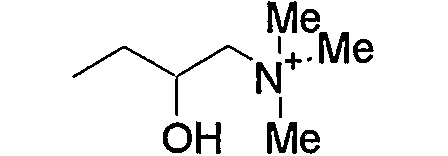
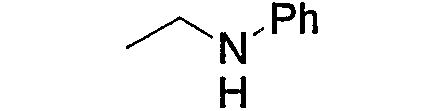
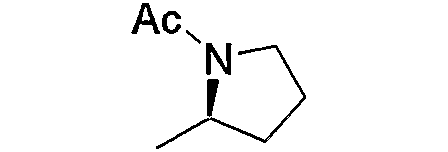
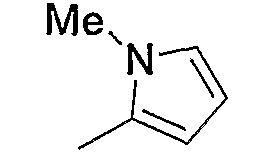
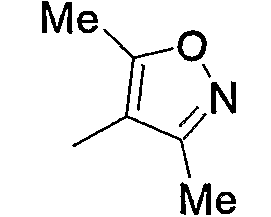
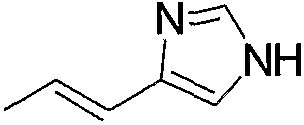
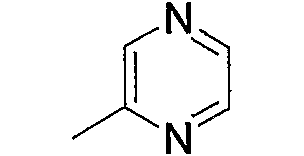
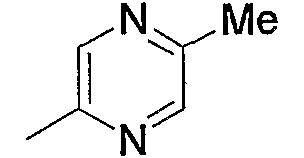
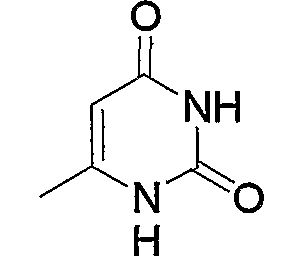
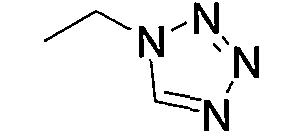
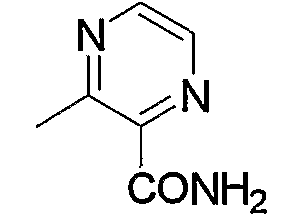
Примеры 194-201
К раствору 20 мг (25 мкМ) соединения, полученного в примере 18 (в виде гидрохлорида), в 0,2 мл ДМФА добавляли МР-карбонат (125 мкМ) и смесь встряхивали при комнатной температуре в течение 3 часов. Затем реакционную смесь фильтровали, фильтрат добавляли к раствору соответствующего сульфонилхлорида в 0,1 мл ДМФА (50 мкМ), затем к смеси добавляли 8,7 мкл диизопропилэтиламина (50 мкМ) и полученную смесь встряхивали при комнатной температуре в течение ночи (примерно 18 часов).
Реакционный раствор подвергали ВЭЖХ в условиях, аналогичных описанным в примерах 83-193, приведенных выше, и очищали с выделением продукта. После очистки фракцию раствора лиофилизовали и лиофилизованный продукт взвешивали и структуру определяли ЖХ/МС в условиях, описанных в примерах 83-193. Формулы и рассчитанные массовые числа и наблюдаемые результаты ЖХ/МС представлены в таблице 8.
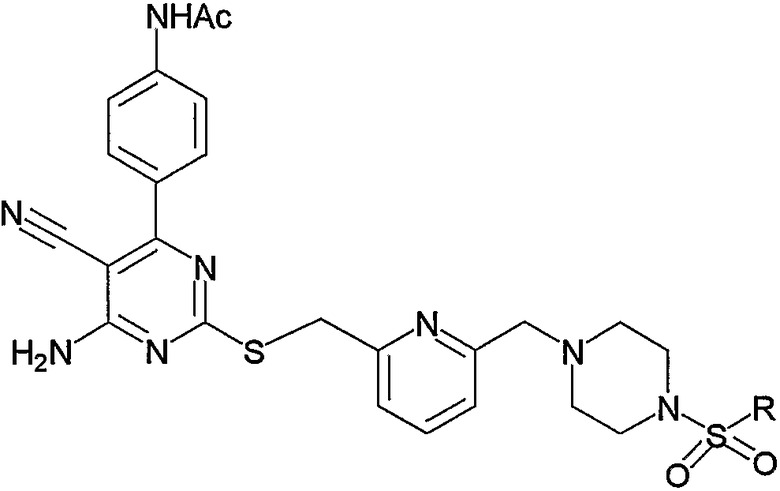
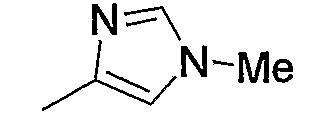
Примеры 202-243
Раствор 16 мг соединения, полученного в примере 18 (в виде его гидрохлорида, 20 мкМ), соответствующего алкилгалогенида (22 мкМ), насыщенного водного раствора карбоната калия (100 мкМ) в 0,2 мл ДМФА встряхивали при комнатной температуре в течение ночи (примерно 18 часов). К реакционному раствору добавляли 0,2 мл ДМФА и тем самым раствор разбавляли, затем разбавленный раствор очищали для выделения продукта ВЭЖХ в условиях, аналогичных описанным в примерах 83-193, приведенных выше. Кроме того, после очистки фракцию раствора лиофилизовали и лиофилизованный продукт взвешивали и структуру определяли ЖХ/МС, как уже представлено выше.
Формулы и рассчитанные массовые числа и наблюдаемые результаты ЖХ/МС для каждого полученного соединения представлены в таблице 9.
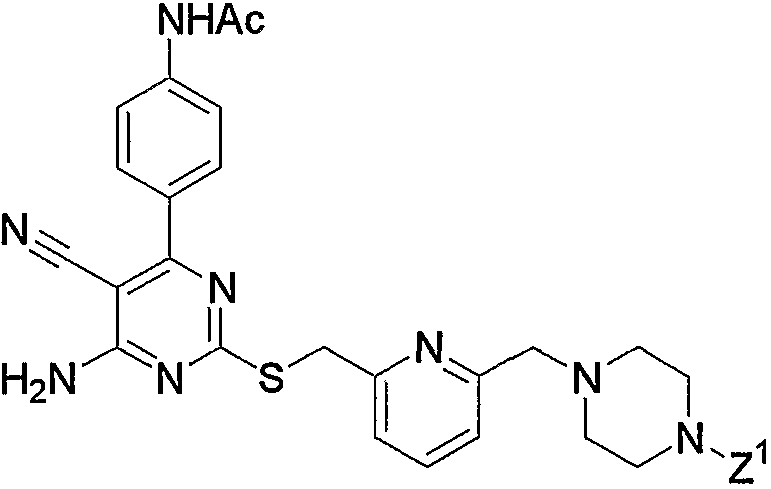

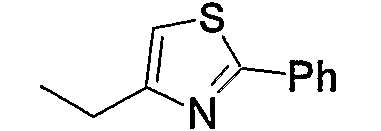
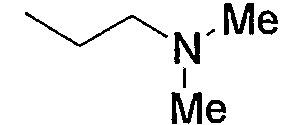
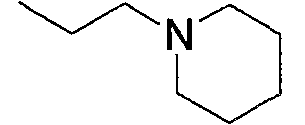
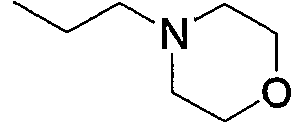
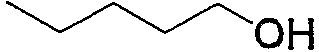
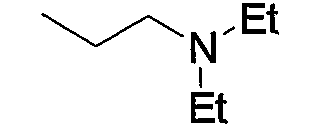
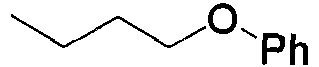
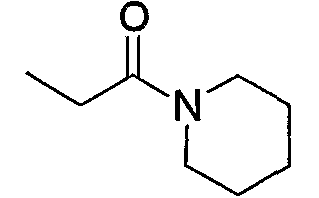
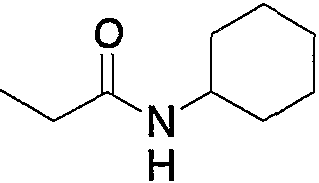
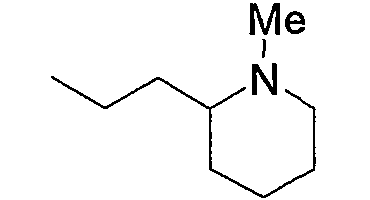
Примеры 244-298
К раствору 20 мг (25 мкМ) соединения, полученного в примере 18 (в виде его гидрохлорида), в 0,6 мл смеси ТГФ-ДМФА (3:1) добавляли соответствующий альдегид (28 мкМ) в 28 мкл ДМФА и 7 мкл (125 мкМ) уксусной кислоты. К реакционной смеси добавляли МР-цианоборгидрид (63 мкМ, производства Argonaut Company, макропористый триэтиламмоний метилполистирол цианоборгидрид) и смесь встряхивали при комнатной температуре в течение 2 суток. МР-цианоборгидрид отфильтровывали, фильтрат подвергали ВЭЖХ в условиях, аналогичных описанным в примерах 83-193, приведенных выше, и очищали для выделения продукта. Кроме того, после очистки фракцию раствора лиофилизовали и лиофилизованный продукт взвешивали и структуру определяли ЖХ/МС, как уже представлено выше.
Формулы и рассчитанные массовые числа и наблюдаемые результаты ЖХ/МС для каждого полученного соединения представлены в таблице 10.
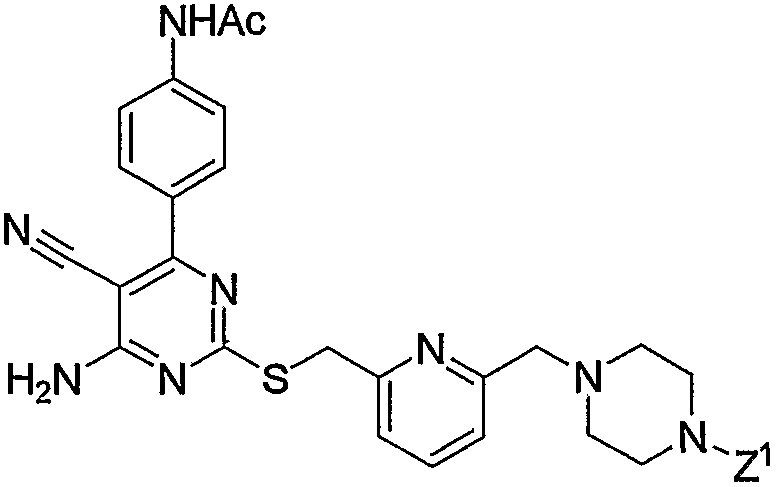
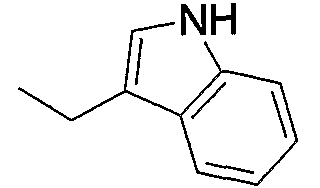
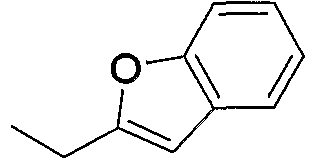
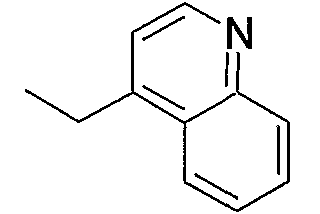
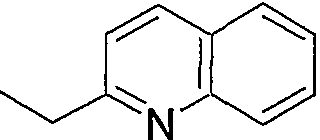
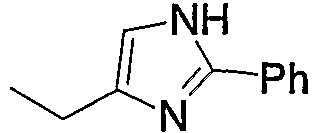
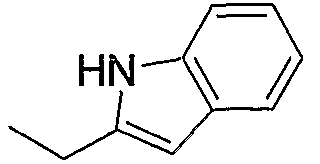
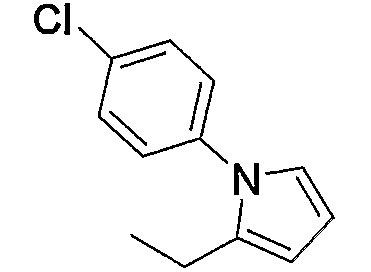
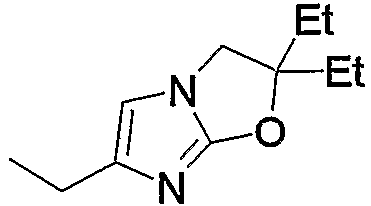
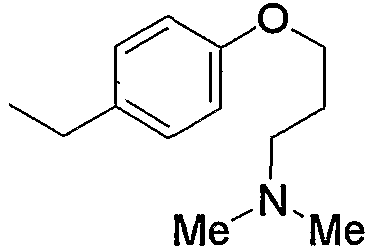
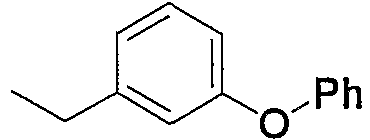
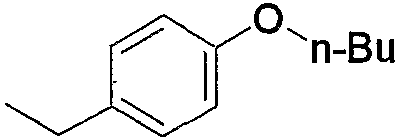
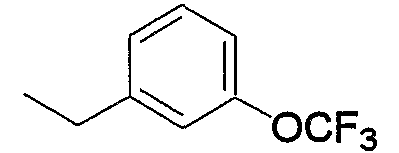


Примеры 299-416
Суспензию 24 мг (50 мкМ) соединения, полученного в примере 45, соответствующего первичного или вторичного алкиламина (100 мкМ) и 8,9 мг HOBt-Н2О (58 мкМ) в смеси этиленхлорид-ДМФА (0,5 мл - 0,2 мл) встряхивали при комнатной температуре в течение 10 минут. Когда в качестве исходного соединения использовали соль амина, то в реакционную смесь добавляли эквимолярное количество МР-карбоната (Argonaut Company). Затем к реакционной смеси добавляли PS-карбодиимид (Argonaut Company, 67 мкМ) и смесь встряхивали при комнатной температуре в течение ночи (примерно 18 часов).
Затем реакционную смесь фильтровали и промывали ДМФА (0,15 мл) для удаления смолы, когда использовали PS-карбодиимид и МР-карбонат. Фильтрат и промывной раствор объединяли, этиленхлорид выпаривали продуванием газообразного азота, остаток разводили 0,15 мл ДМФА и разбавленный раствор очищали для выделения продукта ВЭЖХ в условиях, аналогичных описанным в примерах 83-193, приведенных выше. Кроме того, после очистки фракцию раствора лиофилизовали и лиофилизованный продукт взвешивали и структуру определяли ЖХ/МС, как уже представлено выше.
Формулы и рассчитанные массовые числа и наблюдаемые результаты ЖХ/МС для каждого полученного соединения представлены в таблице 11.
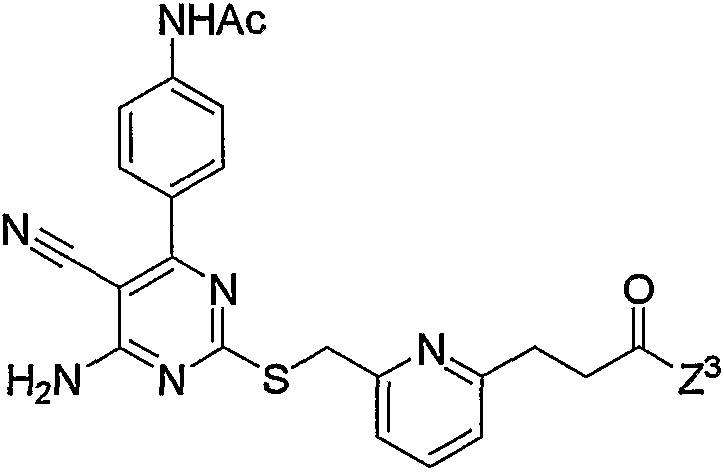
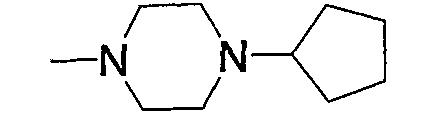
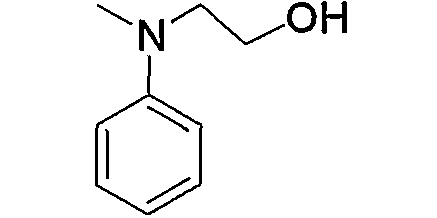
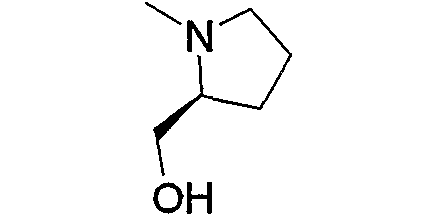
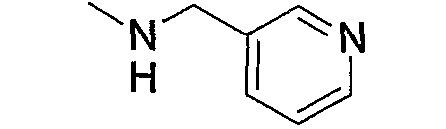
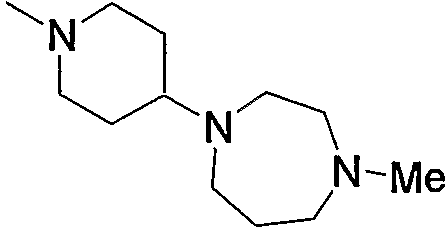
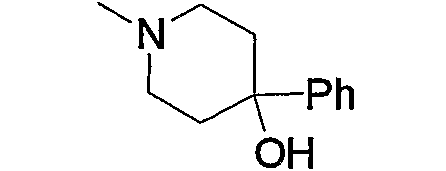

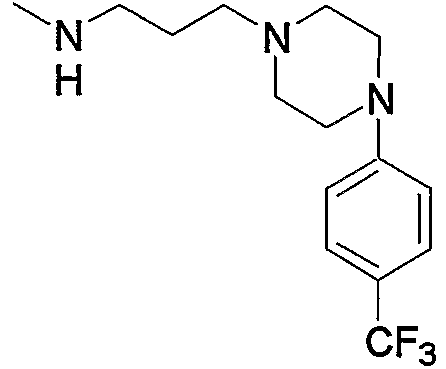
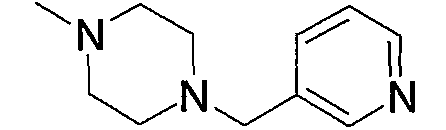
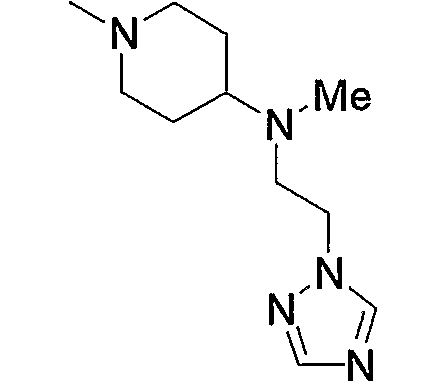
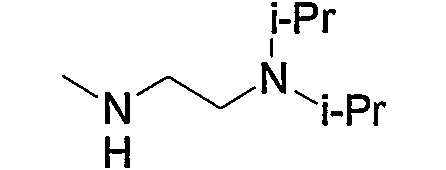
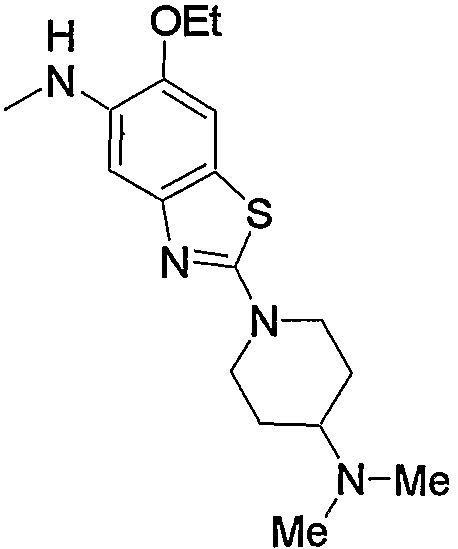
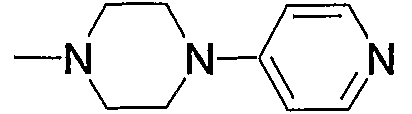
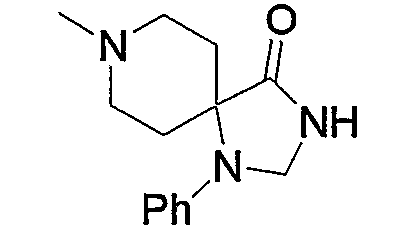
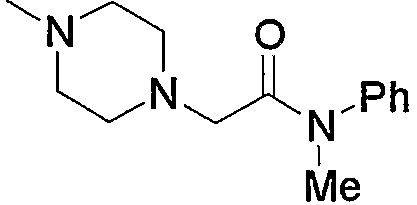
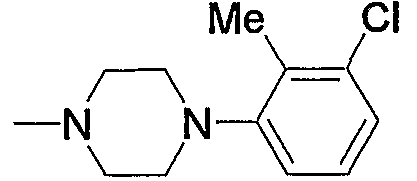
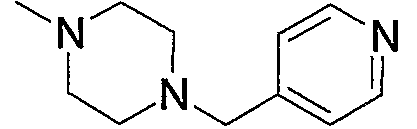
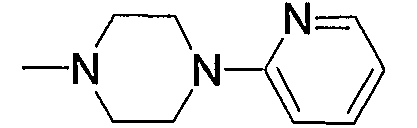
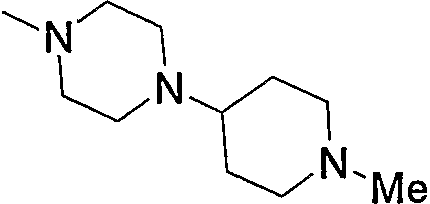
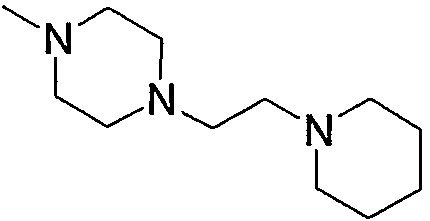
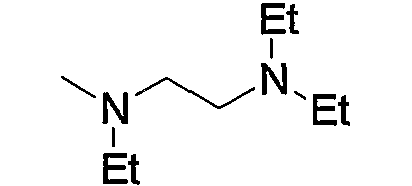
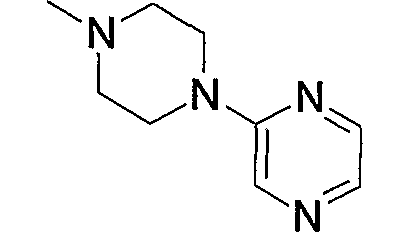
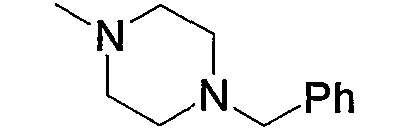
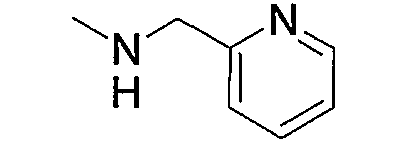
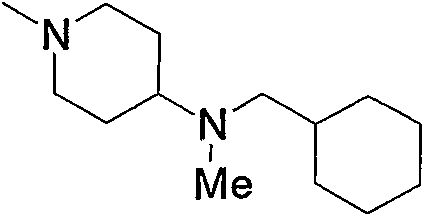
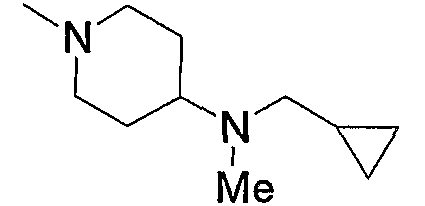
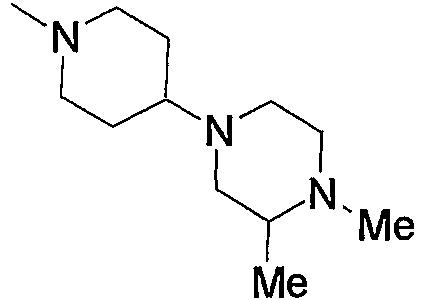
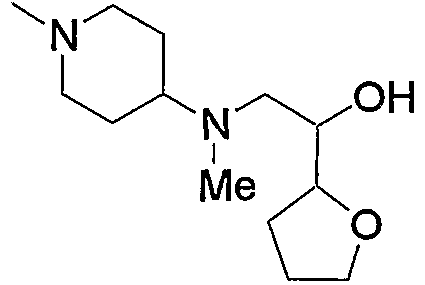
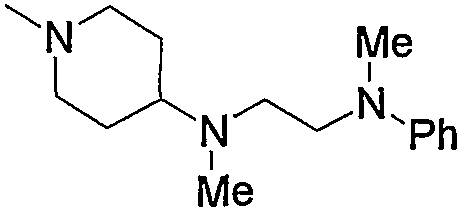
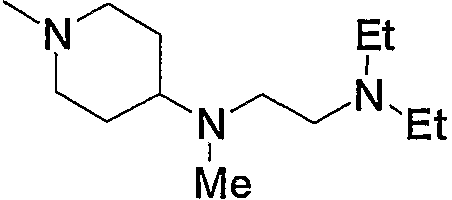
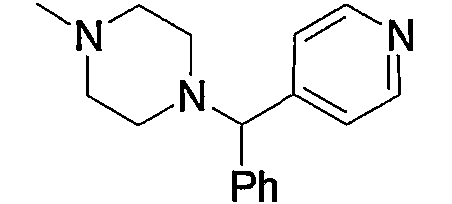
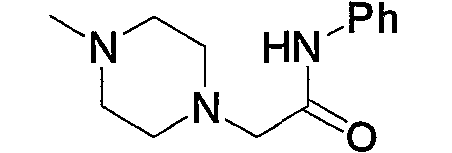
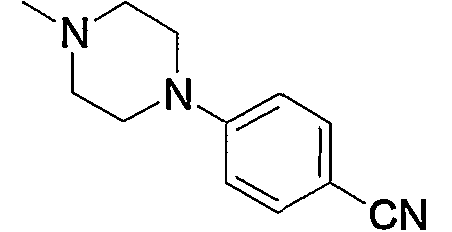
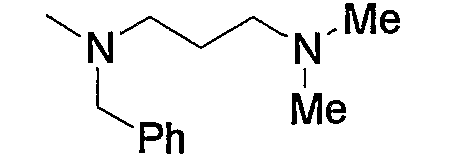
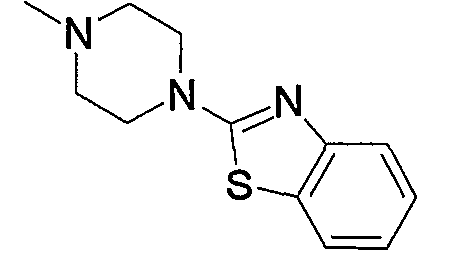
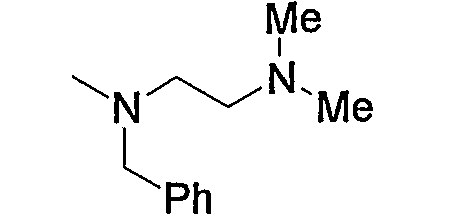
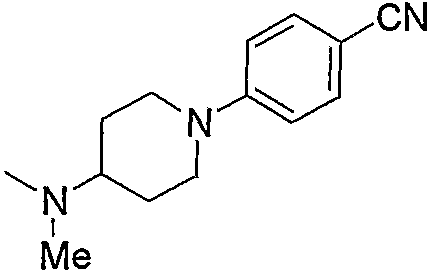
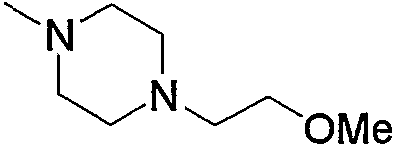
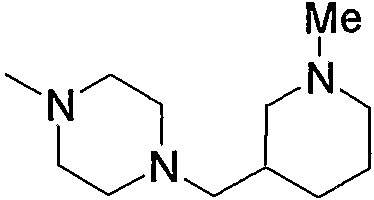
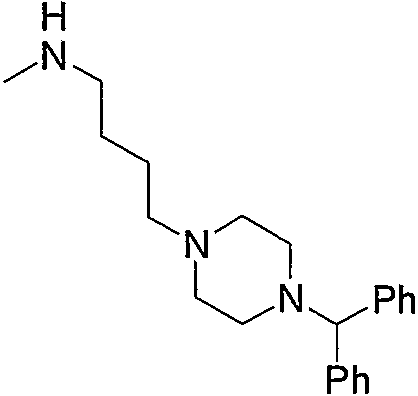
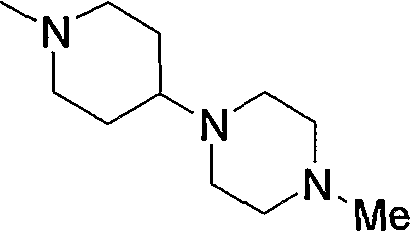
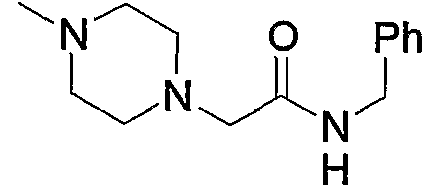
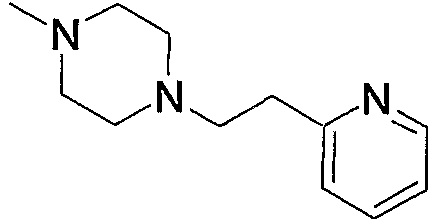
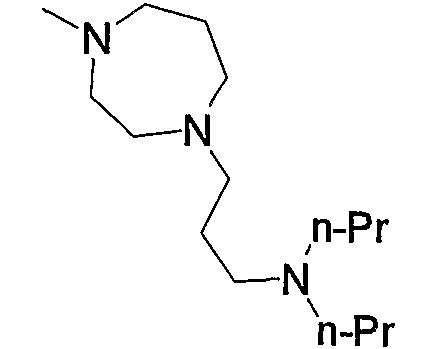
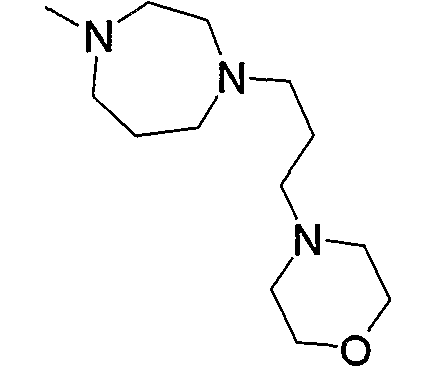
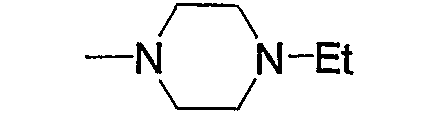
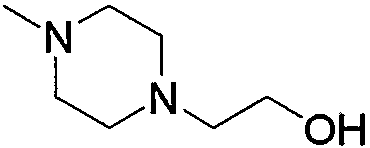
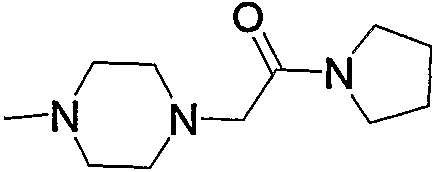
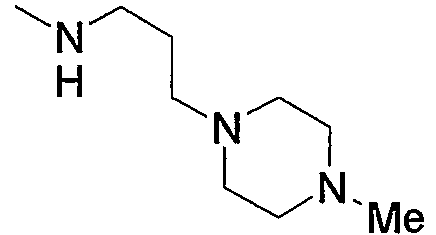
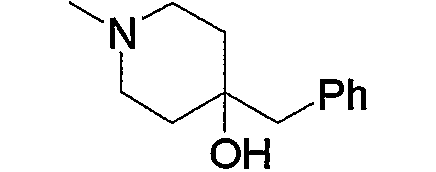
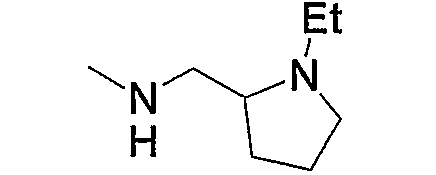
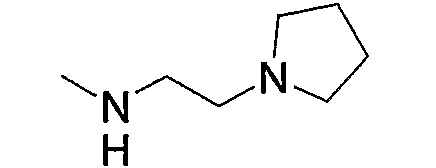
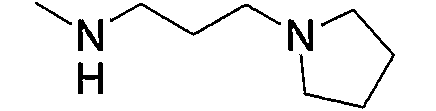
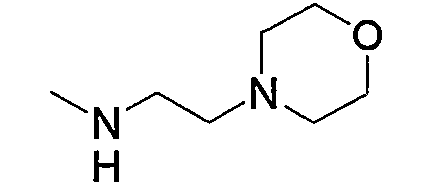
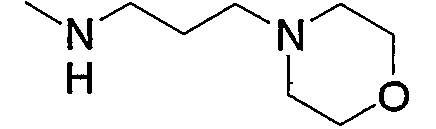
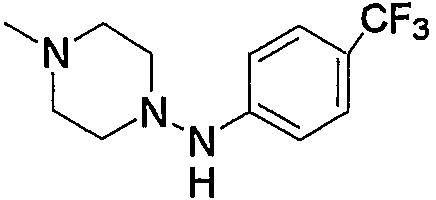
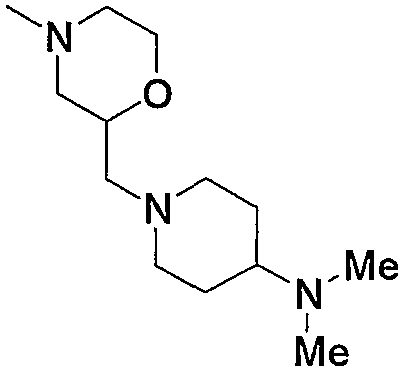
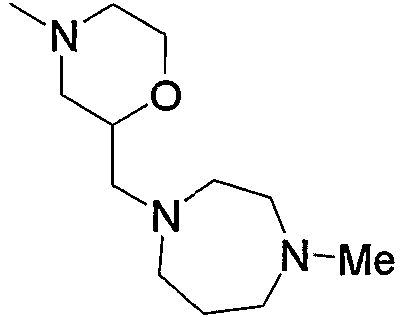
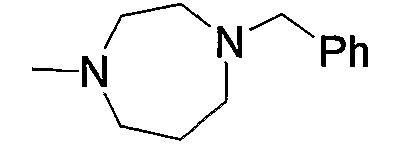
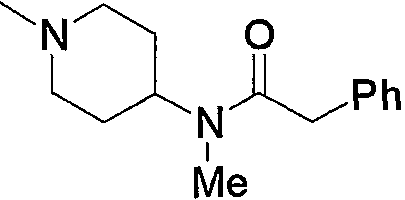
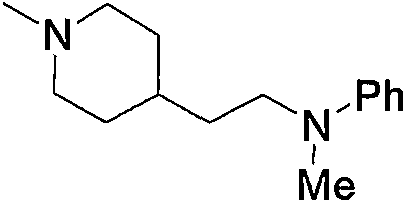
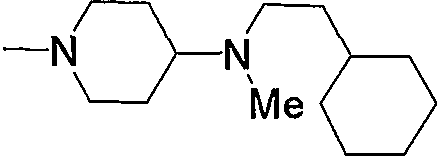
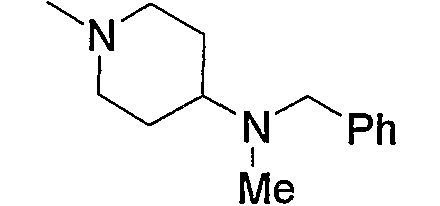
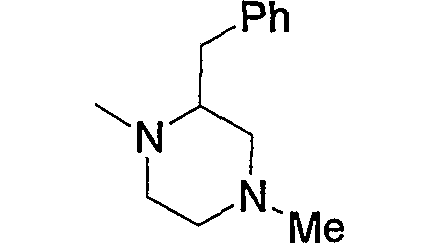
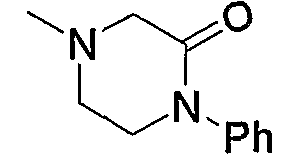
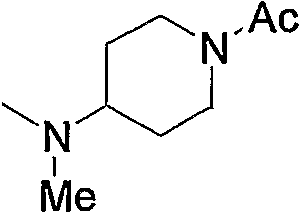
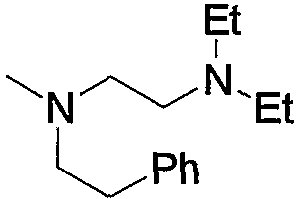
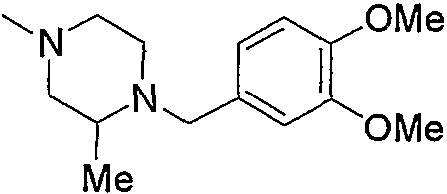
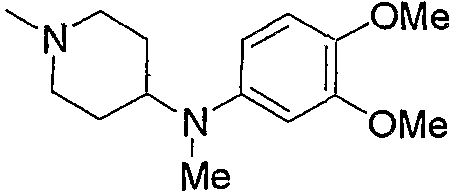
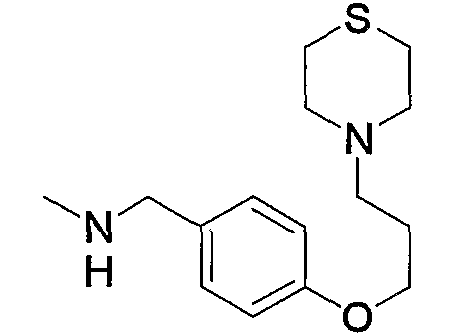
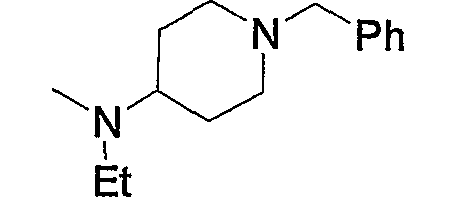
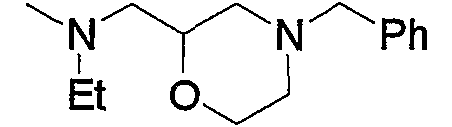
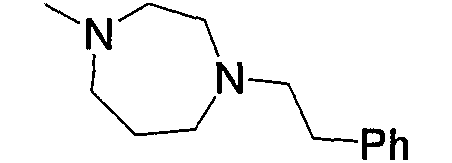
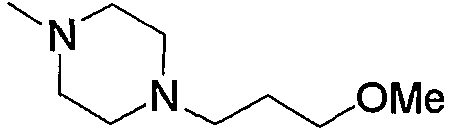
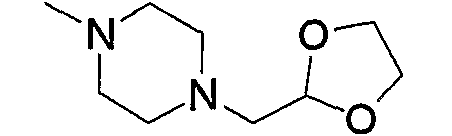
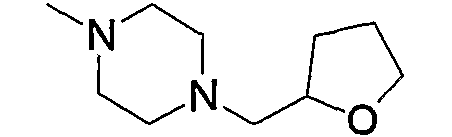
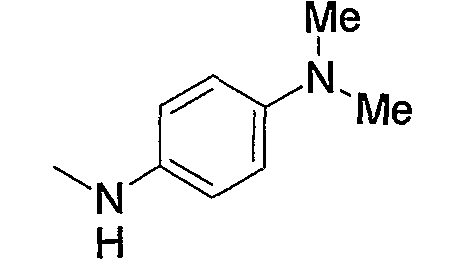
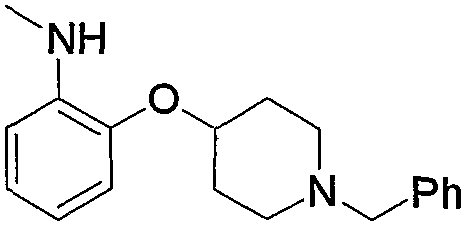
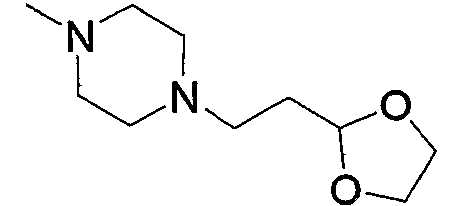
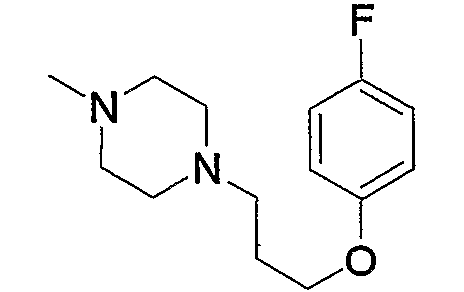

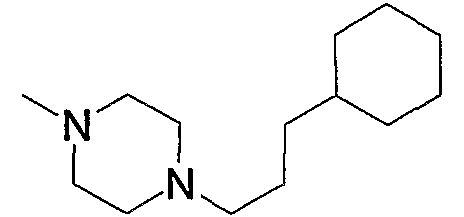
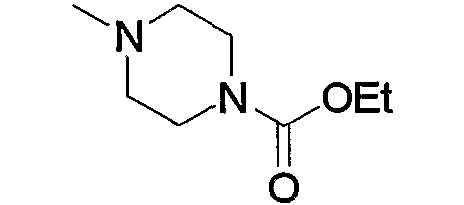
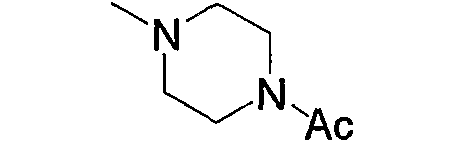
Ниже приводятся примеры фармакологических тестов с использованием соединений по изобретению.
1) Продуцирующее цАМФ действие в клетках, экспрессирующих рецептор аденозина А2а
Тест проводили, как представлено ниже при использовании метода, описанного в источнике (Klotz K.N. et al., Naunyn-Schmiedeberg's Arch. Pharmacol., (1998) 357, 1-9; Shryock J.C. et al., Molecular Pharmacology, (1998) 53, 886-893).
В отношении клеток, использовали клетки HEK293, экспрессирующие рецептор аденозина А2а (человеческий) (PerkinElmer Life Sciences, Code No RBHA2AC).
В отношении культуральной среды, использовали среду Игла, модифицированную по способу Дульбекко (DMEM), включающую 10% FBS (фетальной бычьей сыворотки) и 1 мМ пирувата натрия.
Клетки помещали в 96-луночный планшет (1×105 /лунку) и культивировали в течение ночи. После удаления супернатанта в каждую лунку вносили 0,1 мл DMEM (без FBS), содержащую 20 мМ HEPES, 0,1 мМ IBMX (3-изобутил-1-метилксантина) и 2 Ед/мл аденозиндезаминазы, и инкубировали при 37°С в течение 30 минут. В каждую лунку вносили 0,1 мл культуральной среды, содержащей раствор тестируемого соединения в ДМСО в соответствующей концентрации, и инкубировали еще в течение 30 минут. После удаления супернатанта добавляли цитолитический раствор для гашения реакции. Определяли количество цАМФ в каждой лунке с использованием иммуноферментного анализа для цАМФ (EIA) (Amersham Biosciences, Code No RPN225).
Тот же тест повторяли с использованием CGS-21689 (2-п-карбоксиэтил)фенэтиламино-5'-N-этилкарбоксамидоаденозина гидрохлорида (Sigma, code C141) в качестве стандарта. Количество продуцированного цАМФ в среде, индуцированного 1 мкМ стандарта, принимали за 100%. Концентрацию тестируемого соединения в среде, продуцирующую 50% цАМФ, рассчитывали как значение ЕС50.
Результаты вышеуказанного теста, полученные с использованием соединений по изобретению, полученных в примерах, приведенных выше, представлены в последующей таблице 12. Кроме того, в таблице приведены результаты этого же теста с использованием соединения, описанного в примере 6 заявки WO 03/053441 А1 (относится к сравнительному соединению А), и соединения, описанного в примере 1 заявки WO 03/008384 А1 (относится к сравнительному соединению В), имеющих следующие формулы.
Сравнительное соединение А
Сравнительное соединение В
Из данных, представленных в таблице 12, становится очевидным, что все соединения по изобретению обладают высокой стимулирующей активностью в отношении рецептора А2а.
2) Агонистическое действие по отношению к аденозину А1
Проводили тест, как представлено ниже, при использовании метода, описанного в литературе (Shryock J.C. et al., Molecular Pharmacology, (1998) 53, 886-893; Ito H. et al., European Journal of Pharmacology, (1999) 365, 309-315), т.е. кору большого мозга крыс-самцов Вистар (Charles River Japan, Inc) извлекали, добавляли Трис-буфер (50 мМ Трис-HCl: рН 7,4), гомогенизировали и затем центрифугировали (1000×g, 10 минут). Отбирали супернатант и центрифугировали (20000×g, 20 минут). После удаления супернатанта осадок суспендировали в Трис-буфере и вновь центрифугировали (20000×g, 20 минут). После удаления супернатанта осадок суспендировали в Трис-буфере, содержащем 2 Ед/мл ADA (аденозиндезаминазы) и хранили при -80°С до использования в виде жидкого препарата клеточных мембран для проведения последующих тестов.
Вышеуказанный жидкий препарат клеточных мембран в количестве, соответствующем 10 мкг клеточных мембран, вносили в Трис-буфер, содержащий 5 мМ MgCl2, 1 мМ ЭДТА, 1 мМ дитиотреитола, 100 мМ NaCl, 0,01 мМ GDP (гуанозиндифосфат), 5 мг/мл BSA и 2 Ед/мл ADA, и смесь инкубировали при 25°С в течение 30 минут. Кроме того, к смеси добавляли [35S]GTPγS (гуанозин 5'-[γ-тио]трифосфат) (конечная концентрация: 0,4 нМ) и тестируемое соединение в определенной концентрации (которую рассчитывали на основе конечной концентрации тестируемого соединения) и полученную смесь инкубировали при 25°С в течение 45 минут. Реакционную смесь фильтровали через фильтр из стекловолокна (унифильтр-96 GF/В, Perkin Elmer Life Sciences) для гашения реакции. Фильтр промывали 5 раз охлажденным на льду Трис-буфером, содержащим 5 мМ MgCl2. Радиоактивность фильтра определяли на счетчике Top count NXT (Perkin Elmer Life Sciences). Неспецифическое связывание представляет активность связывания [35S]GTPγS в присутствии 0,01 мМ GTPγS.
Активность (%, агонистическое действие по отношению к А1) каждого тестируемого соединения определяли на основе результатов теста (активность связывания [35S]GTPγS), полученных с 1 мкМ СРА (N6-циклопентиладенозин, Sigma, code C-8031) в контроле, который принимали за 100%.
В последующей таблице 13 представлены результаты тестирования соединений по изобретению (включая их соли) из вышеприведенных примеров в концентрациях 1 мкМ, 100 нМ и 10 нМ. Также в таблице 13 приведены результаты с контрольными соединениями А и В, которые были теми же, что в фармакологическом тесте (1).
Как следует из представленных в таблице 13 данных, активирующее действие в отношении рецептора А1 (агонистическое действие в отношении А1) соединений по изобретению было ниже, по сравнению с контрольными соединениями. Данный установленный факт указывает на то, что соединения по изобретению могут избирательно воздействовать на рецептор аденозина А2а.
При тестировании соединений по изобретению из всех других примеров иных, чем соединения, приведенные в таблице 13, отмечали, что все соединения проявляли примерно такое же агонистическое действие в отношении А1, как и соединения по изобретению, представленные в таблице 13.
3) Тест определения внутриглазного давления у кроликов
Тестируемые соединения растворяли в 10 мМ фосфатном буфере (рН 7,5) (ниже относится к «растворителю глазного препарата») и их закапывали в определенной концентрации. Кроме того, соединения, нерастворимые в данной концентрации, использовали в виде суспензии. Использовали новозеландских кроликов-самок (KITAYAMA LABES Co., Ltd) с массой тела 2,0-4,0 кг.
Определение внутриглазного давления проводили с использованием пневматонометра (Model 30 Classic, Mentor Сompany) без анестезии. Кроме того, перед определением внутриглазного давления проводили поверхностную анестезию 0,4% оксибупрокаином гидрохлоридом («Benoxil» 0,4% глазной раствор, Santen Pharmaceutical Co., Ltd.).
Отбирали животных со стабильным внутриглазным давлением перед закапыванием и данных животных распределяли по 4 животных на каждую группу, 50 мкл глазных капель, включающих тестируемое соединение, вводили в глаз с одной стороны и растворитель вводили в противоположный глаз, который служил в качестве контрольного глаза. Определение внутриглазного давления проводили перед закапыванием и через 0,5, 1, 2, 3, 4 и 6 часов после закапывания. Воздействие на внутриглазное давление представляли в виде разницы, по сравнению с периодом до закапывания (ΔIOP, мм рт. ст., среднее значение ± стандартная ошибка). В последующих таблицах 14 и 15 приведены результаты с контрольными соединениями А и В, использованными в виде 1% суспензий, которые были теми же, что в фармакологическом тесте (1).
Контрольное соединение А,
1% суспендированный глазной препарат (n=4)
Контрольное соединение В,
1% суспендированный глазной препарат (n=4)
Животных предварительно обрабатывали, как описано выше, и среди них отбирали животных со стабильным внутриглазным давлением перед закапыванием, и данных животных распределяли по 5-8 животных на каждую группу. Для каждого из тестируемых соединений использовали две группы. Тестируемое соединение вводили в глаз кролика в опытной группе с одной стороны и определяли внутриглазное давление. Растворитель вводили в глаз кролика в контрольной группе с одной стороны и определяли внутриглазное давление. Как уже указывалось выше, определение внутриглазного давления проводили перед закапыванием и через 0,5, 1, 2, 3, 4 и 6 часов после закапывания и воздействие на внутриглазное давление представляли в виде разницы, по сравнению с периодом до закапывания (ΔIOP, мм рт. ст., среднее значение ± стандартная ошибка).
В последующих таблицах 16-32 представлены результаты с контрольным соединением CGS-21680 и с соединениями по изобретению (соединениями, полученными в примерах), где данные для каждого тестируемого соединения приведены в отдельной таблице.
CGS-21680 (контрольное соединение),
0,3% суспендированный глазной препарат (n=6)
Соединение примера 2,
1% суспендированный глазной препарат (n=8)
Соединение примера 14,
0,3% суспендированный глазной препарат (n=6)
Соединение примера 46,
0,01% глазной раствор (n=6)
Соединение примера 69,
0,01% глазной раствор (n=6)
Соединение примера 75,
0,01% глазной раствор (n=5)
Соединение примера 76,
0,01% глазной раствор (n=5)
Соединение примера 61,
0,03% глазной раствор (n=6)
Соединение примера 62,
0,03% глазной раствор (n=5)
Соединение примера 64,
0,03% глазной раствор (n=6)
Соединение примера 66,
0,03% глазной раствор (n=6)
Соединение примера 67,
0,03% глазной раствор (n=6)
Соединение примера 72,
0,03% глазной раствор (n=6)
Соединение примера 77,
0,03% глазной раствор (n=6)
Соединение примера 78,
0,03% глазной раствор (n=6)
Соединение примера 79,
0,03% глазной раствор (n=6)
Соединение примера 80,
0,03% глазной раствор (n=6)
При аналогичном тестировании соединений по изобретению, полученных в каждом из примеров 1-84, приведенных выше, за исключением соединений по изобретению, представленных выше в таблицах 16-32, становится очевидным, что все соединения проявляли практически одинаковый результат, представленный в таблицах 16-32.
Из данных, представленных в таблицах 14-32, становится очевидным следующее, т.е., как показано в таблицах 14 и 15, контрольные соединения А и В не оказывали какого-либо существенного снижающего внутриглазное давление действия даже при использовании в виде 1% суспензии, где была относительно высокая концентрация.
Как представлено в таблицах 17-32, все тестируемые соединения по изобретению оказывали снижающее внутриглазное давление действие. В частности, соединения по изобретению, представленные в таблицах 19-32, в более низкой концентрации, по сравнению с соединением CGS-21680, проявляли такое же снижающее внутриглазное давление действие, как и CGS-21680, о котором уже сообщалось, что оно оказывает гипотензивное действие на внутриглазное давление (смотрите таблицу 16). Кроме того, соединения по изобретению, представленные в таблицах 20-32, были растворимыми в высокой концентрации (0,3-1%), выше концентраций, использованных в указанном тесте определения (0,01-0,03%), без солюбилизирующего средства, следовательно, они пригодны для применения в качестве глазного раствора.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВОЕ ЦИАНОПИРИМИДИНОВОЕ ПРОИЗВОДНОЕ | 2010 |
|
RU2533115C2 |
| ПРОИЗВОДНЫЕ ПИРИМИДИНА | 2002 |
|
RU2320658C2 |
| ИНГИБИТОРЫ МЕТАЛЛО-β-ЛАКТАМАЗЫ | 2006 |
|
RU2462450C2 |
| ПРОИЗВОДНОЕ БЕНЗОЛА ИЛИ ЕГО СОЛЬ | 2006 |
|
RU2395496C2 |
| ПРОИЗВОДНЫЕ ГУАНИДИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ, СПОСОБ ИНГИБИРОВАНИЯ NA/H - ОБМЕНА В КЛЕТКАХ | 1994 |
|
RU2141946C1 |
| ПРОИЗВОДНЫЕ ПРОПИОНОВОЙ КИСЛОТЫ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1997 |
|
RU2174121C2 |
| ПРОИЗВОДНЫЕ АМИНОДИГИДРОТИАЗИНА, ЗАМЕЩЕННЫЕ ЦИКЛИЧЕСКОЙ ГРУППОЙ | 2008 |
|
RU2476430C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ | 1994 |
|
RU2135478C1 |
| ТРИЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2007 |
|
RU2456278C2 |
| ПРОИЗВОДНОЕ БЕНЗОЛА ИЛИ ТИОФЕНА И ЕГО ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРА VAP-1 | 2009 |
|
RU2526256C2 |
Изобретение относится к новым производным 4-амино-5-цианопиримидина формулы (1) или их фармацевтически приемлемым солям, обладающим агонистической активностью по отношению к рецептору аденозина А2а. Соединения настоящего изобретения обладают снижающим внутриглазное давление свойствами и могут найти применение при лечении глазной гипертензии и глаукомы. В формуле (I):
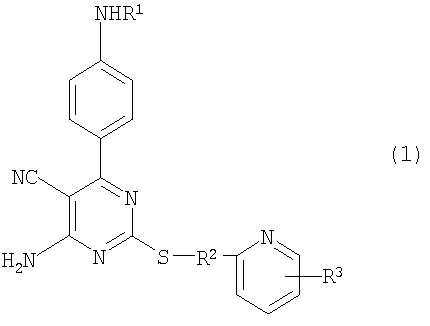
R1 представляет атом водорода, низший алкилкарбонил, низший алкенилкарбонил, фенилкарбонил или низший алкоксикарбонил; R2 представляет низший алкилен; R3 представляет любое из (1) атома водорода, (2) низшего алкила или любую из следующих групп (3)-(9):
группа (3)  группа (4)
группа (4)  группа (5)
группа (5) 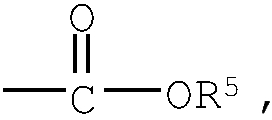 группа (6)
группа (6)  группа (7)
группа (7)  группа (8)
группа (8)  группа (9)
группа (9) 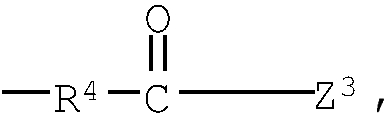 в которых: R4 представляет низший алкилен, R5 является атомом водорода или низшим алкилом; Z1, Z2 и Z3 выбраны соответственно из групп (а1)-(а38), (b1)-(b8) и (с1)-(с22), имеющих значения, определенные ниже: Z1: (а1) низший алкил, (а2) фенил-низший алкил, (а3) аминофенил-низший алкил, (а4) фенил-низший алкенил, (а5) гетероарил-низший алкил, (а6) гетероарил-низший алкенил, (а7) гетероарилфенил-низший алкил, (а8) гидрокси-низший алкил, (а10) амино-низший алкил, (a11) аминокарбонил-низший алкил, (а12) низший алкилкарбонил, (а13) низший алкокси-низший алкилкарбонил, (а14) амино-низший алкилкарбонил, (а15) фенилкарбонил, (а16) фенил-низший алкилкарбонил, (а17) фенил-низший алкенилкарбонил, (а18) фенокси-низший алкилкарбонил, (а19) гетероарилкарбонил, (а20) гетероарил-низший алкилкарбонил, (а21) гетероарил-низший алкенилкарбонил, (а22) гетероарилокси-низший алкилкарбонил, (а23) гетероарилсульфанил-низший алкилкарбонил, (а24) гетероарилфенилкарбонил, (а25) фенилсульфанил-низший алкилкарбонил, (а26) фенилкарбонил-низший алкилкарбонил, (а28) низший алкоксикарбонил, (а29) низший алкилсульфонил, (а30) фенилсульфонил, (а31) гетероарилсульфонил, (а32) атом водорода, (а33) низший алкил, содержащий насыщенный гетероцикл, (а34) карбонил-низший алкил, содержащий насыщенный гетероцикл, (а35) фенил-низший алкил, содержащий насыщенный гетероцикл, (а36) карбонил, содержащий насыщенный гетероцикл, (а37) низший алкилкарбонил, содержащий насыщенный гетероцикл, или (а38) фенилкарбонил, содержащий насыщенный гетероцикл. 5 н. и 4 з.п. ф-лы, 32 табл.
в которых: R4 представляет низший алкилен, R5 является атомом водорода или низшим алкилом; Z1, Z2 и Z3 выбраны соответственно из групп (а1)-(а38), (b1)-(b8) и (с1)-(с22), имеющих значения, определенные ниже: Z1: (а1) низший алкил, (а2) фенил-низший алкил, (а3) аминофенил-низший алкил, (а4) фенил-низший алкенил, (а5) гетероарил-низший алкил, (а6) гетероарил-низший алкенил, (а7) гетероарилфенил-низший алкил, (а8) гидрокси-низший алкил, (а10) амино-низший алкил, (a11) аминокарбонил-низший алкил, (а12) низший алкилкарбонил, (а13) низший алкокси-низший алкилкарбонил, (а14) амино-низший алкилкарбонил, (а15) фенилкарбонил, (а16) фенил-низший алкилкарбонил, (а17) фенил-низший алкенилкарбонил, (а18) фенокси-низший алкилкарбонил, (а19) гетероарилкарбонил, (а20) гетероарил-низший алкилкарбонил, (а21) гетероарил-низший алкенилкарбонил, (а22) гетероарилокси-низший алкилкарбонил, (а23) гетероарилсульфанил-низший алкилкарбонил, (а24) гетероарилфенилкарбонил, (а25) фенилсульфанил-низший алкилкарбонил, (а26) фенилкарбонил-низший алкилкарбонил, (а28) низший алкоксикарбонил, (а29) низший алкилсульфонил, (а30) фенилсульфонил, (а31) гетероарилсульфонил, (а32) атом водорода, (а33) низший алкил, содержащий насыщенный гетероцикл, (а34) карбонил-низший алкил, содержащий насыщенный гетероцикл, (а35) фенил-низший алкил, содержащий насыщенный гетероцикл, (а36) карбонил, содержащий насыщенный гетероцикл, (а37) низший алкилкарбонил, содержащий насыщенный гетероцикл, или (а38) фенилкарбонил, содержащий насыщенный гетероцикл. 5 н. и 4 з.п. ф-лы, 32 табл.
1. Производное 4-амино-5-цианопиримидина формулы (1)
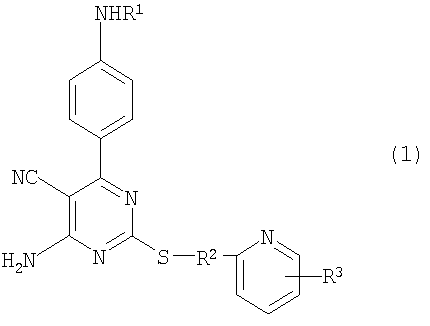
или его фармацевтически приемлемая соль,
в которой
R1 представляет атом водорода, низший алкилкарбонил, низший алкенилкарбонил, фенилкарбонил или низший алкоксикарбонил;
R2 представляет низший алкилен;
R3 представляет любое из (1) атома водорода, (2) низшего алкила или любую из следующих групп (3)-(9):
группа (3) 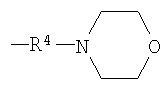 , группа (4)
, группа (4) 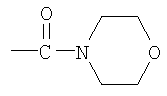 , группа (5)
, группа (5) 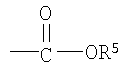 , группа (6)
, группа (6) 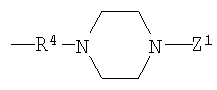 , группа (7)
, группа (7)  , группа (8)
, группа (8) 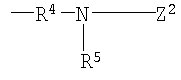 , группа (9)
, группа (9) 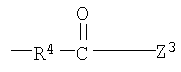 , в которых
, в которых
R4 представляет низший алкилен, R5 является атомом водорода или низшим алкилом;
Z1, Z2 и Z3 выбраны соответственно из групп (a1)-(a38), (b1)-(b8) и (с1)-(с22), имеющих значения, определенные ниже:
Z1: (а1) низший алкил, (а2) фенилнизший алкил, (а3) аминофенилнизший алкил, (а4) фенилнизший алкенил, (а5) гетероарилнизший алкил, (а6) гетероарилнизший алкенил, (а7) гетероарилфенилнизший алкил, (а8) гидроксинизший алкил, (а10) аминонизший алкил,
(a11) аминокарбонилнизший алкил, (а12) низший алкилкарбонил, (а13) низший алкоксинизший алкилкарбонил, (а14) аминонизший алкилкарбонил, (а15) фенилкарбонил, (а16) фенилнизший алкилкарбонил, (а17) фенилнизший алкенилкарбонил, (а18) феноксинизший алкилкарбонил, (а19) гетероарилкарбонил, (а20) гетероарилнизший алкилкарбонил, (а21) гетероарилнизший алкенилкарбонил, (а22) гетероарилоксинизший алкилкарбонил, (а23) гетероарилсульфанилнизший алкилкарбонил, (а24) гетероарилфенилкарбонил, (а25) фенилсульфанилнизший алкилкарбонил, (а26) фенилкарбонилнизший алкилкарбонил, (а28) низший алкоксикарбонил, (а29) низший алкилсульфонил, (а30) фенилсульфонил, (а31) гетероарилсульфонил, (а32) атом водорода, (а33) низший алкил, содержащий насыщенный гетероцикл, (а34) карбонилнизший алкил, содержащий насыщенный гетероцикл, (а35) фенилнизший алкил, содержащий насыщенный гетероцикл, (а36) карбонил, содержащий насыщенный гетероцикл, (а37) низший алкилкарбонил, содержащий насыщенный гетероцикл, или (а38) фенилкарбонил, содержащий насыщенный гетероцикл;
аминогруппа, входящая в состав групп (а3), (а10), (a11) и (а14), представленных выше, может быть необязательно замещена 1 или 2 заместителями, выбранными из группы, состоящей из низшего алкила, формила и низшего алкилкарбонила;
фенильная группа, входящая в состав групп (а2), (а15), (а16), (а17), (а18), (а30) и (а35), представленных выше, может быть необязательно замещена 1-3 заместителями, выбранными из группы, состоящей из атома галогена, гидрокси, низшего алкила, низшего алкокси, галоген-низшего алкокси, фенила, фенокси, метилендиокси, дигалогенметилендиокси, карбоксила, низшего алкоксикарбонила, низшего алкилкарбонилокси, нитро, низшего алкиламино, низшего алкилкарбониламино и аминосульфонила;
гетероарильная группа, входящая в состав групп (а5), (а19)-(а24) и (а31) представляет собой 5-6-членные ароматические гетероциклические группы,содержащие 1-4 гетероатома в кольце,выбранных из атомов азота, кислорода или серы, или указанная гетероциклическая группа конденсирована с 1 бензольным кольцом и может быть необязательно замещена 1-3 заместителями, выбранными из группы, состоящей из атома галогена, гидрокси, низшего алкила, гидроксинизшего алкила, галогеннизшего алкила, фенила, галогенфенила, низшего алкилсульфанила, аминокарбонила и карбоксила; и
насыщенный гетероцикл, входящий в состав групп (а33)-(а38), представленных выше, может представлять 5-7-членную насыщенную азотсодержащую гетероциклическую группу или указанную гетероциклическую группу, сконденсированную с 1 бензольным кольцом, необязательно содержащую низший алкил или низший алкилкарбонил на атоме азота кольцевой системы, или необязательно содержащую 1 или 2 оксогруппы в атомах углерода кольцевой системы;
Z2: (b1) атом водорода, (b2) низший алкоксикарбонил, (b3) аминонизший алкилкарбонил, (b4) низший алкенилкарбонил, (b5) низший алкилкарбонил, содержащий насыщенный гетероцикл, (b6) пиперидинонизший алкилкарбонил, содержащий насыщенный гетероцикл, (b7) карбонил, содержащий насыщенный гетероцикл или (b8) низший алкилсульфонил;
аминогруппа, входящая в состав группы (b3), представленной выше, может быть необязательно замещена 1 или 2 низшими алкилами;
насыщенный гетероцикл, входящий в состав групп (b5)-(b7), представленных выше, может представлять 5-6-членную насыщенную азотсодержащую гетероциклическую группу, содержащую 1-2 гетероатома в цикле, выбранных из азота и кислорода, необязательно содержащую низший алкил на атоме азота кольцевой системы;
Z3: (с1) гидрокси, (с2) низший алкокси, (с3) амино, (с4) аминонизший алкиламино, (с5) пиперазино, (с6) аминонизший алкилпиперазино, (с7) аминокарбонилнизший алкилпиперазино, (с8) 1,4-диазепан-1-ил, (с9) аминонизший алкил-1,4-диазепан-1-ил, (с10) пиперидино, (с11) аминопиперидино, (с12) аминонизший алкиламинопиперидино, (с13) аминонизший алкилпиперидино, (с14) пирролидино, (с15) амино, содержащий насыщенный гетероцикл, (с16) низший алкиламино, содержащий насыщенный гетероцикл, (с17) пиперазино, содержащий насыщенный гетероцикл, (с18) низший алкилпиперазино, содержащий насыщенный гетероцикл, (с19) карбонилнизший алкилпиперазино, содержащий насыщенный гетероцикл, (с20) низший алкил-1,4-диазепан-1-ил, содержащий насыщенный гетероцикл, (с21) пиперидино, содержащий насыщенный гетероцикл, или (с22) низший алкилморфолино, содержащий насыщенный гетероцикл;
аминогруппа в группе (с3), представленной выше, или аминогруппа, входящая в состав групп (с4), (с6), (с7), (с9), (с11), (с12), (с13), (с15) и (с16), представленных выше, может быть необязательно замещена 1 или 2 заместителями, выбранными из группы, состоящей из низшего алкила, гидроксинизшего алкила, фенила, гетероарила, фенилнизшего алкила, алкоксифенилнизшего алкила, гетероарилнизшего алкила и низшего алкоксикарбонила;
аминогруппа, входящая в состав группы (с11), представленной выше, может быть необязательно замещена фенилнизшим алкилкарбонилом;
пиперазино в группе (с5), представленной выше, и 1,4-диазепан-1-ил в группе (с8), представленной выше, могут быть замещены любым из заместителей, выбранным из группы, состоящей из низшего алкила, гидроксинизшего алкила, низший алкоксинизшего алкила, фенила, низшего алкилфенила, гидроксифенила, цианофенила, галогенфенила, фенилнизшего алкила, низший алкоксифенилнизшего алкила, галогенфеноксинизшего алкила, гетероарила, низшего алкилгетероарила, галогеннизшего алкилгетероарила, цианогетероарила, гетероарилнизшего алкила, низшего алкоксикарбонила и низшего алкилкарбонила в положении 4 кольцевой системы; дополнительно
насыщенный гетероцикл, входящий в состав групп (с15)-(с22), представленных выше, может представлять 5-7-членную насыщенную азотсодержащую гетероциклическую группу имеющую 1-2-гетероатома выбранного из азота и кислорода или указанную гетероциклическую группу, сконденсированную с 1 бензольным кольцом, необязательно содержащую любой из заместителей, выбранных из группы, состоящей из низшего алкила, фенила, цианофенила, низшего алкилкарбонила, галогеннизшего алкилфенила и фенилнизшего алкила на атоме азота кольцевой системы; и дополнительно
пиперазино в группе (с5), представленной выше, пиперидино в группе (с10), представленной выше, и насыщенный гетероцикл, входящий в состав групп (с15)-(с22), представленных выше, могут быть замещены любым из заместителей, выбранным из группы, состоящей из гидрокси, оксо, низшего алкила, гидроксинизшего алкила, фенила, фенилнизшего алкила, аминокарбонила и низшего алкиламино, по атому углерода кольцевой системы.
2. Производное 4-амино-5-цианопиримидина по п.1 или его фармацевтически приемлемая соль, в которой R3 представляет собой группу
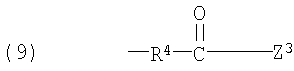 ,
,
в которой R4 представляет низший алкилен,
Z3: (с3) амино, (с4) аминонизший алкиламино, (с5) пиперазино, (с6) аминонизший алкилпиперазино, (с8) 1,4-диазепан-1-ил, (с10) пиперидино, (с11) аминопиперидино, (с18) низший алкилпиперазино, содержащий насыщенный гетероцикл, (с21) пиперидино, содержащий насыщенный гетероцикл, или (с22) низший алкилморфолино, содержащий насыщенный гетероцикл;
аминогруппа в группе (с3), представленной выше, или аминогруппа, входящая в состав групп (с4), (с6) и (с11), представленных выше, может быть необязательно замещена 1 или 2 заместителями, выбранными из группы, состоящей из низшего алкила, гидроксинизшего алкила, фенила, и низшего алкоксикарбонила;
аминогруппа, входящая в состав группы (с11), представленной выше, может быть необязательно замещена фенилнизшим алкилкарбонилом;
пиперазино в группе (с5), представленной выше, и 1,4-диазепан-1-ил в группе (с8), представленной выше, могут быть замещены любым из заместителей, выбранным из группы, состоящей из низшего алкила, гидроксинизшего алкила, низший алкоксинизшего алкила, фенила, низшего алкилфенила, гидроксифенила, цианофенила, галогенфенила, фенилнизшего алкила, низший алкоксифенилнизшего алкила, галогенфеноксинизшего алкила, пиридила, низшего алкилпиридила, галоген-низшего алкилпиридила, цианопиридила, пиридилнизшего алкила, низшего алкоксикарбонила и низшего алкилкарбонила в положении 4 кольцевой системы; дополнительно
насыщенный гетероцикл, входящий в состав групп (с18), (с21) и (с22), представленных выше, может представлять моновалентную насыщенную гетероциклическую группу, выбранную из группы, состоящей из пирролидинила, пирролидино, пиперидила, пиперидино, пиперазинила, пиперазино, 1,4-диазепан-1-ила, тетрагидрофуранила, 1,3-диоксоланила, морфолинила, морфолино и тетрагидроимидазолила, необязательно содержащую любой из заместителей, выбранных из группы, состоящей из низшего алкила, фенила, цианофенила, низшего алкилкарбонила, галогеннизшего алкилфенила и фенилнизшего алкила на атоме азота кольцевой системы; и дополнительно
пиперазино в группе (с5), представленной выше, пиперидино в группе (с10), представленной выше, и насыщенный гетероцикл, входящий в состав представленных выше групп (с18) низший алкилпиперазино, имеющий насыщенный гетероцикл и (с22) низший морфолино, имеющий насыщенный гетероцикл, могут быть замещены любым из заместителей, выбранным из группы, состоящей из гидрокси, оксо, низшего алкила, гидроксинизшего алкила, фенила, фенилнизшего алкила, аминокарбонила и низшего алкиламино, по атому углерода кольцевой системы.
3. Производное 4-амино-5-цианопиримидина по п.2, или его фармацевтически приемлемая соль, в которой R3 представляет собой группу 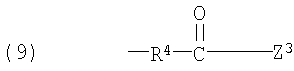 ,
,
в которой R4 представляет низший алкилен,
Z3: (с3) амино, который может быть необязательно замещен 1 или 2 низшими алкильными группами,
(с4) аминонизший алкиламино, где фрагмент амино являющийся частью группы может быть необязательно замещен 1 или 2 заместителями, выбранными из группы, состоящими из низшей алкильной группы и низшей алкоксикарбонильной группы,
(с5) пиперазино, который может быть необязательно замещен 1 заместителем, выбранным из группы, состоящей из низшей алкильной группы и низшей алкоксикарбонильной группы
(с6) аминонизший алкилпиперазино, где фрагмент амино являющийся частью группы, может быть необязательно замещен 1 или 2 низшими алкильными группами,
(с8) 1,4-диазепан-1-ил, может быть необязательно замещен 1 алкильной группой,
(с10) 2-гидроксиметилпиперидино,
(e11) аминопиперидино, где фрагмент амино, являющийся частью группы, может быть необязательно замещен 1 или 2 низшими алкильными группами,
(с18) низший алкилпиперазино, содержащий насыщенный гетероцикл, выбранный из группы, состоящей из пирролидинила, пирролидино, пиперидила, пиперидино, морфолинила, морфолино, необязательно содержащий низшую алкильную группу на атоме азота насыщенной гетероциклической кольцевой системы, или
(с21) 4-(1-пиперидил)пиперидино группа или
(с22) низший алкилморфолино, содержащий насыщенный гетероцикл, выбранный из группы, состоящей из пиперидила, пиперидино, пиперазинила и пиперазино, необязательно содержащий низшую алкильную группу на атоме азота насыщенной гетероциклической кольцевой системы.
4. Производное 4-амино-5-цианопиримидина по п.3 или его фармацевтически приемлемая соль, в которой
R1 представляет атом водорода или низший алкилкарбонил;
R2 представляет метилен;
R3 представляет собой группу 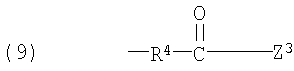 ,
,
в которой R4 представляет низший алкилен,
Z3: (с3) амино, который может быть необязательно замещен 1 или 2 низшими алкильными группами,
(с4) аминонизший алкиламино, где фрагмент амино, являющийся частью группы, может быть необязательно замещен 1 или 2 заместителями, выбранными из группы, состоящими из низшей алкильной группы и низшей алкоксикарбонильной группы,
(с5) пиперазино, который может быть необязательно замещен 1 заместителем, выбранным из группы, состоящей из низшей алкильной группы и низшей алкоксикарбонильной группы
(с6) аминонизший алкилпиперазино, где фрагмент амино, являющийся частью группы, может быть необязательно замещен 1 или 2 низшими алкильными группами,
(с8) 1,4-диазепан-1-ил, может быть необязательно замещен 1 алкильной группой,
(с10) 2-гидроксиметилпиперидино,
(с11) аминопиперидино, где фрагмент амино, являющийся частью группы, может быть необязательно замещен 1 или 2 низшими алкильными группами,
(с18) пирролидинонизший алкилпиперазино, пиперидинилнизший алкилпиперазино, необязательно содержащий низшую алкильную группу на атоме азота в кольцевой системе пиперидина или морфолинонизший алкилпиперазино, или
(с21) 4-(1-пиперидил)пиперидино группа или
(с22) пиперидинонизший алкилморфолино или пиперазинонизший алкилморфолино, необязательно содержащий низшую алкильную группу на атоме азота насыщенной кольцевой системы морфолина.
5. Производное 4-амино-5-цианопиримидина по пп.1-4 или его фармацевтически приемлемая соль, где соединение выбрано из группы, состоящей из следующих соединений 1-15:
1) N-[4-(6-амино-5-циано-2-{6-[3-(4-метилпиперазин-1-ил)-3-оксопропил]пиридин-2-илметилсульфанил}пиримидин-4-ил)фенил]ацетамид,
2) 3-{6-[4-(4-ацетиламинофенил)-6-амино-5-цианопиримидин-2-илсульфанилметил]пиридин-2-ил}-N-(2-диметиламиноэтил)пропионамид,
3) 3-{6-[4-(4-ацетиламинофенил)-6-амино-5-цианопиримидин-2-илсульфанилметил]пиридин-2-ил}-N-(2-диметиламиноэтил)-N-метилпропионамид,
4) 3-{6-[4-(4-ацетиламинофенил)-6-амино-5-цианопиримидин-2-илсульфанилметил]пиридин-2-ил}-N-(2-диметиламинопропил)-N-метилпропионамид,
5) 3-{6-[4-(4-ацетиламинофенил)-6-амино-5-цианопиримидин-2-илсульфанилметил]пиридин-2-ил}-N-(2-метилпиперидин-1-илэтил)пропионамид,
6) 3-{6-[4-(4-ацетиламинофенил)-6-амино-5-цианопиримидин-2-илсульфанилметил]пиридин-2-ил}-N-(2-диэтиламиноэтил)пропионамид,
7) 3-{6-[4-(4-ацетиламинофенил)-6-амино-5-цианопиримидин-2-илсульфанилметил]пиридин-2-ил}-N-метил-N-(1-метилпиперидин-4-ил)пропионамид,
8) N-(4-{6-амино-2-[6-(3-[1,4']бипиперидинил-1'-ил-3-оксопропил)пиридин-2-илметилсульфанил]-5-цианопиримидин-4-ил}фенил)ацетамид,
9) N-[4-(6-амино-5-циано-2-{6-[3-оксо-3-(2-пиперидин-1-илметилморфолин-4-ил)пропил]пиридин-2-илметилсульфанил}пиримидин-4-ил)фенил]ацетамид,
10) N-{4-[6-амино-5-циано-2-(6-{3-[2-(4-этилпиперазин-1-илметил)морфолин-4-ил]-3-оксопропил}пиридин-2-илметилсульфанил)пиримидин-4-ил]фенил}ацетамид,
11) N-{4-[6-амино-5-циано-2-(6-{3-[4-(2-диизопропиламиноэтил)пиперазин-1-ил]-3-оксопропил}пиридин-2-илметилсульфанил)пиримидин-4-ил]фенил}ацетамид,
12) N-{4-[6-амино-5-циано-2-(6-{3-оксо-3-[4-(2-пирролидин-1-илэтил)пиперазин-1-ил]пропил}пиридин-2-илметилсульфанил)пиримидин-4-ил]фенил}ацетамид,
13) N-{4-[6-амино-5-циано-2-(6-{3-[4-(2-морфолин-4-илэтил)пиперазин-1-ил]-3-оксопропил}пиридин-2-илметилсульфанил)пиримидин-4-ил]фенил}ацетамид,
14) N-{4-[6-амино-5-циано-2-(6-{3-[4-(2-диэтиламиноэтил)пиперазин-1-ил]-3-оксопропил}пиридин-2-илметилсульфанил)пиримидин-4-ил]фенил}ацетамид и
15) N-[4-(6-амино-5-циано-2-{6-[3-(4-метил-[1,4]диазепан-1-ил)-3-оксопропил]пиридин-2-илметилсульфанил}пиримидин-4-ил)фенил]ацетамид.
6. Производное 4-амино-5-цианопиримидина по пп.1-4 или его фармацевтически приемлемая соль, где соединение выбрано из группы, состоящей из следующих соединений 1-3:
1) 3-{6-[4-(4-ацетиламинофенил)-6-амино-5-цианопиримидин-2-илсульфанилметил]пиридин-2-ил}-N-(пиперидин-1-илэтил)пропионамид
2) 3-{6-[4-(4-ацетиламинофенил)-6-амино-5-цианопиримидин-2-илсульфанилметил]пиридин-2-ил}-N-метил-N-(1-метилпиперидин-4-ил)пропионамид,
3) 3-{6-[4-(4-ацетиламинофенил)-6-амино-5-цианопиримидин-2-илсульфанилметил]пиридин-2-ил}-N-(4-метилпиперазин-1-ил)пропионамид,
7. Агонист рецептора аденозина А2а, содержащий любое из производных 4-амино-5-цианопиримидина по пп.1-6 или его фармацевтически приемлемую соль.
8. Средство для снижения внутриглазного давления, содержащее эффективное количество любого из производных 4-амино-5-цианопиримидина по пп.1-6 или его фармацевтически приемлемую соль в качестве активного ингредиента.
9. Фармацевтическая композиция для лечения глазной гипертензии или глаукомы, содержащая эффективное количество любого из производных 4-амино-5-цианопиримидина по пп.1-6 или его фармацевтически приемлемую соль в качестве активного ингредиента.
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| SU 689089 A3, 25.04.1979. | |||
Авторы
Даты
2010-04-20—Публикация
2005-04-28—Подача