Область техники, к которой относится изобретение
Настоящее изобретение относится к соединению конденсированного фурана, полезного в качестве лекарственного препарата, особенно в качестве ингибитора фактора Х активации коагуляции крови или его фармацевтически приемлемых солей.
Уровень техники
В последние годы, из-за европеизации жизненной традиции и старения населения, год от года увеличивается количество тромбоэмболических заболеваний, таких как инфаркт миокарда, церебральный инфаркт и периферический артериальный тромбоз, при этом социальная важность лечения указанных заболеваний все более и более повышается. Среди методов терапевтического лечения тромбоэмболических заболеваний, антикоагулянтная терапия, так же как фибринолитическая терапия и антитромбоцитарная терапия, принимает участие в лечении и профилактике тромбоза (Sogorinsho 41: 2141-2145, 1989). В частности, устойчивая безопасность длительного применения, так же как надежная и подходящая экспрессия антикоагулянтной активности являются существенными при профилактике тромбоза. Производное кумарина, особенно варфарин калия часто используют во всем мире как единственное антикоагулирующее средство перорального введения. Однако вследствие характеристик, возникающих из механизма его действия, требуется длительное время, пока проявится эффективность лекарственного средства, которое к тому же имеет очень длинный период полураспада в крови, хотя диапазон концентрации для экспрессии эффективности лекарственного средства относительно узок и также имеются значительные различия в эффективной дозе среди различных больных. По этим причинам антикоагулянтная способность может с трудом контролироваться (Journal Clinical Pharmacology, 1992, vol.32, pp.196-209; NEW ENGLAND JOURNAL OF MEDICINE, 1991, vol.324, no.26, pp.1865-1875). Кроме того, имеются неблагоприятные побочные реакции, вызванные лекарственным средством, такие как опасность кровоизлияния, тошнота, рвота, понос, выпадение волос, и так далее, и, поэтому клиническое применение указанного лекарственного средства является очень сложным и требуется развитие антикоагулянтных средств, которые являются полезными и легкими в обращении.
Увеличение способности крови к свертыванию является одним из значительных причинных факторов нестабильной стенокардии, ишемического инсульта, инфаркта миокарда, инфаркта легкого, эмболии легких, болезни Бюргера, глубокого тромбоза вены, синдрома диссеминированной внутрисосудистой коагуляции, тромбогенеза, возникающего после искусственного смещения сердечного клапана, 85реокклюзии, после реконструкции кровообращения и тромбогенеза во время искусственного кровообращения и так далее. Поэтому, было бы желательным иметь отдельный антикоагулянт, который демонстрирует хорошую реакцию на вводимую дозу лекарственного средства и имеет низкий уровень риска кровотечения с небольшими побочными эффектами при пероральном введении (Thrombosis Research, 1992, vol.68, pp.507-512).
Тромбин участвует не только в процессе превращения фибриногена в фибрин, который является конечной стадией коагуляционного каскада, но также демонстрирует высокую степень активации и агрегации тромбоцитов крови (Matsuo, О., "t-PA и Pro-UK", Gakusaikikaku, 1986, pp.5-40) и его ингибитор долго был центром исследования антикоагулянтов, как направление целевого развития новых препаратов. Однако, ингибитор тромбина демонстрирует низкую биодоступность при пероральном введении, а также имеет недостатки, касающиеся безопасности, такие как тенденция кровоизлияния в качестве одного из побочных эффектов (Biomedica Biochimica Acta, 1985, Vol.44, p.1201-1210), и к настоящему времени не разработано никаких коммерчески доступных ингибиторов тромбина, которые могли бы вводиться перорально.
Фактор Х активации коагуляции крови является ключевым ферментом, локализованным в положении общего пути обоих внешних и внутренних реакций коагуляционного каскада. Фактор Ха расположен выше тромбина в коагуляционном каскаде. В связи с этим, ингибирование фактора Ха является возможно более эффективным и специфическим в системе ингибирования коагуляции по сравнению с ингибированием тромбина (Thrombosis Research, 1980, Vol.19, pp.339-349).
Таким образом, вещество, которое ингибирует фактор коагуляции крови Ха и показывает определенную энзимную селективность и высокую биодоступность, как ожидается, осуществит контроль антикоагулирующей активности в течение длительного периода времени и сможет экспрессировать превосходный терапевтический эффект при пероральном введении по сравнению с существующими антикоагулянтами. Соответственно, настоятельно требуется разработка нового ингибитора фактора Х активации коагуляции крови (FXa ингибитор), который может быть введен перорально.
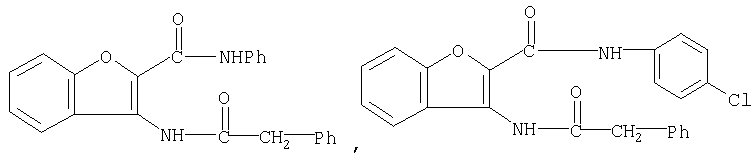
Примеры известных соединений, оказывающих ингибирующий эффект на фактор Х активации коагуляции крови, включают производные тиобензамида, которые являются полезными при профилактике или лечении тромбозов (WO 99/42439).
Следующие бензофурановые соединения также известны (Indian Journal Heterocyclic Chemistry, 1994, Vol.3, pp.3247-3252), но указанный источник не упоминает об ингибирующем эффекте соединений на фактор Х активации коагуляции крови.
Также известны конденсированные бициклические амидные производные формулы:
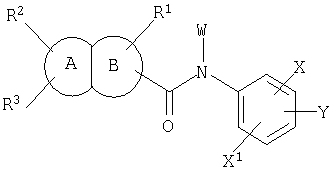
которые обладают активностью подавления роста активированных лимфоцитов и являются полезными в качестве лекарственного средства для профилактики или лечения аутоиммунных заболеваний (WO 02/12189). Однако WO 02/12189 также не упоминает о ингибирующем воздействии на фактор Х активации коагуляции крови. В статье раскрыты соединения, имеющие конденсированное кольцо пиридина и фурана, которое является дизамещеным амидной и карбамоильной группами; однако, указанные соединения все имеют бензольное кольцо на атоме азота карбамоильной группы, и это бензольное кольцо одновременно замещено с помощью Х и Y.
Раскрытие изобретения
Настоящее изобретение обеспечивает новые конденсировнные соединения фурана или его фармацевтически приемлемые соли, обладающие превосходным ингибирующим эффектом на фактор Х активации коагуляции крови.
Было изучено и найдено, что конденсированное соединение фурана формулы, представленной ниже, имеет превосходный ингибирующий эффект на фактор Х активации коагуляции крови, что составляет предмет изобретения.
Таким образом, настоящее изобретение заключается в следующем:
1. Конденсированное соединение фурана формулы (I):
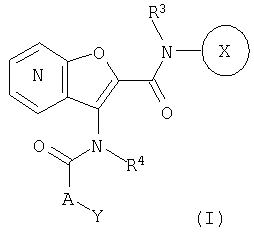
где кольцо: 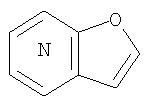 представляет собой
представляет собой
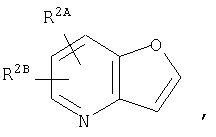
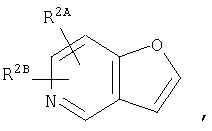
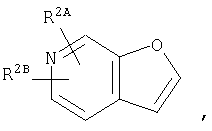
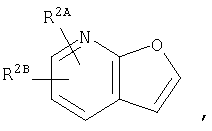 или
или 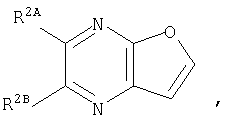
Кольцо Х представляет собой:
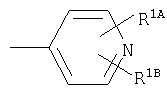
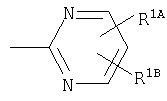
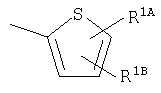
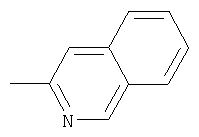
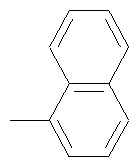
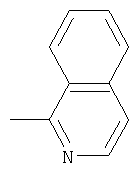
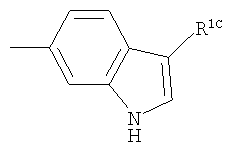
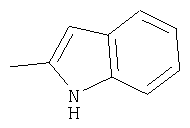 или
или 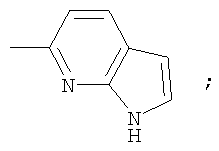
Y представляет собой необязательно замещенную аминогруппу; необязательно замещенный циклоалкил; необязательно замещенный арил; необязательно замещенную насыщенную гетероциклическую группу; или необязательно замещенную ненасыщенную гетероциклическую группу;
А представляет собой простую связь; алкилен, необязательно замещенный с помощью оксо; алкенилен; алкенилиден; или атом кислорода;
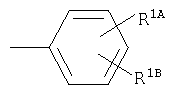
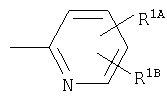
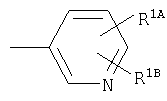
R1A, R1B являются одинаковыми или различными и каждый представляет собой водород; галоген; алкил; галогеналкил; алкокси; циано; нитро; или необязательно замещенную аминогруппу;
R1C представляет собой водород, алкил или галоген;
R2A, R2B являются одинаковыми или различными и каждый представляет собой водород; галоген; необязательно замещенный алкил; необязательно замещенный алкокси; необязательно замещенную аминогруппу; нитро; циано; гидрокси; карбокси; необязательно замещенный алкоксикарбонил; необязательно замещенный карбамоил; карбонил, замещенный с помощью необязательно замещенной насыщенной гетероциклической группы; необязательно замещенную насыщенную гетероциклическую группу; арил; или необязательно замещенную ненасыщенную гетероциклическую группу;
R3 представляет собой водород или алкил; и
R4 представляет собой водород или алкил,
или его фармацевтически приемлемая соль.
2. Конденсированное соединение фурана в соответствии с пунктом 1, где кольцо:
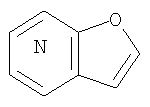 представляет собой
представляет собой



 или
или 
где символы являются теми же самыми, как определено в пункте 1, указанном выше.
3. Конденсированное соединение фурана, в соответствии с пунктами 1 или 2, где кольцо:

представляет собой

 или
или 
где символы являются теми же самыми, как определено в пункте 1, указанном выше, или его фармацевтически приемлемая соль.
4. Конденсированное соединение фурана, в соответствии с любым одним из пунктов с 1 по 3, где
Y представляет собой необязательно замещенный циклоалкил или необязательно замещенную насыщенную гетероциклическую группу,
или его фармацевтически приемлемая соль.
5. Конденсированное соединение фурана, в соответствии с любым одним из пунктов с 1 по 4, указанных выше, где заместитель в определении "необязательно замещенный циклоалкил" для Y представляет собой группу, выбранную из необязательно замещенного алкила; необязательно замещенного карбамоила; карбонила, замещеного с помощью необязательно замещенной насыщенной гетероциклической группы; необязательно замещенной аминогруппы; и необязательно замещенной насыщенной гетероциклической группы,
или его фармацевтически приемлемая соль.
6. Конденсированное соединение фурана, в соответствии с любым одним из пунктов с 1 по 5, указанных выше, где заместитель в определении "необязательно замещенный циклоалкил" для Y представляет собой группу, выбранную из: (1) аминогруппы, необязательно замещенной с помощью группы, выбранной из необязательно замещенного ацила, алкоксикарбонила и необязательно замещенного алкила; (2) аминоалкила, необязательно замещенного с помощью группы, выбранной из необязательно замещенного ацила и необязательно замещенного алкила; (3) карбамоила, необязательно замещенного с помощью необязательно замещенного алкила; (4) карбонила, замещенного с помощью насыщенной гетероциклической группы; и (5) необязательно замещенной насыщенной гетероциклической группы,
или его фармацевтически приемлемая соль.
7. Конденсированное соединение фурана, в соответствии с пунктами 5 или 6, указанных выше, где насыщенная гетероциклическая группа представляет собой от 4- до 7-членную насыщенную гетероциклическую группу, содержащую от 1 до 4 гетероатомов, выбранных из группы, содержащей атом азота, атома кислорода и атома серы,
или его фармацевтически приемлемая соль.
8. Конденсированное соединение фурана, в соответствии с любым одним из пунктов с 5 по 7, где насыщенная гетероциклическая группа представляет собой группу, выбранную из имидазолидинила, пиразолидинила, пиперидила, пиперидино, пиперазинила, морфолинила, морфолино, тиоморфолинила, тиоморфолино, гомопиперазинила, гомопиперидила, гомопиперидино и пирролидинила,
или их фармацевтически приемлемой соли.
9. Конденсированное соединение фурана, в соответствии с любым одним из пунктов с 1 по 6, указанных выше, где заместитель в определении "необязательно замещенный циклоалкил" для Y представляет собой: (1) аминогруппу, необязательно замещенную с помощью группы, выбранной из ацила, алкоксикарбонила, алкила, аминоалкила, алкилзамещенного аминоалкила, алкоксикарбониламиноалкила и ациламиноалкила; (2) алкил, замещенный с помощью аминогруппы, необязательно замещенной с помощью алкила; (3) карбамоила, необязательно моно- или дизамещеный с помощью алкила или аминоалкила, которые могут быть замещены с помощью алкила; (4) группу, выбранную из пирролидинилкарбонила, пиперидилакарбонила, пиперазинилкарбонила, морфолинокарбонила, гомопиперидилкарбонила и гомопиперазинилкарбонила; или (5) насыщенную гетероциклическую группу, выбранную из пирролидинила, необязательно замещенного с помощью оксо, пиперидила, необязательно замещенного с помощью оксо, пиперазинила, необязательно замещенного с помощью оксо, морфолино, необязательно замещенного с помощью оксо, гомопиперидила, необязательно замещенного с помощью оксо, и гомопиперазинила, необязательно замещенного с помощью оксо,
или его фармацевтически приемлемая соль.
10. Конденсированное соединение фурана, в соответствии с любым одним из пунктов с 1 по 6, указанных выше, где заместитель в определении "необязательно замещенный циклоалкил" для Y, представляет собой пирролидинил, необязательно замещенный с помощью оксо; морфолино, необязательно замещенный с помощью оксо; диалкилкарбамоил; пирролидинилкарбонил; амино, который является дизамещеным с помощью алкила и ациламиноалкила; или диалкиламино,
или его фармацевтически приемлемая соль.
11. Конденсированное соединение фурана, в соответствии с любым одним из пунктов с 1 по 3, как указано выше, где Y представляет собой арил или ненасыщенную гетероциклическую группу, замещенную с помощью необязательно замещенного карбамоила,
или его фармацевтически приемлемая соль.
12. Конденсированное соединение фурана, в соответствии с любым одним из пунктов с 1 по 11, указанных выше, где А представляет собой простую связь или метилен,
или его фармацевтически приемлемая соль.
13. Конденсированное соединение фурана, в соответствии с любым одним из пунктов с 1 по 4, указанных выше, где А представляет собой простую связь или метилен, и Y представляет собой ненасыщенную гетероциклическую группу или насыщенную гетероциклическую группу, необязательно замещенную с помощью алкила,
или его фармацевтически приемлемая соль.
14. Конденсированное соединение фурана, в соответствии с любым одним из пунктов с 1 по 3, указанных выше, где А представляет собой тетраметилен, и Y представляет собой необязательно замещенную насыщенную гетероциклическую группу, или его фармацевтически приемлемая соль.
15. Конденсированное соединение фурана, в соответствии с любым одним из пунктов с 1 по 14, указанных выше, где R1A, R1B являются одинаковыми или различными и каждый представляет собой водород, галоген, или алкил или его фармацевтически приемлемая соль.
16. Конденсированное соединение фурана, в соответствии с любым одним из пунктов с 1 по 15, указанных выше, где R2A, R2B являются одинаковыми или различными и каждый представляет собой водород; галоген; необязательно замещенный алкил; необязательно замещенный алкокси; необязательно замещенную аминогруппу; циано; карбокси; алкоксикарбонил; необязательно замещенный карбамоил; карбонил, замещенный с помощью насыщенной гетероциклической группы; или насыщенную гетероциклическую группу,
или его фармацевтически приемлемая соль.
17. Конденсированное соединение фурана, в соответствии с п.16, указанным выше, где насыщенная гетероциклическая группа представляет собой от 4- до 7-членную насыщенную гетероциклическую группу, содержащую от 1 до 4 гетероатомов, выбранных из группы, состоящей из атома азота, атома кислорода и атома серы,
или его фармацевтически приемлемая соль.
18. Конденсированное соединение фурана, в соответствии с любым одним из пунктов с 1 по 17, указанных выше, где R2A, R2B являются одинаковыми или различными и каждый представляет собой водород, фтор, хлор, бром, метил, гидроксиметил, метокси, амино, метилсульфониламино, ацетиламино, трет-бутоксикарбониламино, диметиламино, циано, карбокси, метоксикарбонил, этоксикарбонил, метокси, этокси, изопропокси, метоксиэтокси, диметилкарбамоил, N-метил-N-(2-метоксиэтил)карбамоил, пирролидинил, пирролидинилкарбонил, морфолинокарбонил или морфолино,
или его фармацевтически приемлемая соль.
19. Конденсированное соединение фурана, в соответствии с любым одним из пунктов с 1 по 18, указанных выше, где R3 представляет собой водород,
или его фармацевтически приемлемая соль.
20. Конденсированное соединение фурана, в соответствии с любым одним из пунктов с 1 по 19, указанных выше, где R4 представляет собой водород, или его фармацевтически приемлемая соль.
21. Конденсированное соединение фурана, в соответствии с любым одним из пунктов с 1 по 20, указанных выше, где кольцо Х представляет собой






 или
или 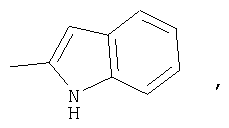
где символы являются теми, как определено в пункте 1, указанном выше,
или его фармацевтически приемлемая соль.
22. Конденсированное соединение фурана, в соответствии с пунктом 21, указанным выше, где кольцо Х представляет собой

 или
или 
где символы являются теми, как определено в пункте 1, указанном выше,
или его фармацевтически приемлемая соль.
23. Конденсированное соединение фурана, в соответствии с любым одним из пунктов с 1-22, указанных выше, которое выбрано из следующих соединений:
(1) 5-амино-N-(5-хлорпиридин-2-ил)-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-b]пиридин-2-карбоксамида,
(2) 6-амино-N-(5-хлорпиридин-2-ил)-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(3) N-(4-хлорфенил)-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-b]пиридин-2-карбоксамида,
(4) N-(5-хлорпиридин-2-ил)-5-[(метилсульфонил)амино]-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-b]пиридин-2-карбоксамида,
(5) 2-{[(5-хлорпиридин-2-ил)амино]карбонил}-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-b]пиридин-5-карбоновой кислоты,
(6) N-(5-хлорпиридин-2-ил)-3-{[(транс-4-пирролидин-1-ил-циклогексил)карбонил]амино}фуро[3,2-с]пиридин-2-карбоксамида,
(7) N-(5-хлорпиридин-2-ил)-5-(гидроксиметил)-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(8) N-(5-хлорпиридин-2-ил)-5-метокси-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(9) N-(5-хлорпиридин-2-ил)-3-{[(транс-4-пирролидин-1-ил-циклогексил)карбонил]амино}фуро[3,2-b]пиридин-2-карбоксамида,
(10) N-(5-хлорпиридин-2-ил)-5-метокси-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-b]пиридин-2-карбоксамида,
(11) N-(4-хлорфенил)-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(12) 5-амино-N-(5-хлорпиридин-2-ил)-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(13) 5-(ацетиламино)-N-(5-хлорпиридин-2-ил)-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-b]пиридин-2-карбоксамида,
(14) N-(5-хлорпиридин-2-ил)-5-фтор-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(15) 5-хлор-N-(5-хлорпиридин-2-ил)-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-b]пиридин-2-карбоксамида,
(16) N-(5-хлорпиридин-2-ил)-5-метил-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-b]пиридин-2-карбоксамида,
(17) N2-(5-хлорпиридин-2-ил)-N5,N5-диметил-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-b]пиридин-2,5-дикарбоксамида,
(18) 5-(ацетиламино)-N-(5-хлорпиридин-2-ил)-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(19) трет-бутил (2-{[(5-хлорпиридин-2-ил)амино]карбонил}-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-b]пиридин-6-ил)-карбамата,
(20) N-(5-хлорпиридин-2-ил)-5-[(метилсульфонил)амино]-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(21) N-(4-хлорфенил)-3-({[транс-4-(2-оксопирролидин-1-ил)-циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(22) N-(5-хлорпиридин-2-ил)-3-{[(1-пиридин-4-илпиперидин-4-ил)карбонил]амино}фуро[3,2-b]пиридин-2-карбоксамида,
(23) N-(5-хлорпиридин-2-ил)-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(24) трет-бутил [2-{[(5-хлорпиридин-2-ил)амино]карбонил}-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-6-ил]карбамата,
(25) 6-амино-N-(5-хлорпиридин-2-ил)-3-({[транс-4-(2-оксопирролидин-1-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(26) 6-амино-N-(5-хлорпиридин-2-ил)-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-b]пиридин-2-карбоксамида,
(27) 2-{[(5-хлорпиридин-2-ил)амино]карбонил}-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-5-карбоновой кислоты,
(28) N2-(5-хлорпиридин-2-ил)-N5,N5-диметил-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2,5-дикарбоксамида,
(29) N-(5-хлорпиридин-2-ил)-5-(морфолин-4-илкарбонил)-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-b]пиридин-2-карбоксамида,
(30) трет-бутил (2-{[(5-хлорпиридин-2-ил)амино]карбонил}-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-b]пиридин-5-ил)-карбамата,
(31) N-(5-хлорпиридин-2-ил)-5-метил-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(32) метил-2-{[(5-хлорпиридин-2-ил)амино]карбонил}-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-b]пиридин-5-карбоновую кислоту,
(33) 5-бром-N-(5-хлорпиридин-2-ил)-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-b]пиридин-2-карбоксамида,
(34) N-(5-хлорпиридин-2-ил)-5-[(метилсульфонил)амино]-3-({[транс-4-(2-оксопирролидин-1-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(35) N-(4-хлорфенил)-3-({[транс-4-(диметиламино)циклогексил]-карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(36) N-(5-хлорпиридин-2-ил)-5-циано-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-b]пиридин-2-карбоксамида,
(37) N-(5-хлорпиридин-2-ил)-5-фтор-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-b]пиридин-2-карбоксамида,
(38) N2-(5-хлорпиридин-2-ил)-N5-(2-метоксиэтил)-N5-метил-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2,5-дикарбоксамида,
(39) N-(5-хлорпиридин-2-ил)-3-({[транс-4-(диметиламино)-циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(40) N-(5-хлорпиридин-2-ил)-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)-5-(пирролидин-1-илкарбонил)фуро[3,2-b]пиридин-2-карбоксамида,
(41) трет-бутил [2-{[(5-хлорпиридин-2-ил)амино]карбонил}-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-5-ил]карбамата,
(42) 5-бром-N-(5-хлорпиридин-2-ил)-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(43) N-(5-хлорпиридин-2-ил)-5-(морфолин-4-илкарбонил)-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(44) N-(5-хлорпиридин-2-ил)-3-({[транс-4-(диметиламино)-циклогексил]карбонил}амино)-5-метоксифуро[3,2-b]пиридин-2-карбоксамида,
(45) 5-хлор-N-(5-хлорпиридин-2-ил)-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(46) 2-{[(5-хлорпиридин-2-ил)амино]карбонил}-3-({[транс-4-(2-оксопирролидин-1-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-5-карбоновой кислоты,
(47) N-(5-хлорпиридин-2-ил)-5-циано-3-({[транс-4-(2-оксопирролидин-1-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(48) N-(5-хлорпиридин-2-ил)-5-циано-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(49) N-(5-хлорпиридин-2-ил)-5-(гидроксиметил)-3-({[транс-4-(2-оксопирролидин-1-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(50) N-(5-хлорпиридин-2-ил)-5-метокси-3-({[транс-4-(2-оксопирролидин-1-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(51) N-(5-хлорпиридин-2-ил)-3-({[транс-4-(2-оксопирролидин-1-ил)циклогексил]карбонил}амино)-5-(пирролидин-1-илкарбонил)фуро[3,2-b]пиридин-2-карбоксамида,
(52) N-(5-хлорпиридин-2-ил)-5-метил-3-({[транс-4-(2-оксопирролидин-1-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(53) N-(5-хлорпиридин-2-ил)-3-({[транс-4-(диметиламино)-циклогексил]карбонил}амино)-5-метилфуро[3,2-b]пиридин-2-карбоксамида,
(54) 5-хлор-N-(5-хлорпиридин-2-ил)-3-({[транс-4-(диметиламино)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(55) N2-(5-хлорпиридин-2-ил)-3-({[транс-4-(диметиламино)-циклогексил]карбонил}амино)-N5,N5-диметилфуро[3,2-b]пиридин-2,5-дикарбоксамида,
(56) Метил-2-{[(5-хлорпиридин-2-ил)амино]карбонил}-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-5-карбоновую кислоту,
(57) N-(5-хлорпиридин-2-ил)-3-({[транс-4-(2-оксопирролидин-1-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(58) 5-амино-N-(5-хлорпиридин-2-ил)-3-({[транс-4-(2-оксопирролидин-1-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(59) N-(5-хлорпиридин-2-ил)-3-({[транс-4-(2-оксопирролидин-1-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(60) 2-{[(5-хлорпиридин-2-ил)амино]карбонил}-3-{[5-(3-оксоморфолин-4-ил)пентаноил]амино}фуро[3,2-b]пиридин-5-карбоновой кислоты,
(61) N-(5-хлорпиридин-2-ил)-3-({[транс-4-(диметиламино)-циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(62) 6-хлор-N-(5-хлорпиридин-2-ил)-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-b]пиридин-2-карбоксамида,
(63) 5-хлор-N-(5-хлорпиридин-2-ил)-3-({[транс-4-(2-оксопирролидин-1-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(64) N2-(5-хлорпиридин-2-ил)-N5,N5-диметил-3-({[транс-4-(2-оксопирролидин-1-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2,5-дикарбоксамида,
(65) 6-(ацетиламино)-N-(5-хлорпиридин-2-ил)-3-({[транс-4-(пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-b]пиридин-2-карбоксамида,
(66) трет-бутил [2-{[(5-хлорпиридин-2-ил)амино]карбонил}-3-({[транс-4-(2-оксопирролидин-1-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-6-ил]карбамата,
(67) 6-хлор-N-(5-хлорпиридин-2-ил)-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(68) N-(4-метилфенил)-3-({[транс-4-(3-оксоморфолин-4-ил)-циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(69) 2-{[(5-хлорпиридин-2-ил)амино]карбонил}-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-b]пиридин-6-карбоновой кислоты,
(70) N-(5-хлорпиридин-2-ил)-3-{[5-(3-оксоморфолин-4-ил)пентаноил]амино}фуро[3,2-b]пиридин-2-карбоксамида,
(71) 5-(ацетиламино)-N-(5-хлорпиридин-2-ил)-3-({[транс-4-(2-оксопирролидин-1-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(72) N-(4-хлорфенил)-3-{[(транс-4-морфолин-4-илциклогексил)-карбонил]амино}фуро[3,2-b]пиридин-2-карбоксамида,
(73) 5-бром-N-(5-хлорпиридин-2-ил)-3-({[транс-4-(диметиламино)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(74) N-(5-хлорпиридин-2-ил)-3-({[транс-4-(диметиламино)-циклогексил]карбонил}амино)фуро[2,3-b]пиридин-2-карбоксамида,
(75) 3-[({транс-4-[[3-(ацетиламино)пропил](метил)амино]-циклогексил}карбонил)амино]-N-(5-хлорпиридин-2-ил)фуро[3,2-b]пиридин-2-карбоксамида,
(76) транс-N'-(2-{[(5-хлорпиридин-2-ил)амино]карбонил}фуро[3,2-b]пиридин-3-ил)-N,N-диметилциклогексан-1,4-дикарбоксамида,
(77) N-(5-хлорпиридин-2-ил)-3-({[транс-4-(пирролидин-1-ил-карбонил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(78) 2-{[(5-хлорпиридин-2-ил)амино]карбонил}-3-[({транс-4-[(диметиламино)карбонил]циклогексил}карбонил)амино]фуро[3,2-b]-пиридин-5-карбоновой кислоты,
(79) метил-2-{[(5-хлорпиридин-2-ил)амино]карбонил}-3-({[транс-4-(пирролидин-1-илкарбонил)циклогексил]карбонил}амино)фуро[3,2-b]-пиридин-5-карбоновую кислоту,
(80) метил-2-{[(5-хлорпиридин-2-ил)амино]карбонил}-3-[({транс-4-[(диметиламино)карбонил]циклогексил}карбонил)амино]фуро[3,2-b]пиридин-5-карбоновую кислоту,
(81) 2-{[(5-хлорпиридин-2-ил)амино]карбонил}-3-({[транс-4-(пирролидин-1-илкарбонил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-5-карбоновой кислоты,
(82) N2-(5-хлорпиридин-2-ил)-3-[({транс-4-[(диметиламино)-карбонил]циклогексил}карбонил)амино]-N5-(2-метоксиэтил)-N5-метилфуро[3,2-b]пиридин-2,5-дикарбоксамида,
(83) N2-(5-хлорпиридин-2-ил)-N5-(2-метоксиэтил)-N5-метил-3-({[транс-4-(пирролидин-1-илкарбонил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2,5-дикарбоксамида,
(84) N-(5-хлорпиридин-2-ил)-5-пирролидин-1-ил-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-b]пиридин-2-карбоксамида,
(85) N-(5-хлорпиридин-2-ил)-5-морфолин-4-ил-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-b]пиридин-2-карбоксамида,
(86) N-(5-хлорпиридин-2-ил)-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)-5-пирролидин-1-илфуро[3,2-b]пиридин-2-карбоксамида,
(87) N-(5-хлорпиридин-2-ил)-5-(диметиламино)-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(88) N-(5-хлорпиридин-2-ил)-5-морфолин-4-ил-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(89) N-(5-хлорпиридин-2-ил)-4-(2-метоксиэтокси)-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-с]пиридин-2-карбоксамида,
(90) N-(5-хлорпиридин-2-ил)-5-(2-метоксиэтокси)-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(91) N-(5-хлорпиридин-2-ил)-5-(пирролидин-1-илкарбонил)-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-b]пиридин-2-карбоксамида,
(92) N-(5-хлорпиридин-2-ил)-4-(2-метоксиэтокси)-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-с]пиридин-2-карбоксамида,
(93) N-(5-хлорпиридин-2-ил)-4-метокси-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-с]пиридин-2-карбоксамида,
(94) N-(5-хлорпиридин-2-ил)-3-({[транс-4-(диметиламино)-циклогексил]карбонил}амино)-5-пирролидин-1-илфуро[3,2-b]пиридин-2-карбоксамида,
(95) N2-(5-хлорпиридин-2-ил)-N5-(2-метоксиэтил)-N5-метил-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-b]пиридин-2,5-дикарбоксамида,
(96) N-(5-хлорпиридин-2-ил)-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-с]пиридин-2-карбоксамида,
(97) N-(5-хлорпиридин-2-ил)-5-(диметиламино)-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-b]пиридин-2-карбоксамида,
(98) N-1Н-индол-6-ил-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(99) N-(5-хлорпиридин-2-ил)-4-метокси-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-с]пиридин-2-карбоксамида,
(100) N-(5-хлорпиридин-2-ил)-3-({[транс-4-(2-оксопирролидин-1-ил)циклогексил]карбонил}амино)-5-пирролидин-1-илфуро[3,2-b]пиридин-2-карбоксамида,
(101) N-(5-хлорпиридин-2-ил)-5-изопропокси-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-b]пиридин-2-карбоксамида,
(102) N-(5-хлорпиридин-2-ил)-5-изопропокси-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(103) N-(5-хлорпиридин-2-ил)-3-({[транс-4-(диметиламино)циклогексил]карбонил}амино)-5-(2-метоксиэтокси)-фуро[3,2-b]пиридин-2-карбоксамида,
(104) N-(5-хлорпиридин-2-ил)-5-морфолин-4-ил-3-({[транс-4-(2-оксопирролидин-1-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(105) N-(5-хлорпиридин-2-ил)-5-(диметиламино)-3-({[транс-4-(2-оксопирролидин-1-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(106) N-(5-хлорпиридин-2-ил)-3-({[транс-4-(диметиламино)-циклогексил]карбонил}амино)-5-морфолин-4-илфуро[3,2-b]пиридин-2-карбоксамида,
(107) N-(5-хлорпиридин-2-ил)-5-(2-метоксиэтокси)-3-({[транс-4-(2-оксопирролидин-1-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(108) N-(5-хлорпиридин-2-ил)-5-(диметиламино)-3-({[транс-4-(диметиламино)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(109) N-(5-хлорпиридин-2-ил)-3-({[транс-4-(диметиламино)-циклогексил]карбонил}амино)-5-изопропоксифуро[3,2-b]пиридин-2-карбоксамида,
(110) N-1Н-индол-6-ил-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-b]пиридин-2-карбоксамида,
(111) N-(5-хлорпиридин-2-ил)-4-циано-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-с]пиридин-2-карбоксамида,
(112) N-(5-хлорпиридин-2-ил)-4-метил-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-с]пиридин-2-карбоксамида,
(113) N-(5-хлорпиридин-2-ил)-4-циано-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-с]пиридин-2-карбоксамида,
(114) N-(5-хлорпиридин-2-ил)-4-метил-3-({[транс-4-(2-оксопирролидин-1-ил)циклогексил]карбонил}амино)фуро[3,2-с]пиридин-2-карбоксамида,
(115) 4-хлор-N-(5-хлорпиридин-2-ил)-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-с]пиридин-2-карбоксамида и
(116) N-(5-хлорпиридин-2-ил)-4-метил-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро{3,2-с]пиридин-2-карбоксамид
или его фармацевтически приемлемая соль.
24. Соединение формулы (II):
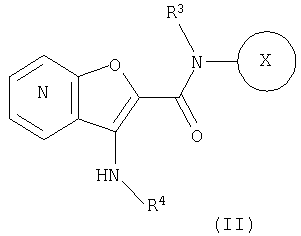
где символы являются теми, как определено в пункте 1, указанном выше, или его соль.
25. Соединение формулы (VI):
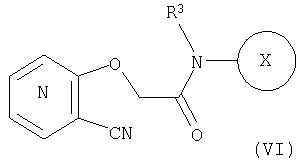
где символы являются теми, как определено в пункте 1, указанном выше, или его соль.
26. Соединение формулы (IV):
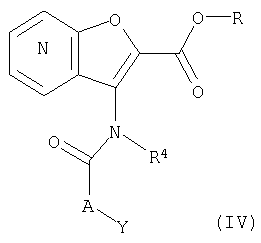
где R представляет собой водород, С1-4 алкил или карбоксизащитную группу, а другие символы являются теми, как как определено в пункте 1, указанном выше, или его соль.
27. Соединение формулы (IX):
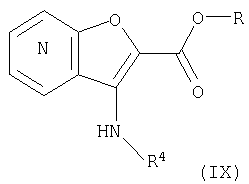
где R представляет собой водород, С1-4 алкил или карбоксизащитную группу, а другие символы являются теми, как определено в пункте 1, указанном выше, или его соль.
Настоящее изобретение также охватывает следующие изобретения.
28. Лекарственный препарат, содержащий соединение формулы (I) или его фармацевтически приемлемую соль.
29. Ингибитор фактора Х активации коагуляции крови, который содержит в виде активного ингредиента соединение формулы (I) или его фармацевтически приемлемую соль.
30. Ингибитор фактора Х активации коагуляции крови в соответствии с пунктом 29, указанным выше, которое представляет собой лекарственный препарат для профилактики или лечения заболевания, вызванного тромбом и/или эмболом.
31. Ингибитор фактора Х активации коагуляции крови в соответствии с пунктом 30, указанным выше, где заболевание, вызванное тромбом и/или эмболом, выбрано из грудной стабильной стенокардии, грудной нестабильной стенокардии, тромбоза сосудов головного мозга, ишемического инсульта, церебральной эмболии, преходящего ишемического нарушения (TIA), ишемической церебрально-васкулярной болезни, такой как церебрально-васкулярный спазм, вызванный после субарахноидального кровоизлияния, ишемического заболевания сердца, вызванного тромбогенезом коронарной артерии, застойной хронической сердечной недостаточности, инфаркта миокарда, острого инфаркта миокарда, инфаркта легкого, легочной эмболии, легочных сосудистых нарушений, синдрома эконом-класса, заболевания почек (диабетическое заболевание почек, хронический гломерулонефрит, нефропатия IgA, и так далее), тромбогенеза с атеросклерозом, периферической артериальной окклюзии, периферической венозной окклюзии, болезнью Бюргера, глубокого тромбоза вены, диссеминированного внутрисосудистого свертывания (DIC), тромбогенеза, после имплантации синтетического сосудистого протеза или замены искусственного сердечного клапана или сустава, неустойчивой хромоты, тромбогенеза и переокклюзии, заболевания после реконструкции кровообращения, такого как подкожная транслюминальная коронарная ангиопластика (РТСА) или подкожная транслюмбальная коронарная реканализация (PTCR), синдром системной воспалительной реакции (SIRS), многократный синдром дисфункции органа (MODOS), тромбогенез в экстракорпоральном кровообращении, коагуляции крови при анализе крови, диабетического нарушения кровообращения, отторжение трансплантата, защита органа, и улучшение функционирования при трансплантации.
32. Фармацевтическая композиция, которая содержит соединение формулы (I) или его фармацевтически приемлемую соль и ее фармацевтический приемлемый носитель.
Значения заместителей, представленные соответствующими символами, используемыми в настоящем описании и формуле изобретения, будут в дальнейшем раскрыты.
(1) Примеры заместителя в определении "необязательно замещенная аминогруппа" для Y включают необязательно замещенный алкил, необязательно замещенную насыщенную гетероциклическую группу, ацил, и им подобные. Среди них, алкил, пиперидил, необязательно замещенный с помощью алкила, или ацил, является предпочтительным.
В этом контексте, термин "алкил" означает, например, прямую или разветвленную цепь алкильной группы, имеющей от 1 до 6 атомов углерода, в частности, метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил, гексил, и им подобные. Среди них, С1-4 алкил является предпочтительным.
Примеры термина "пиперидил, необязательно замещенный с помощью алкила" включают пиперидил, необязательно замещенный с помощью прямой или разветвленной цепи алкильной группы, имеющей от 1 до 6 атомов углерода, предпочтительно, от 1 до 4 атомов углерода, в частности, пиперидин-4-ил, 1-метилпиперидин-4-ил, 1-этилпиперидин-4-ил, 1-изопропилпиперидин-4-ил, и им подобные.
Примеры термина "ацил" включают алканоил, алкилтиокарбонил и алкилсульфонил. Термин "алканоил" означает, например, прямую или разветвленную цепь алканоильной группы, имеющей от 1 до 6 атомов углерода, в частности, формил, ацетил, пропионил, бутирил, и им подобные. Термин "алкилтиокарбонил" означает, например, прямую или разветвленную цепь алкилтиокарбонильной группы, имеющей от 2 до 6 атомов углерода, в частности, тиоацетил, тиопропионил, и им подобные. Термин "алкилсульфонил" означает, например, прямую или разветвленную цепь алкилсульфонильной группы, имеющей от 1 до 6 атомов углерода, в частности, метилсульфонил, этилсульфонил, и им подобные.
(2) Примеры термина "необязательно замещенный циклоалкил" для Y включают циклоалкильную группу, которая может иметь заместитель(и), такие(ой) как: (а) необязательно замещенный алкил, (b) необязательно замещенный карбамоил, (с) карбонил, замещенный с помощью необязательно замещенной насыщенной гетероциклической группы, (d) необязательно замещенную аминогруппу, (е) необязательно замещенную насыщенную гетероциклическую группу, или им подобные. Примеры термина "циклоалкил" включают С3-7 циклоалкильную группу, в частности, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, и им подобные, а циклогексил является предпочтительным.
(а) В этом контексте, термин "необязательно замещенный алкил" означает алкильную группу, необязательно замещенную с помощью аминогруппы, которая может иметь один или два заместителя, выбранных из ацила и алкила. Термин "алкил" означает, например, прямую или разветвленную цепь алкильной группы, имеющей от 1 до 6 атомов углерода, в частности, метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил, гексил, и им подобные.
Примеры термина "ацил", в виде заместителя, включают алканоил, алкилтиокарбонил и алкилсульфонил. Термин "алканоил" означает, например, прямую или разветвленную цепь алканоильной группы, имеющей от 1 до 6 атомов углерода, в частности, формил, ацетил, пропионил, бутирил, и им подобные. Термин "алкилтиокарбонил" означает, например, прямую или разветвленную цепь алкилтиокарбонильной группы, имеющей от 2 до 6 атомов углерода, в частности, тиоацетил, тиопропионил, и им подобные. Термин "алкилсульфонил" означает, например, прямую или разветвленную цепь алкилсульфонильной группы, имеющей от 1 до 6 атомов углерода, в частности, метилсульфонил, этилсульфонил, и им подобные.
Примеры термина "алкил", в виде заместителя, включают прямую или разветвленную цепь алкильной группы, имеющей от 1 до 6 атомов углерода, в частности, метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил, гексил, и им подобные.
Из числа "необязательно замещенного алкила", аминоалкил, необязательно замещенный с помощью группы, выбранной из необязательно замещенного ацила и необязательно замещенного алкила, является предпочтительным, а аминоалкил, замещенный с помощью алкила, является более предпочтительным.
Конкретные примеры "необязательно замещенного алкила" включают аминометил, метиламинометил, диметиламинометил, этиламинометил, диэтиламинометил, диэтиламиноэтил, ацетиламинометил, пропиониламинометил, N-ацетил-N-метиламинометил, и им подобные.
(b) Термин "необязательно замещенный карбамоил" означает карбамоильную группу, которая может иметь в виде заместителя необязательно замещенный алкил.
Примеры термина "алкил", в виде заместителя, включают прямую или разветвленную цепь алкильной группы, имеющей от 1 до 6 атомов углерода, в частности, метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил, гексил, и им подобные, но метил и этил являются особенно предпочтительными. Алкильные группы могут быть замещены с помощью аминогруппы, который является необязательно моно- или дизамещеный с помощью С1-4 алкила; гидрокси; или С1-4 алкокси, например, амино, метиламино, диметиламино, диэтиламино, гидроксигруппа, метокси, этокси, и им подобные. Конкретные примеры замещеного алкила включают аминоэтил, метиламиноэтил, диметиламиноэтил, гидроксиэтил, гидроксипропил, метоксиэтил, этоксиэтил, метоксипропил, и им подобные.
Конкретные примеры "необязательно замещенного карбамоила" включают карбамоил, диметилкарбамоил, диэтилкарбамоил, N-этил-N-метилкарбамоил, N-метил-N-(2-гидроксиэтил)карбамоил, N-метил-N-(2-метоксиэтил) карбамоил, N-метил-N-(2-диметиламиноэтил)-карбамоил, N-этил-N-(2-диметиламиноэтил)карбамоил, и им подобные.
(c) Термин "карбонил, замещенный с помощью необязательно замещенной насыщенной гетероциклической группы" означает, например, карбонильную группу, которая является замещенной с помощью необязательно замещенной от 5- до 7-членной насыщенной гетероциклической группы, содержащей от 1 до 4, предпочтительно 1 или 2 гетероатомов, выбранных из группы, содержащей атом азота, атома кислорода и атом серы, в частности, имидазолидинилкарбонил, пиразолидинилкарбонил, пиперидилакарбонил, пиперидинокарбонил, пиперазинилкарбонил, морфолинилкарбонил, морфолинокарбонил, тиоморфолинилкарбонил, тиоморфолинокарбонил, гомопиперазинилкарбонил, гомопиперидилкарбонил, гомопиперидинокарбонил, пирролидинилкарбонил, и им подобные. Предпочтительные примеры включают пирролидинилкарбонил, пиперидилакарбонил, пиперидинокарбонил, пиперазинилкарбонил, морфолинокарбонил, гомопиперидинокарбонил, гомопиперазинилкарбонил, и им подобные. Насыщенная гетероциклическая группа может быть замещена с помощью необязательно замещенного C1-4 алкила (заместители для C1-4алкила: амино, необязательно моно- или дизамещеный с помощью С1-4алкила; С1-4алкокси; гидрокси, и так далее), амино, который может быть моно- или дизамещеный с помощью С1-4алкила, С1-4алкокси, гидрокси, оксо, или им подобные.
(d) Термин "необязательно замещенная аминогруппа" означает аминогруппу, которая может иметь заместителей), такие как (i) необязательно замещенную ацил, (ii) алкоксикарбонил, или (iii) необязательно замещенный алкил, и им подобные.
В этом контексте, (i) примеры "необязательно замещенного ацила", в виде заместителя, включают алканоил, алкилтиокарбонил и алкилсульфонил. Термин "алканоил" означает, например, прямую или разветвленную цепь алканоильной группы, имеющей от 1 до 6 атомов углерода, в частности, формил, ацетил, пропионил, бутирил, и им подобные. Термин "алкилтиокарбонил" означает, например, прямую или разветвленную цепь алкилтиокарбонильной группы, имеющей от 2 до 6 атомов углерода, в частности, тиоацетил, тиопропионил, и им подобные. Термин "алкилсульфонил" означает, например, прямую или разветвленную цепь алкилсульфонильной группы, имеющей от 1 до 6 атомов углерода, в частности, метилсульфонил, этилсульфонил, и им подобные. Ацильная группа может быть замещена с помощью насыщенной гетероциклической группы (пирролидино, пиперидино, морфолино, пиперазин-1-ил, и так далее), амино, необязательно замещенного с помощью C1-6 ацила или C1-6 алкила, или им подобные.
(ii) Примеры термина "алкоксикарбонил", в виде заместителя, включают прямую или разветвленную цепь алкоксикарбонильной группы, имеющей от 2 до 7 атомов углерода, в частности, метоксикарбонил, этоксикарбонил, пропоксикарбонил, изопропилоксикарбонил, бутоксикарбонил, и им подобные.
(iii) Примеры термина "необязательно замещенный алкил", в виде заместителя, включают прямую или разветвленную цепь алкильной группы, имеющей от 1 до 6 атомов углерода, в частности, метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил, гексил, и им подобные. Алкильные группы могут иметь заместитель(и), выбранный(е) из гидрокси, необязательно замещенного амино, алкоксикарбонила, циано и насыщенной гетероциклической группы.
Из числа этих заместителей, "необязательно замещенную аминогруппу" означает амино, который может иметь 1 или 2 заместителя, выбранных из C1-6 алкила, C1-6 ацила и С2-7 алкоксикарбонила, и их конкретные примеры включают амино, метиламино, диметиламино, диэтиламино, формиламино, ацеталамино, N-ацетил-N-метиламино, N-формил-N-метиламино, N-ацетил-N-этиламино, метоксикарбониламино, трет-бутоксикарбониламино, и им подобные. Термин "алкоксикарбонил" означает алкоксикарбонильную группу, имеющую от 2 до 7 атомов углерода, и ее конкретные примеры включают метоксикарбонил, этоксикарбонил, и им подобные. Термин "насыщенная гетероциклическая группа" означает необязательно замещенную 5- или 6-членную насыщенную гетероциклическую группу, содержащую 1 или 2 гетероатомов, выбранных из группы, содержащей атом азота, атома кислорода и атом серы, и их конкретные примеры включают необязательно замещенный пирролидинил, пиперидил, морфолинил, пиперазинил, и им подобные.
Из числа заместителей для необязательно замещенной аминогруппы, необязательно замещенный ацил, алкоксикарбонил и необязательно замещенный алкил являются предпочтительными, а ацил, алкоксикарбонил, алкил, аминоалкил, алкоксикарбониламиноалкил и ациламиноалкил являются более предпочтительными.
Конкретные примеры "необязательно замещенной аминогруппы" включают амино, метиламино, диметиламино, N-ацетил-N-метиламино, N-формил-N-метиламино, N-трет-бутоксикарбонил-N-метиламино, N-(3-(трет-бутоксикарбониламино)пропил)-N-метиламино, N-(3-аминопропил)-N-метиламино, N-(3-(ацетиламино)пропил)-N-метиламино, N-ацетиламино, метоксикарбонилметиламино, цианометиламино, метоксикарбониламино, и им подобные.
(е) Термин "необязательно замещенная насыщенная гетероциклическая группа" означает, например, от 4- до 7-членную насыщенную гетероциклическую группу, содержащую от 1 до 4, предпочтительно 1 или 2 гетероатомов, выбранных из группы, содержащей атом азота, атома кислорода и атом серы, которая может иметь заместитель(и), такие как алкоксикарбонил, ацил, алкил, оксо, и им подобные, и может образовывать конденсированное кольцо. Конкретные примеры включают пирролидинил, 2-оксопирролидинил, имидазолидинил, пиразолидинил, 2-оксо-оксазолидинил, 4-оксо-оксазолидинил, 4-оксо-тетрагидрооксазинил, 1,1 -диоксо-тетрагидроизотиазолил, пиперидил, пиперидино, пиперазинил, 2-оксопиперазинил, 4-метил-2-оксопиперазинил, 4-ацетил-2-оксопиперазинил, морфолинил, морфолино, 3-оксоморфолино, тиоморфолинил, тиоморфолино, гомопиперазинил, гомопиперидил, гомопиперидино, и им подобные, предпочтительно, пирролидинил, 2-оксопирролидинил, пиперидил, пиперидино, пиперазинил, морфолино, 3-оксоморфолино, гомопиперидино, гомопиперазинил, 2-оксо-оксазолидинил, 4-оксо-оксазолидинил, 4-оксо-тетрагидрооксазинил, 1,1-диоксо-тетрагидроизотиазолил, 2-оксопиперазинил, 4-метил-2-оксопиперазинил и 4-ацетил-2-оксопиперазинил.
(3) Примеры термина "необязательно замещенный арил" для Y включают арильную группу, которая может иметь заместитель(и), такие как необязательно замещенный алкил, необязательно замещенный карбамоил, карбонил, замещенный, с помощью необязательно замещенной насыщенной гетероциклической группы, необязательно замещенную аминогруппу, необязательно замещенная насыщенная гетероциклическая группа, и им подобные. Примеры термина "арил" включают ароматическую углеводородную группу, имеющую от 6 до 14 атомов углерода, в частности, фенил, нафтил, и им подобные, а фенил является предпочтительным.
В этом контексте, заместитель(и) арила является тем же самым, что и заместитель(и) "необязательно замещенного циклоалкила" для Y, как указано выше, прежде всего, необязательно замещенный карбамоил является предпочтительным.
(4) Термин "необязательно замещенная насыщенная гетероциклическая группа" для Y означает, например, необязательно замещенную от 5- до 7-членную насыщенную гетероциклическую группу, содержащую от 1 до 4, предпочтительно 1 или 2 гетероатомов, выбранных из группы, содержащей атом азота, атома кислорода и атом серы, которая может образовывать конденсированное кольцо. Конкретные примеры включают имидазолидинил, пиразолидинил, пиперидил, пиперидино, пиперазинил, морфолинил, морфолино, тиоморфолинил, тиоморфолино, гомопиперазинил, гомопиперидил, гомопиперидино, пирролидинил, и им подобные, а предпочтительно, пирролидинил, пиперидил, пиперидино, пиперазинил, морфолино, гомопиперидино и гомопиперазинил. Примеры заместителя(ей) для насыщенной гетероциклической группы включают (а) необязательно замещенный алкил, (b) необязательно замещенную насыщенную гетероциклическую группу, (с) необязательно замещенный ацил, (d) необязательно замещенную ненасыщенную гетероциклическую группу, (е) оксо, и им подобные.
В этом контексте, (а) примеры "алкила", в виде заместителя, включают прямую или разветвленную цепь алкильной группы, имеющей от 1 до 6 атомов углерода, в частности, метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил, гексил, и им подобные. Алкильные группы могут иметь заместитель(и), такой как ненасыщенная гетероциклическая группа (пиридил, и так далее), аминогруппу, необязательно замещенную с помощью C1-6 алкила, или им подобные.
(b) Примеры термина "необязательно замещенная насыщенная гетероциклическая группа", в виде заместителя, означают, например, 5- или 6-членную насыщенную гетероциклическую группу, содержащую 1 или 2 гетероатомов, выбранных из группы, содержащей атом азота, атома кислорода и атом серы, которая может иметь заместитель(и), такой как оксо, в частности, пиперидил, пирролидинил, 2-оксопирролидинил, и им подобные. Насыщенная гетероциклическая группа может иметь, в виде заместителя(ей), C1-6 алкил, С1-6ацил, и им подобные.
(c) Примеры термина "ацил", в виде заместителя, включают алканоил, алкилтиокарбонил и алкилсульфонил. Термин "алканоил" означает, например, прямую или разветвленную цепь алканоильной группы, имеющей от 1 до 6 атомов углерода, в частности, формил, ацетил, пропионил, бутирил, и им подобные. Термин "алкилтиокарбонил" означает, например, прямую или разветвленную цепь алкилтиокарбонильной группы, имеющей от 2 до 6 атомов углерода, в частности, тиоацетил, тиопропионил, и им подобные. Термин "алкилсульфонил" означает, например, прямую или разветвленную цепь алкилсульфонильной группы, имеющей от 1 до 6 атомов углерода, в частности, метилсульфонил, этилсульфонил, и им подобные. Ацильная группа может быть замещена с помощью необязательно замещенного амино, пиридилом, и им подобными.
(d) Примеры термина "необязательно замещенная ненасыщенная гетероциклическая группа", в виде заместителя, включают, например, 5- или 6-членную ненасыщенную гетероциклическую группу, содержащую 1 или 2 гетероатомов, выбранных из группы, содержащей атом азота, атома кислорода и атом серы, в частности, пиридил, пиримидил, тиазолил, оксазолинил, и им подобные.
Примеры термина "замещенная насыщенная гетероциклическая группа" включают 3-оксоморфолино, 2-оксопирролидинил, 1-изопропилпиперидил, 1-диметилкарбамоилпиперидил, и им подобные.
(5) Примеры термина "необязательно замещенная ненасыщенная гетероциклическая группа" для Y означают, например, необязательно замещенную от 5- до 7-членную ненасыщенную гетероциклическую группу, содержащую от 1 до 4, предпочтительно, 1 или 2 гетероатомов, выбранных из группы, содержащей атом азота, атома кислорода и атом серы, которая может образовывать конденсированное кольцо. Конкретные примеры включают пиридил, пиримидинил, пиразинил, фурил, тиенил, пирролил, имидазолил, пиразолил, оксазолил, изоксазолил, тиазолил, изотиазолил, и им подобные. Предпочтительные примеры включают пиридил, пиримидинил, пиразинил, тиенил, оксазолил и тиазолил. Ненасыщенная гетероциклическая группа может иметь заместитель(и), такие как (а) необязательно замещенную аминогруппу, (b) необязательно замещенную аминогруппу алкил, (с) необязательно замещенную насыщенную гетероциклическую группу, (d) необязательно замещенный карбамоил, и им подобные.
(a) Примеры заместителя "необязательно замещенного амино", в виде заместителя, включают С1-6 алкильную группу, замещенную с помощью аминогруппы, которая может быть замещена с помощью C1-6 алкила.
(b) Примеры термина "аминоалкил", в виде заместителя, включают аминоалкильную группу, содержащую C1-6 алкильную группу, которая может иметь заместитель(и), такой как C1-6 алкил, ненасыщенную гетероциклическую группу (оксазолидинил, и так далее), и им подобные.
(c) Примеры термина "необязательно замещенная насыщенная гетероциклическая группа", в виде заместителя, включают насыщенную от 5- до 7-членную гетероциклическую группу, содержащую 1 или 2 гетероатомов, выбранных из группы, содержащей атом азота, атома кислорода и атом серы, и конкретные примеры включают гомопиперазинил, и им подобные.
(d) Примеры термина «необязательно замещенный карбамоил», в виде заместителя, являются теми же самыми, как это определено для заместителя "циклоалкила" для Y.
Примеры термина "алкилен" для А включают прямую или разветвленную цепь алкиленовой группы, имеющей от 1 до 6 атомов углерода, в частности, метилен, этилен, триметилен, тетраметилен, пентаметилен, гексаметилен, и им подобные. Среди них, алкилены, имеющие от 1 до 5 атомов углерода, являются предпочтительными, а метилен и тетраметилен являются особенно предпочтительными. Алкилен может быть замещен с помощью оксо, и конкретные примеры включают пропионил, бутирил, пентаноил, и им подобные.
Примеры термина "алкенилен" для А включают прямую или разветвленную цепь алкенилена, имеющую от 2 до 6 атомов углерода, в частности, винилен, пропенилен, бутенилен, пентенилен, и им подобные. Среди них, алкенилен, имеющий от 2 до 5 атомов углерода, являются предпочтительным.
Примеры термина "алкенилиден" для А включают алкенилиден, имеющий от 2 до 6 атомов углерода, в частности, винилиден, пропенилиден, бутенилиден, пентенилиден, и им подобные.
Примеры термина "галоген" для R1А, R1В включают фтор, хлор, бром, иод и им подобные.
Примеры термина "алкил" для R1А, R1В включают прямую или разветвленную цепь алкильной группы, имеющей от 1 до 6, предпочтительно от 1 до 4 атомов углерода, в частности, метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил, гексил, и им подобные, прежде всего, метил является особенно предпочтительным.
Примеры термина "галогеналкил" для R1А, R1В включают прямую или разветвленную цепь алкильной группы, имеющей от 1 до 6, предпочтительно от 1 до 4 атомов углерода, которая является замещеной с помощью галогена(ов), в частности, хлорметил, дихлорметил, фторметил, дифторметил, трифторметил, 2,2,2-трифторэтил, и им подобные.
Примеры термина "алкокси" для R1А, R1В включают прямую или разветвленную цепь алкоксигруппы, имеющей от 1 до 6, предпочтительно от 1 до 4 атомов углерода, в частности, метокси, этокси, пропокси, изопропокси, бутокси, трет-бутокси, пентилокси, гексилокси, и им подобные, прежде всего, метокси является особенно предпочтительным.
Примеры заместителя "необязательно замещенной аминогруппы" для R1А, R1В включают прямую или разветвленную цепь алкильной группы, имеющей от 1 до 6, предпочтительно от 1 до 4 атомов углерода, в частности, метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил, гексил, и им подобные, прежде всего, метил является особенно предпочтительным.
Предпочтительный заместитель для R1А, R1В представляет собой галоген и алкил, а хлор и метил являются особенно предпочтительными.
Примеры термина "алкил" и "галоген" для R1С являются теми же самыми, как это определено для терминов "алкил" и "галоген" для R1А, R1В. Предпочтительным заместителем для R1С является водород.
Примеры термина "галоген" для R2А, R2В включают фтор, хлор, бром, иод, и им подобные фтор, хлор и бром являются предпочтительными.
Примеры термина "необязательно замещенный алкил" для R2А, R2В включают прямую или разветвленную цепь алкильной группы, имеющей от 1 до 6, предпочтительно, от 1 до 4 атомов углерода, в частности, метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил, гексил, и им подобные, а метил и этил являются особенно предпочтительными. Алкил может иметь заместитель(и), такой как амино, который может быть замещен с помощью C1-6 алкила, гидрокси, C1-6 алкокси, карбокси, С2-7 алкоксикарбонила, необязательно замещенного карбамоила, и им подобные. Конкретные примеры замещеного алкила включают аминометил, метиламинометил, диметиламинометил, гидроксиметил, 2-гидроксиэтил, метоксиметил, карбоксиметил, метоксикарбонилметил, диметилкарбамоилметил, и им подобные, а гидроксиметил является особенно предпочтительным.
Примеры термина "необязательно замещенный алкокси" для R2А, R2В включают прямую или разветвленную цепь алкоксигруппы, имеющей от 1 до 6, предпочтительно от 1 до 4 атомов углерода, в частности, метокси, этокси, пропокси, изопропокси, бутокси, трет-бутокси, пентилокси, гексилокси, и им подобные, прежде всего, метокси, этокси, изопропокси являются особенно предпочтительными. Алкокси может иметь заместитель(и), такой как амино, который может быть замещен с помощью C1-6 алкила, гидрокси, C1-6 алкокси, и им подобные. Конкретные примеры замещеного алкокси включают аминоэтокси, диметиламиноэтокси, гидроксиэтокси, метоксиэтокси, и им подобные, а метоксиэтокси является предпочтительным.
Примеры заместителя "необязательно замещенная аминогруппа" для R2A, R2В включают С1-6 алкил, C1-6 ацил (например, алканоил, алкилтиокарбонил, алкилсульфонил), C2-7 алкоксикарбонил, и им подобные, в частности, амино, метиламино, диметиламино, этиламино, формиламино, ацетиламино, N-ацетил-N-метиламино, N-метилсульфониламино, N-метил-N-метилсульфониламино, метоксикарбониламино, трет-бутоксикарбониламино, и им подобные, а амино, диметиламино, ацетиламино, метилсульфониламино и трет-бутоксикарбониламино являются особенно предпочтительными.
Примеры термина "необязательно замещенный алкоксикарбонил" для R2A, R2B включают прямую или разветвленную цепь алкоксикарбонильной группы, имеющей от 2 до 7 атомов углерода, в частности, метоксикарбонил, этоксикарбонил, пропоксикарбонил, бутоксикарбонил, и им подобные. Алкоксикарбонил может иметь заместитель(и), такие как гидрокси, C1-6 алкокси, необязательно замещенную аминогруппу, и им подобные.
Примеры заместителя "необязательно замещенный карбамоил" для R2A, R2B включают необязательно замещенную алкильную группу, имеющую от 1 до 6 атомов углерода, и им подобные. Алкил может быть замещен с помощью аминогруппы, которая может быть моно- или дизамещеной с помощью С1-6 алкила или С1-6 ацила, или C1-6 алкокси.
Конкретные примеры карбамоила включают карбамоил, N-метилкарбамоил, N,N-диметилкарбамоил, N-(2-метоксиэтил)-карбамоил, N-метил-N-метоксиэтилкарбамоил, N-(N,N-диметиламиноэтил)карбамоил, N-(N,N-диметиламиноэтил)-N-метилкарбамоил, и им подобные, прежде всего, N,N-диметилкарбамоил, N-метил-N-метоксиэтилкарбамоил и N-(N,N-диметиламиноэтил)-N-метилкарбамоил являются предпочтительными.
Термин "карбонил, замещенный с помощью необязательно замещенной насыщенной гетероциклической группы" для R2A, R2B означает, например, карбонил, замещенный с помощью необязательно замещенной от 5- до 7-членной насыщенной гетероциклической группы, содержащей от 1 до 4, предпочтительно 1 или 2 гетероатомов, выбранных из группы, содержащей атом азота, атома кислорода и атом серы. Конкретные примеры включают имидазолидинилкарбонил, пиразолидинилкарбонил, пиперидилкарбонил, пиперидинкарбонил, пиперазинилкарбонил, морфолинилкарбонил, морфолинокарбонил, тиоморфолинилкарбонил, тиоморфолинкарбонил, гомопиперазинилкарбонил, гомопиперидилкарбонил, гомопиперидинкарбонил, пирролидинилкарбонил, и им подобные, предпочтительно, пирролидинилкарбонил, пиперидилкарбонил, пиперидинкарбонил, пиперазинилкарбонил, морфолинкарбонил, гомопиперидинкарбонил, гомопиперазинилкарбонил, и им подобные. Насыщенная гетероциклическая группа может быть замещена с помощью оксогруппы и им подобным.
Термин "необязательно замещенная насыщенная гетероциклическая группа" для R2A, R2B означает, например, от 5- до 7-членную насыщенную гетероциклическую группу, содержащую от 1 до 4, предпочтительно 1 или 2 гетероатомов, выбранных из группы, содержащей атом азота, атома кислорода и атом серы, которая может иметь заместитель(и) и может образовывать конденсированное кольцо. Конкретные примеры включают имидазолидинил, пиразолидинил, пиперидил, пиперидино, пиперазинил, морфолинил, морфолино, тиоморфолинил, тиоморфолино, гомопиперазинил, гомопиперидил, гомопиперидино, пирролидинил, и им подобные, а предпочтительно, пирролидинил, пиперидил, пиперидино, пиперазинил, морфолино, гомопиперидино и гомопиперазинил. Примеры заместителя(и) для указанной насыщенной гетероциклической группы включают необязательно замещенный алкил, необязательно замещенную насыщенную гетероциклическую группу, необязательно замещенный ацил, необязательно замещенную ненасыщенную гетероциклическую группу, оксо, и им подобные, и эти заместители являются теми же самыми, как это определено для термина "необязательно замещенная насыщенная гетероциклическая группу" для Y.
Примеры термина "арил" для R2А, R2В включают ароматическую углеводородную группу, имеющую от 6 до 14 атомов углерода, в частности, фенил, нафтил, и им подобные.
Термин "необязательно замещенная ненасыщенная гетероциклическая группа" для R2A, R2B означает, например, от 5- до 7-членную ненасыщенную гетероциклическую группу, содержащую от 1 до 4, предпочтительно, 1 или 2 гетероатомов, выбранных из группы, содержащей атом азота, атома кислорода и атом серы, которая может иметь заместитель(и), в частности, пиридил, пиримидинил, пиразинил, фурил, тиенил, пирролил, имидазолил, пиразолил, оксазолил, изоксазолил, тиазолил, изотиазолил, и им подобные. Ненасыщенная гетероциклическая группа может иметь заместителей), такие(ой) как необязательно ди- или монозамещенный амино (заместитель: С1-4алкил, C1-4алканоил, и так далее), необязательно замещенный алкил (заместитель: амино, который является моно- или дизамещеным с помощью С1-4алкила, С1-4алканоила, и так далее), или им подобные.
Предпочтительные примеры заместителя для R2A, R2B включают водород, галоген, необязательно замещенный алкил, необязательно замещенный алкокси, необязательно замещенную аминогруппу, циано, карбокси, алкоксикарбонил, необязательно замещенный карбамоил или карбонил, замещенный с помощью необязательно замещенной насыщенной гетероциклической группы, прежде всего, водород, фтор, хлор, бром, метил, гидроксиметил, метокси, изопропокси, амино, диметиламино, метилсульфониламино, ацетиламино, трет-бутоксикарбониламино, циано, карбокси, метоксикарбонил, этоксикарбонил, диметилкарбамоил, N-метил-N-метоксиэтил-карбамоил, морфолинокарбонил и пирролидинилкарбонил являются предпочтительными.
Примеры термина "Кольцо X" включают следующие группы:
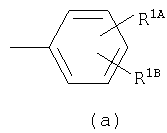
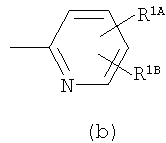
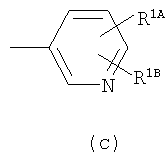
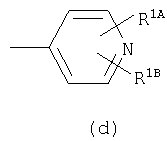
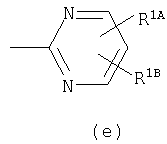
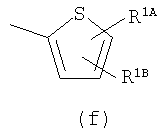
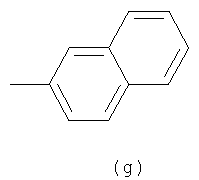
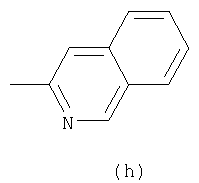
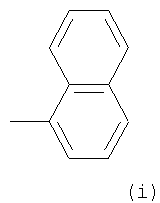
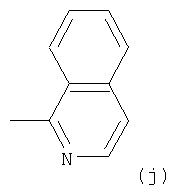
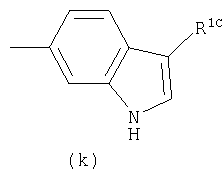
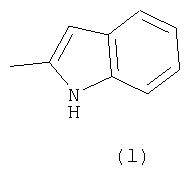 и
и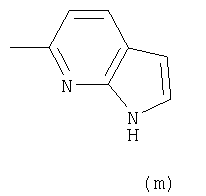
где от (а) до (f), (k) и (l) являются предпочтительными, а (а), (b) и (k) являются особенно предпочтительными. Следующие группы являются особенно предпочтительными.
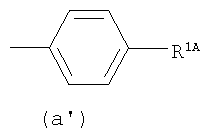
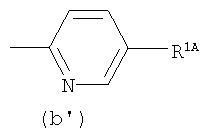
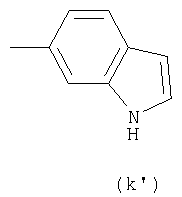
Термин "алкил" для R3 означает, например, прямую или разветвленную цепь алкильной группы, имеющей от 1 до 6, предпочтительно от 1 до 4 атомов углерода, в частности, метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил, гексил, и им подобные. Водород является особенно предпочтительным для R3.
Термин "алкил" для R4 означает, например, прямую или разветвленную цепь алкильной группы, имеющей от 1 до 6, предпочтительно от 1 до 4 атомов углерода, в частности, метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил, гексил, и им подобные. Водород является особенно предпочтительным для R4.
В настоящем описании, термин "насыщенная гетероциклическая группа" представляет собой предпочтительно необязательно замещенную от 5- до 7-членную насыщенную гетероциклическую группу, содержащую, по крайней мере, один атом азота, особенно предпочтительными являются указанные насыщенные гетероциклические группы, имеющие связь на атоме азота.
Кольцо:
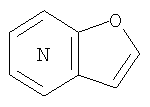
представляет собой предпочтительно:
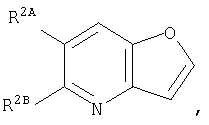
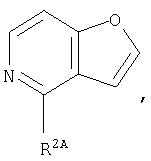 или
или 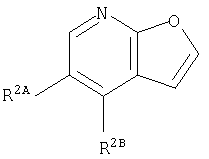
Из числа соединений настоящего изобретения, упомянутые выше соединения от (1) до (110) являются предпочтительными.
Фармацевтически приемлемая соль соединения (I) включает соль неорганической кислоты, такую как соляная кислота, бромистоводородная кислота, йодистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота, и так далее; соль органической кислоты, такую как муравьиная кислота, уксусная кислота, пропионовая кислота, щавелевая кислота, малоновая кислота, янтарная кислота, фумаровая кислота, малеиновая кислота, молочная кислота, яблочная кислота, винная кислота, лимонная кислота, метансульфокислота, этансульфокислота, бензолсульфоновая кислота, и так далее; соль с кислой аминокислотой, такой как аспарагиновая кислота, глутаминовая кислота, и так далее; соль с металлом, таким как натрий, калий, литий, магний, кальций, алюминий, и так далее; соль с амином, таким как аммиак, метиламин, этиламин, этаноламин, и так далее; или соль с основной аминокислотой, такой как лизин или альфа, бета-диаминовалериановая кислота (орнитин), и так далее.
Соединение (I) настоящего изобретения может быть в виде четвертичной соли и эта четвертичная соль входит в границы для настоящего соединения (I).
Кроме того, соединение (I) настоящего изобретения включает внутримолекулярную соль, гидрат, сольват, и тому подобное. Кроме того, когда соединение (I) имеет асимметричный атом(ы) углерода, оно может существовать как оптический изомер, и настоящее изобретение охватывает каждый из них или смесь изомеров. Кроме того, когда соединение (I) имеет двойную связь(и) или циклоалкиленовую группу, имеющую два или больше заместителя на кольце, оно может существовать в виде цис, транс или мезо формы, и когда соединение (I) имеет ненасыщенную связь, такую как карбонил, оно может существовать в виде таутомеров. Настоящее соединение (I) охватывает каждый из них или смесь указанных изомеров.
Кроме того, соединение (I) настоящего изобретения охватывает, как упомянуто выше, пролекарство соединения. Примеры пролекарства включают те, которые получены путем защиты функциональной группы, такой как амино- или карбоксигруппа соединения (I) с помощью обычной защитной группы.
Лучшее осуществление изобретения
Соединение настоящего изобретения может быть получено в соответствии со следующими методиками.
СПОСОБ 1: Соединение (I) настоящего изобретения может быть получено в соответствии со следующей методикой.
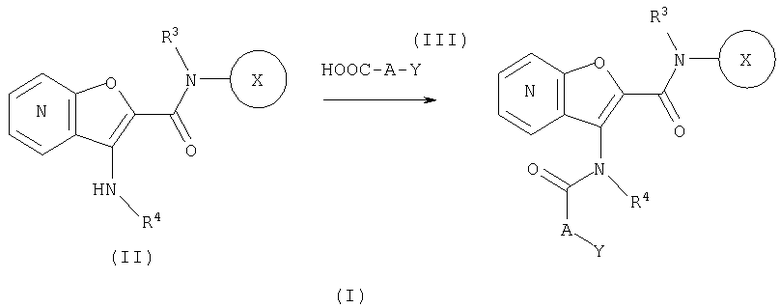
где символы являются теми, как определено выше.
Соединение (I) может быть получено путем введения соединения (II) и соединения (III) в реакцию конденсации.
Конденсация соединения (II) с соединением (III) может быть осуществлена путем введения этих соединений в обычную реакцию конденсации, используя агент конденсации, или превращение соединения (III) в реакционноспособное производное (галогенангидрид кислоты, смешанный ангидрид, реакционноспособный сложный эфир, и так далее), и взаимодействие с соединением (II).
(I) В тех случаях, когда соединение (II) и соединение (III) вводят в обычную реакцию конденсации, реакция может быть осуществлена в подходящем растворителе. Агент конденсации, используемый в реакции, включает следующие соединения N,N-дициклогексилкарбодиимид (DCC), 1-этил-3-(3-диметиламинопропил)карбодиимид (EDC) или их гидрохлорид, карбонилдиимидазол (CDI), дифенилфосфорилазид (DPPA), диэтиловый цианофосфонат (DEPC), и им подобные, прежде всего, DCC, EDC или их гидрохлорид являются предпочтительными.
Настоящую реакцию обычно осуществляют в интервале температур от 0°С до 100°С; однако, более высокая или более низкая температура может быть подобрана соответствующим образом, если необходимо. Время реакции для описываемой реакции обычно составляет от 30 минут и до 24 часов; однако, более длительное или более короткое время реакции может быть подобрано соответствующим образом, если необходимо.
(2) В случаях, когда используют реакционноспособное производное соединения (III), соединение (III) превращают в реакционноспособное производное с помощью обычной методики, такие как, например, в галоидангидрид кислоты, используя агент галогенирования (тионилхлорид, тионилбромид, оксалилхлорид, и так далее) в смешанный ангидрид кислоты, используя эфир хлоркарбоната (метилхлоркарбонат, этилхлоркарбонат, изобутилхлоркарбонат, и так далее) или хлорангидрид кислоты (2,4,6-трихлорбензоилхлорид, и так далее), реакционноспособный эфир, используя 1-гидроксисукцинимид, 1-гидроксибензотриазол или п-нитрофенол, и так далее, или эфир низшего спирта (метиловый эфир, этиловый эфир, и так далее). Полученное реакционноспособное производное затем участвует в реакции конденсации с соединением (II) в подходящем растворителе или в отсутствие растворителя в присутствии поглотителя кислоты, когда необходимо.
Способ, когда соединение (III) превращают в галоидангидрид кислоты, является предпочтительным для реакции конденсации по изобретению.
Когда реакция включает превращение в галоидангидрид кислоты, скорость реакции может быть увеличена путем добавления в виде катализатора диметилформамида или ему подобному.
Кроме того, в упомянутой выше реакции конденсации, реакцию можно активизировать или ускорить путем добавления 4-диметиламинопиридина или ему подобному.
Поглотитель кислоты, который используют, когда необходимо, включает, например, неорганические или органические основания. Примеры неорганических оснований включают карбонаты щелочных металлов (карбонат натрия, карбонат калия, карбонат цезия, и так далее), гидрокарбонаты щелочных металлов (гидрокарбонат натрия, гидрокарбонат калия, и так далее) и гидроксиды щелочных металлов (гидроксид натрия, гидроксид калия, гидроксид лития, и так далее). Примеры органических оснований включают линейные тринизшие алкиламины (триэтиламин, трибутиламин, диизопропилэтиламин, и так далее), циклические третичные амины (1,4-диазабицикло[2.2.2]октан, 1,5-диазабицикло[4.3.0]нон-5-ен, 1,8-диазабицикло[5.4.0]ундек-7-ен, и так далее), ароматические третичные амины (N,N-диметиланилин, N,N-диэталанилин, и так далее), пиридин, лутидин, коллидин, и так далее, прежде всего, триэтиламин, диизопропилэтиламин и пиридин являются предпочтительными для описываемой реакции. Если поглотитель кислоты используют в описываемой реакции, указанный поглотитель кислоты может служить как растворитель.
Описываемую реакцию обычно осуществляют в интервале температур от -20°С до температуры кипения растворителя; однако, более низкая температура может быть подобрана соответствующим образом, если необходимо. Время реакции обычно составляет от 30 минут и до 24 часов; однако, более длительное или более короткое время реакции может быть подобрано соответствующим образом, если необходимо.
В случаях, когда растворитель используют в реакции конденсации, указанной выше, может быть использован любой инертный растворитель, который не разрушает реакцию, например, галогенированные растворители (хлороформ, дихлорметан, дихлопентан, и так далее), ароматические углеводороды (бензол, толуол, ксилол, и так далее), простые эфиры (диэтиловый эфир, диизопроповый эфир, тетрагидрофуран, диоксан, 1,2-диметоксиэтан, и так далее), сложные эфиры (этилацетат, и так далее), амиды (N,N-диметилформамид, N,N-диметилацетамид, 1,3-диметил-2-имидазолидинон, и так далее), нитрилы (ацетонитрил, и так далее), диметилсульфоксид, пиридин, 2,6-лутидин, вода, и им подобные. Смешанный растворитель, содержащий два или более растворителей, является также пригодным. Из числа указанных растворителей, дихлорметан, хлороформ, толуол, ксилол, тетрагидрофуран, диоксан, N,N-диметилформамид, N,N-диметилацетамид, 1,3-диметил-2-имидазолидинон и пиридин являются предпочтительными, а дихлорметан, хлороформ, N,N-диметилформамид, пиридин, и растворитель из их смеси являются особенно предпочтительными.
СПОСОБ 2: Из числа соединений (I), соединения, где Y представляет собой циклоалкил, замещенный с помощью -N(G)R5, -NHR5 и -N(R5)CH2R6, то есть, соединения (I-a), (I-b) и (I-с), соответственно, могут быть получены в соответствии со следующей методикой.
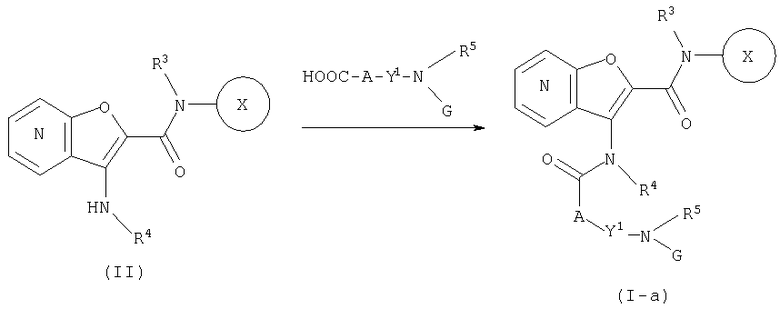
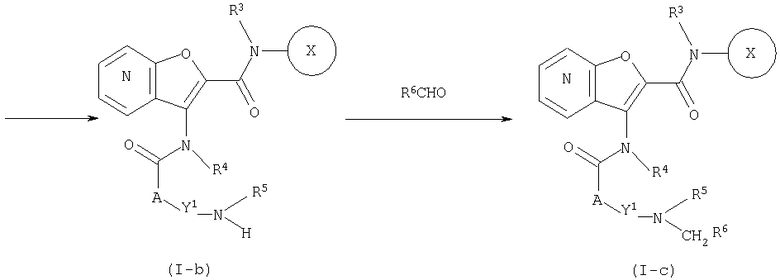
где Y1 представляет собой циклоалкилен, R5 представляет собой водород, алкил, ацил, алкоксикарбонил или ненасыщенную гетероциклическую группу, R6 представляет собой необязательно замещенный алкил или ненасыщенную гетероциклическую группу, G представляет собой аминозащитную группу, такую как трет-бутоксикарбонил, бензилоксикарбонил, и так далее, а другие символы являются теми же самыми, как определено выше.
Соединение (I-b) может быть получено путем конденсации соединения (II) с соединением (III-а), что дает соединение (I-а), и удаления аминозащитной группы. Одновременно соединение (I-е) может быть получено путем введения соединения (I-b) в восстановительное алкилирование, используя альдегид формулы: R6CHO.
Конденсация между соединением (II) и соединением (III-а) может быть осуществлена в условиях, аналогичных тем, которые описаны в СПОСОБЕ 1.
Снятие защиты с соединения (I-а) может быть осуществлено с помощью методики, обычно используемой в области синтетической органической химии. Например, когда G в соединении (I-а) представляет собой трет-бутоксикарбонил, указанное соединение может быть обработано кислотой (например, соляной кислотой, трифторуксусной кислотой, метансульфоновой кислотой, и так далее) в подходящем растворителе (диоксан, тетрагидрофуран, этилацетат, дихлорметан, хлороформ, метанол, этанол, и так далее), что дает соединение (I-b).
Восстановительное алкилирование соединения (I-b) может быть осуществлено путем взаимодействия соединения (I-b) с альдегидом (R6СНО) в подходящем растворителе в присутствие восстановителя.
При восстановительном алкилировании могут быть использованы любые восстановители, которые не воздействуют на амидную связь и так далее, и их примеры включают металлические восстановительные агенты, такие как боргидрид натрия, триацетоксиборгидрид натрия, цианоборгидрид натрия, и так далее.
При восстановительном алкилировании может быть использован любой инертный растворитель, который не разрушает реакцию, например, галогенированные растворители (хлороформ, дихлорметан, дихлопентан, и так далее), простые эфиры (диэтиловый эфир, диизопроповый эфир, тетрагидрофуран, диоксан, 1,2-диметоксиэтан, и так далее), амиды (N,N-диметилформамид, N,N-диметилацетамид, 1,3-диметил-2-имидазолидинон, и так далее), нитрилы (ацетонитрил, и так далее), ароматические углеводороды (бензол, толуол, ксилол, и так далее), спирты (метанол, этанол, пропанол, и так далее), вода, и им подобные. Смешанный растворитель, содержащий два или более указанных растворителей, является также пригодным, когда необходимо, но прежде всего, дихлорметан, дихлопентан, тетрагидрофуран, 1,2-диметоксиэтан, метанол, этанол, пропанол, и им подобные являются предпочтительными.
Восстановительное алкилирование обычно осуществляют в интервале температур от -10°С до температуры кипения растворителя, предпочтительно в интервале температур от охлаждения льдом до комнатной температуры. Время реакции обычно составляет от 30 минут и до 24 часов; однако, более длительное или более короткое время реакции может быть подобрано соответствующим образом, если необходимо.
Описываемая реакция может также быть проведена с помощью каталитического гидрирования, используя водород в качестве металлического катализатора (палладий на угле, платина на угле, оксид платины, никель Ренея, и так далее) вместо упомянутых выше восстановителей.
В описываемой реакции может быть использован любой инертный растворитель, который не разрушает реакцию, например, простые эфиры (диэтиловый эфир, диизопроповый эфир, тетрагидрофуран, диоксан, 1,2-диметоксиэтан, и так далее), амиды (N,N-диметилформамид, N,N-диметилацетамид, 1,3-диметил-2-имидазолидинон, и так далее), сложные эфиры (этилацетат, и так далее), ароматические углеводороды (бензол, толуол, ксилол, и так далее), спирты (метанол, этанол, пропанол, и так далее), вода, и им подобные. Когда необходимо, смешанный растворитель, содержащий два или более указанных растворителей, является также пригодным, прежде всего, тетрагидрофуран, N,N-диметилформамид, метанол и этанол являются предпочтительными.
Описываемую реакцию обычно осуществляют в интервале температур от -10°С до температуры кипения растворителя, предпочтительно в интервале температур от охлаждения льдом до комнатной температуры. Время реакции обычно составляет от 30 минут и до 24 часов; однако, более длительное или более короткое время реакции может быть подобрано соответствующим образом, если необходимо.
Кроме того, может также быть добавлена органическая кислота, такая как уксусная кислота, или минеральная кислота, такая как соляная кислота, для того, чтобы содействовать восстановительному алкилированию.
СПОСОБ 3: Соединение (I) настоящего изобретения может также быть получено в соответствии со следующей методикой.
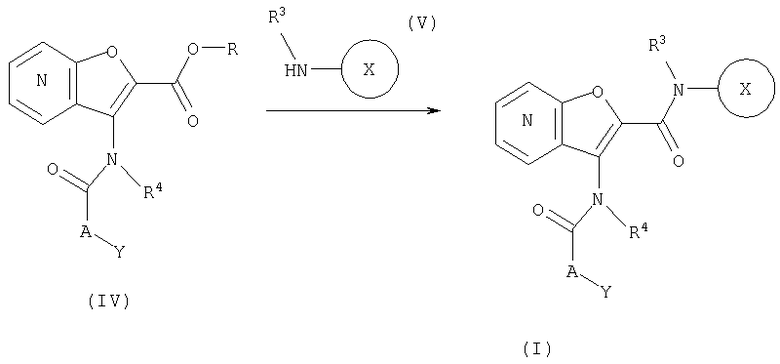
где R представляет собой водород, С1-4алкил или карбоксизащитную группу, а другие символы являются теми, как как определено выше.
Соединение (I) может быть получено путем введения соединения (IV) и соединения (V) в реакцию конденсации.
Реакция конденсации соединения (IV) с соединением (V) может быть осуществлена путем нагревания соединений в отсутствие растворителя, или с помощью превращения соединения (V) в соответствующее производное алюминийамида в присутствии три-низшего алкилалюминия (триметилалюминия), диэтилдигидроалюмината натрия, или им подобным в подходящем растворителе, и взаимодействие с соединением (IV).
В реакции может быть использован любой инертный растворитель, который не разрушает реакцию, например, галогенированные растворители (хлороформ, дихлорметан, дихлопентан, и так далее), ароматические углеводороды (бензол, толуол, ксилол, и так далее), простые эфиры (диэтиловый эфир, диизопроповый эфир, тетрагидрофуран, диоксан, 1,2-диметоксиэтан, и так далее), амиды (N,N-диметилформамид, N,N-диметилацетамид, 1,3-диметил-2-имидазолидинон, и так далее), углеводороды (гексан, и так далее), диметилсульфоксид, пиридин, 2,6-лутидин, вода, и им подобные, а смешанный растворитель, содержащий два или более указанных растворителей, прежде всего, дихлорметан, хлороформ, толуол, ксилол и гексан являются особенно предпочтительными.
Описываемая реакция может быть осуществлена в в широком интервале температур от температуры охлаждения до температуры нагревания, например, от -10°С до температуры кипения растворителя, и особенно предпочтительно от охлаждения льдом до 60°С. Время реакции меняется в зависимости от используемого растворителя; однако, оно обычно составляет между часом и 24 часами, предпочтительно между 2 и 8 часами.
СПОСОБ 4:
Из числа соединений (II), соединение, где R4 представляет собой водород и кольцо:
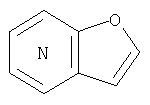 представляет собой
представляет собой 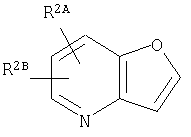 или
или 
где символы являются теми, как определено выше, то есть, соединение формулы (II-а):
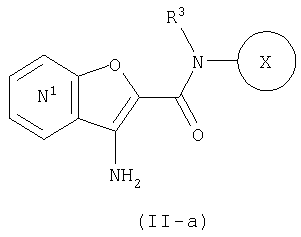
где кольцо:
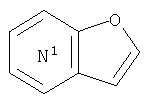 представляет собой
представляет собой  или
или 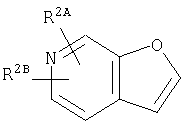
а другие символы являются теми, как как определено выше, может быть получено в соответствии со следующей методикой.
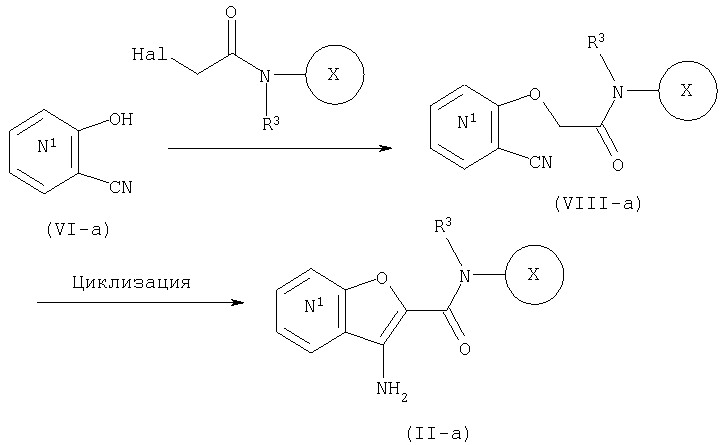
где Hal представляет собой галоген, такие как хлор, бром, или им подобные, а другие символы являются теми, как как определено выше.
(1) Реакция O-алкилирования соединения (VI-а) может быть осуществлена в присутствии основания в подходящем растворителе, если необходимо.
Основание, используемое в O-алкилировании, включает, например, неорганические и органические основания. Примеры неорганических оснований включают карбонаты щелочных металлов (карбонат натрия, карбонат натрия, карбонат цезия, и так далее), гидрокарбонаты щелочных металлов (гидрокарбонат натрия, гидрокарбонат калия, и так далее), гидроксиды щелочных металлов (гидроксид натрия, гидроксид калия, гидроксид лития, и так далее), и им подобные. В O-алкилировании, галогенид (иодид натрия, иодид лития, иодид калия, бромид лития, и так далее), предпочтительно, иодид (иодид натрия, иодид лития, иодид калия, и так далее) используют вместе с основанием.
Примеры органических оснований включают линейные три-низшие алкиламины (триэтиламин, трибутиламин, диизопропилэтиламин, и так далее), циклические третичные-амины (1,4-диазабицикло[2.2.2]октан, 1,5-диазабицикло[4.3.0]-нон-5-ен, 1,8-диазабицикло[5.4.0]ундек-7-ен, и так далее), ароматические третичные амины (N,N-диметиланилин, N,N-диэтиланилин, 4-диметиламинопиридин, и так далее), пиридин, лутидин, коллидин, и так далее. Кроме того, основания, такие как алкоксиды щелочных металлов (метоксид натрия, бутоксид калия, и так далее) являются также доступными. Карбонат щелочного металла является особенно предпочтительным для описываемой реакции. Эти основания могут также служить как растворитель в описываемой реакции.
В O-алкилировании может быть использован любой инертный растворитель, который не разрушает реакцию, например, кетоны (ацетон, метилэтилкетон, и так далее), ароматические углеводороды (бензол, толуол, ксилол, и так далее), простые эфиры (диэтиловый эфир, диизопроповый эфир, тетрагидрофуран, диоксан, 1,2-диметоксиэтан, и так далее), амиды (N,N-диметилформамид, N,N-диметилацетамид, 1,3-диметил-2-имидазолидинон, и так далее), нитрилы (ацетонитрил, и так далее), диметилсульфоксид, пиридин, 2,6-лутидин, и им подобные. Смешанный растворитель, содержащий два или более указанных растворителей, является также пригодным, прежде всего, кетоны и амиды являются предпочтительными.
Описываемую реакцию обычно осуществляют в интервале температур от охлаждения льдом до температуры кипения растворителя. Время реакции обычно составляет от 30 минут и до 24 часов; однако, более длительное или более короткое время реакции может быть подобрано соответствующим образом, если необходимо.
(2) Реакция циклизации соединения (VIII-a) может быть осуществлена путем обработки основанием в подходящем растворителе, если необходимо.
Циклизация может быть осуществлена, используя аналогичное основание, которое описано при рассмотрении O-алкилирования, указанного выше, предпочтительно, основания карбонатов щелочных металлов, трет-бутоксида калия или циклических третичных аминов.
В случаях, когда растворитель используют в циклизации, может быть использован любой инертный растворитель, который не разрушает реакцию, например, кетоны (ацетон, метилэтилкетон, и так далее), ароматические углеводороды (бензол, толуол, ксилол, и так далее), простые эфиры (диэтиловый эфир, диизопроповый эфир, тетрагидрофуран, диоксан, 1,2-диметоксиэтан, и так далее), амиды (N,N-диметилформамид, N,N-диметилацетамид, 1,3-диметил-2-имидазолидинон, и так далее), нитрилы (ацетонитрил, и так далее), спирты (метанол, этанол, пропанол, 2-бутанол, трет-бутанол, и так далее), диметилсульфоксид, пиридин, 2,6-лутидин, и им подобные. Смешанный растворитель, содержащий два или более указанных растворителей, является также пригодньм, прежде всего, кетоны, амиды и спирты являются предпочтительными, а N,N-диметилацетамид, 1,3-диметил-2-имидазолидинон и трет-бутанол являются особенно предпочтительными.
Описываемую реакцию обычно осуществляют в интервале температур от охлаждения льдом до температуры кипения растворителя. Время реакции для циклизации обычно составляет от 30 минут и до 24 часов; однако, более длительное или более короткое время реакции может быть подобрано соответствующим образом, если необходимо.
СПОСОБ 5:
Из числа соединений (II), соединение, где R4 представляет собой водород и кольцо:
 представляет собой
представляет собой

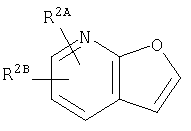 или
или 
где символы являются теми, как определено выше, то есть, соединение формулы (II-b):
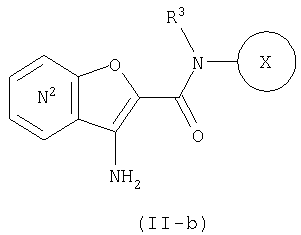
где кольцо:
представляет собой

 или
или 
а другие символы являются теми, как как определено выше, может быть получено в соответствии со следующей методикой.
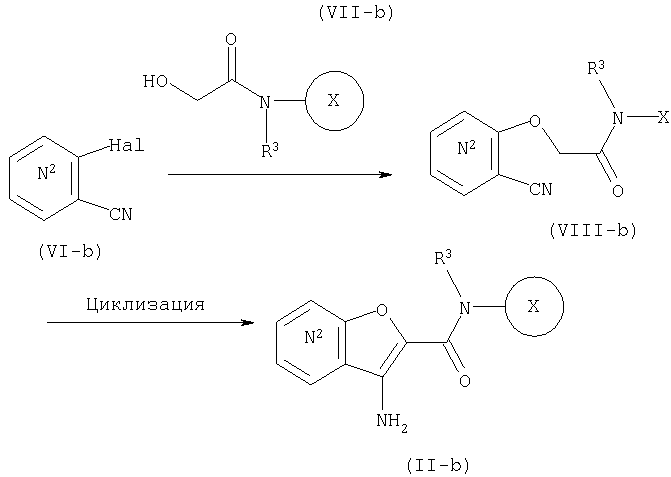
где символы являются теми, как определено выше.
(1) Реакция между соединением (V1-b) и соединением (VH-b) может быть осуществлена в присутствии основания в подходящем растворителе, если необходимо. Примеры основания, используемого в текущей реакции, включают карбонаты щелочных металлов (карбонат натрия, карбонат цезия, и так далее), гидриды щелочных металлов (гидрид натрия, и так далее) и алкоксиды щелочных металлов (метоксид натрия, трет-бутоксид калия, и так далее), прежде всего, гидрид натрия является особенно предпочтительным. Растворители включают амиды (N,N-диметилформамид, N,N-диметилацетамид, 1,3-диметил-2-имидазолидинон, и так далее) и эфиры (диэтиловый эфир, диизопроповый эфир, тетрагидрофуран, диоксан, 1,2-диметоксиэтан, и так далее), прежде всего, N,N-диметилформамид, N,N-диметилацетамид, 1,3-диметил-2-имидазолидинон, и им подобные являются предпочтительными.
(2) Реакция циклизации соединения (VII 1-b) может быть осуществлена в условиях, аналогичных условиям проведения в реакции циклизации, описанных в СПОСОБЕ 3.
СПОСОБ 6:
Соединение (IV) может быть получено в соответствии со следующей методикой.
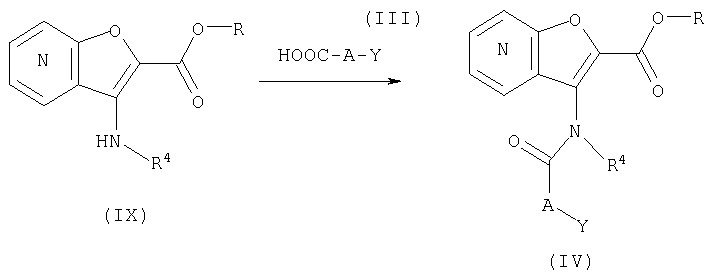
где символы являются теми, как определено выше.
Соединение (IV) может быть получено путем введения соединения (IX) и соединения (III) в реакцию конденсации. Реакция конденсации может быть осуществлена в условиях, аналогичных тем, которые описаны в СПОСОБЕ 1.
СПОСОБ 7:
Из числа соединений (IX), соединение, где R4 представляет собой водород, может быть получено в соответствии со следующей методикой.
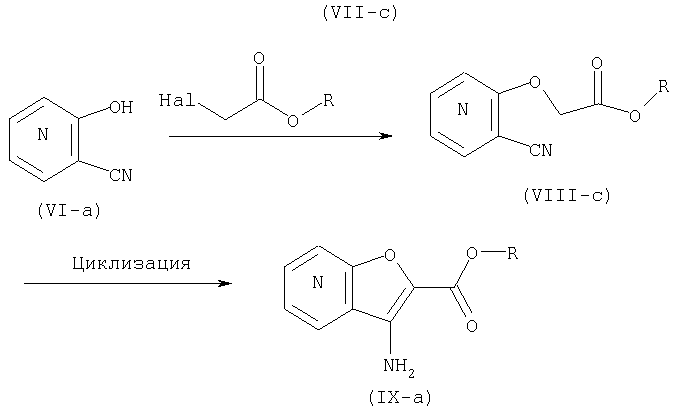
где символы являются теми, как определено выше.
Соединение (IX-а) может быть получено путем введения соединения (VI-а) и соединения (VII-c) в реакцию O-алкилирования в присутствии основания, и циклизации полученного соединения VIII-c. Соответствующие реакции O-алкилирования и циклизации могут быть осуществлены в условиях, аналогичных тем, которые описаны в СПОСОБЕ 4.
СПОСОБ 8:
Соединение (VIII-a) может быть получено в соответствии со следующей методикой.
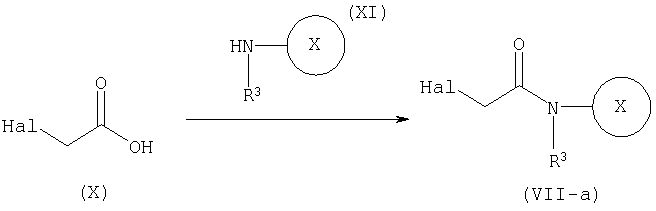
где символы являются теми, как определено выше.
Соединение (VII-a) может быть получено путем введения соединения (X) и соединения (XI) в обычную реакцию конденсации, используя агент конденсации или с помощью превращения соединения (X) в реакционноспособное производное (галоидангидрид кислоты, смешанный ангидрид, реакционноспособный сложный эфир, и так далее), и взаимодействие с соединением (XI).
Описываемая реакция может быть осуществлена в условиях, аналогичных тем, которые описаны в СПОСОБЕ 1. Способ, где используют реакционноспособное производное (галоидангидрид кислоты), соединение (х) является особенно предпочтительным.
СПОСОБ 9:
Соединение (VII-b) может быть получено в соответствии со следующей методикой.
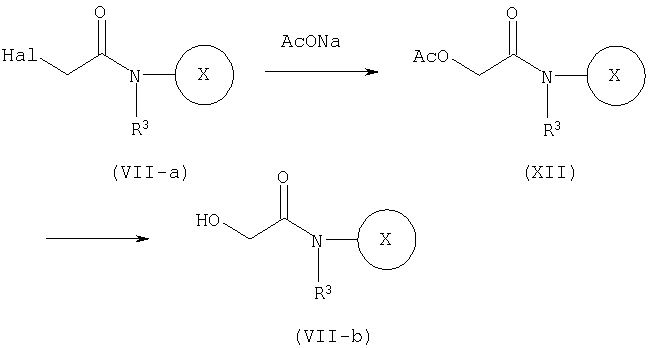
где Ас представляет собой ацетил, а другие символы являются теми, как определено выше.
Соединение (VII-b) может быть получено путем взаимодействия соединения (VII-a) с ацетатом натрия в подходящем растворителе в соответствии с обычной методикой превращения галоида в гидроксильную группу и проведения сольволиза или гидролиза полученного соединения (XII).
В описываемой реакции может быть использован любой инертный растворитель, который не разрушает реакцию, а амиды (N,N-диметилформамид, N,N-диметилацетамид, 1,3-диметил-2-имидазолидинон, и так далее) являются предпочтительными.
Описываемую реакцию обычно осуществляют в интервале температур от 0°С до 100°С; однако, более высокая или более низкая температура может быть подобрана соответствующим образом, если необходимо. Время реакции обычно составляет от 30 минут и до 24 часов; однако, более длительное или более короткое время реакции может быть подобрано соответствующим образом, если необходимо.
Соединение (VII-b) может быть получено путем обработки соединения (XII) неорганическим основанием или им подобным в растворителе, таком как спирт (метанол, этанол, и так далее), вода или им подобные, или с алкоксидом щелочного металла или неорганическим основанием в инертном растворителе. Неорганическое основание, используемое в описываемой реакции, включает карбонаты щелочных металлов (карбонат натрия и так далее), гидроксиды щелочных металлов (гидроксид натрия, гидроксид калия, гидроксид лития, и так далее), а карбонаты щелочных металлов являются особенно предпочтительными.
Алкоксид щелочного металла, используемый в описываемой реакции, включает метоксид натрия, трет-бутоксид калия, и им подобные.
В описываемой реакции может быть использован любой инертный растворитель, который не разрушает реакцию, например, спирты (метанол, этанол, пропанол, 2-бутанол, и так далее), вода, амиды (N,N-диметилформамид, N,N-диметилацетамид, 1,3-диметил-2-имидазолидинон, и так далее), простые эфиры (диэтиловый эфир, диизопроповый эфир, тетрагидрофуран, диоксан, 1,2-диметоксиэтан, и так далее), и им подобные. Смешанный растворитель, содержащий два или более указанных растворителей, является также пригодным, прежде всего, метанол и вода являются предпочтительными.
СПОСОБ 10:
Из числа соединений (III-а), соединение, где R5 представляет собой водород, может быть получено в соответствии со следующей методикой.
где Ra представляет собой алкил, такой как метил, а другие символы являются теми, как как определено выше.
Соединение (XIII-b) может быть получено с помощью превращения соединения (XII) в соединение (XIII) через перегруппировку по Куртису, где соединение (XII) обрабатывают азидным соединением в подходящем растворителе в присутствии основания и, если необходимо, активирующим агентом и обрабатывают спиртом. Соединение (XIII-а) может быть получено путем гидролиза соединения (XIII-b).
Примеры основания, используемые в перегруппировке по Куртису, включают триэтиламин, диизопропилэтиламин и им подобные.
Активирующий агент, используемый в перегруппировке по Куртису, когда необходимо, включает метилхлоркарбонат, этилхлоркарбонат, изобутилхлоркарбонат, изопропилхлоркарбонат, фенилхлоркарбонат, и им подобные.
Азидное соединение, используемое в перегруппировке по Куртису, включает азид натрия, дифенилфосфорилазид, и им подобные.
Примеры растворителя, используемого в перегруппировке по Куртису, включают толуол, ксилол, бензол, тетрагидрофуран, диоксан, этиленгликоль, диметовый эфир, диметилформамид, хлороформ, дихлорпентан, этилацетат, ацетонитрил, трет-бутиловый спирт, и им подобные. Когда используют трет-бутиловый спирт в виде растворителя, обработка спиртом, представленная ниже, не является необходимой и соединение (XIII-b) может быть получено только путем упомянутой выше обработки.
Реакцию перегруппировки по Куртису обычно осуществляют в интервале температур от -20°С до 150°С; однако, более высокая или более низкая температура может быть подобрана, если необходимо.
Время реакции для перегруппировки по Куртису обычно составляет от 30 минут и 10 часов; однако, более длительное или более короткое время реакции может быть подобрано, если необходимо.
Примеры спирта, используемого при получении соединения (XIII-b), включают С1-4спирты с прямой или разветвленной цепью, которые могут иметь фенильное кольцо, в частности, метанол, этанол, трет-бутил спирт, бензиловый спирт, и им подобные.
Реакцию получения соединение (XIII-b) обычно осуществляют в интервале температур от -20°С до температуры кипения растворителя; однако, более высокая или более низкая температура может быть подобрана, если необходимо.
Время реакции получения соединения (XIII-b) обычно составляет от 30 минут и до 24 часов; однако, более длительное или более короткое время реакции может быть подобрано соответствующим образом, если необходимо.
Полученное соединение (XIII-b) может быть превращено в соединение (XIII-а) путем введения соединения (ХХХ-b) в известную реакцию гидролиза, обычно используемого в области синтетической органической химии.
СПОСОБ 11:
Когда соединение настоящего изобретения имеет аминогруппу, оно может быть N-алкилированным или N-ацилированным с помощью методики, известной из области синтетической органической химии. Когда соединение настоящего изобретения имеет карбамоильную группу или амидную группу, оно может быть N-алкилированным, с помощью методики, известной из области синтетической органической химии. Когда соединение настоящего изобретения имеет карбоксильную группу, оно может быть этерифицированным или амидированным с помощью методики, известной из области синтетической органической химии. Когда соединение настоящего изобретения является сложным эфиром или амидом, оно может быть превращено в соответствующую карбоновую кислоту, спирт и амин через гидролиз или восстановление с помощью методики, известной из области синтетической органической химии.
Когда соединение настоящего изобретения имеет галоген на ариле или ненасыщенную гетероциклическую группу, оно может быть превращено в соединение, несущее соответствующий арил, ненасыщенную гетероциклическую группу, необязательно замещенную аминогруппу и алкокси с помощью методики, известной из области синтетической органической химии, такой как реакция конденсации, используя палладиевый или никелевый катализатор. Когда вышеупомянутую реакцию конденсации осуществляют в атмосфере монооксида углерода, указанное соединение может быть превращено в соответствующий алкоксикарбонил или необязательно замещенный карбамоил.
Полученные таким образом соединения настоящего изобретения могут быть выделены и очищены с помощью методики, хорошо известной из области синтетической органической химии, такой как перекристаллизация, колоночная хроматография, и им подобные.
Настоящее соединение (I) или его фармацевтически приемлемая соль обладает отличным ингибиторным эффектом на фактор Х активирования коагуляции крови, и поэтому является полезным при профилактике и лечении различных заболеваний, вызванных тромбом или эмболом у млекопитающих (например, человек, обезьяна, кролик, собака, кот, свинья, лошадь, бык, мышь, крыса, морская свинка, и так далее), указанные заболевания включают, например, грудную стабильную стенокардию, грудную нестабильную стенокардию, тромбоз сосудов головного мозга, ишемический инсульт, церебральную эмболию, преходящего ишемического нарушения (TIA), ишемическую церебрально-васкулярную болезнь, такую как церебрально-васкулярный спазм, заболевания после субарахноидального кровоизлияния, ишемическое заболевание сердца, вызванное тромбогенезом коронарной артерии, застойную хроническую сердечную недостаточность, инфаркт миокарда, острый инфаркт миокарда, инфаркт легкого, легочную эмболию, легочные сосудистые нарушения, синдром эконом-класса, заболевание почек (диабетическое заболевание почек, хронический гломерулонефрит, нефропатия IgA, и так далее), тромбогенез с атеросклерозом, периферическую артериальную окклюзию, периферическую венозную окклюзию, болезнь Бюргера, глубокий тромбоз вены, диссеминированное внутрисосудистое свертывание (DIC), тромбогенез, заболевания после имплантации синтетического сосудистого протеза или замены искусственного сердечного клапана или сустава, неустойчивую хромоту, тромбогенез и переокклюзию, заболевания после реконструкции кровообращения, такого как подкожная транслюминальная коронарная ангиопластика (РТСА) или подкожная транслюмбальная коронарная реканализация (PTCR), синдром системной воспалительной реакции (SIRS), множественный синдром дисфункции органа (MODS), тромбогенез в экстракорпоральном кровообращении, коагуляция крови при анализе крови, диабетическое нарушение кровообращения, отторжение трансплантата, защита органа и улучшение функционирования при трансплантации, и так далее.
Настоящее соединение характеризуется тем, что оно демонстрирует отличное ингибиторное воздействия на фактор Х активирования коагуляции крови, пониженную токсичность и вызывает несколько побочных эффектов (кровоизлияние, и так далее), которые есть у существующих антикоагулянтов.
Настоящее соединение (I) или его фармацевтически приемлемая соль может входить в состав фармацевтической композиции, содержащей терапевтически эффетивное количество соединения (I) и его фармацевтически приемлемый носитель. Фармацевтически приемлемые носители включают разбавители, связующие (например, сироп, аравийская камедь, желатин, сорбит, трагакант, поливинилпирролидон), инертные наполнители (например, лактоза, сахароза, кукурузный крахмал, фосфорнокислый калий, сорбит, аминоуксусная кислота), скользящие (например, стеарат магния, тальк, полиэтиленгликоль, кремнезем), разрыхлители (например, картофельный крахмал) и увлажнители (например, сульфатная целлюлоза), и им подобные.
Соединение (I) настоящего изобретения или его фармацевтически приемлемая соль может быть введено перорально или парентерально и использоваться в качестве подходящего фармацевтического препарата. Примеры подходящего препарата для перорального введения включают твердые препараты (таблетки, гранулы, капсулы, порошки, и так далее), растворы, суспензии и эмульсии. Примеры подходящего препарата для парентерального введения включают свечи, инъекции или препараты для непрерывного введения, используя дистиллированную воду для инъекции, физиологический раствор или водный раствор глюкозы, и так далее, или средство для ингаляции.
Вводимая доза соединения (I) или его фармацевтически приемлемой соли по настоящему изобретению может изменяться в зависимости от пути введения, возраста, веса и состояния пациента или вида или серьезности заболевания, указанная доза обычно находится в диапазоне от около 0.1 до 50 мг/кг/день, предпочтительно от около 0.1 до 30 мг/кг/день.
ПРИМЕРЫ
Настоящее изобретение будет детально проиллюстрировано с помощью примеров осуществления изобретения и ссылочных примеров, которые не должны рассматриваться, как ограничивающие область изобретения.
Пример 1: N-(5-Хлорпиридин-2-ил)-3-({[транс-4-(2-оксопирролидин-1-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамид
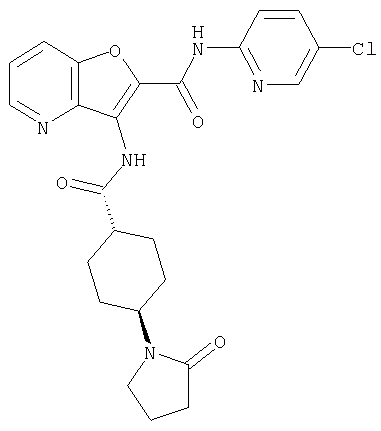
Транс-4-(2-оксопирролидин-1-ил)циклогексанкарбоновую кислоту (22.0 г), полученную в ссылочном примере 2, растворяют в тионилхлориде (150 мл), и смесь перемешивают при комнатной температуре в течение 6 часов. Реакционный раствор концентрируют при пониженном давлении и остаток суспендируют в хлороформе (500 мл). В суспензию добавляют небольшими порциями 3-амино-N-(5-хлорпиридин-2-ил)фуро[3,2-b]пиридин-2-карбоксамид (20.0 г), полученный в ссылочном примере 24 при охлаждении льдом. В реакционную массу добавляют по каплям пиридин (56 мл) и реакционный раствор нагревают до комнатной температуры и перемешивают в течение 15 часов. В реакционный раствор наливают насыщенный водный раствор гидрокарбоната натрия при охлаждении льдом и смесь экстрагируют хлороформом. Органический слой промывают последовательно водой и насыщенным рассолом, сушат над сульфатом натрия и растворитель выпаривают при пониженном давлении. Полученный остаток очищают с помощью хроматографии на колонке с NH-силикагелем (элюент: этилацетат/метанол = 10/1, затем хлороформ). Полученный остаток суспендируют в этилацетате при нагревании. Осадок собирают фильтрованием и сушат, что дает названное соединение (32.2 г). APCI-MS м/е: 482/484[M+H]+.
Названное соединение затем обрабатывают метансульфоновой кислотой, бензолсульфоновой кислотой, серной кислотой и соляной кислотой с помощью обычной методики, что дает соответствующие соли названного соединения.
Метансульфонат: APCI-MS м/е: 482/484 [М+Н]+
Диметансульфонат: APCI-MS м/е: 482/484 [М+Н]+
Бензолсульфонат: APCI-MS м/е: 482/484 [M+H]+
Дибензолсульфонат: APCI-MS м/е: 482/484 [М+Н]+
Сульфат: APCI-MS м/е: 482/484 [M+H]+
Гидрохлорид: APCI-MS м/е: 482/484 [М+Н]+
Пример 2: N-(5-Хлорпиридин-2-ил)-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамид
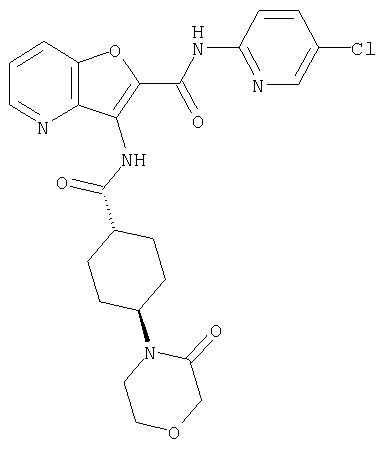
Транс-4-(3-оксоморфолин-4-ил)циклогексанкарбоновую кислоту (118 мг), полученную в ссылочном примере 4, растворяют в тионилхлориде (3 мл) и смесь перемешивают при комнатной температуре в течение 12 часов. Реакционный раствор концентрируют при пониженном давлении и остаток растворяют в хлороформе (5 мл). В раствор добавляют 3-амино-N-(5-хлорпиридин-2-ил)фуро[3,2-b]пиридин-2-карбоксамид (100 мг), полученный в ссылочном примере 24, при охлаждении льдом. В реакционную массу добавляют пиридин (280 мкл) и реакционный раствор нагревают до комнатной температуры и перемешивают в течение 12 часов. В реакционный раствор наливают насыщенный водный раствор гидрокарбоната натрия, и смесь экстрагируют хлороформом. Органический слой промывают последовательно водой и насыщенным рассолом, сушат над сульфатом натрия и растворитель выпаривают при пониженном давлении. Полученный остаток очищают с помощью хроматографии на колонке с NH-силикагелем (элюент: этилацетат, затем этилацетат/метанол = 10/1). Полученное твердое вещество суспендируют в смеси этилацетат/диэтиловый эфир. Осадок собирают фильтрованием, что дает названное соединение (120 мг). APCI-MS м/е: 498/500 [М+Н]+
Примеры 3-78
Соответствующие аминосоединения и соединения карбоновой кислоты обрабатывают в соответствии с методикой, аналогичной методике, изложенной в примере 2, что дает следующие соединения (см. табл.1-19).
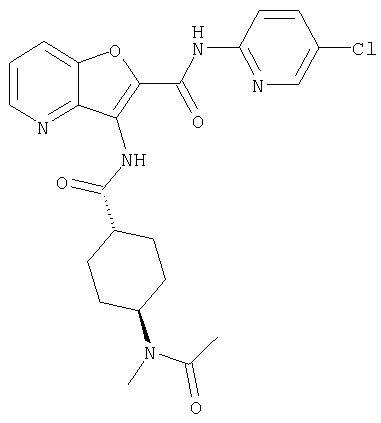
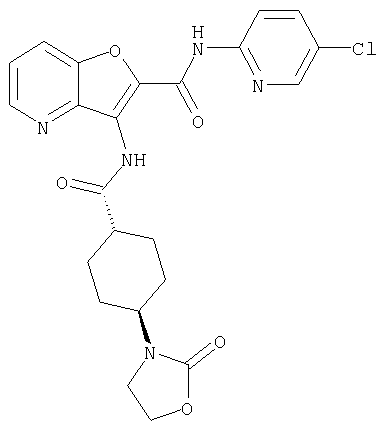
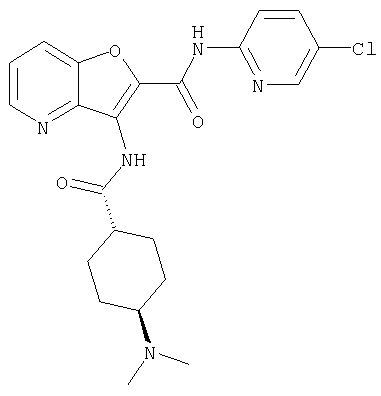
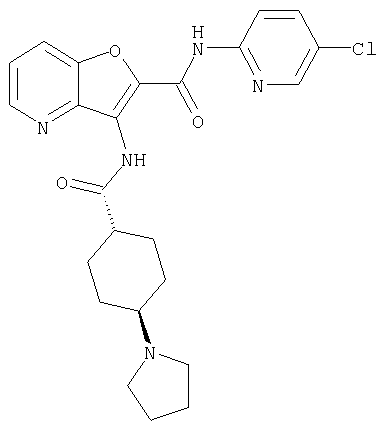
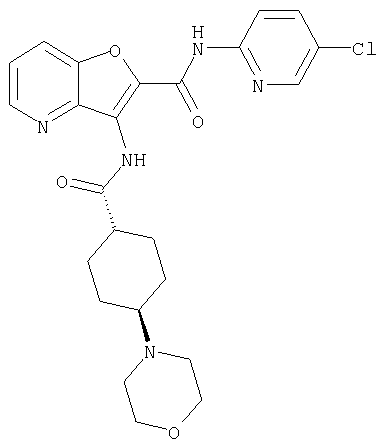
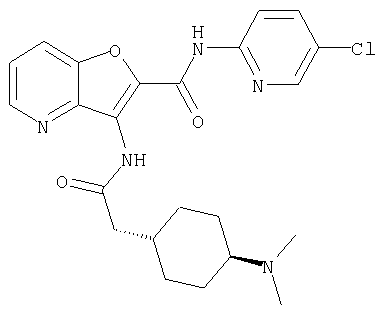
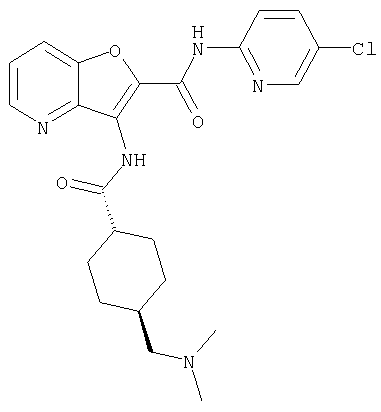
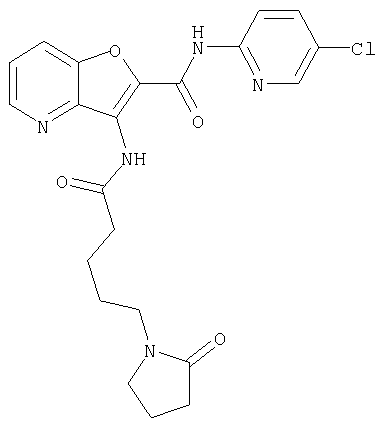
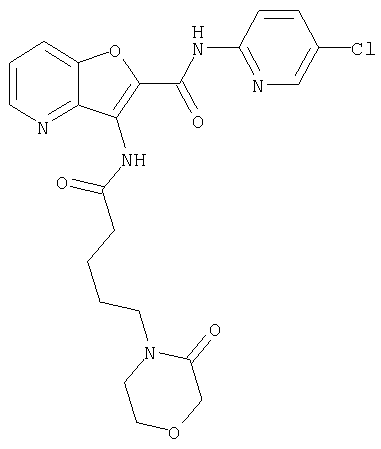
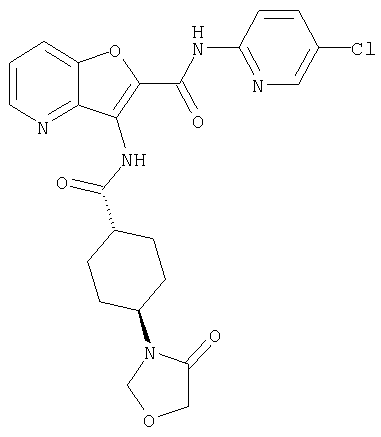
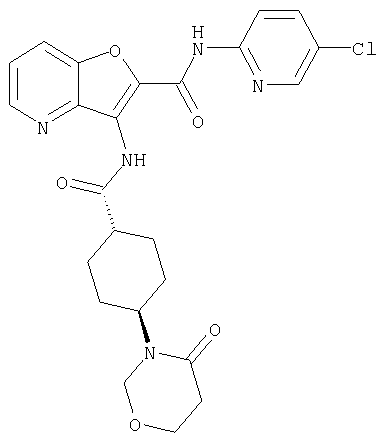
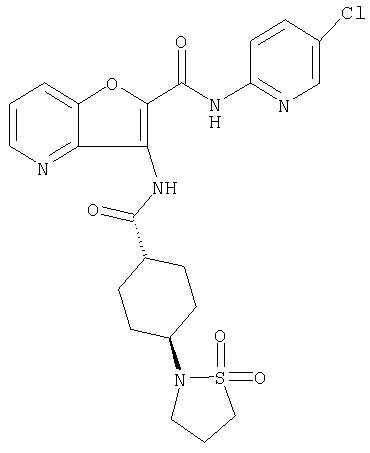

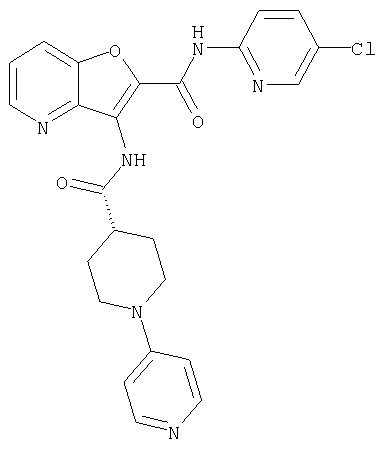
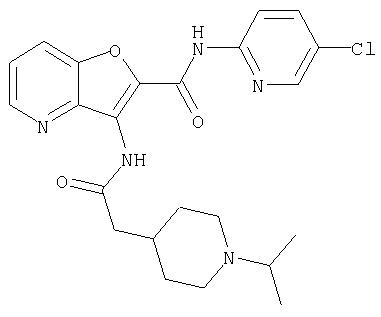
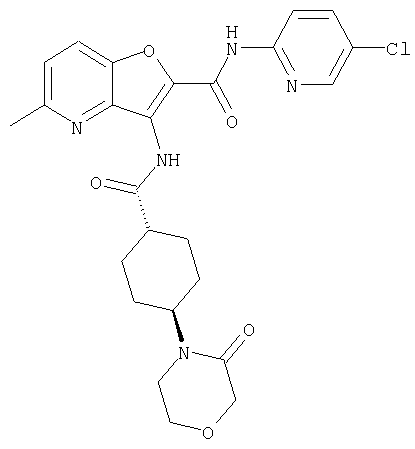
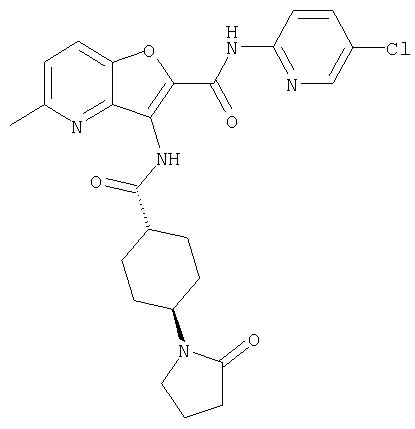
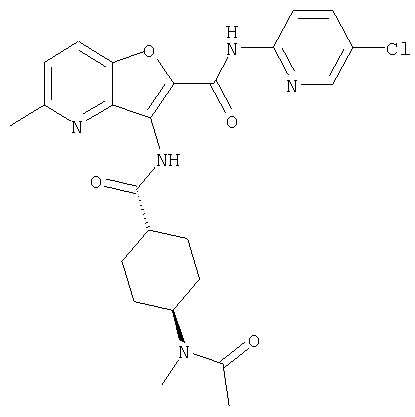
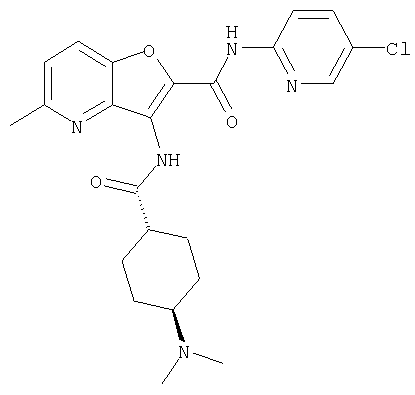
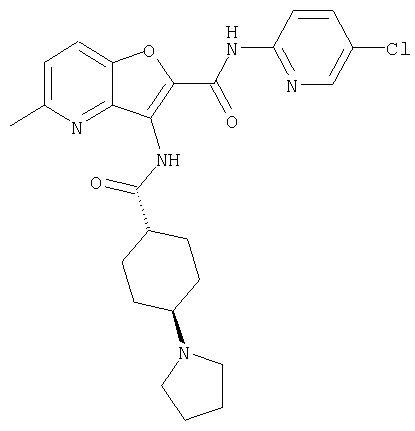
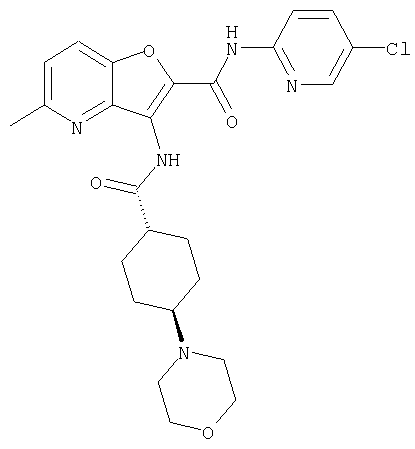
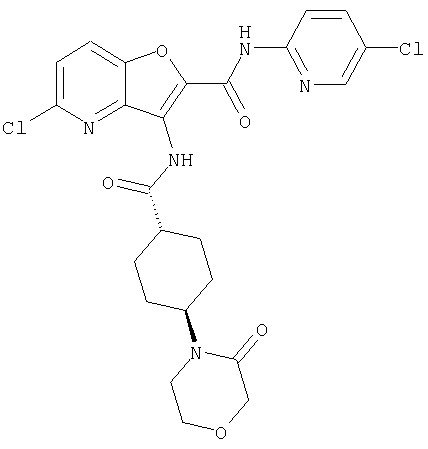
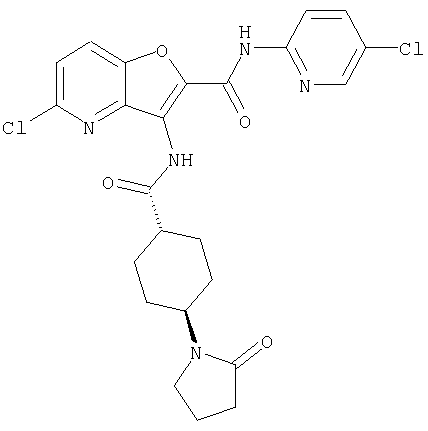
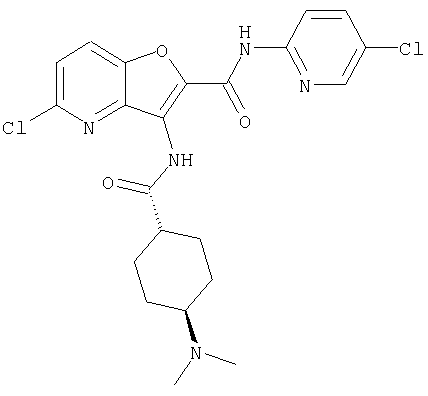
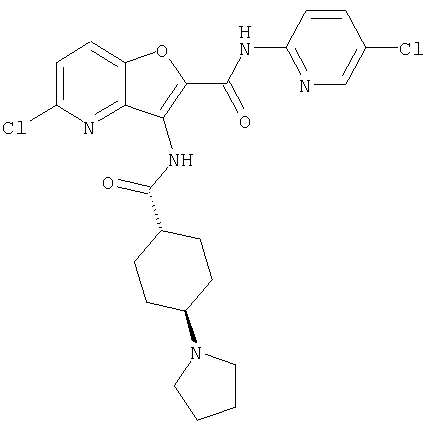
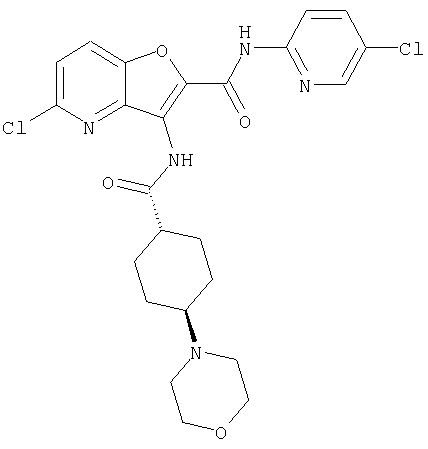
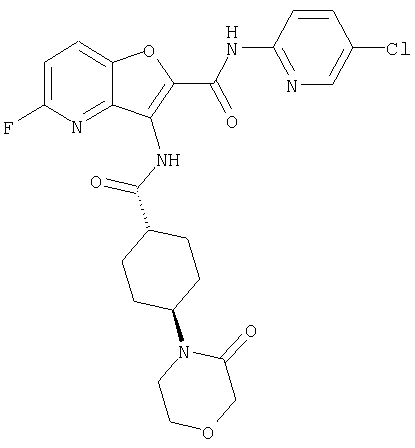
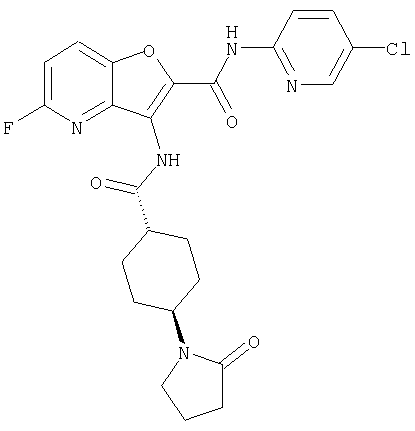
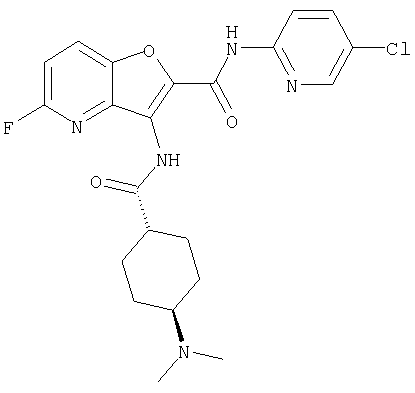
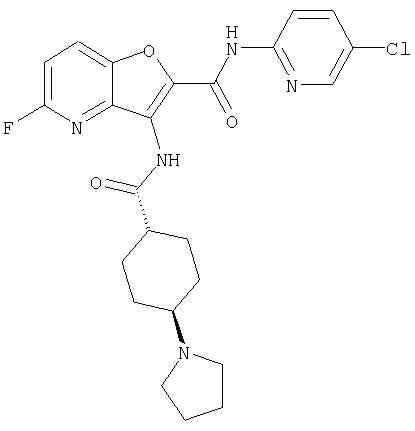
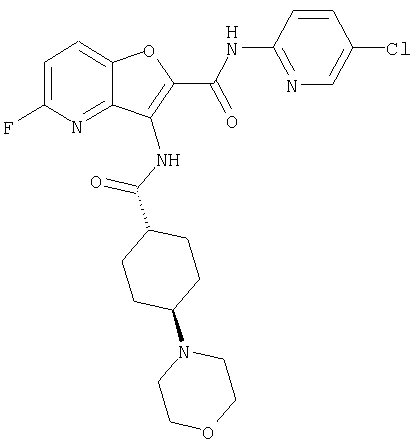
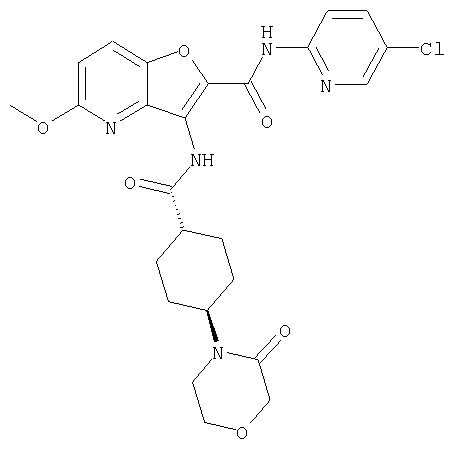
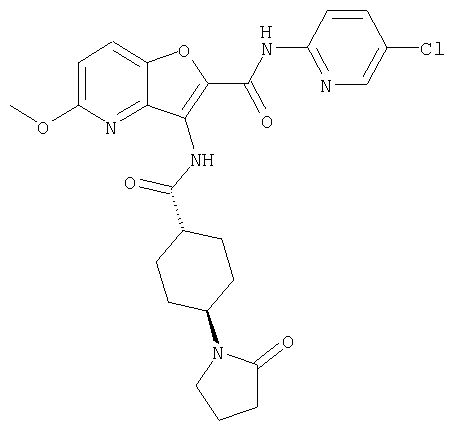
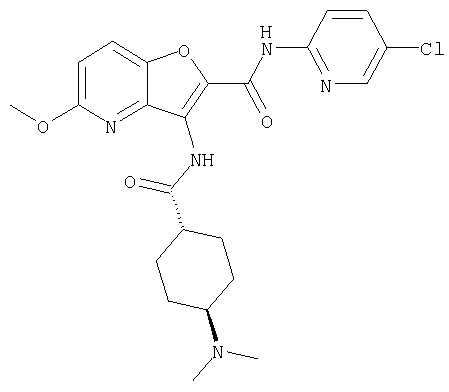
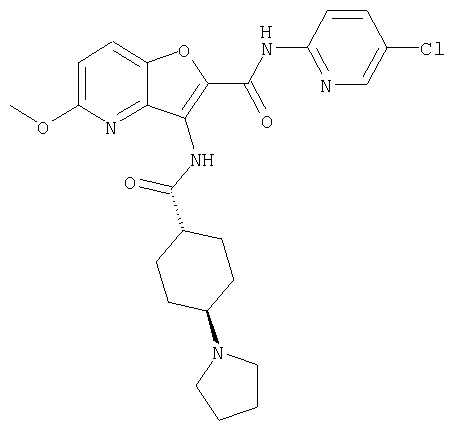
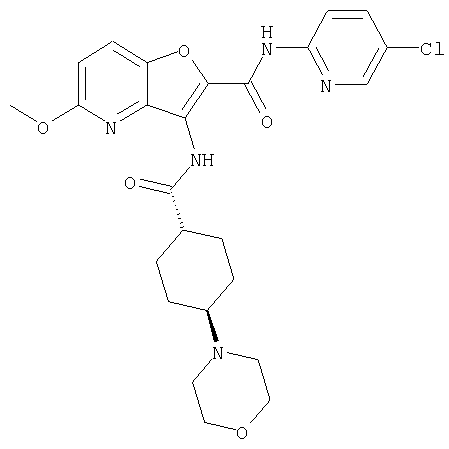
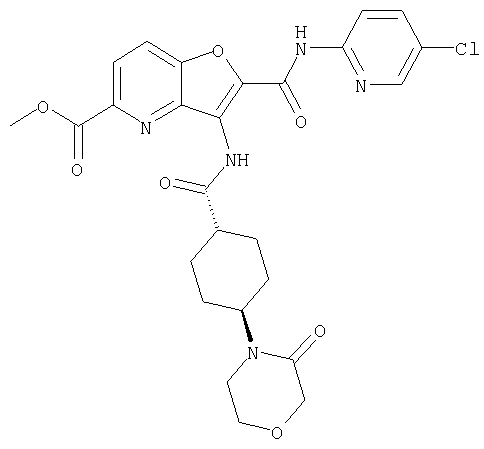
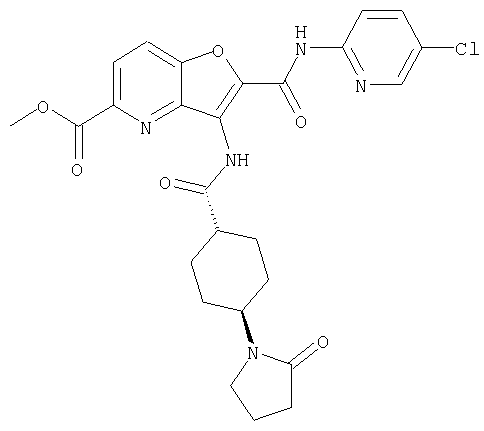
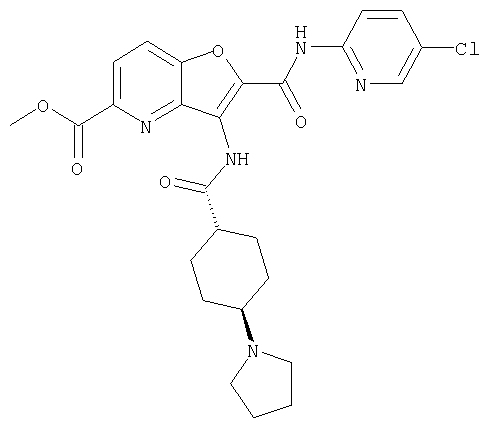
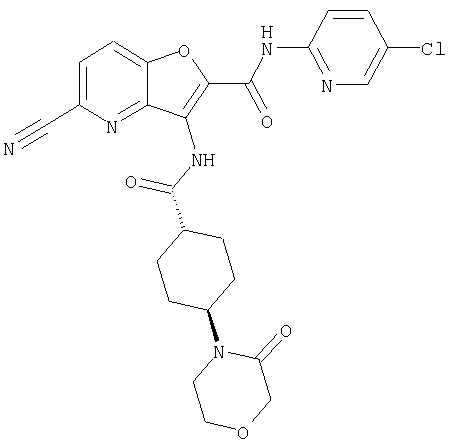
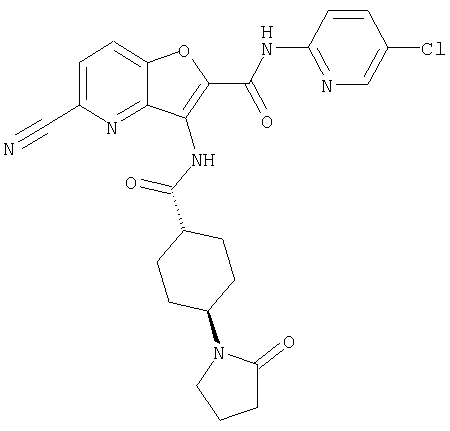
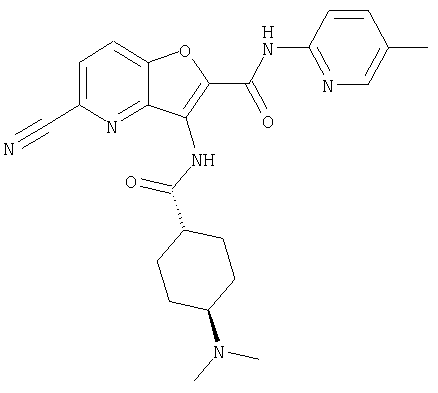
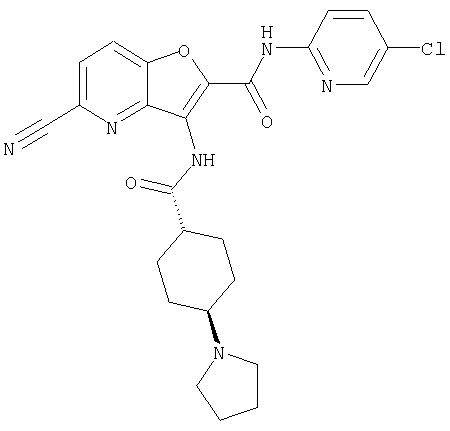
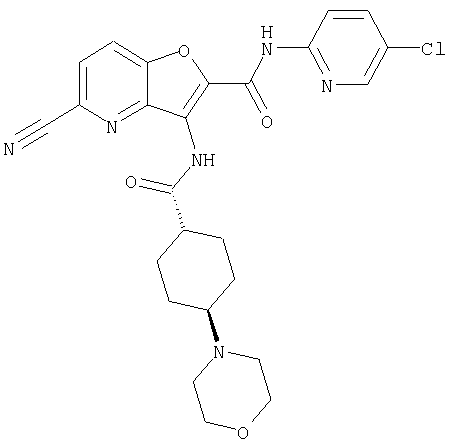
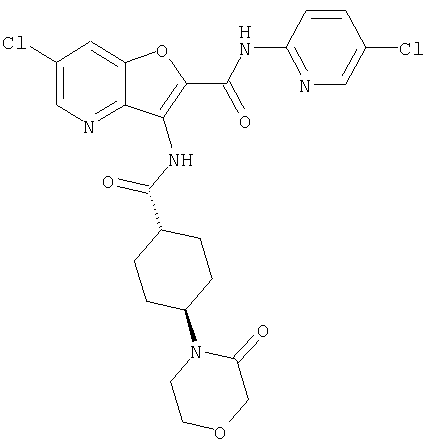
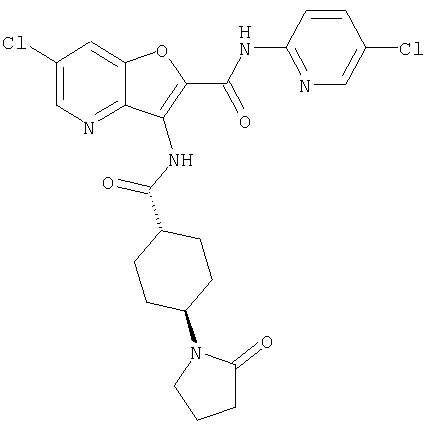
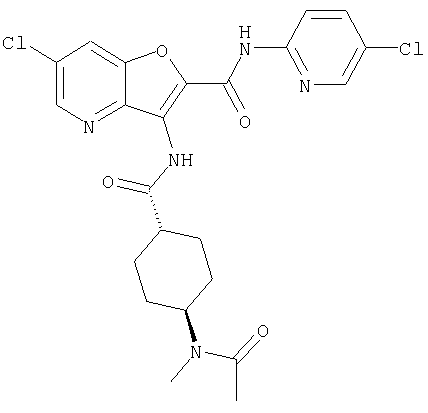
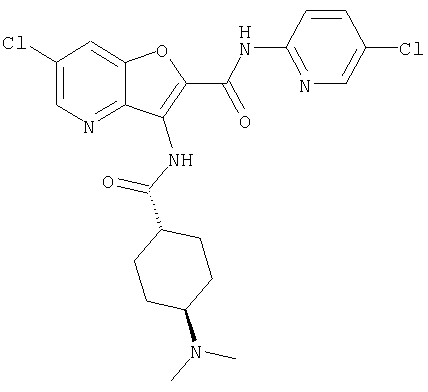
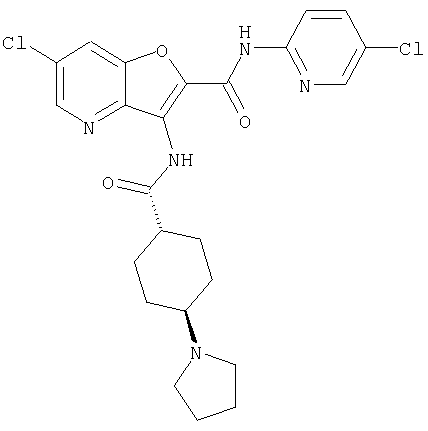
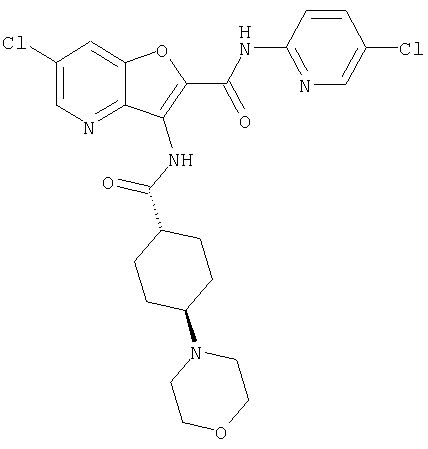
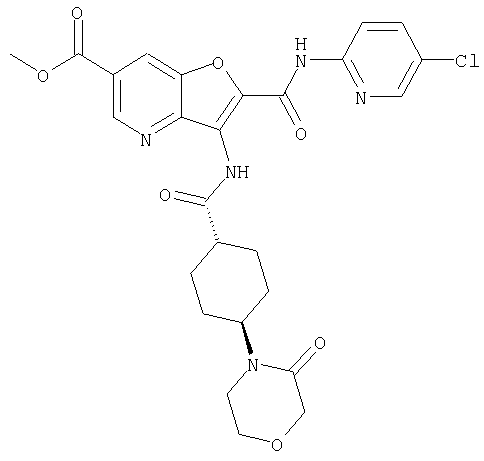
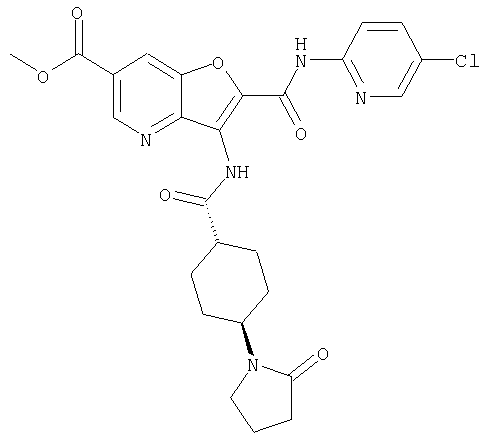
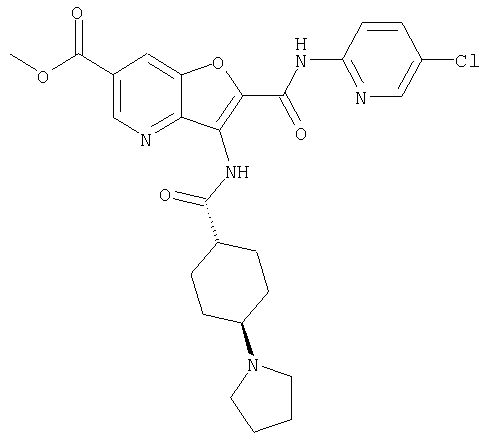
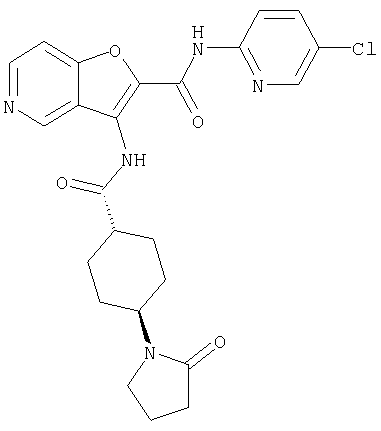
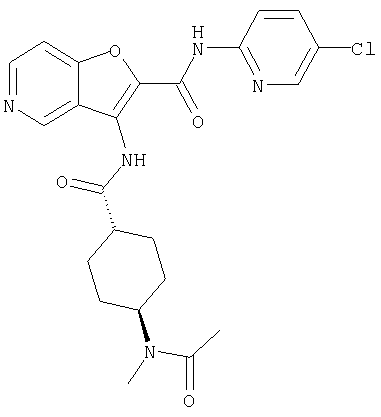
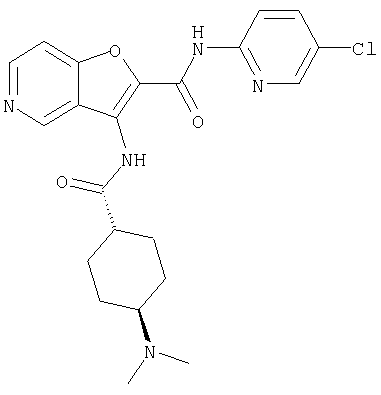
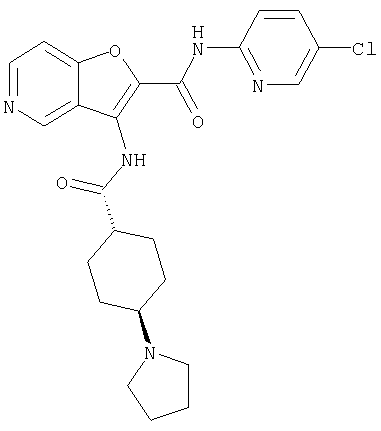
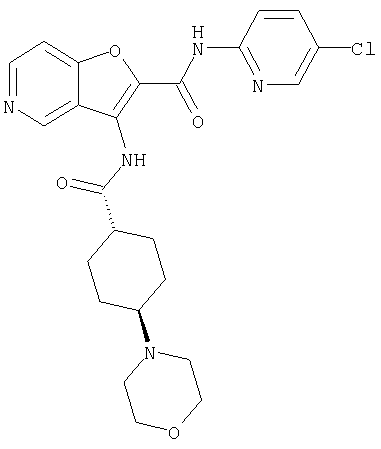
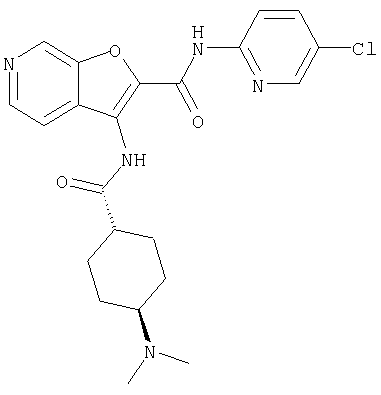
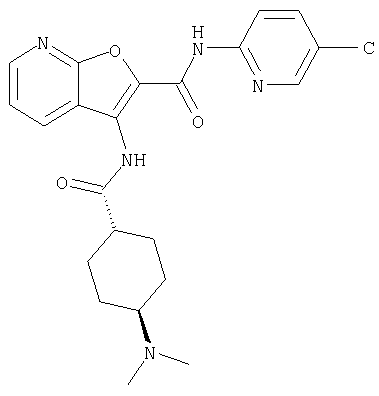
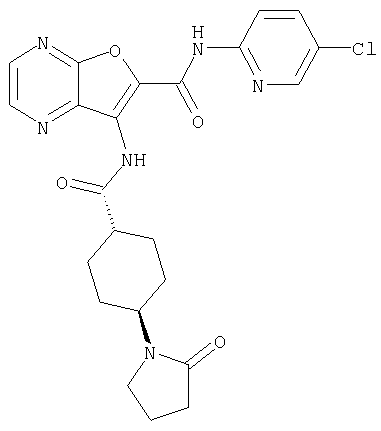
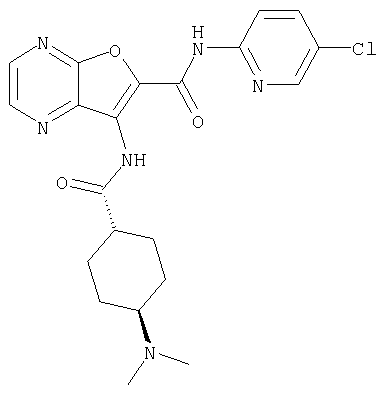
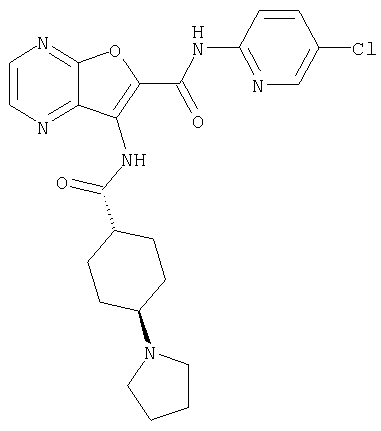
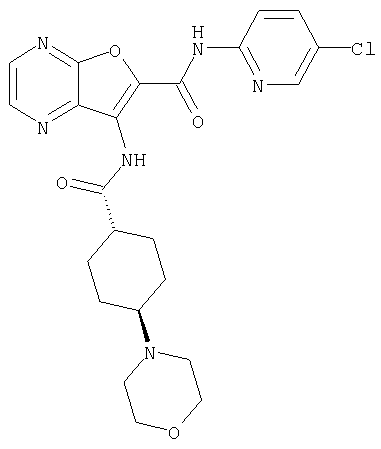
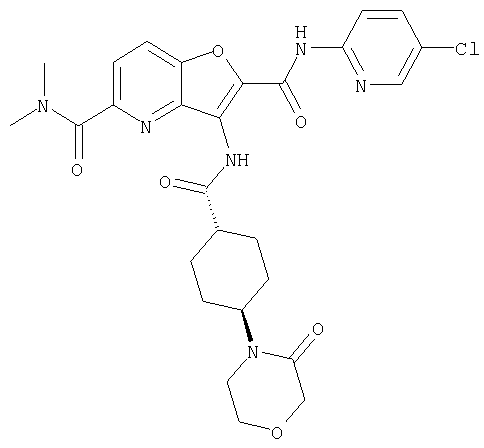
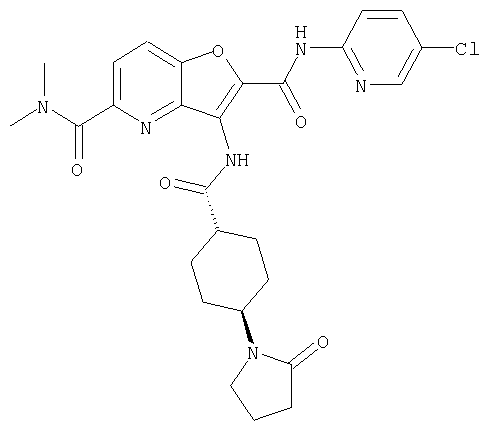
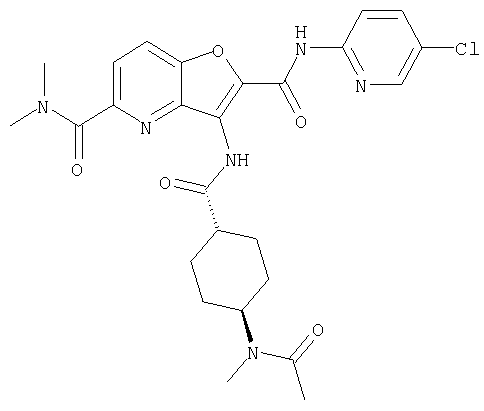
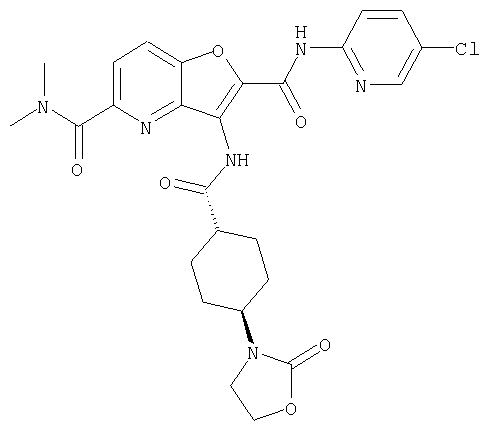
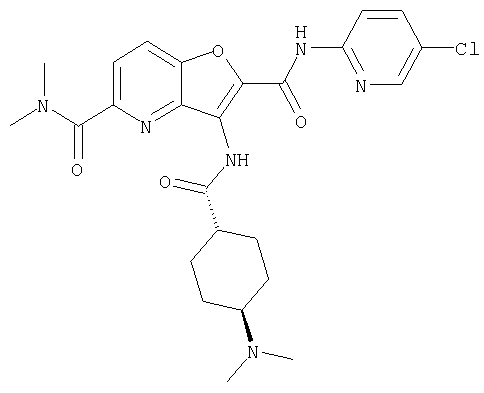
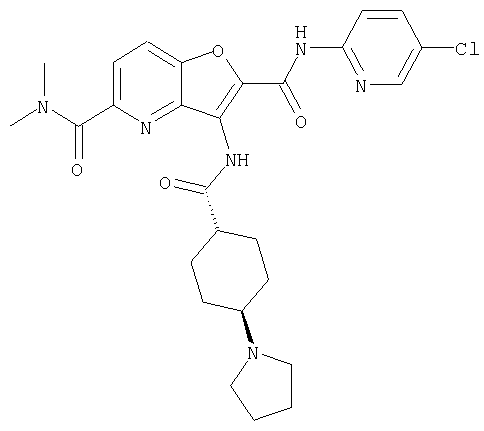
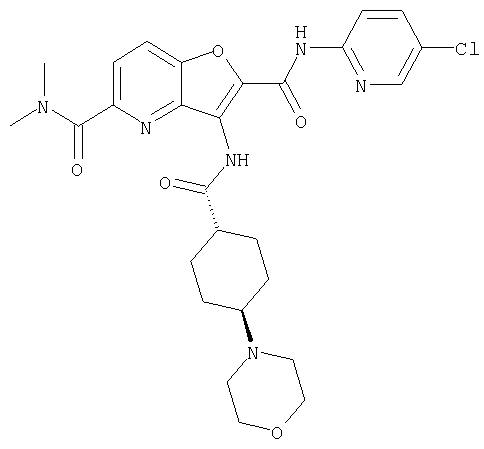
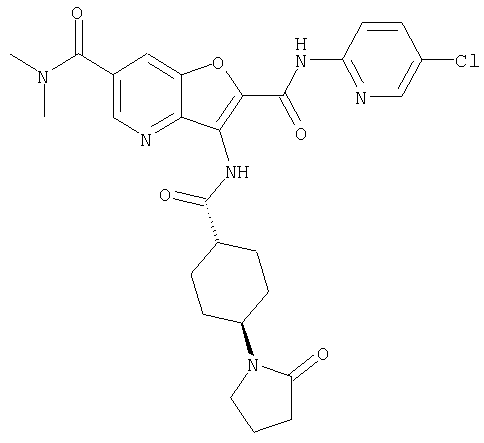
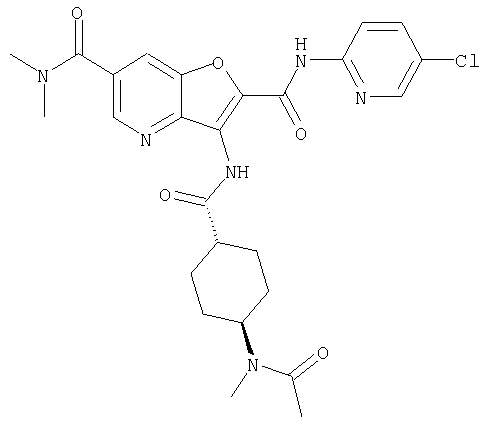
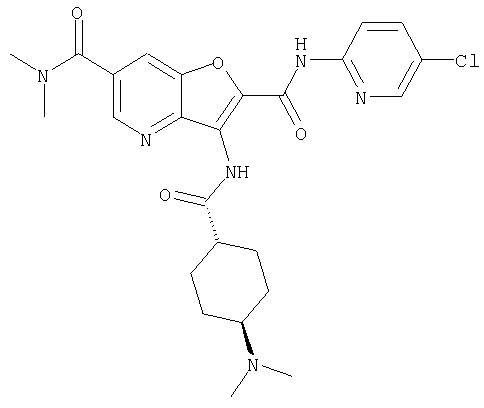
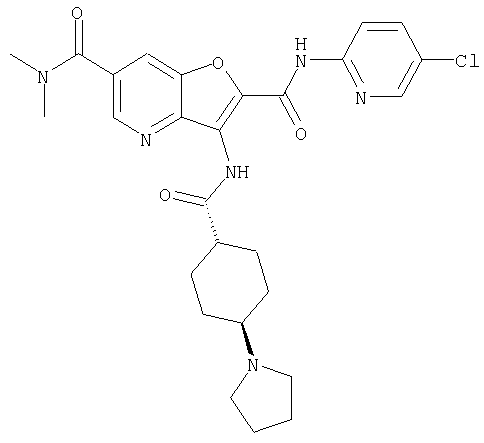
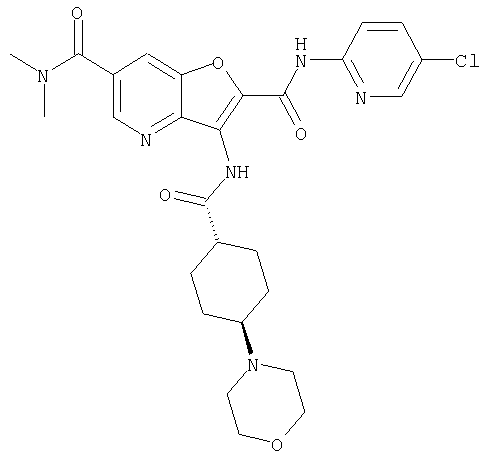
Пример 79: 2-{[(5-Хлорпиридин-2-ил)амино]карбонил}-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-5-карбоновая кислота
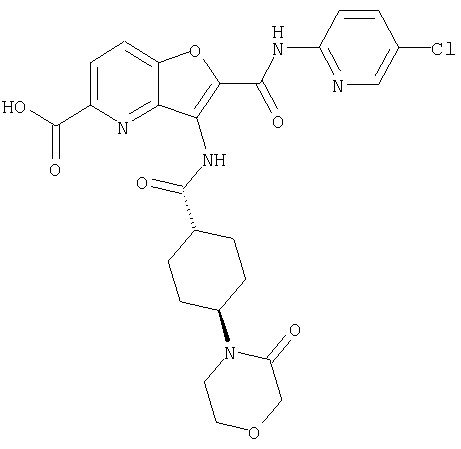
Метил-2-{[(5-хлорпиридин-2-ил)амино]карбонил}-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил] карбонил} амино)фуро [3,2-b]пиридин-5-карбоксилат (9.40 г), полученный в примере 39, суспендируют в тетрагидрофуране (135 мл), после чего в реакционную массу добавляют 1N водный раствор гидроксида натрия (34 мл) при охлаждении льдом. Смесь нагревают до комнатной температуры и перемешивают в течение 3 часов. В реакционный раствор выливают 2N соляную кислоту (17 мл) при охлаждении льдом и реакционный раствор концентрируют при пониженном давлении. Остаток суспендируют в воде и осадок собирают фильтрованием, полученное твердое вещество промывают водой и диэтиловым эфиром, что дает названное соединение (7.83 г).
ESI-MS м/е: 540/542[М-Н]-
Примеры: 80-84
Соответствующие исходные соединения обрабатывают в соответствии с методикой, аналогичной методике, изложенной в примере 79, что дает следующие соединения (см. табл.20, 21).
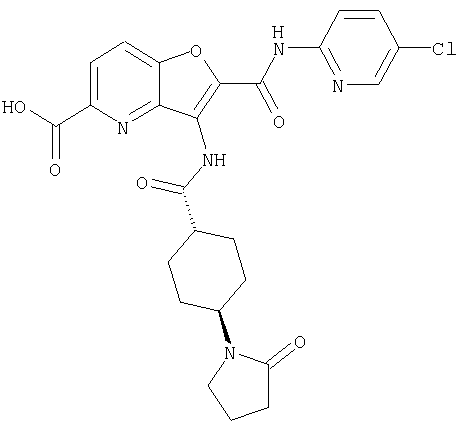
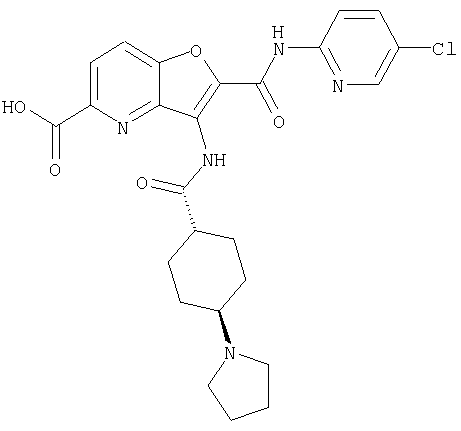
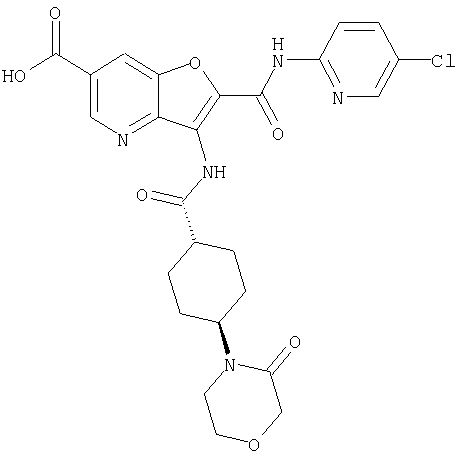
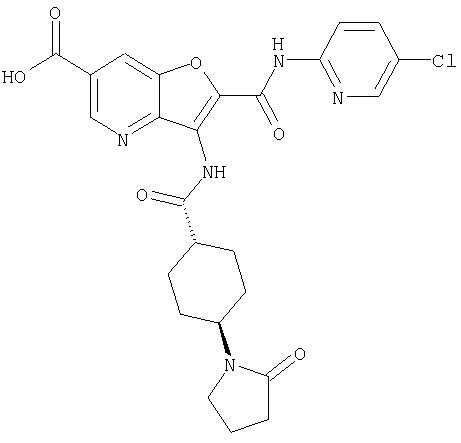
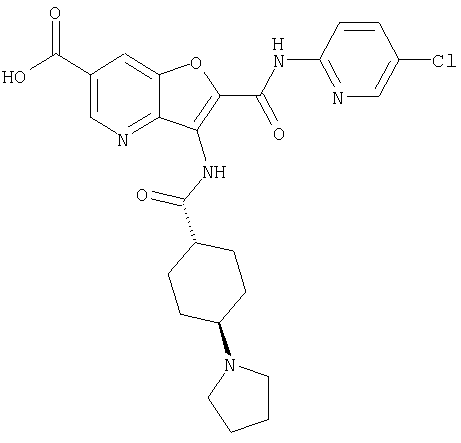
Пример 85: N-(5-Хлорпиридин-2-ил)-5-(морфолин-4-илкарбонил)-3-({[транс-4-(3-оксоморфолин-4-ил}циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамид.
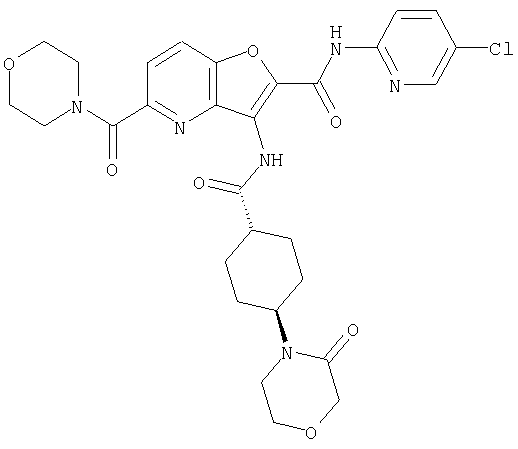
2-{[(5-Хлорпиридин-2-ил)амино]карбонил}-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-5-карбоновую кислоту (100 мг), полученную в примере 79, растворяют в N,N-диметилформамиде (3 мл), после чего в реакционную массу добавляют последовательно морфолин (32 мкл), 1-гидроксибензотриазол (50 мг) и гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (71 мг) и смесь перемешивают при комнатной температуре в течение 15 часов. Реакционный раствор разбавляют смесью этилацетат-тетрагидрофуран и раствор промывают последовательно насыщенным водным раствором гидрокарбоната натрия, водой и насыщенным рассолом, сушат над сульфатом натрия. Растворитель выпаривают при пониженном давлении и полученный остаток суспендируют в смеси этилацетат/диэтиловый эфир. Твердый осадок собирают фильтрованием, что дает названное соединение (109 мг).
APCI-MS м/е: 611/613 [M+H]+
Примеры 86-93
Соответствующие исходные соединения обрабатывают в соответствии с методикой, аналогичной методике, изложенной в примере 85, что дает следующие соединения (см. табл. 22, 23).
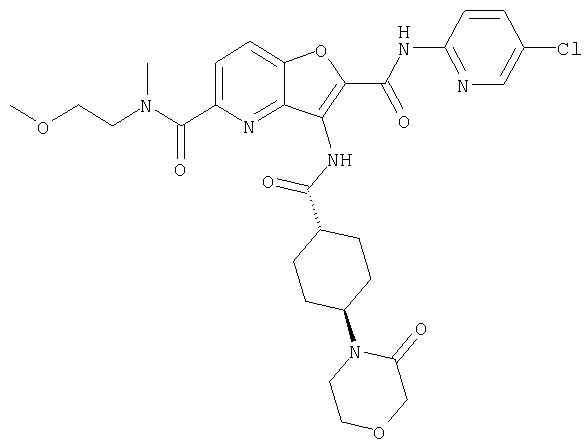
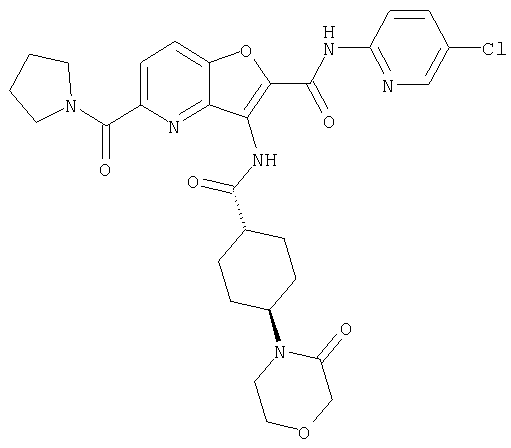
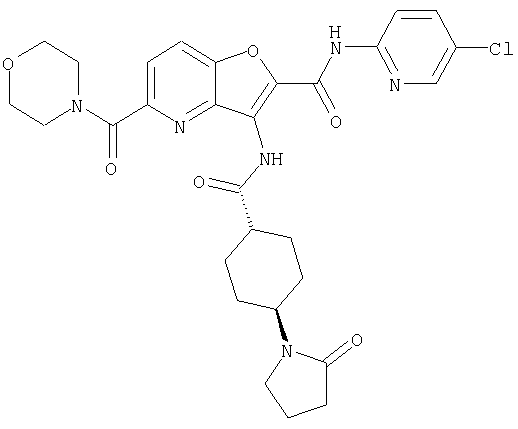
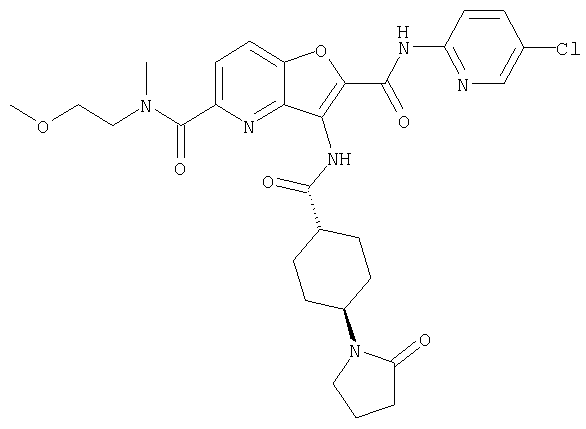
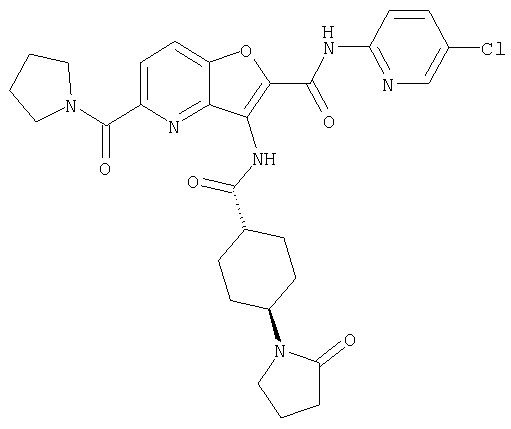
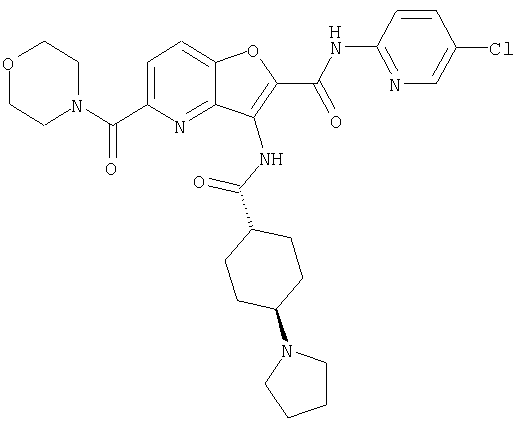
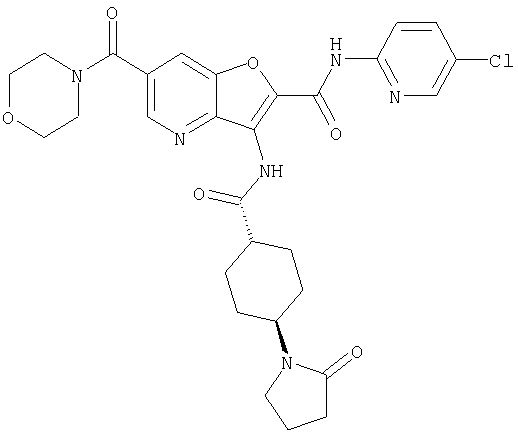
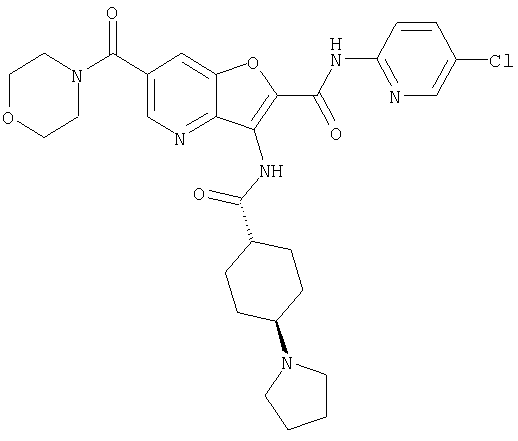
Пример 94: трет-бутил-[2-{[(5-хлорпиридин-2-ил)амино]карбонил}-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-5-ил]карбамат
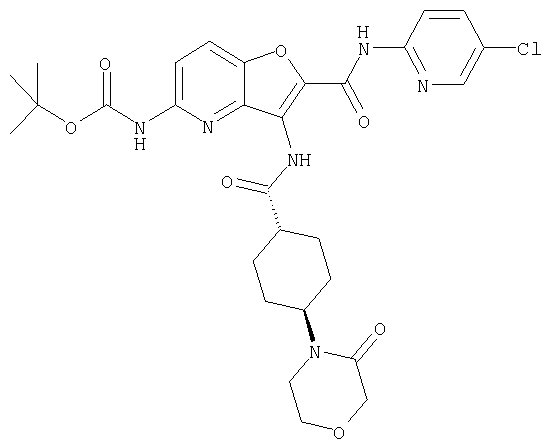
2-{[(5-Хлорпиридин-2-ил)амино]карбонил}-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-5-карбоновую кислоту (6.80 г), полученную в примере 79, суспендируют в трет-бутаноле (300 мл). В суспензию добавляют триэтиламин (3.48 мл) и дифенилфосфорилазид (5.39 мл) при комнатной температуре и смесь перемешивают при температуре 100°С в течение 15 часов. Реакционный раствор концентрируют при пониженном давлении. Остаток разбавляют хлороформом и промывают водой и насыщенным рассолом. Органический слой сушат над сульфатом натрия и растворитель выпаривают при пониженном давлении. Полученный остаток очищают с помощью хроматографии на силикагеле (элюент: хлороформ/метанол = 100/1, затем 20/1), что дает названное соединение (5.64 г).
APCI-MS м/е: 613/615[М+Н]+
Примеры 95-99
Соответствующие исходные соединения обрабатывают в соответствии с методикой, аналогичной методике, изложенной в примере 94, что дает следующие соединения (см. табл.24, 25).
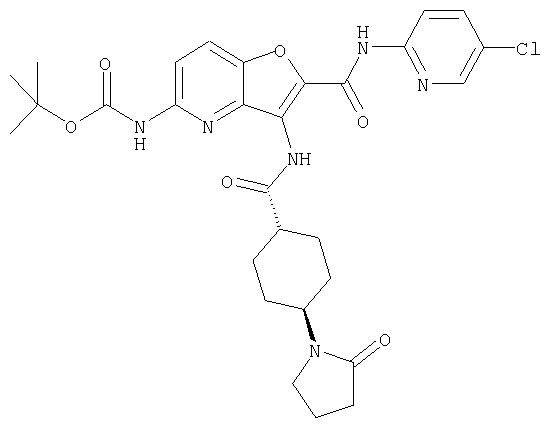
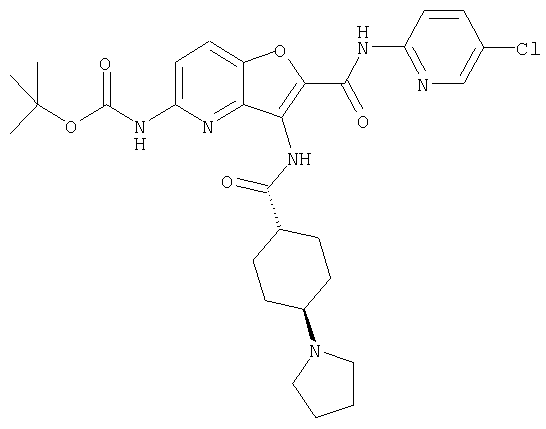
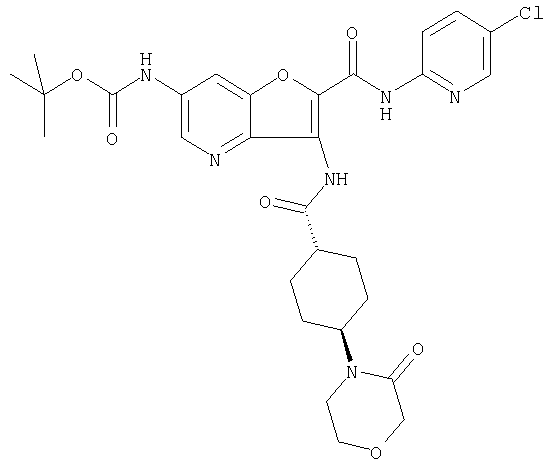
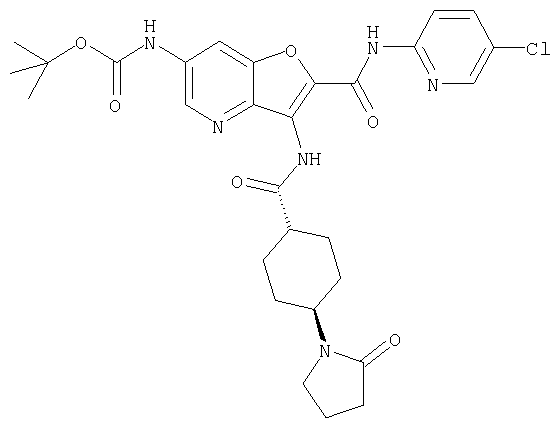
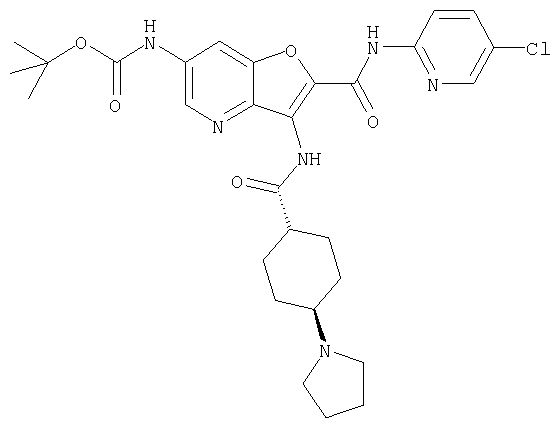
Пример 100: Гидрохлорид 5-амино-N-(5-хлорпиридин-2-ил)-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида
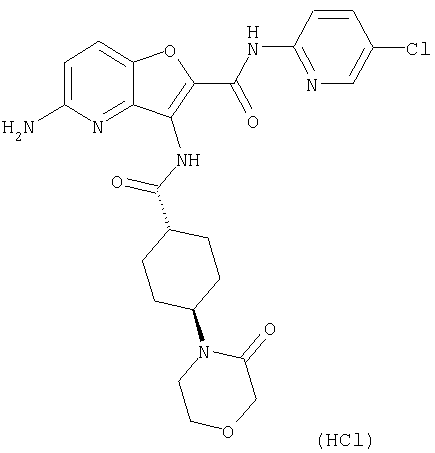
трет-Бутил-[2-{[(5-хлорпиридин-2-ил)амино]карбонил}-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-5-ил]карбамат (5.55 г), полученный в примере 94, суспендируют в метаноле (20 мл), после чего в реакционную массу добавляют 4N раствор хлористого водорода в диоксане (50 мл) при охлаждении льдом. Смесь перемешивают при комнатной температуре в течение 8 часов. Реакционный раствор концентрируют при пониженном давлении и полученный остаток суспендируют в диэтиловом эфире. Осадок собирают фильтрованием, что дает названное соединение (4.67 г).
APCI-MS м/е: 513/515[М+Н]+
Пример 101: 5-Амино-N-(5-хлорпиридин-2-ил)-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-b]пиридин-2-карбоксамид
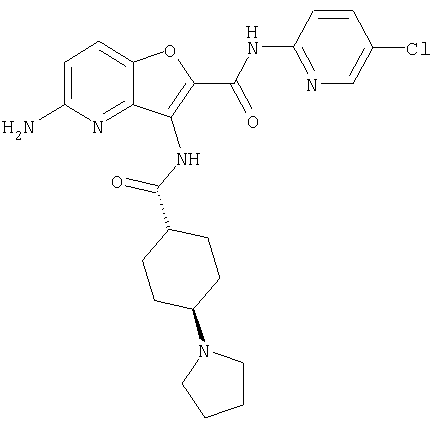
трет-Бутил (2-{[(5-хлорпиридин-2-ил)амино]карбонил}-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-b]пиридин-5-ил]карбамат (280 мг), полученный в примере 96, суспендируют в диоксане (3 мл). В суспензию добавляют 4N раствор хлористого водорода в диоксане (3 мл). Реакционный раствор нагревают до комнатной температуры, после чего в реакционную массу добавляют метанол (2 мл), затем перемешивают в течение 8 часов. Реакционный раствор концентрируют при пониженном давлении, полученный остаток суспендируют в диэтиловом эфире. Осадок собирают фильтрованием, что дает названное соединение (266 мг) в виде гидрохлорида. Полученный гидрохлорид суспендируют в хлороформе, после чего в реакционную массу добавляют насыщенный водный раствор гидрокарбоната. Осажденное твердое вещество собирают фильтрованием, что дает названное соединение (88 мг). APCI-MS м/е: 483/485 [М+Н]+
Примеры 102-105
Соответствующие исходные соединения обрабатывают в соответствии с методикой, изложенной в примерах 100 или 101, что дает следующие соединения (см. табл.26).
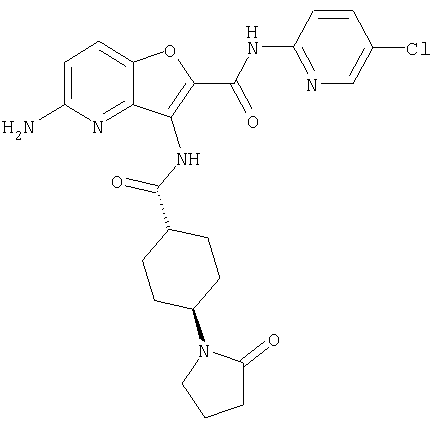
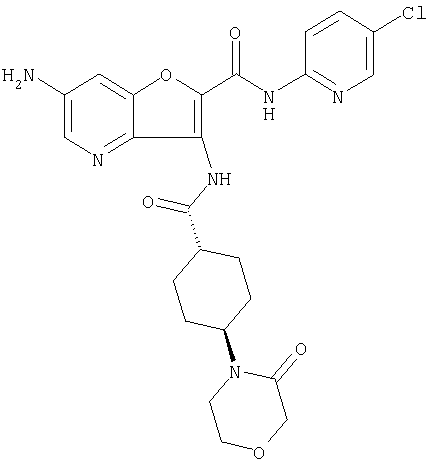
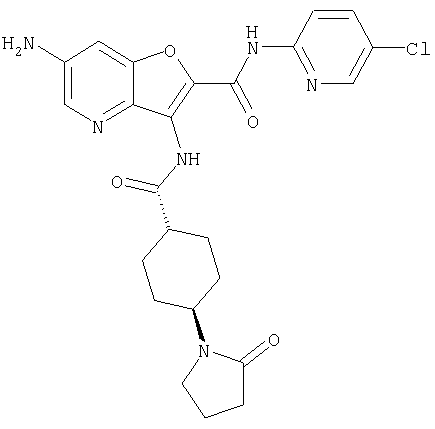
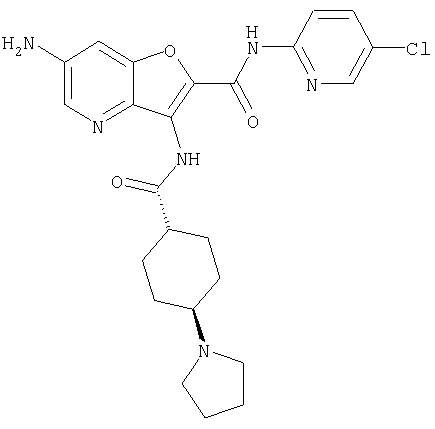
Пример 106: N-(5-Хлорпиридин-2-ил)-5-[(метилсульфонил)амино]-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамид
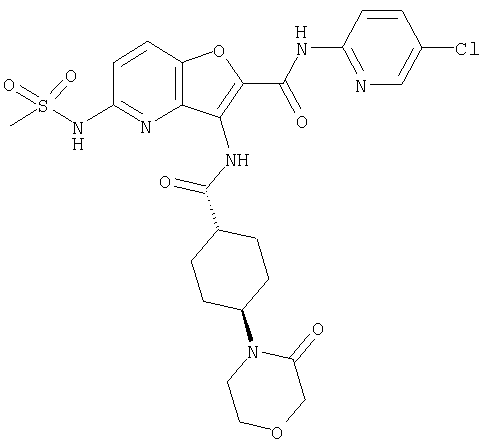
5-Амино-N-(5-хлорпиридин-2-ил)-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-b]пиридин-2-карбоксамид (110 мг), полученный в примере 101, растворяют в пиридине (3 мл), после чего в реакционную массу добавляют метансульфонилхлорид (46 мкл) при охлаждении льдом. Смесь перемешивают при комнатной температуре в течение 3 часов. В реакционный раствор добавляют насыщенный водный раствор гидрокарбоната натрия, и смесь экстрагируют хлороформом. Органический слой сушат над сульфатом натрия, и растворитель выпаривают при пониженном давлении. Полученный остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: хлороформ, затем хлороформ/метанол = 20/1). Полученное твердое вещество суспендируют в диэтиловом эфире и собирают фильтрованием, что дает названное соединение (76 мг).
APCI-MS м/е: 591/593[M+H]+
Примеры 107-114
Соответствующие исходные соединения обрабатывают в соответствии с методикой, аналогичной методике, изложенной в примере 106, что дает следующие соединения (см. табл.27, 28).
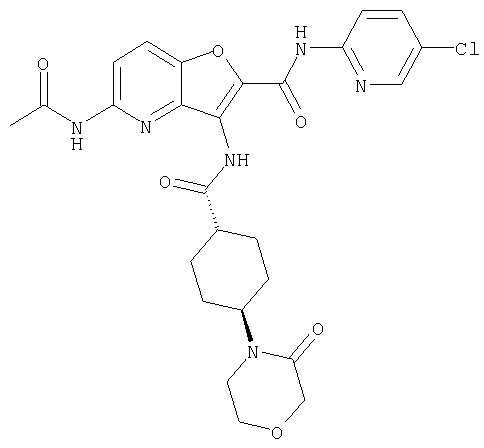
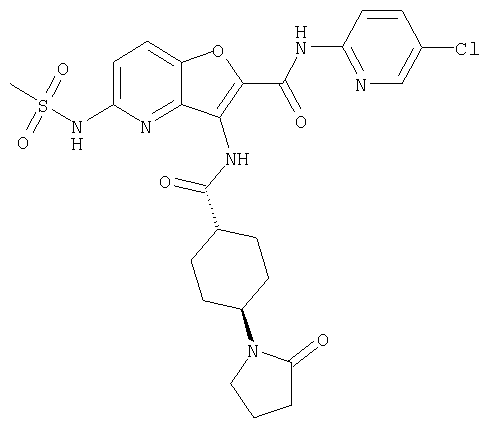
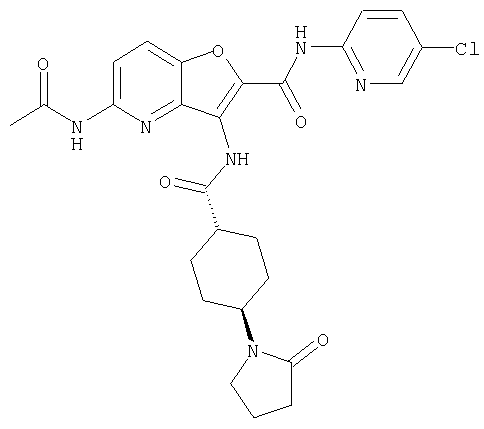
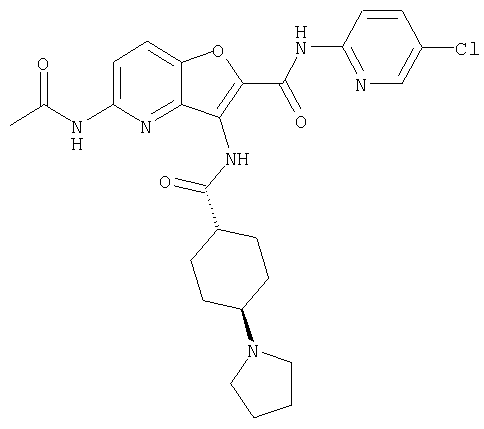
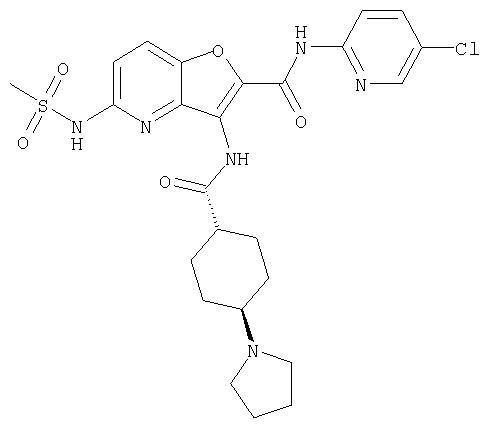

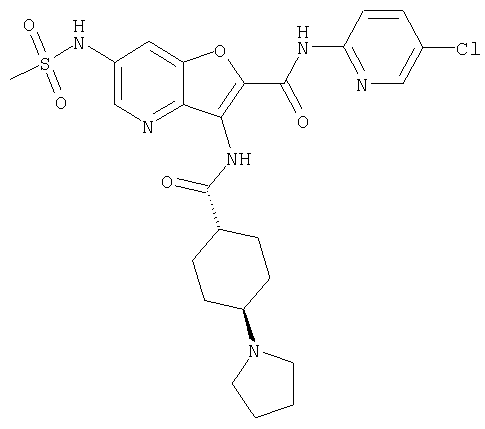
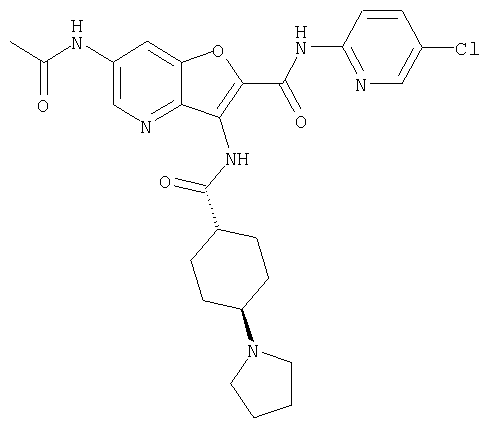
Пример 115: N-(5-Хлорпиридин-2-ил)-5-(гидроксиметил)-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамид
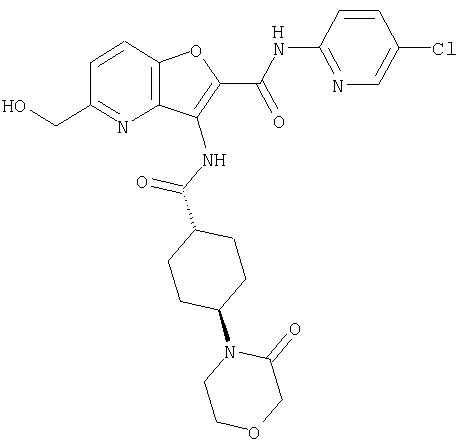
Метил-2-{[(5-Хлорпиридин-2-ил)амино]карбонил}-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-5-карбоксилат (3 00 мг), полученный в примере 39, суспендируют в тетрагидрофуране (15 мл), после чего в реакционную массу добавляют боргидрид лития (24 мг) при охлаждении льдом и смесь перемешивают при комнатной температуре в течение 20 часов. В реакционный раствор выливают 10% раствор соляной кислоты при охлаждении льдом, и смесь перемешивают при комнатной температуре в течение 15 минут. Реакционный раствор подщелачивают с помощью насыщенного водного раствора гидрокарбоната натрия и затем экстрагируют этилацетатом. Органический слой промывают насыщенным рассолом и сушат над сульфатом натрия и растворитель выпаривают при пониженном давлении. Полученный остаток очищают с помощью хроматографии на колонке с NH-силикагелем (элюент:этилацетат, затем этилацетат/метанол = 10/1). Полученное твердое вещество суспендируют в смеси диэтиловый эфир/н-гексан и собирают фильтрованием, что дает названное соединение (80 мг).
APCI-MS м/е: 528/530[M+H]+
Примеры 116 и 117
Соответствующие исходные соединения обрабатывают в соответствии с методикой, аналогичной методике, изложенной в примере 115, что дает следующие соединения (см. табл.29).
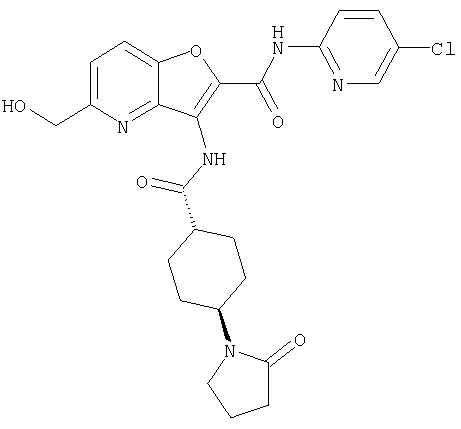
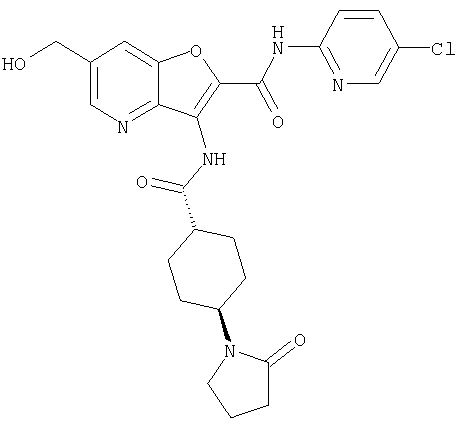
Пример 118: трет-бутил (транс-4-{[(2-{[(5-хлорпиридин-2-ил)амино]-карбонил}фуро[3,2-b]пиридин-3-ил)амино]карбонил}циклогексил)-метилкарбамат
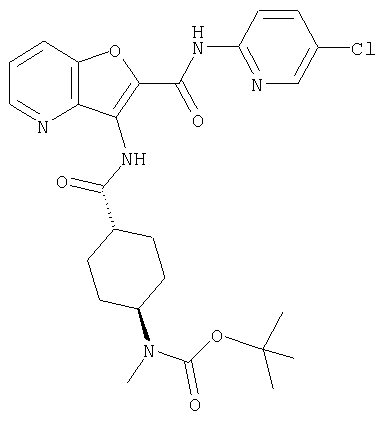
Транс-4-[(трет-бутоксикарбонил)(метил)амино]циклогексанкарбоновую кислоту (1.30 г), полученную в ссылочном примере 12, растворяют в хлороформе (30 мл), после чего в реакционную массу добавляют пиридин (2.80 мл). После добавления, по каплям тионилхлорида при охлаждении льдом (0.38 мл), смесь перемешивают при комнатной температуре в течение 5 часов. В полученный реакционный раствор добавляют последовательно 3-амино-N-(5-хлорпиридин-2-ил)фуро[3,2-b]пиридин-2-карбоксамид (1.00 г), полученный в ссылочном примере 24, и пиридин (7.20 мл) при охлаждении льдом. Реакционный раствор нагревают до комнатной температуры и перемешивают в течение 3 часов. В реакционный раствор выливают насыщенный водный раствор гидрокарбоната натрия и смесь экстрагируют хлороформом. Органический слой промывают последовательно водой и насыщенным рассолом и сушат над сульфатом натрия. Растворитель выпаривают при пониженном давлении и остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: этилацетат), что дает названное соединение (1.71 г).
APCI-MS м/е: 528/530[М+Н]+
Пример 119: тригидрохлорид N-(5-Хлорпиридин-2-ил)-3-({[транс-4-(метиламино)-циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида
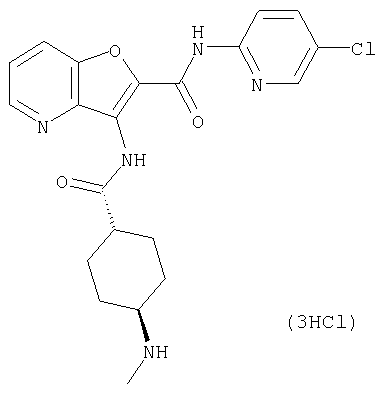
трет-Бутил-(транс-4-{[(2-{[(5-хлорпиридин-2-ил)амино]карбонил}-фуро[3,2-b]пиридин-3-ил)амино]карбонил}циклогексил)метилкарбамат (1.55 г), полученный в примере 118, растворяют в диоксане (10 мл), после чего в реакционную массу добавляют 4N раствор хлористого водорода в диоксане (20 мл), и смесь перемешивают при комнатной температуре в течение 12 часов. Реакционный раствор концентрируют при пониженном давлении и остаток суспендируют в диэтиловом эфире. Осадок собирают фильтрованием и сушат, что дает названное соединение (1.49 г).
APCI-MS м/е: 428/430[M+H]+
Пример 120: трет-Бутил-{3-[(транс-4-{[(2-{[(5-хлорпиридин-2-ил)амино]-карбонил}фуро[3,2-b]пиридин-3-ил)амино]карбонил}циклогексил)(метил)-амино]пропил}карбамат
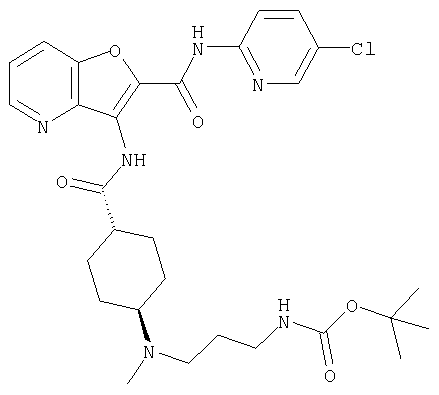
Тригидрохлорид N-(5-хлорпиридин-2-ил)-3-({[транс-4-(метиламино)-циклогексил}карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида (300 мг), полученный в примере 119, суспендируют в хлороформе (7 мл). В суспензию добавляют 3-трет-бутоксикарбониламинопропанала (208 мг), который может быть получен из диэтилацетала 3-аминопропиональдегида в две стадии в соответствии с методикой, описанной в уровне технике (Synthesis, 1994, 37), и триэтиламин (334 мкл) при охлаждении льдом и смесь перемешивают в течение нескольких минут. После добавления триацетоксиборгидрида натрия (190 мг), реакционный раствор нагревают до комнатной температуры и перемешивают в течение 2 часов. В реакционный раствор выливают насыщенный водный раствор гидрокарбоната натрия при охлаждении льдом и смесь экстрагируют хлороформом. Органический слой промывают последовательно водой и насыщенным рассолом, сушат над сульфатом натрия и растворитель выпаривают при пониженном давлении. Полученный остаток очищают с помощью хроматографии на колонке с NH-силикагелем (элюент: этилацетат, затем этилацетат/метанол = 20/1), что дает названное соединение (291 мг).
APCI-MS м/е: 585/587[M+H]+
Пример 121: 3-[({Транс-4-[(3-аминопропил)(метил)амино]циклогексил}-карбонил)амино]-N-(5-хлорпиридин-2-ил)фуро[3,2-b]пиридин-2-карбоксамид
трет-Бутил {3-[(транс-4-{[(2-{[(5-хлорпиридин-2-ил)амино]карбонил}-фуро[3,2-b]пиридин-3-ил)амино]карбонил}циклогексил)(метил)амино]-пропил}карбамат (265 мг), полученный в примере 120, растворяют в диоксане (3 мл), после чего в реакционную массу добавляют 4N раствор хлористого водорода в диоксане (6 мл) и смесь перемешивают при комнатной температуре в течение 20 часов. Реакционный раствор концентрируют при пониженном давлении и остаток суспендируют в диэтиловом эфире. Осадок собирают фильтрованием. Полученное твердое вещество суспендируют в хлороформе и в суспензию добавляют насыщенный водный раствор гидрокарбоната натрия и органический слой отделяют. Органический слой промывают насыщенным рассолом, сушат над сульфатом натрия и растворитель выпаривают при пониженном давлении, что дает названное соединение (206 мг).
APCI-MS м/е: 485/487[M+H]+
Пример 122: 3-[({Транс-4-[[3-(ацетиламино)пропил](метил)амино]-циклогексил}карбонил)амино]-N-(5-хлорпиридин-2-ил)фуро[3,2-b]пиридин-2-карбоксамид
3-[({Транс-4-[(3-аминопропил)(метил)амино]циклогексил}-карбонил)амино]-N-(5-хлорпиридин-2-ил)фуро[3,2-b]пиридин-2-карбоксамид (113 мг), полученный в примере 121, и триэтиламин (65 мкл) растворяют в хлороформе (5 мл), после чего в реакционную массу добавляют ацетилхлорид (25 мкл) при охлаждении льдом. Смесь нагревают до комнатной температуры и перемешивают в течение часа. В реакционный раствор выливают насыщенный водный раствор гидрокарбоната натрия, и смесь экстрагируют хлороформом. Органический слой промывают последовательно водой и насыщенным рассолом, сушат над сульфатом натрия и растворитель выпаривают при пониженном давлении. Полученный остаток очищают с помощью хроматографии на колонке с NH-силикагелем (элюент: этилацетат, затем этилапетат/метанол = 10/1). Полученное твердое вещество суспендируют в н-гександиизопропиловый эфир и собирают фильтрованием, что дает названное соединение (90 мг).
APCI-MS м/е: 527/529[М+Н]+
Пример 123: 6-(Ацетил)амино-N-(5-хлорпиридин-2-ил)-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамид
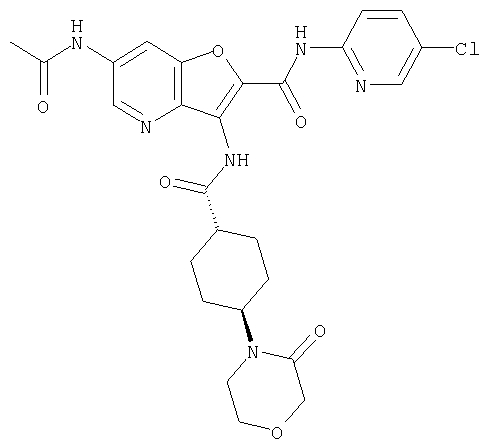
6-Амино-N-(5-хлорпиридин-2-ил)-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамид (56 мг), полученный в примере 103, обрабатывают в соответствии с методикой, аналогичной методике, изложенной в примере 122, что дает названное соединение (39 мг).
APCI-MS м/е: 555/557[M+H]+
Пример 124: трет-Бутил-4-(транс-4-{[(2-{[(5-хлорпиридин-2-ил)амино]-карбонил}фуро[3,2-b]пиридин-3-ил)амино]карбонил}циклогексил)-3-оксопиперазин-1-карбоксилат
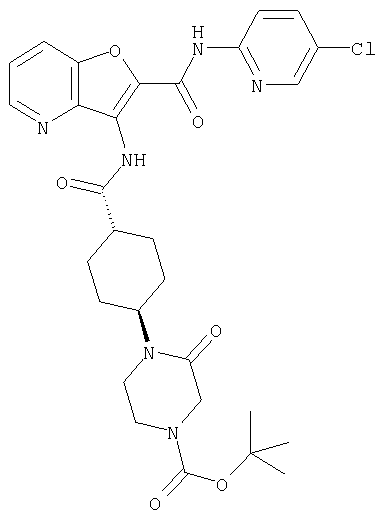
Транс-4-[4-(трет-бутоксикарбонил)-2-оксопиперазин-1-ил]циклогексанкарбоновую кислоту (370 мг), полученную в ссылочном примере 71, и 3-амино-N-(5-хлорпиридин-2-ил)фуро[3,2-b]пиридин-2-карбоксамид (327 мг), полученный в ссылочном примере 24, обрабатывают в соответствии с методикой, аналогичной методике, изложенной в примере 118, что дает названное соединение (151 мг).
APCI-MS м/е: 597/599[M+H]+
Пример 125: N-(5-Хлорпиридин-2-ил)-3-({[транс-4-(2-оксопиперазин-1-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамид
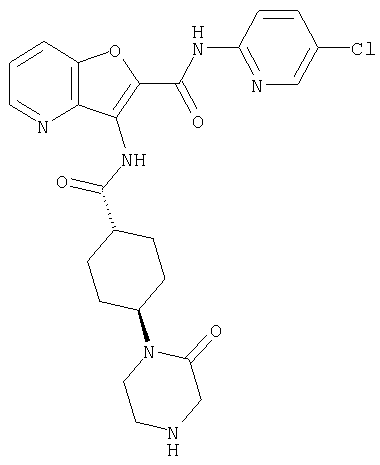
трет-Бутил-4-(транс-4-{[(2-{[(5-хлорпиридин-2-ил)амино]карбонил}-фуро[3,2-b]пиридин-3-ил)амино]карбонил}циклогексил)-3-оксопиперазин-1-карбоксилат (220 мг), полученный в примере 124, обрабатывают в соответствии с методикой, аналогичной методике, изложенной в примере 121, что дает названное соединение (165 мг).
APCI-MS м/е: 497/499[M+H]+
Пример 126: N-(5-Хлорпиридин-2-ил)-3-({[транс-4-(4-метил-2-оксопиперазин-1-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамид
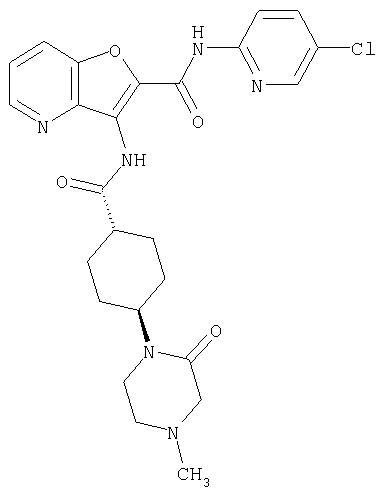
N-(5-Хлорпиридин-2-ил)-3-({[транс-4-(2-оксопиперазин-1-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамид (60 мг), полученный в примере 125, и 35% водный раствор формальдегида (19 мкл) обрабатывают в соответствии с методикой, аналогичной методике, изложенной в примере 120, что дает названное соединение (46 мг).
APCI-MS м/е: 511/513[M+H]+
Пример 127: 3-({[Транс-4-(4-ацетил-2-оксопиперазин-1-ил)пиклогексил]-карбонил}амино)-N-(5-хлорпиридин-2-ил)фуро[3,2-b]пиридин-2-карбоксамид
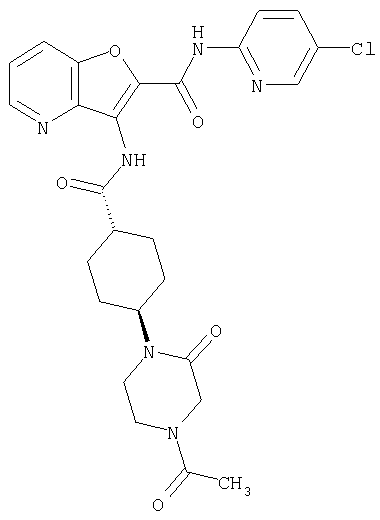
N-(5-Хлорпиридин-2-ил)-3-({[транс-4-(2-оксопиперазин-1-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамид (50 мг), полученный в примере 125, и ацетилхлорид (9 мкл) обрабатывают в соответствии с методикой, аналогичной методике, изложенной в примере 122, что дает названное соединение (41 мг).
APCI-MS м/е: 539/541[М+Н]+
Примеры 128-138
Соответствующие аминосоединения и соединения карбоновой кислоты обрабатывают в соответствии с методикой, аналогичной методике, изложенной в примере 2, что дает следующие соединения (см. табл.30-32).
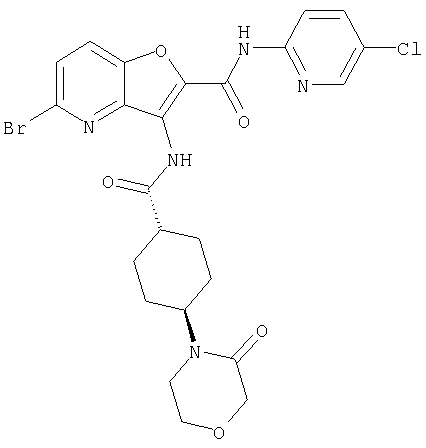
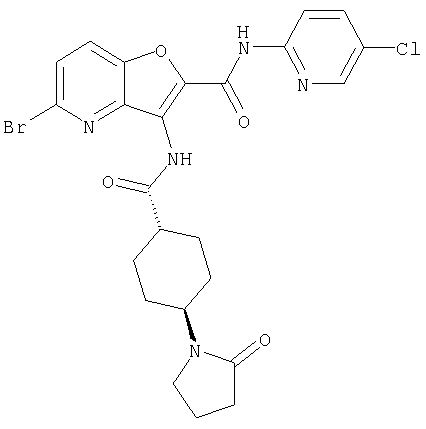
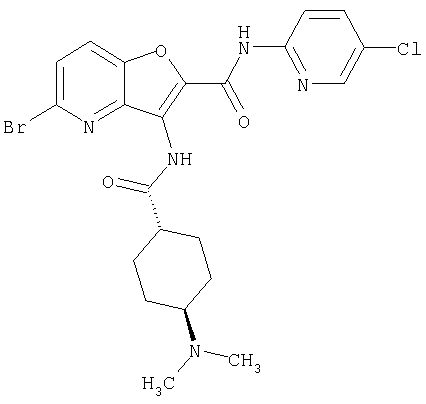
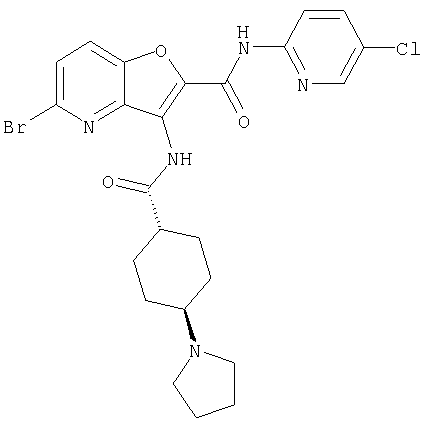
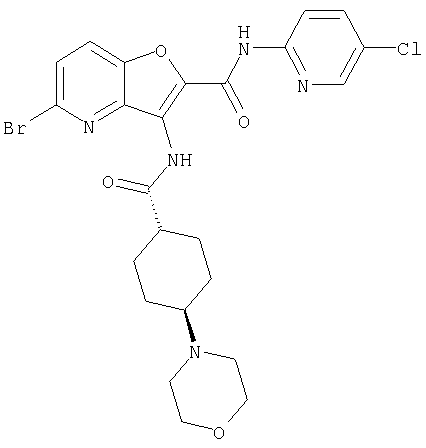
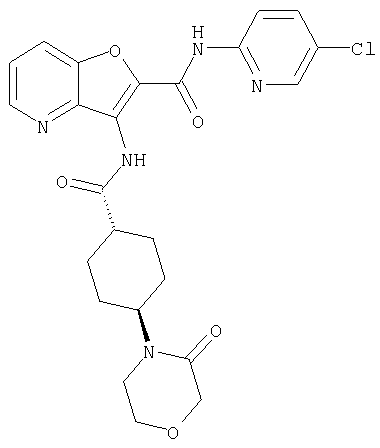
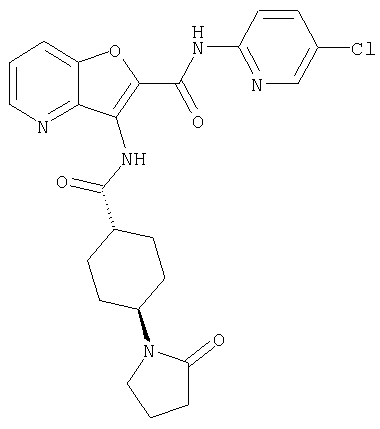
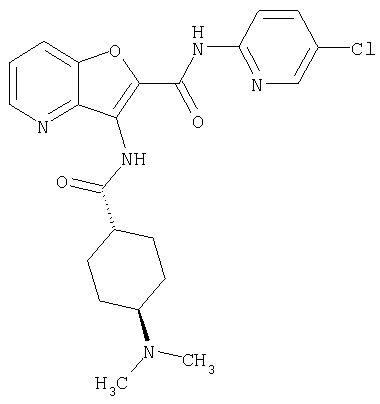
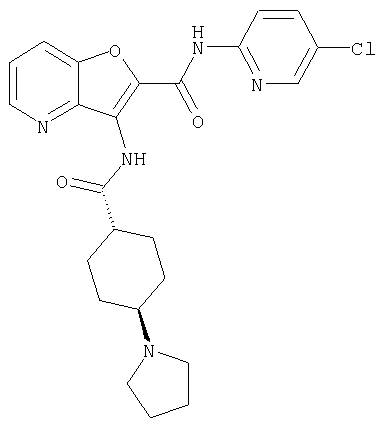
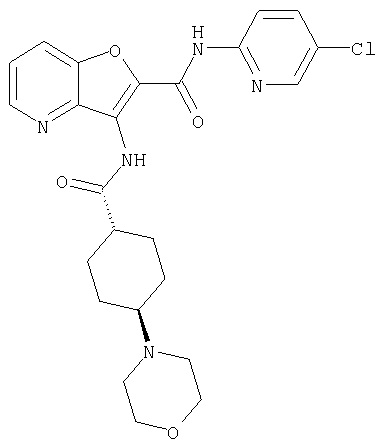
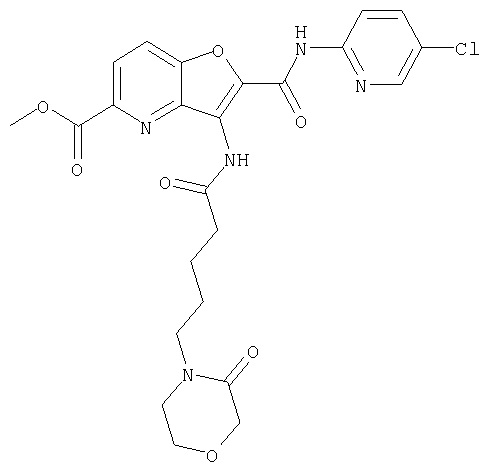
Пример 139: 2-{[(5-Хлорпиридин-2-ил)амино]карбонил}-3-{[5-(3-оксоморфолин-4-ил)пентаноил]амино}фуро[3,2-b]пиридин-5-карбоновая кислота
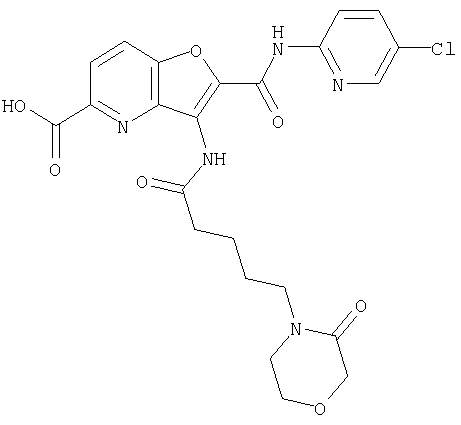
Метил-2-{[(5-хлорпиридин-2-ил)амино]карбонил}-3-{[5-(3-оксоморфолин-4-ил)пентаноил]амино}фуро[3,2-b]пиридин-5-карбоксилат (115 мг), полученный в примере 138, обрабатывают в соответствии с методикой, аналогичной методике, изложенной в примере 79, что дает названное соединение (94 мг).
ESI-MS м/е: 514/516[М-Н]-
Пример 140: N2-(5-Хлоропиридин-2-ил)-N5-(метоксиэтил)-N5-метил-3-{[5-(3-оксомор-фолин-4-ил)пентаноил]амино}фуро[3,2-b]пиридин-2,5-дикарбоксамид
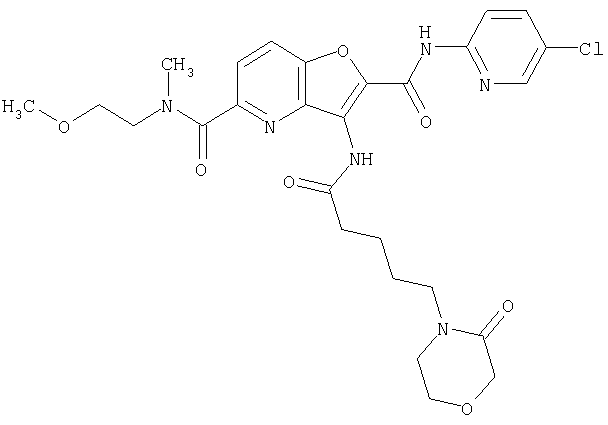
2-{[(5-Хлорпиридин-2-ил)амино]карбонил}-3-{[5-(3-оксоморфолин-4-ил)пентаноил]амино}фуро[3,2-b]пиридин-5-карбоновую кислоту (82 мг), полученную в примере 139, и N-(2-метоксиэтил)метиламин (28 мг) обрабатывают в соответствии с методикой, аналогичной методике, изложенной в примере 85, что дает названное соединение (70 мг).
APCI-MS м/е: 587/589[M+H]+
Пример 141: N-(5-Метилпиридин-2-ил)-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамид
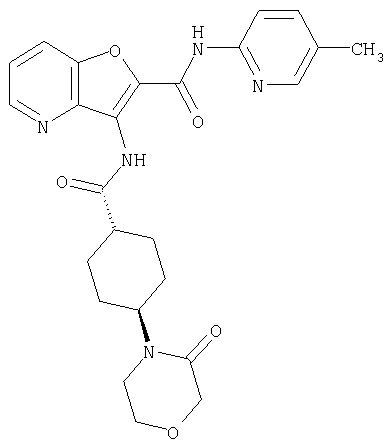
2-Амино-5-метилпиридин (81 мг) растворяют в хлороформе (5 мл). После добавления 0.98 М раствора триметилалюминия в гексане (763 мкл) при охлаждении льдом, реакционный раствор перемешивают при охлаждении льдом в течение 10 минут и затем при комнатной температуре в течение 0.5 часов. В полученный реакционный раствор добавляют метил-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксилат (150 мг), полученный в ссылочном примере 79, и смесь перемешивают при комнатной температуре в течение 2 часов и при нагревании при температуре 50°С в течение 5 часов. В реакционный раствор добавляют 10% раствор соляной кислоты (3 мл) при охлаждении льдом и смесь перемешивают при комнатной температуре в течение 0.5 часов. Реакционный раствор затем нейтрализуют путем добавления насыщенного водного раствора гидрокарбоната натрия и экстрагируют хлороформом. Органический слой промывают насыщенным рассолом, сушат над сульфатом натрия и растворитель выпаривают при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с NH-силикагелем (элюент:этилацетат, затем этилацетат/метанол = 10/1). Полученное твердое вещество суспендируют в диэтиловом эфире и собирают фильтрованием, что дает названное соединение (110 мг).
APCI-MS м/е: 478[М+Н]+
Примеры 142-145
Соответствующие сложные эфиры и аминосоединения обрабатывают в соответствии с методикой, аналогичной методике, изложенной в примере 141, что дает следующие соединения (см. табл.33).
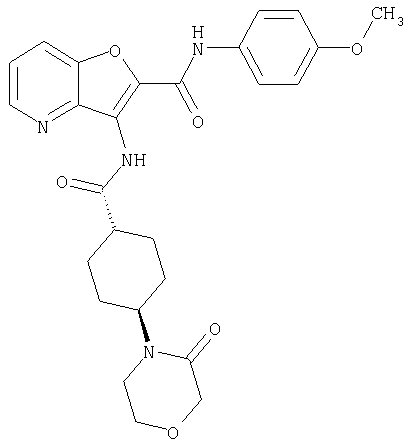
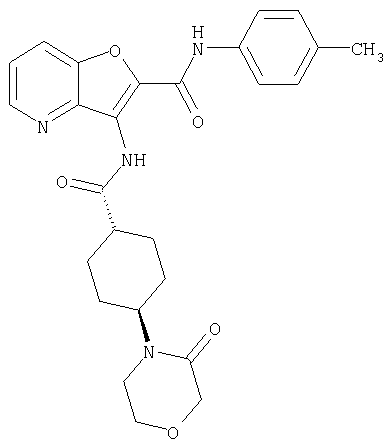
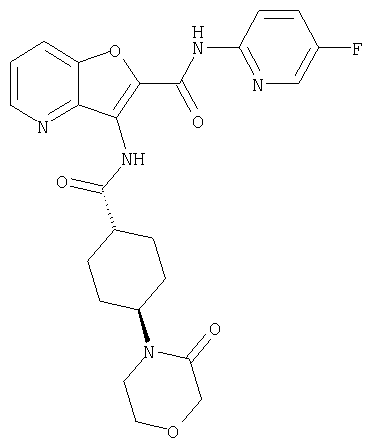
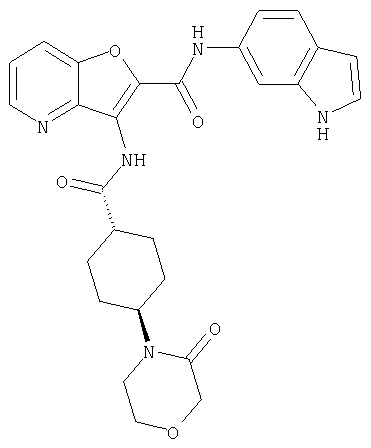
Примеры 146-149
Соответствующие карбоновые кислоты и аминосоединения обрабатывают в соответствии с методикой, аналогичной методике, изложенной в примерах 1 или 2, что дает следующие соединения (см. табл.34).
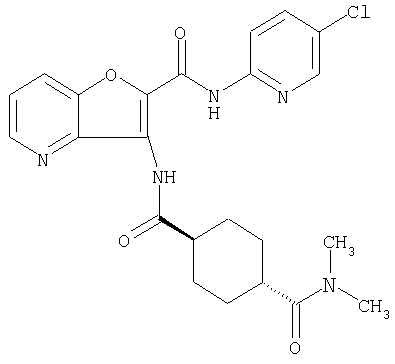
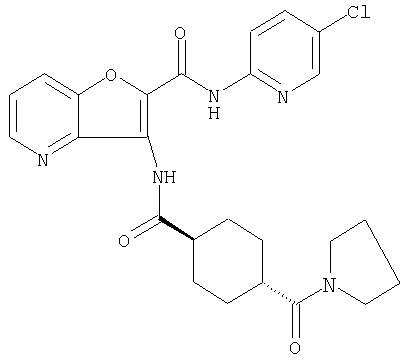
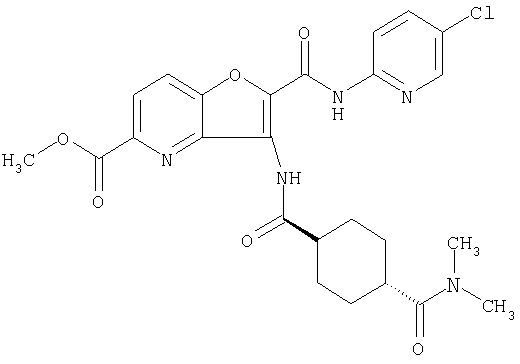
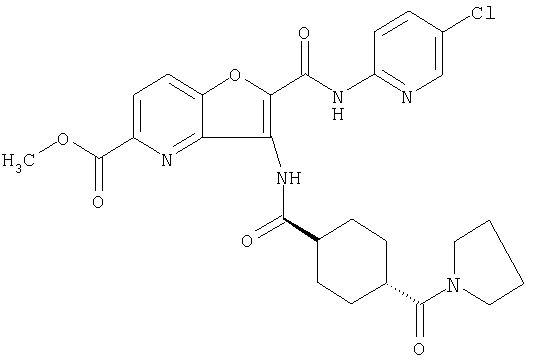
Примеры 150, 151
Соответствующие сложные эфиры обрабатывают в соответствии с методикой, аналогичной методике, изложенной в примере 79, что дает следующие соединения (см. табл.35).
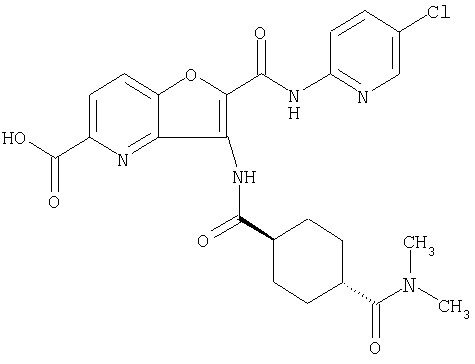
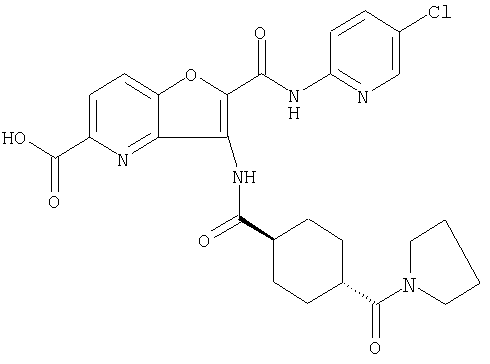
Примеры 152, 153
Соответствующие карбоновые кислоты и аминосоединения обрабатывают в соответствии с методикой, аналогичной методике, изложенной в примере 85, что дает следующие соединения (см. табл.36).
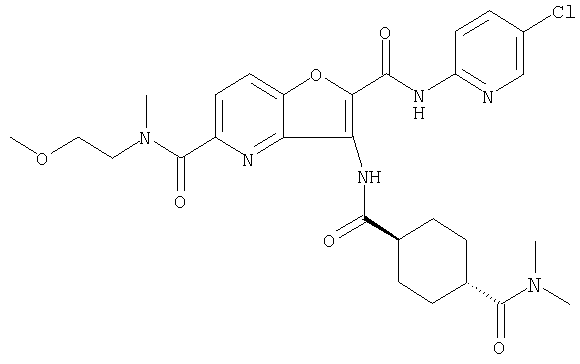
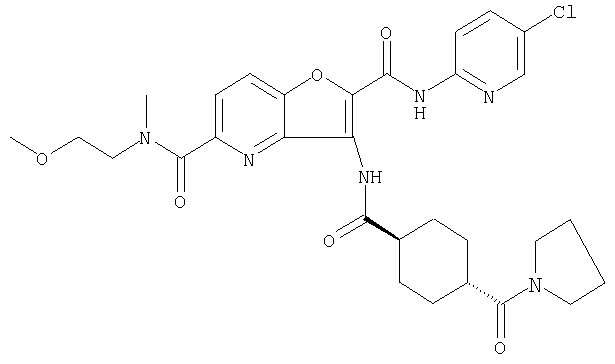
Пример 154: N-(5-Хлорпиридин-2-ил)-4-метокси-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-с]пиридин-2-карбоксамид
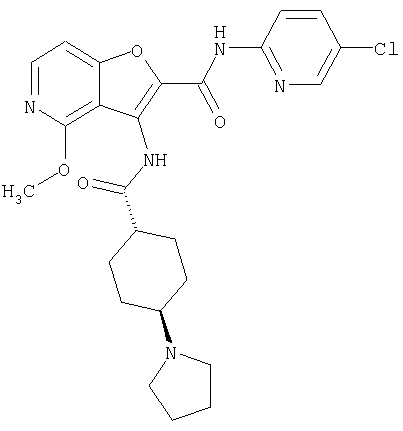
3-Амино-N-(5-хлорпиридин-2-ил)-4-метоксифуро[3,2-с]пиридин-2-карбоксамид (82 мг), полученный в ссылочном примере 88, и гидрохлорид транс-4-пирролидин-1-илциклогексанкарбоновой кислоты (106 мг), полученный в ссылочном примере 10, обрабатывают в соответствии с методикой, аналогичной методике, изложенной в примере 2, что дает названное соединение (39 мг).
APCI-MS м/е: 498/500[М+Н]+
Примеры 155, 156
2-{[(5-Хлорпиридин-2-иламино]карбонил}-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-b]пиридин-5-карбоновую кислоту, полученную в примере 81, и соответствующие аминосоединения обрабатывают в соответствии с методикой, аналогичной методике, изложенной в примере 85, что дает следующие соединения (см. табл.37).
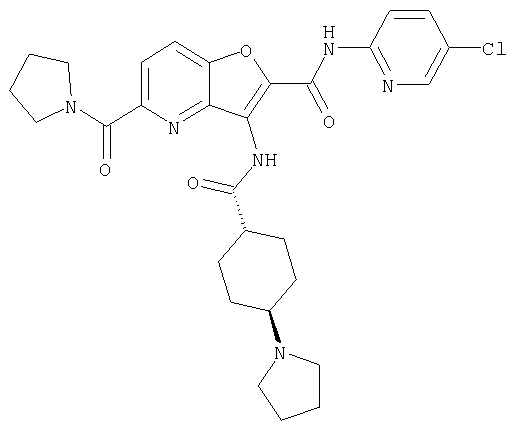
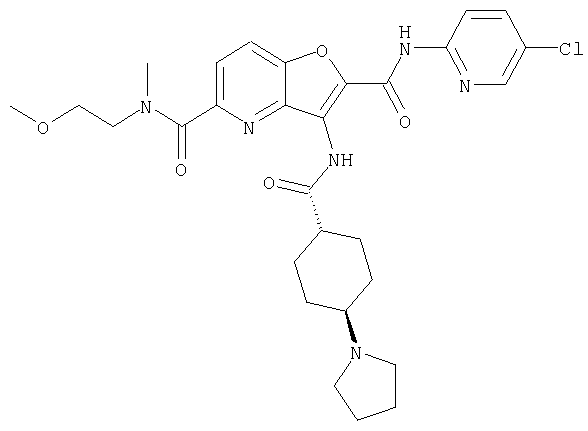
Примеры 157-185
Соответствующие аминосоединения и карбоновые кислоты, полученные в ссылочных примерах, обрабатывают в соответствии с методикой, аналогичной методике, изложенной в примере 2, что дает следующие соединения (см. табл.38-45).
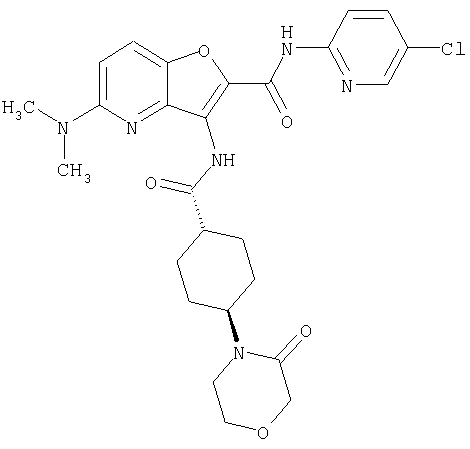
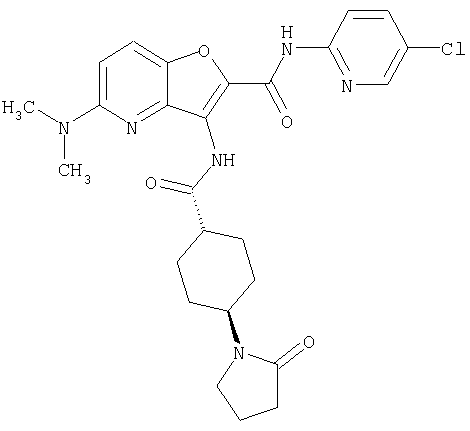
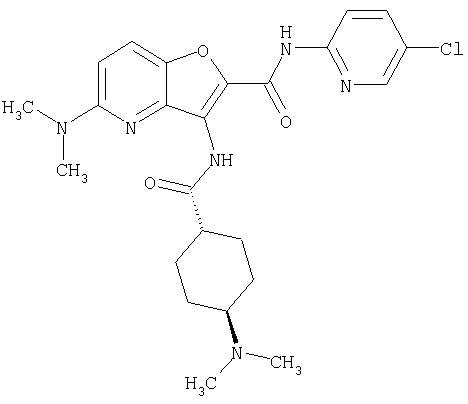
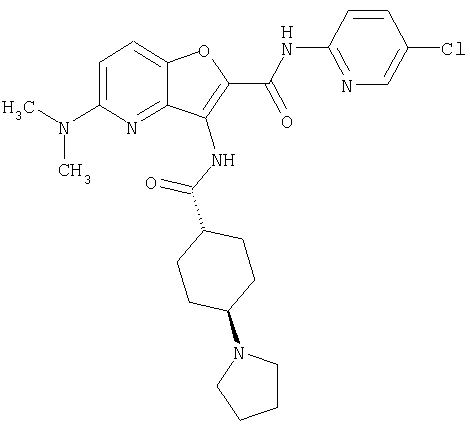
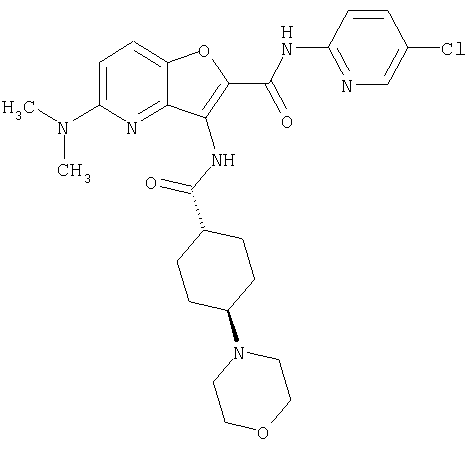
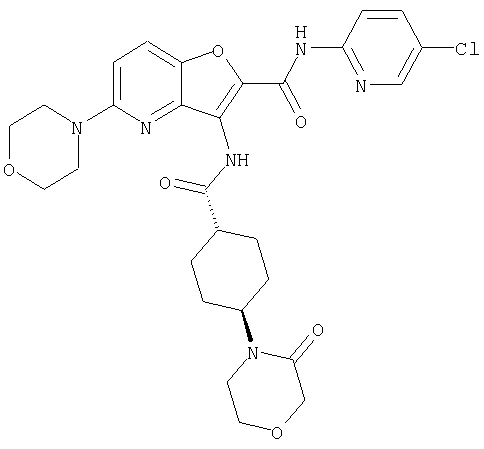
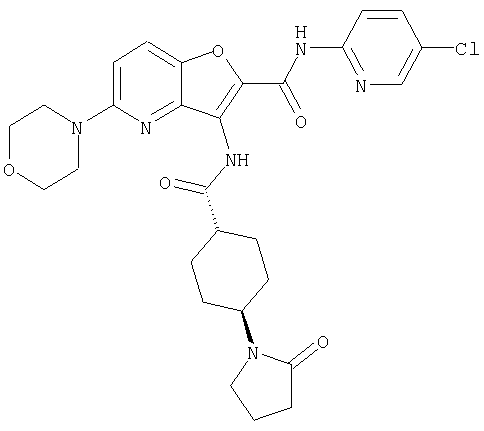
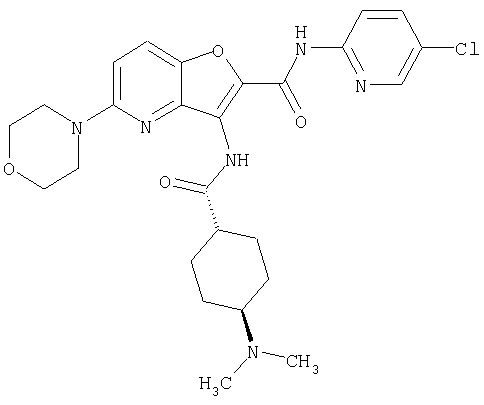
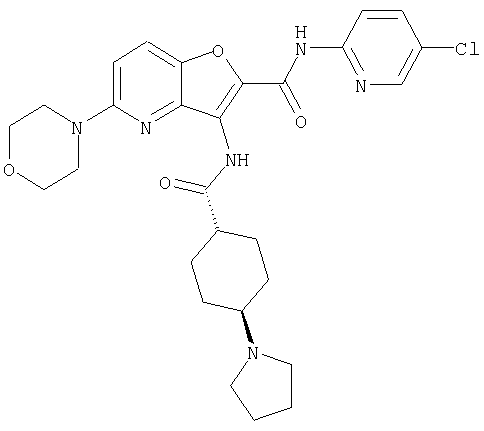
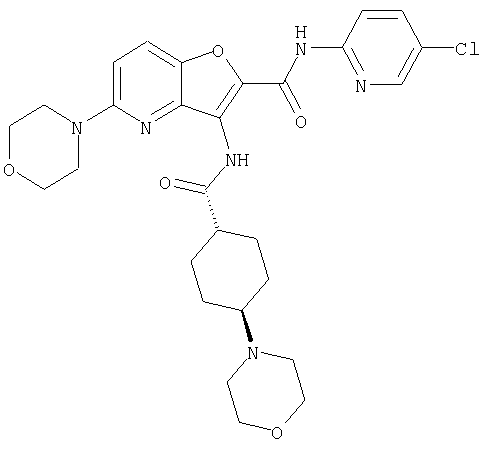
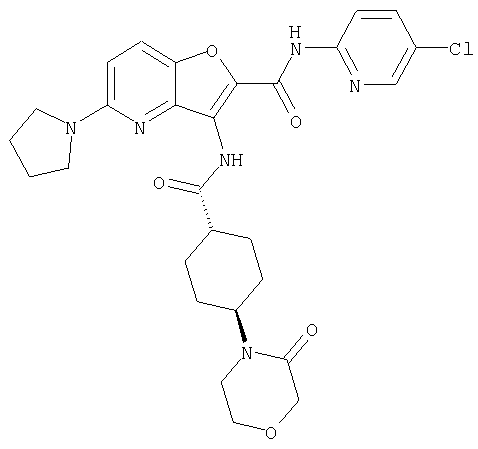
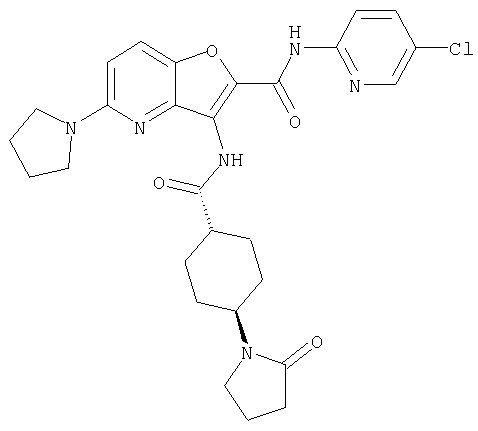
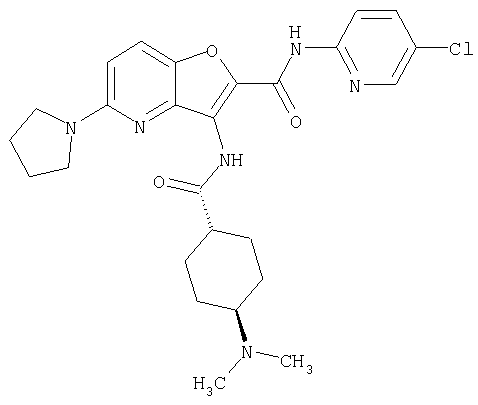
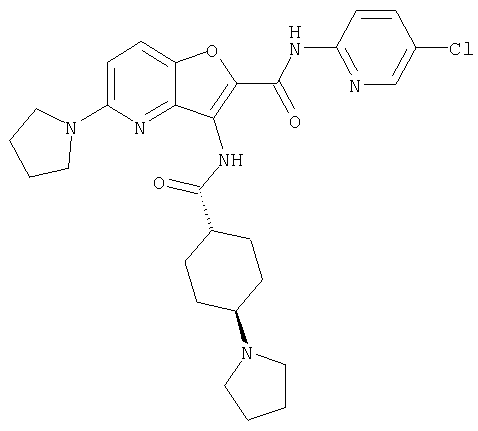
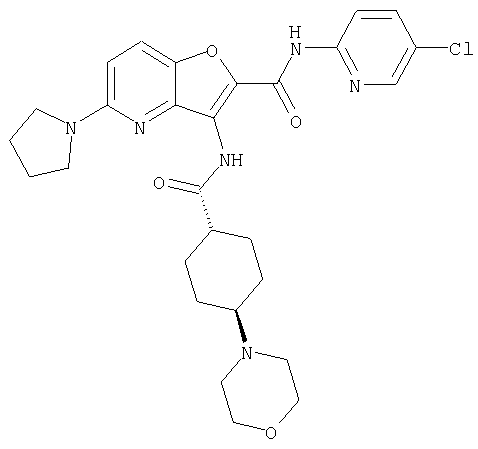
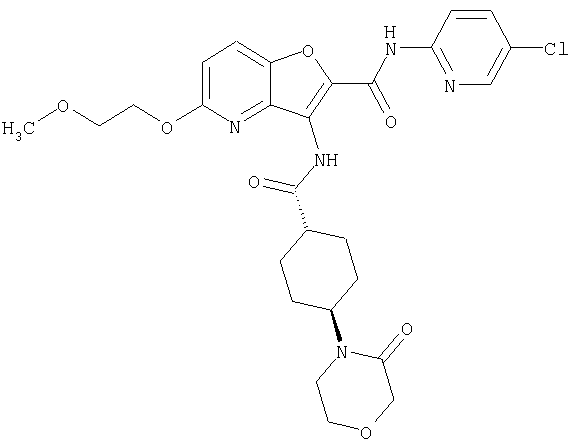
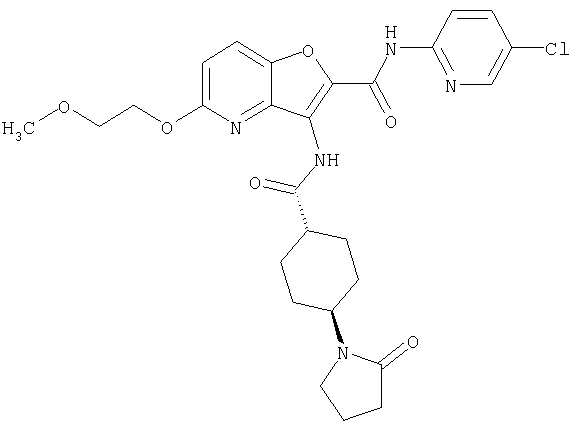
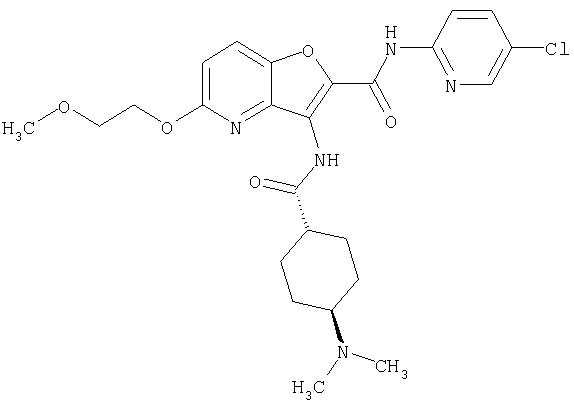
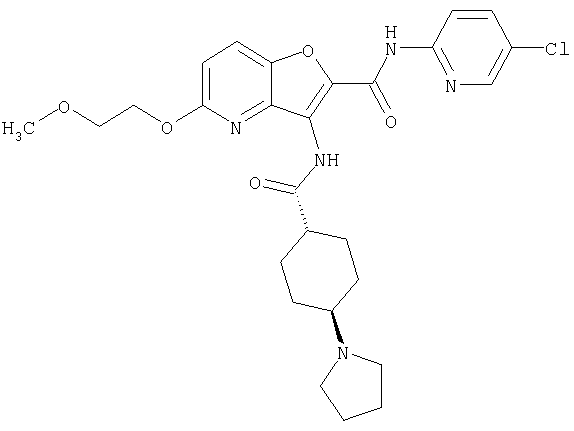
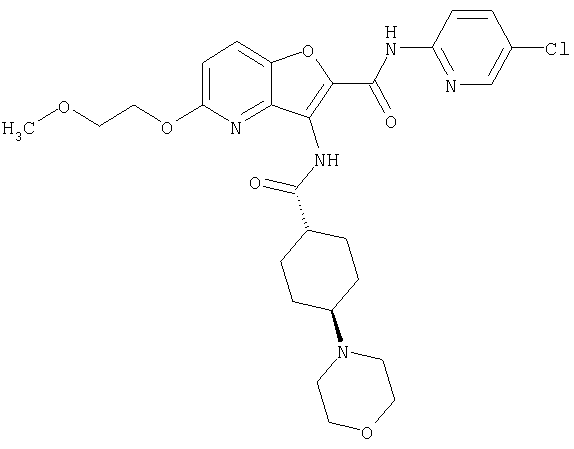
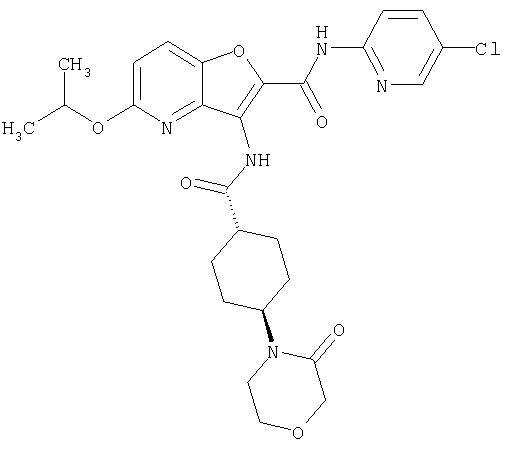
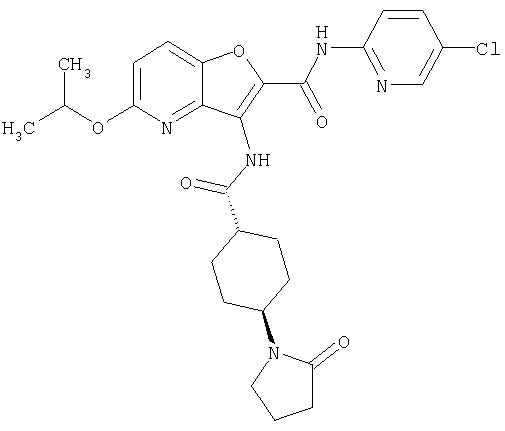
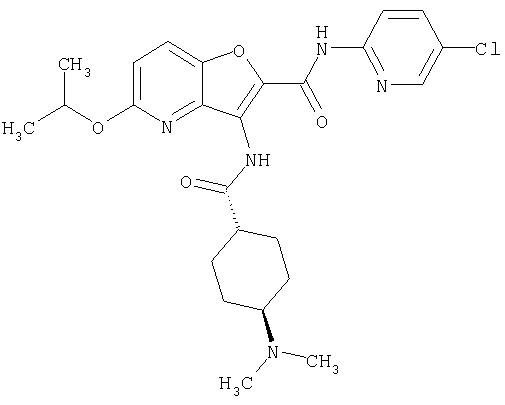
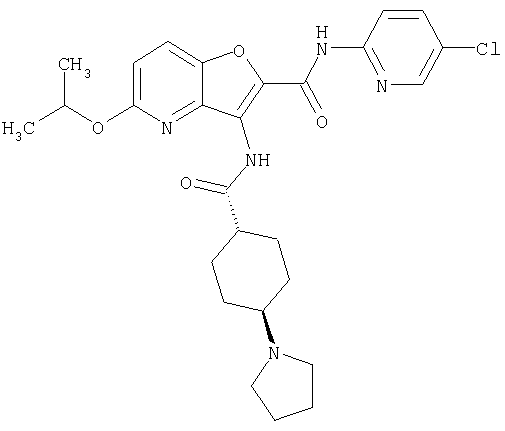
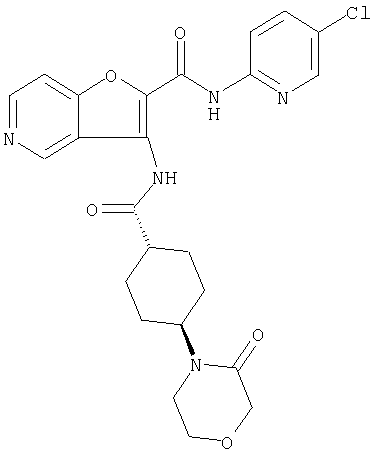
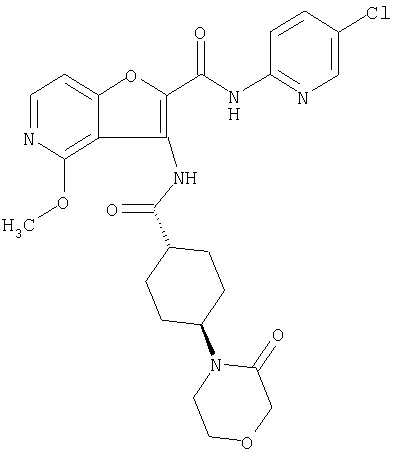
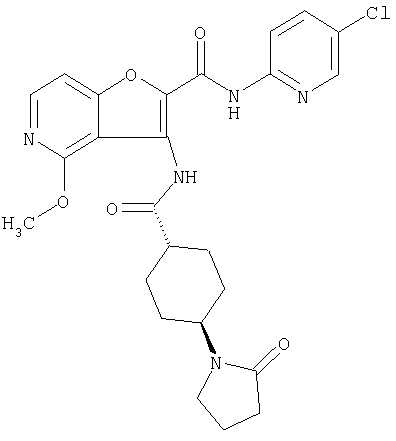
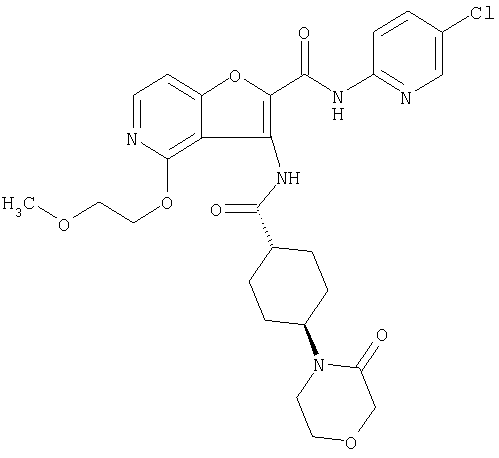
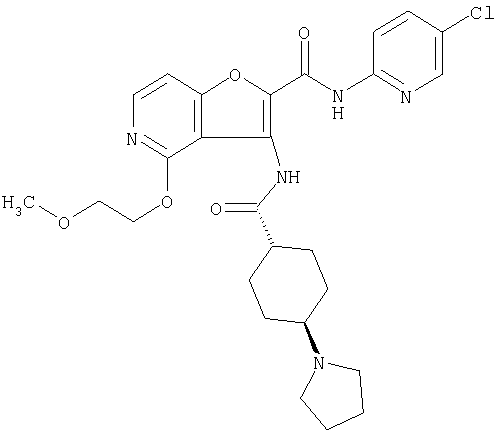
Примеры 186-192
Соответствующие сложные эфиры и аминосоединения обрабатывают в соответствии с методикой, аналогичной методике, изложенной в примере 141, что дает следующие соединения (см. табл.46, 47).
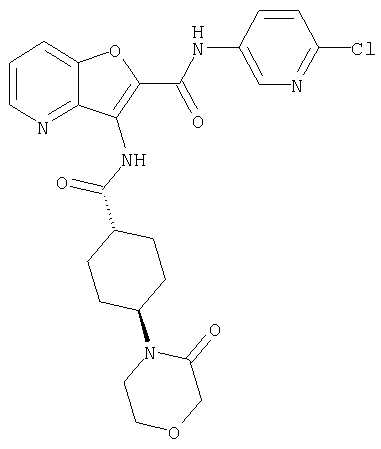
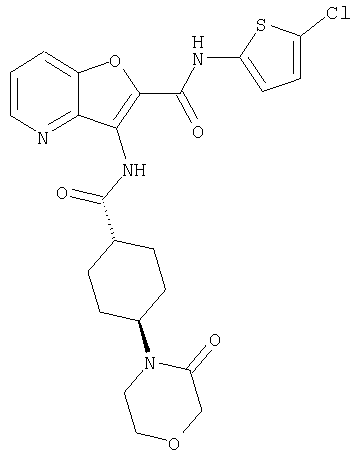
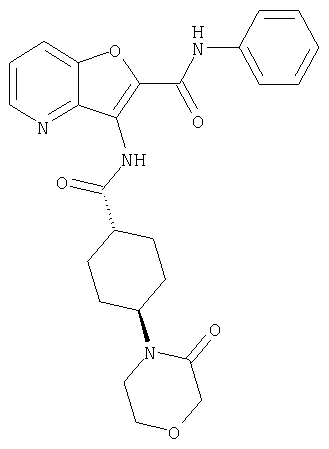
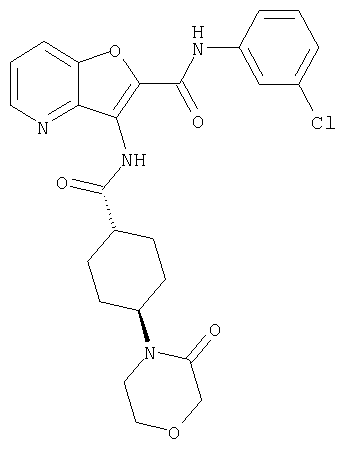
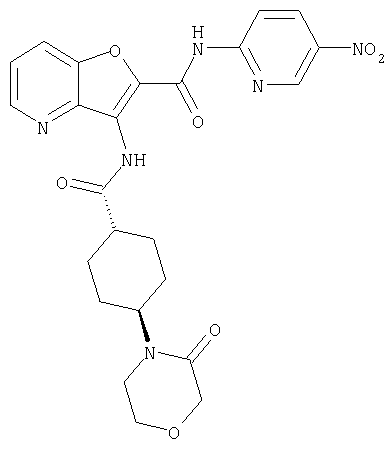
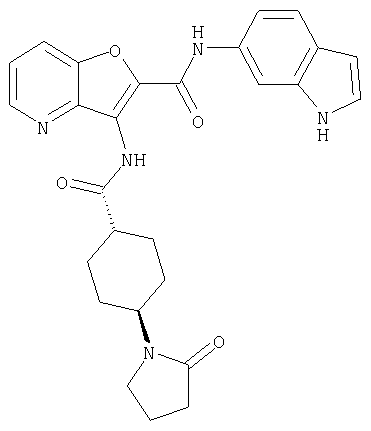
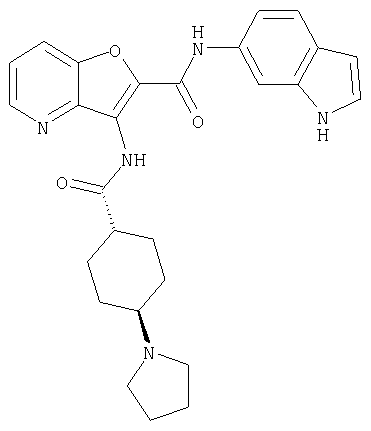
Примеры 193-202
Соответствующие аминосоединения, полученные в ссылочных примерах 24, 87, 90 и 91, и соответствующие карбоновые кислоты обрабатывают в соответствии с методикой, аналогичной методике, изложенной в примере 2, что дает следующие соединения (см. табл.48-50).
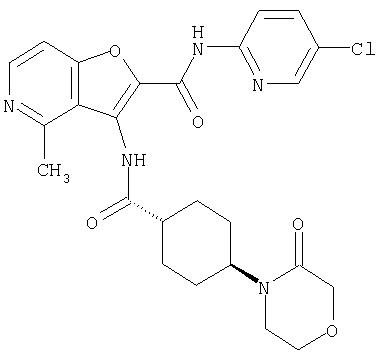
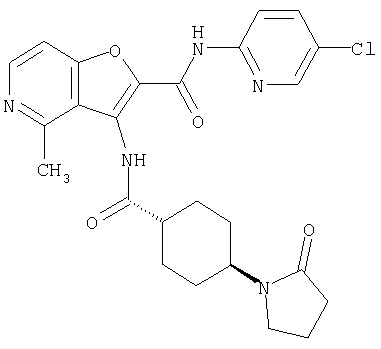
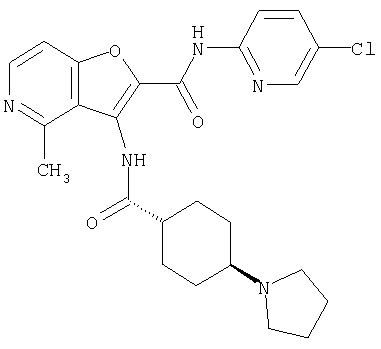
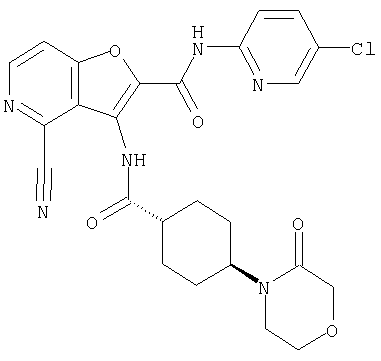
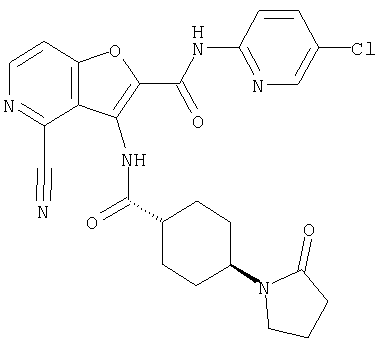
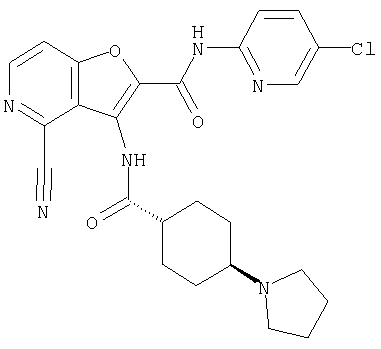
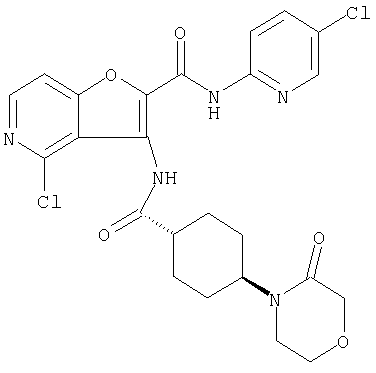
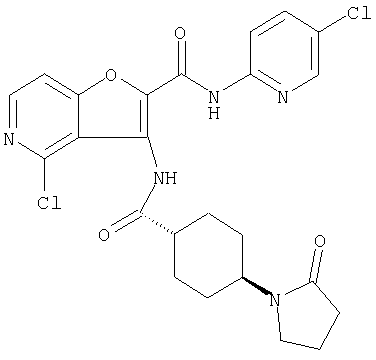


Примеры 203, 204
Сложный эфир, полученный в ссылочном примере 79, и аминосоединения обрабатывают в соответствии с методикой, аналогичной методике, изложенной в примере 141, что дает следующие соединения (см. табл.51).
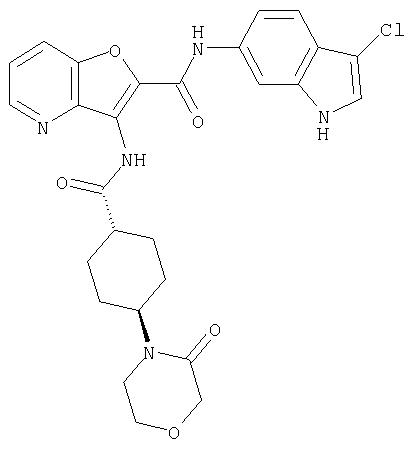
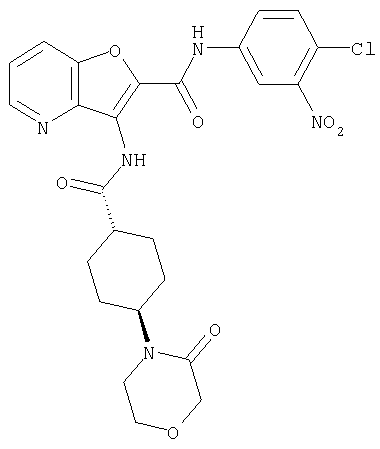
Пример 205: N-(3-Амино-4-хлорфенил)-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамид
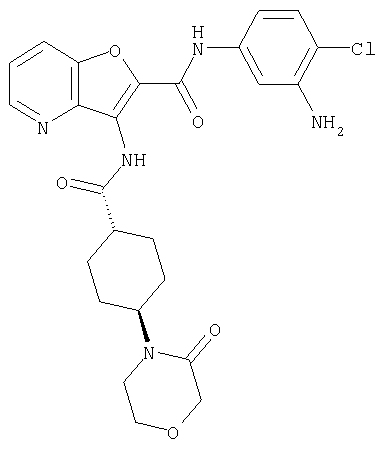
N-(4-Хлор-3-нитрофенил)-3-({[транс-4-(3-оксоморфонил-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамид (50 мг), полученный в примере 204, суспендируют в этанол (3 мл), после чего в реакционную массу добавляют дигидрат хлорида олова(II) (104 мг). Смесь перемешивают при комнатной температуре в течение 15 часов, затем при температуре 50°С в течение 5 часов и затем при температуре 70°С в течение 7 часов. После охлаждения, в реакционный раствор выливают насыщенный водный раствор гидрокарбоната натрия и хлороформ. Затем смесь энергично перемешивают при комнатной температуре. Органический слой отделяют, сушат над сульфатом натрия и выпаривают при пониженном давлении, чтобы удалить растворитель. Остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: хлороформ, затем хлороформ/метанол = 10/1). Полученное твердое вещество суспендируют в диэтиловом эфире. Осадок собирают фильтрованием, что дает названное соединение (32 мг).
APCI-MS м/е: 512/514[М+H]+
Примеры 206-208
Соединение амина, полученное в ссылочном примере 125, и соответствующие карбоновые кислоты обрабатывают в соответствии с методикой, аналогичной методике, изложенной в примере 2, что дает следующие соединения (см. табл.52).
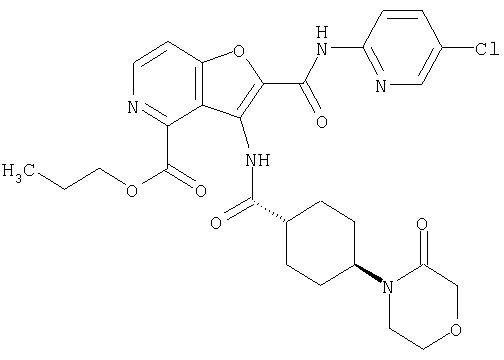
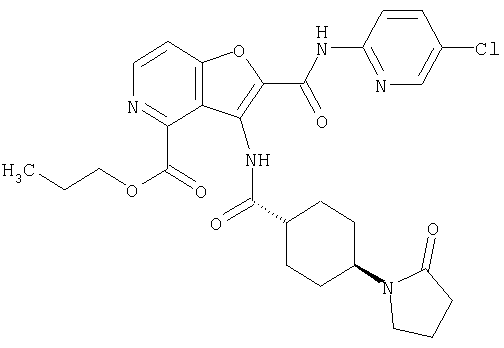
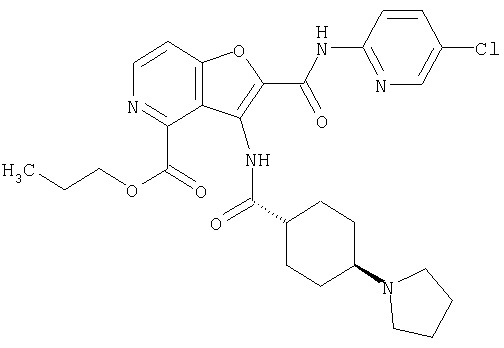
Примеры 209-211
Соединения, полученные в примерах 206-208, обрабатывают в соответствии с методикой, аналогичной методике, изложенной в примере 79, что дает следующие соединения (см. табл.53).
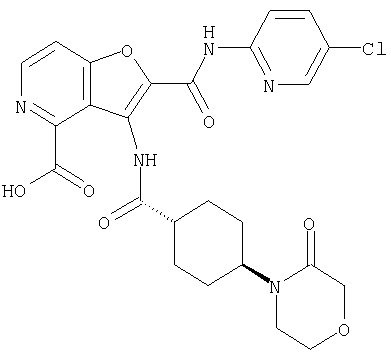
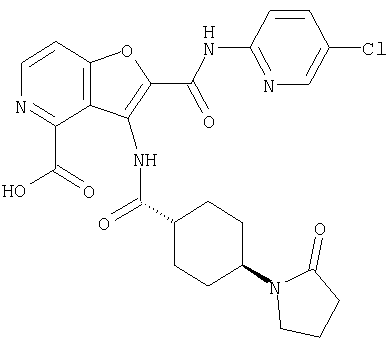
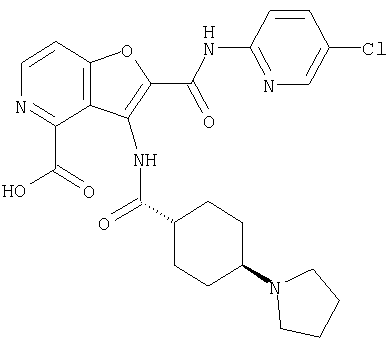
Примеры 212-214
Соединения, полученные в примерах 209-211, обрабатывают в соответствии с методикой, аналогичной методике, изложенной в примере 85, что дает следующие соединения (см. табл.54).
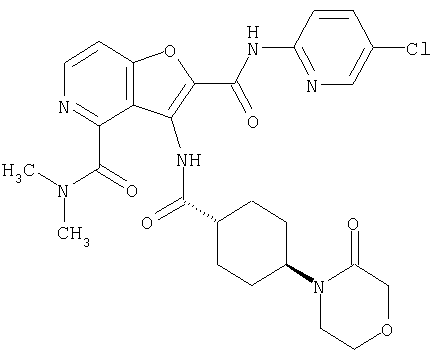
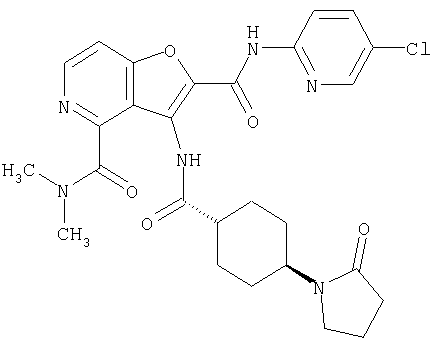
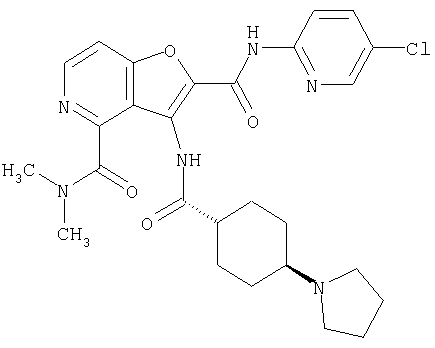
Примеры 215-355
В соответствии с методикой, аналогичной методике, изложенной в примере, описанном выше, могут быть получены следующие соединения (см. табл.55-73).
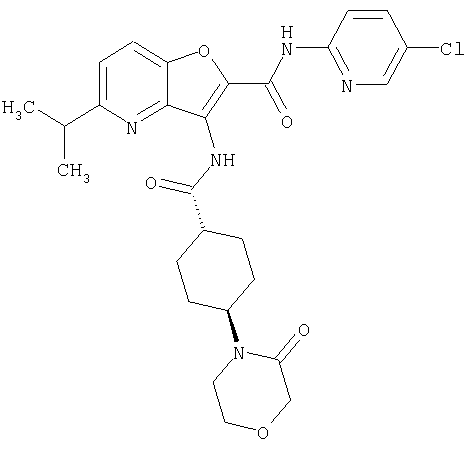

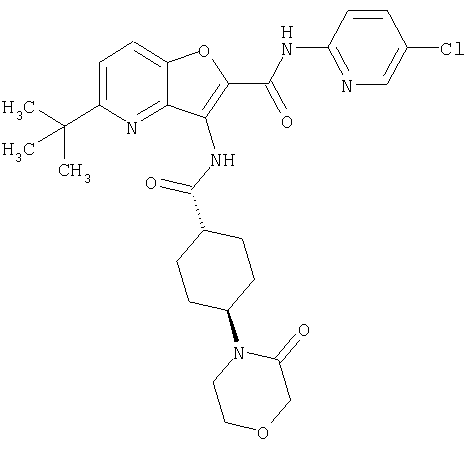
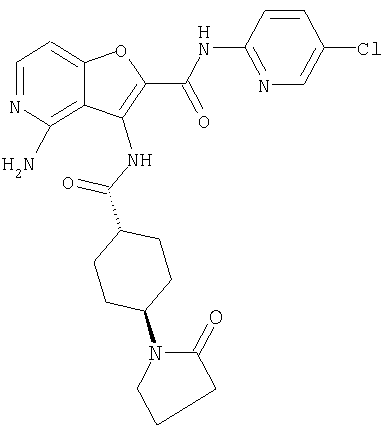
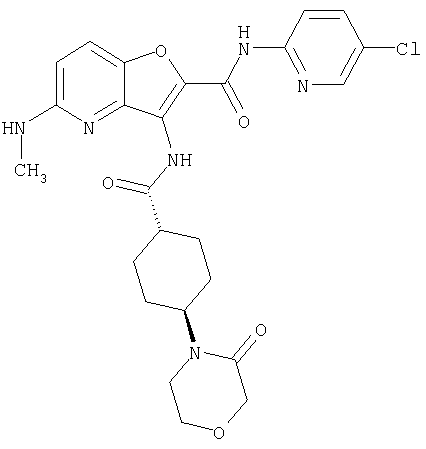
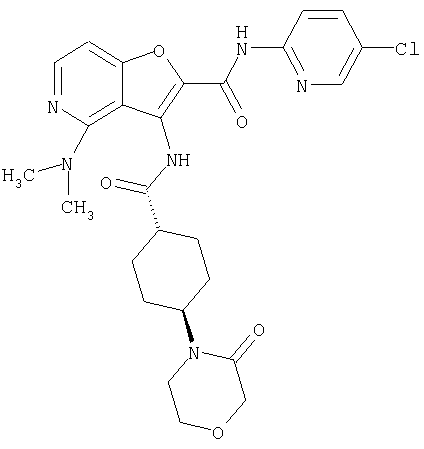
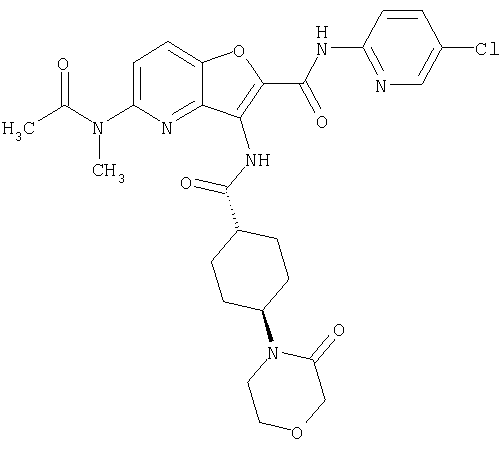
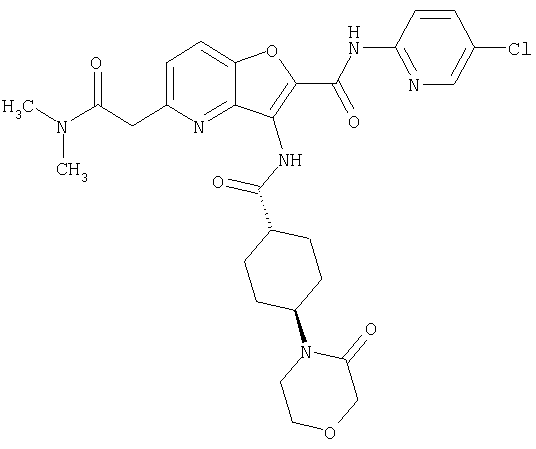
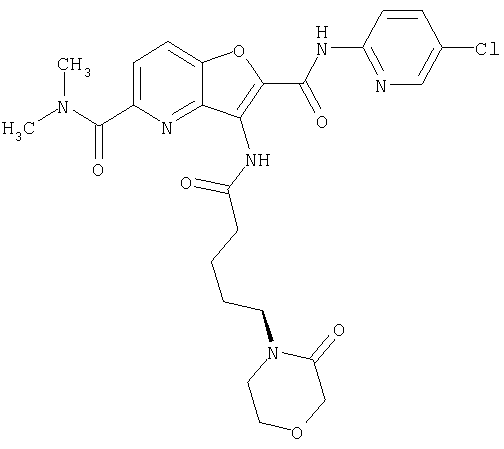
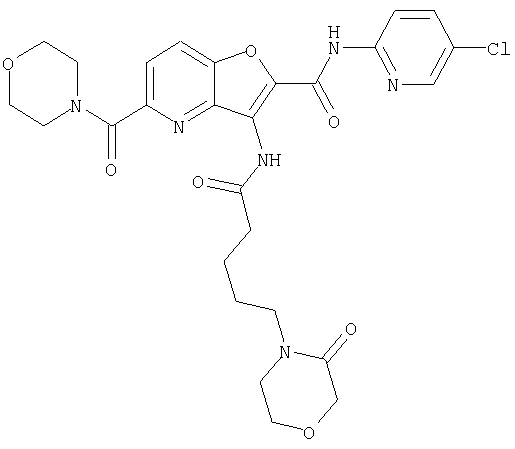
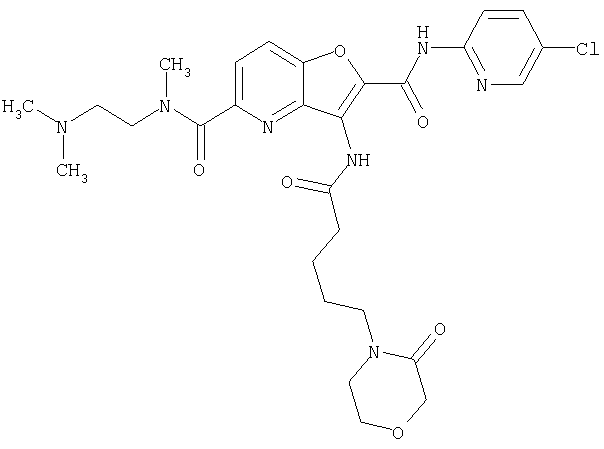
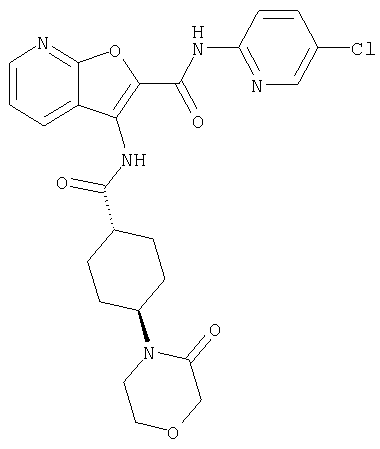
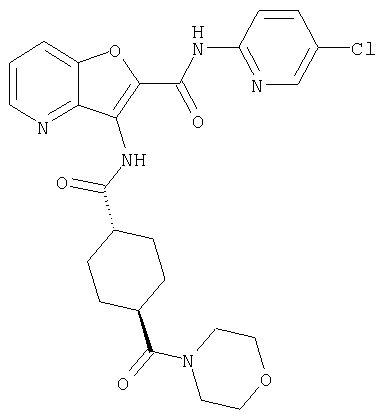
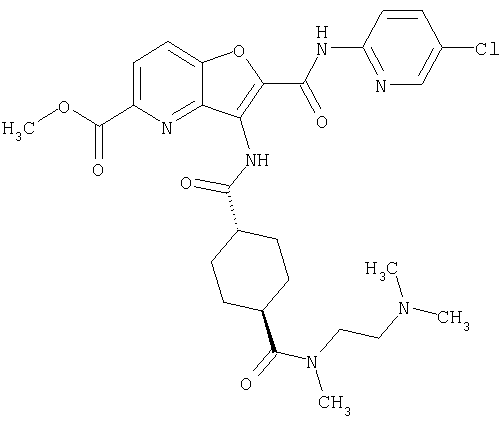
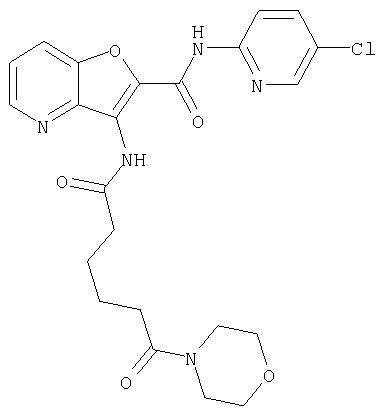
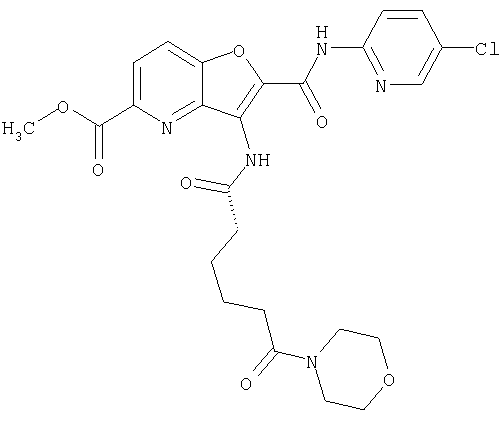
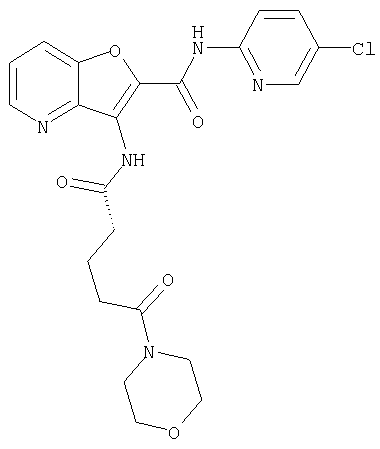
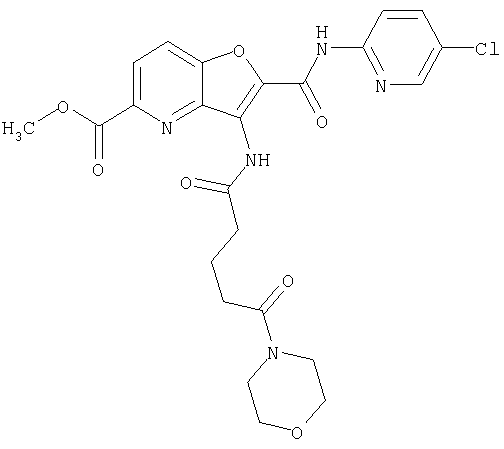
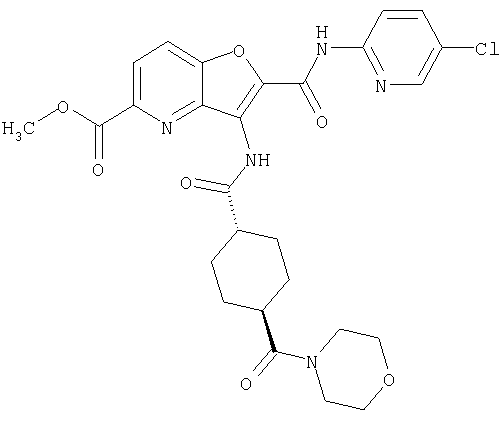
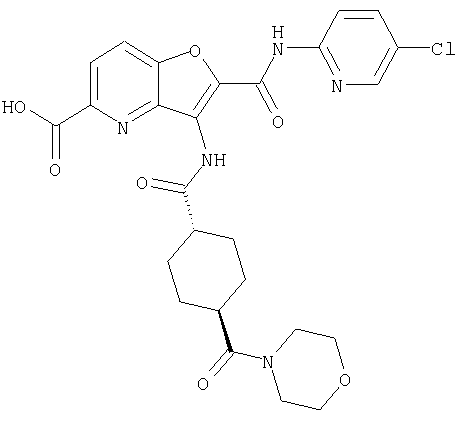
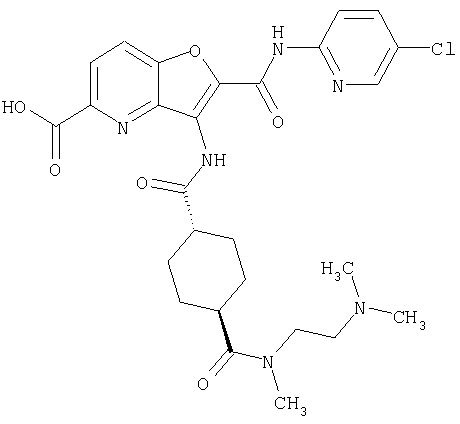
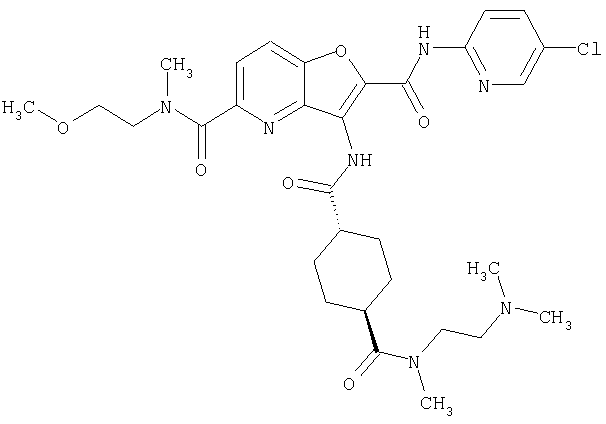
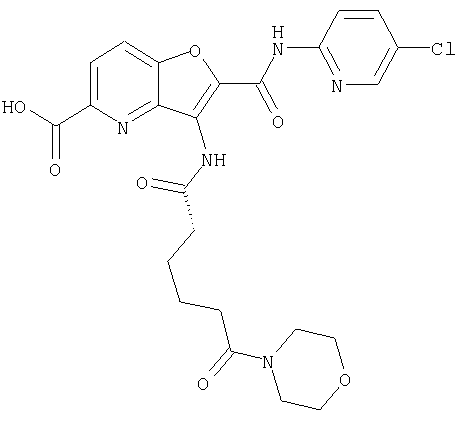
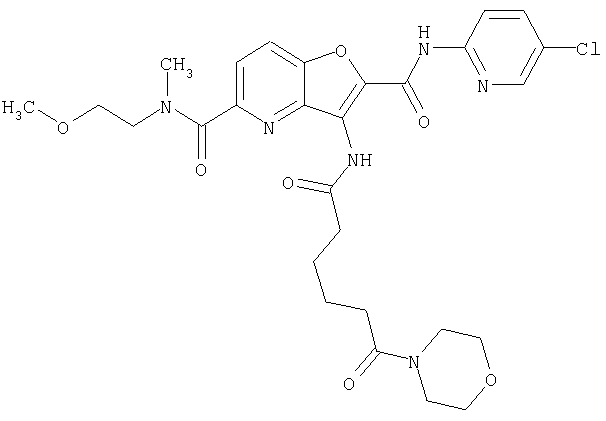
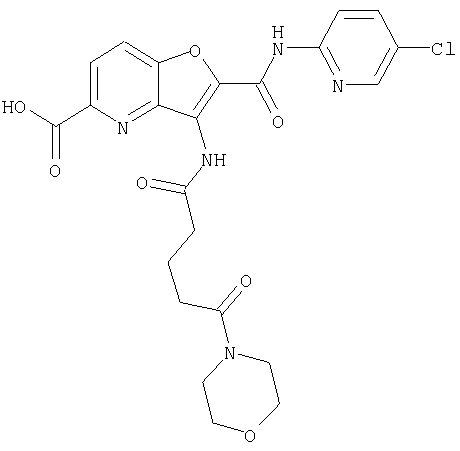
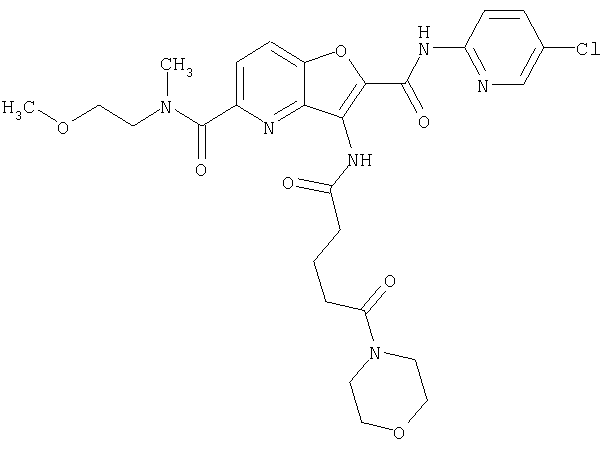
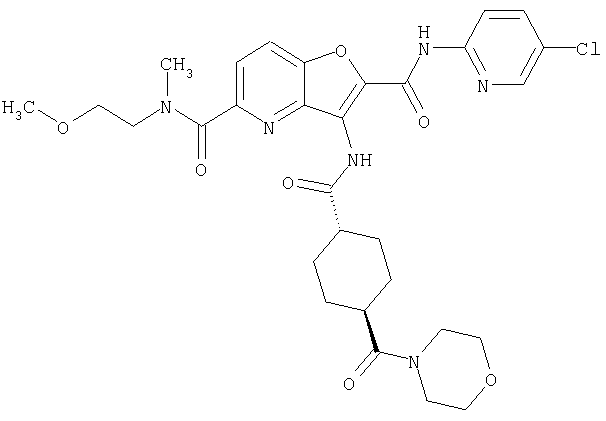
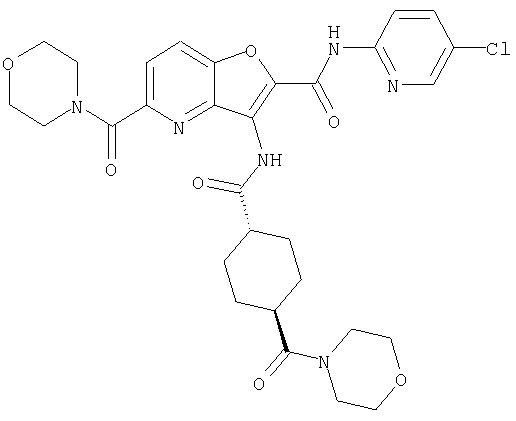
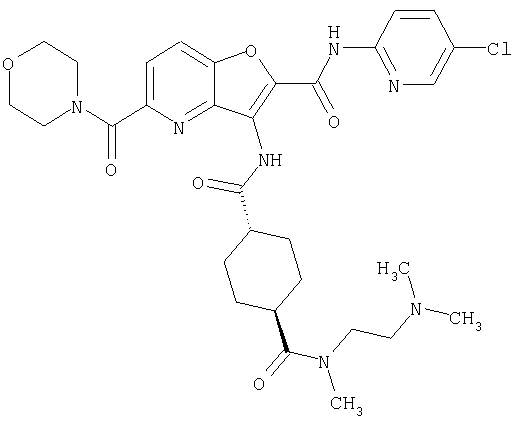
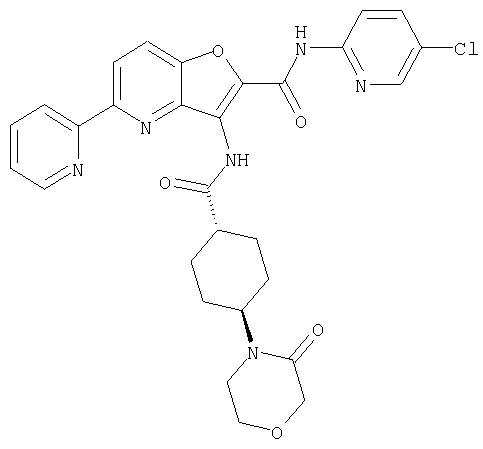
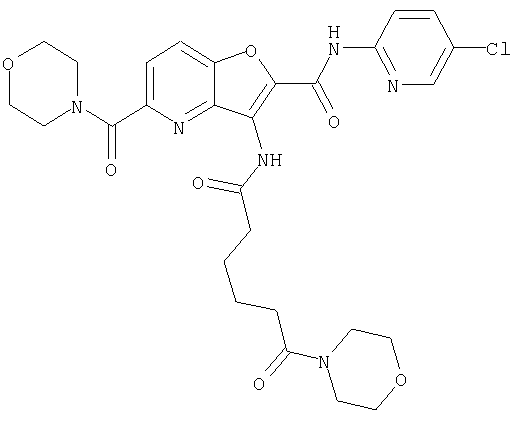
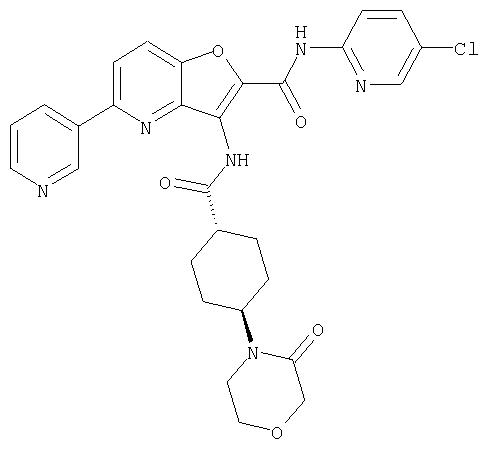
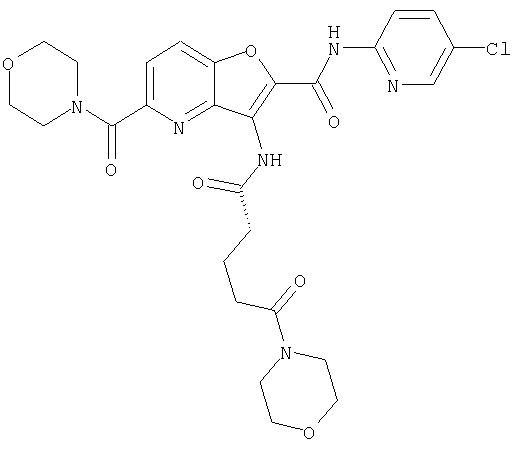
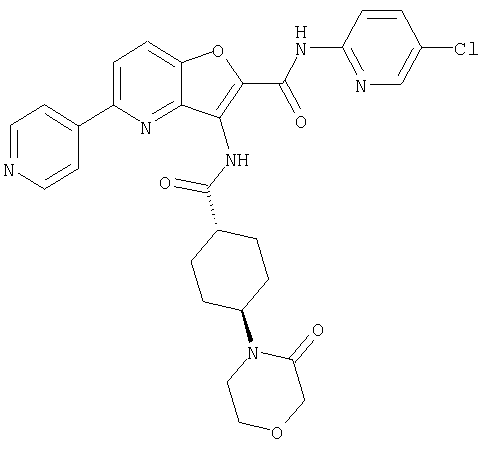
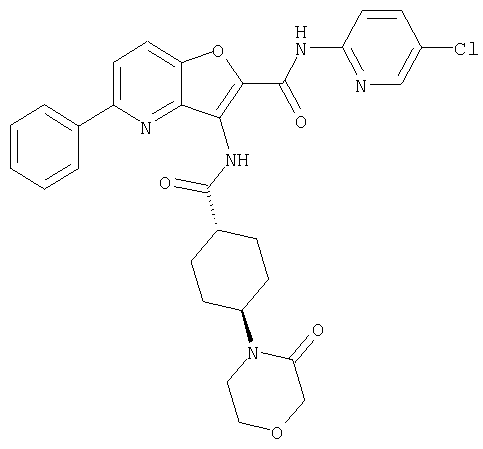
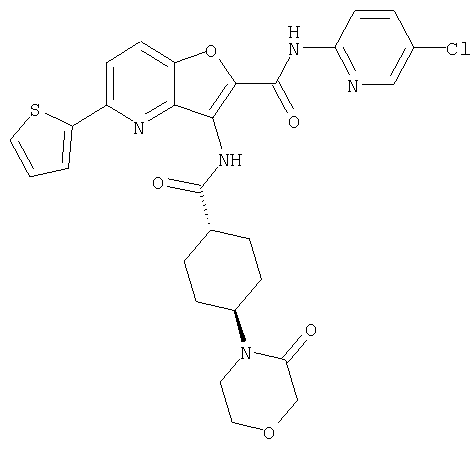
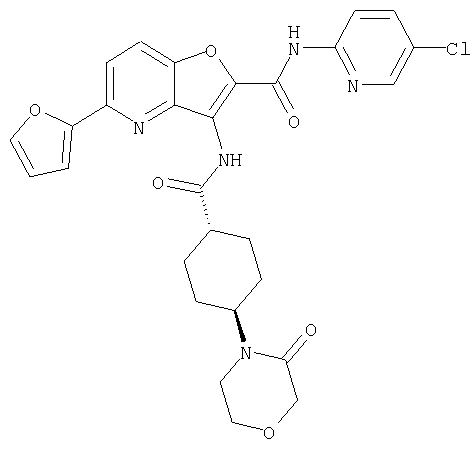
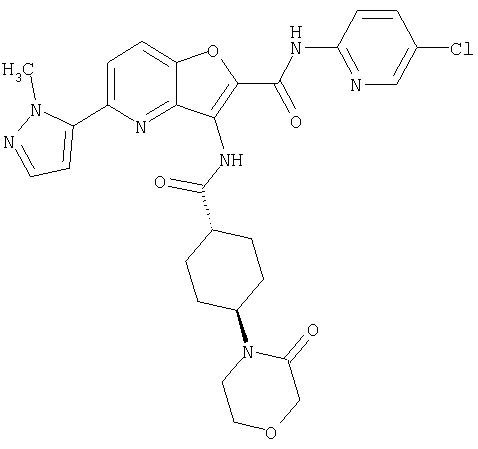
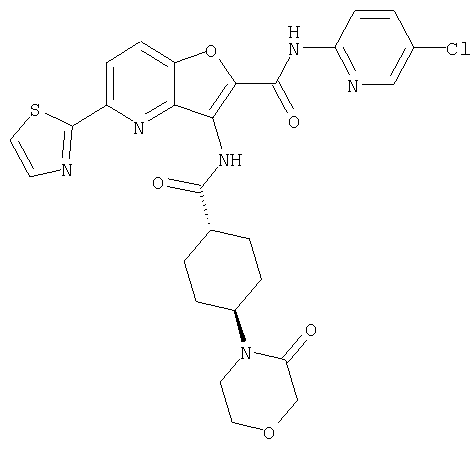
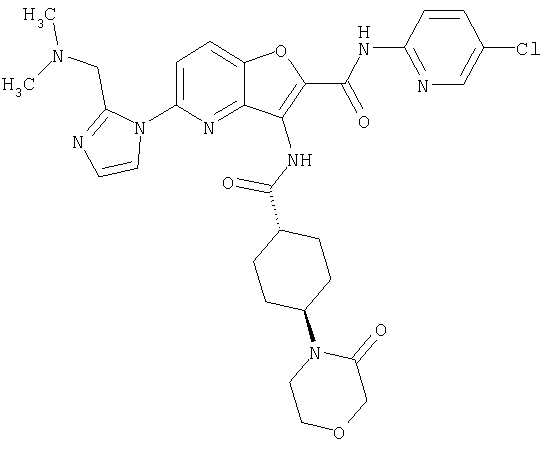

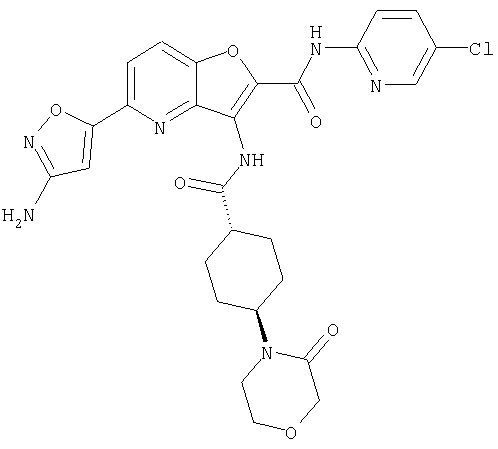
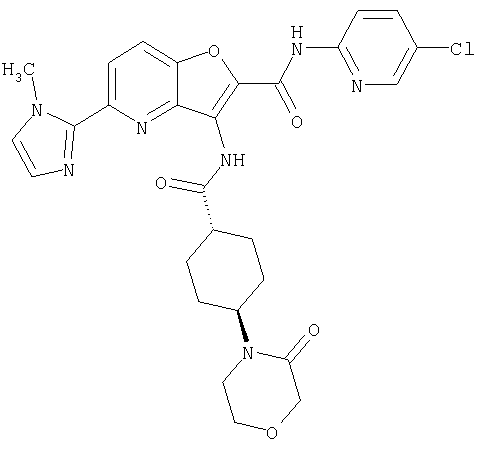
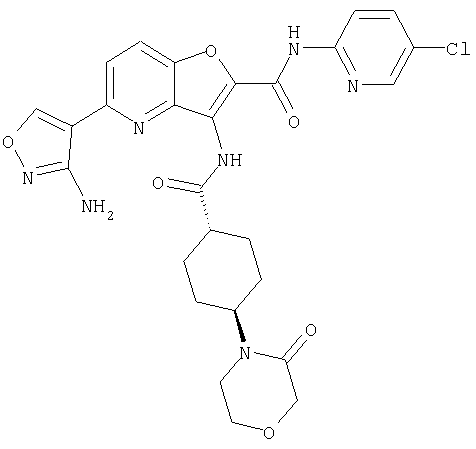
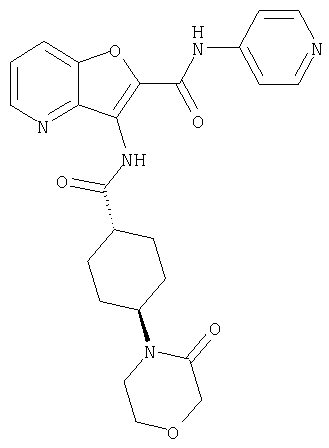
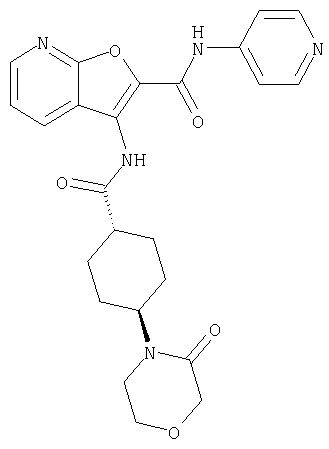
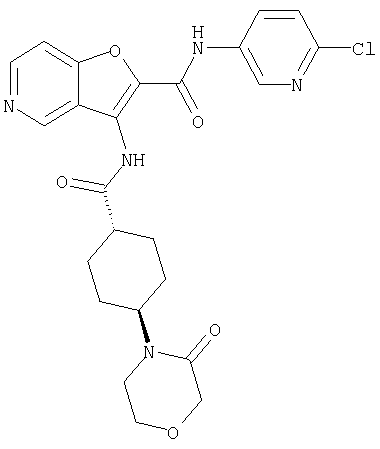
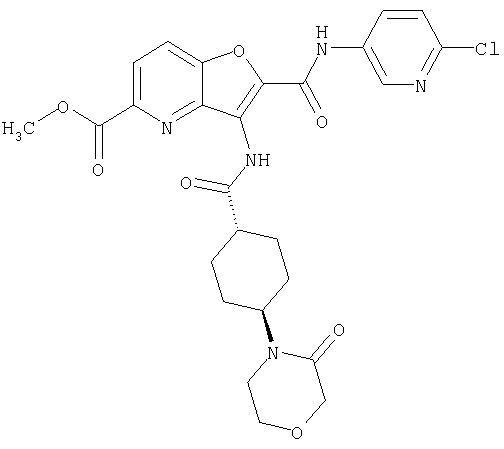
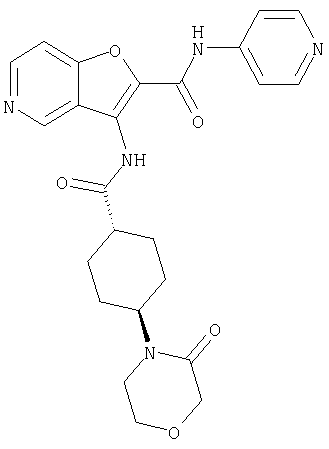
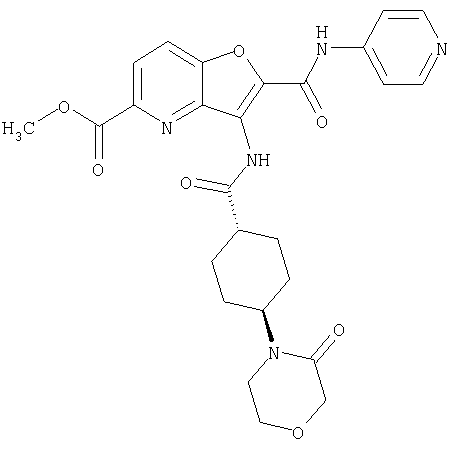
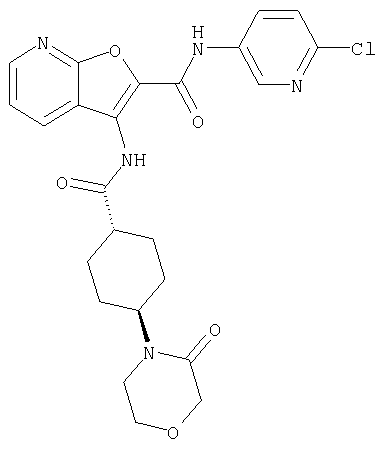
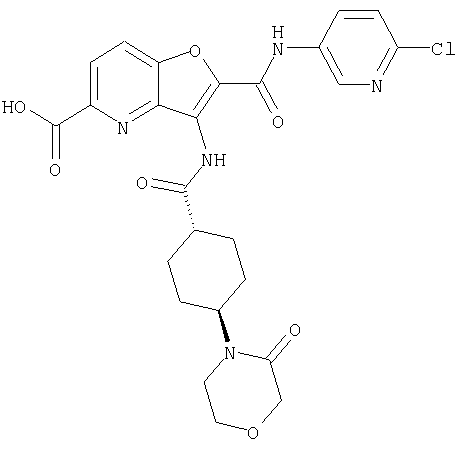
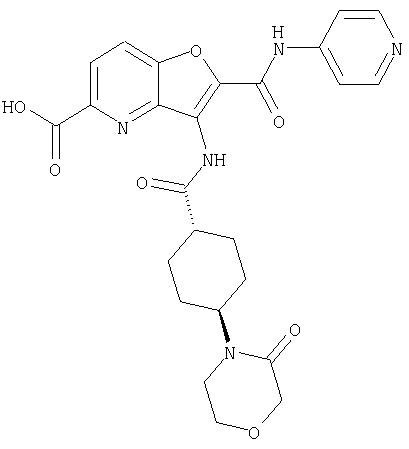
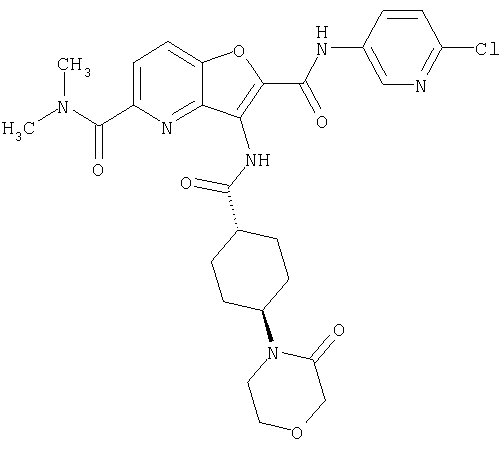
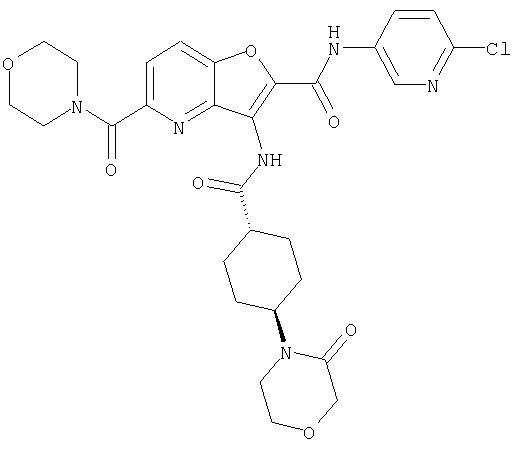
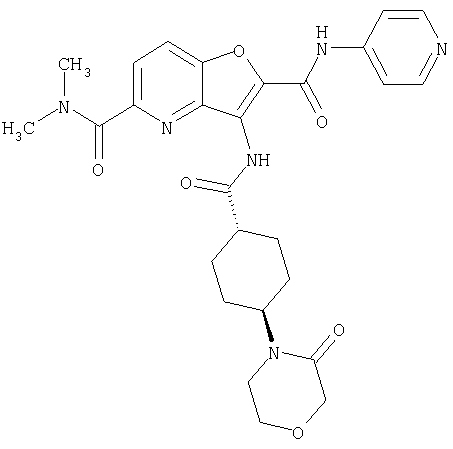
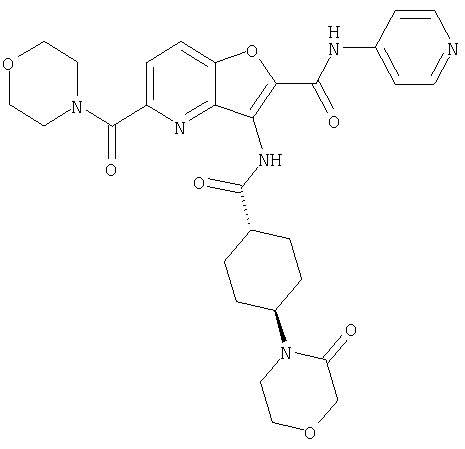
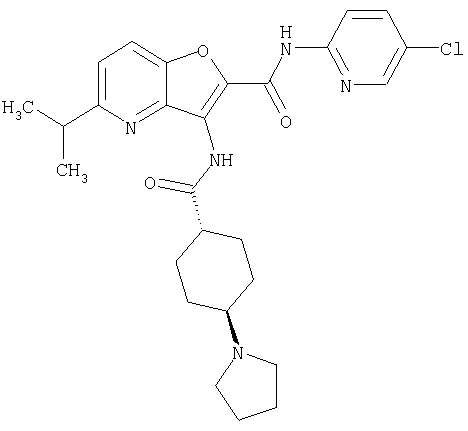
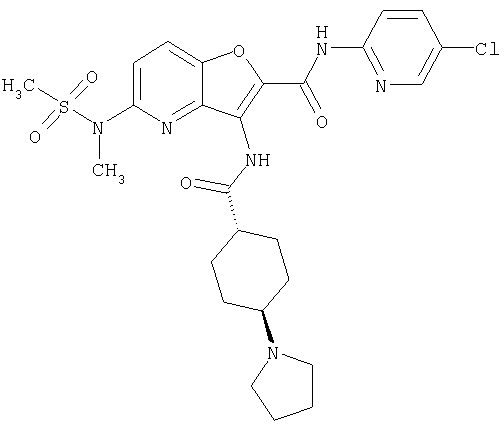
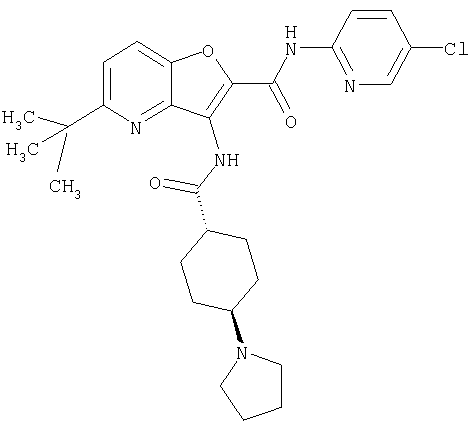
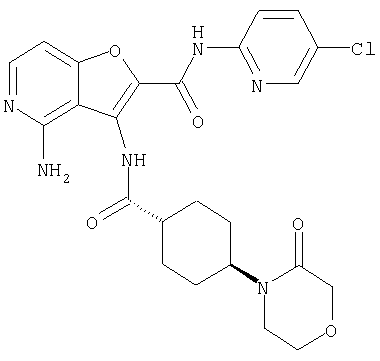

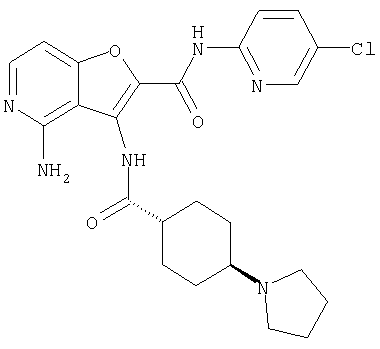
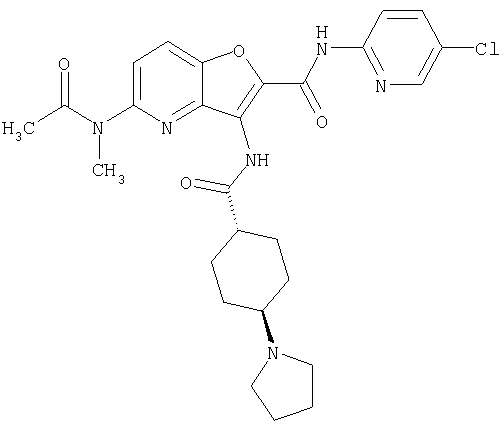
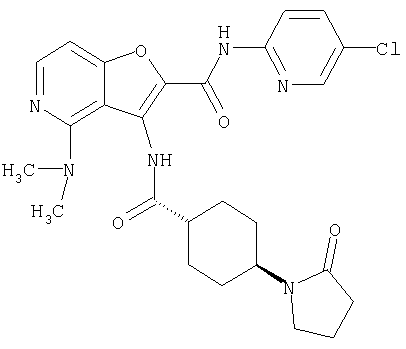
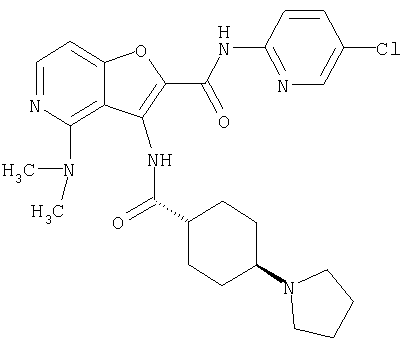
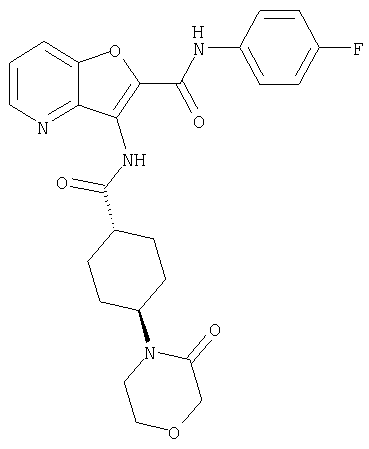
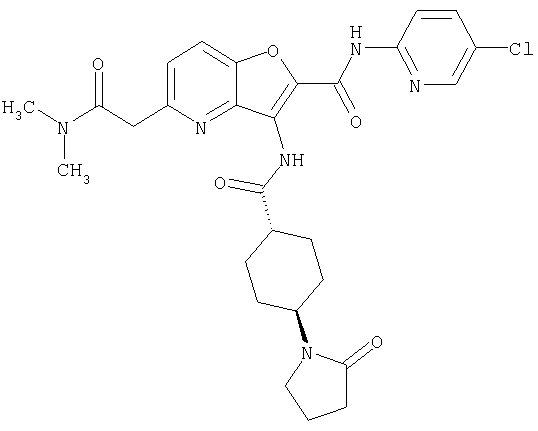
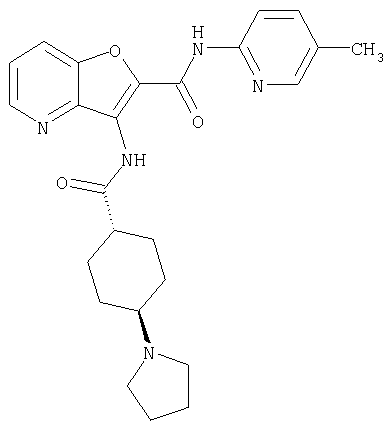
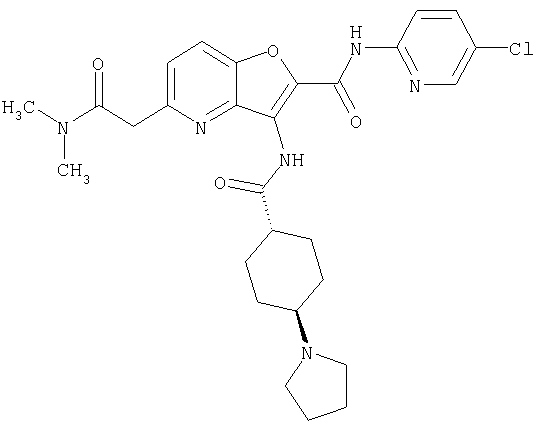
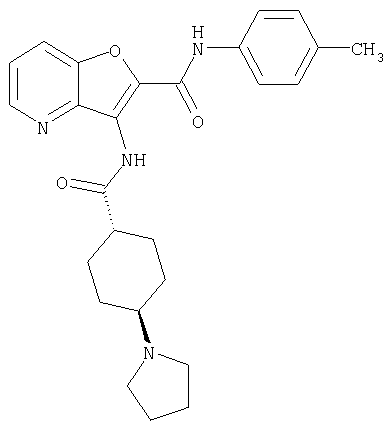
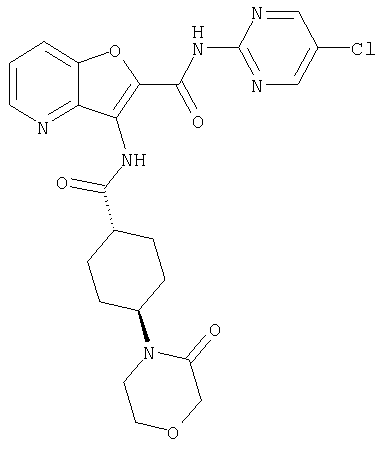
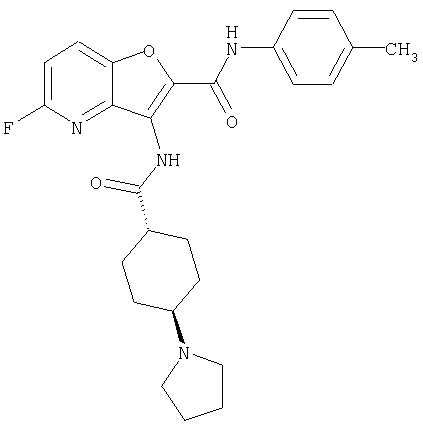
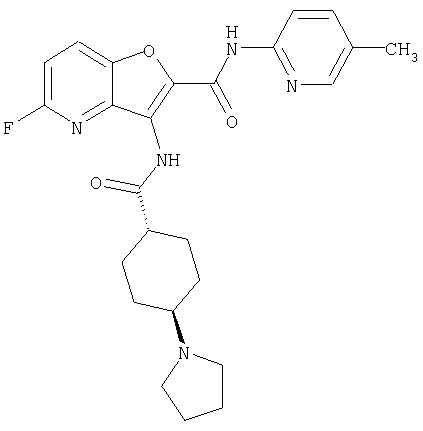

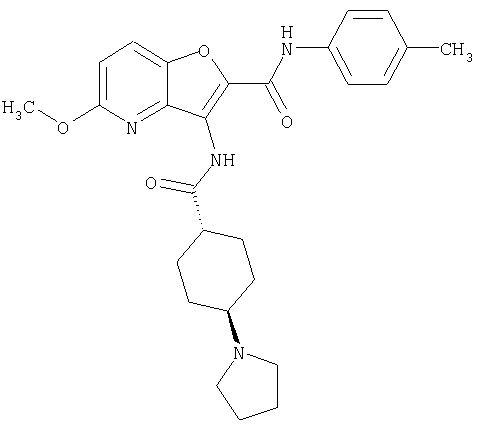
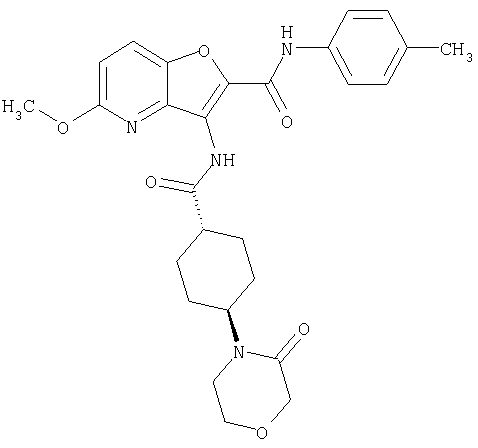
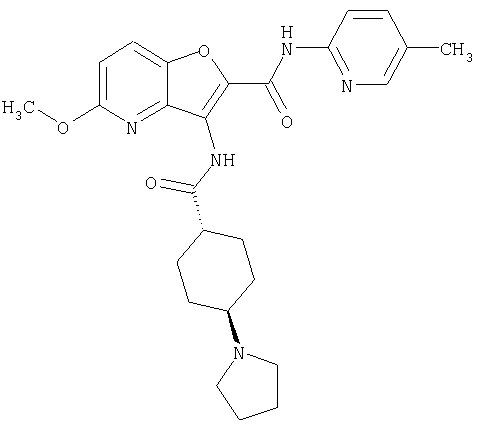
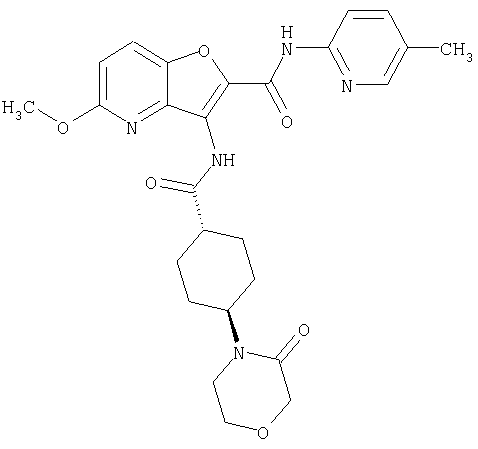
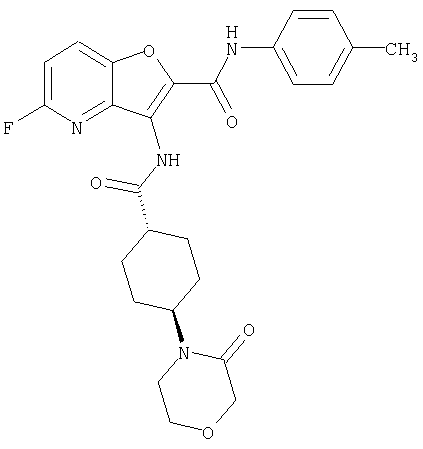
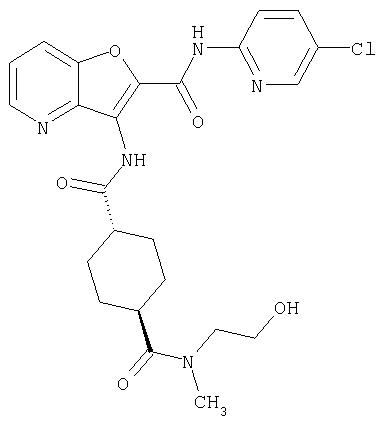
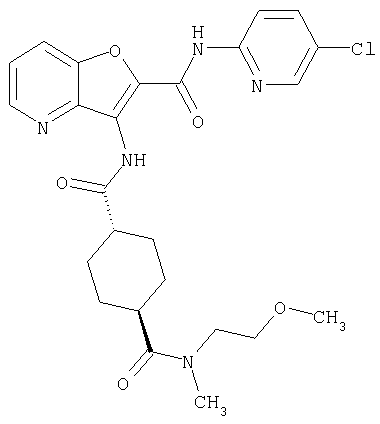
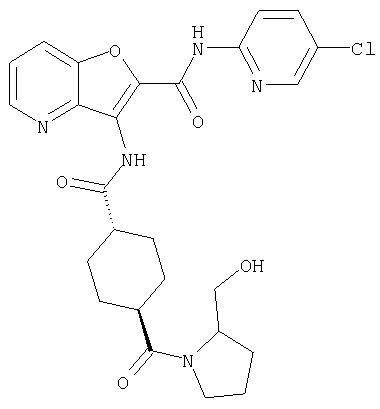
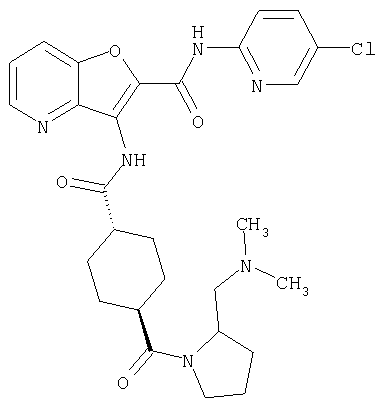
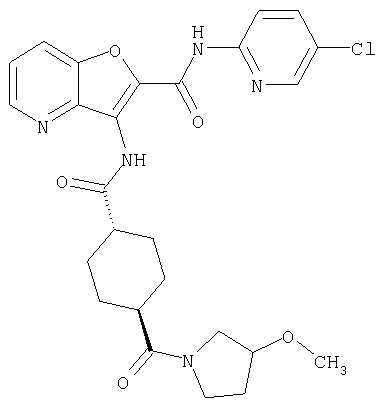
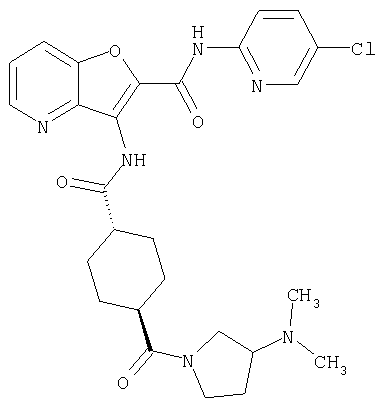

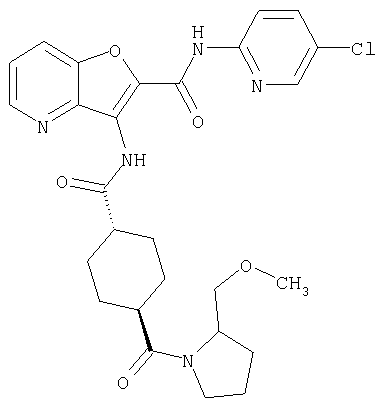
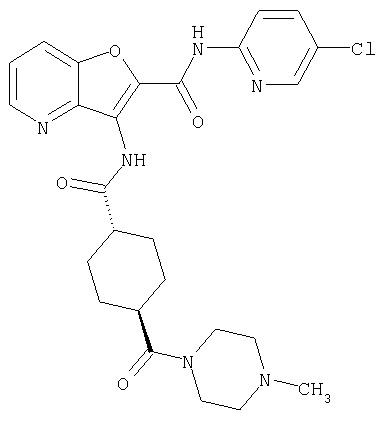
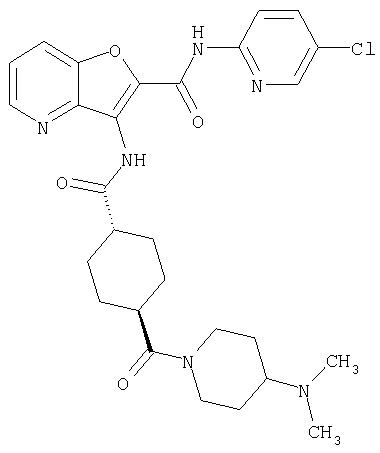
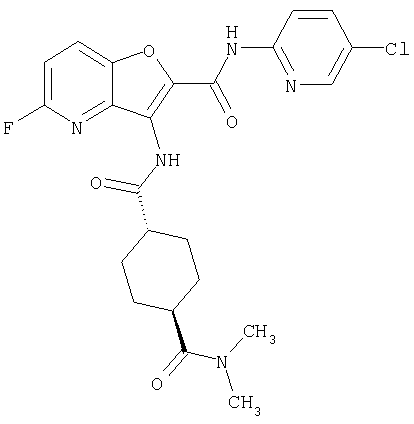
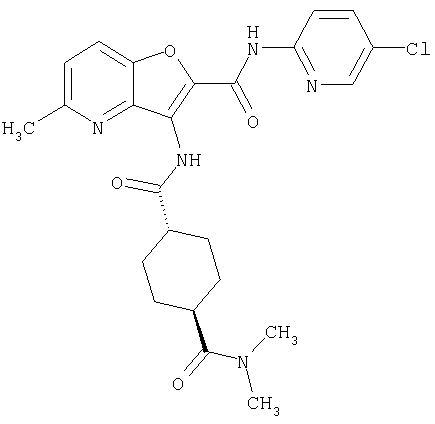
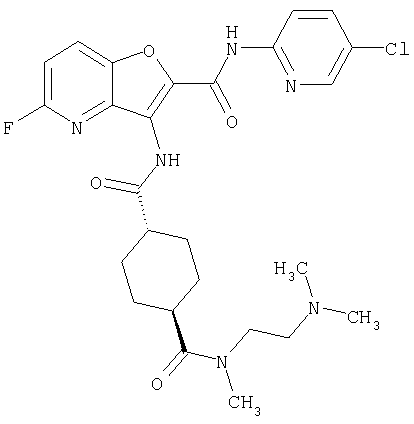
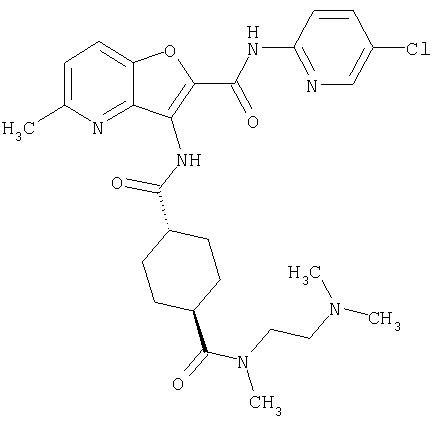
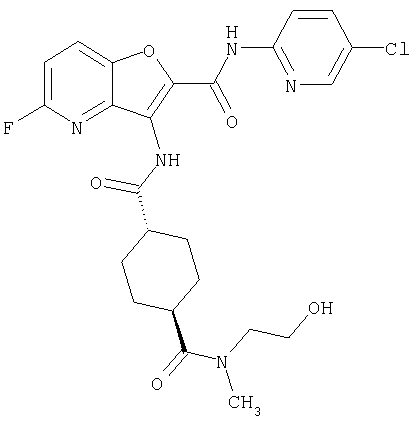
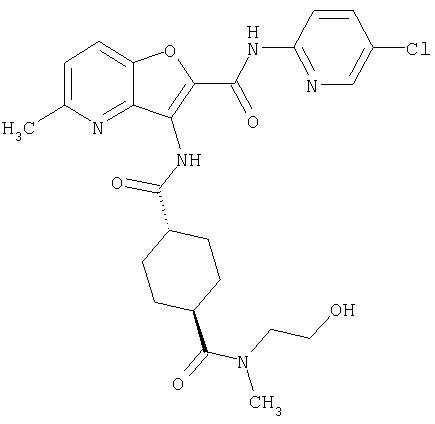
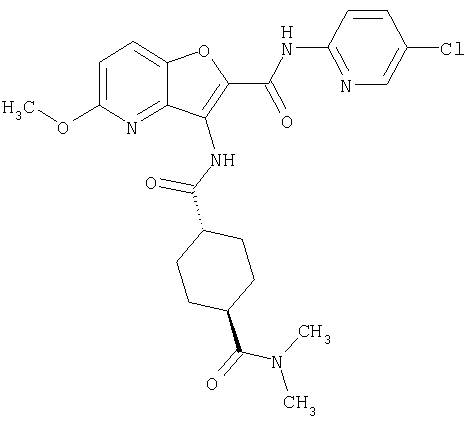
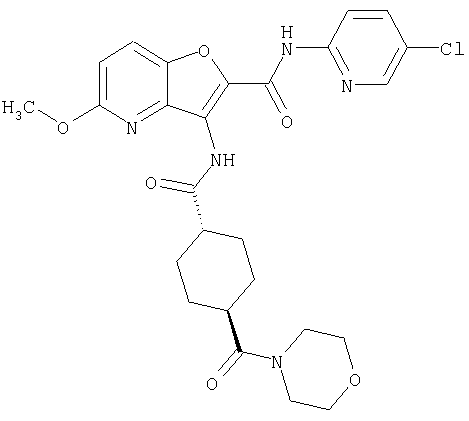
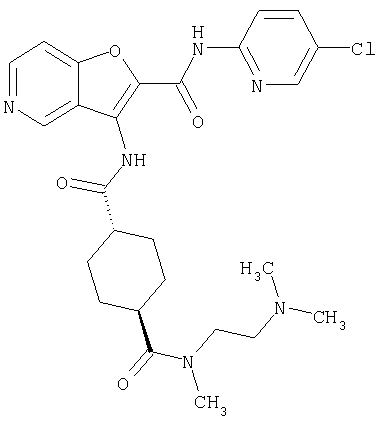
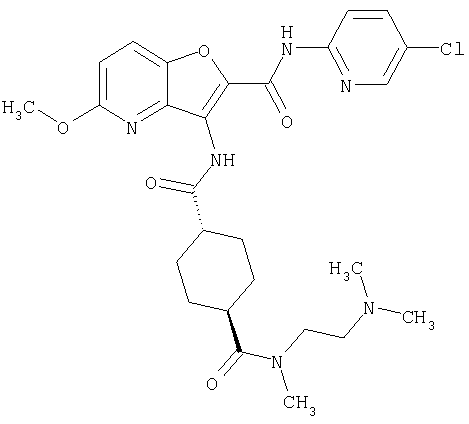
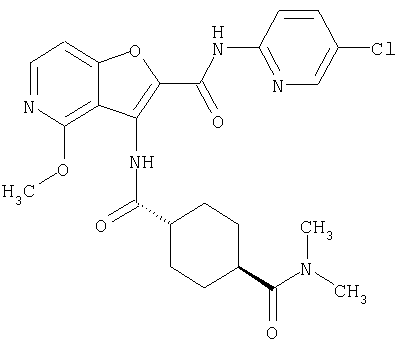
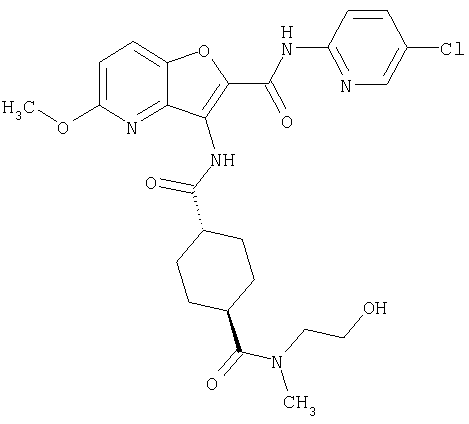
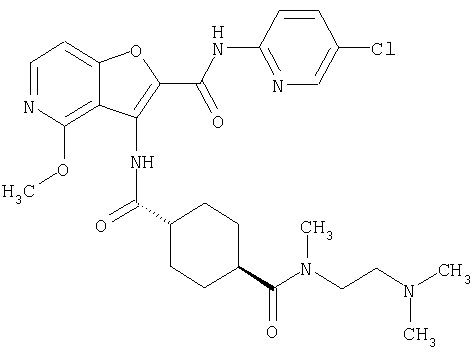
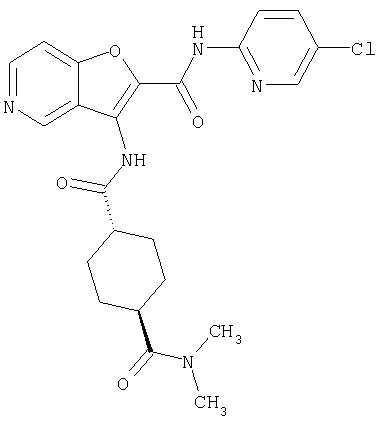
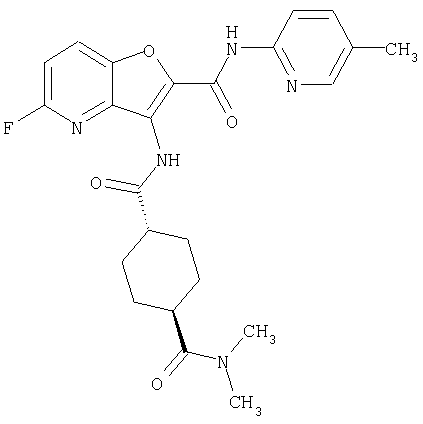
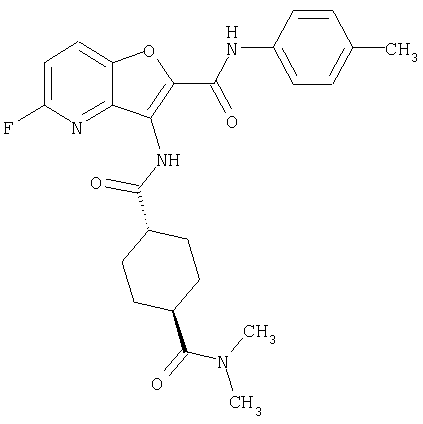
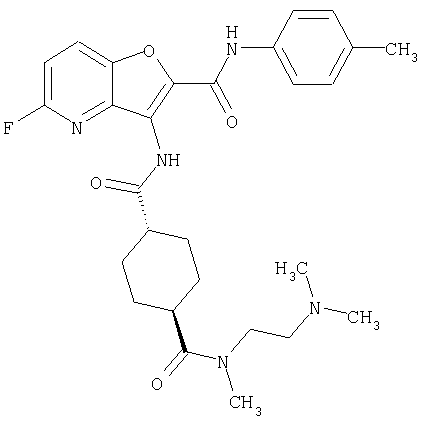

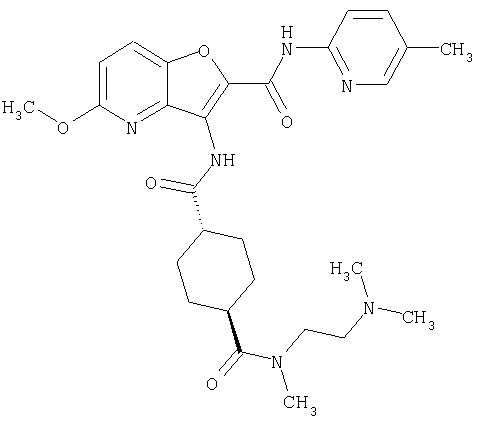
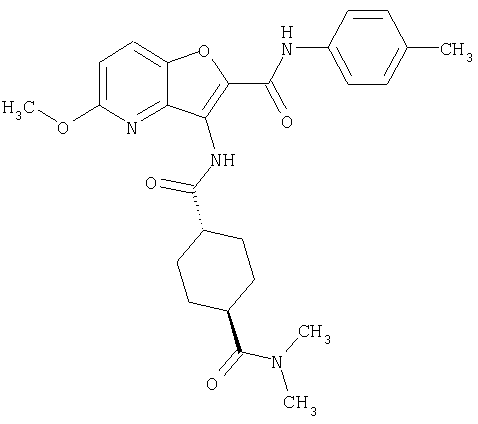
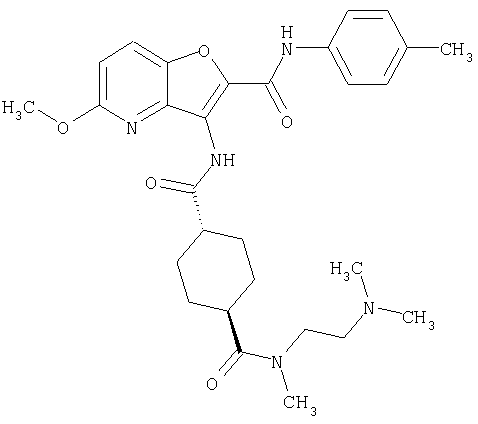
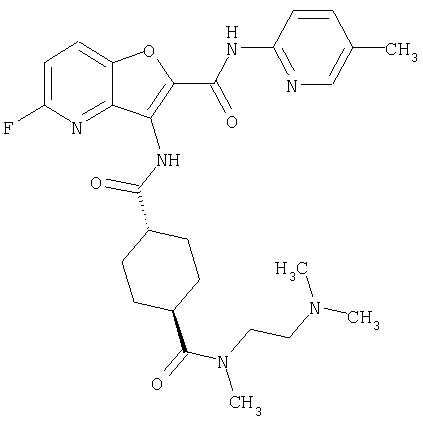
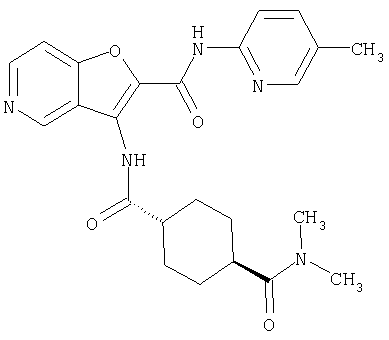
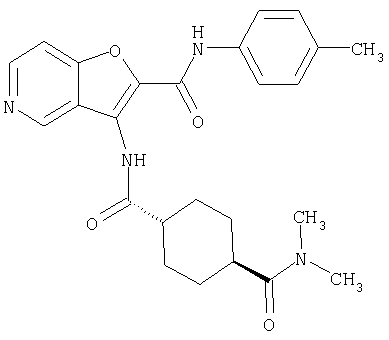
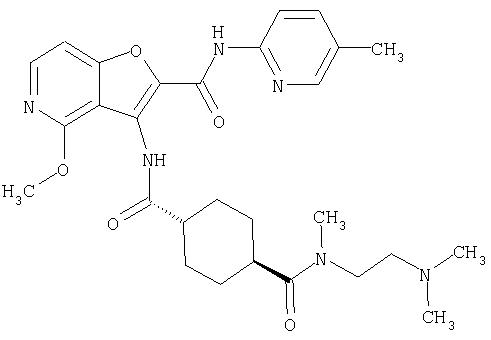
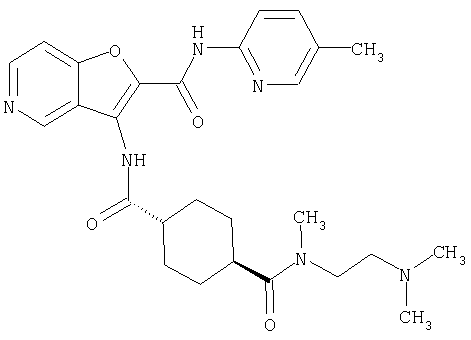
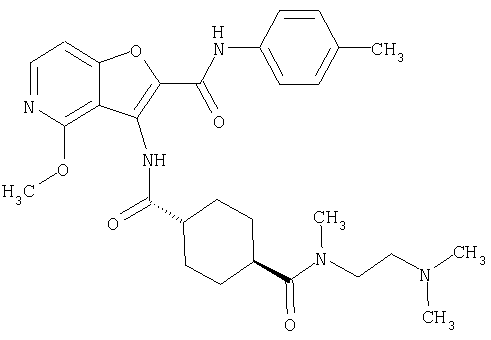
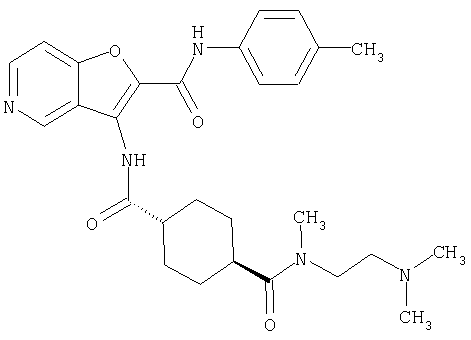
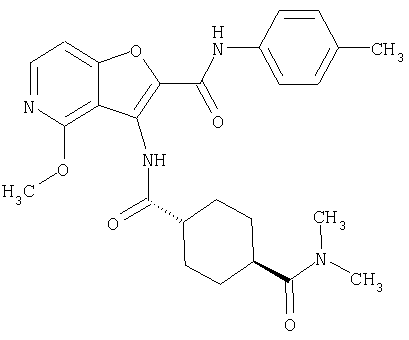
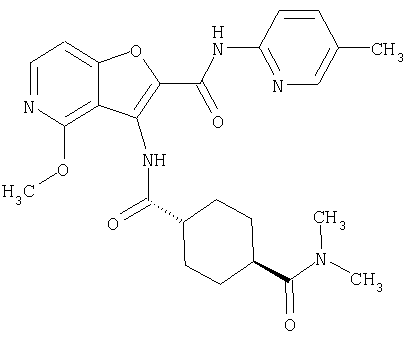
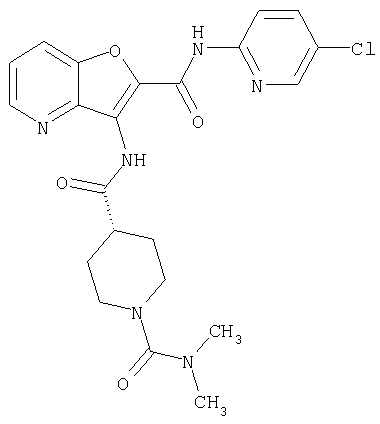
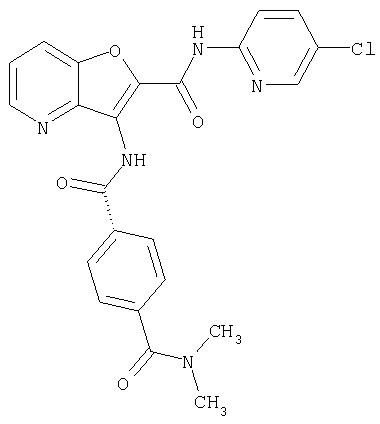
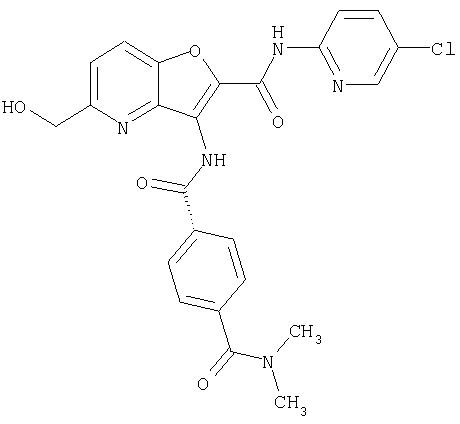
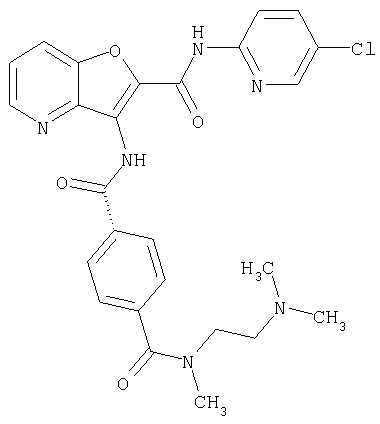
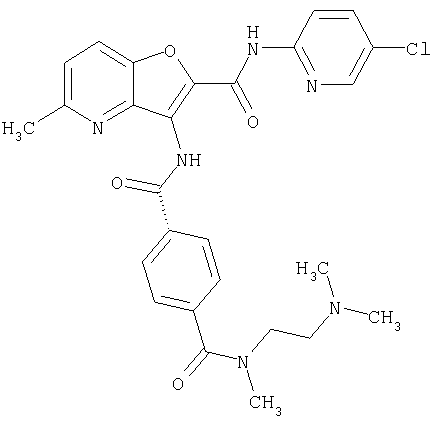
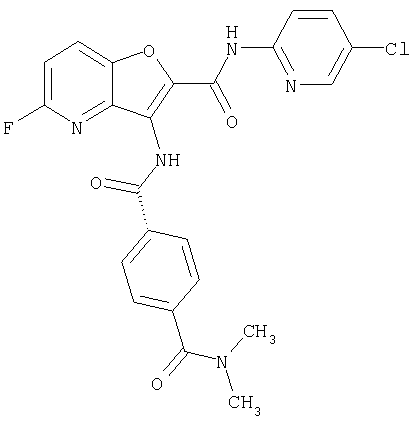
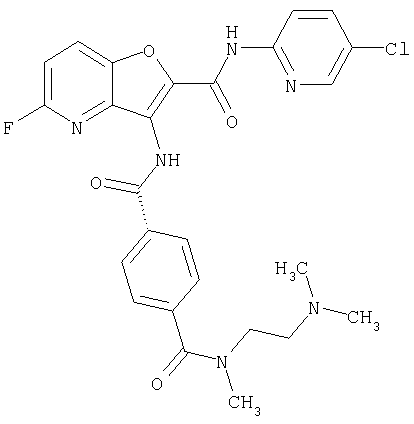
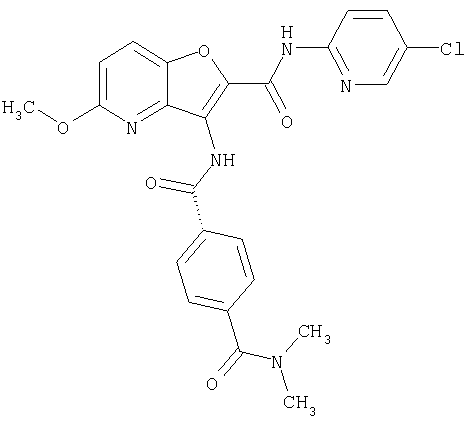
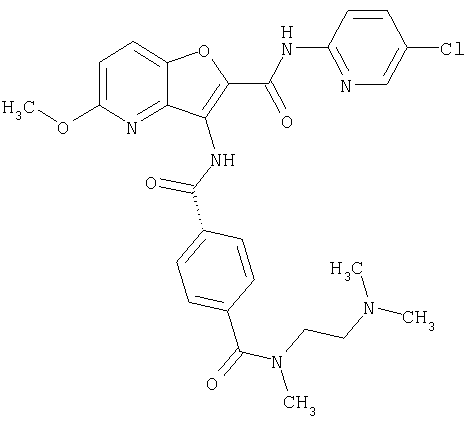
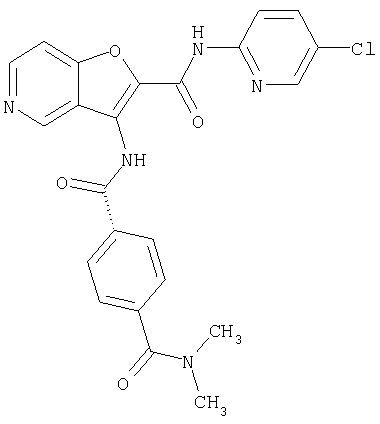
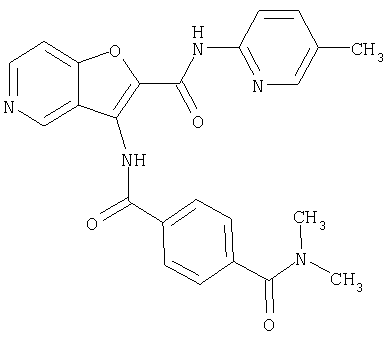
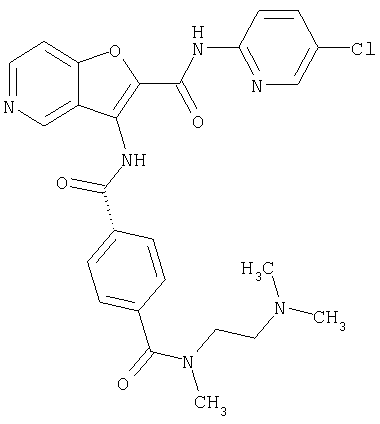
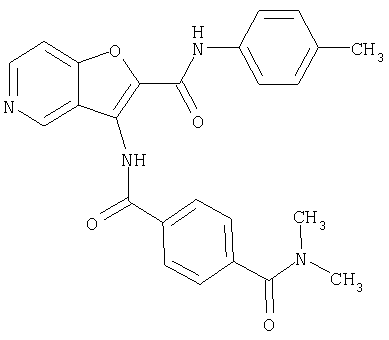
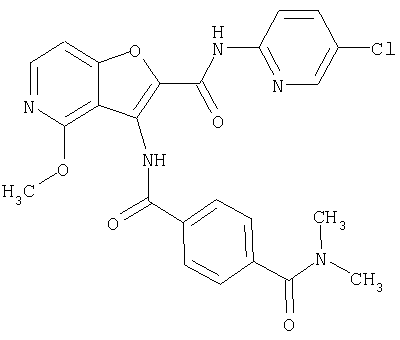
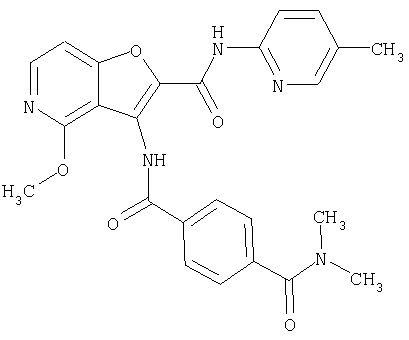
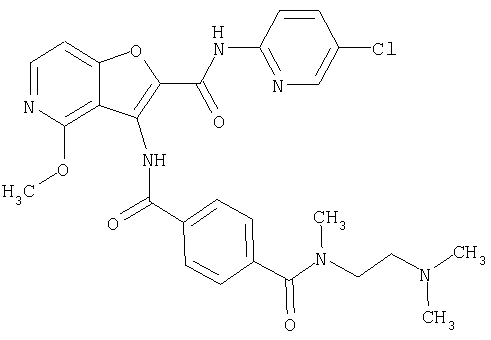
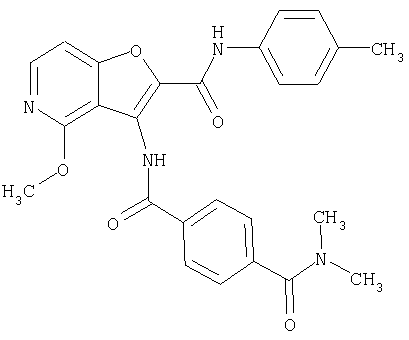
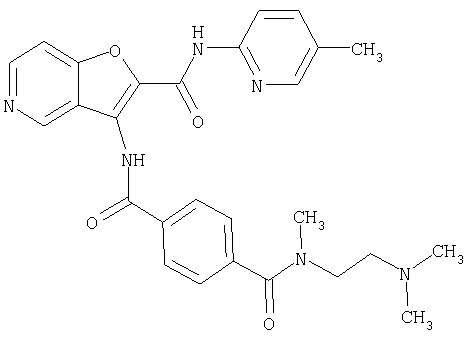
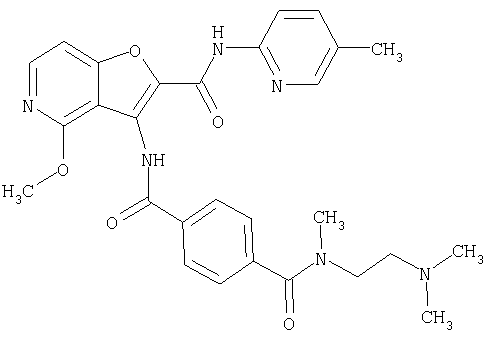
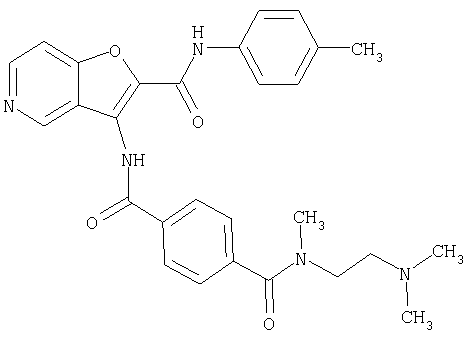
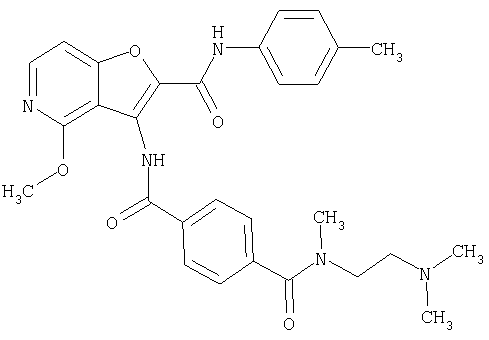
Ссылочный пример 1: Метил-транс-4-[(трет-бутоксикарбонил)амино]-циклогексанкарбоксилат
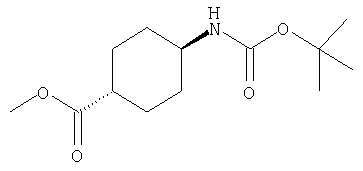
(1) Тионилхлорид (254 мл) добавляют по каплям в метанол (1500 мл) при охлаждении до температуры -30°С в течение около часа. После добавления, реакционную смесь перемешивают при комнатной температуре в течение 0.5 часов, после чего добавляют транс-циклогексан-1,4-дикарбоновую кислоту (500.0 г) и смесь перемешивают при комнатной температуре в течение 17 часов. Реакционный раствор концентрируют при пониженном давлении. Остаток разбавляют хлороформом и промывают насыщенным водным раствором гидрокарбоната натрия и насыщенным рассолом. Органический слой сушат над сульфатом натрия и выпаривают, чтобы удалить растворитель при пониженном давлении. Полученный остаток кристаллизуют из н-гексана. Продукт собирают фильтрованием и сушат, что дает диметил-транс-циклогексан-1,4-дикарбоксилат (545.0 г).
APCI-MS м/е: 201[М+Н]+.
(2) Диметил-транс-циклогексан-1,4-дикарбоксилат (150.0 г), полученный в (1) выше, растворяют в тетрагидрофуране (1500 мл) и в раствор добавляют по каплям 28% раствор смеси метоксид натрия/метанол (149 г) и воды (13.2 г) при охлаждении льдом. Реакционный раствор нагревают до комнатной температуры, перемешивают в течение 3.5 часов, после чего выливают н-гексан (1500 мл) и смесь фильтруют, чтобы собрать осадок. Полученное твердое вещество добавляют в смесь концентрированной соляной кислоты (50 мл), воды (450 мл) и хлороформа (1000 мл) при охлаждении льдом и смесь перемешивают при комнатной температуре в течение 20 минут. Слой хлороформа отделяют, и водный слой экстрагируют хлороформом. Органические слои объединяют, сушат над сульфатом натрия и выпаривают, чтобы удалить растворитель при пониженном давлении. Полученный остаток выкристаллизовывают из н-гексана, собирают фильтрованием и сушат, что дает транс-4-(метоксикарбонил)циклогексанкарбоновую кислоту (106.0 г).
ESI-MS м/e: 185[M-H]-.
(3) Транс-4-(метоксикарбонил)циклогексанкарбоновую кислоту (100.0 г), полученную в (2) выше, растворяют в трет-бутаноле (1000 мл), после чего в реакционную массу добавляют дифенилфосфорилазид (155 г) и триэтиламин (78.6 мл). Смесь нагревают при температуре около 60°С в течение часа и затем нагревают при температуре кипения с обратньм холодильником в течение еще 17 часов. После охлаждения, в реакционный раствор добавляют воду со льдом, и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором гидрокарбоната натрия и насыщенным рассолом, сушат над сульфатом натрия и выпаривают, чтобы удалить растворитель при пониженном давлении. Полученный остаток растворяют в метаноле (250 мл) и туда добавляют воду (750 мл) и смесь перемешивают при охлаждении льдом. Через 0.5 часа, осадок собирают фильтрованием, промывают последовательно водой/метанолом (3:1, 1000 мл) и н-гексаном и сушат, что дает названное соединение (117.0 г).
APCI-MS м/е: 275[M+H]+.
Ссылочный пример 2: Транс-4-(2-оксопирролидин-1-ил)циклогексанкарбоновая кислота
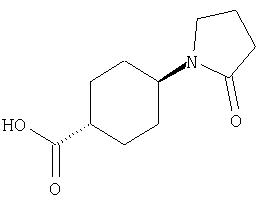
(1) Метил-транс-4-[(трет-бутоксикарбонил)амино]-циклогексанкарбоксилат (234.0 г), полученный в ссылочном примере 1, растворяют в диоксане (500 мл), после чего к реакционной массе добавляют 4 N раствор хлористый водород/диоксан (500 мл), смесь перемешивают при комнатной температуре в течение 19 часов. Реакционный раствор концентрируют при пониженном давлении и полученный остаток суспендируют в диэтиловом эфире. Осадок собирают фильтрованием, что дает гидрохлорид метил-транс-4-аминоциклогексанкарбоксилат (121.9 г).
APCI-MS м/e: 158[M+H]+.
(2) Гидрохлорид метил-транс-4-аминоциклогексанкарбоксилата (45.31 г), полученный в (1), как указано выше, суспендируют в дихлорметане (1000 мл), после чего к реакционной массе добавляют 4-хлорбутирилхлорид (31.5 мл) при охлаждении льдом, затем по каплям добавляют раствор триэтиламина (81.5 мл) в дихлорметане (80 мл). Реакционный раствор нагревают до комнатной температуры, перемешивают в течение 3 часов и концентрируют при пониженном давлении. В полученный остаток выливают этилацетат и 5% раствор соляной кислоты, и органический слой отделяют, промывают насыщенным водным раствором гидрокарбоната натрия и насыщенным рассолом. Органический слой сушат над сульфатом натрия, обрабатывают активированным углем и фильтрат концентрируют при пониженном давлении. Полученный остаток суспендируют в диизопропиловом эфире. Осадок собирают фильтрованием и сушат, что дает метил-транс-4-[(4-хлорбутаноил)амино]циклогексанкарбоксилат (38.81 г).
APCI-MS м/e: 262/264[M+H]+.
(3) 60% Раствор гидрида натрия в масле (9.60 г), суспендируют в N,N-диметилацетамиде (500 мл) и в смесь добавляют небольшими порциями при охлаждении льдом метил-транс-4-[(4-хлорбутаноил)амино)]циклогексанкарбоксилат (52.32 г), полученный в (2), как указано выше. Реакционный раствор нагревают до комнатной температуры, перемешивают в течение 24 часов, после чего в него выливают насыщенный водный раствор хлорида аммония и воду со льдом. Реакционную смесь экстрагируют хлороформом. Органический слой промывают насыщенным рассолом, сушат над сульфатом магния и выпаривают, чтобы удалить растворитель при пониженном давлении. Полученный остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: этилацетат) и остаток суспендируют в смеси н-гексан/диизопропиловый эфир. Полученные кристаллы собирают фильтрованием и сушат, что дает метил-транс-4-(2-оксопирролидин-1-ил)циклогексанкарбоксилат (39.20 г).
APCI-MS м/е: 266[М+Н]+.
(4) Метил-транс-4-(2-оксопирролидин-1-ил)циклогексанкарбоксилат (39.15 г), полученный в (3), как указано выше, растворяют в метаноле (400 мл), после чего к реакционной массе добавляют 2 N водный раствор гидроксида натрия (174 мл). Смесь перемешивают при комнатной температуре в течение 3 часов. Значение рН реакционного раствора доводят до 1-2 с помощью 10% раствора соляной кислоты при охлаждении льдом и насыщенного раствора хлорида натрия, затем экстрагируют хлороформом. Органический слой сушат над сульфатом натрия и затем выпаривают, чтобы удалить растворитель при пониженном давлении. Полученный остаток суспендируют в небольшом количестве этилацетата и выливают туда диизопропиловый эфир. Полученные кристаллы собирают фильтрованием, промывают диизопропиловым эфиром несколько раз и сушат, что дает названное соединение (35.94 г).
ESI-MS м/е: 210[М-Н]-.
Ссылочный пример 3: Транс-4-[ацетил(метил)амино]циклогексанкарбоновая кислота
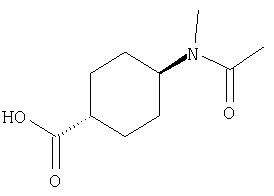
(1) Метил-транс-4-[(трет-бутоксикарбонил)амино]циклогексанкарбоксилат (30.00 г), полученный в ссылочном примере 1, растворяют в N,N-диметилформамиде (150 мл), после чего к реакционной массе добавляют 60% раствор гидрида натрия в масле (5.60 г) при охлаждении льдом. После перемешивания в течение 0.5 часов в тех же самых условиях охлаждения, в реакционный раствор последовательно добавляют метилиодид (14.5 мл) и метанол (0.15 мл). Реакционный раствор нагревают до комнатной температуры и перемешивают в течение 4 часов. При охлаждении льдом, в реакционный раствор выливают насыщенный водный раствор хлорида аммония и воду со льдом, и смесь экстрагируют этилацетатом. Органический слой промывают последовательно водой и насыщенным рассолом, сушат над сульфатом натрия и выпаривают, чтобы удалить растворитель при пониженном давлении. Полученный остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: н-гексан/этилацетат = 10/1, затем 7/1), что дает метил-транс-4-[(трет-бутоксикарбонил)(метил)амино)]циклогексанкарбоксилат (26.33 г).
APCI-MS м/e: 272[M+H]+.
(2) Метил-транс-4-[(трет-бутоксикарбонил)(метил)амино]циклогексанкарбоксилат (26.32 г), полученный в (1), как указано выше, растворяют в диоксане (100 мл), после чего к реакционной массе добавляют 4 N раствор хлористый водород/диоксан (100 мл). Реакционный раствор перемешивают при комнатной температуре в течение 4 часов и в раствор выливают диизопропиловый эфир (500 мл). Осадок собирают фильтрованием, промывают диизопропиловым эфиром и сушат, что дает гидрохлорид метил-транс-4-(метиламино)циклогексанкарбоксилата (19.01 г). APCI-MS м/е: 172[M+Н]+.
(3) Гидрохлорид метил-транс-4-(метиламино)циклогексанкарбоксилата (18.93 г), полученный в (2), как указано выше, суспендируют в дихлорметане (400 мл) и в раствор добавляют ацетилхлорид (8.42 мл) при охлаждении льдом, затем по каплям добавляют раствор триэтиламина (38.1 мл) в дихлорметане (40 мл). Реакционный раствор нагревают до комнатной температуры и перемешивают в течение 2 часов. После добавления 5% раствора соляной кислоты, смесь экстрагируют дихлорметаном. Органический слой промывают насыщенным рассолом, сушат над сульфатом натрия и выпаривают, чтобы удалить растворитель при пониженном давлении. Полученный остаток очищают с помощью хроматографии на колонке с NH-силикагелем (элюент: этилацетат), что дает метил-транс-4-[ацетил(метил)амино]циклогексанкарбоксилат (19.05 г).
APCI-MS м/е: 214[М+Н]+.
(4) Метил-транс-4-[ацетил(метил)амино]циклогексанкарбоксилат (19.00 г), полученный в (3), как указано выше, растворяют в метаноле (200 мл), после чего к реакционной массе добавляют 2 N водный раствор гидроксида натрия (60 мл). Затем смесь перемешивают при комнатной температуре в течение 3 часов. При охлаждении льдом значение рН реакционного раствора доводят до 1-2, приливая 10% раствор соляной кислоты, насыщенный хлоридом натрия, и затем экстрагируют хлороформом. Органический слой сушат над сульфатом натрия и выпаривают, чтобы удалить растворитель при пониженном давлении. Полученный остаток суспендируют в небольшом количестве этилацетата и в смесь выливают диизопропиловый эфир. Кристаллы собирают фильтрованием, промывают диизопропиловым эфиром несколько раз и сушат, что дает названное соединение (16.31 г).
ESI-MS м/e: 198[M-H]-.
Ссылочный пример 4: Транс-4-(3-оксоморфолин-4-ил)циклогексанкарбоновая кислота
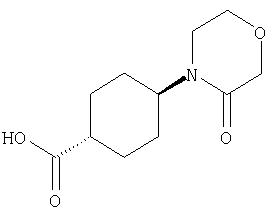
(1) 60% Раствор гидрида натрия в масле (6.80 г) суспендируют в N,N-диметилацетамиде (80 мл) и в смесь добавляют по каплям раствор 2-(бензилокси)этанола (12.9 г) в N,N-диметилацетамиде (50 мл) в течение 10 минут при охлаждении льдом. После перемешивания при комнатной температуре в течение 15 минут, реакционный раствор охлаждают льдом, после чего к реакционной массе добавляют небольшими порциями хлоруксусную кислоту (8.13 г). Затем смесь перемешивают при комнатной температуре в течение часа. Реакционный раствор концентрируют при пониженном давлении и в полученный остаток добавляют водный раствор гидрокарбоната натрия и смесь промывают диэтиловым эфиром. Водный слой подкисляют концентрированной соляной кислотой и затем экстрагируют этилацетатом. Органический слой промывают насыщенным рассолом, сушат над сульфатом натрия и выпаривают, чтобы удалить растворитель при пониженном давлении, что дает [2-(бензилокси)этокси]уксусную кислоту (18.24 г).
ESI-MS м/е: 209[М-Н]-.
(2) [(2-Бензилокси)этокси]уксусную кислоту (6.51 г), полученную в (1), как указано выше, гидрохлорид метил-транс-4-аминоциклогексанкарбоксилата (5.27 г), полученный в ссылочном примере 2(1), и 1-гидроксибензотриазол (5.06 г) растворяют в N,N-диметилформамиде (100 мл). В смесь добавляют последовательно гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (7.10 г) и триэтиламин (4.50 мл) при охлаждении льдом и смесь перемешивают при комнатной температуре в течение 3 дней. Реакционный раствор концентрируют при пониженном давлении и в полученный остаток добавляют водный раствор гидрокарбоната натрия, а затем экстрагируют этилацетатом. Органический слой промывают насыщенным рассолом, сушат над сульфатом натрия и выпаривают, чтобы удалить растворитель при пониженном давлении. Полученный остаток очищают с помощью хроматографии на колонке с силикагелем (элюент:гексан/этилацетат = 1:1, затем этилацетат), что дает метил-транс-4-({[2-(2-бензилокси)этокси]ацетил}амино)циклогексанкарбоксилат (8.24 г).
APCI-MS м/е: 350[М+Н]+.
(3) Метил-транс-4-({[2-(2-бензилокси)этокси]ацетил}амино)-циклогексанкарбоксилат (5.09 г), полученный в (2), как указано выше, растворяют в уксусной кислоте (150 мл), после чего к реакционной массе добавляют 5% палладий на угле (1.01 г) и смесь перемешивают при комнатной температуре в течение 2.4 часов в атмосфере водорода при нормальном давлении. Реакционный раствор фильтруют, чтобы удалить катализатор, и фильтрат концентрируют при пониженном давлении. Полученный остаток растворяют в хлороформе, промывают насыщенным водным раствором гидрокарбоната натрия, сушат над сульфатом натрия и выпаривают, чтобы удалить растворитель, что дает метил-транс-4-{[(2-гидроксиэтокси)ацетил]амино}циклогексанкарбоксилат (3.32 г).
APCI-MS м/е: 260[М+Н]+.
(4) Метил-транс-4-{[(2-гидроксиэтокси)ацетил]амино}циклогексанкарбоксилат (1.37 г), полученный в (3), как указано выше, растворяют в хлороформе (15 мл), после чего к реакционной массе добавляют триэтиламин (890 мкл) при охлаждении льдом. Затем добавляют по каплям метансульфонилхлорид (450 мкл) при той же температуре. Реакционный раствор перемешивают в течение 3 часов при охлаждении льдом, разбавляют водой и экстрагируют хлороформом. Органический слой промывают насыщенным рассолом, сушат над сульфатом натрия и выпаривают, чтобы удалить растворитель при пониженном давлении, что дает метил-транс-4-[({2-метилсульфонил)окси]этокси}ацетил)амино]-циклогексанкарбоксилат (1.83 г).
APCI-MS м/e: 338[M+H]+.
(5) Метил-транс-4-[({2-[(метилсульфонил)окси]этокси}ацетил)амино]-цикло-гексанкарбоксилат (1.08 г), полученный в (4), как указано выше, растворяют в N,N-диметилацетамиде (15 мл), после чего к реакционной массе добавляют 60% раствор гидрида натрия в масле (135 мг) при охлаждении льдом и смесь перемешивают при комнатной температуре в течение 16 часов. Реакционный раствор концентрируют при пониженном давлении и в полученный остаток добавляют воду и избыток хлорида натрия, затем экстрагируют хлороформом. Органический слой сушат над сульфатом натрия и выпаривают, чтобы удалить растворитель при пониженном давлении. Полученный остаток очищают с помощью хроматографии на колонке с силикагелем (элюент:гексан/этилацетат = 1:1, затем этилацетат), что дает метил-транс-4-(3-оксоморфолин-4-ил)циклогексанкарбоксилат (715 мг).
APCI-MS м/е:242[М+Н]+.
(6) Метил-транс-4-(3-оксоморфолин-4-ил)циклогексанкарбоксилат (500 мг), полученный в (5), как указано выше, обрабатывают в соответствии с методикой, аналогичной методике, изложенной в ссылочном примере 2(4), что дает названное соединение (322 мг).
ESI-MS м/е: 226[М-Н]+.
Ссылочный пример 5: Транс-4-(2-оксо-1,3-оксазолидин-3-ил)циклогексанкарбоновая кислота
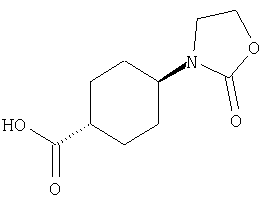
(1) Гидрохлорид метил-транс-4-аминоциклогексанкарбоксилата (5.00 г), полученный в ссылочном примере 2(1), растворяют в хлороформе (60 мл), к реакционной массе добавляют триэтиламин (11 мл) при охлаждении льдом, затем по каплям добавляют раствор 2-хлорэтилхлорформиата (3.3 мл) в хлороформе (10 мл). После перемешивания при комнатной температуре в течение 2.5 часов, в реакционный раствор добавляют 5% раствор соляной кислоты, и смесь экстрагируют хлороформом. Органический слой промывают насыщенным рассолом, сушат над сульфатом натрия и затем выпаривают, чтобы удалить растворитель при пониженном давлении. Полученный остаток суспендируют в смеси хлороформ/диизопропиловый эфир. Осадок собирают фильтрованием и сушат, что дает метил-транс-4-{[(2-хлорэтокси)карбонил]амино}циклогексанкарбоксилат (5.11 г).
APCI-MS м/e: 264/266[M+H]+.
(2) Метил-транс-4-{[(2-хлорэтокси)карбонил]амино}-циклогексанкарбоксилат (3.70 г), полученный в (1), как указано выше, растворяют в N,N-диметилацетамиде (50 мл), после чего к реакционной массе добавляют 60% раствор гидрида натрия в масле (630 мг) при охлаждении льдом. Затем смесь перемешивают при комнатной температуре в течение 16.5 часов. В реакционный раствор добавляют воду, и смесь экстрагируют этилацетатом. Органический слой промывают водой и насыщенным рассолом и затем сушат над сульфатом натрия. Растворитель удаляют путем выпаривания при пониженном давлении и полученный остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: гексан/этилацетат = 1/1, затем этилацетат), что дает метил-транс-4-(2-оксо-1,3-оксазолидин-3-ил)циклогексанкарбоксилат (1.83 г).
APCI-MS м/e: 228[M+H]+.
(3) Метил-транс-4-(2-оксо-1,3-оксазолидин-3-ил)циклогексанкарбоксилат (1.84 г), полученный в (2), как указано выше, обрабатывают в соответствии с методикой, аналогичной методике, изложенной в ссылочном примере 2(4), что дает названное соединение (1.75 г).
ESI-MS м/e: 212[M-H]-.
Ссылочный пример 6: 5-(2-Оксопирролидин-1-ил)пентановая кислота
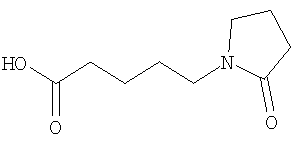
(1) 5-Аминовалериановую кислоту (7.35 г) растворяют в метаноле (50 мл), после чего к реакционной массе добавляют по каплям тионилхлорид (4.9 мл) при охлаждении льдом. Затем его нагревают до комнатной температуры и перемешивают в течение 17 часов. Реакционный раствор концентрируют при пониженном давлении. Полученный остаток суспендируют в диэтиловом эфире и осадок собирают фильтрованием, что дает гидрохлорид метил-5-аминовалерата (9.93 г).
APCI-MS м/е: 132[M+H]+.
(2) Гидрохлорид метил-5-аминовалерата (1.68 г), полученный в (1), как указано выше, суспендируют в хлороформе (20 мл) и в суспензию добавляют триэтиламин (2.54 г) при охлаждении льдом, затем по каплям добавляют 4-хлорбутирилхлорид (1.55 г). Реакционный раствор нагревают до комнатной температуры и перемешивают в течение 2 часов. Воду со льдом выливают в реакционный раствор, и смесь экстрагируют хлороформом. Органический слой промывают 10% раствором соляной кислоты, насыщенным водным раствором гидрокарбоната натрия и насыщенным рассолом и затем сушат над сульфатом натрия. Растворитель выпаривают при пониженном давлении, что дает метил-5-[(4-хлорбутаноил)амино]-пентаноат (2.34 г).
APCI-MS м/е: 236/238[М+Н]+.
(3) Метил-5-[(4-хлорбутаноил)амино]пентаноат (2.33 г), полученный в (2), как указано выше, растворяют в N,N-диметилацетамиде (20 мл), после чего к реакционной массе небольшими порциями добавляют 60% раствор гидрида натрия в масле (0.47 г) при охлаждении льдом. Реакционный раствор нагревают до комнатной температуры, перемешивают в течение 20 часов и выпаривают, чтобы удалить растворитель при пониженном давлении. Полученный остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: хлороформ, затем хлороформ/этилацетат = 20/1), что дает метил-5-(2-оксопирролидин-1-ил)пентаноат (2.15 г).
APCI-MS м/e: 184[M+H]+.
(4) Метил-5-(2-оксопирролидин-1-ил)пентаноат (1.00 г), полученный в (3), как указано выше, растворяют в метаноле (20 мл), после чего к реакционной массе добавляют 4 N водный раствор гидроксида натрия (2.5 мл). Реакционный раствор нагревают до комнатной температуры и перемешивают в течение 18 часов. Реакционный раствор промывают диэтиловым эфиром, после чего к реакционной массе добавляют 2 N соляную кислоту (5.0 мл), а затем концентрируют при пониженном давлении. Полученный остаток экстрагируют хлороформом и сушат над сульфатом натрия. Растворитель выпаривают при пониженном давлении, что дает названное соединение (0.90 г).
ESI-MS м/e: 184[M-H]-.
Ссылочный пример 7: 5-(3-Оксоморфолин-4-ил)пентановая кислота
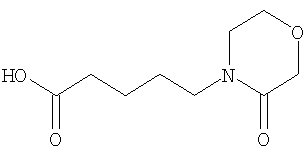
(1) Гидрохлорид метил-5-аминовалерата (3.35 г), полученный в ссылочном примере 6(1), [2-(бензилокси)этокси]уксусную кислоту (4.63 г), полученную в ссылочном примере 4(1), и 1-гидроксибензотриазол (3.78 г) растворяют в N,N-диметилформамиде (80 мл). В смесь добавляют последовательно гидрохлорид 1-этил-3-(3-диметил-аминопропил)карбодиимида (5.37 г) и триэтиламин (3.35 мл) при охлаждении льдом и смесь перемешивают при комнатной температуре в течение 2 дней. Реакционный раствор концентрируют при пониженном давлении, и полученный остаток разбавляют водой со льдом и экстрагируют этилацетатом. Органический слой промывают последовательно водным раствором гидрокарбоната натрия, водой и насыщенным рассолом, сушат над сульфатом натрия и выпаривают, чтобы удалить растворитель при пониженном давлении. Полученный остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: гексан/этилацетат = 1:1, затем этилацетат), что дает метил-5-({[2-(бензилокси)этокси]ацетил}амино)пентаноат (5.56 г).
APCI-MS м/e: 324[M+H]+.
(2) Метил-5-({[2-(бензилокси)этокси]ацетил}амино)пентаноат (5.54 г), полученный в (1), как указано выше, растворяют в тетрагидрофуране (60 мл), после чего в реакционную массу добавляют 20% гидроксид палладия на угле (0.5 г). Затем смесь перемешивают в течение 4 часов при комнатной температуре в атмосфере водорода при нормальном давлении. Реакционный раствор фильтруют, чтобы удалить катализатор, и затем фильтрат концентрируют при пониженном давлении, что дает метил-5-{[(2-гидроксиэтокси)ацетил]амино}пентаноат (3.76 г).
APCI-MS м/е:234[М+Н]+.
(3) Метил-5-{[(2-гидроксиэтокси)ацетил]амино}пентаноат (1.17 г), полученный в (2), как указано выше, растворяют в хлороформе (15 мл), после чего к реакционной массе добавляют триэтиламин (0.84 мл) при охлаждении льдом. Затем в смесь добавляют по каплям метансульфонилхлорид (0.43 мл) при той же температуре. Реакционный раствор нагревают до комнатной температуры, перемешивают в течение часа, и к реакционной массе выливают воду со льдом, затем экстрагируют хлороформом. Органический слой промывают насыщенным рассолом, сушат над сульфатом натрия и выпаривают, чтобы удалить растворитель при пониженном давлении, что дает метил-5-[({2-[(метилсульфонил)окси]этокси}-ацетил)амино]пентаноат (1.51 г).
APCI-MS м/е: 312[М+Н]+.
(4) Метил-5-[({2-[(метилсульфонил)окси]этокси}ацетил)амино]-пентаноат (1.48 г), полученный в (3), как указано выше, растворяют в N,N-диметилацетамиде (22 мл), после чего к реакционной массе добавляют 60% раствор гидрида натрия в масле (0.20 г) при охлаждении льдом. Затем смесь перемешивают при комнатной температуре в течение 18 часов. Воду со льдом выливают в реакционный раствор, и смесь экстрагируют хлороформом. Органический слой промывают насыщенным рассолом, сушат над сульфатом натрия и растворитель удаляют путем выпаривания при пониженном давлении. Полученный остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: гексан/этилацетат = 1/1, затем этилацетат), что дает метил-5-(3-оксоморфолин-4-ил)пентаноат (0.93 г).
APCI-MS м/е: 216[М+Н]+.
(5) Метил-5-(3-оксоморфолин-4-ил)пентаноат (500 мг), полученный в (4), как указано выше, растворяют в метаноле (10 мл), после чего к реакционной массе добавляют водный раствор (2 мл) гидроксида натрия (0.40 г). Реакционный раствор затем нагревают до комнатной температуры и перемешивают в течение 17 часов. Реакционный раствор концентрируют при пониженном давлении, нейтрализуют с 2 N соляной кислотой и концентрируют при пониженном давлении. Полученный остаток экстрагируют хлороформом, сушат над сульфатом натрия и выпаривают, чтобы удалить растворитель при пониженном давлении, что дает названное соединение (0.35 г).
ESI-MS м/е: 200[М-Н]-.
Ссылочный пример 8: Гидрохлорид транс-4-(диметиламино)циклогексанкарбоновая кислоты
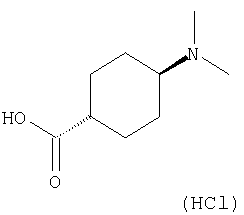
(1) Гидрохлорид метил-транс-4-аминоциклогексанкарбоксилата (93.0 г), полученный в ссылочном примере 2(1), растворяют в метаноле (1000 мл), после чего к реакционной массе добавляют 35% водный раствор формальдегида (95.4 мл), ацетат натрия (39.4 г) и 10% палладий на угле (10 г). Затем смесь перемешивают при комнатной температуре в течение 3.5 часов при атмосферном давлении водорода. Нерастворимые продукты удаляют фильтрованием, и фильтрат концентрируют при пониженном давлении. В полученный остаток выливают 20% водный раствор карбоната натрия (500 мл) и смесь экстрагируют хлороформом. Органический слой сушат над сульфатом натрия и карбонатом натрия и выпаривают, чтобы удалить растворитель при пониженном давлении. Полученный остаток очищают с помощью хроматографии на колонке с NH-силикагелью (элюент: н-гексан/этилацетат = 2/1), что дает метил-транс-4-диметиламиноциклогексанкарбоксилат (87.3 г).
APCI-MS м/е: 186[М+Н]+.
(2) Метил-транс-4-(диметиламино)циклогексанкарбоксилат (27.6 г), полученный в (1), как указано выше, растворяют в диоксане (300 мл) и воде (100 мл), после чего к реакционной массе добавляют 6 N соляную кислоту (50 мл). Смесь нагревают при температуре кипения с обратным холодильником в течение 4 часов. В смесь добавляют еще 6 N соляной кислоты (50 мл) и реакционную смесь нагревают при температуре кипения с обратным холодильником в течение дополнительного часа. Реакционный раствор концентрируют при пониженном давлении и подвергают азеотропной перегонке с помощью толуола. Полученный остаток суспендируют в диизопропиловом эфире. Осадок собирают фильтрованием, промывают диизопропиловым эфиром и сушат, что дает названное соединение (27.5 г).
APCI-MS м/е: 172[М+Н]+.
Ссылочный пример 9: Гидрохлорид транс-4-[(диметиламино)метил]циклогексанкарбоновой кислоты
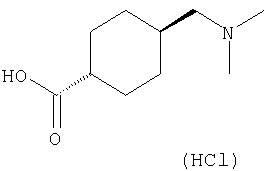
(1) Транс-4-(аминометил)циклогексанкарбоновую кислоту (6.29 г) суспендируют в метаноле (32 мл), после чего к реакционной массе добавляют по каплям тионилхлорид (6 мл) при охлаждении льдом. Реакционный раствор нагревают до комнатной температуры, перемешивают в течение ночи и концентрируют при пониженном давлении досуха, что дает гидрохлорид метил-транс-4-(аминометил)-циклогексанкарбоксилата (8.69 г).
APCI-MS м/е:172[М+Н]+.
(2) Гидрохлорид метил-транс-4-(аминометил)циклогексанкарбоксилата (8.69 г), полученный в (1), как указано выше, суспендируют в дихлорметане (400 мл), после чего к реакционной массе добавляют триэтиламин (11.2 мл). Затем смесь перемешивают при комнатной температуре в течение нескольких минут, после чего к реакционной массе добавляют 35% водный раствор формальдегида (15.9 мл) и триацетоксиборогидрид натрия (25.43 г) при охлаждении льдом. Реакционный раствор нагревают до комнатной температуры и перемешивают в течение 2 часов. Насыщенный водный раствор гидрокарбоната натрия выливают в раствор, и смесь экстрагируют хлороформом. Органический слой промывают последовательно водой и насыщенным рассолом, сушат над сульфатом натрия. Растворитель выпаривают при пониженном давлении, что дает метил-транс-4-[(диметиламино)метил)]-циклогексанкарбоксилат (7.42 г).
APCI-MS м/е: 200[М+Н]+.
(3) Метил-транс-4-[(диметиламино)метил]циклогексанкарбоксилат (7.41 г), полученный в (2), как указано выше, растворяют в диоксане (140 мл), после чего к реакционной массе добавляют 2N соляной кислоты (70 мл). Затем смесь нагревают при температуре кипения с обратньм холодильником в течение 3 часов. После охлаждения, реакционный раствор концентрируют при пониженном давлении. Полученный остаток подвергают азеотропной перегонке с помощью толуола и полученный продукт сушат, что дает названное соединение (8.45 г).
APCI-MS м/е: 186[М+Н]+.
Ссылочный пример 10: Гидрохлорид транс-4-пирролидин-1-илциклогексанкарбоновой кислоты
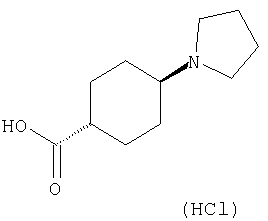
(1) Гидрохлорид метил-транс-4-аминоциклогексанкарбоксилата (10 г), полученный в ссылочном примере 2(1), 1,4-дииодбутан (19.2 г) и карбонат натрия (16.4 г), суспендируют в смеси тетрагидрофурана (300 мл) и N,N-диметилацетамида (60 мл) и смесь перемешивают при температуре 70°С в течение 20 часов. Реакционный раствор концентрируют при пониженном давлении. Остаток растворяют в смеси этилацетат/вода и органический слой отделяют. Органический слой промывают водой и насыщенным рассолом, сушат над сульфатом натрия и выпаривают, чтобы удалить растворитель при пониженном давлении. Полученный остаток очищают с помощью хроматографии на колонке с NH-силикагелью (элюент: этилацетат/гексан = 1/5), что дает метил-транс-4-пирролидин-1-илциклогексанкарбоксилат (10.9 г).
APCI-MS м/е: 212[М+Н]+.
(2) В раствор метил-транс-4-пирролидин-1-илциклогексанкарбоксилата (10.9 г), полученный в (1), как указано выше, в диоксане (150 мл) добавляют 2 N соляной кислоты (80 мл) и смесь перемешивают при температуре 110°С в течение 3 часов, пока происходит выпаривание метанола. Реакционный раствор концентрируют при пониженном давлении.
Полученный остаток суспендируют в диэтиловом эфире и собирают фильтрованием, что дает названное соединение (11.1 г).
APCI-MS м/е: 198[М+Н]+.
Ссылочный пример 11: Гидрохлорид транс-4-морфолин-4-илциклогексанкарбоновой кислоты
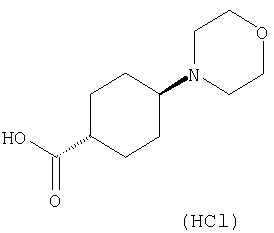
(1) Гидрохлорид метил-транс-4-аминоциклогексанкарбоксилата (47.5 г), полученный в ссылочном примере 2(1), бис(2-хлорэтил)эфир (34.5 мл), карбонат натрия (77.9 г) и иодид натрия (88 г), суспендируют в смеси тетрагидрофурана (1400 мл) и N,N-диметилацетамид (280 мл). Затем смесь нагревают при температуре кипения с обратньм холодильником в течение 18 часов. В реакционный раствор добавляют бис(2-хлорэтил)эфир (23 мл) и иодид натрия (22 г) и смесь нагревают до температуры кипения с обратным холодильником в течение еще 6 часов. Реакционный раствор концентрируют при пониженном давлении. Остаток растворяют в смеси этилацетат/вода и органический слой отделяют, затем органический слой промывают водой и насыщенным рассолом, сушат над сульфатом натрия и выпаривают, чтобы удалить растворитель при пониженном давлении. Полученный остаток очищают с помощью хроматографии на колонке с NH-силикагелью (элюент: этилацетат/гексан = 1/30, затем с помощью смеси этилацетат/гексан = 1/5, затем 1/3), что дает метил-транс-4-морфолин-4-илциклогексанкарбоксилат (53.9 г).
APCI-MS м/e: 228[M+H]+.
(2) В раствор метил-транс-4-морфолин-4-илциклогексанкарбоксилата (53.8 г), полученный в (1), как указано выше, в диоксане (750 мл) добавляют 2 N соляной кислоты (400 мл) и смесь перемешивают при температуре 110 С в течение 4 часов, пока происходит выпаривание метанола. Реакционный раствор концентрируют. Полученный остаток суспендируют в диэтиловом эфире и собирают фильтрованием, что дает названное соединение (54.8 г).
APCI-MS м/е: 214[М+Н]+.
Ссылочный пример 12: Транс-4-[(трет-бутоксикарбонил)(метил)амино]-циклогексанкарбоновая кислота
Метил-транс-4-[(трет-бутоксикарбонил)(метил)амино]циклогексанкарбоксилат (44.78 г), полученный в ссылочном примере 3(1), растворяют в метаноле (300 мл), после чего к реакционной массе добавляют 2N водный раствор гидроксида натрия (100 мл). Затем смесь перемешивают при комнатной температуре в течение 6 часов. Реакционный раствор концентрируют при пониженном давлении. В остаток добавляют воду со льдом, этилацетат и 10% раствор соляной кислоты при охлаждении льдом и смесь экстрагируют этилацетатом. Органический слой промывают последовательно водой и насыщенным рассолом, сушат над сульфатом натрия и выпаривают, чтобы удалить растворитель при пониженном давлении. Полученный остаток суспендируют в небольшом количестве этилацетата и н-гексана и выливают в смесь. Полученные кристаллы собирают фильтрованием, промывают несколько раз смесью н-гексан/диизопропиловый эфир и сушат, что дает названное соединение (39.20 г).
ESI-MS м/е: 256[М-Н]-
Ссылочный пример 13: гидрохлорид [транс-4-(диметиламино)циклогексил]уксусной кислоты
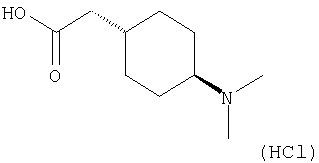
(1) Гидроксид калия (12.8 г) растворяют в воде (30 мл), после чего к реакционной массе добавляют диэтиловый эфир (45 мл). В полученную смесь добавляют N-нитрозо-N-метилмочевину (5.07 г) при охлаждении льдом. Реакционный раствор перемешивают в течение 10 минут в тех же самых условиях охлаждения и органический слой отделяют и сушат над гидроксидом калия, что дает раствор диазометана в диэтиловом эфире.
В атмосфере аргона, транс-4-[(трет-бутоксикарбонил)амино]-циклогексанкарбоновую кислоту (3.0 г), полученную в ссылочном примере 12, суспендируют в диэтиловом эфире (40 мл), после чего к реакционной массе добавляют триэтиламин (1.89 мл) при температуре -10°С, затем по каплям добавляют изобутилхлорформиат (1.75 мл). Реакционный раствор перемешивают при температуре -10°С в течение 30 минут и раствор диазометана в диэтиловом эфире добавляют по каплям в реакционный раствор при температуре -10°C. Реакционный раствор затем нагревают до комнатной температуры и перемешивают в течение 15 часов. При охлаждении льдом, 10% водный раствор лимонной кислоты выливают в раствор и органический слой отделяют. Органический слой промывают насыщенным водным раствором гидрокарбоната натрия, водой и насыщенным рассолом, сушат над сульфатом натрия и выпаривают, чтобы удалить растворитель при пониженном давлении. Полученный остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: этилацетат/гексан = 1/3, затем этилацетат/гексан = 1/2), что дает трет-бутил-[транс-4-(2-диазоацетил)пиклогексил]карбамат (1.86 г).
APCI-MS M/e: 285[M+NH4]+.
(2) трет-Бутил-[транс-4-(2-диазоацетил)циклогексил]карбамат (1.62 г), полученный в (1), как указано выше, растворяют в метаноле (30 мл) в светостойком реакционном сосуде в атмосфере аргона и смесь охлаждают до температуры -25°С. В реакционный раствор добавляют раствор бензоата серебра (153 мг) в триэтиламине (2.4 мл) и смесь нагревают до комнатной температуры и перемешивают в течение 3 часов. Реакционный раствор концентрируют при пониженном давлении. Полученный остаток растворяют в этилацетате и промывают последовательно насыщенным водным раствором гидрокарбоната натрия, насыщенным водным раствором хлорида аммония и насыщенным рассолом. Смесь сушат над сульфатом натрия и выпаривают, чтобы удалить растворитель, что дает метил-{транс-[4-(N-трет-бутоксикарбонил)амино]циклогексил}ацетат (1.25 г).
APCI-MS м/e: 289[M+NH4]+.
(3) В раствор метил-{транс-[4-(N-трет-бутоксикарбонил)амино]-циклогексил} ацетата (1.23 г), полученный в (2), как указано выше, в 1,4-диоксане (8 мл) добавляют 4N раствор смеси хлористого водорода/диоксана (8 мл) и смесь перемешивают при комнатной температуре в течение 5 часов. Реакционный раствор концентрируют досуха при пониженном давлении, что дает гидрохлорид метил-транс-4-аминоциклогексил)ацетата (898 мг).
APCI-MS м/e: 172[М+Н]+.
(4) При охлаждении льдом, триэтиламин (1.2 мл) добавляют в суспензию гидрохлорид метил(транс-4-аминоциклогексил)ацетата (895 мг), полученную в (3), как указано выше, в дихлорметане (30 мл) и смесь перемешивают. Затем последовательно добавляют 35% водный раствор формальдегида (1.71 мл) и триацетоксиборгидрид натрия (2.74 г) при охлаждении льдом. Реакционный раствор нагревают до комнатной температуры и перемешивают в течение 6 часов. Насыщенный водный раствор гидрокарбоната натрия выливают при охлаждении льдом, и смесь экстрагируют хлороформом. Органический слой промывают насыщенным рассолом и сушат над сульфатом натрия. Растворитель удаляют путем выпаривания при пониженном давлении, что дает метил-[транс-4-(диметиламино)циклогексил] ацетат (771 мг).
APCI-MS м/е: 200[М+Н]+.
(5) В раствор метил-[транс-4-(диметиламино)циклогексил]-ацетата (760 мг), полученный в (4), как указано выше, в диоксане (25 мл) добавляют 1N соляной кислоты (15 мл) и смесь нагревают при температуре кипения с обратным холодильником в течение 3 часов. Реакционный раствор концентрируют при пониженном давлении и полученный остаток суспендируют в диэтиловом эфире. Осадок собирают фильтрованием и сушат, что дает названное соединение (795 мг).
APCI-MS м/е: 186[М+Н]+.
Ссылочный пример 14: Гидрохлорид этил пиперидин-4-илацетата
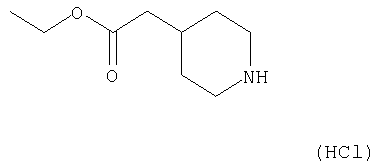
Этил (пиридин-4-ил)ацетат (50.00 г) растворяют в уксусной кислоте (500 мл), после чего к реакционной массе добавляют оксид платины (3.44 г). Смесь встряхивают при комнатной температуре в течение 20 часов при давлении 55 пси в атмосфере водорода. Нерастворимые продукты удаляют фильтрованием, и фильтрат концентрируют при пониженном давлении. Полученный остаток растворяют в диоксане (200 мл), после чего к реакционной массе добавляют 4 N смесь хлористый водород/диоксан (400 мл). Затем смесь выпаривают, чтобы удалить растворитель при пониженном давлении. Полученный остаток суспендируют в смеси диэтиловый эфир/диизопропиловый эфир и осадок собирают фильтрованием. Полученный продукт промывают диизопропиловым эфиром и сушат, что дает названное соединение (61.80 г).
APCI-MS м/е: 172[М+H]+.
Ссылочный пример 15: Гидрохлорид (1-изопропилпиперидин-4-ил)уксусной кислоты
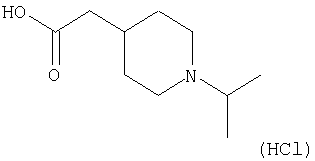
(1) Гидрохлорид этил-(пиперидин-4-ил)ацетата (11.12 г), полученный в ссылочном примере 14, растворяют в этаноле (150 мл), после чего к реакционной массе добавляют 2-иодпропан (6.4 мл) и карбонат натрия (22.2 г). Затем смесь нагревают при температуре кипения с обратным холодильником в течение ночи. Нерастворимые продукты удаляют фильтрованием, и фильтрат концентрируют при пониженном давлении. Остаток разбавляют хлороформом, промывают последовательно водой и насыщенным рассолом, сушат над сульфатом натрия и выпаривают, чтобы удалить растворитель при пониженном давлении. Полученный остаток очищают с помощью хроматографии на колонке с NH-силикагелью (элюент: н-гексан/этилацетат = 10/1), что дает этил (1-изопропилпиперидин-4-ил)ацетат (9.87 г).
APCI-MS м/e: [M+H]+.
(2) К этил-(1-изопропилпиперидин-4-ил)ацетату (9.77 г), полученному в (1), как указано выше, добавляют воду (33 мл) и концентрированную соляную кислоту (66 мл) и смесь нагревают при температуре кипения с обратным холодильником в течение 24 часов. Реакционный раствор концентрируют при пониженном давлении, и остаток подвергают азеотропной перегонке с помощью толуола. Полученный остаток собирают фильтрованием, промывают диизопропиловым эфиром и затем сушат, что дает названное соединение (9.76 г).
APCI-MS м/е: 186[M+Н]+.
Ссылочный пример 16: Гидрохлорид 1-изопропилпиперидин-4-карбоновой кислоты
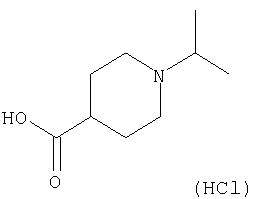
Этилпиперидин-4-карбоксилат обрабатывают в соответствии с методикой, аналогичной методике получения соединения ссылочного примера 15, что дает названное соединение.
APCI-MS м/е: 172[М+H]+.
Ссылочный пример 17: 1-Пиридин-4-илпиперидин-4-карбоновая кислота
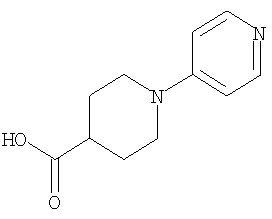
Гидрохлорид 4-хлорпиридина (9.55 г) и триэтиламин (26.0 мл) растворяют в этаноле (10 мл) и воде (30 мл), после чего к реакционной массе добавляют этилизоникотинат (10.00 г). Реакционный раствор затем нагревают при температуре 150°С в течение 96 часов в герметичной колбе. После охлаждения, этанол добавляют в реакционный раствор, и нерастворимые продукты удаляют фильтрованием. Фильтрат концентрируют при пониженном давлении и полученный остаток суспендируют в хлороформе. Осадок собирают фильтрованием и повторно кристаллизуют из смеси вода/N,N-диметилформамид, что дает названное соединение (10.34 г).
APCI-MS м/е: 207[М+Н]+.
Ссылочный пример 18: Транс-4-(4-оксо-1,3-оксазолидин-3-ил)циклогексанкарбоновая кислота
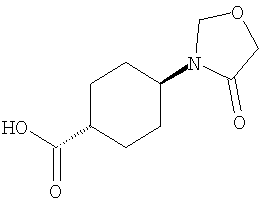
(1) Гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (742 мг) и 1-гидроксибензотриазол (523 мг) добавляют в раствор гидрохлорида метил-транс-4-аминоциклогексанкарбоксилата (500 мг), полученного в ссылочном примере 2(1), триэтиламину (540 мкл) и гликолевой кислоте (295 мг) в N,N-диметилформамиде (10 мл) при охлаждении льдом. Затем смесь перемешивают при комнатной температуре в течение 15 часов. Реакционный раствор концентрируют и приливают насыщенный водный раствор гидрокарбоната натрия, после чего экстрагируют хлороформом. Органический слой сушат над сульфатом натрия и выпаривают, чтобы удалить растворитель при пониженном давлении. Полученный остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: хлороформ в смеси метанол/хлороформ = 1/20), что дает метил-транс-4-(гликолоиламино)циклогексанкарбоксилат (602 мг).
APCI-MS м/е: 216 [М+Н]+.
(2) Метил-транс-4-(гликолоиламино)циклогексанкарбоксилат (280 мг), полученный в (1), как указано выше, параформальдегид (280 мг) и моногидрат пара-толуолсульфоновой кислоты (45 мг) добавляют в толуол (5 мл) и смесь перемешивают при температуре 100°С в течение 4 часов. После охлаждения, насыщенный водный раствор гидрокарбоната натрия выливают в реакционный раствор, и смесь экстрагируют этилацетатом. Органический слой промывают водой и насыщенным рассолом, сушат над сульфатом натрия и выпаривают, чтобы удалить растворитель при пониженном давлении. Полученный остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: этилацетат/гексан = 1/от 1 до этилацетат), что дает метил-транс-4-(4-оксо-1,3-оксазолидин-3-ил)циклогексанкарбоксилат (190 мг).
APCI-MS м/e: 228[M+H]+.
(3) В раствор метил-транс-4-(4-оксо-1,3-оксазолидин-3-ил)циклогексанкарбоксилата (330 мг), полученный в (2), как указано выше, в метаноле (5 мл) добавляют 1N водный раствор гидроксида натрия (2.9 мл). Затем смесь перемешивают при комнатной температуре в течение 3 часов. Реакционный раствор концентрируют, подкисляют 2N соляной кислотой, после чего к реакционной массе добавляют хлорид натрия, затем экстрагируют хлороформом. Органический слой сушат над сульфатом натрия и выпаривают, чтобы удалить растворитель при пониженном давлении. Полученный остаток суспендируют в диэтиловом эфире и собирают фильтрованием, что дает названное соединение (288 мг). ESI-MS м/е: 212[М-Н]-.
Ссылочный пример 19: Транс-4-(4-оксо-1,3-оксазинан-3-ил)циклогексанкарбоновая кислота
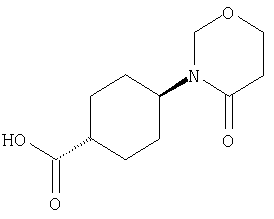
(1) В раствор гидрохлорида метил-транс-4-аминоциклогексанкарбоксилата (1.0 г), полученный в ссылочном примере 2(1), триэтиламин (1.1 мл), 30% водного раствора 3-гидроксипропионовой кислоты (1.86 мл) в N,N-диметилформамиде (15 мл) добавляют гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (1.19 г) и 1-гидроксибензотриазол (837 мг) при охлаждении льдом. Затем смесь перемешивают при комнатной температуре в течение 20 часов. Реакционный раствор концентрируют и выливают в остаток насыщенный водный раствор гидрокарбоната натрия, затем экстрагируют хлороформом. Органический слой сушат над сульфатом натрия и выпаривают, чтобы удалить растворитель. Полученный остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: этилацетат), что дает метил-транс-4-[(3-гидроксипропаноил)амино]циклогексанкарбоксилат (534 мг).
APCI-MS м/е: 230[M+H]+.
(2) Метил-транс-4-[(3-гидроксипропаноил)амино]-циклогексанкарбоксилат (530 мг), полученный в (1), как указано выше, параформальдегид (530 мг) и моногидрат пара-толуолсульфоновой кислоты (85 мг) добавляют в толуол (10 мл) и смесь перемешивают при температуре 100°С в течение 4 часов. После охлаждения выливают в смесь насыщенного водного раствора гидрокарбоната натрия и этилацетата, и нерастворимые продукты отделяют фильтрованием. Органический слой фильтрата отделяют, и водный слой экстрагируют этилацетатом. Органические слои объединяют, промывают водой и насыщенным рассолом, сушат над сульфатом натрия и выпаривают при пониженном давлении, чтобы удалить растворитель. Полученный остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: этилацетат), что дает метил-транс-4-(4-оксо-1,3-оксазинан-3-ил)циклогексанкарбоксилат (306 мг).
APCI-MS м/e: 242[M+H]+.
(3) В раствор метил-транс-4-(4-оксо-1,3-оксазинан-3-ил]циклогексанкарбоксилата (300 мг), полученный в (2), как указано выше, в метаноле (5 мл) добавляют 1 N водный раствор гидроксида натрия (2.5 мл). Затем смесь перемешивают при комнатной температуре в течение 4 часов. Реакционный раствор концентрируют и подкисляют 2 N соляной кислоты, после чего к реакционной массе добавляют хлорид натрия, затем экстрагируют хлороформом. Органический слой сушат над сульфатом натрия и выпаривают, чтобы удалить растворитель при пониженном давлении. Полученный остаток суспендируют в диэтиловом эфире и собирают фильтрованием, что дает названное соединение (252 мг).
ESI-MS м/е: 226[М-Н]-.
Ссылочный пример 20: Транс-4-(1,1-диоксидоизотиазолидин-2-ил)циклогексанкарбоновая кислота
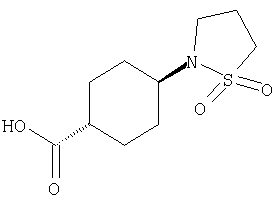
(1) Гидрохлорид метил-транс-4-аминоциклогексанкарбоксилата (4.08 г), полученный в ссылочном примере 2(1), суспендируют в хлороформе (50 мл), после чего к реакционной массе добавляют триэтиламин (8.8 мл) при охлаждении льдом. Затем добавляют по каплям раствор 3-хлорпропансульфонилхлорида (3.35 мл) в хлороформе (20 мл) в течение 20 минут при той же температуре. После перемешивания в течение 2 часов при комнатной температуре добавляют в реакционный раствор 5% раствор соляной кислоты, и смесь экстрагируют хлороформом. Органический слой промывают насыщенным рассолом, сушат над сульфатом натрия и выпаривают, чтобы удалить растворитель при пониженном давлении. Полученный остаток суспендируют в диизопропиламине и фильтруют, чтобы собрать осадок, что дает метил-транс-4-{[(3-хлорпропил)сульфонил]амино}циклогексанкарбоксилат (6.14 г).
APCI-MS м/е: 315/317[М+Н]+.
(2) Метил-транс-4-{[(3-хлорпропил)сульфонил]амино}-циклогексанкарбоксилат (3.08 г), полученный в (1), как указано выше, растворяют в тетрагидрофуране (40 мл) и добавляют по каплям раствор трет-бутоксид калия (1.35 г) в тетрагидрофуране (20 мл) в течение 10 минут при охлаждении льдом. После перемешивания в течение 3.5 часов при комнатной температуре дополнительно добавляют трет-бутоксид калия (370 мг) при охлаждении льдом и смесь перемешивают в течение ночи при комнатной температуре. Реакционный раствор выливают в 5% раствор соляной кислоты (100 мл) и водный слой насыщают избытком хлорида натрия, затем экстрагируют хлороформом. Органический слой сушат над сульфатом натрия и выпаривают, чтобы удалить растворитель при пониженном давлении. Полученный остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: н-гексан/этилацетат = 1/2, затем этилацетат), что дает метил-транс-4-(1,1-диоксидоизотиазолидин-2-ил)-циклогексанкарбоксилат (1.42 г, APCI-MS м/e: 279[M+NH4]+) и названное соединение (0.56 г).
ESI-MS м/е: 246[М-Н]-.
Ссылочный пример 21: 2-Хлор-N-(5-хлорпиридин-2-ил)ацетамид
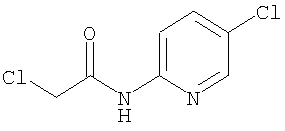
Хлорацетилхлорид (95.5 мл) растворяют в дихлорметане (500 мл), после чего к реакционной массе добавляют по каплям суспензию 2-амино-5-хлорпиридина (128.6 г) и триэтиламин (169 мл) в дихлорметане (1000 мл) при охлаждении льдом. Реакционный раствор нагревают до комнатной температуры и перемешивают в течение 0.5 часов. Реакционный раствор концентрируют при пониженном давлении, после чего в него выливают воду со льдом, затем экстрагируют этилацетатом. Органический слой промывают насыщенным рассолом, сушат над сульфатом натрия и обрабатывают активированным углем. Фильтруют, чтобы удалить нерастворимые продукты, фильтрат концентрируют при пониженном давлении и полученный остаток суспендируют в диизопропиловом эфире. Осадок собирают фильтрованием, промывают диизопропиловым эфиром и сушат, что дает названное соединение (153.4 г).
APCI-MS м/e: 205/207[M+H]+.
Ссылочный пример 22: N-(5-Хлорпиридин-2-ил)-2-гидроксиацетамид
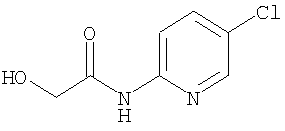
(1) 2-Хлор-N-(5-хлорпиридин-2-ил)ацетамид (30.68 г), полученный в ссылочном примере 21, растворяют в N,N-диметилформамиде (500 мл), после чего к реакционной массе добавляют ацетат натрия (24.55 г). Затем смесь перемешивают при температуре 60°С в течение 5 часов. Реакционный раствор разбавляют этилацетатом и промывают последовательно водой и насыщенным рассолом. Раствор сушат над сульфатом магния, обрабатывают активированным углем и фильтрат концентрируют при пониженном давлении. Полученный остаток суспендируют в н-гексане и кристаллы собирают фильтрованием. Кристаллы промывают н-гексаном и сушат, что дает 2-[(5-хлорпиридин-2-ил)амино]-2-оксоэтилацетат (30.58 г).
APCI-MS м/е: 229/231 [М+Н]+.
(2) 2-[(5-Хлорпиридин-2-ил)амино]-2-оксоэтилацетат (30.36 г), полученный в (1), как указано выше, суспендируют в метаноле (1200 мл), после чего к реакционной массе добавляют карбонат натрия (22.0 г) при охлаждении льдом. Реакционный раствор нагревают до комнатной температуры, перемешивают в течение 0.5 часов и концентрируют при пониженном давлении. В полученный остаток выливают этилацетат (1500 мл) и воду со льдом (1000 мл), затем экстрагируют этилацетатом. Органический слой промывают насыщенным рассолом, сушат над сульфатом натрия и выпаривают, чтобы удалить растворитель при пониженном давлении. Полученный остаток суспендируют в небольшом количестве этилацетата, после чего в него выливают диизопропиловый эфир. Осажденные кристаллы собирают фильтрованием, промывают диизопропиловым эфиром и сушат, что дает названное соединение (22.85 г).
APCI-MS м/e: 187/189 [M+H]+.
Ссылочный пример 23: N-(5-Хлорпиридин-2-ил)-2-[(2-цианопиридин-3-ил)окси]ацетамид
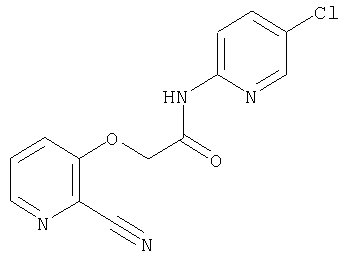
2-Циано-3-гидроксипиридин (35.0 г), полученный в соответствии с методикой, описанной в уровне техники (Synthesis 1983, 316), растворяют в ацетоне (800 мл), после чего к реакционной массе добавляют 2-хлор-N-(5-хлорпиридин-2-ил)ацетамид (62.6 г), полученный в ссылочном примере 21, карбонат натрия (60.0 г) и иодид натрия (45.8 г). Затем смесь нагревают при температуре кипения с обратным холодильником в течение 2 часов. После охлаждения воду и этилацетат выливают в реакционную смесь, и нерастворимые продукты удаляют фильтрованием. Органический слой затем отделяют. Водный слой экстрагируют этилацетатом, и органические слои объединяют, промывают насыщенным рассолом и сушат над сульфатом натрия. Растворитель удаляют путем выпаривания при пониженном давлении и полученный остаток суспендируют в диэтиловом эфире. Осадок собирают фильтрованием, что дает названное соединение (80.3 г).
APCI-MS м/e: 289/291[M+H]+.
Ссылочный пример 24: 3-Амино-N-(5-хлорпиридин-2-ил)фуро[3,2-b]пиридин-2-карбоксамид
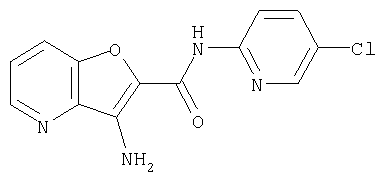
N-(5-Хлорпиридин-2-ил)-2-[(2-цианопиридин-3-ил)окси]ацетамид (80.0 г), полученный в ссылочном примере 23, растворяют в N,N-диметилацетамиде (700 мл), после чего к реакционной массе добавляют карбонат натрия (35.2 г). Затем смесь перемешивают при температуре 100°С в течение 10 часов. После охлаждения, реакционный раствор концентрируют при пониженном давлении, чтобы уменьшить объем на 1/3. После выливания воды со льдом, осадок собирают фильтрованием. Полученное твердое вещество суспендируют в этилацетате и собирают фильтрованием. Полученный продукт промывают последовательно хлороформом и диэтиловым эфиром и сушат, что дает названное соединение (48.5 г).
APCI-MS м/e: 289/291[M+H]+.
Ссылочный пример 25: 4-Хлорникотиннитрил
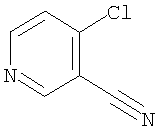
(1) В раствор диизопропиламина (20.0 г) в тетрагидрофуране (200 мл) добавляют по каплям 1.6 раствор н-бутиллития/н-гексана при охлаждении льдом. Затем смесь перемешивают в течение 30 минут в тех же самых условиях. Реакционную смесь охлаждают ацетоном в сухом льду, после чего к реакционной массе добавляют по каплям раствор 4-хлорпиридина (20.4 г) в тетрагидрофуране (100 мл). Затем смесь перемешивают в течение 20 минут в тех же самых условиях. Полученный реакционный раствор выливают в порцию толченого сухого льда и затем нагревают до комнатной температуры. Реакционный раствор охлаждают льдом и подщелачивают с помощью гидроксида натрия, затем концентрируют при пониженном давлении. Полученный остаток растворяют в воде и промывают дихлорметаном. Водный слой охлаждают льдом и подкисляют концентрированной соляной кислотой. Осадок собирают фильтрованием и сушат, что дает гидрохлорид 4-хлорникотиновой кислоты (21.4 г).
(2) Гидрохлорид 4-хлорникотиновой кислоты (500 мг), полученный в (1), как указано выше, растворяют в тионилхлориде (6 мл), после чего к реакционной массе добавляют N,N-диметилформамид (1 капля). Реакционный раствор затем нагревают при температуре кипения с обратным холодильником в течение 12 часов. После охлаждения, реакционный раствор концентрируют досуха при пониженном давлении. Полученный остаток суспендируют в дихлорметане (10 мл), после чего к реакционной массе добавляют хлорид аммония (152 мг) и триэтиламин (1.8 мл) при охлаждении льдом. Затем смесь перемешивают в течение 2 часов в тех же самых условиях охлаждения. В реакционный раствор добавляют насыщенный водный раствор гидрокарбоната натрия и хлорид натрия и смесь экстрагируют хлороформом. Органический слой сушат над сульфатом натрия и выпаривают растворитель при пониженном давлении. Очистка с помощью хроматографии на колонке с силикагелем (элюент: хлороформ, затем хлороформ/метанол = 20/от 1 до 10/1) дает 4-хлорникотинамид (211 мг).
APCI-MS м/е: 157/159[М+Н]+.
(3) 4-Хлорникотинамид (210 мг), полученный в (2), как указано выше, суспендируют в фосфорилхлориде (7 мл) и смесь нагревают при температуре 100°С в течение 2 часов. После охлаждения, реакционный раствор концентрируют при пониженном давлении. В полученный остаток выливают насыщенный водный раствор гидрокарбоната натрия и хлороформ при охлаждении льдом. Затем смесь нагревают до комнатной температуры и перемешивают в течение часа. Органический слой отделяют, промывают насыщенным рассолом, сушат над сульфатом натрия и растворитель удаляют путем выпаривания при пониженном давлении. Полученный остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: хлороформ, затем хлороформ/метанол = 20/1), что дает названное соединение (115 мг).
1Н-ЯМР(CDCl3, 300 МГц): δ: 8.86 (1H, д, J=0.4 Гц), 8.71 (1Н, д, J=5.4 Гц), 7.51(1Н, дд, J=5.4, 0.4 Гц).
Ссылочный пример 26: N-(5-Хлорпиридин-2-ил)-2-[(3-цианопиридин-4-ил)окси]ацетамид
N-(5-Хлорпиридин-2-ил)-2-гадроксиацетамид (142 мг), полученный в ссылочном примере 22, растворяют в N,N-диметилформамиде (3 мл), после чего к реакционной массе добавляют 60% раствор гидрида натрия в масле (61 мг) при охлаждении льдом. Реакционный раствор нагревают до комнатной температуры, перемешивают в течение 15 минут и охлаждают вновь льдом, затем добавляют раствор 4-хлорникотиннитрила (105 мг), полученный в ссылочном примере 25 в N,N-диметилформамиде (1 мл). Реакционный раствор перемешивают при комнатной температуре в течение часа, после чего в него выливают воду при охлаждении льдом, затем экстрагируют этилацетатом. Органический слой промывают водой и насыщенным рассолом, сушат над сульфатом натрия и выпаривают, чтобы удалить растворитель при пониженном давлении. Полученный остаток суспендируют в смеси н-гексан/диизопропиловый эфир, собирают фильтрованием и сушат, что дает названное соединение (200 мг).
APCI-MS м/e: 289/291[M+H]+.
Ссылочный пример 27: 3-Амино-N-(5-хлорпиридин-2-ил)фуро[3,2-с]пиридин-2-карбоксамид
N-(5-Хлорпиридин-2-ил)-2-[(3-цианопиридин-4-ил)окси]ацетамид (195 мг), полученный в ссылочном примере 26, растворяют в N,N-диметилацетамиде (5 мл), после чего к реакционной массе добавляют карбонат натрия (86 мг). Затем смесь перемешивают при температуре 100°С в течение 3 часов. После охлаждения реакционный раствор концентрируют при пониженном давлении и в полученный остаток выливают воду со льдом. Осадок собирают фильтрованием, промывают водой, а затем диэтиловым эфиром, что дает названное соединение (171 мг).
APCI-MS м/e: 289/291[M+H]+.
Ссылочный пример 28: N-(5-Хлорпиридин-2-ил)-2-[(4-цианопиридин-3-ил)окси]ацетамид
(1) Этил-3-аминоизоникотинат (5.55 г) суспендируют в воде (70 мл), после чего к реакционной массе добавляют концентрированную серную кислоту (4.0 мл). Реакционный раствор охлаждают льдом и в него добавляют по каплям раствор нитрита натрия (2.79 г) в воде (30 мл). Реакционный раствор перемешивают в тех же самых условиях охлаждения в течение 20 минут и затем при температуре 90°С в течение 80 минут. Реакционный раствор разбавляют водой (100 мл) и значение рН раствора доводят до от 8 до 9 с помощью добавления насыщенного водного раствора гидрокарбоната натрия, затем экстрагируют хлороформом. Органический слой сушат над сульфатом натрия и выпаривают, чтобы удалить растворитель при пониженном давлении. Полученный остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: н-гексан/этилацетат = 5/1), что дает этил-3-гидроксиизоникотинат (2.64 г).
APCI-MS м/е: [M+H]+.
(2) Этил-3-гидроксиизоникотинат (1.60 г), полученный в (1), как указано выше, растворяют в этаноле (30 мл) и пробулькивают через него газообразный аммиак при охлаждении льдом. В реакционный раствор добавляют тетрагидрофуран (50 мл) и еще раз через смесь пробулькивают газообразный аммиак. Реакционный раствор нагревают до комнатной температуры и перемешивают в течение 3 часов. Пробулькивание газообразным аммиаком останавливают, и смесь перемешивают при комнатной температуре в течение 2.5 дней. Реакционный раствор концентрируют досуха при пониженном давлении, что дает 3-гидроксиизоникотинамид (1.35 г).
ESI-MS м/e: 137[M-H]-.
(3) Пиридин (1.20 мл) добавляют по каплям в раствор трифторуксусного ангидрида (3.10 г) в дихлорметане (30 мл), после чего к реакционной массе добавляют небольшими порциями при охлаждении льдом суспензию 3-гидроксиизониконамида (683 мг), полученную в (2), как указано выше, в дихлорметане (10 мл). Реакционный раствор нагревают до комнатной температуры, перемешивают в течение 13 часов и затем к реакционной массе добавляют воду и насыщенный водный раствор гидрокарбоната натрия. Водный слой отделяют и концентрируют досуха при пониженном давлении, что дает сырой 3-гидроксиизоникотиннитрил. Затем полученный сырой продукт суспендируют в ацетоне (50 мл), после чего к реакционной массе добавляют 2-xnop-N-(5-хлорпиридин-2-ил)ацетамид (1.08 г), полученный в ссылочном примере 21, карбонат цезия (3.03 г) и иодид натрия (0.78 г) и смесь нагревают при температуре кипения с обратным холодильником в течение 19 часов. После охлаждения в смесь выливают воду, тетрагидрофуран и этилацетат, и нерастворимые продукты удаляют фильтрованием. Органический слой отделяют, сушат над сульфатом магния и выпаривают, чтобы удалить растворитель при пониженном давлении. Полученный остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: н-гексан/этилацетат = 1/1, затем 1/2), что дает названное соединение (87 мг).
APCI-MS м/e: 289/291[M+H]+.
Ссылочный пример 29: 3-Амино-N-(5-хлорпиридин-2-ил)фуро[2,3-с]пиридин-2-карбоксамид
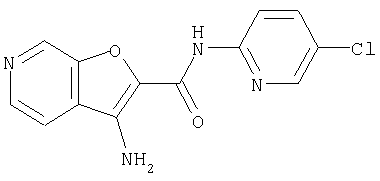
N-(5-Хлорпиридин-2-ил)-2-[(4-цианопиридин-3-ил)окси]ацетамид (82 мг), полученный в ссылочном примере 28, растворяют в N,N-диметилацетамиде (5 мл), после чего к реакционной массе добавляют карбонат натрия (39 мг). Затем смесь перемешивают при температуре 100°С в течение 3 часов. После охлаждения реакционный раствор разбавляют водой. Осадок собирают фильтрованием, промывают водой и сушат, что дает названное соединение (47 мг).
APCI-MS м/е: 289/291 [М+Н]+.
Ссылочный пример 30: N-(5-Хлорпиридин-2-ил)-2-[(3-цианопиридин-2-ил)окси]ацетамид
N-(5-Хлорпиридин-2-ил)-2-гидроксиацетамид (187 мг), полученный в ссылочном примере 22, растворяют в N,N-диметилформамиде (3 мл), после чего к реакционной массе добавляют 60% раствор гидрида натрия в масле (80 мг). Реакционный раствор перемешивают в течение 15 минут, после чего к реакционной массе добавляют 2-хлор-никотиннитрил (139 мг). Реакционный раствор перемешивают при комнатной температуре в течение часа, после чего к реакционной массе добавляют последовательно насыщенный водный раствор хлорида аммония и воду при охлаждении льдом. Осадок собирают фильтрованием, промывают последовательно водой и диизопропиловым эфиром и сушат, что дает названное соединение (212 мг).
APCI-MS м/e: 289/291[M+H]+.
Ссылочный пример 31: 3-Амино-N-(5-хлорпиридин-2-ил)фуро[2,3-b]-пиридин-2-карбоксамид
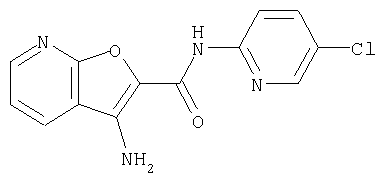
N-(5-Хлорпиридин-2-ил)-2-[(3-цианопиридин-2-ил)окси]ацетамид (209 мг), полученный в ссылочном примере 30, растворяют в N,N-диметилацетамиде (3 мл), после чего к реакционной массе добавляют карбонат натрия (92 мг). Затем смесь перемешивают при температуре 100°С в течение ночи. Дополнительное количество карбоната натрия (90 мг) добавляют в реакционную смесь, и смесь вновь перемешивают при температуре 100°С в течение ночи. После охлаждения в реакционный раствор выливают воду со льдом. Осадок собирают фильтрованием, растворяют в смеси хлороформ/метанол и сушат над сульфатом натрия. Растворитель выпаривают при пониженном давлении и полученный остаток суспендируют в смеси н-гексан/этилацетат. Осадок собирают фильтрованием, что дает названное соединение (111 мг).
APCI-MS м/e: 289/291[M+H]+.
Ссылочный пример 32: 3-Хлорпиразин-2-карбонитрил
Пиразин-2-карбонитрил (26.36 г) растворяют в смеси толуол (187 мл)/N,N-диметилформамид (19 мл), после чего к реакционной массе добавляют по каплям сульфурилхлорид (135 г) при охлаждении льдом. После завершения добавления реакционный раствор постепенно нагревают до комнатной температуры и перемешивают в течение ночи. Слой толуола отделяют и оставшееся масло красного цвета экстрагируют диэтиловым эфиром. Органические слои объединяют, охлаждают льдом и затем выливают в реакционную массу воду со льдом, нейтрализуют путем добавляения насыщенного водного раствора гидрокарбоната натрия. Органический слой отделяют, и водный слой экстрагируют диэтиловым эфиром. Органические слои объединяют, промывают водой, сушат над сульфатом натрия и выпаривают, чтобы удалить растворитель при пониженном давлении. Полученный остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: н-гексан/этилацетат = 4/1), что дает названное соединение (16.58 г). 1Н-ЯМР(CDCl3, 300 МГц) δ: 8.66 (1Н, д, J=2.4 Гц), 8.61 (1Н, д, J=2.4 Гц).
Ссылочный пример 33: N-(5-Хлорпиридин-2-ил)-2-[(3-цианопиразин-2-ил)окси]ацетамид
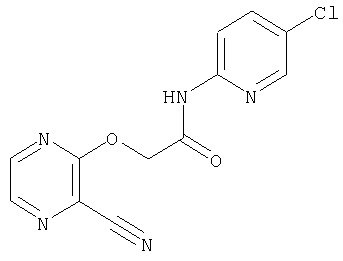
N-(5-Хлорпиридин-2-ил)-2-гидроксиацетамид (1.34 г), полученный в ссылочном примере 22, растворяют в N,N-диметилформамиде (15 мл), после чего к реакционной массе добавляют 60% раствор гидрида натрия в масле (574 мг). Реакционный раствор перемешивают при комнатной температуре в течение 15 минут, охлаждают вновь льдом и добавляют раствор 3-хлорпиразин-2-карбонитрила (1.0 г), полученный в ссылочном примере 32 в N,N-диметилформамиде (5 мл). Реакционный раствор перемешивают при комнатной температуре в течение часа, после чего в него выливают воду при охлаждении льдом, затем экстрагируют этилацетатом. Органический слой промывают водой и насыщенным рассолом, сушат над сульфатом натрия и выпаривают, чтобы удалить растворитель при пониженном давлении. Полученный остаток суспендируют в смеси н-гексан/диизопропиловый эфир. Осадок собирают фильтрованием и сушат, что дает названное соединение (1.92 г).
APCI-MS м/e: 290/292[M+H]+.
Ссылочный пример 34: 7-Амино-N-(5-хлорпиридин-2-ил)фуро[2,3-b]пиразин-6-карбоксамид
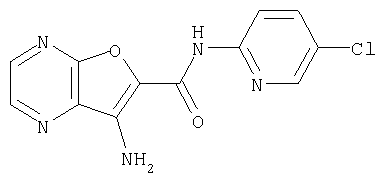
N-(5-Хлорпиридин-2-ил)-2-[(3-цианопиразин-2-ил)окси]ацетамид (1.90 г), полученный в ссылочном примере 33, растворяют в N,N-диметилацетамиде (20 мл), после чего к реакционной массе добавляют карбонат натрия (834 мг) и смесь перемешивают при температуре 100°С в течение 3 дней. После охлаждения, реакционный раствор концентрируют при пониженном давлении и воду выливают в остаток. Осадок собирают фильтрованием, промывают диэтиловым эфиром и сушат, что дает названное соединение (0.38 г).
APCI-MS м/е: 290/292[М+Н]+.
Ссылочный пример 35: Метил-5-гидроксипиридин-2-карбоксилат-1-оксид
В суспензию метил-5-гидроксипиридин-2-карбоксилата (5.30 г) в дихлорметане (75 мл) добавляют при охлаждении льдом мета-хлорпербензойную кислоту (>65%, 11.0 г) и смесь перемешивают при комнатной температуре в течение 5 часов. Реакционный раствор концентрируют при пониженном давлении. Остаток суспендируют в этилацетате и собирают фильтрованием, что дает названное соединение (4.62 г). Маточный раствор концентрируют при пониженном давлении и полученный остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: от хлороформа до смеси метанол/ хлороформ = 1/5). Полученное твердое вещество суспендируют в смеси этилацетат/диэтиловый эфир и собирают фильтрованием, что дает названное соединение (0.68 г).
APCI-MS м/е: 170[М+Н]+.
Ссылочный пример 36: Метил-6-циано-5-гидроксипиридин-2-карбоксилат
Метил-5-гидроксипиридин-2-карбоксилат-1-оксид (5.18 г), полученный в ссылочном примере 35, цианид натрия (4.50 г) и триэтиламин (29.9 мл) добавляют к N,N-диметилформамиду (55 мл), после чего к реакционной массе добавляют хлортриметилсилан (19.4 мл) в течение 20 минут. Затем смесь перемешивают при температуре 80°С в течение 28 часов. Реакционный раствор охлаждают до комнатной температуры, фильтруют, чтобы удалить нерастворимые продукты, и фильтрат концентрируют при пониженном давлении. В остаток добавляют метанол (150 мл) и смесь перемешивают при комнатной температуре в течение 30 минут и выпаривают, чтобы удалить растворитель при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: хлороформ в смеси метанол/хлороформ = 1/5). Полученное твердое вещество суспендируют в диэтиловом эфире и собирают фильтрованием, что дает названное соединение (4.66 г).
ESI-MS м/е: 177[М-Н]-.
Ссылочные примеры 37-43
Соответствующие исходные соединения обрабатывают в соответствии с методикой, аналогичной методике, изложенной в ссылочном примере 35, что дает следующие соединения (см. табл. 74).
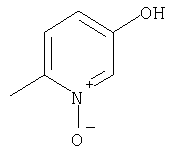
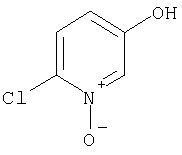
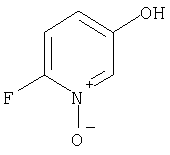
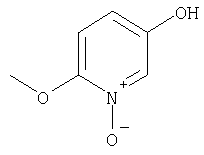
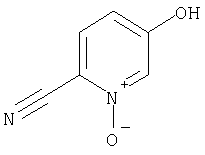
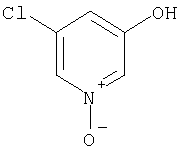
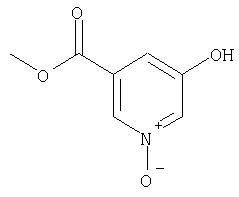
Ссылочные примеры 44-50
Соответствующие исходные соединения обрабатывают в соответствии с методикой, аналогичной методике, изложенной в ссылочном примере 36, что дает следующие соединения (см. табл. 75).
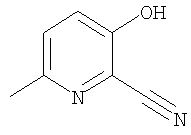
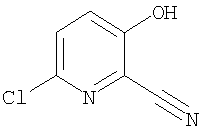
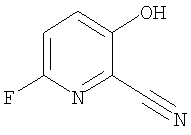
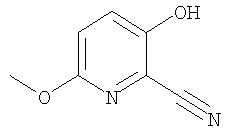
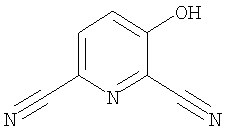
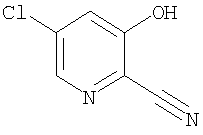
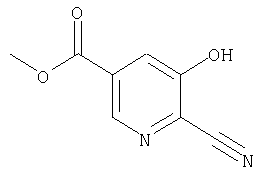
Ссылочные примеры 51-58
Соответствующие исходные соединения обрабатывают в соответствии с методикой, аналогичной методике, изложенной в ссылочном примере 23, что дает следующие соединения (см. табл. 76, 77).
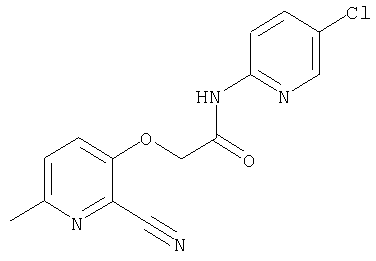
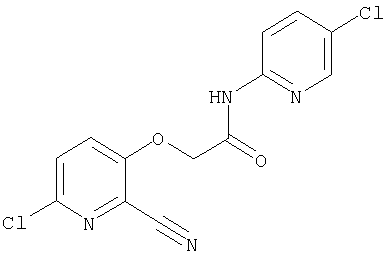
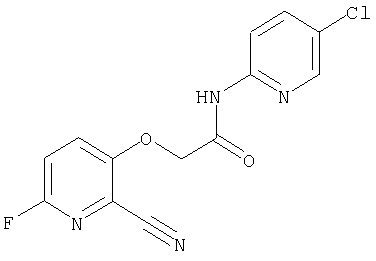
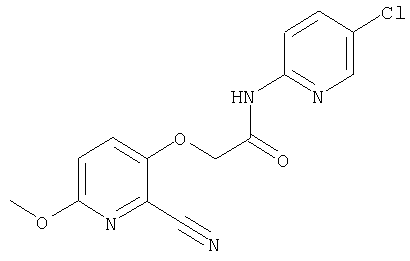
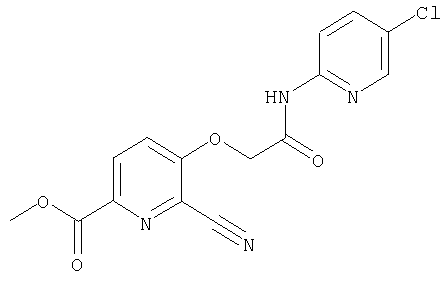
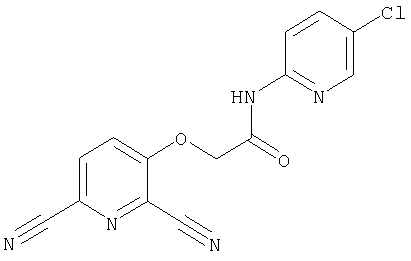
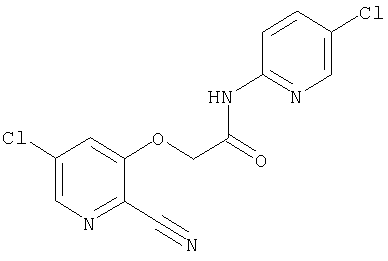
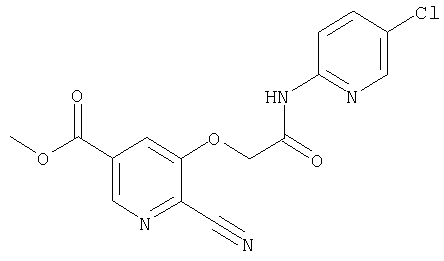
Ссылочные примеры 59-66
Соответствующие исходные соединения обрабатывают в соответствии с методикой, аналогичной методике, изложенной в ссылочном примере 24, что дает следующие соединения (см. табл. 78).
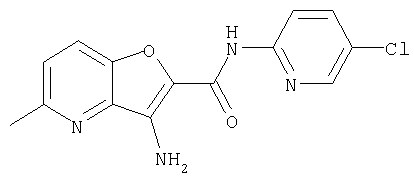
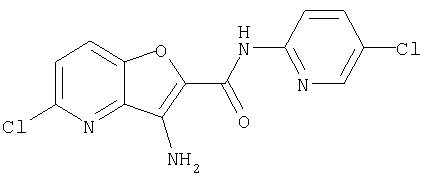
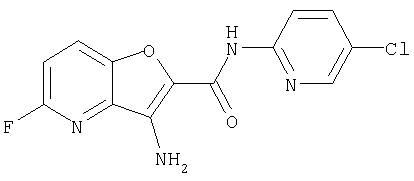
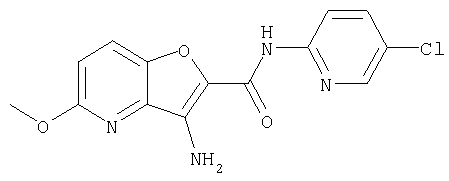
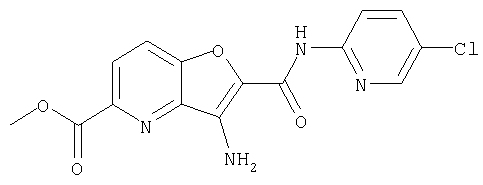
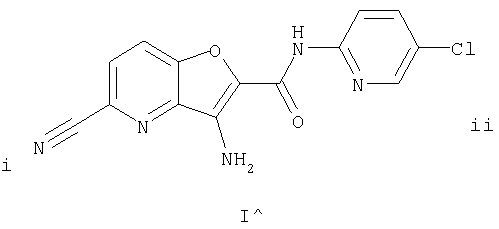
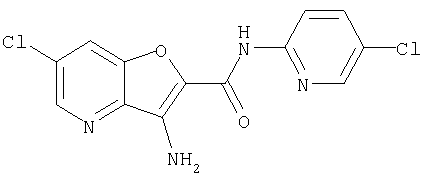
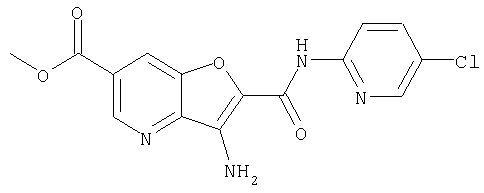
Ссылочный пример 67: 3-Амино-2-{[(5-хлорпиридин-2-ил)амино]-карбонил}фуро[3,2-b]пиридин-5-карбоновая кислота
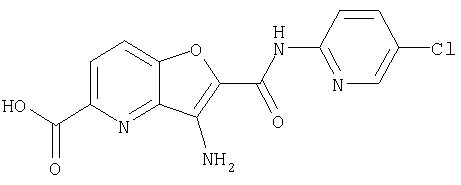
Метил-3-амино-2-{[(5-хлорпиридин-2-ил)амино]карбонил}фуро[3,2-b]пиридин-5-карбоксилат (800 мг), полученный в ссылочном примере 63, суспендируют в смеси тетрагидрофуран/метанол (3:1, 40 мл), после чего к реакционной массе добавляют 1N водный раствор гидроксида натрия (11.5 мл). Затем смесь перемешивают при комнатной температуре в течение 2 дней. Реакционный раствор нейтрализуют 1N соляной кислотой (11.5 мл) и разбавляют водой. Осажденное твердое вещество собирают фильтрованием и сушат, что дает названное соединение (615 мг).
ESI-MS м/е: 331/333 [М-Н]-.
Ссылочный пример 68
Соответствующие исходные соединения обрабатывают в соответствии с методикой, аналогичной методике, изложенной в ссылочном примере 67, что дает следующие соединения (см. табл. 79).
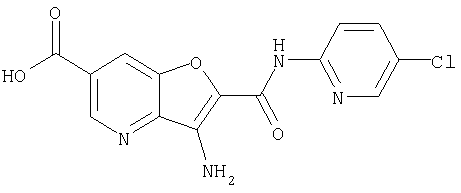
Ссылочный пример 69: 3-Амино-N2-(5-хлорпиридин-2-ил)-N5,N5-диметилфуро[3,2-b]пиридин-2,5-дикарбоксамид

3-Амино-2-{[(5-хлорпиридин-2-ил)амино]карбонил}фуро[3,2-b]-пиридин-5-карбоновую кислоту (605 мг), полученную в ссылочном примере 67, суспендируют в N,N-диметилформамиде (10 мл), после чего к реакционной массе последовательно добавляют гидрохлорид диметиламина (297 мг), 1-гидроксибензотриазол (492 мг), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (698 мг) и триэтиламин (634 мкл). Затем смесь перемешивают при комнатной температуре в течение 24 часов. Реакционный раствор концентрируют при пониженном давлении. В полученный остаток выливают насыщенный водный раствор гидрокарбоната натрия и воды. Осажденное твердое вещество собирают фильтрованием, промывают водой и диэтиловым эфиром и сушат, что дает названное соединение (621 мг).
APCI-MS м/е: 360/362[М+H]+.
Ссылочный пример 70
Соответствующие исходные соединения обрабатывают в соответствии с методикой, аналогичной методике, изложенной в ссылочном примере 69, что дает следующее соединение (см. табл. 80).
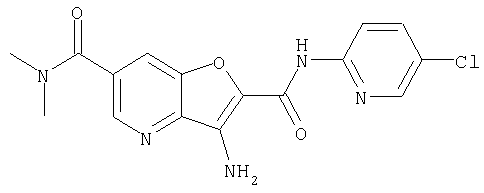
Ссылочный пример 71: Транс-4-[4-(трет-бутоксикарбонил)-2-оксопиперазин-1-ил]циклогексанкарбоновая кислота
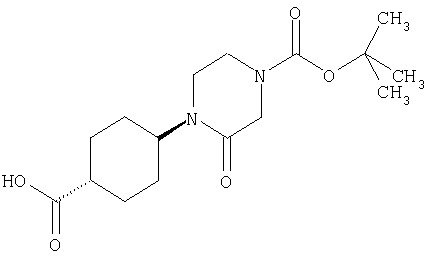
(1) Гидрохлорид метил-транс-4-аминоциклогексанкарбоксилата (1.22 г), полученного в ссылочном примере 2(1), суспендируют в дихлорметан (10 мл), после чего к реакционной массе добавляют триэтиламин (1.76 мл) и смесь перемешивают в течение нескольких минут. Затем последовательно добавляют раствор трет-бутил-(2-оксоэтил)карбамата (1.00 г) в дихлорметане (5 мл) и триацетоксиборогидрид натрия (1.46 г) при охлаждении льдом, реакционный раствор нагревают до комнатной температуры и перемешивают в течение 15 часов. Насыщенный водный раствор гидрокарбоната натрия выливают в реакционный раствор, и смесь экстрагируют хлороформом. Органический слой сушат над сульфатом натрия и выпаривают, чтобы удалить растворитель при пониженном давлении. Порцию (1.71 г) полученного остатка (2.33 г) очищают с помощью хроматографии на колонке с силикагелем (элюент: хлороформ/метанол = 10/1), что дает метил-транс-4-({2-[(трет-бутоксикарбонил)амино]этил}амино)-циклогексанкарбоксилат (793 мг).
APCI-MS м/е: 301[М+Н]+.
(2) Метил-транс-4-({2-[(трет-бутоксикарбонил)амино]этил}амино)-цикло-гексанкарбоксилат (785 мг), полученный в ссылочном примере 71(1), растворяют в хлороформе (8 мл), после чего к реакционной массе добавляют триэтиламин (1.82 мл) и хлорацетилхлорид (249 мкл) при охлаждении льдом. Затем смесь перемешивают при комнатной температуре в течение 2 часов. Реакционный раствор вновь охлаждают льдом и добавляют в него хлорацетилхлорид (62 мкл). Смесь перемешивают при комнатной температуре в течение часа. В реакционный раствор выливают насыщенный водный раствор гидрокарбоната натрия и смесь экстрагируют хлороформом. Органический слой промывают последовательно водой и насыщенным рассолом, сушат над сульфатом натрия и выпаривают, чтобы удалить растворитель при пониженном давлении. Полученный остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: н-гексан/этилацетат = 2/1, затем 1/1), что дает метил-транс-4-[{2-[(трет-бутоксикарбонил)амино]этил}-(хлорацетил)амино]циклогексанкарбоксилат (568 мг).
APCI-MS м/e: 377/379[M+H]+.
(3) Метил-транс-4-[{2-[(трет-бутоксикарбонил)амино]этил}-(хлорацетил)-амино]циклогексанкарбоксилат (560 мг), полученный в ссылочном примере 71(2), растворяют в N,N-диметилацетамиде (5 мл), после чего к реакционной массе добавляют при охлаждении льдом 60% раствор гидрида натрия в масле (119 мг). Реакционный раствор затем перемешивают в течение 0.5 часов в тех же самых условиях охлаждения. Насыщенный водный раствор хлорида аммония и воды последовательно выливают в реакционный раствор при охлаждении льдом, и смесь экстрагируют этилацетатом. Органический слой промывают последовательно водой и насыщенным рассолом, сушат над сульфатом натрия и выпаривают, чтобы удалить растворитель при пониженном давлении. Полученный остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: н-гексан/этилацетат = 1/1), что дает трет-бутил-4-[транс-4-(метоксикарбонил)циклогексил]-3-оксопиперазин-1-карбоксилат (302 мг).
APCI-MS м/е: 341[М+Н]+.
(4) трет-Бутил-4-[транс-4-(метоксикарбонил)циклогексил]-3-оксопиперазин-1-карбоксилат (385 мг), полученный в ссылочном примере 71 (3), растворяют в метаноле (8 мл), после чего к реакционной массе добавляют 1N водный раствор гидроксида натрия (3.4 мл) при охлаждении льдом. Реакционный раствор перемешивают при комнатной температуре в течение 20 часов и концентрируют при пониженном давлении. Воду и хлороформ выливают в остаток, и водный слой подкисляют с помощью добавления 2N соляной кислоты. Органический слой отделяют, промывают насыщенным рассолом и сушат над сульфатом натрия. Растворитель удаляют путем выпаривания при пониженном давлении, что дает названное соединение (375 мг).
ESI-MS м/е: 325[М-Н]-.
Ссылочный пример 72: 2-[(6-Бром-2-цианопиридин-3-ил)окси]-N-(5-хлорпиридин-2-ил) ацетамид
(1) 2-Циано-3-гидроксипиридин (3.00 г) растворяют в смеси ацетонитрил/вода (5:1, 90 мл), после чего к реакционной массе добавляют небольшими порциями при охлаждении льдом N-бромсукцинимид (5.34 г). Затем смесь перемешивают в течение 2 часов в тех же самых условиях охлаждения. Реакционный раствор разбавляют этилацетатом, промывают последовательно водой и насыщенным рассолом и сушат над сульфатом натрия. Растворитель удаляют путем выпаривания при пониженном давлении, что дает сырой 6-бром-3-гидроксипиридин-2-карбонитрил (6.26 г).
ESI-MS м/е: 197/199[М-Н]-.
(2) 6-Бром-3-гидроксипиридин-2-карбонитрил (6.20 г), полученный в ссылочном примере 72(1), обрабатывают в соответствии с методикой, аналогичной методике, изложенной в ссылочном примере 23, что дает названное соединение (4.36 г).
APCI-MS м/е: 367/369[М+Н]+.
Ссылочный пример 73: 3-Амино-5-бром-N-(5-хлорпиридин-2-ил)-фуро[3,2-b]пиридин-2-карбоксамид
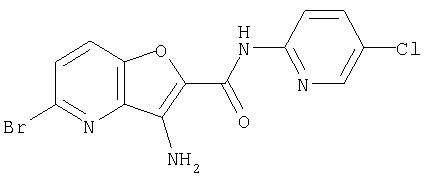
2-[(6-Бром-2-цианопиридин-3-ил)окси]-N-(5-хлорпиридин-2-ил)ацетамид (4.00 г), полученный в ссылочном примере 72, обрабатывают в соответствии с методикой, аналогичной методике, изложенной в ссылочном примере 24, что дает названное соединение (2.96 г).
APCI-MS м/e: 367/369[M+H]+.
Ссылочный пример 74: 2-Хлор-N-(4-хлорфенил)ацетамид
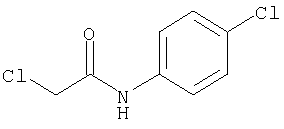
5-Хлоранилин (7.03 г) обрабатывают в соответствии с методикой, аналогичной методике, изложенной в ссылочном примере 21, что дает названное соединение (10.18 г).
APCI-MS м/e: 204/206[M+H]+.
Ссылочный пример 75: N-(4-Хлорфенил)-2-[(2-цианопиридин-3-ил)окси]ацетамид
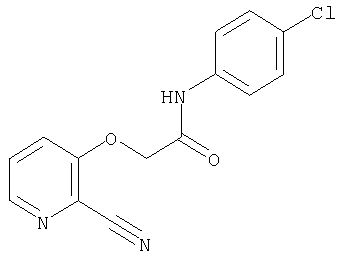
2-Циано-3-гидроксипиридин (2.00 г) и 2-хлор-N-(4-хлорфенил)ацетамид (3.75 г), полученный в ссылочном примере 74, обрабатывают в соответствии с методикой, аналогичной методике, изложенной в ссылочном примере 23, что дает названное соединение (4.58 г).
APCI-MS м/е: 288/290[M+Н]+.
Ссылочный пример 76: 3-Амино-N-(4-хлорфенил)фуро[3,2-b]пиридин-2-карбоксамид
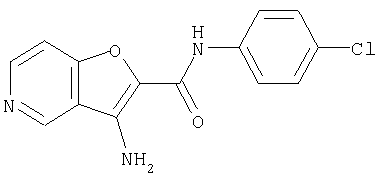
N-(4-Хлорфенил)-2-[(2-цианопиридин-3-ил)окси]ацетамид (4.50 г), полученный в ссылочном примере 75, обрабатывают в соответствии с методикой, аналогичной методике, изложенной в ссылочном примере 24, что дает названное соединение (2.98 г).
APCI-MS м/е: 288/290[М+Н]+.
Ссылочный пример 77: Метил-[(2-цианопиридин-3-ил)окси]ацетат
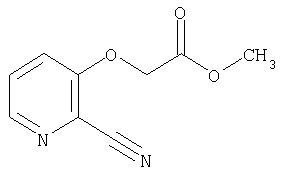
2-Циано-3-гидроксипиридин (5.00 г) растворяют в ацетоне (50 мл), после чего к реакционной массе добавляют метилбромацетат (7.0 г) и карбонат натрия (6.3 г). Смесь нагревают при температуре кипения с обратньм холодильником в течение 1.5 часов. После охлаждения в реакционный раствор выливают воду со льдом и экстрагируют этилацетатом. Органический слой промывают насыщенным рассолом, сушат над сульфатом натрия и выпаривают, чтобы удалить растворитель при пониженном давлении. Полученный остаток суспендируют в смеси диэтиловый эфир/н-гексан и твердое вещество собирают фильтрованием, что дает названное соединение (7.91 г).
APCI-MS м/е: 193 [M+H]+.
Ссылочный пример 78: Метил-3-аминофуро[3,2-b]пиридин-2-карбоксилат
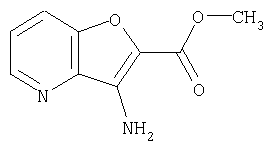
Метил-[(2-цианопиридин-3-ил)окси]ацетат (4.00 г), полученный в ссылочном примере 77, растворяют в тетрагидрофуране (100 мл) и добавляют небольшими порциями при охлаждении льдом 60% раствор гидрида натрия в масле (1.53 г). Реакционный раствор нагревают до комнатной температуры и перемешивают в течение часа. Реакционный раствор выливают в водный раствор хлорид аммония/лимонная кислота при охлаждении льдом, затем экстрагируют этилацетатом. Органический слой промывают насыщенным рассолом, сушат над сульфатом натрия и выпаривают, чтобы удалить растворитель при пониженном давлении. Полученный остаток суспендируют в н-гексане и твердое вещество собирают фильтрованием, что дает названное соединение (2.96 г).
APCI-MS м/е: 193[М+Н]+.
Ссылочный пример 79: Метил-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксилат
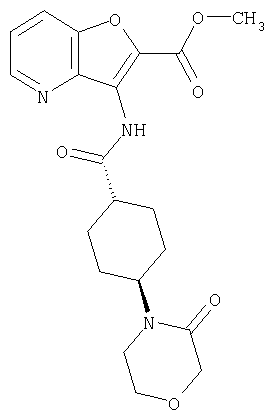
Транс-4-(3-оксоморфолин-4-ил)циклогексанкарбоновую кислоту (3.55 г), полученную в ссылочном примере 4, растворяют в тионилхлориде (20 мл). Затем смесь перемешивают при комнатной температуре в течение 15 часов. Реакционный раствор концентрируют при пониженном давлении, и остаток подвергают азеотропной перегонке с помощью толуола и растворяют в хлороформе (25 мл). При охлаждении льдом по очереди добавляют метил-3-аминофуро[3,2-b]-пиридин-2-карбоксилат (2.00 г), полученный в ссылочном примере 78, и пиридин (1.68 мл) и реакционный раствор нагревают до комнатной температуры и перемешивают в течение 5 часов. Насыщенный водный раствор гидрокарбоната натрия выливают в реакционный раствор при охлаждении льдом, и смесь экстрагируют хлороформом. Органический слой промывают последовательно водой и насыщенным рассолом, сушат над сульфатом натрия и выпаривают, чтобы удалить растворитель при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с NH-силикагелью (элюент: этилацетат, затем этилацетат/метанол = 5/1). Полученное твердое вещество суспендируют в смеси диэтиловый эфир/н-гексан и собирают фильтрованием, что дает названное соединение (3.54 г).
APCI-MS м/e: 402[M+H]+.
Ссылочный пример 80: Транс-4-[(диметиламино)карбонил]циклогексанкарбоновая кислота
(1) Транс-4-(метоксикарбонил)циклогексанкарбоновую кислоту (20.0 г), полученную в ссылочном примере 1(2), растворяют в хлороформе (200 мл), после чего к реакционной массе добавляют гидрохлорид диметиламина (10.5 г), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (24.7 г) и триэтиламин (26.0 г) при охлаждении льдом. Затем смесь перемешивают при комнатной температуре в течение 17 часов. Воду со льдом выливают в реакционный раствор, и смесь экстрагируют хлороформом. Органический слой промывают последовательно 10% раствором соляной кислоты, насыщенным водным раствором гидрокарбоната натрия и насыщенным рассолом и сушат над сульфатом натрия. Растворитель концентрируют при пониженном давлении и полученный остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: хлороформ, затем хлороформ/метанол = 20/1), что дает метил-транс-4-[(диметиламино)карбонил]-циклогексанкарбоксилат (20.1 г).
APCI-MS м/е: [М+Н]+.
(2) Метил-транс-4-[(диметиламино)карбонил]циклогексанкарбоксилат (20.0 г), полученный в ссылочном примере 80(1), растворяют в метаноле (100 мл), после чего к реакционной массе добавляют раствор гидроксида натрия (7.50 г) в воду (40 мл). Затем смесь перемешивают при комнатной температуре в течение 18 часов. Реакционный раствор концентрируют при пониженном давлении, и остаток разбавляют водой со льдом и промывают диэтиловым эфиром. Полученный водный слой подкисляют 10% раствором соляной кислоты и экстрагируют дважды хлороформом. Органический слой промывают насыщенным рассолом и сушат над сульфатом натрия. Растворитель концентрируют при пониженном давлении. Полученный остаток суспендируют в н-гексане и собирают фильтрованием, что дает названное соединение (15.7 г).
ESI-MS м/е: 198[М-Н]-.
Ссылочный пример 81: Транс-4-(пирролидин-1-илкарбонил)циклогексанкарбоновая кислота
(1) Транс-4-(метоксикарбонил)циклогексанкарбоновую кислоту (20.0 г), полученную в ссылочном примере 1(2), растворяют в хлороформе (200 мл), после чего к реакционной массе добавляют пирролидин (9.2 г), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (24.7 г) и триэтиламин (13.6 г) при охлаждении льдом. Затем смесь перемешивают при комнатной температуре в течение 17 часов. Воду со льдом выливают в реакционный раствор, и смесь экстрагируют хлороформом. Органический слой промывают последовательно 10% раствором соляной кислоты, насыщенным водным раствором гидрокарбоната натрия и насыщенным рассолом и сушат над сульфатом натрия. Растворитель концентрируют при пониженном давлении. Полученный остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: хлороформ, затем хлороформ/метанол = 20/1), что дает метил-транс-4-(пирролидин-1-илкарбонил)-циклогексанкарбоксилат (11.8 г).
APCI-MS м/e: 240[M+H]+.
(2) Метил-транс-4-(пирролидин-1-илкарбонил)циклогексанкарбоксилат (11.7 г), полученный в ссылочном примере 81(1), растворяют в метаноле (50 мл), после чего к реакционной массе добавляют раствор гидроксид натрия (3.95 г) в воду (20 мл). Затем смесь перемешивают при комнатной температуре в течение 18 часов. Реакционный раствор концентрируют при пониженном давлении. Остаток разбавляют водой со льдом и промывают диэтиловым эфиром. Полученный водный слой подкисляют 10% соляной кислотой и экстрагируют дважды хлороформом. Органический слой промывают насыщенным рассолом и сушат над сульфатом натрия. Растворитель концентрируют при пониженном давлении. Полученный остаток суспендируют в н-гексане и собирают фильтрованием, что дает названное соединение (10.1 г).
ESI-MS м/е: 224[М-Н]-.
Ссылочный пример 82: Транс-4-(морфолин-4-илкарбонил)циклогексанкарбоновая кислота
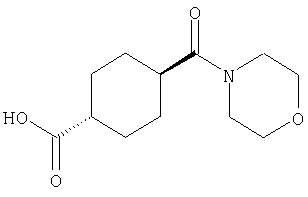
(1) Транс-4-(метоксикарбонил)циклогексанкарбоновую кислоту (800 мг), полученныую в ссылочном примере 1(2), растворяют в хлороформе (30 мл), после чего к реакционной массе добавляют морфолин (560 мг), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (1.24 г) и триэтиламин (650 мг) при охлаждении льдом. Затем смесь перемешивают при комнатной температуре в течение 19 часов. Воду со льдом выливают в реакционный раствор, и смесь экстрагируют хлороформом. Органический слой последовательно промывают 10% раствором соляной кислоты, насыщенным водным раствором гидрокарбоната натрия и насыщенным рассолом и сушат над сульфатом натрия. Растворитель концентрируют при пониженном давлении. Полученный остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: хлороформ, затем хлороформ/метанол = 30/1), что дает метил-транс-4-(морфолин-4-илкарбонил)-циклогексанкарбоксилат (897 мг).
APCI-MS м/е: 256[М+Н]+.
(2) Метил-транс-4-(морфолин-4-илкарбонил)циклогексанкарбоксилат (860 мг), полученный в ссылочном примере 82(1), растворяют в метаноле (40 мл), после чего к реакционной массе добавляют 4N водный раствор гидроксида натрия (1.68 мл). Затем смесь перемешивают при комнатной температуре в течение 18 часов. Реакционный раствор концентрируют при пониженном давлении. Остаток разбавляют водой со льдом, нейтрализуют 10% раствором соляной кислоты и экстрагируют хлороформом. Органический слой сушат над сульфатом натрия и растворитель концентрируют при пониженном давлении, что дает названное соединение (638 мг).
ESI-MS м/е: 240[М-Н]-.
Ссылочный пример 83: Транс-4-{[[2-(диметиламино)этил](метил)-амино]-карбонил}циклогексанкарбоновая кислота
(1) Транс-4-(метоксикарбонил)циклогексанкарбоновую кислоту (8.84 г), полученную в ссылочном примере 1(2), растворяют в хлороформе (100 мл), после чего к реакционной массе добавляют 1-гидроксибензотриазол (7.14 г), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (10.00 г) и N,N,N'-триметилэтилендиамин (5.33 г) при охлаждении льдом. Затем смесь перемешивают при комнатной температуре в течение 4 часов. Насыщенный водный раствор гидрокарбоната натрия выливают в реакционный раствор, и смесь экстрагируют хлороформом. Органический слой промывают насыщенным рассолом и сушат над сульфатом натрия. Растворитель концентрируют при пониженном давлении. Полученный остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: хлороформ/метанол/28% водный раствор аммиака = 200/10/1), что дает метил-транс-4-{[[2-(диметиламино)этил](метил)амино]карбонил}-циклогексанкарбоксилат (11.98 г).
APCI-MS м/е: [М+Н]+.
(2) Метил-транс-4-{[[2-(диметиламино)этил](метил)амино]-карбонил}-циклогексанкарбоксилат (6.32 г), полученный в ссылочном примере 83(1), растворяют в метаноле (20 мл), после чего к реакционной массе добавляют 1N водный раствор гидроксида натрия (25 мл). Смесь перемешивают при комнатной температуре в течение 3 часов. В реакционный раствор добавляют 1N соляную кислоту (25 мл) и реакционный раствор концентрируют при пониженном давлении. Остаток лиофилизуют, что дает названное соединение в сыром виде, которое содержит хлорид натрия в эквимолярном количестве (6.71 г).
APCI-MS м/е: 257[М+Н]+.
Ссылочный пример 84: 6-Морфолин-4-ил-6-оксогексановая кислота
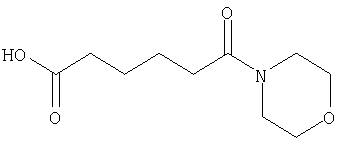
(1) Монометиладипат (3.20 г) растворяют в хлороформе (70 мл), после чего к реакционной массе добавляют морфолин (2.61 г), гидрохлорид 1-этил-3-(3-диметиламинопропил]карбодиимида (5.75 г) и триэтиламин (3.04 г) при охлаждении льдом. Затем смесь перемешивают при комнатной температуре в течение 19 часов. Воду со льдом добавляют в реакционный раствор, и смесь экстрагируют хлороформом. Органический слой промывают последовательно 10% раствором соляной кислоты, насыщенным водным раствором гидрокарбоната натрия и насыщенным рассолом и сушат над сульфатом натрия. Растворитель удаляют путем выпаривания при пониженном давлении, что дает метил-6-морфолин-4-ил-6-оксогексаноат (4.63 г).
APCI-MS м/е: 230[M+Н]+.
(2) Метил-6-морфолин-4-ил-6-оксогексаноат (4.60 г), полученный в ссылочном примере 84(1), растворяют в метаноле (20 мл), после чего к реакционной массе добавляют раствор гидроксида натрия (1.61 г) в воде (8 мл). Смесь перемешивают при комнатной температуре в течение 19 часов. Реакционный раствор концентрируют при пониженном давлении, и остаток нейтрализуют с 2N соляной кислотой. Остаток концентрируют при пониженном давлении и экстрагируют хлороформом. Органический слой сушат над сульфатом натрия и растворитель концентрируют при пониженном давлении, что дает названное соединение (4.11 г).
ESI-MS м/е: 214[М-Н]-.
Ссылочный пример 85: 5-Морфолин-4-ил-5-оксопентаноат
Глутаровый ангидрид (1.14 г) растворяют в тетрагидрофуране (20 мл), после чего к реакционной массе добавляют морфолин (0.87 г). Затем смесь перемешивают при комнатной температуре в течение 19 часов. Реакционный раствор концентрируют при пониженном давлении, и остаток разбавляют хлороформом и промывают 10% раствором соляной кислоты. Органический слой сушат над сульфатом натрия и выпаривают, чтобы удалить растворитель при пониженном давлении, что дает названное соединение (1.05 г).
ESI-MS м/е: 200[М-Н]-.
Ссылочный пример 86: N-(5-Хлорпиридин-2-ил)-2-[(2-бром-3-цианопиридин-4-ил)окси]ацетамид
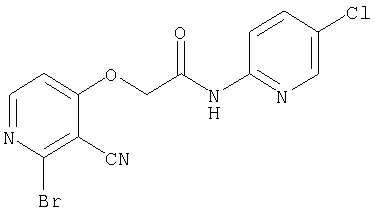
(1) 2-Бром-3-циано-4(1Н)пиридон (уровень техники в виде ссылки: М. Mittelback et al., Arch. Pharm., 1985, 318, 481-486) (837 мг), суспендируют в ацетоне (30 мл), после чего к реакционной массе добавляют карбонат натрия (853 мг), 2-хлор-N-(5-хлорпиридин-2-ил)ацетамид (1.22 г), полученный в ссылочном примере 21, и иодид натрия (900 мг). Смесь нагревают при температуре кипения с обратным холодильником в течение 2 часов и 20 минут. После добавления карбоната натрия (150 мг), 2-хлор-N-(5-хлорпиридин-2-ил)ацетамида (221 мг), полученного в ссылочном примере 21, и иодида натрия (162 мг), реакционную смесь нагревают при температуре кипения с обратным холодильником в течение еще 45 минут. Реакционному раствору дают возможность остыть до комнатной температуры и выливают в воду. Осажденное твердое вещество собирают фильтрованием. Полученное твердое вещество растворяют в тетрагидрофуране, сушат над сульфатом натрия и выпаривают, чтобы удалить растворитель при пониженном давлении. Полученный остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: хлороформ/ метанол = 50/1, затем 30/1 и затем 9/1) и суспендируют в смеси хлороформ/диизопропиловый эфир. Осадок собирают фильтрованием, что дает названное соединение (669 мг).
APCI-MS м/e: 367/369[M+H]+.
Ссылочный пример 87: 3-Амино-4-бром-N-(5-хлорпиридин-2-ил)фуро[3,2-с] пиридин-2-карбоксамид
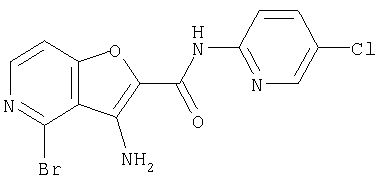
N-(5-Хлорпиридин-2-ил)-2-[(2-бром-3-цианопиридин-4-ил)окси]ацетамид (429 мг), полученный в ссылочном примере 86, обрабатывают в соответствии с методикой, аналогичной методике, изложенной в ссылочном примере 24, что дает названное соединение (260 мг).
APCI-MS м/e: 367/369[M+H]+.
Ссылочный пример 88: 3-Амино-4-метокси-N-(5-хлорпиридин-2-ил)фуро[3,2-с]пиридин-2-карбоксамид
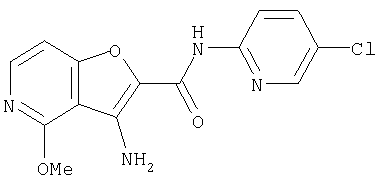
3-Амино-4-бром-N-(5-хлорпиридин-2-ил)фуро[3,2-с]пиридин-2-карбоксамид (125 мг), полученный в ссылочном примере 87, суспендируют в N,N-диметилформамиде (2 мл), после чего к реакционной массе добавляют метанол (200 мкл) и 60% раствор гидрида натрия в масле (69 мг) при охлаждении льдом. Смесь перемешивают при комнатной температуре в течение 3.5 часов. В реакционный раствор добавляют водный раствор лимонной кислоты и осажденное твердое вещество собирают фильтрованием, что дает названное соединение (82 мг).
APCI-MS м/е: 319/321[М+Н]+.
Ссылочный пример 89: 3-Амино-N-(5-хлорпиридин-2-ил)-4-(2-метоксиэтокси)фуро[3,2-с]пиридин-2-карбоксамид
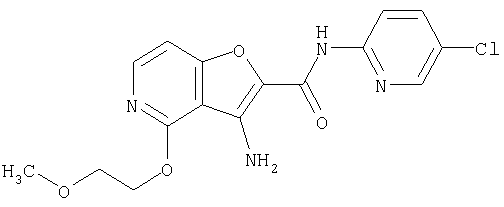
3-амино-4-бром-N-(5-хлорпиридин-2-ил)фуро[3,2-с]пиридин-2-карбоксамид (508 мг), полученный в ссылочном примере 87, суспендируют в N,N-диметилформамиде (10 мл), после чего к реакционной массе добавляют 2-метоксиэтанол (2 мл) и 60% раствор гидрида натрия в масле (280 мг) при охлаждении льдом. Смесь перемешивают при комнатной температуре в течение 20 часов, и реакционный раствор добавляют в водный раствор лимонной кислоты. Осажденное твердое вещество собирают фильтрованием, промывают водой и этанол и сушат при пониженном давлении, что дает названное соединение (377 мг).
APCI-MS м/e: 363/365[M+H]+.
Ссылочный пример 90: 3-Амино-N-(5-хлорпиридин-2-ил)-4-метил-фуро[3,2-с]пиридин-2-карбоксамид
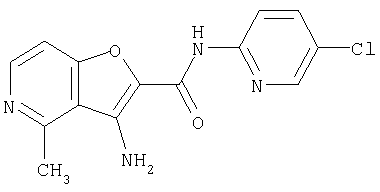
3-Амино-4-бром-N-(5-хлорпиридин-2-ил)фуро[3,2-с]пиридин-2-карбоксамид (1.09 г), полученный в ссылочном примере 87, суспендируют в 10% водном растворе 1,4-диоксана (30 мл), после чего к реакционной массе добавляют триметилбороксин (0.57 мл) и карбонат натрия (1.67 г) при комнатной температуре. Реакционный раствор дегазируют и продувают аргоном, после чего к реакционной массе добавляют тетракис(трифенилфосфин)палладия (0) (416 мг). Затем смесь дегазируют и продувают аргоном и перемешивают при температуре 110°С в течение 2 часов. После добавления воды, реакционный раствор экстрагируют хлороформом, содержащего незначительное количество метанола. Органический слой сушат над сульфатом натрия и выпаривают, чтобы удалить растворитель при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с NH-силикагелью (элюент: н-гексан/этилацетат = 3/1, затем 1/1), что дает названное соединение (775 мг).
APCI-MS м/е: 303/305[М+Н]+.
Ссылочный пример 91: 3-Амино-N-(5-хлорпиридин-2-ил)-4-цианофуро[3,2-с]пиридин-2-карбоксамид
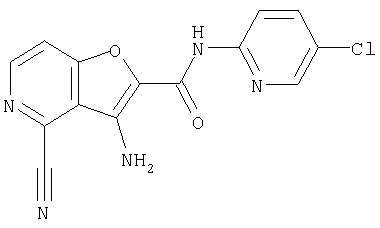
Суспензию 3-амино-4-бром-N-(5-хлорпиридин-2-ил)фуро[3,2-с]пиридин-2-карбоксамида (103 мг), полученную в ссылочном примере 87, и цианид цинка (24 мг) в N,N-диметилформамиде (6 мл), дегазируют и продувают аргоном, после чего к реакционной массе добавляют тетракис(трифенилфосфин)палладия (0) (23 мг). Смесь вновь дегазируют и вновь продувают аргоном и перемешивают при температуре 80°С в течение 4 дней. В реакционный раствор добавляют воду и хлороформ, и нерастворимые продукты удаляют фильтрованием. Органический слой отделяют и сушат над сульфатом натрия. Растворитель удаляют путем выпаривания при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: н-гексан/этилацетат = 70/30, затем 40/60), что дает названное соединение (21 мг).
APCI-MS м/е: 314/316[M+H]+.
Ссылочный пример 92: 3-(Бензилокси)-6-бромпиридин-2-карбонитрил
6-Бром-3-гидроксипиридин-2-карбонитрил (53.8 г), полученный в ссылочном примере 72(1), растворяют в ацетоне (550 мл), после чего к реакционной массе добавляют бензилбромид (35.6 мл) и карбонат натрия (43.1 г). Затем смесь нагревают при температуре кипения с обратным холодильником в течение 4 часов. После охлаждения в реакционный раствор добавляют воду (600 мл) и смесь экстрагируют этилацетатом. Водный слой экстрагируют этилацетатом один раз и объединяют с предыдущим органическим слоем. Раствор промывают насыщенным рассолом и сушат над сульфатом натрия. Растворитель удаляют путем выпаривания при пониженном давлении и остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: н-гексан/этилацетат = 5/1, затем 3/1). Полученный остаток суспендируют в смеси диэтиловый эфир/н-гексан и твердое вещество собирают фильтрованием, что дает названное соединение (24.1 г).
APCI-MS м/е: 289/291[М+Н]+.
Ссылочный пример 93: 3-(Бензилокси)-6-(диметиламино)пиридин-2-карбонитрил
3-(Бензилокси)-6-бромпиридин-2-карбонитрил (2.50 г), полученный в ссылочном примере 92, добавляют в толуол (25 мл), после чего к реакционной массе добавляют 2 моля /1 диметиламин/тетрагидрофуранового раствора (8.65 мл), трикалийфосфат (2.75 г), трис(дибензилиденацетон)дипалладий (0) (158 мг) и 2-(дициклогексилфосфино)бифенил (243 мг). Реакционный раствор нагревают в герметичной колбе при температуре 80°С в течение 24 часов и 2 моля /1 диметиламин/тетрагидрофуранового раствора (8.65 мл), трикалийфосфат (1.38 г), трис(дибензилиденацетон)дипалладий (0) (79 мг) и 2-(дициклогексилфосфино)бифенил (122 мг), с последующим нагреванием в герметичной колбе при температуре 80°С в течение еще 24 часов. После охлаждения воду выливают в реакционный раствор, и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным рассолом и сушат над сульфатом натрия. Растворитель выпаривают при пониженном давлении и остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: н-гексан/хлороформ = 1/2), что дает названное соединение (1.29 г).
APCI-MS м/е: 254[М+H]+.
Ссылочный пример 94: 3-(Бензилокси)-6-(метиламино)пиридин-2-карбонитрил
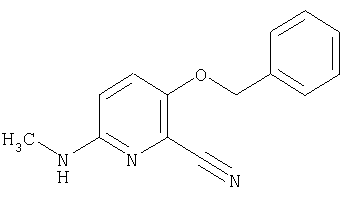
3-(Бензилокси)-6-бромпиридин-2-карбонитрил (2.00 г), полученный в ссылочном примере 92, и 2 моля /1 диметиламин/тетрагидрофуранового раствора (26.0 мл), обрабатывают в соответствии с методикой, аналогичной методике, изложенной в ссылочном примере 93, что дает названное соединение (0.34 г).
APCI-MS м/е: 240[М+Н]+.
Ссылочный пример 95: трет-Бутил-[5-(бензилокси)-6-цианопиридин-2-ил]метилкарбамат
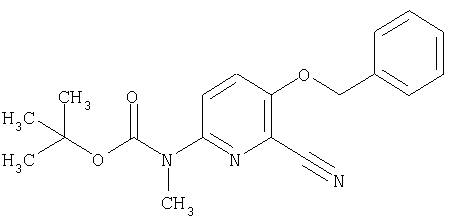
3-(Бензилокси)-6-(метиламино)пиридин-2-карбонитрил (335 мг), полученный в ссылочном примере 94, растворяют в хлороформе (7 мл), после чего к реакционной массе добавляют ди-трет-бутилдикарбонат (321 мг) и 4-диметиламинопиридин (34 мг) при охлаждении льдом. Смесь перемешивают при комнатной температуре в течение 2 часов, затем при температуре 50°С в течение 2 часов. Ди-трет-бутилдикарбонат (321 мг) и 4-диметиламинопиридин (17 мг) добавляют в реакционный раствор, и смесь нагревают при температуре кипения с обратным холодильником в течение 5 часов. Затем ди-трет-бутилдикарбонат (642 мг) и 4-диметиламинопиридин (137 мг) добавляют в реакционную смесь, и смесь перемешивают при температуре 60°С в течение 15 часов. После добавления ди-трет-бутилдикарбоната (920 мг) и 4-диметиламинопиридина (171 мг), смесь нагревают при температуре кипения с обратным холодильником в течение 10 часов. Реакционному раствору дают возможность остыть, после чего в него выливают воду, затем экстрагируют хлороформом. Органический слой промывают насыщенным рассолом и сушат над сульфатом натрия. Растворитель удаляют путем выпаривания при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: н-гексан/этилацетат = 5/1, затем 2/1), что дает названное соединение (156 мг).
APCI-MS м/е: 340[M+H]+.
Ссылочный пример 96: 3-(Бензилокси)-6-морфолин-4-илпиридин-2-карбонитрил
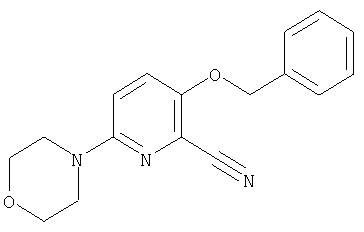
3-(Бензилокси)-6-бромпиридин-2-карбонитрил (1.00 г), полученный в ссылочном примере 92, добавляют в толуол (10 мл), после чего к реакционной массе добавляют морфолин (362 мкл), трикалийфосфат (1.03 г), трис(дибензилиденацетон)дипалладий (0) (63 мг) и 2-(дициклогексилфосфино)бифенил (97 мг). Реакционный раствор перемешивают при температуре 80°С в течение 24 часов в атмосфере аргона, после чего к реакционной массе добавляют морфолин (362 мкл), трикалийфосфат (1.03 г), трис(дибензилиденацетон)дипалладий (0) (63 мг) и 2-(дициклогексил-фосфино)бифенил (97 мг). Смесь перемешивают при температуре 80°С в течение 24 часов. После охлаждения, воду выливают в реакционный раствор, и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным рассолом и сушат над сульфатом натрия. Растворитель удаляют путем выпаривания при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: н-гексан/этилацетат = 2/1), что дает названное соединение (0.62 г).
APCI-MS м/е: 296[М+Н]+.
Ссылочный пример 97: 3-(Бензилокси)-6-пирролидин-1-ил пиридин-2-карбонитрил
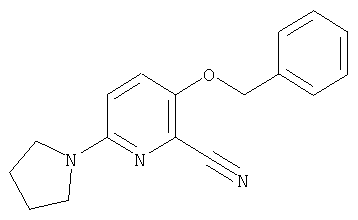
3-(Бензилокси)-6-бромпиридин-2-карбонитрил (2.00 г), полученный в ссылочном примере 92, и пирролидин (3.46 мл), обрабатывают в соответствии с методикой, аналогичной методике, изложенной в ссылочном примере 96, что дает названное соединение (1.30 г).
APCI-MS м/e: 296[M+H]+.
Ссылочный пример 98: 3-(Бензилокси)-6-(2-метоксиэтокси)пиридин-2-карбонитрил
3-(Бензилокси)-6-бромпиридин-2-карбонитрил (100 мг), полученный в ссылочном примере 92, добавляют в толуол (2 мл), после чего к реакционной массе добавляют карбонат цезия (169 мг), ацетат палладия (II) (1.6 мг), 2-(ди-трет-бутилфосфино)-1,1'-бинафтил (рацемат) (3.4 мг) и 2-метоксиэтанол (55 мкл). Смесь перемешивают при температуре 70°С в течение 24 часов. После охлаждения, воду выливают в реакционный раствор, и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным рассолом и сушат над сульфатом натрия. Растворитель удаляют путем выпаривания при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем (элюент: н-гексан/этилацетат = 3/1, затем 2/1), что дает названное соединение (84 мг).
APCI-MS м/e: 285[M+H]+.
Ссылочный пример 99: 3-(Бензилокси)-6-изопропоксипиридин-2-карбонитрил
3-(Бензилокси)-6-бромпиридин-2-карбонитрил (2.00 г), полученный в ссылочном примере 92, и 2-пропанол (3.96 мл), обрабатывают в соответствии с методикой, аналогичной методике, изложенной в ссылочном примере 98, что дает названное соединение (1.53 г).
APCI-MS м/е: 269[М+H]+.
Ссылочный пример 100: 6-(Диметиламино)-3-гидроксипиридин-2-карбонитрил
3-(Бензилокси)-6-(диметиламино)пиридин-2-карбонитрил (1.28 г), полученный в ссылочном примере 93, растворяют в этаноле (50 мл), после чего к реакционной массе добавляют 20% гидроксид палладия на угле (0.13 г). Смесь перемешивают при комнатной температуре в течение 2 часов в атмосфере водорода при нормальном давлении. Катализатор удаляют фильтрованием. Фильтрат концентрируют при пониженном давлении и сушат, что дает названное соединение (0.88 г).
APCI-MS м/е: 164[М+Н]+.
Ссылочные примеры 101-105
Соответствующие исходные соединения обрабатывают в соответствии с методикой, аналогичной методике, изложенной в ссылочном примере 100, что дает следующие соединения (см. табл.81).
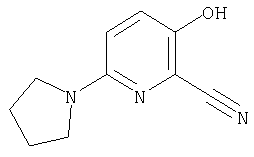
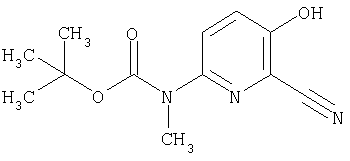
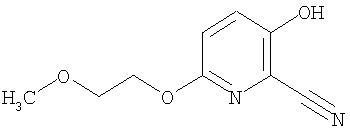
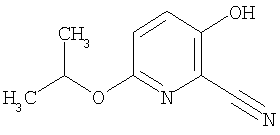
Ссылочные примеры 106-111
Соответствующие исходные соединения обрабатывают в соответствии с методикой, аналогичной методике, изложенной в ссылочном примере 23, что дает следующие соединения (см. табл.82).
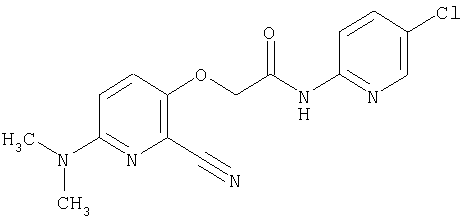
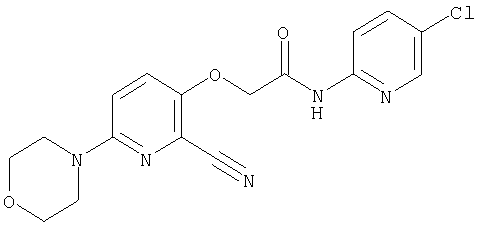
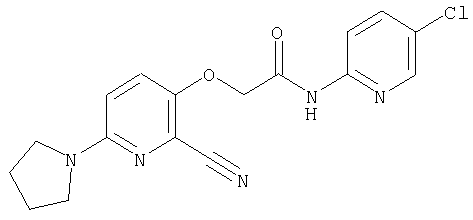
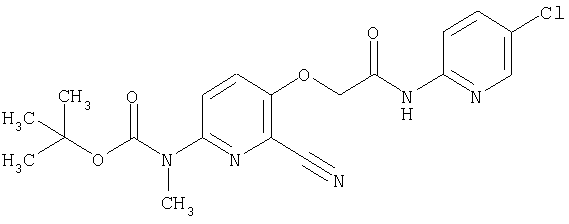
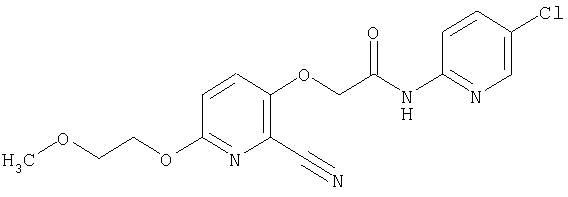
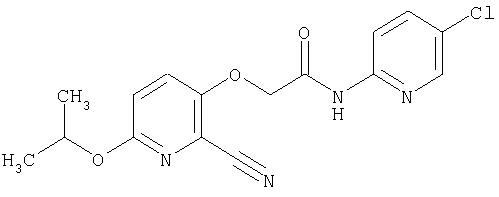
Ссылочный пример 112: 3-Амино-N-(5-хлорпиридин-2-ил)-5-(диметиламино)фуро [3,2-b] пиридин-2-карбоксамид
N-(5-Хлорпиридин-2-ил)-2-{[2-циано-6-(диметиламино)пиридин-3-ил]окси}ацетамид (1.59 г), полученный в ссылочном примере 106, суспендируют в трет-бутаноле (50 мл), после чего к реакционной массе добавляют трет-бутоксид калия (54 мг). Смесь нагревают при температуре кипения с обратным холодильником в течение 2 часов. После охлаждения, воду выливают в реакционный раствор и осажденное твердое вещество собирают фильтрованием. Полученное твердое вещество промывают диэтиловым эфиром и сушат, что дает названное соединение (1.16 г).
APCI-MS м/e: 332/334[M+H]+.
Ссылочные примеры 113-117
Соответствующие исходные соединения обрабатывают в соответствии с методикой, аналогичной методике, изложенной в ссылочном примере 112, что дает следующие соединения (см. табл.83).
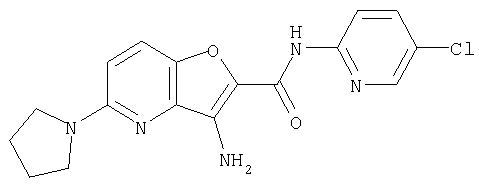
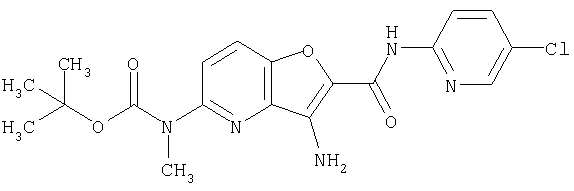
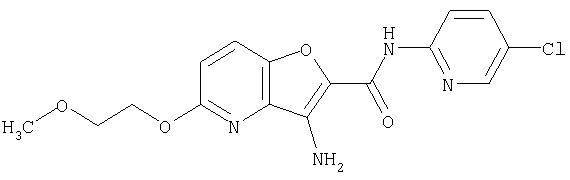
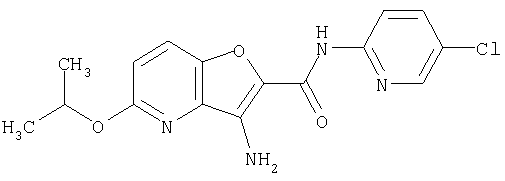
Ссылочные примеры 118 и 119
Соответствующую карбоновую кислоту и метил-3-аминофуро[3,2-b]пиридин-2-карбоксилат, полученный в ссылочном примере 78, обрабатывают в соответствии с методикой, аналогичной методике, изложенной в ссылочном примере 79, что дает следующие соединения (см. табл.84).
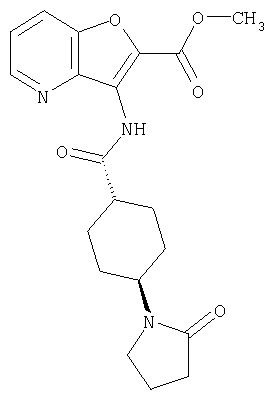
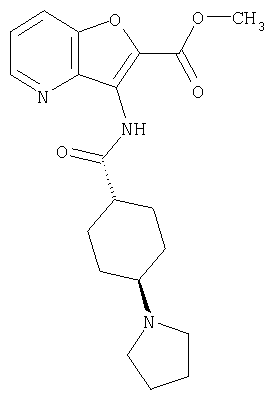
Ссылочный пример 120: 3-Амино-4-хлор-N-(5-хлорпиридин-2-ил)фуро[3,2-с]пиридин-2-карбоксамид
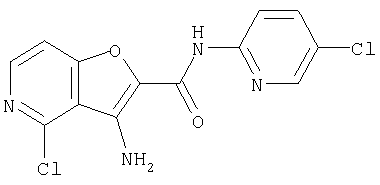
(1) 2-Хлор-4-метокси-3-карбонитрил, известный из уровня техники (ссылка: М. Mittelback et al., Arch. Pharm., 1985, 318, 481-486) деметилируют с помощью 25% смеси бромистый водород /уксусная кислота, что дает 2-хлор-3-циано-4(1Н)-пиридон в виде сырого твердого вещества.
ESI-MS м/e: 153/155 [М-Н]-
(2) 2-Хлор-3-циано-4(1Н)-пиридон, полученный в (1), как указано выше, обрабатывают в соответствии с методикой, аналогичной методике, изложенной в ссылочном примере 23, что дает N-(5-хлорпиридин-2-ил)-2-[(2-хлор-3-цианопиридин-4-ил)окси]ацетамид в виде сырого твердого вещества.
APCI-MS м/е: 323/325[М+Н]+
(3) N-(5-Хлорпиридин-2-ил)-2-[(2-хлор-3-цианопиридин-4-ил)окси]ацетамид, полученный в (2), как указано выше, обрабатывают в соответствии с методикой, аналогичной методике, изложенной в ссылочном примере 112, что дает названное соединение в виде сырого твердого вещества.
APCI-MS м/е: 323/325[М+Н]+
Ссылочный пример 121: 4-(Бензилокси)-2-бромпиридин-3-карбонитрил
2-Бром-3-циано-4(1Н)-пиридон обрабатывают в соответствии с методикой, аналогичной методике, изложенной в ссылочном примере 92, что дает названное соединение.
APCI-MS м/е: 289/291[М+Н]+
Ссылочный пример 122: 4-(Бензилокси)-2-(пропоксикарбонил)пиридин-3-карбонитрил
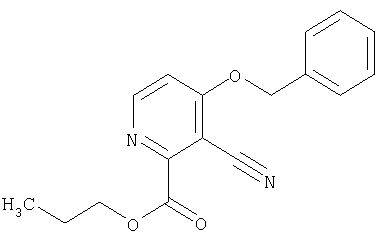
4-(Бензилокси)-2-бромпиридин-3-карбонитрил (500 мг), полученный в ссылочном примере 121, растворяют в N,N-диметилформамиде (10 мл), после чего к реакционной массе добавляют 1-пропанол (20 мл) и триэтиламин (410 мкл) при комнатной температуре и смесь продувают аргоном. В реакционный раствор добавляют 1,3-бис(дифенилфосфино)пропан (114 мг) и ацетат палладия (62 мг) и смесь дегазируют и продувают оксидом углерода. Смесь перемешивают при температуре 90°С в течение 19.5 часов в атмосфере оксида углерода, и реакционный раствор разбавляют водой и экстрагируют хлороформом. Органический слой сушат над сульфатом натрия, и растворитель выпаривают при пониженном давлении. Полученный остаток очищают с помощью хроматографии на колонке с силикагелью (элюент: н-гексан / этилацетат = 4/1, затем 1/1), что дает названное соединение (200 мг).
APCI-MS м/е: 297[М+Н]+
Ссылочный пример 123: 4-Гидрокси-2-(пропоксикарбонил)пиридин-3-карбонитрил
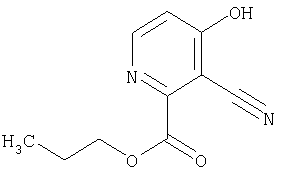
4-(Бензилокси)-2-(пропоксикарбонил)пиридин-3-карбонитрил (199 мг), полученный в ссылочном примере 122, обрабатывают в соответствии с методикой, аналогичной методике, изложенной в ссылочном примере 100, что дает названное соединение (149 мг).
APCI-MS м/е: 207[М+Н]+
Ссылочный пример 124: N-(5-Хлорпиридин-2-ил)-2-[(2-пропоксикарбонил-3-цианопиридин-4-ил)окси]ацетамид
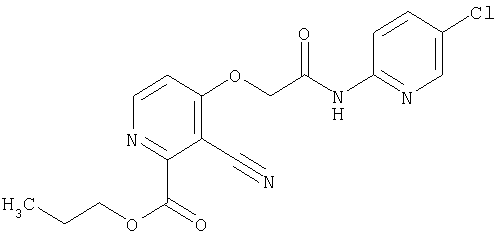
4-Гидрокси-2-(пропоксикарбонил)пиридин-3-карбонитрил (145 мг), полученный в ссылочном примере 123, обрабатывают в соответствии с методикой, аналогичной методике, изложенной в ссылочном примере 23, что дает названное соединение (67.3 мг).
APCI-MS м/e: 375/377[M+H]+
Ссылочный пример 125: 3-Амино-N-(5-хлорпиридин-2-ил)-4-(пропоксикарбонил)фуро[3,2-с]пиридин-2-карбоксамид
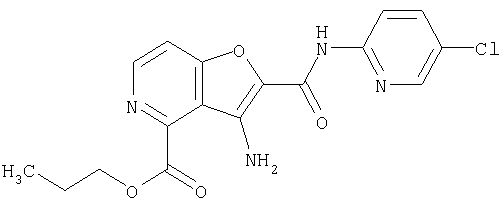
N-(5-Хлорпиридин-2-ил)-2-[(2-пропоксикарбонил-3-цианопиридин-4-ил)окси]ацетамид (65 мг), полученный в ссылочном примере 124, обрабатывают в соответствии с методикой, аналогичной методике, изложенной в ссылочном примере 112, что дает названное соединение (68 мг).
APCI-MS м/е: 375/377[М+Н]+
Экспериментальный пример 1: Эффект ингибирования на фактор Х активации коагуляции крови.
Субстрат раствора получают путем растворения хромогенного субстрата S-2222 при концентрации 0.625 мМ (конечная концентрация 0.5 мМ) в 100 мМ Трис буфера (рН 8.4), содержащего 200 мМ хлорида натрия, и 0.1% раствор бычьего сывороточного альбумина и раствор тестируемого соединения получают путем растворения тестируемого соединения в буфере, содержащем 10% диметилсульфоксид. Раствор тестируемого соединения (25 мкл) добавляют в субстратный раствор (200 мкл). В контрольной группе используют 25 мкл буфера, содержащего 10% диметилсульфоксида вместо раствора тестируемого соединения.
После предварительного нагревания при температуре 37°С в течение 3 минут, 25 мкл человеческого FXa (Enzyme Research Laboratories, Inc.), растворенного при 0.5 U/мл в буфере, добавляют в реакционную смесь (конечная концентрация FXa: 0.05 U/мл), чтобы инициировать реакцию. В течение 5-минутной реакции при температуре 37°С проводят мониторинг абсорбции при 405 нм последовательно на 96-ячеечном микропланшетном ридаре (Spectra MAX250, Molecular Devices) и увеличение абсорбции используют как индекс FXa активности. Для того чтобы оценить FXa ингибиторную активность тестируемого соединения, 50% ингибирующей концентрации тестируемого соединения для FXa активности по сравнению с контрольной группой (значение IC50) рассчитывают, используя аналитическую программу (GraphPad Prism, GraphPad Software, Inc.). Пример результатов показан в Таблице 85.
Соединения настоящего изобретения показывают 50% ингибиторную концентрацию (значение IC50) менее, чем 1 мкМ и предпочтительные соединения среди них демонстрируют значение IC50 менее, чем 20 нМ. Таким образом, соединения по настоящему изобретению демонстрируют наличие отличного ингибиторного эффекта на фактор Х активированной коагуляции крови.
Промышленное применение
Соединение формулы (I) или их фармацевтически приемлемая соль является менее токсичным и безопасным и демонстрирует отличный ингибиторный эффект на фактор Х активации коагуляции крови. Соответственно, указанное соединение (I) является полезньм в качестве лекарственного средства для профилактики и лечения заболеваний, вызванных тромбами или эмболами.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ БЕНЗОФУРАНА | 2003 |
|
RU2286344C2 |
| ЗАМЕЩЕННЫЕ ТРИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ И СПОСОБ ПРИМЕНЕНИЯ | 2016 |
|
RU2744766C2 |
| ГЕТЕРОЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ | 2018 |
|
RU2791533C2 |
| ДИАМИНОВЫЕ ПРОИЗВОДНЫЕ | 2003 |
|
RU2333203C2 |
| ЗАМЕЩЕННЫЕ ГЕТЕРОАРИЛОМ ПИРИДИНЫ И СПОСОБЫ ПРИМЕНЕНИЯ | 2017 |
|
RU2756743C2 |
| ЗАМЕЩЕННЫЕ ИМИДАЗОПИРИДИНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ HDM2 | 2013 |
|
RU2690663C2 |
| АЗОТСОДЕРЖАЩИЕ НАСЫЩЕННЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ | 2012 |
|
RU2595136C2 |
| ПРОИЗВОДНЫЕ ДИАМИНОВ | 2002 |
|
RU2319699C2 |
| ПРОИЗВОДНЫЕ ДИАМИНА | 2002 |
|
RU2314303C2 |
| БИЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ И ЕГО ПРИМЕНЕНИЕ ДЛЯ ИНГИБИРОВАНИЯ SUV39H2 | 2016 |
|
RU2729187C1 |
Изобретение относится к новым производным конденсированного фурана формулы (I):
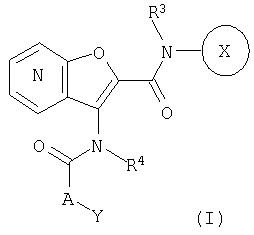
где кольцо Х представляет собой бензол, пиридин или им подобные; Y представляет собой необязательно замещенный циклоалкил, необязательно замещенный арил, необязательно замещенный пиперидил, пирролидил, замещенный оксо, морфолино, замещенный оксо; А представляет собой простую связь или алкилен; R3 представляет собой водород или им подобные; и R4 представляет собой водород или его фармацевтически приемлемую соль, которые являются полезными в виде лекарства, особенно, в виде ингибитора фактора Х активированной коагуляции крови, а также к промежуточным соединениям. 5 н. и 11 з.п. ф-лы. 85 табл.
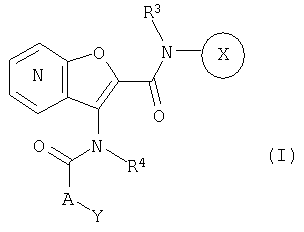
где кольцо 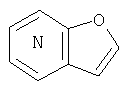 представляет собой
представляет собой
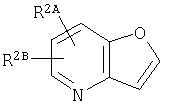 ,
, 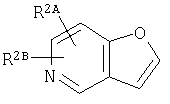 ,
, 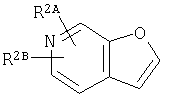 ,
,
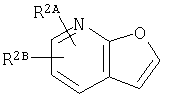 или
или 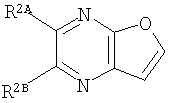 ;
;
кольцо Х представляет собой:
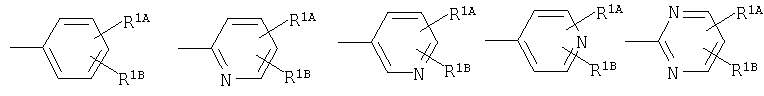
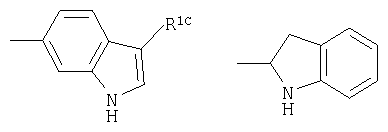 или
или  ;
;
Y представляет собой необязательно замещенный циклоалкил; необязательно замещенный арил; необязательно замещенный пиперидил, пирролидил, замещенный оксо, морфолино, замещенный оксо;
А представляет собой простую связь или алкилен;
где заместитель для Y, представляющий собой циклоалкил, есть (1) аминогруппа, необязательно замещенная группой, выбранной из ацила,
аклоксикарбонила, алкила, аминоалкила, алкилзамещенного аминоалкила, алкоксикарбониламиноалкила, и ациламиноалкила; (2) алкил, замещенный с помощью аминогруппы, необязательно замещенной алкилом; (3) карбамоил, необязательно моно- или дизамещенный алкилом или аминоалкилом, которые могут быть замещены алкилом; (4) группу, выбранную из пирролидинилкарбонила, пиперидилкарбонила, пиперазинилкарбонила, морфолинокарбонила, гомопиперидинилкарбонила и гомопиперазинилкарбонила; или (5) насыщенную гетероциклическую группу, выбранную из пирролидинила, необязательно замещенного оксо, пиперидила, необязательно замещенного оксо, пиперазинила, необязательно замещенного алкоксикарбонила, алкила, ацила, оксо, морфолино, необязательно замещенного с помощью оксо, гомопиперидинила, необязательно замещенного с помощью оксо, гомопиперазинила, необязательно замещенного с помощью оксо, оксазолидинила, необязательно замещенного с помощью оксо, тетрагидрооксазинила, необязательно замещенного с помощью оксо и изотиазолидинила, необязательно замещенного с помощью оксо; а
заместителем для Y в пиперидиле является алкил или пиридил;
R1А, R1В являются одинаковыми или различными и каждый представляет собой водород; галоген; алкил; галогеналкил; алкокси; циано; нитро; или необязательно замещенную аминогруппу;
R1С представляет собой водород, алкил или галоген;
R2A, R2В являются одинаковыми или различными и каждый представляет собой водород; галоген; необязательно замещенный алкил; необязательно замещенный алкокси; необязательно замещенную аминогруппу; нитро; циано; гидрокси; карбокси; необязательно замещенный алкоксикарбонил; необязательно замещенный карбамоил; пирролидинил, пирролидинилкарбонил, морфолинокарбонил или морфолино;
R3 представляет собой водород; R4 представляет собой водород;
или его фармацевтически приемлемая соль.
 представляет собой
представляет собой
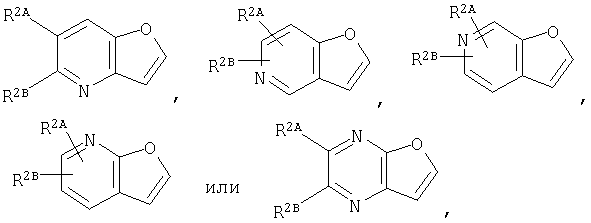
где символы являются теми же самыми, как определено в п.1, указанном выше.
где кольцо

представляет собой
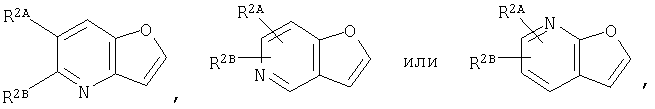
где символы являются теми же самыми, как определено в п.1, или его фармацевтически приемлемая соль.
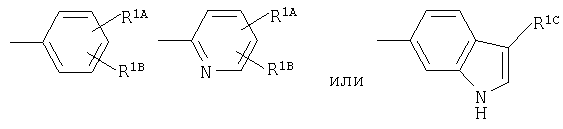
где символы являются теми, как определено в п.1,
или его фармацевтически приемлемая соль.
(1) 5-амино-N-(5-хлорпиридин-2-ил)-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-b]пиридин-2-карбоксамида,
(2) 6-амино-N-(5-хлорпиридин-2-ил)-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(3) N-(4-хлорфенил)-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-b]пиридин-2-карбоксамида,
(4) N-(5-хлорпиридин-2-ил)-5-[(метилсульфонил)амино]-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-b]пиридин-2-карбоксамида,
(5) 2-{[(5-хлорпиридин-2-ил)амино]карбонил}-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-b]пиридин-5-карбоновой кислоты,
(6) N-(5-хлорпиридин-2-ил)-3-{[(транс-4-пирролидин-1-ил-циклогексил)карбонил]амино}фуро[3,2-с]пиридин-2-карбоксамида,
(7) N-(5-хлорпиридин-2-ил)-5-(гидроксиметил)-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(8) N-(5-хлорпиридин-2-ил)-5-метокси-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(9) N-(5-хлорпиридин-2-ил)-3-{[(транс-4-пирролидин-1-ил-циклогексил)карбонил]амино}фуро[3,2-b]пиридин-2-карбоксамида,
(10) N-(5-хлорпиридин-2-ил)-5-метокси-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-b]пиридин-2-карбоксамида,
(11) N-(4-хлорфенил)-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(12) 5-амино-N-(5-хлорпиридин-2-ил)-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(13) 5-(ацетиламино)-N-(5-хлорпиридин-2-ил)-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-b]пиридин-2-карбоксамида,
(14) N-(5-хлорпиридин-2-ил)-5-фтор-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(15) 5-хлор-N-(5-хлорпиридин-2-ил)-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-b]пиридин-2-карбоксамида,
(16) N-(5-хлорпиридин-2-ил)-5-метил-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-b]пиридин-2-карбоксамид,
(17) N2-(5-хлорпиридин-2-ил)-N5,N5-диметил-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-b]пиридин-2,5-дикарбоксамида,
(18) 5-(ацетиламино)-N-(5-хлорпиридин-2-ил)-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(19) трет-бутил(2-{[(5-хлорпиридин-2-ил)амино]карбонил}-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-b]пиридин-6-ил)-карбамата,
(20) N-(5-хлорпиридин-2-ил)-5-[(метилсульфонил)амино]-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(21) N-(4-хлорфенил)-3-({[транс-4-(2-оксопирролидин-1-ил)-циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(22) N-(5-хлорпиридин-2-ил)-3-{[(1-пиридин-4-илпиперидин-4-ил)карбонил]амино}фуро[3,2-b]пиридин-2-карбоксамида,
(23) N-(5-хлорпиридин-2-ил)-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(24) трет-бутил[2-{[(5-хлорпиридин-2-ил)амино]карбонил}-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-6-ил]карбамата,
(25) 6-амино-N-(5-хлорпиридин-2-ил)-3-({[транс-4-(2-оксопирролидин-1-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(26) 6-амино-N-(5-хлорпиридин-2-ил)-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-b]пиридин-2-карбоксамида,
(27) 2-{[(5-хлорпиридин-2-ил)амино]карбонил}-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-5-карбоновой кислоты,
(28) N2-(5-хлорпиридин-2-ил)-N5,N5-диметил-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2,5-дикарбоксамида,
(29) N-(5-хлорпиридин-2-ил)-5-(морфолин-4-илкарбонил)-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-b]пиридин-2-карбоксамида,
(30) трет-бутил(2-{[(5-хлорпиридин-2-ил)амино]карбонил}-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-b]пиридин-5-ил)-карбамата,
(31) N-(5-хлорпиридин-2-ил)-5-метил-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(32) метил-2-{[(5-хлорпиридин-2-ил)амино]карбонил}-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-b]пиридин-5-карбоновую кислоту,
(33) 5-бром-N-(5-хлорпиридин-2-ил)-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-b]пиридин-2-карбоксамида,
(34) N-(5-хлорпиридин-2-ил)-5-[(метилсульфонил)амино]-3-({[транс-4-(2-оксопирролидин-1-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(35) N-(4-хлорфенил)-3-({[транс-4-(диметиламино)циклогексил]-карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(36) N-(5-хлорпиридин-2-ил)-5-циано-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-b]пиридин-2-карбоксамида,
(37) N-(5-хлорпиридин-2-ил)-5-фтор-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-b]пиридин-2-карбоксамида,
(38) N-(5-хлорпиридин-2-ил)-N-(2-метоксиэтил)-N-метил-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2,5-дикарбоксамида,
(39) N-(5-хлорпиридин-2-ил)-3-({[транс-4-(диметиламино)-циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(40) N-(5-хлорпиридин-2-ил)-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)-5-(пирролидин-1-илкарбонил)фуро[3,2-b]пиридин-2-карбоксамида,
(41) трет-бутил[2-{[(5-хлорпиридин-2-ил)амино]карбонил}-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-5-ил]карбамата,
(42) 5-бром-N-(5-хлорпиридин-2-ил)-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(43) N-(5-хлорпиридин-2-ил)-5-(морфолин-4-илкарбонил)-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(44) N-(5-хлорпиридин-2-ил)-3-({[транс-4-(диметиламино)-циклогексил]карбонил}амино)-5-метоксифуро[3,2-b]пиридин-2-карбоксамида,
(45) 5-хлор-N-(5-хлорпиридин-2-ил)-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(46) 2-{[(5-хлорпиридин-2-ил)амино]карбонил}-3-({[транс-4-(2-оксопирролидин-1-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-5-карбоновой кислоты,
(47) N-(5-хлорпиридин-2-ил)-5-циано-3-({[транс-4-(2-оксопирролидин-1-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(48) N-(5-хлорпиридин-2-ил)-5-циано-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(49) N-(5-хлорпиридин-2-ил)-5-(гидроксиметил)-3-({[транс-4-(2-оксопирролидин-1-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(50) N-(5-хлорпиридин-2-ил)-5-метокси-3-({[транс-4-(2-оксопирролидин-1-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(51) N-(5-хлорпиридин-2-ил)-3-({[транс-4-(2-оксопирролидин-1-ил)циклогексил]карбонил}амино)-5-(пирролидин-1-илкарбонил)фуро[3,2-b]пиридин-2-карбоксамида,
(52) N-(5-хлорпиридин-2-ил)-5-метил-3-({[транс-4-(2-оксопирролидин-1-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(53) N-(5-хлорпиридан-2-ил)-3-({[транс-4-(диметиламино)-циклогексил]карбонил}амино)-5-метилфуро[3,2-b]пиридин-2-карбоксамида,
(54) 5-хлор-N-(5-хлорпиридин-2-ил)-3-({[транс-4-(диметиламино)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамид,
(55) N2-(5-хлорпиридин-2-ил)-3-({[транс-4-(диметиламино)-циклогексил]карбонил}амино)-N5,N5-диметилфуро[3,2-b]пиридин-2,5-дикарбоксамида,
(56) Метил-2-{[(5-хлорпиридин-2-ил)амино]карбонил}-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-5-карбоновую кислоту,
(57) N-(5-хлорпиридин-2-ил)-3-({[транс-4-(2-оксопирролидин-1-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(58) 5-амино-N-(5-хлорпиридин-2-ил)-3-({[транс-4-(2-оксопирролидин-1-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(59) N-(5-хлорпиридин-2-ил)-3-({[транс-4-(2-оксопирролидин-1-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(60) 2-{[(5-хлорпиридин-2-ил)амино]карбонил}-3-{[5-(3-оксоморфолин-4-ил)пентаноил]амино}фуро[3,2-b]пиридин-5-карбоновой кислоты,
(61) N-(5-хлорпиридин-2-ил)-3-({[транс-4-(диметиламино)-циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(62) 6-хлор-N-(5-хлорпиридин-2-ил)-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-b]пиридин-2-карбоксамида,
(63) 5-хлор-N-(5-хлорпиридин-2-ил)-3-({[транс-4-(2-оксопирролидин-1-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(64) N2-(5-хлорпиридин-2-ил)-N5,N5-диметил-3-({[транс-4-(2-оксопирролидин-1-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2,5-дикарбоксамида,
(65) 6-(ацетиламино)-N-(5-хлорпиридин-2-ил)-3-({[транс-4-(пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-b]пиридин-2-карбоксамида,
(66) трет-бутил[2-{[(5-хлорпиридин-2-ил)амино]карбонил}-3-({[транс-4-(2-оксопирролидин-1-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-6-ил]карбамата,
(67) 6-хлор-N-(5-хлорпиридин-2-ил)-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(68) N-(4-метилфенил)-3-({[транс-4-(3-оксоморфолин-4-ил)-циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(69) 2-{[(5-хлорпиридин-2-ил)амино]карбонил}-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-b]пиридин-6-карбоновой кислоты,
(70) N-(5-хлорпиридин-2-ил)-3-{[5-(3-оксоморфолин-4-ил)пентаноил]амино}фуро[3,2-b]пиридин-2-карбоксамида,
(71) 5-(ацетиламино)-N-(5-хлорпиридин-2-ил)-3-({[транс-4-(2-оксопирролидин-1-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(72) N-(4-хлорфенил)-3-{[(транс-4-морфолин-4-илциклогексил)-карбонил]амино}фуро[3,2-b]пиридин-2-карбоксамида,
(73) 5-бром-N-(5-хлорпиридин-2-ил)-3-({[транс-4-(диметиламино)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(74) N-(5-хлорпиридин-2-ил)-3-({[транс-4-(диметиламино)-циклогексил]карбонил}амино)фуро[2,3-b]пиридин-2-карбоксамида,
(75) 3-[({транс-4-[[3-(ацетиламино)пропил](метил)амино]-циклогексил}карбонил)амино]-N-(5-хлорпиридин-2-ил)фуро[3,2-b]пиридин-2-карбоксамида,
(76) транс-N-(2-{[(5-хлорпиридин-2-ил)амино]карбонил}фуро[3,2-b]пиридин-3-ил)-N,N-диметилциклогексан-1,4-дикарбоксамида,
(77) N-(5-хлорпиридин-2-ил)-3-({[транс-4-(пирролидин-1-ил-карбонил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(78) 2-{[(5-хлорпиридин-2-ил)амино]карбонил}-3-[({транс-4-[(диметиламино)карбонил]циклогексил}карбонил)амино]фуро[3,2-b]-пиридин-5-карбоновой кислоты,
(79) метил-2-{[(5-хлорпиридин-2-ил)амино]карбонил}-3-({[транс-4-(пирролидин-1-илкарбонил)циклогексил]карбонил}амино)фуро[3,2-b]-пиридин-5-карбоновую кислоту,
(80) метил-2-{[(5-хлорпиридин-2-ил)амино]карбонил}-3-[({транс-4-[(диметиламино)карбонил]циклогексил}карбонил)амино]фуро[3,2-b]пиридин-5-карбоновую кислоту,
(81) 2-{[(5-хлорпиридин-2-ил)амино]карбонил}-3-({[транс-4-(пирролидин-1-илкарбонил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-5-карбоновой кислоты,
(82) N2-(5-хлорпиридин-2-ил)-3-[({транс-4-[(диметиламино)-карбонил]циклогексил}карбонил)амино]-N5-(2-метоксиэтил)-N5-метилфуро[3,2-b]пиридин-2,5-дикарбоксамида,
(83) N2-(5-хлорпиридин-2-ил)-N5-(2-метоксиэтил)-N5-метил-3-({[транс-4-пирролидин-1-илкарбонил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2,5-дикарбоксамида,
(84) N-(5-хлорпиридин-2-ил)-5-пирролидин-1-ил-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-b]пиридин-2-карбоксамида,
(85) N-(5-хлорпиридин-2-ил)-5-морфолин-4-ил-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-b]пиридин-2-карбоксамида,
(86) N-(5-хлорпиридин-2-ил)-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)-5-пирролидин-1-илфуро[3,2-b]пиридин-2-карбоксамида,
(87) N-(5-хлорпиридин-2-ил)-5-(диметиламино)-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(88) N-(5-хлорпиридин-2-ил)-5-морфолин-4-ил-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(89) N-(5-хлорпиридин-2-ил)-4-(2-метоксиэтокси)-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-с]пиридин-2-карбоксамида,
(90) N-(5-хлорпиридин-2-ил)-5-(2-метоксиэтокси)-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(91) N-(5-хлорпиридин-2-ил)-5-(пирролидин-1-илкарбонил)-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-b]пиридин-2-карбоксамида,
(92) N-(5-хлорпиридин-2-ил)-4-(2-метоксиэтокси)-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-с]пиридин-2-карбоксамида,
(93) N-(5-хлорпиридин-2-ил)-4-метокси-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-с]пиридин-2-карбоксамида,
(94) N-(5-хлорпиридин-2-ил)-3-({[транс-4-(диметиламино)-циклогексил]карбонил}амино)-5-пирролидин-1-илфуро[3,2-b]пиридин-2-карбоксамида,
(95) N2-(5-хлорпиридин-2-ил)-N5-(2-метоксиэтил)-N5-метил-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-b]пиридин-2,5-дикарбоксамида,
(96) N-(5-хлорпиридин-2-ил)-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-с]пиридин-2-карбоксамида,
(97) N-(5-хлорпиридин-2-ил)-5-(диметиламино)-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-b]пиридин-2-карбоксамида,
(98) N-1Н-индол-6-ил-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(99) N-(5-хлорпиридин-2-ил)-4-метокси-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-с]пиридин-2-карбоксамида,
(100) N-(5-хлорпиридин-2-ил)-3-({[транс-4-(2-оксопирролидин-1-ил)циклогексил]карбонил}амино)-5-пирролидин-1-илфуро[3,2-b]пиридин-2-карбоксамида,
(101) N-(5-хлорпиридин-2-ил)-5-изопропокси-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-b]пиридин-2-карбоксамида,
(102) N-(5-хлорпиридин-2-ил)-5-изопропокси-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(103) N-(5-хлорпиридин-2-ил)-3-({[транс-4-(диметиламино)циклогексил]карбонил}амино)-5-(2-метоксиэтокси)-фуро[3,2-b]пиридин-2-карбоксамида,
(104) N-(5-хлорпиридин-2-ил)-5-морфолин-4-ил-3-({[транс-4-(2-оксопирролидин-1-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(105) N-(5-хлорпиридин-2-ил)-5-(диметиламино)-3-({[транс-4-(2-оксопирролидин-1-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(106) N-(5-хлорпиридин-2-ил)-3-({[транс-4-(диметиламино)-циклогексил]карбонил}амино)-5-морфолин-4-илфуро[3,2-b]пиридин-2-карбоксамида,
(107) N-(5-хлорпиридин-2-ил)-5-(2-метоксиэтокси)-3-({[транс-4-(2-оксопирролидин-1-ил)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(108) N-(5-хлорпиридин-2-ил)-5-(диметиламино)-3-({[транс-4-(диметиламино)циклогексил]карбонил}амино)фуро[3,2-b]пиридин-2-карбоксамида,
(109) N-(5-хлорпиридин-2-ил)-3-({[транс-4-(диметиламино)-циклогексил]карбонил}амино)-5-изопропоксифуро[3,2-b]пиридин-2-карбоксамида,
(110) N-1Н-индол-6-ил-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-b]пиридин-2-карбоксамида,
(111) N-(5-хлорпиридин-2-ил)-4-циано-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро[3,2-с]пиридин-2-карбоксамида,
(112) N-(5-хлорпиридин-2-ил)-4-метил-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-с]пиридин-2-карбоксамида,
(113) N-(5-хлорпиридин-2-ил)-4-циано-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-с]пиридин-2-карбоксамида,
(114) N-(5-хлорпиридин-2-ил)-4-метил-3-({[транс-4-(2-оксопирролидин-1-ил)циклогексил]карбонил}амино)фуро[3,2-с]пиридин-2-карбоксамида,
(115) 4-хлор-N-(5-хлорпиридин-2-ил)-3-({[транс-4-(3-оксоморфолин-4-ил)циклогексил]карбонил}амино)фуро[3,2-с]пиридин-2-карбоксамида, и
(116) N-(5-хлорпиридин-2-ил)-4-метил-3-{[(транс-4-пирролидин-1-илциклогексил)карбонил]амино}фуро{3,2-с]пиридин-2-карбоксамид
или его фармацевтически приемлемая соль.
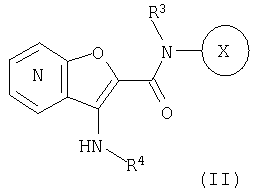
где символы являются теми, как определено в п.1,
или его соль.
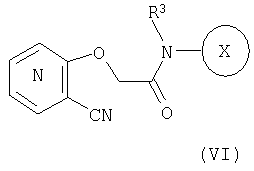
где символы являются теми, как определено в п.1,
или его соль.
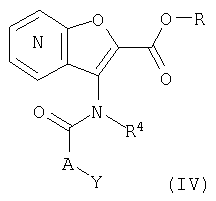
где R представляет собой водород, С1-4 алкил или карбоксизащищенную группу, а другие символы являются теми, как как определено в п.1,
или его соль.
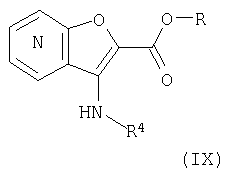
где R представляет собой водород, С1-4 алкил или карбоксизащищенную группу, а другие символы являются теми, как как определено в п.1,
или его соль.
Приоритет по пунктам и признакам:
| US 5635527 А, 03.06.1997.RU 99128088 А, 20.10.2001.SU 926914 A1, 23.05.1992.SU 581868 А, 25.11.1977.SU 1468420 A3, 23.03.1989. |
Авторы
Даты
2007-07-10—Публикация
2004-01-08—Подача