Область техники, к которой относится изобретение
Настоящее изобретение относится к азотсодержащим насыщенным гетероциклическим соединениям, которые применимы в качестве лекарственного средства, главным образом в качестве ингибитора ренина, их фармацевтически приемлемым солям и промежуточным соединениям для их получения.
Уровень техники
Предполагается, что ингибиторы ренина являются лекарственным средством для профилактики и/или лечения таких заболеваний, как гипертензия, сердечная недостаточность, диабетическая нефропатия и т.п., имеются сообщения о 3,4-замещенных производных пиперидина, например (патентная литература 1). Но производные морфолина в указанной литературе не описаны.
Публикация WO 2008/153182 описывает некоторые производные морфолина, которые представляют собой соединения формулы I, где R обозначает атом водорода (патентная литература 2).
Ссылки на литературу
Патентная литература
Патентная литература 1: WO 06/069788 (US 2009/0312304 A);
Патентная литература 1: WO 2008/153182 (US 2010/0240644 A).
Раскрытие изобретения
Техническая задача
Настоящее изобретение относится к азотсодержащим насыщенным гетероциклическим соединениям, обладающим превосходной ингибирующей активностью в отношении ренина.
Решение задачи
Для решения задачи авторы изобретения провели тщательные исследования, чтобы выявить новые азотсодержащие насыщенные гетероциклические соединения, обладающие превосходной ингибирующей активностью в отношении ренина, и в результате осуществили настоящее изобретение.
Настоящее изобретение состоит в следующем:
1. Соединение формулы [I]
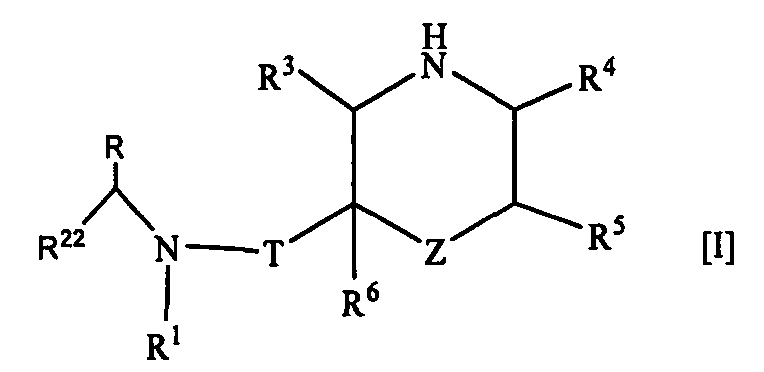
где R1 представляет собой циклоалкильную группу или незамещенную алкильную группу;
R22 представляет собой 1) необязательно замещенную арильную группу, 2) необязательно замещенную тетрагидронафтильную группу, 3) необязательно замещенную нафтилидинильную группу, 4) необязательно замещенную пиридильную группу, 5) необязательно замещенную пиразолопиридильную группу, 6) необязательно замещенную индолильную группу, 7) необязательно замещенную бензофуранильную группу, 8) необязательно замещенную бензотиенильную группу, 9) необязательно замещенную хинолильную группу, 10) необязательно замещенную хроманильную группу, 11) необязательно замещенную дигидробензофуранильную группу, 12) необязательно замещенную индазолильную группу, 13) необязательно замещенную пирролопиридинильную группу, 14) необязательно замещенную бензоизоксазолильную группу, 15) необязательно замещенную ксантенильную группу, 16) необязательно замещенную индолинильную группу, 17) необязательно замещенную хиназолинильную группу, 18) необязательно замещенную дигидрохиназолинильную группу, 19) необязательно замещенную фуропиридильную группу, 20) необязательно замещенную дигидрофуропиридильную группу, 21) необязательно замещенную хиноксалинильную группу 22) необязательно замещенную тиенопиридильную группу, 23) необязательно замещенную дигидропиранопиридильную группу, 24) необязательно замещенную дигидробензотиенильную группу, 25) необязательно замещенную дигидротиенопиридильную группу или 26) необязательно замещенную имидазопиридинильную группу;
R представляет собой низшую алкильную группу или образует кольцо путем связывания с R22 на каждом конце;
Т представляет собой карбонильную группу;
Z представляет собой -O-, -NH- или одинарную связь;
R3, R4, R5 и R6 являются одинаковыми или разными и представляют собой атом водорода, необязательно замещенную карбамоильную группу или необязательно замещенную алкильную группу;
или его фармацевтически приемлемая соль.
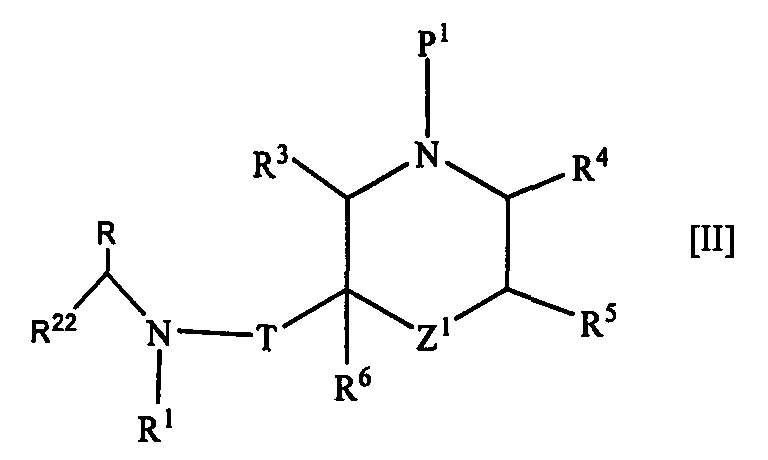
2. Соединение формулы [II]
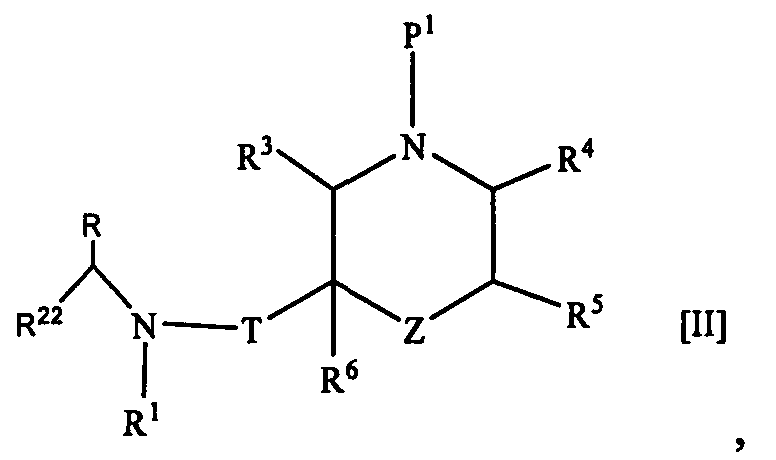
где R1 представляет собой циклоалкильную группу или незамещенную алкильную группу;
R22 представляет собой 1) необязательно замещенную арильную группу, 2) необязательно замещенную тетрагидронафтильную группу, 3) необязательно замещенную нафтилидинильную группу, 4) необязательно замещенную пиридильную группу, 5) необязательно замещенную пиразолопиридильную группу, 6) необязательно замещенную индолильную группу, 7) необязательно замещенную бензофуранильную группу, 8) необязательно замещенную бензотиенильную группу, 9) необязательно замещенную хинолильную группу, 10) необязательно замещенную хроманильную группу, 11) необязательно замещенную дигидробензофуранильную группу, 12) необязательно замещенную индазолильную группу, 13) необязательно замещенную пирролопиридинильную группу, 14) необязательно замещенную бензоизоксазолильную группу, 15) необязательно замещенную ксантенильную группу, 16) необязательно замещенную индолинильную группу, 17) необязательно замещенную хиназолинильную группу, 18) необязательно замещенную дигидрохиназолинильную группу, 19) необязательно замещенную фуропиридильную группу, 20) необязательно замещенную дигидрофуропиридильную группу, 21) необязательно замещенную хиноксалинильную группу, 22) необязательно замещенную тиенопиридильную группу, 23) необязательно замещенную дигидропиранопиридильную группу, 24) необязательно замещенную дигидробензотиенильную группу, 25) необязательно замещенную дигидротиенопиридильную группу или 26) необязательно замещенную имидазопиридинильную группу;
R представляет собой низшую алкильную группу или образует кольцо путем связывания с R22 на каждом конце;
Т представляет собой карбонильную группу;
Z1 представляет собой -O-, -NP2- или ординарную связь;
R3, R4, R5 и R6 являются одинаковыми или разными и представляют собой атом водорода, необязательно замещенную карбамоильную группу или необязательно замещенную алкильную группу;
P1 представляет собой защитную группу и Р2 представляет собой защитную группу; или его соль.
Соединение [I] по настоящему изобретению подробно описано ниже.
Примером термина «алкильная группа» или «алкоксигруппа» в настоящем изобретении является группа с линейной или разветвленной цепью, содержащая 1-10 атомов углерода, предпочтительными являются группы, содержащие 1-6 атомов углерода, особенно предпочтительными являются группы, содержащие 1-4 атома углерода.
Примером термина «низшая алкильная группа» или «низшая алкоксигруппа» в настоящем изобретении является группа с линейной или разветвленной цепью, содержащая 1-6 атомов углерода, предпочтительными являются группы, содержащие 1-4 атома углерода.
Примером термина «низший алканоил» является группа с линейной или разветвленной цепью, содержащая 2-7 атомов углерода, и предпочтительными являются группы, содержащие 2-5 атомов углерода.
Примером термина «циклоалкильная группа» является циклоалкильная группа, содержащая 3-8 атомов углерода, предпочтительными являются группы, содержащие 3 -6 атомов углерода, и особенно предпочтительными являются группы, содержащие 3-4 атома углерода.
Термин «атом галогена» обозначает атом фтора, атом хлора, атом брома и атом йода, особенно предпочтительными являются атом фтора, атом хлора и атом брома.
Примером термина «арильная группа» является фенильная группа, нафтильная группа и т.п.
Примеры заместителей необязательно замещенной алкильной группы в R3-R6 включают гидроксильную группу, необязательно замещенную алкоксигруппу, карбоксильную группу, необязательно замещенную карбамоильную группу и т.п.
Примеры заместителей необязательно замещенной арильной группы, необязательно замещенной тетрагидронафтильной группы, необязательно замещенной нафтилидинильной группы, необязательно замещенной придильной группы, необязательно замещенной пиразолопиридильной группы, необязательно замещенной индолильной группы, необязательно замещенной бензофуранильной группы, необязательно замещенной бензотиенильной группы, необязательно замещенной хинолильной группы, необязательно замещенной хроманильной группы, необязательно замещенной дигидробензофуранильной группы, необязательно замещенной индазолильной группы, необязательно замещенной пирролопиридинильной группы, необязательно замещенной бензоизоксазолильной группы, необязательно замещенной ксантенильной группы, необязательно замещенной индолинильной группы, необязательно замещенной хиназолинильной группы, необязательно замещенной дигидрохиназолинильной группы, необязательно замещенной фуропиридильной группы, необязательно замещенной дигидрофуропиридильной группы, необязательно замещенной хиноксалинильной группы, необязательно замещенной тиенопиридильной группы, необязательно замещенной дигидропиранопиридильной группы, необязательно замещенной дигидробензотиенильной группы, необязательно замещенной дигидротиенопиридильной группы и необязательно замещенной имидазопиридинильной группы включают алкоксигруппу, алкоксигруппу, замещенную алкоксигруппой; алкоксигруппу, замещенную алкилкарбониламиногруппой; алкоксигруппу, замещенную арилкарбониламиногруппой; алкоксигруппу, замещенную гетероциклозамещенной карбониламиногруппой; алкоксигруппу, замещенную циклоалкилкарбониламиногруппой; алкоксигруппу, замещенную алкоксикарбониламиногруппой, алкильную группу, замещенную алкоксикарбониламиногруппой; алкильную группу, замещенную алкоксигруппой, замещенной алкоксигруппой, алкоксигруппу, замещенную арильной группой; гидроксильную группу, алкильную группу, замещенную алкоксигруппой; оксогруппу, атом галогена, алкоксигруппу, замещенную атомом галогена; арилоксигруппу, арильную группу, арильную группу, замещенную алкоксигруппой; гетероциклическую группу, цианогруппу, низшую алканоильную группу, карбамоильную группу, карбамоильную группу, замещенную алкильной группой и т.п.
Примеры заместителей необязательно замещенной алкоксигруппы включают гидроксильную группу, алкоксигруппу, атом галогена, алкоксигруппу, замещенную атомом галогена; аминогруппу, замещенную алкилкарбонильной группой; аминогруппу, замещенную арилкарбонильной группой; карбониламиногруппу, замещенную гетероциклической группой; аминогруппу, замещенную циклоалкилкарбонилом, аминогруппу, замещенную алкоксикарбонильной группой, арильную группу, арилоксигруппу и т.п.
Примеры заместителей необязательно замещенной карбамоильной группы включают алкильную группу, алкильную группу, замещенную гидроксильной группой; алкильную группу, замещенную алкоксигруппой; алкильную группу, замещенную фенильной группой; циклоалкильную группу, пирролидинильную группу, необязательно замещенную гидроксиалкильной группой или алкоксизамещенной алкильной группой и т.п.
Примеры гетероциклической группы включают пиридильную группу, пиримидильную группу, фурильную группу, тиенильную группу, хинолильную группу, тетрагидрохинолильную группу, изохинолильную группу, тетрагидроизохинолильную группу, индолильную группу, индолинильную группу, индазолильную группу, бензофуранильную группу, бензотиенильную группу, дигидробензофуранильную группу, дигидрохроменильную группу, пирролопиридильную группу, бензоксадинильную группу, пиразолильную группу и т.п.
Настоящее изобретение включает следующие изобретения:
(а1) Соединение [I], где R22 представляет собой группу, выбранную из
1) необязательно замещенной арильной группы,
2) необязательно замещенной тетрагидронафтильной группы,
3) необязательно замещенной нафтилидинильной группы,
4) необязательно замещенной пиридильной группы,
5) необязательно замещенной пиразолопиридильной группы,
6) необязательно замещенной индолильной группы,
7) необязательно замещенной бензофуранильной группы,
8) необязательно замещенной бензотиенильной группы,
9) необязательно замещенной хинолильной группы,
10) необязательно замещенной хроманильной группы,
11) необязательно замещенной дигидробензофуранильной группы,
12) необязательно замещенной индазолильной группы,
13) необязательно замещенной пирролопиридильной группы,
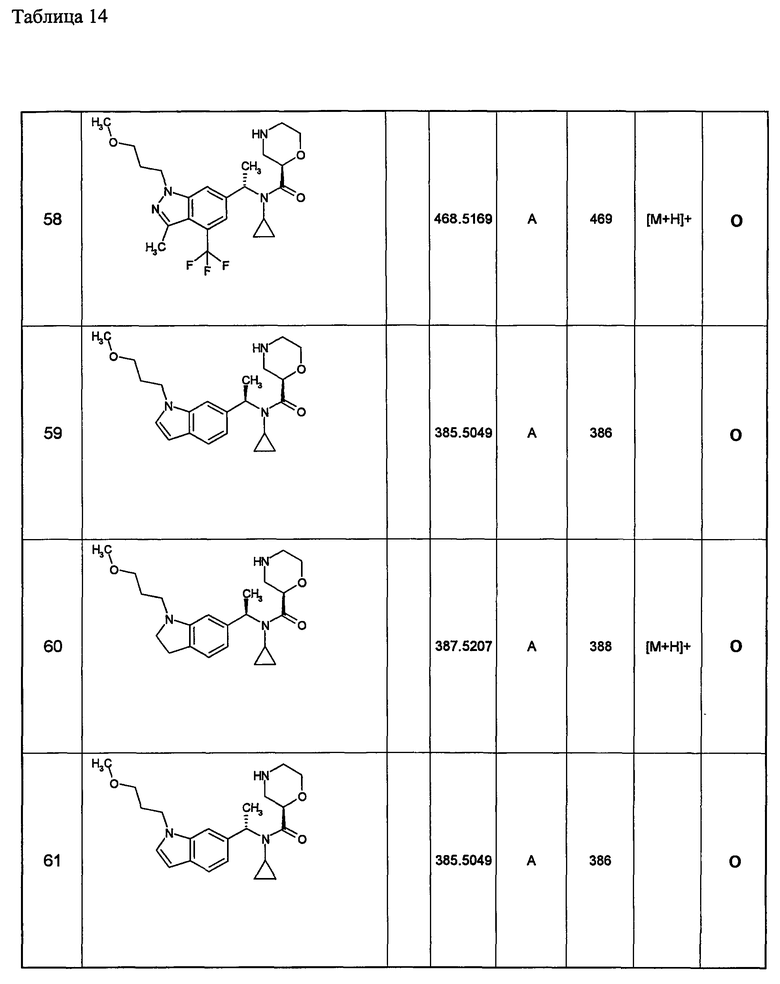
14) необязательно замещенной бензоизоксазолильной группы,
15) необязательно замещенной ксантенильной группы,
16) необязательно замещенной индолинильной группы,
17) необязательно замещенной хиназолинильной группы,
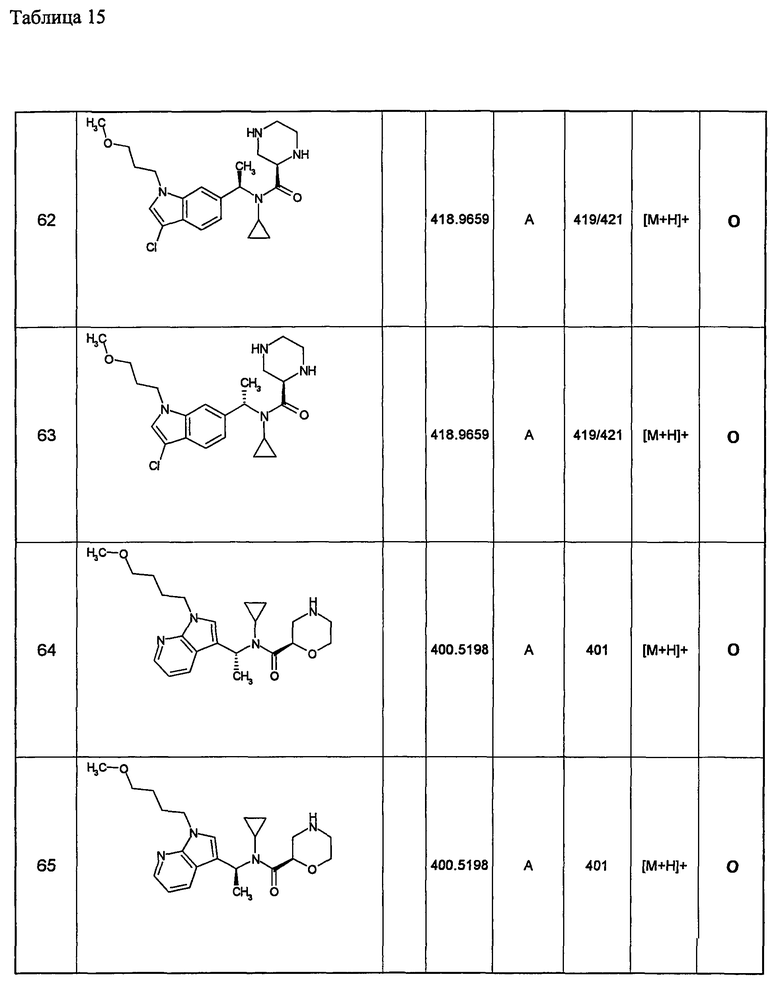
18) необязательно замещенной дигидрохиназолинильной группы,
19) необязательно замещенной фуропиридильной группы,
20) необязательно замещенной дигидрофуропиридильной группы,
21) необязательно замещенной хиноксалинильной группы,
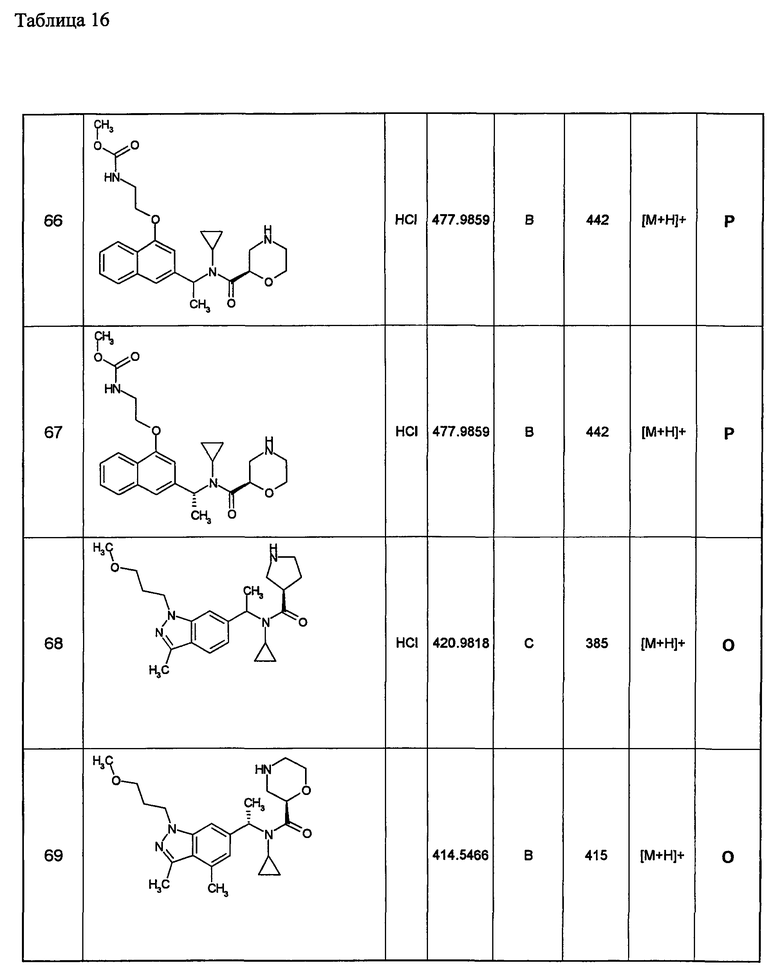
22) необязательно замещенной тиенопиридильной группы,
23) необязательно замещенной дигидропиранопиридильной группы
24) необязательно замещенной дигидробензотиенильной группы,
25) необязательно замещенной дигидротиенопиридильной группы и
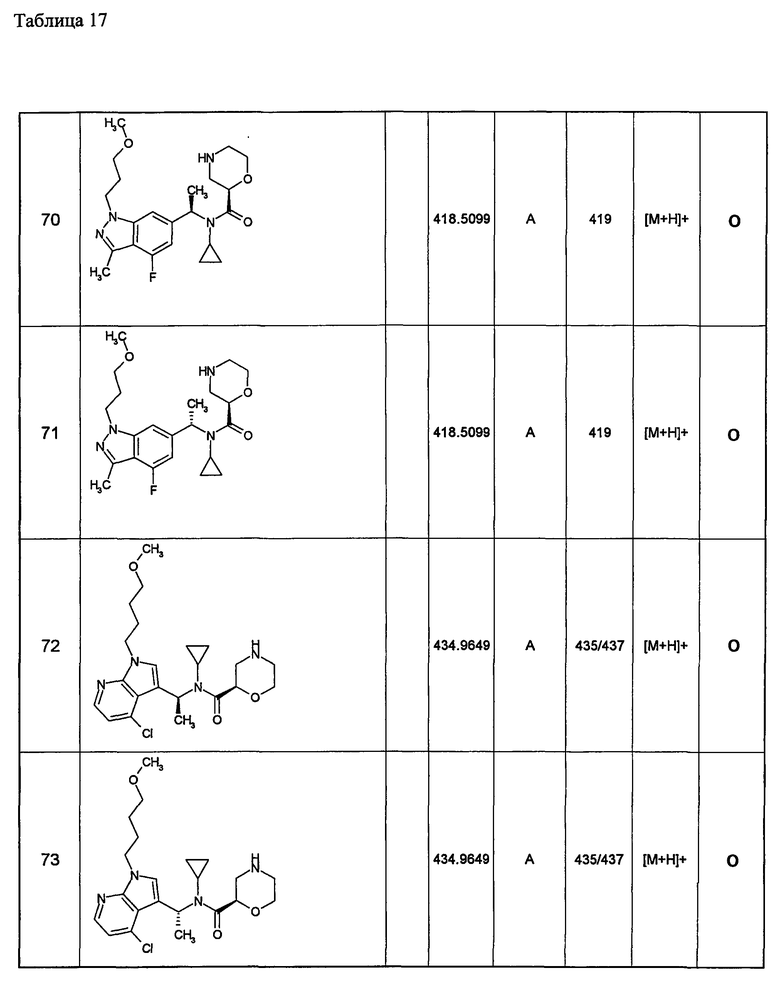
26) необязательно замещенной имидазопиридинильной группы;
R1 представляет собой циклопропильную группу;
Z представляет собой -О- или -NH-; и
R3, R4, R5 и R6 представляют собой атом водорода;
или его фармацевтически приемлемая соль;
(а2) Соединение, где R22 представляет собой группу, выбранную из
1) необязательно замещенной фенильной группы,
2) необязательно замещенной нафтильной группы,
3) необязательно замещенной тетрагидронафтильной группы,
4) необязательно замещенной нафтилидинильной группы,
5) необязательно замещенной пиридильной группы,
6) необязательно замещенной пиразолопиридильной группы,
7) необязательно замещенной индолильной группы,
8) необязательно замещенной бензофуранильной группы,
9) необязательно замещенной бензотиенильной группы,
10) необязательно замещенной хинолильной группы,
11) необязательно замещенной хроманильной группы,
12) необязательно замещенной дигидробензофуранильной группы,
13) необязательно замещенной индазолильной группы,
14) необязательно замещенной пирролопиридильной группы,
15) необязательно замещенной бензоизоксазолильной группы,
16) необязательно замещенной ксантенильной группы,
17) необязательно замещенной индолинильной группы,
18) необязательно замещенной хиназолинильной группы,
19) необязательно замещенной дигидрохиназолинильной группы,
20) необязательно замещенной фуропиридильной группы,
21) необязательно замещенной дигидрофуропиридильной группы,
22) необязательно замещенной хиноксалинильной группы,
23) необязательно замещенной тиенопиридильной группы,
24) необязательно замещенной дигидропиранопиридильной группы
25) необязательно замещенной дигидробензотиенильной группы,
26) необязательно замещенной дигидротиенопиридильной группы и
27) необязательно замещенной имидазопиридинильной группы;
R1 представляет собой циклопропильную группу;
Z представляет собой -О- и
R3, R4, R5 и R6 представляют собой атом водорода;
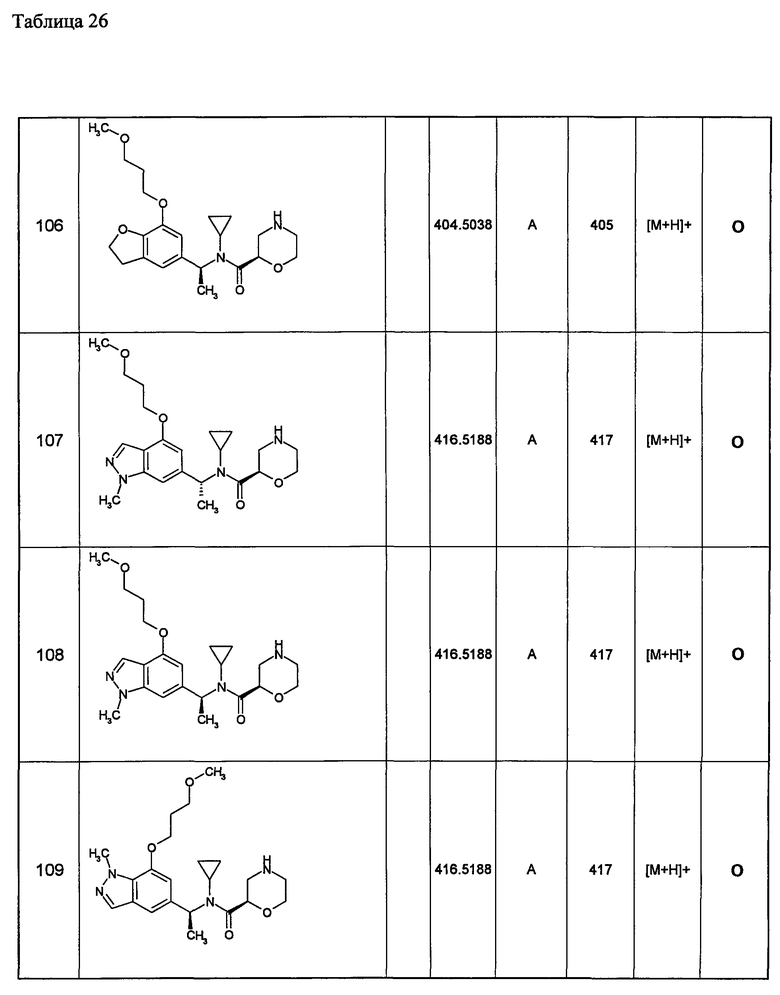
или его фармацевтически приемлемая соль;
(а3) Соединение, указанное выше в (а1) или (а2), где R22 представляет собой любую группу из групп 1)-27), описанных ниже:
1) фенильную группу, необязательно замещенную одинаковыми или разными одной-четырьмя группами, выбранными из фенилзамещенной низшей алкоксигруппы, атома галогена, низшей алкильной группы, низшей алкильной группы, замещенной низшей алкоксигруппой; низшей алкильной группы, замещенной низшей алкоксикарбониламиногруппой; низшей алкоксигруппы. замещенной низшей алкоксигруппой; арильной группы, замещенной низшей алкоксигруппой; гетероциклической группы, цианогруппы и низшей алкоксигруппы;
2) нафтильную группу, необязательно замещенную одинаковыми или разными одной-шестью группами, выбранными из тригалогензамещенной низшей алкоксигруппы, низшей алканоиламино(низшей)алкоксигруппы, атома галогена, низшей алкильной группы, замещенной низшей алкоксигруппой; низшей алкильной группы, замещенной низшей алкоксикарбониламиногруппой; низшей алкильной группы, низшей алкоксигруппы, замещенной низшей алкоксигруппой; арильной группы, арильной группы, замещенной низшей алкоксигруппой; гетероциклической группы, цианогруппы и низшей алкоксигруппы;
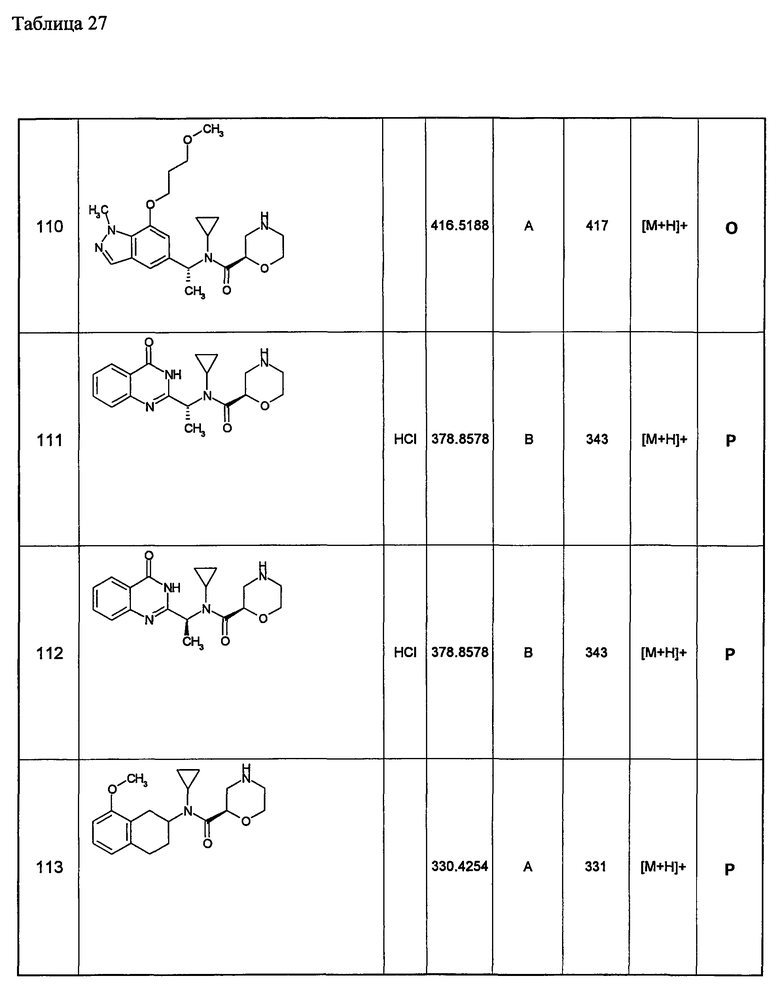
3) тетрагидронафтильную группу, необязательно замещенную одинаковыми или разными одной-шестью группами, выбранными из атома галогена, низшей алкильной группы, замещенной низшей алкоксигруппой, низшей алкильной группы, замещенной низшей алкоксикарбониламиногруппой; низшей алкильной группы, низшей алкоксигруппы, замещенной низшей алкоксигруппой; арильной группы, замещенной низшей алкоксигруппой; гетероциклической группы, цианогруппы и низшей алкоксигруппы;
4) нафтилидинильную группу, необязательно замещенную одинаковыми или разными одной-пятью группами, выбранными из атома галогена, низшей алкильной группы, замещенной низшей алкоксигруппой; низшей алкильной группы, замещенной низшей алкоксикарбониламиногруппой, низшей алкильной группы, низшей алкоксигруппы, замещенной низшей алкоксигруппой; арильной группы, замещенной низшей алкоксигруппой, гетероциклической группы, цианогруппы и низшей алкоксигруппы;
5) пиридильную группу, необязательно замещенную одинаковыми или разными одной-четырьмя группами, выбранными из атома галогена, низшей алкильной группы, замещенной низшей алкоксигруппой; низшей алкильной группы, замещенной низшей алкоксикарбониламиногруппой; низшей алкильной группы, низшей алкоксигруппы, замещенной низшей алкоксигруппой, арильной группы, замещенной низшей алкоксигруппой; гетероциклической группы, цианогруппы и низшей алкоксигруппы;
6) пиразолопиридильную группу, необязательно замещенную одинаковыми или разными одной-четырьмя группами, выбранными из атома галогена, низшей алкильной группы, замещенной низшей алкоксигруппой; низшей алкильной группы, замещенной низшей алкоксикарбониламиногруппой; низшей алкильной группы, низшей алкоксигруппы, замещенной низшей алкоксигруппой; арильной группы, замещенной низшей алкоксигруппой; гетероциклической группы, цианогруппы и низшей алкоксигруппы;
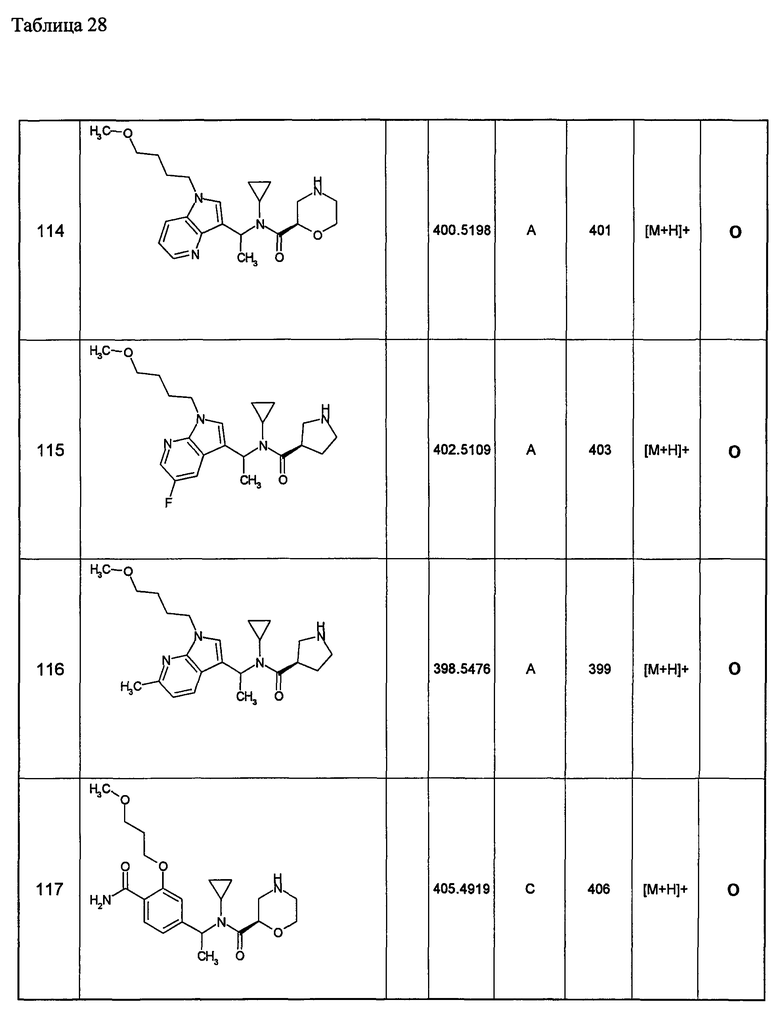
7) индолильную группу, необязательно замещенную одинаковыми или разными одной-пятью группами, выбранными из атома галогена, низшей алкильной группы, замещенной низшей алкоксигруппой; низшей алкильной группы, замещенной низшей алкоксикарбониламиногруппой; низшей алкильной группы, низшей алкоксигруппы, замещенной низшей алкоксигруппой; арильной группы, замещенной низшей алкоксигруппой; гетероциклической группы, цианогруппы и низшей алкоксигруппы;
8) бензофуранильную группу, необязательно замещенную одинаковыми или разными одной-четырьмя группами, выбранными из атома галогена, низшей алкильной группы, замещенной низшей алкоксигруппой; низшей алкильной группы, замещенной низшей алкоксикарбониламиногруппой; низшей алкильной группы, низшей алкоксигруппы, замещенной низшей алкоксигруппой; арильной группы, замещенной низшей алкоксигруппой; гетероциклической группы, цианогруппы и низшей алкоксигруппы;
9) бензотиенильную группу, необязательно замещенную одинаковыми или разными одной-четырьмя группами, выбранными из атома галогена, низшей алкильной группы, замещенной низшей алкоксигруппой; низшей алкильной группы, замещенной низшей алкоксикарбониламиногруппой; низшей алкильной группы, низшей алкоксигруппы, замещенной низшей алкоксигруппой, арильной группы, замещенной низшей алкоксигруппой; гетероциклической группы, цианогруппы и низшей алкоксигруппы;
10) хинолильную группу, необязательно замещенную одинаковыми или разными одной-четырьмя группами, выбранными из атома галогена, низшей алкильной группы, замещенной низшей алкоксигруппой; низшей алкильной группы, замещенной низшей алкоксикарбониламиногруппой; низшей алкильной группы, низшей алкоксигруппы, замещенной низшей алкоксигруппой; арильной группы, замещенной низшей алкоксигруппой, гетероциклической группы, цианогруппы и низшей алкоксигруппы;
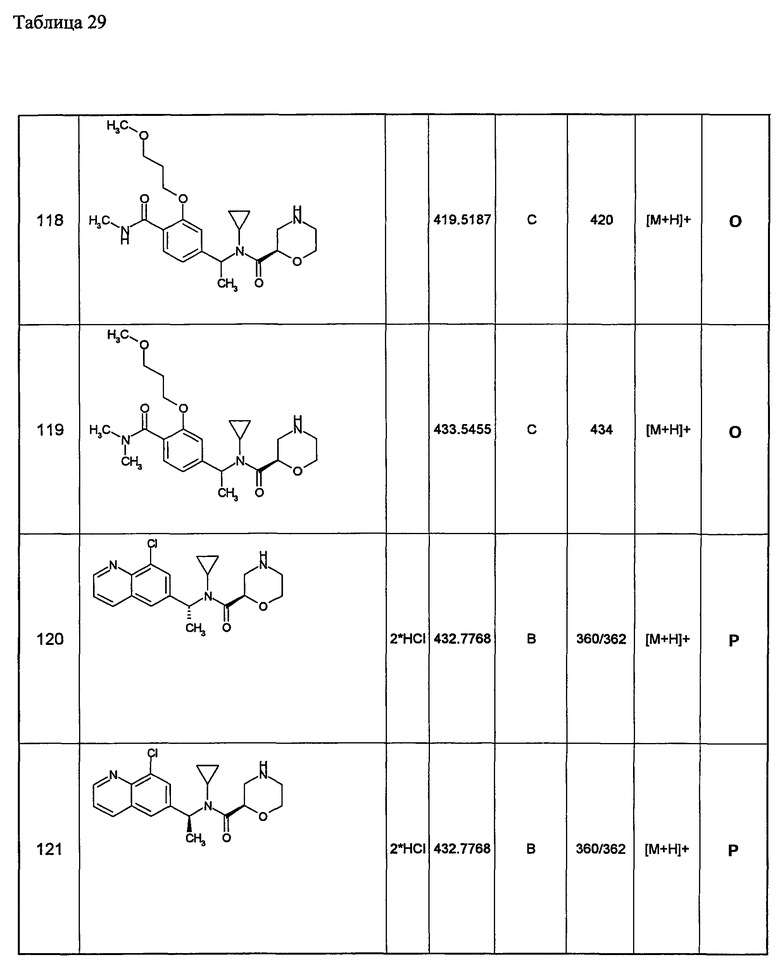
11) хроманильную группу, необязательно замещенную одинаковыми или разными одной-пятью группами, выбранными из атома галогена, низшей алкильной группы, замещенной низшей алкоксигруппой; низшей алкильной группы, замещенной низшей алкоксикарбониламиногруппой; низшей алкильной группы, низшей алкоксигруппы, замещенной низшей алкоксигруппой; арильной группы, замещенной низшей алкоксигруппой, гетероциклической группы, цианогруппы и низшей алкоксигруппы;
12) дигидробензофуранильную группу, необязательно замещенную одинаковыми или разными одной-четырьмя группами, выбранными из атома галогена, низшей алкильной группы, замещенной низшей алкоксигруппой; низшей алкильной группы, замещенной низшей алкоксикарбониламиногруппой; низшей алкильной группы, низшей алкоксигруппы, замещенной низшей алкоксигруппой; арильной группы, замещенной низшей алкоксигруппой; гетероциклической группы, цианогруппы и низшей алкоксигруппы;
13) индазолильную группу, необязательно замещенную одинаковыми или разными одной-пятью группами, выбранными из атома галогена, низшей алкильной группы, замещенной низшей алкоксигруппой; низшей алкильной группы, замещенной низшей алкоксикарбониламиногруппой; низшей алкильной группы, низшей алкоксигруппы, замещенной низшей алкоксигруппой; арильной группы, замещенной низшей алкоксигруппой; гетероциклической группы, цианогруппы и низшей алкоксигруппы;
14) пирролопиридинильную группу, необязательно замещенную одинаковыми или разными одной-тремя группами, выбранными из атома галогена, низшей алкильной группы, замещенной низшей алкоксигруппой; низшей алкильной группы, замещенной низшей алкоксикарбониламиногруппой; низшей алкильной группы, низшей алкоксигруппы, замещенной низшей алкоксигруппой; арильной группы, замещенной низшей алкоксигруппой; гетероциклической группы, цианогруппы и низшей алкоксигруппы;
15) бензоизоксазолильную группу, необязательно замещенную одинаковыми или разными одной-четырьмя группами, выбранными из атома галогена, низшей алкильной группы, замещенной низшей алкоксигруппой; низшей алкильной группы, замещенной низшей алкоксикарбониламиногруппой; низшей алкильной группы, низшей алкоксигруппы, замещенной низшей алкоксигруппой; арильной группы, замещенной низшей алкоксигруппой, гетероциклической группы, цианогруппы и низшей алкоксигруппы;
16) ксантенильную группу, необязательно замещенную одинаковыми или разными одной-шестью группами, выбранными из атома галогена, низшей алкильной группы, замещенной низшей алкоксигруппой; низшей алкильной группы, замещенной низшей алкоксикарбониламиногруппой; низшей алкильной группы, низшей алкоксигруппы, замещенной низшей алкоксигруппой; арильной группы, замещенной низшей алкоксигруппой; гетероциклической группы, цианогруппы и низшей алкоксигруппы;
17) индолинильную группу, необязательно замещенную одинаковыми или разными одной-пятью группами, выбранными из атома галогена, низшей алкильной группы, замещенной низшей алкоксигруппой; низшей алкильной группы, замещенной низшей алкоксикарбониламиногруппой; низшей алкильной группы, низшей алкоксигруппы, замещенной низшей алкоксигруппой; арильной группы, замещенной низшей алкоксигруппой; гетероциклической группы, цианогруппы и низшей алкоксигруппы;
18) хиназолильную группу, необязательно замещенную одинаковыми или разными одной-пятью группами, выбранными из атома галогена, низшей алкильной группы, замещенной низшей алкоксигруппой; низшей алкильной группы, замещенной низшей алкоксикарбониламиногруппой; низшей алкильной группы, низшей алкоксигруппы, замещенной низшей алкоксигруппой; арильной группы, замещенной низшей алкоксигруппой; гетероциклической группы, цианогруппы и низшей алкоксигруппы;
19) дигидрохиназолинильную группу, необязательно замещенную одинаковыми или разными одной-пятью группами, выбранными из атома галогена, низшей алкильной группы, замещенной низшей алкоксигруппой; низшей алкильной группы, замещенной низшей алкоксикарбониламиногруппой; низшей алкильной группы, низшей алкоксигруппы, замещенной низшей алкоксигруппой; арильной группы, замещенной низшей алкоксигруппой; гетероциклической группы, цианогруппы и низшей алкоксигруппы;
20) фуропиридильную группу, необязательно замещенную одинаковыми или разными одной-четырьмя группами, выбранными из атома галогена, низшей алкильной группы, замещенной низшей алкоксигруппой; низшей алкильной группы, замещенной низшей алкоксикарбониламиногруппой; низшей алкильной группы, низшей алкоксигруппы, замещенной низшей алкоксигруппой; арильной группы, замещенной низшей алкоксигруппой; гетероциклической группы, цианогруппы и низшей алкоксигруппы;
21) дигидрофуропиридильную группу, необязательно замещенную одинаковыми или разными одной-четырьмя группами, выбранными из атома галогена, низшей алкильной группы, замещенной низшей алкоксигруппой; низшей алкильной группы, замещенной низшей алкоксикарбониламиногруппой; низшей алкильной группы, низшей алкоксигруппы, замещенной низшей алкоксигруппой; арильной группы, замещенной низшей алкоксигруппой; гетероциклической группы, цианогруппы и низшей алкоксигруппы;
22) хиноксалинильную группу, необязательно замещенную одинаковыми или разными одной-пятью группами, выбранными из атома галогена, низшей алкильной группы, замещенной низшей алкоксигруппой; низшей алкильной группы, замещенной низшей алкоксикарбониламиногруппой; низшей алкильной группы, низшей алкоксигруппы, замещенной низшей алкоксигруппой; арильной группы, замещенной низшей алкоксигруппой; гетероциклической группы, цианогруппы и низшей алкоксигруппы;
23) тиенопиридильную группу, необязательно замещенную одинаковыми или разными одной-четырьмя группами, выбранными из атома галогена, низшей алкильной группы, замещенной низшей алкоксигруппой; низшей алкильной группы, замещенной низшей алкоксикарбониламиногруппой; низшей алкильной группы, низшей алкоксигруппы, замещенной низшей алкоксигруппой; арильной группы, замещенной низшей алкоксигруппой; гетероциклической группы, цианогруппы и низшей алкоксигруппы;
24) дигидропиранопиридильную группу, необязательно замещенную одинаковыми или разными одной-четырьмя группами, выбранными из атома галогена, низшей алкильной группы, замещенной низшей алкоксигруппой; низшей алкильной группы, замещенной низшей алкоксикарбониламиногруппой; низшей алкильной группы, низшей алкоксигруппы, замещенной низшей алкоксигруппой; арильной группы, замещенной низшей алкоксигруппой; гетероциклической группы, цианогруппы и низшей алкоксигруппы;
25) дигидробензотиенильную группу, необязательно замещенную одинаковыми или разными одной-четырьмя группами, выбранными из атома галогена, низшей алкильной группы, замещенной низшей алкоксигруппой; низшей алкильной группы, замещенной низшей алкоксикарбониламиногруппой; низшей алкильной группы, низшей алкоксигруппы, замещенной низшей алкоксигруппой; арильной группы, замещенной низшей алкоксигруппой; гетероциклической группы, цианогруппы и низшей алкоксигруппы;
26) дигидротиенопиридильную группу, необязательно замещенную одинаковыми или разными одной-четырьмя группами, выбранными из атома галогена, низшей алкильной группы, замещенной низшей алкоксигруппой; низшей алкильной группы, замещенной низшей алкоксикарбониламиногруппой; низшей алкильной группы, низшей алкоксигруппы, замещенной низшей алкоксигруппой; арильной группы, замещенной низшей алкоксигруппой; гетероциклической группы, цианогруппы и низшей алкоксигруппы; и
27) имидазопиридинильную группу, необязательно замещенную одинаковыми или разными одной-четырьмя группами, выбранными из атома галогена, низшей алкильной группы, замещенной низшей алкоксигруппой; низшей алкильной группы, замещенной низшей алкоксикарбониламиногруппой; низшей алкильной группы, низшей алкоксигруппы, замещенной низшей алкоксигруппой; арильной группы, замещенной низшей алкоксигруппой; гетероциклической группы, цианогруппы и низшей алкоксигруппы;
или его фармацевтически приемлемая соль.
(а4) Соединение, указанное выше в (а1) или (а2), где R22 представляет собой любую группу из 1)-13), описанных ниже:
1) фенильную группу, необязательно замещенную одинаковыми или разными двумя или тремя группами, выбранными из фенилзамещенной низшей алкоксигруппы, атома галогена, низшей алкильной группы, замещенной низшей алкоксигруппой; низшей алкильной группы, замещенной низшей алкоксикарбониламиногруппой; низшей алкильной группы, низшей алкоксигруппы, замещенной низшей алкоксигруппой и низшей алкоксигруппы.
2) нафтильную группу, необязательно замещенную одинаковыми или разными одной-тремя группами, выбранными из тригалогензамещенной низшей алкоксигруппы, низшей алканоиламино(низшей)алкоксигруппы, атома галогена, арильной группы, арильной группы, замещенной низшей алкоксигруппой; гетероциклической группы, низшей алкильной группы, низшей алкоксигруппы, замещенной низшей алкоксигруппой;
3) тетрагидронафтильную группу, необязательно замещенную одной или двумя группами, выбранными из атома галогена и низшей алкоксигруппы, замещенной низшей алкоксигруппой;
4) индолильную группу, необязательно замещенную одинаковыми или разными одной-тремя группами, выбранными из атома галогена, цианогруппы, низшей алкоксигруппы, низшей алкоксигруппы, замещенной арильной группой; низшей алкильной группы и низшей алкильной группы, замещенной низшей алкоксигруппой;
5) бензофуранильную группу, необязательно замещенную одной или двумя группами, выбранными из атома галогена и низшей алкоксигруппы, замещенной низшей алкоксигруппой;
6) бензотиенильную группу, необязательно замещенную низшей алкоксигруппой, замещенной низшей алкоксигруппой;
7) хинолильную группу, необязательно замещенную низшей алкоксигруппой, замещенной низшей алкоксигруппой;
8) хроманильную группу, необязательно замещенную низшей алкоксигруппой, замещенной низшей алкоксигруппой;
9) дигидробензофуранильную группу, необязательно замещенную одной или двумя группами, выбранными из атома галогена и низшей алкоксигруппы, замещенной низшей алкоксигруппой;
10) индазолильную группу, необязательно замещенную одной или двумя группами, выбранными из атома галогена и низшей алкоксигруппы, замещенной низшей алкоксигруппой;
11) пирролопиридинильную группу, необязательно замещенную одной или двумя группами, выбранными из атома галогена, низшей алкильной группы и низшей алкильной группы, замещенной низшей алкоксигруппой;
12) пиразолопиридильную группу, необязательно замещенную одной или двумя группами, выбранными из низшей алкильной группы, замещенной низшей алкоксикарбониламиногруппой, и низшей алкильной группы; и
13) пиридильную группу, необязательно замещенную одной или двумя группами, выбранными из низшей алкоксигруппы, низшей алкильной группы и низшей алкильной группы, замещенной низшей алкоксикарбониламиногруппой, и низшей алкильной группы;
или его фармацевтически приемлемая соль.
(а5) Соединение, указанное выше в (а1) или (а2), где R22 представляет собой любую группу из групп 1)-13), описанных ниже:
1) фенильную группу, необязательно замещенную одинаковыми или разными двумя или тремя группами, выбранными из фенилзамещенной низшей алкоксигруппы, атома фтора, атома брома, атома хлора, низшей алкильной группы, замещенной низшей алкоксигруппой; низшей алкильной группы, замещенной низшей алкоксикарбониламиногруппой; низшей алкильной группы, низшей алкоксигруппы, замещенной низшей алкоксигруппой; низшей алкоксигруппы, фенильной группы;
2) нафтильную группу, необязательно замещенную одинаковыми или разными одной-тремя группами, выбранными из тригалогензамещенной низшей алкоксигруппы, низшей алканоиламино(низшей)алкоксигруппы, атома фтора, атома брома, атома хлора, фенильной группы, фенильной группы, замещенной низшей алкоксигруппой; пиридильной группы, фурильной группы, тиенильной группы, низшей алкильной группы и низшей алкоксигруппы, замещенной низшей алкоксигруппой;
3) тетрагидронафтильную группу, необязательно замещенную одной или двумя группами, выбранными из атома фтора, атома брома, атома хлора и низшей алкоксигруппы, замещенной низшей алкоксигруппой;
4) индолильную группу, необязательно замещенную одной-тремя группами, выбранными из атома фтора, атома брома, атома хлора, цианогруппы, низшей алкоксигруппы, низшей алкоксигруппы, замещенной фенильной группой; низшей алкильной группы и низшей алкильной группы, замещенной низшей алкоксигруппой;
5) бензофуранильную группу, необязательно замещенную одной или двумя группами, выбранными из атома брома, атома хлора и низшей алкоксигруппы, замещенной низшей алкоксигруппой;
6) бензотиенилметильную группу, необязательно замещенную низшей алкоксигруппой, замещенной низшей алкоксигруппой;
7) хинолильную группу, необязательно замещенную низшей алкоксигруппой, замещенной низшей алкоксигруппой;
8) хроманильную группу, необязательно замещенную низшей алкоксигруппой, замещенной низшей алкоксигруппой;
9) дигидробензофуранильную группу, необязательно замещенную одной или двумя группами, выбранными из атома брома, атома хлора и низшей алкоксигруппы, замещенной низшей алкоксигруппой;
10) индазолильную группу, необязательно замещенную одной или двумя группами, выбранными из атома фтора, атома брома, атома хлора и низшей алкильной группы, замещенной низшей алкоксигруппой;
11) пирролопиридинильную группу, необязательно замещенную одной или двумя группами, выбранными из атома фтора, атома брома, атома хлора, низшей алкильной группы и низшей алкильной группы, замещенной низшей алкоксигруппой;
12) пиразолопиридильную группу, необязательно замещенную одной или двумя группами, выбранными из низшей алкильной группы, замещенной низшей алкоксикарбониламиногруппой, и низшей алкильной группы;
13) пиридильную группу, необязательно замещенную одной или двумя группами, выбранными из низшей алкоксигруппы, низшей алкильной группы и низшей алкильной группы, замещенной низшей алкоксикарбониламиногруппой;
или его фармацевтически приемлемая соль.
(а6) Соединение, указанное выше в (а1) или (а2), где R22 представляет собой любую группу из групп 1)-13), описанных ниже:
1) фенильную группу, необязательно замещенную двумя или тремя группами, выбранными из метоксигруппы, замещенной фенильной группой, этоксигруппы, замещенной фенильной группой, атома фтора, атома брома, атома хлора, метильной группы, пропоксигруппы, замещенной метоксигруппой; бутильной группы, замещенной метоксигруппой, метоксикарбониламинопропильной группы и метоксигруппы;
2) нафтильную группу, необязательно замещенную одинаковыми или разными одной-тремя группами, выбранными из трифторбутоксигруппы, ацетиламиноэтоксигруппы, атома фтора, атома брома, атома хлора, фенильной группы, фенильной группы, замещенной метоксигруппой; пиридильной группы, фурильной группы, тиенильной группы, метальной группы и пропоксигруппы, замещенной метоксигруппой;
3) тетрагидронафтильную группу, необязательно замещенную одной или двумя группами, выбранными из атома брома, атома хлора и пропоксигруппы, замещенной метоксигруппой;
4) индолильную группу, необязательно замещенную одной или двумя группами, выбранными из атома фтора, атома брома, атома хлора, цианогруппы, метоксигруппы, метоксигруппы, замещенной фенильной группой, метальной группы и пропильной группы, замещенной метоксигруппой;
5) бензофуранильную группу, необязательно замещенную одной или двумя группами, выбранными из атома брома, атома хлора и пропоксигруппы, замещенной метоксигруппой;
6) бензотаенильную группу, необязательно замещенную пропоксигруппой, замещенной метоксигруппой;
7) хинолильную группу, необязательно замещенную пропоксигруппой, замещенной метоксигруппой;
8) хроманильную группу, необязательно замещенную пропоксигруппой, замещенной метоксигруппой;
9) дигидробензофуранильную группу, необязательно замещенную одной или двумя группами, выбранными из атома брома, атома хлора и пропоксигруппы, замещенной метоксигруппой;
10) индазолильную группу, необязательно замещенную одной или двумя группами, выбранными из атома фтора, атома хлора и пропильной группы, замещенной метоксигруппой;
11) пирролопиридинильную группу, необязательно замещенную одной или двумя группами, выбранными из атома брома, атома хлора, метальной группы, этильной группы, пропильной группы, замещенной метоксигруппой;
12) пиразолопиридильную группу, необязательно замещенную одной или двумя группами, выбранными из метоксикарбониламинопропильной группы и метальной группы; и
13) пиридильную группу, необязательно замещенную одной или двумя группами, выбранными из метоксигруппы, этильной группы и метоксикарбониламинопропильной группы;
или его фармацевтически приемлемая соль.
(а7) Соединение, указанное выше в (а1) или (а2), где R22 представляет собой любую группу из групп 1)-27), описанных ниже:
1) фенильную группу, необязательно замещенную одной-тремя группами, выбранными из атома галогена, тригалогензамещенной низшей алкильной группы, цианогруппы, бензилоксигруппы, низшей алкоксигруппы, дигалогензамещенной низшей алкильной группы, аминокарбонильной группы, низшей аминокарбонильной группы, ди(низший алкил)аминокарбонильной группы, низшей алкиламинокарбонильной группы, замещенной низшей алкоксигруппой, низшей алкоксигруппы, замещенной низшей алкоксигруппой; низшей алкильной группы, замещенной низшей алкоксигруппой; низшей алкильной группы, замещенной низшей алкоксикарбониламиногруппой; и низшей алкильной группы;
2) нафтильную группу, необязательно замещенную одной или двумя группами, выбранными из низшей алкоксигруппы, замещенной низшей алкоксикарбониламиногруппой, и низшей алкоксигруппы;
3) тетрагидронафтильную группу, необязательно замещенную низшей алкоксигруппой;
4) нафтилидинильную группу,
5) пиридильную группу, необязательно замещенную одной или двумя группами, выбранными из низшей алкоксигруппы, низшей алкильной группы и низшей алкильной группы, замещенной низшей алкоксикарбониламиногруппой;
6) пиразолопиридильную группу, необязательно замещенную одной или двумя группами, выбранными из низшей алкильной группы, замещенной низшей алкоксигруппой; низшей алкильной группы, замещенной низшей алкоксикарбониламиногруппой; и низшей алкильной группы;
7) индолильную группу, необязательно замещенную одной-тремя группами, выбранными из атома галогена, низшей алкильной группы и низшей алкильной группы, замещенной низшей алкоксигруппой;
8) бензофуранильную группу, необязательно замещенную одной или двумя группами, выбранными из низшей алкильной группы, замещенной низшей алкоксигруппой; низшей алкоксигруппы, замещенной низшей алкоксигруппой;
9) бензотиенильную группу,
10) хинолильную группу, необязательно замещенную одной или двумя группами, выбранными из атома галогена и низшей алкоксигруппы;
11) хроманильную группу;
12) дигидробензофуранильную группу, необязательно замещенную низшей алкоксигруппой,
13) индазолильную группу, необязательно замещенную одной-тремя группами, выбранными из атома галогена, низшей алкоксигруппы, замещенной низшей алкоксигруппой; низшей алкильной группы, замещенной низшей алкоксикарбониламиногруппой; тригалогензамещенной низшей алкильной группы, низшей алкильной группы и низшей алкильной группы, замещенной низшей алкоксигруппой;
14) пирролопиридинильную группу, необязательно замещенную одной-тремя группами, выбранными из атома галогена, низшей алкильной группы, низшей алкильной группы, замещенной низшей алкоксикарбониламиногруппой; и низшей алкильной группы, замещенной низшей алкоксигруппой;
15) бензоизоксазолильную группу, необязательно замещенную одной или двумя группами, выбранными из низшей алкильной группы и низшей алкильной группы, замещенной низшей алкоксигруппой;
16) ксантенильную группу;
17) индолинильную группу, необязательно замещенную одной или двумя группами, выбранными из атома галогена и низшей алкильной группы, замещенной низшей алкоксигруппой;
18) хиназолильную группу, необязательно замещенную одной или двумя группами, выбранными из гидроксильной группы и низшей алкоксигруппы, замещенной низшей алкоксигруппой;
19) дигидрохиназолильную группу, необязательно замещенную оксогруппой;
20) фуропиридильную группу;
21) дигидрофуропиридильную группу;
22) хиноксалинильную группу;
23) тиенопиридильную группу;
24) дигидропиранопиридильную группу;
25) дигидробензотиенильную группу;
26) дигидротиенопиридильную группу и
27) имидазопиридинильную группу;
или его фармацевтически приемлемая соль.
(а8) Соединение, указанное выше в (а1) или (а2), где R22 представляет собой любую группу из групп 1)-27), описанных ниже:
1) фенильную группу, необязательно замещенную одной-тремя группами, выбранными из атома фтора, атома брома, атома хлора, трифторметильной группы, цианогруппы, бензилоксигруппы, метоксигруппы, этоксигруппы, изопропоксигруппы, дифторметоксигруппы, аминокарбонильной группы, метиламинокарбонильной группы, диметиламинокарбонильной группы, метоксиэтиламинокарбонильной группы, пропоксигруппы, замещенной метоксигруппой; бутильной группы, замещенной метоксигруппой; метоксикарбониламинопропильной группы и метоксигруппы;
2) нафтильную группу, необязательно замещенную одной или двумя группами, выбранными из этоксигруппы, замещенной метоксикарбониламиногруппой, и метоксигруппы;
3) тетрагидронафтильную группу, необязательно замещенную метоксигруппой;
4) нафтилидинильную группу;
5) пиридильную группу, необязательно замещенную одной или двумя группами, выбранными из метоксигруппы, этильной группы и метоксикарбониламинопропильной группы;
6) пиразолопиридильную группу, необязательно замещенную одной или двумя группами, выбранными из бутильной группы, замещенной метоксигруппой, метоксикарбониламинопропильной группы и метальной группы;
7) индолильную группу, необязательно замещенную одной или двумя группами, выбранными из атома хлора, метальной группы и пропильной группы, замещенной метоксигруппой;
8) бензофуранильную группу, необязательно замещенную одной или двумя группами, выбранными из пропильной группы, замещенной метоксигруппой, и пропоксигруппы, замещенной метоксигруппой;
9) бензотиенильную группу;
10) хинолильную группу, необязательно замещенную одной или двумя группами, выбранными из атома хлора и метоксигруппы;
11) хроманильную группу;
12) дигидробензофуранильную группу, необязательно замещенную пропоксигруппой, замещенной метоксигруппой;
13) индазолильную группу, необязательно замещенную одной-тремя группами, выбранными из атома фтора, атома хлора, пропоксигруппы, замещенной метоксигруппой, пропильной группы, замещенной метоксикарбониламиногруппой, трифторметильной группы, метальной группы, пропильной группы, замещенной метоксигруппой, бутильной группы, замещенной метоксигруппой;
14) пирролопиридинильную группу, необязательно замещенную одной или двумя группами, выбранными из атома фтора, атома хлора, метальной группы, этильной группы, пропильной группы, замещенной метоксикарбониламиногруппой, пропильной группы, замещенной метоксигруппой, бутильной группы, замещенной метоксигруппой;
15) бензоизоксазолильную группу, необязательно замещенную одной или двумя группами, выбранными из метильной группы и пропильной группы, замещенной метоксигруппой;
16) ксантенильную группу;
17) индолинильную группу, необязательно замещенную одной или двумя группами, выбранными из атома хлора и пропильной группы, замещенной метоксигруппой,
18) хиназолинильную группу, необязательно замещенную одной или двумя группами, выбранными из гидроксильной группы и пропоксигруппы, замещенной метоксигруппой;
19) дигидрохиназолильную группу, необязательно замещенную оксогруппой;
20) фуропиридильную группу,
21) дигидрофуропиридильную группу,
22) хиноксалинильную группу,
23) тиенопиридильную группу,
24) дигидропиранопиридильную группу,
25) дигидробензотиенильную группу,
26) дигидротиенопиридильную группу и
27) имидазопиридинильную группу;
или его фармацевтически приемлемая соль.
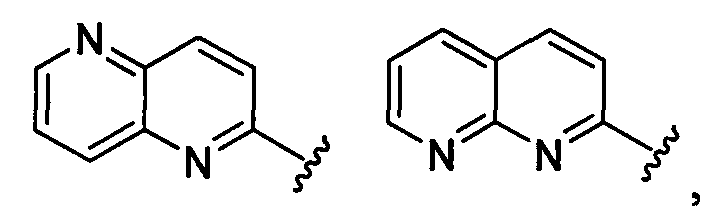
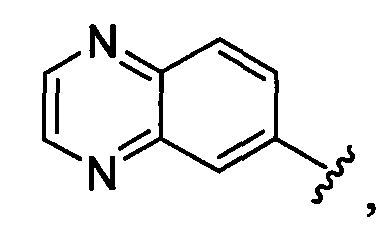
(а9) Соединение, указанное выше в (а1) или (а2), где индолильная группа заместителя R22 представляет собой любую группу из групп следующих формул:
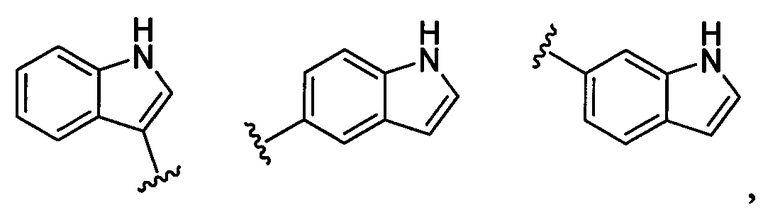
бензофуранильная группа заместителя R22 представляет собой любую группу из групп следующих формул:
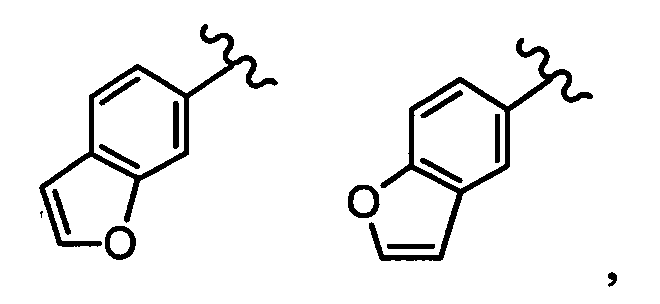
бензотиенильная группа заместителя R22 представляет собой любую группу из групп следующих формул:
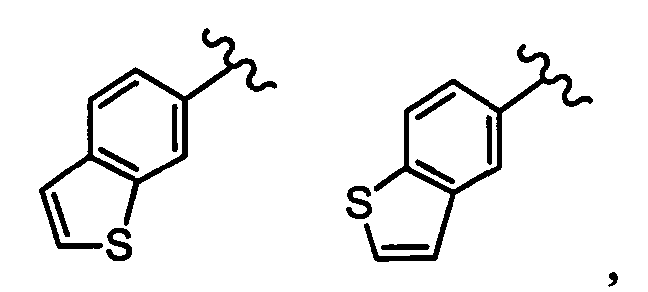
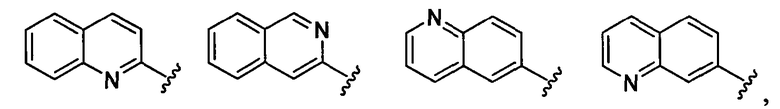
хинолильная группа заместителя R22 представляет собой любую группу из групп следующих формул:
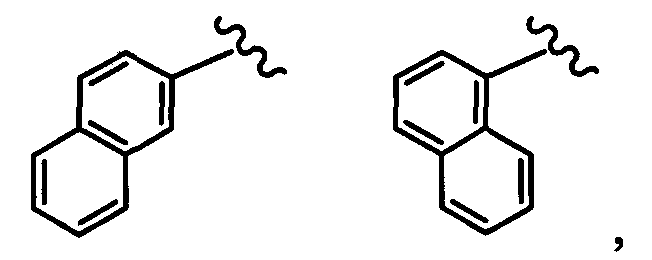
нафтильная группа заместителя R22 представляет собой любую группу из групп следующих формул:
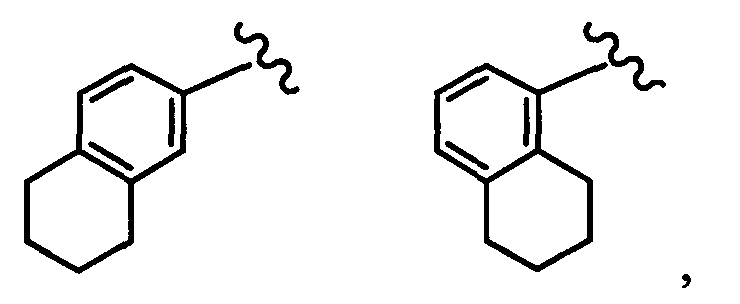
тетрагидронафтильная группа заместителя R22 представляет собой любую группу из групп следующих формул:
хроманильная группа заместителя R22 представляет собой любую группу из групп следующих формул:
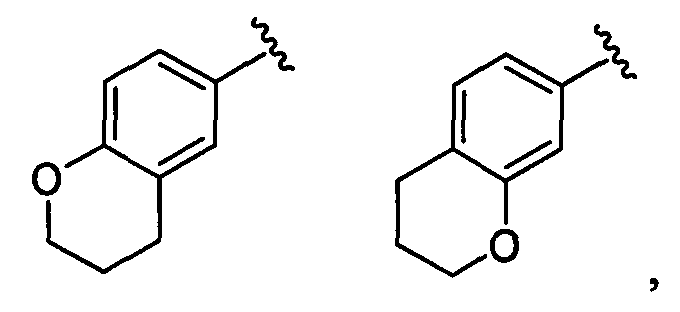
дигидробензофуранильная группа заместителя R22 представляет собой любую группу из групп следующих формул:
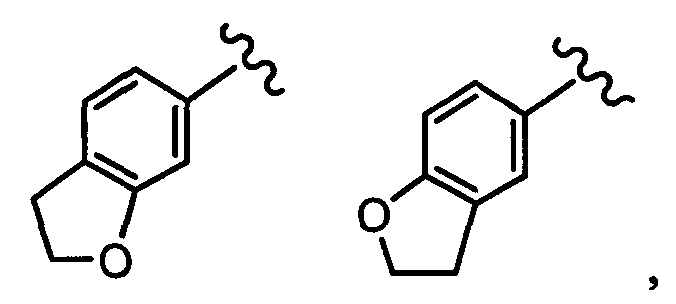
индазолильная группа заместителя R22 представляет собой любую группу из групп следующих формул:
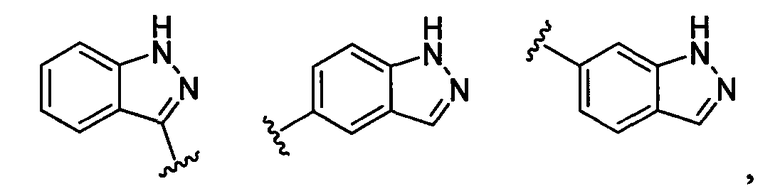
пирролопиридинильная группа заместителя R22 представляет собой любую группу из групп следующих формул:
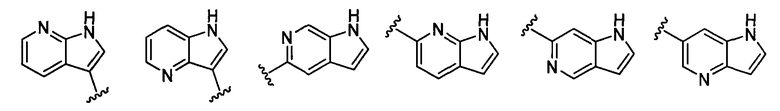
нафтилидинильная группа заместителя R22 представляет собой любую группу из групп следующих формул:
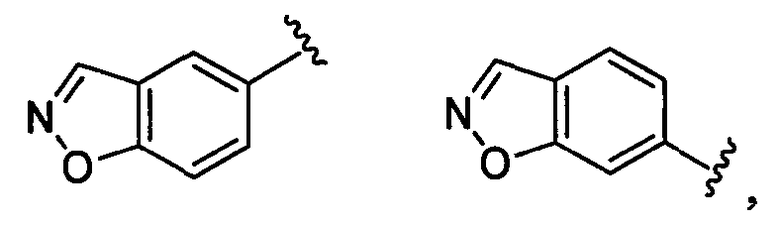
бензоизоксазолильная группа заместителя R22 представляет собой любую группу из групп следующих формул:
ксантенильная группа заместителя R22 представляет собой группу следующей формулы:

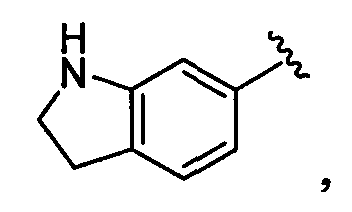
индолинильная группа заместителя R22 представляет собой группу следующей формулы:
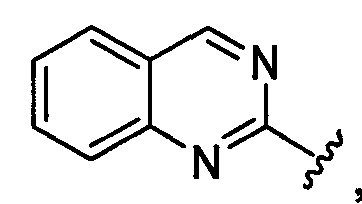
хиназолинильная группа заместителя R22 представляет собой группу следующей формулы:
хиноксалинильная группа заместителя R22 представляет собой группу следующей формулы:
фуропиридильная группа заместителя R22 представляет собой любую группу из групп следующих формул:
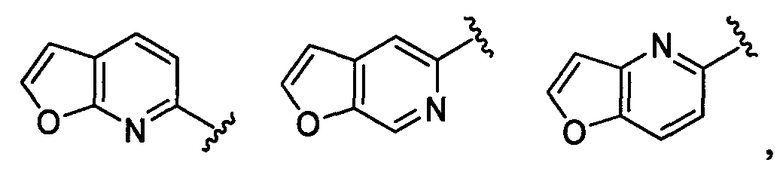
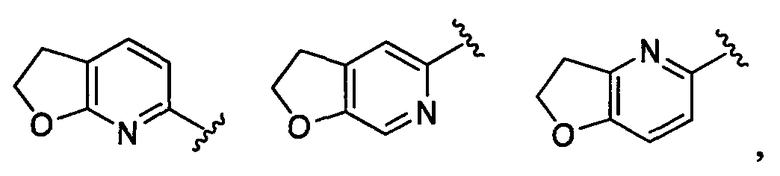
дигидрофуропиридильная группа заместителя R22 представляет собой любую группу из групп следующих формул:
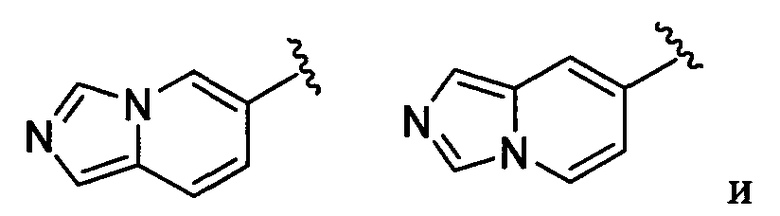
имидазопиридильная группа заместителя R22 представляет собой любую группу из групп следующих формул:
пиразолопиридильная группа заместителя R22 представляет собой любую группу следующих формул:
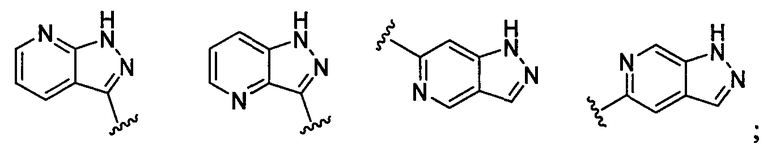
или его фармацевтически приемлемая соль.
(а10) Соединение, указанное выше в (а1) или (а2), которое представлено формулой Ia:
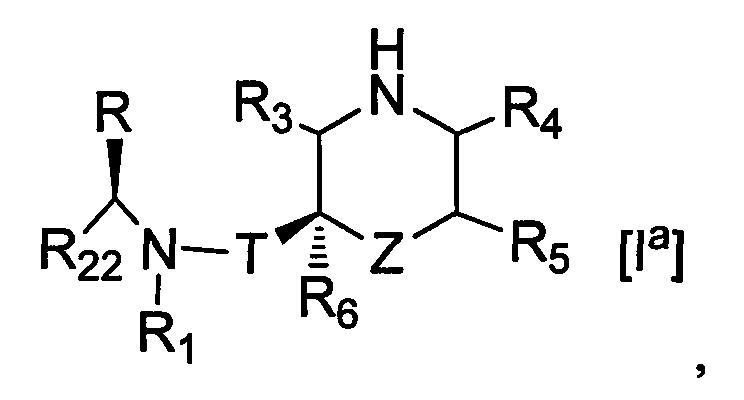
или его фармацевтически приемлемая соль.
(b1) Соединение, описанное выше в любом пункте (а1)-(а10), где R22 в соединении [I] выбран из:
3) необязательно замещенной нафтилидинильной группы,
4) необязательно замещенной пиридильной группы,
5) необязательно замещенной пиразолопиридильной группы,
10) необязательно замещенной хроманильной группы,
17) необязательно замещенную хиназолинильной группы,
18) необязательно замещенной дигидрохиназолинильной группы,
19) необязательно замещенной фуропиридильной группы,
20) необязательно замещенной дигидрофуропиридильной группы,
21) необязательно замещенной хиноксалинильной группы,
22) необязательно замещенной тиенопиридильной группы,
23) необязательно замещенной дигидропиранопиридильной группы,
24) необязательно замещенной дигидробензотиенильной группы и
25) необязательно замещенной дигидротиенопиридильной группы;
или его фармацевтически приемлемая соль.
(с1) Соединения, указанные выше в (а1), которые представлены формулой [Ic1]:
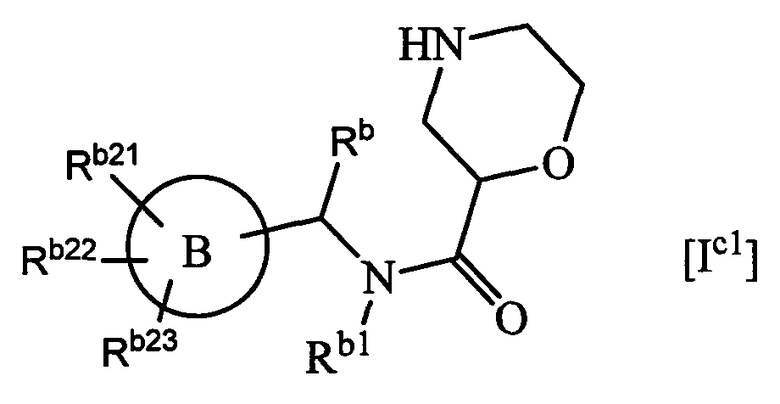
где Rb представляет собой низший алкил,
Rb1 представляет собой циклоалкил или алкил,
кольцо В выбрано из
1) арильной группы,
2) тетрагидронафтильной группы,
3) нафтилидинильной группы,
4) пиридильной группы,
5) пиразолопиридильной группы,
6) индолильной группы,
7) бензофуранильной группы,
8) бензотиенильной группы,
9) хинолильной группы,
10) хроманильной группы,
11) дигидробензофуранильной группы,
12) индазолильной группы,
13) пирролопиридильной группы,
14) бензоизоксазолильной группы,
15) ксантенильной группы,
16) индолинильной группы,
17) хиназолинильной группы,
18) дигидрохиназолинильной группы,
19) фуропиридильной группы,
20) дигидрофуропиридильной группы,
21) хиноксалинильной группы,
22) тиенопиридильной группы,
23) дигидропиранопиридильной группы,
24) дигидробензотиенильной группы,
25) дигидротиенотиенильной группы и
26) имидазопиридинильной группы;
Rb21-Rb23 являются одинаковыми или разными и обозначают группу, выбранную из 1) водорода, 2) галогена, 3) алкила, необязательно замещенного группой, выбранной из галогена, алкокси и алкоксикарбониламино, 4) алкоксигруппы, необязательно замещенной группой, выбранной из алкокси и алкоксикарбониламино, 5) циано, 6) карбамоила, необязательно замещенного алкилом, и 7) оксо;
или его фармацевтически приемлемая соль.
(с2) Соединение, указанное выше в (с1), которое представлено формулой Ic2:
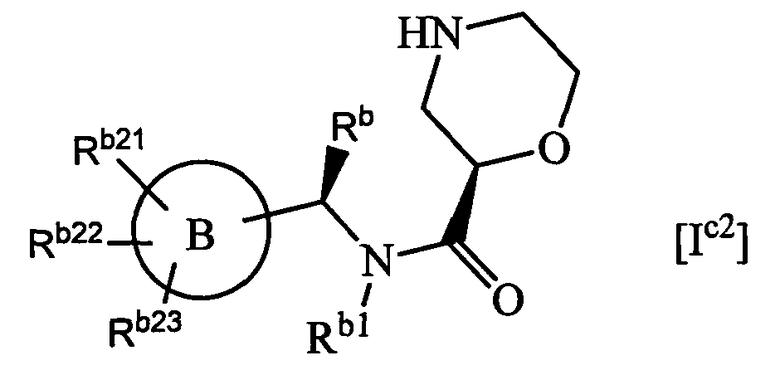
где каждый символ имеет то же значение, что и в формуле Ic1, представленной выше;
или его фармацевтически приемлемая соль.
(с3) Соединение, указанное выше в (с1) или (с2), где кольцо В представляет собой группу, выбранную из:
1) арильной группы,
4) пиридильной группы,
5) пиразолопиридильной группы,
6) индолильной группы,
7) бензофуранильной группы,
9) хинолильной группы,
10) хроманильной группы,
11) дигидробензофуранильной группы,
12) индазолильной группы,
13) пирролопиридинильной группы,
14) бензоизоксазолильной группы,
16) индолинильной группы,
17) хиназолинильной группы,
18) дигидрохиназолинильной группы;
или его фармацевтически приемлемая соль.
(с4) Соединение, указанное выше в (с1) или (с2), где кольцо В представляет собой группу, выбранную из:
3) нафтилидинильной группы,
4) пиридильной группы,
5) пиразолопиридильной группы,
10) хроманильной группы,
17) хиназолинильной группы,
18) дигидрохиназолинильной группы,
19) фуропиридильной группы,
20) дигидрофуропиридильной группы,
21) хиноксалинильной группы,
22) тиенопиридильной группы,
23) дигидропиранопиридильной группы,
24) дигидробензотиенильной группы и
25) дигидротиенопиридильной группы;
или его фармацевтически приемлемая соль.
(с5) Соединение, указанное в (с4), где кольцо В представляет собой группу, выбранную из:
4) пиридильной группы,
5) пиразолопиридильной группы,
17) хиназолинильной группы и
18) дигидрохиназолинильной группы;
или его фармацевтически приемлемая соль.
(с6) Соединение, указанное в (с4), где кольцо В представляет собой группу, выбранную из:
4) пиридильной группы,
5) пиразолопиридильной группы,
или его фармацевтически приемлемая соль.
(с7) Соединение, указанное в (с4), где кольцо В представляет собой группу, выбранную из:
5) пиразолопиридильной группы, предпочтительно 3-пиразолопиридильной группы,
или его фармацевтически приемлемая соль.
(с8) Соединение, указанное в любом пункте (c1)-(с7), где Rb1 представляет собой циклоалкильную группу;
или его фармацевтически приемлемая соль.
(с9) Соединение, указанное в (с8), где Rb1 представляет собой циклоалкильную группу;
или его фармацевтически приемлемая соль.
(с10) Соединение, указанное в любом пункте (c1)-(с9), где Rb21 представляет собой группу, выбранную из алкила, необязательно замещенного алкоксигруппой и алкоксикарбониламиногруппой, и алкоксигруппы, необязательно замещенной алкоксигруппой и алкоксикарбамоилом;
или его фармацевтически приемлемая соль.
(с11) Соединение, указанное в (с10), где Rb21 представляет собой группу, выбранную из алкила, необязательно замещенного алкокси и алкоксикарбониламиногруппой, и алкоксигруппы, необязательно замещенной алкокси и алкоксикарбамоилом;
или его фармацевтически приемлемая соль.
(с12) Соединение, указанное в любом пункте (с10) или (с11), где Rb21-Rb23 являются одинаковыми или разными и представляют собой группу, выбранную из водорода, алкила и алкокси,
или его фармацевтически приемлемая соль.
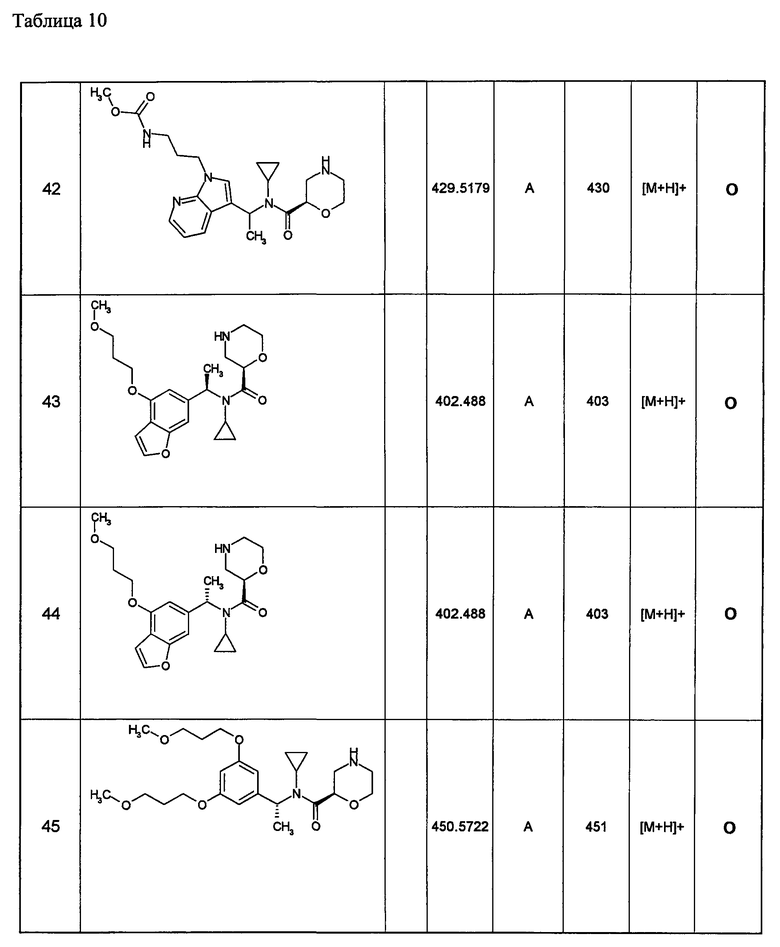
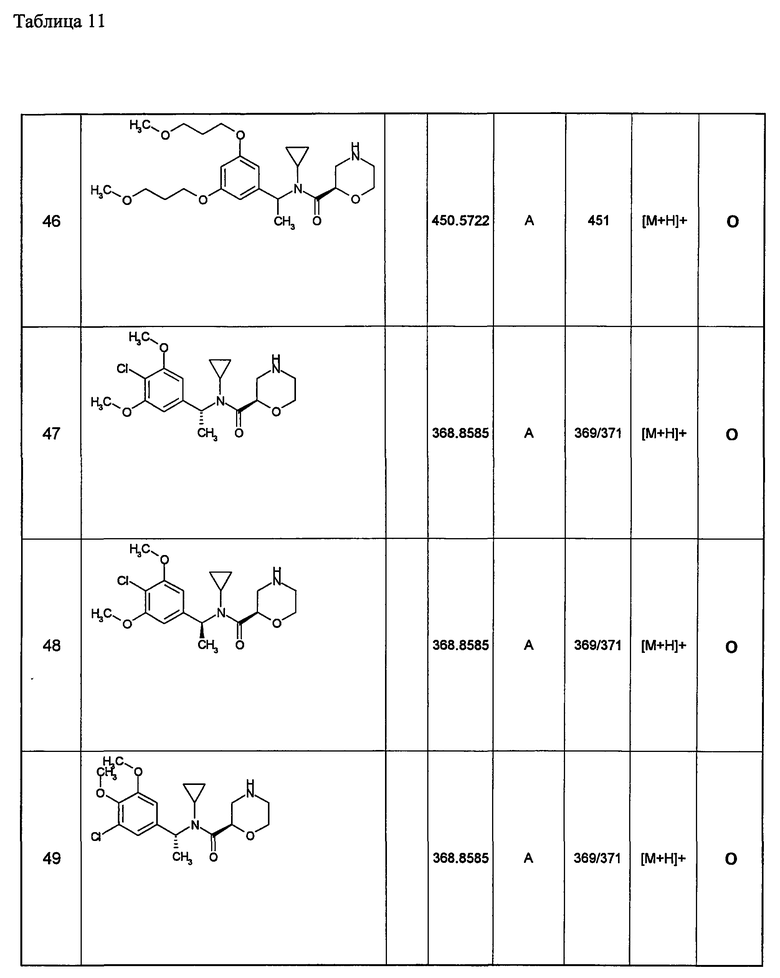
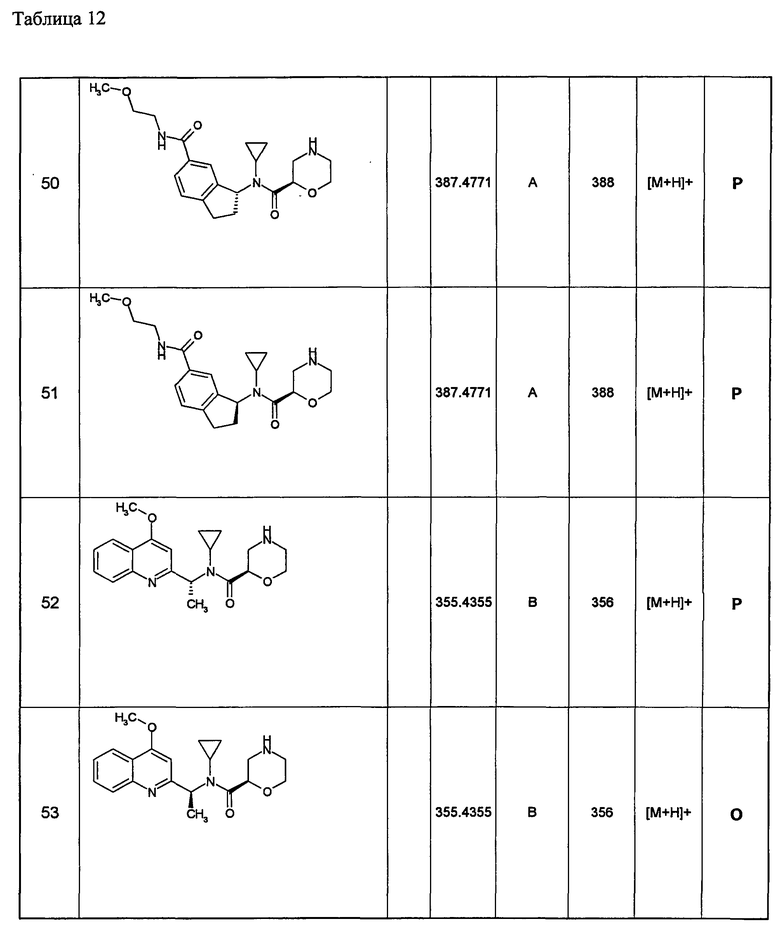
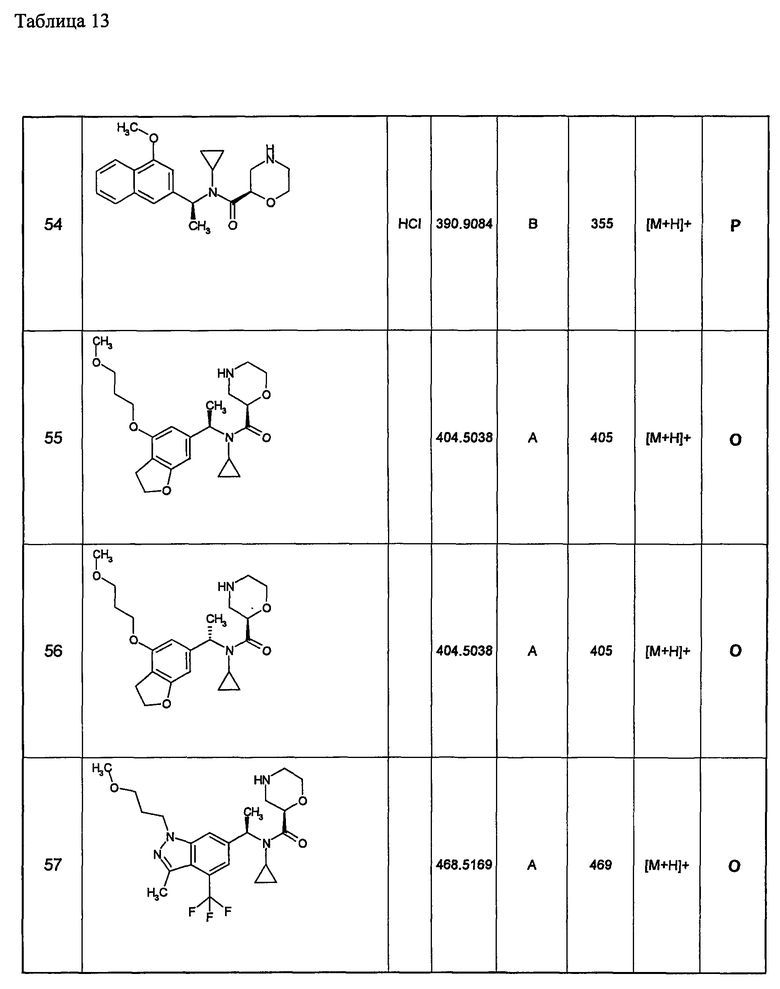
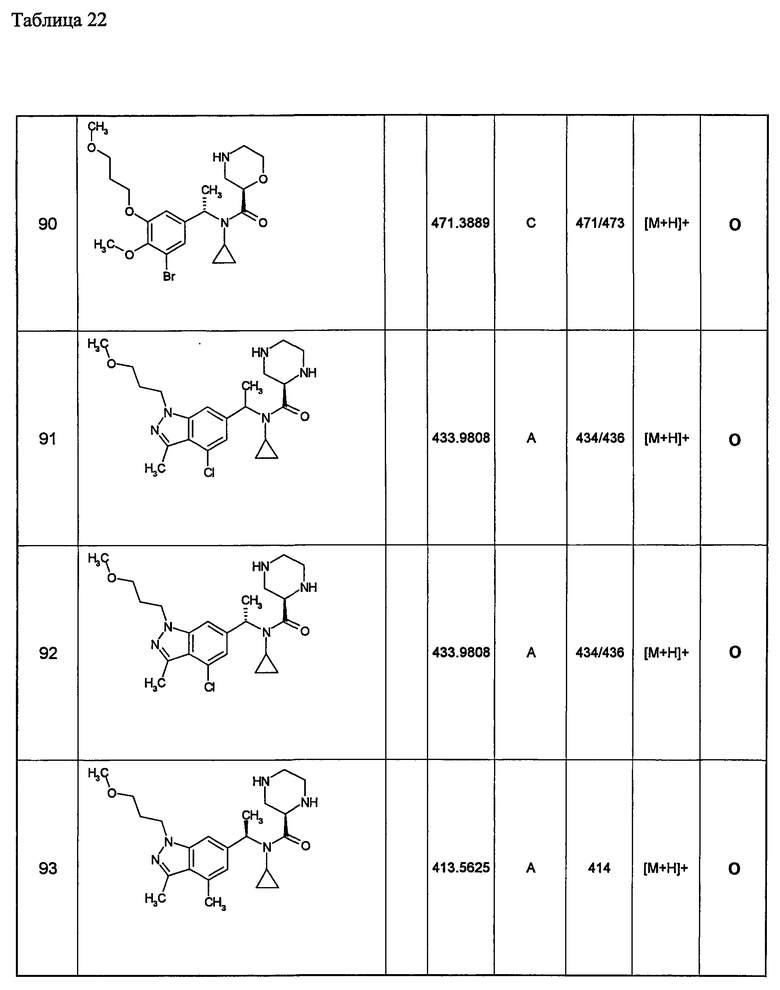
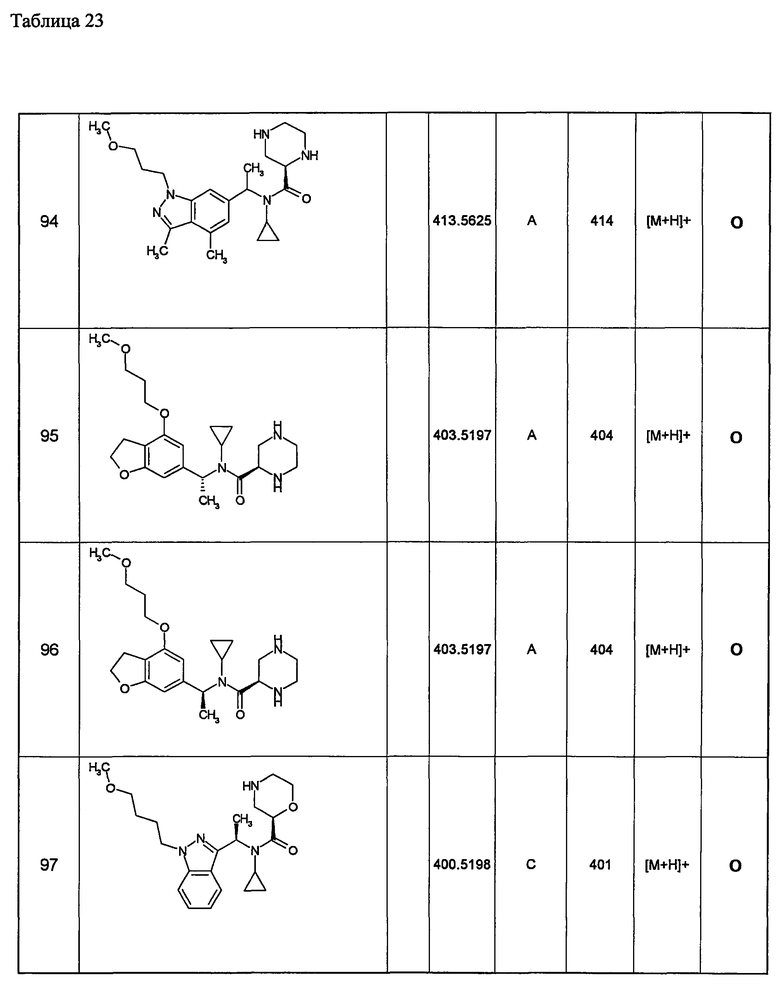
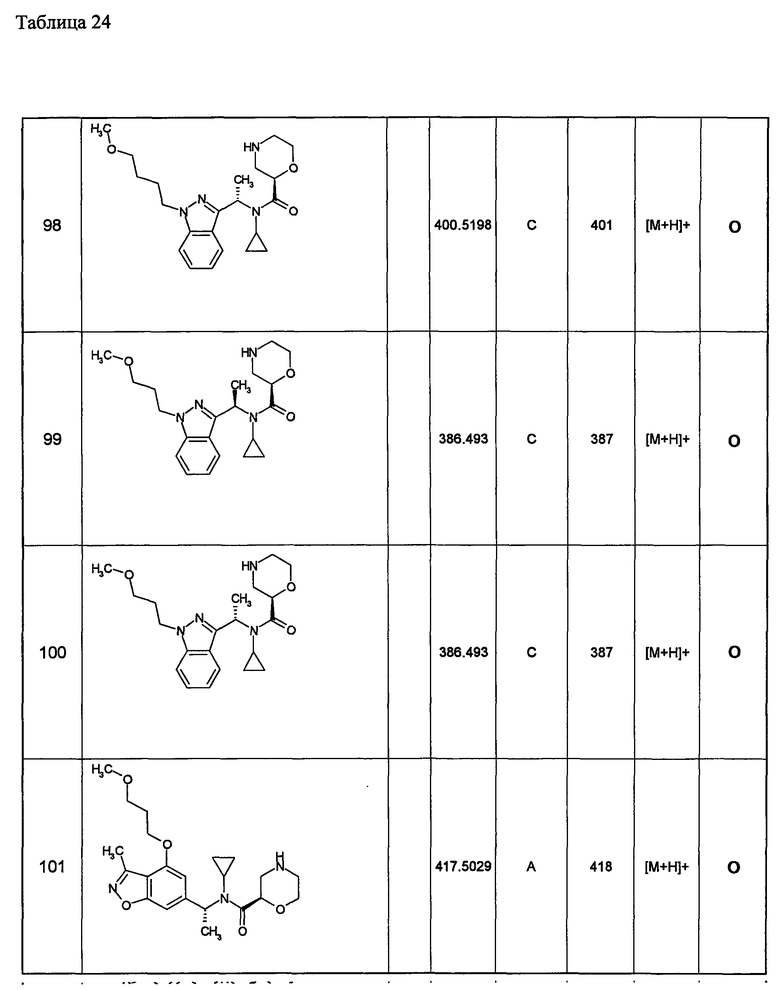
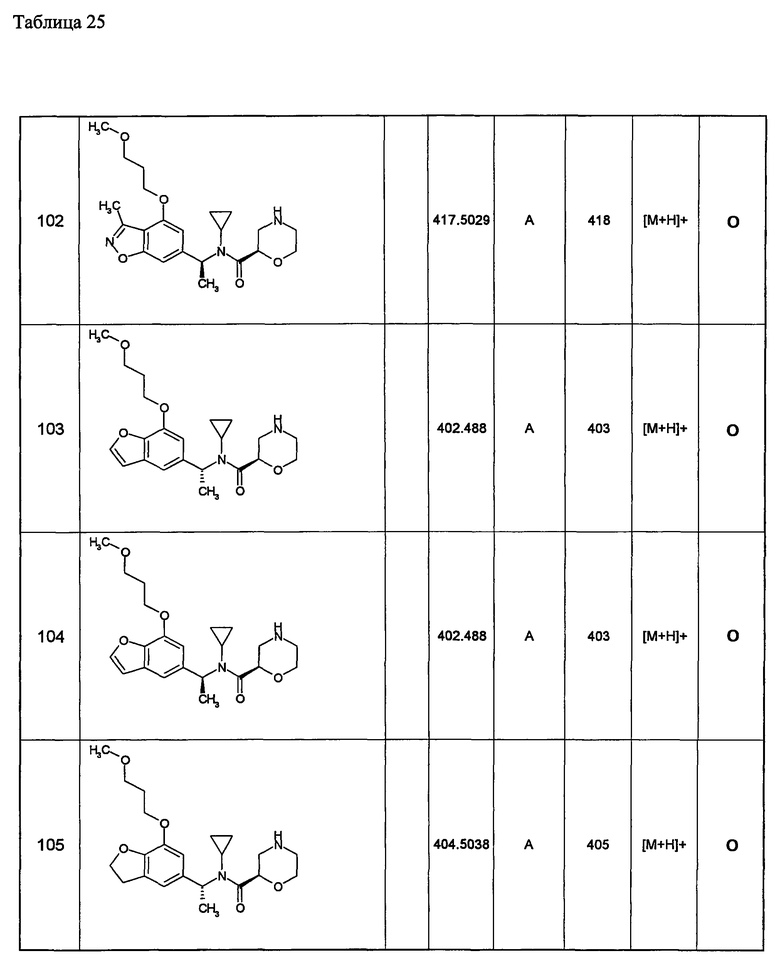
(d1) Соединение (1), выбранное из соединений, описанных в примерах,
или его фармацевтически приемлемая соль.
(d2) Соединение, указанное в (d1), выбранное из соединений, значения IC50 которых приводятся в таблицах 90-92;
или его фармацевтически приемлемая соль.
(d3) Соединение, указанное в (d2), выбранное из соединений, значения IC50 которых в таблицах 90-92 меньше 100 нМ;
или его фармацевтически приемлемая соль.
(d4) Соединение, указанное в (d2), выбранное из соединений, значения IC50 которых, приведенные в таблицах 90-92 меньше 10 нм;
или его фармацевтически приемлемая соль.
(d5) Соединение, указанное в любом пункте (d1)-(d5), которое представлено формулой Ic2;
или его фармацевтически приемлемая соль.
(d6) Соединение, указанное в любом пункте (d1)-(d5), которое выбрано из (с5),
или его фармацевтически приемлемая соль.
(d7) N-циклопропил-N-{1-[1-(4-метоксибутил)-1Н-пиразоло[3,4-b]пиридин-3-ил]этил}морфолин-2-карбоксамид;
метил(3-{3-[1-{циклопропил(морфолин-2-илкарбонил)амино}этил]-1Н-пиразоло[3,4-b]пиридин-1-ил}пропил)карбамат;
метил(3-{3-[1-{циклопропил(морфолин-2-илкарбонил)амино}этил]-6-метил-1Н-пиразоло[3,4-b]пиридин-1-ил} пропил)карбамат;
метил(3-{5-[1-{циклопропил(морфолин-2-илкарбонил)амино}этил]-2-метоксипиридин-3-ил}пропил)карбамат;
метил(3-{5-[1-{циклопропил(морфолин-2-илкарбонил)амино}этил]-2-этилпиридин-3-ил} пропил)карбамат;
метил(3-{4-[1-{циклопропил(морфолин-2-илкарбонил)амино}этил]-6-метоксипиридин-2-ил}пропил)карбамат;
метил(3-{4-[1-{циклопропил(морфолин-2-илкарбонил)амино}этил]-6-этилпиридин-2-ил} пропил)карбамат;
метил(3-{4-[1-{циклопропил(морфолин-2-илкарбонил)амино}этил]-6-(2-метоксиэтокси)пиридин-2-ил} пропил)карбамат;
метил(3-{4-[1-{циклопропил(морфолин-2-илкарбонил)амино}этил]-6-(3-метоксипропил)пиридин-2-ил} пропил)карбамат; или
метил(3-{4-[1-{циклопропил(морфолин-2-илкарбонил)амино}этил]-6-(пропан-2-илокси)пиридин-2-ил} пропил)карбамат,
или его фармацевтически приемлемая соль.
(е1) Фармацевтическая композиция, включающая любое соединение, указанное в (1), (а1)-(а10), (b1), (с1)-(с12) и (d1)-(d7), или его фармацевтически приемлемую соль.
(е2) Ингибитор ренина, содержащий любое соединение, указанное в (1), (а1)-(а10), (b1), (c1)-(с12) и (d1)-(d7), или его фармацевтически приемлемую соль.
(е3) Фармацевтическая композиция для лечения и/или профилактики гипертензии, сердечной недостаточности, дабетической нефропатии и т.п., содержащая любое соединение, указанное в (1), (а1)-(а10), (b1), (c1)-(с12) и (d1)-(d7), или его фармацевтически приемлемую соль.
(е4) Соединение или его фармацевтически приемлемая соль для применения в качестве ингибитора ренина, описанное в любом из пунктов (1), (а1)-(а10), (b1), (c1)-(c12) и (d1)-(d7).
(е5) Соединение или его фармацевтически приемлемая соль, описанные в любом из пунктов (1), (а1)-(а10), (b1), (c1)-(с12) и (d1)-(d7) для применения в лечении и/или профилактике заболеваний, устраняемых ингибированием ренина.
(е7) Способ ингибирования ренина, включающий введение соединения или его фармацевтически приемлемой соли, описанных в любом из пунктов (1), (а1)-(а10), (b1), (c1)-(c12) и (d1)-(d7).
(е8) Способ лечения и/или профилактики заболеваний, устраняемых ингибированием ренина, включающий введение соединения или его фармацевтически приемлемой соли, описанных в любом из пунктов (1), (а1)-(а10), (b1), (c1)-(c12) и (d1)-(d7).
(e9) Способ лечения и/или профилактики гипертензии, сердечной недостаточности, дабетической нефропатии и т.п., включающий введение соединения или его фармацевтически приемлемой соли, описанных в любом из пунктов (1), (а1)-(а10), (b1), (c1)-(c12) и (d1)-(d7).
Соединение [I] по настоящему изобретению может использоваться в клинике в свободной форме или в форме его фармацевтически приемлемой соли. Примеры фармацевтически приемлемой соли соединения [I] включают соль с неорганической кислотой, такую как гидрохлорид, сульфат, фосфат или гидробромид, или соль с органической кислотой, такую как ацетат, фумарат, оксалат, цитрат, метансульфонат, бензолсульфонат, тозилат или малеат. Кроме того, когда соединение [I] по настоящему изобретению содержит в молекуле карбоксильную(ые) группу(ы) и т.п., примеры фармацевтически приемлемой соли включают соли с основанием, такие как соли щелочных металлов (например, натриевая соль, калиевая соль) или соли щелочноземельных металлов (например, кальциевая соль).
Соединение [I] по настоящему изобретению включает также смесь стереоизомера, такого как геометрический изомер, таутомер и энантиомер, и его выделенного стереоизомера. В соединении [I] по настоящему изобретению для ингибирования ренина предпочтительна (Реконфигурация асимметрического атома углерода морфолинового кольца, содержащего заместитель Т. Для ингибирования ренина также предпочтительна (R)-конфигурация асимметрического атома, который замещен R.
Настоящее изобретение также включает внутримолекулярную соль, гидрат, фармацевтически приемлемый сольват и кристаллический полиформ соединения [I]. Кроме того, следует понимать, что соединение [I] по настоящему изобретению не ограничено соединениями, описанными в примерах, приводимых ниже, а включает всю совокупность соединений формулы [I] и их фармацевтически приемлемые соли.
Следовательно, соединение по настоящему изобретению или его фармацевтически приемлемые соли могут быть применимы в качестве средства для профилактики и/или лечения гипертензии, сердечной недостаточности, дабетической нефропатии и т.п., и могут быть предпочтительны в качестве лекарственного средства благодаря их низкой токсичности.
Соединение [I] по настоящему изобретению или его фармацевтически приемлемую соль можно вводить перорально или парентерально, и его можно включать в состав фармацевтических препаратов обычного типа, таких как таблетки, гранулы, капсулы, порошки, препараты для инъекций или для ингаляции и т.п.
Дозу соединения [I] по настоящему изобретению или его фармацевтически приемлемой соли можно варьировать в зависимости от пути введения, возраста, массы тела и состояния пациента, но обычно доза составляет от около 0,001 до 500 мг/кг, предпочтительно от около 0,1 до 100 мг/кг.
Соединение [I] по настоящему изобретению может быть получено описанными далее способами, но не следует считать, что получение соединения [I] ограничивается этими способами.
Способ получения соединения [I]
Соединение [I] по настоящему изобретению или его фармацевтически приемлемую соль можно получать путем снятия защиты Р1 соединения формулы [II]
(где Р1 представляет собой защитную группу, а другие обозначения такие же, как определено выше) и превращения продукта в его фармацевтически приемлемую соль, если необходимо.
Способ получения соединения [II]
Соединение [II] может быть получено путем взаимодействия карбоксил-содержащего соединения формулы [III]
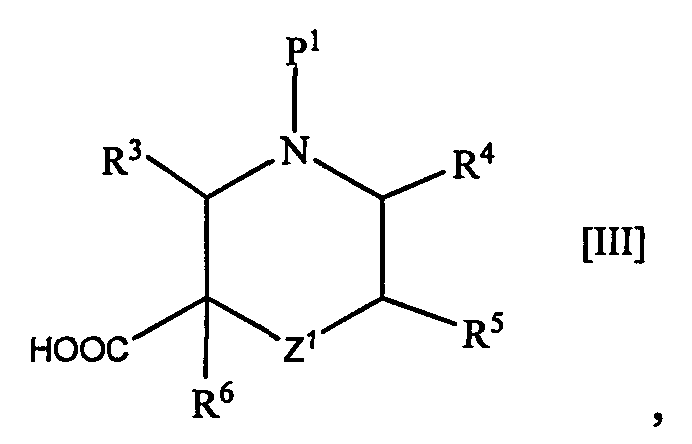
(где обозначения такие же, как определено выше), или его производного, активированного аминосоединением формулы [IV]
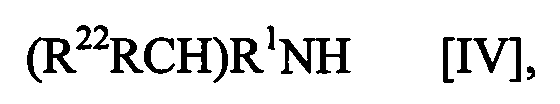
где обозначения такие же, как определено выше.
Соединение по настоящему изобретению содержит два или несколько асимметрических атомов углерода, и продукт реакции может быть получен в виде смеси диастереоизомеров. Такая смесь диастереоизомеров может быть разделена и очищена обычным способом, например, колоночной хроматографией на силикагеле.
Реакция, используемая в способе получения соединения [I]
Примеры защитной группы, обозначенной Р1 или Р2, включают обычные аминозащитные группы, такие как трет-бутоксикарбонильная группа, бензилоксикарбонильная группа, 4-метоксибензилоксикарбонильная группа, бензильная группа, 4-метоксибензильная группа, ацетильная группа, бензоильная группа, тозильная группа и т.п.
Защитная группа Р1 или Р2 соединения [II] может быть удалена обработкой кислотой или основанием или каталитическим восстановлением, или действием агента для снятия защиты в подходящем растворителе или без растворителя. В качестве кислоты может быть предпочтительно использована неорганическая кислота, такая как соляная кислота, серная кислота и т.п., и органическая кислота, такая как уксусная кислота, трифторуксусная кислота, метансульфоновая кислота, пара-толуолсульфоновая кислота и т.п. В качестве основания неорганическое основание (например, гидрид щелочного металла, такой как гидрид натрия; карбонат щелочного металла, такой как карбонаты натрия и карбонаты калия; амид щелочного металла, такой как амиды натрия и лития, алкоксид щелочного металла, такой как метоксид натрия; щелочной металл, такой как натрий; и гидроксид щелочного металла, такой как гидроксид натрия, гидроксид калия и т.п.) может быть предпочтительно использовано. В качестве агентов для удаления защиты могут быть использованы бромид цинка и триметилсилантрифторметансульфонат и т.п. Каталитическое восстановление предпочтительно проводить в атмосфере водорода, используя в качестве катализатора палладий на угле, гидроксид палладия на угле, оксид палладия и т.п. Примеры растворителя включают любой растворитель, который не мешает реакции, такой как метанол, этанол, изопропиловый спирт, 1,4-диоксан, диэтиловый эфир, тетрагидрофуран, метиленхлорид, хлороформ, дихлорэтан, этилацетат, толуол, и их смесь. В качестве растворителя можно использовать кислоту или основание, описанные выше. Реакцию можно проводить при температуре от -78°С до температуры кипения растворителя.
Реакция, используемая в способе получения соединения [II]
Соединение [II] может быть получено конденсацией производного карбоновой кислоты [III] и аминосоединения [IV] в подходящем растворителе или без растворителя.
Конденсацию можно осуществить, используя общепринятую реакцию в присутствии конденсирующего агента или путем взаимодействия активированного производного соединения [III] (например, хлорангидрида кислоты, смешанного ангидрида кислоты, активированного сложного эфира и т.п.) с соединением [IV], после превращения соединения [III] в его реакционноспособное производное. Примеры конденсирующего агента включают N,N-дициклогексилкарбодиимид (DCC), 1-этил-3-(3-диметиламинопропил)карбодиимид (EDC) или его гидрохлорид, карбонилдиимидазол (CDI), дифенилфосфорилазид (DPPA), диэтилцианофосфонат (DEPC) и т.п., из них предпочтительными являются DCC, EDC или его гидрохлорид.
В случае использования реакционноспособного производного соединения [III], его можно подвергать взаимодействию с соединением [IV] в подходящем растворителе или без растворителя в присутствии агента, связывающего кислоту, если это необходимо; после превращения соединения [III] в хлорангидрид кислоты действием галогенирующего агента (например, тионилхлорида, тионилбромида, оксалилхлорида и т.п.), в смешанный ангидрид кислоты действием сложного эфира хлоркарбоната (например, метилхлоркарбоната, этилхлоркарбоната, изобутилхлорформиата и т.п.) или хлорида кислоты (2,4,6-трихлорбензоилхлорида и т.п.), или активированного сложного эфира N-гидроксиламина (1-гидроксисукцинимида, 1-гидроксибензотриазола и т.п.) или производного фенола (пара-нитрофенола. и т.п.) или сложного эфира низшего спирта (метилового эфира, этилового эфира и т.п.). В способе превращения в галогенангидрид кислоты, прибавление катализатора, такого как диметилформамид и т.п., может ускорить реакцию. В качестве агента, связывающего кислоту, если требуется, используют неорганическое основание или органическое основание; примеры неорганического основания включают карбонат натрия, карбонат калия, карбонат цезия, бикарбонат натрия, гидроксид натрия, гидроксид калия, гидроксид лития и т.п., а примеры органического основания включают триэтиламин, трибутиламин, диизопропилэтиламин, 1,8-диазабицикло[5,4,0]ундека-7-ен, N,N-диэтиланилин, пиридин, лутидин, колидин и т.п. В настоящей реакции в качестве агента, связывающего кислоту, применяют предпочтительно триэтиламин, диизопропилэтиламин, пиридин и т.п. При использовании агента, связывающего кислоту, в данной реакции его используют в качестве растворителя.
Реакцию конденсации, показанную выше, можно проводить или ускорять, прибавляя 4-аминопиридин и т.п.
При использовании растворителя в вышеуказанной реакции конденсации, можно применять любой инертный растворитель, который не мешает реакции, и примеры растворителей включают хлороформ, дихлорметан, дихлорэтан, толуол, диэтиловый эфир, тетрагидрофуран, диоксан, 1,2-диметоксиэтан, этилацетат, амидный растворитель (N,N-диметилформамид, N,N-диметилацетамид, 1,3-диметил-2-имидазолидинон и т.д.), пиридин, 2,6-лутидин, воду и т.п., и их смесь также можно использовать. Среди них предпочтительны хлороформ, тетрагидрофуран, диоксан, N,N-диметилформамид, N,N-диметилацетамид и смесь хлороформа и N,N-диметилформамида и т.п.
Обычно реакцию конденсации можно проводить при температурах от -20°С до температуры кипения растворителя и, если требуется, конденсацию можно проводить при более низкой температуре, которую подбирают соответствующим образом.
Примеры соединений [I] по настоящему изобретению, полученных вышеуказанными способами, показаны ниже, но не следует считать, что настоящее изобретение ограничивается ими.
Осуществление изобретения
ПРИМЕРЫ
Пример 1
(2R)-N-Циклопропил-N-{1-[4-(3-метоксипропокси)-1-бензофуран-6-ил]этил}морфолин-2-карбоксамид [Ex(1-1), Ех(1-2)].
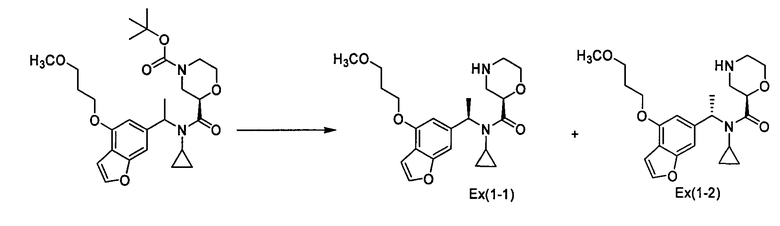
К раствору трет-бутил-(2R)-2-[(циклопропил{1-[4-(3-метоксипропокси)-1-бензофуран-6-ил]этил}амино)карбонил]морфолин-4-карбоксилата (200 мг) и 2,6-лутидина (0,142 мл) в хлороформе (4 мл) прибавляют триметилсилилтрифлат (0,180 мл) при охлаждении льдом и смесь перемешивают при той же температуре в течение 30 минут. Затем к смеси прибавляют насыщенный водный раствор гидрокарбоната натрия при охлаждении льдом и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором хлорида натрия, сушат над сульфатом магния, затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: хлороформ/метанол/водный раствор аммиака=200/2/1), получая (2R)-N-циклопропил-N-{(1R)-1-[4-(3-метоксипропокси)-1-бензофуран-6-ил]этил}морфолин-2-карбоксамид [Ех(1-1)] (12,5 мг) и (2R)-N-циклопропил-N-{(1S)-1-[4-(3-метоксипропокси)-1-бензофуран-6-ил]этил}морфолин-2-карбоксамид [Ех(1-2)] (20,2 мг) в виде бесцветного масла. МС (APCI), m/z: 403 [M+Н]+.
Пример 2
(2R)-N-{(1R)-1-[3-Хлор-1-(3-метоксипропил)-1Н-индол-6-ил]этил}-N-циклопропилпиперазин-2-карбоксамид [Ех(2-1)]

К раствору ди-трет-бутил-(2R)-2-{[{(1R)-1-[3-хлор-1-(3-метоксипропил)-1Н-индол-6-ил]этил}(циклопропил)амино]карбонил}пиперазин-1,4-дикарбоксилата (44,0 мг) и 2,6-лутидина (0,050 мл) в дихлорметане (1,0 мл) прибавляют триметилсилилтрифлат (0,051 мл) при охлаждении льдом и смесь перемешивают при той же температуре в течение 1 часа. Затем к смеси прибавляют насыщенный водный раствор гидрокарбоната натрия и метанол (2,0 мл) при охлаждении льдом и смесь экстрагируют хлороформом. Органический слой промывают насыщенным раствором хлорида натрия, сушат над сульфатом магния и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на NH-силикагеле (элюент: этилацетат→этилацетат/метанол=5/1), получая (2R)-N-{(1R)-1-[3-хлор-1-(3-метоксипропил)-1Н-индол-6-ил]этил}-N-циклопропилпиперазин-2-карбоксамид [Ех(2-1)] (25,4 мг) в виде бесцветного масла. МС (APCI), m/z: 419/421 [M+H]+.
Пример 3
Гидрохлорид (2R)-N-циклопропил-N-{(1R)-1-[1-(3-метоксипропил)-3-метил-1Н-индазол-6-ил]этил}морфолин-2-карбоксамида [Ех(3-1)]
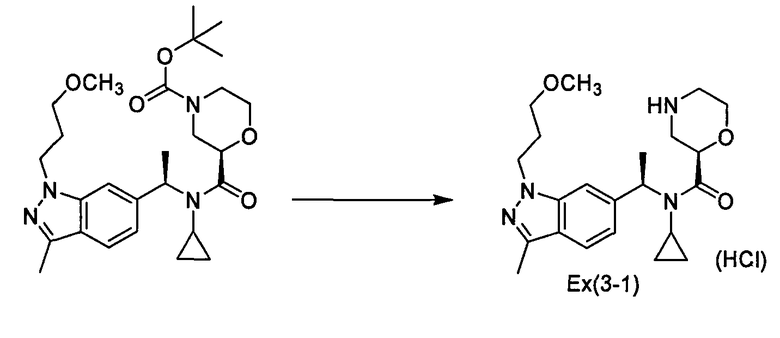
К раствору трет-бутил-(2R)-2-[(циклопропил{(1R)-1-[1-(3-метоксипропил)-3-метил-1Н-индазол-6-ил]этил}амино)карбонил]морфолин-4-карбоксилата (44,4 мг) в хлороформе (2,0 мл) прибавляют 4-нормальный раствор хлорида водорода в диоксане (0,75 мл) при охлаждении льдом и смесь перемешивают при комнатной температуре в течение 20 часов. Реакционный раствор концентрируют при пониженном давлении и полученный остаток растворяют в воде (1 мл) и затем промывают диэтиловым эфиром. Водный слой сушат сублимацией (лиофилизируют), получая гидрохлорид (2R)-N-циклопропил-N-{(1R)-1-[1-(3-метоксипропил)-3-метил-1Н-индазол-6-ил]этил}морфолин-2-карбоксамида [Ех(3-1)] (25 мг) в виде бесцветного порошка.
МС (ХИАД), m/z: 401 [M+H]+.
Пример 4
(2R)-N-{1-[4-Хлор-1-(3-метоксипропил)-3-метил-1Н-индазол-6-ил]этил}-N-циклопропилморфолин-2-карбоксамид [Ех(4-1), Ех(4-2)]
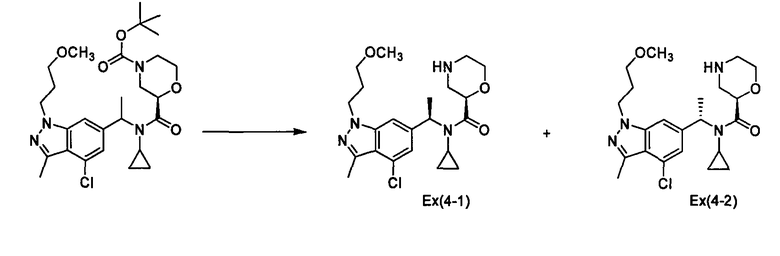
К раствору трет-бутил-(2R)-2-{[{1-[4-хлор-1-(3-метоксипропил)-3-метил-1Н-индазол-6-ил]этил}(циклопропил)амино]карбонил}морфолин-4-карбоксилата (146 мг) в хлороформе (2,0 мл) прибавляют 4-нормальный раствор хлорида водорода в диоксане (2,0 мл) при охлаждении льдом и смесь перемешивают при комнатной температуре в течение 3 часов. Реакционный раствор концентрируют при пониженном давлении, затем к нему прибавляют насыщенный водный раствор гидрокарбоната натрия при охлаждении льдом и смесь экстрагируют хлороформом. Органический слой промывают насыщенным раствором хлорида натрия, сушат над сульфатом магния, и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: хлороформ/метанол/водный раствор аммиака=500/10/1), получая (2R)-N-{(1R)-1-[4-хлор-1-(3-метоксипропил)-3-метил-1Н-индазол-6-ил]этил}-N-циклопропилморфолин-2-карбоксамид [Ех(4-1)] (50,2 мг) и (2R)-N-{(1S)-1-[4-хлор-1-(3-метоксипропил)-3-метил-1Н-индазол-6-ил]этил}-N-циклопропилморфолин-2-карбоксамид [Ех(4-2)] (18,4 мг) в виде бесцветного масла.
МС (ХИАД), m/z: 435/437 [M+H]+.
Пример 5А
(2R)-N-{1-[3-Бром-4-метокси-5-(3-метоксипропокси)фенил]этил}-N-циклопропилморфолин-2-карбоксамид [Ех(5-1), Ех(5-2)]
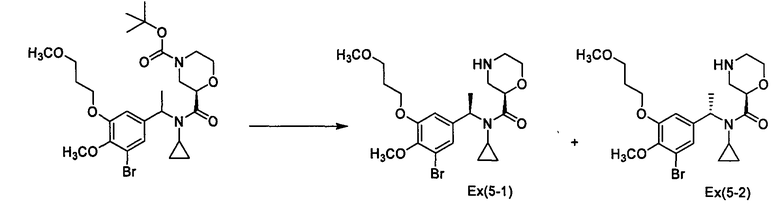
К раствору трет-бутил-(2R)-2-{[{1-[3-бром-4-метокси-5-(3-метоксипропокси)енил]этил}(циклопропил)амино]карбонил}морфолин-4-карбоксилата (135 мг) в дихлорметане (2 мл) прибавляют трифторуксусную кислоту (2 мл) и смесь перемешивают при комнатной температуре в течение 30 минут. Реакционный раствор концентрируют при пониженном давлении, к полученному остатку прибавляют хлороформ и смесь фильтруют через (Bond-Elute: зарегистрированный товарный знак) (NH2). Фильтрат концентрируют при пониженном давлении и полученный остаток очищают колоночной хроматографией на NH-силикагеле (элюент: этилацетат/метанол/водный раствор аммиака=200/10/1), получая (2R)-N-{(1R)-1-[3-бром-4-метокси-5-(3-метоксипропокси)фенил]этил}-N-циклопропилморфолин-2-карбоксамид [Ех(5-1)] (53,7 мг) и (2R)-N-{(1S)-1-[3-бром-4-метокси-5-(3-метоксипропокси)фенил]этил}-N-циклопропилморфолин-2-карбоксамид [Ех(5-2)] (30,5 мг) в виде бесцветного масла.
МС (ХИАД), m/z: 471/473 [М+Н]+.
Пример 5В
Метил {3-[3-((1-{циклопропил[(2R)-морфолин-2-илкарбонил]амино}этил)-1Н-пирроло[2,3-b]пиридин-1-ил]пропил}карбамат.
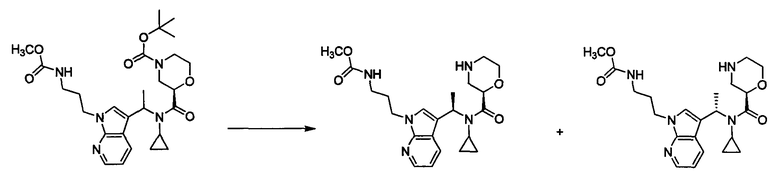
К раствору трет-бутил-(2R)-2-({циклопропил[1-(1-{3-[(метоксикарбонил)амино]пропил}-1Н-пирроло[2,3-b]пиридин-3-ил)этил]амино}карбонил)морфолин-4-карбоксилата (116 мг) и 2,6-лутидина (0,077 мл) в дихлорметане (2 мл) прибавляют триметилсилилтрифлат (0,099 мл) при охлаждении льдом и смесь перемешивают при той же температуре в течение 1 часа. Затем к смеси прибавляют водный раствор гидрокарбоната натрия и метанол (2,0 мл) при охлаждении льдом, и смесь экстрагируют хлороформом. Органический слой промывают насыщенным раствором хлорида натрия, сушат над сульфатом магния, и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на NH-силикагеле (элюент: этилацетат→этилацетат/метанол=9/1), получая метил {3-[3-(1-{циклопропил[(2R)-морфолин-2-илкарбонил]амино}этил)-1Н-пирроло[2,3-b]пиридин-1-ил]пропил}карбамат (50 мг) в виде бесцветного масла. Метил{3-[3-(1-{циклопропил[(2R)-морфолин-2-илкарбонил]амино}этил)-1Н-пирроло[2,3-b]пиридин-1-ил]пропил}карбамат (40 мг) разделяют, используя CHIRALPAK IC (элюент: н-гексан/этанол/диэтиламин=50/50/0,1; прибор: Waters 302 (система 600Е) на диастереомеры, получая метил {3-[3-((1R)-1-{циклопропил[(2R)-морфолин-2-илкарбонил]амино}этил)-1Н-пирроло[2,3-b]пиридин-1-ил]пропил}карбамат (18 мг) в виде бесцветного масла и метил{3-[3-((1S)-1-{циклопропил[(2R)-морфолин-2-илкарбонил]амино}этил)-1Н-пирроло[2,3-b]пиридин-1-ил]пропил}карбамат (18 мг) в виде бесцветного масла.
МС (ХИАД), m/z: 430[M+H]+.
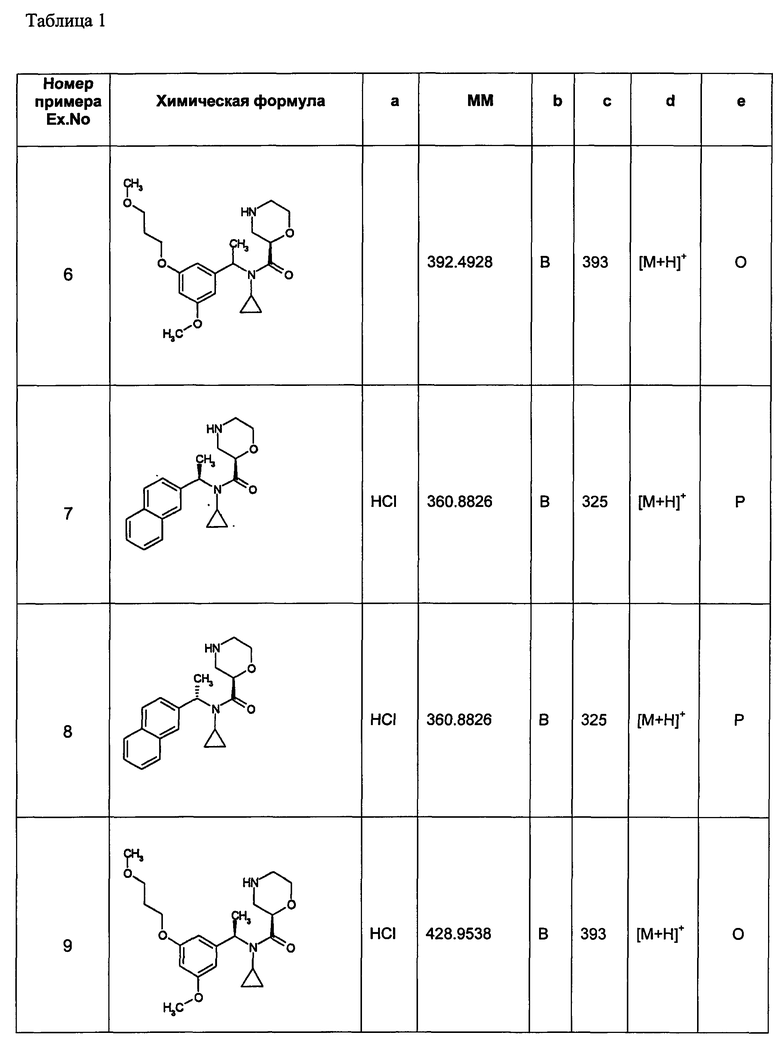
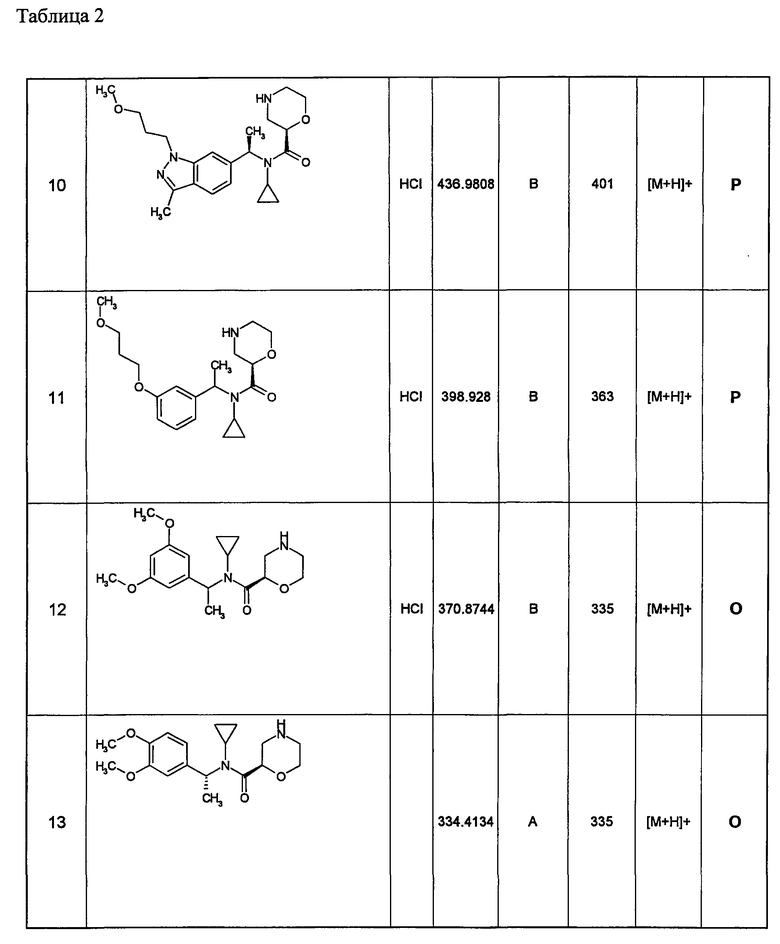
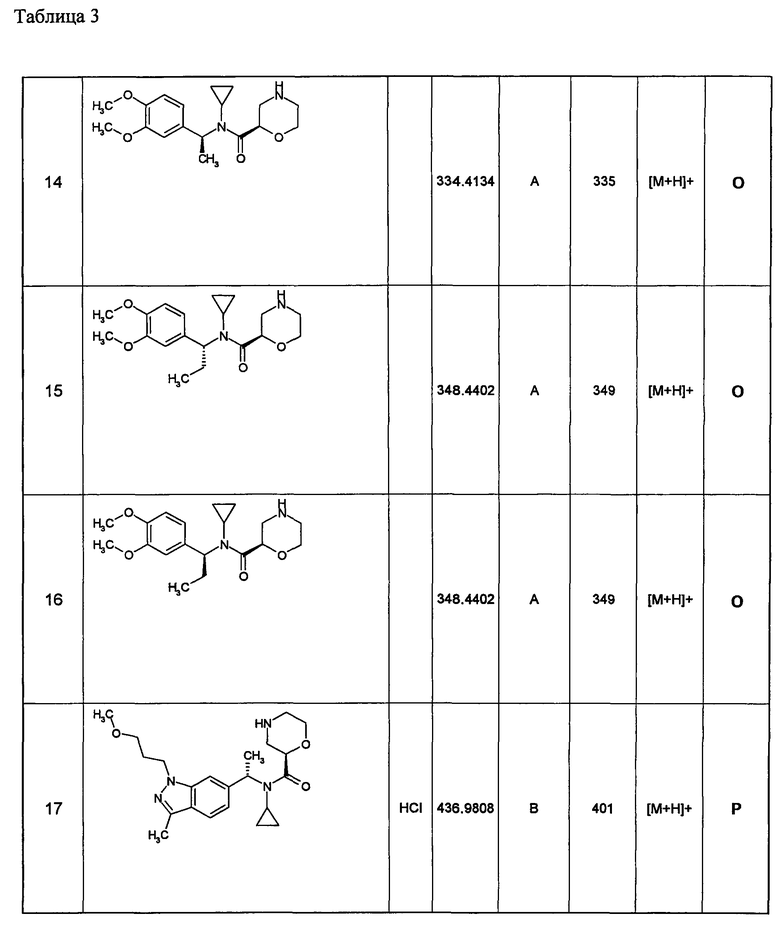
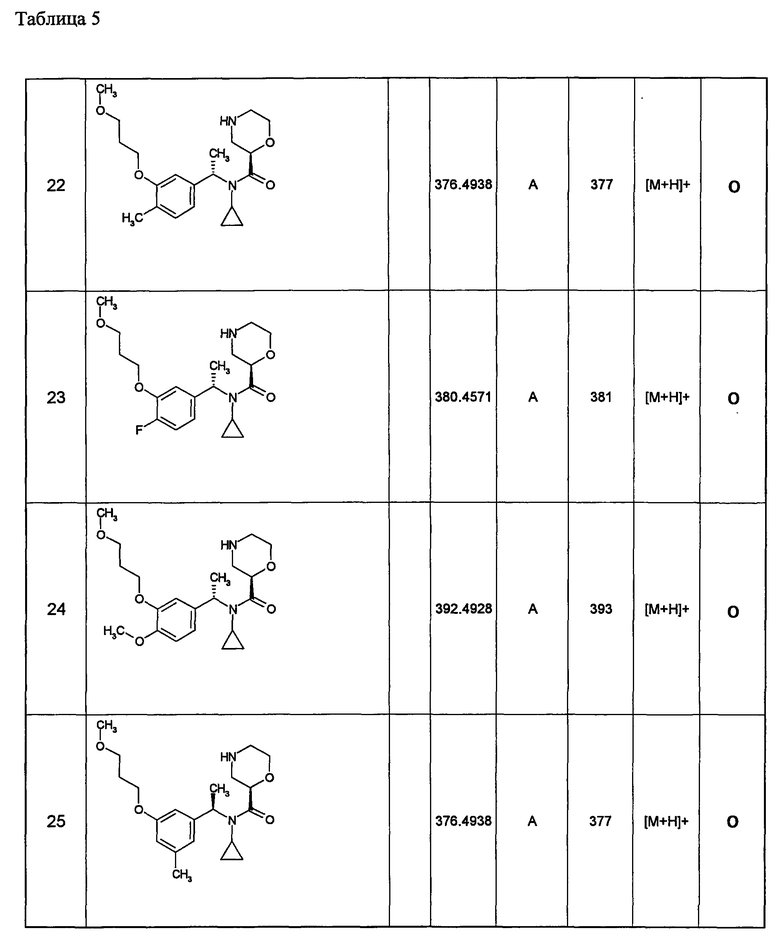
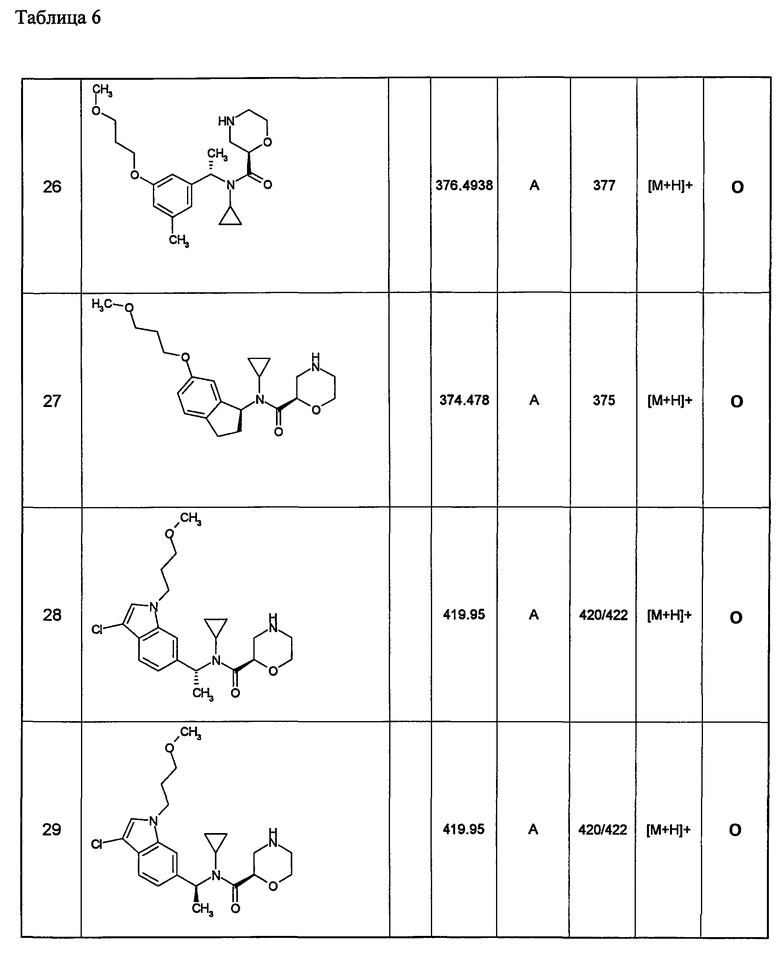
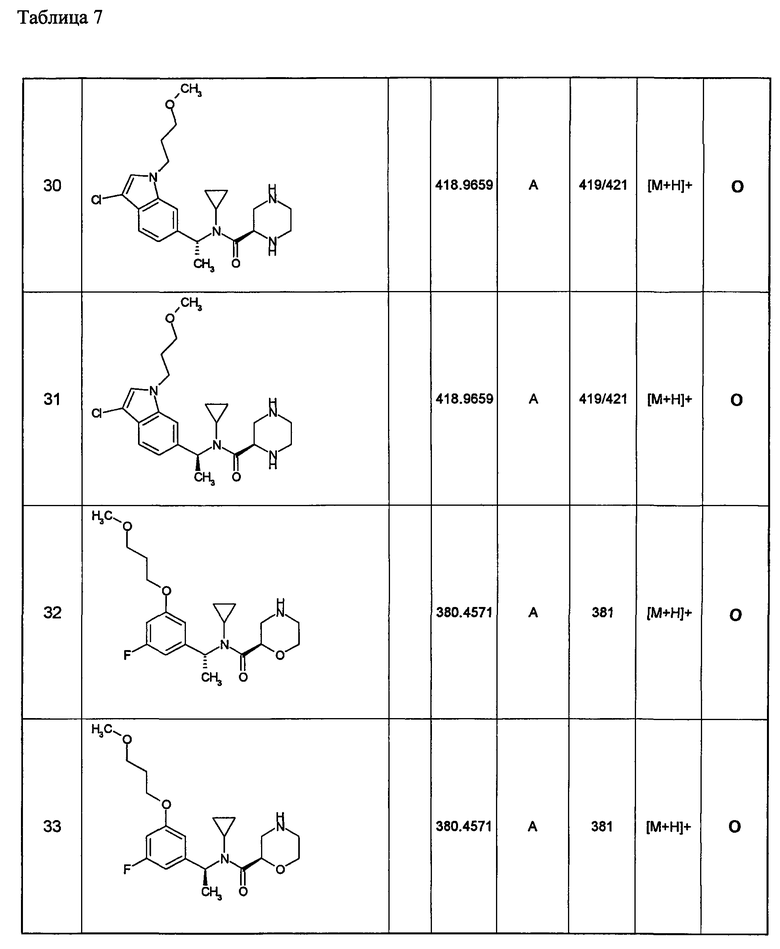
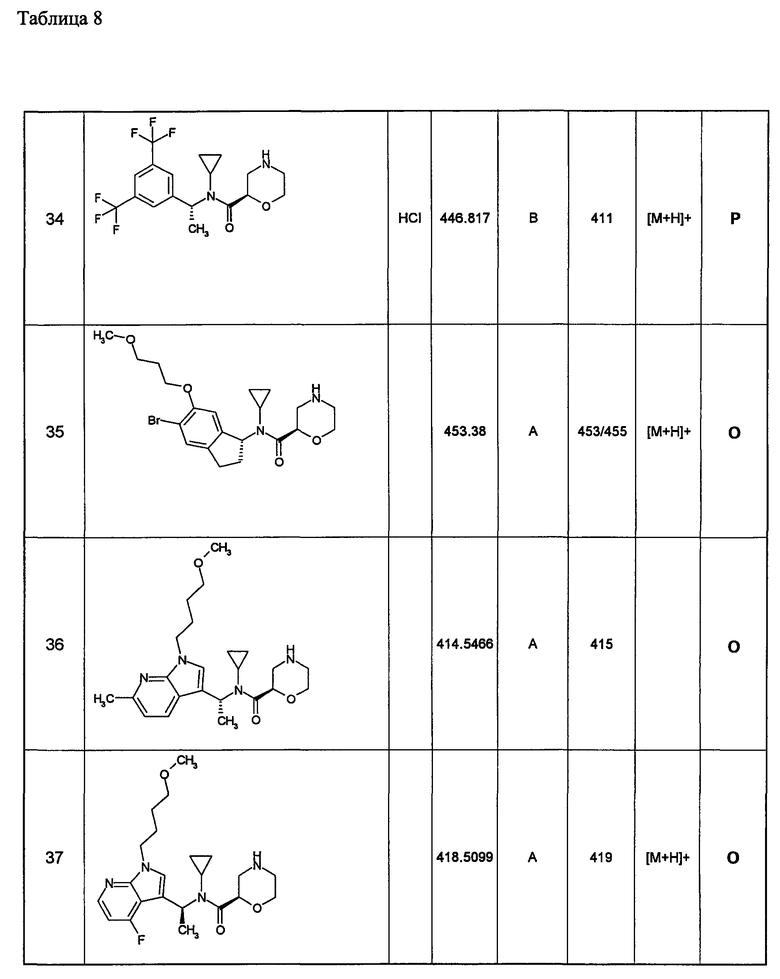
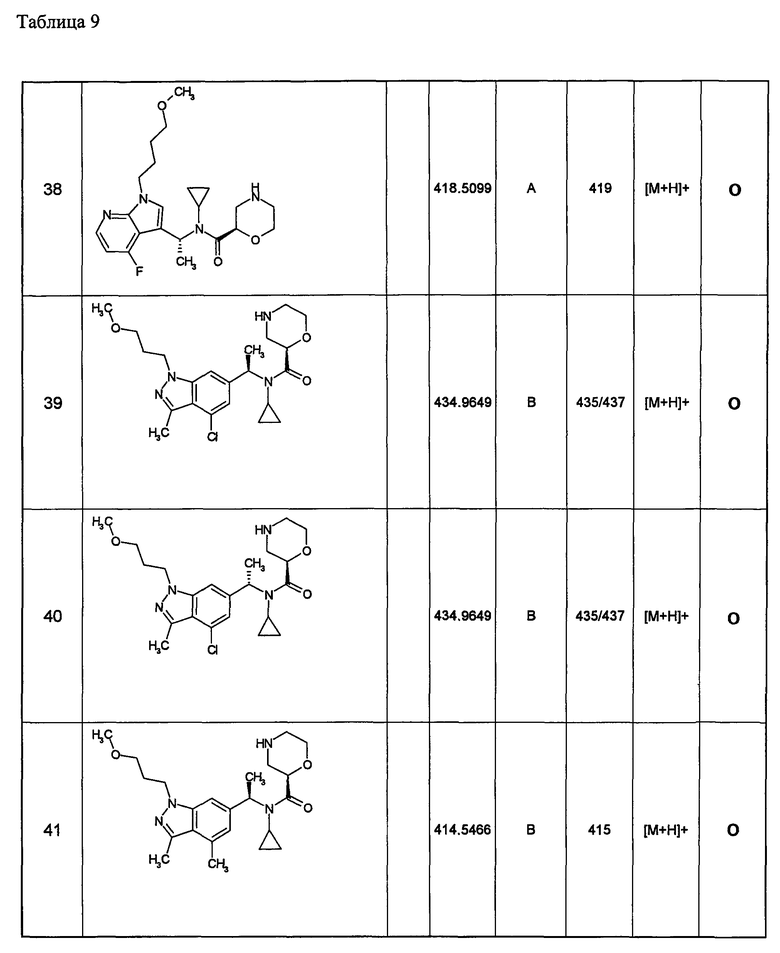
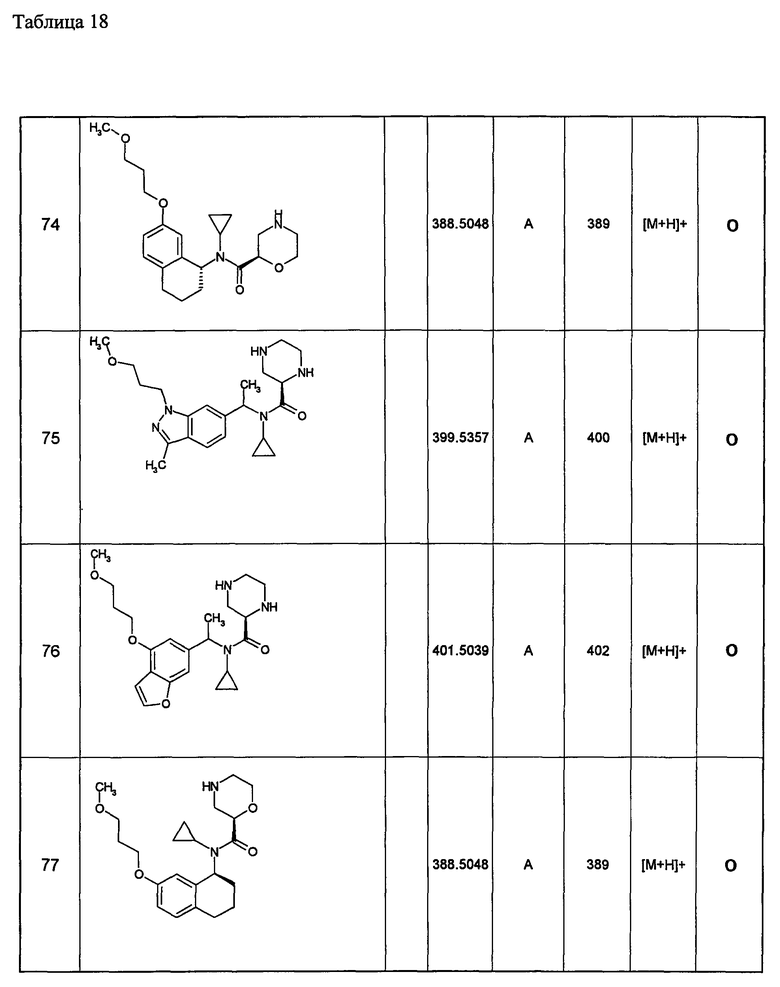
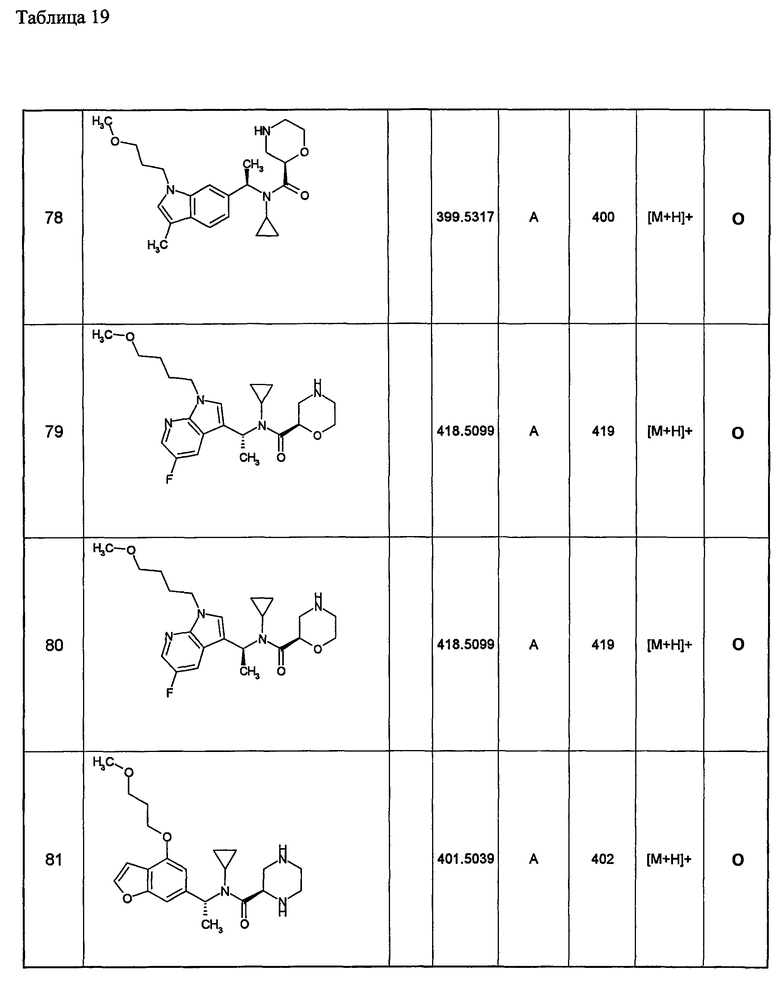
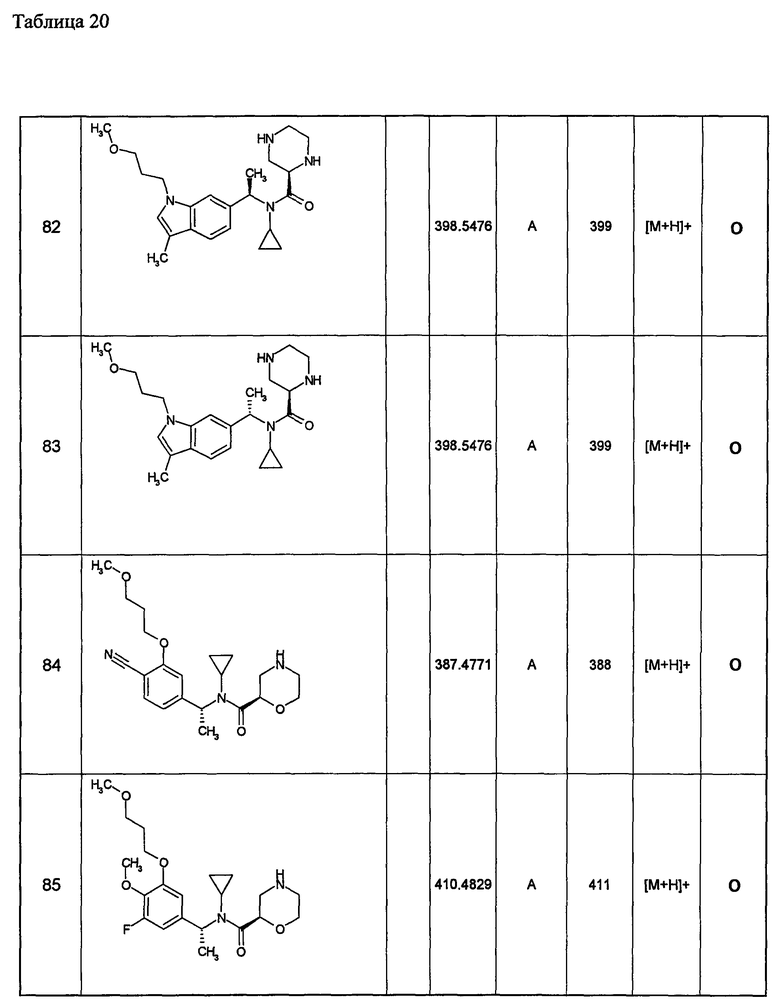
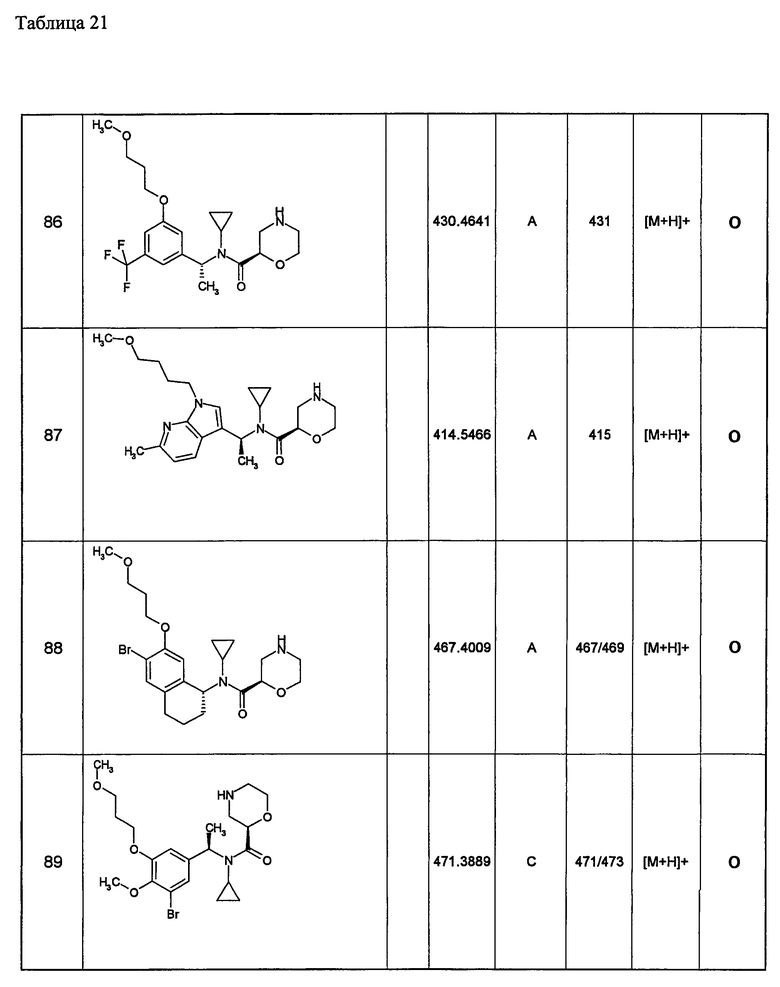
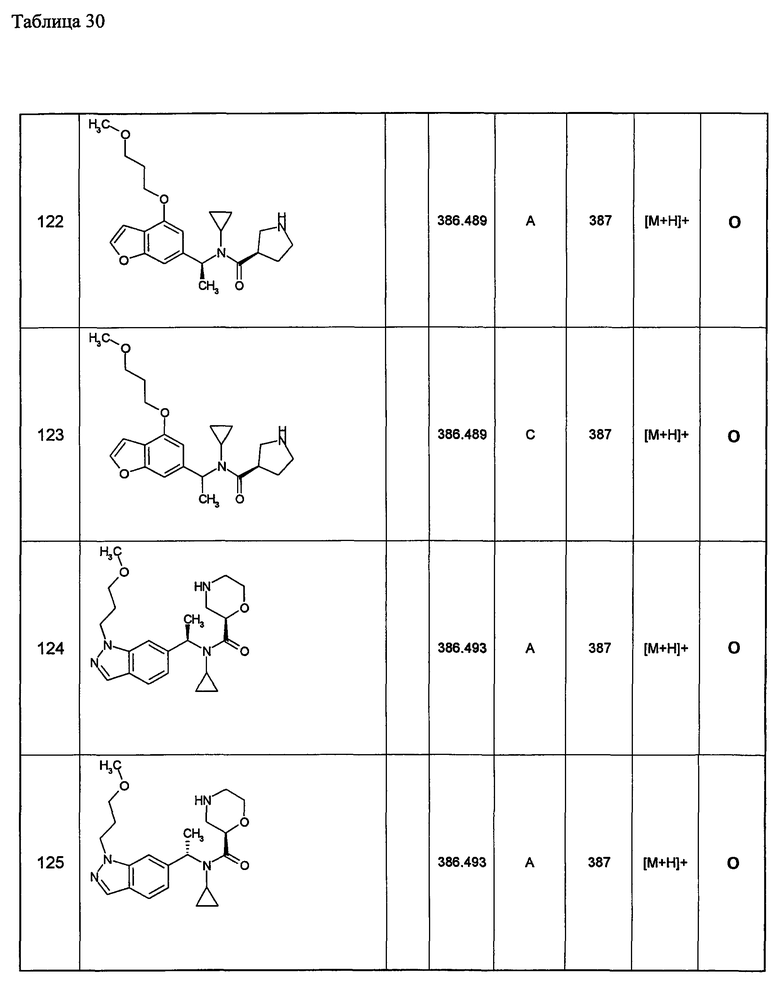
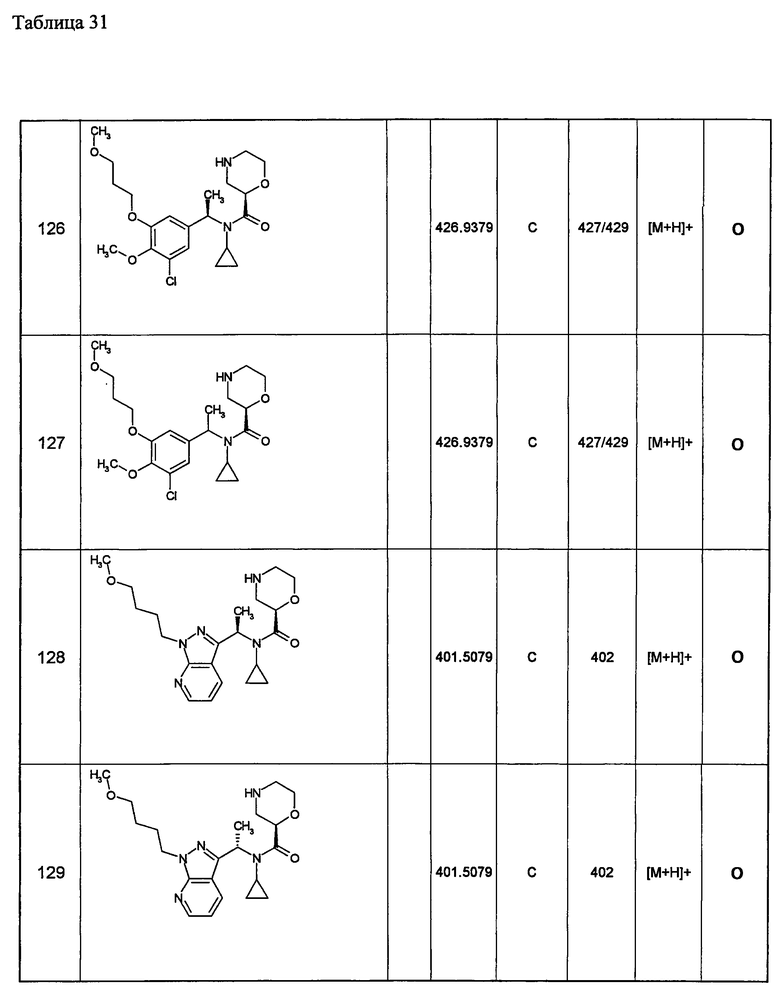
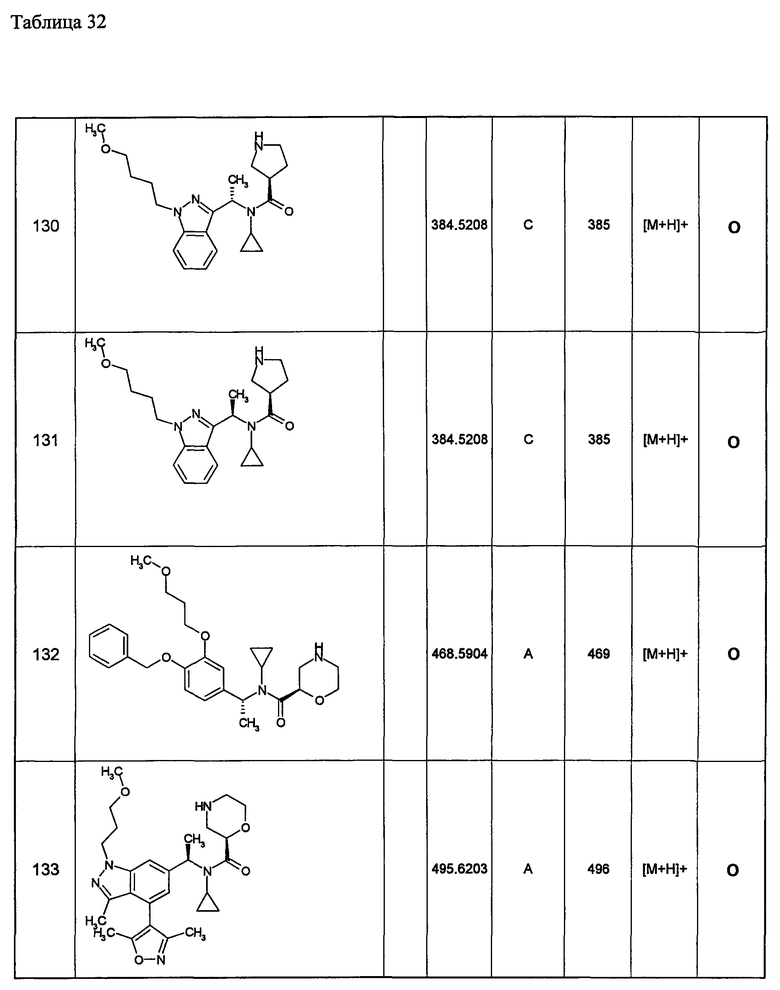
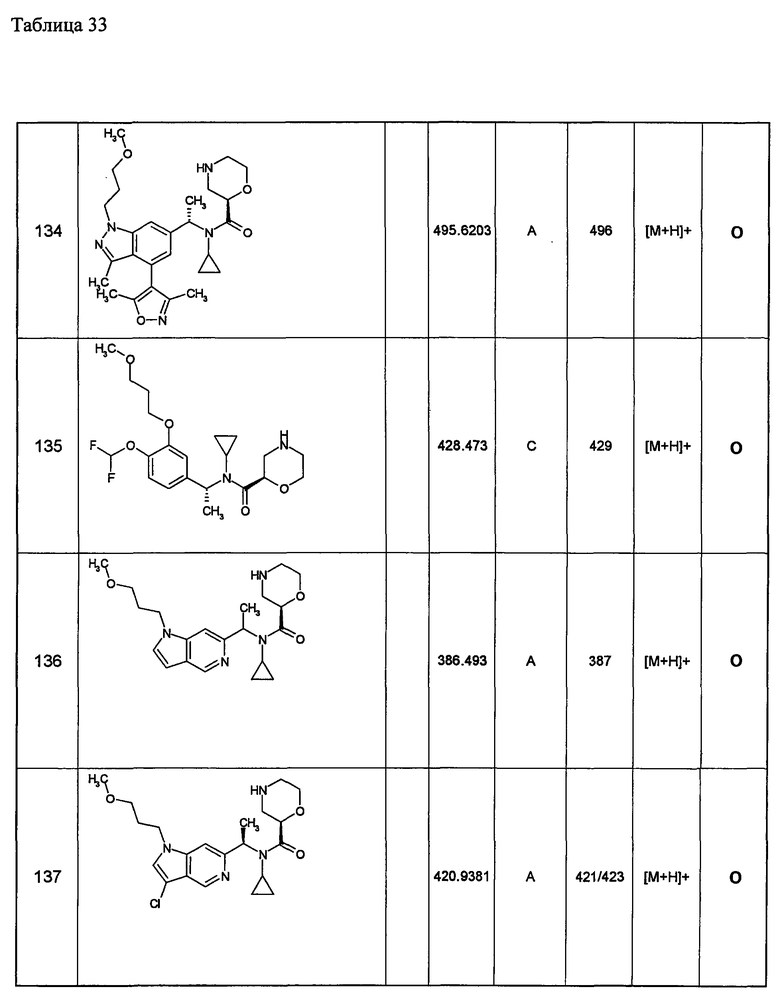
Примеры 6-160
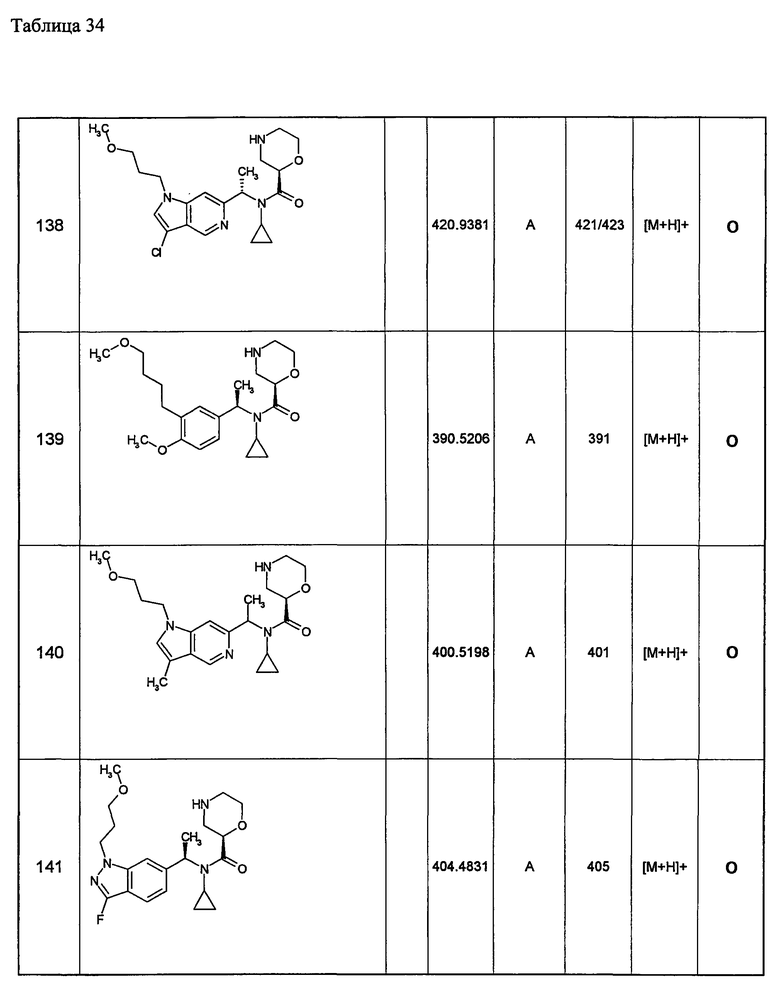
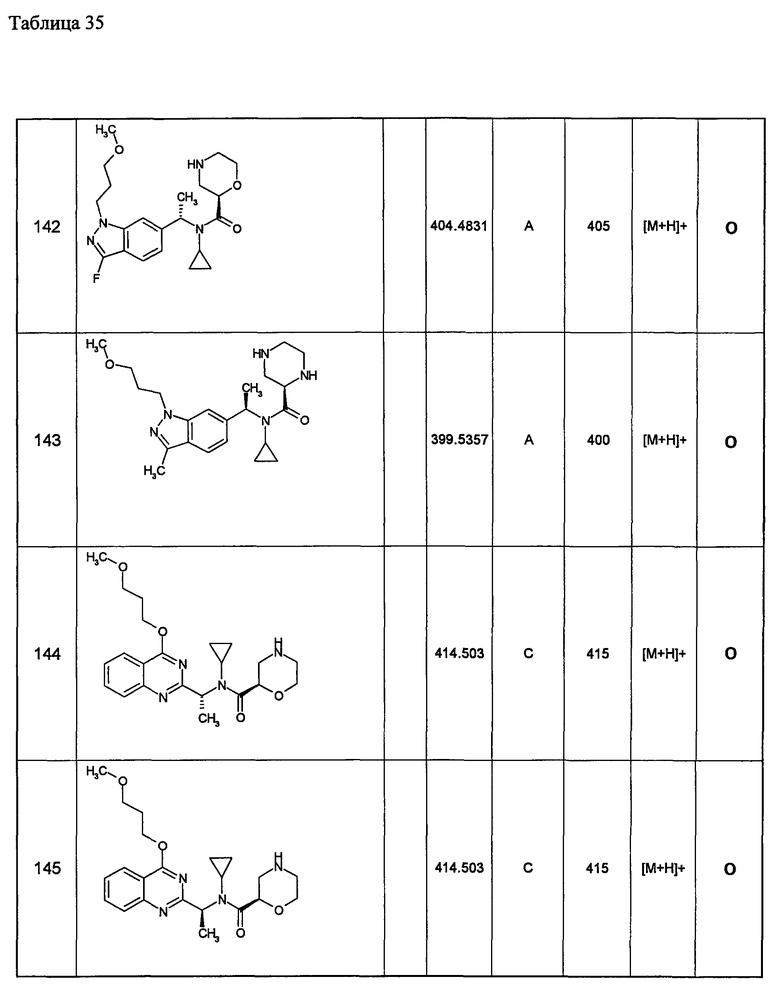
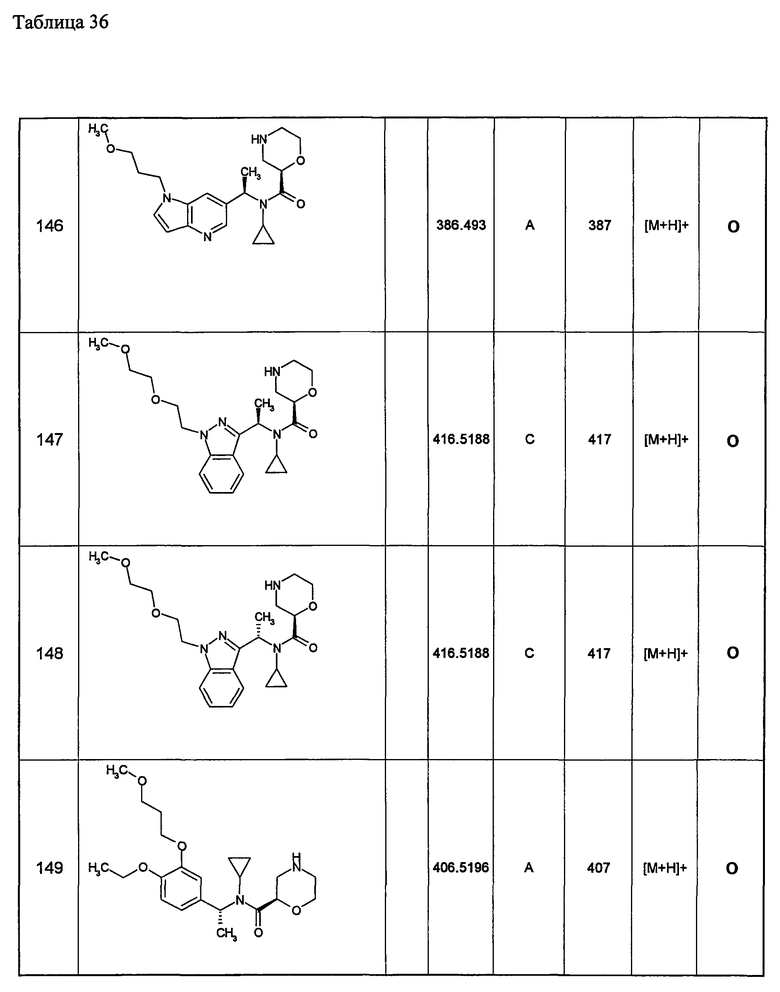
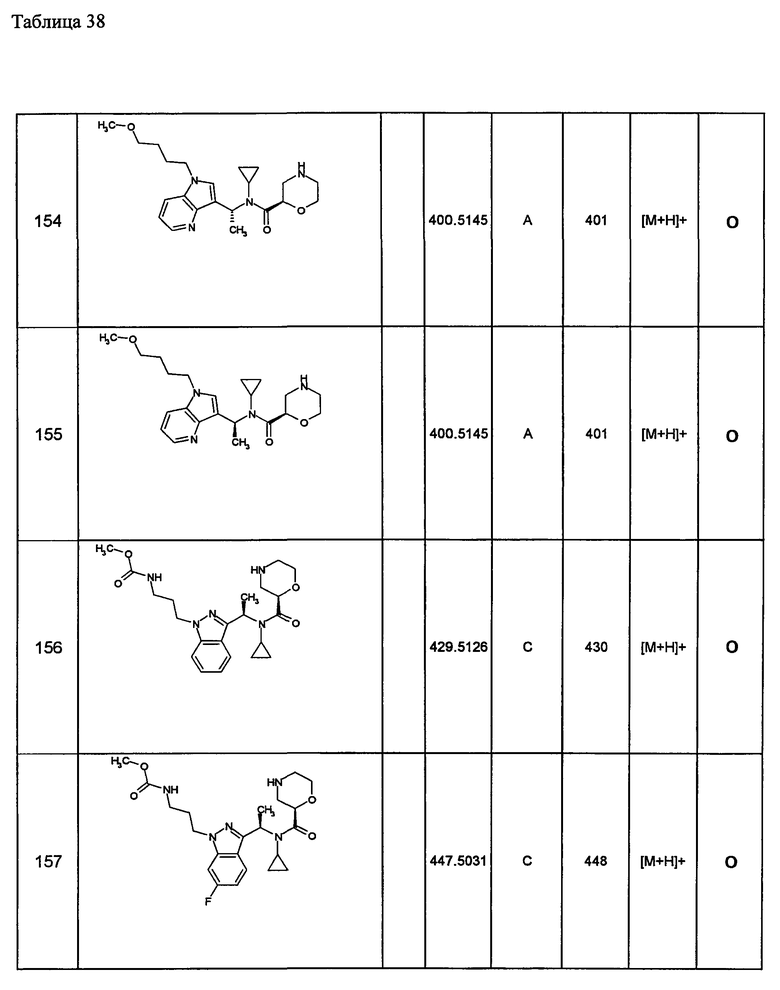
Следующие далее азотсодержащие насыщенные гетероциклические соединения и т.п. получают аналогично соединениям, описанным в примерах 1-5. Каждое обозначение способов от А до С относится к каждому способу в соответствии с их описанием в примерах.
Способ А: - Примеры 1, 2
Способ В: - Примеры 3, 4
Способ С: - Пример 5А


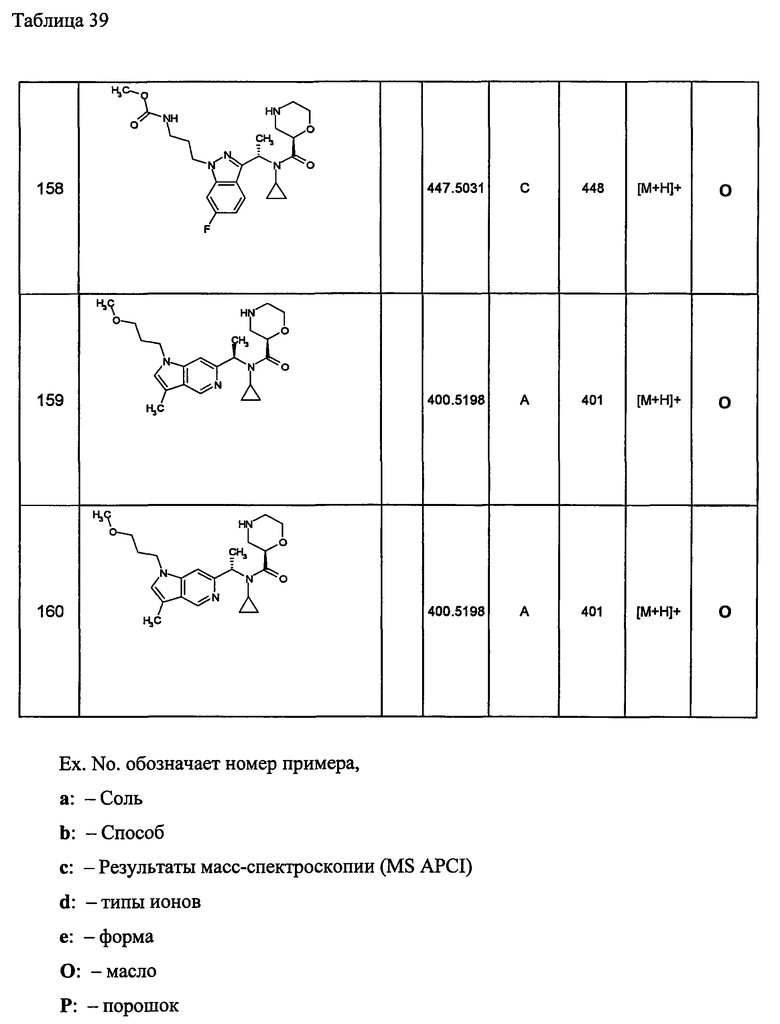
Пример 161
трет-Бутил-(2R)-2-[(циклопропил{1-[4-(3-метоксипропокси)-1-бензофуран-6-ил]этил}амино)карбонил]морфолин-4-карбоксилат [Ех(161-1)]
К раствору N-{1-[4-(3-метоксипропокси)-1-бензофуран-6-ил]этил}циклопропанамина (200 мг) и (2R)-4-(трет-бутоксикарбонил)морфолин-2-карбоновой кислоты (240 мг) в N,N-диметилформамиде (7 мл) прибавляют гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (212 мг) и 1-гидроксибензотриазол (140 мг) при охлаждении льдом, затем смесь перемешивают при комнатной температуре в течение 18 часов. К реакционной смеси прибавляют насыщенный водный раствор гидрокарбоната натрия и смесь экстрагируют этилацетатом. Органический слой промывают последовательно водой, 10% водным раствором лимонной кислоты и насыщенным раствором хлорида натрия, затем концентрируют при пониженном давлении, получая трет-бутил-(2R)-2-[(циклопропил{1-[4-(3-метоксипропокси)-1-бензофуран-6-ил]этил}амино)карбонил]морфолин-4-карбоксилат [Ех(161-1)] (306 мг) в виде желтого масла.
МС (ХИАД), m/z: 503 [М+Н]+.
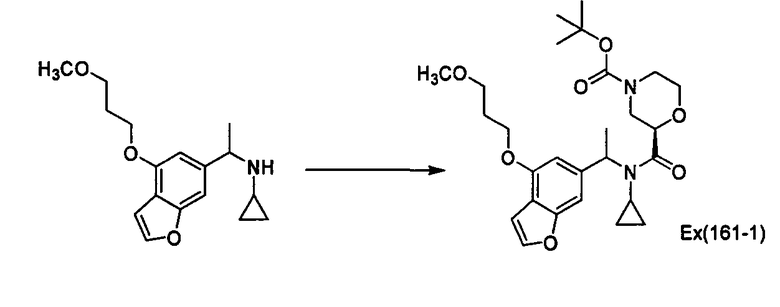
Пример 162
трет-Бутил (2R)-2-[(циклопропил{1-[1-(3-метоксипропил)-3-метил-1Н-индазол-6-ил]этил} амино)карбонил]морфолин-4-карбоксилат [Ех(162-1), Ex(162-2)]
К раствору N-{1-[1-(3-метоксипропил)-3-метил-1Н-индазол-6-ил]этил}циклопропанамина (2,63 г) и (2R)-4-(трет-бутоксикарбонил)морфолин-2-карбоновой кислоты (2,32 г) в N,N-диметилформамиде (25 мл) прибавляют 1-гидроксибензотриазол (1,36 г) и гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (2,11 г) при охлаждении льдом, затем смесь перемешивают при комнатной температуре в течение 3 часов. К реакционной смеси прибавляют этилацетат, смесь промывают насыщенным раствором хлорида натрия, сушат над сульфатом магния и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат/метанол=30/3/1→9/3/1), получая трет-бутил (2R)-2-[(циклопропил{(1R)-1-[1-(3-метоксипропил)-3-метил-1Н-индазол-6-ил]этил}амино)карбонил]морфолин-4-карбоксилат [Ех(162-1)] (1,71 г) и трет-бутил (2R)-2-[(циклопропил{(1S)-1-[1-(3-метоксипропил)-3-метил-1Н-индазол-6-ил]этил}амино)карбонил]морфолин-4-карбоксилат [Ех(162-2)] (468 мг) в виде бесцветного масла.
МС (ХИАД), m/z: 435 [M+H]+.
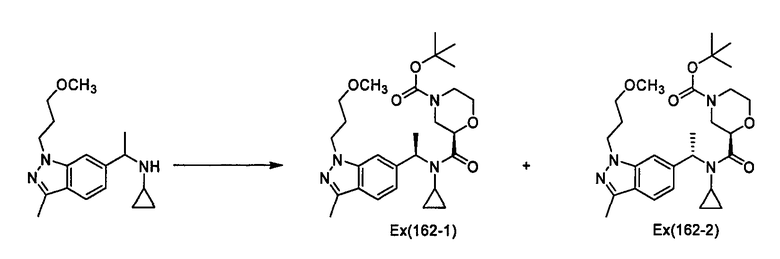
Пример 163
трет-Бутил (2R)-2-({циклопропил[1-(2-нафтил)этил]амино}карбонил)морфолин-4-карбоксилат [Ех(163-1)]
К раствору гидрохлорида N-[1-(2-нафтил)этил]циклопропиламина (149 мг), (2R)-4-(трет-бутоксикарбонил)морфолин-2-карбоновой кислоты (208 мг) и 1-гидроксибензотриазола (122 мг) в N,N-диметилформамиде (6 мл) прибавляют диизопропилэтиламин (0,125 мкл), к смеси прибавляют гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (207 мг) при охлаждении льдом. Смесь перемешивают при комнатной температуре в течение 19 часов, затем к реакционному раствору прибавляют 1-нормальный водный раствор гидрокарбоната натрия и смесь экстрагируют этилацетатом. Органический слой промывают последовательно водой (2 раза) и насыщенным раствором хлорида натрия, сушат над сульфатом натрия и затем концентрируют при пониженном давлении. Остаток растирают в смеси н-гексана и диэтилового эфира (5:1), получая трет-бутил (2R)-2-({циклопропил[1-(2-нафтил)этил]амино}карбонил)морфолин-4-карбоксилат [Ех(163-1)] (153 мг) в виде бесцветного порошка.
МС (ХИАД), m/z: 425 [M+H]+.
Пример 164
Ди(трет-бутил) (2R)-2-{[{1-[3-хлор-1-(3-метоксипропил)-1Н-индол-6-ил]этил)циклопропил)амино]карбонил}пиперазин-1,4-дикарбоксилат [Ех(164-1), Ех(164-2)]
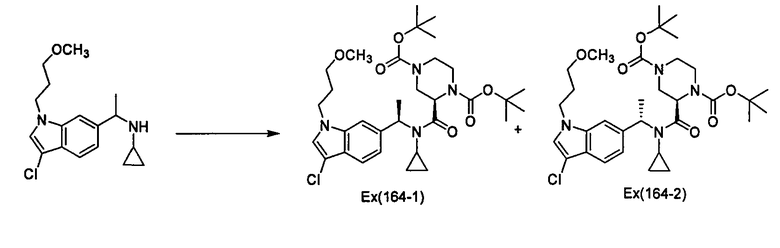
К раствору N-{1-[3-хлор-1-(3-метоксипропил)-1Н-индол-6-ил]этил}циклопропанамина (60 мг) и пиперазинкарбоновой кислоты (77,5 мг) в дихлорметане (2 мл) прибавляют диизопропилэтиламин (0,085 мл) и дифенилфосфорохлоридат (0,037 мл) при охлаждении льдом и смесь перемешивают при комнатной температуре в течение 20 часов. К реакционному раствору прибавляют 0,5% водный раствор соляной кислоты при охлаждении льдом, и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором хлорида натрия, сушат над сульфатом магния и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=99/1→2/1), получая ди(трет-бутил) (2R)-2-{[{(1R)-1-[3-хлор-1-(3-метоксипропил)-1Н-индол-6-ил]этил}(циклопропил)амино]карбонил}пиперазин-1,4-дикарбоксилат [Ех(1б4-1)] (47,5 мг) и ди(трет-бутил) (2R)-2-{[{(1S)-1-[3-хлор-1-(3-метоксипропил)-1Н-индол-6-ил]этил}(циклопропил)амино]карбонил}пиперазин-1,4-дикарбоксилат [Ех(164-2)] (26,8 мг) в виде бесцветного масла.
МС (ХИАД), m/z: 636/638 [М+Н]+.
Пример 165
Ди(трет-бутил) (2R)-2-[(циклопропил{1-[1-(3-метоксипропил)-3,4-диметил-1Н-индазол-6-ил]этил}амино]карбонил}пиперазин-1,4-дикарбоксилат [Ех(165-1), Ех(165-2)]
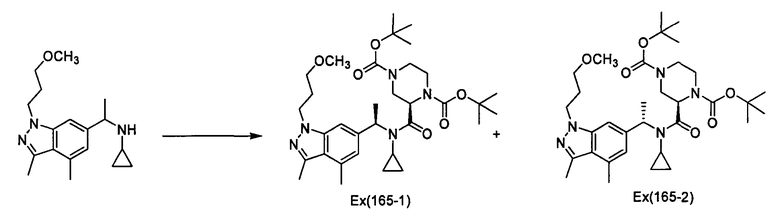
К раствору N-{1-[1-(3-метоксипропил)-3,4-диметил-1Н-индазол-6-ил]этил}циклопропанамин (137 мг) и пиперазинкарбоновой кислоты (180 мг) в дихлорметане (2,5 мл) прибавляют диизопропилэтиламин (0,20 мл) и хлорангидрид бис(2-оксо-3-оксазолидинил)фосфиновой кислоты (150 мг) при охлаждении льдом и смесь перемешивают при комнатной температуре в течение 15 часов. К реакционному раствору прибавляют воду при охлаждении льдом, и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором хлорида натрия, сушат над сульфатом магния, и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=2/1→1/1), получая ди(трет-бутил) (2R)-2-[(циклопропил{(1R)-1-[1-(3-метоксипропил)-3,4-диметил-1Н-индазол-6-ил]этил}амино]карбонил}пиперазин-1,4-дикарбоксилат [Ех(165-1)] (45,6 мг) и ди(трет-бутил) (2R)-2-[(циклопропил{(1S)-1-[1-(3-метоксипропил)-3,4-диметил-1Н-индазол-6-ил]этил}амино]карбонил}пиперазин-1,4-дикарбоксилат [Ех(165-2)] (53,8 мг) в виде бесцветного масла. МС (ХИАД), m/z: 614 [М+Н]+.
Пример 166
(трет-Бутил)-трет-бутил-2-[(циклопропил{1-[7-(3-метоксипропокси)-2,3-дигидро-1-бензофуран-5-ил]этил}амино)карбонил]морфолин-4-карбоксилат [Ех(166-1)]
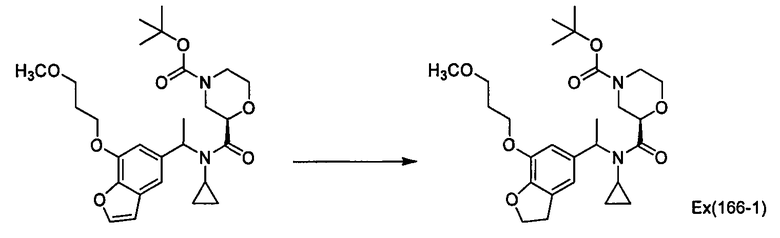
К раствору трет-бутил (2R)-2-[(циклопропил{1-[7-(3-метоксипропокси)-1-бензофуран-5-ил]этил}амино)карбонил]морфолин-4-карбоксилата (200 мг) в этаноле (5,0 мл) прибавляют 20% гидроксид палладия на угле (100 мг) и смесь перемешивают в атмосфере водорода в течение 5 часов. Нерастворимое вещество отфильтровывают и фильтрат затем концентрируют при пониженном давлении, получая трет-бутил трет-бутил-2-[(циклопропил{1-[7-(3-метоксипропокси)-2,3-дигидро-1-бензофуран-5-ил]этил}амино)карбонил]морфолин-4-карбоксилат [Ех(166-1)] (193 мг) в виде бесцветного масла. МС (ХИАД), m/z: 505 [M+H]+.
Пример 167
трет-Бутил-(2R)-1-{[[(1R)-5-бром-6-(3-метоксипропокси)-2,3-дигидро-1Н-инден-1-ил](циклопропил)амино)карбонил]морфолин-4-карбоксилат [Ех(167-1)]
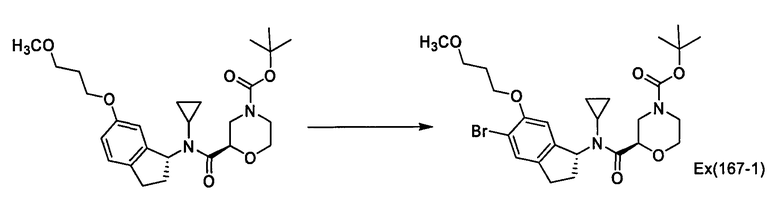
К суспензии N-бромсукцинимида (23,4 мг) в дихлорметане (0,5 мл) прибавляют по каплям раствор трет-бутил (2R)-2-({циклопропил[(1R)-6-(3-метоксипропокси)-2,3-дигидро-1Н-инден-1-ил]амино)карбонил]морфолин-4-карбоксилата (62,4 мг) в дихлорметане (1,5 мл) при охлаждении льдом и смесь перемешивают в течение 5 часов. Реакционный раствор концентрируют при пониженном давлении и полученный остаток растворяют в этилацетате, затем промывают последовательно 1-нормальным водным раствором гидрокарбоната натрия, насыщенным раствором хлорида натрия, сушат над сульфатом натрия и затем концентрируют при пониженном давлении, получая неочищенный продукт - трет-бутил (2R)-2-{[[(1R)-5-бром-6-(3-метоксипропокси)-2,3-дигидро-1Н-инден-1-ил](циклопропил)амино)карбонил]морфолин-4-карбоксилат [Ех(167-1)] (74 мг) в виде желтого масла. МС (ХИАД), m/z: 553/555 [M+H]+.
Пример 168
трет-Бутил-(2R)-2-[(циклопропил{(1R)-1-[4-(3-метоксипропил)хиназолин-2-ил]этил}амино)карбонил]морфолин-4-карбоксилат [Ех(168-1)]
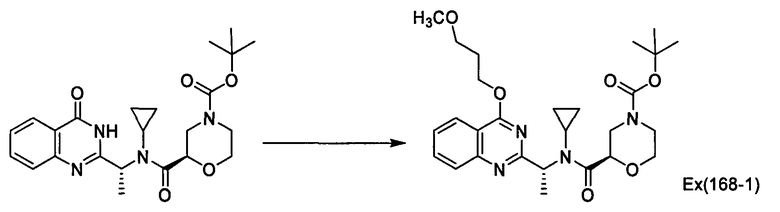
К раствору трет-бутил (2R)-2-({циклопропил[(1R)-1-(4-оксо-3,4-дигидрохиназолин-2-ил)этил]амино}карбонил)морфолин-4-карбоксилата (88 мг), 3-метокси-1-пропанола (36 мг) и трифенилфосфина (105 мг) в тетрагидрофуране (4 мл) прибавляют по каплям диизопропилазодикарбоксилат (84 мкл) при охлаждении льдом, и смесь перемешивают при комнатной температуре в течение 19 часов. Реакционный раствор концентрируют и полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=2/1→1/2), получая трет-бутил (2R)-2-[(циклопропил{(1R)-1-[4-(3-метоксипропил)хиназолин-2-ил]этил}амино)карбонил]морфолин-4-карбоксилат [Ех(168-1)] (38 мг) в виде бесцветного масла.
МС (ХИАД), m/z: 515 [M+H]+.
Пример 169
трет-Бутил (2R)-2-[(циклопропил{(1R)-1-[4-этокси-3-(3-метоксипропокси)фенил]этил}амино)карбонил]морфолин-4-карбоксилат [Ех(169-2)]
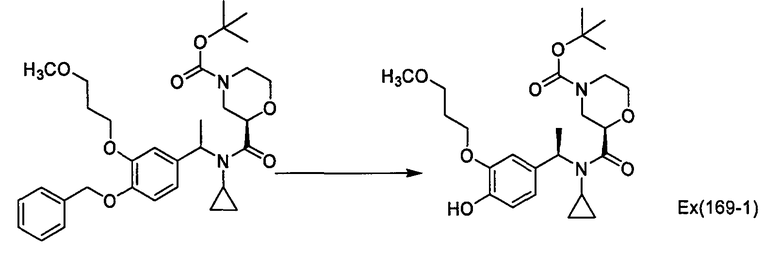
(1) К раствору трет-бутил (2R)-2-{[{1-[4-(бензилоху)-3-(3-метоксипропокси)фенил]этил}(циклопропил)амино]карбонил}морфолин-4-карбоксилата (1,45 г) в метаноле (12 мл) прибавляют 10% палладий на угле (200 мг) и смесь перемешивают в атмосфере водорода в течение 2 часов. Нерастворимое вещество отфильтровывают и фильтрат затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=2/1→1/2), получая трет-бутил (2R)-2-[(циклопропил{(1R)-1-[4-гидрокси-3-(3-метоксипропокси)фенил]этил}амино)карбонил]морфолин-4-карбоксилат [Ех(169-1)] (913 мг) в виде бесцветного масла.
(2) Соединение, указанное в заголовке [Ех(169-2)]

К раствору 100 мг соединения, полученного на стадии (1), описанной выше, в ацетонитриле (1,0 мл) прибавляют карбонат калия (34,7 мг) и йодэтан (35,8 мг), смесь нагревают и кипятят с обратным холодильником в течение 20 часов. Реакционный раствор охлаждают до комнатной температуры и затем разбавляют этилацетатом. Нерастворимое вещество отфильтровывают и фильтрат затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на NH-силикагеле (элюент: н-гексан/этилацетат=10/1→2/1), получая трет-бутил (2R)-2-[(циклопропил{(1R)-1-[4-этокси-3-(3-метоксипропокси)фенил]этил}амино)карбонил]морфолин-4-карбоксилат [Ех(169-2)] (60 мг) в виде бесцветного масла.
МС (ХИАД), m/z: 507 [М+Н]+.
Пример 170
Метил {3-[3-(1-{циклопропил[(2R)-морфолин-2-илкарбонил]амино}этил)-1Н-индазол-1-ил]пропил}карбамат [Ех(170-2)]
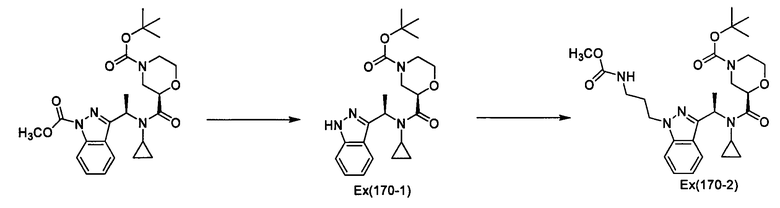
(1) К раствору метил 3-{1-[{[(2R)-4-(трет-бутоксикарбонил)морфолин-2-ил]карбонил}(циклопропил)амино]этил}-1Н-индазол-1-карбоксилата (695 мг) в метаноле (10 мл) прибавляют карбонат калия (407 мг) и смесь перемешивают при комнатной температуре в течение 30 минут. Реакционный раствор концентрируют, затем прибавляют этилацетат и смесь промывают насыщенным водным раствором хлорида натрия. Органический слой сушат над сульфатом магния и затем концентрируют при пониженном давлении, получая трет-бутил (2R)-2-({циклопропил[1-(1-{3-[(метоксикарбонил)амино]пропил}-1Н-индазол-3-ил)этил]амино}карбонил)морфолин-4-карбоксилат [Ех(170-1)] (577 мг) в виде бесцветного порошка.
МС (ХИАД), m/z: 415 [M+H]+.
(2) К раствору соединения, полученного на стадии (1) (90 мг), и метил (3-бромпропил)карбамата (64 мг) в N,N-диметилформамиде (2 мл) прибавляют карбонат калия (60 мг) и смесь перемешивают при комнатной температуре в течение 18 часов. К реакционному раствору прибавляют этилацетат и смесь промывают насыщенным водным раствором хлорида натрия, сушат над сульфатом магния и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=1/20→1/1), получая метил {3-[3-(1-{циклопропил[(2R)-морфолин-2-илкарбонил]амино}этил)-1Н-индазол-1-ил]пропил}карбамат [Ех(170-2)] (74 мг) в виде желтого масла.
Примеры 171-267
Описанные далее N-защищенные азотсодержащие насыщенные гетероциклические соединения и т.п. получают аналогично соединениям, приведенным в примерах 161-169. Каждое обозначение способов получения от А до С относится к каждому способу в соответствии с его описанием в примерах.
Способ А: - Примеры 161-163
Способ В: - Пример 164
Способ C: - Пример 165
Способ D: - Пример 166
Способ Е: - Пример 167
Способ F: - Пример 168
Способ G: - Пример 169

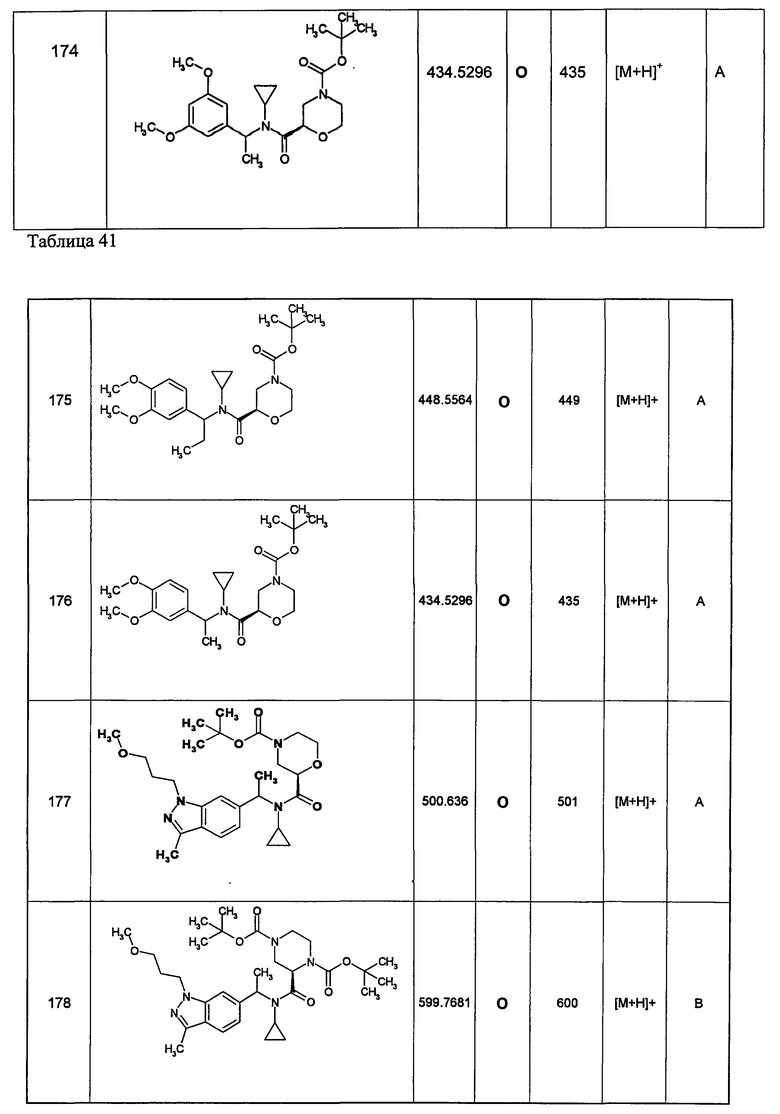
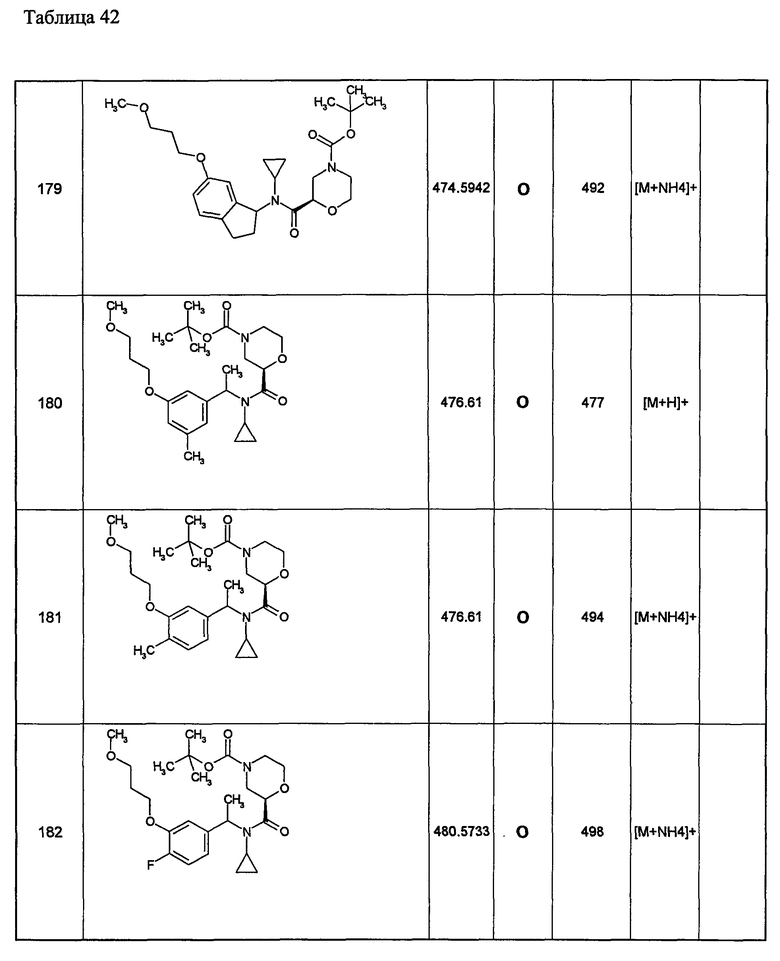
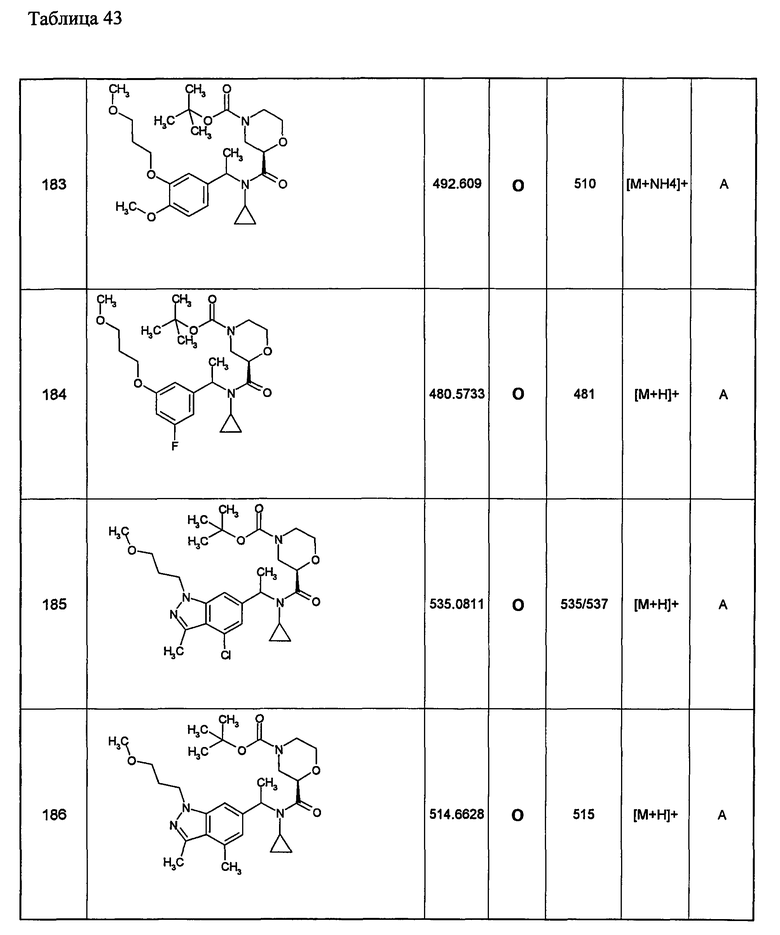
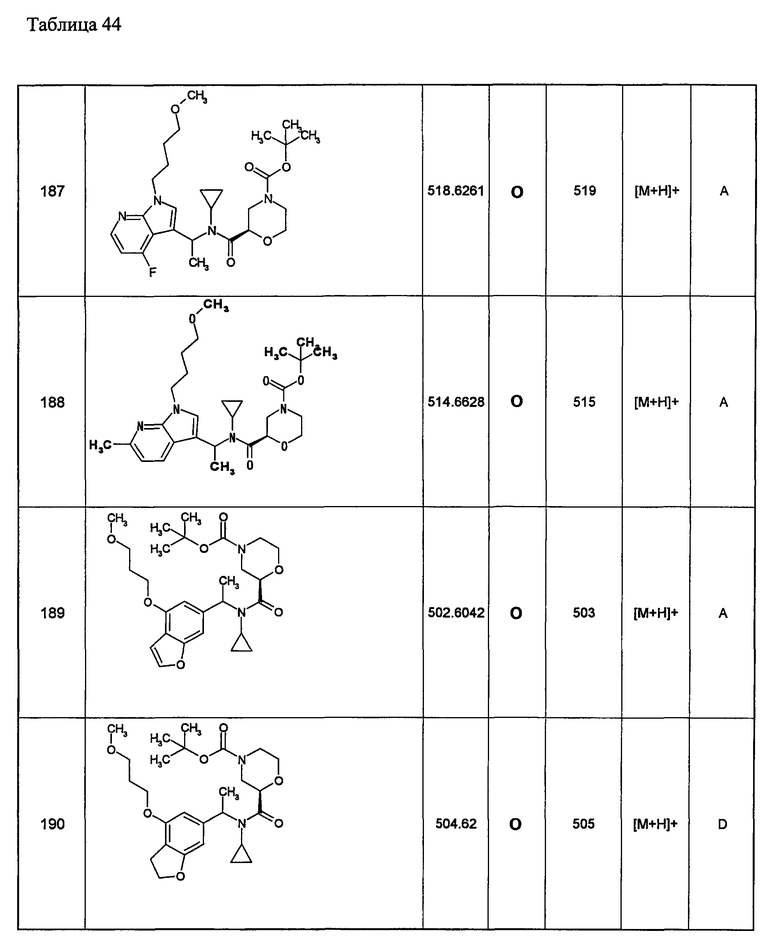
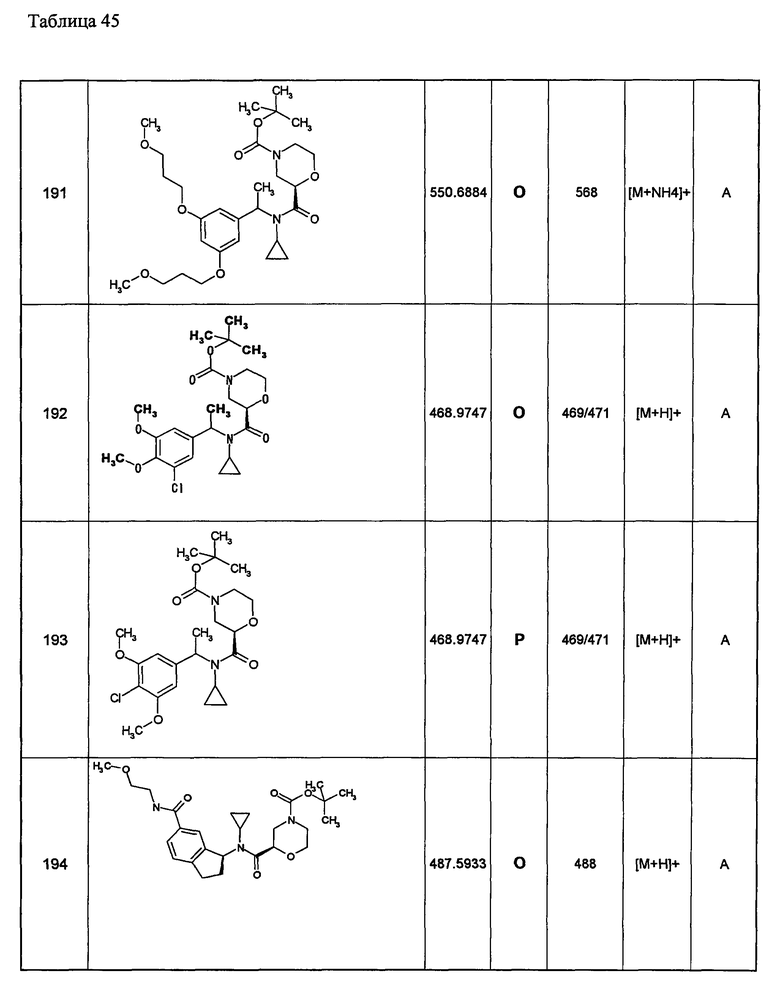
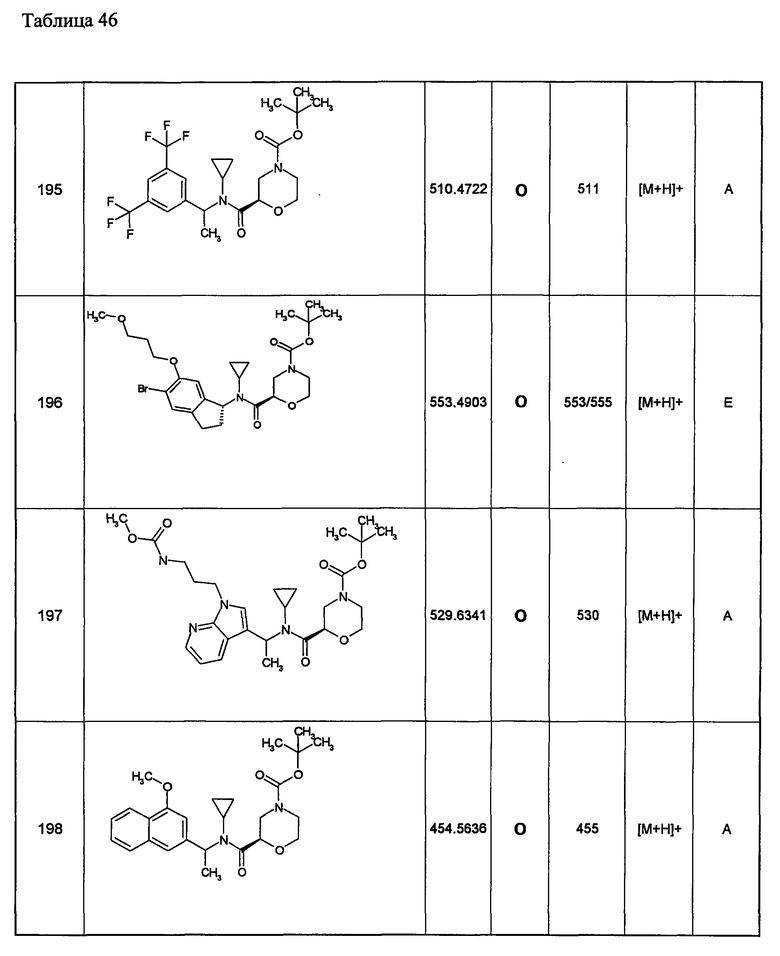
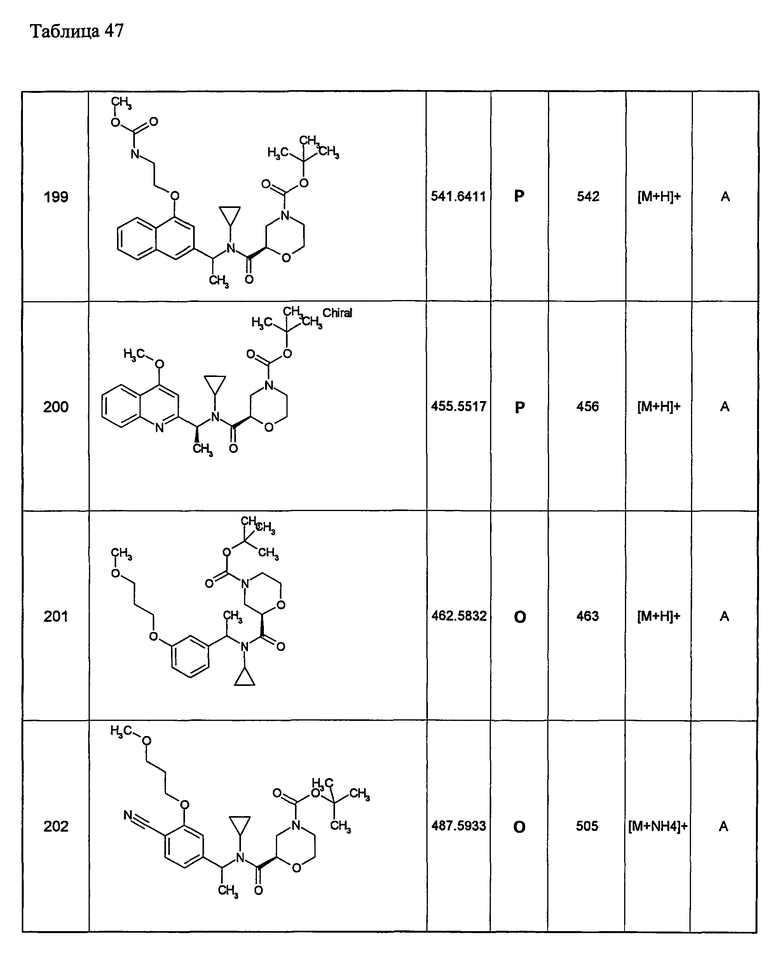
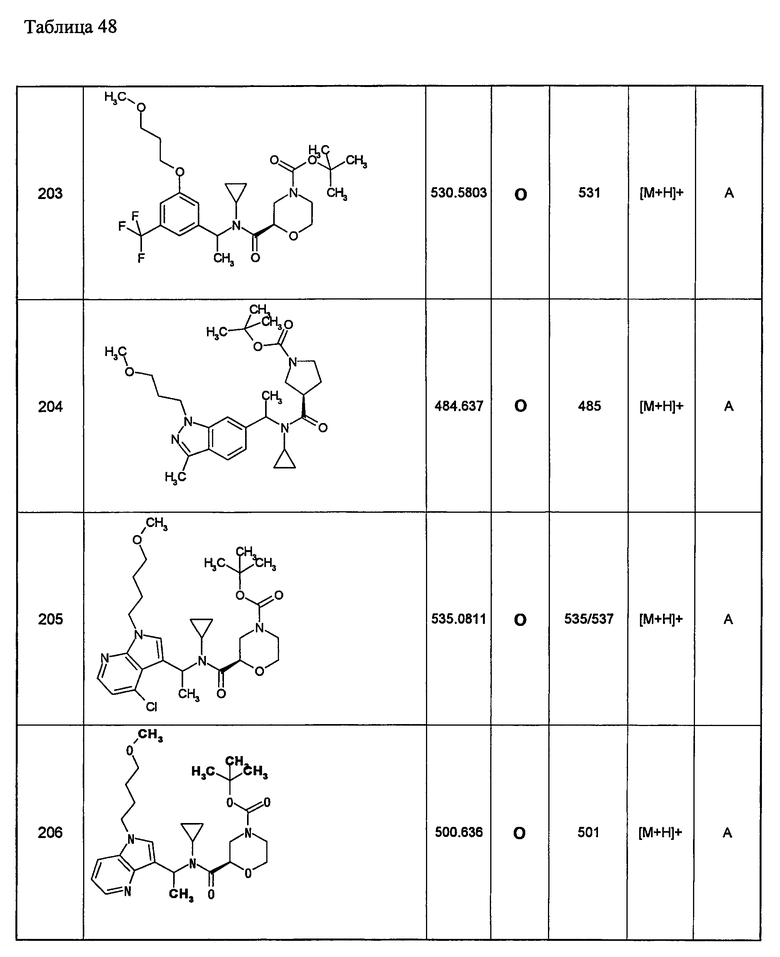

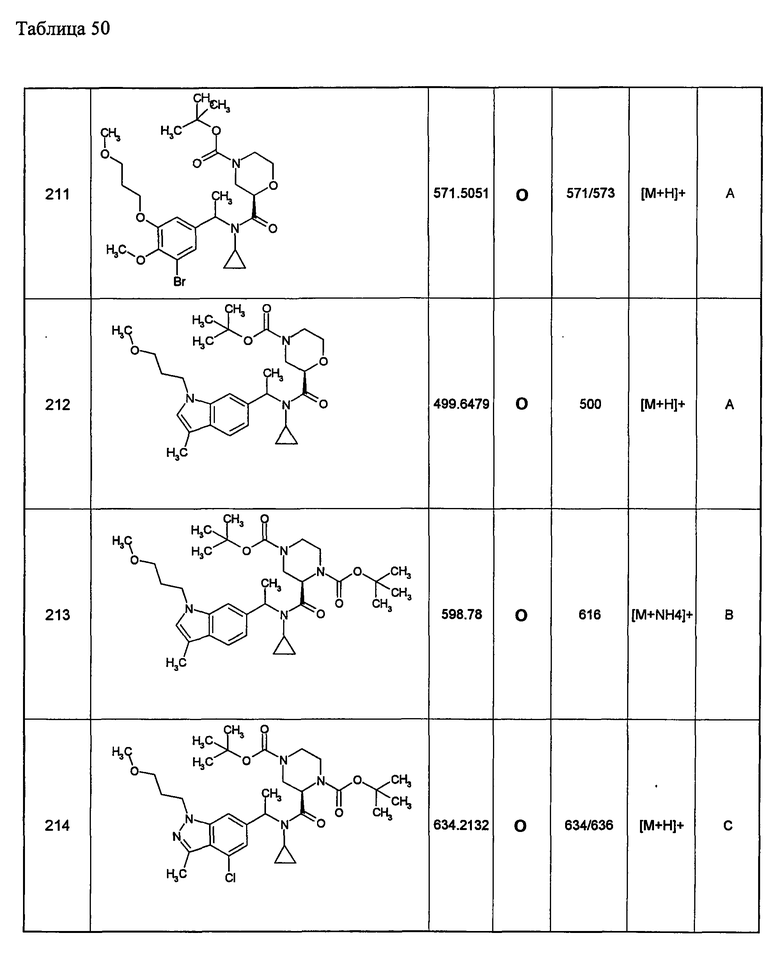
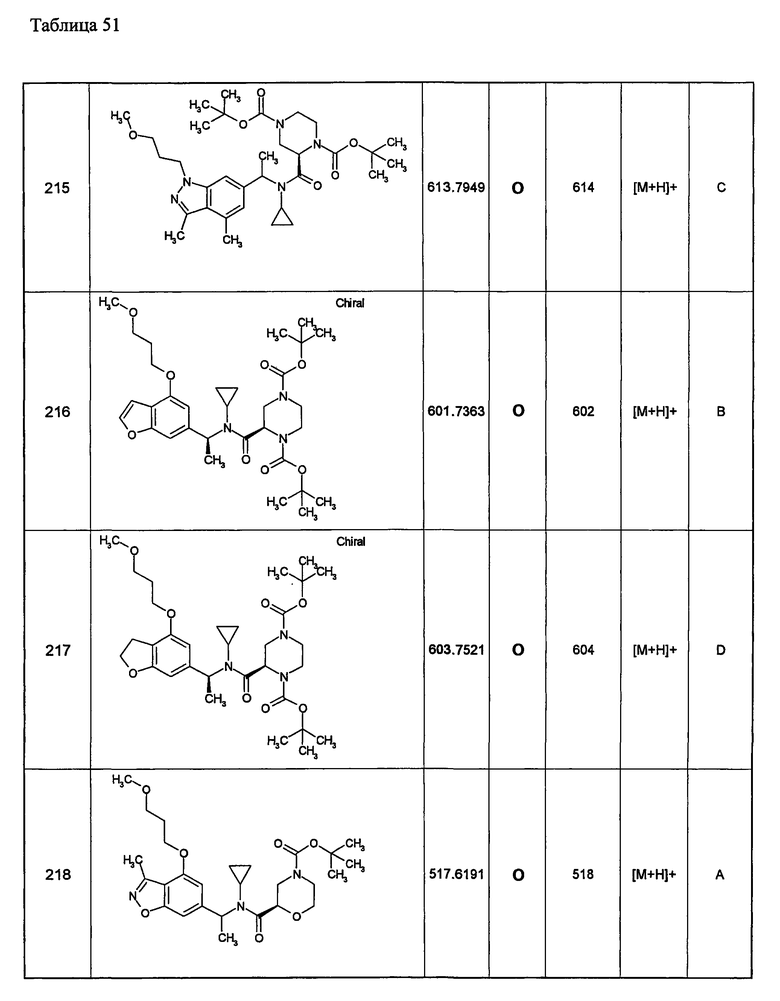
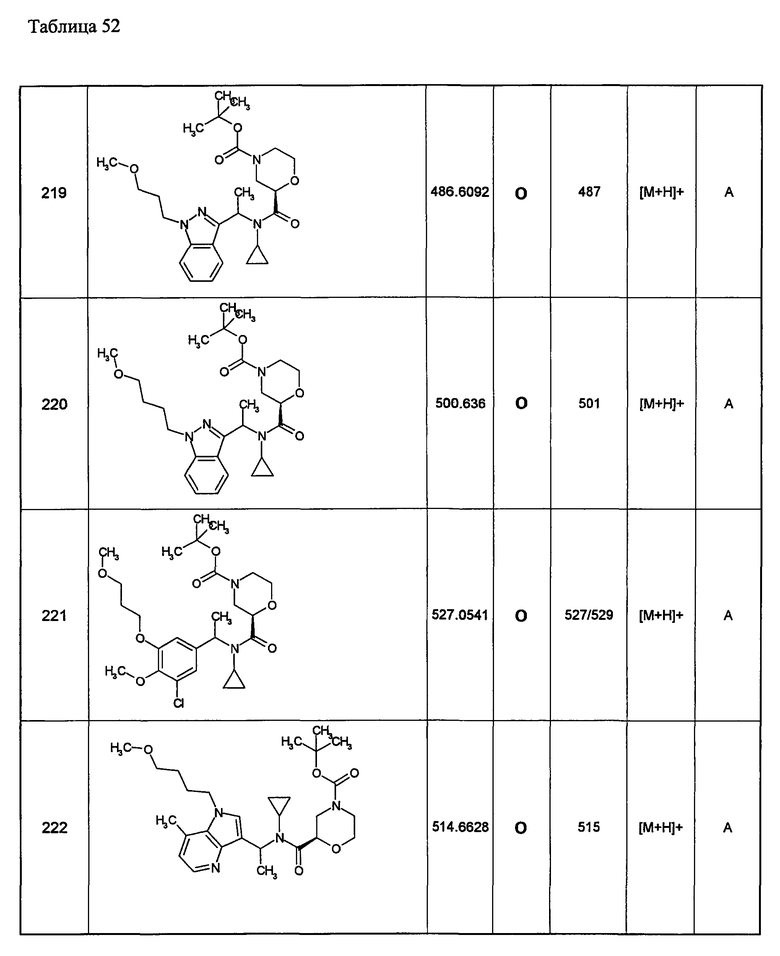
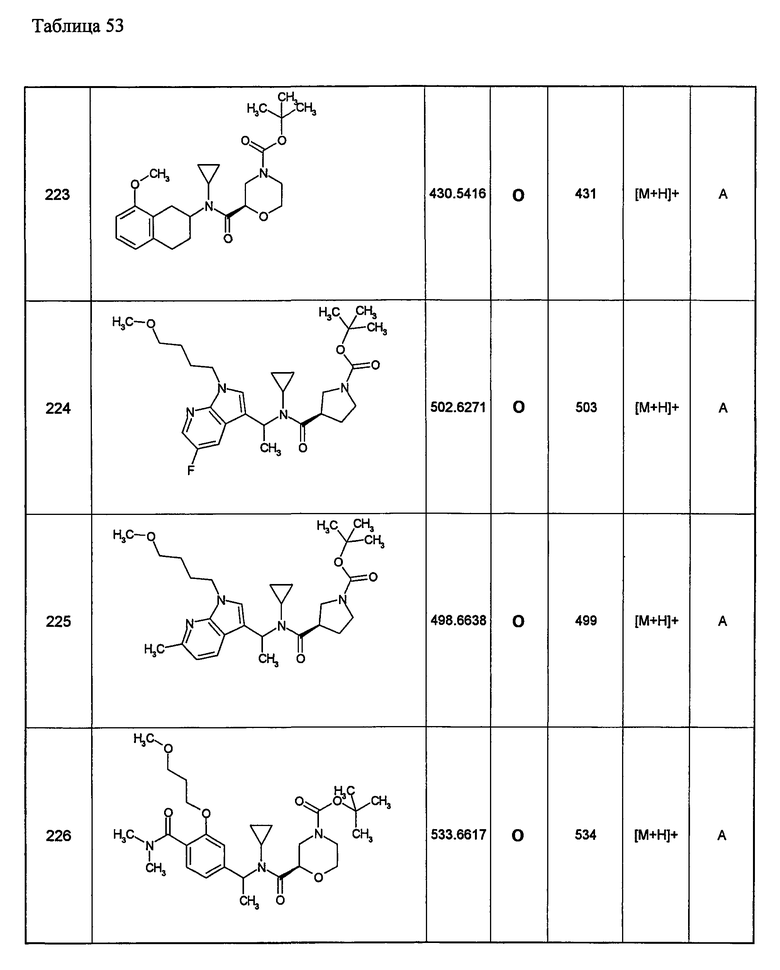
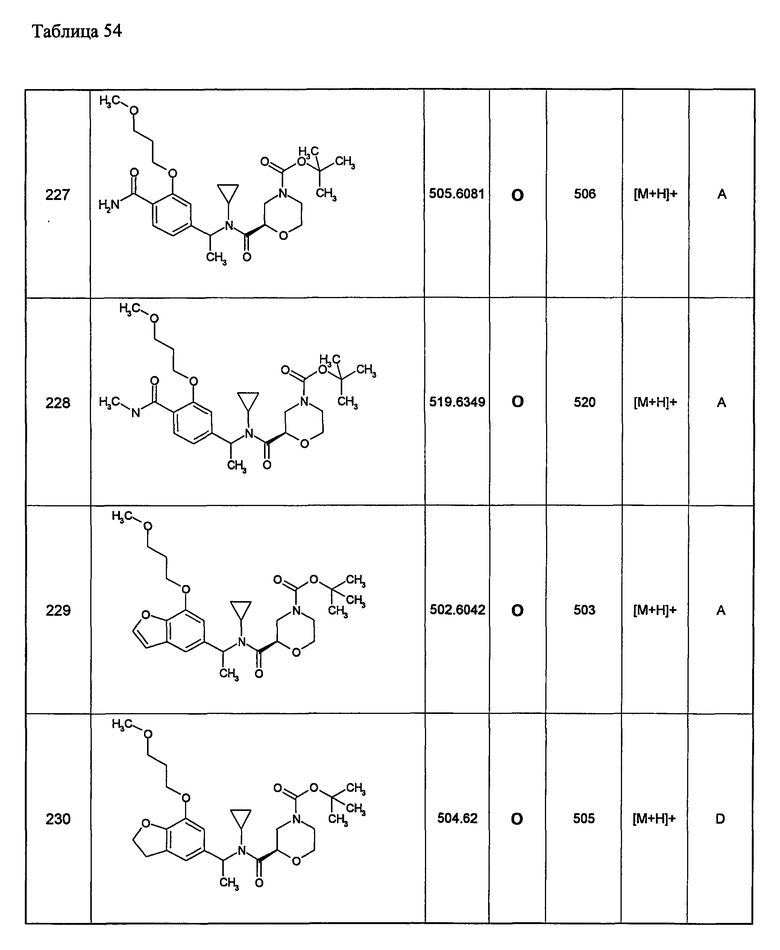
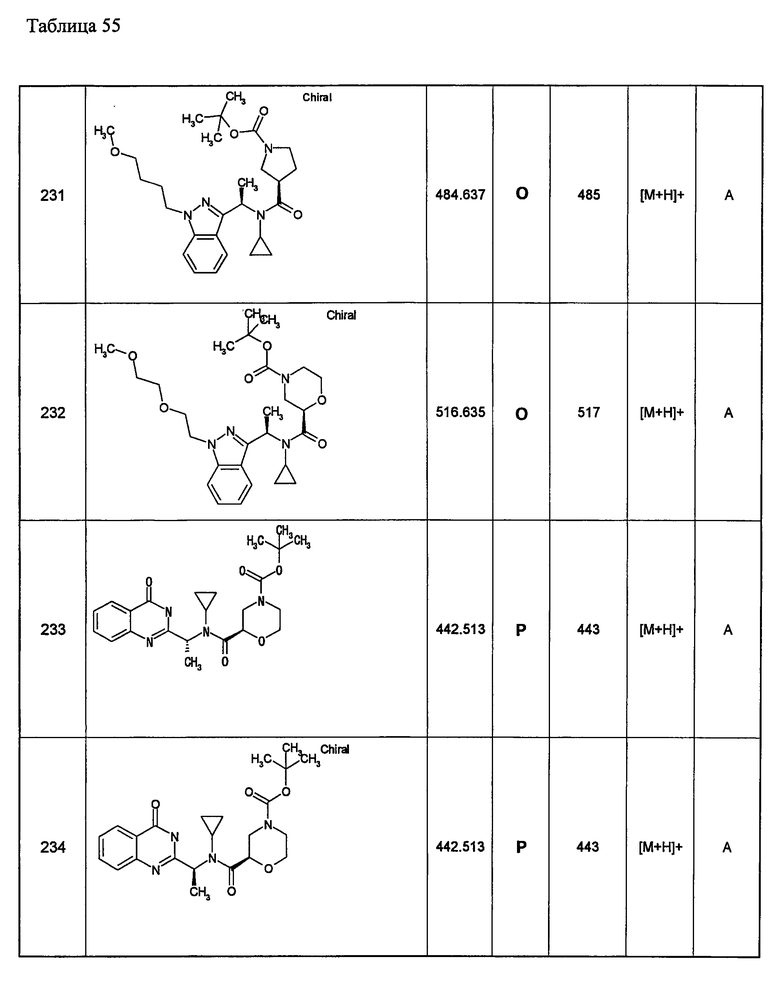
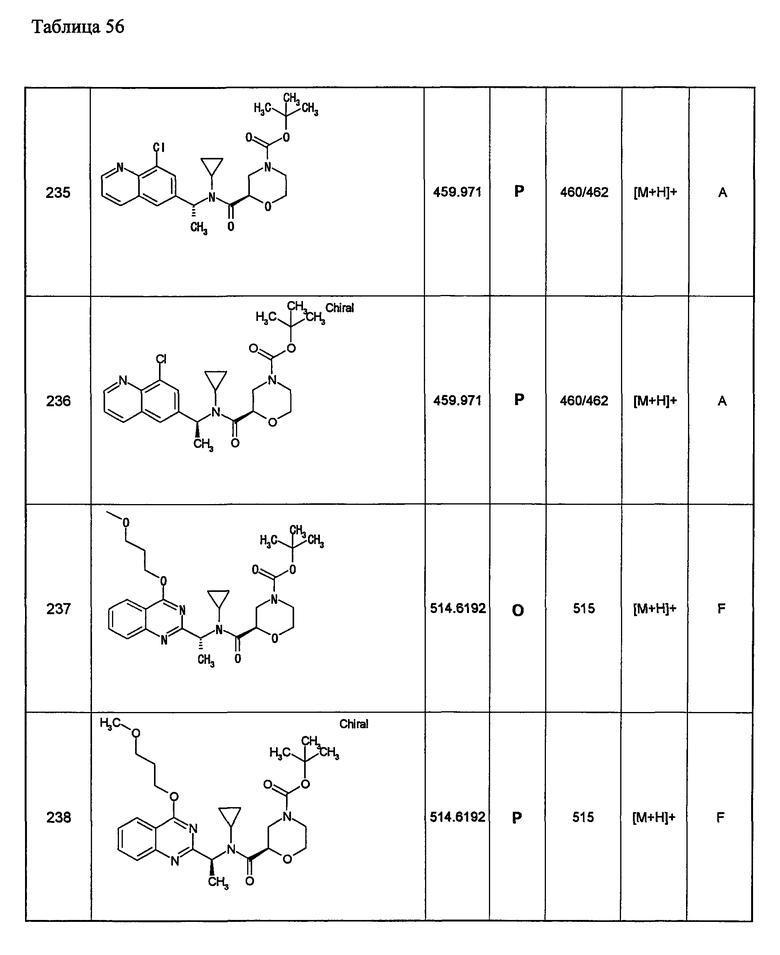
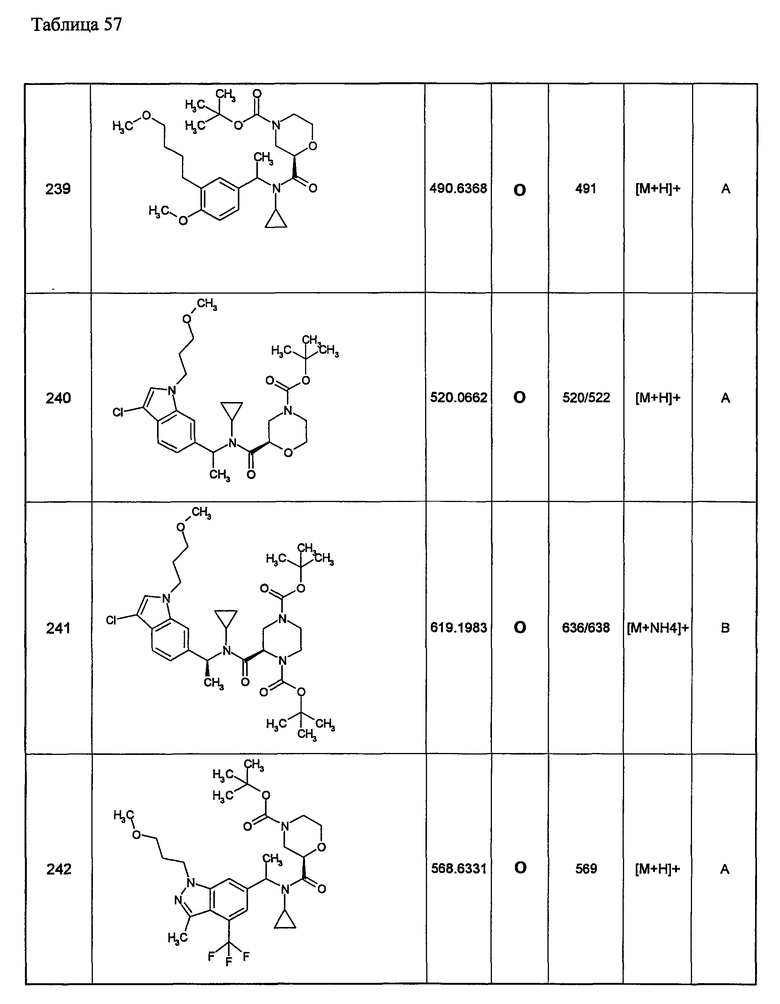

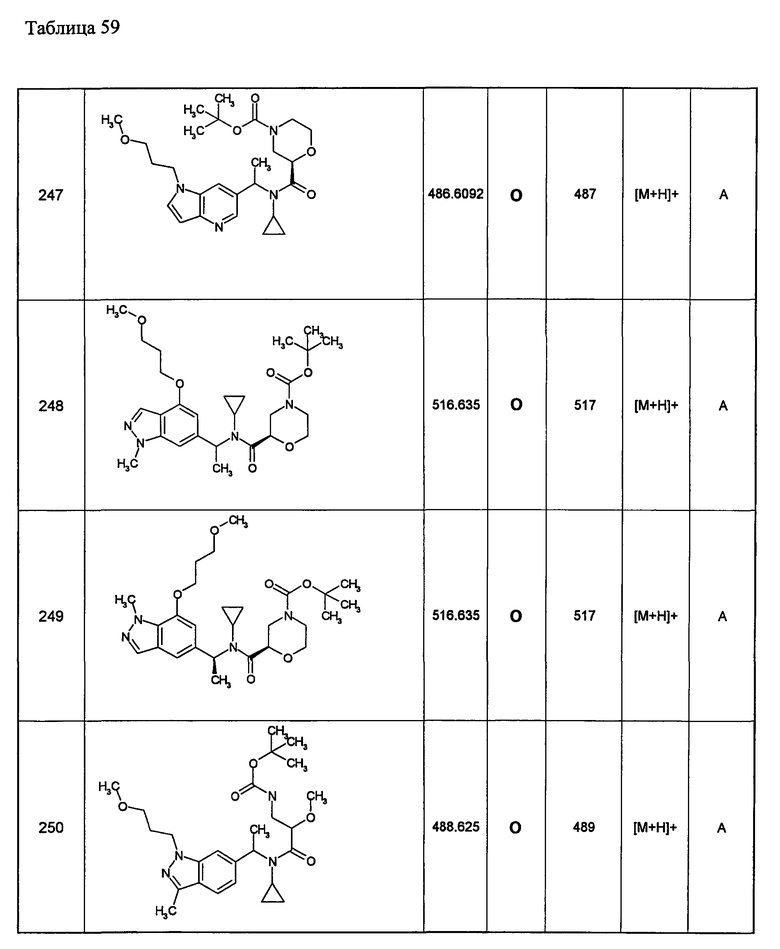
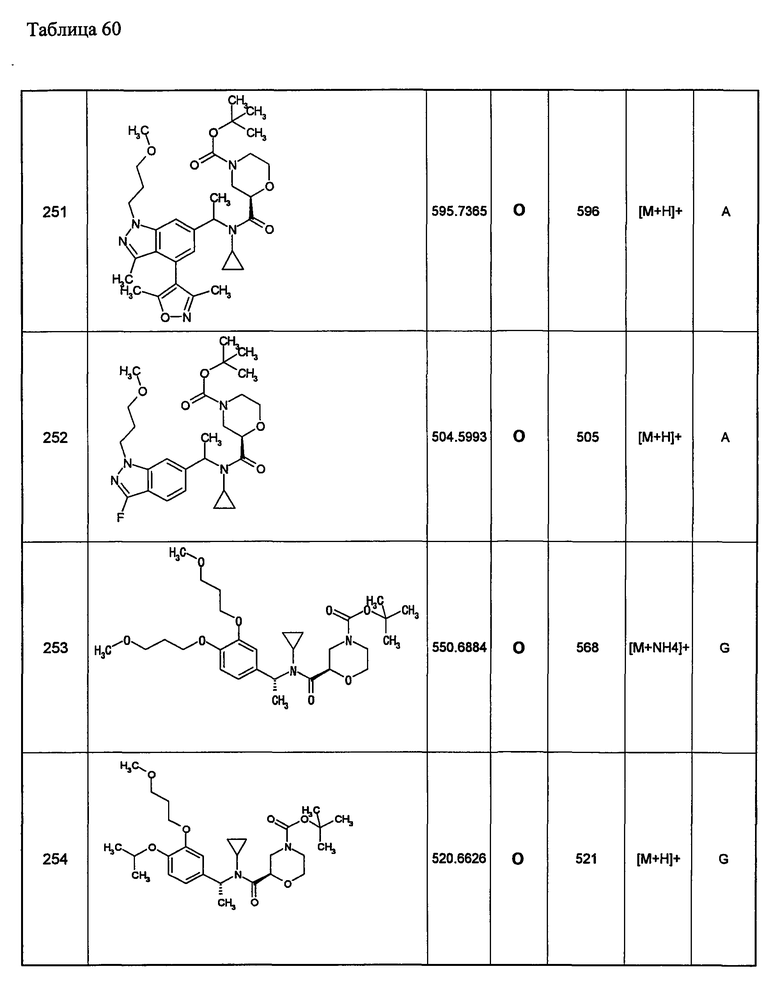

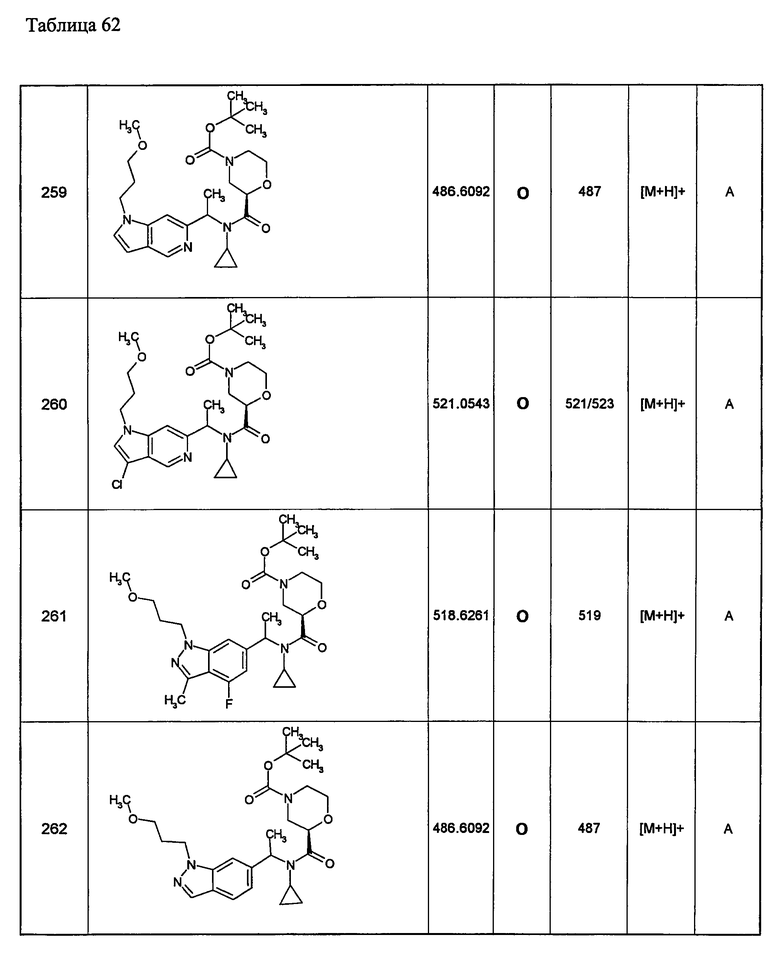
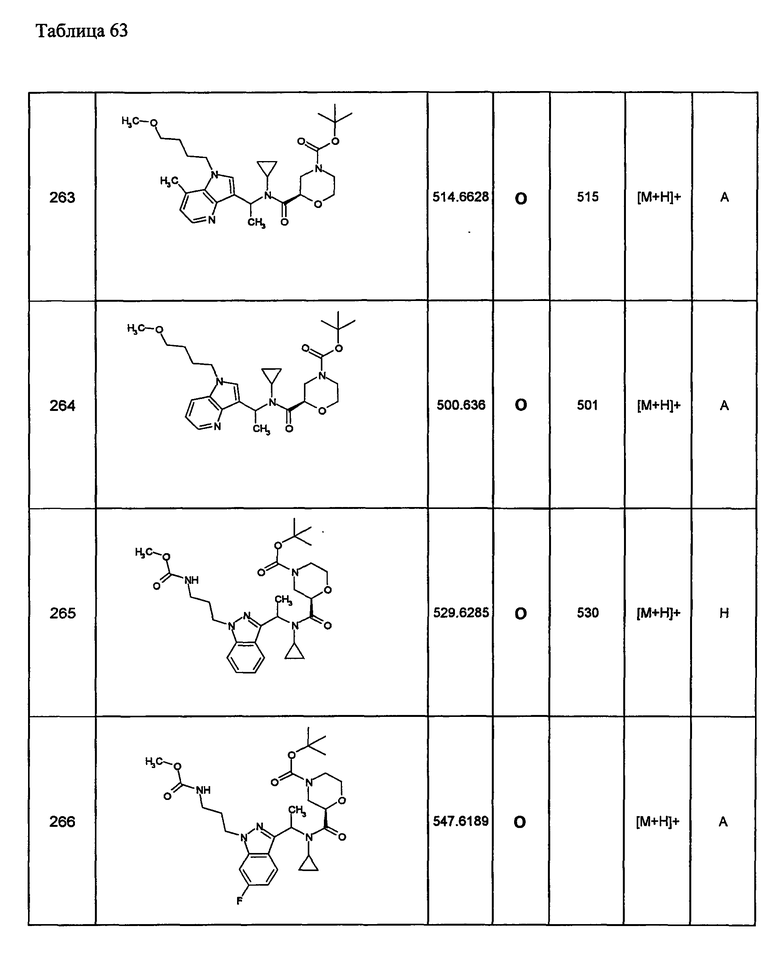
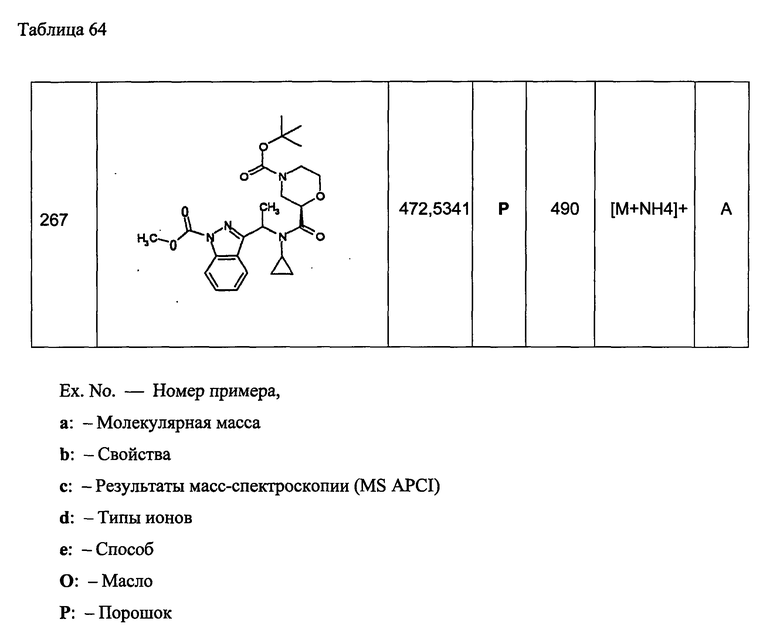
Примеры 268-287
Указанные далее азотсодержащие насыщенные гетероциклические соединения и т.п. получают способами, аналогичными описанным в примерах 1-5. Каждое обозначение способа от А до С относится к каждому из способов в соответствии с их использованием в примерах.
Способ А: - Примеры 1, 2
Способ В: - Примеры 3, 4
Способ С: - Пример 5А
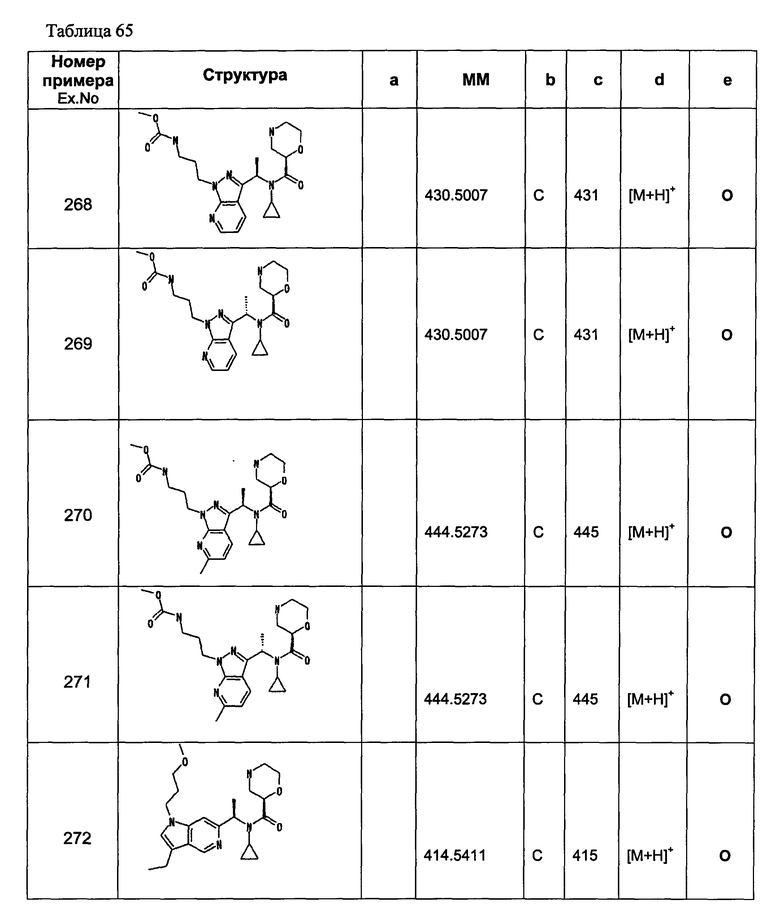
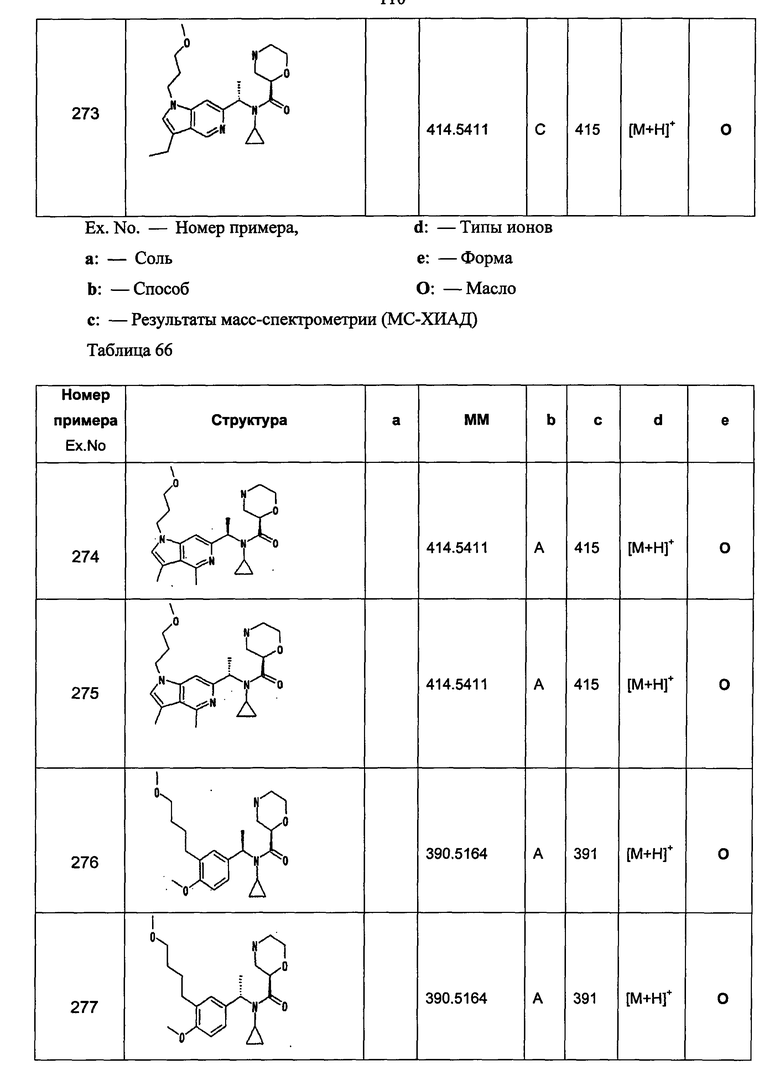
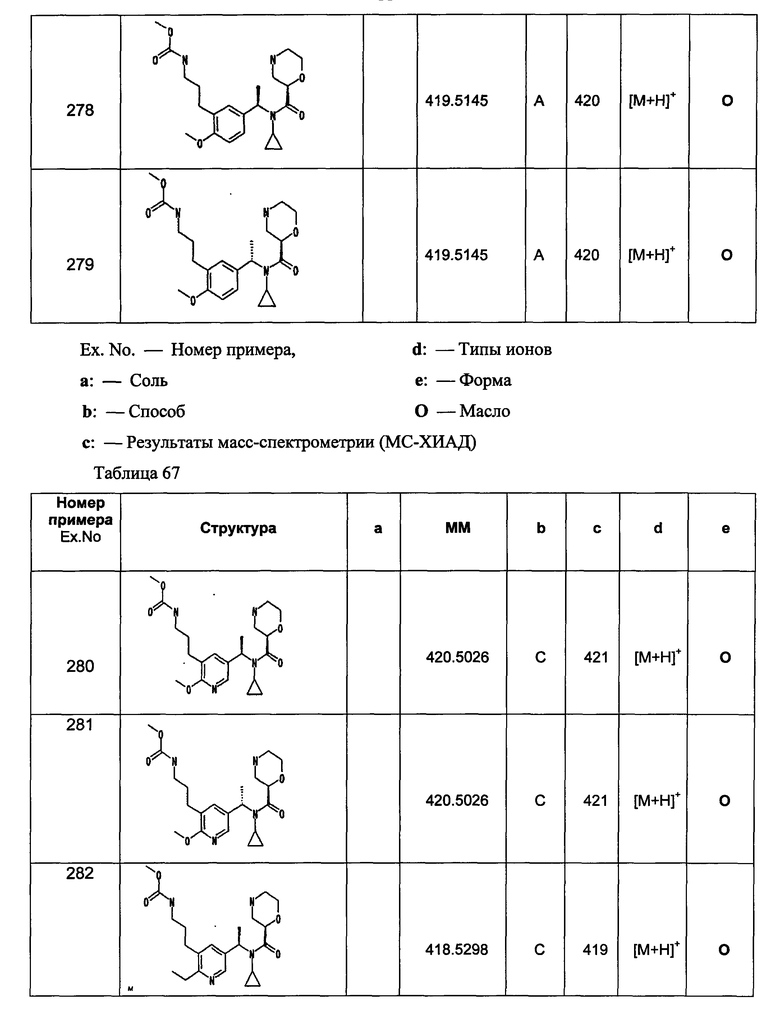
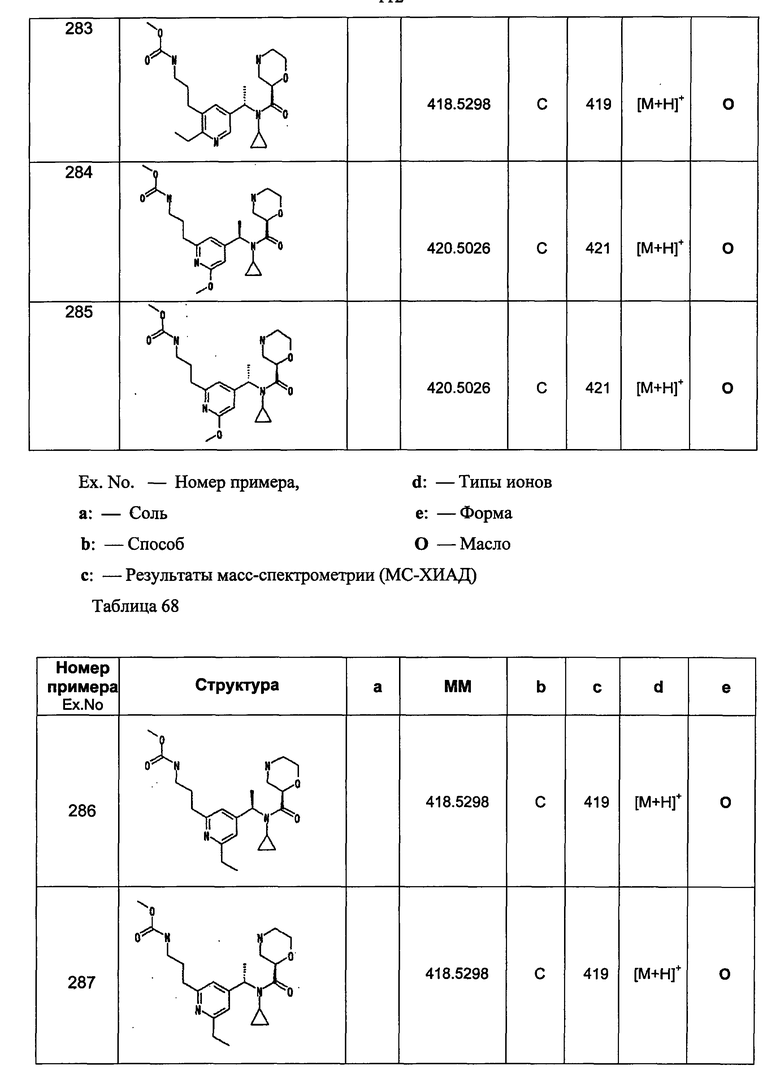

Примеры 288-294
Указанные далее N-защищенные азотсодержащие насыщенные гетероциклические соединения получают способами, аналогичными описанным выше в примерах 161-163 (Способ А).
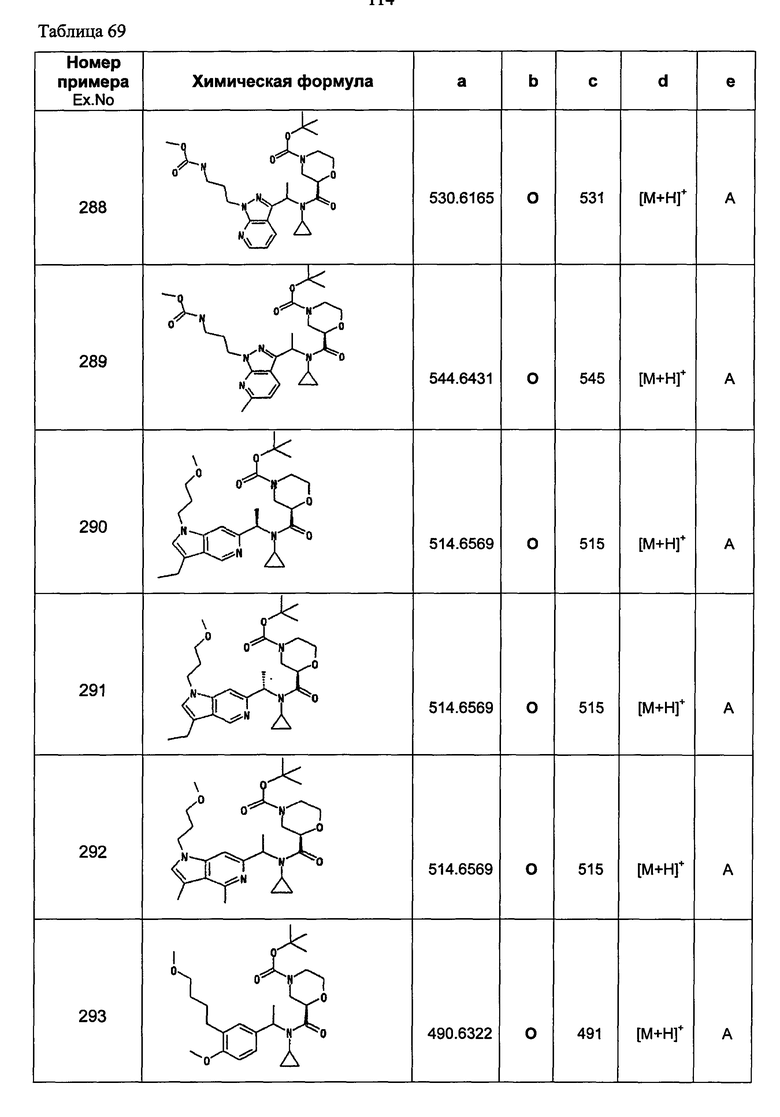
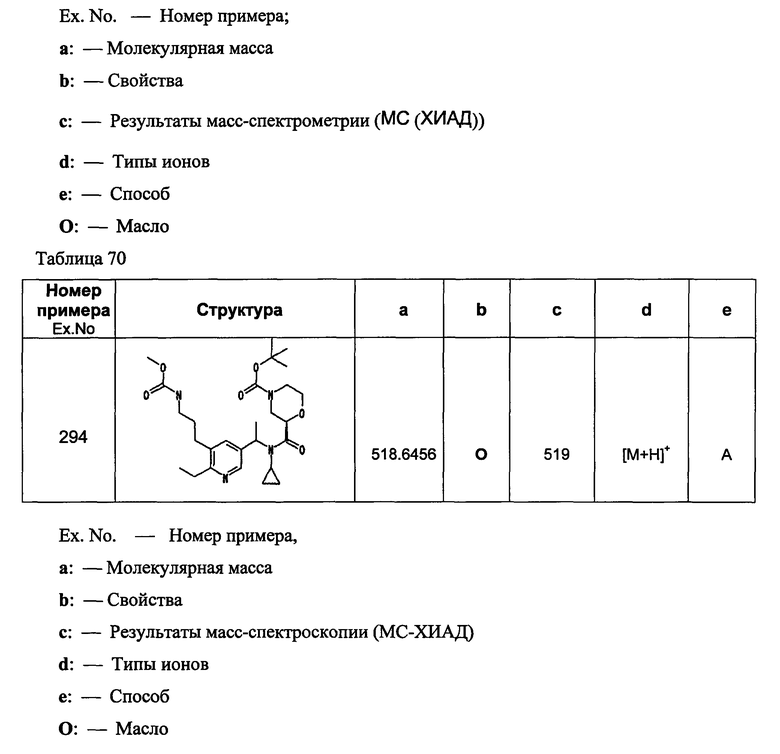
Пример 295

1) К раствору 1-(3-йод-4-метоксифенил)этанона (10 г) в диэтиламине (181 мл) прибавляют бензилпроп-2-ин-1-илкарбамат (8,2 г), дихлорбис(трифенилфосфин)палладий(II) (2,54 г) и йодид меди(I) (689 мг) и смесь перемешивают при 50°С в течение 2 часов. Реакционный раствор охлаждают, затем к нему прибавляют воду и смесь экстрагируют хлороформом. Органический слой промывают последовательно 2-нормальной соляной кислотой, водой, затем сушат над сульфатом магния и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: хлороформ→хлороформ/этилацетат=1/1), получая бензил[3-(5-ацетил-2-метоксифенил)проп-2-ин-1-ил]карбамат [Ех(295-1)] (5,3 г) в виде твердого красного вещества.
МС (ХИАД), m/z: 355 [M+NH4]+.
2) Бензил [3-(5-ацетил-2-метоксифенил)проп-2-ин-1-ил]карбамат и циклопропиламин подвергают обработке, аналогичной описанной в ссылочном примере 6(6), получая бензил (3-{5-[1-(циклопропиламино)этил]-2-метоксифенил}проп-2-ин-1-ил)карбамат [Ех(295-2)] в виде желтого масла.
МС (ХИАД), m/z: 379[M+H]+.
3} Бензил (3-{5-[1-(циклопропиламино)этил]-2-метоксифенил}проп-2-ин-1-ил)карбамат и (2R)-4-(трет-бутоксикарбонил)морфолин-2-карбоновую кислоту подвергают обработке, аналогичной описанной в примере 162, получая трет-бутил-(2R)-2-{[{1-[3-(3-{[(бензилоху)карбонил]амино}проп-1-ин-1-ил)-4-метоксифенил]этил}(циклопропил)амино]карбонил}морфолин-4-карбоксилат [Ех(295-3)] в виде бесцветного твердого вещества.
МС (ХИАД), m/z: 609 [M+NH4]+.
4} К раствору трет-бутил-(2R)-2-{[{1-[3-(3-{[(бензилоху)карбонил]амино}проп-1-ин-1-ил)-4-метоксифенил]этил}(циклопропил)амино]карбонил}морфолин-4-карбоксилата (2,82 г) в метаноле (25 мл) прибавляют 10% палладий на угле (282 мг) и смесь перемешивают в атмосфере водорода в течение 7 часов. Нерастворимое вещество отфильтровывают и затем фильтрат концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на NH-силикагеле (элюент: хлороформ-»хлороформ/метанол=33/1), получая трет-бутил (2R)-2-{[{1-[3-(3-аминопропил)-4-метоксифенил]этил}(циклопропил)амино]карбонил}морфолин-4-карбоксилат [Ех(295-4)] (1,49 г) в виде бесцветного масла.
МС (ХИАД), m/z: 462 [М+Н]+.
5} трет-Бутил-(2R)-2-{[{1-[3-(3-аминопропил)-4-метоксифенил]этил}(циклопропил)амино]карбонил}морфолин-4-карбоксилат и метилхлорформиат подвергают обработке, аналогичной описанной в ссылочном примере примере 28(5), получая трет-бутил (2R)-2-({циклопропил[1-(4-метокси-3-{3-[(метоксикарбонил)амино]пропил}фенил)этил]амино}карбонил)морфолин-4-карбоксилат [Ех(295-5)] в виде бесцветного масла.
МС (ХИАД), m/z: 504 [M+H]+.
Пример 296
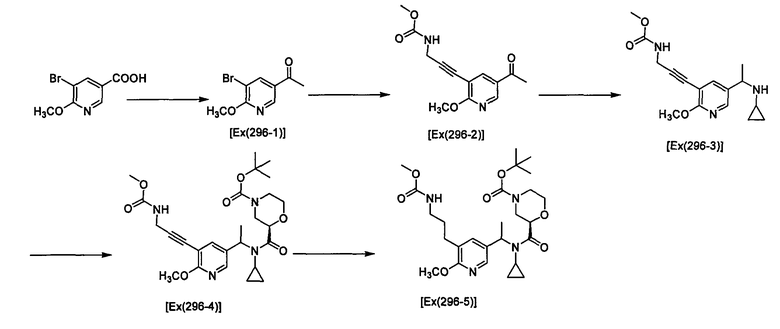
1} 5-Бром-6-метоксиникотиновую кислоту и гидрохлорид N,O-диметилгидроксиламина подвергают обработке, аналогичной описанной в ссылочном примере 7(5), затем полученное соединение и метилмагнийбромид обрабатывают аналогично ссылочному примеру 7(6), получая 1-(5-бром-6-метоксипиридин-3-ил)этанон [Ех(296-1)] в виде бесцветного порошка.
МС (ХИАД), m/z: 230/232 [M+H]+.
2} Бис(бензонитрил)дихлорпалладий(II) (12 мг) и йодид меди(I) (3,8 мг) прибавляют к 1,4-диоксану (1 мл) в атмосфере аргона и затем прибавляют 10% раствор три-трет-бутилфосфина в гексане (179 мкл), диизопропиламин (168 мкл), 1-(5-бром-6-метоксипиридин-3-ил)этанон (230 мг) и раствор метилпроп-2-ин-1-илкарбамата (149 мг) в 1,4-диоксане (1 мл). Смесь перемешивают при комнатной температуре в течение 5 часов. Реакционный раствор концентрируют при пониженном давлении, полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=3/1→1/3), получая метил [3-(5-ацетил-2-метоксипиридин-3-ил)проп-2-ин-1-ил]карбамат [Ех(296-2)] (188 мг) в виде светло-желтого порошка.
МС (ХИАД), m/z 263 [M+H]+.
3) Метил[3-(5-ацетил-2-метоксипиридин-3-ил)проп-2-ин-1-ил]карбамат и циклопропиламин подвергают обработке, аналогичной описанной в ссылочном примере 6(6), получая метил (3-{5-[1-(циклопропиламино)этил]-2-метоксипиридин-3-ил}проп-2-ин-1-ил)карбамат [Ех(296-3)] в виде бесцветного масла.
МС (ХИАД), m/z: 304 [M+H]+.
4) Метил (3-{5-[1-(циклопропиламино)этил]-2-метоксипиридин-3-ил}проп-2-ин-1-ил)карбамат и (2R)-4-(трет-бутоксикарбонил)морфолин-2-карбоновую кислоту подвергают обработке, аналогичной описанной в примере 162, получая трет-бутил (2R)-2-({циклопропил[1-(6-метокси-5- {3-[(метоксикарбонил)амино]проп-1-ин-1-ил}пиридин-3-ил)этил]амино}карбонил)морфолин-4-карбоксилат [Ex(296-4)] в виде бесцветного масла.
МС (ХИАД), m/z: 517 [M+Н]+.
5) К раствору трет-бутил-(2R)-2-({циклопропил[1-(6-метокси-5-{3-[(метоксикарбонил)амино]проп-1-ин-1-ил}пиридин-3-ил)этил]амино}карбонил)морфолин-4-карбоксилата (150 мг) в смеси этилацетат-тетрагидрофуран (по 2,5 мл) прибавляют 10% палладий на угле (30 мг) и смесь перемешивают в атмосфере водорода в течение 45 минут. Нерастворимое вещество отфильтровывают, затем фильтрат концентрируют при пониженном давлении, полученный остаток очищают колоночной хроматографией на NH-силикагеле (элюент: этилацетат), получая трет-бутил (2R)-2-({циклопропил[1-(6-метокси-5-{3-[(метоксикарбонил)амино]пропил}пиридин-3-ил)этил]амино}карбонил)морфолин-4-карбоксилат [Ех(296-5)] (159 мг) в виде бесцветного масла.
МС (ХИАД), m/z: 521 [М+Н]+.
Пример 297
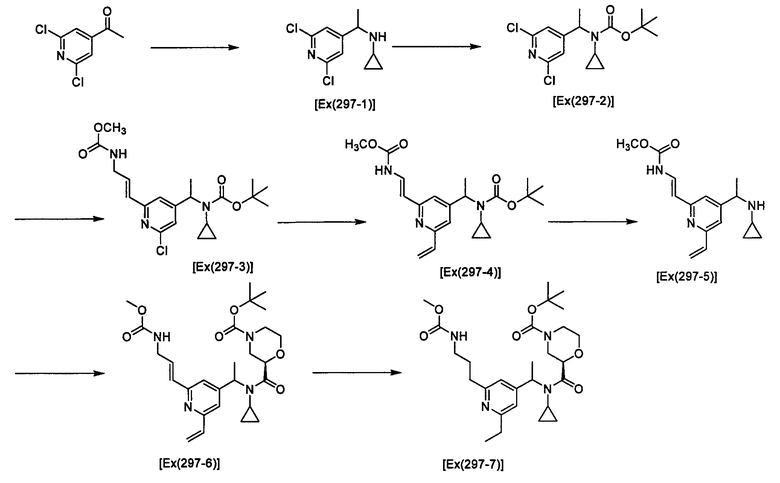
1) 1-(2,6-Дихлорпиридин-4-ил)этанон подвергают обработке, аналогичной описанной в ссылочном примере 6(6), получая N-[1-(2,6-дихлорпиридин-4-ил)этил]циклопропиламин [Ех(297-1)] в виде светло-желтого масла.
МС (ХИАД), m/z: 231/233 [М+Н]+.
2) К раствору N-[1-(2,6-дихлорпиридин-4-ил)этил]циклопропиламина (430 мг) в тетрагидрофуране (5 мл) прибавляют ди-трет-бутилдикарбонат (487 мг) и триэтиламин (518 мкл) и смесь нагревают и кипятят с обратным холодильником в течение 24 часов. Реакционный раствор охлаждают, затем к нему прибавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором хлорида натрия, сушат над сульфатом натрия и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=10/1→4/1), получая трет-бутилциклопропил [1-(2,6-дихлорпиридин-4-ил)этил]карбамат [Ех(297-2)] (420 мг) в виде светло-желтого масла.
МС (ХИАД), m/z: 331/333 [М+Н]+.
3) К раствору трет-бутилциклопропил [1-(2,6-дихлорпиридин-4-ил)этил]карбамата (155 мг) в диметоксиэтане (4 мл) прибавляют метил [(2Е)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборан-2-ил)проп-2-ен-1-ил]карбамат (113 мг), 2М раствор карбоната калия (257 мкл) и тетракис(трифенилфосфин)палладий(0) (27 мг), смесь нагревают и кипятят с обратным холодильником в течение 3 часов. Реакционный раствор охлаждают, затем к нему прибавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором хлорида натрия, сушат над сульфатом магния и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=3/1→этилацетат), получая метил [(2Е)-3-(4-{1-[(трет-бутоксикарбонил)(циклопропил)амино]этил}-6-хлорпиридин-2-ил)проп-2-ен-1-ил]карбамат [Ех(297-3)] (98 мг) в виде светло-желтого масла.
МС (ХИАД), m/z: 410/412 [M+H]+.
4) Метил [(2Е)-3-(4-{1-[(трет-бутоксикарбонил)(циклопропил)амино]этил}-6-хлорпиридин-2-ил)проп-2-ен-1-ил]карбамат и сложный эфир винилбороновой кислоты и пинакола обрабатывают аналогично ссылочному примеру 113(6), получая метил [(Е)-2-(4-{1-[(трет-бутоксикарбонил)(циклопропил)амино]этил}-6-винилпиридин-2-ил)винил]карбамат [Ех(297-4)] в виде желтого масла.
МС (ХИАД), m/z: 402[М+Н]+.
5) Метил [(Е)-2-(4-{1-[(трет-бутоксикарбонил)(циклопропил)амино]этил}-6-винилпиридин-2-ил)винил]карбамат и трифторуксусную кислоту подвергают обработке, аналогичной описанной в ссылочном примере 113(8), получая метил ((Е)-2-{4-[1-(циклопропиламино)этил]-6-винилпиридин-2-ил}винил)карбамат [Ех(297-5)] в виде светло-желтого масла.
МС (ХИАД), m/z: 302 [M+H]+.
6) Метил ((Е)-2-{4-[1-(циклопропиламино)этил]-6-винилпиридин-2-ил}винил)карбамат и (2R)-4-(трет-бутоксикарбонил)морфолин-2-карбоновую кислоту подвергают обработке, аналогичной описанной в примере 162, получая трет-бутил (2R)-2-({циклопропил[1-(2-{(1Е)-3-[(метоксикарбонил)амино]проп-1-ен-1-ил}-6-винилпиридин-4-ил)этил]амино}карбонил)морфолин-4-карбоксилат [Ех(297-6)] в виде желтого масла.
МС (ХИАД), m/z: 515 [М+Н]+.
7) трет-Бутил-(2R)-2-({циклопропил[1-(2-{(1Е)-3-[(метоксикарбонил)амино]проп-1-ен-1-ил}-6-винилпиридин-4-ил)этил]амино}карбонил)морфолин-4-карбоксилат восстанавливают методом, аналогичным описанному в примере 296(5), получая трет-бутил-(2R)-2-({циклопропил[1-(2-этил-6-{3-[(метоксикарбонил)амино]пропил}пиридин-4-ил)этил]амино}карбонил)морфолин-4-карбоксилат [Ех(297-7)] в виде бесцветного масла.
МС (ХИАД), m/z: 519 [М+Н]+.
Пример 298
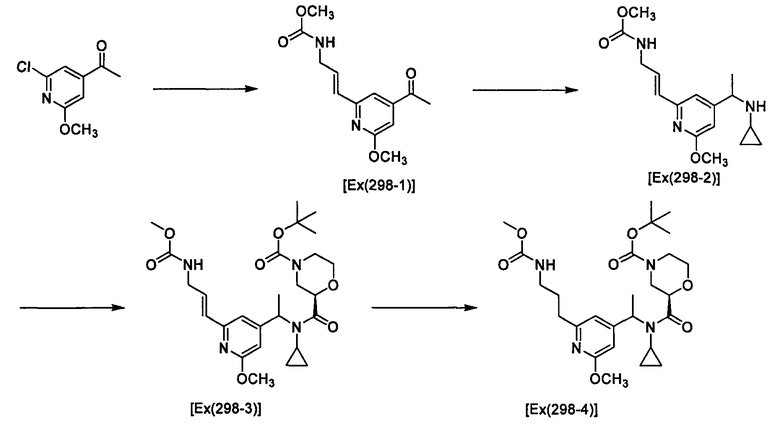
1) 1-(2-Хлор-6-метоксипиридин-4-ил)этанон и метил [(2Е)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборан-2-ил)проп-2-ен-1-ил]карбамат подвергают обработке, аналогичной описанной в примере 297(3), получая метил [(2Е)-3-(4-ацетил-6-метоксипиридин-2-ил)проп-2-ен-1-ил]карбамат [Ех(298-1)] в виде бесцветного порошка.
МС (ХИАД), m/z: 265 [M+H]+.
2) Метил [(2Е)-3-(4-ацетил-6-метоксипиридин-2-ил)проп-2-ен-1-ил]карбамат и циклопропиламин обрабатывают аналогично описанному в ссылочном примере 6(6), получая метил ((2Е)-3-{4-[1-(циклопропиламино)этил]-6-метоксипиридин-2-ил}проп-2-ен-1-ил)карбамат [Ех(298-2)] в виде бесцветного масла.
МС (ХИАД), m/z: 306 [М+Н]+.
3) Метил ((2Е)-3-{4-[1-(циклопропиламино)этил]-6-метоксипиридин-2-ил}проп-2-ен-1-ил)карбамат и (2R)-4-(трет-бутоксикарбонил)морфолин-2-карбоновую кислоту подвергают обработке, аналогичной описанной в примере 162, получая трет-бутил (2R)-2-({циклопропил[1-(2-метокси-6-{(1Е)-3-[(метоксикарбонил)амино]проп-1-ен-1-ил}пиридин-4-ил)этил]амино}карбонил)морфолин-4-карбоксилат [Ех(298-3)] в виде бесцветного масла.
МС (ХИАД), m/z: 519 [M+H]+.
4) трет-Бутил (2R)-2-({циклопропил[1-(2-метокси-6-{(1Е)-3-[(метоксикарбонил)амино]проп-1-ен-1-ил}пиридин-4-ил)этил]амино}карбонил)морфолин-4-карбоксилат восстанавливают аналогично описанному в примере 296(5), получая трет-бутил-(2R)-2-({циклопропил[1-(2-метокси-6-{3-[(метоксикарбонил)амино]пропил}пиридин-4-ил)этил]амино}карбонил)морфолин-4-карбоксилат [Ех(298-4)] в виде бесцветного масла.
МС (ХИАД), m/z: 521 [M+H]+.
Соединения примеров 299-308 синтезируют, комбинируя способы, описанные в данной заявке и общепринятые способы.
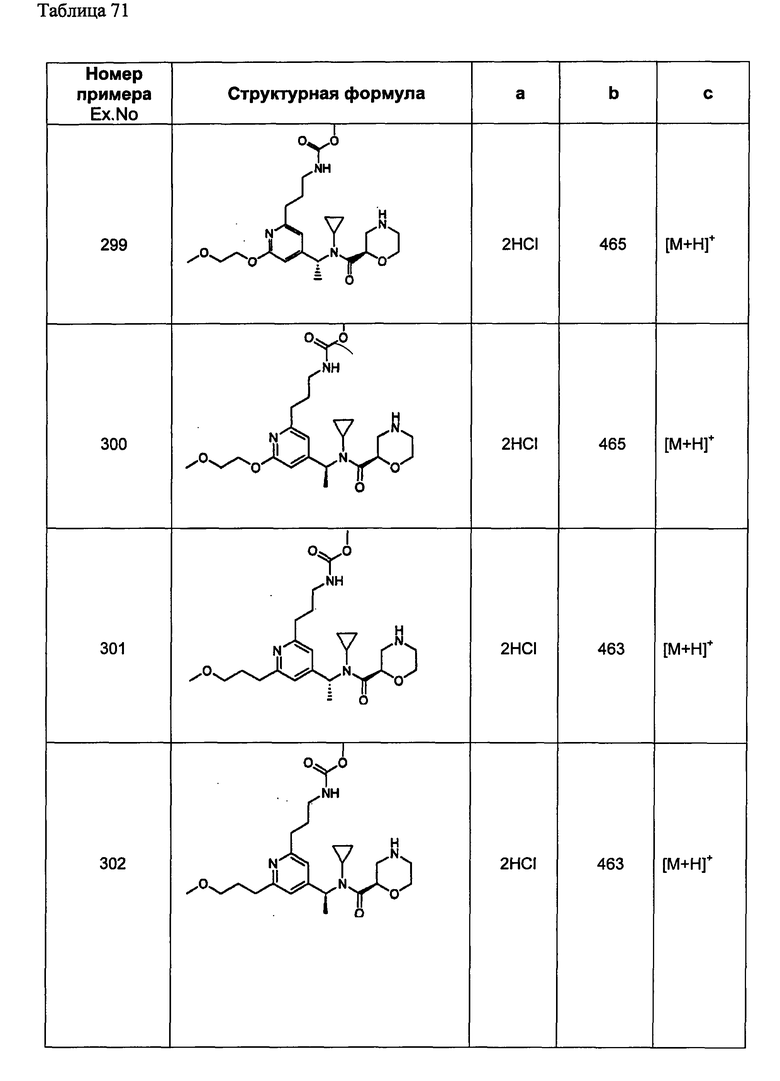
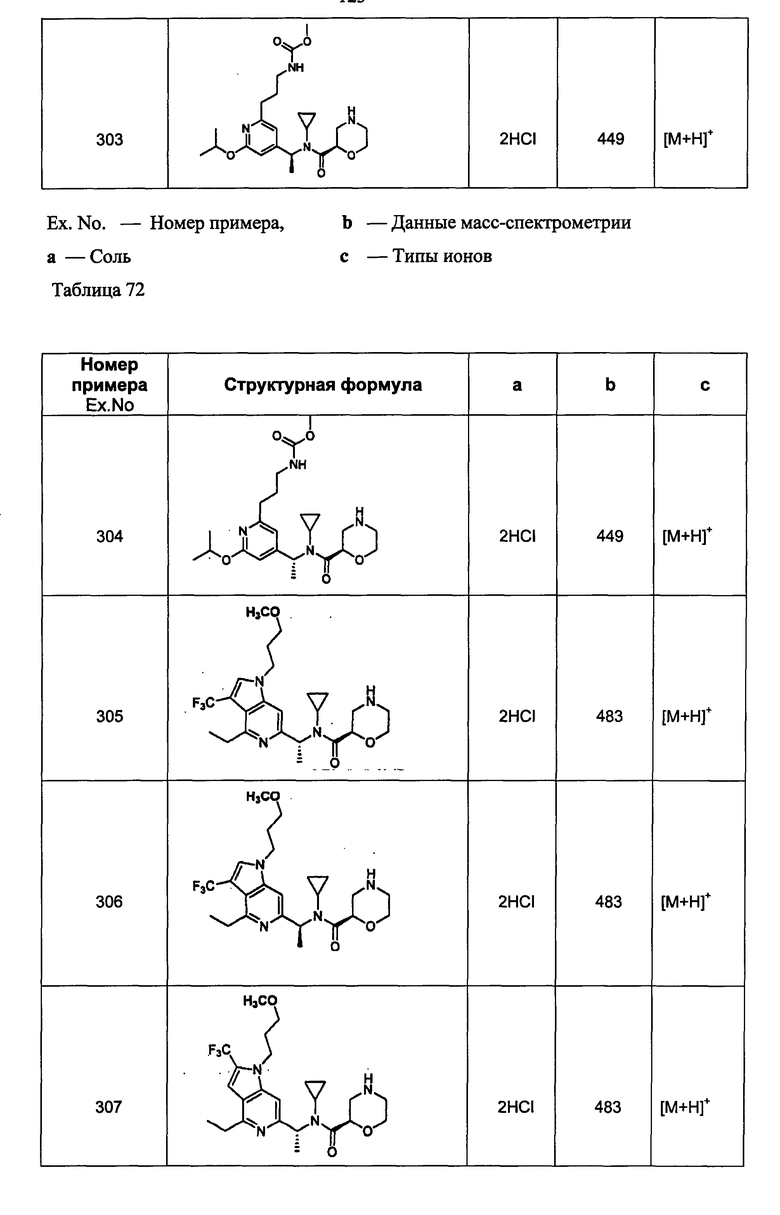
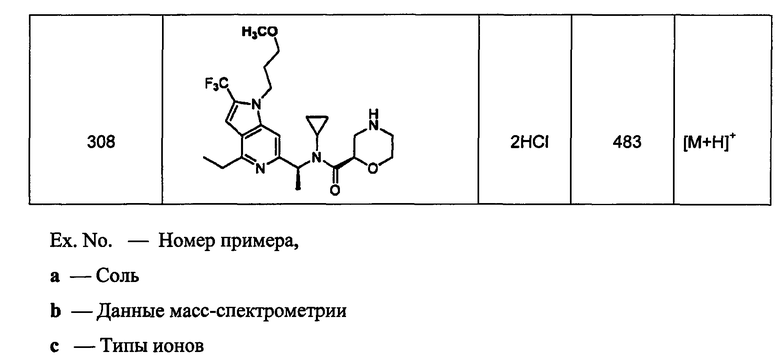
Ссылочный пример 1
Гидрохлорид N-[1-(2-нафтил)этил]циклопропиламина [REx(1-2)]

(1) N-Циклопропил-N-[1-(2-нафтил)этил]-2-нитробензолсульфонамид [REx(1-1)]
К раствору 1-(2-нафтил)этанола (344 мг), N-циклопропил-2-нитробензолсульфонамида (581 мг) и трифенилфосфина (787 мг) в тетрагидрофуране (10 мл) прибавляют по каплям диизопропилазодикарбоксилат (590 мкл) при охлаждении льдом и смесь перемешивают при комнатной температуре в течение 3 часов. Реакционный раствор концентрируют, полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=4/1→1/1), затем растирают в смеси диэтиловый эфир-н-гексан (1:1), получая N-циклопропил-N-[1-(2-нафтил)этил]-2-нитробензолсульфонамид [REx(1-1)] (499 мг) в виде бесцветного порошка.
МС (ХИАД), m/z: 397 [M+H]+.
(2) Гидрохлорид N-[1-(2-нафтил)этил]циклопропиламин [REx(1-2)]
К раствору 480 мг соединения, полученного на стадии (1), и 4-бромтиофенола (250 мг) в N,N-диметилформамиде (12 мл) прибавляют карбонат калия (304 мг) и смесь перемешивают при комнатной температуре в течение 17 часов. К реакционному раствору прибавляют воду, и смесь экстрагируют этилацетатом. Органический слой промывают последовательно водой (2 раза) и насыщенным раствором хлорида натрия, сушат над сульфатом натрия, затем концентрируют при пониженном давлении. Полученный остаток растворяют в этилацетате (5 мл), затем прибавляют 4-нормальный раствор хлорида водорода в этилацетате (1 мл). Выпавшее в осадок твердое вещество отфильтровывают, получая гидрохлорид N-[1-(2-нафтил)этил]циклопропиламина [REx(1-2)] (211 мг) в виде бесцветного порошка.
МС (ХИАД), m/z: 212 [M+H]+.
Ссылочный пример 2
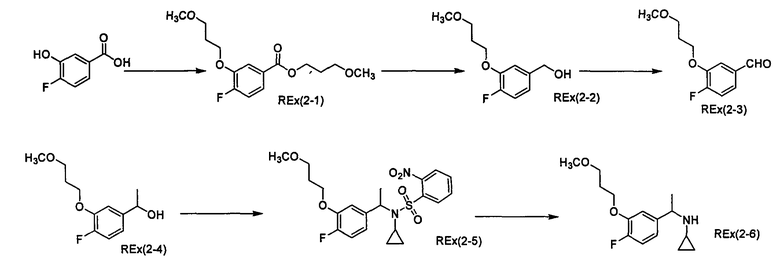
(1) 3-Метоксипропил 4-фтор-3-(3-метоксипропокси)бензоат [REx(2-1)]
К раствору 4-фтор-3-гидроксибензойной кислоты (2,0 г) в смеси ацетонитрила (100 мл), N,N-диметилформамида (50 мл) и воды (2,0 мл) прибавляют карбонат калия (5,31 г) и 1-бром-3-метоксипропан (4,32 г), затем смесь нагревают с обратным холодильником при 90°С в течение 18 часов. К реакционной смеси прибавляют воду при охлаждении льдом и затем смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором хлорида натрия, сушат над сульфатом магния и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=4/1→1/2), получая 3-метоксипропил 4-фтор-3-(3-метоксипропокси)бензоат [REx(2-1)] (2,72 г) в виде бесцветного масла.
МС (ХИАД), m/z: 301 [М+Н]+.
(2) [Фтор-3-(3-метоксипропокси)фенил]метанол [REx(2-2)]
К суспензии литийалюминийгидрида (344 мг) в тетрагидрофуране (20 мл) прибавляют по каплям раствор 2,72 г соединения, полученного на стадии (1), в тетрагидрофуране (8 мл) при охлаждении льдом, затем смесь перемешивают при охлаждении в течение 1 часа. При охлаждении к реакционной смеси медленно прибавляют последовательно воду и 2-нормальный водный раствор гидроксида натрия (1 мл), затем смесь перемешивают при комнатной температуре в течение 1 часа. Нерастворимое вещество отфильтровывают через Целит, фильтрат промывают насыщенным водным раствором гидрокарбоната натрия, затем сушат над сульфатом магния. Полученный раствор концентрируют при пониженном давлении, остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=2/1→1/2), получая [фтор-3-(3-метоксипропокси)фенил]метанол [REx(2-2)] (1,78 г) в виде бесцветного масла.
МС (ХИАД), m/z: 232[M+NH4]+.
(3) 4-Фтор-3-(3-метоксипропокси)бензальдегид [REx(2-3)]
К раствору 1,65 г соединения, полученного на стадии (2), в дихлорметане (43 мл) прибавляют 85% активированный диоксид марганца (7,88 г) и смесь перемешивают при комнатной температуре в течение 1 часа, затем смесь нагревают и кипятят с обратным холодильником в течение 2 часов. Нерастворимое вещество отфильтровывают через Целит, затем фильтрат концентрируют при пониженном давлении, получая 4-фтор-3-(3-метоксипропокси)бензальдегид [REx(2-3)] (1,59 г) в виде бесцветного масла.
МС (ХИАД), m/z: 213 [М+Н]+.
(4) 1-[4-Фтор-3-(3-метоксипропокси)фенил]этанол [REx(2-4)]
К раствору 1,55 г соединения, полученного на стадии (3), в тетрагидрофуране (30 мл) прибавляют по каплям 3М раствор метилмагнийбромида в диэтиловом эфире (2,68 мл) при охлаждении льдом и смесь перемешивают при той же температуре в течение 10 минут. При охлаждении льдом к смеси прибавляют водный раствор хлорида аммония и смесь экстрагируют этилацетатом. Органический слой промывают последовательно водой и насыщенным раствором хлорида натрия, затем сушат над сульфатом магния, концентрируют при пониженном давлении, получая 1-[4-фтор-3-(3-метоксипропокси)фенил]этанол [REx(2-4)] (1,43 г) в виде желтого масла.
МС (ХИАД), m/z: 246 [M+NH4]+.
(5) Далее может быть получено аминосоединение [REx(2-6)] аналогично описанному в ссылочном примере 1.
Ссылочный пример 3
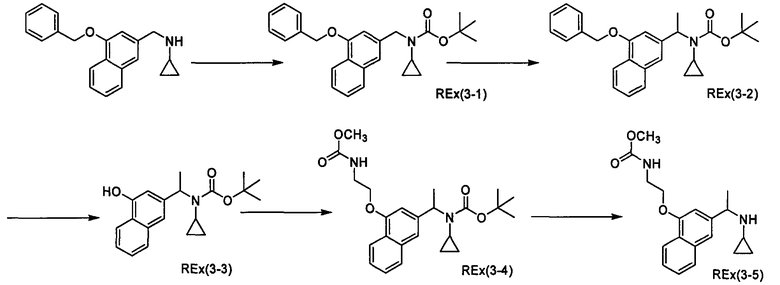
(1) трет-Бутил {[4-(бензилоху)-2-нафтил]метил}циклопропилкарбамат [REx(3-1)]
К раствору N-{[4-(бензилоху)-2-нафтил]метил}циклопропиламина (12,3 г) в дихлорметане (150 мл) прибавляют триэтиламин (5,93 мл) и ди-трет-бутилдикарбонат (9,29 г) при охлаждении льдом и смесь перемешивают при комнатной температуре в течение 3 часов. К реакционному раствору прибавляют насыщенный водный раствор хлорида аммония при охлаждении льдом и смесь экстрагируют хлороформом. Органический слой промывают водой и насыщенным раствором хлорида натрия, сушат над сульфатом натрия и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=19/1→9/1), получая трет-бутил {[4-(бензилоху)-2-нафтил]метил}циклопропилкарбамат [REx(3-1)] (15,8 г) в виде бесцветного порошка.
МС (ХИАД), m/z: 404 [M+H]+.
(2) трет-Бутил {1-[4-(бензилоху)-2-нафтил]этил}циклопропилкарбамат [REx(3-2)]
К раствору 807 мг соединения, полученного на стадии (1), и тетраметилэтилендиамина (0,39 мкл) в тетрагидрофуране (10 мл) прибавляют по каплям раствор 1,55М н-бутиллития в гексане (1,55 мл) при -78°С в атмосфере аргона в течение 5 минут. Смесь перемешивают при той же температуре в течение 1 часа, затем к смеси прибавляют йодметан (0,187 мкл) при температуре -78°С. Смесь перемешивают при той же температуре в течение 30 минут, затем при охлаждении льдом перемешивают в течение 2 часов. К реакционному раствору при охлаждении льдом прибавляют насыщенный водный раствор хлорида аммония, и затем смесь экстрагируют этилацетатом. Органический слой промывают водой (2 раза) и насыщенным раствором хлорида натрия, сушат над сульфатом натрия, и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=20/1→6/1), получая трет-бутил {1-[4-(бензилоху)-2-нафтил]этил}циклопропилкарбамат [REx(3-2)] (611 мг) в виде бесцветного масла.
МС (ХИАД), m/z: 418 [M+H]+.
(3) трет-Бутил [1-(4-гидрокси2-нафтил)этил]карбамат [REx(3-3)]
К раствору 126 мг соединения, полученного на стадии (2), в метаноле (3 мл) прибавляют 10% палладия на угле (13 мг) и смесь перемешивают в атмосфере водорода в течение 3 часов. Реакционный раствор разбавляют этилацетатом, катализатор отфильтровывают и затем полученный фильтрат концентрируют при пониженном давлении. Полученный остаток растирают в смеси изопропиловый эфир/н-гексан (1:1), получая трет-бутилциклопропил [1-(4-гидрокси2-нафтил)этил]карбамат [REx(3-3)] (50 мг) в виде бесцветного порошка.
МС (ХИАД), m/z: 326 [M-H]-.
(4) Метил {2-[(3-{1-[(трет-бутоксикарбонил)(циклопропил)амино]этил}-1-нафтил)окси]этил}карбамат [REx(3-4)]
К раствору 243 мг соединения, полученного на стадии (3), и метил (2-бромэтил)карбамата (203 мг) в ацетонитриле (10 мл) прибавляют карбонат калия (205 мг) и смесь перемешивают при 80°С в течение 7 часов. После охлаждения к реакционному раствору прибавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором хлорида натрия, сушат над сульфатом натрия и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=4/1→1/1), получая метил{2-[(3-{1-[(трет-бутоксикарбонил)(циклопропил)амино]этил}-1-нафтил)окси]этил}карбамат [REx(3-4)] (161 мг) в виде светло-желтого масла.
МС (ХИАД), m/z: 429 [M+H]+.
(5) Метил [2-({3-[1-(циклопропиламино)этил]-1-нафтил}оху)этил]карбамат [REx(3-5)]
К раствору 156 мг соединения, полученного на стадии (4), в хлороформе (2 мл) прибавляют 4-нормальный раствор хлорида водорода в диоксане (2 мл) при охлаждении льдом и смесь перемешивают при комнатной температуре в течение 1 часа. Смесь концентрируют при пониженном давлении, к полученному остатку прибавляют насыщенный водный раствор гидрокарбоната натрия и смесь экстрагируют хлороформом. Органический слой сушат над сульфатом натрия и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: этилацетат→этилацетат/метанол=10/1), получая метил [2-({3-[1-(циклопропиламино)этил]-1-нафтил}окси)этил]карбамат [REx(3-5)] (76 мг) в виде светло-желтого масла. МС (ХИАД), m/z: 329 [M+Н]+.
Ссылочный пример 4
[1-(4-Метокси-2-нафтил)этил]циклопропиламин [REx(4-1)]
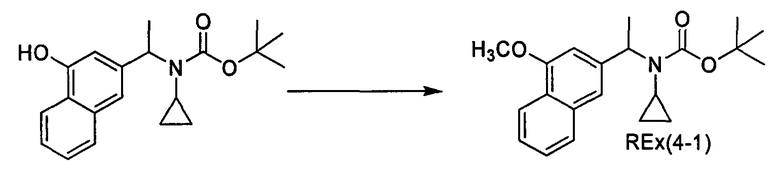
К смеси трет-бутилциклопропил [1-(4-гидрокси2-нафтил)этил]карбамата (43 мг) и карбоната калия (27 мг) прибавляют N,N-диметилформамид (2,0 мл), затем прибавляют метилйодид (0,016 мл) и смесь перемешивают при комнатной температуре в течение 4 часов. После охлаждения к реакционному раствору прибавляют воду, и смесь экстрагируют этилацетатом. Органический слой промывают последовательно водой (2 раза) и насыщенным раствором хлорида натрия, сушат над сульфатом натрия и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=10/1→4/1), получая трет-бутил циклопропил [1-(4-метокси-2-нафтил)этил]карбамат [REx(4-1)] (33 мг) в виде бесцветного масла. МС (ХИАД), m/z: 342 [M+H]+.
Затем в результате удаления защитной Воc группы любым способом из описанных в примерах 1-5 может быть получено целевое аминосоединение.
Ссылочный пример 5
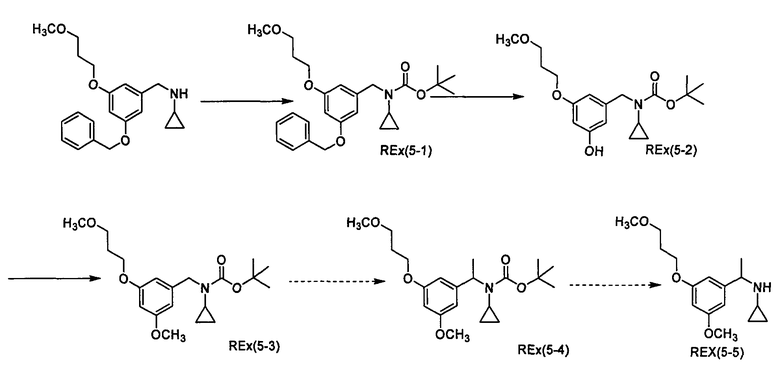
(1) трет-Бутил [3-(бензилоху)-5-(3-метоксипропокси)бензил]циклопропилкарбамат [REx(5-1)]
К раствору N-[3-(бензилоху)-5-(3-метоксипропокси)бензил]циклопропиламина (15,4 г) в дихлорметане (190 мл) прибавляют триэтиламин (6,60 мл) и ди-трет-бутилдикарбонат (10,3 г) при охлаждении льдом и смесь перемешивают при комнатной температуре в течение 4 часов. К реакционному раствору прибавляют насыщенный водный раствор хлорида аммония при охлаждении льдом и смесь экстрагируют хлороформом. Органический слой промывают водой и насыщенным раствором хлорида натрия, сушат над сульфатом натрия и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=14/1), получая трет-бутил [3-(бензилоху)-5-(3-метоксипропокси)бензил]циклопропилкарбамат [REx(5-1)] (20,0 г) в виде бесцветного масла. МС (ХИАД), m/z: 459[M+NH4]+.
(2) трет-бутилциклопропил [3-гидрокси-5-(3-метоксипропокси)бензил]карбамат [REx(5-2)]
К раствору 14,0 г соединения, полученного на описанной выше стадии (1), в этаноле (210 мл) прибавляют 20% гидроксид палладия на угле (2,80 г) и смесь перемешивают в атмосфере водорода в течение 30 минут. Нерастворимое вещество отфильтровывают и фильтрат затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=4/1→2/1), получая трет-бутилциклопропил [3-гидрокси-5-(3-метоксипропокси)бензил]карбамат [REx(5-2)] (11,0 г) в виде бесцветного масла.
МС (ХИАД), m/z: 352 [M+H]+.
(3) трет-Бутилциклопропил [3-метокси-5-(3-метоксипропокси)бензил]карбамат [REx(5-3)]
К раствору 3,51 г соединения, полученного на описанной выше стадии (2), в N,N-диметилформамиде (50 мл) прибавляют карбонат калия (2,07 г), затем при охлаждении льдом к смеси прибавляют йодметан (0,75 мл) и смесь перемешивают при комнатной температуре в течение 23 часов. К реакционному раствору прибавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают последовательно водой (2 раза) и насыщенным раствором хлорида натрия, сушат над сульфатом натрия, затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=3/1), получая трет-бутилциклопропил [3-метокси-5-(3-метоксипропокси)бензил]карбамат [REx(5-3)] (3,65 г) в виде бесцветного масла.
МС (ХИАД), m/z: 366 [M+Н]+.
(4) Метилированием соединения [REx(5-3)] способом, описанным в ссылочном примере 3(2), с последующим удалением защитной группы Вое одним из способов, указанных в примерах 1-5, получают целевое аминосоединение [REx(5-5)].
Ссылочный пример 6
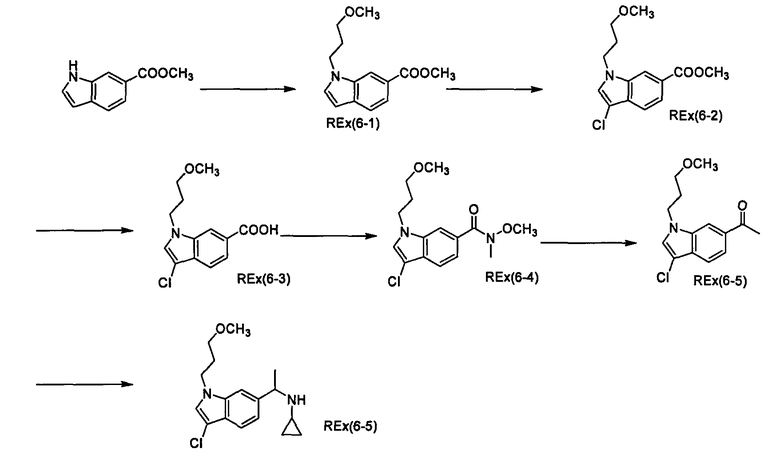
(1) Метил-1-(3-метоксипропил)-1Н-индол-6-карбоксилат [REx(6-1)]
К раствору метил-1H-индол-6-карбоксилата (5,0 г) в N,N-диметилформамиде (40 мл) прибавляют по каплям 60% гидрид натрия в масле (1,37 г) при охлаждении льдом и затем смесь перемешивают при комнатной температуре в течение 15 минут. Затем по каплям прибавляют раствор 1-бром-3-метоксипропана (5,24 г) в N,N-диметилформамиде (10 мл) при охлаждении льдом, далее прибавляют йодид калия (948 мг) и смесь перемешивают при комнатной температуре в течение 3 часов. К реакционной смеси прибавляют последовательно этилацетат и воду при охлаждении льдом и отделяют органический слой. Органический слой промывают водой (2 раза) и насыщенным раствором хлорида натрия, сушат над сульфатом натрия и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=9/1→4/1), получая метил-1-(3-метоксипропил)-1Н-индол-6-карбоксилат [REx(6-1)] (5,8 г) в виде бесцветного масла.
МС (ХИАД), m/z: 248 [M+H]+.
(2) Метил-3-хлор-1-(3-метоксипропил)-1Н-индол-6-карбоксилат [REx(6-2)]
К раствору 2,78 г соединения, полученного на описанной выше стадии (1), в дихлорметане (35 мл) прибавляют N-хлорсукцинимид (1,65 г) при охлаждении льдом и смесь перемешивают при комнатной температуре в течение 8 часов. К ракционной смеси прибавляют воду и смесь экстрагируют хлороформом. Органический слой промывают насыщенным раствором хлорида натрия, сушат над сульфатом натрия и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан→н-гексан/этилацетат=2/1), получая метил-3-хлор-1-(3-метоксипропил)-1Н-индол-6-карбоксилат [REx(6-2)] (3,10 г) в виде желтого масла.
МС (ХИАД), m/z: 282/284 [М+Н]+.
(3) 3-Хлор-1-(3-метоксипропил)-1H-индол-6-карбоновая кислота [REx(6-3)]
К раствору 1,20 г соединения, полученного на описанной выше стадии (2), в этаноле (10 мл) прибавляют 2-нормальный водный раствор гидроксида натрия (4,26 мл) при охлаждении льдом и смесь перемешивают при комнатной температуре в течение 20 часов. Реакционную смесь концентрируют, затем подкисляют, прибавляя 2-нормальную соляную кислоту при охлаждении льдом, затем прибавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором хлорида натрия, затем концентрируют при пониженном давлении, получая 3-хлор-1-(3-метоксипропил)-1Н-индол-6-карбоновую кислоту [REx(6-3)] (1,14 г) в виде бесцветного порошка.
ESI-MS m/z: 266/268 [М-Н]-.
(4) 3-Хлор-N-метокси-1-(3-метоксипропил)-N-метил-1Н-индол-6-карбоксамид [REx(6-4)]
К раствору 1,14 г соединения, полученного на описанной выше стадии (3), 831 мг гидрохлорида N,O-диметилгидроксиламина, гидрохлорида 1-этил-3-(3-диметиламинопропил)карбодиимида (1,25 г) и 1-гидроксибензотриазол (863 мг) в хлороформе (12 мл) прибавляют диизопропилэтиламин (1,85 мл) при охлаждении льдом и затем смесь перемешивают при комнатной температуре в течение 24 часов. К реакционной смеси прибавляют насыщенный водный раствор гидрокарбоната натрия при охлаждении льдом и экстрагируют хлороформом. Органический слой промывают последовательно водой и насыщенным раствором хлорида натрия, сушат над сульфатом магния и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=1/1→1/3), получая 3-хлор-N-метокси-1-(3-метоксипропил)-N-метил-1Н-индол-6-карбоксамид [REx(6-4)] (1,20 г) в виде светло-желтого масла.
МС (ХИАД), m/z: 311/3 [М+Н]+.
(5) 1-[3-Хлор-1-(3-метоксипропил)-1Н-индол-6-ил]этанон [REx(6-5)]
К раствору 1,20 г соединения, полученного выше на стадии (4), в тетрагидрофуране (15 мл) прибавляют по каплям 3М раствор метилмагнийбромида в диэтиловом эфире (2,56 мл) при охлаждении льдом и смесь перемешивают при той же температуре в течение 1 часа. К реакционному раствору прибавляют 1-нормальную соляную кислоту при охлаждении льдом, и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором хлорида натрия, затем сушат над сульфатом магния и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=4/1→1/1), получая 1-[3-хлор-1-(3-метоксипропил)-1Н-индол-6-ил]этанон [REx(6-5)] (945 мг) в виде светло-желтого масла.
МС (ХИАД), m/z: 266/268 [М+Н]+.
(6) N-{1-[3-Хлор-1-(3-метоксипропил)-1Н-индол-6-ил]этил}циклопропанамин [REx(6-6)]
К раствору 155 мг соединения, полученного на описанной выше стадии (5), и циклопропиламина (99,9 мг) в дихлорэтане (3,0 мл) прибавляют сульфат магния (351 мг), триацетоксиборгидрид натрия (371 мг) и уксусную кислоту (105 мг), затем смесь перемешивают при комнатной температуре в течение 17 часов. К реакционной смеси прибавляют насыщенный водный раствор гидрокарбоната натрия при охлаждении льдом и смесь экстрагируют хлороформом. Органический слой промывают насыщенным раствором хлорида натрия, сушат над сульфатом магния и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: этилацетат→этилацетат/метанол=20/1), получая N-{1-[3-хлор-1-(3-метоксипропил)-1Н-индол-6-ил]этил}циклопропанамин [REx(6-6)] (111 мг) в виде светло-желтого масла.
МС (ХИАД), m/z: 307/309 [M+H]+.
Ссылочный пример 7
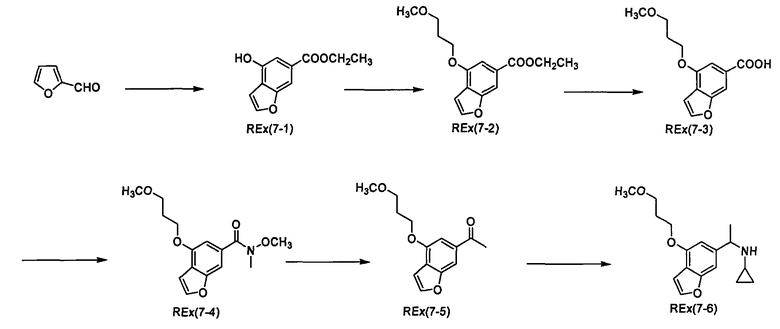
(1) Этил-4-(ацетилоху)бензофуран-6-карбоксилат
К 60% суспензии гидрида натрия в масле (6,50 г) в тетрагидрофуране (400 мл) при охлаждении льдом прибавляют по каплям раствор 4-трет-бутил-1-этил-2-(диэтоксифосфорил)сукцината (55,0 г) в тетрагидрофуране (100 мл) в течение 30 минут и затем смесь перемешивают при охлаждении в течение 1 часа. Затем к смеси прибавляют раствор фуральдегида (12,8 мл) в тетрагидрофуране (40 мл) в течение 15 минут при охлаждении льдом и смесь перемешивают при комнатной температуре в течение 1 часа. В реакционную смесь вливают ледяную воду при охлаждении льдом и смесь экстрагируют этилацетатом. Органический слой промывают последовательно водой и насыщенным раствором хлорида натрия, сушат над сульфатом натрия, затем концентрируют при пониженном давлении, получая 4-трет-бутил-1-этил (2Е)-2-(2-фурилметилен)сукцинат (47,0 г) в виде коричневого масла-сырца. Затем масло (47,0 г) перемешивают в трифторуксусной кислоте (100 мл) при комнатной температуре в течение 1 часа и концентрируют при пониженном давлении. Полученный остаток несколько раз подвергают азеотропной обработке с толуолом, получая (3Е)-3-(этоксикарбонил)-4-(2-фурил)-бут-3-еновую кислоту-сырец (39,2 г) в виде коричневого масла. Затем масло (39,2 г) растворяют в уксусном ангидриде (100 мл), к раствору прибавляют ацетат калия (19,8 г), смесь нагревают и кипятят с обратным холодильником в течение 45 минут. Реакционной смеси дают охладиться, затем прибавляют воду (100 мл) и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором хлорида натрия, сушат над сульфатом натрия, затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=5/1), получая этил-4-(ацетилокси)бензофуран-6-карбоксилат (24,7 г) в виде светло-оранжевого твердого вещества.
МС (ХИАД), m/z: 266 [M+NH4]+.
(2) Этил-4-гидрокси-1-бензофуран-6-карбоксилат [REx(7-1)]
К раствору 24,7 г соединения, полученного на описанной выше стадии (1), в этаноле (150 мл) прибавляют карбонат калия (42,0 г), смесь нагревают и кипятят с обратным холодильником в течение 30 минут. Реакционную смесь охлаждают льдом, затем подкисляют 10% соляной кислотой и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором хлорида натрия, сушат над сульфатом натрия и затем концентрируют при пониженном давлении. Полученный остаток растирают в смеси н-гексан-дихлорметан (5:1), получая этил-4-гидрокси-1-бензофуран-6-карбоксилат [REx(7-1)] (19,6 г) в виде светло-желтого порошка.
МС (ХИАД), m/z: 207 [M+H]+.
(3) Этил-4-(3-метоксипропокси)-1-бензофуран-6-карбоксилат [REx(7-2)]
К раствору 5,0 г соединения, полученного на описанной выше стадии (2), в ацетонитриле (50 мл) прибавляют карбонат калия и 1-бром-3-метоксипропан (4,54 г), смесь нагревают и кипятят с обратным холодильником в течение 1,5 часов. К реакционной смеси прибавляют воду при охлаждении льдом и затем смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором хлорида натрия, сушат над сульфатом натрия и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=5/1→2/1), получая этил-4-(3-метоксипропокси)-1-бензофуран-6-карбоксилат [REx(7-2)] (6,61 г) в виде бесцветного масла.
МС (ХИАД), m/z: 279 [M+H]+.
(4) 4-(3-Метоксипропокси)-1-бензофуран-6-карбоновая кислота [REx(7-3)]
К раствору 2,64 г соединения, полученного на описанной выше стадии (3), в этаноле (20 мл) прибавляют 2-нормальный водный раствор гидроксида натрия (9,5 мл) и смесь перемешивают при комнатной температуре в течение 3 часов. Затем к смеси прибавляют 2-нормальную соляную кислоту при охлаждении льдом и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором хлорида натрия, сушат над сульфатом магния, затем концентрируют при пониженном давлении, получая 4-(3-метоксипропокси)-1-бензофуран-6-карбоновую кислоту [REx(7-3)] (2,40 г) в виде бесцветного порошка.
МС (ХИАД), m/z: 265 [M+H+MeOH-H2O]+.
(5) N-Метокси-4-(3-метоксипропокси)-N-метил-1-бензофуран-6-карбоксамид [REx(7-4)]
К раствору 2,39 г соединения, полученного на описанной выше стадии (4), 1,86 г гидрохлорида N,O-диметилгидроксиламина, 2,74 г гидрохлорида 1-этил-3-(3-диметиламинопропил)карбодиимида и 1,93 г 1-гидроксибензотриазола в хлороформе (30 мл) прибавляют диизопропилэтиламин (4,2 мл) при охлаждении льдом, и смесь перемешивают при комнатной температуре в течение 4 часов. К реакционной смеси прибавляют насыщенный водный раствор гидрокарбоната натрия при охлаждении льдом и смесь экстрагируют хлороформом. Органический слой промывают последовательно водой и насыщенным раствором хлорида натрия, сушат над сульфатом магния и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=1/1→1/3), получая N-метокси-4-(3-метоксипропокси)-N-метил-1-бензофуран-6-карбоксамид [REx(7-4)] (2,67 г) в виде светло-желтого порошка.
МС (ХИАД), m/z: 294 [M+H]+.
(6) 1-[4-((3-Метоксипропокси)-1-бензофуран-6-ил]этанон [REx(7-5)]
К раствору 2,67 г соединения, полученного на описанной выше стадии (5), в тетрагидрофуране (30 мл) прибавляют по каплям 3М раствор метилмагнийбромида в диэтиловом эфире (6,1 мл) при охлаждении льдом и смесь перемешивают при той же температуре в течение 15 минут. При охлаждении льдом в смесь вливают 10% соляную кислоту, и затем смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором хлорида натрия, затем сушат над сульфатом магния и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=4/1→1/1), получая 1-[4-((3-метоксипропокси)-1-бензофуран-6-ил]этанон [REx(7-5)] (2,15 г) в виде бесцветного порошка.
МС (ХИАД), m/z: 249 [М+Н]+.
(7) N-{1-[4-(3-Метоксипропокси)-1-бензофуран-6-ил]этил}циклопропанамин [REx(7-6)]
К раствору 2,15 г соединения, полученного на описанной выше стадии (6), и 2,10 мл циклопропиламина в дихлорэтане (150 мл) прибавляют триацетоксиборгидрид натрия (5,50 г), уксусную кислоту (1,48 мл) и сульфат магния (5,20 г), затем смесь перемешивают при комнатной температуре в течение 23 часов. К смеси прибавляют насыщенный водный раствор гидрокарбоната натрия при охлаждении льдом и экстрагируют хлороформом. Органический слой промывают насыщенным водным раствором хлорида натрия, сушат над сульфатом магния и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: хлороформ/метанол=20/1→13/1), получая N-{1-[4-(3-метоксипропокси)-1-бензофуран-6-ил]этил}циклопропанамин [REx(7-6)] (2,47 г) в виде светло-желтого масла.
МС (ХИАД), m/z: 290 [M+H]+.
Ссылочный пример 8
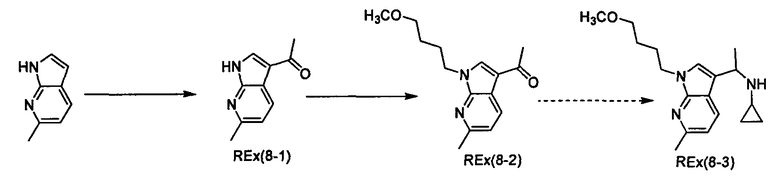
(1) 1-(6-Метил-1Н-пирроло[2,3-b]пиридин-3-ил)этанон [REx(8-1)]
К раствору 6-метил-1Н-пирроло[2,3-b]пиридина (500 мг) в дихлорэтане (6 мл) прибавляют хлорид алюминия (1,09 г) и ацетилхлорид (0,40 мл), затем смесь перемешивают при комнатной температуре в течение 1,5 часов. Реакционный раствор выливают в насыщенный водный раствор гидрокарбоната натрия и экстрагируют хлороформом. Органический слой промывают насыщенным раствором хлорида натрия, сушат над сульфатом магния, и затем концентрируют при пониженном давлении. Полученный остаток растирают с изопропиловым эфиром, получая 1-(6-метил-1Н-пирроло[2,3-b]пиридин-3-ил)этанон [REx(81l)] (481 мг) в виде желтого порошка.
МС (ХИАД), m/z: 175 [M+H]+.
(2) 1-[1-(4-Метоксибутил)-6-метил-1Н-пирроло[2,3-b]пиридин-3-ил]этанон [REx(8-2)]
К раствору 280 мг соединения, полученного выше на стадии (1) в N,N-диметилформамиде (6 мл) прибавляют 60% гидрид натрия в масле (83,6 мг), затем смесь перемешивают при комнатной температуре в течение 30 минут. К смеси по каплям прибавляют раствор 4-метоксибутил-4-метилбензолсульфоната в N,N-диметилформамиде (1 мл), затем прибавляют йодид калия (267 мг) и смесь перемешивают при 50°С в течение 1 часа. реакционную смесь выливают в воду и экстрагируют этилацетатом. Органический слой промывают водой (два раза) и насыщенным раствором хлорида натрия, сушат над сульфатом магния и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=2/1→1/9), получая 1-[1-(4-метоксибутил)-6-метил-1Н-пирроло[2,3-b]пиридин-3-ил]этанон [REx(8-2)] (366 мг) в виде желтого масла.
МС (ХИАД), m/z: 261 [М+Н]+.
(3) Аминосоединение [REx(8-3)] получают способом, аналогичным описанному в ссылочном примере 7(7).
Ссылочный пример 9
1-[1-(3-Метоксипропил)-3-метил-1Н-индол-6-ил]этанон [REx(9-1)]
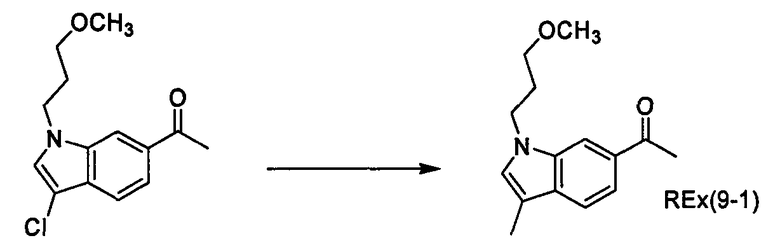
К раствору 1-[3-хлор-1-(3-метоксипропил)-1Н-индол-6-ил]этанона (843 мг) в 1,4-диоксане (15 мл) прибавляют фосфат калия (1,35 г), триметилбороксин (883 мг), трис(дибензилиденацетон)дипалладий (290 мг) и 2-дициклогексилфосфино-2′,4′,6′-триизопропил-1,1′-бифенил (X-Phos) (605 мг) в атмосфере аргона и смесь нагревают при перемешивании и температуре 110°С в течение 4 часов. К смеси прибавляют воду при охлаждении льдом и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором хлорида натрия, сушат над сульфатом магния и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=3/1→3/2), получая 1-[1-(3-метоксипропил)-3-метил-1Н-индол-6-ил]этанон [REx(9-1)] (663 мг) в виде желтого масла.
МС (ХИАД), m/z: 246 [M+H]+.
Ссылочный пример 10
Метил-1-(3-метоксипропил)индолин-6-карбоксилат [REx(10-1)]
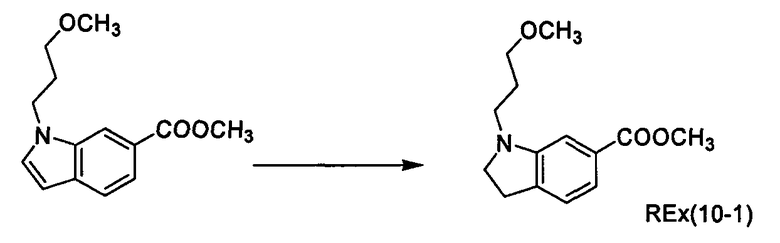
К смеси метил-1-(3-метоксипропил)-1Н-индол-6-карбоксилата (1,5 г) и цианогидробората натрия (1,61 г) прибавляют уксусную кислоту (15 мл) при охлаждении льдом и смесь перемешивают при комнатной температуре в течение 3 часов. К реакционному раствору прибавляют насыщенный водный раствор гидрокарбоната натрия при охлаждении льдом, смесь нейтрализуют, прибавляя гидрокарбонат натрия и затем экстрагируют этилацетатом. Органический слой промывают насыщенным раствором хлорида натрия, сушат над сульфатом натрия, и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан→н-гексан/этилацетат=2/1), получая метил-1-(3-метоксипропил)индолин-6-карбоксилат [REx(10-1)] (1,20) в виде светло-желтого масла.
МС (ХИАД), m/z: 250 [M+H]+.
Ссылочный пример 11
6-(3-Метоксипропокси)индан-1-он [REx(11-1)]
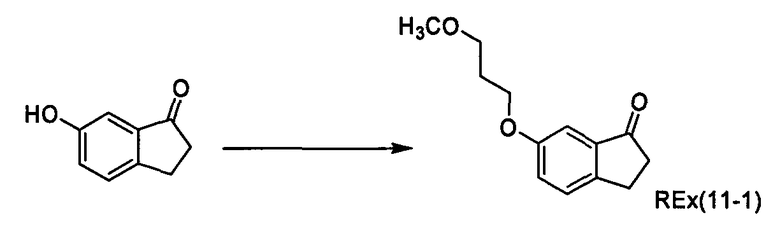
К раствору 6-гидроксииндан-1-она (1,48 г) в ацетонитриле (30 мл) прибавляют 4-метоксибутил-4-метилбензолсульфонат (2,93 г), йодид калия (166 мг) и карбонат калия (2,07 г) и нагревают смесь при перемешивании и температуре 80°С в течение 5 часов. К реакционной смеси прибавляют воду при охлаждении льдом и затем смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором хлорида натрия, сушат над сульфатом натрия и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=7/3) и затем растирают в смеси н-гексана и изопропилового эфира (2:1), получая 6-(3-метоксипропокси)индан-1-он [REx(11-1)] (1,1 г) в виде бесцветного порошка.
МС (ХИАД), m/z: 221 [M+H]+.
Ссылочный пример 12
7-(3-Метоксипропокси)-3,4-дигидронафталин-1 (2Н)-он [REx(12-1)]
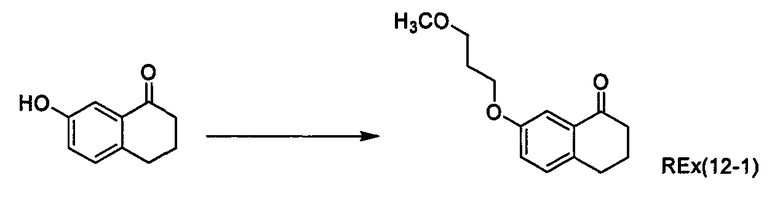
К раствору 7-гидрокси-1-тетралона (4,05 г) в ацетонитриле (75 мл) прибавляют 1-бром-3-метоксипропан (4,59 г), йодид калия (415 мг) и карбонат калия (5,18 г) и нагревают смесь при перемешивании и температуре 80°С в течение 23 часов. К реакционной смеси прибавляют воду при охлаждении льдом и затем смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором хлорида натрия, сушат над сульфатом натрия и затем концентрируют при пониженном давлении. Полученный остаток растирают в н-гексане, получая 7-(3-метоксипропокси)-3,4-дигидронафталин-1(2Н)-он [REx(12-1)] (4,80 г) в виде бесцветного порошка.
МС (ХИАД), m/z: 235 [M+Н]+.
Ссылочный пример 13
N-(2-Метоксиэтил)-3-оксоиндан-5-карбоксамид [REx(13-1)]
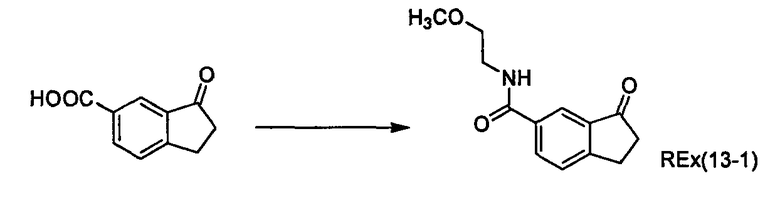
К суспензии 1-инданон-6-карбоновой кислоты (1,76 г) в N,N-диметилформамиде (50 мл) прибавляют карбонилдиимидазол (3,24 г) и смесь перемешивают при комнатной температуре в течение 1 часа. К смеси при охлаждении льдом прибавляют раствор 2-метоксиэтиламина (3,76 г) в дихлорметане (50 мл) и смесь перемешивают при комнатной температуре в течение 4 часов. Реакционный раствор концентрируют при пониженном давлении и затем растворяют в хлороформе. Органический слой промывают насыщенным водным раствором гидрокарбоната натрия, сушат над сульфатом натрия, затем концентрируют при пониженном давлении. Полученный остаток растворяют в тетрагидрофуране (20 мл), затем к нему прибавляют 1-нормальную соляную кислоту (20 мл), и смесь перемешивают при комнатной температуре в течение 12 часов. К реакционному раствору прибавляют воду, и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором хлорида натрия, сушат над сульфатом натрия, и затем концентрируют при пониженном давлении. Полученный остаток растирают в смеси изопропилового эфира и этилацетата (2:1), получая N-(2-метоксиэтил)-3-оксоиндан-5-карбоксамид [REx(13-1)] (1,87 г) в виде коричневого порошка.
МС (ХИАД), m/z: 234 [М+Н]+.
Ссылочный пример 14
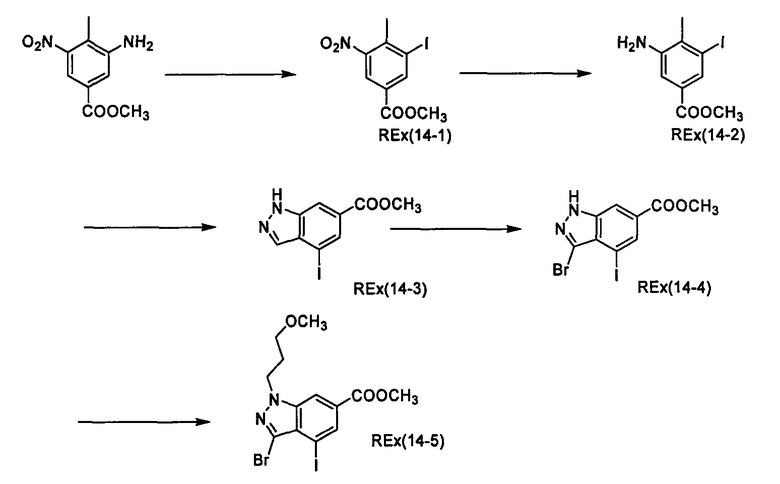
(1) Метил-3-йод-4-метил-5-нитробензоат [REx(14-1)]
К суспензии метил-3-амино-4-метил-5-нитробензоата (36,0 г) в 6-нормальной соляной кислоте (276 мл) прибавляют по каплям раствор нитрита натрия (13,0 г) в воде (35 мл) при охлаждении смесью лед-соль в течение 20 минут и смесь перемешивают при охлаждении льдом в течение 1 часа. Затем прибавляют по каплям раствор йодида калия (34,1 г) в воде (280 мл) при охлаждении льдом в течение 20 минут и смесь перемешивают при комнатной температуре в течение 2 часов. К реакционному раствору прибавляют воду при охлаждении льдом, и смесь экстрагируют хлороформом. Органический слой промывают последовательно насыщенным водным раствором тиосульфата натрия и насыщенным раствором хлорида натрия, сушат над сульфатом натрия и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=50/1), получая метил-3-йод-4-метил-5-нитробензоат [REx(14-1)] (40,5 г) в виде желтого порошка.
(2) Метил 3-амино-5-йод-4-метилбензоат [REx(14-2)]
К раствору 40,5 г соединения [REx(14-1)], полученного на описанной выше стадии (1), в этилацетате (500 мл) прибавляют дигидрат хлорида олова(II) (142 г) и смесь нагревают при перемешивании при 60°С в течение 1 часа. Водный раствор гидрокарбоната натрия вливают в реакционную смесь при охлаждении льдом и затем отфильтровывают нерастворимое вещество фильтрованием через Целит. Органический слой отделяют, затем промывают насыщенным раствором хлорида натрия, сушат над сульфатом натрия и затем концентрируют при пониженном давлении, получая метил-3-амино-5-йод-4-метилбензоат [REx(14-2)] (35,3 г) в виде светло-желтого порошка.
МС (ХИАД), m/z: 292 [М+Н]+.
(3) Метил-4-йод-1Н-индазол-6-карбоксилат [REx(14-3)]
К суспензии 35,3 г соединения, полученного на описанной выше стадии (2), в воде (615 мл) прибавляют концентрированную соляную кислоту (102 мл) и тетрафторборат аммония (16,5 г) и охлаждают смесь до -3°С. При охлаждении к смеси прибавляют по каплям раствор нитрита натрия (9,20 г) в воде (34 мл) в течение 20 минут. Смесь перемешивают при -3°С в течение 1 часа, затем выпавшие в осадок кристаллы отфильтровывают и промывают последовательно водой (100 мл) и диэтиловым эфиром (100 мл), затем сушат при пониженном давлении. Полученное твердое вещество суспендируют в хлороформе (420 мл), к суспензии прибавляют ацетат калия (13,1 г) и 18-краун-6 (801 мг) и смесь перемешивают при комнатной температуре в течение 15 часов. К реакционной смеси прибавляют воду при охлаждении льдом и затем смесь экстрагируют хлороформом. Органический слой промывают насыщенным раствором хлорида натрия, сушат над сульфатом натрия и затем концентрируют при пониженном давлении. Полученный остаток растирают в хлороформе, получая метил-4-йод-1Н-индазол-6-карбоксилат [REx(14-3)] (18,9 г) в виде светло-оранжевого порошка.
МС (ХИАД), m/z: 303 [М+Н]+.
(4) Метил-3-бром-4-йод-1Н-индазол-6-карбоксилат [REx(14-4)]
Соединение, полученное на описанной выше стадии (3), (24,5 г), растворяют в уксусной кислоте (720 мл) и после блокирования доступа света к смеси прибавляют по каплям бром (8,30 мл) при комнатной температуре. После перемешивания при комнатной температуре в течение 40 часов к смеси прибавляют 4,15 мл брома и смесь дополнительно перемешивают в течение 24 часов при комнатной температуре. Затем прибавляют уксусную кислоту (100 мл) и 4,15 мл брома и смесь перемешивают при комнатной температуре в течение 6 часов. Реакционную смесь выливают в ледяную воду, затем прибавляют тиосульфат натрия и смесь перемешивают при комнатной температуре в течение 20 минут, затем отфильтровывают твердое вещество, выпавшее в осадок. Твердое вещество промывают водой, затем растворяют в этилацетате и промывают насыщенным раствором хлорида натрия. Органический слой сушат над сульфатом натрия и затем концентрируют при пониженном давлении. Полученный остаток растирают с изопропиловым эфиром, получая метил-3-бром-4-йод-1H-индазол-6-карбоксилат [REx(14-4)] (27,3 г) в виде светло-желтого порошка.
МС (ХИАД), m/z: 381/383 [M+H]+.
(5) Метил-3-бром-4-йод-1-(3-метоксипропил)-1Н-индазол-6-карбоксилат [RExC 14-5)]
К раствору 22,3 г соединения, полученного на описанной выше стадии (4), в N,N-диметилформамиде (200 мл) прибавляют 60% гидрид натрия в масле (2,81 г) при охлаждении льдом и смесь перемешивают при комнатной температуре в течение 15 минут. К смеси прибавляют раствор 1-бром-3-метоксипропана (10,8 г) в N,N-диметилформамиде (40 мл) при охлаждении льдом и перемешивают при комнатной температуре в течение 18 часов. В реакционный раствор прибавляют 10% соляную кислоту при охлаждении льдом и затем смесь экстрагируют этилацетатом. Органический слой промывают последовательно водой и насыщенным раствором хлорида натрия, сушат над сульфатом натрия и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=9/1), получая метил-3-бром-4-йод-1-(3-метоксипропил)-1Н-индазол-6-карбоксилат [REx(14-5)] (23,5 г) в виде светло-оранжевого порошка.
МС (ХИАД), m/z: 453/455 [M+H]+.
Ссылочный пример 15
1-[4-Хлор-1-(3-метоксипропил)-3-метил-1H-индазол-6-ил]этанон [REx(15-1)]
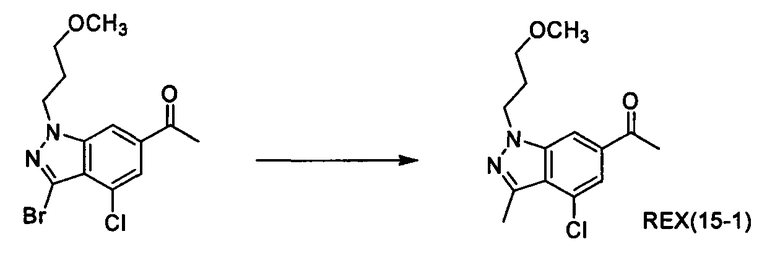
К раствору 1-[3-бром-4-хлор-1-(3-метоксипропил)-1Н-индазол-6-ил]этанона (1,0 г) в 1,4-диоксане (20 мл) прибавляют карбонат калия (1,2 г), триметилбороксин (0,41 мл) и 1,1′-бис(дифенилфосфино)ферроцендихлорпалладий(II) (212 мг) в атмосфере аргона и смесь нагревают при перемешивании и температуре 80°С в течение 24 часов. Затем к смеси прибавляют воду при охлаждении льдом и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором хлорида натрия, сушат над сульфатом магния и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на NH-силикагеле (элюент: н-гексан/этилацетат=4/1→3/2), получая 1-[4-хлор-1-(3-метоксипропил)-3-метил-1Н-индазол-6-ил]этанон [REx(15-1)] (392 мг) в виде светло-желтого масла.
МС (ХИАД), m/z: 281/283 [M+H]+.
Ссылочный пример 16
1-[1-(3-Метоксипропил)-3,4-диметил-1Н-индазол-6-ил]этанон [REx(16-1)]
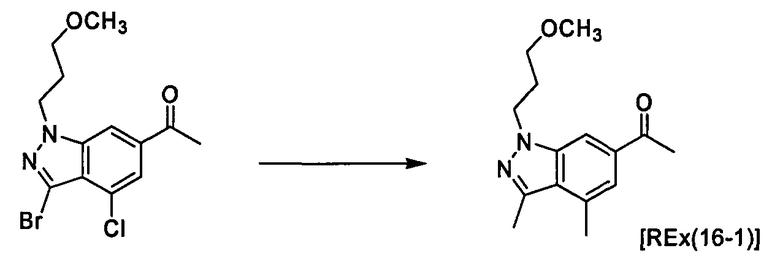
К раствору 1-[3-бром-4-хлор-1-(3-метоксипропил)-1Н-индазол-6-ил]этанона (1,0 г) в 1,4-диоксане (7,5 мл) прибавляют карбонат калия (1,2 г), триметилбороксин (1,0 мл) и 1,1′-бис(дифенилфосфино)ферроцендихлорпалладий (212 мг) в атмосфере аргона и смесь нагревают при перемешивании и температуре 110°С в течение 24 часов. Затем к смеси прибавляют воду при охлаждении льдом и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором хлорида натрия, сушат над сульфатом магния и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на NH-силикагеле (элюент: н-гексан/этилацетат=3/1→1/1), получая 1-[1-(3-метоксипропил)-3,4-диметил-1Н-индазол-6-ил]этанон [REx(16-1)] (689 мг) в виде оранжевого масла.
МС (ХИАД), m/z: 261 [М+Н]+.
Ссылочный пример 17
1-[3-Бром-1-(3-метоксипропил)-4-(трифторметил)-1Н-индазод-6-ил]этанон [REx(17-1)]
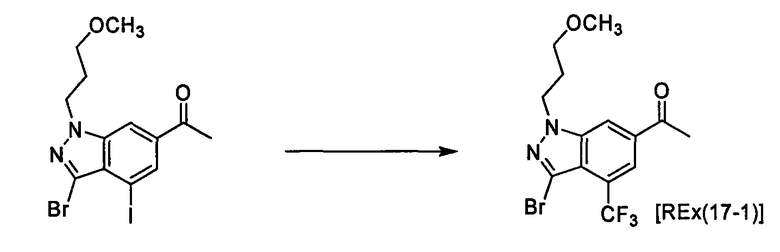
Смесь 1-[3-бром-4-йод-1-(3-метоксипропил)-1Н-индазол-6-ил]этанона (500 мг), метилфторсульфонилдифторацетата (1,36 г), гексаметилфосфориламида (1,27 г) и йодида меди(I) (337 мг) нагревают при перемешивании в N,N-диметилформамиде (7,0 мл) в атмосфере аргона при 75°С в течение 15 часов. В реакционную смесь вливают воду и этилацетат при охлаждении льдом и затем отфильтровывают нерастворимое вещество фильтрованием через целит. Органический слой отделяют и затем промывают последовательно водой и насыщенным раствором хлорида натрия, сушат над сульфатом натрия и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан→н-гексан/этилацетат=1/1), получая 1-[3-бром-1-(3-метоксипропил)-4-(трифторметил)-1Н-индазол-6-ил]этанон [REx(17-1)] (87 мг) в виде желтого масла.
МС (ХИАД), m/z: 379/381 [М+Н]+.
Ссылочный пример 18
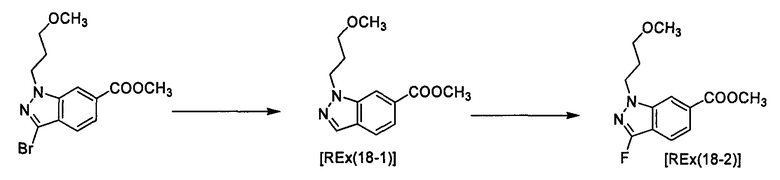
(1) Метил-1-(3-метоксипропил)-1Н-индазол-6-карбоксилат [REx(18-1)]
К раствору метил-3-бром-1-(3-метоксипропил)-1Н-индазол-6-карбоксилата (3,0 г) и диизопропилэтиламина (2,4 мл) в метаноле (60 мл) прибавляют катализатор 10% палладий на угле (600 мг) и смесь перемешивают в атмосфере водорода в течение 1 часа. Нерастворимые вещества отфильтровывают, и фильтрат концентрируют при пониженном давлении. Остаток растворяют в хлороформе, промывают последовательно 10% соляной кислотой, водой и насыщенным раствором хлорида натрия, затем концентрируют при пониженном давлении, получая метил-1-(3-метоксипропил)-1Н-индазол-6-карбоксилат [REx(18-1)] (2,40 г) в виде светло-желтого масла.
(2) Метил-3-фтор-1-(3-метоксипропил)-1Н-индазол-6-карбоксилат [REx(18-2)]
К раствору 2,20 г соединения, полученного на вышеописанной стадии (1), в ацетонитриле (30 мл) прибавляют Selectfluor (зарегистрированная торговая марка) (3,45 г) и смесь перемешивают при 80°С в течение 15 часов. Затем прибавляют водный раствор гидрокарбоната натрия при охлаждении льдом, и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором хлорида натрия, сушат над сульфатом натрия и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан→н-гексан/этилацетат=5/1), получая метил-3-фтор-1-(3-метоксипропил)-1Н-индазол-6-карбоксилат [REx(18-2)] (1,01 г) в виде бесцветного масла.
МС (ХИАД), m/z: 267 [M+H]+.
Ссылочный пример 19
1-[3-Фтор-5-(3-метоксипропокси)фенил]этанон [REx(19-2)]
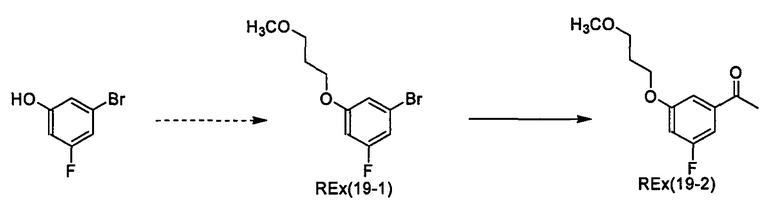
1-Бром-3-фтор-5-(3-метоксипропокси)бензол (4,0 г) прибавляют к воде (30,4 мл), затем прибавляют моновиниловый эфир этиленгликоля (6,8 мл), карбонат калия (2,52 г), 1,3-бис(дифенилфосфино)пропан (125 мг) и ацетат палладия (34 мг) и нагревают смесь при перемешивании и температуре 90°С в течение 22 часов. После охлаждения к смеси прибавляют концентрированную соляную кислоту (7,2 мл) и перемешивают при комнатной температуре в течение 20 минут. Реакционный раствор экстрагируют этилацетатом, промывают насыщенным раствором хлорида натрия и затем сушат над сульфатом магния. После концентрирования при пониженном давлении полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=20/1→2/1), получая 1-[3-фтор-5-(3-метоксипропокси)фенил]этанон [REx(19-2)] (1,03 г) в виде желтого масла.
МС (ХИАД), m/z: 227 [M+H]+.
Исходное вещество получают из 1-бром-3-фторфенола, например, способом, аналогичным описанному в ссылочном примере 11 или 12.
Ссылочный пример 20
1-[3-Гидрокси-5-(3-метоксипропокси)фенил]этанон [REx(20-1)]

К раствору 1-(3,5-дигидроксифенил)этанона (10 г) в смеси N,N-диметилформамида (164 мл) и воды (5 мл) прибавляют карбонат калия (13,6 г) и 3-метоксипропил-4-метилбензолсульфонат (16,1 г) и нагревают смесь при перемешивании и температуре 80°С в течение 2 часов. Реакционный раствор концентрируют при пониженном давлении, затем прибавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором хлорида натрия, сушат над сульфатом натрия и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=3/1→1/1), получая 1-[3-гидрокси-5-(3-метоксипропокси)фенил]этанон [REx(20-1)] (4,65 г) в виде бесцветного порошка и 1-[3,5-бис(3-метоксипропокси)фенил]этанон [REx(20-2)] (4,98 г) в виде бесцветного масла.
2: МС (ХИАД), m/z: 225 [M+H]+.
3: МС (ХИАД), m/z: 297 [М+Н]+.
Ссылочный пример 21
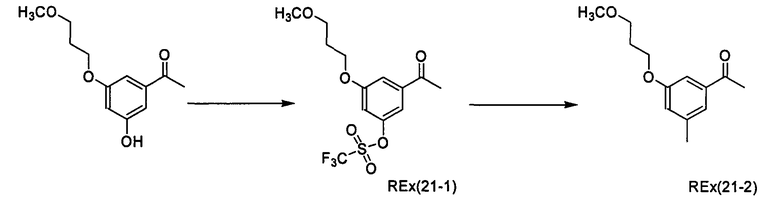
(1) 3-Ацетил-5-(3-метоксипропокси)фенилтрифторметансульфонат [REx(21-1)]
К раствору 1-[3-гидрокси-5-(3-метоксипропокси)фенил]этанона (4,65 г) в хлороформе (100 мл) прибавляют пиридин (5,02 мл) при охлаждении льдом, затем прибавляют по каплям ангидрид трифторметансульфоновой кислоты (3,67 мл) при охлаждении льдом и смесь перемешивают при той же температуре в течение 20 минут. Затем к смеси прибавляют 1-нормальную соляную кислоту, смесь экстрагируют хлороформом и органический слой промывают последовательно водой и насыщенным раствором хлорида натрия, сушат над сульфатом магния, затем концентрируют при пониженном давлении, получая продукт-сырец - 3-ацетил-5-(3-метоксипропокси)фенилтрифторметансульфонат [REx(21-1)] (8,22 г) в виде желтого масла.
МС (ХИАД), m/z: 374 [M+NH4]+.
(2) 1-[3-(3-Метоксипропокси)-5-метилфенил]этанон [REx(21-2)]
К раствору 8,22 г соединения, полученного на описанной выше стадии (1), в 1,4-диоксане (100 мл), прибавляют карбонат калия (8,6 г), триметилбороксин (3,5 мл) и 1,1′-бис(дифенилфосфино)ферроцендихлорпалладий(II) (1,51 г) и смесь нагревают при перемешивании и температуре 110°С в течение 2 часов. После охлаждения до комнатной температуры прибавляют воду, и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором хлорида натрия, сушат над сульфатом магния и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан→н-гексан/этилацетат=5/1), получая 1-[3-(3-метоксипропокси)-5-метилфенил]этанон [REx(21-2)] (4,15 г) в виде коричневого масла.
МС (ХИАД), m/z: 223 [М+Н]+.
Ссылочный пример 22
(1) 1-(4-Хлор-3,5-диметоксифенил)этанол [REx(22-2)]
К раствору 4-хлор-3,5-диметоксибензальдегида (1,0 г) в тетрагидрофуране (20 мл) прибавляют по каплям 3М раствор метилмагнийбромида в диэтиловом эфире (1,83 мл) при охлаждении льдом и смесь перемешивают при той же температуре в течение 1 часа. Затем прибавляют водный раствор хлорида аммония при охлаждении льдом и смесь экстрагируют этилацетатом. Органический слой промывают последовательно водой и насыщенным раствором хлорида натрия, затем сушат над сульфатом магния, концентрируют при пониженном давлении, получая продукт-сырец - 1-(4-хлор-3,5-диметоксифенил)этанол [REx(22-1)] (1,23 г) в виде бесцветного порошка.
МС (ХИАД), m/z: 200 [М+Н-НО]+.
(2) 1-(4-Хлор-3,5-диметоксифенил)этанон [REx(22-2)]
К раствору 1,23 г соединения, полученного на описанной выше стадии (1), в дихлорметане (28 мл) прибавляют 85% активированный диоксид марганца (5,81 г) и смесь перемешивают при 40°С в течение 4 часов. Реакционный раствор охлаждают до комнатной температуры, к нему прибавляют смесь вода-хлороформ и нерастворимое вещество отфильтровывают через целит, затем органический слой отделяют. Органический слой концентрируют при пониженном давлении, полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=10/1→1/1), получая 1-(4-хлор-3,5-диметоксифенил)этанон [REx(22-2)] (723 мг) в виде бесцветного порошка.
МС (ХИАД), m/z: 215 [M+H]+.
Ссылочный пример 23
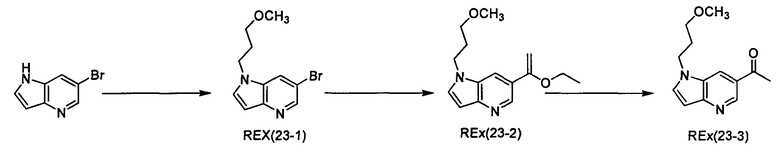
(1) 6-(1-Этоксивинил)-1-(3-метоксипропил)-1Н-пирроло[3,2-b]пиридин [REx(23-2)]
К раствору 6-бром-1-(3-метоксипропил)-1Н-пирроло[3,2-b]пиридин (1,5 г) в толуоле (30 мл) прибавляют три-н-бутилолово-1-этоксивинил (5,65 мл) и дихлорбис(трифенилфосфин)палладий(II) (782 мг), смесь нагревают при перемешивании и температуре 110°С в течение 30 минут. Реакционный раствор охлаждают до комнатной температуры, затем прибавляют смесь вода-этилацетат и нерастворимое вещество отфильтровывают через целит. Органический слой отделяют и промывают насыщенным раствором хлорида натрия, сушат над сульфатом магния и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на NH-силикагеле (элюент: н-гексан/этилацетат=4/1→1/1), получая 6-(1-этоксивинил)-1-(3-метоксипропил)-1Н-пирроло[3,2-b]пиридин [REx(23-2)] (1,69 г) в виде желтого масла.
Исходное вещество [REx(23-1)] получают 3-метоксипропилированием на азоте 6-бром-1-1Н-пирроло[3,2-b]пиридина.
МС (ХИАД), m/z: 261 [M+H]+.
(2) 1-[1-(3-Метоксипропил)-1Н-пирроло[3,2-b]пиридин-6-ил]этанон [REx(23-3)]
Соединение (1,69 г), полученное на описанной выше стадии (1), растворяют в хлороформе (20 мл), затем прибавляют 4-нормальный раствор хлорида водорода в 1,4-диоксане при охлаждении льдом и смесь перемешивают при той же температуре в течение 2 часов. Затем прибавляют насыщенный водный раствор гидрокарбоната натрия при охлаждении льдом, и смесь экстрагируют хлороформом. Органический слой промывают насыщенным раствором хлорида натрия, сушат над сульфатом магния и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на NH-силикагеле (элюент: н-гексан/этилацетат=2/1→1/1), получая 1-[1-(3-метоксипропил)-1Н-пирроло[3,2-b]пиридин-6-ил]этанон [REx(23-3)] (766 мг) в виде желтого масла.
МС (ХИАД), m/z: 233 [M+H]+.
Ссылочный пример 24
1-[4-Метокси-3-(4-метоксибутил)фенил]этанон [REx(24-1)]
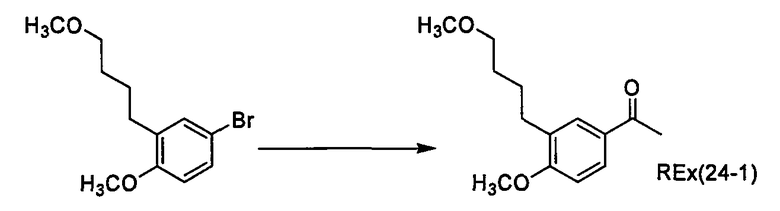
К раствору 4-бром-1-метокси-2-(4-метоксибутил)бензола (523 мг) в тетрагидрофуране (10 мл) прибавляют хлорид лития (326 мг), тетракис(трифенилфосфин)палладий(0) (381 мг) и три-н-бутил(1-этоксивинил)олово (1,11 мл) и смесь нагревают при перемешивании и температуре 80°С в течение 20 часов. Реакционный раствор охлаждают до комнатной температуры, прибавляют водный раствор фторида калия, и смесь перемешивают в течение 30 минут. Смесь экстрагируют диэтиловым эфиром, затем прибавляют 10% соляную кислоту и смесь перемешивают в течение 1 часа. Органический слой отделяют, сушат над сульфатом магния и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=9/1→1/1), получая 1-[4-метокси-3-(4-метоксибутил)фенил]этанон [REx(24-1)] (195 мг) в виде желтого масла.
МС (ХИАД), m/z: 237 [M+H]+.
Ссылочный пример 25
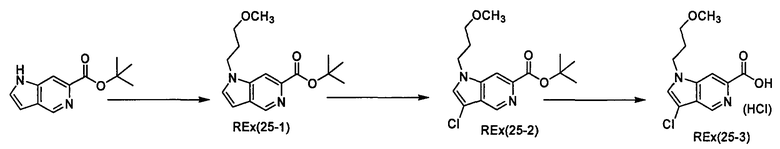
(1) трет-бутил 1-(3-метоксипропил)-1Н-пирроло[3,2-с]пиридин-6-карбоксилат [REx(25-1)]
К раствору трет-бутил-1Н-пирроло[3,2-с]пиридин-6-карбоксилата (2,0 г) в N,N-диметилформамиде (15 мл) прибавляют по каплям 60% гидрид натрия в масле (385 мг) при охлаждении льдом, смесь перемешивают при комнатной температуре в течение 15 минут. Затем прибавляют по каплям раствор 1-бром-3-метоксипропана (1,47 г) в N,N-диметилформамиде (5 мл) при охлаждении льдом и смесь перемешивают при комнатной температуре в течение 18 часов. К реакционной смеси прибавляют воду при охлаждении льдом и смесь экстрагируют этилацетатом. Органический слой промывают последовательно водой и насыщенным раствором хлорида натрия, сушат над сульфатом натрия и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=1/1), получая трет-бутил-1-(3-метоксипропил)-1Н-пирроло[3,2-с]пиридин-6-карбоксилат [REx(25-1)] (2,52 г) в виде желтого масла.
МС (ХИАД), m/z: 291 [М+Н]+.
(2) трет-бутил-3-хлор-1-(3-метоксипропил)-1Н-пирроло[3,2-с]пиридин-6-карбоксилат [REx(25-2)]
К раствору 2,52 г соединения, полученного на вышеуказанной стадии (1), в дихлорметане (50 мл) прибавляют N-хлорсукцинимид (1,50 г) при охлаждении льдом и смесь перемешивают при комнатной температуре в течение 72 часов. К реакционной смеси прибавляют воду при охлаждении льдом и смесь экстрагируют хлороформом. Органический слой промывают насыщенным раствором хлорида натрия, сушат над сульфатом натрия и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на NH-силикагеле (элюент: н-гексан/этилацетат=9/1), получая трет-бутил-3-хлор-1-(3-метоксипропил)-1Н-пирроло[3,2-с]пиридин-6-карбоксилат [REx(25-2)] (2,45 г) в виде бесцветного порошка.
МС (ХИАД), m/z: 325/327 [M+H]+.
(3) Гидрохлорид 3-хлор-1-(3-метоксипропил)-1Н-пирроло[3,2-с]пиридин-6-карбоновой кислоты [REx(25-3)]
Соединение (2,42 г), полученное на описанной выше стадии (2), прибавляют к трифторуксусной кислоте (24 мл) и смесь перемешивают при комнатной температуре в течение 2 часов. К реакционному раствору прибавляют 1-нормальный водный раствор соляной кислоты (15 мл) при охлаждении льдом и затем смесь концентрируют при пониженном давлении. Полученный остаток растирают в изопропиловом эфире, получая гидрохлорид 3-хлор-1-(3-метоксипропил)-1Н-пирроло[3,2-с]пиридин-6-карбоновой кислоты [REx(25-3)] (2,20 г) в виде коричневого порошка.
MS (ESI), m/z: 267/269 [M-H]-.
Ссылочный пример 26
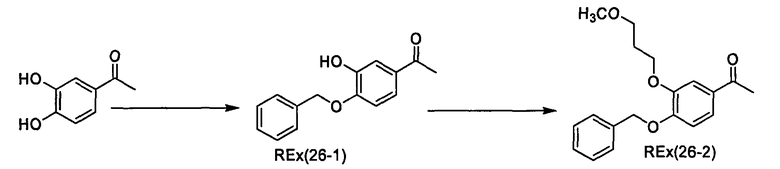
(1) 1-[4-(Бензилокси)-3-гидроксифенил]этанон [REx(26-1)]
К раствору 3′,4′-дигидроксиацетофенона (25,4 г) в N,N-диметилацетамиде (420 мл) прибавляют карбонат калия (23,1 г) и бензилбромид (19,9 мл) при охлаждении льдом и смесь перемешивают при комнатной температуре в течение 90 минут. Нерастворимое вещество отфильтровывают и затем разбавляют этилацетатом. Органический слой промывают последовательно водой и насыщенным раствором хлорида натрия, сушат над сульфатом магния и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан→н-гексан/этилацетат=20/1), затем растирают в этилацетате, получая 1-[4-(бензилоху)-3-гидроксифенил]этанон [REx(26-1)] (11,0 г) в виде бесцветного порошка.
МС (ХИАД), m/z: 243 [М+Н]+.
(2) 1-[4-(Бензилокси)-3-(3-метоксипропил)фенил]этанон [REx(26-2)]
К раствору 11,0 г соединения, полученного на описанной выше стадии (1), в ацетонитриле (113 мл) прибавляют карбонат калия (9,37 г) и 3-метоксипропил-4-метилбензолсульфонат (13,2 г) и смесь нагревают и кипятят с обратным холодильником в течение 20 часов. Реакционный раствор охлаждают до комнатной температуры, затем прибавляют воду и смесь экстрагируют этилацетатом. Органический слой сушат над сульфатом магния и затем концентрируют при пониженном давлении. Полученный остаток растирают в диизопропиловом эфир, получая 1-[4-(бензилокси)-3-(3-метоксипропил)фенил]этанон [REx(26-2)] (8,75 г) в виде бесцветного порошка.
МС (ХИАД), m/z: 315 [M+H]+.
Ссылочный пример 27
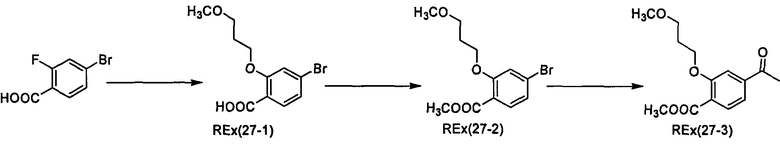
(1) 4-Бром-2-(3-метоксипропокси)бензойная кислота [REx(27-1)]]
К раствору 3-метокси-1-пропанола (5,02 г) в N,N-диметилформамиде (37 мл) прибавляют 60% гидрид натрия в масле (2,05 г) и смесь перемешивают при комнатной температуре в течение 30 минут. Затем прибавляют по каплям раствор 4-бром-2-фторбензойной кислоты (300 мг) в N,N-диметилформамиде (60 мл) и смесь перемешивают при комнатной температуре в течение 20 часов. К реакционному раствору прибавляют воду и н-гексан, затем смешанный раствор подкисляют концентрированной соляной кислотой. Полученный бесцветный порошок отфильтровывают, получая 4-бром-2-(3-метоксипропокси)бензойную кислоту [REx(27-1)] (4,43 г).
MS (ESI), m/z: 289 [М-Н]-.
(2) Метил 4-бром-2-(3-метоксипропокси)бензоат [REx(27-2)]
К смеси 4,42 г соединения, полученного на описанной выше стадии (1), и карбоната калия (4,22 г) прибавляют N,N-диметилформамид (20 мл), затем прибавляют метилйодид (1,43 мл) и смесь перемешивают при комнатной температуре в течение 30 минут. После охлаждения к реакционному раствору прибавляют воду, и смесь экстрагируют этилацетатом. Органический слой промывают последовательно водой (2 раза) и насыщенным раствором хлорида натрия, сушат над сульфатом магния и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=20/1→3/1), получая метил-4-бром-2-(3-метоксипропокси)бензоат [REx(27-2)] (4,01 г) в виде бесцветного масла.
МС (ХИАД), m/z: 343/305 [М+Н]+.
(3) Метил-4-ацетил-2-(3-метоксипропокси)бензоат [REx(27-3)]
К раствору 4,0 г соединения, полученного на описанной выше стадии (2) в толуоле (44 мл) прибавляют три(н-бутил)(1-этоксивинил)олово (8,90 мл) и дихлорбис(трифенилфосфин)палладий(II) (1,85 г) и смесь нагревают при перемешивании при 100°С в течение 17 часов. Реакционный раствор охлаждают до комнатной температуры, затем прибавляют 4-нормальный раствор хлорида водорода в 1,4-диоксане (24 мл) и смесь перемешивают при комнатной температуре в течение 1 часа. К реакционному раствору прибавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором хлорида натрия, затем прибавляют сульфат магния и NH-силикагель, нерастворимое вещество отфильтровывают. Фильтрат концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=20/1), получая метил-4-ацетил-2-(3-метоксипропокси)бензоат [REx(27-3)] (1,02 г) в виде желтого масла.
МС (ХИАД), m/z: 267 [M+H]+.
Ссылочный пример 28
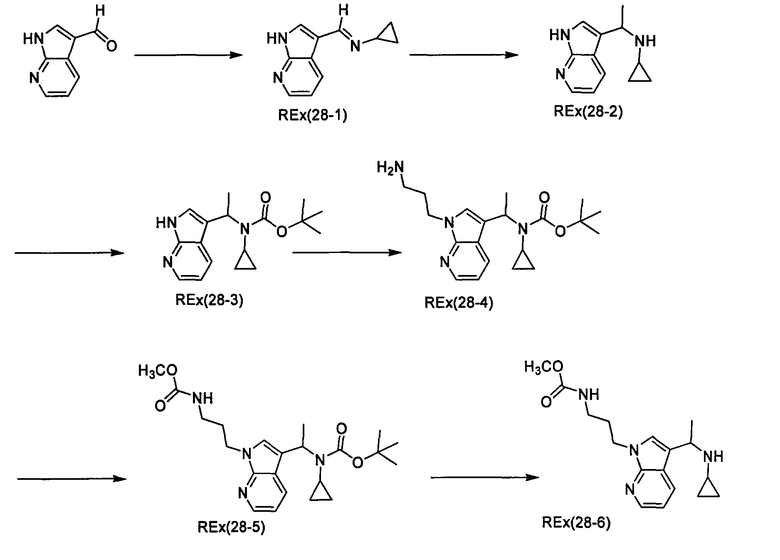
(1) N-[(1Е)-1Н-Пирроло[2,3-b]пиридин-3-илметилен]циклопропиламин [REx(28-1)]
К суспензии 1Н-пирроло[2,3-b]пиридин-3-карбальдегида (1,46 г) в этаноле (30 мл) прибавляют циклопропиламин (1,41 мл) и смесь перемешивают при 50°С в течение 19 часов. Реакционный раствор концентрируют при пониженном давлении и затем подвергают азеотропной обработке толуолом. Полученный остаток растирают со смесью изопропиловый эфир/н-гексан (3:1), получая N-[(1Е)-1Н-пирроло[2,3-b]пиридин-3-илметилепе]циклопропиламин [REx(28-l)] (1,75 г) в виде бесцветного порошка.
МС (ХИАД), m/z: 186 [М+Н]+.
(2) N-[1-(1Н-Пирроло[2,3-b]пиридин-3-ил)этил]циклопропиламин [REx(28-2)]
К суспензии 1,11 г соединения, полученного на описанной выше стадии (1), и 1-(триметилсилил)-1Н-бензотриазола (2,20 мл) в толуоле (50 мл) прибавляют по каплям 3М раствор метилмагнийбромида в диэтиловом эфире (10 мл) при охлаждении льдом в течение 10 минут и смесь перемешивают при 110°С в течение 6 часов. Реакционный раствор выливают в охлаждаемый льдом раствор хлорида аммония и экстрагируют этилацетатом. Нерастворимое вещество отфильтровывают, органический слой отделяют и водный слой экстрагируют хлороформом. Органические слои объединяют, сушат над сульфатом натрия и затем концентрируют при пониженном давлении. Полученный остаток растворяют в этилацетате и экстрагируют 10% водным раствором лимонной кислоты. Водный слой подщелачивают водным раствором карбоната калия и затем экстрагируют хлороформом. Органический слой сушат над сульфатом натрия, затем концентрируют при пониженном давлении, получая продукт-сырец - N-[1-(1Н-пирроло[2,3-b]пиридин-3-ил)этил]циклопропиламин [REx(28-2)] (800 мг) в виде желтого масла.
(3) трет-Бутил циклопропил [1-(1Н-пирроло[2,3-b]пиридин-3-ил)этил]карбамат [REx(28-3)]
К раствору 800 мг соединения, полученного на описанной выше стадии (2), и карбоната калия (1,10 г) в смеси тетрагидрофурана (10 мл) и воды (10 мл) прибавляют раствор ди-трет-бутилдикарбоната (786 мг) в тетрагидрофуране (1 мл) и смесь перемешивают при комнатной температуре в течение 6 часов. К реакционному раствору прибавляют воду, и смесь экстрагируют этилацетатом. Органический слой промывают последовательно водой и насыщенным раствором хлорида натрия, сушат над сульфатом натрия и затем концентрируют при пониженном давлении. Полученный остаток растворяют в ацетонитриле (20 мл), прибавляют гидроксид натрия (320 мг) и гидросульфат тетрабутиламмония (68 мг) и смесь перемешивают при 50°С в течение 30 минут. Реакционный раствор охлаждают, нерастворимое вещество отфильтровывают, и фильтрат концентрируют при пониженном давлении. Полученный остаток растворяют в этилацетате и промывают водой. Органический слой сушат над сульфатом натрия и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=3/1→1/3), получая трет-бутилциклопропил [1-(1Н-пирроло[2,3-b]пиридин-3-ил)этил]карбамат [REx(28-3)] (338 мг) в виде светло-желтого масла.
МС (ХИАД), m/z: 302 [M+H]+.
(4) трет-Бутил {1-[1-(3-аминопропил)-1Н-пирроло[2,3-b]пиридин-3-ил]этил}циклопропилкарбамат [REx(28-4)]
К раствору 301 мг соединения, полученного на описанной выше стадии (3), в ацетонитриле (10 мл) прибавляют гидроксид натрия (300 мг) и гидросульфат тетрабутиламмония (17 мг) и смесь перемешивают при комнатной температуре в течение 15 минут. Затем прибавляют гидрохлорид 3-хлорпропиламина (650 мг) и смесь перемешивают при 70°С в течение 4 часов. Реакционный раствор охлаждают, затем отфильтровывают нерастворимое вещество, и фильтрат концентрируют при пониженном давлении. Полученный остаток растворяют в этилацетате и промывают последовательно водой и насыщенным раствором хлорида натрия. Органический слой сушат над сульфатом натрия, затем концентрируют при пониженном давлении, получая продукт-сырец - трет-бутил {1-[1-(3-аминопропил)-1Н-пирроло[2,3-b]пиридин-3-ил]этил}циклопропилкарбамат [REx(28-4)] (378 мг) в виде желтого масла.
МС (ХИАД), m/z: 359 [M+H]+.
(5) Метил [3-(3-{1-[(трет-бутоксикарбонил)(циклопропил)амино]этил}-1Н-пирроло[2,3-b]пиридин-1-ил)пропил]карбамат [REx(28-5)]
К раствору 370 мг соединения, полученного на описанной выше стадии (4), в хлороформе (10 мл) прибавляют пиридин (0,25 мл) и метилхлороформиат (0,16 мл) при охлаждении льдом и смесь перемешивают при комнатной температуре в течение 2 часов. Реакционный раствор концентрируют и затем подвергают азеотропной обработке Полученный остаток растворяют в хлороформе и промывают 1-нормальным водным раствором гидрокарбоната натрия. Органический слой сушат над сульфатом натрия и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=1/1→этилацетат), получая метил [3-(3-{1-[(трет-бутоксикарбонил)(циклопропил)амино]этил}-1Н-пирроло[2,3-b]пиридин-1-ил)пропил]карбамат [REx(28-5)] (203 мг) в виде бесцветного масла.
МС (ХИАД), m/z: 417 [M+H]+.
(6) Метил (3-{3-[1-(циклопропиламино)этил]-1Н-пирроло[2,3-b]пиридин-1-ил}пропил)карбамат [REx(28-6)]
К раствору 187 мг соединения, полученного на описанной выше стадии (5), и 0,157 мл 2,6-лутидина в 4 мл дихлорметана (4 мл) прибавляют триметилсилилтрифлат (0,180 мкл) при охлаждении льдом и смесь перемешивают при той же температуре в течение 1 часа. Затем прибавляют насыщенный водный раствор гидрокарбоната натрия и метанол (2 мл) при охлаждении льдом и смесь экстрагируют хлороформом. Органический слой сушат над сульфатом магния и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: хлороформ-»хлороформ/метанол=5/1→хлороформ/метанол/водный раствор аммиака=50/10/1), получая метил (3-{3-[1-(циклопропиламино)этил]-1Н-пирроло[2,3-b]пиридин-1-ил}пропил)карбамат [REx(28-6)] (89 мг) в виде бесцветного масла.
Ссылочный пример 29
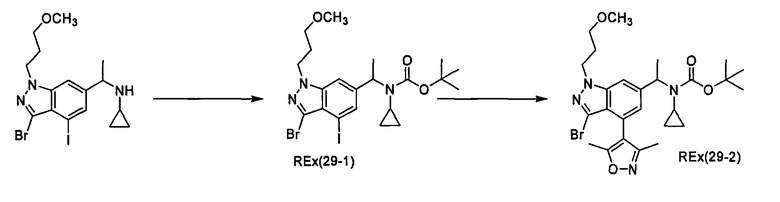
(1) трет-Бутил N-{1-[3-бром-4-йод-1-(3-метоксипропил)-1Н-индазол-6-ил]этил}циклопропилкарбамат [REx(29-1)]
К раствору N-{1-[3-бром-4-йод-1-(3-метоксипропил)-1Н-индазол-6-ил]этил}циклопропанамина (10,2 г) в дихлорметане (200 мл) прибавляют ди-трет-бутилдикарбонат (5,12 г) при охлаждении льдом и смесь перемешивают при комнатной температуре в течение 21 часов. Затем прибавляют диметиламинопиридин (261 мг) и смесь перемешивают дополнительно 6 часов при комнатной температуре. К реакционному раствору прибавляют воду при охлаждении льдом, и смесь экстрагируют хлороформом. Органический слой промывают насыщенным раствором хлорида натрия, сушат над сульфатом натрия, и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=9/1→4/1), получая трет-бутил-N-{1-[3-бром-4-йод-1-(3-метоксипропил)-1Н-индазол-6-ил]этил}циклопропилкарбамат [REx(29-1)] (7,62 г) в виде желтого масла.
(2) трет-Бутил {1-[3-бром-4-(3,5-диметилизоксазол-4-ил)-1-(3-метоксипропил)-1Н-индазол-6-ил]этил)циклопропилкарбамат [REx(29-2)]
К раствору 300 мг соединения, полученного на описанной выше стадии (1), и 146 мг 3,5-диметилизоксазол-4-бороновой кислоты в 5,0 мл диметоксиэтана прибавляют 2М водный раствор карбоната натрия (2,6 мл) в атмосфере аргона и затем прибавляют тетракис(трифенилфосфин)палладий(0) (30 мг) и смесь перемешивают при 105°С в течение 22 часов. Затем к смеси прибавляют воду при охлаждении льдом и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором хлорида натрия, сушат над сульфатом натрия и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан→н-гексан/этилацетат=3/2), получая трет-бутил {1-[3-бром-4-(3,5-диметилизоксазол-4-ил)-1-(3-метоксипропил)-1Н-индазол-6-ил]этил}циклопропилкарбамат [REx(29-2)] (154 мг) в виде бесцветного масла.
МС (ХИАД), m/z: 547/549 [M+H]+.
Удаление защитной Boc группы осуществляют способом, описанным выше.
Ссылочный пример 30
трет-Бутилциклопропил {1-[1-(3-метоксипропил)-1Н-индазол-6-ил]этил}карбамат [REx(30-1)]
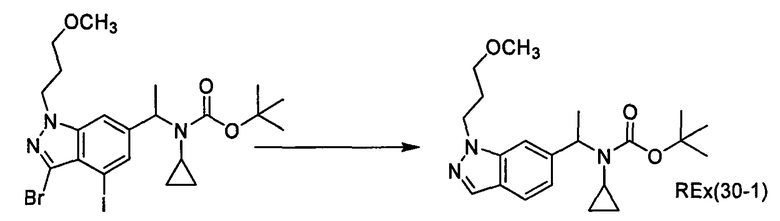
К раствору трет-бутил-N-{1-[3-бром-4-йод-1-(3-метоксипропил)-1Н-индазол-6-ил]этил}циклопропилкарбамата (1,0 г) в 1,4-диоксане (20 мл) прибавляют диизопропилэтиламин (0,90 мл) и катализатор 10% палладий на угле (200 мг), смесь перемешивают в атмосфере водорода в течение 42 часов. Нерастворимое вещество отфильтровывают, и фильтрат промывают последовательно насыщенным водным раствором гидрокарбоната натрия и насыщенным раствором хлорида натрия, сушат над сульфатом натрия и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=9/1→4/1), получая трет-бутилциклопропил {1-[1-(3-метоксипропил)-1Н-индазол-6-ил]этил}карбамат [REx(30-1)] (167 мг) в виде бесцветного масла.
МС (ХИАД), m/z: 374 [М+Н]+.
Ссылочный пример 31
N-{1-[3-(3-Метоксипропил)-5-(трифторметил)фенил]этил}циклопропанамин [REx(31-1)]
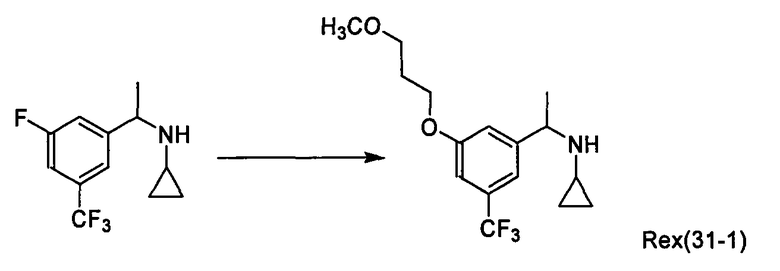
К раствору 3-метокси-1-пропанола (0,14 мл) в N,N-диметилформамиде (3,0 мл) прибавляют 60% суспензию гидрида натрия в масле (97 мг) и смесь перемешивают при комнатной температуре в течение 10 минут. Затем прибавляют по каплям раствор N-{1-[3-фтор-5-(трифторметил)фенил]этил}циклопропиламина (300 мг) в N,N-диметилформамиде (1,0 мл) и смесь нагревают при перемешивании и температуре 40°С в течение 4 часов. После охлаждения до комнатной температуры прибавляют воду, и смесь экстрагируют этилацетатом. Органический слой промывают последовательно водой и насыщенным раствором хлорида натрия, сушат над сульфатом магния и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=10/1→2/3), получая N-{1-[3-(3-метоксипропил)-5-(трифторметил)фенил]этил}циклопропанамин [REx(31-1)] (227 мг) в виде бесцветного масла.
МС (ХИАД), m/z: 318 [M+H]+.
Ссылочный пример 32
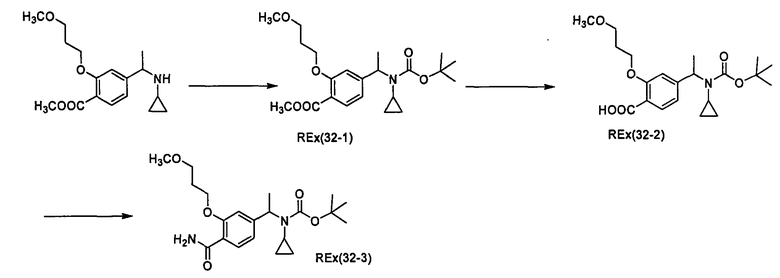
(1) Метил-4-{1-[(трет-бутоксикарбонил)(циклопропил)амино]этил}-2-(3-метоксипропокси)бензоат [REx(32-1)]
К раствору метил-4-[1-(циклопропиламино)этил]-2-(3-метоксипропокси)бензоата (1,20 г) в хлороформе (9,6 мл) прибавляют ди-трет-бутилдикарбонат (2,00 г) и триэтиламин (2,34 мл) при охлаждении льдом и смесь перемешивают при комнатной температуре в течение 20 часов. К реакционному раствору прибавляют воду при охлаждении льдом, и смесь экстрагируют хлороформом. Органический слой сушат над сульфатом магния и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=10/1→2/1), получая метил-4-{1-[(трет-бутоксикарбонил)(циклопропил)амино]этил}-2-(3-метоксипропокси)бензоат (7,62 г) в виде бесцветного масла.
МС (ХИАД), m/z: 408 [M+H]+.
(2) 4-{1-[(трет-БутоксикарбонилУциклопропил)амино]этил}-2-(3-метоксипропокси)бензойная кислота [REx(32-2)]
К раствору 1,10 г соединения, полученного на описанной выше стадии (1), в метаноле (13,5 мл) прибавляют 2-нормальный водный раствор гидроксида натрия (13,5 мл) и смесь перемешивают при комнатной температуре в течение 2 часов. К реакционному раствору прибавляют хлороформ, затем прибавляют 2-нормальную соляную кислоту (13,5 мл) при охлаждении льдом. Органический слой отделяют, промывают водой, сушат над сульфатом магния и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: хлороформ→хлороформ/метанол=20/1), получая 4-{1-[(трет-бутоксикарбонил)(циклопропил)амино]этил}-2-(3-метоксипропокси)бензойную кислоту (1,14 г) в виде бесцветного масла.
ESI-MS m/z: 392 [M-H]-.
(3) трет-Бутил {1-[4-(аминокарбонил)-3-(3-метоксипропокси)фенил]этил}циклопропилкарбамат [REx(32-3)]
К раствору 250 мг соединения, полученного на описанной выше стадии (2), в N,N-диметилформамиде (3,2 мл) прибавляют хлорид аммония (40,8 мг), диизопропилэтиламин (0,133 мл), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (146 мг) и 1-гидроксибензотриазол (103 мг), затем смесь перемешивают при комнатной температуре в течение 30 минут. К реакционной смеси прибавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают последовательно водой и насыщенным раствором хлорида натрия и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=3/2→1/6), получая трет-бутил{1-[4-(аминокарбонил)-3-(3-метоксипропокси)фенил]этил}циклопропилкарбамат (164 мг) в виде бесцветного масла.
МС (ХИАД), m/z: 393 [М+Н]+.
Удаление защитной Boc группы осуществляют аналогично способом, описанным выше.
Ссылочный пример 33
2-[1-(Циклопропиламино)этил]хиназолин-4(3Н)-он [REx(33-1)]
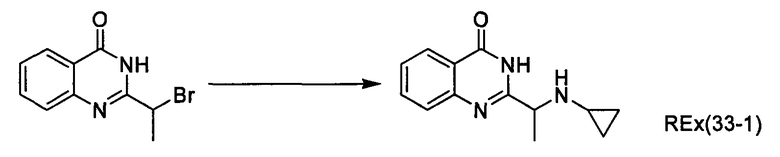
К суспензии 2-(1-бромэтил)хиназолин-4(3Н)-она (2,53 г) в N,N-диметилформамиде (30 мл) прибавляют циклопропиламин (3,46 мл) и смесь разбавляют N,N-диметилформамидом (20 мл) и водой (1 мл), затем перемешивают в течение 18 часов. Реакционный раствор концентрируют при пониженном давлении, к остатку прибавляют водный раствор гидрокарбоната натрия и затем смесь экстрагируют хлороформом. Органический слой сушат над сульфатом натрия и затем концентрируют при пониженном давлении. Полученный остаток растирают со смесью диизопропиловый эфир/этилацетат (20:1), получая 2-[1-(циклопропиламино)этил]хиназолин-4(3Н)-он [REx(33-1)] (1,71 г) в виде бесцветного порошка.
МС (ХИАД), m/z: 230 [M+H]+.
Ссылочные примеры 34-100
Соединения, указанные далее в ссылочных примерах 34-100, получают способами, вышеописанными в ссылочных примерах. Каждый символ, обозначающий способы от А-1 до F, относится к каждому способу в соответствии с указанием способов в ссылочных примерах.
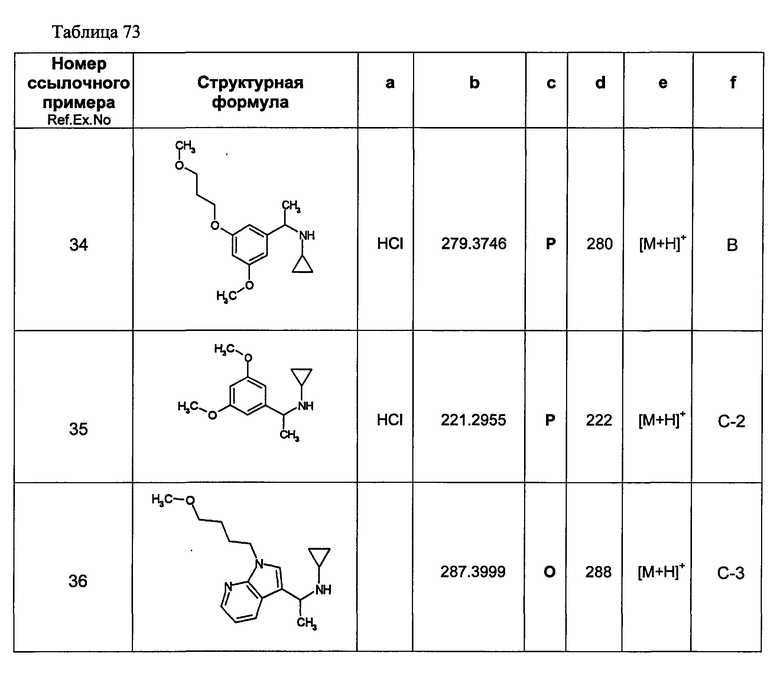
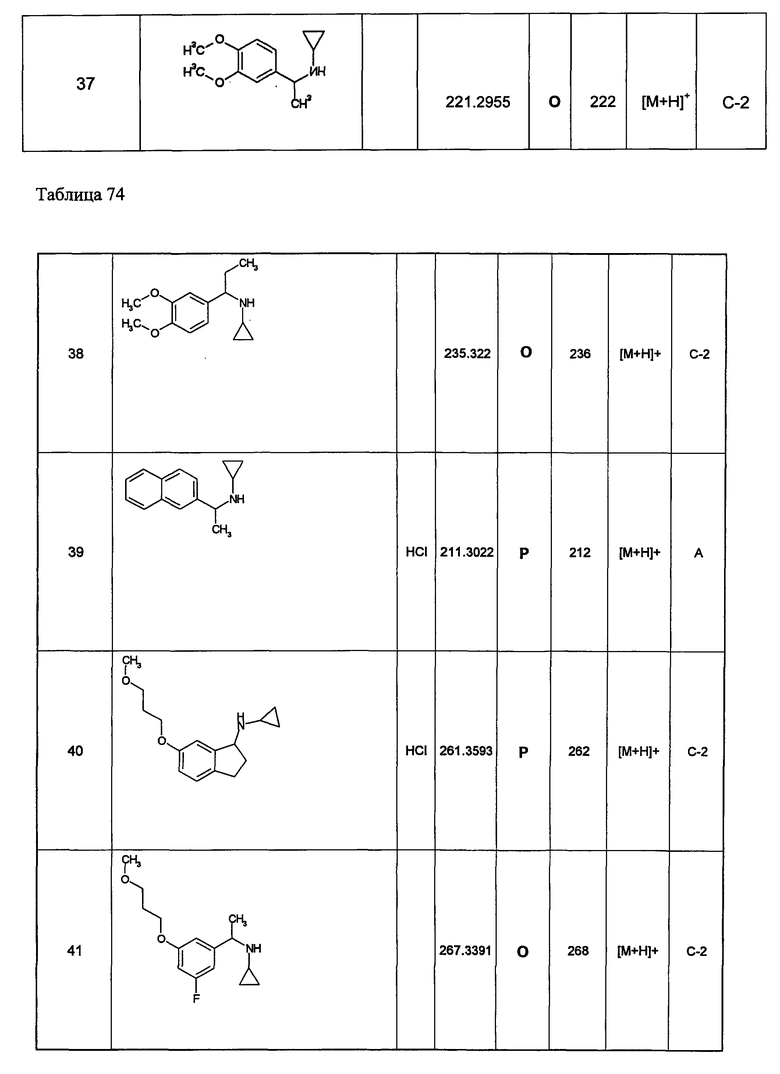
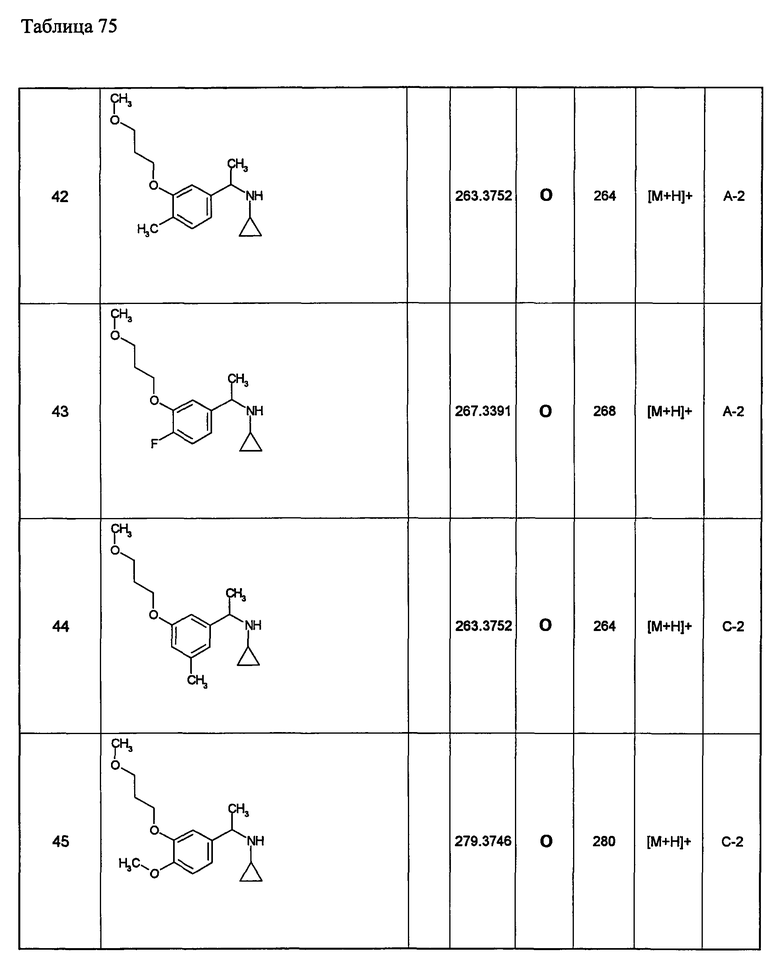

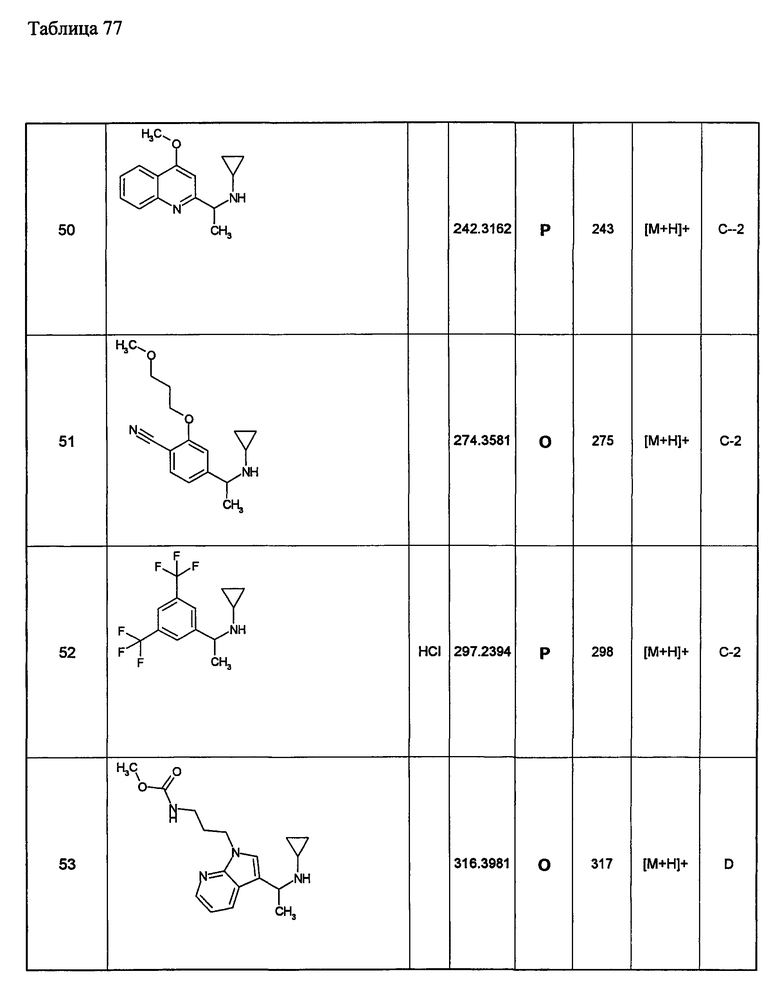
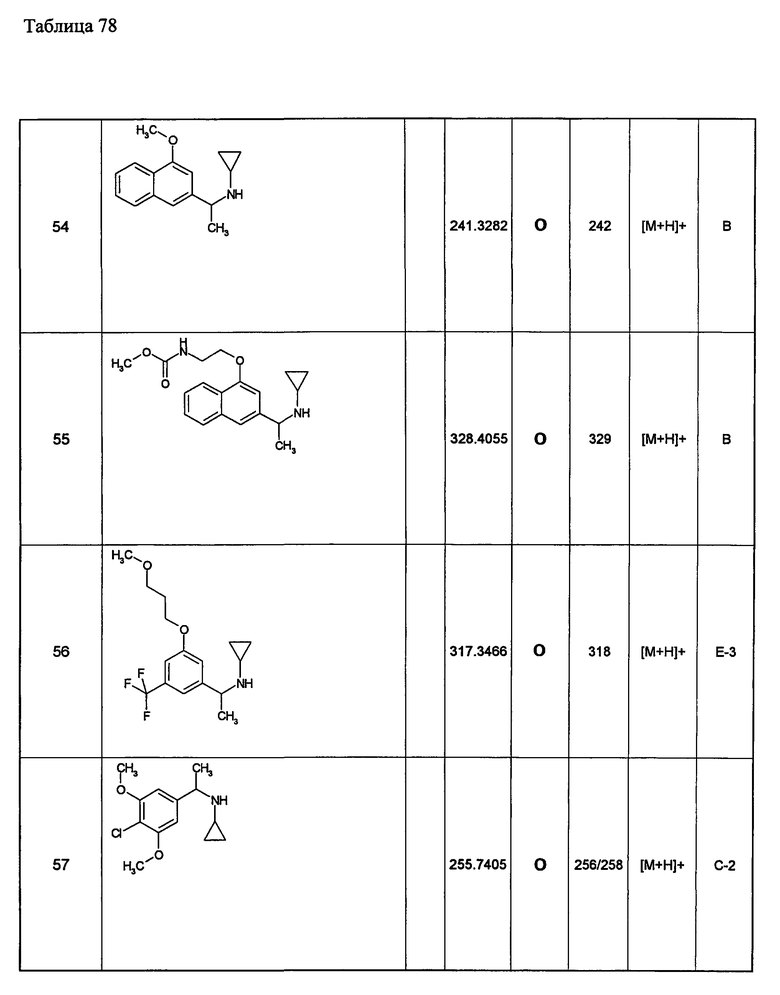
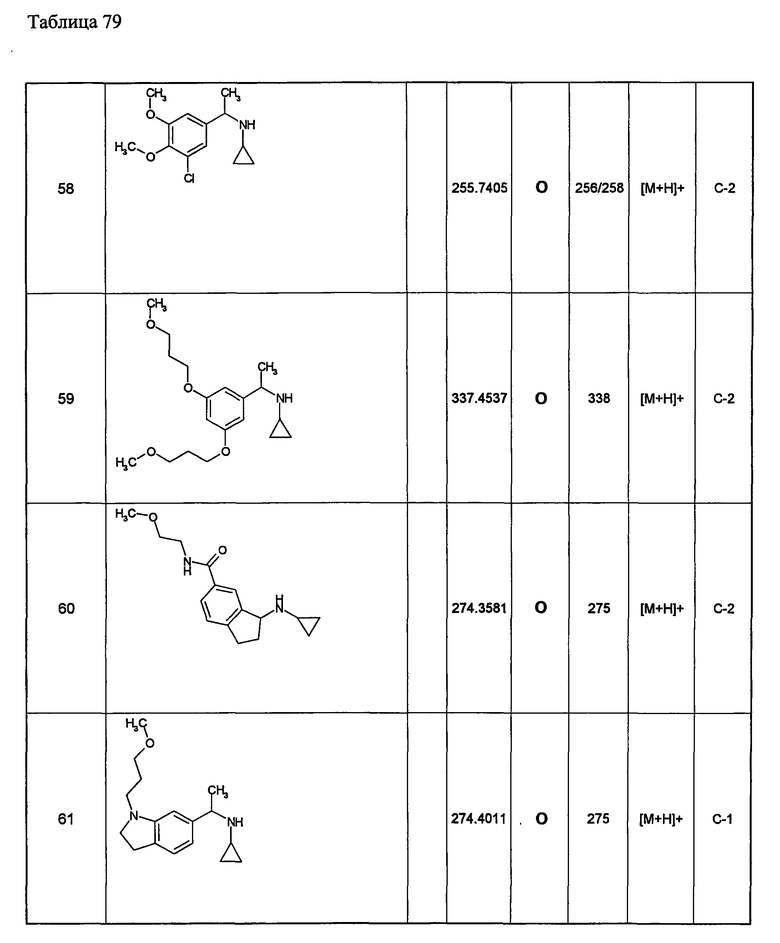
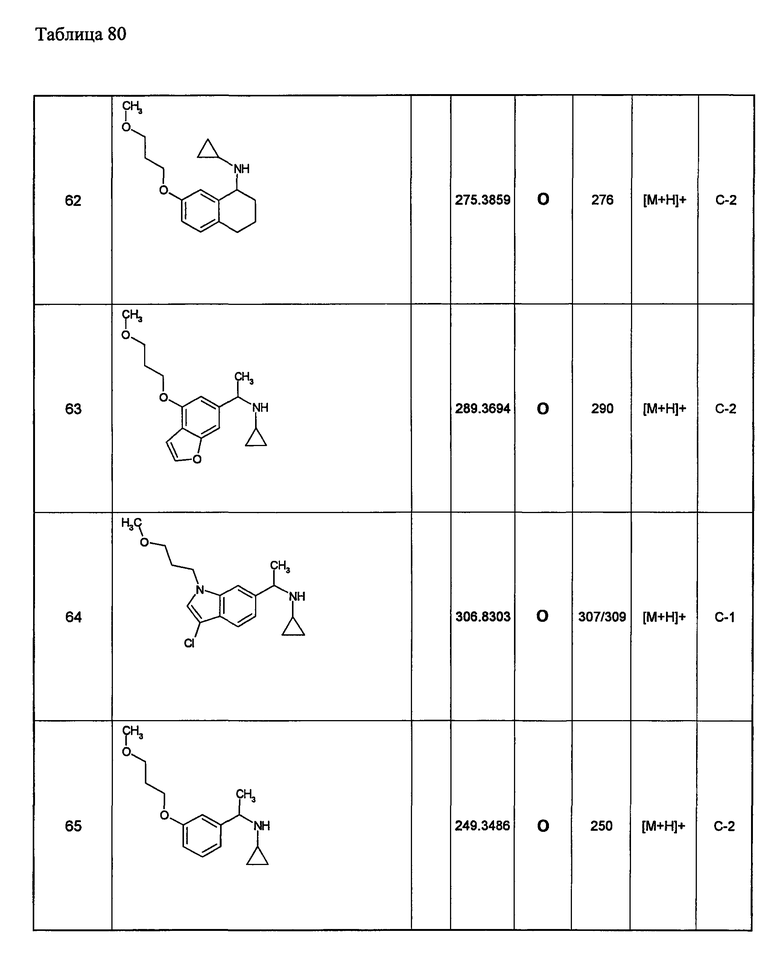
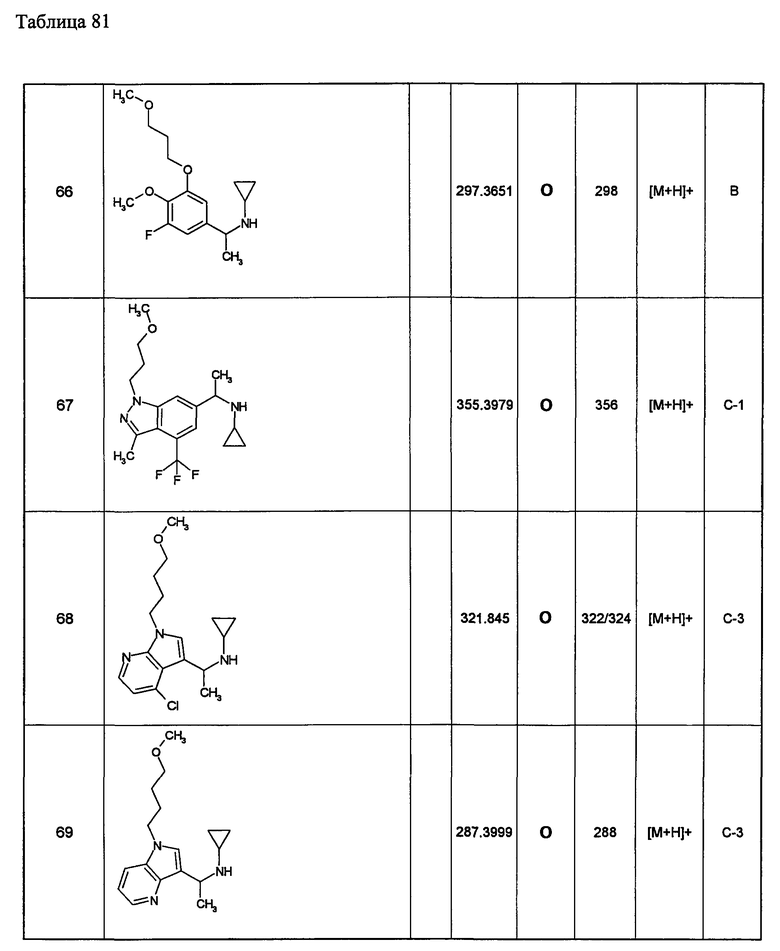
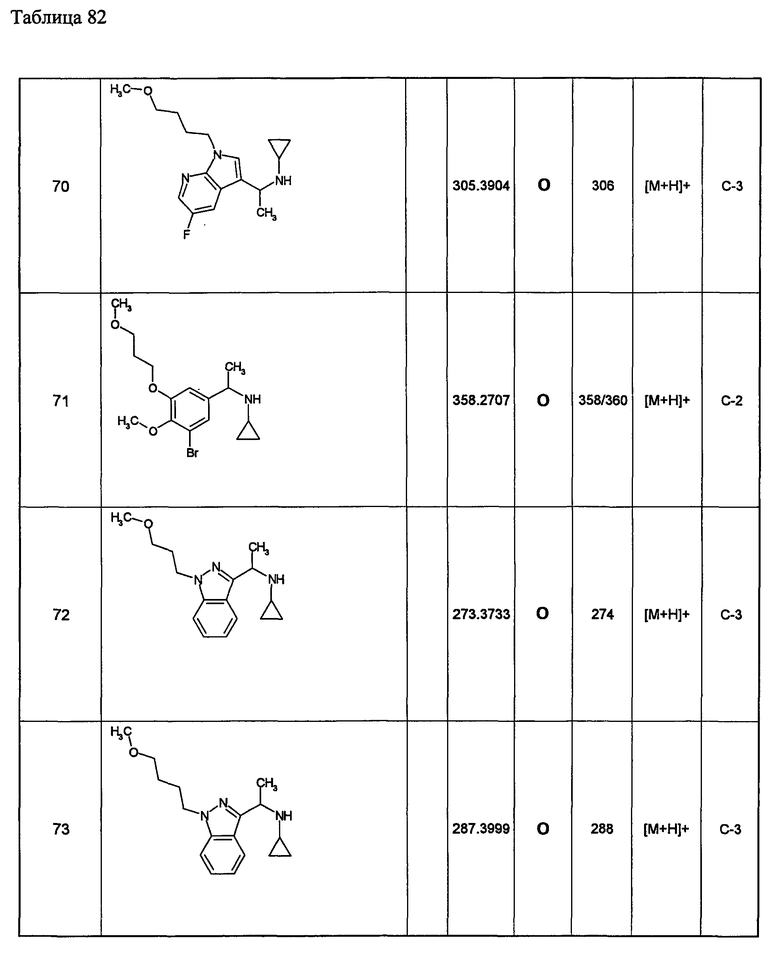
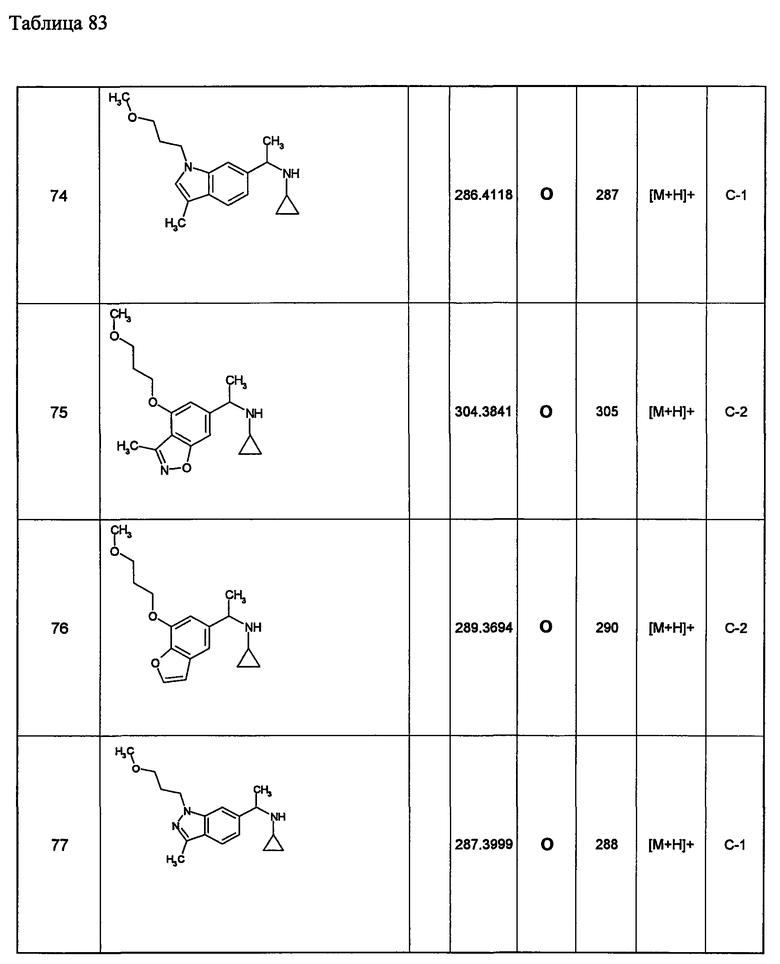

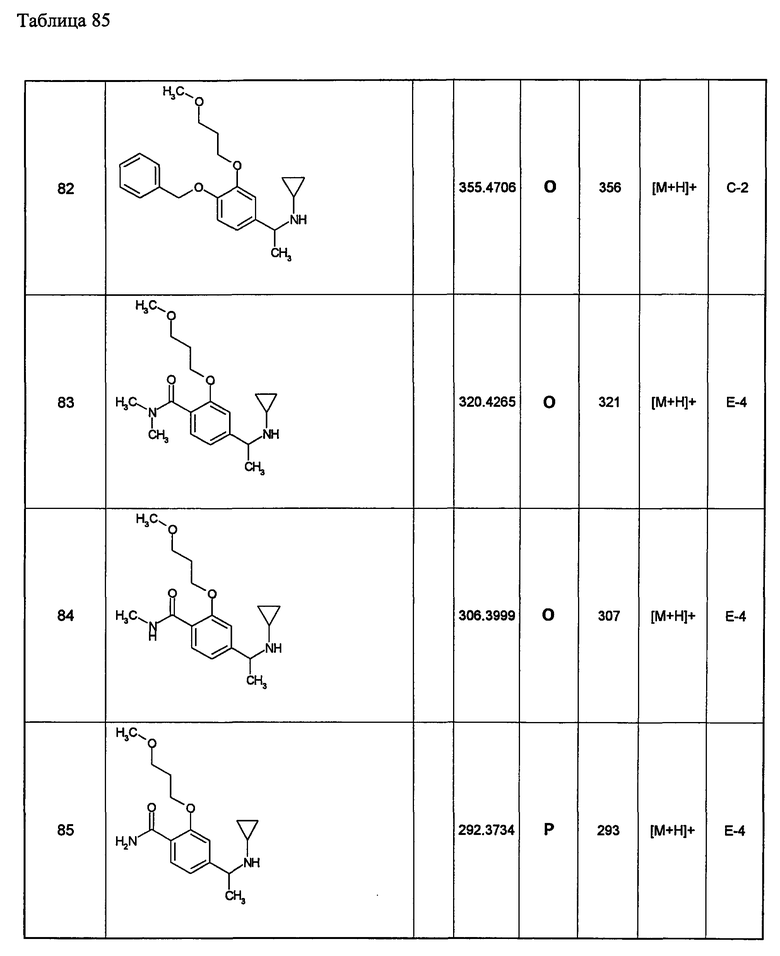
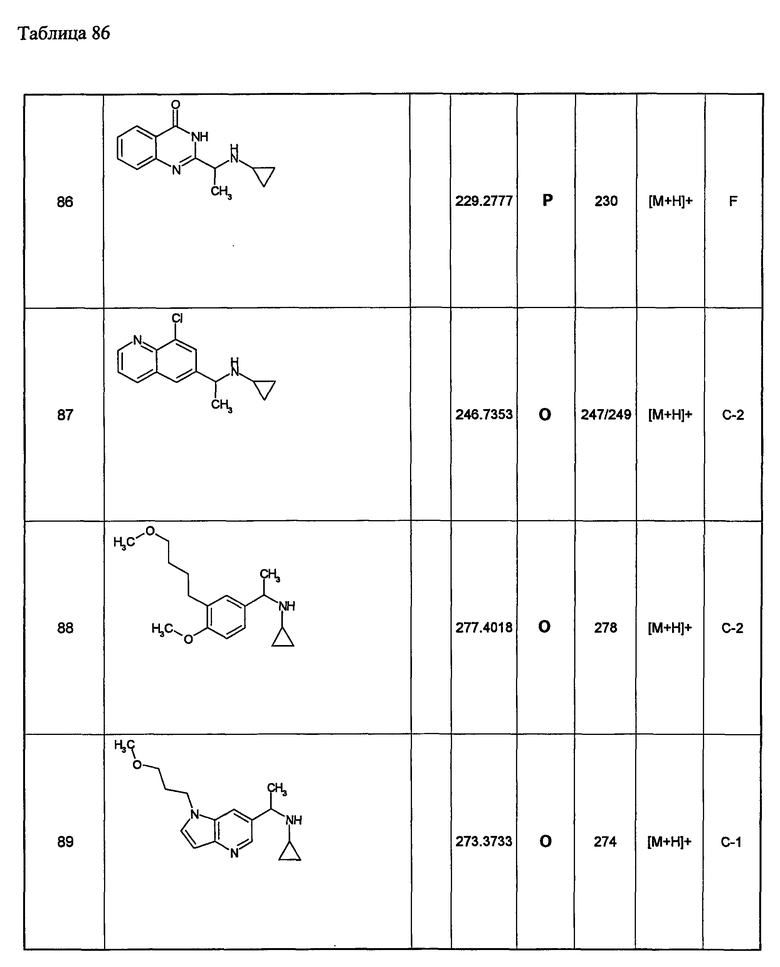
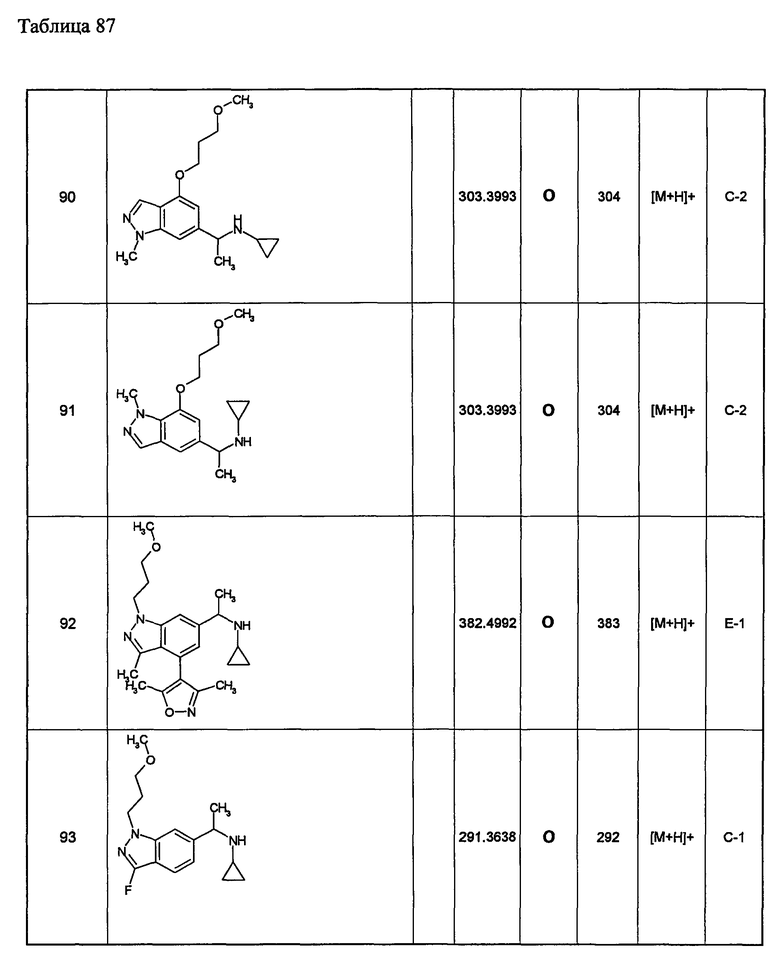
Ссылочный пример 101
Метил-3-ацетил-1Н-индазол-1-карбоксилат
К раствору 1-(1Н-индазол-3-ил)этанона (5,0 г) и триэтиламина (6,53 мл) в хлороформе (80 мл) прибавляют по каплям раствор метилхлоркарбоната (3,24 г) в хлороформе (20 мл) при охлаждении льдом в течение 1 часа и смесь перемешивают при комнатной температуре в течение 14 часов. Реакционный раствор промывают водным насыщенным раствором хлорида натрия, сушат над сульфатом магния, и затем концентрируют при пониженном давлении. Полученный остаток растирают с н-гексаном, получая метил-3-ацетил-1Н-индазол-1-карбоксилат) [REx(101-1)] (6,67 г) в виде бесцветного порошка.
МС (ХИАД), m/z: 219 [M+H]+.
Ссылочный пример 102
Метил-[3-(3-ацетил-6-фтор-1Н-индазол-1-ил)пропил]карбамат [REx(102-2)]
(1) К раствору 6-фтор-3-йод-1H-индазола (1,5 г) и метил (3-бромпропил)карбамата (1,68 г) в N,N-диметилформамиде (5 мл) прибавляют карбонат калия (1,58 г) и смесь перемешивают при комнатной температуре в течение 3 дней. К реакционному раствору прибавляют этилацетат и смесь промывают насыщенным водным раствором хлорида натрия, сушат над сульфатом магния и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=1/20→3/2), получая метил [3-(6-фтор-3-йод-1Н-индазол-1-ил)пропил]карбамат [REx(102-1)] (836 мг) в виде красного масла.
МС (ХИАД), m/z: 378 [M+H]+.
(2) К раствору 830 мг соединения, полученного на описанной выше стадии (1), в 1,4-диоксане (10 мл) прибавляют три(н-бутил)(1-этоксивинил)олово (1,03 г) и дихлорбис(трифенилфосфин)палладий(II) (155 мг), смесь нагревают и кипятят с обратным холодильником в течение 17 часов. Реакционный раствор охлаждают до комнатной температуры, прибавляют раствор фторида калия (250 мг) в воде (3 мл) и смесь перемешивают при комнатной температуре в течение 15 минут, затем прибавляют 1-нормальную соляную кислоту (5 мл) и смесь перемешивают при комнатной температуре в течение 1 часа, затем отфильтровывают нерастворимое вещество. К фильтрату прибавляют этилацетат, смесь промывают насыщенным водным раствором хлорида натрия, сушат над сульфатом магния и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=20/1→1/1), получая метил [3-(3-ацетил-6-фтор-1Н-индазол-1-ил)пропил]карбамат [REx(102-2)] (437 мг) в виде красного масла.
МС (ХИАД), m/z: 294 [M+H]+.
Ссылочный пример 103
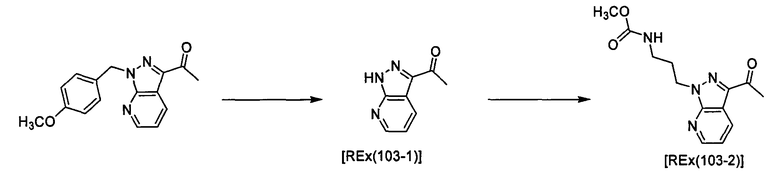
1) К 1-[1-(4-метоксибензил)-1Н-пиразоло[3,4-b]пиридин-3-ил]этанону (3,14 г) прибавляют трифторуксусную кислоту (20 мл) и смесь нагревают и кипятят с обратным холодильником в течение 2 дней. Реакционный раствор концентрируют при пониженном давлении. Полученный остаток разбавляют этилацетатом и промывают последовательно насыщенным водным раствором гидрокарбоната натрия и насыщенным раствором хлорида натрия, сушат над сульфатом магния и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=95/5→7/3), получая 1-(1Н-пиразоло[3,4-b]пиридин-3-ил)этанон) [REx(103-1)] (1,73 г) в виде светло-желтого порошка.
МС (ХИАД), m/z: 162 [M+H]+.
2) К раствору 1-(1Н-пиразоло[3,4-b]пиридин-3-ил)этанона (500 мг) и метил(3-бромпропил)карбамата (912 мг) в N,N-диметилформамиде (5 мл) прибавляют карбонат калия (864 мг) и смесь перемешивают при комнатной температуре в течение 3 дней. К реакционному раствору прибавляют этилацетат, и смесь промывают насыщенным раствором хлорида натрия, сушат над сульфатом магния и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=95/5→1/1), получая метил [3-(3-ацетил-1Н-пиразоло[3,4-b]пиридин-1-ил)пропил]карбамат) [REx(103-2)] (308 мг) в виде масла красного цвета.
МС (ХИАД), m/z: 277 [M+H]+.
Ссылочный пример 104
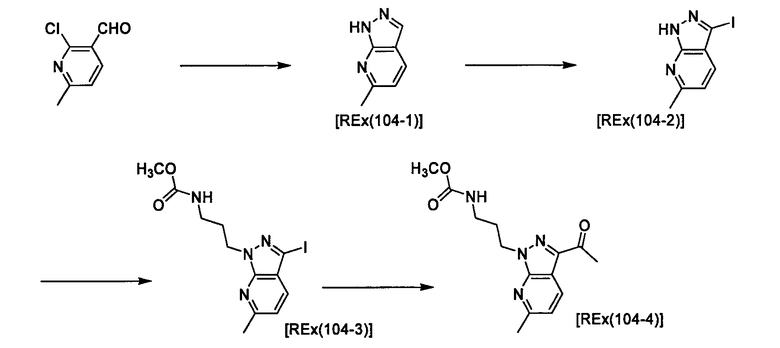
1) К смеси 2-хлор-6-метилникотинового альдегида (5,0 г) и моногидрата гидразина (6,24 мл) прибавляют моногидрат пара-толуолсульфоновой кислоты (3,67 г) и смесь перемешивают при 130°С в течение 18 часов, реакционный раствор охлаждают и затем к нему прибавляют 10% водный раствор лимонной кислоты и смесь перемешивают при комнатной температуре в течение 30 минут. Реакционный раствор экстрагируют этилацетатом и промывают насыщенным раствором хлорида натрия. Органический слой сушат над сульфатом натрия и затем концентрируют при пониженном давлении, получая 6-метил-1Н-пиразоло[3,4-b]пиридин [REx(104-1)] (3,61 г) в виде коричневого порошка.
МС (ХИАД), m/z: 134 [M+H]+.
2) К раствору 6-метил-1Н-пиразоло[3,4-b]пиридина (4,44 г) и йода (16,9 г) в N,N-диметилформамиде (100 мл) прибавляют гидроксид калия (7,48 г) при охлаждении льдом и смесь перемешивают при комнатной температуре в течение 4 часов. Реакционный раствор выливают в ледяную воду и осадок отфильтровывают. Фильтрат экстрагируют этилацетатом, промывают насыщенным раствором хлорида натрия, затем сушат над сульфатом натрия и концентрируют при пониженном давлении. Полученный остаток объединяют с вышеупомянутым осадком и очищают колоночной хроматографией на силикагеле (элюент: н-хлороформ→хлороформ/метанол=19/1), получая 3-йод-6-метил-1H-пиразоло[3,4-b]пиридин [REx(104-2)] (6,48 г) в виде коричневого порошка.
МС (ХИАД), m/z: 260 [M+H]+.
3) 3-Йод-6-метил-1Н-пиразоло[3,4-b]пиридин и метил (3-бромпропил)карбамат обрабатывают аналогично описанному в ссылочном примере 102(1), получая метил [3-(3-йод-6-метил-1Н-пиразоло[3,4-b]пиридин-1-ил)пропил]карбамат [REx(104-3)] в виде бесцветного порошка.
МС (ХИАД), m/z: 375 M+H]+.
4) Метил [3-(3-йод-6-метил-1Н-пиразоло[3,4-b]пиридин-1-ил)пропил]карбамат и три(н-бутил)(этоксивинил)олово- обрабатывают аналогично описанному в ссылочном примере 102(2), получая метил[3-(3-ацетил-6-метил-1Н-пиразоло[3,4-b]пиридин-1-ил)пропил]карбамат [REx(104-4)] в виде бесцветного порошка.
МС (ХИАД), m/z: 291 [М+Н]+.
Ссылочный пример 105
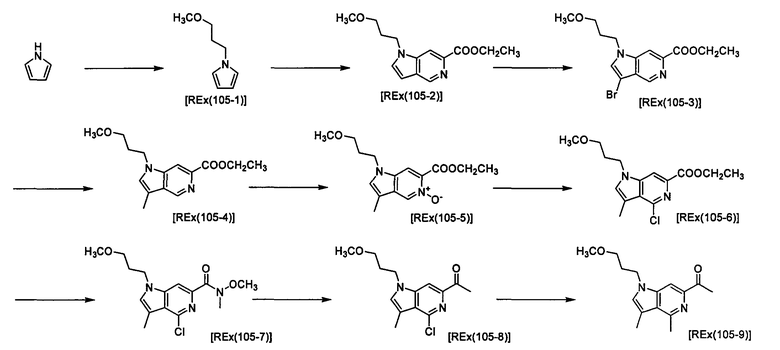
1) К раствору 1H-пиррола (5,0 г) в N,N-диметилформамиде (40 мл) прибавляют по каплям гидрид натрия (3,58 г) при охлаждении льдом и смесь премешивают при комнатной температуре в течение 20 минут. Затем к смеси прибавляют по каплям раствор 1-бром-3-метоксипропана (2,74 г) в N,N-диметилформамиде (2 мл) при охлаждении льдом и смесь премешивают при комнатной температуре в течение 2 часов. К реакционной смеси прибавляют воду при охлаждении льдом и затем смесь экстрагируют диэтиловым эфиром. Органический слой промывают насыщенным раствором хлорида натрия, сушат над сульфатом натрия и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=100/1→20/1), получая 1-(3-метоксипропил)-1Н-пиррол [REx(105-1)] (9,07 г) в виде бесцветного масла.
2) Раствор 1-(3-метоксипропил)-1H-пиррола (3,92 г), этил-3-диметиламино-2-(диметиламинометиленамино)акрилата (7,20 г) (Liebigs Ann. Chem. 1980, 344-357) и трифторуксусной кислоты (8,33 мл) в уксусной кислоте (32 мл) перемешивают при комнатной температуре в течение 18 часов и затем нагревают и кипятят с обратным холодильником в течение 3 часов. После охлаждения реакционный раствор концентрируют при пониженном давлении. К полученному остатку прибавляют насыщенный водный раствор гидрокарбоната натрия при охлаждении льдом и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором хлорида натрия, сушат над сульфатом натрия и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=1/1→AcOEt), получая этил-1-(3-метоксипропил)-1Н-пирроло[3,2-с]пиридин-6-карбоксилат [REx(105-2)] (4,79 г) в виде коричневого масла.
МС (ХИАД), m/z: 263 [M+H]+.
3) К раствору этил-1-(3-метоксипропил)-1Н-пирроло[3,2-с]пиридин-6-карбоксилата (2,00 г) в дихлорметане (40 мл) прибавляют N-бромсукцинимид (1,49 г) при охлаждении льдом, и смесь перемешивают при комнатной температуре в течение 3 часов. К реакционному раствору прибавляют воду, и смесь экстрагируют хлороформом. Органический слой промывают насыщенным раствором хлорида натрия, сушат над сульфатом натрия и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на NH-силикагеле (элюент: н-гексан/этилацетат=9/1→4/1), получая этил-3-бром-1-(3-метоксипропил)-1Н-пирроло[3,2-с]пиридин-6-карбоксилат [REx(105-3)] (2,12 г) в виде желтого масла.
МС (ХИАД), m/z: 341/343 [М+Н]+.
4) К раствору этил-3-бром-1-(3-метоксипропил)-1Н-пирроло[3,2-c]пиридин-6-карбоксилата (1,70 г) в 1,4-диоксане (25 мл) прибавляют триметилбороксин (2,09 мл), карбонат цезия (4,87 г), 2-дициклогексилфосфино-2′,4′,6′-триизопропил-1,1′-бифенил (X-Phos) (297 мг) и трис(дибензилиденацетон)дипалладий (228 мг) в атмосфере аргона и смесь перемешивают при 110°С в течение 15 часов. Реакционный раствор охлаждают, затем к нему прибавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором хлорида натрия, сушат над сульфатом натрия и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан→этилацетат), получая этил-1-(3-метоксипропил)-3-метил-1Н-пирроло[3,2-с]пиридин-6-карбоксилат [REx(105-4)] (831 мг) в виде желтого масла.
МС (ХИАД), m/z: 277 [M+H]+.
5) К раствору этил-1-(3-метоксипропил)-3-метил-1Н-пирроло[3,2-с]пиридин-6-карбоксилат (100 мг) в хлороформе (2 мл) прибавляют мета-хлорпероксибензойную кислоту (250 мг) при охлаждении льдом и смесь перемешивают при комнатной температуре в течение 2 часов. Реакционный раствор концентрируют и полученный остаток очищают колоночной хроматографией на NH-силикагеле (элюент: этилацетат→этилацетат/метанол=10/1), получая этил-1-(3-метоксипропил)-3-метил-1Н-пирроло[3,2-с]пиридин-6-карбоксилат 5-оксид [REx(105-5)] (41 мг) в виде светло-желтого масла.
МС (ХИАД), m/z: 293 [M+H]+.
6) Раствор этил-1-(3-метоксипропил)-3-метил-1Н-пирроло[3,2-с]пиридин-6-карбоксилат 5-оксида (40 мг) в оксихлориде фосфора (2 мл) перемешивают при 100°С в течение 1 часа. Реакционный раствор концентрируют и полученный остаток растворяют в этилацетате. Его промывают последовательно насыщенным водным раствором гидрокарбоната натрия и насыщенным раствором хлорида натрия, сушат над сульфатом натрия и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан→н-гексан/этилацетат=1/1), получая этил-4-хлор-1-(3-метоксипропил)-3-метил-1Н-пирроло[3,2-с]пиридин-6-карбоксилат [REx(105-6)] (23 мг) в виде бесцветного порошка.
МС (ХИАД), m/z: 311/3 [М+Н]+.
7) К раствору этил-4-хлор-1-(3-метоксипропил)-3-метил-1Н-пирроло[3,2-с]пиридин-6-карбоксилата (290 мг) в этанол (6 мл) прибавляют 2-нормальный водный раствор гидроксида натрия (0,95 мл) при охлаждении льдом и смесь перемешивают при комнатной температуре в течение 90 минут. Затем к ней прибавляют 2-нормальную соляную кислоту (0,95 мл) при охлаждении льдом и концентрируют реакционный раствор. К раствору остатка в хлороформе (6 мл) прибавляют гидрохлорид N,О-диметилгидроксиамина (137 мг), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (268 мг), 1-гидроксибензотриазол (189 мг) и диизопропилэтиламин (325 мкL) при охлаждении льдом, затем смесь перемешивают при комнатной температуре в течение 15 часов. К реакционной смеси прибавляют насыщенный водный раствор гидрокарбоната натрия при охлаждении льдом и смесь экстрагируют хлороформом. Органический слой промывают последовательно водой и насыщенным раствором хлорида натрия, сушат над сульфатом натрия и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан→этилацетат), получая 4-хлор-N-метокси-1-(3-метоксипропил)-N,3-диметил-1Н-пирроло[3,2-с]пиридин-6-карбоксамид [REx(105-7)] (277 мг) в виде бесцветного масла.
МС (ХИАД), m/z: 326/328 [М+Н]+.
8) 4-Хлор-N-метокси-1-(3-метоксипропил)-N,3-диметил-1Н-пирроло[3,2-с]пиридин-6-карбоксамид и метилмагнийбромид обрабатывают аналогично were treated in the similar manner to ссылочному примеру 6(5), получая 1-[4-хлор-1-(3-метоксипропил)-3-метил-1Н-пирроло[3,2-с]пиридин-6-ил]этанон [REx(105-8)] в виде бесцветного порошка.
МС (ХИАД), m/z: 281/283 [М+Н]+.
9) К раствору 1-[4-хлор-1-(3-метоксипропил)-3-метил-1Н-пирроло[3,2-с]пиридин-6-ил]этанона (50 мг) в 1,4-диоксане (2 мл) прибавляют триметилбороксин (50 мкл), карбонат цезия (174 мг), 2-дициклогексилфосфино-2′,4′,6′-триизопропил-1,1′-бифенил (X-Phos) (17 мг) и трис(дибензилиденацетон)дипалладий (8 мг) в атмосфере аргона, и смесь перемешивают при 80°С в течение 2 часов. Реакционный раствор охлаждают, затем к нему прибавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором хлорида натрия, сушат над сульфатом натрия и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан→н-гексан/этилацетат=1/1), получая 1-[1-(3-метоксипропил)-3,4-диметил-1Н-пирроло[3,2-с]пиридин-6-ил]этанон [REx(105-9)] (105 мг) в виде бесцветного масла.
МС (ХИАД), m/z: 261 [M+H]+.
Ссылочный пример 106
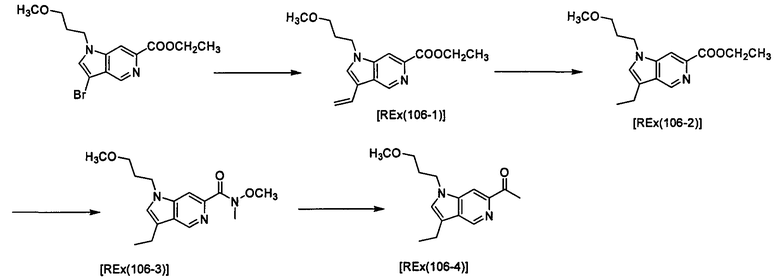
1} К раствору этил-3-бром-1-(3-метоксипропил)-1Н-пирроло[3,2-с]пиридин-6-карбоксилата (200 мг) в 1,4-диоксане (2 мл) прибавляют комплекс тривинилбороксин-пиридин (141 мг), карбонат цезия (573 мг), 2-дициклогексилфосфино-2′,4′,6′-триизопропил-1,1′-бифенил (X-Phos) (56 мг) и трис(дибензилиденацетон)дипалладий (27 мг) в атмосфере аргона и смесь перемешивают при 100°С в течение 1 часа. Реакционный раствор охлаждают, затем к нему прибавляют воду, и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором хлорида натрия, сушат над сульфатом натрия и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=9/1→4/1), получая этил-1-(3-метоксипропил)-3-винил-1Н-пирроло[3,2-е] пиридин-6-карбоксилат [REx(106-1)] (118 мг) в виде желтого масла.
МС (ХИАД), m/z: 289 [М+Н]+.
2) К раствору этил-1-(3-метоксипропил)-3-винил-1Н-пирроло[3,2-с]пиридин-6-карбоксилата (460 мг) в этаноле (9 мл) прибавляют 10% палладия на угле (92 мг) и смесь перемешивают в атмосфере водорода в течение 1 часа. Нерастворимое вещество отфильтровывают, и фильтрат концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=9/1→1/1), получая этил-3-этил-1-(3-метоксипропил)-1Н-пирроло[3,2-с]пиридин-6-карбоксилат [REx(106-2)] (294 мг) в виде желтого масла.
МС (ХИАД), m/z: 291 [М+Н]+.
3) Этил-3-этил-1-(3-метоксипропил)-1Н-пирроло[3,2-с]пиридин-6-карбоксилат обрабатывают водным раствором гидроксида натрия и гидрохлоридом N,O-диметилгидроксиамина аналогично ссылочному примеру 105(7), получая 3-этил-N-метокси-1-(3-метоксипропил)-N-метил-1Н-пирроло[3,2-с]пиридин-6-карбоксамид [REx(106-3)] в виде светло-желтого масла.
МС (ХИАД), m/z: 306 [M+H]+.
4) 3-Этил-N-метокси-1-(3-метоксипропил)-1H-метил-1Н-пирроло[3,2-с]пиридин-6-карбоксамид и метилмагнийбромид обрабатывают аналогично ссылочному примеру 6(5), получая 1-[3-этил-1-(3-метоксипропил)-1Н-пирроло[3,2-с]пиридин-6-ил]этанон [REx(106-4)] в виде светло-желтого масла.
МС (ХИАД), m/z: 261 [M+H]+.
Ссылочный пример 107

4-Бром-1-метокси-2-(4-метоксибутил)бензол и три(н-бутил)(1-этоксивинил)олово обрабатывают аналогично ссылочному примеру 27(3), получая 1-[4-метокси-3-(4-метоксибутил)фенил]этанон в виде желтого масла.
МС (ХИАД), m/z: 237 [M+H]+.
Ссылочные примеры 108-112
Соединения ссылочных примеров 103-107 подвергают обработке, аналогичной описанной в ссылочном примере 6-(6) и получают указанные ниже соединения.
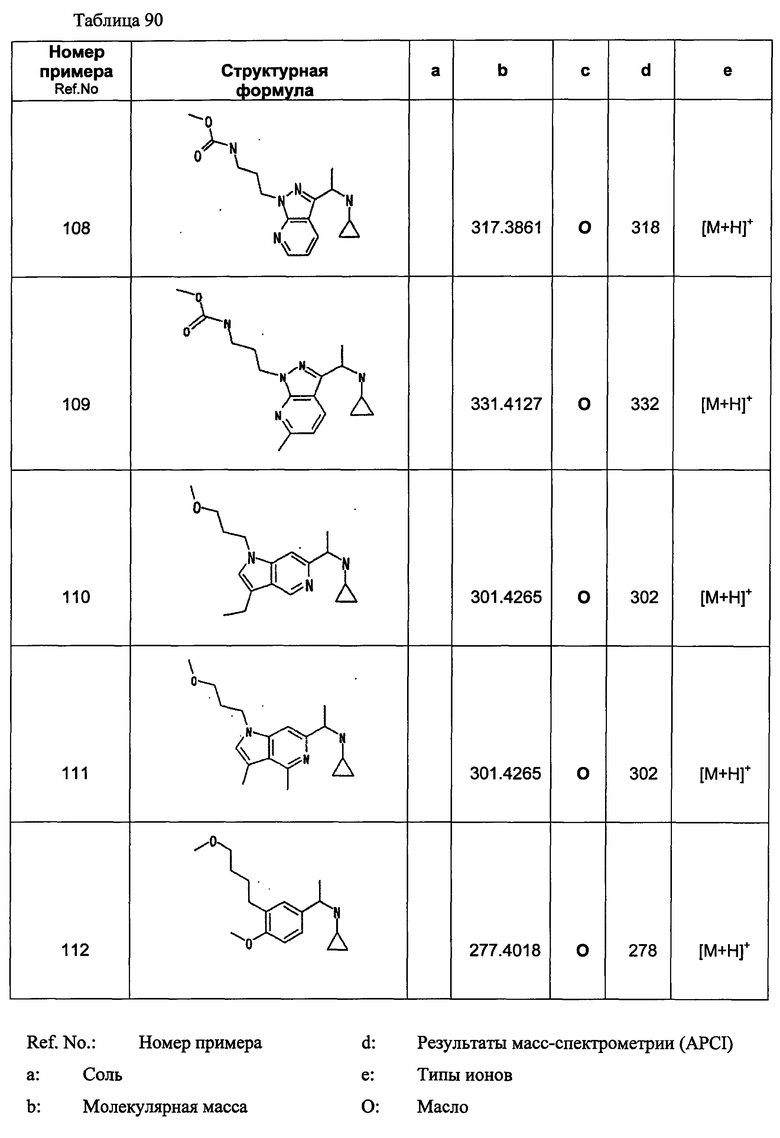

Ссылочный пример 113
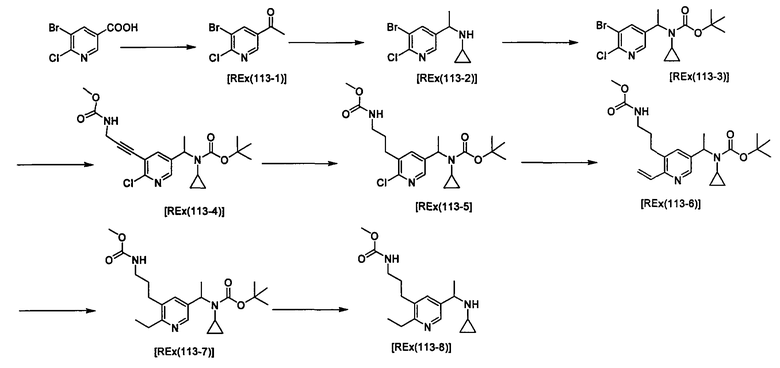
1) 5-Бром-6-хлорникотиновую кислоту и гидрохлорид N,O-диметилгидроксиамина обрабатывают аналогично ссылочному примеру 7(5) и затем полученное соединение и метилмагнийбромид подвергают обработке, аналогичной описанной в ссылочном примере 7(6), получая 1-(5-бром-6-хлорпиридин-3-ил)этанон [REx(113-l)] в виде бесцветного порошка.
МС (ХИАД), m/z: 234/236 [M+H]+.
2) 1-(5-Бром-6-хлорпиридин-3-ил)этанон и циклопропиламин подвергают обработке, аналогичной описанной в ссылочном примере 6(6), получая N-[1-(5-бром-6-хлорпиридин-3-ил)этил]циклопропиламин [REx(113-2)] в виде светло-желтого масла.
МС (ХИАД), m/z: 275/277 [M+H]+.
3) К раствору N-[1-(5-бром-6-хлорпиридин-3-ил)этил]циклопропиламина (2,47 г) в смеси этилацетата (15 мл), тетрагидрофурана (15 мл) и воды (15 мл) прибавляют гидрокарбонат натрия (3,78 г) и ди-трет-бутилдикарбонат (3,94 г), смесь перемешивают при комнатной температуре в течение 41 часа. К реакционному раствору прибавляют воду и затем смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором хлорида натрия, сушат над сульфатом натрия и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=4/1→1/1), получая трет-бутил [1-(5-бром-6-хлорпиридин-3-ил)этил]циклопропилкарбамат [REx(113-3)] (2,6 г) в виде светло-желтого масла.
4) К раствору трет-бутил [1-(5-бром-6-хлорпиридин-3-ил)этил]циклопропилкарбамата (530 мг) в N,N-диметилформамиде (8 мл) прибавляют метилпроп-2-ин-1-илкарбамат (384 мг), триэтиламин (1,96 мл), дихлорбис(трифенилфосфин)палладий(II) (69 мг) и йодид меди(I) (40 мг) и смесь перемешивают при 60°С в течение 2 часов. Реакционный раствор охлаждают, затем разбавляют этилацетатом и нерастворимое вещество отфильтровывают. Фильтрат промывают последовательно водой и насыщенным раствором хлорида натрия, сушат над сульфатом натрия и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=4/1→1/1), получая метил [3-(5-{1-[(трет-бутоксикарбонил)(циклопропил)амино]этил}-2-хлорпиридин-3-ил)проп-2-ин-1-ил]карбамат [REx(113-4)] (362 мг) в виде светло-желтого масла.
МС (ХИАД), m/z: 408/410 [M+H]+.
5) Метил [3-(5-{1-[(трет-бутоксикарбонил)(циклопропил)амино]этил}-2-хлорпиридин-3-ил)проп-2-ин-1-ил]карбамат восстанавливают аналогично описанному в примере 296(5), получая метил [3-(5-{1-[(трет-бутоксикарбонил)(циклопропил)амино]этил}-2-хлорпиридин-3-ил)пропил]карбамат [REx(113-5)] в виде светло-желтого масла.
МС (ХИАД), m/z: 412/414 [M+H]+.
6) К раствору метил [3-(5-{1-[(трет-бутоксикарбонил)(циклопропил)амино]этил}-2-хлорпиридин-3-ил)пропил]карбамата (380 мг) в диметоксиэтане (8 мл) прибавляют сложный эфир винилбороновой кислоты и пинакола (235 мкл), 2М карбонат натрия (1,38 мл) и дихлорбис(трифенилфосфин)палладий(II) (65 мг) и смесь перемешивают при 85°С в течение 17 часов. Реакционный раствор охлаждают, затем нерастворимое вещество отфильтровывают через целит, к фильтрату прибавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором хлорида натрия, сушат над сульфатом натрия и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=3/1→1/4), получая метил[3-(5-{1-[(трет-бутоксикарбонил)(циклопропил)амино]этил}-2-винилпиридин-3-ил)пропил]карбамат [REx(113-6)] (282 мг) в виде светло-желтого масла.
МС (ХИАД), m/z: 404 [M+H]+.
7) К раствору метил [3-(5-{1-[(трет-бутоксикарбонил)(циклопропил)амино]этил}-2-винилпиридин-3-ил)пропил]карбамата (280 мг) в метаноле (10 мл) прибавляют 10% палладий на угле (140 мг) и смесь перемешивают в атмосфере водорода в течение 2 часов. Нерастворимое вещество отфильтровывают и затем фильтрат концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: хлороформ→хлороформ/метанол=4/1), получая метил[3-(5-{1-[(трет-бутоксикарбонил)(циклопропил)амино]этил}-2-этилпиридин-3-ил)пропил]карбамат [REx(113-7)] (210 мг) в виде светло-желтого масла.
МС (ХИАД), m/z: 406 [M+H]+.
8) К раствору метил [3-(5-{1-[(трет-бутоксикарбонил)(циклопропил)амино]этил}-2-этилпиридин-3-ил)пропил]карбамата (204 мг) в дихлорметане (1,5 мл) прибавляют трифторуксусную кислоту (1,5 мл) при охлаждении льдом и смесь перемешивают при комнатной температуре в течение 1 часа. Реакционный раствор выливают в охлаждаемый льдом насыщенный водный раствор гидрокарбоната натрия и экстрагируют хлороформом. Органический слой промывают насыщенным раствором хлорида натрия, сушат над сульфатом натрия и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на NH-силикагеле (элюент: хлороформ→хлороформ/метанол=20/1), получая метил (3-{5-[1-(циклопропиламино)этил]-2-этилпиридин-3-ил}пропил)карбамат [REx(113-8)] (142 мг) в виде светло-желтого масла.
МС (ХИАД), m/z: 306 [М+Н]+.
Ссылочный пример 114
К раствору (-)-α-пинена (3,64 мл) в тетрагидрофуране (5 мл) прибавляют по каплям комплекс боран-диметилсульфид (1,09 мл) при охлаждении льдом и смесь перемешивают при комнатной температуре в течение 15 часов. К реакционному раствору прибавляют по каплям раствор метилпроп-2-ин-1-илкарбамата (1,0 г) в тетрагидрофуране (3 мл) при охлаждении льдом и затем смесь перемешивают при комнатной температуре в течение 17 часов. К реакционному раствору прибавляют по каплям ацетальдегид (5 мл) при охлаждении льдом и смесь перемешивают при комнатной температуре в течение 3 часов. Реакционный раствор концентрируют при пониженном давлении, и полученный остаток растворяют в диэтиловом эфире (15 мл). К раствору прибавляют пинакол (1,56 г) и смесь перемешивают при комнатной температуре в течение 2 часов. Реакционный раствор промывают водой, затем сушат над сульфатом магния и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=10/1→3/2), получая метил[(2Е)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборан-2-ил)проп-2-ен-1-ил]карбамат (1,18 г) в виде светло-желтого масла.
МС (ХИАД), m/z: 242 [M+H]+.
Пример испытаний
[Ингибирующая активность в отношении ренина человека]
Смешивают субстрат синтетического пептида (Nma-KHPFH LVIHK(Dnp)-NH2) и испытываемое соединение и оценивают интенсивность флуоресценции с помощью флуорофотометра до начала ферментативной реакции (длина волны возбуждения: 340 nm, измерительная длина волны: 460 nm). Прибавляют рекомбинантный ренин человека и смесь инкубируют при 37°С в течение 1 часа и измеряют интенсивность флуоресценции после реакции с помощью флуорофоторметра (длина волны возбуждения: 340 нм, измерительная длина: 460 нм). Активность ренина оценивают, исходя из интенсивности флуоресценции, которую получают путем вычитания интенсивности до реакции из интенсивности после реакции, а концентрацию 50% ингибирования (IC50) рассчитывают из данных по активности ренина в условиях наличия различных концентраций испытываемого соединения. Соединения примеров, представленных в данной заявке показали следующие величины IC50.
Результат испытания 1
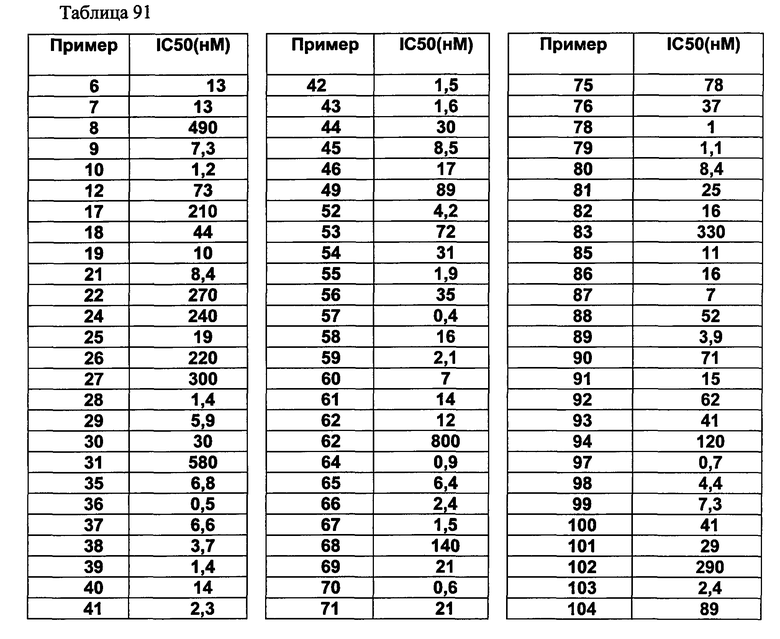
Результат испытания 2
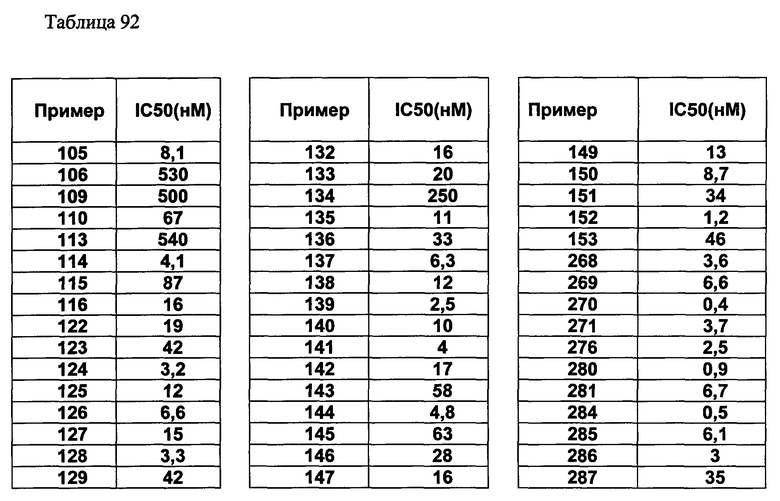
Результат испытания 3
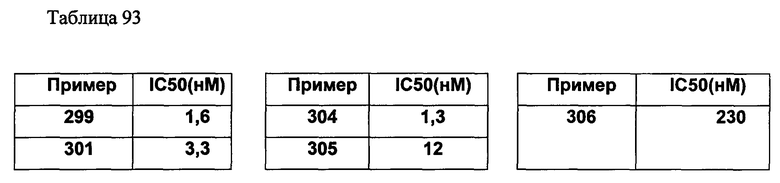
Промышленная применимость
Соединение [I] по настоящему изобретению или его фармацевтически приемлемая соль обладают ингибирующей активностью в отношении ренина и могут быть применимы для лечения и/или профилактики гипертензии, сердечной недостаточности, диабетической нефропатии и т.п. Кроме того, соединение [II] применимо в качестве промежуточного соединения в синтезе для получения соединения [I].
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ИЗОКСАЗОЛА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБ ЛЕЧЕНИЯ АУТОИММУННЫХ ИЛИ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ | 1998 |
|
RU2196770C2 |
| ПРОИЗВОДНЫЕ АРОМАТИЧЕСКИХ АМИНОВ, ОБЛАДАЮЩИХ ПОДАВЛЯЮЩИМ ОАС ДЕЙСТВИЕМ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИНГИБИТОР НОАС | 1997 |
|
RU2193554C2 |
| ПРОИЗВОДНЫЕ 1,1-ДИОКСОТИОМОРФОЛИНИЛИНДОЛИЛМЕТАНОНА ДЛЯ ПРИМЕНЕНИЯ В КАЧЕСТВЕ МОДУЛЯТОРОВ ГИСТАМИНА 3 (Н3) | 2006 |
|
RU2412182C2 |
| ПРОИЗВОДНЫЕ 2-ПИРИДОНА | 2010 |
|
RU2551847C2 |
| ПРОИЗВОДНЫЕ БЕНЗОФУРАНА | 2003 |
|
RU2286344C2 |
| ПРОИЗВОДНЫЕ ТРИ- ИЛИ ТЕТРА-ЗАМЕЩЕННОГО-3-АМИНОПИРРОЛИДИНА | 2006 |
|
RU2420524C2 |
| АМИДЫ δ-АМИНО-γ-ГИДРОКСИ-ω-АРИЛАЛКАНОВОЙ КИСЛОТЫ | 2004 |
|
RU2413716C2 |
| ТРИЦИКЛИЧЕСКИЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1992 |
|
RU2072997C1 |
| ПРОИЗВОДНЫЕ АМИНОХИНОЛОНА, ЗАМЕЩЕННЫЕ ФЕНИЛЬНОЙ ИЛИ ГЕТЕРОАРОМАТИЧЕСКОЙ ГРУППОЙ | 1993 |
|
RU2124510C1 |
| ПРОИЗВОДНЫЕ АРИЛ- И ГЕТЕРОАРИЛЭТИЛАЦИЛГУАНИДИНА, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ В ТЕРАПИИ | 2007 |
|
RU2446165C2 |
Изобретение относится к соединению формулы [I] и его фармацевтически приемлемым солям. Соединение формулы [I] обладает ренин-ингибирующей активностью. В формуле [I]
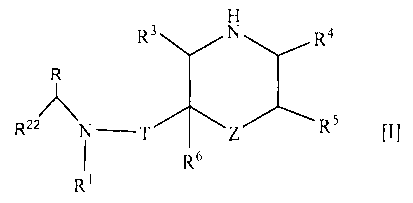
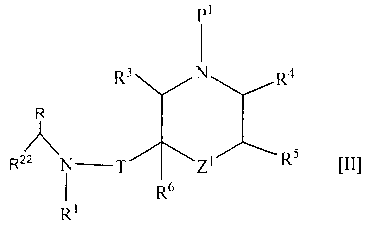
R1 представляет собой С3-6-циклоалкильную группу; R представляет собой низшую алкильную группу или образует 5-6-членное кольцо путем связывания с R22 на каждом конце; Т представляет собой карбонильную группу; Z представляет собой -О-, -NH- или одинарную связь; и R3, R4, R5 и R6 представляют собой атом водорода. Изобретение относится также к фармацевтической композиции, содержащей соединение изобретения, и к соединению формулы [II]. Технический результат: получены новые соединения формулы [I], обладающие ренин-ингибирующей активностью. 3 н. и 8 з.п. ф-лы, 93 табл., 422 пр.
1. Соединение формулы [I]

где R1 представляет собой С3-6-циклоалкильную группу;
R22 представляет собой:
1) фенильную группу, замещенную одинаковыми или разными одной-тремя группами, выбранными из атома галогена; цианогруппы; карбамоильной группы; N-(низший)алкил-карбамоильной группы; N,N-ди(низший)алкил-карбамоильной группы; (низшей) алкильной группы; низшей алкоксигруппы; тригалогензамещенной (низшей) алкильной группы; дигалогензамещенной (низшей) алкоксигруппы; фенилзамещенной (низшей) алкоксигруппы; (низшей) алкильной группы, замещенной низшей алкоксикарбониламиногруппой; (низшей) алканоиламино (низшей) алкоксигруппы; (низшей) алкоксигруппы, замещенной (низшей) алкоксигруппой;
2) нафтильную группу, необязательно замещенную одной группой, выбранной из (низшей) алкоксигруппы; (низшей) алканоиламино (низшей) алкоксигруппы;
3) пиридильную группу, замещенную одинаковыми или разными одной-двумя группами, выбранными из (низшей) алкильной группы; (низшей) алкоксигруппы; (низшей) алкильной группы, замещенной (низшей) алкоксигруппой; (низшей) алкильной группы, замещенной (низшей) алкоксикарбамоиламиногруппой; (низшей) алкоксигруппы, замещенной (низшей) алкоксигруппой;
4) пиразолопиридильную группу, замещенную одинаковыми или разными одной-двумя группами, выбранными из (низшей) алкильной группы; (низшей) алкильной группы, замещенной (низшей) алкоксигруппой; (низшей) алкильной группы, замещенной (низшей) алкоксикарбониламиногруппой;
5) индолильную группу, замещенную одинаковыми или разными одной-двумя группами, выбранными из атома галогена; (низшей) алкильной группы; (низшей) алкильной группы, замещенной (низшей) алкоксигруппой;
6) бензофуранильную группу, замещенную одной группой, выбранной из (низшей) алкоксигруппы, замещенной (низшей) алкоксигруппой;
7) хинолильную группу, замещенную одной группой, выбранной из атома галогена; (низшей) алкоксигруппы;
8) дигидробензофуранильную группу, замещенную одной группой, выбранной из (низшей) алкоксигруппы, замещенной (низшей) алкоксигруппой;
9) индазолильную группу, замещенную одинаковыми или разными одной-тремя группами, выбранными из атома галогена; (низшей) алкильной группы; тригалогензамещенной (низшей) алкильной группы; (низшей) алкильной группы, замещенной (низшей) алкоксигруппой; (низшей) алкильной группы, замещенной (низшей) алкоксикарбониламиногруппой; (низшей) алкоксигруппы, замещенной (низшей) алкоксигруппой; изоксазолильной группы, замещенной двумя группами, выбранными из (низшего) алкила;
10) пирролопиридинильную группу, замещенную одинаковыми или разными одной-тремя группами, выбранными из атома галогена; (низшей) алкильной группы; (низшей) алкильной группы, замещенной (низшей) алкоксигруппой; (низшей) алкильной группы, замещенной (низшей) алкоксикарбониламиногруппой; тригалогензамещенной (низшей) алкильной группы;
11) бензоизоксазолильную группу, необязательно замещенную одинаковыми или разными одной-двумя группами, выбранными из (низшей) алкильной группы; (низшей) алкоксигруппы, замещенной (низшей) алкоксигруппой;
12) индолинильную группу, замещенную одной группой, выбранной из (низшей) алкильной группы, замещенной (низшей) алкоксигруппой;
13) хиназолинильную группу, замещенную одной группой, выбранной из оксогруппы; (низшей) алкоксигруппы, замещенной (низшей) алкоксигруппой;
R представляет собой низшую алкильную группу или образует 5-6-членное кольцо путем связывания с R22 на каждом конце;
Т представляет собой карбонильную группу;
Z представляет собой -О-, -NH- или одинарную связь; и
R3, R4, R5 и R6 представляют собой атом водорода;
или его фармацевтически приемлемая соль.
2. Соединение по п. 1, где R22 представляет собой любую группу, выбранную из:
1) фенильную группу, замещенную одинаковыми или разными одной-тремя группами, выбранными из атома галогена; C1-6 алкоксигруппы, замещенной C1-6 алкоксигруппой; и C1-6 алкоксигруппы;
2) нафтильную группу, необязательно замещенную одной группой, выбранной из С2-7 алканоиламиноС1-6 алкоксигруппы и C1-6 алкоксигруппы;
3) пиридильную группу, замещенную одинаковыми или разными одной-двумя группами, выбранными из C1-6 алкильной группы, замещенной C1-6 алкоксигруппой; C1-6 алкильной группы, замещенной C1-6 алкоксикарбамоиламиногруппой; C1-6 алкоксигруппы;
4) пиразолопиридильную группу, замещенную одинаковыми или разными одной-двумя группами, выбранными из C1-6 алкильной группы, замещенной C1-6 алкоксигруппой; C1-6 алкильной группы, замещенной C1-6 алкоксикарбониламиногруппой; C1-6 алкильной группы;
5) индолильную группу, замещенную одинаковыми или разными одной-двумя группами, выбранными из атома галогена; C1-6 алкильной группы, замещенной C1-6 алкоксигруппой; C1-6 алкильной группы;
6) бензофуранильную группу, замещенную одной группой, выбранной из C1-6 алкоксигруппы, замещенной C1-6 алкоксигруппой;
7) хинолильную группу, замещенную одной группой, выбранной из C1-6 алкоксигруппы;
8) дигидробензофуранильную группу, замещенную одной группой, выбранной из C1-6 алкоксигруппы, замещенной C1-6 алкоксигруппой;
9) индазолильную группу, замещенную одинаковыми или разными одной-тремя группами, выбранными из атома галогена; C1-6 алкильной группы, замещенной C1-6 алкоксигруппой; C1-6 алкильной группы;
10) пирролопиридинильную группу, замещенную одинаковыми или разными одной-тремя группами, выбранными из атома галогена; C1-6 алкильной группы, замещенной C1-6 алкоксигруппой; C1-6 алкильной группы, замещенной C1-6 алкоксикарбониламиногруппой; C1-6 алкильной группы;
11) индолинильную группу, замещенную одной группой, выбранной из C1-6 алкильной группы, замещенной C1-6 алкоксигруппой;
12) хиназолинильную группу, замещенную одной группой, выбранной из C1-6 алкоксигруппы, замещенной C1-6 алкоксигруппой;
или его фармацевтически приемлемая соль.
3. Соединение по п. 1 или 2, где R1 представляет собой циклопропильную группу, или его фармацевтически приемлемая соль.
4. Соединение по п. 1, которое представляет собой метил (3-{4-[1-{циклопропил [морфолин-2-илкарбонил]амино}этил]-6-метоксипиридин-2-ил}пропил)карбамат, или его фармацевтически приемлемая соль.
5. Соединение по п. 1, которое представляет собой метил (3-{4-[(1R)-l-{циклопропил[(2R)-морфолин-2-илкарбонил]амино}этил]-6-метоксипиридин-2- ил}пропил)карбамат, или его фармацевтически приемлемая соль.
6. Соединение по п. 1, которое представляет собой N-циклопропил-N-{1-[1-(3-метоксипропил)-3,4-диметил-1Н-пирроло[3,2-с]пиридин-6-ил]этил}морфолин-2-карбоксамид, или его фармацевтически приемлемая соль.
7. Соединение по п. 1, которое представляет собой (2R)-N-циклопропил-N-{(1R)-1-[1-(3-метоксипропил)-3,4-диметил-1Н-пирроло[3,2-с]пиридин-6-ил]этил}морфолин-2-карбоксамид, или его фармацевтически приемлемая соль.
8. Соединение по п. 1, которое представляет собой метил (3-{3-[1-{циклопропил[морфолин-2-илкарбонил]амино}этил]-6-метил-1Н-пиразоло[3,4-b]пиридин-1-ил}пропил)карбамат, или его фармацевтически приемлемая соль.
9. Соединение по п. 1, которое представляет собой метил (3-{3-[(1R)-l-{циклопропил [(2R)-морфолин-2-илкарбонил]амино}этил]-6-метил-1Н-пиразоло[3,4-b]пиридин-1-ил}пропил)карбамат, или его фармацевтически приемлемая соль.
10. Фармацевтическая композиция, обладающая ренин-ингибирующей активностью, содержащая соединение по любому из пп. 1-9 или его фармацевтически приемлемую соль.
11. Соединение формулы [II]

где R1 представляет собой С3-6-циклоалкильную группу;
R22 представляет собой:
1) фенильную группу, замещенную одинаковыми или разными одной-тремя группами, выбранными из атома галогена; цианогруппы; карбамоильной группы; N-(низший)алкил-карбамоильной группы; N,N-ди(низший)алкил-карбамоильной группы; (низшей) алкильной группы; низшей алкоксигруппы; тригалогензамещенной (низшей) алкильной группы; дигалогензамещенной (низшей) алкоксигруппы; фенилзамещенной (низшей) алкоксигруппы; (низшей) алкильной группы, замещенной низшей алкоксикарбониламиногруппой; (низшей) алканоиламино (низшей) алкоксигруппы; (низшей) алкоксигруппы, замещенной (низшей) алкоксигруппой;
2) нафтильную группу, необязательно замещенную одной группой, выбранной из (низшей) алкоксигруппы; (низшей) алканоиламино (низшей) алкоксигруппы;
3) пиридильную группу, замещенную одинаковыми или разными одной-двумя группами, выбранными из (низшей) алкильной группы; (низшей) алкоксигруппы; (низшей) алкильной группы, замещенной (низшей) алкоксигруппой; (низшей) алкильной группы, замещенной (низшей) алкоксикарбамоиламиногруппой; (низшей) алкоксигруппы, замещенной (низшей) алкоксигруппой;
4) пиразолопиридильную группу, замещенную одинаковыми или разными одной-двумя группами, выбранными из (низшей) алкильной группы; (низшей) алкильной группы, замещенной (низшей) алкоксигруппой; (низшей) алкильной группы, замещенной (низшей) алкоксикарбониламиногруппой;
5) индолильную группу, замещенную одинаковыми или разными одной-двумя группами, выбранными из атома галогена; (низшей) алкильной группы; (низшей) алкильной группы, замещенной (низшей) алкоксигруппой;
6) бензофуранильную группу, замещенную одной группой, выбранной из (низшей) алкоксигруппы, замещенной (низшей) алкоксигруппой;
7) хинолильную группу, замещенную одной группой, выбранной из атома галогена; (низшей) алкоксигруппы;
8) дигидробензофуранильную группу, замещенную одной группой, выбранной из (низшей) алкоксигруппы, замещенной (низшей) алкоксигруппой;
9) индазолильную группу, замещенную одинаковыми или разными одной-тремя группами, выбранными из атома галогена; (низшей) алкильной группы; тригалогензамещенной (низшей) алкильной группы; (низшей) алкильной группы, замещенной (низшей) алкоксигруппой; (низшей) алкильной группы, замещенной (низшей) алкоксикарбониламиногруппой; (низшей) алкоксигруппы, замещенной (низшей) алкоксигруппой; изоксазолильной группы, замещенной двумя группами, выбранными из (низшего) алкила;
10) пирролопиридинильную группу, замещенную одинаковыми или разными одной-тремя группами, выбранными из атома галогена; (низшей) алкильной группы; (низшей) алкильной группы, замещенной (низшей) алкоксигруппой; (низшей) алкильной группы, замещенной (низшей) алкоксикарбониламиногруппой; тригалогензамещенной (низшей) алкильной группы;
11) бензоизоксазолильную группу, необязательно замещенную одинаковыми или разными одной-двумя группами, выбранными из (низшей) алкильной группы; (низшей) алкоксигруппы, замещенной (низшей) алкоксигруппой;
12) индолинильную группу, замещенную одной группой, выбранной из (низшей) алкильной группы, замещенной (низшей) алкоксигруппой;
13) хиназолинильную группу, замещенную одной группой, выбранной из оксогруппы; (низшей) алкоксигруппы, замещенной (низшей) алкоксигруппой;
R представляет собой низшую алкильную группу или образует 5-6-членное кольцо путем связывания с R22 на каждом конце;
Т представляет собой карбонильную группу;
Z1 представляет собой -О-, -NP2- или одинарную связь;
R3, R4, R5 и R6 представляют собой атом водорода;
Р1 представляет собой (низшую) алкоксикарбонильную группу и Р2 представляет собой (низшую) алкоксикарбонильную группу;
или его соль.
| WO 2006113376 A1, 26.10.2006 | |||
| EP 21168952 A1, 31.03.2010 | |||
| RU 2007138892 A, 27.04.2009 | |||
| WO 2006128659 A2, 07.12.2006. |
Авторы
Даты
2016-08-20—Публикация
2012-03-15—Подача