Изобретение относится к медицине, а именно к клинической лабораторной диагностике, и может быть использовано при проведении внешней оценки качества результатов клинических лабораторных исследований, преимущественно на региональном уровне.
Как известно, оценка достоверности результатов лабораторных исследований является очень важной проблемой современной медицины, поскольку в последние годы в практическую лабораторную диагностику вошли высокие автоматизированные технологии многих производителей диагностических средств, увеличился перечень лабораторных исследований, больные получили возможность обследоваться в различных учреждениях здравоохранения, которые могут находиться в разных районах, городах, странах. Поэтому необходимо иметь систему мониторинга сходимости, воспроизводимости и стабильности работы каждой индивидуальной лаборатории, позволяющую минимизировать расхождение (смещение) полученных в ходе исследований данных посредством проведения межлабораторных сравнений и регрессионного анализа, которые должны проводиться оперативно, по мере возникновения необходимости, доступными средствами и в удобные временные сроки.
Известен способ контроля качества клинических лабораторных исследований на уровне системы здравоохранения России и субъектов Российской Федерации (межлабораторный контроль качества), который осуществляется в соответствии с Приказом Минздрава РФ №45 от 07.02.2000 г., Федеральной системой внешней оценки качества (ФСВОК) на основе обработки результатов, проведенных клинико-диагностическими лабораториями исследований образцов контрольных материалов, рассылаемых Центром внешнего контроля качества клинических лабораторных исследований и его региональными отделениями. Целью внешней оценки качества исследований является оценка степени сопоставимости результатов исследований, выполняемых в различных учреждениях здравоохранения, и соответствия их установленным нормативными документами Минздравсоцразвития России нормам аналитической точности. ФСВОК является общенациональной системой внешней оценки качества лабораторных исследований в России. Участие в мероприятиях ФСВОК обязательно для лабораторий учреждений здравоохранения всех форм собственности и учитывается при их аккредитации и лицензировании.
Согласно условиям ФСВОК контроль проводится по 40 показателям лабораторных исследований на одной или двух контрольных пробах аналита заводского изготовления с участием клинико-диагностических лабораторий всех регионов России 2-4 раза в год. В каждой лаборатории-участнице каждую пробу измеряют по 2 раза, затем вычисляют среднее значение двух результатов (Хср) и результаты отсылают в Центр ФСВОК, где их обрабатывают на компьютере по специальной программе с использованием метода «выбраковки» и расчетом статистических параметров средних значений, стандартного отклонения и коэффициента вариации. В качестве критерия для сравнения и оценки правильности результатов используют средние величины показателей, полученных от всех лабораторий-участников.
Результаты оценки контроля качества представляются лабораториям в виде графиков (гистограмм) и в таблицах, в которых указываются, в частности, диапазон допустимых значений, число лабораторий-участниц, среднее значение для всех лабораторий, коэффициент межлабораторной вариации, полученный и допустимый относительный размах. По выявленным результатам делают вывод о качестве исследований в той или иной клинической лаборатории и соответственно о необходимости проведения корректирующих мероприятий.
Ответы по результатам исследований приходят в лаборатории-участницы в среднем через 6-8 недель. Участие в ФСВОК платное: каждая лаборатория тратит на это от 5 до 10 тысяч рублей в год, причем эти расходы, как правило, оплачиваются из городского бюджета.
Основным недостатком известного способа оценки качества лабораторных исследований является недостаточная достоверность получаемых результатов, т.к. статистическая обработка данных проводится на основании только 2-х измерений контрольной пробы, что не исключает вероятность случайной ошибки и отрицательно сказывается на результатах сравнения. Принципы данного математического подхода соответствуют уровню 1970-х годов и требуют обновления в соответствии с современными методами статистики.
Кроме того, применение контрольных материалов заводского приготовления дорого для проведения более частого межлабораторного сравнения и не доступно для многих лабораторий. При этом межлабораторное сравнение результатов исследований осуществляется строго по расписанию в установленные сроки, хотя производственная необходимость может потребовать оперативного проведения оценки качества по наиболее проблемным показателям. Результаты межлабораторных сравнений отсылаются в лаборатории-участницы в течение длительного срока (4-6 недель), что не позволяет оперативно отреагировать на них на рабочих местах.
Известен способ межлабораторного сравнения и оценки смещения с применением разделенных проб пациентов, который описан в документе ЕР-9А Национального Комитета клинико-лабораторных стандартов (NCCLS), в котором было уточнено количество требуемых измерений для каждой пробы (см. Method comparison and bias estimation Using Patient Samples. Approved Guideline EP9-A, NCCLS, 1995. ISBN 1-56238-283-7). Согласно этому способу в оценке участвуют только две лаборатории, результаты измерений которых сравниваются. Для получения достаточного количества данных необходимо как минимум 40 проб пациентов, отобранных согласно определенной схеме для того, чтобы обеспечить распределение проб в соответствующем интервале. Каждую пробу разливают на две части (аликвоты) в разные пробирки и измеряют дважды (в дубликате) в каждой из двух лабораторий (или двумя разными инструментами, между которыми проводится сравнение). Итого получают 160 результатов измерений. Все пробы должны быть измерены в течение 2-х часов, чтобы сохранить стабильность измеряемого аналита. Поскольку в день рекомендуется измерять не более 4-8 дубликатов, то такие исследования занимают 5-10 дней. На основе разницы средних значений каждого дубликата в результатах измерений, полученных в каждой лаборатории-участнице, строят график регрессии, по которому судят о качестве проведенных исследований и о необходимости проведения корректирующих мероприятий.
Этот способ межлабораторного сравнения также характеризуется низкой достоверностью, обусловленной небольшим (недостаточным) количеством статистических данных по каждому аналиту (всего две лаборатории-участницы, два повторных измерения образца пробы, причем со случайно взятой концентрацией аналита), а также тем, что сравниваются результаты лабораторий, возможно, одного уровня оснащения и квалификации. Кроме того, такой способ требует длительных трудозатрат на сбор биоматериала и на измерения (необходимо собрать образцы проб у 40 пациентов, провести по два измерения в каждой лаборатории, итого 160 повторных измерений для каждого аналита за несколько дней), что существенно снижает его эффективность с экономической точки зрения. Сокращение же количества исследований неизбежно приведет к увеличению неопределенности измерения.
Наиболее близким по технической сущности к заявленному является способ оценки качества исследований, проведенных в медицинской клинике и лабораториях с помощью разделенной пробы пациента, описанный в статье Shahangian S., Cohn R.D., Gaunt E.E., Krolak J.M. System to monitor a portion of the total testing process in medical clinic and laboratories: evaluation of a split specimen design. Clinical Chemistry v.45:2, p.269-280, 1999 г.
Сравнение результатов лабораторных анализов проводилось только по двум аналитам - холестерину и калию. Согласно этому способу персонал одной медицинской клиники собирает 3 образца (пробирки) крови от каждого больного. Первый образец (S1) исследуют в лаборатории этой же клиники, как обычно, в плановом порядке; второй образец (S2) отправляют в периферийную (RL) лабораторию для измерения с целью сравнения, третий образец (S3) передают на хранение в специальную организацию-хранилище, где его замораживают с возможностью последующего восстановления. В периферийной лаборатории образец (S2) исследуют не позднее 18 часов с момента взятия пробы.
При выявлении существенных различий в результатах измерений одной и той же пробы пациента в лаборатории клиники и в периферийной лаборатории (при разнице от 6,4% до 8,5%) предпринимают следующий этап сравнения, на котором используют находящийся на хранении третий образец S3. Восстановленный до нормальной температуры третий образец вновь разделяют на 3 пробы (А1, А2, A3). Пробу А1 отсылают в лабораторию клиники, пробу А2 - в периферийную лабораторию, а пробу A3 - в специализированную по исследуемым аналитам, в частности по холестерину и калию, арбитражную (или референтную) лабораторию, предназначенную для проведения анализа проверяемого образца и вынесения решения в отношении выявленных расхождений. В качестве арбитражной лаборатории, как правило, выбирают такую, которая обладает специальным сертификатом, подтверждающим стандартизованную процедуру измерения оцениваемых аналитов (компонентов). Затем снова проводят исследования этих образцов, а их результаты обрабатывают с оценкой вариабельности измерений и разницей результатов по сравнению с данными, полученными арбитражной лабораторией, после чего делают выводы о качестве лабораторных анализов в тестируемых лабораториях и необходимости проведения рекалибровки (корректирующих мероприятий). Аналогично проводят оценку качества измерений и в отношении других периферийных лабораторий.
Анализ разделенной пробы пациента, выполненный в 11 различных лабораториях, показал различия результатов в пределах 2,5-8,7% по калию (допустимая погрешность измерения составляет 2%) и 1,5-4,6% по холестерину (при допустимой погрешности до 4%), т.е. довольно большой их разброс, причем частично за границами допустимых отклонений, особенно для калия, что может привести к серьезным ошибкам в дальнейшей диагностике заболеваний обследуемых пациентов.
Как и предыдущие, этот способ оценки качества лабораторных исследований также оказывается недостаточно эффективным и имеет ряд существенных недостатков. Основным из них является то, что согласно способу каждый образец измеряют по одному разу, причем исследованию подвергают аналит только одного уровня концентрации, что не позволяет получить статистически достоверные результаты и оценить работу лаборатории в широком диапазоне изменений концентрации аналита.
Кроме того, для проведения сравнения по данному способу предусмотрено участие специализированной организации, осуществляющей хранение проб и рассылку аудиторских образцов на втором этапе исследований, а для обработки полученных результатов к исследованиям дополнительно подключен отдельный аналитический исследовательский центр (ASI), т.е. исследования осуществляют многоступенчато, что увеличивает длительность и стоимость их проведения, а также неоправданно усложняет процедуру. К тому же повторное размораживание пробы снижает достоверность результатов.
Необходимо учесть также, что количество референтных (или арбитражных) лабораторий сокращается с каждым годом не только в России, но и за рубежом из-за больших экономических затрат на их содержание. В настоящий момент в России нет официально признанных референтных лабораторий. Наиболее известных референтных лабораторий на территории Европы всего 3 - одна во Франции и 2 в Германии. Поэтому получить сертификат качества такой лаборатории на определенный вид исследования весьма затруднительно как для Европейского Союза, так и для РФ.
Изобретение решает задачу повышения эффективности оценки качества клинических лабораторных исследований и сопоставимости результатов путем оптимизации соотношения затрат на проведение оценки и достоверности полученных данных, используемых для дальнейшей их обработки и принятия решения о необходимости осуществления корректирующих мероприятий.
Технический результат, достигаемый изобретением, заключается в повышении надежности и достоверности получаемых данных лабораторных исследований, снижении времени и стоимости их проведения.
Для достижения указанного результата в соответствии со способом оценки качества клинических лабораторных исследований, включающим приготовление пробы из биоматериалов пациента, разделение ее на отдельные части по числу лабораторий-участниц оценки, рассылку образцов разделенных проб в каждую из лабораторий-участниц, измерение в каждой лаборатории показателей предоставленной разделенной пробы и проведение по результатам их сравнения оценки качества результатов измерений, согласно заявленному способу выбирают одну из лабораторий в качестве лаборатории-куратора, все разделенные пробы сохраняют при определенных температурных условиях, для проведения измерений по каждому показателю биоматериала используют два образца пробы пациента, первый из которых имеет высокую концентрацию аналита, а второй - более низкую, в каждой из лабораторий-участниц проводят измерение первой и второй проб от 6 до 10 раз каждую, по полученным данным в лаборатории-кураторе методом регрессионного анализа строят графики регрессии и по ним сравнивают результаты исследований, а о качестве лабораторных исследований судят по полученным параметрам этих графиков.
При этом высокая и низкая концентрации аналита пробы пациента имеют соотношение не менее чем 1,3:1 соответственно.
Для поддержания стабильности исследуемого биоматериала разделенные пробы сохраняют в лаборатории-кураторе при температуре от -20°С до -25°С в зависимости от вида аналита и предполагаемых сроков его хранения, измерения разделенных проб пациента производят в одно и то же заранее определенное время во всех лабораториях-участницах, а время транспортировки рассылаемых проб устанавливают не более 2-5 часов.
Чтобы обеспечить достаточное (оптимальное) для повторных измерений количество аналита, разделенные пробы пациента рассылают в лаборатории-участницы в объеме не менее 1 мл.
Решение о необходимости выполнения процедуры рекалибровки лабораторного оборудования принимают на основе проведенной оценки качества работы лабораторий и полученных данных регрессионного анализа.
Сущность изобретения заключается в том, что в каждой лаборатории-участнице оценки качества лабораторных исследований производят 6-10 измерений пробы пациента с высокой концентрацией исследуемого аналита и 6-10 измерений пробы другого пациента с низкой концентрацией того же аналита. В случае участия в процедуре, например, двух лабораторий (или двух сравниваемых инструментов) всего получается от 24 до 40 измерений, по 12-20 измерений в каждой.
Выбор кратности (6-10 раз) повторных измерений проб исследуемого аналита основан на экспериментальных данных. Известно, что повторные измерения любого параметра уменьшают погрешность полученных результатов, причем погрешность будет уменьшаться обратно пропорционально квадратному корню из количества измерений. Как показывают проведенные исследования (см. таблицу (а) и график (б) на фиг.1), стандартная ошибка (общая погрешность измерения) существенно уменьшается при увеличении количества повторных измерений до 6 (с 68% при двукратном измерении до 39% при 6-ти кратном). При увеличении количества измерений более десяти погрешность снижается не столь существенно (например, с 30% при 10-ти повторных измерениях до 21% при 21 повторном измерении). Таким образом, оптимальным с точки зрения достигаемой точности, трудозатрат и стоимости исследования является количество измерений в пределах 6-10 раз.
Использование в заявленном способе проб пациентов с высокой и низкой концентрацией аналита (исследуемого компонента) можно пояснить следующим образом. Для обработки результатов измерений согласно заявленному способу применяют регрессионный анализ и построение графиков регрессии по двум точкам, между которыми, как известно, можно провести только одну линию. Координаты этих точек определяются путем повторных измерений исследуемых компонентов в двух концентрациях. При этом соотношение между концентрациями одного и того же аналита может быть различным, важно, чтобы были две различные концентрации - одна ниже, а другая выше. В обычной поликлинической практике врач оценивает результаты клинических анализов относительно интервала нормальных значений (референтного интервала), то есть по отношению к нижней и верхней границам нормы. В соответствии с этим значения, приближающиеся к нижней границе нормы или еще ниже, можно рассматривать как низкую концентрацию аналита, а приближающиеся к верхней границе нормы или превышающие ее - как высокую концентрацию. Такой подход удобнее согласуется с оценкой измерительных процедур с медицинской точки зрения.
Как правило, верхняя и нижняя границы нормы по большинству клинических показателей отличаются друг от друга приблизительно в 1,3 раза или немногим более. Соответственно и соотношение значений высокой и низкой концентрации исследуемого аналита согласно способу целесообразно установить не ниже 1,3:1. Данная разница в 1,3 раза обусловлена и тем, что погрешность, при которой определяется достоверная минимальная разница между двумя концентрациями, равняется корню квадратному из 2-х (по числу уровней концентрации), что составляет примерно 1,414. Поэтому разница в 1,3 раза идеально соответствует и правилам статистики. Таким образом, хотя разница между концентрациями может быть и иной, но ориентир на границы референтных интервалов или норм облегчает интерпретацию данных с медицински значимой и статистической точек зрения.
Процесс клинико-лабораторного исследования имеет целью определение истинного значения измеряемого аналита в жидкостях человеческого тела (биоматериале) при определенных условиях преаналитической фазы (забор биоматериала, его транспортировка, пробоподготовка), которые влияют на стабильность проб крови, сыворотки, плазмы, мочи, спинно-мозговой жидкости и др. Одним из таких условий является температура хранения проб.
Основными температурными режимами хранения биоматериала в ежедневной практике обычной лаборатории является комнатная температура, 4-8°С, -20°С, от -20°С до -25°С. В некоторых случаях, когда стабильность биоматериала необходимо сохранить на протяжении 6-10 месяцев, его подвергают глубокой заморозке при температуре -70°С. Температурный режим устанавливается в зависимости от схемы проводимых исследований.
Как показывает практика, для щелочной фосфатазы (распространенный тест для диагностики заболеваний печени, особенно желчно-каменной болезни), например, стабильность пробы при комнатной температуре снижается на 4-й день, при 4-8°С - на 7-й день, а при -20°С проба стабильна в течение 2 месяцев. Для амилазы (маркер панкреатита) стабильность пробы при комнатной температуре снижается также на 4-й день, при 4-8°С - на 7-й день, а при -20°С проба сохраняется до 1 года. Для общего белка в моче хранить пробу при комнатной температуре вообще не рекомендуется, при 4-8°С она стабильна 7 дней, а при -20°С - 1 месяц. Для гематологических проб, для таких показателей, как виды нейтрофилов, эозинофилы, базофилы, моноциты, снижение температуры хранения не ниже -25°С позволяет увеличить время стабильности до 12 часов, чего не достигается при -20°С. Для лимфоцитов это различие возрастает от 3 часов до 4 суток. Стабильность эритропоэтина, который применяется для допинг-контроля у спортсменов, вообще не ясна для температур выше -20°С. Только при -25°С она определяется в 2 недели.
Таким образом, анализ вышеприведенных данных показывает, что для гарантии стабильности проб пациента в ходе проведения оценки качества лабораторных исследований наиболее оптимальным является режим сохранения проб при температуре от -20 до -25°С, что позволяет получить достоверные результаты лабораторных исследований и оптимизировать процесс хранения и транспортировки биоматериала.
Применение построения графика регрессии по двум точкам, координаты которых определены путем повторных (6-10 раз) измерений исследуемых аналитов в двух различных концентрациях (высокой и низкой), позволяет представить результаты исследования в виде линейной зависимости в широком диапазоне изменений концентрации исследуемого аналита. Теоретически, при совпадении результатов измерения, полученных в разных лабораториях, должна получиться линейная зависимость между ними, близкая к «равной линии», когда Y=X.
При отклонении результатов измерений в лаборатории-участнице от эталона для сравнения линейная зависимость будет иметь вид:
Y=bX+a,
где b - угол наклона прямой, называемый коэффициентом регрессии,
а - координата пересечения прямой с осью Y.
Это позволяет проанализировать все возможные причины отклонения полученной линейной функции от «равной линии» в целях устранения ошибки и дать рекомендации по проведению в тестируемой лаборатории корректирующих действий, таких как исследование реагентов, калибраторов, контрольных материалов и инструментов, а также проверку работы персонала. Если все перечисленные факторы соответствуют требованиям и операционный процесс осуществляется без ошибок или сбоев, то необходимо решить вопрос о корректирующей калибровке (рекалибровке), основанной на выявленном отклонении от «равной линии».
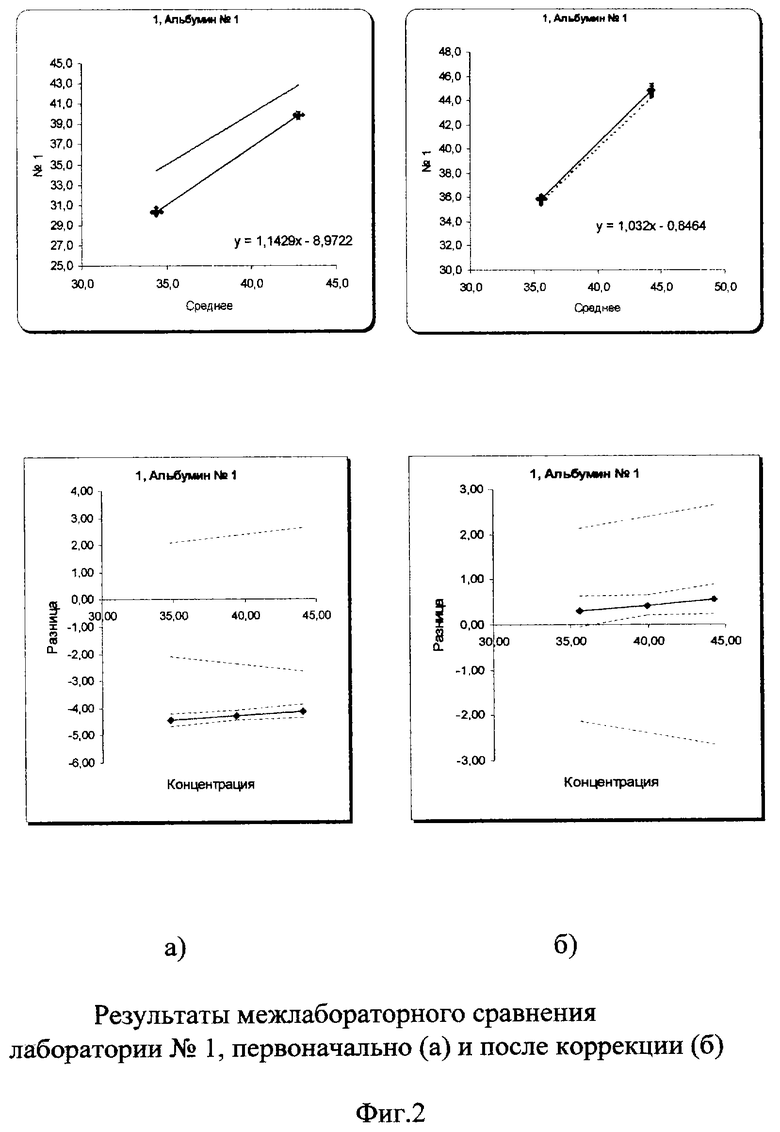
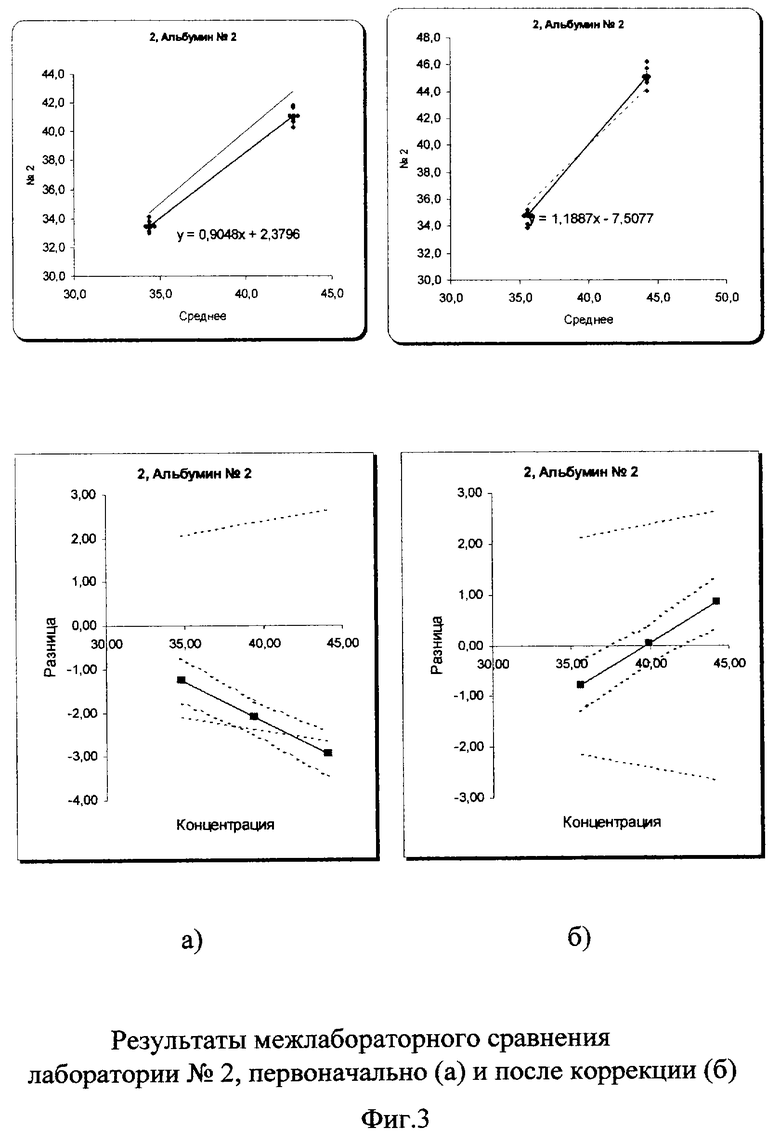
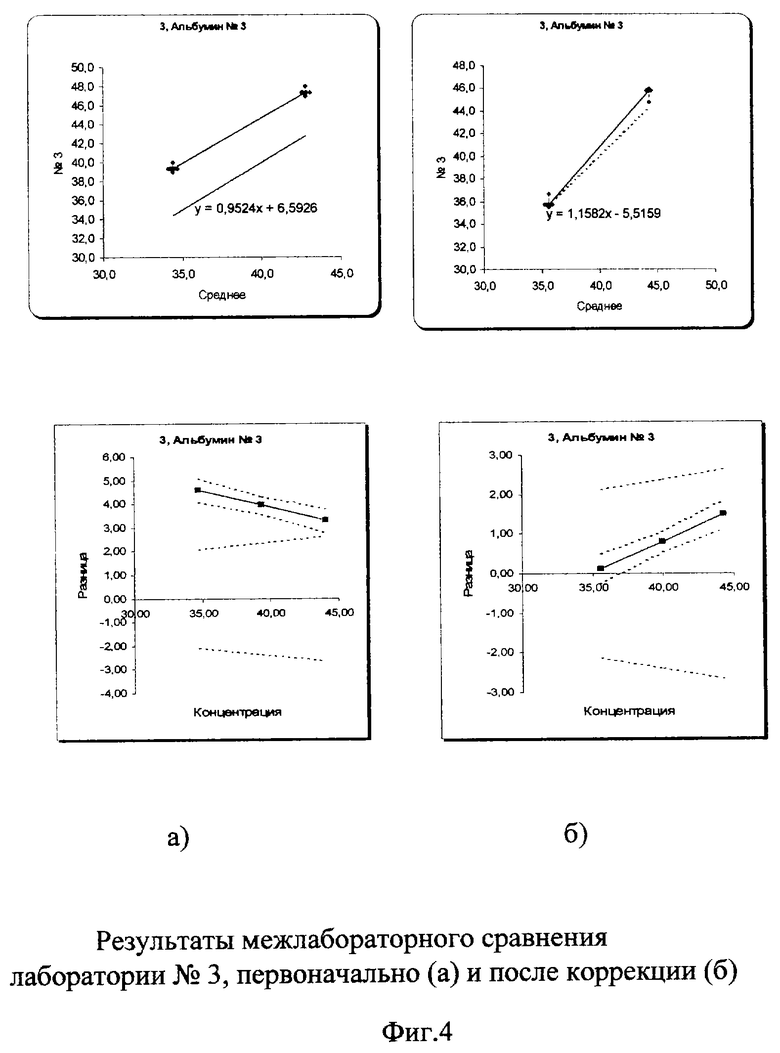
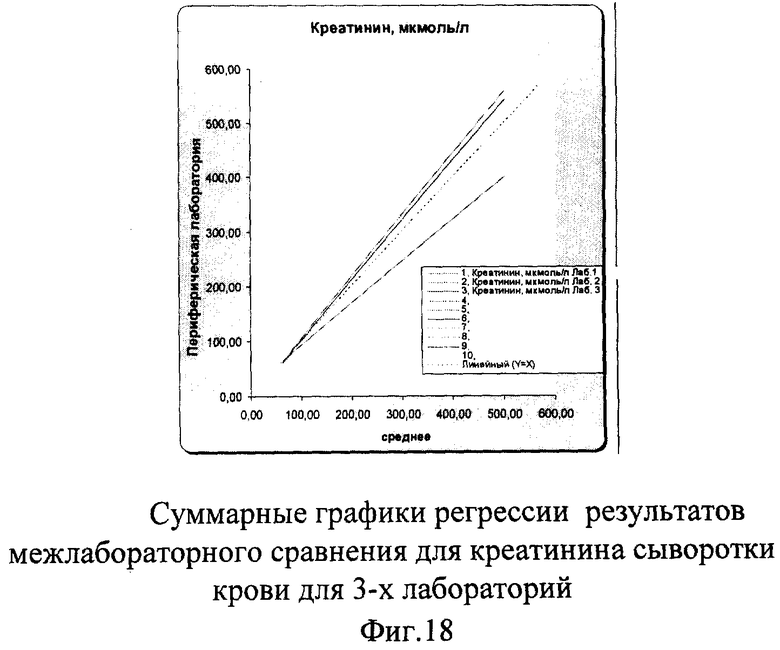
На фиг.2-5 графически представлены результаты межлабораторной оценки качества клинических лабораторных исследований по 3 лабораториям.
Способ осуществляют следующим образом.
Пробы для проведения межлабораторного сравнения приготавливают в одной из лабораторий-участниц. Пробоподготовку берет на себя лаборатория, выбранная в качестве лаборатории-куратора, которая и руководит данным экспериментом. Лабораторией-куратором должна являться лаборатория, находящаяся на высоком метрологическом уровне, то есть использующая высокоточное (по сравнению с другими лабораториями) оборудование, качественные калибраторы и контрольные материалы со ссыкой на международный эталон, с которым они соотносятся (установлена прослеживаемость), и т.д., и соответствующая стандартам, предъявляемым к медицинским лабораториям, например, Международному стандарту ISO/FDIS 15189 Медицинские лаборатории - специфические требования к качеству и компетентности (см., например, В.В.Меньшиков. Стандартизация в клинической лабораторной медицине. Организационные и метрологические аспекты. - М., 2005 г., с.81-83, 195-216).
Биоматериал пациентов, который остается после обязательных рутинных измерений, разливают в отдельные пробирки таким образом, чтобы в одной пробирке была сыворотка пациента или сливная сыворотка нескольких пациентов с высоким уровнем концентрации исследуемого аналита, а в другой - с низким (с разницей не менее чем в 1,5 раза), что позволит оценить качество работы лаборатории в разных уровнях концентрации. Объем общего количества биоматериала в высокой и низкой концентрациях, который приготавливает кураторская лаборатория, зависит от количества участников межлабораторного сравнения. Каждая лаборатория должна получить не менее 1 мл сыворотки каждого уровня концентрации для конкретного исследуемого аналита, что достаточно для проведения 6-10 повторных измерений из каждой пробирки. При проведении межлабораторного сравнения по одному исследуемому аналиту для каждой лаборатории-участницы подготавливают по две пробирки, например, с сывороткой крови, объемом по 1 мл в высоком и низком уровнях концентрации. Пробы с гемолизированной и липемичной сывороткой не берут для исследования.
Для поддержания и гарантии стабильности исследуемого биоматериала подготовленные разделенные пробы замораживают при температуре от -20°С до -25°С в зависимости от вида аналита и предполагаемых сроков проведения процедуры оценки, и хранят их до рассылки. Затем лаборатории назначают дату и время проведения межлабораторного сравнения. Пробирки транспортируют во все лаборатории-участницы с помощью специальных термостатируемых контейнеров со льдом, причем время транспортировки должно составлять не более 2-5 часов, что соответствует оценке качества лабораторных исследований на региональном уровне. Повторное замораживание не рекомендуется. Все лаборатории измеряют доставленные пробы в один и тот же день, чтобы избежать влияния различного времени хранения биоматериала на результаты измерений.
Пробы измеряют по 6-10 раз по каждому исследуемому аналиту в высоком и низком уровнях концентрации в течение рабочего дня в режиме обычного рутинного процесса. Проведение дополнительных повторных измерений исключается.
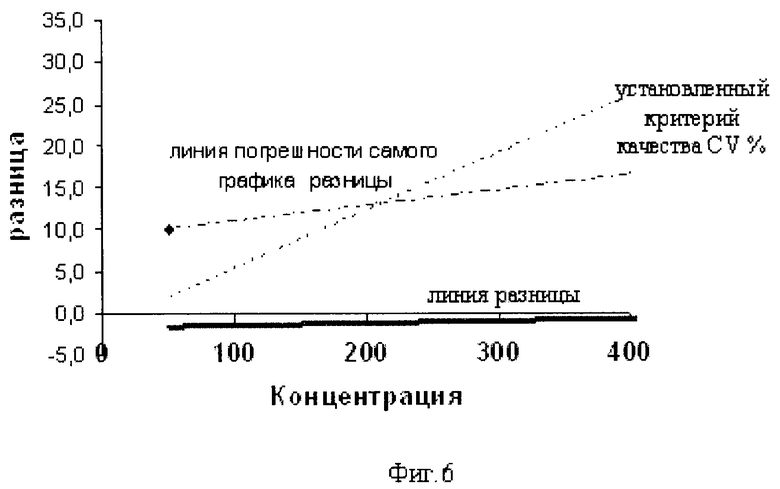
Результаты выполненных измерений систематизируют путем занесения в специальный протокол на бумажном или электронном носителе, который отсылают в лабораторию-куратор, например, с помощью факса или электронной почты. Протокол содержит основную информацию о лаборатории, инструменте, реагентах, методе, калибраторе и дополнительные сведения, имеющие значения для эксперимента. После этого лаборатория-куратор по результатам, полученным от каждой лаборатории-участницы, определяет параметры регрессии, по которым оценивает качество исследований. При этом параметрами для сравнения служат средние значения для каждого из измерений, внутрилабораторные показатели погрешности (сходимость) измерений каждой лаборатории-участницы в виде стандартного отклонения SD и коэффициента вариации CV%, общая погрешность в виде межлабораторного SD и CV% по каждому уровню концентрации для каждого аналита, что позволяет оценить разброс данных в лабораториях региона проведения оценки по конкретному исследуемому показателю (аналиту), а также эффективно оценить сопоставимость данных лабораторного анализа. Обозначения линий графика разницы представлены на фиг.6.
Оценка данных может быть проведена, например, с помощью компьютерной программы «Внешняя оценка качества медицинских анализов методом кураторского подхода и разделенной пробы пациента» (регистрационный №2005611346), разработанной в СПбГМУ им. акад. И.П.Павлова, Санкт-Петербург, используя которую на основании введенных данных межлабораторного сравнения вычисляют показатели функции рекалибровки и другие показатели.
Способ иллюстрируется следующим примером.
Пробы для проведения межлабораторного сравнения приготавливались в одной из лабораторий-участниц. В данном примере участвовали 3 лаборатории, в качестве исследуемого компонента (аналита) был использован альбумин.
Надо отметить, что альбумин сыворотки крови является важным лабораторным показателем, особенно при обследовании больных с заболеваниями почек. Известно, что при хронической почечной недостаточности больные теряют белок с мочой, и в сыворотке крови его содержание падает. Норма альбумина 35-50 г/л. Низкие концентрации альбумина (ниже 25 г/л) опасны для жизни, что требует дополнительного внутривенного введения раствора альбумина. Высокие концентрации альбумина могут быть диагностическими признаками такого опасного заболевания, как миеломная болезнь. По международным нормам точности ошибка при измерении альбумина сыворотки крови не должна превышать 3%. Таким образом, важно получать надежные результаты альбумина как в низком, так и в высоком уровнях концентрации.
Перед началом процедуры оценки из числа лабораторий-участниц была выбрана кураторская лаборатория, которая взяла на себя пробоподготовку и руководила проведением оценки качества исследований. Биоматериал пациентов, который остался после обязательных рутинных измерений, разливали в две отдельные пробирки по 3 мл в каждой таким образом, чтобы в одной пробирке была сыворотка пациента или сливная сыворотка нескольких пациентов с высоким уровнем концентрации альбумина, а в другой - с низким. После этого для каждой лаборатории в отдельные мини-пробирки с закрывающимися крышками (пробирка типа эппендорф) разлили по 1 мл забранной сыворотки каждого уровня концентрации альбумина (или другого исследуемого компонента), что достаточно для проведения шести повторных измерений из каждой пробирки. Для каждой лаборатории подготовили по 2 эппендорфа с низкой и высокой концентрациями альбумина. Подготовленный биоматериал замораживали при -20°С и хранили его до рассылки в морозильной камере в кураторской лаборатории. Затем лаборатории согласовали дату и время проведения межлабораторного сравнения. В назначенный день пробирки транспортировали во все лаборатории с помощью специальных термостатируемых контейнеров со льдом в течение 2-5 часов. Все лаборатории измеряли доставленные пробы в один и тот же день, чтобы избежать влияния различного времени хранения биоматериала на результаты измерений.
Каждая лаборатория измеряла пробу альбумина по шесть раз в высоком и низком уровнях концентрации в течение рабочего дня. Результаты выполненных измерений заносились в специальный протокол на бумажном или электронном носителе, который отсылался по факсу или электронной почте в кураторскую лабораторию, проводящую вычисления и анализ данных межлабораторного сравнения. В данном примере протоколы отсылались на кафедру клинической лабораторной диагностики СПбГМУ им. акад. И.П.Павлова, которая выполняла роль кураторской лаборатории.
Данные повторных измерений альбумина заносились в электронную таблицу. Автоматически рассчитывались средние значения всех измерений и погрешности каждой лаборатории в виде стандартного отклонения SD и коэффициента вариации CV% (фиг.6). Полученные результаты сравнивались со средним значением, полученным во всех лабораториях.
В пределах самих лабораторий погрешности измерений были в допустимых пределах коэффициента вариации (3%). В лаборатории №1 коэффициент вариации составил 0,9% в низкой концентрации аналита и 0,54% в высокой. В лаборатории №2 - 1,2% и 1,41%, в лаборатории №3 - 1,3% и 0,9% соответственно. Несмотря на хорошие показатели внутрилабораторной сходимости, данные межлабораторного сравнения выявили существенные различия между всеми лабораториями.
Межлабораторный коэффициент вариации составил 13,4% в низкой концентрации и 9,4% в высокой, что в 3-4 раза превышает допустимую погрешность 3%. Построение регрессионных графиков и графиков разницы позволяет наглядно это продемонстрировать на фиг.2а, 3а, 4а.
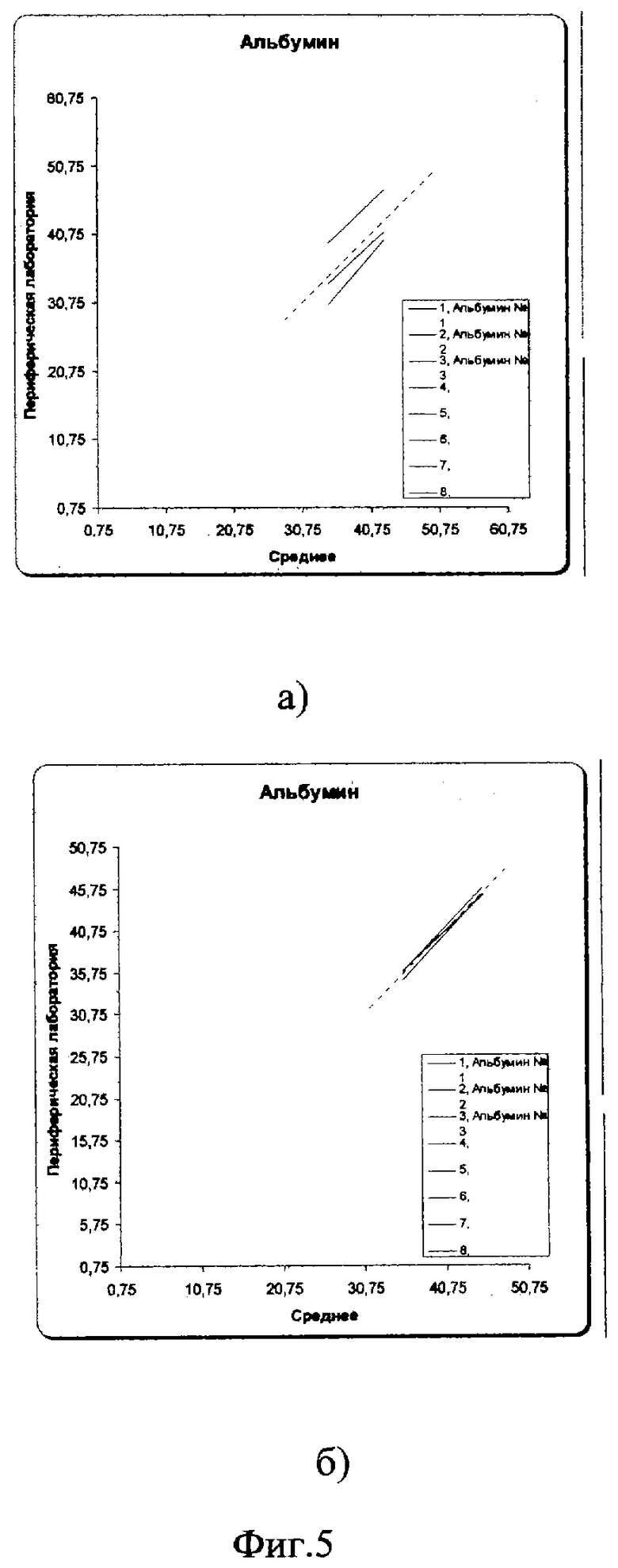
После проведения корректирующих мероприятий (рекалибровки, смены реагентов, очистки кюветы и т.д.) межлабораторный коэффициент вариации существенно уменьшился и вошел в допустимые пределы: 2,1% в низкой концентрации и 1,6% в высокой (фиг.2б, 3б, 4б). На фиг.5(а) показано, насколько были сильно выражены различия в результатах лабораторий первоначально из-за большой погрешности (межлабораторного коэффициента вариации) и насколько удалось уменьшить эти различия после проведения корректирующих процедур (фиг.5б).
На фиг.2а показано, что график регрессии лаборатории №1 отличается от идеальной линии регрессии (пунктирная линия), при которой результаты во всех лабораториях должны совпадать. На графике разницы видно, что данные сравнения этой лаборатории (сплошная линия) находятся за установленными пределами качества, когда коэффициент вариации составляет не более 3% (показано симметричной по отношению к нулевой отметке пунктирной линией). После проведения коррекции (рекалибровка, смена реагентов и т.д.) на фиг.2b видно, что регрессионный график приблизился к идеальной линии. Тангенс угла наклона (Slope) уменьшился с 1,14 до 0,92, точка пересечений с осью Y (Intersept) также более приблизилась к «0» от -8,97 до 3,39. График разницы вошел в установленные пределы качества 3%.
Результаты измерения лаборатории №2 были лучше, чем №1 (см. фиг.3а). Однако данные высокой концентрации альбумина были за пределами критериев качества, что показано на графике разницы. После проведения коррекции на фиг.3b видно практически полное совпадение графика регрессии и идеальной линии регрессии за счет улучшения такого показателя регрессии, как тангенс угла наклона (Slope), который приблизился практически к идеальному показателю с 0,9 до 1,06. График разницы также попал в установленные критерии качества.
Данные лаборатории №3 были значительно выше полученных показателей других лабораторий и находились за пределами допустимой погрешности (фиг.4а). После проведения процесса рекалибровки оборудования в соответствии с данными регрессионного анализа график регрессии практически совпал с идеальным. Тангенс угла наклона (Slope) уменьшился с 0,95 до 1,03, точка пересечений с осью Y (bitersept) максимально приблизилась к «0», от 6,59 до -0,76. График разницы оказался в допустимых пределах качества (фиг.4б).
Заявленный способ контроля качества клинических лабораторных исследований может быть проиллюстрирован другим примером, в котором в качестве исследуемого компонента (аналита) используется один из энзимов, например энзим аланинаминотрасфераза (АЛТ).
Энзим АЛТ также является важным лабораторным биохимическим маркером, в частности при заболеваниях печени, который определяется в сыворотке или плазме крови. Его уровень активности в норме составляет 7-40 МЕ/л (кинетический метод). Находясь в цитоплазме гепатоцита, данный энзим быстро выходит из клетки при нарушении целостности цитоплазматической мембраны и говорит о выраженности цитолитического синдрома, который является ведущим при большинстве заболеваний печени. Повышение активности АЛТ в 1,5-5 раз по сравнению с верхней границей нормы рассматривают как умеренную гиперферментемию; в 6-10 раз - как гиперферментемию средней степени, и более чем в 10 раз - как высокую (Г.И.Назаренко, А.А.Кишкун. Клиническая оценка результатов лабораторных исследований. // Москва, «Медицина». - 2000. - с.163). Для клинической практики и диагностики патологии печени важно иметь надежные результаты АЛТ, сопоставимые с данными различных лабораторий, куда может обратиться пациент.
Как и в предыдущем примере, пробы для проведения межлабораторного сравнения приготавлялись одной из лабораторий-участников. В данном примере участвовали 3 лаборатории. Пробоподготовку взяла на себя кураторская лаборатория, которая руководила проведением сравнения. Биоматериал пациентов, который остался после обязательных рутинных измерений, разливался в 2 отдельные пробирки по 3 мл в каждой таким образом, чтобы в одной пробирке была сыворотка пациента или сливная сыворотка нескольких пациентов с высоким уровнем концентрации АЛТ, а в другой - с низким уровнем. При этом была взята нативная (неизмененная, без добавок и разбавлений) сыворотка или плазма конкретных пациентов с известными уровнями высокой и низкой концентрации. После этого для каждой лаборатории в отдельные мини-пробирки с закрывающимися крышками (пробирка типа эппендорф) было разлито по 1 мл забранной сыворотки каждого уровня концентрации АЛТ (аналогично тому, как и для других исследуемых компонентов), что достаточно для проведения шести повторных измерений из каждой пробирки. Тем самым для каждой лаборатории приготавливается 2 эппендорфа, один с низкой и один с высокой концентрациями АЛТ. Подготовленный биоматериал замораживался при -20°С и хранился до его рассылки в морозильной камере в кураторской лаборатории. Проба для исследования на АЛТ стабильна при комнатной температуре в течение 24 часов, а при -20° - до 1 месяца. Затем лаборатории назначали дату и время проведения межлабораторного сравнения. В назначенный день пробирки транспортировались во все лаборатории с помощью специальных термостатируемых контейнеров со льдом в течение 2-3 часов. Повторное замораживание не рекомендуется. Все лаборатории измеряли доставленные пробы в один и тот же день, чтобы избежать влияния различного времени хранения биоматериала на результаты измерений.
Каждая лаборатория измеряла пробу АЛТ по шесть раз в высоком и низком уровнях концентрации в течение рабочего дня в режиме обычного рутинного процесса.
Результаты выполненных измерений заносятся в специальный протокол на бумажном или электронном носителе, который затем отсылается по факсу или электронной почте в кураторскую лабораторию или ответственному лицу, проводящему вычисления и анализ данных межлабораторного сравнения. Протокол содержит основную информацию о лаборатории, инструменте, реагентах, методе, калибраторе, а также дополнительные сведения, имеющие значение для эксперимента. В данном примере использования способа протоколы отсылались на кафедру клинической лабораторной диагностики СПбГМУ им. акад. И.П.Павлова, которая выполняла роль кураторской лаборатории.
Данные повторных измерений АЛТ заносились в электронную таблицу. Автоматически рассчитывались средние значения всех измерений и погрешности каждой лаборатории в виде стандартного отклонения SD и коэффициента вариации CV%. Полученные результаты сравниваются со средним значением, полученным во всех лабораториях.
В результате проведенного межлабораторного сравнения все лаборатории показали хорошо сопоставимые результаты, не требующие коррекции. В пределах самих лабораторий показатели сходимости были в допустимых пределах коэффициента вариации от 4,2% в лаборатории 1 до 7,4% в лаборатории 3 в низком уровне концентрации и от 0,96% до 1,86% в высоком уровне концентрации.
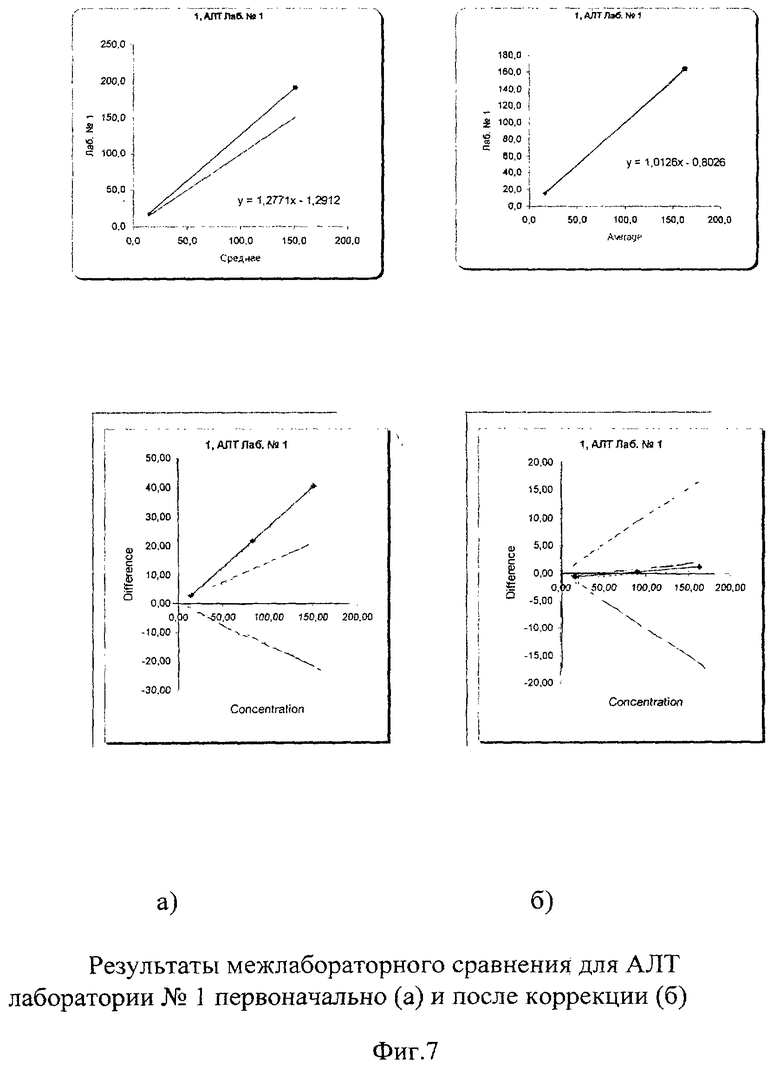
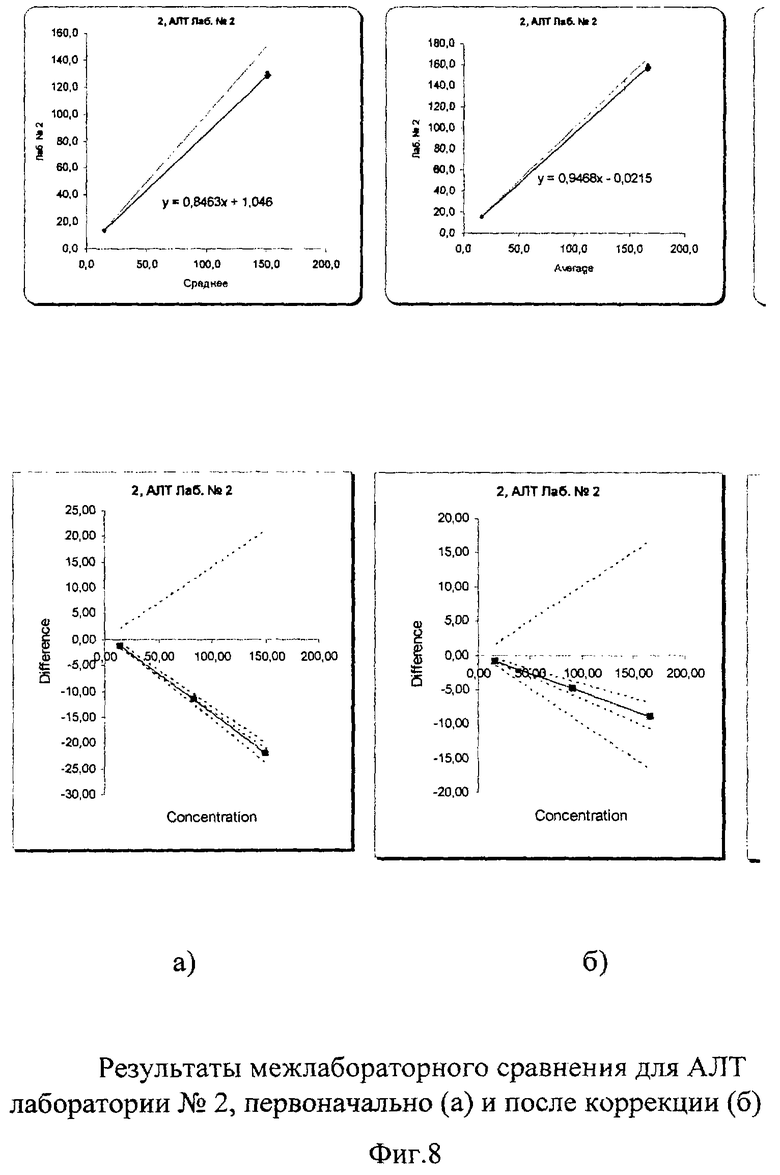
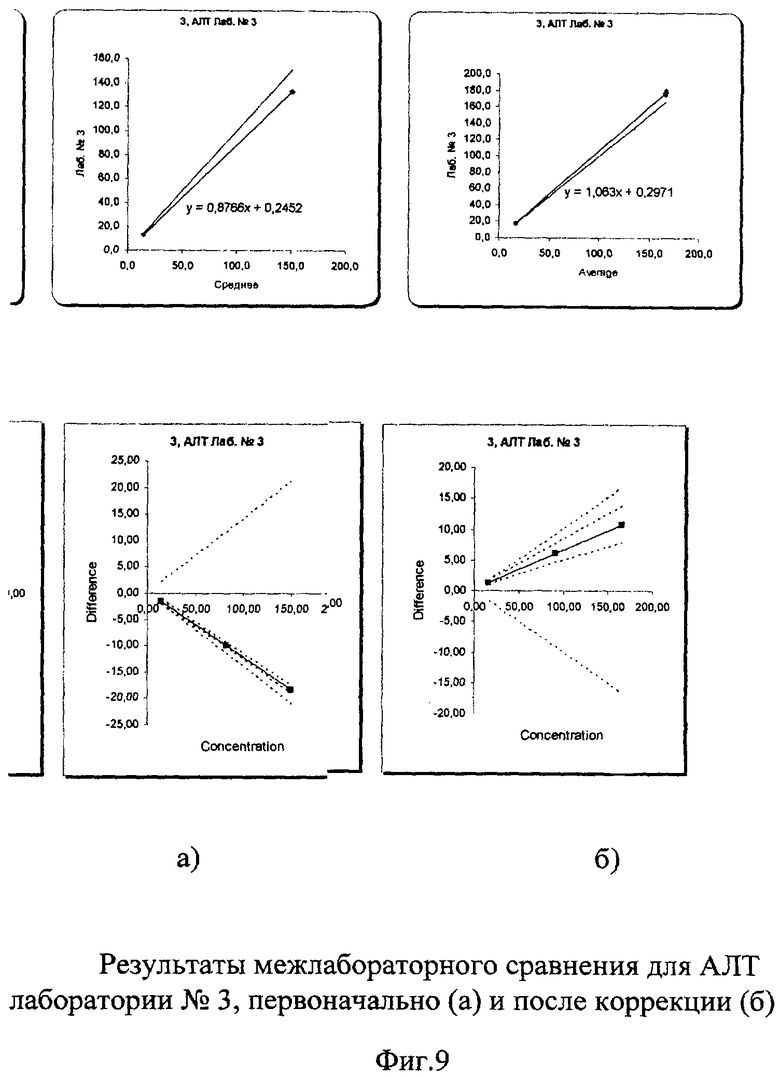
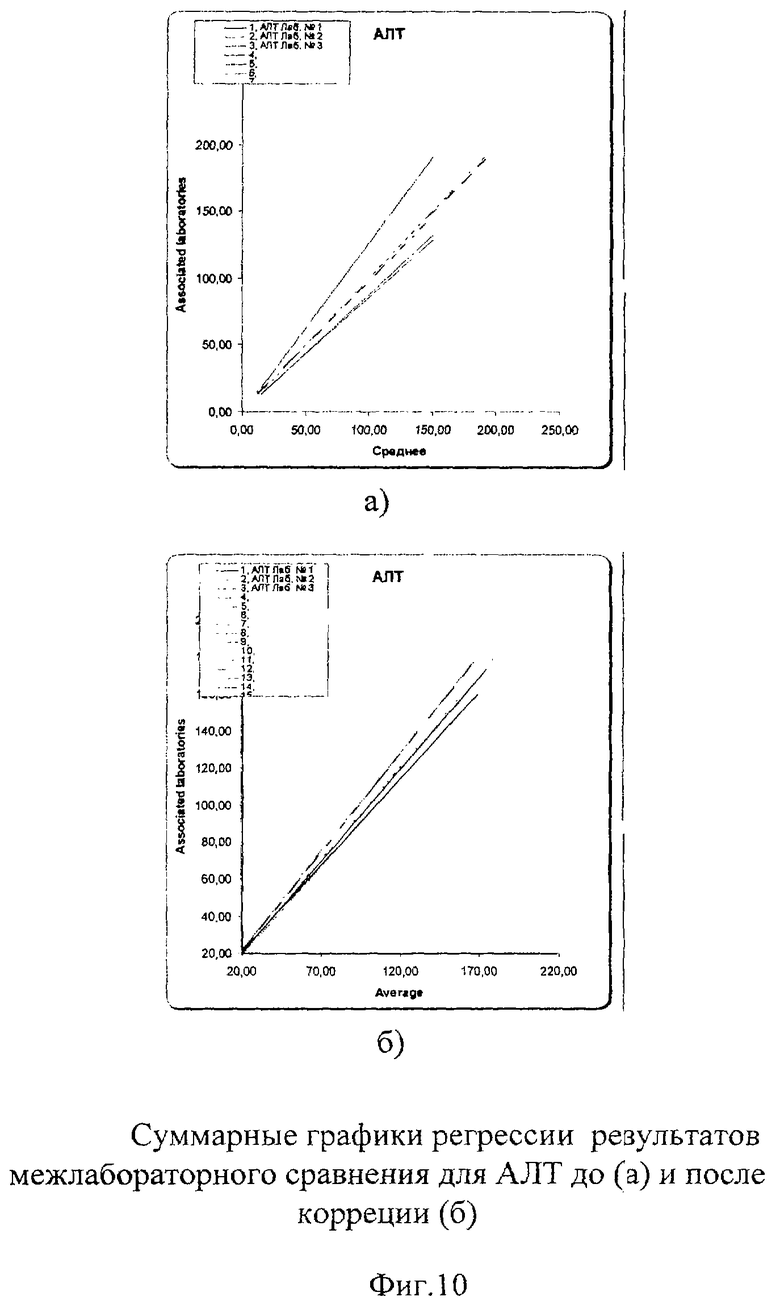
Межлабораторный коэффициент вариации составил 3,8% в низкой концентрации и 5,9% в высокой, что абсолютно укладывается в допустимые пределы как по международным критериям, так и по российским требованиям (до 17%). Построение регрессионных графиков и графиков разницы позволяет наглядно это продемонстрировать на фиг.7а, 8а, 9а, из которых видно, что графики регрессии незначительно отличаются от идеальной линии.
На графике разницы (Фиг.7б, 8б, 9б) показано, что данные сравнения всех лабораторий (сплошная линия) находятся в установленных пределах качества. На фиг.10 наглядно представлены суммарные результаты, полученные во всех лабораториях. Все графики регрессии находятся рядом с идеальной линией, что говорит о хорошей сопоставимости и высоком уровне качества выполненных исследований. Корректирующих мероприятий при этом не требуется.
Следующий пример иллюстрирует применение заявленного способа для случая, когда в качестве исследуемого компонента (аналита) используется неорганическое вещество - общий кальций в сыворотке крови.
Кальций - основной минерал человеческого скелета и самый распространенный катион организма. В сыворотке/плазме крови концентрация кальция относительно постоянна в течение всей жизни человека. В норме уровень общего кальция в сыворотке/плазме крови составляет от 2,25-2,85 ммоль/л (Медицинские лабораторные технологии, т.2. Справочник под редакцией А.И.Карпищенко // Санкт-Петербург «Интермедика». - 1999. - с.208-227). Содержание кальция в сыворотке крови изменяется при дисфункции паращитовидных и щитовидных желез, патологии костной ткани, новообразованиях различной локализации, при почечной недостаточности, патологии желудочно-кишечного тракта, при дисфункции половых гормонов и нарушении питания. Незначительные изменения уровня общего кальция являются опасными для здоровья пациента. К критическому уровню, не совместимому с жизнью человека, относятся концентрации общего кальция ниже 1,50 ммоль/л и выше 3,25 ммоль/л (Peter J. Howanitz, Steven J. Steindel, Nan V.Head. Laboratory Critical Values Policies and Procedures/Arch pathol Lab Med - Vol 126, June 2002). Для медицинских лабораторий очень важно иметь надежные результаты по общему кальцию, сопоставимые с данными различных лабораторий, куда может обратиться пациент.
В данном примере участвовали 3 лаборатории. В соответствии с заявленным способом пробы для проведения межлабораторного сравнения приготавливаются одной из лабораторий-участников, в частности пробоподготовку взяла на себя кураторская лаборатория, которая руководила проведением сравнения. Биоматериал пациентов, который остался после обязательных рутинных измерений, разливался в 2 отдельные пробирки по 3 мл в каждой таким образом, чтобы в одной пробирке находилась сыворотка пациента или сливная сыворотка нескольких пациентов с высоким уровнем концентрации общего кальция, а в другой пробирке - с низким. Необходимо подчеркнуть, что сыворотка/плазма для проведения исследований не разводится, а берется сыворотка конкретных пациентов с известными уровнями высокой и низкой концентрации.
После этого для каждой лаборатории в отдельные мини-пробирки с закрывающимися крышками (пробирка типа эппендорф) разливалось по 1 мл забранной сыворотки каждого уровня концентрации общего кальция, что достаточно для проведения шести повторных измерений из каждой пробирки. Для каждой лаборатории приготавливалось по 2 пробирки с низкой и высокой концентрациями общего кальция. Подготовленный биоматериал замораживался при -20°С и хранился до его рассылки в морозильной камере в кураторской лаборатории. Проба для исследования на кальций стабильна при комнатной температуре в течение 24 часов, а при -20°С - до 8 месяцев. Затем лаборатории назначили дату и время проведения межлабораторного сравнения. В назначенный день пробирки транспортировались во все лаборатории с помощью специальных термостатируемых контейнеров со льдом в течение 2-3 часов. Повторное замораживание биоматериала не рекомендуется. Все лаборатории измеряли доставленные пробы в один и тот же день, чтобы избежать влияния различного времени хранения биоматериала на результаты измерений.
Каждая лаборатория измеряла пробу на общий кальций по шесть раз в высоком и низком уровнях концентрации в течение рабочего дня. Пробы измерялись в режиме обычного рутинного процесса. Результаты выполненных измерений заносились в специальный протокол на бумажном или электронном носителе, который отсылается по факсу или электронной почте в кураторскую лабораторию или ответственному лицу, проводящему вычисления и анализ данных межлабораторного сравнения. В настоящей работе протоколы отсылались на кафедру клинической лабораторной диагностики СПбГМУ им. акад. И.П.Павлова, которая выполняла роль кураторской лаборатории.
Данные повторных измерений по общему кальцию заносились в электронную таблицу, автоматически рассчитывались средние значения всех измерений и погрешности каждой лаборатории в виде стандартного отклонения SD и коэффициента вариации CV%. Полученные результаты сравнивались со средним значением, полученным во всех лабораториях.
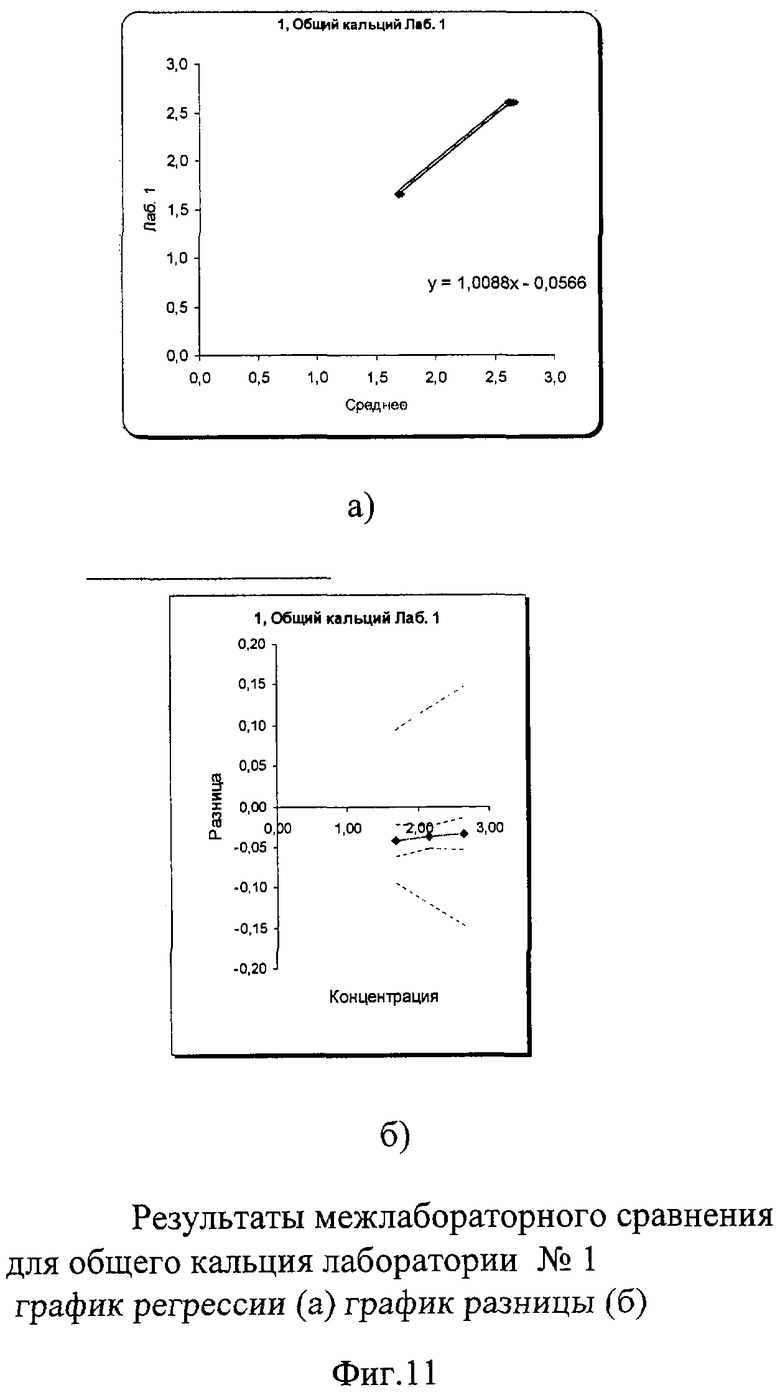
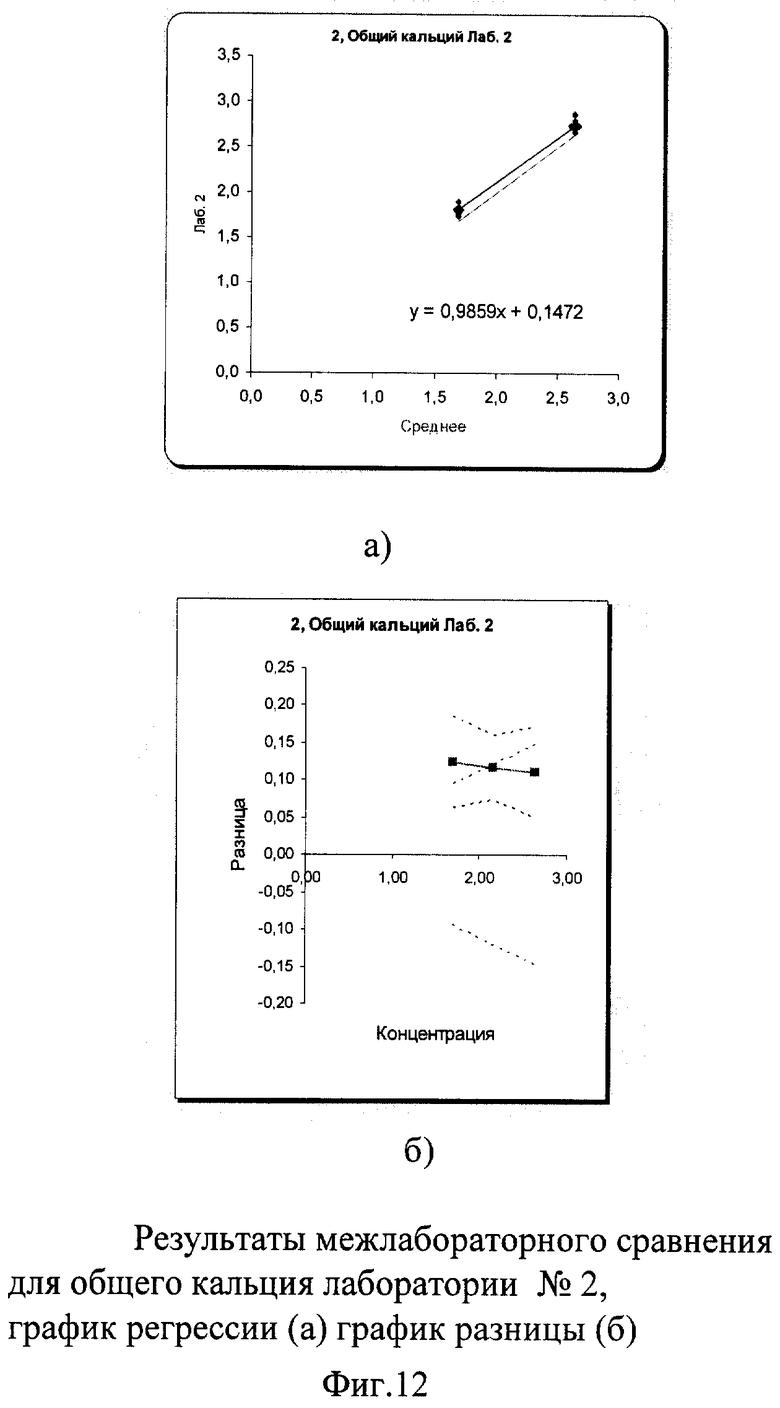
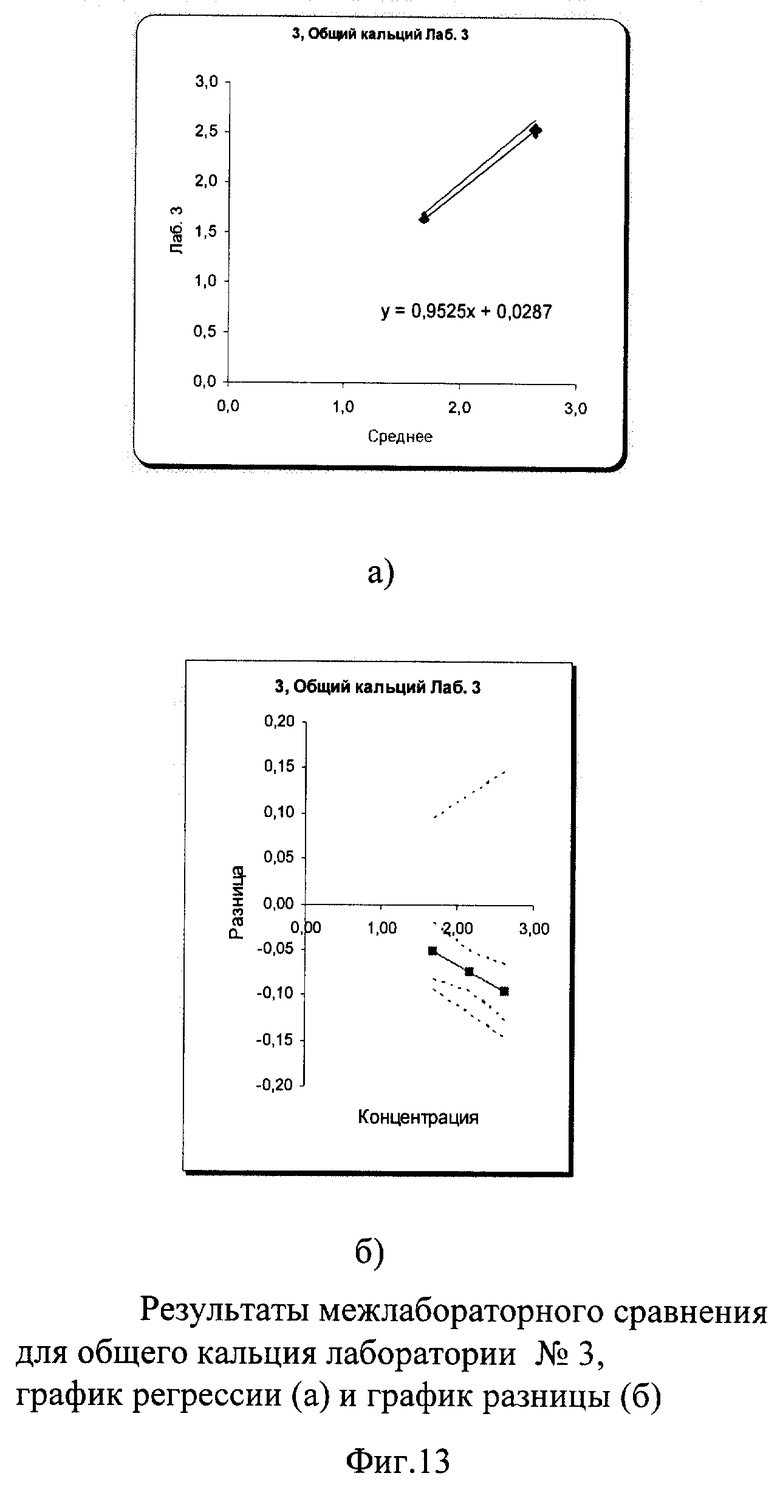
В результате проведенного межлабораторного сравнения лаборатории №1 и №3 показали хорошо сопоставимые результаты, не требующие коррекции. Лаборатория №2 несколько вышла за пределы допустимых критериев качества при измерении пробы в низкой концентрации. По международным и российским критериям качества погрешность в виде коэффициента вариации при измерении общего кальция не должна превышать 3% во всех уровнях концентрации. В пределах лаборатории №1 показатели сходимости были в допустимых пределах коэффициента вариации: 0,7% в низком уровне концентрации и 0,4% в высоком. В лаборатории №3 сходимость составила 1,6% в низком и 1,25% в высоком уровне концентрации, что также укладывается в допустимые критерии качества. В лаборатории №2 в низком уровне концентрации коэффициент вариации составил 3,3%, что незначительно превысило допустимые пределы возможной погрешности, в высоком уровне он составил 2,9%. Необходимо отметить, что лаборатория №2 к моменту проведения межлабораторного сравнения получила новый биохимический анализатор и проводила проверку его работы. Выявленные несоответствия указали на то, что прибор несколько завышает результаты измерения по общему кальцию, что требует продолжения работы по настройке работы анализатора.
Межлабораторный коэффициент вариации составил 6,1% в низкой концентрации и 4,4% в высокой, что превышает допустимые критерии качества из-за результатов апробации работы нового анализатора в лаборатории №2. Однако эти показатели составили 1,62% и 1,2% для демонстрации отличной сопоставимости лабораторий №1 и №3, что абсолютно укладывается в допустимые пределы точности как по международным критериям, так и по российским требованиям (до 3%). Построение регрессионных графиков и графиков разницы позволяет наглядно это продемонстрировать. На фиг.11а, 13а графики регрессии почти полностью совпадают с идеальной линией, тогда как на фиг.12а график регрессии идет параллельно значительно выше идеальной линии.
На графике разницы на фиг.11б, 13б видно, что данные межлабораторного сравнения лаборатории №1 и лаборатории №3 находятся в установленных пределах качества. На фиг.12б видно, что график разницы выходит за пределы критериев качества (пунктирная расходящаяся линия) в низкой концентрации и находится на их верхней границе для высокого уровня концентрации, причем погрешность самой линии разницы в любом случае превышает допустимые границы. Это наглядно демонстрирует, что показатели по общему кальцию явно завышены в лаборатории №2, на что необходимо обратить внимание при дальнейшей апробации работы нового анализатора.
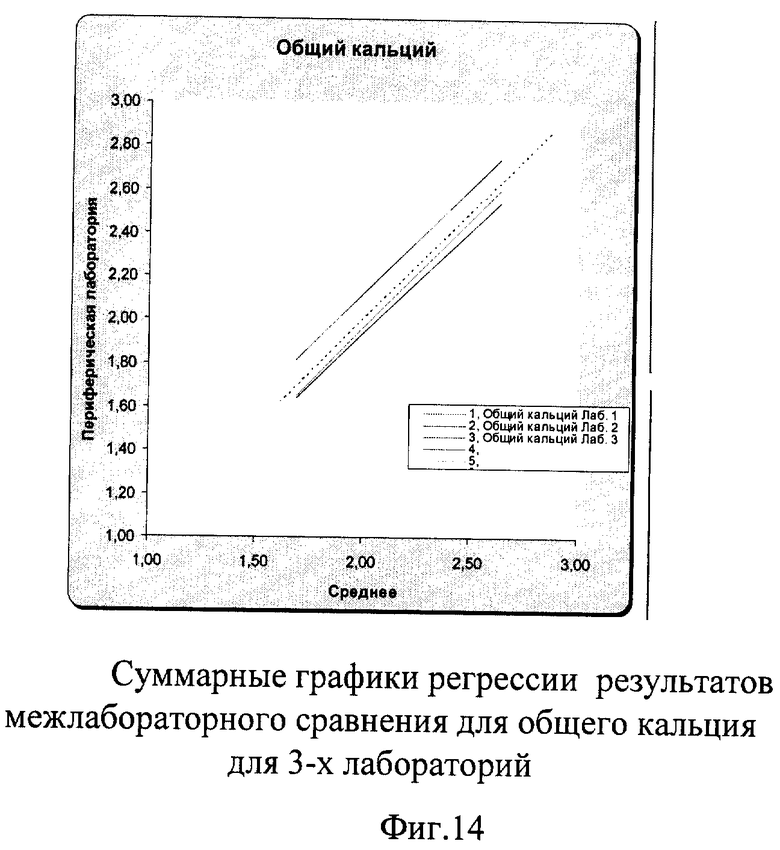
На фиг.14 наглядно представлены суммарные результаты, полученные во всех лабораториях. Графики регрессии для лаборатории №1 и №3 находятся рядом с идеальной линией, что говорит о хорошей сопоставимости и высоком уровне качества выполненных исследований в этих лабораториях, в то время как регрессионный график лаборатории №2 находится выше всех других линий, что требует коррекции.
Общий кальций определялся во всех лабораториях-участниках унифицированным колориметрическим методом. При исследовании контроля качества результатов лабораторного исследования согласно заявленному способу уравнение регрессии характеризует лишь сходство и различие в работе лабораторий при определении одного и того же параметра одним и тем же методом независимо от того, какое оборудование используется лабораториями-участниками. Показатель же линейности тех или иных диагностических наборов описан в инструкциях их производителей и является их аналитической характеристикой.
Следующий пример можно привести для иллюстрации применения заявленного способа для внешней оценки качества лабораторных исследований такого субстрата, как креатинин, который служит показателем азотистого обмена в организме пациента.
Креатинин определялся во всех лабораториях-участниках унифицированным колориметрическим методом, основанном на реакции Яффе. При исследовании контроля качества креатинина так же, как и в предыдущих примерах, использовалось формальное описание отличий между результатами, полученными в различных лабораториях с помощью общепринятых критериев качества лабораторного анализа и показателей регрессионного линейного анализа. Показатель линейности диагностических наборов описан в инструкциях производителей наборов реагентов и является их аналитической характеристикой. Концентрация креатинина в пробах пациентов была в пределах аналитического диапазона оборудования.
Определение креатинина в сыворотке/плазме широко используется в диагностике и лечении заболеваний почек, мониторинге гемодиализа. Содержание креатинина в крови здоровых людей - величина довольно постоянная. Нормальные величины креатинина составляют для женщин от 53 до 97 мкмоль/л, для мужчин - от 61 до 115 мкмоль/л. При превышении верхней границы нормы даже на незначительные величины необходимо тщательно исследовать функцию почек, так как это может быть опасно для пациента. Критическое значение креатинина, опасное и практически не совместимое с жизнью больного - 442 мкмоль/л, что требует неотложной медицинской помощи (Peter J. Howanitz, Steven J. Steindel, Nan V.Head. Laboratory Critical Values Policies and Procedures/Arch pathol Lab Med - Vol 126, June 2002). Для всех медицинских лабораторий очень важно иметь надежные результаты по креатинину, сопоставимые с данными различных лабораторий, куда может обратиться пациент.
В данном исследовании также принимали участие 3 лаборатории. Пробоподготовку взяла на себя кураторская лаборатория, которая руководила проведением сравнения. Биоматериал пациентов, который остался после обязательных рутинных измерений, разливался в 2 отдельные пробирки по 3 мл в каждой таким образом, чтобы в одной пробирке была сыворотка пациента или сливная сыворотка нескольких пациентов с высоким уровнем концентрации креатинина, а в другой - с низким, причем была взята сыворотка конкретных пациентов с известными уровнями высокой и низкой концентрации. После этого для каждой лаборатории в отдельные мини-пробирки с закрывающимися крышками было разлито по 1 мл забранной сыворотки каждого уровня концентрации креатинина, что достаточно для проведения шести повторных измерений из каждой пробирки. Для каждой лаборатории приготовлялось по 2 пробирки типа эппендорф с низкой и высокой концентрациями креатинина. Подготовленный биоматериал замораживался при -20°С и хранился до его рассылки в морозильной камере в кураторской лаборатории. Проба для исследования на креатинин стабильна при комнатной температуре в течение 2-3-х дней и при -20°С - до 3 месяцев. Лаборатории назначили дату и время проведения межлабораторного сравнения. В назначенный день пробирки транспортировались во все лаборатории с помощью специальных термостатируемых контейнеров со льдом в течение 2-3 часов. Все лаборатории измеряли доставленные пробы в один и тот же день, чтобы избежать влияния различного времени хранения биоматериала на результаты измерений. Каждая лаборатория измеряла пробу на креатинин по шесть раз в высоком и низком уровнях концентрации в течение рабочего дня.
Результаты выполненных измерений заносились в специальный протокол на бумажном или электронном носителе, который отсылался по факсу или электронной почте в кураторскую лабораторию или ответственному лицу, проводящему вычисления и анализ данных межлабораторного сравнения, в частности, на кафедру клинической лабораторной диагностики СПбГМУ им. акад. И.П.Павлова, которая выполняла роль кураторской лаборатории.
Данные повторных измерений по креатинину заносились в электронную таблицу, автоматически рассчитывались средние значения всех измерений и погрешности каждой лаборатории в виде стандартного отклонения SD и коэффициента вариации CV%. Полученные результаты сравнивались со средним значением, полученным во всех лабораториях.
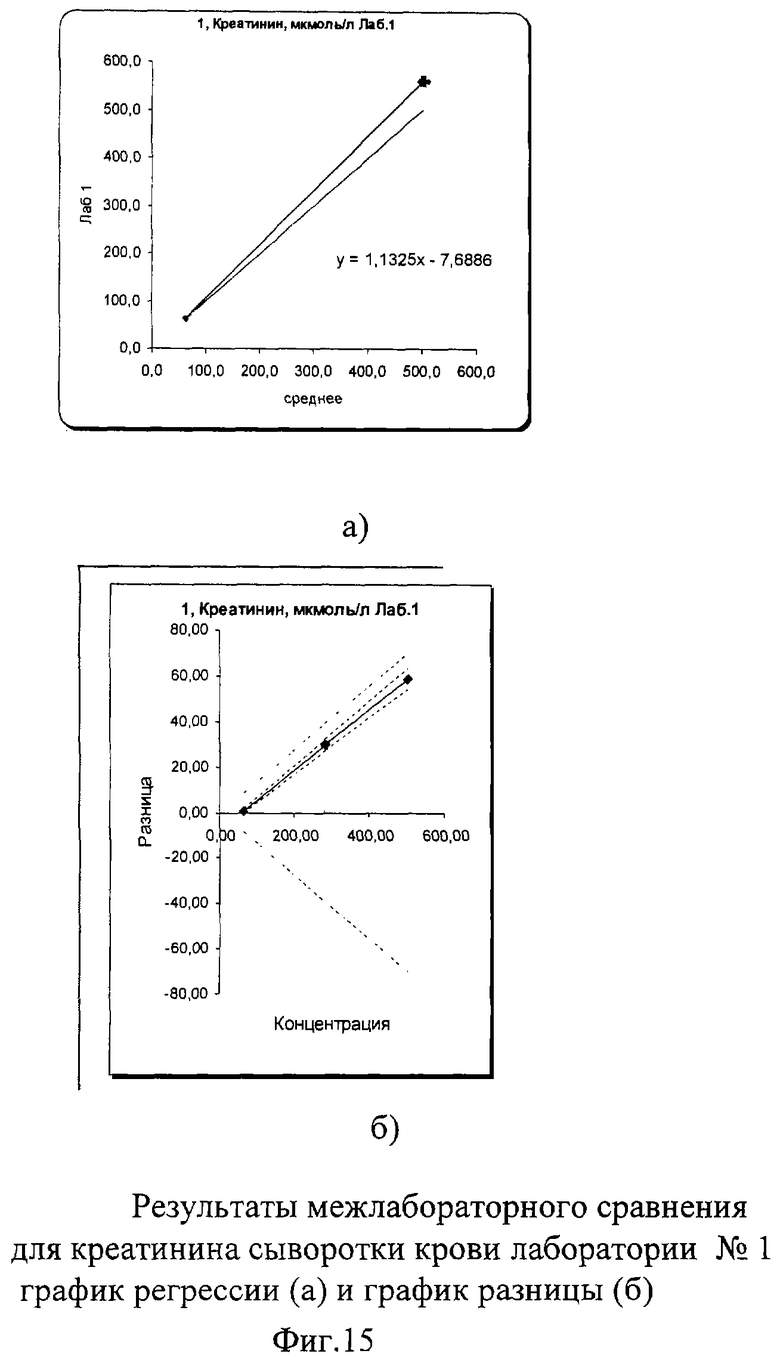
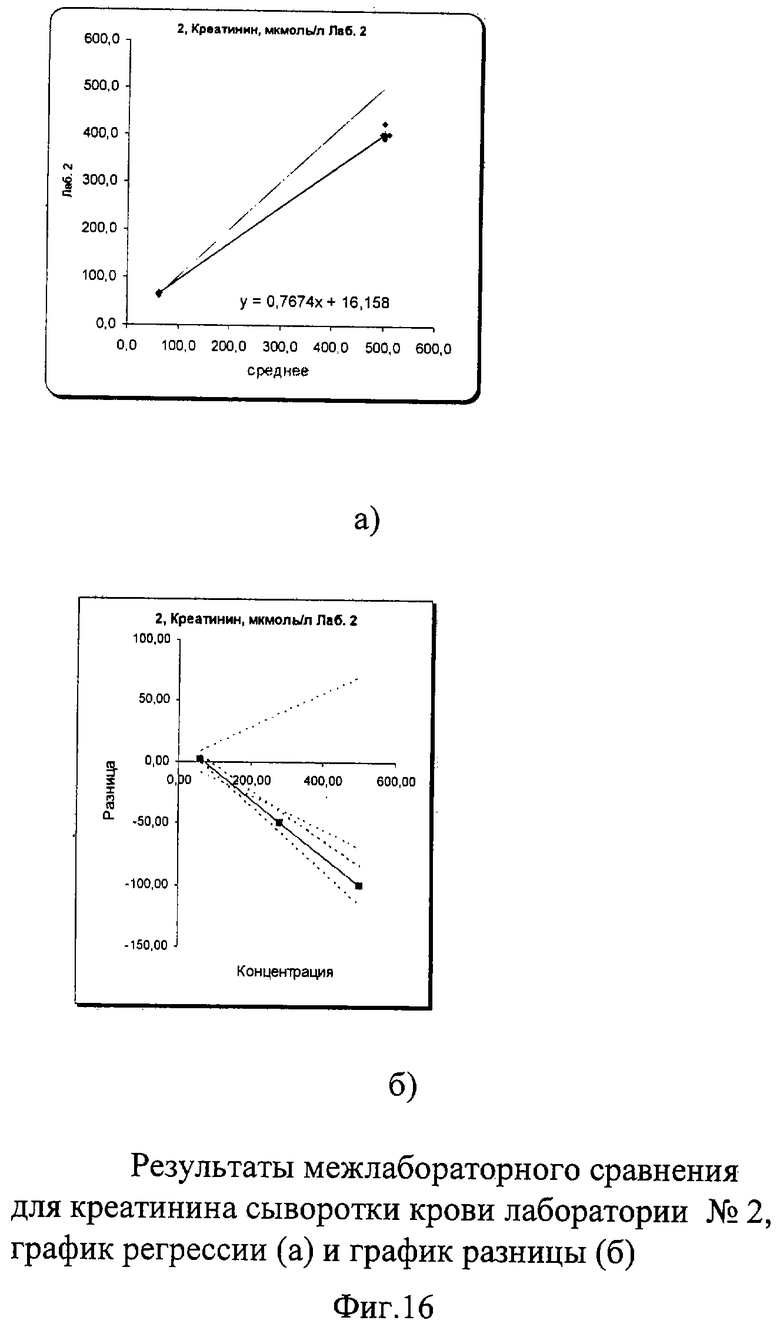
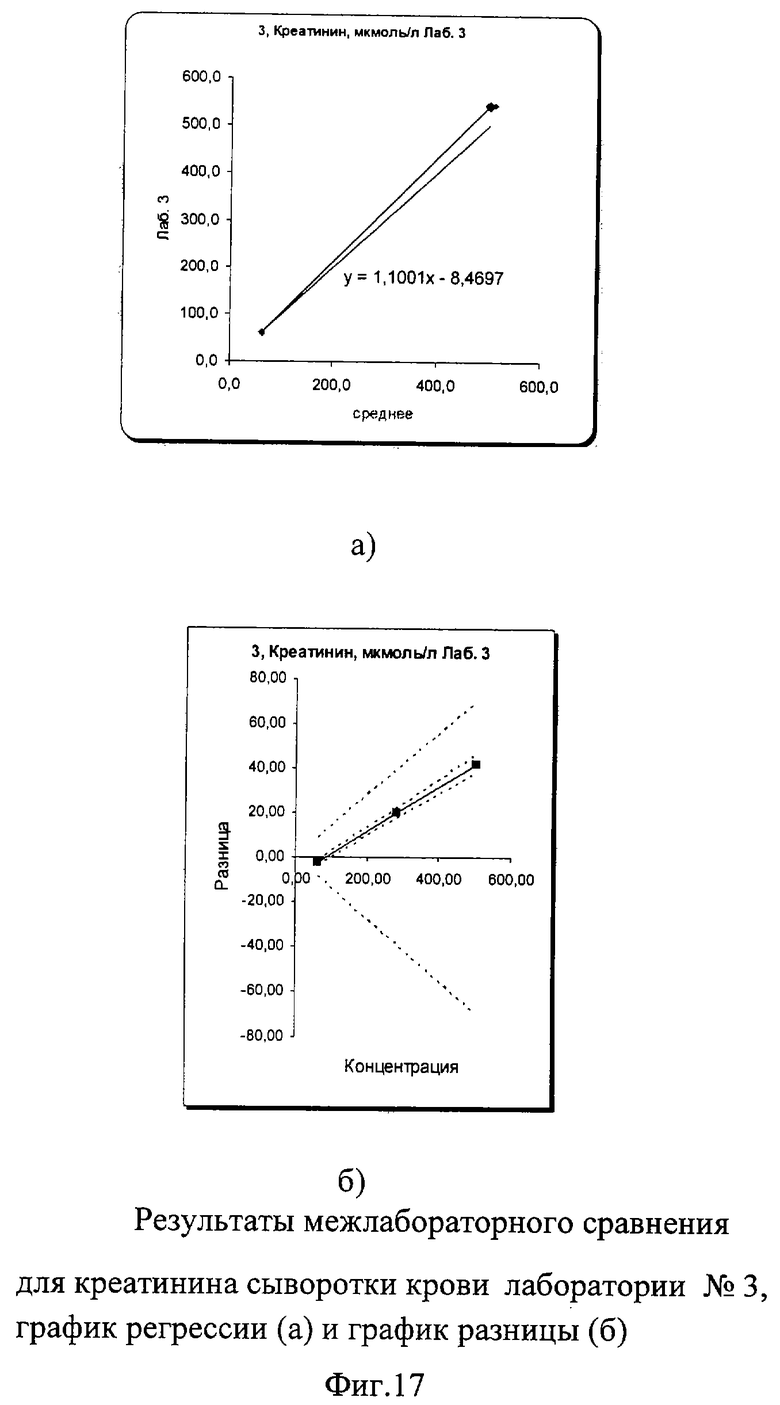
В результате проведенного межлабораторного сравнения лаборатории №1 и №3 показали хорошо сопоставимые результаты, не требующие коррекции. Лаборатория №2 несколько вышла за пределы допустимых критериев качества при измерении пробы в низкой концентрации. По международным и российским критериям качества погрешность в виде коэффициента вариации при измерении креатинина сыворотки/плазмы крови не должна превышать 7% во всех уровнях концентрации. В пределах лаборатории №1 показатели сходимости были в допустимых пределах коэффициента вариации: 1,6% в низком уровне концентрации и 0,66% в высоком. В лаборатории №3 сходимость составила 1,9% в низком и 0,42% в высоком уровне концентрации, что также укладывается в допустимые критерии качества. В лаборатории №2 в низком уровне концентрации коэффициент вариации составил 4,2%, а в высоком уровне он составил 3,02%, что тоже укладывалось в допустимые пределы возможной погрешности. Необходимо отметить, что лаборатория №2 к моменту проведения межлабораторного сравнения получила новый биохимический анализатор и проводила проверку его работы. Выявленные несоответствия указали на то, что прибор несколько занижает результаты измерения по креатинину при измерении высокой концентрации (укладывающейся в аналитические пределы приборов), что требует продолжения работы по настройке работы анализатора.
Межлабораторный коэффициент вариации составил 2,8% в низкой концентрации и 4,1% в высокой, что соответствует критериям качества. Для высокой концентрации общая погрешность составила 17,5% что превышает допустимые критерии качества из-за результатов апробации работы нового анализатора в лаборатории №2. Однако если отбросить результаты лаборатории №2 и сравнить результаты лаборатории №1 и №3, то этот показатель составил всего 2,2%, что абсолютно укладывается в допустимые пределы точности как по международным критериям, так и по российским требованиям (до 7%). Построение регрессионных графиков и графиков разницы позволяет наглядно это продемонстрировать. На фиг.15а, 17а графики регрессии немного не совпадают с идеальной линией, тогда как на фиг.16а график регрессии идет значительно ниже идеальной линии.
На графике разницы на фиг.15б, 17б видно, что данные межлабораторного сравнения лаборатории №1 и лаборатории №3 находятся в установленных пределах качества. На фиг.16б видно, что график разницы выходит ниже установленных критериев качества (пунктирная расходящаяся линия). Это наглядно демонстрирует, что показатели по креатинину сыворотки крови явно занижены в лаборатории №2, на что необходимо обратить внимание при дальнейшей апробации работы нового анализатора.
На фиг.18 наглядно суммарно представлены результаты, полученные во всех лабораториях. Графики регрессии для лаборатории №1 и №3 находятся рядом с идеальной линией, что говорит о хорошей сопоставимости и высоком уровне качества выполненных исследований в этих лабораториях, в то время как регрессионный график лаборатории №2 находится ниже всех других линий, что требует коррекции. В результате проведенного межлабораторного сравнения сделан вывод о том, что коррекцию надо провести только в лаборатории №2, где проводилась апробация нового анализатора. Производителям этого оборудования было предложено продолжить работу по налаживанию технических характеристик прибора, в противном случае данный анализатор не будет принят для работы в лаборатории №2.
Еще один пример иллюстрирует применение заявленного способа для случая, когда в качестве исследуемого компонента (аналита) используется один из показателей липидного обмена - холестерин сыворотки крови.
Общий холестерин сыворотки крови определялся во всех лабораториях-участниках унифицированным энзиматическим методом по конечной точке. При проведении внешней оценки качества результатов лабораторных исследований устанавливается сходство и различие в работе лабораторий при определении одного и того же параметра одним биохимическим методом независимо от того, какое оборудование и наборы реагентов используются лабораториями-участниками.
Измерение концентрации общего холестерина в крови важно для диагностики и мониторинга атеросклероза, нарушений липидного обмена и оценки риска развития сердечно-сосудистых заболеваний. Уровень холестерина также зависит от режима питания, уровня физической активности, наличия заболеваний печени и других нарушений обмена веществ. Рекомендуемые допустимые пределы общего холестерина для взрослых - от 3,63 до 5,2 ммоль/л. При превышении верхней границы нормы даже на незначительные величины необходимо исследовать липидный обмен пациента для предотвращения риска развития сердечно-сосудистых заболеваний (Г.И.Назаренко, А.А.Кишкун. Клиническая оценка результатов лабораторных исследований. // Москва, «Медицина». 2000 г., с.148-149). Для правильной диагностики и контроля терапии атеросклероза и сердечно-сосудистых заболеваний очень важно иметь надежные результаты по общему холестерину, сопоставимые с данными различных лабораторий, куда может обратиться пациент.
В данном примере участвовали 3 лаборатории. Как и в предыдущих примерах, пробоподготовку взяла на себя кураторская лаборатория, руководившая проведением сравнения. Биоматериал пациентов, который остался после обязательных рутинных измерений, разливался в отдельные 2 пробирки по 3 мл в каждой таким образом, чтобы в одной пробирке была сыворотка пациента или сливная сыворотка нескольких пациентов с известным высоким уровнем концентрации холестерина, а в другой - с низким. Сыворотка/плазма не разводится. Липемичная сыворотка не используется для проведения контроля качества. Для каждой лаборатории приготовлялось по 2 мини-пробирки типа эппендорф, в каждой по 1 мл забранной сыворотки каждого уровня концентрации общего холестерина, что достаточно для проведения шести повторных измерений из каждой пробирки. Подготовленный биоматериал замораживался при температуре -20°С и хранился до его рассылки в морозильной камере в кураторской лаборатории. Проба для исследования на общий холестерин стабильна при комнатной температуре в течение 7 дней, а при -20°С - до 3 месяцев (Banfi G., Bauer К., Fraser С. et al. Die Qualitat diagnostischer Proben.//Arb Praanalytic der Deutschen Gesellschaff fur Klinische und der Deutschen Gesellschaff fur Laboratoriumsmedizin. - Dritte Auflage. 2002 г., р.22-23). Затем лаборатории назначили дату и время проведения межлабораторного сравнения. В назначенный день пробирки транспортировались во все лаборатории с помощью специальных термостатируемых контейнеров со льдом в течение 2-3 часов. Все лаборатории измеряли доставленные пробы в один и тот же день, чтобы избежать влияния различного времени хранения биоматериала на результаты измерений. Повторное замораживание не рекомендуется.
Каждая лаборатория измеряла пробу на общий холестерин по шесть раз в высоком и низком уровнях концентрации в течение рабочего дня. Пробы измерялись в режиме обычного рутинного процесса.
Результаты выполненных измерений заносились в специальный протокол, отсылаемый по факсу или электронной почте в кураторскую лабораторию, проводящую вычисления и анализ данных межлабораторного сравнения. В данных исследованиях протоколы отсылались на кафедру Клинической химии Каролинского Госпиталя, Стокгольм (Швеция), которая выполняла роль кураторской лаборатории.
Данные повторных измерений по общему холестерину заносились в электронную таблицу. Автоматически рассчитывались средние значения всех измерений и погрешности каждой лаборатории в виде стандартного отклонения SD и коэффициента вариации CV%, полученные результаты сравнивались со средним значением, полученным во всех лабораториях.
В результате проведенного межлабораторного сравнения все лаборатории показали очень хорошо сопоставимые результаты, не требующие коррекции.
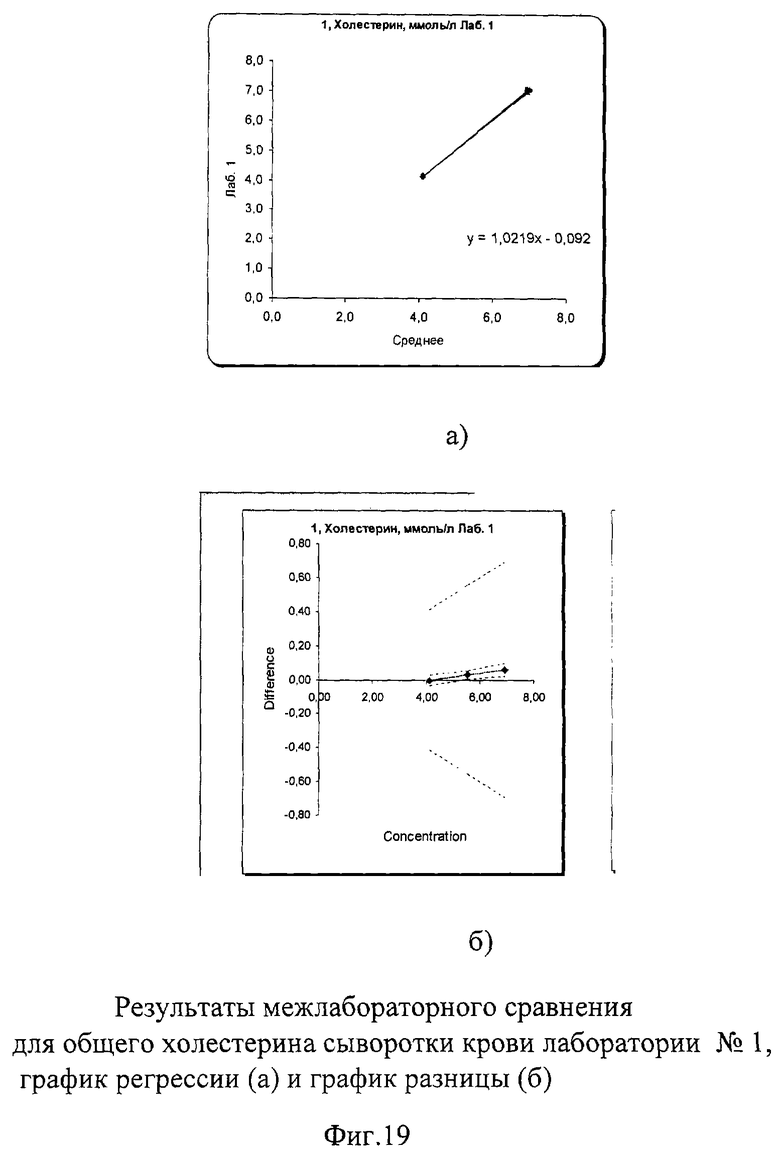
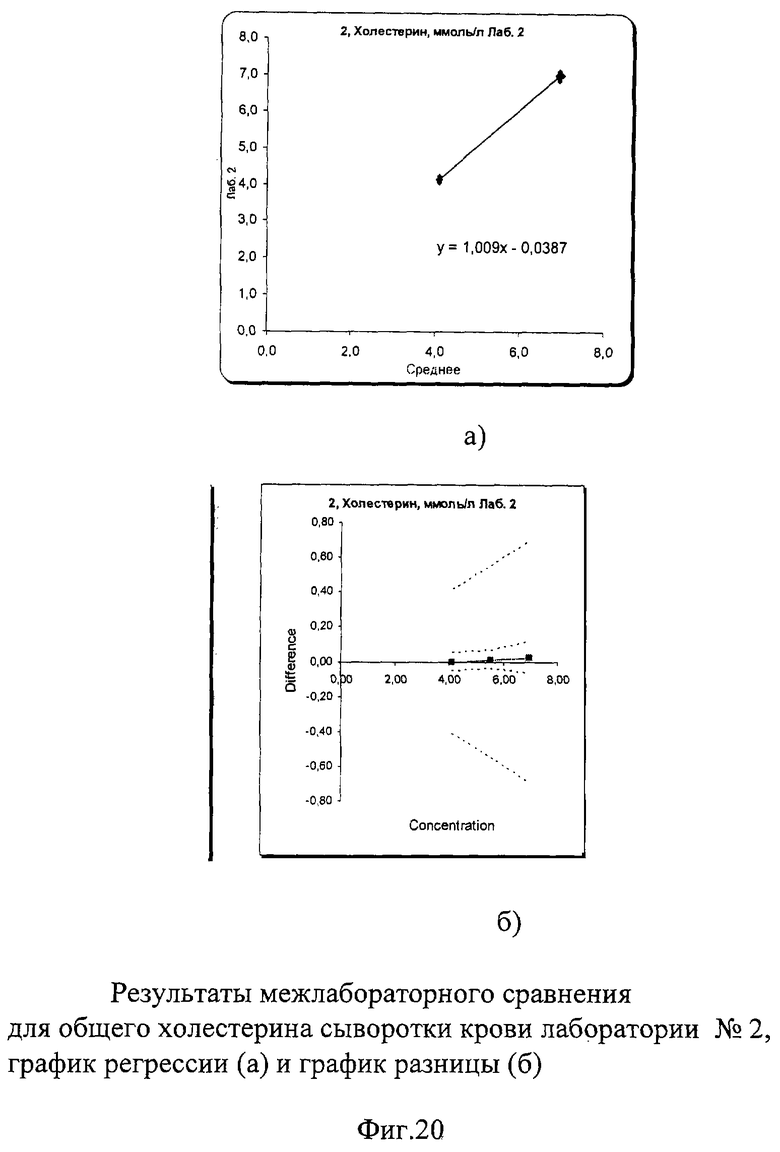
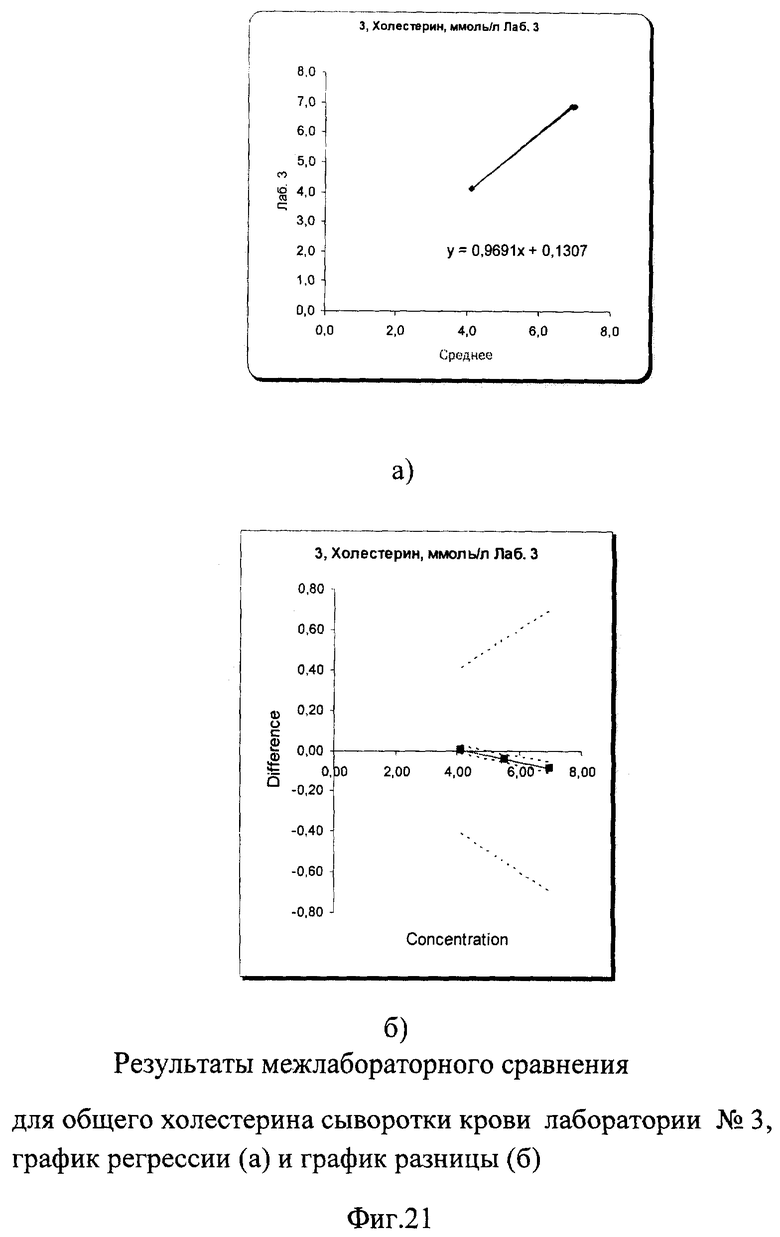
Результаты полностью соответствовали международным и российским критериям качества, в соответствии с которыми погрешность в виде коэффициента вариации при измерении холестерина сыворотки/плазмы крови не должна превышать 7% во всех уровнях концентрации. Показатели сходимости составили от 0,3% до 1,4% в низком уровне концентрации и от 0,18% до 1,57% - в высоком.
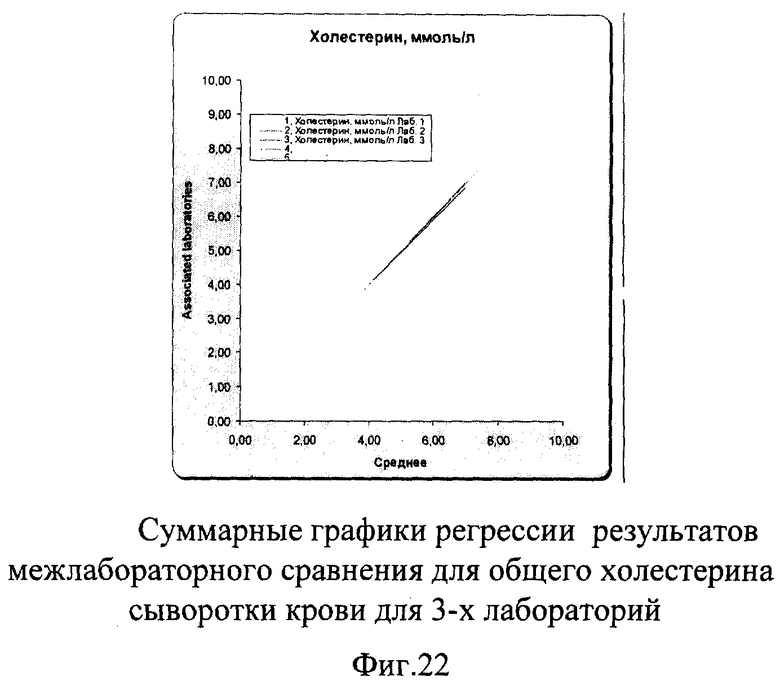
Межлабораторный коэффициент вариации составил 0,9% в низкой концентрации и 1,4% в высокой, что не только соответствует критериям качества, но и значительно их превосходит. На фиг.19а, 20а и 21а графики регрессии практически полностью совпадают с идеальной линией. На графиках разницы на фиг.19б, 20б и 21б видно, что данные линии разницы находятся в самом центре расходящихся линий установленных пределов качества, что говорит о прекрасной сопоставимости полученных данных. На фиг.22 наглядно представлены суммарные результаты, полученные во всех лабораториях. Графики регрессии для всех лабораторий практически совпадают с идеальной линией, что говорит об отличной сопоставимости и высоком уровне качества выполненных исследований в этих лабораториях.
В результате проведенного межлабораторного сравнения сделан вывод о том, что нет необходимости в проведении коррекции.
Наконец, следующий пример иллюстрирует применение заявленного способа для случая, когда в качестве исследуемого компонента (аналита) используется такой субстрат, как аполипопротеин А-1.
Аполипопротеины являются важным показателем липидного обмена и принимаются во внимание для диагностики атеросклероза. Аполипопротеин А-1 (Апо-А-1-протеин, Апо-А-1, Аро А1) участвует в транспорте триглицеридов и холестерина и способствует выведению холестерина из сосудистой стенки. Низкие концентрации Апо-А-1 расцениваются как фактор риска развития атеросклероза. Апо-А-1 является определенной молекулой, которая может быть измерена с помощью иммунологических методов и калибруется международным калибратором с прослеживаемыми свойствами, утвержденным IFCC. В норме Апо-А-1 должен быть выше 1,15 г/л. Результат менее этого свидетельствует об увеличении риска развития атеросклероза. Для клинической практики важно достоверно определять уровень концентрации аполипопротеинов для профилактики, диагностики и мониторинга атеросклероза. Только в этом случае клиницист может адекватно оценить риск развития атеросклероза и ишемической болезни сердца. Для женщин референтные пределы Апо-А-1 составляют от 1,15 г/л до 2,20 г/л, для мужчин - от 1,15 г/л до 1,90 г/л (Г.И.Назаренко, А.А.Кишкун. Клиническая оценка результатов лабораторных исследований. // Москва, «Медицина». 2000 г., с.154-155).
При исследовании контроля качества иммунохимических методов используется формальное описание отличий между результатами массовых концентраций аналитов, в том числе и для Апо-А-1, полученными в различных лабораториях с помощью общепринятых критериев качества лабораторного анализа и показателей регрессионного линейного анализа. При приготовлении проб для межлабораторного сравнения необходимо отобрать пробы пациентов с низкой и высокой концентрациями Апо-А-1. Для обеспечения достаточного количества биоматериала можно применять сливную сыворотку пациентов с определенными известными уровнями низкой и высокой концентрации. При этом необходимо избегать применения липемичной и гемолитической сыворотки, так как это существенно повлияет на результаты исследования.
Пробы для проведения межлабораторного сравнения приготавливаются одной из 3 лабораторий-участников, в частности, пробоподготовку берет на себя кураторская лаборатория. Биоматериал пациентов, который остался после обязательных рутинных измерений, разливался в отдельные 2 пробирки по 3 мл в каждой таким образом, чтобы в одной пробирке была сыворотка пациента или сливная сыворотка нескольких пациентов с высоким уровнем концентрации Апо-А-1, а в другой - с низким. Сыворотка не разводится. После этого для каждой лаборатории в отдельные мини-пробирки с закрывающимися крышками разливалось по 1 мл забранной сыворотки каждого уровня концентрации Апо-А-1, что достаточно для проведения шести повторных измерений из каждой пробирки. Для каждой лаборатории приготавливалось по 2 пробирки с низкой и высокой концентрациями Апо-А-1. Подготовленный биоматериал замораживали при -20°С и хранили до его рассылки в морозильной камере в кураторской лаборатории. Проба для исследования на Апо-А-1 стабильна при температуре от +4°С до 8°С до 8 дней и при -20°С - до 3-х месяцев (Banfi G., Bauer К., Fraser С. et al. Die Qualitat diagnostischer Proben.//Arb Praanalytic der Deutschen Gesellschaff fur Klinische und der Deutschen Gesellschaff fur Laboratoriumsmedizin. - Dritte Auflage. 2002 г., p.18-19. Тиц Н. Энциклопедия клинических лабораторных тестов/Перевод с анг. под редакцией В.В.Меньшикова; М.: Издательство «Лабинформ», 1997 г., с.325). Лаборатории назначили дату и время проведения межлабораторного сравнения, и в назначенный день пробирки транспортировались во все лаборатории с помощью специальных термостатируемых контейнеров со льдом в течение 2-3 часов. Все лаборатории измеряли доставленные пробы в один и тот же день, чтобы избежать влияния различного времени хранения биоматериала на результаты измерений.
Каждая лаборатория измеряла пробу Апо-А-1 по шесть раз в высоком и низком уровнях концентрации в течение рабочего дня. Пробы измерялись в режиме обычного рутинного процесса. Результаты выполненных измерений заносились в специальный протокол на бумажном или электронном носителе, который отсылался по факсу или электронной почте в кураторскую лабораторию для последующих вычислений и анализа данных межлабораторного сравнения. Настоящее исследование проводилось только в лабораториях Швеции, так как на территории Российской Федерации данный аналит пока не входит в стандарты лабораторного обследования. Протоколы отсылались на кафедру клинической химии Каролинского госпиталя г.Стокгольма (Швеция), которая выполняла роль кураторской лаборатории по оценке качества Апо-А-1.
Результаты повторных измерений Апо-А-1 заносились в электронную таблицу, автоматически осуществлялся расчет средних значений всех измерений и погрешности каждой лаборатории в виде стандартного отклонения SD и коэффициента вариации CV%. Полученные результаты сравнивались со средним значением, полученным во всех лабораториях.
В результате проведенного межлабораторного сравнения все лаборатории показали достаточно хорошо сопоставимые результаты. Межлабораторный коэффициент вариации составил 6,4% в низкой концентрации и 12% - в высокой. Показатели межлабораторной воспроизводимости полностью вошли в допустимые пределы для низкой концентрации и на 3% превысили международные критерии (9%) для высокого уровня концентрации.
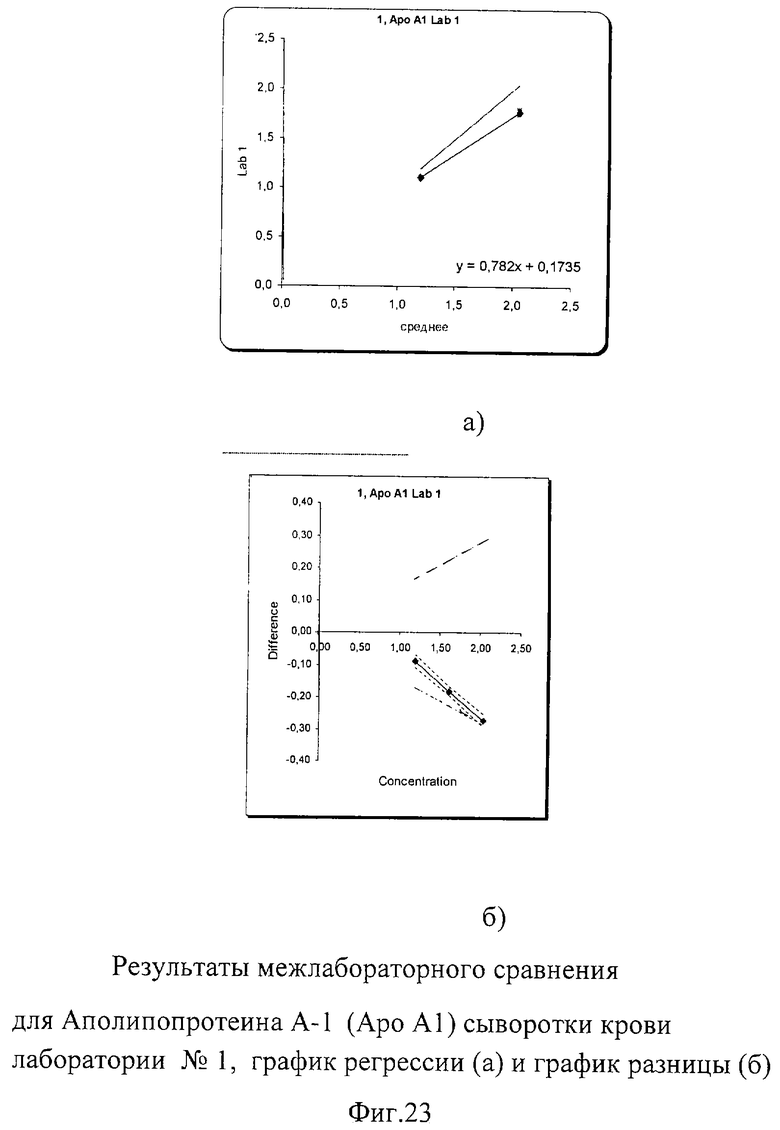
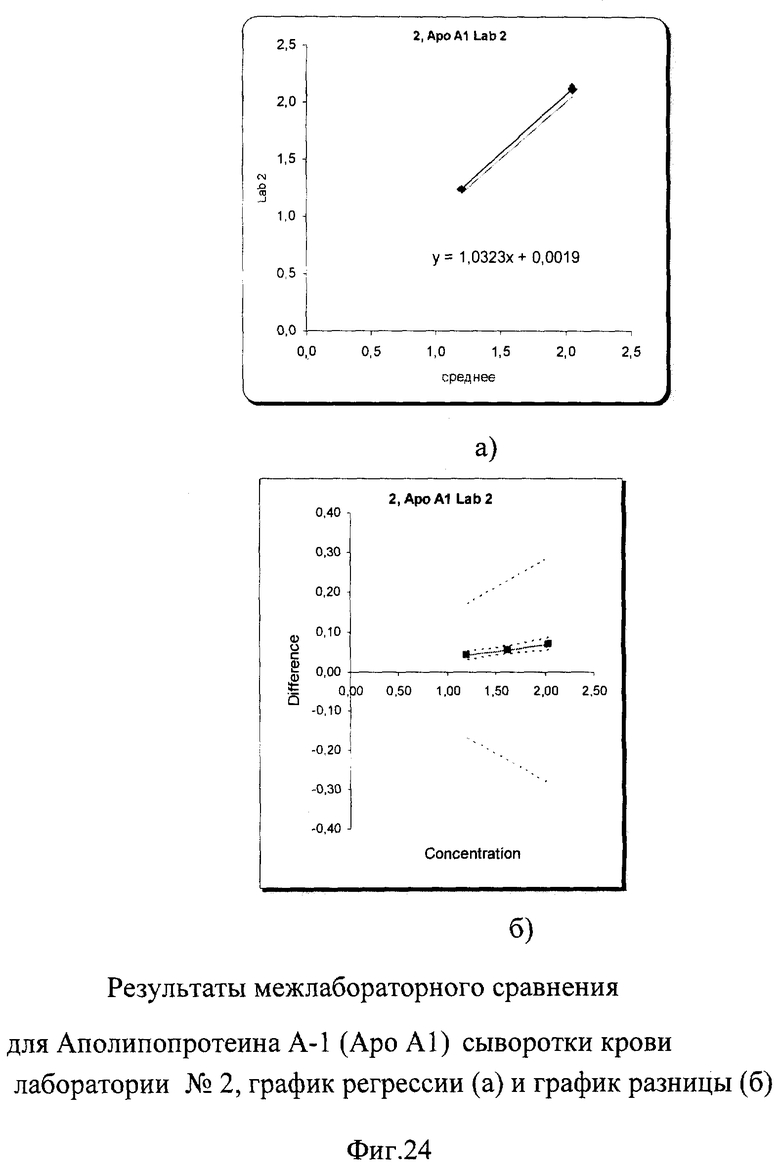
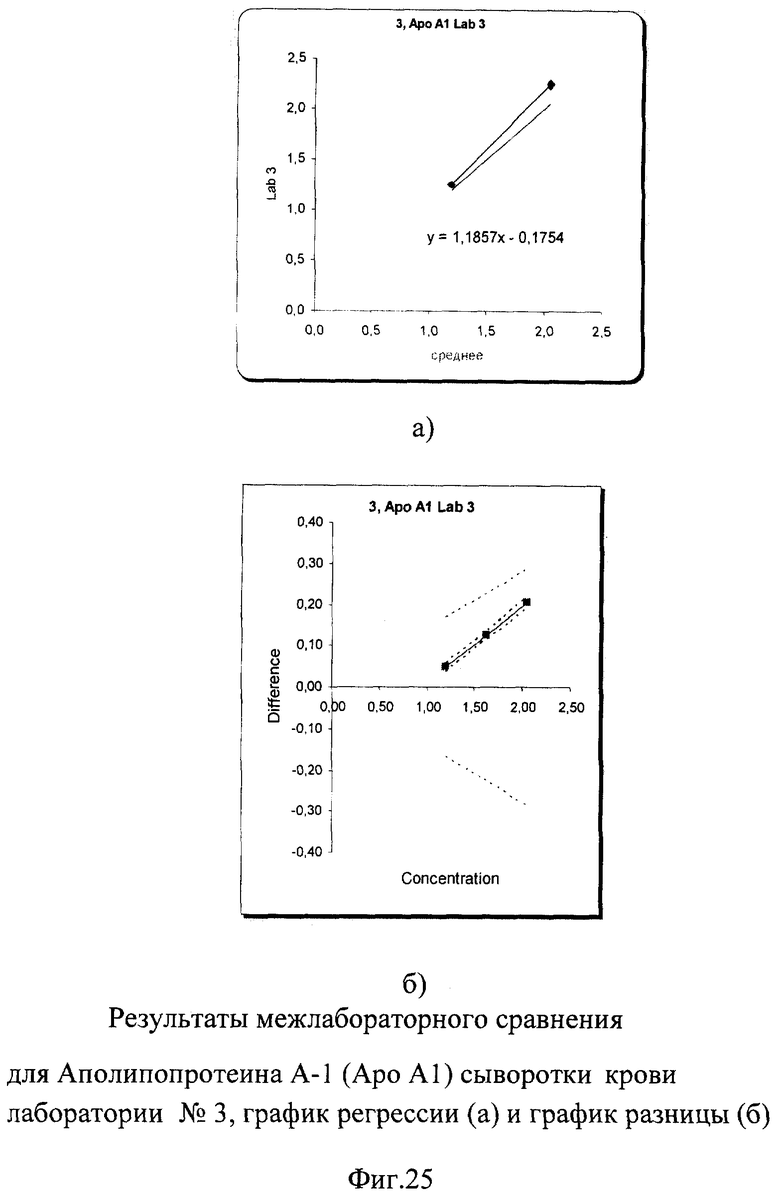
Несмотря на небольшое превышение погрешности измерения, выявленное при межлабораторном сравнении при высокой концентрации Апо-А-1, показатели внутрилабораторной сходимости составили от 0,8% до 1% для низкой концентрации и от 0,7% до 1,5% для высокой, что абсолютно укладывается в международные критерии качества 9%. Построение регрессионных графиков и графиков разницы позволяет наглядно это продемонстрировать на фиг.23а, 24а, 25а. Графики регрессии незначительно отличаются от идеальной линии.
На графиках разницы (фиг.23б, 24б, 25б) видно, что данные сравнения всех лабораторий (сплошная линия) находятся в установленных пределах качества (расходящаяся пунктирная линия). График разницы для лаборатории №3 находится на границе критериев качества для высокой концентрации, но все равно в них укладывается. На фиг.2б наглядно представлены суммарные результаты, полученные во всех лабораториях. Графики регрессии для лаборатории №1 и №2 находятся рядом с идеальной линией, а результаты лаборатории №3 находятся несколько ниже остальных.
С учетом показателей внутрилабораторной сходимости и межлабораторной воспроизводимости можно говорить о хорошей сопоставимости данных лабораторных исследований для Апо-А-1 и высоком уровне качества выполненных исследований. Корректирующие мероприятия не проводились.
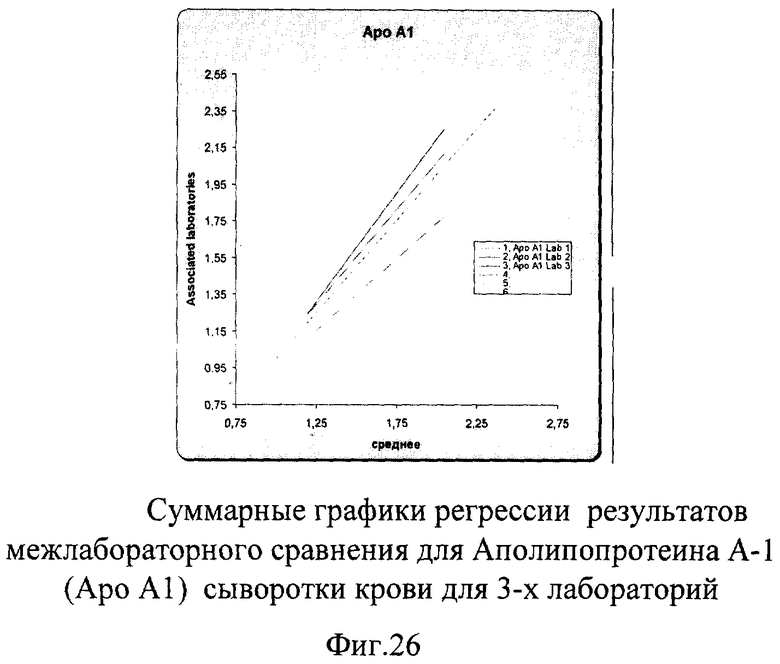
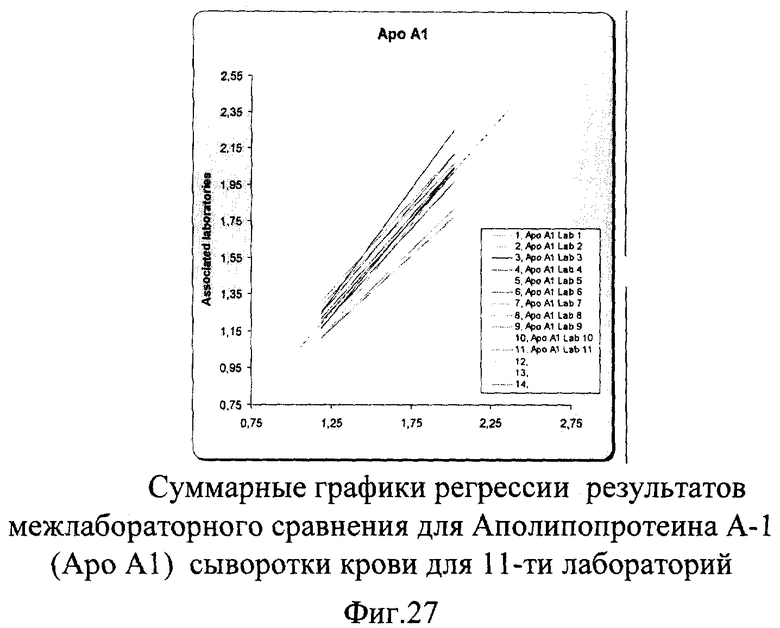
Авторами заявленного способа был проведен дополнительный аналогичный эксперимент по оценке качества Апо-А-1 для оценки сопоставимости конгломерата лабораторий Швеции и Финляндии, состоящего из 11 лабораторий. Суммарные результаты этого сравнения представлены на фиг.27. Показатель межлабораторной сходимости составил 5,7% для низкой концентрации Апо-А-1 и 7% для высокого уровня его концентрации, что полностью укладывается в международные критерии качества для Апо-А-1 (9%).
Данные проведенной оценки качества показали достаточно хорошие результаты сопоставимости в экспериментах между тремя и одиннадцатью различными лабораториями, что демонстрирует эффективность данного способа оценки качества как для небольшого количества лабораторий-участников, так и для целого конгломерата лабораторий, имеющих в своем ассортименте тестирование на Апо-А-1.
В приведенных выше примерах показаны результаты оценки качества различных видов аналитов, относящихся к ферментам (энзимам), к субстратам (белки, показатели липидного обмена, азотистого обмена) и электролитам. Примеры контроля качества на альбумин, аланинаминотрансферазу, кальций, креатинин, холестерин и аполипопротеин А1 наглядно продемонстрировали, что данный способ оценки качества может применяться при сравнении результатов исследований, полученных с помощью измерительных процедур, основанных на разных аналитических принципах колориметрического, кинетического, энзиматического и иммунохимического анализа, которые наиболее часто применяются в клинической лабораторной диагностике.
Таким образом, как следует из приведенных примеров, практическое использование заявленного способа оценки качества клинических лабораторных исследований позволяет повысить эффективность ее проведения за счет повышения достоверности получаемых данных лабораторных исследований, снижения времени и стоимости их проведения, а также дает возможность получить обоснованные рекомендации для коррекции ошибок лабораторных исследований.
Вместе с тем, необходимо отметить, что, помимо участия в обязательных мероприятиях внешней оценки качества (ВОК), допускается участие лабораторий и в других программах внешней оценки (международных, коммерческих и региональных), в частности, для показателей, отсутствующих в ФСВОК. Чем больше схем ВОК использует в своей практике медицинская лаборатория, тем выше качество ее работы. Различные схемы ВОК позволяют адекватно оценить сопоставимость результатов лабораторного анализа конкретной лаборатории с ее аналогами в пределах региона, страны и за рубежом.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОЦЕНКИ КАЧЕСТВА ОПРЕДЕЛЕНИЯ D-ДИМЕРА В ПЛАЗМЕ КРОВИ В УСЛОВИЯХ КЛИНИКО-ДИАГНОСТИЧЕСКОЙ ЛАБОРАТОРИИ | 2014 |
|
RU2572226C1 |
| СПОСОБ КОЛИЧЕСТВЕННОЙ ОЦЕНКИ РЕЗУЛЬТАТОВ ВНУТРИЛАБОРАТОРНОГО КОНТРОЛЯ КАЧЕСТВА ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКИХ ПРОБ КРОВИ, СПЕРМЫ И СЛЮНЫ ЧЕЛОВЕКА, ПОЛУЧЕННЫХ ИЗ ВЫТЯЖЕК СО СЛЕДОВ НА ВЕЩЕСТВЕННЫХ ДОКАЗАТЕЛЬСТВАХ | 2020 |
|
RU2737015C1 |
| СПОСОБ ОЦЕНКИ ВЕЛИЧИНЫ НЕСТАБИЛЬНОСТИ БИОПРОБ | 2015 |
|
RU2609852C1 |
| ПОЛУЧЕНИЕ СЫВОРОТКИ | 2011 |
|
RU2643957C2 |
| СПОСОБ НЕИНВАЗИВНОЙ ОЦЕНКИ РЕЦЕПТИВНОСТИ ЭНДОМЕТРИЯ ПРИ ЭКСТРАКОРПОРАЛЬНОМ ОПЛОДОТВОРЕНИИ | 2023 |
|
RU2817061C1 |
| СПОСОБ ЭКСПРЕСС-ДИАГНОСТИКИ ОТРАВЛЕНИЙ ГЕМОЛИТИЧЕСКИМИ ЯДАМИ | 2012 |
|
RU2497456C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ВЕРОЯТНОСТИ НАСТУПЛЕНИЯ БЕРЕМЕННОСТИ ПРИ ЭКСТРАКОРПОРАЛЬНОМ ОПЛОДОТВОРЕНИИ | 2023 |
|
RU2817062C1 |
| Способ изготовления набора стандартных образцов для контроля качества молекулярно-генетической диагностики Ph-негативных миелопролиферативных заболеваний | 2024 |
|
RU2832111C1 |
| СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ МАРГАНЦА, СВИНЦА И НИКЕЛЯ В ЖЕЛЧИ МЕТОДОМ АТОМНО-АБСОРБЦИОННОГО АНАЛИЗА С АТОМИЗАЦИЕЙ В ПЛАМЕНИ | 2009 |
|
RU2410691C1 |
| СИСТЕМЫ И СПОСОБЫ УЛУЧШЕНИЯ ДИАГНОСТИКИ ЗАБОЛЕВАНИЙ С ПРИМЕНЕНИЕМ ИЗМЕРЯЕМЫХ АНАЛИТОВ | 2018 |
|
RU2782359C2 |
Изобретение относится к медицине и может быть использовано при проведении внешней оценки качества результатов клинических лабораторных исследований, преимущественно на региональном уровне. Способ оценки качества клинических лабораторных исследований включает приготовление пробы из биоматериалов пациента, разделение ее на отдельные части по числу лабораторий-участниц оценки, рассылку образцов разделенных проб в каждую из лабораторий-участниц, измерение в каждой лаборатории показателей предоставленной разделенной пробы и проведение по результатам их сравнения оценки качества результатов, при этом выбирают одну из лабораторий в качестве лаборатории-куратора, все разделенные пробы сохраняют при температуре от -20°С до -25°С для проведения измерений по каждому показателю биоматериала используют два образца пробы пациента, первый из которых имеет высокую концентрацию аналита, а второй - более низкую, в каждой из лабораторий-участниц проводят измерение первой и второй проб от 6 до 10 раз каждую, по полученным данным в лаборатории-кураторе методом регрессионного анализа строят графики регрессии и по ним сравнивают результаты исследований, а о качестве лабораторных исследований судят по полученным параметрам этих графиков. Изобретение обеспечивает повышение эффективности проведения оценки качества клинических лабораторных исследований за счет повышения достоверности получаемых данных лабораторных исследований, снижения времени и стоимости их проведения. 5 з.п. ф-лы, 27 ил.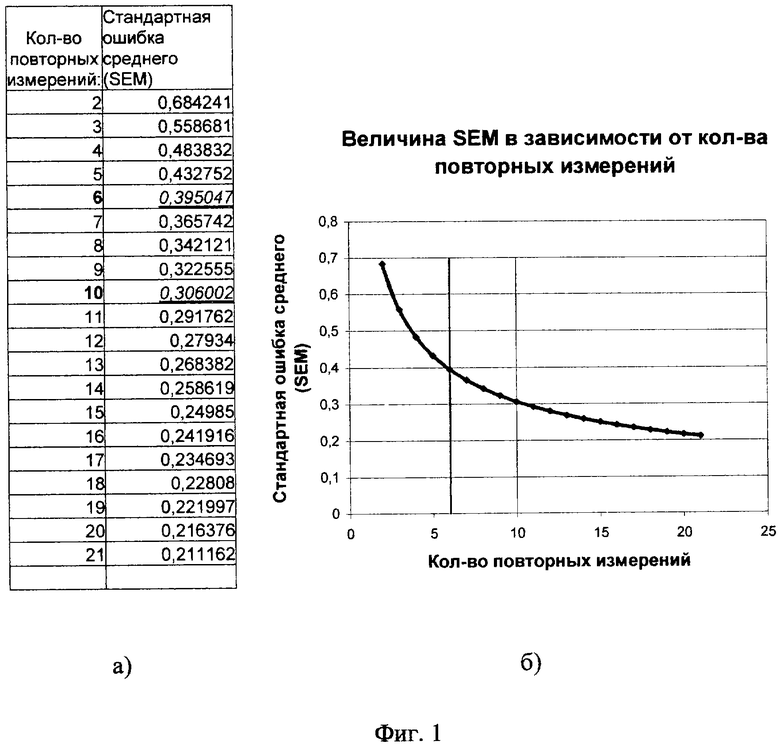
| SHAHANGIAN S | |||
| et al | |||
| System to monitor a portion of the total testing process in medical clinic and laboratories: evaluation of a split-specimen design | |||
| Clinical Chemistry, 1999, v.45:2, p.269-280 | |||
| US 2004102904 A, 27.05.2004 | |||
| US 20020116224 A, 22.08.2002 | |||
| НАЗАРЕНКО Г.И | |||
| и др | |||
| Современные технологии повышения эффективности использования |
Авторы
Даты
2007-08-10—Публикация
2006-04-04—Подача