Область техники
Данное изобретение относится к способам получения производных глутаминовой кислоты, обычно включающих монатин, которые применимы в качестве промежуточных соединений для производства подсластителей или фармацевтических продуктов, а также для производства промежуточных соединений для данных способов, включая новое важное промежуточное соединение. Более конкретно, изобретение относится к эффективному способу получения в промышленности производных глутаминовой кислоты, способу получения промежуточных соединений для этого, включая новое промежуточное соединение, к способу получения оптически активного монатина, способу получения промежуточных соединений для данного способа, включая новое промежуточное соединение, и им подобным.
Предшествующий уровень техники
Производные глутаминовой кислоты, обычно включающие монатин, являются соединениями, перспективными для применения в качестве подсластителей или для производства промежуточных соединений для фармацевтических продуктов и им подобным. Например, известно, что 4-гидрокси-4-(3-индолилметил)-2-аминоглутаровая кислота (3-(1-амино-1,3-дикарбокси-3-гидроксибутан-4-ил)индол, иногда называемая "монатин" далее в данном описании), представленная формулой (7'), в (2S,4S) форме содержится в корнях растения Schlerochiton ilicifolius и обладает сладостью, которая в несколько сотен раз превышает сладость сахарозы (см. JP-A-64-25757 (US патент № 4975298))
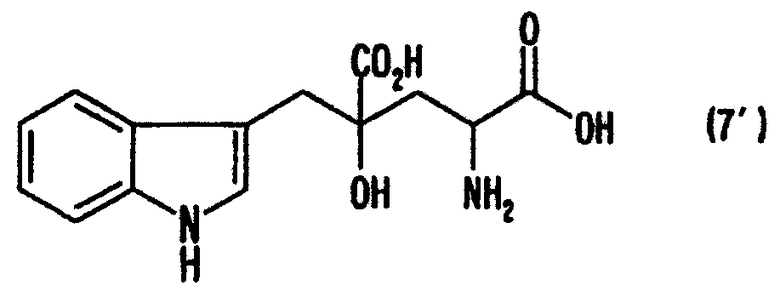
В данном описании термин "монатин" не ограничен только природной (2S,4S) формой, но использован также в качестве общего названия 4-гидрокси-4-(3-индолилметил)-2-аминоглутаровой кислоты (3-(1-амино-1,3-дикарбокси-3-гидроксибутан-4-ил)индола), включающей индивидуальные изомеры в формах (2S,4S), (2S,4R), (2R,4S) и (2R,4R).
Имеются следующие сообщения о способах получения монатина (следующие ниже примеры (2)-(5)) и защищенного монатина (следующий ниже пример (1)).
(1) Способ, описанный в Tetrahedron Letters, 2001, Vol. 42, No. 39, pp. 6793-6796
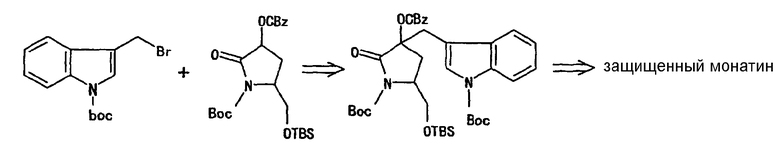
(2) Способ, описанный в Organic Letters, 2000, Vol. 2, No. 19, pp. 2967-2970
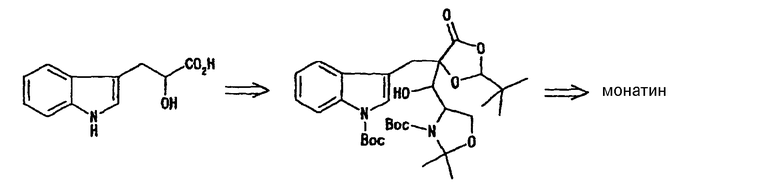
(3) Способ, описанный в патенте США 5994559
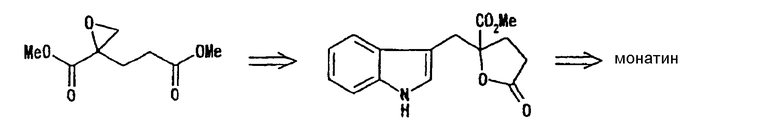
(4) Способ, описанный в Synthetic Communications, 1994, Vol. 24, No. 22, pp. 3197-3211
и
(5) Способ, описанный в Synthetic Communications, 1993, Vol. 23, No. 18, pp. 2511-2526 и патентах США № 4975298 и № 5128164
Так как любой из указанных способов состоит из нескольких стадий, внедрение их в промышленность действительно связано с многочисленными трудностями. В некоторых работах, указанных выше, или в других ссылках (см. T. Kitahara, et al., Japanese Agrochemical Association, the 2000-th Conference, Abstracts of Proceedings, 3B128β (p.221)) описывается анализ способов производства оптически активного монатина. Невыгодно, однако, что способы состоят из многих стадий и включают стадии, которые очень трудно осуществить практически в промышленности. Таким образом, существует потребность в разработке эффективного промышленного способа для получения производных глутаминовой кислоты, обычно включающих монатин, конкретно, в эффективном промышленном способе получения оптически активного монатина.
Раскрытие изобретения
Задача изобретения
Данное изобретение должно решить следующие задачи: предложить способы для эффективного получения в промышленности производных глутаминовой кислоты, обычно включающих монатин, и для получения промежуточных соединений (в том числе в виде солей) для этих способов, и предоставить важные промежуточные соединения для указанных способов. Более конкретно, в данном изобретении предлагается эффективный способ получения в промышленности производных глутаминовой кислоты, способ получения промежуточных соединений для этого, включающих новое важное промежуточное соединение, способ получения оптически активного монатина и способ получения промежуточных соединений для этого и новое важное промежуточное соединение для данного способа.
Средства для решения задач
Для решения данных задач авторы изобретения провели ряд исследований. Авторы установили, что производные глутаминовой кислоты, обычно включающие монатин (в том числе в виде солей), могут быть эффективнополучены перекрестной альдольной конденсацией конкретного производного пировиноградной кислоты с щавелево-уксусной кислотой или пировиноградной кислотой, которая дает производные кетоглутаровой кислоты в качестве предшественников целевых производных глутаминовой кислоты, и последующим превращением карбонильной группы полученных производных кетоглутаровой кислоты в аминогруппу.
В случае альдольной конденсации с карбонильными соединениями различного типа, как в данном изобретении, обычно образуется четыре типа продуктов в смеси за счет собственно альдольной конденсации соединений одного и того же типа и прекрестной альдольной конденсации соединений разного типа. Хотя альдольная конденсация щавелево-уксусной кислоты (Journal of Organic Chemistry, 1973, Vol. 38, No. 20, pp.3582-3585) или пировиноградной кислоты (Journal of American Chemical Society, 1964, Vol. 86, pp. 2805-2810; Analytical Chemistry, 1986, Vol. 58, No. 12, pp. 2504-2510) уже известна, как перекрестная альдольная конденсация в системе, содержащей карбонильное соединение, которое не конденсируется само с собой, такое, как, например, глиоксиловая кислота или щавелево-уксусная кислота, так что относительно легко можно получить единственный продукт (Tetrahedron Letters, 1987, Vol. 28, pp. 1277-1280), не имеется сообщений о каком-либо примере селективного получения единственного продукта перекрестной альдольной конденсации щавелево-уксусной кислоты или пировиноградной кислоты с производными пировиноградной кислоты.
Кроме того, авторы данного изобретения нашли, что оптически активный монатин можно получить взаимодействием производного глутаровой кислоты формулы (9) с конкретным оптически активным амином, которое приводит к образованию диастереоизомерной соли, с последующей кристаллизацией и выделением полученной диастереоизомерной соли, дальнейшей диссоциацией этой диастереоизомерной соли или обменом диастереоизомерной соли с другой солью для получения оптически активного производного глутаровой кислоты, с последующим превращением алкоксииминогруппы (или гидроксииминогруппы) диастереоизомерной соли или оптически активного производного глутаровой кислоты в аминогруппу, кристаллизацией полученного монатина, представленного ниже формулой (13) (рацемат по 2-положению), в смешанном растворителе, состоящем из воды и органического растворителя.
На основании многочисленных данных, описанных выше, задачи данного изобретения в конечном счете успешно решены.
Другими словами, данное изобретение включает изобретения, относящиеся к следующим способам получения от [1] до [23] и к новому соединению [24] в их отдельных различных вариантах.
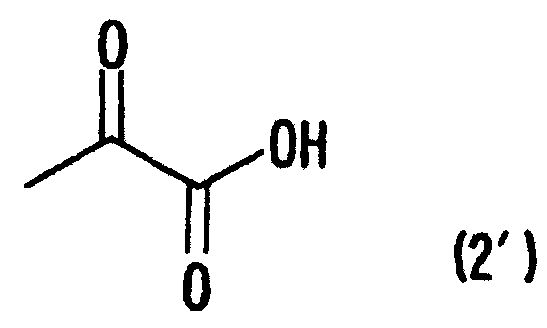
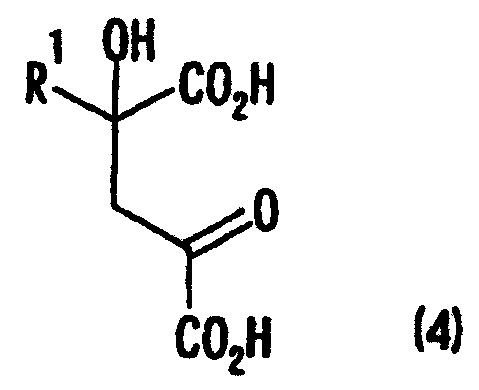
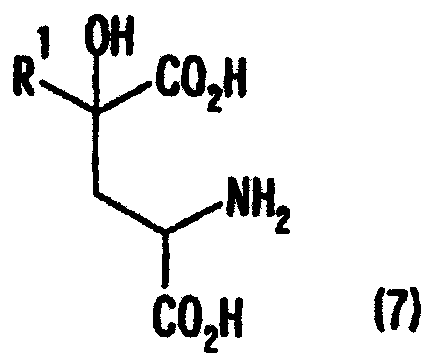
[1] Способ получения производных глутаминовой кислоты, представленных формулой (7), или их солей, включающий стадию перекрестной альдольной конденсациипроизводного пировиноградной кислоты, представленного формулой (1), и щавелево-уксусной кислоты, представленной формулой (2), и декарбоксилирования, или перекрестную альдольную конденсацию производного пировиноградной кислоты (кроме пировиноградной кислоты) и пировиноградной кислоты, представленной формулой (2'), для получения производного кетоглутаровой кислоты, представленного формулой (4), или его соли, и стадию превращения карбонильной группы производного кетоглутаровой кислоты или его соли в аминогруппу, где производное пировиноградной кислоты, щавелево-уксусная кислота и пировиноградная кислота, могут по отдельности быть в виде их солей
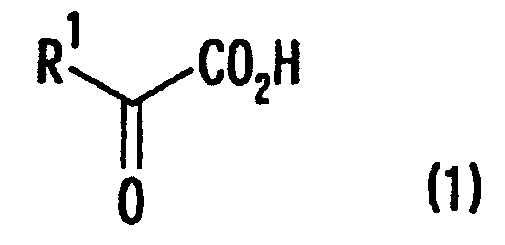
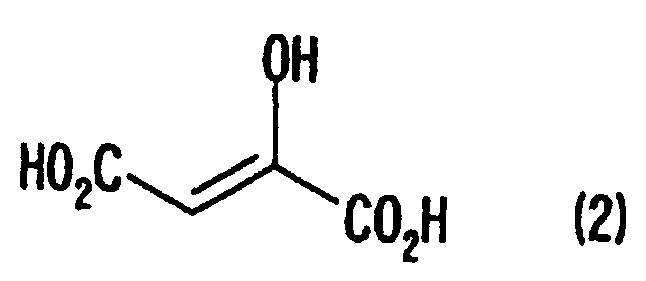
где в вышеуказанных формулах R1 представляет собой группу, выбранную из алкильных групп, арильных групп, аралкильных групп и углеводородных групп, содержащих гетероцикл; и R1 может иметь по меньшей мере один заместитель, выбранный из атомов галогена, гидроксильной группы, алкильных групп с 1-3 атомами углерода, алкоксигрупп с 1-3 атомами углерода и аминогруппы.
[2] Способ как описано выше в [1], где стадия превращения карбонильной группы производного кетоглутаровой кислоты, представленного формулой (4), или его соли в аминогруппу включает стадию взаимодействия аминосоединения, представленного формулой (5), или его соли с производным кетоглутаровой кислоты или его солью для получения производного глутаровой кислоты, представленного формулой (6), или его соли, и стадию восстановления полученного производного глутаровой кислоты, или его соли:
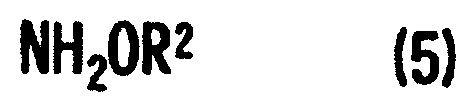
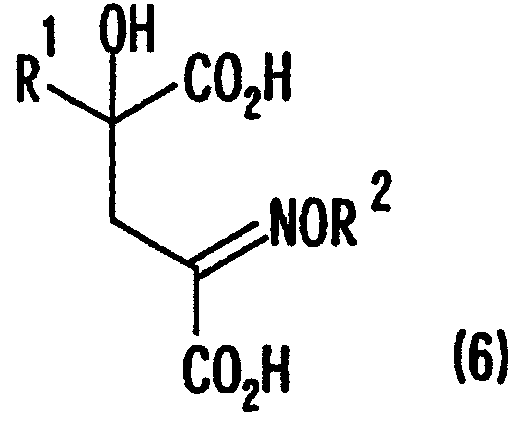
где в представленных выше формулах R1 представляет собой группу, выбранную из алкильных групп, арильных групп, аралкильных групп и углеводородных групп, содержащих гетероцикл; R2 представляет собой атом водорода или группу, выбранную из алкильных групп, арильных групп, аралкильных групп; и R1 может иметь по меньшей мере один заместитель, выбранный из атомов галогена, гидроксильной группы, алкильных групп, содержащих от 1 до 3 атомов углерода, алкоксигрупп, содержащих от 1 до 3 атомов углерода, и аминогруппы.
[3] Способ, как описано выше в [1], где стадия превращения карбонильной группы производного кетоглутаровой кислоты, представленного формулой (4), или его соли в аминогруппу включает стадию восстановительного аминирования производного кетоглутаровой кислоты или его соли.
[4] Способ, как описано в [1]-[3], где перекрестную альдольную конденсацию осуществляют в интервале pH от 10 до 14.
[5] Способ полученияпроизводного кетоглутаровой кислоты, представленного формулой (4), или его соли, включающий стадию перекрестной альдольной конденсации производного пировиноградной кислоты формулы (1), представленной ниже, и щавелево-уксусной кислоты, представленной формулой (2), и декарбоксилирования, или перекрестную альдольную конденсацию производного пировиноградной кислоты формулы (1), (кроме пировиноградной кислоты) с пировиноградной кислотой, представленной формулой (2'), где производное пировиноградной кислоты, щавелево-уксусная кислота и пировиноградная кислота могут в отдельности быть в виде соответствующей соли




где в вышеуказанных формулах R1 представляет собой группу, выбранную из алкильных групп, арильных групп, аралкильных групп и углеводородных групп, содержащих гетероцикл; и R1 может иметь по меньшей мере один заместитель, выбранный из атомов галогена, гидроксильной группы, алкильных групп с числом атомов углерода от 1 до 3, алкоксигрупп с числом атомов углерода от 1 до 3, и аминогруппы.
[6] Способ, как описано выше в [5], где перекрестную альдольную конденсацию осуществляют в интервале рН от 10 до 14.
[7] Способ получения производного глутаминовой кислоты, представленного ниже формулой (7), или его соли, включающий стадию взаимодействия производного кетоглутаровой кислоты, представленного ниже формулой (4), или его соли с аминосоединением, представленным ниже формулой (5), или его солью, для получения производного глутаровой кислоты, представленного ниже формулой (6), или его соли, и стадию восстановления полученного производного глутаровой кислоты или его соли

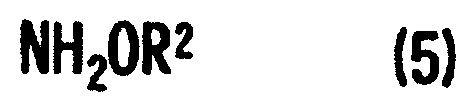


где в вышеуказанных формулах R1 представляет собой группу, выбранную из алкильных групп, арильных групп, аралкильных групп и углеводородных групп, содержащих гетероцикл; R2 представляет собой атом водорода или группу, выбранную из алкильных групп, арильных групп и аралкильных групп; и R1 может содержать по меньшей мере один заместитель, выбранный из атомов галогена, гидроксильной группы, алкильных групп, содержащих 1-3 атома углерода, алкоксигрупп, содержащих 1-3 атома углерода, и аминогруппы.
[8] Способ получения производного глутаминовой кислоты, представленного формулой (7), или его соли, включающий стадию восстановительного аминирования производного кетоглутаровой кислоты, представленного формулой (4), или его соли:


где в вышеуказанных формулах R1 представляет собой группу, выбранную из алкильных групп, арильных групп, аралкильных групп и углеводородных групп, содержащих гетероцикл; и R1 может содержать по меньшей мере один заместитель, выбранный из атомов галогена, гидроксильной группы, алкильных групп, содержащих 1-3 атома углерода, алкоксигрупп, содержащих 1-3 атома углерода, и аминогруппы.
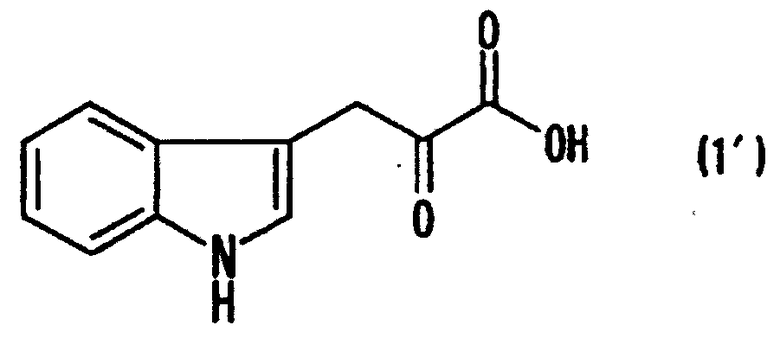
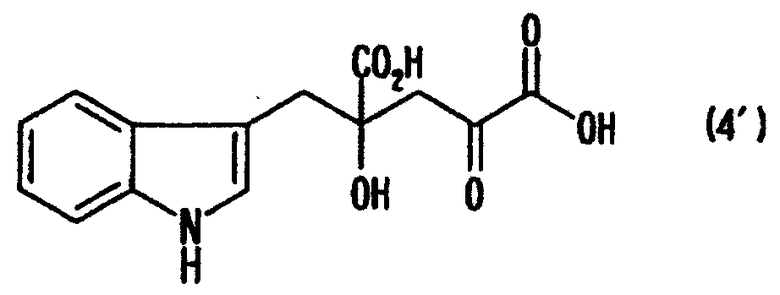
[9] Способ получения монатина, представленного ниже формулой (7'), или его соли, включающий стадию альдольной конденсации индол-3-пировиноградной кислоты формулы (1') и щавелево-уксусной кислоты формулы (2) и декарбоксилирования, или перекрестную альдольную конденсацию индол-3-пировиноградной кислоты формулы (1') и пировиноградной кислоты формулы (2') для получения 4-гидрокси-4-(3-индолилметил)-2-кетоглутаровой кислоты, представленной формулой (4'), или ее соли, и стадию превращения карбонильной группы кетоглутаровой кислоты или ее соли в аминогруппу, где индол-3-пировиноградная кислота, щавелево-уксусная кислота и пировиноградная кислота могут по отдельности быть в виде своих солей:



[10] Способ, как описано выше в [9], где стадия превращения карбонильной группы 4-гидрокси-4-(3-индолилметил)-2-кетоглутаровой кислоты, представленной формулой (4'), или ее соли в аминогруппу включает стадию взаимодействия аминосоединения формулы (5) или его соли с кетоглутаровой кислотой или ее солью для получения производного глутаровой кислоты, представленного формулой (6'), или его соли и стадию восстановленияпроизводного глутаровой кислоты или его соли:
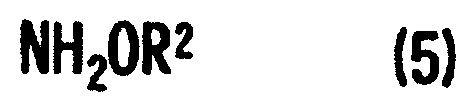
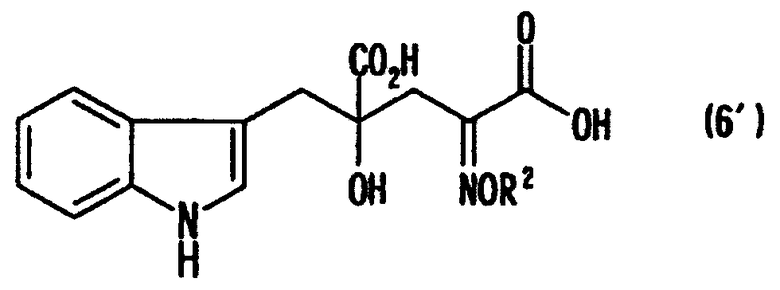
где в формуле R2 представляет собой атом водорода или заместитель, выбранный из алкильных групп, арильных групп и аралкильных групп.
[11] Способ, как описано выше в [9], где стадия превращения карбонильной группы 4-гидрокси-4-(3-индолилметил)-2-кетоглутаровой кислоты, представленной формулой (4'), или ее соли в аминогруппу, включает стадию восстановительного аминирования производного кетоглутаровой кислоты или ее соли.
[12] Способ, как описано выше в [9]-[11], где перекрестную альдольную конденсацию осуществляют в интервале рН от 10 до 14.
[13] Способ получения 4-гидрокси-4-(3-индолилметил)-2-кетоглутаровой кислоты, представленной формулой (4'), или ее соли, включающий стадию перекрестной альдольной конденсации индол-3-пировиноградной кислоты формулы (1') и щавелево-уксусной кислоты формулы (2) и декарбоксилирования, или альдольную конденсацию индол-3-пировиноградной кислоты формулы (1') и пировиноградной кислоты формулы (2'), где индол-3-пировиноградная кислота, щавелево-уксусная кислота и пировиноградная кислота могут в отдельности быть в виде соответствующей соли




[14] Способ, как описано в [13], где перекрестную альдольную конденсацию осуществляют в интервале рН от 10 до 14.
[15] Способ получения монатина, представленного формулой (7'), или его соли, включающий стадию взаимодействия 4-гдрокси-4-(3-индолилметил)-2-кетоглутаровой кислоты, представленной формулой (4'), или ее соли с аминосоединением, представленным формулой (5), или его солью для получения производного глутаровой кислоты, представленного формулой (6'), или его соли, и стадию последующего восстановления производного глутаровой кислоты или его соли

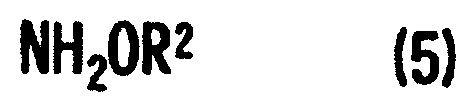


где в формуле R2 представляет собой атом водорода и заместитель, выбранный из алкильных групп, арильных групп и аралкильных групп.
[16] Способ получения монатина, представленного формулой (7'), или его соли, включающий стадию восстановительного аминирования 4-гидрокси-4-(3-индолилметил)-2-кетоглутаровой кислоты, представленной формулой (4'), или ее соли:


[17] Способ получения оптически активного монатина, представленного формулой (8), или его соли, включающий стадии а-с:
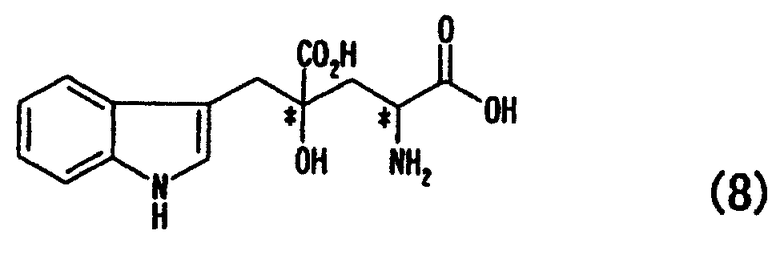
[в формуле обозначение * указывает на асимметрический центр и независимо представляет R- или S-конфигурацию]:
стадия а: стадияполучения соли оптически активного производного глутаровой кислоты, представленной формулой (11)
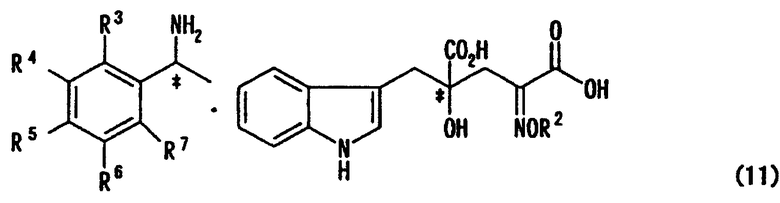
[в формуле R2, R3, R4, R5, R6 и R7 представляют собой те же заместители, как указано ниже; обозначение * указывает на асимметрический центр и независимо представляет R- или S-конфигурацию] взаимодействием производного глутаровой кислоты, представленного формулой (9)
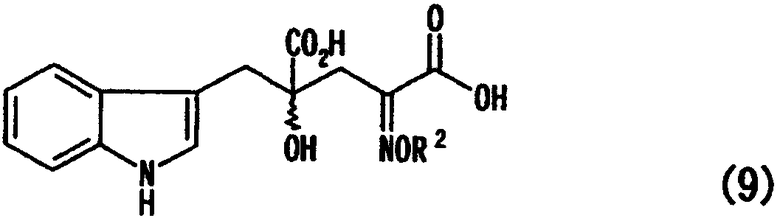
[в формуле R2 представляет собой атом водорода, алкильную группу, арильную группу или аралкильную группу; а связь, отмеченная волнистой линией, указывает, что включены как R-конфигурация, так и S-конфигурация] с оптически активным амином, представленным следующей формулой (10)
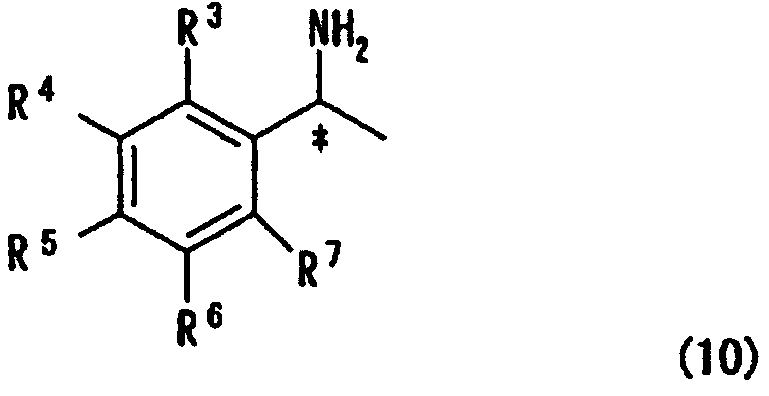
[в формуле R3, R4, R5, R6 и R7 независимо представляют собой атом водорода или алкильную группу, содержащую 1-3 атома углерода; обозначение * указывает на асимметрический центр и представляет R-конфигурацию или S-конфигурацию], которое приводит к образованию диастереоизомерной соли, и стадия выделения диастереоизомерной соли кристаллизацией;
стадия b: стадия генерирования монатина, представленного формулой (13), или его соли
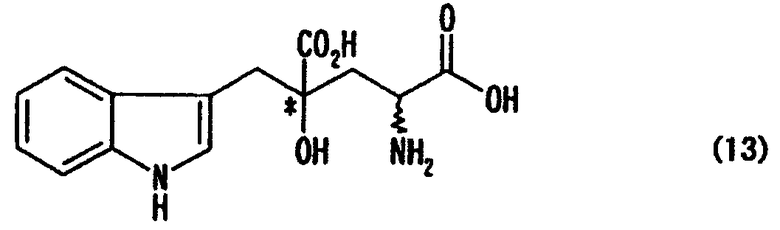
[в формуле обозначение * указывает на асимметрический центр и независимо представляет собой R- или S-конфигурацию; а связь, отмеченная волнистой линией, указывает, что включены как R-конфигурация, так и S-конфигурация], диссоциацией соли оптически активного производного глутаровой кислоты, представленной формулой (11), или обменом соли оптически активного производного глутаровой кислоты с другой солью, что необходимо, чтобы получить оптически активное производное глутаровой кислоты, представленное формулой (12), или его соль (кроме соли оптически активного производного глутаровой кислоты, представленной формулой (11))
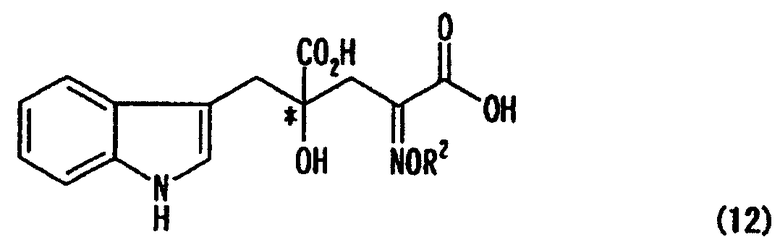
[в формуле R2 представляет собой атом водорода, алкильную группу, арильную группу или аралкильную группу; в формуле обозначение * указывает на асимметрический центр и независимо представляет собой R- или S-конфигурацию] и стадия превращения алкоксииминогруппы или гидроксииминогруппы в аминогруппу;
стадия с: стадия получения оптически активного монатина, представленного формулой (8), или его соли кристаллизацией монатина, представленного формулой (13), или его соли с помощью смешанного растворителя, состоящего из воды и органического растворителя.
[18] Способ получения оптически активного монатина, представленного формулой (8), или его соли, включающий стадии b и c:

[в формуле обозначение * указывает на асимметрический центр и независимо представляет R- или S-конфигурацию]
стадия b: стадия генерирования монатина, представленного формулой (13), или его соли

[в формуле обозначение * указывает на асимметрический центр и независимо представляет собой R- или S-конфигурацию, а связь, отмеченная волнистой линией, указывает, что включены как R-конфигурация, так и S-конфигурация], диссоциацией соли оптически активного производного глутаровой кислоты, представленной формулой (11)

[в формуле R2 представляет собой атом водорода, алкильную группу, арильную группу или аралкильную группу; R3, R4, R5, R6 и R7 независимо представляют собой атом водорода или алкильную группу, содержащую 1-3 атома углерода; а обозначение * указывает на асимметрический центр и независимо представляет R- или S-конфигурацию] или обменом соли оптически активного производного глутаровой кислоты с другой солью, необходимым, чтобы получить оптически активное производное глутаровой кислоты, представленное формулой (12), или его соль (кроме соли оптически активного производного глутаровой кислоты, представленной формулой (11))

[в формуле R2 представляет собой атом водорода, алкильную группу, арильную группу или аралкильную группу; а обозначение * указывает на асимметрический центр и представляет R-конфигурацию или S-конфигурацию],
и осуществления превращения алкоксииминогруппы или гидроксииминогруппы оптически активного производного глутаровой кислоты в аминогруппу
и
стадия с: стадия получения оптически активного монатина, представленного формулой (8), или его соли кристаллизацией монатина, представленного формулой (13), или его соли, с использованием смешанного растворителя, состоящего из воды и спирта.
[19] Способ получения оптически активного монатина, представленного формулой (8), или его соли

[в формуле обозначение * указывает на асимметрический центр и независимо представляет собой R- или S-конфигурацию], включающий стадию кристаллизации соли монатина, представленной формулой (13), с помощью смешанного растворителя, состоящего из воды и спирта:

[в формуле обозначение * указывает на асимметрический центр и представляет собой R- или S-конфигурацию; а связь, отмеченная волнистой линией, указывает, что включены как R-конфигурация, так и S-конфигурация].
[20] Способ получения соли оптически активного производного глутаровой кислоты, представленной формулой (11),

[в формуле R2 представляет собой атом водорода, алкильную группу, арильную группу или аралкильную группу; R3, R4, R5, R6 и R7 независимо представляют собой атом водорода или алкильную группу с 1-3 атомами углерода; а обозначение * указывает на асимметрический центр и независимо представляет собой R- или S-конфигурацию], включающий стадию взаимодействия производного глутаровой кислоты, представленного формулой (9)

[в формуле R2 представляет собой атом водорода, алкильную группу, арильную группу или аралкильную группу; а связь, отмеченная волнистой линией, означает, что включены как R-конфигурация, так и S-конфигурация] с оптически активным амином, представленным следующей формулой (10)

[в формуле R3, R4, R5, R6 и R7 независимо представляют собой атом водорода или алкильную группу с 1-3 атомами углерода; обозначение * указывает на асимметрический центр и представляет собой R- или S-конфигурацию], с образованием диастереоизомерной соли, и стадиювыделения диастереоизомерной соли кристаллизацией.
[21] Способ получения оптически активного производного глутаровой кислоты, представленного формулой (12), или его соли (кроме соли оптически активного производного глутаровой кислоты, представленной формулой (11))

[в формуле R2 представляет собой атом водорода, алкильную группу, арильную группу или аралкильную группу; обозначение * указывает на асимметрический центр и представляет R- или S-конфигурацию], включающий стадию диссоциации соли оптически активного производного глутаровой кислоты, представленной формулой (11)

[в формуле R2 представляет собой атом водорода, алкильную группу, арильную группу или аралкильную группу; R3, R4, R5, R6 и R7 независимо представляют собой атом водорода или алкильную группу, содержащую 1-3 атома углерода; а обозначение * указывает на асимметрический центр и независимо представляет R- или S-конфигурацию] или обмена соли оптически активного производного глутаровой кислоты с другой солью.
[22] Способ получения монатина, представленного формулой (13), или его соли:

[в формуле обозначение * указывает на асимметрический центр и представляет R- или S-конфигурацию; а связь, отмеченная волнистой линией, указывает, что включены как R-конфигурация, так и S-конфигурация], включающий стадию диссоциации соли оптически активного производного глутаровой кислоты, представленнойформулой (11)

[в формуле R2 представляет собой атом водорода, алкильную группу, арильную группу или аралкильную группу; R3, R4, R5, R6 и R7 независимо представляют атом водорода или алкильную группу с 1-3 атомами углерода; а обозначение * указывает на асимметрический центр и независимо представляет собой R- или S-конфигурацию] или обмена соли оптически активного производного глутаровой кислоты с другой солью, необходимого для получения оптически активного производного глутаровой кислоты, представленного формулой (12), или его соли (кроме соли оптически активного производного глутаровой кислоты формулы (11))

[в формуле R2 представляет собой атом водорода, алкильную группу, арильную группу или аралкильную группу; обозначение * указывает на асимметрический центр и представляет R- или S-конфигурацию] и стадиюпревращения алкоксииминогруппы или гидроксииминогруппы полученного оптически активного производного глутаровой кислоты в аминогруппу.
[23] Способ получения монатина, представленного структурной формулой (7'), (включая монатин в виде солей), осуществляемый согласно способу по любому из пунктов 1-22:

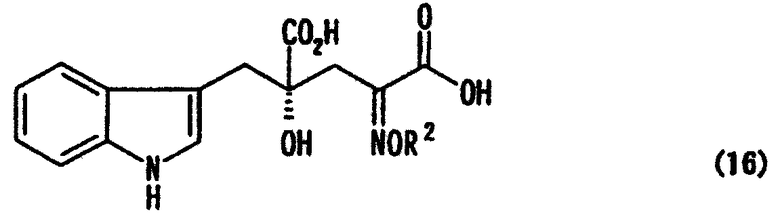
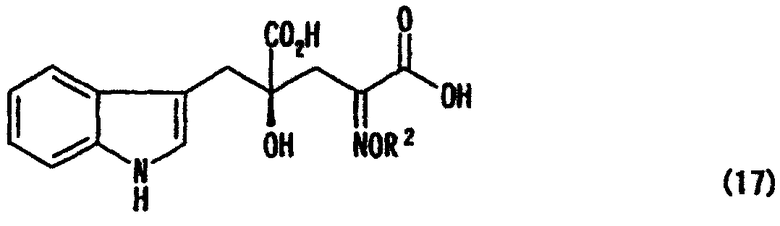
[24] Соединение, представленное любой из следующих формул: (4'), (6'), (7"), (11), (12), (14), (15), (16) или (17) (включая данные соединения в виде солей), где в формулах R2 представляет собой атом водорода, алкильную группу, арильную группу или аралкильную группу; R3, R4, R5, R6 и R7 независимо представляют собой атом водорода или алкильную группу, содержащую 1-3 атома углерода; а обозначение * указывает на асимметрический центр и представляет R- или S-конфигурацию:


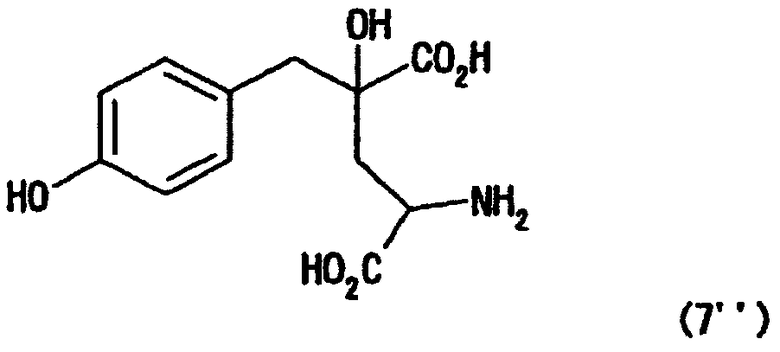


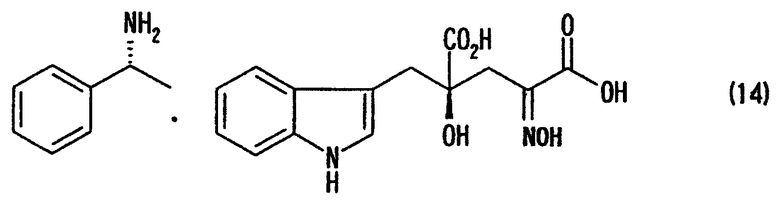
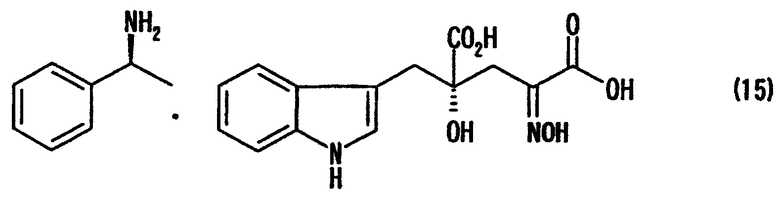
В случае, где производное используют или получают в виде соответствующей соли по данному изобретению, нет конкретных ограничений по типу соли. Такие соли включают, например, натриевую соль, калиевую соль, литиевую соль, магниевую соль, кальциевую соль, аммониевую соль и дициклогексиламмониевую соль. Целевая соль может быть получена способом образования соли, способом обессоливания, способом обмена соли и им подобными, как уже известными для широкого применения.
Вариант осуществления данного изобретения
Вариант осуществления данного изобретения ниже описан подробно.
(Получение производного кетоглутаровой кислоты перекрестной альдольной конденсацией производного пировиноградной кислоты и щавелево-уксусной кислоты с последующим декарбоксилированием и получением производного глутаминовой кислоты)
Производное пировиноградной кислоты, представленное формулой (1), и щавелево-уксусную кислоту, представленную формулой (2), подвергают перекрестной альдольной конденсации и реакции декарбоксилирования, или производное пировиноградной кислоты (кроме пировиноградной кислоты) и пировиноградную кислоту, представленную формулой (2'), подвергают альдольной конденсации и получают производное кетоглутаровой кислоты формулы (4) или его соль, а затем карбонильную группу производного кетоглутаровой кислоты или его соли превращают в аминогруппу и получают производное глутаминовой кислоты, представленное формулой (7), или его соль. В данном случае производное пировиноградной кислоты, щавелево-уксусная кислота и пировиноградная кислота могут в отдельности быть в виде соответствующей соли





В формулах R1 представляет собой группу, выбранную из алкильных групп, арильных групп, аралкильных групп и углеводородных групп, содержащих гетероцикл. Эти группы могут содержать по меньшей мере один заместитель, выбранный из атомов галогена (атома йода, атома брома, атома хлора, атома фтора и т.д.), гидроксильной группы, алкильных групп, содержащих 1-3 атома углерода, алкоксигрупп, содержащих 1-3 атома углерода, и аминогруппы.
В качестве R1 предпочтительными являются алкильные группы, арильные группы, аралкильные группы и углеводородные группы, содержащие гетероцикл с числом атомов углерода от 1 до 11 (в это число никогда не включают число атомов углерода в заместителях, если эти группы содержат заместители). Например, R1 включает алкильные группы, такие как изопропильная группа, изобутильная группа и 1-метилпропильная группа, арильные группы, такие как фенильная группа и 3-индолильная группа, аралкильные группы, такие как бензильная группа, 2-фенилэтильная группа и 2-нафтилметильная группа и углеводородные группы, содержащие гетероцикл, такие как 3-индолилметильная группа и 3-(6-метилиндолил)метильная группа.
Для альдольной конденсации производного пировиноградной кислоты, представленного формулой (1), и пировиноградной кислоты, представленной формулой (2'), в данном изобретении никогда не бывает так, что производное пировиноградной кислоты, представленное формулой (1), является пировиноградной кислотой, т.е. не имеет места тот случай, когда R1 является метильной группой (алкильной группой с одним атомом углерода).
Примеры R1 с заместителями включают R1, содержащий ароматическое кольцо или гетероциклическое кольцо при условии, что ароматическое кольцо или гетероциклическое кольцо содержит по меньшей мере один заместитель, выбранный из алкильных групп, содержащих 1-3 атома углерода, алкоксигрупп, содержащих 1-3 атома углерода, и аминогрупп. Например, когда бензильную группу или 3-индолилметильную группу выбирают в качестве R1 в формуле, конкретно, бензольное кольцо или индольное кольцо, содержащееся в группе, может содержать по меньшей мере один заместитель, выбранный из атомов галогена (атома йода, атома брома, атома хлора, атома фтора и т.д.), гидроксильной группы, алкильных групп, содержащих 1-3 атома углерода, алкоксигрупп, содержащих 1-3 атома углерода, и аминогруппы.
В случае, где R1 представляет собой 3-индолилметильную группу, другими словами, где индол-3-пировиноградную кислоту (формула 1') используют в качестве производного пировиноградной кислоты, 4-гидрокси-4-(3-индолилметил)-2-кетоглутаровая кислота (формула 4') или ее соль может быть получена, и она является промежуточным соединением, существенным для производства монатина. Затем превращением карбонильной группы кетоглутаровой кислоты или ее соли в аминогруппу может быть получен монатин (формула 7') или его соль.
Перекрестная альдольная конденсация
Перекрестную альдольную конденсацию предпочтительно проводят в щелочных условиях. Производное пировиноградной кислоты и щавелево-уксусная кислота или производное пировиноградной кислоты (кроме пировиноградной кислоты) и пировиноградная кислота могут находиться в соответствующем растворителе для реакции.
В качестве растворителя для реакции предпочтительны полярные растворители, такие как вода, метанол, этанол, пропанол, ацетонитрил и диметилформамид или составленные из них смешанные растворители. Конкретно, предпочтительны вода и смешанный растворитель (водный органический растворитель), состоящий из воды и полярных растворителей.
Значения рН растворителя составляют предпочтительно от 10 до 14, более предпочтительно от 10,5 до 14, еще более предпочтительно от 11 до 13.
Когда pH слишком высок, выход, вероятно, уменьшается. Когда рН слишком низок, по-видимому, во время перекрестной альдольной конденсации имеют место вторичные реакции.
Можно удовлетворительно использовать основания для доведения рН до данных значений в щелочных условиях, и данные основания включают, например, неорганические основания, такие как соли щелочных металлов, соли щелочно-земельных металлов, в том числе гидроксиды и карбонаты щелочных металлов, например гидроксид лития, гидроксид натрия, гидроксид калия, карбонат натрия, карбонат калия, карбонат кальция и органические основания, например триэтиламин.
Хотя количество щавелево-уксусной кислоты или пировиноградной кислоты, которое должно использоваться, по отношению к количеству производного пировиноградной кислоты конкретно не ограничено, выход реакции, вероятно, повышается при использовании избытка пировиноградной кислоты, обычно от 1 до 10 эквивалентов и предпочтительно от 3 до 6 эквивалентов на один эквивалент производного пировиноградной кислоты.
Реакцию можно проводить при температуре предпочтительно от -10 до 70°С, более предпочтительно от 10 до 50°С. Когда температура реакции слишком низкая, нужная реакция происходит так медленно, что вероятно идут вторичные реакции. Когда температура реакции высока, целевое производное кетоглутаровой кислоты (или его соль) очевидно разлагается.
Время реакции специально не ограничивается и обычно составляет от 1 до 72 ч, предпочтительно от 3 до 24 ч.
Реакция декарбоксилирования
Реакция, в которой применяют щавелево-уксусную кислоту, приводит к декарбоксилированию полученного продукта, которое потом дает целевое производное кетоглутаровой кислоты (или его соль). Реакцию декарбоксилирования продукта альдольной конденсации между щавелево-уксусной кислотой и производным пировиноградной кислоты можно осуществить как самопроизвольное декарбоксилирование. Однако декарбоксилирование можно эффективно осуществить добавлением к реакционному раствору кислоты или иона металла, или и того, и другого. Кислота для такого применения включает, например, соляную кислоту, серную кислоту, фосфорную кислоту, уксусную кислоту, п-толуолсульфокислоту, твердые кислоты, такие как ионообменные смолы, тогда как ион металла включает, например, ионы переходных металлов, таких как ион никеля, ион меди и ион железа. Температуру реакции можно выбрать предпочтительно от -10 до 100°C, более предпочтительно от около 0 до 60°C.
Реакционный раствор после перекрестной альдольной конденсации или после перекрестной альдольной конденсации и декарбоксилирования можно удовлетворительно использовать для следующей стадии как таковой. Из реакционного раствора выделяют производное кетоглутаровой кислоты (или его соль), представленное формулой (4), и очищают для применения на следующей стадии. Когда следующую стадию аминирования осуществляют без перерыва, обычно нет необходимости выделять производное кетоглутаровой кислоты (или его соль). После завершения реакции реакционный раствор концентрируют или отгоняют, если это необходимо для стадии аминирования. Если для стадии аминирования применяют тот же растворитель, что и в реакции перекрестной альдольной конденсации, следующую стадию можно проводить без отгонки или замены растворителя для реакции или подобной процедуры. В случае, где производное кетоглутаровой кислоты, представленное формулой (4), получают в виде соли, соль получают в свободной форме способом, который известен специалистам в данной области для применения на стадии аминирования. Однако обычно в этом нет необходимости. Соль можно использовать в виде ее соли.
В перекрестной альдольной конденсации (и декарбоксилировании, если необходимо) по данному изобретению, где R1 является 3-индолилметильной группой, т.е. где индол-3-пировиноградная кислота (формула 1') используется в качестве производного пировиноградной кислоты, может быть получена 4-гидрокси-4-(3-индолилметил)-2-кетоглутаровая кислота (формула 4'), важное промежуточное соединение для производства монатина или его соли.
Превращение карбонильной группы в аминогруппу
После проведения перекрестной альдольной конденсации (а затем проведения декарбоксилирования, если необходимо) карбонильную группу производного кетоглутаровой кислоты, представленного формулой (4), или его соли превращают в аминогруппу и получают производное глутаминовой кислоты, представленное формулой (7). Реакция для превращения карбонильной группы в аминогруппу не имеет особых ограничений, и ее проводят, например, следующими способами.
Пример 1 превращения карбонильной группы в аминогруппу
После проведения перекрестной альдольной конденсации (а затем проведения декарбоксилирования, если необходимо) аминосоединение (которое может быть в виде соли), представленное формулой (5), подвергают взаимодействию с производным кетоглутаровой кислоты, представленным формулой (4), или его солью для получения производного глутаровой кислоты, представленного формулой (6), или его соли, которое затем подвергают восстановлению и получают производное глутаминовой кислоты, представленное формулой (7)
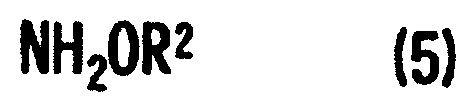

В формуле R1 такой, как описано выше.
В случае, где R1 представляет собой 3-индолилметильную группу, т.е. в случае, где 4-гидрокси-4-(3-индолилметил)-2-кетоглутаровую кислоту (формула 4') используют в качестве кетоглутаровой кислоты, представленной формулой (4), или ее соли, получают производное глутаровой кислоты, представленное формулой (6'), или его соль, которое затем подвергают восстановлению и получают монатин, представленный формулой (7'), или его соль.
В формуле R2 представляет собой атом водорода или группу, выбранную из алкильных групп, арильных групп, аралкильных групп и им подобных. R2 предпочтительно выбирают из атома водорода, алкильных групп и аралкильных групп, содержащих 7 или меньше атомов углерода.
Более конкретно, R2 предпочтительно представляет собой атом водорода, метильную группу или бензильную группу, особенно предпочтительно атом водорода. Другими словами, конкретные примеры аминосоединения, представленного формулой (5), предпочтительно включают гидроксиламин, метоксиамин и бензилоксиамин, особенно предпочтительно включают гидроксиламин.
Соль аминосоединения, представленного формулой (5), включает соли аминосоединения с органическими кислотами или неорганическими кислотами и конкретно включает, например, следующие соли: гидрохлорид гидроксиламина, сульфат гидроксиламина и гидрохлорид метоксиамина.
Когда гидрохлорид гидроксиламина реагирует с 4-гидрокси-4-(3-индолилметил)-2-кетоглутаровой кислотой, представленной формулой (4'), получают, например, соответствующую 4-гидрокси-4-(3-индолилметил)-2-гидроксииминоглутаровую кислоту (производное формулы (6'), где R2 представляет собой атом водорода) с хорошим выходом.
Для реакции производного кетоглутаровой кислоты, представленного формулой (4), или его соли с аминосоединением, представленным формулой (5), или его солью, температура реакции может быть установлена предпочтительно от около -10 до 100°С, более предпочтительно от около 0 до 60°С. Далее, время реакции может быть предпочтительно от около 1 до 100 ч, более предпочтительно от около 1 до 24 ч.
Для реакции аминосоединения или его соли рН реакционного раствора составляет предпочтительно 2 или больше, так как реакция идет медленно, когда рН слишком низкий. Реакция может происходить более предпочтительно в интервале рН от около 2 до 13, еще более предпочтительно в интервале рН от около 4 до 12.
Соотношение количества аминопроизводного или его соли, которое используют, конкретно не ограничивается. Однако используют предпочтительно от около 1 до 7 молей, более предпочтительно от около 1 до 2 молей аминосоединения (или его соли) на 1 моль производного кетоглутаровой кислоты (или его соли), представленного формулой (4).
В качестве растворителя для реакции предпочтительными являются полярные растворители, такие как вода, метанол, этанол, пропанол, ацетонитрил и диметилформамид или смеси данных растворителей. Конкретно, предпочтительными являются вода и смешанный растворитель (водный органический растворитель), состоящий из воды и полярных растворителей.
Поскольку таким образом получают производное глутаровой кислоты (или его соль), представленное формулой (6), реакционный раствор может быть использован как таковой для последующей стадии. Или же перед использованием для следующей стадии производное глутаровой кислоты можно выделить и очистить от реакционного раствора.
При проведении выделения и очистки можно соответствующим образом использовать способы, известные специалистам в данной области, такие как экстракция и кристаллизация. Например, в случае производного глутаровой кислоты, представленного формулой (6'), подкисляя реакционный раствор и регулируя его рН кислотами, например соляной кислотой, экстракциейпроизводного глутаровой кислоты органическими растворителями, такими как этилацетат, концентрированием полученного органического слоя и кристаллизацией остатка в смешанном растворителе, состоящем из водного аммиака и спирта, может быть получено производное глутаровой кислоты, представленное формулой (6'), в виде кристаллической диаммониевой соли. С помощью ионообменных смол или адсоробционных смол или им подобных из реакционного раствора можно выделить данное производное в свободной форме. Производное глутаровой кислоты, представленное формулой (6'), или его соль, полученные таким способом, представляют собой рацемат, из которого можно получить оптически активные формы, используя способ, описанный ниже.
Затем производное глутаровой кислоты, представленное формулой (6) (или его соль), подвергают восстановлению, которое дает производное глутаминовой кислоты, представленное формулой (7). С помощью данной реакции алкоксииминогруппу (или гидроксииминогруппу) в положении 2 производного глутаровой кислоты, представленного формулой (6), можно превратить в аминогруппу


В формулах R1 и R2 такие, как описано выше.
Восстановление алкоксииминогруппы (или гидроксииминогруппы) в аминогруппу можно предпочтительно осуществить реакцией гидрирования, с использованием катализатора гидрирования.
В качестве катализатора гидрирования можно использовать палладиевые катализаторы (палладий на угле и т.п.), платиновые катализаторы (платина на угле и т.п.), родиевые катализаторы (родий на угле и т.п.), рутениевые катализаторы (рутений на угле), никелевые катализаторы (никель Ренея и т.п.) и им подобные.
Данные катализаторы предпочтительно применяют в количестве от 1 до 20% (мол), более предпочтительно от 0,5 до 5% (мол) от количества субстрата.
В качестве растворителя для реакции предпочтительными являются полярные растворители, такие как вода, метанол, этанол, пропанол, ацетонитрил и диметилформамид или смеси данных растворителей. Особенно предпочтительны вода и смешанный растворитель, состоящий из воды и полярных растворителей.
Данную стадию предпочтительно осуществлять в щелочных условиях, обычно в интервале рН от 7 до 14, предпочтительно от 8 до 12. Конкретно, в случае использования родиевых катализаторов (родий на угле и т.п.), реакцию обычно проводят в интервале рН от 7,5 до 11, предпочтительно в интервале рН от 8 до 10. При применении никелевых катализаторов (никель Ренея и т.п.), однако, реакция предпочтительно происходит в нейтральных условиях, обычно в интервале рН от 5 до 9, предпочтительно в интервале рН от 6,5 до 7,5. Если рН слишком высокий, вероятно, увеличивается образование побочных продуктов реакции. Если рН слишком низкий, реакция, по-видимому, идет медленно. Когда данную реакцию осуществляют в щелочных условиях, тип щелочи, применяемой для регулирования рН, специально не ограничивается. Для реакции восстановления с помощью родиевых катализаторов и палладиевых катализаторов применяют водный аммиак, что особенно предпочтительно из-за увеличения выхода и низкого содержания побочных продуктов.
Реакцию гидрирования обычно проводят в атмосфере водорода. Желательно, чтобы давление водорода было предпочтительно от 0,5 до 100 атмосфер, более предпочтительно от 3 до 70 атмосфер.
Температура реакции составляет предпочтительно от -20 до 100°С, более предпочтительно от 0 до 70°С. Время реакции может составлять от 6 до 24 ч.
Пример 2 превращения карбонильной группы в аминогруппу
Превращая карбонильную группу во 2-м положении производного кетоглутаровой кислоты, представленного формулой (4) (или его соли), восстановительным аминированием, с помощью аминов, таких как аммиак, бензиламин и 1-фенилэтиламин, можно получить производное глутаминовой кислоты, представленное формулой (7)


В формулах R1 такой, как описано выше.
Когда R1 представляет собой 3-индолилметильную группу, т.е. в случае, где 4-гидрокси-4-(3-индолилметил)-2-кетоглутаровую кислоту (формула 4') используют как производное кетоглутаровой кислоты, представленное формулой (4), или его соль, в данном изобретении, можно получить монатин, представленный формулой (7'), или его соль.
Амин можно использовать в количестве, составляющем предпочтительно от 1 до 10 эквивалентов на 1 эквивалент производного кетоглутаровой кислоты (или его соли). Когда в качестве амина используется аммиак, предпочтительно используют большой избыток аммиака.
В качестве катализаторов для восстановления можно, кроме катализаторов гидрирования, описанных выше, применять гидридные катализаторы, например NaBH4. Гидридный катализатор обычно можно использовать в количестве от 0,5 до 2 эквивалентов. В случае катализатора гидрирования, можно использовать катализатор в количестве, близком к количеству, применяемому для контактного гидрирования производного глутаровой кислоты формулы (6). Реакция может происходить предпочтительно при температуре от 0 до 50°C, более предпочтительно от 20 до 35°C. Время реакции составляет предпочтительно от 1 до 72 ч. Когда применяют катализатор гидрирования, реакцию проводят при давлении водорода от 1 до 15 атмосфер.
В качестве растворителя для данной реакции предпочтительными являются полярные растворители, такие как вода, метанол, этанол, пропанол, ацетонитрил и диметилформамид или смеси данных растворителей. Конкретно, предпочтительными являются вода и смешанный растворитель (водный органический растворитель), состоящий из воды и полярных растворителей.
Производное глутаровой кислоты (или его соль), представленное формулой (7), как полученное данными способами в двух примерах, можно выделить и очистить, с помощью способов, известных специалисту в данной области, например экстракцией и кристаллизацией. В случае, где R1 представляет собой 3-индолилметильную группу, т.e. в случае, где 4-гидрокси-4-(3-индолилметил)-2-кетоглутаровую кислоту (формула 4′) используют в качестве производного кетоглутаровой кислоты, представленного формулой (4), или его соли, можно получить монатин, представленный формулой (7'), или его соль. Монатин, представленный формулой (7'), или его соль можно выделить и очистить способом для получения оптически активного монатина, как описано ниже, и получить оптически активную форму.
Получение оптически активного монатина
Монатин содержит асимметрические атомы углерода в положениях 2 и 4, так что существуют следующие четыре типа оптических изомеров.
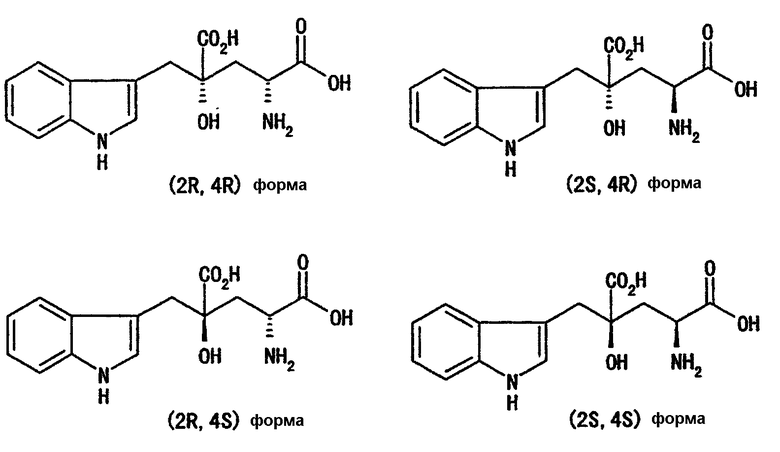
Когда 4-гидрокси-4-(3-индолилметил)-2-кетоглутаровую кислоту (формула 4') используют в качестве производного кетоглутаровой кислоты, представленного формулой (4), или его соли, как описано выше, реакция с аминосоединением, представленным формулой (5), или с реагентом, генерирующим данное соединение, или с реагентом, способным генерировать данное соединение, может дать производное глутаровой кислоты формулы (6') (или его соль), которое обычно является рацематом.
Рацемат или производное глутаровой кислоты, содержащее R-форму или S-форму в соответствующем соотношении (они включены в производное глутаровой кислоты, представленное формулой (9)) используют на следующих стадиях от а до с для получения оптически активных форм монатина или его соли.
Стадия а: стадия получения соли оптически активного производного глутаровой кислоты, представленной формулой (11)

[в формуле R2, R3, R4, R5, R6 и R7 имеют такие значения, как описано ниже; и обозначение * указывает на асимметрический центр и независимо представляет R- или S-конфигурацию], взаимодействием производного глутаровой кислоты, представленного формулой (9)

[в формуле R2 представляет собой атом водорода, алкильную группу, арильную группу или аралкильную группу, а связь, отмеченная волнистой линией, означает, что включены как R-конфигурация, так и S-конфигурация] с оптически активным амином, представленным формулой (10)

[в формуле R3, R4, R5, R6 и R7 независимо представляют собой атом водорода или алкильную группу, содержащую 1-3 атома углерода; и обозначение * указывает на асимметрический центр и представляет R-конфигурацию или S-конфигурацию], которое приводит к образованию диастереоизомерной соли, с последующим выделением диастереоизомерной соли кристаллизацией;
Стадия b: стадия генерирования (образования) монатина, представленного формулой (13), или его соли

[в формуле обозначение * указывает на асимметрический центр и представляет R- или S-конфигурацию, а связь, отмеченная волнистой линией, означает, что включены как R-конфигурация, так и S-конфигурация], диссоциацией соли оптически активного производного глутаровой кислоты, представленной формулой (11), или обменом соли оптически активного производного глутаровой кислоты с другой солью, что необходимо для получения оптически активного производного глутаровой кислоты, представленного формулой (12), или его соли (кроме соли оптически активного производного глутаровой кислоты, представленной формулой (11)

[в формуле R2 представляет собой атом водорода, алкильную группу, арильную группу или аралкильную группу, а обозначение * указывает на асимметрический центр и представляет R-конфигурацию или S-конфигурацию], и затем превращением алкоксииминогруппы или гидроксииминогруппы в аминогруппу;
Стадия с: стадия получения оптически активного монатина, представленного формулой (8), или его соли кристаллизацией монатина, представленного формулой (13), или его соли с помощью смешанного растворителя, состоящего из воды и органического растворителя.
Теперь описывается стадия а.
Чтобы сделать возможным образование диастереоизомерной соли производного глутаровой кислоты, представленного формулой (9), и оптически активного амина, представленного формулой (10), например, такие соединения или их соли растворяют в растворителе для реакции. Если производное глутаровой кислоты находится в виде его соли, соль превращают в свободную форму нейтрализацией соли кислотой, если необходимо, затем экстрагируют свободную форму органическим растворителем, а потом свободная форма реагирует с оптически активным амином, образуя соль. Кроме того, кислоту вполне можно прибавлять к растворителю, содержащему растворенную в нем соль производного глутаровой кислоты, для нейтрализации соли, а затем можно прибавить оптически активный амин для реакции с образованием диастереоизомерной соли. Когда соль производного глутаровой кислоты, представленного формулой (11), образуется в результате реакции солевого обмена с оптически активным амином, представленным формулой (10), в растворителе, для реакции с оптически активным амином, представленным формулой (10), можно даже использовать исходное производное в виде соли без изменений. В этом случае оптически активный амин, представленный формулой (10), предпочтительно использовать в виде соли, такой как гидрохлорид или сульфат.
Особенно предпочтительные примеры оптически активного амина, представленного формулой (10), включают (R)-(+)-1-фенилэтиламин и (S)-(-)-1-фенилэтиламин,
где R3, R4, R5, R6 и R7 в формуле представляют собой атомы водорода.
Оптически активный амин используют в количестве предпочтительно от около 0,1 до 1-кратного (в молях), более предпочтительно от 0,3 до 0,6-кратного (в молях) относительно количества (в молях) производного глутаровой кислоты.
Температуру реакции устанавливают предпочтительно в интервале от около -20 до 100°C, более предпочтительно от около 0 до 60°C. Время реакции конкретно не ограничивается, но оно довольно краткое для быстрого образования соли.
Растворитель для реакции включает один растворитель, выбранный из воды, метанола, этанола, ацетонитрила, толуола и этилацетата, и соответствующий смешанный растворитель, состоящий из двух и более данных растворителей. Конкретно, предпочтительно используют воду или смешанный растворитель, состоящий из воды и органического растворителя, смешивающегося с водой (например, полярных растворителей, таких как метанол, этанол и ацетонитрил). Из них более предпочтительным является одиночный растворитель - вода.
После завершения реакции, например, реакционный раствор концентрируют, если необходимо, и добавляют воду для кристаллизации диастереоизомерной соли. Реакционный раствор можно охладить, если требуется. Так как в воде плохо растворяется образующаяся диастереоизомерная соль, воду или смешанный растворитель, состоящий из воды и органического растворителя, смешивающегося с водой, используют в качестве растворителя для реакции образования диастереоизомерной соли, чтобы кристаллы могли осаждаться и кристаллизоваться, одновременно с протеканием реакции (образование соли). Кристаллы, полученные кристаллизацией, отделяют от реакционного раствора фильтрованием и подобными процедурами для получения диастереоизомерной соли, представленной формулой (11). Диастереоизомерная соль, полученная в виде кристаллов, в случае применения воды в качестве плохого растворителя для нее, изменяется в зависимости от стерической конфигурации применяемого оптически активного амина. При использовании (R)-(+)-1-фенилэтиламина в качестве оптически активного амина, представленного формулой (10), для 4-гидрокси-4-(3-индолилметил)-2-гидроксииминоглутаровой кислоты (производного формулы (9), где R2 представляет собой атом водорода), можно получить, например, диастереоизомерную соль, представленную формулой (14). В случае применения (S)-(-)-1-фенилэтиламина, может быть получена диастереоизомерная соль, представленная формулой (15)


В случае использования (R)-(+)-1-фенилэтиламина, другими словами, кристалл диастереоизомерной соли можно получить, где производное глутаровой кислоты в S-конфигурации в 4-положении образует соль с (R)-(+)-1-фенилэтиламином.
В случае применения (S)-(-)-1-фенилэтиламина можно получить кристалл диастереоизомерной соли, где производное глутаровой кислоты в R-конфигурации в 4-положении образует соль с (S)-(-)-1-фенилэтиламином. Специалист в данной области может выбрать оптически активный амин, подходящий для предполагаемого соединения, чтобы образовалась и кристаллизовалась диастереоизомерная соль в нужной стерической кофигурации.
Кроме того, маточный раствор, после отделения этих диастереоизомерных солей в виде кристаллов, содержит в качестве основного компонента производное глутаровой кислоты в стерической конфигурации, противоположной конфигурации производного глутаровой кислоты, отделенного в виде кристаллов. Таким образом, при добавлении оптически активного амина со стерической конфигурацией, противоположной конфигурации оптически активного амина, используемого для образования соли в маточном растворе, чтобы образовать и кристаллизовать диастереоизомерную соль таким же образом, как описано выше, один дополнительный кристалл диастереоизомерной соли может быть отделен от маточного раствора. Другими словами, стадия а по данному изобретению может быть применена к маточному раствору для получения другой диастереоизомерной соли кристаллизацией, как описано выше.
Теперь описывается стадия b.
Оптически активная соль производного глутаровой кислоты, представленная формулой (11), как полученная на стадии а, диссоциирует, образуя оптически активное производное глутаровой кислоты, представленное формулой (12), если требуется. Альтернативно, соль может быть заменена другой солью (солевой обмен), если необходимо.
Способы, известные специалистам в данной области, можно использовать для воздействия на диссоциацию и замещение другой солью (солевой обмен). Способ диссоциации представляет собой, например, способ, включающий стадию растворения или суспендирования соли в воде, спирте или смешанном растворителе, состоящем из них, стадию нейтрализации полученного раствора или суспензии кислотами, например соляной кислотой или серной кислотой, и стадию экстракции органическим растворителем, способ, включающий стадию растворения соли в воде и отделения свободной формы, представленной формулой (12), ионообменными смолами или адсорбирующими смолами. Для выделения свободной формы намеченное выделение можно легко провести известным способом, например перегонкой раствора элюента со смолы или раствора экстракта, содержащего свободную форму, при пониженном давлении. В случае замещения другой солью, например, соль оптически активного производного глутаровой кислоты, представленной формулой (11), можно растворить в водных растворах гидроксидов щелочных металлов: гидроксида натрия, гидроксида калия и водного раствора аммиака, из которых свободный оптически активный амин экстрагируют органическим растворителем таким образом, что соль может быть обменена. Используя известный прием, такой как перегонка при пониженном давлении водного раствора после экстракции или кристаллизации, можно дополнительно выделить соль оптически активного производного глутаровой кислоты, представленного формулой (12), (кроме соли оптически активного производного глутаровой кислоты, представленной формулой (11)).
Монатин, представленный формулой (13), может быть получен из оптически активного производного глутаровой кислоты, представленного формулой (12), таким образом полученного из его соли превращением алкоксииминогруппы (или гидроксииминогруппы) в аминогруппу. Кроме того, монатин, представленный формулой (13), может быть получен превращением алкоксииминогруппы (или гидроксииминогруппы) соли оптически активного производного глутаровой кислоты, представленной формулой (11), в аминогруппу так же, как описано выше.
Как описано выше, превращение алкоксииминогруппы (или гидроксииминогруппы) в аминогруппу можно осуществить реакцией гидрирования, используя катализатор гидрирования в условиях реакции, как описано выше.
После окончания реакции катализатор удаляют фильтрованием или подобным приемом, а фильтрат концентрируют, если требуется, из него можно получить монатин, представленный формулой (13), используя приемы выделения, известные специалисту в данной области (например, кристаллизация, ВЭЖХ и т.п.). Кроме того, если следующую стадию с осуществляют без перерыва, вообще нет необходимости выделять монатин, представленный формулой (13). После окончания реакции катализатор удаляют из реакционного раствора фильтрованием или подобным приемом. Затем реакционный раствор концентрируют или отгоняют, если требуется, для того, чтобы провести кристаллизацию согласно стадии с. Используя тот же растворитель, который применяют как растворитель для кристаллизации, для реакции гидрирования, следующую стадию с можно осуществить без отгонки растворителя реакции или растворителя для обмена и т.п. Когда основание используют для реакции гидрирования, монатин существует в реакционном растворе в виде соли. Обработкой реакционного раствора после удаления катализатора ионообменной смолой или подобным веществом можно, например, получить монатин в свободной форме или превратить в другую соль (солевой обмен, включающий, например, превращение аммониевой соли в натриевую соль, калиевую соль и им подобные). Затем полученный продукт можно кристаллизовать. Для проведения следующей стадии с предпочтительно использовать полученный монатин в виде его соли как таковой.
Теперь описывается стадия с.
Хотя монатин, представленный формулой (13), или его соль, полученные на стадии b, могут сохранять оптическую активность в положении 4, полученный монатин может быть выделен в виде смеси S-формы и R-формы в положении 2. Монатин и его соль могут быть оптически разделены кристаллизацией в соответствии со стадией с, описанной ниже, так что могут быть получены оптически активный монатин или его соль, оптически активные как в положении 2, так и в положении 4.
Монатин, представленный формулой (13), или его соль подвергают стадии кристаллизации, используя смешанный растворитель, состоящий из воды и органического растворителя, чтобы получить оптически активный монатин (кристаллический), представленный формулой (8).
Когда для реакции гидрирования на стадии b используют основание, обычно можно получить монатин в виде соли, который предпочтительно подвергают стадии кристаллизации в таком виде. В этом случае вода является хорошим растворителем для соли монатина. Способ кристаллизации не особенно ограничен и включает, например, подходы, известные специалисту в данной области, такие как кристаллизация при охлаждении и концентрирование раствора перед кристаллизацией. Для кристаллизации соли монатина, например, можно получить кристалл монатина в свободной форме добавлением кислоты к водному раствору, содержащему соль монатина, растворенную в нем, для нейтрализации раствора, и прибавлением органического растворителя к полученному раствору. Так как монатин, вероятно, разлагается кислотой, тем не менее, изобретение можно предпочтительно использовать конкретно для случая, где монатин должен быть получен в виде соли.
В качестве органического растворителя можно использовать органический растворитель, который смешивается с водой. Конкретно, предпочтительными являются спирты, такие, например, как метанол, этанол, пропанол и изопропанол. Смешанный растворитель из двух или более типов различных органических растворителей можно удовлетворительно использовать в качестве органического растворителя. Соотношение воды и органического растворителя в смешанном растворителе, содержащем воду, можно установить предпочтительно в диапазоне органический растворитель:вода = от примерно 1:0,1 до 1:1 (объемное отношение), более предпочтительно в диапазоне органический растворитель:вода = от примерно 1:0,3 до 1:0,9 (объемное отношение). Температуру кристаллизации достаточно установить в интервале предпочтительно от около -20 до 100°C, более предпочтительно от около 0 до 60°C.
Как показано ниже, на следующих схемах, стерическая конфигурация кристалла монатина, полученного на стадии с, следующая. В случае использования монатина, представленного формулой (13), в R форме в 4-м положении и S форме в 4-м положении, получают кристаллы монатина (2R,4R) и (2S,4S), соответственно. Кроме того, маточный раствор после отделения кристаллов в отдельности содержит (2S,4R) монатин и (2R,4S) монатин, в качестве основных компонентов. Обработкой маточных растворов адсорбирующими смолами и им подобными можно выделить (2S,4R) монатин или (2R,4S) монатин
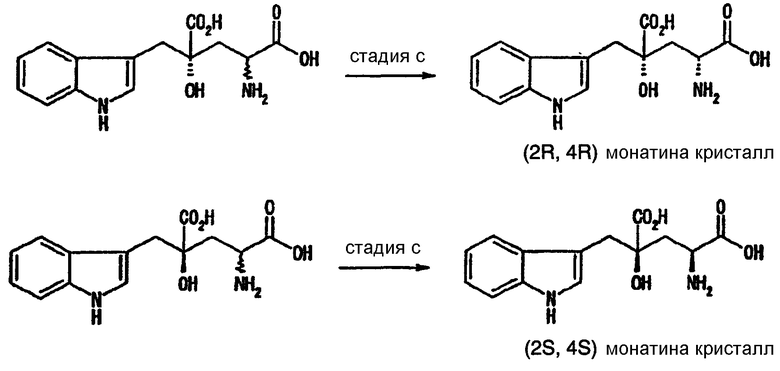
Если требуется, оптически активный монатин, полученный в свободной форме, можно получить в виде соли. Способами, известными специалистам в данной области (образование соли), монатин можно получить в виде соли, например, в виде натриевой соли или калиевой соли. Кроме того, даже оптически активный монатин, полученный в виде его соли, можно получить аналогичным образом в свободной форме, если требуется, или можно превратить в другую соль. Используя методы, известные специалисту в данной области, например, данную соль можно превратить в свободную форму методом для превращения солей в свободные формы диссоциацией или подобным образом. Альтернативно, соль можно превратить в другую соль обменом (реакцией обмена) полученной соли с другой солью (солевой обмен).
Предпочтительные варианты осуществления данного изобретения
Данное изобретение теперь подробно описывается следующими примерами. Однако данное изобретение не ограничено указанными примерами.
В примерах, кроме того, оптическую чистоту определяют ВЭЖХ в следующих условиях
<Колонка для разделения оптических изомеров>
SUMICHIRAL OA-7100, изготовленная Sumika Chemical Analysis Service
<Элюент>
20 мМ фосфатный буфер (pH 2,8):ацетонитрил = 7:3
<Температура колонки >
10°C; и
<Скорость потока >
0,6 мл/мин.
Пример 1
Синтез 4-гидрокси-4-(3-индолилметил)-2-кетоглутаровой кислоты; № 1
Гидроксид калия (8,28 г) (с чистотой 85% мас.) растворяют в 27 мл воды, к полученному раствору прибавляют 3,0 г (14,76 ммоль) индол-3-пировиноградной кислоты и 5,85 г (44,29 ммоль) щавелево-уксусной кислоты для реакции при температуре окружающей среды в течение 72 ч (pH около 13 в начале реакции). Доводят рН раствора до 3,0 добавлением ионообменной смолы (Amberlite IR 120B H AG) к реакционному раствору, для экстракции этилацетатом (200 мл) при 0°C. К полученному этилацетатному слою добавляют 100 мл насыщенного водного раствора бикарбоната натрия, отгоняют этилацетат из экстракта и рН раствора доводят до 7,9 ионообменной смолой (IRA400 OH AG, производимой Organo Corporation). Полученный раствор подвергают лиофильной сушке. Получают натриевую соль 4-гдрокси-4-(3-индолилметил)-2-кетоглутаровой кислоты в виде неочищенного продукта. Затем к полученному остатку прибавляют 40 мл воды и 200 мл этанола и твердое вещество отфильтровывают. Полученный маточный раствор упаривают досуха и получают натриевую соль 4-гидрокси-4-(3-индолилметил)-2-кетоглутаровой кислоты (1,5 г) в виде неочищенного продукта.
Пример 2
Синтез 4-гидрокси-4-(3-индолилметил)-2-кетоглутаровой кислоты; №. 2
После растворения 18,91 г (286,5 ммоль) гидроксида калия (85% мас. чистоты) в 64,45 мл воды к полученному раствору добавляют 7,50 г (35,8 ммоль) индол-3-пировиноградной кислоты (97,0% мас. чистоты) и 14,18 г (107,4 ммоль) щавелево-уксусной кислоты и растворяют в нем (при pH примерно 13 в начале реакции). Полученную смесь перемешивают при 35°C в течение 24 ч. Затем добавляют 40,0 мл 3н. соляной кислоты для нейтрализации (pH 7,0) и получают 153,5 г нейтрализованного реакционного раствора. Нейтрализованный реакционный раствор содержит 5,55 г 4-гидрокси-4-(3-индолилметил)-2-кетоглутаровой кислоты, выход которой 53,5% (в расчете на индол-3-пировиноградую кислоту). К нейтрализованному реакционному раствору прибавляют воду, доводя объем раствора до 168 мл, и раствор пропускают через колонку со смолой (диаметром 4,8 см), заполненную синтетическим адсорбентом (840 мл) (DIAION-SP207, выпускаемым Mitsubishi Chemical Corporation). Затем через колонку пропускают чистую воду со скоростью 23,5 мл в минуту. От 1,73 до 2,55 L/L-R собирают и получают водный раствор, содержащий 3,04 г 4-гидрокси-4-(3-индолилметил)-2-кетоглутаровой кислоты - выход 54,7% (относительно количества, загруженного на смолу).
ЯМР данные
1H-ЯМР (400 МГц, D2O): δ 3,03 (д, 1H, J=14,6 Гц), 3,11 (д, 1H, J=14,6 Гц), 3,21 (д, 1H, J=18,1 Гц), 3,40 (д, 1H, J=18,1 Гц), 7,06-7,15 (м, 3H), 7,39 (д, 1H, J=7,8 Гц), 7,66 (д, 1H, J=7,8 Гц).
13C-ЯМР (400 МГц, D2O): δ 35,43, 47,91, 77,28, 109,49, 112,05, 119,44, 119,67, 121,91, 125,42, 128,41, 136,21, 169,78, 181,43, 203,58.
Определение молекулярной массы
Вычисленное значение (MS-ESI)C14H13NO6= 291,07
Найденное значение = 290,02 (MH-)
Пример 3
Синтез 4-гидрокси-4-(3-индолилметил)-2-кетоглутаровой кислоты; №. 3
Гидроксид калия 3,70 г (56,0 ммоль) (с содержанием основного вещества 85% мас.) растворяют в 72,1 мл воды, затем добавляют 0,81 г (4,0 ммоль) индол-3-пировиноградной кислоты и 3,17 г (24,0 ммоль) щавелево-уксусной кислоты и растворяют в полученном растворе (pH около 13 в начале реакции). Растворенную смесь перемешивают при 35°C в течение 24 ч. Часть реакционного раствора обрабатывают гидроксиламином и получают 4-гидрокси-4-(3-индолилметил)-2-гидроксииминоглутаровую кислоту, которую анализируют ВЭЖХ. В результате было найдено, что 4-гидрокси-4-(3-индолилметил)-2-кетоглутаровая кислота образуется с выходом 76,6% (в расчете на индол-3-пировиноградную кислоту).
Пример 4
Синтез 4-бензил-4-гидрокси-2-кетоглутаровой кислоты
После растворения 16,23 г гидроксида калия (с чистотой 85% мас.) в 48 мл воды к полученному раствору добавляют 5,0 г (30,5 ммоль) фенилпировиноградной кислоты и 12,1 г (91,4 ммоль) щавелево-уксусной кислоты для взаимодействия при температуре окружающей среды в течение 72 ч (рН составляет около 13 в начале реакции). С помощью концентрированной соляной кислоты рН раствора доводят до 2,2 и раствор экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом магния, концентрируют и получают остаток. Остаток перекристаллизовывают из этилацетата и толуола и получают кристаллы 4-бензил-4-гидрокси-2-кетоглутаровой кислоты (2,8 г, 11,3 ммоль).
ЯМР данные
1H-ЯМР (D2O) δ: 2,48 (д, J=14,4 Гц, 0,18H), 2,60 (д, J=14,4 Гц, 0,18H), 2,85-3,30 (м, 3,64H), 7,17-7,36 (м, 5H).
Определение молекулярной массы
Вычисленное значение (МС-ESI)C12H12O6 = 252,23
Полученное значение 251,22 (MH-)
Пример 5
Синтез 4-гидрокси-4-(3-индолилметил)-2-гидроксииминоглутаровой кислоты; №. 1
После растворения 13,8 г гидроксида калия (с чистотой 85% мас.) в 50 мл воды к полученному раствору добавляют 5,0 г (24,6 ммоль) индол-3-пировиноградной кислоты и 9,8 г (73,8 ммоль) щавелево-уксусной кислоты для взаимодействия при температуре окружающей среды в течение 72 ч (рН составляет около 13 в начале реакции). К реакционному раствору прибавляют 6,8 г (98,4 ммоль) гидроксиламингидрохлорида. Затем рН реакционного раствора доводят до 7,5 водным 4н. раствором гидроксида натрия. Реакционный раствор перемешивают в течение 24 ч при температуре окружающей среды, затем рН раствора доводят до 2,6 6н. соляной кислотой. После экстракции этилацетатом органический слой промывают насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом магния и упаривают досуха. Полученный остаток растворяют в 10 мл водного 14% аммиака, затем постепенно по каплям прибавляют 70 мл этанола и перемешивают при температуре окружающей среды в течение 3 ч. Образовавшуюся взвесь фильтруют. Полученные кристаллы сушат и получают 2,7 г (7,9 ммоль) 4-гидрокси-4-(3-индолилметил)-2-гидроксииминоглутаровой кислоты в виде аммониевой соли.
ЯМР данные
1H-ЯМР (ДМСО-d6) δ: 2,66 (c, 2H), 2,89 (д, J=14,4 Гц, 1H), 3,04 (д, J=14,4 Гц, 1H), 6,89-6,94 (м, 1H), 6,97-7,03 (м, 1H), 7,11 (д, J=2,8 Гц, 1H), 7,27 (д, J=7,8 Гц, 1H), 7,53 (д, J=7,8 Гц, 1H), 10,71 (уш.с, 1H).
Определение молекулярной массы
Вычисленное значение(МС-ЭСИ) (МС-ESI)C14H14N2O6 = 306.28
Найденное значение = 305,17 (MH-)
Пример 6
Синтез 4-гидрокси-4-(3-индолилметил)-2-метоксииминоглутаровой кислоты
После растворения 9,12 г (138,1 ммоль) гидроксида калия (с содержанием основного вещества 85% мас.) в 23 мл воды к полученному раствору добавляют 2,55 г (12,2 ммоль при чистоте 97,0% мас.) индол-3-пировиноградной кислоты и 7,46 г (56,5 ммоль) щавелево-уксусной кислоты и растворяют в нем (рН около 13 в начале реакции). Раствор перемешивают при 35°C в течение 24 ч. К реакционному раствору постепенно прибавляют 5,76 г (69 ммоль) соли, гидрохлорида метоксиамина, тогда какpH реакционного раствора доводят до примерно 10 водным 25% раствором гидроксида натрия. После продолжения взаимодействия при температуре окружающей среды в течение 14 ч рН реакционного раствора доводят до 2,23 с помощью 6н. соляной кислоты и затем раствор экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом магния. Сульфат магния отфильтровывают, затем полученный раствор упаривают и получают 4,66 г остатка. Полученный остаток очищают колоночной хроматографией на силикагеле и затем очищают препаративной тонкослойной хроматографией (ПТСХ; этилацетат/гексан/уксусная кислота = 5/5/1) и получают 0,93 г (2,92 ммоль) указанного в заголовке соединения - 4-гидрокси-4-(3-индолилметил)-2-метоксииминоглутаровой кислоты. Выход 24% (по индол-3-пировиноградной кислоте).
ЯМР данные
1H-ЯМР (400 МГц, ДМСО-d6): δ 2,89 (д, J=14,9 Гц, 1H), 3,04 (c, 2H), 3,15 (д, J=14,9 Гц, 1H), 3,90 (c, 3H), 6,91-6,96 (м, 1H), 6,98-7,04 (м, 1H), 7,09-7,12 (м, 1H), 7,29 (д, J=7,4 Гц, 1H), 7,50 (д, J=7,4 Гц, 1H), 10,80 (уш.с, 1H).
Пример 7
Синтез 4-бензил-4-гидрокси-2-гидроксииминоглутаровой кислоты
После растворения 16,23 г гидроксида калия (85% мас. чистоты) в 45 мл воды к полученному раствору добавляют 5,0 г (30,5 ммоль) фенилпировиноградной кислоты и 12,1 г (91,4 ммоль) щавелево-уксусной кислоты для взаимодействия при температуре окружающей среды в течение 24 ч (pH около 13 в начале реакции). К реакционному раствору добавляют 8,5 г (121,8 ммоль) соли - гидрохлорида гидроксиламина - для взаимодействия при температуре окружающей среды в течение 72 ч. Доводят рН реакционного раствора до 2,6 6н. соляной кислотой и затем экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом магния и упаривают досуха. Полученный остаток перекристаллизовывают из 20 мл этилацетата и 80 мл толуола и получают 4,0 г (15,1 ммоль) 4-бензил-4-гидрокси-2-гидроксииминоглутаровой кислоты.
ЯМР данные
1H-ЯМР (ДМСО-d6) δ: 2,80 (д, J=13,9 Гц, 1H), 2,99 (д, J=12,7 Гц, 1H), 3,01 (д, J=13,9 Гц, 1H), 3,03 (д, J=12,7 Гц, 1H), 7,13-7,25 (м, 5H).
Определение молекулярной массы
Вычисленное значение(МС-ESI) C12H13NO6 = 267,24
Найденное значение= 266,12 (MH-)
Пример 8
Синтез 4-гидрокси-4-(3-индолилметил)-2-аминоглутаровой кислоты (монатин); №. 1
Аммониевую соль 4-гидрокси-4-(3-индолилметил)-2-гидроксииминоглутаровой кислоты (0,13 г, 0,38 ммоль) растворяют в 5 мл водного 28% аммиака, к полученному раствору добавляют 0,09 г 5% родия на угле для взаимодействия при температуре окружающей среды и давлении водорода 7,5 атм. Через 14 ч катализатор отфильтровывают, полученный раствор упаривают досуха и получают смесь 0,075 г (0,23 ммоль) аммониевой соли (2S,4S)/(2R,4R)-4-гидрокси-4-(3-индолилметил)-2-аминоглутаровой кислоты (монатина) и 0,036 г (0,11 ммоль) аммониевой соли (2S,4R)/(2R,4S)-4-гидрокси-4-(3-индолилметил)-2-аминоглутаровой кислоты (монатин).
ЯМР данные
1H-ЯМР (D2O) δ: 2,05 (дд, J=12,2, 15,1 Гц, 0,67H), 2,21 (дд, J=9,9, 15,6 Гц, 0,33H), 2,48 (дд, J=3,2, 15,6 Гц, 0,33H), 2,68 (дд, J=2,2, 15,1 Гц, 0,67H), 3,08 (д, J=14,4 Гц, 0,67H), 3,17-3,25 (м, 0,66H), 3,28 (д, J=14,4 Гц, 0,67H), 3,63 (дд, J=2,2, 12,2 Гц, 0,67H), 3,98 (дд, J=3,2, 9,9 Гц, 0,33H), 7,12-7,18 (м, 1H), 7,19-7,26 (м, 2H), 7,45-7,51 (м, 1H), 7,70-7,76 (м, 1H).
Определение молекулярной массы
Вычисленное значение(МС-ESI)C14H16N2O5 = 292,29
Найденное значение = 291,28 (MH-)
Пример 9
Синтез 4-гидрокси-4-(3-индолилметил)-2-аминоглутаровой кислоты (монатин); №. 2
4-Гидрокси-4-(3-индолилметил)-2-метоксииминоглутаровую кислоту (0,264 г, 0,824 ммоль) растворяют в 10 мл водного 28% аммиака. Прибавляют 0,18 г 5% родия на угле (сухой продукт) и смесь перемешивают в течение 18 ч при давлении водорода 7,5 атм. Катализатор отфильтровывают, растворитель отгоняют при пониженном давлении, получают остаток. Полученный остаток исследуют (анализируют) методом ЯМР и обнаруживают, что образуется смесь 0,115 г (0,395 ммоль; выход 48%) (2S,4S)/(2R,4R)-4-гидрокси-4-(3-индолилметил)-2-аминоглутаровой кислоты (монатина) и 0,065 г (0,223 ммоль; выход 27%) (2S,4R)/(2R,4S)-4-гидрокси-4-(3-индолилметил)-2-аминоглутаровой кислоты.
Пример 10
Синтез 4-гидрокси-4-(3-индолилметил)-2-аминоглутаровой кислоты (монатина); №. 3
4-Гидрокси-4-(3-индолилметил)-2-гидроксииминоглутарат аммония (1,0 г; 2,94 ммоль) растворяют в 10 мл воды, к полученному раствору добавляют с помощью шприца 1 мл катализатора "никель Ренея" (производимого Kawaken Fine Chemicals Co., Ltd.; активный никелевый катализатор NDHT-90) и смесь перемешивают в течение 10 ч при давлении водорода 20 атм. Катализатор отфильтровывают и образовавшийся раствор упаривают, получая остаток. Полученный остаток анализируют методом ЯМР. Показано, что образуется 0,29 г (0,89 ммоль; выход 30%) (2S,4S)/(2R,4R)-4-гидрокси-4-(3-индолилметил)-2-аминоглутаровой кислоты (монатина) и 0,29 г (0,89 ммоль; выход 30%) (2S,4R)/(2R,4S)-4-гидрокси-4-(3-индолилметил)-2-аминоглутаровой кислоты.
Пример 11
Синтез 2-амино-4-бензил-4-гидроксиглутаровой кислоты; №.1
4-Бензил-4-гидрокси-2-гидроксииминоглутаровую кислоту (0,25 г; 0,94 ммоль) растворяют в 10 мл водного 50% раствора метанола, к которому добавляют 0,5 мл водного 28% раствора аммиака. Добавляют 1,0 г 5% палладия на угле (50% водный продукт) для реакции при температуре окружающей среды и давлении водорода 7,7 атмосфер. Через 72 ч катализатор отфильтровывают, реакционный раствор упаривают досуха и получают смесь 0,10 г (0,35 ммоль) аммониевой соли (2S,4S)/(2R,4R)-2-амино-4-бензил-4-гидроксиглутаровой кислоты и 0,10 г (0,35 ммоль) аммониевой соли (2R,4S)/(2S,4R)-2-амино-4-бензил-4-гидроксиглутаровой кислоты.
ЯМР данные
1H-ЯМР (D2O) δ: 1,94 (дд, J=11,9, 15,3 Гц, 0,5H), 2,10 (дд, J=10,2, 15,3 Гц, 0,5H), 2,36 (дд, J=3,1, 15,3 Гц, 0,5H), 2,56 (дд, J=2,4, 15,3 Гц, 0,5H), 2,81 (д, J=13,6 Гц, 0,5H), 2,94 (д, J=13,5 Гц, 0,5H), 3,01 (д, J=13,5 Гц, 0,5H), 3,06 (д, J=13,6 Гц, 0,5H), 3,55 (дд, J=2,4, 11,9 Гц, 0,5H), 3,88 (дд, J=3,1, 10,2 Гц, 0,5H), 7,17-7,31 (м, 5H).
Определение молекулярной массы
Вычисленное значение (МС-ESI) C12H15NO5 = 253.26
Найденное значение = 252,23 (MH-)
Пример 12
Синтез 2-амино-4-бензил-4-гидроксиглутаровой кислоты; №.2
4-Бензил-4-гидрокси-2-кетоглутаровую кислоту (0,13 г, 0,52 ммоль) и 0,11 мл (1,0 ммоль) бензиламина растворяют в 5 мл метанола, к которому добавляют 0,1 г 5% палладия на угле (50% водный продукт) для взаимодействия в атмосфере водорода при температуре окружающей среды и атмосферном давлении. Через два дня катализатор отфильтровывают, реакционный раствор упаривают досуха и получают смесь 0,03 г (0,12 ммоль) (2S,4S)/(2R,4R)-2-амино-4-бензил-4-гидроксиглутаровой кислоты и 0,06 г (0,24 ммоль) (2R,4S)/(2S,4R)-2-амино-4-бензил-4-гидроксиглутаровой кислоты.
Пример 13
Синтез 4-гидрокси-4-(4-гидроксифенилметил)-2-гидроксииминоглутаровой кислоты
К 10 мл воды, в которой растворены 3,18 г гидроксида калия, добавляют 1,0 г (5,55 ммоль) 4-гидроксифенилпировиноградной кислоты и 2,2 г (16,7 ммоль) щавелево-уксусной кислоты для взаимодействия при температуре окружающей среды в течение 72 ч (рН составляет примерно 13 в начале реакции). Гидрохлорид гидроксиламина (1,54 г, 22,2 ммоль) прибавляют к реакционному раствору для взаимодействия при температуре окружающей среды в течение 10 ч. Затем доводят рН реакционного раствора до 2,6 6н. раствором соляной кислоты для экстракции этилацетатом. Органический слой промывают насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом магния и упаривают досуха, получая 0,7 г (2,47 ммоль) 4-гидрокси-4-(4-гидроксифенилметил)-2-гидроксииминоглутаровой кислоты в виде неочищенного продукта. Далее неочищенный продукт перекристаллизовывают из метанола и толуола и получают 0,22 г (0,78 ммоль) 4-гидрокси-4-(4-гидроксифенилметил)-2-гидроксииминоглутаровую кислоту в виде кристаллов.
ЯМР данные
1H-ЯМР (ДМСО-d6) δ: 2,67 (д, J=13,7 Гц, 1H), 2,89 (д, J=13,7 Гц, 1H), 2,95 (д, J=12,5 Гц, 1H), 2,99 (д, J=12,5 Гц, 1H), 6,59 (д, J=8,0 Гц, 2H), 6,97 (д, J=8,0 Гц, 2H), 9,11 (уш.с, 1H).
Определение молекулярной массы
Вычисленное значение (МС-ESI) C12H13NO6 = 283.24
Найденное значение = 281,93 (MH-)
Пример 14
Синтез 4-гидрокси-4-(4-гидроксифенилметил)-2-гидроксииминоглутаровой кислоты
В 2,5 мл водного 28% аммиака растворяют 0,06 г (0,21 ммоль) 4-гидрокси-4-(4-гидроксифенилметил)-2-гидроксииминоглутаровой кислоты, к полученному раствору добавляют 0,04 г 5% родия на угле для реакции при температуре окружающей среды и давлении водорода 7,5 атмосфер. Через 14 ч катализатор отфильтровывают, полученный раствор упаривают досуха и получают смесь 0,044 г (0,145 ммоль) (2S,4S)/(2R,4R)-4-гидрокси-4-(4-гидроксифенилметил)-2-аминоглутаровой кислоты и 0,021 г (0,069 ммоль) (2S,4R)/(2R,4S)-4-гидрокси-4-(4-гидроксифенилметил)-2-аминоглутаровой кислоты.
1H-ЯМР (D2O) δ: 1,89 (дд, J=11,9, 15,7 Гц, 0,68H), 2,06 (дд, J=10,2, 15,0 Гц, 0,32H), 2,30 (дд, J=3,3, 15,0 Гц, 0,32H), 2,51 (дд, J=2,4, 15,7 Гц, 0,68H), 2,70 (д, J=13,4 Гц, 0,68H), 2,83 (д, J=13,4 Гц, 0,32H), 2,90 (д, J=13,4 Гц, 0,32H), 2,96 (д, J=13,4 Гц, 0,68 H), 3,52 (дд, J=2,4, 11,9 Гц, 0,68H), 3,84 (дд, J=3,3, 10,2 Гц, 0,32H), 6,71-6,77 (м, 2H), 7,02-7,08 (м, 2H).
Определение молекулярной массы
Вычисленное значение (МС-ESI)C12H15NO6 = 269,26
Найденное значение = 268,11 (MH-)
Пример 15
Синтез 4-гидрокси-4-(3-индолилметил)-2-кетоглутаровой кислоты; №. 4
Индолпировиноградную кислоту (12,30 г, 58,7 ммоль) (97,0% мас. чистоты) добавляют к 209 мл воды, содержащей 2,45 г растворенного гидроксида натрия, и растворяют. К полученному раствору добавляют в течение 2 часов 47,61 г водного 25% мас. раствора гидроксида натрия и смесь 25,85 г (293,5 ммоль) пировиноградной кислоты и 25,85 г воды в атмосфере азота при 35°C, поддерживая рН 11,0 в реакционной смеси. Затем реакционную систему перемешивают в течение 14 ч. Таким путем получают реакционный раствор, который содержит 4-гидрокси-4-(3-индолилметил)-2-кетоглутаровую кислоту (выход 44,1%, в расчете на индолпировиноградную кислоту). К раствору добавляют 3,60 г 1н. соляной кислоты для нейтрализации (pH 6,91) и получают 275 мл нейтрализованного реакционного раствора.
Часть (168 мл) полученного таким образом нейтрализованного реакционного раствора пропускают через колонку со смолой (диаметром 4,8 см), заполненной 840 мл синтетического адсорбента (DIAION-SP207, выпускаемого Mitsubishi Chemical Corporation). Затем через колонку пропускают чистую воду со скоростью 23,5 мл в минуту, собирая от 1,7 до 2,9 L/L-R, и получают 4-гидрокси-4-(3-индолилметил)-2-кетоглутаровую кислоту высокой чистоты с выходом 66,3%.
ЯМР спектр
1H-ЯМР (400 МГц, D2O): δ 3,03 (д, 1H, J=14,6 Гц), 3,11 (д, 1H, J=14,6 Гц), 3,21 (д, 1H, J=18,1 Гц), 3,40 (д, 1H, J=18,1 Гц), 7,06-7,15 (м, 3H), 7,39 (д, 1H, J=7,8 Гц), 7,66 (д, 1H, J=7,8 Гц).
13C-ЯМР (400 МГц, D2O): δ 35,43, 47,91, 77,28, 109,49, 112,05, 119,44, 119,67, 121,91, 125,42, 128,41, 136,21, 169,78, 181,43, 203,58.
Масс-спектрометрический анализ
Вычисленное значение(МС-ESI)C14H13NO6 = 291,07
Найденное значение = 290,02 (MH-)
Пример 16
Синтез 4-гидрокси-4-(3-индолилметил)-2-гидроксииминоглутаровой кислоты; №. 2
После добавления 1,0 г (4,92 ммоль) индол-3-пировиноградной кислоты в 10 мл насыщенного водного раствора карбоната натрия и ее растворения, доводят рН полученного раствора до 12,55 с помощью водного 25% раствора гидроксида натрия. Затем прибавляют 1,3 г (14,8 ммоль) пировиноградной кислоты и доводят рН полученного раствора до 12,6 с помощью водного 25% раствора гидроксида натрия для взаимодействия при температуре окружающей среды в течение 2 ч и получают реакционный раствор, содержащий 4-гдрокси-4-(3-индолилметил)-2-кетоглутаровую кислоту. Гидрохлорид гидроксиламина (1,37 г, 19,7 ммоль) прибавляют к реакционному раствору, в то время как рН реакционного раствора доводят до значения, близкого к нейтральному, с помощью водного 25% раствора гидроксида натрия и затем перемешивают при температуре окружающей среды в течение 4 ч. Концентрированной соляной кислотой доводят рН реакционного раствора до кислого значения для экстракции органического вещества этилацетатом. Органический слой промывают насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом магния, затем упаривают, получая остаток. Полученный остаток перекристаллизовывают в водном 28% аммиаке и этаноле и получают 0,52 г (1,5 ммоль) кристаллической 4-гидрокси-4-(3-индолилметил)-2-гидроксииминоглутаровой кислоты (выход 31% по индол-3-пировиноградной кислоте).
ЯМР спектр
1H-ЯМР (ДМСО-d6) δ: 2,66 (c, 2H), 2,89 (д, J=14,4 Гц, 1H), 3,04 (д, J=14,4 Гц, 1H), 6,89-6,94 (м, 1H), 6,97-7,03 (м, 1H), 7,11 (д, J=2,8 Гц, 1H), 7,27 (д, J=7,8 Гц, 1H), 7,53 (д, J=7,8 Гц, 1H), 10,71 (уш.с, 1H).
МС - анализ
Вычисленное значение(МС-ESI)C14H14N2O6 = 306.28
Найденное значение = 305,17 (MH-)
Пример 17
Синтез 4-гидрокси-4-(3-индолилметил)-2-гидроксииминоглутаровой кислоты; №. 3
После добавления 10,0 г (49,2 ммоль) индол-3-пировиноградной кислоты в 98 мл насыщенного водного раствора карбоната натрия и ее растворения, доводят рН полученного раствора до 12,4 с помощью водного 25% раствора гидроксида натрия. Затем прибавляют 16,3 г (147,6 ммоль) пирувата натрия для взаимодействия при температуре окружающей среды в течение 2 ч и получают реакционный раствор, содержащий 4-гидрокси-4-(3-индолилметил)-2-кетоглутаровую кислоту. Гидрохлорид гидроксиламина (13,7 г (197 ммоль)) прибавляют к реакционному раствору, в то время как рН реакционного раствора доводят до значения, близкого к нейтральному, с помощью водного 25% раствора гидроксида натрия и затем перемешивают при температуре окружающей среды в течение 4 ч. С помощью концентрированной соляной кислоты доводят рН реакционного раствора до кислого значения для экстракции органического вещества этилацетатом. Органический слой промывают насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом магния, затем упаривают, получая остаток. Полученный остаток перекристаллизовывают из водного 28% аммиака и этанола и получают 5,51 г (16,2 ммоль) кристаллической 4-гидрокси-4-(3-индолилметил)-2-гидроксииминоглутаровой кислоты (выход 32% по индол-3-пировиноградной кислоте).
Пример 18
После добавления 1,0 г (4,92 ммоль) индол-3-пировиноградной кислоты в 10 мл насыщенного водного раствора карбоната натрия и ее растворения таким же образом, как в примере 16, доводят рН полученного раствора до 12,7 с помощью водного 25% раствора гидроксида натрия. Затем добавляют 1,3 г (14,8 ммоль) пировиноградной кислоты и доводят рН полученного раствора до 10,0 с помощью водного 25% раствора гидроксида натрия для взаимодействия при температуре окружающей среды в течение 6 ч. Гидрохлорид гидроксиламина (1,37 г, 19,7 ммоль) прибавляют к реакционному раствору, в то время как рН реакционного раствора доводят до значения, близкого к нейтральному, с помощью водного 25% раствора гидроксида натрия и затем перемешивают при температуре окружающей среды в течение 13 ч. Концентрированной соляной кислотой доводят рН реакционного раствора до кислого значения для экстракции органического вещества этилацетатом. Органический слой промывают насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом магния, затем упаривают и получают остаток. Полученный остаток анализируют ВЭЖХ, которой показывают, что образовалась 4-гидрокси-4-(3-индолилметил)-2-гидроксииминоглутаровая кислота с выходом около 14%.
Пример 19
Синтез 4-гидрокси-4-(3-индолилметил)-2-гидроксииминоглутаровой кислоты; №. 4
Индол-3-пировиноградную кислоту (73,8 г, 352 ммоль) добавляют в 917 г водного 1,6% (масс) раствора гидроксида натрия и растворяют в нем. Температуру полученного раствора доводят до 35°C и добавляют по каплям 310,2 г (1761 ммоль) водного 50% раствора пировиноградной кислоты в течение 2 ч, в то время как рН реакционного раствора поддерживают равным 11,1 с помощью водного 30% раствора гидроксида натрия. После взаимодействия в течение еще 4,5 ч, получают реакционный раствор, содержащий 4-гидрокси-4-(3-индолилметил)-2-кетоглутаровую кислоту. Водный 40% раствор гидрохлорида гидроксиламина (367,2 г, 2114 ммоль) добавляют к реакционному раствору, в то время как рН реакционного раствора поддерживают равным 7 с помощью водного 30% раствора гидроксида натрия, и перемешивают при 5°C в течение 17,5 ч. Концентрированной соляной кислотой доводят рН реакционного раствора до 2, чтобы экстрагировать органическое вещество этилацетатом. Органический слой промывают насыщенным водным раствором хлорида натрия, затем упаривают, получая остаток. Полученный остаток перекристаллизовывают в 60 мл водного 28% аммиака и 1350 мл 2-пропанола и получают 43,4 г (142 ммоль) кристаллов диаммониевой соли 4-гидрокси-4-(3-индолилметил)-2-гидроксииминоглутаровой кислоты (выход 40% по индол-3-пировиноградной кислоте).
Пример 20
Получение соли (R)-(+)-1-фенилэтиламина и (4S)-4-гидрокси-4-(3-индолилметил)-2-гидроксииминоглутаровой кислоты
После растворения 44,7 г (0,131 моль) аммониевой соли 4-гидрокси-4-(3-индолилметил)-2-гидроксииминоглутаровой кислоты в 500 мл воды при 25°C, рН полученного раствора доводят до 2 36%-ной соляной кислотой (25,5 г). Кислый раствор экстрагируют 1300 мл этилацетата и полученный этилацетатный раствор промывают 200 мл насыщенного водного раствора хлорида натрия. К полученному этилацетатному раствору добавляют 500 мл водного раствора карбоната натрия (13,9 г, 0,131 моль карбоната натрия) для перемешивания, чтобы отделить водный щелочной раствор от этилацетата. К полученному водному щелочному раствору прибавляют 23,1 г 36% соляной кислоты, чтобы довести рН раствора до 2. К полученному водному кислому раствору по каплям прибавляют 6,99 г (57,6 ммоль) (R)-(+)-1-фенилэтиламина и раствор перемешивают при 25°C в течение 1 ч. Образовавшиеся кристаллы отфильтровывают, сушат при пониженном давлении и получают 21,8 г (47,8 ммоль) соли (R)-(+)-1-фенилэтиламина и (4S)-4-гидрокси-4-(3-индолилметил)-2-гидроксииминоглутаровой кислоты. (Выход 72,7%; оптическая чистота 87,4%).
1H-ЯМР (400 МГц, ДМСО-d6) δ: 1,48 (д, 3H, J=6,8 Гц), 2,63 (д, 1H, J=14,0 Гц), 2,70 (д, 1H, J=14,0 Гц), 2,90 (д, 1H, J=14,1 Гц), 3,06 (д, 1H, J=14,1 Гц), 4,40 (кв, 1H, J=6,8 Гц), 6,91-7,54 (м, 10H).
Пример 21
Получение соли (S)-(-)-1-фенилэтиламина и (4R)-4-гидрокси-4-(3-индолилметил)-2-гидроксииминоглутаровой кислоты
(S)(-)-1-Фенилэтиламин (7,12 г, 58,7 ммоль) добавляют по каплям к раствору из примера 20 (остающемуся после того, как отфильтровывают кристаллы), и смесь перемешивают при 25°C в течение 1 ч. Образовавшиеся кристаллы отфильтровывают, сушат при пониженном давлении и получают 23,8 г (53,3 моль) соли (S)(-)-1-фенилэтиламина с (4R)-4-гидрокси-4-(3-индолилметил)-2-гидроксииминоглутаровой кислотой. (Выход 81,1%; оптическая чистота 92,1%.)
Пример 22
Получение аммониевой соли (4S)-4-гидрокси-4-(3-индолилметил)-2-гидроксииминоглутаровой кислоты
Воду (200 мл) и водный 28% аммиак (18,5 г) прибавляют к 21,8 г (51,0 ммоль) соли (R)-(+)-1-фенилэтиламина и (4S)-4-гидрокси-4-(3-индолилметил)-2-гидроксииминоглутаровой кислоты при 25°C, чтобы растворить указанную соль, затем прибавляют 200 мл толуола и перемешивают. Водный слой, полученный при разделении образовавшихся слоев, нагревают до 60°C. К полученному водному раствору прибавляют по каплям 900 мл 2-пропанола за 2 ч. После охлаждения водного 2-пропанольного раствора до 10°С за 5 ч раствор перемешивают при 10°С в течение 10 ч. Образовавшиеся кристаллы отфильтровывают, сушат при пониженном давлении и получают 14,75 г аммониевой соли (4S)-4-гидрокси-4-(3-индолилметил)-2-гидроксииминоглутаровой кислоты. (Выход 85,1%; оптическая чистота 99,0%.)
Температура плавления 205°C (с разложением)
Удельное вращение [α]20 D + 13.4 (c=1,00, H2O)
Пример 23
Получение аммониевой соли (4R)-4-гидрокси-4-(3-индолилметил)-2-гидроксииминоглутаровой кислоты
Таким же образом, как в примере, описанном выше, 16,2 г аммониевой соли (4R)-4-гидрокси-4-(3-индолилметил)-2-гидроксииминоглутаровой кислоты выделяют из 23,8 г (53,3 ммоль) соли (S)-(-)-1-фенилэтиламина и (4R)-4-гидрокси-4-(3-индолилметил)-2-гидроксииминоглутаровой кислоты. (Выход 89,3%; оптическая чистота 99,9%.)
Удельное вращение [α]20 D - 13.6 (c = 1,00, H2O)
Пример 24
Получение (2S,4S) монатина
Аммониевую соль (4S)-4-гидрокси-4-(3-индолилметил)-2-гидроксииминоглутаровой кислоты (4,5 г, 13,1 ммоль) растворяют в 100 мл водного 28% аммиака, затем добавляют 3,4 г 5% родия на угле (50% водный продукт) для взаимодействия при температуре окружающей среды и давлении водорода 10 атмосфер (1 МПа). Через 24 ч, катализатор отфильтровывают. Фильтрат концентрируют. К концентрату добавляют 40 мл водного 90% этанола и перемешивают при 25°C в течение 1,5 ч. Выпавшие в осадок неочищенные кристаллы отфильтровывают. К неочищенным кристаллам прибавляют 40 мл водного 90% этанола и перемешивают при 25°C в течение 1,5 ч. Выпавшие в осадок очищенные кристаллы отфильтровывают, сушат при пониженном давлении и получают 0,57 г (1,84 ммоль) аммониевой соли (2S,4S) монатина. (Выход 14,1%; оптическая чистота 99,5%).
1H-ЯМР (400 МГц, D2O) δ: 2,06 (дд, J=11,8, 15,3 Гц, 1H), 2,67 (дд, J=2,0, 15,2 Гц, 1H), 3,08 (д, J=14,4 Гц, 1H), 3,28 (д, J=14,4 Гц, 1H), 3,63 (дд, J=2,2, 12,2 Гц, 1H), 7,12-7,16 (м, 1H), 7,20-7,24 (м, 2H), 7,48-7,49 (м, 1H), 7,71-7,73 (м, 1H).
Вычисленное значение (МС-ESI) C14H16N2O5 = 292,29
Найденное значение= 291,28 (MH-)
Пример 25
Получение аммониевой соли (2S,4S) монатина
Аммониевую соль (4S)-4-гидрокси-4-(3-индолилметил)-2-гидроксииминоглутаровой кислоты (14,0 г, 41,1 ммоль) растворяют в 120 мл водного 28% аммиака, затем добавляют 7,38 г 5% родия на угле (50% водный продукт) для взаимодействия при температуре окружающей среды и давлении водорода 1 МПа. Через 24 ч катализатор отфильтровывают. Фильтрат концентрируют. К 17,68 г концентрата добавляют 110 мл водного 88% этанола и перемешивают при 25°C в течение 19 ч. Образовавшиеся неочищенные кристаллы отфильтровывают и растворяют в 15 мл воды, затем добавляют 100 мл этанола. После перемешивания при 25°С в течение 1,5 ч выпавшие в осадок очищенные кристаллы отфильтровывают, сушат при пониженном давлении и получают 4,94 г (16,0 ммоль) аммониевой соли (2S,4S) монатина. (Выход 39,2%; оптическая чистота 99,9%.)
Пример26
Получение (2S,4S) монатина в свободной форме
Аммониевую соль (2S,4S) монатина (2,22 г, 7,18 ммоль), полученную в описанном выше примере, растворяют в смешанном растворителе (4,5 мл воды и 4,2 мл (71,8 ммоль) уксусной кислоты), затем к полученному раствору по каплям добавляют 50 мл этанола при 25°C за примерно 3 ч. После дополнительного перемешивания в течение 0,5 ч образовавшиеся кристаллы отфильтровывают, сушат при пониженном давлении и получают 1,93 г (6,62 ммоль) (2S,4S) монатина. (Выход 92,2%; содержание аммония 0,19% масс).
Сравнительный пример1
Применяя цинхонидин вместо оптически активного амина, используемого в примере 20, осуществляют те же методики. Оптическая чистота полученных кристаллов составляет 0%.
Сравнительный пример 2
Вместо оптически активного амина, используемого в примере 20, применяют L-лизин. Однако никаких кристаллов не получают.
Сравнительный пример 3
Вместо оптически активного амина, используемого в примере 20, применяют L-аргинин. Однако никаких кристаллов не получают.
Промышленная применимость
Согласно данному изобретению производные глутаминовой кислоты, обычно включающие монатин, применимы в качестве подсластителя или промежуточного соединения для производства фармацевтических продуктов и могут быть эффективно получены в промышленности. В соответствии с данным изобретением оптически активный монатин, кроме того, может быть получен в промышленности.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВАЯ АЛЬДОЛАЗА И СПОСОБ ПОЛУЧЕНИЯ ОПТИЧЕСКИ АКТИВНЫХ IHOG И МОНАТИНА | 2005 |
|
RU2313579C2 |
| СПОСОБ ПОЛУЧЕНИЯ МОНАТИНА | 2005 |
|
RU2351587C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНОГО ГЛУТАМИНОВОЙ КИСЛОТЫ И ПРОИЗВОДНОГО ПИРОГЛУТАМИНОВОЙ КИСЛОТЫ И НОВОЕ ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ ДЛЯ ПОЛУЧЕНИЯ ЭТИХ ПРОИЗВОДНЫХ | 2003 |
|
RU2342360C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНОГО БЕНЗОКСАЗИНА, СПОСОБЫ ПОЛУЧЕНИЯ ЕГО ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ | 2000 |
|
RU2258069C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНОГО ГЛЮТАМАТА (ВАРИАНТЫ) И СПОСОБ ПОЛУЧЕНИЯ МОНАТИНА | 2002 |
|
RU2280078C2 |
| НОВАЯ АЛЬДОЛАЗА И СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ α-КЕТОКИСЛОТ | 2003 |
|
RU2307871C2 |
| СПОСОБ ПОЛУЧЕНИЯ ИНДОЛ-3-ПИРОВИНОГРАДНОЙ КИСЛОТЫ И ЕЕ ПРОИЗВОДНЫХ | 2006 |
|
RU2325442C2 |
| СПОСОБЫ ДИАСТЕРЕОСЕЛЕКТИВНОГО СИНТЕЗА НУКЛЕОЗИДОВ, ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ, СПОСОБЫ ПОЛУЧЕНИЯ ПРОМЕЖУТОЧНЫХ СОЕДИНЕНИЙ | 1992 |
|
RU2140925C1 |
| СПОСОБЫ И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ | 2010 |
|
RU2531588C2 |
| ПРОМЕЖУТОЧНЫЕ ПРОДУКТЫ ДЛЯ ПОЛУСИНТЕЗА ТАКСАНОВ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 1996 |
|
RU2159237C2 |
В настоящем изобретении заявлен способ получения производных глутаминовой кислоты общей формулы (7)
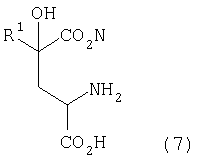
в частности, такого как монатин
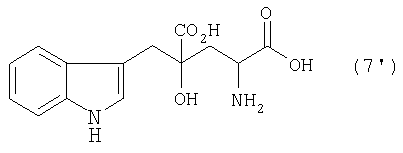
(значения радикалов указаны в описании)
для применения в качестве подсластителей или промежуточных соединений для производства лекарств или им подобных. Также заявлен способ получения промежуточных соединений, используемых в данном способе, включающий новые промежуточные соединения; способ получения оптически активного монатина и промежуточных соединений, используемых в данном способе, с включением новых промежуточных соединений. Конкретно, способ получения производных глутаминовой кислоты или их солей, включая монатин, включает получение производного кетоглутаровой кислоты, служащего в качестве предшественника целевого производного глутаминовой кислоты, перекрестной альдольной конденсацией конкретного производного пировиноградной кислоты с щавелево-уксусной кислотой или пировиноградной кислотой и, если необходимо, декарбоксилированием полученного продукта конденсации, и замену карбонильной группы производного кетоглутаровой кислоты аминогруппой. 10 н. и 14 з.п. ф-лы.
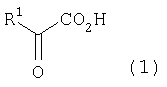
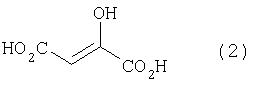
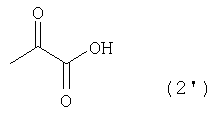
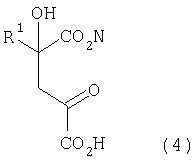
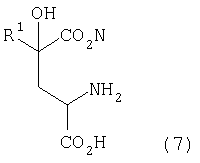
где R1 представляет собой группу, выбранную из низшей(С1-3)алкильной группы, 3-индолильной группы, фенильной группы, фенил(С1-3)алкильной группы или 3-индолил(С1-3)алкильной группы; R1 может иметь, по меньшей мере, один заместитель, выбранный из гидроксильной группы, алкильной группы, содержащей 1-3 атома углерода или аминогруппы.

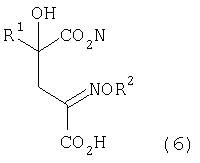
где R1 представляет собой группу, выбранную из низшей(С1-3)алкильной группы, 3-индолильной группы, фенильной группы, фенил(С1-3)алкильной группы или 3-индолил(С1-3)алкильной группы; R2 представляет собой атом водорода, низшую(С1-3)алкильную группу, фенильную группу или фенил(С1-3)алкильную группу; R1 может иметь, по меньшей мере, один заместитель, выбранный из гидроксильной группы, алкильной группы, содержащей от 1 до 3 атомов углерода, или аминогруппы.
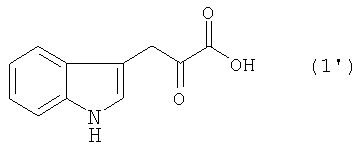
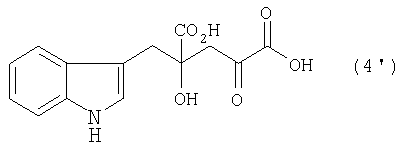
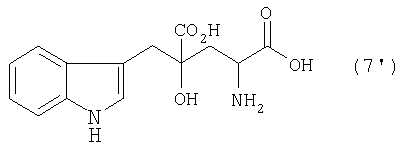

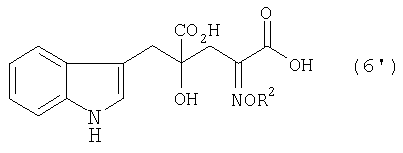
где R2 представляет собой атом водорода, низшую(С1-3)алкильную группу, фенильную группу или фенил(С1-3)алкильную группу.




где R1 представляет собой группу, выбранную из низшей(С1-3)алкильной группы, 3-индолильной группы, фенильной группы, фенил(С1-3)алкильной группы или 3-индолил(С1-3)алкильной группы; и R1 может иметь по меньшей мере один заместитель, выбранный из гидроксильной группы, алкильной группы, содержащей 1-3 атома углерода, или аминогруппы.




где R1 представляет собой группу, выбранную из низшей(С1-3)алкильной группы, 3-индолильной группы, фенильной группы, фенил(С1-3)алкильной группы или 3-индолил(С1-3)алкильной группы; R2 представляет собой атом водорода, низшую(С1-3)алкильную группу, фенильную группу или фенил(С1-3)алкильную группу; и R1 может содержать, по меньшей мере, один заместитель, выбранный из гидроксильной группы, алкильной группы, содержащей от 1 до 3 атомов углерода, или аминогруппы.



где R2 представляет собой атом водорода, низшую(С1-3)алкильную группу, фенильную группу или фенил(С1-3)алкильную группу.


где R1 представляет собой группу, выбранную из низшей(С1-3)алкильной группы, 3-индолильной группы, фенильной группы, фенил(С1-3)алкильной группы или 3-индолил(С1-3)алкильной группы; и R1 может содержать, по меньшей мере, один заместитель, выбранный из гидроксильной группы, алкильной группы, содержащей 1-3 атома углерода, или аминогруппы.






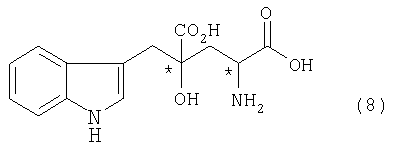
где обозначение * указывает на асимметрический центр и независимо представляет собой R- или S-конфигурацию,
включающий стадию кристаллизации монатина, представленного формулой (13), или его соли с помощью смешанного растворителя, состоящего из воды и спирта
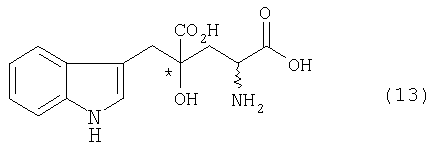
где обозначение * указывает на асимметрический центр и независимо представляет собой R- или S-конфигурацию, а связь, отмеченная волнистой линией, указывает, что включены как R-конфигурация, так и S-конфигурация.

где обозначение * указывает на асимметрический центр и независимо представляет собой R- или S-конфигурацию, а связь, отмеченная волнистой линией, указывает, что включены как R-конфигурация, так и S-конфигурация,
получают способом, включающим стадии a-b:
стадия а: стадия получения соли оптически активного производного глутаровой кислоты, представленной формулой (11)
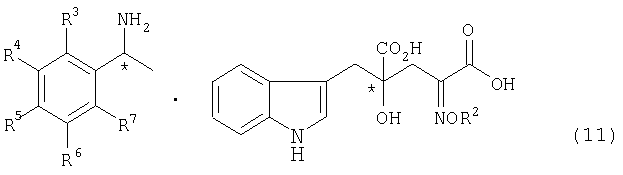
где R2, R3, R4, R5, R6 и R7 обозначают такие заместители, как указано ниже; обозначение * указывает на асимметрический центр и независимо представляет R- или S-конфигурацию,
взаимодействием производного глутаровой кислоты, представленного формулой (9)
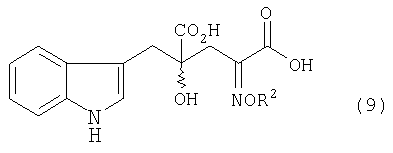
где R2 представляет собой атом водорода, низшую(С1-3)алкильную группу, фенильную группу или фенил(С1-3)алкильную группу, а связь, отмеченная волнистой линией, указывает, что включены как R-конфигурация, так и S-конфигурация,
с оптически активным амином, представленным следующей формулой (10)
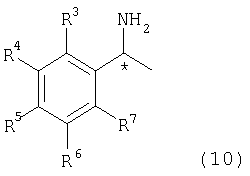
где R3, R4, R5, R6 и R7 независимо представляют собой атом водорода, обозначение * указывает на асимметрический центр и представляет R-конфигурацию или S-конфигурацию,
которое приводит к образованию диастереоизомерной соли, и стадию выделения диастереоизомерной соли кристаллизацией;
стадия b: стадия генерирования монатина формулы (13) или его соли диссоциацией соли оптически активного производного глутаровой кислоты, представленной формулой (11), или обменом соли оптически активного производного глутаровой кислоты с другой солью, что необходимо, чтобы получить оптически активное производное глутаровой кислоты, представленное формулой (12), или его соль (кроме соли оптически активного производного глутаровой кислоты, представленной формулой (11))
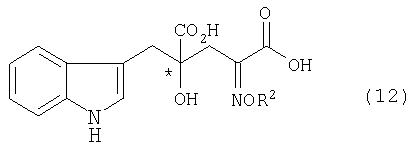
где R2 представляет собой атом водорода, низшую(С1-3)алкильную группу, фенильную группу или фенил(С1-3)алкильную группу, обозначение * указывает на асимметрический центр и независимо представляет R- или S-конфигурацию,
и стадия превращения алкоксииминогруппы или гидроксииминогруппы в аминогруппу.

где обозначение * указывает на асимметрический центр и независимо представляет собой R- или S-конфигурацию, а связь, отмеченная волнистой линией, указывает, что включены как R-конфигурация, так и S-конфигурация,
получают способом, включающим стадию генерирования монатина, представленного формулой (13), или его соли, диссоциацией соли оптически активного производного глутаровой кислоты, представленного ниже формулой (11)

где R2 представляет собой атом водорода, низшую(С1-3)алкильную группу, фенильную группу или фенил(С1-3)алкильную группу; R3, R4, R5, R6 и R7 независимо представляют собой атом водорода; обозначение * указывает на асимметрический центр и независимо представляет R-конфигурацию или S-конфигурацию,
или обменом соли оптически активного производного глутаровой кислоты с другой солью, необходимым, чтобы получить оптически активное производное глутаровой кислоты, представленное формулой (12), или его соль (кроме соли оптически активного производного глутаровой кислоты, представленной формулой (11))

где R представляет собой атом водорода, низшую(С1-3)алкильную группу, фенильную группу или фенил(С1-3)алкильную группу; а обозначение * указывает на асимметрический центр и независимо представляет R-конфигурацию или S-конфигурацию,
и осуществления превращения алкоксииминогруппы или гидроксииминогруппы оптически активного производного глутаровой кислоты в аминогруппу.

где R2 представляет собой атом водорода, низшую(С1-3)алкильную группу, фенильную группу или фенил(С1-3)алкильную группу; R3, R4, R5, R6 и R7 независимо представляют собой атом водорода, а обозначение * указывает на асимметрический центр и независимо представляет R- или S-конфигурацию,
включающий стадию взаимодействия производного глутаровой кислоты, представленного ниже формулой (9)

где R2 представляет собой атом водорода, низшую(С1-3)алкильную группу, фенильную группу или фенил(С1-3)алкильную группу, а связь, отмеченная волнистой линией, означает, что включены как R-конфигурация, так и S-конфигурация,
с оптически активным амином, представленным следующей формулой (10)

где R3, R4, R5, R6 и R7 независимо представляют собой атом водорода, обозначение * указывает на асимметрический центр и представляет R- или S-конфигурацию, которое приводит к образованию диастереоизомерной соли,
и стадию выделения диастереоизомерной соли кристаллизацией.

где R2 представляет собой атом водорода, низшую(С1-3)алкильную группу, фенильную группу или фенил(С1-3)алкильную группу, обозначение * указывает на асимметрический центр и представляет R- или S-конфигурацию,
включающий стадию диссоциации соли оптически активного производного глутаровой кислоты, представленной формулой (11)

где R2 представляет собой атом водорода, низшую(С1-3)алкильную группу, фенильную группу или фенил(С1-3)алкильную группу; R3, R4, R5, R6 и R7 независимо представляют собой атом водорода, а обозначение * указывает на асимметрический центр и независимо представляет R- или S-конфигурацию,
или обмена соли оптически активного производного глутаровой кислоты с другой солью.

где обозначение * указывает на асимметрический центр и представляет R- или S-конфигурацию, а связь, отмеченная волнистой линией, указывает, что включены как R-конфигурация, так и S-конфигурация,
включающий стадию диссоциации соли оптически активного производного глутаровой кислоты, представленной формулой (11)

где R2 представляет собой атом водорода, низшую(С1-3)алкильную группу, фенильную группу или фенил(С1-3)алкильную группу; R3, R4, R5, R6 и R7 независимо представляют атом водорода, а обозначение * указывает на асимметрический центр и независимо представляет R- или S-конфигурацию,
или обменом соли оптически активного производного глутаровой кислоты с другой солью, необходимым для получения оптически активного производного глутаровой кислоты, представленного формулой (12) или его соли (кроме соли оптически активного производного глутаровой кислоты формулы (11))

где R2 представляет атом водорода, низшую(С1-3)алкильную группу, фенильную группу или фенил(С1-3)алкильную группу, обозначение * указывает на асимметрический центр и представляет R- или S-конфигурацию,
и стадию превращения алкоксииминогруппы или гидроксииминогруппы полученного оптически активного производного глутаровой кислоты в аминогруппу.



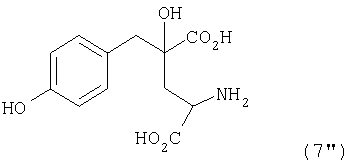


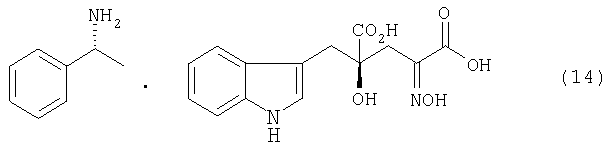
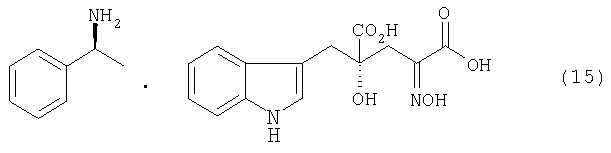
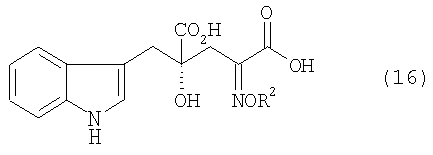
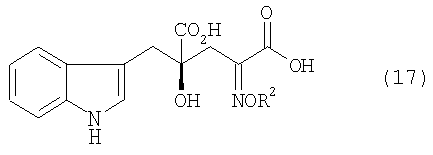
| RU 2002747 C1, 15.11.1993 | |||
| Juhl K | |||
| et al., "Karsten asymmetric homo-aldol reaction of pyruvate - a chiral Lewis acid catalyst that mimics aldolase enzymes", Chem | |||
| Commun., 2000, №22, p.2211, 2212 | |||
| Buldain G | |||
| et al., "Carbon-13 nuclear magnetic resonance spectra of the hydrate, keto and forms of oxalacetic acid", Magnetic resonance in chemistry, |
Авторы
Даты
2007-09-10—Публикация
2002-11-29—Подача