ОБЛАСТЬ ТЕХНИКИ
Данное изобретение относится к альдолазе и способу получения замещенных α-кетокислот и более конкретно к альдолазе, которая может быть выгодным образом использована в синтезе 4-(индол-3-илметил)-4-гидрокси-2-оксоглутарата (далее "IHOG"), который применим в качестве промежуточного продукта в синтезе монатина, и способу получения замещенных α-кетокислот.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
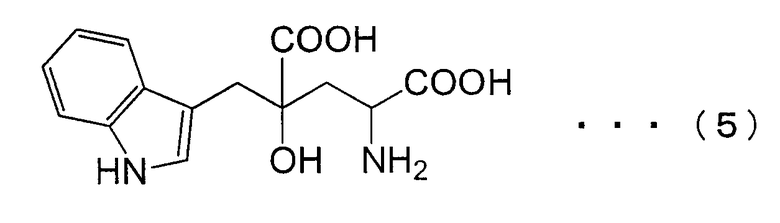
Монатин, который имеет структуру, показанную в формуле (5) ниже, является природной сладкой аминокислотой, которая выделена и экстрагирована из корней кустарников Южной Африки. Он имеет сильный сладкий вкус, в несколько десятков - несколько тысяч раз более сладкий, чем вкус сахарозы, и ожидается, что он может быть использован в качестве подслащивающего вещества. Однако применимость монатина была обнаружена лишь недавно, а способ синтеза монатина на уровне промышленного производства до сих пор не был установлен.
В этих обстоятельствах авторы данного изобретения разработали новый способ получения монатина, предусматривающий две следующие реакции (1) и (2), с использованием индолпировиноградной кислоты и пировиноградной кислоты, которые могут быть получены в качестве реагентов.
(1) Стадия реакции синтеза кетокислоты-предшественника (IHOG) альдольной конденсацией индолпировиноградной кислоты и пировиноградной кислоты (и/или щавелевоуксусной кислоты); и
(2) стадия реакции аминирования второго положения IHOG.

Не было более ранних сообщений о примерах синтеза кетокислоты - предшественника (IHOG) из индолпировиноградной кислоты и пировиноградной кислоты (или щавелевоуксусной кислоты) с использованием ферментной системы микроорганизмов для реакции альдольной конденсации (1) в вышеуказанном пути синтеза монатина.
Примеры ферментов микроорганизмов, которые катализируют альдольную конденсацию с использованием двух молекул α-кетокислоты (или замещенной α-кетокислоты) в качестве субстрата, сообщенные до сих пор, включают 4-гидрокси-4-метил-2-оксоглутаратальдолазу, полученную из бактерий, принадлежащих к роду Pseudomonas, и 4-гидрокси-2-оксоглутаратальдолазу, присутствующую в E. coli, B. subtilis и т.д.
Сообщалось, что первый фермент, 4-гидрокси-4-метил-2-оксоглутаратальдолаза, катализирует реакцию, в которой 4-гидрокси-4-метил-2-оксоглутарат (4-HMG) образуется из двух молекул пировиноградной кислоты, и реакцию, в которой одна молекула щавелевоуксусной кислоты и одна молекула пировиноградной кислоты образуются из оксалоцитрамалата (Kiyofumi Maruyama, Journal of Biochemistry, 108, 327-333 (1990)). Кроме того, известно, что последний фермент, 4-гидрокси-2-оксоглутаратальдолаза, катализирует реакцию, в которой 4-гидрокси-2-оксоглутарат (4HG) образуется из одной молекулы глиоксиловой кислоты и одной молекулы пировиноградной кислоты.
Однако не было сообщений или открытий, указывающих на то, что любой из этих микроорганизмов ассоциирован с активностью, которая расщепляет 4-фенилметил-4-гидрокси-2-оксоглутарат (PHOG), или активностью, которая синтезирует кетокислоту - предшественник (IHOG) монатина из индолпировиноградной кислоты и пировиноградной кислоты (или щавелевоуксусной кислоты), и неизвестно, могут ли или не могут альдолазы, продуцируемые этими штаммами микроорганизмов, быть использованы в вышеуказанном пути синтеза монатина.
Целью данного изобретения является обеспечение альдолазы, которая может быть подходящим образом использована в синтезе IHOG, который применим в качестве промежуточного продукта в синтезе монатина, и способа получения замещенных α-кетокислот.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В результате интенсивного исследования, проводимого в связи с вышеуказанными проблемами, авторы данного изобретения обнаружили, что альдолаза, которая может быть выгодным образом использована в синтезе желаемого IHOG, присутствует в некоторых видах микроорганизмов, что привело к выполнению данного изобретения.
Конкретно данное изобретение описывается ниже.
[1] ДНК согласно (а) или (b):
(а) ДНК, содержащая нуклеотидную последовательность SEQ ID NO:1 или последовательность нуклеотидных оснований с номерами 444-1118 или номерами 456-1118 той же самой последовательности;
(b) ДНК, которая гибридизуется в жестких условиях с ДНК, имеющей нуклеотидную последовательность, комплементарную нуклеотидной последовательности SEQ ID NO:1 или последовательности нуклеотидных оснований с номерами 444-1118 или номерами 456-1118 той же самой последовательности, и кодирует белок, имеющий альдолазную активность.
[2] ДНК согласно (с) или (d):
(с) ДНК, которая кодирует белок, содержащий аминокислотную последовательность SEQ ID NO:2 или последовательность аминокислотных остатков с номерами 5-225 той же самой последовательности;
(d) ДНК, которая кодирует белок, имеющий аминокислотную последовательность, которая содержит замену, делецию, инсерцию, добавление или инверсию одного или нескольких аминокислотных остатков последовательности SEQ ID NO:2 или последовательности аминокислотных остатков с номерами 5-225 той же самой последовательности, и имеет альдолазную активность.
[3] ДНК согласно (е) или (f):
(е) ДНК, содержащая нуклеотидную последовательность SEQ ID NO:15 или последовательность нуклеотидных оснований с номерами 398-1141 той же самой последовательности;
(f) ДНК, которая гибридизуется при жестких условиях с ДНК, имеющей нуклеотидную последовательность, комплементарную нуклеотидной последовательности SEQ ID NO:15 или последовательности нуклеотидных оснований с номерами 398-1141 той же самой последовательности, и кодирует белок, имеющий альдолазную активность.
[4] ДНК согласно (g) или (h):
(g) ДНК, которая кодирует белок, содержащий аминокислотную последовательность SEQ ID NO:16;
(h) ДНК, которая кодирует белок, имеющий аминокислотную последовательность, которая содержит замену, делецию, инсерцию, добавление или инверсию одного или нескольких аминокислотных остатков последовательности SEQ ID NO:16, и имеет альдолазную активность.
[5] Рекомбинантная ДНК, получаемая из лигирования ДНК по любому из [1]-[4] с векторной ДНК.
[6] Клетка, трансформированная рекомбинантной ДНК по [5].
[7] Способ получения белка, имеющего альдолазную активность, предусматривающий культивирование клеток по [6] в среде и накопление белка, имеющего альдолазную активность, либо в среде, либо в клетках, либо и в среде, и в клетках.
[8] Белок согласно (i) или (j):
(i) белок, содержащий аминокислотную последовательность SEQ ID NO:2 или последовательность аминокислотных остатков с номерами 5-225 той же самой последовательности;
(j) белок, который имеет аминокислотную последовательность, которая содержит замену, делецию, инсерцию, добавление или инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO:2 или последовательности аминокислотных остатков с номерами 5-225 той же самой последовательности, и имеет альдолазную активность.
[9] Белок согласно (k) или (l):
(k) белок, содержащий аминокислотную последовательность SEQ ID NO:16;
(l) белок, который имеет аминокислотную последовательность, которая содержит замену, делецию, инсерцию, добавление или инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO:16, и имеет альдолазную активность.
[10] Белок, который:
(А) имеет, по меньшей мере, одну из активностей, которые катализируют реакции, в которых:
4-(индол-3-илметил)-4-гидрокси-2-оксоглутарат образуется альдольной конденсацией индол-3-пировиноградной кислоты и пировиноградной кислоты, и
4-фенилметил-4-гидрокси-2-оксоглутарат образуется альдольной конденсацией фенилпировиноградной кислоты и пировиноградной кислоты; причем
(В) оптимум рН активности согласно (А) равен приблизительно 9 при 33°С, и
(С) молекулярная масса, измеренная гель-фильтрацией, равна приблизительно 146 кДа, а молекулярная масса на субъединицу, измеренная электрофорезом в ДСН-ПААГ, равна приблизительно 25 кДа.
[11] Белок, который:
(А) имеет альдолазную активность,
(В) получен из вида Pseudomonas,
(С) имеет рН-стабильность при рН 6 и выше,
(D) имеет термоустойчивость при 70°С или ниже, и
(Е) имеет молекулярную массу, измеренную гель-фильтрацией, равную приблизительно 146 кДа, и молекулярную массу на субъединицу, измеренную электрофорезом в ДСН-ПААГ, равную приблизительно 25 кДа.
[12] Белок по [11], где альдолазная активность улучшена содержанием неорганического фосфата в реакционной смеси фермента.
[13] Композиция, имеющая альдолазную активность, получаемую из культивирования бактерий вида Pseudomonas в среде, накопления любого из белков по (i)-(l) в среде или клетках или и в среде, и в клетках и очистки либо среды, либо клеток, либо и среды, и клеток:
(i) белок, содержащий аминокислотную последовательность SEQ ID NO:2 или последовательность аминокислотных остатков с номерами 5-225 той же самой последовательности;
(j) белок, который имеет аминокислотную последовательность, которая содержит замену, делецию, инсерцию, добавление или инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO:2 или последовательности аминокислотных остатков с номерами 5-225 той же самой последовательности, и имеет альдолазную активность;
(k) белок, содержащий аминокислотную последовательность SEQ ID NO:16;
(l) белок, который имеет аминокислотную последовательность, которая содержит замену, делецию, инсерцию, добавление или инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO:16, и имеет альдолазную активность.
[14] Способ получения замещенной α-кетокислоты, представленной следующей общей формулой (3):

(где R1 представляет собой атом водорода, алкильную группу, имеющую 1-8 атомов углерода, алкоксильную группу, имеющую 1-8 атомов углерода, карбоксиалкильную группу, имеющую 2-9 атомов углерода, арильную или аралкильную группу, имеющую до 20 атомов углерода, содержащую гетероцикл углеводородную группу, имеющую до 11 атомов углерода, гидроксильную группу или ее сложноэфирное производное, и R1 может быть замещен, по меньшей мере, одним заместителем, выбранным из группы, состоящей из атома галогена, гидроксильной группы, алкильной группы, имеющей до 3 атомов углерода, алкоксигруппы, имеющей до 3 атомов углерода и аминогруппы; и R2 представляет собой атом водорода, алкильную группу, имеющую 1-8 атомов углерода, алкоксильную группу, имеющую 1-8 атомов углерода, карбоксиалкильную группу, имеющую 2-9 атомов углерода, арильную или аралкильную группу, имеющую до 20 атомов углерода, содержащую гетероцикл углеводородную группу, имеющую до 11 атомов углерода, гидроксильную группу или ее сложноэфирное производное, и R2 может быть замещен, по меньшей мере, одним заместителем, выбранным из группы, состоящей из атома галогена, гидроксильной группы, алкильной группы, имеющей до 3 атомов углерода, алкоксигруппы, имеющей до 3 атомов углерода и аминогруппы; и, когда R1 представляет атом водорода, метильную группу или карбоксиметильную группу в общей формуле (1), R2 не представляет собой атом водорода), предусматривающий реакцию замещенной α-кетокислоты, представленной общей формулой (1):

(где R1 имеет то же самое значение, что и R1 в общей формуле (3)), с замещенной α-кетокислотой, представленной общей формулой (2):

(где R2 имеет то же самое значение, что и R2 в общей формуле (3));
где эту реакцию проводят в присутствии белка, который катализирует эту реакцию.
[15] Способ получения замещенной α-кетокислоты по [14], где R2 представляет собой атом водорода или карбоксильную группу.
[16] Способ получения замещенной α-кетокислоты по [15], где R2 представляет собой атом водорода.
[17] Способ получения замещенной α-кетокислоты по [14], где R1 представляет собой бензильную группу или 3-индолилметильную группу, а R2 представляет собой атом водорода или карбоксильную группу.
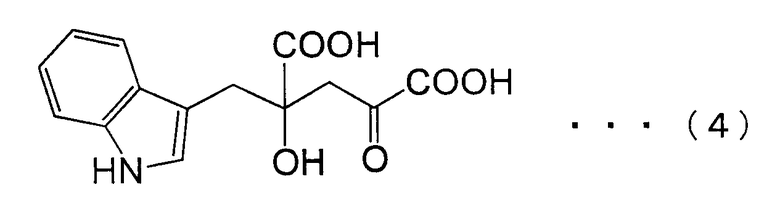
[18] Способ получения замещенной α-кетокислоты, представленной следующей формулой (4):
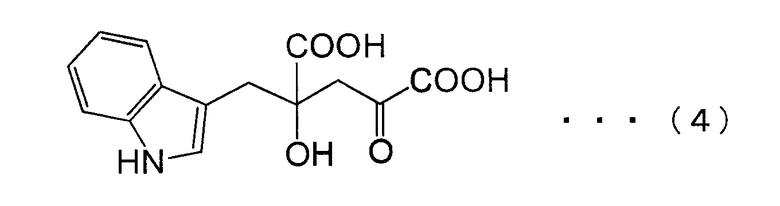
из щавелевоуксусной кислоты или пировиноградной кислоты и индол-3-пировиноградной кислоты, где эту реакцию выполняют в присутствии белка, который катализирует эту реакцию.
[19] Способ получения замещенной α-кетокислоты по [14]-[18], где белок, который катализирует эту реакцию, получен из микроорганизма, выбранного из группы, состоящей из вида Pseudomonas, вида Erwinia, вида Flavobacterium и вида Xanthomonas.
[20] Способ получения замещенной α-кетокислоты по [19], где этим микроорганизмом является Pseudomonas taetrolens, Pseudomonas coronafaciens, Pseudomonas desmolytica, Erwinia sp., Flavobacterium rhenanum или Xanthomonas citri.
[21] Способ получения замещенной α-кетокислоты по [20], где этим микроорганизмом является Pseudomonas taetrolens АТСС4683 или Pseudomonas coronafaciens AJ2791.
[22] Способ получения замещенной α-кетокислоты по [14]-[21], где белок, который катализирует эту реакцию, является белком по любому из следующих (i)-(l):
(i) белок, содержащий аминокислотную последовательность SEQ ID NO:2 или последовательность аминокислотных остатков с номерами 5-225 той же самой последовательности;
(j) белок, который имеет аминокислотную последовательность, которая содержит замену, делецию, инсерцию, добавление или инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO:2 или последовательности аминокислотных остатков с номерами 5-225 той же самой последовательности, и имеет альдолазную активность;
(k) белок, содержащий аминокислотную последовательность SEQ ID NO:16;
(l) белок, который имеет аминокислотную последовательность, которая содержит замену, делецию, инсерцию, добавление или инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO:16, и имеет альдолазную активность.
[23] Способ получения замещенной α-кетокислоты, представленной следующей общей формулой (3'):
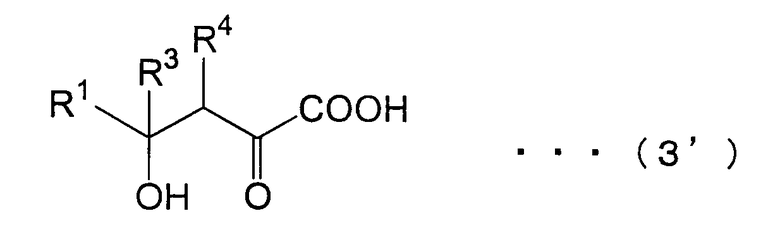
(где R1 представляет собой атом водорода, алкильную группу, имеющую 1-8 атомов углерода, алкоксильную группу, имеющую 1-8 атомов углерода, карбоксиалкильную группу, имеющую 2-9 атомов углерода, арильную или аралкильную группу, имеющую до 20 атомов углерода, содержащую гетероцикл углеводородную группу, имеющую до 11 атомов углерода, гидроксильную группу или ее сложноэфирное производное, R3 представляет собой атом водорода или карбоксильную группу и R1 может быть замещен, по меньшей мере, одним заместителем, выбранным из группы, состоящей из атома галогена, гидроксильной группы, алкильной группы, имеющей до 3 атомов углерода, алкоксигруппы, имеющей до 3 атомов углерода и аминогруппы; и R4 представляет собой атом водорода, алкильную группу, имеющую 1-8 атомов углерода, алкоксильную группу, имеющую 1-8 атомов углерода, карбоксиалкильную группу, имеющую 2-9 атомов углерода, арильную или аралкильную группу, имеющую до 20 атомов углерода, содержащую гетероцикл углеводородную группу, имеющую до 11 атомов углерода, гидроксильную группу или ее сложноэфирное производное, и R4 может быть замещен, по меньшей мере, одним заместителем, выбранным из группы, состоящей из атома галогена, гидроксильной группы, алкильной группы, имеющей до 3 атомов углерода, алкоксигруппы, имеющей до 3 атомов углерода и аминогруппы) предусматривающий реакцию соединения, представленного следующей общей формулой (1'):

(где R1 и R3 имеют значения, определенные в общей формуле (3')), с замещенной α-кетокислотой, представленной следующей общей формулой (2'):
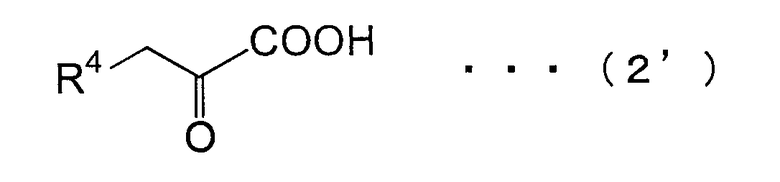
(где R4 имеет значение, определенное в общей формуле (3'));
где эту реакцию выполняют в присутствии белка [8] или [9].
[24] Способ получения замещенной α-кетокислоты [23], где R4 обозначает атом водорода или карбоксильную группу
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг.1 показывает графическое представление процесса получения альдолазы данного изобретения.
Фиг.2 показывает результаты измерения активности альдолазы, полученной из Pseudomonas taetrolens АТСС4683 (PtALD), в зависимости от концентрации PHOG.
Фиг.3 показывает результаты измерения активности альдолазы PtALD в зависимости от концентрации MgCl2.
Фиг.4 показывает результаты измерения активности альдолазы PtALD в зависимости от концентрации KPi.
Фиг.5 показывает результаты измерения рН-стабильности PtALD.
Фиг.6 показывает результаты измерения термоустойчивости PtALD.
НАИЛУЧШИЙ СПОСОБ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Следующее описание дает подробное объяснение [I] альдолазы и [II] способа получения замещенной α-кетокислоты с использованием альдолазы данного изобретения со ссылкой на сопутствующий графический материал.
[I] Альдолаза
В соответствии с исследованием авторов данного изобретения было подтверждено, что существуют бактериальные штаммы, которые образуют альдолазу, имеющую способность расщеплять 4-фенилметил-4-гидрокси-2-оксоглутарат (PHOG), в родах Pseudomonas, Erwinia, Flavobacterium и Xanthomonas.
Поскольку альдолаза, продуцируемая этими микроорганизмами, катализирует реакцию, в которой образуется одна молекула фенилпировиноградной кислоты и одна молекула пировиноградной кислоты расщеплением одной молекулы PHOG, авторы данного изобретения считали, что эта альдолаза могла бы катализировать реакцию, в которой 4-(индол-3-илметил)-4-гидрокси-2-оксоглутарат (IHOG) образуется из индолпировиноградной кислоты и пировиноградной кислоты (или щавелевоуксусной кислоты). На основе этого подхода для выяснения существования новой альдолазы вместе с очисткой и выделением альдолазы из культивируемых клеток этих микроорганизмов авторы данного изобретения обнаружили, что этот фермент синтезирует IHOG альдольной конденсацией индолпировиноградной кислоты и пировиноградной кислоты (или щавелевоуксусной кислоты).
Кроме того, авторы данного изобретения определили аминокислотную последовательность альдолазы очисткой альдолазы, полученной из Pseudomonas taetrolens АТСС4683 (которая может быть сокращенно обозначена в виде PtALD). Кроме того, авторы данного изобретения также синтезировали ДНК-молекулу приблизительно 30 п.н., расшифрованную из аминокислотной последовательности этой альдолазы, выделили и получили фрагмент ДНК, который кодирует альдолазу, при помощи ПЦР с использованием этой ДНК-молекулы, и им удалось выделить полноразмерную ДНК, кодирующую PtALD, из библиотеки хромосомных ДНК этого микроорганизма с использованием указанного ДНК-фрагмента в качестве зонда.
ДНК, кодирующая PtALD данного изобретения, которая идентифицирована в соответствии с вышеуказанным способом, показана в SEQ ID NO:1 в Списке последовательностей. Кроме того, аминокислотная последовательность PtALD, кодируемая нуклеотидной последовательностью SEQ ID NO:1, показана в SEQ ID NO:2 и SEQ ID NO:3. SEQ ID NO:2 является аминокислотной последовательностью PtALD, кодируемой последовательностью нуклеотидных оснований с номерами 456-1118 в нуклеотидной последовательности SEQ ID NO:1. Кроме того, SEQ ID NO:3 является аминокислотной последовательностью PtALD, кодируемой последовательностью нуклеотидных оснований с номерами 444-1118 в нуклеотидной последовательности SEQ ID NO:1, и является эквивалентной последовательности аминокислотных остатков с номерами 5-225 в аминокислотной последовательности SEQ ID NO:2. Как PtALD с SEQ ID NO:2, так и PtALD с SEQ ID NO:3 имеет альдолазную активность и катализирует реакцию, в которой 4-(индол-3-илметил)-4-гидрокси-2-оксоглутарат (IHOG), показанный в следующей формуле (4), синтезируется из одной молекулы индолпировиноградной кислоты и одной молекулы щавелевоуксусной кислоты (или пировиноградной кислоты).
Кроме того, авторам данного изобретения удалось также выделить полноразмерную ДНК, которая кодирует альдолазу, происходящую из Pseudomonas coronafaciens AJ2791 (которая может быть сокращенно обозначена в виде PcALD), из библиотеки хромосомных ДНК этого микроорганизма с использованием полученного ДНК-фрагмента, который кодирует PtALD, в качестве зонда. ДНК, которая кодирует PcALD данного изобретения, идентифицированная в соответствии с вышеуказанным способом, показана в SEQ ID NO:15. Аминокислотная последовательность PcALD, кодируемая нуклеотидной последовательностью SEQ ID NO:15, показана в SEQ ID NO:16. SEQ ID NO:16 является аминокислотной последовательностью PcALD, кодируемой последовательностью нуклеотидных оснований с номерами 398-1141 нуклеотидной последовательности SEQ ID NO:15. PcALD SEQ ID NO:16 также имеет альдолазную активность и катализирует реакцию, в которой 4-(индол-3-илметил)-4-гидрокси-2-оксоглутарат (IHOG), показанный в следующей формуле (4), синтезируется из одной молекулы индолпировиноградной кислоты и одной молекулы щавелевоуксусной кислоты (или пировиноградной кислоты).
Далее дается подробное объяснение (1) ДНК, кодирующей альдолазу, (2) свойств альдолазы и (3) способа получения альдолазы, в указанном порядке.
(1) ДНК, кодирующая альдолазу
Ген альдолазы данного изобретения, имеющий нуклеотидную последовательность SEQ ID NO:1, был выделен из хромосомной ДНК штамма АТСС4683 Pseudomonas taetrolens, как описано выше. Нуклеотидная последовательность SEQ ID NO:1 демонстрирует 29% гомологию с известной альдолазой 4-гидрокси-4-метил-2-оксоглутарата (название гена: proA) (Biosci. Biotechnol. Biochem., 65(12), 2701-2709 (2001), Maruyama, K. et al.), полученной из бактерии Pseudomonas ochraceae на уровне аминокислотной последовательности.
Ген альдолазы данного изобретения, имеющий нуклеотидную последовательность SEQ ID NO:15, был выделен из хромосомной ДНК штамма AJ2791 Pseudomonas coronafaciens, как описано выше. Аминокислотная последовательность, кодируемая нуклеотидной последовательностью SEQ ID NO:15, демонстрирует 28% гомологию с известной альдолазой 4-гидрокси-4-метил-2-оксоглутарата (название гена: proA) (Biosci. Biotechnol. Biochem., 65(12), 2701-2709 (2001), Maruyama, K. et al.), полученной из бактерии, Pseudomonas ochraceae. Кроме того, аминокислотная последовательность, кодируемая нуклеотидной последовательностью SEQ ID NO:15, демонстрирует 41% гомологию с альдолазой, полученной из штамма АТСС4683 Pseudomonas taetrolens, описанной выше.
Здесь анализ гомологии указывает величину, полученную расчетом этого параметра в виде исходной установленной величины с использованием генетического аналитического программного обеспечения "Genetyx Ver. 6" (Genetyx).
Далее приведено объяснение способа получения ДНК, кодирующей альдолазу, из продуцирующих альдолазу бактерий.
Сначала определяют аминокислотную последовательность очищенной альдолазы. В настоящее время аминокислотная последовательность может быть определена с использованием способа Эдмана (Edman, P., Acta Chem. Scand. 4, 227 (1950)). Кроме того, аминокислотная последовательность может быть определена с использованием секвенатора, изготовляемого Applied Biosystems. После ограниченного гидролиза протеазой альдолазы данного изобретения, полученной из штамма АТСС4683 Pseudomonas taetrolens, пептидные фрагменты фракционировали обращенно-фазовой ВЭЖХ. Определение внутренних аминокислотных последовательностей двух из этих фрагментов ясно выявило, что они являются последовательностями, показанными в SEQ ID NO:4 и SEQ ID NO:5.
Затем нуклеотидную последовательность ДНК, которая кодирует эти аминокислотные последовательности, можно расшифровать на основе определенных аминокислотных последовательностей. Для расшифровки нуклеотидной последовательности этой ДНК используют универсальные кодоны.
Затем были синтезированы ДНК-молекулы из приблизительно 30 п.н. на основе этой расшифрованной нуклеотидной последовательности. Способ, используемый для синтеза этих ДНК-молекул, описан в Tetrahedron Letters, 22, 1859 (1981). Кроме того, эти ДНК-молекулы могут быть также синтезированы с использованием секвенатора, изготовляемого Applied Biosystems. Эти ДНК-молекулы могут быть использованы в качестве зонда при выделении полноразмерной ДНК, кодирующей альдолазу, из библиотеки хромосомных ДНК микроорганизма, продуцирующего альдолазу. Альтернативно, они могут быть также использованы в качестве праймера при амплификации ДНК, кодирующей альдолазу данного изобретения, при помощи ПЦР. Однако поскольку ДНК, амплифицированная при помощи ПЦР, не содержит полноразмерную ДНК, кодирующую альдолазу, полноразмерную ДНК, кодирующую альдолазу, выделяют из библиотеки хромосомных ДНК микроорганизма, который продуцирует альдолазу, с использованием ПЦР-амплифицированной ДНК в качестве зонда.
Процедура, используемая для ПЦР, описана в таких публикациях, как White, T.J. et al., Trends Genet. 5, 185 (1989). Способ выделения хромосомной ДНК, а также способ выделения желаемой ДНК-молекулы из библиотеки генов с использованием ДНК-молекулы в качестве зонда описаны в таких публикациях, как Molecular Cloning, 2nd edition, Cold Spring Harbor Press (1989).
Способ определения нуклеотидной последовательности ДНК, кодирующей альдолазу, описан в A Practical Guide to Molecular Cloning, John Wiley & Sons, Inc. (1985). Кроме того, нуклеотидная последовательность может быть определена с использованием ДНК-секвенатора, изготовляемого Applied Biosystems. ДНК, кодирующая альдолазу, полученную из штамма АТСС4683 Pseudomonas taetrolens, показана в SEQ ID NO:1, тогда как ДНК, кодирующая альдолазу, полученную из штамма AJ2791 Pseudomonas coronafaciens, показана в SEQ ID NO:15.
ДНК, кодирующая альдолазу, которая катализирует реакцию, в которой IHOG образуется из индолпировиноградной кислоты и пировиноградной кислоты (или щавелевоуксусной кислоты), является не только ДНК, показанной в SEQ ID NO:1 и SEQ ID NO:15. Это является следствием того, что могут быть различия в нуклеотидных последовательностях, наблюдаемые для каждого вида и штамма среди видов Pseudomonas, которые образуют альдолазу, катализирующую реакцию, в которой IHOG синтезируется из индолпировиноградной кислоты и пировиноградной кислоты (или щавелевоуксусной кислоты).
ДНК данного изобретения включает не только выделенную ДНК, которая кодирует альдолазу, но и ДНК, в которой мутации были искусственно добавлены к ДНК, кодирующей альдолазу, выделенной из хромосомной ДНК продуцирующего альдолазу микроорганизма, также включена в ДНК данного изобретения, если она кодирует альдолазу. Способы искусственного добавления мутаций включают обычно используемые способы, такие как способ введения сайт-специфических мутаций, описанный в Method. in Enzymol., 154 (1987).
ДНК, которая гибридизуется в жестких условиях с ДНК, имеющей нуклеотидную последовательность, комплементарную нуклеотидной последовательности SEQ ID NO:1, и кодирует белок, имеющий альдолазную активность, также включена в ДНК данного изобретения. В данном контексте «жесткие условия» означают условия, при которых образуется специфический гибрид, тогда как неспецифический гибрид не образуется. Хотя трудно точно выразить в цифрах эти условия, можно, например, упомянуть условия, при которых ДНК-молекулы, имеющие более высокую гомологию, например предпочтительно 50% или более, более предпочтительно 80% или более, еще более предпочтительно 90% или более и особенно предпочтительно 95% или более, гибридизуются друг с другом, тогда как ДНК-молекулы, имеющие более низкую гомологию, не гибридизуются друг с другом, или условия, при которых гибридизация имеет место в обычных условиях промывки в гибридизации по Саузерну, т.е. при концентрации соли, соответствующей 0,1×SSC, и 0,1% ДСН при 37°С, предпочтительно 0,1×SSC и 0,1% ДСН при 60°С и более предпочтительно 0,1×SSC и 0,1% ДСН при 65°С. Кроме того, "альдолазная активность" может быть достаточной для активности, которая синтезирует IHOG из индолпировиноградной кислоты и пировиноградной кислоты (или щавелевоуксусной кислоты). Однако в случае нуклеотидной последовательности, которая гибридизуется в жестких условиях с нуклеотидной последовательностью, комплементарной нуклеотидной последовательности SEQ ID NO:1, она предпочтительно сохраняет 10% или более, предпочтительно 30% или более, более предпочтительно 50% или более и еще более предпочтительно 70% или более альдолазной активности белка, имеющего аминокислотную последовательность SEQ ID NO:2 или 3, в условиях 33°С и рН 9.
ДНК, которая гибридизуется в жестких условиях с ДНК, имеющей нуклеотидную последовательность, коплементарную нуклеотидной последовательности SEQ ID NO:15, и кодирует белок, имеющий альдолазную активность, также включена в ДНК данного изобретения. В данном контексте, «жесткие условия» означают условия, при которых образуется специфический гибрид, тогда как неспецифический гибрид не образуется. Хотя трудно точно выразить в цифрах эти условия, можно, например, упомянуть условия, при которых ДНК-молекулы, имеющие более высокую гомологию, например, предпочтительно 50% или более, более предпочтительно 80% или более, еще более предпочтительно 90% или более и особенно предпочтительно 95% или более, гибридизуются друг с другом, тогда как ДНК-молекулы, имеющие более низкую гомологию, не гибридизуются друг с другом, или условия, при которых гибридизация имеет место в обычных условиях промывки в гибридизации по Саузерну, т.е. при концентрации соли, соответствующей 0,1×SSC, и 0,1% ДСН при 37°С, предпочтительно 0,1×SSC и 0,1% ДСН при 60°С и более предпочтительно 0,1×SSC и 0,1% ДСН при 65°С. Кроме того, "альдолазная активность" может быть достаточной для активности, которая синтезирует IHOG из индолпировиноградной кислоты и пировиноградной кислоты (или щавелевоуксусной кислоты). Однако в случае нуклеотидной последовательности, которая гибридизуется в жестких условиях с нуклеотидной последовательностью, комплементарной нуклеотидной последовательности SEQ ID NO:15, она предпочтительно сохраняет 10% или более, предпочтительно 30% или более, более предпочтительно 50% или более и еще более предпочтительно 70% или более альдолазной активности белка, имеющего аминокислотную последовательность SEQ ID NO:16, в условиях 33°С и рН 9.
Кроме того, ДНК, кодирующая белок, который по существу идентичен альдолазе, кодируемой ДНК SEQ ID NO:1 или 15, также включена в ДНК данного изобретения. А именно, следующие ДНК также включены в ДНК данного изобретения:
(а) ДНК, содержащая последовательность нуклеотидных оснований с номерами 444-1118 или 456-1118 в нуклеотидной последовательности SEQ ID NO:1;
(b) ДНК, которая гибридизуется в жестких условиях с ДНК, имеющей нуклеотидную последовательность, комплементарную последовательности нуклеотидных оснований с номерами 444-1118 или 456-1118 в нуклеотидной последовательности SEQ ID NO:1, и кодирует белок, имеющий альдолазную активность;
(с) ДНК, которая кодирует белок, содержащий аминокислотную последовательность SEQ ID NO:2 или последовательность аминокислотных остатков с номерами 5-225 той же самой последовательности;
(d) ДНК, которая кодирует белок, имеющий аминокислотную последовательность, которая содержит замену, делецию, инсерцию, добавление или инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO:2 или последовательности аминокислотных остатков с номерами 5-225 той же самой последовательности, и имеет альдолазную активность;
(е) ДНК, содержащая последовательность нуклеотидных оснований с номерами 398-1141 в нуклеотидной последовательности SEQ ID NO:15;
(f) ДНК, которая гибридизуется в жестких условиях с ДНК, имеющей нуклеотидную последовательность, комплементарную последовательности нуклеотидных оснований с номерами 398-1141 в нуклеотидной последовательности SEQ ID NO:15, и кодирует белок, имеющий альдолазную активность;
(g) ДНК, которая кодирует белок, содержащий аминокислотную последовательность SEQ ID NO:16; и
(h) ДНК, которая кодирует белок, имеющий аминокислотную последовательность, которая содержит замену, делецию, инсерцию, добавление или инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO:16, и имеет альдолазную активность. Здесь «один или несколько» обозначает диапазон, на протяжении которого стерическая структура белка из этих аминокислотных остатков или альдолазная активность не нарушаются значимо, и более конкретно диапазон 1-50, предпочтительно 1-30 и более предпочтительно 1-10 аминокислотных остатков. Кроме того, «альдолазная активность» обозначает активность, которая синтезирует IHOG из индолпировиноградной кислоты и пировиноградной кислоты (или щавелевоуксусной кислоты), как описано выше. Однако в случае аминокислотой последовательности, которая содержит замену, делецию, инсерцию, добавление или инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO:2, 3 или 16, она предпочтительно сохраняет 10% или более, предпочтительно 30% или более, более предпочтительно 50% или более и еще более предпочтительно 70% или более альдолазной активности белка, имеющего аминокислотную последовательность SEQ ID NO:2, 3 или 16, в условиях 33°С и рН 9.
(2) Свойства альдолазы
Далее, обеспечено объяснение свойств очищенной альдолазы, полученной из штамма АТСС4683 Pseudomonas taetrolens (PtALD), и очищенной альдолазы, полученной из штамма AJ2791 Pseudomonas coronafaciens (PcALD).
PtALD данного изобретения имеет аминокислотную последовательность SEQ ID NO:2 или 3, как ясно определено описанным ранее выделением и анализом гена. Однако данное изобретение включает белок, имеющий аминокислотную последовательность, которая содержит замену, делецию, инсерцию, добавление или инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO:2 или 3, который также имеет альдолазную активность.
PcALD данного изобретения имеет аминокислотную последовательность SEQ ID NO:16, как ясно определено описанным ранее выделением и анализом гена. Однако данное изобретение включает белок, имеющий аминокислотную последовательность, которая содержит замену, делецию, инсерцию, добавление или инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO:16, который также имеет альдолазную активность.
То есть альдолаза данного изобретения состоит из белков, указанных в (i)-(l) ниже:
(i) белок, содержащий аминокислотную последовательность SEQ ID NO:2 или последовательность аминокислотных остатков с номерами 5-225 той же самой последовательности;
(j) белок, который имеет аминокислотную последовательность, которая содержит замену, делецию, инсерцию, добавление или инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO:2 или последовательности аминокислотных остатков с номерами 5-225 той же самой последовательности, и имеет альдолазную активность;
(k) белок, содержащий аминокислотную последовательность SEQ ID NO:16; и
(l) белок, который имеет аминокислотную последовательность, которая содержит замену, делецию, инсерцию, добавление или инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO:16, и имеет альдолазную активность.
Здесь определения «несколько» и «альдолазная активность» являются такими же, какие определены в разделе (1), ДНК, кодирующая альдолазу.
Альдолаза данного изобретения катализирует реакцию, которая синтезирует 4-(индол-3-илметил)-4-гидрокси-2-оксоглутарат (IHOG) альдольной конденсацией из индолпировиноградной кислоты и пировиноградной кислоты (или щавелевоуксусной кислоты).
Альдолазная активность альдолазы данного изобретения может быть определена измерением количества IHOG, образованного из индолпировиноградной кислоты и пировиноградной кислоты (или щавелевоуксусной кислоты), при помощи высокоэффективной жидкостной хроматографии (ВЭЖХ).
Более конкретно альдолазная активность может быть приближенно оценена с использованием следующих стадий добавления альдолазы в реакционный раствор, состоящий из 100 мМ буфера, 50 мМ индол-3-пировиноградной кислоты, 250 мМ пировиноградной кислоты, 1 мМ MgCl2 и 1% (об./об.) толуола; и встряхивания во время реакции при 33°С в течение 4 часов; и затем количественного определения образованного количества IHOG при помощи ВЭЖХ.
IHOG может быть количественно определен ВЭЖХ-анализом с использованием "Inertsil ODS-2" (GL Sciences Inc., 5 мкм, 4,6×250 мм). Далее приведен пример условий этого анализа.
Подвижная фаза: 40% (об./об.) ацетонитрил/5 мМ раствор дигидрофосфата тетрабутиламмония
Скорость тока: 1 мл/мин
Температура колонки: 40°С
Детектирование: 210 нм УФ
Альдолаза данного изобретения способна катализировать реакцию, которая синтезирует IHOG альдольной конденсацией из индолпировиноградной кислоты и пировиноградной кислоты (или щавелевоуксусной кислоты). Хотя до сих пор сообщались два примера ферментов микроорганизмов, способных катализировать альдольную конденсацию с использованием 2 молекул α-кетокислоты (или замещенной α-кетокислоты) в качестве субстрата, в том числе 4-гидрокси-4-метил-2-оксоглутаратальдолаза, полученная из бактерий, принадлежащих к виду Pseudomonas, и 4-гидрокси-2-оксоглутаратальдолаза, присутствующая в E. coli и B. subtilis, не было открытий или сообщений, описывающих первый фермент, действующий на PHOG или IHOG, и полностью неизвестно, можно ли синтезировать PHOG или IHOG с использованием этого фермента. Кроме того, активность расщепления PHOG не наблюдали для последнего фермента и не удавалось синтезировать PHOG (и IHOG) также и с использованием этого фермента. То есть альдолаза данного изобретения отличается от альдолаз, которые были сообщены до сих пор, тем, что она имеет свойство быть способной катализировать реакцию, в которой IHOG синтезируется альдольной конденсацией индолпировиноградной кислоты и пировиноградной кислоты (или щавелевоуксусной кислоты).
Далее, обеспечено описание ферментативных свойств, исследованных для очищенной PtALD.
PtALD катализирует реакцию, в которой образуется замещенная α-кетокислота, представленная следующей общей формулой (3'):

(где R1 представляет собой атом водорода, алкильную группу, имеющую 1-8 атомов углерода, алкоксильную группу, имеющую 1-8 атомов углерода, карбоксиалкильную группу, имеющую 2-9 атомов углерода, арильную или аралкильную группу, имеющую до 20 атомов углерода, содержащую гетероцикл углеводородную группу, имеющую до 11 атомов углерода, гидроксильную группу или ее сложноэфирное производное, R3 представляет собой атом водорода или карбоксильную группу и R1 может быть замещен, по меньшей мере, одним заместителем, выбранным из группы, состоящей из атома галогена, гидроксильной группы, алкильной группы, имеющей до 3 атомов углерода, алкоксигруппы, имеющей до 3 атомов углерода, и аминогруппы; и R4 представляет собой атом водорода, алкильную группу, имеющую 1-8 атомов углерода, алкоксильную группу, имеющую 1-8 атомов углерода, карбоксиалкильную группу, имеющую 2-9 атомов углерода, арильную или аралкильную группу, имеющую до 20 атомов углерода, содержащую гетероцикл углеводородную группу, имеющую до 11 атомов углерода, гидроксильную группу или ее сложноэфирное производное, и R4 может быть замещен, по меньшей мере, одним заместителем, выбранным из группы, состоящей из атома галогена, гидроксильной группы, алкильной группы, имеющей до 3 атомов углерода, алкоксигруппы, имеющей до 3 атомов углерода, и аминогруппы) из соединения, представленного следующей общей формулой (1'):

(где R1 и R3 имеют значения, определенные в общей формуле (3')), и замещенной α-кетокислоты, представленной следующей общей формулой (2'):
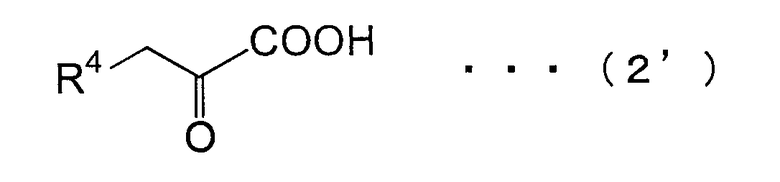
(где R4 имеет значение, определенное в общей формуле (3')). Таким образом, способ, посредством которого соединение общей формулы (3') образуется из соединений общей формулы (1') и общей формулы (2') с использованием PtALD данного изобретения, также относится к данному изобретению. Здесь R4 является предпочтительно атомом водорода или карбоксильной группой.
Оптимум рН PtALD равен приблизительно 9 при 33°С. Кроме того, PtALD данного изобретения имеет рН-стабильность при рН 6 или более и имеет особенно высокую рН-стабильность в диапазоне рН 6 - 11. Кроме того, PtALD данного изобретения имеет термостабильность при 70°С или ниже, и имеет особенно высокую термостабильность в диапазоне 20-60°С. Кроме того, PtALD данного изобретения имеет свойство альдолазной активности, улучшенное добавлением неорганической фосфорной кислоты, такой как KPi, к реакционной смеси фермента.
Поскольку молекулярная масса PtALD равна приблизительно 146 кДа, как измерено гель-фильтрацией, и приблизительно 25 кДа, как измерено электрофорезом в ДСН-ПААГ, авторы предположили, что PtALD имеет гексамерную структуру, состоящую из шести субъединиц, имеющих молекулярную массу приблизительно 25 кДа.
(3) Способ получения альдолазы
Далее дается объяснение способа получения альдолазы данного изобретения. Имеются два пути получения альдолазы данного изобретения. Они включают в себя (i) способ культивирования продуцирующего альдолазу микроорганизма для образования и накопления альдолазы и (ii) способ получения трансформанта для образования альдолазы технологией рекомбинантных ДНК и культивирования этого трансформанта для накопления альдолазы.
(i) Способ образования и накопления альдолазы культивированием микроорганизмов
Примеры микроорганизмов, служащих в качестве источников получения альдолазы в способе образования и накопления альдолазы посредством культивирования продуцирующих альдолазу микроорганизмов, включают микроорганизмы, принадлежащие к роду Pseudomonas, Erwinia, Flavobacterium и Xanthomonas.
Любые микроорганизмы, принадлежащие к роду Pseudomonas, Erwinia, Flavobacterium или Xanthomonas, могут быть использованы в данном изобретении при условии, что они являются микроорганизмами, которые образуют альдолазу, которая катализирует реакцию, синтезирующую кетокислоту-предшественник (IHOG) из индолпировиноградной кислоты и пировиноградной кислоты (или щавелевоуксусной кислоты), и предпочтительные микроорганизмы включают Pseudomonas taetrolens ATCC4683, Pseudomonas coronafaciens AJ2791, Pseudomonas desmolytica AJ1582, Erwinia sp. AJ2917, Xanthomonas citri AJ2797 и Flavobacterium rhenanum AJ2468, которые используются предпочтительно. Среди них особенно предпочтительными являются Pseudomonas taetrolens ATCC4683 и Pseudomonas coronafaciens AJ2791. Места депонирования этих микроорганизмов указаны ниже.
(1) Штамм Pseudomonas coronafaciens AJ2791
(i) Номер депозита: FERM BP-8246 (перенесенный из FERM P-18881)
(ii) Дата депонирования: 10 июня 2002 года
(iii) Местонахождение депозита: Национальный Институт Передовой Промышленной Науки и Технологии, Международный Депозитарий патентуемых организмов (Chuo No. 6, 1-1-1 Higashi, Tsukuba City, Ibaraki Prefecture, Japan)
(2) Штамм Pseudomonas desmolytica AJ1582
(i) Номер депозита: FERM BP-8247 (перенесенный из FERM P-18882)
(ii) Дата депонирования: 10 июня 2002 года
(iii) Местонахождение депозита: Национальный Институт Передовой Промышленной Науки и Технологии, Международный Депозитарий патентуемых организмов (Chuo No. 6, 1-1-1 Higashi, Tsukuba City, Ibaraki Prefecture, Japan)
(3) Штамм Erwinia sp. AJ2917
(i) Номер депозита: FERM BP-8245 (перенесенный из FERM P-18880)
(ii) Дата депонирования: 10 июня 2002 года
(iii) Местонахождение депозита: Национальный Институт Передовой Промышленной Науки и Технологии, Международный Депозитарий патентуемых организмов (Chuo No. 6, 1-1-1 Higashi, Tsukuba City, Ibaraki Prefecture, Japan)
(4) Штамм Flavobacterium rhenanum AJ2468
(i) Номер депозита: FERM BP-1862
(ii) Дата депонирования: 30 сентября 1985 года
(iii) Местонахождение депозита: Национальный Институт Передовой Промышленной Науки и Технологии, Международный Депозитарий патентуемых организмов (Chuo No. 6, 1-1-1 Higashi, Tsukuba City, Ibaraki Prefecture, Japan)
(5) Штамм Xanthomonas citri AJ2797
(i) Номер депозита: FERM BP-8250 (перенесенный из FERM P-8462)
(ii) Дата депонирования: 30 сентября 1985 года
(iii) Местонахождение депозита: Национальный Институт Передовой Промышленной Науки и Технологии, Международный Депозитарий патентуемых организмов (Chuo No. 6, 1-1-1 Higashi, Tsukuba City, Ibaraki Prefecture, Japan)
Хотя микроорганизм, служащий в качестве источника получения альдолазы, может культивироваться в любой форме, например в виде жидкого культивирования либо твердого культивирования, предпочтительным промышленным способом является глубоко аэрируемое перемешиваемое культивирование. Источники углерода, источники азота, неорганические соли и другие питательные элементы, например микроэлементы, обычно используемые при культивировании микроорганизмов, могут быть использованы в качестве питательных элементов питательной среды. Все пищевые источники могут использоваться при условии, что они могут быть использованы используемым микробным штаммом.
Аэробные условия используют для условий аэрации. Температура культивирования может быть достаточной в диапазоне, в котором эти микроорганизмы растут и продуцируют альдолазу. Таким образом, хотя эти условия не являются строгими, обычно температура культивирования равна 10-50°С и предпочтительно 30-40°С. Время культивирования варьируется в соответствии с другими условиями культивирования. Например, микроорганизмы могут культивироваться, пока не продуцируется наибольшее количество альдолазы, и обычно это составляет приблизительно 5 часов - 7 дней и предпочтительно около приблизительно 10 часов - 3 дней.
После культивирования клетки микроорганизмов извлекают центрифугированием (например, 10000хg в течение 10 минут). Поскольку большая часть альдолазы присутствует в клетках, альдолазу солюбилизируют разрушением или лизисом клеток микроорганизмов. Разрушение ультразвуком, разрушение при помощи Френч-пресса или стеклянных гранул могут быть использованы для разрушения клеток микроорганизмов. В случае лизиса клеток используют способ, в котором применяют лизоцим яичного белка, обработку пептидазой или их подходящую комбинацию.
При очистке альдолазы из продуцирующего альдолазу микроорганизма, хотя эту альдолазу очищают при помощи солюбилизирующего фермент раствора для начального материала, если остается неразрушенный или нелизированный материал, для очистки предпочтительным являются повторное центрифугирование раствора для солюбилизации и удаление любого остатка, который осаждается.
Все обычно используемые способы очистки обычных ферментов могут быть использованы для очистки альдолазы, примеры которых включают высаливание сульфатом аммония, гель-фильтрационную хроматографию, ионообменную хроматографию, гидрофобную хроматографию и хроматографию на гидроксиапатите. В результате может быть получена содержащая альдолазу фракция с более высокой удельной активностью, имеющая более высокую удельную активность.
(ii) Способ получения с использованием технологии рекомбинантных ДНК
Далее приведено объяснение способа получения альдолазы с использованием технологии рекомбинантных ДНК. Имеются многочисленные известные примеры получения полезных белков, таких как ферменты и физиологически активные вещества, с использованием технологии рекомбинантных ДНК, и это применение технологии рекомбинантных ДНК делает возможным массовое получение полезных белков, присутствующих лишь в следовых количествах в природе.
Фиг.1 является графической схемой способа получения альдолазы данного изобретения. Сначала получают ДНК, которая кодирует альдолазу данного изобретения (стадия S1).
Затем полученную ДНК лигируют с ДНК-вектором для получения рекомбинантной ДНК (стадия S2), и клетки трансформируются этой рекомбинантной ДНК для получения трансформанта (стадия S3). Продолжением является культивирование трансформанта в среде и обеспечение возможности образования и накопления альдолазы либо в этой среде, либо в клетках, либо и в среде, и в клетках (стадия S4).
После этого этот способ продолжается до стадии S5, где очищенную альдолазу получают извлечением и очисткой фермента.
Желаемая замещенная α-кетокислота может быть получена в большом количестве с использованием очищенной альдолазы, полученной в стадии S5, или любой среды и любых клеток, или и тех, и других, в которых накопилась альдолаза на стадии S4, в альдольной реакции (стадии S6).
ДНК, лигированная с ДНК-вектором, может обеспечить возможность экспрессии альдолазы данного изобретения.
Здесь примеры генов альдолазы, лигированных в ДНК-вектор, включают ранее описанную ДНК, такую как указанная ниже:
(а) ДНК, содержащая нуклеотидную последовательность SEQ ID NO:1, или последовательность нуклеотидных оснований с номерами 444-1118 или номерами 456-1118 в той же самой нуклеотидной последовательности;
(b) ДНК, которая гибридизуется в жестких условиях с ДНК, имеющей нуклеотидную последовательность, комплементарную нуклеотидной последовательности SEQ ID NO:1 или последовательности нуклеотидных оснований с номерами 444-1118 или 456-1118 той же самой нуклеотидной последовательности, и кодирует белок, имеющий альдолазную активность;
(с) ДНК, которая кодирует белок, содержащий аминокислотную последовательность SEQ ID NO:2 или последовательность аминокислотных остатков с номерами 5-225 той же самой последовательности;
(d) ДНК, которая кодирует белок, имеющий аминокислотную последовательность, которая содержит замену, делецию, инсерцию, добавление или инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO:2 или последовательности аминокислотных остатков с номерами 5-225 той же самой последовательности, и имеет альдолазную активность;
(е) ДНК, содержащая нуклеотидную последовательность SEQ ID NO:15 или последовательность нуклеотидных оснований с номерами 398-1141 той же самой нуклеотидной последовательности;
(f) ДНК, которая гибридизуется в жестких условиях с ДНК, имеющей нуклеотидную последовательностью, комплементарную нуклеотидной последовательности SEQ ID NO:15 или последовательности нуклеотидных оснований с номерами 398-1141 той же самой нуклеотидной последовательности, и кодирует белок, имеющий альдолазную активность;
(g) ДНК, которая кодирует белок, содержащий аминокислотную последовательность SEQ ID NO:16; и
(h) ДНК, которая кодирует белок, имеющий аминокислотную последовательность, которая содержит замену, делецию, инсерцию, добавление или инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO:16, и имеет альдолазную активность.
В случае массового производства белка с использованием технологии рекомбинантных ДНК предпочтительно образовывать тельце включения белка связыванием этого белка в трансформанте, который продуцирует этот белок. Преимущества этого экспрессионного способа получения включают возможность защиты желаемого белка от расщепления протеазами, присутствующими в клетках микроорганизмов, и возможность легкой очистки желаемого белка процедурой центрифугирования после разрушения клеток микроорганизмов.
Белковые тельца включения, которые могут быть получены таким образом, солюбилизируют с помощью денатурирующего белок агента и после прохождения через процедуру ренатурации, состоящую из первичного удаления денатурирующего агента, такой белок превращают в правильным образом уложенный физиологически активный белок. Имеются многочисленные примеры этого, такие как восстановление активности интерлейкина-2 человека (JP-A-S61-257931).
Для получения активного белка из тельца включения необходим ряд процедур, в том числе солюбилизация и восстановление активности, и эти процедуры являются более сложными, чем непосредственно получение активного белка. Однако в случае широкомасштабного получения в клетках микроорганизмов белка, который влияет на рост микроорганизмов, эти эффекты могут быть ингибированы, что позволяет белку накапливаться в клетках микроорганизмов в форме неактивных телец включения.
Способы массового производства желаемого белка в форме телец включения включают способ, в котором желаемый белок экспрессируется независимо под контролем сильного промотора, и способ, в котором желаемый белок экспрессируется в виде белка, слитого с белком, о котором известно, что он экспрессируется в крупном масштабе.
Кроме того, эффективным является также помещение последовательности узнавания рестриктирующей протеазы в подходящем местоположении для вырезания желаемого белка после экспрессии в форме слитого белка.
В случае крупномасштабного производства с использованием технологии рекомбинантных ДНК, клетки, такие как бактериальные клетки, клетки Actinomyces, дрожжевые клетки, плесневые клетки, растительные клетки и клетки животных, могут быть использованы в качестве клеток-хозяев, которые трансформируют. Примеры бактериальных клеток, для которых были разработаны системы клетка-хозяин, включают виды Escherichia, виды Pseudomonas, виды Corynebacterium и виды Bacillus и предпочтительно Escherichia coli. Это связано с тем, что имеется большой запас знаний, касающихся технологий для массового производства белка с использованием Escherichia coli. Следующее описание дает объяснение способа получения альдолазы с использованием трансформированной E. coli.
Промотор, обычно используемый для получения гетерогенных белков в E. coli, может быть использован в качестве промотора, который экспрессирует ДНК, кодирующую альдолазу, примеры которого включают сильные промоторы, такие как промотор Т7, промотор trp, промотор lac, промотор tac и промотор PL.
Для получения альдолазы в форме тельца включения слитого белка ген, который кодирует другой белок, предпочтительно гидрофильный пептид, лигируют либо «слева», либо «справа» от гена альдолазы с образованием гена слитого белка. Геном, который кодирует другой белок, может быть ген, который увеличивает количество накапливаемого слитого белка и усиливает растворимость слитого белка после стадий денатурации и регенерации, примеры кандидатов для которого включают ген 10 Т7, ген β-галактозидазы, ген дегидрофолатредуктазы, ген интерферона-γ, ген интерлейкина-2 и ген прохимозина.
При лигировании этих генов с геном, кодирующим альдолазу, рамки считывания кодонов делают совместимыми. Эти гены могут быть лигированы либо в подходящем сайте рестрикционного фермента, либо с использованием синтетической ДНК подходящей последовательности.
Для увеличения получаемого количества предпочтительно связывать последовательность терминации транскрипции в форме терминатора «справа» от гена слитого белка. Примеры этого терминатора включают терминатор Т7, терминатор фага fd, терминатор Т4, терминатор гена устойчивости к тетрациклину и терминатор гена trpA E. coli.
Мультикопийные векторы являются предпочтительными для вектора, используемого для введения гена, кодирующего альдолазу или слитый белок альдолазы с другим белком, в E. coli, примеры которых включают плазмиды, имеющие точку инициации репликации, происходящую из Col E1, такие как плазмиды pUC, плазмиды pBR322 или их производные. "Производное" обозначает здесь результат изменения плазмиды посредством замены, делеции, инсерции, добавления или инверсии основания. Используемый здесь термин "изменение" включает изменение, вызываемое мутагенной обработкой с использованием мутагена или УФ-излучения или спонтанной мутацией.
Предпочтительно вектор имеет маркер, такой как ген устойчивости к ампициллину, для отбора трансформанта. Примеры таких плазмид включают коммерчески доступные экспрессионные векторы, имеющие сильный промотор (такие как pUC (Takara), pPROK (Clontech) и рКК233-2 (Clontech)).
Рекомбинантная ДНК может быть получена из лигирования ДНК-фрагмента, в котором промотор, ген, кодирующий альдолазу или слитый белок, состоящий из альдолазы и другого белка, и терминатор, лигируют в этом порядке с ДНК вектора.
При трансформации E. coli с использованием этой рекомбинантной ДНК и затем культивировании этой E. coli экспрессируется и продуцируется альдолаза или слитый белок альдолазы. Штамм, который обычно используют для экспрессии гетерогенных генов, может быть использован в качестве трансформированного хозяина, и особенно предпочтительными являются штамм E. coli JM109(DE3) и штамм E. coli JM109. Способ трансформации и способ отбора трансформанта описаны, например, в Molecular Cloning, 2nd edition, Cold Spring Harbor Press (1989).
В случае экспрессии в виде слитого белка альдолаза может быть вырезана с использованием рестриктирующей протеазы, такой как фактор Ха свертывания крови или калликреин, который узнает последовательности, не существующие в альдолазе, в качестве последовательности узнавания.
Среда, обычно используемая для культивирования E. coli, может быть использована для продукционной среды, примеры которой включают среду с М9-казаминокислотами и среду LB. Кроме того, условия культивирования и индукции продуцирования могут быть подходящим образом выбраны в соответствии с типом маркера и промотора используемого вектора и типом используемого микроорганизма-хозяина.
Следующий способ может быть использован для извлечения альдолазы или белка альдолазы, слитого с другим белком. Если альдолаза или ее слитый белок солюбилизирована в клетках микроорганизмов, то ее можно использовать в форме раствора неочищенного фермента после извлечения клеток микроорганизмов и разрушения или лизиса извлеченных клеток. Кроме того, альдолаза или ее слитый белок могут быть также использованы после очистки осаждением, фильтрованием, колоночной хроматографией или другим обычным способом по мере необходимости. В этом случае может быть также использован способ очистки, который использует антитело альдолазы или ее слитого белка.
При образовании белкового тельца включения его солюбилизируют с помощью денатурирующего агента. Хотя оно может быть солюбилизировано вместе с белком клетки микроорганизма, с учетом последующей процедуры очистки предпочтительно выделять тельце включения и затем солюбилизировать его. Для извлечения тельца включения из клетки микроорганизма может быть использован способ, известный в предыдущем уровне техники. Например, тельце включения может быть извлечено разрушением клетки микроорганизма с последующим центрифугированием. Примеры денатурирующих агентов, которые растворяют белковые тельца включения, включают гидрохлорид гуанидина (например, 6 М, рН 5-8) и мочевину (например, 8 М).
Белковое тельце включения может быть регенерировано в виде активного белка удалением этих денатурирующих агентов обработкой, например, диализом. Диализные растворы, такие как Трис-HCl-буфер или фосфатный буфер, могут быть использованы для диализа, и концентрация может быть 20 мМ-0,5 М, а рН может быть рН 5 - рН 8.
Концентрация белка во время стадии регенерации предпочтительно поддерживается до приблизительно 500 мкг/мл или менее. Для предотвращения самосшивания регенерированной альдолазы температура диализа равна предпочтительно 5°С или ниже. Кроме того, можно также ожидать, что активность будет восстанавливаться другими способами, используемыми для удаления денатурирующего агента, такими как разбавление и ультрафильтрация, наряду с вышеуказанным диализом.
При получении гена альдолазы из бактерий, принадлежащих к роду Pseudomonas, альдолаза может экспрессироваться и продуцироваться с использованием бактерий видов Pseudomonas в качестве хозяина в одном предпочтительном режиме. Описания примеров клеток-хозяев в этом случае включают сообщение о рекомбинантном способе экспрессии в Pseudomonas syringae Shi-En Lu et al. (FEMS Microbiology Letters 210 (2002) p. 115-121), сообщение о рекомбинантном способе экспрессии в Pseudomonas aeruginosa Olsen, R.H. et al. (Journal of Bacteriology, (1982) 150, p. 60-69) и сообщение о рекомбинантном способе экспрессии в Pseudomonas stutzeri Grapner, S. et al. (Biomol. Eng., (2000), 17, p. 11-16). Однако бактерии видов Pseudomonas, используемые в качестве клеток-хозяев для экспрессии альдолазы, не ограничиваются перечисленными здесь бактериями.
Далее, что касается вектора, используемого для введения гена альдолазы в бактерий видов Pseudomonas, может быть использована плазмида, которая имеет точку инициации репликации, которая функционирует в бактериальных клетках видов Pseudomonas. Например, Eza Kalyaeva et al. сообщали, что плазмида pKLH4.05 имеет репликон TFK, который функционирует в Pseudomonas aeruginosa. Могут быть также использованы векторы с широким спектром хозяев, которые применимы для трансформации грамотрицательных бактерий. Известно, что эти векторы функционируют также в бактериях видов Pseudomonas, примеры этих векторов включают RK404 (Ditta, G. et al., Plasmid 13 (1985) p. 149-153) и RSF1010 (Frey, J. et al., Gene 24 (1982) p. 289-296).
В случае использования ДНК, указанной в SEQ ID NO:1, в качестве ДНК, кодирующей альдолазу, может быть получена альдолаза, которая имеет аминокислотную последовательность SEQ ID NO:2 или 3, а в случае использования ДНК, указанной в SEQ ID NO:15, получают альдолазу, которая имеет аминокислотную последовательность SEQ ID NO:16.
[II] Способ получения замещенной α-кетокислоты с использованием альдолазы
Далее дается описание способа получения замещенной α-кетокислоты данного изобретения. Способ получения замещенной α-кетокислоты данного изобретения является способом получения α-кетокислоты, представленной следующей общей формулой (3):

реакцией замещенной α-кетокислоты, представленной следующей общей формулой (1):

с замещенной α-кетокислотой, представленной следующей общей формулой (2):

где эту реакцию выполняют в присутствии белка, который катализирует эту реакцию.
В общей формуле (1) R1 представляет собой алкильную группу, имеющую 1-8 атомов углерода, алкоксильную группу, имеющую 1-8 атомов углерода, карбоксиалкильную группу, имеющую 2-9 атомов углерода, арильную или аралкильную группу, имеющую до 20 атомов углерода, содержащую гетероцикл углеводородную группу, имеющую до 11 атомов углерода, гидроксильную группу или ее сложноэфирное производное. R1 может быть также замещен атомом галогена, гидроксильной группой, алкильной группой, имеющей до 3 атомов углерода, алкоксигруппой, имеющей до 3 атомов углерода или аминогруппой. R1 обозначает предпочтительно заместитель, имеющий 4 или более атомов углерода и предпочтительно 6 или более атомов углерода, тогда как арильная группа или аралкильная группа, имеющая до 20 атомов углерода (арильные группы, такие как фенильная группа, толильная группа, ксилильная группа, бифенильная группа, нафтильная группа, антрильная группа или фенантолильная группа; аралкильные группы, такие как бензильная группа, бензгидрильная группа, стирильная группа, фенетильная группа, тритильная группа или циннамильная группа), и содержащая гетероцикл углеводородная группа, имеющая до 11 атомов углерода (гетероциклические группы, такие как фурильная группа, тиенильная группа, пиридильная группа, пиперидильная группа, пиперидиногруппа, морфолиногруппа или индолильная группа; алкильные группы, замещенные этими гетероциклическими группами) являются особенно предпочтительными. В качестве R1 особенно предпочтительной является бензильная группа или 3-индолилметильная группа и наиболее предпочтительной является 3-индолилметильная группа. То есть в качестве замещенной α-кетокислоты общей формулы (1) предпочтительной является фенилпировиноградная кислота или индолпировиноградная кислота и индолпировиноградная кислота является особенно предпочтительной.
В общей формуле (2) R2 представляет собой алкильную группу, имеющую 1-8 атомов углерода, алкоксильную группу, имеющую 1-8 атомов углерода, карбоксиалкильную группу, имеющую 2-9 атомов углерода, арильную или аралкильную группу, имеющую до 20 атомов углерода, содержащую гетероцикл углеводородную группу, имеющую до 11 атомов углерода, гидроксильную группу или ее сложноэфирное производное. Когда R2 содержит ароматическое кольцо или гетероциклическое кольцо, это ароматическое кольцо или гетероциклическое кольцо может быть замещено, по меньшей мере, одним типом заместителя, выбранного из группы, состоящей из атома галогена, гидроксильной группы, алкильной группы, имеющей до 3 атомов углерода, алкоксигруппы, имеющей до 3 атомов углерода, и аминогруппы. Однако когда R1 представляет атом водорода, метильную группу или карбоксиметильную группу в общей формуле (1), R2 не представляет атом водорода. R2 обозначает предпочтительно атом водорода или карбоксильную группу и особенно предпочтительно атом водорода. То есть замещенная α-кетокислота общей формулы (2) является предпочтительно щавелевоуксусной кислотой или пировиноградной кислотой и особенно предпочтительно пировиноградной кислотой.
В общей формуле (3) R1 и R2 имеют те же самые значения, что и R1 и R2 в общих формулах (1) и (2).
В способе получения замещенной α-кетокислоты данного изобретения наиболее предпочтительным является синтез IHOG, показанной в следующей формуле (4), с использованием индолпировиноградной кислоты в качестве замещенной α-кетокислоты общей формулы (1) и с использованием пировиноградной кислоты в качестве замещенной α-кетокислоты общей формулы (2).

В отношении белка, катализирующего эту реакцию, нет особых ограничений, и может быть использован любой белок при условии, что он является белком, катализирующим реакцию, которая синтезирует замещенную α-кетокислоту, представленную общей формулой (3), альдольной конденсацией замещенной α-кетокислоты, представленной общей формулой (1), и замещенной α-кетокислоты, представленной общей формулой (2). То есть пока этот белок катализирует данную реакцию, он может быть белком, происходящим из микроорганизма, или белком, синтезированным способом химического синтеза.
Предпочтительным примером такого белка является альдолаза, описанная в разделе [1], описывающем альдолазу. В этом случае (1) может быть использована альдолаза, которая была получена культивированием клеток микроорганизмов, которые образуют белок, катализирующий эту реакцию (альдолазу), среди микроорганизмов, принадлежащих к роду Pseudomonas, Erwinia, Flavobacterium или Xanthomonas, или (2) может быть использована альдолаза, которая была получена посредством получения трансформанта, образующего белок, который катализирует эту реакцию, с использованием технологии рекомбинантных ДНК с последующим культивированием трансформанта.
Белок, который катализирует эту реакцию, может быть добавлен в любой форме к реакционной смеси при условии, что он способен катализировать реакцию, которая синтезирует вышеуказанную замещенную α-кетокислоту, представленную общей формулой (3). А именно, белок, который катализирует эту реакцию, может быть добавлен к реакционной смеси отдельно, или он может быть добавлен к реакционной смеси в форме композиции, имеющей альдолазную активность, содержащей белок, который катализирует эту реакцию (альдолазу).
Термин «композиция, имеющая альдолазную активность» в данном контексте обозначает композицию, единственным требованием к которой является то, что она содержит белок, который катализирует эту реакцию (альдолазу), и конкретные примеры включают культуру, среду (в которой клетки микроорганизмов были удалены из культуры), клетки микроорганизмов (в том числе как культивируемые клетки микроорганизмов, так и промытые клетки микроорганизмов), продукт обработанных клеток микроорганизмов, которые были разрушены или лизированы, и композицию, имеющую альдолазную активность, получаемую из очистки либо среды, либо клеток, либо и среды и клеток (раствор неочищенного фермента, очищенный фермент). Например, в случае получения замещенной α-кетокислоты с использованием продуцирующих альдолазу микроорганизмов или клеток, которые были трансформированы рекомбинантной ДНК, субстрат может быть добавлен непосредственно в культуру при культивировании или может быть использован в форме клеток микроорганизмов или промытых клеток микроорганизмов, которые были отделены от культуры. Кроме того, продукт обработанных клеток микроорганизмов, которые были разрушены или лизированы, может быть использован непосредственно, или альдолаза может быть извлечена из этого продукта обработанных клеток микроорганизмов и использована в виде раствора неочищенного фермента или использована после очистки этого фермента. То есть пока он находится в форме фракции, имеющей альдолазную активность, он может быть использован в способе получения замещенной α-кетокислоты данного изобретения в любой форме.
Для проведения альдольной реакции с использованием альдолазы или композиции, имеющей альдолазную активность, реакционный раствор, содержащий замещенную α-кетокислоту, представленную общей формулой (1), замещенную α-кетокислоту, представленную общей формулой (2), и белок или содержащую альдолазу композицию, которая катализирует эту реакцию, доводят до подходящей температуры 20-50°С и дают им стоять без перемешивания, со встряхиванием или перемешиванием в течение 30 минут - 5 дней при поддержании рН 6-12.
Скорость реакции может быть также улучшена добавлением двухвалентного катиона, такого как Mg2+, Mn2+, Ni2+ или Со2+, к этой реакционной смеси. Mg2+ может быть использован предпочтительно в связи со стоимостью и т.д.
При добавлении этих двухвалентных катионов к реакционному раствору предпочтительно могут использоваться MgCl2, MgSO4, MnSO4 и т.д., хотя может быть использована любая соль при условии, что она не препятствует этой реакции. Концентрации этих двухвалентных катионов могут быть определены простыми предварительными исследованиями, проводимыми лицом с обычной квалификацией в данной области. Эти двухвалентные катионы могут быть добавлены в диапазоне 0,01-10 мМ, предпочтительно 0,1 мМ - 5 мМ и более предпочтительно 0,1 мМ - 1 мМ.
В качестве предпочтительного примера условий реакции при проведении способа получения замещенной α-кетокислоты данного изобретения источник фермента в форме промытых клеток экспрессирующей альдолазу E. coli добавляют при 10% (масса/объем) в реакционный раствор, состоящий из 100 мМ буфера, 50 мМ индол-3-пировиноградной кислоты, 250 мМ пировиноградной кислоты, 1 мМ MgCl2 и 1% (об./об.) толуола, с последующей реакцией при встряхивании при 33оС в течение 4 часов с получением 4-(индол-3-илметил)-4-гидрокси-2-оксоглутарата (IHOG).
Замещенная α-кетокислота общей формулы (3), которая образуется, может быть отделена и очищена в соответствии с известными способами. Примеры такого способа могут включать способ, в котором замещенную α-кетокислоту контактируют с ионообменной смолой для адсорбции основных аминокислот с последующими элюцией и кристаллизацией, и способ, в котором продукт, полученный элюцией, обесцвечивают и фильтруют с использованием активированного угля с последующей кристаллизацией с получением замещенной α-кетокислоты.
Применение способа получения замещенной α-кетокислоты данного изобретения делает возможным образование кетокислоты-предшественника (IHOG) монатина из индолпировиноградной кислоты и щавелевоуксусной кислоты (или пировиноградной кислоты). Поскольку IHOG может быть использован для получения монатина аминированием положения 2, он применим в качестве промежуточного продукта в синтезе монатина.
ПРИМЕРЫ
Данное изобретение будет объяснено более подробно со ссылкой на приведенные ниже примеры, однако данное изобретение не ограничивается этими примерами. В примерах IHOG и PHOG, используемые в качестве субстратов, синтезировали в соответствии со способами, описанными в ссылочных примерах 1 и 2.
Пример 1
[I] Скрининг микроорганизмов, имеющих альдолазную активность в отношении PHOG
Проводили скрининг на штаммы микроорганизмов, имеющие альдолазную активность, использующую 4-фенилметил-4-гидрокси-2-оксоглутарат (PHOG) в качестве субстрата.
Микроорганизмы (бактерии, дрожжи) инокулировали в бульонную среду для чашек (Eiken Chemical Co., Ltd.) и культивировали при 30оС в течение 24 часов. Затем эти микроорганизмы инокулировали на чашки, содержащие 0,5 г/дл глицерина, 0,5 г/дл фумаровой кислоты, 0,3 г/дл дрожжевого экстракта, 0,2 г/дл пептона, 0,3 г/дл сульфата аммония, 0,3 г/дл К2НРО4, 0,1 г/дл КН2РО4, 0,05 г/дл MgSO4 · 7Н2О, 0,25 г/дл фталата натрия и 2 г/дл порошка агара (рН 6,5), с последующим культивированием при 30°С в течение 24 часов. Полученные клетки микроорганизмов инокулировали в реакционный раствор, состоящий из 100 мМ Трис-HCl (рН 8,0), 50 мМ PHOG, 1 мМ MgCl2, 5 мМ раствора фосфата калия (KPi) и 1% (об./об.) толуола, до массы сырых клеток приблизительно 1% (масса/объем) и инкубировали при 30°С в течение 24 часов. Концентрацию свободной пировиноградной кислоты в реакционном растворе определяли количественно ферментативным способом с использованием лактатдегидрогеназы (LDH). Затем 10 мкл пробы добавляли к 200 мкл реакционного раствора, состоящего из 100 мМ Трис-HCl (рН 8,0), 1,5 мМ НАДН, 5 мМ MgCl2 и 25 Е/мл LDH, с последующим инкубированием при 30°С в течение 10 минут. Оптическую плотность при 340 нм измеряли после этой реакции и количество пировиноградной кислоты в данной пробе определяли количественно из уменьшения количества НАДН.
Количество образованной фенилпировиноградной кислоты определяли количественно ВЭЖХ-анализом с использованием колонки "Inertsil ODS-2" (GL Sciences Inc., 5 мкм, 4,6х250 мм). Условия анализа указаны ниже.
Подвижная фаза: 20% (об./об.) ацетонитрил/0,05% (об./об.) водная трифторуксусная кислота
Скорость тока: 1 мл/мин
Температура колонки: 40оС
Детектирование: 210 нм УФ
При этих условиях PHOG элюировался при времени удерживания около 9,8 минут, тогда как пировиноградная кислота элюировалась при времени удерживания около 12 минут, и каждое из этих соединений могло быть выделено и определено количественно.
Величину, полученную вычитанием количества пировиноградной кислоты или фенилпировиноградной кислоты, образованного из PHOG в контроле (эталоне) (реакция без добавления микроорганизма), из количества, образованного в реакции с добавлением тест-микроорганизма, использовали для получения количества, образованного альдолазой. В результате альдолазная активность, использующая PHOG в качестве субстрата, была получена для штаммов микроорганизмов, перечисленных в таблице 1.
Результаты скрининга на штаммы микроорганизмов, имеющие альдолазную активность в отношении PHOG
PHOG синтезировали из фенилпировиноградной кислоты и щавелевоуксусной кислоты или пировиноградной кислоты с использованием клеток Pseudomonas taetrolens ATCC4683. Клетки микроорганизмов Р. taetrolens ATCC4683 (AJ2212) инокулировали до конечной концентрации около 1% (масса/объем) в реакционный раствор, состоящий из 100 мМ Трис-HCl (рН 8,0), 50 мМ фенилпировиноградной кислоты, 1 мМ MgCl2, 5 мМ KPi, 100 мМ щавелевоуксусной кислоты или пировиноградной кислоты и 1% (мас./мас.) толуола, с последующим инкубированием при 30°С в течение 16 часов. После реакции количество образованного PHOG определяли при помощи ВЭЖХ. Количества PHOG, образованного из фенилпировиноградной кислоты и щавелевоуксусной кислоты или пировиноградной кислоты, показаны в таблице 2.
Количества PHOG, образованного из фенилпировиноградной кислоты и щавелевоуксусной кислоты и/или пировиноградной кислоты
Согласно таблице 2 увеличение образованного количества PHOG наблюдали в реакции с добавлением микроорганизма, и было определено, что PHOG может образовываться под действием альдолазы при комбинациях как фенилпировиноградная кислота + щавелевоуксусная кислота, так и фенилпировиноградная кислота + пировиноградная кислота.
[II] Очистка IHOG-альдолазы, полученной из штамма Pseudomonas taetrolens ATCC4683
IHOG-альдолазу очищали, как описано ниже, из растворимой фракции штамма P. taetrolens ATCC4683. Альдолазную активность, использующую PHOG в качестве субстрата, измеряли при следующих условиях.
Условия реакции: 50 мМ Трис-HCl (рН 8,0), 2 мМ PHOG, 0,2 мМ НАДН, 0,2 мМ KPi, 1 мМ MgCl2, 16 Е/мл лактатдегидрогеназы и 3 мкл фермента/600 мкл реакционного раствора, оптическая плотность при 340 нм, измеренная при 30°С
(1) Получение растворимой фракции
Петлю клеток P. taetrolens ATCC4683, культивируемых при 30°С в течение 24 часов на бульонной среде для чашек, выскребали из чашки и инокулировали в мерную колбу на 500 мл, содержащую 50 мл среды для получения фермента (0,5 г/дл глицерина, 0,5 г/дл фумаровой кислоты, 0,5 г/дл сульфата аммония, 0,3 г/дл К2НРО4, 0,1 г/дл КН2РО4, 0,05 г/дл MgSO4 · 7Н2О, 0,3 г/дл дрожжевого экстракта, 0,2 г/дл пептона, 0,25 г/дл фталата натрия и 0,005% пеногасителя Antifoam А (Sigma), доведенные до рН 6,5 с использованием КОН) с последующим культивированием при встряхивании при 30°С в течение 24 часов. 0,5 мл этой культуры инокулировали в мерные колбы на 500 мл, содержащие 50 мл среды для получения фермента, с последующим культивированием при встряхивании при 30°С в течение 24 часов. Микроорганизмы собирали из полученной культуры (всего 2 л) центрифугированием и после промывания суспендированием в буфере А (20 мМ Трис-HCl (рН 7,6)) опять извлекали центрифугированием. Полученные промытые клетки микроорганизмов суспендировали в 200 мл буфера А и затем разрушали ультразвуком при 4°С в течение 30 минут. Остаток клеток микроорганизмов удаляли из подвергнутого разрушению раствора центрифугированием (8000 об/мин, 10 минут  2 раза) с последующим дополнительным ультрацентрифугированием (50000 об/мин, 30 минут). После ультрацентрифугирования полученный супернатант получали в виде растворимой фракции.
2 раза) с последующим дополнительным ультрацентрифугированием (50000 об/мин, 30 минут). После ультрацентрифугирования полученный супернатант получали в виде растворимой фракции.
(2) Анионообменная хроматография: Q-Sepharose FF
80 мл вышеописанной растворимой фракции наносили на анионообменную хроматографическую колонку, Q-Sepharose FF 26/10 (Pharmacia, CV=20 мл), уравновешенную буфером А, и адсорбировали на этот носитель. После вымывания всех несвязанных белков буфером А адсорбированный белок элюировали с использованием линейного градиента концентрации KCl от 0 М до 0,7 М (всего: 140 мл). Альдолазную активность в отношении PHOG детектировали во фракции, эквивалентной приблизительно 0,5 М. Одну и ту же процедуру хроматографии повторяли два раза.
(3) Гидрофобная хроматография: Phenyl Sepharose HP HR 16/10
Фракцию, в которой была детектирована альдолазная активность, диализовали при 4°С в течение ночи против буфера В (50 мМ Трис-HCl (рН 7,6), 1 М сульфат аммония, рН 7,6) и затем фильтровали с использованием фильтра 0,45 мкм. Полученный фильтрат наносили на гидрофобную хроматографическую колонку, Phenyl Sepharose HP HR 16/10 (Pharmacia), уравновешенную буфером В. Альдолаза адсорбировалась на этот носитель.
После вымывания всех несвязанных белков буфером В альдолазу элюировали с использованием линейного градиента концентрации сульфата аммония от 1 М до 0 М. Альдолазную активность детектировали во фракции элюции, где концентрация сульфата аммония была приблизительно 0,2 М.
(4) Гель-фильтрационная хроматография: Sephadex 200 HP 16/60
Каждую фракцию, содержащую альдолазу, собирали, диализовали против буфера А и фильтровали с использованием фильтра 0,45 мкм. Полученный фильтрат концентрировали с использованием ультрафильтрационной мембраны Centriprep 10. Полученный концентрат наносили на гель-фильтрационную хроматографическую колонку, Sephadex 200 HP 16/60 (Pharmacia), уравновешенную буфером С (20 мМ Трис-HCl (рН 7,6), 0,1 М KCl), и элюировали при скорости тока 1 мл/мин. Альдолаза элюировалась во фракции от 66 до 71 мл. Молекулярная масса альдолазы, определенная из положения элюции пика активности, была равна приблизительно 146 кДа.
(5) Анионообменная хроматография: Mono Q HR5/5
Полученную фракцию фильтровали с использованием фильтра 0,45 мкм. Здесь полученный фильтрат наносили на ионообменную хроматографическую колонку, Mono Q HR5/5, (Pharmacia), уравновешенную буфером А. Альдолаза адсорбировалась на этом носителе. После вымывания всех несвязанных белков буфером А белок элюировали с использованием линейного градиента концентрации KCl от 0 мМ до 700 мМ (всего: 24 мл). Альдолазную активность измеряли для каждой элюированной фракции, и альдолазную активность наблюдали в положении элюции, где концентрация KCl была приблизительно 0,4 М.
(6) Гидроксиапатитная хроматография: СНТ-II
Полученную фракцию диализовали при 4°С в течение ночи против буфера D (10 мМ калий-фосфатный буфер (рН 7,0)) и фильтровали с использованием фильтра 0,45 мкм. Здесь, полученный фильтрат наносили на гидроксиапатитную хроматографическую колонку, 5 мл СНТ-II (BioRad), уравновешенную буфером D. Альдолазную активность детектировали в несвязанной фракции, альдолаза могла быть отделена от адсорбированного белка.
При нанесении фракции, очищенной в соответствии с процедурами колоночной хроматографии, описанными выше, на ДСН-ПААГ для электрофореза, детектировали почти единственную полосу в положении, соответствующем приблизительно 25 кДа. Поскольку оценная молекулярная масса, определенная гель-фильтрационной хроматографией, была приблизительно 146 кДа, авторы сделали предположение, что эта альдолаза образует гексамер. Таблица очистки показана в таблице 3.
Таблица очистки IHOG-альдолазы, полученной из штамма Pseudomonas taetrolens ATCC4683
(мг)
(Е/мг)
(Е)
(%)
[III] Определение внутренней аминокислотной последовательности IHOG-альдолазы
После нанесения аликвоты приблизительно 2 мкг очищенной альдолазы на ДСН-ПААГ для электрофореза пробу в ДСН-ПААГ обрабатывали трипсином (рН 8,5, 35°С, 20 часов) и затем подвергали обращенно-фазовой ВЭЖХ для разделения пептидов-фрагментов. Аминокислотные последовательности, состоящие из 20 остатков и 12 остатков, соответственно (SEQ ID NO:4 и 5), определяли, как показано ниже, для двух из разделенных фракций.
Определенные внутренние аминокислотные последовательности
[IV] Клонирование гена IHOG-альдолазы, полученного из штамма P. taetrolens ATCC4683
(1) Получение хромосомной ДНК
Штамм P. taetrolens ATCC4683 культивировали при 30°С в течение ночи с использованием 50 мл бульонной среды (предварительное культивирование). 5 мл этой культуры инокулировали в 50 мл свежей бульонной среды. После культивирования до поздней фазы логарифмического роста 50 мл культуры центрифугировали (12000хg, 4°С, 15 минут) для извлечения микроорганизмов. Затем хромосомную ДНК получали в соответствии с установленными способами с использованием этих клеток микроорганизмов.
(2) Клонирование внутренней ДНК гена альдолазы при помощи ПЦР
Следующие смешанные праймеры (SEQ ID NO:6 и 7) синтезировали на основе внутренней аминокислотной последовательности, определенной для IHOG-альдолазы.
Смешанные праймеры, сконструированные и синтезированные на основе внутренней аминокислотной последовательности
Амплификацию выполняли при помощи ПЦР с синтезированными смешанными праймерами и хромосомной ДНК P. taetrolens ATCC4683 в качестве матрицы. ПЦР-реакцию выполняли с использованием PCR Thermal PERSONEL (Takara) в течение 30 циклов при условиях, указанных ниже.
94°С, 30 секунд
55°С, 30 секунд
72°С, 1 минута
Продукт ПЦР наносили на агарозный гель для электрофореза, и амплифицировали фрагмент приблизительно 500 п.н. Этот ДНК-фрагмент клонировали в pUC18 с последующим определением нуклеотидной последовательности. Аминокислотная последовательность, выведенная из полученного ДНК-фрагмента, совпадала со внутренней аминокислотной последовательностью IHOG-альдолазы, что подтверждало, что был получен желаемый ген альдолазы.
(3) Клонирование полноразмерного гена посредством гибридизации колоний
Полноразмерный ген клонировали с использованием анализа гибридизации по Саузерну и гибридизации колоний с ДНК-фрагментом, амплифицированным при помощи ПЦР. ДНК-зонд получали с использованием набора DIG High Prime (Roche Diagnostics K.K.), инкубированием в течение ночи (т.е. О/N) при 37°С в соответствии с руководством-инструкцией для мечения этого зонда. Анализ гибридизации по Саузерну выполняли в соответствии с руководством расщеплением 1 мкг хромосомной ДНК каждой из рестриктаз, электрофорезом в 0,8% агарозном геле и блоттингом на найлоновую мембрану. Гибридизацию выполняли с использованием набора DIG Easy Hyb (Roche Diagnostics K.K.) предварительной гибридизацией при 50°С в течение 1 часа, добавлением зонда и затем гибридизацией в течение ночи. Полосы детектировали с использованием набора для детектирования нуклеотидов Dig Nucleotide Detection. В результате детектировали PstI-фрагмент размером приблизительно 4 т.п.н., который сильно гибридизовался с использованием этого ПЦР-фрагмента в качестве зонда. Затем этот PstI-фрагмент получали гибридизацией колоний. 20 мкг хромосомной ДНК обрабатывали PstI с последующим подверганием электрофорезу в агарозном геле и извлечением фрагмента, размер которого был приблизительно 4 т.п.н. Затем его лигировали в pUC118 с получением библиотеки в E. coli JM109. Затем эти колонии переносили на найлоновый мембранный фильтр (Hybond-N, Amersham) с последующей обработкой для щелочной денатурации, нейтрализации и иммобилизации. Гибридизацию выполняли с использованием набора DIG Easy Hyb. Этот фильтр погружали в буфер и предварительно гибридизовали при 42°С в течение 1 часа. Затем добавляли приготовленный заранее меченый зонд с последующей гибридизацией при 42°С в течение 16 часов. После промывки SSC колонии, которые гибридизовались с этим зондом, детектировали с использованием набора для детектирования нуклеотидов DIG (Roche Diagnostics K.K.). В результате получали клон, который сильно гибридизовался с этим зондом.
Была определена нуклеотидная последовательность плазмидной ДНК, извлеченной из полученного клона, и было ясно показано, что она имеет нуклеотидную последовательность SEQ ID NO:1. Была обнаружена ORF из 678 п.н., которая содержала нуклеотидную последовательность, соответствующую определенной аминокислотной последовательности (номерам 507-566 и номерам 1046-1082 в SEQ ID NO:1), и была получена полная длина желаемого гена альдолазы.
(4) Экспрессия IHOG-альдолазы в E. coli (Часть 1)
Фрагмент, амплифицированный с использованием праймеров, показанных в таблице 6 (SEQ ID NO:8 и 9), из хромосомной ДНК P. taetrolens ATCC4683, расщепляли BamHI/HindIII, встраивали в сайт BamHI/HindIII pUC18 для конструирования плазмиды pUCALD. E. coli JM109 трансформировали полученной таким образом pUCALD и трансформант культивировали при 37°С в течение ночи в LB-среде, содержащей 50 мкг/мл ампициллина (предварительное культивирование). Эту предварительную культуру инокулировали при 1% в 50 мл LB-среды с последующим культивированием при 37°С. IPTG добавляли до конечной концентрации 1 мМ при приблизительно 2 часах после начала культивирования с последующим дополнительным культивированием в течение 3 часов. После культивирования микроорганизмы извлекали, промывали и затем суспендировали в 1 мл 20 мМ Трис-HCl (рН 7,6) с последующим разрушением клеток микроорганизмов с использованием Multi-Beads Shocker (Yasui Kikai Corporation). Затем неочищенный экстракт центрифугировали при 15000 об/мин в течение 10 минут, и полученный супернатант использовали в качестве раствора неочищенного фермента.
Праймер
При измерении альдолазной активности с использованием раствора неочищенного фермента и PHOG в качестве субстрата, в противоположность альдолазной активности в отношении PHOG, не детектируемой в E. coli, несущей pUC18 (контроле), альдолазную активность в отношении PHOG 0,81 Е/мг белка детектировали в штамме, несущем pUCALD. В результате было показано, что этот ген кодирует желаемую альдолазу.
[V] Синтез 4-(индол-3-илметил)-4-гидрокси-2-оксоглутарата (IHOG) из индол-3-пировиноградной кислоты и пировиноградной кислоты с использованием экспрессирующего альдолазу штамма
4-(индол-3-илметил)-4-гидрокси-2-оксоглутарат (IHOG) синтезировали из индол-3-пировиноградной кислоты и пировиноградной кислоты с помощью промытых клеток экспрессирующей альдолазу E. coli, полученной в [IV], в качестве источника этого фермента. Количество IHOG определяли при помощи ВЭЖХ-анализа с использованием колонки "Inertsil ODS-2" (GL Sciences Inc., 5 мкм, 4,6 250 мм). Условия анализа указаны ниже.
250 мм). Условия анализа указаны ниже.
Подвижная фаза: 40% (об./об.) ацетонитрил/5 мМ раствор дигидрофосфата тетрабутиламмония
Скорость тока: 1 мл/мин
Температура колонки: 40°С
Детектирование: 210 нм УФ
Промытые клетки экспрессирующей альдолазу E. coli добавляли при 10% (масса/объем) к реакционному раствору, содержащему 100 мМ буфер (Трис-HCl, 8,0, 9,0 или глицин-NaOH 10,0), 50 мМ индол-3-пировиноградную кислоту, 250 мМ пировиноградную кислоту, 1 мМ MgCl2 и 1% (об./об.) толуол, и давали взаимодействовать при встряхивании при 33°С в течение 4 часов. Реакционный раствор фермента подходящим образом разбавляли, и определяли количество образованного IHOG.
Количество IHOG, образованного альдолазой
В результате количество продуцируемого IHOG увеличивалось в группе с добавлением экспрессирующей альдолазу E. coli, и IHOG образовывался этой альдолазой.
Пример 2
Экспрессия высокого уровня IHOG-альдолазы в E. coli (Часть 2)
(1) Конструирование плазмиды pTrp4, содержащей промотор trp и терминатор rrnB
Район промотора оперона trp в хромосомной ДНК E. coli W3310 с использованием ПЦР с олигонуклеотидами, показанными в таблице 8, в качестве праймеров (комбинация SEQ ID NO:10 и 11) и полученный ДНК-фрагмент лигировали в вектор pGEM-Teasy (Promega). Затем E. coli JM109 трансформировали этой смесью для лигирования и отбирали штамм среди устойчивых к ампициллину штаммов, который имел желаемую плазмиду, в которую был встроен промотор trp в ориентации, противоположной промотору lac. Затем этот ДНК-фрагмент, содержащий промотор trp, полученный обработкой этой плазмиды Eco0109I/EcoRI, лигировали с продуктом обработки pUC19 (Takara) Eco0109I/EcoRI. Затем E. coli JM109 трансформировали этой смесью для лигирования, отбирали штамм среди устойчивых к ампициллину штаммов, который имел желаемую плазмиду, и эта плазмида была названа pTrp1. Затем pKK223-3 (Amersham-Pharmacia) обрабатывали HindIII/HincII, и полученный ДНК-фрагмент, содержащий терминатор rrnB, лигировали с продуктом обработки pTrp1 HindIII/PvuII. Затем E. coli JM109 трансформировали этой смесью для лигирования, отбирали штамм среди устойчивых к ампициллину штаммов, который имел эту желаемую плазмиду, и эта плазмида была названа pTrp2. Затем район промотора trp амплифицировали с использованием ПЦР с pTrp2 в качестве матрицы и олигонуклеотидов, показанных в таблице, в качестве праймеров (комбинация SEQ ID NO:10 и 12). Этот ДНК-фрагмент обрабатывали Eco0109I/NdeI и лигировали с продуктом обработки pTrp2 Eco0109I/NdeI. Затем E. coli трансформировали этой смесью для лигирования, отбирали штамм среди устойчивых к ампициллину штаммов, который имел эту желаемую плазмиду, и эта плазмида была названа pTrp4.
Праймер
(2) Конструирование экспрессирующих ген альдолазы плазмид ptrpALD1 и ptrpALD2 и экспрессия в E. coli
Фрагмент, амплифицированный из хромосомной ДНК P. taetrolens ATCC4683 с использованием праймеров, показанных в таблице 9 (SEQ ID NO:9 и 13), расщепляли NdeI/HindIII для конструирования плазмиды ptrpALD1 и встраивали в сайт NdeI/HindIII pTrp4. Эта плазмида экспрессирует ген альдолазы, имеющей аминокислотную последовательность SEQ ID NO:3, транслируемую от 444-ого ATG в нуклеотидной последовательности SEQ ID NO:1 в качестве инициирующего кодона. Кроме того, фрагмент, амплифицированный из хромосомной ДНК P. taetrolens ATCC4683 с использованием праймеров (SEQ ID NO:9 и 14), расщепляли NdeI/HindIII для конструирования плазмиды ptrpALD2 и встраивали в сайт NdeI/HindIII pTrp4. Эта плазмида экспрессирует ген альдолазы, имеющей аминокислотную последовательность SEQ ID NO:2, транслируемую от 456-ого ATG в нуклеотидной последовательности SEQ ID NO:1 в качестве инициирующего кодона. Каждую из сконструированных экспрессионных плазмид вводили в E. coli JM109, и эти трансформанты культивировали при 37°С в течение ночи в LB-среде, содержащей 50 мкг/мл ампициллина (предварительное культивирование). Эту предварительную культуру инокулировали при 1% в 50 мл LB-среды с последующим культивированием при 37°С. Клетки микроорганизмов собирали, промывали и суспендировали в 1 мл 20 мМ Трис-HCl (рН 7,6) с последующим разрушением клеток микроорганизмов с использованием Multi-Beads Shocker (Yasui Kikai Corporation). Затем неочищенный экстракт центрифугировали при 15000 об/мин в течение 10 минут и полученный супернатант использовали в качестве раствора неочищенного фермента.
Праймер
При измерении альдолазной активности с использованием неочищенного фермента и PHOG в качестве субстрата, в противоположность альдолазной активности в отношении PHOG, не детектируемой в E. coli, несущей pTrp4 (контроле), PHOG-альдолазную активность 16,1 Е/мг белка детектировали в штамме, несущем ptrpALD1, тогда как PHOG-альдолазную активность 36,0 Е/мг белка детектировали в штамме, несущем ptrpALD2. В результате независимо от того, какую альдолазу, имеющую аминокислотную последовательность SEQ ID NO:2 или 3, использовали, обе альдолазы демонстрировали наличие альдолазной активности.
Пример 3
Клонирование IHOG-альдолазы, полученной из штамма Pseudomonas coronafaciens AJ2791
(1) Получение хромосомной ДНК
Штамм P. coronafaciens AJ2791 культивировали при 30°С в течение ночи с использованием 50 мл бульонной среды (предварительное культивирование). 5 мл этой культуры инокулировали в 50 мл бульонной среды. После культивирования до поздней фазы логарифмического роста 50 мл культуры центрифугировали (12000хg, 4°С, 15 минут) для извлечения микроорганизмов. Затем хромосомную ДНК получали в соответствии с установленными способами с использованием этих клеток микроорганизмов.
(2) Клонирование полноразмерного гена посредством анализа по Саузерну и гибридизации колоний
Клонирование гена IHOG-альдолазы, полученного из штамма P. coronafaciens AJ2791 (далее, "PcALD"), выполняли с использованием анализа гибридизации по Саузерну и гибридизации колоний с геном IHOG-альдолазы, полученным из штамма P. taetrolens ATCC4683, в качестве зонда. Полноразмерный ген IHOG-альдолазы амплифицировали при помощи ПЦР из хромосомной ДНК P. taetrolens ATCC4683 с использованием праймеров ALD-5'Nde-1 (SEQ ID NO:13) и ALD-3'Hind (SEQ ID NO:9), показанных в таблице 9. Затем полноразмерный ген получали анализом по Саузерну и гибридизацией колоний с этим амплифицированным ДНК-фрагментом в качестве зонда. ДНК-зонд получали с использованием набора DIG High Prime (Roche Diagnostics K.K.), инкубированием в течение ночи (т.е. О/N) при 37°С в соответствии с руководством-инструкцией для мечения этого зонда. Анализ гибридизации по Саузерну выполняли в соответствии с руководством полным расщеплением 1 мкг хромосомной ДНК штамма P. coronafaciens AJ2791 каждым типом рестриктазы, электрофорезом в 0,8% агарозном геле и блоттингом на найлоновую мембрану. Гибридизацию выполняли с использованием набора DIG Easy Hyb (Roche Diagnostics K.K.) предгибридизацией при 37°С в течение 1 часа, добавлением зонда и затем гибридизацией в течение ночи при 37°С. Мембрану промывали дважды при комнатной температуре в течение 5 минут при помощи 2×SSC и затем промывали дважды при 37°С в течение 15 минут с использованием 0,1×SSC. Полосы детектировали с использованием набора для детектирования нуклеотидов Dig Nucleotide Detection. В результате детектировали PstI/HindIII-фрагмент размером 2,2 т.п.н., который гибридизовался с этим зондом. Затем, этот PstI/HindIII-фрагмент получали гибридизацией колоний. 20 мкг хромосомной ДНК обрабатывали PstI/HindIII с последующим подверганием электрофорезу в агарозном геле и извлечением фрагмента, размер которого был приблизительно 2,2 т.п.н.. Затем его лигировали в плазмиду pUC118, обработанную PstI/HindIII, с получением библиотеки в E. coli JM109. Затем эти колонии переносили на найлоновый мембранный фильтр (Hybond-N, Amersham) с последующей обработкой для щелочной денатурации, нейтрализации и иммобилизации. Гибридизацию выполняли с использованием набора DIG Easy Hyb. Этот найлоновый мембранный фильтр погружали в буфер и предварительно гибридизовали при 37°С в течение 1 часа. Затем добавляли приготовленный заранее меченый зонд и гибридизовали при 37°С в течение 16 часов. Найлоновый мембранный фильтр промывали дважды при комнатной температуре в течение 5 минут при помощи 2×SSC и затем промывали дважды при 37°С в течение 15 минут при помощи 0,1×SSC. Колонии, которые гибридизовались с этим зондом, детектировали с использованием набора для детектирования нуклеотидов DIG (Roche Diagnostics K.K.). В результате получали клон, который гибридизовался с этим зондом.
При определении нуклеотидной последовательности плазмидной ДНК, извлеченной из этого положительного клона, была обнаружена ORF 744 п.н. и была получена полная длина желаемой альдолазы. Сконструированная плазмида, в которую был встроен ген PcALD, была названа pUCPcALD.
E. coli JM109 трансформировали pUCPcALD и трансформант культивировали при 37°С в течение ночи в LB-среде, содержащей 50 мкг/мл ампициллина (LB-амп-среде) (предварительное культивирование). Полученную таким образом предварительную культуру инокулировали при 1% в 50 мл свежей LB-среды с последующим культивированием при 37°С. IPTG добавляли до конечной концентрации 1 мМ при приблизительно 2 часах после начала культивирования с последующим дополнительным культивированием в течение 3 часов. После культивирования микроорганизмы извлекали, промывали и затем суспендировали в 1 мл 20 мМ Трис-HCl (рН 7,6) с последующим разрушением клеток микроорганизмов с использованием Multi-Beads Shocker (Yasui Kikai Corporation). Затем неочищенный экстракт центрифугировали при 15000 об/мин в течение 10 минут и полученный супернатант использовали в качестве раствора неочищенного фермента.
При измерении альдолазной активности с использованием этого неочищенного фермента и PHOG в качестве субстрата, в противоположность альдолазной активности в отношении PHOG, не детектируемой в E. coli, несущей pUC18 (контроле), PHOG-альдолазную активность 39,3 Е/мг белка детектировали в штамме, несущем pUCALD. В результате было показано, что этот ген кодирует желаемую альдолазу.
Пример 4
Очистка рекомбинантного фермента альдолазы, полученного из штамма Pseudomonas taetrolens ATCC4683
Рекомбинантную альдолазу, полученную из P. taetrolens ATCC4683 (PtALD), очищали, как описано ниже, из растворимой фракции E. coli, которая в высокой степени экспрессирует PtALD. Альдолазную активность определяли измерением альдолазной активности с использованием PHOG в качестве субстрата при следующих условиях.
Условия реакции: 50 мМ Трис-HCl (рН 8,0), 2 мМ PHOG, 0,2 мМ НАД, 0,2 мМ KPi, 1 мМ MgCl2, 16 Е/мл лактатдегидрогеназы и 3 мкл фермента/600 мкл реакционного раствора, оптическая плотность при 340 нм, измеренная при 30°С
(1) Получение растворимой фракции
Петлю клеток E. coli JM109/ptrpALD2, культивируемых при 37°С в течение 16 часов на LB-амп-среде для чашек, выскребали из чашки и инокулировали в тест-пробирку, содержащую 3 мл LB-амп-среды, и проводили культивирование при встряхивании при 37°С в течение 16 часов. Затем 0,5 мл этой культуры инокулировали в десять мерных колб на 500 мл, содержащих 50 мл LB-амп-среды, с последующим культивированием при 37°С в течение 16 часов. Микроорганизмы извлекали из полученной культуры центрифугированием и после промывания суспендированием в буфере А (20 мМ Hepes-КОН (рН 7,6)) опять извлекали центрифугированием. Полученные промытые клетки микроорганизмов суспендировали в 25 мл буфера А и затем разрушали ультразвуком при 4°С в течение 30 минут. Остаток клеток микроорганизмов удаляли из неочищенного экстракта центрифугированием (8000 об/мин, 10 минут × 2 раза), после чего полученный супернатант использовали в качестве неочищенной фракции.
(2) Анионообменная хроматография: Q-Sepharose FF
23 мл этой неочищенной фракции наносили на анионообменную хроматографическую колонку, Q-Sepharose FF 26/10 (Pharmacia, CV=20 мл), уравновешенную буфером А, и адсорбировали на этот носитель. После вымывания всех несвязанных белков буфером А PtALD элюировали с использованием линейного градиента концентрации KCl от 0 М до 0,7 М (всего: 140 мл). Альдолазную активность в отношении PHOG наблюдали во фракции, эквивалентной приблизительно 0,5 М.
(3) Гидрофобная хроматография: Phenyl Sepharose HP HR 16/10
Фракцию, в которой была детектирована альдолазная активность, диализовали при 4°С в течение ночи против буфера В (20 мМ Hepes-KOH (рН 7,6), 1 М сульфат аммония, рН 7,6) и затем фильтровали полученный супернатант с использованием фильтра 0,45 мкм. Полученный фильтрат наносили на гидрофобную хроматографическую колонку, Phenyl Sepharose HP HR 16/10 (Pharmacia), уравновешенную буфером В. Эта процедура приводила к альдолазе, адсорбированной на этот носитель.
После вымывания всех несвязанных белков буфером В альдолазу элюировали с использованием линейного градиента концентрации сульфата аммония от 1 М до 0 М. Альдолазную активность детектировали во фракции элюции, где концентрация сульфата аммония была приблизительно 0,2 М.
При подвергании фракции, очищенной в соответствии с хроматографическими процедурами, описанными выше, электрофорезу в ДСН-ПААГ наблюдали единственную полосу в положении, соответствующем приблизительно 25 кДа, согласно окрашиванию СВВ. Полученный раствор рекомбинантной PtALD диализовали при 4°С в течение ночи против буфера А. В результате этой процедуры получали 17 мл раствора PtALD с 350 Е/мл.
Пример 5
Очистка рекомбинантного фермента альдолазы, полученного из штамма Pseudomonas coronafaciens AJ2791
Рекомбинантную альдолазу, полученную из Р. coronafaciens AJ2791 (PcALD), очищали из растворимой фракции E. coli, которая в высокой степени экспрессирует PcALD.
Петлю клеток E. coli JM109/pUCPcALD, культивируемых при 37°С в течение 16 часов на LB-амп-среде для чашек, выскребали из чашки и инокулировали в тест-пробирку, содержащую 3 мл LB-амп-среды, и проводили культивирование при встряхивании при 37°С в течение 16 часов. Затем 0,5 мл этой культуры инокулировали в семь мерных колб на 500 мл, содержащих 50 мл LB-амп-среды (+0,1 мМ IPTG), с последующим культивированием при 37°С в течение 16 часов. Микроорганизмы извлекали из полученной культуры центрифугированием и после промывания суспендированием в буфере А (20 мМ Hepes-КОН (рН 7,6)) опять извлекали центрифугированием. Полученные промытые клетки микроорганизмов суспендировали в 30 мл буфера А и затем разрушали ультразвуком при 4°С в течение 30 минут. Остаток клеток микроорганизмов удаляли из неочищенного экстракта центрифугированием (8000 об/мин, 10 минут × 2 раза), после чего полученный супернатант использовали в качестве неочищенной фракции.
Полученную фракцию неочищенного экстракта очищали хроматографией с использованием той же самой процедуры, какую использовали в очистке рекомбинантной PtALD, описанной в примере 4. При подвергании фракции, очищенной в двухстадийной процедуре хроматографии с использованием Q-Sepharose и Phenyl Superose, электрофорезу в ДСН-ПААГ наблюдали единственную полосу в положении, соответствующем приблизительно 25 кДа, при окрашивании СВВ. Полученный раствор рекомбинантной PcALD диализовали при 4°С в течение ночи против буфера А. В результате вышеуказанной процедуры получали 10 мл раствора PcALD 108 Е/мл.
Пример 6
Синтез 4-(индол-3-илметил)-4-гидрокси-2-оксоглутарата из индол-3-пировиноградной кислоты и пировиноградной кислоты с использованием PtALD и PcALD
4-(индол-3-илметил)-4-гидрокси-2-оксоглутарат (IHOG) синтезировали из индол-3-пировиноградной кислоты и пировиноградной кислоты с использованием PtALD и PcALD, полученных в примерах 4 и 5, в качестве источников фермента. Количество IHOG определяли при помощи ВЭЖХ-анализа с использованием колонки "Inertsil ODS-2" (GL Sciences Inc., 5 мкм, 4,6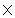 250 мм). Условия анализа указаны ниже.
250 мм). Условия анализа указаны ниже.
Подвижная фаза: 40% (об./об.) ацетонитрил/5 мМ раствор дигидрофосфата тетрабутиламмония
Скорость тока: 1 мл/мин
Температура колонки: 40°С
Детектирование: 210 нм УФ
PtALD и PcALD добавляли при 1,8 Е/мл и 0,8 Е/мл соответственно к реакционному раствору, состоящему из 100 мМ Hepes-КОН-буфера (рН 8,5), 50 мМ индол-3-пировиноградной кислоты, 250 мМ пировиноградной кислоты и 1 мМ - 5 мМ MgCl2, и давали взаимодействовать при 33°С в течение 4 часов. Реакционный раствор фермента подходящим образом разбавляли и определяли количество образованного IHOG. В результате IHOG мог быть образован этими альдолазами.
Пример 7
Ферментативный синтез различных замещенных α-кетокислот с использованием PtALD
Активность альдольной конденсации пировиноградной кислоты измеряли для различных субстратов, показанных в таблице 11, с использованием PtALD, полученного в примере 4. Готовили реакционный раствор, состоящий из 100 мМ глицин-NaOH (рН 9), 50 мМ субстрата, 250 мМ пирувата натрия, 1 мМ MgCl2 и 0,1 мг/мл PtALD, и инкубировали при 33°С в течение 2 часов. Полученный реакционный раствор подвергали ультрафильтрации с использованием ультрафильтрационной мембраны Microcon 10 (Amicon) для фракции молекулярной массы 10000. 2 мкл фильтрата разбавляли в 200 мкл смеси 50% ацетонитрил/0,1% водный раствор аммиака с последующим ESI/MS-анализом.
В результате детектировали пики в соответствующих величинах m/z для субстратов, показанных в таблице 12, что свидетельствовало о том, что были образованы желаемые альдольные конденсаты пировиноградной кислоты.
Альдольные конденсаты пировиноградной кислоты для различных субстратов с использованием PtALD
(вычислено)
(измерено)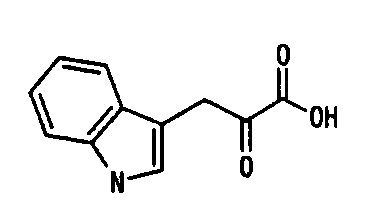
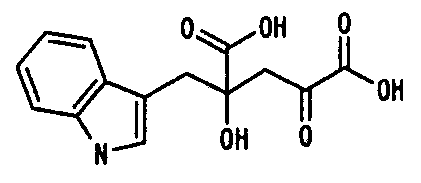

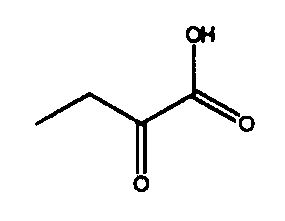

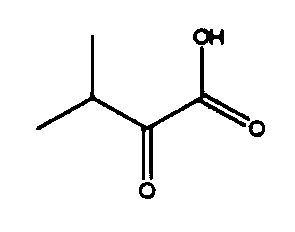

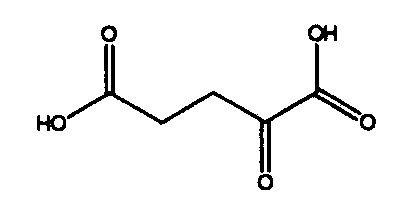

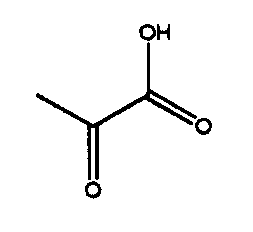


Альдольные конденсаты пировиноградной кислоты для различных субстратов с использованием PtALD
(вычислено)
(измерено)

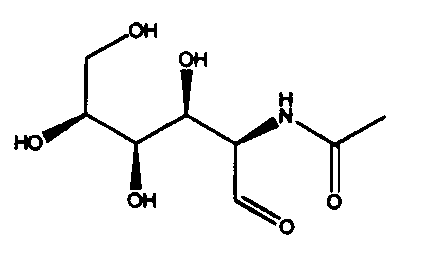

Пример 8
Ферментативные свойства PtALD
Проводили исследование в отношении следующих параметров, касающихся PtALD, полученной в примере 4.
Базовые (стандартные) условия реакции: 50 мМ Hepes-KOH (рН 8,0), 2 мМ PHOG, 5 мМ MgCl2, 3 мМ КРВ (калий-фосфатный буфер) (рН 8), 16 Е/мл лактатдегидрогеназы, измерение оптической плотности при 340 нм при 30°С
(1) Константы кинетики при использовании PHOG в качестве субстрата
Vmax (для PHOG)=91,7 мкмоль/мин/мг, Km (для PHOG)=0,10 мМ, Km (для MgCl2)=0,019 мМ и Ка (для KPi)=0,95 мМ были соответственно определены из результатов, показанных на фигурах 2-4. Альдолазная активность увеличивалась в 2,7 раза по сравнению с партией без добавления после добавления 1 мМ MgCl2 и увеличивалась в 2 раза по сравнению с партией без добавления после добавления 5 мМ КРВ.
(2) рН-стабильность
рН-стабильность измеряли на протяжении диапазона рН 3 - 11. Используемыми для измерения буферами были следующие буферы: натрий-ацетатный буфер (рН 3, 4, 5, 6), калий-фосфатный буфер (рН 5, 6,5, 7, 7,5), Трис-HCl-буфер (рН 7, 7,5, 8, 8,5), глицин-NaOH-буфер (рН 9, 9,5, 10), CAPS-NaOH-буфер (рН 10, 10,5, 11). Остаточную активность после инкубирования PtALD при 37°С в течение 30 минут в каждом из этих буферных растворов при концентрации 100 мМ измеряли при базовых условиях реакций. Эти результаты показаны на фиг.5.
(3) Термоустойчивость
Остаточную активность измеряли при базовых условиях реакций после инкубирования PtALD при 25-70°С в течение 30 минут в 100 мМ калий-фосфатном буфере (рН 7,0) и 100 мМ глицин-NaOH-буфере (рН 9,0). Эти результаты показаны на фиг.6.
Пример 9
Синтез замещенной α-кетокислоты с использованием PtALD
Активность альдольной конденсации PtALD, полученной в примере 4, измеряли с использованием ацетальдегида и α-кетобутирата. Готовили реакционный раствор, состоящий из 100 мМ глицин-NaOH (рН 9), 50 мМ ацетальдегида, 250 мМ α-кетобутирата, 1 мМ MgCl2 и 0,1 мг/мл PtALD, и его инкубировали при 33°С в течение 16 часов. Полученный реакционный раствор подвергали ультрафильтрации с использованием ультрафильтрационной мембраны Microcon 10 (Amicon) для фракции молекулярной массы 10000. 10 мкл фильтрата разбавляли в 200 мкл смеси 50% ацетонитрил/0,1% водный раствор аммиака с последующим ESI/MS-анализом (анализом масс-спектрометрии с ионизацией распылением электронов).
В результате в противоположность точной массе (рассчитанной величине) предсказанного продукта 146,06 детектировали пик (m/z=+146,8) величины m/z, соответствующий [M+H], что подтверждало образование желаемого альдольного конденсата в соответствии с реакцией, показанной ниже.

Ссылочный пример 1
Синтез 4-гидрокси-4-(3-индолилметил)-2-кетоглутарата (IHOG)
7,50 г (35,8 ммоль, содержание: 97,0 мас.%) индол-3-пировиноградной кислоты и 14,18 г (107,4 ммоль) щавелевоуксусной кислоты добавляли к 64,45 мл водного раствора, содержащего 18,91 г (286,5 ммоль, содержание: 85 мас.%) гидроксида калия, и растворяли. Затем этот смешанный раствор перемешивали при 35°С в течение 24 часов.
Кроме того, этот смешанный раствор нейтрализовали (рН 7,0) добавлением 40,0 мл 3 н. хлористоводородной кислоты с получением 153,5 г нейтрализованного реакционного раствора. Этот нейтрализованный реакционный раствор содержал 5,55 г 4-гидрокси-4-(3-индолилметил)-2-кетоглутарата, и выход был 53,3% (в отношении индолпировиноградной кислоты).
К этому нейтрализованному реакционному раствору добавляли воду для доведения объема до 168 мл и затем его пропускали через колонку со смолой (диаметр: 4,8 см), заполненную 840 мл синтетического адсорбента (DIAION-SP207, Mitsubishi Chemical Corporation). Кроме того, через эту колонку пропускали воду при скорости тока 23,5 мл/мин и посредством извлечения продукта из 1,73-2,55 (L/L-R) получали водный раствор, содержащий 3,04 г высокоочищенного 4-гидрокси-4-(3-индолилметил)-2-кетоглутарата с выходом 54,7% (относительно количества, загруженного в колонку).
(Измерение ЯМР)
1Н-ЯМР (400 МГц, D2O): 3,03(д, 1Н, J=14,6 Гц), 3,11 (д, 1Н, J=14,6 Гц), 3,21 (д, 1Н, J=18,1 Гц), 3,40 (д, 1Н, J=18,1 Гц), 7,06-7,15 (м, 3Н), 7,39 (д, 1Н, J=7,8 Гц), 7,66 (д, 1Н, J=7,8 Гц)
13С-ЯМР (100 МГц, D2O): 35,43, 47,91, 77,28, 109,49, 112,05, 119,44, 119,67, 121,91, 125,42, 128,41, 136,21, 169,78, 181,43, 203,58.
Ссылочный пример 2
Синтез 4-фенилметил-4-гидрокси-2-кетоглутарата (PHOG)
5,0 г (30,5 ммоль) фенилпировиноградной кислоты и 12,1 г (91,4 ммоль) щавелевоуксусной кислоты добавляли к 25 мл воды, в которой растворяли 13,8 г гидроксида калия (чистота: 85%), и полученной смеси давали реагировать при комнатной температуре в течение 72 часов. Затем величину рН этого реакционного раствора доводили до 2,2 концентрированной хлористоводородной кислотой с последующей экстракцией этилацетатом. После промывания органического слоя насыщенным водным раствором NaCl и сушки безводным сульфатом магния и затем концентрирования получали остаток. Этот остаток перекристаллизовывали из этилацетата и толуола с получением 2,8 г (11,3 ммоль) 4-фенилметил-4-гидрокси-2-кетоглутарата в форме кристаллов.
(Измерение ЯМР)
1Н-ЯМР (D2O) δ: 2,48 (д, J=14,4 Гц, 0,18Н), 2,60 (д, J=14,4 Гц, 0,18Н), 2,85-3,30 (м, 3,64Н), 7,17-7,36 (м, 5Н)
(Измерение молекулярной массы)
Рассчитанная величина ESI-MS (масс-спектрометрии с ионизацией распылением электронов) для С12Н12О6=252,23, аналитическая величина=251,22 (МН-)
ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
Альдолаза данного изобретения является новой альдолазой, которая катализирует реакцию альдольной конденсации индолпировиноградной кислоты и пировиноградной кислоты (или щавелевоуксусной кислоты), и может быть выгодным образом использована для синтеза 4-(индол-3-илметил)-4-гидрокси-2-оксоглутарата (IHOG), который применим в качестве промежуточного продукта в синтезе монатина.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНОГО ГЛЮТАМАТА (ВАРИАНТЫ) И СПОСОБ ПОЛУЧЕНИЯ МОНАТИНА | 2002 |
|
RU2280078C2 |
| СПОСОБ ПОЛУЧЕНИЯ ИНДОЛ-3-ПИРОВИНОГРАДНОЙ КИСЛОТЫ И ЕЕ ПРОИЗВОДНЫХ | 2006 |
|
RU2325442C2 |
| НОВАЯ АЛЬДОЛАЗА И СПОСОБ ПОЛУЧЕНИЯ ОПТИЧЕСКИ АКТИВНЫХ IHOG И МОНАТИНА | 2005 |
|
RU2313579C2 |
| НОВАЯ АЛЬДОЛАЗА, ДНК, КОДИРУЮЩАЯ АЛЬДОЛАЗУ, КЛЕТКИ, ТРАНСФОРМИРОВАННЫЕ ДНК, СПОСОБ ПОЛУЧЕНИЯ АЛЬДОЛАЗЫ И СПОСОБ ПОЛУЧЕНИЯ 4-ГИДРОКСИ-L-ИЗОЛЕЙЦИНА (ВАРИАНТЫ) | 2006 |
|
RU2338784C2 |
| НОВАЯ ЛИЗИНДЕКАРБОКСИЛАЗА И СПОСОБ ПОЛУЧЕНИЯ КАДАВЕРИНА С ЕЕ ИСПОЛЬЗОВАНИЕМ | 2016 |
|
RU2699516C2 |
| УСТОЙЧИВЫЕ К ЦИАНИДАМ НИТРИЛГИДРАТАЗЫ | 2005 |
|
RU2385876C2 |
| НИТРИЛГИДРАТАЗА ИЗ Rhodococcus | 2005 |
|
RU2385932C2 |
| СПОСОБ ПРОДУКЦИИ 2-АМИНО-3-МЕТИЛ-4-КЕТОПЕНТАНОАТА | 2007 |
|
RU2392323C2 |
| СПОСОБ ПОЛУЧЕНИЯ МОНАТИНА | 2011 |
|
RU2505606C2 |
| МУТАНТ ПРОМОТОРА ГЕНА ПИРУВАТКАРБОКСИЛАЗЫ И ЕГО ПРИМЕНЕНИЕ | 2021 |
|
RU2812048C1 |

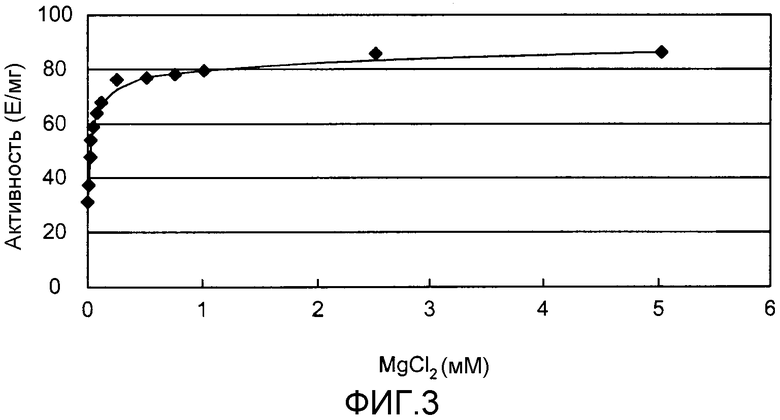
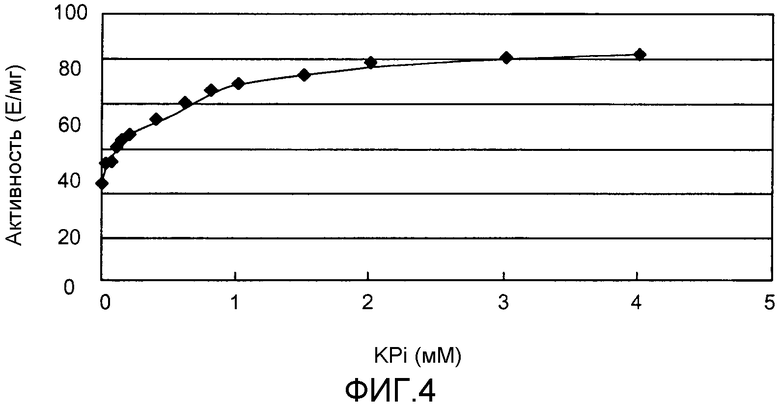


Изобретение относится к биотехнологии и представляет собой новую альдолазу, которая катализирует реакцию получения замещенной альфа-кетокислоты из щавелевоуксусной или пировиноградной кислоты и индол-3-пировиноградной кислоты. Изобретение позволяет получать кетокислоты с высокой степенью эффективности. 15 н. и 4 з.п. ф-лы, 6 ил., 12 табл.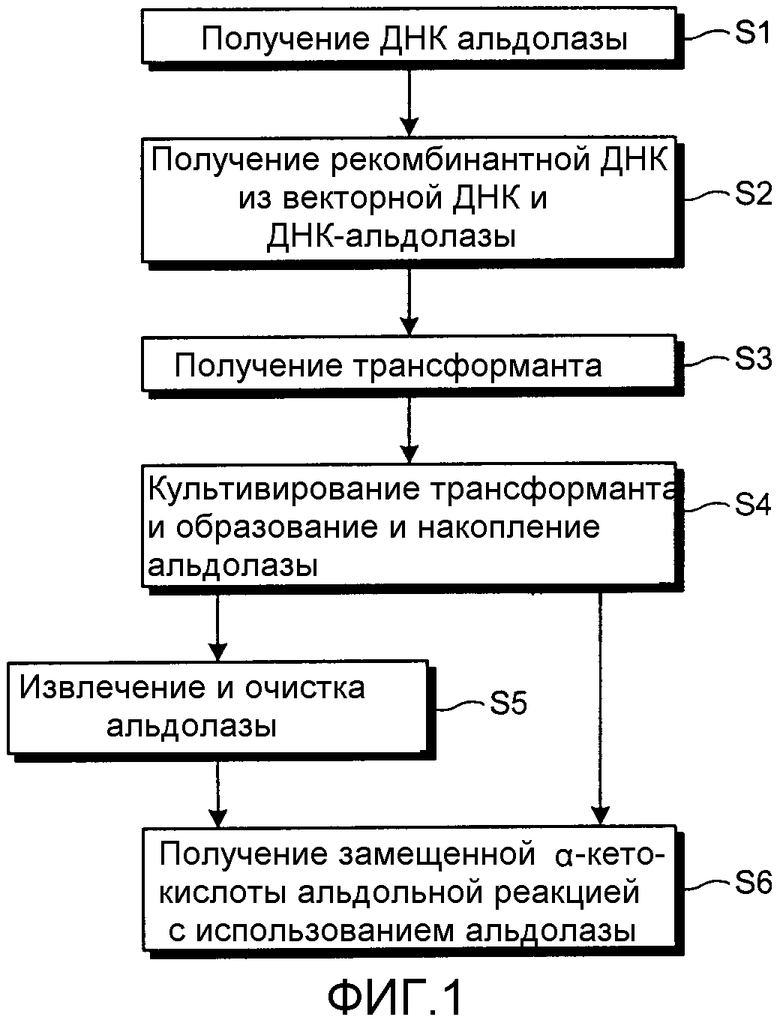
(a) ДНК, содержащей нуклеотидную последовательность SEQ ID NO: 1 или последовательность нуклеотидных оснований с номерами 444-1118 или номерами 456-1118 той же самой последовательности; и
(b) ДНК, которая гибридизуется в жестких условиях с ДНК, имеющей нуклеотидную последовательность, комплементарную нуклеотидной последовательности SEQ ID NO: 1 или последовательности нуклеотидных оснований с номерами 444-1118 или номерами 456-1118 той же самой последовательности.
(c) ДНК, которая кодирует белок, обладающий альдолазной активностью, содержащий аминокислотную последовательность SEQ ID NO: 2 или последовательность аминокислотных остатков с номерами 5-225 той же самой последовательности;
(d) ДНК, которая кодирует белок, обладающий альдолазной активностью, имеющий аминокислотную последовательность, которая содержит замену, делецию, инсерцию, добавление или инверсию одного или нескольких аминокислотных остатков последовательности SEQ ID NO: 2 или последовательности аминокислотных остатков с номерами 5-225 той же самой последовательности.
(e) ДНК, содержащей нуклеотидную последовательность SEQ ID NO: 15 или последовательность нуклеотидных оснований с номерами 398-1141 той же самой последовательности; и
(f) ДНК, которая гибридизуется в жестких условиях с ДНК, имеющей нуклеотидную последовательность, комплементарную нуклеотидной последовательности SEQ ID NO: 15 или последовательности нуклеотидных оснований с номерами 398-1141 той же самой последовательности.
(g) ДНК, которая кодирует белок, обладающий альдолазной активностью, содержащий аминокислотную последовательность SEQ ID NO: 16;
(h) ДНК, которая кодирует белок, обладающий альдолазной активностью, имеющий аминокислотную последовательность, которая содержит замену, делецию, инсерцию, добавление или инверсию одного или нескольких аминокислотных остатков последовательности SEQ ID NO: 16.
культивирование клеток по п.6 в среде и накопление белка, имеющего альдолазную активность, либо в среде, либо в клетках, либо и в среде, и в клетках.
(i) белок, обладающий альдолазной активностью, содержащий аминокислотную последовательность SEQ ID NO: 2 или последовательность аминокислотных остатков с номерами 5-225 той же самой последовательности;
(j) белок, обладающий альдолазной активностью, который имеет аминокислотную последовательность, которая содержит замену, делению, инсерцию, добавление или инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO: 2 или последовательности аминокислотных остатков с номерами 5-225 той же самой последовательности.
(k) белок, обладающий альдолазной активностью, содержащий аминокислотную последовательность SEQ ID NO: 16;
(l) белок, обладающий альдолазной активностью, который имеет аминокислотную последовательность, которая содержит замену, делецию, инсерцию, добавление или инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO: 16.
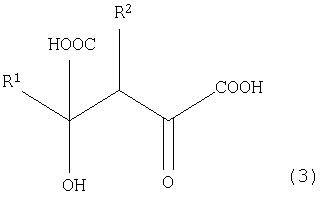
где R1 представляет собой атом водорода, алкильную группу, имеющую 1-8 атомов углерода, алкоксильную группу, имеющую 1-8 атомов углерода, карбоксиалкильную группу, имеющую 2-9 атомов углерода, арильную или аралкильную группу, имеющую до 20 атомов углерода, содержащую гетероцикл углеводородную группу, имеющую до 11 атомов углерода, гидроксильную группу или ее сложноэфирное производное, и R1 может быть замещен, по меньшей мере, одним заместителем, выбранным из группы, состоящей из атома галогена, гидроксильной группы, алкильной группы, имеющей до 3 атомов углерода, алкоксигруппы, имеющей до 3 атомов углерода, и аминогруппы;
R2 представляет собой атом водорода, карбоксильную группу, алкильную группу, имеющую 1-8 атомов углерода, алкоксильную группу, имеющую 1-8 атомов углерода, карбоксиалкильную группу, имеющую 2-9 атомов углерода, арильную или аралкильную группу, имеющую до 20 атомов углерода, содержащую гетероцикл углеводородную группу, имеющую до 11 атомов углерода, гидроксильную группу или ее сложноэфирное производное, и R2 может быть замещен, по меньшей мере, одним заместителем, выбранным из группы, состоящей из атома галогена, гидроксильной группы, алкильной группы, имеющей до 3 атомов углерода, алкоксигруппы, имеющей до 3 атомов углерода и аминогруппы; и, когда R1 представляет собой атом водорода, метильную группу или карбоксиметильную группу в общей формуле (1), R2 не представляет собой атом водорода,
предусматривающий реакцию замещенной α-кетокислоты, представленной общей формулой (1)
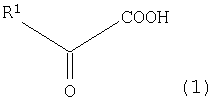
где R1 имеет то же значение, что и R1 в общей формуле (3),
с замещенной α-кетокислотой, представленной общей формулой (2)
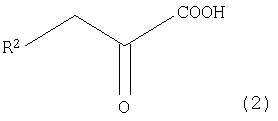
где R2 имеет значение, определенное в общей формуле (3);
где эту реакцию проводят в присутствии белка по п.8 или 9, который катализирует эту реакцию.

из щавелевоуксусной кислоты, или пировиноградной кислоты и индол-3-пировиноградной кислоты, где эту реакцию проводят в присутствии белка по п.8 или 9, который катализирует эту реакцию.
(i) белок, содержащий аминокислотную последовательность SEQ ID NO: 2 или последовательность аминокислотных остатков с номерами 5-225 той же последовательности;
(j) белок, который имеет аминокислотную последовательность, которая содержит замену, делецию, инсерцию, добавление или инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO: 2 или последовательности аминокислотных остатков с номерами 5-225 той же последовательности, и имеет альдолазную активность;
(k) белок, содержащий аминокислотную последовательность SEQ ID NO: 16;
(l) белок, который имеет аминокислотную последовательность, которая содержит замену, делецию, инсерцию, добавление или инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO: 16, и имеет альдолазную активность.

где R1 представляет собой атом водорода, алкильную группу, имеющую 1-8 атомов углерода, алкоксильную группу, имеющую 1-8 атомов углерода, карбоксиалкильную группу, имеющую 2-9 атомов углерода, арильную или аралкильную группу, имеющую до 20 атомов углерода, содержащую гетероцикл углеводородную группу, имеющую до 11 атомов углерода, гидроксильную группу или ее сложноэфирное производное, R3 представляет собой атом водорода или карбоксильную группу и R1 может быть замещен, по меньшей мере, одним заместителем, выбранным из группы, состоящей из атома галогена, гидроксильной группы, алкильной группы, имеющей до 3 атомов углерода, алкоксигруппы, имеющей до 3 атомов углерода и аминогруппы; и R4 представляет собой атом водорода, карбоксильную группу, алкильную группу, имеющую 1-8 атомов углерода, алкоксильную группу, имеющую 1-8 атомов углерода, карбоксиалкильную группу, имеющую 2-9 атомов углерода, арильную или аралкильную группу, имеющую до 20 атомов углерода, содержащую гетероцикл углеводородную группу, имеющую до 11 атомов углерода, гидроксильную группу или ее сложноэфирное производное, и R4 может быть замещен, по меньшей мере, одним заместителем, выбранным из группы, состоящей из атома галогена, гидроксильной группы, алкильной группы, имеющей до 3 атомов углерода, алкоксигруппы, имеющей до 3 атомов углерода и аминогруппы,
предусматривающий реакцию соединения, представленного общей формулой (1')
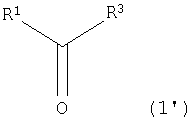
где R1 и R3 имеют значения, определенные в общей формуле (3'),
с замещенной α-кетокислотой, представленной общей формулой (2')

где R4 имеет значение, определенное в общей формуле (3');
где эту реакцию выполняют в присутствии белка по п.8 или 9.
Приоритеты:
пп.5 и 7 в части, зависящей от пп.1 и 2;
пп.10-19 в части, зависящей от п.8.
пп.5-7 в части, зависящей от пп.3 и 4;
пп.10-19 в части, зависящей от п.9.
| MARUYAMA К | |||
| et.al | |||
| Cloning, sequencing and expression of the gene encoding 4-hydroxy-4-methyl-2-oxoglutarate aldolase from Pseudomonas ochraceae NGJ1 | |||
| Biosci Biotechnol Biochem | |||
| Перекатываемый затвор для водоемов | 1922 |
|
SU2001A1 |
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
| Способ получения -кетокарбоновой кислоты | 1977 |
|
SU793376A3 |
Авторы
Даты
2007-10-10—Публикация
2003-08-26—Подача