Область техники, к которой относится изобретение
Настоящее изобретение относится к области химии биологически активных соединений из группы гетероциклических соединений и к фармацевтической промышленности, представлены новые производные аминоалкилпиридинов, способы их получения, фармацевтические композиции, содержащие эти соединения, и их применение для ингибирования биосинтеза холестерина. Новые производные аминоалкилпиридинов согласно настоящему изобретению представляют собой лиганды сигма-рецепторов, ингибиторы биосинтеза холестерина на уровне стерол-Δ7,8-изомеразы и могут быть использованы для лечения гиперхолестеринемии и гиперлипидемии у человека.
Техническая задача
Существует постоянная необходимость в новых биологически активных соединениях, которые ингибируют биосинтез холестерина, в эффективных агентах, оказывающих воздействие против гиперхолестеринемии и гиперлипидемии, и таких, которые являются более целенаправленными при терапии и обладают меньшим побочным действием по сравнению с биологически активными веществами, известными из предшествующего уровня техники.
Предшествующий уровень техники
Поскольку высокое содержание холестерина в крови рассматривают как фактор риска развития атеросклероза, целью многочисленных исследований был поиск лекарственных средств, которые позволили бы снизить содержание холестерина в крови у млекопитающих и таким образом были бы весьма эффективными при лечении гиперхолестеринемии и гиперлипидемии. Было установлено, что одним из способов лечения является снижение биосинтеза холестерина при воздействии ингибиторов биосинтеза холестерина.
Некоторые ингибиторы биосинтеза холестерина, работающие на уровне ингибирования 3-гидрокси-3-метилглутарил-кофермент А редуктазы (HMG-CoA редуктаза), что описано, например, в патентах США US 4231938 (ловастатин), US 4444784 (симвастатин), US 4346227 (правастатин натрий) или US 5273995 (аторвастатин), уже используются в терапии и представляют собой коммерческие препараты мевакор (Mevacor®), синвакор (Sinvacor®), липитор (Lipitor®). Эти ингибиторы HMG-CoA редуктазы, которые также известны под общепринятым названием статины, значительно снижают содержание холестерина в крови.
Производные пиридинэтаноламина, которые могут быть использованы для лечения ожирения и/или диабета, в особенности для лечения ожирения, наблюдающегося у взрослых пациентов, известны из патента US 4800206.
Известно, что сигма-лиганды связываются с сигма-рецепторами, которые имеют структуру, гомологичную структуре стерол-Δ8,7-изомеразы (F.F.Moebius et al., Brit. J. Pharmacol. (1997), 121, 1-C6), и относятся к заключительным стадиям биосинтеза холестерина. Однако нет активных соединений или лекарственных средств, которые могли бы ингибировать биосинтез холестерина на уровне стерол-Δ8,7-изомеразы.
Описание решения технической задачи, включая примеры
Целью настоящего изобретения является нахождение новых активных веществ, которые могли бы значительно снизить содержание холестерина в крови у млекопитающих посредством ингибирования биосинтеза холестерина на завершающих стадиях биосинтеза, то есть на уровне стерол-Δ7,8-изомеразы, осуществляя таким образом более селективное ингибирующее воздействие, чем воздействие известных статинов, которые ингибируют HMG-CoA редуктазу на начальных стадиях биосинтеза холестерина.
Применение новых соединений согласно настоящему изобретению могло бы позволить осуществить более направленное терапевтическое воздействие с меньшими побочными эффектами по сравнению с воздействием биологически активных соединений, уже используемых в медицине.
Поставленная задача решается настоящим изобретением, которое относится к новым производным аминоалкилпиридина, к способам их получения, к фармацевтическим композициям, содержащим эти соединения, и к применению этих соединений в соответствии с настоящим изобретением для лечения гиперхолестеринемии и гиперлипидемии.
Новые аминоалкилпиридины согласно настоящему изобретению представляют собой соединения общей формулы I

в которой n означает целое число от 1 до 4,
R1 представляет собой атом водорода, гидроксильную группу или низшую (С1-С6)алкоксигруппу;
R2 представляет собой атом водорода или (C1-С6)алкильную группу с линейной или разветвленной цепью,
X представляет собой водород, фтор, хлор, бром, гидроксильную группу, трифторметильную группу, 3,4-ди-Cl, 2,4-ди-Cl или низшую (C1-C6)алкоксигруппу,
а также соли этих соединений - продукты присоединения физиологически приемлемых кислот.
Термин низшая алкильная группа относится к низшей алкильной группе с линейной или разветвленной цепью, содержащей 1-6, предпочтительно 1-4, атома углерода (т.е. к группе (C1-С6алкил)), например, такой как метильная, этильная, н-пропильная, изопропильная, н-бутильная и изобутильная группа. Термин низшая алкоксигруппа относится к алкоксигруппе, содержащей 1-6, предпочтительно 1-4, атома углерода (т.е. к группе (C1-С6алкокси)), например, к такой группе, как метокси, этокси, пропокси, изопропокси, бутокси и изобутокси.
Соединения формулы I образуют соли с кислотами и такие соли входят в объем настоящего изобретения. Примеры таких солей включают соли, образованные с физиологически совместимыми минеральными кислотами, например, такими как хлороводородная кислота, бромоводородная кислота, фосфорная кислота, или с органическими кислотами, например, такими как метансульфоновая кислота, лимонная кислота, щавелевая кислота, малеиновая кислота, бензолсульфоновая кислота и другие кислоты.
Новые соединения согласно настоящему изобретению содержат по меньшей мере один асимметрический атом углерода и могут, таким образом, существовать в виде оптически активных энантиомеров, например, таких как диастереомеры, или в виде рацематов.
Соединения формулы I, в которых n=2 и в которых R1 означает гидроксильную группу, R2 означает метильную или н-пропильную группу и Х означает атом водорода или два атома хлора в положениях 3 и 4 фенильного ядра, являются новыми производными аминоалкилпиридинов и относятся к предпочтительным соединениям согласно настоящему изобретению.
Что касается соединений, указанных выше, то предпочтительными соединениями являются следующие:
1-(3-пиридил)-2-(N-(2-фенилэтил)-N-пропиламино)этанол и его соль - дигидробромид - формулы II (обозначение ВК-31 в описании и на чертежах)

1-(3-пиридил)-2-(N-(2-(3,4-дихлорфенил)этил)-N-метиламино)этанол и его соль - дигидробромид - формулы III (обозначение ВК-33 в описании и на чертежах)

1-(3-пиридил)-2-(N-(2-(3,4-дихлорфенил)этил)-N-пропиламино)этанол и его соль - дигидробромид - формулы IV (обозначение ВК-35 в описании и на чертежах)

и 1-(4-пиридил)-2-(N-(2-(3,4-дихлорфенил)этил)-N-метиламино)этанол и его соль - дигидробромид - формулы V (обозначение ВК-38 в описании и на чертежах)

Из числа вышеупомянутых соединений в особенности предпочтительными в качестве ингибитора биосинтеза холестерина являются соединение 1-(3-пиридил)-2-(N-(2-(3,4-дихлорфенил)этил)-N-пропиламино)этанол и его соль - дигидробромид (ВК-35 · 2HBr), вследствие чего они подходят для лечения гиперхолестеринемии и гиперлипидемии.
Соединения, являющиеся предметом настоящего изобретения, могут быть получены двумя различными способами, которые показаны на приведенной ниже схеме как вариант (а) и вариант (б).
Вариант (а)
алкилирование вторичных аминов формулы VI

в которой R2 является таким, как определено выше, и Z представляет собой группу

где Х является таким, как определено выше,
пиридилоксираном (пиридилэтиленоксидом) формулы VII

с получением аминоалкилпиридинов формулы I и, если это необходимо, последующее превращение этих соединений в их соль - продукт присоединения физиологически приемлемой кислоты.
Вторичные амины формулы VI могут быть получены посредством алкилирования первичных аминов формулы XII

алкилиодидами формулы XIII

в соответствии со следующей схемой реакции:

где заместители R2 и Z являются такими, как определено выше.
Первичные амины формулы XII и алкилиодиды формулы XIII являются известными и коммерчески доступными химическими соединениями.
2-, 3- или 4-Замещенные пиридилоксираны формулы VII, используемые при осуществлении способа алкилирования вторичных аминов формулы VI, получают in situ посредством взаимодействия 2-, 3- или 4-замещенных бромацетилпиридингидробромидов с комплексными гидридами металлов, например, такими как борогидрид натрия, в инертном растворителе, таком как низший алифатический спирт (алканол), например этанол, при температуре, приблизительно равной комнатной температуре.
2-, 3- или 4-Замещенный гидробромид бромацетилпиридина получают взаимодействием исходного 2-, 3- или 4-замещенного ацетилпиридина, который является известным и коммерчески доступным соединением, осуществляя бромирование бромом и бромоводородной кислотой.
Стадию алкилирования вторичных аминов формулы VI пиридилоксираном формулы VII осуществляют при температуре приблизительно от комнатной температуры до температуры образования флегмы реакционной смесью, в инертном растворителе, например таком как низший алифатический спирт (алканол), например этанол.
Полученные неочищенные аминоалкилпиридины формулы I выделяют и очищают в соответствии с общепринятыми методиками, известными из предшествующего уровня техники, предпочтительно посредством колоночной хроматографии.
Вариант (б)
Алкилирование первичных аминов формулы VIII

в которой R2 является таким, как определено выше,
пиридилоксираном формулы VII
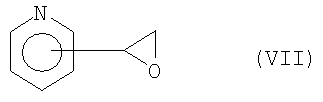
с получением при этом промежуточных соединений формулы IX

где R2 является таким, как определено выше,
и конденсация с производными фенилуксусной кислоты формулы X
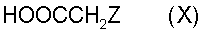
где Z является таким, как определено выше,
с получением при этом промежуточных соединений формулы XI

в которой заместители R2 и Z являются такими, как указано выше,
и их восстановление с получением аминоалкилпиридинов формулы I, и, если это необходимо, последующее превращение их в соли - продукты присоединения физиологически приемлемой кислоты.
Первичные алифатические амины формулы VIII, например, такие как метиламин или н-пропиламин, являются известными и коммерчески доступными химическими соединениями, которые подвергают алкилированию с использованием пиридилоксирана формулы VII в инертном растворителе, таком как низший алифатический спирт (алканол), например этанол, с получением при этом промежуточных соединений формулы IX. Эти промежуточные соединения подвергают конденсации с производными фенилуксусной кислоты формулы X, в которой заместитель Z является таким, как определено выше, в инертном растворителе и при температуре, приблизительно равной комнатной температуре. Могут быть использованы конденсирующие агенты, известные из предшествующего уровня техники, например, такие как дициклогексилкарбодиимид (ДЦГ), а в качестве инертного растворителя, например, метиленхлорид (дихлорметан).
На заключительной стадии синтеза карбонильную группу в новых промежуточных соединениях XI восстанавливают до спиртовой группы. Взаимодействие проводят, используя обычные восстанавливающие агенты, предпочтительно такие, которые подходят для восстановления карбонильной группы в группу -R2HN-СО-. Наиболее подходящим является комплексный гидрид металла, например, такой как LiAlH4, в инертном растворителе, предпочтительно в эфирном растворителе, таком как тетрагидрофуран (ТГФ), диэтиловый эфир, диоксан и подобные растворители. Образующиеся целевые указанные в заголовке аминоалкилпиридины формулы I выделяют и очищают общепринятым образом, предпочтительно посредством колоночной хроматографии на силикагеле, и затем, если это необходимо, их превращают в их соль - продукт присоединения физиологически приемлемой кислоты.
Способы получения новых производных аминоалкилпиридина формулы I в соответствии с вариантами (а) и (б) показаны на фиг.5.
Синтез новых производных аминоалкилпиридинов формулы I, в которой R1 означает атом водорода, могут быть осуществлен таким образом, что новые соединения формулы I в соответствии с настоящим изобретением, в которых R1 означает гидроксильную группу, сначала подвергают ацилированию общепринятым образом, например, с использованием ацетангидрида, и затем образующиеся O-ацетилпроизводные каталитически гидрируют в соответствии с общепринятыми методиками, например, с использованием палладия на носителе, таком как сульфат бария, согласно следующему варианту (в):

Согласно другому варианту могут быть получены новые производные аминоалкилпиридина формулы I, в которой R1 представляет собой атом водорода, в соответствии со следующим вариантом (г):

Исходная замещенная в положении 2-, 3- или 4-пиридилуксусная кислота подвергается этерификации общепринятым образом, как это известно из предшествующего уровня техники, например посредством превращения ее в сложный этиловый эфир пиридилуксусной кислоты, который затем восстанавливают с использованием общепринятых восстановителей, предпочтительно таких, которые используют для восстановления сложноэфирной группы в спиртовую группу. Особенно подходящими являются комплексные гидриды металлов, например, такие как литийалюминийгидрид (LiAlH4) в инертном растворителе, предпочтительно в эфирном растворителе, например, таком как диэтиловый эфир, тетрагидрофуран, диоксан и подобные растворители. Получаемые по этой методике 2-, 3- или 4-замещенные пиридилэтанолы превращают в 2-, 3- или 4-замещенные пиридилэтиленхлориды, используя общепринятые хлорирующие агенты, например, такие как тионилхлорид в инертном растворителе, таком как хлороформ. Полученный замещенный пиридилэтиленхлорид используют для алкилирования первичных аминов формулы VI с получением при этом указанных в заголовке производных аминоалкилпиридинов формулы I, в которых R1 означает атом водорода.
В соответствии с целью изобретения оценивают воздействие новых производных аминоалкилпиридина в качестве лигандов сигма-рецепторов на процесс ингибирования биосинтеза холестерина. Используют методику ex vivo введения метаболической метки иммортальных гепатоцитов человека. Радиоактивно меченный ранний предшественник холестерина [3Н] ацетат добавляют к клеткам без добавления или с добавлением сигма-лигандов. Проводят два независимых эксперимента с введением метаболической метки и анализом стерола. Результаты этих двух анализов являются воспроизводимыми и свидетельствуют о том, что тестируемые соединения значительно снижают синтез холестерина.
Что касается новых лигандов сигма-рецепторов, являющихся предметом настоящего изобретения, то наиболее высокий потенциал ингибирования биосинтеза холестерина проявляет соединение 1-(3-пиридил)-2-(N-(2-(3,4-дихлорфенил)этил)-N-пропиламино)этанол в виде соли - дигидробромида (обозначение ВК 35 · 2HBr).
В последнее время было установлено, что сигма-лиганды связываются с сигма-рецепторами, которые имеют структуру, гомологичную структуре стерол-Δ8,7-изомеразы, поскольку они относятся к тому же самому семейству генов. Стерол-Δ8,7-изомераза вносит свой вклад на заключительной стадии биосинтеза холестерина, что следует из сведений, приведенных на фиг.1. На фиг.1 показано, что наиболее часто используемыми субстратами являются Δ8-холестенол и зимостерол, которые отличаются по насыщенности боковой цепи в положении Δ24,25. На фиг.2 показан биосинтез холестерина, где указаны участки воздействия ингибиторов биосинтеза холестерина.
Воздействие новых аминоалкилпиридинов в качестве сигма-лигандов в соответствии с настоящим изобретением является более селективным, чем действие статинов, используемых в терапии, таких как ловастатин или правастатин, которые ингибируют HMG-CoA редуктазу, имеющую отношение к ранней ступени биосинтеза холестерина.
При использовании новых аминоалкилпиридинов, являющихся предметом настоящего изобретения, обеспечивается более селективное воздействие с меньшими побочными эффектами вследствие ингибирования биосинтеза холестерина на последних стадиях процесса его биосинтеза. Следовательно, эти соединения в особенности полезны для лечения гиперхолестеринемии и гиперлипидемии. Такое действие новых аминоалкилпиридинов является совершенно неожиданным и неочевидным, поскольку в медицинской практике и терапии нет соединений, которые могли бы снижать уровень холестерина посредством целевого воздействия на ферменты на заключительных стадиях биосинтеза холестерина.
Применение новых аминоалкилпиридинов формулы I, являющихся предметом настоящего изобретения, в значительной степени снижает повышенный из-за патологии уровень холестерина в крови у получающих лечение пациентов. Дозировка и частота использования зависят от характеристик конкретного лекарственного средства, его биодоступности и фармакокинетических характеристик, а также от состояния пациента.
Фармацевтические препараты содержат активное соединение совместно с физиологически совместимым органическим или неорганическим носителем, например, таким как вода, лактоза, крахмал и его производные, стеарат магния, тальк, растительные масла и подобные вещества. Фармацевтические препараты предпочтительно вводят перорально, например, в виде таблеток, капсул, пилюль, порошков, гранул, растворов, сиропов, суспензий, эликсиров и подобного. Введение также может быть осуществлено парентерально, например, в виде стерильных растворов, суспензий или эмульсий. Фармацевтические препараты могут быть простерилизованы и/или могут включать другие ингредиенты, такие как консерванты, стабилизаторы, эмульгаторы, буферные вещества и другие добавки.
Настоящее изобретение проиллюстрировано приведенными ниже примерами, которые никоим образом не ограничивают объема изобретения.
Пример 1
1-(3-Пиридил)-2-(N-(2-фенилэтил)-N-пропиламино)этанол (ВК 31)
Получение исходных соединений
N-Пропил-(β-фенилэтил)амин
В колбу помещают 1,2 мл (9,5 ммоль) фенилэтиламина, 0,93 мл (9,5 ммоль) н-пропилиодида, 5 мл триэтиламина и 5 мл ТГФ (тетрагидрофуран) и затем реакционную смесь кипятят с обратным холодильником в течение 3,5 часов, после чего охлаждают. Образовавшуюся соль отфильтровывают, полученный раствор упаривают и очищают целевое соединение колоночной хроматографией на силикагеле (силикагель 60, подвижная фаза CHCl3:СН3ОН=10:3). В результате получают 0,62 г (выход 40%) N-пропил-(β-фенилэтил)амина в виде маслянистого вещества (молекулярная масса 163,264, брутто-формула C11H17N).
Гидробромид 3-бромацетилпиридина
К 10 г (82,5 ммоль) 3-ацетилпиридина добавляют 30 мл 48%-ной бромоводородной кислоты. Реакционную смесь нагревают до 70°С и добавляют по каплям 4,2 мл брома при перемешивании. После завершения добавления брома реакционную смесь перемешивают дополнительно в течение 15 минут при той же самой температуре и охлаждают на льду. Образовавшееся кристаллическое соединение отфильтровывают и тщательно промывают ацетоном. В результате получают 21 г (выход 90%) 3-бромацетилпиридина гидробромида, температура плавления составляет 195-200°С.
Получение указанного в заголовке 1-(3-пиридил)-2-(N-(2-фенилэтил)-N-пропиламино)этанола
К 1,01 г (3,6 ммоль) 3-бромацетилпиридина гидробромида добавляют 20 мл абсолютного этанола и 0,5 г (13,2 ммоль) борогидрида натрия. Реакционную смесь перемешивают при 20°С в течение 2 часов, фильтруют и затем к фильтрату, содержащему 3-пиридилоксиран, добавляют 0,96 г (5,9 ммоль) N-пропил-(β-фенилэтил)амина. Полученную реакционную смесь кипятят с обратным холодильником в течение 4 часов и упаривают до получения сухого остатка, к которому добавляют 20 мл хлороформа. Твердую часть отфильтровывают, фильтрат упаривают и образовавшийся маслянистый остаток очищают колоночной хроматографией на силикагеле (силикагель 60, подвижная фаза CHCl3:СН3ОН=10:3). В результате получают 0,56 г (выход 55%) указанного в заголовке соединения в виде маслянистого основания.
0,56 г (2 ммоль) очищенного маслоподобного основания - 1-(3-пиридил)-2-(N-(2-фенилэтил)-N-пропиламино)этанола растворяют в 5 мл ацетона. Полученный раствор охлаждают на льду и при перемешивании добавляют 2,5 мл этанольного раствора бромоводородной кислоты (0,35 г (4,3 ммоль HBr)). К образовавшемуся осадку добавляют 3 мл диэтилового эфира. После перемешивания в течение 2 часов на льду кристаллический продукт отфильтровывают и промывают диэтиловым эфиром. В результате получают 0,7 г (выход 80%) дигидробромида 1-(3-пиридил)-2-(N-(2-фенилэтил)-N-пропиламино)этанола, температура плавления 113-120°С (молекулярная масса 446,238, брутто-формула C18H24N2O · 2HBr).
1Н ЯМР-спектр, D2O, м.д. относительно стандарта DSS (0 м.д.): 8,89, 8,80 (2Н), 8,65, 8,57 (1Н), 8,10 (1H), 7,38 (5H), 5,47 (1Н), 3,7-3,1 (8H), 1,80 (2Н), 0,97 (3Н).
ИК-спектр (таблетка с KBr) приведен на фиг.6.
Пример 2
1-(3-Пиридил)-2-(N-(2-(3,4-дихлорфенил)этил)-N-метиламино)этанол (ВК 33)
Получение 1-(3-пиридил)-2-метиламиноэтанола
К 1,01 г (3,6 ммоль) гидробромида 3-бромацетилпиридина, полученного, как описано в примере 1, добавляют 20 мл абсолютного этанола и 0,5 г (13,2 ммоль) борогидрида натрия, реакционную смесь перемешивают при 20°С в течение 2 часов и фильтруют. К фильтрату, содержащему 3-пиридилоксиран, добавляют 1,3 мл 33%-ного этанольного раствора метиламина и кипятят с обратным холодильником в течение 5 часов. Затем реакционную смесь упаривают до получения сухого остатка и к этому остатку добавляют 20 мл хлороформа. Твердую часть отфильтровывают, фильтрат упаривают и образовавшийся маслянистый остаток очищают колоночной хроматографией на силикагеле (подвижная фаза CHCl3:СН3ОН=10:3). В результате получают 0,33 г (выход 60%) указанного в заголовке соединения в виде маслянистого вещества - основания (молекулярная масса 152,196, брутто-формула C8H12N2O).
Получение 1-(3-пиридил)-2-(N-(2-(3,4-дихлорфенил)ацетил-N-метиламино)этанола
В колбу, содержащую 542 мг (2,6 ммоль) ДЦГ (дициклогексилкарбодиимид) добавляют 2 мл метиленхлорида и затем добавляют по каплям раствор 538 мг (2,6 ммоль) 3,4-дихлорфенилуксусной кислоты в 3 мл метиленхлорида при перемешивании, что приводит к образованию осадка. После перемешивания в течение 5 минут к реакционной смеси добавляют 400 мг (2,6 ммоль) 1-(3-пиридил)-2-метиламиноэтанола и дополнительно перемешивают в течение 1 часа при 20°С. Образовавшийся осадок отфильтровывают и полученный раствор упаривают. Полученный в результате упаривания фильтрат очищают колоночной хроматографией на силикагеле (силикагель 60, подвижная фаза CHCl3:СН3ОН=10:0,5). В результате получают 715 мг (выход 80%) 1-(3-пиридил)-2-(N-(2-(3,4-дихлорфенил)ацетил-N-метиламино)этанола (молекулярная масса 339,224, брутто-формула C16H16N2O2Cl2).
Получение указанного в заголовке 1-(3-пиридил)-2-(N-(2-(3,4-дихлорфенил)этил-N-метиламино)этанола (ВК-33)
В колбу помещают 0,53 г (13,9 ммоль) литийалюминийгидрида (LiAlH4), добавляют 6 мл безводного тетрагидрофурана (ТГФ) и полученную смесь охлаждают на льду. К реакционной смеси добавляют по каплям при перемешивании раствор 1,1 г (3,2 ммоль) 1-(3-пиридил)-2-(N-(2-(3,4-дихлорфенил)ацетил)-N-этиламино)этанола в 10 мл безводного тетрагидрофурана (ТГФ). После завершения добавления реакционную смесь перемешивают дополнительно в течение 1 часа при 20°С, охлаждают на льду и при энергичном перемешивании постепенно добавляют 6,5 мл 15%-ного раствора NaOH и затем 16 мл метиленхлорида (CH2Cl2). Отделяют органическую фазу, высушивают над безводным Na2SO4 и упаривают на роторном испарителе, получая при этом маслянистый остаток, который затем очищают колоночной хроматографией на силикагеле (силикагель 60, подвижная фаза СН3ОН:этилацетат=10:2). В результате получают 0,63 г (выход 60%) указанного в заголовке соединения в виде маслянистого вещества - основания.
Затем 0,60 г (1,84 ммоль) очищенного маслянистого вещества - основания - растворяют в 3,5 мл ацетона. Полученный раствор охлаждают на льду и при перемешивании добавляют 2,4 мл этанольного раствора бромоводородной кислоты (0,328 г HBr; 4,1 ммоль). К образовавшемуся остатку добавляют 2 мл диэтилового эфира. После перемешивания реакционной смеси в течение 2 часов на льду образовавшийся кристаллический продукт отфильтровывают и промывают диэтиловым эфиром. В результате получают 0,72 г (выход 80%) 1-(3-пиридил)-2-(N-(2-(3,4-дихлорфенил)этил)-N-метиламино)этанола дигидробромида, температура плавления 157-161°С (молекулярная масса 487,074, брутто-формула C17H18N2OCl2 · 2HBr).
1Н ЯМР-спектр, D2О, м.д. по отношению к DSS (0 м.д.): 8,90 (1Н), 8,78 (1Н), 8,64 (1Н), 8,10 (1Н), 7,50 (2Н), 7,24 (1Н), 5,50 (1Н), 3,52 (4Н), 3,08 (5Н).
ИК-спектр (таблетка с KBr) приведен на фиг.9.
Пример 3
1-(3-Пиридил)-2-(N-(2-(3,4-дихлорфенил)этил)-N-пропиламино)этанол (ВК-35)
Получение 1-(3-пиридил)-2-пропиламиноэтанола
К 1,01 г (3,6 ммоль) 3-бромацетилпиридина гидробромида, полученного, как описано в примере 1, добавляют 20 мл абсолютного этанола и 0,5 г (13,2 ммоль) борогидрида натрия (NaBH4). Реакционную смесь перемешивают при 20°С в течение 2 часов и фильтруют. К фильтрату, содержащему 3-пиридилоксиран, добавляют 0,7 мл (8,5 ммоль) н-пропиламина и кипятят с обратным холодильником в течение 5 часов. Реакционную смесь затем упаривают до получения сухого остатка, к которому добавляют 20 мл хлороформа, твердую часть отфильтровывают, полученный фильтрат упаривают и образовавшийся маслянистый остаток очищают колоночной хроматографией на силикагеле (силикагель 60, подвижная фаза CHCl3:этилацетат=10:2). В результате получают 0,33 г (выход 50%) 1-(3-пиридил)-2-пропиламиноэтанола в виде маслянистого вещества - основания (молекулярная масса 180,25, брутто-формула C10H16N2O).
Получение 1-(3-пиридил)-2-(N-(2-(3,4-дихлорфенил)ацетил)-N-пропиламино)этанола
В колбу, содержащую 630 мг (3,1 ммоль) ДЦГ (дициклогексилкарбодиимид), добавляют 3 мл метиленхлорида и при перемешивании добавляют по каплям раствор 625 мг (3,1 ммоль) 3,4-дихлорфенилуксусной кислоты в 5 мл метиленхлорида, что приводит к образованию осадка. Реакционную смесь перемешивают в течение 5 минут и затем добавляют к ней 550 мг (3,05 ммоль) 1-(3-пиридил)-2-метиламиноэтанола в 6 мл метиленхлорида, затем перемешивают дополнительно в течение 1 часа при 20°С. Образовавшийся осадок отфильтровывают и раствор упаривают. Полученный при упаривании фильтрат очищают колоночной хроматографией на силикагеле (силикагель 60, подвижная фаза CHCl3:СН3ОН=10:0,5). В результате получают 0,56 г (выход 50%) 1-(3-пиридил)-2-(N-(2-(3,4-дихлорфенил)ацетил)-N-пропиламино)этанола в виде маслянистого вещества (молекулярная масса 367,278, брутто-формула C18H20N2O2Cl2).
Получение указанного в заголовке 1-(3-пиридил)-2-[N-(2-(3,4-дихлорфенил)этил)-N-пропиламино]этанола (ВК-35)
В колбу помещают 0,43 г (11,3 ммоль) литийалюминийгидрида (LiAlH4), добавляют 6 мл безводного тетрагидрофурана (ТГФ) и полученную смесь охлаждают на льду. К реакционной смеси добавляют по каплям при перемешивании раствор 1 г (2,7 ммоль) 1-(3-пиридил)-2-(N-(2-(3,4-дихлорфенил)ацетил)-N-пропиламино)этанола в 10 мл безводного ТГФ. После завершения добавления реакционную смесь дополнительно перемешивают в течение 1 часа при 20°С, охлаждают на льду и при энергичном перемешивании постепенно добавляют 6,4 мл 15% NaOH и затем 16 мл метиленхлорида. Отделяют органическую фазу, высушивают над безводным Na2SO4 и упаривают на роторном испарителе. Полученный в результате упаривания остаток очищают колоночной хроматографией на силикагеле (силикагель 60, первая подвижная фаза CHCl3:СН3ОН=10:0,5; вторая подвижная фаза этилацетат:СН3ОН=10:1,5). В результате получают 0,58 г (выход 60%) указанного в заголовке соединения в виде маслянистого вещества - основания.
0,50 г (1,4 ммоль) полученного очищенного маслянистого вещества - основания - растворяют в 4 мл ацетона. Полученный раствор охлаждают на льду и при перемешивании добавляют 1,1 мл этанольного раствора бромоводородной кислоты (0,25 г HBr; 3,1 ммоль). Образуется белый осадок, к которому добавляют 3 мл диэтилового эфира и затем после перемешивания на льду в течение 2 часов образовавшийся кристаллический продукт отфильтровывают и промывают диэтиловым эфиром. В результате получают 0,62 г (выход 85%) дигидробромида 1-(3-пиридил)-2-(N-(2-(3,4-дихлорфенил)этил)-N-пропиламино)этанола, температура плавления 198-202°С (молекулярная масса 515,124; брутто-формула C18H22N2OCl2 · 2HBr).
1Н ЯМР-спектр, D2O, м. д. по отношению к DSS (0 м.д.): 8,91 (1Н), 8,81 (1Н), 8,64 (1Н), 8,12 (1Н), 7,54 (2Н), 7,27 (1Н), 5,50 (1Н), 3,58 (2Н), 3,48 (2Н), 3,34 (2Н), 3,16 (2Н), 1,82 (2Н), 1,00 (3Н).
ИК-спектр (таблетка с KBr) приведен на фиг.8.
Пример 4
1-(4-Пиридил)-2-(N-(2-(3,4-дихлорфенил)этил)-N-метиламино)этанол (ВК-38)
Получение 1-(4-пиридил)-2-метиламиноэтанола
К 1,01 г (3,6 ммоль) 4-бромацетилпиридина гидробромида, полученного, как описано в примере 1, добавляют 20 мл абсолютного этанола и 0,5 г (13,2 ммоль) борогидрида натрия и реакционную смесь перемешивают при 20°С в течение 2 часов, после чего фильтруют и к фильтрату, содержащему 4-пиридилоксиран, добавляют 1,3 мл 33%-ного этанольного раствора метиламина. Реакционную смесь кипятят с обратным холодильником в течение 3 часов, упаривают до получения сухого остатка, к которому добавляют 20 мл хлороформа, и затем твердую часть отфильтровывают. Фильтрат упаривают и полученный маслянистый остаток очищают колоночной хроматографией на силикагеле (силикагель 60, подвижная фаза CHCl3:этилацетат=10:2). В результате получают 0,30 г (выход 55%) указанного в заголовке соединения в виде маслянистого вещества - основания (молекулярная масса 152,196, брутто-формула C8H12N2O).
Получение 1-(4-пиридил)-2-(N-(2-(3,4-дихлорфенил)ацетил)-N-метиламино)этанола
В колбу, содержащую 0,54 г (2,6 ммоль) ДЦГ (дициклогексилкарбодиимид), добавляют по каплям 2 мл метиленхлорида и 0,54 г (2,6 ммоль) 3,4-дихлорфенилуксусной кислоты в 4 мл метиленхлорида для того, чтобы вызвать образование осадка. Реакционную смесь перемешивают в течение 5 минут и затем добавляют 400 мг (2,6 ммоль) 1-(4-пиридил)-2-метиламиноэтанола в 3 мл метиленхлорида, после чего перемешивают дополнительно в течение 1 часа при 20°С. Образовавшийся осадок отфильтровывают и полученный раствор упаривают. Полученный при упаривании фильтрат очищают колоночной хроматографией на силикагеле (силикагель 60, подвижная фаза CHCl3:СН3ОН=10:0,5). В результате получают 0,53 г (выход 60%) 1-(4-пиридил)-2-(N-(2-(3,4-дихлорфенил)ацетил)-N-метиламино)этанола.
Получение указанного в заголовке 1-(4-пиридил)-2-[N-(2-(3,4-дихлорфенил)этил)-N-метиламино]этанола (ВК-38)
В колбу помещают 510 мг (13,5 ммоль) литийалюминийгидрида (LiAlH4), добавляют 6 мл безводного ТГФ и полученную смесь охлаждают на льду. К реакционной смеси добавляют по каплям при перемешивании раствор 1,02 г (3 ммоль) 1-(4-пиридил)-2-(N-(2-(3,4-дихлорфенил)ацетил)-N-метиламино)этанола в 10 мл безводного ТГФ. После завершения добавления реакционную смесь дополнительно перемешивают в течение 1 часа при комнатной температуре, охлаждают на льду и при энергичном перемешивании постепенно добавляют 6,6 мл 15% NaOH и затем 16 мл метиленхлорида. Отделяют органическую фазу, высушивают над безводным Na2SO4 и упаривают на роторном испарителе, получая при этом маслянистый остаток, который очищают колоночной хроматографией на силикагеле (силикагель 60, подвижная фаза CHCl3:СН3ОН=10:1). В результате получают 0,54 г (выход 55%) указанного в заголовке соединения в виде маслоподобного основания.
0,50 г (1,54 ммоль) очищенного маслоподобного основания растворяют в 3 мл ацетона. Полученный раствор охлаждают на льду и при перемешивании добавляют 1,8 мл этанольного раствора бромоводородной кислоты (0,274 г HBr; 3,4 ммоль). Образуется осадок, к которому добавляют 3 мл диэтилового эфира. После перемешивания реакционной смеси на льду в течение 2 часов образовавшийся кристаллический продукт отфильтровывают и промывают диэтиловым эфиром. В результате получают 0,64 г (выход 85%) дигидробромида 1-(4-пиридил)-2-(N-(2-(3,4-дихлорфенил)этил)-N-метиламино)этанола, температура плавления 191-194°С (молекулярная масса 487,074; брутто-формула C17H18N2OCl2 · 2HBr).
1Н ЯМР-спектр, D2O, м.д. по отношению к DSS (0 м.д.): 8,81 (2Н), 8,14 (2Н), 7,47 (2Н), 7,22 (1Н), 5,54 (1H), 3,50 (4H), 3,08 (5Н).
ИК-спектр (таблетка с KBr) приведен на фиг.7.
Пример 5
Тестирование четырех лигандов сигма-рецепторов (ВК-31 · 2HBr, ВК-33 · HBr, ВК-35 · 2HBr и ВК-38 · 2HBr), полученных согласно примерам 1-4, ингибиторов биосинтеза холестерина на уровне стерол-Δ7,8-изомеразы
Проведена оценка ингибирующего воздействия на биосинтез холестерина четырех новых лигандов сигма-рецепторов - ВК-31 · 2HBr, ВК-33 · 2HBr, ВК-35 · 2HBr и ВК-38 · 2HBr), полученных согласно примерам 1-4. Используют методику ex vivo для введения метаболической метки иммортальных гептоцитов человека. Радиоактивно меченный предшественник биосинтеза холестерина [3Н] ацетат добавляют к клеткам с введением или без введения сигма-лигандов. В заключение проводят два независимых эксперимента по введению метаболической метки и по анализу стерола для каждого соединения.
Материалы и методы
Культура клеток и добавление сигма-лигандов рецепторов
Клетки иммортальных гепатоцитов человека линии HepG2 помещают в колбы емкостью 75 см2 в соотношении 1:2, по две колбы для каждого вида условий. Клетки выращивают в среде DMEM (L-аргинин · HCl 0,084 г/л, L-цистеин · 2HCl 0,0626 г/л, L-глутамин 0,584 г/л, глицин 0,03 г/л, L-гистидин · HCl·Н2О 0,042 г/л, L-изолейцин 0,105 г/л, L-лейцин 0,105 г/л, L-лизин · HCl 0,146 г/л, L-метионин 0,03 г/л, L-фенилаланин 0,066 г/л, L-серин 0,042 г/л. L-треонин 0,095 г/л, L-триптофан 0,016 г/л, L-тирозин 2Na · 2Н2О 0,10379 г/л, L-валин 0,094 г/л, хлорид холина 0,004 г/л, фолиевая кислота 0,004 г/л, миоинозитол 0,0072 г/л, ниацинамид 0,004 г/л, D-пантотеновая кислота 0,004 г/л, пиридоксаль · HCl 0,004 г/л, рибофлавин 0,0004 г/л, тиамин · HCl 0,004 г/л, хлорид кальция · 2Н2O 0,265 г/л, нитрат железа · 9H2O 0,0001 г/л, сульфат магния [безводный] 0,09767 г/л, хлорид калия 0,4 г/л, хлорид натрия 6,4 г/л, одноосновный фосфат натрия [безводный] 0,109 г/л, глюкоза 4,5 г/л и феноловый красный, Na 0,0159 г/л) с 5% бычьей сыворотки и 1% L-глутамина. Через 24 часа среду с 100 мкМ лигандов сигма-рецепторов (ВК-31 · 2HBr, ВК-33 · 2HBr, ВК-35 · 2HBr и ВК-38 · 2HBr) добавляют к клеткам. В качестве положительного контроля используют известные ингибиторы биосинтеза холестерина, 100 мкМ ловастатина или правастатина, которые оба являются ингибиторами HMG-СоА редуктазы, и 100 мкМ флуконазола, который ингибирует ферменты семейства Р450, к которому также принадлежит ланостерол-14α-деметилаза (CYP51). Клетки, выращенные в нормальной среде без добавления ингибиторов, используют в качестве отрицательного контроля. Среду заменяют через 24 часа. Через 48 часов добавляют 40 микроКюри [3Н] ацетата на 1 мл среды (400 микроКюри на флакон). Среду удаляют через 24 часа и затем клетки обрабатывают трипсином, используя 2 мл. Клетки собирают в 4 мл среды, центрифугируют, и осадок клеток ресуспендируют в дистиллированной воде (1 мл на колбу). Клетки гомогенизируют посредством замораживания и оттаивания. Стеролы экстрагируют из гомогената. Концентрацию белка в гомогенате определяют, используя реагент Био-рад (Bio-rad) в соответствии с инструкцией производителя.
Экстракция стерола
Гомогенат переносят в стеклянные флаконы с крышкой из инертного материала. Затем добавляют 3 мл экстракционного раствора (75% н-гептана : 25% изопропанола (об./об.)). Закрытые флаконы энергично встряхивают, используя устройство для встряхивания, в темной комнате в течение 2 часов. После экстракции флаконы центрифугируют (2000 g, 10 мин), органическую фазу переносят в стеклянные пробирки, высушивают в атмосфере азота, промывают, используя 2 мл н-гептана с показателем чистоты «чистый» по данным жидкостной хроматографии высокого разрешения), центрифугируют (2000 g, 5 мин) и переносят в другие чистые стеклянные пробирки. До начала анализа образцы хранят в растворителе с показателем чистоты ЖХВР в темноте и на холоде.
Анализ методом ЖХВР (жидкостная хроматография высокого разрешения)
Сухие экстракты растворяют в 250 мкл н-гептана. Аликвоты по 100 мкл вводят в колонку с нормальной фазой («ChromSpher Si», 150 мм × 3 мм, размер частиц 5 мкм), подвижная фаза: смесь н-гептана и изопропанола в соотношении 99,5% : 0,5% при скорости потока 1 мл/мин при комнатной температуре.
Определение стеролов
Стеролы детектируют, используя УФ-детектор при двух длинах волн: 200 нм для ланостерола/T-MAS и холестерина и 249 нм для 4,4-диметил-α-холеста-8,14,24-триен-3β-ола (FF-MAS), внутренний стандарт - эргостерол. Для определения стерола после введения метаболической метки используют проточный цитометрический радиодетектор. Определение стерола осуществляют и соответствии с временами удерживания следующих стандартов: ланостерол (фирма «Steraloids»), холестерин (фирма «Steraloids»), эргостерол (фирма «Sigm»), 4,4-диметил-α-холеста-8,14,24,-триен-3β-ол (FF-MAS) и [3H] FF-MAS (лабораторный источник: А.Г.Бысков, Рикоспиталитет, Университет Копенгагена (A.G.Byskov, Rikhospitalitet, University of Copenhagen)). Полученные результаты нормализуют в соответствии с количеством внутреннего стандарта эргостерола и концентрацией белков в гомогенате. Результаты представляют среднее значение для двух измерений с соответствующим стандартным отклонением.
Результаты
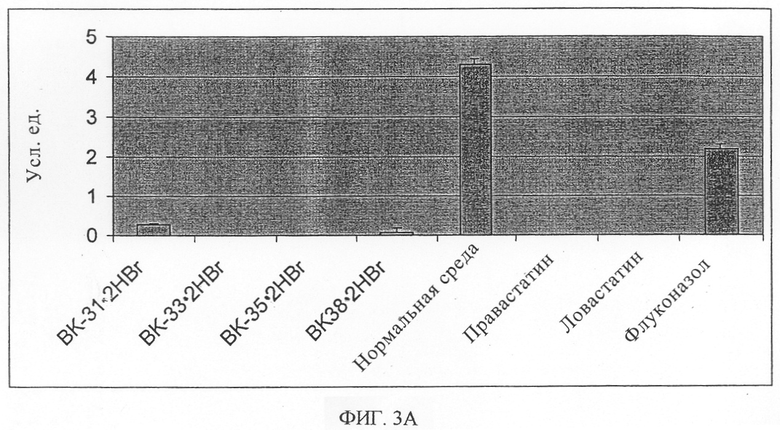
Данные, полученные после введения метаболической метки в клетки, свидетельствуют о значительном снижении количества синтезированного холестерина. Холестерину соответствует пик радиодетектирования при приблизительно 6,0 мин. На фиг.3 показано количество радиоактивно меченного холестерина после введения радиоактивной метки в клетки и добавления различных ингибиторов. Отрицательный контроль, нормальная среда - среда без добавления ингибиторов, А - анализ 1, Б - анализ 2. Усл. ед. - условные единицы. Пик, соответствующий холестерину, как показано на фиг.3, значительно меньше в случае клеток, к которым добавляли сигма-лиганды, причем он наиболее выражен в случае добавления соединения, обозначенного как ВК-35 · 2HBr. В дополнение к полному блокированию синтеза холестерина, как следует из приведенных на фиг.3 данных, протестированные соединения также оказывают воздействие на аккумулирование ранних промежуточных соединений, относящихся к постскваленовому участку биосинтеза холестерина. Отмечается повышенное количество стеролов, представляющих ланостерол или 4,4-диметил-α-холеста-8(9),24-диен-3β-ол (T-MAS). Наибольшее воздействие оказывает соединение, обозначенное как ВК-35 · 2HBr, с 10-кратным повышением продуцирования промежуточного соединения, как показано на фиг.4. Данные, приведенные на фиг.4, показывают количество радиоактивно меченного промежуточного соединения стерол X, который элюируется после холестерина (7-дегидрохолестерин или латостерол). Обозначения такие же, как и на фиг.3. А - анализ 1, Б - анализ 2.
Все результаты анализов подтверждают, что новые производные аминоалкилпиридинов в качестве сигма-лигандов в соответствии с настоящим изобретением блокируют синтез холестерина, наиболее вероятно на уровне стерол Δ8,7-изомеразы. В присутствии соединения, обозначенного как ВК-35 · 2HBr, количество холестерина является наименьшим и количество промежуточных соединений, остающихся до стадии стерол-Δ8,7-изомеразы повышено.
Хорошо известные ингибиторы HMG-CoA-редуктазы (ловастатин и правастатин) и ланостерол 14α-деметилазы (флуконазол) используют в качестве положительного контроля точности анализов. Ловастатин и правастатин полностью блокируют биосинтез, как показано на фиг.3. Флуконазол, как ожидается, является более слабым ингибитором биосинтеза холестерина, поскольку он не является специфическим ингибитором ланостерол-14α-деметилазы человека. Количество ланостерола или 4,4-диметил-α-холеста-8(9),24-диен-3β-ола (T-MAS) не повышается при воздействии статинов, поскольку эти соединения блокируют биосинтез на уровне HMG-CoA редуктазы, которая остается на начальных стадиях процесса биосинтеза холестерина, таким образом, до ланостерола и T-MAS.
Заключение
Авторы настоящего изобретения установили, что клетки, выращенные в присутствии тестируемых соединений, обозначенных как ВК-31 · 2HBr, ВК-33 · 2HBr, ВК-35 · 2HBr и ВК-382HBr, синтезируют значительно пониженное количество холестерина. На основе этих результатов можно заключить, что все протестированные соединения, то есть новые производные аминоалкилпиридинов согласно настоящему изобретению, являются ингибиторами биосинтеза холестерина, наиболее вероятно, на уровне стерол-Δ7,8-изомеразы. Наибольшее снижение холестерина наблюдается в случае соединения, обозначенного как ВК-35 · 2HBr, то есть дигидробромида 1-(3-пиридил)-2-(N-(2-(3,4-дихлорфенил)этил)-N-пропиламино)этанола. Результаты, полученные в по меньшей мере двух независимых экспериментах, являются воспроизводимыми и свидетельствуют о том, что все протестированные сигма-лиганды, в том числе соединение, обозначенное как ВК-35 · 2HBr, являются наиболее эффективными ингибиторами биосинтеза холестерина согласно настоящему изобретению и таким образом особенно подходят для лечения гиперхолестеринемии и гиперлипидемии.
Краткое описание чертежей
На фиг.1 изображен вносимый стерол-Δ8,7-изомеразой вклад на заключительной стадии биосинтеза холестерина.
На фиг.2 изображен биосинтез холестерина с отмеченными сайтами воздействия ингибиторов биосинтеза холестерина.
На фиг.3 изображено количество радиоактивно меченного холестерина после введения радиоактивной метки в клетки и добавления различных ингибиторов.
На фиг.4 изображено количество радиоактивно меченного промежуточного стерола X, который элюируется после холестерина.
На фиг.5 изображена схема способов получения новых производных аминоалкилпиридина формулы I.
На фиг.6 изображен инфракрасный спектр соединения ВК-31 · 2HBr.
На фиг.7 изображен инфракрасный спектр соединения ВК-38 · 2HBr.
На фиг.8 изображен инфракрасный спектр соединения ВК-35 · 2HBr.
На фиг.9 изображен инфракрасный спектр соединения ВК-33 · 2HBr.











Изобретение относится к новым производным аминоалкилпиридинов общей формулы I

где n означает целое число от 1 до 4; R1 представляет собой атом водорода, гидроксильную группу или низшую (C1-С6)алкоксигруппу, R2 представляет собой атом водорода или низшую (C1-С6)алкильную группу с линейной или разветвленной цепью, Х представляет собой водород, фтор, хлор, бром, гидроксильную группу, трифторметильную группу, 3,4-ди-Cl, 2,4-ди-Cl или низшую (C1-С6)алкоксигруппу, или к солям этих соединений - продуктам присоединения физиологически приемлемой кислоты. Данное изобретение относится также к фармацевтической композиции, ингибирующей биосинтез холестерина, на основе этих соединений. Также рассматривается применение вышеуказанных соединений для получения фармацевтической композиции и способ получения соединений формулы I. Технический результат - получение новых соединений, обладающих ценными биологическими свойствами, и фармацевтической композиции на их основе. 4 н. и 6 з.п. ф-лы, 12 ил.

где n означает целое число от 1 до 4;
R1 представляет собой атом водорода, гидроксильную группу или низшую (C1-С6)алкоксигруппу,
R2 представляет собой атом водорода или низшую (C1-С6)алкильную группу с линейной или разветвленной цепью,
Х представляет собой водород, фтор, хлор, бром, гидроксильную группу, трифторметильную группу, 3,4-ди-Cl, 2,4-ди-Cl или низшую (C1-С6)алкоксигруппу,
или соли этих соединений - продукты присоединения физиологически приемлемой кислоты.
а) алкилирование соединения формулы VI:

в которой
R2 является таким, как определено выше в формуле I, и Z означает группу:

в которой Х является таким, как определено выше в формуле I, соединением формулы VII:
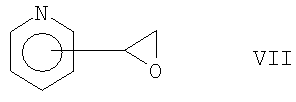
и, если это необходимо, последующее превращение полученных соединений формулы I в соль, или
б) алкилирование соединения формулы VIII

где R2 является таким, как определено выше в формуле I, соединением формулы VII

с получением при этом промежуточных соединений формулы IX:

в которой R2 является таким, как определено выше в формуле I, и конденсацию с производными фенилуксусной кислоты формулы X:

в которой Z является таким, как определено выше,
с получением промежуточных соединений формулы XI:

и восстановление их с получением соединений формулы I, и, если это необходимо, с последующим превращением соединений формулы I в соль.
| RU 20024493 C1, 15.12.1994 | |||
| ω- ПИРИДИЛОВЫЕ ЭФИРЫ БУТИЛИРОВАННОГО ГИДРОКСИТОЛУОЛА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ ГИПЕРЛИПИДЕМИИ И АТЕРОСКЛЕРОЗА | 1992 |
|
RU2120938C1 |
| УСТРОЙСТВО для ТАРИРОВКИ ПРИБОРОВ для ИЗМЕРЕНИЯ НАТЯЖЕНИЯ ГРУПП НИТЕЙ | 0 |
|
SU254856A1 |
| US 6057371 A, 02.05.2000. | |||
Авторы
Даты
2007-11-10—Публикация
2003-07-09—Подача