Изобретение относится к медицине, в частности к гематологии, и касается раннего иммунологического прогнозирования прогрессирующего течения хронического лимфолейкоза (ХЛЛ), определяемого по повышенному количественному содержанию ядрышкового антигена В23/нуклеофозмина (в последующем - В23), ассоциированному с началом пролиферативной активности лимфоидных клеток, до появления общепризнанного маркера пролиферации Ki-67.
Оценка пролиферативной активности лимфоидных клеток при ХЛЛ является одним из важных показателей в диагностике варианта заболевания и определении степени злокачественности процесса. Этот показатель используется для прогнозирования скорости опухолевого роста и выбора адекватной терапии [2, 4, 11, 12, 14].
Для оценки пролиферативной активности клеточной популяции применяют различные методы:
1) селективное окрашивание клеток солями серебра с целью выявления и учета аргентофильных ядрышкообразующих районов хромосом [5, 6, 7];
2) включение в ДНК аналогов тимидина, например - 3H-тимидина или бромдезоксиуридина [16, 18];
3) проточную цитометрию с подсчетом содержания ДНК, окрашенной флюоресцентным красителем [18];
4) иммуноцитохимический метод с использованием моноклональных антител (МКА) к антигенам, ассоциированным с клеточной пролиферацией [4, 8, 10].
При сравнении вышеперечисленных методов было показано, что иммуноцитохимический метод с применением МКА является наиболее предпочтительным, так как позволяет выявлять пролиферацию клеток на более ранних стадиях клеточного цикла, чем остальные, которые также уступают ему в чувствительности и воспроизводимости.
В мире получен ряд МКА к ядерным антигенам, ассоциированным с клеточной пролиферацией, часть из которых локализуется в особом компартменте клеточного ядра - ядрышках. Наибольшее признание и клиническое применение получили МКА к белку Ki-67, появляющемуся в поздней G1-стадии и маркирующему S, G2 и М фазы клеточного цикла, но отсутствующему в G0 и раннем G1 периодах [9, 10]. За последние два десятилетия в результате получения и применения моноклональных антител был открыт ряд новых белков, имеющих ядрышковую локализацию, которые можно рассматривать в качестве возможных маркеров клеточной пролиферации. К ним, в частности, можно отнести и основной ядрышковый белок В23/нуклеофозмин, участвующий в сборке прерибосомных частиц [15].
Нами в 2000 г. были получены МКА к ядрышковому антигену В23/нуклеофозмину [3], с помощью которых иммуноцитохимически (непрямой иммунофлюоресцентный и непрямой иммунопероксидазный методы) была изучена его экспрессия на различных стадиях клеточного цикла. Учитывая, что белок В23 является обязательным компонентом ядрышек, он присутствует в норме в минимальных количествах во всех донорских лимфоцитах, достигая видимого уровня экспрессии менее чем у 10% обследованных доноров. Проведенные нами исследования показали, что при искусственно вызванной с помощью фитогемагглютинина (ФГА) пролиферации лимфоцитов повышение экспрессии белка В23 наступает раньше (уже через 6-14 часов от начала стимуляции), чем появление Ki-67 (наблюдаемое только через 24 часа), что позволяет выявлять начало усиления пролиферативной активности клеток на более ранних стадиях, чем при использовании МКА к Ki-67. В последующие часы экспрессия обоих маркеров возрастает параллельно.
Таким образом, было впервые выявлено, что ядрышковый белок В23 может явиться ранним маркером активации лимфоцитов к пролиферации, экспрессия которого возрастает в последующие фазы клеточного цикла.
В качестве прототипа предлагаемого нами методического подхода мы рассматриваем:
1. Определение пролиферативной активности клеток по выявлению с помощью МКА антигена Ki-67 [9, 10]. Однако антиген Ki-67 выявляется впервые только в поздней G1 фазе, т.е. уже после заметного возрастания уровня В23.
2. Определение пролиферативной активности клеток по выявлению с помощью МКА антигена PCNA (proliferating cell nuclear antigen) [13, 17]. Однако антиген PCNA начинает выявляться только перед началом репликации ДНК, т.е. при переходе клеток из G1 в S-фазу.
Непосредственных аналогов предлагаемого нами метода нет, поскольку при выходе клеток из состояния покоя в клеточный цикл повышение экспрессии В23 наступает почти сразу же, в раннем G1 периоде, что, применительно к хроническому ЛПЗ, соответствует самому началу активации лимфоидных клеток к пролиферации.
При одновременном изучении иммуноцитохимическими методами экспрессии антигенов В23 и Ki-67 у больных с различными формами лимфопролиферативных заболеваний было обнаружено, что у некоторых из них выявлялась повышенная экспрессия В23, при отсутствии Ki-67, что указывало на начало активации клеток к пролиферации. По мере увеличения злокачественности процесса экспрессия обоих маркеров возрастала, достигая максимальных значений при лимфосаркомах и лимфоме Беркитта.
Таким образом, минимальная экспрессия В23 в лимфоцитах здоровых людей (<10% В23-положительных клеток) и максимальная экспрессия (>90% В23-положительных клеток) при достоверно выраженной пролиферации свидетельствуют о диагностической значимости этого показателя и необходимости дальнейшего совершенствования методов исследования с целью объективизации визуальной оценки уровня экспрессии белка В23 по результатам иммуноцитохимических реакций.
Для решения этой задачи нами был применен метод количественной оценки содержания В23 в лизатах лимфоидных клеток с помощью иммуноблоттинга и последующим сканированием полученных иммуноблотов с определением условного содержания белка по специальной компьютерной программе с учетом ширины и интенсивности окраски белковых полос.
Способ осуществляли следующим образом:
Из периферической крови больного с помощью градиентного центрифугирования на фиколле выделяли лимфоидные клетки, из которых готовили клеточные лизаты. Каждый образец для исследования содержал 500 тыс. клеток. Затем методом денатурирующего двухступенчатого электрофореза в полиакриламидном геле по Лэммли проводили разделение полученных лизатов по фракциям белка [1, 8]. В качестве маркера при проведении электрофореза использовали стандартную готовую смесь белков (Sigma, США) с различным молекулярным весом (125, 62, 47, 34, 14 кДа). Электрофорез проводили с использованием камеры для электрофореза фирмы "ELMI" (Латвия). Концентрирующий гель имел 2,5% концентрацию, а разделяющий гель - 12% концентрацию.
После проведения электрофореза производили полусухой перенос на нитроцеллюлозную мембрану. Затем мембрану обрабатывали красителем ПонсоС (Sigma, США). Далее проводили иммуноферментное окрашивание белков с помощью полученных к В23 антител по стандартной методике [1, 8]. Выявление связавшихся антител производили иммунопероксидазным методом, используя диаминобензидин в качестве колориметрического агента.
Количество белка В23 в лизатах лимфоидных клеток выражали в условных единицах, принимая за "нулевую точку" отсутствие окраски. При этом наименьшее содержание В23 (в среднем, 0.314±0.012 у.е.) было выявлено, как и предполагалось, в лизатах лимфоцитов, выделенных из крови здоровых лиц, в качестве которых были исследованы 12 кадровых доноров станции переливания крови ГНЦ РАМН, не имеющих никаких отклонений в состоянии здоровья.
В качестве положительного стандартного контроля, с предполагаемым максимальным содержанием белка В23, были исследованы лизаты клеток перевиваемой лимфобластоидной клеточной линии человека - Ramos, находящихся на пике пролиферативной активности (72 часа после пассажа). Количество В23 в лизатах этих клеток составило, в среднем, 13.25±0.095 у.е.
Для оценки диагностического и прогностического значения количественного содержания В23 были исследованы лизаты лимфоидных клеток 33 больных В-ХЛЛ на разных стадиях течения заболевания.
Выявлено, что у большинства больных в периоде диагностики заболевания (у 14 из 16) со спокойным доброкачественным течением и отсутствием признаков активации и прогрессии заболевания (определяемых по окрашиванию клеток МКА к антигенам Ki-67, CD38 и CD71) количество В23 в лизатах лимфоидных клеток было также наименьшим (от 0.572 до 1.354 у.е., в среднем, 1.0086±0.003 у.е.), хотя оно и превышало в 3.2 раза значение этого показателя у здоровых лиц.
При типичном течении заболевания у 12 обследованных больных с отсутствием клинико-лабораторных признаков прогрессирования в течение ближайших месяцев отмечалось некоторое повышение количества клеток с маркерами активации и пролиферации (Ki-67<5%, CD38 и CD71<50%), при этом содержание В23 в лизатах клеток у 10 из них также несколько увеличивалось, составляя, в среднем, 1.4309±0.1469 у.е. (от 0.572 до 1.354 у.е.), что почти в 1.5 раза превышало уровень, характерный для начальной стадии заболевания.
При прогрессирующей компенсированной форме В-ХЛЛ у 5 больных при наличии высокого уровня клеток с маркерами активации и пролиферации (Ki-67≥5%; CD38 и CD71>50%) у 4 из них наблюдалось еще большее увеличение количества В23 в лизатах клеток, в среднем, до 3.32±0.1258 у.е. (от 2.997 до 3.387 у.е.), что в 2-3 раза превышало этот показатель при непрогрессирующей форме.
Однако среди обследованных больных с отсутствием в период исследования по клинико-лабораторным данным и результатам иммунофенотипического обследования каких-либо признаков прогрессирования и активации опухолевого процесса (количество Ki-67 не превышало 5%, CD71 и CD38 - 10%) были выявлены 5 человек (2 - в начальной стадии, 2 - при типичном течении и 1 - при прогрессирующей форме ХЛЛ), у которых было выявлено значительное (более 13 у.е.) повышение количества В23 (р<0,001). При этом уровень В23 у некоторых больных оказался даже выше, чем в лизатах клеток перевиваемой культуры Ramos, составляя, в среднем, 14.172±0.0031 у.е. (от 13.562 до 15.672 у.е.).
Проведенный в последующем ретроспективный анализ течения заболевания у всех этих больных выявил резкое прогрессирование заболевания спустя 1-3 месяца после обследования с развитием уже всех клинико-лабораторных признаков обострения.
Полученные данные свидетельствуют о том, что определение количества В23 в лизатах лимфоидных клеток может явиться важным дополнительным методом исследования больных В-ХЛЛ, имеющим не только диагностическое значение, но и прогностическую ценность, выявляя по повышенному количеству В23 в клетках (свыше 14 у.е.), еще до появления маркеров активации (CD38, CD71) и пролиферации (Ki-67), начальную фазу прогрессирования заболевания за 1-3 месяца до его клинико-лабораторного подтверждения. Не исключено, что своевременная коррекция лечения, направленная на подавление активации опухолевого клона клеток, позволит профилактировать прогрессирование процесса, продлевая жизнь больного.
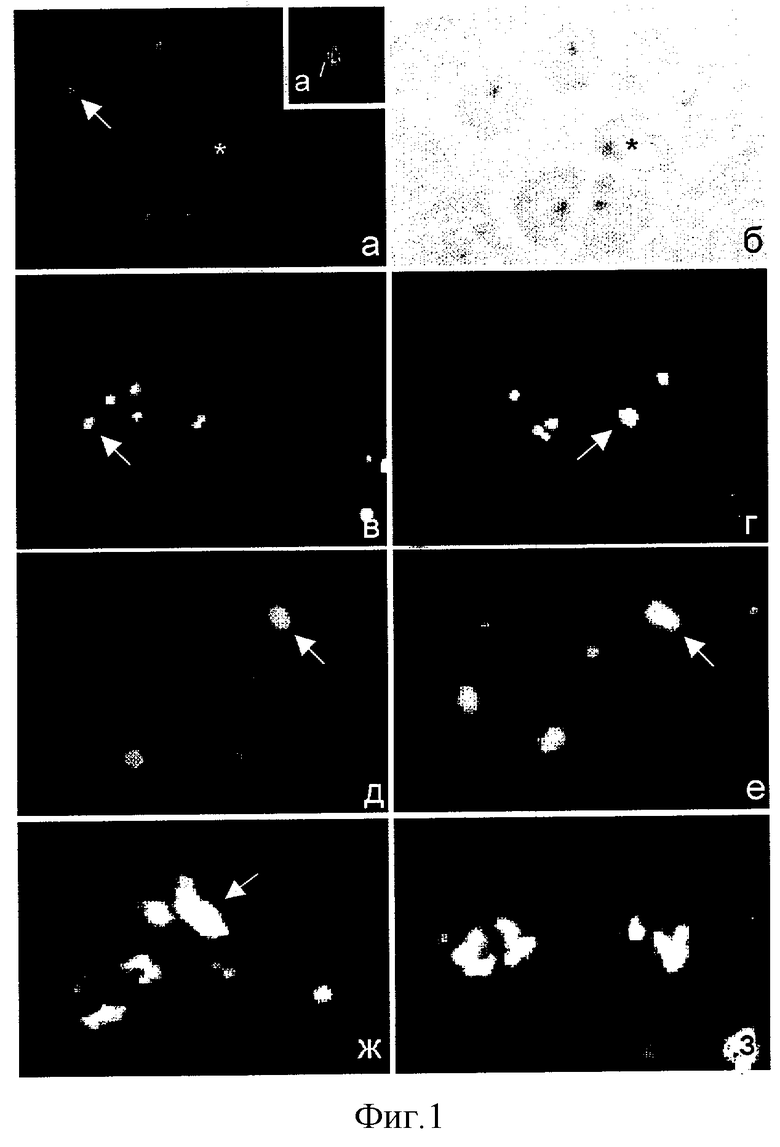
На фиг.1 представлены результаты непрямого иммунофлюоресцентного окрашивания антителами к В23 и Ki-67 лимфоцитов здорового человека на последовательных стадиях активации к пролиферации с помощью ФГА. На фигуре видно изменение характера окрашивания клеток по мере увеличения срока культивирования с митогеном (от 0 до 92 ч). Следует отметить, что Ki-67-окрашивание обнаруживалось в единичных клетках лишь через 24 часа от начала стимуляции, достигая максимума к 72 часам.
На фиг.2 представлены иммуноблоты лимфоцитов, выделенных из периферической крови здоровых лиц, и затем искусственно активированных к пролиферации в культуре с помощью ФГА. Лизаты клеток исследовали в различные сроки от начала ФГА-стимуляции. Видно постепенное нарастание количества В23 (по интенсивности и ширине мажорной полосы) по мере увеличения срока культивирования с митогеном, выявляемое уже через 6-10 часов с момента внесения ФГА и достигающее максимума к 72-96 часам, приближаясь по значениям к данным, полученным для перевиваемой культуры Ramos.
Именно эти данные, свидетельствующие о повышении количества белка В23 в процессе перехода лимфоцитов из состояния покоя к активной пролиферации, и легли в основу разработки метода количественной оценки содержания В23 в лимфоидных клетках у больных ХЛЛ на разных стадиях болезни, характеризующихся различной пролиферативной активностью.
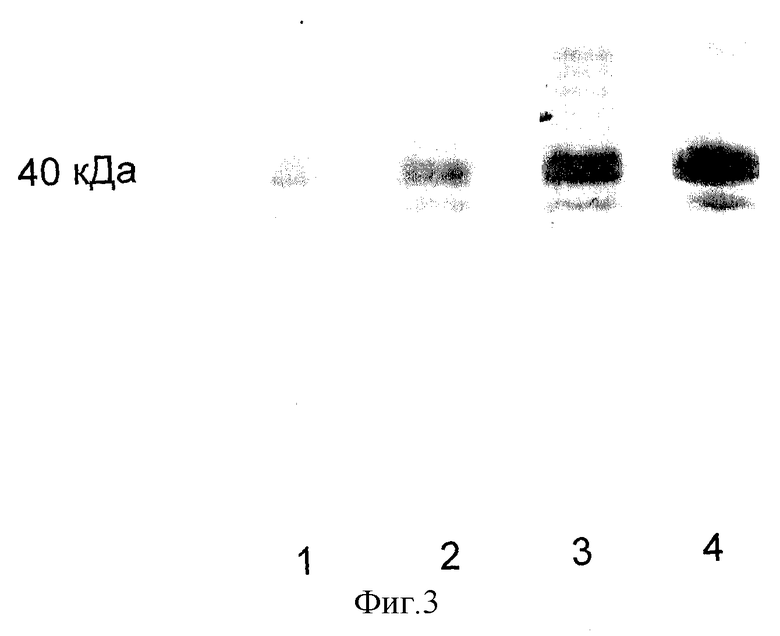
На фиг.3 представлены иммуноблоты лизатов лимфоидных клеток больных ХЛЛ (дорожки 2, 3) в сравнении с иммуноблотами лизатов лимфоцитов здорового донора (дорожка 1) и клеток культуры Ramos (дорожка 4), по которым рассчитывалось количественное содержание В23. Как видно из фигуры, интенсивность полосы у больного со спокойным течением заболевания, без развития прогрессирования в ближайшие месяцы (дорожка 2), сходна с таковой у здорового человека (дорожка 1). В то же время, у больного с развившимся впоследствии прогрессированием заболевания (дорожка 3), интенсивность полосы на иммуноблоте оказалась сходной с таковой у пролиферирующей культуры Ramos (дорожка 4). Как было обнаружено при ретроспективном анализе, у этого больного, несмотря на отсутствие каких-либо клинико-лабораторных признаков активации процесса в момент обследования, через 3 месяца наступило резкое ухудшение со всеми признаками опухолевой прогрессии, т.е. повышенный уровень В23 в лизатах лимфоидных клеток оказался предвестником прогрессирования заболевания.
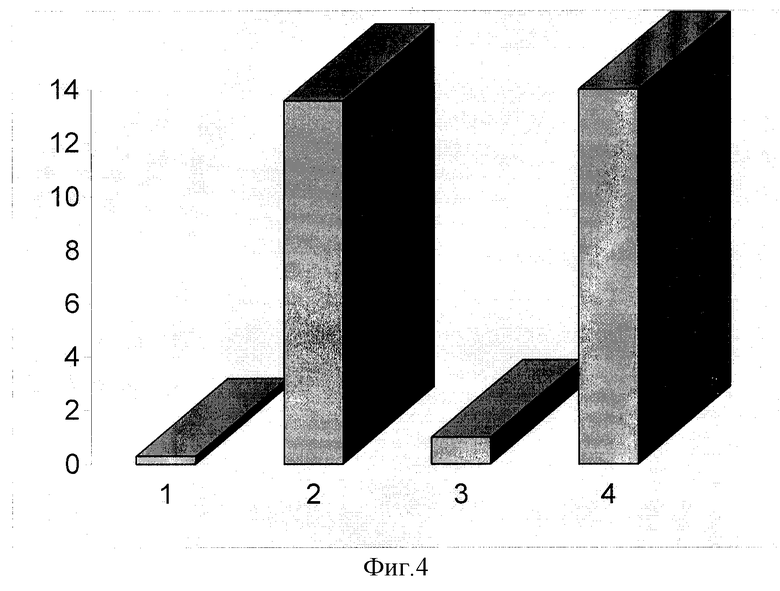
На фиг.4 представлены графические данные по среднему количественному содержанию белка В23 в лизатах лимфоидных клеток больных со спокойным течением болезни (№3) и больных с развившимся прогрессированием заболевания через 1-3 месяца от даты проведения исследования (№4), когда еще никаких клинико-лабораторных предвестников начинающегося обострения процесса выявлено не было. Данные представлены в сравнении с содержанием В23 в лизатах лимфоцитов здоровых лиц (№1) и лизатах лимфоидных клеток культуры Ramos (№2) на стадии максимального роста. На фигуре видно, что количество В23 в лимфоидных клетках больных со спокойным течением заболевания, не имевших последующего прогрессирования, практически не отличается от количества В23 в лимфоцитах здоровых лиц. В то же время, значительное повышение содержания В23 у 5 выявленных нами больных при отсутствии антигенов активации и пролиферации оказалось предвестником прогрессирования болезни, проявившегося через 1-3 месяца от момента обследования.
В качестве примеров приводим данные обследования больных, наиболее характерных для каждого периода ХЛЛ.
I При отсутствии повышения количества В23 в лизатах лимфоидных клеток:
1. Б-ной Т-ец, 76 л., поступил для установления диагноза.
В анализе крови: L - 9×109/мм3; лимфоциты - 63%.
Поставлен диагноз - В-ХЛЛ, начальная стадия.
Данные иммунофенотипического исследования:
CD19 - 84%, CD20 - 85%, CD23 - >80%, CD3 - 12%;
антигены активации и пролиферации:
Ki-67 - 0%, CD38 - 2%, CD71 - 0%.
Заключение: В-ХЛЛ, начальная стадия без антигенов активации и пролиферации.
При этом количество В23 в иммуноблотах - 0,852 у.е.
У больного отмечалось компенсированное состояние, не требующее специфического лечения, течение спокойное, без прогрессирования на протяжении ближайших месяцев наблюдения.
2. Б-ной Т-кий, 69 л. Болен ХЛЛ 2 года. Лечен лейкераном с эффектом.
В анализе крови: L - 11×109/мм3; лимфоциты - 92%.
Поставлен диагноз: В-ХЛЛ, типичное течение.
Данные иммунофенотипического исследования:
CD19 - 83%, CD20 - 83%, CD23 - >80%, CD3 - 9%;
антигены активации и пролиферации:
Ki-67 - 0%, CD38 - 4%, CD71 - 0%.
Заключение: В-ХЛЛ, без антигенов активации и пролиферации.
При этом количество В23 в иммуноблотах - 0,760 у.е.
У больного течение заболевания спокойное, не требующее дополнительного лечения, без прогрессирования на протяжении ближайших месяцев наблюдения.
II С выявленным резким повышением количества В23 в лизатах лимфоидных клеток:
3. Б-ная Н-ва, 39 л., поступила для установления диагноза.
В анализе крови: L - 36×109/мм3; лимфоциты - 75%.
Поставлен диагноз - В-ХЛЛ, начальная стадия.
Данные иммунофенотипического исследования:
CD19 - 72%, CD20 - 55%, CD23 - 48%, CD3 - 10%;
антигены активации и пролиферации:
Ki-67 - 1%, CD38 - 29%, CD71 - 0%.
Заключение: В-ХЛЛ, начальная стадия без антигенов активации и пролиферации.
Однако количество В23 в иммуноблотах составило 15,672 у.е.
Учитывая, что в тот период исследования еще не было установлено прогностическое значение этого показателя, больной было назначено лишь симптоматическое лечение. Однако через месяц у больной отмечено резкое прогрессирование заболевания с увеличением лимфоузлов, селезенки, лейкоцитоза в крови, потребовавшее назначения интенсивной циторедукционной терапии.
4. Б-ной К-ко, 60 л., болен В-ХЛЛ, опухолевая форма, в течение 3-х лет. Первоначально были увеличены все группы лимфоузлов, селезенка, сдвиг в крови до пролимфоцитов и лимфобластов. Получал лечение эндоксаном с эффектом.
При очередном обследовании: L - 90×109/мм3; лимфоциты - 90%, лимфоузлы и селезенка увеличены незначительно.
Данные иммунофенотипического исследования:
CD19 - 94%, CD20 - 70%, CD23 - 44%, CD3 - 5%;
антигены активации и пролиферации:
Ki-67 - 5%, CD38 - 8%, CD71 - 2%.
Заключение: В-ХЛЛ, предположительно с некоторыми признаками трансформации, т.е. на основании общепринятых методов исследования явных показателей прогрессирования заболевания не было выявлено.
Однако количество В23 в иммуноблотах - 14,625 у.е. В связи с отсутствием в то время данных о прогностическом значении количественного содержания В23 в лизатах клеток, больному было продолжено специфическое лечение лишь в сдерживающих дозах. Несмотря на это, самочувствие его ухудшалось, и через 3 месяца констатировано резкое прогрессирование заболевания, потребовавшее уже назначения более интенсивной терапии, адекватной прогрессирующей стадии болезни.
Итак, в приведенных примерах №1 и №2, низкое количественное содержание В23 в лизатах лимфоидных клеток больных соотносилось со спокойным течением заболевания без наступления обострения в ближайшие месяцы. Выявленное же резкое повышение уровня В23 в иммуноблотах лизатов клеток в примерах №3 и 4, несмотря на незначительное количество клеток с антигенами активации (CD38, CD71) и пролиферации (Ki-67), указывало, как впоследствии оказалось, на изначально прогрессирующую форму заболевания (пример №3) или явилось предвестником прогрессирования (пример №4), которое разворачивалось по всем клинико-лабораторным показателям лишь через 1-3 месяца от момента исследования и требовало немедленного назначения более интенсивной терапии.
Таким образом, как показали наши данные, метод количественного определения белка В23 может явиться более информативным в определении начальных этапов активации клеток к пролиферации, когда еще отсутствуют общепризнанные маркеры активации и пролиферации (т.е. в раннем и среднем G1-периодах). При этом постановка иммуноблотов лизатов клеток больных ХЛЛ параллельно с лизатами донорских нестимулированных лимфоцитов (в качестве отрицательного контроля) и клеток пролиферирующей культуры Ramos (положительный контроль) уже позволяет определять относительное количественное значение содержания В23 по ширине и интенсивности полученной полосы. Описанное выше исследование занимает один рабочий день. На следующий день проводится компьютерный анализ полученных результатов. Данное исследование целесообразно проводить параллельно с иммуноцитохимическим выявлением антигенов Ki-67 и В23, хотя в этом случае повышенное содержание В23 визуально оценить труднее, чем при количественном способе с помощью иммуноблотов. Диагностическая ценность выявленного повышения количества В23 в иммуноблотах возрастает в случае отрицательных результатов окрашивания антителами к В23 и Ki-67 в иммунофлюоресцентном и иммунопероксидазном методах, позволяя обнаружить самую начальную фазу активации клеток к пролиферации, благодаря чему становится возможным раннее прогнозирование начинающегося прогрессирования заболевания, и, как следствие, своевременная коррекция лечения, направленного на сдерживание опухолевого роста.
Фиг.1.
Иммунофлюоресцентное окрашивание лимфоцитов периферической крови человека МКА к В23 (а, в-ж) и Ki-67 (з) в контроле (а, а*), а также через 6 ч (в), 16 ч (г), 24 ч (д), 48 ч (е) и 72 ч (ж) после ФГА-стимуляции.
Фиг.2.
Иммуноблоты лизатов лимфоцитов периферической крови здорового человека на разных сроках стимуляции фитогемагглютинином (ФГА) (дорожки 1-7) и тотальных клеточных лизатов Ramos (дорожка 8), окрашенных МКА к В23.
1 - до стимуляции ФГА
2 - начало стимуляции ФГА (0 часов)
3 - через 6 часов от начала стимуляции ФГА
4 - через 16 часов от начала стимуляции ФГА
5 - через 24 часов от начала стимуляции ФГА
6 - через 48 часов от начала стимуляции ФГА
7 - через 72 часа от начала стимуляции ФГА
8 - культура пролиферирующих клеток Ramos
Фиг.3.
Иммуноблоты лизатов лимфоидных клеток, окрашенные МКА к В23.
Дорожка 1 - здоровый донор.
Дорожка 2 - больной со спокойным течением ХЛЛ.
Дорожка 3 - больной с последующим прогрессированием ХЛЛ.
Дорожка 4 - пролиферирующие клетки культуры Ramos.
Фиг.4.
Среднее количество В23 в лизатах лимфоидных клеток. (по вертикали: условные единицы в 500 тыс. клеток)
1 - здоровые лица.
2 - пролиферирующие клетки культуры Ramos.
3 - больные при спокойном течении ХЛЛ.
4 - больные с последующим прогрессированием ХЛЛ.
Литература:
1. Булычева Т.И., Артеменко Е.Г., Дергунова Н.Н., Дудник О.А., Шпакова А.П., Малашенко О.С., Зацепина О.В. Анализ пролиферативной активности клеток с помощью новых моноклональных антител к ядрышковому белку В23/нуклеофозмину. // Цитология. 2000; №3, т.42(10): 944-954.
2. Крокер Д.Ж. Показатели клеточной пролиферации при злокачественных лимфомах с особым рассмотрением ядрышкообразующих районов. // Гематол. Трансфузиол. 1994; 39(6): 12-19.
3. Малашенко О.С., Булычева Т.И., Дудник О.А. "Штамм культивируемых клеток мышиной гибридомы, используемый для получения моноклональных антител к ядрышковому антигену, ассоциированному с клеточной пролиферацией", патент на изобретение №2145634 от 2000 г.
4. Малашенко О.С., Самойлова Р.С., Булычева Т.И. Иммуноцитохимический метод оценки пролиферативного статуса лимфоидных клеток при лимфопролиферативных заболеваниях. // Клиническая лабораторная диагностика. 1995; 3: 51-54.
5. Мамаев Н.Н., Мамаева С.Е. Структура и функция ядрышковых организаторов хромосом: молекулярные, цитологические и клинические аспекты. // Цитология. 1992; 34(10): 3-25.
6. Погорелов В. М. Оценка Ag-положительных ядрышкообразующих районов хромосом в нуклеолах интерфазных злокачественных клеток. // Гематол. Трансфузиол. 1994; 39(6): 19-21.
7. Arden K.C., Johnston D.A., Cork A., Pathak S. Differential nucleolus organizer activity in normal and leukemic bone marrow. // Am. J. Hematol. 1989; 30(3): 164-173.
8. Dergunova N.N., Bulycheva T.I., Artemenko E.G., Shpakova A.P., Pegova A.N., Gemjian E.G., Dudnik O.A., Zatsepina O.V., Malashenko O.S. A major nucleolar protein B23 as a marker of proliferation activity of human peripheral lymphocytes. // Immunology Letters 2002; 83: 67-72.
9. Gerdes J., Lemke H., Baisch H. et al. Cell cycle analysis of a cell proliferation - associated human nuclear antigen defined by the monoclonal antibody Ki-67. // J. Immunol. 1984; 133: 1710-1715.
10. Gerdes J., Schwab U., Lemke H. et al. Production of a mouse monoclonal antibody reactive with a human nuclear antigen associated with cell proliferation. // Int. J. Cancer. 1983; 31: 12-16.
11. Gore S., Weng L., Burke P. Identification of growth factor-responsive acute myelogenous leukemia based on factor-dependence for survival and proliferation. // Leukemia. 1994; 8: 1854-1863.
12. Kotelnikov V. Prognostic significance of neoplastic cell proliferation in human haematological malignancies. // Folia Haematol. 1990; 117(3): 391-397.
13. Kurki P., Vanderlaan M., Polbear F. et al. Expression of proliferation cell nuclear antigen (PCNA/cyclin) during the cell cycle. // Exp. Cell Res. 1986; 2166: 209-219.
14. Pogorelov V., Kaplanskaya I., Baydurin S. et al. Computerized histopathologic estimation of malignant potential in non-Hodgkin′s lymphomas. // In: Modeling and signal processing of cellular systems. Ulm University, 1991; 221-226.
15. Shaw PJ., Jordan E.G. The nucleolus. // Ann. Rev. Cell Dev. Biol. 1995; 11: 93-121.
16. Shibuya M., Ito S., Miwa Т., et al. Proliferative potential of brain tumors. Analyses with Ki-67 and anti-DNA polymerase alpha monoclonal antibodies, bromodeoxyuridine labeling, and nuclear organizer region counts. // Cancer. 1993; 71(1): 199-206.
17. Takasaki Y., Deng J.S., Tan E.M. A nuclear antigen associated with cell proliferation and blast transformation. Its distribution in synchronized cells. // J. Exp. Med. 1981; 154: 1899-1903.
18. Trere D., Ceccarelli С., Danova M., Derenzini M. In vivo bromodeoxyuridine labelling index, AgNOR protein expression and DNA content in human tumours. // Eur. J. Histochem. 1996; 40(1): 17-26.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ИММУНОЦИТОХИМИЧЕСКОЙ ОЦЕНКИ ПРОЛИФЕРАТИВНОГО СОСТОЯНИЯ ЛИМФОЦИТОВ ПО ХАРАКТЕРУ ЭКСПРЕССИИ C-КОНЦЕВОГО ФРАГМЕНТА БЕЛКА B23/НУКЛЕОФОЗМИНА В РЕАКЦИИ НЕПРЯМОЙ ИММУНОФЛЮОРЕСЦЕНЦИИ | 2010 |
|
RU2438135C1 |
| ИММУНОЦИТОХИМИЧЕСКИЙ СПОСОБ ОЦЕНКИ РЕАКЦИИ БЛАСТТРАНСФОРМАЦИИ ЛИМФОЦИТОВ (РБТЛ) ПРИ СТИМУЛЯЦИИ ИХ ФИТОГЕМАГГЛЮТИНИНОМ (ФГА) | 2012 |
|
RU2514039C2 |
| СПОСОБ ИММУНОХИМИЧЕСКОЙ ОЦЕНКИ ПРОЛИФЕРАЦИИ ЛИМФОЦИТОВ ЧЕЛОВЕКА С ПОМОЩЬЮ НОВОГО МАРКЕРА - ЯДРЫШКОВОГО БЕЛКА А3 | 2010 |
|
RU2431670C1 |
| ШТАММ КУЛЬТИВИРУЕМЫХ КЛЕТОК МЫШИНОЙ ГИБРИДОМЫ А3, ИСПОЛЬЗУЕМЫЙ ДЛЯ ПОЛУЧЕНИЯ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ К АНТИГЕНУ ЯДРЫШЕК КЛЕТОК ЧЕЛОВЕКА | 2005 |
|
RU2296159C2 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ "ТЛЕЮЩЕЙ" ФОРМЫ ХРОНИЧЕСКОГО ЛИМФОЛЕЙКОЗА | 2012 |
|
RU2496110C1 |
| Способ прогнозирования течения хронического лимфолейкоза | 2022 |
|
RU2788816C1 |
| МЫШИНАЯ ГИБРИДОМА S79 - ПРОДУЦЕНТ МОНОКЛОНАЛЬНОГО АНТИТЕЛА, ОБЛАДАЮЩЕГО СПЕЦИФИЧНОСТЬЮ К БЕЛКУ ЯДРЫШКА SURF-6 ЧЕЛОВЕКА | 2010 |
|
RU2422516C1 |
| Способ дооперационной дифференциальной диагностики доброкачественных и злокачественных узловых образований щитовидной железы | 2021 |
|
RU2783304C1 |
| ПЕПТИД, СТИМУЛИРУЮЩИЙ ОБРАЗОВАНИЕ СПЕЦИФИЧЕСКИХ АНТИТЕЛ ПРОТИВ ОЛИГОМЕРНОЙ ФОРМЫ НУКЛЕОФОЗМИНА В ОПУХОЛЕВЫХ КЛЕТКАХ | 2009 |
|
RU2401275C1 |
| МЫШИНАЯ ГИБРИДОМА Р56 - ПРОДУЦЕНТ МОНОКЛОНАЛЬНОГО АНТИТЕЛА, ОБЛАДАЮЩЕГО СПЕЦИФИЧНОСТЬЮ К ЯДЕРНОМУ АНТИГЕНУ ПРОЛИФЕРИРУЮЩИХ КЛЕТОК PCNA ЧЕЛОВЕКА | 2010 |
|
RU2435850C1 |

Изобретение относится к области медицины. С помощью моноклональных антител (МКА) к ядрышковому белку В23/нуклеофозмину и на основе выявленных данных об его изменениях при переходе клеток из состояния покоя к пролиферации используют белок В23/нуклеофозмина в качестве маркера для распознавания ранней стадии активации клеток к пролиферации, приводящей к началу прогрессирования заболевания. При повышении экспрессии В23/нуклеофозмина может быть выявлено в иммуноблотах раньше, чем в иммуноцитохимических методах на фиксированных клетках. Из периферической крови с помощью градиентного центрифугирования на фиколле выделяют лимфоидные клетки, лизируют их и затем в лизатах определяют количественное содержание ядрышкового белка В23/нуклеофозмина методом иммуноблоттинга с последующим сканированием полученных иммуноблотов и определением условного содержания белка по компьютерной программе с учетом ширины и интенсивности окраски белковых полос. Изобретение обеспечивает возможность более ранней диагностики прогрессирующей формы хронического лимфолейкоза (ХЛЛ) в начальном периоде заболевания или прогрессирования в процессе лечения. 4 ил.
Способ прогнозирования прогрессирования хронического лимфолейкоза, основанный на выявлении повышенной пролиферативной активности клеток, приводящей к нарастанию опухолевого клона и оцениваемой иммуноцитохимически с помощью специфических моноклональных антител по экспрессии маркеров пролиферации клеток, отличающийся тем, что для выявления начальных стадий активации клеток к пролиферации применяется определение количественного содержания ядрышкового белка В23/нуклеофозмина в иммуноблотах лизатов клеток, повышенный уровень которого является наиболее ранним предвестником прогрессирования заболевания.
| ШТАММ КУЛЬТИВИРУЕМЫХ КЛЕТОК МЫШИНОЙ ГИБРИДОМЫ, ИСПОЛЬЗУЕМЫЙ ДЛЯ ПОЛУЧЕНИЯ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ К ЯДРЫШКОВОМУ АНТИГЕНУ, АССОЦИИРОВАННОМУ С КЛЕТОЧНОЙ ПРОЛИФЕРАЦИЕЙ | 1998 |
|
RU2145634C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ТЕЧЕНИЯ ХРОНИЧЕСКОГО ЛИМФОЛЕЙКОЗА | 2004 |
|
RU2256921C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РАЗВИТИЯ И ТЕЧЕНИЯ ХРОНИЧЕСКОГО ЛИМФОЛЕЙКОЗА | 2003 |
|
RU2248574C1 |
| US 6436948 A, 20.08.2002 | |||
| SHALAEV V.A | |||
| et al | |||
| Immunoregulation effect of prostaglandins on the course of chronic lympholeukemia | |||
| Ter Arkh | |||
| Приспособление заменяющее сигнальную веревку | 1921 |
|
SU989A1 |
| СПОСОБ ПОЛУЧЕНИЯ СУЛЬФОБЕТАИНОВ НА ОСНОВЕ БЕТУЛИНОВОЙ КИСЛОТЫ | 2015 |
|
RU2588138C1 |
Авторы
Даты
2007-11-10—Публикация
2005-11-25—Подача