Изобретение относится к медицине, а именно к химико-фармацевтической промышленности, и касается средств, направленных на предотвращение прогрессирования (снижения скорости) апоптотических изменений в клетках различных органов и их перехода в некротическое поражение тканей при самых различных, этиологически и патогенетически нетождественных, патологических состояниях организма.
Апоптоз или программируемая гибель клеток представляет собой сложный эволюционно развитый, физиологический, в отличие от некроза, механизм клеточной гибели, который регулирует клеточную массу и архитектуру многих тканей. До настоящего времени он мало изучен. Впервые описан J.Kerr и его сотрудниками в 1972 г. (1). Апоптотические процессы первоначально были определены как изменения, связанные с запрограммированной гибелью клеток, и прежде всего характеризующие процесс старения организма в результате снижения синтеза энергии. В последние годы считается, что ускорение апоптотических процессов характеризует такие различные патологические процессы, как тканевая деструкция и выраженная локальная или общая гипоксия, хроническое отравление, ишемические и реперфузионные повреждения, атеросклероз, артериальная гипертензия, острая и хроническая сердечная недостаточности независимо от этиологии (2, 3), MILAS синдром и другие типы митохондриальной недостаточности, деформирующий остеоартроз и ревматоидный артрит, гестоз у беременных, лучевая болезнь и другие заболевания, связанные с нарушениями экологии и токсическими поражениями. Активация апоптотических изменений, которые в случае сопряжения с прогрессированием гипоксически-ишемических повреждений неминуемо переходят в некротические, ведет к гибели клеток, деструкции ишемизированных тканей, нарушению функций ЦНС, дыхательной недостаточности, снижению диуреза, рефрактерности к проводимой терапии, смерти. Установлено, что гибель кардиомиоцитов при сердечной недостаточности увеличивается в 109 раз. Программируемая клеточная гибель участвует в постнатальном морфогенезе проводящей системы сердца: синусного и атриовентрикулярного узла, пучка Гиса; в развитии пароксизмальных аритмий и нарушений проводимости (4). Апоптоз пейсмейкерных клеток может играть роль в генезе внезапной коронарной смерти. В настоящее время можно с определенной уверенностью утверждать, что основной вклад в суммарную клеточную гибель при атеросклерозе вносит апоптоз (6). Все клеточные элементы, обнаруживаемые в атеросклеротических бляшках, подвергаются программированной гибели (5). Установлено, что апоптотический индекс медиа нормальных коронарных сосудов равен 3+1%, в интиме - 8+1%. В атероме апоптотический индекс медиа статистически значимо не менялся (5+1%), в то время как в интиме он возрастал почти в 4 раза (34+5%) (6).
Следовательно, ингибирование апоптоза миоцитов и других клеток может быть ключевым механизмом превенции и купирования заболевания и представляет собой новую терапевтическую мишень в мультикомпонентной терапии перечисленных заболеваний, позволяющее значительно повысить выживаемость и качество жизни клетки, ткани, организма.
Превенция апоптоза кардиомиоцитов и других клеток различных органов и тканей организма является важной, качественно новой задачей в терапии сердечно-сосудистых и других заболеваний организма (7).
Таким образом, традиционная мультикомпонентная терапия сердечной недостаточности, ишемических и гипоксических заболеваний: мозга, артериальной гипертонии, кардиомиопатиях, хронических и инфекционных поражений печени и многих других заболеваний, индуцирующих ускорение апоптоза, должна предусматривать включение антиапоптотических средств. Однако такой терапии на сегодняшний день не существует.
В качестве антиапоптотических средств предлагается использовать ингибиторы различных точек в каскадах апоптотических реакций, например ингибиторы кальпаина (ингибитор ростового фактора), ингибиторы цистеиновых протеаз (действие на экстрацеллюлярный матрикс), ингибиторы каспаз (нейтральные аминокислоты), раковые промоторы (эстрогены), фенобарбитал (андрогены), никотин (интерлейкин-9). H.Yaoita и соавторы продемонстрировали, что Z-VAD-fmk, общий ингибитор каспаз, способен ингибировать процессы апоптоза кардиомиоцитов и площадь инфаркта миокарда у крыс, подвергшихся реперфузии in vivo (8).
Указанные вещества - Z-VAD-fmk, SB 203580, PD 98059, инсулиноподобный ростовой фактор, N-ацетил-цистеин применяют в основном в экспериментальных условиях.
Определенные перспективы связаны с дальнейшим клиническим исследованием карведилола (1-[9H-carbazol-4-yloxy]-3-[-(methoxyphenoxy)ethyl-2-propanol). Препарат представляет собой β-адреноблокатор и частичный α-адренергический антагонист с выраженной антиоксидантной и умеренной сосудорасширяющей активностью. При проведении клинических исследований карведилол продемонстрировал значительное снижение уровня смертности больных с сердечной недостаточностью. Механизм антиапоптотического действия препарата предположительно сводится в подавлению экспрессии Fas-рецептора на кардиомиоцитах (9, 10).
Однако ни одно из перечисленных средств не предусматривает одновременного сбалансированного воздействия на различные звенья такого сложного универсального процесса, каким является апоптоз, что не позволяет не только замедлить явление апоптоза, но и, что особенно важно, купировать его переход к некротизации ткани.
Таким образом, разработка и внедрение антиапоптотических средств в практику здравоохранения является актуальной нерешенной проблемой различных областей медицины. Специфические антиапоптотические средства должны "работать" практически на всех уровнях процесса, поскольку существует единый универсальный механизм, контролирующий апоптоз клеток различной гистологической принадлежности, который дает сбой при различных патологических процессах.
Задачей изобретения является создание высокоэффективного средства для предотвращения прогрессирования апоптотических и купирования некротических изменений в тканях организма, обладающего широким спектром терапевтического действия, низкой токсичностью, позволяющего устранять или минимизировать причины активации апоптотических изменений, уменьшать степень некротического поражения тканей при патологических процессах различной этиологии.
Сущность изобретения состоит в том, что средство для предотвращения прогрессирования апоптотических и купирования некротических изменений в тканях организма характеризуется тем, что оно содержит производное 3-оксипиридина, никотинамидадениндинуклеотид, инозин при следующем соотношении компонентов, в мг:
производное 3-оксипиридина - 25-1500,
никотинамидадениндинуклеотид - 0,5-100,
инозин - 100-1200.
В качестве производного 3-оксипиридина средство преимущественно содержит 2-этил-6-метил-3-оксипиридина сукцинат.
При ишемически-реперфузионных, гипоксических и инфекционных поражениях сердца, осложненных и не осложненных сердечной недостаточностью, средство дополнительно содержит L-карнитин или его производные при следующем соотношении компонентов, в мг:
L-карнитин или его производные - 10-100,
производное 3-оксипиридина - 25-1500,
никотинамидадениндинуклеотид - 0,5-100,
инозин - 100-1200.
При ишемических, гипоксических и других дегенеративных поражениях мозга средство дополнительно содержит холина альфосцерат или его производные при следующем соотношении ингредиентов, в мг:
холина альфосцерат - 50-1000,
производное 3-оксипиридина - 25-1500,
никотинамидадениндинуклеотид - 0,5-100,
инозин - 100-1200.
Использование изобретения позволяет получить следующий технический результат.
Впервые разработано высокоэффективное антиапоптотическое лекарственное средство, имеющее широкий спектр действия и характеризующееся низкой токсичностью. Оно работает практически на всех уровнях апоптотического процесса при различных патологических состояниях.
Оно может быть использовано в различных областях медицины в комплексном лечении заболеваний и патологических состояний для предотвращения развития и прогрессирования апоптотических и купирования некротических изменений в тканях организма, замедления старения организма.
Использование препарата позволит сократить сроки раннего реабилитационно-восстановительного периода после хирургических операций, в том числе после операций по хирургической реваскуляризации миокарда, значительно сократить сроки выхода из наркоза и его последствия, повысить эффективность химиотерапии, ограничить ее применение.
Препарат дает возможность улучшить фармакоэкономические показатели лечения заболеваний, характеризующихся мультиорганной дисфункцией.
С помощью предлагаемого средства можно значительно повысить качество жизни и выживаемость больных сердечной цереброваскулярной недостаточностью, постгипосической энцефалопатией, острыми и хроническими интоксикациями, наследственными и специфическими кардиомиопатиями, нейродегенеративными заболеваниями, повысить адаптационные возможности организма, фармакоэкономические показатели лечения заболеваний, характеризующихся мультиорганной дисфункцией, адаптационные возможности организма, поддержать пластические процессы при больших физических нагрузках и экстремальных состояниях.
Технический результат достигается за счет создания нового лекарственного средства с оригинальной комбинацией компонентов.
Препарат имеет комплексную направленность на все звенья апоптотического процесса и его клинические проявления и обладает широким спектром терапевтического воздействия на весь организм в целом.
Высокая эффективность препарата обусловлена также синергизмом действия входящих в него компонентов, которые взаимно дополняют и усиливают друг друга.
Впервые удалось получить эффект замедления апоптоза и купирования перехода апоптотических изменений в некротические комбинацией ингредиентов, для каждого из которых, кроме производных 3-оксипиридина, ранее было показано наличие антиапоптотического действия, однако в медицинской практике ни один из них с этой целью не применялся.
Производные 3-оксипиридина, в частности 2-этил-6-метил-3-оксипиридина сукцинат, обладают антигипоксическим действием и, по-видимому, является "ловушкой" свободных радикалов, активных форм кислорода, играющих важную роль и в прогрессировании апоптотических процессов. Производные 3-оксипиридина влияют на регуляцию функционально-метаболической активности клеток прежде всего благодаря ингибированию свободно-радикального окисления мембран, влиянию на содержание биогенных аминов и энергетический обмен клеток. 2-этил-6-метил-3-оксипиридина сукцинат стабилизирует биологические мембраны, повышает содержание полярных фракций глицерофосфолипидов, снижает соотношение холестерин/фосфолипиды и тем самым уменьшает вязкость липидного слоя. Важное значение имеет способность производных 3-оксипиридина ингибировать фосфодиэстеразную активность и повышать содержание циклических нуклеотидов, а также способность ингибировать в определенной степени синтез простагландинов и лейкотриенов.
Поддержание уровня никотинамидадениндинуклеотида (НАД), входящего в состав разработанного средства, и редокс-потенциала НАД/НАДН является прямым ключевым механизмом ингибирования ускорения апоптотических процессов и их перехода в некротические изменения. Оказалось, что деструктивные изменения в ядре, запускаемые апоптозом, в результате активации поли-АДФ-рибозы полимеразы истощают уровень НАД, что и является тригерром некротической гибели клетки (11, 12). Инозин, как и его предшественник гипоксантин и продукт его деградации аденозин, также способны дозо-зависимо ингибировать активацию поли-АДФ-рибозы полимеразы в макрофагах [13). Кроме того, и НАД, и инозин, и 2-этил-6-метил-3-оксипиридина сукцинат восстанавливают различные звенья в системе энергетического обеспечения клетки, тем самым повышают использование кислорода на синтез АТФ в клетке, с одной стороны, и с другой, ингибируют образование свободных радикалов, которые сами по себе являются мощными индукторами апоптоза и некроза.
Включение в комбинацию L-карнитина усиливает ингибирование ускорения апоптоза через поддержание стабильности митохондриальной мембраны, воздействие на метаболизм керамидов, ингибирование образования свободных радикалов и положительный эффекта на повышение резервных возможностей иммунной системы. Антиапоптотический эффект L-карнитина и его производных показан как на моделях in vitro, так и in vivo (14, 15, 16, 17). На основании этих свойств им усилена комбинация при ишемически-реперфузионных, гипоксических и инфекционных поражениях сердца.
Основной компонент холина альфосцеарата, холин, является важнейшим естественным ингредиентом живой клетки, играет особую роль в мозговой ткани человека. Холин является предшественником одного из важнейших нейротрансмиттеров ацетилхолина, одновременно выполняя роль донатора метальных групп и структурным компонентом фосфолипидов. Дефицит холина также вызывает апоптоз как in vitro, так in toto (18, 19, 20), хотя механизм холина-дефицитного апоптоза остается неизвестным (21). Учитывая важность восстановления холинергической регуляции при деструктивных процессах в мозге, холина альфосцерат включен в комбинацию при ишемических, гипоксических и других дегенеративных поражениях мозга.
Таким образом, разработанное средство обладает направленным действием на различные звенья в сложной цепи апоптотических и некротических реакций, и в результате при низкой токсичности ингибирует ускорение апоптоза, купирует переход апоптотических процессов в некротические, существенно повышает толерантность организма к физической нагрузке, время жизни на высоте и на больших глубинах, сокращает зону инфаркта (ишемиии) миокарда, мозга, последствия постреперфузионных повреждений, эндо- и экзогенной интоксикации, сокращает сроки и выживаемость больных при сердечной недостаточности, существенно снижает риск кардиохирургических, хирургических операций, создавать условия для хранения органов при трансплантации и подготовки к пересадке стволовых клеток.
Использованные в формуле количественные соотношения компонентов, включенных в препарат, отражают результат экспериментальных наблюдений, которые продемонстрировали, что выход за пределы представленных концентраций снижают синергетическое действие ингредиентов и, как следствие, терапевтическую эффективность препарата.
Новое средство предлагается к выпуску в стеклянных или пластиковых флаконах или ампулах, содержащих прозрачную жидкость или лиофилизированный порошок, белого цвета или слегка кремового цвета (в последнем случае возможна комплектация растворителем), или в виде кишечно-растворимых и подъязычных таблеток белого цвета, а также суппозиториев.
Средство для предотвращения прогрессирования апоптотических и купирования некротических изменений в тканях организма готовят в зависимости от вида лекарственной формы следующим образом.
Для приготовления инъекционной лекарственной формы в смеситель засыпают компоненты в необходимых соотношениях, тщательно перемешивают. Затем смесь разводят в предварительно очищенной воде, используемой в фармацевтической промышленности, добавляют вспомогательные вещества, пропускают через миллипоровые фильтры диаметром 22 мкм, далее разливают в ампулы или флаконы и проверяют на герметичность и стерильность. Возможен вариант лиофилизированной инъекционной формы (более стабильной), в этом случае препарат, разлитый в ампулы или флаконы, высушивают в специальных лиофильных сушках при низких температурах.
При изготовлении лекарственного средства в виде твердой дозированной лекарственной формы, в частности кишечно-растворимых таблеток, приготовленную смесь в виде порошка или гранулята прессуют в таблетки и покрывают желудочно-резистентной оболочкой (кишечно-растворимые таблетки), или получают прессованием гранул и частиц, предварительно покрытых желудочно-резистентной оболочкой, или прессованием лекарственных веществ в смеси с желудочно-резистентным наполнителем (дурулы). При изготовлении таблеток, используемых в полости рта, делают непокрытые таблетки, полученные по специальной технологии с целью высвобождения лекарственного вещества в полости рта и обеспечения местного или общерезорбтивного действия (таблетки защечные, сублингвальные и др.). Возможно изготовление таблетированных форм с модифицированным высвобождением - покрытые или непокрытые таблетки, содержащие специальные вспомогательные вещества или полученные по особой технологии, что позволяет программировать скорость или место высвобождения лекарственного вещества. При изготовлении таблеток вспомогательные вещества добавляют в количестве, необходимом для обеспечения прочности гранул и таблеток. В технологии изготовления используют вспомогательные вещества, разрешенные Фармакопеей СССР XI издания, вып.2.
При приготовлении лекарственного средства в форме суппозиториев приготовленную смесь ингредиентов растворяют, в подобранном с учетом физико-химических свойств смеси растворителе, и вводят в основу. Готовую суппозиторную массу перемешивают, анализируют и подают на фасовку. Выливание суппозиториев производят на автоматах с разделенными операциями отливки и упаковки. Готовые свечи принимают держателем и упаковывают в целлофан. С помощью отсекающего устройства происходит их деление по 5 штук отрезающими устройствами.
Технологический процесс осуществляют в асептических условиях с выполнением контрольных исследований качества готовой лекарственной формы. Предлагаемое средство независимо от формы выпуска обладает высокой стабильностью.
Пример 1. В смеситель засыпают ингредиенты лекарственного средства в следующих соотношениях, в мг:
2-этил-6-метил-3-оксипиридина сукцинат - 25,
никотинамидадениндинуклеотид - 0,5,
инозин - 100,
затем тщательно перемешивают. Полученную смесь используют для приготовления необходимой лекарственной формы по соответствующей общепринятой технологии.
Пример 2. В смеситель засыпают ингредиенты лекарственного средства в следующих соотношениях, в мг:
2-этил-6-метил-3-оксипиридина сукцинат - 1500,
никотинамидадениндинуклеотид- 10,
инозин - 1200,
затем тщательно перемешивают и готовят необходимую лекарственную форму по общепринятой соответствующей технологии.
Пример 3. В смеситель засыпают ингредиенты лекарственного средства в следующих соотношениях, в мг:
2-этил-6-метил-3-оксипиридина сукцинат - 25,
никотинамидадениндинуклеотид - 0,5,
инозин - 100,
L-карнитин - 10,
смесь тщательно перемешивают и готовят из нее по общепринятой технологии необходимые лекарственные формы
Пример 4. В смеситель засыпают ингредиенты лекарственного средства в следующих соотношениях, в мг:
2-этил-6-метил-3-оксипиридина сукцинат - 1500,
никотинамидадениндинуклеотид - 10,
инозин - 1200,
L-карнитин - 100,
тщательно перемешивают, затем из полученной смеси готовят нужные лекарственные формы по соответствующим общепринятым технологиям.
Пример 5. В смеситель засыпают ингредиенты лекарственного средства в следующих соотношениях, в мг:
2-этил-6-метил-3-оксипиридина сукцинат - 25,
никотинамидадениндинуклеотид - 0,5,
инозин - 100,
холина альфосцеарат - 50,
смесь тщательно перемешивают и готовят из нее лекарственные формы по соответствующим общепринятым технологиям.
Пример 6. В смеситель засыпают ингредиенты лекарственного средства в следующих соотношениях, в мг:
2-этил-6-метил-3-оксипиридина сукцинат - 1500,
никотинамидадениндинуклеотид - 10,
инозин - 1200,
холина альфосцеарат - 1000,
затем тщательно перемешивают.
Из полученной смеси по соответствующей технологии изготавливают или иную лекарственную форму.
Лекарственное средство применяют у больных с различными нозоологиями формами заболеваний, патогенетические механизм развития которых включает гипоксический компонент, и/или прогрессирование апоптоза, и/или некротические изменения в зависимости от тяжести заболевания. Возможно применение в качестве адаптогенной терапии для профилактики развития органических изменений в различных органах у спортсменов, летчиков, подводников, у персонала, обслуживающего источники СВЧ, радио- и телекоммуникационные системы, частоболеющих детей и подростков.
Однократная доза лекарственного средства содержит действующее начало, весовые соотношения компонентов в котором не выходит за следующие пределы, в мг:
2-этил-6-метил-3-оксипиридина сукцинат - 25-1500,
никотинамидадениндинуклеотид - 0,5-100,
инозин - 100-1200.
Доза в зависимости от тяжести заболевания варьируется от однократного приема до 4 раз в сутки (каждые 6 часов). При ишемически-реперфузионных, гипоксических и инфекционных поражениях сердца, осложненных и не осложненных сердечной недостаточностью лекарственное средство применяют в форме инъекций, таблеток или суппозиториев, действующее начало которых содержит L-карнитин или его производные при следующем соотношении компонентов, в мг:
L-карнитин или его производные - 10-100,
2-этил-6-метил-3-оксипиридина сукцинат - 25-1500,
никотинамидадениндинуклеотид - 0,5-100,
инозин - 100-1200.
Доза в зависимости от тяжести заболевания варьируется от однократного приема до 4 раз в сутки (каждые 6 часов).
При ишемических, гипоксических и других дегенеративных поражениях мозга лекарственное средство применяют в инъекционной, таблетированной форме или в виде суппозиториев, действующее начало которых содержит компоненты при соотношении, в мг:
холина альфосцерат - 50-1000,
2-этил-6-метил-3-оксипиридина сукцинат - 25-1500,
никотинамидадениндинуклеотид - 0,5-100,
инозин - 100-1200.
Доза в зависимости от тяжести заболевания варьируется от однократного приема до 4 раз в сутки (каждые 6 часов).
Об активности апоптоза судят по степени активности поли-(АДФ-рибозы)-полимеразы (ключевого фермента активации апоптотической гибели клеток), которую определяют с использованием тест-наборов Amersham Pharmacia Biotech. Глубину некротических повреждений кардиомиоцитов оценивают по количеству выхода миостобина в кровь, содержание миоглобина измеряли спектрофотометрически.
Примеры экспериментальной проверки препарата.
Пример 7. Острую гипобарическую гипоксию (как одно из наиболее адекватных методик для изучения состояний гипоксии) в сочетании с гиперкапнией моделировали путем "подъема" низкоустойчивых к гипоксии животных на критическую высоту 11500 м со скоростью около 200 м/мин. Если время жизни на "высоте" превышало 10 мин, то моделирование гипоксии прекращали и животных относили к условно высокоустойчивым, а животных, время жизни которых на "высоте" было меньше 10 мин, - к условно низкоустойчивым. В исследования брали только низкоустойчивых (НУ) к гипоксии животных. В ходе повторного эксперимента по подъему НУ животных на "высоту" - моделировании острой гипобарическрй гипоксии в сочетании с гиперкапнией - регистрировали время потери позы (ВПП), время жизни - время от окончания подъема на высоту до остановки дыхания либо появления первого агонального вдоха, время реституции (ВР) - от остановки дыхания до момента восстановления активной позы после спуска животного. Рассчитаны коэффициент устойчивости к гипоксии как отношение времени жизни к времени реституции, увеличение которого говорит о возрастании резистентности организма к действию экстремальной кислородной недостаточности.
Исследуемые соединения вводили внутривенно (способ введения выбран как отражающий максимальный эффект препарата) за 15 минут до опыта. Разработанное средство также вводили внутривенно в форме инфузии, либо в таблетированной форме перорально, либо в виде суппозиторий.
В норме в миокарде активность поли-(АДФ-рибозы)-полимеразы в миокарде равна 0,035±0,006 пкМоль/мг белка, а в мозге - 0,030±0,004 пкМоль/мг белка
Как показало исследование, эффект разработанного средства не является простой суммой входящих в него ингредиентов - имеет место выраженный положительный синергизм ингредиентов по антиапоптотическому действию (сумма эффектов отдельных ингредиентов в тех же дозах дает эффект, почти в два раза менее выраженный, чем в созданном лекарственном средстве). По степени выраженности эффекта при оптимальном соотношении ингредиентов в созданном лекарственном средстве независимо от его формы сила эффекта существенно не изменяется.
Пример 8. Купирование апоптоза при ишемии миокарда, развившихся на фоне артериальной гипертонии.
Артериальную гипертензию нормотензивных крыс воспроизводили путем наложения лигатуры в виде титанового спиралевидного кольца на участок аорты с отходящими от нее артериями почек. Достигали сужения просвета аорты на 2/3 диаметра. Животных оперировали под наркозом и вскрывали брюшную полость. Артериальное давление измеряли путем использования датчика с резиновой манжеткой на хвосте животного. Сигнал от датчика регистрировали на Мингографе ЕМТ 118. На 30 сутки после операции все животные были разделены на две группы: в первой группе животным была лигирована левая нисходящая межжелудочковая артерия в верхней ее трети - воспроизведена жесткая ишемия миокарда, а во второй необратимая двусторонняя окклюзия общих сонных артерий шелковой нитью (смотреть пример 9). Операцию проводили стандартно, она занимала не более 7-10 мин, затем крысы быстро восстанавливались после наркоза. Животных подвергали эфтаназии на 10 сутки после операции в обоих группах. Все исследуемые соединения вводили внутривенно (способ введения выбран как отражающий максимальный эффект препарата) через минут после перевязки коронарной артерии. Разработанное средство также вводили внутривенно в форме инфузии на 5% глюкозе, либо в таблетированной форме перорально, либо в виде суппозиториев.
Защитное действие разработанного средства, независимо от способа введения, в экстремальных условиях острой глубокой ишемии миокарда, показало ее значительное превосходство, выявило синергизм в действии входящих в него ингредиентов, и в результате позволило перейти от трансмурального инфаркта миокарда до не угрожающего для жизни ишемического поражения мышцы сердца. Описанный положительный эффект не удается достичь ни препаратом 2-этил-6-метил-3- оксипиридина сукцинат, ни при его комбинации с каким либо из ингредиентов в отдельности. Обращает на себя внимание тот факт, что резко сокращается отношение некротизируемой зоны к общей массы пораженного миокарда (зоны ишемии), что коррелирует с регистрируемым при этом резким снижением активности поли-(АДФ-рибозы)-полимеразы - маркера апоптоза (r 0,76, р<0,001). Это означает, что ингибирование апоптотического процесса и его перехода в некротические изменения под влиянием патентуемого средства купирует некротические изменения в миокарде и тем самым резко ограничивает зону некроза миокарда, значительно уменьшает степень выраженность аритмий.
Пример 9. Купирование апоптоза при ишемии мозга, развившейся на фоне артериальной гипертонии.
Воспроизведение патологии описано в примере 2. Неврологический дефицит оценивали «слепо» (без информации о распределении крыс по группам) через каждые 30 мин в течение 1 суток по шкалам балльной оценки C.P.McGrow (1977). По шкале C.P.McGrow (1977) Stroke Index возрастал с появлением отдельных признаков неврологического дефицита (неврологический балл изменялся от 0-1 (норма) до 20 (смерть). Основные признаки неврологического дефицита включали ограничение подвижности животного, птоз (одно- или двусторонний), кружение, гиперактивное поведение, вращательное, тонические и клонические судороги, кому со слабым болевым ответом или его отсутствием. Для статического анализа полученных данных по динамике неврологического дефицита использовали дисперсионный факторный анализ ANOVA. Для оценки летальности и отдельных неврологических проявлений применяли тест Фишера.
В контрольной группе в первые 3 часа после окклюзии общих сонных артерий вращательные и клонические судороги зарегистрировали у 80% животных, а в подгруппе, получавшей 100 мг/кг массы животного 2-этил-6-метил-3-оксипиридина сукцината+100 мг/кг холина альфосцерата+1,0 мг/кг НАД+100 мг/кг инозина, всего в 24% случаев. При оценке до-суточной летальности необходимо отметить, что в контроле 50% летальность отмечалась в интервале до 8 часов, тогда как в подгруппах, леченных комбинированным средством: 100 мг/кг 2-этил-6-метил-3-оксипиридина сукцината+100 мг/кг холина альфосцерата+1,0 мг/кг НАД+100 мг/кг инозина и 100 мг/кг 2-этил-6-метил-3-оксипиридина сукцината+1,0 мг/кг НАД+100 мг/кг инозина в интервале до 8 часов ни одного летального исхода не зарегистрировано. Оценка летальности к концу первых суток после глобальной ишемии мозга показала 100% гибель в первой подгруппе, 85% во второй подгруппе, 70 и 68% в 3-1 и 4-й подгруппах соответственно и 50 и 45% - в 5-й и 6-й подгруппах соответственно. Средняя продолжительность жизни в 1-ой подгруппе составила - 8,7±1,7 ч, во 2-ой - 12,2±1,5 ч (р<0,05), в 3-ей - 14,5±2,1 ч (р<0,03), в 4-ой -14,2±1,9(р<0,01), в 5-ой - 18,3±1,4(р<0,002), в 6-ой - 23,9±2,3 ч (р<0,001). Следует отметить, что к концу первых суток средний балл по шкале McGrow (1977) у контрольных животных на 11 пунктов выше, чем под воздействием разработанного средства: 100 мг/кг 2-этил-6-метил-3-оксипиридина сукцината+100 мг/кг холина альфосцерата+1,0 мг/кг НАД+100 мг/кг инозина. Полученные результаты позволяют заключить, что разработанная комбинация обладает выраженной способностью повышать выживаемость животных при глобальной ишемии мозга и значительно уменьшать выраженность неврологического дефицита при сравнении с контрольной группой.
На фиг.1 показана динамика изменения среднего балла неврологического дефицита по шкале McGrow (1977) у крыс после одномоментной окклюзии обеих общих сонных артерий.
Ряд 1 - контроль, ряд 2 - +100 мг/кг массы 3-оксипиридина, ряд 3 - 50 мг/кг 100 мг/кг 2-этил-6-метил-3-оксипиридина сукцината+100 мг/кг инозина, ряд 4 - 50 мг/кг 100 мг/кг 2-этил-6-метил-3-оксипиридина сукцината +1,0 мг/кг НАД, ряд 5 - 50 мг/кг 100 мг/кг 2-этил-6-метил-3-оксипиридина сукцината +1,0 мг/кг НАД+100 мг/кг инозина, ряд 6 - лекарственное средство (100 мг/кг 2-этил-6-метил-3-оксипиридина сукцината +100 мг/кг холина альфосцерата +1,0 мг/кг НАД+100 мг/кг инозина), растворенное в воде для инъекций, введенное внутривенно, ряд 7 - лекарственное средство (100 мг/кг 2-этил-6-метил-3-оксипиридина сукцината +100 мг/кг холина альфосцерата+1,0 мг/кг НАД+100 мг/кг инозина), в таблетированной форме перорально через зонд, ряд 8 - лекарственное средство (100 мг/кг 2-этил-6-метил-3-оксипиридина сукцината +100 мг/кг холина альфосцерата +1,0 мг/кг НАД+100 мг/кг инозина), в виде суппозиториев.
В основе положительного эффекта созданного лекарственного средства независимо от способа введения лежит его способность в существенно большей степени ингибировать активность поли-(АДФ-рибозы)-полимеразы и тем самым предотвращать развитие апоптотической и некротической гибели клеток мозга.
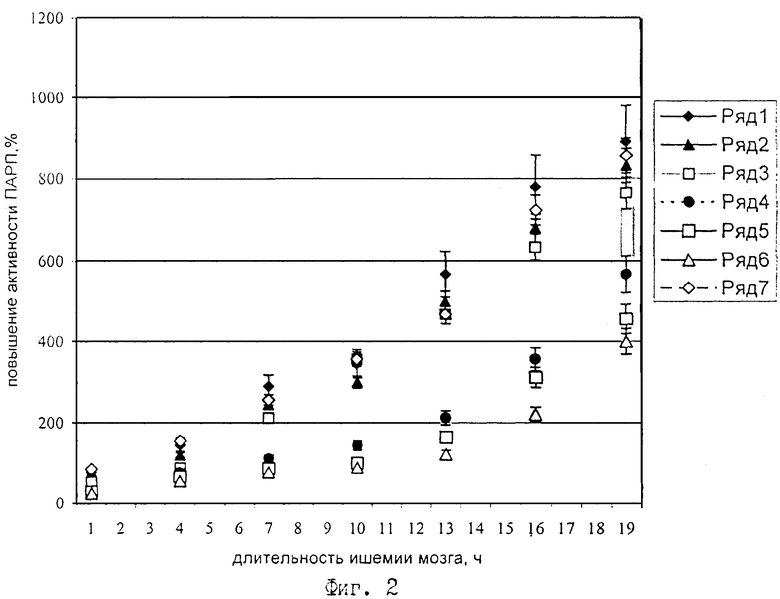
На фиг.2 показана динамика изменения активности поли-(АДФ-рибозы)-полимеразы в ткани мозга у крыс после одномоментной окклюзии обеих общих сонных артерий.
Ряд 1 - контроль, ряд 2 - +100 мг/кг массы 2-этил-6-метил-3-оксиипиридина сукцината, ряд 3 - 50 мг/кг 2-этил-6-метил-3-оксипиридина сукцината +100 мг/кг инозина, ряд 4 - 50 мг/кг 2-этил-6-метил-3-оксипиридина сукцината +1,0 мг/кг НАД, ряд 5 - 50 мг/кг 2-этил-6-метил-3-оксипиридина сукцината +1,0 мг/кг НАД+100 мг/кг инозина, ряд 6 - лекарственное средство (100 мг/кг 2-этил-6-метил-3-оксипиридина сукцината +100 мг/кг холина альфосцерата +1,0 мг/кг НАД+100 мг/кг инозина) внутривенная инъекция, ряд 7 - 100 мг/кг оксибутирата лития.
Особо обращает внимание, что на фоне введения разработанной комбинации уменьшение неврологического дефицита сопровождается купированием повышения активности фермента в течение первых суток, тогда как все препараты сравнения оказывают благоприятный эффект только в первые 6 часов после лигирования общих сонных артерий.



Средство содержит, мг: 2-этил-6-метил-3-оксипиридина сукцинат 25-1500, никотинамидадениндинуклеотид 0,5-100 и инозин 100-1200. Средство может дополнительно содержать L-карнитин в количестве 10-100 мг. Также средство может дополнительно содержать холина альфосцерат в количестве 50-1000 мг. Средство может быть выполнено в инъекционной или таблетированной лекарственной форме или в форме суппозиториев. Средство обеспечивает эффективное замедление апоптоза и купирование перехода апоптотических изменений в некротические при патологических процессах различной этиологии. 3 з.п. ф-лы, 2 ил., 2 табл.
| RU 98104073 A1, 27.01.2000 | |||
| RU 2000108431 A1, 10.03.2002 | |||
| ИНДИВИДУАЛЬНЫЕ ВЕЩЕСТВА, ПОЛУЧЕННЫЕ НА ОСНОВЕ ХИМИЧЕСКОГО ВЗАИМОДЕЙСТВИЯ ДИСУЛЬФИДСОДЕРЖАЩИХ ПЕПТИДОВ С ПРОИЗВОДНЫМИ ПУРИНОВЫХ ИЛИ ПИРИМИДИНОВЫХ ОСНОВАНИЙ, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И ПРЕПАРАТЫ НА ИХ ОСНОВЕ, СПОСОБЫ ИХ ПРИМЕНЕНИЯ ДЛЯ ЛЕЧЕНИЯ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ И ПРОФИЛАКТИКИ ОСЛОЖНЕНИЙ | 2001 |
|
RU2178710C1 |
| СТИМУЛЯТОР ЭНДОГЕННОЙ ПРОДУКЦИИ ЦИТОКИНОВ И ГЕПОПОЭТИЧЕСКИХ ФАКТОРОВ И СПОСОБ ЕГО ИСПОЛЬЗОВАНИЯ | 1995 |
|
RU2089179C1 |
| СПОСОБ ЛЕЧЕНИЯ ОСТРОГО ИНФАРКТА МИОКАРДА | 2000 |
|
RU2235564C2 |
Авторы
Даты
2007-11-27—Публикация
2005-04-28—Подача