Область техники изобретения
Изобретение относится к способу получения аллергенов пыльцы березы, которые отличаются отсутствием или, по крайней мере, снижением связывания иммуноглобулина Е, то есть гипоаллергенностью. Эти аллергены полностью сохраняют терапевтически релевантную стимуляцию Т-клеток. Таким образом, они могут быть использованы в качестве терапевтических агентов с низкими побочными эффектами для специфической иммунотерапии.
Предпосылки создания изобретения
Количество аллергий типа 1 значительно увеличилось во всем мире в последние десятилетия. До 20% популяции населения в индустриально развитых странах страдают от заболеваний, таких, как аллергический ринит, конъюнктивит или бронхиальная астма, которые вызываются аллергенами, присутствующими в воздухе (аэроаллергены), и которые выделяются различными источниками, такими, как растительная пыльца, клещи, млекопитающие (коты, собаки, лошади) и плесневые грибки. Тяжелые аллергии могут также инициироваться укусами или ужалением насекомых, таких как, например, пчелы и осы.
Вещества, вызывающие аллергию типа 1, представляют собой гликопротеины или полипептиды. Эти аллергены после попадания воздействуют через мембраны или взаимодействуют с IgE антителами, связанными с поверхностью тучных клеток у сенсибилизированных людей после ужаления или укуса. Если два или более IgE антител поперечно являются поперечно-связанными друг с другом с помощью аллергена, то это приводит к высвобождению медиаторов (например, гистамина, простагландинов) и цитокинов эффекторной клеткой, и таким образом, к инициации аллергических симптомов.
Пыльца березы представляет собой наиболее частый инициатор аллергических реакций среди пыльцы деревьев (Jarolim E. и др., 1989, Allergy 44: 385-95). Более чем 90% страдающих от аллергий, вызываемых пыльцой березы, имеют IgE антитела против основного аллергена Bet v 1 (Elfman, L. и др., 1997, Int. Arch. Allergy Immunol., 113: 249-51).
С помощью последовательностей кДНК возможно получить рекомбинантные аллергены, которые могут быть использованы для диагностики и терапии аллергий (Scheiner и Kraft, 1995, Allergy 50, 384-391). Получение рекомбинантных аллергенов Bet v 1 (rBet v 1) и их очистка для фармацевтических целей были описаны, например, Hoffmann-Sommergruber и др. (Protein Exp. Purif. 9(1), 1997: 33-39).
Кроме того, возможны специфические генетические модификации рекомбинантных аллергенов, что дает возможность снизить достигнутый аллергенный потенциал (Schramm и др., 1999, J. Immunol. 162 (4): 2406-2414; Valenta и др., 1999, Biol. Chem. 380: 815-24; Singh и др., 1999, Int. Arch. Allergy Immunol. 119: 75-85).). Варианты аллергенов этого типа представляют собой будущих кандидатов для специфической иммунотерапии аллергии типа 1.
Однако потенциальный недостаток вариантов рекомбинантного аллергена заключается в том, что модификация первичной структуры вызывает потерю или снижение реактивности эпитопов Т-клеток, которые необходимы для достижения терапевтического эффекта. Такая возможность может исключаться только тогда, когда первичная структура, соответствующая природному аллергену, служит как основа для получения препарата рекомбинантного белка.
В случае основного аллергена пыльцы березы rBet v 1 осуществляли получение такового, состоящего из двух частей (Vrtala, S., и др., 1997, J. Clin. Invest. 99: 1673-81) или такого, который представляет собой тример (Vrtala, S., и др., 1999, Int. Arch. Allergy Immunol. 118: 218-9), для того, чтобы оптимизировать его для терапевтических целей, то есть снизить способность связывания с IgE при использовании рекомбинантных способов. Потенциальная потеря эпитопов Т-клеток и нерастворимость белков также оказывают негативный эффект в таких подходах. Другой недостаток в этом случае может заключаться в комплексном способе получения этих вариантов rBet v 1.
Приемлемая начальная точка получения рекомбинантного основного аллергена rBet v 1, который может использоваться для терапевтических целей, будет соответственно представлять собой молекулу, которая соответствует дикому типу в отношении первичной структуры и является неограниченной в ее стимуляции Т-клеток, но имеет сниженную IgE активность, то есть является гипоаллергенной.
Задача данного изобретения решается в соответствии с настоящим изобретением путем проведения серии этапов биохимической очистки, которые известны сами по себе, при использовании растворимого рекомбинантного основного аллергена rBet v 1 в качестве исходного материала. Неожиданно было обнаружено, что в белках, очищенных таким образом, наблюдается сниженная IgE активность и в то же время поддержание стимуляции Т-клеток. Соответственно способ в соответствии с изобретением обеспечивает улучшенную терапевтическую эффективность и в то же время значительное снижение или отсутствие побочных эффектов.
Форма способа получения рекомбинантных аллергенов представляется проблемой исключительной важности в данной заявке, поскольку белки превращаются при проведении этого процесса в конформацию, которая не имеет аффинности или имеет значительно сниженную способность к связыванию с IgE при сохранении постоянной стимуляции Т-клеток.
Фигуры
Фигура 1А: Электрофорез в полиакриламидном геле при использовании (SDS-PAGE) для характеристики гипоаллергенного rBet v 1
Полоса 1: Белковый стандарт для оценки молекулярного веса
Полоса 2: Природный nBet v 1
Полоса 3: rBet v 1, очищенный в соответствии с изобретением
Полоса 4: Традиционно очищенный rBet v 1
Фигура 1В: Блоттинг на нитроцеллюлозный фильтр SDS-PAGE, представленного на фигуре 1А
Фигура 2А: Блоттинг на нитроцеллюлозный фильтр для определения активности IgE при использовании сывороток 20 индивидуальных пациентов
Положение 3: Природный nBet v 1
Положение 4: rBet v 1, очищенный в соответствии с изобретением
Положение 5: Традиционно очищенный rBet v 1
Фигура 2В: Блоттинг на нитроцеллюлозный фильтр для определения идентичности образцов Bet v 1
Блоты 21-26: Различные поликлональные кроличьи анти-Bet v 1 антитела
Блот 27: Моноклональное мышиное анти-Bet v 1 антитело 6В6
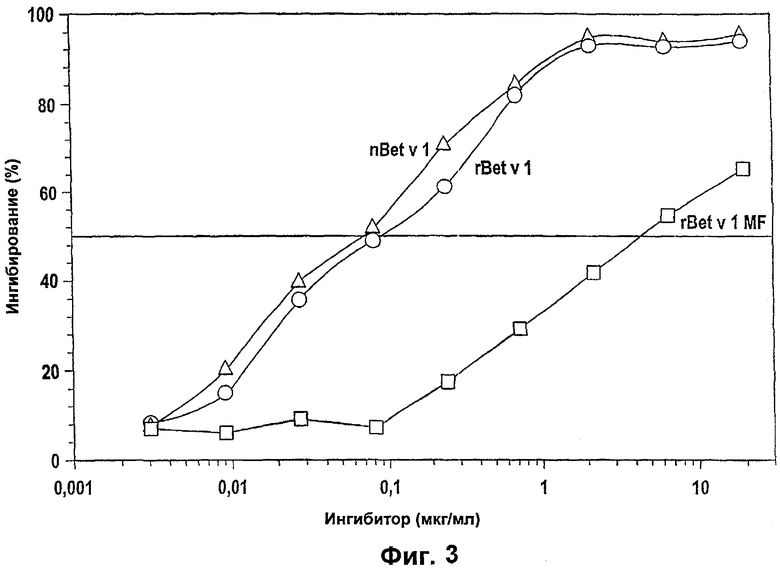
Фигура 3: Ферментный аллерго-сорбентный тест (EAST) для количественной оценки связывания IgE
Концентрация ингибитора связывания IgE-Bet v 1 приведена на вертикальной оси, степень ингибирования в % показана по горизонтальной оси.
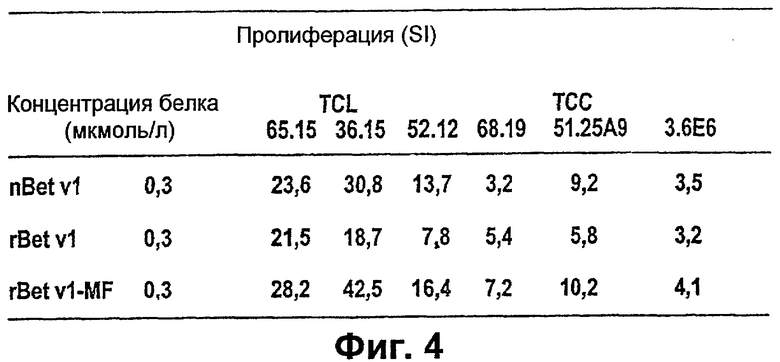
Фигура 4: Определение стимуляции Т-клеток с помощью вариантов Bet v 1. Сравнивали концентрации природного nBet v 1, традиционно очищенного рекомбинантного rBet v 1 и рекомбинантного rBet v 1, очищенного в соответствии с изобретением, и соответствующие индексы стимуляции (SI), полученные с различными линиями Т-клеток (TCL) и клонами Т-клеток (ТСС).
Подробное описание изобретения
Данное изобретение относится к способу биохимической очистки, который приводит к получению белков, которые имеют свойства, модифицированные в соответствии с изобретением с помощью эффективной очистки, при этом для очистки белков, например, аллергенов, полученных с помощью рекомбинантных способов, используют специфические элюенты. Эти свойства заключаются в отсутствии или, по крайней мере, в значительном снижении активности IgE с одновременным поддержанием стимуляции Т-клеток.
Таким образом, изобретение относится к способу снижения активности в отношении IgE основного аллергена пыльцы березы rBet v 1, который заключается в использовании растворимого рекомбинантного основного аллергена пыльцы березы rBet v 1 и осуществлении хроматографических этапов, описанных ниже, для его очистки и при осуществлении последующего этапа нейтрализации.
Изобретение также касается способа получения гипоаллергенного основного аллергена пыльцы березы rBet v 1 с помощью ряда этапов хроматографической очистки при использовании существенно небуферизованных водных оснований в качестве элюента, а также последующей нейтрализации, при этом используемый исходный материал представляет собой неочищенный растворимый белок rBet v 1, полученный с помощью рекомбинантных способов.
Этапы хроматографической очистки предпочтительно включают анионообменную хроматографию, хроматографию на основе гидрофобного взаимодействия и гель-фильтрацию, при этом они могут применяться один раз, несколько раз друг после друга или несколько раз альтернативно. Однако этапы хроматографической очистки предпочтительно осуществляют в следующей последовательности: проводят первую гель-фильтрацию, анионообменную хроматографию, хроматографию на основе гидрофобного взаимодействия, вторую гель-фильтрацию.
Хроматографическую очистку обычно осуществляют при использовании основания в концентрации от 5 до 100 мМ, но предпочтительно от 5 до 40 мМ и особенно предпочтительно от 10 до 30 мМ, при этом используемым веществом с основными свойствами является предпочтительно NaOH. Вместо использования исключительно водной системы также возможно применять смешанную систему, которая включает, например, воду и метанол. Неводная, например, метаноловая система также является возможной. Однако предпочтение отдается использованию водной системы.
В зависимости от соответствующего хроматографического этапа к элюенту могут прибавляться различные концентрации нейтральной соли - предпочтительно NaOH - приблизительно до 5 М.
Любое снижение значения рН, которое может быть необходимым для достижения значений, которые являются приемлемыми для соответствующих чувствительных белков, может быть достигнуто путем добавления гидрокарбоната натрия.
Намерение установить физиологические условия в конце очистки может быть причиной наличия гидрокарбоната натрия во время проведения хроматографических этапов. Концентрации до 100 мМ являются, в основном, возможными для данной заявки. Однако процесс предпочтительно проводят в физиологическом интервале концентрации, которая ниже 20 мМ, в частности, при концентрации 11 мМ.
В случае rBet v 1 снижение значения рН не является необходимым. Тем не менее, к rBet v 1 обычно прибавляют гидрокарбонат натрия при осуществлении способа в соответствии с изобретением для того, чтобы установить физиологические концентрации простым способом в конце очистки.
Изобретение, таким образом, относится к способу получения гипоаллергенного основного аллергена пыльцы березы rBet v 1, в котором существенно небуферизованные элюенты создают в растворе мягкие условия для белков, которые подвергаются очистке, и таким образом, поддерживают их в состоянии, позволяющем проводить хроматографию.
В предпочтительном воплощении способа неочищенный белок rBet v 1 предварительно подвергают очистке перед основной очисткой с помощью хроматографии, например, при использовании хроматографии на основе гидрофобных взаимодействий или ионообменной хроматографии и/или высаливания, где в отличие от последующей основной очистки, используется забуференный элюент или забуференный раствор.
Исходные материалы для осуществления способа являются растворимыми, рекомбинантные аллергены экспрессируются бактериальными клетками или другими приемлемыми хозяйскими клетками (такими, как, например, дрожжи). Поскольку способ представляет общее применение этих экспрессионных продуктов, растворимые аллергены различного происхождения в соответствии с изобретением могут также быть очищены с помощью данного способа, подвергнуты ренатурации и использованы для введения в состав препаратов. В частности, в случае соответствующей подобности этих аллергенов различного происхождения основному аллергену пыльцы березы rBet v 1 можно ожидать, что будут достигнуты свойства в соответствии с изобретением. Однако процесс является, в частности, приемлемым для получения основного аллергена пыльцы березы rBet v 1, полученного с помощью рекомбинантных способов. Однако природный основной аллерген пыльцы березы nBet v 1 также является по существу пригодным в качестве исходного материала.
Заключительная нейтрализация рекомбинантных активных ингредиентов путем модификации значения рН позволяет сделать соответствующий выбор концентрации ингредиентов элюента, получить готовый к использованию физиологический раствор, который может быть получен непосредственно.
Фармацевтически активные ингредиенты могут также использоваться непосредственно после нейтрализации в качестве продуктов для парентерального введения. Кроме того, воспроизводимый и стандартизованный способ может быть осуществлен в условиях в соответствии с установленным порядком производства товаров (GMP), соблюдение которого необходимо для получения фармацевтических препаратов.
Таким образом, изобретение предназначено для получения улучшенных препаратов для специфической иммунотерапии аллергий, чего достигают при использовании способа в соответствии с изобретением. Значительно сниженная или отсутствующая активность обеспечивает преимущественные свойства для специфической иммунотерапии. Рекомбинантные гипоаллергенные аллергены, полученные таким образом, могут сделать свой вклад в усовершенствование терапии аллергических заболеваний.
Изобретение, таким образом, относится к гипоаллергенному основному аллергену пыльцы березы rBet v 1, который получают с помощью процесса в соответствии с данным изобретением, в частности, при его применении в качестве лекарственного средства.
Также является возможным для дополнительного влияния на свойства основного аллергена пыльцы березы rBet v 1, например, для того, чтобы достичь дальнейшего снижения активности IgE или дальнейшего повышения стимуляции Т-клеток, осуществить фармацевтически приемлемые модификации белка и, таким образом, получить производные белка. Такие модификации могут, с одной стороны, быть генетическими модификациями на уровне ДНК, в которых, например, вставки, делеции и замены аминокислот, разрезание белка на фрагменты или слияние белка или его фрагментов с другими белками или пептидами также являются приемлемыми. Однако модификации также должны иметь химическую природу и происходить на белковом уровне.
Изобретение, таким образом, относится к применению гипоаллергенного основного аллергена пыльцы березы rBet v 1 в соответствии с изобретением и/или его фармацевтически приемлемых производных, включая их смеси во всех соотношениях, для получения лекарственного средства для специфической иммунотерапии аллергий, в инициацию которых вовлечен основной аллерген пыльцы березы rBet v 1.
В заключение изобретение относится к фармацевтической композиции, содержащей гипоаллергенный основной аллерген пыльцы березы rBet v 1 в соответствии с изобретением и/или его фармацевтически используемые производные, включая их смеси во всех соотношениях. Активные ингредиенты в соответствии с изобретением могут быть превращены в приемлемые дозированные формы в сочетании с, по крайней мере, одним твердым, жидким и/или полужидким наполнителем или адъювантом и необязательно в комбинации с одним или более дополнительными активными ингредиентами.
Эти композиции могут использоваться в качестве терапевтических агентов для человека или в ветеринарной медицине. Приемлемые наполнители представляют собой органические или неорганические вещества, которые являются приемлемыми для парентерального введения и которые не взаимодействуют с гипоаллергенным основным аллергеном пыльцы березы rBet v 1. Приемлемыми для парентерального введения являются, в частности, растворы, предпочтительно растворы на основе масла или водные растворы, кроме того, суспензии, эмульсии или имплантаты. Гипоаллергенный основной аллерген пыльцы березы rBet v 1 в соответствии с изобретением может также быть лиофилизирован, а полученный лиофилизат используют, например, для получения препаратов для инъекции. Указанные композиции могут подвергаться стерилизации и/или включать вспомогательные вещества, такие, как лубриканты, консервирующие агенты, стабилизаторы и/или смачивающие агенты, эмульгаторы, соли для модификации осмотического давления, буферные вещества и/или ряд других активных ингредиентов.
Кроме того, соответствующие препараты гипоаллергенного основного аллергена пыльцы березы rBet v 1 в соответствии с изобретением дают возможность получить препараты длительного высвобождения, например, с помощью адсорбции на гидроокиси алюминия.
Способ получения в соответствии с изобретением в общей форме приведен ниже. В этом описании все хроматографические материалы, упомянутые в виде примеров, получены от Amersham Biosciences (Freiburg, Germany). Первый предварительный этап для удаления нуклеиновых кислот может заключаться в хроматографии на основе гидрофобного взаимодействия, которую осуществляют при физиологических условиях (при значении рН 6-8, неденатурирующем), при этом белок, который представляет интерес, одновременно подвергается фокусированию. Альтернативно можно также осуществлять высаливание или ионообменную хроматографию. Однако не является абсолютно необходимым проводить этот этап предварительной очистки для достижения эффекта в соответствии с изобретением.
Последующий этап очистки служит для перевода белков в слабо соленый элюент, который имеет концентрацию в пределах от 10 до 1000 мМ, например, 20 мМ NaCl, например, путем гель-фильтрации на колонке Сефадекс G-25. Создают, таким образом, условия, которые улучшают проведение ионообменной хроматографии при использовании щелочных элюентов. Раствор белка, приготовленный таким образом, в последующем используют для анионообменной хроматографии, например, при использовании колонки Source Q. Большинство аллергенов связываются с носителем. Щелочной элюент вызывает тот факт, что изначально слабо растворимые или нерастворимые белки остаются в растворе. Элюирование при использовании градиента NaCl приводит к частичному удалению бактериальных загрязнений и фрагментов активного ингредиента.
В ходе дальнейших этапов очистки, на этапе хроматографии на основе гидрофобного взаимодействия и гель-фильтрации, предварительно очищенные и уравновешенные аллергены существенно отделяют от бактериальных загрязнений, которые еще остались. С этой целью применение, в основном, осуществляют на основе тех же веществ элюента, которые состоят из основания низкого молекулярного веса и варьирующего соотношения неорганической нейтральной соли. Таким образом, аллергены могут быть связаны с колонкой при проведении хроматографии на основе гидрофобного взаимодействия при использовании, например, до 5 М NaCl, 20 мМ NaOH и 11 мМ NaHCO3 и в дальнейшем элюируют при использовании раствора с низким содержанием соли щелочного металла или не содержащего соли щелочного металла, например, содержащего 20 мМ NaOH.
На этапе заключительной хроматографической очистки осуществляют замену элюента таким образом, что очищенные рекомбинантные белки получают в растворимой, готовой к применению форме путем простой нейтрализации основания, присутствующего в элюенте при использовании соответствующей кислоты. При осуществлении приемлемого выбора концентраций добавок, входящих в состав элюента, получают физиологический раствор, который является приемлемым для парентерального введения.
Очищенные аллергены идентифицируют при использовании известных физических, химических или биологических свойств, в частности, путем SDS-PAGE и специфических моноклональных антител. Для дальнейшей характеристики можно осуществлять, например, анализ на основе EAST ингибирования (EAST означает ферментный аллерго-сорбентный тест), с помощью которого специфическое связывание белка с IgE сравнивают со стандартом, который может быть определен, и/или на основе анализа пролиферации Т-клеток. Растворитель подвергают исследованию с помощью измерения рН и количественной оценки ионов Na+ и Cl-, и в случае необходимости, концентрации СО3 -. Эти способы являются общеизвестными и описанными в литературе.
Выход аллергенов, полученных в соответствии с изобретением, в общем случае составляет 75-95% от исходного белка.
Способ, таким образом, предусматривает минимальную обработку образца, короткий период отстаивания, предпочтительное использование исключительно фармакологически совместимых веществ, совместимость одного элюента с различными принципами разделения, а также дает возможность избежать длительных и, при некоторых обстоятельствах, неподтвержденных способов, таких, как диализ. Кроме того, раствор гидроокиси натрия, который предпочтительно используют в качестве основания, является известным в качестве эффективного бактериостатика, который предотвращает процесс деградации белков, присутствующих в растворе, или его контаминацию микроорганизмами. Эндотоксины, которые вызывают проблемы в бактериальной экспрессии, другие чужеродные белки и ДНК также эффективно удаляются или разлагаются.
Последовательность и количество хроматографических этапов, описанных выше, может изменяться. Таким образом, среди прочих, могут быть взяты во внимание специфические физико-химические свойства белка, представляющего интерес.
Даже без дальнейших комментариев предполагается, что специалист в данной области будет в состоянии использовать приведенное выше описание в его более широком объеме. Предпочтительные воплощения, описанные ниже, таким образом, должны восприниматься только как описательное раскрытие, которое абсолютно не ограничивает изобретение любым путем.
В частности, предпочтительное воплощение способа показано на следующей схеме (Таблица 1)
Обзор способа получения в соответствии с изобретением
Изобретение описано ниже посредством приведения примера очистки терапевтически эффективного рекомбинантного Bet v 1 (rBet v 1). Все хроматографические материалы являются коммерчески доступными от Amersham Biosciences (Freiburg, Germany).
Пример 1: Получение гипоаллергенного rBet v 1
Сначала с помощью стандартных способов получают лизат Е. coli, содержащий растворимый алерген rBet v 1 (Breiteneder H., и др., EMBO J. 1989, 8: 1935-8; Hoffmann-Sommergruber и др., Protein Exp. Purif. 9 (1), 1997: 33-39).
Для того чтобы удалить нуклеиновые кислоты, осуществляют хроматографию на основе гидрофобного взаимодействия при использовании фенил-Сефарозы в Трис/аммонийном буфере (20 мМ Трис/HCl, 1 М сульфата аммония, рН 8,0). Элюирование осуществляют при использовании дистиллированной воды. При осуществлении этапов дальнейшей очистки при использовании слабо щелочных элюентов остаточный сульфат аммония заменяют на 20 мМ NaCl путем гель-фильтрации через Сефадекс G-25.
Белковый раствор, предварительно очищенный таким образом, используют для анионообменной хроматографии, применяя Source 15Q, при этом материал носителя уравновешивают с помощью щелочного раствора (20 мМ NaOH; 11 мМ NaHCO3; 20 мМ NaCl до 20 мМ NaOH; 11 мМ NaHCO3; 0,5 М NaCl) и проводят удаление загрязнений (белков хозяйской клетки) и фрагментов активного ингредиента.
Последующий хроматографический этап представляет собой хроматографию на основе гидрофобного взаимодействия при использовании Source PHE. С этой целью элюат, полученный при использовании ионообменной хроматографии, доводят до 3 М NaCl; 20 мМ NaOH; 11 мМ NaHCO3 путем прибавления соответствующих количеств 5 М маточного раствора NaCl, 2 М маточного раствора NaOH и гидрокарбоната натрия. В этих условиях rBet v 1 связывается с материалом колонки. Элюирование связанного белка, представляющего интерес, осуществляют при использовании 20 мМ NaOH.
В качестве заключительного этапа осуществляют гель-фильтрацию через Супрадекс 75 в щелочных условиях. Хроматографический раствор выбирают таким образом, чтобы нейтрализация основания, прибавленного к элюенту, приводила к получению желаемой заключительной композиции: 10 мМ NaOH, 11 мМ NaHCO3 и 148,4 мМ NaCl, что соответствует концентрациям физиологического раствора. Элюат, полученный путем гель-фильтрации, на конечном этапе нейтрализуют при использовании кислоты HCl, что соответствует используемому основанию NaOH и приводит к получению нейтрального значения рН и в то же время к достижению желательного содержания соли физиологического раствора. Этого достигают путем прибавления 1/10 (об./об.) 100 мМ HCl.
Пример 2: Характеристика с помощью SDS-PAGE
Для характеристики гипоаллергенного rBet v 1 из Примера 1 осуществляли SDS-PAGE (15%). Как видно из Фигуры 1А, природный nBet v 1 (полоса 2), рекомбинантный rBet v 1, очищенный традиционным способом по методике Hoffmann-Sommergruber и др. (Protein Exp. Purif. 9(1), 1997: 33-39) (полоса 4), и rBet v 1, очищенный в соответствии с изобретением (полоса 3), имели одинаковый молекулярный вес в SDS-PAGE.
Пример 3: Определение активности в отношении IgE при использовании пула сывороток
Для определения активности в отношении IgE SDS-PAGE из Примера 2 подвергали блоттингу на нитроцеллюлозный фильтр. После того, как прибавляли пул сывороток крови пациентов, страдающих от аллергии на пыльцу березы, к блоту, блот подвергали инкубации с конъюгатом, содержащим анти-IgE антитело и щелочную фосфатазу. Цветная реакция, усиленная при использовании щелочной фосфатазы (Фиг.1В), показала активность в отношении IgE природного nBet v 1 и рекомбинантного, традиционным образом очищенного rBet v 1, но не rBet v 1-MF, очищенного в соответствии с изобретением.
Пример 4: Определение активности в отношении IgE при использовании индивидуальных сывороток
Для определения активности в отношении IgE при использовании сывороток крови, полученных от индивидуальных пациентов, страдающих от аллергии на пыльцу березы, использовали nBet v 1 (положение 3), рекомбинантный, традиционным образом очищенный rBet v 1 (положение 5) и rBet v 1, очищенный в соответствии с изобретением (положение 4), как представлено на Фигуре 2А, нитроцеллюлозную мембрану анализировали аналогично Примеру 3. Фиг.2А показывает, что за исключением сыворотки 5, в которой rBet v 1, очищенный в соответствии с изобретением, имел слабую активность в отношении IgE, только природный nBet v 1 и рекомбинантный, очищенный традиционным способом rBet v 1, но не rBet v 1, очищенный в соответствии с изобретением, имели активность в отношении IgE.
Для определения идентичности изучаемых аллергенов нитроцеллюлозный фильтр подвергали инкубации с различными кроличьими анти-rBet v 1 антителами (образцы от 21 до 26) и с моноклональным мышиным анти-rBet v 1 антителом 6В6 (образец 27) и последовательно обработанным так, как описано в Примере 3 (Фигура 2В).
Пример 5: Количественная оценка связывания IgE
В анализе ингибирования EAST, который осуществляли в соответствии со способом Suck и др. (Int. Arch. Allergy Immunol. 2000; 121: 284-291) при использовании пула сывороток крови пациентов, страдающих от аллергии, сравнивали друг с другом природный nBet v 1, рекомбинантный, традиционным образом очищенный rBet v 1 и rBet v 1, очищенный в соответствии с изобретением, в отношении силы их связывания с IgE (Фиг.3). Было обнаружено, что rBet v 1, очищенный в соответствии с изобретением, имеет сниженную более чем в 100 активность связывания с IgE по сравнению с другими белками rBet v 1.
Пример 6: Определение стимуляции Т-клеток
Для определения влияния аллергена rBet v 1 в соответствии с изобретением на рост Т-клеток осуществляли анализ пролиферации при использовании линий Т-клеток (TCL) и клонов Т-клеток (ТСС) при использовании способа Schramm и др. (1999, J. Immunol. 162 (4): 2406-2414) (Фиг.4). Из сравнения индексов стимуляции (SI) можно увидеть, что Т-клетки исследуемых доноров реагируют, по крайней мере, также сильно с rBet v 1, как и с природным nBet v 1 или рекомбинантным rBet v 1, очищенным традиционным способом. В зависимости от выбранных условий реакция с rBet v 1 даже превышает реакцию с nBet v 1 или rBet v 1 на одну треть.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ВЫДЕЛЕНИЯ И ОЧИСТКИ РЕКОМБИНАНТНЫХ ВАРИАНТОВ Bet v 1 | 2001 |
|
RU2299214C2 |
| Рекомбинантный полипептид на основе аллергена пыльцы березы и аллергена яблока в качестве вакцины от аллергии | 2020 |
|
RU2761431C1 |
| ГИБРИДНЫЕ БЕЛКИ-НОСИТЕЛИ ПЕПТИДОВ В КАЧЕСТВЕ ВАКЦИН ОТ АЛЛЕРГИИ | 2012 |
|
RU2630652C2 |
| ВАРИАНТЫ ГРУППЫ 5 АЛЛЕРГЕНОВ ЗЛАКОВЫХ СО СНИЖЕННОЙ АЛЛЕРГЕННОСТЬЮ ВСЛЕДСТВИЕ МУТАГЕНЕЗА ОСТАТКОВ ПРОЛИНА | 2010 |
|
RU2658767C1 |
| ВАРИАНТЫ ГРУППЫ 5 АЛЛЕРГЕНОВ ЗЛАКОВЫХ СО СНИЖЕННОЙ АЛЛЕРГЕННОСТЬЮ ВСЛЕДСТВИЕ МУТАГЕНЕЗА ОСТАТКОВ ПРОЛИНА | 2010 |
|
RU2575606C2 |
| ГИПОАЛЛЕРГИЧЕСКИЕ ВАРИАНТЫ Mal d 1, ГЛАВНОГО АЛЛЕРГЕНА Malus domectica | 2012 |
|
RU2624030C2 |
| ВАРИАНТЫ ОСНОВНОГО АЛЛЕРГЕНА Phl p 1 ИЗ ТИМОФЕЕВКИ ЛУГОВОЙ | 2003 |
|
RU2323942C2 |
| НОВЫЕ МУТАНТНЫЕ АЛЛЕРГЕНЫ | 2001 |
|
RU2285042C2 |
| Способы получения молекулярных конструкций, содержащих антигенные эпитопы актуальных аллергенов и сигнальные пептиды, обладающие иммунорегуляторными свойствами | 2012 |
|
RU2622004C2 |
| ПРОИЗВОДНЫЕ PhI p 5а, ОБЛАДАЮЩИЕ СНИЖЕННОЙ АЛЛЕРГЕННОСТЬЮ И СОХРАНЕННОЙ Т-КЛЕТОЧНОЙ РЕАКТИВНОСТЬЮ | 2004 |
|
RU2368620C2 |



Изобретение относится к биохимии. Препарат гипоаллергенного основного аллергена пыльцы березы r Bet v 1 получают с помощью одного или более этапов хроматографической очистки при использовании существенно небуферизованных водных оснований в качестве элюента и последующей нейтрализации. Гипоаллергенные основные аллергены пыльцы березы отличаются отсутствием или снижением связывания иммуноглобулина Е с одновременным сохранением терапевтически релевантной стимуляции Т-клеток. Поэтому полученный препарат может быть использован в качестве терапевтического агента с уменьшенными побочными эффектами для специфической иммунотерапии. 5 н. и 22 з.п. ф-лы, 1 табл., 4 ил.
| PROTEIN EXPRESSION AND PURIFICATION, vol | |||
| Разборный с внутренней печью кипятильник | 1922 |
|
SU9A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Прибор, замыкающий сигнальную цепь при повышении температуры | 1918 |
|
SU99A1 |
| Способ проведения точечного иммуноферментного анализа | 1989 |
|
SU1691754A1 |
Авторы
Даты
2007-11-27—Публикация
2003-02-07—Подача