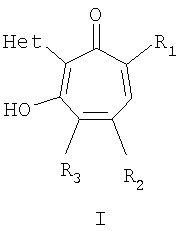
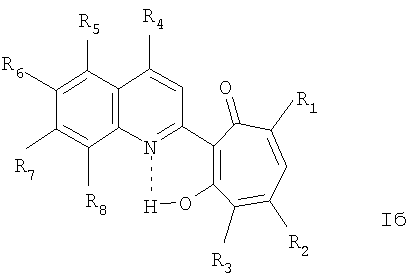
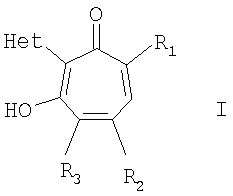
Изобретение относится к ранее неописанным производным в ряду 2-гетарилзамещенных 1,3-трополонов общей формулы Iа,
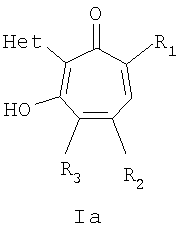
где R1 и R2=C1-С6 алкил, R3=водород, C1-С6 алкил, нитрогруппа, Het=шестичленный азотистый гетероцикл, конденсированный с одним или двумя бензольными кольцами, который может быть замещен заместителями, выбранными из группы, включающей галоид, нитрогруппа, C1-С6алкил, окси C1-С6 алкил, вторичная аминогруппа, выбранная из анилино, замещенного анилино, гидроксиэтиламино, или третичная аминогруппа, выбранная из морфолино, пиперидино, пиперазино, 1H-1-имидазолила, за исключением соединений, где Het=2-(хинолин-2-ил)замещенные группы общей формулы IIа,
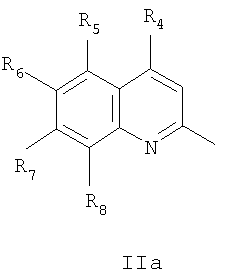
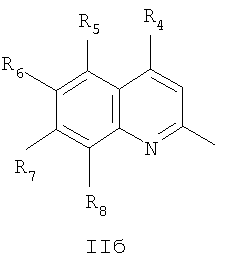
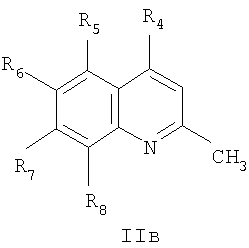
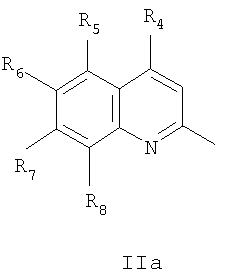
где R4=галоид, R5=водород, нитрогруппа, R6=водород, метил, R7=водород, метил, R8=метил, в случаях, когда
1. R1 и R2=трет-бутил, R3=водород, Het=2-(хинолин-2-ил), где R4=хлор, R5 и R7=водород, R6 и R8=метил;
2. R1 и R2=трет-бутил, R3=водород, Het=2-(хинолин-2-ил), где R4=хлор, R5, R6 и R7=водород, R8=метил;
3. R1 и R2=трет-бутил, R3=водород, Het=2-(хинолин-2-ил), где R4=хлор, R5 и R6=водород, R7 и R8=метил;
4. R1 и R2=трет-бутил, R3=водород, Het=2-(хинолин-2-ил), где R4=хлор, R5=нитрогруппа, R6 и R7=водород, R8=метил;
5. R1 и R2=трет-бутил, R3=водород, Het=2-(хинолин-2-ил), где R4=хлор, R5=нитрогруппа, R6 и R8=метил, R7=водород;
6. R1 и R2=трет-бутил, R3=водород, Het=2-(хинолин-2-ил), где R4=хлор, R5=нитрогруппа, R5=водород, R7 и R8=метил;
7. R1 и R2=трет-бутил, R3=нитрогруппа, Het=2-(хинолин-2-ил), где R4=хлор, R5 и R7=водород, R6 и R8=метил;
8. R1 и R2=трет-бутил, R3:=нитрогруппа, Het=2-(хинолин-2-ил), где R4=хлор, R5, R6 и R7=водород, R8=метил;
9. R1 и R2=трет-бутил, R3=нитрогруппа, Het=2-(хинолин-2-ил), где R4=хлор, R5 и R6=водород, R7 и R8=метил;
10. R1 и R2=трет-бутил, R3=нитрогруппа, Het=2-(хинолин-2-ил), где R4=хлор, R5=нитрогруппа, R6 и R7=водород, R8=метил;
11. R1 и R2=трет-бутил, R3=нитрогруппа, Het=2-(хинолин-2-ил), где R4=хлор, R5=нитрогруппа, R6 и R8=метил, R7=водород;
12. R1 и R2=трет-бутил, R3=нитрогруппа, Het=2-(хинолин-2-ил), где R4=хлор, R5=нитрогруппа, R6=водород, R7 и R8=метил.
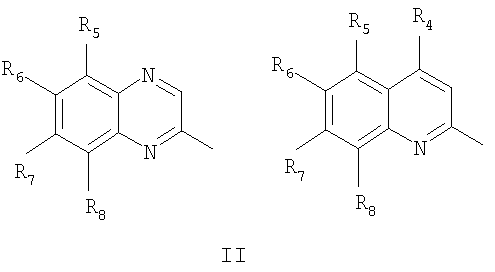
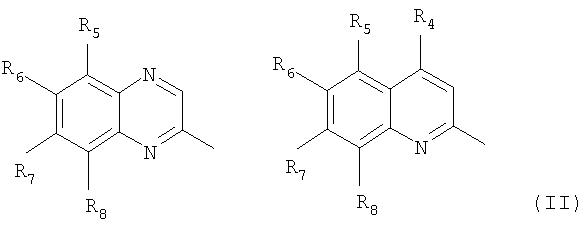
Частным случаем соединений Iа являются соединения, где Het=2-(хиноксалин-2-ил)замещенные или 2-(хинолин-2-ил)замещенные группы, общей формулы II,
 ,
,
где R4=водород, галоид, C1-С6 алкил, вторичная аминогруппа, выбранная из анилино, замещенного анилино, гидроксиэтиламино, или третичная аминогруппа, выбранная из морфолино, пиперидино, пиперазино, 1H-1-имидазолил, R5=водород, нитрогруппа, R6=водород, C1-С6 алкил, окси C1-С6 алкил, R7=водород, C1-С6 алкил, R8=водород, C1-С6 алкил, нитрогруппа, или R7 и R8 вместе с атомами углерода, к которым они присоединены, образуют бензольное кольцо.
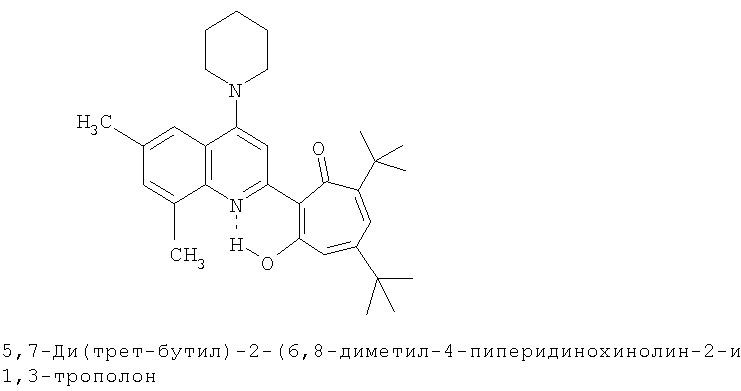
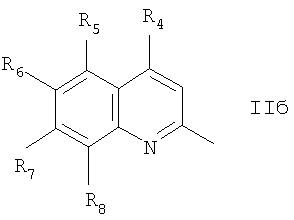
Частным случаем соединений Iа являются соединения, где Het=2-(хинолин-2-ил)замещенные группы, a R4=вторичная или третичная аминогруппа, а именно соединения общей формулы Iб,
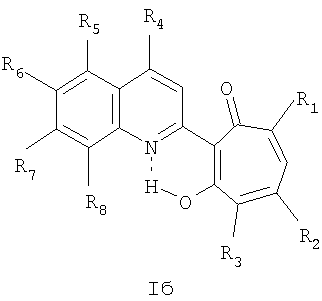
где R1 и R2=C1-С6 алкил, R3=водород, C1-С6 алкил, нитрогруппа, R4=вторичная аминогруппа, выбранная из анилино, замещенного анилино, гидроксиэтиламино, или третичная аминогруппа, выбранная из морфолино, пиперидино, пиперазино, 1H-1-имидазолил, R5=водород, нитрогруппа, R6=водород, C1-С6 алкил, окси C1-С6 алкил, R7=водород, C1-С6 алкил, R8=водород, C1-С6 алкил, нитрогруппа, или R7 и R8 вместе с атомами углерода, к которым они присоединены, образуют бензольное кольцо.
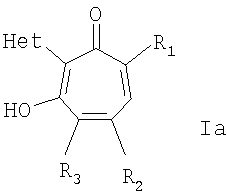
Изобретение относится также к способу получения 2-гетарилзамещенных 1,3-трополона общей формулы I,
где R1 и R2=C1-С6 алкил, R3=водород, C1-С6 алкил, нитрогруппа, Het=шестичленный азотистый гетероцикл, конденсированный с одним или двумя бензольными кольцами, который может быть замещен заместителями, выбранными из группы, включающей галоид, нитрогруппа, C1-С6алкил, окси C1-С6 алкил, вторичная аминогруппа, выбранная из анилино, замещенного анилино, гидроксиэтиламино, или третичная аминогруппа, выбранная из морфолино, пиперидино, пиперазино, 1H-1-имидазолила.
Изобретение относится также к получению соединений общей формулы Iб (вариант).
Изобретение относится также к фармацевтической композиции антимикробного действия на основе 2-гетарилзамещенных 1,3-трополона.
Группа изобретений может быть использована в производстве биологически активных соединений и лекарственных средств.
Известны 2-(хинолин-2-ил)замещенные 1,3-трополона /Komissarov V. N., Dyong Nghia Bang, Minkin V. I., Aldoshin S. M., Tkachev V. V. and Shilov G. V. Mendeleev Commun. 2003, 13, 219-221/. Способ их получения заключается во взаимодействии в присутствии в качестве катализатора n-толуолсульфокислоты 3,5-ди(трет-бутил)-1,2-бензохинона с замещенными 2-метилхинолина при кипячении в о-ксилоле (Метод А) или при их сплавлении при 160-170°С в течение 15-20 минут (Метод Б) /там же/. Выход продуктов составляет 10-15%.
Известны 2-(хинолин-2-ил)замещенные 4-нитро-1,3-трополона / Ю.А.Саяпин, В.Н.Комиссаров, В.И.Минкин и др., ЖОрХ, 2005, т.41, вып.4, с. 1571-1575. Способ их получения заключается во взаимодействии в присутствии n-толуолсульфокислоты 4,6-ди(трет-бутил)-3-нитро-1,2-бензохинона с замещенными 2-метилхинолина при кипячении в о-ксилоле. Выход продуктов составляет 6-10% (Метод А).
Техническим результатом изобретения является получение новых производных в ряду 1,3-трополона, проявляющих новое для данного ряда свойство - биологическую активность, и увеличение выходов целевых продуктов, а также фармацевтическая композиция, с использованием в качестве активного начала производных ряда 1,3-трополона.
Технический результат достигается соединениями общей формулой Iа, а также условиями проведения конденсации бензохинонов-1,2 с 2-метилгетероциклами при нагревании в присутствии уксусной кислоты в количестве, обеспечивающей ее роль как катализатора, так и растворителя в процессе получения соединений общей формулы I. Технический результат достигается также фармацевтической композицией антимикробного действия, содержащей в эффективном количестве в качестве активного начала 2-гетарилзамещенные 1,3-трополона общей формулы I.
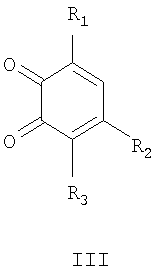
Способ получения соединений общей формулы I, в том числе Iа, за исключением соединений, где R3=нитрогруппа, a Het=2-(хинолин-2-ил)замещенные общей формулы IIб,
где R4=вторичная аминогруппа, выбранная из анилино, замещенного анилино, гидроксиэтиламино, или третичная аминогруппа, выбранная из морфолино, пиперидино, пиперазино, 1H-1-имидазолила, R5=водород, нитрогруппа, R6=водород, C1-С6алкил, окси C1-С6 алкил, R7=водород, C1-С6 алкил, R8=водород, C1-С6 алкил, нитрогруппа, или R7 и R8 вместе с атомами углерода, к которым они присоединены, образуют бензольное кольцо, заключается в том, что о-хиноны общей формулы III,
где R1 и R2=C1-С6 алкил, R3=водород, C1-С6 алкил, галоид, нитрогруппа, вводят во взаимодействие с 2-метилазотистыми гетероциклами общей формулы Het,
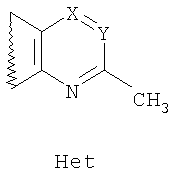
где Х=N, CR4, где R4=водород, галоид, C1-С6 алкил, вторичная аминогруппа, выбранная из анилино, замещенного анилино, гидроксиэтиламино, или третичная аминогруппа, выбранная из морфолино, пиперидино, пиперазино, 1H-1-имидазолила; Y=СН, N; в среде уксусной кислоты при нагревании.
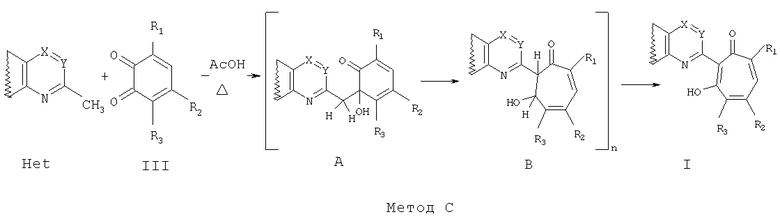
Способ получения соединений общей формулы I, где R3=нитрогруппа, а Het=2-(хинолин-2-ил)замещенные общей формулы IIб, а именно, способ получения соединений общей формулы Iб, где R3=нитрогруппа, а остальные R имеют вышеприведенные значения, заключается в том, что о-хиноны общей формулы III, где R3=нитрогруппа, а остальные R имеют вышеприведенные значения, вводят во взаимодействие с замещенными 2-метилхинолинами общей формулы IIв,
где R4=галоид, а остальные R имеют вышеприведенные значения по общей формуле II, с выделением 2-(хинолин-2-ил)галоидзамещенных 1,3-трополона и последующего проведения нуклеофильного замещения галоида первичными или вторичными аминами NH(R)2,
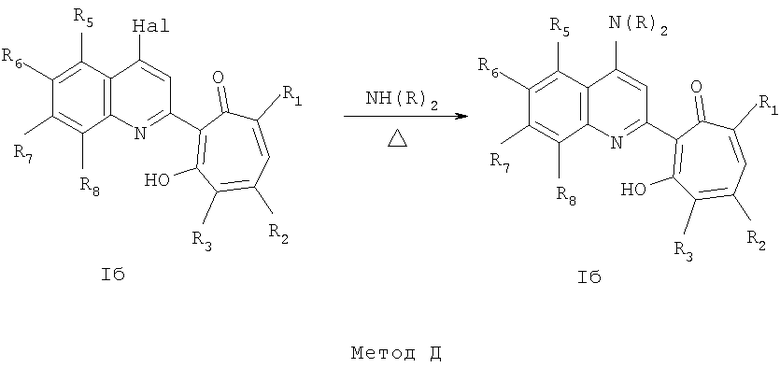
где NH(R)2 - первичные амины, выбранные из ряда, анилин, замещенный анилин, гидроксиэтиламин, или вторичные амины, выбранные из ряда, морфолин, пиперидин, пиперазин, 1H-1-имидазол, a N(R)2=R4, где R4=соответствующая вторичная или третичная аминогруппа.
Соединения общей формулы Iб, где R3=водород, C1-С6 алкил, галоид, наряду с методом С также могут быть получены по методу Д.
Способ получения фармацевтической композиции заключается в смешении соединения общей формулы I (активного начала) с нейтральными носителями из круга традиционно применяющихся в фармацевтических композициях.
Ниже приведены примеры (Метод С и Д) осуществления изобретения.
Пример 1 (Метод С). 5,7-Ди(трет-бутил)-2-(8-метил-4-хлорохинолин-2-ил)-1,3-трополон: Раствор 4.40 г (20 ммоль) 3,5-ди(трет-бутил)-1,2-бензохинона, 1.91 г (10 ммоль) 2,8-диметил-4-хлорохинолина в 10 мл АсОН нагревали при 50-60°С 50 часов. Охлаждали и разбавляли водой. Осадок экстрагировали хлороформом и хлороформенный раствор пропускали через хроматографическую колонку с Al2О3 (eluent - hexane/CHCl3 = 1:1). Собирали ярко-желтую фракцию. Получали 3.19 г. Выход 78%, желтые кристаллы, т.пл. 189-191°С (2-пропанол). ИК-спектр, ν, 1660, 1647, 1607, 1580, 1513, 1473, 1420 см-1. Спектр ЯМР 1H (CDCl3), δ, м.д.: 1.24 (с, 9Н, 5-С(СН3)3), 1.37 (с, 9Н, 7-С(СН3)3), 2.72 (с, 3Н, 8'-СН3), 6.65 (д, 1Н, 4-Н, J 1,7 Гц), 6.72 (д, 1Н, 6-Н, J 1,7 Гц), 7.41 (т, 1Н, 6'-Н, J 7,7 Гц), 7.54 (д, 1Н, 7'-Н, J 7,6 Гц), 7.95 (д, 1Н, 5'-Н, J 7,6 Гц), 8.23 (с, 1Н, 3'-Н), 19.12 (с, 1Н, 3-ОН). Масс-спектр, m/z (Iотн, %): 409 (10) [M]+, 381 (90), 366 (100), 350 (40), 338 (40), 310 (45), 57 (40), 41 (50). Найдено, %: С 73.22; H 6.71; Cl 8.62; N 3.44. C25H28ClNO2. Вычислено, %: С 73.25; H 6.88; Cl 8.65; N 3.42, O 7.81. M 409.1809.
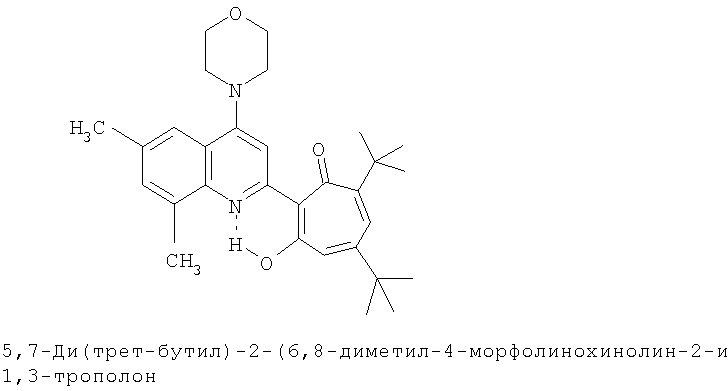
Пример 2 (Метод С). 5,7-Ди(трет-бутил)-2-(6,8-диметил-4-хлорохинолин-2-ил)-1,3-трополон: получали при взаимодействии 20 ммоль 3,5-ди(трет-бутил)-1,2-бензохинона и 10 ммоль 2,6,8-триметил-4-хлорохинолина аналогично 5,7-ди(трет-бутил)-2-(8-метил-4-хлорохинолин-2-ил)-1,3-трополону (пример 1). Выход 84%, желтые кристаллы, т.пл. 198-201°С (2-пропанол). ИК-спектр, ν, 1606, 1580, 1460, 1313, 1300, 1233 см-1. Спектр ЯМР 1H (CDCl3), δ, м.д.: 1.23 (с, 9Н, 5-С(СН3)3), 1.37 (с, 9Н, 7-С(СН3)3), 2.51 (с, 3Н, 6'-СН3), 2.68 (с, 3Н, 8'-СН3), 6.65 (д, 1Н, 4-Н, J 1,88 Гц), 6.73 (д, 1Н, 6-Н, J 1,88 Гц), 7.43 (с, 1Н, 7'-Н), 7.78 (с, 1Н, 5'-Н), 8.23 (с, 1Н, 3'-Н), 19.19 (с, 1Н, 3-ОН). Масс-спектр, m/z (Iотн, %): 423 (8) [М]+ 395 (88), 380 (100), 352 (25), 57 (50), 41 (45). Найдено, %: С 73.61, H 7.02, Cl 8.12, N 3.34. С26Н30ClNO2. Вычислено, %: С 73.65, H 7.08, Cl 8.36, N 3.30, O 7.55. М 423.1965.
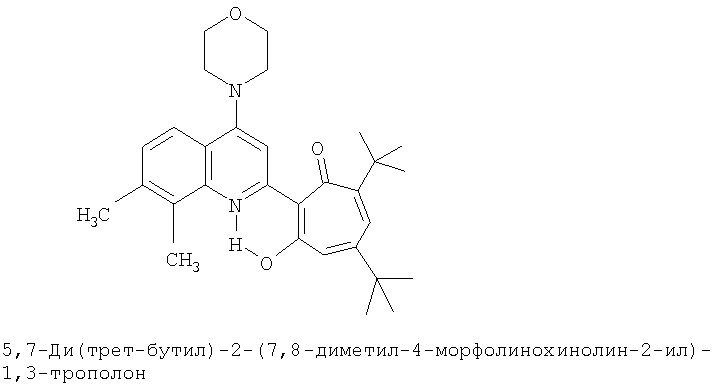
Пример 3 (Метод С). 5,7-Ди(трет-бутил)-2-(7,8-диметил-4-хлорохинолин-2-ил)-1,3-трополон: получали при взаимодействии 20 ммоль 3,5-ди(трет-бутил)-1,2-бензохинона и 10 ммоль 2,7,8-триметил-4-хлорохинолина аналогично 5,7-ди(трет-бутил)-2-(8-метил-4-хлорохинолин-2-ил)-1,3-трополону (пример 1). Выход 83%, желтые кристаллы, т.пл. 174-176°С (2-пропанол). ИК-спектр, ν, 1633, 1607, 1580, 1500, 1447, 1367, 1220 см-1. Спектр ЯМР 1H (CDCl3), δ, м.д.: 1.23 (с, 9Н, 5-С(СН3)3), 1.37 (с, 9Н, 7-С(СН3)3), 2.52 (с, 3Н, 7'-СН3), 2.63 (с, 3Н, 8'-СН3), 6.64 (д, 1Н, 4-Н, J 1,86 Гц), 6.68 (д, 1Н, 6-Н, J 1,86 Гц), 7.37 (д, 1Н, 6'-Н, J 8,5 Гц), 7.89 (д, 1Н, 5'-Н, J 8.5 Гц), 8.20 (с, 1Н, 3'-Н), 19.31 (с, 1Н, 3-ОН). Масс-спектр, m/z (Iотн, %): 423 (2) [M]+, 395 (88), 380 (100), 352 (28), 338 (12.5), 57 (35), 41 (37.5). Найдено, %: С 73.63, Н 6.94, Cl 8.21, N 3.23. С26Н30ClNO2. Вычислено, %: С 73.65, Н 7.08, Cl 8.36, N 3.30, O 7.55. М 423.1965.
Пример 4 (Метод С). 5,7-Ди(трет-бутил)-2-(хинолин-2-ил)-1,3-трополон: получали при взаимодействии 20 ммоль 3,5-ди(трет-бутил)-1,2-бензохинона и 10 ммоль 2-метилхинолина аналогично 5,7-ди(трет-бутил)-2-(8-метил-4-хлорохинолин-2-ил)-1,3-трополону (пример 1). Выход 53%, желтые кристаллы, т.пл. 126-128°С (2-пропанол). ЯК спектр, ν, 1640, 1620, 1600 см-1. Спектр ЯМР 1Н (CDCl3), δ, м.д.: 1.25 (с, 9Н, 5-С(СН3)3), 1.39 (с, 9Н, 7-С(СН3)3), 6.62 (д, 1Н, 4-Н, J 1,5 Гц), 6.69 (д, 1Н, 6-Н, J 1,5 Гц), 7.44-8.18 (м, 6Н, хинолин), 19.3 (уш. с, 1Н, 3-ОН). Масс-спектр, m/z (Iотн, %): 361 (4) [М]+ 333 (62), 318 (100), 290 (29), 57 (23), 40 (80). Найдено, %: С 79.61, Н 7.40, N 3.72. C24H27NO2. Вычислено, %: С 79.74, Н 7.53, N 3.87, O 8.85. М 361.2042.
Пример 5 (Метод С). 5,7-Ди(трет-бутил)-2-(4-хлоробензо[h]хинолин-2-ил)-1,3-трополон: получали при взаимодействии 20 ммоль 3,5-ди(трет-бутил)-1,2-бензохинона и 10 ммоль 2-метил-4-хлоробензо[h]хинолина аналогично 5,7-ди(трет-бутил)-2-(8-метил-4-хлорохинолин-2-ил)-1,3-трополону (пример 1). Выход 58%, желтые кристаллы, т.пл. 173-175°С (2-пропанол). Спектр ЯМР 1Н (CDCl3), δ, м.д.: 1.30 (с, 9Н, 5-С(СН3)3), 1.44 (с, 9Н, 7-С(СН3)3), 6.77 (д, 1Н, 4-Н, J 1,76 Гц), 6.84 (д, 1Н, 6-Н, J 1,76 Гц), 7.7-8.9 (м, 6Н, аромат.), 8.41 (с, 1Н, 3'-Н), 19.35 (с, 1Н, 3-ОН). Масс-спектр, m/z (Iотн, %): 445 (7) [М]+ 417 (53), 402 (70), 374 (25), 190 (40), 91 (30), 57 (85), 41 (100). Найдено, %; С 75.31, Н 6.32, Cl 7.84, N 3.06. C28H28ClNO2. Вычислено, %: С 75.41, Н 6.33, Cl 7.95, N 3.14, О 7.17. М 445.1809.
Пример 6 (Метод С). 5,7-Ди(трет-бутил)-2-(6-метокси-4-хлорохинолин-2-ил)-1,3-трополон: получали при взаимодействии 20 ммоль 3,5-ди(трет-бутил)-1,2-бензохинона и 10 ммоль 2-метил-6-метокси-4-хлорохинолина аналогично 5,7-ди(трет-бутил)-2-(8-метил-4-хлорохинолин-2-ил)-1,3-трополону (пример 1). Выход 43%, желтые кристаллы, т.пл. 157-159°С (2-пропанол). Спектр ЯМР 1Н (CDCl3), δ, м.д.: 1.26 (с, 9Н, 5-С(СН3)3), 1.41 (с, 9Н, 7-С(СН3)3), 3.97 (с, 3Н, 6'-ОСН3), 6.65 (д, 1Н, 4-Н, J 1,8 Гц), 6.80 (д, 1Н, 6-Н, J 1,8 Гц), 7.38 (д, 1Н, 7'-Н, J 9,0 Гц), 7.41 (д, 1Н, 5'-Н, J 2,6 Гц), 7.78 (д, 1Н, 8'-Н, J 9,0 Гц), 8.22 (с, 1Н, 3'-Н), 18.53 (с, 1Н, 3-ОН). Найдено, %: С 70.56, Н 6.72, Cl 8.48, N 3.40. C25H28ClNO3. Вычислено, %: С 70.49, Н 6.63, Cl 8.32, N 3.29, О 11.27. М 425.1758.
Пример 7 (Метод С). 5,7-Ди(трет-бутил)-2-(8-метил-5-нитро-4-хлорохинолин-2-ил)-1,3-трополон: получали при взаимодействии 20 ммоль 3,5-ди(трет-бутил)-1,2-бензохинона и 10 ммоль 2,8-диметил-5-нитро-4-хлорохинолина аналогично 5,7-ди(трет-бутил)-2-(8-метил-4-хлорохинолин-2-ил)-1,3-трополону (пример 1). Выход 73%, желтые кристаллы, т.пл. 210-212°С (2-пропанол). Спектр ЯМР 1Н (CDCl3), δ, м.д.: 1.23 (с, 9Н, 5-С(СН3)3), 1.37 (с, 9Н, 7-С(СН3)3), 2.73 (с, 3Н, 8'-СН3), 6.68 (д, 1Н, 4-Н, J 1,82 Гц), 6.83 (д, 1Н, 6-Н, J 1,82 Гц), 7.57-7.64 (м, 2Н, 6',7'-Н), 8.32 (с, 1Н, 3'-Н), 18.02 (с, 1Н, 3-ОН). Масс-спектр, m/z (Iотн, %): 454 (7) [M]+, 426 (92), 411 (100), 383 (28), 365 (38), 57 (46), 41 (48). Найдено, %: С 65.93, Н 5.92, Cl 7.84, N 6.03. C25H27ClN2O4. Вычислено, %: С 66.00, Н 5.98, Cl 7.79, N 6.16, О 14.07. М 454.1659.
Пример 8 (Метод С). 5,7-Ди(трет-бутил)-2-(6,8-диметил-5-нитро-4-хлорохинолин-2-ил)-1,3-трополон: получали при взаимодействии 20 ммоль 3,5-ди(трет-бутил)-1,2-бензохинона и 10 ммоль 2,6,8-триметил-5-нитро-4-хлорохинолина аналогично 5,7-ди(трет-бутил)-2-(8-метил-4-хлорохинолин-2-ил)-1,3-трополону (пример 1). Выход 76%, желтые кристаллы, т.пл. 223-225°С (2-пропанол). ИК-спектр, ν, 1647, 1620, 1567, 1527, 1460 см-1. Спектр ЯМР 1H (CDCl3), δ, м.д.: 1.25 (с, 9Н, 5-С(СН3)3), 1.38 (с, 9Н, 7-С(СН3)3), 2.40 (с, 3Н, 6'-СН3), 2.70 (с, 3Н, 8'-СН3), 6.68 (д, 1Н, 4-Н, J 1,82 Гц), 6.82 (д, 1Н, 6-Н, J 1,82 Гц), 7.50 (с, 1Н, 7'-Н), 8.28 (с, 1Н, 3'-Н), 18.02 (с, 1Н, 3-ОН). Масс-спектр, m/z (Iотн, %): 468 (5) [М]+ 440 (75), 425 (75), 397 (20), 379 (18), 91 (33), 57 (90), 41 (100). Найдено, %: С 66.64, H 6.21, Cl 7.4, N 5.92. С26Н29ClN2O4. Вычислено, %: С 66.59, H 6.23, Cl 7.56, N 5.97, O 13.65. М 468.1816.
Пример 9 (Метод С). 5,7-Ди(трет-бутил)-2-(7,8-диметил-5-нитро-4-хлорохинолин-2-ил)-1,3-трополон: получали при взаимодействии 20 ммоль 3,5-ди(трет-бутил)-1,2-бензохинона и 10 ммоль 2,7,8-триметил-5-нитро-4-хлорохинолина аналогично 5,7-ди(трет-бутил)-2-(8-метил-4-хлорохинолин-2-ил)-1,3-трополону (пример 1). Выход 70%, желтые кристаллы, т.пл. 234-236°С (2-пропанол). ИК-спектр, ν, 1647, 1607, 1580, 1527, 1460 см-1. Спектр ЯМР 1Н (CDCl3), δ, м.д.: 1.24 (с, 9Н, 5-С(СН3)3), 1.39 (с, 9Н, 7-С(СН3)3), 2.54 (с, 3Н, 7'-СН3), 2.65 (с, 3Н, 8'-СН3), 6.67 (д, 1Н, 4-Н, J 1,87 Гц), 6.81 (д, 1Н, 6-Н, J 1,87 Гц), 7.51 (с, 1Н, 6'-Н), 8.25 (с, 1Н, 3'-Н), 18.30 (с, 1Н, 3-ОН). Масс-спектр, m/z (Iотн, %): 468 (5) [М]+, 440 (75), 425 (75), 397 (20), 379 (18), 91 (33), 57 (90), 41 (100). Найдено, %: С 66.62, H 6.13, Cl 7.52, N 5.93. С26Н29ClN2O4. Вычислено, %: С 66.59, H 6.23, Cl 7.56, N 5.97, O 13.65. М 468.1816.
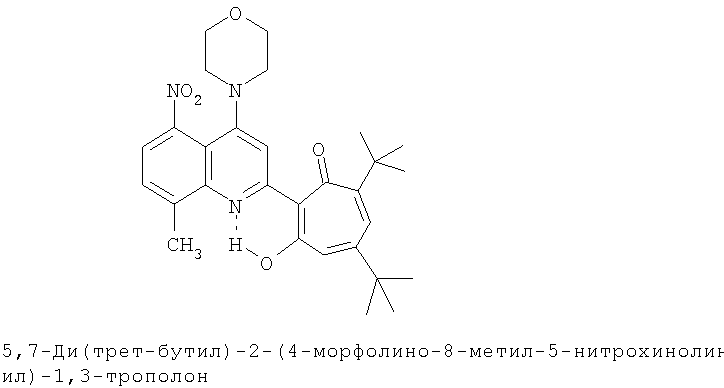
Пример 10 (Метод С). 5,7-ди(трет-бутил)-2-(4-морфолино-8-метилхинолин-2-ил)-1,3-трополон: получали при взаимодействии 20 ммоль 3,5-ди(трет-бутил)-1,2-бензохинона и 10 ммоль 2,8-диметил-4-морфолинохинолина аналогично 5,7-ди(трет-бутил)-2-(8-метил-4-хлорохинолин-2-ил)-1,3-трополону (пример 1). Выход 70%, желтые кристаллы, т.пл. 200-202°С (2-пропанол).
Пример 10а (Метод Д). 5,7-Ди(трет-бутил)-2-(4-морфолино-8-метилхинолин-2-ил)-1,3-трополон. Раствор 0.3 г (0.73 ммоль) 5,7-ди(трет-бутил)-2-(8-метил-4-хлорохинолин-2-ил)-1,3-трополона в 3 мл морфолина кипятили 1 ч. Охлажденный раствор разбавляли холодной водой и отфильтровывали выпавший осадок. Осадок промывали теплой водой (200 мл) и после высушивания получали 0.3 г 5,7-ди(трет-бутил)-2-(4-морфолино-8-метилхинолин-2-ил)-1,3-трополона. Выход 89%, желтые кристаллы, т.пл. 200-202°С (2-пропанол). ИК-спектр, ν, 1633, 1620, 1593, 1513, 1500, 1460, 1447, 1415, 1380, 1367 см-1. Спектр ЯМР 1H (CDCl3), δ, м.д.: 1.23 (с, 9Н, 5-С(СН3)3), 1.38 (с, 9Н, 7-С(СН3)3), 2.74 (с, 3Н, 8'-СН3), 3.29 (т, 4Н, 4'-N(CH2)2=), 3.99 (т, 4Н, 4'-O(СН2)2=), 6.62 (с, 2Н, 4,6-Н), 7.35 (т, 1Н, 6'-Н, J 7.8 Гц), 7.5 (д, 1Н, 7'-Н, J 7.7 Гц), 7.73 (с, 1Н, 3'-Н), 7.78 (д, 1Н, 5'-Н, J 7.7 Гц), 19.15 (уш. с, 1Н, 3-ОН). Масс-спектр, m/z (Iотн, %): 460 (8) [M]+, 432 (100), 417 (75), 401 (15), 375 (18), 115 (15), 91 (18), 57 (48), 41 (52). Найдено, %: С 75.52, H 7.79, N 5.99. С29Н36N2O3. Вычислено, %: С 75.62, H 7.88, N 6.08, O 10.42. М 460.2726.
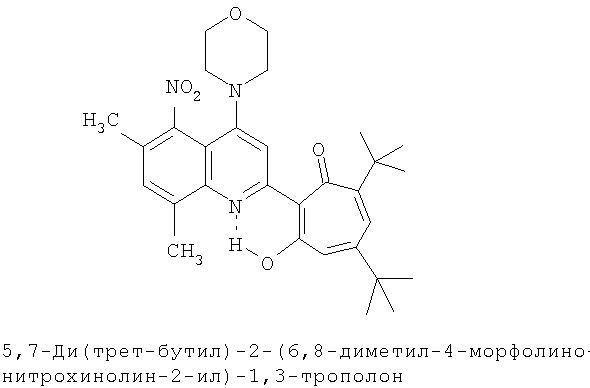
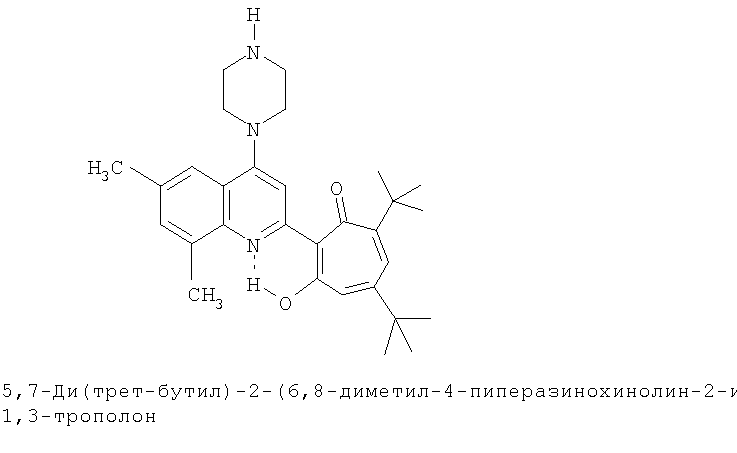
Пример 11 (Метод С). 5,7-Ди(трет-бутил)-2-(6,8-диметил-4-морфолинохинолин-2-ил)-1,3-трополон: получали при взаимодействии 20 ммоль 3,5-ди(трет-бутил)-1,2-бензохинона и 10 ммоль 2,6,8-триметил-4-морфолинохинолина аналогично 5,7-ди(трет-бутил)-2-(8-метил-4-хлорохинолин-2-ил)-1,3-трополону (пример 1). Выход 72%, желтые кристаллы, т.пл. 222-224°С (2-пропанол).
Пример 11а (Метод Д). 5,7-Ди(трет-бутил)-2-(6,8-диметил-4-морфолинохинолин-2-ил)-1,3-трополон. Раствор 0.73 ммоль 5,7-ци(трет-бутил)-2-(6,8-диметил-4-хлорохинолин-2-ил)-1,3-трополона в 3 мл морфолина кипятили 1 ч. Последующее выделение как и в примере 10а. Выход 92%, желтые кристаллы, т.пл. 222-224°С (2-пропанол). ИК-спектр, ν, 1633, 1607, 1580, 1460, 1447, 1367, 1273 см-1. Спектр ЯМР 1H (CDCl3), δ, м.д.: 1.23 (с, 9Н, 5-С(СН3)3), 1.38 (с, 9Н, 7-С(СН3)3), 2.47 (с, 3Н, 6'-СН3), 2.67 (с, 3Н, 8'-СН3), 3.25 (т, 4Н, 4'-N(CH2)2=), 3.98 (т, 4Н, 4'-O(СН2)2=), 6.62 (с, 2Н, 4,6-Н), 7.37 (с, 1Н, 7'-Н), 7.52 (с, 1Н, 5'-Н), 7.65 (с, 1Н, 3'-Н), 19.09 (уш. с, 1Н, 3-ОН). Масс-спектр, m/z (Iотн, %): 474 (8) [М]+, 446 (100), 431 (65), 415 (10), 403 (18), 45 (18). Найдено, %: С 75.94, H 7.95, N 5.81. С30Н38N2O3. Вычислено, %: С 75.92, H 8.07, N 5.90, O 10.11. М 474.2882.
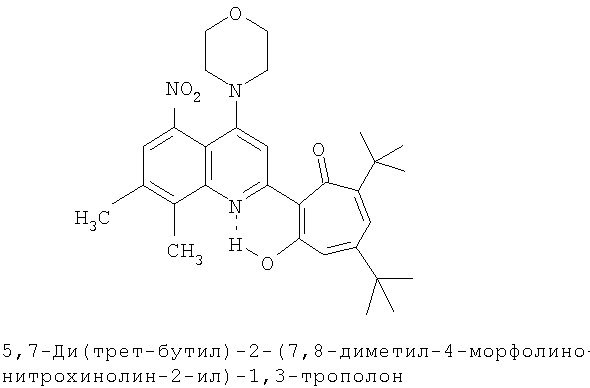
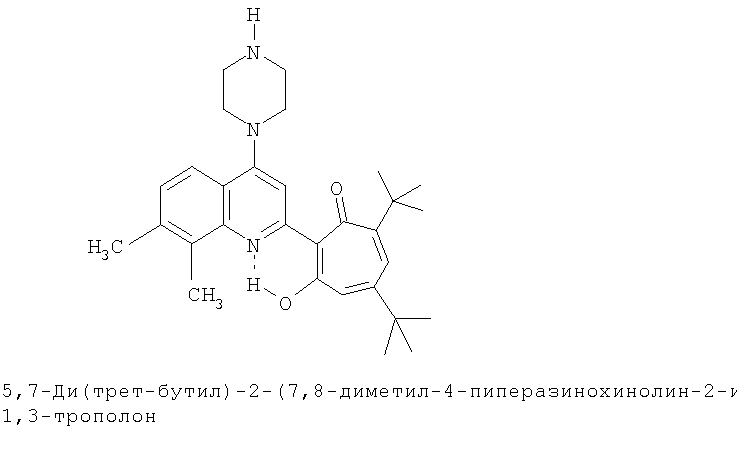
Пример 12 (Метод С). 5,7-Ди(трет-бутил)-2-(7,8-диметил-4-морфолинохинолин-2-ил)-1,3-трополон: получали при взаимодействии 20 ммоль 3,5-ди(трет-бутил)-1,2-бензохинона и 10 ммоль 2,7,8-триметил-4-морфолинохинолина аналогично 5,7-ди(трет-бутил)-2-(8-метил-4-хлорохинолин-2-ил)-1,3-трополону (пример 1). Выход 67%, желтые кристаллы, т.пл. 227-229°С (2-пропанол).
Пример 12а (Метод Д). 5,7-Ди(трет-бутил)-2-(7,8-диметил-4-морфолинохинолин-2-ил)-1,3-трополон. Раствор 0.73 ммоль 5,7-ди(трет-бутил)-2-(7,8-диметил-4-хлорохинолин-2-ил)-1,3-трополона в 3 мл морфолина кипятили 1 ч. Последующее выделение как и в примере 10а. Выход 95%, желтые кристаллы, т.пл. 227-229°С (2-пропанол). Спектр ЯМР 1Н (CDCl3), δ, м.д.: 1.24 (с, 9Н, 5-С(СН3)3), 1.37 (с, 9Н, 7-С(СН3)3), 2.50 (с, 3Н, 7'-СН3), 2.62 (с, 3Н, 8'-СН3), 3.28 (т, 4Н, 4'-N(CH2)2=), 3.98 (т, 4Н, 4'-O(СН2)2=), 6.61 (с, 2Н, 4,6-Н), 7.24 (д, 1Н, 6'-Н, J 10,33 Гц), 7.65 (д, 1Н, 5'-Н, J 10,33 Гц), 7.66 (с, 1Н, 3'-Н), 18.93 (уш. с, 1Н, 3-ОН). Найдено, %: С 75.84, Н 7.99, N 5.93. С30Н38N2O3. Вычислено, %: С 75.92, Н 8.07, N 5.90, О 10.11. М 474.2882.
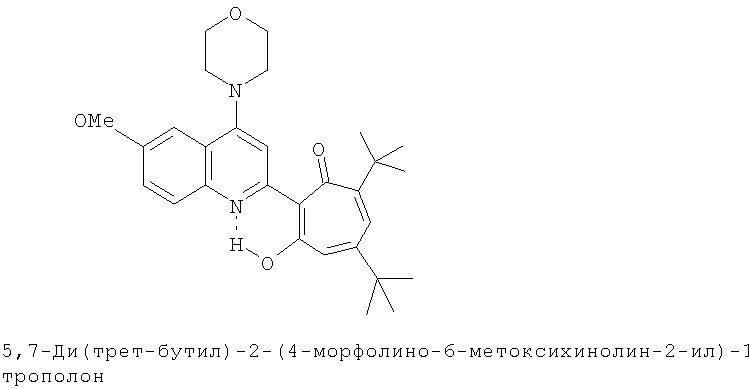
Пример 13 (Метод С). 5,7-Ди(трет-бутил)-2-(4-морфолино-6-метоксихинолин-2-ил)-1,3-трополон: получали при взаимодействии 20 ммоль 3,5-ди(трет-бутил)-1,2-бензохинона и 10 ммоль 4-морфолино-6-метоксихинолина аналогично 5,7-ди(трет-бутил)-2-(8-метил-4-хлорохинолин-2-ил)-1,3-трополону (пример 1). Выход 56%, желтые кристаллы, т.пл. 187-189°С (2-пропанол).
Пример 13а (Метод Д). 5,7-Ди(трет-бутил)-2-(4-морфолино-6-метоксихинолин-2-ил)-1,3-трополон. Раствор 0.73 ммоль 5,7-ди(трет-бутил)-2-(6-метокси-4-хлорохинолин-2-ил)-1,3-трополона в 3 мл морфолина кипятили 1 ч. Последующее выделение как и в примере 10а. Выход 94%, желтые кристаллы, т.пл. 187-189°С (2-пропанол). Спектр ЯМР 1Н (CDCl3), δ, м.д.: 1.24 (с, 9Н, 5-С(СН3)3), 1.39 (с, 9Н, 7-С(СН3)3), 3.25 (т, 4Н, 4'-N(CH2)2=), 3.98 (т, 4Н, 4'-O(СН2)2=), 3.97 (с, 3Н, 6'-ОСН3), 6.59 (д, 1Н, 4-Н, J 1,8 Гц), 6.69 (д, 1H, 6-H, J 1,8 Гц), 7.23 (д, 1Н, 5'-Н, J1 2,7 Гц), 7.30 (д.д., 1Н, 7'-Н, J1 2,7 Гц, J2 9,0 Гц), 7.70 (д, 1H, 8'-H, J 9,0 Гц), 7.70 (с, 1H, 3'-Н), 19.11 (уш. с, 1H, 3-ОН). Найдено, %: С 73.14, Н 7.55, N 5.98. C29H36N2O4. Вычислено, %: С 73.08, Н 7.61, N 5.88, О 13.43. М 476.2675.
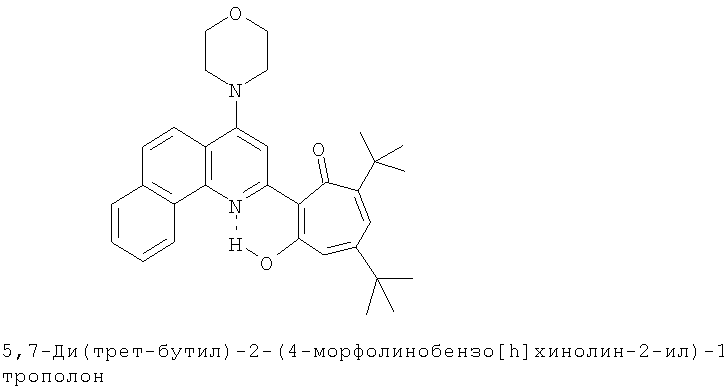
Пример 14 (Метод С). 5,7-Ди(трет-бутил)-2-(4-морфолинобензо[h]хинолин-2-ил)-1,3-трополон: получали при взаимодействии 20 ммоль 3,5-ди(трет-бутил)-1,2-бензохинона и 10 ммоль 2-метил-4-морфолинобензо[h]хинолина аналогично 5,7-ди(трет-бутил)-2-(8-метил-4-хлорохинолин-2-ил)-1,3-трополону (пример 1). Выход 52%, желтые кристаллы, т.пл. 211-213°С (2-пропанол).
Пример 14а (Метод Д). 5,7-Ди(трет-бутил)-2-(4-морфолинобензо[h]хинолин-2-ил)-1,3-трополон. Раствор 0.73 ммоль 5,7-ди(трет-бутил)-2-(4-хлоробензо[h]хинолин-2-ил)-1,3-трополона в 3 мл морфолина кипятили 1 ч. Последующее выделение как и в примере 10а. Выход 89%, желтые кристаллы, т.пл. 211-213°С (2-пропанол). Спектр ЯМР 1Н (CDCl3), δ, м.д.: 1.28 (с, 9Н, 5-С(СН3)3), 1.42 (с, 9Н, 7-С(СН3)3), 3.32 (т, 4Н, 4'-N(CH2)2=), 4.02 (т, 4Н, 4'-O(СН2)2=), 6.72 (с, 1H, 4-Н), 6.73 (с, 1H, 6-H), 7.7-8.0 (м, 6Н, аромат.), 8.75 (д, 1H, 3'-Н, J 8,0 Гц), 20.05 (с, 1H, 3-ОН). Найдено, %: С 77.47, Н 7.25, N 5.71. С32Н36N2O3. Вычислено, %: С 77.39, Н 7.31, N 5.64, O 9.66. М 496.2726.
Пример 15 (Метод С). 5,7-Ди(трет-бутил)-2-(4-морфолино-8-метил-5-нитрохинолин-2-ил)-1,3-трополон: получали при взаимодействии 20 ммоль 3,5-ди(трет-бутил)-1,2-бензохинона и 10 ммоль 2,8-диметил-4-морфолино-5-нитрохинолина аналогично 5,7-ди(трет-бутил)-2-(8-метил-4-хлорохинолин-2-ил)-1,3-трополону (пример 1). Выход 55%, желтые кристаллы, т.пл. 272-274°С (2-пропанол).
Пример 15а (Метод Д). 5,7-Ди(трет-бутил)-2-(4-морфолино-8-метил-5-нитрохинолин-2-ил)-1,3-трополон. Раствор 0.73 ммоль 5,7-ди(трет-бутил)-2-(8-метил-5-нитро-4-хлорохинолин-2-ил)-1,3-трополона в 3 мл морфолина кипятили 1 ч. Последующее выделение как и в примере 10а. Выход 88%, желтые кристаллы, т.пл. 272-274°С (2-пропанол). Спектр ЯМР 1Н (CDCl3), δ, м.д.: 1.24 (с, 9Н, 5-С(СН3)3), 1.39 (с, 9Н, 7-С(СН3)3), 2.78 (с, 3Н, 8'-СН3), 2.8-3.2 (м, 4Н, 4'-N(CH2)2=), 3.7-3.97 (м, 4Н, 4'-O(СН2)2=), 6.7 (д, 1Н, 4-Н, J 1,8 Гц), 6.78 (д, 1Н, 6-Н, J 1,8 Гц), 7.5-7.6 (м, 2Н, 6',7'-Н), 7.92 (с, 1Н, 3'-Н), 18.9 (уш. с, 1Н, 3-ОН). Масс-спектр, m/z (Iотн, %): 505 (8) [М]+, 477 (100), 462 (44), 83 (18), 57 (10), 41 (10). Найдено, %: С 68.87, Н 6.88, N 8.26. С29Н35N3O5. Вычислено, %: С 68.89, Н 6.98, N 8.31, О 15.82. М 505.2576.
Пример 16 (Метод С). 5,7-Ди(трет-бутил)-2-(6,8-диметил-4-морфолино-5-нитрохинолин-2-ил)-1,3-трополон: получали при взаимодействии 20 ммоль 3,5-ди(трет-бутил)-1,2-бензохинона и 10 ммоль 2,6,8-триметил-4-морфолино-5-нитрохинолина аналогично 5,7-ди(трет-бутил)-2-(8-метил-4-хлорохинолин-2-ил)-1,3-трополону (пример 1). Выход 50%, желтые кристаллы, т.пл. 203-205°С (2-пропанол).
Пример 16а (Метод Д). 5,7-Ди(трет-бутил)-2-(6,8-диметил-4-морфолино-5-нитрохинолин-2-ил)-1,3-трополон. Раствор 0.73 ммоль 5,7-ди(трет-бутил)-2-(6,8-диметил-5-нитро-4-хлорохинолин-2-ил)-1,3-трополона в 3 мл морфолина кипятили 1 ч. Последующее выделение как и в примере 10а. Выход 76%, желтые кристаллы, т.пл. 272-274°С (2-пропанол). Спектр ЯМР 1Н (CDCl3), δ, м.д.: 1.27 (с, 9Н, 5-С(СН3)3), 1.43 (с, 9Н, 7-С(СН3)3), 2.42 (с, 3Н, 6'-СН3), 2.70 (с, 3Н, 8'-СН3), 2.8-3.1 (м, 4Н, 4'-N(CH2)2=), 3.7-3.85 (м, 4Н, 4'-O(СН2)2=), 6.67 (д, 1Н, 4-Н, J 1.70 Гц), 6.80 (д, 1Н, 6-Н, J 1.70 Гц), 7.44 (с, 1Н, 7'-Н), 7.98 (с, 1Н, 3'-Н), 18.8 (с, 1Н, 3-ОН). Найдено, %: С 69.33, Н 7.07, N 8.11. С30Н37N3О5. Вычислено, %: С 69.34, Н 7.18, N 8.09, О 15.39. М 519.2733.
Пример 17 (Метод С). 5,7-Ди(трет-бутил)-2-(7,8-диметил-4-морфолино-5-нитрохинолин-2-ил)-1,3-трополон: получали при взаимодействии 20 ммоль 3,5-ди(трет-бутил)-1,2-бензохинона и 10 ммоль 2,7,8-триметил-4-морфолино-5-нитрохинолина аналогично 5,7-ли(трет-бутил)-2-(8-метил-4-хлорохинолин-2-ил)-1,3-трополону (пример 1). Выход 54%, желтые кристаллы, т.пл. 264-266°С (2-пропанол).
Пример 17а (Метод Д). 5,7-Ди(трет-бутил)-2-(7,8-диметил-4-морфолино-5-нитрохинолин-2-ил)-1,3-трополон. Раствор 0.73 ммоль 5,7-ди(трет-бутил)-2-(7,8-диметил-5-нитро-4-хлорохинолин-2-ил)-1,3-трополона в 3 мл морфолина кипятили 1 ч. Последующее выделение как и в примере 10а. Выход 86%, желтые кристаллы, т.пл. 264-266°С (2-пропанол). ИК-спектр, ν, 1633, 1620, 1593, 1527, 1460, 1447, 1367, 1353 см-1. Спектр ЯМР 1H (CDCl3), δ, м.д.: 1.26 (с, 9Н, 5-С(СН3)3), 1.4 (с, 9Н, 7-С(СН3)3), 2.54 (с, 3Н, 7'-СН3), 2.65 (с, 3Н, 8'-СН3), 2.82-3.22 (м, 4Н, 4'-N(CH2)2=), 3.64-3.98 (м, 4Н, 4'-O(СН2)2=), 6.66 (д, 1Н, 4-Н, J 1.86 Гц), 6.75 (д, 1Н, 6-Н, J 1.86 Гц), 7.46 (с, 1Н, 6'-Н), 7.84 (с, 1Н, 3'-Н), 19,05 (с, 1Н, 3-ОН). Масс-спектр, m/z (Iотн, %): 519 (8) [М]+, 491 (100), 476 (50), 448 (19), 57 (48), 41 (50). Найдено, %: С 69.30, H 7.10, N 8.05. C30H37N3O5. Вычислено, %: С 69.34, H 7.18, N 8.09, O 15.39. М 519.2733.
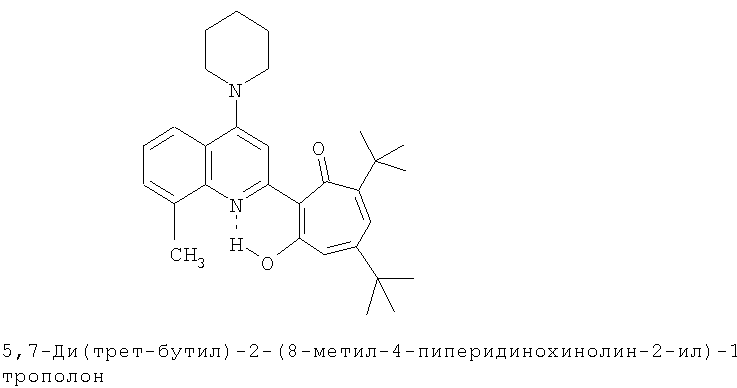
Пример 18 (Метод С). 5,7-Ди(трет-бутил)-2-(8-метил-4-пиперидинохинолин-2-ил)-1,3-трополон: получали при взаимодействии 20 ммоль 3,5-ди(трет-бутил)-1,2-бензохинона и 10 ммоль 2,8-диметил-4-пиперидинохинолина аналогично 5,7-ди(трет-бутил)-2-(8-метил-4-хлорохинолин-2-ил)-1,3-трополону (пример 1). Выход 42%, желтые кристаллы, т.пл. 144-146°С (2-пропанол).
Пример 18а (Метод Д). 5,7-Ди(трет-бутил)-2-(8-метил-4-пиперидинохинолин-2-ил)-1,3-трополон. Раствор 0.73 ммоль 5,7-ди(трет-бутил)-2-(8-метил-4-хлорохинолин-2-ил)-1,3-трополона в 3 мл пиперидина кипятили 1 ч. Последующее выделение как и в примере 10а. Выход 96%, желтые кристаллы, т.пл. 144-146°С (2-пропанол). Спектр ЯМР 1H (CDCl3), δ, м.д.: 1.24 (с, 9Н, 5-С(СН3)3), 1.38 (с, 9Н, 7-С(СН3)3), 1.6-2.0 (м, 6Н, (СН2)2), 2.71 (с, 3Н, 8'-СН3), 3.2-3.4 (м, 4Н, 4'-N(CH2)2), 6.60 (с, 2Н, 4,6-Н), 7.29 (т, 1Н, 6'-Н, J 7,7 Гц), 7.45 (д, 1Н, 7'-Н, J 7,8 Гц), 7.67 (с, 1Н, 3'-Н), 7.73 (д, 1Н, 5'-Н, J 7,8 Гц), 18.84 (уш. с, 1Н, 3-ОН). Найдено, %: С 78.48, Н 8.17, N 6.13. C30H35N2O2. Вычислено, %: С 78.56, H 8.35, N 6.11, О 6.98. М 458.2933.
Пример 19 (Метод С). 5,7-Ди(трет-бутил)-2-(6,8-диметил-4-пиперидинохинолин-2-ил)-1,3-трополон: получали при взаимодействии 20 ммоль 3,5-ди(трет-бутил)-1,2-бензохинона и 10 ммоль 2,6,8-триметил-4-пиперидинохинолина аналогично 5,7-ди(трет-бутил)-2-(8-метил-4-хлорохинолин-2-ил)-1,3-трополону (пример 1). Выход 38%, желтые кристаллы, т.пл. 191-193°С (2-пропанол).
Пример 19а (Метод Д). 5,7-Ди(трет-бутил)-2-(6,8-диметил-4-пиперидинохинолин-2-ил)-1,3-трополон. Раствор 0.73 ммоль 5,7-ди(трет-бутил)-2-(6,8-диметил-4-хлорохинолин-2-ил)-1,3-трополона в 3 мл пиперидина кипятили 1 ч. Последующее выделение как и в примере 10а. Выход 81%, желтые кристаллы, т.пл. 191-193°С (2-пропанол). Спектр ЯМР 1H (CDCl3), δ, м.д.: 1.23 (с, 9Н, 5-С(СН3)3), 1.37 (с, 9Н, 7-С(СН3)3), 1.6-2.0 (м, 6Н, (СН2)2), 2.47 (с, 3Н, 6'-СН3), 2.67 (с, 3Н, 8'-СН3), 3.2-3.4 (м, 4Н, 4'-N(CH2)2), 6.59 (д, 1Н, 4-Н, J 1,8 Гц), 6.60 (д, 1H, 6-H, J 1,8 Гц), 7.31 (с, 1Н, 7'-Н), 7.50 (с, 1H, 5'-Н), 7.66 (с, 1H, 3'-Н), 18.89 (с, 1H, 3-ОН). Найдено, %: С 78.55, Н 8.47, N 6.18. C31H40N2O2. Вычислено, %: С 78.77, Н 8.53, N 5.93, О 6.77. М 472.3090.
Пример 20 (Метод С). 5,7-Ди(трет-бутил)-2-(7,8-диметил-4-пиперидинохинолин-2-ил)-1,3-трополон: получали при взаимодействии 20 ммоль 3,5-ди(трет-бутил)-1,2-бензохинона и 10 ммоль 2,7,8-триметил-4-пиперидинохинолина аналогично 5,7-ди(трет-бутил)-2-(8-метил-4-хлорохинолин-2-ил)-1,3-трополону (пример 1). Выход 44%, желтые кристаллы, т.пл. 169-171°С (2-пропанол).
Пример 20а (Метод Д). 5,7-Ди(трет-бутил)-2-(7,8-диметил-4-пиперидинохинолин-2-ил)-1,3-трополон. Раствор 0.73 ммоль 5,7-ди(трет-бутил)-2-(7,8-диметил-4-хлорохинолин-2-ил)-1,3-трополона в 3 мл пиперидина кипятили 1 ч. Последующее выделение как и в примере 10а. Выход 86%, желтые кристаллы, т.пл. 169-171°С (2-пропанол). Спектр ЯМР 1Н (CDCl3), δ, м.д.: 1.23 (с, 9Н, 5-С(СН3)3), 1.37 (с, 9Н, 7-С(СН3)3), 1.6-2.0 (м, 6Н, (СН2)3), 2.49 (с, 3Н, 7'-СН3), 2.61 (с, 3Н, 8'-СН3), 3.2-3.4 (м, 4Н, 4'- N(CH2)2), 6.57 (д, 1H, 4-H, J 1,73 Гц), 6.60 (д, 1Н, 6-Н, J 1,73 Гц), 7.22 (д, 1Н, 6'-H, J 8,53 Гц), 7.63 (д, 1H, 5'-Н, J 8,53 Гц), 7.63 (с, 1H, 3'-Н), 18.72 (уш. с, 1H, 3-ОН). Масс-спектр, m/z (Iотн, %): 472 (8) [M]+, 444 (100), 429 (70), 413 (14), 387 (20), 57 (52), 41 (75). Найдено, %: С 78.80, Н 8.41, N 5.81. C31H40N2O2. Вычислено, %: С 78.77, Н 8.53, N 5.93, O 6.77. М 472.3090.
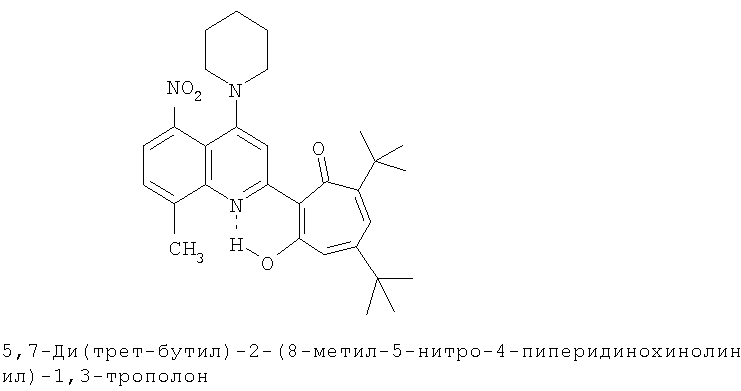
Пример 21 (Метод С). 5,7-Ди(трет-бутил)-2-(8-метил-5-нитро-4-пиперидинохинолин-2-ил)-1,3-трополон: получали при взаимодействии 20 ммоль 3,5-ди(трет-бутил)-1,2-бензохинона и 10 ммоль 2,8-диметил-5-нитро-4-пиперидинохинолина аналогично 5,7-ди(трет-бутил)-2-(8-метил-4-хлорохинолин-2-ил)-1,3-трополону (пример 1). Выход 48%, желтые кристаллы, т.пл. 244-246°С (2-пропанол).
Пример 21а (Метод Д). 5,7-Ди(трет-бутил)-2-(8-метил-5-нитро-4-пиперидинохинолин-2-ил)-1,3-трополон. Раствор 0.73 ммоль 5,7-ди(трет-бутил)-2-(8-метил-5-нитро-4-хлорохинолин-2-ил)-1,3-трополона в 3 мл пиперидина кипятили 1 ч. Последующее выделение как и в примере 10а. Выход 74%, желтые кристаллы, т.пл. 244-246°С (2-пропанол). Спектр ЯМР 1Н (CDCl3), δ, м.д.: 1.25 (с, 9Н, 5-С(СН3)3), 1.39 (с, 9Н, 7-С(СН3)3), 1.6-3.2 (м, CH, 4'-N(CH2)5), 2.72 (с, 3Н, 8'-СН3), 6.64 (д, 1H, 4-H, J 1,8 Гц), 6.72 (д, 1H, 6-Н, J 1,8 Гц), 7.49 (д, 1H, 7'-Н, J 7,7 Гц), 7.55 (д, 1H, 6'-H, J 7,7 Гц), 7.85 (с, 1H, 3'-Н), 19.0 (уш. с, 1H, 3-ОН). Масс-спектр, m/z (Iотн, %): 503 (8) [М]+, 475 (100), 460 (44), 432 (15), 45 (15). Найдено, %: С 71.48, Н 7.27, N 8.54. C30H37N3O4. Вычислено, %: С 71.54, Н 7.40, N 8.34, O 12.71. М 503.2784.
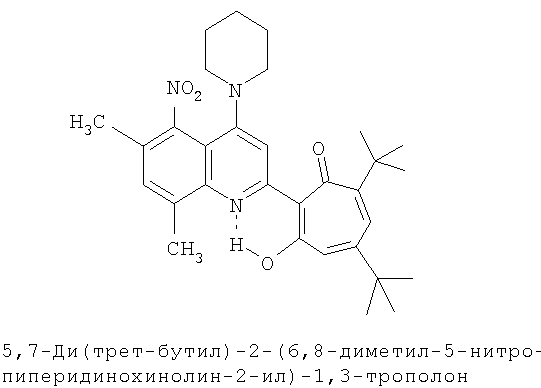
Пример 22 (Метод С). 5,7-Ди(трет-бутил)-2-(6,8-диметил-5-нитро-4-пиперидинохинолин-2-ил)-1,3-трополон: получали при взаимодействии 20 ммоль 3,5-ди(трет-бутил)-1,2-бензохинона и 10 ммоль 2,6,8-триметил-5-нитро-4-пиперидинохинолина аналогично 5,7-ди(трет-бутил)-2-(8-метил-4-хлорохинолин-2-ил)-1,3-трополону (пример 1). Выход 41%, желтые кристаллы, т.пл. 198-200°С (2-пропанол).
Пример 22а (Метод Д). 5,7-Ди(трет-бутил)-2-(6,8-диметил-5-нитро-4-пиперидинохинолин-2-ил)-1,3-трополон. Раствор 0.73 ммоль 5,7- ди(трет-бутил)-2-(6,8-диметил-5-нитро-4-хлорохинолин-2-ил)-1,3-трополона в 3 мл пиперидина кипятили 1 ч. Последующее выделение как и в примере 10а. Выход 82%, желтые кристаллы, т.пл. 198-200°С (2-пропанол). Спектр ЯМР 1Н (CDCl3), δ, м.д: 1.25 (с, 9Н, 5-С(СН3)3), 1.39 (с, 9Н, 7-С(СН3)3), 1.6-3.2 (м, 10Н, 4'-N(CH2)5), 2.39 (с, 3Н, 6'-СН3), 2.68 (с, 3Н, 8'-СН3), 6.65 (д, 1Н, 4-Н, J 1,42 Гц), 6.74 (д, 1Н, 6-Н, J 1,42 Гц), 7.39 (с, 1Н, 7'-Н), 7.96 (с, 1Н, 3'-Н), 18.96 (уш. с, 1Н, 3-ОН). Найдено, %: С 71.79, Н 7.41, N 8.02. С31Н39N3O4. Вычислено, %: С 71.93, Н 7.59, N 8.12, О 12.36. М 517.2941.
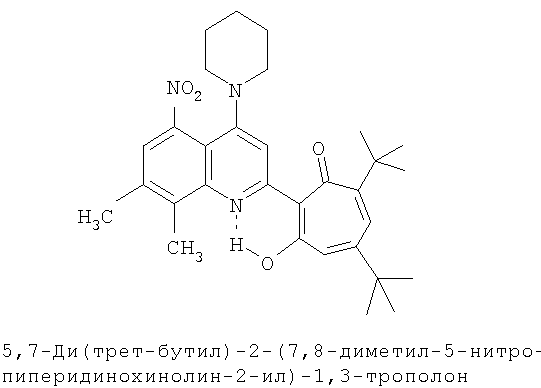
Пример 23 (Метод С). 5,7-Ди(трет-бутил)-2-(7,8-диметил-5-нитро-4-пиперидинохинолин-2-ил)-1,3-трополон: получали при взаимодействии 20 ммоль 3,5-ди(трет-бутил)-1,2-бензохинона и 10 ммоль 2,7,8-триметил-5-нитро-4-пиперидинохинолина аналогично 5,7-ди(трет-бутил)-2-(8-метил-4-хлорохинолин-2-ил)-1,3-трополону (пример 1). Выход 37%, желтые кристаллы, т.пл. 223-225°С (2-пропанол).
Пример 23а (Метод Д). 5,7-Ди(трет-бутил)-2-(7,8-диметил-5-нитро-4-пиперидинохинолин-2-ил)-1,3-трополон. Раствор 0.73 ммоль 5,7-ди(трет-бутил)-2-(7,8-диметил-5-нитро-4-хлорохинолин-2-ил)-1,3-трополона в 3 мл пиперидина кипятили 1 ч. Последующее выделение как и в примере 10а. Выход 78%, желтые кристаллы, т.пл. 223-225°С (2-пропанол). Спектр ЯМР 1Н (CDCl3), δ, м.д: 1.24 (с, 9Н, 5-С(СН3)3), 1.38 (с, 9Н, 7-С(СН3)3), 1.6-3.2 (м, 10Н, 4'-N(CH2)5), 2.51 (с, 3Н, 7'-СН3), 2.62 (с, 3Н, 8'-СН3), 6.62 (д, 1Н, 4-Н, J 1,76 Гц), 6.68 (д, 1Н, 6-Н, J 1,76 Гц), 7.47 (с, 1Н, 6'-Н), 7.79 (с, 1Н, 3'-Н), 19.08 (уш. с, 1Н, 3-ОН). Масс-спектр, m/z (Iотн, %): 517 (8) [М]+, 489 (100), 474 (44), 446 (20), 57 (68), 41 (80). Найдено, %: С 71.85, Н 7.47, N 8.03. C31H39N3O4. Вычислено, %: С 71.93, Н 7.59, N 8.12, O 12.36. М 517.2941.
Пример 24 (Метод С). 5,7-Ди(трет-бутил)-2-[4-(2-гидроксиэтиламино)-8-метилхинолин-2-ил]-1,3-трополон: получали при взаимодействии 20 ммоль 3,5-ди(трет-бутил)-1,2-бензохинона и 10 ммоль 4-(2-гидроксиэтиламино)-2,8-диметилхинолина аналогично 5,7-ди(трет- бутил)-2-(8-метил-4-хлорохинолин-2-ил)-1,3-трополону (пример 1). Выход 31%, желтые кристаллы, т.пл. 264-265°С (этанол).
Пример 24а (Метод Д). 5,7-Ди(трет-бутил)-2-[4-(2-гидроксиэтиламино)-8-метилхинолин-2-ил]-1,3-трополон. Раствор 0.73 ммоль 5,7-ди(трет-бутил)-2-(8-метил-4-хлорохинолин-2-ил)-1,3-трополона в 3 мл моноэтаноламина кипятили 1 ч. Последующее выделение как и в примере 10а. Выход 94%, желтые кристаллы, т.пл. 264-265°С (этанол). ИК-спектр, ν, 3420, 3260, 1633, 1607, 1580, 1513, 1447, 1393, 1367, 1353, 1340 см-1. Спектр ЯМР 1Н (CDCl3), δ, м.д: 1.22 (с, 9Н, 5-С(СН3)3), 1.31 (с, 9Н, 7-С(СН3)3), 2.60 (с, 3Н, 8'-СН3), 3.22 (м, 2Н, СН3), 3.73 (м, 2Н, CH2), 4.71 (т, 1Н, ОН), 6.33 (д, 1Н, 4-Н, J 1,8 Гц), 6.43 (д, 1Н, 6-Н, J 1,8 Гц), 7.10-7.50 (м, 4Н, аром.), 7.46 (м, 1Н, NH), 8.05 (д, 1Н, 3'-Н), 18.28 (с, 1Н, 3-ОН). Найдено, %: С 74.55, Н 7.47, N 6.63. С27Н34N2O3. Вычислено, %: С 74.62, Н 7.89, N 6.45, О 11.04. М 434.2569.
Пример 25 (Метод С). 5,7-Ди(трет-бутил)-2-[4-(2-гидроксиэтиламино)-6,8-диметилхинолин-2-ил]-1,3-трополон: получали при взаимодействии 20 ммоль 3,5-ди(трет-бутил)-1,2-бензохинона и 10 ммоль 4-(2-гидроксиэтиламино)-2,6,8-триметилхинолина аналогично 5,7-ди(трет-бутил)-2-(8-метил-4-хлорохинолин-2-ил)-1,3-трополону (пример 1). Выход 35%, желтые кристаллы, т.пл. 238-240°С (этанол).
Пример 25а (Метод Д). 5,7-ди(трет-бутил)-2-[4-(2-гидроксиэтиламино)-6,8-диметилхинолин-2-ил]-1,3-трополон. Раствор 0.73 ммоль 5,7-ди(трет-бутил)-2-(6,8-диметил-4-хлорохинолин-2-ил)-1,3-трополона в 3 мл моноэтаноламина кипятили 1 ч. Последующее выделение как и в примере 10а. Выход 95%, желтые кристаллы, т.пл. 238-240°С (этанол). ИК-спектр, ν, 3340, 3180, 1633, 1593, 1540, 1460, 1367, 1260, 1233 см-1. Спектр ЯМР 1H (CDCl3), δ, м.д: 1.22 (с, 9Н, 5-С(СН3)3), 1.31 (с, 9Н, 7-С(СН3)3), 2.52 (с, 3Н, 6'-СН3), 2.60 (с, 3Н, 8'-СН3), 3.34 (м, 2Н, СН3), 3.73 (м, 2Н, СН3), 4.70 (т, 1Н, ОН), 6.35 (д, 1Н, 4-Н, J 1,8 Гц), 6.44 (д, 1Н, 6-Н, J 1,8 Гц), 7.18 (с, 1Н, 7'-Н), 7.24 (с, 1Н, 5'-Н), 7.34 (м, 1Н, NH), 7.86 (с, 1Н, 3'-Н), 18.30 (с, 1Н, 3-ОН). Спектр ЯМР 1H (ДМСО-d6), δ, м.д: 1.23 (с, 9Н, 5-С(СН3)3), 1.36 (с, 9Н, 7-С(СН3)3), 2.42 (с, 3Н, 6'-СН3), 2.57 (с, 3Н, 8'-СН3), 2.57 (уш. с, 1Н, ОН), 3.54 (т, 2Н, СН2), 4.05 (т, 2Н, СН3), 5.76 (уш. с, 1Н, NH), 6.57 (д, 1Н, 4-Н, J 1,7 Гц), 6.58 (д, 1Н, 6-Н, J 1,7 Гц), 7.20-7.30 (м, 3Н, аром.), 18.17 (с, 1Н, 3-ОН). Найдено, %: С 74.75, Н 7.97, N 6.53. С28Н36N2O3. Вычислено, %: С 74.97, Н 8.09, N 6.24, О 10.70. М 448.2726.
Пример 26 (Метод С). 5,7-Ди(трет-бутил)-2-[4-(2-гидроксиэтиламино)-7,8-диметилхинолин-2-ил]-1,3-трополон: получали при взаимодействии 20 ммоль 3,5-ди(трет-бутил)-1,2-бензохинона и 10 ммоль 4-(2-гидроксиэтиламино)-2,7,8-триметилхинолина аналогично 5,7-ди(трет-бутил)-2-(8-метил-4-хлорохинолин-2-ил)-1,3-трополону (пример 1). Выход 39%, желтые кристаллы, т.пл. 270-272°С (этанол).
Пример 26а (Метод Д). 5,7-Ди(трет-бутил)-2-[4-(2-гидроксиэтиламино)-7,8-диметилхинолин-2-ил]-1,3-трополон. Раствор 0.73 ммоль 5,7-ди(трет-бутил)-2-(7,8-диметил-4-хлорохинолин-2-ил)-1,3-трополона в 3 мл моноэтаноламина кипятили 1 ч. Последующее выделение как и в примере 10а. Выход 98%, желтые кристаллы, т.пл. 270-272°С (этанол). Спектр ЯМР 1Н (CDCl3, δ, м.д: 1.22 (с, 9Н, 5-С(СН3)3), 1.31 (с, 9Н, 7-С(СН3)3), 2.48 (с, 3Н, 7'-СН3), 2.51 (с, 3Н, 8'-СН3), 3.37 (м, 2Н, СН3), 3.73 (м, 2Н, СН3), 4.70 (т, 1Н, ОН), 6.33 (д, 1Н, 4-Н, J 1,8 Гц), 6.41 (д, 1Н, 6-Н, J 1,8 Гц), 7.05-7.15 (м, 2Н, 5',6'-Н), 7.37 (м, 1Н, NH) 7.94 (д, 1Н, 3'-Н), 18.16 (с, 1Н, 3-ОН). Найдено, %: С 74.86, Н 7.91, N 6.38. С28Н36N2O3. Вычислено, %: С 74.97, Н 8.09, N 6.24, О 10.70. М 448.2726.
Пример 27 (Метод С). 5,7-Ди(трет-бутил)-2-(8-метил-4-пиперазинохинолин-2-ил)-1,3-трополон: получали при взаимодействии 20 ммоль 3,5-ди(трет-бутил)-1,2-бензохинона и 10 ммоль 2,8-диметил-4-пиперазинохинолина аналогично 5,7-ди(трет-бутил)-2-(8-метил-4-хлорохинолин-2-ил)-1,3-трополону (пример 1). Выход 48%, желтые кристаллы, т.пл. 162-164°С (этанол).
Пример 27а (Метод Д). 5,7-Ди(трет-бутил)-2-(8-метил-4-пиперазинохинолин-2-ил)-1,3-трополон. Расплав 0.73 ммоль 5,7-ди(трет-бутил)-2-(8-метил-4-хлорохинолин-2-ил)-1,3-трополона в 2 ммоль пиперазина нагревали 30 минут при 100°С. Последующее выделение как и в примере 10а. Выход 93%, желтые кристаллы, т.пл. 162-164°С (бензол/петрол. эфир). ИК-спектр, ν, 3328, 1593, 1580, 1553, 1500, 1460, 1407, 1367, 1313, 1273, 1233 см-1. Спектр ЯМР 1Н (CDCl3), δ, м.д: 1.23 (с, 9Н, 5-С(СН3)3), 1.37 (с, 9Н, 7-С(СН3)3), 2.71 (с, 3Н, 8'-СН3), 3.16 (т, 4Н, (CLH2), 3.26 (т, 4Н, (СН2)2), 6.60 (с, 2Н, 4,6-Н), 7.32 (т, 1Н, 6'-Н, J 7,8 Гц), 7.48 (д, 1Н, 7'-Н, J 7,8 Гц), 7.68 (с, 1Н, 3'-Н), 7.76 (д, 1Н, 5'-Н, J 7,8 Гц), 18.95 (уш. с, 1Н, 3-ОН). Найдено, %: С 75.86, Н 7.96, N 9.38. С29Н37N3O2. Вычислено, %: С 75.78, Н 8.11, N 9.14, О 6.96. М 459.2886.
Пример 28 (Метод С). 5,7-Ди(трет-бутил)-2-(6,8-диметил-4-пиперазинохинолин-2-ил)-1,3-трополон: получали при взаимодействии 20 ммоль 3,5-ди(трет-бутил)-1,2-бензохинона и 10 ммоль 2,6,8-триметил-4-пиперазинохинолина аналогично 5,7-ди(трет-бутил)-2-(8-метил-4-хлорохинолин-2-ил)-1,3-трополону (пример 1). Выход 55%, желтые кристаллы, т.пл. 190-192°С (бензол/петрол. эфир).
Пример 28а (Метод Д). 5,7-Ди(трет-бутил)-2-(6,8-диметил-4-пиперазинохинолин-2-ил)-1,3-трополон. Расплав 0.73 ммоль 5,7-д,и(трет-бутил)-2-(6,8-диметил-4-хлорохинолин-2-ил)-1,3-трополона в 2 ммоль пиперазина нагревали 30 минут при 100°С. Последующее выделение как и в примере 10а. Выход 93%, желтые кристаллы, т.пл. 190-192°С (бензол/петрол. эфир). Спектр ЯМР 1Н (CDCl3), δ, м.д: 1.23 (с, 9Н, 5-С(СН3)3), 1.40 (с, 9Н, 7-С(СН3)3), 2.48 (с, 3Н, 7'-СН3), 2.67 (с, 3Н, 8'-СН3), 3.17 (т, 4Н, (СН2)2), 3.24 (т, 4Н, (СН2)2), 6.61 (с, 2Н, 4,6-Н), 7.33 (с, 1Н, 7'-Н), 7.53 (с, 1Н, 5'-Н), 7.68 (с, 1Н, 3'-Н),19.00 (уш. с, 1Н, 3-ОН). Найдено, %: С 75.96, Н 8.16, N 9.18. C30H39N3O2. Вычислено, %: С 76.07, Н 8.30, N 8.87, О 6.76. М 473.3042.
Пример 29 (Метод С). 5,7-Ди(трет-бутил)-2-(7,8-диметил-4-пиперазинохинолин-2-ил)-1,3-трополон: получали при взаимодействии 20 ммоль 3,5-ди(трет-бутил)-1,2-бензохинона и 10 ммоль 2,7,8-триметил-4-пиперазинохинолина аналогично 5,7-ди(трет-бутил)-2-(8-метил-4-хлорохинолин-2-ил)-1,3-трополону (пример 1). Выход 50%, желтые кристаллы, т.пл. 194-195°С (бензол/петрол. эфир).
Пример 29а (Метод Д). 5,7-Ди(трет-бутил)-2-(7,8-диметил-4-пиперазинохинолин-2-ил)-1,3-трополон. Расплав 0.73 ммоль 5,7-ди(трет-бутил)-2-(7,8-диметил-4-хлорохинолин-2-ил)-1,3-трополона в 2 ммоль пиперазина нагревали 30 минут при 100°С. Последующее выделение как и в примере 10а. Выход 90%, желтые кристаллы, т.пл. 194-195°С (бензол/петрол. эфир). ИК-спектр, ν, 3353, 1607, 1593, 1553, 1513, 1460, 1407, 1367, 1273, 1233 см-1. Спектр ЯМР 1H (CDCl3), δ, м.д: 1.23 (с, 9Н, 5-С(СН3)3), 1.36 (с, 9Н, 7-С(СН3)3), 2.50 (с, 3Н, 7'-СН3), 2.61 (с, 3Н, 8'-СН3), 3.15 (м, 4Н, (СН2)2), 3.25 (т, 4Н, (СН2)2), 6.58 (д, 1Н, 4-Н, J 1,8 Гц), 6.60 (д, 1Н, 6-Н, J 1,8 Гц), 7.23 (д, 1Н, 6'-Н, J 8,3 Гц), 7.65 (д, 1Н, 5'-Н, J 8,3 Гц), 7.70 (с, 1Н, 3'-Н), 18.84 (с, 1Н, 3-ОН). Найдено, %: С 76.02, Н 8.12, N 9.06. С30H39N3O2. Вычислено, %: С 76.07, Н 8.30, N 8.87, О 6.76. М 473.3042.
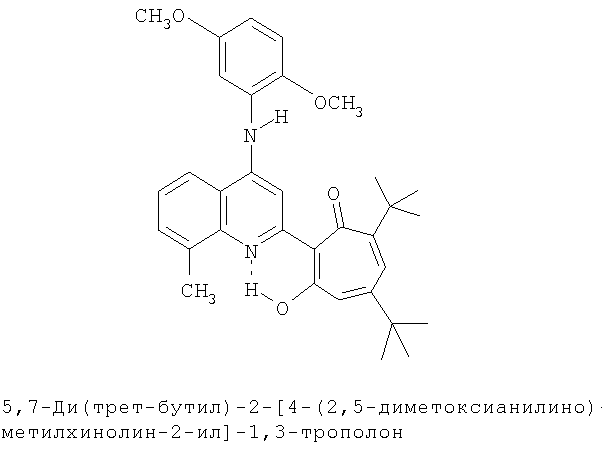
Пример 30 (Метод С). 5,7-Ди(трет-бутил)-2-[4-(2,5-диметоксианилино)-8-метилхинолин-2-ил]-1,3-трополон: получали при взаимодействии 20 ммоль 3,5-ди(трет-бутил)-1,2-бензохинона и 10 ммоль 4-(2,5-диметоксианилино)-2,8-диметилхинолина аналогично 5,7-ди(трет-бутил)-2-(8-метил-4-хлорохинолин-2-ил)-1,3-трополону (пример 1). Выход 41%, оранжевые кристаллы, т.пл. 235-237°С (2-пропанол). Спектр ЯМР 1Н (CDCl3), δ, м.д: 1.22 (с, 9Н, 5-С(СН3)3), 1.27 (с, 9Н, 7-С(СН3)3), 2.72 (с, 3Н, 8'-СН3), 3.89 (с, 3Н, 5''-ОСН3), 3.98 (с, 3Н, 2''-ОСН3), 6.57 (д, 1Н, 4-Н, J 1,3 Гц), 6.59 (д, 1Н, 6-Н, J 1,3 Гц), 6.68 (д.д., 1Н, 4''-Н, J1 8,9 Гц, 2 2,7 Гц), 6.92 (д, 1Н, 3''-Н, J, 8,9 Гц), 7.29 (с, 1Н, 4'-NH) 7.38 (т, 1Н, 6'-Н, J 7,6 Гц), 7.39 (д, 1Н, 6''-Н, J 2,7 Гц), 7.55 (д, 1Н, 7'-Н, J 6,95 Гц), 7.75 (д, 1Н, 5'-Н, J 8,32 Гц), 7.97 (с, 1Н, 3'-Н), 18.80 (уш. с, 1Н, 3-ОН). Найдено, %: С 75.33, Н 7.17, N 5.23. С33Н38N2O4. Вычислено, С 75.26, Н 7.27, N 5.32, О 12.15. М 526.2832.
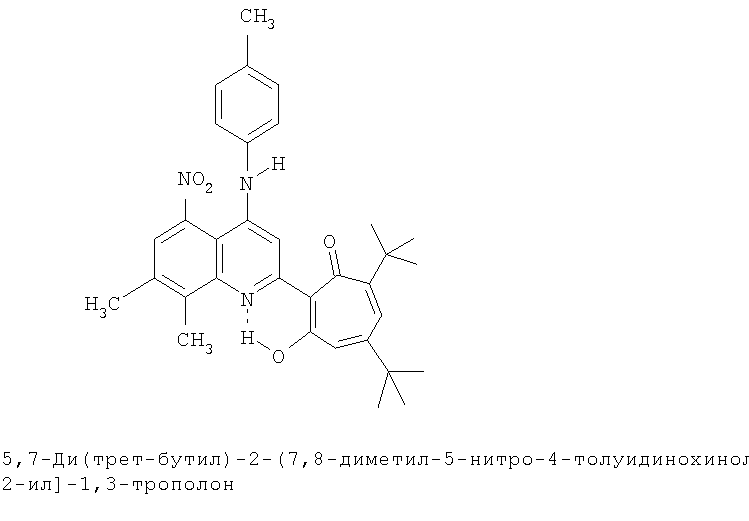
Пример 31 (Метод С). 5,7-Ди(трет-бутил)-2-(7,8-диметил-5-нитро-4-толуидинохинолин-2-ил]-1,3-трополон: получали при взаимодействии 20 ммоль 3,5-ди(трет-бутил)-1,2-бензохинона и 10 ммоль 2,7,8-триметил-5-нитро-4-толуидинохинолина аналогично 5,7-ди(трет-бутил)-2-(8-метил-4-хлорохинолин-2-ил)-1,3-трополону (пример 1). Выход 53%, оранжевые кристаллы, т.пл. 220-222°С (2-пропанол). ИК-спектр, ν, 3380, 1633, 1580, 1500, 1433, 1367, 1353, 1233 см-1. Спектр ЯМР 1Н (CDCl3), δ, м.д: 1.16 (с, 9Н, 5-С(СН3)3), 1.22 (с, 9Н, 7-С(СН3)3), 2.38 (с, 3Н, 4''-СН3), 2.56 (с, 3Н, 7'-СН3), 2.67 (с, 3Н, 8'-СН3), 6.59 (д, 1Н, 4-Н, J 1,3 Гц), 6.62 (д, 1Н, 6-Н, J 1,3 Гц),), 6.89 (с, 1Н, 4'-NH), 7.05 (д, 2Н, 3'',5''-Н, J 8,3 Гц), 7.21 (д, 2Н, 2'',6''-Н, J 8,3 Гц), 7.55 (с, 1Н, 6'-Н), 7.61 (с, 1Н, 3'-Н), 18.98 (с, 1Н, 3-ОН). Найдено, %: С 73.54, Н 6.73, N 7.82. C33H37N3O4. Вычислено, С 73.44, Н 6.91, N 7.79, О 11.86. М 539.2784.
Пример 32 (Метод С). 5,7-Ди(трет-бутил)-2-[6,8-диметил-4-(1H-1-имидазолил)-5-нитрохинолин-2-ил]-1,3-трополон: получали при взаимодействии 20 ммоль 3,5-ди(трет-бутил)-1,2-бензохинона и 10 ммоль 2,6,8-триметил-4-(1H-1-имидазолил)-5-нитрохинолина аналогично 5,7-ди(трет-бутил)-2-(8-метил-4-хлорохинолин-2-ил)-1,3-трополону (пример 1). Выход 44%, желтые кристаллы, т.пл. 262-264°С (этанол).
Пример 32а (Метод Д). 5,7-Ди(трет-бутил)-2-[6,8-диметил-4-(1H-1-имидазолил)-5-нитрохинолин-2-ил]-1,3-трополон. Расплав 0.73 ммоль 5,7-ди(трет-бутил)-2-(6,8-диметил-5 -нитро-4-хлорохинолин-2-ил)-1,3 -трополона в 5 ммоль имидазола нагревали 30 минут при 100°С. Последующее выделение как и в примере 10а. Выход 74%, желтые кристаллы, т.пл. 262-264°С (этанол). ИК-спектр, ν, 1620, 1593, 1580, 1513, 1447, 1367, 1353, 1300 см-1. Спектр ЯМР 1Н (CDCl3), δ, м.д: 1.29 (с, 9Н, 5-С(СН3)3), 1.37 (с, 9Н, 7-С(СН3)3), 2.42 (с, 3Н, 6'-СН3), 2.80 (с, 3Н, 8'-СН3), 6.77 (д, 1Н, 4-Н, J 1,7 Гц), 6.88 (д, 1Н, 6-Н, J 1,7 Гц), 7.08 (с, 1Н, 7'-Н), 7.25 (д, 1Н, 4''-H, J 8,55 Гц), 7.57 (д, 1Н, 5''-Н, J 8,55 Гц), 7.59 (с, 1H, 3'-H), 8.12 (с, 1Н, 2''-Н), 17.85 (с, 1H, 3-ОН). Масс-спектр, m/z (Iотн, %): 500 (8) [М]+, 472 (100), 457 (72), 429 (20), 91 (25), 57 (72), 41 (90). Найдено, %: С 69.32, Н 6.21, N 11.29. C29H32N4O4. Вычислено, %: С 69.58, Н 6.44, N 11.19, О 12.78. М 500.2424.
Пример 33 (Метод С). 5,7-Ди(трет-бутил)-2-[4-(1H-1-имидазолил)-8-метилхинолин-2-ил]-1,3-трополон: получали при взаимодействии 20 ммоль 3,5-ди(трет-бутил)-1,2-бензохинона и 10 ммоль 2,8-диметил-4-(1H-1-имидазолил)хинолина аналогично 5,7-ди(трет-бутил)-2-(8-метил-4-хлорохинолин-2-ил)-1,3-трополону (пример 1). Выход 52%, желтые кристаллы, т.пл. 190-191°С (этанол).
Пример 33а (Метод Д). 5,7-Ди(трет-бутил)-2-[4-(1H-1-имидазолил)-8-метилхинолин-2-ил]-1,3-трополон. Расплав 0.73 ммоль 5,7-ди(трет-бутил)-2-(8-метил-4-хлорохинолин-2-ил)-1,3-трополона в 5 ммоль имидазола нагревали 30 минут при 100°С. Последующее выделение как и в примере 10а. Выход 84%, желтые кристаллы, т.пл. 190-191°С (этанол). ИК-спектр, ν, 1633, 1607, 1500, 1460, 1407, 1367 1340, 1300, 1260, 1233 см-1. Спектр ЯМР 1Н (CDCl3), δ, м.д: 1.27 (с, 9Н, 5-С(СН3)3), 1.38 (с, 9Н, 7-С(СН3)3), 2.78 (с, 3Н, 8'-СН3), 6.71 (д, 1H, 4-Н, J 1,7 Гц), 6.78 (д, 1H, 6-Н, J 1,7 Гц), 7.34 (с, 2Н, 4'',5''-Н), 7.45 (т, 1H, 6'-Н), 7.62 (д, 1H, 7'-Н, J 8,4 Гц), 7.65 (д, 1H, 5'-Н, J 8,4 Гц), 7.85 (с, 1H, 3'-Н), 8.14 (с, 1H, 2''-Н), 19.01 (с, 1H, 3-ОН). Найдено, %: С 76.32, Н 7.01, N 9.49. С28Н31N3O2. Вычислено, %: С 76.16, Н 7.08, N 9.52, О 7.25. М 441.2416.
Пример 34 (Метод С). 5,7-Ди(трет-бутил)-2-[6,8-диметил-4-(1H-1-имидазолил)хинолин-2-ил]-1,3-трополон: получали при взаимодействии 20 ммоль 3,5-ди(трет-бутил)-1,2-бензохинона и 10 ммоль 4-(1H-1-имидазолил)-2,6,8-триметилхинолина аналогично 5,7-ди(трет-бутил)-2-(8-метил-4-хлорохинолин-2-ил)-1,3-трополону (пример 1). Выход 55%, желтые кристаллы, т.пл. 191-193°С (этанол).
Пример 34а (Метод Д). 5,7-Ди(трет-бутил)-2-[6,8-диметил-4-(1H-1-имидазолил)хинолин-2-ил]-1,3-трополон. Расплав 0.73 ммоль 5,1-ди(трет-бутил)-2-(6,8-диметил-4-хлорохинолин-2-ил)-1,3-трополона в 5 ммоль имидазола нагревали 30 минут при 100°С. Последующее выделение как и в примере 10а. Выход 86%, желтые кристаллы, т.пл. 191-193°С (этанол). Спектр ЯМР 1Н (CDCl3), δ, м.д: 1.27 (с, 9Н, 5-С(СН3)3), 1.37 (с, 9Н, 7-С(СН3)3), 2.46 (с, 3Н, 6'-СН3), 2.75 (с, 3Н, 8'-СН3), 6.71 (д, 1Н, 4-Н, J 1,7 Гц), 6.79 (д, 1Н, 6-Н, J 1,7 Гц), 7.33 (с, 1Н, 7'-Н), 7.35 (с, 1Н, 4''-Н), 7.36 (с, 1Н, 5''-Н), 7.49 (с, 1Н, 5'-Н), 7.84 (с, 1Н, 3'-Н), 8.11 (с, 1Н, 2''-Н), 19.10 (с, 1Н, 3-ОН). Найдено, %: С 76.22, Н 7.14, N 9.39. С29Н33N3O2. Вычислено, %: С 76.45, Н 7.30, N 9.22, О 7.02. М 455.2573.
Пример 35 (Метод С). 5,7-Ди(трет-бутил)-2-[7,8-диметил-4-(1H-1-имидазолил)хинолин-2-ил]-1,3-трополон: получали при взаимодействии 20 ммоль 3,5-ди(трет-бутил)-1,2-бензохинона и 10 ммоль 4-(1Н-1-имидазолил)-2,7,8-триметилхинолина аналогично 5,7-ди(трет-бутил)-2-(8-метил-4-хлорохинолин-2-ил)-1,3-трополону (пример 1). Выход 62%, желтые кристаллы, т.пл. 204-206°С (этанол).
Пример 35а (Метод Д). 5,7-Ди(трет-бутил)-2-[7,8-диметил-4-(1H-1-имидазолил)хинолин-2-ил]-1,3-трополон. Расплав 0.73 ммоль 5,7-ли(трет-бутил)-2-(7,8-диметил-4-хлорохинолин-2-ил)-1,3-трополона в 5 ммоль имидазола нагревали 30 минут при 100°С. Последующее выделение как и в примере 10а. Выход 93%, желтые кристаллы, т.пл. 204-206°С (этанол). Спектр ЯМР 1Н (CDCl3), δ, м.д: 1.27 (с, 9Н, 5-С(СН3)3), 1.37 (с, 9Н, 7-С(СН3)3), 2.56 (с, 3Н, 7'-СН3), 2.69 (с, 3Н, 8'-СН3), 6.70 (д, 1Н, 4-Н, J 1,7 Гц), 6.75 (д, 1Н, 6-Н, J 1,7 Гц), 7.32 (с, 1Н, 4''-Н), 7.33 (с, 1Н, 5''-Н), 7.36 (д, 1Н, 6'-Н, J 8,5 Гц), 7.51 (д, 1Н, 5'-Н, J 8,5 Гц), 7.84 (с, 1Н, 3'-Н), 8.08 (с, 1Н, 2''-Н), 19.25 (с, 1Н, 3-ОН). Найдено, %: С 76.34, Н 7.18, N 9.43. C29H33N3O2. Вычислено, %: С 76.45, Н 7.30, N 9.22, О 7.02. М 455.2573.
Пример 36 (Метод С). 5,7-ди(трет-бутил)-2-[4-метил-8-нитрохинолин-2-ил]-1,3-трополон: получали при взаимодействии 20 ммоль 3,5-ди(трет-бутил)-1,2-бензохинона и 10 ммоль 2,4-диметил-8-нитрохинолина аналогично 5,7-ди(трет-бутил)-2-(8-метил-4-хлорохинолин- 2-ил)-1,3-трополону (пример 1). Выход 58%, желтые кристаллы, т.пл. 223-225°С (2-пропанол). ИК-спектр, ν, 1620, 1513, 1500, 1460, 1447, 1367, 1353, 1327, 1300, 1233 см-1. Спектр ЯМР 1H (CDCl3), δ, м.д: 1.25 (с, 9Н, 5-С(СН3)3), 1.39 (с, 9Н, 7-С(СН3)3), 2.72 (с, 3Н, 4'-СН3), 6.71 (д, 1Н, 4-Н, J 1,7 Гц), 6.73 (д, 1Н, 6-Н, J 1,7 Гц), 7.56 (т, 1Н, 6'-Н), 8.05 (с, 1Н, 3'-Н), 8.19 (д, 1Н, 5'-Н, J 8,0 Гц), 8.43 (д, 1Н, 7'-Н, J 8,0 Гц), 17.96 (с, 1Н, 3-ОН). Найдено, %: С 71.54, Н 6.73, N 6.82. C25H28N2O4. Вычислено, С 71.41, Н 6.71, N 6.66, О 15.22. М 420.2049.
Пример 37 (Метод С). 5,7-ди(трет-бутил)-2-[5-нитрохинолин-2-ил]-1,3-трополон: получали при взаимодействии 20 ммоль 3,5-ди(трет-бутил)-1,2-бензохинона и 10 ммоль 2-метил-5-нитрохинолина аналогично 5,7-ди(трет-бутил)-2-(8-метил-4-хлорохинолин-2-ил)-1,3-трополону (пример 1). Выход 57%, желтые кристаллы, т.пл. 172-174°С (2-пропанол). Спектр ЯМР 1Н (CDCl3), 5, м.д: 1.27 (с, 9Н, 5-С(СН3)3), 1.41 (с, 9Н, 7-С(СН3)3), 6.67 (д, 1Н, 4-Н, J 1,7 Гц), 6.82 (д, 1Н, 6-Н, J 1,7 Гц), 7.78 (т, 1Н, 7'-Н), 8.15 (д, 1Н, 3'-Н, J 8,4 Гц), 8.24-8.30 (м, 2Н, 6',8'-Н), 8.89 (д, 1Н, 4'-Н, J 8,4 Гц), 18.25 (с, 1Н, 3-ОН). Найдено, %: С 70.74, Н 6.33, N 7.02. С24Н26N2O4. Вычислено, С 70.92, Н 6.45, N 6.89, О 15.74. М 406.1893.
Пример 38 (Метод С). 4,7-Ди(трет-бутил)-2-(8-метил-4-хлорохинолин-2-ил)-1,3-трополон: получали при взаимодействии 10 ммоль 3,6-ди(трет-бутил)-1,2-бензохинона и 5 ммоль 2,8-диметил-4-хлорохинолина аналогично 5,7-ди(трет-бутил)-2-(8-метил-4-хлорохинолин-2-ил)-1,3-трополону (пример 1). Выход 20%, желтые кристаллы, т.пл. 180-182°С (2-пропанол). Спектр ЯМР 1Н (CDCl3), δ, м.д: 1.30 (с, 9Н, 4-С(СН3)3), 1.35 (с, 9Н, 7-С(СН3)3), 2.75 (с, 3Н, 8'-СН3), 6.38 (д, 1Н, 5-Н, J 8,0 Гц), 6.58 (д, 1Н, 6-Н, J 8,0 Гц), 7.44 (т, 1Н, 6'-Н ), 7.6 (д, 1Н, 7'-Н ), 8.0 (д, 1Н, 5'-Н ), 8.26 (с, 1Н, 3'-Н ), 19.05 (с, 1Н, 3-ОН). Масс-спектр, m/z (Iотн, %): 409 (100) [М]+, 394 (15), 381 (30), 366 (70), 338 (75), 57 (40), 41 (44). Найдено, %: С 73.13, H 6.80, Cl 8.68, N 3.42. C25H28ClNO2. Вычислено, %: С 73.25, Н 6.88, Cl 8.65, N 3.42, O 7.81. М 409.1808.
Пример 39 (Метод С). 5,7-Ди(трет-бутил)-2-(хиноксалин-2-ил)-1,3-трополон: получали при взаимодействии 20 ммоль 3,5-д,и(трет-бутил)-1,2-бензохинона и 10 ммоль 2-метилхиноксалина аналогично 5,1-ди(трет-бутил)-2-(8-метил-4-хлорохинолин-2-ил)-1,3-трополону (пример 1). Выход 44%, желтые кристаллы, т.пл. 126-127°С (2-пропанол). Спектр ЯМР 1Н (CDCl3), δ, м.д: 1.29 (с, 9Н, 5-С(СН3)3), 1.45 (с, 9Н, 7-С(СН3)3), 6.71 (д, 1Н, 4-Н, J 1,7 Гц), 6.92 (д, 1Н, 6-Н, J 1,7 Гц), 7.6-8.2 (м, 4Н, аром), 9.44 (с, 1Н, 3'-Н), 17.17 (с, 1Н, 3-ОН). Найдено, %: С 76.11, Н 7.10, N 7.52. C23H26N2O2. Вычислено, %: С 76.21, Н 7.23, N 7.73, О 8.83. М 362.1994.
Пример 40 (Метод С). 5,7-Ди(трет-бутил)-2-(8-метил-4-хлорохинолин-2-ил)-4-нитро-1,3-трополон: получали при взаимодействии 5.30 г (20 ммоль) 4,6-ди(трет-бутил)-3-нитро-1,2-бензохинона и 1.91 г (10 ммоль) 2,8-диметил-4-хлорохинолина аналогично 5,7-ди(трет-бутил)-2-(8-метил-4-хлорохинолин-2-ил)-1,3-трополону (пример 1). Собирали вторую ярко-желтую фракцию. Получали 0.9 г. Выход 20%, желтые кристаллы, т.пл. 228-230°С (2-пропанол). Спектр ЯМР 1Н (CDCl3), δ, м.д.: 1.30 (с, 9Н, 5-С(СН3)3), 1.31 (с, 9Н, 7-С(СН3)3), 2.72 (с, 3Н, 8'-СН3), 6.38 (с, 1Н, 6-Н), 7.51 (т, 1Н, 6'-Н, J 7.7 Гц), 7.65 (д, 1Н, 7'-Н, J 7.6 Гц), 8.03 (д, 1Н, 5'-H, J 7.6 Гц), 8.34 (с, 1Н, 3'-Н), 18.03 (уш. с, 1Н, 3-ОН). Масс-спектр, m/z (Iотн, %): 454.9(10)[M]+, 426 (25), 408 (50), 384 (10), 352 (25), 322 (20), 176 (30), 154 (30), 91 (35), 57 (70), 41 (100). Найдено, %: С 66.12; Н 5.73; Cl 7.62; N 6.04. C25H27ClN2O4. Вычислено, %: С 66.00; Н 5.98; Cl 7.79; N 6.16, O 14.07. М 454.1659.
Пример 41 (Метод Д). 5,7-Ди(трет-бутил)-2-(8-метил-4-морфолинохинолин-2-ил)-4-нитро-1,3-трополон. Раствор 0.73 ммоль 5,7-ди(трет-бутил)-2-(8-метил-4-хлорохинолин-2-ил)-4-нитро-1,3-трополона в 3 мл морфолина кипятили 1 ч. Последующее выделение как и в примере 10а. Выход 89%, желтые кристаллы, т.пл. 220-222°С (2-пропанол). Спектр ЯМР 1Н (CDCl3), δ, м.д.: 1.30 (с, 18Н, 5,7-С(СН3)3), 2.69 (с, 3Н, 8'-СН3), 3.34 (м, 4Н, 4'-N(CH2)2=), 3.99 (м, 4Н, 4'-O(СН2)2=), 6.33 (с, 1Н, 6-Н), 7.38 (т, 1Н, 6'-Н, J 7,7 Гц), 7.53 (д, 1Н, 7'-H, J 7,6 Гц), 7.75 (д, 1H, 5'-H, J 7,6 Гц), 7.77 (с, 1Н, 3'-Н), 17.15 (с, 1H, 3-ОН). Найдено, %: С 68.62; Н 6.73; N 8.14. С29Н35N3O5. Вычислено, %: С 68.89; Н 6.98; N 8.31, О 15.82. М 505.2577.
Пример 42 (Метод Д). 5,7-Ди(трет-бутил)-2-(8-метил-4-пиперидинохинолин-2-ил)-4-нитро-1,3-трополон. Раствор 0.73 ммоль 5,7-ди(трет-бутил)-2-(8-метил-4-хлорохинолин-2-ил)-4-нитро-1,3-трополона в 3 мл пиперидина кипятили 1 ч. Последующее выделение как и в примере 10а. Выход 90%, желтые кристаллы, т.пл. 199-201°С (2-пропанол). ИК-спектр, ν, 1633, 1607, 1590, 1527, 1460, 1420, 1367, 1340, 1273, 1233 см-1. Спектр ЯМР 1H (CDCl3), δ, м.д.: 1.29 (с, 18Н, 5,7-С(СН3)3), 1.6-2.0 (м, 6Н, (СН3)3), 2.67 (с, 3Н, 8'-СН3), 3.2-3.4 (м, 4Н, 4'-N(CH2)2), 6.31 (с, 1H, 6-Н), 7.32 (т, 1H, 6'-Н, J 7,8 Гц), 7.49 (д, 1H, 7'-H, J 7,8 Гц), 7.71 (д, 1H, 5'-H, J 7,8 Гц), 7.74 (с, 1H, 3'-Н), 16.94 (с, 1H, 3-ОН). Найдено, %: С 71.62; Н 7.43; N 8.12. С30Н37N3O4. Вычислено, %: С 71.54; Н 7.40; N 8.34, О 12.71. М 503.2784.
5,7-Ди(трет-бутил)-хинолин-2-илпроизводные 1,3-трополона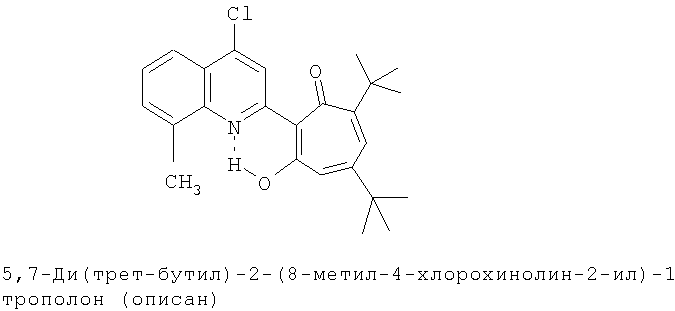
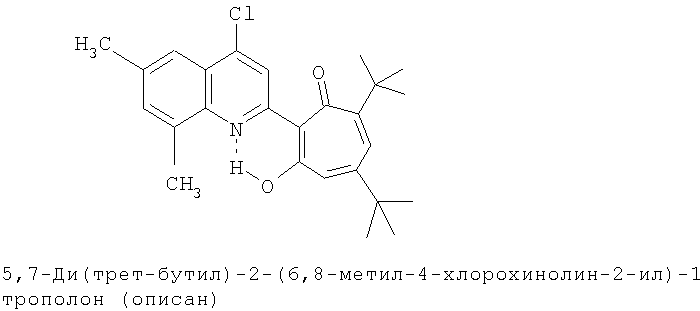
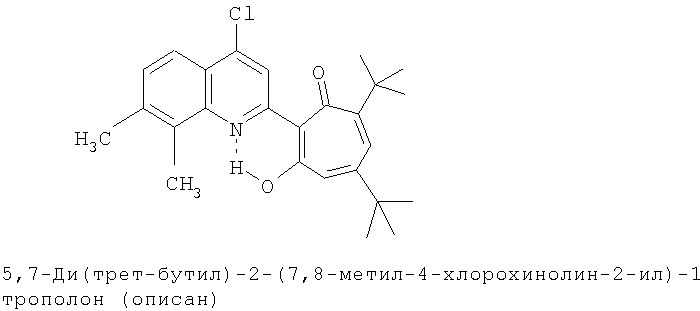
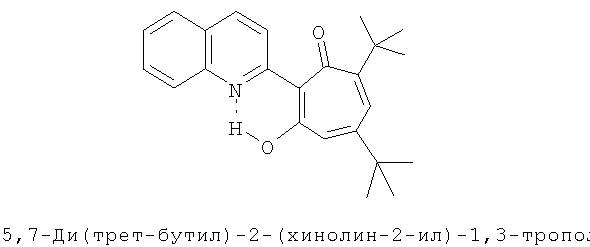

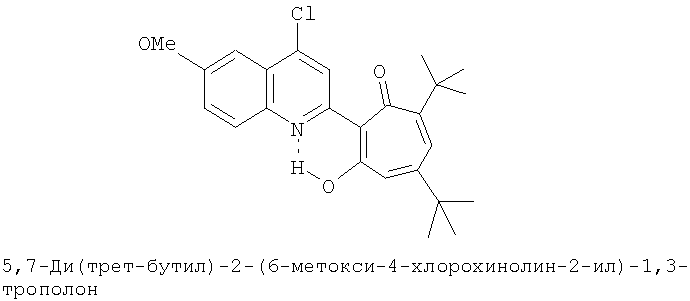
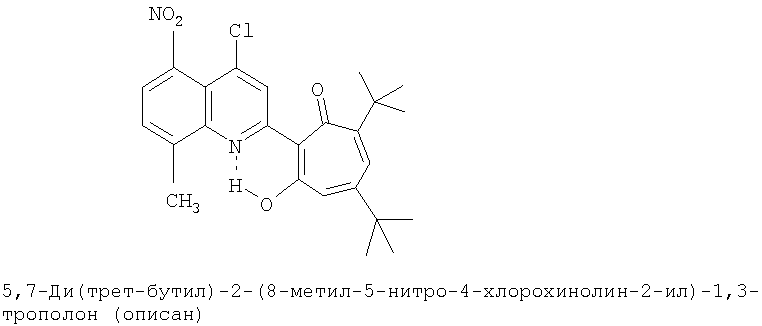
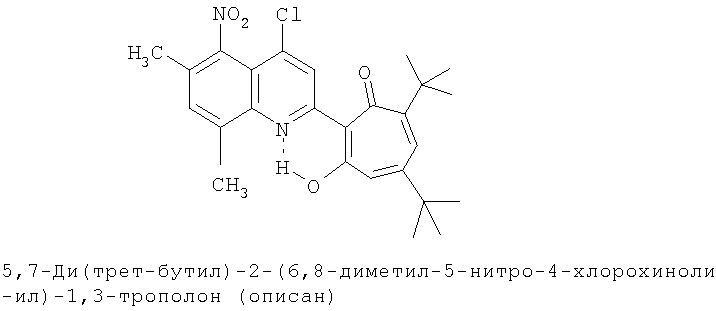
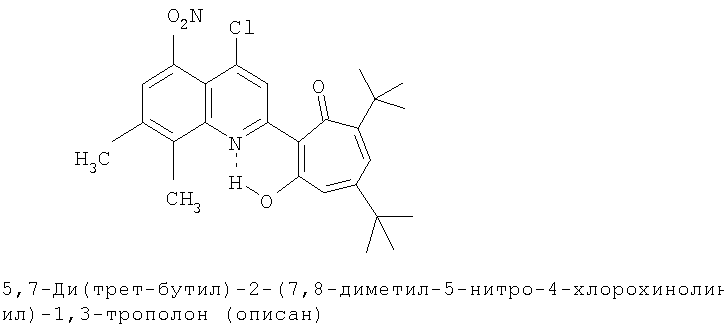
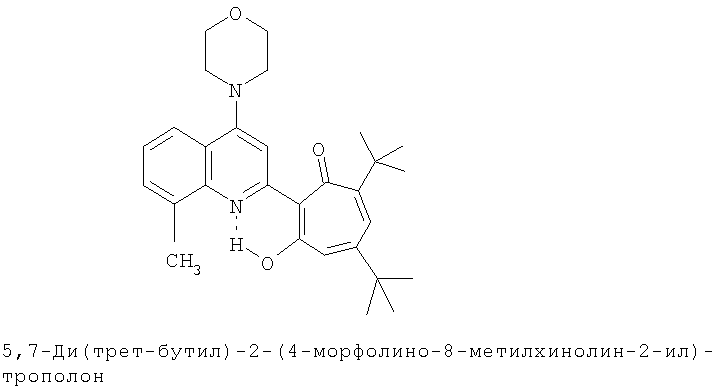

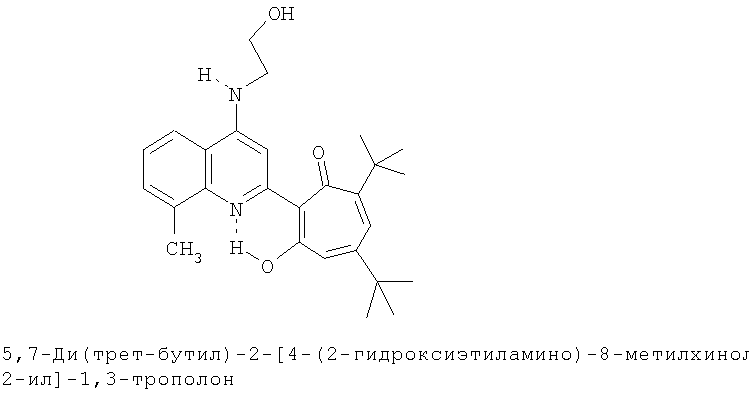
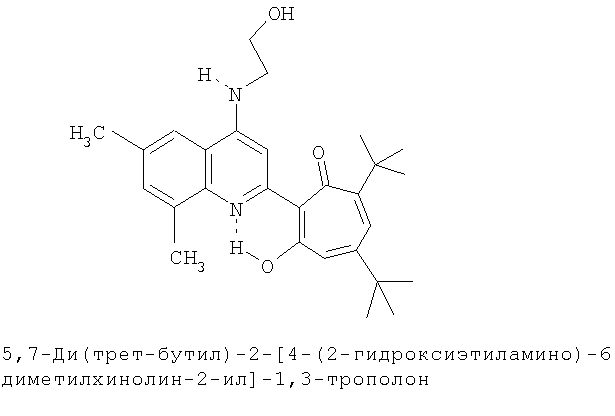
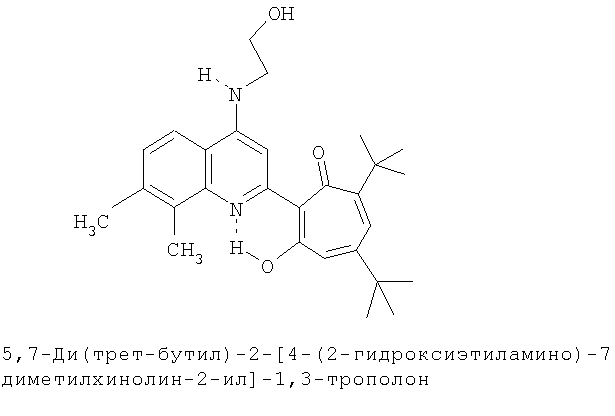
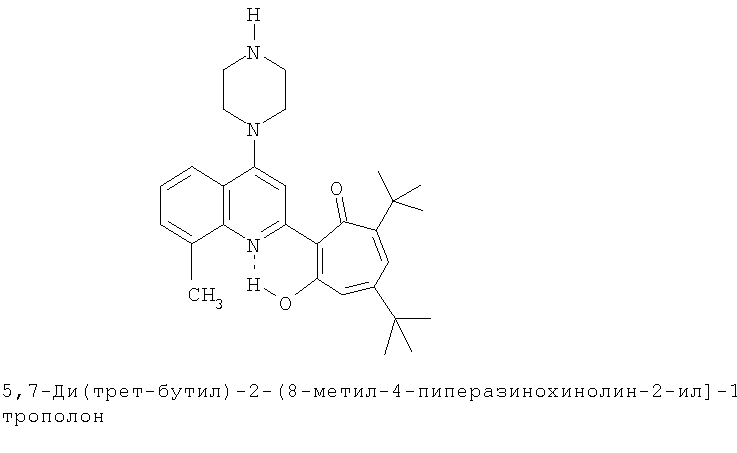
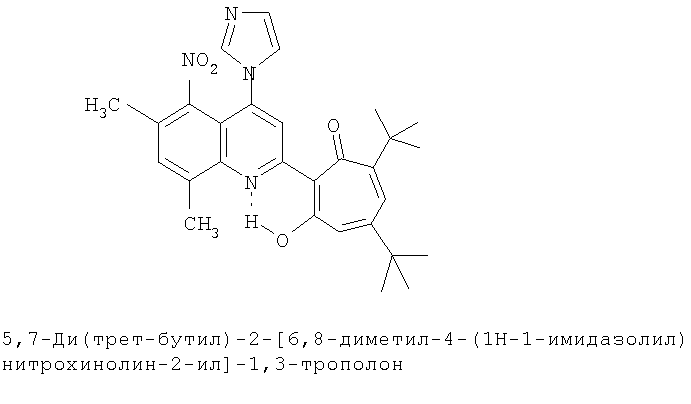
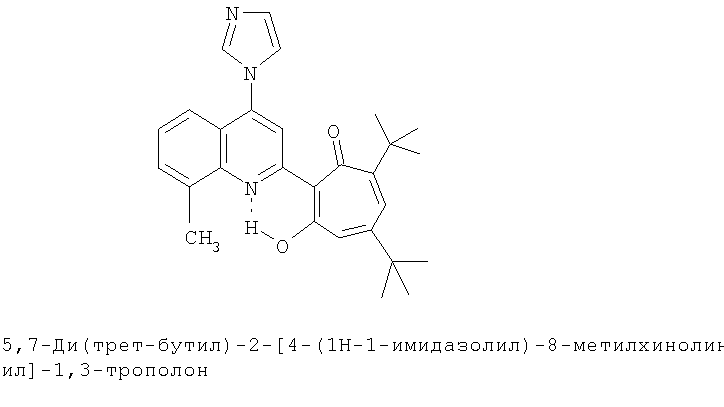
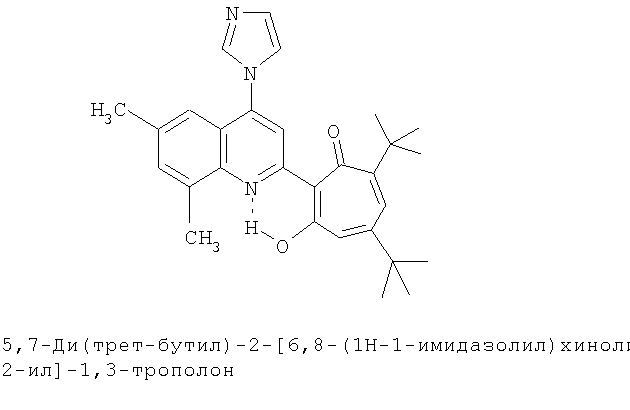

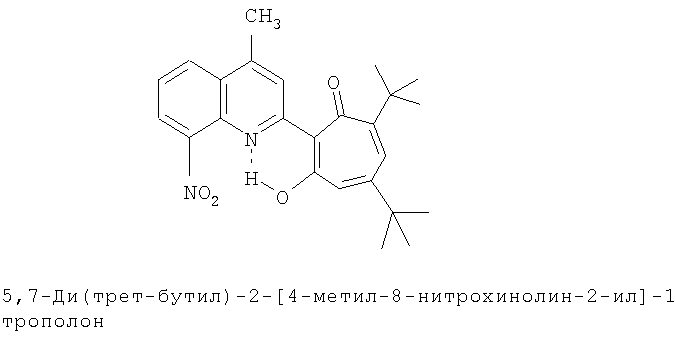

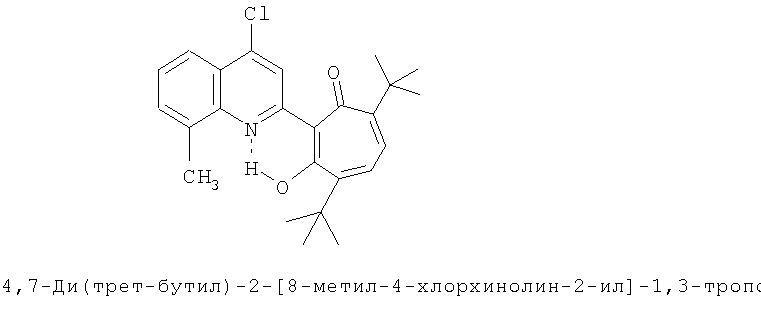
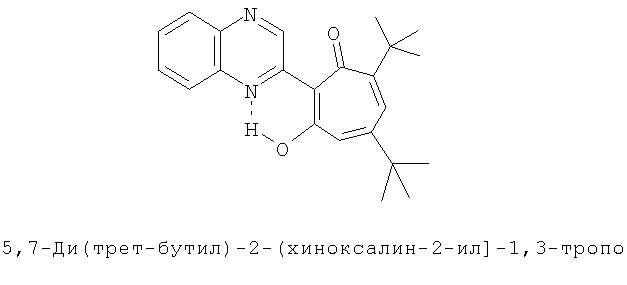
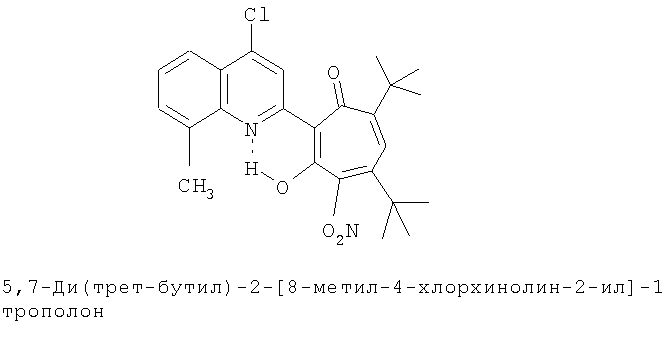
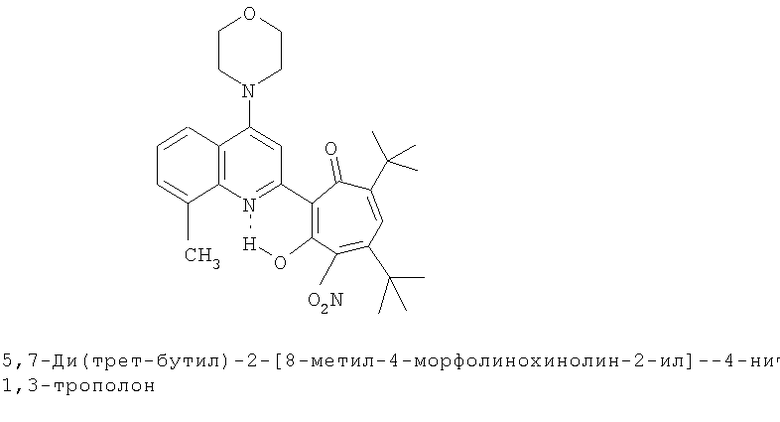
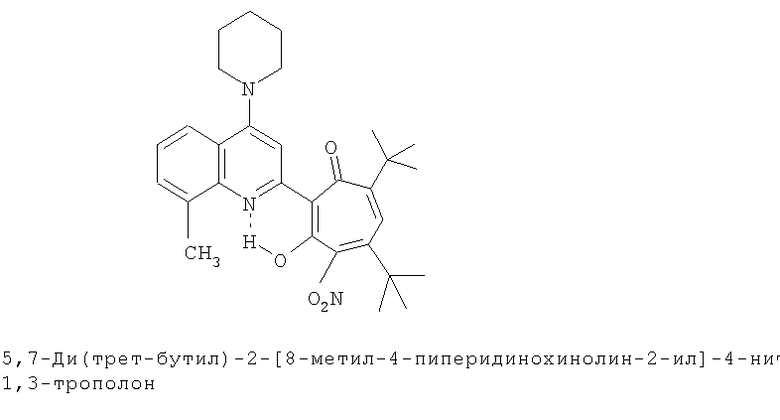
Испытание антимикробной активности.
5,7-ди(трет-бутил)-2-(хинолин-2-ил)-1,3-трополона (пример №4) и 5,7-ди(трет-бутил)-2-(7,8-диметил-4-морфолино-5-нитрохинолин-2-ил)-1,3-трополона (пример №17) исследовали на антимикробную активность.
Исследования проведены по методу двукратных серийных разведении (Г.Н.Першин, 1971, с.101) с использованием двух штаммов условно-патогенных культур (Escherichia coli, штамм 25922, Staphylococcus aureus, штамм 906), полученных из Государственного научно-исследовательского института стандартизации и контроля медицинских и биологических препаратов им. А.Н.Тарасевича. Для культивирования бактерий и использования бактерий использовали рыбно-пептонный агар и бульон (рН 7,2-7,4). Исходные разведения микробных тел готовили по оптическому стандарту из суточной агаровой культуры. Микробная нагрузка соответствовала 2,5×105 микробных тел в 1 мл. Химические соединения растворяли в диоксане. Микробную взвесь вносили в приготовленные разведения препарата в питательной среде. Результаты учитывали после 20-ти часового и 7-ми суточного термостатирования при 37°С. Противомикробную: бактериостатическую (МИК) и бактерицидную (МБК) активность оценивали по минимально действующей концентрации. Максимально испытанные концентрации новых соединений соответствовали 1000,0 мкг/мл.
1. Соединение 17 обнаружило как ингибирующее действие в отношении St. aureus в концентрации <1000,0...>500,0 мкг/мл, так и бактерицидное действие в концентрации 1000,0 мкг/мл.
2. Соединение 4 показало ингибирующее действие в отношении культуры St. aureus в концентрации 62,5 мкг/мл. Бактерицидного действия выявлено не было.
| название | год | авторы | номер документа |
|---|---|---|---|
| 5,7-Ди(трет-бутил)-2-(4,7-дихлор-8-метил-5-нитрохинолин-2-ил)-4-нитро-1,3-трополон, обладающий цитотоксической активностью | 2019 |
|
RU2702648C1 |
| ТРИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ БЕНЗОПИРАНА В КАЧЕСТВЕ ПРОТИВОАРИТМИЧЕСКИХ АГЕНТОВ | 2005 |
|
RU2380370C2 |
| СПОСОБ ПОЛУЧЕНИЯ ХЛОРИДОВ [1,4]СЕЛЕНАЗИНО [2,3,4-i,j] ХИНОЛИНИЯ | 2010 |
|
RU2446155C1 |
| ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ БЕНЗОПИРАНА ПРОТИВ АРИТМИИ | 2002 |
|
RU2291867C2 |
| С-2'-МЕТИЛИРОВАННЫЕ ПРОИЗВОДНЫЕ ПАКЛИТАКСЕЛА ДЛЯ ПРИМЕНЕНИЯ В КАЧЕСТВЕ ПРОТИВООПУХОЛЕВЫХ АГЕНТОВ | 2002 |
|
RU2287528C2 |
| СПОСОБ ПОДАВЛЕНИЯ РОСТА ОПУХОЛЕВЫХ КЛЕТОК, ОПОСРЕДОВАННОГО КИНАЗОЙ RAF, ГЕТЕРОЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ МОЧЕВИНЫ (ВАРИАНТЫ), ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ (ВАРИАНТЫ) | 1998 |
|
RU2232015C2 |
| КОНДЕНСИРОВАННЫЕ ПРОИЗВОДНЫЕ ИМИДАЗОЛА И ПИРАЗОЛА В КАЧЕСТВЕ МОДУЛЯТОРОВ АКТИВНОСТИ TNF | 2014 |
|
RU2686117C1 |
| БИСЧЕТВЕРТИЧНЫЕ СОЛИ АЛКАЛОИДА ХИННОГО ДЕРЕВА В КАЧЕСТВЕ АСИММЕТРИЧЕСКИХ МЕЖФАЗНЫХ КАТАЛИЗАТОРОВ | 2013 |
|
RU2667909C2 |
| ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ СОЕДИНЕНИЯ НА ОСНОВЕ КЕТОАМИДА | 2021 |
|
RU2819346C1 |
| ПРОИЗВОДНЫЕ ПИПЕРИДИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ | 1997 |
|
RU2193029C2 |
Изобретение относится к 2-гетарилзамещенным 1,3-трополонов общей формулы Ia,
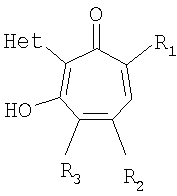 где R1 и R2=C1-С6 алкил, R3=водород, C1-С6 алкил, нитрогруппа, Het=шестичленный азотистый гетероцикл, конденсированный с одним или двумя бензольными кольцами, который может быть замещен заместителями, выбранными из группы, включающей галоид, нитрогруппу, C1-С6 алкил, окси C1-С6 алкил, вторичная аминогруппа, выбранная из анилино, замещенного анилино, гидроксиэтиламино, или третичная аминогруппа, выбранная из морфолино, пиперидино, пиперазино, 1H-1-имидазолила. Изобретение относится также к способу получения 2-гетарилзамещенных 1,3-трополона, который заключается в конденсации бензохинонов-1,2 с 2-метилгетероциклами при нагревании в присутствии уксусной кислоты в количестве, обеспечивающей ее роль как катализатора, так и растворителя. Изобретение относится также к фармацевтической композиции антимикробного действия на основе 2-гетарилзамещенных 1,3-трополона. 4 н. и 4 з.п. ф-лы, 1 табл.
где R1 и R2=C1-С6 алкил, R3=водород, C1-С6 алкил, нитрогруппа, Het=шестичленный азотистый гетероцикл, конденсированный с одним или двумя бензольными кольцами, который может быть замещен заместителями, выбранными из группы, включающей галоид, нитрогруппу, C1-С6 алкил, окси C1-С6 алкил, вторичная аминогруппа, выбранная из анилино, замещенного анилино, гидроксиэтиламино, или третичная аминогруппа, выбранная из морфолино, пиперидино, пиперазино, 1H-1-имидазолила. Изобретение относится также к способу получения 2-гетарилзамещенных 1,3-трополона, который заключается в конденсации бензохинонов-1,2 с 2-метилгетероциклами при нагревании в присутствии уксусной кислоты в количестве, обеспечивающей ее роль как катализатора, так и растворителя. Изобретение относится также к фармацевтической композиции антимикробного действия на основе 2-гетарилзамещенных 1,3-трополона. 4 н. и 4 з.п. ф-лы, 1 табл.
где R1 и R2=C1-С6 алкил, R3=водород, C1-С6 алкил, галоид, нитрогруппа, Het - шестичленный азотистый гетероцикл, конденсированный с одним или двумя бензольными кольцами, который может быть замещен заместителями, выбранными из группы, включающей галоид, нитрогруппу, C1-С6 алкил, окси C1-С6 алкил,
вторичная аминогруппа, выбранная из анилино, замещенного анилино, гидроксиэтиламино, или третичная аминогруппа, выбранная из морфолино, пиперидино, пиперазино, 1H-1-имидазолила,
за исключением соединений, где Het=2-(хинолин-2-ил)замещенные группы, общей формулы IIa
где R1 и R2=трет-бутил, R3=водород, Het=2-(хинолин-2-ил), где R4=хлор, R5 и R7=водород, R6 и R8=метил;
R1 и R2=трет-бутил, R3=водород, Het=2-(хинолин-2-ил), где R4=хлор, R5, R6 и R7=водород, R8=метил;
R1 и R2=трет-бутил, R3=водород, Het=2-(хинолин-2-ил), где R4=хлор, R5 и R6=водород, R7 и R8=метил;
R1 и R2=трет-бутил, R3=водород, Het=2-(хинолин-2-ил), где R4=хлор, R5=нитрогруппа, R6 и R7=водород, R8=метил;
R1 и R2=трет-бутил, R3=водород, Het=2-(хинолин-2-ил), где R4=хлор, R5=нитрогруппа, R6 и R8=метил, R7=водород;
R1 и R2=трет-бутил, R3=водород, Het=2-(хинолин-2-ил), где R4=хлор, R5=нитрогруппа, R6=водород, R7 и R8=метил;
R1 и R2=трет-бутил, R3=нитрогруппа, Het=2-(хинолин-2-ил), где R4=хлор, R5 и R7=водород, R6 и R8=метил;
R1 и R2=трет-бутил, R3=нитрогруппа, Het=2-(хинолин-2-ил), где R4=хлор, R5, R6 и R7=водород, R8=метил;
R1 и R2=трет-бутил, R3=нитрогруппа, Het=2-(хинолин-2-ил), где R4=хлор, R5 и R6=водород, R7 и R8=метил;
R1 и R2=трет-бутип, R3=нитрогруппа, Het=2-(хинолин-2-ил), где R4=хлор, R5=нитрогруппа, R6 и R7=водород, R8=метил;
R1 и R2=трет-бутил, R3=нитрогруппа, Het=2-(хинолин-2-ил), где R4=хлор, R5=нитрогруппа, R6 и R8=метил, R7=водород;
R1 и R2=трет-бутил, R3=нитрогруппа, Het=2-(хинолин-2-ил), где R4=хлор, R5=нитрогруппа, R6=водород, R7 и R8=метил.
где R4=водород, галоид, C1-С6 алкил, вторичная аминогруппа, выбранная из анилино, замещенного анилино, гидроксиэтиламино, или третичная аминогруппа, выбранная из морфолино, пиперидино, пиперазино, 1H-1-имидазолил, R5=водород, нитрогруппа, R6=водород, C1-С6 алкил, окси C1-С6 алкил, R7=водород, C1-С6 алкил, R8=водород, C1-С6 алкил, нитрогруппа, или R7 и R8 вместе с атомами углерода, к которым они присоединены образуют бензольное кольцо.
где R1 и R2=C1-С6 алкил, R3=водород, C1-С6 алкил, нитрогруппа, R4=вторичная аминогруппа, выбранная из анилино, замещенного анилино, гидроксиэтиламино, или третичная аминогруппа, выбранная из морфолино, пиперидино, пиперазино, 1H-1-имидазолил, R5=водород, нитрогруппа, R6=водород, C1-С6 алкил, окси C1-С6 алкил, R7=водород, C1-С6 алкил, R8=водород, C1-С6 алкил, нитрогруппа, или R7 и R8 вместе с атомами углерода, к которым они присоединены, образуют бензольное кольцо.
где R1 и R2=C1-С6 алкил, R3=водород, C1-С6 алкил, нитрогруппа, Het=шестичленный азотистый гетероцикл, конденсированный с одним или двумя бензольными кольцами, который может быть замещен заместителями, выбранными из группы, включающей галоид, нитрогруппу, C1-С6 алкил, окси C1-С6 алкил,
вторичная аминогруппа, выбранная из анилино, замещенного анилино, гидроксиэтиламино, или третичная аминогруппа, выбранная из морфолино, пиперидино, пиперазино, 1H-1-имидазолила,
за исключением соединений, где R3=нитрогруппа, а Het=2-(хинолин-2-ил)замещенные группы общей формулы IIб
где R4=вторичная аминогруппа, выбранная из анилино, замещенного анилино, гидроксиэтиламино, или третичная аминогруппа, выбранная из морфолино, пиперидино, пиперазино, 1H-1-имидазолила, R5=водород, нитрогруппа, R6=водород, C1-С6 алкил, окси C1-С6 алкил, R7=водород, C1-С6 алкил, R8=водород, C1-С6 алкил, нитрогруппа, или R7 и R8 вместе с атомами углерода, к которым они присоединены, образуют бензольное кольцо,
заключающийся в том, что о-хиноны общей формулы III
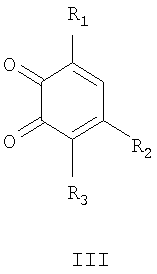
где R1, R2 и R3 имеют вышеприведенные значения, вводят во взаимодействие с 2-метилазотистыми гетероциклами общей формулы
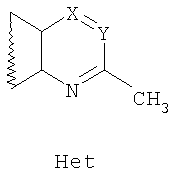
где Y=СН, N; Х=N, CR4, где R4=водород, галоид, C1-С6 алкил, вторичная группа, выбранная из анилино, замещенного анилино, гидроксиэтиламино, или третичная аминогруппа, выбранная из морфолино, пиперидино, пиперазино, 1H-1-имидазолила, в среде уксусной кислоты при нагревании.
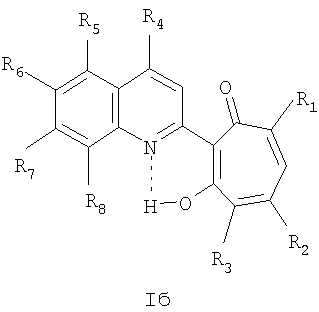
где R1 и R2=C1-С6 алкил, R3=водород, C1-С6 алкил, нитрогруппа, R4=вторичная аминогруппа, выбранная из анилино, замещенного анилино, гидроксиэтиламино, или третичная аминогруппа, выбранная из морфолино, пиперидино, пиперазино, 1H-1-имидазолила, R5=водород, нитрогруппа, R6=водород, C1-С6 алкил, окси C1-С6 алкил, R7=водород, C1-С6 алкил, R8=водород, C1-С6 алкил, нитрогруппа, или R7 и R8=R7 и R8 вместе с атомами углерода, к которым они присоединены образуют бензольное кольцо,
заключающийся в том, что о-хиноны общей формулы III

где R1, R2 и R3 имеют вышеприведенные значения,
вводят во взаимодействие с замещенными 2-метилхинолинами общей формулы IIв
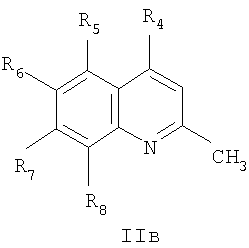
где R4=галоид, а остальные R имеют вышеприведенные значения, с выделением 2-(хинолин-2-ил)галоидзамещенных 1,3-трополона и последующего проведения нуклеофильного замещения галоида первичными аминами, выбранными из анилина, замещенного анилина, гидроксиэтиламина, или вторичными аминами, выбранными из морфолина, пиперидина, пиперазина, 1H-1-имидазола.

где R1 и R2=C1-С6 алкил, R3=водород, C1-С6 алкил, нитрогруппа, Het=шестичленный азотистый гетероцикл, конденсированный с одним или двумя бензольными кольцами, который может быть замещен заместителями, выбранными из группы, включающей галоид, нитрогруппу, C1-С6 алкил, окси C1-С6 алкил,
вторичная аминогруппа, выбранная из анилино, замещенного анилино, гидроксиэтиламино, или третичная аминогруппа, выбранная из морфолино, пиперидино, пиперазино, 1H-1-имидазолила.
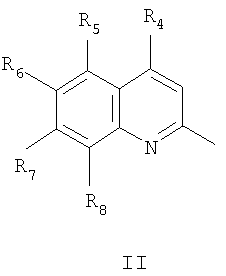
где R4=водород, галоид, C1-С6 алкил, вторичная аминогруппа, выбранная из анилино, замещенного анилино, гидроксиэтиламино, или третичная аминогруппа, выбранная из морфолино, пиперидино, пиперазино, 1H-1-имидазолил, R5=водород, нитрогруппа, R6=водород, C1-С6 алкил, окси C1-С6 алкил, R7=водород, C1-С6 алкил, R8=водород, C1-С6 алкил, нитрогруппа,
или R7 и R8 вместе с атомами углерода, к которым они присоединены образуют бензольное кольцо.
| САЯПИНА Ю.А | |||
| и др., Синтез и структура новых производных 2-(хинолин-2-ил)-1,3-трополона | |||
| ЖОргХ, 2005, т.41, вып.10, с.1571-1575 | |||
| US 6696467 В2, 24.02.2004 | |||
| УСТРОЙСТВО для ФОРМОВКИ СПИРАЛЬНОШОВНЫХТРУБ | 0 |
|
SU172710A1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ХЛОРМЕТИЛХИНОЛИНА | 1987 |
|
RU2012560C1 |
Авторы
Даты
2008-01-10—Публикация
2006-03-01—Подача