Область техники
Настоящее изобретение относится к новым синтетическим промежуточным соединениям для общего синтеза производных витамина D, более конкретно оно относится к промежуточным соединениям для синтеза производных 19-норвитамина D, у которых экзометиленовая группа, образующая двойную связь вне кольца А производных витамина D, заменена двумя атомами водорода.
Уровень техники
Что касается природных витаминов, обнаруживающих высокую биологически эффективную ценность, имеются витамины D2 (эргокальциферол) и D3 (холекальциферол), причем физиологическое действие этих производных витамина D в организме человека является одинаковым. Эти производные витамина D синтезируются в коже человека под действием ультрафиолетовых лучей и их структура изменяется в почках и печени с образованием активной формы производных витамина D, посредством чего достигается в первую очередь физиологическое действие. Активная форма витамина D является разновидностью гормона и механизм ее действия схож с механизмом стероидных гормонов. Так, он связывается с рецептором, существующим в ядре клетки, и регулирует транскрипцию специфических генов, за счет чего реализуется его активность.
Что касается 1α,25-дигидроксивитамина D3, который является активной формой витамина D, получены многие его структурные аналоги и уже испытана их активность. Некоторые из этих соединений проявляют значительный эффект, относящийся к дифференциации клеток и регулированию содержания кальция, и, следовательно, они, как известно, являются применимыми для лечения различных заболеваний, таких как почечная остеодистрофия, резистентные к витамину D рахиты, остеопороз, псориаз и рак.
Была получена новая группа аналогов витамина D, у которых экзометиленовая группа (С-19), специфичная для производных витамина D, заменена двумя атомами водорода, или производные 19-норвитамина D, такие как 1α,25-дигидрокси-19-норвитамин D3, и уже были проведены их биологические испытания. Было выяснено, что эти соединения демонстрируют профиль селективной активности и обладают очень слабой активностью по переносу кальция, обладая высокой эффективностью в отношении индукции клеточной дифференциации. Поэтому эти соединения предложено использовать в качестве агентов для лечения не только злокачественной опухоли, лейкемии, рака, рака толстой кишки, рака молочной железы и рака простаты, но также для лечения остеомаляции, сенильного остеопороза, постклимактерического остеопороза, индуцированного стероидами остеопороза, остеопороза вследствие низкого обновления костей, почечной остеодистрофии, псориаза, дисбаланса иммунной системы, рассеянного склероза, сахарного диабета, для реинфузии при трансплантации и для лечения различных кожных болезней (выложенная заявка на патент Японии № 05/186421, патент США № 5086191, WO 01/92221, WO 02/05823, WO 01/74765, WO 02/20021, WO 01/74766, WO 02/05824, WO 00/10548, WO 01/03704, WO/72292 и так далее).
Требуемые производные 19-норвитамина D получают взаимодействием кетона Виндауса Грудмана с фосфиноксидом в присутствии основания с последующим, если необходимо, удалением защитной группы. Здесь фосфиноксид синтезируют через много стадий с применением хинной кислоты в качестве исходного вещества (соединение формулы 1 в стадии реакции в выложенной заявке на патент Японии № 05/186421).
Недавно были также синтезированы соединения, у которых 2-положение 1α,25-дигидрокси-19-норвитамина D3 замещено гидроксильной группой или алкоксигруппой (патент США № 5536713).
Кроме того, опубликованы соединения 2-алкилиден-19-норвитамина D, в особенности, соединения 2-метилен-19-норвитамина D, имеющие алкилиденовую группу (в особенности, метиленовую группу) в 2-положении, где экзоалкилиденовая группа кольца А 1α,25-дигидроксивитамина D3 перемещается от углерода 10 (С-10) к углероду (С-2), так как относительно небольшая алкилиденовая (особенно, метиленовая) группа у С-2 не ингибирует рецептор витамина D (выложенная заявка на патент Японии № 2001/504135). Это соединение можно также синтезировать взаимодействием кетона Виндауса Грудмана с фосфиноксидом, имеющим метиленовую группу у С-2, в присутствии основания с последующим, если необходимо, удалением защитной группы. Здесь фосфиноксид, имеющий метиленовую группу у С-2, можно также синтезировать через много стадий с применением хинной кислоты в качестве исходного вещества (схема I выложенной заявки на патент Японии № 2001/504135).
Однако в указанном выше способе применяют хинную кислоту, которая является дорогой, и поэтому стоимость синтезированного производного витамина D также становится высокой. Следовательно, существует потребность в синтезе производных витамина D из менее дорогих веществ.
Сущность изобретения
Авторы настоящего изобретения провели интенсивные исследования для разрешения таких проблем и обнаружили возможность получения фосфиноксида с применением карвона, такого как (R)-(-)-карвон, вместо хинной кислоты в качестве исходного материала, после чего было создано настоящее изобретение. В соответствии с настоящим изобретением теперь можно синтезировать требуемые производные витамина D из карвона, который является менее дорогим сырьем.
Таким образом, настоящее изобретение относится к соединению, представленному нижеследующей формулой (I):

где Y1 и Y2 могут быть одинаковыми или разными и каждый представляет собой атом водорода или защитную группу для гидроксильной группы; Y3 представляет собой атом водорода или защитную группу для гидроксильной группы, где группа Y3O- имеет либо R-конфигурацию, либо S-конфигурацию; R1 и R2 могут быть одинаковыми или разными и каждый представляет собой группу, выбранную из группы, состоящей из атома водорода, атома тяжелого водорода, атома фтора, гидроксильной группы, защищенной гидроксильной группы, алкильной группы, арильной группы, алкоксигруппы, гидроксиалкоксигруппы, фторалкоксигруппы, арилалкоксигруппы, арилоксигруппы, аминогруппы и -NR3R4 (в которой R3 и R4 могут быть одинаковыми или разными и каждый выбран из группы, состоящей из атома водорода, алкильной группы, арильной группы, гидроксиалкильной группы, фторалкильной группы и ацильной группы), или R1 и R2 могут быть связаны вместе с образованием алкеновой структуры =СВ1В2 или иминовой структуры =NB3; B1 и В2 могут быть одинаковыми или разными и их стерическая конфигурация может быть либо Е-конфигурацией, либо Z-конфигурацией; каждая из В1, В2 и В3 представляет собой группу, выбранную из группы, состоящей из атома водорода, атома тяжелого водорода, атома фтора, гидроксильной группы, защищенной гидроксильной группы, алкильной группы, арильной группы, алкоксигруппы, гидроксиалкоксигруппы, фторалкоксигруппы, арилалкоксигруппы и арилоксигруппы, или В1 и В2 могут быть связаны вместе с образованием группы -(СН2)х- (где х равен целому числу 2-5), и каждый из R1 и R2 может иметь либо R-конфигурацию, либо S-конфигурацию.
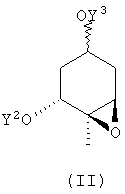
Настоящее изобретение относится также к соединению, представленному следующей формулой (II), используемому в качестве промежуточного соединения для синтеза соединения, представленного указанной выше формулой (I):

где Y2 и Y3 могут быть одинаковыми или разными и каждый представляет собой атом водорода или защитную группу гидроксильной группы и группа Y3O- может иметь либо R-конфигурацию, либо S-конфигурацию.
Краткое описание чертежей
Чертеж представляет собой схему синтеза производного 2-метилен-19-норвитамина D (2-МР) из карвона через соединение настоящего изобретения.
Подробное описание изобретения
Примерами карвона, который является исходным веществом для получения соединений настоящего изобретения, являются (R)-(-)-карвон и (S)-(+)-карвон. Стадия получения (1S-(1α,2α,4α,6α))-1-метил-4-(1-метилэтенил)-7-оксабицикло[4,1,0]гептан-2-ола (соединение 3), который является предшественником получения соединений настоящего изобретения из указанных карвонов, является уже известной (сравните с чертежом). Эта стадия упоминается, например, в Synthetic Communication, 10(8), 1980, 623 и Journal of Organic Chemistry, 63(20), 1988, 6984.
В соединении, представленном формулой (I), примерами защитной группы для гидроксильной группы являются силильная группа, такая как третбутилдиметилсилил, триметилсилил, трифенилсилил, триэтилсилил и третбутилдифенилсилил; замещенная алкильная группа, такая как метоксиметил, этоксиметил и метоксиэтоксиметил; аралкильная группа, такая как бензил и п-метоксифенилметил; ацильная группа, такая как ацетильная группа и бензоильная группа; алкильная группа, такая как метильная группа, этильная группа, пропильная группа, изопропильная группа и бутильная группа; тетрагидро-2-пиранильная группа и тетрагидрофуранильная группа.
Что касается соединения, представленного формулой (I), конкретными примерами являются следующие соединения.
В первую очередь, предлагается соединение, у которого Y1 и Y2 представляют собой защитную группу для гидроксильной группы, Y3 представляет собой атом водорода, группа Y3O- имеет R-конфигурацию или S-конфигурацию, и R1 и R2 связаны вместе с образованием метиленовой группы в формуле (I). Более конкретно, предлагается соединение, у которого Y1 и Y2 представляют собой третбутилдиметилсилильную группу, Y3 представляет собой атом водорода, и R1 и R2 связаны вместе с образованием метиленовой группы или (3R,5R)-3,5-бис[(третбутилдиметилсилил)окси]-4-метиленциклогексанол (соединение 9), соединение, у которого Y1 и Y2 представляют собой третбутилдиметилсилильную группу, Y3 представляет собой атом водорода, и каждый из R1 и R2 представляет собой атом водорода или (3R,5R)-3,5-бис[(третбутилдиметилсилил)окси]циклогексанол и тому подобное.
Предлагаются также соединения, у которых Y1 и Y2 представляют собой защитную группу для гидроксильной группы, Y3 также представляет собой защитную группу для гидроксильной группы, где Y3O- имеет R-конфигурацию или S-конфигурацию, и R1 и R2 связаны вместе с образованием метиленовой группы. Более конкретно, имеется соединение, у которого Y1 и Y2 представляют собой третбутилдиметилсилильную группу, Y3 представляет собой тетрагидро-2-пиранильную группу, и R1 и R2 связаны вместе с образованием метиленовой группы или (3R,5R)-3,5-бис[(третбутилдиметилсилил)окси]-4-метилен-1-(тетрагидро-2-пиранилокси)циклогексан (соединение 8), и соединение, у которого Y1 и Y2 представляют собой третбутилдиметилсилильную группу, Y3 представляет собой тетрагидро-2-пиранильную группу, и каждый из R1 и R2 представляет собой атом водорода или (3R,5R)-3,5-бис[(третбутилдиметилсилил)окси]-1-(тетрагидро-2-пиранилокси)циклогексан.
Предлагаются также соединения, у которых Y1 представляет собой атом водорода, Y2 и Y3 представляют собой защитную группу для гидроксильной группы, где группа Y3O- имеет R-конфигурацию или S-конфигурацию, и R1 и R2 связаны вместе с образованием метиленовой группы. Более конкретно, предлагается соединение, у которого Y1 представляет собой атом водорода, Y2 представляет собой третбутилдиметилсилильную группу, Y3 представляет собой тетрагидро-2-пиранильную группу, где Y3O- имеет R-конфигурацию, и R1 и R2 связаны вместе с образованием метиленовой группы или (1R-(1β,3α,5α))-3-[(третбутилдиметилсилил)окси]-2-метилен-5-(тетрагидро-2-пиранилокси)циклогексанол (соединение 7), и соединение, у которого Y3 представляет собой тетрагидро-2-пиранильную группу, где Y3O- имеет R-конфигурацию, и R1 и R2 представляют собой атом водорода или (1R-(1β,3α,5α))-3-[(третбутилдиметилсилил)окси]-5-(тетрагидро-2-пиранилокси)циклогексанол.
В соединении, представленном формулой (II) и используемом в качестве промежуточного соединения для синтеза соединения, представленного формулой (I), защитная группа для гидроксильной группы является такой же, как защитная группа для гидроксильной группы в соединении, представленном указанной выше формулой (I). Что касается таких соединений, предлагаются (1) соединение, у которого Y2 и Y3 представляют собой защитную группу для гидроксильной группы, где Y3O- имеет R-конфигурацию или S-конфигурацию, или, более конкретно, соединение, у которого Y2 представляет собой третбутилдиметилсилильную группу, и Y3 представляет собой тетрагидро-2-пиранильную группу, где группа Y3O- имеет R-конфигурацию или (1R-(1α,2α,4α,6α))-2-[(третбутилдиметилсилил)окси]-1-метил-4-(тетрагидро-2-пиранилокси)-7-оксабицикло[4.1.0]гептан (соединение 6), (2) соединение, у которого Y2 представляет собой защитную группу для гидроксигруппы, Y3 представляет собой атом водорода, где Y3O- имеет R-конфигурацию, или, более конкретно, соединение, у которого Y2 представляет собой третбутилдиметилсилильную группу, и Y3 представляет собой атом водорода, где группа Y3O- имеет R-конфигурацию или (1R-(1α,2α,4α,6α))-2-[(третбутилдиметилсилил)окси]-1-метил-7-оксабицикло[4.1.0]гептан-4-ол (соединение 5), и (3) соединение, у которого Y2 и Y3 представляют собой атом водорода и тому подобное.
В соединении, представленном формулой (III) и используемом в качестве промежуточного соединения для синтеза указанного выше соединения, представленного формулой (I), защитная группа для гидроксильной группы является такой же, как защитная группа для гидроксильной группы в указанном выше соединении, представленном формулой (I). Что касается таких соединений, предлагается соединение, у которого Y2 представляет собой защитную группу для гидроксильной группы, Y4 представляет собой 1-метилэтенильную группу, и Y4 имеет R-конфигурацию или S-конфигурацию, или, более конкретно, соединение, у которого Y2 представляет собой третбутилдиметилсилильную группу, и Y4 имеет R-конфигурацию или (1R-(1α,2α,4α,6α))-2-[(третбутилдиметилсилил)окси]-1-метил-4-(1-метилэтенил)-7-оксабицикло[4.1.0]гептан (соединение 4) и тому подобное.
Общая схема примера синтеза производного витамина D (2-МР) из карвона, такого как (R)-(-)-карвон, через получение синтетического промежуточного соединения настоящего изобретения показана на чертеже. На чертеже каждая цифра (целое число) является обозначением для каждого из соединений. Другие аббревиатуры обозначают следующие соединения или группы. Так, TBDMSCl обозначает третбутилдиметилхлорсилан; TBDMSO обозначает третбутилдиметилсилилоксигруппу; DMAP обозначает N,N'-диметил-4-аминопиридин; DHP обозначает 3,4-дигидро-2Н-пиран; TsOH обозначает тозилсульфоновую кислоту; ТНРО обозначает тетрагидро-2-пиранилоксигруппу; PPTS обозначает п-толуолсульфонат пиридиния; LDA обозначает диизопропиламид лития; DIBALH обозначает гидрид диизобутилалюминия; AG50W-X2 обозначает ионообменную смолу, изготовленную Bio-Rad Laboratories Inc.; и 2-МР обозначает 1α-гидрокси-2-метилен-19-нор-17-изопропилкальциферол. На чертеже показан пример получения производных витамина D, и настоящее изобретение не ограничивается синтетическим путем, показанным на чертеже.
Способ получения (1S-(1α,2α,4α,6α))-1-метил-4-(1-метилэтенил)-7-оксабицикло[4.1.0]гептан-2-ола (соединение 3) из (R)-(-)-карвона (соединение 1) уже известен и описан, например, в Synthetic Communication, 10(8), 1980, 623 и Journal of Organic Chemistry, 63(20), 1988, 6984. На чертеже показан пример способа получения (1S-(1α,2α,4α,6α))-1-метил-4-(1-метилэтенил)-7-оксабицикло[4.1.0]гептан-2-ола (соединение 3) из (R)-(-)-карвона (соединение 1) через образование (1R-(1α,4α,6α))-1-метил-4-(1-метилэтенил)-7-оксабицикло[4.1.0]гептан-2-она (соединение 2).
В соответствии с чертежом (R)-(-)-карвон (соединение 1) растворяют в растворителе, таком как метанол, к раствору добавляют пероксид водорода, реакцию проводят путем дополнительного добавления гидроксида натрия при охлаждении льдом и образуется эпоксидное кольцо из двойной связи кольца циклогексена, при этом получают (1R-(1α,4α,6α))-1-метил-4-(1-метилэтенил)-7-оксабицикло[4.1.0]гептан-2-он (соединение 2).
После этого указанное выше соединение 2 растворяют в полярном растворителе, таком как метанол, к раствору добавляют катализатор, такой как гептагидрат хлорида церия(III), и взаимодействие проводят добавлением восстанавливающего агента, такого как боргидрид натрия, при охлаждении льдом таким образом, чтобы карбонильная группа в 2-положении превратилась в гидроксильную группу и чтобы получить (1S-(1α,2α,4α,6α))-1-метил-4-(1-метилэтенил)-7-оксабицикло[4.1.0]гептан-2-ол (соединение 3).
Указанное выше соединение 3 далее растворяют в растворителе, таком как ДМФА, к раствору добавляют основание, такое как имидазол, и взаимодействие проводят добавлением третбутилдиметилсилилирующего агента, такого как третбутилдиметилхлорсилан, при охлаждении льдом таким образом, чтобы гидроксильная группа в 2-положении была защищена в виде третбутилдиметилсилилоксигруппы и чтобы получить (1R-(1α,2α,4α,6α))-2-[(третбутилдиметилсилил)окси]-1-метил-4-(1-метилэтенил)-7-оксабицикло[4.1.0]гептан (соединение 4). Указанное соединение относится к типу соединений, представленных формулой (III). Его химическая формула показана ниже

После этого указанное выше соединение 4 растворяют в растворителе, таком как метанол и метиленхлорид, затем при -65°С в раствор, например, вводят газообразный озон с последующей заменой его газообразным азотом и взаимодействие проводят добавлением уксусного ангидрида в присутствии основания, такого как триэтиламин, и катализатора, такого как N,N'-диметил-4-аминопиридин, так, чтобы 1-метилэтенильная группа в 4-положении замещалась на гидроксильную группу через ацетоксигруппу и был получен (1R-(1α,2α,4α,6α))-2-[(третбутилдиметилсилил)окси]-1-метил-7-оксабицикло[4.1.0]гептан-4-ол (соединение 5). Указанное соединение относится к типу соединений, представленных формулой (II). Его химическая формула показана ниже

Затем указанное выше соединение 5 растворяют в растворителе, таком как метиленхлорид, и взаимодействие проводят добавлением кислотного катализатора, такого как п-толуолсульфоновая кислота, и 3,4-дигидро-2Н-пирана (DHP) так, чтобы гидроксильную группу в 4-положении защитить в виде тетрагидро-2-пиранилоксигруппы и получить (1R-(1α,2α,4α,6α))-2-[(третбутилдиметилсилил)окси]-1-метил-4-(тетрагидро-2-пиранилокси)-7-оксабицикло[4.1.0]гептан (соединение 6). Здесь можно также применять другое соединение, которое образует защитную группу для гидроксильной группы, такое как ацетилхлорид, метоксиметилхлорид или бензоилхлорид, вместо 3,4-дигидро-2Н-пирана (DHP) для защиты гидроксильной группы в 4-положении. Образовавшееся соединение относится к типу соединений, представленных формулой (II). Его химическая формула показана ниже

После этого указанное выше соединение 6 растворяют в растворителе, таком как толуол, и взаимодействие проводят добавлением изопропилата алюминия так, чтобы произошел разрыв 7-оксабицикло[4.1.0]кольца и образовалась гидроксильная группа и экзометиленовая группа в 1-положении и 2-положении, соответственно, вследствие чего был получен (1R-(1β,3α,5α))-2-[(третбутилдиметилсилил)окси]-2-метилен-5-(тетрагидро-2-пиранилокси)циклогексанол (соединение 7). Здесь можно также применять алкоголят алюминия, такой как третбутилат алюминия, вместо изопропилата алюминия. Указанное соединение относится к типу соединений, представленных формулой (I). Его химическая формула показана ниже

Указанное выше соединение 7 далее растворяют в растворителе, таком как ДМФА, к раствору добавляют основание, такое как имидазол, и взаимодействие проводят при охлаждении льдом добавлением силилирующего агента, такого как третбутилдиметилхлорсилан, так, чтобы защитить гидроксильную группу в 1-положении в виде третбутилдиметилсилилоксигруппы и получить (3R,5R)-3,5-бис[(третбутилдиметилсилил)окси]-2-метилен-1-(тетрагидро-2-пиранилокси)циклогексан (соединение 8). Указанное соединение относится к типу соединений, представленных формулой (I). Его химическая формула показана ниже

После этого указанное выше соединение 8 растворяют в растворителе, таком как метанол, к раствору добавляют кислотный катализатор, такой как п-толуолсульфонат пиридиния (PPTS), и проводят взаимодействие, например, при нагревании на водяной бане до 50-55°С, так, чтобы тетрагидро-2-пиранилоксигруппа в 1-положении освободилась от защитной группы для превращения в гидроксильную группу и в результате этого был получен (3R,5R)-3,5-бис[(третбутилдиметилсилил)окси]-4-метиленциклогексанол (соединение 9). Указанное соединение относится к типу соединений, представленных формулой (I). Его химическая формула показана ниже

Синтетический пример получения производного витамина D, которое является конечным продуктом синтеза из указанного выше соединения 9, можно проводить известным способом. Примеры известного способа являются способами, которые описаны, например, в формулах I и II стадии реакции в выложенной заявке на патент Японии № 05/186421 и в схеме II в выложенной заявке на патент Японии № 2001/504135.
Получение 1α-гидрокси-2-метилен-19-нор-17-изопропилкальциферола (соединение 15, 2-МР) из (3R,5R)-3,5-бис[(третбутилдиметилсилил)окси]-4-метиленциклогексанола (соединение 9) можно проводить известным обычным способом.
Например, раствор (3R,5R)-3,5-бис[(третбутилдиметилсилил)окси]-4-метиленциклогексанола (соединения 9) в толуоле подвергают взаимодействию с изопропилатом алюминия и циклогексаноном с получением (3R,5R)-3,5-бис[(третбутилдиметилсилил)окси]-4-метиленциклогексанона (соединения 10).
После этого при перемешивании в потоке аргона при -78°С н-BuLi (н-бутиллитий) добавляют к раствору диизопропиламина в безводном ТГФ и затем к раствору добавляют метил(триметилсилил)ацетат с последующим взаимодействием смеси с указанным выше карбонильным соединением (соединение 10), получая при этом метил-[(3'R,5'R)-3',5'-бис[(третбутилдиметилсилил)окси]-4'-метиленциклогексилиден]ацетат (соединение 11).
Затем к перемешиваемому раствору указанного выше сложного метилового эфира (соединение 11) в смеси толуол/метиленхлорид при -78°С в потоке аргона добавляют диизобутилалюминийгидрид и смесь перемешивают при -78°С в течение 1 часа и при -46°С в течение 25 минут, получая при этом 2-[(3'R,5'R)-3',5'-бис[(третбутилдиметилсилил)окси]-4'-метиленциклогексилиден]этанол (соединение 12).
После этого к указанному выше производному аллилового спирта (соединение 12) в безводном ТГФ добавляют н-BuLi (н-бутиллитий) в потоке аргона при 0°С и затем к смеси добавляют тозилхлорид/безводный ТГФ. К раствору реакции добавляют смесь, полученную добавлением н-BuLi к смеси дифенилфосфин/безводный ТГФ в потоке аргона при 0°С до завершения взаимодействия. Растворитель выпаривают, остаток растворяют в метиленхлориде и к раствору при 0°С добавляют пероксид водорода, получая при этом оксид {2-(3'R,5'R)-3',5'-бис[(третбутилдиметилсилил)окси-4'-метиленциклогексилиден]этил}дифенилфосфина (соединения 13).
Затем к раствору указанного выше производного фосфиноксида (соединение 13) в безводном ТГФ в потоке аргона при перемешивании добавляют н-BuLi и смесь охлаждают при -78°С и подвергают сочетанию Виттинг-Хорнера с кетоном Грудмана, который предварительно сохраняют при -78°С, получая при этом витамин D (соединение 14), у которого гидроксильные группы в 1- и 3-положениях защищены третбутилдиметилсилильной группой.
Что касается кетона Грудмана, применимым является соединение, представленное нижеследующей формулой (IV). Когда группа R в 1-положении данного соединения модифицирована, можно получить различные типы производных витамина D

где R представляет собой любую из репрезентативных боковых цепей, которые известны для соединений типа витамина D. Более конкретно, R представляет собой линейный, разветвленный или циклический и насыщенный или ненасыщенный углеводородный радикал, имеющий 1-35 атомов углерода, и может быть углеводородным радикалом, который может содержать один или несколько дополнительных заместителей, таких как гидроксильная группа, защищенная гидроксильная группа, атом фтора, карбонильная группа, сложноэфирная группа, эпоксигруппа, аминогруппа или другая группа гетероатома. Предпочтительная боковая цепь этого типа представлена следующей структурой
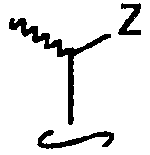
где стереохимический центр (соответствующий С-20 в стероидной нумерации) может иметь R- или S-конфигурацию (которая является либо природной конфигурацией вокруг углерода 20 либо 20-эпи-конфигурацией); Z выбран из Y, -OY, -CH2OY, -C≡CY и -СН=CHY, где двойная связь может иметь цис- или транс-геометрию; Y выбран из атома водорода, метильной группы, -COR7 и следующей радикальной структуры

в которой каждый из m и n независимо равен целому числу от 0 до 5; R3 выбран из атома водорода, атома тяжелого водорода, гидроксильной группы, защищенной гидроксильной группы, атома фтора, трифторметильной группы и С1-5алкильной группы, которая может быть линейной или разветвленной и может иметь гидроксильную или защищенную гидроксильную группу; каждый из R4, R5 и R6 независимо выбран из атома тяжелого водорода, дейтероалкильной группы, атома водорода, атома фтора, трифторметильной группы и С1-5алкильной группы, которая может быть линейной или разветвленной и может иметь гидроксильную или защищенную гидроксильную группу; R3 и R4 могут быть связаны вместе с образованием оксогруппы, алкилиденовой группы, группы =CR4R5 или группы -(СН2)р- (где р равно целому числу от 2 до 5); R5 и R6 могут быть связаны вместе с образованием оксогруппы или группы -(СН2)q- (где q равно целому числу от 2 до 5); R7 представляет собой атом водорода, гидроксильную группу, защищенную гидроксильную группу или С1-5алкильную группу, где любая из групп -СН в положении 20, 22 или 23 в боковой цепи может быть замещена атомом азота и любая из групп -СН(СН3)-, -СН(R5)- и -СН(R4)- в положениях 20, 22 и 23 может быть замещена атомом кислорода или серы.
Волнистая линия к метильной группе С-20 означает, что атом углерода 20 может иметь любую из R- и S-конфигураций.
Важными конкретными примерами боковой цепи, имеющей природную 20R-конфигурацию, являются структуры, представленные следующими формулами (а), (b), (c), (d) и (е) (т.е. боковая цепь, которая имеется у 25-гидроксивитамина D3 (а), витамина D3 (b), 25-гидроксивитамина D2 (c), витамина D2 (d) и С-24-эпимера 25-гидроксивитамина D2 (е)).

После этого защитную группу удаляют у указанного выше, защищенного соединения витамина (соединение 14), получая при этом 1α-гидрокси-2-метилен-19-нор-17-изопропилкальциферол (соединение 15; 2-МР).
Вместо способа получения соединений 4-9 настоящего изобретения из (R)-(-)-карвона через образование указанных выше соединений 2 и 3 соединение настоящего изобретения можно также получить аналогичным образом из (S)-(+)-карвона. Можно далее получить соединения, имеющие другой заместитель, превращением метиленовой группы в 4-положении (3R,5R)-3,5-бис[(третбутилдиметилсилил)окси]-4-метилен-1-(тетрагидро-2-пиранилокси)циклогексана (соединения 8) в карбонильную группу (соединение 16). Например, можно получить различные соединения превращением указанной выше карбонильной группы в алкильную группу (2) через алкилиденовую группу (1), в аминогруппу (4) через оксим иминогруппы (3) или в гидроксильную группу (5) (ссылка на хим. 17). В формулах каждый из R8, R9, R10, R11 и R12 может быть любым из атома водорода, атома тяжелого водорода, атома фтора, гидроксильной группы, защищенной гидроксильной группы, алкильной группы, арильной группы, алкоксигруппы, гидроксиалкоксигруппы, фторалкоксигруппы, арилалкоксигруппы, арилоксигруппы и так далее.
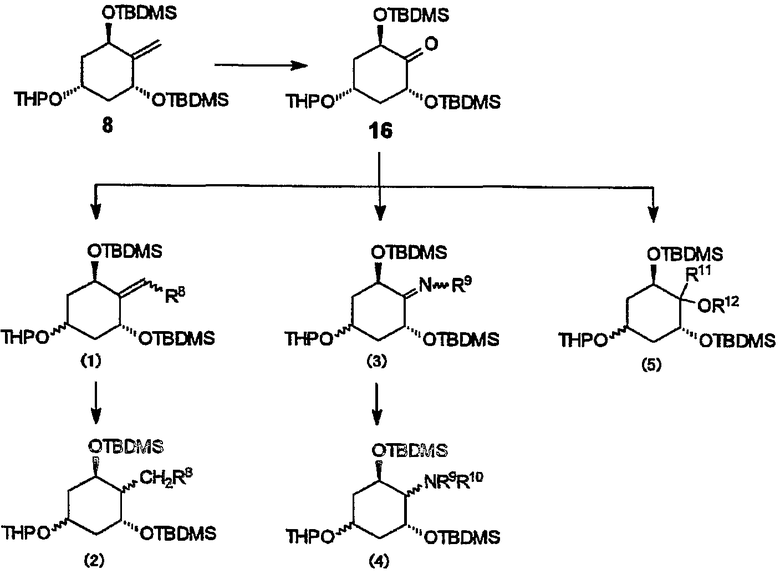
Можно далее получить производные 19-норвитамина D, имеющие различные заместители, такие как метиленовая группа или этилиденовая группа в 2-положении, из этих соединений (вышеуказанных соединений (1)-(5)) по известному способу (такому как способ, описанный в формулах I и II стадии реакции в выложенной заявке на патент Японии № 05/186421 и схеме II в выложенной заявке на патент Японии № 2001/504135).
Примеры
Настоящее изобретение теперь будет иллюстрировано подробно посредством ссылочных примеров и примеров, хотя настоящее изобретение не ограничивается этими ссылочными примерами и примерами.
Ссылочный пример 1
Получение (1R-(1α,4α,6α))-1-метил-4-(1-метилэтенил)-7-оксабицикло[4.1.0]гептан-2-ола (соединение 2)
(R)-(-)-карвон (соединение 1) (60 г, 0,40 моль) растворяют в 390 мл метанола, к раствору добавляют 30% раствор пероксида водорода (133 г, 1,17 моль), к смеси по каплям добавляют 6 М NaOH (32,7 г) при охлаждении льдом и смесь перемешивают при такой же температуре в течение 3 часов. К раствору реакции добавляют воду (1,170 мл), смесь экстрагируют третбутилметиловым эфиром (500 мл) два раза, экстракт промывают водой и насыщенным раствором соли, сушат над Na2SO4 и растворитель выпаривают в вакууме, получая при этом указанное в заголовке соединение (соединение 2) (62,5 г, выход 98%) в виде бесцветного маслянистого продукта. Данные его ЯМР показаны ниже.
1H-ЯМР (CDCl3) 4,77 (1H, шир.с), 4,70 (1H, шир.с), 3,43 (1H, дд, J=1,1, J=3,1), 2,70 (1H, м), 2,57 (1H, дд, J=6,1, J=17,6), 2,36 (1H, м), 2,01 (1H, дд, J=11,6, J=17,6), 1,89 (1H, м), 1,70 (3H, с), 1,40 (3H, с).
Ссылочный пример 2
Получение (1S-(1α,2α,4α,6α))-1-метил-4-(1-метилэтенил)-7-оксабицикло[4.1.0]гептан-2-ола (соединение 3)
Указанное выше соединение 2 (50,0 г, 0,30 моль) растворяют в метаноле (750 мл), к раствору добавляют гептагидрат хлорида цезия(III) (56,0 г, 0,15 моль), к смеси при охлаждении льдом постепенно добавляют боргидрид натрия (11,4 г, 0,30 моль) и смесь перемешивают при такой же температуре в течение 1 часа. К смеси добавляют воду (650 мл), смесь экстрагируют метиленхлоридом (1200 мл, 650 мл и 650 мл), экстракт промывают водой и сушат над Na2SO4 и растворитель выпаривают в вакууме, получая при этом указанное в заголовке соединение (соединение 3) (49,9 г, выход 99%) в виде бесцветного маслянистого продукта. Данные его ЯМР показаны ниже.
1H-ЯМР (CDCl3) 4,71 (2H, м), 3,89 (1H, м), 3,13 (1H, м), 2,15 (2H, м), 1,96 (1H, м), 1,71 (3H, с), 1,66 (1H, м), 1,39 (3H, с), 1,19 (1H, м).
Пример 1
Получение (1R-(1α,2α,4α,6α))-2-[(третбутилдиметилсилил)окси]-1-метил-4-(1-метилэтенил)-7-оксабицикло[4.1.0]гептана (соединения 4)
Указанное выше соединение 3 (49,5 г, 0,294 моль) растворяют в ДМФА (500 мл), к раствору добавляют имидазол (24,0 г, 0,353 моль), к смеси при охлаждении льдом добавляют третбутилдиметилхлорсилан (53,2 г, 0,353 моль) и смесь перемешивают при комнатной температуре в течение 15 часов. К продукту реакции добавляют воду (1500 мл), смесь экстрагируют этилацетатом (1500 мл), экстракт промывают водой и сушат над Na2SO4 и растворитель выпаривают в вакууме, получая при этом указанное в заголовке соединение (соединение 4) (84 г, количественный выход) в виде бесцветного маслянистого продукта. Данные его ЯМР показаны ниже.
1H-ЯМР (CDCl3) 4,69 (2H, м), 3,84 (1H, дд, J=6,3, J=10,3), 3,10 (1H, с), 2,11 (2H, м), 1,80 (1H, м), 1,69 (3H, с), 1,63 (1H, м), 1,32 (3H, с), 1,16 (1H, м), 0,91 (9H, с), 0,10 (3H, с), 0,07 (3H, с).
Пример 2
Получение (1R-(1α,2α,4α,6α))-2-[(третбутилдиметилсилил)окси]-1-метил-7-оксабицикло[4.1.0]гептан-4-ола (соединения 5)
Указанное выше соединение 4 (65 г, 0,23 моль) растворяют в метаноле (260 мл) и метиленхлориде (1300 мл) и в раствор при -65°С вводят газообразный озон до тех пор, пока цвет реакционного раствора не станет синим. В раствор вводят газообразный азот для удаления избыточного озона, затем к нему последовательно добавляют триэтиламин (140 г, 1,38 моль), N,N-диметил-4-аминопиридин (3,3 г, 0,023 моль) и уксусный ангидрид (117 г, 1,15 моль) и температуру смеси повышают до комнатной температуры и смесь перемешивают при 40°С в течение 9 часов. После охлаждения продукт реакции выливают в ледяную воду (1500 мл), органический слой промывают водой и сушат над Na2SO4, растворитель выпаривают в вакууме и остаток подвергают хроматографии на силикагеле (н-гексан/этилацетат = 5:1), получая при этом указанное в заголовке соединение (соединение 5) (35 г, выход 57%) в виде бесцветного маслянистого продукта. Данные его ЯМР показаны ниже.
1H-ЯМР (CDCl3) 4,16 (1H, т, J=3,4), 4,05 (1H, д, J=8,2), 3,82 (1H, м), 3,05 (1H, д, J=4,2), 2,11 (2H, м), 1,78 (2H, м), 1, 37 (3H, с), 0,91 (9H, с), 0,15 (3H, с), 0,13 (3H, с).
Пример 3
Синтез (1R-(1α,2α,4α,6α))-2-[(третбутилдиметилсилил)окси]-1-метил-4-(тетрагидро-2-пиранилокси)-7-оксабицикло[4.1.0]гептана (соединения 6)
Указанное выше соединение 5 (24,0 г, 0,093 моль) растворяют в метиленхлориде (200 мл), затем к раствору добавляют п-толуолсульфоновую кислоту (10 мг) и 3,4-дигидро-2Н-пиран (8,6 г, 0,102 моль) и смесь перемешивают при комнатной температуре в течение 20 часов. Продукт реакции промывают насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли и сушат над Na2SO4 и растворитель выпаривают в вакууме. Остаток подвергают колоночной хроматографии на силикагеле (н-гексан/этилацетат = 9:1), получая при этом указанное в заголовке соединение (соединение 6) (25,3 г, выход 79%) в виде бесцветного маслянистого продукта. Данные его ЯМР показаны ниже.
1H-ЯМР (CDCl3) 4,62 (1H, м), 3,88 (2H, м), 3,74 (1H, м), 3,47 (1H, м), 3,10 (1H, т, J=1,3), 2,48 (1H, м), 2,10 (1H, м), 1,82-1,23 (8H, м), 1,30 (3H, c), 0,90 (9H, c), 0,09 (3H, c), 0,07 (3H, c).
Пример 4
Получение (1R-(1β,3α,5α))-3-[(третбутилдиметилсилил)окси]-2-метилен-5-(тетрагидро-2-пиранилокси)циклогексанола (соединения 7)
Указанное выше соединение 6 (25,0 г, 0,073 моль) растворяют в толуоле (300 мл), к раствору добавляют изопропилат алюминия (29,8 г, 0,146 моль) и смесь нагревают для кипячения с обратным холодильником в течение 19 часов. После охлаждения продукт реакции выливают в холодную 1 М HCl (150 мл), органический слой промывают насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли и сушат над Na2SO4 и растворитель выпаривают в вакууме, получая при этом указанное в заголовке соединение (соединение 7) (25,0 г, количественный выход). Данные его ЯМР показаны ниже.
1H-ЯМР (CDCl3) 5,13 (1H, м), 4,97 (1H, шир.c), 4,71 (1H, м), 4,50 (2H, м), 4,20 (1H, м), 3,90 (1H, м), 3,50 (1H, м), 2,31 (2H, м), 1,84-1,23 (8H, м), 0,91 (9H, c), 0,08 (3H, c), 0,07 (3H, c).
Пример 5
Получение (3R,5R)-3,5-бис[(третбутилдиметилсилил)окси]-4-метилен-1-(тетрагидро-2-пиранилокси)циклогексана (соединения 8)
Указанное выше соединение 7 (25,0 г, 0,073 моль) растворяют в ДМФА (150 мл), к раствору добавляют имидазол (10,9 г, 0,16 моль), затем к смеси при охлаждении льдом добавляют третбутилдиметилхлорсилан (12,1 г, 0,08 моль) и смесь перемешивают при комнатной температуре в течение 15 часов. К смеси добавляют диизопропиловый эфир (300 мл), смесь промывают водой и насыщенным раствором соли и сушат над Na2SO4 и растворитель выпаривают в вакууме, получая при этом указанное в заголовке соединение (соединение 8) (34 г, количественный выход) в виде бесцветного маслянистого продукта. Данные его ЯМР показаны ниже.
1H-ЯМР (CDCl3) 5,02 (1H, м), 4,83 (1H, c), 4,74 (1H, м), 4,45 (2H, м), 4,18 (1H, м), 3,90 (1H, м), 3,49 (1H, м), 2,30 (1H, м), 2,10 (1H, м), 1,83-1,25 (8H, м), 0,91 (9H, c), 0,86 (9H, c), 0,068 (3H, c), 0,062 (3H, c), 0,010 (3Н, с), 0,005 (3Н, с).
Пример 6
Получение (3R,5R)-3,5-бис[(третбутилдиметилсилил)окси]-4-метиленциклогексанола (соединения 9)
Указанное выше соединение 8 (15,9 г, 34,8 моль) растворяют в метаноле (150 мл), к раствору добавляют п-толуолсульфонат пиридиния (75 мг) и смесь перемешивают при 50-55°С на водяной бане в течение 1 часа. После охлаждения к смеси добавляют карбонат калия (50 мг), растворитель раствора реакции выпаривают в вакууме и остаток подвергают хроматографии на силикагеле (н-гексан/этилацетат - от 20:1 до 10:1), получая при этом указанное в заголовке соединение (соединение 9) (7,0 г, выход 54%) в виде бесцветного маслянистого продукта. Данные его ЯМР показаны ниже.
1H-ЯМР (CDCl3) 5,04 (1H, т, J=1,83), 4,92 (1H, s), 4,73 (1H, дд, J=4,58, J=9,52), 4,59 (1H, т, J=4,0), 4,14 (1H, м), 3,55 (1H, шир.с), 2,11 (1H, м), 1,95 (1H, м), 1,79 (1H, м), 1,63 (1H, м), 0,91 (9H, с), 0,89 (9H, с), 0,098 (3H, с), 0,086 (3H, с), 0,070 (3H, с), 0,063 (3H, с).
Преимущества изобретения
На основании указанного выше текста настоящее изобретение может обеспечить получение нового синтетического промежуточного соединения для общего синтеза производных витамина D или, конкретно, промежуточного соединения для синтеза производного 19-норвитамина D, у которого экзометиленовая группа, образующая двойную связь вне кольца А производного витамина D, заменена двумя атомами водорода. Указанное промежуточное соединение, как таковое, можно получать из карвона, который является менее дорогим сырьем.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЕ ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ ДЛЯ ПОЛУЧЕНИЯ ТРИАЗОЛО(4,5-d)ПИРИМИДИНА | 2012 |
|
RU2593201C2 |
| ПРОИЗВОДНЫЕ 3-Н-1,2,3-ТРИАЗОЛО-[4,5-D]ПИРИМИДИНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1996 |
|
RU2174518C2 |
| НОВАЯ КРИСТАЛЛИЧЕСКАЯ ФОРМА ТРИАЗОЛО (4,5-d) ПИРИМИДИНА | 2005 |
|
RU2418802C2 |
| ПРОИЗВОДНЫЕ АМИНОКИСЛОТЫ | 1994 |
|
RU2127261C1 |
| НОВАЯ КРИСТАЛЛИЧЕСКАЯ И АМОРФНАЯ ФОРМА ТРИАЗОЛО[4,5-d]ПИРИМИДИНА | 2001 |
|
RU2325391C2 |
| АЗАБИЦИКЛО-ХИНОЛОН-КАРБОНОВЫЕ КИСЛОТЫ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ КИСЛОТНО-АДДИТИВНЫЕ СОЛИ И ПРОМЕЖУТОЧНЫЕ ПРОДУКТЫ ДЛЯ ИХ ПОЛУЧЕНИЯ | 1989 |
|
RU2049777C1 |
| НОВЫЕ АКТИВАТОРЫ РЕЦЕПТОРОВ ВИТАМИНА D И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2008 |
|
RU2535448C2 |
| АНАЛОГИ ВИТАМИНА D, СПОСОБ ИХ ПОЛУЧЕНИЯ, ДИАСТЕРЕОИЗОМЕР, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1993 |
|
RU2163234C2 |
| ТАКСОИДЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1995 |
|
RU2153496C2 |
| ПИРИМИДИНОВЫЕ СОЕДИНЕНИЯ, СПОСОБ ИХ ПОЛУЧЕНИЯ (ВАРИАНТЫ), ПРОМЕЖУТОЧНЫЕ ПРОДУКТЫ (ВАРИАНТЫ) И СПОСОБЫ ИХ ПОЛУЧЕНИЯ (ВАРИАНТЫ), СПОСОБ ПОЛУЧЕНИЯ ТРИАЗОЛОПИРИМИДИНОВЫХ СОЕДИНЕНИЙ | 2001 |
|
RU2295526C2 |

Изобретение относится к новым промежуточным соединениям для синтеза производных витамина D, представленным формулой (I), в которой Y1 представляет собой атом водорода или третбутилдиметилсилильную группу; Y2 представляет собой третбутилдиметилсилильную группу; Y3 представляет собой атом водорода или тетрагидро-2-пиранильную группу, где группа Y3O- имеет R-конфигурацию; R1 и R2 связаны вместе с образованием метиленовой группы. Кроме того, изобретение относится к новым соединениям, представленным формулой (II), в которой Y2 представляет собой третбутилдиметилсилильную группу, Y3 представляет собой атом водорода или тетрагидро-2-пиранильную группу, и группа Y3O- имеет R-конфигурацию, которые используются в качестве промежуточных соединений для синтеза соединений формулы (I). 2 н. и 6 з.п. ф-лы, 1 ил.
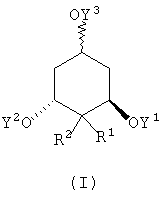

где Y1 представляет собой атом водорода или трет-бутилдиметилсилильную группу; Y2 представляет собой трет-бутилдиметилсилильную группу; Y3 представляет собой атом водорода или тетрагидро-2-пиранильную группу, где группа Y3O- имеет R-конфигурацию; R1 и R2 связаны вместе с образованием метиленовой группы.

где Y2 представляет собой трет-бутилдиметилсилильную группу, Y3 представляет собой атом водорода или тетрагидро-2-пиранильную группу и группа Y3O- имеет R-конфигурацию.
| US 5886233A, 23.03.1999 | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| KNOELKER H.-J | |||
| et al, Enantioselective synthesis of calcitriol A-ring fragments | |||
| Tetrahedron, 1997, vol | |||
| Веникодробильный станок | 1921 |
|
SU53A1 |
| WANG J | |||
| et al, Enantioselective approach to the synthesis of cyclohexane carbocyclic nucleosides | |||
| J | |||
| Org | |||
| Chem., 1998, vol.63, №9, pp.3051-3058 | |||
| HATAKEYAMA S | |||
| et | |||
Авторы
Даты
2008-02-27—Публикация
2004-02-18—Подача