ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новым соединениям, полезным в лечении вирусов папилломы человека, а также к способам получения и к применению таких соединений.
ПРЕДШЕСТВУЮЩИЙ ИЗОБРЕТЕНИЮ УРОВЕНЬ ТЕХНИКИ
Вирусы папилломы человека (human papillomavirus, HPV) представляют собой небольшие, не имеющие внешней оболочки ДНК-содержащие вирусы, вовлеченные в многочисленные состояния и заболевания. Например, HPV являются причиной большого разнообразия доброкачественных и предзлокачественных опухолей.
HPV распространяется при непосредственном контакте. HPV можно разделить на две категории: кожные вирусы и вирусы слизистых оболочек. Кожные HPV являются причиной появления бородавок на руках и ногах, таких как обыкновенные, подошвенные, нитевидные или плоские бородавки. Типы HPV слизистых оболочек поражают аногенитальную область и полость рта. К настоящему времени охарактеризовано приблизительно 100 различных типов HPV. Приблизительно 40 типов HPV специфически поражают слизистую оболочку гениталий и рта.
HPV слизистых оболочек чаще всего передаются половым путем и, при распространенности приблизительно в два раза большей по сравнению с инфекцией вируса простого герпеса, HPV считают одним из наиболее распространенных заболеваний в мире, передаваемых половым путем (sexually transmitted disease, STD).
Заражение вирусом папилломы человека (HPV) может не вызывать каких-либо симптомов и не всегда приводит к видимым генитальным бородавкам. Если симптомы развиваются, то они обычно появляются через 2-3 месяца после заражения вирусом. Однако известно, что симптомы развиваются в течение периода от 3 недель до многих лет после того, как произошло заражение. Как таковой HPV может распространяться случайно.
Более 25 типов HPV, которые вовлечены в аногенитальные заболевания, широко классифицированы как типы HPV с низким риском или с высоким риском. HPV с низким риском, такие как HPV-6 и HPV-11, являются этиологической причиной генитальных бородавок (остроконечных кондилом). HPV с высоким риском, такие как HPV-16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 и 68, обычно не дают видимых генитальных бородавок. Лучше всего вирусные типы с высоким риском можно идентифицировать тестированием ДНК. HPV с высоким риском, такие как HPV-16 и HPV-18, могут быть обнаружены в Рар-скрининговых тестах и иметь отношение к предраковому цервикальному клеточному изменению, цервикальной дисплазии и цервикальному раку. Фактически такие типы HPV с высоким риском, как 16, 18, 31, 33 и 35, в значительной степени ассоциированы с предраковыми и раковыми изменениями шейки матки. Большая часть видов цервикального рака (приблизительно 90%) включает в себя один из этих типов с высоким риском. HPV-инфекция с высоким риском приводит к риску инвазивного рака в течение жизни в 5-10% случаев для нелеченой инфекции.
В дополнение к цервикальному раку HPV с высоким риском ассоциированы с рядом видов рака анальной и перианальной областей.
Существующие в настоящее время терапии для генитальных бородавок и цервикальной дисплазии включают физическое удаление, как, например, криотерапию, электрохирургию и хирургическое иссечение. В настоящее время не существует никакой эффективной противовирусной терапии для HPV-инфекции.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение охватывает соединения формулы (I)
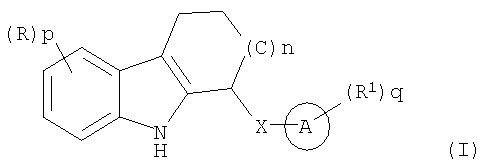
где n равно 0, 1 или 2;
Х представляет собой NH, О или S(O)m;
каждый R является одинаковым или разным и независимо выбран из группы, состоящей из
галогена, галогеноалкила, алкила, алкенила, алкинила, циклоалкила, циклоалкенила, -R10циклоалкила, Ay, -NHR10Ay, Het, -NHHet, -NHR10Het, -OR2, -OAy, -OHet, -R10OR2, -NR2R3, -NR2Ay, -R10NR2R3, -R10NR2Ay, -R10C(O)R2, -C(O)R2, -CO2R2, -R10CO2R2, -C(O)NR2R3, -C(O)Ay, -C(O)NR2Ay, -C(O)Het, -C(O)NHR10Het, -R10C(O)NR2R3, -C(S)NR2R3, -R10C(S)NR2R3, -R10NHC(NH)NR2R3, -C(NH)NR2R3, -R10C(NH)NR2R3, -S(O)2NR2R3, -S(O)2NR2Ay, -R10SO2NHCOR2, -R10SO2NR2R3, -R10SO2R2, -S(O)mR2, циано, нитро или азидо;
каждый R1 является одинаковым или разным и независимо выбран из группы, состоящей из галогена, галогеноалкила, алкила, алкенила, алкинила, циклоалкила, циклоалкенила, -R10циклоалкила, Ay, -NHR10Ay, Het, -NHHet, -NHR10Het, -OR2, -OAy, -OHet, -R10OR2, -NR2R3, -NR2Ay, -R10NR2R3, -R10NR2Ay, -R10C(O)R2, -C(O)R2, -CO2R2, -R10CO2R2, -C(O)NR2R3, -C(O)Ay, -C(O)NR2Ay, -C(O)Het, -C(O)NHR10Het, -R10C(O)NR2R3, -C(S)NR2R3, -R10C(S)NR2R3, -R10NHC(NH)NR2R3, -C(NH)NR2R3, -R10C(NH)NR2R3, -S(O)2NR2R3, -S(O)2NR2Ay, -R10SO2NHCOR2, -R10SO2NR2R3, -R10SO2R2, -S(O)mR2, циано, нитро или азидо;
каждое m независимо равно 0, 1 или 2;
каждый R10 является одинаковым или разным и независимо выбран из алкилена, циклоалкилена, алкенилена, циклоалкенилена и алкинилена;
p и q каждое независимо выбрано из 0, 1, 2, 3, 4 или 5;
каждый из R2 и R3 является одинаковым или разным и независимо выбран из группы, состоящей из Н, алкила, алкенила, алкинила, циклоалкила, циклоалкенила, -R10циклоалкила, -R10OH, -R10(OR10)w и -R10NR4R5;
w равно 1-10;
каждый из R4 и R5 является одинаковым или разным и независимо выбран из группы, состоящей из алкила, циклоалкила, алкенила, циклоалкенила и алкинила;
Ay представляет собой арильную группу;
Het представляет собой 5- или 6-членную гетероциклическую или гетероарильную группу;
кольцо А представляет собой арил или гетероарил,
включая их фармацевтически приемлемые соли, сольваты и физиологически функциональные производные.
Предпочтительно Х представляет собой NH.
Предпочтительно ссылки на алкил включают C1-С6алкил, ссылки на алкокси включают C1-С6алкокси и ссылки на галогеноалкил включают C1-С6галогеноалкил.
В одном из воплощений по меньшей мере p или q не равно 0. В другом воплощении как p, так и q каждое равно 1. В одном из воплощений p равно 1 и q равно 0-2.
Предпочтительно n равно 0, 1 или 2. Более предпочтительно n равно 1.
Предпочтительно R выбран из галогена, алкила, галогеноалкила, циклоалкила, -R10циклоалкила, Ay, Het, -OR2, -R10OR2, -NR2R3, -COR2, -CO2R2, -CONR2R3, -SO2NR2R3, циано, нитро или азидо. Более предпочтительно R выбран из галогена, алкила, галогеноалкила, циклоалкила, -R10циклоалкила, Ay, Het, -R10OR2, -NR2R3, -COR2, -CONR2R3, -SO2NR2R3 или циано. Еще более предпочтительно R выбран из галогена, алкила или галогеноалкила. В одном воплощении R замещен по пара-положению относительно изображенного атома N.
Предпочтительно R1 выбран из галогена, алкила, галогеноалкила, Ay, Het, -OR2, -R10OR2, -NR2R3, -COR2, -CO2R2, -CONR2R3, -S(O)2NR2R3, -S(O)mR2, циано, нитро или азидо. Более предпочтительно R1 выбран из галогена, алкила, галогеноалкила, -OR2, циано или нитро. В одном воплощении q предпочтительно равно 1 или 2, более предпочтительно 1.
В одном воплощении кольцо А предпочтительно представляет собой арил. Более предпочтительно кольцо А представляет собой фенил.
В другом воплощении кольцо А предпочтительно представляет собой гетероарил. Более предпочтительно гетероарил представляет собой пиримидинил, пиридил или бензотиазолил. Более предпочтительно гетероарил представляет собой пиримидинил или пиридил. Кроме того, q предпочтительно равно 0-2.
В одном воплощении, когда p не равно 0, тогда каждый R является одинаковым или разным и независимо выбран из группы, состоящей из галогена, галогеноалкила, алкила, алкенила, алкинила, циклоалкила, циклоалкенила, -R10циклоалкила, Ay, -NHR10Ay, Het, -NHHet, -NHR10Het, -R10OR2, -NR2R3, -NR2Ay, -R10NR2R3, -R10NR2Ay, -R10C(O)R2, -C(O)R2, -CO2R2, -R10CO2R2, -C(O)NR2R3, -C(O)Ay, -C(O)NR2Ay, -C(O)Het, -C(O)NHR10Het, -R10C(O)NR2R3, -C(S)NR2R3, -R10C(S)NR2R3, -R10NHC(NH)NR2R3, -C(NH)NR2R3, -R10C(NH)NR2R3, -S(O)2NR2R3, -S(O)2NR2Ay, -R10SO2NHCOR2, -R10SO2NR2R3, -R10SO2R2, -S(O)mR2, циано, нитро или азидо.
Особо предпочтительные соединения по настоящему изобретению включают
6-бром-N-фенил-2,3,4,9-тетрагидро-1H-карбазол-1-амин;
6-хлор-N-фенил-2,3,4,9-тетрагидро-1H-карбазол-1-амин;
6-хлор-N-(4-метоксифенил)-2,3,4,9-тетрагидро-1Н-карбазол-1-амин;
6-хлор-N-(4-хлорфенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амин;
6-хлор-N-(4-фторфенил)-2,3,4,9-тетрагидро-1Н-карбазол-1-амин;
6-хлор-N-(4-метилфенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амин;
6-бром-N-(4-метоксифенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амин;
6-бром-N-(4-хлорфенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амин;
6-бром-N-(4-фторфенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амин;
6-бром-N-пиримидин-2-ил-2,3,4,9-тетрагидро-1H-карбазол-1-амина гидрохлорид;
6-хлор-N-пиримидин-2-ил-2,3,4,9-тетрагидро-1H-карбазол-1-амин;
6-хлор-N-(4,6-диметоксипиримидин-2-ил)-2,3,4,9-тетрагидро-1H-карбазол-1-амин;
6-хлор-N-(4-метилпиримидин-2-ил)-2,3,4,9-тетрагидро-1H-карбазол-1-амин;
6-хлор-N-(4,6-диметилпиримидин-2-ил)-2,3,4,9-тетрагидро-1H-карбазол-1-амин;
6-бром-N-пиридин-2-ил-2,3,4,9-тетрагидро-1H-карбазол-1-амина гидрохлорид;
6-бром-N-(5-пропилпиримидин-2-ил)-2,3,4,9-тетрагидро-1H-карбазол-1-амин;
6-метокси-N-пиримидин-2-ил-2,3,4,9-тетрагидро-1H-карбазол-1-амин;
N-(4,6-диметоксипиримидин-2-ил)-6-метил-2,3,4,9-тетрагидро-1H-карбазол-1-амина гидрохлорид;
6-бром-N-(4,6-диметилпиримидин-2-ил)-2,3,4,9-тетрагидро-1H-карбазол-1-амина гидрохлорид;
6-бром-N-[5-(трифторметил)пиримидин-2-ил]-2,3,4,9-тетрагидро-1H-карбазол-1-амин;
6-бром-N-[5-(трифторметил)пиридин-2-ил]-2,3,4,9-тетрагидро-1H-карбазол-1-амин;
6-[(6-бром-2,3,4,9-тетрагидро-1H-карбазол-1-ил)амино]никотинонитрил;
N-(1,3-бензотиазол-2-ил)-6-бром-2,3,4,9-тетрагидро-1H-карбазол-1-амин;
N-пиримидин-2-ил-2,3,4,9-тетрагидро-1H-карбазол-1-амин;
2-бром-N-пиримидин-2-ил-5,6,7,8,9,10-гексагидроциклогепта[b]индол-6-амин;
6-метил-N-пиридин-2-ил-2,3,4,9-тетрагидро-1H-карбазол-1-амина гидрохлоридную соль;
метил-1-анилино-2,3,4,9-тетрагидро-1H-карбазол-6-карбоксилат;
6-[(6-метил-2,3,4,9-тетрагидро-1H-карбазол-1-ил)амино]никотинонитрила гидрохлоридную соль;
N-фенил-6-(трифторметил)-2,3,4,9-тетрагидро-1H-карбазол-1-амина гидрохлорид;
N-фенил-2,3,4,9-тетрагидро-1H-карбазол-1-амин;
6-бром-N-(3-метоксифенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амин;
6-бром-N-(3-фторфенил)-2,3,4,9-тетрагидро-1Н-карбазол-1-амин;
6-бром-N-(1Н-индол-5-ил)-2,3,4,9-тетрагидро-1Н-карбазол-1-амин;
6-бром-N-(2-метоксифенил)-2,3,4,9-тетрагидро-1Н-карбазол-1-амин;
6-бром-N-(2-хлорфенил)-2,3,4,9-тетрагидро-1Н-карбазол-1-амин;
6-бром-N-(2-фторфенил)-2,3,4,9-тетрагидро-1Н-карбазол-1-амин;
6-бром-N-(3,4-дихлорфенил)-2,3,4,9-тетрагидро-1Н-карбазол-1-амин и
6-бром-N-(4-фторфенокси)-2,3,4,9-тетрагидро-1Н-карбазола.
Еще более предпочтительные соединения включают
6-бром-N-фенил-2,3,4,9-тетрагидро-1H-карбазол-1-амин;
6-хлор-N-фенил-2,3,4,9-тетрагидро-1H-карбазол-1-амин;
6-хлор-N-(4-метоксифенил)-2,3,4,9-тетрагидро-1Н-карбазол-1-амин;
6-хлор-N-(4-хлорфенил)-2,3,4,9-тетрагидро-1Н-карбазол-1-амин;
6-хлор-N-(4-фторфенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амин;
6-хлор-N-(4-метилфенил)-2,3,4,9-тетрагидро-1Н-карбазол-1-амин;
6-бром-N-(4-метоксифенил)-2,3,4,9-тетрагидро-1Н-карбазол-1-амин;
6-бром-N-(4-хлорфенил)-2,3,4,9-тетрагидро-1Н-карбазол-1-амин;
6-бром-N-(4-фторфенил)-2,3,4,9-тетрагидро-1Н-карбазол-1-амин;
6-бром-N-пиримидин-2-ил-2,3,4,9-тетрагидро-1Н-карбазол-1-амина гидрохлорид;
6-хлор-N-пиримидин-2-ил-2,3,4,9-тетрагидро-1Н-карбазол-1-амин;
6-хлор-N-(4,6-диметоксипиримидин-2-ил)-2,3,4,9-тетрагидро-1Н-карбазол-1-амин;
6-хлор-N-(4-метилпиримидин-2-ил)-2,3,4,9-тетрагидро-1Н-карбазол-1-амин;
6-хлор-N-(4,6-диметилпиримидин-2-ил)-2,3,4,9-тетрагидро-1Н-карбазол-1-амин;
6-бром-N-пиридин-2-ил-2,3,4,9-тетрагидро-1Н-карбазол-1-амина гидрохлорид;
6-бром-N-(5-пропилпиримидин-2-ил)-2,3,4,9-тетрагидро-1Н-карбазол-1-амин;
N-(4,6-диметоксипиримидин-2-ил)-6-метил-2,3,4,9-тетрагидро-1Н-карбазол-1-амина гидрохлорид;
6-бром-N-(4,6-диметилпиримидин-2-ил)-2,3,4,9-тетрагидро-1H-карбазол-1-амина гидрохлорид;
6-бром-N-[5-(трифторметил)пиримидин-2-ил]-2,3,4,9-тетрагидро-1H-карбазол-1-амин;
6-бром-N-[5-(трифторметил)пиридин-2-ил]-2,3,4,9-тетрагидро-1Н-карбазол-1-амин;
6-[(6-бром-2,3,4,9-тетрагидро-1H-карбазол-1-ил)амино]никотинонитрил;
N-(1,3-бензотиазол-2-ил)-6-бром-2,3,4,9-тетрагидро-1H-карбазол-1-амин;
2-бром-N-пиримидин-2-ил-5,6,7,8,9,10-гексагидроциклогепта[b]индол-6-амин;
6-метил-N-пиридин-2-ил-2,3,4,9-тетрагидро-1H-карбазол-1-амина гидрохлоридную соль;
метил-1-анилино-2,3,4,9-тетрагидро-1Н-карбазол-6-карбоксилат;
6-[(6-метил-2,3,4,9-тетрагидро-1Н-карбазол-1-ил)амино]никотинонитрила гидрохлоридную соль;
N-фенил-6-(трифторметил)-2,3,4,9-тетрагидро-1H-карбазол-1-амина гидрохлорид;
N-фенил-2,3,4,9-тетрагидро-1H-карбазол-1-амин;
6-бром-N-(3-метоксифенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амин;
6-бром-N-(3-фторфенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амин;
6-бром-N-(2-метоксифенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амин;
6-бром-N-(2-хлорфенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амин;
6-бром-N-(2-фторфенил)-2,3,4,9-тетрагидро-1Н-карбазол-1-амин;
6-бром-N-(3,4-дихлорфенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амин и
6-бром-N-(4-фторфенокси)-2,3,4,9-тетрагидро-1Н-карбазол.
Еще более предпочтительные соединения включают
6-бром-N-фенил-2,3,4,9-тетрагидро-1H-карбазол-1-амин;
6-хлор-N-фенил-2,3,4,9-тетрагидро-1H-карбазол-1-амин;
6-хлор-N-(4-метоксифенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амин;
6-хлор-N-(4-хлорфенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амин;
6-хлор-N-(4-фторфенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амин;
6-хлор-N-(4-метилфенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амин;
6-бром-N-(4-метоксифенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амин;
6-бром-N-(4-хлорфенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амин;
6-бром-N-(4-фторфенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амин;
N-фенил-6-(трифторметил)-2,3,4,9-тетрагидро-1H-карбазол-1-амина гидрохлорид;
N-фенил-2,3,4,9-тетрагидро-1H-карбазол-1-амин;
6-бром-N-(3-метоксифенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амин;
6-бром-N-(3-фторфенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амин;
6-бром-N-(2-метоксифенил)-2,3,4,9-тетрагидро-1Н-карбазол-1-амин;
6-бром-N-(2-хлорфенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амин;
6-бром-N-(2-фторфенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амин;
6-бром-N-(3,4-дихлорфенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амин и
6-бром-N-(4-фторфенокси)-2,3,4,9-тетрагидро-1H-карбазол.
Другое воплощение настоящего изобретения включает
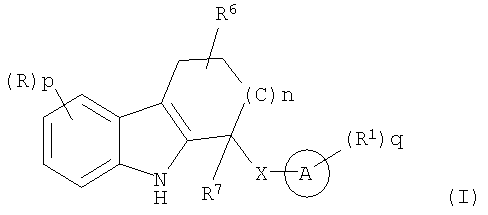
включая соли, сольваты и фармацевтически функциональные производные,
где R6 представляет собой Н, алкил, -OR2, -NR2R3, Ay, Het, -C(O)R2, -CO2R2, -CONR2RЗ, -S(O)mR2 или оксо, где R2 и R3 такие, как определено выше, и
R7 представляет собой Н или алкил, при условии, что R6 и R7 оба не являются Н.
Другой аспект настоящего изобретения включает фармацевтические композиции, содержащие одно или более соединений по настоящему изобретению и фармацевтически приемлемый носитель.
Другой аспект настоящего изобретения включает соединение по настоящему изобретению для применения в качестве активного терапевтического вещества.
Другой аспект настоящего изобретения включает соединение по настоящему изобретению для использования в лечении или профилактике заболеваний и состояний, вызванных онкогенными вирусами, включая аденовирусы, ретровирусы, и семейством паповавирусов, включая полиомавирусы и папилломавирусы.
Другой аспект настоящего изобретения включает соединение по настоящему изобретению для использования в лечении или профилактике состояний или расстройств, вызванных HPV-инфекцией. В частности, состояние или заболевание представляет собой бородавки, генитальные бородавки, цервикальную дисплазию, рецидивирующий респираторный папилломатоз или виды рака, ассоциированные с папилломавирусной инфекцией. Более конкретно, рак представляет собой виды аногенитального рака, рака головы и шеи и рака кожи. Более конкретно, виды аногенитального рака представляют собой цервикальный рак, рак анальной и перианальной областей, рак вульвы, рак влагалища и рак полового члена; виды рака головы и шеи представляют собой рак ротоглоточной области и пищевода; виды рака кожи представляют собой базальноклеточный рак и плоскоклеточный рак.
Другой аспект настоящего изобретения включает применение соединения по настоящему изобретению в изготовлении лекарства для использования в лечении или профилактике онкогенных вирусов, включая аденовирусы, ретровирусы, и семейства паповавирусов, включая полиомавирусы и папилломавирусы. Таким образом, настоящее изобретение включает применение соединения по настоящему изобретению в изготовлении лекарства для использования в лечении или профилактике состояний или расстройств, вызванных HPV-инфекцией. Более конкретно, состояние или расстройство представляет собой бородавки, генитальные бородавки, цервикальную дисплазию, рецидивирующий респираторный папилломатоз или виды рака ассоциированные с папилломавирусной инфекцией.
Другой аспект настоящего изобретения охватывает способ лечения или профилактики онкогенных вирусов, аденовирусов, ретровирусов, небольших ДНК-содержащих онкогенных вирусов семейства аденовирусов и паповавирусов (таких как полиомавирусы и папилломавирусы), включающий введение соединения по настоящему изобретению. Таким образом, настоящее изобретение охватывает способ лечения или профилактики состояний или расстройств, вызванных HPV-инфекцией, включающий введение соединения по настоящему изобретению. Более конкретно, состояние или расстройство представляет собой бородавки, генитальные бородавки, цервикальную дисплазию, рецидивирующий респираторный папилломатоз или виды. рака, ассоциированные с папилломавирусной инфекцией.
Как указано в данном описании, p и q каждый независимо определен как 0, 1, 2, 3, 4 или 5. А именно, как будет очевидно специалисту в данной области, величина(ы) p и/или q не должны превышать количество замещаемых положений на изображенных кольцах.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНОГО ВОПЛОЩЕНИЯ
Термины использованы в своих принятых значениях. Следующие далее определения предназначены для уточнения определенных терминов, а не для их ограничения.
Используемый в данном описании термин "алкил" относится к прямому или разветвленному углеводороду, предпочтительно имеющему от одного до двенадцати атомов углерода, который может быть возможно замещен со множественными степенями замещения, включенными в объем настоящего изобретения. Примеры "алкила", как использовано в данном описании, включают метил, этил, пропил, изопропил, изобутил, н-бутил, трет-бутил, изопентил, н-пентил и их замещенные варианты, но не ограничиваются этим.
Как использовано во всем описании, предпочтительное количество атомов, таких как атомы углерода, будет представлено, например фразой "Сx-Сyалкил", которая относится к алкильной группе, как определено в данном описании, содержащей конкретное количество атомов углерода. Аналогичная терминология будет применяться и к другим предпочтительным терминам, а также к диапазонам.
Используемый в данном описании термин "алкенил" относится к прямому или разветвленному алифатическому углеводороду, содержащему одну или более чем одну углерод-углеродную двойную связь, который может быть возможно замещен со множественными степенями замещения, включенными в объем настоящего изобретения. Примеры включают, но не ограничиваются этим, винил, аллил и тому подобное и их замещенные варианты.
Используемый в данном описании термин "алкинил" относится к прямому или разветвленному алифатическому углеводороду, содержащему одну или более чем одну углерод-углеродную тройную связь, который может быть возможно замещен со множественными степенями замещения, включенными в объем настоящего изобретения. Примеры включают, но не ограничиваются этим, этинил и тому подобное и их замещенные варианты.
Используемый в данном описании термин "алкилен" относится к прямому или разветвленному двухвалентному углеводородному радикалу, предпочтительно имеющему от одного до десяти атомов углерода. Алкиленовые группы, как определено в данном описании, могут быть возможно замещены со множественными степенями замещения, включенными в объем настоящего изобретения. Примеры "алкилена", как использовано в данном описании, включают метилен, этилен, н-пропилен, н-бутилен и их замещенные варианты, но не ограничиваются этим.
Используемый в данном описании термин "алкенилен" относится к прямому или разветвленному двухвалентному углеводородному радикалу, предпочтительно имеющему от одного до десяти атомов углерода, содержащему одну или более чем одну углерод-углеродную двойную связь, который может быть возможно замещен со множественными степенями замещения, включенными в объем настоящего изобретения. Примеры включают, но не ограничиваются этим, винилен, аллилен или 2-пропенилен и тому подобное и их замещенные варианты.
Используемый в данном описании термин "алкинилен" относится к прямому или разветвленному двухвалентному углеводородному радикалу, предпочтительно имеющему от одного до десяти атомов углерода, содержащему одну или более чем одну углерод-углеродную тройную связь, который может быть возможно замещен со множественными степенями замещения, включенными в объем настоящего изобретения. Примеры включают, но не ограничиваются этим, этинилен и тому подобное и их замещенные варианты.
Используемый в данном описании термин "циклоалкил" относится к возможно замещенному неароматическому циклическому углеводородному кольцу, возможно содержащему алкиленовый линкер, посредством которого данный циклоалкил может присоединяться, со множественными степенями замещения, включенными в объем настоящего изобретения. Типичные "циклоалкильные" группы включают, но не ограничиваются этим, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и их замещенные варианты. Используемый в данном описании термин "циклоалкил" включает возможно замещенную конденсированную полициклическую углеводородную насыщенную кольцевую и ароматическую кольцевую систему, то есть полициклические углеводороды с меньшим, чем максимальное, количеством некумулятивных двойных связей, например когда насыщенное углеводородное кольцо (такое как циклопентильное кольцо) конденсировано с ароматическим кольцом (в данном описании "арилом", таким как бензольное кольцо) с образованием, например, такой группы, как индан.
Используемый в данном описании термин "циклоалкенил" относится к возможно замещенному неароматическому циклическому углеводородному кольцу, содержащему одну или более чем одну углерод-углеродную двойную связь и возможно содержащему алкиленовый линкер, посредством которого данный циклоалкенил может присоединяться, со множественными степенями замещения, включенными в объем настоящего изобретения. Типичные "циклоалкенильные" группы включают, но не ограничиваются этим, циклопропенил, циклобутенил, циклопентенил, циклогексенил, циклогептенил и их замещенные варианты.
Используемый в данном описании термин "циклоалкилен" относится к двухвалентному возможно замещенному неароматическому циклическому углеводородному кольцу со множественными степенями замещения, включенными в объем настоящего изобретения. Типичные "циклоалкиленовые" группы включают, но не ограничиваются этим, циклопропилен, циклобутилен, циклопентилен, циклогексилен, циклогептилен и их замещенные варианты.
Используемый в данном описании термин "циклоалкенилен" относится к двухвалентному возможно замещенному неароматическому циклическому углеводородному кольцу, содержащему одну или более чем одну углерод-углеродную двойную связь, со множественными степенями замещения, включенными в объем настоящего изобретения. Типичные "циклоалкениленовые" группы включают, но не ограничиваются этим, циклопропенилен, циклобутенилен, циклопентенилен, циклогексенилен, циклогептенилен и их замещенные варианты.
Используемый в данном описании термин "гетероцикл" или "гетероциклил" относится к возможно замещенной моно- или полициклической кольцевой системе с одной или более степенями ненасыщения, содержащей также один или более гетероатомов. Предпочтительные гетероатомы включают N, О и/или S, включая N-оксиды, оксиды серы и диоксиды. Предпочтительно кольцо является трех-двенадцатичленным и является либо полностью насыщенным, либо имеет одну или более степеней ненасыщения. В объеме настоящего определения находятся множественные степени замещения. Такие кольца могут быть возможно конденсированы с одним или более чем одним другим "гетероциклическим(и)" кольцом(ами) или циклоалкильным(и) кольцом(ами). Примеры "гетероциклических" групп включают, но не ограничиваются этим, тетрагидрофуран, пиран, 1,4-диоксан, 1,3-диоксан, пиперидин, пирролидин, морфолин, тетрагидротиопиран и тетрагидротиофен.
Используемый в данном описании термин "арил" относится к возможно замещенному бензольному кольцу или к возможно замещенной конденсированной бензольной кольцевой системе, например антраценовой, фенантреновой или нафталиновой кольцевой системе. В объеме настоящего определения находятся множественные степени замещения. Примеры "арильных" групп включают, но не ограничиваются этим, фенил, 2-нафтил, 1-нафтил и их замещенные варианты.
Используемый в данном описании термин "гетероарил" относится к возможно замещенному моноциклическому пяти - семичленному ароматическому кольцу или к возможно замещенной конденсированной бициклической ароматической кольцевой системе, состоящей из двух таких ароматических колец. Эти гетероарильные кольца содержат также один или более атомов азота, серы и/или кислорода, причем N-оксиды, оксиды серы и диоксиды являются допустимыми замещениями гетероатомов. В объеме настоящего определения находятся множественные степени замещения. Примеры "гетероарильных" групп, используемых в данном описании, включают фуран, тиофен, пиррол, имидазол, пиразол, триазол, тетразол, тиазол, оксазол, изоксазол, оксадиазол, тиадиазол, изотиазол, пиридин, пиридазин, пиразин, пиримидин, хинолин, изохинолин, бензофуран, бензтиофен, индол, индазол, бензимидазолил, имидазопиридинил, пиразолопиридинил, пиразолопиримидинил и их замещенные варианты, но не должны ограничиваться этим.
Используемый в данном описании термин "галоген" относится к фтору, хлору, брому или иоду.
Используемый в данном описании термин "галогеноалкил" относится к алкильной группе, как определено в данном описании, замещенной по меньшей мере одним галогеном. Примеры галогеноалкильных групп с разветвленной или прямой цепью, полезных в настоящем изобретении, включают, но не ограничиваются этим, метил, этил, пропил, изопропил, н-бутил и трет-бутил, независимо замещенные одним или более галогеном, например фторо, хлоро, бромо и иодо. Термин "галогеноалкил" следует интерпретировать как включающий такие заместители, как перфторалкильные группы и тому подобное.
Используемый в данном описании термин "алкокси" относится к группе -ORa, где Ra представляет собой алкил, как определено выше.
Используемый в данном описании термин "алкоксикарбонил" относится к таким группам, как
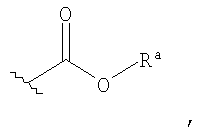
где Ra представляет собой алкильную группу, как определено в данном описании.
Используемый в данном описании термин "арилоксикарбонил" относится к таким группам, как
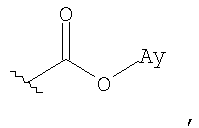
где Ay представляет собой арильную группу, как определено в данном описании.
Используемый в данном описании термин "гетероарилоксикарбонил" относится к таким группам, как
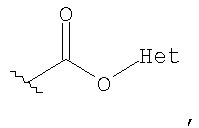
где Het представляет собой гетероарильную группу, как определено в данном описании.
Используемый в данном описании термин "нитро" относится к группе -NO2.
Используемый в данном описании термин "циано" относится к группе -CN.
Используемый в данном описании термин "азидо" относится к группе -N3.
Используемый в данном описании термин "ацил" относится к группе RbC(O)-, где Rb представляет собой алкил, арил, гетероарил или гетероциклил, как каждый определен в данном описании.
Используемый в данном описании термин "оксо" относится к группе =O.
Кроме того, как использовано в данном описании, фраза "возможно замещенный" или ее варианты означает возможное замещение, включая множественные степени замещения, одной или более чем одной замещающей группой. Данную фразу не следует интерпретировать как удвоение замещений, описанных и изображенных в данном описании. Типичные возможные замещающие группы включают ацил; алкил; алкенил; алкинил; алкилсульфонил; алкокси; алкоксикарбонил; циано; галоген; галогеноалкил; гидрокси; нитро; арил, который может быть дополнительно замещен ацилом, алкокси, алкилом, алкенилом, алкинилом, алкилсульфонилом, циано, галогеном, галогеноалкилом, гидрокси или нитро; гетероарил, который может быть дополнительно замещен ацилом, алкокси, алкилом, алкенилом, алкинилом, алкилсульфонилом, циано, галогеном, галогеноалкилом, гидрокси или нитро; арилсульфонил, который может быть дополнительно замещен ацилом, алкокси, алкилом, алкенилом, алкинилом, алкилсульфонилом, циано, галогеном, галогеноалкилом, гидрокси или нитро; гетероарилсульфонил, который может быть дополнительно замещен ацилом, алкокси, алкилом, алкенилом, алкинилом, алкилсульфонилом, циано, галогеном, галогеноалкилом, гидрокси или нитро; арилокси, который может быть дополнительно замещен ацилом, алкокси, алкилом, алкенилом, алкинилом, алкилсульфонилом, циано, галогеном, галогеноалкилом, гидрокси или нитро; гетероарилокси, который может быть дополнительно замещен ацилом, алкокси, алкилом, алкенилом, алкинилом, алкилсульфонилом, циано, галогеном, галогеноалкилом, гидрокси или нитро; арилоксикарбонил, который может быть дополнительно замещен ацилом, алкокси, алкилом, алкенилом, алкинилом, алкилсульфонилом, циано, галогеном, галогеноалкилом, гидрокси или нитро; гетероарилоксикарбонил, который может быть дополнительно замещен ацилом, алкокси, алкилом, алкенилом, алкинилом, алкилсульфонилом, циано, галогеном, галогеноалкилом, гидрокси или нитро, или -N(R*)2, где для каждого случая R* независимо выбран из Н, алкила, алкенила, алкинила, циклоалкила, гетероциклила, арила, аралкила, гетероарила, гетероаралкила, алкилсульфонила, арилсульфонила или гетероарилсульфонила, где в каждом случае такой арил или гетероарил может быть замещен одним или более чем одним из ацила, алкокси, алкила, алкенила, алкилсульфонила, циано, галогена, галогеноалкила, гидрокси или нитро, либо два R* могут объединяться с образованием кольца, возможно имеющего дополнительные гетероатомы, возможно имеющего одну или более степеней замещения и возможно дополнительно замещенного ацилом, алкокси, алкилом, алкенилом, алкинилом, алкилсульфонилом, циано, галогеном, галогеноалкилом, гидрокси или нитро.
Соединения формул (I) могут кристаллизоваться в виде более чем одной формы, свойство, известное как полиморфизм, и такие полиморфные формы (полиморфы) находятся в пределах объема формулы (I). Как правило, полиморфизм может иметь место как ответ на изменения в температуре, давлении или в том и другом. Полиморфизм также может быть результатом изменений в процессе кристаллизации. Полиморфы можно отличить по различным физическим характеристикам, известным в данной области, таким как картины дифракции рентгеновских лучей, растворимость и точка плавления.
Некоторые из раскрытых в данном описании соединений содержат один или более чем один хиральный центр либо иным образом могут существовать в виде многочисленных стереоизомеров. Объем настоящего изобретения охватывает смеси стереоизомеров, а также очищенные энантиомеры или энантиомерно/диастереомерно обогащенные смеси. Кроме того, в объем изобретения включены индивидуальные изомеры соединений, представленных формулой (I), а также любые полностью или частично уравновешенные их смеси. Настоящее изобретение также охватывает индивидуальные изомеры соединений, представленных приведенными выше формулами, в виде смеси с их изомерами, в которых один или более чем один хиральный центр инвертирован.
В типичном случае, но не всегда, соли по настоящему изобретению являются фармацевтически приемлемыми солями. Соли, подпадающие под термин "фармацевтически приемлемые соли", относятся к нетоксичным солям соединений по этому изобретению. Соли соединений по настоящему изобретению могут включать соли присоединения кислоты. Типичные соли включают соли ацетата, бензолсульфоната, бензоата, бикарбоната, бисульфата, битартрата, бората, кальция эдетата, камзилата, карбоната, клавуланата, цитрата, дигидрохлорида, эдизилата, эстолата, эзилата, фумарата, глуцептата, глюконата, глутамата, гликолиларсанилата, гексилрезорцината, гидрабамина, гидробромида, гидрохлорида, гидроксинафтоата, иодида, изетионата, лактата, лактобионата, лаурата, малата, малеата, манделата, мезилата, метилсульфата, монокалия малеата, муката, напзилата, нитрата, N-метилглюкамина, оксалата, памоата (эмбоната), пальмитата, пантотената, фосфата/дифосфата, полигалактуроната, калия, салицилата, натрия, стеарата, субацетата, сукцината, сульфата, танната, тартрата, теоклата, тозилата, триэтиодида, триметиламмония и валерата. Другие соли, не являющиеся фармацевтически приемлемыми, могут быть полезны в получении соединений по этому изобретению, и их следует рассматривать как дополнительный аспект изобретения.
Используемый в данном описании термин "сольват" относится к комплексу с вариабельной стехиометрией, образованному растворенным веществом (в этом изобретении соединением формулы I или его солью или физиологически функциональным производным) и растворителем. Такие растворители, для цели изобретения, не должны влиять на биологическую активность растворенного вещества. Неограничивающие примеры подходящих растворителей включают, но не ограничиваются этим, воду, метанол, этанол и уксусную кислоту. Предпочтительно, чтобы используемый растворитель был фармацевтически приемлемым растворителем. Неограничивающие примеры подходящих фармацевтически приемлемых растворителей включают воду, этанол и уксусную кислоту. Более предпочтительно, когда используемым растворителем является вода.
Используемый в данном описании термин "физиологически функциональное производное" относится к любому фармацевтически приемлемому производному соединения по настоящему изобретению, которое при введении млекопитающему способно давать (напрямую или опосредовано) соединение по настоящему изобретению или его активный метаболит. Такие производные, например сложные эфиры и амиды, будут очевидны специалистам в данной области без излишнего экспериментирования. Ссылка может быть сделана на учебное пособие Burger's Medicinal Chemistry And Drug Discovery, 5th Edition, Vol.1: Principles and Practice, которое включено в данное описание посредством ссылки на ту часть, которая знакомит с физиологически функциональными производными.
Используемый в данном описании термин "эффективное количество" означает количество лекарственного средства или фармацевтического агента, которое будет вызывать биологический или терапевтический ответ ткани, системы, животного или человека, устанавливаемый, например, исследователем или клиническим врачом. Термин "терапевтически эффективное количество" означает любое количество, которое при сравнении с соответствующим субъектом, не получавшим такого количества, приводит к улучшенному лечению, заживлению, предупреждению или уменьшению заболевания, расстройства или побочного действия или к снижению скорости прогрессирования заболевания или расстройства. В свой объем термин также включает количества, эффективные для усиления обычного физиологического действия. Для применения в терапии терапевтически эффективные количества соединения формулы (I), а также его солей, сольватов и физиологически функциональных производных, могут быть введены в виде неочищенного химического реагента. Вдобавок активный ингредиент может быть представлен в виде фармацевтической композиции.
В связи с этим согласно данному изобретению далее предложены фармацевтические композиции, включающие в себя эффективные количества соединений формулы (I) и их солей, сольватов и физиологически функциональных производных и один или более чем один фармацевтически приемлемый носитель, разбавитель или эксципиент. Соединения формулы (I) и их соли, сольваты и физиологически функциональные производные такие, как они изложены в данном описании. Носитель(и), разбавитель(и) или эксципиент(ы) должны быть приемлемыми в смысле совместимости с другими ингредиентами препарата и безопасными для реципиента фармацевтической композиции.
Согласно другому аспекту изобретения также предложен способ приготовления фармацевтического препарата, включающий смешивание соединения формулы (I) или его солей, сольватов и физиологически функциональных производных с одним или более чем одним фармацевтически приемлемым носителем, разбавителем или эксципиентом.
Терапевтически эффективное количество соединения по настоящему изобретению будет зависеть от ряда факторов. Например, вид, возраст и масса реципиента, правильно установленное состояние, требующее лечения, и его тяжесть, природа препарата и путь введения - все это является факторами, требующими рассмотрения. В конечном счете терапевтически эффективное количество должно оставаться на усмотрении ведущего врача или ветеринара. Безотносительно к чему-либо эффективное количество соединения формулы (I) для лечения людей, страдающих слабостью, в общем случае должно находиться в диапазоне от 0,1 до 100 мг/кг массы тела реципиента (млекопитающего) в сутки. В более типичном случае эффективное количество должно находиться в диапазоне от 1 до 10 мг/кг массы тела в сутки. Таким образом, для взрослого млекопитающего массой 70 кг фактическое количество в сутки в типичном случае будет составлять от 70 до 700 мг. Это количество может быть предложено в разовой дозе или в виде ряда (например двух, трех, четырех, пяти или более) субдоз в сутки, так чтобы суммарная суточная доза являлась одинаковой. Эффективное количество его соли, сольвата или физиологически функционального производного может быть определено как доля эффективного количества соединения формулы (I) per se. Аналогичные дозировки должны соответствовать лечению других состояний, ссылки на которые приведены в данном описании.
Фармацевтические препараты могут быть представлены в стандартных лекарственных формах, содержащих заранее установленное количество активного ингредиента на стандартную дозу. Такая единица может содержать в качестве неограничивающего примера от 0,5 мг до 1 г соединения формулы (I) в зависимости от состояния, которое лечат, пути введения и возраста, массы и состояния пациента. Предпочтительными препаратами в стандартной дозировке являются препараты, содержащие суточную дозу или субдозу, как изложено выше в данном описании, или соответствующую ее часть активного ингредиента. Такие фармацевтические препараты могут быть приготовлены любым из способов, хорошо известных в области фармацевтики.
Фармацевтические препараты могут быть адаптированы для введения любым подходящим путем, например пероральным (включая трансбуккальный или сублингвальный), ректальным, назальным, местным (включая трансбуккальный, сублингвальный или трансдермальный), вагинальным или парентеральным (включая подкожный, внутримышечный, внутривенный или интрадермальный) путем. Такие препараты могут быть приготовлены любым способом, известным в области фармацевтики, например посредством объединения активного ингредиента с носителем(ями) или эксципиентом(ами). В качестве примера, а не для ограничения изобретения, что касается некоторых состояний и расстройств, для которых предполагают применимость соединений по настоящему изобретению, некоторые пути (введения) будут предпочтительнее по сравнению с другими. В зависимости от физических проявлений, которые зачастую ассоциируются с HPV-инфекцией, могут быть предпочтительны ректальный, местный или вагинальный пути введения. В качестве одного из примеров для лечения или профилактики цервикальной дисплазии предпочтительным путем может быть вагинальный путь.
Фармацевтические препараты, адаптированные для перорального введения, могут быть представлены в виде дискретных единиц, таких как капсулы или таблетки; порошки или гранулы; растворы или суспензии, каждый с водными или неводными жидкостями; пищевые пенки или взбитые массы; жидкие эмульсии по типу масло-в-воде или жидкие эмульсии по типу вода-в-масле. Например, для перорального введения в форме таблетки или капсулы активный лекарственный компонент может быть скомбинирован с пероральным нетоксичным фармацевтически приемлемым инертным носителем, таким как этанол, глицерин, вода и тому подобное. В общем случае порошки готовят посредством измельчения соединения до подходящего малого размера и смешивания с соответствующим фармацевтическим носителем, таким как пищевой углевод, как, например, крахмал или маннит. Также могут присутствовать корригенты, консерванты, диспергирующие агенты и красители.
Капсулы получают путем приготовления порошковой, жидкой или суспензионной смеси и заполнения ею оболочки из желатина или из некоторых других соответствующих материалов. Перед заполнением капсул к такой смеси могут быть добавлены глиданты и смазывающие вещества, такие как коллоидный диоксид кремния, тальк, стеарат магния, стеарат кальция или твердый полиэтиленгликоль. Кроме того, для улучшения доступности лекарственного средства при проглатывании капсулы может быть добавлен разрыхляющий или солюбилизирующий агент, такой как агар-агар, карбонат кальция или карбонат натрия. Более того, при желании или необходимости, в смесь также могут быть введены подходящие связующие, смазывающие вещества, разрыхляющие агенты и красители. Примеры подходящих связующих включают крахмал, желатин, природные сахара, такие как глюкоза или бета-лактоза, зерновые подсластители, природные и синтетические камеди, такие как аравийская, трагакантовая камеди или альгинат натрия, карбоксиметилцеллюлозу, полиэтиленгликоль, воски и тому подобное. Полезные в этих лекарственных формах смазывающие вещества включают, например, олеат натрия, стеарат натрия, стеарат магния, бензоат натрия, ацетат натрия, хлорид натрия и тому подобное. Разрыхлители включают, но не ограничиваются этим, крахмал, метилцеллюлозу, агар, бентонит, ксантановую камедь и тому подобное.
Таблетки изготавливают, например, путем приготовления порошковой смеси, гранулирования или комкования, добавления смазывающего вещества и разрыхлителя и прессования в таблетки. Порошковую смесь можно приготовить путем смешивания соединения, подходящим образом измельченного, с разбавителем или основой, как описано выше. Возможные ингредиенты включают связующие, такие как карбоксиметилцеллюлоза, альгинаты, желатины или поливинилпирролидон, замедлители растворения, такие как парафин, ускорители всасывания, такие как четвертичная соль, и/или абсорбирующие агенты, такие как бентонит, каолин или дикальцийфосфат. Порошковая смесь может быть подвергнута гранулированию путем увлажнения связующим, таким как сироп, крахмальная паста, клейкая масса из аравийской камеди или растворы целлюлозных или полимерных материалов, и продавливания через сито. Вместо гранулирования порошковая смесь может быть пропущена через таблеточную машину, и результатом этого являются неидеально сформованные комки, разломанные до гранул. Эти гранулы могут быть смазаны для предотвращения прилипания к формирующим таблетки пресс-формам посредством добавления стеариновой кислоты, стеаратной соли, талька или минерального масла. Смесь с добавленными смазывающими веществами затем прессуют в таблетки. Соединения по настоящему изобретению также могут быть объединены со свободно текучим инертным носителем и прессоваться в таблетки сразу без прохождения стадий гранулирования или комкования. Может быть предложено прозрачное или непрозрачное защитное покрытие, состоящее из уплотненного покрытия из щеллака, покрытия из сахара или полимерного материала и полированного покрытия из воска. Для различения разных стандартных дозировок в эти покрытия могут быть добавлены красители.
Пероральные жидкости, такие как растворы, сиропы и эликсиры, могут быть приготовлены в стандартной лекарственной форме таким образом, чтобы заданное количество содержало заранее установленное количество соединения. Сиропы могут быть приготовлены, например, путем растворения соединения в подходящим образом корригированном водном растворе, в то время как эликсиры готовят посредством использования нетоксичного спиртового наполнителя. В общем случае суспензии могут быть приготовлены путем диспергирования соединения в нетоксичном наполнителе. Также могут быть добавлены солюбилизаторы и эмульгаторы, такие как этоксилированные изостеариловые спирты и простые эфиры полиоксиэтиленсорбита, консерванты; корригирующие добавки, такие как мятное масло, или природные подсластители, сахарин или другие искусственные подсластители и тому подобное.
При необходимости стандартные лекарственные формы препаратов для перорального введения могут быть микроинкапсулированы. Кроме того, данный препарат может быть приготовлен для пролонгированного или непрерывного высвобождения, как, например, путем нанесения покрытия или внедрения сыпучего материала в полимеры, воск или тому подобное.
Соединения формулы (I) и их соли, сольваты и физиологически функциональные производные также могут быть введены в форме систем доставки на основе липосом, таких как малые однослойные везикулы, большие однослойные везикулы и многослойные везикулы. Липосомы могут быть образованы из различных фосфолипидов, таких как холестерин, стеариламин или фосфатидилхолины.
Соединения формулы (I) и их соли, сольваты и физиологически функциональные производные также могут быть доставлены посредством использования моноклональных антител в качестве индивидуальных носителей, к которым присоединены молекулы данных соединений.
Соединения также могут быть присоединены к растворимым полимерам, как носителям, способным доставлять лекарственные средства к мишени. Такие полимеры могут включать поливинилпирролидон (PVP), сополимер на основе пирана, полигидроксипропилметакриламид-фенол, полигидроксиэтиласпартамидфенол или полиэтиленоксидполилизин, замещенный пальмитоиловыми остатками. Кроме того, соединения могут быть присоединены к классу биодеградируемых полимеров, полезных для достижения контролируемого высвобождения лекарственного средства, таких как полимолочная кислота, поли-эпсилон-капролактон, полигидроксимасляная кислота, полиортоэфиры, полиацетали, полидигидропираны, полицианоакрилаты и перекрестно сшитые или амфипатические блок-сополимеры гидрогелей.
Фармацевтические препараты, адаптированные для трансдермального введения, могут быть представлены в виде разделенных пластырей, предназначенных для сохранения тесного контакта с эпидермисом реципиента в течение продолжительного периода времени. Например, активный ингредиент может быть доставлен из пластыря посредством ионофореза, как в целом описано в Pharmaceutical Research, 3(6): 318 (1986), включенном в данное описание посредством ссылки, относящейся к таким системам доставки.
Фармацевтические препараты, адаптированные для местного введения, могут быть приготовлены в виде мазей, кремов, суспензий, лосьонов, порошков, растворов, паст, гелей, спреев, аэрозолей или масел.
Для лечения глазных или других наружных тканей, например рта и кожи, препараты можно наносить в виде мази или крема для местного применения. В случае приготовления в составе мази активный ингредиент может быть использован либо с парафиновой, либо со смешиваемой с водой мазевой основой. Альтернативно активный ингредиент может быть приготовлен в виде крема с основой для крема по типу масло-в-воде или с основой по типу вода-в-масле.
Фармацевтические препараты, адаптированные для местного введения в глаз, включают глазные капли, где активный ингредиент растворен или суспендирован в подходящем носителе, в частности водном растворителе.
Фармацевтические препараты, адаптированные для местного введения в рот, включают лепешки, пастилки и жидкости для полоскания рта.
Фармацевтические препараты, адаптированные для назального введения, где носитель представляет собой твердое вещество, содержат крупный порошок, имеющий размер частиц, например, в диапазоне от 20 до 500 микрон. Порошок вводят посредством вдыхания через нос, то есть быстрой ингаляцией этого порошка через носоглотку из контейнера, удерживаемого близко к носу. Подходящие препараты, где носитель представляет собой жидкость для введения в виде назального спрея или в виде назальных капель, содержат водные или масляные растворы активного ингредиента.
Фармацевтические препараты, адаптированные для введения путем ингаляции, содержат мелкие частицы пыли или аэрозоли, которые могут быть генерированы посредством различных типов дозирующих, находящихся под давлением распылителей, небулайзеров или инсуффляторов.
Фармацевтические препараты, адаптированные для ректального введения, могут быть представлены в виде суппозиториев или клизм.
Фармацевтические препараты, адаптированные для вагинального введения, могут быть представлены в виде пессариев, тампонов, кремов, гелей, паст, пенок или спрей-препаратов.
Фармацевтические препараты, адаптированные для парентерального введения, включают водные и неводные стерильные инъекционные растворы, которые могут содержать антиоксиданты, буферы, бактериостатические вещества и растворенные вещества, делающие препарат изотоничным крови предполагаемого реципиента; водные и неводные стерильные суспензии, которые могут включать в себя суспендирующие агенты и загустители. Данные препараты могут быть представлены в контейнерах для однократного или многократного введения, например в герметично закрытых ампулах и флаконах, и могут храниться в высушенном сублимацией (лиофилизированном) состоянии, требующем только добавления стерильного жидкого носителя, например воды для инъекций, непосредственно перед использованием. Приготовленные для немедленного приема инъекционные растворы и суспензии могут быть получены из стерильных порошков, гранул и таблеток.
В дополнение к ингредиентам, в частности, упомянутым выше, препараты могут включать в себя другие традиционные в данной области агенты, имеющие отношение к данному типу рассматриваемого препарата. Например, препараты, подходящие для перорального введения, могут включать в себя корригенты или красители.
Соединения по настоящему изобретению и их соли, сольваты и их физиологически функциональные производные могут быть использованы как таковые или в комбинации с другими терапевтическими агентами. Соединение(я) формулы (I) и другой(ие) фармацевтически активный(е) агент(ы) могут быть введены вместе или по отдельности, и при введении по отдельности введение может осуществляться одновременно или последовательно в любом порядке. Количества соединения(й) формулы (I) и другого(их) фармацевтически активного(ых) агента(ов) и относительные временные интервалы введения выбираются с целью достижения желаемого комбинированного терапевтического эффекта. Введение в комбинации соединения формулы (I), его солей, сольватов или физиологически функциональных производных с другими терапевтическими агентами может происходить в комбинации путем введения соответственно в (1) единой фармацевтической композиции, включающей в себя оба соединения, или (2) в раздельных фармацевтических композициях, включающих в себя каждая одно из соединений. Альтернативно такая комбинация может быть введена по отдельности последовательным образом, при этом один терапевтический агент вводят первым, а другой вторым или наоборот. Такое последовательное введение может осуществляться близко по времени или отдаленно по времени.
Соединения по настоящему изобретению можно использовать в лечении ряда расстройств и состояний и, по существу, соединения по настоящему изобретению можно использовать в комбинации с рядом других подходящих терапевтических агентов, полезных в лечении или профилактике таких расстройств или состояний. Лечение будет зависеть от природы и типа HPV-инфекции. Как кратко обсуждалось выше, лечение бородавок можно подразделить на аблятивный и лечебный подходы. Соединения по настоящему изобретению можно комбинировать с одним из этих двух или обоими подходами.
Аблятивные способы (удаления) включают классическое хирургическое иссечение и разрушение посредством электродесикации, лазера или жидкого азота. Таким образом, соединения по настоящему изобретению могут быть использованы в сочетании с такими способами или по мере повторного появления после таких способов.
Альтернативно настоящее изобретение можно комбинировать с другими видами лекарственной терапии, включая ряд цитотоксических или противовирусных агентов. Например, и это не означает ограничения изобретения, соединения по настоящему изобретению можно объединять с другими терапевтическими агентами, такими как 5-фторурацил, ретиноевая кислота, подофиллин, подофилокс, кератолитические агенты, такие как салициловая кислота и/или молочная кислота, гаптены, такие как дифенципрон (DPC), дибутиловый эфир сквареновой кислоты (SADBE) или динитрохлорбензол (DNCB), формалин, трифторуксусная кислота для местного применения, третиноин для местного применения, цидофовир, имиквимод и/или цитокины, такие как интерферон альфа-2b.
Одним из аспектов настоящего изобретения является применение соединений по настоящему изобретению для лечения или профилактики ряда расстройств, включая, но не ограничиваясь этим, заболевания и состояния, вызванные онкогенными вирусами (такими как аденовирусы, паповавирусы, ретровирусы) и, в частности, небольшими ДНК-содержащими опухолевыми вирусами семейства аденовирусов и паповавирусов (полиомавирусы и папилломавирусы), и более конкретно, папилломавирусных инфекций. Настоящее изобретение включает введение субъекту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли, сольвата или их физиологически функционального производного.
Более конкретно, настоящее изобретение включает лечение или профилактику состояний или заболеваний, ассоциированных с папилломавирусными инфекциями. Эти состояния и заболевания включают бородавки (например, подошвенные бородавки), генитальные бородавки, рецидивирующий респираторный папилломатоз (ларингеальные папилломы) и виды рака, ассоциированные с папилломавирусной инфекцией. Виды рака, которые были ассоциированы с папилломавирусной инфекцией, включают виды аногенитального рака (цервикальный рак, рак анальной и перианальной областей, рак вульвы, рак влагалища, рак полового члена), виды рака головы и шеи (ротоглоточной области, пищевода) и виды рака кожи (базально-клеточный рак, плоскоклеточный рак). Настоящее изобретение включает введение субъекту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли, сольвата или физиологически функционального производного.
Соединения по данному изобретению могут быть получены различными способами, включая хорошо известные стандартные способы синтеза. Иллюстративные общие способы синтеза представлены ниже, и далее в разделе рабочие Примеры получены конкретные соединения по изобретению.
Во всех описанных ниже примерах использованы защитные группы для чувствительных или реакционноспособных групп, где необходимо, в соответствии с общими принципами химического синтеза. Манипуляции с защитными группами выполняют согласно стандартным методам органического синтеза (Т.W.Greene and P.G.M.Wuts (1991, Protecting Groups in Organic Synthesis, John Wiley & Sons; включено посредством ссылки в отношении защитных групп). Эти группы удаляют на удобной стадии синтеза соединения, используя методы, очевидные специалистам в данной области. Выбор способов, а также реакционных условий и порядка их осуществления будут согласовываться с получением соединений формулы (I).
Специалисты в данной области смогут понять, имеется ли стереоцентр в соединениях формулы (I). Поэтому настоящее изобретение охватывает все возможные стереоизомеры и охватывает не только рацемические соединения, но также и все индивидуальные энантиомеры. Если желательно соединение в виде единичного энантиомера, то такое соединение можно получить посредством стереоспецифического синтеза, посредством разрешения конечного продукта или любого удобного промежуточного соединения или посредством способов хиральной хроматографии, которые известны в данной области. Разрешение конечного продукта, промежуточного соединения или исходного материала может быть осуществлено любым подходящим способом, известным в данной области. Смотри, например, Stereochemistry of Organic Compounds (E.L.Eliel, S.H.Wilen, and L.N.Mander, Wiley-Interscience, 1994); включено посредством ссылки в отношении стереохимии.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Сокращения
Как использовано в данном описании, символы и условные обозначения, используемые в этих способах, схемах и примерах, согласуются с таковыми, используемыми в современной научной литературе, например в Journal of the American Chemical Society или в Journal of Biological Chemistry. Конкретно, в примерах и во всем описании могут быть использованы нижеследующие сокращения:
Если не указано иначе, все температуры выражают в °С (градусах по Цельсию). Все реакции проводили при комнатной температуре, если не указано иначе.
1H ЯМР-спектры регистрировали на приборе Varian VXR-300, Varian Unity-300, Varian Unity-400 или General Electric QE-300. Химические сдвиги выражали в миллионных долях (млн-1, единицы δ). Константы взаимодействия представлены в единицах герц (Гц). Картины расщепления описываются видимыми мультиплетностями и обозначаются как s (синглет), d (дублет), t (триплет), q (квартет), m (мультиплет) или br (уширенный).
Масс-спектры получали на масс-спектрометрах Micromass Platform или ZMD от Micromass Ltd., Altricham, UK, используя либо химическую ионизацию при атмосферном давлении (APCl), либо ионизацию электрораспылением (ESI).
Аналитическую тонкослойную хроматографию использовали для оценки чистоты промежуточного(ых) соединения(ий), которые невозможно было выделить или которое(ые) были слишком нестабильны для полной характеристики, а также для слежения за протеканием реакции(й).
Соединения формулы (I), где общие термины такие, как определено выше, и LV представляет собой уходящую группу, такую как галоген (F, Cl, Br, I), SOAy, SO2Ay, SORa, SO2Ra, где Ra представляет собой алкильную группу, могут быть соответственно получены способом, изображенным ниже на Схеме 1.
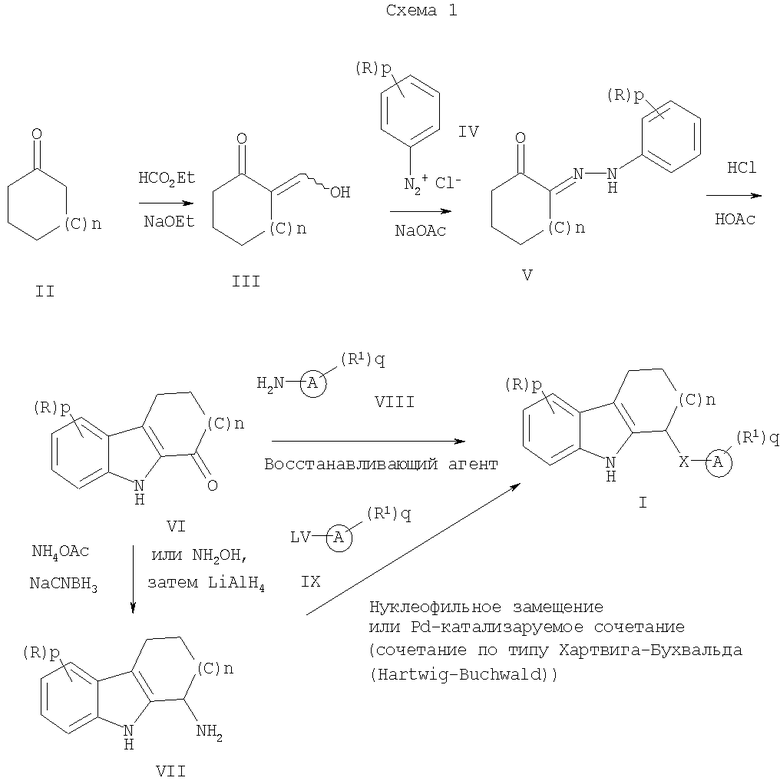
В общем случае способ получения соединений формулы (I), где LV представляет собой уходящую группу, которая определена выше, и Х представляет собой NH (причем все формулы и все другие переменные были определены выше), включает следующие стадии:
а) взаимодействие соединения формулы (II) с этилформиатом;
б) взаимодействие соединения формулы (III) с диазасоединением формулы (IV);
в) индолизация соединения формулы (V) с получением соединения формулы (VI);
г) восстановительное аминирование соединения формулы (VI) с образованием соединения формулы (VII) и
д) образование соединений формулы (I) из соединения (VII) путем нуклеофильного замещения или путем использования условий катализируемого палладием сочетания.
Альтернативно:
е) образование соединений формулы (I) посредством восстановительного аминирования соединения (VI).
Более конкретно, соединение формулы (I), где все переменные такие, как определено выше, может быть получено взаимодействием соединения формулы (VI) с амином формулы (VIII) в присутствии восстанавливающего агента:
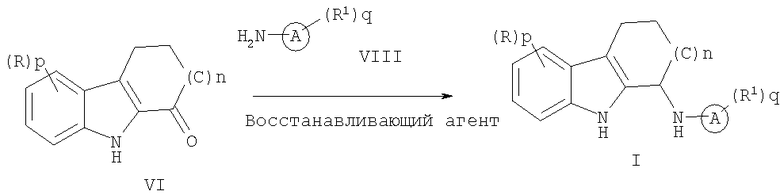
вновь, где все переменные такие, как определено в данном описании.
Реакцию можно проводить как двустадийный процесс, где имин образуется в условиях, позволяющих удалять воду после восстановления. Альтернативно эту реакцию можно провести в одном реакторе путем добавления амина (VIII) и восстанавливающего агента последовательно или одновременно.
Для двустадийного процесса обычно соединение формулы (VI) растворяют в инертном растворителе, таком как толуол, добавляют эквивалент или избыток амина формулы (VIII) с последующим возможным добавлением кислотного катализатора, такого как пара-толуолсульфоновая кислота. Реакционную смесь нагревают до температуры дефлегмации для азеотропного удаления воды. Для удаления воды могут быть возможно использованы молекулярные сита или дегидратирующие агенты, такие как триметилортоформиат.
Имин можно выделить или использовать непосредственно на следующей стадии. Имин растворяют в подходящем растворителе и восстанавливают путем добавления восстанавливающего агента. Подходящие растворители включают низшие спирты, такие как метанол, этанол и тому подобное, тетрагидрофуран или подобные растворители, хорошо известные специалистам в данной области. Подходящие восстанавливающие агенты включают, но не ограничиваются этим, цианоборогидрид натрия, триацетоксиборогидрид натрия, боран-тетрагидрофурановый комплекс, борогидрид натрия и тому подобное.
Для проведения процесса в одном реакторе соединение формулы (VI) растворяют в инертном растворителе. К этому раствору добавляют амин формулы (VIII) с последующим добавлением подходящего восстанавливающего агента. Реакционная смесь может быть возможно нагрета до приблизительно 50-150°С. Подходящие растворители включают, но не ограничиваются этим, дихлорметан, дихлорэтан и тому подобное. Подходящие восстанавливающие агенты включают, но не ограничиваются этим, цианоборогидрид натрия, триацетоксиборогидрид натрия, борогидрид натрия и тому подобное.
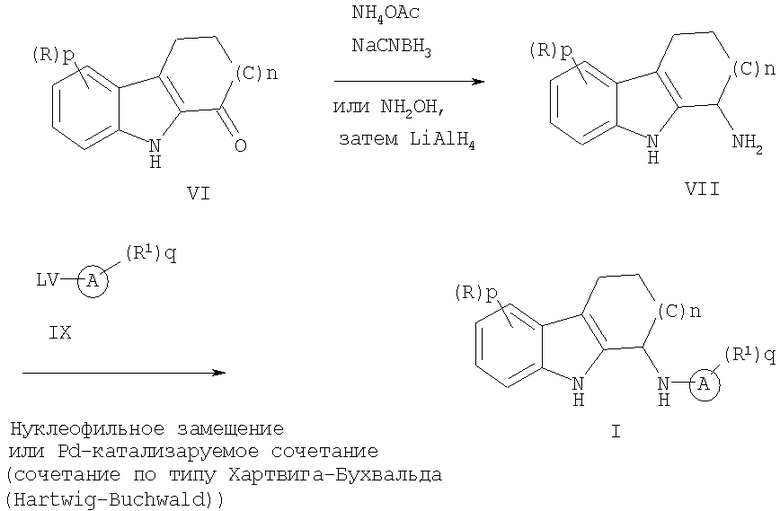
Альтернативно соединение формулы (I) может быть образовано из амина формулы (VII). Обработка соединения формулы (VI) в инертном растворителе аммониевой солью и восстанавливающим агентом, возможно с нагреванием, дает амин формулы (VII). Подходящие растворители включают, но не ограничиваются этим, метанол, этанол, дихлорметан, дихлорэтан и тому подобное. Подходящие восстанавливающие агенты включают, но не ограничиваются этим, цианоборогидрид натрия, триацетоксиборогидрид натрия, борогидрид натрия и тому подобное. Подходящие аммониевые соли включают, но не ограничиваются этим, ацетат аммония, формиат аммония и тому подобное. Амин формулы (VII) также может быть образован в результате обработки соединения формулы (VI) гидроксиламином с последующим восстановлением подходящими восстанавливающими агентами, которые включают, но не ограничиваются этим, алюмогидрид лития и тому подобное.
Конденсация соединения формулы (VII) с соединением формулы (IX) дает соединение формулы (I). Эту конденсацию можно проводить в отсутствие или в присутствии растворителя, возможно с нагреванием или в микроволновой печи. Подходящие растворители включают, но не ограничиваются этим, N,N-диметилформамид, 1-метил-2-пирролидинон, диметилсульфоксид, ацетонитрил, нитрометан и тому подобное. В реакцию конденсации возможно может быть добавлено основание, примеры подходящих оснований включают карбонат натрия, бикарбонат натрия, триэтиламин и тому подобное.
Кроме того, как изображено выше, амин формулы (VII) можно сочетать с соединением формулы (IX) с получением соединения формулы (I), используя соответствующее Pd-катализируемое сочетание, очевидное в данной области.
Соединения формулы (VI) получают аналогичным образом, как описано в литературе (J. Med. Chem. 1973, 16, 425, и J. Org. Chem. 1968, 32, 1265).
Как будет очевидно специалистам в данной области, соединение формулы (I) можно превратить в другое соединение формулы (I).
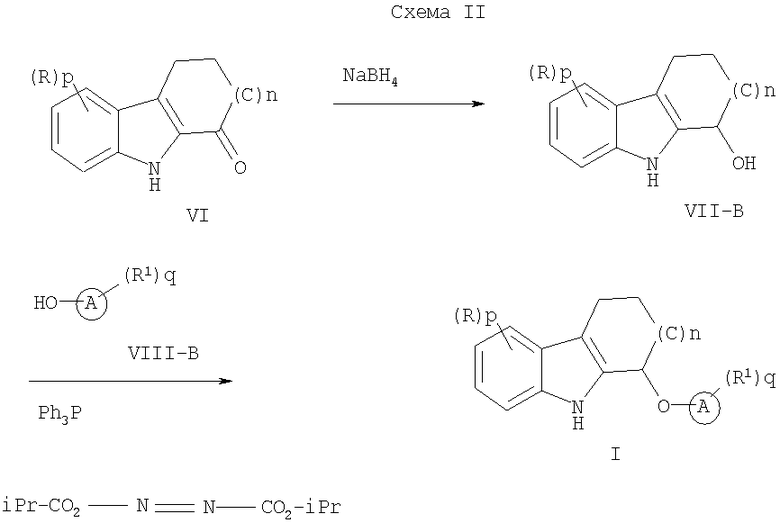
В общем случае способ получения соединения формулы (I), где Х представляет собой О, состоит из
(1) восстановления соединения формулы (VI) с получением соединения формулы VII-B;
(2) взаимодействия соединения формулы VII-B с соединением формулы VIII-B с получением соединения формулы I (где все переменные заместители такие, как определено в данном описании).
Более конкретно, соединение формулы (VII-B), где все переменные такие, как определено выше, могут быть получены путем восстановления соединения формулы (VI). Подходящий восстанавливающий агент включает, но не ограничивается этим, борогидрид натрия, боран-тетрагидрофурановый комплекс и тому подобное. Подходящие растворители включают метанол, этанол, тетрагидрофуран и тому подобное. Соединение формулы (I) может быть образовано в результате взаимодействия соединения формулы (VII-B) с соединением формулы (VIII-B) в присутствии диэтилазодикарбоксилата или диизопропилазодикарбоксилата и трифенилфосфина. Подходящие растворители включают тетрагидрофуран и тому подобное.
ПРИМЕРЫ
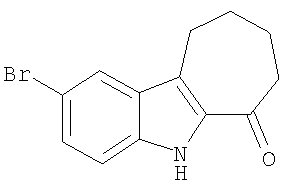
Пример 1. 6-Хлор-2,3,4,9-тетрагидро-1Н-карбазол-1-он
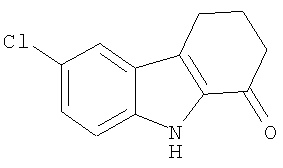
а) Циклогексан-1,2-дион-(4-хлорфенил)гидразон. К охлажденному раствору (0°С) 4-хлоранилина (5,6 г; 44 ммоль) в концентрированной соляной кислоте (5 мл) порциями в течение 20 минут добавляли нитрит натрия (3,0 г; 44 ммоль), растворенный в воде (10 мл). Смесь перемешивали при 0°С в течение 30 мин. В отдельной колбе охлажденный раствор 2-(гидроксиметилен)циклогексанона (Organic Syntheses, Collective Vol 4, 1963, pg.536) (5,0 г; 40 ммоль) в метаноле (30 мл) обрабатывали раствором ацетата натрия (8,3 г; 101 ммоль) в воде (25 мл). Смесь перемешивали при 0°С в течение 20 минут и добавляли суспензию соли диазония. Объединенную смесь перемешивали в течение 10-15 минут, собирали фильтрацией, растирали с этанолом и собирали фильтрацией, получая циклогексан-1,2-дион-(4-хлорфенил)гидразон (4,6 г; выход 49%) в виде твердого вещества желтого цвета. 1H-ЯМР (ДМСО-d6): δ 9.93 (s, 1Н), 7.29 (m, 4H), 2.55 (m, 2H), 2.40 (m, 2H), 1.84-1.75 (m, 4H).
b) 6-Хлор-2,3,4,9-тетрагидро-1Н-карбазол-1-он. Раствор циклогексан-1,2-дион-(4-хлорфенил)гидразона (2,3 г; 9,7 ммоль) в соляной кислоте (2 мл) и уксусной кислоте (8 мл) нагревали при 120°С в течение 20 минут. Смесь немного охлаждали и обрабатывали ледяной водой. Образовавшийся осадок собирали фильтрацией, получая 6-хлор-2,3,4,9-тетрагидро-1H-карбазол-1-он (1,9 г; выход 88%) в виде твердого вещества коричневого цвета. 1H-ЯМР (ДМСО-d6): δ 11.78 (s, 1Н), 7.75 (m, 1Н), 7.38 (d, 1Н), 7.28 (dd, 1Н), 2.92 (t, 2H), 2.55 (t, 2H), 2.13 (q, 2H). MC m/z 220 (M+1).
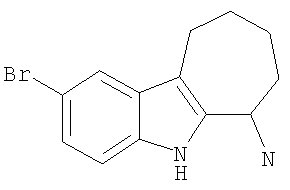
Пример 2. 6-Хлор-2,3,4,9-тетрагидро-1H-карбазол-1-амин
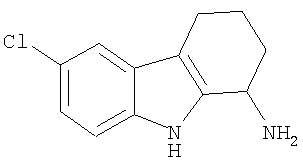
К раствору 6-хлор-2,3,4,9-тетрагидро-1H-карбазол-1-она (500 мг; 2,3 ммоль) и ацетата аммония (1,8 г; 23 ммоль) в метаноле (9 мл) добавляли цианоборогидрид натрия (720 мг; 11,5 ммоль). После нагревания при 60°С в течение 15 часов смесь охлаждали и обрабатывали концентрированной соляной кислотой до рН, равного 1. Органические вещества удаляли при пониженном давлении и полученный осадок собирали фильтрацией, растворяли в этилацетате и метаноле и промывали насыщенным водным карбонатом натрия. Фазы разделяли и органическую фазу концентрировали, получая 6-хлор-2,3,4,9-тетрагидро-1H-карбазол-1-амин (260 мг; выход 52%) в виде твердого вещества светло-коричневого цвета. 1H-ЯМР (ДМСО-d6): δ 10.90 (s, 1Н), 7.34 (m, 1H), 7.27 (d, 1H), 6.97 (dd, 1H), 3.90 (t, 1H), 2.54 (m, 2H), 2.04-1.89 (m,2H), 1.66 (m, 1H), 1.50 (m, 1H). MC m/z 221 (M+1).
Пример 3. 6-Бром-2,3,4,9-тетрагидро-1H-карбазол-1-он
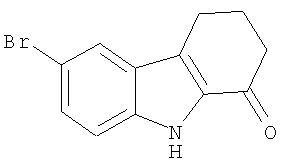
6-Бром-2,3,4,9-тетрагидро-1H-карбазол-1-он получали из броманилина и 2-(гидроксиметилен)циклогексанона аналогично тому, как описано в Примере 1, получая твердое вещество коричневого цвета. 1H-ЯМР (CDCl3): δ 8.79 (s, 1H), 7.80 (s, 1H), 7.44 (d, 1H), 7.30 (d, 2H), 2.97 (t, 2H), 2.66 (t, 2H), 2.27 (quint, 2H). MC m/z 265 (M+1).
Пример 4. 6-Бром-2,3,4,9-тетрагидро-1H-карбазол-1-амин
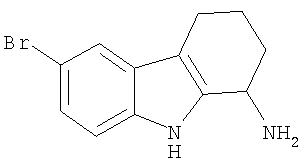
6-Бром-2,3,4,9-тетрагидро-1H-карбазол-1-амин получали аналогично тому, как описано в Примере 2, получая твердое вещество. 1H-ЯМР (CDCl3): δ 8.58 (s, 1H), 7.55 (s, 1H), 7.20 (m, 2H), 4.12 (t, 1H), 2.70 (t, 2H), 2.24 (m, 1H), 2.05 (m, 1H), 1.92 (m,3H), 1.66 (m, 1H). MC m/z 266 (M+1).
Пример 5. 6-Метил-2,3,4,9-тетрагидро-1Н-карбазол-1-он
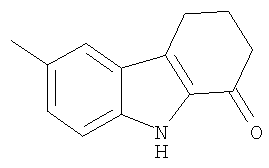
6-Метил-2,3,4,9-тетрагидро-1H-карбазол-1-он получали из п-толуидина и 2-(гидроксиметилен)циклогексанона аналогично тому, как описано в Примере 1, получая твердое вещество желтовато-коричневого цвета. 1H-ЯМР (CDCl3): δ 8.65 (s, 1H), 7.43 (s, 1H), 7.30 (d, 1H), 7.20 (d, 1H), 2.98 (t, 2H), 2.65 (t, 2H), 2.45 (s, 3Н), 2.26 (quint, 2H). MC m/z 220 (M+1).
Пример 6. 6-Метил-2,3,4,9-тетрагидро-1H-карбазол-1-амин
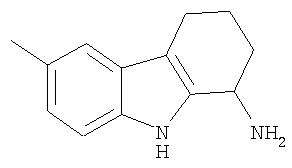
6-Метил-2,3,4,9-тетрагидро-1H-карбазол-1-амин получали аналогично тому, как описано в Примере 2, получая твердое вещество. 1H-ЯМР (ДМСО-d6): δ 10.5 (s, 1H), 7.15 (d, 1H), 7.11 (s, 1H), 6.81 (d, 1H), 3.98 (t, 1H), 3.30 (s, 2H), 2.53 (t, 2H), 2.32 (s, 3Н), 2.02 (m, 1H), 1.90 (m, 1H), 1.68 (m, 1H), 1.65 (m, 1H). MC m/z 201 (M+1).
Пример 7а. 2,3,4,9-Тетрагидро-1H-карбазол-1-он
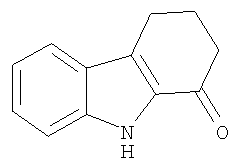
2,3,4,9-Тетрагидро-1H-карбазол-1-он получали из анилина (2,9 г; 31 ммоль) и 2-(гидроксиметилен)циклогексанона (3,5 г; 28 ммоль) аналогично тому, как описано в Примере 1, получая 2,5 г (49%) твердого вещества коричневого цвета. 1H-ЯМР (ДМСО-d6): δ 11.6 (s, 1H), 7.66 (d, 1H), 7.38 (d, 1H), 7.30 (t, 1H), 7.07 (t, 1H), 2.90 (t, 2H), 2.56 (t, 2H), 2.15 (quint, 2H). MC m/z 186 (M+1).
Пример 7b. 2,3,4,9-Тетрагидро-1H-карбазол-1-амина гидрохлорид
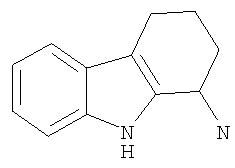
К раствору 2,3,4,9-тетрагидро-1Н-карбазол-1-она (1,5 г; 8,10 ммоль) в этаноле (20 мл) добавляли раствор гидроксиламина гидрохлорида (1,13 г; 16,2 ммоль) в воде (10 мл) и раствор ацетата натрия (2,19 г; 26,7 ммоль) в воде (10 мл). Реакционную смесь нагревали при температуре дефлегмации в течение 2 ч, охлаждали и концентрировали. Остаток разбавляли водой и экстрагировали этилацетатом (2×100 мл). Органическую фазу сушили над сульфатом натрия, фильтровали и концентрировали до твердого вещества коричневого цвета. Оксим растворяли в ТГФ (80 мл) и по каплям добавляли LAH (1,0 М в ТГФ; 24,3 мл). Реакционную смесь нагревали при температуре дефлегмации в течение 7 ч и охлаждали в ледяной бане. По каплям добавляли метанол до прекращения выделения газа. Смесь разбавляли водным Na/K-тартратом, интенсивно перемешивали в течение 15 мин и экстрагировали этилацетатом (2×100 мл). Экстракты объединяли, сушили над сульфатом натрия, фильтровали и концентрировали. Неочищенный амин очищали флэш-хроматографией на силикагеле (градиент метанол/метиленхлорид, 2%-5%), получая 2,3,4,9-тетрагидро-1H-карбазол-1-амин в виде коричневого масла. Масло разбавляли диэтиловым эфиром и добавляли HCl (1,0 М в диэтиловом эфире). Образовавшийся осадок собирали фильтрацией, получая 2,3,4,9-тетрагидро-1H-карбазол-1-амина гидрохлорид (760 мг; 42%) в виде твердого вещества светло-коричневого цвета. 1H-ЯМР (CD3OD): δ 7.54 (d, 1H), 7.42 (d, 1H), 7.22 (t, 1H), 7.09 (t, 1H), 4.66 (t, 1H), 2.95-2.73 (m, 2H), 2.39-2.28 (m, 1H), 2.18-2.03 (m, 3H). MC m/z (M+1) 170.
Пример 8. 6-Метокси-2,3,4,9-тетрагидро-1Н-карбазол-1-он
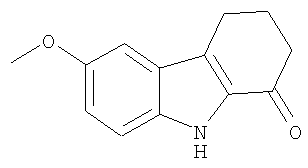
6-Метокси-2,3,4,9-тетрагидро-1Н-карбазол-1-он получали из п-анизидина и 2-(гидроксиметилен)циклогексанона аналогично тому, как описано в Примере 1, получая твердое вещество желтовато-коричневого цвета. 1H-ЯМР (CDCl3): δ 8.77 (br s, 1Н), 7.32 (d, 1H), 7.06 (d, 1H), 7.03 (s, 1H), 3.88 (s, 3H), 2.98 (t, 2H), 2.66 (t, 2H), 2.28 (quint, 2H). MC m/z 216 (M+1).
Пример 9. 6-Метокси-2,3,4,9-тетрагидро-1H-карбазол-1-амин
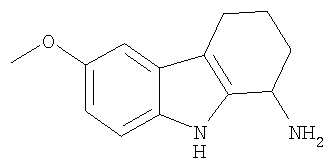
6-Метокси-2,3,4,9-тетрагидро-1H-карбазол-1-амин получали аналогично тому, как описано выше, получая твердое вещество. 1H-ЯМР (CDCl3): δ 8.38 (s, 1H), 7.20 (d, 1H), 6.92 (s, 1H), 6.80 (d, 1H), 4.06 (t, 1H), 3.85 (s, 3H), 2.67 (t, 2H), 2.18 (m, 1H),2.00 (m, 1H), 1.83 (m, 1H), 1.60 (m, 1H). MC m/z 217 (M+1).
Пример 10. 6-(Трифторметил)-2,3,4,9-тетрагидро-1H-карбазол-1-он
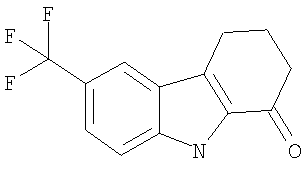
6-(Трифторметил)-2,3,4,9-тетрагидро-1H-карбазол-1-он получали из 4-(трифторметил)анилина (5,5 г; 34 ммоль) и 2-(гидроксиметилен)циклогексанона (3,9 г; 31 ммоль) аналогично тому, как описано выше, получая 2,25 г (29%) твердого вещества темно-коричневого цвета. 1H-ЯМР (ДМСО-d6): δ 12.05 (s, 1H), 8.11 (s, 1H), 7.56 (s, 2H), 3.00 (t, 2H), 2.58 (t, 2H), 2.19-2.13 (m, 2H).
Пример 11. 2-Бром-7,8,9,10-тетрагидроциклогепта[b]индол-6(5Н)-он
2-Бром-7,8,9,10-гексагидроциклогепта[b]индол-6(5Н)-он получали из 4-броманилина (7,8 г; 46 ммоль) и 2-(гидроксиметилен)циклогептанона (5,8 г; 41 ммоль) аналогично тому, как описано в Примере 1, получая 3,5 г (31%) твердого вещества темно-коричневого цвета. 1H-ЯМР (ДМСО-d6): δ 8.95. (s, 1H), 7.79 (s, 1H), 7.41 (d, 1H), 7.25 (d, 1H), 3.09 (t, 2H), 2.85 (t, 2H), 2.12-2.06 (m, 2H), 2.02-1.96 (m, 2H). MC m/z (M+1) 278, 280.
Пример 12. 2-Бром-5,6,7,8,9,10-гексагидроциклогепта[b]индол-6-амина гидрохлорид
2-Бром-5,6,7,8,9,10-гексагидроциклогепта[b]индол-6-амина гидрохлорид получали из 2-бром-7,8,9,10-гексагидроциклогепта[b]индол-6(5H)-она (1,5 г; 5,4 ммоль) аналогично тому, как описано выше, получая 0,98 г (57%) твердого вещества светло-коричневого цвета. 1H-ЯМР (CD3OD): δ 7.65 (s, 1H), 7.28-7.21 (m, 2H), 4.67 (t, 1H), 3.07-3.02 (m, 1H), 2.84-2.76 (m, 1H), 2.31-2.25 (m, 1H), 2.14-1.93 (m, 4H), 1.65-1.55 (m, 1H).
Пример 13. 6-Бром-N-фенил-2,3,4,9-тетрагидро-1H-карбазол-1-амин
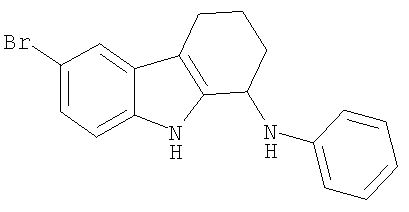
Раствор 6-бром-2,3,4,9-тетрагидро-1H-карбазол-1-она (500 мг; 1,9 ммоль), анилина (350 мг; 3,8 ммоль) и п-толуолсульфоновой кислоты (каталитическое количество) в толуоле (15 мл) нагревали при температуре дефлегмации в течение 16 ч с ловушкой Дина-Старка на месте. Реакционную смесь охлаждали, концентрировали и имин очищали флэш-хроматографией на силикагеле (градиент этилацетат/гексаны, от 5% до 50%). Имин растворяли в метаноле (10 мл) и порциями добавляли борогидрид натрия (140 мг; 3,8 ммоль). Реакционную смесь перемешивали в течение 30 мин и гасили водой, концентрировали и разбавляли этилацетатом. Органическую фазу отделяли, абсорбировали на диатомовую землю и очищали флэш-хроматографией на силикагеле (градиент этилацетат/гексаны, от 2% до 20%), получая 6-бром-N-фенил-2,3,4,9-тетрагидро-1Н-карбазол-1-амин в виде коричневого масла. 1H-ЯМР (ДМСО-d6): δ 8.04 (s, 1H), 7.61 (s, 1H), 7.25-7.21 (m, 4H), 6.80-6.72 (m, 3H), 4.84-4.78 (m, 1H), 3.86-3.82 (m, 1H), 2.27-2.21 (m, 2H), 2.08-2.00 (m, 1H), 1.89-1.78 (m, 3H). Масло растворяли в диэтиловом эфире и добавляли HCl (1,0 М в диэтиловом эфире). Образовавшийся осадок собирали фильтрацией, получая 6-бром-N-фенил-2,3,4,9-тетрагидро-1H-карбазол-1-амина гидрохлорид (352 мг; 51%) в виде твердого вещества желтого цвета. 1H-ЯМР (ДМСО-d6): δ 11.12 (s, 1Н), 7.58 (s, 1H), 7.26 (d, 1H), 7.15-7.13 (m, 3H), 6.88-6.78 (m, 2H), 6.72-6.64 (m, 1H), 4.82-4.79 (m, 1H), 2,69-2.45 (m, 2H), 1.96-1.90 (m, 2H), 1.83-1,73 (m, 2H). MC m/z (M-1) 339, 341.
Пример 14. 6-Хлор-N-фенил-2,3,4,9-тетрагидро-1H-карбазол-1-амин
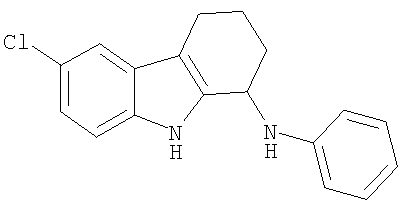
6-Хлор-N-фенил-2,3,4,9-тетрагидро-1H-карбазол-1-амин получали из 6-хлор-2,3,4,9-тетрагидро-1H-карбазол-1-она и анилина аналогично тому, как описано в Примере 13, получая 200 мг (выход 74%) твердого вещества желтого цвета. 1H-ЯМР (CDCl3): δ 8.04 (s, 1H), 7.46 (d, 1H), 7.27-7.20 (m, 2H), 7.17 (dd, 1H), 7.10 (dd, 1H), 6.79 (m, 1H), 6.74 (m, 2H), 4.81 (m, 1H), 3.85 (s, 1H), 2.70 (m, 2H), 2.25 (m, 1H), 2.03 (m, 1H), 1.93-1.78 (m, 2H). MC m/z 295 (М-1).
Пример 15. 6-Хлор-N-(4-метоксифенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амин
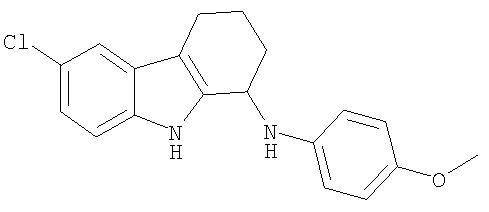
6-Хлор-N-(4-метоксифенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амин получали из 6-хлор-2,3,4,9-тетрагидро-1H-карбазол-1-она и 4-метоксианилина аналогично тому, как описано в Примере 13, получая 32 мг (выход 21%) твердого вещества коричневого цвета. 1H-ЯМР (CDCl3): δ 8.13 (s, 1H), 7.50 (d, 1H), 7.23 (dd, 1H), 7.14 (dd, 1H), 6.92-6.84 (m, 2H), 6.79-6.73 (m, 2H), 4.76 (m, 1H), 3.83 (s, 3H), 2.74 (m, 2H), 2.28 (m, 1H), 2.08 (m, 1H), 1.98-1.75 (m, 2H). MC m/z 325 (М-1).
Пример 16. 6-Хлор-N-(4-хлорфенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амин
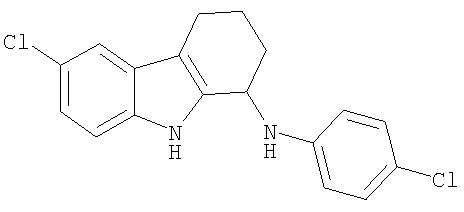
6-Хлор-N-(4-хлорфенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амин получали из 6-хлор-2,3,4,9-тетрагидро-1H-карбазол-1-она и 4-хлоранилина аналогично тому, как описано в Примере 13, получая 25 мг (выход 16%) твердого вещества желтовато-коричневого цвета. 1H-ЯМР (CDCl3): δ 8.01 (m, 1H), 7.46 (d, 1H), 7.21-7.14 (m, 3Н), 7.11 (dd, 1H), 6.65 (d, 2H), 4.76 (m, 1H), 2.70 (m, 2Н), 2.22 (m, 1H),2.01 (m,1H), 1.94-1.75 (m, 2H). MC m/z 329 (M-1).
Пример 17. 6-Хлор-N-(4-фторфенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амин
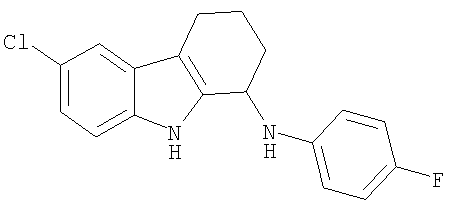
6-Хлор-N-(4-фторфенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амин получали из 6-хлор-2,3,4,9-тетрагидро-1H-карбазол-1-она и 4-фторанилина аналогично тому, как описано в Примере 13, получая 63 мг (выход 43%) твердого вещества желтого цвета. 1H-ЯМР (CDCl3): δ 8.03 (s, 1H), 7.46 (m, 1H), 7.23-7.05 (m, 2H), 6.95 (m, 2H), 6.66 (m, 2H), 4.72 (s, 1H), 3.70 (s, 1H), 2.70 (m, 2H),2.21 (m, 1Н),2.01 (m, 1H), 1.93-1.71 (m, 2H). MC m/z 313 (M-1).
Пример 18. 6-Хлор-N-(4-метилфенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амин
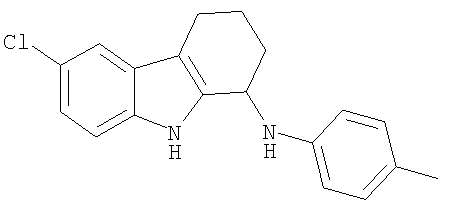
6-Хлор-N-(4-метилфенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амин получали из 6-хлор-2,3,4,9-тетрагидро-1H-карбазол-1-она и п-толуидина аналогично тому, как описано в Примере 13, получая 59 мг (выход 41%) твердого вещества желтого цвета. 1H-ЯМР (CDCl3): δ 8.10 (s, 1H), 7.51 (m, 1H), 7.22 (d, 1H), 7.17-7.06 (m, 3Н), 6.72 (d, 2H), 4.82 (m, 1H), 3.74 (s, 1H), 2.74 (m, 2H), 2.33 (s, 3Н), 2.27 (m, 1H), 2.07 (m, 1H), 1.98-1.76 (m, 2H). MC m/z 309 (M-1).
Пример 19. 6-Бром-N-(4-метоксифенил)-2,3,4,9-тетрагидро-1Н-карбазол-1-амин
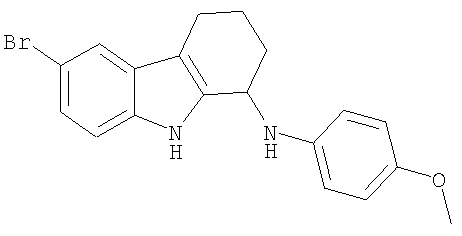
6-Бром-N-(4-метоксифенил)-2,3,4,9-тетрагидро-1Н-карбазол-1-амин получали из 6-бром-2,3,4,9-тетрагидро-1H-карбазол-1-она (100 мг; 0,38 ммоль) и п-анизидина (94 мг; 0,76 ммоль) аналогично тому, как описано в Примере 13, получая 41 мг (29%) твердого вещества светло-коричневого цвета. 1H-ЯМР (ДМСО-d6): δ 11.05 (s, 1Н), 7.54 (s, 1H), 7.22 (d, 1H), 7.11 (d, 1H), 6.73-6.66 (m, 4H), 5.48 (d, 1H), 4.70-4.65 (m, 1H), 3.63 (s, 3Н), 2.66-2.53 (m, 2H), 1.98-1.89 (m, 2H), 1.79-1.71 (m, 2H). MC m/z (M-1) 369, 371.
Пример 20. 6-Бром-N-(4-хлорфенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амин
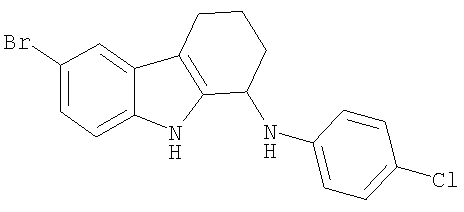
6-Бром-N-(4-хлорфенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амин получали из 6-бром-2,3,4,9-тетрагидро-1H-карбазол-1-она (100 мг; 0,38 ммоль) и 4-хлоранилина (97 мг; 0,76 ммоль) аналогично тому, как описано в Примере 13, получая 29 мг (20%) твердого вещества желтоватого цвета. 1H-ЯМР (ДМСО-d6): δ 11.07 (s, 1H), 7.56 (s, 1H), 7.23 (d, 1H), 7.13-7.08 (m, 3Н), 6.71 (d, 2H), 6.20 (d, 1H), 4.76-4.72 (m, 1H), 2.68-2.54 (m, 2H), 1.99-1.85 (m, 2H), 1.80-1.74 (m, 2H). MC m/z (M-1) 373, 375.
Пример 21. 6-Бром-N-(4-фторфенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амин
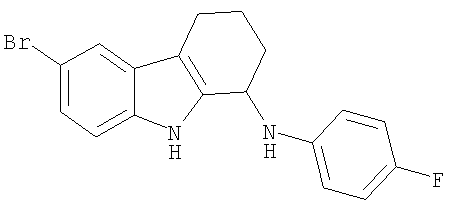
6-Бром-N-(4-фторфенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амин получали из 6-бром-2,3,4,9-тетрагидро-1H-карбазол-1-она (100 мг; 0,38 ммоль) и 4-фторанилина (84 мг; 0,76 ммоль) аналогично тому, как описано в Примере 13, получая 26 мг (19%) твердого вещества желтоватого цвета. 1H-ЯМР (ДМСО-d6): δ 11.07 (s, 1H), 7.55 (d, 1H), 7.23 (d, 1H), 7.12 (dd, 1H), 6.92 (t, 2H), 6.70-6.68 (m, 2H), 5.89 (d, 1H), 4.73-4.71 (m, 1H), 2.68-2.53 (m, 2H), 1.99-1.73 (m, 4H). МС m/z (M-1) 357, 359.
Пример 22. 6-Бром-N-пиримидин-2-ил-2,3,4,9-тетрагидро-1H-карбазол-1-амина гидрохлорид
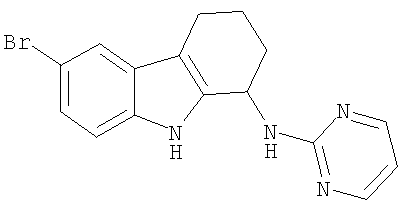
Раствор 6-бром-2,3,4,9-тетрагидро-1Н-карбазол-1-амина (43 мг; 0,16 ммоль) и 2-хлорпиримидина (56 мг; 0,49 ммоль) в N,N-диметилформамиде (1,0 мл) герметично закрывали во флаконе для микроволновой печи и нагревали в микроволновой печи Smith Synthesizer при 150°С в течение 15 минут. Смесь разбавляли этилацетатом (10 мл) и промывали водой (2×10 мл). Органическую фазу концентрировали и очищали колоночной флэш-хроматографией на силикагеле (градиент этилацетат/гексаны, 20%-50%), получая 6-бром-N-пиримидин-2-ил-2,3,4,9-тетрагидро-1H-карбазол-1-амин. Амин разбавляли диэтиловым эфиром (3 мл) и добавляли хлористый водород (1,0 М в диэтиловом эфире). Суспензию концентрировали, разбавляли ацетонитрилом и водой, замораживали и лиофилизовали, получая 6-бром-N-пиримидин-2-ил-2,3,4,9-тетрагидро-1H-карбазол-1-амина гидрохлорид (16 мг; 26%) в виде твердого вещества желтого цвета. 1H-ЯМР (ДМСО-d6): δ 10.94 (s, 1H), 8.44-8.39 (m, 2H), 8.03-7.96 (m, 1H), 7.55 (s, 1H), 7.23 (d, 1H), 7.12 (d, 1H), 6.72 (t, 1H), 5.37-5.32 (m, 1H), 2.63-2.59 (m, 2H), 2.09-1.95 (m, 2H), 1.87-1.75 (m, 2H). МС m/z (M-1) 341,343.
Пример 23. 6-Хлор-N-пиримидин-2-ил-2,3,4,9-тетрагидро-1Н-карбазол-1-амин
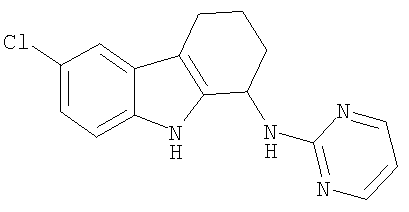
Раствор 6-хлор-2,3,4,9-тетрагидро-1H-карбазол-1-амина (50 мг; 0,23 ммоль) и 2-метилсульфонилпиримидина (69 мг; 0,44 ммоль) в N,N-диметилформамиде (0,50 мл) нагревали при 150°С в течение 900 секунд в микроволновой печи Smith Synthesizer. Смесь разбавляли этилацетатом и экстрагировали 5%-ным водным хлоридом лития. Органический слой отделяли и концентрировали на силикагеле. Очистка флэш-хроматографией (градиент: этилацетат/гексаны, 0%-30%) давала 6-хлор-N-пиримидин-2-ил-2,3,4,9-тетрагидро-1H-карбазол-1-амин (8 мг; выход 12%) в виде твердого вещества желтого цвета.
Альтернативно 6-хлор-N-пиримидин-2-ил-2,3,4,9-тетрагидро-1H-карбазол-1-амин может быть получен с 9%-ным выходом путем нагревания смеси 6-хлор-2,3,4,9-тетрагидро-1H-карбазол-1-амина и 2-хлорсульфонилпиримидина в N,N-диметилформамиде при 60°С в течение 15 часов.
1H-ЯМР (CDCl3): δ 8.88 (s, 1H), 8.37 (m, 2H), 7.46 (m, 1H), 7.19 (d, 1H), 7.09 (dd, 1H), 6.66 (t, 1H), 5.72 (s, 1H), 5.22 (m, 1H), 2.72 (m, 2H), 2.29 (m, 1H), 2.06-1.90 (m, 3H). МС m/z 297 (М-1).
Пример 24. 6-Хлор-N-(4,6-диметоксипиримидин-2-ил)-2,3,4,9-тетрагидро-1H-карбазол-1-амин
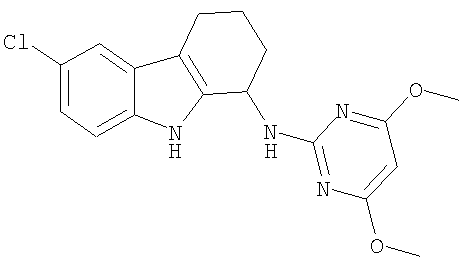
6-Хлор-N-(4,6-диметоксипиримидин-2-ил)-2,3,4,9-тетрагидро-1Н-карбазол-1-амин получали из 6-хлор-2,3,4,9-тетрагидро-1Н-карбазол-1-амина и 4,6-диметокси-2-метилсульфонилпиримидина аналогично тому, как описано выше, получая 8 мг (выход 10%) твердого вещества бледно-желтого цвета. 1H-ЯМР (CDCl3): δ 8.79 (s, 1H), 7.45 (s, 1H), 7.18 (dd, 1H), 7.08 (dd, 1H), 5.50 (s, 1H), 5.24 (m, 1H), 5.18 (m, 1H), 3.88 (2s, 6H), 2.70 (m, 2H), 2.28 (m, 1H), 2.04-1.83 (m, 3H). MC m/z 359 (M+1).
Пример 25. 6-Хлор-N-(4-метилпиримидин-2-ил)-2,3,4,9-тетрагидро-1H-карбазол-1-амин
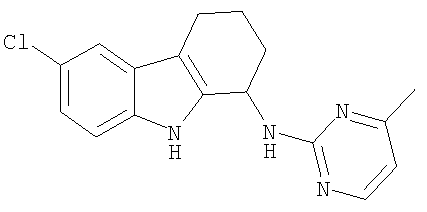
6-Хлор-N-(4-метилпиримидин-2-ил)-2,3,4,9-тетрагидро-1H-карбазол-1-амин получали из 6-хлор-2,3,4,9-тетрагидро-1Н-карбазол-1-амина и 4-метил-2-метилсульфонилпиримидина аналогично тому, как описано выше, получая 6 мг (выход 7%) твердого вещества желтого цвета. 1H-ЯМР (CDCl3): δ 9.05 (s, 1H), 8,23 (d, 1H), 7.45 (m, 1H), 7.17 (d, 1H), 7.07 (dd, 1H), 6.52 (d, 1H), 5.36 (m, 1H), 5.20 (m, 1H), 2.70 (m, 2H), 2.38 (s, 3Н), 2.29 (m, 3Н), 2.02-1.85 (m, 3H). МС m/z 311 (М-1).
Пример 26. 6-Хлор-N-(4,6-диметилпиримидин-2-ил)-2,3,4,9-тетрагидро-1H-карбазол-1-амин
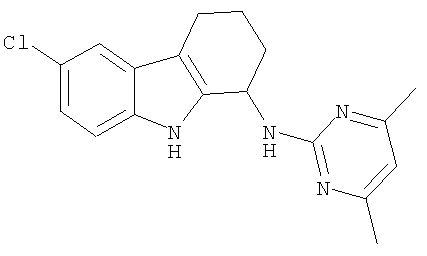
6-Хлор-N-(4,6-диметилпиримидин-2-ил)-2,3,4,9-тетрагидро-1H-карбазол-1-амин получали из 6-хлор-2,3,4,9-тетрагидро-1H-карбазол-1-амина и 2-хлор-4,6-диметилпиримидина аналогично тому, как описано выше, получая 6 мг (выход 8%) масла бледно-желтого цвета. 1H-ЯМР (CDCl3): δ 9.23 (s, 1H), 7.45 (s, 1H), 7.16 (d, 1H), 7.07 (d, 1H), 6.42 (s, 1H), 5.25 (m, 1H), 5.20 (m, 1H), 2.70 (m, 2H), 2.35 (s, 6H), 2.29 (m, 1H), 2.03-1.83 (m, 3Н). МС m/z 327 (М+1).
Пример 27. 6-Бром-N-пиридин-2-ил-2,3,4,9-тетрагидро-1Н-карбазол-1-амина гидрохлорид
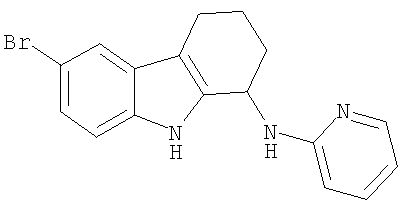
6-Бром-N-пиридин-2-ил-2,3,4,9-тетрагидро-1H-карбазол-1-амина гидрохлорид получали из 6-бром-2,3,4,9-тетрагидро-1Н-карбазол-1-она (150 мг; 0,57 ммоль) и 2-аминопиридина (107 мг; 1,1 ммоль) аналогично тому, как описано выше, получая 10 мг белого порошка в виде гидрохлоридной соли. 1H-ЯМР (ДМСО-d6): δ 11.20 (s, 1Н), 7.99 (d, 1Н), 7.92-7.86 (m, 1H), 7.65 (s, 1H), 7.30 (d, 1H), 7.20 (d, 1H), 7.09-7.02 (m, 1H), 6.91-6.86 (m, 1H), 5.30-5.25 (m, 1H), 2.76-2.60 (m, 1H), 2.16-2.09 (m, 1H), 1.95-1.82 (m, 3H). MC m/z (M-1) 340, 342.
Пример 28. 6-Бром-N-(5-пропилпиримидин-2-ил)-2,3,4,9-тетрагидро-1H-карбазол-1-амин
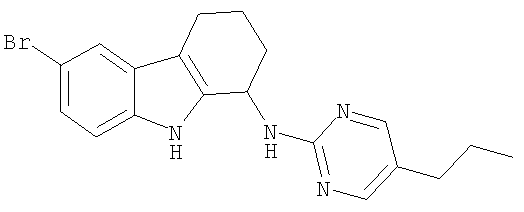
6-Бром-N-(5-пропилпиримидин-2-ил)-2,3,4,9-тетрагидро-1H-карбазол-1-амин получали из 6-бром-2,3,4,9-тетрагидро-1Н-карбазол-1-амина (75 мг; 0,28 ммоль) и 5-пропил-2-хлорпиримидина (0,5 мл) аналогично тому, как описано выше, получая 5 мг (5%) твердого вещества желтого цвета. 1H-ЯМР (ДМСО-d6): δ 10.86 (s, 1H), 8.17 (s, 2Н), 7.53 (s, 1H), 7.30 (d, 1H), 7.22 (d, 1H), 7.10 (d, 1H), 5.30-5.23 (m, 1H), 2.63-2.56 (m, 2Н), 2.36 (t, 2Н), 2.06-1.96 (m, 2Н), 1.84-1.73 (m, 2Н), 1.56-1.47 (m, 2Н), 0.88 (t, 3H). MC m/z (M-1) 383, 385.
Пример 29. 6-Метил-N-пиримидин-2-ил-2,3,4,9-тетрагидро-1H-карбазол-1-амин
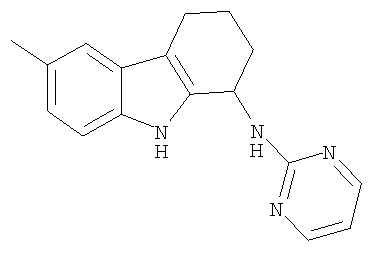
6-Метил-N-пиримидин-2-ил-2,3,4,9-тетрагидро-1H-карбазол-1-амин получали из 6-метил-2,3,4,9-тетрагидро-1Н-карбазол-1-амина и 2-хлорпиримидина аналогично тому, как описано выше, получая 5 мг (4%) твердого вещества желтого цвета. 1H-ЯМР (CDCl3): δ 8.63 (s, 1H), 8.40 (d, 1H), 7.32 (d, 2Н), 7.24 (d, 1H), 7.01 (d, 1H), 6.64 (t, 1H), 5.47 (d, 1H), 5.24 (q, 1H), 2.74 (m, 2Н), 2.44 (s, 3H), 2.36 (t, 1H), 2.00 (m, 3H). MC m/z 279 (M+1).
Пример 30. 6-Метокси-N-пиримидин-2-ил-2,3,4,9-тетрагидро-1H-карбазол-1 амин
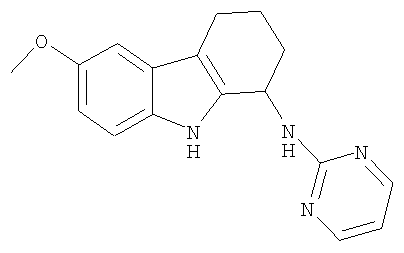
6-Метокси-N-(5-пропилпиримидин-2-ил)-2,3,4,9-тетрагидро-1H-карбазол-1-амин получали из 6-метокси-2,3,4,9-тетрагидро-1H-карбазол-1-амина и 2-хлорпиримидина аналогично тому, как описано выше, получая 4 мг (4%) твердого вещества желтого цвета. 1H-ЯМР (CDCl3): δ 8.72 (s, 1H), 8.40 (d, 2H), 7.25 (d, 1H), 7.00 (s, 1H), 6.84 (d, 1H), 6.64 (t, 1H), 5.47 (d, 1H), 5.24 (q, 1H), 3.85 (s, 3Н), 2.74 (m, 2H), 2.36 (t, 1H), 2.00 (m, 3H). МС m/z 295 (М+1).
Пример 31. N-(4,6-Диметоксипиримидин-2-ил)-6-метил-2,3,4,9-тетрагидро-1H-карбазол-1-амина гидрохлорид
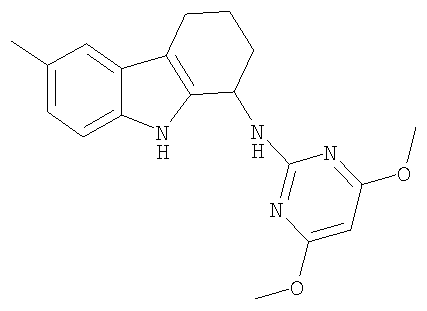
N-(4,6-Диметоксипиримидин-2-ил)-6-метил-2,3,4,9-тетрагидро-1H-карбазол-1-амина гидрохлорид получали из 6-метил-2,3,4,9-тетрагидро-1H-карбазол-1-амина и 2-хлор-4,6-диметоксипиримидина аналогично тому, как описано в Примере 22, получая 12 мг (8%) твердого вещества красноватого цвета. 1H-ЯМР (CDCl3): δ 10.4 (s, 1H), 7.40 (s, 1H), 7.13 (m, 2H), 6.82 (s, 1H), 5.46 (d, 1H), 5.30 (s, 1H), 4.08 (s, 6H), 2.65 (m, 2H), 2.33 (s, 3Н), 2.06 (m, 2H), 1-80 (m, 2H). МС m/z 339 (М+1).
Пример 32. 6-Бром-N-(4,6-диметилпиримидин-2-ил)-2,3,4,9-тетрагидро-1H-карбазол-1-амина гидрохлорид
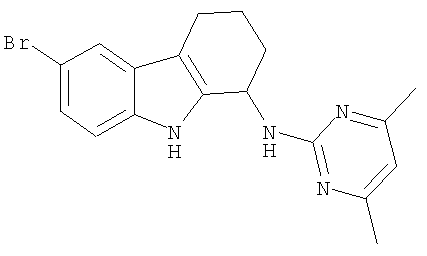
6-Бром-N-(4,6-диметилпиримидин-2-ил)-2,3,4,9-тетрагидро-1Н-карбазол-1-амина гидрохлорид получали из 6-бром-2,3,4,9-тетрагидро-1H-карбазол-1-амина (50 мг; 0,19 ммоль) и 4,6-диметил-2-хлорпиримидина (134 мг; 0,94 ммоль) аналогично тому, как описано в Примере 22, получая 12 мг (16%) твердого вещества желтого цвета. 1H-ЯМР (ДМСО-d6): δ 10.98 (s, 1H), 8.40 (br s, 2H), 7.59 (s, 1H), 7.26 (d, 1H), 7.16 (d, 1H), 6.77 (s, 1H), 5.52-5.48 (m, 1H), 2.68-2.61 (m, 2H), 2.41 (2s, 6H), 2.15-2.06 (m, 1H), 2.04-1.96 (m, 1H), 1.91-1.76 (m, 2H). MC m/z (M+1) 371, 373. (M-1) 369, 371.
Пример 33. 6-Бром-N-[5-(трифторметил)пиримидин-2-ил]-2,3,4,9-тетрагидро-1H-карбазол-1-амин
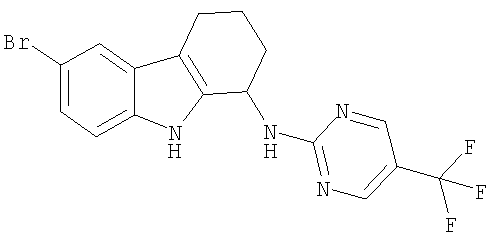
6-Бром-N-[5-(трифторметил)пиримидин-2-ил]-2,3,4,9-тетрагидро-1H-карбазол-1-амин получали из 6-бром-2,3,4,9-тетрагидро-1H-карбазол-1-амина (75 мг; 0,28 ммоль) и 2-хлор-5-(трифторметил)пиримидина (0,5 мл) аналогично тому, как описано в Примере 22, получая 5 мг (4%) твердого вещества желтого цвета. 1H-ЯМР (ДМСО-d6), снятый при 80°С: δ 10.94-10.88 (m, 1H), 8.69-8.62 (m, 1H), 8.30-8.24 (m, 1H), 7.55 (s, 1H), 7.21 (d, 1H), 7.13-7.10 (m, 1H), 7.02 (d, 1H), 5.40-5.27 (m, 1H), 2.62-2.58 (m, 2H), 2.08-1.96 (m, 2H), 1.87-1.76 (m, 2H). MC m/z (М-1) 409, 411.
Пример 34. 6-Бром-N-[5-(трифторметил)пиридин-2-ил]-2,3,4,9-тетрагидро-1H-карбазол-1-амин

6-Бром-N-[5-(трифторметил)пиридин-2-ил]-2,3,4,9-тетрагидро-1H-карбазол-1-амин получали из 6-бром-2,3,4,9-тетрагидро-1H-карбазол-1-амина (75 мг; 0,28 ммоль) и 5-(трифторметил)-2-бромпиридина (192 мг; 0,85 ммоль) аналогично тому, как описано в Примере 22, получая 6,5 мг (6%) твердого вещества желтоватого цвета. 1H-ЯМР (ДМСО-d6): δ 10.95 (s, 1Н), 8.36 (s, 1H), 7.79 (d, 1H), 7.64 (dd, 1H), 7.57 (s, 1H), 7.23 (d, 1H), 7.13 (dd, 1H), 6.62 (d, 1H), 5.40-5.36 (m, 1H), 2.70-2.55 (m, 2H), 2.06-1.78 (m, 4H). MC m/z (M-1) 408, 410.
Пример 35. 6-[(6-Бром-2,3,4,9-тетрагидро-1Н-карбазол-1-ил)амино]никотинонитрил
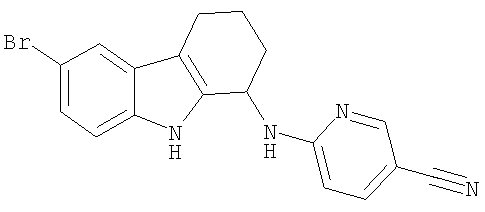
6-[(6-Бром-2,3,4,9-тетрагидро-1Н-карбазол-1-ил)амино]никотинонитрил получали из 6-бром-2,3,4,9-тетрагидро-1H-карбазол-1-амина (75 мг; 0,28 ммоль) и 6-хлорникотинонитрила (118 мг; 0,85 ммоль) аналогично тому, как описано в Примере 22, получая 6,5 мг (6%) твердого вещества светло-коричневого цвета. 1H-ЯМР (ДМСО-d6): δ 10.95 (s, 1H), 8.36 (s, 1H), 7.79 (d, 1H), 7.64 (dd, 1H), 7.57 (d, 1H), 7.23 (d, 1H), 7.13 (dd, 1H), 6.62 (d, 1H), 5.40-5.36 (m, 1H), 2.70-2.55 (m, 2H), 2.07-1.78 (m, 4H). MC m/z (M-1) 365, 367.
Пример 36. N-(1,3-Бензотиазол-2-ил)-6-бром-2,3,4,9-тетрагидро-1Н-карбазол-1-амин
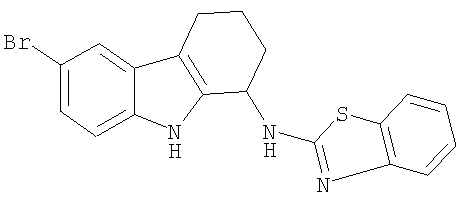
N-(1,3-Бензотиазол-2-ил)-6-бром-2,3,4,9-тетрагидро-1H-карбазол-1-амин получали из 6-бром-2,3,4,9-тетрагидро-1Н-карбазол-1-амина (75 мг; 0,28 ммоль) и 2-хлорбензотиазола (143 мг; 0,84 ммоль) аналогично тому, как описано в Примере 22, получая 11 мг (10%) твердого вещества желтого цвета. 1H-ЯМР (CDCl3): δ 9.31 (s, 1H), 7.70-7.62 (m, 3H), 7.39 (t, 1H), 7.29-7.17 (m, 4H), 5.38-5.32 (m, 1H), 2.77-2.75 (m, 2H), 2.45-2.38 (m, 1H), 2.10-1.99 (m, 3H). MC m/z (M-1) 396, 398.
Пример 37. N-Пиримидин-2-ил-2,3,4,9-тетрагидро-1Н-карбазол-1-амин
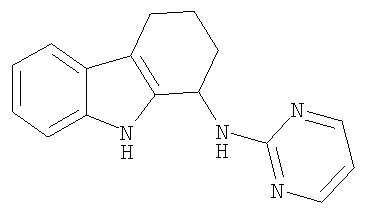
N-Пиримидин-2-ил-6-бром-2,3,4,9-тетрагидро-1H-карбазол-1-амин получали из 6-бром-2,3,4,9-тетрагидро-1H-карбазол-1-амина (150 мг; 0,81 ммоль) и 2-хлорпиримидина (184 мг; 1,62 ммоль) аналогично тому, как описано в Примере 22, получая 16 мг (8%) твердого вещества желтого цвета. 1H-ЯМР (ДМСО-d6): δ 10.63 (s, 1H), 8.32 (d, 2H), 7.43 (d, 1H), 7.36 (d, 1H), 7.25 (d, 1H), 7.01-6.97 (m, 1H), 6.93-6.89 (m, 1H), 6.60 (t, 1H), 5.32-5.28 (m, 1H), 2.68-2.57 (m, 2H), 2.04-1.97 (m, 2H), 1.87-1.75 (m, 2H).
Пример 38. 2-Бром-N-пиримидин-2-ил-5,6,7,8,9,10-гексагидроциклогепта[b]индол-6-амин
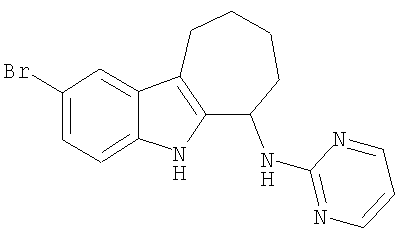
2-Бром-N-пиримидин-2-ил-5,6,7,8,9,10-гексагидроциклогепта[b]индол-6-амин получали из 6-бром-5,6,7,8,9,10-гексагидроциклогепта[b]индол-6-амина (150 мг; 0,54 ммоль) и 2-хлорпиримидина (123 мг; 1,07 ммоль) аналогично тому, как описано в Примере 22, получая 18 мг (9%) твердого вещества желтого цвета. 1H-ЯМР (ДМСО-d6): δ 10.80 (s, 1H), 8.31 (d, 2H). 7.57 (s, 1H), 7.49 (d, 1H), 7.20 (d, 1H), 7.07-7.04 (m, 1H), 6.60 (t, 1H), 5.36-5.33 (m, 1H), 2.94-2.89 (m, 1H), 2.70-2.63 (m, 1H), 2.05-1.94 (m, 2H), 1.89-1.59 (m, 4H). МС m/z (M+1) 357, 359; (М-1) 355, 357.
Пример 39. 6-Метил-N-пиридин-2-ил-2,3,4,9-тетрагидро-1H-карбазол-1-амина гидрохлоридная соль
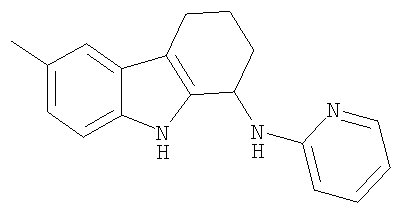
6-Метил-N-пиридин-2-ил-6-бром-2,3,4,9-тетрагидро-1H-карбазол-1-амина гидрохлоридную соль получали из 6-метил-2,3,4,9-тетрагидро-1Н-карбазол-1-она (0,10 г; 0,5 ммоль) и 2-аминопиридина (0,51 г; 0,55 ммоль) аналогично тому, как описано выше, получая твердое вещество коричневого цвета (0,002 г; 1,0%). 1H-ЯМР (CDCl3): δ 8.72 (s, 1H), 8.23 (d, 1H), 7.48 (t, 1H), 7.32 (s, 1H), 7.20 (d, 1H), 7.00 (d, 1H), 6.69 (t, 1H), 6.49 (d, 1H), 5.25 (d, 1H), 4.71 (d, 1H), 2.80-2.75 (m, 2H), 2.40-2.28 (m, 1H), 2.09-1.91 (m, 3Н). МС m/z 183 (M-94).
Пример 40. Метил-1-анилино-2,3,4,9-тетрагидро-1H-карбазол-6-карбоксилат
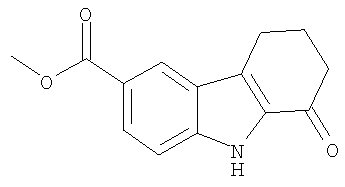
Метил-1-анилино-2,3,4,9-тетрагидро-1H-карбазол-6-карбоксилат получали из 6-бром-2,3,4,9-тетрагидро-1H-карбазол-1-она (0,05 г; 0,19 ммоль), ацетата палладия (0,04 г; 0,02 ммоль), dppf (1,1'-бис(дифенилфосфино)ферроцен) (0,01 г; 0,02 ммоль) и триэтиламина (0,025 мл; 0,19 ммоль). Реагенты добавляли в круглодонную колбу с мешалкой вместе со смесью диметилсульфоксид/метанол (3:1; 5,0 мл) и нагревали до 85°С при атмосферном давлении оксида углерода в течение 4 часов. Раствор охлаждали до комнатной температуры, добавляли воду (5,0 мл) и этилацетат (25 мл), слои разделяли и органический слой промывали водой (5,0 мл). Органический слой сушили над Na2SO4, фильтровали и упаривали, получая масло, которое очищали хроматографией (градиент: этилацетат/гексаны, 5-50%), получая твердое вещество белого цвета (0,03 г; 65%). 1H-ЯМР (CDCl3): δ 9.35 (s, 1H), 8.46 (s, 1H), 8.05 (d, 1H), 7.45 (d, 1H), 3.95 (t, 3H), 3.06 (t, 2H), 2.69 (t, 2H), 2.30 (t, 2H). MC m/z 244(M+1).
Пример 41. Метил-1-анилино-2,3,4,9-тетрагидро-1H-карбазол-6-карбоксилат
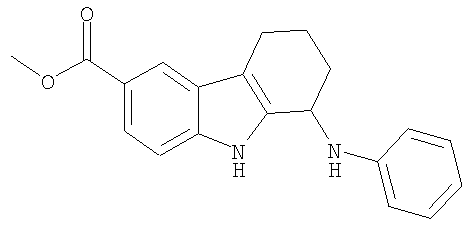
Метил-1-анилино-2,3,4,9-тетрагидро-1H-карбазол-6-карбоксилат получали из 6-метил-2,3,4,9-тетрагидро-1Н-карбазол-1-она (0,03 г; 0,11 ммоль) и анилина (0,13 мл; 0,13 ммоль) аналогично тому, как описано выше. Дальнейшая очистка посредством ВЭЖХ с обращенной фазой (колонка Waters С18 Symmetry, 50-90% ацетонитрил/вода, 8,5 мин, 35 мл/мин) давала твердое вещество желтого цвета (0,005 г; 13%). 1H-ЯМР (CDCl3): δ 8.27 (s, 1H), 8.25 (s, 1H), 7.86 (d, 1H), 7.27 (t, 2H), 7.23 (d, 1H), 6.79 (t, 1H), 6.75 (d, 2H), 4.83 (t, 1H), 3.93 (s, 3H), 2.78 (t, 2H), 2.28-2.20 (m, 1H), 2.07-2.00 (m, 1H), 1.92-1.80 (m, 1H). MC m/z 228 (M-93).
Пример 42. 6-[(6-Метил-2,3,4,9-тетрагидро-1Н-карбазол-1-ил)амино]никотинонитрила гидрохлоридная соль
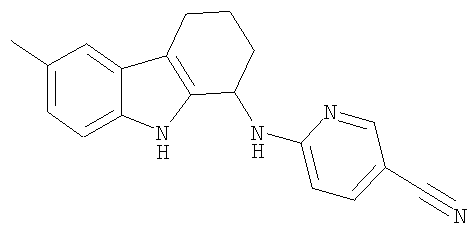
6-[(6-Метил-2,3,4,9-тетрагидро-1H-карбазол-1-ил)амино]никотинонитрила гидрохлоридную соль получали из 6-метил-2,3,4,9-тетрагидро-1Н-карбазол-1-амина (0,10 г; 0,50 ммоль) и 6-хлорникотинонитрила (0,138 г; 0,1 ммоль) аналогично тому, как описано выше, получая твердое вещество светло-коричневого цвета (0,005 г; 3,0%). 1H-ЯМР (CDCl3): δ 8.49 (s, 1H), 8.33 (s, 1H), 7.56 (d, 1H), 7.28 (s, 1H), 7.18 (d, 1H), 6.99 (d, 1H), 6.42 (d, 1H), 5.31 (d, 1H), 5.15 (d, 1H), 2.77-2.70 (m, 2H), 2.28-2.25 (m, 1H), 2.00-1.92 (m, 3H). MC m/z 301 (M-1).
Пример 43. N-Фенил-6-(трифторметил)-2,3,4,9-тетрагидро-1H-карбазол-1-амина гидрохлорид
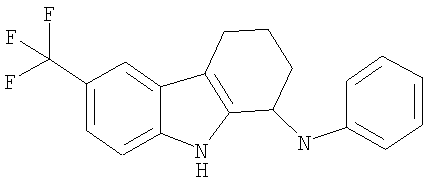
N-Фенил-6-(трифторметил)-2,3,4,9-тетрагидро-1H-карбазол-1-амина гидрохлорид получали из 6-(трифторметил)-2,3,4,9-тетрагидро-1Н-карбазол-1-она (150 мг; 0,59 ммоль) и анилина (110 мг; 1,2 ммоль) аналогично тому, как описано выше, получая 15 мг (7%) твердого вещества белого цвета. 1H-ЯМР (ДМСО-d6): δ 11.36 (s, 1Н), 7.77 (s, 1H), 7.46-7.30 (m, 4H), 7.14-7.10 (m, 2H), 6.81-6.58 (m, 2H), 4.83-4.80 (m, 1H), 2.75-2.58 (m, 2H), 2.08-1.80 (m, 4H). MC m/z (M-1) 329.
Пример 44. N-Фенил-2,3,4,9-тетрагидро-1Н-карбазол-1-амин
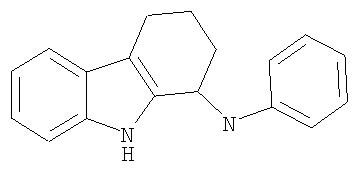
N-Фенил-2,3,4,9-тетрагидро-1H-карбазол-1-амин получали из 2,3,4,9-тетрагидро-1H-карбазол-1-она (150 мг; 0,81 ммоль) и анилина (1,0 г; 11 ммоль) аналогично тому, как описано выше, получая 24 мг (11%) твердого вещества белого цвета. 1H-ЯМР (ДМСО-d6): δ 10.83 (s, 1H), 7.40 (d, 1H), 7.28 (d, 1H), 7.09 (t, 2H), 7.03 (t, 1H), 6.94 (t, 1H), 6.72 (d, 2H), 6.54 (t, 1H), 5.91 (d, 1H), 4.79-4.75 (m, 1H), 2.73-2.67 (m, 1H), 2.64-2.57 (m, 1H), 2.01-1.73 (m, 4H). MC m/z (M-93) 170.
Пример 45. 6-Бром-N-(3-метоксифенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амин
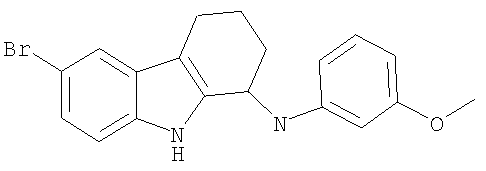
6-Бром-N-(3-метоксифенил)-2,3,4,9-тетрагидро-1Н-карбазол-1-амин получали из 6-бром-2,3,4,9-тетрагидро-1Н-карбазол-1-она (100 мг; 0,38 ммоль) и м-анизидина (94 мг; 0,76 ммоль) аналогично тому, как описано выше, получая 37 мг (26%) твердого вещества белого цвета. 1H-ЯМР (ДМСО-d6): δ 11.04 (s, 1Н), 7.55 (s, 1H), 7.23 (d, 1H), 7.12 (dd, 1H), 6.97 (t, 1H), 6.32-6.27 (m, 2H), 6.13 (dd, 1H), 5.96 (d, 1H), 4.76-4.72 (m, 1H), 3.65 (s, 3Н), 2.68-2.52 (m. 2H), 2.00-1.87 (m, 2H), 1.82-1.74 (m, 2H). MC m/z (M-1) 369, 371.
Пример 46. 6-Бром-N-(3-фторфенил)-2,3,4,9-тетрагидро-1Н-карбазол-1-амин
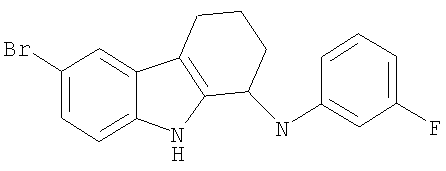
6-Бром-N-(3-фторфенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амин получали из 6-бром-2,3,4,9-тетрагидро-1Н-карбазол-1-она (100 мг; 0,38 ммоль) и 3-фторанилина (84 мг; 0,76 ммоль) аналогично тому, как описано выше, получая 17 мг (12%) твердого вещества белого цвета. 1H-ЯМР (ДМСО-d6): δ 11.08 (s, 1H), 7.56 (s, 1H), 7.23 (d, 1H), 7.14-7.04 (m, 2H), 6.53-6.48 (m, 2H), 6.36-6.26 (m, 2H), 4.78-4.76 (m, 1H), 2.69-2.53 (m, 2H), 2.00-1.85 (m, 2H), 1.81-1.76 (m, 2H). MC m/z (M+1) 357,359.
Пример 47. 6-Бром-N-(1H-индол-5-ил)-2,3,4,9-тетрагидро-1Н-карбазол-1-амин
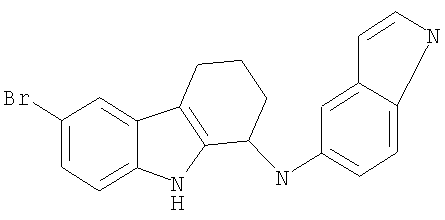
6-Бром-N-(1H-индол-5-ил)-2,3,4,9-тетрагидро-1Н-карбазол-1-амин получали из 6-бром-2,3,4,9-тетрагидро-1H-карбазол-1-она (100 мг; 0,76 ммоль) и 5-аминоиндола (100 мг; 0,76 ммоль) аналогично тому, как описано выше, получая 54 мг (37%) твердого вещества белого цвета. 1H-ЯМР (ДМСО-d6): δ 11.08 (s, 1H), 10.61 (s, 1H), 7.55 (d, 1H), 7.23 (d, 1H), 7.14-7.11 (m, 2H), 7.10 (d, 1H), 6.84-6.83 (m, 1H), 6.65 (dd, 1H), 6.18-6.17 (m, 1H), 5.21 (d, 1H), 4.77-4.71 (m, 1H), 2.68-2.54 (m, 2H), 2.02-1.89 (m, 2H), 1.84-1.73 (m, 2H). MC m/z (M+1) 378, 380.
Пример 48. 6-Бром-N-(2-метоксифенил)-2,3,4,9-тетрагидро-1Н-карбазол-1-амин
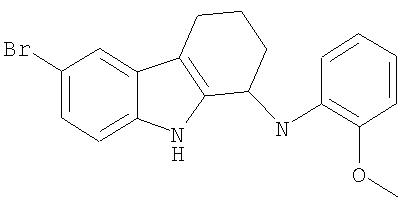
6-Бром-N-(2-метоксифенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амин получали из 6-бром-2,3,4,9-тетрагидро-1Н-карбазол-1-она (200 мг; 0,76 ммоль) и о-анизидина (187 мг; 1,52 ммоль) аналогично тому, как описано выше, и перекристаллизовывали из ацетонитрила, получая 30 мг (11%) кристаллов желтого цвета. 1H-ЯМР (ДМСО-d6): δ 11.07 (s, 1H), 7.56 (d, 1H), 7.22 (d, 1H), 7.13 (dd, 1H), 6.84-6.73 (m, 3H), 6.60-6.56 (m, 1H), 4.85-4.80 (m, 1H), 4.72 (d, 1H), 3.73 (s, 3H), 2.70-2.53 (m, 2H), 2.00-1.75 (m, 4H). МС m/z (M-1) 369, 371.
Пример 49. 6-Бром-N-(2-хлорфенил)-2,3,4,9-тетрагидро-1Н-карбазол-1-амин
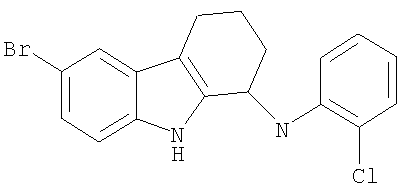
6-Бром-N-(2-хлорфенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амин получали из 6-бром-2,3,4,9-тетрагидро-1H-карбазол-1-она (200 мг; 0,76 ммоль) и 2-хлоранилина (193 мг; 1,51 ммоль) аналогично тому, как описано выше, получая 43 мг (15%) твердого вещества белого цвета. 1H-ЯМР (ДМСО-d6): δ 11.08 (s, 1H), 7.57 (d, 1H), 7.27-7.23 (m, 2H), 7.16-7.12 (m, 2H), 6.92 (d, 1H), 6.64-6.60 (m, 1H), 5.12 (d, 1H), 4.95-4.90 (m, 1H), 2.71-2.56 (m, 2H), 2.04-1.76 (m, 4H). MC m/z (M-1) 373, 375.
Пример 50. 6-Бром-N-(2-фторфенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амин
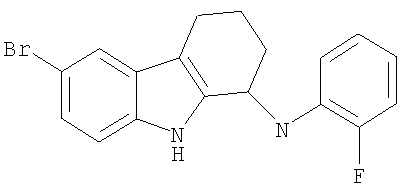
6-Бром-N-(2-фторфенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амин получали из 6-бром-2,3,4,9-тетрагидро-1H-карбазол-1-она (200 мг; 0,76 ммоль) и 2-фторанилина (168 мг; 1,51 ммоль) аналогично тому, как описано выше, получая 37 мг (14%) твердого вещества белого цвета. 1H-ЯМР (ДМСО-d6): δ 11.04 (s, 1H), 7.55 (d, 1H), 7.23 (d, 1H), 7.12 (dd, 1H), 7.0.5-6.85 (m, 3H), 6.59-6.54 (m, 1H), 5.53 (m, 1H), 4.87-4.82 (m, 1H), 2.68-2.57 (m, 2H), 2.04-1.92 (m, 2H), 1.87-1.72 (m, 2H).
Пример 51. 6-Бром-N-(3,4-дихлорфенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амин
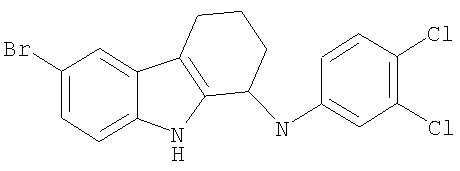
6-Бром-N-(3,4-дихлорфенил)-2,3,4,9-тетрагидро-1Н-карбазол-1-амин получали из 6-бром-2,3,4,9-тетрагидро-1Н-карбазол-1-она (200 мг; 0,76 ммоль) и 3,4-дихлоранилина (245 мг; 1,51 ммоль) аналогично тому, как описано выше, получая 12 мг (4%) твердого вещества желтоватого цвета. 1H-ЯМР (ДМСО-d6): δ 11.08 (s, 1H), 7.57 (d, 1H), 7.26 (d, 1H), 7.23 (d, 1H), 7.13 (dd, 1H), 6.92 (d, 1H), 6.70 (dd, 1H), 6.52 (d, 1H), 4.79-4.77 (m, 1H), 2.68-2.52 (m, 2H), 1.99-1.72 (m, 4H). MC m/z (M-1) 409.
Пример 52. 6-Бром-N-(4-фторфенокси)-2,3,4,9-тетрагидро-1H-карбазол
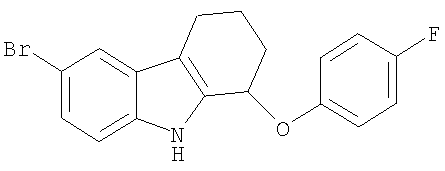
a) 6-Бром-2,3,4,9-тетрагидро-1H-карбазол-1-ол
К раствору 6-бром-2,3,4,9-тетрагидро-1H-карбазол-1-она (500 мг; 1,9 ммоль) в метаноле (20 мл) порциями добавляли борогидрид натрия (144 мг; 3,8 ммоль). Реакционную смесь перемешивали в течение одного часа и гасили водой (5 мл). Реакционную смесь концентрировали, разбавляли метиленхлоридом и промывали водой. Органическую фазу концентрировали и неочищенный спирт очищали флэш-хроматографией на силикагеле (градиент: этилацетат/гексаны, от 5% до 30%), получая 6-бром-2,3,4,9-тетрагидро-1Н-карбазол-1-ол (255 мг; 50%) в виде твердого вещества светло-коричневого цвета: 1H-ЯМР (ДМСО-d6): δ 10.99 (s, 1H), 7.54 (d, 1H), 7.25 (d, 1H), 7.12 (dd, 1H), 5.18 (d, 1H), 4.75-4.70 (m, 1H), 2.64-2.53 (m, 2H), 2.02-1.91 (m, 2H), 1.77-1.66 (m, 2H). MC m/z (M-1) 339, 341.
b) 6-Бром-N-(4-фторфенокси)-2,3,4,9-тетрагидро-1H-карбазол
К раствору 6-бром-2,3,4,9-тетрагидро-1Н-карбазол-1-ола (50 мг; 0,19 ммоль) в ТГФ (5 мл) добавляли п-фторфенол (43 мг; 0,38 ммоль), трифенилфосфин на полимерной подложке (1,67 ммоль/г; 228 мг; 0,38 ммоль) и диизопропилазодикарбоксилат (77 мг; 0,38 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 16 ч и добавляли дополнительное количество диизопропилазодикарбоксилата (77 мг; 0,38 ммоль). Реакционную смесь перемешивали в течение 16 ч, фильтровали и концентрировали. Неочищенный продукт очищали флэш-хроматографией на силикагеле (градиент: этилацетат/гексаны, от 2% до 20%), получая 6-бром-N-(4-фторфенокси)-2,3,4,9-тетрагидро-1Н-карбазол (8 мг, 12%) в виде твердого вещества белого цвета. 1H-ЯМР (ДМСО-d6): δ 11.20 (s, 1H), 7,61 (d, 1H), 7.26 (d, 1H), 7.16-7.06 (m, 5H), 5.53 (t, 1H), 2.75-2.69 (m, 1H), 2.57-2.50 (m, 1H), 2.02-1.76 (m, 4H).
БИОЛОГИЧЕСКИЕ ЭКСПЕРИМЕНТЫ И РЕЗУЛЬТАТЫ
Предполагается, что соединения по настоящему изобретению полезны в лечении и/или профилактике состояний и заболеваний, ассоциированных с HPV-инфекцией. Активность, опосредованную через HPV, определяли, используя следующий W-12 клеточный анализ.
Культура клеток и среда
Используемая линия клеток W12 содержит ДНК HPV16 и происходит из цервикальной ткани с дисплазией слабой степени от Margaret Stanley и впоследствии клонально селектирована Paul Lambert (University of Wisconsin). Один из этих клонов, W12-20850, содержит 1000 копий эписомальной ДНК HPV16 и был использован в клеточном анализе. Клетки W12-20850 культивировали обычным образом с гамма-облученным (6000 рад) питающим слоем клеток 3Т3. Однако анализы проводили в отсутствие питающего слоя 3Т3. Клетки W12-20850 и 3Т3 обычным образом разделяли, когда они становились субконфлюэнтными. W12-20850 растили в среде W12, состоящей из 25% DMEM (Gibco BRL, № по каталогу 12430-047), 75% среды F12 (Gibco BRL, № по каталогу 11765-021) и 2,5% FBS. Добавки включают аденин (24,0 мг/мл; Sigma, № по каталогу А-9795), гидрокортизон (0,4 мг/мл; Calbiochem, № по каталогу 386698), бычий инсулин (5,0 мг/мл; Sigma, № по каталогу 1-1882), холерный токсин (8,4 нг/мл; Fluka, № по каталогу 26694) и EGF (10 нг/мл; Invitrogen, № по каталогу 13247-051). Клетки 3Т3 выращивали в DMEM, содержащей 10% FBS. Клеточные линии инкубировали при 37°С в присутствии 5% CO2.
Клеточный анализ
Для проведения анализа клетки W12-20850 рассевали в 96-луночные планшеты, содержащие соединения. Планшеты инкубировали при 37°С в присутствии 5% CO2 в течение четырех суток. На четвертые сутки клетки лизировали, и количество эписомальной ДНК HPV-16 определяли с использованием методики нерадиоактивного гибридного захвата со специфическими зондами для захвата HPV-16 и детекции. Затем определяли процент ингибирования относительно необработанных контрольных клеток.
Гибридный захват
Анализ гибридного захвата проводили в формате 96-луночного планшета. Гибридизационные планшеты (Nunc Maxisorb, № по каталогу 450320) покрывали смесью зонда для захвата и раствора ReactiBind по меньшей мере в течение 4 часов и затем промывали 0,2XSSC, 0,05% Tween 20 (SSCT) перед тем, как блокировать 150 мкл на лунку 0,2 н. NaOH, 1% igepal, 10 мг/мл hsDNA в течение 6-8 часов. Гибридизацию проводили путем смешивания 27 мкл лизированных клеток с 45 мкл денатурированного зонда для детекции в 6 М гуанидина изотиоцианате. Для предупреждения испарения в каждую лунку добавляли по 50 мкл минерального масла. Затем планшет нагревали до 90°С в течение 6,5 минут и гибридизацию продолжали при 42°С в течение ночи. Анализируемые планшеты промывали 6 раз SSC/T. Конъюгированные с пероксидазой хрена (HRP) антитела против дигоксигенина (Boehringer Mannheim 1207733, 1:5000) инкубировали в лунках в течение 30 мин при комнатной температуре и промывали PBS/0,05% Tween-20. Добавляли субстрат SuperSignal LBA (№ по каталогу Pierce 37070), и хемилюминесценцию измеряли с использованием планшет-ридера Wallac 1420 Victor.
Тестируемые соединения использовали в свободной форме или в форме соли.
Все исследования проводили в соответствии с принципами заботы о лабораторных животных (публикация Национального института здоровья №85-23, исправлена в 1985 году) и правилами GlaxoSmithKline по использованию животных.
Примеры фармацевтических композиций
1. Таблетка
Соединение по изобретению просеивают и смешивают с лактозой, кукурузным крахмалом и предварительно желатинизированным кукурузным крахмалом. В очищенной воде растворяют полисорбат 80. К смеси добавляют подходящие объемы полисорбата 80 и смесь гранулируют. После сушки гранулы просеивают и смешивают со стеаратом магния. Затем гранулы прессуют в таблетки.
2. Капсула
Исходные компоненты отвешивают и затем просеивают. Действующее вещество (1) перемешивают с исходными компонентами (2) и (3) в течение 30 минут и затем измельчают. Полученную смесь перемешивают с компонентами (4) и (5) в течение 15 минут. Затем полученной смесью заполняют твердые желатиновые капсулы подходящего размера, которые затем упаковывают надлежащим образом.
Хотя в данном описании подробно проиллюстрированы и описаны конкретные воплощения настоящего изобретения, данное изобретение не ограничивается ими. Приведенные выше подробные описания даются как типичные примеры настоящего изобретения, и их не следует истолковывать как ограничивающие изобретение каким-либо образом. Модификации будут очевидны специалистам в данной области, и любые модификации, которые не отступают от сущности изобретения, подразумеваются включенными в объем приложенной формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ТЕТРАГИДРОКАРБАЗОЛА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 2005 |
|
RU2430088C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ ПИРРОЛО[3,2-d]ПИРИМИДИН-4-ОНА И ИХ ПРИМЕНЕНИЕ В ТЕРАПИИ | 2005 |
|
RU2577858C2 |
| ТРИЦИКЛИЧЕСКИЕ ИНДОЛЬНЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ ЛИГАНДОВ PBR | 2010 |
|
RU2525196C2 |
| 1-(2-ИЗОПРОПОКСИЭТИЛ)-2-ТИОКСО-1,2,3,5-ТЕТРАГИДРО-ПИРРОЛО[3,2-d]ПИРИМИДИН-4-ОН И ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ | 2005 |
|
RU2409578C2 |
| ПРОИЗВОДНЫЕ ЗАМЕЩЕННОГО ПИРРОЛОПИРИДИНОНА, ПРИГОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ФОСФОДИЭСТЕРАЗЫ | 2001 |
|
RU2267490C2 |
| ПРОИЗВОДНЫЕ 3-(ГЕТЕРОАРИЛАМИНО)-1,2,3,4-ТЕТРАГИДРО-9Н-КАРБАЗОЛА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ МОДУЛЯТОРОВ РЕЦЕПТОРОВ ПРОСТАГЛАНДИНА D2 | 2011 |
|
RU2562255C2 |
| ПРОИЗВОДНЫЕ БЕТА-КАРБОЛИНА, ОБЛАДАЮЩИЕ ДЕЙСТВИЕМ ИНГИБИТОРОВ ФОСФОДИЭСТЕРАЗЫ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ (ВАРИАНТЫ), СПОСОБ ЕЕ ПОЛУЧЕНИЯ, СПОСОБ ИНГИБИРОВАНИЯ ДЕЙСТВИЯ ФОСФОДИЭСТЕРАЗЫ (ВАРИАНТЫ) И СПОСОБ УВЕЛИЧЕНИЯ КОНЦЕНТРАЦИИ ЦГМФ | 2001 |
|
RU2271358C2 |
| ПРОИЗВОДНЫЕ ПИПЕРИДИНОВ | 2011 |
|
RU2554353C2 |
| НОВЫЕ ПИРАЗОЛПИРИМИДИНОВЫЕ ПРОИЗВОДНЫЕ | 2017 |
|
RU2769448C2 |
| НОВЫЕ БИЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ИХ | 2016 |
|
RU2760554C1 |
Настоящее изобретение относится к новым производным тетрагидрокарбазола формулы (I)
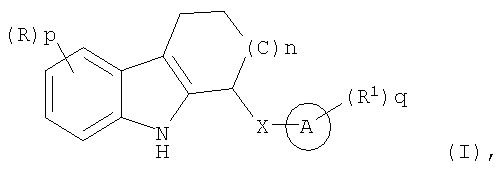
где n равно 0, 1 или 2; Х представляет собой NH или О; каждый R является одинаковым или разным и независимо выбран из группы, состоящей из галогена, галогеноалкила, алкила, алкенила, алкинила, циклоалкила, циклоалкенила, -R10циклоалкила, -OR2, -R10OR2, -R10C(O)R2, -C(O)R2, -CO2R2, -R10CO2R2, -R10SO2R2, -S(O)mR2, циано или нитро; каждый R1 является одинаковым или разным и независимо выбран из группы, состоящей из галогена, галогеноалкила, алкила, алкенила, алкинила, циклоалкила, циклоалкенила, -R10циклоалкила, -OR2, -R10OR2, -R10C(O)R2, -C(O)R2, -CO2R2, -R10CO2R2, -R10SO2R2, -S(O)mR2, циано или нитро; каждое m независимо равно 2; каждый R10 является одинаковым или разным и независимо выбран из алкилена; p и q каждое независимо выбрано из 0, 1, 2, 3, 4 или 5; каждый R2 является одинаковым или разным и независимо выбран из группы, состоящей из Н, алкила, алкенила, алкинила, циклоалкила, циклоалкенила, -R10циклоалкила и -R10OH; кольцо А представляет собой фенил, нафтил или гетероарил, где гетероарил представляет собой моноциклическое пяти - семичленное ароматическое кольцо или конденсированную бициклическую ароматическую кольцевую систему, состоящую из двух таких ароматических колец, содержащих один или два атома азота и/или серы, и его фармацевтически приемлемые соли, сольваты, сложные эфиры и амиды. Соединения формулы (I) обладают действием против расстройств, вызванных HPV-инфекцией, и полезным в лечении вирусов папилломы человека. Изобретение также относится к фармацевтической композиции на основе соединений формулы 1 и к их применению в изготовлении лекарств для использования в лечении и профилактике состояний или расстройств, вызванных HPV-инфекцией. 7 н. и 24 з.п. ф-лы, 2 табл.
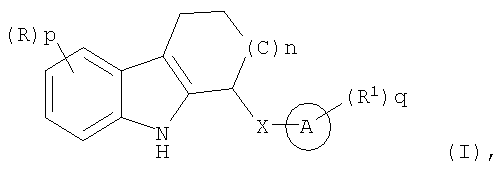
где n равно 0, 1 или 2;
Х представляет собой NH или О;
каждый R является одинаковым или разным и независимо выбран из группы, состоящей из
галогена, галогеноалкила, алкила, алкенила, алкинила, циклоалкила, циклоалкенила, -R10циклоалкила, -OR2, -R10OR2, -R10C(O)R2, -C(O)R2, -CO2R2, -R10CO2R2, -R10SO2R2, -S(O)mR2, циано или нитро;
каждый R1 является одинаковым или разным и независимо выбран из группы, состоящей из галогена, галогеноалкила, алкила, алкенила, алкинила, циклоалкила, циклоалкенила, -R10циклоалкила, -OR2, -R10OR2, -R10C(O)R2, -C(O)R2, -CO2R2, -R10CO2R2, -R10SO2R2, -S(O)mR2, циано или нитро;
каждое m независимо равно 2;
каждый R10 является одинаковым или разным и независимо выбран из алкилена;
p и q каждое независимо выбрано из 0, 1, 2, 3, 4 или 5;
каждый R2 является одинаковым или разным и независимо выбран из группы, состоящей из Н, алкила, алкенила, алкинила, циклоалкила, циклоалкенила, -R10циклоалкила и -R10OH;
кольцо А представляет собой фенил, нафтил или гетероарил;
где гетероарил представляет собой моноциклическое пяти-семичленное ароматическое кольцо или конденсированную бициклическую ароматическую кольцевую систему, состоящей из двух таких ароматических колец, содержащие один или два атома азота и/или серы, и
его фармацевтически приемлемые соли, сольваты, сложные эфиры и амиды.
6-бром-N-фенил-2,3,4,9-тетрагидро-1H-карбазол-1-амина;
6-хлор-N-фенил-2,3,4,9-тетрагидро-1H-карбазол-1-амина;
6-хлор-N-(4-метоксифенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амина;
6-хлор-N-(4-хлорфенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амина;
6-хлор-N-(4-фторфенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амина;
6-хлор-N-(4-метилфенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амина;
6-бром-N-(4-метоксифенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амина;
6-бром-N-(4-хлорфенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амина;
6-бром-N-(4-фторфенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амина;
6-бром-N-пиримидин-2-ил-2,3,4,9-тетрагидро-1H-карбазол-1-амина гидрохлорида;
6-хлор-N-пиримидин-2-ил-2,3,4,9-тетрагидро-1H-карбазол-1-амина;
6-хлор-N-(4,6-диметоксипиримидин-2-ил)-2,3,4,9-тетрагидро-1H-карбазол-1-амина;
6-хлор-N-(4-метилпиримидин-2-ил)-2,3,4,9-тетрагидро-1H-карбазол-1-амина;
6-хлор-N-(4,6-диметилпиримидин-2-ил)-2,3,4,9-тетрагидро-1H-карбазол-1-амина;
6-бром-N-пиридин-2-ил-2,3,4,9-тетрагидро-1H-карбазол-1-амина гидрохлорида;
6-бром-N-(5-пропилпиримидин-2-ил)-2,3,4,9-тетрагидро-1H-карбазол-1-амина;
6-метокси-N-пиримидин-2-ил-2,3,4,9-тетрагидро-1H-карбазол-1-амина;
N-(4,6-диметоксипиримидин-2-ил)-6-метил-2,3,4,9-тетрагидро-1H-карбазол-1-амина гидрохлорида;
6-бром-N-(4,6-диметилпиримидин-2-ил)-2,3,4,9-тетрагидро-1H-карбазол-1-амина гидрохлорида;
6-бром-N-[5-(трифторметил)пиримидин-2-ил]-2,3,4,9-тетрагидро-1H-карбазол-1-амина;
6-бром-N-[5-(трифторметил)пиридин-2-ил]-2,3,4,9-тетрагидро-1H-карбазол-1-амина;
6-[(6-бром-2,3,4,9-тетрагидро-1H-карбазол-1-ил)амино]никотинонитрила;
N-(1,3-бензотиазол-2-ил)-6-бром-2,3,4,9-тетрагидро-1H-карбазол-1-амина;
N-пиримидин-2-ил-2,3,4,9-тетрагидро-1H-карбазол-1-амина;
2-бром-N-пиримидин-2-ил-5,6,7,8,9,10-гексагидроциклогепта[b]индол-6-амина;
6-метил-N-пиридин-2-ил-2,3,4,9-тетрагидро-1H-карбазол-1-амина гидрохлоридной соли;
метил-1-анилино-2,3,4,9-тетрагидро-1H-карбазол-6-карбоксилата;
6-[(6-метил-2,3,4,9-тетрагидро-1H-карбазол-1-ил)амино]никотинонитрила гидрохлоридной соли;
N-фенил-6-(трифторметил)-2,3,4,9-тетрагидро-1H-карбазол-1-амина гидрохлорида;
N-фенил-2,3,4,9-тетрагидро-1H-карбазол-1-амина;
6-бром-N-(3-метоксифенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амина;
6-бром-N-(3-фторфенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амина;
6-бром-N-(1H-индол-5-ил)-2,3,4,9-тетрагидро-1H-карбазол-1-амина;
6-бром-N-(2-метоксифенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амина;
6-бром-N-(2-хлорфенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амина;
6-бром-N-(2-фторфенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амина;
6-бром-N-(3,4-дихлорфенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амина; и
6-бром-N-(4-фторфенокси)-2,3,4,9-тетрагидро-1H-карбазола.
6-бром-N-фенил-2,3,4,9-тетрагидро-1H-карбазол-1-амина;
6-хлор-N-фенил-2,3,4,9-тетрагидро-1H-карбазол-1-амина;
6-хлор-N-(4-метоксифенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амина;
6-хлор-N-(4-хлорфенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амина;
6-хлор-N-(4-фторфенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амина;
6-хлор-N-(4-метилфенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амина;
6-бром-N-(4-метоксифенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амина;
6-бром-N-(4-хлорфенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амина;
6-бром-N-(4-фторфенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амина;
6-бром-N-пиримидин-2-ил-2,3,4,9-тетрагидро-1H-карбазол-1-амина гидрохлорида;
6-хлор-N-пиримидин-2-ил-2,3,4,9-тетрагидро-1H-карбазол-1-амина;
6-хлор-N-(4,6-диметоксипиримидин-2-ил)-2,3,4,9-тетрагидро-1H-карбазол-1-амина;
6-хлор-N-(4-метилпиримидин-2-ил)-2,3,4,9-тетрагидро-1H-карбазол-1-амина;
6-хлор-N-(4,6-диметилпиримидин-2-ил)-2,3,4,9-тетрагидро-1H-карбазол-1-амина;
6-бром-N-пиридин-2-ил-2,3,4,9-тетрагидро-1H-карбазол-1-амина гидрохлорида;
6-бром-N-(5-пропилпиримидин-2-ил)-2,3,4,9-тетрагидро-1H-карбазол-1-амина;
N-(4,6-диметоксипиримидин-2-ил)-6-метил-2,3,4,9-тетрагидро-1H-карбазол-1-амина гидрохлорида;
6-бром-N-(4,6-диметилпиримидин-2-ил)-2,3,4,9-тетрагидро-1H-карбазол-1-амина гидрохлорида;
6-бром-N-[5-(трифторметил)пиримидин-2-ил]-2,3,4,9-тетрагидро-1H-карбазол-1-амина;
6-бром-N-[5-(трифторметил)пиридин-2-ил]-2,3,4,9-тетрагидро-1H-карбазол-1-амина;
6-[(6-бром-2,3,4,9-тетрагидро-1H-карбазол-1-ил)амино]никотинонитрила;
N-(1,3-бензотиазол-2-ил)-6-бром-2,3,4,9-тетрагидро-1H-карбазол-1-амина;
2-бром-N-пиримидин-2-ил-5,6,7,8,9,10-гексагидроциклогепта[b]индол-6-амина;
6-метил-N-пиридин-2-ил-2,3,4,9-тетрагидро-1H-карбазол-1-амина гидрохлоридной соли;
метил-1-анилино-2,3,4,9-тетрагидро-1H-карбазол-6-карбоксилата;
6-[(6-метил-2,3,4,9-тетрагидро-1H-карбазол-1-ил)амино]никотинонитрила гидрохлоридной соли;
N-фенил-6-(трифторметил)-2,3,4,9-тетрагидро-1H-карбазол-1-амина гидрохлорида;
N-фенил-2,3,4,9-тетрагидро-1H-карбазол-1-амина;
6-бром-N-(3-метоксифенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амина;
6-бром-N-(3-фторфенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амина;
6-бром-N-(2-метоксифенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амина;
6-бром-N-(2-хлорфенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амина;
6-бром-N-(2-фторфенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амина;
6-бром-N-(3,4-дихлорфенил)-2,3,4,9-тетрагидро-1H-карбазол-1-амина; и
6-бром-N-(4-фторфенокси)-2,3,4,9-тетрагидро-1H-карбазола.
| Способ обессоливания воды электродиализом | 1972 |
|
SU451634A1 |
| УСТРОЙСТВО для ИЗМЕРЕНИЙ ИЗБЫТОЧНЫХ (ТОКОВЫХ) Ш|УМОВ НЕПРОВОЛОЧНЫХ СОПРОТИВЛЕНИЙ | 0 |
|
SU200632A1 |
| ПРОИЗВОДНЫЕ КАРБАЗОЛОНА И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1993 |
|
RU2119914C1 |
Авторы
Даты
2008-03-10—Публикация
2004-06-07—Подача