Настоящее изобретение относится к способам получения рацемического 2-(7-хлор-1,8-нафтиридин-2-ил)-3-(5-метил-2-оксогексил)-1-изоиндолинона и (+)-2-(7-хлор-1,8-нафтиридин-2-ил)-3-(5-метил-2-оксогексил)-1-изоиндолинона.
Уровень техники
Соединение (+)-2-(7-хлор-1,8-нафтиридин-2-ил)-3-(5-метил-2-оксогексил)-1-изоиндолинон, также называемое пагоклоном (pagoclone), представляет собой лиганд GABA (гамма-аминомаслянная кислота) рецептора, который в настоящее время проходит клинические испытания на людях в лечении прогрессирующих тревожных и панических состояний.
Пагоклон также может использоваться для лечения компульсивно-навязчивых состояний, острых стрессов, нарушений, связанных с посттравматическим стрессом, нарушений, связанных с социальной тревогой, соматических нарушений, специфической социофобии, предменструальной дисфории, тревожных состояний, связанных с медицинским состоянием, реабилитационных нарушений с тревожным настроением, дистимии, специфических фобий или фибромиалгии.
Патент US №4960779 от 2 октября 1990 г. относится к производным пиррола и композициям, содержащим производные пиррола, включая пагоклон, а также к способам анксиолитического, снотворного, противосудорожного, противоэпилептического или мышечно-релаксирующего терапевтического воздействия, предусматривающим применение производного пиррола.
Настоящее изобретение предусматривает удобный способ получения рацемического 2-(7-хлор-1,8-нафтиридин-2-ил)-3-(5-метил-2-оксогексил)-1-изоиндолинона и (+)-2-(7-хлор-1,8-нафтиридин-2-ил)-3-(5-метил-2-оксогексил)-1-изоиндолинона.
Раскрытие изобретения
Настоящее изобретение относится к способам получения рацемического 2-(7-хлор-1,8-нафтиридин-2-ил)-3-(5-метил-2-оксогексил)-1-изоиндолинона, включающим следующие стадии:
а) реакцию 2,6-диаминопиридина с яблочной и серной кислотами с образованием соли 2-амино-7-гидрокси-1,8-нафтиридинсульфокислоты;
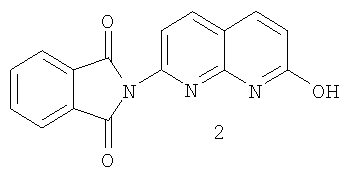
b) реакцию соли 2-амино-7-гидрокси-1,8-нафтиридинсульфокислоты с фталильным реагентом в среде растворителя с образованием фталимидилнафтиридина 2:
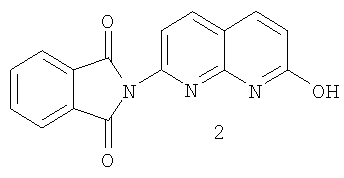
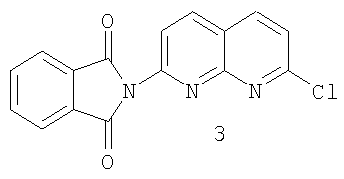
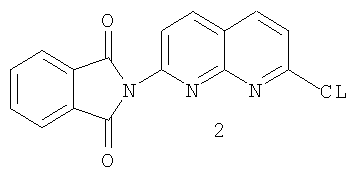
с) реакцию фталимидилнафтиридина 2 с хлорирующим агентом с образованием хлорида 3:

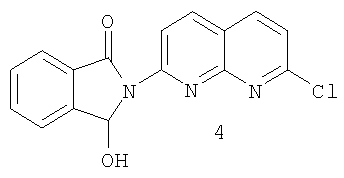
d) реакцию хлорида 3 с восстанавливающим агентом с образованием гидроксииндолинона 4:
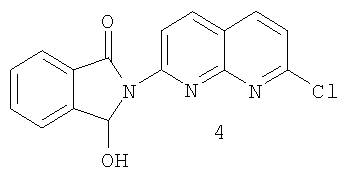
е) реакцию гидроксииндолинона 4 с производным 5-метил-2-оксо-гексила с образованием рацемического 2-(7-хлор-1,8-нафтиридин-2-ил)-3-(5-метил-2-оксогексил)-1-изоиндолинона.
В соответствии с предпочтительным воплощением рассматриваемых способов фталильный реагент на стадии b представляет собой фталевый ангидрид; хлорирующий агент стадии с представляет собой оксихлорид фосфора; восстанавливающий агент стадии d представляет собой борогидрид калия; а производное 5-метил-2-оксо-гексила стадии е представляет собой бромистый [(5-метил-2-оксо)-гексил] трифенилфосфоний.
Изобретение также предусматривает способы получения (+)-2-(7-хлор-1,8-нафтиридин-2-ил)-3-(5-метил-2-оксогексил)-1-изоиндолинона, включающие следующие стадии:
a) реакцию 2,6-диаминопиридина с яблочной и серной кислотами с образованием соли 2-амино-7-гидрокси-1,8-нафтиридинсульфокислоты;
b) реакцию соли 2-амино-7-гидрокси-1,8-нафтиридинсульфокислоты с фталильным реагентом в среде растворителя с образованием фталимидилнафтиридина 2:

с) реакцию фталимидилнафтиридина 2 с хлорирующим агентом с образованием хлорида 3:

d) реакцию хлорида 3 с восстанавливающим агентом с образованием гидроксииндолинона 4:
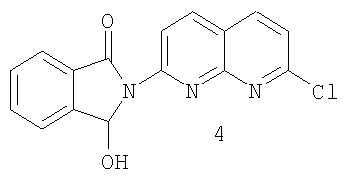
e) реакцию гидроксииндолинона 4 с производным 5-метил-2-оксо-гексила с образованием рацемического 2-(7-хлор-1,8-нафтиридин-2-ил)-3-(5-метил-2-оксогексил)-1-изоиндолинона; и
f) разделение рацемического 2-(7-хлор-1,8-нафтиридин-2-ил)-3-(5-метил-2-оксогексил)-1-изоиндолинона с получением (+)-2-(7-хлор-1,8-нафтиридин-2-ил)-3-(5-метил-2-оксогексил)-1-изоиндолинона.
Согласно предпочтительному воплощению способов, в которых рацемический 2-(7-хлор-1,8-нафтиридин-2-ил)-3-(5-метил-2-оксогексил)-1-изоиндолинон разделяют с образованием (+)-2-(7-хлор-1,8-нафтиридин-2-ил)-3-(5-метил-2-оксогексил)-1-изоиндолинона, разделение с получением оптически активного стереоизомера включает следующие стадии:
g) реакцию рацемического 2-(7-хлор-1,8-нафтиридин-2-ил)-3-(5-метил-2-оксогексил)-1-изоиндолинона с основанием с образованием кислоты 6:

h) реакцию кислоты 6 с (+)-эфедрином с образованием соли 6а:

i) реакцию соли 6а с амидообразующим агентом с получением (+)-2-(7-хлор-1,8-нафтиридин-2-ил)-3-(5-метил-2-оксогексил)-1-изоиндолинона.
Согласно предпочтительному воплощению разделения основание на стадии g представляет собой гидроксид калия; а амидообразующий агент на стадии i представляет собой карбонилдиимидазол.
В настоящем изобретении также предусматривается соединение соль 2-амино-7-гидрокси-1,8-нафтиридинсульфокислоты.
Кроме этого, обеспечены способы получения соли 2-амино-7-гидрокси-1,8-нафтиридинсульфокислоты, включающие стадию реакции 2,6-диаминопиридина с яблочной и серной кислотами с образованием соли 2-амино-7-гидрокси-1,8-нафтиридинсульфокислоты.
Также предусматриваются способы получения рацемического 2-(7-хлор-1,8-нафтиридин-2-ил)-3-(5-метил-2-оксогексил)-1-изоиндолинона, включающие следующие стадии:
а) реакцию в среде растворителя соли 2-амино-7-гидрокси-1,8-нафтиридинсульфокислоты с фталильным реагентом с образованием фталимидилнафтиридина 2:

b) реакцию фталимидилнафтиридина 2 с хлорирующим агентом с образованием хлорида 3:

с) реакцию хлорида 3 с восстанавливающим агентом с образованием гидроксииндолинона 4:

d) реакцию гидроксииндолинона 4 с производным 5-метил-2-оксогексила с образованием рацемического 2-(7-хлор-1,8-нафтиридин-2-ил)-3-(5-метил-2-оксогексил)-1-изоиндолинона.
Кроме этого, предусматриваются способы получения рацемического 2-(7-хлор-1,8-нафтиридин-2-ил)-3-(5-метил-2-оксогексил)-1-изоиндолинона, включающие следующие стадии:
а) реакцию фталимидилнафтиридина 2

с хлорирующим агентом с образованием хлорида 3

b) реакцию хлорида 3 с восстанавливающим агентом с образованием гидроксииндолинона 4

с) реакцию гидроксииндолинона 4 с производным 5-метил-2-оксогексила с образованием рацемического 2-(7-хлор-1,8-нафтиридин-2-ил)-3-(5-метил-2-оксогексил)-1-изоиндолинона.
Предусматриваются также способы получения рацемического 2-(7-хлор-1,8-нафтиридин-2-ил)-3-(5-метил-2-оксогексил)-1-изоиндолинона, включающие следующие стадии:
а) реакцию хлорида 3:

с восстанавливающим агентом с образованием гидроксииндолинона 4
 и
и
b) реакцию гидроксииндолинона 4 с производным 5-метил-2-оксогексила с образованием рацемического 2-(7-хлор-1,8-нафтиридин-2-ил)-3 -(5 -метил-2-оксогексил)-1-изоиндолинона.
Кроме этого, обеспечены способы получения рацемического 2-(7-хлор-1,8-нафтиридин-2-ил)-3-(5-метил-2-оксогексил)-1 -изоиндолинона, включающие стадию реакции гидроксииндолинона 4

с производным 5-метил-2-оксогексила с образованием рацемического 2-(7-хлор-1,8-нафтиридин-2-ил)-3-(5-метил-2-оксогексил)-1-изоиндолинона.
Осуществление изобретения
Настоящее изобретение предусматривает способы получения рацемического 2-(7-хлор-1,8-нафтиридин-2-ил)-3-(5-метил-2-оксогексил)-1-изоиндолинона и его последующего разделения для получения (+)-2-(7-хлор-1,8-нафтиридин-2-ил)-3-(5-метил-2-оксогексил)-1-изоиндолинона, известного под названием пагоклон (pagoclone).
Настоящее изобретение иллюстрируется приведенной ниже схемой 1.
Схема 1
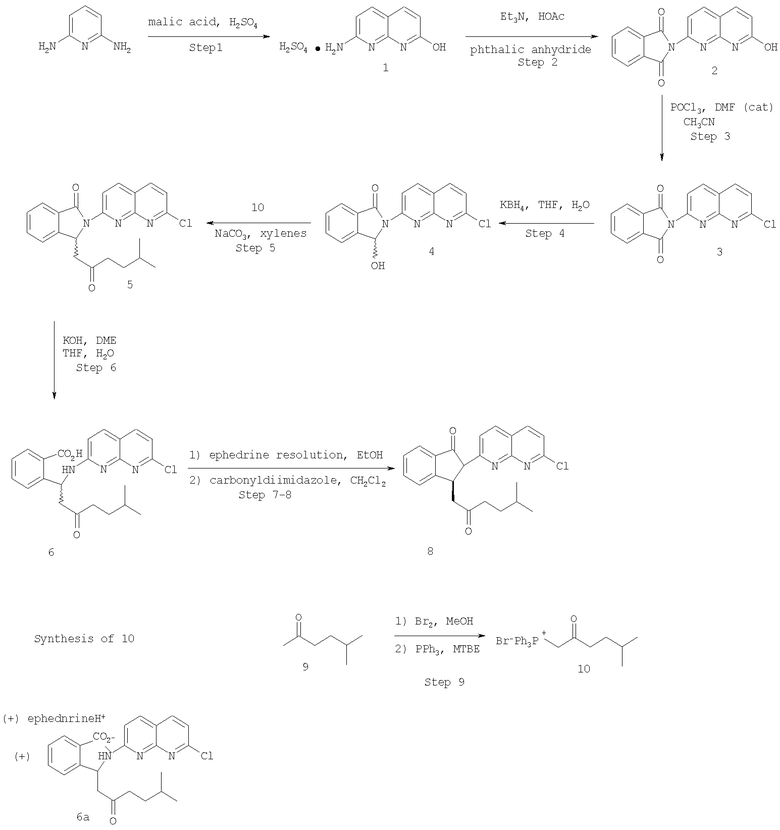
Стадия 1
Стадия 1 предлагаемого способа заключается в реакции коммерчески доступного 2,6-диаминопиридина (например, Aldrich, Milwaukee, WI) с яблочной кислотой в среде серной кислоты с образованием соли 2-амино-7-гидрокси-1,8-нафтиридинсульфокислоты. Следует отметить, что 2-амино-7-гидрокси-1,8-нафтиридин в виде свободного основания описан S. Carboni et al., в Gazz. Chim. Ital., 95, 1498 (1965).
Соль 2-амино-7-гидрокси-1,8-нафтиридинсульфокислоты (1)
2,6-Диаминопиридин (167 г, 1,53 моля) порциями добавляли к серной кислоте (1,14 кг, 11,7 моля) при 40°С. В ходе добавления температура раствора поддерживалась в интервале 40-50°С с помощью водяной бани. После полного растворения 2,6-диаминопиридина раствор охлаждали до 20°С. В раствор добавляли яблочную кислоту (206 г, 1,53 моля) и реакционную смесь в течение 90 минут постепенно нагревали до 110°С. Смесь в течение часа перемешивали при 110-120°С, охлаждали до комнатной температуры и медленно выливали в холодный раствор рассола (167 г NaCl, 1,6 кг ледяной воды). Охлажденную смесь перемешивали в течение часа при комнатной температуре и фильтровали. Полученный материал промывали гексанами (335 мл) и сушили в вакууме при 60°С с получением соли 2-амино-7-гидрокси-1,8-нафтиридинсульфокислоты в виде твердого желтого вещества: 354 г, выход 89%; MS(DCI) М+1 при 162, 100%; 1Н ЯМР (200 МГц, ДМСО-d6) δ 4,32 (br. s, 5H, -ОН, NH2, H2SO4), 6,41(d, J=9,0 Гц, 1H, С6), 6,56 (d, J=9,0 Гц, 1H, C5), 7,85 (d, J=6,6 Гц, 1H, C3), 7,91 (d, J=6,6 Гц, 1H, C4).
Стадии 2-4
На стадии 2 проводят реакцию между солью 2-амино-7-гидрокси-1,8-нафтиридинсульфокислоты и фталильным реагентом с образованием фталимидилнафтиридина 2

Обычно реакцию проводят в среде растворителя, предпочтительно в уксусной кислоте, и добавляют основание. Основание выбирают таким образом, чтобы оно было достаточно сильным для депротонирования соли серной кислоты, но не разрушало фталильный реагент. Подходящие основания представляют собой ди-, три- и арилзамещенные амины, причем триэтиламин является предпочтительным основанием. Фталильный реагент представляет собой вещество, реагирующее с аминогруппой соли 2-амино-7-гидрокси-1,8-нафтиридинсульфокислоты с образованием фталимидил нафтиридина 2. Примерами подходящих фталильных реагентов могут служить фталилхлорид, фталевая кислота и сложные эфиры фталевой кислоты. Предпочтительным фталильным реагентом является фталевый ангидрид, а предпочтительным основанием для применения с фталевым ангидридом служит триэтиламин. Фталимидилнафтиридин 2 также может быть получен по методике, аналогичной той, что раскрыта в патенте US №220646.
На стадии 3 проводят реакцию между фталимидилнафтиридином 2 и хлорирующим агентом, приводящую к образованию хлорида 3

Для проведения такой реакции требуются хлорирующие агенты, способные превращать гидроксигруппу фталимидилнафтиридина в хлор. Походящие для этой цели хлорирующие агенты, без конкретных ограничений, включают тионилхлорид, цианурхлорид кислоты, хлористо-водородную кислоту, петахлорид фосфора, трихлорид фосфора и хлорангидрид щавелевой кислоты. Хлорокись фосфора является предпочтительным хлорирующим агентом. Реакцию хлорирования обычно проводят в среде полярного, апротонного растворителя, но также можно проводить без растворителя в среде хлорокиси фосфора. Предпочтительное хлорирование проводят с использованием ацетонитрила в качестве растворителя и хлорокиси фосфора в качестве хлорирующего агента. Также используют каталитическое количество диметилформамида. Кроме этого, хлорид 3 может быть получен по методике, аналогичной той, что описана в патенте US №4220646.
На стадии 4 хлорид 3

восстанавливают с помощью восстанавливающего агента с образованием гидроксииндолинона 4

Восстанавливающий агент может представлять собой любое соединение, способное восстанавливать карбонильную группу фталильного кольца в спиртовую группу. Примерами предпочтительных восстанавливающих агентов могут служить соли борогидрида, боран и замещенные бораны. Предпочтительной борогидридной солью является борогидрид калия. В качестве растворителя может использоваться спирт, простой эфир и любой другой растворитель, совместимый с хлоридом и восстанавливающим агентом. В том случае, когда восстанавливающий агент представляет собой борогидрид калия, предпочтительным растворителем является вода. Следует отметить, что стадии 3 и 4 могут проводиться последовательно без выделения промежуточных продуктов. Гидроксииндолинон 4 также может быть получен по методике, аналогичной той, что описана в патенте US №4220646.
2-N-Фталимидил-7-гидрокси-1,8-нафтиридин (2)
Соль 2-амино-7-гидрокси-1,8-нафтиридинсульфокислоты (5,5 г) и фталевый ангидрид (8,3 г) перемешивали в среде уксусной кислоты (27 мл). Реакционную смесь охлаждали в ледяной бане, добавляя при этом триэтиламин (11 мл) с такой скоростью, чтобы температура реакционной среды не превышала 30°С. После добавления всего количества триэтиламина реакционную смесь в течение 5 часов нагревали при 115°С. Реакционную смесь охлаждали до 25°С и реакцию останавливали метанолом (30 мл). Продукт отфильтровывали и промывали метанолом (30 мл). Полученный продукт сушили в вакууме при 60°С. В результате получали 5,9 г 2-N-фталимидил-7-гидрокси-1,8-нафтиридина 2 (выход 95%). 1Н ЯМР: δ 12,45 (s, 1Н), 8,43 (d, J=8,1 Гц, 1H), 8,09 (m, 5H), 7,49 (d, J=8,1, 1H), 6,74 (d, J=9,5, 1H); CI (MS) M+1 при 292,100%.
N-(7-Хлор-1,8-нафтиридин-2-ил)3-гидроксииндолинон (4)
Хлорокись фосфора (83,9 г, 547 ммоля) добавляли к нагреваемой с обратным холодильником суспензии 2-N-фталимидил-7-гидрокси-1,8-нафтиридина (140 г, 481 ммоль) в ацетонитриле (1,05 л), содержащем N,N-диметилформамид (8,87 г, 121 ммоль). Реакционную смесь нагревали с обратным холодильником в течение 4 часов и охлаждали до 3°С. Затем в течение 30 минут добавляли водный раствор гидроксида калия (45%, 109 мл, 1,28 моля), поддерживая температуру ниже 25°С. После этого реакционную смесь охлаждали до 3°С. Медленно добавляли борогидрид калия (84 г, 1,56 моля) в виде водного раствора (7000 мл), поддерживая при этом температуру реакционной смеси ниже 35°С. Полученную смесь в течение часа нагревали при 35-40°С и охлаждали до комнатной температуры. В смесь добавляли водный раствор уксусной кислоты (385 мл уксусной кислоты в 350 мл воды), после чего добавляли ледяную уксусную кислоту (875 мл). Реакционную смесь перемешивали в течение 15 минут и фильтровали. Полученный материал промывали водой (350 мл), метанолом (350 мл), водой (350 мл) и метанолом (350 мл). Материал сушили при 60°С в вакууме с получением N-(7-хлор-1,8-нафтиридин-2-ил)3-гидроксииндолинона в виде твердого светло-желтого вещества: 140,1 г, выход 94%; MS(DCI) M+1 при 312, 100%; 13С ЯМР (101 М Гц, ДМСО-d6) δ 80,74 (С2) 115, 98 (С19) 119, 068 (С17) 121,91 (С15) 123,39 (С9) 124,10 (С6) 129,90 (С8) 130,23 (С4) 133,90 (С7) 139,40 (С18) 140,53 (С16) 144,45 (C3) 152,69 (С12) 153,06 (С10) 153,77 (С14) 166,43 (С5).
Стадия 5
На стадии 5 проводят реакцию между N-(7-хлор-1,8-нафтиридин-2-ил)3-гидроксииндолиноном и производным 5-метил-2-оксогексила с получением рацемического 2-(7-хлор-1,8-нафтиридин-2-ил)-3-(5-метил-2-оксогексил)-1-изоиндолинона. В качестве производного 5-метил-2-оксогексила может использоваться любое производное 5-метил-2-оксогексана, обеспечивающее получение рацемического 2-(7-хлор-1,8-нафтиридин-2-ил)-3-(5-метил-2-оксогексил)-1-изоиндолинона. Предпочтительным производным 5-метил-2-оксогексила является галогенид [(5-метил-2-оксо)-гексил]трифенилфосфония, из которых предпочтительным галогенидом является бромид. Ниже иллюстрируется синтез бромистого [(5-метил-2-оксо)-гексил]трифенилфосфония. Реакцию обычно проводят в среде апротонного растворителя при температуре около 100°С или выше и в реакции используют основание, способное депротонировать соль фосфония. Предпочтительным основанием является карбонат натрия. Примерами других подходящих оснований могут служить соли карбонатов, гидроксидов и алкоксидов.
Рацемический 2-(7-хлор-1,8-нафтиридин-2-ил)-3-(5-метил-2-оксогексил)-1-изоиндолинон (5)
В реактор загружали воду (330 л), карбонат натрия (34 кг), бромистый [(5-метил-2-оксо)-гексил]трифенилфосфоний (10) (99 кг) и ксилолы (390 кг). Двухфазную систему перемешивали в течение 30 минут при 20°С. Водный слой удаляли и добавляли N-(7-хлор-1,8-нафтиридин-2-ил)-3-гидроксииндолинон (159 кг). Реакционную смесь нагревали до 136°С (отгоняя остаточную воду) и выдерживали при этой температуре в течение 24 часов. Затем реакционную смесь охлаждали до 90°С, и ксилолы удаляли вакуумной дистилляцией. К остатку добавляли изопропанол (650 л). Суспензию нагревали до начала отекания флегмы, охлаждали до температуры ниже 5°С и фильтровали. Каждую загрузку промывали изопропанолом (200 л) и метанолом (100 л). В результате вакуумной сушки при 60°С получали 170 кг (выход 82%) кристаллического рацемического 2-(7-хлор-1,8-нафтиридин-2-ил)-3-(5-метил-2-оксогексил)-1-изоиндолинона. APCI/MS: М+Н+ при 408, 100%. Т.пл. 173-174°С.
Бромистый [(5-Метил-2-оксо)-гексил]трифенилфосфоний (10)
Раствор, содержащий метанол (760 мл) и 5-метил-2-гексанон (9), который может быть приобретен у Eastman Chemical Company, Kingsport, TN (152 мл, 1,15 моля), охлаждали до 0-5°С. Затем в раствор одной порцией добавляли бром (53 мл, 1,03 моля). Реакционную смесь перемешивали в течение 50 минут при 5°С. После прекращения экзотермической реакции (около 90 минут), реакцию останавливали водой (132 мл) и перемешивали в течение 30 минут. Добавляли метил-трет-бутиловый эфир (МТВЕ, 1325 мл). Затем реакционную смесь промывали 700 мл раствора рассола (238 г NaCl растворенного в 1325 мл Н2O). Органический слой промывали 700 мл раствора бикарбоната натрия (31,8 г НаНСО3 в 66 мл Н2О). После этого органический слой промывали указанным выше раствором рассола. Растворитель удаляли в вакууме, и к органическому остатку добавляли дополнительное количество МТВЕ (663 мл). Добавленный МТВЕ также удаляли в вакууме. После этого оставшееся масло растворяли в МТВЕ (340 мл).
Трифенилфосфин (270,2 г, 1,03 моля) растворяли в МТВЕ (340 мл). К полученному раствору добавляли раствора бромкетона и смеси давали реагировать в течение 16 часов при 20°С. Образовавшийся белый осадок отфильтровывали и высушивали в вакууме при 40°С. В результате получали 273,1 г (выход 58%) бромистого [(5-метил-2-оксо)-гексил] трифенилфосфония. 1Н-ЯМР: δ 7,87 (m, 15Н), 5,66 (dd, J=2,9, 12,8, 2Н), 2,71 (m, 2H), 1,35 (m, 3Н), 0,80 (d, J=6,2, 6Н); CI (MS) M при 455, 100%. Бромистый [(5- метил-2-оксо)-гексил] трифенилфосфоний также может быть получен по методике, аналогичной описанной в патенте US №5532228.
Стадия 6
На стадии 6 осуществляется раскрытие лактамного кольца 2-(7-хлор-1,8-нафтиридин-2-ил)-3-(5-метил-2-оксогексил)-1 -изоиндолинона с образованием рацемической 2-[1-(7-хлор-1,8-нафтиридин-2-иламино)-6-метил-3-оксогептил]-бензойной кислоты. Реакция такого типа описана в US Patent №5498716.
Рацемическая 2-[1-(7-хлор-1,8-нафтиридин-2-иламино)-6-метил-3 -оксогептил]-бензойная кислота (6)
В реактор загружали рацемический 2-(7-хлор-1,8-нафтиридин-2-ил)-3-(5-метил-2-оксогексил)-1-изоиндолинон (170 кг), 1,2-диметоксиэтан (730 л), тетрагидрофуран (THF, 990 л). Суспензию нагревали до 30°С и добавляли раствор гидроксида калия (140 кг) в воде (1730 л). Полученную суспензию перемешивали при 34°С в течение 34 часов. Раствор охлаждали до 20°С, после чего нижний водный слой удаляли и заменяли на воду (1000 л). рН раствора устанавливали равным 9,0 с помощью 4N хлористо-водородной кислоты. Полученный раствор подвергали вакуумной дистилляции при 30°С с целью удаления THF. Добавляли воду (550 л), и с помощью 2N раствора гидроксида калия устанавливали рН раствора 11,5. Полученный раствор фильтровали для удаления остаточного количества рацемического 2-(7-хлор-1,8-нафтиридин-2-ил)-3-(5-метил-2-оксогексил)-1-изоиндолинона. К полученному жидкому продукту добавляли хлористый метилен (1200 л), и устанавливали рН 1,4 с помощью 4N HCI. Водный слой удаляли. Органический слой промывали водой (700 л), и воду сливали. Полученный органический слой концентрировали в вакууме и заменяли метанолом (500 л). Образовавшуюся суспензию охлаждали до 10°С, добавляли воду (500 л), и смесь охлаждали до 0°С. Образовавшийся осадок отделяли фильтрацией и сушили в вакууме с получением 150 кг (85%) рацемической 2-[1-(7-хлор-1,8-нафтиридин-2-иламино)-6-метил-3-оксогептил]-бензойной кислоты в виде белого твердого вещества. DCI/MS: М+Н+426, 100%. Т.пл. 173-174°С. УФ-максимумы при длинах волн 236, 268 и 353 нм.
Стадии 7-8
Способ разделения рацемической 2-[1-(7-хлор-1,8-нафтиридин-2-иламино)-6-метил-3-оксогептил]-бензойной кислоты описан в патенте US №5498716. На первой стадии такого разделения проводят реакцию между рацемической 2-[1-(7-хлор-1,8-нафтиридин-2-иламино)-6-метил-3-оксогептил]-бензойной кислотой и хиральным агентом с образованием соли. Предпочтительное хиральное соединение представляет собой (+)-эфедрин. На второй стадии, стадия 8 на схеме 1, проводят реакцию между полученной солью и соединением, способствующим образованию амидной связи. Соединения, используемые для образования амидной связи (т.е. амидообразующие соединения), хорошо известны специалистам в данной области, и они включают вещества, активирующие карбоновую кислоту в отношении образования амида, в результате ее превращения в активный сложный эфир, хлоранигдрид, ангидрид и т.п. Примерами подходящих реагентов могут служить хлорангидриды, ангидриды, хлорформиаты, хлористый тионил, хлорокись фосфора, замещенные карбодиимиды, фосфорные кислоты и т.п. Особенно предпочтительным реагентом является карбонилдиимидазол. Следует отметить, что стадии 7 и 8 могут осуществляться последовательно без выделения промежуточных продуктов.
(+)-2-(7-хлор-1,8-нафтиридин-2-ил)-3-(5-метил-2-оксогексил)-1-изоиндолинон (8)
Раствор, содержащий 2-{1-[(7-хлор-1,8-нафтиридин-2-ил)амино]-6-метил-3-оксогептил}-бензойную кислоту (74,9 кг, 175,9 моля), (1S, 2R)-эфедрин полугидрат (32,5 кг, 186,5 моля), 100% этанол (290 кг) и воду (17 л) нагревали при перемешивании в течение 35 минут до 35°С. Полученный раствор фильтровали и затем охлаждали до 20°С до начала кристаллизации. Реакционную смесь в течение 2 часов дополнительно охлаждали до 0-5°С. Промежуточную соль эфедрина отфильтровывали и промывали холодным (0-5°С) раствором этанола крепостью 200 (206 кг) и водой (10 л). Эфедриновую соль растворяли в 377 л дихлорметана и перемешивали с 125 л воды и 9,7 кг 3% хлористо-водородной кислоты. Водный слой отбрасывали. Органический слой промывали водой (125 л). Полученный органический слой концентрировали дистилляцией до 60% от исходного объема. Карбонилдиимидазол растворяли в СН2Cl2 (128 л) и медленно переносили в реакционный раствор. Реакция завершалась за 20 минут. Полученную реакционную смесь дважды промывали водой (порциями по 250 л). Раствор в СН2Cl2 отгоняли при атмосферном давлении, и отогнанную часть заменяли равным объемом этанола крепости 200 (500 кг). Полученный этанольный раствор охлаждали со скоростью 20±5°С в час до температуры 0-5°С. После этого раствор в течение 16 часов выдерживали при 0-5°С. Полученный продукт фильтровали и промывали этанолом крепости 200 (100 кг). После этого продукт сушили в течение 16 часов в вакууме при 60°С. В результате получали 26,0 кг (+)-2-(7-хлор-1,8-нафтиридин-2-ил)-3-(5-метил-2-оксогексил)-1-изоиндолинона в виде белого твердого вещества (выход 36%). Спектр 1Н-ЯМР: δ 8,87 (d, J=8,8, 1H), 8,61 (m, 2H), 7,93 (d, J=7,0, 1H), 7,74 (m, 4H), 6,05 (m, 1H), 3,62 (m, 1H), 3,28 (dd, J=7,0, 17,2, 1H), 2,42 (m, 2H), 1,35 (m, ЗН), 0,79 (d, J=6,2, 6H); CI(MS) M+1 408, 100%; [α]D 20=+135° (с=1, дихлорметан).
Разделение рацемического 2-(7-хлор-1,8-нафтиридин-2-ил)-3-(5-метил-2-оксогексил)-1-изоиндолинона в результате раскрытия кольца, разделение с помощью реагента для разделения и последующего замыкания кольца с образованием (+)-2-(7-хлор-1,8-нафтиридин-2-ил)-3-(5-метил-2-оксогексил)-1-изоиндолинона, описано в патенте US №5498716. Специалисту в данной области известны другие способы разделения рацемического 2-(7-хлор-1,8-нафтиридин-2-ил)-3-(5-метил-2-оксогексил)-1-изоиндолинона непосредственно до (+)-2-(7-хлор-1,8-нафтиридин-2-ил)-3-(5-метил-2-оксогексил)-1-изоиндолинона без раскрытия лактамного кольца. Настоящее изобретение предусматривает любые методики разделения в сочетании с синтезом рацемического 2-(7-хлор-1,8-нафтиридин-2-ил)-3-(5-метил-2-оксогексил)-1-изоиндолинона. Другими словами, после получения рацемического 2-(7-хлор-1,8-нафтиридин-2-ил)-3-(5-метил-2-оксогексил)-1-изоиндолинона специалист может использовать различные способы его разделения для получения (+)-2-(7-хлор-1,8-нафтиридин-2-ил)-3-(5-метил-2-оксогексил)-1-изоиндолинона.
Все цитированные документы, включая патенты и заявки на патенты, включены в настоящее описание путем отсылки. В тексте используются следующие сокращения:
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения конденсированных производных пиррола | 1987 |
|
SU1577698A3 |
| Способ получения производных пиррола | 1989 |
|
SU1630612A3 |
| Способ получения производных пиррола или их оптических изомеров либо фармацевтически приемлемых солей | 1987 |
|
SU1616515A3 |
| АНТИБИОТИЧЕСКИЕ ПРОИЗВОДНЫЕ 2-ОКСО-ОКСАЗОЛИДИН-3, 5-ДИИЛА | 2012 |
|
RU2616609C2 |
| ПРОИЗВОДНЫЕ 2-ГИДРОКСИЭТИЛ-1Н-ХИНОЛИН-2-ОНА И ИХ АЗАИЗОСТЕРИЧЕСКИЕ АНАЛОГИ С АНТИБАКТЕРИАЛЬНОЙ АКТИВНОСТЬЮ | 2010 |
|
RU2540862C2 |
| Способ получения гетероциклических соединений | 1976 |
|
SU604496A3 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНОГО 1,8-НАФТИРИДИН-3-КАРБОНОВОЙ КИСЛОТЫ | 2004 |
|
RU2310654C1 |
| ПРОИЗВОДНЫЕ АДАМАНТИЛА, ПОЛЕЗНЫЕ ДЛЯ ЛЕЧЕНИЯ JNK-ОПОСРЕДОВАННОГО РАССТРОЙСТВА | 2012 |
|
RU2626890C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ ПИРИДОНОВЫХ КАРБОНОВЫХ КИСЛОТ, СПОСОБ И ПРОМЕЖУТОЧНЫЕ ДЛЯ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ | 1993 |
|
RU2161154C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ ЗИЛПАТЕРОЛА И ЕГО СОЛЕЙ | 2008 |
|
RU2442786C2 |
Настоящее изобретение относится к способу (варианты) получения рацемического 2-(7-хлор-1,8-нафтиридин-2-ил)-3-(5-метил-2-оксогексил)-1-изоиндолинона и его (+)-энантиомера. Один вариант способа получения рацемического 2-(7-хлор-1,8-нафтиридин-2-ил)-3-(5-метил-2-оксогексил)-1-изоиндолинонодина включает стадию (е), другой - стадии (b)-(е), способ получения (+)-энантиомера включает стадии (a)-(f) нижеследующего списка стадий: (а) 2,6-диаминопиридин подвергают взаимодействию с яблочной и серной кислотами, получают гидросульфат 2-амино-7-гидрокси-1,8-нафтиридина, который (b) обрабатывают фталильным реагентом в среде растворителя с образованием фталимидилнафтиридина 2, который (с) хлорируют с образованием хлорида 3, который (d) восстанавливают до гидроксииндолинона 4, который (е) обрабатывают галогенидом 5-метил-2-оксо-гексилтрифенилфосфония и получают рацемический 2-(7-хлор-1,8-нафтиридин-2-ил)-3-(5-метил-2-оксогексил)-1-изоиндолинон, который (f) разделяют и получают (+)-2-(7-хлор-1,8-нафтиридин-2-ил)-3-(5-метил-2-оксогексил)-1-изоиндолинон. Технический результат - усовершенствование способа получения 2-(7-хлор-1,8-нафтиридин-2-ил)-3-(5-метил-2-оксогексил)-1-изоиндолинона из 2-(7-хлор-1,8-нафтиридин-2-ил)-3-гидроксиизоиндолин-1-она за счет использования галогенида 5-метил-2-оксо-гексилтрифенилфосфония. 3 н. и 10 з.п. ф-лы.


с галогенидом 5-метил-2-оксо-гексилтрифенилфосфония с образованием рацемического 2-(7-хлор-1,8-нафтиридин-2-ил)-3-(5-метил-2-оксогексил)-1-изоиндолинона.
а) взаимодействия хлорида 3
с восстанавливающим агентом с образованием гидроксииндолинона 4
b) взаимодействия гидроксииндолинона 4 с галогенидом 5-метил-2-оксо-гексилтрифенилфосфония с образованием рацемического 2-(7-хлор-1,8-нафтиридин-2-ил)-3-(5-метил-2-оксогексил)-1-изоиндолинона.
а) взаимодействия фталимидилнафтиридина 2
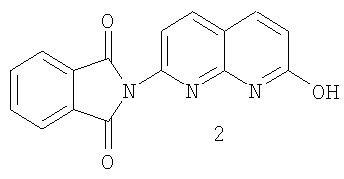
с хлорирующим агентом с образованием хлорида 3

b) взаимодействие хлорида 3 с восстанавливающим агентом с образованием гидроксииндолинона 4

с) взаимодействия гидроксииндолинона 4 с галогенидом 5-метил-2-оксо-гексилтрифенилфосфония с образованием рацемического 2-(7-хлор-1,8-нафтиридин-2-ил)-3-(5-метил-2-оксогексил)-1-изоиндолинона.
a) взаимодействия 2,6-диаминопиридина с яблочной и серной кислотами с образованием гидросульфата 2-амино-7-гидрокси-1,8-нафтиридина;
b) взаимодействия гидросульфата 2-амино-7-гидрокси-1,8-нафтиридина с фталильным реагентом в растворителе с образованием фталимидилнафтиридина 2

с) взаимодействия фталимидилнафтиридина 2 с хлорирующим агентом с образованием хлорида 3

d) взаимодействие хлорида 3 с восстанавливающим агентом с образованием гидроксииндолинона 4

е) взаимодействия гидроксииндолинона 4 с галогенидом 5-метил-2-оксо-гексилтрифенилфосфония с образованием рацемического 2-(7-хлор-1,8-нафтиридин-2-ил)-3-(5-метил-2-оксогексил)-1-изоиндолинона.
a) взаимодействия 2,6-диаминопиридина с яблочной и серной кислотами с образованием гидросульфата 2-амино-7-гидрокси-1,8-нафтиридина;
b) взаимодействия гидросульфата 2-амино-7-гидрокси-1,8-нафтиридина с фталильным реагентом в среде растворителя с образованием фталимидилнафтиридина 2

с) взаимодействия фталимидилнафтиридина 2 с хлорирующим агентом с образованием хлорида 3

d) взаимодействия хлорида 3 с восстанавливающим агентом с образованием гидроксииндолинона 4

e) взаимодействия гидроксииндолинона 4 с галогенидом 5-метил-2-оксо-гексилтрифенилфосфония с образованием рацемического 2-(7-хлор-1,8-нафтиридин-2-ил)-3-(5-метил-2-оксогексил)-1-изоиндолинона; и
f) разделение рацемического 2-(7-хлор-1,8-нафтиридин-2-ил)-3-(5-метил-2-оксогексил)-1-изоиндолинона с получением (+)-2-(7-хлор-1,8-нафтиридин-2-ил)-3-(5-метил-2-оксогексил)-1-изоиндолинона.
g) взаимодействия рацемического 2-(7-хлор-1,8-нафтиридин-2-ил)-3-(5-метил-2-оксогексил)-1-изоиндолинона с основанием с образованием кислоты 6
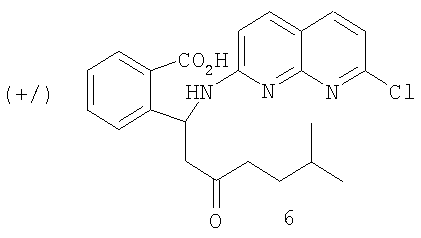
h) взаимодействия кислоты 6 с (+)-эфедрином с образованием соли 6а
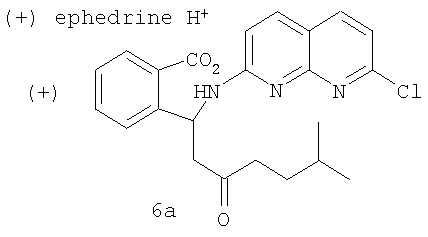
i) взаимодействия соли 6а с амидообразующим агентом с получением (+)-2-(7-хлор-1,8-нафтиридин-2-ил)-3-(5-метил-2-оксогексил)-1-изоиндолинона.
а) взаимодействия гидросульфата 2-амино-7-гидрокси-1,8-нафтиридина с фталильным реагентом в среде растворителя с образованием фталимидилнафтиридина 2

b) взаимодействия фталимидилнафтиридина 2 с хлорирующим агентом с образованием хлорида 3

с) взаимодействия хлорида 3 с восстанавливающим агентом с образованием гидроксииндолинона 4

d) взаимодействия гидроксииндолинона 4 с галогенидом 5-метил-2-оксо-гексилтрифенилфосфония с образованием рацемического 2-(7-хлор-1,8-нафтиридин-2-ил)-3-(5-метил-2-оксогексил)-1-изоиндолинона.
| SORBERA L.A | |||
| et al | |||
| Pagoclone anxiolytic GABA-A/BZD site partial agonist, Drugs of the Future, 2001, 26(7):651-7 | |||
| NEWKOME G.R | |||
| et al | |||
| Устройство для сортировки каменного угля | 1921 |
|
SU61A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2008-03-10—Публикация
2003-03-17—Подача