Изобретение относится к диагностике гепатоцеллюлярной карциномы. В частности, изобретение относится к антителам и способам определения уровня глипикана-3 как маркера гепатоцеллюлярной карциномы.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
В этой заявке на изобретение приводятся разные ссылки, для того чтобы более полно описать состояние той области, к которой относится это изобретение. Описания этих ссылок, таким образом, включены в настоящее описание посредством цитирования.
Гепатоцеллюлярная карцинома (ГЦК) является наиболее распространенной в мире солидной опухолью, ответственной за более чем 1 миллион смертей ежегодно (Parkin, et al., (1999) CA. Cancer J. Clin., 49:33-64, и Okuda, et al., (1993), Neoplasms of the Liver в Diseases of Liver, 7th edition, 1236).
Заболеваемость ГЦК увеличивается в большинстве западных стран (Deuffic, et al., (1998), Lancet 351:214-215). Несмотря на отсутствие достаточных эпидемиологических исследований данные органов здравоохранения Канады указывают на то, что смертность людей от ГЦК за последние 15 лет почти удвоилась. Демографическая статистика пациентов с вирусным гепатитом позволяет предположить, что заболеваемость ГЦК снова удвоится в ближайшие 10 лет (Zou et al., (2000), Can. J. Gastroenterol., 14:575-580).
На ранних стадиях ГЦК протекает обычно бессимптомно и имеет значительную склонность к инвазии сосудов или желчных путей, даже в тех случаях, когда первичная опухоль является небольшой (Fong, et al., (2001), Cancer of the Liver and Biliary Tree в Cancer: Principles & Practice of Oncology, 6th Edition, 1162-1199). Как следствие, ГЦК обнаруживают обычно на поздней стадии. Исторически только 10-20% обнаруженных первичных ГЦК являются операбельными в момент постановки диагноза (Fong, et al., (2001), Cancer of the Liver and Biliary Tree в Cancer: Principles & Practice of Oncology, 1162-1199). В последнее время с введением программ скрининга ГЦК доля потенциально излечимых опухолей увеличивается, хотя большая часть пациентов в момент постановки диагноза все же имеет неизлечимое заболевание.
ГЦК ассоциирована с хроническим поражением печени, первичным хроническим вирусным гепатитом и алкогольным заболеванием печени (Rustgi, (1987), Gastroenterol. Clin. North Am., 16:545-551). Самая высокая заболеваемость ГЦК обнаружена в областях, где вирус гепатита В (HBV от англ. hepatitis В virus) и вирус гепатита С (HCV от англ. hepatitis С virus) являются эндемическими. В случае HBV было показано, что относительный риск развития ГЦК у индивидуумов с признаками хронической инфекции в 50-100 раз выше, чем у неинфицированных индивидуумов (Beasley, et al., (1994), Epidemiology of hepatocellular carcinoma в Viral hepatitis and liver disease, 209). В отличие от других случаев ГЦК цирроз, ассоциированный с хроническим гепатитом В, не является непременным условием развития ГЦК. Нет никаких оценок относительного риска развития ГЦК у пациентов с хроническим гепатитом С, но заболеваемость ГЦК у носителей HCV с циррозом печени может составлять до 5% в год по сравнению с 0,5% для носителей HBV (Di Bisceglie, (1995), Semin. Liver Dis., 15:64-69). Хроническая (персистентная) HCV-инфекция является причиной 70% случаев ГЦК в Японии, а наиболее вероятной причиной увеличения заболеваемости ГЦК в Северной Америке является увеличивающееся распространение HCV-инфекции в популяции населения (Hasan, et al., (1990), Hepatology, 12:589-591 и EI-Serag, et al., (1999), N. Engl. J. Med., 340:745-750).
В развитии ГЦК участвуют некоторые химические вещества. Наиболее важным из них является этанол, и злоупотребление алкоголем связывают с развитием ГЦК (Schiff, (1997), Hepatology, 26:398-428 и Nalpas, et al., (1995), Alcohol, 12:17-120). Считают, что этанол порождает ГЦК в результате развития цирроза печени или в качестве ко-карциногена с другими агентами, такими как HBV и HCV. Афлатоксины, продуцируемые некоторыми грибами, также связывают с ГЦК (Yu, (1995), J. Gastroenterot. Hepatol., 10:674-682). Эти грибы имеют тенденцию расти на зерне, арахисе и других продуктах питания и являются наиболее частой причиной порчи продуктов.
Диагностика ГЦК является относительно простой у пациентов с объемным новообразованием, выявляемым ультразвуковой эхографией или компьютерной томографией (КГ), и уровнем сывороточного альфа-фетопротеина (АФП) более 500 нг/мл (Fong, et al., (2001), в Cancer of the Liver and Biliary Tree в Cancer: Principles & Practice of Oncology, 6th Edition, 1162-1199). Однако обычно к тому времени, когда эти условия встречаются, ГЦК является неизлечимой, поскольку уровень АФП очень часто не повышается до диагностируемого уровня.
Диагностика путем визуализации небольших новообразований является относительно неточной, независимо от того, выявляются ли они ультразвуковой эхографией, КГ сканированием или ядерно-магнитным резонансом (ЯМР от англ. MRI, Magnetic Resonance Imaging) (Fong, et al., (2001), в Cancer of the Liver and Biliary Tree в Cancer: Principles & Practice of Oncology, 6th Edition, 1162-1199); и Murakami, et al., (1995), Detectability of hypervascular hepatocellular carcinoma by arterial phase images of MR and spiral CT. Acta Radiol., 36:372-376). В частности, два новообразования, которые могут имитировать ГЦК радиологически, представляют собой цирротические узелки и диспластичесие узелки. Биопсия печени из небольших новообразований также является недостаточно чувствительной или специфичной (Levy, et al., (2001), Ann. Surg., 234:206-209). Даже при использовании пункционной биопсии, хорошо дифференцированный рак с трудом можно отличить от доброкачественных новообразований из-за ограниченного количества материала, получаемого обычно в результате этой процедуры (Fong, et al., (2001), в Cancer of the Liver and Biliary Tree в Cancer: Principles & Practice of Oncology 6th Edition, 1162-1199). Таким образом, несмотря на преимущества технологии визуализации все же существует потребность в подходящем молекулярном маркере, для того чтобы в трудных случаях отличить ГЦК от доброкачественных новообразований печени.
Размер опухоли представляет собой значительный фактор риска внутрипеченочного распространения и метастазирования ГЦК (Yuki, et al., (1990), Cancer, 66:2174-2179). Кроме того, гораздо больше возможностей для лечения имеется у пациентов с небольшими опухолями. Симптоматические опухоли являются обычно большими и выходят за рамки терапевтического воздействия. Иная ситуация наблюдается в тех случаях, когда чувствительный и специфический маркер ГЦК может оказаться полезным при скрининге пациентов с риском развития ГЦК, таких как хронические носители HBV и индивидуумы с HCV плюс циррозом. Хотя этот скрининг широко применяется, имеется пока еще мало данных для предположения, что он эффективен в лечении заболевания (Collier, et al., (1998), Hepatology, 27:273-278). Одна из причин, почему не удалось продемонстрировать эффективность скрининга, состоит в том, что серологический тест, который используется в настоящее время, а именно последовательные анализы АФП, имеет низкую чувствительность и специфичность (Collier, et al., (1998), Viral Hepatitis Reviews, 4:31-41). Таким образом, для улучшения скрининга ГЦК необходимы улучшенные тест-системы.
Единственным молекулярным маркером, который был широко использован для скрининга и диагностики ГЦК, является альфа-фетопротеин (АФП). Этот белок синтезируется в больших количествах желточным мешком и печенью во время эмбрионального развития (Chan, et al., (1999), в Tumor Markers, в Tietz textbook of clinical chemistry, 3rd, 722-749, Taketa, К (1990), Hepatology, 12:1420-1432). Через 12-18 месяцев после рождения концентрация АФП постепенно уменьшается до значения ниже 10 нг/мл. Во время беременности АФП снова появляется в материнской сыворотке. Повышенная циркуляция АФП связана с ГЦК, карциномой желудка, раком легкого, раком поджелудочной железы, раком желчных путей и тестикулярной карциномой (Chan, et al., (1999), в Tumor Markers, в Tietz textbook of clinical chemistry, 3rd, 722-749).
Если уровни АФП 20 нг/мл или выше рассматривать в качестве диагностических, то можно выявить от 60 до 80% случаев ГЦК, но в случае небольших опухолей чувствительность значительно ниже (40%) (Trevisani, et al., (2001), J.Hepatol., 34:570-575). Другая проблема с использованием АФП в качестве маркера ГЦК заключается в отсутствии его специфичности; значительное повышение уровней АФП (20-200 нг/мл) наблюдается у большого количества пациентов с хроническими заболеваниями печени (Collier, et al., (1998), Viral Hepatitis Reviews, 4:31-41). Сообщается, что 15-58% пациентов с хроническим гепатитом и 11-47% пациентов с циррозом имели повышенное содержание АФП в сыворотке (Taketa, (1990), Hepatology, 12:1420-1432). Поэтому неудивительно, что уровни АФП в сыворотке у пациентов с ГЦК и циррозом перекрываются, что затрудняет интерпретацию результатов анализа АФП. Следовательно, полезность определения уровня АФП в качестве средства контроля за пациентами с риском развития ГЦК подвергается сомнению (Sherman, (2001), J.Hepatol., 34:603-605). Поэтому считают, что единственным условием, при котором измерение АФП является оправданным, это подтверждение первоначального диагноза, основанного на методе визуализации (Sherman, (2001), J.Hepatol., 34:603-605).
Из-за недостоверности уровней АФП большинство режимов скрининга включают в себя ультразвуковую эхографию, которая высоко чувствительна к объемным новообразованиям печени. Однако ультразвуковая эхография не имеет специфичности и не может дать достоверных различий между ГЦК, цирротическим узелком и диспластическим узелком, если новообразования меньше 2 см.
В последние несколько лет были исследованы некоторые новые потенциальные маркеры ГЦК, но ничего явно превосходящего АФП обнаружено не было (Seow, et al., (2001), Proteomics, 1:1249-1263). Например, в качестве возможного маркера был предложен дес-гамма-карбоксипротромбин. Однако эта молекула, как и АФП, не пригодна для выявления небольших опухолей (Nomura, et al., (1999), Am. J. Gastroenterol., 94:650-654).
В 1997 Hsu с соавт. сообщил, что при анализе нормальной печени и ГЦК методом дифференциального дисплея мРНК (Differential display) они идентифицировали транскрипт, который активировался при ГЦК (Hsu, et al., (1997), Cancer Res., 57:5179-5184). Оказалось, что этот транскрипт, который они назвали MXR7, представляет собой глипикан-3 (GPC3). GPC3 является гепарансульфат протеогликаном, который связывается с клеточной поверхностью липидным хвостом (Duenas Gonzales, et al., (1998), J. Cell. Biol., 141:1407-1414). Hsu с соавт. обнаружил, что мРНК GPC3 экспрессировалась в 143 из 191 (74,8%) первичных и рецидивирующих ГЦК, и только в 5 из 154 (3,2%) нормальных образцах печени.
Второе исследование обнаружило сверхэкспрессию мРНК GPC3 в 75% случаев ГЦК, но никакой сверхэкспрессии не было обнаружено в случае местной узелковой гиперплазии и цирроза печени (Zhu et al., (2001), Gut, 48, 558-564).
Эти исследования проанализировали только уровни мРНК, а известно, что уровни мРНК не всегда коррелируют с экспрессией и секрецией белков. Кроме того, в норме только ограниченное количество белков печени секретируется в кровоток.
Хотя эти результаты позволили предположить, что анализ мРНК GPC3 в печеночной ткани можно использовать для обнаружения ГЦК, этот тип анализа является инвазивным, так как он требует выделения опухолевой ткани. Кроме того, анализ мРНК требует много времени и является трудным для рутинного выполнения.
Поэтому существует потребность в сывороточном маркере, который может быть использован для скрининга (т.е. который будет положительным у значительной части бессимптомных пациентов с небольшими ГЦК). У пациентов, у которых с помощью ультразвука было определено небольшое объемное новообразование, этот тест также должен достоверно отделять пациентов с ГЦК от пациентов с незлокачественными новообразованиями.
В заключение следует отметить, что все еще существует потребность в лучших молекулярных маркерах ГЦК, в частности, для контроля за популяциями с высоким риском развития ГЦК, такими как пациенты с вирусным гепатитом С с установленным циррозом. Поиск таких маркеров был очень трудным из-за высокой степени гетерогенности, которая характеризует ГЦК (Thorgeirsson, et al., (2002), Nature Genet., 31:339-346).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Авторы изобретения обнаружили новый сывороточный маркер ГЦК, глипикан-3 (GPC3), который лежит в основе нового быстрого, удобного и неинвазивного анализа, который предлагает улучшенную специфичность в диагностике ГЦК.
В соответствии с одной из форм осуществления настоящего изобретения предложен способ скрининга субъекта на гепатоцеллюлярную карциному (ГЦК), включающий:
- получение образца жидкости из организма субъекта, и
- определение уровня глипикана-3 (GPC3) в этом образце;
- где присутствие выявляемого уровня GPC3 в образце указывает на наличие ГЦК у субъекта.
Согласно другой форме осуществления настоящего изобретения предложено по существу очищенное антитело или его фрагмент, которое специфически связывается с GPC3 или его фрагментом.
Согласно другой форме осуществления настоящего изобретения предложен способ диагностики ГЦК у субъекта, включающий:
- получение образца печеночной ткани от субъекта, и
- определение присутствия GPC3 в этом образце ткани;
- где обнаружение GPC3 в образце указывает на наличие ГЦК.
Согласно другой форме осуществления настоящего изобретения предложен способ обнаружения присутствия GPC3 в образце, включающий:
- приведение образца в контакт с антителом или его фрагментом, которое специфически связывается с GPC3 или его фрагментом, для обеспечения формирования комплекса антитело-GРС3 или комплекса антитело-фрагмент GPC3; и
- обнаружение комплекса антитело-GРС3 или антитело-фрагмент GPC3.
Согласно другой форме осуществления настоящего изобретения предложен способ определения уровня GPC3 в образце, включающий:
- приведение образца в контакт с антителом или его фрагментом, которое специфически связывается с GPC3 или его фрагментом, для обеспечения формирования комплекса антитело-GРС3 или антитело-фрагмент GPC3; и
- определение комплекса антитело-GРС3 или антитело-фрагмент GPC3.
Согласно другой форме осуществления настоящего изобретения предложен набор для обнаружения или определения уровня GPC3 в образце, содержащий:
- по существу очищенное антитело или его фрагмент, которое специфически связывается с GPC3 или его фрагментом.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Предпочтительные формы осуществления изобретения описаны со ссылкой на чертежи, где:
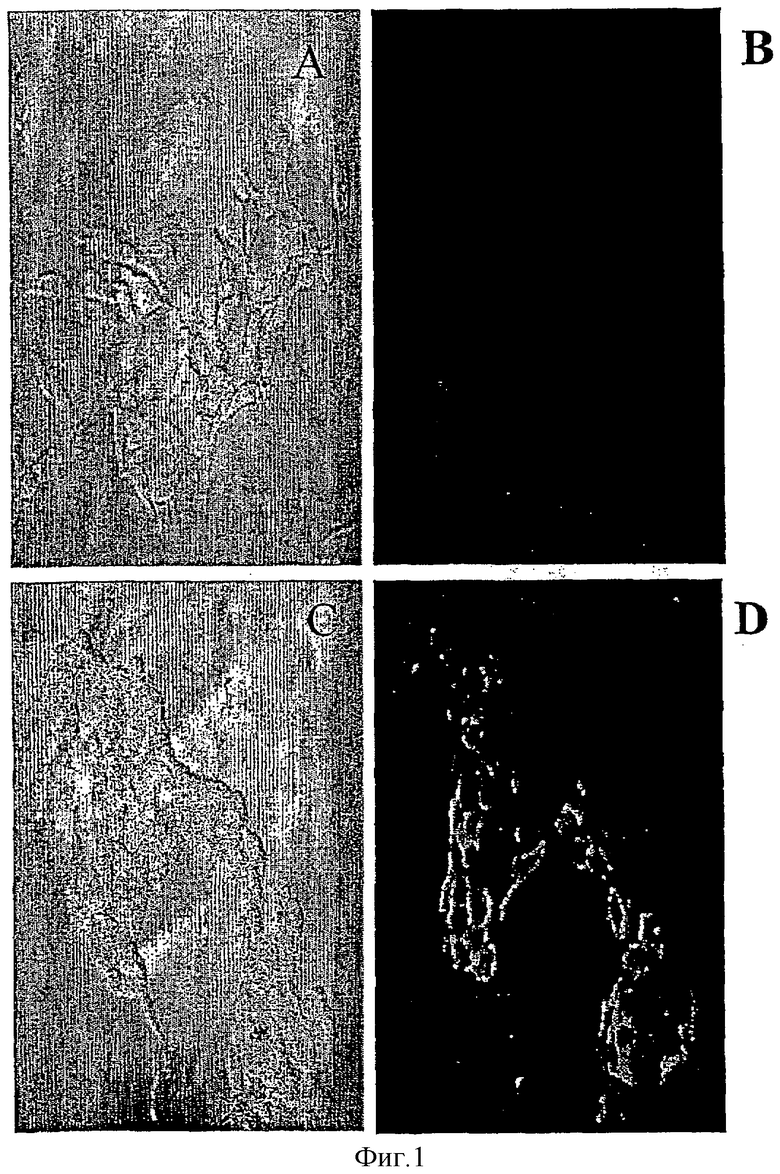
Фигура 1 демонстрирует микрофотографии СРС3-трансфицированных клеток линии 293 (Панели С и D) и контрольных клеток, трансфицированных только вектором (Панели и В), окрашенных анти-GРС3 моноклональным антителом 1G12. Панели А и С представляют собой фазово-контрастные микрофотографии, а Панели В и D - флуоресцентные микрофотографии.
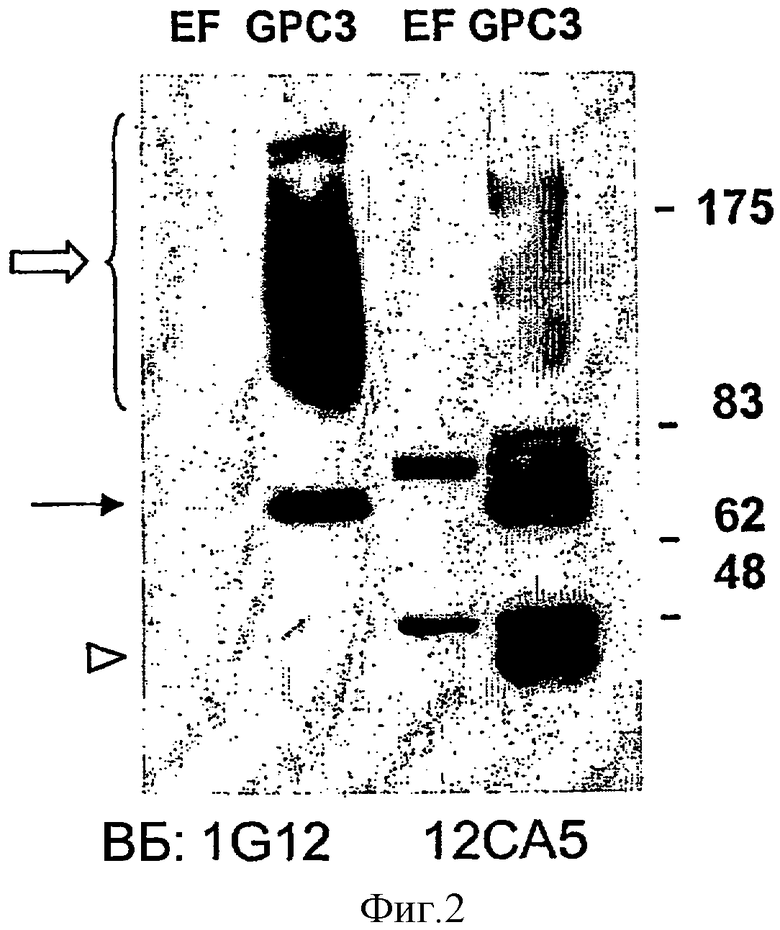
Фигура 2 демонстрирует Вестерн-блот (ВБ) анализ белков из клеток линии 293, трансфицированных только вектором (EF) или ГА-меченным GPC3 (GPC3). Мембраны инкубировали с анти-GРС3 антителом 1G12 или анти-ГА антителом (12СА5). Объемная стрелка: сердцевинный белок GPC3; линейная стрелка: гликанированные формы GPC3; кончик стрелки: продукт расщепления, содержащий N-конец GPC3, который не содержит эпитоп, выявляемый 1G12. Числа справа соответствуют маркерам молекулярной массы.
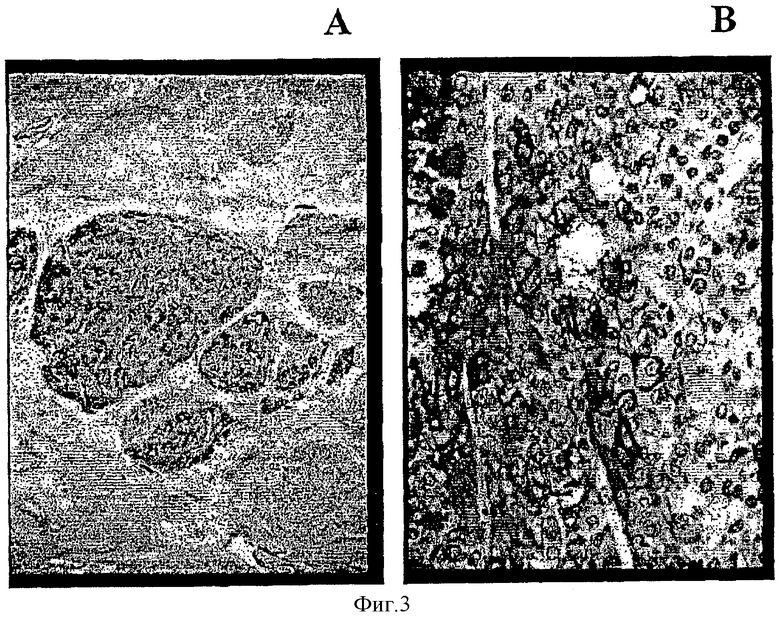
Фигура 3 демонстрирует микрофотографии иммуногистохимически окрашенных срезов гепатоцеллюлярной карциномы с использованием моноклонального антитела 1G12. Панель А: 16× общий вид ГЦК с высоким содержанием GРС3-положительно окрашенной ткани (Т), окруженной неокрашенной неопухолевой печеночной тканью (N); Панель В: 400× вид той же ткани, демонстрирующий цитоплазматические гранулы и мембранное окрашивание.
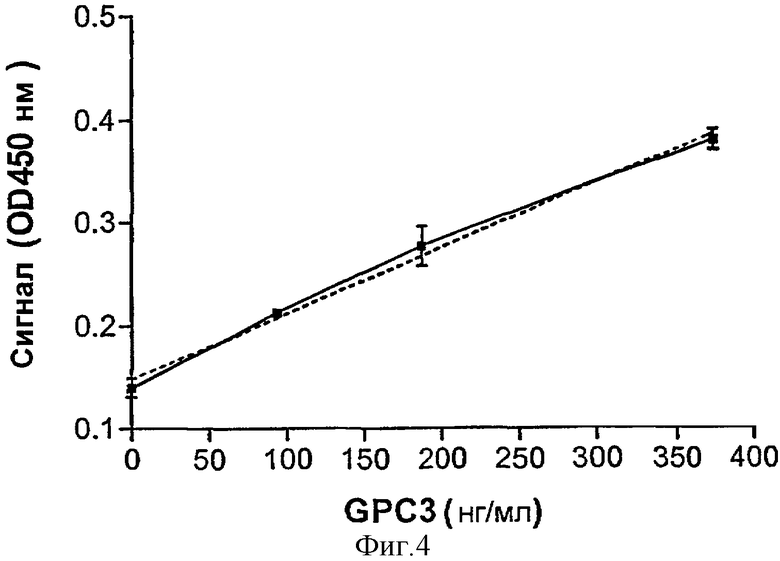
Фигура 4 демонстрирует зависимость между концентрацией GPC3 и оптической плотностью GPC3 в ELISA-тесте.
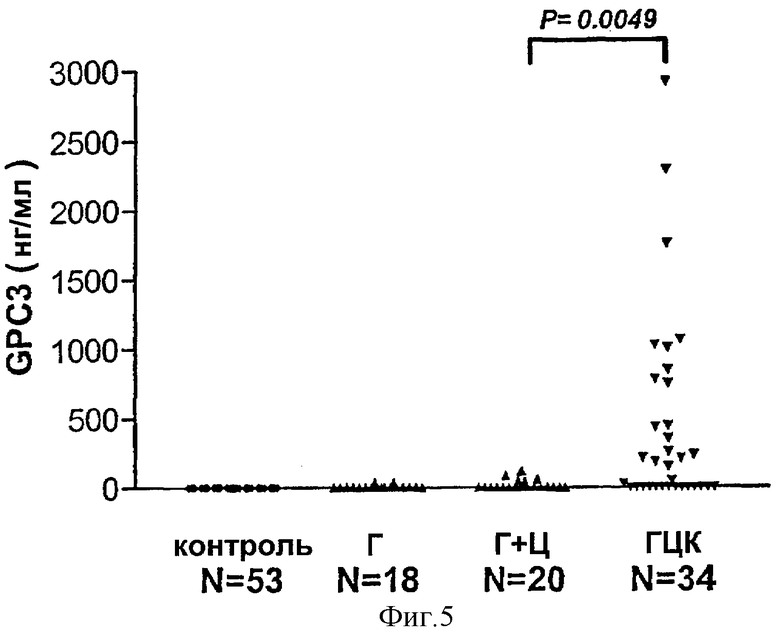
Фигура 5 демонстрирует уровни GPC3 в сыворотке от контрольных пациентов, пациентов с гепатитом (Г), пациентов с гепатитом плюс циррозом (Г+Ц) и пациентов с гепатоцеллюлярной карциномой (ГЦК), определенные с помощью ELISA; приведенные результаты представляют собой среднее четырех измерений. Достоверность различия между средними значениями GPC3 для пациентов с ГЦК и пациентов с циррозом показана в верхней части фигуры.
СВЕДЕНИЯ, ПОДТВЕРЖДАЮЩИЕ ВОЗМОЖНОСТЬ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
В настоящем изобретении предложен новый способ скрининга млекопитающего субъекта на гепатоцеллюлярную карциному (ГЦК). Авторы изобретения установили, что протеогликан клеточной поверхности GPC3 может быть определен в кровотоке, в сыворотке или плазме от субъектов с ГЦК, но не встречается на выявляемом уровне, т.е. уровне существенно выше фонового, в сыворотке или плазме от нормальных субъектов при использовании стандартного теста достоверности, описанного здесь. Было также показано, что мало или вовсе не определяется GPC3 в сыворотке или плазме от субъектов, страдающих гепатитом или гепатитом плюс циррозом.
Таким образом, предложен удобный неинвазивный способ скрининга субъекта на ГЦК путем определения уровней GPC3 в жидкости организма, полученной от субъекта. Подходящие для тестирования жидкости организма включают в себя сыворотку, плазму и цельную кровь. Скрининг сыворотки или плазмы является предпочтительным.
Уровни GPC3 в жидкости организма могут быть определены любым подходящим способом измерения этого белка. Иммунологические способы определения уровней GPC3 являются весьма удобными, и соответствующие виды способов хорошо известны специалистам в данной области и дополнительно описаны здесь.
Например, антитела или фрагменты антител, которые специфически связываются с GPC3 человека, являются основой для многочисленных аналитических способов определения GPC3 с использованием антител. ГЦК можно диагностировать путем приведения в контакт жидкости организма, полученной от субъекта, с антителом или его фрагментом, которые специфически связываются с GPC3 в условиях, способствующих формированию комплекса антитело-GРС3, и затем обнаружения и/или определения уровня этого комплекса. Количество комплекса антитело-GРС3 коррелирует с уровнем GPC3 в этом образце.
Используемый здесь термин "антитело", если не указано иначе, включает в себя поликлональное антитело, моноклональное антитело, химерное антитело, гуманизированное антитело и одноцепочечное антитело.
Термин "фрагмент антитела" означает часть антитела, которая демонстрирует специфическое связывание исходного антитела и включает в себя Fab-, F(ab')2- и Fv-фрагменты.
Считается, что используемое здесь антитело или фрагмент антитела "специфически связывается" с молекулой-мишенью, если это антитело или фрагмент антитела распознает и связывается с молекулой-мишенью, но по существу не распознает и не связывается с другими молекулами, присутствующими в образце, содержащем молекулы-мишени.
Химерные антитела представляют собой антитела, которые содержат участки антител от различных видов. Например, химерное антитело может иметь константную область от человека и вариабельную область от других видов. Химерные антитела могут быть получены хорошо известными рекомбинантными способами, как описано в Патентах США №5354847 и №5500362 и в научной литературе (Couto et al., (1993), Hybridoma, 12:485-489).
Гуманизированные антитела представляют собой антитела, в которых только участки, определяющие комплементарность и отвечающие за связывание антигена и специфичность, происходят из иного, чем человек источника, тогда как по существу вся остальная молекула антитела имеет человеческое происхождение. Гуманизированные антитела и их получение также хорошо известны в данной области - см., например, Патенты США №5225539, №5585089, №5693761 и №5693762.
Одноцепочечные антитела представляют собой полипептидные последовательности, которые могут специфически связываться с пептидом или эпитопом, где одноцепочечное антитело происходит или из легкой, или из тяжелой цепи моноклонального или поликлонального антитела. Одноцепочечные антитела включают полипептиды, происходящие из гуманизированных, химерных или полностью человеческих антител, где одноцепочечное антитело происходит или из их легких, или из их тяжелых цепей.
Антитела
Поликлональные антитела
Для получения поликлональных антител может быть получен очищенный GPC3 человека или другого животного.
GPC3 может быть очищен, например, из плаценты человека стандартными способами, например, как описано у Bonneh-Barkay с соавт. (J. Biol. Chem., 1997, v.272, pp.12415-12421).
Очищенный белок может быть при необходимости сшит с белком-носителем, таким как гемоцианин лимфы улитки, который хорошо известен в данной области, и затем смешан с адъювантом Фрейнда и инъецирован в кроликов или других подходящих лабораторных животных.
В качестве альтернативы весь или часть белка GPC3 могут быть синтезированы рекомбинантно в подходящем хозяине, таком как бактерия, путем экспрессии соответствующей последовательности ДНК, встроенной в подходящий клонирующий вектор. ДНК, кодирующая GPC3, может быть клонирована описанными ранее способами (Filmus et al., (1988), Molec. & Cell Biol., v.8, pp.4243-4249; Linsley et al., (1993), Ann. Rev. Immunol., v.11, pp.191-212; Peach et al., (1994), J. Exp. Med., v.180, pp.2049-2058). GPC3 или его часть могут быть экспрессированы в виде слитого (химерного) белка аналогичными способами.
Две широко использующиеся экспрессирующие системы для продуцирования рекомбинантных слитых белков в клетках Е.coli представляют собой гибриды генов белка, связывающего глутатион-8-трансферазу или мальтозу с векторами серии pUR, и гибриды гена trpE с векторами рАТН.
Экспрессирующийся белок GPC3 затем может быть очищен, например, с использованием глутатионной колонки, при необходимости сшит с белком-носителем и смешан с адъювантом Фрейнда (для стимуляции антигенного ответа животного) и инъецирован в кроликов или других подходящих лабораторных животных. После бустерных инъекций с недельными интервалами кроликов или других лабораторных животных обескровливают и выделяют сыворотки. Сыворотки могут быть использованы непосредственно или очищены перед использованием различными способами, включая аффинную хроматографию с применением протеин А-сефарозы, антиген-сефарозы или антимышиных Ig, сшитых с сефарозой.
Поликлональные антитела могут быть также получены с использованием фрагмента GPC3 в качестве антигена. Могут быть использованы фрагменты трех или более последовательных аминокислот из аминокислотной последовательности GPC3. Фрагмент GPC3, включающий 70 аминокислот карбокси-концевой аминокислотной последовательности, или его часть являются предпочтительным антигеном. Фрагменты могут быть получены рекомбинантным путем, возможно, в виде слитых белков, как описано здесь. Для улучшения антигенности in vivo такие пептидные антигены могут быть конъюгированы с гемоцианином лимфы улитки.
Моноклональные антитела
Моноклональные анти-GРС3 антитела также могут быть получены стандартными способами после инъекции в мышей очищенного GPC3 или его фрагментов, возможно, в виде слитых белков, полученных, как описано выше для получения поликлональных антител.
Кратко, очищенный белок или пептид инъецируют в мышей в адъюванте Фрейнда, например, девять раз в течение трехнедельного периода. Мышиные селезенки удаляют и ресуспендируют в фосфатно-солевом буфере (ФСБ). Клетки селезенок служат в качестве источника лимфоцитов, некоторые из которых продуцируют антитело соответствующей специфичности. Эти клетки затем подвергают слиянию с постоянно растущими миеломными клетками-партнерами и продукты слияния - гибридомы - культивируют в лунках планшетов для тканевых культур в присутствии селективного агента, такого как HAT. Затем эти лунки подвергают скринингу с помощью ELISA (твердофазного иммуноферментного анализа) для идентификации лунок, которые содержат клетки, продуцирующие антитело, специфичное к GPC3. Эти клетки затем культивируют и после периода роста эти лунки снова подвергают скринингу для идентификации антителообразующих клеток. Некоторые процедуры клонирования выполняют до тех пор, пока более 90% лунок не будут содержать отдельные клоны, которые являются положительными в смысле продукции антител. Эта процедура дает стабильную линию клонов, которые продуцируют антитело. Монокпональное антитело затем может быть очищено с помощью аффинной хроматографии с использованием протеин А-сефарозы или с помощью ионообменной хроматографии, а также вариантов и комбинаций этих методов.
В дополнительном примере осуществления получают фрагменты антител, включая, но не ограничиваясь, F(ab)2-, F(ab')2- и Fv-фрагменты или одноцепочечные компоненты GРС3-специфических моноклональных антител. Такие фрагменты могут быть получены путем протеолитического расщепления интактных анти-GРС3 антител, например, как описано у Lin с соавт. (PNAS, 1978, 75(6); 2649-2653), или путем генетической манипуляции с генами, кодирующими такие фрагменты, и ферментации трансфицированных продуцирующих систем, которые способны секретировать такие анти-GРС3 фрагменты антител.
Предпочтительными являются анти-GРС3 антитела с антигенной аффинностью, составляющей, по меньшей мере, 1×108.
Для анализа GPC3 в образце могут быть использованы различные виды аналитических форматов. Они включают "сэндвич"-ELISA, радиоиммунный анализ, иммунофлуоресцентный анализ, дот-блот, индикаторные полоски (технологии «dipstick») и Вестерн-блот.
В предпочтительном примере осуществления используют антитело, которое специфически связывается с GPC3 или его фрагментом и несет выявляемую метку, и полученный комплекс GРС3-антитело определяют путем измерения выявляемой метки, определяя при этом также уровень GPC3 в образце. В качестве альтернативы используют первое антитело, специфичное к GPC3 или его фрагменту, затем второе антитело, специфичное к первому антителу и несущее метку, которая может представлять собой непосредственно выявляемую метку или может быть компонентом сигнал-генерирующей системы. Такие меченые антитела и системы хорошо известны в данной области.
Обнаружение и определение метки или сигнала, производимого сигнал-генерирующей системой, при сравнении с соответствующими калибровочными стандартами, позволяет определять комплекс GРС3-антитело, присутствующий в образце, и, следовательно, GPC3.
Второе антитело несет метку, которая может представлять собой любую подходящую непосредственно выявляемую метку или компонент любой подходящей сигнал-генерирующей системы. Многочисленные их примеры хорошо известны из области иммуноанализа.
Мечение второго антитела выявляемой меткой или компонентом сигнал-генерирующей системы может быть выполнено методами, хорошо известными в данной области. Примеры меток, которые могут быть использованы для того, чтобы сделать антитело обнаружимым, включают в себя радиоизотопы, ферменты, флуоресцентные и хемилюминесцентные вещества. Например, в качестве непосредственно выявляемой метки может быть использован радиоактивный элемент; примеры радиоактивной метки включают в себя γ-излучатели 124I,125I, 128I и 131I. В качестве непосредственно выявляемой метки может быть использована также флуоресцентная метка; например, подходящие флюорофоры включают в себя кумарин, ионы редкоземельных металлов, хелаты или хелатные комплексы, флуоресцеин, родамин и производные родамина.
Подходящие метки также включают в себя комплексы металлов, стабильные свободные радикалы, везикулы, липосомы, коллоидные частицы, частицы латекса, спиновые метки, биотин/авидин и их производные.
Могут быть использованы иммуноферментные сигнал-генерирующие системы, включающие щелочную фосфатазу, амилазу, люциферазу, каталазу, бета-галактозидазу, глюкозооксидазу, глюкозо-6-фосфатдегидрогеназу, гексокиназу, пероксидазу хрена, лактамазу, уреазу и малатдегидрогеназу. Активность фермента может быть определена измерением поглощательной способности, интенсивности флуоресценции или люминесценции после взаимодействия фермента с соответствующим субстратом. При использовании ферментов в качестве метки соединение между ферментом и антителом может быть получено стандартными способами, такими как способы с глютаральдегидом, йодной кислотой и малеинимидом.
Твердые матрицы, действующие в качестве твердых подложек, подходящих для иммобилизации антитела, включают микротитровальные планшеты, такие как планшеты, получаемые от фирмы Falcon Plastics (Oxnard, Калифорния), или, например, стандартные микротитровальные планшеты для ELISA (Immulon II, Dynax, Chantilly, Вирджиния) и покрытые стрептавидином микротитровальные планшеты для ELISA (Reacti-Bind, Pierce, Rockford, Иллинойс), и микротитровальные узкие пластинки (strips), получаемые, например, от фирмы Dynatech (Alexandria, Вирджиния). Лунки пластинок или микротитровальных планшетов изготавливают из прозрачной пластмассы, предпочтительно поливинилхлорида или полистирола. Другие твердые матрицы, пригодные для иммобилизации антител, включают в себя полистирольные пробирки, полоски (sticks) или лопастные мешалки любого удобного размера, или полистирольные шарики, или полиакриламидные матрицы.
Антитела могут быть иммобилизованы на твердой подложке стандартными способами, которые хорошо известны в данной области, например, как описано в Патенте США №5352583.
В соответствии с предпочтительным примером осуществления изобретения образец жидкости организма приводят в контакт с первым антителом, которое специфически связывается с GPC3 с образованием комплекса, при этом первое антитело иммобилизовано на твердой подложке. Достаточный период времени дают для того, чтобы обеспечить связывание GPC3 образца с иммобилизованным антителом. Твердую подложку затем промывают и приводят в контакт со вторым антителом, которое специфически связывается с первым антителом и помечено выявляемой меткой или присоединенной к нему сигнал-генерирующей системой. Метку или генерируемый сигнал, связанные с твердой подложкой, определяют, измеряя комплекс, присутствующий в этом образце, и, следовательно, определяя уровень GPC3 в этом образце.
В соответствии с еще одним примером осуществления образец приводят в контакт одновременно с иммобилизованным на твердой подложке первым антителом и меченым вторым антителом.
В другом примере осуществления второе антитело может не иметь метку или компонент сигнал-генерирующей системы, и это второе антитело, связанное с твердой подложкой, определяют посредством третьего антитела, несущего выявляемую метку или компонент сигнал-генерирующей системы, при этом третье антитело избирательно связывается со связанным вторым антителом.
В соответствии с еще одним примером осуществления образец приводят в контакт либо одновременно, либо поэтапно с первым антителом, которое специфически связывается с GPC3 и к которому присоединен один член связывающей пары, и с меченым вторым антителом, которое связывается с первым антителом. Полученную смесь затем приводят в контакт с твердой подложкой, на которой иммобилизован другой член связывающей пары. По прошествии достаточного периода времени, необходимого для того, чтобы меченый комплекс связался с твердой подложкой путем взаимодействия членов связывающей пары, твердую подложку промывают и определяют количество метки, связанной с ней, для того чтобы определить уровень GPC3 в этом образце. Подходящие связывающие пары включают биотин/стрептавидин. Другие подходящие пары известны специалистам в данной области. Специфичности антител могут быть обратимыми: первое антитело специфически связывается с комплексом, и меченое второе антитело специфически связывается с GPC3.
Описанный здесь способ скрининга, по-видимому, весьма специфичен для ГЦК, поскольку GPC3 не определялся в образцах, полученных от нормальных субъектов и лиц, страдающих гепатитом, и был обнаружен в совсем незначительных количествах у редких лиц, страдающих гепатитом плюс циррозом.
В исследованиях с привлечением субъектов с установленной ГЦК от 53 до 55% субъектов имели определяемые в сыворотке уровни GPC3, варьирующие от 151 нг/мл до 2924 нг/мл.
Когда в качестве маркера ГЦК у тех же пациентов использовали сывороточный АФП и концентрацию 20 нг/мл в качестве порогового уровня отклонения от нормы, выявляли 59% пациентов с ГЦК. Если пороговый уровень АФП, указывающий на наличие заболевания, повышают до 100 нг/мл, то выявляют только 32% случаев ГЦК. Пороговый уровень АФП 20 нг/мл, однако, будет включать ряд ошибочных положительных ответов, так как уровни АФП более 20 нг/мл наблюдаются при многих хронических заболеваниях печени, отличных от ГЦК.
Авторы изобретения обнаружили, что повышенные уровни GPC3 у пациентов с ГЦК недостаточно коррелировали с уровнями АФП (Таблица 4). Поэтому в способе по настоящему изобретению предложено дополнительное полезное средство для идентификации случаев ГЦК, не выявленных скринингом АФП. Способ по настоящему изобретению может быть использован сам по себе или в дополнение к скринингу АФП стандартными способами для улучшения способности идентифицировать ГЦК на ранней и излечимой стадии.
В дополнительном примере осуществления изобретения скрининг GPC3 и АФП можно использовать в комбинации для обеспечения теста, объединяющего специфичность скрининга высоких уровней АФП с улучшенной чувствительностью скрининга GPC3. Например, как видно из данных, представленных в Таблице 4, если определяют сывороточные уровни АФП и GPC3 и в качестве критерия достоверности используют пороговый уровень АФП 100 нг/мл, то 70% пациентов с ГЦК демонстрируют повышение по меньшей мере одного из маркеров: АФП и GPC3, по сравнению с 32%, если в качестве маркера ГЦК используют только 100 нг/мл АФП, или 53%, если в качестве маркера используют только GPC3. Если рассматривают и АФП, и GPC3 и используют пороговое значение 20 нг/мл АФП, то 82% пациентов демонстрируют повышение по меньшей мере одного из маркеров: АФП и GPC3.
Серологические анализы GPC3 по настоящему изобретению особенно полезны для дополнительной оценки субъектов, демонстрирующих клинические признаки объемного новообразования печени. Эти анализы могут быть также использованы для скрининга популяций с риском развития ГЦК, например, лиц, страдающих хроническим гепатитом В или являющихся носителями вируса гепатита С или страдающих от него.
В дополнительном примере осуществления изобретения предложен иммуногистохимический способ диагностики ГЦК путем исследования биопсийных образцов печени от субъектов с объемным новообразованием печени. Образцы печеночной ткани, полученные путем биопсии, часто демонстрируют искаженную морфологию, затрудняющую стандартную гистологическую диагностику. Тканевые срезы из таких биопсий окрашивают анти-GРС3 антителами, как описано здесь в примерах, и обнаружение GPC3 в срезах указывает на то, что биопсийная масса представляет собой ГЦК. Анти-GР3 антитела могут сами нести выявляемую метку, такую как флуоресцентная метка, или первое анти-GРС3 антитело может быть выявлено с помощью поддающегося обнаружению меченого второго антитела.
В настоящем изобретении также предложены антитела, которые специфически связываются с GPC-3. Антитела, которые связываются с теми же эпитопами, что и эти антитела, также охвачены рамками изобретения. Антитела могут представлять собой любой класс иммуноглобулинов, включая IgG, IgM, IgA, IgE и IgD, и любой его подкласс.
В дополнительном примере осуществления изобретения предложен набор, включающий по существу очищенное антитело или его фрагмент, которые специфически связываются с GPC3 или его фрагментом.
В дополнительном примере осуществления предложен набор для стандартного "сэндвич"-анализа с двумя антителами, в котором первое GPC3-специфичное антитело "улавливает" GPC3, присутствующий в образце жидкости, а второе антитело выявляет присутствие "захваченного" GPC3. Антитело, участвующее в захвате другого антитела, обычно иммобилизуют на твердой фазе, такой как планшет для ELISA, нитроцеллюлозная мембрана, шарик или любой другой носитель, известный в данной области. Выявляемое антитело либо непосредственно метят колориметрической или радиоизотопной меткой, либо определяют его с помощью второго меченого антитела, специфичного к изотипу выявляемого антитела.
ОПИСАНИЕ ПРИМЕРОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Эти примеры описаны с целью иллюстрации и не предназначены для ограничения объема изобретения.
Методы химии, молекулярной биологии, белковой и пептидной биохимии и иммунологии, на которые ссылаются, но которые подробно не описаны в описании изобретения и примерах, обсуждаются в научной литературе и хорошо известны специалистам в данной области.
СПОСОБЫ
Ткани пациентов: Образцы печеночной ткани были получены из Отдела патологии Центрального госпиталя Торонто (Toronto General Hospital). Все препараты печени представляли собой большие блоки из иссеченных хирургическим путем опухолей и окружающей паренхимы. Все ткани фиксировали в 10%-ном формалине и заливали парафином для рутинного гистологического исследования.
Сыворотки пациентов: Образцы крови были получены от 34 пациентов с ГЦК (см. Таблица 3 для характеристики пациентов), 20 пациентов с гепатитом плюс циррозом печени (12 с HCV и 8 с HBV), 18 пациентов с гепатитом (12 с HCV, 1 с HCV плюс HIV, 1 с HCV плюс таласемия, 1 коинфицирован HCV и HBV и 3 с HBV) (Toronto General Hospital) и от 53 здоровых доноров крови (Sunnybrook and Women's College Health Sciences Centre, Торонто, Канада) при наличии письменного согласия от этих пациентов. ГЦК диагностировали гистологически при наличии биопсии печени или исходя из клинических данных, следуя инструкциям Европейской ассоциации по изучению болезней печени (European Association for Study of Liver Disease20). Сыворотку выделяли непосредственно путем центрифугирования и замораживали при -20°С. Сыворотки от пациентов, у которых диагностировали незлокачественное заболевание печени (гепатит с циррозом печени и гепатит), во время забора сыворотки включали в это исследование только в том случае, если не было признака злокачественного заболевания спустя 6 месяцев после такого забора.
Клеточные линии: ГЦК клеточные линии HepG2, Нер3В и PLC-PRF-5 культивировали в минимальной питательной среде (MEM) с 10% сыворотки плода коров (FBS) (Gibco BRL) и с добавлением раствора MEM незаменимых аминокислот и пирувата натрия (1 мМ). Клеточную линию 293 культивировали в DMEM и 10% FBS. Все клеточные линии получали из Американской Коллекции Типовых Культур (АТСС) и поддерживали при 37°С во влажной атмосфере с 5% CO2. Для отбора кондиционированных сред клеточные линии выращивали при высокой плотности в течение ночи в отсутствие сыворотки. Отобранные среды концентрировали с помощью фильтров Centricon YM-10000 (Millipore).
Трансфекция GPC3: Клеточную линию 293 трансфицировали GPC3 кДНК21, меченной гемагглютинином А (ГА), введенной в вектор pEF (или пустой вектор в качестве контроля), и трансфицированные клетки селектировали (отбирали) с помощью G418 в концентрации 800 мкг/мл (Gibco BRL). Клетки, экспрессирующие высокие уровни GPC3, сортировали с помощью цитофлуориметра FACS после окрашивания С418-селектированных клеток анти-ГА 12СА5 моноАТ (моноклональным антителом) и FITC-конъюгированным вторым антителом. Отсортированные клетки затем наращивали до тканевой культуры.
Получение анти-GРС3 мышиных моноклональных антител: Самок мышей Balb/C иммунизировали однократной внутрибрюшинной инъекцией по 50 мкг His-меченого фрагмента GPC3, содержащего последние 70 аминокислот сердцевинного белка. Этот иммуноген эмульгировали с адъювантом Titermax Gold (Cedarlane). Через 21 день мышей бустировали 50 мкг того же иммуногена в отсутствие адъюванта. Через два дня из хвостовой вены отбирали образцы крови и получали соответствующие сыворотки. Титр анти-GРС3 в образцах сывороток оценивали с помощью ELISA, используя в качестве отрицательного контроля преиммунизированную сыворотку от тех же мышей. Спленоциты, полученные от двух мышей с самым высоким титром, подвергали слиянию с клетками мышиной миеломы SP2/0 Ag14 (соотношение 6:1) в присутствии полиэтиленгликоля 4000 (Sigma), используя стандартные методы. Гибридные клетки помещали в 96-луночные планшеты и растили в α-МЕМ, 10 мМ Hepes, 50 мкМ 2-меркаптоэтанола, 20% FBS с добавлением Nutridoma-CS (Roche) и гипоксантина, аминоптерина и тимидина (добавка HAT, Gibco BRL). Для отбора продуцирующих гибридом выросшие клоны подвергали скринингу с помощью ELISA, используя 96-луночные планшеты, "нагруженные" 0,05 мкг иммуногена GPC3 на лунку. Планшеты блокировали в течение 2 ч 1%-ным бычьим сывороточным альбумином (БСА) в фосфатно-солевом буфере (ФСБ) и добавляли кондиционированные среды от каждого клона. Присутствие анти-GPCS антител, связанных с антигеном, выявляли, используя пероксидазу хрена, конъюгированную с козьими антимышиными IgG и козьими антимышиными IgM (StressGen), с O-фенилендиамином (Sigma) и перекисью водорода в качестве субстратов. Положительные клоны затем дополнительно наращивали, и их способность окрашивать GPC3-трансфицированные клетки линии 293 определяли иммунофлуоресценцией. Положительные гибридомы, обозначенные 1G12 и 8Н5, дважды реклонировали и определяли их изотип (IgG1, К), используя набор Isostrip (Roche). Антитела очищали из кондиционированных культуральных супернатантов, используя протеин А-колонки (Affi-Gel Protein A MAPS II kit, Bio-Rad).
Иммунофлуоресценция: Клетки линии 293, трансфицированные GPC3- или одним вектором, сеяли на предметные стекла, обработанные поли-L--лизином, и фиксировали 4%-ным параформальдегидом в ФСБ. Через 1 час инкубации с анти-GPC3 моноАТ или нормальными мышиными IgG (Santa Cruz Biotechnology) (15 мкг/мл), предметные стекла трижды промывали ФСБ и связывание первого антитела выявляли с помощью ПТС-конъюгированного овечьего антимышиного F(ab')2-фрагмента IgG (StressGen).
Вестерн-блот-анализ: Клетки лизировали в буфере RIPA, содержащем ингибиторы протеаз (2 мМ PMSF, 10 мкг/мл лейпептина, 10 мкг/мл апротинина), в течение 30 мин на льду. Образцы белков прогоняли на 6%-ном полиакриламидном геле (ПААГ) с додецилсульфатом натрия (ДСН) и переносили на мембрану PVDF (Pall Corporation). Мембраны блокировали в блокирующем буфере (10 мМ Tris-HCl рН 8,0, 150 мМ NaCl, 0,1% Tween 20, 5% обезжиренного сухого молока) в течение 1 часа при комнатной температуре и затем инкубировали с 1 мкг/мл 1G12 или 12СА5 моноАТ в течение ночи при 4°С. После инкубации с пероксидазой хрена, конъюгированной со вторым антителом (антимышиным IgG) в течение одного часа, определяли белковые полосы, используя реагенты для ECL хемолюминесценции (DuPont MEN).
Иммуногистохимия: Заключенные в парафин тканевые срезы освобождали от парафина с помощью ксилола и повторно гидратировали в последовательной серии растворов этанола. Затем осуществляли метод восстановления антигена, нагревая предметные стекла в 10 мМ цитратном буфере с рН 6 в микроволновой печи Kenmore (2 мин при уровне мощности 10, 1,5 мин при уровне мощности 6 и 2,5 мин при уровне мощности 9, и повторяя эти три стадии дважды). Предметные стекла промывали дистиллированной водой, обезвоживали в последовательной серии растворов этанола и погружали в 10%-ную перекись водорода в метаноле на 10 минут для блокирования эндогенной пероксидазы. Предметные стекла вновь гидратировали и иммуноокрашивание проводили, используя анти-GPCS моноАТ в концентрации 20 мкг/мл (или нормальные мышиные IgG и ФСБ в качестве отрицательных контролей) согласно инструкциям для набора Histostain-SP (Zymed Laboratories) и TSATM Biotin System (MEN Life Science Products). Последовательные срезы окрашивали кроличьим поликлональным антителом к АФП (Dako, A008) в разведении 1/400. Эндогенную пероксидазу блокировали водной перекисью водорода и связывание антитела определяли с помощью системы Ultra HRP (ID Labs).
"Сэндвич"-ELISA: 96-луночные планшеты для ELISA покрывали 0,5 мкг анти-GPC3 моноАТ 1G12 в 50 мкл ФСБ на лунку. Планшеты блокировали в течение 2 ч 1%-ным БСА в ФСБ, добавляли 50 мкл разбавленных образцов сыворотки (1:3 в ФСБ) и инкубировали в течение ночи при 4°С. После отмывки несвязанного материала 0,1%-ным БСА в ФСБ определяли связанный GPC3, используя анти-GPC3 овечье поликлональное антитело22, с последующей инкубацией с пероксидазой хрена, конъюгированной с ослиными антиовечьими IgG (Sigma) с использованием о-фенилендиамина (Sigma) и перекиси водорода в качестве субстратов. Для того чтобы определить количество GPC3, присутствующего в сыворотке, параллельно строили калибровочную кривую очищенного GPC3, добавленного к такому же разведению пула нормальной сыворотки. Для определения присутствия GPC3 в нормальной сыворотке калибровочную кривую GPC3 строили в ФСБ. Каждый образец измеряли три раза в четырех повторностях.
Статистический анализ: Достоверность различий между группами определяли с помощью критерия Манна-Уитни (Mann-Whitney).
Концентрация АФП в сыворотке: Уровни АФП в параллельных образцах сыворотки определяли с помощью имеющегося в продаже набора для ELISA (Axsym, Abbott).
Пример 1
Получение и характеристика поликлональных антител к GPC3
Участок клонированной кДНК GPC3 (Filmus et al., выше), кодирующий 70 последовательных С-концевых аминокислот GPC3 человека, экспрессировали в виде слитого белка с глутатион-3-трансферазой в стандартной экспрессирующей системе в клетках Е.coli.
Слитый белок, очищенный на глутатионной колонке, использовали для иммунизации овцы согласно стандартному протоколу. Поликлональные антитела были аффинно очищены против 70-ти аминокислотного иммуногена стандартными способами, как описано в "Antibodies, a Laboratory Manual", (1988), Ed. Harlow et al., Cold Spring Harbor. Поликлональные антитела использовали для исследований Вестерн-блотом и иммунопреципитацией.
Пример 2
Получение гибридом, продуцирующих моноклональные антитела к GPC3
Тот же иммуноген - GST-слитый белок, включающий 70 С-концевых аминокислот GPC3 человека, использовали для получения моноклональных антител. Этот участок размером в 70 аминокислот является наименее консервативным среди видов и поэтому использовался для производства антител, специфичных к GPC3 человека. Гибридомы получали, используя методы, известные специалистам в данной области, например, как описано у Kohler и Milstein (Nature, 256:495-497, (1975)).
Кратко, самок мышей Balb/C иммунизировали однократной внутрибрюшинной инъекцией, содержащей 50 мкг His-меченого карбокси-концевого 70-ти аминокислотного фрагмента GPC3 человека, эмульгированного с адъювантом Titermax Gold™ (Cedarlane). Через 21 день мышей бустировали по 50 мкг того же иммуногена в отсутствие адъюванта. Через два дня из хвостовой вены отбирали образцы крови и получали мышиные сыворотки. Титр анти-GPCS в образцах сывороток определяли твердофазным иммуноферментным анализом (ELISA), используя в качестве отрицательного контроля преиммунную сыворотку от тех же мышей. Спленоциты, полученные от двух мышей с самым высоким титром, подвергали слиянию с клетками мышиной миеломы SP2/0 Ад14 (соотношение 6:1) с помощью полиэтиленгликоля 4000, используя стандартные методы1 (Parkin, DM, Pisani, P. & Ferlay, J., Global cancer statistics. CA. Cancer J. Clin., 49, 33-64, 1, (1999). Гибридные клетки культивировали в 96-луночных планшетах в α-МЕМ, 10 мМ Hepes, 50 мкМ 2-меркаптоэтанола, 20% FBS с добавлением Nutridoma-CS™ (Roche) в качестве источника факторов роста, и гипоксантина, аминоптерина и тимидина для отбора гибридов. Полученные клоны подвергали скринингу с помощью ELISA, используя 96-луночные планшеты, "нагруженные" 0,05 мкг карбокси-концевого фрагмента GPC3 на лунку. Планшеты блокировали в течение 2 часов 1%-ным бычьим сывороточным альбумином (БСА) в фосфатно-солевом буфере (ФСБ) и инкубировали с кондиционированными культуральными супернатантами. Связывание первого антитела определяли, используя пероксидазу хрена, конъюгированную с козьими антимышиными IgG и козьими антимышиными IgM (StressGen™), с о-фенилендиамином и перекисью водорода в качестве субстратов. Положительные клоны подвергали повторному скринингу посредством иммунофлуоресценции, используя GРС3-трансфицированные клетки. Отобранные гибридомы (1G12 и 8Н5) дважды клонировали, определяли их изотип (IgG1, К), используя Isostrip™ (Roche), и очищали их из кондиционированных культуральных супернатантов, используя хроматографию на протеин А-колонке Affi-Gel Protein MAPSIIkit(Bio-Rad™).
Антитела, продуцируемые гибридомами, подвергали скринингу против 70-ти аминокислотного фрагмента GPC3, используя ELISA. Положительные клоны затем тестировали на их способность специфически окрашивать GPC3-трансфицированные клетки. Две гибридомы (1G12 и 8Н5) продуцировали антитела, которые продемонстрировали сильное и специфичное иммуноокрашивание GPC3-трансфицированных клеток. Фигура 1 иллюстрирует окрашивание клеток 293 антителами 1G12, затем флуоресцентным вторым антителом. Панели А и С представляют собой фазово-контрастные микрофотографии, а панели В и D-флуоресцентные микрофотографии. Панели А и В демонстрируют клетки 293, трансфицированные только вектором, тогда как панели С и D демонстрируют клетки, трансфицированные GРС3-содержащим вектором. В этом примере клетки окрашивали в присутствии 10 мкг/мл моноклонального антитела (моноАТ) 1G12. Панель D ясно демонстрирует специфичное окрашивание с моноАТ 1G12. Никакого окрашивания не видно в клетках, трансфицированных только вектором (панель В).
Пример 3
Характеристика моноклональных антител
Специфичность двух моноклональных антител, продуцируемых гибридомами 1G12 и 8Н5, подтверждали Вестерн-блот-анализом белковых лизатов из клеток, трансфицированных ГА-меченным GPC3. Как показано на Фигуре 2, антитело 1G12 выявляло полосу, соответствующую сердцевинному белку GPC3, и пятно, соответствующее гликанированной форме GPC3. В качестве контроля проводили параллельный Вестерн-блот с анти-ГА антителом (12СА5).
Пример 4
GPC3 в тканевых срезах
Парафиновые срезы ГЦК опухоли и окружающих незлокачественных клеток окрашивали иммуногистохимически анти-GРС3 моноклональным антителом 1G12, как описано выше. Анти-GРС3 антитело выявляли, используя второе антитело - биотинилированный антимышиный иммуноглобулин, и связанное второе антитело выявляли, используя стрептавидин, конъюгированный с пероксидазой хрена.
Фигура 3 демонстрирует, что анти-GРС3 моноклональное антитело 1G12 сильно связывалось с опухолевыми клетками, но совсем не связывалось с нормальными гепатоцитами. Помимо предсказанного присутствия GPC3 на клеточной мембране значительное окрашивание наблюдали также в цитоплазме. Цитоплазматическое окрашивание было главным образом гранулярным и примыкало к клеточной поверхности. Иногда наблюдали околоядерное окрашивание. Непаренхимальные клетки были обычно отрицательными за исключением макрофагов. Эти результаты показывают, что анти-GРС3 моноклональные антитела могут быть использованы для диагностики ГЦК в срезах печеночной ткани путем выявления GPC3.
Пример 5
Определение экспрессии GPC3 in vitro в злокачественных и доброкачественных новообразованиях
Таблица 1 суммирует результаты иммуногистохимического исследования моноклональных антител к GPC3, взаимодействующих с пятнадцатью разными гепатоцеллюлярными карциномами. Двенадцать (80%) из этих ГЦК взаимодействовали с моноклональыми антителами к GPC3. Существовало некоторое варьирование в количестве окрашенных клеток, которые взаимодействуют с анти-GРС3 моноАТ в каждый опухоли. Положительные клетки обычно располагались кластерами в участках, напоминающих клоны. Во всех случаях незлокачественные клетки печени, окружающие опухоль, были отрицательными.
Таблица 2 суммирует результаты взаимодействий анти-GРС3 моноклонального антитела со злокачественными и незлокачественными печеночными тканями. 6 аденом печени и 9 дисплазий печени дали отрицательный ответ на GPC3.
Данные показывают, что GPC3 не экспрессируется в нормальной печени и в доброкачественных новообразованиях, тогда как большинство ГЦК экспрессируют выявляемые уровни глипикана-3.
Пример 6
Иммунологический анализ для выявления GPC3
"Сэндвич"-ELISA использовали для определения GPC3 в сыворотке пациентов с диагностированной ГЦК. Для проведения ELISA 96-луночные планшеты покрывали анти-GРС3 моноклональным антителом 1G12 и добавляли аликвоту исследуемой сыворотки. Несвязанный материал удаляли промывкой, а связанный GPC3 выявляли, используя анти-GРС3 овечьи поликлональные антитела, полученные, как описано в Примере 1, образующие комплексы прямо или опосредованно с проявляющим реагентом, использующимся для обнаружения присутствия иммунного комплекса. Измеряли оптическую плотность образца и сравнивали с результатами стандартной кривой. Фигура 4 иллюстрирует стандартную кривую для этого анализа. Результаты анализа были линейными в пределах исследуемого диапазона.
Разработали протокол для забора сывороток от пациентов, которых лечили от ГЦК в Центральном госпитале Торонто и чье письменное согласие было получено. В предварительном исследовании сыворотки были получены от 9 пациентов с установленной ГЦК. От 38 доноров крови были получены также нормальные сыворотки, которые смешивали. Уровни GPC3 определяли с помощью "сэндвич"-ELISA-теста, используя разведение образца 1:3 (сыворотка : ФСБ). Каждый образец анализировали в четырех повторениях. Концентрацию GPC3 получали, сравнивая оптическую плотность OD, полученную для каждого образца, со стандартной кривой, полученной путем добавления различных количеств GPC3 к такому же разбавлению смешанной нормальной сыворотки.
Таблица 3 суммирует результаты этого исследования. Пять из девяти пациентов с ГЦК (55%) имели значения GPC3, которые были существенно повышенными. Ни один из этих пациентов не имел существенно повышенных уровней АФП. GPC3 не определялся ни в одном из нормальных образцов.
Дополнительные исследования проводили, используя "сэндвич"-ELISA для измерения уровней сывороточного GPC3 у 53 здоровых индивидуумов, у 18 пациентов с гепатитом, у 20 - с гепатитом плюс циррозом и у 34 - с ГЦК. Нашли, что GPC3 не выявлялся у всех здоровых индивидуумов и что 18 из 34 пациентов с ГЦК (чувствительность 53%) имели существенно повышенные уровни сывороточного GPC3 со значениями, варьирующими от 151 до 2924 нг/мл (Фиг.5 и Таблица 4). Кроме того, GPC3 не выявлялся у всех пациентов с гепатитом, и он был выявлен только у 1 из 20 (5%) пациентов с гепатитом плюс циррозом при уровне 117 нг/мл (специфичность 95%). Статистический анализ с использованием критерия Манна-Уитни показал, что средние сывороточные уровни (нг/мл) GPC3 у пациентов с ГЦК существенно выше, чем у пациентов с гепатитом плюс циррозом, гепатитом и у здоровых доноров, и что среди последних трех групп существенного различия не наблюдалось.
Пример 7
Сравнение уровней GPC3 и АФП
Сывороточные уровни АФП измеряли в той же группе из 34 пациентов с ГЦК, описанных в Примере 6, используя имеющийся в продаже набор для ELISA (Axsym, Abbott). Таблица 4 демонстрирует сравнение полученных значений АФП и GPC3.
Настоящее изобретение не ограничивается особенностями примеров осуществления, описанных здесь, но включает все вариации и модификации в рамках формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЙ ОПУХОЛЕВЫЙ БИОМАРКЕР | 2010 |
|
RU2567005C2 |
| МУТАНТНЫЙ ШТАММ ВИРУСА ГЕПАТИТА В И ЕГО ПРИМЕНЕНИЕ | 1998 |
|
RU2270863C2 |
| ГЛИПИКАН-3 (GPC3)-ПРОИЗВОДНЫЕ АНТИГЕННЫЕ ПЕПТИДЫ, ОТТОРГАЮЩИЕ ОПУХОЛИ, ИСПОЛЬЗУЕМЫЕ ДЛЯ НLA-A2-ПОЛОЖИТЕЛЬНЫХ ПАЦИЕНТОВ, И ФАРМАЦЕВТИЧЕСКАЯ ПРОДУКЦИЯ, ВКЛЮЧАЮЩАЯ ИХ | 2006 |
|
RU2395519C2 |
| АНТИТЕЛА ПРОТИВ ВИРУСА ГЕПАТИТА В И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2803082C2 |
| ДЕТЕКТИРОВАНИЕ РАКА ЯИЧНИКА ПО ПОВЫШЕННЫМ УРОВНЯМ BCL-2 В МОЧЕ | 2007 |
|
RU2436098C2 |
| НОВЫЙ ОПУХОЛЕВЫЙ БИОМАРКЕР | 2010 |
|
RU2714750C2 |
| БЕЛКИ, СВЯЗЫВАЮЩИЕ ПРОСТАГЛАНДИН Е2, И ИХ ПРИМЕНЕНИЕ | 2009 |
|
RU2559525C2 |
| КОМПОЗИЦИИ И СПОСОБЫ АНАЛИЗА РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ | 2012 |
|
RU2641968C2 |
| МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА ПРОТИВ АННЕКСИНА А3 ДЛЯ ОБНАРУЖЕНИЯ КАРЦИНОМЫ ПРОСТАТЫ | 2007 |
|
RU2467335C2 |
| УЛУЧШЕННЫЙ БЕЛОК REP ДЛЯ ПРИМЕНЕНИЯ В ДИАГНОСТИЧЕСКИХ АНАЛИЗАХ | 2018 |
|
RU2736275C1 |
Изобретение относится к диагностике гепатоцеллюлярной карциномы. Предложен способ скрининга субъекта, имеющего заболевание печени или риск его развития на гепатоцеллюлярную карциному (ГЦК), путем определения уровня глипикана-3 (GPC3) в образце сыворотки, плазмы крови и цельной крови, взятой из организма этого субъекта. Кроме того, предложен способ диагностики гепатоцеллюлярной карциномы путем выявления GPC3 в образце. Также предложены антитела, которые специфически связываются с GPC3. Изобретение раскрывает новый сывороточный маркер ГЦК глипикан-3 (GPC3), который лежит в основе нового быстрого, удобного и неинвазивного анализа, который предлагает улучшенную специфичность в диагностике ГЦК. 4 н. и 19 з.п. ф-лы, 4 табл., 5 ил.
получение образца сыворотки, плазмы крови или цельной крови из организма субъекта и
определение уровня глипикана-3 (GPC3) в этом образце иммунологическим способом,
характеризующийся тем, что присутствие выявляемого уровня GPC3 в образце указывает на наличие ГЦК у этого субъекта.
определение уровня альфа-фетопротеина (АФП) в этом образце, причем, по меньшей мере, один из выявляемых уровней GPC3 в образце и уровень АФП более высокий, чем уровень АФП у нормальных контрольных субъектов в этом образце, указывает на наличие ГЦК у этого субъекта.
приведение образца в контакт с антителом или его фрагментом, которое специфически связывается с GPC3 или его фрагментом для обеспечения формирования комплекса антитело-GРС3 или комплекса антитело-фрагмент GPC3; и
обнаружение комплекса антитело-GРС3 или антитело-фрагмент GPC3.
приведение образца в контакт с антителом или его фрагментом, которое специфически связывается с GPC3 или его фрагментом для обеспечения формирования комплекса антитело-GРС3 или антитело-фрагмент GPC3; и
определение комплекса антитело-GРС3 или антитело-фрагмент GPC3, посредством чего определяют уровень GPC3 в образце.
| Capurro M.I | |||
| et al | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| for Cancer Research Annual Meeting, 03.2002, Vol.43, p.219 | |||
| Пружинный угловой зажим для временного соединения свариваемых труб фюзеляжа | 1929 |
|
SU23109A1 |
| WO 9937764 А, 29.07.1999 | |||
| Способ определения изоэнзимов лактатдегидрогеназы | 1975 |
|
SU663329A3 |
Авторы
Даты
2008-03-20—Публикация
2003-05-22—Подача