Изобретение относится к гетероциклическим соединениям, в частности к применению 2-имидозолилпропан-2-сульфокислоты формулы I
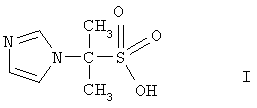
в качестве бактеристатического, иммуностимулирующего, антиагрегационного, дезагрегационного в отношении тромбоцитов и усиливающего сократительную активность скелетных мышц средства, что может быть использовано в медицине и ветеринарии.
Известны гипохолестеринанемическая и антиатеросклеротическая активность 2-имидозолилпропан-2-сульфокислоты формулы I (Влияние диметил-(имидазол-1-ил)метансульфоновой кислоты на экспериментальный атерогенез у кроликов // Даутова Г.С., Косых В.А., Репин B.C., Камбург Р.А. - Ж. Экспериментальная и клиническая фармакология, 1994, 57 (5), с.21-24).
Заявляемые в данном изобретении свойства для этого соединения ранее описаны не были.
В качестве прототипа выбран n-аминобензолсульфонамид стрептоцид формулы
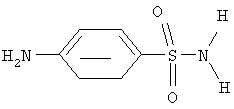
проявляющий антимикробную активность, см. М.Д.Машковский "Лекарственные средства", часть 2, Москва "Медицина", 1985 г., с 275.
Недостатками известного препарата является то, что он, обладая антимикробной активностью, неактивен в отношении стафилококков, к тому же в связи с активным участием указанного соединения в метаболических процессах оно оказывает побочные действия и имеет противопоказания. При длительном употреблении в почках могут образовываться трудно растворимые соединения, уменьшается содержание гемоглобина, возникает цианоз, агранулоцитоз, лейкопения. Более чувствительны к препарату молодые животные. Противопоказания к применению стрептоцида следующие: общий ацидоз, гепатит, гемолитическая анемия, агранулоцитоз, нефриты, нефрозы. Он не обладает выраженной антивирусной и иммуностимулирующей активностью.
Применение одних и тех же соединений в качестве антимикробных средств в течение продолжительного времени, как правило, сопровождается привыканием к ним микроорганизмов и появлением устойчивых к ним форм возбудителей. Это вызывает необходимость пополнения арсенала средств против патогенных возбудителей.
Задача изобретения - расширение арсенала средств, проявляющих бактеристатическую активность, соединением, относящимся к имидазолдилсульфокислотам, проявляющем как бактеристатическую, так и иммуностимулирующую, антиагрегационную, дезагрегационную в отношении тромбоцитов активность, а также усиливающем сократительную активность скелетных мышц без проявления кумулятивных свойств и патологических изменений в органах и тканях животных.
Техническая задача решается применением 2-имидозолилпропан-2-сульфокислоты, которая проявляет, кроме бактеристатической, иммуностимулирующую, антиагрегационную, дезагрегационную в отношении тромбоцитов активность, а также усиливает сократительную активность скелетных мышц.
2-имидозолилпропан-2-сульфокислоту получают путем взаимодействия имидазола с сернистым ангидридом и пропаноном-2 в присутствии воды.
Способ получения 2-имидозолилпропан-2-сульфокислоты включает растворение имидазола в растворителе, выбранном из ряда низших спиртов или ацетона, барботировании в него газообразного сернистого ангидрида при температуре не выше 20°С в течение 20-25 минут при массовом соотношении имидазол: сернистый ангидрид - 1:1, добавлении пропанона-2 и воды в массовом соотношении имидазол:пропанон-2:вода 1:1:1.
Пример 1.
Получение 2-имидозолилпропан-2-сульфокислоты.
К 5 грамм (0,073 моль) имидазола добавляют 50 мл ацетона. Затем при 20°С в течение 20 мин барботируют сернистый ангидрид 4,67 г (0,073 моль) (контроль за количеством ангидрида проводился весовым методом), добавляют 1,3 мл (0,073 моль) воды и перемешивают еще 5 минут. Выпавший осадок отфильтровывают и перекристаллизуют из этанола.
Выход 92%
Тпл.=69-70°С.
ИК (KBr): νs(SO2) 1010 см-1, с.;
νas(SO2) 1135 см-1, с.
Найдено, %: С 36,81; Н 5,19; N 14,64; S 16,62
Вычислено, %: С 37,89; Н 5,26; N 14,73; S 16,84.
Вещество представляет собой кристаллический порошок белого цвета, растворимый в воде и органических растворителях.
Пример 2.
Определение бактериостатической активности.
Определение бактериостатической активности in vitro в отношении грамположительных (стрептококки, стафилококки, листерии) и грамотрицательных (сальмонеллы, эшерихии) микроорганизмов проводят методом серийных последовательных разведении, [Игудин Л.И. и др. "Стандарты, штаммы, методы контроля бактериальных и вирусных препаратов", М. 1982 г.].
Для этого берут ряд пробирок с 4,5 мл питательной среды. В первую пробирку вносят 0,5 мл вещества (разведение 1:10). Смесь тщательно перемешивают и из нее переносят 0,5 мл смеси во вторую пробирку. После тщательного перемешивания 0,5 мл переносят в третью пробирку и т.д. В последнюю пробирку вещество не вносят, она является контролем роста культуры. Засев в пробирки проводят 0,1 мл суточной бульонной культурой (50000 микроорганизмов), а после засева пробирки встряхивают и термостатируют при 37°С. Опыты проводят с троекратной повторяемостью.
Учет результатов ведут через 18-24-48 часов инкубации в термостате. Наименьшая концентрация вещества, при которой не происходит размножения микробов и пробирка остается прозрачной, служит показателем бактериостатической концентрации.
Бактериостатическая концентрация заявляемого вещества и прототипа n-аминобензолсульфонамида (стрептоцида) соответствует разбавлению 1:100 в г на 1 мл среды в таблицах 1-3.
В результате эксперимента показано, что 2-имидазолилпропан-2-сульфокислота проявляет бактериостатическую активность как в отношении грамположительных, так и в отношении грамотрицательных бактерий.
Испытания заявляемого вещества, 2-имидазолилпропан-2-сульфокислоты, были неоднократно проведены на группах сельскохозяйственных животных от 10 до 50 голов. 2-имидазолилпропан-2-сульфокислоту использовали для лечения и профилактики респираторных и желудочно-кишечных болезней.
Для лечения и профилактики респираторных болезней 2-имидазолилпропан-2-сульфокислоту вводят телятам, поросятам и ягнятам внутримышечно или аэрогенно в камерных условиях.
Внутримышечно вводят 5% водные растворы (на дистиллированной воде) из расчета 15 мг/кг живой массы поросятам и ягнятам, а телятам из расчета 6 мг/кг живой массы. Курс лечения два раза в сутки до клинического выздоровления.
При аэрогенном введении используют камеры-ингаляторы, габариты которых определяются из расчета на одного теленка 1-1,5 м3, ягненка и поросенка 0,3-0,5 м3 объема камеры. Необходимое количество для распыления 2-имидазолилпропан-2-сульфокислоты при лечебной и профилактической обработке определяют из расчета 0,7-0,75 г/м3 камеры. Расчетное количество 2-имидазолилпропан-2-сульфокислоты растворяют дистиллированной водой. Курс лечения - один раз в сутки до клинического выздоровления, а с профилактической целью животных обрабатывают один раз в течение 3-х суток.
При необходимости курс лечебных обработок повторяют через 6-7 суток, профилактических - через 8-10 суток.
Как показали исследования на животных, симптомы бронхолегочных заболеваний исчезли через 4-5 дней со средней тяжестью заболевания, у тяжелобольных - через 10 дней, тогда как в контрольной группе состояние животных за время проведения исследований существенно ухудшилось.
Для лечения и профилактики желудочно-кишечных болезней животным выпаивают водные растворы 2-имидазолилпропан-2-сульфокислоты поросятам и ягнятам в 5% концентрации до 10-дневного возраста в объеме 3 и 6 мл/гол., а старше 10 дней - 5 и 10 мл/гол соответственно; телятам 1-60 дневного возраста в 5% концентрации в объеме 30-40 мл/гол. Курс лечения 2 раза в день до клинического выздоровления, а с профилактической целью выпаивают 1 раз в течение 3-х суток.
Как показали исследования на животных, симптомы диареи исчезли в течение 2 дней, тогда как в контрольной группе диарея не прекратилась до окончания исследований.
2-имидазолилпропан-2-сульфокислота, по данным изучения экстрактов из внутренних органов методом высокоэффективной жидкостной хроматографии, не обладает кумулятивными свойствами.
По данным патологоанатомических исследований она не вызывает патологических изменений в организме животных при длительном (свыше 30 дней) использовании.
Таким образом 2-имидазолилпропан-2-сульфокислота обладает выраженной бактериостатичностью в отношении грамположительных и грамотрицательных бактерий, обладает выраженной иммуностимулирующей активностью, сопоставимой с эталоном ЛПС Е coli (липополисахарид), не проявляет кумулятивных свойств, не вызывает патологических изменений в органах и тканях животных. Противопоказаний для ее использования не обнаружено, соединение успешно прошло испытания в сельском хозяйстве, в частности в ветеринарии.
Из представленных в таблицах 1-3 данных видно, что минимальная бактериостатическая концентрация (МБСК) для Е.coli - 31.25 мкг/мл; Salmonella pullorum - gallinarum - 62.5 мкг/мл; St. aureus - 31.25 мкг/мл.
Пример 3
Изучение иммуномоделирующих свойств 2-имидазолинпропан-2-сульфокислоты.
Изучение иммуномоделирующих свойств 2-имидазолинпропан-2-сульфокислоты проводили в реакции локального гемолиза в геле. В работе использовали беспородных белых мышей обоего пола в возрасте 8-12 недель. Животных иммунизировали внутрибрюшным введением липополисахарида /ЛПС/ Shigella flexnerii, в концентрации 0,05 мг/кг физиологического раствора. Исследуемые соединения вводили одновременно иммунизацией ЛПС в дозах, равных 1/1Т МТД. Через 4 суток животных брали в опыт.
Мышей забивали цервикальной дислокацией, асептически извлекали селезенку, взвешивали и помещали в холодную среду RPMI-1640 /SERVIA ФРГ/ с добавлением пенициллина /100 Ед/мл/ и стрептомицина /50 мкг/мл/. Затем орган измельчали в гомогенизаторе и подсчитывали число ядросодержащих клеток в полученной клеточной суспензии с помощью камеры Горячева. Конечную концентрацию клеток /106/0.5 мл/ готовили, добавляя необходимое количество среды RPMI-1640 /SERVIA ФРГ/ с добавлением антибиотиков. Клеточные суспензии хранили при 4°С.
В день опыта чашки Петри /*100 мм/ покрывали 1,4%-ным раствором агарозы /SERVIA ФРГ/ на среде RPMI-1640 /SERVIA ФРГ/. После застывания геля чашки помещали в термостат при 37°С на 1 ч вверх дном, чтобы из геля испарилось некоторое количество воды (около 1 г). После инкубации чашки вынимали и хранили при комнатной температуре.
В водную баню KL-I /Lab. Pcistroge/ помещали штатив с вассермановскими пробирками и нагревали ее до 49°С. Через 30 минут в пробирки помещали 0,5 мл 1,4 раствора агарозы на дистилляте и 0,5 мл двойного концентрата среды RPMI-1640. В полученную смесь помещали 0.5 мл суспензии клеток селезенки и 0,1 мл 20% взвеси эритроцитов барана, покрытых ЛПС Shigella flexnerii. Смесь перемешивали и наслаивали на чашке Петри с агарозным покрытием и оставляли до застывания при 21°С. Затем чашки Петри инкубировали 2 часа в термостате при 37°С. После чего на агарозный гель наслаивали комплемент из сыворотки крови морской свинки в разведении 1:10 и инкубировали еще 1 ч при 37°С. Затем производили подсчет зон гемолиза (антителообразующих клеток), видимых как маленькие (1-2 мм) просветления на красном матовом фоне. По изменению зон гемолиза (числа антителообразующих клеток) оценивали влияние препаратов на иммунный ответ к липополисахариду Shigella flexnerii (Таблица 4).
Как видно из таблицы 4, коэффициент стимуляции 2-имидазолинпропан-2-сульфокислоты в 1,4 раза превышает коэффициент стимуляции диуцифона.
Пример 4.
Исследования агрегации тромбоцитов.
Для исследования агрегации тромбоцитов использовали классические индукторы агрегации (АДФ, адреналин и др.).
Кровь доноров, стабилизированную 0.1 м цитратом натрия (9:1), центрифугировали при 12°С, 250 g, 10 мин. Супернатант содержал тромбоцитарную плазму без примеси других форменных элементов. Бестромбоцитарную плазму получали центрифугированием крови при 4°С, 3000 g, 30 мин. Счет тромбоцитов проводили методом фазовоконтрастной микроскопии в камере Горячева. Для измерения агрегации использовали плазму, содержащую 150·106-300·106 тромбоцитов в 1 мкл. Исходная агрегационная активность тромбоцитов в плазме сохранялась при 4°С в течение 4 часов после взятия крови у доноров.
Агрегацию тромбоцитов измеряли при помощи агреометра, представляющего собой термостатированный фотометр с присоединенным к нему самописцем, непрерывно регистрирующем изменения светопропускающей способности тромбоцитарной плазмы при перемешивании с индукторами агрегации. В качестве редукторов агрегации использовали АДФ в конечной концентрации 10; 5,0; 2,5 мг/мл = 2,0; 1,0; 0,5; 10-6 М. В кювету агреометра вносили 1,0 мл исследуемой тромбоцитарной плазмы и производили настройку агреометра.
При настроенном приборе тромбоцитарная плазма имеет 100%, а бестромбоцитарная плазма 0% оптической плотности по шкале регистратора. Для измерения агрегации в кювету, содержащую 0,1 мл тромбоцитарной плазмы, вносили 0,1 мл индуктора агрегации и записывали изменения оптической плотности тромбоцитарной плазмы.
Для изучения антиагрегационной активности 2-имидазолилпропан-2-сульфокислоты препарат в конечной концентрации 1,68 мг/мл вводили в тромбоцитарную плазму и регистрировали агрегацию тромбоцитов, индуцированную АДФ и адренолином.
В параллельном эксперименте вместо препарата в тромбоцитарную плазму вводили гепарин в концентрации 500 ед/мл.
В контрольном эксперименте регистрировали агрегацию тромбоцитов в тромбоцитарной плазме, индуцированную АДФ и адренолином.
Результаты экспериментов представлены в таблице 5.
Анализ результатов показывает, что 2-имидазолилпропан-2-сульфокислота обладает выраженной способностью ингибировать агрегацию тромбоцитов, индуцированную АДФ и адренолином. Антиагрегационный эффект 2-имидазолилпропан-2-сульфокислоты в 4,5 раза выше антиагрегационного эффекта гепарина в указанных концентрациях.
Пример 5.
Изучение дезагрегационной активности 2-имидазолилпропан-2-сульфокислоты.
Для изучения дезагрегационной активности препарат вводили в тромбоцитарную плазму через 1, 2, 3 минуты после введения агрегирующего агента (АДФ, адренолин).
Результаты исследований представлены в таблицах 6-9.
Анализ результатов показывает выраженную дезагрегационную активность 2-имидазолилпропан-2-сульфокислоты 1-3 минуты после начала агрегации тромбоцитов, индуцированной АДФ и адренолином. Гепарин дезагрегационным эффектом не обладает.
Пример 6.
Изучение сократительных свойств скелетных мышц.
Изучение сократительных свойств скелетных мышц производили на полосках диафрагменной мышцы морской свинки. Диафрагменная мышца забиралась у умерщвленного под гексеналовым наркозом посредством кровопускания животного и помещалась в физиологический раствор следующего состава: мМ: Na+ - 142,90, К+ - 5,88, Са2+ - 1,26, Mg2+ - 1,18, Cl- - 125,22, /НСО3/- - 24,90, /SO4/2- - 1,18, /H2PO4/- - 1,18, через который 40 минут пропускали карбоген (95% О2 и 5% СО2); рН доводился до 7,35-7,42.
Производилась калибровка датчика фотоэлектрического преобразователя - отклонение самописца 14 мм вызывалось нагрузкой в 200 мг. Полоска диафрагмальной мышцы из центральной части левой ее половинки шириной 5 мм помещалась в перфузионную термостатируемую (38°С) ванночку рабочим объемом 5 мл, прикреплялась к датчику фотоэлектрического преобразователя и растягивалась до 2 г в течение 20 минут при постоянной перфузии физиологическим раствором.
Измерение сократительной реакции препарата диафрагмы производилось с помощью фотоэлектрического преобразователя, изменение напряжения на выходе которого регистрировалось самописцем Н 327-1 со скоростью лентопротяжки 1 мм/с. Таким образом, в исследованиях наблюдалось условие измерения сокращения в изотермическом режиме при помощи электронной аппаратуры. Подача физиологического раствора из основного резервуара к термостатируемой ванночке осуществлялась с помощью одноразовой системы для переливания крови. Скорость перфузии регулировалась зажимом и контролировалась с помощью капельницы и в среднем составляла 1 каплю в 1 с. При необходимости прекращения перфузии перекрывали приток жидкости в термостатируемую камеру и с целью сохранения термостатируемого режима на уровне 38°С изменялся режим работы ультратермостата.
Первое контрольное сокращение вызывалось добавлением в ванночку карбахолина, раствор которого готовился на дистиллированной воде и вносился в камеру в объеме 50 мл (соблюдение условия введения раствора в отношении 1/100 к объему термостатируемой камеры) с конечной концентрацией карбахолина в объеме физиологического раствора термостатируемой камеры - 2·10-4 м.
Для изучения сократительной реакции с последующей математической обработкой в каждом случае регистрировались следующие параметры: сила одиночного сокращения (мг), временные параметры: латентный период, время развития максимального напряжения, время полурасслабления, время релаксации, плато, длительность сокращения.
После регистрации контрольного сокращения на карбахолин, занимающего 2-4 минуты, в течение 30-60 сек обеспечивается стабильная перфузия, после чего препарат перфузируется при равных условиях физиологическим раствором, содержащим изучаемую концентрацию исследуемого вещества. Через 20 минут перфузия физиологическим раствором с исследуемым веществом прекращается и в камеру, при соблюдении описанных условий, добавляется раствор карбахолина. Полученные данные по сократительной реакции сравнивают с полученным контрольным результатом и выражают в процентном отношении к ним.
За МТД исследуемых веществ для клеток диафрагмы морской свинки in vitro принимали минимальную концентрацию, инкубация с которой приводила к отсутствию сократительной реакции на карбахолин.
Данные по сократительным свойствам диафрагмальной мышцы морской свинки после 20-минутной перфузии ее 2-имидазолилпропан-2-сульфокислоты приведены в таблице 9.
Как видно из таблицы 9, 2-имидазолилпропан-2-сульфокислота вызывает увеличение силы сокращения скелетной мышцы по сравнению с базовым объектом (АТФ).
Таким образом, заявлено применение 2-имидазолилпропан-2-сульфокислоты в качестве бактеристатического средства, обладающего выраженной бактериостатичностью в отношении грамположительных и грамотрицательных бактерий, которое, кроме того, обладает выраженной иммуностимулирующей активностью, сопоставимой с эталоном ЛПС Е coli (Липополисахарид), не проявляет кумулятивных свойств, не вызывает патологических изменений в органах и тканях животных, противопоказаний для его использования не обнаружено, соединение успешно прошло испытания в сельском хозяйстве, в частности в ветеринарии.
Кроме того, предлагаемое соединение проявляет антиагрегационную, дезагрегационную в отношении тромбоцитов активность, а также усиливает сократительную активность скелетных мышц.
Результаты изучения бактериостатических свойств 2-имидазолилпропан-2-сульфокислоты в отношении Е.coli
"+" - рост исходной культуры
Результаты изучения бактериостатических свойств 2-имидазолилпропан-2-сульфокислоты в отношении Salmonella pullorum - gallinarum
"+" - рост исходной культуры
Лилпропан-6. Результаты изучения бактериостатических свойств 2-имидазолилпропан-2-сульфокислоты в отношении St.aureus
"+" - рост исходной культуры
Иммуностимулирующая активность 2-имидазолилпропан-2-сульфокислоты в ответ на ведение ЛПС Shigella flexnerii в дозе 0,05 мг/кг
кг/кг
мг/кг
Антиагрегационная активность 2-имидазолилпропан-2-сульфокислоты в ответ на ведение индукаторов агрегации
мг/мл
Ед/мл
Дезагрегационная активность 2-имидазолилпропан-2-сульфокислоты, введенной через 1 мин от начала агрегации под влиянием индукторов агрегации
мг/мл
Ед/мл
Дезагрегационная активность 2-имидазолилпропан-2-сульфокислоты, введенной через 2 мин от начала агрегации под влиянием индукторов агрегации
мг/кг
мг/кг
мг/мл
Ед/мл
Дезагрегационная активность 2-имидазолилпропан-2-сульфокислоты, введенной через 3 мин от начала агрегации под влиянием индукторов агрегации
мг/мл
Ед/мл
Сократительные свойства диафрагмальной мышцы морской свинки после 20-минутной перфузии ее 2-имидазолилпропан-2-сульфокислотой
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ 2-ИМИДОЗОЛИЛПРОПАН-2-СУЛЬФОКИСЛОТЫ | 2006 |
|
RU2312103C1 |
| 3-МЕТИЛ-8-ПИПЕРАЗИНО-7-(ТИЕТАНИЛ-3)-1-ЭТИЛКСАНТИНА ГИДРОХЛОРИД, ПРОЯВЛЯЮЩИЙ АНТИАГРЕГАЦИОННУЮ И ДЕЗАГРЕГАЦИОННУЮ АКТИВНОСТЬ | 2009 |
|
RU2404181C1 |
| 2-ЦИКЛОАЛКИЛАМИНО-5-ТИЕНИЛ-1,3,4-ТИАДИАЗИНЫ ГИДРОБРОМИДЫ, ОБЛАДАЮЩИЕ АНТИАГРЕГАНТНЫМ ДЕЙСТВИЕМ | 2008 |
|
RU2379306C1 |
| АНТИАГРЕГАЦИОННОЕ СРЕДСТВО | 2005 |
|
RU2353363C2 |
| Применение пинанилсульфида с метилмеркаптоацетатным фрагментом - метил 2-({ [(1S, 2R, 5S)-6,6-диметилбицикло[3.1.1]гепт-2-ил]метил} тио)ацетата, обладающий ингибирующим действием на активацию тромбоцитов | 2015 |
|
RU2671567C2 |
| 5-(4'-ГИДРОКСИФЕНИЛ)- И 5-(2',5'-ДИГИДРОКСИФЕНИЛ)-6Н-1,3,4-ТИАДИАЗИН-2-АМИНЫ, ГИДРОГАЛАГЕНИДЫ, ИНГИБИРУЮЩИЕ АГРЕГАЦИЮ ТРОМБОЦИТОВ ПРИ ВНУТРИВЕННОМ ВВЕДЕНИИ | 2009 |
|
RU2458060C2 |
| СПОСОБ ИССЛЕДОВАНИЯ АНТИАГРЕГАЦИОННОГО ДЕЙСТВИЯ ПРЕПАРАТОВ С ПОМОЩЬЮ ОПРЕДЕЛЕНИЯ АГРЕГАЦИИ ТРОМБОЦИТОВ IN VITRO | 2000 |
|
RU2188419C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ФУНКЦИОНАЛЬНОГО СОСТОЯНИЯ СИСТЕМЫ ГЕМОСТАЗА | 1997 |
|
RU2138054C1 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ АНТИАГРЕГАЦИОННОЙ АКТИВНОСТЬЮ | 1990 |
|
RU2033791C1 |
| СПОСОБ ОЦЕНКИ ГЕМОСТАТИЧЕСКОЙ АКТИВНОСТИ ТРОМБОЦИТОВ | 2015 |
|
RU2601111C1 |
Изобретение относится к гетероциклическим соединениям, в частности к применению 2-имидозолилпропан-2-сульфокислоты формулы
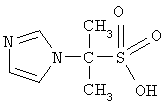
в качестве бактеристатического, иммуностимулирующего, антиагрегационного, дезагрегационного в отношении тромбоцитов и усиливающего сократительную активность скелетных мышц средства. Технический результат - новые свойства 2-имидозолилпропан-2-сульфокислоты, позволяют более широко использовать соединение в медицине и ветеринарии. 9 табл.
Применение 2-имидозолилпропан-2-сульфокислоты в качестве бактеристатического, иммуностимулирующего, антиагрегационного, дезагрегационного в отношении тромбоцитов и усиливающего сократительную активность скелетных мышц средства.
| DAUTOVA G.S | |||
| et al | |||
| Effect of dimethyl-(imidazol-l-yl) methanesulfonic acid on experimental aterogenesis in rabbits | |||
| Eksperimentalnaya i Klinicheskaya Farmakologiya | |||
| Прибор для охлаждения жидкостей в зимнее время | 1921 |
|
SU1994A1 |
| МАШКОВСКИЙ М.Д | |||
| Лекарственные средства | |||
| Ч | |||
| II, 1985, с.275. | |||
Авторы
Даты
2008-05-27—Публикация
2006-04-20—Подача