Настоящее изобретение относится к производным 1-N-фениламино-1H-имидазола в качестве ингибитора ароматазы и фармацевтическим композициям, содержащим указанные производные. Ароматаза является физиологическим ферментом, ответственным за специфическую конверсию андрогенов, таких как андростендион или тестостерон, в эстрогены, такие как эстрон и эстрадиол соответственно (Simpson E.R. et al., Endocrine Reviews, 1994, 15: 342-355). Поэтому принцип подхода состоит в ингибировании ароматазы, позволяющем препятствовать нормальным или патологическим эстроген-индуцируемым или эстроген-зависимым биологическим процессам, таким как женская половая дифференциация, овуляция, имплантация, беременность, пролиферация клеток молочной железы и эндометриальная клеточная пролиферация, а также обеспечивать регуляцию сперматогенеза или пролиферации клеток предстательной железы у мужчин, или нерепродуктивных функций, таких как остеогенез или иммунный баланс T-клеток и цитокинов (Simpson E.R. et al., Recent Progress in Hormone Research, 1997, 52: 185-213 and the whole issues of Endocrine Related Cancer (1999, volume 6, n 2) and Breast Cancer Research Treatment (1998, volume 49, supplement n 1)).
Известно большое число производных азола, используемых в качестве противогрибковых средств. Некоторые производные имидазола или триазола уже описаны в качестве ингибиторов фермента ароматазы. Как правило, имидазолильная или триазолильная группа связана с ароматическими циклами, как обнаружено для летрозола (EP-A-236940; Lamb HM and Adkins JC, Drugs, 1998, 56: 1125-1140):
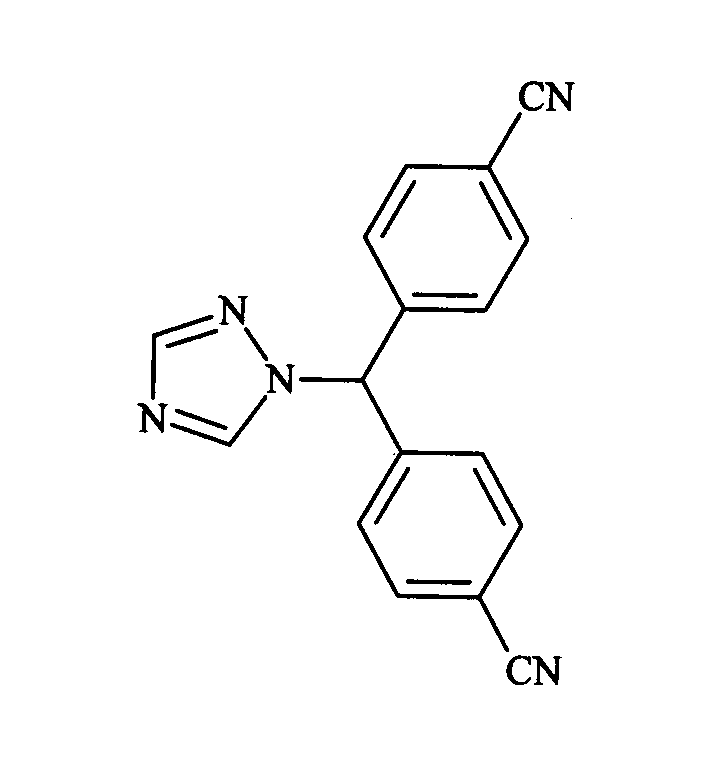
или анастрозола (EP-A-296749; Wiseman LR and Adkins JC, Drugs Aging, 1998, 13: 321-332):
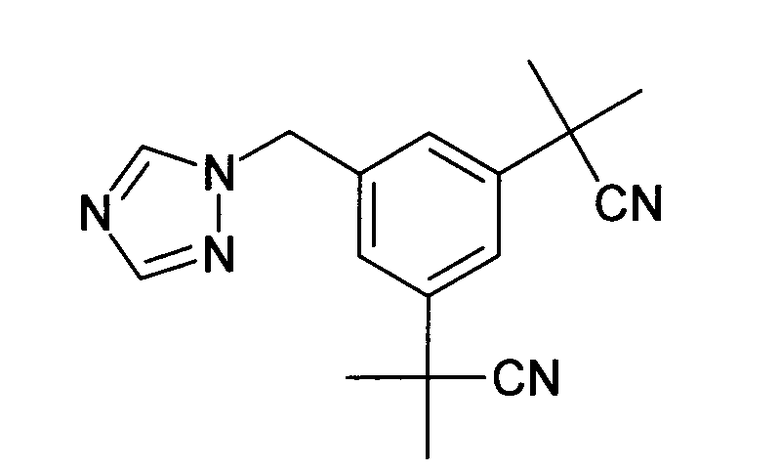
Имидазолы или триазолы, связанные через метиленовую группу с бензотриазолом, описаны в EP-A-293978:
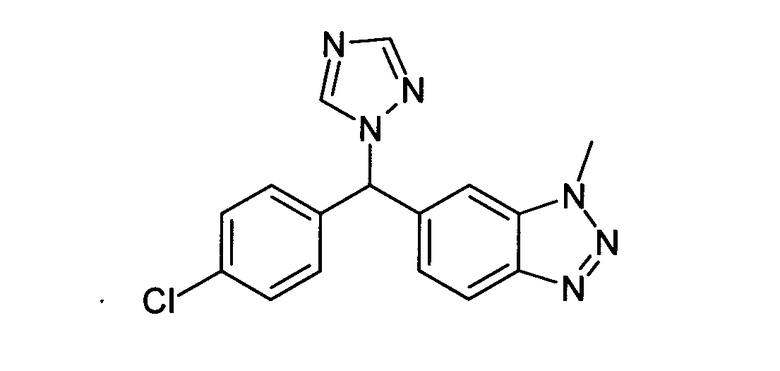
Ди-трет-бутилфенолы, содержащие N-аминоимидазольную группу в параположении, описаны в патенте США 4908363 и представлены как обладающие ингибирующими воспаление и эдему свойствами:
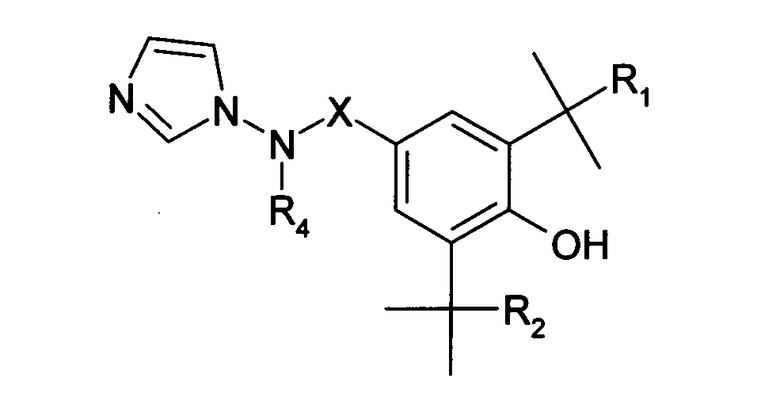
Позднее M. OKADA и др. (Chem. Pharm. Bull., 44 (10), 1996, 1871-1879) описали ряд [4-(бромфенилметил)-4-(цианофенил)амино]азолов и их азиновых аналогов:
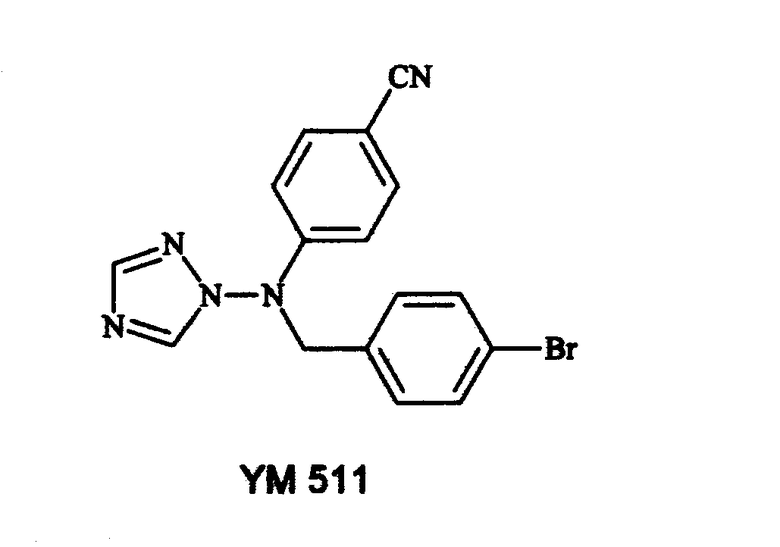
Установлено, что производные имидазола, которые неизменно содержат 1-[N-фениламино]-группу, проявляют неожиданно высокую эффективность в ингибировании ароматазы.
Следовательно, одна из задач настоящего изобретения состоит в получении производных 1-[N-фениламино]имидазола, являющихся эффективными ингибиторами ароматазы.
Другая задача настоящего изобретения состоит в разработке фармацевтической композиции, содержащей в качестве активного ингредиента производное 1-[N-фениламино]имидазола, представленное ниже, или фармацевтически приемлемую кислотно-аддитивную соль указанного соединения.
Еще одна задача настоящего изобретения состоит в применении производного 1-[N-фениламино]имидазола для получения лекарственного средства, предназначенного для лечения или профилактики различных заболеваний и для управления репродуктивными функциями у женщин, у мужчин, а также у женских и мужских особей диких и домашних животных.
Производные 1-[N-фениламино]имидазола по настоящему изобретению представлены следующей общей формулой (I):
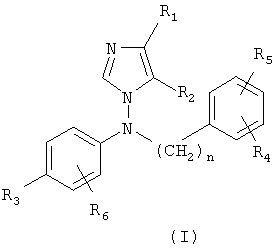
и кислотно-аддитивными солями, сольватами и стереоизомерными формами указанных соединений, где
• каждый из R1 и R2 независимо означает водород, (C1-C6)алкил или (C3-C8)циклоалкил;
• n = 0, 1, 2;
• каждый из R3, R4, R5 и R6 независимо означает водород или (C1-C6)алкил, галоген, циано, (C1-C6)алкокси, трифторметил, (C1-C6)алкилтио, (C1-C6)алкилсульфонил, сульфонамидо, ацил, (C1-C6)алкоксикарбонил или карбоксамидогруппу;
• R3 и R6 вместе с несущим их фенильным кольцом могут также образовывать бензофуран или N-метилбензотриазол.
Подразумевается, что в описании и формуле изобретения термин "(C1-C6)алкил" означает линейную или разветвленную углеводородную цепь с 1-6 атомами углерода. Радикал (C1-C6)алкил означает, например, радикал: метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил, изопентил или гексил.
Подразумевается, что термин "галоген" означает атом хлора, брома, иода или фтора.
Подразумевается, что термин "(C3-C8)циклоалкил" означает насыщенный моноциклический углеводород с 3-8 атомами углерода. Радикал (C3-C8)циклоалкил означает, например, радикал: циклопропил, циклобутил, циклопентил, циклогексил, циклогептил или циклооктил.
Подразумевается, что термин "(C1-C6)алкокси" означает группу OR, в которой R означает вышеуказанный (C1-C6)алкил. Радикал (C1-C6)алкокси означает, например, радикал: метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, трет-бутокси, н-пентилокси или изопентилокси.
Подразумевается, что термин "ацил" означает группу,
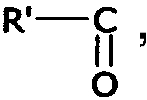
где R' означает водород или вышеуказанный (C1-C6)алкил.
Соединения формулы (I) образуют кислотно-аддитивные соли, например, с неорганическими кислотами, такими как хлористоводородная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и тому подобное, или с органическими карбоновыми кислотами, такими как уксусная кислота, пропионовая кислота, гликолевая кислота, пировиноградная кислота, щавелевая кислота, яблочная кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота и тому подобное.
Предпочтительными соединениями формулы (I) являются соединения, в которых
• n равно 0 или 1;
• каждый из R1 и R2 независимо означает водород или (C1-C6)алкил;
• R3 означает циано или трифторметил;
• R4 означает водород, (C1-C6)алкил, галоген, циано, (C1-C6)алкокси, трифторметил, (C1-C6)алкилтио, (C1-C6)алкилсульфонил или (C1-C6)алкоксикарбонил;
• R5 означает водород, галоген, (C1-C6)алкокси или трифторметил;
• R6 означает водород;
• или R3 и R6 вместе с фенильным циклом образуют N-метилбензотриазол.
Также предпочтительны соединения формулы (I), где
• n равно 0 или 1;
• каждый из R1, R2 и R6 означает водород;
• R4 означает галоген, циано или трифторметил.
В особенности предпочтительными соединениями формулы (I) являются соединения, в которых R3 означает циано; в которых R5 означает водород или трифторметил; и в которых n равно 1.
В особенности полезные соединения выбирают из группы, включающей
4-[N-(1Н-имидазол-1-ил)-N-(4-трифторметилфенилметил)амино]бензонитрил,
4-[N-(1Н-имидазол-1-ил)-N-(4-хлорфенилметил)амино]бензонитрил,
4-[N-(1Н-имидазол-1-ил)-N-(4-цианофенилметил)амино]бензонитрил,
4,4'-[N-(1Н-имидазол-1-ил)амино]бис-бензонитрил,
4-[N-(1Н-имидазол-1-ил)-N-(4-фторфенилметил)амино]бензонитрил,
4-[N-(1Н-имидазол-1-ил)-N-(3,4-дифторфенилметил)амино]бензонитрил и
кислотно-аддитивные соли, сольваты или стереоизомерные формы указанных соединений.
Благодаря способности рассматриваемых соединений ингибировать ароматазу и, следовательно, извлекать все источники эндогенных эстрогенов, соединения по настоящему изобретению могут быть использованы по отдельности или в комбинации с другими активными ингредиентами для лечения или профилактики любого эстроген-зависимого нарушения или для управления эстроген-регулируемыми репродуктивными функциями у людей, а также у диких или домашних животных.
Поскольку молочные железы являются наиболее восприимчивыми объектами эстроген-стимулируемой пролиферации и/или дифференциации, ингибиторы ароматазы в особенности полезны в терапии или профилактике доброкачественных болезней молочной железы у женщин, гинекомастии у мужчин и доброкачественных или злокачественных опухолей молочной железы с наличием или отсутствием метастазов как у мужчин, так и у женщин (Brodie A.M. and Njar V.C., Steroids, 2000, 65: 171-179; Pritchard KI, Cancer, 2000, 85, suppl 12: 3065-3072), или у мужских и женских особей домашних животных.
Благодаря вовлеченности эстрогенов в механизмы овуляции, имплантации и беременности, ингибиторы ароматазы по настоящему изобретению могут быть использованы соответственно в контрацептивных, контрагестивных или абортивных целях у женщин (Njar V.C. and Brodie A.M., Drugs, 1999, 58: 233-255), а также у самок диких или домашних животных.
Матка является другим репродуктивным органом, реагирующим на эстрогенную стимуляцию, и ингибирование ароматазы является поэтому полезным для лечения или предупреждения эндометриоза, доброкачественных болезней матки или доброкачественных или злокачественных опухолей матки с наличием или отсутствием метастазов у женщин (Njar V.C. and Brodie A.M., Drugs, 1999, 58: 233-255) или у самок домашних животных.
Поскольку яичник является физиологическим источником эстрогена, ингибиторы ароматазы могут быть использованы для лечения аномального или несвоевременного овариального продуцирования эстрогена, такого как синдром поликистозных яичников или преждевременная половая зрелост соответственно (Bulun et al., J. Steroid Biochem Mol Biol, 1997, 61: 133-139). Овариальные, а также неовариальные, но эстроген-продуцируемые доброкачественные или злокачественные опухоли с наличием или отсутствием метастазов (Sasano H. and Harada N., Endocrine Reviews, 1998, 19: 593-607) также можно эффективно излечивать ингибиторами ароматазы по настоящему изобретению.
У мужчин предстательная железа и тестикулярные ткани также реагируют на эстрогенную стимуляцию (Abney T.O., Steroids, 1999, 64: 610-617; Carreau S. et al., Int J. Androl, 1999, 22: 133-138). Поэтому ингибиторы ароматазы могут быть использованы для лечения или предупреждения доброкачественных (Sciarra F. and Toscano V., Archiv Androl, 2000, 44: 213-220) или злокачественных опухолей предстательной железы с наличием или отсутствием метастазов (Auclerc G. et al., Oncologist, 2000, 5: 36-44) или для лечения, предупреждения нарушения или регуляции сперматогенезных функций или дисфункций у мужчин, а также самцов диких или домашних животных.
Известно также, что эстрогены вовлечены в регуляцию обновления костей; поэтому ингибиторы ароматазы могут быть полезны, по отдельности или в комбинации с другими антирезорбтивными или проостеогенными средствами, в лечении или профилактике костных нарушений согласно соответствующим терапевтическим схемам или режимам. Кроме того, эстрогены вовлечены в регуляцию баланса между предоминантными иммунными функциями Th1 и Th2 и могут быть, поэтому, полезны в лечении или предупреждении гендерно-зависимых аутоиммунных заболеваний, таких как волчанка, рассеянный склероз, ревматоидный артрит и тому подобное.
Когда соединения формулы (I) вводят для лечения или предупреждения эстроген-зависимых нарушений, указанные соединения можно комбинировать с одним или несколькими другими терапевтическими эндокринными гормональными препаратами, относящимися к половой функции. В случае регуляции или управления репродуктивными функциями, такими как мужская или женская плодовитость, беременность, аборт или родоразрешение, соединения формулы (I) могут быть комбинированы, например, с агонистом или антагонистом LH-RH, эстропрогестативным контрацептивом, прогестином, антипрогестином или простагландином. Когда соединения формулы (I) предназначены для лечения или предупреждения доброкачественных или злокачественных заболеваний молочной железы, матки или яичника, указанные соединения могут быть комбинированы, например, с антипрогестином, прогестином или агонистом или антагонистом LH-RH. В случае лечения или предупреждения доброкачественных или злокачественных заболеваний предстательной железы или яичка, соединения формулы (I) могут быть комбинированы, например, с антиандрогеном, прогестином, ингибитором лиазы или агонистом или антагонистом LH-RH.
Термин "комбинированный" означает любой протокол для совместного введения соединения формулы (I) и одного или более других фармацевтических веществ, независимо от природы, времени введения и изменения дозы со временем для любого из веществ. Совместное введение может быть, например, параллельным или последовательным.
Таким образом, изобретение относится также к способу лечения или предупреждения вышеуказанных заболеваний, включающего введение нуждающемуся в этом пациенту терапевтически эффективного количества соединения формулы (I) или фармацевтически приемлемой кислотно-аддитивной соли указанного соединения, необязательно, в комбинации с другим активным ингредиентом.
Для лечения/предупреждения любого из этих заболеваний, соединения формулы (I) могут быть введены, например, перорально, местно, парентерально, в стандартных лекарственных составах, содержащих общепринятые нетоксичные фармацевтически приемлемые носители, вспомогательные вещества и разбавители. Эти дозированные формы приведены в качестве примеров, но специалистами в области фармации могут быть разработаны другие лекарственные формы для введения соединений формулы (I). Термин парентеральный, как использован в описании, включает подкожные инъекции, внутривенные, внутримышечные, интрастенальные способы инъекции или инфузии. Помимо применения для лечения людей соединения по изобретению эффективны для лечения теплокровных, таких как мыши, крысы, лошади, крупный рогатый скот, овцы, собаки, кошки и прочее.
Фармацевтические композиции, содержащие активный ингредиент, могут быть в подходящей для перорального употребления форме, например, такой как таблетки, пастилки, лепешки, водные или масляные суспензии, диспергируемые порошки или гранулы, эмульсии, твердые или мягкие капсулы, или сиропы или эликсиры. Композиции, предназначенные для перорального употребления, могут быть получены любым способом, известным из уровня техники для получения фармацевтических составов, и такие композиции могут содержать одно или более средств, выбираемых из группы, включающей подсластители, корригенты, красители и консерванты, обеспечивающие фармацевтически изысканные и приятные на вкус препараты. Таблетки содержат активный ингредиент в смеси с нетоксичными фармацевтически приемлемыми наполнителями, которые удобны для получения таблеток. Этими наполнителями могут быть, например, инертные разбавители, такие как карбонат кальция, карбонат натрия, лактоза, фосфат кальция или фосфат натрия; гранулирующие и дезинтегрирующие средства, например, кукурузный крахмал или альгиновая кислота; связующие средства, например, крахмал, желатин или камедь акации, и смазывающие средства, например стеарат магния, стеариновая кислота или тальк. Таблетки могут быть без оболочки, либо на таблетки может быть нанесена известными способами оболочка, препятствующая распаду и поглощению в желудочно-кишечном тракте, тем самым обеспечивается замедленное действие в течение длительного периода. Например, может быть использован такой материал для задержки времени, как глицерил моностеарат или глицерил дистеарат.
Оболочка также может быть нанесена способом, описанным в патентах США 4256108; 4166452 и 4265874, с целью получения осмотических терапевтических таблеток для регулируемого высвобождения. Составы для перорального употребления могут также быть представлены в виде твердых желатиновых капсул, где активный ингредиент смешан с инертным твердым разбавителем, например, карбонатом кальция, фосфатом кальция или каолином, или в виде мягких желатиновых капсул, где активный ингредиент смешан с водной или масляной средой, например арахисовым маслом, жидким парафином или оливковым маслом.
Водные суспензии содержат активный ингредиент в смеси с наполнителями, подходящими для получения водных суспензий. Такими наполнителями являются суспендирующие средства, например, натрийкарбоксиметилцеллюлоза, метилцеллюлоза, гидроксипропилметилцеллюлоза, альгинат натрия, поливинилпирролидон, трагакантовая камедь и камедь акации; диспергирующими или смачивающими средствами, например, природными фосфатидами, такими как лецитин, или продуктами конденсации алкиленоксида с жирными кислотами, например, полиоксиэтиленстеаратом, или продуктами конденсации этиленоксида с длинноцепными алифатическими спиртами, например, гептадекаэтиленоксицетанолом, или продуктами конденсации этиленоксида с неполными эфирами, образованными жирными кислотами и гекситом, такими как полиоксиэтиленсорбитмоноолеат, или продуктами конденсации этиленоксида с неполными эфирами, образованными жирными кислотами и ангидридами гекситов, например, с полиэтиленсорбитанмоноолеат. Водные суспензии могут также содержать один или более консервантов, например, этил- или н-пропил-п-гидроксибензоат, один или более красителей, один или более корригентов и один или более подсластителей, таких как сахароза, сахарин или аспартам.
Масляные суспензии могут быть приготовлены путем суспендирования активного ингредиента в растительном масле, например, арахисовом масле, оливковом масле, кунжутном масле или кокосовом масле или минеральном масле, таком как жидкий парафин. Масляные суспензии могут содержать загустители, например, пчелиный воск, твердый парафин или цетиловый спирт. Для получения приятного на вкус перорального препарата могут быть добавлены вышеуказанные подсластители и корригенты. Для сохранности таких композиций может быть добавлен антиоксидант, такой как аскорбиновая кислота.
Диспергируемые порошки и гранулы, пригодные для получения водной суспензии путем добавления воды, содержат активный ингредиент в смеси с диспергирующим или смачивающим средством, суспендирующим средством и одним или более консервантами. Примерами подходящих диспергирующих или смачивающих средств и суспендирующих средств являются вышеупомянутые средства. Могут также присутствовать дополнительные наполнители, например, подсластители, корригенты и красители. Фармацевтические композиции по настоящему изобретению могут также быть в форме эмульсии масло-в-воде. Масляной фазой может служить растительное масло, например, арахисовое масло, оливковое масло, или минеральное масло, например, жидкий парафин, либо их смеси. Подходящими эмульгирующими средствами могут служить природные фосфатиды, например, соевыйлецитин, и эфиры или неполные эфиры, образованные жирными кислотами и ангидридами гекситов, например, сорбитанмоноолеат, и продукты конденсации указанных неполных эфиров с этиленоксидом, например, полиоксиэтиленсорбитанмоноолеат. Эмульсии могут также содержать подсластители и корригенты.
Фармацевтические композиции могут быть в форме стерильной водной или масляной суспензии для инъекции. Такая суспензия может быть приготовлена в соответствии с известным уровнем техники с применением вышеуказанных подходящих диспергирующих или смачивающих средств и суспендирующих средств. Стерильный препарат для инъекции может также быть в виде стерильного раствора или стерильной суспензии для инъекции в нетоксичном парентерально-приемлемом разбавителе или растворителе, например, в виде раствора в 1,3-бутандиоле. В качестве приемлемых разбавителей и растворителей могут также быть использованы вода, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, в качестве растворяющей или суспендирующей среды обычно используют стерильные нелетучие масла. Для этой цели может быть использовано любое смягчающее нелетучее масло, включая моно- или диглицериды. Кроме того, жирные кислоты, такие как олеиновая кислота, находят применение в препаратах для инъекции. Для лечения вышеуказанных состояний используют дозировки в интервале от около 0,0001 мг до около 20 мг/кг массы тела в день, либо альтернативно, в интервале от около 0,1 мг до около 2000 мг на пациента в день.
Количество активного ингредиента, которое может быть объединено с носителями для получения разовой лекарственной формы, изменяется в зависимости от пациента, подвергаемого лечению, и конкретного способа введения. Стандартные лекарственные формы обычно содержат приблизительно от 0,1 мг до 400 мг, предпочтительно, от 1 мг до 100 мг, активного ингредиента, в основном 0,1 мг, 1 мг, 2 мг, 5 мг, 10 мг, 20 мг, 40 мг, 50 мг, 60 мг, 80 мг, 100 мг или 400 мг.
Понятно, однако, что конкретный уровень дозы для каждого отдельного пациента варьируется в зависимости от факторов, включающих возраст, массу тела, общее состояние здоровья, пол, диету, время введения, способ введения, скорости выведения, комбинации лекарственных средств и тяжести конкретного излечиваемого заболевания.
Производные 1-N-фениламино-1H-имидазола формулы (I) по изобретению и соответствующие им кислотно-аддитивные соли могут быть получены по следующей общей схеме 1. 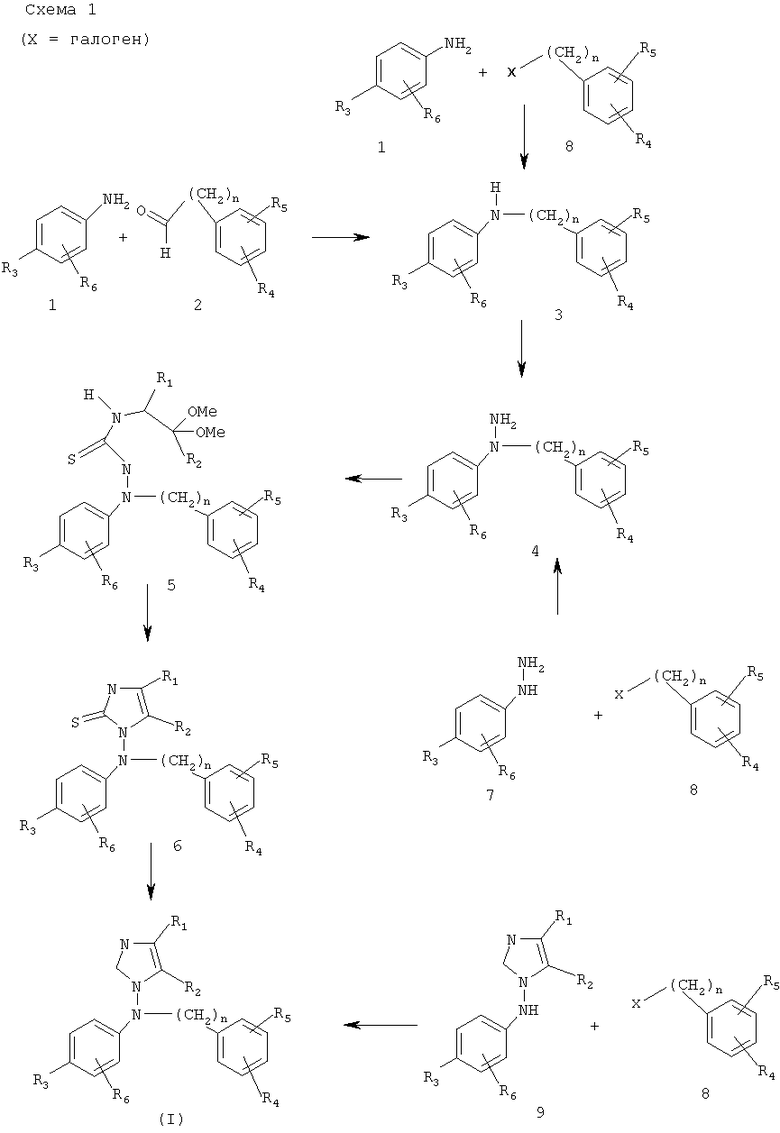
Согласно схеме 1 производное анилина (1) конденсируют с альдегидом формулы (2) и промежуточный имин восстанавливают натрийборгидридом или гидрогенизируют, используя оксид палладия или платины в качестве катализатора, что дает N,N-дизамещенный анилин (3). Указанный анилин (3) может также быть получен путем взаимодействия галогенового производного (8) с анилином формулы (1).
N,N-дизамещенный анилин (3) превращают в соответствующее нитрозо-производное, используя стандартные условия, затем восстанавливают, получая 1,1-дизамещенный гидразин формулы (4). Альтернативно, 1,1-дизамещенный гидразин (4) может быть получен путем селективного N-алкилирования соединения формулы (7) соединением формулы (8) с использованием условий, описанных U. LERCH и J. KÖNIG (Synthesis, 1983, 2, 157-8).
После чего конденсация (4) с диалкилоксиалкилизотиоцианатным или этилендиоксиалкилизоцианатным производным дает тиосемикарбазид (5), который превращают в 1-аминоимидазол-2-тион (6) путем обработки кислотой, такой как уксусная кислота или серная кислота.
Десульфуризация (6) в уксусной кислоте в условиях, описанных S.GRIVAS и E.RONNE в Acta Chemica Scandinavia, 1995, 49, 225-229, дает конечное производное 1-N-фениламино-1H-имидазола (I), которое, необязательно, превращают в одну из фармацевтически приемлемых кислотно-аддитивных солей. Альтернативно, соединение (I), где R3 или R6означает электроноакцепторную группу, может быть получено конденсацией N-имидазолоанилина (9) с галогеновым производным (8).
Следующие примеры и испытания приведены в целях иллюстрации изобретения и не могут рассматриваться в качестве ограничивающих.
ПОЛУЧЕНИЕ N-АЛКИЛАНИЛИНОВ (3)
ПРИМЕР 1
N-(4-хлорфенилметил)-4-цианоанилин
К раствору 4-хлорбензальдегида (35,69 г, 0,253 моль) в абсолютном этаноле (250 мл) добавляют порциями 4-аминобензонитрил (30 г, 0,253 моль). Реакционную смесь перемешивают при комнатной температуре в течение 3 ч, осадок фильтруют, промывают диэтиловым эфиром и выливают в 1/1 смесь ТГФ/этанол (250 мл). Образовавшуюся суспензию охлаждают льдом, добавляют порциями NaBH4 (4,8 г, 0,127 моль) и реакционную смесь перемешивают при комнатной температуре 0,75 ч. После добавления уксусной кислоты (3 мл) и воды (500 мл) осадок фильтруют, промывают водой и сушат, получая белое твердое вещество (51,27 г, 84%), т.пл. 130°C.
1Н ЯМР (CDCl3): 4,35 (д, 2Н), 4,75 (с, 1Н), 6,55 (д, 2Н), 7,20-7,50 (м, 6Н).
Используя аналогичную методику, но заменяя 4-хлорбензальдегид на
- 4-метоксибензальдегид,
- 3-фтор-4-метоксибензальдегид,
получают
- 4-циано-N-(4-метоксифенилметил)анилин (т.пл. 109°C) и
- 4-циано-N-(3-фтор-4-метоксифенилметил)анилин (т.пл. 108°C) соответственно.
ПРИМЕР 2
4-циано-N-(4-метилфенилметил)анилин
Смесь п-толуальдегида (40,68 г, 0,338 моль), 4-аминобензонитрила (40 г, 0,338 моль) и 5% Pd/C (4 г) в абсолютном этаноле (300 мл) гидрируют при комнатной температуре в течение ночи. Реакционную смесь разбавляют метиленхлоридом, фильтруют на целите и концентрируют досуха. Кристаллизация из этанола дает белое твердое вещество (74,9 г, 99%), т.пл. 100°C.
1Н ЯМР (CDCl3): 2,35 (с, 3Н), 4,3 (д, 2Н), 4,7 (с, 1Н), 6,55 (д, 2Н), 7,10-7,30 (м, 4Н), 7,35 (д, 2Н).
Используя аналогичную методику, но заменяя п-толуальдегид на
- 4-цианобензальдегид,
- 3,4-диметоксибензальдегид,
получают
- 4-циано-N-(4-цианофенилметил)анилин (т.пл. 156°C) и
- 4-циано-N-(3,4-диметоксифенилметил)анилин (т.пл. 150°C) соответственно.
ПОЛУЧЕНИЕ N,N-ДИЗАМЕЩЕННЫХ ГИДРАЗИНОВ (4)
Указанные соединения обычно получают по методике, описанной в Tetrahedron 1982, 38(3): 419-423 и Organic Fonctional Group Preparations 1968, 1: 374-376.
ПРИМЕР 3
N1-(4-хлорфенилметил)-N1-(4-цианофенил)гидразин
К охлаждаемой льдом суспензии 4-циано-N-(4-хлорфенилметил)анилина (30 г, 0,125 моль) в 2 н. H2SO4 (150 мл) добавляют раствор нитрита натрия (9,48 г, 0,137 моль) в воде (30 мл). Реакционную смесь перемешивают при комнатной температуре в течение 2 ч. Добавляют раствор нитрита натрия (9,48 г, 0,137 моль) в воде (30 мл) и реакционную смесь перемешивают в течение ночи. Добавляют раствор нитрита натрия (6,6 г, 0,095 моль) в воде (20 мл) и реакционную смесь перемешивают в течение 1 ч. После экстракции этилацетатом органический слой промывают последовательно насыщенным раствором гидрокарбоната натрия, водой, насыщенным раствором соли, сушат над сульфатом натрия и упаривают в вакууме, получая белое твердое вещество (30,5 г). К суспензии полученного твердого вещества в смеси из диэтилового эфира (60 мл), AcOH (60 мл) и воды (60 мл) добавляют цинковый порошок (24,5 г, 0,375 моль) с такой скоростью, чтобы поддерживать температуру ниже 35°С. Смесь перемешивают в течение 2 ч, добавляют AcOH (60 мл), воду (60 мл) и цинк (6 г) и перемешивание продолжают еще в течение 0,5 ч. После добавления эфира (200 мл) реакционную смесь фильтруют, неорганическое вещество промывают этилацетатом, продукт экстрагируют этилацетатом и органический слой промывают водой, насыщенным раствором соли и сушат над сульфатом натрия. Растворители концентрируют в вакууме и кристаллизацией из диизопропилового эфира получают твердое вещество (18,78 г, 58%), т.пл. 90оС.
1Н ЯМР (CDCl3): 3,75 (с, 2Н), 4,69 (с, 2Н), 7,05 (д, 2Н), 7,15 (д, 2Н), 7,35 (д, 2Н), 7,49 (д, 2Н).
Используя аналогичную методику, но заменяя 4-циано-N-(4-хлорфенилметил)анилин на
- 4-циано-N-(4-метоксифенилметил)анилин,
- 4-циано-N-(3-фтор-4-метоксифенилметил)анилин,
- 4-циано-N-(4-метилфенилметил)анилин,
- 4-циано-N-(4-цианофенилметил)анилин,
- 4-циано-N-(3,4-диметоксифенилметил)анилин,
- 4-бром-N-(4-цианофенилметил)анилин,
получают
- N1-(4-метоксифенилметил)-N1-(4-цианофенил)гидразин (т.пл. 74°C),
- N1-(3-фтор-4-метоксифенилметил)-N1-(4-цианофенил)гидразин (т.пл. 102°C),
- N1-(4-метилфенилметил)-N1-(4-цианофенил)гидразин (т.пл. 74°C),
- N1-(4-цианофенилметил)-N1-(4-цианофенил)гидразин (т.пл. 215°C),
- N1-(3,4-диметоксифенилметил)-N1-(4-цианофенил)гидразин (т.пл. 134°C) и
- N1-цианофенилметил)-N1-(4-бромфенил)гидразин (т.пл. 114°C) соответственно.
ПРИМЕР 4
N1-(4-трифторметилфенилметил)-N1-(4-цианофенил)гидразин
В атмосфере азота порошкообразный амид натрия (95%, 4,8 г, 0,117 моль) вносят при перемешивании в колбу, содержащую ТГФ (100 мл). Раствор охлаждают льдом и добавляют порциями 4-цианофенилгидразингидрохлорид (получен по José L.Castro et al. J. Med. Chem. 1994, 37, 3023-3032) (10 г, 0,058 моль). Ледяную баню убирают и через оранжевую суспензию пропускают ток азота в течение 1 ч для удаления большей части растворенного аммиака. При охлаждении льдом добавляют 4-трифторметилбензилхлорид (12 г, 0,062 моль), затем реакционную смесь перемешивают при комнатной температуре в течение 1,5 ч и выливают в воду (100 мл). После экстракции этилацетатом органический слой промывают водой, сушат над сульфатом натрия и упаривают в вакууме. Тритурирование из диизопропилового эфира дает желтое твердое вещество (7,5 г, 43%), т.пл. 98°C.
1Н ЯМР (CDCl3): 3,8 (с, 2Н), 4,8 (с, 2Н), 7,05 (д, 2Н), 7,33 (д, 2Н), 7,5 (д, 2Н), 7,6 (д, 2Н).
Используя аналогичную методику, но заменяя 4-трифторметилбензилхлорид на
- 4-фторбензонитрил,
- 4-фторбензилбромид,
- 4-метилтиобензилхлорид,
- 3,4-дифторбензилхлорид,
- 2,4-дифторбензилхлорид,
- 3,5-дифторбензилхлорид,
- 4-бромбензилбромид,
получают
- N1-бис-(4-цианофенил)гидразин (т.пл. 222°C),
- N1-(4-фторфенилметил)-N1-(4-цианофенил)гидразин (т.пл. 114-115°C),
- N1-(4-метилтиофенилметил)-N1-(4-цианофенил)гидразин (т.пл. 72°C),
- N1-(3,4-дифторфенилметил)-N1-(4-цианофенил)гидразин (т.пл. 72°C),
- N1-(2,4-дифторфенилметил)-N1-(4-цианофенил)гидразин (т.пл. 70°C),
- N1-(3,5-дифторфенилметил)-N1-(4-цианофенил)гидразин (т.пл. 124°C) и
- N1-бромфенилметил)-N1-(4-цианофенил)гидразин (т.пл. 90°C) соответственно.
ПРИМЕР 4A
N1-(4-цианофенилметил)-N1-(4-метоксифенил)гидразин
Хлорметилбензонитрил (25 г, 164,90 ммоль) вносят при перемешивании в колбу, содержащую толуол (200 мл) и триэтиламин (46,40 мл, 329,80 ммоль). Добавляют порциями 4-цианофенилгидразингидрохлорид (получен по José L. Castro et al., J. Med. Chem. 1994, 37, 3023-3032) (28,80 г, 164,90 ммоль) и реакционную смесь перемешивают 3 ч при нагревании до кипения с обратным холодильником. После охлаждения смесь фильтруют, промывают толуолом (50 мл) и водой (200 мл) и получают белое твердое вещество (27,20 г, 65%), т.пл. 115°C.
1Н ЯМР (ДМСО d6): 3,65 (с, 3Н), 4,30 (с, 2Н), 4,57 (с, 2Н), 6,77 (д, 2Н), 6,94 (д, 2Н), 7,48 (д, 2Н), 7,76 (д, 2Н).
ПОЛУЧЕНИЕ ИМИДАЗОЛОВ ФОРМУЛЫ (I)
ПРИМЕР 5
4-[N-(1Н-имидазол-1-ил)-N-(4-трифторметилфенил)амино]бензонитрил
К охлажденному раствору (10-15°C) трет-BuOK (1,06 г, 0,00895 моль) в ДМСО (18 мл) добавляют порциями N-(1Н-имидазол-1-ил)-4-трифторметиланилин (1,85 г, 0,00814 моль) (получен десульфуризацией из соответствующего 2,3-дигидро-1H-имидазол-2-тиона, J. G. Schantl, Heterocycles, 37(3), 1873, 1994). Реакционную смесь перемешивают при комнатной температуре в течение 1 ч, затем добавляют 4-фторбензонитрил (0,936 г, 0,00773 моль) в ДМСО (18 мл), реакционную смесь перемешивают в течение 2 ч и выливают в воду концентрированный раствор гидроксида натрия. Осадок собирают и сушат в вакууме. Флэш-хроматография на силикагеле (смесь толуол/диоксан: 7/3) и кристаллизация из диизопропилового эфира дают твердое вещество (1,6 г, 60%), т.пл. 104°C.
Анализ Рассчитано: С: 62,2; Н: 3,38; F: 17,36; N: 17,07
Найдено: С: 62,22; Н: 3,40; F: 17,3; N: 17,1
1Н ЯМР (ДМСО d6): 6,96 (д, 2Н), 7,15 (с, 1Н), 7,31 (д, 2Н), 7,68 (с, 1Н), 7,6-7,85 (м, 4Н), 7,87 (с, 1Н).
ПРИМЕР 6
4-[N-(1Н-имидазол-1-ил)-N-(4-трифторметилфенилметил)амино]бензонитрил
a) 4-[N-(2,3-дигидро-1H-имидазол-1-ил-2-тион)-N-(4-трифторметилфенилметил)амино]бензонитрил
К суспензии N1-(4-трифторметилфенилметил)-N1-(4-цианофенил)гидразина (7,5 г, 0,025 моль) в этаноле (100 мл) добавляют по каплям 2,2-диметоксиэтилизотиоцианат (4 г, 0,027 моль) и реакционную смесь нагревают до температуры кипения с обратным холодильником в течение 2 ч. После охлаждения растворитель выпаривают в вакууме, полученный остаток выливают в 2 н. H2SO4 (20 мл) и суспензию нагревают до температуры кипения с обратным холодильником в течение 0,3 ч. После экстракции этилацетатом органический слой промывают водой, сушат над сульфатом натрия и концентрируют в вакууме. Флэш-хроматография на силикагеле (толуол/диоксан: 8/2) и тритурирование из смеси диизопропиловый эфир/этанол дают желтое твердое вещество (2,7 г, 28%), т.пл. 200°C.
1Н ЯМР (ДМСО d6): 5-5,4 (м, 2Н), 6,65 (д, 2Н), 6,95 (д, 1Н), 7,15 (д, 1Н), 7,7 (м, 6Н).
b) 4-[N-(1Н-имидазол-1-ил)-N-(4-трифторметилфенилметил)амино]бензонитрил
35% пероксид водорода (1,1 мл, 0,035 моль) добавляют по каплям к охлаждаемой льдом суспензии 4-[N-(2,3-дигидро-1H-имидазол-1-ил-2-тион)-N-(4-трифторметилфенилметил)амино]бензонитрила (2,7 г, 0,0072 моль) в уксусной кислоте (20 мл). После того как ТСХ подтвердит завершение взаимодействия, реакционную смесь разбавляют водой, доводят до pH 11 с помощью гидроксида натрия, обрабатывают гидросульфитом натрия и экстрагируют этилацетатом. Органический слой сушат над сульфатом натрия и концентрируют в вакууме. Флэш-хроматография на силикагеле (смесь толуол/этилацетат: 7/3, затем 6/4) и кристаллизация из диизопропилового эфира дают твердое вещество (1 г, 41%), т.пл. 134°C.
Анализ Рассчитано: С: 63,1; Н: 3,8; N: 16,3
Найдено: С: 63,4; Н: 3,58; N: 16,3
1Н ЯМР (ДМСО d6): 5,15 (с, 2Н), 6,65 (д, 2Н), 7 (с, 1Н), 7,4 (с, 1Н), 7,5-7,9 (м, 7Н).
М+ =342.
Используя аналогичную методику, но заменяя N1-(4-трифторметилфенилметил)-N1-(4-цианофенил)гидразин на
- N1-(4-хлорфенилметил)-N1-(4-цианофенил)гидразин,
- N1-(4-метоксифенилметил)-N1-(4-цианофенил)гидразин,
- N1-(3-фтор-4-метоксифенилметил)-N1-(4-цианофенил)гидразин,
- N1-(4-метилфенилметил)-N1-(4-цианофенил)гидразин,
- N1-(4-цианофенилметил)-N1-(4-цианофенил)гидразин,
- N1-(3,4-диметоксифенилметил)-N1-(4-цианофенил)гидразин,
- N1-бис-(4-цианофенил)гидразин,
- N1-(4-фторфенилметил)-N1-(4-цианофенил)гидразин,
- N1-(4-метилтиофенилметил)-N1-(4-цианофенил)гидразин,
- N1-(3,4-дифторфенилметил)-N1-(4-цианофенил)гидразин,
- N1-(2,4-дифторфенилметил)-N1-(4-цианофенил)гидразин,
- N1-(3,5-дифторфенилметил)-N1-(4-цианофенил)гидразин,
- N1-(4-бромфенилметил)-N1-(4-цианофенил)гидразин,
- N1-(4-цианофенилметил)-N1-(4-бромфенил)гидразин,
- N1-(4-цианофенилметил)-N1-(1-метилбензотриазол-6-ил)гидразин,
- N1-(4-цианофенилметил)-N1-(3-трифторметил-4-цианофенил)гидразин,
- N1-(фенилметил)-N1-(4-цианофенил)гидразин,
- N1-(4-цианофенил)-N1-(3-трифторметил-4-цианофенил)гидразин,
- N1-(3-фторфенилметил)-N1-(4-цианофенил)гидразин,
- N1-(4-метоксикарбонилфенилметил)-N1-(4-цианофенил)гидразин,
- N1-(4-цианофенил)-N1-(4-фторфенил)гидразин,
- N1-(3-трифторметилфенилметил)-N1-(4-цианофенил)гидразин,
получают, соответственно, следующие соединения:
ПРИМЕР 7
4-[N-(1Н-имидазол-1-ил)-N-(4-хлорфенилметил)амино]бензонитрилгидрохлорид
Т.пл. 190°С.
Анализ Рассчитано: С: 59,15; Н: 4,09; Cl: 20,54; N: 16,23
Найдено: С: 59,04; Н: 3,99; Cl: 20,5; N: 16,2
1Н ЯМР (ДМСО d6): 5,15 (с, 2Н), 6,95 (д, 2Н), 7,4 (с, 4Н), 7,75 (м, 3Н), 8,10 (с, 1Н), 9,6 (с, 1Н).
ПРИМЕР 8
4-[N-(1Н-имидазол-1-ил)-N-(4-метоксифенилметил)амино]бензонитрилгидрохлорид
Т.пл. 178°С.
Анализ Рассчитано: С: 63,44; Н: 5,03; Cl: 10,40; N: 16,44
Найдено: С: 63,4; Н: 5,01; Cl: 10,4; N: 16,6
1Н ЯМР (ДМСО d6): 3,70 (c, 3H), 5,05 (c, 2H), 6,85 (д, 2H), 7 (д, 2H), 7,25 (д, 2H), 7,79 (с, 1H), 7,80 (д, 2H), 8,1 (c, 1H), 9,50 (c, 1H).
ПРИМЕР 9
4-[N-(1Н-имидазол-1-ил)-N-(3-фтор-4-метоксифенилметил)амино]бензонитрилгидрохлорид
Т.пл. 190°С.
1Н ЯМР (ДМСО d6): 3,80 (с, 3Н), 5,05 (с, 2Н), 7 (д, 2Н), 7,05-7,15 (м, 2Н), 7,30 (д, 1Н), 7,8 (д, 2Н), 7,75 (с, 1Н), 8,1 (с, 1Н), 9,50 (с, 1Н).
ПРИМЕР 10
4-[N-(1Н-имидазол-1-ил)-N-(4-метилфенилметил)амино]бензонитрил
Т.пл. 156°С.
Анализ Рассчитано: С: 74,98; Н: 5,59; N: 19,43
Найдено: С: 74,55; Н: 5,56; N: 19,3
1Н ЯМР (ДМСО d6): 2,25 (с, 3H), 4,95 (с, 2H), 6,65 (д, 2H), 6,98 (с, 1H), 7,10 (д, 2H), 7,2 (д, 2H), 7,35 (с, 1H), 7,70 (м, 3H).
ПРИМЕР 11
4-[N-(1Н-имидазол-1-ил)-N-(4-цианофенилметил)амино]бензонитрилгидрохлорид
Т.пл. 195°С
Анализ Рассчитано: С: 64,38; Н: 4,2; Cl: 10,56; N: 20,86
Найдено: С: 64,31; Н: 4,29; Cl: 10,6; N: 20,9
1Н ЯМР (ДМСО d6): 5,30 (c, 2H), 7,10 (д, 2H), 7,62 (д, 2H), 7,70-8 (м, 5H), 8,17 (c, 1H), 9,7 (c, 1H)
ПРИМЕР 12
4-[N-(1Н-имидазол-1-ил)-N-(3,4-диметоксифенилметил)амино]бензонитрилгидрохлорид
Т.пл. 167°С.
Анализ Рассчитано: С: 61,54; Н: 5,16; Cl: 9,56; N: 15,11
Найдено: С: 61,39; Н: 5,13; Cl: 9,57; N: 15,1
1Н ЯМР (ДМСО d6): 3,70 (с, 3H), 3,73 (с, 3H), 5 (с, 2H), 6,65-7,15 (м, 5H), 7,75 (с, 1H), 7,80 (с, 2H), 8,10 (с, 1H), 9,5 (с, 1H).
ПРИМЕР 13
4,4'-[N-(1Н-имидазол-1-ил)амино]бис-бензонитрилгидрохлорид
Т.пл. 199°С.
Анализ Рассчитано: С: 63,46; Н: 3,76; Cl: 11,02; N: 21,76
Найдено: С: 63,2; Н: 3,81; Cl: 11,0; N: 21,9
1Н ЯМР (ДМСО d6): 7,26 (д, 4H), 7,9 (с, 1H), 7,92 (д, 4H), 8,30 (с, 1H), 9,80 (с, 1H).
ПРИМЕР 14
4-[N-(1Н-имидазол-1-ил)-N-(4-фторфенилметил)амино]бензонитрилгидрохлоридгемигидрат
Т.пл. 176-178°С.
Анализ Рассчитано: С: 60,45; Н: 4,48; F: 5,62; Cl: 10,05; N: 16,59
Найдено: С: 60,71; Н: 4,64; F: 5,54; Cl: 10,6; N: 17,0
1Н ЯМР (ДМСО d6): 5,15 (с, 2H), 7,2 (т, 2H), 7,4 (кв, 2H), 7,8 (с, 1H), 7,0-7,8 (AB, 4H), 9,6 (с, 1H).
ПРИМЕР 15
4-[N-(1Н-имидазол-1-ил)-N-(4-метилтиофенилметил)амино]бензонитрил
Т.пл. 128°С.
Анализ Рассчитано: С: 67,56; Н: 5,03; N: 17,5; S: 10,02
Найдено: С: 67,12; Н: 4,90; N: 17,2; S: 9,51
1Н ЯМР (ДМСО d6): 2,4 (с, 3H), 5,05 (с, 2H), 6,65 (д, 2H), 7 (с, 1H), 7,15-7,3 (м, 4H), 7,35 (с, 1H), 7,7 (м, 3H).
ПРИМЕР 16
4-[N-(1Н-имидазол-1-ил)-N-(4-метилсульфонилфенилметил)амино]бензонитрил
Т.пл. 190°С.
1Н ЯМР (ДМСО d6): 3,2 (с, 3H), 5,2 (с, 2H), 6,6 (д, 2H), 7 (с, 1H), 7,45 (с, 1H), 7,6-7,9 (м, 7H).
ПРИМЕР 17
4-[N-(1Н-имидазол-1-ил)-N-(3,4-дифторфенилметил)амино]бензонитрил
Т.пл. 132°С.
Анализ Рассчитано: С: 65,86; Н: 3,9; N: 18,07
Найдено: С: 65,47; Н: 3,78; N: 18,1
1Н ЯМР (ДМСО d6): 5,0 (с, 2H), 6,7 (д, 2H), 6,9-7,8 (м, 8H).
ПРИМЕР 18
4-[N-(1Н-имидазол-1-ил)-N-(2,4-дифторфенилметил)амино]бензонитрил
Т.пл. 149°С.
Анализ Рассчитано: С: 65,86; Н: 3,9; N: 18,07
Найдено: С: 66,0; Н: 3,84; N: 18,2
1Н ЯМР (ДМСО d6): 5,1 (с, 2H), 6,7 (д, 2H), 6,9-7,8 (м, 8H).
ПРИМЕР 19
4-[N-(1Н-имидазол-1-ил)-N-(3,5-дифторфенилметил)амино]бензонитрил
Т.пл. 170°С.
Анализ Рассчитано: С: 65,86; Н: 3,9; N: 18,07
Найдено: С: 65,73; Н: 3,8; N: 18,02
1Н ЯМР (ДМСО d6): 5,1 (с, 2H), 6,6 (д, 2H), 7-7,2 (м, 4H), 7,5 (с, 1H), 7,75 (д, 2H), 7,9 (с, 1H).
ПРИМЕР 20
4-[N-(1Н-имидазол-1-ил)-N-(4-бромфенилметил)амино]бензонитрилгидрохлорид
Т.пл. 125°С.
1Н ЯМР (CDCl3): 5 (с, 2H), 6,8 (д, 2H), 7 (с, 1H), 7,25 (м, 3H), 7,35 (с, 1H), 7,4 (д, 2H), 7,65 (д, 2H), 9,85 (с, 1H).
ПРИМЕР 21
4-[N-(1Н-имидазол-1-ил)-N-(4-бромфенил)аминометил]бензонитрил
Т.пл. 138°С.
Анализ Рассчитано: С: 57,81; Н: 3,71; N: 15,86; Br: 22,62
Найдено: С: 57,85; Н: 3,7; N: 15,9; Br: 23,2
1Н ЯМР (ДМСО d6): 4,85 (с, 2H), 6,5 (д, 2H), 7 (с, 1H), 7,1 (с, 1H), 7,25-7,55 (м, 5H), 7,6 (д, 2H)
ПРИМЕР 22
4-[N-(1-метилбензотриазол-6-ил)-N-(1Н-имидазол-1-ил)аминометил]бензонитрил
Т.пл. 184°С.
1Н ЯМР (ДМСО d6): 4,20 (с, 3H), 5,1 (с, 2H), 6,5 (дд, 1H), 6,95 (с, 1H), 7,2 (с, 1H), 7,4 (с, 1H), 7,57 (д, 2H), 7,7-7,85 (м, 3H), 7,9 (д, 1H)
ПРИМЕР 23
4-[N-(1Н-имидазол-1-ил)-N-(4-цианофенилметил)амино]-3-трифторметилбензонитрил
Т.пл. 226°С.
Анализ Рассчитано: С: 62,18; Н: 3,29; N: 19,08
Найдено: С: 61,89; Н: 3,35; N: 18,9
1Н ЯМР (ДМСО d6): 5,25 (с, 2H), 6,8-7,05 (м, 3H), 7,45 (с, 1H), 7,55 (д, 2H), 7,8 (д, 3H), 8,05 (д, 1H)
ПРИМЕР 24
4-[N-(1Н-имидазол-1-ил)-N-(фенилметил)амино]бензонитрил
Т.пл. 107°С.
1Н ЯМР (ДМСО d6): 5,05 (с, 2H), 6,65 (д, 2H), 7 (с, 1H), 7,25-7,4 (м, 6H), 7,65-7,75 (м, 3H)
ПРИМЕР 25
4-[N-(1Н-имидазол-1-ил)-N-(4-цианофенил)амино]-3-трифторметилбензонитрил
Т.пл. 166°С.
1Н ЯМР (ДМСО d6): 7,2 (м, 3H), 7,3 (д, 2H), 7,75 (с, 1H), 7,95 (д, 2H), 8,15 (д, 1H), 8,25 (с, 1H)
ПРИМЕР 26
4-[N-(1Н-имидазол-1-ил)-N-(3-фторфенилметил)амино]бензонитрил
Т.пл. 112°С.
Анализ Рассчитано: С: 69,9; Н: 4,48; N: 19,18
Найдено: С: 69,38; Н: 4,35; N: 19,3
1Н ЯМР (ДМСО d6): 5,05 (с, 2H), 6,65 (д, 2H), 7 (с, 1H), 7,05-7,25 (м, 3H), 7,3-7,45 (м, 2H), 7,7-7,85 (м, 3H)
ПРИМЕР 27
Метил 4-[N-(4-цианофенил)-N-(1Н-имидазол-1-ил)аминометил]бензоат
Т.пл. 178°С.
1Н ЯМР (ДМСО d6): 3,85 (с, 3H), 5,15 (с, 2H), 6,65 (д, 2H), 7 (с, 1H), 7,4 (с, 1H), 7,5 (д, 2H), 7,65-7,8 (м, 3H), 7,9 (д, 2H).
ПРИМЕР 28
4-[N-(1Н-имидазол-1-ил)-N-(4-фторфенил)амино]бензонитрил
Т.пл. 113°С.
1Н ЯМР (ДМСО d6): 6,45 (д, 2H), 7,1 (с, 1H), 7,25-7,45 (м, 2H), 7,5-7,7 (м, 5H), 8,2 (с, 1H)
ПРИМЕР 29
4-[N-(1Н-имидазол-1-ил)-N-(3-трифторметилфенилметил)амино]бензонитрил
Т.пл. 122°С.
1Н ЯМР (ДМСО d6): 5,15 (с, 2H), 6,7 (д, 2H), 7 (с, 1H), 7,4 (с, 1H), 7,5-7,8 (м, 7H).
Используя методику, аналогичную приведенной в примере 6, но заменяя 2-изоцианатоацетальдегиддиметилацеталь на
- 2-изотиоцианатопропиональдегиддиэтилацеталь,
- 1-изотиоцианатопропан-2-ондиэтилацеталь,
- 2-изотиоцианатобутан-3-ондиэтилацеталь,
получают следующие соединения:
ПРИМЕР 30
4-[N-(4-метил-1H-имидазол-1-ил)-N-(4-бромфенилметил)амино]бензонитрил
Т.пл. 152°С.
Анализ Рассчитано: С: 58,9; Н: 4,11; N: 15,26
Найдено: С: 58,67; Н: 4,16; N: 15,3
1Н ЯМР (ДМСО d6): 2,1 (с, 3H), 5 (с, 2H), 6,65 (д, 2H), 7,05 (с, 1H), 7,3 (д, 2H), 7,5 (д, 2H), 7,6 (с, 1H), 7,7 (д, 2H).
M+ = 366.
ПРИМЕР 31
4-[N-(5-метил-1H-имидазол-1-ил)-N-(4-бромфенилметил)амино]бензонитрил
Т.пл. 152°С.
1Н ЯМР (CDCl3): 2 (с, 3H), 4,9-5,2 (м, 2H), 6,65 (д, 2H), 7 (с, 1H), 7,25 (д, 2H), 7,5 (д, 2H), 7,6 (д, 2H), 9,25 (с, 1H)
M+ = 366.
ПРИМЕР 32
4-[N-(4,5-диметил-1H-имидазол-1-ил)-N-(4-бромфенилметил)амино]бензонитрил
Т.пл. 150°С.
Анализ Рассчитано: С: 59,8; Н: 4,49; N: 14,7
Найдено: С: 58,7; Н: 4,41; N: 14,6
1Н ЯМР (ДМСО d6): 1,9 (с, 3H), 2,1 (с, 3H), 4,95-5,25 (м, 2H), 6,6 (д, 2H), 7,3-7,8 (м, 7H)
M+ = 380.
ПРИМЕР 33
4-[N-(1Н-имидазол-1-ил)-N-(4-метоксифенил)амино]метилбензонитрил
a) 4-[N-(2,3-дигидро-1H-имидазол-1-ил-2-тион)-N-(4-метоксифенил)амино]метилбензонитрил
К суспензии N1-(4-цианофенилметил)-N1-(4-метоксифенил)гидразина (27,10 г, 106,98 ммоль) в этаноле (250 мл) добавляют по каплям 2,2-диметоксиэтилизотиоцианат (17,30 г, 117,67 ммоль) и реакционную смесь нагревают до температуры кипения с обратным холодильником в течение 2 ч. После охлаждения растворитель выпаривают в вакууме, полученное масло разбавляют смесью уксусная кислота/вода (9/1, 250 мл) и суспензию нагревают до температуры кипения с обратным холодильником в течение 1,5 ч и при комнатной температуре в течение ночи. Полученный остаток выливают в воду (1400 мл) и собирают коричневый осадок. После тритурирования с этанолом коричневое твердое вещество дает белый твердый продукт (9,60 г, 27%), т.пл.: 150°C.
1Н ЯМР (ДМСО d6): 3,70 (с, 3H), 5,08 (с, 2H), 6,60 (д, 2H), 6,75-7,00 (м, 3H), 7,20 (с, 1H), 7,80 (с, 4H).
b) 4-[N-(1Н-имидазол-1-ил)-N-(4-метоксифенил)амино]метилбензонитрил
35% пероксид водорода (1,1 мл, 0,035 моль) добавляют по каплям к охлаждаемой льдом суспензии 4-[N-(2,3-дигидро-1H-имидазол-1-ил-2-тион)-N-(4-метоксифенил)амино]метилбензонитрила (9,50 г, 28,24 ммоль) в уксусной кислоте (50 мл). После того, как ТСХ подтвердит завершение взаимодействия, реакционную смесь разбавляют водой, доводят до pH 11 с помощью гидроксида натрия, обрабатывают гидросульфитом натрия и экстрагируют этилацетатом. Органический слой сушат над сульфатом натрия и концентрируют в вакууме. Флэш-хроматография на силикагеле (смесь толуол/диоксан: 6/4) дает чистое оранжевое масло (5,80 г, 67%).
1Н ЯМР (ДМСО d6): 3,70 (с, 3H), 4,90 (с, 2H), 6,60-7,00 (м, 5H), 7,40 (с, 1H), 7,55 (д, 2Н), 7,70 (с, 1H), 7,78 (д, 2Н).
Кристаллизация из хлористоводородного этанола дает белые кристаллы (5,70 г, 66%).
Т.пл. 207°C.
1Н ЯМР (ДМСО d6): 3,70 (с, 3H), 4,97 (с, 2H), 6,93 (д, 2H), 7,13 (д, 2H), 7,45 (д, 2H), 7,70 (с, 1H), 7,84 (д, 2Н), 8,04 (с, 1Н), 8,18 (с, 1Н), 9,55 (с, 1Н).
РЕЗУЛЬТАТЫ БИОЛОГИЧЕСКИХ ИСПЫТАНИЙ
Испытание in vitro
Клеточная линия JEG-3, полученная из плацентарной хореокарциномы человека, является, по своей природе, очень богатой ароматазой человека (Bahn R.S. et al., J. Clin Endocrinol Metab, 1981, 52: 447-450) и, следовательно, полезной практической биологической системой для скрининга и оценки предполагаемых ингибиторов ароматазы in vitro (Yue W and Brodie AM, J Steroid Biochem Mol Biol, 1997, 63: 317-328). Исходную линию клеток JEG-3 выращивают до 80% слияния в монослоях, используя пластиковые колбы, в минимальной среде Игла с 1 г/л глюкозы и без 10% сыворотки плода теленка, при pH 7,4 и 37°C, в атмосфере 5% CO2. Затем, за 24 часа до определения активности ароматазы, клетки JEG-3 распределяют для культивирования по 96-луночным микропланшетам (60000-100000 жизнеспособных клеток в 100 мкл культуральной среды на ячейку); спустя 24 часа микропланшеты промывают и добавляют свежую среду, содержащую радиоактивный субстрат ароматазы (1β-3H-андростендион, 10 нМ) вместе с испытуемым соединением, растворенным 1% диметилсульфоксидом, при интервале испытуемых концентраций от 10-12до 10-4 M в общем объеме 150 мкл. Через два часа после начала инкубации 100 мкл супернатантов переносят на новые гомологические 96-луночные микропланшеты. Раствор, содержащий нагруженную декстраном угольную пыль (1%), добавляют в каждую ячейку (100 мкл/ячейка); после выдерживания в течение 10 минут на льду микропланшеты центрифугируют (1500 g) свыше 10 минут при 4°С. Все стероиды, включая радиоактивный субстрат и заново биосинтезированные эстрогены, захватываются за счет комплексного связывания с углем; только 3H-вода, специфично образующаяся при ароматизации 1β-3H-андростендиона, включающей специфическую окислительную ступень отщепления 1β-3H, остается на этой стадии в супернатанте. Перенесенные на другой гомологический 96-луночный микропланшет супернатанты в количестве 100 мкл приобретают некую жидкость (200 мкл/ячейка), пригодную для сцинтилляционного измерения β-радиоактивности с помощью счетчика для микропланшетов Microbeta Plus 1450 (Wallac, EG & G).
Параллельно, реакцию ароматазы в содержащих клетки микропланшетах останавливают путем деструкции и растворения клеток JEG-3 в 10 мМ растворе этилендиаминтетраацетата при pH 12,3. Затем ДНК определяют стандартным люминисцентным методом, используя флюорохром Hoechst 33258 и Victor2 (Wallac, EG & G) флуориметр для микропланшетов.
Наконец, активность ароматазы выражают в фмолях/мкг ДНК за 2 часа и ингибирование ароматазы в процентах от контрольной инкубации без ингибиторов. Нелинейный анализ степени согласия подобранной кривой с эмпирическими данными, графика зависимости % ингибирования от концентрации,позволяет определить концентрацию 50% ингибирования (IC50): наименьшая IC50 соответствует наиболее эффективным ингибиторам (таблица A).
(нМ)
ИНГИБИРОВАНИЕ АРОМАТАЗЫ IN VIVO
Ароматаза является стероидогенным ферментом, ответственным за биосинтез эстрадиола, основного женского полового гормона из числа эстрогенов. У крыс эстрадиол физиологически синтезируется на высоких циркуляционных уровнях в определенный период в течение 4-дневного эстрального цикла: это так называемый предовуляторный всплеск, имеющий место в день, предшествующий течке, непосредственно перед овуляцией, которая происходит за ночь между проэструсной и эстральной фазами. Чувствительная физиологическая модель для оценки in vivo ингибирования ароматазы разработана на основе ингибирования этого предовуляторного всплеска уровней эстрадиола.
Проводят мониторинг взрослых самок крыс Wistar на регулярную 4-дневную эстральную цикличность с помощью ежедневного вагинального мазка; после 2 или 3 регулярных циклов животным однократно перорально вводят очень низкую дифференцировочную дозу в 10 микрограммов/кг в объеме 4 мл/кг около 04:00 после полудня на диэструс, т.е.на день, предшествующий проэструсу.
Спустя ровно 24 часа берут пробы крови из аорты при анестезии газом. Уровни эстрадиола в плазме измеряют радиоиммунологическим анализом с помощью промышленно выпускаемых наборов (Diagnostic Systems Laboratories, Webster, Texas, USA). Контрольные и испытуемые группы обычно состоят из 7-10 крыс, в зависимости от числа крыс с регулярным циклом, распределяемых на исследуемые группы. Результаты приведены в пг/мл и затем в % ингибирования, где уровни эстрадиола контрольных животных, получающих перорально только растворитель, приняты за 100%, что позволяет провести сравнение между различными независимыми исследованиями, поскольку уровень предовуляторного всплеска может изменяться в каждой контрольной группе при переходе от одного исследования к другому приблизительно в пределах от 25 до 40 пг/мл.
Очевидно, что соединения, описываемые общей формулой (I) по настоящему изобретению, вызывают незначительно большее или заметно большее ингибирование биосинтеза эстрадиола благодаря ингибированию ароматазы in vivo, чемYM 511, взятый в качестве структурного эталона N-триазола (Okada et al., Chem Pharm Bull, 1996, 44: 1871-1879), или анастрозол, стандартная антиароматаза, уже используемая терапевтически. Таким образом, соединения, описываемые общей формулой (I), являются существенным усовершенствованием по сравнению с последними веществами.
Данные in vivo (таблица B) не имеют абсолютной корреляции с данными in vitro (таблица A), но, в целом, оба приведенных биологических результата свидетельствуют о том, что ряд производных 1-N-фениламино-1H-имидазола по настоящему изобретению дает многочисленные наномолярные и субнаномолярные ингибиторы ароматазы, некоторые из которых вызывают эффективное ингибирование in vivo биосинтеза эстрогена. Следовательно, эти соединения полезны в противодействии или управлении патологическими или физиологическими эстроген-зависимыми механизмами, преимущественно у женских особей (женщин и самок животных), но также и у мужских (мужчин или самцов животных).
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ 1-N-ФЕНИЛАМИНО-1Н-ИМИДАЗОЛА И СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 2004 |
|
RU2365586C2 |
| ИНДАЗОЛЫ, БЕНЗИЗОКСАЗОЛЫ И БЕНЗИЗОТИАЗОЛЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И ПРИМЕНЕНИЕ В КАЧЕСТВЕ ЭСТРОГЕННЫХ СРЕДСТВ | 2005 |
|
RU2402536C2 |
| 2-ТИОЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ ИМИДАЗОЛА И ИХ ПРИМЕНЕНИЕ В ФАРМАЦЕВТИКЕ | 2003 |
|
RU2331638C2 |
| ЗАМЕЩЕННЫЕ 2-ФЕНИЛИНДОЛЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФУНГИЦИДНЫЕ КОМПОЗИЦИИ НА ИХ ОСНОВЕ | 2010 |
|
RU2440339C1 |
| НОВОЕ СОЕДИНЕНИЕ БИФЕНИЛА ИЛИ ЕГО СОЛЬ | 2016 |
|
RU2726622C2 |
| ПРОИЗВОДНЫЕ ИМИДАЗОЛА КАК ИНГИБИТОРЫ ПРЕНИЛТРАНСФЕРАЗЫ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБЫ ЛЕЧЕНИЯ НА ИХ ОСНОВЕ | 1999 |
|
RU2241712C9 |
| НОВЫЕ ЗАМЕЩЕННЫЕ ИНДОЛЫ | 2003 |
|
RU2288914C2 |
| ПРОИЗВОДНОЕ КУМАРИНА | 2013 |
|
RU2646756C2 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ТЕРАПЕВТИЧЕСКОГО ЭФФЕКТА ИНГИБИТОРА LSD1 НА ОСНОВЕ ЭКСПРЕССИИ INSM1 | 2018 |
|
RU2789449C2 |
| ПРОИЗВОДНЫЕ 5-АРИЛ-1Н-1,2,4-ТРИАЗОЛА И СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2000 |
|
RU2249588C2 |
Настоящее изобретение относится к производным имидазола формулы (I)
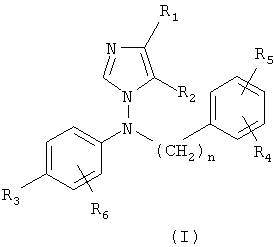
где каждый из R1 и R2 независимо означает водород, (C1-C6)алкил или (С3-С8)циклоалкил; n=0, 1 или 2; каждый из R3, R4, R5 и R6 независимо означает водород или (C1-C6)алкил, галоген, циано, (C1-C6)алкокси, трифторметил, (C1-C6)алкилтио, (C1-C6)алкилсульфонил или (C1-C6)алкоксикарбонил; R3 и R6 вместе с несущим их фенильным циклом могут также образовывать N-метилбензотриазол и к его кислотно-аддитивным солям, сольватам и стереоизомерным формам. Также данное изобретение относится к фармацевтическим композициям, ингибирующим ароматозу, и применению производных имидазола формулы (I) для получения лекарственного средства. Технический результат: описаны новые соединения, обладающие полезными биологическими свойствами. 6 н. и 17 з.п. ф-лы, 2 табл.
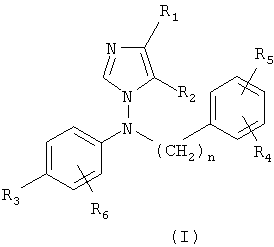
и его кислотно-аддитивные соли, сольваты и стереоизомерные формы, где
каждый из R1 и R2 независимо означает водород, (С1-С6)алкил или (С3-С8)циклоалкил;
n=0, 1 или 2;
каждый из R3, R4, R5 и R6 независимо означает водород или (С1-С6)алкил, галоген, циано, (С1-С6)алкокси, трифторметил, (С1-С6)алкилтио, (С1-С6)алкилсульфонил или (С1-С6)алкоксикарбонил;
R3 и R6 вместе с несущим их фенильным циклом могут также образовывать N-метилбензотриазол.
n равно 0 или 1;
каждый из R1 и R2 независимо означает водород или (С1-С6)алкил;
R3 означает циано или трифторметил;
R4 означает водород, (С1-С6)алкил, галоген, циано, (С1-С6)алкокси, трифторметил, (С1-С6)алкилтио, (С1-С6)алкилсульфонил или (С1-С6)алкоксикарбонил;
R5 означает водород, галоген, (С1-С6)алкокси или трифторметил;
R6 означает водород;
или R3 и R6 вместе с несущим их фенильным циклом образуют N-метилбензотриазол;
и его кислотно-аддитивные соли, сольваты и стереоизомерные формы.
n равно 0 или 1;
каждый из R1, R2 и R6 означает водород;
R4 означает галоген, циано или трифторметил;
и его кислотно-аддитивные соли, сольваты и стереоизомерные формы.
| ЕР 0641785 А, 08.03.1995 | |||
| US 5071861 А, 10.12.1991 | |||
| Экономайзер | 0 |
|
SU94A1 |
| ЕР 0640595 А, 01.03.2001 | |||
| АЦИЛИРОВАННЫЕ АМИНОАЛКИЛИМИДАЗОЛЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1995 |
|
RU2152933C2 |
| Способ получения имидазолпроизводных или их фармацевтически приемлемых солей с кислотами | 1988 |
|
SU1657057A3 |
Авторы
Даты
2008-06-27—Публикация
2003-12-15—Подача