Предшествующий уровень техники
Настоящее изобретение относится к замещенным трициклическим антагонистам тромбинового рецептора, фармацевтическим композициям, содержащим эти антагонисты, и их применению в лечении заболеваний, связанных с тромбозом, атеросклерозом, рестенозом, гипертензией, стенокардией, аритмией, сердечной недостаточностью, церебральной ишемией, инсультом, воспалительными заболеваниями, нейродегенеративными заболеваниями и раком. Изобретения также относится к комбинации новых соединений по изобретению и других сердечно-сосудистых агентов.
Известно, что тромбин обладает различными активностями в разных типах клеток, а тромбиновые рецепторы присутствуют в таких типах клеток, как тромбоциты, клетки гладкой мускулатуры сосудов, эндотелиальные клетки и фибробласты человека. Таким образом, возможно, что антагонисты тромбинового рецептора, также известные как антагонисты рецептора, активируемого протеазой (PAR), могут быть применимы при лечении тромбических, воспалительных, атеросклеротических и фибропролиферативных заболеваний, а также других заболеваний, в которых тромбин и его рецептор играют патологическую роль.
Пептиды антагонистов тромбинового рецептора были идентифицированы в исследованиях зависимости активности от структуры, включающих замены аминокислот в тромбиновых рецепторах. В работе Bernatowicz et al., J. Med. Chem., vol.39, pp.4879-4887 (1996), описаны тетра- и пентапептиды, являющиеся мощными антагонистами тромбинового рецептора, например, N-транс-циннамоил-п-фторPhe-п-гуанидиноPhe-Leu-Arg-NH2 и N-транс-циннамоил-п-фторPhe-п-гуанидиноPhe-Leu-Arg-Arg-NH2. Пептидные антагонисты тромбинового рецептора также описаны в WO 94/03479, опубликованной 17 февраля 1994.
Замещенные трициклические антагонисты тромбинового рецептора описаны в патентах США 6063847, US 6326380 и патентных заявках США 09/880222 (WO 01/96330) и 10/271715.
Краткое содержание изобретения
Настоящее изобретение относится к антагонистам тромбинового рецептора, описываемым Формулой I
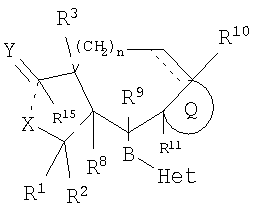
или их фармацевтически приемлемым солям или сольватам,
где
одинарная пунктирная линия означает необязательную простую связь;
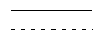 означает необязательную двойную связь;
означает необязательную двойную связь;
n означает 0-2;
Q означает
R1 независимо выбирают из группы, включающей Н, алкил с 1-6 атомами углерода, фтор(алкил с 1-6 атомами углерода)-, дифтор(алкил с 1-6 атомами углерода)-, трифтор(алкил с 1-6 атомами углерода)-, циклоалкил с 3-6 атомами углерода, алкенил с 2-6 атомами углерода, гидрокси-(алкил с 1-6 атомами углерода)- и амино(алкил с 1-6 атомами углерода)-;
R2 независимо выбирают из группы, включающей Н, алкил с 1-6 атомами углерода, фтор(алкил с 1-6 атомами углерода)-, дифтор(алкил с 1-6 атомами углерода)-, трифтор(алкил с 1-6 атомами углерода)-, циклоалкил с 3-6 атомами углерода, алкенил с 2-6 атомами углерода, гидрокси-(алкил с 1-6 атомами углерода)- и амино(алкил с 1-6 атомами углерода)-;
R3 представляет собой Н, гидроксигруппу, алкоксигруппу с 1-6 атомами углерода, -SOR16, -SO2R17, -C(O)OR17, -C(O)NR18R19, -(алкил с 1-6 атомами углерода)-C(O)NR18R19, алкил с 1-6 атомами углерода, галоген, фтор(алкил с 1-6 атомами углерода)-, дифтор(алкил с 1-6 атомами углерода)-, трифтор(алкил с 1-6 атомами углерода)-, циклоалкил с 3-6 атомами углерода, (циклоалкил с 3-6 атомами углерода)-(алкил с 1-6 атомами углерода)-, алкенил с 2-6 атомами углерода, арил(алкил с 1-6 атомами углерода)-, арил(алкенил с 2-6 атомами углерода)-, гетероарил(алкил с 1-6 атомами углерода)-, гетероарил(алкенил с 2-6 атомами углерода)-, гидрокси(алкил с 1-6 атомами углерода)-, -NR22R23, NR22R23-(алкил с 1-6 атомами углерода)-, арил, тио(алкил с 1-6 атомами углерода)-, (алкил с 1-6 атомами углерода)-тио(алкил с 1-6 атомами углерода)-, (алкокси с 1-6 атомами углерода)-(алкил с 1-6 атомами углерода), NR18R19-С(O)-(алкил с 1-6 атомами углерода)- или (циклоалкил с 3-6 атомами углерода)-(алкил с 1-6 атомами углерода)-;
Het означает моно- или бициклическую гетероарильную группу из 5-10 атомов, содержащую от 1 до 9 атомов углерода и от 1 до 4 гетероатомов, независимо выбираемых из следующих: N, О и S, причем кольцевой атом азота может образовывать N-оксид или четвертичную группу с алкильной группой из 1-4 атомов углерода, где Het соединяется с В через кольцевой атом углерода, и группа Het имеет заместитель W;
W представляет собой от 1 до 4 заместителей, независимо выбираемых из группы, включающей Н, алкил с 1-6 атомами углерода, фтор(алкил с 1-6 атомами углерода)-, дифтор(алкил с 1-6 атомами углерода)-, трифтор(алкил с 1-6 атомами углерода)-, циклоалкил с 3-6 атомами углерода, гидрокси-(алкил с 1-6 атомами углерода)-, ди-гидрокси(алкил с 1-6 атомами углерода)-, NR25R26(алкил с 1-6 атомами углерода)-, тио(алкил с 1-6 атомами углерода)-, -ОН, алкоксигруппу с 1-6 атомами углерода, галоген, -NR4R5, -C(O)OR17, -C(O)R16, (алкил с 1-6 атомами углерода)тио-, R21-арил, R21-арил(алкил с 1-6 атомами углерода)-, арил, в котором прилегающие атомы углерода образуют кольцо, включающее метилендиоксигруппу, и R21-гетероарил;
R4 и R5 независимо выбирают из группы, включающей Н, алкил с 1-6 атомами углерода, фенил, бензил и циклоалкил с 3-6 атомами углерода, или R4 и R5 вместе представляют собой -(CH2)4-, -(CH2)5- или -(CH2)2NR7-(CH2)2- и образуют кольцо с атомом азота, к которому они присоединены;
R6 представляет собой Н, алкил с 1-6 атомами углерода или фенил;
R7 представляет собой Н, алкил с 1-6 атомами углерода, -C(O)-R16, -C(O)OR17 или -SO2R17;
R8, R10 и R11 независимо выбирают из группы, включающей R1 и -OR1, при условии, что если присутствует необязательная двойная связь, R10 отсутствует;
R9 представляет собой Н, ОН или алкоксигруппу с 1-6 атомами углерода;
В представляет собой -(СН2)n3-, цис или транс -(CH2)n4CR12=CR12a(CH2)n5 или -(СН2)n4С≡С(СН2)n5, где n3 означает 0-5, n4 и n5 независимо означают 0-2, а R12 и R12a независимо выбирают из группы, включающей Н, алкил с 1-6 атомами углерода и галоген;
Х представляет собой -О- или -NR6, если пунктирная линия означает простую связь, или Х представляет собой -ОН или -NHR20, если связь отсутствует;
Y представляет собой =O, =S, (Н, Н), (Н, ОН) или (Н, (алкоксигруппа с 1-6 атомами углерода)), если пунктирная линия означает простую связь, или, при отсутствии связи, Y представляет собой =O, (Н, Н), (Н, ОН), (Н, SH) или (Н, (алкоксигруппа с 1-6 атомами углерода));
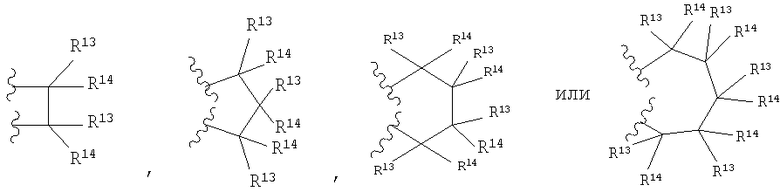
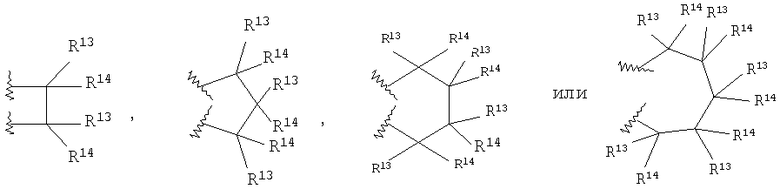
каждый R13 независимо выбирают из группы, включающей Н, алкил с 1-6 атомами углерода, циклоалкил с 3-8 атомами углерода, -(CH2)n6NHC(O)OR16b, -(CH2)n6NHC(O)R16b, -(CH2)n6NHC(O)NR4R5, -(CH2)n6NHSO2R16, -(CH2)n6NHSO2NR4R5 и -(CH2)n6C(O)NR28R29, где n6 означает 0-4, галоалкил и галоген;
каждый R14 независимо выбирают из группы, включающей Н, алкил с 1-6 атомами углерода, -ОН, алкоксигруппу с 1-6 атомами углерода, R27-арил(алкил с 1-6 атомами углерода), гетероарил, гетероарилалкил, гетероциклил, гетероциклилалкил, -(CH2)n6NHC(O)OR16b, -(CH2)n6NHC(O)R16b, -(CH2)n6NHC(O)NR4R5, -(CH2)n6NHSO2R16, -(CH2)n6NHSO2NR4R5, и -(CH2)n6C(O)NR28R29, где n6 означает 0-4, галоген и галоалкил, или
R13 и R14 вместе образуют спироциклическое или гетероспироциклическое кольцо из 3-6 атомов,
где, по крайней мере, один из R13 и R14 выбирают из группы, включающей -(CH2)n6NHC(O)OR16b, -(CH2)n6NHC(O)R16b, -(CH2)n6NHC(O)NR4R5, -(CH2)n6NHSO2R16, -(CH2)n6NHSO2NR4R5, и -(CH2)n6C(O)NR28R29, где n6 означает 0-4;
R15 отсутствует, если пунктирная линия означает простую связь, и представляет собой Н, алкил с 1-6 атомами углерода, -NR18R19 или -OR17, если связь отсутствует;
R16 независимо выбирают из группы, включающей алкил с 1-6 атомами углерода, фенил или бензил;
R16b представляет собой Н, алкоксигруппу, алкил с 1-6 атомами углерода, (алкокси с 1-6 атомами углерода)-(алкил с 1-6 атомами углерода)-, R22-О-С(O)-(алкил с 1-6 атомами углерода)-, циклоалкил с 3-6 атомами углерода, R21-арил, R21-арил(алкил с 1-6 атомами углерода), галоалкил, алкенил, галозамещенный алкенил, алкинил, галозамещенный алкинил, R21-гетероарил, R21-(алкал с 1-6 атомами углерода)гетероарил, R21-(алкил с 1-6 атомами углерода)гетероциклоалкил, R28R29N-(алкил с 1-6 атомами углерода), R28R29N-(СО)-(алкил с 1-6 атомами углерода), R28R29N-(СО)О-(алкил с 1-6 атомами углерода), R28O(СО)N(R29)-(алкил с 1-6 атомами углерода), R28S(O)2N(R29)-(алкил с 1-6 атомами углерода), R28R29N-(СО)-N(R29)-(алкил с 1-6 атомами углерода), R28R29N-S(O)2N(R29)-(алкил с 1-6 атомами углерода), R28-(CO)N(R29)-(алкил с 1-6 атомами углерода), R28R29N-S(O)2-(алкил с 1-6 атомами углерода), HOS(O)2-(алкил с 1-6 атомами углерода), (ОН)2Р(O)2-(алкил с 1-6 атомами углерода), R28-S-(алкил с 1-6 атомами углерода), R28-S(O)2-(алкил с 1-6 атомами углерода) или гидрокси(алкил с 1-6 атомами углерода);
R17, R18 и R19 независимо выбирают из группы, включающей Н, алкил с 1-6 атомами углерода, фенил и бензил;
R20 представляет собой Н, алкил с 1-6 атомами углерода, фенил, бензил, -С(O)R6 или-SO2R6;
R21 представляет собой от 1 до 3 заместителей, независимо выбираемых из группы, включающей H, -CN, -CF3, -OCF3, галоген, -NO2, алкил с 1-6 атомами углерода, -ОН, алкоксигруппу с 1-6 атомами углерода, алкиламиногруппу с 1-6 атомами углерода, ди(алкил с 1-6 атомами углерода)аминогруппу, NR25R26(алкил с 1-6 атомами углерода)-, гидрокси(алкил с 1-6 атомами углерода)-, -C(O)OR17, -COR17, -NHCOR16, -NHSO2R16, -NHSO2СН2CF3, -C(O)NR25R26, -NR25-C(O)-NR25R26, -S(O)R13, -S(O)2R13 и -SR13;
R22 представляет собой Н или алкил с 1-6 атомами углерода;
R23 представляет собой Н, алкил с 1-6 атомами углерода, -C(O)R24, -SO2R24, -CONHR24 или -SO2NHR24;
R24 представляет собой алкил с 1-6 атомами углерода, гидрокси(алкил с 1-6 атомами углерода) или NR25R26-(алкил с 1-6 атомами углерода)-;
R25 и R26 независимо выбирают из группы, включающей Н и алкил с 1-6 атомами углерода;
R27 представляет собой 1, 2 или 3 заместителя, выбираемых из группы, включающей Н, алкил с 1-6 атомами углерода, циклоалкил с 3-6 атомами углерода, алкоксигруппу с 1-6 атомами углерода, галоген и -ОН, и
R28 и R29 независимо выбирают из группы, включающей Н, алкил с 1-6 атомами углерода, алкоксигруппу с 1-6 атомами углерода, R27-арил(алкил с 1-6 атомами углерода), гетероарил, гетероарилалкил, гидрокси(алкил с 1-6 атомами углерода), (алкокси с 1-6 атомами углерода)-(алкил с 1-6 атомами углерода), гетероциклил, гетероциклилалкил и галоалкил, или
R28 и R29 вместе образуют спироциклическое или гетероспироциклическое кольцо из 3-6 атомов.
Соединения-антагонисты тромбинового рецептора по настоящему изобретению могут обладать активностью против тромбоза, агрегации тромбоцитов, атеросклероза, рестеноза и/или коагуляции. К заболеваниям, связанным с тромбозом, которые можно лечить при помощи соединений настоящего изобретения, относятся тромбоз, атеросклероз, рестеноз, гипертензия, стенокардия, аритмия, сердечная недостаточность, инфаркт миокарда, гломерулонефрит, тромбический или тромбоэмболический инсульт, заболевания периферических сосудов, другие сердечно-сосудистые заболевания, церебральная ишемия, воспалительные заболевания и рак, а также другие заболевания, в которых тромбин и его рецептор играют патологическую роль.
Определенные варианты осуществления настоящего изобретения также относятся к способу применения, по крайней мере, одного соединения Формулы I в комбинации с одним или более дополнительными сердечно-сосудистыми агентами для лечения тромбоза, агрегации тромбоцитов, коагуляции, рака, воспалительных или респираторных заболеваний, включающему введение комбинации, по крайней мере, одного соединения Формулы I и, по крайней мере, одного дополнительного сердечно-сосудистого агента млекопитающему, нуждающемуся в лечении. В частности, настоящее изобретение относится к способу применения указанной комбинации в лечении тромбоза, атеросклероза, рестеноза, гипертензии, стенокардии, аритмии, сердечной недостаточности, инфаркта миокарда, гломерулонефрита, тромбического инсульта, тромбоэмболического инсульта, заболеваний периферических сосудов, церебральной ишемии, рака, ревматоидного артрита, системной красной волчанки, рассеянного склероза, диабета, остеопороза, почечной ишемии, мозгового инсульта, нефрита, воспалительных заболеваний легких и желудочно-кишечного тракта, обратимого обструктивного заболевания дыхательных путей, хронической астмы или бронхита. Предполагается, что комбинация согласно настоящему изобретению может быть применима при лечении более, чем одного из приведенных заболеваний.
Некоторые способы осуществления настоящего изобретения относятся к фармацевтической композиции, содержащей терапевтически эффективное количество комбинации, по крайней мере, одного соединения формулы I и, по крайней мере, одного дополнительного сердечно-сосудистого агента в фармацевтически приемлемом носителе.
Некоторые способы осуществления настоящего изобретения относятся к применению антагонистов тромбинового рецептора, описанных в любом из патентов США 6063847, 6326380 и патентных заявок США 09/880222 и 10/271715, включенных в настоящую заявку посредством ссылки, в комбинации с одним или более дополнительными сердечно-сосудистыми агентами при лечении тромбоза, агрегации тромбоцитов, коагуляции, рака, воспалительных или респираторных заболеваний. В частности, настоящее изобретение относится к способу применения указанной комбинации при лечении тромбоза, атеросклероза, рестеноза, гипертензии, стенокардии, аритмии, сердечной недостаточности, инфаркта миокарда, гломерулонефрита, тромбического инсульта, тромбоэмболического инсульта, заболеваний периферических сосудов, церебральной ишемии, рака, ревматоидного артрита, системной красной волчанки, рассеянного склероза, диабета, остеопороза, почечной ишемии, мозгового инсульта, нефрита, воспалительных заболеваний легких и желудочно-кишечного тракта, обратимого обструктивного заболевания дыхательных путей, хронической астмы или бронхита.
Далее предполагается, что комбинация согласно изобретению может быть представлена в виде набора, включающего в одной упаковке, по меньшей мере, одно соединение формулы I в фармацевтической композиции и, по меньшей мере, одну отдельную фармацевтическую композицию, содержащую сердечно-сосудистый агент.
Подробное описание
Для соединений Формулы I предпочтительными являются следующие значения переменных.
Переменная n преимущественно означает 0-2, более предпочтительно 0. Необязательная двойная связь предпочтительно отсутствует (т.е. связь является простой).
Q предпочтительно представляет собой

причем предпочтительным является шестичленное кольцо Q. R13 предпочтительно представляет собой Н или -СН3. R14 предпочтительно представляет собой Н или -СН3. В случае пятичленного кольца Q предпочтительно, чтобы не более двух заместителей R13 и R14 были отличны от водорода. В случае шестичленного кольца Q предпочтительно, чтобы не более четырех заместителей R13 и R14 были отличны от водорода, более предпочтительно, чтобы не более двух заместителей R13 и R14 были отличны от водорода.
Наиболее предпочтительно кольца Q представляют собой
 ,
,
предпочтительно изображаемые как
соответственно.
В предпочтительных вышеуказанных кольцах Q R предпочтительно представляет собой -(CH2)n6NHC(O)OR16b, -(CH2)n6NHC(O)R16b, -(CH2)n6NHC(O)NR4R5, -(CH2)n6NHSO2R16 или -(CH2)n6NHSO2NR4R5, где n6 означает 0-2, a R16b, R16 и R4 представляют собой алкил с 1-6 атомами углерода и R5 представляет собой Н. Более предпочтительными являются соединения Формулы I, в которых R представляет собой -NHC(O)OR16b, -NHC(O)R16b, -NHC(O)NR4R5, -NHSO2R16 или -NHSO2NR4R5, где R16b, R16 и R4 представляют собой алкил с 1-6 атомами углерода и R5 представляет собой Н. Еще более предпочтительными являются соединения Формулы I, в которых R представляет собой -NHC(O)OR16b, -NHC(O)R16b или -NHC(O)NR4R5, где R16b и R4 представляют собой алкил с 1-6 атомами углерода и R5 представляет собой Н.
R1 и R2 предпочтительно независимо выбирают из группы, включающей Н и алкил с 1-6 атомами углерода, более предпочтительно R1 представляет собой алкил с 1-6 атомами углерода и R2 представляет собой Н, наиболее предпочтительны соединения, в которых R1 представляет собой -СН3 и R2 представляет собой Н.
R3 предпочтительно представляет собой Н, -ОН, алкил с 1-6 атомами углерода, алкоксигруппу с 1-6 атомами углерода, галоген, циклоалкил с 3-6 атомами углерода, -C(O)OR17 или -NR22R23, более предпочтительно R3 представляет собой Н или алкил с 1-6 атомами углерода.
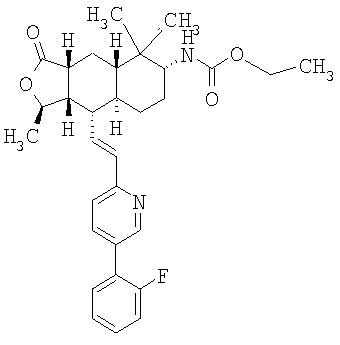
Het предпочтительно означает пиридил, связанный с В через кольцевой атом углерода, и предпочтительно имеет 1 или 2 заместителя, выбираемых из W, более предпочтительно 1 заместитель. W предпочтительно представляет собой R21-арил или R21-гетероарил. Арил предпочтительно представляет собой фенил. Гетероарил предпочтительно представляет собой пиридил. R21 предпочтительно представляет собой Н, галоген или -CN или -CF3, особенно F, -CN или -CF3.
Каждый из R8, R10 и R11 независимо представляет собой Н или алкил с 1-6 атомами углерода, более предпочтительно - Н или -СН3, наиболее предпочтительными являются соединения Формулы I, в которых каждый из R8, R10 и R11 представляет собой Н.
R9 предпочтительно представляет собой Н, ОН или алкоксигруппу с 1-6 атомами углерода, более предпочтительно Н.
В предпочтительно представляет собой цис- или транс- -(CH2)n4CR12=CR12a(CH2)n5-, где n4, n5, R12 и R12a соответствуют вышеприведенным определениям, более предпочтительно каждый из R12 и R12a представляет собой Н, а каждый из n4 и n5 - ноль.
Особенно предпочтительными являются соединения, в которых В представляет собой транс-алкенил, особенно -СН=СН-.
К одной из предпочтительных групп соединений относятся те, в которых присутствует необязательная простая связь, Х представляет собой -O-, Y-, =O, a R15 отсутствует. К другой группе предпочтительных соединений относятся те, в которых необязательная простая связь отсутствует, Х представляет собой -ОН, Y-(Н, ОН), а R15 представляет собой Н. Наиболее предпочтительными являются соединения, в которых присутствует необязательная простая связь, Х представляет собой -O-, Y представляет собой =O, а R15 отсутствует.
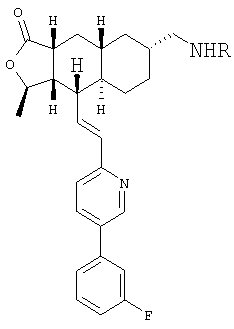
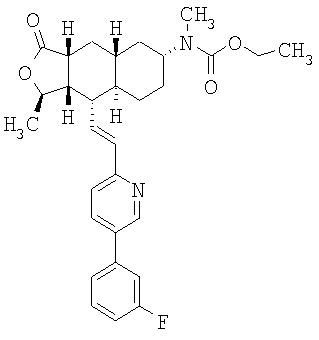
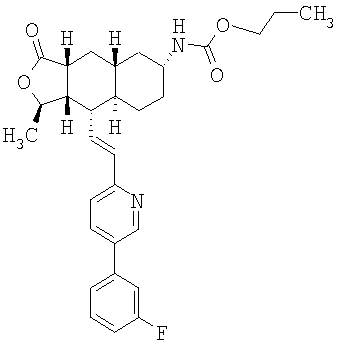
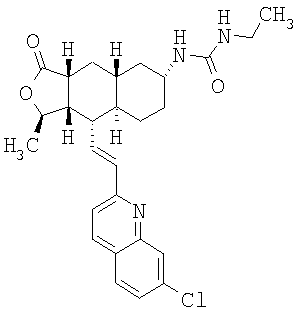
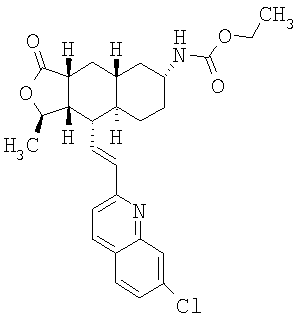
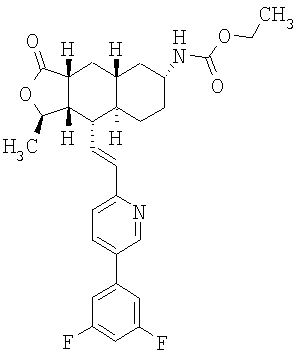
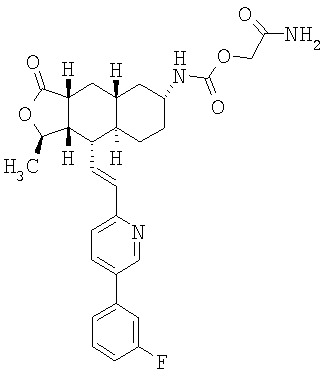
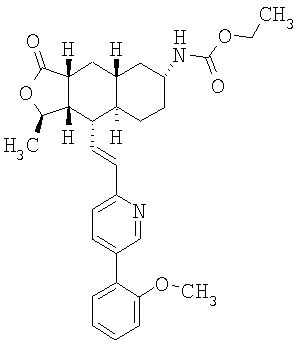
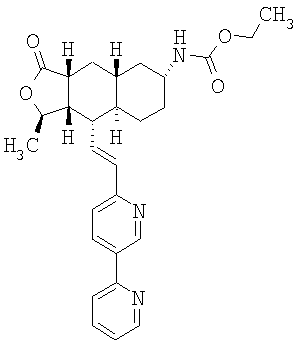
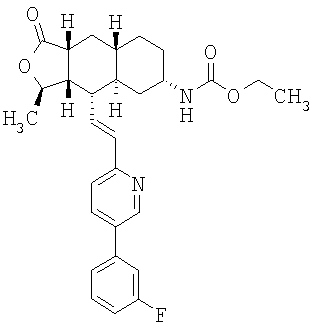
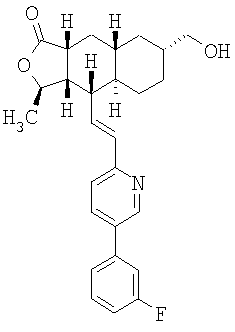
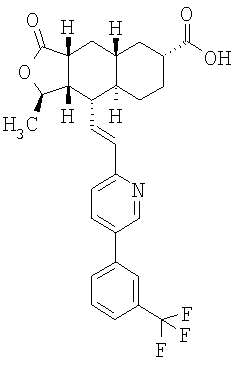
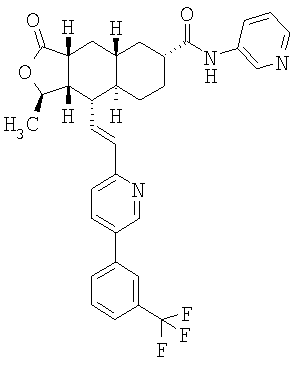
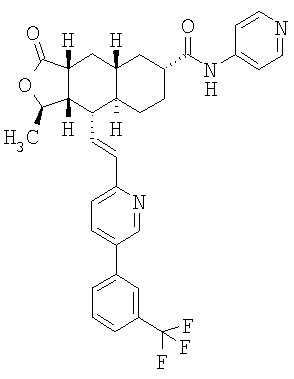
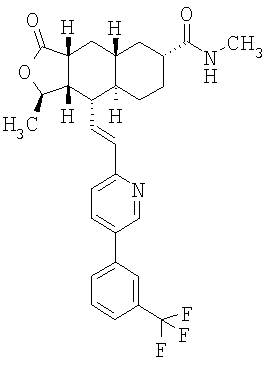
Особенно предпочтительными являются соединения Формулы I, в которых R представляет собой -НС(O)OR16b, где R16b представляет собой алкил с 1-6 атомами углерода. Предпочтительно R16b представляет собой метил или этил. Также предпочтительными являются соединения, в которых группа R присоединена к кольцу Q в положении С-7, как показано ниже в Формуле IA.
Предпочтительным осуществлением настоящего изобретения является соединение Формулы IA
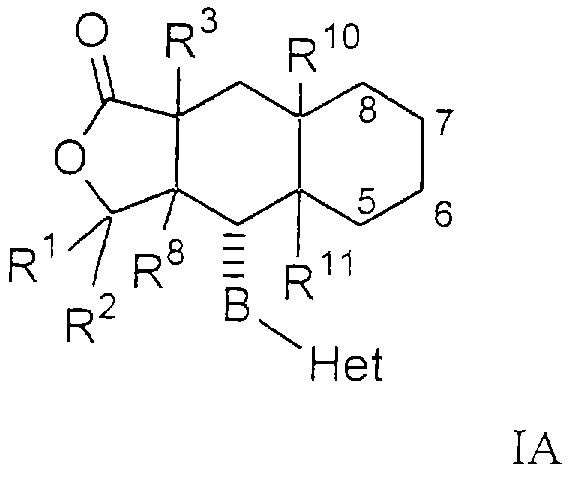
где R1, R2, R3, R8, R10, R11, В и Het соответствуют приведенным выше предпочтительным определениям. По крайней мере, один из кольцевых атомов углерода 5-8 предпочтительно замещен -(CH2)n6NHC(O)OR16b, -(CH2)n6NHCOR16b, -(CH2)n6NHCONR4R5, -(CH2)n6NHSO2R16 или -(CH2)n6NHSO2NR4R5, где n6 означает 0-2, а R16b, R16 и R4 представляют собой алкил с 1-6 атомами углерода и R5 представляет собой Н.
Более предпочтительным осуществлением настоящего изобретения является соединение Формулы IB
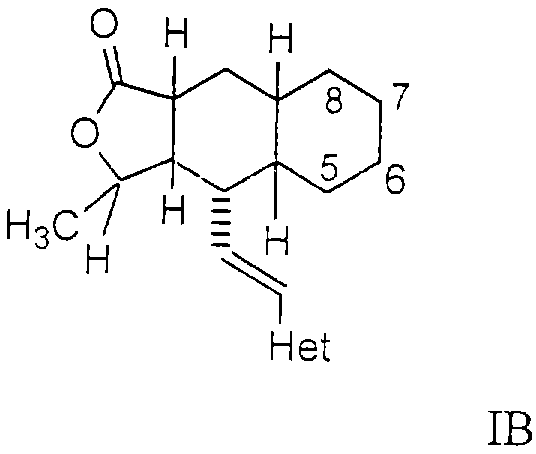
где Het представляет собой пиридил, замещенный R21-арильной группой, предпочтительно R21-фенильной группой, где R21 предпочтительно представляет собой F или -CF3.
Особенно предпочтительными являются соединения Формул IA или IB, в которых, по крайней мере, один из кольцевых атомов углерода 5-8 замещен на -NHC(O)OR16b, где R16b представляет собой алкил с 1-6 атомами углерода, предпочтительно R16b представляет собой метил или этил.
Выше и далее по настоящему описанию следующие термины, если не указано иначе, имеют следующие значения.
Под термином “субъект” понимают как млекопитающих, так и не млекопитающих животных.
Под термином “млекопитающее” понимают человека и других млекопитающих животных.
Термин “необязательно замещенный” означает возможное замещение указанными группами, радикалами или фрагментами. Следует отметить, что предполагается, что любой атом со свободными валентностями в тексте, схемах, примерах и таблицах настоящего документа имеет атом(ы) водорода для заполнения валентностей.
Следующие определения применимы в независимости от того, используется ли термин сам по себе или в комбинации с другими терминами, если не указано иначе. Так, определение алкила применимо как к термину “алкил”, так и к фрагменту “алкил” в терминах “гидроксиалкил”, “галоалкил”, “алкокси” и т.п.
В настоящем документе термин “алкил” означает алифатическую углеводородную группу, разветвленную или неразветвленную, содержащую от 1 до приблизительно 20 атомов углерода в цепи. Предпочтительные алкильные группы содержат от 1 до приблизительно 12 атомов углерода в цепи. Более предпочтительные алкильные группы содержат от 1 до приблизительно 6 атомов углерода в цепи. Термин “разветвленная” означает, что одна или более низших алкильных групп типа метила, этила или пропила присоединены к линейной алкильной цепи. Алкил может иметь один или более заместителей, независимо выбираемых из группы, включающей гало, арил, циклоалкил, циано, гидрокси, алкокси, алкилтио, амино, -NH(алкил), -NH(циклоалкил), -N(алкил)2 (эти алкилы могут быть одинаковыми или различными), карбокси и -С(O)O-алкил. К примерам подходящих алкильных групп относятся, без ограничения, метил, этил, н-пропил, изопропил, н-бутил, т-бутил, н-пентил, гептил, нонил, децил, фторметил, трифторметил и циклопропилметил.
Термин “алкенил” означает алифатическую углеводородную группу (неразветвленную или разветвленную улеродную цепь), которая содержит одну или более двойных связей в цепи и может быть конъюгированной или неконъюгированной. Подходящие алкенильные группы могут содержать от 2 до приблизительно 15 атомов углерода в цепи, предпочтительно от 2 до приблизительно 12 атомов углерода, наиболее предпочтительно от 2 до приблизительно 6 атомов углерода в цепи. Алкенильная группа может иметь один или более заместителей, независимо выбираемых из группы, включающей гало, алкил, арил, циклоалкил, циано и алкокси. К примерам подходящих алкенильных групп относятся, без ограничения, этенил, пропенил, н-бутенил, 3-метилбутенил и н-пентенил.
Если алкильная или алкенильная цепь соединена с двумя другими фрагментами и, таким образом, является бивалентной, то применяются термины алкилен и алкенилен соответственно.
Термин “алкокси” означает группу алкил-O-, в которой алкильная группа соответствует вышеприведенному определению. Применимые алкоксигруппы содержат от 1 до около 12 атомов углерода, предпочтительно от 1 до около 6 атомов углерода. К примерам подходящих алкоксигрупп относятся, без ограничения, метокси-, этокси- и изопропоксигруппы. Алкильная часть алкоксигруппы соединена с соседним фрагментом через эфирный атом кислорода.
Термин “алкинил” означает алифатическую углеводородную группу, которая содержит, по крайней мере, одну тройную связь углерод-углерод и может быть разветвленной и неразветвленной и содержать приблизительно от 2 до 15 атомов углерода в цепи. Предпочтительные алкинильные группы содержат от около 2 до около 12 атомов углерода в цепи, более предпочтительные от около 2 до около 4 атомов углерода в цепи. Термин “разветвленная” означает, что одна или более низших алкильных групп типа метила, этила или пропила присоединены к линейной алкинильной цепи. К примерам подходящих алкинильных групп относятся, без ограничения, этинил, пропинил, 2-бутинил, 3-метилбутинил, н-пентинил и децинил. Алкинильная группа может иметь один или более заместителей, одинаковых или различных, каждый из которых независимо выбирают из группы, включающей алкил, арил и циклоалкил.
Термин “арил” означает ароматическую моно- или мультициклическую кольцевую систему, содержащую от около 5 до около 14 атомов углерода, предпочтительно от около 6 до около 10 атомов углерода. Арильная группа может иметь один или более одинаковых или различных заместителей, определенных выше. К примерам подходящих арильных групп относятся, без ограничения, фенил, нафтил, инденил, тетрагидронафтил и инданил. Термин “арилен” означает бивалентную фенильную группу, включая замещения по орто-, мета- и пара-положениям.
Термин “Вос” означает N-трет-бутоксикарбонил.
Термин “циклоалкил” означает неароматическую моно- или мультициклическую кольцевую систему, содержащую от около 3 до около 10 атомов углерода, предпочтительно от около 5 до около 10 атомов углерода. Предпочтительные циклоалкильные кольца содержат от около 5 до около 7 атомов углерода. Циклоалкильная группа может иметь один или более одинаковых или различных заместителей, определенных выше. К примерам подходящих моноциклических циклоалкилов относятся, без ограничения, циклопропил, циклобутил, циклопентил, цилогексил и подобные. К примерам подходящих мультициклических циклоалкилов относятся, без ограничения, 1-декалинил, норборнил, адамантил и подобные. Термин “циклоалкилен” означает соответствующее бивалентное кольцо, в котором точки соединения с другими группами включают все позиционные изомеры.
Термин “дигидроксиалкил с 1-6 атомами углерода” относится к алкильной цепи, замещенной двумя гидроксигруппами по двум различным атомам углерода.
Термины “фторалкил”, “дифторалкил” и “трифторалкил” означают алкильные цепи, в которых концевой атом углерода замещен 1, 2 или 3 атомами фтора соответственно, например, -CF3, -СН2CF3, -СН2CHF2 или -СН2CH2F.
Термины “галоген” или “гало” относятся к радикалам фтора, хлора, брома или йода. Предпочтительными являются радикалы фтора, хлора и брома, наиболее предпочтительными фтора и хлора.
Термин “гетероарил” означает гетероарильную группу с одним, двумя кольцами или слитую с бензольным кольцом, содержащую от 5 до 14 кольцевых атомов, предпочтительно от около 5 до 10 кольцевых атомов, включающих от 1 до 13 атомов углерода и от 1 до 4 гетероатомов, независимо выбираемых из группы, включающей N, О и S, при условии, что кольца не содержат атомов кислорода и/или серы в соседних положениях. Сюда также относятся N-оксиды кольцевых атомов азота, а также соединения, в которых кольцевой атом азота замещен алкильной группой с 1-4 атомами углерода с образованием четвертичного амина. К примерам гетероарильных групп с одним кольцом относятся пиридил, оксазолил, изоксазолил, оксадиазолил, фуранил, пирролил, тиенил, имидазолил, пиразолил, тетразолил, тиазолил, изотиазолил, тиадиазолил, пиразинил, пиримидил, пиридазинил и триазолил. К примерам бициклических гетероарильных групп относятся нафтиридил (например, 1, 5 или 1, 7), имидазопиридил, пиридо[2,3]имидазолил, пиридопиримидинил и 7-азаиндолил. К примерам гетероарильных групп, слитых с бензольным кольцом, относятся индолил, хинолил, изохинолил, фталазинил, бензотиенил (т.е. тионафтенил), бензимидазолил, бензофуранил, бензоксазолил и бензофуразанил. Сюда относятся также и все позиционные изомеры, например 2-пиридил, 3-пиридил и 4-пиридил.
Под термином “Het” понимают моно-, бициклические и слитые с бензольным кольцом гетероарильные группы, определенные выше. Het-группы соединены с группой В через кольцевой атом углерода, например Het означает 2-пиридил, 3-пиридил или 2-хинолил. Группа Het может иметь заместитель W по любому доступному кольцевому атому углерода; на кольце Het могут быть от 1 до 4 заместителей W.
Термин “гетероциклоалкил” означает 4-6-членное насыщенное кольцо, содержащее от 3 до 5 атомов углерода и 1 или 2 гетероатома из следующих: N, S и О, при условии, что гетероатомы не находятся в соседних положениях. Примерами гетероциклоалкильных колец являются пирролидинил, пиперидинил, пиперазинил, морфолинил, тиоморфолинил, тиазолидинил, 1,3-диоксоланил, 1,4-диоксанил, тетрагидрофуранил, тетрагидротиофенил и тетрагидротиопиранил.
Термин “гетероспироцикл” относится к спироциклической структуре, содержащей от 3 до 5 атомов углерода и 1 или 2 гетероатома из следующих: N, S и О, при условии, что гетероатомы не находятся в соседних положениях.
Термин “необязательная простая связь” относится к связи, обозначенной пунктирной линией между Х и атомом углерода, с которым соединены Y и R15, в структуре Формулы I. Необязательная двойная связь, обозначенная  , означает, что присутствует, по крайней мере, простая связь, но может присутствовать и двойная; в случае, когда есть двойная связь, R10 отсутствует.
, означает, что присутствует, по крайней мере, простая связь, но может присутствовать и двойная; в случае, когда есть двойная связь, R10 отсутствует.
В случае, когда R4 и R5 образуют кольцо с атомом азота, с которым они соединены, образуются следующие кольца: 1-пирролидинил, 1-пиперидинил и 1-пиперазинил, причем пиперазинил может быть замещен группой R7 по атому азота в 4 положении.
Положения о том, что, например, R4 и R5 независимо выбирают из группы заместителей, означают, что R4 и R5 выбирают независимо, если они соединены с одним атомом азота, но также и если переменные R4 и R5 встречаются в молекуле более одного раза, то эти заместители выбирают независимо. Аналогичен выбор каждого заместителя R13 и R14 независим от других R13 и R14 в том же кольце Q. Специалисту в данной области техники будет понятно, что размер и природа заместителя(ей) влияет на число возможных заместителей.
Соединения согласно настоящему изобретению содержат, по меньшей мере, один асимметрический атом углерода, и, таким образом, все изомеры, включая энантиомеры, стереоизомеры, ротамеры, таутомеры и рацематы соединений Формулы I (если они существуют) рассматриваются как часть настоящего изобретения. Изобретение охватывает d- и l-изомеры как в чистом виде, так и в виде смеси, включая рацемические смеси. Изомеры можно получить традиционными способами, либо вводя в реакцию оптически чистые или оптически обогащенные исходные вещества, либо разделяя изомеры соединения Формулы I. К изомерам относятся также геометрические изомеры, например, в случае наличия двойной связи. Полиморфные формы соединений Формулы I, кристаллических или аморфных, также рассматриваются как часть настоящего изобретения.
Специалисту в данной области техники будет понятно, что для некоторых соединений Формулы I один изомер обладает большей фармакологической активностью, чем другие.
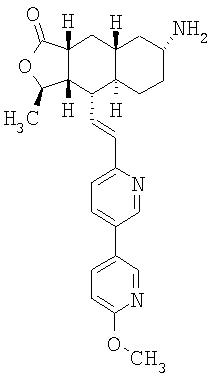
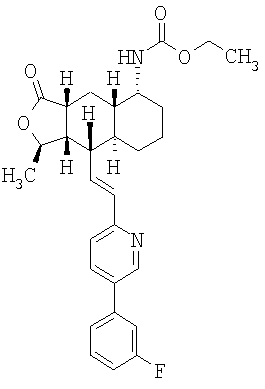
Типичные предпочтительные соединения настоящего изобретения имеют следующую стереохимию:
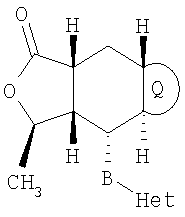
причем наиболее предпочтительны соединения именно с такой стереохимией.
Специалисту в данной области техники будет понятно, что для некоторых соединений Формулы I один изомер обладает большей фармакологической активностью, чем другие.
Соединения настоящего изобретения с основной группой могут образовывать фармацевтически приемлемые соли с органическими и неорганическими кислотами. Примерами подходящих кислот для образования солей являются соляная, серная, фосфорная, уксусная, лимонная, щавелевая, малоновая, салициловая, яблочная, фумаровая, янтарная, аскорбиновая, малеиновая, метансульфоновая и другие минеральные и карбоновые кислоты, известные специалисту в данной области техники. Предпочтительными являются бисульфаты. Соли получают реакцией свободной основной формы с достаточным количеством требуемой кислоты. Свободную основную форму можно восстановить обработкой соли подходящим количеством разбавленного водного раствора основания, например, разбавленного водного раствора бикарбоната натрия. Свободная основная форма отличается от соответствующей соли по определенным физическим свойствам, таким как растворимость в полярных растворителях, но в других отношениях, для целей настоящего изобретения соль эквивалентна соответствующим свободным основным формам. Соединения настоящего изобретения могут также образовывать фармацевтически приемлемые сольваты, включая гидраты.
Определенные соединения настоящего изобретения являются кислотными (например, соединения, содержащие карбоксильную группу). Эти соединения образуют фармацевтически приемлемые соли с неорганическими и органическими основаниями. Примерами таких солей являются соли натрия, калия, кальция, алюминия, лития, золота и серебра. Также сюда относятся соли, образуемые с фармацевтически приемлемыми аминами, например аммиаком, алкиламинами, гидроксиалкиламинами, N-метилглюкамином и подобными.
Термин “сольват” означает физическую ассоциацию соединения настоящего изобретения с одной или более молекулами растворителя. Эта физическая ассоциация включает различные степени ионных и ковалентных связей, включая водородные связи. При определенных условиях возможно выделение сольвата, например если одна или более молекул растворителя включены в кристаллическую решетку кристаллического твердого вещества. Термин “сольват” охватывает как сольваты в виде раствора, так и те, которые можно выделить. Примерами подходящих сольватов являются, без ограничения, этанолаты, метанолаты и подобные. “Гидратом” называется сольват, в котором молекула растворителя представляет собой Н2О.
Соединения настоящего изобретения, в которых n6 означает 0, можно получить способами, известными в данной области техники, например согласно процессам, описанным в патенте США 6063847, включенном в настоящий документ посредством ссылки, или согласно процессам, приведенным в примерах ниже.
Соединения настоящего изобретения, в которых n6 означает 1 или 2, в общем, получают согласно процессам следующей общей схемы:
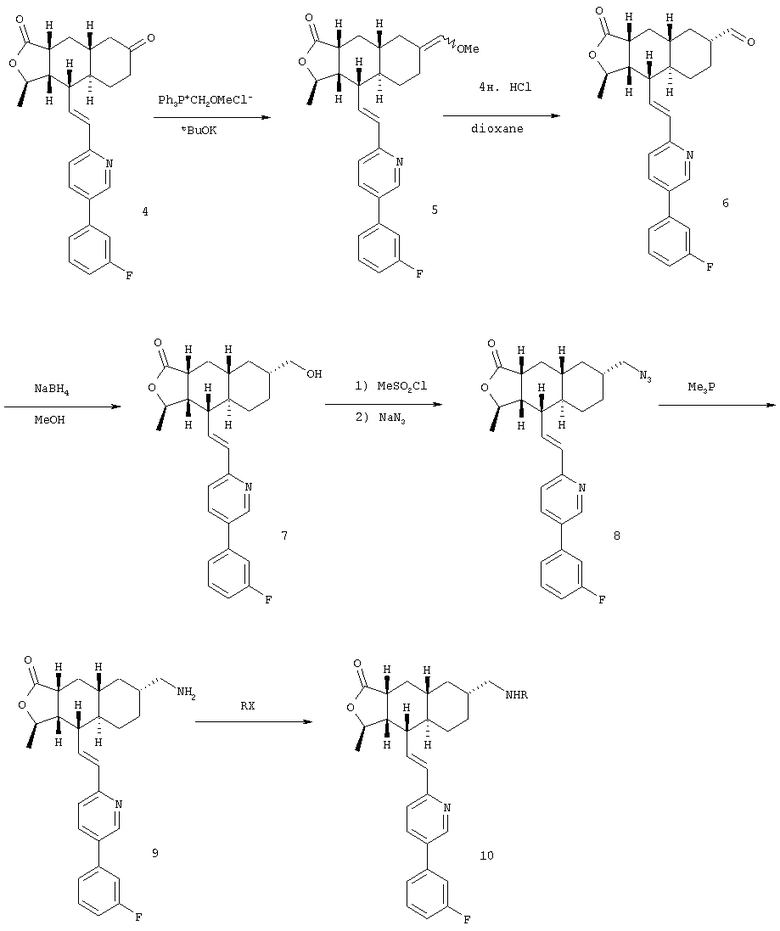
Кетон 4 вводят в реакцию Виттига, получают виниловый эфир 5, который гидролизуют в кислых условиях, получают альдегид 6. Альдегид восстанавливают до спирта 7 и превращают в азид 8 через его мезилат. Восстановлением азидогруппы Ме3Р получают амин 9, который обрабатывают различными электрофилами, получая разнообразные аналоги.
Далее приведены примеры получения соединений Формулы I. В примерах используются следующие сокращения: Et (этил), Me (метил), Pr (пропил), Ас (ацетил), кт (rt) (комнатная температура), ПТСХ (PTLC) (препаративная тонкослойная хроматография), ТГФ (THF) (тетрагидрофуран), ТБАФ (TBAF) (фторид тетра-н-бутиламмония), Tips (триизопропилсилил) и Tf (трифторметансульфонил).
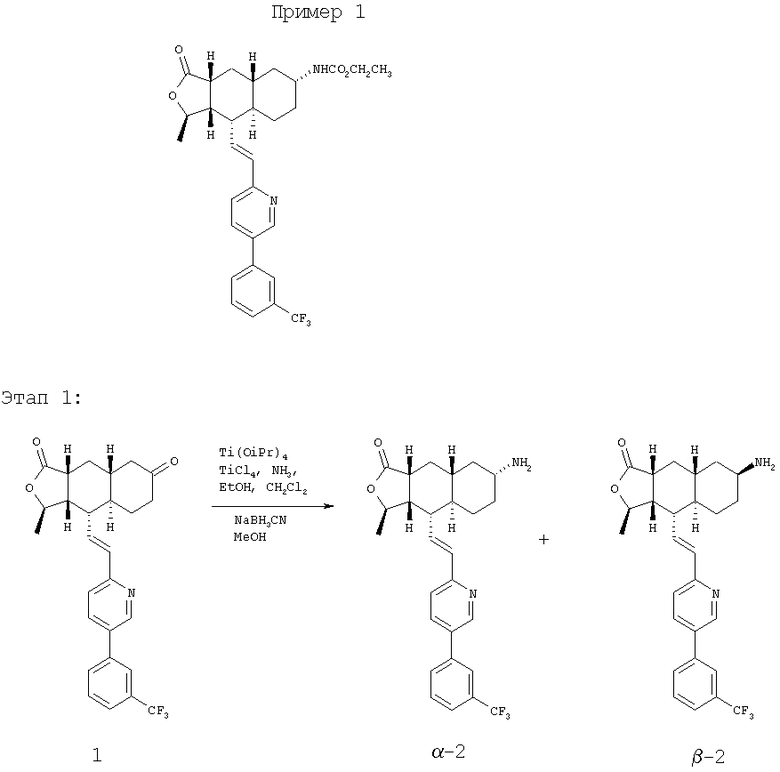
Соединение 1, описанное в патенте США 6063847 (1,95 г, 4,2 ммоль) растворяют в EtOH (40 мл) и СН2Cl2 (10 мл). Затем через раствор в течение 10 минут пропускают газообразный NH3. Реакционную смесь охлаждают до 0°C и добавляют Ti(OiPr)4 (1,89 мл, 6,3 ммоль). После перемешивания в течение 1 часа при 0°C добавляют 1М раствор TiCl4 (6,3 мл, 6,3 ммоль). Реакционную смесь перемешивают при комнатной температуре еще 45 минут и концентрируют досуха при пониженном давлении. Остаток растворяют в СН3ОН (10 мл) и добавляют NaBH3CN (510 мг, 8 ммоль). Полученную суспензию перемешивают при комнатной температуре в течение ночи. Реакционную смесь вливают в 1 н. раствор NaOH (100 мл) и экстрагируют EtOAc (3×100 мл). Органические фракции объединяют и сушат над Na2SO4. После удаления растворителя получают продукт 2 (1,2 г, 62%). После разделения методом ПТСХ (5% 2М NH3 в СН3ОН/CH2Cl2) получают β-2 (пятно 1) и α-2 (пятно 2) в соотношении 1:2. β-2; 1Н ЯМР (CDCl3): δ 0.81-1.15 (m, 2Н), 1.11-1.38 (m, 4H), 1.42 (d, J=6 Гц, 3Н), 1.82-2.01 (m, 3Н), 2.37 (m, 2Н), 2.45 (br m, 1H), 2.65 (m, 1H), 2.81 (m, 1H), 4.75 (m, 1H), 6.61 (m, 2Н), 7.26 (m, 2Н), 7.75-7.85 (m, 4H), 8.77 (d, J=1.6 Гц, 1H). α-2: 1H ЯМР (CDCl3): δ 0.95 (m, 1H), 1.10-1.40 (m, 5H), 1.41 (d, J=6 Гц, 3Н), 1.52-1.65 (m, 2H), 1.75 (m, 1H), 1.84-2.0 (m, 2H), 2.37 (m, 1H), 2.45 (m, 1H), 2.65 (m, 1H), 3.42 (br s, 1H), 4.70 (m, 1H), 6.61 (m, 2H), 7.26 (m, 2H), 7.75-7.85 (m, 4H), 8.77 (d, J=1.6 Гц, 1Н).
Этап 2:
Смесь соединения α-2 (110 мг), этилхлороформиата (0,4 мл) и Et3Н (0,5 мл) в CH2Cl2 (6 мл) перемешивают 2 часа. Реакционную смесь непосредственно разделяют методом ПТСХ (EtOAc/гексан, 1:1), получают целевое соединение (100 мг, 79%). МС m/z 543 (М+1). МСВР для С30Н34Н2O4F3 (М+1) вычисленный 543.2471, полученный 543.2467.
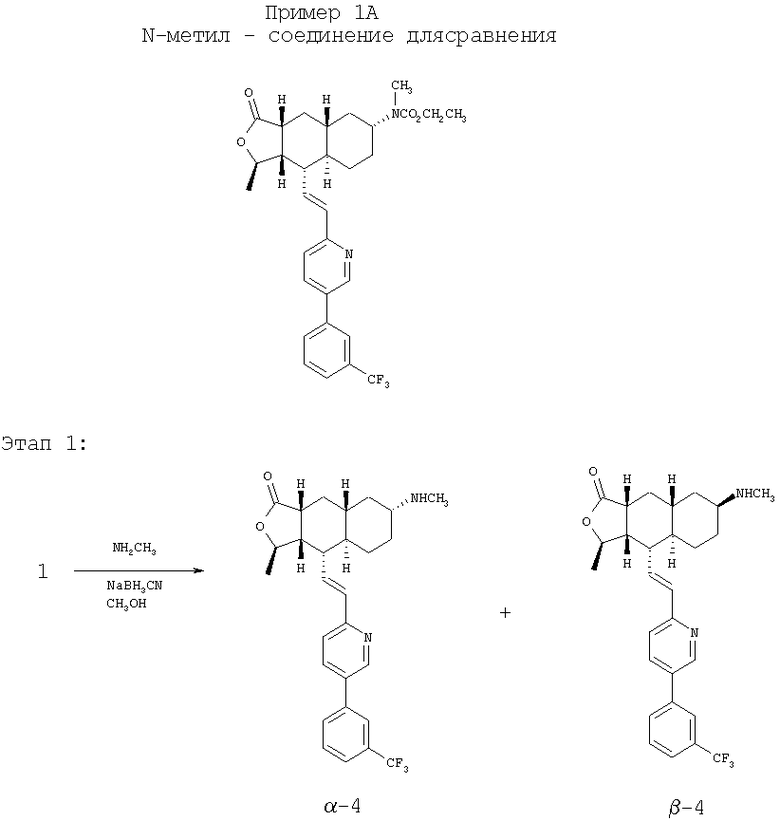
Соединение 1 (646 мг, 1,38 ммоль) растворяют в 2,0M растворе СН3NH2 в СН3ОН (15 мл, 30 ммоль) и перемешивают при комнатной температуре 5 минут, затем добавляют NaCNBH3 9173 мг, 2,75 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи и концентрируют досуха при пониженном давлении. После удаления растворителя и разделения методом ПТСХ получают β-4 (пятно 1, 76 мг, 11%) и α-4 (пятно 2, 100 мг, 15%). β-4: 1Н ЯМР (CDCl3): δ 1.15-1.24 (m, 5Н), 1.42 (d, J=6 Гц, 3Н), 1.42-1.61 (m, 2H), 1.71-1.95 (m, 4H), 2.21 (m, 1H), 2.38 (s, 3Н), 2.45 (m, 1H), 2.71 (m, 1H), 2.84 (m, 1H), 4.75 (m, 1H), 6.51-6.63 (m, 2H), 7.26 (m, 2H), 7.75-7.85 (m, 4H), 8.77 (d, J=2.0 Гц, 1H). α-4: 1Н ЯМР (CDCl3): δ 0.95 (m, 2H), 1.10-1.40 (m, 5Н), 1.41 (d, J=6 Гц, 3Н), 1.82-1.95 (m, 5Н), 2.38 (m, 2H), 2.42 (s, 3Н), 2.65 (m, 1H), 4.79 (m, 1Н), 6.51-6.63 (m, 2H), 7.26 (m. 2H), 7.75-7.85 (m, 4H), 8.77 (d, J=2.0 Гц, 1Н).
Этап 2:
Смесь соединения α-4 (50 мг), этилхлороформиата (0,15 мл) и Et3N (0,3 мл) в CH2Cl2 (5 мл) перемешивают 2 часа. Реакционную смесь непосредственно разделяют методом ПТСХ (EtOAc/гексан, 1:1), получают целевое соединение (48 мг, 84%). МС m/z 557 (М+1). МСВР для С31Н36Н2O4F3 (М+1): вычисленный 557,2627, полученный 557,2620.
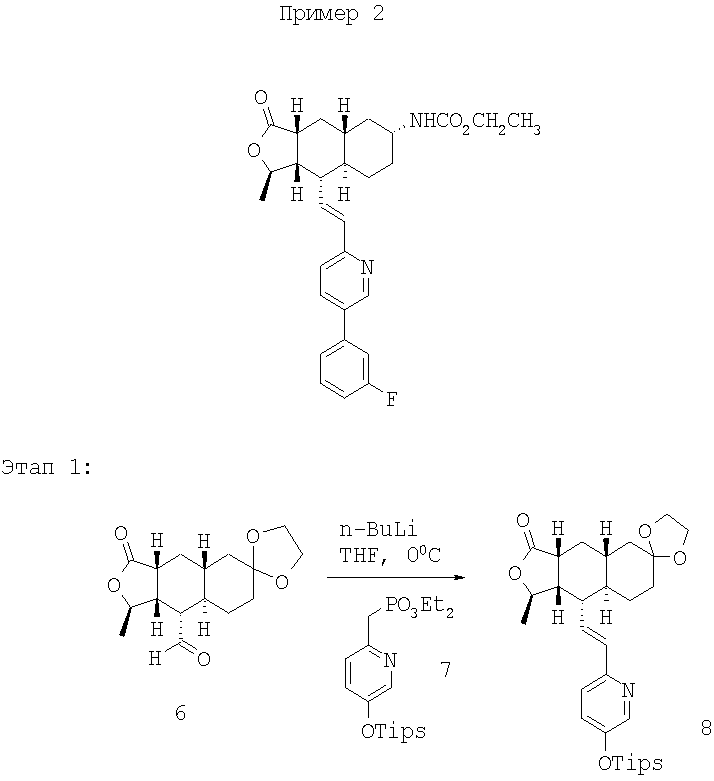
Фосфонат 7, описанный в патенте США 6063847 (3,27 г, 8,1 ммоль) растворяют в ТГФ (12 мл) и охлаждают до 0°С, а затем добавляют 2,5М раствор n-BuLi (3,2 мл, 8,1 ммоль). Реакционную смесь перемешивают 10 минут при 0°С и нагревают до комнатной температуры. К реакционной смеси добавляют раствор альдегида 6, описанного в патенте США 6063847, в ТГФ (12 мл). Реакционную смесь перемешивают 30 минут. После стандартной водной обработки и последующей колоночной хроматографии (30-50% EtOAc в гексане) получают продукт 8. 1Н ЯМР (CDCl3): δ 0.92-1.38 (m, 31Н), 1.41 (d, J=6 Гц, 3Н), 1.40-1.55 (m, 2H), 1.70-1.80 (m, 2H), 1.81-1.90 (m, 2H), 2.36 (m, 2H), 2.69 (m, 1Н), 3.89 (m, 4H), 4.75 (m, 1Н), 6.28-6.41 (m, 2H), 7.05-7.15 (m, 2H),8.19 (br s, 1H).
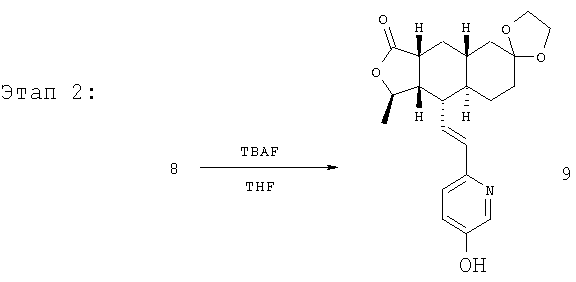
Соединение 8 (2,64 г, 4,8 ммоль) растворяют в ТГФ (48 мл). Реакционную смесь охлаждают до 0°С, затем добавляют 1М раствор ТБАФ (4,8 мл). Реакционную смесь перемешивают 5 минут с последующей стандартной водной обработкой. После колоночной хроматографии (50% EtOAc/гексан) получают продукт 9 (19 г, 100%). 1Н ЯМР (CDCl3): δ 1.15-1.55 (m, 6H), 1.41 (d, J=6 Гц, 3Н), 1.70-1.82 (m, 3H), 1.85-1.90 (m, 1H), 2.36 (m, 2H), 2.69 (m, 1H), 3.91 (m, 4H), 4.75 (m, 1H), 6.18-6.45 (m, 2H), 7.19 (br s, 2H), 8.19 (br s, 1H).

К раствору соединения 9 (250 мг, 0,65 ммоль) в пиридине (5 мл), охлажденному до 0°С, добавляют Tf2O (295 мкл, 2,1 ммоль). Реакционную смесь перемешивают в течение ночи при комнатной температуре. После стандартной водной обработки с последующей колоночной хроматографией получают продукт 10 (270 мг, 80%). 1Н ЯМР (CDCl3): δ 1.15-1.55 (m, 6H), 1.41 (d, J=6 Гц, 3Н), 1.70-1.82 (m, 3H), 1.85-1.90 (m, 1H), 2.36 (m, 2H), 2.69 (m, 1H), 3.91 (m, 4H), 4.75 (m, 1H), 6.42-6.68 (m, 2H), 7.25 (m, 1H), 7.55 (m, 1H), 8.49 (d, J=2.8 Гц, 1H).
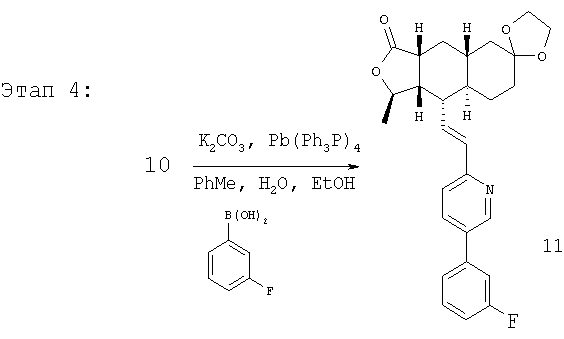
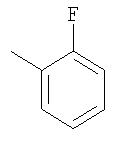
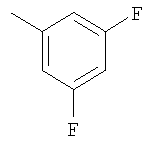
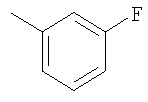
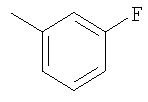
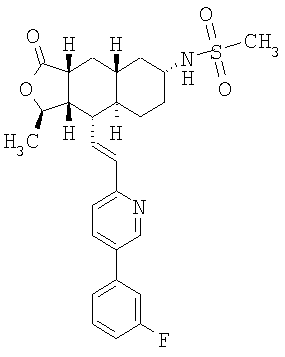
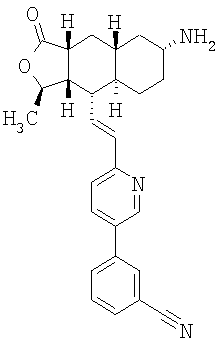
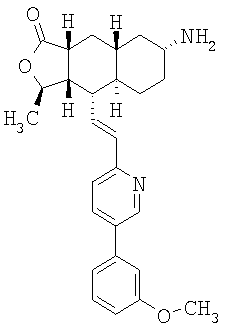
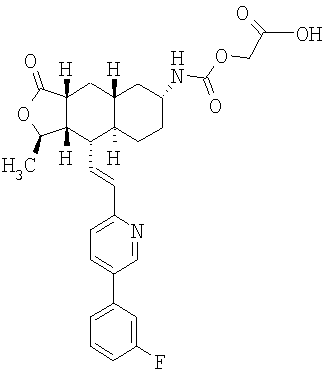
Соединение 10 (560 мг, 1,1 ммоль), 3-фторфенилбороновую кислоту (180 мг, 1,3 ммоль) и К2СО3 (500 мг, 3,6 ммоль) смешивают с толуолом (4,4 мл), H2O (1,5 мл) и EtOH (0,7 мл) в герметичном сосуде. В атмосфере N2 добавляют Pd(Ph3Р)4 (110 мг, 0,13 ммоль). Реакционную смесь нагревают 2 часа при температуре 100°С в атмосфере N2. Реакционную смесь охлаждают до комнатной температуры, вливают в EtOAc (30 мл) и промывают водой (2×20 мл). Фазу EtOAc сушат с NaHCO3 и концентрируют при пониженном давлении. После разделения остатка методом препаративной ТСХ (50% EtOAc в гексане) получают продукт 11 (445 мг, 89%). 1Н ЯМР (CDCl3): δ 1.15-1.59 (m, 6Н), 1.43 (d, J=6 Гц, 3Н), 1.70-1.79 (m, 2H), 1.82 (m, 1H), 1.91 (m, 2H), 2.41 (m, 2H), 2.69 (m, 1H), 3.91 (m, 4H), 4.75 (m, 1H), 6.52-6.68 (m, 2H), 7.15 (m, 1H), 7.22 (m, 2H), 7.35 (m, 1H), 7.44 (m, 1H), 7.81 (m, 1H), 8.77 (d, J=1.2 Гц, 1H).
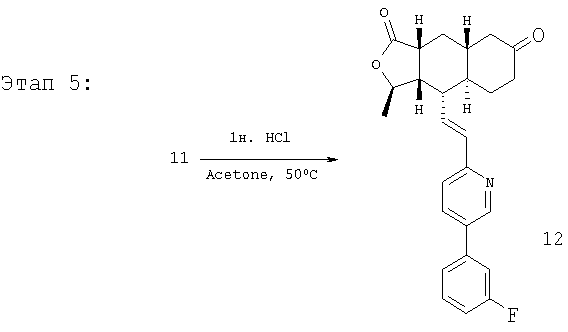
Соединение 11 (445 мг, 0,96 ммоль) растворяют в смеси ацетона (10 мл) и 1 н. раствора HCl (10 мл). Реакционную смесь нагревают при 50°С 1 час. После стандартной водной обработки с последующим разделением методом ПТСХ (50% EtOAc в гексане) получают продукт 12 (356 мг, 89%). 1Н ЯМР (CDCl3): δ 1.21-1.45 (m, 2H), 1.47 (d, J=5.6 Гц, 3Н), 1.58-1.65 (m, 2H), 2.15 (m, 1H), 2.18-2.28 (m, 2H), 2.35-2.51 (m, 5H), 2.71 (m, 1H), 4.79 (m, 1H), 6.52-6.68 (m, 2H), 7.15 (m, 1H), 7.22 (m, 2H), 7.35 (m, 1H), 7.44 (m, 1H), 7.81 (m, 1H), 8.77 (d, J=1.2 Гц, 1H).
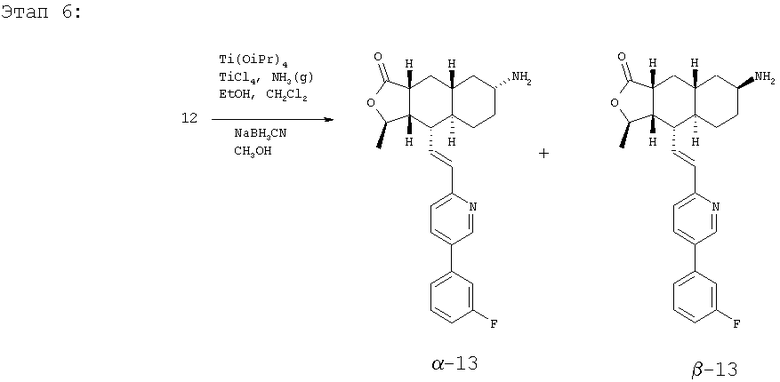
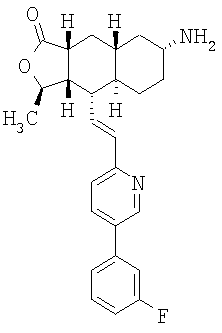
Соединение 12 (500 мг, 4,2 ммоль) растворяют в EtOH (40 мл) и CH2Cl2 (15 мл) и пропускают через раствор газообразный NH3 в течение 5 минут. Реакционную смесь охлаждают до 0°С, затем добавляют Ti(OiPr)4 (1,89 мл, 6,3 ммоль). После перемешивания при 0°С в течение 1 часа добавляют 1М раствор TiCl4 (6,3 мл, 6,3 ммоль). Реакционную смесь перемешивают при комнатной температуре 45 минут и концентрируют досуха при пониженном давлении. Остаток растворяют в СН3ОН (10 мл) и добавляют NaBH3CN (510 мг, 8 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Реакционную смесь вливают в 1 н. раствор NaOH (100 мл) и экстрагируют EtOAc (3×100 мл). Органические фазы объединяют и сушат с NaHCO3. После удаления растворителя и разделения методом ПТСХ (5% 2М NH3 в СН3ОН/CH2Cl2 получают β-13 (пятно 1, 30 мг, 6%) и α-13 (пятно 2, 98 мг, 20%). β-13: 1Н ЯМР (CDCl3): δ 1.50-1.38 (m, 5H), 1.42 (d, J=6 Гц, 3Н), 1.51-1.75 (m, 5H). 1.84 (m, 2H), 2.38 (m, 1H), 2.45 (m, 1H), 3.38 (br s, 1H), 4.78 (m, 1H), 6,59 (m, 2H), 7.15 (m, 1H), 7.26 (m, 2H), 7.36 (m, 1H), 7.42 (m, 1H), 7.82 (m. 1H), 8.77 (d, J=2 Гц, 1H). α-13: 1H ЯМР (CDCl3): δ 0.95 (m, 2H), 1.02-1.35 (m, 6H), 1.41 (d, J=6 Гц, 3Н), 1.82-1.95 (m, 4H), 2.37 (m, 2H), 2.69 (m, 2H), 4.71 (m, 1H), 6.71 (m, 2H), 7.11 (m, 1H), 7.25 (m, 2H), 7.38 (m, 1H), 7.42 (m, 1H), 7.80 (m, 1H), 8.76 (d, J=1.6 Гц, 1H).
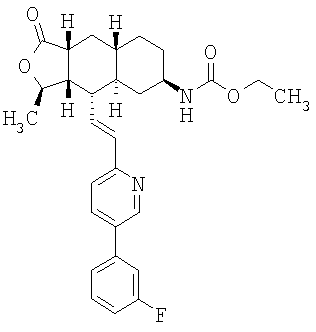
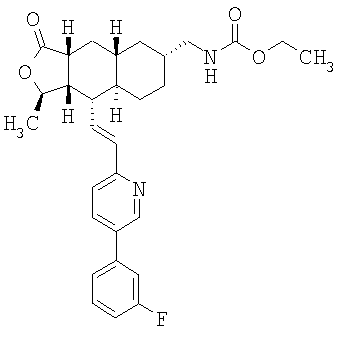
Этап 7:
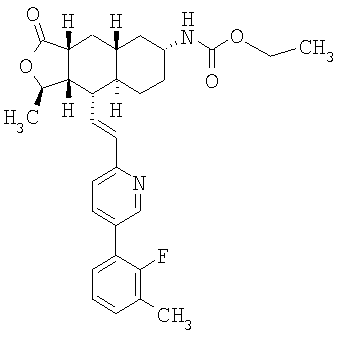
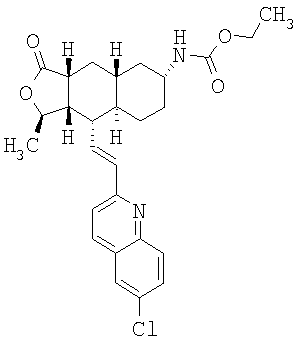
Соединение α-13 (300 мг, 0,71 ммоль) растворяют в СН2Cl2 (10 мл), затем добавляют Et3Н (0,9 мл). Реакционную смесь охлаждают до 0°С и добавляют этилхлороформиат (0,5 мл). Реакционную смесь перемешивают при комнатной температуре 1 час. Реакционную смесь непосредственно разделяют методом препаративной ТСХ (EtOAc/гексан, 1:1), получают целевое соединение (14) (300 мг, 86%). МС m/z 493 (М+1). МСВР для C29H34N2O4F (M+1): вычисленный 493,2503, полученный 493,2509.
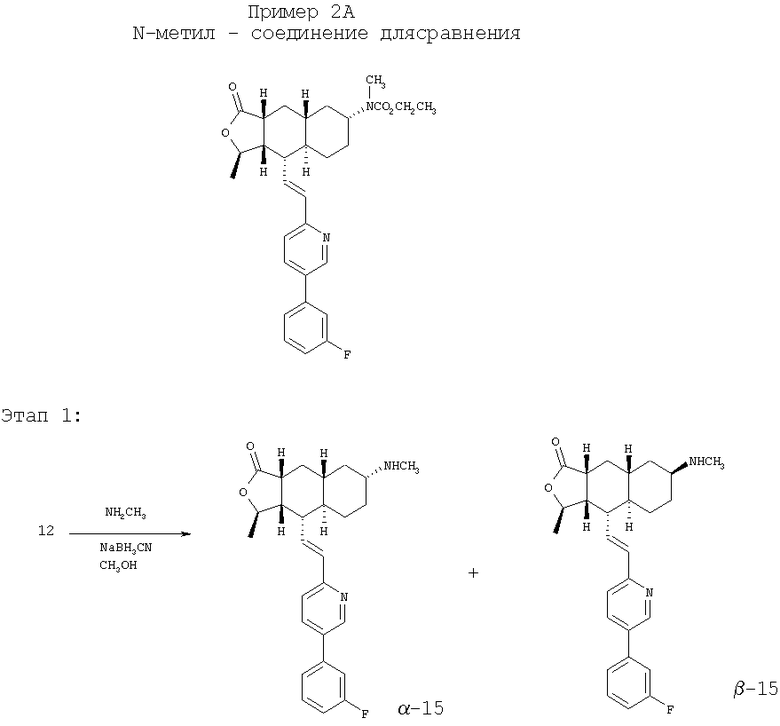
Соединение 12 (130 мг, 0,31 ммоль) растворяют в 2М растворе СН3NH2 в СН3ОН (5 мл, 10 ммоль). После перемешивания в течение 5 минут при комнатной температуре добавляют NaCNBH3 (40 мг, 0,62 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи. После удаления растворителя и последующего разделения методом ПТСХ (7% 1М NH3 в СН3ОН/СН2Cl2) получают β-15 (пятно 1, 20 мг, 15%) и α-15 (пятно 2, 25 мг, 19%). β-15: 1Н ЯМР (CDCl3): δ 1.15-1.25 (m, 5H), 1.42 (m, 3Н), 1.42-1.61 (m, 2H), 1.75-1.90 (m, 3H), 2.25-2.45 (m, 2H), 2.41 (s, 3H), 2.70 (m, 1H), 2.85 (m, 1H), 4.75 (m, 1H), 6.51-6.61 (m, 2H), 7.11 (m, 1H). 7.23-7.27 (m, 2H), 7.35 (m, 1H), 7.45 (m, 1H), 7.80 (m, 1H), 8.76 (d, J=2.4 Гц, 1H). α-15: 1H ЯМР (CDCl3): δ 0.90 (m, 2H), 1.10-1.35 (m, 5H), 1.41 (d, J=5.6 Гц, 3Н), 1.82-2.01 (m, 4H), 2.36 (m, 2H), 2.39 (s, 3Н), 2.55-2.65 (br s, 1H), 2.71 (m, 1H), 4.79 (m, 1H), 6.51-6.63 (m, 2H), 7.08 (m, 1H), 7.26 (m, 2H), 7.34 (m 1H), 7.42 (m, 1H), 7.81 (m, 1H), 8.76 (d, J=2.0 Гц, 1H).
Этап 2:
Соединение α-15 (25 мг, 0,06 ммоль) растворяют в CH2Cl2 (5 мл), затем добавляют Et3N (0,2 мл). Реакционную смесь охлаждают до 0°С и добавляют этилхлороформиат (0,1 мл). Реакционную смесь перемешивают при комнатной температуре 1 час. Реакционную смесь непосредственно разделяют методом препаративной ТСХ (EtOAc/гексан, 1:1), получают целевое соединение (25 мг, 85%). МС m/z 507 (M+1). МСВР для C30H36N2O4F (M+1): вычисленный 507,2659, полученный 507,2652.
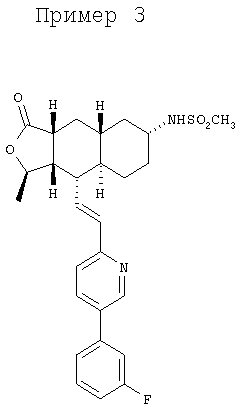
Соединение α-13 (10 мг, 0,02 ммоль) растворяют в CH2Cl2 (3 мл), затем добавляют Et3N (0,5 мл). Реакционную смесь охлаждают до 0°С и добавляют СН3SO2Cl (0,2 мл). Реакционную смесь перемешивают при комнатной температуре 1 час. Реакционную смесь непосредственно разделяют методом препаративной ТСХ (EtOAc/гексан, 1:1), получают целевое соединение (10 мг, 84%). МС m/z 499 (M+1). МСВР для C27H32N2O4FS (M+1): вычисленный 499,2067, полученный 499,2071.
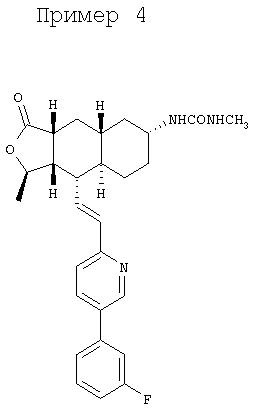
Соединение α-13 (10 мг, 0,02 ммоль) растворяют в СН2Cl2 г (5 мл), затем добавляют CH3NCO (250 мг). Реакционную смесь перемешивают при комнатной температуре 1 час. Реакционную смесь непосредственно разделяют методом препаративной ТСХ (СН3ОН/СН2Cl2, 7%), получают целевое соединение (60 мг в виде соли HCl, 98%). МС m/z 478 (M+1). МСВР для С28Н33N3О3Р (M+1): вычисленный 478,2506, полученный 478,2516.
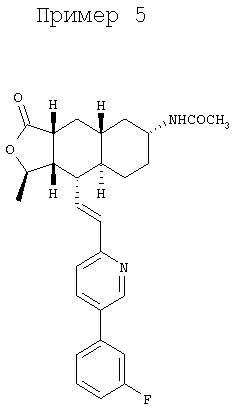
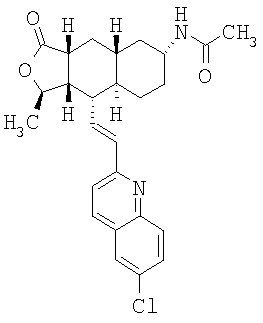
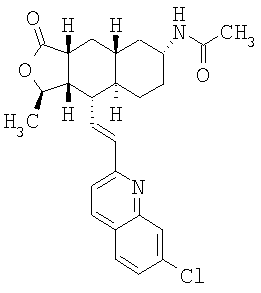
Соединение α-13 (50 мг, 0,1 ммоль) растворяют в CH2Cl2 (3 мл), затем добавляют Et3N (0,5 мл). Реакционную смесь охлаждают до 0°С и добавляют уксусный ангидрид (0,2 мл). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Реакционную смесь непосредственно разделяют методом препаративной ТСХ (СН3ОН/СН2Cl2, 8%), получают целевое соединение (52 мг, 94%). МС m/z 463 (М+1). МСВР для С28Н32N2O3F (М+1): вычисленный 463,2397, полученный 463,2399.
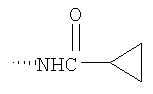
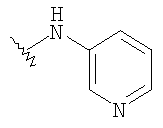
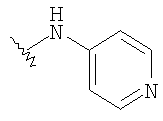
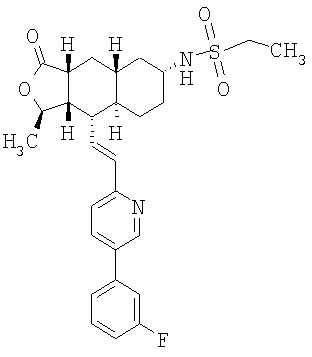
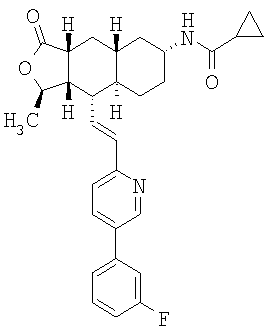
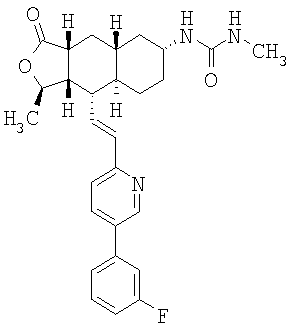
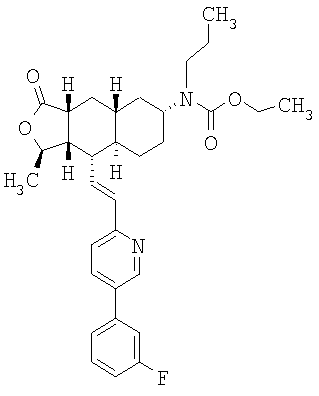
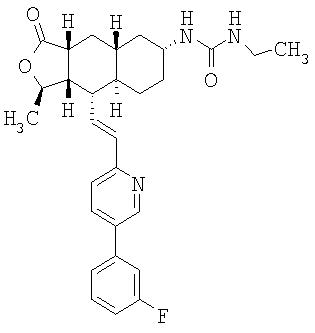
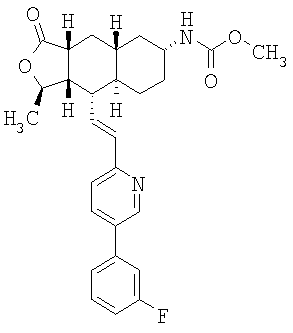
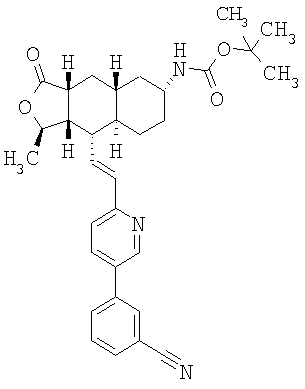
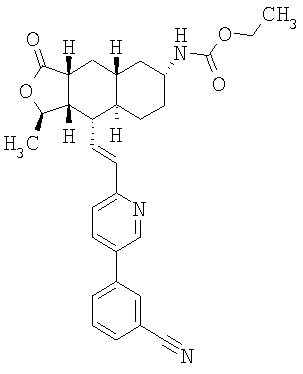
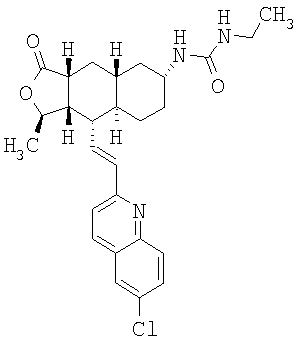
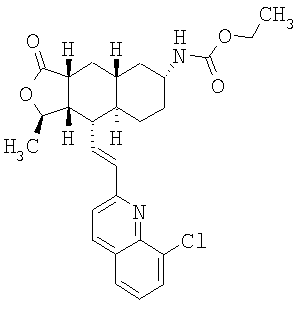
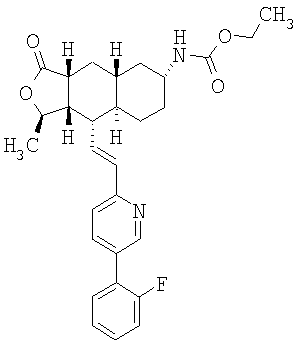
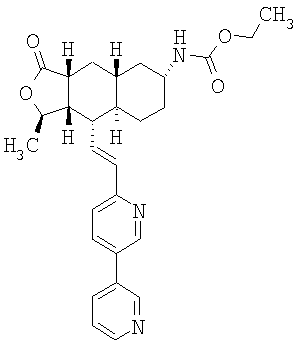
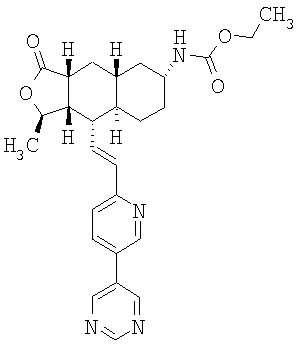
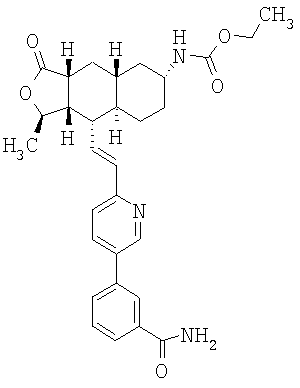
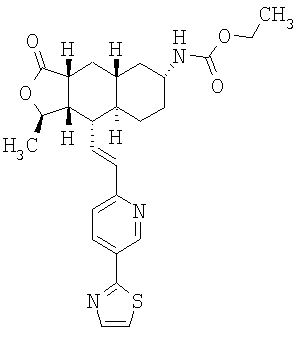
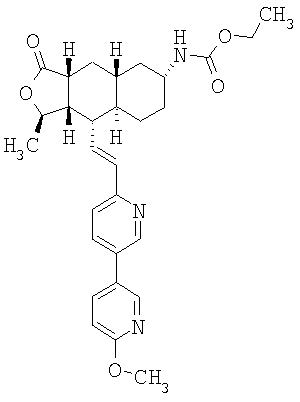
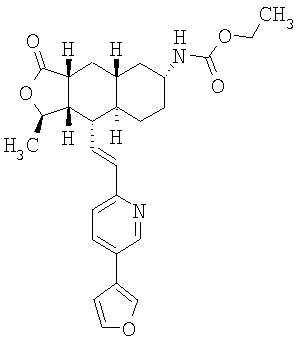
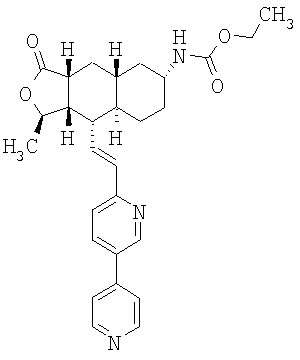
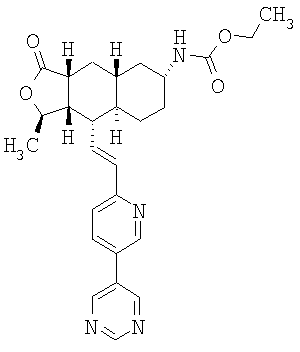
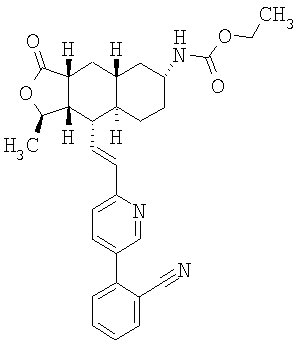
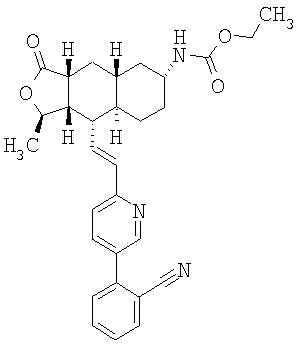
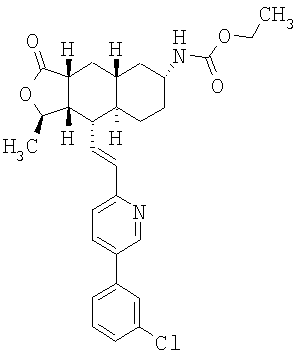
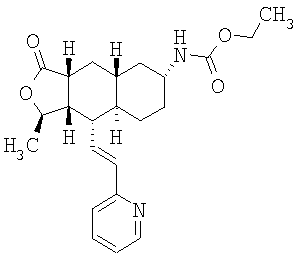
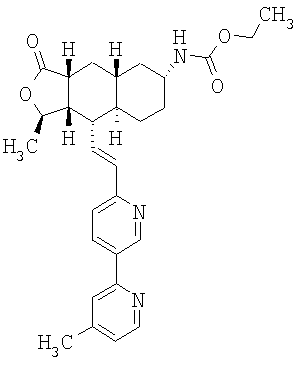
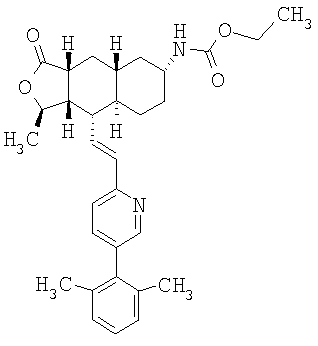
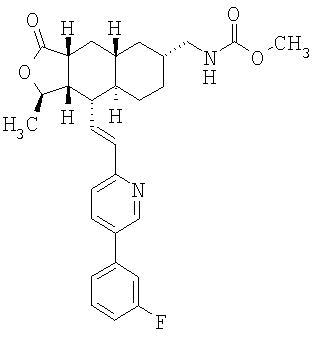
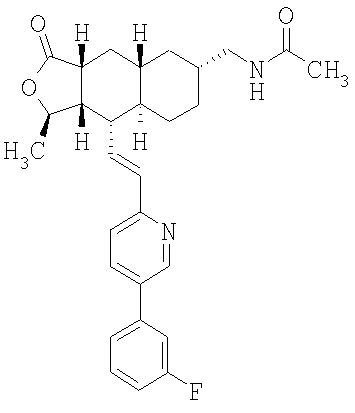
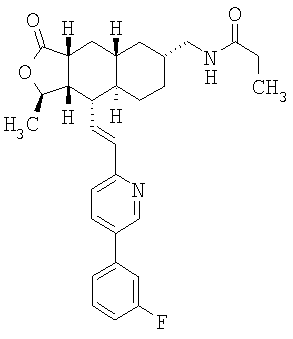
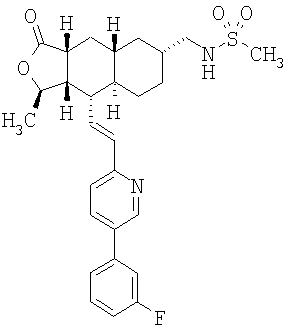
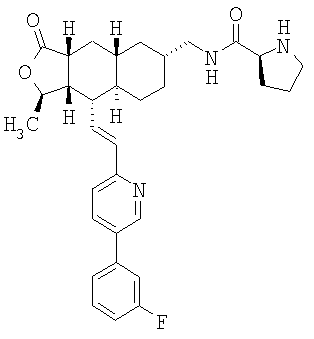
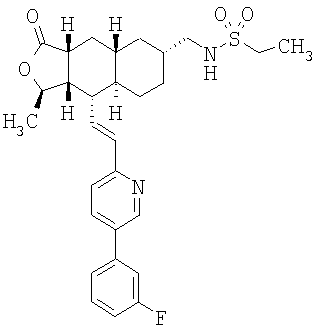
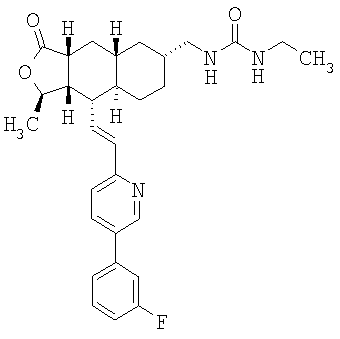
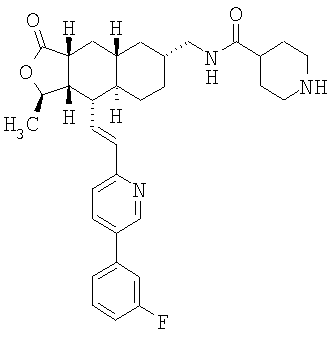
При использовании описанных выше методов получают следующие соединения,
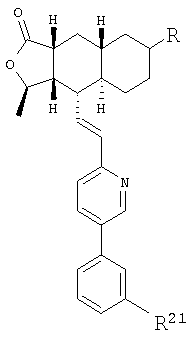
где R21 и R соответствуют определениям в таблице 1.
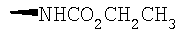
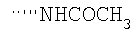
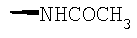
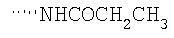
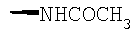
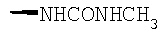
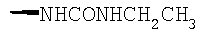
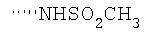
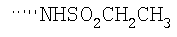
При замене пиридиновой группы соединения 1 на хинолиновую получают соединения следующей структуры:
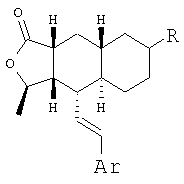
где R и Ar соответствуют определениям в таблице 2.
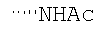
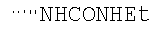

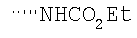

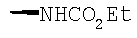
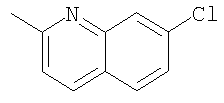
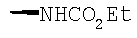
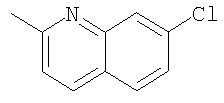
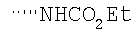

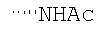
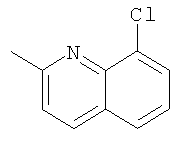
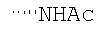
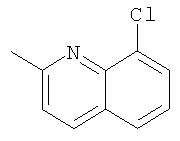
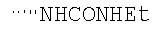

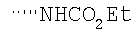

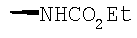
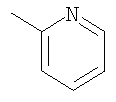
При использовании следующих вариаций группы W, выбираемых из замещенных фенильных и гетероарильных групп, получают следующие аналоги:

где R и Ar соответствуют определениям в таблице 3.
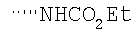
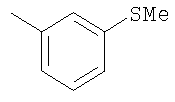
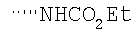

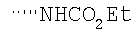
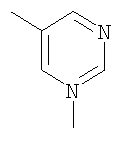
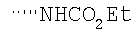
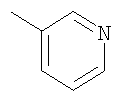
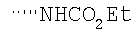
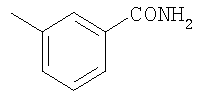
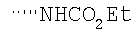
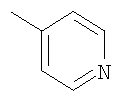
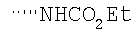
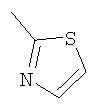
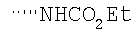
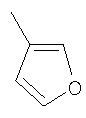
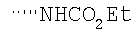

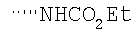

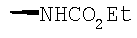

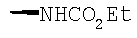

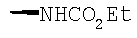

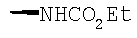
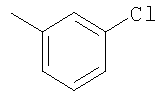
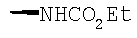
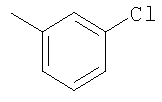
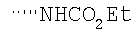
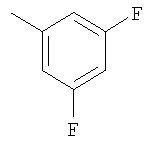
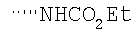
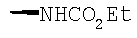
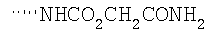
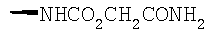
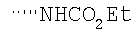
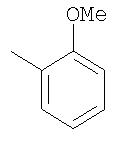
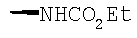

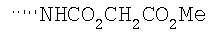

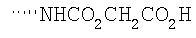
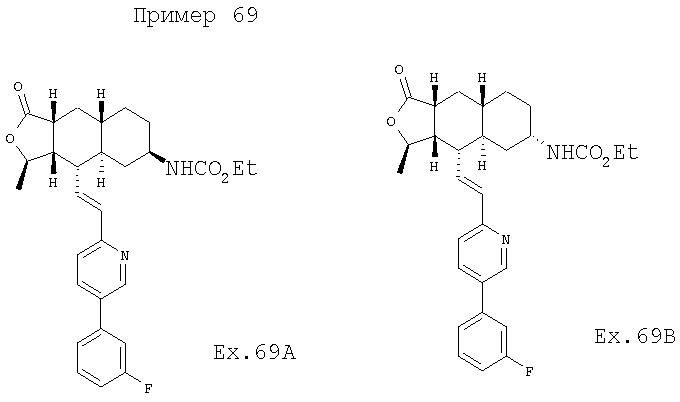
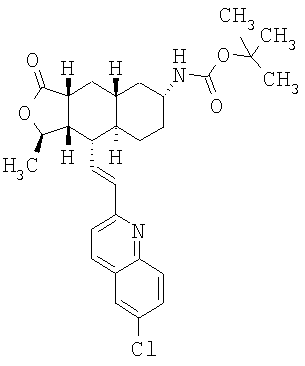
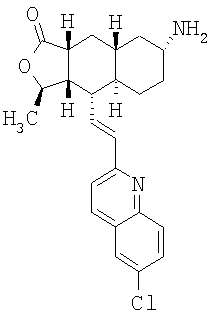
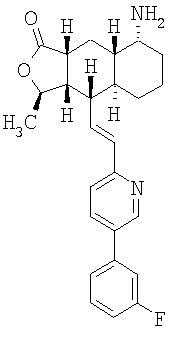
Соединение 17 (100 мг, 0,239 ммоль), полученное, как описано в патенте США 6063847, перемешивают с ацетатом аммония (1,84 г, 23,9 ммоль) и NaCNBH3 (24 мг, 0,38 ммоль) в СН3ОН (7 мл) при комнатной температуре в атмосфере N2 в течение 16 часов. Смесь обрабатывают NH4OH (10 мл, 29% водный раствор), разбавляют CH2Cl2 (75 мл) и промывают насыщенным раствором NaHCO3. Органический слой сушат (MgSO4) и концентрируют в вакууме. После разделения остатка методом ПТСХ (элюент 2,0М NH3/СН3ОН-СН2Cl2 (5-95)) получают соединения 18А (43 мг, 43%, более низкий Rf), МС (ESI) (масс-спектрометрия с электрораспылительной ионизацией) m/z 421 (МН+) и 18В (17 мг, 17%, более высокий Rf) МС (ESI) m/z 421 (MH+).
Этап 2:
Соединение 18А (0,100 г, 0,238 ммоль) перемешивают с этилхлороформиатом (0,195 мл, 2,38 ммоль) и Et3N (0,5 мл, 3,6 ммоль) в СН2Cl2 (10 мл) при 0°С в течение 10 минут и при комнатной температуре в течение 1 часа. Реакционную смесь разбавляют EtOAc (50 мл) и промывают насыщенным раствором NaHCO3. Органический слой сушат (MgSO4) и концентрируют в вакууме. После разделения остатка методом флэш-хроматографии на колонке с силикагелем (элюент EtOAc-гексан, 50:50) получают соединение примера 69А (100 мг, 85%). МС (ESI) m/z 493 (MH+). Аналогичным образом из соединения 18В получают Соединение 32В. МС (ESI) m/z 493 (МН+).
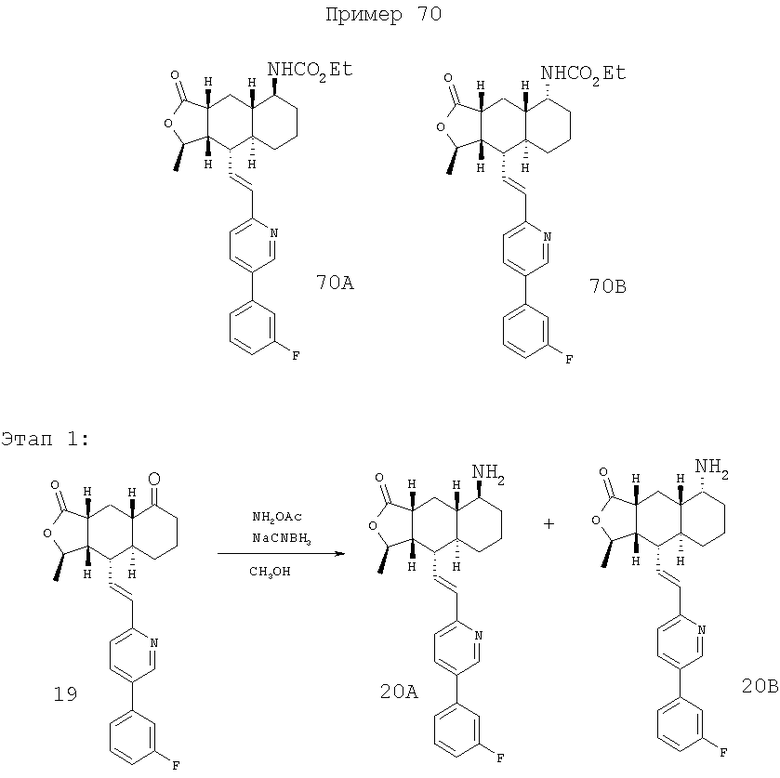
При использовании процессов, описанных на этапе 1 примера 32, и соединения 19 (см. патент США 6063847) в качестве исходного получают соединения 20А (более низкий Rf), MC (FAB) m/z 421 (MH+), и 20В (более высокий Rf), MC (FAB) m/z 421 (МН+).
Этап 2:
При использовании процессов, описанных на этапе 2 примера 69, из соединения 20А получают соединение 70А: MC (ESI) m/z 493 (МН+). При использовании процессов, описанных на Этапе 2 Примера 69, из соединения 20В получают соединение 70В: MC (ESI) m/z 493 (МН+).
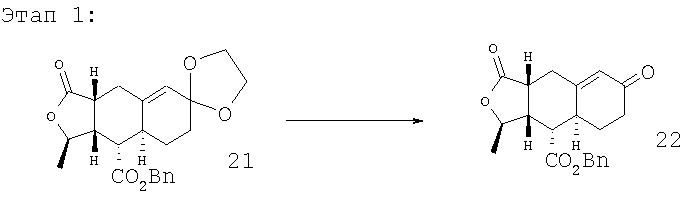
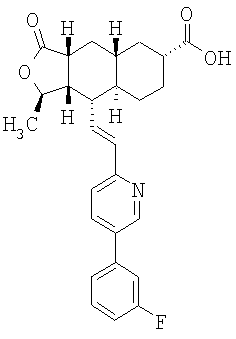
Лактон 21, описанный в патенте США 6063847, (10 г, 0,0251 моль) растворяют в ацетоне, добавляют 1 н. раствор HCl и нагревают смесь 4 часа при 55°С. Реакционную смесь оставляют остывать до комнатной температуры, нейтрализуют NaHCO3 и экстрагируют EtOAc. Экстракты сушат и концентрируют при пониженном давлении, получают соединение 22 (7,35 г) в виде масла. МС m/z 355 (M+1).

Кетон 22 (7,35 г, 0,0207 моль) растворяют в ТГФ и охлаждают до 0°С. Добавляют трет-бутоксид калия (2,55 г, 1,1 экв.). После перемешивания в течение 10 минут добавляют СН3I (2,58 мл, 2 экв.). Реакционную смесь перемешивают 2,5 часа. После водной обработки с насыщенным раствором NH4Cl и последующей колоночной хроматографии (30-50% EtOAc в гексане) получают соединение 23 (1,63 г). МС m/z 383 (M+1).
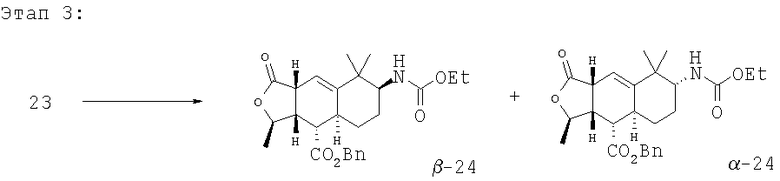
Кетон 23 (1,634 г, 0,00426 моль) растворяют в СН3ОН, добавляют NH4OAc и NaCNBH3. Реакционную смесь перемешивают 2 часа. Реакцию нейтрализуют NH4OH, экстрагируют смесь СН2Cl2. Органические экстракты сушат и концентрируют, получают масло. МС m/z 383 (M+1).
Масло растворяют в CH2Cl2, добавляют Et3N и охлаждают смесь до 0°С. Добавляют этилхлороформиат и перемешивают реакционную смесь в течение ночи. После водной обработки с насыщенным раствором NH4Cl и последующей колоночной хроматографии (30% EtOAc в гексане) получают неразделимую смесь соединений α-24 и β-24 в соотношении 3:1. МС m/z 456 (M+1).
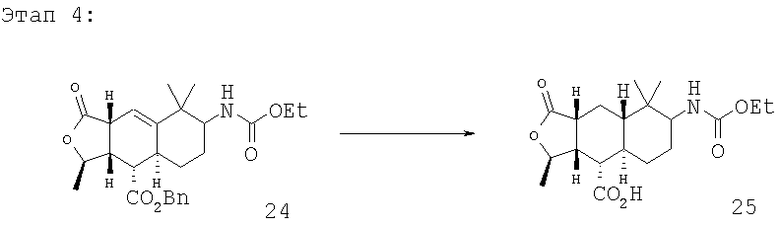
Смесь продуктов этапа 3 (330 мг, 0,724 ммоль) растворяют в EtOAc (14 мл) и добавляют Pd(C) (10 мас.%). Смесь перемешивают в атмосфере Н2 (1 атм) в течение 2 часов. Смесь фильтруют, концентрируют и растворяют в СН3ОН (15 мл). Добавляют PtO2 (10 мас.%), помещают смесь в атмосферу Н2 (50 фунтов/кв.дюйм) и встряхивают на шейкере в течение 3 дней. Смесь фильтруют и концентрируют, получают 280 мг кислот 25. МС m/z 368 (M+1).

Неочищенные кислоты 25 (0,724 ммоль) растворяют в СН2Cl2, добавляют (COCl)2 (0,1 мл, 1,5 экв.) и каплю ДМФ (диметилформамида). Реакционную смесь перемешивают 30 минут, после чего полное превращение подтверждается данными 1Н ЯМР. СН2Cl2 заменяют на толуол и полученный раствор охлаждают до 0°С. Добавляют Pd(Ph3Р)4, затем по каплям добавляют Bu3SnH. После перемешивания при 0°С в течение 30 минут завершение реакции подтверждается ТСХ. После колоночной хроматографии (20-50% EtOAc в гексане) получают 248 мг альдегидов 26. МС m/z 352 (M+1).
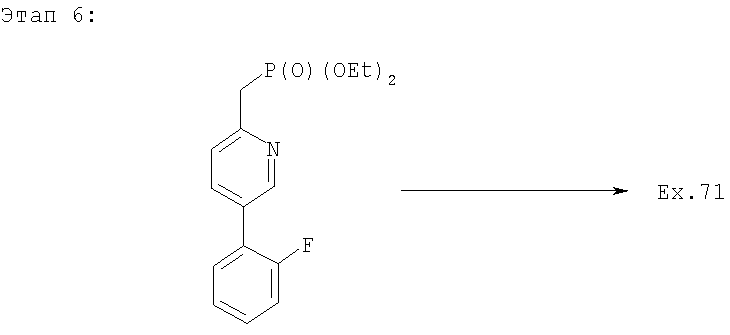
Фосфонат 27 (248 мг, 0,768 ммоль, 3 экв.), см. патент США 603847, растворяют в ТГФ (4 мл) и охлаждают смесь до 0°С. Добавляют LHMDS (гексаметилдисилазид лития) (0,768 мл, 3 экв. 1М раствора в ТГФ) и перемешивают реакционную смесь 30 минут. Добавляют Ti(i-OPr)4 (0,227 мл, 3 экв.), а через 5 минут - раствор альдегидов 26 (90 мг, 0,256 ммоль) в ТГФ (4 мл). Реакционную смесь перемешивают 1,5 часа, полное превращение подтверждается ТСХ. Добавляют насыщенный раствор тартрата натрия-калия и удаляют ТГФ в вакууме. Остаток экстрагируют EtOAc, сушат, концентрируют и очищают методом ПТСХ (1:1 EtOAc/гексан), получают целевое соединение (80 мг). МС m/z 521 (M+1).
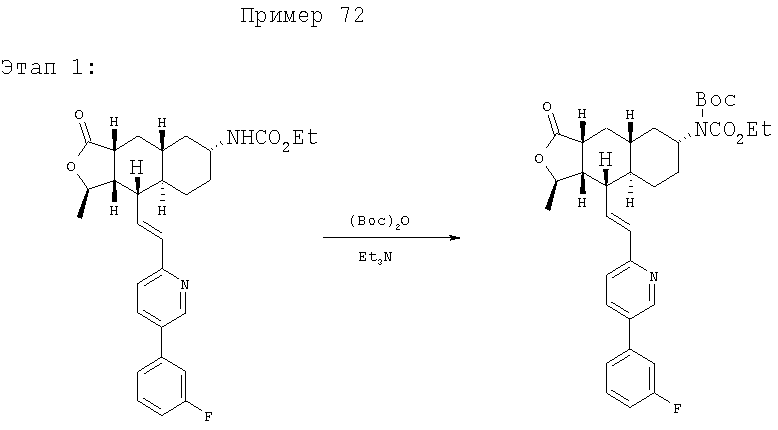
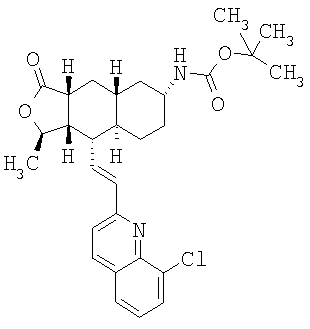
К раствору 1,35 г (2,75 ммоль) исходного вещества, 0,57 мл Et3N (4,13 ммоль, 1,5 экв.) и 70 мг DMAP (диметиламинопиридин) (0.57 ммоль, 0,2 экв.) в 20 мл CH3CN при 60°С добавляют 2 экв. (Вос)2O. Затем 5 экв. (Вос)2O добавляют в течение 5 часов. Раствор охлаждают, концентрируют и хроматографируют, получают 0,86 г продукта. МС 593,1 (MH+).
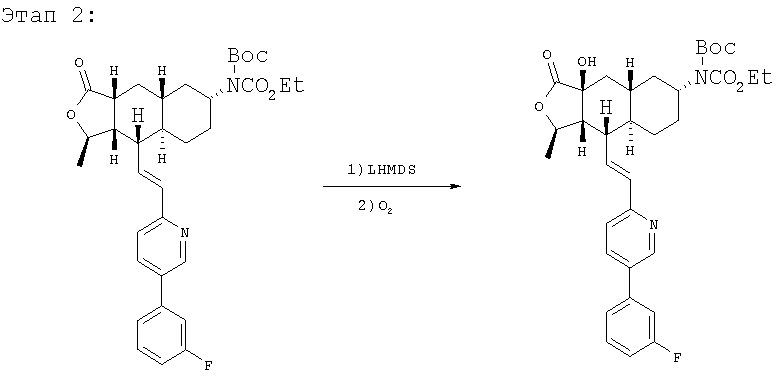
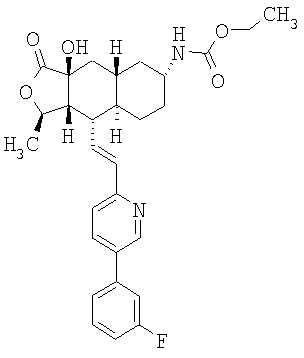
К раствору 280 мг исходного вещества (0,47 ммоль) в 5 мл ТГФ при 0°С добавляют 0,95 мл (0,95 ммоль, 2 экв.) 1М раствора LHMDS в ТГФ. Реакционную смесь перемешивают 30 минут и через баллон вводят O2. После перемешивания в течение 1 часа реакцию нейтрализуют добавлением 50 мл водного раствора Na2SO3 и перемешивают 1 час. Водную фазу экстрагируют этилацетатом (3×25 мл), объединенную органическую фазу промывают солевым раствором, сушат над MgSO4 и хроматографируют (30% EtOAc-гексан), получают 125 мг гидроксилированного продукта. МС 609,1 (МН+).
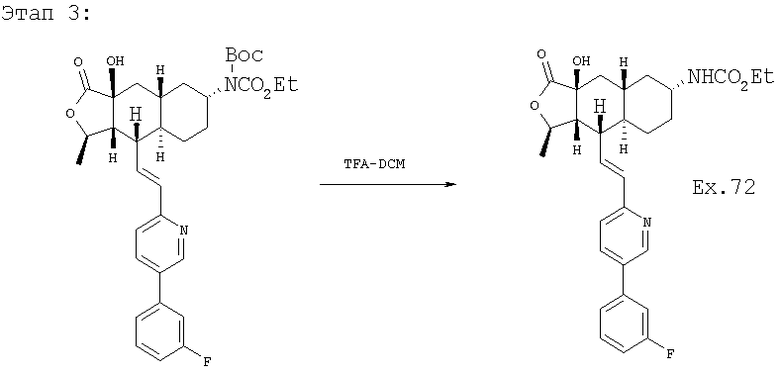
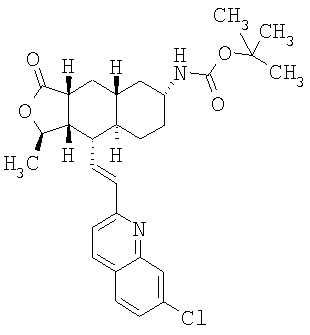
К раствору 125 мг исходного вещества в 1 мл СН2Cl2 при комнатной температуре добавляют 1 мл трифторуксусной кислоты (ТФУ), перемешивают 1 час и концентрируют. Добавляют 50 мл водного раствора Na2СО3 и экстрагируют CH2Cl2 (3×10 мл). Объединенную органическую фазу промывают 10 мл солевого раствора, сушат над MgSO4, фильтруют, концентрируют и хроматографируют (50% EtOAc-гексан), получают 90 мг продукта. МСВР 509,2459 (МН+).
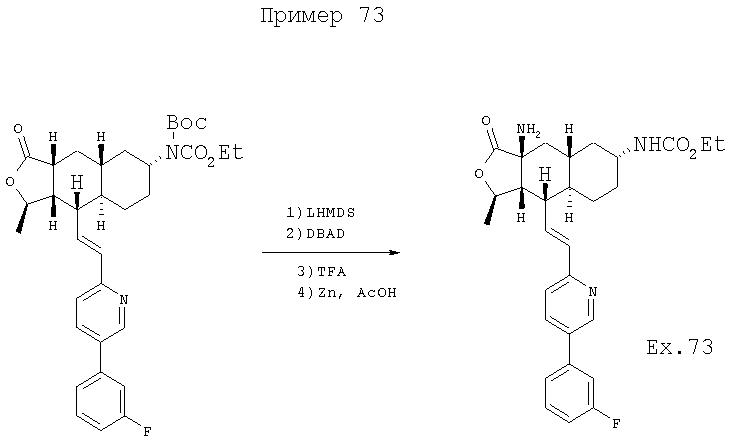
К раствору 500 мг (0,84 ммоль) исходного вещества в 8 мл ТГФ добавляют 1,7 мл (1,7 ммоль, 2 экв.) 1М раствора LHMDS в ТГФ. Раствор перемешивают 30 минут и охлаждают до -78°С, добавляют раствор 390 мг (1,7 ммоль, 2 экв.) ди-трет-бутилазодикарбоксилата (DBAD) в 2 мл ТГФ. Реакционную смесь оставляют нагреться до комнатной температуры в течение 3 часов, вливают ее в 100 мл водного раствора NH4Cl и экстрагируют EtOAc (3×30 мл). Объединенную органическую фазу промывают 30 мл солевого раствора, сушат над MgSO4, фильтруют и концентрируют, получают неочищенный продукт,
Этот продукт перемешивают с 15 мл смеси ТФУ-ДХМ (дихлорметан) 1:1 при комнатной температуре в течение 1 часа, концентрируют и подщелачивают 100 мл водного раствора Na2CO3. Водную фазу экстрагируют ДХМ (3×25 мл), объединенную органическую фазу промывают 25 мл солевого раствора, сушат над MgSO4, фильтруют и концентрируют, получают неочищенный гидразид.
Этот гидразид растворяют в 10 мл ледяной уксусной кислоты и небольшими порциями добавляют 2 г порошкообразного Zn, перемешивают приблизительно 1,5 часа. Смесь фильтруют через целит и промывают 100 мл ДМ. Раствор ДХМ промывают Н2О (2×50 мл), водным раствором NaHCO3 (2×50 мл), 50 мл солевого раствора, сушат над MgSO4, фильтруют, концентрируют и хроматографируют (ДХМ-ацетон-МеОН, 87:10:3), получают 105 мг продукта. МСВР 508,2607 (МН+).
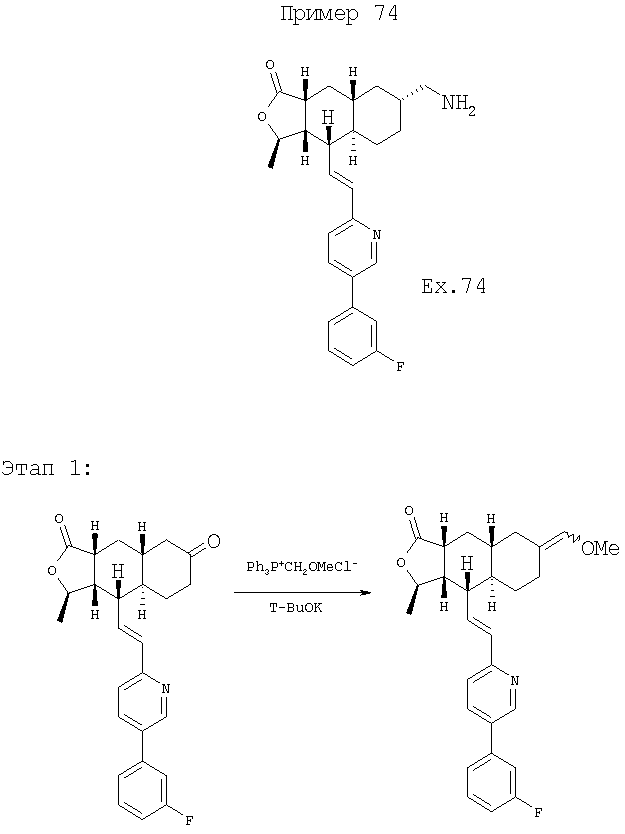
К суспензии хлорида (метоксиметил)трифенилфосфония (3,20 г, 9,34 ммоль) в 30 мл ТГФ при 0°С добавляют 1М раствор т-BuOK в ТГФ (10,3 мл, 10,3 ммоль) и перемешивают 30 минут. К этому раствору добавляют раствор кетона (1,95 г, 4,65 ммоль) в 25 мл ТГФ и 10 мл ДМФ. Реакционную смесь перемешивают 1 час при комнатной температуре, вливают в 300 мл водного раствора NH4Cl и экстрагируют EtOAc (3×75 мл). Объединенную органическую фазу промывают 75 мл солевого раствора, сушат над MgSO4, фильтруют, концентрируют и хроматографируют (40% EtOAc-гексаны), получают 1,67 г продукта. МС 448,1 (МН+).
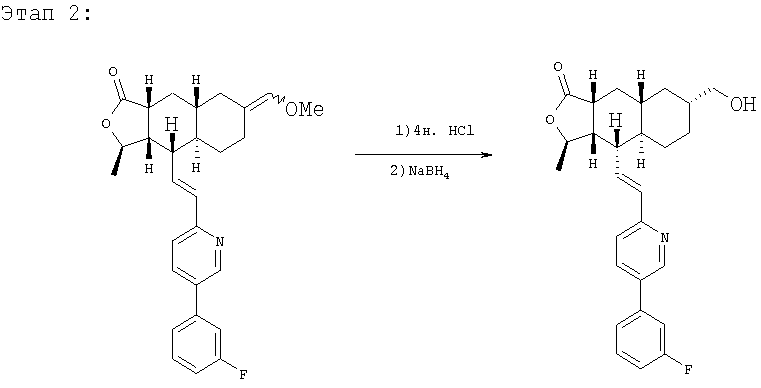
Раствор 1,67 г винилового эфира в 15 мл 4 н. раствора HCl в диоксане и 1,5 мл Н2О перемешивают 1,5 часа при комнатной температуре, вливают в 250 мл водного раствора Na2CO3 и экстрагируют ДХМ (3×50 мл). Объединенную органическую фазу промывают 50 мл солевого раствора, сушат над MgSO4, фильтруют, концентрируют и хроматографируют (40% EtOAc-гексаны), получают 1,36 г альдегида.
К раствору этого альдегида в 20 мл МеОН и 10 мл ТГФ при 0°С добавляют 120 мг NaBH4 и перемешивают 10 минут. Реакционную смесь вливают в 150 мл водного раствора NH4Cl и экстрагируют EtOAc (3×50 мл). Объединенную органическую фазу промывают 50 мл солевого раствора, сушат над MgSO4, фильтруют и концентрируют, получают 1,27 г спирта в виде белого твердого вещества. МСВР 436,2275 (МН+).
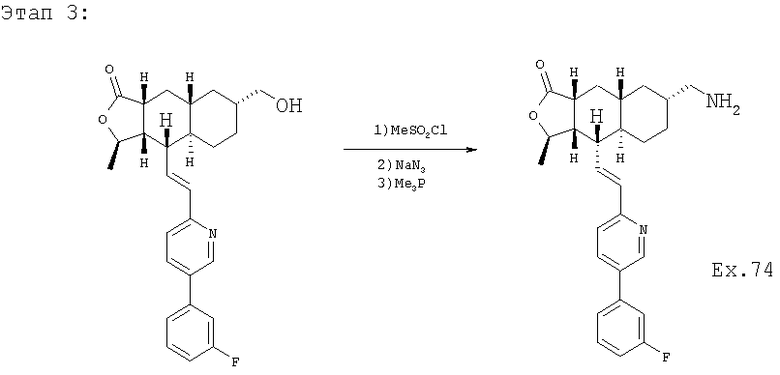
К раствору спирта (1,27 г, 2,92 ммоль) в 20 мл ДХМ при приблизительно -40°С добавляют 0,63 мл Et3N и 0,27 мл MeSO2Cl и оставляют раствор нагреться до 0°С в течение 1 часа. Затем добавляют еще 0,16 мл Et3N и 0,07 мл MeSO2Cl и перемешивают при 0°С еще 1 час. Смесь разбавляют 100 мл EtOAc и промывают водным раствором NaHCO3 (2×30 мл), 30 мл солевого раствора, сушат над MgSO4, фильтруют и концентрируют, получают 1,6 г мезилата.
Раствор этого мезилата перемешивают с 950 мг NaN3 (14,6 ммоль, 5 экв.) в 10 мл ДМСО (диметилсульфоксид) при 65°С в течение 1,5 часа. Реакционную смесь разбавляют 150 мл EtOAc, промывают Н2О (3×50 мл), 50 мл солевого раствора, сушат над MgSO4, фильтруют и концентрируют, получают 1,3 г азида.
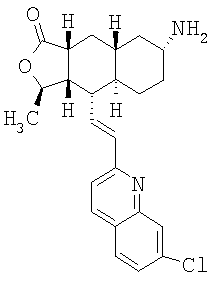
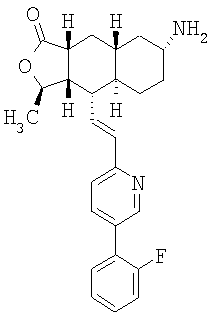
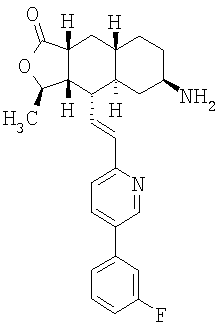
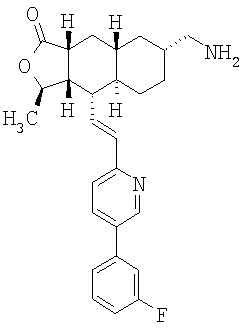
К раствору азида в 15 мл EtOAc и 0,2 мл Н2О при 0°С добавляют 1М раствор Ме3Р в ТГФ и перемешивают 4 часа при комнатной температуре. Реакционную смесь концентрируют и хроматографируют (4% МеОН-ДХМ), получают 1,06 г амина. МСВР 435,2445 (МН+).
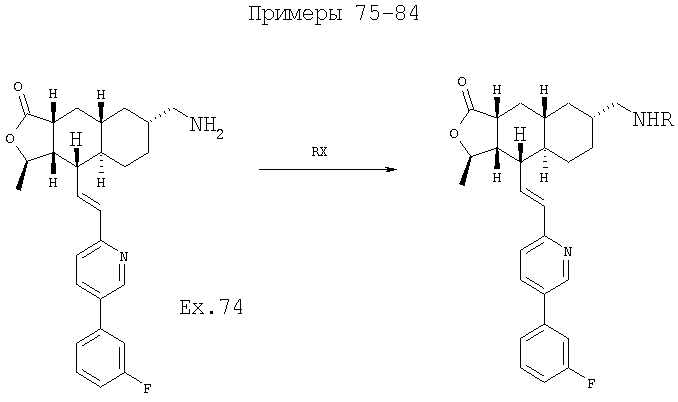
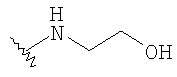
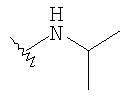
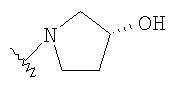
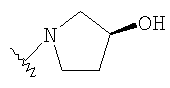
При использовании описанных выше методов амин обрабатывают различными электрофилами и получают соединения следующей структуры,
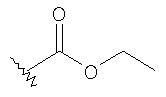
где R соответствует определениям в таблице 4.

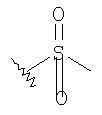
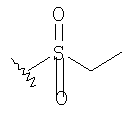
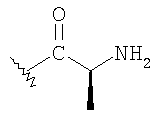
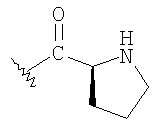
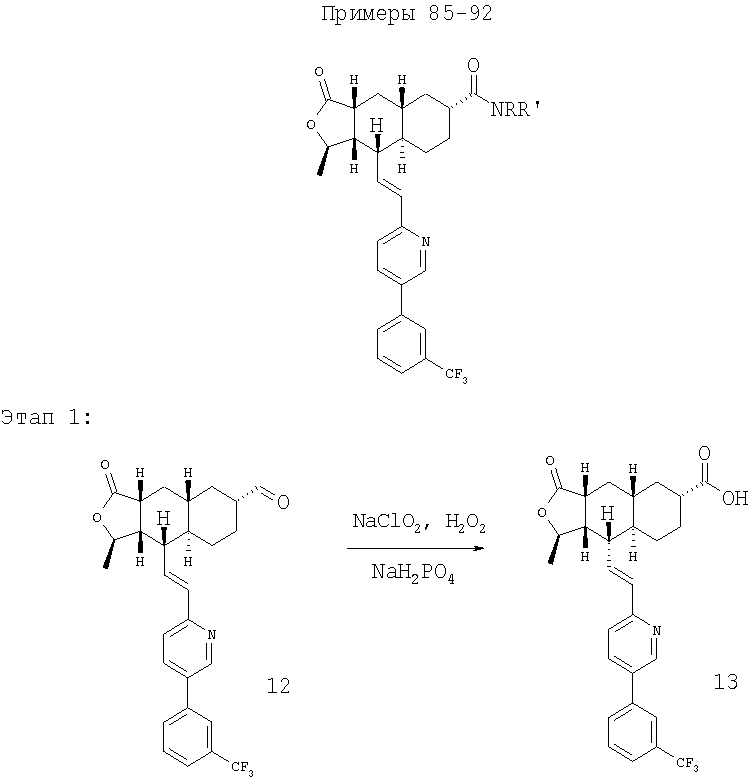
К раствору альдегида (2,19 г, 4,53 ммоль) в 40 мл СН3CN и 5 мл ДХМ добавляют раствор NaH2PO4 (135 мг, 1,13 ммоль, 0.25 экв.) и 30% водный раствор H2О2 (0,51 мл, 4,99 ммоль, 1,1 экв.) в 8 мл H2O. К этому добавляют раствор 80% NaClO2 (0.72 г, 6,37 момоль, 1,4 экв.) в 5 мл Н2O и перемешивают реакционную смесь при комнатной температуре в течение 2 часов. Смесь разбавляют 150 мл H2О, подкисляют 1 н. раствором HCl приблизительно до рН 3 и экстрагируют ДХМ (3×50 мл). Объединенную органическую фазу промывают 50 мл солевого раствора, сушат над MgSO4, фильтруют и концентрируют, получают 2,2 г карбоновой кислоты в виде твердого вещества. МСВР 450.2077 (МН+).

Общий метод
К раствору кислоты и амина (3 экв.) в смеси ДМФ-ДХМ добавляют HATU (2 экв.) и перемешивают в течение ночи при комнатной температуре. Реакционную смесь разбавляют EtOAc, промывают водным раствором NaHCO3, солевым раствором, сушат над MgSO4, фильтруют, концентрируют и хроматографируют, получают амид.
При использовании описанного выше метода получают соединения следующей структуры:
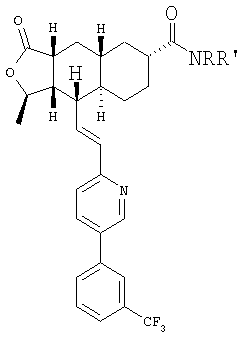
где NRR' соответствует определениям в таблице 5.
Для получения фармацевтических композиций из соединений, описанных в настоящем изобретении, можно использовать инертные, фармацевтически приемлемые носители в твердой или жидкой форме. К препаратам в твердой форме относятся порошки, таблетки, диспергированные гранулы, капсулы, пакетики и суппозитории. Содержание активного ингредиента в порошках и таблетках может составлять от около 5 до около 95%. В данной области техники известны подходящие твердые носители, например карбонат магния, стеарат магния, тальк, сахар или лактоза. Таблетки, порошки, пакетики и капсулы можно использовать в виде твердых дозировочных форм для перорального введения. Примеры фармацевтически приемлемых носителей и способы получения различных композиций можно найти в А. Gennaro (ed.), The Science and Practice of Pharmacy, 20th Edition, Lippincott Williams & Wilkins, Baltimore, MD (2000).
К препаратам в жидкой форме относятся растворы, суспензии и эмульсии. В качестве примера можно указать растворы в воде или смеси вода-пропиленгликоль для парентерального введения или добавление подсластителей и загустителей в растворы, суспензии и эмульсии для перорального введения. К препаратам в жидкой форме также могут относиться растворы для интраназального введения.
К аэрозольным препаратам для ингаляции относятся растворы и твердые вещества в форме порошка, которые могут быть скомбинированы с фармацевтически приемлемым носителем, таким как сжатый инертный газ, например азот.
Также рассматриваются препараты в твердой форме, которые незадолго до применения должны быть переведены в жидкую форму либо для перорального, либо парентерального применения. К таким жидким формам относятся растворы, суспензии и эмульсии.
Соединения согласно настоящему изобретению можно вводить также трансдермально. Для трансдермального введения применяют композиции в форме кремов, лосьонов, аэрозолей и/или эмульсий, а также в составе трансдермальных пластырей и резервуаров, как это принято в данной области техники.
Предпочтительным является пероральное введение соединения.
Предпочтительно применение фармацевтической композиции в единичной дозировочной форме. В таком случае препарат поделен на подходящие по размеру единичные дозы, содержащие требуемое количество активного компонента, например количество, эффективное для достижения желаемой цели.
Ежедневная доза соединения Формулы I для лечения указанных выше заболеваний и состояний составляет от около 0,001 до около 100 мг/кг массы тела в день, предпочтительно от около 0,001 до около 10 мг/кг. Для среднего тела массой 70 кг дозировка составляет, таким образом, от около 0,1 до около 700 мг лекарства в день одной дозой или 2-4 дробными дозами.
Количество и частота введения соединений согласно изобретению и/или их фармацевтически приемлемых солей регулируется по усмотрению врача с учетом таких факторов, как возраст, состояние и размер пациента, а также тяжесть симптомов.
Далее способы осуществления изобретения охватывают введение соединений Формулы I вместе с, по крайней мере, одним дополнительным сердечно-сосудистым агентом. Подходящий дополнительный сердечно-сосудистый агент отличается от соединений Формулы I либо по атомному составу, либо по структуре. К дополнительным сердечно-сосудистым агентам, которые можно использовать в комбинации с новыми соединениями настоящего изобретения, относятся лекарства, обладающие активностью против тромбоза, против агрегации тромбоцитов, против атеросклероза, против рестеноза и против коагуляции. Такие лекарства применяют в лечении заболеваний, связанных с тромбозом, к которым относятся тромбоз, атеросклероз, рестеноз, гипертензия, стенокардия, аритмия, сердечная недостаточность, инфаркт миокарда, гломерулонефрит, тромбический и тромбоэмболический инсульт, заболевания периферических сосудов, другие сердечно-сосудистые заболевания, церебральная ишемия, воспалительные заболевания и рак, а также другие заболевания, при которых тромбин и его рецептор играют патологическую роль. Подходящие сердечно-сосудистые агенты выбирают из группы, включающей ингибиторы биосинтеза тромбоксана А2, такие как аспирин; антагонисты тромбоксана, такие как сератродаст, пикотамид и раматробан; ингибиторы аденозиндифосфата (АДФ), такие как клопидогрел; ингибиторы циклооксигеназы, такие как аспирин, мелоксикам, рофекоксиб и целекоксиб; антагонисты ангиотензина, такие как валсартан, телмисартан, кандесартран, ирбесартран, лосартан и эпросартан; антагонисты эндотелина, такие как тезосентан; ингибиторы фосфодиэстеразы, такие как милринон и эноксимон; ингибиторы фермента, превращающего ангиотензин (АСЕ), такие как каптоприл, эналаприл, эналиприлат, спираприл, хинаприл, периндоприл, рамиприл, фосиноприл, трандолаприл, лизиноприл, моэксиприл и беназаприл; ингибиторы нейтральной эндопептидазы, такие как кандоксатрил и экадотрил; антикоагулянты, такие как ксимелагатран, фондапарин и эноксапарин; диуретики, такие как хлоротиазид, гидрохлоротиазид, этакриновая кислота, фуросемид и амилорид; ингибиторы агрегации тромбоцитов, такие как абсиксимаб и эптифибатид, и антагонисты GP IIb/IIIa.
Предпочтительными типами лекарств для применения в комбинации с новыми соединениями настоящего изобретения являются ингибиторы биосинтеза тромбоксана А2, ингибиторы циклооксигеназы и антагонисты АДФ. Наиболее предпочтительными для применения в комбинации являются аспирин и клопидогрел бисульфат.
Если изобретением предусмотрена комбинация соединения Формулы I и другого сердечно-сосудистого агента, два активных компонента можно вводить одновременно или последовательно или в виде одной фармацевтической композиции, содержащей соединение Формулы I и другой сердечно-сосудистый агент в фармацевтически приемлемом носителе. Компоненты комбинации можно вводить индивидуально или вместе в любой удобной дозировочной форме, такой как капсула, таблетка, порошок, пакетик, суспензия, раствор, суппозиторий, назальный спрей и подобные. Дозировку сердечно-сосудистого агента можно определить по печатным материалам, она может составлять от 1 до 1000 мг на дозу.
В настоящем описании термин "по крайней мере, одно соединение Формулы I" означает, что в фармацевтической композиции или способе лечения можно использовать от одного до трех различных соединений формулы I. Предпочтительно использовать одно соединение Формулы I. Аналогично термин “один или более дополнительных сердечно-сосудистых агентов” означает, что в комбинации с соединением Формулы I можно вводить от одного до трех дополнительных лекарств; предпочтительно вводить одно дополнительное соединение в комбинации с соединением Формулы I. Дополнительные сердечно-сосудистые агенты можно вводить последовательно или одновременно по отношению к соединению Формулы I.
Если отдельные соединения Формулы I и другие сердечно-сосудистые агенты вводят в виде отдельных композиций, они могут входить в состав набора, содержащего в одной упаковке один контейнер с соединением Формулы I в фармацевтически приемлемом носителе и отдельный контейнер с другим сердечно-сосудистым агентом в фармацевтически приемлемом носителе, причем количества соединения Формулы I и другого сердечно-сосудистого агента таковы, чтобы комбинация была терапевтически эффективной. Применение набора предпочтительно, например, если компоненты следует вводить с разными временными интервалами или они находятся в разных дозировочных формах.
Активность соединений Формулы I можно определить следующими способами.
Метод анализа антагонистов тромбинового рецептора in vitro
Получение [3H]haTRAP
A(pF-F)R(ChA)(hR)(I2-Y)-NH2 (1,03 мг) и 10% Pd/C (5,07 мг) суспендируют в ДМФ (250 мкл) и диизопропилэтиламине (10 мкл). Сосуд подсоединяют к тритиевой линии, замораживают в жидком азоте и отсоединяют. Затем в колбу добавляют газообразный тритий (342 мКи) и перемешивают при комнатной температуре 2 часа. После завершения реакции удаляют избыток трития, а раствор прореагировавшего пептида разбавляют ДМФ (0,5 мл) и фильтруют для удаления катализатора. Собранный раствор неочищенного пептида в ДМФ разбавляют водой и лиофилизируют для удаления лабильного трития. Твердый пептид растворяют в воде и повторяют процесс лиофилизации. Обработанный тритием пептид ([3H]haTRAP) растворяют в 0,5 мл 0,1% водного раствора ТФУ и очищают методом ВЭЖХ в следующих условиях: колонка, Vydac С18, 25 см×9,4 мм I.D. (внутренний диаметр); подвижная фаза, (А) 0,1% ТФУ в воде, (В) 0,1% ТФУ в СН3CN; градиент, (А/В) от 100/0 до 40/60 в течение 30 минут; скорость потока 5 мл/мин; детекция, УФ при 215 нм. Радиохимическая чистота [3H]haTRAP по результатам ВЭЖХ составляла 99%. Была получена порция 14,9 мКи со специфической активностью 18,4 Ки/ммоль.
Получение мембран тромбоцитов
Мембраны тромбоцитов получают модифицированным способом Natarajan et al. (Natarajan et al. Int. J. Peptide Protein Res., vol.45, pp.145-151 (1995) из 20 единиц концентратов тромбоцитов, полученных из North Jersey Blood Center (East Orange, N.J.) в течение 48 часов после сбора. Все этапы проводят при 4°С в условиях биобезопасности. Тромбоциты центрифугируют при 100×g в течение 20 минут при 4°С для удаления эритроцитов. Супернатанты декантируют и центрифугируют 15 минут при 3000×g для осаждения тромбоцитов. Тромбоциты ресуспендируют в растворе (10 мМ Tris-HCl, pH 7,5, 150 мМ NaCl, 5 мМ ЭДТА) до общего объема 200 мл и центрифугируют 10 минут при 4400×g. Этот этап повторяют еще два раза. Тромбоциты ресуспендируют в растворе (5 мМ Tris-HCl, pH 7,5, 5 мМ ЭДТА) до конечного объема приблизительно 30 мл и гомогенизируют 20 ударами в гомогенизаторе Даунса. Мембраны осаждают при 41000× g, ресуспендируют в растворе (40-50 мл 20 мМ Tris-HCl, pH 7,5, 1 мМ ЭДТА, 0,1 мМ дитиотрейтол), делят на аликвоты по 10 мл, замораживают их в жидком азоте и хранят при -80°С. Для завершения приготовления мембран аликвоты оттаивают, объединяют и гомогенизируют 5 ударами в гомогенизаторе Даунса. Мембраны осаждают и промывают 3 раза в растворе (10 мМ три-этаноламин-HCl, pH 7,4, 5 мМ ЭДТА) и ресуспендируют в 20-25 мл раствора (50 мМ Tris-HCl, pH 7,5, 10 мМ MgCl2, 1 мМ EGTA (этиленгликоль бис-2-аминоэтиловый эфир-NN'N"n'-тетрауксусная кислота) и 1% ДМСО (диметилсульфоксид)). Аликвоты мембран замораживают в жидком азоте и хранят при -80°С. Мембраны стабильны в течение, по крайней мере, 3 месяцев. Из 20 единиц концентратов тромбоцитов обычно получают 250 мг мембранного белка. Концентрацию белка определяют посредством анализа Лоури (Lowry et al., J. Biol. Chem., vol.193, pp.265-275 (1951).
Высокопроизводительный анализ связывания с радиолигандом тромбинового рецептора
Антагонисты тромбинового рецептора исследовали модифицированным методом анализа связывания с радиолигандом тромбинового рецептора Ahn et al. (Ahn et al., Mol. Pharmacol, vol.51, p.350-356 (1997). Исследование проводят в 96-луночных планшетах Nunc (Cat. No. 269620) в конечном объеме 200 мкл. Мембраны тромбоцитов и [3H]haTRAP разбавляют до концентрации 0,4 мг/мл и 22,2 нМ, соответственно, в буфере для связывания (50 мМ Tris-HCl, pH 7,5, 10 мМ MgCl2, 1 мМ EGTA, 0,1% БСА (бычий сывороточный альбумин)). Исходные растворы (10 мМ в 100% ДМСО) исследуемых соединений далее разбавляют в 100% ДМСО. Если не указано иначе, в каждую лунку добавляют 10 мкл разбавленного раствора соединения и 90 мкл радиолиганда (конечная концентрация 10 нМ в 5% ДМСО) и начинают реакцию добавлением 100 мкл мембран (40 мгк белка/лунку). 5% ДМСО не оказывает заметного ингибирующего действия на связывание. Соединения исследуют в трех концентрациях (0,1, 1 и 10 мкМ). Планшеты накрывают и аккуратно встряхивают на шейкере Lab-Line Titer Plate Shaker в течение одного часа при комнатной температуре. Планшеты для фильтрования Packard UniFiIter GF/C осушают, по крайней мере, в течение 1 часа в 0,1% полиэтиленимине. Инкубированные мембраны собирают при помощи Packard FilterMate Universal Harvester и быстро промывают четыре раза 300 мкл ледяного 50 мМ Tris-HCl, pH 7,5, 10 мМ MgCl2 1 мМ EGTA. В каждую лунку добавляют сцинтилляционную смесь MicroScint 20 (25 мкл) и учитывают планшеты при помощи сцинтилляционного счетчика Packard TopCount Microplate Scintillation Counter. Специфическое связывание определяют как разницу между общим связыванием и неспецифическим связыванием, наблюдаемым в присутствии избытка (50 мкМ) немеченого haTRAP. Процент ингибирования соединением связывания [3H]haTRAP с тромбиновыми рецепторами определяют из следующего соотношения:

Затем при помощи следующей формулы определяют величины аффинности (Кi):
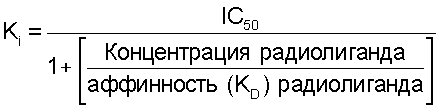
Таким образом, более низкое значение Кi указывает на большую аффинность связывания.
Материалы
A(pF-F)R(ChA)(hR)Y-NH2 и A(pF-F)R(ChA)(hR)(I2-Y)-NH2 синтезированы в AnaSpec Inc. (San Jose, CA). Чистота этих пептидов составляла >95%. Газообразный тритий (97%) получали из EG&G Mound, Miamisburg Ohio. Затем газ загружали и хранили в IN/US Systems Inc. Trisorber. Сцинтилляционную смесь MicroScint 20 получали из Packard Instrument Co.
Протокол агрегации тромбоцитов ex vivo в цельной крови обезьян Cynomolgus
Введение лекарств и сбор крови
Обезьян Cynomolgus в сознании иммобилизуют в кресле и оставляют успокоиться на 30 минут. В плечевую вену вводят иглу-катетер для подачи исследуемых препаратов. Еще одну иглу-катетер вводят в другую плечевую или ножную вену и используют для отбора крови. В экспериментах, где соединение вводят перорально, используют только один катетер. Базовый образец крови (1-2 мл) собирают в вакуумируемые пробирки, содержащие в качестве антикоагулянта ингибитор тромбина CVS 2139 (100 мкг/0,1 мл физраствора). Затем внутривенно в течение 30 минут вводят препарат. Образцы крови (1 мл) отбирают через 5, 10, 20, 30 минут во время и 30, 60, 90 минут после окончания введения препарата. В экспериментах с пероральным введением препарат дают животным при помощи зонда. Образцы крови отбирают через 0, 30, 60, 90, 120, 180, 240, 300, 360 минут после введения. 0,5 мл крови используют для агрегации цельной крови, а другие 0,5 мл используют для определения концентрации препарата или его метаболитов в плазме. Агрегацию проводят сразу после отбора образца крови, как описано ниже.
Агрегация цельной крови
Образец крови 0,5 мл добавляют к 0,5 мл физиологического раствора и нагревают до 37°С в агрегометре цельной крови Chronolog. Одновременно электрод импеданса нагревают в физиологическом растворе до 37°С. Образец крови с мешалкой помещают в лунку блока подогрева, помещают в образец электрод импеданса и запускают программное обеспечение. Программа идет до стабилизации базовой линии, затем проводят калибровку 20Ω. 20Ω соответствуют 4 блокам на графике, выдаваемом компьютерной программой. Пипеткой с переменным объемом (5-25 мкл) вносят агонист (haTRP) и в течение 10 минут записывают кривую агрегации. Записывают величину, соответствующую максимальной агрегации через 6 минут после добавления агониста.
Агрегация тромбоцитов in vitro
Исследование агрегации тромбоцитов поводят согласно методу Bednar et al. (Bednar, В., Condra, С., Gould, R.J., and Connolly, T.M., Throm. Res.. vol.77, pp.453-463 (1995)). Кровь получают от здоровых людей, не получавших аспирин, по крайней мере, 7 дней, путем отбора из вены при использовании в качестве антикоагулянта ACD. Плазму, богатую тромбоцитами, получают центрифугированием при 100×g при 15°С в течение 15 минут. Тромбоциты осаждают при 3000×g и дважды промывают буферным физиологическим раствором, содержащим 1 мМ EGTA и 20 мкг/мл апиразы для ингибирования агрегации. Агрегацию проводят при комнатной температуре в буферном физиологическом растворе с 0,2 мг/мл фибриногена человека. Исследуемые соединения и тромбоциты предварительно инкубируют в течение 60 минут в 96-луночных планшетах с плоским дном. Агрегацию инициируют добавлением 0,3 мкМ haTRAP или 0,1 ед/мл тромбина и быстрым встряхиванием смеси на шейкере Lab Line Titer Plate Shaker (скорость 7). Процент агрегации отслеживают по увеличению пропускания света при 405 нм на приборе Spectromax Plate Reader.
Противоопухолевая процедура in vivo
Исследования на модели рака молочной железы человека на голых мышах проводят согласно методу, описанному S. Even-Ram et. al. Nature Medicine. 4, 8, pp.909-914 (1988).
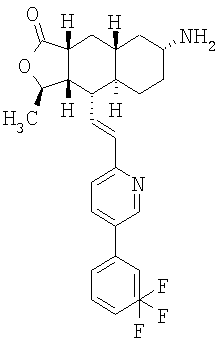
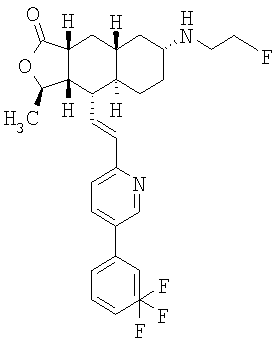
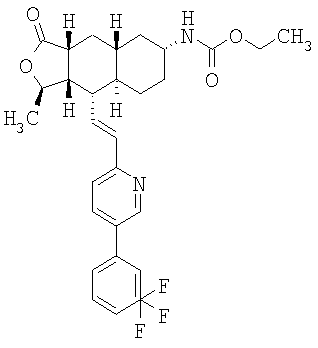
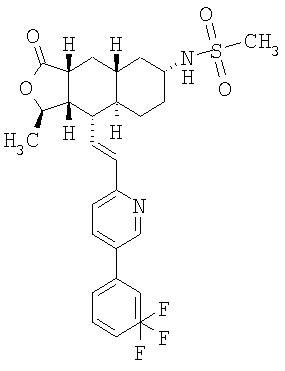
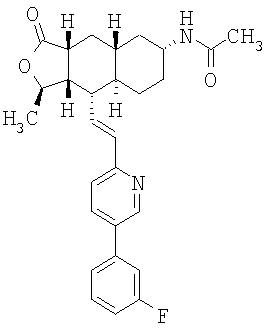
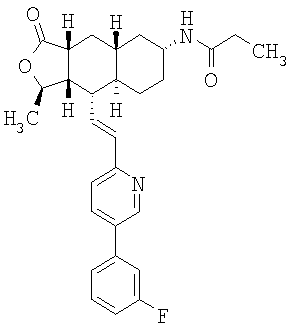
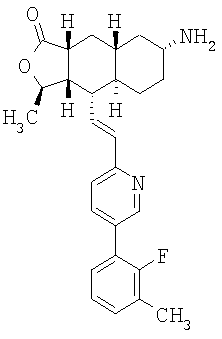
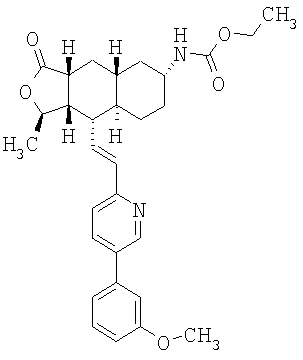
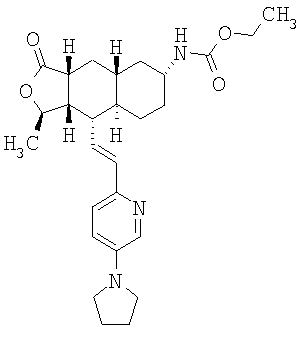
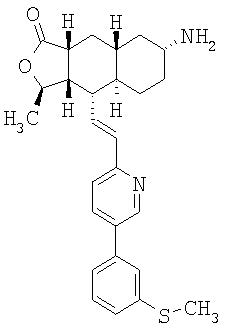
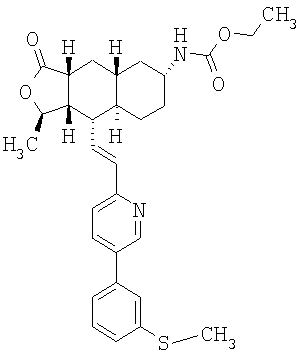
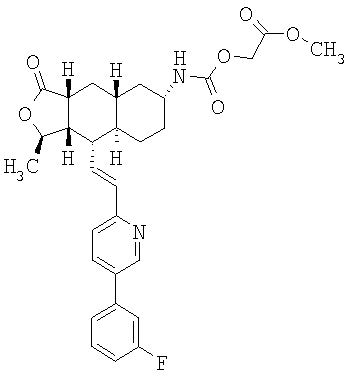
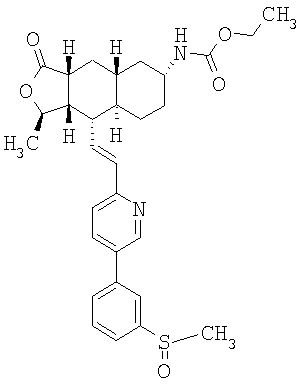
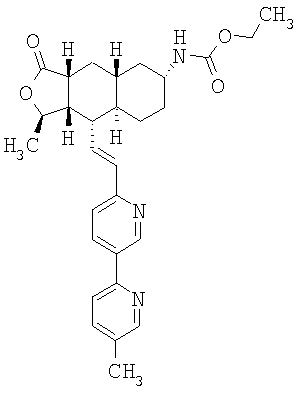
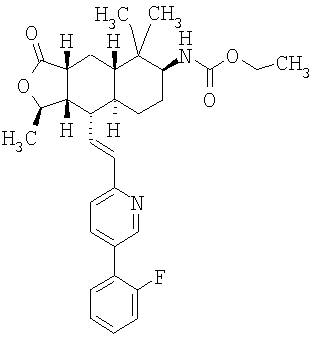
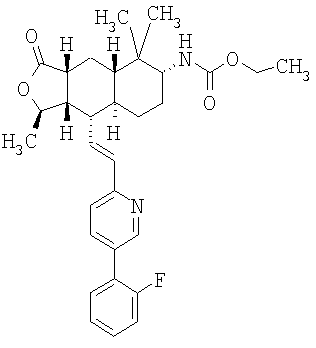
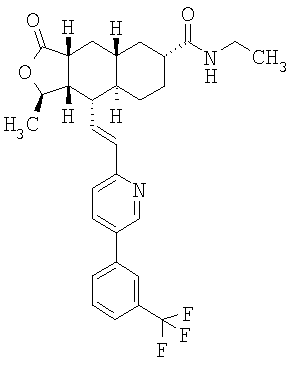
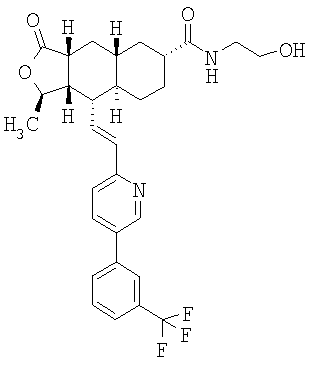
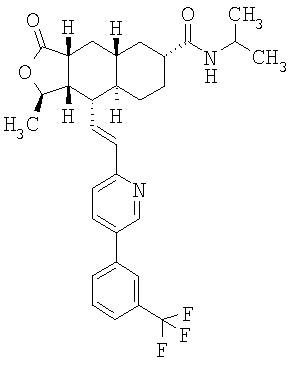
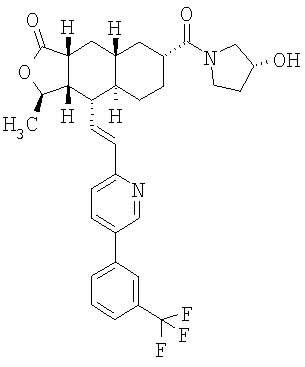
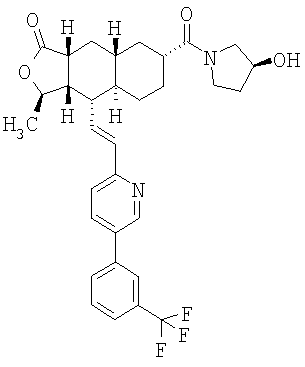
Соединения настоящего изобретения удивительно активны в модели агрегации тромбоцитов ex-vivo. В этих исследованиях соединение Примера 2 настоящего изобретения после введения в дозе 0,1 мг/кг полностью ингибирует агрегацию тромбоцитов, индуцированную добавленным извне пептидом, активирующим тромбиновый рецептор, в течение 24 часов. Даже спустя 48 часов сохранялось приблизительно 65%-ное ингибирование агрегации тромбоцитов. Для сравнения N-алкилкарбаматные аналоги, соединения Примеров 1А, 2А и 13 патента США 6063847 исследовали в подобных условиях, в концентрации 0,5 мг/кг, что в 5 раз превышает дозу соединения Примера 2. В этих условиях N-алильные соединения не вызывали заметного ингибирования агрегации тромбоцитов в разные моменты времени.
Хотя настоящее изобретение описано вместе со специфическими способами осуществления, приведенными выше, специалист в данной области техники может предположить различные альтернативы, модификации и вариации этих способов. Все такие альтернативы, модификации и вариации рассматриваются как составляющие объем и сущность настоящего изобретения.





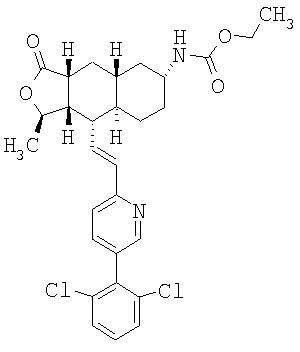
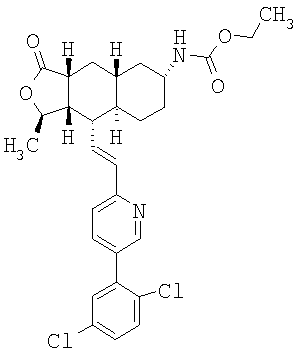
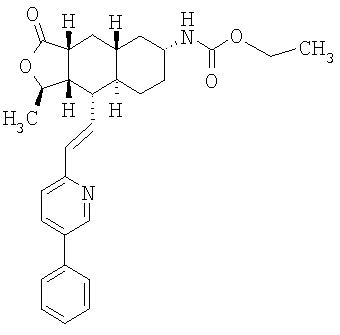
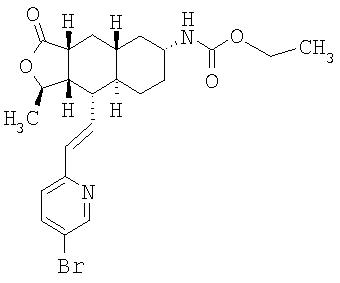

| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ НОР-СЕКО ХИМБАЦИНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ИНГИБИРОВАНИЯ НА ИХ ОСНОВЕ | 2001 |
|
RU2293735C2 |
| ИНГИБИТОРЫ АРОМАТАЗЫ | 2010 |
|
RU2572244C2 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛОПИРИМИДИНА, КАК ИНГИБИТОРЫ ЦИКЛИН-ЗАВИСИМОЙ КИНАЗЫ | 2005 |
|
RU2414472C9 |
| МАКРОГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ | 2001 |
|
RU2275373C2 |
| НОВЫЕ БИЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ИХ | 2016 |
|
RU2760554C1 |
| АЗОЛЬНЫЕ И ТИАЗОЛЬНЫЕ ПРОИЗВОДНЫЕ И ИХ ПРИМЕНЕНИЯ | 2006 |
|
RU2436779C2 |
| ПРОИЗВОДНЫЕ N2-(2-ФЕНИЛ)-ПИРИДО[3,4-d]ПИРИМИДИН-2,8-ДИАМИНА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ MPS1 ИНГИБИТОРА | 2015 |
|
RU2693460C2 |
| НОВЫЕ ГИДРОКСИКИСЛОТНЫЕ ПРОИЗВОДНЫЕ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ИХ | 2016 |
|
RU2745430C1 |
| ТЕТРАЦИКЛИЧЕСКИЕ ГЕТЕРОСОЕДИНЕНИЯ В КАЧЕСТВЕ МОДУЛЯТОРОВ ЭСТРОГЕННЫХ РЕЦЕПТОРОВ | 2002 |
|
RU2305099C2 |
| ТРИЦИКЛИЧЕСКИЕ ПРОТИВООПУХОЛЕВЫЕ СОЕДИНЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ НА ИХ ОСНОВЕ | 2001 |
|
RU2293734C9 |
Трициклические соединения, замещенные гетероциклом, имеющие формулу (I)
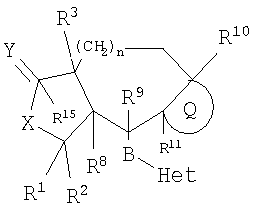
или их фармацевтически приемлемая соль или сольват,
в которых n означает 0-2;
Q означает
R1 означает Н,
R2 представляет собой Н или алкил с 1-6 атомами углерода,
R3 представляет собой Н, гидроксигруппу, -NR22R23,
Het означает моно- или бициклическую гетероарильную группу из 5-10 атомов, содержащую от 1 до 9 атомов углерода и 1 гетероатом N, где Het соединяется с В через кольцевой атом углерода, и группа Het имеет заместитель W,
W представляет собой от 1 до 4 заместителей, независимо выбираемых из группы, включающей Н, галоген, R21-арил и R21-гетероарил,
R4 и R5 независимо выбирают из группы, включающей Н и алкил с 1-6 атомами углерода,
R7, R8, R10 и R11 означает R1,
R9 представляет собой Н,
В представляет собой -(СН2)n3-, цис- или транс-(CH2)n4CR12=CR12a(CH2)n5 или -(СН2)n4С≡С(СН2)n5, где n3 означает 0-5, n4 и n5 независимо означают 0-2, а R12 и R12a означает Н,
X представляет собой -O-,
Y представляет собой =O,
каждый R13 независимо выбирают из группы, включающей Н, алкил с 1-6 атомами углерода, -(CH2)n6NHC(O)OR16b, -(CH2)n6NHC(O)R16b,
-(CH2)n6NHC(O)NR4R5, -(CH2)n6NHSO2R16 и
-(CH2)n6C(O)NR28R29, где n6 означает 0,
каждый R14 независимо выбирают из группы, включающей Н, алкил с 1-6 атомами углерода, -(CH2)n6NHC(O)OR16b, -(CH2)n6NHC(O)R16b, -(CH2)n6NHC(O)NR4R5, -(CH2)n6NHSO2R16 и -(CH2)n6C(O)NR28R29, где n6 означает 0,
где, по крайней мере, один из R13 и R14 выбирают из группы, включающей
-(CH2)n6NHC(O)OR16b, -(CH2)n6NHC(O)R16b, -(CH2)n6NHC(O)NR4R5, -(CH2)n6NHSO2R16 и -(CH2)n6C(O)NR28R29, где n6 означает 0,
R16 представляет собой алкил с 1-6 атомами углерода,
R16b представляет собой Н, алкил с 1-6 атомами углерода, (алкокси с 1-6 атомами углерода)-(алкил с 1-6 атомами углерода)-, R22-О-С(О)-(алкил с 1-6 атомами углерода)-, циклоалкил с 3-6 атомами углерода,
R21 представляет собой от 1 до 3 заместителей, независимо выбираемых из группы, включающей Н, -CN, -CFa3, галоген, алкил с 1-6 атомами углерода, -ОН, алкоксигруппу с 1-6 атомами углерода, -C(O)NR25R26 и -SR13,
R22 представляет собой Н или алкил с 1-6 атомами углерода,
R23 представляет собой Н,
R25 и R26 независимо выбирают из группы, включающей Н и алкил с 1-6 атомами углерода, и
R28 и R29 независимо выбирают из группы, включающей Н, алкил с 1-6 атомами углерода, гетероарил, гетероциклил,
а также фармацевтические композиции, содержащие эти соединения, и их применения для получения лекарственного средства для лечения заболеваний, связанных с тромбозом, атеросклерозом, рестенозом, гипертензией, стенокардией, аритмией, сердечной недостаточностью и раком, путем введения указанных соединений. Также заявлена терапия в комбинации с другими сердечно-сосудистыми агентами. 5 н. и 18 з.п. ф-лы, 7 табл.
1. Соединение, представляемое структурной формулой
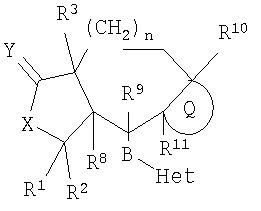
или его фармацевтически приемлемая соль или сольват, в котором:
п означает 0-2,
Q означает
R1 означает Н, алкал с 1-6 атомами углерода,
R2 представляет собой Н или алкил с 1-6 атомами углерода,
R3 представляет собой Н, гидроксигруппу, -NR22R23,
Het означает моно- или бициклическую гетероарильную группу из 5-10 атомов,
содержащую от 1 до 9 атомов углерода и 1 гетероатом N, где Het соединяется с В через кольцевой атом углерода и группа Het имеет заместитель W,
W представляет собой от 1 до 4 заместителей, независимо выбираемых из группы, включающей Н, галоген, R21-арил и R21-гетероарил,
R4 и R5 независимо выбирают из группы, включающей Н и алкил с 1-6 атомами углерода,
R7, R8, R10 и R11 означают R1,
R9 представляет собой Н,
В представляет собой -(СН2)n3-, цис или транс -(CH2)n4CR12=CR12a(CH2)n5- или -(СН2)n4С≡С(СН2)n5-, где n3 означает 0-5, n4 и n5 независимо означают 0-2, а R12 и R12a означает Н,
Х представляет собой -O-,
Y представляет собой =O,
каждый R13 независимо выбирают из группы, включающей Н, алкил с 1-6 атомами углерода, -(CH2)n6NHC(O)OR16b, -(CH2)n6NHC(O)R16b,
-(CH2)n6NHC(O)NR4R5, -(CH2)n6NHSO2R16, и
-(CH2)n6C(O)NR28R29, где n6 означает 0,
каждый R14 независимо выбирают из группы, включающей Н, алкил с 1-6 атомами углерода, -(CH2)n6NHC(O)OR16b, -(CH2)n6NHC(O)R16b, -(CH2)n6NHC(O)NR4R5,
-(CH2)n6NHSO2R16 и -(CH2)n6C(O)NR28R29, где n6 означает 0,
где, по крайней мере, один из R13 и R14 выбирают из группы, включающей
-(CH2)n6NHC(O)OR16b, -(CH2)n6NHC(O)R16b, -(CH2)n6NHC(O)NR4R5, -(CH2)n6NHSO2R16 и -(CH2)n6C(O)NR28R29, где n6 означает 0,
R16 представляет собой алкил с 1-6 атомами углерода,
R16b представляет собой Н, алкил с 1-6 атомами углерода, (алкокси с 1-6 атомами углерода)-(алкил с 1-6 атомами углерода)-, R22-О-С(О)-(алкил с 1-6 атомами углерода)-, циклоалкил с 3-6 атомами углерода, R21 представляет собой от 1 до 3 заместителей, независимо выбираемых из группы, включающей Н, -CN, -CF3, галоген, алкил с 1-6 атомами углерода; -ОН, алкоксигруппу с 1-6 атомами углерода, -C(O)NR25R26 и -SR13,
R22 представляет собой Н или алкил с 1-6 атомами углерода,
R23 представляет собой Н,
R25 и R26 независимо выбирают из группы, включающей Н и алкил с 1-6 атомами углерода, и
R28 и R29 независимо выбирают из группы, включающей Н, алкил с 1-6 атомами углерода, гетероарил, гетероциклил.
2. Соединение по п.1, в котором n означает 0.
3. Соединение по п.1, в котором R3 представляет собой Н.
4. Соединение по п.1, в котором Het представляет собой пиридил, соединенный с В через кольцевой атом углерода, и имеет 1-2 заместителя, выбираемых из W.
5. Соединение по п.4, в котором W представляет собой R21-фенил или R21-пиридил.
6. Соединение по п.1, в котором каждый R8, R10 и R11 независимо выбирают из группы, включающей Н и алкил с 1-6 атомами углерода, а R9 представляет собой Н.
7. Соединение по п.5 или 6, в котором В представляет собой -СН=СН-.
8. Соединение по п.1, в котором Q представляет собой
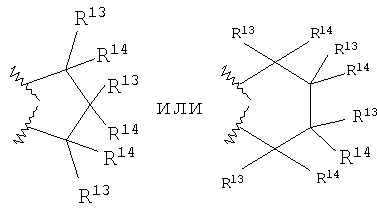
где, по крайней мере, один из R13 и R14 представляет собой R, причем R представляет собой -(CH2)n6NHC(O)OR16b, -(CH2)n6NHC(O)R16b, -(CH2)n6NHC(O)NR4R5, -(CH2)n6NHSO2R16 где n6 означает 0, R16b, R16 и R4 представляют собой алкил с 1-6 атомами углерода, а R5 представляет собой Н.
9. Соединение по п.8, в котором Q представляет собой
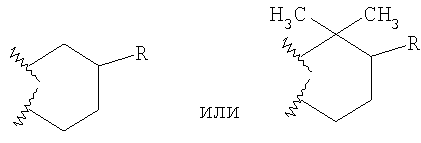
где R имеет указанное в п.8 значение.
10. Соединение по п.8, в котором R представляет собой -NHC(O)OR16b, -NHC(O)R16b или -NHC(O)NR4R5, R16b и R4 представляют собой алкил с 1-6 атомами углерода, а R5 представляет собой Н.
11. Соединение по п.10, в котором R представляет собой -NHC(O)OR16b, где R16b представляет собой алкил с 1-6 атомами углерода.
12. Соединение по п.1, в котором каждый из R2, R3, R8, R9, R10 и R11 представляет собой водород, R1 представляет собой -СН3, В представляет собой -СН=СН-, Het представляет собой W-пиридил, W представляет собой R21-фенил или R21-пириил, а R21 представляет собой -CF3 или F.
13. Соединение по п.12, в котором R представляет собой -NHC(O)OR16b, где R16b представляет собой -СН3 или -СН2СН3.
14. Соединение по п.1, выбираемое из группы, включающей:
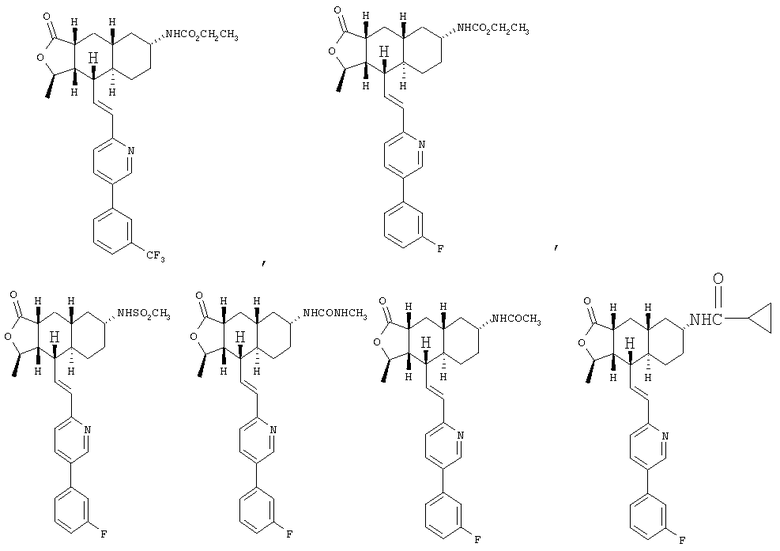
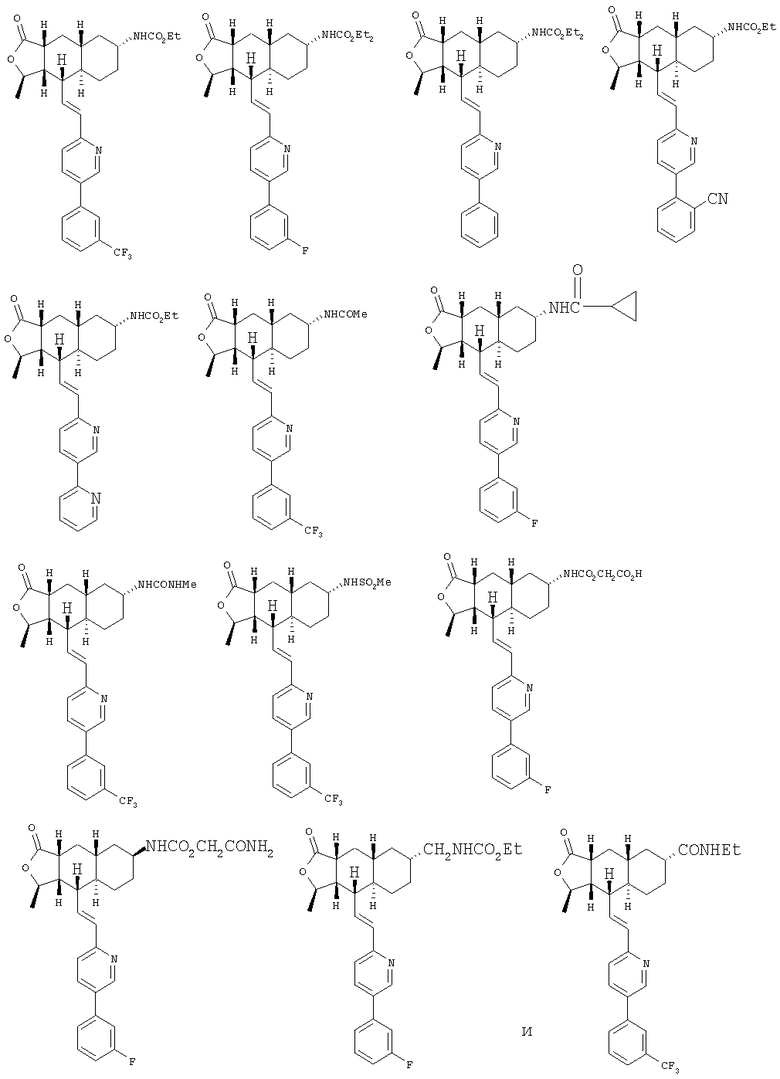 .
.
15. Соединение по п.1, представляющее собой
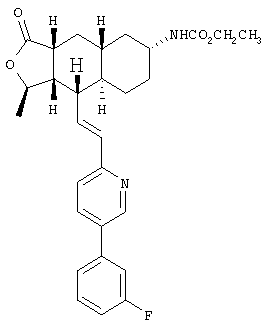 .
.
16. Соединение по п.15, представляющее собой бисульфат.
17. Соединение по п.1, выбираемое из группы, включающей
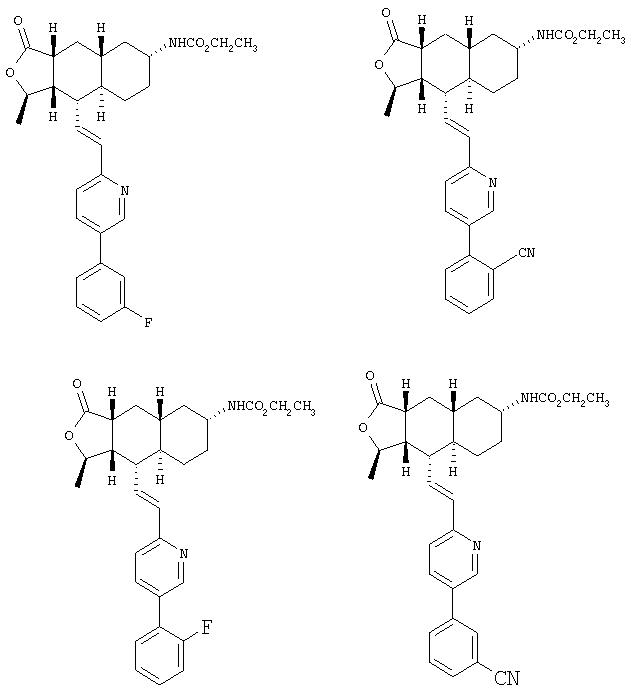
18. Фармацевтическая композиция, обладающая свойствами антагониста рецептора тромбина, содержащая эффективное количество соединения по п.1 и фармацевтически приемлемый носитель.
19. Применение соединения по п.1 для получения лекарственного средства для ингибирования рецепторов тромбина.
20. Применение соединения по п.1 для получения лекарственного средства для лечения тромбоза, атеросклероза, рестеноза, гипертензии, стенокардии, аритмии, сердечной недостаточности, инфаркта миокарда, гломерулонефрита, тромбического инсульта, тромбоэмболического инсульта, заболеваний периферических сосудов, воспалительных заболеваний, церебральной ишемии и рака.
21. Применение соединения по п.1 в комбинации с другим сердечно-сосудистым агентом для получения лекарственного средства для лечения тромбоза, атеросклероза, рестеноза, гипертензии, стенокардии, аритмии, сердечной недостаточности, инфаркта миокарда, гломерулонефрита, тромбического инсульта, тромбоэмболического инсульта, заболеваний периферических сосудов, воспалительных заболеваний, церебральной ишемии и рака.
22. Применение по п.21, в котором другой сердечно-сосудистый агент выбирают из группы, включающей ингибиторы биосинтеза тромбоксана А2, антагонисты GP IIb/IIIa, антагонисты тромбоксана, ингибиторы аденозин дифосфата, ингибиторы циклооксигеназы, антагонисты ангиотензина, антагонисты эндотелина, ингибиторы фермента, превращающего ангиотензин, ингибиторы нейтральной эндопептидазы, антикоагулянты, диуретики и ингибиторы агрегации тромбоцитов.
23. Применение по п.22, в котором другой сердечно-сосудистый агент выбирают из ацетилсалициловой кислоты или клопидогрела в виде бисульфата.
| US 6063847 A, 16.02.2000 | |||
| WO 9926943 A1, 03.06.1999 | |||
| WO 0196330 A2, 20.12.2001 | |||
| N-ИМИДАЗОЛИЛЬНЫЕ ПРОИЗВОДНЫЕ ЗАМЕЩЕННЫХ АЛКОКСИИМИНОТЕТРАГИДРОНАФТАЛИНОВ ИЛИ ХРОМАНОВ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ПРОЯВЛЯЮЩАЯ АКТИВНОСТЬ АНТАГОНИСТА ТРОМБОКСАНА И ИНГИБИТОРА ТРОМБОКСАНСИНТАЗЫ | 1992 |
|
RU2083566C1 |
| КОНДЕНСИРОВАННЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1991 |
|
RU2095361C1 |
Авторы
Даты
2008-07-20—Публикация
2003-04-14—Подача