Изобретение касается способа получения 2-циан-3-гидрокси-N-(фенил)бут-2-енамида, в особенности получения 2-циан-3-гидрокси-N-[(4-трифторметил)(фенил)]бут-2-енамида из 2-циан-N-(4-трифторметилфенил)ацетамида.
Соединение 2-циан-3-гидрокси-N-[(4-трифторметил)(фенил)]бут-2-енамид является известным (патент США 5679709). Способ получения 2-циан-3-гидрокси-N-[(4-трифторметил)(фенил)]бут-2-енамида описан, например, в патенте США 5519042 или патенте США 5700822. Недостатками известных способов являются малый выход продукта и низкая чистота.
Было установлено, что 2-циан-3-гидрокси-N-[фенил]бут-2-енамиды могут быть получены из 2-циан-N-(фенил)ацетамида в присутствии уксусного ангидрида и гидроксида натрия.
В связи с этим изобретение касается способа получения соединения формулы I
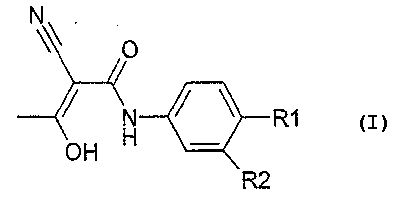
причем
R1 обозначает
a) -CF3,
b) -O-CF3,
c) -S-CF3,
d) -OH,
e) -NO2,
f) галоген,
g) бензил,
h) фенил,
i) -O-фенил,
k)-CN,
l)-O-фенил, одно- или многократно замещенный
1) -(С1-С4)-алкилом,
2) галогеном,
3) -O-CF3 или
4) -O-CH3, и
R2 обозначает
a) -(С1-С4)-алкил,
b) галоген или
c) атом водорода,
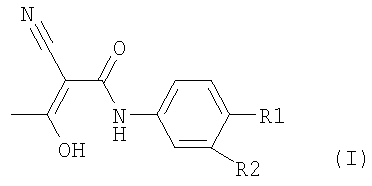
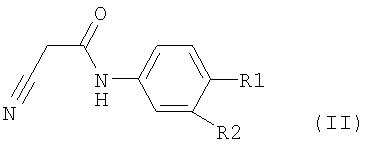
отличающегося тем, что соединение формулы II,

где R1 и R2 определены, как описано выше,
подвергают превращению в присутствии, по меньшей мере, одного основания, уксусного ангидрида и, по меньшей мере, одного растворителя и затем выделяют образовавшееся соединение формулы I.
Далее изобретение касается способа получения соединения формулы III
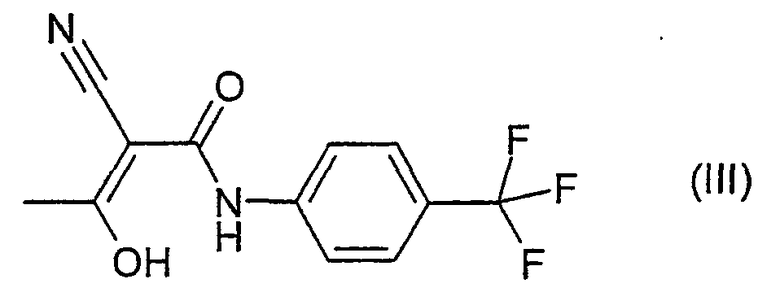

отличающегося тем, что соединение формулы IV
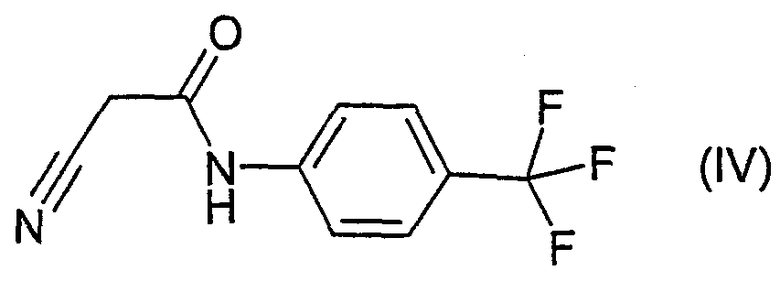
подвергают превращению в присутствии воды, гидроксида натрия, уксусного ангидрида и дополнительного растворителя и затем выделяют образовавшееся соединение формулы III.
При получении соединения формулы I исходят из того, что сначала соединение формулы II или (2-циан-N-(4-трифторметилфенил)ацетамид) вводят в растворитель и полученный раствор или суспензию охлаждают. Затем добавляют водный раствор гидроксида натрия и уксусный ангидрид и полученную реакционную смесь при охлаждении перемешивают или встряхивают.
Через соответствующее время реакции соединение формулы I осаждают кислотой. Выделение соединения формулы I происходит, например, путем кристаллизации или экстракцией, например, этилацетатом или толуолом. Кристаллизации способствует охлаждение суспензии или последующее выпаривание растворителя.
Под термином «растворитель» имеют в виду, например, воду, органические растворители, например кетонные растворители, такие как ацетон, метилэтилкетон или метилизобутилкетон; галогенированные углеводороды, такие как дихлорметан; спирты, такие как этанол, изопропанол или н-бутанол; простые эфиры, такие как диизопропиловый эфир, диэтоксиметан или диметиловый эфир диэтиленгликоля; углеводороды, такие как толуол; сложные эфиры, такие как этилацетат; апротонные растворители, такие как диметилформамид, диметилацетамид, диметилсульфоксид или N-метилпирролидинон, или смеси названных растворителей, или имеют в виду катализаторы межфазного переноса, такие как четвертичные аммониевые или фосфониевые соли, например диметилдитетрадециламмоний бромид, бензил-триэтил-аммоний хлорид, Alliquat® 336 (3-метил-триоктиламмоний хлорид), тетрабутиламмоний гидросульфат, или тетрабутилфосфоний хлорид; краун-эфиры или криптанды, такие как 18-краун-6 или криптанд 222 [=4,7,13,16,21,24-гексаокса-1,10-диазабицикло-(8.8.8)гексакозан]; или могут использовать полиэтиленгликоль, что особенно имеет преимущество для плохо смешивающихся с водой растворителей, таких как толуол.
Под термином «основание» понимают гидроксиды щелочных металлов, например гидроксид натрия или гидроксид калия, гидроксид натрия в твердой форме или в форме щелочей различных концентраций, гидриды щелочных металлов и гидриды щелочноземельных металлов, например гидрид натрия, гидрид кальция; амиды, например амид натрия; алкоголяты, например этилат натрия, трет.-бутилат калия, металлорганические соединения, например н-бутиллитий; или амины, например диэтилизопропиламин, или смеси названных неорганических оснований. Вода, присутствующая в щелочи, затем принимается в расчет при приготовлении реакционной смеси.
Под термином «галоген» понимают фтор, хлор, бром и йод.
Под термином «-(С1-С4)-алкил» понимают углеводородные остатки, такие как метил, этил, пропил, н-бутил или изобутил.
Пригодными кислотами являются, например, соляная кислота, серная кислота, азотная кислота или фосфорная кислота или смеси кислот.
Для реакции согласно изобретению предпочтительно используют на 100 моль соединения формулы II или IV 150 моль - 300 моль уксусного ангидрида и 100-550 моль гидроксида натрия.
Используемое количество растворителя в общем составляет от 3 кг до 11 кг на кг соединения формулы II или IV, предпочтительно от 4 кг до 6 кг.
Время реакции, в общем, составляет от нескольких минут до 24 часов, предпочтительно 1-3 часа в зависимости от состава смеси и выбранной области температур.
Температура реакции имеет значение от -5°C до 50°C, предпочтительно от 0°C до 30°C, в особенности 10°С.
Остаточное содержание исходного вещества соединения формулы II или 2-циан-N-(4-трифторметилфенил)ацетамида в выделенном 2-циан-3-гидрокси-N-[(4-трифторметил)фенил]бут-2-енамиде могло быть сокращено до значения ниже 0,5%.
Исходное вещество для реакции согласно изобретению получают по известному из литературы способу, например, описанному в патенте DE 1900947.
Продукт способа является биологически активным и пригоден, например, для лечения ревматоидного артрита или рассеянного склероза.
В способе согласно изобретению преимуществами являются: очень сокращенное время реакции, отсутствие дополнительных стадий очистки, высокие выходы и высокая чистота получаемого продукта. Преимуществом способа согласно изобретению является по существу полное превращение до соединения формулы I или 2-циан-3-гидрокси-N-[(4-трифторметил)фенил]бут-2-енамида и общее содержание побочных продуктов менее 1%.
Пример 1
Получение 2-циан-3-гидрокси-N-[(4-трифторметил)фенил]бут-2-енамида
В тефлоновый реактор с баней (фриттой) (Fritte) помещают 2,5 г 2-циан-N-(4-трифторметилфенил]ацетамида и 0,127 г диметилдитетрадециламмоний бромида. Реактор заполняют аргоном и добавляют 15 мл диэтоксиметана. Осуществляют встряхивание, и охлаждают до 15°С. Добавляют вручную 1,73 мл водного 50%-ного раствора NaOH и в течение 5-20 мин прибавляют в совокупности 2,12 мл уксусного ангидрида. Вслед за этим происходит многократный контроль реакционной смеси посредством ВЭЖХ. Суспензию после добавления уксусного ангидрида встряхивают еще 8,5 часов (час).
После этого реактор охлаждают до 5°С. В течение 10 минут добавляют по 3,20 мл воды и 2,90 мл HCl, 37%-ной, причем температуру реакции поддерживают при 5°С. При этой температуре встряхивают 1 час. Вслед за этим в каждый реактор добавляют 13,0 мл воды, нагревают до 10°C и встряхивают 1 час. Белую суспензию поддавливают аргоном. Отделившееся твердое вещество три раза промывают водой (по 15 мл), сушат при 45°C и 150 мбар до постоянного веса, выгружают и анализируют с помощью ВЭЖХ.
Методика ВЭЖХ для 2-циан-3-гидрокси-N-[(4-трифторметил)фенил]бут-2-енамида
Waters Alliance Separations Module 2690
доводят до pH 6,0 с помощью H3PO4 (85%)
(фенил)]бут-2-енамид: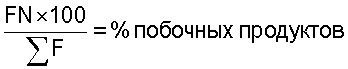
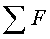 = сумма всех площадей пиков в хроматограмме испытуемого раствора за исключением пика впрыскивания.
= сумма всех площадей пиков в хроматограмме испытуемого раствора за исключением пика впрыскивания.
Примеры 2-7
Опыты, проведенные аналогично примеру 1, приведены в таблице 1.
Различные смеси растворителей
мл
эквив.
КМП
% от
теории
Пример 8
В тефлоновый реактор с баней помещают 2,5 г 2-циан-N-(4-трифторметилфенил)ацетамида и 15 мл ацетона. Осуществляют встряхивание и охлаждают до 15°С. Добавляют вручную 1,73 мл водного 50%-ного раствора NaOH и в течение 5-20 мин прибавляют 2,12 мл уксусного ангидрида, при этом осуществляют многократный отбор проб и контроль посредством ВЭЖХ. Суспензию после добавления уксусного ангидрида встряхивают еще 8,5 часов и охлаждают до 5°С. В течение 10 минут добавляют по 3,20 мл воды и 2,90 мл HCl, 37%-ной, причем температуру реакции поддерживают при 5°С. При этой температуре встряхивают 1 час. Вслед за этим добавляют 13,0 мл воды, нагревают до 10°C и встряхивают 1 час. Белую суспензию поддавливают аргоном. Отделившееся твердое вещество три раза промывают водой (обессоленной) (Е) (по 15 мл), сушат при 45°C и 150 мбар до постоянного веса, выгружают и анализируют с помощью ВЭЖХ. Выход 2,76 г (92% от теории, чистота по ВЭЖХ 98,3).
Пример 9
В 200-мл четырехгорлую колбу помещают 9,1 г 2-циан-N-(4-трифторметилфенил)ацетамида и затем суспендируют при добавлении 49 мл метилизобутилкетона (слегка желтая тонкая суспензия), которую затем охлаждают до 10°С. При этой температуре добавляют непосредственно из мерного цилиндра 17,8 мл 33%-ного раствора NaOH. При этом температура повышается до 12°C и образуется трудно перемешиваемая суспензия кремового цвета. Ее сильно перемешивают в течение 10 мин. После этого в течение 1 часа и 20 мин прикапывают 9,7 мл уксусного ангидрида при температуре 7-12°С. При этом вязкая суспензия переходит в слабо мутный оранжевый раствор, из которого через 50 мин прикапывания (прикапано около 7 мл) выкристаллизовывается твердое вещество, вследствие чего наблюдается спонтанный подъем температуры (максимум более 12°С). После отбора проб и анализа посредством ВЭЖХ при этом в реакционной смеси еще остается около 1,29% (по площади) исходного вещества 2-циан-N-(4-трифторметилфенил)ацетамида. Прикапывание не прерывают. В конце прикапывания через 1 час и 20 мин по анализу ВЭЖХ достигают полного превращения (около 0,13% (по площади) 2-циан-N-(4-трифторметилфенил)ацетамида).
Далее перемешивают 50 мин и охлаждают при этом до 3-5°С. Затем при этой температуре в течение 10 минут прикапывают 11,5 мл воды, смесь имеет pH 7,1. Затем в течение 1 часа прикапывают 16 мл 37%-ной HCl, так что при остающейся постоянной температуре pH достигает 1,1. После дальнейшего перемешивания в течение 25 мин pH все еще остается 1,1 (кремовая, негомогенная перемешиваемая суспензия, уже после приблизительно 7 мл HCl). В течение последующих 20 мин прикапывают 47,5 мл воды, причем температура поднимается до 10°С. pH повышается до 1,7. Затем перемешивают еще 40 мин. После этого суспензию отсасывают, и осадок промывают 5 раз 30 мл воды, свободной от хлоридов. Получают твердое вещество кремового цвета, которое сушат при 40°С и пониженном давлении. Выход 9,8 г (91% от теории, чистота по ВЭЖХ 99,0).
Реакции, проведенные аналогично примерам 8 и 9, приведены в таблице 2.
уксусного
ангидрида
NaOH
% от
теории
(чистота
ВЭЖХ)
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЙ СПОСОБ ПОЛУЧЕНИЯ ТЕРИФЛУНОМИДА | 2016 |
|
RU2722316C2 |
| СПОСОБ ПОЛУЧЕНИЯ ХИРАЛЬНЫХ 2-АРИЛМОРФОЛИНОВ | 2014 |
|
RU2677328C1 |
| ПРОИЗВОДНЫЕ 2-ЦИАНО-3-ГИДРОКСИЕНАМИДОВ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1993 |
|
RU2112772C1 |
| ПРОИЗВОДНЫЕ ХИНОКСАЛИНДИОНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКОЕ СРЕДСТВО НА ИХ ОСНОВЕ | 1994 |
|
RU2140420C1 |
| МОДУЛЯТОРЫ ROR ГАММА (RORγ) | 2016 |
|
RU2733406C2 |
| МОДУЛЯТОРЫ АТФ-СВЯЗЫВАЮЩИХ ТРАНСПОРТЕРОВ | 2010 |
|
RU2552353C2 |
| НОВЫЕ ДИАЗАБИЦИКЛИЧЕСКИЕ АРИЛЬНЫЕ ПРОИЗВОДНЫЕ, СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И ИХ ПРИМЕНЕНИЕ | 2004 |
|
RU2338746C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 2-АМИНО-4-ХЛОР-1,3,5-ТРИАЗИНОВ | 1999 |
|
RU2271353C2 |
| КАРБОКСИЛ- ИЛИ ГИДРОКСИЛЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ БЕНЗИМИДАЗОЛА | 2008 |
|
RU2493153C2 |
| ПРОИЗВОДНЫЕ ПИРРОЛОПИРИМИДИНА И ПИРРОЛОПИРИДИНА, ЗАМЕЩЕННЫЕ ЦИКЛИЧЕСКОЙ АМИНОГРУППОЙ КАК АНТАГОНИСТЫ CRF | 2005 |
|
RU2385321C2 |
Изобретение относится к способу получения соединения формулы I, причем R1 обозначает -CF3, R2 обозначает атом водорода, которое заключается в том, что соединение формулы II, где R1 и R2 определены, как описано выше, вводят в, по меньшей мере, один растворитель и полученный раствор или суспензию охлаждают и затем добавляют водный раствор, по меньшей мере, одного основания, выбранного из группы, состоящей из гидроксидов щелочных металлов, таких как гидроксид натрия или гидроксид калия, гидроксид натрия в твердой форме или в форме щелочи, амидов, таких как амид натрия, алкоголятов, таких как этилат натрия или трет.-бутилат калия, металлорганических соединений, таких как н-бутиллитий или смеси оснований, в присутствии уксусного ангидрида и затем выделяют образовавшееся соединение формулы I. Способ позволяет сократить время реакции и увеличить выход получаемого продукта. 5 з.п. ф-лы, 2 табл.
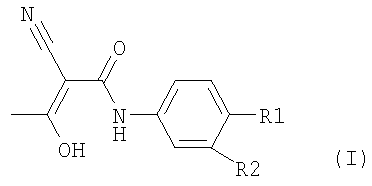
причем R1 обозначает -CF3,
R2 обозначает атом водорода,
отличающийся тем, что соединение формулы II
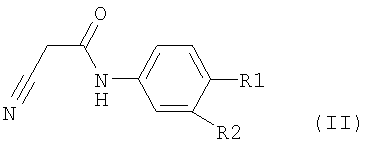
где R1 и R2 определены, как описано выше,
вводят в, по меньшей мере, один растворитель и полученный раствор или суспензию охлаждают и затем добавляют водный раствор, по меньшей мере, одного основания, выбранного из группы, состоящей из гидроксидов щелочных металлов, таких как гидроксид натрия или гидроксид калия, гидроксид натрия в твердой форме или в форме щелочи, амидов, таких как амид натрия, алкоголятов, таких как этилат натрия или трет.-бутилат калия, металлорганических соединений, таких как н-бутиллитий или смеси оснований, в присутствии уксусного ангидрида и затем выделяют образовавшееся соединение формулы I.
галогенированные углеводороды, такие как дихлорметан;
спирты, такие как этанол, изопропанол или н-бутанол;
простые эфиры, такие как диизопропиловый эфир, диэтоксиметан или диметиловый эфир диэтиленгликоля;
углеводороды, такие как толуол;
сложные эфиры, такие как этилацетат;
апротонные растворители, такие как диметилформамид, диметилацетамид, диметилсульфоксид или N-метилпирролидинон, или смеси названных растворителей,
или используют катализаторы межфазного переноса, такие как четвертичные аммониевые или фосфониевые соли, например диметилдитетрадециламмоний бромид, бензилтриэтиламмоний хлорид, 3-метилтриоктиламмоний хлорид, тетрабутиламмоний гидросульфат, или тетрабутилфосфоний хлорид; краун-эфиры или 4,7,13,16,21,24-гексаокса-1,10-диазабицикло-(8.8.8)гексакозан; или полиэтиленгликоль.
| US 5700822 А, 23.12.1997 | |||
| SUTAPA GHOSH et al | |||
| Three leflunomide metabolite analogs, Acta Crystallographica Section С Crystal Structure Communications, 2000, C56, 1254-1257 | |||
| Способ получения 2-циано-(4-трет-алкилфенил)-3-оксибут-2-енамида | 1987 |
|
SU1771472A3 |
| US 5519042 A, 21.05.1996. | |||
Авторы
Даты
2008-08-10—Публикация
2004-03-06—Подача