Область техники
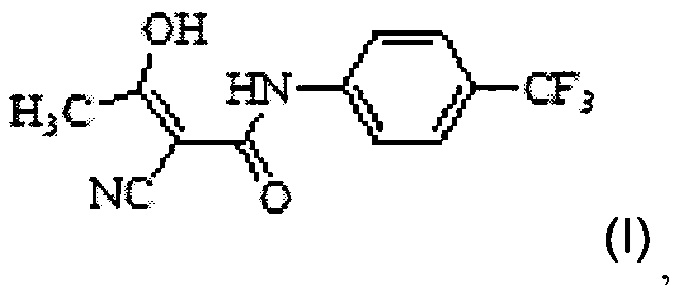
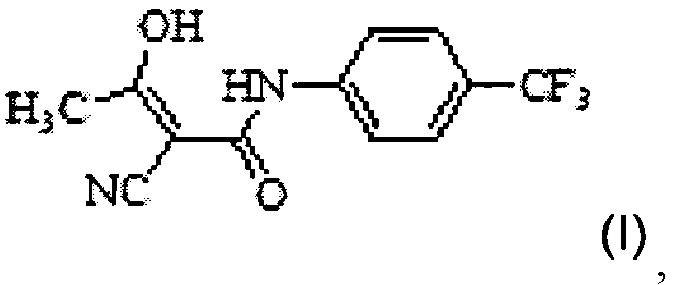
Настоящее изобретение относится к новому способу получения Терифлуномида, представленного структурной Формулой I,
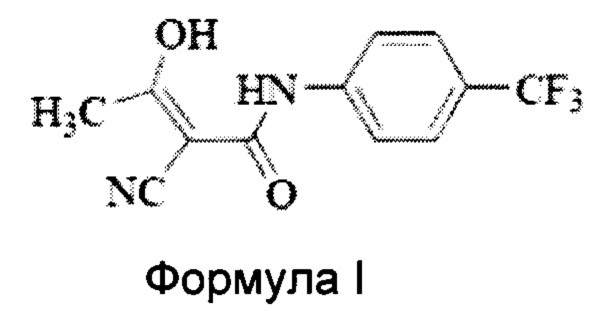
Терифлуномид (AUBAGIO™) представляет собой пероральный ингибитор синтеза пиримидина de novo, фермента DHO-DH, с химическим названием (4-трифторметилфенил)-амид (Z)-2-циано-3-гидрокси-бут-2-еноевой кислоты.
Предшествующий уровень техники
Терифлуномид, иммуномодулирующий агент с противовоспалительными свойствами, ингибирует дигидрооротат дегидрогеназу, митохондриальный фермент, участвующий в синтезе пиримидина de novo. Точный механизм, по которому Терифлуномид осуществляет свой терапевтический эффект в лечении рассеянного склероза, не известен, но может включать снижение числа активированных лимфоцитов в ЦНС.
В патенте США №5679709 заявлен Терифлуномид и его фармацевтически приемлемые соли, композиция и способ лечения аутоиммунных заболеваний.
В патенте США №5494911 раскрыт синтез Терифлуномида: сочетание 5-метилизоксазол-4-карбонилхлорида с 4-(трифторметил)анилином в ацетонитриле в качестве растворителя, с получением Лефлуномида. Последующая реакция раскрытия кольца с помощью основания, а затем подкисление дают на выходе Терифлуномид. Этот синтез показан на Схеме 1.
Схема 1.
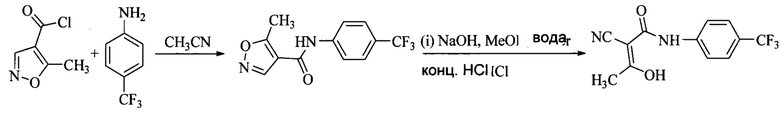
Данный способ имеет недостаток в том, что в реакции сочетания используют ацетонитрил, и это создает необходимость выделять Лефлуномид.
В публикации РСТ WO 2015/029063 заявлен способ получения Терифлуномида путем введения в реакцию 5-метилизоксазол-4-карбоновой кислоты с тионилхлоридом с использованием смешанных растворителей и превращения Лефлуномида in-situ в ходе реакции с 4-(трифторметил)анилином, за счет введения в реакцию Лефлуномида с основанием и последующего подкисления. Этот синтез представлен на схеме 2.
Схема 2.
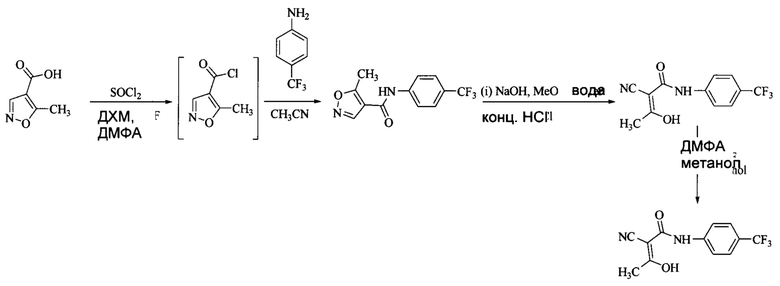
В публикации РСТ WO 2001/60363 упоминается применение двухфазной среды для синтеза Лефлуномида. Однако применение органического растворителя, в частности толуола, ведет к потерям в ходе выделения из-за сложностей, возникающих при разделении фаз. Применение диметилацетамида нежелательно, и требуются способы, позволяющие исключить его применение.
Известные в настоящее время способы имеют несколько недостатков, включая следующие.
(i) Применение смешанных растворителей (включая растворитель с боле высокой точкой кипения) в получении хлорида кислоты. Отгонка такого растворителя может приводить к потере продукта, поскольку точка кипения хлорида кислоты находится очень близко к точке кипения диметилформамида (ДМФА). Иными словами, эта процедура сильно зависит от значений вакуума/температуры, которые применяют при удалении растворителя.
(ii) Трудоемкая процедура обработки продукта при выделении Лефлуномида.
(iii) Очистка включает растворитель с более высокой точкой кипения, что является нежелательным.
(iv) Общий выход часто бывает низким (~50%).
Предложенные способы, в которых Лефлуномид применяют в качестве промежуточного продукта, включают выделение Лефлуномида в виде твердого вещества тем или иным образом. Такое выделение включает концентрирование летучих растворителей в присутствии основания, что приводит к образованию примесей (DE 634286).
Таким образом, требуется надежный, простой и эффективный способ получения Терифлуномида, который не только позволяет избежать стадий выделения, но также дает на выходе продукт требуемого качества и без нежелательных примесей. В связи с этим необходимо разработать способ, который не только свободен от недостатков предшествующего уровня техники, но также является экономичным, простым в осуществлении и промышленно применимым.
Настоящее изобретение предлагает улучшенный способ получения Терифлуномида за счет исключения стадий выделения промежуточного продукта - Лефлуномида. Иными словами, способ по настоящему изобретению включает сокращенный переход от 5-метилизоксазол-4-карбонилхлорида к неочищенному Терифлуномиду Формулы I.
Цели изобретения
Цель настоящего изобретения - предложить улучшенный способ получения Терифлуномида с более высоким выходом и степенью чистоты.
Цель настоящего изобретения - предложить более надежный, простой и экономичный способ получения Терифлуномида.
Другая цель настоящего изобретения - предложить коммерчески полезный способ получения Терифлуномида за счет исключения стадий выделения промежуточного продукта - Лефлуномида.
Еще одна цель настоящего изобретения - предложить продукт с более высоким выходом и более высокой степенью химической чистоты.
Еще одна цель настоящего изобретения - предложить чистый кристаллический Терифлуномид.
Краткая сущность изобретения
Одним аспектом настоящего изобретения предложен способ получения (4-трифторметилфенил)-амида (Z)-2-циано-3-гидрокси-бут-2-еноевой кислоты Формулы I,
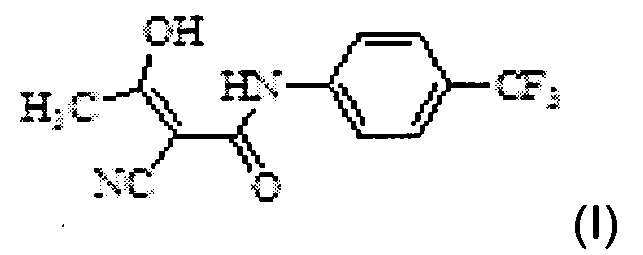
включающий следующие стадии:
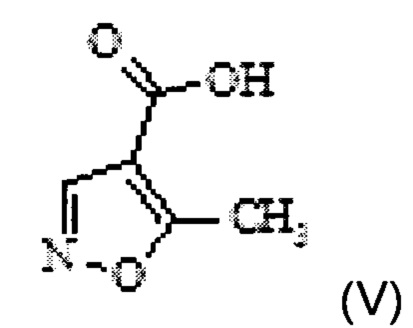
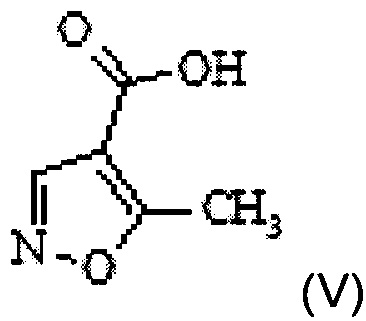
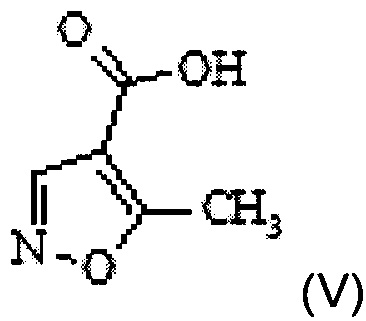
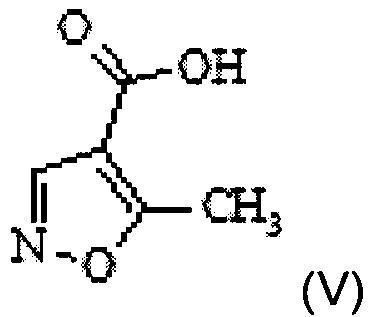
a) превращение 5-метилизоксазол-4-карбоновой кислоты Формулы V
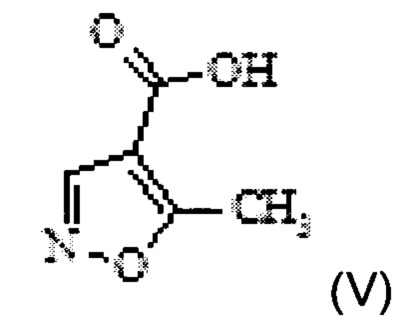
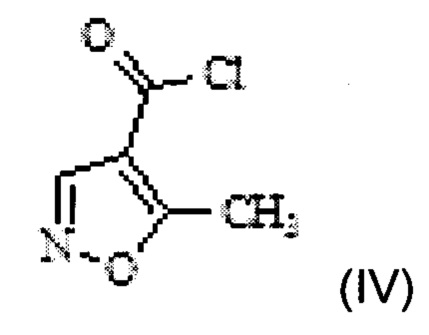
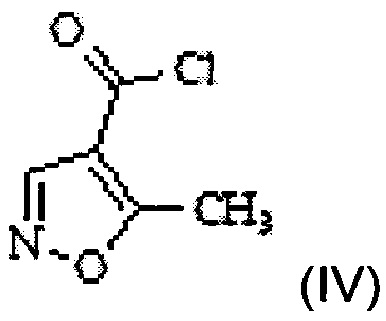
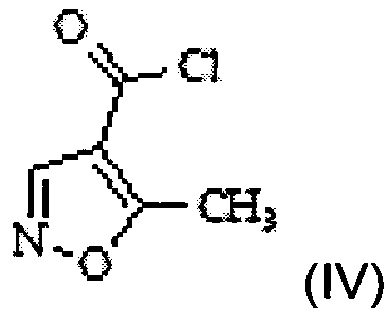
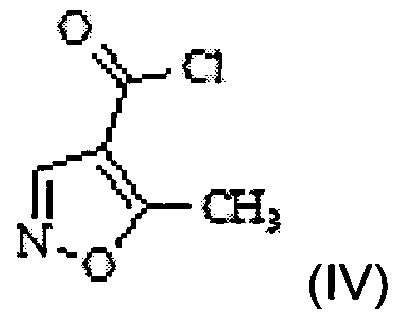
в 5-метилизоксазол-4-карбонилхлорид Формулы IV
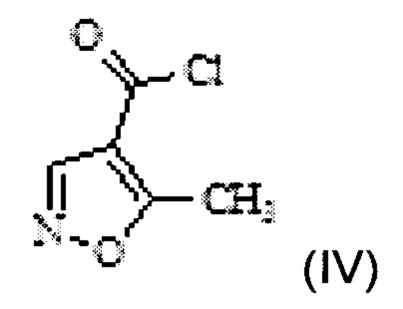
с помощью хлорирующего агента;
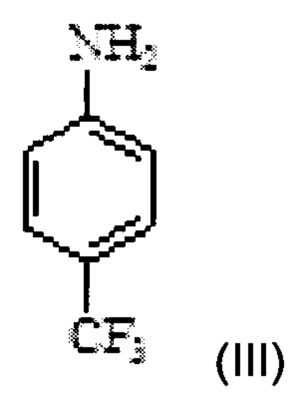
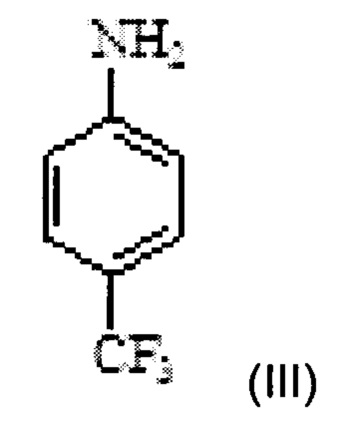
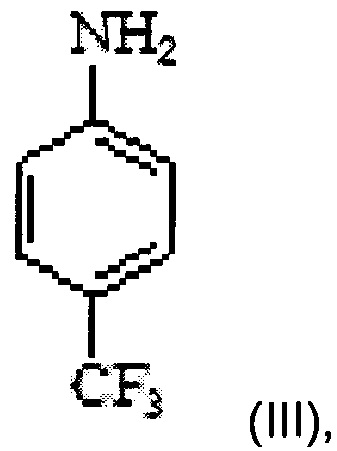
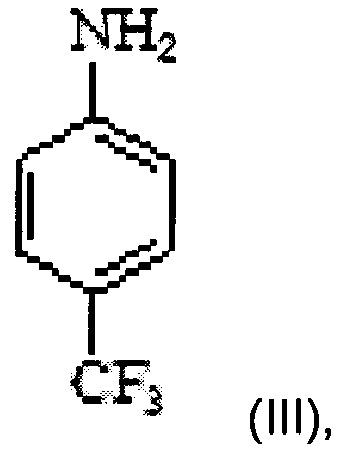
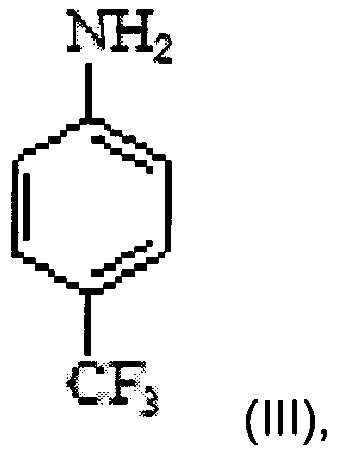
b) введение в реакцию соединения Формулы IV с 4-(трифторметил)анилином Формулы III
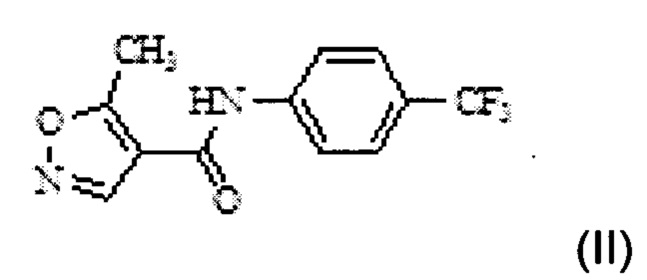
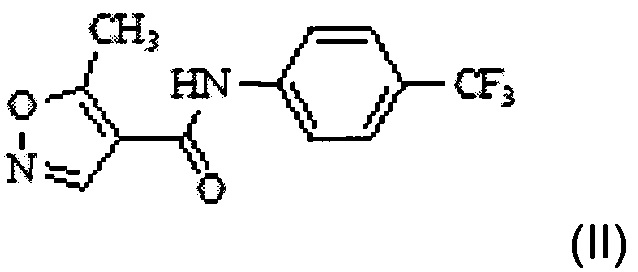
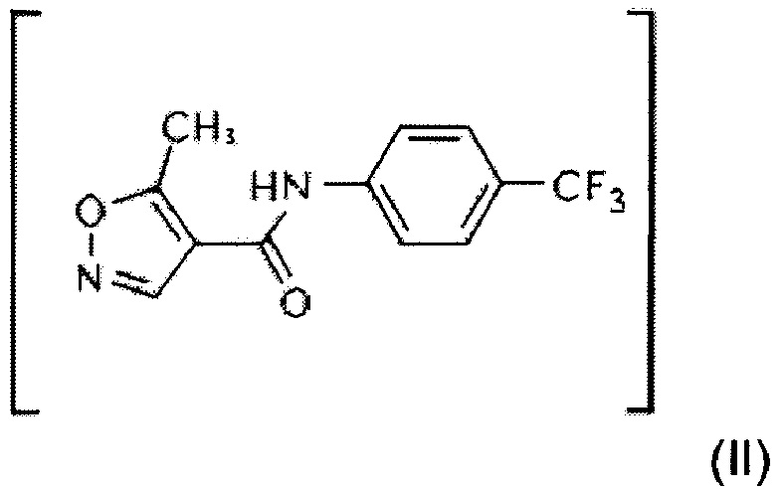
в двухфазной среде в присутствии неорганического основания с получением N-(4'-трифторметилфенил)-5-метилизоксазол-4-карбоксамида Формулы II;
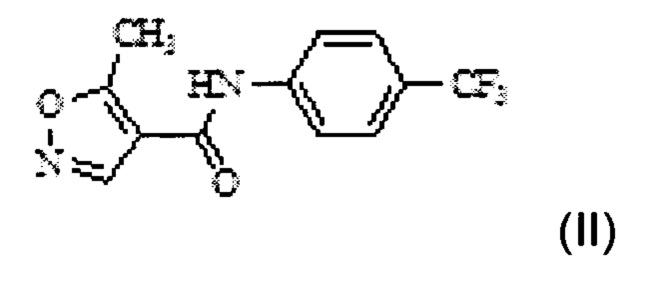
c) введение в реакцию соединения Формулы II с водным гидроксидом натрия в смеси растворителей с получением (4-трифторметил фенил)-амида (Z)-2-циано-3-гидрокси-бут-2-еноевой кислоты Формулы I;
d) возможно, очистка соединения Формулы I из смеси растворителей с получением чистого кристаллического соединения (4-трифторметил фенил)-амида (Z)-2-циано-3-гидроксибут-2-еноевой кислоты Формулы I.
Другим аспектом настоящего изобретения предложен способ получения (4-трифторметилфенил)-амида (Z)-2-циано-3-гидроксибут-2-еноевой кислоты Формулы I,
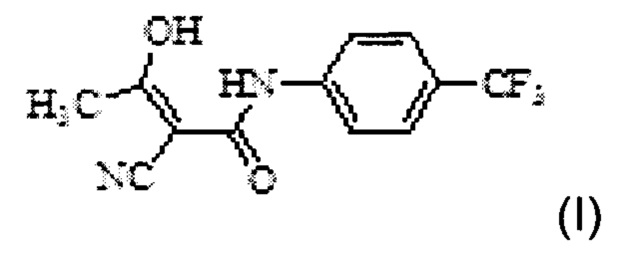
включающий следующие стадии:
a) превращение 5-метилизоксазол-4-карбоновой кислоты Формулы V

в 5-метилизоксазол-4-карбонилхлорид Формулы IV

с помощью хлорирующего агента в ароматическом углеводородном растворителе;
b) введение в реакцию соединения Формулы IV с 4-(трифторметил)анилином Формулы III
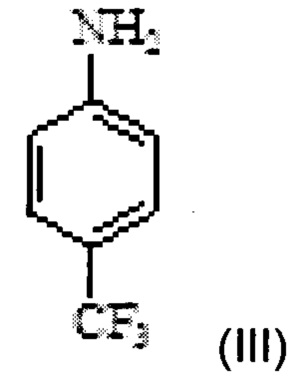
в двухфазной среде в присутствии неорганического основания с получением N-(4'-трифторметилфенил)-5-метилизоксазол-4-карбоксамида Формулы II,
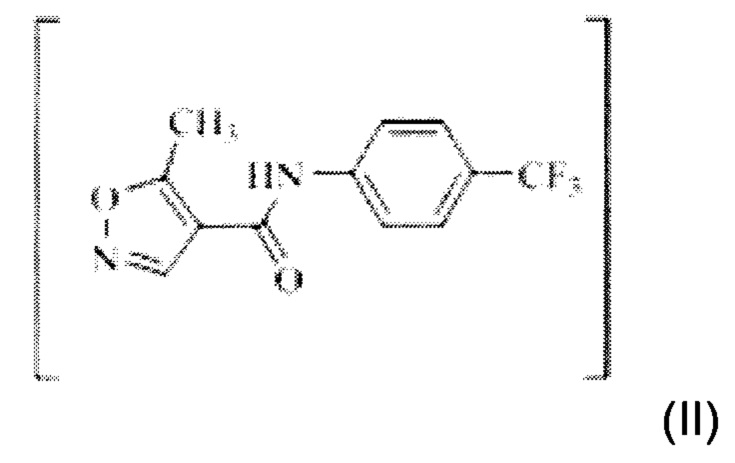
c) введение в реакцию соединения Формулы II с водным гидроксидом натрия в смеси растворителей с получением (4-трифторметилфенил)-амида (Z)-2-циано-3-гидроксибут-2-еноевой кислоты Формулы I, причем реакцию на стадии с) проводят без выделения соединения Формулы II
d) возможно, очистка соединения Формулы I из смеси растворителей с получением чистого кристаллического (4-трифторметилфенил)-амида (Z)-2-циано-3-гидроксибут-2-еноевой кислоты Формулы I
Еще одним аспектом настоящего изобретения предложен способ получения (4-трифторметилфенил)-амида (Z)-2-циано-3-гидроксибут-2-еноевой кислоты Формулы I
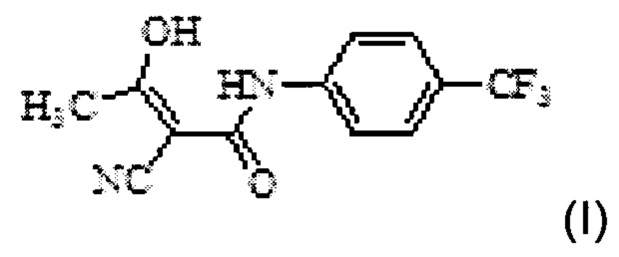
включающий следующие стадии:
а) превращение 5-метилизоксазол-4-карбоновой кислоты Формулы V
в 5-метилизоксазол-4-карбонилхлорид Формулы IV
с использованием тионилхлорида в толуоле;
b) введение в реакцию соединения Формулы IV с 4-(трифторметил)анилином Формулы III
в этилметилкетоне и воде в присутствии карбоната цезия с получением N-(4'-трифторметилфенил)-5- метилизоксазол-4-карбоксамида Формулы II;
c) введение в реакцию соединения Формулы II с водным гидроксидом натрия в смеси растворителей с получением (4-трифторметилфенил)-амида (Z)-2-циано-3-гидроксибут-2-еноевой кислоты Формулы I, причем реакцию на стадии с) проводят без выделения соединения Формулы II;
d) возможно, очистка соединения Формулы I из смеси ацетонитрила и воды с получением чистого кристаллического (4-трифторметилфенил)-амида (Z)-2-циано-3-гидроксибут-2-еноевой кислоты Формулы I.
Краткое описание Фигур
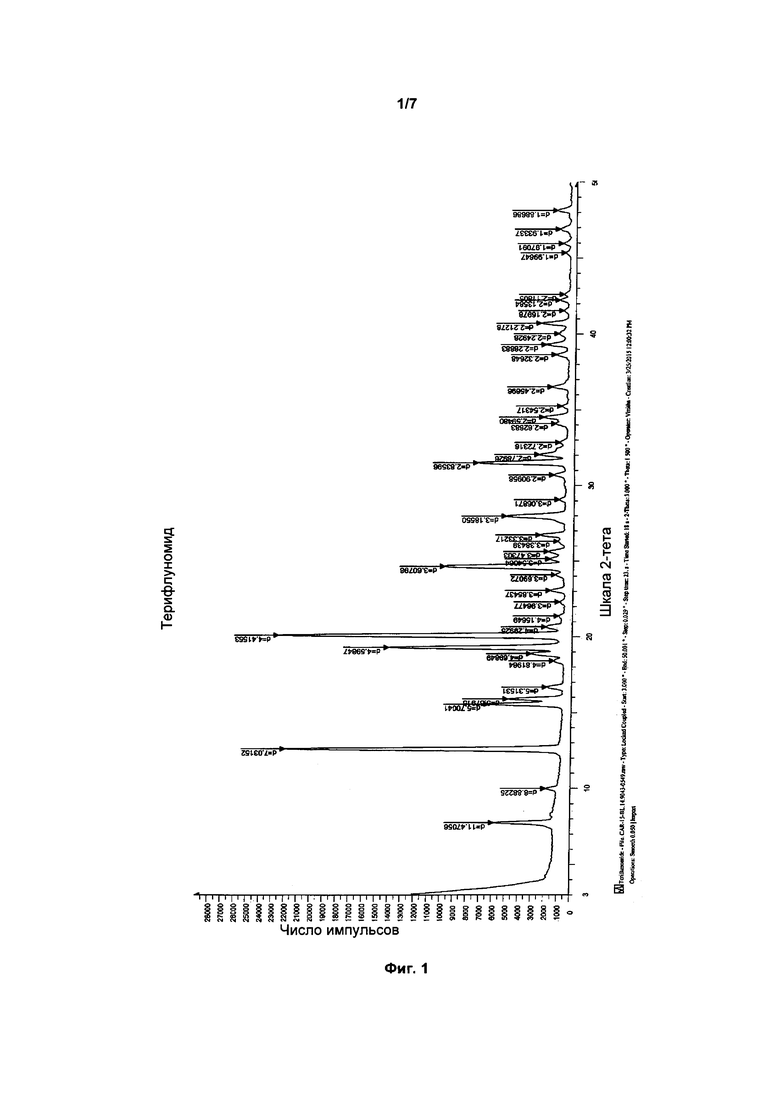
Фиг. 1: спектр порошковой рентгеновской рефракции кристаллической формы (4-трифторметилфенил)-амида (Z)-2-циано-3-гидроксибут-2-еноевой кислоты.
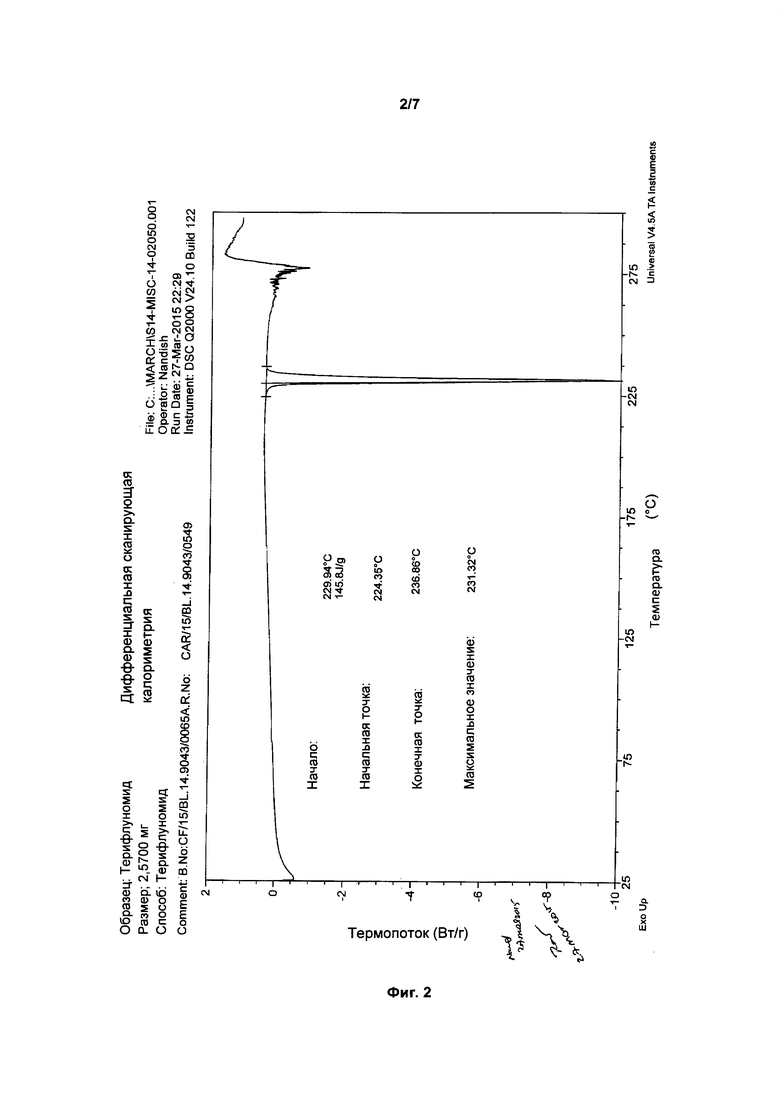
Фиг. 2: термограмма дифференциальной сканирующей калориметрии кристаллической формы (4-трифторметилфенил)-амида (Z)-2-циано-3-гидроксибут-2-еноевой кислоты.
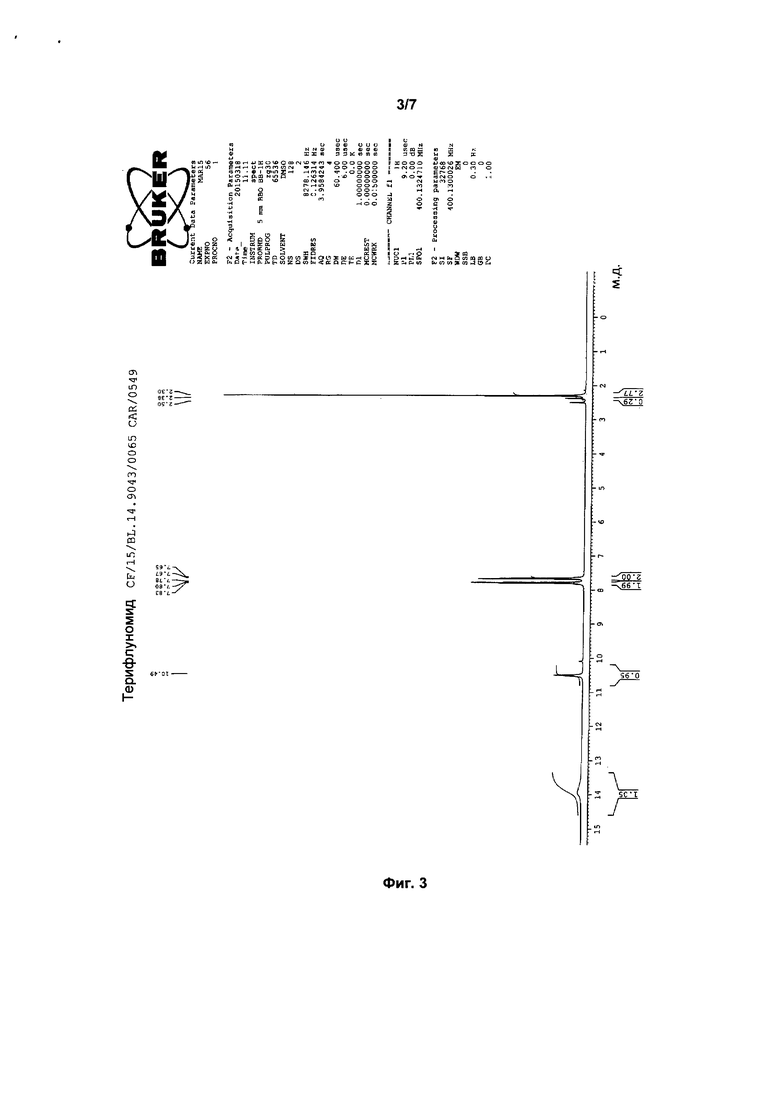
Фиг. 3: 1Н ЯМР-спектр кристаллической формы (4-трифторметилфенил)-амида (Z)-2-циано-3-гидроксибут-2-еноевой кислоты.
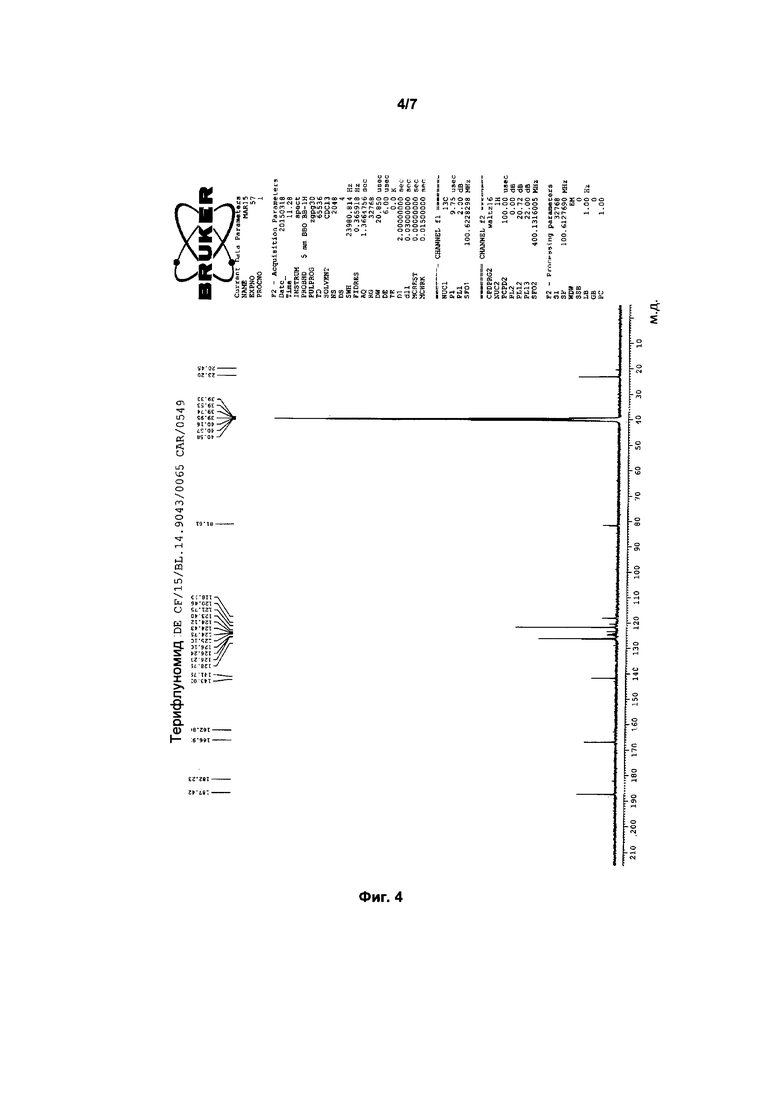
Фиг. 4: 13С ЯМР-спектр кристаллической формы (4-трифторметилфенил)-амида (Z)-2-циано-3-гидроксибут-2-еноевой кислоты.
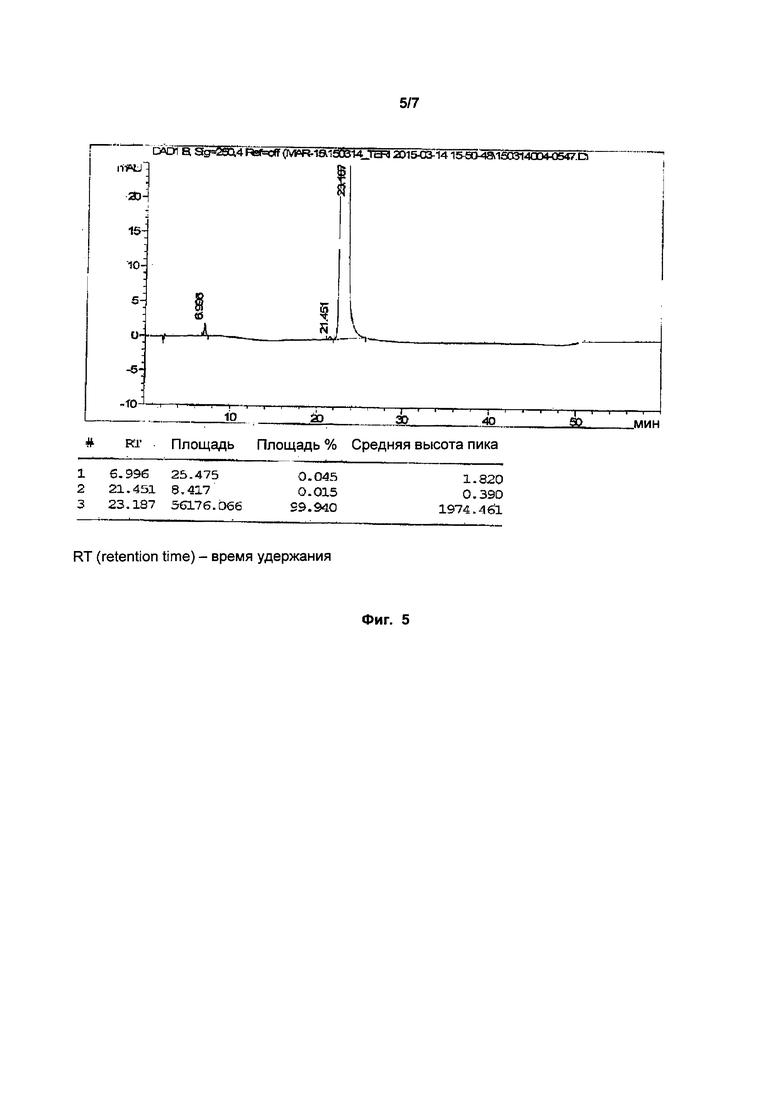
Фиг.5: ВЭЖХ кристаллической формы (4-трифторметилфенил)-амида (Z)-2-циано-3-гидроксибут-2-еноевой кислоты.
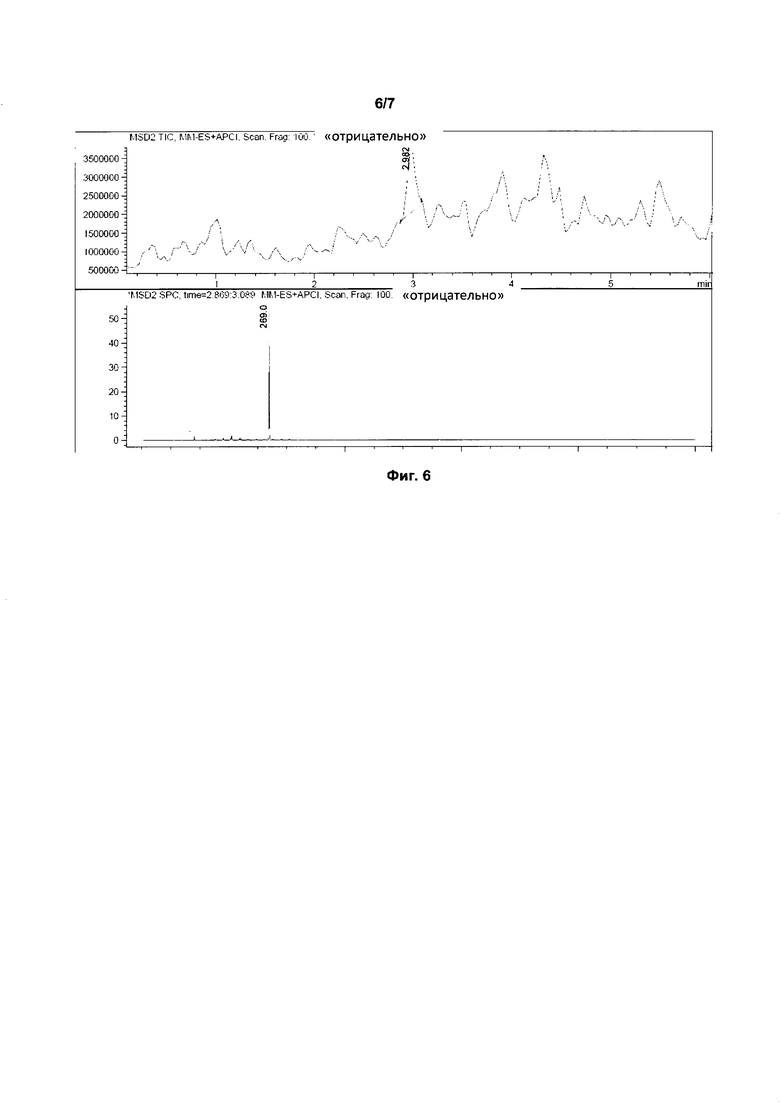
Фиг. 6: ЖХ/МС-спектр кристаллической формы (4-трифторметилфенил)-амида (Z)-2-циано-3-гидроксибут-2-еноевой кислоты.
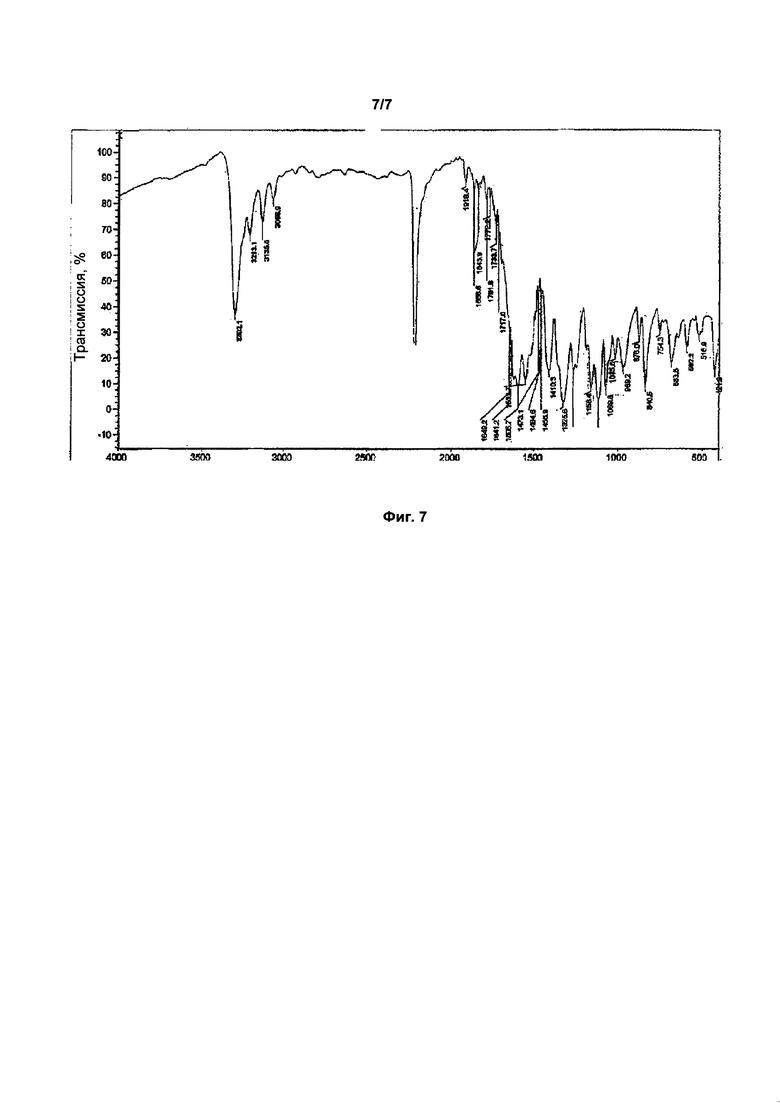
Фиг. 7: ИК-спектр кристаллической формы (4-трифторметилфенил)-амида (Z)-2-циано-3-гидроксибут-2-еноевой кислоты.
Подробное описание изобретения
Настоящее изобретение раскрывает синтез Терифлуномида (Формула I) без выделения промежуточного продукта - Лефлуномида. По настоящему изобретению Терифлуномид получают из 5-метилизоксазол-4-карбоновой кислоты путем ее превращения в хлорид кислоты и сочетания с 4-трифторметиланилином, с получением Лефлуномида (который не выделяют), с последующей реакцией раскрытия кольца с помощью водного NaOH. Данный способ сокращает переход от 5-метилизоксазол-4-карбонилхлорида.
Каждая стадия данного способа, раскрытая в заявке, рассматривается как в контексте описанных многостадийных последовательностей, так и по отдельности.
Схема синтеза по настоящему изобретению:
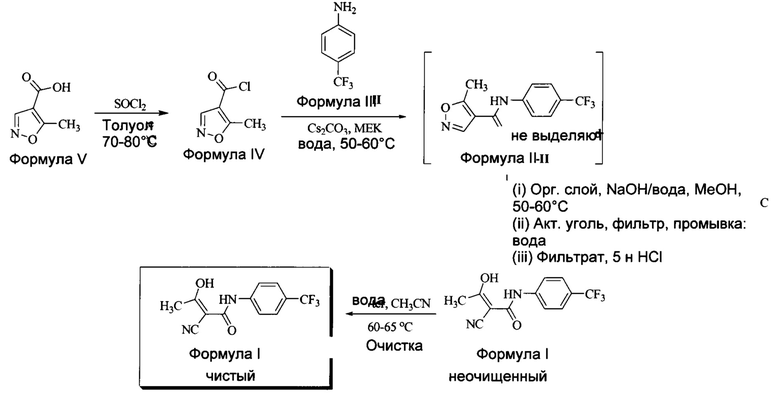
Настоящее изобретение позволяет избежать стадии выделения промежуточного продукта - Лефлуномида (Формула II), которая требует больших затрат времени и часто приводит к образованию примесей в смеси продукта. Иными словами, настоящий способ включает сокращенный путь от 5-метилизоксазол-4-карбонилхлорида до неочищенного (4-трифторметилфенил)-амида (Z)-2-циано-3-гидроксибут-2-еноевой кислоты Формулы I (Терифлуномид), со значительными преимуществами перед другими способами.
Настоящий способ дает ряд преимуществ над известными способами, включая следующие.
- Использование желаемого стехиометрического количества 4-(трифтор-метил)анилина, а не избыточного количества, как в предшествующем уровне техники.
- Устранение необходимости выделять Лефлуномид.
- Применение более дешевых растворителей.
- Твердое основание, которое растворимо в воде.
- Легкость манипулирования.
Таким образом, настоящее изобретение предлагает способ получения (4-трифторметилфенил)-амида (Z)-2-циано-3-гидроксибут-2-еноевой кислоты (Формула I) (Терифлуномида), включающий следующие стадии.
i. Превращение 5-метилизоксазол-4-карбоновой кислоты (Формула V) в 5-метилизоксазол-4-карбонилхлорид (Формула IV) с использованием тионилхлорида и, возможно, растворителя.
ii. Сочетание соединения Формулы IV с соединением Формулы III в присутствии основания и в двухфазной среды, с получением Лефлуномида (Формула II). Указанное основание может представлять собой органическое основание, такое как триэтиламин, 4-(трифтор-метил)анилин, или неорганическое основание, состоящее из NaOH или карбоната цезия. Двухфазная среда состоит из органического растворителя и воды. Органический растворитель можно выбирать из метилизобутилкетона, этилацетата и изопропилацетата, предпочтительно из метилэтилкетона. Кроме того, данный способ включает использование желаемого стехиометрического количества соединения Формулы III.
iii. Превращение Лефлуномида Формулы II в (4-трифторметилфенил)-амид (Z)-2-циано-3-гидроксибут-2-еноевой кислоты Формулы I с помощью основания и смеси растворителей. Такая смесь растворителей включает воду, спирт, предпочтительно метанол, и органический растворитель, предпочтительно метилэтилкетон. Основание включает карбонаты или гидроксиды металлов. Кроме того, такое основание можно выбирать из карбоната цезия, карбоната натрия, карбоната калия или гидроксида натрия, предпочтительно карбоната цезия.
iv. Очистка неочищенного (4-трифторметилфенил)-амида (Z)-2-циано-3-гидроксибут-2-еноевой кислоты Формулы I с использованием смеси воды и органического растворителя с получением чистого (4-трифтор-метилфенил)-амида (Z)-2-циано-3-гидроксибут-2-еноевой кислоты Формулы I, Терифлуномида. Указанный органический растворитель может представлять собой спирт или нитрил, предпочтительно метанол, более предпочтительно ацетонитрил. Указанный способ очистки был разработан для ограничения количества соединения Формулы III как примеси ниже определенного предела.
Выпаривание избытка тионилхлорида происходит быстрее, если реакция была осуществлена в инертном растворителе, по сравнению с обычными условиями. Такой растворитель может представлять собой ароматический углеводород, выбранный из толуола, бензола или ксилола; предпочтительно из толуола.
В одном воплощении настоящего изобретения такой хлорирующий агент выбирают из тионилхлорида, оксалилхлорида, оксихлорида фосфора и пентахлорида фосфора; предпочтительно из тионилхлорида.
В другом воплощении настоящего изобретения такое неорганическое основание выбирают из карбоната натрия, карбоната калия, гидроксида натрия и карбоната цезия; предпочтительно из карбоната цезия.
В другом воплощении настоящего изобретения двухфазную среду, применяемую на стадии b), выбирают из этилацетата, этилметилкетона, метилизобутилкетона, 2-метилтетрагидрофурана и воды.
Еще в одном воплощении настоящего изобретения смесь растворителей, применяемую на стадии с), выбирают из метилэтилкетона, метанола, метилизобутилкетона, 2-метилтетрагидрофурана, этилацетата и воды.
Еще в одном воплощении настоящего изобретения растворитель, используемый для очистки соединения Формулы I, выбирают из смесей ацетонитрил-вода, метанол-вода и этанол-вода.
По предпочтительному воплощению настоящего изобретению предложен способ получения чистой кристаллической формы Терифлуномида (Формула I).
Некоторые преимущества настоящего изобретения включают, без ограничения, следующие.
Применение карбоната цезия.
С карбонатом цезия представляет легко работать, он коммерчески доступен, хорошо растворим в воде и поэтому его легко удалять из продукта. Остаточные кислотные примеси легко реагируют с карбонатом цезия, давая растворимые в воде продукты. Цезия карбонат представляет собой мягкое основание, которое создает необходимую основность в реакционной среде.
Применение двухфазной среды.
- Применение одного только органического растворителя приводит к разложению Лефлуномида в ходе реакции. Более того, такой способ трудно поддается масштабированию из-за активного выделения диоксида углерода.
- Применение одной только воды приводит к разложению хлорида кислоты, обуславливая низкий выход продукта.
- Применение двухфазной среды позволяет легко удалять побочный продукт, по мере того как он образуется. Это опосредованно увеличивает скорость реакции, а также выход и качество продукта.
- Отсутствие основания в контакте с продуктом предотвращает разложение последнего в ходе технологических операций.
Применение метилэтилкетона.
- Экономичен по сравнению со стандартно применяемым ацетонитрилом.
- Коммерчески доступен.
- Метилэтилкетон инертен в условиях реакции.
- Менее летучий и менее вязкий растворитель, и поэтому с ним легче обращаться при масштабировании процесса.
- Растворитель III класса.
- Продукт хорошо растворим в этом растворителе, и поэтому объем реакционной смеси сравнительно меньше. Применение таких растворителей, как дихлорметан (ДХМ), толуол, в которых продукт растворим хуже, приводит к осаждению продукта и к необходимости таких стадий, как декантация, концентрирование или фильтрация.
- Последующие стадии данного способа могут не включать концентрирование растворителя, поскольку он смешивается с водой и метанолом (растворители на последующей стадии).
- Присутствие растворителя на последующей стадии способствует протеканию реакции, ввиду растворимости натриевой соли API. Иными словами, концентрация растворителя не является необходимым критерием.
- Кроме того, присутствие растворителя способствует выделению продукта, поскольку позволяет избежать образования комков продукта. Иными словами, продукт можно легко фильтровать. Напротив, применение сходных растворителей, таких как метилизобутилкетон, приводит к образованию комков.
- Раствор Лефлуномида в метилэтилкетоне стабилен.
Контроль содержания соединения Формулы III.
Другим преимуществом способа представляет собой контроль содержания соединения Формула III до конкретного предела. Предложенные ранее способы включают применение для реакции сочетания избытка соединения Формулы III, по сравнению со стехиометрическим количеством. Это было необходимо, поскольку соединение Формулы III применяли как в качестве основания, так и реагента. Но в настоящем способе применяется желаемое стехиометрическое количество соединения Формулы III для сочетания, поскольку основанием служит неорганическое основание. Разработанный способ позволяет контролировать содержание соединения Формулы III как примеси на уровне ниже 0,15%. Кроме того, данный способ дает возможность контролировать содержание соединения Формулы III как примесь на уровне ниже 100 м.д. (миллионных долей). Кроме того, данный способ позволяет контролировать соединение Формулы III как примесь на уровне ниже 32 м.д.
Схема реакции представлена ниже в следующих примерах. Эти примеры служат в целях наглядного представления, и поэтому их не следует рассматривать как ограничение объема изобретения.
Пример 1. Получение 5-метилизоксазол-4-карбонилхлорида [Формула IV]
В круглодонную колбу с механической мешалкой, холодильником, карманом для термометра и пробкой вносили 5-метилизоксазол-4-карбоновую кислоту [Формула V] (75,0 г; 0,59 моль) и толуол (225 мл). В полученную суспензию вносили тионилхлорид (140,41 г; 1,18 моль) и реакционную смесь постепенно нагревали до 75±5°С и перемешивали при той же температуре в течение 10-12 ч. Ход реакции отслеживали с помощью ВЭЖХ (хлорид кислоты анализировали как соответствующий метиловый эфир путем гашения образца в метаноле). По завершении реакции смесь концентрировали при пониженном давлении при 55±5°С с получением 5-метилизоксазол-4-карбонилхлорида Формулы IV в виде жидкости.
Пример 1А. Получение 5-метилизоксазол-4-карбонилхлорида [Формула IV]
В круглодонную колбу с механической мешалкой, холодильником, карманом для термометра и пробкой вносили 5-метилизоксазол-4-карбоновую кислоту (3,00 г; 0,02 моль) и тионилхлорид (14,66 г; 0,12 моль), и реакционную смесь постепенно нагревали до 45±5°С и перемешивали при той же температуре в течение 2-3 ч. Ход реакции отслеживали с помощью ТСХ (хлорид кислоты анализировали как соответствующий метиловый эфир путем гашения образца в метаноле). По завершении реакции смесь концентрировали при пониженном давлении при 45±5°С с получением 5-метилизоксазол-4-карбонилхлорида в виде жидкости (0,59 моль).
Пример 2. Получение 5-метил-N-[4-(трифторметил)фенил]изоксазол-4-карбоксамида (Лефлуномида) [Формула II]
В круглодонную колбу с механической мешалкой, холодильником, индикатором температуры и дополнительной воронкой вносили 4-(трифторметил)анилин [Формула III] (95,08 г; 0,59 моль), этилметилкетон (150 мл), карбонат цезия (144,19 г; 0,44 моль) и воду (150 мл). Реакционную смесь нагревали до 45±2°С. В реакционную смесь при 55±10°С медленно вносили раствор 5-метилизоксазол-4-карбонилхлорида [Формула IV] (из Примера 1) в этилметилкетоне (75,0 мл) и перемешивали в течение 1 ч. Ход реакции отслеживали с помощью ВЭЖХ. По завершении реакции полученную реакционную смесь охлаждали до комнатной температуры и разделяли слои. Органический слой (этилметилкетон), содержащий 5-метил-N-[4-(трифторметил)фенил]изоксазол-4-карбоксамид (Лефлуномид) [Формула II], использовали в реакции раскрытия кольца без выделения.
Пример 3. Получение 5-метил-N-[4-(трифторметил)фенил]изоксазол-4-карбоксамида (Лефлуномида) [Формула II]
В круглодонную колбу с механической мешалкой, холодильником, индикатором температуры и дополнительной воронкой вносили 4-(трифторметил)анилин [Формула III] (3,80 г; 0,023 моль), этилацетат (12,0 мл), карбонат цезия (7,69 г; 0,023 моль), воду (9,00 мл), и реакционную смесь нагревали до 40±2°С. В реакционную смесь при 45±5°С медленно вносили раствор 5-метилизоксазол-4-карбонилхлорида [Формула IV] (0,023 моль) в этилацетате (6,00 мл) и перемешивали в течение 1 ч. Ход реакции отслеживали с помощью ВЭЖХ. По завершении реакции полученную реакционную смесь, содержащую 5-метил-N-[4-(трифторметил)фенил]изоксазол-4-карбоксамид (Лефлуномид) [Формула II], использовали в последующей стадии раскрытия кольца без выделения.
Пример 4: Получение 5-метил-N-[4-(трифторметил)фенил]изоксазол-4-карбоксамида (Лефлуномида) [Формула II]
В круглодонную колбу с механической мешалкой, холодильником, индикатором температуры и дополнительной воронкой вносили 4-(трифторметил)анилин [Формула III] (6,34 г; 0,039 моль), этилметилкетон (10,0 мл), гидроксид натрия (1,57 г; 0,039 моль) и воду (10,0 мл), и реакционную смесь нагревали до 45±5°С. В реакционную смесь медленно вносили раствор 5-метилизоксазол-4-карбонилхлорида [Формула IV] (0,039 моль) в этилметилкетоне (5,00 мл), выдерживая ту же температуру, и перемешивали в течение 1 ч. Ход реакции отслеживали с помощью ВЭЖХ. По завершении реакции полученную реакционную смесь охлаждали в интервале 25-30°С и разделяли слои. Органический слой (этилметилкетон), содержащий 5-метил-N-[4-(трифторметил)фенил]изоксазол-4-карбоксамид (Лефлуномид) [Формула II] использовали в последующей стадии раскрытия кольца без выделения.
Пример 5. Получение (Z)-2-циано-3-гидрокси-N-[4-(трифторметил)фенил]бут-2-енамида (неочищенный Терифлуномид) [Формула I]
В круглодонную колбу с механической мешалкой, холодильником, индикатором температуры и дополнительной воронкой вносили органический слой (этилметилкетон), содержащий 5-метил-N-[4-(трифторметил)фенил]изоксазол-4-карбоксамид (Лефлуномид) [Формула II] (из Примера 2). Добавляли метанол (150 мл) и реакционную смесь нагревали до 45±2°С. Медленно вносили раствор гидроксида натрия (30,69 г; 0,76 моль) в воде (150 мл), и реакционную смесь перемешивали при 55±5°С в течение 1 ч. Ход реакции отслеживали с помощью ВЭЖХ. По завершении реакции реакционную смесь обрабатывали суспензией активированного угля (15,0 г; 20 об.% по отношению к 5-метилизоксазол-4-карбоновой кислоте) в воде (300 мл) при 55±5°С в течение 1 ч. Реакционную смесь охлаждали в интервале 25-30°С, фильтровали через слой Celite® и промывали осадок на фильтре водой (300 мл). Фильтрат подкисляли с помощью 5 н HCl и перемешивали в течение 1 ч. Твердого вещество фильтровали и промывали водой (300 мл). Влажный осадок на фильтре помещали в колбу и перемешивали с водой (750 мл), фильтровали и промывали водой (300 мл). Влажный осадок на фильтре высушивали при 60±5°С при пониженном давлении в течение 20 ч с получением (Z)-2-циано-3-гидрокси-N-[4-(трифторметил)фенил]бут-2-енамида (неочищенный Терифлуномид) [Формула I] в виде твердого вещества (140 г; выход 87,8%; площадь под кривой 99,36%).
Пример 6. Получение (Z)-2-циано-3-гидрокси-N-[4-(трифторметил)фенил]бут-2-енамида (неочищенного Терифлуномида) [Формула I]
В круглодонную колбу с механической мешалкой, холодильником, индикатором температуры и дополнительной воронкой вносили реакционную смесь (из Примера 3), содержащую раствор 5-метил-N-[4-(трифторметил)фенил]изоксазол-4-карбоксамида (Лефлуномида) [Формула II] в этилацетате. В реакционную смесь медленно вносили раствор гидроксида натрия (1,23 г; 0,030 моль) в воде (12,0 мл). Вносили метанол (12,0 мл) и реакционную смесь нагревали до 50±5°С и эту смесь перемешивали при той же температуре в течение 1 ч. Ход реакции отслеживали с помощью ВЭЖХ. Реакционную массу разбавляли водой (30,0 мл). Реакционную массу подкисляли с помощью 2 н раствора HCl при 25±5°С и перемешивали в течение 1 ч. Твердое вещество отфильтровывали, промывали водой (12,0 мл). Влажный осадок на фильтре высушивали при 55±2°С при пониженном давлении в течение 15 ч с получением (Z)-2-циано-3-гидрокси-N-[4-(трифторметил)фенил]бут-2-енамида (неочищенный Терифлуномид) [Формула I] в виде твердого вещества (5,75 г; выход 90,15%; площадь под кривой 99,42%).
Пример 7. Получение (Z)-2-циано-3-гидрокси-N-[4-(трифторметил)фенил]бут-2-енамида (неочищенного Терифлуномида) [Формула I]
В круглодонную колбу с механической мешалкой, холодильником, индикатором температуры и дополнительной воронкой вносили органическое слой (из Примера 4), содержащий раствор 5-метил-N-[4-(трифторметил)фенил]изоксазол-4-карбоксамида (Лефлуномида) [Формула II] в этилметилкетоне. Вносили метанол (10,0 мл) и реакционную смесь нагревали до 50±5°С. В реакционную смесь медленно вносили раствор гидроксида натрия (1,57 г; 0,039 моль) в воде (10,0 мл) и эту смесь перемешивали при той же температуре в течение 1 ч. Ход реакции отслеживали с помощью ВЭЖХ. Реакционную массу разбавляли водой (10,0 мл) и этилметилкетоном (10 мл). Реакционную массу подкисляли 5 н раствором HCl при 25±5°С и перемешивали в течение 1 ч. Твердое вещество отфильтровывали и промывали водой (20,0 мл). Влажный осадок на фильтре высушивали при 55±2°С при пониженном давлении в течение 15 ч с получением (Z)-2-циано-3-гидрокси-N-[4-(трифторметил)фенил]бут-2-енамида (неочищенного Терифлуномида) [Формула I] в виде твердого вещества (10,0 г; выход 94,0%; площадь под кривой 99,38%).
Пример 8. Очистка Терифлуномида
i. В круглодонную колбу с механической мешалкой, холодильником и индикатором температуры вносили неочищенный Терифлуномид [Формула I] (90,0 г; 0,33 моль; площадь под кривой 99,12%), метанол (2250 мл) и воду (180 мл). Реакционную смесь нагревали до 62±2°С и выдерживали при той же температуре в течение 1-2 ч. Полученную суспензию охлаждали в интервале 25-30°С и перемешивали в течение 1 ч. Суспензию фильтровали, промывали влажное твердое вещество метанолом (180 мл). Влажный осадок на фильтре высушивали при 60±2°С при пониженном давлении в течение 15 ч с получением чистого кристаллического Терифлуномида [Формула I] (78,7 г; выход 87,44%; площадь под кривой более 99,9%)
ii. В круглодонную колбу с механической мешалкой, холодильником и индикатором температуры вносили неочищенный Терифлуномид [Формула I] (232,5 г; 0,86 моль), метанол (3022,5 мл) и воду (465 мл). Реакционную смесь нагревали до 65±2°С и выдерживали при той же температуре в течение 1-2 ч. Полученную суспензию охлаждали в интервале 25-30°С и перемешивали в течение 2-3 ч. Суспензию фильтровали и промывали влажное твердое вещество метанолом (465 мл). Влажный осадок на фильтре высушивали при 55±5°С при пониженном давлении в течение 15 ч с получением чистого кристаллического Терифлуномида [Формула I] (210 г; выход 90,0%, площадь под кривой белее 99,8%).
Пример 9. Очистка Терифлуномида
В круглодонную колбу с механической мешалкой, холодильником, индикатором температуры и дополнительной воронкой вносили неочищенный Терифлуномид [Формула I] (140 г; 0,52 моль; из Примера 5), ацетонитрил (1820 мл) и воду (280 мл). Суспензию нагревали до 65±5°С и перемешивали в течение 1-2 ч. Полученную суспензию охлаждали до 25±5°С и выдерживали при той же температуре в течение 2-3 ч. Суспензию фильтровали, промывали влажное твердое вещество ацетонитрилом (280 мл). Влажный осадок на фильтре высушивали при 60±5°С при пониженном давлении в течение 15 ч с получением чистого соединения (4-трифторметилфенил)-амида (Z)-2-циано-3-гидроксибут-2-еноевой кислоты (Терифлуномида) [Формула I] (125,2 г; выход 89,46%; площадь под кривой более 99,9%). Содержание соединения Формулы III в соединении Формулы I оказалось менее 32 м.д.
Пример 10. Получение Терифлуномида
В суспензию 5-метилизоксазол-4-карбоновой кислоты (1,00 кг; 7,86 моль) в толуоле (3,00 л) при перемешивании вносили тионилхлорид (~2,34 кг; 19,67 моль), реакционную смесь постепенно нагревали до 75±5°С и перемешивали при той же температуре в течение 10-12 ч. По завершении реакции реакционную смесь концентрировали при пониженном давлении при 55±5°С с получением 5-метил-изоксазол-4-карбонилхлорида в виде жидкости.
Смесь 4-(трифторметил)анилина (1,27 кг; 7,86 моль), этилметилкетона (2,00 л), карбоната цезия (1,92 кг; 5,89 моль) и воды (2,00 л) нагревали до 55±5°С. В реакционную смесь медленно вносили раствор 5-метилизоксазол-4-карбонилхлорида (7,86 моль) в этилметилкетоне (1,00 л) при той же температуре и перемешивали в течение 1 ч. По завершении реакции полученную реакционную смесь охлаждали до комнатной температуры и слои разделяли. Органический слой (этилметилкетон), содержащий 5-метил-N-[4-(трифторметил)фенил]изоксазол-4-карбоксамид (Лефлуномид), использовали на следующей стадии без выделения.
К органическому слою (этилметилкетон), содержащему 5-метил-N-[4-(трифторметил)фенил]изоксазол-4-карбоксамид (Лефлуномид) (7,86 моль), вносили метанол (2,00 л) и реакционную смесь нагревали до 55±5°С. Медленно вносили раствор гидроксида натрия (0,41 кг; 10,25 моль) в воде (2,00 л) и реакционную смесь перемешивали при той же температуре в течение 1 ч. По завершении реакции реакционную смесь обрабатывали суспензией активированного угля (0,20 кг; 20 об.% относительно 5-метилизоксазол-4-карбоновой кислоты) в воде (4,00 л) при 55±5°С в течение 1 ч. Реакционную смесь охлаждали, фильтровали через слой Celite® и промывали осадок на фильтре водой (4,00 л). Фильтрат подкисляли с помощью 5 н HCl и перемешивали. Твердое вещество фильтровали и промывали водой (4,00 л). Влажный осадок на фильтре перемешивали водой (10,0 л), фильтровали и промывали водой (4,00 л). Влажный осадок на фильтре высушивали при 60±5°С при пониженном давлении с получением (Z)-2-циано-3-гидрокси-N-[4-(трифторметил)фенил]бут-2-енамида (неочищенный Терифлуномид) в виде твердого вещества (1,81 кг; выход 85,15%).
Неочищенный Терифлуномид (1,81 кг; 6,70 моль) суспендировали с ацетонитрилом (23,53 л) и водой (36,2 л). Суспензию нагревали до 65±5°С и перемешивали. Затем суспензию охлаждали до комнатной температуры и перемешивали. Суспензию фильтровали, промывали влажное твердое вещество ацетонитрилом (36,2 л). Влажный осадок на фильтре высушивали при 60±5°С при пониженном давлении с получением чистого Терифлуномида (1,63 кг; выход 90,05%, площадь под кривой более 99,9%). Содержание 4-(трифторметил)анилина (соединение Формулы III) составило менее 32 м.д. Общий выход Терифлуномида, исходя из 5-метилизоксазол-4-карбоновой кислоты, составил 76,68%.
Спектр порошковой рентгеновской рефракции кристаллического (4-трифтор-метилфенил)-амида (Z)-2-циано-3-гидроксибут-2-еноевой кислоты показан на Фиг. 1.
Термограмма дифференциальной сканирующей калориметрии кристаллического (4-трифторметилфенил)-амида (Z)-2-циано-3-гидроксибут-2-еноевой кислоты показана на Фиг. 2.
1Н ЯМР (DMSO-d6, 400 МГц): δ 14,0-13,9 (bs, 1Н); 10,50-10,40 (s, 1Н); 7,85-7,75 (d, 2Н); 7,70-7,60(d, 2Н); 2,5-2,2 (s, 3Н). 1Н ЯМР-спектр кристаллической формы (4-трифторметилфенил)-амида (Z)-2-циано-3-гидроксибут-2-еноевой кислоты показан на Фиг. 3.
13С ЯМР (DMSO-d6, 100 МГц): δ 187,42; 166,91; 141,79; 126,24; 123,40; 121,75; 120,46; 118,10; 81,61; 23,20. 13С ЯМР-спектр кристаллической формы (4-трифторметилфенил)-амида (Z)-2-циано-3-гидроксибут-2-еноевой кислоты показан на Фиг. 4.
Масс-спектр: 269,0 (М+-1). Спектр ЖХ/МС кристаллической формы (4-трифторметилфенил)-амида (Z)-2-циано-3-гидроксибут-2-еноевой кислоты показан на Фиг. 6.
ИК (см-1): 3302,1; 2220,3; 1918,4; 1641,2; 1596,7; 1551,7; 1410,3; 1325,6; 1158,4; 1069,8; 969,2; 840,5 и 683,6. ИК-спектр кристаллической формы (4-трифторметилфенил)-амида (Z)-2-циано-3-гидроксибут-2-еноевой кислоты показан на Фиг. 7.
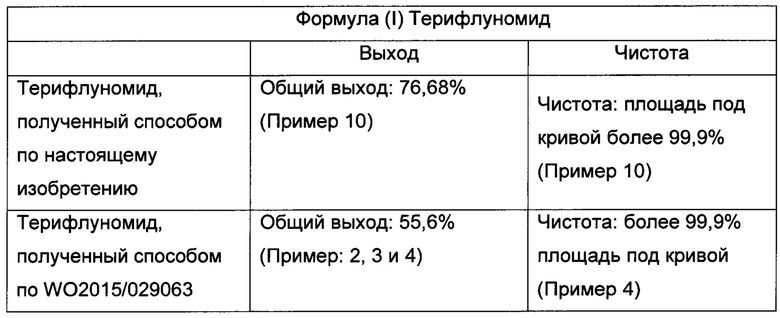
В таблице приведены сравнительные данные: выход и чистота конечного продукта Терифлуномида по настоящему изобретению и из предшествующего уровня техники.
Изобретение относится к способу получения (4-трифторметилфенил)-амида (Z)-2-циано-3-гидроксибут-2-еноевой кислоты формулы I (терифлуномида). Способ включает стадии a)-d). На стадии a) осуществляют превращение 5-метилизоксазол-4-карбоновой кислоты формулы V в 5-метилизоксазол-4-карбонилхлорид формулы IV с помощью хлорирующего агента. На стадии b) осуществляют реакцию соединения формулы IV с 4-(трифторметил)анилином формулы III в двухфазной среде в присутствии неорганического основания с получением N-(4'-трифторметилфенил)-5-метилизоксазол-4-карбоксамида формулы II. На стадии c) осуществляют реакцию соединения формулы II с водным гидроксидом натрия в смеси растворителей с получением (4-трифторметилфенил)-амида (Z)-2-циано-3-гидроксибут-2-еноевой кислоты формулы I, причем N-(4'-трифторметилфенил)-5-метилизоксазол-4-карбоксамид формулы II не выделяют. На стадии d) возможно осуществляют очистку соединения формулы I от смеси растворителей с получением чистого кристаллического соединения формулы I - (4-трифторметилфенил)-амида (Z)-2-циано-3-гидроксибут-2-еноевой кислоты. Предлагаемый способ позволяет сократить количество стадий и получить продукт с более высоким выходом и степенью чистоты. Изобретение относится также к вариантам указанного способа. 3 н. и 16 з.п. ф-лы, 7 ил., 1 табл., 10 пр.
1. Способ получения (4-трифторметилфенил)-амида (Z)-2-циано-3-гидроксибут-2-еноевой кислоты формулы I
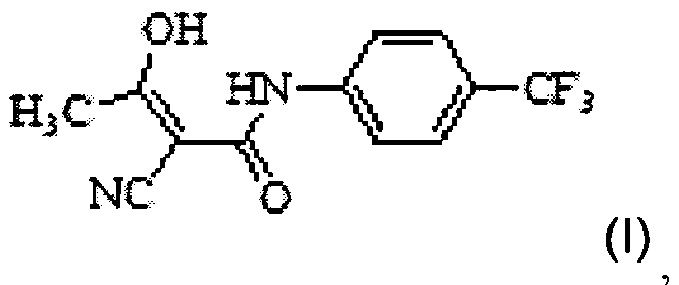 ,
,
включающий следующие стадии:
a) превращение 5-метилизоксазол-4-карбоновой кислоты формулы V
в 5-метилизоксазол-4-карбонилхлорид формулы IV
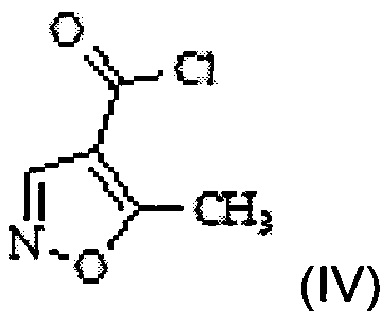
с помощью хлорирующего агента;
b) осуществление реакции соединения формулы IV с 4-(трифторметил)анилином формулы III
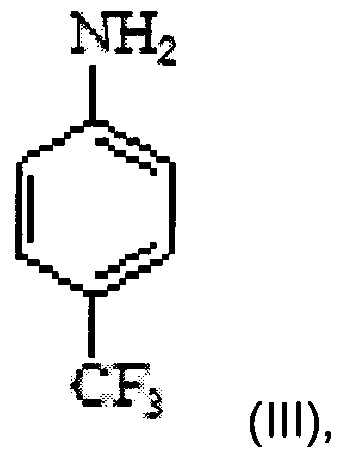
в двухфазной среде в присутствии неорганического основания с получением N-(4'-трифторметилфенил)-5-метилизоксазол-4-карбоксамида формулы II
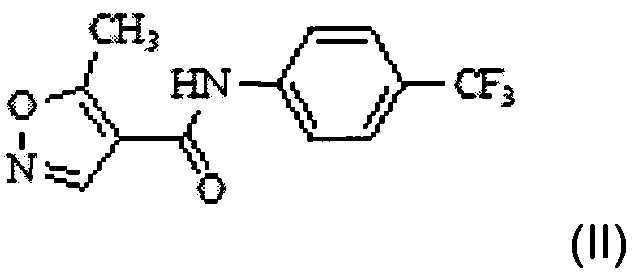 ;
;
c) осуществление реакции соединения формулы II с водным гидроксидом натрия в смеси растворителей с получением (4-трифторметилфенил)-амида (Z)-2-циано-3-гидроксибут-2-еноевой кислоты формулы I, причем N-(4'-трифторметилфенил)-5-метилизоксазол-4-карбоксамид формулы II не выделяют;
d) возможно, очистка соединения формулы I от смеси растворителей с получением чистого кристаллического соединения формулы I - (4-трифторметилфенил)-амида (Z)-2-циано-3-гидроксибут-2-еноевой кислоты.
2. Способ по п. 1, отличающийся тем, что хлорирующий агент, применяемый на стадии а), выбирают из тионилхлорида, оксалилхлорида, оксихлорида фосфора или пентахлорида фосфора.
3. Способ по п. 1, отличающийся тем, что неорганическое основание, применяемое на стадии b), выбирают из карбоната натрия, карбоната калия, гидроксида натрия или карбоната цезия.
4. Способ по п. 1, отличающийся тем, что двухфазную среду, применяемую на стадии b), выбирают из этилацетата, этилметилкетона, метилизобутилкетона, 2-метилтетрагидрофурана и воды.
5. Способ по п. 1, отличающийся тем, что на стадии b) соединение формулы II остается в органическом слое, предпочтительно в слое метилэтилкетона.
6. Способ по п. 5, отличающийся тем, что соединение формулы II в метилэтилкетоне используют на последующей стадии с) с отделением или без отделения от водного слоя.
7. Способ по п. 1, отличающийся тем, что смесь растворителей, применяемую на стадии с), выбирают из метилэтилкетона, метанола, метилизобутилкетона, 2-метилтетрагидрофурана, этилацетата и воды.
8. Способ по п. 1, отличающийся тем, что смесь растворителей, применяемую на стадии d), выбирают из смеси ацетонитрил-вода, метанол-вода и этанол-вода.
9. Способ получения (4-трифторметилфенил)-амида (Z)-2-циано-3-гидроксибут-2-еноевой кислоты формулы I
 ,
,
включающий следующие стадии:
a) превращение 5-метилизоксазол-4-карбоновой кислоты формулы V
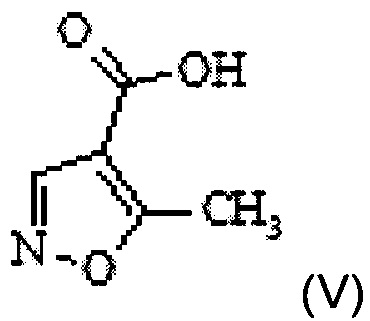
в 5-метилизоксазол-4-карбонилхлорид формулы IV
с помощью хлорирующего агента в ароматическом углеводородном растворителе;
b) осуществление реакции соединения формулы IV с 4-(трифторметил)анилином формулы III
в двухфазной среде в присутствии неорганического основания с получением N-(4'-трифторметилфенил)-5-метилизоксазол-4-карбоксамида формулы II
 ;
;
c) осуществление реакции соединения формулы II с водным гидроксидом натрия в смеси растворителей с получением (4-трифторметилфенил)-амида (Z)-2-циано-3-гидроксибут-2-еноевой кислоты формулы I, причем реакцию на стадии с) проводят без выделения соединения формулы II;
d) возможно, очистка соединения формулы I из смеси растворителей с получением чистого кристаллического (4-трифторметилфенил)-амида (Z)-2-циано-3-гидроксибут-2-еноевой кислоты формулы I.
10. Способ по п. 9, отличающийся тем, что ароматический углеводородный растворитель, применяемый на стадии а), выбирают из толуола, бензола и ксилола.
11. Способ по п. 10, отличающийся тем, что ароматический углеводородный растворитель, применяемый на стадии а), представляет собой толуол.
12. Способ по п. 9, отличающийся тем, что хлорирующий агент, применяемый на стадии а), выбирают из тионилхлорида, оксалилхлорида, оксихлорида фосфора и пентахлорида фосфора.
13. Способ по п. 9, отличающийся тем, что неорганическое основание, применяемое на стадии b), выбирают из карбоната натрия, карбоната калия и карбоната цезия.
14. Способ по п. 9, отличающийся тем, что органический растворитель, применяемый на стадии b), выбирают из этилацетата и этилметилкетона.
15. Способ по п. 9, отличающийся тем, что смесь растворителей, применяемую на стадии с), выбирают из метилэтилкетона, метанола, метилизобутилкетона, 2-метилтетрагидрофурана, этилацетата и воды.
16. Способ по п. 15, отличающийся тем, что смесь растворителей, применяемую на стадии с), выбирают из метилэтилкетона, метанола и воды.
17. Способ по п. 9, отличающийся тем, что смесь растворителей, применяемую на стадии d), выбирают из смеси ацетонитрил-вода и метанол-вода.
18. Способ получения (4-трифторметилфенил)-амида (Z)-2-циано-3-гидроксибут-2-еноевой кислоты формулы I
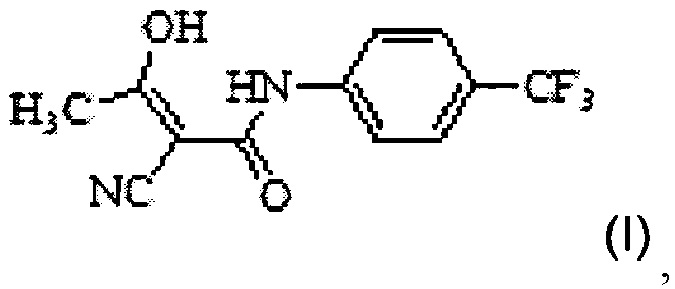 ,
,
включающий следующие стадии:
a) превращение 5-метилизоксазол-4-карбоновой кислоты формулы V
в 5-метилизоксазол-4-карбонилхлорид формулы IV
с помощью тионилхлорида в толуоле;
b) осуществление реакции соединения формулы IV с 4-(трифторметил)анилином формулы III
в этилметилкетоне и воде в присутствии карбоната цезия с получением N-(4'-трифторметилфенил)-5-метилизоксазол-4-карбоксамида формулы II
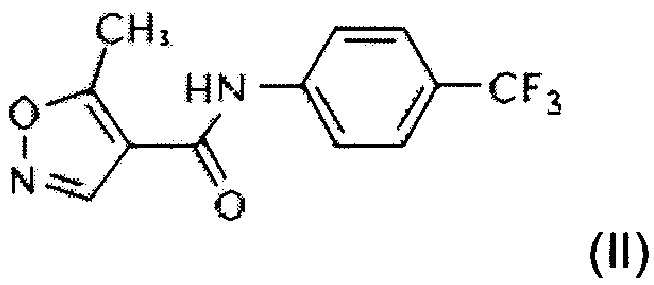 ;
;
c) осуществление реакции соединения формулы II с водным гидроксидом натрия в смеси метилэтилкетона и метанола с получением (4-трифторметилфенил)-амида (Z)-2-циано-3-гидроксибут-2-еноевой кислоты формулы I, причем N-(4'-трифторметилфенил)-5-метилизоксазол-4-карбоксамид формулы II не выделяют;
d) возможно, очистка соединения формулы I из смеси ацетонитрила и воды с получением чистого кристаллического (4-трифторметилфенил)-амида (Z)-2-циано-3-гидроксибут-2-еноевой кислоты формулы I.
19. Способ по п. 1, дополнительно включающий очистку (4-трифторметилфенил)-амида (Z)-2-циано-3-гидроксибут-2-еноевой кислоты формулы I, где указанная очистка включает следующие стадии:
i) разведение неочищенного соединения формулы I в смеси ацетонитрила и воды;
ii) нагревание полученной суспензии;
iii) перемешивание суспензии в горячих условиях;
iv) охлаждение суспензии;
v) перемешивание суспензии;
vi) фильтрация твердого вещества и промывание ацетонитрилом;
vii) сушка твердого вещества с получением чистого соединения формулы I.
| Устройство для закрепления лыж на раме мотоциклов и велосипедов взамен переднего колеса | 1924 |
|
SU2015A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| ПРИМЕНЕНИЕ АМИДОВ ИЗОКАЗОЛ-4-КАРБОНОВОЙ КИСЛОТЫ И АМИДОВ ГИДРОКСИАЛКИЛИДЕНЦИАНУКСУСНОЙ КИСЛОТЫ | 1990 |
|
RU2084223C1 |
Авторы
Даты
2020-05-29—Публикация
2016-06-16—Подача