Настоящее изобретение относится к макролидным соединениям, обладающим противовоспалительной активностью, и, более конкретно, относится к макролидным производным, не содержащим кладинозу в положении 3, с противовоспалительной активностью, к их фармацевтически приемлемым солям и фармацевтическим композициям, содержащим их в качестве активного ингредиента.
Известно, что многие антибиотики, в особенности класс макролидов на основе эритромицина, содержащих в цикле 14 атомов, обладают противовоспалительными свойствами помимо их антибактериальной активности [Clin. Immunother., (1996), 6, 454-464].
Эритромицин представляет собой природный макролид (The Merck Index, 13th Edition, № 3714, р. 654), который находит очень широкое клиническое применение при лечении инфекций, вызванных грамположительными бактериями, рядом грамотрицательных бактерий и микоплазмами.
В последнее время научное сообщество заинтересовалось противовоспалительными и иммуномодуляторными свойствами эритромицина и его производных [Journal of Antimicrobial Chemotherapy (1998), 41, Suppl., B, 37-46].
Указанная активность хорошо представлена как клиническими исследованиями, так и опытами in vivo и in vitro.
Например, установлено, что макролиды эффективны при лечении воспалительных заболеваний, таких как панбронхиолит [Thorax, (1997), 52, 915-918], бронхиальная астма [Chest, (1991), 99, 670-673] и фиброзно-кистозная дегенерация [The Lancet (1998), 351, 420], как в животных моделях воспаления, например, при вызванном зимосаном перитоните у мышей [Journal of Antimicrobial Chemotherapy, (1992), 30, 339-348] и вызванном эндотоксином накоплении нейтрофилов в трахее крыс [Antimicrobial Agents and Chemotherapy, (1994), 38, 1641-1643], так и при исследованиях in vitro на клетках иммунной системы, таких как нейтрофилы [The Journal of Immunology, (1997), 159, 3395-4005] и Т-лимфоциты [Life Sciences, (1992), 51, PL 231-236], или при модуляции цитокинов, таких как интерлейкин 8 (IL-8) [Am. J. Respir. Crit. Care Med., (1997), 156, 266-271] или интерлейкин 5 (IL-5) [патентная заявка ЕР 0775489 и ЕР 0771564, Taisho Pharmaceutical Co., Ltd.].
Введение макролидных соединений больным астмой сопровождается снижением бронхиальной повышенной секреции и повышенной чувствительности (Inflammation, Vol. 20, № 6, 1996), являющимся результатом их взаимодействия с нейтрофилами; и указанное взаимодействие, как полагают, препятствует многим биоактивным липидам, вовлеченным в патогенез бронхиальной астмы, проявлять их предшествующую воспалению дестабилизирующую мембраны активность.
Особая терапевтическая эффективность макролидных соединений при заболеваниях, когда противовоспалительные лекарства, например кортикостероиды, являются эффективными [Thorax, (1997), 52, 915-918, уже цитировалась], объясняет огромный интерес к такому новому эффективному классу противовоспалительных средств.
Однако тот факт, что обычные макролидные соединения обладают сильной противобактериальной активностью, не разрешает их более широкое применение при хроническом лечении воспалительных процессов, не вызванных патогенными микроорганизмами, так как это могло бы привести к быстрому развитию устойчивых линий.
Следовательно, было бы желательно иметь доступные новые вещества со структурой макролида, которые обладают противовоспалительной активностью и которые одновременно не обладают антибиотическими свойствами.
Для большей ясности приведена формула эритромицина, где указана нумерация, принятая в данной патентной заявке.

В литературе описано большое число классов эритромициновых соединений, обладающих противобактериальной активностью и отличающихся более высокой кислотной стабильностью и, следовательно, лучшими фармакокинетическими свойствами.
Патентная заявка WO 96/18633 (Zambon Group) описывает соединения 9-[О-(аминоалкил)оксим]эритромицина А, которые обладают антибиотической активностью против грамположительных и грамотрицательных микроорганизмов.
Полученные из эритромицина кетолиды, модифицированные в положении 3' и 6-О-замещенные, которые используют при лечении бактериальных инфекций, описаны в патентной заявке WO 99/16779 (Abbott Laboratories).
Соединения 9-оксиминоэритромицина, этерифицированные в положении 3 и 3'-модифицированные, которые полезны в качестве антибактериальных и противоязвенных агентов, описаны в патентной заявке JP 2001-181294 (Hokuriku Pharmaceutical Co.).
Среди макролидных соединений, описанных в литературе, есть несколько 3'-дездиметиламино-9-оксиминовых производных.
Патентная заявка ЕР 0254534 (Robinson, William S.) заявляет очень широкий класс макролидных соединений, среди которых раскрыты 9-О-метилоксим эритронолида А и 9-оксимино-производные эритромицина А, включая 9-О-метилоксим 3'-дездиметиламино-3',4'-дегидроэритромицина А.
Приведенные выше патентные публикации заявляют соединения, обладающие противовирусной активностью.
9-Оксим 3'-дездиметиламино-3',4'-дегидроэритромицина А и 9-оксим эритронида А описаны в патенте США 3928387 (Hoffmann-La Roche Inc.) в качестве промежуточных соединений, которые могут быть использованы для получения антибиотика 1745А/Х.
В литературе описан ряд классов эритромициновых соединений, обладающих противовоспалительной активностью.
Например, эритромициновые соединения, модифицированные в положениях 3, 9, 11 и 12, заявлены в приведенных выше европейских патентных заявках, принадлежащих Taisho, в качестве эффективных ингибиторов синтеза IL-5.
Применение эритромицина в качестве противовоспалительного средства, которое действует путем снижения высвобождения интерлейкина 1 посредством ингибирования гликопротеина млекопитающих mdr-P, заявлено в патентной публикации WO 92/16226 (Smith-Kline Beecham Corporation).
Соединения 3'-дездиметиламино-9-оксиминомакролида, обладающие противовоспалительной активностью и не проявляющие антибиотическую активность, описаны в патентной заявке WO 00/42055 (Zambon Group).
Эффективный вклад в противовоспалительную активность, проявляемую макролидными соединениями, прослеживается по изменениям, производимым ими, на ряде метаболических функций нейтрофилов.
В частности, в ряде исследований было показано, что макролидные соединения вмешиваются в экзоцитоз [Journal of Antimicrobial Chemotherapy, 1996, 38, 81] и в производство окисляющих веществ с помощью нейтрофильных гранулоцитов (PMNL) [Journal of Antimicrobial Chemotherapy, 1989, 24, 561].
Роль структурного ключевого элемента при модулировании упомянутых выше функциональных метаболических активностей нейтрофилов приписана наличию L-кладинозы в положении 3 цикла макролидных соединений [The Journal of Immunology, 1997, 159, 3395-4005, уже цитировалась].
Действие сахара в соответствии с упомянутой выше статьей может быть связано или с большим значением этого сахара в клеточном поглощении макролидных соединений, или с их взаимодействием с клеточной мишенью, вовлеченной в обе метаболические активности нейтрофилов.
Названный факт подтверждает то, что такой нейтральный сахар L-кладиноза, независимо от его включения в большую макролидную структуру, описан как обладающий объявленной противовоспалительной активностью.
Фармацевтические препараты, содержащие кладинозу или L-кладинозу в качестве медицинского продукта для лечения воспалительных состояний, описаны в международной патентной заявке № WO 97/00684 (Roussel Uclaf).
Неожиданно заявителями данной заявки установлено, что путем удаления кладинозы в положении 3 из производных макролида могут быть получены соединения, обладающие противовоспалительной активностью и по существу не имеющие антибиотических свойств.
Таким образом, цель настоящего изобретения состоит в получении соединений формулы:

где
R представляет собой атом водорода или метильную группу;
R1 представляет собой атом водорода, N,N-ди(С1-С3)алкиламиногруппу, N,N-ди(С1-С3)алкиламино-N-оксидную группу, N-(С1-С3)алкил-N-бензиламиногруппу, N-(С1-С4)ацил-N-(С1-С3)алкиламиногруппу, N-[N,N-диметиламино(С1-С4)алкиламино]ацетил-N-(С1-С3)алкиламиногруппу или цепочку формулы

где
А представляет собой атом водорода, фенил или пяти- или шестичленный гетероарильный цикл, содержащий от одного до трех гетероатомов, выбранных из атома азота, кислорода и серы;
Х представляет собой O, S, SO, SO2 и NR6, и R6 представляет собой атом водорода, линейный или разветвленный С1-С3алкил, С1-С3алкоксикарбонильную группу или бензилоксикарбонильную группу;
Y представляет собой С6Н4-группу, пяти- или шестичленный гетероарильный цикл, содержащий от одного до трех гетероатомов, выбранных из атома азота, кислорода и серы, или представляет собой O, S, SO, SO2 или NR6, где R6 имеет значения, приведенные выше;
r принимает целые значения от 1 до 3;
m принимает целые значения от 1 до 6;
n принимает целые значения от 0 до 2;
или R1 образует связь вместе с R2;
R2 представляет собой атом водорода или образует связь вместе с R1;
R3 представляет собой гидроксигруппу или образует группу =N-O-R5 вместе с R4, и R5 представляет собой атом водорода, линейный или разветвленный С1-С5алкил, бензил, необязательно замещенный одним или двумя заместителями, выбранными из нитро, гидрокси, карбокси, аминогруппы, линейного или разветвленного С1-С5алкила, С1-С4алкоксикарбонильных групп, аминокарбонильных групп или цианогрупп, или цепочку формулы:
-(СН2)r-X-(CH2)m-Y-(CH2)n-A
где
r, m, n, X, Y и А имеют значения, определенные выше;
R4 представляет собой атом водорода или образует группу =N-O-R5 вместе с R3, и R5 имеет значения, определенные выше;
и их фармацевтически приемлемые соли,
при условии, однако, что R1 не является диметиламиногруппой, когда R3 представляет собой гидроксигруппу, и как R2, так и R4 представляют собой атом водорода.
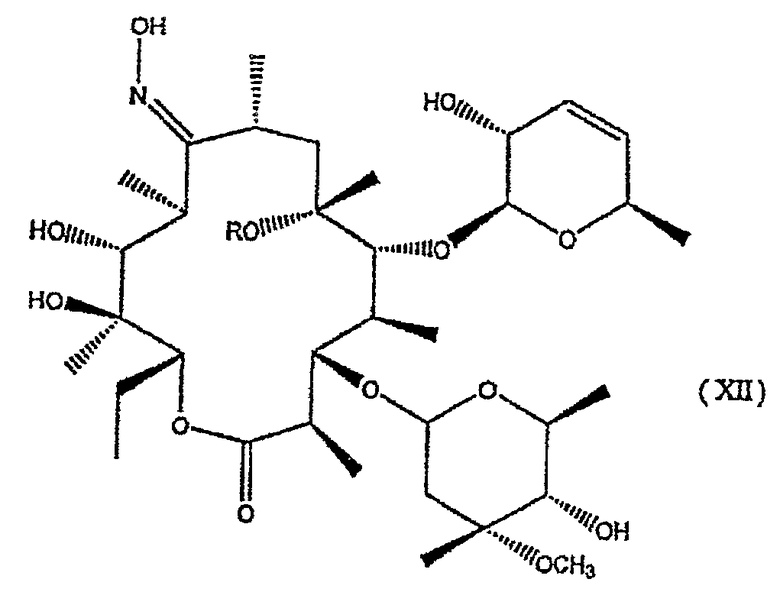
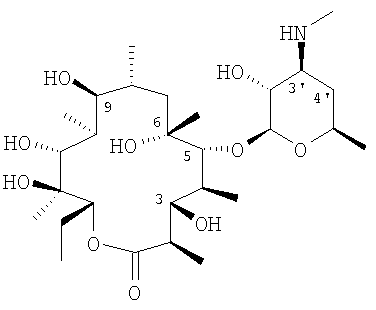
Оба соединения формулы I, где R представляет собой атом водорода или метильную группу, R1 представляет собой диметиламиногруппу, R3 представляет собой гидроксигруппу, R2 и R4 представляют собой атом водорода, известны как химические объекты. А именно: соединение, где R представляет собой атом водорода, R1 представляет собой диметиламиногруппу, R3 представляет собой гидроксигруппу, R2 и R4 представляют собой атом водорода, описано в публикации Max V. Sigal, et al., J. Am. Chem. Soc., 1956, 78, 388-395, как продукт разложения эритромицина А. Кроме того, оба соединения, где R представляет собой атом водорода или метильную группу, R1 представляет собой диметиламиногруппу, R3 представляет собой гидроксигруппу, R2 и R4 представляет собой атом водорода, описаны в публикации ЕР-А-0941998 в качестве исходных продуктов при получении макролидов, обладающих антибиотической активностью.
Однако их противовоспалительная активность до сих пор не была представлена. Следовательно, они все еще являются новыми в качестве противовоспалительных лекарственных средств.
Оксимы формулы I имеют Z или Е конфигурацию. Соединения формулы I являются противовоспалительными макролидами, не проявляющими антибиотическую активность и, следовательно, полезными для лечения и профилактики воспалительных заболеваний, также, когда R представляет собой атом водорода или метильную группу, R1 представляет собой диметиламиногруппу, R3 представляет собой гидроксигруппу, R2 и R4 представляют собой атом водорода.
Определение «линейный или разветвленный С1-С5алкил» означает группу, выбранную из метила, этила, н-пропила, изопропила, н-бутила, изобутила, втор-бутила, трет.-бутила, н-пентила и изопентила.
Выражение «пяти- или шестичленный гетероарильный цикл, содержащий от одного до трех гетероатомов, выбранных из атомов азота, кислорода и серы», означает гетероциклические кольца, такие как пиррол, тиофен, фуран, имидазол, пиразол, тиазол, изотиазол, изоксазол, оксазол, пиридин, пиразин, пиримидин, пиридазин, триазол или тиадиазол.
Для квалифицированного в данной области специалиста очевидно, что замещение гетероарильных циклов их частично или полностью насыщенными формами, а также присутствие заместителей на ароматических (фенильном или гетероарильном) циклах, предусмотренных значениями А и Y, дает соединения, которые подпадают под объем настоящего изобретения.
Предпочтительные соединения формулы I представляют собой соединения, где R1, R2, R3, R4, R5 и R6 имеют значения, приведенные в формуле I, и R1 представляет собой атом водорода, N-(С1-С3)алкил-N-метиламиногруппу, N-(С1-С3)алкил-N-метиламино-N-оксидную группу, N-бензил-N-метиламиногруппу, N-(С1-С4)ацил-N-метиламиногруппу, N-[N,N-диметиламино(С1-С4)алкиламино]ацетил-N-метиламиногруппу или цепочку формулы:
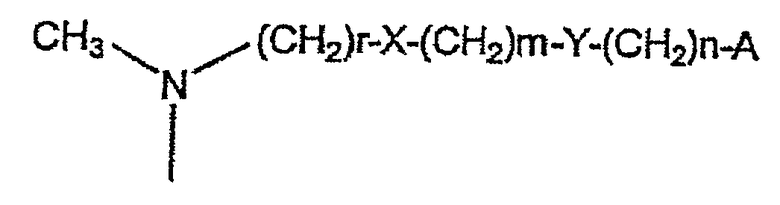
где
А представляет собой атом водорода, фенил или пяти- или шестичленный гетероарильный цикл, содержащий от одного до трех гетероатомов, выбранных из атома азота, кислорода и серы;
Х представляет собой O или NR6, и R6 представляет собой атом водорода или линейный или разветвленный С1-С3алкил;
Y, когда n равно 0, представляет собой С6Н4-группу или пяти- или шестичленный гетероарильный цикл, содержащий от одного до трех гетероатомов, выбранных из атома азота, кислорода и серы, или, когда n имеет значение, отличное от 0, представляет собой O или NR6, и R6 представляет собой атом водорода или линейный или разветвленный С1-С3алкил;
r принимает целые значения от 1 до 3;
m принимает целые значения 1 или 2;
n принимает целые значения от 0 до 2;
или R1 образует связь вместе с R2.
В этой группе соединения, которые являются даже более предпочтительными, представляют собой соединения, где R1 представляет собой атом водорода, N,N-диметиламино-N-оксидную группу, N-бензил-N-метиламиногруппу, N-ацетил-N-метиламиногруппу, N-[N,N-диметиламино(С1-С2)алкиламино]ацетил-N-метиламиногруппу или цепочку формулы:

где
А представляет собой атом водорода, фенил или пяти- или шестичленный гетероарильный цикл, выбранный из пиррола, тиофена, фурана, имидазола, оксазола, тиазола, пиридина, пиримидина, триазола и тиадиазола;
Х представляет собой O или NR6, и R6 представляет собой атом водорода;
Y, когда n равно 0, представляет собой С6Н4-группу или пяти- или шестичленный гетероарильный цикл, выбранный из пиррола, тиофена, фурана, имидазола, оксазола, тиазола, пиридина, пиримидина, триазола и тиадиазола, или, когда n равно 1, представляет собой NR6, и R6 представляет собой атом водорода;
r принимает целые значения от 1 до 3;
m принимает целые значения 1 или 2;
n принимает целые значения 0 или 1;
или R1 образует связь вместе с R2.
Другие соединения, которые принадлежат к этой группе и являются даже более предпочтительными, представляют собой соединения, где R1 представляет собой атом водорода, N,N-диметиламино-N-оксидную группу, N-бензил-N-метиламиногруппу, N-ацетил-N-метиламиногруппу, N-[N,N-диметиламиноэтиламино]ацетил-N-метиламиногруппу или цепочку формулы:
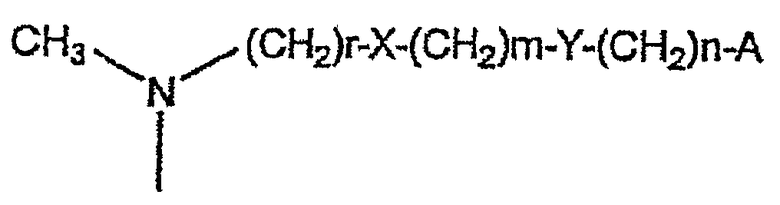
где
А представляет собой атом водорода, фенил или гетероарильный цикл, выбранный из тиофена, фурана, тиазола, пиридина и триазола;
Х представляет собой NR6, и R6 представляет собой атом водорода;
Y, когда n равно 0, представляет собой С6Н4-группу или гетероарильный цикл, выбранный из тиофена, фурана, тиазола, пиридина и триазола, или, когда n равно 1, представляет собой NR6, и R6 представляет собой атом водорода;
или R1 образует связь вместе с R2.
Другие предпочтительные соединения представляют собой соединения, в которых R, R1, R2 и R6 имеют значения, уже приведенные в формуле I, R3 представляет собой гидроксигруппу и R4 представляет собой атом водорода, при условии, однако, что R1 не является диметиламиногруппой.
Соединения, которые являются предпочтительными в пределах данной группы, представляют собой соединения, где R1 представляет собой атом водорода, N-(С1-С3)алкил-N-метиламиногруппу, N-(С1-С3)алкил-N-метиламино-N-оксидную группу, N-бензил-N-метиламиногруппу, N-(С1-С4)ацил-N-метиламиногруппу, N-[N,N-диметиламино(С1-С4)алкиламино]ацетил-N-метиламиногруппу или цепочку формулы:

где
А представляет собой атом водорода, фенил или пяти- или шестичленный гетероарильный цикл, содержащий от одного до трех гетероатомов, выбранных из атома азота, кислорода и серы;
Х представляет собой O или NR6, и R6 представляет собой атом водорода или линейный или разветвленный С1-С3алкил;
Y, когда n равно 0, представляет собой С6Н4-группу или пяти- или шестичленный гетероарильный цикл, содержащий от одного до трех гетероатомов, выбранных из атома азота, кислорода и серы, или, когда n имеет значение, отличное от 0, представляет собой O или NR6, и R6 представляет собой атом водорода или линейный или разветвленный С1-С3алкил;
r принимает целые значения от 1 до 3;
m принимает целые значения 1 или 2;
n принимает целые значения от 0 до 2;
или R1 образует связь вместе с R2.
Соединения, которые являются даже более предпочтительными в пределах указанной группы, представляют собой соединения, где R1 представляет собой атом водорода, N,N-диметиламино-N-оксидную группу, N-бензил-N-метиламиногруппу, N-ацетил-N-метиламиногруппу, N-[N,N-диметиламино(С1-С2)алкиламино]ацетил-N-метиламиногруппу или цепочку формулы:

где
А представляет собой атом водорода, фенил или пяти- или шестичленный гетероарильный цикл, выбранный из пиррола, тиофена, фурана, имидазола, оксазола, тиазола, пиридина, пиримидина, триазола и тиадиазола;
Х представляет собой O или NR6, и R6 представляет собой атом водорода;
Y, когда n равно 0, представляет собой С6Н4-группу или пяти- или шестичленный гетероарильный цикл, выбранный из пиррола, тиофена, фурана, имидазола, оксазола, тиазола, пиридина, пиримидина, триазола и тиадиазола, или, когда n равно 1, представляет собой NR6, и R6 представляет собой атом водорода;
r принимает целые значения от 1 до 3;
m принимает целые значения 1 или 2;
n принимает целые значения 0 или 1;
или R1 образует связь вместе с R2.
Соединения этой группы, которые являются даже более предпочтительными, представляют собой соединения, где R1 представляет собой атом водорода, N,N-диметиламино-N-оксидную группу, N-бензил-N-метиламиногруппу, N-ацетил-N-метиламиногруппу, N-[N,N-диметиламиноэтиламино]ацетил-N-метиламиногруппу или цепочку формулы:

где
А представляет собой атом водорода, фенил или гетероарильный цикл, выбранный из тиофена, фурана, тиазола, пиридина и триазола;
Х представляет собой NR6, и R6 представляет собой атом водорода;
Y, когда n равно 0, представляет собой С6Н4-группу или гетероарильный цикл, выбранный из тиофена, фурана, тиазола, пиридина и триазола, или, когда n равно 1, представляет собой NR6, и R6 представляет собой атом водорода;
или R1 образует связь вместе с R2.
Среди соединений, где R, R1 и R2 имеют значения, уже приведенные для формулы I, и R3 образует группу =N-O-R5 вместе с R4, соединения, которые являются предпочтительными, представляют собой соединения, где R5 представляет собой атом водорода, линейный или разветвленный (С1-С3)алкил, бензил, необязательно замещенный одним или двумя заместителями, выбранными из нитро, гидрокси, карбокси, аминогруппы, линейного или разветвленного (С1-С3)алкила и цианогруппы, или цепочку формулы:
-(СН2)r-X-(CH2)m-Y-(CH2)n-A
где
А представляет собой атом водорода, фенил или пяти- или шестичленный гетероарильный цикл, содержащий от одного до трех гетероатомов, выбранных из атома азота, кислорода и серы;
Х представляет собой O или NR6, и R6 представляет собой атом водорода или линейный или разветвленный С1-С3алкил;
Y, когда n равно 0, представляет собой С6Н4-группу или пяти- или шестичленный гетероарильный цикл, содержащий от одного до трех гетероатомов, выбранных из атома азота, кислорода и серы, или, когда n имеет значение, отличное от 0, представляет собой O или NR6, и R6 представляет собой атом водорода или линейный или разветвленный С1-С3алкил;
r принимает целые значения 1 или 2;
m принимает целые значения от 1 до 6;
n принимает целые значения от 0 до 2.
Соединения, которые являются предпочтительными в пределах данной группы соединений формулы I, представляют собой соединения, где R5 представляет собой атом водорода, метил, бензил, или цепочку формулы:
-(СН2)r-X-(CH2)m-Y-(CH2)n-A
где
А представляет собой атом водорода, фенил или пяти- или шестичленный гетероарильный цикл, выбранный из пиррола, тиофена, фурана, имидазола, оксазола, тиазола, пиридина, пиримидина, триазола и тиадиазола;
Х представляет собой O или NR6, и R6 представляет собой атом водорода;
Y, когда n равно 0, представляет собой С6Н4-группу или пяти- или шестичленный гетероарильный цикл, выбранный из пиррола, тиофена, фурана, имидазола, оксазола, тиазола, пиридина, пиримидина, триазола и тиадиазола, или, когда n равно 1, представляет собой NR6, и R6 представляет собой атом водорода;
r равно 2;
m принимает целые значения от 1 до 6;
n принимает целые значения 0 или 1.
Соединения этой группы, которые являются даже более предпочтительными, представляют собой соединения формулы I, где R5 представляет собой атом водорода, метил, бензил или цепочку формулы:
-(СН2)r-X-(CH2)m-Y-(CH2)n-A
где
А представляет собой атом водорода, фенил или гетероарильный цикл, выбранный из тиофена, фурана, тиазола, пиридина и триазола;
Х представляет собой NR6, и R6 представляет собой атом водорода;
Y, когда n равно 0, представляет собой С6Н4-группу или гетероарильный цикл, выбранный из тиофена, фурана, тиазола, пиридина и триазола, или, когда n равно 1, представляет собой NR6, и R6 представляет собой атом водорода.
Соединения, которые также являются предпочтительными, представляют собой соединения, где R и R2 имеют значения, приведенные в формуле I; R1 представляет собой атом водорода, N-(С1-С3)алкил-N-метиламиногруппу, N-(С1-С3)алкил-N-метиламино-N-оксидную группу, N-бензил-N-метиламиногруппу, N-(С1-С4)ацил-N-метиламиногруппу, N-[N,N-диметиламино(С1-С4)алкиламино]ацетил-N-метиламиногруппу или цепочку формулы:

где
А представляет собой атом водорода, фенил или пяти- или шестичленный гетероарильный цикл, выбранный из пиррола, тиофена, фурана, имидазола, оксазола, тиазола, пиридина, пиримидина, триазола и тиадиазола;
Х представляет собой O или NR6, и R6 представляет собой атом водорода;
Y, когда n равно 0, представляет собой С6Н4-группу или пяти- или шестичленный гетероарильный цикл, выбранный из пиррола, тиофена, фурана, имидазола, оксазола, тиазола, пиридина, пиримидина, триазола и тиадиазола, или, когда n равно 1, представляет собой NR6, и R6 представляет собой атом водорода;
r принимает целые значения от 1 до 3;
m принимает целые значения 1 или 2;
n принимает целые значения 0 или 1;
или R1 образует связь вместе с R2;
одновременно R3 образует группу =N-O-R5 вместе с R4, где R5 представляет собой атом водорода, линейный или разветвленный (С1-С3)алкил, бензил, необязательно замещенный одним или двумя заместителями, выбранными из нитро, гидрокси, карбокси, аминогруппы, линейного или разветвленного (С1-С3)алкила и цианогруппы, или цепочку формулы:
-(СН2)r-X-(CH2)m-Y-(CH2)n-A
где
А представляет собой атом водорода, фенил или пяти- или шестичленный гетероарильный цикл, содержащий от одного до трех гетероатомов, выбранных из атома азота, кислорода и серы;
Х представляет собой O или NR6, и R6 представляет собой атом водорода или линейный или разветвленный С1-С3алкил;
Y, когда n равно 0, представляет собой С6Н4-группу или пяти- или шестичленный гетероарильный цикл, содержащий от одного до трех гетероатомов, выбранных из атома азота, кислорода и серы, или, когда n имеет значение, отличное от 0, представляет собой O или NR6, и R6 представляет собой атом водорода или линейный или разветвленный С1-С3алкил;
r принимает целые значения 1 или 2;
m принимает целые значения от 1 до 6;
n принимает целые значения от 0 до 2.
Соединения, которые являются более предпочтительными в пределах данной группы соединений формулы I, представляют собой соединения, где R5 представляет собой атом водорода, метил, бензил или цепочку формулы:
-(СН2)r-X-(CH2)m-Y-(CH2)n-A
где
А представляет собой атом водорода, фенил или пяти- или шестичленный гетероарильный цикл, выбранный из пиррола, тиофена, фурана, имидазола, оксазола, тиазола, пиридина, пиримидина, триазола и тиадиазола;
Х представляет собой O или NR6, и R6 представляет собой атом водорода;
Y, когда n равно 0, представляет собой С6Н4-группу или пяти- или шестичленный гетероарильный цикл, выбранный из пиррола, тиофена, фурана, имидазола, оксазола, тиазола, пиридина, пиримидина, триазола и тиадиазола, или, когда n равно 1, представляет собой NR6, и R6 представляет собой атом водорода;
r равно 2;
m принимает целые значения от 1 до 6;
n принимает целые значения 0 или 1.
Соединения этой группы, которые являются даже более предпочтительными, представляют собой соединения формулы I, где R5 представляет собой атом водорода, метил, бензил или цепочку формулы:
-(СН2)r-X-(CH2)m-Y-(CH2)n-A
где
А представляет собой атом водорода, фенил или гетероарильный цикл, выбранный из тиофена, фурана, тиазола, пиридина и триазола;
Х представляет собой NR6, и R6 представляет собой атом водорода;
Y, когда n равно 0, представляет собой С6Н4-группу или гетероарильный цикл, выбранный из тиофена, фурана, тиазола, пиридина и триазола, или, когда n равно 1, представляет собой NR6, и R6 представляет собой атом водорода.
Соединения этой последней группы, которые являются даже более предпочтительными, представляют собой соединения формулы I, где R1 представляет собой атом водорода, N,N-диметиламиногруппу, N,N-диметиламино-N-оксидную группу, N-бензил-N-метиламиногруппу, N-ацетил-N-метиламиногруппу, N-[N,N-диметиламино(С1-С2)алкиламино]ацетил-N-метиламиногруппу или цепочку формулы:

где
А представляет собой атом водорода, фенил или гетероарильный цикл, выбранный из тиофена, фурана, тиазола, пиридина и триазола;
Х представляет собой NR6, и R6 представляет собой атом водорода;
Y, когда n равно 0, представляет собой С6Н4-группу или гетероарильный цикл, выбранный из тиофена, фурана, тиазола, пиридина и триазола, или, когда n равно 1, представляет собой NR6, и R6 представляет собой атом водорода;
или R1 образует связь вместе с R2.
Целью настоящего изобретения является разработка соединений формулы I, имеющих Z или Е конфигурацию возможного оксима в положении 9 с предпочтением для последних соединений.
Примерами фармацевтически приемлемых солей соединений формулы I являются соли с органическими или минеральными кислотами, такими как хлористый водород, бромистый водород, иодистый водород, азотная кислота, серная кислота, фосфорная кислота, уксусная кислота, винная кислота, лимонная кислота, бензойная кислота, янтарная кислота и глутаровая кислота.
Конкретными примерами соединений настоящего изобретения являются соединения, где R, R2 и R4 имеют значения, приведенные для формулы I, R1 образует связь вместе с R2, или R1 представляет собой атом водорода, N,N-диметиламино-N-оксидную группу, N-бензил-N-метиламиногруппу, N-ацетил-N-метиламиногруппу, N-[N,N-диметиламиноэтиламино]ацетил-N-метиламиногруппу, N-метил-N-3-[(2-тиазолилметил)амино]пропиламиногруппу, N-2-[2-[(2-тиазолилметил)амино]этиламино]этил-N-метиламиногруппу или N-2-[2-(бензиламино)этиламино]этил-N-метиламиногруппу, R3 представляет собой гидроксигруппу или образует группу =N-O-R5 вместе с R4, и R5 представляет собой атом водорода, метил, бензил, 2-[2-[(2-тиазолилметил)амино]этиламино]этильную группу, 2-(бензиламино)этильную группу, 2-[2-[(2-фурилметил)амино]этиламино]этильную группу, 2-[2-[(3-фурилметил)амино]этиламино]этильную группу, 2-[2-[(2-тиенилметил)амино]этиламино]этильную группу или 2-[6-[(2-тиазолилметил)амино]гексиламино]этильную группу.
Соединения формулы I настоящего изобретения получают в соответствии с синтетическим маршрутом, который включает удаление остатка L-кладинозы в положении 3 из соединения формулы:
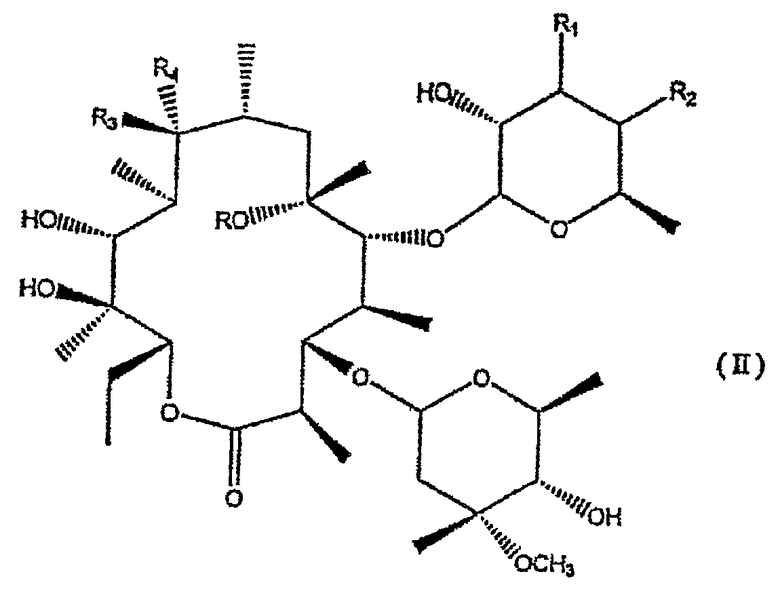
где
R, R1, R2, R3 и R4 имеют значения, приведенные для соединений формулы I.
Удаление остатка кладинозы предпочтительно проводят реакцией кислотного гидролиза, катализируемого в присутствии минеральной кислоты, например серной кислоты, или хлористого водорода, и протонного органического растворителя, например воды, метанола или этанола.
9-Гидроксисоединения, которые являются промежуточными соединениями формулы II, являются новыми, за исключением соединений, где (i) R1 представляет собой N,N-диметиламиногруппу, и (ii) R представляет собой атом водорода, а R1 представляет собой N,N-диметиламино-N-оксидную группу.
Например, 9-гидроксисоединения, где R представляет собой атом водорода или метильную группу и R1 представляет собой N,N-диметиламиногруппу, описаны как противобактериальные агенты в публикации R. Faghih et al., J. of Antibiotics, 1990, 43, 1334-36.
Соединения формулы II получены из эритромицина А или 6-О-метилэритромицина А (общепринятое название: Кларитромицин) путем воздействия на кетогруппу в положении 9 и необязательно на диметиламиногруппу в положении 3'. Предпочтительно воздействие вначале направляют на кетогруппу в положении 9; она может быть восстановлена с получением гидроксисоединения или может быть обработана реагентами, способными давать оксиминосоединения, которые затем могут быть функционализованы.
Возможные модификации диметиламиногруппы в положении 3' включают окисление, удаление или деметилирование и последующую функционализацию (алкилирование и ацилирование).
Для квалифицированного в данной области специалиста очевидно, что, чтобы исключить вмешательство функциональных групп, которые могут присутствовать в третьих положениях, где может быть произведена структурная модификация, будет более или менее удобно соответствующим образом выбирать данный приоритет при синтетической модификации, которая должна быть произведена.
Таким образом, например, возможная функционализация оксиминосоединений может иметь место сразу после их синтеза, может быть проведена до или после возможной модификации, где бы она не могла быть, в положении 3', или может быть последней стадией синтеза.
Что касается еще одного примера относительно удаления кладинозы, то такое удаление может быть осуществлено после модификации кетогруппы в положении 9, может следовать за или предшествовать функционализации оксиминосоединений в этом положении, может следовать за или предшествовать возможной модификации на диметиламиногруппе или может завершать процесс синтеза.
Предпочтительно реакцию гидролиза сахара проводят после модификации кетогруппы в положении 9 макролидного цикла, чтобы исключить присутствие кладинозы в реакционной среде и необходимость ее последующего отделения от конечного продукта, а не от промежуточного соединения синтеза; однако в общем случае отсутствуют взаимодействия, которые могли бы препятствовать удалению кладинозы на другой промежуточной стадии или в конце процесса синтеза.
Такие процедурные альтернативы будут определяться в каждом случае техническими требованиями, направленными на оптимизацию процесса синтеза рассматриваемого продукта.
Пути осуществления упомянутых выше структурных модификаций макролидов описаны ниже более подробно.
Оксимы эритромицина А с Z и Е конфигурацией известны. Они являются коммерчески доступными соединениями и могут быть получены посредством обычных методик, например, в соответствии с патентом США 3478014 (Pliva or J.C. Gasc et al.) (The Journal of Antibiotics; 44, 313-330, 1991) с получением соединений формулы:

где
R имеет значения, приведенные для формулы I.
Гидроксипроизводные в положении 9 представляют собой соединения, которые также известны и которые могут быть получены обычными методиками, путем обработки эритромицина А восстанавливающими агентами, например гидридами (боргидридом натрия, боргидридом лития, цианборгидридом натрия или алюмогидридом лития (Faghih, Journal of Antibiotics, 1990, 1334-1336), или посредством процессов каталитического гидрирования с получением соединений формулы

где
R имеет значения, приведенные для формулы I.
Соединения формулы I, где R5 имеет значения, отличные от атома водорода, могут быть получены прямым синтезом или путем функционализации оксима в положении 9 по обычным методикам.
Обычно необязательную функционализацию проводят реакцией с соединением формулы:

где
R5' имеет все значения R5, за исключением атома водорода, и L представляет собой уходящую группу, предпочтительно атом хлора или брома или мезильную группу.
Другой путь, который особенно подходит для получения соединений формулы I, где R5 представляет собой цепочку формулы:
-(СН2)r-X-(CH2)m-Y-(CH2)n-A
где
X, Y, A, r, m и n имеют значения, приведенные в формуле I;
включает взаимодействие соединения формулы II, где R5 представляет собой атом водорода и из которого кладиноза уже необязательно удалена, с промежуточным соединением формулы:
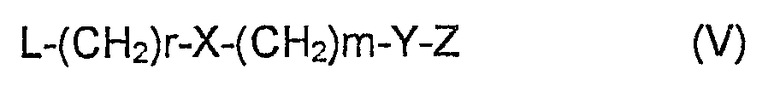
где
L, X, Y, m и n имеют значения, уже приведенные, и Z представляет собой защитную группу, например уретан (карбобензилоксигруппы, карбоаллилоксигруппы или трихлорацетилоксикарбонильные группы);
с получением промежуточного соединения формулы:


где
R, R1, R2, X, Y, Z, r и m имеют значения, уже приведенные, и R7 представляет собой атом водорода или L-кладинозу; которое после удаления защитной группы Z, вводят в реакцию с соединением формулы:
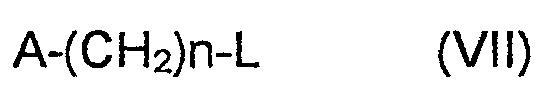
где A, L и n имеют значения, приведенные ранее,
с получением соединения формулы I.
Соединения формулы I, где Y представляет собой NR6, могут быть получены способом синтеза, приведенным выше, включающим использование альдегида формулы:

где А имеет ранее приведенные значения;
вместо промежуточного соединения формулы VII, после удаления защитной группы Z из промежуточного соединения формулы VI.
Удаление диметиламиногруппы проводят путем окисления, пиролиза или возможным восстановлением в соответствии с известными способами, например способами, описанными в международной патентной заявке WO 00/42055 (Zambon Group) или в патенте США 3928387 (Hoffmann-La Roche Inc.), которые уже цитировались.
Для специалиста в данной области очевидно, что для того, чтобы исключить вмешательство функциональных групп, которые могут присутствовать в заместителе R5, удаление диметиламиногруппы предпочтительно проводить в промежуточных соединениях формулы:

где
R и R7 имеют ранее приведенные значения, а R5" представляет собой атом водорода или линейный или разветвленный С1-С5алкил.
Окисление дает N-оксиды формулы:

где
R, R5" и R7 имеют ранее приведенные значения;
которые за счет пиролиза, после которого необязательно следует восстановление, дают соответственно соединения формул:

и

где
R, R5" и R7 имеют ранее приведенные значения.
Превращение в соответствующие N-оксиды происходит в соответствии с известными способами путем обработки надкислотами, например перекисью водорода или мета-хлорнадбензойной кислотой, в присутствии органического растворителя (патент США 3928387, Hoffmann-La Roche Inc., уже цитировался) (J. Am. Chem. Soc., 1954, 76, 3121).
Деметилирование диметиламиногруппы в положении 3' может быть осуществлено с помощью обычных методик, например обработкой ацетатом натрия и иодом в присутствии органического растворителя, как это описано в патенте США 3725385 (Abbott Laboratories); последующее алкилирование вторичного амина, полученного таким образом, проводят в соответствии с обычными методиками синтеза.
Кроме того, соединения формулы I, где R1=R2=H, могут быть получены восстановлением соответствующих соединений формулы I, где R1 и R2 вместе образуют связь.
Другой способ синтеза 3',4'-дегидрооксиминопроизводных эритромицина А состоит в обработке, которая описана в патенте США 3928387 (Hoffmann-La Roche Inc., уже цитировался), так, чтобы получить промежуточное соединение формулы:
и затем, в зависимости от необходимого соединения, связь с кладинозой может быть гидролизована, а оксим в положении 9 может быть необязательно функционализирован так, как описано ранее, и наоборот.
Макролидные соединения имеют широкое терапевтическое применение в качестве противобактериальных агентов; в каждом случае клинические и экспериментальные данные показывают, что они могут вовлекаться в модулирование воспалительной реакции.
Большое число доказательств, полученных в исследованиях как in vitro, так и in vivo, показывает, что, несмотря на ингибирование высвобождения цитокинов, модуляторные эффекты макролидных соединений направлены на важные клеточные мишени, такие как лимфоциты и нейтрофилы.
Такие клетки, в частности, представляют собой первую линию защиты против патогенов, причем эта функция выражается через фагоцитоз, высвобождение гидролитических ферментов и продуцирование токсичных кислородных метаболитов.
Хотя нейтрофилы являются существенными при иммунной защите, известно, что нефизиологическое высвобождение окисляющих веществ и гидролитических ферментов может быть вовлечено во многие патологические состояния, например атеросклероз, реперфузионное ишемическое поражение, ревматоидный артрит, септический шок и хронические легочные воспаления, такие как ARDS (острый респираторный дистресс-синдром), COPD и астма (воспаление и лихорадка; Viera "Stvrtinova, Jan Jakubovsky, Ivan Hulin; Academic Electronic Press, 1995).
Лечение с помощью эритромицина в низких дозах в течение длительного периода времени описано как являющееся эффективным при ослаблении бронхиальной гиперчувствительности у больных астмой (Miyatake H. et al., Chest, 1991, 99, 670-673, уже цитировалась).
В дополнительном исследовании показано, что определенное лечение больных, страдающих COPD, может значительно понизить частоту и риск обострения такого заболевания, вызываемого острыми респираторными инфекциями (CHEST 2001, 120, 730-733).
Полученные результаты объясняют не антибиотической активностью макролида, а ингибированием экспрессии и высвобождения воспалительных цитокинов.
Такое лечение в соответствии с уже цитировавшейся статьей предпочтительно должно ограничиваться больными с высоким риском обострения COPD вследствие потенциального риска появления устойчивых патогенных линий.
Соединения формулы I настоящего изобретения обладают противовоспалительной активностью и не имеют антибиотической активности.
Фармакологическая активность соединений формулы I оценена в моделях кожного и легочного воспаления в сравнении с известными макролидными соединениями, такими как эритромицин и азитромицин, которые обладают как противовоспалительной, так и антибиотической активностью.
Противовоспалительная активность оценена как через ингибирование РМА-индуцированного отека уха мышей и через понижение LPS-индуцированного накопления нейтрофилов в легких крыс.
Во всех экспериментах соединения настоящего изобретения, как установлено, являются высоко активными в качестве противовоспалительных агентов и указанная активность аналогична или выше, чем противовоспалительная активность соединений сравнения.
Антибиотическую активность оценивают in vitro по способности ингибировать развитие чувствительных к эритромицину бактериальных линий.
Кроме того, соединения настоящего изобретения не проявляют антибиотической активности, как доказано с помощью проведенных испытаний, и, следовательно, могут быть использованы при хроническом лечении воспалительных процессов без появления нежелательного явления устойчивости.
Таким образом очевидно, что соединения формулы I, обладающие противовоспалительной активностью и не имеющие антибиотической активности, могут быть использованы при остром и хроническом лечении и при профилактике воспалительных заболеваний, в особенности заболеваний, относящихся к нарушенной клеточной функциональности нейтрофилов, например ревматоидного артрита, реперфузионного ишемического поражения, септического шока, атеросклероза, ARDS, COPD и астмы.
Терапевтически эффективные количества будут зависеть от возраста и общего физиологического состояния пациента, способа введения и используемого фармацевтического препарата; терапевтические дозы обычно будут составлять приблизительно от 10 до 2000 мг/день и предпочтительно приблизительно от 30 до 1500 мг/день.
Соединения настоящего изобретения для применения при лечении и/или при профилактике названных выше заболеваний предпочтительно используют в фармацевтической форме, которая подходит для перорального, ректального, подъязычного, парентерального, местного, трансдермального и ингаляционного введения.
Таким образом, еще одним объектом настоящего изобретения является разработка фармацевтических препаратов, содержащих терапевтически эффективное количество соединения формулы I или его соли вместе с фармацевтически приемлемым носителем.
Фармацевтические препараты настоящего изобретения могут представлять собой жидкость, подходящую для перорального и/или парентерального введения, например капли, сиропы, растворы, инъецируемые растворы, уже пригодные для применения или полученные путем растворения лиофилизата, но предпочтительными являются твердые препараты, например таблетки, капсулы, гранулы, порошки, пеллеты, вагинальные свечи, свечи, кремы, помады, гели или мази; или, с другой стороны, растворы, суспензии, эмульсии или другие формы, приемлемые для ингаляции и трансдермального введения.
В зависимости от типа препарата такие формы будут содержать помимо терапевтически эффективного количества одного (или нескольких) соединения(ий) формулы I, твердый или жидкий наполнитель или разбавитель для фармацевтического применения и необязательно другие вспомогательные вещества, обычно используемые при получении фармацевтических препаратов, например загустители, агенты, вызывающие агрегацию, смазывающие вещества, диспергирующие агенты, корригенты и красители.
Фармацевтические препараты настоящего изобретения могут быть получены в соответствии с обычными методиками.
Приведенные ниже примеры даны с целью более четкой иллюстрации настоящего изобретения.
Химические структуры и аналитические характеристики промежуточных соединений, а также соединений формулы I приведены в следующей таблице.






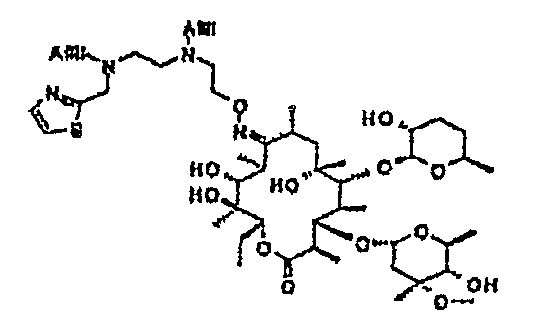
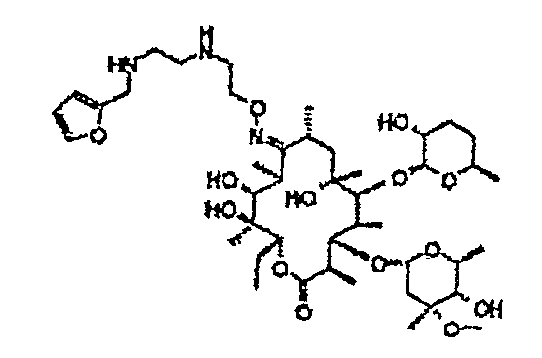

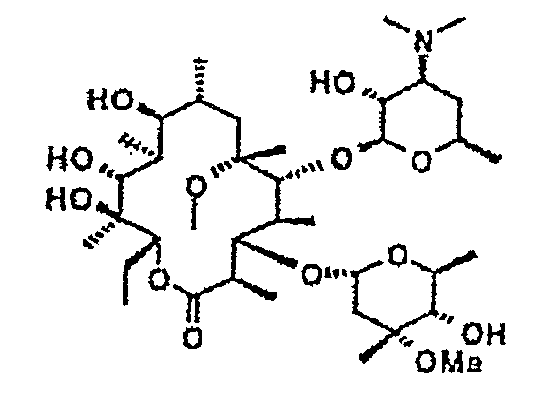

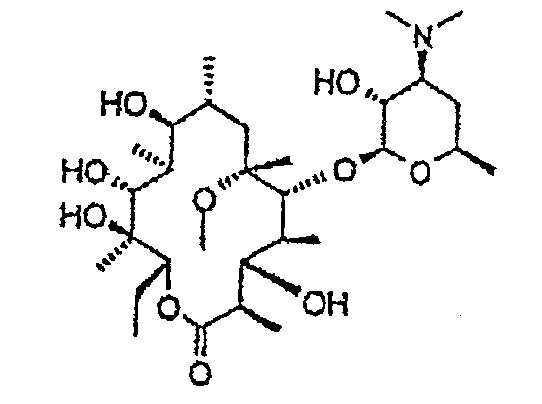
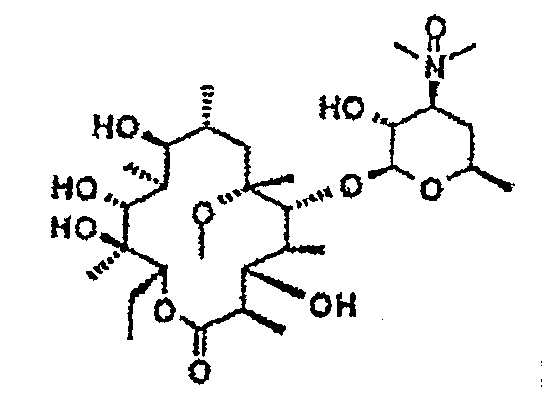
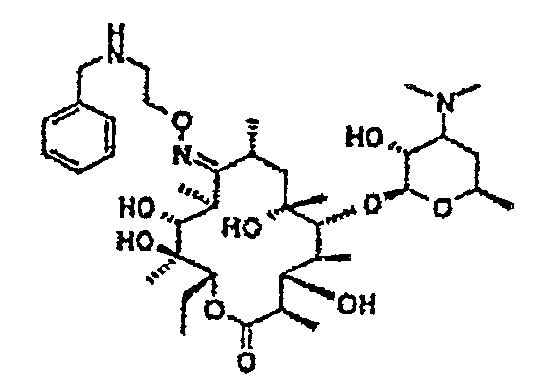




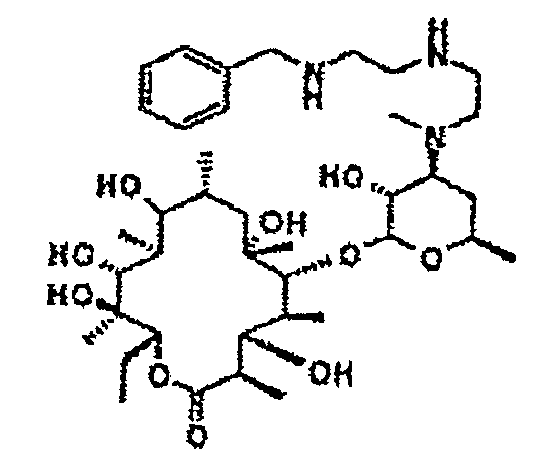
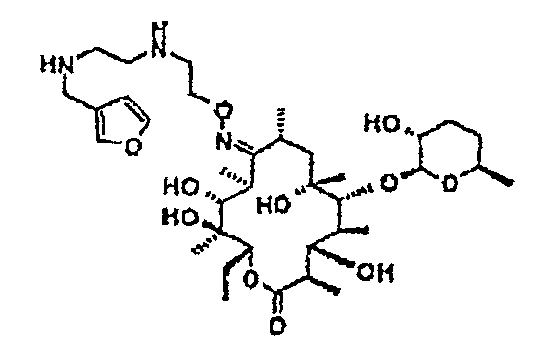



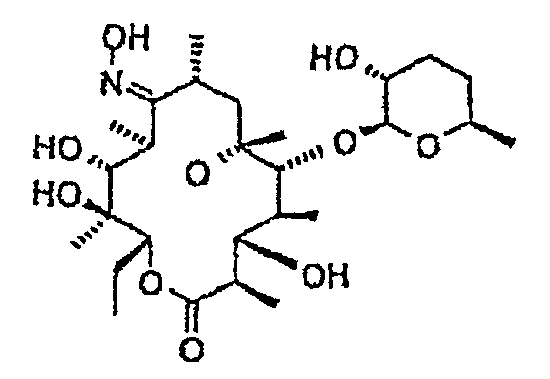
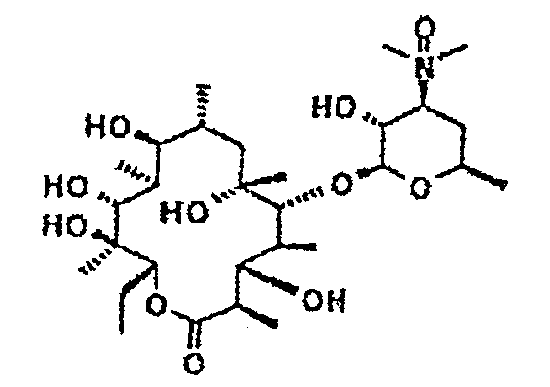
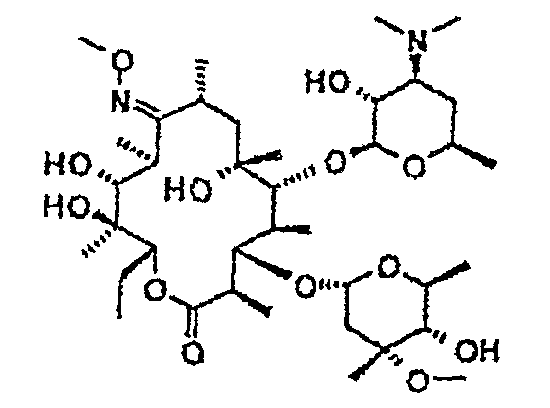

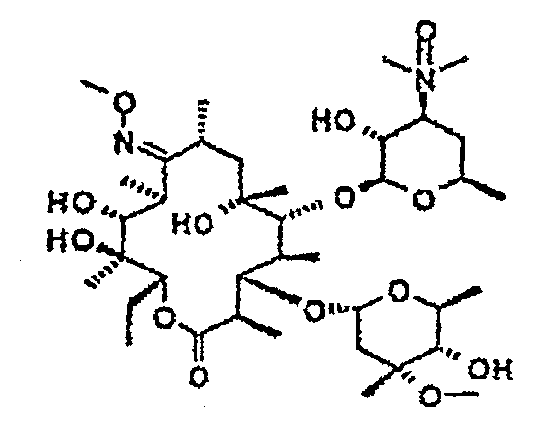




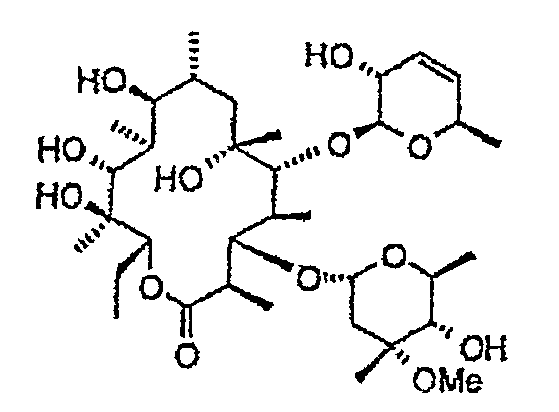
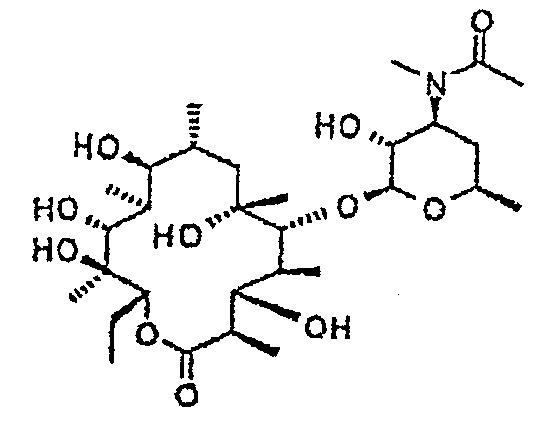
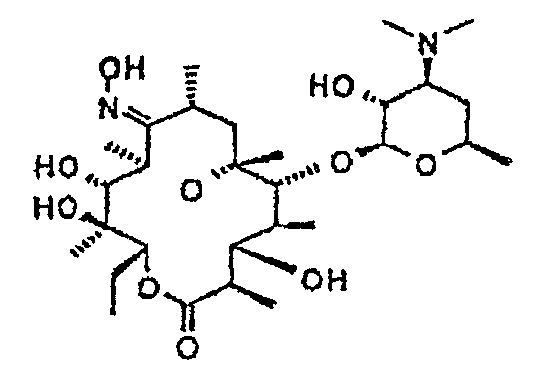

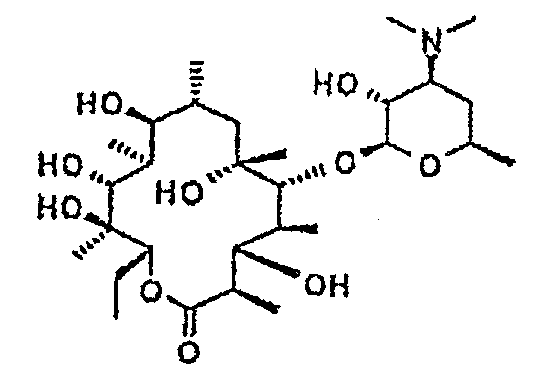

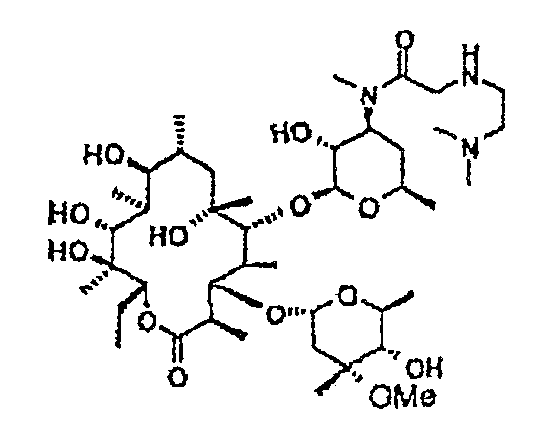




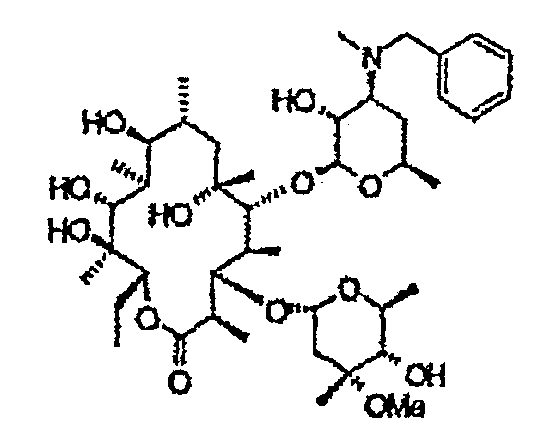
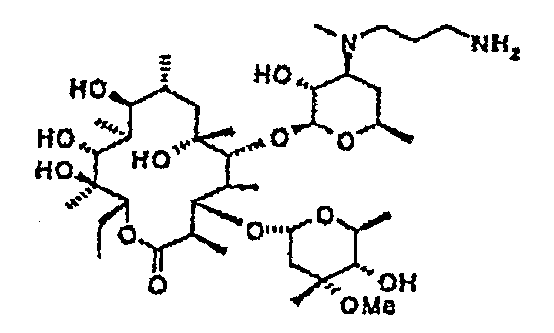



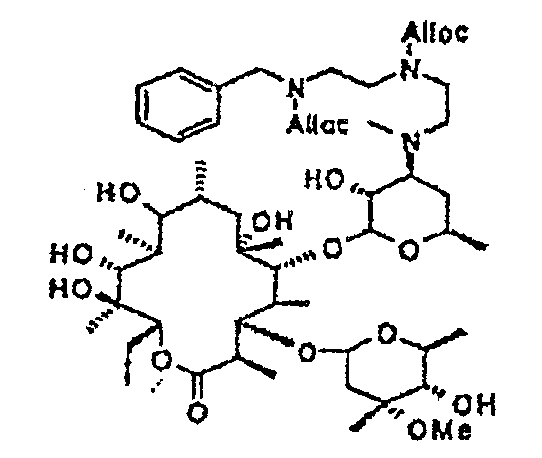

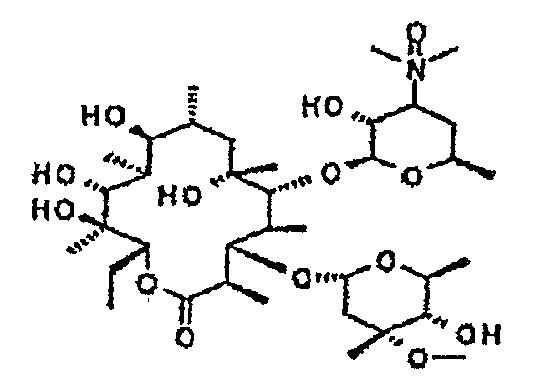




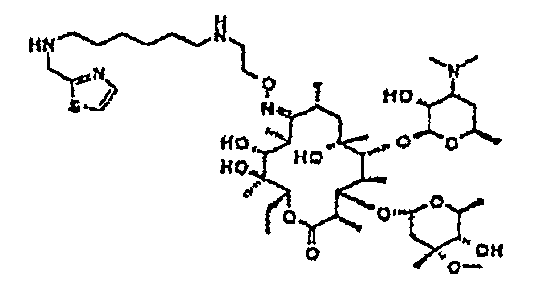
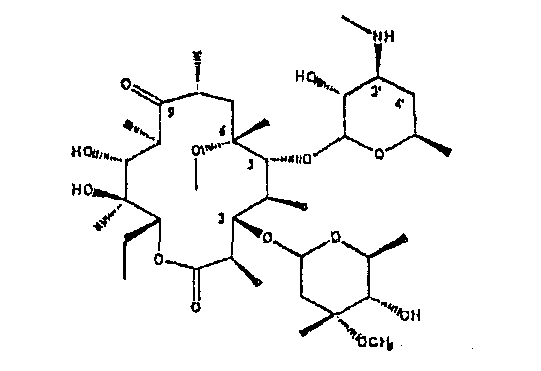


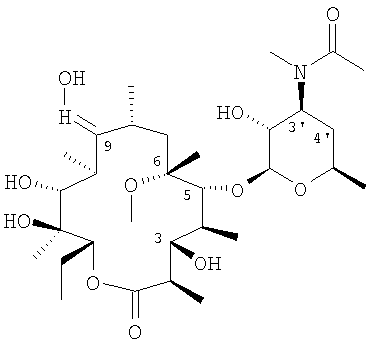


Пример 1
Получение промежуточного соединения 1
Раствор NaBH4 (11,3 г, 300 ммоль) в Н2О (75 мл) добавляют по каплям (в течение более 20 мин) к раствору эритромицина (100 г, 136,3 ммоль) в ТГФ (1,5 л), температура которого поддерживается при 0°С. Реакционную смесь перемешивают 1 час при 0°С и 3 часа при комнатной температуре. После упаривания ТГФ в вакууме получают сырой продукт, который растворяют в этилацетате (0,5 л) и лимонной кислоте (1 л 5%-ного водного раствора). Водную фазу экстрагируют, промывают этилацетатом (3×0,5 л) и нейтрализуют К2СО3. Экстракция этилацетатом (3×1 л) дает органическую фазу, которую сушат над сульфатом натрия, фильтруют и упаривают в вакууме, получают промежуточное соединение 1 (72,1 г, выход 72%, 89,6% d.e.) в виде белого твердого вещества.
[M+1]+ 736.
Пример 2
Получение промежуточного соединения 2
Раствор промежуточного соединения 1 (10,3 г, 14 ммоль) в метаноле (120 мл) удерживают в потоке азота и последовательно к нему добавляют ацетат натрия (5,7 г, 70 ммоль) и йод (4,28 г, 16,9 ммоль). Реакционную смесь перемешивают и облучают 6 часов УФ лампой на 400 ватт, поддерживая при этом температуру 20-30°С с помощью ледяной бани. Метанол упаривают в вакууме, остаток забирают в этилацетат и экстрагируют 5%-ным метабисульфатом натрия. Объединенную водную фазу обрабатывают 10%-ным раствором NaOH до щелочного значения рН и экстрагируют этилацетатом (4×0,5 л). После сушки с помощью сульфата натрия органическую фазу фильтруют и упаривают в вакууме, получают 10 г белого твердого сырого продукта, который растворяют в этилацетате (40 мл при 50°С) и кристаллизуют, получают промежуточное соединение 2 (5,3 г, выход 53%) в виде белого твердого вещества.
[M+1]+ 722.
Пример 3
Получение промежуточного соединения 3
Раствор уксусного ангидрида (31 мкл, 0,33 ммоль) в диоксане (1 мл) добавляют к раствору промежуточного соединения 2 (200 мг, 0,277 ммоль) и К2СО3 (76 мг, 0,554 ммоль) в диоксане (4 мл) и в воде (5 мл). Через 3 часа добавляют метанол и раствор упаривают в вакууме. Сырое твердое вещество растворяют в этилацетате (20 мл) и промывают 5%-ной лимонной кислотой (2×10 мл) и 10%-ным раствором К2СО3 (2×10 мл). Органическую фазу сушат над сульфатом натрия и фильтруют, растворитель упаривают, получают промежуточное соединение 3 (130 мг, выход 62%) в виде белого твердого вещества.
[M-1]- 763.
Пример 4
Получение соединения 1 (1-й путь синтеза)
Концентрированную HCl (0,5 мл) добавляют по каплям к раствору промежуточного соединения 3 (470 мг, 0,618 ммоль) в метаноле (50 мл) и реакционную смесь перемешивают 1 час. После нейтрализации концентрированным NH3 раствор упаривают, растворяют в СН2Cl2, неорганические соли отфильтровывают и растворитель отгоняют в вакууме. Очистка с помощью хроматографии Biotage (картридж с диоксидом кремния 40M, элюент СН2Cl2/МеОН, 30/1) дает соединение 1 (329 мг, выход 90%) в виде белого твердого вещества.
[M-1]- 604.
Пример 5
Получение промежуточного соединения 4
Концентрированную HCl (5 мкл) добавляют к гетерогенному раствору промежуточного соединения 2 (1 г, 1,38 ммоль) в Н2О (10 мл) и реакционную смесь перемешивают интенсивно в течение 5 дней. К раствору добавляют 1 мл концентрированного NH3 (рН>8), после чего экстрагируют этилацетатом (3×10 мл). Объединенную органическую фазу промывают раствором NaCl (10 мл, 20%-ный), сушат над сульфатом натрия, фильтруют и упаривают в вакууме, получают промежуточное соединение 4 (0,73 г, выход 90%) в виде белого твердого вещества.
[M+1]+ 565.
ВЭЖХ-МС: колонка Zorbax SB-C18, 2,1×50 мм, 3,5 мм; температура колонки 45°С; подвижная фаза А 0,1% муравьиной кислоты в Н2О, В 0,1% муравьиной кислоты в ацетонитриле; градиент 0 мин, 5% В, 8 мин 95% В; скорость потока 1 мл/мин; объем инъекции 2 мкл; концентрация образца 0,5-1 мг/мл; масс-спектрометрический детектор, снабженный источником ионизации пучком электронов, положительная ионизация; время удерживания 3,01 мин, которое соответствует 3,22 для соединения 2; общее время опыта 8 мин плюс 2 мин повторного уравновешивания.
Пример 6
Получение соединения 1 (2-й путь синтеза)
Соединение 1 получают из промежуточного соединения 4 (0,73 г, 0,97 ммоль) и уксусного ангидрида (91 мл, 0,97 ммоль) в соответствии с методикой, описанной при получении промежуточного соединения 3. Через 3 часа реакционную смесь разбавляют метанолом и упаривают в вакууме. Твердый сырой продукт растворяют в 5%-ном водном растворе лимонной кислоты и экстрагируют этилацетатом. Объединенные органические фазы промывают 20%-ным водным раствором NaCl, сушат над сульфатом натрия, фильтруют и упаривают в вакууме, получают соединение 1 (0,56 г, выход 95%) в виде белого твердого вещества.
[M-1]- 604.
Пример 7
Получение соединения 2
Соединение 2 получают из промежуточного соединения 1 (322 мг, 0,438 ммоль) в соответствии с методикой, описанной для получения соединения 1. После нейтрализации концентрированным NH3 раствор упаривают. Сырой продукт растворяют в 1н. HCl, промывают CH2Cl2 (3×10 мл) и добавляют к фазе водного К2СО3 до щелочного значения рН. Экстракция этилацетатом дает органическую фазу, которую сушат над сульфатом натрия и фильтруют, получают соединение 2 (225 мг, выход 89%) в виде белого твердого вещества.
[M+1]+ 578.
Пример 8
Получение промежуточного соединения 5
К раствору промежуточного соединения 1 (4,4 г, 6 ммоль) в хлороформе (250 мл) добавляют порциями мета-хлорнадбензойную кислоту (1,35 г, 6,06 ммоль) и реакционную смесь разбавляют 5%-ным раствором бикарбоната натрия до основного значения рН. Органическую фазу отделяют и водную фазу промывают СН2Cl2 (3×50 мл). Объединенный органический раствор промывают 20%-ным раствором NaCl, сушат над сульфатом натрия, фильтруют и упаривают, получают твердое желтое вещество. Очистка с помощью хроматографии Biotage (картридж с диоксидом кремния 40М, элюент СН2Cl2/МеОН/NH3, 20/1/0,1) дает белые кристаллы промежуточного соединения 5 (1,3 г, выход 70%).
[M+1]+ 753.
Пример 9
Получение соединения 3
Соединение 3 получают из промежуточного соединения 5 (2,07 г, 0,275 ммоль) в соответствии с методикой, описанной для получения соединения 1. Очистка с помощью хроматографии Biotage (картридж с диоксидом кремния 40М, элюент СН2Cl2/МеОН/NH3, 16/1/0,1) дает соединение 3 (1,44 г, выход 88%) в виде белого твердого вещества.
[M+1]+ 595.
Пример 10
Получение промежуточного соединения 6
Уксусный ангидрид (26 мл, 276 ммоль) добавляют по каплям к раствору промежуточного соединения 5 (70 г, 95 ммоль) в СН2Cl2 (0,5 л) и реакционную смесь перемешивают 1 день. Хотя небольшое количество непрореагировавшего материла еще присутствует, реакционную массу нейтрализуют путем добавления 5%-ного раствора NaHCO3 (1 л) и перемешивают еще 10 мин. Раствор разбавляют СН2Cl2 (0,5 л); органическую фазу отделяют и промывают 10%-ным раствором К2СО3 (3×0,5 л), 5%-ным раствором лимонной кислоты (3×0,5 л) и 20%-ным раствором NaCl (0,3 л). Раствор упаривают с получением сырого белого твердого продукта (50 г), который, хотя и содержит 40% непрореагировавшего материала, используют непосредственно на следующей стадии синтеза.
[M-1]- 805.
ВЭЖХ-МС: колонка Zorbax SB-C18, 2,1×50 мм, 3,5 мм; температура колонки 45°С; подвижная фаза А 0,1% муравьиной кислоты в Н2О, В 0,1% муравьиной кислоты в ацетонитриле; градиент 0 мин, 5% В, 8 мин 95% В; скорость потока 1 мл/мин; объем инъекции 2 мкл; концентрация образца 0,5-1 мг/мл; масс-спектрометрический детектор, снабженный источником ионизации пучком электронов, отрицательная ионизация; время удерживания 6,17 мин, которая соответствует 3,22 для соединения 2; общее время опыта 8 мин плюс 2 мин повторного уравновешивания.
Пример 11
Получение промежуточного соединения 3 (2-й путь синтеза)
К раствору промежуточного соединения 6 (50 г сырой смеси) в метаноле (500 мл) и воде (160 мл) добавляют К2СО3 (34 г, 250 ммоль) и смесь перемешивают при 60°С в течение 8 часов. После охлаждения до 0°С на водяной бане добавляют HCl (120 мл 2 н. раствора) до рН 7. Раствор упаривают в вакууме для удаления метанола и экстрагируют CH2Cl2 (4×0,5 л). Органическую фазу сушат над сульфатом натрия, фильтруют и упаривают, получают сырое белое твердое вещество (36 г). Очистка флэш-хроматографией (диоксид кремния, элюент CH2Cl2/MeOH, 25/1) дает промежуточное соединение 3 (14 г, общий выход 20% для последних 2 стадий).
[M-1]- 763.
Пример 12
Получение промежуточного соединения 7
К раствору промежуточного соединения 2 (336 мг, 0,465 ммоль) в дихлорэтане (15 мл) последовательно добавляют молекулярные сита размером 4Е (0,2 г), бензальдегид (0,060 л, 0,56 ммоль), уксусную кислоту (0,04 мл, 0,7 ммоль) и тетраметиламмонийтриацетоксиборгидрид (306 г, 1,16 ммоль). Реакционную массу перемешивают 1 день, фильтруют через слой Celite, промывая СН2Cl2 (20 мл), и разбавляют 5%-ным раствором NaHCO3 (10 мл) и 20%-ным раствором NaCl (10 мл). Органический слой отделяют и водную фазу экстрагируют CH2Cl2 (3×20 мл). Объединенную органическую фазу сушат над сульфатом натрия, фильтруют и упаривают в вакууме. Очистка с помощью хроматографии Biotage (картридж с диоксидом кремния 12М, элюент СН2Cl2/МеОН/NH3, 30/1/0,1) дает промежуточное соединение 7 (250 мг, выход 67%).
[M+1]+ 813.
Пример 13
Получение соединения 4
Соединение 4 получают из промежуточного соединения 2 (200 мг, 0,868 ммоль) в соответствии с методикой, описанной для получения соединения 1. Очистка с помощью хроматографии Biotage (картридж с диоксидом кремния 12М, элюент СН2Cl2/МеОН/NH3, 30/1/0,1) дает соединение 4 (92 мг, выход 57%).
[M+1]+ 654.
Пример 14
Получение промежуточного соединения 8
Раствор промежуточного соединения 2 (530 мг, 0,734 ммоль) в ацетонитриле (10 мл) кипятят с обратным холодильником в течение 6 часов. Избыток ацетонитрила отгоняют в вакууме, получают сырой продукт, N-метил-N-[2-(циано)этил]производное, которое растворяют в 1,5М растворе NH3 в метаноле (10 мл), переносят в колбу высокого давления и после добавления родиевого катализатора (5% на Al2O3, 100 мг) и 3 циклов гидрирования, реакционную смесь перемешивают 4 часа в атмосфере водорода с давлением 50 фунт/кв.дюйм. Очистка с помощью хроматографии Biotage (картридж с диоксидом кремния 12М, элюент СН2Cl2/МеОН/NH3, 90/10/1) дает промежуточное соединение 8 (310 мг, выход 55% по двум стадиям).
[M+1]+ 780.
Пример 15
Получение промежуточного соединения 9
К раствору промежуточного соединения 8 (306 мг, 0,397 ммоль) в абсолютном этаноле (5 мл) последовательно добавляют молекулярные сита размером 3Е (1 г) и раствор 2-тиазолкарбальдегида (45 мг, 0,4 ммоль) в этаноле (1 мл). Через 6 часов реакционную смесь фильтруют через слой диоксида кремния, промывая этанолом (5 мл), и переносят в колбу высокого давления, в которую добавляют уксусную кислоту (0,5 мл) и 10% Pd/С (150 мг). Используя аппарат Парра, раствор перемешивают в атмосфере водорода в течение ночи при давлении 50 фунт/кв.дюйм. Фильтрование через слой Celite, упаривание в вакууме и очистка с помощью хроматографии Biotage (картридж с диоксидом кремния 12М, элюент СН2Cl2/МеОН/NH3, 20/1/0,1) дает промежуточное соединение 9 (140 мг, выход 41%) в виде белого твердого вещества.
[M+1]+ 877.
Пример 16
Получение соединения 5
Соединение 5 получают из промежуточного соединения 9 (70 мг, 0,08 ммоль) по методике, описанной для соединения 1. Реакционную смесь разбавляют дистиллированной водой (20 мл), растворитель отгоняют и водную фазу промывают CH2Cl2 (3×10 мл), добавляют концентрированный водный аммиак до рН>7, органическую фазу сушат над сульфатом натрия, фильтруют и упаривают в вакууме, получают соединение 5 (50 мг, выход 87%).
[M+1]+ 719.
Пример 17
Получение промежуточного соединения 10
Смесь N-циклогексилкарбодиимида и N-метилполистирола (1,8 г, 1,69 ммоль/г) в СН2Cl2 (40 мл) центрифугируют 5 мин, последовательно добавляют хлоруксусную кислоту (216 мг, 2,28 ммоль) и промежуточное соединение 2 (1,5 г, 2,078 ммоль) и смесь центрифугируют при 300 об/мин в течение 40 часов. Раствор отфильтровывают от смолы, промывая смолу метанолом, и фильтрат упаривают в вакууме. Очистка с помощью хроматографии Varian Mega Bond Elut (10 г диоксид кремния/60 мл картридж) при элюировании СН2Cl2 и метанолом (градиент от 0% до 10%) дает промежуточное соединение 10 (1,1 г, выход 66%) в виде белого твердого вещества.
[M+1]+ 799.
Пример 18
Получение промежуточного соединения 11
Раствор промежуточного соединения 10 (500 мг, 0,626 ммоль), триэтиламин (0,35 мл, 2,5 ммоль) и диметиламиноэтиленамин (0,082 мл, 0,75 ммоль) в ТГФ (10 мл) кипятят с обратным холодильником 16 часов. Реакционную смесь упаривают и очищают с помощью хроматографии Biotage (картридж с диоксидом кремния 40S, элюент СН2Cl2/МеОН/NH3, 20/1/0,1), получают промежуточное соединение 11 (400 мг, выход 75%) в виде белого твердого вещества.
[M+1]+ 851.
Пример 19
Получение соединения 6
Соединение 6 получают из промежуточного соединения 11 (270 мг, 0,323 ммоль) по методике, описанной для соединения 1. Очистка с помощью препаративной ВЭЖХ и элюирование через картридж С18 дают соединение 6 (100 мг, выход 45%).
[M+1]+ 693.
Пример 20
Получение промежуточного соединения 12
Промежуточное соединение 12 получают из промежуточного соединения 2 (488 мг, 0,67 ммоль) и из аллил[2-(аллилоксикарбонил-2-тиазолилметиламино)этил]-2-(оксоэтил)карбамата (248 мг, 0,67 ммоль) по методике, описанной для промежуточного соединения 7. Очистка с помощью хроматографии Biotage (картридж с диоксидом кремния 40М, элюент СН2Cl2/МеОН/NH3, 20/1/0,1) дает промежуточное соединение 12 (390 мг, выход 55%) в виде коричневого масла.
[M+1]+ 1074.
Пример 21
Получение промежуточного соединения 13
К раствору промежуточного соединения 12 (380 мг, 0,354 ммоль) в CHCl3 (5 мл), находящему в атмосфере аргона, последовательно добавляют пирролидин (0,083 мл, 1 ммоль) и тетракис(трифенилфосфин)палладия (20 мг, 0,02 ммоль). Реакционную смесь перемешивают 2 часа, нейтрализуют водой (10 мл), органическую фазу отделяют и водную фазу экстрагируют СН2Cl2 (2×10 мл). Объединенную органическую фазу сушат над сульфатом натрия, фильтруют и упаривают в вакууме, получают сырое масло. Очистка с помощью хроматографии Biotage (картридж с диоксидом кремния 12М, элюент СН2Cl2/МеОН/NH3, 15/1/0,1) дает промежуточное соединение 13 (180 мг, выход 56%).
[M+1]+ 906.
Пример 22
Получение соединения 7
Соединение 7 получают из промежуточного соединения 13 (128 мг, 0,141 ммоль) по методике, описанной для соединения 1. Реакционную смесь разбавляют дистиллированной водой (20 мл) и метанол упаривают в вакууме, получают водную фазу, которую промывают CH2Cl2 (3×10 мл), добавляют концентрированный водный аммиак до рН>7 и смесь экстрагируют СН2Cl2 (3×10 мл). Объединенную органическую фазу сушат над сульфатом натрия, фильтруют и упаривают в вакууме, получают соединение 7 (50 мг, выход 47%).
[M+1]+ 748.
Пример 23
Получение промежуточного соединения 14
Промежуточное соединение 14 получают из промежуточного соединения 2 (500 мг, 0,693 ммоль) и из аллил[2-(аллилоксикарбонилфенилметиламино)этил]-(2-оксоэтил)карбамата (256 мг, 0,7 ммоль) по методике, описанной для промежуточного соединения 7. Очистка с помощью хроматографии Biotage (картридж с диоксидом кремния 40М, элюент СН2Cl2/МеОН/NH3, 40/1/0,1) дает промежуточное соединение 14 (600 мг, выход 82%) в виде масла.
[M+1]+ 1067.
Пример 24
Получение промежуточного соединения 15
Промежуточное соединение 15 получают из промежуточного соединения 14 (594 мг, 0,557 ммоль) по методике, описанной для промежуточного соединения 13. Очистка с помощью хроматографии Biotage (картридж с диоксидом кремния 40S, элюент СН2Cl2/МеОН/NH3, 30/1/0,1) дает промежуточное соединение 15 (310 мг, выход 62%) в виде белого твердого вещества.
[M+1]+ 899.
Пример 25
Получение соединения 8
Соединение 8 получают из промежуточного соединения 15 (250 мг, 0,278 ммоль) по методике, описанной для соединения 1. Очистка с помощью хроматографии Biotage (картридж с диоксидом кремния 12М, элюент СН2Cl2/МеОН/NH3, 30/1/0,1) дает промежуточное соединение 8 (110 мг, выход 54%) в виде белого твердого вещества.
[M+1]+ 741.
Пример 26
Получение промежуточного соединения 16
К раствору 3'-дездиметиламино-3',4'-дегидроэритромицина А (1,3 г, 1,9 ммоль), полученного по методике, описанной в статье J. Am. Chem. Soc., 1981, 103, (11), 3213-3215), в ТГФ (10 мл) и метаноле (20 мл) добавляют порциями NaBH4 (160 мг, 4,2 ммоль). Реакционную смесь перемешивают в течение ночи при комнатной температуре, нейтрализуют путем добавления уксусной кислоты (1 мл) и после перемешивания в течение еще 30 мин добавляют концентрированный NH3 до щелочного значения рН. Растворитель отгоняют в вакууме, сырую смесь растворяют в этилацетате (100 мл) и промывают 20%-ным раствором NaCl (3×100 мл). Органическую фазу сушат над сульфатом натрия, фильтруют и упаривают в вакууме. Очистка с помощью хроматографии Biotage (картридж с диоксидом кремния 40М, элюент СН2Cl2/МеОН, 35/1) дает промежуточное соединение 16 (800 мг, выход 65%) в виде белого твердого вещества.
[M+1]+ 692.
Пример 27
Получение соединения 9
Соединение 9 получают из промежуточного соединения 16 (600 мг, 0,868 ммоль) по методике, описанной для соединения 1. Очистка с помощью хроматографии Biotage (картридж с диоксидом кремния 40М, элюент СН2Cl2/МеОН, 37/1) дает соединение 9 (380 мг, выход 82%) в виде белого твердого вещества.
[M+1]+ 534.
Пример 28
Получение соединения 10
К раствору соединения 9 (300 мг, 0,56 ммоль) в абсолютном этаноле добавляют PtO2 (10 мг) в тигеле высокого давления. После 3 последовательных циклов гидрирования реакционную смесь выдерживают в атмосфере водорода при 45 фунт/кв.дюйм. Через 4 часа смесь фильтруют через слой Celite и упаривают в вакууме, получают соединение 10 (300 мг, выход 99,9%) в виде аморфного белого твердого вещества.
[M+1]+ 536.
Пример 29
Получение соединения 11
Соединение 11 получают из оксима эритромицина А (2,5 г, 3,34 ммоль) по методике, описанной для соединения 1. Очистка с помощью хроматографии Biotage (картридж с диоксидом кремния 40М, элюент СН2Cl2/МеОН/NH3, 90/5/0,5) дает соединение 11 (1,8 г, выход 91%) в виде белого твердого вещества.
[M+1]+ 592.
Пример 30
Получение соединения 12
Соединение 12 получают из N-оксида оксима эритромицина А (3 г, 3,83 ммоль), полученного, как описано в международной патентной заявке WO 00/42055, пример 4 (Zambon Group), по методикам, описанным для соединения 1. Очистка с помощью хроматографии Biotage (картридж с диоксидом кремния 40М, элюент СН2Cl2/МеОН/NH3, 90/10/1) дает соединение 12 (1,5 г, выход 65%) в виде белого твердого вещества.
[M+1]+ 608.
Пример 31
Получение соединения 13
Соединение 13 получают из оксима 3'-дездиметиламино-3',4'-дегидроэритромицина А (30 г, 42,6 ммоль), полученного, как описано в международной патентной заявке WO 00/42055, пример 5 (Zambon Group), по методикам, описанным для соединения 1. Очистка флэш-хроматографией (диоксид кремния, элюент СН2Cl2/МеОН, 90/7) дает соединение 13 (19,2 г, выход 82%) в виде белого твердого вещества.
[M+1]+ 546.
Пример 32
Получение соединения 14
Соединение 14 получают из оксима 3'-дездиметиламиноэритромицина А (36,2 г, 51,3 ммоль), полученного, как описано в международной патентной заявке WO 00/42055, пример 6 (Zambon Group), по методикам, описанным для соединения 1. Очистка флэш-хроматографией (диоксид кремния, элюент СН2Cl2/МеОН, от 97/3 до 95/5) дает соединение 14 (22,1 г, выход 79%) в виде белого твердого вещества.
[M+1]+ 548.
Пример 33
Получение промежуточного соединения 17
К раствору эритромицина А (21,9 г, 29,9 ммоль) в метаноле (150 мл), находящемуся в атмосфере азота, добавляют гидрохлорид 0-метилгидроксиламина (10 г, 197 ммоль), затем через 10 мин добавляют триэтиламин (8,33 мл, 59,8 ммоль). После перемешивания в течение одного дня реакционную смесь нейтрализуют 10%-ным водным раствором аммиака (300 мл) и отфильтровывают образовавшееся в результате твердое вещество, промывают водой и сушат на воздухе в течение 3 дней. Очистка флэш-хроматографией (элюент CHCl3/гексан/триэтиламин, 50/50/10) дает промежуточное соединение 17 (7 г, выход 31%) в виде белого кристаллического твердого вещества.
[M+1]+ 764.
Пример 34
Получение соединения 15
Соединение 15 получают из промежуточного соединения 17 (400 мг, 0,52 ммоль) по методикам, описанным для соединения 1. Очистка с помощью хроматографии Variant Mega bond Elut (картридж с диоксидом кремния, 10 г, элюент от СН2Cl2 до СН2Cl2/МеОН/NH3, 90/5/0,5) дает соединение 15 (249 мг, выход 78,8%) в виде белого твердого вещества.
[M+1]+ 764.
Пример 35
Получение промежуточного соединения 18
Промежуточное соединение 18 получают из промежуточного соединения 17 (0,9 г, 1,18 ммоль) по методикам, описанным для соединения 5. Продукт (0,91 г, выход 99%) экстрагируется в чистой форме без дополнительной очистки в виде светло-желтого твердого вещества.
[M+1]+ 779.
Пример 36
Получение соединения 16
Соединение 16 получают из промежуточного соединения 18 (720 мг, 0,92 ммоль) по методикам, описанным для соединения 1. Очистка с помощью хроматографии Variant Mega bond Elut (картридж с диоксидом кремния, 20 г, элюент от СН2Cl2 до СН2Cl2/МеОН/NH3, 90/10/1) дает соединение 16 (430 мг, выход 84%) в виде белого твердого вещества.
[M+1]+ 621.
Пример 37
Получение промежуточного соединения 19
Промежуточное соединение 19 получают из промежуточного соединения 18 (500 мг, 0,64 ммоль) по методикам, описанным для оксима 3'-дездиметиламино-3',4'-дегидроэритромицина А, полученного, как описано в международной патентной заявке WO 00/42055, пример 5 (Zambon Group). Очистка с помощью хроматографии Variant Mega bond Elut (картридж с диоксидом кремния, 10 г, элюент от СН2Cl2 до СН2Cl2/МеОН, 95/5) дает соединение 19 (150 мг, выход 32%) в виде белого твердого вещества.
[M+1]+ 718.
Пример 38
Получение соединения 17
Соединение 17 получают из промежуточного соединения 19 (720 мг, 0,92 ммоль) по методикам, описанным для соединения 1. Очистка с помощью хроматографии Variant Mega bond Elut (картридж с диоксидом кремния, 10 г, элюент от СН2Cl2 до СН2Cl2/МеОН, 100/1) дает соединение 17 (130 мг, выход 68%) в виде белого твердого вещества.
[M+1]+ 560.
Пример 39
Получение промежуточного соединения 20
Промежуточное соединение 20 получают из промежуточного соединения 19 (143 мг, 0,20 ммоль) по методикам, описанным для оксима 3'-дездиметиламиноэритромицина А, полученного, как описано в международной патентной заявке WO 00/42055, пример 5 (Zambon Group). После фильтрования через слой Celite и упаривания в вакууме получают чистое промежуточное соединение 20 (120 мг, выход 83,3%) в виде белого твердого вещества.
[M+1]+ 720.
Пример 40
Получение соединения 18
Соединение 18 получают из промежуточного соединения 20 (720 мг, 0,92 ммоль) по методике, описанной для соединения 1. Очистка с помощью хроматографии Biotage (картридж с диоксидом кремния 12М, элюент СН2Cl2/МеОН, 100/1,5) дает соединение 18 (121 мг, выход 66%) в виде белого твердого вещества.
[M+1]+ 562.
Пример 41
Получение 2-[2-[(2-тиазолилметил)амино]этиламино]этанола (промежуточное соединение 21)
К раствору 2-(2-аминоэтиламино)этанола (13,35 г, 128 ммоль) в безводном этаноле последовательно добавляют молекулярные сита размером 3Е (22,5 г) и раствор 2-тиазолкарбальдегида (14,5 г, 128 ммоль) в этаноле (90 мл). Реакционную смесь перемешивают 4 часа, фильтруют через слой Celite, промывая этанолом (100 мл), и помещают в колбу высокого давления. После добавления уксусной кислоты (3 мл) и Pd (10% на С, 2 г) раствор вводят в аппарат Парра и после нескольких циклов гидрирования перемешивают 2 дня в атмосфере водорода при 40 фунт/кв.дюйм. Реакционную смесь фильтруют через слой Celite, упаривают в вакууме и очищают флэш-хроматографией (диоксид кремния, элюент СН2Cl2/МеОН/NH3, 80/20/10), получают 2-[2-[(2-тиазолилметил)амино]этиламино]этанол (15,4 г, выход 60%) в виде коричневого масла.
[M+1]+ 202.
Пример 42
Получение аллил[2-(аллилоксикарбонил-2-тиазолилметиламино]этил](2-гидроксиэтил)карбамата
(промежуточное соединение 22)
При 0°С раствор аллилформиата (1,22 мл, 11,5 ммоль) в СН2Cl2 (30 мл) добавляют по каплям в течение 30 мин к раствору промежуточного соединения 21 (1,16 г, 5,76 ммоль) и К2СО3 (1,14 г, 8,4 ммоль) в СН2Cl2 (30 мл) и Н2О (50 мл). После перемешивания при комнатной температуре 16 часов и разбавления К2СО3 (50 мл 10%-ного водного раствора) органический слой отделяют и водную фазу экстрагируют CH2Cl2 (2×40 мл). Объединенную органическую фазу промывают лимонной кислотой (50 мл 5%-ного водного раствора), сушат над сульфатом натрия и фильтруют, растворитель упаривают и остаток очищают флэш-хроматографией (диоксид кремния, элюент CH2Cl2/МеОН, 18/1), получают промежуточное соединение 22 (1,27 г, выход 60%) в виде коричневого масла.
[M+1]+ 370.
Пример 43
Получение этил-2-[аллилоксикарбонил-[2-(аллилоксикарбонил-2-тиазолилметиламино)этил]амино]метансульфоната
(промежуточное соединение 23)
При 0°С раствор мезилхлорида (3,64 мл, 47 ммоль) в СН2Cl2 (10 мл) добавляют по каплям в течение 15 мин к раствору промежуточного соединения 22 (12,96 г, 35 ммоль) и триэтиламина (9,74 мл, 70 ммоль) в CH2Cl2 (130 мл). Через 1 час исходный материал вводят в реакцию, реакционную смесь разбавляют СН2Cl2 (50 мл) и промывают 50 мл 5%-ной лимонной кислоты, 50 мл 5%-ного NaHCO3 и 20%-ным раствором NaCl (50 мл). Органическую фазу сушат над сульфатом натрия и фильтруют, растворитель упаривают в вакууме, получают промежуточное соединение 23 (1,6 г, количественный выход) в виде красного масла, которое используют сразу же в следующей реакции.
[M+1]+ 448.
Пример 44
Получение промежуточного соединения 24
Раствор трет.-бутоксида калия (3,6 г, 32,1 ммоль) в ТГФ (180 мл) готовят в безводной колбе в атмосфере азота. Оксим 3'-дездиметиламиноэритромицина А (20,6 г, 29,2 ммоль) добавляют к реакционной смеси и полученную смесь перемешивают 30 мин, после чего последовательно добавляют 18-краун-6-эфир (7,72 г, 29,2 ммоль) и по каплям в течение более чем 30 мин раствор промежуточного соединения 23 (15,7 г, 35 ммоль) в ТГФ (70 мл). Через 18 часов смесь упаривают в вакууме, разбавляют 20%-ным раствором NaCl (0,5 л) и экстрагируют этилацетатом (3×0,5 л). Объединенную органическую фазу сушат над сульфатом натрия и фильтруют, растворитель упаривают и остаток очищают флэш-хроматографией (диоксид кремния, элюент CH2Cl2/МеОН, 95/5), получают промежуточное соединение 24 (20 г, выход 65%) в виде белого твердого вещества.
[M+1]+ 1058.
Пример 45
Получение промежуточного соединения 25
Промежуточное соединение 25 получают из оксима эритромицина А (4,2 г, 9,82 ммоль) по методике, описанной для соединения 24. Очистка флэш-хроматографией (диоксид кремния, элюент СН2Cl2/МеОН/NH3, 95/5/0,5) дает промежуточное соединение 25 (8,2 г, выход 76%) в виде твердого вещества.
[M+1]+ 1101.
Пример 46
Получение промежуточного соединения 26
Промежуточное соединение 26 получают из промежуточного соединения 25 (1,1 г, 1 ммоль) по методикам, описанным для получения N-оксида оксима эритромицина А (международная патентная заявка WO 00/42055, пример 4, Zambon Group). Сырую реакционную смесь упаривают в вакууме (дважды после разбавления дистиллированной водой и дважды после разбавления CH2Cl2), получают промежуточное соединение 26 (1 г, выход 90%) в виде твердого вещества, которое является достаточно чистым для проведения следующей стадии синтеза.
[M+1]+ 1117.
Пример 47
Получение промежуточного соединения 27
К раствору промежуточного соединения 24 (14 г, 13,2 ммоль) в СН2Cl2 (140 мл), находящемуся в атмосфере аргона, последовательно добавляют морфолин (2,3 г, 2,7 ммоль), трифенилфосфин (262 мг, 1 ммоль) и ацетат палладия(II) (75 мг, 0,34 ммоль). Реакционную смесь перемешивают 2 ч и нейтрализуют водой (50 мл), органическую фазу отделяют и водную фазу экстрагируют СН2Cl2 (2×50 мл). Объединенную органическую фазу сушат над сульфатом натрия, фильтруют и упаривают в вакууме, получают сырое масло (13,4 г). Очистка хроматографией при атмосферном давлении (диоксид кремния 230/70 меш, элюент СН2Cl2/МеОН/NH3, 90/9/0,9) дает промежуточное соединение 27 (9,3 г, выход 79%) в виде белого твердого вещества.
Промежуточное соединение 27 является известным соединением, которое описано в международной патентной заявке WO 00/42055, пример 9 (Zambon Group).
Пример 48
Получение промежуточного соединения 28
Промежуточное соединение 28 получают из промежуточного соединения 25 (1,55 г, 1,41 ммоль) по методикам, описанным для промежуточного соединения 27, заменяя морфолин пирролидином (0,5 г, 7 ммоль). Очистка хроматографией при атмосферном давлении (диоксид кремния 230/70 меш, элюент СН2Cl2/МеОН/NH3, 90/10/1) дает промежуточное соединение 28 (1 г, выход 76%) в виде твердого вещества.
[M+1]+ 933.
Пример 49
Получение промежуточного соединения 29
Промежуточное соединение 29 получают из промежуточного соединения 26 (1 г, 1,41 ммоль) по методикам, описанным для промежуточного соединения 27. Очистка с помощью хроматографии Biotage (картридж с диоксидом кремния 40М, элюент СН2Cl2/МеОН/NH3, 90/10/1) дает промежуточное соединение 29 (0,76 г, выход 90%) в виде твердого вещества.
[M+1]+ 949.
Пример 50
Получение соединения 19
Соединение 19 получают из промежуточного соединения 28 (600 мг, 0,64 ммоль) по методикам, описанным для соединения 1. Учитывая, что полученный продукт растворим в воде, сырое твердое вещество растворяют в воде (50 мл) и промывают CH2Cl2 (3×20 мл). Растворитель упаривают из водной фазы в вакууме и сушат, получают соединение 19 (480 мг, выход 95%) в виде кристаллического твердого вещества.
[M+1]+ 775.
Пример 51
Получение соединения 20
Соединение 20 получают из промежуточного соединения 29 (450 мг, 0,47 ммоль) по методикам, описанным для соединения 1. Очистка с помощью хроматографии Biotage (картридж с диоксидом кремния 40М, элюент СН2Cl2/МеОН/NH3, 90/10/1) дает соединение 20 (180 мг, выход 49%) в виде белого твердого вещества.
[M+1]+ 791.
Пример 52
Получение соединения 21
Соединение 21 получают из промежуточного соединения 27 (2,6 г, 2,92 ммоль) по методикам, описанным для соединения 1. Очистка хроматографией при атмосферном давлении (диоксид кремния, элюент СН2Cl2/МеОН/NH3, 90/8/0,8) дает соединение 21 (1,84 г, выход 86%) в виде белого кристаллического вещества.
[M+1]+ 732.
Пример 53
Получение этил-2-(бензилбензилоксикарбониламино)метансульфоната
См. международную патентую заявку WO 96/18633, пример 1, Zambon Group.
Пример 54
Получение промежуточного соединения 30
Промежуточное соединение 30 получают из оксима эритромицина А (8,74 г, 11,7 ммоль) и этил-2-(бензилбензилоксикарбониламин)метансульфоната (4,24 г, 11,7 ммоль) по методике, описанной для промежуточного соединения 24. Очистка флэш-хроматографией (диоксид кремния, элюент СН2Cl2/МеОН/NH3, 95/5/0,5) дает промежуточное соединение 30 (8,5 г, выход 72%).
Пример 55
Получение промежуточного соединения 31
К раствору промежуточного соединения 30 (8,5 г, 8,36 ммоль) в безводном этиловом спирте (180 мл) добавляют 10% Pd/С (0,85 г) и после 3 циклов гидрирования смесь перемешивают в аппарате Парра в атмосфере водорода при 20 фунт/кв.дюйм. Через один час реакционную смесь фильтруют через слой Celite, растворитель упаривают и остаток очищают флэш-хроматографией (диоксид кремния, элюент СН2Cl2/МеОН/NH3, 95/5/0,5), получают промежуточное соединение 31 (5 г, выход 67%) в виде белого твердого вещества.
[M+1]+ 883.
Пример 56
Получение соединения 22
Соединение 22 получают из промежуточного соединения 31 (0,5 г, 0,57 ммоль) по методикам, описанным для соединения 1. Очистка с помощью хроматографии Biotage (картридж с диоксидом кремния 12М, элюент СН2Cl2/МеОН/NH3, 80/4/0,4) дает соединение 22 (0,36 г, выход 87%) в виде белого твердого вещества.
[M+1]+ 725.
Пример 57
Получение (Е)-9-[O-[2-[6-[(2-трифторметилфенил)метиламино]гексиламино]этил]оксим] эритромицина А (промежуточное соединение 32)
Соединение получают так, как описано в международной патентной заявке WO 96/18633, пример 19 (Zambon Group).
Пример 58
Получение промежуточного соединения 33
К раствору промежуточного соединения 32 (7,64 г, 8,57 ммоль) в СН2Cl2 (60 мл) последовательно добавляют 2-тиазолкарбоксальдегид (1 г, 8,57 ммоль), NaCN(BH3) (0,9 г, 13,71 ммоль) и уксусную кислоту (2 мл). Реакционную смесь перемешивают 16 часов, фильтруют через слой Celite, промывая СН2Cl2 (20 мл), и разбавляют водным раствором уксусной кислоты (рН 5, 50 мл). Водный раствор промывают СН2Cl2 (3×30 мл), добавляют NaHCO3 до рН 8 и смесь экстрагируют СН2Cl2 (3×30 мл). Разбавленную органическую фазу сушат над сульфатом натрия, фильтруют и упаривают в вакууме. Очистка флэш-хроматографией (диоксид кремния, элюент СН2Cl2/МеОН/NH3, 90/10/1) дает промежуточное соединение 33 (2,04 г, выход 24%) в виде белого твердого вещества.
[M+1]+ 989.
Пример 59
Получение соединения 23
Соединение 23 получают из промежуточного соединения 33 (100 мг, 0,1 ммоль) по методикам, описанным для соединения 1. Очистка с помощью хроматографии Biotage (картридж с диоксидом кремния 12S, элюент СН2Cl2/МеОН/NH3, 15/1/0,1) дает соединение 23 (50 мг, выход 61%) в виде белого твердого вещества.
[M+1]+ 831.
Пример 60
Получение (Е)-9-[O-[2-[2-(бензилоксикарбониламино)этил]бензилоксикарбониламино]этил] оксим] 3'-дездиметиламиноэритромицина А
(промежуточное соединение 34)
Соединение получают так, как описано в международной патентной заявке WO 00/42055, пример 7 (Zambon Group).
Пример 61
Получение промежуточного соединения 35
К раствору промежуточного соединения 34 (0,8 г, 1 ммоль) в этаноле (16 мл) последовательно добавляют молекулярные сита (1,8 г) и 3-фуральдегид (98 мг, 1 ммоль) и смесь перемешивают 3 часа. После фильтрования через слой Celite к раствору добавляют NaBH4 (29 мг, 0,75 ммоль) и полученную смесь перемешивают еще один час и упаривают в вакууме. Сырой материал растворяют в этилацетате и промывают насыщенным раствором NaCl. Органическую фазу сушат над сульфатом натрия, фильтруют и упаривают в вакууме. Очистка флэш-хроматографией (диоксид кремния, элюент СН2Cl2/МеОН/NH3, 90/6/0,6) дает промежуточное соединение 35 (530 мг, выход 60%) в виде твердого вещества.
[M+1]+ 872.
Пример 62
Получение промежуточного соединения 36
Промежуточное соединение 36 получают из промежуточного соединения 34 (800 мг, 1 ммоль) и тиофенкарбальдегида (115 мг, 1 ммоль) по методикам, описанным для промежуточного соединения 35. Очистка флэш-хроматографией (диоксид кремния, элюент СН2Cl2/МеОН/NH3, 90/6/0,6) дает промежуточное соединение 36 (362 мг, выход 40%) в виде белого твердого вещества.
[M+1]+ 888.
Пример 63
Получение промежуточного соединения 37
Промежуточное соединение 37 получают из промежуточного соединения 34 (800 мг, 1 ммоль) и 2-фуральдегида (98 мг, 1 ммоль) по методикам, описанным для промежуточного соединения 35. Очистка флэш-хроматографией (диоксид кремния, элюент СН2Cl2/МеОН/NH3, 90/6/0,6) дает промежуточное соединение 37 (475 мг, выход 54%) в виде белого твердого вещества.
[M+1]+ 872.
Пример 64
Получение соединения 24
Соединение 24 получают из промежуточного соединения 35 (200 мг, 0,22 ммоль) по методикам, описанным для соединения 1. Очистка флэш-хроматографией (диоксид кремния, элюент СН2Cl2/МеОН/NH3, 90/5/0,5) дает соединение 24 (120 мг, выход 73%) в виде белого твердого вещества.
[M+1]+ 715.
Пример 65
Получение соединения 25
Соединение 25 получают из промежуточного соединения 36 (200 мг, 0,22 ммоль) по методикам, описанным для соединения 1. Очистка с помощью хроматографии Biotage (картридж с диоксидом кремния 12М, элюент СН2Cl2/МеОН/NH3, 90/5/0,5) дает соединение 25 (130 мг, выход 81%) в виде белого твердого вещества.
[M+1]+ 731.
Пример 66
Получение соединения 26
Соединение 26 получают из промежуточного соединения 37 (200 мг, 0,23 ммоль) по методикам, описанным для соединения 1. Очистка с помощью хроматографии Biotage (картридж с диоксидом кремния 12М, элюент СН2Cl2/МеОН/NH3, 90/5/0,5) дает соединение 26 (125 мг, выход 76%) в виде белого твердого вещества.
[M+1]+ 715.
Пример 67
Получение промежуточного соединения 38
Промежуточное соединение 38 получают из кларитромицина (1 г, 1,33 ммоль) по методикам, описанным для промежуточного соединения 16. Очистка флэш-хроматографией (диоксид кремния, элюент СН2Cl2/МеОН/NH3, 90/10/1) дает промежуточное соединение 38 (500 мг, выход 50%) в виде белого твердого вещества.
[M+1]+ 751.
Пример 68
Получение соединения 27
Соединение 27 получают из промежуточного соединения 38 (202 мг, 0,27 ммоль) по методикам, описанным для соединения 1. Очистка с помощью препаративной ВЭЖХ (подвижная фаза: вода/ацетонитрил от 95/5 до 60/40 в течение 10 мин) дает соединение 27 (55 мг, выход 36%) в виде белого твердого вещества.
[M+1]+ 592.
Пример 69
Получение соединения 28
Соединение 28 получают из соединения 27 (26 мг, 0,034 ммоль) по методикам, описанным для получения N-оксида оксима эритромицина А (международная патентная заявка WO 00/42055, Zambon Group). Реакционную смесь разбавляют водой и растворитель упаривают (три раза для полного удаления Н2О2) и сушат, получают соединение 28 (26 г, выход 95%) в виде белого твердого вещества.
[M+1]+ 609.
Пример 70
Получение промежуточного соединения 39
Суспензию кларитромицина (5 г, 6,7 ммоль) в метаноле (150 мл) удерживают в слабом токе N2 при механическом перемешивании. Добавляют ацетат натрия (0,66 г, 8 ммоль) и йод (2,03 г, 8 ммоль) и на полученную смесь воздействуют светом лампы на 400 ватт, стараясь поддерживать температуру при 10-20°С с помощью бани лед-вода. Через 6 часов растворитель отгоняют при пониженном давлении, сырой продукт забирают в этилацетат и 5%-ный водный раствор метабисульфита натрия, водную фазу экстрагируют и подщелачивают путем добавления водного аммиака, затем экстрагируют дихлорметаном. После сушки органической фазы над безводным Na2SO4 фильтруют и упаривают растворитель, получают сырой продукт (5,1 г), который очищают с помощью хроматографии Biotage (картридж с диоксидом кремния 40М, элюент СН2Cl2/МеОН/NH3, 100/3/0,3 и затем 100/5/0,5), получают промежуточное соединение 39 (3,2 г, выход 65%).
[M+1]+ 734,5.
Пример 71
Получение промежуточного соединения 40
Промежуточное соединение 39 (2 г, 2,72 ммоль) растворяют в 1н. растворе HCl (50 мл, 50 ммоль) и перемешивают 2 часа при комнатной температуре. Раствор подщелачивают с помощью концентрированного NH3 и затем экстрагируют этилацетатом (3×50 мл). Полученную органическую фазу сушат над безводным Na2SO4 и фильтруют, растворитель отгоняют, получают промежуточное соединение 40 (1,56 г, выход 90%).
[M+1]+ 576,3.
Пример 72
Получение промежуточного соединения 41
Раствор уксусного ангидрида (0,168 мл, 1,78 ммоль) в диоксане (3 мл) добавляют по каплям к раствору промежуточного соединения 40 (0,93 г, 1,62 ммоль) в диоксане (30 мл) и Н2О (4 мл) и полученную смесь перемешивают 8 часов. Реакционную массу обрабатывают путем добавления метанола и отгонкой растворителя при пониженном давлении. Сырой продукт, полученный таким образом, разбавляют 2н. HCl (50 мл) и экстрагируют этилацетатом (3×50 мл). Полученный в результате органический раствор сушат над безводным Na2SO4 и фильтруют, растворитель отгоняют, получают промежуточное соединение 41 (0,85 г, выход 85%).
[M-1]- 616,8.
Пример 73
Получение соединения 29
Раствор промежуточного соединения 41 (500 мг, 0,79 ммоль) в этаноле (20 мл) обрабатывают избытком гидрохлорида гидроксиламина (1,5 г, 21,6 ммоль) и триэтиламина (1,5 мл, 22 ммоль) и реакционную массу выдерживают при кипении с обратным холодильником, контролируя возможное разложение продукта. Через 6 часов растворитель упаривают из раствора и остаток разбавляют этилацетатом и промывают насыщенным раствором NaCl. Полученный органический растворитель сушат над безводным Na2SO4 и фильтруют, растворитель отгоняют, получают сырое твердое вещество. Очистка с помощью хроматографии Biotage (картридж колонки 12М, элюент СН2Cl2/МеОН, 100/0 и затем 30/1) дает соединение 29 (198 мг, выход 40%).
[M+1]+ 633,4.
Пример 74
Получение промежуточного соединения 42
Раствор пиридинметанола (0,5 г, 4,7 ммоль) в ДМФА (20 мл) помещают в соответствующим образом высушенную двухгорлую круглодонную колбу, находящуюся в атмосфере азота, после чего добавляют гидрид натрия (60%, 0,4 г, 10 ммоль). Получают гетерогенный раствор, который перемешивают 15 мин. Затем по каплям добавляют раствор 2-(2-бромэтил)-1,3-диоксана (0,92 г, 4,7 ммоль) в ДМФА (3 мл) и полученную смесь оставляют для проведения реакции на 16 часов при 60°С. Реакционную среду разбавляют этилацетатом (100 мл) и промывают 10%-ным водным раствором Na2CO3 (3×50 мл). Органическую фазу сушат над безводным сульфатом натрия Na2SO4 и фильтруют, растворитель упаривают, получают сырой продукт реакции (1 г), который очищают хроматографией (колонка с диоксидом кремния Varian Mega Bond Elut; элюент от 100% СН2Cl2 до 25/1 СН2Cl2/МеОН), получают промежуточное соединение 42 (650 мг, выход 31%) в виде бесцветной жидкости.
[M+1]+ 633,4.
Rt=1,4 мин
1Н ЯМР (CDCl3): 8,59, 8,53, 8,01 и 7,25 (4м, 4Н, Py); 4,70 (т, 1Н, С-СН[-O]2); 4,52 (с, 2Н, CH2Py); 4,09 (м, 2Н, О-СН2-С); 3,79 (м, 2Н, С-СН2-С); 3,60 (м, 2Н, СН2 диоксан); 2,05, 1,92 и 1,3 (3м, 4Н, диоксан).
Пример 75
Получение промежуточного соединения 43
Избыток трифторуксусной кислоты (2 мл) добавляют к раствору промежуточного соединения 42 (150 мг, 0,67 ммоль) в CHCl3 (4 мл) и полученную смесь оставляют для проведения реакции при комнатной температуре на 48 часов. Реакционную среду разбавляют СН2Cl2 (50 мл) и промывают 10%-ным водным Na2CO3 (3×20 мл). Органическую фазу сушат над безводным Na2SO4 и фильтруют, растворитель упаривают. Очистка с помощью хроматографии Biotage (колонка с диоксидом кремния 12М, элюент СН2Cl2/МеОН/NH3, 30/1/0,1) дает промежуточное соединение 43 (45 мг, выход 40%), которое используют непосредственно для проведения следующей реакции.
[M+1]+ 166,4.
Rt=2,5 мин.
ВЭЖХ/МС проводят с помощью прибора Gilson, снабженного колонкой C18 Zorbax SBC18 (3,5 мкм, 2,1×50 мм) и с использованием в качестве детектора комплекта УФ диодов (220 нм), масс-спектрометра Finnigan Aqa (рассеянный пучок электронов, положительная или отрицательная ионизация) и проявитель ELSD.
Условия:
Скорость потока: 1 мл/мин
Температура колонки: 40°С
Градиент элюирования А/В (элюент А: 0,5% муравьиной кислоты в воде; элюент В: 0,5% муравьиной кислоты в ацетонитриле): t=0 мин, А/В=95:5; t=8 мин, А/В=5:95.
Пример 76
Получение соединения 30
К раствору промежуточных соединений 4 (100 мг, 0,178 ммоль) и 43 (30 мг, 0,178 ммоль) в дихлорэтане (10 мл) добавляют последовательно молекулярные сита (4Е, 100 мг), уксусную кислоту (16 мкл, 0,267 ммоль) и гидрид трет.-бутилалюминия (120 мг, 0,445 ммоль). Смесь оставляют для протекания реакции на 48 часов при комнатной температуре, затем фильтруют через слой Celite, фильтрат разбавляют 10%-ным раствором Na2CO3 (20 мл) и экстрагируют СН2Cl2 (3×20 мл). Объединенные органические экстракты сушат над безводным Na2SO4 и фильтруют, растворитель отгоняют при пониженном давлении. Очистка с помощью хроматографии Biotage (картридж колонки 12М, элюент СН2Cl2/МеОН/NH3, 30/1/0,1) дает соединение 30 (50 мг, выход 39%).
[M-1]- 714,5.
Пример 77
Фармакологическая активность in vivo
А) Острый контактный дерматит
- Животные
Используют группу из 5-6 CD1 мышей (18-24 г).
- Введение соединений
Все макролидные соединения растворяют в системе межфазной доставки (Trans-phase Delivery System, TPDS), носителе, полученном из 10% бензилового спирта, 40% ацетона и 50% изопропанола.
На внутреннюю поверхность уха наносят локально 15 микролитров соединений (500 мкг), растворенных в TPDS; через 30 мин на тот же участок наносят 12 микролитров раствора тетрадеканоилфорболацетата (ТРА), растворенного в ацетоне, при концентрации 0,01%.
Через 6 часов животных умерщвляют путем ингаляции CO2.
- Оценка результатов
Используют два способа для оценки ушного отека:
а) Взвешивают данную часть ушной раковины.
б) Измеряют толщину уха с использованием точного прибора для измерения толщины.
Степень отека рассчитывают путем вычитания массы или толщины необработанного уха из массы или толщины расположенного на противоположной стороне обработанного уха. Для определения степени ремиссии опухоли разности (массы или толщины) групп, обработанных смесью ТРА+макролиды, затем сравнивают с группами, обработанными только ТРА.
Активность макролидных соединений измеряют с использованием модифицированного способа Zunic et al. (1998): MDL (Lysyl) GDP, нетоксичное производное мурамилдипептида, ингибирует продуцирование цитокина с помощью активированных макрофагов и защищает мышей от индуцированного форболовым эфиром и оксазолоном воспаления (J. Invest. Dermatol., 111(1), 77-82).
Данные, относящиеся к эритромицину и азитромицину, относятся к лечению разовой дозой 500 мкг/ухо.
Результаты, полученные для ряда соединений формулы I, являющихся типичными представителями всего класса, приведены в следующей таблице.
В) Индуцированное LPS воспаление легких у крыс
- Введение
Крысам дают эндотрахеально через пероральный путь разовую дозу 0,4 мг/кг LPS (E.Coli, серотип 026:6). Трахеальное закапывание проводят под анестезией галотаном и через 20 час после эндотрахеального введения смеси LPS/физиологический раствор животных умерщвляют сверхдозой уретана.
- Промывание
Легкие промывают 4 аликвотами, по 5 мл каждая, физиологического раствора с 10 ИЕ/мл гепарина. Суспензию клеток концентрируют с помощью низкоскоростной центрифуги и пеллету клеток взвешивают.
- Подсчет клеток и дифференцирование
Подсчет общего числа клеток проводят в гемоцитометре.
Дифференцированный подсчет проводят на цитоспиновых препаратах, окрашенных May-Grunwald-Giemsa (Tamaoki J., Tagaya E., Yamawaki I., Sakai N., Nagai А., Konno K., 1995. Effect of erythromycin on endotoxin-induced microvascular leakage in rat trachea and lungs. Am. J. Respir. Crit. Care Med., 151, 1582-8). Крысам дают испытуемые соединения перорально в дозах 100, 40 и 10 мкмоль/кг в виде разового введения дозы перорально за один час до воздействия LPS.
Значение ED50 представляет собой дозу, которая вызывает 50%-ное снижение числа нейтрофилов в промывной бронхиальной жидкости.
Данные, относящиеся к эритромицину, относятся к лечению разовой дозой 130 мкмоль/кг.
Результаты, полученные для ряда соединений формулы I, являющихся типичными представителями всего класса, приведены в следующей таблице.
Пример 78
Фармакологическая активность in vitro
Антибиотическая активность
- Препарат для испытания
Все соединения растворяют в ДМСО в виде 100-кратного концентрированного раствора при концентрации 12,8 мг/мл. Концентрированный раствор разбавляют в отношении 1:100 в инкубационной среде до конечной концентрации 128 мкг/мл (конечная концентрация ДМСО 1%). Для оценки МИК проводят последовательные разбавления 1:2 100-кратного концентрированного раствора в ДМСО и разводят до 1:100 в инкубационной среде.
- Экспериментальный способ
МИК (минимальную ингибирующую концентрацию) или антибиотическую активность оценивают при концентрации 128 мкг/мл.
Значение МИК определяют в жидкой среде в соответствии со способом, описанным в публикации «Manual of Clinical Mircobiology, 7-th edition (1999), American Society for Microbiology».
Используют бактериальные линии:
Streptococcus pneumoniae ATCC 49619
Staphylococcus aureus ATCC 29213 или ATCC 6538
Enterococcus faecalis ATCC 29212
Streptococcus pyogenes ATCC 19615
- Оценка данных
Полученные результаты представлены в виде МИК (мкг/мл), оцениваемой как самая низкая концентрация испытуемого вещества, которое полностью ингибирует рост, заметный для невооруженного глаза.
Результаты, полученные для ряда соединений формулы I, являющихся типичными представителями всего класса, приведены в следующих таблицах.
МИК (мкг/мл)
МИК (мкг/мл)
МИК (мкг/мл)
ATCC 6538
128 (мкг/мл)
128 (мкг/мл)
128 (мкг/мл)
Данные, приведенные в таблице, однозначно показывают, что соединения формулы I настоящего изобретения по существу не обладают антибиотической активностью.
| название | год | авторы | номер документа |
|---|---|---|---|
| 9А-АЗАЛИДЫ С ПРОТИВОВОСПАЛИТЕЛЬНОЙ АКТИВНОСТЬЮ | 2003 |
|
RU2320668C2 |
| КОНДЕНСИРОВАННЫЕ ПРОИЗВОДНЫЕ ИМИДАЗОЛА И ПИРАЗОЛА В КАЧЕСТВЕ МОДУЛЯТОРОВ АКТИВНОСТИ TNF | 2014 |
|
RU2686117C1 |
| ПРОИЗВОДНЫЕ НОР-СЕКО ХИМБАЦИНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ИНГИБИРОВАНИЯ НА ИХ ОСНОВЕ | 2001 |
|
RU2293735C2 |
| ИНГИБИТОРЫ ФАКТОРА XIa | 2016 |
|
RU2728783C2 |
| КОНДЕНСИРОВАННЫЕ БИЦИКЛИЧЕСКИЕ ГЕТЕРОАРОМАТИЧЕСКИЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ МОДУЛЯТОРОВ АКТИВНОСТИ TNF | 2014 |
|
RU2685234C1 |
| СОЕДИНЕНИЯ ДЛЯ КОНТРОЛИРУЕМОГО ВЫСВОБОЖДЕНИЯ АКТИВНЫХ МОЛЕКУЛ | 2002 |
|
RU2296118C2 |
| ФЛЮОРЕСЦЕНТНЫЙ КОНТРАСТИРУЮЩИЙ АГЕНТ БЛИЖНЕЙ ИНФРАКРАСНОЙ ОБЛАСТИ СПЕКТРА И СПОСОБ ФЛУОРЕСЦЕНТНОЙ ТОМОГРАФИИ | 2003 |
|
RU2350355C9 |
| ПИРИМИДИНАМИДНЫЕ СОЕДИНЕНИЯ КАК ИНГИБИТОРЫ PGDS | 2006 |
|
RU2420519C2 |
| МОНОЦИКЛИЧЕСКИЕ L-НУКЛЕОЗИДЫ, ИХ АНАЛОГИ И ПРИМЕНЕНИЯ | 1997 |
|
RU2188828C2 |
| СПОСОБ ПОЛУЧЕНИЯ ДИСКОДЕРМОЛИДА И ЕГО АНАЛОГОВ И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ | 2001 |
|
RU2283309C2 |
Описаны макролидные соединения формулы I, где R - водород или метил; R1 - водород, N,N-ди(С1-С3)алкиламино, N,N-ди(C1-С3)алкиламино-N-оксид, N-(C1-С3)алкил-N-бензиламино, N-(C1-С4)ацил-N-(C1-С3)алкиламино, N-[N,N-диметиламино-(C1-С4)алкиламино]ацетил-N-(С1-С3)алкиламино или цепочка формулы:
 где А - водород, фенил или тиазолил; Х - О или NR6, где R6 - водород; Y - тиазолил, пиридинил или NR6, где R6 - водород; r - целые значения от 1 до 3; m - целые значения от 1 до 6; n - целые значения от 0 до 2; R2 - водород; или R1 и R2 совместно образуют связь; R3 - гидроксигруппа или образует группу =N-O-R5 вместе с R4, где R5 - водород, алкил или цепочка формулы -(CH2)r-X-(CH2)m-Y-(CH2)n-A, где r, m, n имеют значения, определенные выше; А - водород, тиазолил, фуранил или тиофенил; Х - NR6, где R6 - водород; Y - фениленовая группа или NR6, где R6 - водород; R4 - водород или образует группу =N-O-R5 вместе с R3, и R5 имеет значения, определенные выше; и его фармацевтически приемлемые соли, при условии, что R1 не является диметиламиногруппой, когда R3 - гидроксигруппа, и как R2, так и R4 - водород; R1 не является диметиламиногруппой, когда в заместителе =N-O-R5 в положении 9 R5 - водород, линейный или разветвленный (C1-С5)алкил; R1 не является метилэтиламиногруппой, когда в заместителе =N-O-R5 в положении 9 R5 - линейный или разветвленный (С1-С5)алкил. Изобретение относится также к способу получения указанных соединений путем удаления остатка L-кладинозы в положении 3 в соединениях общей формулы II, где R, R1, R2, R3 и R4 имеют значения, определенные выше. Кроме того, изобретение относится также к соединениям общей формулы II, где R - водород или метил; R1 - водород, N,N-ди(С1-С3)алкиламино, N,N-ди(С1-С3)алкиламино-N-оксид, N-(C1-С3)алкил-N-бензиламино, N-(С1-С4)ацил-N-(С1-С3)алкиламино, N-[N,N-диметиламино(С1-С4)алкиламино]ацетил-N-(С1-С3)алкиламино или цепочка формулы:
где А - водород, фенил или тиазолил; Х - О или NR6, где R6 - водород; Y - тиазолил, пиридинил или NR6, где R6 - водород; r - целые значения от 1 до 3; m - целые значения от 1 до 6; n - целые значения от 0 до 2; R2 - водород; или R1 и R2 совместно образуют связь; R3 - гидроксигруппа или образует группу =N-O-R5 вместе с R4, где R5 - водород, алкил или цепочка формулы -(CH2)r-X-(CH2)m-Y-(CH2)n-A, где r, m, n имеют значения, определенные выше; А - водород, тиазолил, фуранил или тиофенил; Х - NR6, где R6 - водород; Y - фениленовая группа или NR6, где R6 - водород; R4 - водород или образует группу =N-O-R5 вместе с R3, и R5 имеет значения, определенные выше; и его фармацевтически приемлемые соли, при условии, что R1 не является диметиламиногруппой, когда R3 - гидроксигруппа, и как R2, так и R4 - водород; R1 не является диметиламиногруппой, когда в заместителе =N-O-R5 в положении 9 R5 - водород, линейный или разветвленный (C1-С5)алкил; R1 не является метилэтиламиногруппой, когда в заместителе =N-O-R5 в положении 9 R5 - линейный или разветвленный (С1-С5)алкил. Изобретение относится также к способу получения указанных соединений путем удаления остатка L-кладинозы в положении 3 в соединениях общей формулы II, где R, R1, R2, R3 и R4 имеют значения, определенные выше. Кроме того, изобретение относится также к соединениям общей формулы II, где R - водород или метил; R1 - водород, N,N-ди(С1-С3)алкиламино, N,N-ди(С1-С3)алкиламино-N-оксид, N-(C1-С3)алкил-N-бензиламино, N-(С1-С4)ацил-N-(С1-С3)алкиламино, N-[N,N-диметиламино(С1-С4)алкиламино]ацетил-N-(С1-С3)алкиламино или цепочка формулы:  где А - водород, фенил или тиазолил; Х - О или NR6, где R6 - водород или C1-С3алкоксикарбонил; Y - тиазолил, пиридинил или NR6, где R6 - водород или C1-С3алкоксикарбонил; r - целые значения от 1 до 3; m - целые значения от 1 до 6; n - целые значения от 0 до 2; R2 - водород; или R1 образует связь вместе с R2; R3 - гидроксигруппу; R4 - водород; и их фармацевтически приемлемым солям; при условии, что (i) R1 не является N,N-диметиламино или (ii) R1 не является N,N-диметиламино-N-оксидом, когда R - водород. Изобретение относится также к фармацевтической композиции на основе соединения формулы I, обладающей противовоспалительной активностью. 6 н. и 23 з.п. ф-лы, 5 табл.
где А - водород, фенил или тиазолил; Х - О или NR6, где R6 - водород или C1-С3алкоксикарбонил; Y - тиазолил, пиридинил или NR6, где R6 - водород или C1-С3алкоксикарбонил; r - целые значения от 1 до 3; m - целые значения от 1 до 6; n - целые значения от 0 до 2; R2 - водород; или R1 образует связь вместе с R2; R3 - гидроксигруппу; R4 - водород; и их фармацевтически приемлемым солям; при условии, что (i) R1 не является N,N-диметиламино или (ii) R1 не является N,N-диметиламино-N-оксидом, когда R - водород. Изобретение относится также к фармацевтической композиции на основе соединения формулы I, обладающей противовоспалительной активностью. 6 н. и 23 з.п. ф-лы, 5 табл.
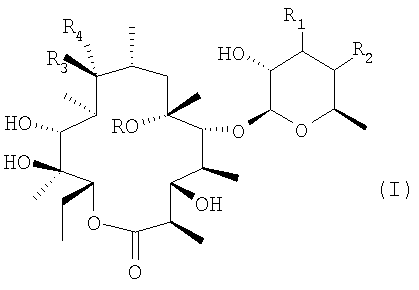


где R представляет собой атом водорода или метильную группу;
R1 представляет собой атом водорода, N,N-ди(C1-С3)алкиламиногруппу, N,N-ди(С1-С3)алкиламино-N-оксидную группу, N-(С1-С3)алкил-N-бензиламиногруппу, N-(C1-С4)ацил-N-(С1-С3)алкиламиногруппу, N-[N,N-диметиламино-(С1-С4)алкиламино]ацетил-N-(С1-С3)алкиламиногруппу или цепочку формулы:
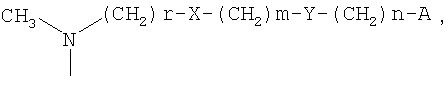
где А представляет собой атом водорода, фенил или тиазолил;
Х представляет собой О или NR6, и R6 представляет собой атом водорода;
Y представляет собой тиазолил или пиридинил, или представляет собой NR6, где R6 представляет собой атом водорода;
r принимает целые значения от 1 до 3;
m принимает целые значения от 1 до 6;
n принимает целые значения от 0 до 2;
R2 представляет собой атом водорода; или
R1 и R2 совместно образуют связь;
R3 представляет собой гидроксигруппу или образует группу =N-O-R5 вместе с R4, где R5 представляет собой атом водорода, линейный или разветвленный С1-С5алкил, или цепочку формулы:
-(CH2)r-X-(CH2)m-Y-(CH2)n-A,
где r, m, n имеют значения, определенные выше;
А представляет собой атом водорода, тиазолил, фуранил или тиофенил;
Х представляет собой NR6, и R6 представляет собой атом водорода;
Y представляет собой фениленовую группу или NR6, где R6 представляет собой атом водорода;
R4 представляет собой атом водорода или образует группу =N-O-R5 вместе с R2, и R5 имеет значения, определенные выше;
и его фармацевтически приемлемые соли,
при условии, что
R1 не является диметиламиногруппой, когда R3 представляет собой гидроксигруппу, и как R2, так и R4 представляют собой атом водорода;
R1 не является диметиламиногруппой, когда в заместителе =N-O-R5 в положении 9 R5 представляет собой атом водорода, линейный или разветвленный (С1-С5)алкил;
R1 не является метилэтиламиногруппой, когда в заместителе =N-O-R5 в положении 9 R5 представляет собой линейный или разветвленный (C1-С5)алкил.
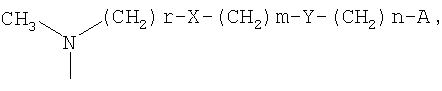
где А представляет собой атом водорода, фенил или тиазолил;
Х представляет собой О или NR6, и R6 представляет собой атом водорода;
Y, когда n равно 0, представляет собой тиазолил или пиридинил, или, когда n имеет значение, отличное от 0, представляет собой NR6, и R6 представляет собой атом водорода;
r принимает целые значения от 1 до 3;
m принимает целые значения 1 или 2;
n принимает целые значения от 0 до 2;
или R1 образует связь вместе с R2.

где А представляет собой атом водорода, фенил или тиазолил;
Х представляет собой О или NR6, и R6 представляет собой атом водорода;
Y, когда n равно 0, представляет собой тиазолил или пиридинил, или, когда n равно 1, представляет собой NR6, и R6 представляет собой атом водорода;
r принимает целые значения от 1 до 3;
m принимает целые значения 1 или 2;
n принимает целые значения 0 или 1;
или R1 образует связь вместе с R2.

где А представляет собой атом водорода, фенил или тиазолил;
Х представляет собой NR6, и R6 представляет собой атом водорода;
Y, когда n равно 0, представляет собой тиазолил или пиридинил,
или, когда n равно 1, представляет собой NR6, и R6 представляет собой атом водорода;
или R1 образует связь вместе с R2.
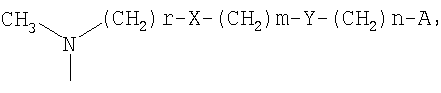
где А представляет собой атом водорода, фенил или тиазолил;
Х представляет собой О или NR6, и R6 представляет собой атом водорода;
Y, когда n равно 0, представляет собой тиазолил или пиридинил, или, когда n имеет значение, отличное от 0, представляет собой NR6, и R6 представляет собой атом водорода;
r принимает целые значения от 1 до 3;
m принимает целые значения 1 или 2;
n принимает целые значения от 0 до 2;
или R1 образует связь вместе с R2.
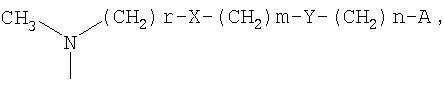
где А представляет собой атом водорода, фенил или тиазолил;
Х представляет собой О или NR6, и R6 представляет собой атом водорода;
Y, когда n равно 0, представляет собой тиазолил или пиридинил, или, когда n равно 1, представляет собой NR6, и R6 представляет собой атом водорода;
r принимает целые значения от 1 до 3;
m принимает целые значения 1 или 2;
n принимает целые значения 0 или 1;
или R1 образует связь вместе с R2.

где А представляет собой атом водорода, фенил или тиазолил;
Х представляет собой NR6, и R6 представляет собой атом водорода;
Y, когда n равно 0, представляет собой тиазолил или пиридинил, или, когда n равно 1, представляет собой NR6, и R6 представляет собой атом водорода;
или R1 образует связь вместе с R2.
-(CH2)r-X-(CH2)m-Y-(CH2)n-A,
где А представляет собой атом водорода, тиофенил, тиазолил или фуранил;
Х представляет собой NR6, и R6 представляет собой атом водорода или линейный или разветвленный C1-С3алкил;
Y, когда n равно 0, представляет собой фениленовую группу, или, когда n имеет значение, отличное от 0, представляет собой NR6, и R6 представляет собой атом водорода;
r принимает целые значения 1 или 2;
m принимает целые значения от 1 до 6;
n принимает целые значения от 0 до 2.
-(CH2)r-X-(CH2)m-Y-(CH2)n-A,
где А представляет собой атом водорода, тиофенил, тиазолил или фуранил;
Х представляет собой NR6, и R6 представляет собой атом водорода;
Y, когда n равно 0, представляет собой фениленовую группу, или, когда n равно 1, представляет собой NR6, и R6 представляет собой атом водорода;
r равно 2;
m принимает целые значения от 1 до 6;
n принимает целые значения 0 или 1.

где А представляет собой атом водорода, фенил или тиазолил;
Х представляет собой О или NR6, и R6 представляет собой атом водорода;
Y, когда n равно 0, представляет собой тиазолил или пиридинил, или, когда n равно 1, представляет собой NR6, и R6 представляет собой атом водорода;
r принимает целые значения от 1 до 3;
m принимает целые значения 1 или 2;
n принимает целые значения 0 или 1;
или R1 образует связь вместе с R2;
одновременно R3 образует группу =N-O-R5 вместе с R4, где R5 представляет собой атом водорода, линейный или разветвленный (С1-С3)алкил, или цепочку формулы:
-(CH2)r-X-(CH2)m-Y-(CH2)n-A,
где А представляет собой атом водорода, тиофенил, тиазолил или фуранил;
Х представляет собой NR6, и R6 представляет собой атом водорода;
Y, когда n равно 0, представляет собой фениленовую группу, или, когда n имеет значение, отличное от 0, представляет собой NR6, и R6 представляет собой атом водорода;
r принимает целые значения 1 или 2;
m принимает целые значения от 1 до 6;
n принимает целые значения от 0 до 2.
-(CH2)r-X-(CH2)m-Y-(CH2)n-A,
где А представляет собой атом водорода, тиофенил, тиазолил или фуранил;
Х представляет собой NR6, и R6 представляет собой атом водорода;
Y, когда n равно 0, представляет собой фениленовую группу, или, когда n равно 1, представляет собой NR6, и R6 представляет собой атом водорода;
r равно 2;
m принимает целые значения от 1 до 6;
n принимает целые значения 0 или 1.
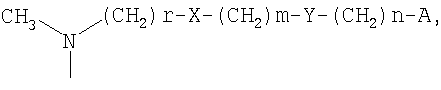
где А представляет собой атом водорода, фенил или тиазолил;
Х представляет собой NR6, и R6 представляет собой атом водорода;
Y, когда n равно 0, представляет собой тиазолил или пиридинил, или, когда n равно 1, представляет собой NR6, и R6 представляет собой атом водорода;
или R1 образует связь вместе с R2.

где R, R1, R2, R3 и R4 имеют значения, определенные в п.1;
посредством реакции кислого гидролиза, катализируемой в присутствии минеральной кислоты и протонного органического растворителя.

где R представляет собой атом водорода или метальную группу;
R1 представляет собой атом водорода, N,N-ди(C1-С3)алкиламиногруппу, N,N-ди(С1-С3)алкиламино-N-оксидную группу, N-(С1 -С3)алкил-N-бензиламиногруппу, N-(C1-С4)ацил-N-(С1-С3)алкиламиногруппу, N-[N,N-диметиламино(С1-С4)алкиламино]ацетил-N-(С1-С3)алкиламиногруппу или цепочку формулы:

где А представляет собой атом водорода, фенил или тиазолил;
Х представляет собой О или NR6, где R6 представляет собой атом водорода или C1-С3алкоксикарбонильную группу;
Y представляет собой тиазолил, пиридинил или NR6, где R6 представляет собой атом водорода или C1-С3алкоксикарбонильную группу;
r принимает целые значения от 1 до 3;
m принимает целые значения от 1 до 6;
n принимает целые значения от 0 до 2;
R2 представляет собой атом водорода;
или R1 образует связь вместе с R2;
R3 представляет собой гидроксигруппу;
R4 представляет собой атом водорода;
и их фармацевтически приемлемые соли;
при условии, что (i) R1 не является N,N-диметиламиногруппой или (ii) R1 не является N,N-диметиламино-N-оксидной группой, когда R представляет собой атом водорода.


| ПРОИЗВОДНЫЕ ЭРИТРОМИЦИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ АНТИБИОТИЧЕСКОЙ АКТИВНОСТЬЮ | 1991 |
|
RU2100367C1 |
| US 5969161 A, 19.10.1999 | |||
| JP 2001181294 A, 03.07.2001. | |||
Авторы
Даты
2008-08-10—Публикация
2003-07-29—Подача