Данное изобретение относится к периферически-селективным ингибиторам дофамин-β-гидролазы и способу их получения.
В последние годы интерес в разработке ингибиторов дофамин-β-гидролазы (DβH) опирался на гипотезу, заключающуюся в том, что ингибирование данного фермента может привести к значительным клиническим улучшениям у пациентов, страдающих кардиоваскулярными расстройствами, такими как гипертензия или хроническая сердечная недостаточность. Главная причина применения ингибиторов DβH основана на их способности ингибировать биосинтез норадреналина, который осуществляется через ферментативное гидроксилирование дофамина. Активация медиаторных систем, особенно симпатической нервной системы, представляет собой принципиальное клиническое проявление застойной сердечной недостаточности (Parmley, W.W., Clinical Cardiology, 18: 440-445, 1995). Для пациентов с застойной сердечной недостаточностью характерны повышенные концентрации норадреналина в плазме (Levine, T.B. et al., Am. J. Cardiol., 49; 1659-1666, 1982), увеличенный центральный симпатический отток (Leimbach, W.N. et al., Circulation, 73: 913-919, 1986) и нарастающий кардиоренальный избыток норадреналина (Hasking, G.J. et al., Circulation, 73: 615-621, 1966). Пролонгированное и избыточное воздействие норадреналина на миокард может привести к снижению регуляторных функций кардиальных β1-адренорецепторов, изменению левого желудочка, аритмии и некрозу и все указанные эффекты могут уменьшить функциональную целостность сердца. Пациенты с застойной сердечной недостаточностью, в плазме которых содержатся высокие концентрации норадреналина, также имеют самый неблагоприятный отдаленный прогноз (Cohn, J.N. et al., N. Engl. J. Med., 311: 819-823, 1984). Более важным является наблюдение, что концентрации плазменного норадреналина уже повышены у бессимптомных пациентов с отсутствием явных признаков сердечной недостаточности и могут быть использованы для прогноза последующей заболеваемости и летальности (Benedict, C.R. et al., Circulation, 94: 690-697, 1996). Приведенные сведения означают, что активированный симпатический эффект не является единственным клиническим маркером застойной сердечной недостаточности, но может вносить вклад в прогрессирующее ухудшение заболевания.
Ингибирование симпатической нервной функции адренорецепторными антагонистами оказалось перспективным методом, однако значительная часть пациентов не переносит непосредственного гемодинамического ухудшения, которое сопровождает β-блокаторное лечение (Pfeffer, M.A. et al., N. Engl. J. Med., 334: 1396-7, 1996). Альтернативная стратегия для прямого модулирования симпатической нервной функции состоит в снижении биосинтеза норадреналина через ингибирование DβH, фермента, ответственного за превращение дофамина в норадреналин в симпатических нервах. Данный подход имеет значительные достоинства, включающие постепенное модулирование в отличие от прерывистого ингибирования симпатической системы и вызывающие повышенное высвобождение дофамина, что может улучшить функцию почек, такую как почечная вазодилатация, диурез и натрийурез. Поэтому ингибиторы DβH могут обладать значительными преимуществами в сравнении с обычными β-блокаторами.
В литературе сообщено пока о нескольких ингибиторах DβH. Было установлено, что самая первая и вторая генерации соединений, таких как дисульфирам (Goldstein, M. et al., Life Sci., 3: 763, 1964) и диэтилдитиокарбамат (Lippmann, W. et al., Biochem. Pharmacol., 18: 2507, 1969) или фузаровая кислота (Hidaka, H., Nature, 231, 1971) и ароматические или алкилтиомочевины (Johnson, G.A. et al., J. Pharmacol. Exp. Ther., 171: 80, 1970) обладали низкой эффективностью, проявляли слабую селективность для DβH и вызывали токсические эффекты. Третья генерация ингибиторов DβH обладала, однако, более высокой эффективностью, такой как, например, у непикастата (RS-25560-197, IC50 9нМ) (Stanley, W.C. et al., Br. J. Pharmacol., 121: 1803-1809, 1997), который был разработан в ранних клинических опытах. Несмотря на устранение некоторых проблем, связанных с ингибиторами DβH первой и второй генерации, было сделано важное открытие, состоящее в том, что непикастат пересекает гематоэнцефалический барьер (ВВВ) и в результате способен вызывать центральные, а также и периферические эффекты, ситуацию, которая могла бы привести к нежелательным и потенциально серьезным побочным эффектам для ЦНС (CNS) от лекарственных средств. Следовательно, еще остается невыполненным клиническое требование для потенциального, нетоксичного и периферически-селективного ингибитора DβH, который можно было бы использовать для лечения определенных кардиоваскулярных расстройств. Ингибитор DβH с подобной или с более высокой эффективностью, чем непикастат, но не воздействующий на ЦНС (неспособный пересекать ВВВ), должен обладать значительными преимуществами по сравнению с соединениями-ингибиторами DβH, описанными ранее в данной области.
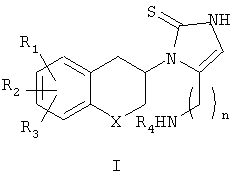
Заявители неожиданно установили, что включение некоторых гетероатомов в карбоциклическое кольцо и/или удлиннение аминоалкильной боковой цепи в каркасной структуре непикастата приводит к ряду соединений, проявляющих значительные или резко выраженные эффекты, потенциально применимые для ингибирования DβH. Многие из данных соединений наделены большей эффективностью и значительно сниженным доступом к мозгу и являются сильными и периферически-селективными ингибиторами DβH. Таким образом, данное изобретение относится к соединениям общей формулы I
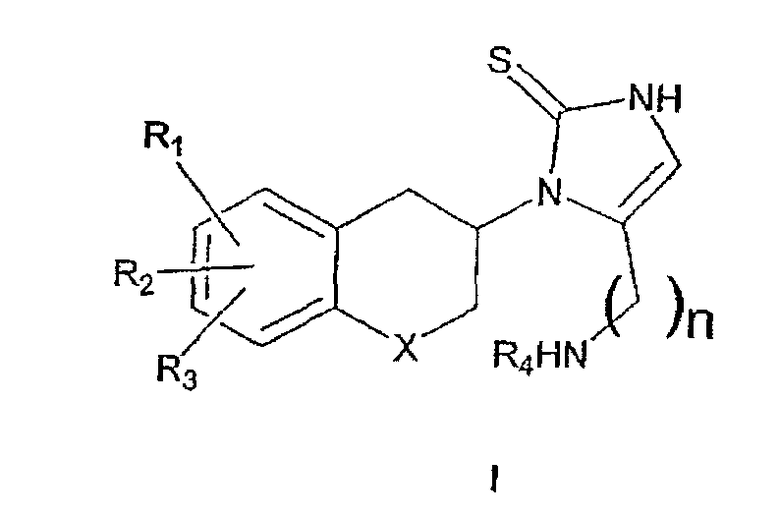
где R1, R2 и R3 одинаковы или различны и представляют собой водород, галоген, алкил, алкиларил, алкилокси, гидрокси, нитро, амино, алкилкарбониламино, алкиламино или диалкиламиногруппу; R4 представляет собой водород, алкил или алкиларилгруппу; Х представляет собой СН2, атом кислорода или атом серы; n представляет собой 1, 2 или 3 с условием, что при n, равном 1, Х не означает СН2,
и к индивидуальным (R)- и (S)-энантиомерам или их смесям; к их фармацевтически приемлемым солям.
Если не оговорено особо, то в описании данного изобретения термин алкил (примененный отдельно или в комбинации с другими группами) означает прямые или разветвленные углеводородные цепи, содержащие от одного до шести атомов углерода, необязательно замещенные арилом, алкокси, галогеном, алкоксикарбонильной или гидроксикарбонильной группами; термин арил (примененный отдельно или в комбинации с другими группами) означает фенильную или нафтильную группу, необязательно замещенную алкилокси, галогеном или нитрогруппой; термин галоген означает фтор, хлор, бром или йод.
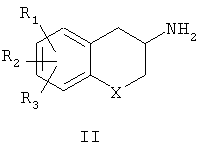
Другой аспект настоящего изобретения относится к способу получения соединений формулы I. Некоторые соединения формулы I, где Х означает метилен (СН2), кислород или серу, известны (Martinez, G.R. et al., US Patent 5538988, Jul. 23, 1996; Eriksson, M., PCT Int. Appl. WO 9959988A1, 25 Nov. 1999; Napoletano, M., PCT Int. Appl. WO 9608489A1, 21 March 1996; Sarda, N. et al., Tetrahedron Lett., 17: 271-272, 1976; Neirabeyeh, M.A. et al., Eur. J. Med. Chem., 26: 497-504, 1991) в литературе, а другие могут быть получены специалистами в данной области. Соединения формулы II являются хиральными и поэтому формула II должна соответствовать изображению как оптически чистых индивидуальных (R)- и (S)-энантиомеров, так и смесей энантиомеров
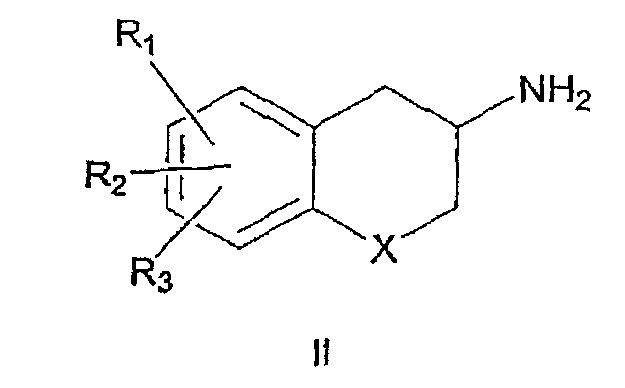
Соединения формулы I получены взаимодействием соединения формулы II, в которой Х представляет собой СН2, кислород или серу; R1, R2 и R3 одинаковы или различны и представляют собой водород, галоген, алкил, алкиларил, алкилокси, гидрокси, нитро, алкилкарбониламино, алкиламино или диалкиламиногруппу,
с соединением формулы III
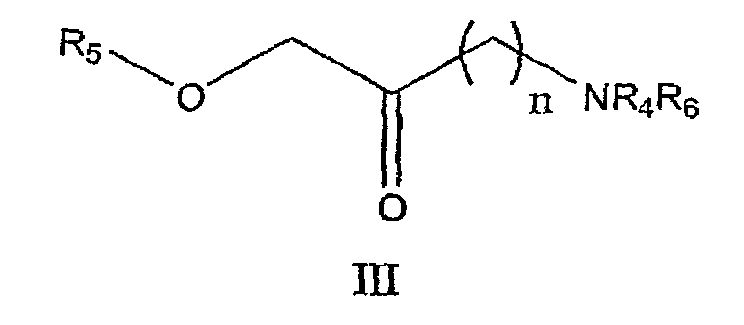
где n представляет собой 1, 2 или 3, R4 представляет собой водород, алкил или алкиларильную группу; R5 представляет собой гидроксилзащитную группу и R6 представляет собой аминозащитную группу; когда n равно 3, R5 принимает значения, указанные выше, но R4 и R6 вместе представляют собой фталимидогруппу,
и с водорастворимой тиоцианатной солью в инертном органическом растворителе и в присутствии органической кислоты, где водорастворимая тиоцианатная соль представляет собой тиоцианат щелочного металла или тиоцианат тетраалкиламмония.
Подходящие тиоцианатные соли щелочных металлов включают тиоцианаты натрия, лития и цезия, но предпочтительно тиоцианат калия.
Соединение формулы III, где n равно 1, известно (Wolf, E. et al., Can. J. Chem., 75: 942-948, 1997) и соединения формулы III, где n равно 2 или 3, представляют собой новые соединения, которые могут быть получены специалистами в данной области. Предпочтительные гидроксилзащитные группы (R5) включают силилорганические соединения, выбранные из триалкилсилильной, трифенилсилильной, фенилдиалкилсилильной или алкилдифенилсилильной групп. Особенно предпочтительна трет-бутилдиметилсилильная группа (TBDMS). Предпочтительные аминозащитные группы (R6) включают карбаматы, такие как алкилкарбаматы, в частности трет-бутилкарбаматную группу, и алкиларилкарбаматы. Реакция может быть проведена с небольшим избытком соединения формулы III и тиоцианатом калия (предпочтительно 1,1-1,3 эквивалента).
Данное изобретение относится также к соединениям формулы II, где, по меньшей мере, один из R1, R2 и R3 представляет собой фтор.
Реакция может быть проведена в основном в инертном растворителе (предпочтительно в этилацетате) и при различных температурах (предпочтительно при температуре кипения растворителя). Предпочтительные органические кислоты включают уксусную кислоту. При применении соединений формулы III, в которой n равно 1, промежуточный продукт формулы IV затем обрабатывают минеральной кислотой в подходящем растворителе для удаления Вос-аминозащитной группы с получением соединения формулы I (схема 1). Предпочтительные минеральные кислоты включают хлористоводородную кислоту и предпочтительные растворители включают этилацетат.
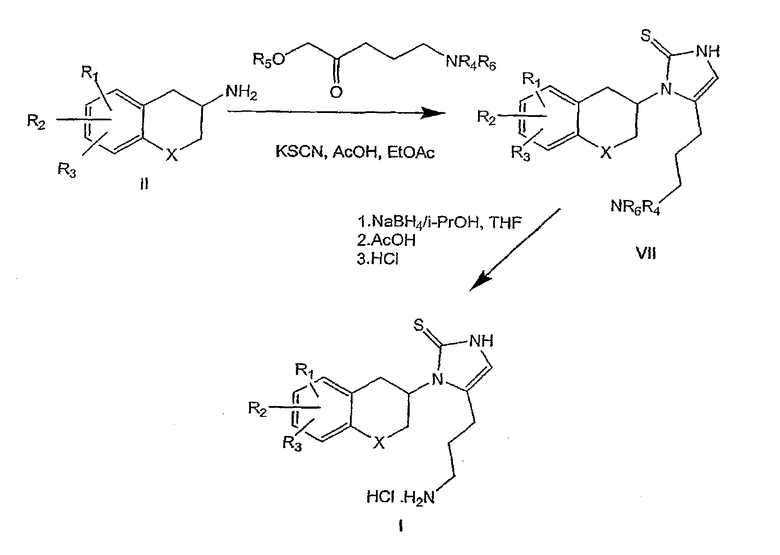
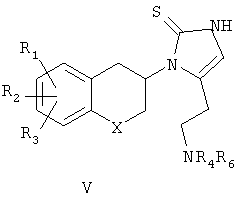
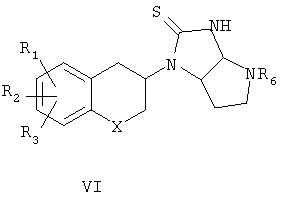
При использовании соединений формулы III, в которой n равно 2 и R4 представляет собой водород, смесь промежуточных продуктов формулы V и VI подвергают взаимодействию с хлористоводородной кислотой в этилацетате с получением соответствующих определенных соединений формулы I (схема 2); при R4, представляющем собой алкил (включающий алкил, замещенный арилом), единственный промежуточный продукт формулы V подвергают взаимодействию с хлористоводородной кислотой в этилацетате для получения соединений формулы I.
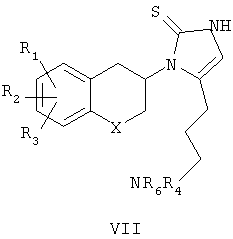
При использовании соединений формулы III, в которой n равно 3, промежуточный продукт формулы VII затем обрабатывают борогидридом натрия в подходящей системе растворителей с последующей обработкой уксусной кислотой для удаления фталимидо-аминозащитной группы, как описано в литературе (Osby et al., Tetrahedron Lett., 1984, 25(20), 2093-2096) с получением соединений формулы I (схема 3). Соединения формулы I получены с хорошей степенью чистоты, но, если требуется, то могут быть перекристаллизованы из подходящего растворителя.
Схема 1
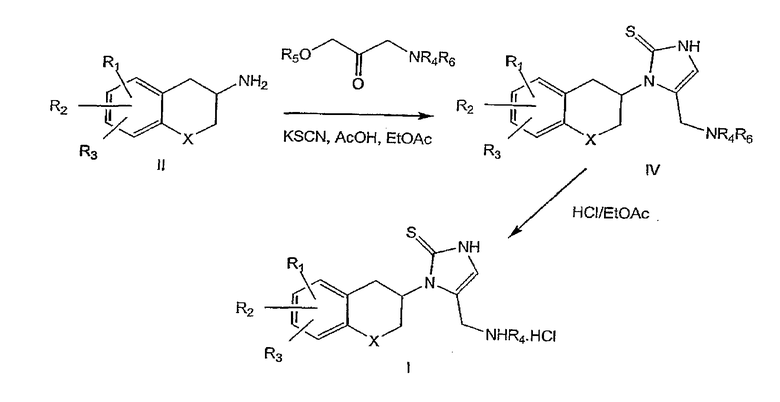
Схема 2
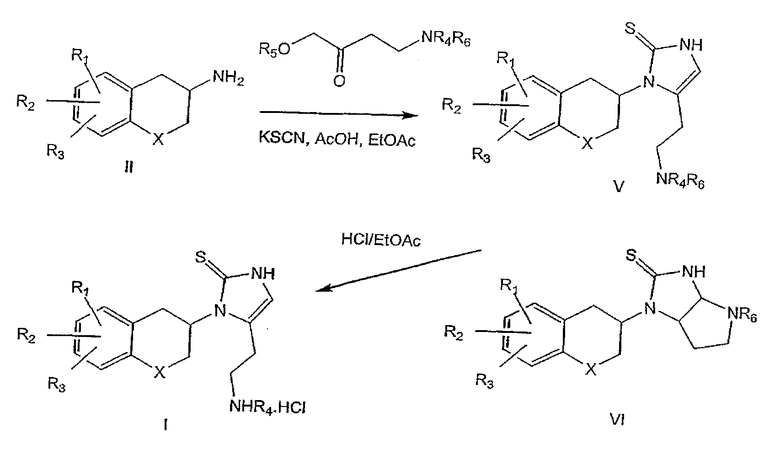
Схема 3
Для приготовления фармацевтических композиций соединений формулы I смешивают инертные фармацевтически приемлемые наполнители с активными соединениями. Фармацевтически приемлемые наполнители могут быть либо твердыми, либо жидкими. Твердые формы препаратов включают порошки, таблетки, диспергируемые гранулы и капсулы. Твердый наполнитель может представлять собой одно или несколько веществ, которые также могут быть разбавителями, ароматизаторами, растворителями, лубрикантами, суспендирующими средствами, связующими веществами или таблеточными диспергирующими средствами; наполнитель может быть также капсулирующим веществом.
Предпочтительно фармацевтический препарат представляет собой стандартную лекарственную форму, например упакованный препарат, причем упаковка содержит дискретные количества препарата в виде таблеток, капсул и порошков в баночках или ампулах.
Дозировка может быть изменена в зависимости от потребностей пациента, тяжести заболевания и применяемого конкретного соединения. Для удобства общая дневная дозировка может быть разделена и введена порциями в течение дня. Предполагается, что одноразовое или двухразовое введение в течение дня будет самым подходящим. Определение правильной дозировки в конкретной ситуации находится в компетенции специалистов-медиков.
Материалы и методы
Исследования in vitro
Активность DβH оценивали по ее способности β-гидроксилировать дофамин до норадреналина по методике, описанной ранее (Kojima, K., Parvez, S. and Nagatsu T. 1993. Analysis of enzymes in catecholamine biosynthesis. In Methods in Neurotransmitter and Neuropeptide Research, pp. 349-380: Elsiever Science Publishers). SK-N-SH клетки (АТСС НТВ-11), клеточная линия из нейробластомы человека, применяли в качестве источника человеческой DβH. SK-N-SH клетки, культивируемые в 24-луночных планшетах, предварительно инкубировали в течение 20 мин в реакционной среде, содержащей 200 мМ ацетата натрия, 30 мМ N-этилимида малеиновой кислоты, 5 мкМ сульфата меди, 0,5 мг/мл каталазы в виде водного раствора, 1 мМ паргилина, 10 мМ фумарата натрия и 20 мМ аскорбиновой кислоты. Затем клетки инкубировали дополнительно в течение 45 мин в реакционной среде с добавлением повышающихся концентраций дофамина (от 0,5 до 100 мМ). В течение предварительной и последующей инкубаций клетки непрерывно встряхивали и выдерживали при 37°С. Реакцию завершали добавлением 0,2 М перхлорной кислоты. Подкисленные образцы хранили при 4°С перед инъекцией в жидкостной хроматограф высокого давления для количественного определения норадреналина. В опытах, проводимых с целью исследования действия новых ингибиторов DβH на активность фермента, выделившиеся перспективные соединения (от 0,3 до 10000 нМ) добавляли к растворам для предварительной и последующей инкубации; инкубацию проводили в присутствии концентрации (50 мМ) дофамина, большей в 2,5 раза, чем соответствующая Кm величина, как определено в экспериментах по насыщению.
Исследования in vivo
NMRI мыши-самцы или крысы Wistar были получены от Harlan-Interfauna (Испания) и содержались в клетке по 10 и 5 особей соответственно при контролируемых условиях окружающей среды (12 ч цикл чередования света и темноты и комнатная температура 22 ± 1°С). Пища и вода были предоставлены неограниченно и опыты были проведены в светлое время дня.
В момент времени, равный 0 ч, животным вводили либо тестируемые соединения в данной дозе, либо растворитель (вода) орально с помощью желудочного зонда. Через 2, 6, 9, 12, 18 и 24 часа после введения дозы животных обезглавливали и извлекали сердце (левое предсердие и левый желудочек) и мозг (фронтальный и париетальный кортекс), образцы взвешивали и хранили в емкости с 0,2 М перхлорной кислотой в течение 12 ч при 4°С в темноте. После инкубации образовавшиеся супернатанты, собирали фильтрацией инкубатов с помощью центрифуги (0,2 мкМ/10 мин/˜5000 оборотов в минуту, 4°С). Супернатанты до анализа хранили замороженными при -80°С. Определение количества дофамина и норадреналина в супернатантах проводили с помощью жидкостной хроматографии высокого давления с электрохимическим детектированием.
Результаты
Исследования in vitro
Инкубация SK-N-SH клеток в присутствии возрастающих концентраций дофамина приводила к зависимому от концентрации образованию норадреналина и величинам Кm (в мкМ) и Vmax (в нмоль мг протеин-1 ч-1), равным соответственно 20,6±1,6 и 153,8±4,4. По данным кинетическим параметрам была выбрана концентрация дофамина, приближающаяся к насыщению (50 мМ), для применения в опытах по ингибированию. Было установлено, что перечисленные в таблице 1 соединения 2, 3, 4, 5, 6, 7, 8, 10, 12, 16, 19, 24, 26, 28 и 29 значительно ингибируют активность DβH. Соединения 2, 3, 4 и непикастат 1 (эталонное соединение) вызывали зависимое от концентрации снижение β-гидроксилирования дофамина и характеризовались величинами IC50 c низким значением нМ в сравнении с активностью на человеческой DβH (смотри таблицу 2). Соединение 4 было выбрано для дальнейших исследований in vivo, причем даное соединение наибольшим образом родственно непикастату 1, что позволяет сделать заключение о том, что структурные модификации, предпринятые в ходе настоящего изобретения, ответствены за наблюдаемые заметно улучшенные биологические свойства.
Действие отобранных соединений (5 мкМ) на активность DβH в
SK-N-SH клетках. Величины указаны в % к контролю
Величины IC50 (в нМ) по ингибированию DβH в SK-N-SH клетках
Исследования in vivo
Мышь
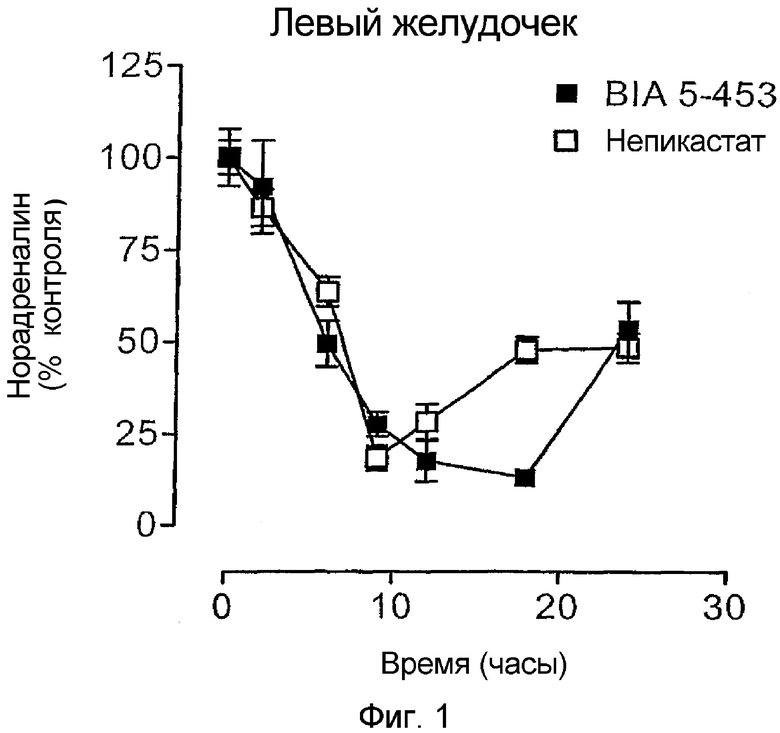
Длительное проведение экспериментов с соединением 4 и непикастатом (1) на сердце при 100 мг/кг основывается на предположении, что оба соединения являются пролонгированного действия. Оказывается, максимальный эффект (Tmax) по снижению норадреналина в ткани под воздействием 4 и 1 проявляется через 9 ч после введения дозы (см. фиг.1). Затем уровни норадреналина в ткани восстанавливаются, достигая 50% от начальных уровней в тканях через 24 ч.
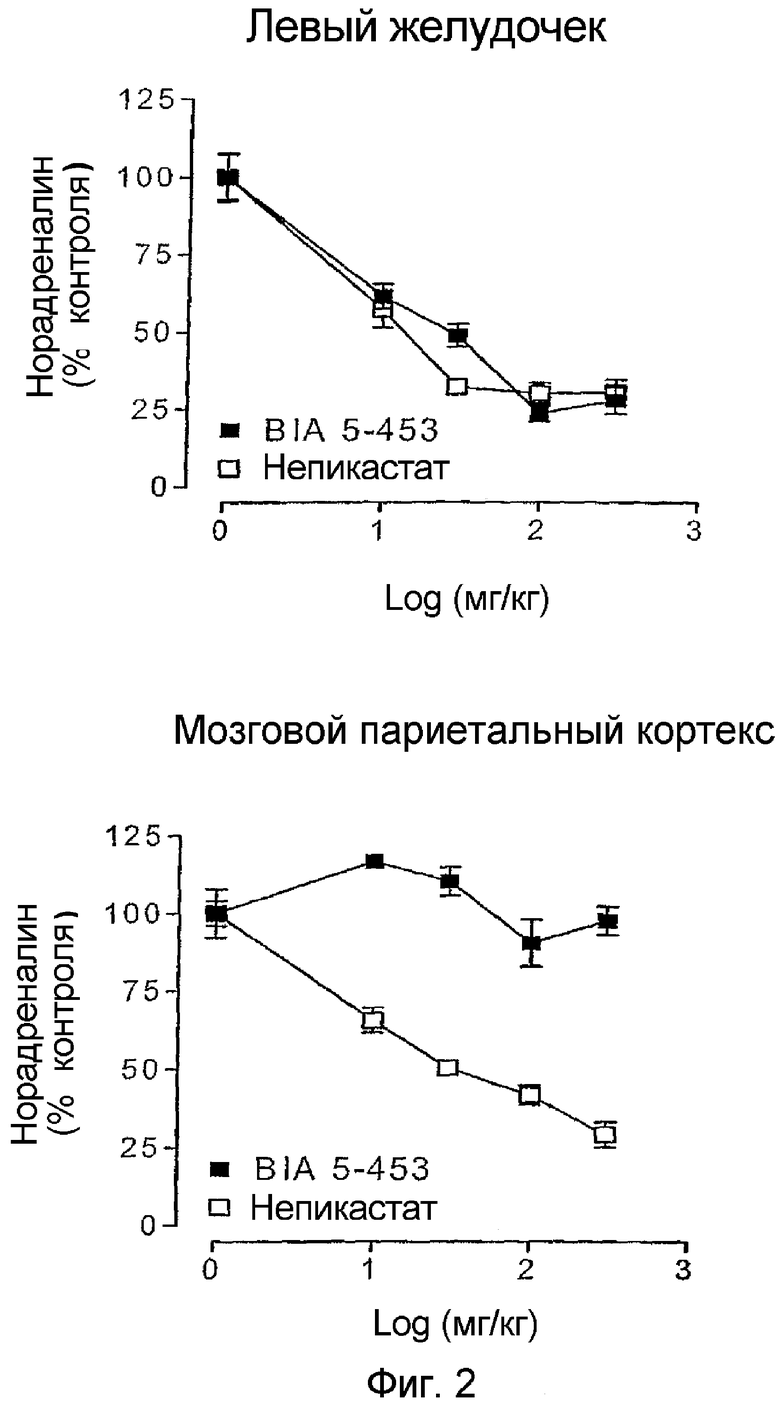
При Тmax (9 ч после введения) как 4, так и 1 снижали уровни норадреналина в левом желудочке дозозависимым образом. Максимальный ингибирующий эффект для обоих соединений, 4 и 1, был достигнут при дозе 100 мг/кг. В противоположность данным, установленным на сердце, соединение 4 оказывало слабое действие на тканевые уровни норадреналина в мозговом париетальном кортексе, в то время как 1 вызывало дозозависимое снижение уровней норадреналина в указанной области мозга (см. фиг.2).
Крыса
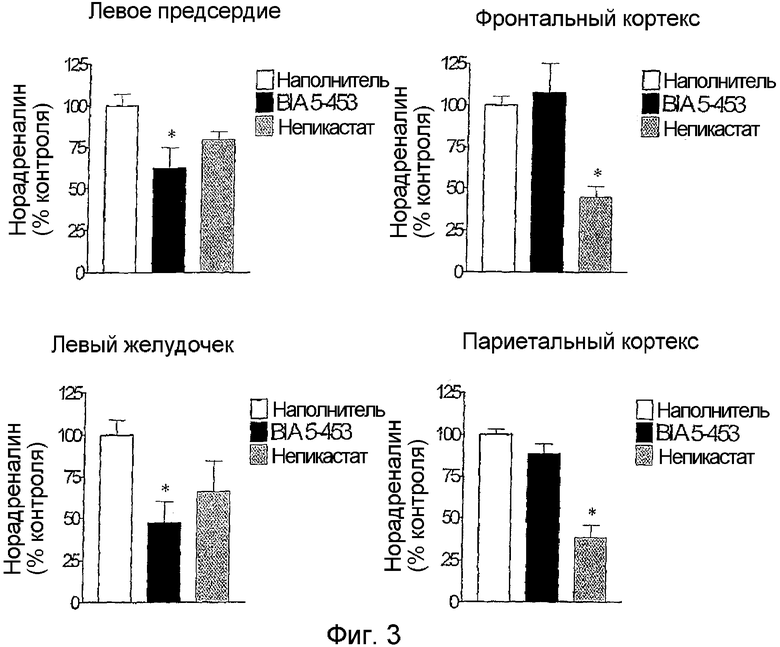
Как показано на мыши, воздействия обоих соединений, 4 и 1, на норадреналин зависели от введенной дозы и достигали максимума за 9 ч (данные не приведены). Однако, как показано на фиг.3, ингибирующие эффекты соединения 4 (100 мг/кг) на уровни норадреналина в левом предсердии и в левом желудочке были более выражены, чем эффекты, проявленные соединением 1 (100 мг/кг). Напротив, как показано на мыши, соединение 4 оказывало слабое действие на тканевые уровни норадреналина в мозговом париетальном кортексе и в мозговом фронтальном кортексе, в то время как соединение 1 производило заметное снижение уровней норадреналина в указанных областях мозга.
Сделан вывод о том, что соединение 4, резко отличаясь от непикастата 1, проявляет свой ингибирующий эффект на DβH исключительно периферийно, причем не обладает ингибирующим действием на мозг.
Ниже даны уточнения к приведенным чертежам, где фиг.1 представляет собой графическое изображение дозозависимого снижения уровней норадреналина в левых желудочках мышей, получивших орально 100 мг/мг соединения 4 или непикастата 1. Обозначения относятся к 5 определениям на группу; вертикальные линии указывают среднеквадратичную ошибку, SEM.
Фиг.2 представляет собой два графика, показывающих уровни норадреналина в левом желудочке мыши и в мозговом париетальном кортексе за 9 ч после орального введения соединения 4 или непикастата 1. Обозначения относятся к 5 определениям на группу; вертикальные линии указывают среднеквадратичную ошибку, SEM.
Фигура 3 представляет собой два графика, показывающих уровни норадреналина в сердце крысы (левое предсердие и левый желудочек) и в мозге (фронтальный и париетальный кортекс) за 9 ч после орального введения соединения 4 или непикастата 1. Обозначения относятся к 5 определениям на группу; вертикальные линии указывают среднеквадратичную ошибку, SEM.
Заключение
Некоторые соединения общей формулы I являются перспективными ингибиторами дофамин-β-гидроксилазы и обладают потенциально ценными фармацевтическими свойствами в лечении некоторых кардиоваскулярных нарушений, где снижение ферментативного гидроксилирования дофамина до норадреналина может привести к терапевтическому улучшению, в таких случаях как гипертензия и хроническая сердечная недостаточность. Возможность применения ингибиторов DβH пролонгированного действия с ограниченным доступом к мозгу (ЦНС), таких как соединение 4, открывает новые перспективы в лечении гипертензии и хронической сердечной недостаточности путем более эффективного и селективного ингибирования DβH на периферии.
Изобретение, раскрываемое ниже, представлено последующими примерами синтеза, которые не следует воспринимать как ограничивающие объем данного изобретения. Альтернативные направления и аналогичные структуры могут быть очевидными для специалистов в данной области.
ПРИМЕРЫ
Пример 1
(R)-5-Аминометил-1-(6,8-дифторхроман-3-ил)-1,3-дигидроимидазол-2-тион гидрохлорид (соединение 3, таблица 1)
Перемешиваемую смесь гидрохлорида (R)-6,8-дифторхроман-3-иламина (0,22 г, 1,0 ммоль), трет-бутилового эфира [3-(трет-бутилдиметилсиланилокси)-2-оксопропил]карбаминовой кислоты (0,33 г, 1,1 ммоль), тиоцианата калия (0,11 г, 1,1 ммоль) и уксусной кислоты (0,3 мл, 5,0 ммоль) в этилацетате (3 мл) кипятили с обратным холодильником 2 часа, охлаждали до комнатной температуры, затем промывали раствором бикарбоната натрия, сушили над безводным сульфатом магния и упаривали в вакууме. Остаток очищали колоночной хроматографией на силикагеле, используя в качестве элюента смесь этилацетат-петролейный эфир. Полученное масло (0,23 г) растворяли в этилацетате (2 мл), после чего добавляли 2 М раствор HCl в этилацетате (2 мл, 4 ммоль) и смесь перемешивали 2 часа при комнатной температуре. Осадок отделяли фильтрованием и промывали этилацетатом, получая кристаллы с т. пл. 192°С (разл.).
Примеры 2-3
Применением вышеописанной методики и родственных процедур, известных специалистам в данной области, с использованием гидрохлоридов соответствующих хроман-3-иламинов получали следующие соединения:
(R)-5-аминометил-1-хроман-3-ил-1,3-дигидроимидазол-2-тион гидрохлорид (соединение 24, таблица 1),
(R)-5-аминометил-1-(6-гидроксихроман-3-ил)-1,3-дигидроимидазол-2-тион гидрохлорид (соединение 22, таблица 1).
Пример 4
(R,S)-5-Аминометил-1-(6-гидрокситиохроман-3-ил)-1,3-дигидроимидазол-2-тион гидрохлорид
Перемешиваемую смесь гидрохлорида 6-гидрокситиохроман-3-иламина (0,22 г, 1,0 ммоль), трет-бутилового эфира [3-(трет-бутилдиметилсиланилокси)-2-оксопропил]карбаминовой кислоты (0,33 г, 1,1 ммоль), тиоцианата калия (0,11 г, 1,1 ммоль) и уксусной кислоты (0,3 мл, 5,0 ммоль) в этилацетате (3 мл) кипятили с обратным холодильником 2 часа, затем охлаждали до комнатной температуры и промывали раствором бикарбоната натрия, сушили над безводным сульфатом магния и упаривали в вакууме. Остаток очищали колоночной хроматографией на силикагеле, используя в качестве элюента смесь этилацетат-петролейный эфир. Полученное масло (0,25 г) растворяли в этилацетате (2 мл), после чего добавляли 2 М раствор HCl в этилацетате (2 мл, 4 ммоль) и смесь перемешивали 2 часа при комнатной температуре. Осадок отделяли фильтрованием и промывали этилацетатом, получая кристаллы, которые разлалались без плавления.
Пример 5
трет-Бутиловый эфир (3,4-дигидроксибутил)карбаминовой кислоты
К перемешиваемому раствору 4-амино-1,2-пропандиола (2,10 г, 20 ммоль) в этаноле (50 мл) при комнатной температуре добавляли порцию ди-трет-бутилдикарбоната (4,80 г, 22 ммоль). Полученную смесь перемешивали при комнатной температуре два часа, затем упаривали в вакууме и очищали колоночной хроматографией на силикагеле, используя в качестве элюента смесь этилацетат-петролейный эфир, что приводило к образованию бесцветного масла.
Примеры 6-7
Применением вышеописанной методики и родственных процедур, известных специалистам в данной области, с использованием соответствующих N-замещенных 4-амино-1,2-пропандиолов получали следующие соединения:
трет-бутиловый эфир (3,4-дигидроксибутил)метилкарбаминовой кислоты,
трет-бутиловый эфир (3,4-дигидроксибутил)бензилкарбаминовой кислоты.
Пример 8
трет-Бутиловый эфир [4-(трет-бутилдиметилсиланилокси)-3-гидроксибутил]карбаминовой кислоты
К перемешиваемому раствору трет-бутилового эфира (3,4-дигидроксибутил)карбаминовой кислоты (2,60 г, 12,7 ммоль), триэтиламина (2,03 мл, 14,50 ммоль) и 4-(диметиламино)пиридина (0,05 г, 0,4 ммоль) в безводном дихлорметане (40 мл) при комнатной температуре добавляли порцию трет-бутилдиметилхлорсилана (2,0 г, 13,17 ммоль). Полученную смесь перемешивали при комнатной температуре 18 часов, промывали водой, соляным раствором и сушили над безводным сульфатом магния. После фильтрования и концентрирования фильтрата в вакууме получали масло, которое очищали колоночной хроматографией на силикагеле, используя в качестве элюента смесь этилацетат-петролейный эфир, что приводило к образованию бесцветного масла.
Примеры 9-10
Применением вышеописанной методики и родственных процедур, известных специалистам в данной области, с использованием соединений из примеров 6 и 7 получали следующие соединения:
трет-бутиловый эфир [4-(трет-бутилдиметилсиланилокси)-3-гидроксибутил]метилкарбаминовой кислоты,
трет-бутиловый эфир [4-(трет-бутилдиметилсиланилокси)-3-гидроксибутил]бензилкарбаминовой кислоты.
Пример 11
трет-Бутиловый эфир [4-(трет-бутилдиметилсиланилокси)-3-оксобутил]карбаминовой кислоты
К раствору периодинана (periodinane) Dess-Martin (5,0 г, 11,8 ммоль) в безводном дихлорметане (35 мл) при комнатной температуре добавляли раствор трет-бутилового эфира [4-(трет-бутилдиметилсиланилокси)-3-гидроксибутил]карбаминовой кислоты (3,77 г, 11,8 ммоль) в безводном дихлорметане. Полученную смесь перемешивали при комнатной температуре один час, упаривали в вакууме до одной трети от начального объема и попускали через колонку с силикагелем. Элюирование смесью растворителей этилацетат-петролейный эфир приводило к получению бесцветного масла.
Примеры 12-13
Применением вышеописанной методики и родственных процедур, известных специалистам в данной области, с использованием соединений из примеров 9 и 10 получали следующие соединения:
трет-бутиловый эфир [4-(трет-бутилдиметилсиланилокси)-3-оксобутил]метилкарбаминовой кислоты,
трет-бутиловый эфир [4-(трет-бутилдиметилсиланилокси)-3-оксобутил]бензилкарбаминовой кислоты.
Пример 14
(S)-5-(2-Аминоэтил)-1-(5,7-дифтор-1,2,3,4-тетрагидронафталин-2-ил)-1,3-дигидроимидазол-2-тион гидрохлорид (соединение 2, таблица 1)
Перемешиваемую смесь гидрохлорида (S)-5,7-дифтор-1,2,3,4-тетрагидронафталин-2-иламина (0,17 г, 0,79 ммоль), трет-бутилового эфира [4-(трет-бутилдиметилсиланилокси)-3-оксобутил]карбаминовой кислоты (0,28 г, 0,87 ммоль), тиоцианата калия (0,085 г, 0,85 ммоль), воды (0,014 мл, 0,80 ммоль) и уксусной кислоты (0,2 мл, 3,3 ммоль) в этилацетате (2 мл) кипятили с обратным холодильником 7 часов, охлаждали до комнатной температуры, промывали раствором бикарбоната натрия, сушили над безводным сульфатом магния и упаривали в вакууме. Остаток очищали колоночной хроматографией на силикагеле, используя в качестве элюента смесь этилацетат-петролейный эфир. Полученное масло (0,24 г) растворяли в этилацетате (2 мл), после чего добавляли 2 М раствор HCl в этилацетате (2 мл, 4 ммоль) и смесь перемешивали 2 часа при комнатной температуре. Осадок отделяли фильтрованием и промывали этилацетатом, получая кристаллы, которые разлагались без плавления.
Пример 15
Применением вышеописанной методики и родственных процедур, известных специалистам в данной области, с использованием гидрохлорида соответствующего 1,2,3,4-тетрагидронафталин-2-иламина получали следующее соединение:
(S)-5-(2-аминоэтил)-1-(1,2,3,4-тетрагидронафталин-2-ил)-1,3-дигидроимидазол-2-тион гидрохлорид (соединение 20, таблица 1).
Пример 16
(R)-5-(2-Аминоэтил)-1-(6,8-дифторхроман-3-ил)-1,3-дигидроимидазол-2-тион гидрохлорид (соединение 4, таблица 1)
Перемешиваемую смесь гидрохлорида (R)-6,8-дифторхроман-3-иламина (1,68 г, 7,58 ммоль), трет-бутилового эфира [4-(трет-бутилдиметилсиланилокси)-3-оксобутил]карбаминовой кислоты (3,13 г, 9,85 ммоль), тиоцианата калия (0,96 г, 9,85 ммоль), воды (0,18 мл, 10 ммоль) и уксусной кислоты (3,0 мл, 50 ммоль) в этилацетате (30 мл) кипятили с обратным холодильником 7 часов, охлаждали до комнатной температуры, промывали раствором бикарбоната натрия, сушили над безводным сульфатом магния и упаривали в вакууме. Остаток очищали колоночной хроматографией на силикагеле, используя в качестве элюента смесь этилацетат-петролейный эфир. Полученное масло (2,15 г) растворяли в этилацетате (20 мл), после чего добавляли 2 М раствор HCl в этилацетате (20 мл, 40 ммоль) и смесь перемешивали 2 часа при комнатной температуре. Осадок отделяли фильтрованием и промывали этилацетатом, получая кристаллы, которые разлагались без плавления.
Примеры 17-37
Применением вышеописанной методики и родственных процедур, известных специалистам в данной области, с использованием соответствующих гидрохлоридов хроман-3-иламинов и трет-бутиловых эфиров [4-(трет-бутилдиметилсиланилокси)-3-оксобутил]карбаминовой кислоты получали следующие соединения:
(R)-5-(2-аминоэтил)-1-хроман-3-ил-1,3-дигидроимидазол-2-тион гидрохлорид (соединение 12, таблица 1),
(R)-5-(2-аминоэтил)-1-(6-гидроксихроман-3-ил)-1,3-дигидроимидазол-2-тион гидрохлорид (соединение 16, таблица 1),
(R)-5-(2-аминоэтил)-1-(8-гидроксихроман-3-ил)-1,3-дигидроимидазол-2-тион гидрохлорид (соединение 21, таблица 1),
(R)-5-(2-аминоэтил)-1-(6-метоксихроман-3-ил)-1,3-дигидроимидазол-2-тион гидрохлорид (соединение 23, таблица 1),
(R)-5-(2-аминоэтил)-1-(8-метоксихроман-3-ил)-1,3-дигидроимидазол-2-тион гидрохлорид (соединение 19, таблица 1),
(R)-5-(2-аминоэтил)-1-(6-фторхроман-3-ил)-1,3-дигидроимидазол-2-тион гидрохлорид (соединение 7, таблица 1),
(R)-5-(2-аминоэтил)-1-(8-фторхроман-3-ил)-1,3-дигидроимидазол-2-тион гидрохлорид (соединение 6, таблица 1),
(R)-5-(2-аминоэтил)-1-(6,7-дифторхроман-3-ил)-1,3-дигидроимидазол-2-тион гидрохлорид (соединение 8, таблица 1),
(S)-5-(2-аминоэтил)-1-(6,8-дифторхроман-3-ил)-1,3-дигидроимидазол-2-тион гидрохлорид (соединение 9, таблица 1),
(R)-5-(2-аминоэтил)-1-(6,7,8-трифторхроман-3-ил)-1,3-дигидроимидазол-2-тион гидрохлорид (соединение 10, таблица 1),
(R)-5-(2-аминоэтил)-1-(6-хлор-8-метоксихроман-3-ил)-1,3-дигидроимидазол-2-тион гидрохлорид (соединение 11, таблица 1),
(R)-5-(2-аминоэтил)-1-(6-метокси-8-хлорхроман-3-ил)-1,3-дигидроимидазол-2-тион гидрохлорид (соединение 13, таблица 1),
(R)-5-(2-аминоэтил)-1-(6-нитрохроман-3-ил)-1,3-дигидроимидазол-2-тион гидрохлорид (соединение 18, таблица 1),
(R)-5-(2-аминоэтил)-1-(8-нитрохроман-3-ил)-1,3-дигидроимидазол-2-тион гидрохлорид (соединение 17, таблица 1),
(R)-5-(2-аминоэтил)-1-[6-(ацетиламино)хроман-3-ил]-1,3-дигидроимидазол-2-тион гидрохлорид (соединение 14, таблица 1),
(R)-5-(2-аминоэтил)-1-(6-гидрокси-7-бензилхроман-3-ил)-1,3-дигидроимидазол-2-тион гидрохлорид (соединение 15, таблица 1),
(R)-5-(2-бензиламиноэтил)-1-(6-метоксихроман-3-ил)-1,3-дигидроимидазол-2-тион гидрохлорид (соединение 25, таблица 1),
(R)-5-(2-бензиламиноэтил)-1-(6-гидроксихроман-3-ил)-1,3-дигидроимидазол-2-тион гидрохлорид (соединение 26, таблица 1),
(R)-1-(6-гидроксихроман-3-ил)-5-(2-метиламиноэтил)-1,3-дигидроимидазол-2-тион гидрохлорид (соединение 27, таблица 1),
(R)-1-(6,8-дифторхроман-3-ил)-5-(2-метиламиноэтил)-1,3-дигидроимидазол-2-тион гидрохлорид (соединение 28, таблица 1),
(R)-1-хроман-3-ил-5-(2-метиламиноэтил)-1,3-дигидроимидазол-2-тион гидрохлорид (соединение 29, таблица 1).
Пример 38
(R,S)-5-(2-Аминоэтил)-1-(6-метокситиохроман-3-ил)-1,3-дигидроимидазол-2-тион гидрохлорид (соединение 30, таблица 1)
Перемешиваемую смесь гидрохлорида 6-метокситиохроман-3-иламина (0,12 г, 0,50 ммоль), трет-бутилового эфира [3-(трет-бутилдиметилсиланилокси)-2-оксопропил]карбаминовой кислоты (0,17 г, 0,55 ммоль), тиоцианата калия (0,055 г, 0,55 ммоль), воды (0,009 г, 0,50 ммоль) и уксусной кислоты (0,2 мл, 3,3 ммоль) в этилацетате (2 мл) кипятили с обратным холодильником 7 часов, охлаждали до комнатной температуры, промывали раствором бикарбоната натрия, сушили над безводным сульфатом магния и упаривали в вакууме. Остаток очищали колоночной хроматографией на силикагеле, используя в качестве элюента смесь этилацетат-петролейный эфир. Полученное масло (0,12 г) растворяли в этилацетате (1 мл), после чего добавляли 2 М раствор HCl в этилацетате (1 мл, 2 ммоль) и смесь перемешивали 2 часа при комнатной температуре. Осадок отделяли фильтрованием и промывали этилацетатом, получая кристаллы, которые разлагались без плавления.
Пример 39
Применением вышеописанной методики и родственных процедур, известных специалистам в данной области, с использованием гидрохлоридов соответствующих хроман-3-иламинов получали следующее соединение:
(R,S)-5-(2-аминоэтил)-1-(6-гидрокситиохроман-3-ил)-1,3-дигидроимидазол-2-тион гидрохлорид (соединение 31, таблица 1).
Пример 40
2-[3-(2,2-Диметил[1,3]диоксолан-4-ил)пропил]изоиндол-1,3-дион
К перемешиваемому раствору 3-(2,2-диметил[1,3]диоксолан-4-ил)пропиламина (1,05 г, 6,60 ммоль) и карбоэтоксифталимида (1,45 г, 6,60 ммоль) в ацетонитриле (10 мл) при комнатной температуре порцией добавляли триэтиламин (0,92 мл, 6,60 ммоль) и полученную смесь перемешивали при комнатной температуре 18 часов, упаривали в вакууме и остаток растворяли в этилацетате (50 мл). Раствор промывали соляным раствором, 10% раствором лимонной кислоты, снова соляным раствором, затем сушили над безводным сульфатом магния. После фильтрования и концентрирования фильтрата в вакууме получали масло, которое очищали колоночной хроматографией на силикагеле, используя в качестве элюента смесь этилацетат-петролейный эфир, что приводило к образованию бесцветного масла.
Пример 41
2-(4,5-Дигидроксипентил)изоиндол-1,3-дион
К перемешиваемому раствору 2-[3-(2,2-диметил[1,3]диоксолан-4-ил)пропил]изоиндол-1,3-диона (1,65 г, 5,70 ммоль) в ТГФ (THF) (20 мл) при комнатной температуре порцией добавляли 2 н. раствор HCl (15 мл, 30 ммоль) и полученную смесь перемешивали при комнатной температуре два часа, затем упаривали в вакууме до половины от первоначального объема. Остаток насыщали NaCl и экстрагировали этилацетатом. Органическую фазу сушили над безводным сульфатом магния. После фильтрования и концентрирования фильтрата в вакууме получали бесцветное масло.
Пример 42
Применением методики, описанной в примере 8, к 2-(4,5-дигидроксипентил)изоиндол-1,3-диону получали следующее соединение:
2-[5-(трет-бутилдиметилсиланилокси)-4-гидроксипентил]изоиндол-1,3-дион.
Пример 43
Применением методики, описанной в примере 11, к 2-[5-(трет-бутилдиметилсиланилокси)-4-гидроксипентил]изоиндол-1,3-диону получали следующее соединение:
2-[5-(трет-бутилдиметилсиланилокси)-4-оксопентил]изоиндол-1,3-дион.
Пример 44
(S)-5-(3-Аминопропил)-1-(5,7-дифтор-1,2,3,4-тетрагидронафталин-2-ил)-1,3-дигидроимидазол-2-тион гидрохлорид (соединение 5, таблица 1)
Перемешиваемую смесь гидрохлорида (S)-5,7-дифтор-1,2,3,4-тетрагидронафталин-2-иламина (0,22 г, 1,0 ммоль), 2-[5-(трет-бутилдиметилсиланилокси)-4-оксопентил]изоиндол-1,3-диона (0,38 г, 1,05 ммоль), тиоцианата калия (0,11 г, 1,10 ммоль), воды (0,18 г, 1,0 ммоль) и уксусной кислоты (0,3 мл, 5,0 ммоль) в этилацетате (3 мл) кипятили с обратным холодильником 7 часов, охлаждали до комнатной температуры, промывали раствором бикарбоната натрия, сушили над безводным сульфатом магния и упаривали в вакууме. Остаток очищали колоночной хроматографией на силикагеле, используя в качестве элюента смесь этилацетат-петролейный эфир. Полученное масло (0,18 г) растворяли в смеси изопропанола (5 мл) и ТГФ (2 мл). К раствору при комнатной температуре добавляли воду (0,8 мл) и борогидрид натрия (0,066 г, 1,74 ммоль) и смесь перемешивали 1,5 часа. Затем к смеси добавляли уксусную кислоту (0,6 мл, 10 ммоль), раствор кипятили с обратным холодильником два часа и упаривали в вакууме досуха. Остаток обрабатывали ацетоном, твердое вещество отфильтровывали и фильтрат подкисляли 2 н. HCl раствором в этилацетате. Осадок отделяли и промывали ацетоном, получая кристаллы, которые разлагались без плавления.
Пример 45
(R)-5-(3-Аминопропил)-1-(6,8-дифторхроман-3-ил)-1,3-дигидроимидазол-2-тион гидрохлорид
Перемешиваемую смесь гидрохлорида (R)-6,8-дифторхроман-3-иламина (0,11 г, 0,50 ммоль), 2-[5-(трет-бутилдиметилсиланилокси)-4-оксопентил]изоиндол-1,3-диона (0,19 г, 0,55 ммоль), тиоцианата калия (0,055 г, 0,55 ммоль), воды (0,009 г, 0,50 ммоль) и уксусной кислоты (0,15 мл, 2,5 ммоль) в этилацетате (1,5 мл) кипятили с обратным холодильником 7 часов, охлаждали до комнатной температуры, промывали раствором бикарбоната натрия, сушили над безводным сульфатом магния и упаривали в вакууме. Остаток очищали колоночной хроматографией на силикагеле, используя в качестве элюента смесь этилацетат-петролейный эфир. Полученное масло (0,10 г) растворяли в смеси изопропанола (2,5 мл) и ТГФ (1 мл). К раствору при комнатной температуре добавляли воду (0,4 мл) и борогидрид натрия (0,038 г, 1,0 ммоль) и смесь перемешивали 1,5 часа. Затем к смеси добавляли уксусную кислоту (0,3 мл, 5 ммоль), раствор кипятили с обратным холодильником два часа и упаривали в вакууме досуха. Остаток обрабатывали ацетоном, твердое вещество отфильтровывали и фильтрат подкисляли 2 н. HCl раствором в этилацетате. Осадок отделяли и промывали ацетоном, получая кристаллы, которые разлагались без плавления.
Пример 46
(R,S)-5-(3-Аминопропил)-1-(6-гидрокситиохроман-3-ил)-1,3-дигидроимидазол-2-тион гидрохлорид
Перемешиваемую смесь гидрохлорида 6-гидрокситиохроман-3-иламина (0,22 г, 1,0 ммоль), 2-[5-(трет-бутилдиметилсиланилокси)-4-оксопентил]изоиндол-1,3-диона (0,38 г, 1,05 ммоль), тиоцианата калия (0,11 г, 1,10 ммоль), воды (0,18 г, 1,0 ммоль) и уксусной кислоты (0,3 мл, 5,0 ммоль) в этилацетате (3 мл) кипятили с обратным холодильником 7 часов, охлаждали до комнатной температуры, промывали раствором бикарбоната натрия, сушили над безводным сульфатом магния и упаривали в вакууме. Остаток очищали колоночной хроматографией на силикагеле, используя в качестве элюента смесь этилацетат-петролейный эфир. Полученное масло (0,17 г) растворяли в смеси изопропанола (5 мл) и ТГФ (2 мл). К раствору при комнатной температуре добавляли воду (0,8 мл) и борогидрид натрия (0,066 г, 1,74 ммоль) и смесь перемешивали 1,5 часа. Затем к смеси добавляли уксусную кислоту (0,6 мл, 10 ммоль), раствор кипятили с обратным холодильником два часа и упаривали в вакууме досуха. Остаток обрабатывали ацетоном, твердое вещество отфильтровывали и фильтрат подкисляли 2 н. HCl раствором в этилацетате. Осадок отделяли и промывали ацетоном, получая кристаллы, которые разлагались без плавления.
| название | год | авторы | номер документа |
|---|---|---|---|
| Производные 1,3-дигидроимидазол-2-тиона для применения в лечении легочной артериальной гипертензии и повреждения легкого | 2013 |
|
RU2718055C2 |
| ПРОИЗВОДНЫЕ 1,3-ДИГИДРОИМИДАЗОЛ-2-ТИОНА В КАЧЕСТВЕ ИНГИБИТОРОВ ДОФАМИН-БЕТА-ГИДРОКСИЛАЗЫ | 2008 |
|
RU2501796C2 |
| ПРОИЗВОДНЫЕ БЕНЗОЦИКЛОАЛКИЛАЗОЛОТИОНА | 1995 |
|
RU2145321C1 |
| КРИСТАЛЛИЧЕСКАЯ ФОРМА И СПОСОБ ЕЕ ОЧИСТКИ | 2011 |
|
RU2604734C2 |
| ПРОИЗВОДНЫЕ ХРОМАНА ИЛИ ТИОХРОМАНА И СПОСОБЫ ИХ ПОЛУЧЕНИЯ (ВАРИАНТЫ) | 1990 |
|
RU2092483C1 |
| ЛЕЧЕНИЕ ПОСТТРАВМАТИЧЕСКОГО СТРЕССОВОГО РАССТРОЙСТВА | 2008 |
|
RU2458691C2 |
| 2,3-ДИГИДРОИЗОИНДОЛ-1-ОНЫ, ОБЛАДАЮЩИЕ ИНГИБИРУЮЩЕЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ МАО-В | 2003 |
|
RU2322437C2 |
| АМИНОЗАМЕЩЕННЫЕ ЭТИЛАМИНО-АГОНИСТЫ β-АДРЕНЕРГИЧЕСКИХ РЕЦЕПТОРОВ | 2004 |
|
RU2385317C2 |
| ПРОИЗВОДНЫЕ ТРОПАН-2-АЛЬДОКСИМА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ВЕЩЕСТВА ДЛЯ ПРОИЗВОДСТВА ЛЕКАРСТВ НА ИХ ОСНОВЕ И СПОСОБ ЛЕЧЕНИЯ РАСТРОЙСТВА ИЛИ БОЛЕЗНИ ОРГАНИЗМА | 1995 |
|
RU2134264C1 |
| ПРОИЗВОДНЫЕ 4-ГИДРОКСИПИПЕРИДИНА | 1997 |
|
RU2178412C2 |
Изобретение относится к соединению формулы I
где R1, R2 и R3 одинаковы или различны и представляют собой водород, галоген, алкил, алкилокси, гидрокси, нитро, амино, алкилкарбониламино, алкиламино или диалкиламиногруппу; R4 представляет собой водород, алкил или алкиларилгруппу; Х представляет собой СН2, атом кислорода или атом серы; n представляет собой 2 или 3, и индивидуальным (R)- и (S)-энантиомерам или смеси энантиомеров и его фармацевтически приемлемым солям; термин алкил означает прямые или разветвленные углеводородные цепи, содержащие от одного до шести атомов углерода, необязательно замещенные арилом, алкокси, галогеном, алкоксикарбонильной или гидроксикарбонильной группами; термин арил означает фенильную или нафтильную группу, необязательно замещенную алкилоксигруппой, галогеном или нитрогруппой; термин галоген означает фтор, хлор, бром или йод. Соединения обладают ценными фармакологическими свойствами и перспективны для лечения кардиоваскулярных расстройств, таких как гипертензия и хроническая сердечная недостаточность. Также описываются способ получения индивидуальных (R)- и (S)-энантиомеров или смесей энантиомеров и фармацевтически приемлемых солей соединения формулы I, фармацевтическая композиция, обладающая ингибирующей дофамин-β-гидролазу активностью, содержащая терапевтически эффективное количество соединения формулы I, различные варианты применения соединения формулы I и промежуточные соединения. Технический результат - получены новые соединения, обладающие полезными биологическими свойствами. 10 н. и 11 з.п. ф-лы, 3 ил., 2 табл.
где R1, R2 и R3 одинаковы или различны и представляют собой водород, галоген, алкил, алкилокси, гидрокси, нитро, амино, алкилкарбониламино, алкиламино или диалкиламиногруппу; R4 представляет собой водород, алкил или алкиларилгруппу; Х представляет собой СН2, атом кислорода или атом серы; n представляет собой 2 или 3, и индивидуальные (R)- и (S)-энантиомеры или смеси энантиомеров и его фармацевтически приемлемые соли; где термин алкил означает прямые или разветвленные углеводородные цепи, содержащие от одного до шести атомов углерода, необязательно замещенные арилом, алкокси, галогеном, алкоксикарбонильной или гидроксикарбонильной группами; термин арил означает фенильную или нафтильную группу, необязательно замещенную алкилоксигруппой, галогеном или нитрогруппой; термин галоген означает фтор, хлор, бром или йод.
(S)-5-(2-аминоэтил)-1-(1,2,3,4-тетрагидронафталин-2-ил)-1,3-дигидроимидазол-2-тион;
(S)-5-(2-аминоэтил)-1-(5,7-дифтор-1,2,3,4-тетрагидронафталин-2-ил)-1,3-дигидроимидазол-2-тион;
(R)-5-(2-аминоэтил)-1-хроман-3-ил-1,3-дигидроимидазол-2-тион;
(R)-5-(2-аминоэтил)-1-(6-гидроксихроман-3-ил)-1,3-дигидроимидазол-2-тион;
(R)-5-(2-аминоэтил)-1-(8-гидроксихроман-3-ил)-1,3-дигидроимидазол-2-тион;
(R)-5-(2-аминоэтил)-1-(6-метоксихроман-3-ил)-1,3-дигидроимидазол-2-тион;
(R)-5-(2-аминоэтил)-1-(8-метоксихроман-3-ил)-1,3-дигидроимидазол-2-тион;
(R)-5-(2-аминоэтил)-1-(6-фторхроман-3-ил)-1,3-дигидроимидазол-2-тион;
(R)-5-(2-аминоэтил)-1-(8-фторхроман-3-ил)-1,3-дигидроимидазол-2-тион;
(R)-5-(2-аминоэтил)-1-(6,7-дифторхроман-3-ил)-1,3-дигидроимидазол-2-тион;
(R)-5-(2-аминоэтил)-1-(6,8-дифторхроман-3-ил)-1,3-дигидроимидазол-2-тион;
(S)-5-(2-аминоэтил)-1-(6,8-дифторхроман-3-ил)-1,3-дигидроимидазол-2-тион;
(R)-5-(2-аминоэтил)-1-(6,7,8-трифторхроман-3-ил)-1,3-дигидроимидазол-2-тион;
(R)-5-(2-аминоэтил)-1-(6-хлор-8-метоксихроман-3-ил)-1,3-дигидроимидазол-2-тион;
(R)-5-(2-аминоэтил)-1-(6-метокси-8-хлорхроман-3-ил)-1,3-дигидроимидазол-2-тион;
(R)-5-(2-аминоэтил)-1-(6-нитрохроман-3-ил)-1,3-дигидроимидазол-2-тион;
(R)-5-(2-аминоэтил)-1-(8-нитрохроман-3-ил)-1,3-дигидроимидазол-2-тион;
(R)-5-(2-аминоэтил)-1-[6-(ацетиламино)хроман-3-ил]-1,3-дигидроимидазол-2-тион;
(R)-5-(2-аминоэтил)-1-(6-гидрокси-7-бензилхроман-3-ил)-1,3-дигидроимидазол-2-тион;
(R)-5-(3-аминопропил)-1-(6,8-дифторхроман-3-ил)-1,3-дигидроимидазол-2-тион;
(S)-5-(3-аминопропил)-1-(5,7-дифтор-1,2,3,4-тетрагидронафталин-2-ил)-1,3-дигидроимидазол-2-тион;
(R,S)-5-(2-аминоэтил)-1-(6-гидрокситиохроман-3-ил)-1,3-дигидроимидазол-2-тион;
(R,S)-5-(2-аминоэтил)-1-(6-метокситиохроман-3-ил)-1,3-дигидроимидазол-2-тион;
(R)-5-(2-бензиламиноэтил)-1-(6-метоксихроман-3-ил)-1,3-дигидроимидазол-2-тион;
(R)-5-(2-бензиламиноэтил)-1-(6-гидроксихроман-3-ил)-1,3-дигидроимидазол-2-тион;
(R)-1-(6-гидроксихроман-3-ил)-5-(2-метиламиноэтил)-1,3-дигидроимидазол-2-тион;
(R)-1-(6,8-дифторхроман-3-ил)-5-(2-метиламиноэтил)-1,3-дигидроимидазол-2-тион
или (R)-1-хроман-3-ил-5-(2-метиламиноэтил)-1,3-дигидроимидазол-2-тион или его фармацевтически приемлемые соли.
(S)-5-(2-аминоэтил)-1-(1,2,3,4-тетрагидронафталин-2-ил)-1,3-дигидроимидазол-2-тион гидрохлорид;
(S)-5-(2-аминоэтил)-1-(5,7-дифтор-1,2,3,4-тетрагидронафталин-2-ил)-1,3-дигидроимидазол-2-тион гидрохлорид;
(R)-5-(2-аминоэтил)-1-хроман-3-ил-1,3-дигидроимидазол-2-тион гидрохлорид;
(R)-5-(2-аминоэтил)-1-(6-гидроксихроман-3-ил)-1,3-дигидроимидазол-2-тион гидрохлорид;
(R)-5-(2-аминоэтил)-1-(8-гидроксихроман-3-ил)-1,3-дигидроимидазол-2-тион гидрохлорид;
(R)-5-(2-аминоэтил)-1-(6-метоксихроман-3-ил)-1,3-дигидроимидазол-2-тион гидрохлорид;
(R)-5-(2-аминоэтил)-1-(8-метоксихроман-3-ил)-1,3-дигидроимидазол-2-тион гидрохлорид;
(R)-5-(2-аминоэтил)-1-(6-фторхроман-3-ил)-1,3-дигидроимидазол-2-тион гидрохлорид;
(R)-5-(2-аминоэтил)-1-(8-фторхроман-3-ил)-1,3-дигидроимидазол-2-тион гидрохлорид;
(R)-5-(2-аминоэтил)-1-(6,7-дифторхроман-3-ил)-1,3-дигидроимидазол-2-тион гидрохлорид;
(R)-5-(2-аминоэтил)-1-(6,8-дифторхроман-3-ил)-1,3-дигидроимидазол-2-тион гидрохлорид;
(S)-5-(2-аминоэтил)-1-(6,8-дифторхроман-3-ил)-1,3-дигидроимидазол-2-тион гидрохлорид;
(R)-5-(2-аминоэтил)-1-(6,7,8-трифторхроман-3-ил)-1,3-дигидроимидазол-2-тион гидрохлорид;
(R)-5-(2-аминоэтил)-1-(6-хлор-8-метоксихроман-3-ил)-1,3-дигидроимидазол-2-тион гидрохлорид;
(R)-5-(2-аминоэтил)-1-(6-метокси-8-хлорхроман-3-ил)-1,3-дигидроимидазол-2-тион гидрохлорид;
(R)-5-(2-аминоэтил)-1-(6-нитрохроман-3-ил)-1,3-дигидроимидазол-2-тион гидрохлорид;
(R)-5-(2-аминоэтил)-1-(8-нитрохроман-3-ил)-1,3-дигидроимидазол-2-тион гидрохлорид;
(R)-5-(2-аминоэтил)-1-[6-(ацетиламино)хроман-3-ил]-1,3-дигидроимидазол-2-тион гидрохлорид;
(R)-5-(2-аминоэтил)-1-(6-гидрокси-7-бензилхроман-3-ил)-1,3-дигидроимидазол-2-тион гидрохлорид;
(R)-5-(3-аминопропил)-1-(6,8-дифторхроман-3-ил)-1,3-дигидроимидазол-2-тион гидрохлорид;
(S)-5-(3-аминопропил)-1-(5,7-дифтор-1,2,3,4-тетрагидронафталин-2-ил)-1,3-дигидроимидазол-2-тион гидрохлорид;
(R,S)-5-(2-аминоэтил)-1-(6-гидрокситиохроман-3-ил)-1,3-дигидроимидазол-2-тион гидрохлорид;
(R,S)-5-(2-аминоэтил)-1-(6-метокситиохроман-3-ил)-1,3-дигидроимидазол-2-тион гидрохлорид;
(R)-5-(2-бензиламиноэтил)-1-(6-метоксихроман-3-ил)-1,3-дигидроимидазол-2-тион гидрохлорид;
(R)-5-(2-бензиламиноэтил)-1-(6-гидроксихроман-3-ил)-1,3-дигидроимидазол-2-тион гидрохлорид;
(R)-1-(6-гидроксихроман-3-ил)-5-(2-метиламиноэтил)-1,3-дигидроимидазол-2-тион гидрохлорид;
(R)-1-(6,8-дифторхроман-3-ил)-5-(2-метиламиноэтил)-1,3-дигидроимидазол-2-тион гидрохлорид
или (R)-1-хроман-3-ил-5-(2-метиламиноэтил)-1,3-дигидроимидазол-2-тион гидрохлорид.
в которой Х представляет собой СН2, кислород или серу; R1, R2 и R3 одинаковы или различны и представляют собой водород, галоген, алкил, алкилокси, гидрокси, нитро, алкилкарбониламино, алкиламино или диалкиламиногруппу; с соединением формулы III
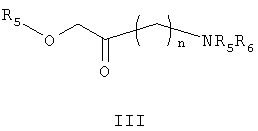
где n представляет собой 2 или 3; при n, равном 2, R4 представляет собой водород, алкильную группу; R5 представляет собой гидроксилзащитную группу и R6 представляет собой аминозащитную группу; когда n равно 3, R5 принимает значения, указанные выше, но R4 и R6 вместе представляют собой фталимидную группу; и с водорастворимой тиоцианатной солью в присутствии органической кислоты в инертном органическом растворителе с последующим удалением защиты в промежуточных продуктах IV-VII
где водорастворимая тиоцианатная соль представляет собой тиоцианат щелочного металла или тиоцианат тетраалкиламмония и где термин алкил означает прямые или разветвленные углеводородные цепи, содержащие от одного до шести атомов углерода, необязательно замещенные арилом, алкокси, галогеном, алкоксикарбонильной или гидроксикарбонильной группами; термин арил означает фенильную или нафтильную группу, необязательно замещенную алкилоксигруппой, галогеном или нитрогруппой; термин галоген означает фтор, хлор, бром или йод.

где R1, R2 и R3 могут быть одинаковыми или различными и представляют собой фтор или водород при условии, что, по меньшей мере, один из R1, R2 и R3 представляет собой фтор, и где Х представляет собой атом кислорода или серы.
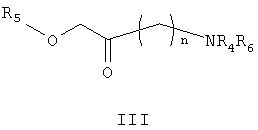
где n равно 2; R4 представляет собой водород, алкильную группу или аралкильную группу; R5 представляет собой гидроксилзащитную группу и R6 представляет собой аминозащитную группу; или
где n равно 3; R5 представляет собой гидроксилзащитную группу; R4 и R6 вместе представляют собой фталимидогруппу, где гидроксилзащитная группа представляет собой органосилильную группу; и аминозащитная группа представляет собой алкилкарбаматную или алкиларилкарбаматную группу, и где термин алкил означает прямые или разветвленные углеводородные цепи, содержащие от одного до шести атомов углерода, необязательно замещенные арильной, алкоксигруппами, галогеном, алкоксикарбонильной или гидроксикарбонильной группами; термин арил означает фенильную или нафтильную группу, необязательно замещенную алкилоксигруппой, галоген или нитрогруппой; термин галоген означает фтор, хлор, бром или йод.
Приоритет по пунктам:
| Прибор для очистки паром от сажи дымогарных трубок в паровозных котлах | 1913 |
|
SU95A1 |
| RU 2056419 C1, 20.03.1996. | |||
Авторы
Даты
2008-08-27—Публикация
2003-10-10—Подача