Настоящее изобретение относится к новым соединениям, обладающим ингибирующей активностью, направленной против продуцирования и секреции β-амилоидного белка; и к лекарственному средству для лечения различных заболеваний, вызванных аномальной продукцией или секрецией β-амилоидного белка, таких как болезнь Альцгеймера, синдром Дауна и другие заболевания, связанные с амилоидными отложениями.
Болезнь Альцгеймера представляет собой нейродегенеративное заболевание, имеющее патологические особенности, такие как дегенерация или утрата нервных клеток, образование сенильных бляшек и нейрофибриллярных сплетений. Болезнь Альцгеймера вызывает симптомы деменции, такие как постепенная потеря памяти, способности к распознаванию, мышлению, рассуждению и т.п. и, в конечном счете, приводит к смерти. До настоящего времени не был известен эффективный способ лечения или профилактики этого заболевания.
Основным белком, образующим сенильные бляшки, отложения которых происходят в головном мозге, является β-амилоидный белок (амилоидный β-протеин, Aβ), который состоит из 39-43 аминокислот. β-Амилоидный белок проявляет цитотоксичность, которая, как полагают, вызывает болезнь Альцгеймера (непатентный документ 1). β-Амилоидный белок, секретируемый из клеток, представляет собой полипептид, состоящий, в основном, из 40 или 42 аминокислот, и, в частности, известно, что в головном мозге происходит быстрое отложение именно того белка, который состоит из 42 аминокислот, в силу его высокой способности к агрегации, и, кроме того, он обладает сильной цитотоксичностью (непатентный документ 2). β-Амилоидный белок продуцируется повсеместно in vivo, но его функция остается неизвестной.
β-Амилоидный белок образуется путем процессинга амилоидного белка-предшественника (APP), который представляет собой мембранный белок. Мутацию гена APP наблюдают у пациентов, страдающих наследственной болезнью Альцгеймера. Известно, что увеличение количества продуцируемого или секретируемого β-амилоидного белка происходит в клетках, в которые был включен этот мутированный ген APP. Это дает основание предположить, что лекарственное средство, ингибирующее продукцию или секрецию β-амилоидного белка, должно быть эффективным для профилактики или лечения болезни Альцгеймера.
Что касается стадии процессинга амилоидного белка-предшественника для продуцирования β-амилоидного белка, сообщалось о BACE (отщепляющий фермент β-сайта APP) (непатентный документ 3) или Asp1 (непатентный документ 4), каждая представляющая собой аспарагинпротеазу, в качестве β-секретазы для отщепления N-конца β-амилоидного белка. Имеются весьма обоснованные предположения, что γ-секретаза, которая отщепляет C-концевой участок, частично состоит из пресенилина (непатентный документ 5). Хотя уже были сообщения об ингибиторах β-секретазы и γ-секретазы (непатентный документ 6), большинство из них являются пептидоподобными соединениями.
В патентном документе 1, SMITH и другие, раскрываются соединения, имеющие сульфонамидную структуру и способные контролировать продукцию β-амилоидного белка. В патентном документе 2, BELANGER и другие, раскрываются соединения, имеющие бициклоалкилсульфонамидную структуру и ингибирующие γ-секретазу. Также в патентных документах 3, 4 и 5 раскрываются диарилсульфоновые соединения, ингибирующие γ-секретазу. В патентном документе 6 раскрываются тионафталиновые производные, ингибирующие агрегацию амилоидного белка.
Непатентный документ 1: Science, 259, 514 (1993).
Непатентный документ 2: Journal of Biological Chemistry, 270, 7013 (1995).
Непатентный документ 3: Science, 286, 735 (1999).
Непатентный документ 4: Molecular and Cellular Neuroscience, 16, 609 (2000).
Непатентный документ 5: Journal of Medicinal Chemistry, 44, 2039 (2001).
Патентный документ 1: WO00/50391.
Патентный документ 2: WO01/70677.
Патентный документ 3: WO02/081433.
Патентный документ 4: WO02/081435.
Патентный документ 5: WO03/18543.
Патентный документ 6: JP-A-1997-95444.
Задачей настоящего изобретения является создание соединений, имеющих структуру, отличную от структуры указанных выше известных соединений, которые обладают ингибирующей активностью, направленной против продукции или секреции β-амилоидного белка, и которые обладают желаемыми свойствами в качестве фармацевтических средств.
Авторы настоящего изобретения провели различные исследования. Как результат, было обнаружено, что гетероциклические метилтиосоединения, гетероциклические метилсульфиновые соединения и гетероциклические метилсульфоновые соединения, представленные описанной ниже формулой (1), обладают отличной ингибирующей активностью против продукции или секреции β-амилоидного белка и поэтому являются полезными в качестве лекарственных средств для лечения различных заболеваний, являющихся результатом аномальной продукции или секреции β-амилоидного белка, что привело к созданию настоящего изобретения.
Таким образом, в настоящем изобретении представлено соединение, представленное формулой (1):
[Химическая формула 1]
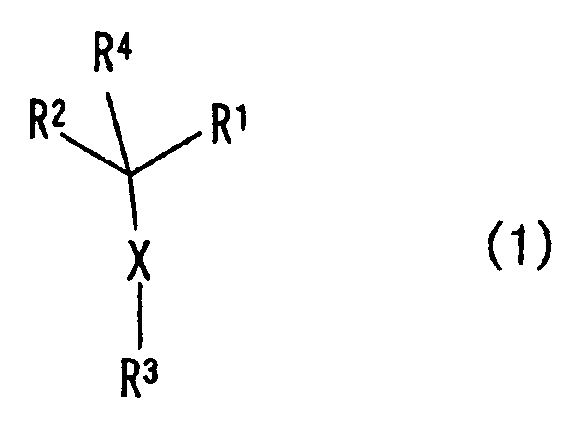
(где R1 и R3, каждый независимо, представляет собой ароматическую углеводородную группу, которая может иметь заместитель, или ароматическую гетероциклическую группу, которая может иметь заместитель, R2 представляет собой насыщенную или ненасыщенную моноциклическую гетероциклическую группу или ненасыщенную полициклическую гетероциклическую группу, которая может иметь заместитель, R4 представляет собой атом водорода или C1-6 алкильную группу и X представляет собой -S-, -SO- или -SO2-); его N-оксид или S-оксид; его соль или его сольват.
Настоящее изобретение также относится к лекарственному средству, содержащему в качестве активного ингредиента соединение, представленное формулой (1); его N-оксид или S-оксид; его соль или его сольват.
Настоящее изобретение также относится к фармацевтической композиции, содержащей соединение, представленное формулой (1), его N-оксид или S-оксид; его соль или его сольват; и фармацевтически приемлемый носитель.
Настоящее изобретение также относится к применению соединения, представленного формулой (1), его N-оксида или S-оксида, его соли или его сольвата для получения лекарственного средства.
Настоящее изобретение также относится к способу лечения заболевания, являющегося результатом аномальной продукции или секреции β-амилоидного белка, включающему введение эффективного количества соединения, представленного формулой (1), его N-оксида или S-оксида, его соли или его сольвата.
Настоящее изобретение позволяет обеспечить соединения, обладающие отличной ингибирующей активностью, направленной против продукции или секреции β-амилоидного белка, и обладающие желаемыми свойствами как лекарственное средство.
Лучший способ осуществления настоящего изобретения
Соединение, представленное формулой (1), описано ниже.
Примеры ароматической углеводородной группы, представленной R1 или R3, включают фенильную и нафтильную группы, из которых фенильная группа является предпочтительной.
Примеры ароматической гетероциклической группы, представленной R1 или R3, включают 5- или 6-членные ароматические гетероциклические группы, содержащие 1-4 атома, выбранных из атомов азота, кислорода и серы. Конкретные примеры включают группы пирролил, фурил, тиенил, пиразолил, имидазолил, триазолил, оксазолил, тиазолил, изоксазолил, изотиазолил, пиридил, пиримидинил, тетразолил, тиадиазолил, пиразинил и пиридазинил.
Из этих групп предпочтительными группами являются тиенил, пиразолил, имидазолил, триазолил, оксазолил, тиазолил, тиадиазолил, пиридил, пиримидинил и пиридазинил; более предпочтительными являются тиенил, пиридил, пиримидинил и пиридазинил и особенно предпочтительными являются тиенил, пиридил и пиримидинил.
Примеры насыщенной моноциклической гетероциклической группы, представленной R2, включают 3-7-членные гетероциклические группы, содержащие 1-4 атома, выбранных из атомов азота, кислорода и серы. Конкретные примеры включают группы пирролидинил, тетрагидрофуранил, оксетанил, тетрагидротиенил, пиперидинил, пиперазинил, гомопиперазинил, морфолинил, тиоморфолинил, азиридинил, имидазолидинил, пиразолидинил, тетрагидропиранил, тетрагидротиопиранил, диоксоланил, оксатиоланил и гексагидропиримидинил.
Из этих групп предпочтительными группами являются пирролидинил, тетрагидрофуранил, тетрагидротиенил, пиперидинил, пиперазинил, гомопиперазинил, морфолинил, тиоморфолинил, имидазолидинил, пиразолидинил, тетрагидропиранил и тетрагидротиопиранил и более предпочтительными являются пиперидинил, тетрагидропиранил, тетрагидротиопиранил и гексагидропиримидинил.
Примеры ненасыщенной моноциклической гетероциклической группы, представленной R2, включают 4-7-членные группы, содержащие 1-4 атома, выбранных из атомов азота, кислорода и серы. Конкретные примеры включают группы пирролил, фурил, тиенил, пиразолил, имидазолил, триазолил, оксазолил, тиазолил, изоксазолил, изотиазолил, триазинил, тетразолил, тиадиазолил, оксадиазолил, пиридил, пиримидинил, пиразинил, пиридазинил, пирролил, имидазолинил, пиразолинил, оксазолинил, тиазолинил, изоксазолинил, изотиазолинил, пиранил, дигидропиридил, тетрагидропиридил, дигидропиримидинил, тетрагидропиридазинил и тетрагидропиримидинил.
Из этих групп предпочтительными группами являются пирролил, фурил, тиенил, пиразолил, имидазолил, триазолил, оксазолил, тиазолил, изоксазолил, изотиазолил, пиридил, пиримидинил, пиразинил, триазинил, тетразолил, пирролинил, имидазолинил, пиразолинил, тиадиазолил, пиразинил, пиридазинил, тетрагидропиридил, дигидропиримидинил и тетрагидропиридазинил и более предпочтительными являются имидазолил, пиридил, пиримидинил и тиазолил.
Примеры ненасыщенной полициклической гетероциклической группы, представленной R2, включают 8-10-членные группы, содержащие 1-4 атома, выбранных из атомов азота, кислорода и серы. Конкретные примеры включают группы бензофуранил, бензотиазолил, индолил, хинолил, изохинолил, бензопиранил, бензоксазолил, бензотиазолил, бензимидазолил, бензодиоксанил, бензотиофенил, бензизотиазолил, бензизоксазолил, хроменил, хроманил, изохроменил, изохроманил, индолинил, индазолил, индолизинил, изоиндолил, изоиндолинил, хинолизинил, хиноксалинил, хиназолинил, циннолинил, фталазинил, нафтиридинил, пуринил, тетрагидротиазолопиридил, имидозопиридил, триазолопиридил, пирролопиридил, карбазолил, ксантенил, акридинил, феназинил, феноксазинил, фенотиазинил и хинуклидинил.
Из этих групп предпочтительными группами являются бензофуранил, бензотиазолил, индолил, хинолил, изохинолил, бензопиранил, бензоксазолил, бензотиазолил, бензимидазолил, бензодиоксанил, бензотиофенил, бензизотиазолил, бензизоксазолил, хроменил, хроманил, изохроменил, изохроманил, индолинил, индазолил, индолизинил, хинолизинил, хиноксалинил, хиназолинил, циннолинил, фталазинил, нафтиридинил, имидозопиридил и триазолопиридил; и более предпочтительными являются бензимидазолил, хроменил, имидозопиридил и триазолопиридил.
Ароматическая углеводородная группа или ароматическая гетероциклическая группа, представленная R1 или R3, может быть замещена 1-3 заместителями, которые являются одинаковыми или отличными друг от друга и выбраны из атомов галогенов, C1-6 алкильных групп, тригалогенметильных групп, C1-6 алкоксигрупп, C2-6 алкенильных групп, формильной группы, C2-6 алканоильных групп, карбоксильной группы, карбоксиамино C1-6 алкильных групп, C1-6 алкоксикарбониламино C1-6 алкильных групп, оксогруппы, нитрогруппы, цианогруппы, амидиногруппы, C2-6 алкенилоксигрупп, гидроксигруппы, тиоксогруппы, аминогруппы, C1-6 алкиламиногрупп, ди(C1-6 алкил)аминогрупп, C1-6 алкоксикарбонильных групп, карбамоильной группы, C1-6 алкилкарбамоильных групп, ди(C1-6 алкил)карбамоильных групп, тиокарбамоильной группы, C1-6 алкилтиокарбамоильных групп, ди(C1-6 алкил)тиокарбамоильных групп, меркаптогруппы, C1-6 алкилтиогрупп, C1-6 алкилсульфинильных групп, C1-6 алкилсульфонильных групп и C6-10 ароматический углеводород-C1-6 алкильных групп.
В качестве заместителя для ароматической углеводородной группы или ароматической гетероциклической группы, представленной R1 или R3, предпочтительными являются атомы галогенов, C1-6 алкильные группы, тригалогенметильные группы, C1-6 алкоксигруппы, цианогруппа, амидиногруппа, гидроксигруппа, C1-6 алкиламиногруппы, ди(C1-6 алкил)аминогруппы, карбамоильная группа, C1-6 алкилкарбамоильные группы и ди(C1-6 алкил)карбамоильные группы; более предпочтительными являются атомы галогенов, C1-6 алкильные группы, тригалогенметильные группы, C1-6 алкоксигруппы и цианогруппа и особенно предпочтительными являются атомы галогенов и цианогруппа. Из атомов галогенов атомы хлора и фтора являются наиболее предпочтительными.
Примеры заместителя для насыщенной или ненасыщенной моноциклической гетероциклической группы или ненасыщенной полициклической гетероциклической группы, представленной R2, включают группу -Q101-Q102-Q103-Q104-Q105-Q106-Q107 (где Q101 представляет собой простую связь, C1-6 алкиленовую группу, C2-6 алкениленовую группу или гетероциклическую группу; Q102 представляет собой простую связь, -O-, -NH-, -CH=N-, -C(алкил)=N-, -N (алкил)- или -S-; Q103 представляет собой простую связь, -CO-, -CS-, -SO-, -SO2- или -CONH-; Q104 представляет собой простую связь, C1-6 алкиленовую группу, C2-6 алкениленовую группу, C3-8 циклоалкиленовую группу, C4-7 циклоалкениленовую группу, ароматическую углеводородную группу или гетероциклическую группу; Q105 представляет собой простую связь, -NH- или -N(алкил)-; Q106 представляет собой простую связь, -O-, -CO-, -CS-, -SO2-, -SO- или -S- и Q107 представляет собой атом водорода, атом галогена, гидроксигруппу, оксогруппу, C1-6 алкильную группу, C2-6 алкенильную группу, C3-7 циклоалкильную группу, C1-6 алкоксигруппу, C2-6 алкенилоксигруппу, группу азида, цианогруппу, аминогруппу, C1-6 алкиламиногруппу, ди(C1-6 алкил)аминогруппу, C2-6 алканоиламиногруппу, ди(C2-6 алканоил)аминогруппу, карбоксиаминогруппу, C1-6 алкоксикарбониламиногруппу, ди(C1-6 алкоксикарбонил)аминогруппу, гетероциклическую группу, ароматическую углеводородную группу, C4-7 циклоалкенильную группу, гетероцикл-оксигруппу или ароматический углеводород-оксигруппу, где C1-6 алкиленовая или алкильная группа, C2-6 алкениленовая или алкенильная группа, C3-7 циклоалкиленовая или C3-7 циклоалкильная группа, C4-7 циклоалкениленовая или C4-7 циклоалкенильная группа, гетероциклическая группа, гетероцикл-оксигруппа, ароматическая углеводородная группа или ароматический углеводород-оксигруппа могут быть замещены 1-3 заместителями, выбранными из атомов галогенов, C1-6 алкильных групп, C1-6 алкоксигрупп, C2-6 алкенильных групп, карбоксиамино C1-6 алкильных групп, C1-6 алкоксикарбониламино C1-6 алкильных групп, формильной группы, C2-6 алканоильных групп, оксогруппы, нитрогруппы, цианогруппы, группы азида, амидиногруппы, C2-6 алкенилоксигрупп, гидроксигруппы, карбоксильной группы, C7-16 аралкильных групп, тиоксогруппы, C2-6 алканоильных групп, C2-6 тиоалканоильных групп, тиоформильной группы, аминогруппы, C1-6 алкиламиногрупп, ди(C1-6 алкил)аминогрупп, C1-6 алкоксикарбонильных групп, карбамоильной группы, C1-6 алкилкарбамоильных групп, ди(C1-6 алкил)карбамоильных групп, тиокарбамоильной группы, C1-6 алкилтиокарбамоильных групп, ди(C1-6 алкил)тиокарбамоильных групп, C1-6 алкоксикарбамоиламиногрупп, C1-6 алкоксикарбамоил (C1-6 алкил)аминогрупп, C2-6 алканоиламиногрупп, C2-6 алканоил (C1-6 алкил)аминогрупп, тио C2-6 алканоиламиногрупп, тио C2-6 алканоил (C1-6 алкил)аминогрупп, формиламиногруппы, формил (C1-6 алкил)аминогрупп, тиоформиламиногруппы, тиоформил (C1-6 алкил)аминогрупп, C2-6 алканоилоксигрупп, формилоксигруппы, C1-6 алкоксикарбонилоксигрупп, карбамоилоксигруппы, C1-6 алкилкарбамоилоксигрупп, ди(C1-6 алкил)карбамоилоксигрупп, аминокарбониламиногруппы, C1-6 алкиламинокарбониламиногрупп, ди(C1-6 алкил)аминокарбониламиногрупп, аминокарбонил (C1-6 алкил)аминогрупп, C1-6 алкиламинокарбонил (C1-6 алкил)аминогрупп, ди(C1-6 алкил)аминокарбонил (C1-6 алкил)аминогрупп, меркаптогруппы, C1-6 алкилтиогрупп, C1-6 алкилсульфинильных групп, C1-6 алкилсульфонильных групп, аминосульфонильной группы, C1-6 алкиламиносульфонильных групп, ди(C1-6 алкил)аминосульфонильных групп, аминосульфониламиногруппы, C1-6 алкиламиносульфониламиногрупп, ди(C1-6 алкил)аминосульфониламиногрупп, аминосульфонил (C1-6 алкил)аминогрупп, C1-6 алкиламиносульфонил (C1-6 алкил)аминогрупп и ди(C1-6 алкил)аминосульфонил (C1-6 алкил)аминогрупп.
Заместители для гетероциклической группы, представленной R2, более конкретно описаны ниже.
Гетероциклическая группа, представленная R2, может быть замещена 1-3 заместителями, выбранными из атомов галогенов, цианогруппы, C1-6 алкильных групп, гидроксигруппы, C1-6 алкоксигрупп, C2-6 алкенилоксигрупп, карбокси C1-6 алкильных групп, C1-6 алкоксикарбонил C1-6 алкильных групп, гетероцикл-карбонил C1-6 алкильных групп, гидрокси C1-6 алкильных групп, C6-10 ароматический углеводород-сульфонил C1-6 алкильных групп, N,N-диалкиламиносульфонил C1-6 алкильных групп, гетероцикл-C1-6 алкильных групп, C6-10 ароматический углеводород-C1-6 алкильных групп, C6-10 ароматический углеводород-тио C1-6 алкильных групп, азидо-C1-6 алкильных групп, амино C1-6 алкильных групп, C1-6 алкиламино C1-6 алкильных групп, ди(C1-6 алкил)амино C1-6 алкильных групп, гидрокси C1-6 алкиламино C1-6 алкильных групп, C1-6 алкокси C1-6 алкиламиноC1-6 алкильных групп, ди(C1-6 алкоксиC1-6 алкил)амино C1-6 алкильных групп, N-гидрокси C1-6 алкил-N-C1-6 алкокси C1-6 алкиламино C1-6 алкильных групп, C2-6 алканоиламино C1-6 алкильных групп, ди(C2-6 алканоил)амино C1-6 алкильных групп, карбоксиамино C1-6 алкильных групп, ди(C1-6 алкилкарбониламино C1-6 алкил)амино C1-6 алкильных групп, C1-6 алкоксикарбониламино C1-6 алкильных групп, ди(C1-6 алкоксикарбонил)амино C1-6 алкильных групп, карбамоиламино C1-6 алкильных групп, N-C1-6 алкилкарбамоиламино C1-6 алкильных групп, (N,N-ди(C1-6 алкил)карбамоил)амино C1-6 алкильных групп, аминосульфониламино C1-6 алкильных групп, N-C1-6 алкилсульфониламино C1-6 алкильных групп, (ди(C1-6 алкил)аминосульфонил)амино C1-6 алкильных групп, C6-10 ароматический углеводород-сульфониламино-C2-6 алканоиламино C1-6 алкильных групп, амино C1-6 алкилкарбониламино C1-6 алкильных групп, N-C1-6 алкиламино C1-6 алкилкарбониламино C1-6 алкильных групп, N,N-ди(C1-6 алкил)амино C1-6 алкилкарбониламино C1-6 алкильных групп, гетероцикл-C1-6 алкилкарбониламино C1-6 алкильных групп, гетероцикл-C2-6 алкенилкарбониламино C1-6 алкильных групп, C6-10 ароматический углеводород-C2-6 алкенилкарбониламино C1-6 алкильных групп, C6-10 ароматический углеводород-карбониламино C1-6 алкильных групп, C6-10 ароматический углеводород-тиокарбониламино C1-6 алкильных групп, гетероцикл-карбониламино C1-6 алкильных групп, C1-6 алкоксиоксалиламино C1-6 алкильных групп, N-(C6-10 ароматический углеводород-сульфонил)-N-C1-6 алкиламино C1-6 алкильных групп, C1-6 алкилсульфониламино C1-6 алкиламиногрупп, карбамоилокси C1-6 алкильных групп, N-C1-6 алкилкарбамоилокси C1-6 алкильных групп, N,N-ди(C1-6 алкил)карбамоилокси C1-6 алкильных групп, C6-10 ароматический углеводород-C1-6 алкилкарбамоилокси C1-6 алкильных групп, C1-6 алкоксикарбонилокси-C1-6 алкильных групп, C6-10 ароматический углеводород оксикарбонилокси C1-6 алкильных групп, гетероциклических карбонилгидразонометильных групп, C6-10 ароматический углеводород карбонилгидразонометильных групп, C2-6 алкенильных групп, карбокси-C2-6 алкенильных групп, C1-6 алкоксикарбонил-C2-6 алкенильных групп, карбамоил C2-6 алкенильных групп, гетероцикл-C2-6 алкенильных групп, формильной группы, карбоксильной группы, гетероцикл-карбонильных групп, C6-10 ароматический углеводород-карбонильных групп, C1-6 алкоксикарбонильных групп, карбамоильной группы, N-C1-6 алкилкарбамоильных групп, N,N-ди(C1-6 алкил)карбамоильных групп, (C3-7 циклоалкил-C1-6 алкил)карбамоильных групп, C1-6 алкилтио C1-6 алкилкарбамоильных групп, C1-6 алкилсульфинил C1-6 алкилкарбамоильных групп, C1-6 алкилсульфонил C1-6 алкилкарбамоильных групп, гидроксиаминокарбонильной группы, C1-6 алкоксикарбамоильных групп, гидрокси C1-6 алкилкарбамоильных групп, C1-6 алкокси C1-6 алкилкарбамоильных групп, амино C1-6 алкилкарбамоильных групп, амино C1-6 алкилтиокарбамоильных групп, гидрокси C1-6 алкилкарбамоильных групп, C1-6 алкоксикарбонил C1-6 алкилкарбамоильных групп, (C1-6 алкоксикарбониламино)C1-6 алкилкарбамоильных групп, (C1-6 алкоксикарбониламино)C1-6 алкилтиокарбамоильных групп, гетероцикл-карбамоильных групп, гетероцикл-C1-6 алкилкарбамоильных групп, C6-10 ароматический углеводород-карбамоильных групп, гидразинокарбонильных групп, N-C1-6 алкилгидразинокарбонильных групп, N'-C1-6 алкилгидразинокарбонильных групп, N',N'-ди(C1-6 алкил)гидразинокарбонильных групп, N,N'-ди(C1-6 алкил)гидразинокарбонильных групп, N,N',N'-три(C1-6 алкил)гидразинокарбонильных групп, N'-(гетероциклкарбонил)гидразинокарбонильных групп, аминогруппы, C1-6 алкокси C1-6 алкиламиногрупп, амино C1-6 алкиламиногрупп, (C1-6 алкиламино C1-6 алкил)аминогрупп, N-C1-6 алкиламино C1-6 алкил-N-C1-6 алкиламиногрупп, (C1-6 алкоксикарбониламино C1-6 алкил)аминогрупп, (ди(C1-6 алкил)амино C1-6 алкил)аминогрупп, гетероцикл-амино C1-6 алкиламиногрупп, карбоксил C1-6 алкиламиногрупп, N-карбоксил C1-6 алкил-N-C1-6 алкиламиногрупп, гетероцикл-C1-6 алкиламиногрупп, N-(гетероцикл-C1-6 алкил)-N-C1-6 алкиламиногрупп, гидроксиC1-6 алкиламиногрупп, N-гидрокси C1-6 алкил-N-C1-6 алкиламиногрупп, (C1-6 алкилтио C1-6 алкил)аминогрупп, (C1-6 алкилкарбамоилокси C1-6 алкил)аминогрупп, N-C1-6 алкиламинокарбонилокси C1-6 алкил-N-C1-6 алкиламиногрупп, C1-6 алкилсульфинил C1-6 алкиламиногрупп, C1-6 алкилсульфонил C1-6 алкиламиногрупп, групп, представленных формулой: -N(R12)SO2R11 (где R11 представляет собой C1-6 алкильную группу, гетероциклическую группу, C1-6 алкил-гетероциклическую группу, гетероцикл-C1-6 алкильную группу, гидрокси C1-6 алкильную группу, амино C1-6 алкильную группу, C1-6 алкиламино C1-6 алкильную группу, ди(C1-6 алкил)амино C1-6 алкильную группу, карбокси C1-6 алкильную группу, карбамоил C1-6 алкильную группу, трифторметильную группу, дифторметильную группу, фторметильную группу, аминогруппу, C1-6 алкиламиногруппу или ди(C1-6 алкил)аминогруппу и R12 представляет собой атом водорода, C1-6 алкильную группу, гидроксигруппу или аминогруппу), гидрокси C1-6 алкокси C1-6 алкиламиногрупп, C6-10 ароматический углеводород-C1-6 алкиламиногрупп, гетероцикл-карбониламиногрупп, C1-6 алкоксикарбониламиногрупп, гетероцикл-C1-6 алкилкарбониламиногрупп, C6-10 ароматический углеводород-карбониламиногрупп, гетероцикл-аминогрупп, гидроксииминогруппы, C1-6 алкоксииминогрупп, оксогруппы, гидроксиимино C1-6 алкильных групп, C1-6 алкоксикарбонил C1-6 алкиламиногрупп, (C2-6 алканоиламино C1-6 алкил)аминогрупп, C6-10 ароматических углеводородных групп и гетероциклических групп (где C6-10 ароматическая углеводородная группа, или гетероцикл, или гетероциклическая группа может быть замещена 1-3 заместителями, выбранными из атомов галогенов, C1-6 алкильных групп, C1-6 алкоксигрупп, C2-6 алкенильных групп, формильной группы, C2-6 алканоильных групп, карбоксильной группы, карбоксиамино C1-6 алкильных групп, C1-6 алкоксикарбониламино C1-6 алкильных групп, оксогруппы, нитрогруппы, цианогруппы, амидиногруппы, C2-6 алкенилоксигрупп, гидроксигруппы, тиоксогруппы, аминогруппы, C1-6 алкиламиногрупп, ди(C1-6 алкил)аминогрупп, амино C1-6 алкильных групп, C1-6 алкоксикарбонильных групп, карбамоильной группы, C1-6 алкилкарбамоильных групп, ди(C1-6 алкил)карбамоильных групп, тиокарбамоильной группы, C1-6 алкилтиокарбамоильных групп, ди(C1-6 алкил)тиокарбамоильных групп, C2-6 алканоиламиногрупп, C2-6 алканоил (C1-6 алкил)аминогрупп, тио C2-6 алканоиламиногрупп, тио C2-6 алканоил (C1-6 алкил)аминогрупп, формиламиногруппы, формил (C1-6 алкил)аминогрупп, тиоформиламиногруппы, тиоформил (C1-6 алкил)аминогрупп, C2-6 алканоилоксигрупп, формилоксигруппы, меркаптогруппы, C1-6 алкилтиогрупп, C1-6 алкилсульфинильных групп, C1-6 алкилсульфонильных групп, аминосульфонильных групп, C1-6 алкиламиносульфонильных групп, ди(C1-6 алкил)аминосульфонильных групп, C1-6 алкилсульфониламиногрупп, C1-6 алкилсульфонил (C1-6 алкил)аминогрупп и гидрокси C1-6 алкильных групп).
Гетероциклическая группа, представленная R2, предпочтительно замещена 1-3, более предпочтительно 2 заместителями, выбранными из атомов галогенов, цианогруппы, C1-6 алкильных групп, гидроксигруппы, C1-6 алкоксигрупп, C2-6 алкенилоксигрупп, карбокси C1-6 алкильных групп, C1-6 алкоксикарбонил C1-6 алкильных групп, гидрокси C1-6 алкильных групп, C6-10 ароматический углеводород-сульфонил C1-6 алкильных групп, гетероцикл-C1-6 алкильных групп, C6-10 ароматический углеводород-C1-6 алкильных групп, C6-10 ароматический углеводород-тио C1-6 алкильных групп, азидо-C1-6 алкильных групп, амино C1-6 алкильных групп, ди(C1-6 алкил)амино C1-6 алкильных групп, ди(C1-6 алкокси C1-6 алкил)амино C1-6 алкильных групп, C2-6 алканоиламино C1-6 алкильных групп, ди(C2-6 алканоил)амино C1-6 алкильных групп, C1-6 алкоксикарбониламино C1-6 алкильных групп, ди(C1-6 алкоксикарбонил)амино C1-6 алкильных групп, (N,N-ди(C1-6 алкил)карбамоил)амино C1-6 алкильных групп, N-C1-6 алкилсульфониламино C1-6 алкильных групп, (ди(C1-6 алкил)аминосульфонил)амино C1-6 алкильных групп, C6-10 ароматический углеводород-сульфониламино-C2-6 алканоиламино C1-6 алкильных групп, N,N-ди(C1-6 алкил)аминоC1-6 алкилкарбониламино C1-6 алкильных групп, гетероцикл-C1-6 алкилкарбониламино C1-6 алкильных групп, гетероцикл-C2-6 алкенилкарбониламино C1-6 алкильных групп, C6-10 ароматический углеводород-карбониламино C1-6 алкильных групп, C6-10 ароматический углеводород-тиокарбониламино C1-6 алкильных групп, гетероцикл-карбониламино C1-6 алкильных групп, C1-6 алкоксиоксалиламино C1-6 алкильных групп, N-(C6-10 ароматический углеводород-сульфонил)-N-C1-6 алкиламино C1-6 алкильных групп, C1-6 алкилсульфониламино C1-6 алкиламиногрупп, N,N-ди(C1-6 алкил)карбамоилокси C1-6 алкильных групп, C6-10 ароматический углеводород-C1-6 алкилкарбамоилокси C1-6 алкильных групп, C1-6 алкоксикарбонилокси-C1-6 алкильных групп, C6-10 ароматический углеводород-оксикарбонилокси C1-6 алкильных групп, карбокси-C2-6 алкенильных групп, C1-6 алкоксикарбонил-C2-6 алкенильных групп, карбамоил C2-6 алкенильных групп, гетероцикл-C2-6 алкенильных групп, формильной группы, карбоксильной группы, гетероцикл-карбонильных групп, C1-6 алкоксикарбонильных групп, карбамоильной группы, N,N-ди(C1-6 алкил)карбамоильных групп, (C3-7 циклоалкил-C1-6 алкил)карбамоильных групп, C1-6 алкилтио C1-6 алкилкарбамоильных групп, C1-6 алкилсульфинил C1-6 алкилкарбамоильных групп, C1-6 алкилсульфонил C1-6 алкилкарбамоильных групп, C1-6 алкоксикарбамоильных групп, амино C1-6 алкилкарбамоильных групп, амино C1-6 алкилтиокарбамоильных групп, гидрокси C1-6 алкилкарбамоильных групп, C1-6 алкоксикарбонил C1-6 алкилкарбамоильных групп, (C1-6 алкоксикарбониламино)C1-6 алкилкарбамоильных групп, (C1-6 алкоксикарбониламино)C1-6 алкилтиокарбамоильных групп, гетероциклкарбамоильных групп, гетероцикл-C1-6 алкилкарбамоильных групп, N',N'-ди(C1-6 алкил)гидразинокарбонильных групп, N'-(гетероцикл-карбонил)-гидразинокарбонильных групп, аминогруппы, C1-6 алкокси C1-6 алкиламиногрупп, амино C1-6 алкиламиногрупп, C1-6 алкиламино C1-6 алкиламиногрупп, (C1-6 алкиламино C1-6 алкил) (C1-6 алкил)аминогрупп, C1-6 алкоксикарбониламино C1-6 алкиламиногрупп, ди(C1-6 алкил)амино C1-6 алкиламиногрупп, гетероцикламино C1-6 алкиламиногрупп, карбоксил C1-6 алкиламиногрупп, (карбоксил C1-6 алкил) (C1-6 алкил)аминогрупп, гетероцикл-C1-6 алкиламиногрупп (гетероцикл-C1-6 алкил) (C1-6 алкил)аминогрупп, гидрокси C1-6 алкиламиногрупп, (гидрокси C1-6 алкил) (C1-6 алкил)аминогрупп, C1-6 алкилтио C1-6 алкиламиногрупп, C1-6 алкиламинокарбонилокси C1-6 алкиламиногрупп, (C1-6 алкиламинокарбонилокси C1-6 алкил) (C1-6 алкил)аминогрупп, C1-6 алкилсульфинил C1-6 алкиламиногрупп, C1-6 алкилсульфонил C1-6 алкиламиногрупп, групп, представленных формулой: -N(R12)SO2R11 (где R11 представляет собой C1-6 алкильную группу, гетероциклическую группу, C1-6 алкил-гетероциклическую группу, гетероцикл-C1-6 алкильную группу, гидрокси C1-6 алкильную группу, амино C1-6 алкильную группу, C1-6 алкиламино C1-6 алкильную группу, ди(C1-6 алкил)амино C1-6 алкильную группу, карбокси C1-6 алкильную группу, карбамоил C1-6 алкильную группу, трифторметильную группу, дифторметильную группу, фторметильную группу, аминогруппу, C1-6 алкиламиногруппу или ди(C1-6 алкил)аминогруппу и R12 представляет собой атом водорода, C1-6 алкильную группу, гидроксигруппу или аминогруппу), гидрокси C1-6 алкокси C1-6 алкиламиногрупп, C6-10 ароматический углеводород-C1-6 алкиламиногрупп, гетероцикл-карбониламиногрупп, C1-6 алкоксикарбониламиногрупп, гетероцикл-алкилкарбониламиногрупп, C6-10 ароматический углеводород-карбониламиногрупп, оксогруппы, гидроксиимино C1-6 алкильных групп, C1-6 алкоксикарбонил C1-6 алкиламиногрупп, (C2-6 алканоиламино C1-6 алкил)аминогрупп, C6-10 ароматических углеводородных групп и гетероциклических групп (где C6-10 ароматическая углеводородная группа или гетероциклическая группа может быть замещена 1-3 заместителями, выбранными из атомов галогенов, C1-6 алкильных групп, C1-6 алкоксигрупп, C2-6 алканоильных групп, оксогруппы, нитрогруппы, цианогруппы, гидроксигруппы, амино C1-6 алкильных групп, C1-6 алкоксикарбонильных групп, формиламиногруппы и гидрокси C1-6 алкильных групп).
В качестве R2 более предпочтительна группа, представленная формулой:
[Химическая формула 2]
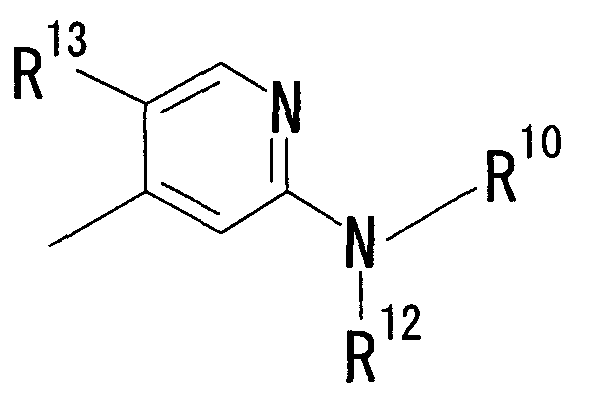
(где R10 представляет собой атом водорода, C1-6 алкильную группу, гидрокси C1-6 алкильную группу, C1-6 алкилсульфинил C1-6 алкильную группу, C1-6 алкилсульфонил C1-6 алкильную группу, карбокси C1-6 алкильную группу, гетероцикл-C1-6 алкильную группу или группу, представленную формулой: -SO2-R11 (где R11 представляет собой C1-6 алкильную группу, гетероциклическую группу, C1-6 алкил-гетероциклическую группу, группу гетероцикл-C1-6 алкил, гидрокси C1-6 алкил, амино C1-6 алкил, C1-6 алкиламино C1-6 алкил, ди(C1-6 алкил)амино C1-6 алкил, карбокси C1-6 алкил, карбамоил C1-6 алкил, трифторметил, дифторметил, фторметил, амино, C1-6 алкиламино или ди(C1-6 алкил)амино), R12 представляет собой атом водорода, C1-6 алкильную группу, гидроксигруппу или аминогруппу, или R11 и R12, взятые вместе с атомом серы, с которым связан R11, и с атомом азота, с которым связан R12, могут образовывать 5- или 6-членный алифатический гетероцикл, и R13 представляет собой C1-6 алкильную группу, атом галогена или цианогруппу).
В качестве R2 также предпочтительна группа, представленная формулой:
[Химическая формула 3]
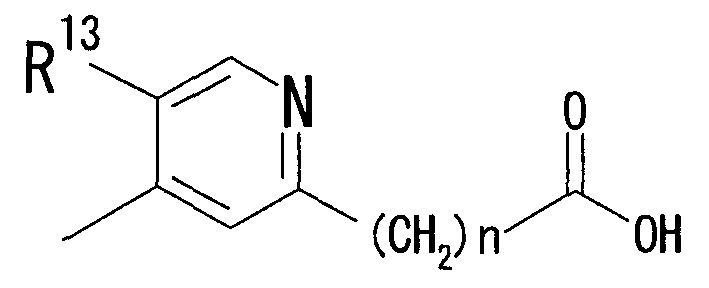
(где R13 представляет собой C1-6 алкильную группу, атом галогена или цианогруппу и n представляет собой целое число, имеющее значение от 0 до 6).
В качестве R4 особенно предпочтительным является атом водорода. В качестве X предпочтительными являются -SO2- и -SO- с точки зрения их фармакологического эффекта, из которых -SO2- является особенно предпочтительным с точки зрения его фармакологического эффекта.
Конкретные заместители для ароматической углеводородной группы или ароматической гетероциклической группы, представленной R1 или R3, и заместители для насыщенной или ненасыщенной моноциклической гетероциклической группы или ненасыщенной полициклической гетероциклической группы, представленной R2, описаны ниже.
Термин "гетероцикл" означает цикл, содержащий 1-4 гетероатома (N, O, S и т.д.) в качестве компонента его циклической структуры, и может представлять собой любой из насыщенного, ненасыщенного или ароматического цикла или может представлять собой либо моноцикл, либо полицикл. Полициклический гетероцикл охватывает гетероциклические спиросоединения и гетероциклические соединения, имеющие поперечносвязанную циклическую структуру. Термин "гетероцикл" в определении "гетероцикл-C1-6 алкильная группа" и т.п. означает гетероциклическую группу, выбранную из описанного выше гетероцикла. Термин "гетероциклическая группа" означает моновалентную группу, выбранную из "гетероцикла".
Примеры насыщенной моноциклической гетероциклической группы включают 3-7-членные группы, содержащие 1-4 атома, выбранных из атомов азота, кислорода и серы. Конкретные примеры включают группы пирролидинил, тетрагидрофуранил, оксетанил, тетрагидротиенил, пиперидинил, пиперазинил, гомопиперазинил, морфолинил, тиоморфолинил, оксиранил, тиоланил, диоксанил, азиридинил, имидазолидинил, пиразолидинил, тетрагидропиранил, тетрагидротиопиранил, оксазолидинил, тиазолидинил, изоксазолидинил, изотиазолидинил, диоксоланил, оксатиоланил и гексагидропиримидинил.
Примеры ненасыщенной или ароматической моноциклической гетероциклической группы включают 4-7-членные группы, содержащие 1-4 атома, выбранных из атомов азота, кислорода и серы. Конкретные примеры включают пирролил, фурил, тиенил, пиразолил, имидазолил, триазолил, оксазолил, тиазолил, изоксазолил, изотиазолил, триазинил, тетразолил, тиадиазолил, оксадиазолил, пиридил, пиримидинил, пиразинил пиридазинил, пирролидинил, имидазолидинил, пиразолидинил, оксазолидинил, тиазолидинил, изоксазолидинил, изотиазолидинил, пиранил, дигидропиридил, тетрагидропиридил, дигидропиридазинил, дигидропиримидинил, тетрагидропиридазинил и тетрагидропиримидинил.
Примеры полициклической гетероциклической группы включают 8-14-членные группы, содержащие 1-4 атома, выбранных из атомов азота, кислорода и серы. Конкретные примеры включают группы бензофуранил, бензотиазолил, индолил, хинолил, изохинолил, бензопиранил, бензоксазолил, бензотиазолил, бензимидазолил, бензодиоксанил, бензотиофенил, бензизотиазолил, бензизоксазолил, хроменил, хроманил, изохроменил, изохроманил, индолинил, индазолил, индолизинил, изоиндолил, изоиндолинил, хинолизинил, хиноксалинил, хиназолинил, циннолинил, фталазинил, нафтиридинил, пуринил, тетрагидротиазолопиридил, имидазопиридил, пирролопиридил, карбазолил, ксантенил, акридинил, феназинил, феноксазинил, фенотиазинил и хинуклидинил.
Термин "атомы галогенов" означает атомы хлора, фтора, брома и иода, из которых атомы хлора и фтора являются предпочтительными.
Термин "C1-6 алкильная группа" означает линейную или разветвленную C1-6 алкильную группу. Конкретные примеры такой алкильной группы включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, 2-метилпентил и н-гексил.
Термин "C1-6 алкиленовая группа" означает линейную или разветвленную C1-6 алкиленовую группу. Конкретные примеры такой алкиленовой группы включают метилен, этилен, пропилен, триметилен, тетраметилен, пентаметилен и гексаметилен.
Термин "C2-6 алкенильная группа" означает линейную или разветвленную C2-6 алкенильную группу. Конкретные примеры такой алкенильной группы включают винил, аллил, пропенил, бутенил и пентенил.
Термин "C2-6 алкениленовая группа" означает линейную или разветвленную C2-6 алкениленовую группу. Конкретные примеры такой алкениленовой группы включают винилен, пропенилен, бутенин и пентенилен.
Примеры "C3-7 циклоалкильной группы" включают C3-7 циклоалкильные группы, такие как циклопропил, циклобутил, циклопентил, циклогексил и циклогептил.
Примеры C4-7 циклоалкенильной группы включают C4-7 циклоалкенильные группы, такие как циклопентенил и циклогексенил.
Примеры сочетания циклоалкильной группы и алкильной группы включают циклоалкилалкильные группы, из которых C3-7 циклоалкил-C1-6 алкильные групп являются особенно предпочтительными.
Термин "C1-7 алкоксигруппа" означает алкоксигруппу, содержащую описанную выше алкильную или циклоалкильную группу. Примеры включают метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, пентокси, циклопентилокси, циклогексилокси и циклогептилокси.
Термин "C2-6 алканоильная группа" означает линейную или разветвленную C2-6 алканоильную группу, и примеры включают ацетил, пропионил, бутирил, валерил и гексаноил.
В качестве R1 особенно предпочтительными являются 2,5-дифторфенильная или 2-фтор-5-цианофенильная группа. В качестве R3 особенно предпочтительными являются 4-хлорфенильная, 4-фторфенильная, 2,4-дифторфенильная, 3,4-дифторфенильная, 3-фтор-4-хлорфенильная, 4-трифторметилфенильная, 5-хлор-2-тиенильная, 5-хлор-2-пиридильная, 6-хлор-3-пиридильная и 6-трифторметил-3-пиридильная группы.
Соединения по настоящему изобретению, представленные формулой (1), могут иметь стереоизомер или энантиомер, образованные из асимметрического углеводорода. Настоящим изобретением охватываются все стереоизомеры и энантиомеры и их смеси. S-оксид соединения по настоящему изобретению существует, когда гетероциклическая группа содержит атом серы. S-оксид охватывает как моноксид, так и диоксид.
Нет никаких конкретных ограничений, касающихся соли соединения по настоящему изобретению, представленного формулой (1), при условии, что она должна быть фармацевтически приемлемой солью. Конкретные примеры соли включают соли минеральных кислот, такие как гидрохлорид, гидробромид, гидроиодид, фосфат, нитрат и сульфат, органические сульфонаты, такие как метансульфонат, 2-гидроксиэтансульфонат и п-толуолсульфонат, и органические карбоксилаты, такие как бензоат, ацетат, пропаноат, оксалат, малонат, сукцинат, глутарат, адипат, тартрат, малеат, малат и манделат.
Когда соединение, представленное формулой (1), содержит кислотную группу, такое соединение может образовывать соль с ионом щелочного металла или ионом щелочноземельного металла. Нет никаких конкретных ограничений, касающихся сольвата, при условии, что он должен быть фармацевтически приемлемым. Конкретные примеры включают гидраты и этанольные сольваты.
Способы получения соединений по настоящему изобретению, представленных формулой (1), описаны ниже.
Соединения по настоящему изобретению, представленные формулой (1), или их соли, или их сольваты можно получить с использованием широко известных химических способов получения, в их сочетании. Типичные способы синтеза описаны ниже.
Типичные способы получения сульфидного (1a), сульфинильного (1b) и сульфонильного (1c) соединения по настоящему изобретению, представленного формулой (1), описаны ниже.
1) Способ получения сульфида (1a)
Сульфидное соединение (1a) по настоящему изобретению получают, как описано ниже.
[Химическая формула 4]
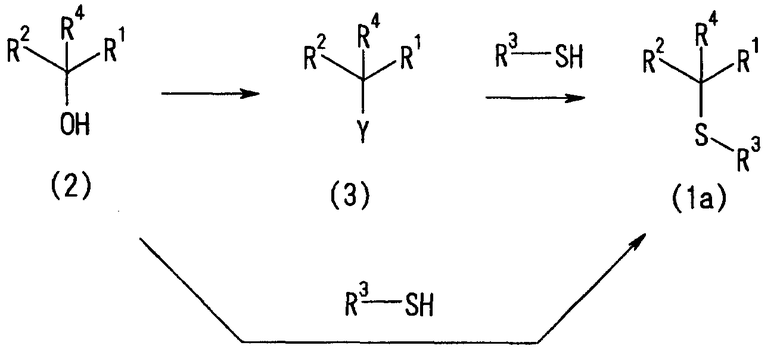
(где Y представляет собой удаляемую группу и R1-R4 определены выше).
Сульфидное производное (1a) по настоящему изобретению можно получить преобразованием спиртового производного (2) в соединение (3) с последующим взаимодействием соединения (3) с тиолом (R3-SH) в присутствии основания. В этом случае соединение тиола можно использовать в виде соли щелочного металла или щелочноземельного металла (например, соли лития, соли натрия или соли калия).
Температура реакции соединения (3) и тиола (R3-SH) обычно находится в пределах от -20 до 200°C, предпочтительно от комнатной температуры до 100°C. Иногда может быть предпочтительной температура реакции выше указанных пределов, в зависимости от соединения (3) или соединения тиола (R3-SH). Иногда предпочтительно осуществление реакции в герметично закрытой пробирке. Время реакции обычно составляет от 0,5 часа до одного дня.
Примерами основания являются гидриды щелочных металлов или щелочноземельных металлов (такие как гидрид лития, гидрид натрия, гидрид калия и гидрид кальция); амиды щелочных металлов или щелочноземельных металлов (такие как амид лития, амид натрия, диизопропиламид лития, дициклогексиламид лития, гексаметилдисилазид лития, гексаметилдисилазид натрия и гексаметилдисилазид калия); низшие алкоксиды щелочных металлов или щелочноземельных металлов (такие как метоксид натрия, этоксид натрия и трет-бутоксид калия); гидроксиды щелочных металлов, щелочноземельных металлов или серебра (такие как гидроксид серебра, гидроксид натрия, гидроксид калия, гидроксид лития и гидроксид бария); карбонаты щелочных металлов, щелочноземельных металлов или серебра (карбонат натрия, карбонат калия, карбонат цезия и карбонат серебра); бикарбонаты щелочных металлов (такие как бикарбонат натрия и бикарбонат калия); соединения алкиллития (такие как н-бутиллитий) или алкилированные реагенты Гриньяра (такие как метилмагнийбромид); неорганические основания, такие как оксид серебра, или амины (такие как триэтиламин, диизопропилэтиламин и N-метилморфолин); и органические основания, например, оснóвные гетероциклические соединения (такие как диметиламинопиридин, пиридин, имидазол, 2,6-лутидин, коллидин, 1,8-диазабицикло[5,4,0]ундец-7-ен, 1,5-диазабицикло[4,3,0]нон-5-ен, и 1,4-диазабицикло[2,2,2]октан).
Примерами растворителя являются спиртовые растворители, эфирные растворители, галогенированные растворители, ароматические растворители, нитрильные растворители, амидные растворители, кетоновые растворители, сульфоксидные растворители и вода. Можно использовать смесь из двух таких растворителей. Из указанных растворителей метиленхлорид, тетрагидрофуран и диметилформамид являются предпочтительными.
Спиртовые производные (2), используемые на описанной выше стадии получения, можно получить известным способом. Известны различные способы, и один пример такого способа описан ниже. Спиртовое производное (2) можно получить добавлением металлоорганического реагента (типично, литийорганического реагента формулы R2-Li, или реагента Гриньяра формулы R2-MgCl, R2-MgBr, или т.п.), в количестве от эквивалентного до избыточного, к альдегиду или кетону формулы R1 (C=O)-R4, в растворителе, таком как тетрагидрофуран или диэтиловый эфир, для взаимодействия с ними. Указанный выше металлоорганический реагент можно легко получить, например, когда R2 представляет собой ароматическую углеводородную группу или ароматическую гетероциклическую группу, добавлением алкиллитиевого реагента или алкилированногореагента Гриньяра к арилгалогениду или гетероарилгалогениду для обмена металлов, как описано в диссертации H. Gilman, et. al., J. Org. Chem., 16, 1788-1791 (1951), или в диссертации F. Trecourt, et al., Tetrahedron, 56, 1349-1460 (2000).
Соединение (3), содержащее удаляемую группу Y, можно получить преобразованием гидроксильной группы спиртового производного (2) в удаляемую группу известным способом. Примеры удаляемой группы, представленной Y, включают атомы галогенов (таких как хлор, бром и иод), C1-6 алкилсульфонилоксигруппы, которые могут быть галогенированы (такие как метансульфонилокси, этансульфонилокси и трифторметансульфонилокси), и C6-10 ароматический углеводород- сульфонилоксигруппы, которые могут иметь заместитель. Заместители для группы ароматический углеводород- сульфонилокси включают 1-3 атома галогена, C1-6 алкильные группы, которые могут быть галогенированы, и C1-6 алкоксигруппы. Предпочтительные примеры удаляемой группы включают бензолсульфонилокси, п-толуолсульфонилокси, 1-нафталинсульфонилокси и 2-нафталинсульфонилокси.
В качестве альтернативного способа синтеза сульфидного соединения (1a) можно указать реакцию Мицунобу между спиртовым производным (2) и соединением тиола (R3-H). Конкретно, соединение (1a) можно получить взаимодействием спиртового производного (2) с 1-3 эквивалентами тиола (R3-SH) в растворителе в присутствии 1-3 эквивалентов либо триарилфосфина (такого как трифенилфосфин), либо триалкилфосфина (такого как трибутилфосфин) и 1-2 эквивалентов соединения азодикарбоновой кислоты (такого как диэтилазодикарбоксилат, диизопропилазодикарбоксилат, дипиперидинамид азодикарбоновой кислоты или бисдиметиламид азодикарбоновой кислоты).
Температура реакции обычно находится в пределах от -20°C до 150°C, предпочтительно от 0 до 80°C. Время реакции обычно составляет от 0,5 часа до 5 дней. Примеры растворителя включают эфирные растворители, галогенированные растворители и ароматические растворители. Можно использовать смесь двух или более таких растворителей. Из указанных растворителей тетрагидрофуран является предпочтительным.
2) Способ получения сульфинильного соединения (1b)
Сульфинильное соединение (1b) согласно настоящему изобретению можно получить, как описано ниже, путем окисления сульфидного соединения (1a) при помощи окисляющего агента в растворителе.
[Химическая формула 5]

(где каждый из R1-R4 определен выше).
Температура реакции обычно находится в пределах от -20°C до 200°C, предпочтительно от 0 до 100°C. Время реакции обычно составляет от 0,1 часа до 7 дней, предпочтительно от 0,5 часа до 2 дней. Примеры растворителя включают спиртовые растворители, эфирные растворители, галогенированные растворители, ароматические растворители, нитрильные растворители, амидные растворители, кетоновые растворители, сульфоксидные растворители и воду. Можно использовать смесь двух или более таких растворителей. Из указанных растворителей метиленхлорид, хлороформ, метанол и этанол являются предпочтительными.
Примеры окисляющего агента включают перекись водорода, органические перкислотные соединения (такие как перуксусная кислота и мета-хлорпербензойная кислота), метапериодаты (такие как метапериодат натрия), ацилнитраты, динитротетроксид, галогены, N-галогенированные соединения (такие как N-хлорсукцинимид и N-бромсукцинимид), гидропероксиды (такие как трет-бутилгидропероксид), диацетат иодбензола, дихлорид иодбензола, трет-бутилгипохлорит, сульфурилхлорид, несвязанный кислород, озон, оксид селена и селениновую кислоту.
Конкретные условия реакции следующие. Сульфинильное соединение (1b) можно получить обработкой сульфидного соединения (1a) 1-2 эквивалентами мета-хлорпербензойной кислоты, периодата натрия или перекиси водорода, в растворителе, таком как метиленхлорид, тетрагидрофуран-вода, метанол или т.п., при температуре 0-100°C в течение времени от около 1 часа до 2 дней.
Оптически активный сульфоксид (1b) можно получить, используя в качестве окислителя тетраизопропоксид титана/оптически чистый диэтилтартрат/трет-бутилгидропероксид, тетраизопропоксид титана/оптически чистый диэтилтартрат/перуксусную кислоту или т.п.
3-1) Способ получения сульфонильного соединения (1c)
Сульфонильное соединение (1c) согласно настоящему изобретению можно получить, как описано ниже, путем окисления сульфидного соединения (1a) или сульфинильного соединения (1b) при помощи окисляющего агента в растворителе.
[Химическая формула 6]
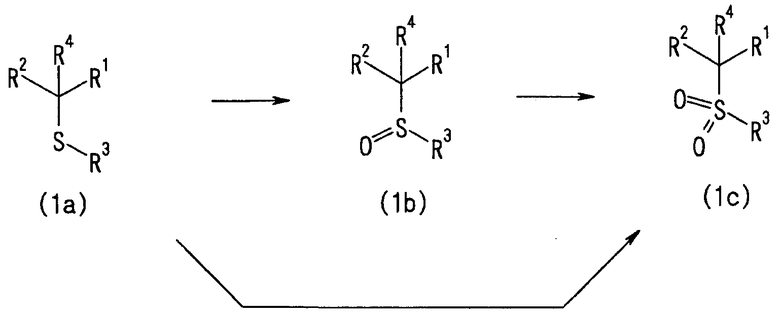
(где каждый из R1-R4 определен выше).
Температура реакции обычно находится в пределах от -20°C до 150°C, предпочтительно от 0°C до 100°C, и время реакции обычно составляет от 0,1 часа до 7 дней, предпочтительно от 1 часа до 5 дней.
Примеры растворителя включают спиртовые растворители, эфирные растворители, галогенированные растворители, ароматические растворители, карбоновокислотные растворители, нитрильные растворители, амидные растворители, кетоновые растворители, сульфоксидные растворители и воду. Можно использовать смесь двух или более таких растворителей. Из указанных растворителей метиленхлорид, хлороформ, метанол, этанол, уксусная кислота, вода и т.п. являются предпочтительными.
Примеры окисляющего агента включают перекись водорода, перекись водорода - катализатор на основе переходного металла (такой как молибдат аммония или хлорид железа (III)), органические перкислотные соединения (такие как перуксусная кислота и мета-хлорпербензойная кислота), метапериодаты (такие как метапериодат натрия), пероксисульфат калия, перманганаты (такие как перманганат калия), перборат натрия, галогены, N-галогенированные соединения (такие как N-хлорсукцинимид и N-бромсукцинимид), гидропероксиды (такие как трет-бутилгидропероксид), диацетат иодбензола, дихлорид иодбензола, гипохлориты (такие как гипохлорит натрия или трет-бутилгипохлорит), несвязанный кислород, озон, оксид селена и селениновую кислоту. Предпочтительный пример реакционных условий включает взаимодействие сульфидного соединения (1a) с 2-5 эквивалентами окисляющего агента (такого как мета-хлорпербензойная кислота, периодат натрия, перекись водорода или перекись водорода-молибдат аммония) в метиленхлориде, смеси тетрагидрофуран-вода или метаноле, при температуре в пределах от 0 до 100°C, в течение времени примерно от 1 часа до 5 дней.
3-2) Способ получения сульфонильного соединения (1c)
Сульфонильное соединение (1c) также можно получить способом, описанным ниже.
[Химическая формула 7]
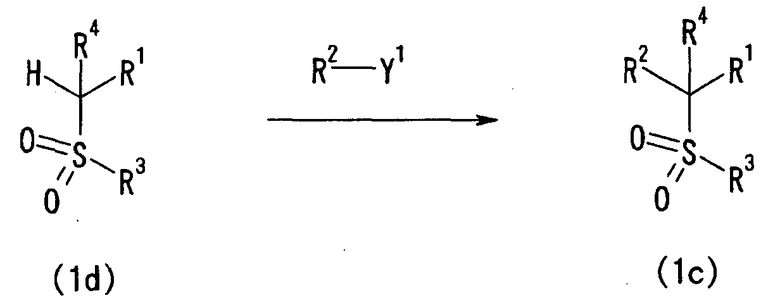
[где Y1 представляет собой удаляемую группу или гидроксильную группу и каждый из R1-R4 определен выше].
Каждое из сульфонильных соединений (1c), содержащих различные группы в качестве R2, может быть получено взаимодействием сульфонильного соединения (1d), которое можно получить известным способом или в соответствии с известным способом, с электрофильным реагентом (R2-Y1) в присутствии основания.
Конкретно, соединение (1d) подвергают взаимодействию с количеством R2-Y1 от эквивалентного до избыточного, в присутствии основания в количестве от эквивалентного до избыточного. Температура реакции обычно находится в пределах от -78°C до 200°C, и время реакции обычно составляет от 0,5 часа до 1 дня.
В качестве растворителя можно использовать эфирные растворители, галогенированные растворители, ароматические растворители, нитрильные растворители, амидные растворители и т.п., отдельно или в сочетании. Из указанных растворителей тетрагидрофуран, диметоксиэтан, диэтиловый эфир, диметилформамид, толуол и т.п. являются предпочтительными.
Примеры удаляемой группы, представленной Y1, включают атомы галогенов (таких как хлор, бром и иод), C1-6 алкилсульфонилоксигруппы, которые могут быть галогенированы (такие как метансульфонилокси, этансульфонилокси и трифторметансульфонилокси) и C6-10 ароматический углеводородсульфонилоксигруппы, которые могут иметь заместитель. Примеры заместителя для группы ароматический углеводородсульфонилокси включают 1-3 атома галогена, C1-6 алкильные группы, которые могут быть галогенированы, и C1-6 алкоксигруппы. Конкретные примеры групп C1-6 ароматический углеводородсульфонилокси, которые могут иметь заместитель, включают бензолсульфонилокси, п-толуолсульфонилокси, 1-нафталинсульфонилокси и 2-нафталинсульфонилокси.
Примеры основания включают соединения алкиллития (такие как н-бутиллитий, втор-бутиллитий и трет-бутиллитий), гидриды щелочных металлов или щелочноземельных металлов (такие как гидрид лития, гидрид натрия, гидрид калия и гидрид кальция), амиды щелочных металлов или щелочноземельных металлов (такие как амид лития, амид натрия, диизопропиламид лития, дициклогексиламид лития, гексаметилдисилазид лития, гексаметилдисилазид натрия и гексаметилдисилазид калия), низшие алкоксиды щелочных металлов или щелочноземельных металлов (такие как метоксид натрия, этоксид натрия и трет-бутоксид калия), гидроксиды щелочных металлов, щелочноземельных металлов или серебра (такие как гидроксид серебра, гидроксид натрия, гидроксид калия, гидроксид лития и гидроксид бария), карбонаты щелочных металлов, щелочноземельных металлов или серебра (карбонат натрия, карбонат калия, карбонат цезия и карбонат серебра), бикарбонаты щелочных металлов (такие как бикарбонат натрия и бикарбонат калия) и оксид серебра.
3-3) Способ получения сульфонильного соединения (1c)
Сульфонильное соединение (1c) в соответствии с настоящим изобретением можно также получить, как описано ниже, взаимодействием соединения (3) с солью щелочного металла, щелочноземельного металла или тетрабутиламмония и сульфиновой кислоты формулы R3-SO2 - M+ (5).
[Химическая формула 8]
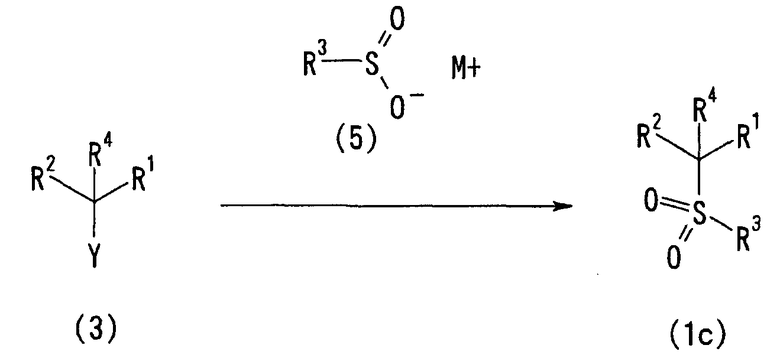
(где Y представляет собой удаляемую группу, M+ представляет собой ион металла и каждый из R1 - R4 определен выше).
Конкретно, соединение (3) подвергают взаимодействию с эквивалентным или избыточным количеством сульфиновой кислоты или ее соли (5) в растворителе. Температура реакции обычно находится в пределах от -20°C до 200°C, предпочтительно, от комнатной температуры до 100°C. Иногда может быть предпочтительной температура реакции выше указанных пределов, в зависимости от соединения (3) или сульфината (5). Иногда предпочтительно осуществление реакции в герметично закрытой пробирке. Время реакции обычно составляет от 0,5 часа до 3 дней, предпочтительно от 0,5 часа до 1 дня.
Примеры растворителя включают спиртовые растворители, эфирные растворители, галогенированные растворители, ароматические растворители, нитрильные растворители, амидные растворители, кетоновые растворители, сульфоксидные растворители и воду. Можно использовать смесь таких растворителей. Из указанных растворителей бутанол, диметоксиэтан, N-метилпирролидон, диметилформамид и и т.п. являются предпочтительными.
В описанных выше способах получения соединения (1) по настоящему изобретению иногда необходима защита заместителя, такого как атом азота, гидроксильная группа или карбоксильная группа, и в этом случае можно использовать хорошо известную защитную группу, которую можно при необходимости удалить. Защитную группу, если это необходимо, можно удалить общепринятым в области органической химии способом.
Один или несколько заместителей в R1-R4 сульфидного соединения (1a), сульфинильного соединения (1b) и сульфонильного соединения (1c), полученного любым из описанных выше способов, могут быть подвергнуты дальнейшим структурным преобразованиям. Например, когда соединение содержит, в любом из R1-R4, заместитель, замещенный 1,3-диоксолан-2-ильной группой, его можно преобразовать в соединение, замещенное формильной группой, при помощи гидролиза, осуществляемого известным способом. Когда соединение содержит, в любом из R1-R4, заместитель, замещенный группой брома, его можно преобразовать в соединение, замещенное формильной группой, известным способом. Формильную группу можно известным способом преобразовать в группу карбоновой кислоты, замещенную или незамещенную аминометильную группу, гидроксиметильную группу, 2-(алкоксикарбонил)этенильную группу или т.п. Кроме того, гидроксильную часть гидроксиметильной группы можно преобразовать в группу сложного эфира, карбоната, карбамата, галогена, нитрила, сульфоната или т.п. группу известным способом. Далее эти группы можно преобразовать в группу алкокси, амина, амида, карбоновой кислоты, сульфида или т.п. 2-(Алкоксикарбонил)этенильную группу можно преобразовать в 2-карбоксиэтильную группу или т.п. известным способом. Не только описанные выше группы, но и различные функциональные группы, помимо гидроксильной группы, также можно подвергнуть такому преобразованию. Преобразование можно осуществить известным методом. Конкретно, когда R2 представляет собой 2-хлор-4-пиридильную группу, путем взаимодействия этого соединения с амином, таким как алкиламин, диалкиламин, бензиламин, пирролидин, пиперидин или морфолин, можно получить пиридиновое производное, содержащее группу хлора в положении 2, которое замещено указанным выше амином. В этом случае использование 3,4-диметоксибензиламина дает 3,4-диметоксибензиламинопиридин, и обработка полученного соединения трифторуксусной кислотой или нитратом церия-диаммония дает 2-аминопиридиновое производное. Более того, путем обработки 2-аминопиридинового производного метансульфонилхлоридом в присутствии пиридина это соединение преобразуют в 2-метансульфониламинопиридиновое производное. На таких стадиях преобразования можно использовать реагенты, растворители и реакционные условия, известные специалистам в данной области.
Соединения (1) по настоящему изобретению, полученные описанным выше способом, можно преобразовать в их соли или сольваты, используя обычные способы.
Соединения (1) по настоящему изобретению являются сильными ингибитрами продуцирования или секреции β-амилоидного белка и, таким образом, являются полезными в качестве лекарственного средства для профилактики или лечения заболеваний, являющихся результатом аномальной продукции или секреции β-амилоидного белка, таких как болезнь Альцгеймера и синдром Дауна, или других заболеваний, связанных с амилоидными отложениями.
Когда соединение по настоящему изобретению используют в качестве лекарственного средства для человека, суточная доза для взрослого составляет от 1 мг до 1 г, предпочтительно от 10 мг до 300 мг. Когда его вводят животным, доза варьируется в зависимости от цели введения (лечение или профилактика), вида или размера животного, подвергаемого обработке, вида бактерий, которыми это животное инфицировано, или степени инфицирования, но суточная доза обычно составялет от 0,1 мг до 200 мг, предпочтительно от 0,5 мг до 100 мг на кг массы тела животного. Суточную дозу вводят раз в сутки или ее делят на две-четыре дозы для введения в течение суток. Если необходимо, суточная доза может превышать указанное выше количество.
Фармацевтическую композицию, содержащую соединение по настоящему изобретению, можно сформулировать в желаемую форму, выбираемую в зависимости от пути введения, при помощи различных обычно используемых для этого способов получения. Примеры формы фармацевтической композиции, содержащей в качестве основного ингредиента соединение по настоящему изобретению, включают препараты для перорального введения, такие как таблетки, порошки, гранулы, капсулы, жидкости, сиропы, эликсиры, масляные или водные суспензии.
Препараты для инъекций могут содержать стабилизатор, антисептик, солюбилизирующее вещество или т.п. Также возможно реструктурирование непосредственно перед применением твердого препарата, который был получен путем заполнения сосуда раствором, который может содержать такое вещество, а затем лиофилизирован. В один сосуд может быть включено количество для разового введения или в один сосуд может быть включено количество для нескольких введений.
Примеры препаратов для внешнего применения включают жидкости, суспензии, эмульсии, мази, гели, кремы, лосьоны, спреи и пластыри.
Твердые препараты вместе с соединением по настоящему изобретению содержат фармацевтически приемлемые добавки. Их можно получить смешиванием соединения по настоящему изобретению с добавками, выбранными из наполнителей, веществ, создающих объем, связующих, разрыхлителей, агентов, способствующих растворению, увлажнителей и смазывающих веществ, как это необходимо.
Примеры жидких препаратов включают растворы, суспензии и эмульсии. В качестве добавок они содержат суспендирующее вещество или эмульгатор.
Примеры
Далее настоящее изобретение описано более подробно при помощи примеров. Однако следует иметь в виду, что объем настоящего изобретения не ограничивается приведенными ниже примерами. Все соединения, полученные, как описано ниже в примерах, относятся либо к E-типу, либо к Z-типу, если специально не указано иное.
Ссылочный Пример 1: 2-[(4-Хлорфенил)сульфонилметил]-1,4-дифторбензол
[Химическая формула 9]
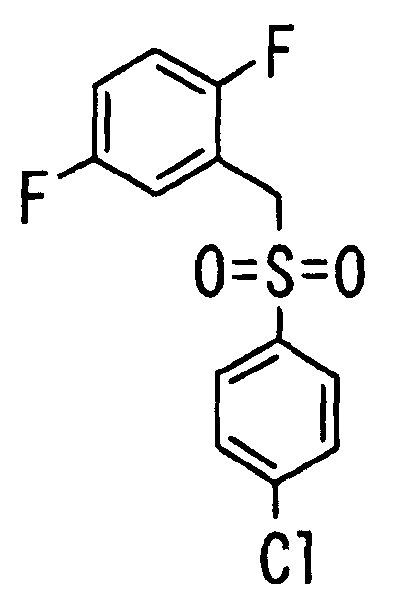
Способ 1:
1) При 0°C 4-хлорбензолтиол (5,45 г, 38,2 ммоль), трифенилфосфин (11,1 г, 41,6 ммоль) и диизопропилазодикарбоксилат (8,16 мл, 41,6 ммоль) последовательно добавляли к раствору 2,5-дифторбензилового спирта (5,00 г, 34,7 ммоль) в тетрагидрофуране (150 мл). Реакционную смесь перемешивали при комнатной температуре в течение 4 дней, а затем концентрировали. Полученный остаток очищали колоночной хроматографией на силикагеле (1% этилацетат―гексан) с получением 2-[(4-хлорфенил)тиометил]-1,4-дифторбензола (2,68 г, 29%) в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ: 4,04 (2H, с), 6,85-7,00 (3H, м), 7,23 (4H, с).
2) После добавления 3-хлорпербензойной кислоты (225 мг, 1,30 ммоль) к раствору 2-[(4-хлорфенил)тиометил]-1,4-дифторбензола (271 мг, 1,00 ммоль) в метиленхлориде (5 мл) при 0°C полученную смесь перемешивали при комнатной температуре в течение 15 часов. Реакционную смесь разбавляли метиленхлоридом, промывали насыщенным водным раствором бикарбоната калия и насыщенным солевым раствором, сушили (над MgSO4) и концентрировали. Полученный остаток растворяли в метиленхлориде (5 мл). После охлаждения до 0°C добавляли 3-хлорпербензойную кислоту (450 мг, 2,60 ммоль) и полученную смесь перемешивали при комнатной температуре в течение 15 часов. Реакционную смесь разбавляли метиленхлоридом. Разбавленный раствор промывали насыщенным водным раствором бикарбоната калия и насыщенным солевым раствором, сушили (над MgSO4) и концентрировали. Полученный остаток очищали колоночной хроматографией на силикагеле (9% этилацетат:гексан) с получением указанного в заголовке соединения (210 мг, 69%) в виде бесцветного твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 4,36 (2H, с), 6,91 (1H, тд, J=9,0, 4,4 Гц), 6,99-7,06 (1H, м), 7,11 (1H, ддд, J=8,3, 5,6, 3,2 Гц), 7,45 (2H, д, J=8,8 Гц), 7,62 (2H, д, J=8,8 Гц).
MS (m/z): 303 (M++H).
Способ 2:
1) После добавления карбоната калия (4,00 г, 29,0 ммоль) и 2-бромметил-1,4-дифторбензола (5,00 г, 24,2 ммоль) к раствору 4-хлорбензолтиола (3,86 г, 26,6 ммоль) в N,N-диметилформамиде (120 мл) полученную смесь перемешивали при комнатной температуре в течение 3 часов. К реакционной смеси добавляли насыщенный раствор хлорида аммония (50 мл) и воду (20 мл), затем экстрагировали диэтиловым эфиром. Экстракты объединяли, промывали водой и насыщенным солевым раствором, сушили (над MgSO4) и концентрировали. Полученный остаток очищали колоночной хроматографией на силикагеле (1% этилацетат:гексан) с получением 2-[(4-хлорфенил)тиометил]-1,4-дифторбензола (6,41 г, 98%) в виде бесцветного масла.
2) H2O (16,4 мл), 30% H2O2 (16,4 мл, 145 ммоль) и тетрагидрат гексааммонийгептамолибдата (425 мг, 0,344 ммоль) добавляли при 0°C к раствору 2-[(4-хлорфенил)тиометил]-1,4-дифторбензола (6,54 г, 24,1 ммоль) в метаноле (100 мл). Полученную смесь перемешивали в течение 1 часа с последующим перемешиванием при комнатной температуре в течение 15 часов. Осажденное таким образом твердое вещество собирали фильтрованием и фильтрат концентрировали примерно до половины его количества. Полученный водный раствор экстрагировали метиленхлоридом. Полученное твердое вещество сначала растворяли в экстракте. Полученный раствор промывали последовательно водой и насыщенным солевым раствором, сушили (над MgSO4) и концентрировали. Полученный остаток перекристаллизовывали из гексана с получением указанного в заголовке соединения (6,34 г, 87%) в виде бесцветных игольчатых кристаллов.
Способ 3: К суспензии 4-хлорбензолсульфината натрия (19,0 г, 95,5 ммоль) в бутаноле (200 мл) добавляли 2-бромметил-1,4-дифторбензол (12,3 мл, 95,5 ммоль). Полученную смесь нагревали при кипячении с обратным холодильником в течение 5 часов. Осажденное таким образом твердое вещество собирали фильтрованием и растворяли в метиленхлориде. Полученный раствор промывали насыщенным солевым раствором, сушили (над MgSO4). После концентрирования полученное твердое вещество перекристаллизовывали из гексана с получением указанного в заголовке соединения (12,3 г, 43%) в виде бесцветных игольчатых кристаллов.
Ссылочный Пример 2: 4-(4-Хлорфенилсульфонилметил)пиридин
[Химическая формула 10]
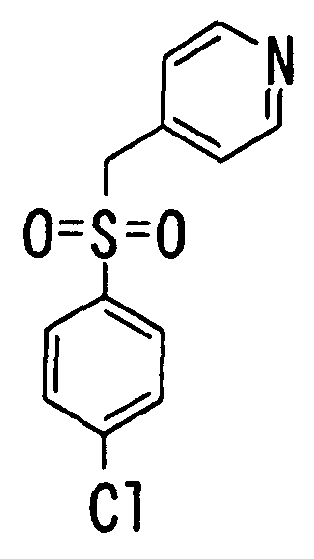
Раствор гидрохлорида 4-хлорметилпиридина (1,26 г, 7,65 ммоль), 4-хлорбензолсульфината натрия (1,52 г, 7,65 ммоль) и ацетата калия (1,50 г, 15,3 ммоль) в 1-пропаноле (50 мл) перемешивали при нагревании при 70°C в течение 8 часов. Реакционную смесь охлаждали до комнатной температуры и затем концентрировали при пониженном давлении. Полученный остаток пропускали через короткую колонку (силикагель, этилацетат) и элюат концентрировали при пониженном давлении. Полученный остаток подвергали колоночной хроматографии на силикагеле и фракцию, полученную при элюировании гексан:этилацетат (=2:3), концентрировали при пониженном давлении с получением указанного в заголовке соединения (1,26 г, 62%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 4,29 (2H, с), 7,06 (2H, д, J=6,1 Гц), 7,47 (2H, д, J=8,8 Гц), 7,59 (2H, д, J=8,5 Гц), 8,57 (2H, д, J=6,1 Гц).
MS (m/z): 268 (M++H).
Ссылочный Пример 3: 2-[(2,5-Дифторфенил)-гидроксиметил]пиридин
[Химическая формула 11]
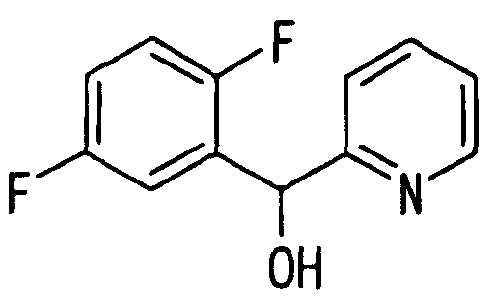
Раствор (1,53M, 3,92 мл, 0,6 ммоль) н-бутиллития в гексане в атмосфере аргона при -78°C добавляли по каплям к раствору 2-бромпиридина (572 мкл, 6 ммоль) в тетрагидрофуране (10 мл) с последующим перемешиванием в течение 30 минут. К полученному коричневому раствору добавляли по каплям 2,5-дифторбензальдегид (655 мкл, 6 ммоль) и температуру реакционной смеси постепенно повышали до комнатной температуры. К реакционной смеси добавляли воду. Полученную смесь затем экстрагировали этилацетатом. После удаления растворителя при помощи сушки остаток, полученный концентрацией при пониженном давлении, очищали хроматографией на силикагеле с получением указанного в заголовке соединения (120 мг, 9%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 5,45 (1H, шир.), 6,08 (1H, с), 6,87-7,15 (3H, м), 7,2-7,3 (2H, м), 7,65 (1H, м), 8,56 (1H, м).
Т.пл.: 65-66°C.
Ссылочный Пример 4: гидрохлорид 2-[хлор-(2,5-дифторфенил)метил]-3-метилпиридина
[Химическая формула 12]
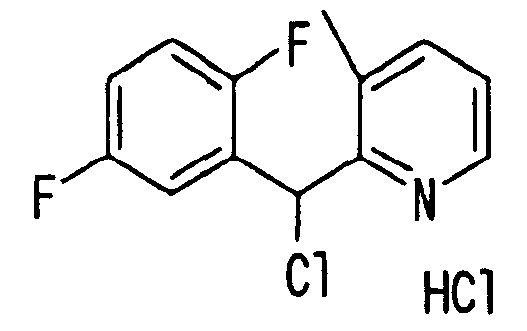
В атмосфере аргона раствор (1,5 мл, 3 ммоль) изопропилмагнийхлорида в тетрагидрофуране добавляли по каплям при охлаждении льдом к раствору 2-бром-3-метилпиридина (510 мг, 3 ммоль) в тетрагидрофуране (2,0 мл). Полученную смесь перемешивали при комнатной температуре в течение 60 минут. К полученному коричневому раствору добавляли по каплям при охлаждении льдом 2,5-дифторбензальдегид (328 мкл, 3 ммоль). Температуру реакционной смеси затем постепенно повышали до комнатной температуры. После добавления насыщенного водного раствора хлорида аммония полученную смесь экстрагировали этилацетатом. После удаления растворителя при помощи сушки остаток, полученный концентрацией при пониженном давлении, очищали хроматографией на силикагеле (гексан:этилацетат=8:1) с получением смеси, содержащей указанное в заголовке соединение. К смеси добавляли тионилхлорид (2,0 мл) и одну каплю диметилформамида. Полученную смесь перемешивали при комнатной температуре в течение 14 часов. Избыток тионилхлорида отгоняли при пониженном давлении с получением белого осадка. Осадок растирали в порошок с гексаном и диэтиловым эфиром с получением указанного в заголовке соединения (101 мг, 12%).
1H-ЯМР (400 МГц, CDCl3)δ: 2,37 (3H, с), 6,95-7,10 (2H, м), 7,28 (1H, с), 7,7-7,8 (2H, м), 8,11 (1H, д, J=6,3 Гц), 8,72 (1H, д, J=4,9 Гц).
Т.пл.: 118-119°C.
MS m/z: 254 (M++H).
Ссылочный Пример 5: 2-[(2,5-Дифторфенил)-гидроксиметил]-5-метилпиридин
[Химическая формула 13]
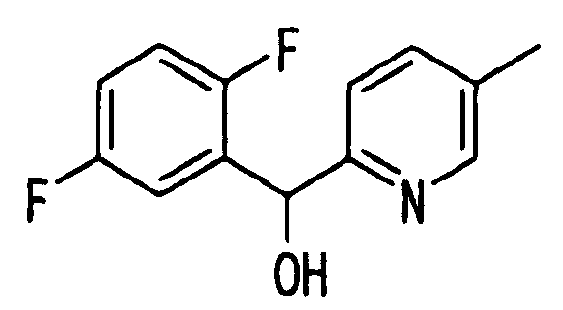
В атмосфере аргона раствор (1,5 мл, 3 ммоль) изопропилмагнийхлорида в тетрагидрофуране добавляли по каплям при охлаждении льдом к раствору 2-бром-5-метилпиридина (510 мг, 3 ммоль) в тетрагидрофуране (2 мл). Полученную смесь перемешивали при комнатной температуре в течение 60 минут. К полученному коричневому раствору добавляли по каплям при охлаждении льдом 2,5-дифторбензальдегид (328 мкл, 3 ммоль) и затем температуру реакционной смеси постепенно повышали до комнатной температуры. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония и затем смесь экстрагировали этилацетатом. После удаления растворителя при помощи сушки остаток, полученный концентрацией при пониженном давлении, очищали хроматографией на силикагеле (гексан:этилацетат=5:1) с получением указанного в заголовке соединения (130 мг, 18%) в виде масла.
1H-ЯМР (400 МГц, CDCl3)δ: 2,31 (3H, с), 5,38 (1H, шир.), 6,04 (1H, с), 6,83-7,18 (4H, м), 7,44 (1H, дд, J=2,0, 8,0 Гц), 8,37 (1H, м).
MS m/z: 236 (M++H).
Ссылочный Пример 6: 2-[(2,5-Дифторфенил)-гидроксиметил]-4-метилпиридин
[Химическая формула 14]
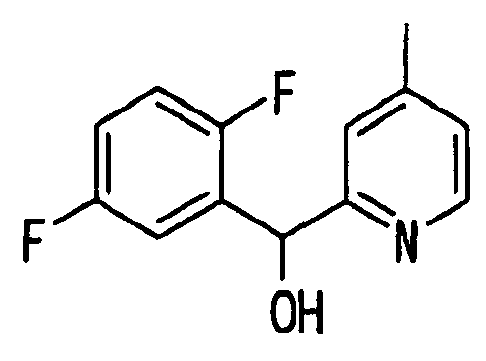
В атмосфере аргона раствор (1,5 мл, 3 ммоль) изопропилмагнийхлорида в тетрагидрофуране добавляли по каплям при охлаждении льдом к раствору 2-бром-4-метилпиридина (334 мкл, 3 ммоль) в тетрагидрофуране (2 мл). Полученную смесь перемешивали при комнатной температуре в течение 60 минут. К полученному коричневому раствору добавляли по каплям при охлаждении льдом 2,5-дифторбензальдегид (328 мкл, 3 ммоль). Температуру полученной смеси постепенно повышали до комнатной температуры. После добавления насыщенного водного раствора хлорида аммония полученную смесь экстрагировали этилацетатом. Затем удаляли растворитель при помощи сушки. Остаток, полученный концентрацией при пониженном давлении, очищали хроматографией на силикагеле (гексан:этилацетат=5:1) с получением указанного в заголовке соединения (456 мг, 65%) в виде игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3)δ: 2,30 (3H, с), 5,48 (1H, шир.с), 6,02 (1H, с), 6,83-7,13 (5H, м), 8,38 (1H, м).
Т.пл.: 105-106°C.
MS m/z: 236 (M++H).
Ссылочный Пример 7: 2-Бром-3-метоксипиридин
[Химическая формула 15]
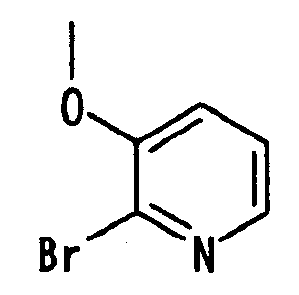
В атмосфере азота гидрид натрия, 60% в масле (605 мг, 15,1 ммоль), добавляли по порциям при охлаждении льдом к метанолу (10 мл). Через двадцать минут добавляли раствор 2-бром-3-гидроксипиридина (2,5 г, 14,4 ммоль) в диметилформамиде (20 мл). Из полученной смеси отгоняли метанол при пониженном давлении. К остатку добавляли метилиодид (0,94 мл, 15,1 ммоль) с последующим перемешиванием при комнатной температуре в течение 3 часов. Затем реакционную смесь концентрировали досуха, к концентрату добавляли воду (50 мл) и простой эфир (50 мл). Органический слой отделяли и промывали насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором. Экстракт сушили над безводным сульфатом магния и концентрировали при пониженном давлении для удаления растворителя. Остаток очищали хроматографией на силикагеле (гексан:этилацетат=8:1) с получением указанного в заголовке соединения (1,51 г, 56%) в виде игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3)δ: 3,90 (3H, с), 7,12 (1H, м), 7,21 (1H, дд, J=4,8, 8,0 Гц), 7,97 (1H, м).
Т.пл.: 34°C.
Ссылочный Пример 8: 3-Аллилокси-2-бромпиридин
[Химическая формула 16]
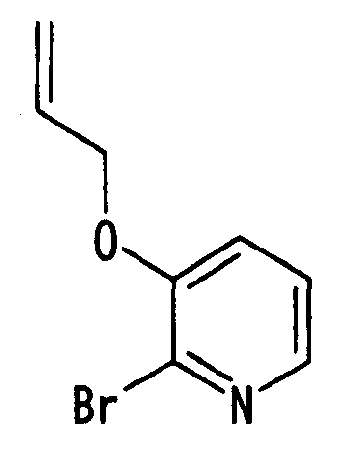
Синтез осуществляли таким же способом, который использовали для синтеза 2-бром-3-метоксипиридина, с получением указанного в заголовке соединения (2,35 г, 76%) в виде масла.
1H-ЯМР (400 МГц, CDCl3)δ: 4,62 (2H, м), 5,33 (1H, дд, J=1,2, 10,4 Гц), 5,47 (1H, дд, J=1,2, 17,6 Гц), 6,06 (1H, м), 7,11 (1H, дд, J=1,2 Гц, 8,0 Гц), 7,18 (1H, дд, J=4,8, 8,0 Гц), 7,98 (1H, м).
MS m/z: 215 (M++H).
Ссылочный Пример 9: 2-[(2,5-Дифторфенил)-гидроксиметил]-3-метоксипиридин
[Химическая формула 17]
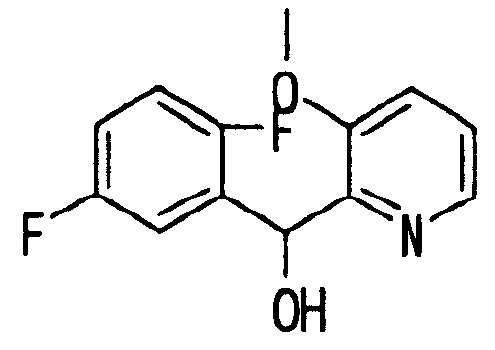
В атмосфере аргона раствор (1,5 мл, 3 ммоль) изопропилмагнийхлорида в тетрагидрофуране добавляли по каплям при охлаждении льдом к раствору 2-бром-3-метоксипиридина (564 мг, 3 ммоль) в тетрагидрофуране (2 мл). Реакционную смесь затем перемешивали при комнатной температуре в течение 60 минут. К полученному коричневому раствору добавляли по каплям при охлаждении льдом 2,5-дифторбензальдегид (328 мкл, 3 ммоль). Температуру реакционной смеси постепенно повышали до комнатной температуры. После добавления насыщенного водного раствора хлорида аммония полученную смесь экстрагировали этилацетатом. После удаления растворителя при помощи сушки игольчатые кристаллы, полученные концентрацией при пониженном давлении, растирали в порошок с гексаном с получением указанного в заголовке соединения (660 мг, 88%).
1H-ЯМР (400 МГц, CDCl3)δ: 3,71 (3H, с), 5,56 (1H, шир., J=6,0 Гц), 6,16 (1H, д, J=6,0 Гц), 6,75-7,00 (3H, м), 7,14 (1H, м), 7,26 (1H, м), 8,18 (1H, м).
Т.пл.: 94-95°C.
MS m/z: 252 (M++H).
Ссылочный Пример 10: 3-Аллилокси-2-[(2,5-дифторфенил)-гидроксиметил]пиридин
[Химическая формула 18]
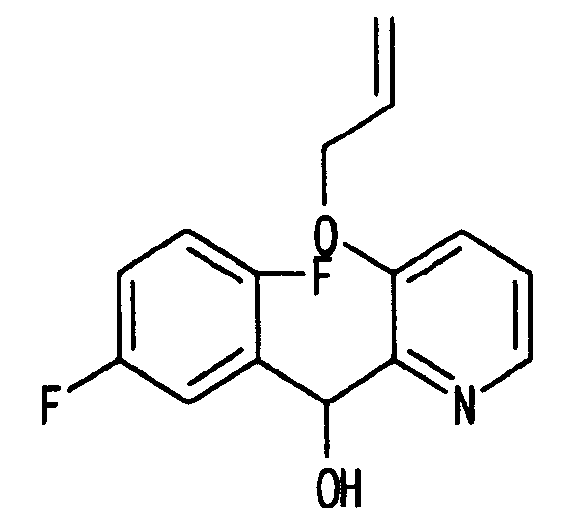
В атмосфере аргона раствор (1,5 мл, 3 ммоль) изопропилмагнийхлорида в тетрагидрофуране добавляли по каплям при охлаждении льдом к раствору 3-аллилокси-2-бромпиридина (642 мг, 3 ммоль), полученного в ссылочном примере 8, в тетрагидрофуране (2 мл). Смесь перемешивали при комнатной температуре в течение 60 минут. К полученному коричневому раствору добавляли по каплям при охлаждении льдом 2,5-дифторбензальдегид (328 мкл, 3 ммоль). Температуру реакционной смеси постепенно повышали до комнатной температуры. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония, а затем экстрагировали этилацетатом. Затем удаляли растворитель при помощи сушки и остаток, полученный концентрацией при пониженном давлении, очищали хроматографией на силикагеле (гексан:этилацетат=4:1) с получением указанного в заголовке соединения (375 мг, 45%) в виде масла.
1H-ЯМР (400 МГц, CDCl3)δ: 4,38 (1H, м), 4,44 (1H, м), 5,16 (1H, м), 5,18 (1H, м), 5,61 (1H, шир., J=6,4 Гц), 5,78 (1H, м), 6,17 (1H, д, J=6,0 Гц), 6,73-6,96 (3H, м), 7,10 (1H, м), 7,22 (1H, м), 8,19 (1H, м).
MS m/z: 278 (M++H).
Ссылочный Пример 11: 3-[(2,5-Дифторфенил)-гидроксиметил]пиридин
[Химическая формула 19]

В атмосфере аргона раствор (1,5 мл, 3 ммоль) изопропилмагнийхлорида в тетрагидрофуране добавляли по каплям при охлаждении льдом к раствору 3-бромпиридина (286 мкл, 3 ммоль) в тетрагидрофуране (2 мл). Смесь перемешивали при комнатной температуре в течение 60 минут. К полученному коричневому раствору добавляли по каплям при охлаждении льдом 2,5-дифторбензальдегид (328 мкл, 3 ммоль). Температуру реакционной смеси постепенно повышали до комнатной температуры. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония, а затем экстрагировали этилацетатом. Затем удаляли растворитель при помощи сушки. Остаток, оставшийся после концентрации при пониженном давлении, очищали хроматографией на силикагеле (гексан:этилацетат=1:1) с получением указанного в заголовке соединения (296 мг, 45%) в виде игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3)δ: 3,76 (1H, шир.), 6,10 (1H, с), 6,88-6,98 (2H, м), 7,20-7,30 (2H, м), 7,70 (1H, м), 8,42 (1H, д, J=4,8 Гц), 8,53 (1H, м).
Т.пл.: 79-80°C.
Ссылочный Пример 12: 5-[(2,5-Дифторфенил)-гидроксиметил]пиримидин
[Химическая формула 20]
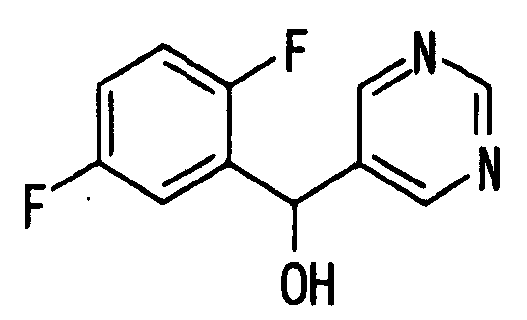
Таким же способом, как в ссылочном примере 11, получали указанное в заголовке соединение (117 мг, 18%) в виде масла, используя 5-бромпиримидин.
1H-ЯМР (400 МГц, CDCl3)δ: 6,12 (1H, с), 6,90-7,02 (2H, м), 7,26 (1H, м), 8,70 (2H, с), 9,04 (1H, с).
MS m/z: 205 (M+-OH).
Ссылочный Пример 13: 2-[(трет-Бутоксикарбонилокси)-(2,5-дифторфенил)метил]-1-метил-1H-бензимидазол
[Химическая формула 21]
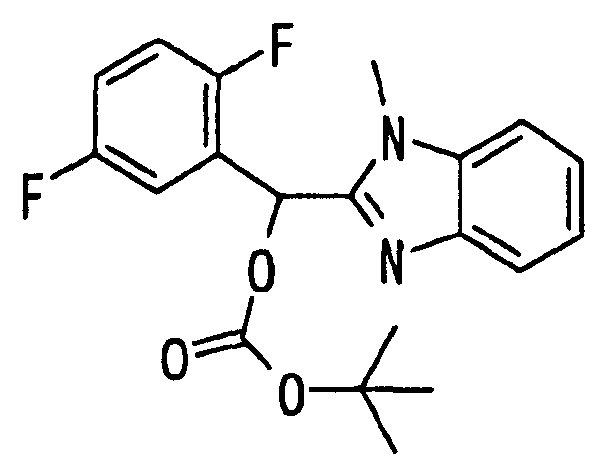
Раствор в ацетонитриле (3 мл) 2,5-дифторбензальдегида (164 мкл, 1,5 ммоль), 1-метилбензимидазола (132 мг, 1 ммоль) и ди-трет-бутилдикарбоната (252 мкл, 1,1 ммоль) перемешивали при комнатной температуре в течение 20 часов. Образовавшийся осадок собирали фильтрованием и затем растирали в порошок с гексаном с получением указанного в заголовке соединения (310 мг, 83%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 1,45 (9H, с), 3,86 (3H, с), 6,9-7,0 (2H, м), 7,12 (1H, с), 7,22-7,35 (3H, м), 7,45 (1H, м), 7,77 (1H, д, J=8,0 Гц).
Т.пл.: 163-164°C.
MS m/z: 375 (M++H).
Ссылочный Пример 14: 2-[(трет-Бутоксикарбонилокси)-(2,5-дифторфенил)метил]-1-метил-5-хлор-1H-имидазол
[Химическая формула 22]
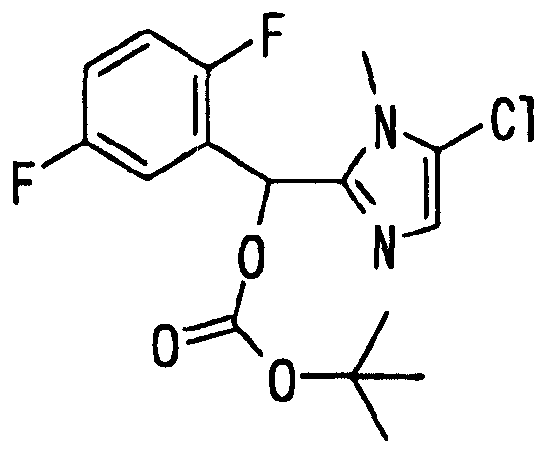
Раствор в ацетонитриле (6 мл) 2,5-дифторбензальдегида (327 мкл, 3 ммоль), 5-хлор-1-метилимидазола (187 мкг, 2 ммоль) и ди-трет-бутилдикарбоната (504 мкл, 2,2 ммоль) перемешивали при комнатной температуре в течение 20 часов. Образовавшийся осадок собирали фильтрованием, а затем растирали в порошок с гексаном с получением указанного в заголовке соединения (472 мг, 66%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 1,48 (9H, с), 3,67 (3H, с), 6,88-7,1 (4H, м), 7,39 (1H, м).
Т.пл.: 125-126°C.
MS m/z: 359 (M++H).
Ссылочный Пример 15: 2-[(2,5-Дифторфенил)-гидроксиметил]тиазол
[Химическая формула 23]
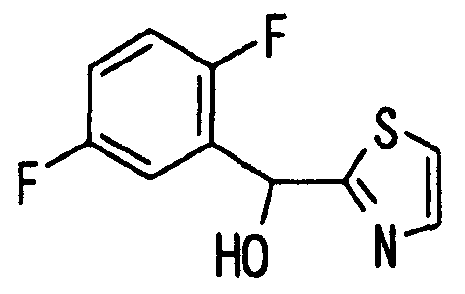
К раствору 2-бромтиазола (180 мкг, 2 ммоль) в тетрагидрофуране (10 мл) добавляли по каплям при -78°C раствор н-бутиллития (1,57M, 1,40 мл, 2,2 ммоль) в гексане с последующим перемешиванием в течение 10 минут. Затем добавляли 2,5-дифторбензальдегид (238 мкл, 2,2 ммоль) и температуру полученной смеси постепенно повышали до 0°C при перемешивании. Для завершения реакции добавляли водный раствор хлорида аммония и к реакционной смеси добавляли простой эфир. Эфирный слой промывали водой и насыщенным солевым раствором и затем сушили над безводным сульфатом магния. После фильтрования раствор концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле (гексан:этилацетат=1:1) с получением указанного в заголовке соединения (358 мг, 79%) в виде масла.
1H-ЯМР (400 МГц, CDCl3)δ: 3,77 (1H, д, J=4,0 Гц), 6,33 (1H, д, J=4,0 Гц), 6,95-7,10 (2H, м), 7,24 (1H, м), 7,34 (1H, д, J=3,6 Гц), 7,75 (1H, д, J=3,6 Гц).
MS m/z: 228 (M++H).
Ссылочный Пример 16: 2-[(трет-Бутоксикарбонилокси)-(2,5-дифторфенил)метил]-1-(4-метоксифенил)-1H-имидазол
[Химическая формула 24]
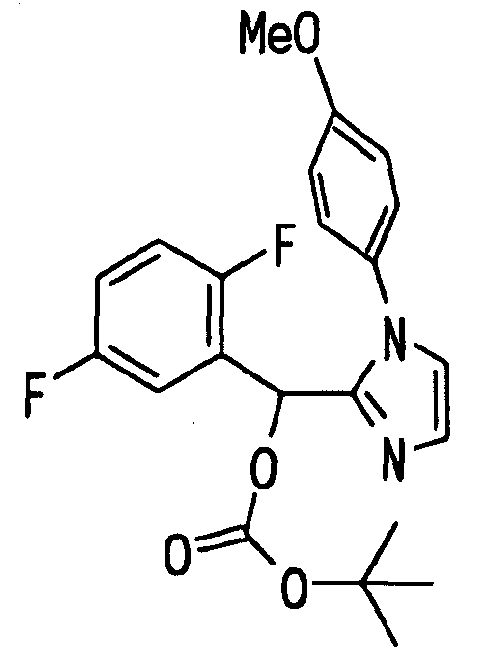
Раствор 2,5-дифторбензальдегида (327 мкл, 3 ммоль), 1-(4-метоксифенил)имидазола (348 мг, 2 ммоль) и ди-трет-бутилдикарбоната (504 мкл, 2,2 ммоль) в ацетонитриле (6 мл) перемешивали при комнатной температуре в течение 20 часов. Реакционную смесь концентрировали и затем остаток очищали хроматографией на силикагеле (гексан:этилацетат=5:1 → 1:1) с получением указанного в заголовке соединения (774 мг, 93%) в виде масла.
1H-ЯМР (400 МГц, CDCl3)δ: 1,40 (9H, с), 3,86 (3H, с), 6,76 (1H, с), 6,90-7,00 (4H, м), 7,02 (1H, с), 7,11 (1H, с), 7,26 (2H, м), 7,33 (1H, м).
MS m/z: 417 (M++H).
Ссылочный Пример 17: 5-Хлор-2-пиридинтиол
[Химическая формула 25]
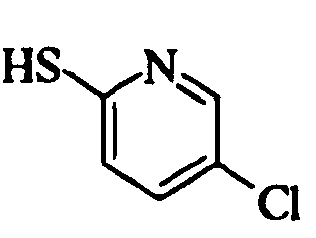
К раствору 2,5-дихлорпиридина (296 мг, 2,00 ммоль) в этаноле (4 мл) добавляли тиомочевину (152 мг, 2,00 ммоль). Затем смесь нагревали при кипячении с обратным холодильником в течение 18 часов. После охлаждения реакционной смеси до комнатной температуры добавляли водный (1 мл) раствор гидроксида калия (198 мг, 3,00 ммоль) и смесь нагревали при кипячении с обратным холодильником в течение 3 часов. Реакционную смесь охлаждали до комнатной температуры. Затем добавляли воду и смесь промывали дихлорметаном. Водный слой подкисляли уксусной кислотой, а затем экстрагировали дихлорметаном. Органический слой сушили над безводным сульфатом натрия и затем фильтровали. После фильтрования фильтрат концентрировали при пониженном давлении. Полученное твердое вещество промывали диэтиловым эфиром и собирали фильтрованием с получением указанного в заголовке соединения (83 мг, 0,57 ммоль, 29%) в виде желтого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 7,35 (1H, дд, J=9,3, 2,4 Гц), 7,46 (1H, д, J=9,3 Гц), 7,64 (1H, д, J=2,4 Гц).
MS m/z: 146 (M++H).
Ссылочный Пример 18: 2,5-Дифторфенил-4-пиридилметанол
[Химическая формула 26]
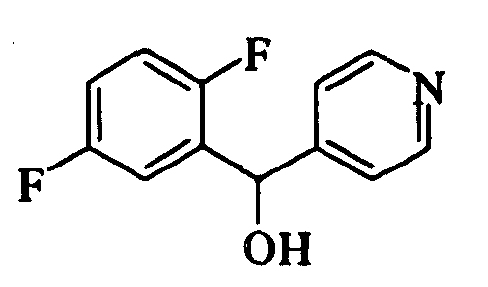
Раствор 1-бром-2,5-дифторбензола (1,08 мл, 9,60 ммоль) в тетрагидрофуране (30 мл) перемешивали при -78°C, а затем добавляли раствор н-бутиллития (7,32 мл, 11,5 ммоль) в гексане. К реакционной смеси добавляли при -78°C раствор 4-пиридинкарбоксиальдегида (0,764 мл, 8,00 ммоль) в тетрагидрофуране (10 мл). Полученную смесь перемешивали при указанной температуре в течение 30 минут. После того как температуру реакционной смеси повышали до комнатной температуры, добавляли диэтиловый эфир. Полученную смесь промывали насыщенным водным раствором бикарбоната натрия. Органический слой сушили над безводным сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=7:3, концентрировали при пониженном давлении. Полученное твердое вещество промывали диизопропиловым эфиром и затем собирали фильтрованием с получением указанного в заголовке соединения (1,15 г, 5,20 ммоль, 65%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 4,25 (1H, шир. с), 6,09 (1H, с), 6,89-7,05 (2H, м), 7,14-7,23 (1H, м), 7,34 (2H, д, J=5,4 Гц), 8,44 (2H, д, J=5,4 Гц).
Ссылочный Пример 19: Тетрагидротиопиран-4-ол
[Химическая формула 27]
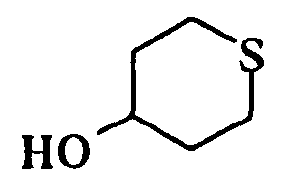
Тетрагидротиопиран-4-он (5,00 г, 43,0 ммоль) растворяли в метаноле (100 мл). Затем к полученному раствору добавляли при охлаждении льдом борогидрид натрия (1,6 г, 42,3 ммоль) и полученную смесь перемешивали при комнатной температуре в течение 14 часов. К остатку, полученному концентрацией реакционной смеси при пониженном давлении, добавляли воду (50 мл). Затем жидкую полученную смесь слегка подкисляли 1 н. раствором хлористоводородной кислоты, а затем экстрагировали диэтиловым эфиром. Экстракт последовательно промывали 1 н. раствором хлористоводородной кислоты, насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором. Органический слой сушили над безводным сульфатом магния. После фильтрования фильтрат концентрировали при пониженном давлении с получением указанного в заголовке соединения (4,40 г, 37,2 ммоль, 87%) в виде бледно желто-коричневатого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 1,47 (1H, шир. с), 1,64-1,80 (2H, м), 2,10-2,24 (2H, м), 2,55-2,70 (2H, м), 2,73-2,88 (2H, м), 3,60-3,75 (1H, м).
MS m/z: 119 (M++H).
Ссылочный Пример 20: 5-Дибромметил-2-(2,5-дифторбензоил)пиридин (Соединение A) и 5-бромметил-2-(2,5-дифторбензоил)пиридин (Соединение B)
[Химическая формула 28]
При нагревании и кипячении с обратным холодильником н-бромсукцинимид (17,0 г, 95,7 ммоль) и каталитическое количество 2,2'-азобис(2-метилпропионитрил) добавляли к раствору 2-[(2,5-дифторфенил)-гидроксиметил]-5-метилпиридина (7,50 г, 31,9 ммоль), полученного в ссылочном примере 5, в тетрахлориде углерода (100 мл). Полученную смесь перемешивали при температуре кипения с обратным холодильником в течение 24 часов. Реакционную смесь охлаждали до комнатной температуры и образовавшийся осадок отфильтровывали. Осадок добавляли к водному раствору тиосульфата натрия, а затем экстрагировали хлороформом. Экстракт промывали насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором, затем сушили над сульфатом натрия. Остаток, полученный концентрацией раствора при пониженном давлении, очищали хроматографией на силикагеле (гексан:этилацетат =10:1) с получением указанного в заголовке соединения A (3,91 г, 31%) и указанного в заголовке соединения B (3,34 г, 34%), каждое в виде масла.
Соединение A
1H-ЯМР (400 МГц, CDCl3)δ: 6,70 (1H, с), 7,12 (1H, м), 7,24 (1H, м), 7,39 (1H, м), 8,12 (1H, д, J=8,4 Гц), 8,19 (1H, дд, J=2,0, 8,4 Гц), 8,77 (1H, д, J=2,0 Гц).
MS m/z: 392 (M++H).
Соединение B
1H-ЯМР (400 МГц, CDCl3)δ: 4,52 (2H, с), 7,12 (1H, м), 7,21 (1H, м), 7,39 (1H, м), 7,94 (1H, дд, J=2,0, 8,0 Гц), 8,08 (1H, д, J=8,0 Гц), 8,67 (1H, д, J=2,0 Гц).
MS m/z: 313 (M++H).
Ссылочный Пример 21: [6-(2,5-Дифторфенилкарбонил)пиридин-3-ил]метилацетат
[Химическая формула 29]
При нагревании и кипячении с обратным холодильником н-бромсукцинимид (6,0 г, 33,6 ммоль) и каталитическое количество 2,2'-азобис(2-метилпропионитрил) добавляли к раствору 2-[(2,5-дифторфенил)-гидроксиметил]-5-метилпиридина (2,64 г, 11,2 ммоль), полученного в ссылочном примере 5, в тетрахлориде углерода (60 мл). Полученную смесь затем перемешивали. После кипячения с обратным холодильником в течение 7 часов реакционную смесь охлаждали до комнатной температуры и добавляли к водному раствору тиосульфата натрия. Полученную смесь экстрагировали простым эфиром. Экстракт промывали насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором, затем сушили над сульфатом натрия. Остаток, полученный концентрацией раствора при пониженном давлении, растворяли в толуоле. Полученный раствор снова концентрировали.
Полученный остаток растворяли в N,N-диметилформамиде (20 мл). К полученному раствору добавляли ацетат натрия (4,59 г, 56 ммоль) и смесь перемешивали при 70°C в течение 17 часов. После охлаждения реакционную смесь растворяли в этилацетате (100 мл). Раствор промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом магния и затем концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат=5:1) с получением указанного в заголовке соединения (600 мг, 18%) в виде масла.
1H-ЯМР (400 МГц, CDCl3)δ: 2,12 (3H, с), 5,19 (2H, с), 7,10 (1H, м), 7,19 (1H, м), 7,37 (1H, с), 7,88 (1H, дд, J=2,4,8,0 Гц), 8,07 (1H, д, J=8,0 Гц), 8,62 (1H, д, J=2,4 Гц).
MS m/z: 292 (M++H).
Ссылочный Пример 22: 2-[(2,5-Дифторфенил)-гидроксиметил]-5-(1,3-диоксолан-2-ил)пиридин
[Химическая формула 30]
К раствору в пиридине (60 мл) 5-дибромметил-2-(2,5-дифторбензоил)пиридина (Соединение A) (3,91 г, 10 ммоль), полученного в ссылочном примере 20, добавляли этиленгликоль (6,2 г, 100 ммоль). Полученную смесь перемешивали при нагревании при 90°C в течение 17 часов. Реакционную смесь концентрировали при пониженном давлении. Полученный остаток растворяли в простом эфире (200 мл). Полученный раствор промывали водой, насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток растворяли в этаноле (60 мл). К полученному раствору добавляли при охлаждении льдом борогидрид натрия (190 мг, 5 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 1 часа. После добавления воды смесь экстрагировали этилацетатом. Экстракт промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и затем концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат=5:1 → 1:1) с получением указанного в заголовке соединения (1,52 г, 52%) в виде масла.
1H-ЯМР (400 МГц, CDCl3)δ: 4,0-4,2 (4H, м), 5,84 (1H, с), 6,10 (1H, с), 6,91 (1H, м), 6,99 (1H, м), 7,09 (1H, м), 7,26 (1H, д, J=8,0 Гц), 7,76 (1H, дд, J=2,0, 8,0 Гц), 8,64 (1H, д, J=2,0 Гц).
MS m/z: 294 (M++H).
Ссылочный Пример 23: 3-Хлор-4-[(2,5-дифторфенил)-гидроксиметил]пиридин
[Химическая формула 31]
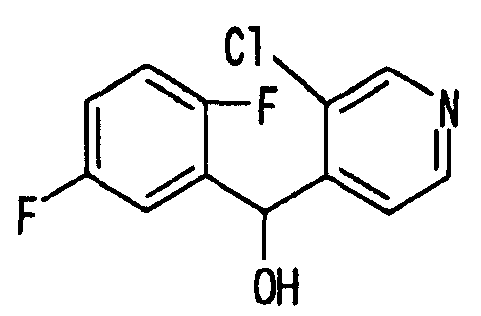
К раствору диизопропиламина (1,4 мл, 10 ммоль) в тетрагидрофуране (14 мл) при -78°C добавляли н-бутиллитий (6,3 мл, 1,59M раствор в гексане). Полученную смесь перемешивали в течение 10 минут, затем добавляли 3-хлорпиридин (1,13 г, 10 ммоль). Через тридцать минут добавляли 2,5-дифторбензальдегид (1,09 мл, 10 ммоль) и температуру полученной смеси постепенно повышали до 0°C. Смесь перемешивали еще в течение 10 минут. После добавления водного раствора хлорида аммония полученную смесь разбавляли этилацетатом (80 мл). Органический слой отделяли, промывали насыщенным солевым раствором и затем сушили. После фильтрования осадок, полученный концентрацией раствора при пониженном давлении, растирали в порошок с этанолом с получением указанного в заголовке соединения (1,33 г, 52%).
1H-ЯМР (400 МГц, CDCl3)δ: 4,87 (1H, шир.), 6,26 (1H, с), 6,90-7,02 (3H, м), 7,58 (1H, д, J=4,8 Гц), 8,47 (1H, с), 8,48 (1H, д, J=4,8 Гц).
Т.пл.: 169-170°C.
MS m/z: 255 (M+).
Ссылочный Пример 24: 2,5-Дихлор-4-[(2,5-дифторфенил)-гидроксиметил]пиридин
[Химическая формула 32]
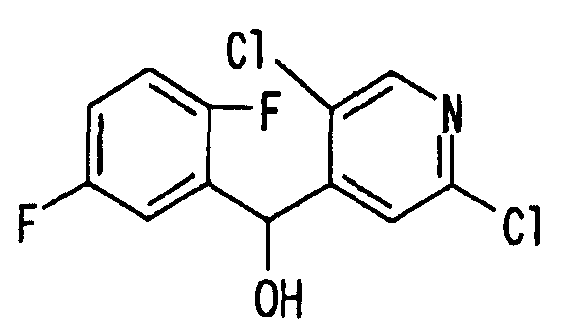
К раствору диизопропиламина (1,4 мл, 10 ммоль) в тетрагидрофуране (14 мл) при -78°C добавляли н-бутиллитий (6,3 мл, 1,59M раствор в гексане). После перемешивания в течение 10 минут к реакционной смеси добавляли 2,5-дихлорпиридин (1,48 г, 10 ммоль). Через тридцать минут добавляли 2,5-дифторбензальдегид (1,09 мл, 10 ммоль) и температуру полученной смеси постепенно повышали до 0°C. Перемешивание продолжали еще в течение 10 минут. После добавления водного раствора хлорида аммония полученную смесь разбавляли этилацетатом (80 мл). Органический слой отделяли, промывали насыщенным солевым раствором и затем сушили. После фильтрования осадок, полученный концентрацией фильтрата при пониженном давлении, растирали в порошок с этанолом с получением указанного в заголовке соединения (1,93 г, 67%).
1H-ЯМР (400 МГц, CDCl3)δ: 2,64 (1H, д, J=4,0 Гц), 6,28 (1H, д, J=4,0 Гц), 6,89 (1H, м), 7,02 (2H, м), 7,64 (1H, с), 8,30 (1H, с).
Т.пл.: 160-161°C.
MS m/z: 289 (M+).
Ссылочный Пример 25: (3,6-Дихлорпиридин-2-ил)(пиридин-4-ил)метанол
[Химическая формула 33]
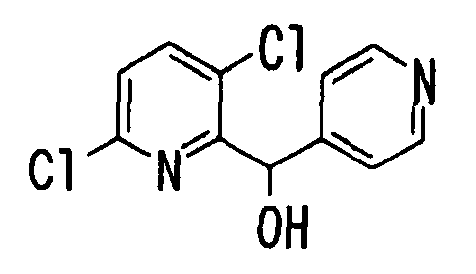
При перемешивании при -78°C трет-бутиллитий (1,51M раствор в пентане: 4,6 мл) добавляли по каплям к раствору 2,5-дихлорпиридина (1,02 г, 6,89 ммоль) в простом эфире (20 мл). После перемешивания при -78°C в течение 2 часов к реакционной смеси добавляли пиридин-4-карбальдегид (0,65 мл, 6,89 ммоль). Полученную смесь перемешивали при -78°C в течение 1 часа. Затем к реакционной смеси добавляли воду. Температуру полученной смеси повышали до комнатной температуры. Смесь экстрагировали метиленхлоридом. Экстракт затем сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали колоночной хроматографии на силикагеле. Фракцию, полученную при элюировании смесью метанол:метиленхлорид (=1:50), концентрировали при пониженном давлении. Полученное твердое вещество промывали простым эфиром и затем собирали фильтрованием с получением указанного в заголовке соединения (819 мг, 3,21 ммоль, 47%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 4,64 (1H, шир.д, J=6,3 Гц), 6,00 (1H, шир.д, J=6,3 Гц), 7,27 (1H, д, J=8,6 Гц), 7,31 (2H, д, J=5,8 Гц), 7,67 (1H, д, J=8,6 Гц), 8,57 (2H, д, J=5,8 Гц).
MS (m/z): 254 (M+).
Ссылочный Пример 26: O-этил S-(6-хлор-3-пиридил)дитиокарбонат
[Химическая формула 34]
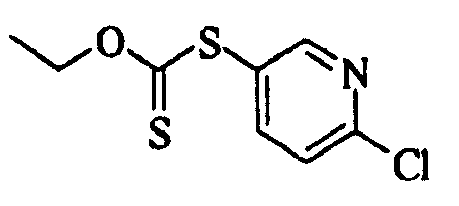
5-Амино-2-хлорпиридин (643 мг, 3,00 ммоль) растворяли в 1 н. хлористоводородной кислоте (10 мл). Добавляли по каплям при -5°C водный (1 мл) раствор нитрита натрия (207 мг, 3,00 ммоль). Реакционную смесь перемешивали при 60°C в течение 30 минут и затем при указанной температуре добавляли по каплям водный (1 мл) раствор O-этилдитиокарбонат калия (481 мг, 3,00 ммоль). Реакционную смесь перемешивали при 80°C в течение 1 часа, затем реакционную смесь охлаждали до комнатной температуры. Добавляли этилацетат и полученную смесь промывали насыщенным водным раствором бикарбоната натрия. Органический слой сушили над безводным сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=49:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (148 мг, 0,63 ммоль, 21%) в виде желтого масла.
1H-ЯМР (400 МГц, CDCl3)δ: 1,37 (3H, т, J=7,1 Гц), 4,63 (2H, т, J=7,1 Гц), 7,41 (1H, д, J=8,3 Гц), 7,76 (1H, дд, J=8,3,2,4 Гц), 8,45 (1H, д, J=2,4 Гц).
MS m/z: 234(M++H).
Ссылочный Пример 27: (2,6-Дихлор-5-фторпиридин-3-ил)метанол
[Химическая формула 35]
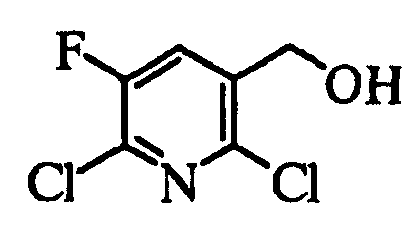
Этилхлорформиат (1,32 мл, 13,8 ммоль) добавляли при охлаждении льдом к раствору 2,6-дихлор-5-фторникотиновой кислоты (2,76 г, 13,1 ммоль) и триэтиламина (1,92 мл, 13,8 ммоль) в толуоле (60 мл). После перемешивания при комнатной температуре в течение 1 часа реакционную смесь концентрировали при пониженном давлении.
Остаток растворяли в тетрагидрофуране (30 мл). Полученный раствор добавляли по каплям, при -78°C, к суспензии литийалюминийгидрида (524 мг, 13,8 ммоль) в тетрагидрофуране (20 мл). Температуру реакционной смеси повышали до 0°C. К смеси добавляли по каплям 1 н. водный раствор гидроксида натрия (3,25 мл). Осадок отфильтровывали через целит и фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=9:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (1,93 г, 9,85 ммоль, 75%) в виде оранжевого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 2,18 (1H, шир. с), 4,77 (2H, с), 7,77 (1H, д, J=7,8 Гц).
Т.пл.: 65-67°C.
Ссылочный Пример 28: 3-(трет-Бутилдифенилсилилоксиметил)-5-фторпиридин
[Химическая формула 36]
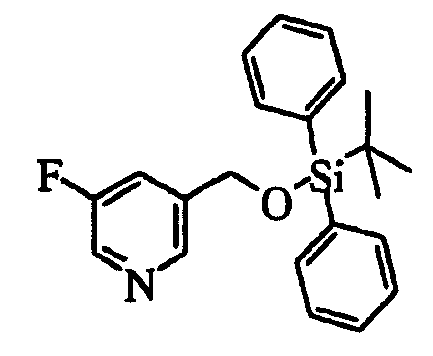
К раствору (2,6-дихлор-5-фторпиридин-3-ил)метанола (18,9 г, 96,2 ммоль), полученного в ссылочном примере 27, и триэтиламина (32,2 мл, 231 ммоль) в этаноле (650 мл) добавляли катализатор 10% палладий на углероде (3,20 г). Полученную смесь перемешивали в течение 7 часов в атмосфере водорода. Катализатор отфильтровывали через целит, затем фильтрат концентрировали при пониженном давлении. К полученному остатку добавляли насыщенный водный раствор бикарбоната натрия, а затем экстрагировали хлороформом. Органический слой сушили над безводным сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении.
Полученный остаток растворяли в дихлорметане (600 мл). К полученному раствору последовательно добавляли триэтиламин (14,8 мл, 106 ммоль), трет-бутилхлордифенилсилан (25,0 мл, 96,3 ммоль) и 4-диметиламинопиридин (1,18 г, 9,63 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 14 часов. Реакционную смесь промывали насыщенным водным раствором бикарбоната натрия. Органический слой сушили над безводным сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали флэш-хроматографии на силикагеле, и фракцию, полученную при элюировании смесью гексан:этилацетат=19:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (30,0 г, 81,9 ммоль, 85%) в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3)δ: 1,10 (9H, с), 4,78 (2H, с), 7,36-7,49 (7H, м), 7,63-7,70 (4H, м), 8,32 (1H, с), 8,36 (1H, д, J=2,4 Гц).
MS m/z: 366 (M++H).
Ссылочный Пример 29: [5-(трет-Бутилдифенилсилилоксиметил)-3-фторпиридин-2-ил] (2,5-дифторфенил)метанол
[Химическая формула 37]
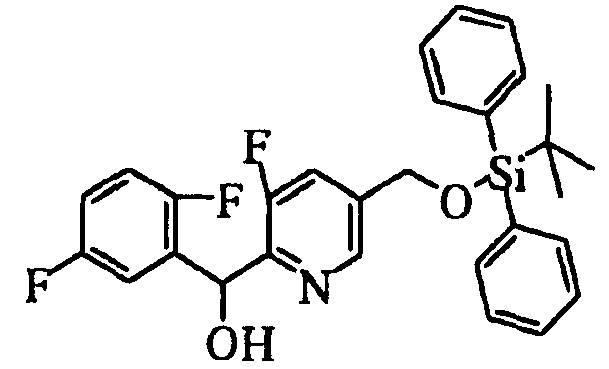
При -78°C раствор н-бутиллития в гексане (30,0 мл, 46,8 ммоль) и N,N,N',N'-тетраметилэтилендиамин (7,06 мл, 46,8 ммоль) добавляли последовательно к диэтиловому эфиру (250 мл). После перемешивания при -20°C в течение 30 минут реакционную смесь охлаждали до -78°C и добавляли раствор 3-(трет-бутилдифенилсилилоксиметил)-5-фторпиридина (15,5 г, 42,5 ммоль) в диэтиловом эфире (50 мл). Полученную смесь перемешивали при указанной температуре в течение 30 минут. К реакционной смеси добавляли 2,5-дифторбензальдегид (6,04 г, 42,5 ммоль). Полученную смесь перемешивали в течение 2 часов. К реакционной смеси добавляли воду, а затем насыщенный водный раствор бикарбоната натрия. Полученную смесь экстрагировали диэтиловым эфиром. Органический слой сушили над безводным сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=9:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (17,0 г, 33,5 ммоль, 79%) в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3)δ: 1,10 (9H, с), 4,78 (2H, с), 5,12 (1H, д, J=6,6 Гц), 6,22 (1H, д, J=6,6 Гц), 6,87-7,04 (3H, м), 7,33-7,48 (7H, м), 7,61-7,70 (4H, м), 8,32 (1H, с).
MS m/z: 508 (M++H).
Ссылочный Пример 30: (2,5-Дифторфенил) (3-фтор-5-гидроксиметилпиридин-2-ил)метанол
[Химическая формула 38]
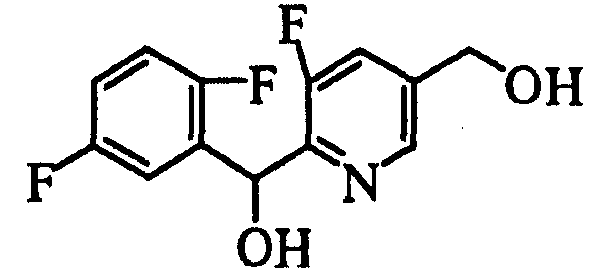
К раствору [5-(трет-бутилдифенилсилилоксиметил)-3-фторпиридин-2-ил] (2,5-дифторфенил)метанола (853 мг, 1,68 ммоль) в тетрагидрофуране (7 мл) добавляли раствор (1,04 мл, 1,04 ммоль) тетрабутиламмонийфторида в тетрагидрофуране. Смесь перемешивали при комнатной температуре в течение 5 часов. Реакционную смесь концентрировали при пониженном давлении и затем полученный остаток растворяли в этилацетате. Полученный раствор промывали насыщенным водным раствором бикарбоната натрия. Органический слой сушили над безводным сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=1:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (413 мг, 1,53 ммоль, 91 %) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 1,91 (1H, т, J=5,4 Гц), 4,79 (2H, д, J=5,4 Гц), 5,16 (1H, д, J=6,6 Гц), 6,23 (1H, д, J=6,6 Гц), 6,75-7,04 (3H, м), 7,46 (1H, д, J=9,8 Гц), 8,41 (1H, с).
Т.пл.: 94-96°C.
MS m/z: 270 (M++H).
Ссылочный Пример 31: 6-(2,5-Дифторфенил)гидроксиметил-5-фторникотинамид
[Химическая формула 39]
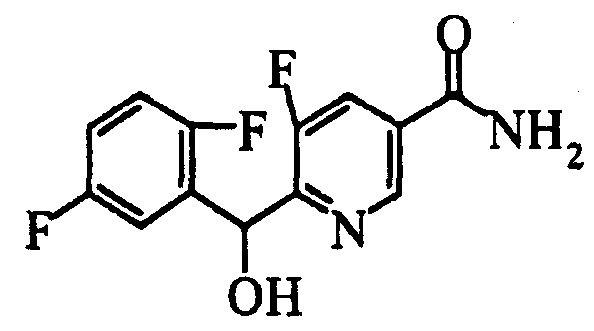
К раствору (2,5-дифторфенил) (3-фтор-5-гидроксиметилпиридин-2-ил)метанола (406 мг, 1,51 ммоль), полученного в ссылочном примере 30, в ацетоне (9 мл) добавляли водный (9 мл) раствор перманганата калия (795 мг, 7,03 ммоль) и полученную смесь нагревали при кипячении с обратным холодильником в течение 4 часов. Осадок отфильтровывали через целит. Фильтрат подкисляли 1 н. раствором хлористоводородной кислоты, а затем экстрагировали дихлорметаном. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток промывали смесью растворителей гексана и дихлорметана и затем собирали фильтрованием с получением белого твердого вещества (367 мг).
К раствору полученного твердого вещества (240 мг) в N,N-диметилформамиде (8 мл) добавляли гексафторфосфат 1H-бензотриазол-1-илокситрипирролидинофосфония (666 мг, 1,28 ммоль), бензотриазол-1-ол (173 мг, 1,28 ммоль), N-этилдиизопропиламин (0,595 мл, 3,41 ммоль) и хлорид аммония (91 мг, 1,71 ммоль) и полученную смесь перемешивали при комнатной температуре в течение 9 часов. К реакционной смеси добавляли этилацетат. Полученную смесь промывали последовательно насыщенным водным раствором хлорида аммония, насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали флэш-хроматографии на силикагеле и фракцию, полученную при элюировании смесью гексан:этилацетат=1:4, концентрировали при пониженном давлении.
Полученный остаток растворяли в этаноле (8 мл). При 0°C к полученному раствору добавляли борогидрид натрия (30 мг, 0,79 ммоль). После перемешивания при комнатной температуре в течение 1 часа к реакционной смеси добавляли воду. Полученную смесь экстрагировали дихлорметаном. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную элюированием этилацетатом, концентрировали при пониженном давлении с получением указанного в заголовке соединения (118 мг, 0,42 ммоль, 42%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 4,97 (1H, д, J=6,6 Гц), 6,27 (1H, д, J=6,6 Гц), 6,91-7,06 (3H, м), 7,87 (1H, дд, J=9,4, 1,6 Гц), 8,81 (1H, с).
Т.пл.: 162-164°C.
MS m/z: 283 (M++H).
Ссылочный Пример 32: 2-[(2,5-Дифторфенил)гидроксиметил]-6-(1,3-диоксолан-2-ил)пиридин
[Химическая формула 40]
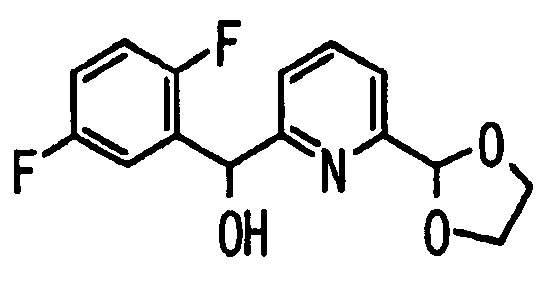
Раствор изопропилмагнийхлорида (2,0M, 12,4 мл, 24,8 ммоль) в тетрагидрофуране в атмосфере аргона добавляли по каплям при охлаждении льдом к раствору 2-бром-6-(1,3-диоксолан-2-ил)пиридина (2,7 мл, 24,8 ммоль) в тетрагидрофуране (20 мл). Реакционную смесь перемешивали при комнатной температуре в течение 3 часов. К полученному коричневому раствору добавляли по каплям при охлаждении льдом 2,5-дифторбензальдегид (2,7 мл, 24,8 ммоль). Температуру реакционной смеси постепенно повышали до комнатной температуры и затем перемешивание продолжали в течение 16 часов. Добавляли насыщенный водный раствор хлорида аммония, затем полученную смесь экстрагировали этилацетатом. Экстракт промывали последовательно водой и насыщенным солевым раствором. Полученный органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=4:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (2,90 г, 9,89 ммоль, 40%) в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3)δ: 4,09-4,21 (4H, м), 5,43 (1H, д, J=4,4 Гц), 5,90 (1H, с), 6,11 (1H, д, J=4,4 Гц), 6,87-6,95 (1H, м), 6,99-7,05 (1H, м), 7,10-7,15 (1H, м), 7,23 (1H, д, J=7,8 Гц), 7,48 (1H, д, J=7,8 Гц), 7,72 (1H, т, J=7,8 Гц).
MS m/z: 294 (M++H).
Ссылочный Пример 33: 1-[3-(трет-Бутилдиметилсилилокси)пропил]пиперидин-2-он
[Химическая формула 41]
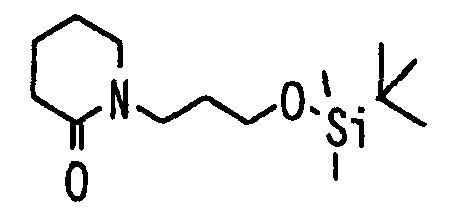
Гидрид натрия (60% в масле, 2,22 г, 55,6 ммоль) добавляли по порциям при 0°C к раствору (200 мл) пиперидин-2-она (5,00 г, 50,5 ммоль) в тетрагидрофуране. Реакционную смесь затем перемешивали при комнатной температуре в течение 3 часов. После добавления к реакционной смеси (3-бромпропокси)-трет-бутилдиметилсилана (14,1 мл, 60,6 ммоль) и N,N-диметилформамида (20 мл) полученную смесь перемешивали при комнатной температуре в течение 4 дней. К реакционной смеси добавляли воду, а затем экстрагировали этилацетатом. Экстракт промывали водой и насыщенным солевым раствором, сушили над сульфатом магния и концентрировали. Полученный остаток подвергали колоночной хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=2:1, концентрировали с получением указанного в заголовке соединения (6,44 г, 23,8 ммоль, 47%) в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3)δ: 0,05 (6H, с), 0,89 (9H, с), 1,74-1,85 (6H, м), 2,36 (2H, т, J=6,0 Гц), 3,27-3,32 (2H, м), 3,39-3,43 (2H, м), 3,65 (2H, т, J=6,3 Гц).
MS m/z: 272 (M++H).
Ссылочный Пример 34: 3-Бром-1-[3-(трет-бутилдиметилсилилокси)пропил]пиперидин-2-он
[Химическая формула 42]
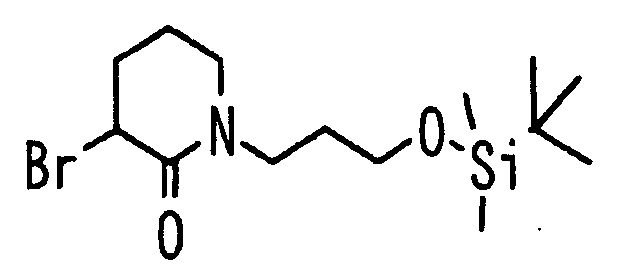
трет-Бутиллитий (1,50M раствор в пентане, 1,40 мл, 2,10 ммоль) добавляли по каплям в атмосфере аргона к раствору (5 мл) 1-[3-(трет-бутилдиметилсилилокси)пропил]пиперидин-2-она (542 мг, 2,00 ммоль) в тетрагидрофуране при -78°C. Реакционную смесь перемешивали при -78°C в течение 15 минут. После добавления к реакционной смеси раствора трибромида тетрабутиламмония (1,16 г, 2,40 ммоль) в тетрагидрофуране (5 мл) температуру полученной смеси постепенно повышали до -40°C при перемешивании. К реакционной смеси при -40°C добавляли воду и затем температуру смеси повышали до комнатной температуры. Реакционную смесь экстрагировали этилацетатом. Экстракт промывали водой и насыщенным солевым раствором, сушили над сульфатом магния и концентрировали. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=2:3, концентрировали с получением указанного в заголовке соединения (72,8 мг, 0,208 ммоль, 10%) в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3)δ: 0,05 (6H, с), 0,89 (9H, с), 1,74-1,88 (3H, м), 2,18-2,32 (3H, м), 3,28-3,48 (4H, м), 3,65 (2H, т, J=6,1 Гц), 4,53-4,57 (1H, м).
MS m/z: 350 (M++H).
Пример 1: 2-[[(4-Хлорфенил)сульфонил](циклогексил)метил]-1,4-дифторбензол
[Химическая формула 43]
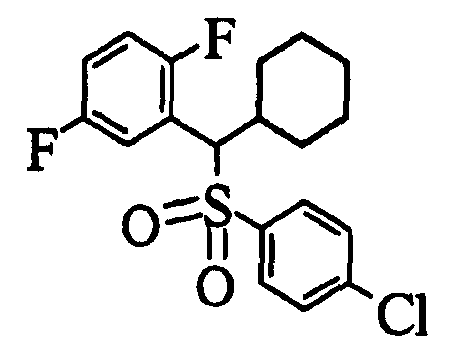
2-[(4-Хлорфенил)сульфонилметил]-1,4-дифторбензол (240 мг, 0,793 ммоль), полученный в ссылочном примере 1, растворяли в толуоле (20 мл). После добавления циклогексанола (0,11 мл, 1,0 ммоль) и цианометилентри-н-бутилфосфорана (250 мг, 1,0 ммоль) полученную смесь нагревали при кипячении с обратным холодильником в течение 14 часов в атмосфере аргона. Реакционной смеси давали охладиться и затем добавляли циклогексанол (0,22 мл, 2,1 ммоль) и цианометилентри-н-бутилфосфоран (500 мг, 2,08 ммоль). Полученную смесь нагревали при кипячении с обратным холодильником в течение 14 часов в атмосфере аргона. Реакционной смеси давали охладиться и концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат=30:1) с получением белого твердого вещества. Белое твердое вещество промывали гексаном с получением указанного в заголовке соединения (188 мг, 62%) в виде белого порошка.
Температура плавления: 107-109°C.
1H-ЯМР (400 МГц, CDCl3)δ: 0,92-1,08 (1H, м), 1,08-1,22 (1H, м), 1,22-1,50 (3H, м), 1,60-1,75 (3H, м), 1,75-1,88 (1H, м), 2,37 (1H, шир.д, J=12,5 Гц), 2,48-2,62 (1H, м), 4,44 (1H, д, J=7,6 Гц), 6,68-6,80 (1H, м), 6,86-6,95 (1H, м), 7,30 (2H, дм, J=8,6 Гц), 7,38-7,52 (1H, м), 7,49 (2H, дм, J=8,6 Гц).
Элементный Анализ для C19H19ClF2O2S. Рассчитано: C 59,29; H 4,98; Cl 9,21; F 9,87; S 8,33. Найдено: C 59,11; H 4,93; Cl 9,18; F 9,82; S 8,49.
Пример 2: 4-[(4-Хлорфенилсульфонил)(циклопентил)метил]-пиридин
[Химическая формула 44]
Раствор в толуоле (5 мл) 4-(4-хлорфенилсульфонилметил)пиридина (70 мг, 0,261 ммоль), полученного в ссылочном примере 2, циклопентанола (49 мкл, 0,538 ммоль) и цианометилентри-н-бутилфосфорана (129 мг, 0,538 моль) нагревали при кипячении с обратным холодильником в течение 3 дней в атмосфере аргона. После охлаждения до комнатной температуры к реакционной смеси добавляли циклопентанол (49 мкл, 0,538 ммоль) и цианометилентри-н-бутилфосфоран (129 мг, 0,538 моль). Реакционную смесь нагревали при кипячении с обратным холодильником в течение 22 часов в атмосфере аргона. Реакционную смесь охлаждали до комнатной температуры и затем концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле и фракцию, полученную при элюировании смесью гексан:этилацетат (=2:1), концентрировали при пониженном давлении с получением указанного в заголовке соединения (77 мг, 88%) в виде белого твердого вещества. Полученное твердое вещество промывали смесью гексан-простой эфир и фильтровали с получением указанного в заголовке соединения в виде белого порошка.
Температура плавления: 133-135°C.
1H-ЯМР (400 МГц, CDCl3)δ: 0,92-1,08 (1H, м), 1,44-1,83 (6H, м), 2,33-2,45 (1H, м), 2,78-2,90 (1H, м), 3,88 (1H, д, J=10,3 Гц), 7,03 (2H, д, J=5,1 Гц), 7,32 (2H, д, J=8,6 Гц), 7,43 (2H, д, J=8,6 Гц), 8,46 (2H, д, J=5,6 Гц).
Элементный Анализ для C17H18ClNO2S. Рассчитано: C 60,80; H 5,40; Cl 10,56; N 4,17; S 9,55. Найдено: C 60,76; H 5,44; Cl 10,68; N 4,20; S 9,61.
Пример 3: 4-[(4-Хлорфенилсульфонил)(тетрагидропиран-4-ил)метил]пиридин
[Химическая формула 45]
Раствор в толуоле (5 мл) 4-(4-хлорфенилсульфонилметил)пиридина (70 мг, 0,261 ммоль), полученного в ссылочном примере 2, тетрагидропиран-4-ола (51 мкл, 0,538 ммоль) и цианометилентри-н-бутилфосфорана (129 мг, 0,538 моль) нагревали при кипячении с обратным холодильником в течение 3 дней в атмосфере аргона. После охлаждения реакционной смеси до комнатной температуры к смеси добавляли тетрагидропиран-4-ол (51 мкл, 0,538 ммоль) и цианометилентри-н-бутилфосфоран (129 мг, 0,538 моль). Смесь нагревали при кипячении с обратным холодильником в атмосфере аргона в течение 22 часов. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат (=1:2), концентрировали при пониженном давлении с получением указанного в заголовке соединения (65 мг, 71%) в виде белого твердого вещества. Полученное твердое вещество промывали смесью гексан-простой эфир и фильтровали с получением указанного в заголовке соединения в виде белого порошка.
Температура плавления: 208-209°C.
1H-ЯМР (400 МГц, CDCl3)δ: 1,22-1,42 (2H, м), 1,60-1,75 (1H, м), 2,30-2,40 (1H, м), 2,78-3,01 (1H, м), 3,41 (1H, тд, J=11,7, 2,4 Гц), 3,51 (1H, тд, J=11,9, 2,0 Гц), 3,80-3,93 (1H, м), 3,87 (1H, д, J=8,6 Гц), 3,98-4,06 (1H, м), 7,00-7,12 (2H, м), 7,30 (2H, д, J=8,8 Гц), 7,43 (2H, д, J=8,6 Гц), 8,47 (2H, д, J=5,4 Гц).
MS (m/z): 352 (M++H).
Пример 4: 4-[(1-Бензилпиперидин-4-ил)(4-хлорфенилсульфонил)метил]пиридин
[Химическая формула 46]
Раствор в толуоле (5 мл) 4-(4-хлорфенилсульфонилметил)пиридина (70 мг, 0,261 ммоль), полученного в ссылочном примере 2, 1-бензилпиперидин-4-ола (103 мг, 0,538 ммоль) и цианометилентри-н-бутилфосфорана (129 мг, 0,538 моль) нагревали при кипячении с обратным холодильником в течение 3 дней в атмосфере аргона. После охлаждения до комнатной температуры к реакционной смеси добавляли 1-бензилпиперидин-4-ол (103 мг, 0,538 ммоль) и цианометилентри-н-бутилфосфоран (129 мг, 0,538 моль). Полученную смесь нагревали в атмосфере аргона при кипячении с обратным холодильником в течение 22 часов. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью метанол:метиленхлорид (=1:10), концентрировали при пониженном давлении. Полученный остаток очищали высокоэффективной жидкостной хроматографией (используя смешанную систему растворителей вода/ацетонитрил/муравьиная кислота), с получением указанного в заголовке соединения (40 мг, 35%) в виде аморфного вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 1,21-1,37 (2H, м), 1,49-1,70 (1H, м), 1,92-2,01 (1H, м), 2,03-2,14 (1H, м), 2,25-2,35 (1H, м), 2,52-2,65 (1H, м), 2,79-2,85 (1H, м), 2,90-3,00 (1H, м), 3,47 (2H, с), 3,86 (1H, д, J=8,1 Гц), 7,02-7,12 (2H, м), 7,20-7,38 (7H, м), 7,43 (2H, д, J=8,5 Гц), 8,45 (2H, д, J=5,4 Гц).
HRMS (FAB): как C24H26O2N2ClS (M++H).
Рассчитано: 441,1404. Найдено: 441,1387.
Пример 5: 4-[(4-Хлорфенилсульфонил)(1-метилпиперидин-4-ил)метил]пиридин
[Химическая формула 47]
Раствор 4-(4-хлорфенилсульфонилметил)пиридина (70 мг, 0,261 ммоль), полученного в ссылочном примере 2, 1-метилпиперидин-4-ола (62 мкл, 0,538 ммоль) и цианометилентри-н-бутилфосфорана (62 мкл, 0,538 моль) в толуоле (5 мл) нагревали при кипячении с обратным холодильником в течение 3 дней в атмосфере аргона. После охлаждения до комнатной температуры к реакционной смеси добавляли 1-метилпиперидин-4-ол (62 мкл, 0,538 ммоль) и цианометилентри-н-бутилфосфоран (129 мг, 0,538 моль). Полученную смесь нагревали при кипячении с обратным холодильником в течение 22 часов в атмосфере аргона. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Полученный остаток подвергали колоночной хроматографии на силикагеле. Фракцию, полученную при элюировании смесью метанол:метиленхлорид (=1:50), концентрировали при пониженном давлении. Полученный остаток очищали высокоэффективной жидкостной хроматографией (использовали смешанную систему растворителей вода/ацетонитрил/муравьиная кислота) с получением указанного в заголовке соединения (31 мг, 33%) в виде белого твердого вещества. Полученное твердое вещество промывали смесью гексан-эфир и фильтровали с получением указанного в заголовке соединения в виде белого порошка.
Температура плавления: 176-177°C.
1H-ЯМР (400 МГц, CDCl3)δ: 1,22-1,38 (2H, м), 1,50-1,68 (1H, м), 1,88-1,99 (1H, м), 2,00-2,10 (1H, м), 2,25 (3H, с), 2,30-2,40 (1H, м), 2,50-2,63 (1H, м), 2,74-2,83 (1H, м), 2,89-2,95 (1H, м), 3,86 (1H, д, J=8,3 Гц), 7,08 (2H, д, J=4,6 Гц), 7,30 (2H, д, J=8,6 Гц), 7,44 (2H, д, J=8,6 Гц), 8,46 (2H, д, J=5,6 Гц).
Элементный Анализ для C18H21ClN2O2S. Рассчитано: C 59,25; H 5,80; Cl 9,72; N 7,68; S 8,79. Найдено: C 59,00; H 5,76; Cl 9,75; N 7,61; S 8,77.
Пример 6: 2-[[(4-Хлорфенил)тио]-(2,5-дифторфенил)-метил]пиридин
[Химическая формула 48]
2-[(2,5-Дифторфенил)-гидроксиметил]пиридин (88 мг, 0,40 ммоль), полученный в ссылочном примере 3, растворяли в тионилхлориде (2,0 мл). К полученному раствору добавляли каталитическое количество диметилформамида с последующим перемешиванием в течение 15 часов. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли диоксан и полученную смесь снова концентрировали. Остаток растворяли в диметилформамиде (5 мл). К полученному раствору в атмосфере азота добавляли 4-хлорбензолтиол (79 мг, 0,55 ммоль) и карбонат калия (226 мг, 1,64 ммоль) и смесь перемешивали при 50°C в течение 1 часа. После охлаждения реакционной смеси до комнатной температуры к смеси добавляли диэтиловый эфир (50 мл). Полученную смесь промывали водой и насыщенным солевым раствором. Органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток подвергали хроматографии на силикагеле (гексан:этилацетат=10:1) с получением указанного в заголовке соединения (128 мг, 92%) в виде масла.
1H-ЯМР (400 МГц, CDCl3)δ: 5,89 (1H, с), 6,80-7,27 (7H, м), 7,38 (1H, д, J=7,6 Гц), 7,48 (1H, м), 7,65 (1H, м), 8,63 (1H, м).
MS m/z: 348 (M++H).
Пример 7: 2-[[(4-Хлорфенил)тио]-(2,5-дифторфенил)метил]-3-метилпиридин
[Химическая формула 49]
К раствору гидрохлорида 2-[хлор-(2,5-дифторфенил)метил]-3-метилпиридина (94 мг, 0,32 ммоль), полученного в ссылочном примере 4, в диметилформамиде (5 мл) добавляли в атмосфере азота 4-хлорбензолтиол (70 мг, 0,49 ммоль) и карбонат калия (265 мг, 1,92 ммоль). Полученную смесь перемешивали при 50°C в течение 1 часа. После охлаждения реакционной смеси до комнатной температуры к смеси добавляли диэтиловый эфир (50 мл). Полученную смесь промывали водой и насыщенным солевым раствором. Органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток подвергали хроматографии на силикагеле (гексан:этилацетат=10:1) с получением указанного в заголовке соединения (103 мг, 89%) в виде масла.
1H-ЯМР (400 МГц, CDCl3)δ: 2,21 (3H, с), 5,87 (1H, с), 6,77 (1H, м), 7,00-7,19 (5H, м), 7,36 (1H, м), 7,45 (1H, м), 8,45 (1H, дд, J=1,2, 4,8 Гц).
MS m/z: 362 (M++H).
Пример 8: 2-[[(4-Хлорфенил)тио]-(2,5-дифторфенил)метил]-4-метилпиридин
[Химическая формула 50]
После растворения 2-[(2,5-дифторфенил)-гидроксиметил]-4-метилпиридина (235 мг, 0,53 ммоль), полученного в ссылочном примере 6, в тионилхлориде (2,0 мл) к полученному раствору добавляли каталитическое количество диметилформамида. Полученную смесь перемешивали в течение 16 часов. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли диоксан, а затем снова концентрировали. Полученный остаток растворяли в диметилформамиде (10 мл). К полученному раствору в атмосфере азота добавляли 4-хлорбензолтиол (217 мг, 1,5 ммоль) и карбонат калия (828 мг, 6,0 ммоль). Полученную смесь перемешивали при 50°C в течение 1 часа. После охлаждения реакционной смеси до комнатной температуры к смеси добавляли диэтиловый эфир (50 мл). Полученную смесь промывали водой и насыщенным солевым раствором. Органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток подвергали хроматографии на силикагеле (гексан:этилацетат=10:1) с получением указанного в заголовке соединения (290 мг, 80%) в виде масла.
1H-ЯМР (400 МГц, CDCl3)δ: 2,31 (3H, с), 5,82 (1H, с), 6,80-7,0 (3H, м), 7,15 (2H, д, J=8,8 Гц), 7,16 (1H, м), 7,21 (2H, д, J=8,8 Гц), 7,45 (1H, м), 8,45 (1H, д, J=5,6 Гц).
MS m/z: 362 (M++H).
Пример 9: 2-[[(4-Хлорфенил)тио]-(2,5-дифторфенил)метил]-3-метоксипиридин
[Химическая формула 51]
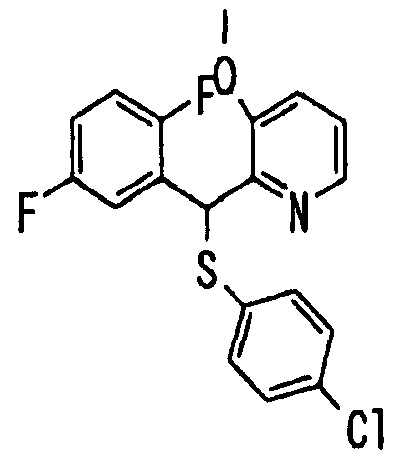
После растворения 2-[(2,5-дифторфенил)-гидроксиметил]-3-метоксипиридина (251 мг, 1,0 ммоль), полученного в ссылочном примере 9, в тионилхлориде (2,0 мл) к полученному раствору добавляли каталитическое количество диметилформамида. Полученную смесь перемешивали в течение 16 часов. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли диоксан, а затем снова концентрировали. Полученный остаток растворяли в диметилформамиде (10 мл). К полученному раствору добавляли в атмосфере азота 4-хлорбензолтиол (289 мг, 2,0 ммоль) и карбонат калия (1,10 г, 8,0 ммоль). Полученную смесь перемешивали при 50°C в течение 1 часа. После охлаждения реакционной смеси до комнатной температуры к смеси добавляли диэтиловый эфир (50 мл). Полученную смесь промывали водой и насыщенным солевым раствором. Органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток подвергали хроматографии на силикагеле (гексан:этилацетат=10:1) с получением указанного в заголовке соединения (256 мг, 58%) в виде масла.
1H-ЯМР (400 МГц, CDCl3)δ: 3,77 (3H, с), 6,25 (1H, с), 6,82 (2H, м), 7,15 (2H, д, J=8,4 Гц), 7,10-7,20 (2H, м), 7,25 (2H, д, J=8,8 Гц), 7,52 (1H, м), 8,24 (1H, м).
MS m/z: 378 (M++H).
Пример 10: 3-Аллилокси-2-[[(4-хлорфенил)тио]-(2,5-дифторфенил)метил]пиридин
[Химическая формула 52]
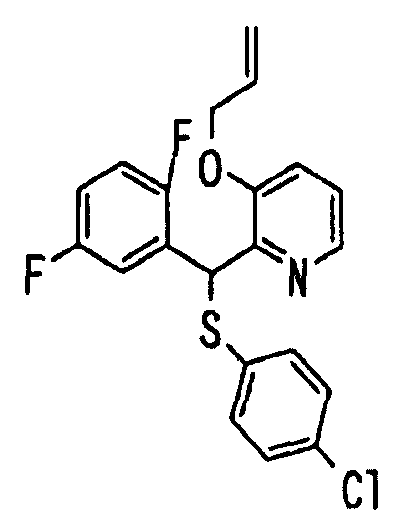
3-Аллилокси-2-[(2,5-дифторфенил)-гидроксиметил]пиридин (370 мг, 1,33 ммоль), полученный в ссылочном примере 10, растворяли в тионилхлориде (2,0 мл). К полученному раствору добавляли каталитическое количество диметилформамида. Полученную смесь перемешивали в течение 16 часов. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли диоксан, а затем снова концентрировали. Полученный остаток растворяли в диметилформамиде (10 мл). К полученному раствору добавляли в атмосфере азота 4-хлорбензолтиол (217 мг, 1,5 ммоль) и карбонат калия (828 мг, 6,0 ммоль). Полученную смесь перемешивали при 50°C в течение 1 часа. После охлаждения реакционной смеси до комнатной температуры к смеси добавляли диэтиловый эфир (50 мл). Полученную смесь промывали водой и насыщенным солевым раствором. Органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток подвергали хроматографии на силикагеле (гексан:этилацетат=10:1) с получением указанного в заголовке соединения (256 мг, 68%) в виде масла.
1H-ЯМР (400 МГц, CDCl3)δ: 4,46 (2H, м), 5,24 (1H, д, J=10,6 Гц), 5,28 (1H, д, J=17,2 Гц), 5,90 (1H, м), 6,29 (1H, д, J=1,2 Гц), 6,82 (2H, м), 7,15 (2H, д, J=8,4 Гц), 7,06-7,20 (2H, м), 7,24 (2H, д, J=8,4 Гц), 7,50 (1H, м), 8,24 (1H, м).
MS m/z: 404 (M++H).
Пример 11: 3-[[(4-Хлорфенил)тио]-(2,5-дифторфенил)метил]пиридин
[Химическая формула 53]
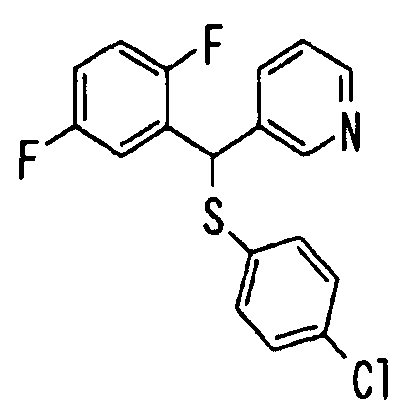
3-[(2,5-Дифторфенил)-гидроксиметил]пиридин (87 мг, 0,39 ммоль), полученный в ссылочном примере 11, растворяли в тионилхлориде (1,0 мл). К полученному раствору добавляли каталитическое количество диметилформамида и полученную смесь перемешивали в течение 14 часов. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли диоксан и полученную смесь снова концентрировали. Полученный остаток растворяли в диметилформамиде (5 мл), а затем добавляли в атмосфере азота 4-хлорбензолтиол (84 мг, 0,58 ммоль) и карбонат калия (323 мг, 2,34 ммоль). Полученную смесь перемешивали при 50°C в течение 1 часа. После охлаждения реакционной смеси до комнатной температуры к смеси добавляли диэтиловый эфир (50 мл). Полученную смесь промывали водой и насыщенным солевым раствором. Органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток подвергали хроматографии на силикагеле (гексан:этилацетат=1:1) с получением указанного в заголовке соединения (131 мг, 96%) в виде масла.
1H-ЯМР (400 МГц, CDCl3)δ: 5,73 (1H, с), 6,84-6,96 (2H, м), 7,18 (2H, м), 7,19 (2H, м), 7,15-7,22 (2H, м), 7,71 (1H, м), 8,49 (1H, дд, J=1,6,4,8 Гц), 8,58 (1H, д, J=2,0 Гц).
MS m/z: 348 (M++H).
Пример 12: 5-[[(4-Хлорфенил)тио]-(2,5-дифторфенил)метил]пиримидин
[Химическая формула 54]
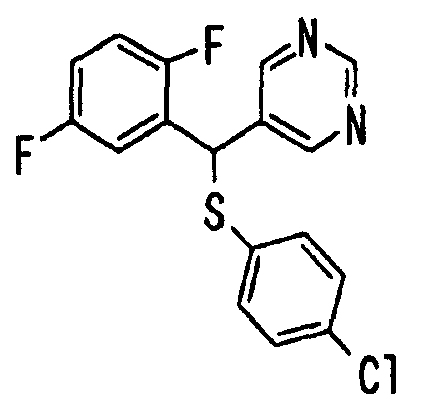
5-[(2,5-Дифторфенил)-гидроксиметил]пиримидин (111 мг, 0,5 ммоль), полученный в ссылочном примере 12, растворяли в тионилхлориде (1,0 мл). К полученному раствору добавляли каталитическое количество диметилформамида и полученную смесь перемешивали в течение 16 часов. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли диоксан и полученную смесь снова концентрировали. Остаток растворяли в диметилформамиде (5 мл), а затем добавляли в атмосфере азота 4-хлорбензолтиол (108 мг, 0,75 ммоль) и карбонат калия (414 мг, 3,0 ммоль). Полученную смесь перемешивали при 50°C в течение 1 часа. После охлаждения реакционной смеси до комнатной температуры к смеси добавляли диэтиловый эфир (50 мл). Полученную смесь промывали водой и насыщенным солевым раствором. Органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток подвергали хроматографии на силикагеле (гексан:этилацетат=4:1) с получением смеси (202 мг) в виде масла указанного в заголовке соединения и неидентифицированного соединения.
1H-ЯМР (400 МГц, CDCl3)δ: 5,66 (1H, с), 6,96 (2H, м), 7,17-7,34 (5H, д), 8,70 (2H, с), 9,09 (1H, с).
MS m/z: 349 (M++H).
Пример 13: 2-[[(4-Хлорфенил)сульфонил]-(2,5-дифторфенил)метил]пиридин
[Химическая формула 55]
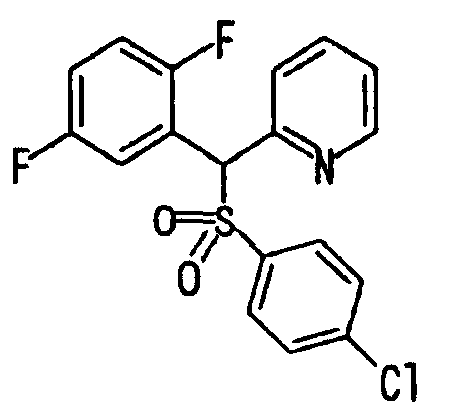
К раствору 2-[[(4-хлорфенил)тио]-(2,5-дифторфенил)-метил]пиридина (120 мг, 0,345 ммоль), полученного в примере 6, в метаноле (12 мл) добавляли тетрагидрат гексааммонийгептамолибдата (80 мг). К полученной смеси добавляли 30% водный раствор перекиси водорода (6 мл) с последующим перемешиванием в течение 24 часов. Образовавшийся осадок собирали фильтрованием и перекристаллизовывали из этанола с получением указанного в заголовке соединения (96 мг, 73%) в виде игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3)δ: 5,93 (1H, с), 6,87-7,00 (2H, м), 7,28 (1H, м), 7,37 (2H, д, J=8,8 Гц), 7,53 (2H, д, J=8,8 Гц), 7,60 (1H, д, J=8,0 Гц), 7,71 (1H, м), 8,00 (1H, м), 8,59 (1H, м).
Т.пл.: 171-172°C.
MS m/z: 380 (M++H).
Элементный Анализ для C18H12ClF2NO2S. Рассчитано: C, 56,92; H, 3,18; N, 3,69; S, 8,44; Cl, 9,33; F, 10,00. Найдено: C, 56,76; H, 3,19; N, 3,77; S, 8,55; Cl, 9,27; F, 10,02.
Пример 14: 2-[[(4-Хлорфенил)сульфонил]-(2,5-дифторфенил)-метил]-3-метилпиридин
[Химическая формула 56]
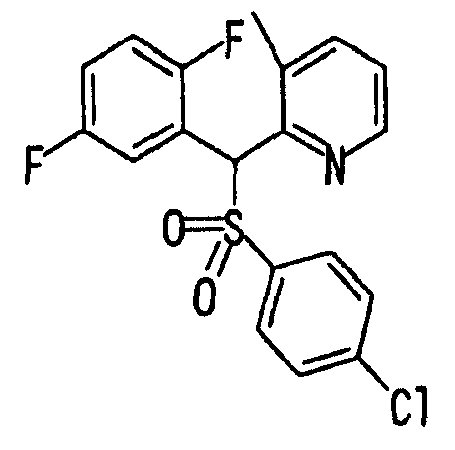
Таким же способом, как в примере 13, получали указанное в заголовке соединение (35 мг, 35%) в виде игольчатых кристаллов при помощи синтеза с использованием 2-[[(4-хлорфенил)тио]-(2,5-дифторфенил)метил]-3-метилпиридина, полученного в примере 7, и очистки хроматографией на силикагеле (гексан:этилацетат=5:1).
1H-ЯМР (400 МГц, CDCl3)δ: 2,36 (3H, с), 6,18 (1H, с), 6,89-7,02 (2H, м), 7,17 (1H, м), 7,37 (2H, д, J=8,4 Гц), 7,46 (1H, д, J=7,2 Гц), 7,53 (2H, д, J=8,4 Гц), 8,06 (1H, м), 8,53 (1H, д, J=4,0 Гц).
Т.пл.: 142-143°C.
Элементный Анализ для C19H14ClF2NO2S. Рассчитано: C,57,94; H,3,58; N,3,56; S,8,12; Cl,9,00; F,9,65. Найдено: C,58,03; H,3,66; N,3,78; S,8,12; Cl,9,13; F,9,59.
Пример 15: 2-[[(4-Хлорфенил)сульфонил]-(2,5-дифторфенил)метил]-5-метилпиридин
[Химическая формула 57]
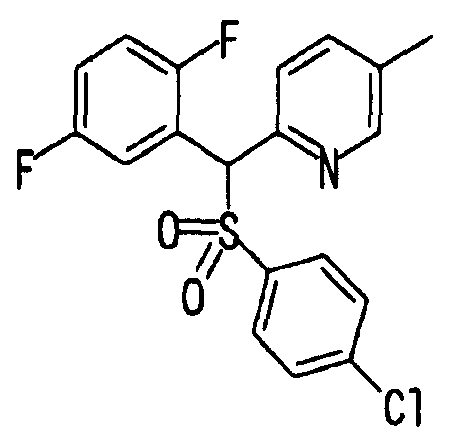
1) 2-[[(4-Хлорфенил)тио]-(2,5-дифторфенил)метил]-5-метилпиридин
[Химическая формула 58]
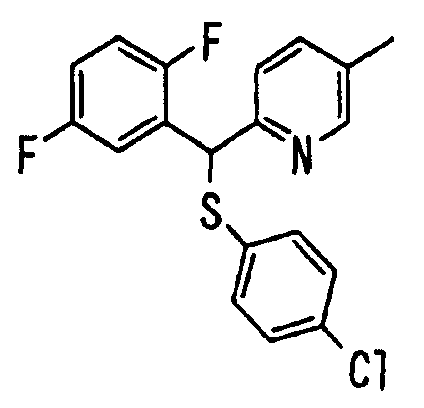
2-[(2,5-Дифторфенил)-гидроксиметил]-5-метилпиридин (125 мг, 0,53 ммоль), полученный в ссылочном примере 5, растворяли в тионилхлориде (1,0 мл). К полученному раствору добавляли каталитическое количество диметилформамида. Полученную смесь перемешивали в течение 14 часов. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли диоксан, а затем снова концентрировали. Остаток растворяли в диметилформамиде (5 мл). К полученному раствору добавляли в атмосфере азота 4-хлорбензолтиол (115 мг, 0,80 ммоль) и карбонат калия (438 мг, 3,18 ммоль). Полученную смесь перемешивали при 50°C в течение 1 часа. После охлаждения реакционной смеси до комнатной температуры к смеси добавляли диэтиловый эфир (50 мл). Полученную смесь промывали водой и насыщенным солевым раствором. Органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток подвергали хроматографии на силикагеле (гексан:этилацетат=10:1) с получением указанного в заголовке соединения (120 мг, 66%) в виде масла.
1H-ЯМР (400 МГц, CDCl3)δ: 2,29 (3H, с), 5,83 (1H, с), 6,80-6,93 (2H, м), 7,16 (2H, м), 7,20 (2H, м), 7,28 (1H, м), 7,43 (1H, м), 8,41 (1H, д, J=0,8 Гц).
MS m/z: 362 (M++H).
2) 2-[[(4-Хлорфенил)сульфонил]-(2,5-дифторфенил)метил]-5-метилпиридин
Таким же способом, как в примере 13, получали указанное в заголовке соединение (91 мг, 73%) в виде игольчатых кристаллов при помощи синтеза с использованием 2-[[(4-хлорфенил)тио]-(2,5-дифторфенил)метил]-5-метилпиридина, полученного реакцией, описанной выше.
1H-ЯМР (400 МГц, CDCl3)δ: 2,33 (3H, с), 5,89 (1H, с), 6,88-7,01 (2H, м), 7,37 (2H, д, J=8,8 Гц), 7,48-7,56 (2H, м), 7,53 (2H, д, J=8,8 Гц), 7,99 (1H, м), 8,42 (1H, с).
Т.пл.: 159-160°C.
Элементный Анализ для C19H14ClF2NO2S. Рассчитано: C,57,94; H,3,58; N,3,56; S,8,12; Cl,9,00; F,9,56. Найдено: C.57,88; H,3,61; N,3,68; S,8,27; Cl,9,11; F,9,70.
Пример 16: 2-[[(4-Хлорфенил)сульфонил]-(2,5-дифторфенил)метил]-4-метилпиридин
[Химическая формула 59]
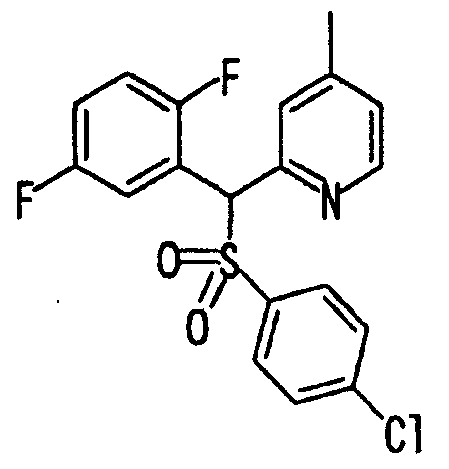
Таким же способом, как в примере 13, получали указанное в заголовке соединение (140 мг, 95%) в виде игольчатых кристаллов при помощи синтеза с использованием 2-[[(4-хлорфенил)тио]-(2,5-дифторфенил)метил]-4-метилпиридина, полученного в примере 8, и очистки хроматографией на силикагеле (гексан:этилацетат=3:1).
1H-ЯМР (400 МГц, CDCl3)δ: 2,36 (3H, с), 5,88 (1H, с), 6,88-7,02 (2H, м), 7,09 (1H, д, J=5,2 Гц), 7,37 (2H, д, J=8,8 Гц), 7,41 (1H, м), 7,52 (2H, д, J=8,8 Гц), 7,97 (1H, м), 8,43 (1H, д, J=5,2 Гц).
Т.пл.: 116-117°C.
Элементный Анализ для C19H14ClF2NO2S. Рассчитано: C,57,94; H,3,58; N,3,56; S,8,12; Cl,9,00; F,9,65. Найдено: C,57,80; H,3,66; N,3,72; S,8,29; Cl,9,05; F,9,71%.
Пример 17: 2-[[(4-Хлорфенил)сульфонил]-(2,5-дифторфенил)метил]-3-метоксипиридин
[Химическая формула 60]
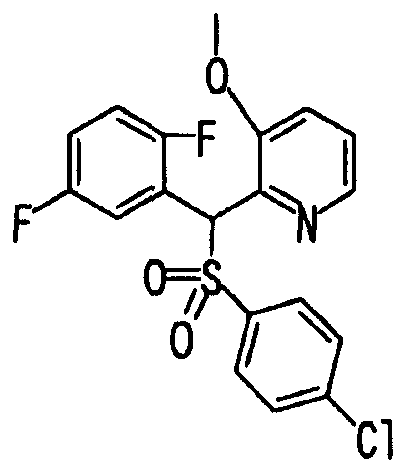
Таким же способом, как в примере 13, получали указанное в заголовке соединение (71 мг, 87%) в виде бесцветных столбчатых кристаллов при помощи синтеза с использованием 2-[[(4-хлорфенил)тио]-(2,5-дифторфенил)метил]-3-метоксипиридина, полученного в примере 9, и перекристаллизации из этанола.
1H-ЯМР (400 МГц, CDCl3)δ: 3,72 (3H, с), 6,62 (1H, с), 6,90-7,04 (2H, м), 7,09 (1H, м), 7,24 (1H, м), 7,35 (2H, д, J=8,8 Гц), 7,53 (2H, д, J=8,8 Гц), 8,18 (1H, м), 8,30 (1H, м).
Т.пл.: 184-185°C.
Элементный Анализ для C19H14ClF2NO3S. Рассчитано: C,55,68; H,3,44; N,3,42; S,7,82; Cl,8,65; F,9,27. Найдено: C,55,68; H,3,45; N,3,60; S,7,98; Cl,8,74; F,9,23.
Пример 18: 3-Аллилокси-2-[[(4-хлорфенил)сульфонил]-(2,5-дифторфенил)метил]пиридин
[Химическая формула 61]
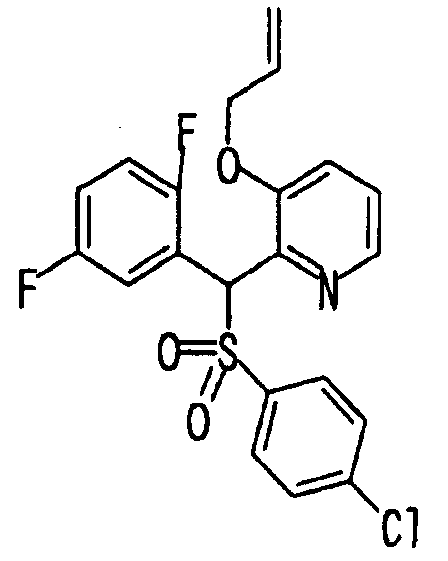
Таким же способом, как в примере 13, получали указанное в заголовке соединение (135 мг, 80%) в виде игольчатых кристаллов при помощи синтеза с использованием 3-аллилокси-2-[[(4-хлорфенил)тио]-(2,5-дифторфенил)метил]пиридина, полученного в примере 10, и кристаллизации из этанола.
1H-ЯМР (400 МГц, CDCl3)δ: 4,38 (1H, м), 4,46 (1H, м), 5,29 (1H, дд, J=1,2, 10,4 Гц), 5,35 (1H, дд, J=1,2,17,2 Гц), 5,93 (1H, м), 6,68 (1H, с), 6,91-7,04 (2H, м), 7,08 (1H, м), 7,22 (1H, дд, J=4,8, 8,4 Гц), 7,34 (2H, д, J=8,8 Гц), 7,53 (2H, д, J=8,8 Гц), 8,17 (1H, м), 8,31 (1H, м).
Т.пл.: 119-120°C.
Элементный Анализ для C21H16ClF2NO3S. Рассчитано: C,57,87; H,3,70; N,3,21; S,7,36; Cl,8,13; F,8,72. Найдено: C,57,90; H,3,75; N,3,37; S,7,51; Cl,8,20; F,8,73.
Пример 19: 3-[[(4-Хлорфенил)сульфонил]-(2,5-дифторфенил)метил]пиридин
[Химическая формула 62]
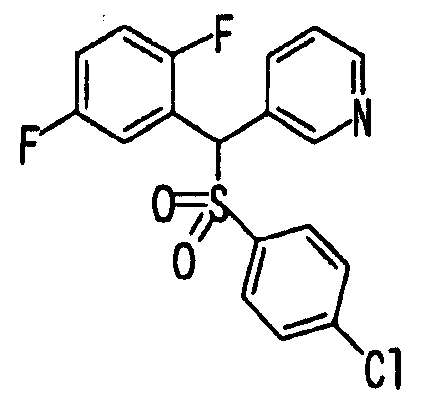
Таким же способом, как в примере 13, получали указанное в заголовке соединение (118 мг, 86%) в виде игольчатых кристаллов при помощи синтеза с использованием 3-[[(4-хлорфенил)тио]-(2,5-дифторфенил)метил]пиридина, полученного в примере 11, и очистки хроматографией на силикагеле (гексан:этилацетат=4:1).
1H-ЯМР (400 МГц, CDCl3)δ: 5,68 (1H, с), 6,91-7,07 (2H, м), 7,34 (1H, м), 7,40 (2H, д, J=8,4 Гц), 7,57 (2H, д, J=8,4 Гц), 7,76 (1H, м), 8,04 (1H, м), 8,53 (1H, д, J=2,0 Гц), 8,59 (1H, м).
Т.пл.: 130-131°C.
Элементный Анализ для C18H12ClF2NO2S. Рассчитано: C,56,92; H,3,18; N,3,69; S,8,44; Cl,9,33; F,10,00. Найдено: C,56,87; H,3,16; N,3,74; S,8,51; Cl,9,34; F,10,00.
Пример 20: 4-[[(4-Хлорфенил)сульфонил]-(2,5-дифторфенил)-метил]пиридин
[Химическая формула 63]
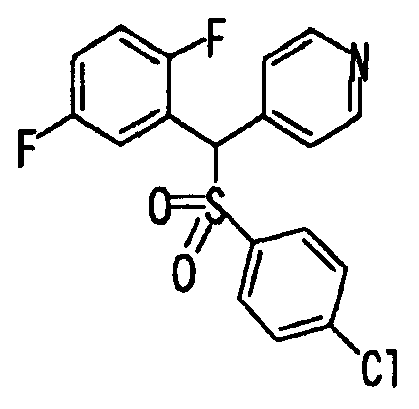
2,5-Дифторфенил-4-пиридилметанол (75 мг, 0,34 ммоль), полученный в ссылочном примере 18, растворяли в тионилхлориде (1,0 мл). К полученному раствору добавляли каталитическое количество диметилформамида и смесь перемешивали в течение 14 часов. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли диоксан. Полученную смесь снова концентрировали. Полученный остаток растворяли в диметилформамиде (5 мл), а затем добавляли в атмосфере азота 4-хлорбензолтиол (74 мг, 0,51 ммоль) и карбонат калия (281 мг, 2,04 ммоль). Полученную смесь перемешивали при 50°C в течение 1 часа. После охлаждения реакционной смеси до комнатной температуры к смеси добавляли диэтиловый эфир (50 мл). Полученную смесь промывали водой и насыщенным солевым раствором. Органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток подвергали хроматографии на силикагеле (гексан:этилацетат=1:1) с получением смеси, содержащей 4-[[(4-хлорфенил)тио]-(2,5-дифторфенил)метил]пиридин.
К раствору полученной смеси в метаноле (12 мл) добавляли тетрагидрат гексааммонийгептамолибдата (60 мг) и 30% водный раствор перекиси водорода (6 мл) последовательно. Полученную смесь перемешивали в течение 65 часов. К реакционной смеси добавляли этилацетат (80 мл). Полученную смесь промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении для удаления растворителя. Остаток очищали хроматографией на силикагеле (гексан:этилацетат=4:1-1:1) с получением указанного в заголовке соединения (51 мг, 39%). Перекристаллизация полученного соединения из этанола давала бесцветные игольчатые кристаллы.
1H-ЯМР (400 МГц, CDCl3)δ: 5,64 (1H, с), 6,91-7,06 (2H, м), 7,40 (2H, д, J=8,0 Гц), 7,45 (2H, д, J=4,8 Гц), 7,58 (2H, д, J=8,0 Гц), 7,70 (1H, с), 8,61 (2H, д, J=4,8 Гц).
Т.пл.: 126-127°C.
Элементный Анализ для C18H12ClF2NO2S. Рассчитано: C,56,92; H,3,18; N,3,69; S,8,44; Cl,9,33; F,10,00. Найдено: C,56,66; H,3,16; N,3,83; S,8,58; Cl,9,32; F,9,99.
Пример 21: 5-[[(4-Хлорфенил)сульфонил]-(2,5-дифторфенил)метил]пиримидин
[Химическая формула 64]
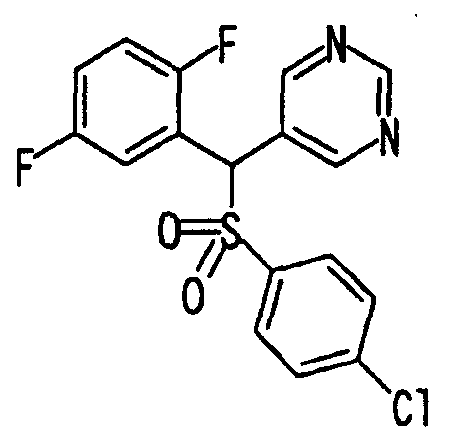
Таким же способом, как в примере 13, получали указанное в заголовке соединение (71 мг, 87%; выход: две стадии после получения 5-[(2,5-дифторфенил)-гидроксиметил]пиримидина в ссылочном примере 12) в виде бесцветных столбчатых кристаллов при помощи синтеза с использованием 5-[[(4-хлорфенил)тио]-(2,5-дифторфенил)метил]пиримидина, полученного в примере 12, и очистки хроматографией на силикагеле (гексан:этилацетат=5:1).
1H-ЯМР (400 МГц, CDCl3)δ: 5,65 (1H, с), 6,93-7,10 (2H, м), 7,43 (2H, д, J=8,8 Гц), 7,61 (2H, д, J=8,8 Гц), 7,73 (1H, м), 8,90 (2H, с), 9,21 (1H, с). Т.пл.: 136-137°C.
Элементный Анализ для C17H11ClF2N2O2S. Рассчитано: C,53,62; H,2,91; N,7,36; S,8,42; Cl,9,31; F,9,98. Найдено: C,53,64; H,2,83; N,7,44; S,8,61; Cl,9,34; F,9,96.
Пример 22: 3-[[(4-Хлорфенил)тио]-(2,5-дифторфенил)метил]-4-гидроксихромен-2-он
[Химическая формула 65]
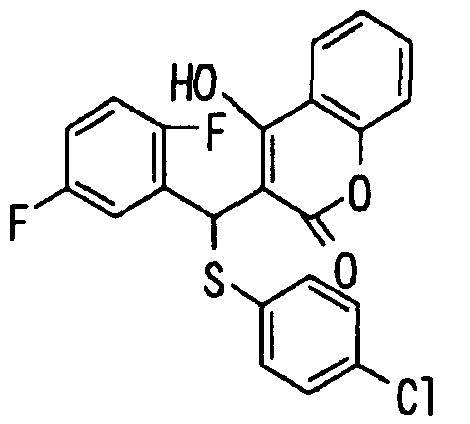
После добавления при комнатной температуре ледяной уксусной кислоты (60 мг, 1 ммоль) и пиридина (80,5 мкл, 1 ммоль) к раствору 2,5-дифторбензальдегида (109 мкл, 1 ммоль), 4-гидроксикумарина (162 мг, 1 ммоль) и 4-хлортиофенола (144,6 мг, 1 ммоль) в этаноле (4 мл) полученную смесь перемешивали в течение 24 часов. Образовавшийся осадок собирали фильтрованием и промывали небольшим количеством этанола с получением указанного в заголовке соединения (345 мг, 80%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 6,16 (1H, с), 6,95-7,12 (3H, м), 7,24-7,27 (1H, м), 7,27 (2H, д, J=8,8 Гц), 7,32 (1H, т, J=7,6 Гц), 7,43 (2H, д, J=8,8 Гц), 7,56 (1H, м), 7,94 (1H, дд, J=1,6,7,6 Гц).
Т.пл.: 146-147°C.
MS m/z: 431 (M++H).
Пример 23: 3-[[(4-Хлорфенил)сульфонил]-(2,5-дифторфенил)метил]-4-метоксихромен-2-он (Соединение A) и 3-[[(4-хлорфенил)сульфонил]-(2,5-дифторфенил)метил]-2-метоксихромен-4-он (Соединение B)
[Химическая формула 66]
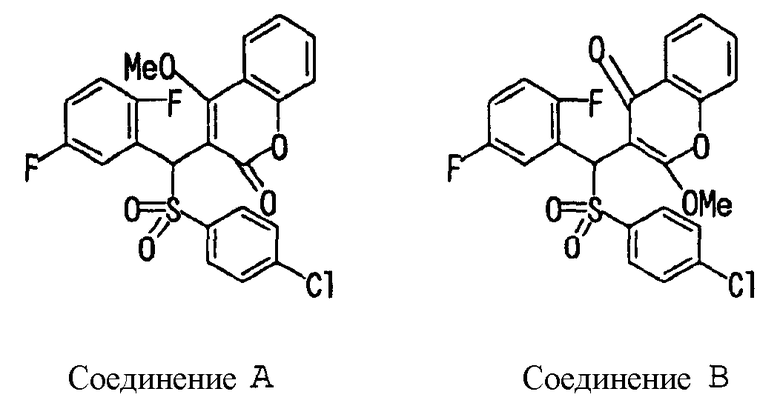
Раствор 2 н. триметилсилилдиазометана в гексане (0,41 мл, 0,822 ммоль) добавляли по порциям к раствору 3-[[(4-хлорфенил)тио]-(2,5-дифторфенил)метил]-4-гидроксихромен-2-она (118 мг, 0,274 ммоль) в смеси бензол-метанол (10:1) при комнатной температуре. Полученную смесь перемешивали в течение 5 минут. Добавляли уксусную кислоту до тех пор, пока раствор не становился бесцветным, затем реакционную смесь концентрировали при пониженном давлении.
Остаток растворяли в метаноле (12 мл). К полученному раствору добавляли 30% водный раствор перекиси водорода (6 мл) и тетрагидрат гексааммонийгептамолибдата (60 мг). Полученную смесь перемешивали в течение 20 часов. К реакционной смеси добавляли этилацетат (50 мл). Полученную смесь промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле (гексан:этилацетат=5:1-3:1) с получением неполярного соединения (22 мг, 17%) в виде игольчатых кристаллов и полярного соединения (9,0 мг, 7%) в виде белого твердого вещества после отверждения из гексана. В результате анализа неполярного соединения методом NOE (ядерный эффект Оверхаузера (nuclear Overhauser effect)) NOE наблюдали между метокси и водородом в положении 5 хроменона. Анализ полярного соединения, с другой стороны, показал отсутствие NOE между метокси и водородом в ароматическом кольце хроменона, но этот эффект наблюдали между метокси и водородом в положении 6 дифторбензольного кольца. На основании этих результатов структуру неполярного соединения идентифицировали как 3-[[(4-хлорфенил)сульфонил]-(2,5-дифторфенил)метил]-4-метоксихромен-2-он (Соединение A), а структуру полярного соединения идентифицировали как 3-[[(4-хлорфенил)сульфонил]-(2,5-дифторфенил)метил]-2-метоксихромен-4-он (Соединение B).
Соединение A
1H-ЯМР (400 МГц, CDCl3)δ: 4,13 (3H, с), 6,39 (1H, с), 6,88 (1H, м), 6,98 (1H, м), 7,3-7,4 (2H, м), 7,43 (2H, д, J=8,8 Гц), 7,58 (1H, м), 7,70 (2H, д, J=8,8 Гц), 7,73 (1H, м), 8,09 (1H, м).
Т.пл.: 178-179°C.
Элементный Анализ для C23H15ClF2O3S. Рассчитано: C,57,93; H,3,17; S,6,72; Cl,7,43; F,7,97. Найдено: C,57,59; H,3,14; S,6,85; Cl,7,52; F,8,01.
Соединение B
1H-ЯМР (400 МГц, CDCl3)δ: 4,23 (3H, с), 6,54 (1H, с), 6,89 (1H, м), 6,96 (1H, м), 7,41 (2H, д, J=8,4 Гц), 7,4-7,46 (2H, м), 7,63 (1H, м), 7,73 (2H, д, J=8,4 Гц), 8,02 (1H, м), 8,14 (1H, дд, J=1,6, 8,0 Гц).
Т.пл.: 162-163°C.
FAB-MS: 477,0366 (Рассчитано для C23H16ClF2O5S: 477,0375).
Пример 24: 2-[[(4-Хлорфенил)тио]-(2,5-дифторфенил)метил]-1-метил-1H-бензимидазол
[Химическая формула 67]
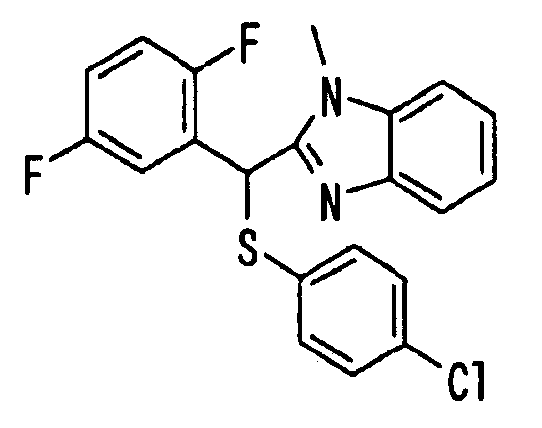
К 2-[(трет-бутоксикарбонилокси)-(2,5-дифторфенил)метил]-1-метил-1H-бензимидазолу (204 мг, 0,545 ммоль), полученному в ссылочном примере 13, добавляли трифторуксусную кислоту (2,0 мл). Полученную смесь перемешивали при комнатной температуре в течение 30 минут. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли диоксан, а затем снова концентрировали при пониженном давлении. Остаток растворяли в тионилхлориде (1,0 мл). К полученному раствору добавляли одну каплю диметилформамида. Полученную смесь перемешивали в течение 16 часов при комнатной температуре. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли диоксан и полученную смесь снова концентрировали при пониженном давлении. Остаток растворяли в диметилформамиде (5,0 мл). После добавления 4-хлорбензолтиола (118 мг, 0,82 ммоль) и карбоната калия (451 мг, 3,27 ммоль) полученную смесь перемешивали при 50°C в течение 2 часов. Реакционной смеси затем давали выстояться при комнатной температуре и к смеси добавляли этилацетат (60 мл). Полученную смесь промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат=10:1 → 5:1) с получением указанного в заголовке соединения (195 мг, 89%) в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3)δ: 3,67 (3H, с), 5,91 (1H, с), 6,87-6,93 (2H, м), 7,19 (2H, д, J=8,8 Гц), 7,27 (2H, д, J=8,8 Гц), 7,25-7,33 (3H, м), 7,60 (1H, м), 7,85 (1H, м).
MS m/z: 401 (M++H).
Пример 25: 2-[[(4-Хлорфенил)тио]-(2,5-дифторфенил)метил]-1-метил-5-хлор-1H-имидазол
[Химическая формула 68]
К 2-[(трет-бутоксикарбонилокси)-(2,5-дифторфенил)метил]-1-метил-5-хлор-1H-имидазолу (404 мг, 1,13 ммоль), полученному в ссылочном примере 14, добавляли трифторуксусную кислоту (10 мл). Полученную смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли диоксан, а затем снова концентрировали при пониженном давлении. Остаток растворяли в тионилхлориде (2,0 мл) и к полученному раствору добавляли каплю диметилформамида. Смесь перемешивали при комнатной температуре в течение 17 часов. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли диоксан, затем снова концентрировали при пониженном давлении. Остаток растворяли в диметилформамиде (5,0 мл). К полученному раствору добавляли 4-хлорбензолтиол (244 мг, 1,69 ммоль) и карбонат калия (936 мг, 6,78 ммоль). Полученную смесь перемешивали при 50°C в течение 2 часов. Реакционной смеси давали выстояться до достижения комнатной температуры. Добавляли этиловый эфир (60 мл). Полученную смесь промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле (гексан:этилацетат=10:1 → 5:1) с получением указанного в заголовке соединения (195 мг, 89%) в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3)δ: 3,57 (3H, с), 5,67 (1H, с), 6,89-6,95 (2H, м), 6,97 (1H, с), 7,20 (2H, д, J=8,4 Гц), 7,21 (2H, д, J=8,4 Гц), 7,54 (1H, м).
MS m/z: 386 (M++H).
Пример 26: 2-[[(4-Хлорфенил)тио]-(2,5-дифторфенил)метил]тиазол
[Химическая формула 69]
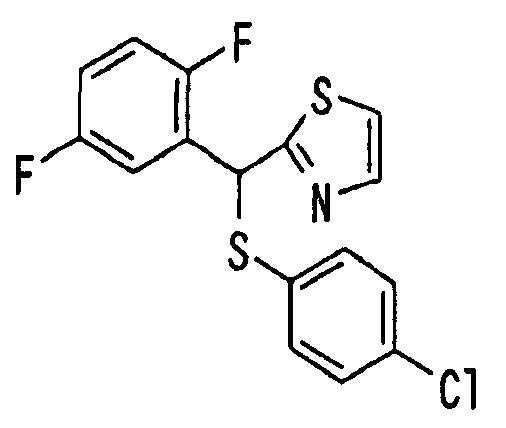
2-[(2,5-Дифторфенил)-гидроксиметил]тиазол (348 мг, 1,53 ммоль), полученный в ссылочном примере 15, растворяли в тионилхлориде (1,5 мл). К полученному раствору добавляли каплю диметилформамида. Полученную смесь перемешивали при комнатной температуре в течение 14 часов. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли диоксан, а затем снова концентрировали при пониженном давлении. Остаток растворяли в диметилформамиде (10,0 мл). К полученному раствору добавляли 4-хлорбензолтиол (332 мг, 2,3 ммоль) и карбонат калия (845 мг, 6,12 ммоль). Полученную смесь перемешивали при 50°C в течение 2 часов. Реакционной смеси давали выстояться до достижения комнатной температуры и затем к смеси добавляли этилацетат (60 мл). Полученную смесь промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле (гексан:этилацетат=10:1 → 6:1) с получением указанного в заголовке соединения (130 мг, 24%) в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3)δ: 6,04 (1H, с), 6,90-7,06 (2H, м), 7,22 (2H, д, J=8,4 Гц), 7,30 (2H, д, J=8,4 Гц), 7,15-7,35 (2H, м), 7,76 (1H, д, J=3,2 Гц).
MS m/z: 354 (M++H).
Пример 27: 2-[[(4-Хлорфенил)тио]-(2,5-дифторфенил)метил]-1-(4-метоксифенил)-1H-имидазол
[Химическая формула 70]
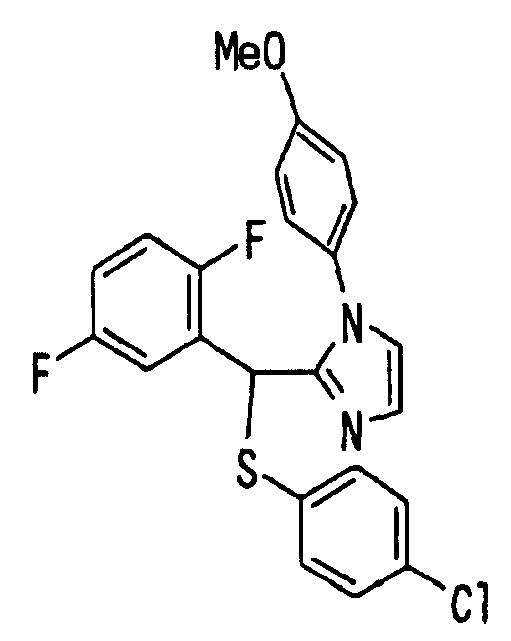
Трифторуксусную кислоту (10 мл) добавляли к 2-[(трет-бутоксикарбонилокси)-(2,5-дифторфенил)метил]-1-(4-метоксифенил)-1H-имидазолу (667 мг, 1,6 ммоль), полученному в ссылочном примере 16. Полученную смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли диоксан, а затем снова концентрировали при пониженном давлении. Остаток растворяли в тионилхлориде (2,0 мл) и к полученному раствору добавляли каплю диметилформамида. Полученную смесь перемешивали при комнатной температуре в течение 17 часов. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли диоксан, а затем снова концентрировали при пониженном давлении. Остаток растворяли в диметилформамиде (5,0 мл). К полученному раствору добавляли 4-хлорбензолтиол (347 мг, 2,4 ммоль) и карбонат калия (1,32 г, 9,6 ммоль). Полученную смесь перемешивали при 50°C в течение 2 часов. Реакционной смеси давали выстояться до достижения комнатной температуры и затем к смеси добавляли этиловый эфир (60 мл). Полученную смесь промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле (гексан:этилацетат=10:1 → 5:1), а затем кристаллизовали из этанола с получением указанного в заголовке соединения (535 мг, 75%) в виде игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3)δ: 3,86 (3H, с), 5,57 (1H, с), 6,8-6,9 (3H, м), 6,91 (2H, д, J=8,4 Гц), 7,00 (2H, д, J=8,4 Гц), 7,06 (2H, д, J=6,8 Гц), 7,11 (2H, д, J=6,8 Гц), 7,16 (1H, с), 7,81 (1H, м).
MS m/z: 443 (M++H).
Пример 28: 2-[[(4-Хлорфенил)сульфонил]-(2,5-дифторфенил)метил]-1-метил-1H-бензимидазол (Соединение A) и 2-[[(4-хлорфенил)сульфинил]-(2,5-дифторфенил)метил]-1-метил-1H-бензимидазол (Соединение B)
[Химическая формула 71]
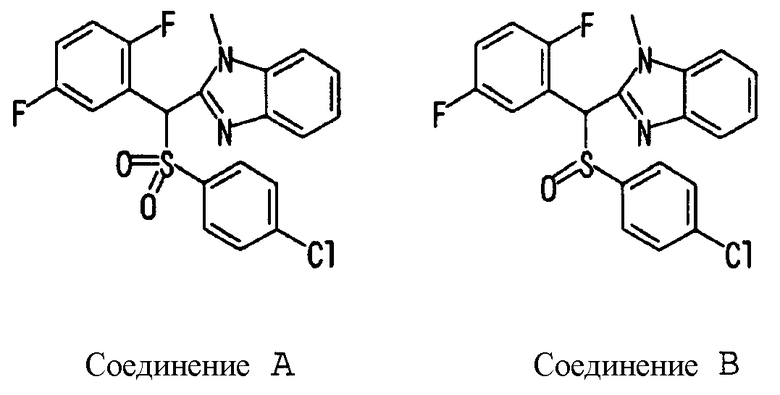
Тетрагидрат гексааммонийгептамолибдата (60 мг) добавляли к раствору 2-[[(4-хлорфенил)тио]-(2,5-дифторфенил)метил]-1-метил-1H-бензимидазола (190 мг, 0,474 ммоль), полученного в примере 24, в метаноле (12 мл). К полученной смеси добавляли 30% водный раствор перекиси водорода (6 мл) с последующим перемешиванием в течение 17 часов. К реакционной смеси добавляли этилацетат (60 мл). Полученную смесь промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле (гексан:этилацетат=6:1 → 4:1) с получением неполярного соединени (Соединение A) (48 мг, 23%) и полярного соединения (Соединение B) (23 мг, 12%), которые имели форму игольчатых кристаллов и белого твердого вещества соответственно.
Соединение A
1H-ЯМР (400 МГц, CDCl3)δ: 3,90 (3H, с), 6,14 (1H, с), 6,9-7,1 (2H, м), 7,26-7,42 (3H, м), 7,39 (2H, д, J=8,8 Гц), 7,46 (2H, д, J=8,8 Гц), 7,81 (1H, д, J=8,0 Гц), 8,16 (1H, м).
Т.пл.: 213-214°C.
Элементный Анализ для C21H15ClF2N2OS. Рассчитано: C,58,27; H,3,49; N,6,47; S,7,41; Cl,8,19; F,8,78. Найдено: C,58,08; H,3,62; N,6,53; S,7,35; Cl,8,10; F,8,74.
Соединение B
1H-ЯМР (400 МГц, CDCl3)δ: 3,35 (3/2H, с), 3,78 (3/2H, с), 5,52 (1/2H, с), 5,57 (1/2H, с), 6,78-7,1 (2H, м), 7,2-7,4 (7H, м), 7,76-7,95 (2H, м).
Т.пл.: 130-131°C.
FAB-MS: 477,0646 (Рассчитано для C21H16ClF2N2OS: 477,0640).
Пример 29: 2-[[(4-Хлорфенил)сульфонил]-(2,5-дифторфенил)метил]-1-метил-5-хлор-1H-имидазол
[Химическая формула 72]
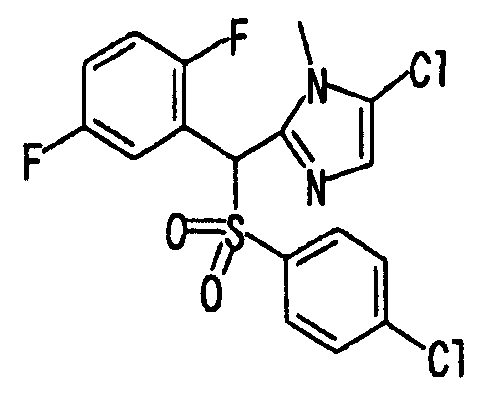
Тетрагидрат гексааммонийгептамолибдата (60 мг) добавляли к раствору 2-[[(4-хлорфенил)тио]-(2,5-дифторфенил)метил]-1-метил-5-хлор-1H-имидазола (141 мг, 0,37 ммоль), полученного в примере 25, в метаноле (12 мл). К полученной смеси добавляли 30% водный раствор перекиси водорода (6 мл) с последующим перемешиванием в течение 64 часов. К реакционной смеси добавляли этилацетат (60 мл). Полученную смесь промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток кристаллизовали из этанола с получением указанного в заголовке соединения (103 мг, 67%) в виде игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3)δ: 3,71 (3H, с), 5,88 (1H, с), 6,93-7,08 (2H, м), 7,03 (1H, с), 7,43 (4H, с), 7,98 (1H, м).
Т.пл.: 179-180°C.
Элементный Анализ для C17H12Cl2F2N2O2S. Рассчитано: C,48,90; H,2,93; N,6,71; S,7,68; Cl,16,99; F,9,11. Найдено: C,48,90; H,2,93; N,6,77; S,7,80; Cl,17,02; F,9,19.
Пример 30: 2-[[(4-Хлорфенил)сульфонил]-(2,5-дифторфенил)метил]тиазол
[Химическая формула 73]
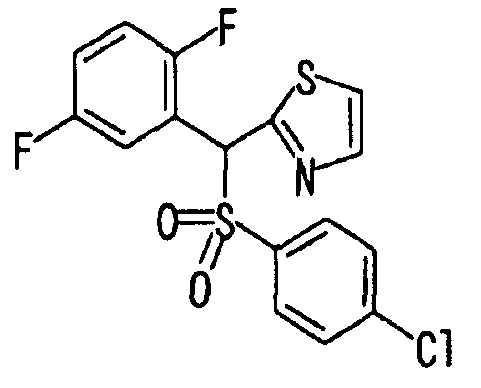
Тетрагидрат гексааммонийгептамолибдата (30 мг) добавляли к раствору 2-[[(4-хлорфенил)тио]-(2,5-дифторфенил)метил]тиазола (124 мг, 0,35 ммоль), полученного в примере 26, в метаноле (6,0 мл). К полученной смеси добавляли 30% водный раствор перекиси водорода (3 мл) и смесь перемешивали в течение 15 часов. К реакционной смеси добавляли этилацетат (60 мл). Полученную смесь промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток кристаллизовали из этанола с получением указанного в заголовке соединения (91 мг, 67%) в виде бесцветных столбчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3)δ: 6,21 (1H, с), 6,92-7,08 (2H, м), 7,41 (2H, д, J=8,8 Гц), 7,45 (1H, д, J=3,6 Гц), 7,56 (2H, д, J=8,8 Гц), 7,86 (1H, д, J=3,6 Гц), 7,94 (1H, м).
Т.пл.: 163-164°C.
Элементный Анализ для C16H10ClF2NO2S2. Рассчитано: C,49,81; H,2,61; N,3,63; S,16,62; Cl,9,19; F,9,85. Найдено: C,49,98; H,2,61; N,3,77; S,16,60; Cl,9,25; F,9,87.
Пример 31: 2-[[(4-Хлорфенил)сульфонил]-(2,5-дифторфенил)метил]-1-(4-метоксифенил)-1H-имидазол
[Химическая формула 74]
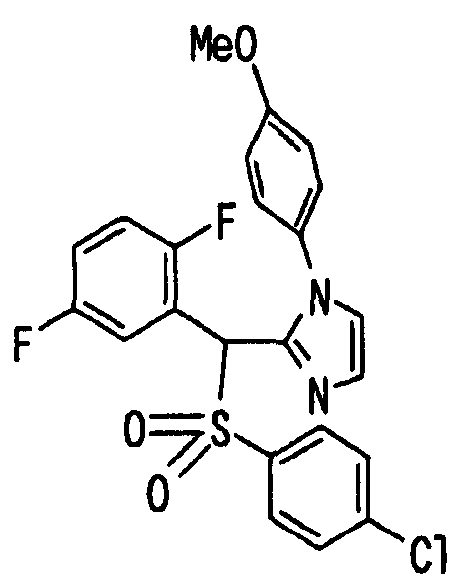
Тетрагидрат гексааммонийгептамолибдата (60 мг) добавляли к раствору 2-[[(4-хлорфенил)тио]-(2,5-дифторфенил)метил]-1-(4-метоксифенил)-1H-бензимидазола (118 мг, 0,27 ммоль), полученного в примере 27, в метаноле (12 мл). К полученной смеси добавляли 30% водный раствор перекиси водорода (6 мл) с последующим перемешиванием в течение 64 часов. К реакционной смеси добавляли этилацетат (60 мл). Полученную смесь промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток кристаллизовали из этанола с получением указанного в заголовке соединения (76 мг, 60%) в виде игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3)δ: 3,89 (3H, с), 5,83 (1H, с), 6,93-7,05 (4H, м), 6,97 (2H, д, J=8,8 Гц), 7,01 (2H, д, J=8,8 Гц), 7,38 (2H, д, J=8,8 Гц), 7,41 (2H, д, J=8,8 Гц), 8,15 (1H, м).
Т.пл.: 150-151°C.
Элементный Анализ для C23H17ClF2N2O3S. Рассчитано: C,58,13; H,3,61; N,5,90; S,6,75; Cl,7,47; F,8,00. Найдено: C,58,09; H,3,51; N,5,99; S,6,88; Cl,7,48; F,8,06.
Пример 32: 5-Хлор-2-[(2,5-дифторфенил-4-пиридилметил)тио]пиридин
[Химическая формула 75]
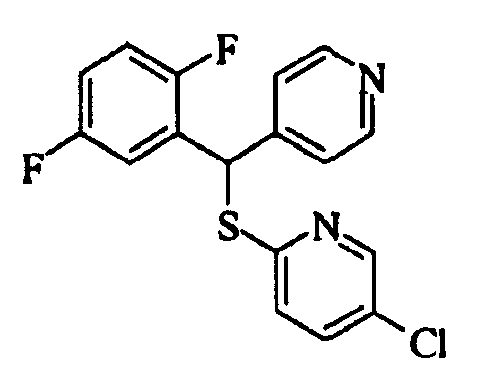
К раствору 2,5-дифторфенил-4-пиридилметанола (221 мг, 1,00 ммоль), полученного в ссылочном примере 18, в дихлорметане (10 мл) при 0°C добавляли триэтиламин (0,279 мл, 2,00 ммоль), а затем метансульфонилхлорид (0,116 мл, 1,50 ммоль). Полученную смесь перемешивали в течение 3 часов при комнатной температуре. Реакционную смесь промывали насыщенным водным раствором бикарбоната натрия. Органический слой сушили над безводным сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении. К раствору полученного остатка в N,N-диметилформамиде (10 мл) последовательно добавляли 5-хлор-2-пиридинтиол (145 мг, 1,00 ммоль), полученный в ссылочном примере 17, и карбонат калия (166 мг, 1,20 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 2 часов. К реакционной смеси добавляли этилацетат. Полученную смесь промывали водой. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на силикагеле и фракцию, полученную при элюировании смесью гексан:этилацетат=17:3, концентрировали при пониженном давлении с получением указанного в заголовке соединения (267 мг, 0,77 ммоль, 77%) в виде желтого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 6,52 (1H, с), 6,92-6,98 (1H, м), 6,99-7,06 (1H, м), 7,48 (1H, дд, J=8,5,0,7 Гц), 7,17-7,23 (1H, м), 7,34 (2H, д, J=6,1 Гц), 7,47 (1H, дд, J=8,5, 2,4 Гц), 8,33 (1H, дд, J=2,4,0,7 Гц), 8,54 (2H, д, J=6,1 Гц).
MS m/z: 349 (M++H).
Пример 33: 5-Хлор-2-[(2,5-дифторфенил-4-пиридилметил)-сульфонил]пиридин
[Химическая формула 76]
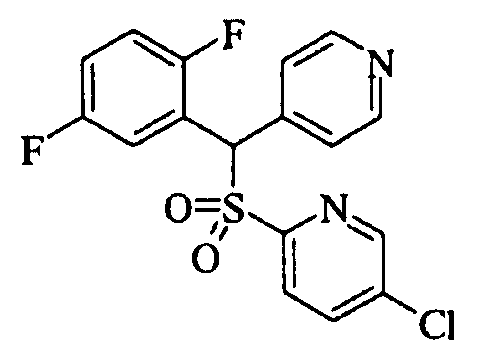
К раствору 5-хлор-2-[(2,5-дифторфенил-4-пиридилметил)-тио]пиридина (239 мг, 0,68 ммоль) в метаноле (6 мл) добавляли водный (12 мл) раствор оксона (соединение пероксомоносульфата калия, 2KHSO5·KHSO4·K2SO4) (631 мг, 1,03 ммоль) при 0°C. Реакционную смесь перемешивали при комнатной температуре в течение 3 дней, затем к смеси добавляли дихлорметан. Полученную смесь промывали насыщенным водным раствором бикарбоната натрия. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали препаративной высокоэффективной жидкостной хроматографией (используя смешанную систему растворителей вода/ацетонитрил/муравьиная кислота). Полученное твердое вещество промывали гексаном/диизопропиловым эфиром и затем собирали фильтрованием с получением указанного в заголовке соединения (67 мг, 0,18 ммоль, 26%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 6,44 (1H, с), 6,96-7,08 (2H, м), 7,48 (2H, д, J=6,3 Гц), 7,70-7,77 (1H, м), 7,79 (1H, дд, J=8,3,2,2 Гц), 7,84 (1H, дд, J=8,3,0,7 Гц), 8,61 (2H, д, J=6,3 Гц), 8,67 (1H, дд, J=2,2, 0,7 Гц).
Элементный Анализ для C17H11ClF2N2O2S. Рассчитано: C,53,62; H,2,91; F,9,98; N,7,36; S,8,42. Найдено: C,53,55; H,2,87; F,10,10; N,7,40; S,8,55.
MS m/z: 381 (M++H).
Пример 34: 4-[[(4-Хлорфенил)сульфонил](2,5-дифторфенил)метил]тетрагидропиран
[Химическая формула 77]
2-[(4-Хлорфенил)сульфонилметил]-1,4-дифторбензол (200 мг, 0,661 ммоль), полученный в ссылочном примере 1, и тетрагидро-4H-пиран-4-ол (0,13 мл, 1,36 ммоль) растворяли в толуоле (10 мл). После добавления цианометилентри-н-бутилфосфорана (330 мг, 1,37 ммоль) полученную смесь нагревали при кипячении с обратным холодильником в течение 14 часов в атмосфере аргона. Реакционной смеси затем давали охладиться. После добавления цианометилентри-н-бутилфосфорана (200 мг, 0,829 ммоль) полученную смесь нагревали при кипячении с обратным холодильником в течение 14 часов в атмосфере аргона. Реакционной смеси давали охладиться и затем концентрировали при пониженном давлении. Полученный остаток подвергали флэш-хроматографии на силикагеле и фракцию, полученную при элюировании смесью гексан:этилацетат=4:1, концентрировали при пониженном давлении с получением белого твердого вещества. Полученное белое твердое вещество промывали гексаном с получением указанного в заголовке соединения (157 мг, 0,406 ммоль, 61%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 1,28-1,48 (2H, м), 1,71 (1H, ддд, J=25,3, 11,7, 4,3 Гц), 2,37 (1H, шир.д, J=12,7 Гц), 2,70-2,88 (1H, м), 3,40 (1H, тд, J=11,7,2,5 Гц), 3,50 (1H, тд, J=12,0, 2,2 Гц), 3,91 (1H, дм, J=11,2 Гц), 4,02 (1H, дм, J=11,7 Гц), 4,46 (1H, д, J=8,8 Гц), 6,68-6,80 (1H, м), 6,88-6,98 (1H, м), 7,31 (2H, д, J=8,5 Гц), 7,36-7,45 (1H, м), 7,49 (2H, д, J=8,5 Гц).
Т.пл.: 150-152°C.
MS m/z: 387 (M++H).
Элементный Анализ для C18H17ClF2O3S. Рассчитано: C,55,89; H,4,43; Cl,9,16; F,9,82; S,8,29. Найдено: C,55,64; H,4,27; Cl,9,41; F,9,89; S,8,28.
Пример 35: 4-[[(4-Хлорфенил)сульфонил](2,5-дифторфенил)метил]тетрагидротиопиран
[Химическая формула 78]
2-[(4-Хлорфенил)сульфонилметил]-1,4-дифторбензол (500 мг, 1,65 ммоль), полученный в ссылочном примере 1, и тетрагидротиопиран-4-ол (400 мг, 3,38 ммоль), полученный в ссылочном примере 19, растворяли в толуоле (20 мл). После добавления цианометилентри-н-бутилфосфорана (800 мг, 3,31 ммоль) полученную смесь нагревали при кипячении с обратным холодильником в течение 14 часов в атмосфере аргона. Реакционной смеси давали охладиться и к смеси добавляли цианометилентри-н-бутилфосфоран (400 мг, 1,66 ммоль). Полученную смесь нагревали при кипячении с обратным холодильником в течение 14 часов в атмосфере аргона. Реакционной смеси давали охладиться и затем концентрировали при пониженном давлении. Полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=15:1, концентрировали при пониженном давлении с получением белого твердого вещества. Полученное белое твердое вещество промывали смесью гексан/диизопропиловый эфир с получением указанного в заголовке соединения (404 мг, 1,00 ммоль, 61%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 1,47 (1H, ддд, J=23,4, 10,0, 3,3 Гц), 1,68 (1H, ддд, J=25,0, 11,4, 3,3 Гц), 2,13 (1H, дм, J=11,4 Гц), 2,50-2,78 (5H, м), 2,82 (1H, тд, J=12,8, 2,6 Гц), 4,47 (1H, д, J=7,3 Гц), 6,72-6,82 (1H, м), 6,90-7,00 (1H, м), 7,31 (2H, д, J=8,8 Гц), 7,40-7,60 (1H, м), 7,49 (2H, д, J=8,8 Гц).
Т.пл.: 150-152°C.
MS m/z: 403 (M++H).
Элементный Анализ для C18H17ClF2O2S2. Рассчитано: C,53,66; H,4,25; Cl,8,80; F,9,43; S,15,92. Найдено: C,53,52; H,4,21; Cl,9,00; F,9,54; S,15,88.
Пример 36: 4-[[(4-Хлорфенил)сульфонил] (2,5-дифторфенил)метил]тетрагидротиопиран-1,1-диоксид (Соединение A) и 4-[[(4-хлорфенил)сульфонил](2,5-дифторфенил)метил]тетрагидротиопиран-1-оксид (Соединение B (Изомер A) и Соединение B (Изомер B))
[Химическая формула 79]
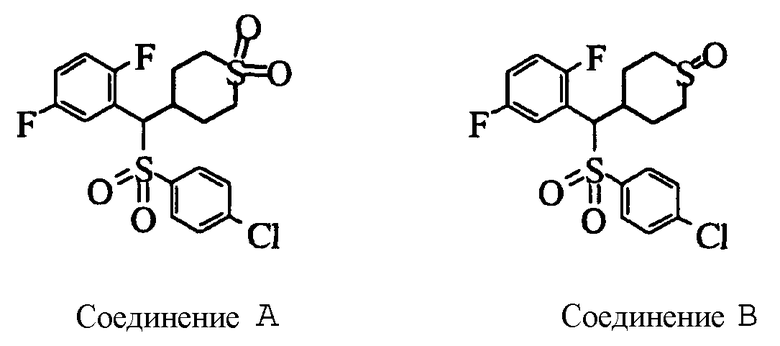
После растворения 4-[[(4-хлорфенил)сульфонил](2,5-дифторфенил)метил]тетрагидротиопирана (360 мг, 0,893 ммоль) в дихлорметане (15 мл) к полученному раствору при охлаждении льдом добавляли 3-хлорпербензойную кислоту (320 мг, 1,85 ммоль). После перемешивания при комнатной температуре в течение 14 часов реакционную смесь концентрировали при пониженном давлении. Полученный остаток подвергали флэш-хроматографии на силикагеле и фракцию, полученную при элюировании гексан:этилацетат=1:1, концентрировали при пониженном давлении с получением белого твердого вещества. Полученное белое твердое вещество растворяли в дихлорметане. Полученный раствор промывали последовательно 1 н. водным раствором гидроксида натрия и насыщенным солевым раствором. Органический слой сушили над безводным сульфатом магния. После фильтрования фильтрат концентрировали при пониженном давлении с получением белого твердого вещества. Полученное белое твердое вещество промывали диэтиловым эфиром с получением указанного в заголовке соединения A (187 мг, 0,430 ммоль, 48%) в виде белого порошка. Помимо этого, фракцию, полученную при элюировании смесью дихлорметан:метанол=50:1, концентрировали при пониженном давлении с получением смеси указанного в заголовке Соединения B (Изомер A) и указанного в заголовке Соединения B (Изомер B) в виде белого твердого вещества. Полученную смесь разделяли и очищали флэш-хроматографией на силикагеле (дихлорметан:метанол=80:1). Полученные белые твердые вещества промывали диэтиловым эфиром с получением указанного в заголовке соединения B (Изомер A) (низкополярное) (78 мг, 0,19 ммоль, 21%) в виде белого порошка и указанного в заголовке Соединения B (Изомер B) (высокополярное) (69 мг, 0,17 ммоль, 19%) в виде белого порошка.
Соединение A
1H-ЯМР (400 МГц, CDCl3)δ: 1,85-2,00 (1H, м), 2,18-2,35 (2H, м), 2,68-2,91 (2H, м), 2,98-3,10 (2H, м), 3,10-3,28 (2H, м), 4,54 (1H, шир.д, J=7,1 Гц), 6,74-6,90 (1H, м), 6,94-7,06 (1H, м), 7,33 (2H, д, J=8,7 Гц), 7,35-7,55 (1H, м), 7,49 (2H, д, J=8,7 Гц).
Т.пл.: 245-248°C.
Элементный Анализ для C18H17ClF2O4S2. Рассчитано: C,49,71; H,3,94; Cl,8,15; F,8,74; S,14,75. Найдено: C,49,38; H,3,87; Cl,8,50; F,8,86; S,14,62.
Соединение B (Изомер A)
1H-ЯМР (400 МГц, CDCl3)δ: 1,76 (1H, шир.д, J=13,4 Гц), 2,18 (1H, ддм, J=25,4, 12,5 Гц), 2,32-2,70 (4H, м), 2,74-2,90 (1H, м), 2,98 (1H, дм, J=14,0 Гц), 3,09 (1H, дм, J=14,4 Гц), 4,53 (1H, д, J=7,3 Гц), 6,72-6,86 (1H, м), 6,90-7,02 (1H, м), 7,32 (2H, д, J=8,5 Гц), 7,40-7,60 (1H, м), 7,49 (2H, д, J=8,5 Гц).
Т.пл.: 255-256°C.
Элементный Анализ для C18H17ClF2O3S2. Рассчитано: C,51,61; H,4,09; Cl,8,46; F,9,07; S,15,31. Найдено: C,51,51; H,4,04; Cl,8,69; F,9,15; S,15,20.
Соединение B (Изомер B)
1H-ЯМР (400 МГц, CDCl3)δ: 1,42 (1H, ддм, J=22,3, 11,7 Гц), 1,92 (1H, ддм, J=11,7, 11,0 Гц), 2,14-2,27 (1H, м), 2,66 (1H, тд, J=12,2, 2,7 Гц), 2,70-2,90 (3H, м), 3,10-3,24 (1H, м), 3,32-3,44 (1H, м), 4,49 (1H, д, J=8,1 Гц), 6,72-6,85 (1H, м), 6,90-7,02 (1H, м), 7,32 (2H, д, J=8,5 Гц), 7,34-7,50 (1H, м), 7,48 (2H, д, J=8,5 Гц).
Т.пл.: 184-187°C.
Элементный Анализ для C18H17ClF2O3S2. Рассчитано: C,51,61; H,4,09; Cl,8,46; F,9,07; S,15,31. Найдено: C,51,82; H,4,23; Cl,8,42; F,9,12; S,15,07.
Пример 37: трет-Бутил 4-[[(4-хлорфенил)сульфонил](2,5-дифторфенил)метил]-1-пиперидинкарбоксилат
[Химическая формула 80]
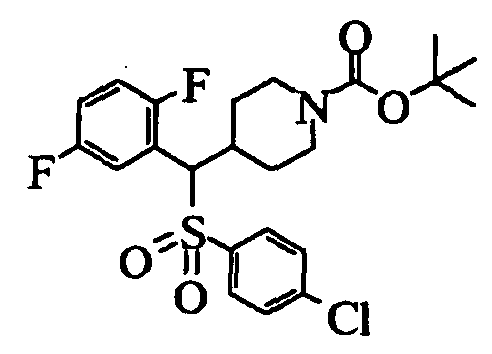
2-[(4-Хлорфенил)сульфонилметил]-1,4-дифторбензол (1,25 г, 4,13 ммоль), полученный в ссылочном примере 1, и трет-бутил 4-гидрокси-1-пиперидинкарбоксилат (1,70 г, 8,44 ммоль) растворяли в толуоле (50 мл). К полученному раствору добавляли цианометилентри-н-бутилфосфоран (2,00 г, 8,29 ммоль). Полученную смесь нагревали при кипячении с обратным холодильником в течение 14 часов в атмосфере аргона. Реакционной смеси давали охладиться и затем концентрировали при пониженном давлении. Полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=1:1, концентрировали при пониженном давлении с получением белого твердого вещества. Полученное белое твердое вещество промывали диэтиловым эфиром с получением указанного в заголовке соединения (1,68 г, 3,46 ммоль, 84%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 1,10-1,25 (1H, м), 1,40-1,70 (2H, м), 1,44 (9H, с), 2,30-2,50 (1H, м), 2,60-2,95 (3H, м), 4,00-4,25 (2H, м), 4,45 (1H, д, J=7,8 Гц), 6,69-6,80 (1H, м), 6,88-6,98 (1H, м), 7,31 (2H, д, J=8,6 Гц), 7,35-7,50 (1H, м), 7,49 (2H, д, J=8,6 Гц).
Т.пл.: 193-196°C.
Элементный Анализ для C23H26ClF2NO4S. Рассчитано: C,56,84; H,5,39; Cl,7,30; F,7,82; N,2,88; S,6,60. Найдено: C,56,41; H,5,43; Cl,7,77; F,7,61; N,2,99; S,6,58.
Пример 38: гидрохлорид 4-[[(4-Хлорфенил)сульфонил](2,5-дифторфенил)метил]пиперидина
[Химическая формула 81]

трет-Бутил 4-[[(4-хлорфенил)сульфонил](2,5-дифторфенил)метил]-1-пиперидинкарбоксилат (1,56 г, 3,21 ммоль) растворяли в дихлорметане (50 мл). К полученному раствору при охлаждении льдом добавляли по каплям трифторуксусную кислоту (5,0 мл). Реакционную смесь перемешивали при комнатной температуре в течение 2 часов и затем концентрировали при пониженном давлении. К полученному остатку добавляли дихлорметан (10 мл) и 1 н. раствор хлористоводородной кислоты в этаноле (10 мл). Полученную смесь концентрировали при пониженном давлении с получением белого твердого вещества. Полученное твердое вещество промывали диэтиловым эфиром с получением указанного в заголовке соединения (1,36 г, 3,12 ммоль, 97%) в виде белого порошка.
1H-ЯМР (400 МГц, CD3OD)δ: 1,38-1,52 (1H, м), 1,70-1,92 (2H, м), 2,73 (1H, шир.д, J=14,2 Гц), 2,86-3,00 (1H, м), 3,05 (1H, тд, J=12,9, 3,1 Гц), 3,13 (1H, тд, J=13,1, 3,1 Гц), 3,30-3,40 (1H, м), 3,48 (1H, дм, J=13,0 Гц), 4,72 (1H, д, J=8,6 Гц), 6,82-6,98 (1H, м), 7,04-7,12 (1H, м), 7,40-7,55 (1H, м), 7,44 (2H, д, J=8,6 Гц), 7,57 (2H, д, J=8,6 Гц).
Т.пл.: 184-190°C.
Элементный Анализ для C18H18ClF2NO2S·HCl·0,75H2O. Рассчитано: C,49,61; H,4,74; Cl,16,27; F,8,72; N,3,21; S,7,36. Найдено: C,49,57; H,4,75; Cl,15,79; F,9,16; N,3,34; S,7,25.
Пример 39: 2-[(4-Хлорфенилтио)-(2,5-дифторфенил)метил]-5-[(4-хлорфенилтио)метил]пиридин
[Химическая формула 82]
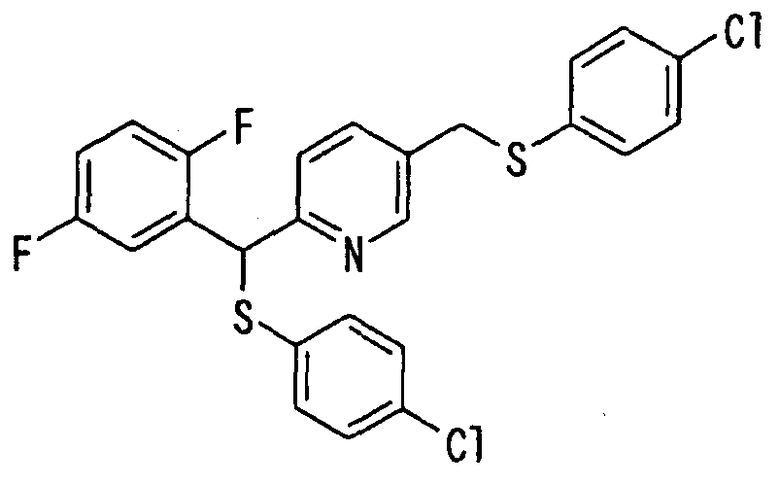
Суспензию борогидрида натрия (33 мг, 0,88 ммоль) в этаноле (15 мл) охлаждали до -78°C. К суспензии добавляли по порциям при перемешивании раствор [6-(2,5-дифторфенилкарбонил)пиридин-3-ил]метилацетата (510 мг, 1,75 ммоль), полученного в ссылочном примере 21, в этаноле (10 мл). Реакционную смесь перемешивали в течение 30 минут. Добавляли водный раствор хлорида аммония и полученной смеси давали выстояться до достижения комнатной температуры. Реакционную смесь экстрагировали этилацетатом (100 мл). Экстракт промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток растворяли в метиленхлориде (30 мл), а затем добавляли при охлаждении льдом триэтиламин (270 мкл) и метансульфонилхлорид (270 мкл). Реакционную смесь перемешивали при комнатной температуре в течение 3 дней. После добавления воды смесь экстрагировали этилацетатом (60 мл). Экстракт промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток растворяли в N,N-диметилформамиде (25 мл). К полученному раствору в атмосфере азота добавляли 4-хлорбензолтиол (751 мг, 5,3 ммоль) и карбонат калия (718 мг, 5,2 ммоль). Реакционную смесь перемешивали при 60°C в течение 1 часа. После охлаждения реакционной смеси до комнатной температуры к смеси добавляли диэтиловый эфир (80 мл). Полученную смесь промывали водой и насыщенным солевым раствором. Органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток подвергали хроматографии на силикагеле (гексан:этилацетат=10:1) с получением указанного в заголовке соединения (237 мг, 27%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 3,99 (2H, с), 5,81 (1H, с), 6,90 (2H, м), 7,15 (2H, д, J=8,8 Гц), 7,16 (2H, д, J=8,8 Гц), 7,19 (4H, д, J=8,8 Гц), 7,20 (1H, д, J=7,6 Гц), 7,38 (1H, м), 7,49 (1H, дд, J=2,0,7,6 Гц), 8,38 (1H, шир.).
Т.пл.: 87-88°C.
Пример 40: 2-[(4-Хлорфенилсульфонил)-(2,5-дифторфенил)метил]-5-[(4-хлорфенилсульфонил)метил]пиридин
[Химическая формула 83]
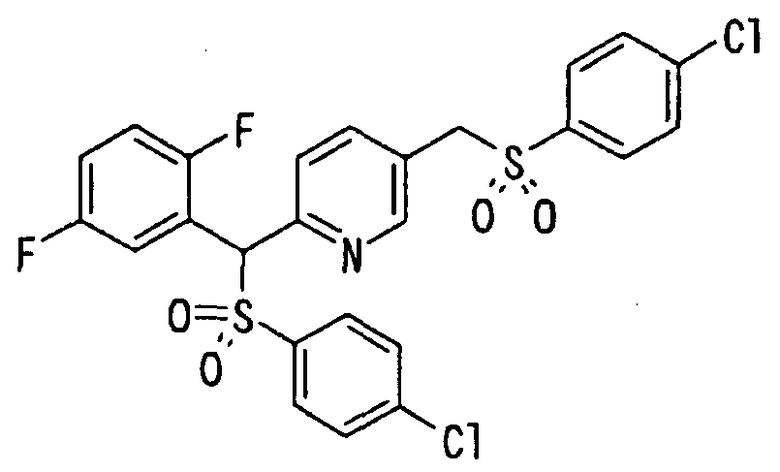
Тетрагидрат гексааммонийгептамолибдата (30 мг) добавляли к раствору 2-[(4-хлорфенилтио)-(2,5-дифторфенил)метил]-5-[(4-хлорфенилтио)метил]пиридина (75 мг, 0,15 ммоль) в метаноле (6,0 мл), а затем добавляли 30% водный раствор перекиси водорода (3 мл). Полученную смесь перемешивали в течение 22 часов. К реакционной смеси добавляли этилацетат. Полученную смесь промывали водой, водным раствором тиосульфата натрия и насыщенным солевым раствором, сушили и концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (2% MeOH/CHCl3) с получением указанного в заголовке соединения (70 мг, 62%) в виде игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3)δ: 4,29 (2H, с), 5,91 (1H, с), 6,90-7,08 (2H, м), 7,39 (2H, дд, J=1,6, 6,8 Гц), 7,45 (2H, дд, J=1,6, 6,8 Гц), 7,51 (2H, д, J=8,8 Гц), 7,55 (2H, д, J=8,8 Гц), 7,60 (1H, д, J=8,0 Гц), 7,65 (1H, дд, J=2,4, 8,0 Гц), 7,91 (1H, м), 8,23 (1H, с).
Т.пл.: 186-187°C.
Элементный Анализ для C25H17Cl2F2NO4S2. Рассчитано: C,52,82; H,3,01; N,2,46; S,11,28; Cl,12,47; F,6,68. Найдено: C,52,88; H,3,10; N,2,63; S,11,38; Cl,12,40; F,6,83.
Пример 41: 2-[(4-Хлорфенилтио)-(2,5-дифторфенил)метил]-5-(1,3-диоксолан-2-ил)пиридин
[Химическая формула 84]
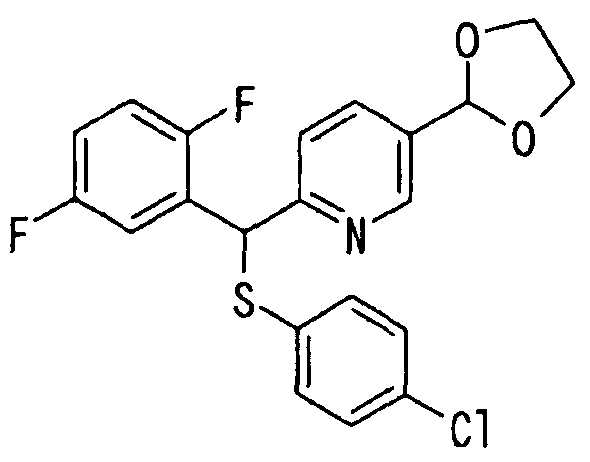
Триэтиламин (1,08 мл, 7,8 ммоль) и метансульфонилхлорид (0,52 мл, 6,8 ммоль) добавляли в атмосфере азота при охлаждении льдом к раствору 2-[(2,5-дифторфенил)-гидроксиметил]-5-(1,3-диоксолан-2-ил)пиридина (1,52 г, 5,2 ммоль), полученного в ссылочном примере 22, в метиленхлориде (30 мл). Полученную смесь перемешивали при комнатной температуре в течение 3 часов. После добавления насыщенного водного раствора бикарбоната натрия полученную смесь экстрагировали простым эфиром. Экстракт промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток растворяли в диметилформамиде (30 мл). К полученному раствору добавляли хлорбензолтиол (901 мг, 6,2 ммоль) и карбонат калия (1,08 г, 7,8 ммоль) с последующим перемешиванием при 60°C в течение 3 часов. После охлаждения до комнатной температуры реакционную смесь разбавляли простым эфиром. Разбавленный раствор промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат=5:1) с получением указанного в заголовке соединения (1,56 г, 71%) в виде игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3)δ: 4,0-4,15 (4H, м), 5,84 (1H, с), 5,92 (1H, с), 6,85-6,96 (2H, м), 7,19 (2H, д, J=8,8 Гц), 7,25 (2H, д, J=8,8 Гц), 7,43 (1H, д, J=8,0 Гц), 7,43 (1H, м), 7,77 (1H, дд, J=2,0, 8,0 Гц), 8,70 (1H, д, J=2,0 Гц).
Т.пл.: 70-73°C.
MS m/z: 420 (M++H).
Пример 42: 2-[(4-Хлорфенилсульфонил)-(2,5-дифторфенил)метил]-5-(1,3-диоксолан-2-ил)пиридин
[Химическая формула 85]
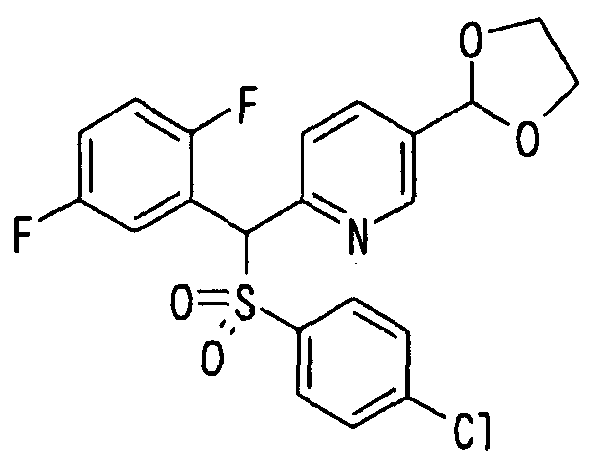
Тетрагидрат гексааммонийгептамолибдата (150 мг) добавляли к раствору 2-[(4-хлорфенилтио)-(2,5-дифторфенил)метил]-5-(1,3-диоксолан-2-ил)пиридина (1,54 г, 3,67 ммоль) в метаноле (30 мл). К полученной смеси добавляли 30% водный раствор перекиси водорода (15 мл) с последующим перемешиванием в течение 24 часов. Реакционную смесь разбавляли этилацетатом, затем разбавленный раствор промывали водой и насыщенным солевым раствором и концентрировали при пониженном давлении. Полученный остаток кристаллизовали из этанола с получением указанного в заголовке соединения (1,22 г, 74%) в виде игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3)δ: 4,02-4,10 (4H, м), 5,85 (1H, с), 5,97 (1H, с), 6,91 (1H, м), 6,96 (1H, м), 7,38 (2H, д, J=8,4 Гц), 7,53 (2H, д, J=8,4 Гц), 7,63 (1H, д, J=7,6 Гц), 7,82 (1H, д, J=8,0 Гц), 7,94 (1H, м), 8,67 (1H, шир.с).
Т.пл.: 167-168°C.
FAB-MS: 452,0544 (Рассчитано для C21H17ClF2NO4S: 452,0535).
Пример 43: 2-[(4-Хлорфенилсульфонил)-(2,5-дифторфенил)-метил]-5-(гидроксиметил)пиридин
[Химическая формула 86]
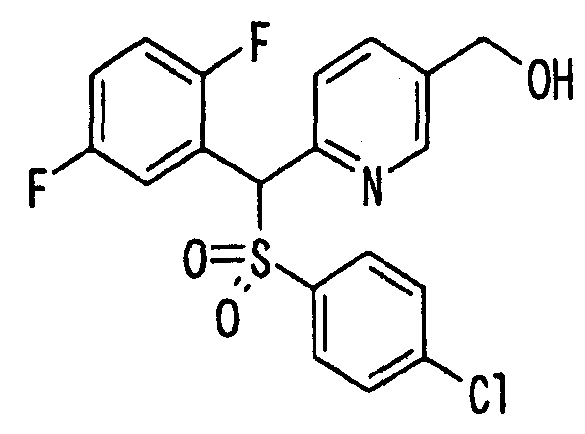
К раствору (30 мл) 2-[(4-хлорфенилсульфонил)-(2,5-дифторфенил)метил]-5-(1,3-диоксолан-2-ил)пиридина (295 мг, 0,54 ммоль) в 1,4-диоксане добавляли 1 н. раствор хлористоводородной кислоты (30 мл). Полученную смесь перемешивали при комнатной температуре в течение 18 часов. Реакционную смесь экстрагировали этилацетатом. Экстракт промывали водой, насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении с получением остатка.
Полученный остаток растворяли в этаноле (10 мл). К полученному раствору при охлаждении льдом добавляли борогидрид натрия (10 мг, 0,27 ммоль). Полученную смесь перемешивали в течение 1 часа. Добавляли воду и полученную смесь экстрагировали этилацетатом. Экстракт промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении с получением остатка. Полученный остаток очищали хроматографией на силикагеле (3% метанол/хлороформ) с получением указанного в заголовке соединения (205 мг, 93%) в виде игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3)δ: 4,74 (2H, с), 5,94 (1H, с), 6,91 (1H, м), 6,99 (1H, м), 7,38 (2H, д, J=8,4 Гц), 7,53 (2H, д, J=8,4 Гц), 7,62 (1H, д, J=8,0 Гц), 7,76 (1H, дд, J=2,0, 8,0 Гц), 7,98 (1H, м), 8,58 (1H, д, J=2,0 Гц).
Т.пл.: 151-152°C.
FAB-MS: 410,0444 (Рассчитано для C19H15ClF2NO3S: 410,0429).
Пример 44: Метил 3-[6-[(4-хлорфенилсульфонил)-(2,5-дифторфенил)метил]пиридин-3-ил]акрилат
[Химическая формула 87]
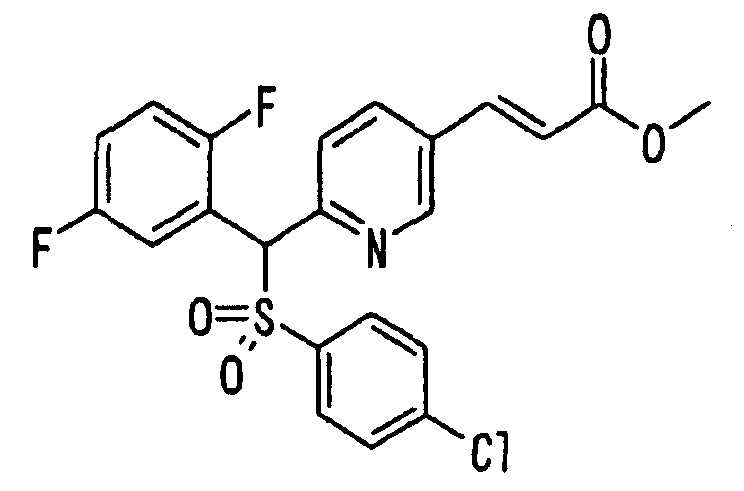
К раствору (10 мл) 2-[(4-хлорфенилсульфонил)-(2,5-дифторфенил)метил]-5-(1,3-диоксолан-2-ил)пиридина (212 мг, 0,47 ммоль), полученного в примере 42, в 1,4-диоксане добавляли 1 н. раствор хлористоводородной кислоты (10 мл). Полученную смесь перемешивали при комнатной температуре в течение 19 часов. Реакционную смесь экстрагировали этилацетатом. Экстракт промывали водой, насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении с получением остатка.
Полученный остаток растворяли в тетрагидрофуране (15 мл). В атмосфере азота добавляли метил(трифенилфосфоранилиден)ацетат (188 мг, 0,56 ммоль) и полученную смесь перемешивали в течение 17 часов. Реакционную смесь концентрировали при пониженном давлении с получением остатка. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат=5:1) с получением указанного в заголовке соединения (187 мг, 86%) в виде игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3)δ: 3,80 (3H, с), 5,94 (1H, с), 6,50 (1H, д, J=16,0 Гц), 6,91 (1H, м), 6,99 (1H, м), 7,38 (2H, д, J=8,8 Гц), 7,53 (2H, д, J=8,8 Гц), 7,63 (1H, д, J=8,0 Гц), 7,63 (1H, д, J=16,0 Гц), 7,84 (1H, дд, J=2,0, 8,0 Гц), 7,98 (1H, м), 8,70 (1H, д, J=2,0 Гц).
Т.пл.: 145-146°C.
MS m/z: 464 (M++H).
Пример 45: Метил 3-[6-[(4-хлорфенилсульфонил)-(2,5-дифторфенил)метил]пиридин-3-ил]пропионат
[Химическая формула 88]
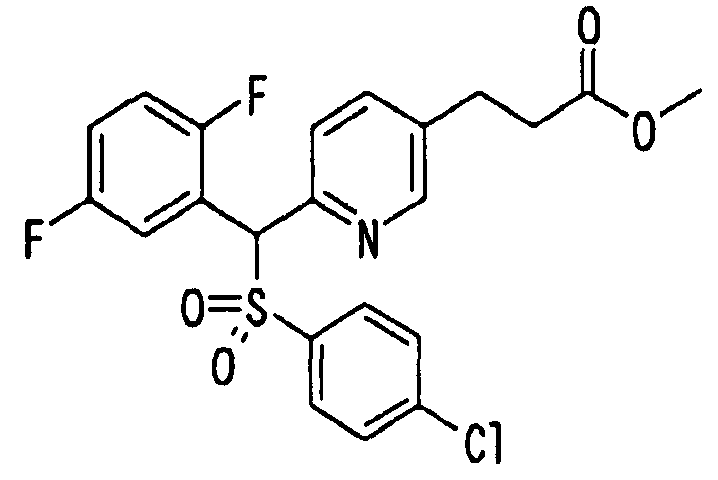
Метил 3-[6-[(4-хлорфенилсульфонил)-(2,5-дифторфенил)метил]пиридин-3-ил]акрилат (160 мг, 0,34 ммоль) растворяли в этаноле (15 мл). К полученному раствору добавляли палладий на углероде (30 мг). Полученную смесь интенсивно перемешивали в атмосфере водорода при давлении 1 атмосфера в течение 24 часов. Реакционную смесь фильтровали и затем фильтрат концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат=5:1) с получением указанного в заголовке соединения (94 мг, 58%) в виде игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3)δ: 2,63 (2H, т, J=7,6 Гц), 2,95 (2H, т, J=7,6 Гц), 3,65 (3H, с), 5,89 (1H, с), 6,90 (1H, м), 6,97 (1H, м), 7,36 (2H, д, J=8,4 Гц), 7,53 (2H, д, J=8,4 Гц), 7,55 (2H, м), 8,00 (1H, м), 8,45 (1H, д, J=1,6 Гц).
Т.пл.: 121-123°C.
MS m/z: 466 (M++H).
Пример 46: 3-[6-[(4-Хлорфенилсульфонил)-(2,5-дифторфенил)метил]пиридин-3-ил]пропионовая кислота
[Химическая формула 89]
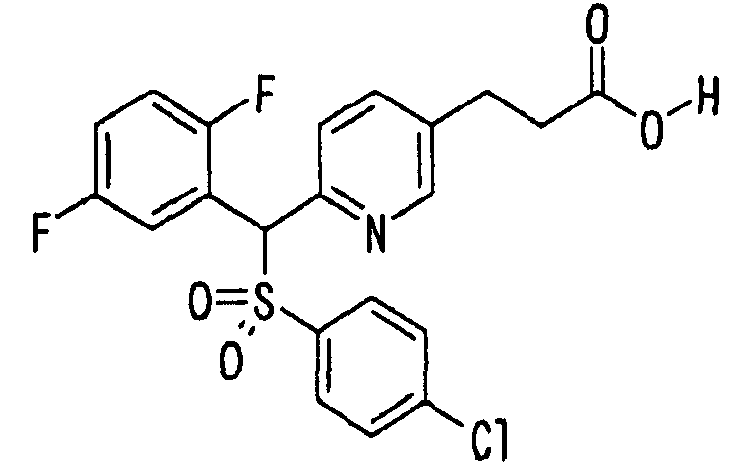
Метил 3-[6-[(4-хлорфенилсульфонил)-(2,5-дифторфенил)метил]пиридин-3-ил]пропионат (92 мг, 0,20 ммоль) растворяли в тетрагидрофуране (5 мл). К полученному раствору добавляли водный раствор (3 мл) гидроксида лития (23 мг, 0,5 ммоль) и смесь перемешивали в течение 2 часов. После добавления 10% раствора гидросульфата натрия полученную смесь экстрагировали этилацетатом. Экстракт промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении с получением остатка. Полученный остаток кристаллизовали из этанола с получением указанного в заголовке соединения (67 мг, 75%) в виде игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3)δ: 2,69 (2H, т, J=7,6 Гц), 2,96 (2H, т, J=7,6 Гц), 5,92 (1H, с), 6,90 (1H, м), 6,98 (1H, м), 7,36 (2H, д, J=8,4 Гц), 7,52 (2H, д, J=8,4 Гц), 7,56 (2H, м), 7,99 (1H, м), 8,47 (1H, д, J=2,4 Гц).
Т.пл.: 158-160°C.
MS m/z: 452 (M++H).
Элементный Анализ для C21H16ClF2NO4S. Рассчитано: C,55,82; H,3,57; N,3,10; S,7,10; Cl,7,85; F,8,41. Найдено: C,55,70; H,3,75; N,3,19; S,7,12; Cl,8,64; F,8,11.
Пример 47: [6-[(4-Хлорфенилсульфонил)-(2,5-дифторфенил)метил]пиридин-3-ил]карбальдегид
[Химическая формула 90]
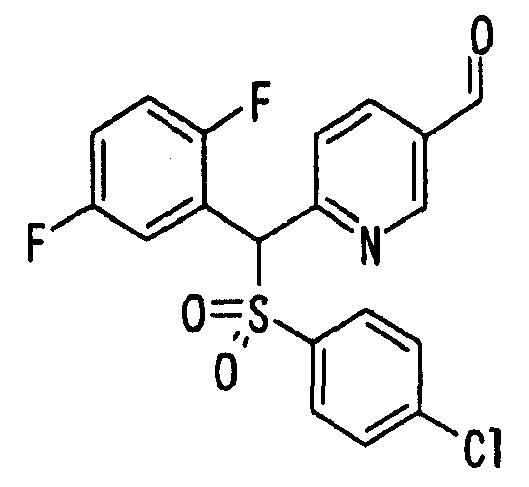
К раствору (30 мл) 2-[(4-хлорфенилсульфонил)-(2,5-дифторфенил)метил]-5-(1,3-диоксолан-2-ил)пиридина (602 мг, 1,3 ммоль), полученного в примере 42, в 1,4-диоксане добавляли 1 н. раствор хлористоводородной кислоты (30 мл). Полученную смесь перемешивали при комнатной температуре в течение 18 часов. Реакционную смесь экстрагировали этилацетатом. Экстракт промывали водой, насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении с получением остатка. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат=5:1) с получением указанного в заголовке соединения (530 мг, 98%) в виде игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3)δ: 6,01 (1H, с), 6,94 (1H, м), 7,01 (1H, м), 7,40 (2H, д, J=8,4 Гц), 7,54 (2H, д, J=8,4 Гц), 7,81 (1H, д, J=8,4 Гц), 7,97 (1H, м), 8,20 (1H, дд, J=2,0, 8,4 Гц), 9,05 (1H, д, J=2,0 Гц), 10,12 (1H, с).
Пример 48: 2-[(4-Хлорфенилсульфонил)-(2,5-дифторфенил)метил]-5-(пиперидин-1-илметил)пиридин
[Химическая формула 91]
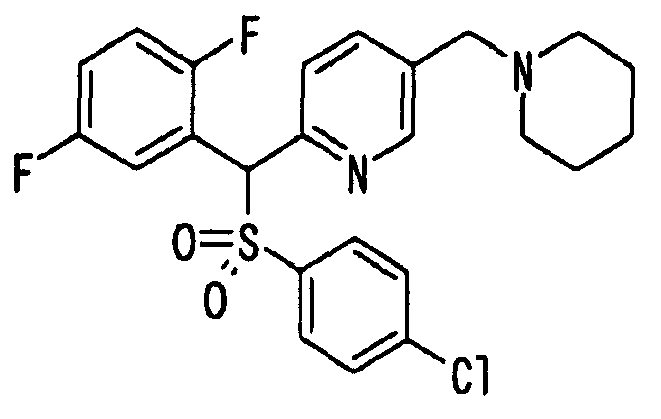
К раствору (5 мл) [6-[(4-хлорфенилсульфонил)-(2,5-дифторфенил)метил]пиридин-3-ил]карбальдегида (82 мг, 0,2 ммоль) и пиперидина (40 мкл, 0,4 ммоль) в метиленхлориде добавляли при комнатной температуре уксусную кислоту (23 мкл, 0,4 ммоль) и триацетоксиборогидрид натрия (85 мг, 0,4 ммоль). Полученную смесь перемешивали в течение 3 часов. Реакцию завершали добавлением насыщенного водного раствора бикарбоната натрия, после чего реакционную смесь разбавляли этилацетатом (80 мл). Органический слой отделяли, промывали водой и насыщенным солевым раствором, сушили и концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат=1:1) с последующей кристаллизацией из этанола с получением указанного в заголовке соединения (89 мг, 93%).
1H-ЯМР (400 МГц, CDCl3)δ: 1,5-1,6 (6H, м), 2,3-2,4 (4H, м), 3,45 (2H, с), 5,91 (1H, с), 6,90 (1H, м), 6,98 (1H, м), 7,35 (2H, д, J=8,4 Гц), 7,52 (2H, д, J=8,4 Гц), 7,53 (1H, м), 7,7 (1H, шир.), 8,02 (1H, м), 8,49 (1H, д, J=2,4 Гц).
Т.пл.: 113-114°C.
MS m/z: 477 (M++H).
Элементный Анализ для C24H23ClF2N2O2S. Рассчитано: C,60,44; H,4,86; N,5,87; S,6,72; Cl,7,43; F,7,97. Найдено: C,59,87; H,4,81; N,5,83; S,6,87; Cl,7,55; F,8,02.
Пример 49: 4-[[6-[(4-Хлорфенилсульфонил)-(2,5-дифторфенил)метил]пиридин-3-ил]метил]морфолин
[Химическая формула 92]
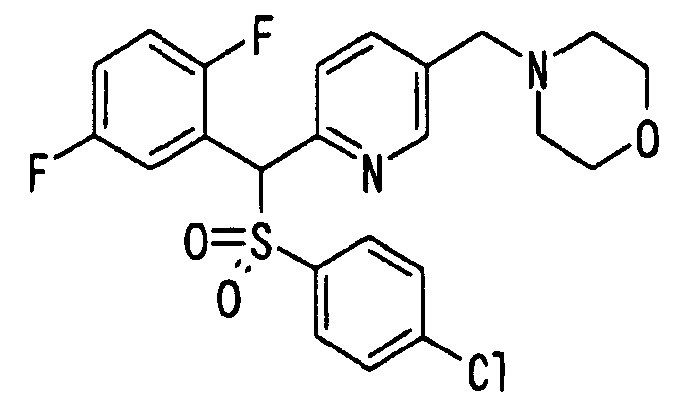
К раствору [6-[(4-хлорфенилсульфонил)-(2,5-дифторфенил)метил]пиридин-3-ил]карбальдегида (82 мг, 0,2 ммоль), полученного в примере 47, и морфолина (35 мкл, 0,4 ммоль) в метиленхлориде (5 мл) добавляли при комнатной температуре уксусную кислоту (23 мкл, 0,4 ммоль) и триацетоксиборогидрид натрия (85 мг, 0,4 ммоль). Полученную смесь перемешивали в течение 3 часов. Реакцию завершали добавлением насыщенного водного раствора бикарбоната натрия, после чего реакционную смесь разбавляли этилацетатом (80 мл). Органический слой отделяли, промывали водой и насыщенным солевым раствором, сушили и затем концентрировали при пониженном давлении с получением остатка. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат=1:1) с последующей кристаллизацией из этанола с получением указанного в заголовке соединения (90 мг, 94%).
1H-ЯМР (400 МГц, CDCl3)δ: 2,4 (4H, м), 3,49 (2H, с), 3,6 (4H, м), 5,92 (1H, с), 6,90 (1H, м), 6,98 (1H, м), 7,36 (2H, д, J=8,4 Гц), 7,53 (2H, д, J=8,4 Гц), 7,57 (1H, д, J=8,0 Гц), 7,71 (1H, шир.- д, J=8,0 Гц), 8,02 (1H, м), 8,53 (1H, д, J=2,0 Гц).
Т.пл.: 120-121°C.
MS m/z: 479 (M++H).
Элементный Анализ для C22H21ClF2N2O3S. Рассчитано: C,57,68; H,4,42; N,5,85; S,6,70; Cl,7,40; F,7,93. Найдено: C,57,41; H,4,43; N,5,90; S,6,82; Cl,7,52; F,7,91.
Пример 50: [6-[(4-Хлорфенилсульфонил)-(2,5-дифторфенил)метил]пиридин-3-ил]карбоновая кислота
[Химическая формула 93]
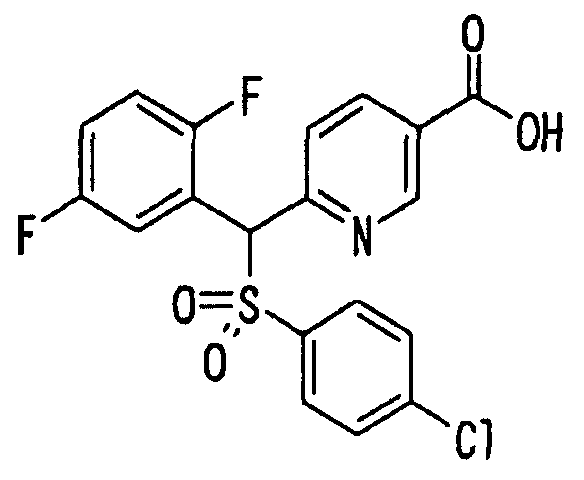
К раствору [6-[(4-хлорфенилсульфонил)-(2,5-дифторфенил)метил]пиридин-3-ил]карбальдегида (110 мг, 0,27 ммоль), полученного в примере 47, в трет-бутаноле (3,0 мл) добавляли 2 метил-2-бутен (143 мкл, 1,35 ммоль). К полученной суспензии добавляли водный раствор (0,6 мл) дигидрофосфата натрия (32,4 мг, 0,27 ммоль). Затем добавляли хлорит натрия (98 мг, 1,08 ммоль) и смесь перемешивали в течение 2 часов. К реакционной смеси добавляли воду (30 мл) и уксусную кислоту (1 мл). Полученную смесь экстрагировали этилацетатом (100 мл). Экстракт промывали насыщенным солевым раствором, сушили и дистиллировали при пониженном давлении. Полученный остаток кристаллизовали из этанола с получением указанного в заголовке соединения (71 мг, 62%) в виде игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3)δ: 6,03 (1H, с), 6,96 (1H, м), 7,03 (1H, м), 7,42 (2H, д, J=8,4 Гц), 7,56 (2H, д, J=8,4 Гц), 7,73 (1H, д, J=8,4 Гц), 7,97 (1H, м), 8,35 (1H, дд, J=2,0, 8,4 Гц), 9,20 (1H, д, J=2,0 Гц).
Т.пл.: >230°C.
MS m/z: 424 (M++H).
Элементный Анализ для C19H12ClF2NO4S. Рассчитано: C,53,84; H,2,85; N,3,30; S,7,57; Cl,8,37; F,8,97. Найдено: C,53,47; H,2,81; N,3,46; S,7,65; Cl,8,49; F,9,00.
Пример 51: 3-[(4-Хлорфенилсульфонил)-(2,5-дифторфенил)метил]пиридин-N-оксид
[Химическая формула 94]
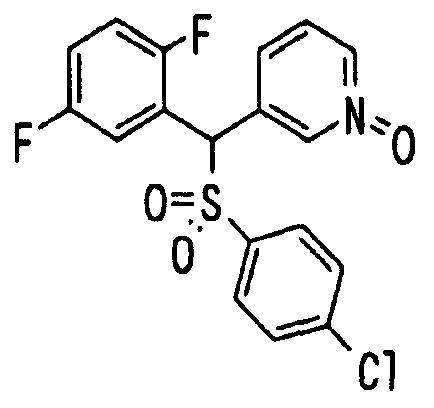
К раствору 3-[(4-хлорфенилсульфонил)-(2,5-дифторфенил)метил]пиридина (162 мг, 0,427 ммоль), полученного в примере 19, в метиленхлориде (15 мл) добавляли 3 хлорпербензойную кислоту (81 мг, 0,47 ммоль). Полученную смесь перемешивали в течение 24 часов. Реакционную смесь разбавляли простым эфиром (60 мл). Разбавленную смесь промывали насыщенным водным раствором бикарбоната натрия, водой и насыщенным солевым раствором, сушили и фильтровали. Фильтрат концентрировали при пониженном давлении с получением остатка. Полученный остаток подвергали хроматографии на силикагеле (этилацетат) с получением указанного в заголовке соединения (68 мг, 40%). Это соединение кристаллизовали из этанола с получением бесцветных игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3)δ: 5,58 (1H, с), 6,95 (1H, м), 7,03 (1H, м), 7,29 (1H, дд, J=6,6, 8,0 Гц), 7,42 (2H, д, J=8,6 Гц), 7,57 (1H, д, J=8,0 Гц), 7,62 (2H, д, J=8,4 Гц), 7,66 (1H, м), 8,10 (1H, д, J=6,6 Гц), 8,29 (1H, с).
Т.пл.: 183-184°C.
Элементный Анализ для C18H12ClF2NO3S. Рассчитано: C,54,62; H,3,06; N,3,54; S,8,10; Cl,8,96; F,9,60. Найдено: C,54,19; H,2,99; N,3,67; S,8,27; Cl,8,92; F,9,53.
Пример 52: 4-[(4-Хлорфенилсульфонил)-(2,5-дифторфенил)-метил]пиридин-N-оксид
[Химическая формула 95]
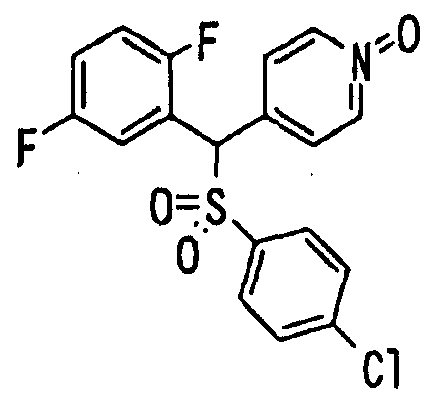
К раствору 4-[(4-хлорфенилсульфонил)-(2,5-дифторфенил)-метил]пиридина (221 мг, 0,58 ммоль), полученного в примере 20, в метиленхлориде (20 мл) добавляли 3-хлорпербензойную кислоту (100 мг, 0,58 ммоль). Полученную смесь перемешивали в течение 20 часов. Реакционную смесь разбавляли простым эфиром (60 мл). Разбавленную смесь промывали насыщенным водным раствором бикарбоната натрия, водой и насыщенным солевым раствором, сушили и затем фильтровали. Фильтрат концентрировали при пониженном давлении с получением остатка. Полученный остаток подвергали хроматографии на силикагеле (этилацетат) с получением указанного в заголовке соединения (183 мг, 80%). Это соединение кристаллизовали из этанола с получением бесцветных игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3)δ: 5,62 (1H, с), 6,97 (1H, м), 7,06 (1H, м), 7,42 (2H, д, J=7,2 Гц), 7,44 (2H, д, J=8,8 Гц), 7,60 (2H, д, J=8,8 Гц), 7,68 (1H, м), 8,17 (2H, д, J=7,2 Гц).
Т.пл.: 211-212°C.
Элементный Анализ для C18H12ClF2NO3S. Рассчитано: C,54,62; H,3,06; N,3,54; S,8,10; Cl,8,96; F,9,60. Найдено: C,54,19; H,2,92; N,3,65; S,8,26; Cl,8,99; F,9,61.
Пример 53: 3-Хлор-4-[(4-хлорфенилтио)-(2,5-дифторфенил)-метил]пиридин
[Химическая формула 96]
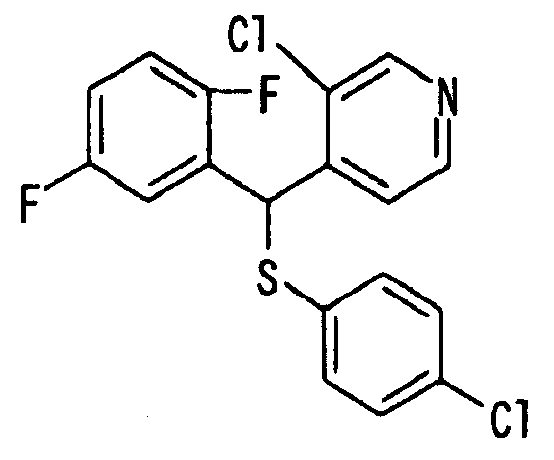
3-Хлор-4-[(2,5-дифторфенил)-гидроксиметил]пиридин (511 мг, 2,0 ммоль), полученный в ссылочном примере 23, растворяли в тионилхлориде (3,0 мл). К полученному раствору добавляли каталитическое количество диметилформамида и смесь перемешивали в течение 17 часов. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли толуол, а затем снова концентрировали.
Полученный остаток растворяли в диметилформамиде (10 мл). К полученному раствору добавляли 4-хлорбензолтиол (375 мг, 2,6 ммоль) и карбонат калия (414 мг, 3 ммоль) в атмосфере азота. Полученную смесь перемешивали при 60°C в течение 3 часов. После охлаждения реакционной смеси до комнатной температуры к смеси добавляли диэтиловый эфир (60 мл). Полученную смесь промывали водой и насыщенным солевым раствором. Органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток подвергали хроматографии на силикагеле (гексан:этилацетат=8:1) с получением указанного в заголовке соединения (196 мг, 26%) в виде твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 6,07 (1H, с), 6,95-7,08 (2H, м), 7,18 (1H, м), 7,23 (2H, д, J=8,8 Гц), 7,26 (2H, д, J=8,8 Гц), 7,58 (1H, д, J=5,2 Гц), 8,51 (1H, д, J=5,2 Гц), 8,58 (1H, с).
Т.пл.: 70-72°C.
MS m/z: 382 (M++1).
Пример 54: 2,5-Дихлор-4-[(4-хлорфенилтио)-(2,5-дифторфенил)-метил]пиридин
[Химическая формула 97]
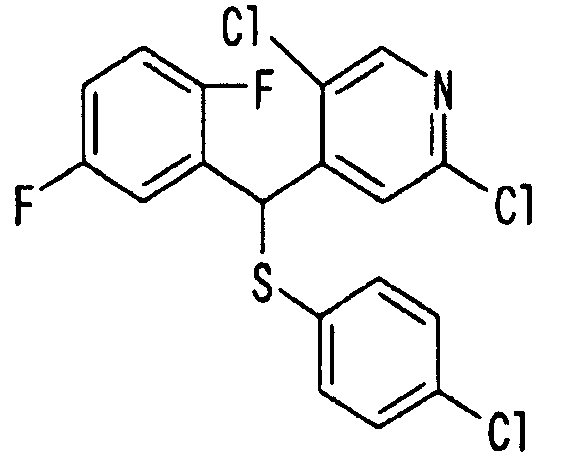
2,5-Дихлор-4-[(2,5-дифторфенил)-гидроксиметил]пиридин (580 мг, 2,0 ммоль), полученный в ссылочном примере 24, растворяли в тионилхлориде (3,0 мл). К полученному раствору добавляли каталитическое количество диметилформамида. Полученную смесь перемешивали в течение 17 часов. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли толуол, а затем снова концентрировали. Остаток растворяли в диметилформамиде (10 мл). К полученному раствору добавляли 4-хлорбензолтиол (375 мг, 2,6 ммоль) и карбонат калия (414 мг, 3 ммоль) в атмосфере азота. Полученную смесь перемешивали при 50°C в течение 17 часов. После охлаждения реакционной смеси до комнатной температуры к смеси добавляли диэтиловый эфир (60 мл). Полученную смесь промывали водой и насыщенным солевым раствором. Органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток подвергали хроматографии на силикагеле (гексан:простой эфир=10:1) с получением указанного в заголовке соединения (484 мг, 58%) в виде твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 5,96 (1H, с), 6,95-7,04 (2H, м), 7,01 (1H, м), 7,23 (2H, д, J=8,8 Гц), 7,26 (2H, д, J=8,8 Гц), 7,54 (1H, с), 8,33 (1H, с).
Т.пл.: 128-129°C.
MS m/z: 416 (M++1).
Пример 55: 3-Хлор-4-[(4-хлорфенилсульфонил)-(2,5-дифторфенил)метил]пиридин
[Химическая формула 98]
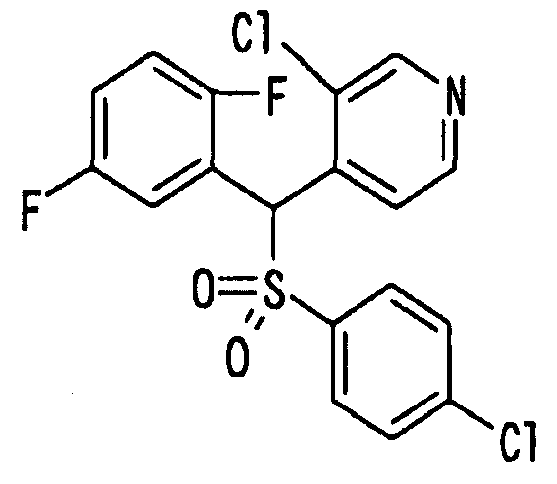
К раствору 3-хлор-4-[(4-хлорфенилтио)-(2,5-дифторфенил)метил]пиридина (122 мг, 0,32 ммоль), полученного в примере 53, в метаноле (12 мл) добавляли тетрагидрат гексааммонийгептамолибдата (60 мг), а затем добавляли 30% водный раствор перекиси водорода (6 мл). Полученную смесь перемешивали в течение 24 часов. Реакционную смесь разбавляли этилацетатом. Разбавленный раствор промывали водой и насыщенным солевым раствором и концентрировали при пониженном давлении. Полученный остаток кристаллизовали из этанола с получением указанного в заголовке соединения (103 мг, 78%) в виде игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3)δ: 6,23 (1H, с), 6,94 (1H, м), 7,06 (1H, м), 7,41 (2H, д, J=8,0 Гц), 7,53 (1H, м), 7,59 (2H, д, J=8,0 Гц), 8,11 (1H, д, J=5,2 Гц), 8,55 (1H, с), 8,60 (1H, д, J=5,2 Гц).
Т.пл.: 160-161°C.
Элементный Анализ для C18H11Cl2F2NO2S. Рассчитано: C,52,19; H,2,68; N,3,38; S,7,74; Cl,17,12; F,9,17. Найдено: C,52,17; H,2,69; N,3,44; S,7,96; Cl,17,12; F,9,00.
Пример 56: 3-Хлор-4-[(4-хлорфенилсульфинил)-(2,5-дифторфенил)-метил]пиридин
[Химическая формула 99]
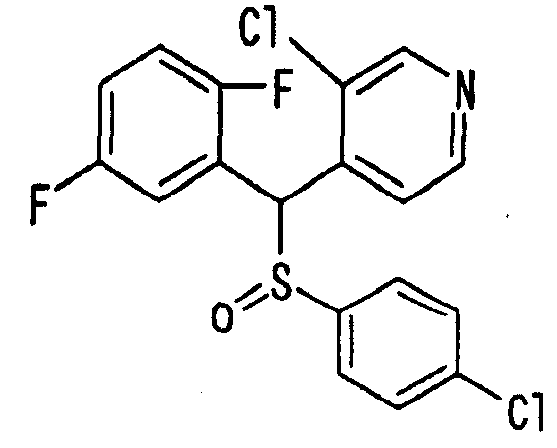
К раствору 3-хлор-4-[(4-хлорфенилтио)-(2,5-дифторфенил)метил]пиридина (75 мг, 0,20 ммоль), полученного в примере 53, в метиленхлориде (10 мл) добавляли 3-хлорпербензойную кислоту (33 мг, 0,20 ммоль). Полученную смесь перемешивали в течение 3 часов при охлаждении льдом. После разбавления простым эфиром (80 мл) разбавленную смесь промывали водой и насыщенным солевым раствором и концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат=3:1) с получением указанного в заголовке соединения (48 мг, 60%) в виде смеси диастереомеров (1:1).
1H-ЯМР (400 МГц, CDCl3)δ: 5,53 (1/2H, с), 5,66 (1/2H, с), 6,83 (1/2H, с), 6,95-7,08 (3/2H, м), 7,23 (1/2H, м), 7,25 (1H, д, J=8,4 Гц), 7,26 (1H, д, J=8,4 Гц), 7,34 (1H, д, J=8,4 Гц), 7,36 (1H, д, J=8,4 Гц), 7,37 (1/2H, м), 7,76 (1/2H, д, J=5,2 Гц), 7,98 (1/2H, д, J=5,2 Гц), 8,47 (1/2H, с), 8,56 (1/2H, д, J=5,2 Гц), 8,60 (1/2H, с), 8,61 (1/2H, д, J=5,2 Гц).
FAB-MS: 397,9992 (Рассчитано для C18H12Cl2F2NOS: 397,9985).
Пример 57: 2,5-Дихлор-4-[(4-хлорфенилсульфонил)-(2,5-дифторфенил)метил]пиридин, 0,5 гидрат
[Химическая формула 100]
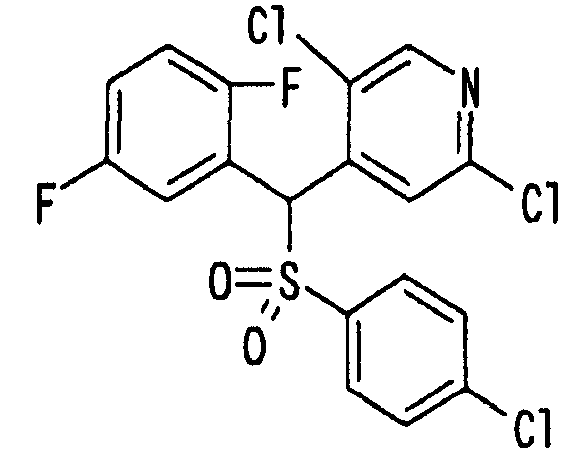
К раствору 2,5-дихлор-4-[(4-хлорфенилтио)-(2,5-дифторфенил)метил]пиридина (60 мг, 0,14 ммоль), полученного в примере 54, в метиленхлориде (3,0 мл) добавляли 3-хлорпербензойную кислоту (62 мг, 0,36 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 3 часов. После разбавления простым эфиром (80 мл) разбавленную смесь промывали насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором и концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат=5:1) и кристаллизовали из гексана с получением указанного в заголовке соединения (55 мг, 88%).
1H-ЯМР (400 МГц, CDCl3)δ: 6,15 (1H, с), 6,93 (1H, м), 7,05 (1H, м), 7,44 (2H, д, J=8,8 Гц), 7,50 (1H, м), 7,59 (2H, д, J=8,8 Гц), 8,13 (1H, с), 8,55 (1H, с), 8,33 (1H, с).
Т.пл.: 147-148°C.
Элементный Анализ для C18H10Cl3F2NO2S,0,5H2O. Рассчитано: C,47,23; H,2,42; N,3,06; S,7,01; Cl,23,24; F,8,30. Найдено: C,47,25; H,2,24; N,3,21; S,7,19; Cl,23,25; F,8,32.
Пример 58: 4-[5-Хлор-4-[(4-хлорфенилтио)-(2,5-дифторфенил)метил]пиридин-2-ил]морфолин
[Химическая формула 101]
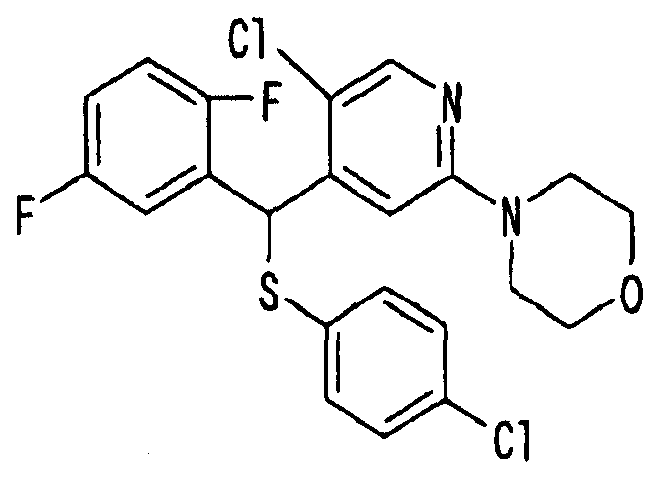
Раствор 2,5-дихлор-4-[(4-хлорфенилтио)-(2,5-дифторфенил)метил]пиридина (100 мг, 0,24 ммоль), полученного в примере 54, и морфолина (200 мкл) в 1,4-диоксане (1,0 мл) перемешивали при 100°C в течение 2 дней в атмосфере азота. После охлаждения до комнатной температуры реакционную смесь разбавляли этилацетатом (40 мл). Разбавленную смесь промывали водой и насыщенным солевым раствором, сушили и затем концентрировали при пониженном давлении с получением остатка. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат=5:1) с получением указанного в заголовке соединения (100 мг, 89%) в виде масла.
1H-ЯМР (400 МГц, CDCl3)δ: 3,48 (4H, м), 3,82 (4H, м), 6,00 (1H, с), 6,94 (1H, с), 6,94-7,04 (2H, м), 7,09 (1H, м), 7,23 (2H, д, J=8,4 Гц), 7,24 (2H, д, J=8,4 Гц), 8,12 (1H, с).
MS m/z: 467 (M++H).
Пример 59: 4-[5-Хлор-4-[(4-хлорфенилсульфонил)-(2,5-дифторфенил)метил]пиридин-2-ил]морфолин
[Химическая формула 102]
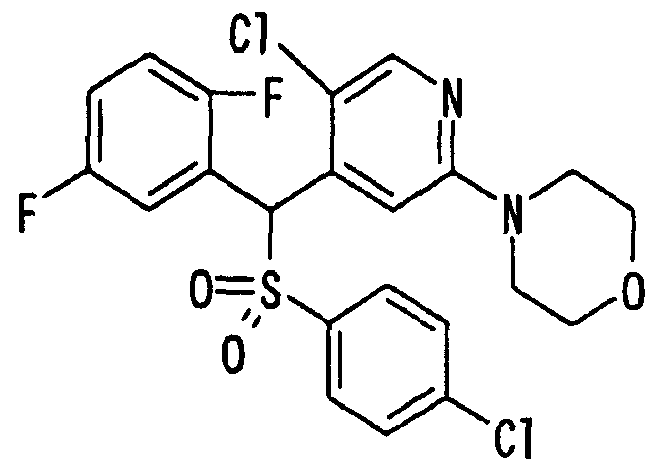
Тетрагидрат гексааммонийгептамолибдата (60 мг) добавляли к раствору 4-[5-хлор-4-[(4-хлорфенилтио)-(2,5-дифторфенил)метил]пиридин-2-ил]морфолина (90 мг, 0,19 ммоль) в метаноле (12 мл), а затем добавляли 30% водный раствор перекиси водорода (6 мл). Полученную смесь перемешивали в течение 6 часов. Реакционную смесь разбавляли этилацетатом. Разбавленную смесь промывали водой и насыщенным солевым раствором и концентрировали при пониженном давлении. Полученный остаток подвергали хроматографии на силикагеле (гексан:этилацетат=3:1) и кристаллизовали из этанола с получением указанного в заголовке соединения (80 мг, 83%) в виде игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3)δ: 3,54 (4H, м), 3,84 (4H, м), 6,12 (1H, с), 6,90 (1H, м), 7,02 (1H, м), 7,42 (2H, д, J=8,4 Гц), 7,45 (1H, с), 7,46 (1H, м), 7,58 (2H, д, J=8,4 Гц), 8,06 (1H, с).
Т.пл.: 180-181°C.
Элементный Анализ для C22H18Cl2F2N2O3S. Рассчитано: C,52,92; H,3,63; N,5,61; S,6,42; Cl,14,20; F,7,61. Найдено: C,52,68; H,3,56; N,5,69; S,6,70; Cl,14,32; F,7,97.
Пример 60: 4-[2-[5-Хлор-4-[(4-хлорфенилтио)-(2,5-дифторфенил)метил]пиридин-2-ил]аминоэтил]морфолин
[Химическая формула 103]
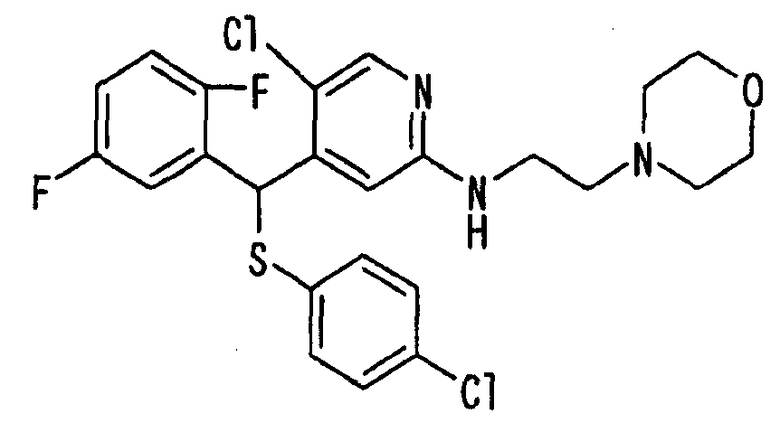
Раствор 2,5-дихлор-4-[(4-хлорфенилтио)-(2,5-дифторфенил)метил]пиридина (100 мг, 0,24 ммоль), полученного в примере 54, и 4-(2-аминоэтил)морфолина (200 мкл) в 1,4-диоксане (1,0 мл) перемешивали при 100°C в течение 2 дней в атмосфере азота. После охлаждения до комнатной температуры реакционную смесь разбавляли этилацетатом (40 мл). Разбавленную смесь промывали водой и насыщенным солевым раствором, сушили и концентрировали при пониженном давлении с получением остатка. Полученный остаток очищали хроматографией на силикагеле (3% метанол/хлороформ) с получением указанного в заголовке соединения (12 мг, 10%) в виде масла.
1H-ЯМР (400 МГц, CDCl3)δ: 2,42 (4H, м), 2,54 (2H, д, J=6,0 Гц), 3,27 (2H, кв, J=6,0 Гц), 3,67 (4H, м), 5,12 ( шир.,1H), 5,90 (1H, с), 6,61 (1H, с), 6,86-7,0 (2H, м), 7,06 (1H, м), 7,15 (2H, д, J=8,4 Гц), 7,16 (2H, д, J=8,4 Гц), 7,95 (1H, с).
MS m/z: 510 (M++H).
Пример 61: 4-[2-[5-Хлор-4-[(4-хлорфенилсульфонил)-(2,5-дифторфенил)метил]пиридин-2-ил]аминоэтил]морфолин-N-оксид
[Химическая формула 104]
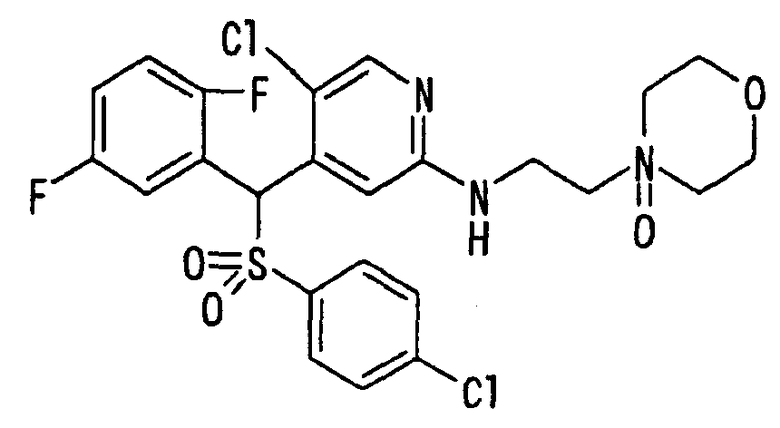
Тетрагидрат гексааммонийгептамолибдата (10 мг) добавляли к раствору 4-[2-[5-хлор-4-[(4-хлорфенилтио)-(2,5-дифторфенил)метил]пиридин-2-ил]аминоэтил]морфолина (11 мг, 0,032 ммоль) в метаноле (12 мл), а затем добавляли 30% водный раствор перекиси водорода (1 мл). Полученную смесь перемешивали в течение 8 часов. Реакционную смесь разбавляли этилацетатом. Разбавленную смесь промывали водой и насыщенным солевым раствором и концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (3% метанол, 3% раствор трет-бутиламина в хлороформе) с получением указанного в заголовке соединения (5,0 мг, 42%).
1H-ЯМР (400 МГц, CDCl3)δ: 3,2-3,4 (4H, м), 3,54 (2H, м), 3,81 (2H, м), 3,91 (2H, м), 4,44 (2H, м), 6,09 (1H, с), 6,88 (1H, м), 6,98 (1H, м), 7,22 (1H, с), 7,40 (2H, д, J=8,4 Гц), 7,51 (1H, м), 7,60 (2H, д, J=8,4 Гц), 7,94 (1H, с).
FAB-MS: 558,0837 (Рассчитано для C24H24Cl2F2N3O4S: 558,0833).
Пример 62: 5-Азидометил-2-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин
[Химическая формула 105]
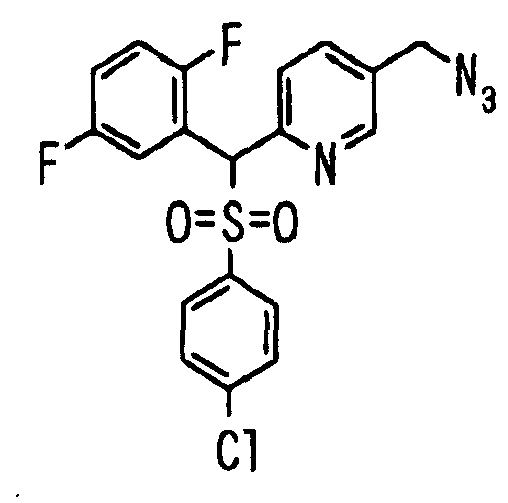
2-[(4-Хлорфенилсульфонил)(2,5-дифторфенил)метил]-5-(гидроксиметил)пиридин (471 мг, 1,15 ммоль), полученный в примере 43, растворяли в смеси тетрахлорида углерода (4 мл) и N,N-диметилформамида (16 мл). К полученному раствору добавляли азид натрия (112 мг, 1,72 ммоль) и трифенилфосфин (451 мг, 1,72 ммоль). Полученную смесь перемешивали при 90°C в течение 3 часов. К реакционной смеси добавляли воду, а затем экстрагировали этилацетатом. Органический слой промывали последовательно водой и насыщенным солевым раствором. Полученный органический слой сушили над сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток подвергали колоночной хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=3:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (244 мг, 0,561 ммоль, 49%) в виде бесцветного аморфного вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 4,42 (2H, с), 5,96 (1H, с), 6,94 (1H, м), 6,99-7,05 (1H, м), 7,40 (2H, д, J=8,8 Гц), 7,55 (2H, д, J=8,8 Гц), 7,60 (1H, д, J=8,1 Гц), 7,72 (1H, дд, J=8,1, 2,0 Гц), 8,02 (1H, м), 8,57 (1H, д, J=2,0 Гц).
MS m/z: 435 (M++H).
Пример 63: [6-[(4-Хлорфенилсульфонил)(2,5-дифторфенил)-метил]пиридин-3-ил]метиламин
[Химическая формула 106]
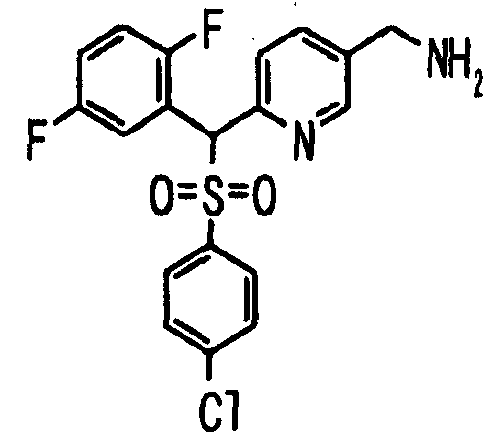
В атмосфере аргона к этанолу (10 мл) добавляли 5-азидометил-2-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин (77 мг, 0,177 ммоль), палладий на углероде (14 мг) и этилацетат (2 мл). Полученную смесь перемешивали в течение 50 минут в атмосфере водорода при давлении 1 атмосфера. Реакционную смесь фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали колоночной хроматографии на силикагеле. Фракцию, полученную при элюировании смесью дихлорметан:метанол=10:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (28 мг, 0,0685 ммоль, 39%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 1,84 (2H, шир. с), 3,92 (2H, с), 5,94 (1H, с), 6,92 (1H, м), 7,03-6,98 (1H, м), 7,39 (2H, д, J=8,3 Гц), 7,56 (2H, д, J=8,3 Гц), 7,60 (1H, д, J=8,1 Гц), 7,74 (1H, д, J=8,1 Гц), 8,01 (1H, м), 8,57 (1H, с).
MS m/z: 409 (M++H).
Пример 64: трет-Бутил [[6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]метил]карбамат
[Химическая формула 107]
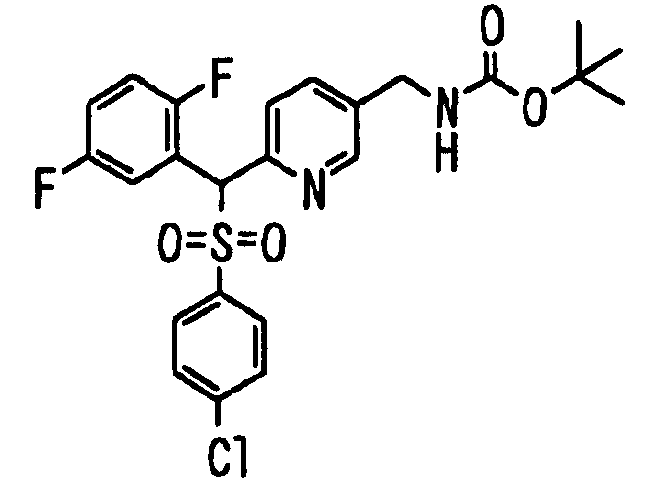
5-Азидометил-2-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин (230 мг, 0,529 ммоль), полученный в примере 62, и палладий на углероде (46 мг) добавляли к смеси этилацетата (15 мл) и этанола (15 мл). Полученную смесь перемешивали в течение 45 минут в атмосфере водорода при давлении 1 атмосфера. Реакционную смесь фильтровали. Фильтрат затем концентрировали при пониженном давлении. Полученный остаток растворяли в дихлорметане (5 мл). К полученному раствору добавляли триэтиламин (70 мкл, 0,499 ммоль) и ди-трет-бутил карбонат (174 мг, 0,996 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 3 дней. Реакционную смесь концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле и фракцию, полученную при элюировании смесью гексан:этилацетат=4:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (78 мг, 0,153 ммоль, 37%) в виде бесцветного аморфного вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 1,45 (9H, с), 4,34 (2H, д, J=5,6 Гц), 4,91 (1H, шир. с), 5,93 (1H, с), 6,91 (1H, м), 6,98-7,04 (1H, м), 7,39 (2H, д, J=8,8 Гц), 7,54 (2H, д, J=8,8 Гц), 7,59 (1H, д, J=7,8 Гц), 7,67 (1H, дд, J=7,8,2,2 Гц), 7,99 (1H, м), 8,53 (1H, д, J=2,2 Гц).
MS m/z: 509 (M++H).
Пример 65: трет-Бутил [[6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]метил]-N-(трет-бутоксикарбонил)карбамат
[Химическая формула 108]
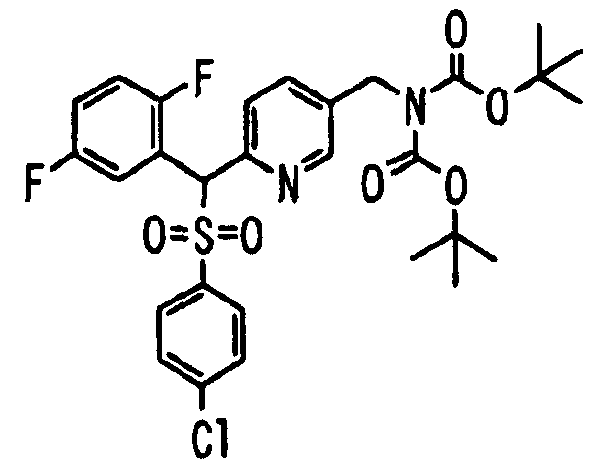
Диизопропилазодикарбоксилат (128 мкл, 0,653 ммоль) добавляли в атмосфере азота к раствору 2-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]-5-(гидроксиметил)пиридина (178 мг, 0,435 ммоль), полученного в примере 43, ди-трет-бутил иминодикарбоксилата (142 мг, 0,653 ммоль) и трифенилфосфина (171 мг, 0,653 ммоль) в тетрагидрофуране (5 мл). Полученную смесь перемешивали при комнатной температуре в течение 5 часов. К реакционной смеси добавляли воду, а затем экстрагировали этилацетатом. Органический слой промывали последовательно водой и насыщенным солевым раствором. Полученный органический слой сушили над сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле и фракцию, полученную при элюировании смесью гексан:этилацетат=4:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (78 мг, 0,128 ммоль, 32%) в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3)δ: 1,48 (18H, с), 4,78 (2H, с), 5,94 (1H, с), 6,93 (1H, тд, J=9,0, 4,4 Гц), 6,98-7,04 (1H, м), 7,38 (2H, д, J=8,6 Гц), 7,56 (2H, д, J=8,6 Гц), 7,58 (1H, д, J=8,1 Гц), 7,71 (1H, дд, J=8,1, 2,4 Гц), 7,96-8,00 (1H, м), 8,57 (1H, д, J=2,4 Гц).
MS m/z: 609 (M++H).
Пример 66: Гидрохлорид [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]метиламина
[Химическая формула 109]
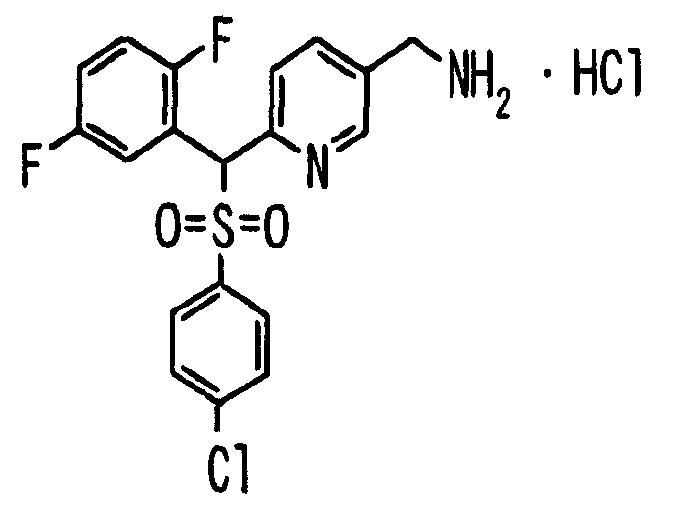
К раствору трет-бутил[[6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]метил]-N-(трет-бутоксикарбонил)карбамата (70 мг, 0,115 ммоль) в этаноле (2 мл) добавляли концентрированную хлористоводородную кислоту (2 мл). Полученную смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь концентрировали при пониженном давлении. К полученному остатку добавляли этанол. Смесь концентрировали при пониженном давлении с получением указанного в заголовке соединения (51 мг, 0,115 ммоль, 100%) в виде белого порошка.
1H-ЯМР (400 МГц, CD3OD)δ: 4,18 (2H, с), 6,22 (1H, с), 7,03 (1H, тд, J=9,3, 4,4 Гц), 7,11-7,17 (1H, м), 7,52 (2H, д, J=8,8 Гц), 7,64 (2H, д, J=8,8 Гц), 7,79 (1H, д, J=8,3 Гц), 7,92 (1H, дд, J=8,3, 2,2 Гц), 8,05-8,09 (1H, м), 8,71 (1H, д, J=2,2 Гц).
Элементный Анализ для C20H15ClF2N2O2S·HCl. Рассчитано: C,51,25; H,3,62; Cl,15,92; F,8,53; N,6,29. Найдено: C,51,11; H,3,57; Cl,15,50; F,8,39; N,5,83.
Пример 67: N-ацетил-N-[[6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]метил]ацетамид (Соединение A) и N-[[6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]метил]ацетамид (Соединение B)
[Химическая формула 110]
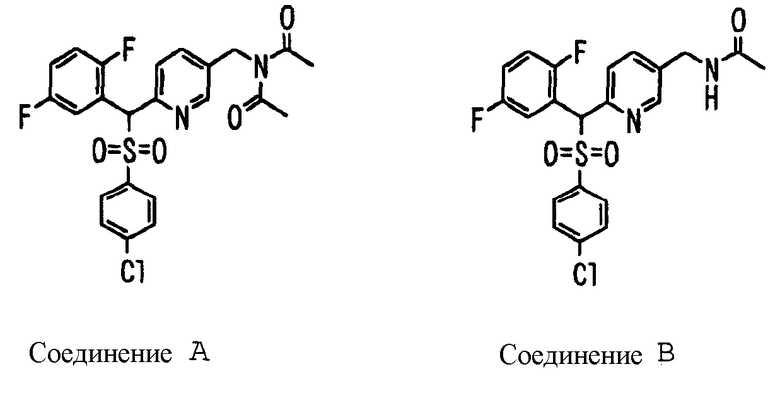
К раствору [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]метиламина (40 мг, 0,0978 ммоль), полученного в примере 63, в дихлорметане (3 мл) добавляли при охлаждении льдом N-метилморфолин (26 мкл, 0,234 ммоль) и ацетилхлорид (16 мкл, 0,234 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 16 часов. К реакционной смеси добавляли воду, а затем экстрагировали этилацетатом. Органический слой промывали последовательно водой и насыщенным солевым раствором. Органический слой сушили над сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=2:3, концентрировали при пониженном давлении с получением указанного в заголовке соединения A (низкополярное соединение) (15 мг, 0,0304 ммоль, 40%) в виде белого порошка и указанного в заголовке Соединения B (высокополярное соединение) (12 мг, 0,0266 ммоль, 27%) в виде белого порошка.
Соединение A
1H-ЯМР (400 МГц, CDCl3)δ: 2,43 (6H, с), 4,96 (2H, с), 5,93 (1H, с), 6,91 (1H, м), 6,98-7,03 (1H, м), 7,39 (2H, д, J=8,5 Гц), 7,54-7,61 (2H, м), 7,55 (2H, д, J=8,5 Гц), 8,02 (1H, м), 8,51 (1H, д, J=1,7 Гц).
Т.пл.: 60-64°C.
MS m/z: 493 (M++H).
Соединение B
1H-ЯМР (400 МГц, CDCl3)δ: 2,03 и 2,04 (3H,ротамер с), 4,42-4,50 (2H, м), 5,89 (1H, шир. с), 5,93 (1H, с), 6,92 (1H, тд, J=9,1, 4,4 Гц), 6,97-7,02 (1H, м), 7,41 (2H, д, J=8,1 Гц), 7,57 (2H, д, J=8,1 Гц), 7,61 (1H, д, J=8,1 Гц), 7,71 (1H, д, J=8,1 Гц), 7,98-8,03 (1H, м), 8,54 (1H, с).
Т.пл.: 177-178°C
MS m/z: 451 (M++H).
Пример 68: N-[[6-[(4-Хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]метил]-N',N'-диметилсульфамид
[Химическая формула 111]
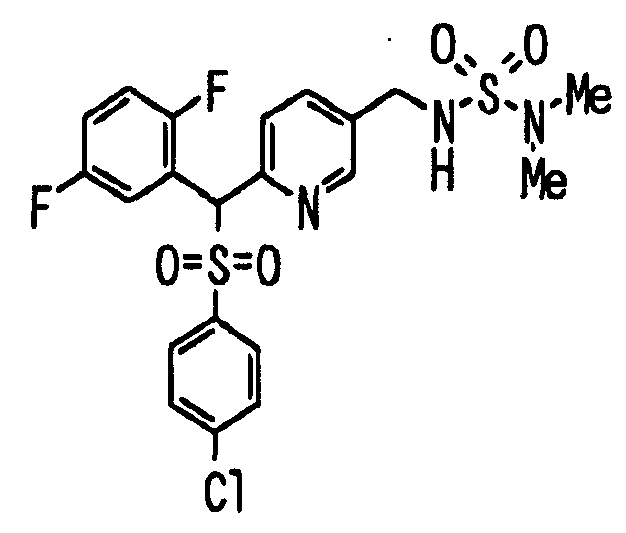
К раствору гидрохлорида [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]метиламина (60 мг, 0,135 ммоль), полученного в примере 66, в дихлорметане (5 мл) добавляли N-метилморфолин (180 мкл, 1,62 ммоль), 4-диметиламинопиридин (10 мг, 0,0819 ммоль) и N,N-диметилсульфамоилхлорид (66 мкл, 0,609 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 24 часов. К реакционной смеси добавляли воду, а затем экстрагировали дихлорметаном. Органический слой промывали последовательно насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором. Полученный органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=3:2, концентрировали при пониженном давлении с получением указанного в заголовке соединения (48 мг, 0,0930 ммоль, 70%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 2,76 (6H, с), 4,29 (2H, д, J=6,4 Гц), 4,43 (1H, т, J=6,4 Гц), 5,94 (1H, с), 6,92 (1H, м), 6,98-7,04 (1H, м), 7,41 (2H, д, J=8,6 Гц), 7,58 (2H, д, J=8,6 Гц), 7,66 (1H, д, J=8,1 Гц), 7,79 (1H, дд, J=8,1, 2,5 Гц), 8,02 (1H, м), 8,61 (1H, д, J=2,5 Гц).
Т.пл.: 177-178 (C.
MS m/z: 516 (M++H).
Пример 69: Этил 2-[[6-[(4-Хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]метиламино]-2-оксоацетат
[Химическая формула 112]
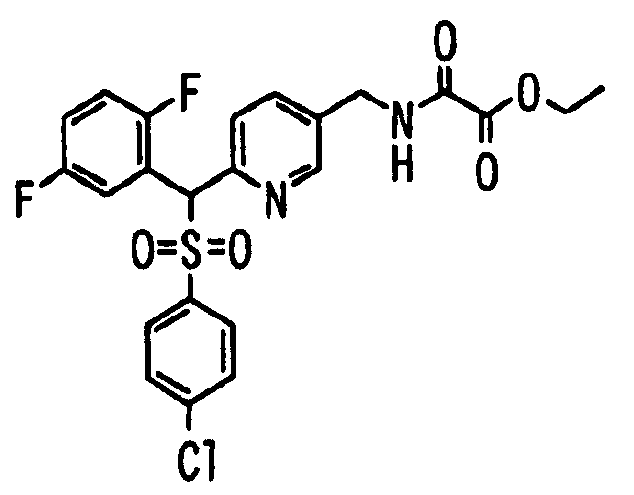
К раствору [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]метиламина (30 мг, 0,0734 ммоль), полученного в примере 63, в дихлорметане (4 мл) добавляли при охлаждении льдом N-метилморфолин (10 мкл, 0,0881 ммоль) и этилхлорглиоксилат (9 мкл, 0,0807 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли воду, а затем экстрагировали дихлорметаном. Органический слой затем последовательно промывали насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором. Полученный органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=3:2, концентрировали при пониженном давлении с получением указанного в заголовке соединения (28 мг, 0,0550 ммоль, 76%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 1,39 (3H, т, J=7,1 Гц), 4,37 (2H, кв, J=7,1 Гц), 4,55 (2H, д, J=5,9 Гц), 5,94 (1H, с), 6,89-6,94 (1H, м), 6,98-7,05 (1H, м), 7,40 (2H, д, J=8,3 Гц), 7,56 (2H, д, J=8,3 Гц), 7,53 (1H, шир. с), 7,62 (1H, д, J=8,1 Гц), 7,72 (1H, д, J=8,1 Гц), 7,97-8,03 (1H, м), 8,58 (1H, с).
Т.пл.: 193-194°C.
MS m/z: 509 (M++H).
Пример 70: N-[[6-[(4-Хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]метил]-2-(4-метилфенилсульфониламино)ацетамид
[Химическая формула 113]
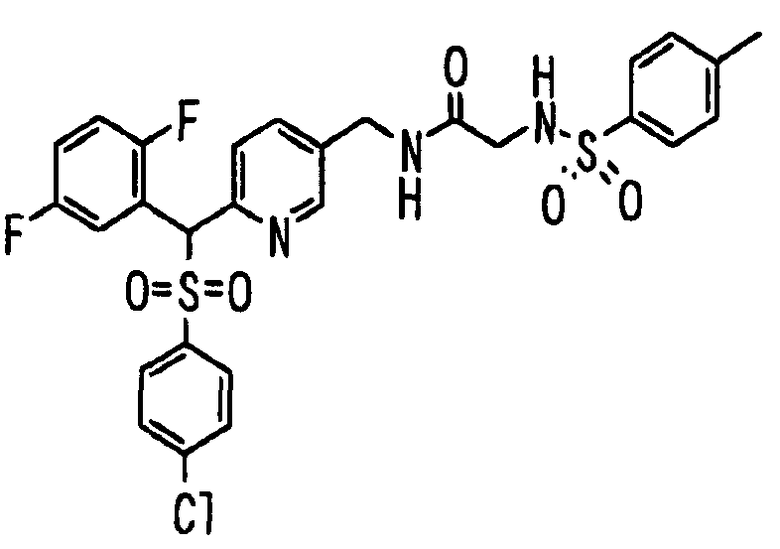
К раствору гидрохлорида [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]метиламина (40 мг, 0,0898 ммоль), полученного в примере 66, в дихлорметане (6 мл) добавляли триэтиламин (45 мкл, 0,324 ммоль), 4-диметиламинопиридин (5 мг, 0,0449 ммоль), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (21 мг, 0,108 ммоль) и N-п-тозилглицин (25 мг, 0,108 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 16 часов. Реакционную смесь разбавляли дихлорметаном. Разбавленную смесь затем промывали последовательно водой, насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором. Полученный органический слой сушили над сульфатом магния и затем концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=2,3, концентрировали при пониженном давлении с получением указанного в заголовке соединения (41 мг, 0,0661 ммоль, 73%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 2,44 (3H, с), 3,59 (2H, д, J=6,4 Гц), 4,44 (2H, дд, J=6,1, 2,8 Гц), 5,42 (1H, т, J=6,1 Гц), 5,95 (1H, с), 6,91 (1H, м), 6,96-7,03 (2H, м), 7,33 (2H, д, J=8,3 Гц), 7,41 (2H, д, J=8,6 Гц), 7,57 (2H, д, J=8,6 Гц), 7,58 (1H, д, J=8,1 Гц), 7,66 (1H, дд, J=8,1, 2,4 Гц), 7,74 (2H, д, J=8,3 Гц), 8,01 (1H, м), 8,49 (1H, д, J=2,4 Гц).
Т.пл.: 217-218°C.
MS m/z: 620 (M++H).
Пример 71: N-[[6-[(4-Хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]метил]-2-диметиламиноацетамид
[Химическая формула 114]
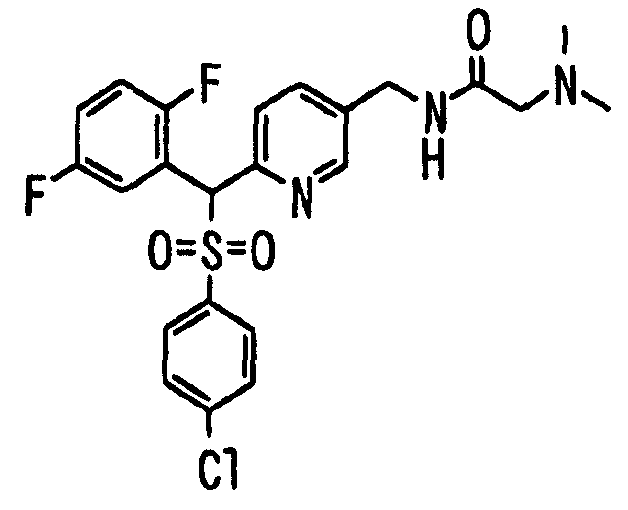
К раствору [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]метиламина (30 мг, 0,0734 ммоль), полученного в примере 63, в дихлорметане (5 мл) добавляли триэтиламин (12 мкл, 0,0881 ммоль), 4-диметиламинопиридин (5 мг, 0,0367 ммоль), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (17 мг, 0,0881 ммоль) и N,N-диметилглицин (9 мг, 0,0881 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 14 часов. Реакционную смесь разбавляли дихлорметаном. Разбавленную смесь промывали последовательно водой, насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором. Полученный органический слой сушили над сульфатом магния и затем концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=1:4, концентрировали при пониженном давлении с получением указанного в заголовке соединения (21 мг, 0,0425 ммоль, 58%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 2,30 (6H, с), 3,01 (2H, с), 4,50 (2H, д, J=6,1 Гц), 5,93 (1H, с), 6,91 (1H, м), 6,98-7,04 (1H, м), 7,40 (2H, д, J=8,6 Гц), 7,55 (2H, д, J=8,6 Гц), 7,60 (1H, д, J=8,1 Гц), 7,62 (1H, шир. с), 7,69 (1H, дд, J=8,1, 2,4 Гц), 8,02 (1H, м), 8,56 (1H, д, J=2,4 Гц).
Т.пл.: 177-179°C.
MS m/z: 494 (M++H).
Пример 72: N-[[6-[(4-Хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]метил]-4-(формилметиламино)бензамид
[Химическая формула 115]
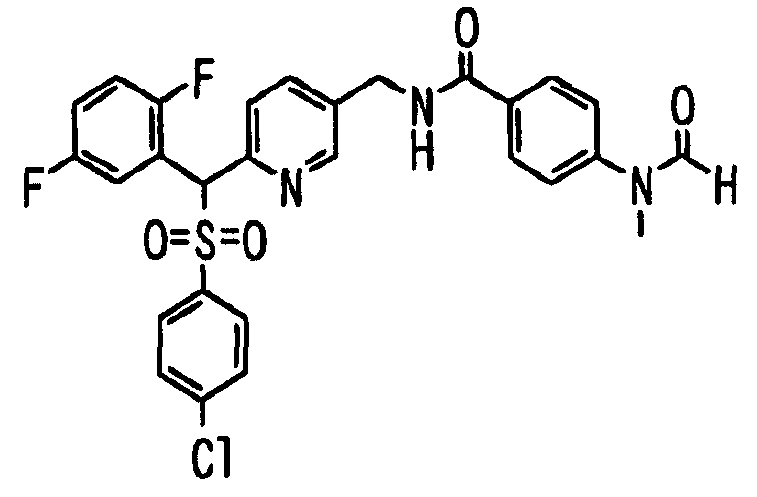
К раствору [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]метиламина (50 мг, 0,122 ммоль), полученного в примере 63, в дихлорметане (5 мл) добавляли триэтиламин (21 мкл, 0,147 ммоль), 4-диметиламинопиридин (7 мг, 0,0610 ммоль), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (28 мг, 0,147 ммоль) и N-формил-4-(метиламино)бензойную кислоту (26 мг, 0,147 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь разбавляли дихлорметаном. Разбавленную смесь промывали последовательно водой, насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором. Полученный органический слой сушили над сульфатом магния и затем концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=3:7, концентрировали при пониженном давлении с получением указанного в заголовке соединения (60 мг, 0,105 ммоль, 87%) в виде бесцветного аморфного вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 3,35 (3H, с), 4,67-4,71 (2H, м), 5,94 (1H, с), 6,53 (1H, шир. с), 6,90 (1H, м), 6,97-7,03 (1H, м), 7,25 (2H, д, J=8,6 Гц), 7,40 (2H, д, J=8,6 Гц), 7,56 (2H, д, J=8,6 Гц), 7,63 (1H, д, J=8,1 Гц), 7,78 (1H, дд, J=8,1, 2,2 Гц), 7,86 (2H, д, J=8,6 Гц), 8,03 (1H, м), 8,61 (1H, с), 8,64 (1H, д, J=2,2 Гц).
MS m/z: 570 (M++H).
Пример 73: N-[[6-[(4-Хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]метил]-4-(метилтиоформиламино)тиобензамид
[Химическая формула 116]
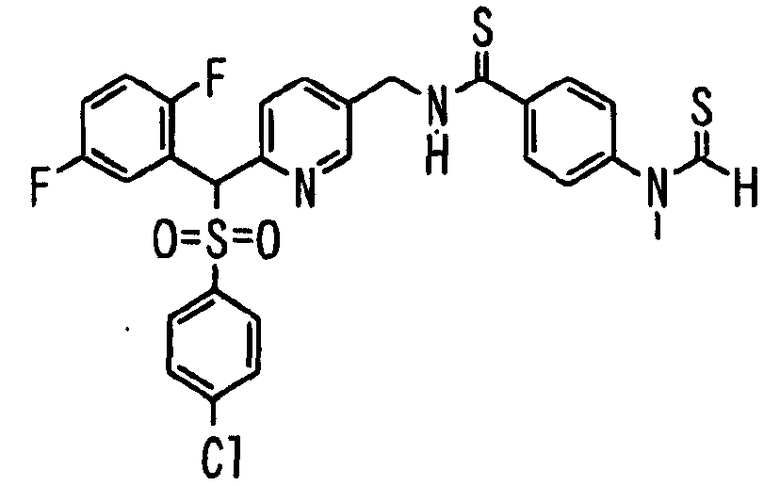
В атмосфере аргона к раствору N-[[6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]метил]-4-(формилметиламино)бензамида (46 мг, 0,0807 ммоль) в толуоле (5 мл) добавляли реагент Lawson (69 мг, 0,169 ммоль). Полученную смесь нагревали при кипячении с обратным холодильником в течение 12 часов. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=4:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (40 мг, 0,0664 ммоль, 83%) в виде желтого аморфного вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 3,72 (3H, с), 5,08 (2H, д, J=4,4 Гц), 5,92 (1H, с), 6,89 (1H, тд, J=9,0, 4,4 Гц), 6,98-7,05 (1H, м), 7,25 (2H, д, J=8,6 Гц), 7,40 (2H, д, J=8,6 Гц), 7,55 (2H, д, J=8,6 Гц), 7,60 (1H, д, J=8,1 Гц), 7,81 (1H, д, J=8,1 Гц), 7,87 (2H, д, J=8,6 Гц), 8,02-8,06 (1H, м), 8,20 (1H, шир. с), 8,62 (1H, с), 9,70 (1H, с).
MS m/z: 602 (M++H).
Пример 74: N-[[6-[(4-Хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]метил]-2-(пиридин-3-ил)ацетамид
[Химическая формула 117]
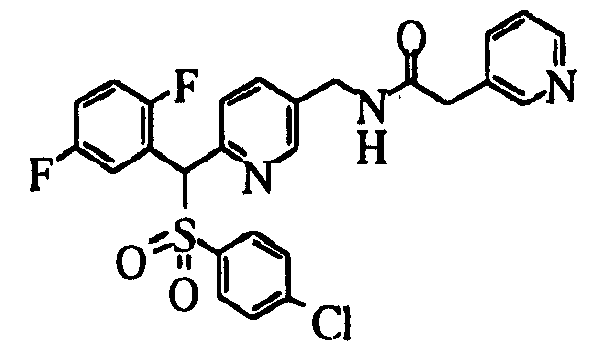
[6-[(4-Хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]метиламин (30 мг, 0,073 ммоль), полученный в примере 63, гидрохлорид 3-пиридилуксусной кислоты (16 мг, 0,092 ммоль), 4-(диметиламино)пиридин (5 мг, 0,04 ммоль) и триэтиламин (0,025 мл, 0,18 ммоль) растворяли в дихлорметане (5 мл). К полученному раствору добавляли при комнатной температуре гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (17 мг, 0,089 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 14 часов. К реакционной смеси добавляли насыщенный водный раствор (0,1 мл) бикарбоната натрия. Остаток, полученный концентрацией реакционной смеси при пониженном давлении, подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью дихлорметан:метанол=30:1, концентрировали при пониженном давлении с получением белого твердого вещества. Полученное твердое вещество промывали простым эфиром с получением указанного в заголовке соединения (35 мг, 0,066 ммоль, 90%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 3,59 (2H, с), 4,45 (2H, дд, J=5,9, 1,5 Гц), 5,92 (1H, с), 5,96-6,10 (1H, м), 6,86-6,98 (1H, м), 6,99-7,05 (1H, м), 7,24-7,35 (1H, м), 7,39 (2H, д, J=8,8 Гц), 7,55-7,60 (3H, м), 7,60-7,71 (2H, м), 7,96-8,06 (1H, м), 8,50 (2H, д, J=1,6 Гц), 8,55 (1H, д, J=4,8, 1,6 Гц).
MS m/z: 528 (M++H).
Пример 75: [6-(4-Хлорфенилсульфонил)(2,5-дифторфенил)метилпиридин-3-ил]метилдиметилкарбамат
[Химическая формула 118]
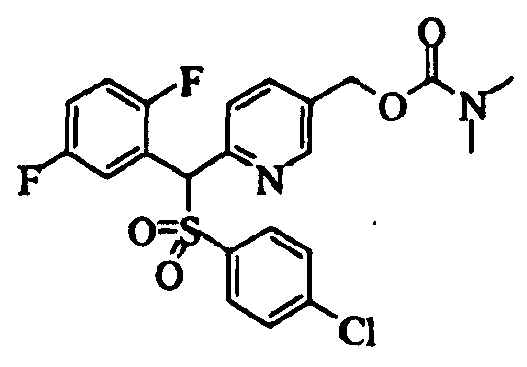
К раствору в дихлорметане (0,3 мл) 2-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]-5-(гидроксилметил)пиридина (20 мг, 0,049 ммоль), полученного в примере 43, добавляли последовательно при 0°C N-метилморфолин (0,011 мл, 0,10 ммоль) и п-нитрофенилхлорформиат (15 мг, 0,074 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 30 минут. К реакционной смеси затем добавляли последовательно при 0°C N-метилморфолин (0,033 мл, 0,30 ммоль) и п-нитрофенилхлорформиат (15 мг, 0,074 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 30 минут. После добавления к реакционной смеси при 0°C гидрохлорида диметиламина (20 мг, 0,25 ммоль) и перемешивания в течение 13 часов реакционную смесь промывали насыщенным водным раствором хлорида аммония. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=7:3, концентрировали при пониженном давлении. Полученное твердое вещество промывали гексаном и собирали фильтрованием с получением указанного в заголовке соединения (13 мг, 0,027 ммоль, 55%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 2,94 (6H, с), 5,14 (2H, с), 5,94 (1H, с), 6,87-7,07 (2H, м), 7,39 (2H, д, J=8,5 Гц), 7,55 (2H, д, J=8,5 Гц), 7,62 (1H, д, J=7,8 Гц), 7,75 (1H, дд, J=7,8, 2,0 Гц), 7,99-8,07 (1H, м), 8,63 (1H, д, J=2,0 Гц).
MS m/z: 481 (M++H).
Пример 76: [6-(4-Хлорфенилсульфонил)(2,5-дифторфенил)метилпиридин-3-ил]метил 4-нитрофенилкарбонат
[Химическая формула 119]
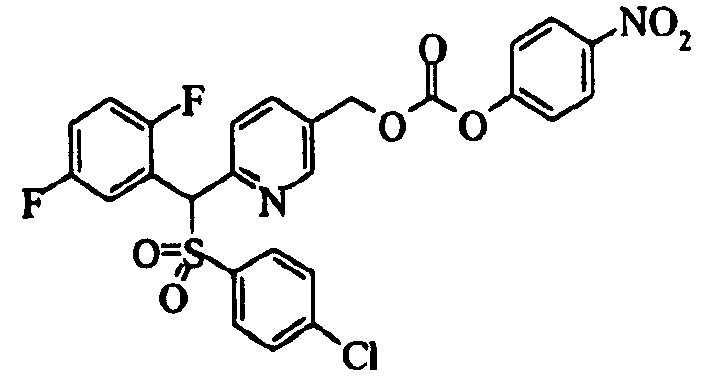
К раствору 2-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]-5-(гидроксилметил)пиридина (41 мг, 0,10 ммоль), полученного в примере 43, в дихлорметане (0,5 мл) добавляли последовательно при 0°C N-метилморфолин (0,033 мл, 0,30 ммоль) и 4-нитрофенилхлорформиат (40 мг, 0,20 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь промывали водой. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=4:1, концентрировали при пониженном давлении. Полученное твердое вещество промывали гексаном и собирали фильтрованием с получением указанного в заголовке соединения (52 мг, 0,090 ммоль, 90%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 5,33 (2H, с), 5,97 (1H, с), 6,87-6,95 (1H, м), 6,98-7,06 (1H, м), 7,39 (2H, д, J=9,0 Гц), 7,40 (2H, д, J=8,5 Гц), 7,57 (2H, д, J=8,5 Гц), 7,71 (1H, д, J=7,6 Гц), 7,85 (1H, дд, J=7,6, 2,0 Гц), 7,97-8,05 (1H, м), 8,29 (2H, д, J=9,0 Гц), 8,72 (1H, д, J=2,0 Гц).
MS m/z: 575 (M++H).
Пример 77: [6-(4-Хлорфенилсульфонил)(2,5-дифторфенил)метилпиридин-3-ил]метилбензилкарбамат
[Химическая формула 120]
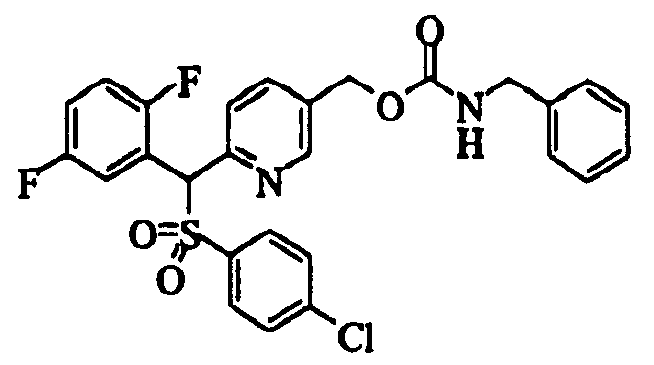
К раствору [6-(4-хлорфенилсульфонил)(2,5-дифторфенил)метилпиридин-3-ил]метил 4-нитрофенилкарбоната (51 мг, 0,089 ммоль) в дихлорметане (1 мл) добавляли последовательно при 0°C N-метилморфолин (0,020 мл, 0,18 ммоль) и бензиламин (0,012 мл, 0,11 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 20 часов. Реакционную смесь промывали насыщенным водным раствором хлорида аммония. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=4:1, концентрировали при пониженном давлении. Полученное твердое вещество промывали диизопропиловым эфиром и собирали фильтрованием с получением указанного в заголовке соединения (33 мг, 0,060 ммоль, 68%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 4,38 (2H, шир. д, J=5,4 Гц), 5,06 (1H, шир. с), 5,16 (2H, с), 5,94 (1H, с), 6,87-7,04 (2H, м), 7,22-7,38 (5H, м), 7,39 (2H, д, J=8,3 Гц), 7,54 (2H, д, J=8,3 Гц), 7,62 (1H, д, J=8,3 Гц), 7,74 (1H, д, J=8,3 Гц), 7,96-8,03 (1H, м), 8,61 (1H, с).
MS m/z: 543 (M++H).
Пример 78: N-[[6-(4-Хлорфенилсульфонил)(2,5-дифторфенил)метилпиридин-3-ил]метил]-3-цианобензолсульфонамид
[Химическая формула 121]
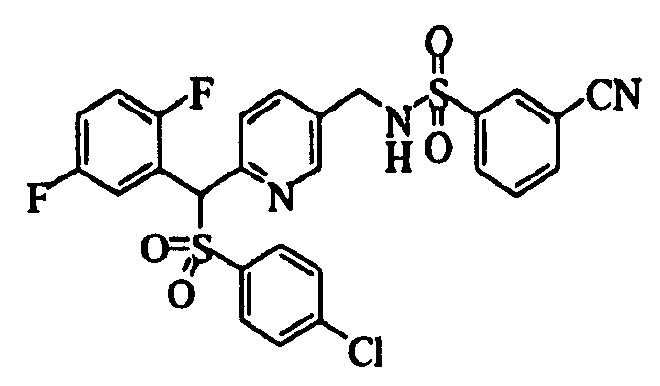
К раствору [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]метиламина (28 мг, 0,068 ммоль), полученного в примере 63, в дихлорметане (0,5 мл) добавляли последовательно при 0°C N-метилморфолин (0,015 мл, 0,14 ммоль) и 3-цианобензолсульфонилхлорид (22 мг, 0,10 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 6 часов. Реакционную смесь промывали 1 н. раствором хлористоводородной кислоты. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=7:3, концентрировали при пониженном давлении. Полученное твердое вещество промывали гексаном и собирали фильтрованием с получением указанного в заголовке соединения (23 мг, 0,040 ммоль, 59%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 4,26 (2H, д, J=6,4 Гц), 5,08 (1H, т, J=6,4 Гц), 5,91 (1H, с), 6,86-7,06 (2H, м), 7,40 (2H, д, J=8,1 Гц), 7,55 (2H, д, J=8,1 Гц), 7,57-7,70 (3H, м), 7,81 (1H, д, J=7,4 Гц), 7,94-8,05 (2H, м), 8,11 (1H, с), 8,46 (1H, с).
MS m/z: 574 (M++H).
Пример 79: N-[[6-(4-Хлорфенилсульфонил)(2,5-дифторфенил)метилпиридин-3-ил]метил]-3-циано-N-метилбензолсульфонамид
[Химическая формула 122]
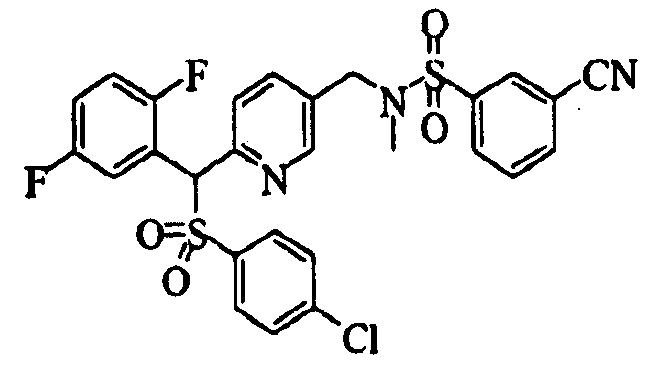
К раствору N-[[6-(4-хлорфенилсульфонил)(2,5-дифторфенил)метилпиридин-3-ил]метил]-3-цианобензолсульфонамида (21 мг, 0,037 ммоль) в тетрагидрофуране (0,5 мл) добавляли последовательно при 0°C метанол (0,003 мл, 0,073 ммоль), трифенилфосфин (19 мг, 0,073 ммоль) и диизопропилазодикарбоксилат (0,014 мл, 0,073 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь концентрировали при пониженном давлении. Полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=2:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (13 мг, 0,021 ммоль, 58%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 2,70 (3H, с), 4,25 (2H, д, J=6,4 Гц), 5,95 (1H, с), 6,87-7,05 (2H, м), 7,40 (2H, д, J=8,5 Гц), 7,56 (2H, д, J=8,5 Гц), 7,66 (1H, д, J=8,1 Гц), 7,73 (1H, т, J=7,8 Гц), 7,81 (1H, дд, J=8,1, 2,2 Гц), 7,91 (1H, д, J=7,8 Гц), 7,99-8,09 (2H, м), 8,12 (1H, с), 8,53 (1H, т, J=2,2 Гц).
MS m/z: 588 (M++H).
Пример 80: 3-[[6-(4-Хлорфенилсульфонил)(2,5-дифторфенил)-метилпиридин-3-ил]метил]-1,1-диметилмочевина
[Химическая формула 123]
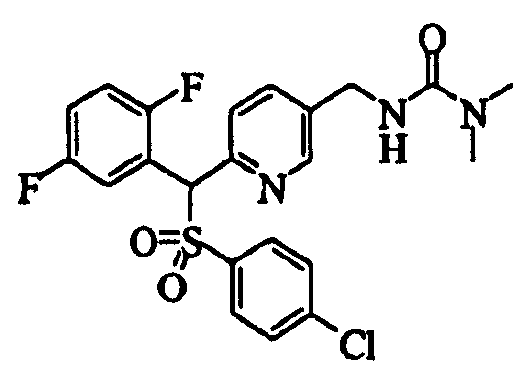
К раствору [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]метиламина (31 мг, 0,076 ммоль), полученного в примере 63, в дихлорметане (1 мл) добавляли последовательно при 0°C триэтиламин (0,032 мл, 0,23 ммоль) и N,N-диметилкарбамоилхлорид (0,014 мл, 0,15 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 17 часов. К реакционной смеси добавляли последовательно при 0°C триэтиламин (0,032 мл, 0,23 ммоль) и N,N-диметилкарбамоилхлорид (0,014 мл, 0,15 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 29 часов. Реакционную смесь промывали насыщенным водным раствором бикарбоната натрия. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную элюированием этилацетатом, концентрировали при пониженном давлении. Полученное твердое вещество промывали гексаном и собирали фильтрованием с получением указанного в заголовке соединения (18 мг, 0,036 ммоль, 48%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 2,93 (6H, с), 4,44 (2H, д, J=4,2 Гц), 4,76 (1H, т, J=4,2 Гц), 5,93 (1H, с), 6,85-7,04 (2H, м), 7,39 (2H, д, J=8,3 Гц), 7,56 (2H, д, J=8,3 Гц), 7,58 (1H, д, J=8,5 Гц), 7,74 (1H, дд, J=8,5, 2,0 Гц), 7,98-8,06 (1H, м), 8,57 (1H, д, J=2,0 Гц).
MS m/z: 480 (M++H).
Пример 81: Метил [6-(4-хлорфенилсульфонил)(2,5-дифторфенил)метилпиридин-3-ил]метилкарбамат
[Химическая формула 124]
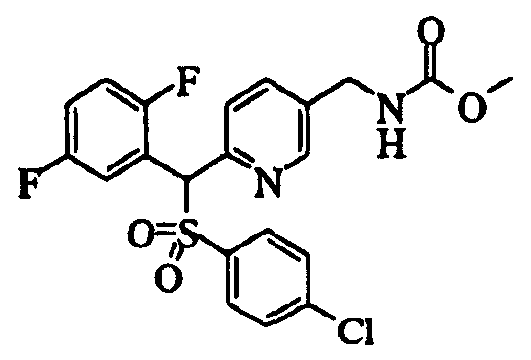
Таким же способом, как в примере 80, получали указанное в заголовке соединение (16 мг, 0,034 ммоль, 42%) в виде желтого твердого вещества, используя [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]метиламин (34 мг, 0,082 ммоль), полученный в примере 63, и метилхлоркарбонат (0,019 мл, 0,25 ммоль).
1H-ЯМР (400 МГц, CDCl3)δ: 3,71 (3H, с), 4,40 (2H, д, J=6,1 Гц), 5,07 (1H, шир. с), 5,93 (1H, с), 6,87-7,04 (2H, м), 7,39 (2H, д, J=8,5 Гц), 7,55 (2H, д, J=8,5 Гц), 7,60 (1H, д, J=7,8 Гц), 7,70 (1H, д, J=7,8 Гц), 7,97-8,04 (1H, м), 8,55 (1H, с).
MS m/z: 467 (M++H).
Пример 82: N-[[6-(4-Хлорфенилсульфонил)(2,5-дифторфенил)метилпиридин-3-ил]метил]метансульфонамид
[Химическая формула 125]
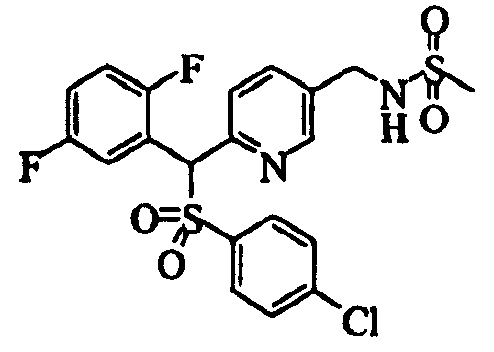
Таким же способом, как в примере 80, получали указанное в заголовке соединение (20 мг, 0,040 ммоль, 49%) в виде белого твердого вещества, используя [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]метиламин (34 мг, 0,082 ммоль), полученный в примере 63, и метансульфонилхлорид (0,019 мл, 0,25 ммоль).
1H-ЯМР (400 МГц, CDCl3)δ: 2,97 (3H, с), 4,37 (2H, д, J=6,1 Гц), 4,70 (1H, шир. с), 5,95 (1H, с), 6,88-7,07 (2H, м), 7,40 (2H, д, J=8,3 Гц), 7,56 (2H, д, J=8,3 Гц), 7,65 (1H, д, J=8,1 Гц), 7,80 (1H, д, J=8,1 Гц), 7,97-8,07 (1H, м), 8,61 (1H, с).
MS m/z: 487 (M++H).
Пример 83: N-[[6-(4-Хлорфенилсульфонил)(2,5-дифторфенил)метилпиридин-3-ил]метил]-1-ацетил-4-пиперидинкарбоксамид
[Химическая формула 126]
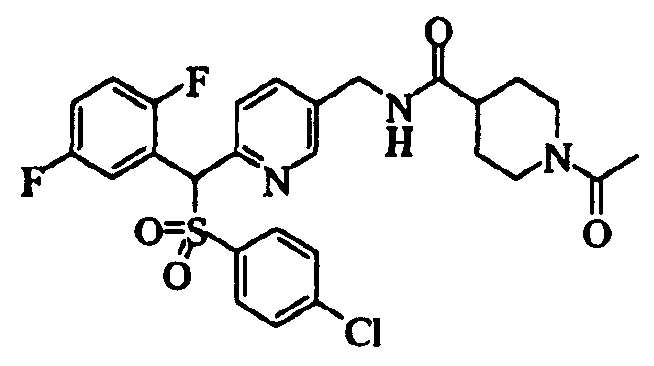
Таким же способом, как в примере 80, получали указанное в заголовке соединение (24 мг, 0,043 ммоль, 52%) в виде бесцветного пенистого вещества, используя [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]метиламин (34 мг, 0,082 ммоль), полученный в примере 63, и 1-ацетил-4-пиперидинкарбонилхлорид (56 мг, 0,25 ммоль).
1H-ЯМР (400 МГц, CDCl3)δ: 1,58-1,79 (2H, м), 1,82-1,95 (2H, м), 2,09 (3H, с), 2,30-2,41 (1H, м), 2,59-2,70 (1H, м), 3,03-3,13 (1H, м), 3,82-3,92 (1H, м), 4,41-4,53 (2H, м), 4,55-4,63 (1H, м), 5,90-5,98 (2H, м), 6,85-6,94 (1H, м), 6,97-7,04 (1H, м), 7,40 (2H, д, J=8,5 Гц), 7,55 (2H, д, J=8,5 Гц), 7,60 (1H, д, J=8,1 Гц), 7,66 (1H, д, J=8,1 Гц), 7,98-8,05 (1H, м), 8,53 (1H, с).
MS m/z: 562 (M++H).
Пример 84: [6-(4-Хлорфенилсульфонил)(2,5-дифторфенил)метилпиридин-3-ил]метил метилкарбонат
[Химическая формула 127]
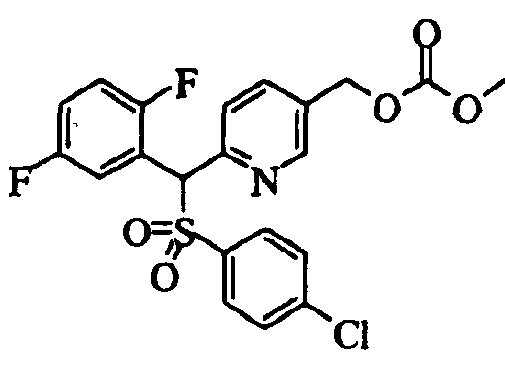
К раствору в дихлорметане (2 мл) 2-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]-5-(гидроксиметил)пиридина (50 мг, 0,12 ммоль), полученного в примере 43, добавляли последовательно при 0°C пиридин (0,040 мл, 0,49 ммоль) и метилхлорформиат (0,019 мл, 0,24 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли при 0°C метилхлорформиат (0,019 мл, 0,24 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 5 часов. Реакционную смесь промывали 1 н. раствором хлористоводородной кислоты. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=4:1, концентрировали при пониженном давлении. Полученное твердое вещество промывали гексаном и собирали фильтрованием с получением указанного в заголовке соединения (50 мг, 0,11 ммоль, 88%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 3,81 (3H, с), 5,18 (2H, с), 5,95 (1H, с), 6,89-7,04 (2H, м), 7,40 (2H, д, J=8,5 Гц), 7,55 (2H, д, J=8,5 Гц), 7,65 (1H, д, J=8,1 Гц), 7,78 (1H, дд, J=8,1, 2,2 Гц), 7,97-8,03 (1H, м), 8,64 (1H, д, J=2,2 Гц).
MS m/z: 468 (M++H).
Пример 85: [6-[(4-Хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]карбальдегидоксим (Изомер A и Изомер B)
[Химическая формула 128]
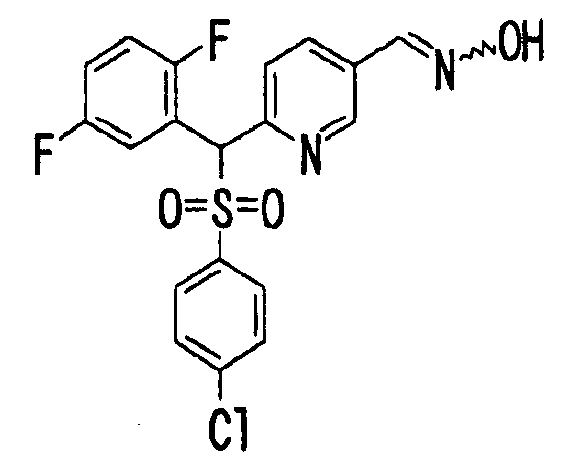
К раствору [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]карбальдегида (100 мг, 0,25 ммоль), полученного в примере 47, в дихлорметане (3 мл) добавляли N-метилморфолин (32 мкл, 0,29 ммоль) и гидрохлорид гидроксиламина (26 мг, 0,36 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 3 дней. Реакционную смесь разбавляли дихлорметаном, промывали последовательно водой, насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором. Полученный органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=3:2, концентрировали при пониженном давлении с получением указанного в заголовке Изомера A (низкополярное соединение) (79 мг, 0,19 ммоль, 72%) в виде белого порошка и указанного в заголовке Изомера B (высокополярное соединение) (17 мг, 0,040 ммоль, 17%) в виде белого порошка.
Изомер A
1H-ЯМР (400 МГц, CDCl3)δ: 5,97 (1H, с), 6,91-6,96 (1H, м), 6,99-7,05 (1H, м), 7,40 (2H, д, J=8,6 Гц), 7,56 (2H, д, J=8,6 Гц), 7,66 (1H, д, J=8,1 Гц), 7,78 (1H, с), 7,96-8,02 (2H, м), 8,14 (1H, с), 8,75 (1H, д, J=1,7 Гц).
Т.пл.: 187-188°C.
MS m/z: 423 (M++H).
Изомер B
1H-ЯМР (400 МГц, CDCl3)δ: 5,98 (1H, с), 6,91-6,97 (1H, м), 7,00-7,06 (1H, м), 7,40 (1H, с), 7,41 (2H, д, J=8,6 Гц), 7,57 (2H, д, J=8,6 Гц), 7,71 (1H, д, J=8,3 Гц), 7,90-8,02 (2H, м), 8,41 (1H, дд, J=8,3, 2,1 Гц), 9,00 (1H, с).
Т.пл.: 194-196°C.
MS m/z: 423 (M++H).
Пример 86: 6-[(4-Хлорфенилсульфонил)(2,5-дифторфенил)метил]-N-циклогексилметилникотинамид
[Химическая формула 129]
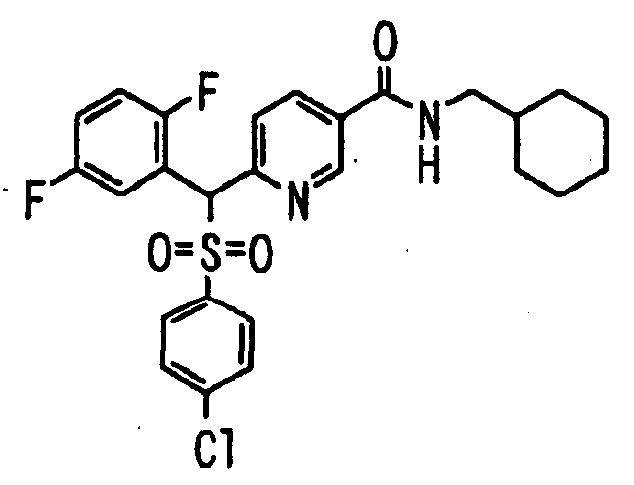
К раствору [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]карбоновой кислоты (80 мг, 0,19 ммоль), полученной в примере 50, в дихлорметане (5 мл) добавляли триэтиламин (32 мкл, 0,23 ммоль), 4-диметиламинопиридин (12 мг, 0,095 ммоль), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (44 мг, 0,23 ммоль) и аминометилциклогексан (30 мкл, 0,23 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 4,5 часов. Реакционную смесь разбавляли дихлорметаном и промывали последовательно водой, насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором. Полученный органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=3:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (58 мг, 0,11 ммоль, 59%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 0,95-1,80 (11H, м), 3,32 (2H, д, J=6,4 Гц), 5,98 (1H, с), 6,13-6,16 (1H, м), 6,90-6,96 (1H, м), 7,00-706 (1H, м), 7,40 (2H, д, J=8,6 Гц), 7,55 (2H, д, J=8,6 Гц), 7,69 (1H, д, J=8,3 Гц), 7,97-8,02 (1H, м), 8,13 (1H, дд, J=8,3, 2,2 Гц), 8,94 (1H, д, J=2,2 Гц).
MS m/z: 519 (M++H).
Пример 87: 6-[(4-Хлорфенилсульфонил)(2,5-дифторфенил)метил]-N-(5-хлорпиридин-2-ил)никотинамид
[Химическая формула 130]
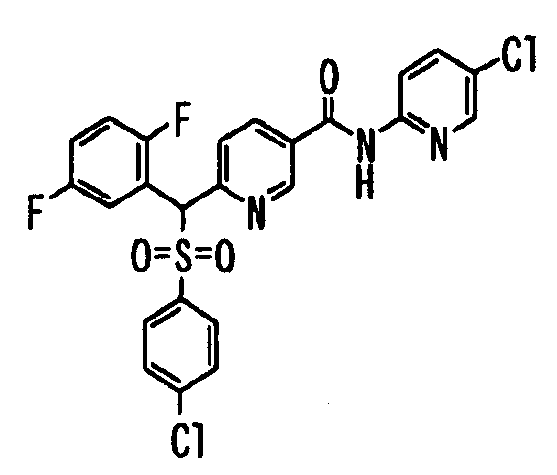
К раствору в дихлорметане (5 мл) [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]карбоновой кислоты (80 мг, 0,19 ммоль), полученной в примере 50, добавляли триэтиламин (32 мкл, 0,23 ммоль), 4-диметиламинопиридин (12 мг, 0,095 ммоль), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (44 мг, 0,23 ммоль) и 2-амино-5-хлорпиридин (29 мг, 0,23 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 5 часов. Реакционную смесь разбавляли дихлорметаном и промывали последовательно водой, насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором. Полученный органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=3:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (27 мг, 0,051 ммоль, 27%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 6,04 (1H, с), 6,92-6,97 (1H, м), 7,01-7,07 (1H, м), 7,42 (2H, д, J=8,6 Гц), 7,57 (2H, д, J=8,6 Гц), 7,75 (1H, дд, J=9,1,2,4 Гц), 7,80 (1H, д, J=8,1 Гц), 7,97-8,01 (1H, м), 8,26 (1H, дд, J=8,1,2,2 Гц), 8,28 (1H, д, J=2,4 Гц) 8,33 (1H, д, J=9,1 Гц), 8,51 (1H, с), 9,12 (1H, д, J=2,2 Гц).
MS m/z: 534 (M++H).
Пример 88: N',N'-диметилгидразид 6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]никотиновой кислоты
[Химическая формула 131]
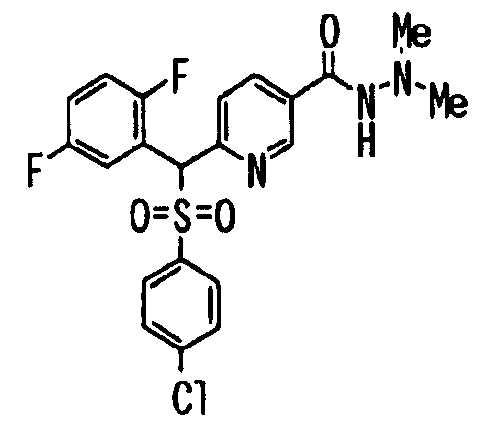
К раствору в дихлорметане (5 мл) [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]карбоновой кислоты (80 мг, 0,19 ммоль), полученной в примере 50, добавляли триэтиламин (32 мкл, 0,23 ммоль), 4-диметиламинопиридин (12 мг, 0,095 ммоль), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (44 мг, 0,23 ммоль) и 1,1-диметилгидразин (21 мкл, 0,23 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 7 часов. Реакционную смесь разбавляли дихлорметаном. Разбавленную смесь промывали последовательно водой, насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором. Полученный органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью дихлорметан:метанол=50:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (60 мг, 0,13 ммоль, 68%) в виде бесцветного аморфного вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 2,57 (0,9H, с), 2,72 (5,1H, с), 5,98 (1H, с), 6,48 (0,15H, с), 6,90-7,06 (2,85H, м), 7,41 (2H, д, J=8,6 Гц), 7,56 (2H, д, J=8,6 Гц), 7,68 (1H, д, J=8,1 Гц), 7,97-8,04 (1H, м), 8,13-8,17 (1H, м), 8,94 (0,85H, с), 9,07 (0,15H, с).
MS m/z: 466 (M++H).
Пример 89: N'-(Фуран-2-карбонил)гидразид 6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]никотиновой кислоты
[Химическая формула 132]
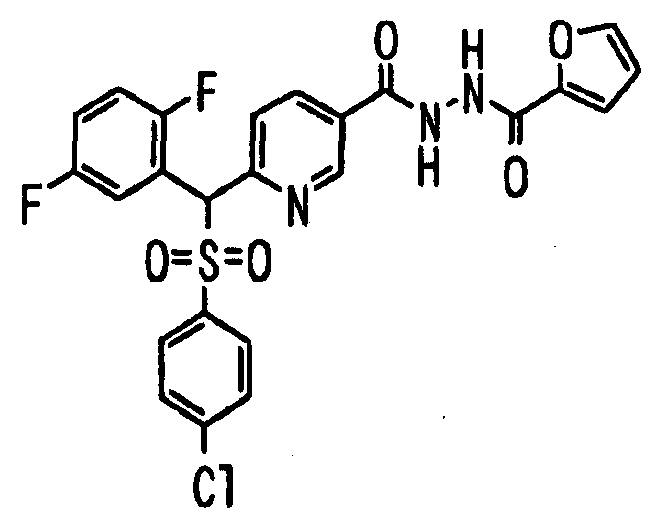
К раствору в дихлорметане (5 мл) [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]карбоновой кислоты (80 мг, 0,19 ммоль), полученной в примере 50, добавляли триэтиламин (32 мкл, 0,23 ммоль), 4-диметиламинопиридин (12 мг, 0,095 ммоль), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (44 мг, 0,23 ммоль) и 2-фурангидразид (29 мг, 0,23 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 7,5 часов. Реакционную смесь разбавляли дихлорметаном. Разбавленную смесь затем промывали последовательно водой, насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором. Полученный органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью дихлорметан:метанол=50:1, концентрировали при пониженном давлении. Полученное твердое вещество перекристаллизовывали из дихлорметана-гексана с получением указанного в заголовке соединения (58 мг, 0,11 ммоль, 58%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 6,01 (0,7H, с), 6,02 (0,3H, с), 6,55 (0,7H, дд, J=3,4, 1,7 Гц), 6,91-6,96 (1H, м), 6,99-7,04 (1H, м), 7,21 (0,7H, д, J=3,4 Гц), 7,41 (2H, д, J=8,6 Гц), 7,53 (0,3H, дд, J=1,7, 0,7 Гц), 7,56-7,60 (3H, м), 7,74 (1H, д, J=8,3 Гц), 7,77 (0,3H, д, J=8,8 Гц), 7,95-7,99 (1H, м), 8,15-8,19 (1H, м), 8,99 (0,3H, с), 9,03 (1H, д, J=2,2 Гц), 9,14 (0,7H, шир. с), 9,67 (0,7H, шир. с), 9,98 (0,3H, шир. с).
MS m/z: 532 (M++H).
Пример 90: N-[[6-[(4-Хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]метил]-(E)-3-(пиридин-4-ил)акриламид
[Химическая формула 133]
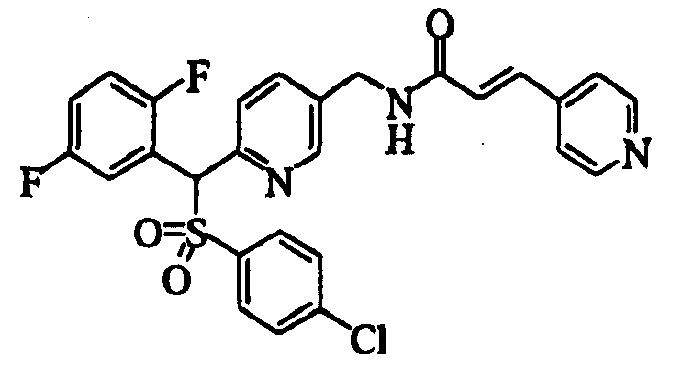
К раствору в дихлорметане (1 мл) [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]метиламина (41 мг, 0,10 ммоль), полученного в примере 63, (E)-3-(пиридин-4-ил)акриловой кислоты (15 мг, 0,10 ммоль), бензотриазол-1-ола (14 мг, 0,10 ммоль) и N-метилморфолина (0,011 мл, 0,10 ммоль) добавляли при 0°C гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (19 мг, 0,10 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 19 часов. Реакционную смесь промывали насыщенным водным раствором бикарбоната натрия. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании этилацетатом, концентрировали при пониженном давлении. Полученное твердое вещество промывали диэтиловым эфиром и собирали фильтрованием с получением указанного в заголовке соединения (35 мг, 0,065 ммоль, 65%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 4,53-4,66 (2H, м), 5,93 (1H, с), 6,09-6,17 (1H, м), 6,57 (1H, д, J=15,6 Гц), 6,86-6,93 (1H, м), 6,96-7,04 (1H, м), 7,34 (2H, д, J=5,9 Гц), 7,40 (2H, д, J=8,5 Гц), 7,56 (2H, д, J=8,5 Гц), 7,60 (1H, д, J=15,6 Гц), 7,61 (1H, д, J=8,1 Гц), 7,74 (1H, дд, J=8,1,2,2 Гц), 7,99-8,06 (1H, м), 8,59 (1H, д, J=2,2 Гц), 8,64 (2H, д, J=5,9 Гц).
MS m/z: 540 (M++H).
Пример 91: [6-[(4-Хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил] (тиоморфолин-4-ил)метанон
[Химическая формула 134]
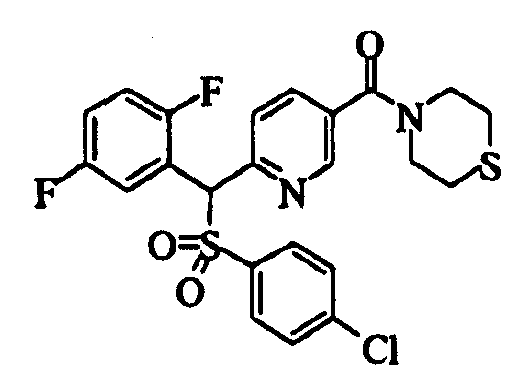
Таким же способом, как в примере 90, получали указанное в заголовке соединение (240 мг, 0,47 ммоль, 94%) в виде белого твердого вещества, используя [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]карбоновую кислоту (212 мг, 0,50 ммоль), полученную в примере 50, и тиоморфолин (0,047 мл, 0,50 ммоль).
1H-ЯМР (400 МГц, CDCl3)δ: 2,61 (2H, шир. с), 2,74 (2H, шир. с), 3,69 (2H, шир. с), 4,04 (2H, шир. с), 5,97 (1H, с), 6,88-6,95 (1H, м), 6,98-7,06 (1H, м), 7,41 (2H, д, J=8,5 Гц), 7,57 (2H, д, J=8,5 Гц), 7,73 (1H, д, J=8,1 Гц), 7,79 (1H, дд, J=8,1, 2,2 Гц), 7,95-8,02 (1H, м), 8,64 (1H, д, J=2,2 Гц).
MS m/z: 509 (M++H).
Пример 92: [6-[(4-Хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил] (1,1-диоксо-1λ6-тиоморфолин-4-ил)метанон (Соединение A) и [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил] (1-оксо-1λ4-тиоморфолин-4-ил)метанон (Соединение B)
[Химическая формула 135]
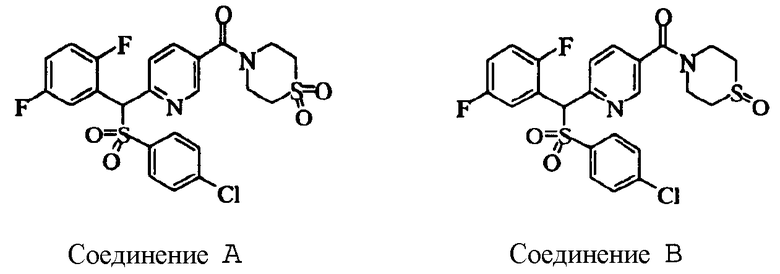
К раствору [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил] (тиоморфолин-4-ил)метанона (153 мг, 0,30 ммоль) в дихлорметане (3 мл) добавляли при охлаждении льдом 3-хлорпербензойную кислоту (96 мг, 0,36 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь разбавляли дихлорметаном и промывали последовательно 1 н. водным раствором гидроксида натрия и насыщенным солевым раствором. Полученный органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=1:2, концентрировали при пониженном давлении с получением указанного в заголовке соединения A (низкополярное соединение) (81 мг, 0,15 ммоль, 50%) в виде белого порошка, тогда как фракцию, полученную при элюировании смесью дихлорметан:метанол=10:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения B (высокополярное соединени) (73 мг, 0,14 ммоль, 46%) в виде белого порошка.
Соединение A
1H-ЯМР (400 МГц, CDCl3)δ: 3,10 (4H, шир. с), 4,13 (4H, шир. с), 5,99 (1H, с), 6,88-6,93 (1H, м), 7,00-7,06 (1H, м), 7,42 (2H, д, J=8,5 Гц), 7,58 (2H, д, J=8,5 Гц), 7,79 (1H, д, J=8,1 Гц), 7,86 (1H, дд, J=8,1, 1,7 Гц), 7,97-8,02 (1H, м), 8,71 (1H, д, J=1,7 Гц).
MS m/z: 541 (M++H).
Соединение B
1H-ЯМР (400 МГц, CDCl3)δ: 2,70-3,00 (4H, м), 3,74 (1H, шир. с), 4,10 (2H, шир. с), 4,63 (1H, шир. с), 5,98 (1H, с), 6,88-6,94 (1H, м), 7,00-7,06 (1H, м), 7,42 (2H, д, J=8,6 Гц), 7,58 (2H, д, J=8,6 Гц), 7,77 (1H, д, J=8,1 Гц), 7,84 (1H, дд, J=8,1, 2,2 Гц), 7,98-8,02 (1H, м), 8,70 (1H, д, J=2,2 Гц).
MS m/z: 525 (M++H).
Пример 93: N-(3-Метилтиопропил)-6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]никотинамид
[Химическая формула 136]
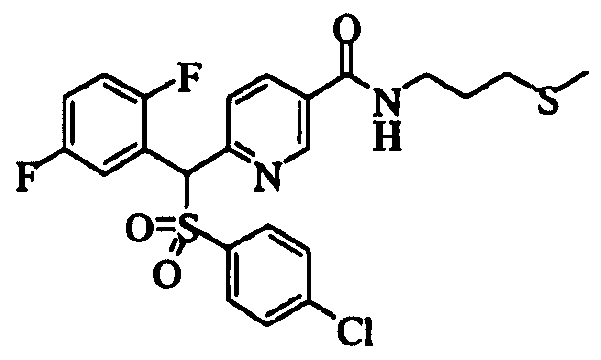
Таким же способом, как в примере 90, получали указанное в заголовке соединение (238 мг, 0,47 ммоль, 93%) в виде белого твердого вещества, используя [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]карбоновую кислоту (212 мг, 0,50 ммоль), полученную в примере 50, и 3-метилтиопропиламин (0,055 мл, 0,50 ммоль).
1H-ЯМР (400 МГц, CDCl3)δ: 1,92-2,01 (2H, м), 2,14 (3H, с), 2,63 (2H, т, J=6,8 Гц), 3,58-3,64 (2H, м), 5,99 (1H, с), 6,57-6,64 (1H, м), 6,90-6,97 (1H, м), 6,99-7,06 (1H, м), 7,41 (2H, д, J=8,5 Гц), 7,56 (2H, д, J=8,5 Гц), 7,71 (1H, д, J=8,1 Гц), 7,96-8,03 (1H, м), 8,16 (1H, дд, J=8,1, 2,2 Гц), 8,96 (1H, д, J=2,2 Гц).
MS m/z: 511 (M++H).
Пример 94: N-(3-Метилсульфонилпропил)-6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]никотинамид (Соединение A) и N-(3-метилсульфинилпропил)-6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]никотинамид (Соединение B)
[Химическая формула 137]
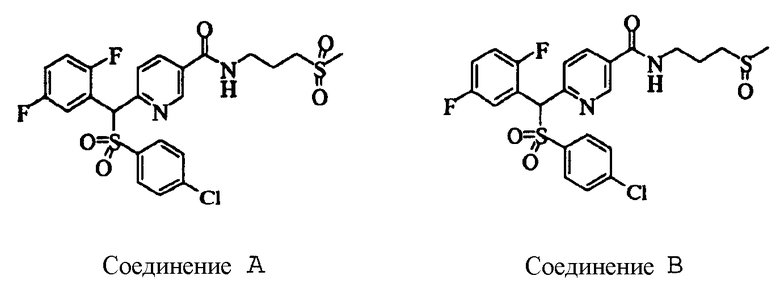
К раствору N-(3-метилтиопропил)-6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]никотинамида (153 мг, 0,30 ммоль) в дихлорметане (3 мл) добавляли при 0°C 3-хлорпербензойную кислоту (чистота: 65% или выше) (96 мг, 0,36 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь промывали 1 н. водным раствором гидроксида натрия. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании этилацетатом, концентрировали при пониженном давлении. Полученное твердое вещество промывали диэтиловым эфиром и собирали фильтрованием с получением указанного в заголовке Соединения A (53 мг, 0,098 ммоль, 32%) в виде белого твердого вещества. Фракцию, полученную при элюировании смесью дихлорметан:метанол=15:1, затем концентрировали при пониженном давлении. Полученное твердое вещество промывали диэтиловым эфиром и собирали фильтрованием с получением указанного в заголовке соединения B (68 мг, 0,13 ммоль, 43%) в виде белого твердого вещества.
Соединение A
1H-ЯМР (400 МГц, CDCl3)δ: 2,20-2,30 (2H, м), 2,98 (3H, с), 3,17 (2H, т, J=6,8 Гц), 3,65-3,72 (2H, м), 5,99 (1H, с), 6,82-6,88 (1H, м), 6,90-6,97 (1H, м), 6,99-7,06 (1H, м), 7,41 (2H, д, J=8,5 Гц), 7,56 (2H, д, J=8,5 Гц), 7,72 (1H, д, J=8,1 Гц), 7,96-8,02 (1H, м), 8,16 (1H, дд, J=8,1, 2,2 Гц), 9,00 (1H, д, J=2,2 Гц).
MS m/z: 543 (M++H).
Соединение B
1H-ЯМР (400 МГц, CDCl3)δ: 2,11-2,23 (1H, м), 2,26-2,37 (1H, м), 2,63 (3H, с), 2,78-2,86 (1H, м), 2,92-3,00 (1H, м), 3,51-3,61 (1H, м), 3,66-3,75 (1H, м), 5,99 (1H, с), 6,90-6,98 (1H, м), 6,99-7,06 (1H, м), 7,40 (2H, д, J=8,5 Гц), 7,55 (2H, д, J=8,5 Гц), 7,69 (1H, д, J=8,1 Гц), 7,88-8,01 (2H, м), 8,22 (1H, дд, J=8,1, 2,2 Гц), 9,08 (1H, д, J=2,2 Гц).
MS m/z: 527 (M++H).
Пример 95: 2-Хлор-5-[(3-хлорпиридин-4-ил) (2,5-дифторфенил)метилтио]пиридин
[Химическая формула 138]
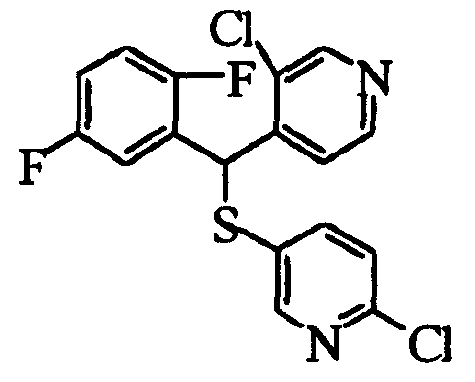
К раствору O-этил S-(6-хлор-3-пиридил)дитиокарбоната (164 мг, 0,70 ммоль), полученного в ссылочном примере 26, в этаноле (7 мл) добавляли 1 н. водный раствор гидроксида натрия (7 мл). Полученную смесь перемешивали при 80°C в течение 3 часов. После охлаждения реакционной смеси до комнатной температуры к смеси добавляли 1 н. раствор хлористоводородной кислоты. Полученную смесь экстрагировали дихлорметаном. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении с получением 6-хлор-3-пиридинтиола в виде желтого твердого вещества.
К раствору в дихлорметане (3 мл) 3-хлор-4-[(2,5-дифторфенил)-гидроксиметил]пиридина (153 мг, 0,60 ммоль), полученного в ссылочном примере 23, добавляли последовательно при 0°C триэтиламин (0,167 мл, 1,20 ммоль) и метансульфонилхлорид (0,070 мл, 0,90 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь промывали насыщенным водным раствором бикарбоната натрия. Органический слой затем сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. К раствору полученного остатка в N,N-диметилформамиде (3 мл)последовательнодобавлялираствор 6-хлор-3-пиридинтиола в N,N-диметилформамиде (2 мл) и карбонат калия (100 мг, 0,72 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 18 часов. К реакционной смеси добавляли этилацетат. Полученную смесь промывали насыщенным водным раствором бикарбоната натрия. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=17:3, концентрировали при пониженном давлении с получением указанного в заголовке соединения (111 мг, 0,29 ммоль, 48%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 6,04 (1H, с), 6,95-7,05 (2H, м), 7,10-7,20 (1H, м), 7,25 (1H, д, J=8,1 Гц), 7,57 (1H, д, J=5,1 Гц), 7,60 (1H, дд, J=8,1, 2,5 Гц), 8,31 (1H, д, J=2,5 Гц), 8,54 (1H, д, J=5,1 Гц), 8,59 (1H, с).
MS m/z: 383 (M++H).
Пример 96: 2-Хлор-5-[(3-хлорпиридин-4-ил)(2,5-дифторфенил)метилсульфонил]пиридин
[Химическая формула 139]
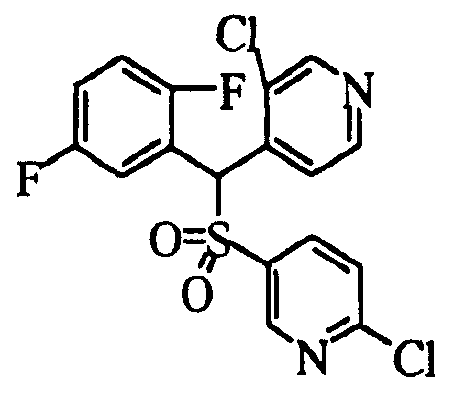
К раствору 2-хлор-5-[(3-хлорпиридин-4-ил)(2,5-дифторфенил)метилтио]пиридина (109 мг, 0,28 ммоль) в метаноле (4 мл) добавляли 31% водный раствор перекиси водорода (2 мл) и тетрагидрат гексааммонийгептамолибдата (30 мг). Полученную смесь перемешивали при комнатной температуре в течение 17 часов. К реакционной смеси добавляли этилацетат. Полученную смесь промывали насыщенным водным раствором бикарбоната натрия. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=17:3, концентрировали при пониженном давлении с получением указанного в заголовке соединения (108 мг, 0,26 ммоль, 92%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 6,26 (1H, с), 6,94-7,03 (1H, м), 7,06-7,15 (1H, м), 7,44 (1H, д, J=8,3 Гц), 7,50-7,56 (1H, м), 7,89 (1H, дд, J=8,3, 2,7 Гц), 8,12 (1H, д, J=5,1 Гц), 8,59 (1H, д, J=2,7 Гц), 8,61 (1H, с), 8,66 (1H, д, J=5,1 Гц).
MS m/z: 415 (M++H).
Пример 97: 5-[(3-Хлорпиридин-4-ил) (2,5-дифторфенил)-метилсульфонил]-2-фторпиридин
[Химическая формула 140]
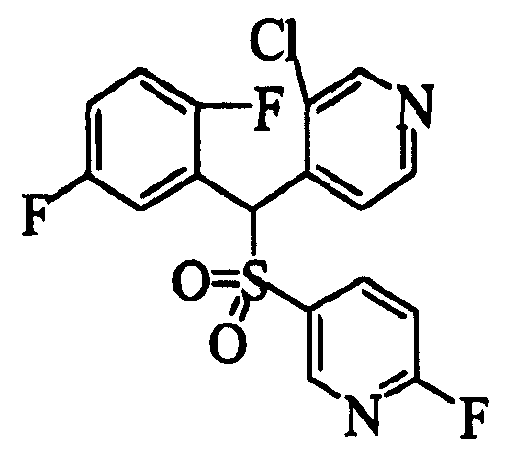
К раствору 2-хлор-5-[(3-хлорпиридин-4-ил)(2,5-дифторфенил)метилсульфонил]пиридина (66 мг, 0,16 ммоль) в ацетонитриле (2 мл) добавляли фторид калия (94 мг, 1,60 ммоль) и бромид тетрафенилфосфония (134 мг, 0,32 ммоль). Полученную смесь нагревали при кипячении с обратным холодильником в течение 16 часов. После охлаждения реакционной смеси до комнатной температуры к смеси добавляли дихлорметан. Полученную смесь промывали водой. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=17:3, концентрировали при пониженном давлении с получением указанного в заголовке соединения (4,5 мг, 0,011 ммоль, 7%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 6,26 (1H, с), 6,93-7,13 (3H, м), 7,50-7,56 (1H, м), 8,01-8,08 (1H, м), 8,13 (1H, д, J=5,1 Гц), 8,48 (1H, д, J=2,2 Гц), 8,60 (1H, с), 8,66 (1H, д, J=5,1 Гц).
MS m/z: 440 (M++H+MeCN).
Пример 98: N'-[6-[(4-Хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-илметилиден]-2-тиофенкарбогидразид
[Химическая формула 141]
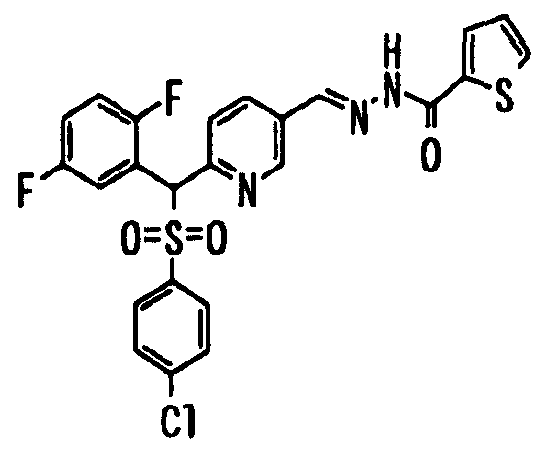
[6-[(4-хлорфенилсульфонил)-(2,5-дифторфенил)метил]пиридин-3-ил]карбальдегид (100 мг, 0,245 ммоль), полученный в примере 47, и 2-тиофенкарбогидразид (41,7 мг, 0,294 ммоль) растворяли в этаноле (3 мл). Полученную смесь перемешивали при комнатной температуре в течение 3 дней. Осажденное таким образом твердое вещество собирали фильтрованием и промывали этанолом. Полученное твердое вещество перекристаллизовывали из этанола с получением указанного в заголовке соединения (91,0 мг, 0,171 ммоль, 70%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3/DMSO-d6)δ: 5,98 (1H, с), 6,93-7,01 (1H, м), 7,02-7,09 (1H, м), 7,14-7,20 (1H, шир. м), 7,42 (2H, д, J=8,5 Гц), 7,57 (2H, д, J=8,5 Гц), 7,62-7,73 (2H, шир. м), 8,02-8,20 (3H, м), 8,95 (1H, с), 11,5 (1H, с).
MS m/z: 532 (M++H).
Пример 99: 6-[(4-Хлорфенилсульфонил)(2,5-дифторфенил)-метил]никотинамид
[Химическая формула 142]
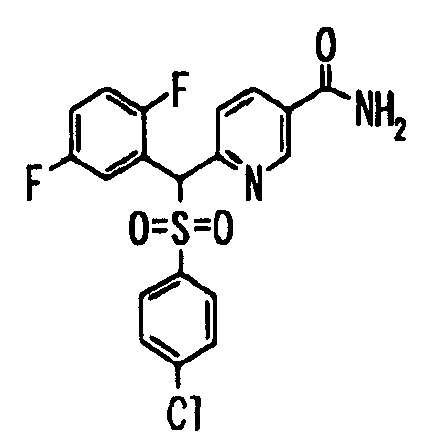
К суспензии в дихлорметане (4 мл) [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]карбоновой кислоты (100 мг, 0,236 ммоль), полученной в примере 50, добавляли тионилхлорид (1,00 мл) и N,N-диметилформамид (одну каплю). Полученную смесь перемешивали при комнатной температуре в течение 18 часов. Реакционную смесь концентрировали досуха. Полученный остаток растворяли в дихлорметане (6 мл). К полученному раствору добавляли 28% водный раствор аммиака (2 мл). Смесь перемешивали при комнатной температуре в течение 3 часов, а затем реакционную смесь подкисляли 1 н. раствором хлористоводородной кислоты. Полученную смесь концентрировали и образовавшееся твердое вещество собирали фильтрованием. Полученное твердое вещество промывали водой и этанолом и затем перекристаллизовывали из этанола с получением указанного в заголовке соединения (47,9 мг, 0,113 ммоль, 46%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3/DMSO-d6)δ: 6,00 (1H, с), 6,38 (1H, шир. с), 6,94-6,99 (1H, м), 7,02-7,08 (1H, м), 7,43 (2H, д, J=8,5 Гц), 7,56 (2H, д, J=8,5 Гц), 7,67 (1H, д, J=7,6 Гц), 7,65-7,75 (1H, шир. м), 7,99-8,04 (1H, м), 8,26 (1H, дд, J=8,1, 2,4 Гц), 9,12 (1H, д, J=1,7 Гц).
MS m/z: 423 (M++H).
Пример 100: 6-[(4-Хлорфенилсульфонил)(2,5-дифторфенил)метил]-N-(4-метилциклогексил)никотинамид
[Химическая формула 143]
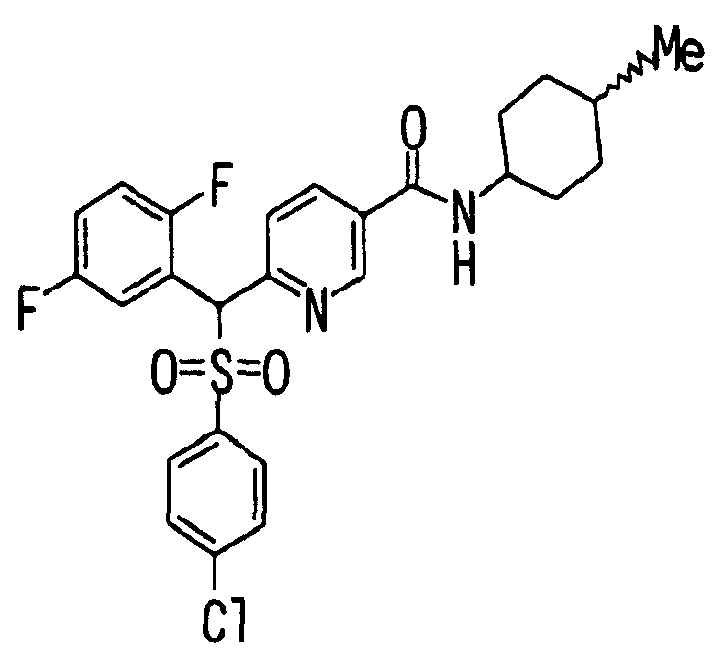
К суспензии [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]карбоновой кислоты (100 мг, 0,236 ммоль), полученной в примере 50, в дихлорметане (4 мл) добавляли тионилхлорид (1,00 мл) и N,N-диметилформамид (одну каплю). Полученную смесь перемешивали при комнатной температуре в течение 6 часов. Реакционную смесь концентрировали досуха и полученный остаток растворяли в дихлорметане (6 мл). К полученному раствору добавляли N-метилморфолин (51,8 мкл, 0,472 ммоль) и 4-метилциклогексиламин (37,4 мкл, 0,283 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 18 часов, а затем разбавляли дихлорметаном. Разбавленную смесь промывали последовательно 1 н. раствором хлористоводородной кислоты, водой и насыщенным солевым раствором, сушили над сульфатом магния и концентрировали. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=3:1, концентрировали с получением белого твердого вещества. Полученное твердое вещество перекристаллизовывали из этилацетата-гексана с получением указанного в заголовке соединения (70,3 мг, 0,135 ммоль, 57%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 0,92 (1,8H, д, J=6,6 Гц), 0,96 (1,2H, д, J=6,4 Гц), 1,05-1,30 (3H, м), 1,32-1,43 (0,6H, м), 1,55-1,83 (4,4H, м), 2,03-2,12 (1H, м), 3,86-3,97 (0,6H, м), 4,20-4,28 (0,4H, м), 5,88 (0,6H, д, J=7,1 Гц), 5,98 (1H, с), 6,18 (0,4H, д, J=7,3 Гц), 6,90-6,96 (1H, м), 6,98-7,06 (1H, м), 7,41 (1,2H, д, J=8,1 Гц), 7,41 (0,8H, д, J=8,1 Гц), 7,56 (1,2H, д, J=8,1 Гц), 7,57 (0,8H, д, J=8,1 Гц), 7,67-7,72 (1H, м), 7,97-8,05 (1H, м), 8,10-8,18 (1H, м), 8,93 (0,6H, д, J=2,2 Гц), 8,96 (0,4H, д, J=2,2 Гц).
MS m/z: 519 (M++H).
Пример 101: 6-[(4-Хлорфенилсульфонил)(2,5-дифторфенил)метил]-N-метоксиникотинамид
[Химическая формула 144]
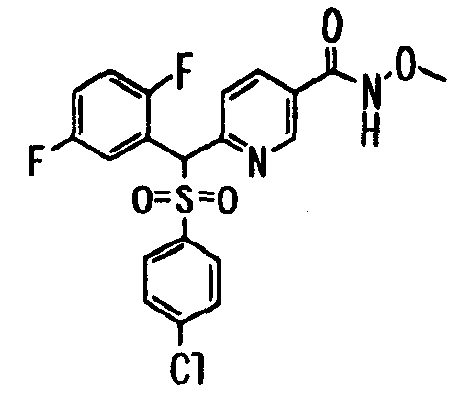
К суспензии в дихлорметане (6 мл) [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]карбоновой кислоты (100 мг, 0,236 ммоль), полученной в примере 50, добавляли N-метилморфолин (77,7 мкл, 0,708 ммоль), гидрохлорид O-метилгидроксиламина(23,6 мг, 0,283 ммоль) и гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (54,3 мг, 0,283 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли тетрагидрофуран (1 мл). После перемешивания при комнатной температуре в течение 18 часов реакционную смесь разбавляли дихлорметаном. Разбавленную смесь промывали водой и насыщенным солевым раствором. Полученный органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=1:1, концентрировали с получением белого твердого вещества. Полученное твердое вещество промывали этилацетатом с получением указанного в заголовке соединения (55,1 мг, 0,122 ммоль, 52%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 3,90 (2,4H, с), 3,97 (0,6H, с), 5,97 (0,2H, с), 5,98 (0,8H, с), 6,90-7,07 (2H, м), 7,39-7,46 (2H, м), 7,54-7,59 (2H, м), 7,63 (0,2H, д, J=8,3 Гц), 7,73 (0,8H, д, J=8,1 Гц), 7,94-8,00 (1H, м), 8,10-8,15 (1H, м), 8,76 (1H, шир. с), 8,92 (0,8H, д, J=1,7 Гц), 9,01 (0,2H, д, J=1,5 Гц).
MS m/z: 453 (M++H).
Пример 102: N,N-Диметил-[6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]метиламин
[Химическая формула 145]
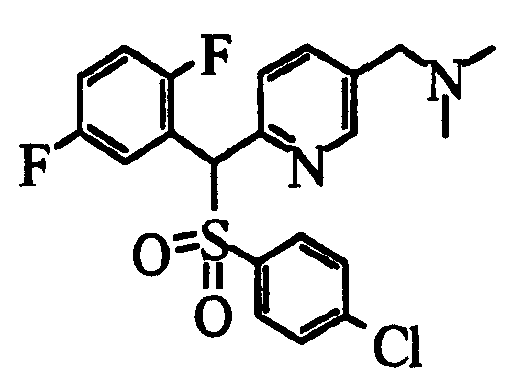
[6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]карбальдегид (100 мг, 0,245 ммоль), полученный в примере 47, раствор диметиламина в тетрагидрофуране (2,0M, 0,25 мл, 0,50 ммоль) и уксусную кислоту (0,029 мл, 0,51 ммоль) растворяли в 1,2-дихлорэтане (5 мл), а затем добавляли триацетоксиборогидрид натрия (115 мг, 0,515 ммоль) при комнатной температуре. Полученную смесь перемешивали при комнатной температуре в течение 3 дней. К реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия и этилацетат. Полученную смесь разделяли на слои. Полученный органический слой промывали последовательно насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором и сушили над безводным сульфатом магния. После фильтрования фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью дихлорметан:метанол=40:1, концентрировали при пониженном давлении с получением белого твердого вещества. Полученное твердое вещество промывали гексаном с получением указанного в заголовке соединения (88 мг, 0,20 ммоль, 82%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 2,23 (6H, с), 3,43 (2H, с), 5,94 (1H, с), 6,88-6,98 (1H, м), 6,98-7,06 (1H, м), 7,38 (2H, д, J=8,6 Гц), 7,52-7,62 (3H, м), 7,71 (1H, дд, J=8,1, 2,1 Гц), 7,98-8,08 (1H, м), 8,51 (1H, д, J=2,1 Гц).
MS m/z: 437 (M++H).
Пример 103: N-[[6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]метил]бис(2-метоксиэтил)амин
[Химическая формула 146]
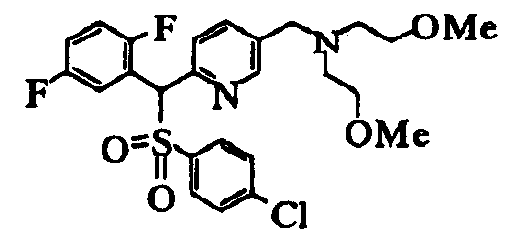
[6-[(4-Хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]карбальдегид (100 мг, 0,245 ммоль), полученный в примере 47, бис(2-метоксиэтил)амин (70 мг, 0,53 ммоль) и уксусную кислоту (0,029 мл, 0,51 ммоль) растворяли в 1,2-дихлорэтане (5 мл). К полученному раствору добавляли при комнатной температуре триацетоксиборогидрид натрия (115 мг, 0,515 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 3 дней. К реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия и этилацетат. Полученную смесь разделяли на слои. Полученный органический слой промывали последовательно насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором и сушили над безводным сульфатом магния. После фильтрования фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=3:2, концентрировали при пониженном давлении с получением белого твердого вещества. Полученное твердое вещество промывали гексаном с получением указанного в заголовке соединения (101 мг, 0,192 ммоль, 78%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 2,73 (4H, т, J=5,8 Гц), 3,31 (6H, с), 3,47 (4H, д, J=5,8 Гц), 3,75 (2H, с), 5,93 (1H, с), 6,88-6,97 (1H, м), 6,97-7,07 (1H, м), 7,38 (2H, д, J=8,8 Гц), 7,50-7,60 (3H, м), 7,76 (1H, дд, J=8,1, 2,0 Гц), 7,98-8,08 (1H, м), 8,54 (1H, д, J=2,0 Гц).
MS m/z: 525 (M++H).
Пример 104: 6-[(4-Хлорфенилсульфонил)(2,5-дифторфенил)метил]-N,N-диметилникотинамид
[Химическая формула 147]
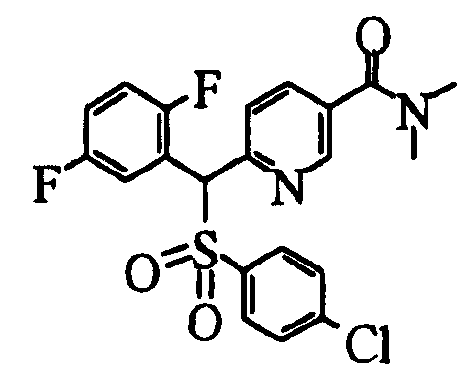
[6-[(4-Хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]карбоновую кислоту (90 мг, 0,21 ммоль), полученную в примере 50, раствор в тетрагидрофуране диметиламина(2,0M, 0,21 мл, 0,42 ммоль), 4-(диметиламино)пиридина (15 мг, 0,12 ммоль) и триэтиламина (0,045 мл, 0,32 ммоль) растворяли в дихлорметане (5 мл). К полученному раствору добавляли гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (61 мг, 0,32 ммоль) при комнатной температуре с последующим перемешиванием при комнатной температуре в течение 14 часов. Остаток, полученный концентрацией реакционной смеси при пониженном давлении, подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=2:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (35 мг, 0,066 ммоль, 90%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 3,01 (3H, с), 3,14 (3H, с), 5,97 (1H, с), 6,88-6,99 (1H, м), 6,99-7,08 (1H, м), 7,40 (2H, д, J=8,7 Гц), 7,57 (2H, д, J=8,7 Гц), 7,70 (1H, дд, J=8,0, 0,7 Гц), 7,82 (1H, дд, J=8,0, 2,2 Гц), 7,93-8,04 (1H, м), 8,68 (1H, дд, J=2,2, 0,7 Гц).
MS m/z: 451 (M++H).
Пример 105: [6-[(4-Хлорфенилсульфонил)(2,5-дифторфенил)-метил]пиридин-3-ил] (4-метилпиперазин-1-ил)метанон
[Химическая формула 148]
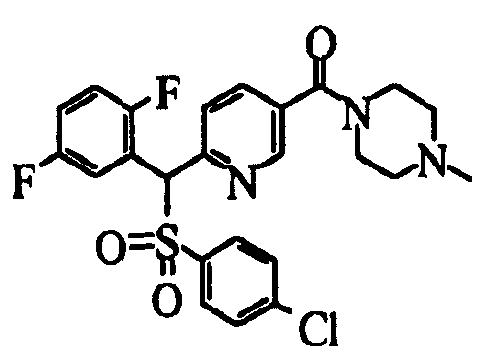
[6-[(4-Хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]карбоновую кислоту (90 мг, 0,21 ммоль), полученную в примере 50, N-метилпиперазин (0,036 мл, 0,33 ммоль), 4-(диметиламино)пиридин (15 мг, 0,12 ммоль) и триэтиламин (0,045 мл, 0,32 ммоль) растворяли в дихлорметане (5 мл). К полученному раствору добавляли при комнатной температуре гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (61 мг, 0,32 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 14 часов. К реакционной смеси добавляли N-метилпиперазин (0,036 мл, 0,33 ммоль), триэтиламин (0,045 мл, 0,32 ммоль) и гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (61 мг, 0,32 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 14 часов. Реакционную смесь затем концентрировали при пониженном давлении. Полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью дихлорметан:метанол=25:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (86 мг, 0,17 ммоль, 80%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 2,33 (3H, с), 2,38 (2H, шир. с), 2,50 (2H, шир. с), 3,44 (2H, шир. с), 3,81 (2H, шир. с), 5,97 (1H, с), 6,87-6,98 (1H, м), 6,98-7,08 (1H, м), 7,40 (2H, д, J=8,8 Гц), 7,57 (2H, д, J=8,8 Гц), 7,71 (1H, дд, J=8,1, 0,7 Гц), 7,81 (1H, дд, J=8,1, 2,2 Гц), 7,94-8,04 (1H, м), 8,66 (1H, дд, J=2,2, 0,7 Гц).
MS m/z: 506 (M++H).
Пример 106: 4-[2-[5-Хлор-4-[(4-хлорфенилсульфонил)-(2,5-дифторфенил)метил]пиридин-2-ил]аминоэтил]морфолин
[Химическая формула 149]
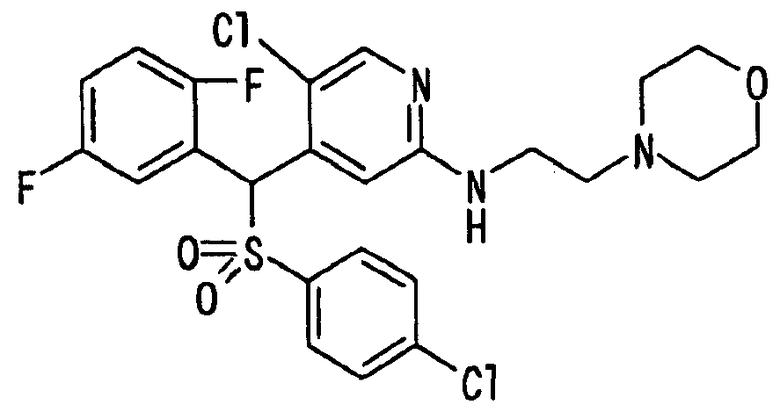
4-[2-[5-Хлор-4-[(4-хлорфенилсульфонил)-(2,5-дифторфенил)метил]пиридин-2-ил]аминоэтил]морфолин-N-оксид (78 мг, 0,14 ммоль), полученный в примере 61, растворяли в смеси растворителей уксусной кислоты (2,0 мл) и воды (2,0 мл). Полученный раствор нагревали до 60°C и к смеси добавляли порошок железа (40 мг, 0,72 ммоль). Полученную смесь перемешивали в течение 30 минут. После охлаждения реакционную смесь выливали в насыщенный водный раствор карбоната калия, а затем экстрагировали этилацетатом (60 мл). Экстракт промывали насыщенным солевым раствором, сушили и концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (3% метанол/хлороформ раствор) с получением указанного в заголовке соединения (30 мг, 40%).
1H-ЯМР (400 МГц, CDCl3)δ: 2,5-2,8 (6H, м), 3,59 (2H, шир.), 3,81 (4H, шир.), 5,45 (1H, шир.), 6,10 (1H, с), 6,88 (1H, м), 7,01 (1H, м), 7,25 (1H, с), 7,42 (2H, д, J=8,8 Гц), 7,49 (1H, м), 7,60 (2H, д, J=8,4 Гц), 7,97 (1H, с).
MS m/z: 542 (M++H).
Пример 107: трет-Бутил 2-[N-[5-хлор-4-[(4-хлорфенилтио)-(2,5-дифторфенил)метил]пиридин-2-ил]-N-метиламино]этил-метилкарбамат
[Химическая формула 150]
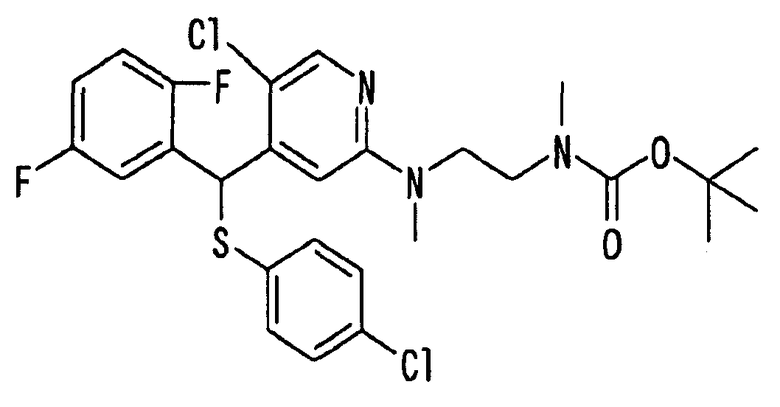
Раствор 2,5-дихлор-4-[(4-хлорфенилтио)-(2,5-дифторфенил)метил]пиридина (78 мг, 0,19 ммоль), полученного в примере 54, в 1,4-диоксане (2,0 мл) и N,N'-диметилэтилендиамина (400 мкл) перемешивали при 100°C в течение 2 дней в атмосфере азота. После охлаждения до комнатной температуры реакционную смесь разбавляли этилацетатом (40 мл). Разбавленную смесь промывали водой и насыщенным солевым раствором, сушили и затем концентрировали при пониженном давлении с получением остатка. Полученный остаток растворяли в тетрагидрофуране (10 мл). К полученному раствору добавляли при комнатной температуре триэтиламин (31 мкл, 0,22 ммоль) и ди-трет-бутилдикарбонат (49 мг, 0,22 ммоль). Полученную смесь перемешивали в течение 15 часов. Реакционную смесь концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат=4:1) с получением указанного в заголовке соединения (68 мг, 64%) в виде масла.
1H-ЯМР (400 МГц, CDCl3)δ: 1,26 и 1,32 (9H, шир.-с, ротамер), 2,75 и2,78 (3H, шир.-с, ротамер), 2,95 (3H, шир.с), 3,30 (2H, м), 3,65 (2H, м), 5,92 (1H, с), 6,6-6,8 (1H, м), 6,84-6,97 (2H, м), 7,05 (1H, м), 7,14 (2H, д, J=8,8 Гц), 7,17 (2H, д, J=8,4 Гц), 7,98 (1H, с).
MS m/z: 568 (M++H).
Пример 108: трет-Бутил 2-[N-[5-хлор-4-[(4-хлорфенилсульфонил)-(2,5-дифторфенил)метил]пиридин-2-ил]-N-метиламино]этилметилкарбамат
[Химическая формула 151]
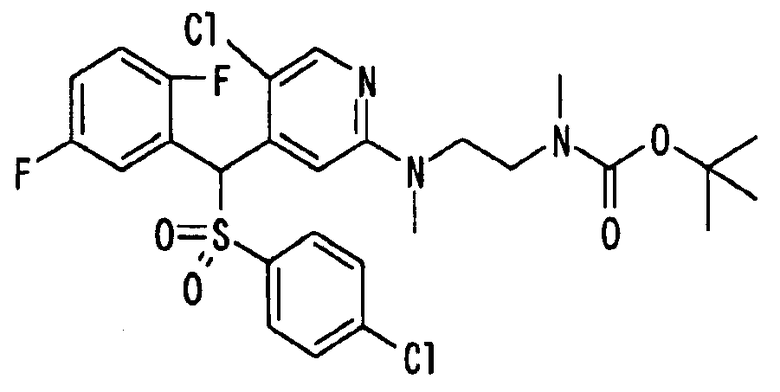
К раствору трет-бутил 2-[N-[5-хлор-4-[(4-хлорфенилтио)-(2,5-дифторфенил)метил]пиридин-2-ил]-N-метиламино]этил-метилкарбамата (67 мг, 0,12 ммоль) в метаноле (6 мл) добавляли тетрагидрат гексааммонийгептамолибдата (30 мг), а затем добавляли 30% водный раствор перекиси водорода (3 мл). Полученную смесь перемешивали в течение 17 часов. Реакционную смесь разбавляли этилацетатом, а затем разбавленную смесь промывали водой и насыщенным солевым раствором и концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат=3:1) с получением указанного в заголовке соединения (64 мг, 91%).
1H-ЯМР (400 МГц, CDCl3)δ: 1,33 и 1,38 (9H, шир.-с, ротамер), 2,87 и 2,89 (3H, шир.с, ротамер), 3,11 (3H, шир.с), 3,3-3,4 (2H, м), 3,6-3,9 (2H, м), 6,12 (1H, с), 6,89 (1H, м), 7,00 (1H, м), 7,26 (1H, м), 7,41 (2H, д, J=8,4 Гц), 7,53 (1H, м), 7,59 (2H, д, J=8,4 Гц), 8,00 (1H, с).
EI-MS: 599,1204 (Рассчитано для C27H29Cl2F2N3O4S: 599,1224).
Пример 109: 5-Хлор-4-[(4-хлорфенилсульфонил)-(2,5-дифторфенил)метил]-2-[N-метил-N-[2-(метиламино)этил]амино]-пиридин
[Химическая формула 152]
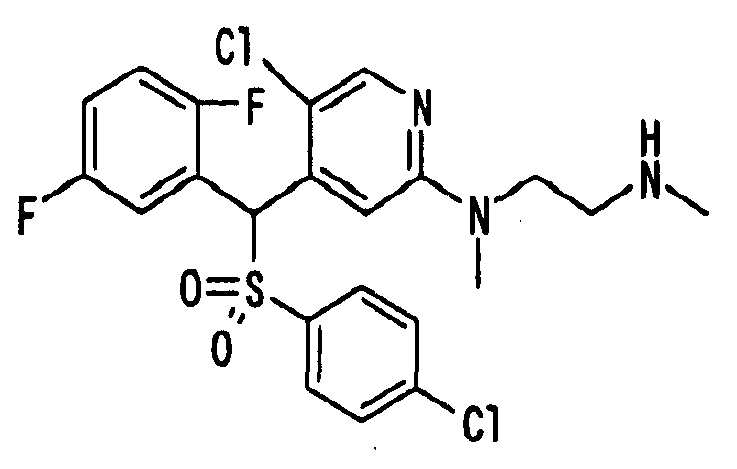
трет-Бутил 2-[N-[5-хлор-4-[(4-хлорфенилсульфонил)-(2,5-дифторфенил)метил]пиридин-2-ил]-N-метиламино]этилметилкарбамат (61 мг, 0,10 ммоль) растворяли в метиленхлориде (2,0 мл). К полученному раствору добавляли при комнатной температуре анизол (40 мкл) и трифторуксусную кислоту (200 мкл) и смесь перемешивали в течение 1 часа. Остаток, полученный концентрацией реакционной смеси при пониженном давлении, очищали хроматографией на силикагеле (3% метанол/хлороформ 3% → метанол, 3% трет-бутиламин/хлороформ) с получением указанного в заголовке соединения (21 мг, 41%) в виде масла.
1H-ЯМР (400 МГц, CDCl3)δ: 2,51 (3H, с), 2,90 (2H, д, J=6,0 Гц), 3,14 (3H, с), 3,72 (2H, м), 6,13 (1H, с), 6,89 (1H, м), 7,00 (1H, м), 7,36 (1H, м), 7,41 (2H, д, J=8,4 Гц), 7,52 (1H, м), 7,60 (2H, д, J=8,4 Гц), 8,00 (1H, с).
FAB-MS: 500,0770 (Рассчитано для C22H22Cl2F2N3O2S: 500,0778).
Пример 110: (2'S)-5-Хлор-4-[(4-хлорфенилтио)-(2,5-дифторфенил)метил]-2-[2'-(гидроксиметил)пирролидин-1'-ил]пиридин
[Химическая формула 153]
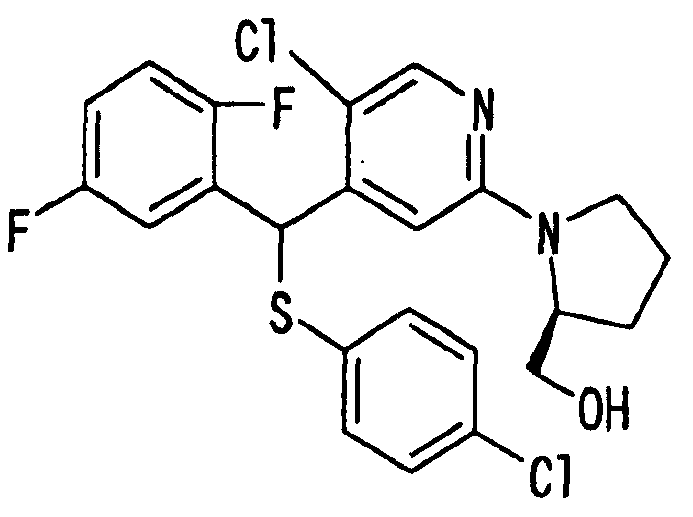
Раствор в 1,4-диоксане (1,0 мл) 2,5-дихлор-4-[(4-хлорфенилтио)-(2,5-дифторфенил)метил]пиридина (60 мг, 0,14 ммоль), полученного в примере 54, и (S)-2-пирролидинметанола (200 мкл) перемешивали при 100°C в течение 3 дней в атмосфере азота. После охлаждения до комнатной температуры реакционную смесь разбавляли этилацетатом (50 мл). Разбавленную смесь промывали водой и насыщенным солевым раствором, сушили и затем концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат=5:1) с получением указанного в заголовке соединения (40 мг, 58%) в виде масла.
1H-ЯМР (400 МГц, CDCl3)δ: 1,78 (1H, м), 2,06 (3H, м), 3,29 (1H, м), 3,50 (1H, м), 3,66 (1H, м), 3,72 (1H, м), 4,33 (1H, м), 5,97 и 5,98 (1H, с, ротамер), 6,73 и 6,77 (1H, с, ротамер), 6,92-7,15 (3H, м), 7,25 (4H, м), 7,98 (1H, с).
MS m/z: 481 (M++H).
Пример 111: (2'S)-5-Хлор-4-[(4-хлорфенилсульфонил)-(2,5-дифторфенил)метил-2-[2'-(гидроксиметил)пирролидин-1'-ил]пиридин
[Химическая формула 154]
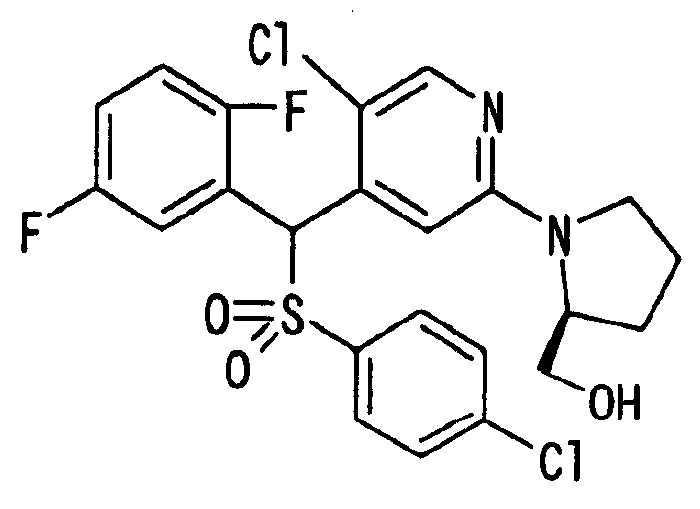
Тетрагидрат гексааммонийгептамолибдата (30 мг) добавляли к раствору (2'S)-5-хлор-4-[(4-хлорфенилтио)-(2,5-дифторфенил)метил]-2-[2'-(гидроксиметил)пирролидин-1'-ил]пиридина (39 мг, 0,08 ммоль) в метаноле (6 мл), а затем добавляли 30% водный раствор перекиси водорода (3 мл). Полученную смесь перемешивали в течение 17 часов. Реакционную смесь разбавляли этилацетатом (60 мл). Разбавленную смесь промывали водой и насыщенным солевым раствором и концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат=1:1) с получением указанного в заголовке соединения (33 мг, 79%) в виде масла.
1H-ЯМР (400 МГц, CDCl3)δ: 1,75 (1H, м), 2,02 (3H, м), 3,3-3,5 (1H, м), 3,52-3,75 (3H, м), 4,2-4,35 (1H, м), 6,05 (1H, шир.с), 6,84 (1H, м), 6,96 (1H, м), 7,36 (1H, с), 7,36 и 7,37 (2H, д, J=8,8 Гц, ротамер), 7,43 (1H, м), 7,53 и 7,54 (2H, д, J=8,8 Гц, ротамер), 7,89 и 7,90 (1H, с, ротамер).
FAB-MS: 513,0627 (Рассчитано для C23H21Cl2F2N2O3S: 513,0618).
Пример 112: трет-Бутил [4-[5-хлор-4-[(4-хлорфенилтио)-(2,5-дифторфенил)метил]пиридин-2-ил]морфолин-2-ил]метилкарбамат
[Химическая формула 155]
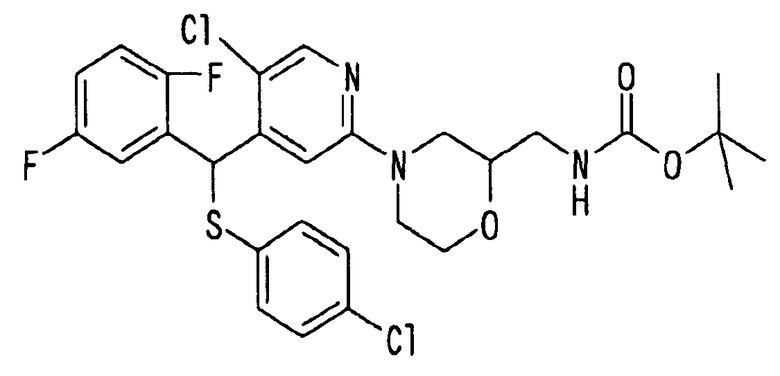
Раствор трет-бутил-2,5-дихлор-4-[(4-хлорфенилтио)-(2,5-дифторфенил)метил]пиридина (60 мг, 0,14 ммоль), полученного в примере 54, в 1,4-диоксане (1,0 мл) и трет-бутил (морфолин-2-ил)метилкарбамата (200 мг) перемешивали при 100°C в течение 2 дней в атмосфере азота. После охлаждения до комнатной температуры реакционную смесь разбавляли этилацетатом (50 мл). Разбавленную смесь промывали водой и насыщенным солевым раствором, сушили и концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:простой эфир=5:1) с получением указанного в заголовке соединения (45 мг, 52%) в виде масла.
1H-ЯМР (400 МГц, CDCl3)δ: 1,46 (9H, с), 2,72 (1H, м), 3,00 (1H, м), 3,22 (1H, м), 3,44 (1H, м), 3,6-3,75 (2H, м), 3,9-4,1 (3H, м), 4,95 (1H, шир.), 5,99 и 6,00 (1H, с, ротамер), 6,96 и 6,97 (1H, с, ротамер), 6,9-7,1 (3H, м), 7,24 (4H, с), 8,11 (1H, с).
MS m/z: 596 (M++H).
Пример 113: трет-Бутил [4-[5-хлор-4-[(4-хлорфенилсульфонил)-(2,5-дифторфенил)метил]пиридин-2-ил]морфолин-2-ил]метилкарбамат
[Химическая формула 156]
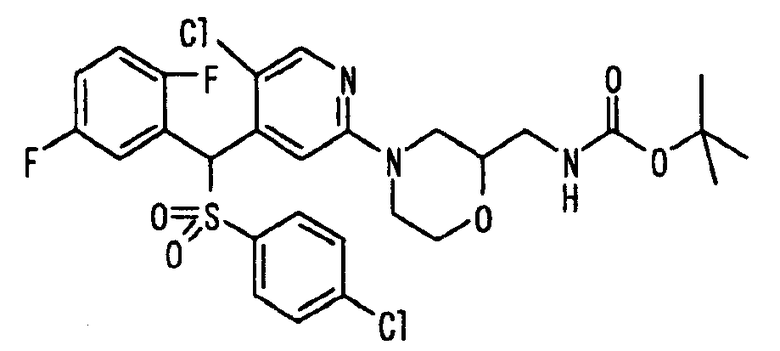
Тетрагидрат гексааммонийгептамолибдата (30 мг) добавляли к раствору трет-бутил [4-[5-хлор-4-[(4-хлорфенилтио)-(2,5-дифторфенил)метил]пиридин-2-ил]морфолин-2-ил]метилкарбамата (44 мг, 0,074 ммоль) в метаноле (6 мл), а затем добавляли 30% водный раствор перекиси водорода (3 мл). Полученную смесь перемешивали в течение 17 часов. Реакционную смесь разбавляли этилацетатом (60 мл), а затем разбавленную смесь промывали водой и насыщенным солевым раствором и концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат=3:1) с получением указанного в заголовке соединения (31 мг, 67%) в виде масла.
1H-ЯМР (400 МГц, CDCl3)δ: 1,40 (9H, с), 2,69 (1H, м), 3,02 (1H, м), 3,18 (1H, м), 3,41 (1H, шир.), 3,6-3,75 (2H, м), 3,92 (1H, м), 4,02 (1H, м), 4,13 (1H, м), 4,91 (1H, шир.), 6,07 (1H, с), 6,85 (1H, м), 6,99 (1H, м), 7,37 (2H, д, J=8,4 Гц), 7,35-7,45 (2H, м), 7,53 (2H, д, J=8,4 Гц), 8,17 (1H, с).
FAB-MS: 628,1255 (Рассчитано для C28H30Cl2F2N3O5S: 628,1251).
Пример 114: 2-Аминометил-4-[5-хлор-4-[(4-хлорфенилсульфонил)-(2,5-дифторфенил)метил]пиридин-2-ил]морфолин
[Химическая формула 157]
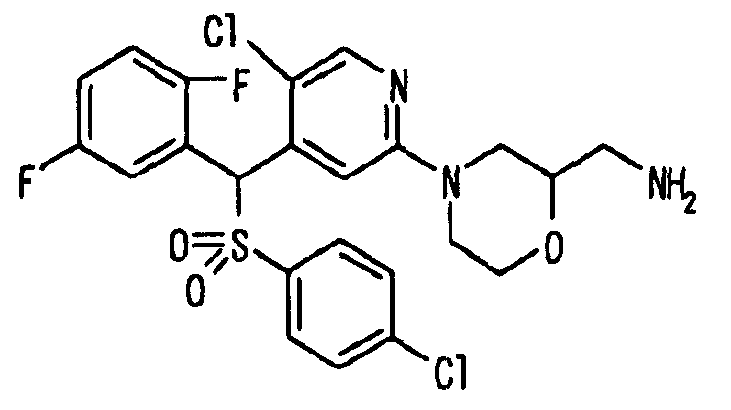
трет-Бутил [4-[5-хлор-4-[(4-хлорфенилсульфонил)-(2,5-дифторфенил)метил]пиридин-2-ил]морфолин-2-ил]метилкарбамат (30 мг, 0,05 ммоль) растворяли в метиленхлориде (1,5 мл). К полученному раствору добавляли при комнатной температуре анизол (30 мкл) и трифторуксусную кислоту (150 мкл). Полученную смесь перемешивали в течение 1 часа. Остаток, полученный концентрацией реакционной смеси при пониженном давлении, очищали хроматографией на силикагеле (3% метанол/хлороформ → 3% метанол, 3% трет-бутиламин/хлороформ) с получением указанного в заголовке соединения (17 мг, 67%) в виде масла.
1H-ЯМР (400 МГц, CDCl3)δ: 2,77 (1H, м), 2,9-3,3 (2H, м), 3,5-3,85 (3H, м), 3,97 (1H, м), 4,04-4,25 (2H, м), 6,12 (1H, с), 6,90 (1H, м), 7,02 (1H, м), 7,42 (2H, д, J=8,4 Гц), 7,4-7,55 (2H, м), 7,58 (2H, д, J=8,4 Гц), 8,05 (1H, с).
FAB-MS: 528,0695 (Рассчитано для C23H22Cl2F2N3O3S: 528,0727).
Пример 115: 5-Хлор-4-[(4-хлорфенилтио)-(2,5-дифторфенил)метил]-2-(4'-гидроксипиперидин-1'-ил)пиридин
[Химическая формула 158]
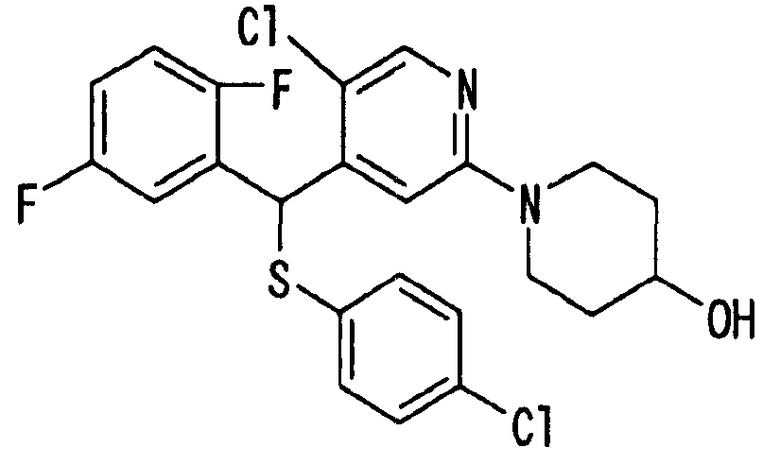
Раствор в 1,4-диоксане (1,0 мл) 2,5-дихлор-4-[(4-хлорфенилтио)-(2,5-дифторфенил)метил]пиридина (60 мг, 0,14 ммоль), полученного в примере 54, и 4-гидроксипиперидина (200 мг) перемешивали при 100°C в течение 1 дня в атмосфере азота. После охлаждения до комнатной температуры реакционную смесь разбавляли диэтиловым эфиром (50 мл). Разбавленную смесь промывали водой и насыщенным солевым раствором, сушили и затем концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат=3:1) с получением указанного в заголовке соединения (30 мг, 43%) в виде масла.
1H-ЯМР (400 МГц, CDCl3)δ: 1,62 (2H, м), 2,05 (2H, м), 3,30 (2H, м), 3,98 (3H, м), 5,97 (1H, с), 6,96-7,12 (3H, м), 7,23 (4H, м), 7,26 (1H, с), 8,10 (1H, с).
MS m/z: 481 (M++H).
Пример 116: 5-Хлор-4-[(4-хлорфенилсульфонил)-(2,5-дифторфенил)метил]-2-(4'-гидроксипиперидин-1'-ил)пиридин
[Химическая формула 159]
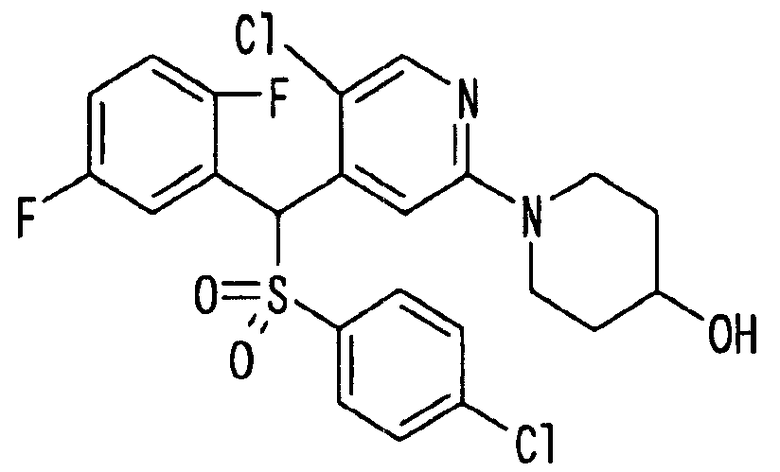
Тетрагидрат гексааммонийгептамолибдата (30 мг) добавляли к раствору 5-хлор-4-[(4-хлорфенилтио)-(2,5-дифторфенил)метил]-2-(4'-гидроксипиперидин-1'-ил)пиридина (29 мг, 0,06 ммоль) в метаноле (6 мл), а затем добавляли 30% водный раствор перекиси водорода (3 мл). Полученную смесь перемешивали в течение 17 часов. Реакционную смесь разбавляли этилацетатом (60 мл). Разбавленную смесь промывали водой и насыщенным солевым раствором и концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат=2:1), а затем кристаллизовали из простого эфира с получением указанного в заголовке соединения (17 мг, 55%) в виде твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 1,64 (2H, м), 2,02 (2H, м), 3,33 (2H, м), 3,98 (1H, м), 4,08 (2H, м), 6,11 (1H, с), 6,92 (1H, м), 7,02 (1H, м), 7,42 (2H, д, J=8,8 Гц), 7,45 (1H, м), 7,53 (1H, с), 7,58 (2H, д, J=8,8 Гц), 8,05 (1H, с).
Т.пл.: 146-148°C.
FAB-MS: 513,0588 (Рассчитано для C23H21Cl2F2N2O3S: 513,0618).
Пример 117: 3,6-Дихлор-2-[(4-хлорфенилсульфонил)(пиридин-4-ил)метил]пиридин
[Химическая формула 160]
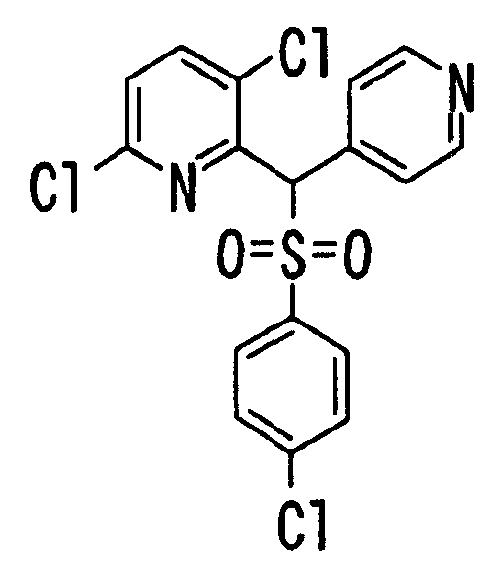
К раствору (3,6-дихлорпиридин-2-ил)(пиридин-4-ил)метанола (161 мг, 0,631 ммоль), полученного в ссылочном примере 25, в метиленхлориде (10 мл) добавляли триэтиламин (208 мкл, 1,89 ммоль) и тионилхлорид (138 мкл, 1,89 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 4 часов, а затем концентрировали при пониженном давлении. К полученному остатку добавляли этилацетат. Полученную смесь промывали последовательно насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток растворяли в ацетонитриле (10 мл). К полученному раствору добавляли 4-хлорбензолтиол (137 мг, 0,947 ммоль) и карбонат калия (131 мг, 0,947 ммоль). Полученную смесь перемешивали при комнатной температуре в атмосфере азота в течение 2 дней, а затем перемешивали при 60°C в течение 4 часов. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. К остатку добавляли этилацетат. Полученную смесь промывали последовательно водой и насыщенным солевым раствором, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали флэш-хроматографии. Фракцию, полученную при элюировании смесью 40% этилацетата/гексан, концентрировали при пониженном давлении. Полученный остаток растворяли в метаноле (10 мл). К полученному раствору добавляли 30% водный раствор перекиси водорода (3 мл) и тетрагидрат гексааммонийгептамолибдата (73 мг). Полученную смесь перемешивали при комнатной температуре в течение 5 часов, а затем метанол отгоняли при пониженном давлении. К полученному таким образом раствору добавляли насыщенный водный раствор бикарбоната натрия и затем экстрагировали метиленхлоридом. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали флэш-хроматографии. Фракцию, полученную при элюировании смесью метанол:метиленхлорид=1:80, концентрировали при пониженном давлении с получением указанного в заголовке соединения (49 мг, 0,118 ммоль, 19%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 6,08 (1H, с), 7,31 (1H, д, J=8,3 Гц), 7,41 (2H, д, J=8,8 Гц), 7,45 (2H, д, J=6,0 Гц), 7,51 (2H, д, J=8,8 Гц), 7,69 (1H, д, J=8,3 Гц), 8,58 (2H, д, J=6,0 Гц).
MS (m/z): 413,415 (M++H).
Пример 118: 2-[1-(4-Хлорфенилсульфонил)-1-(2,5-дифторфенил)этил]-5-метилпиридин
[Химическая формула 161]
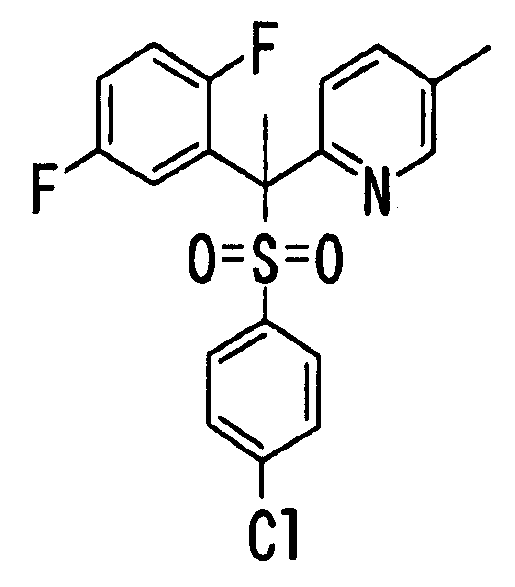
Раствор 2-[[(4-хлорфенил)сульфонил] (2,5-дифторфенил)метил]-5-метилпиридина (52 мг, 0,132 ммоль), полученного в примере 15, в N,N-диметилформамиде (5 мл) добавляли по каплям при охлаждении льдом к суспензии гидрида натрия (60% в масле) (30 мг, 0,75 ммоль) в N,N-диметилформамиде (5 мл). Реакционную смесь перемешивали в течение 15 минут при охлаждении льдом, затем к смеси добавляли метилиодид (12 мкл, 0,198 ммоль). После перемешивания при комнатной температуре в течение 1 часа к реакционной смеси добавляли воду при охлаждении льдом. Полученную смесь концентрировали при пониженном давлении. К остатку добавляли воду и полученную смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали колоночной хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=8:1, концентрировали при пониженном давлении. Полученный остаток отверждали при помощи гексана и собирали фильтрованием с получением указанного в заголовке соединения (50 мг, 0,122 ммоль,93%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 2,14 (3H, с), 2,33 (3H, с), 6,80-7,10 (2H, м), 7,23-7,34 (4H, м), 7,39-7,51 (2H, м), 7,88-8,00 (1H, м), 8,15 (1H, с).
MS (m/z): 408 (M++H).
Пример 119: 3,6-Дихлор-2-[(6-хлорпиридин-3-илтио)(пиридин-4-ил)метил]пиридин
[Химическая формула 162]
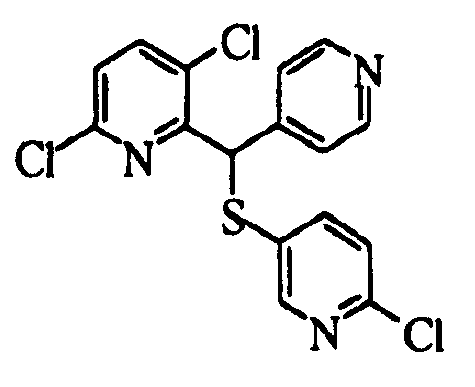
К раствору в этаноле (7 мл) O-этил S-(6-хлор-3-пиридил)дитиокарбоната (164 мг, 0,70 ммоль), полученного в ссылочном примере 26, добавляли 1 н. водный раствор гидроксида натрия (7 мл). Полученную смесь перемешивали при 80°C в течение 3 часов. После охлаждения реакционной смеси до комнатной температуры к смеси добавляли 1 н. раствор хлористоводородной кислоты. Полученную смесь экстрагировали дихлорметаном. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении с получением 6-хлор-3-пиридинтиола в виде желтого твердого вещества.
К раствору (3,6-дихлорпиридин-2-ил)(пиридин-4-ил)метанола (153 мг, 0,60 ммоль), полученного в ссылочном примере 25, в дихлорметане (3 мл) добавляли последовательно при 0°C триэтиламин (0,167 мл, 1,20 ммоль) и метансульфонилхлорид (0,070 мл, 0,90 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь промывали насыщенным водным раствором бикарбоната натрия, а затем органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. К раствору полученного остатка в N,N-диметилформамиде (3 мл) добавляли раствор 6-хлор-3-пиридинтиола в N,N-диметилформамиде (2 мл), а затем карбонат калия (100 мг, 0,72 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 18 часов. К реакционной смеси добавляли этилацетат. Полученную смесь промывали насыщенным водным раствором бикарбоната натрия. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=7:3, концентрировали при пониженном давлении с получением указанного в заголовке соединения (83 мг, 0,22 ммоль, 36%) в виде желтого масла.
1H-ЯМР (400 МГц, CDCl3)δ: 5,69 (1H, с), 7,20 (1H, д, J=8,3 Гц), 7,24 (1H, д, J=8,3 Гц), 7,35 (2H, д, J=6,1 Гц), 7,52 (1H, дд, J=8,3, 2,4 Гц), 7,62 (1H, д, J=8,3 Гц), 8,32 (1H, д, J=2,4 Гц), 8,55 (2H, д, J=6,1 Гц).
MS m/z: 382 (M++H).
Пример 120: 3,6-Дихлор-2-[(6-хлорпиридин-3-илсульфонил)(пиридин-4-ил)метил]пиридин (Соединение A) и 3,6-дихлор-2-[(6-хлорпиридин-3-илсульфинил)(пиридин-4-ил)метил]пиридин (Соединение B (Изомер A) и Соединение B (Изомер B))
[Химическая формула 163]

К раствору в метаноле (4 мл) 3,6-дихлор-2-[(6-хлорпиридин-3-илтио)(пиридин-4-ил)метил]пиридина (82 мг, 0,24 ммоль) добавляли 31% водный раствор перекиси водорода (2 мл) и тетрагидрат гексааммонийгептамолибдата (30 мг). Полученную смесь перемешивали при комнатной температуре в течение 2 часов. К реакционной смеси добавляли этилацетат. Полученную смесь промывали насыщенным водным раствором бикарбоната натрия. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=3:2, концентрировали при пониженном давлении с получением указанного в заголовке соединения A (41 мг, 0,098 ммоль, 46%), тогда как фракцию, полученную при элюировании смесью гексан:этилацетат=1:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения B (Изомер A) (низкополярное соединение) (8 мг, 9%) и указанно в заголовке Соединение B (Изомер B) (высокополярное соединение) (8 мг, 9%), каждое получали в виде белого твердого вещества.
Соединение A
1H-ЯМР (400 МГц, CDCl3)δ: 6,11 (1H, с), 7,35 (1H, д, J=8,3 Гц), 7,36 (2H, д, J=6,1 Гц), 7,40 (1H, д, J=8,3 Гц), 7,73 (1H, д, J=8,3 Гц), 7,78 (1H, дд, J=8,3, 2,4 Гц), 8,48 (1H, д, J=2,4 Гц), 8,61 (2H, д, J=6,1 Гц).
MS m/z: 414 (M++H).
Соединение B (Изомер A)
1H-ЯМР (400 МГц, CDCl3)δ: 5,54 (1H, с), 6,99 (2H, д, J=6,1 Гц), 7,27 (1H, д, J=8,3 Гц), 7,37 (1H, д, J=8,3 Гц), 7,55 (1H, дд, J=8,3, 2,2 Гц), 7,73 (1H, д, J=8,3 Гц), 8,47 (1H, д, J=2,2 Гц), 8,51 (2H, д, J=6,1 Гц).
MS m/z: 398 (M++H).
Соединение B (Изомер B)
1H-ЯМР (400 МГц, CDCl3)δ: 5,40 (1H, с), 7,26 (1H, д, J=8,5 Гц), 7,42 (1H, д, J=8,3 Гц), 7,53 (2H, д, J=6,1 Гц), 7,57 (1H, д, J=8,5 Гц), 7,96 (1H, дд, J=8,3, 2,4 Гц), 8,34 (1H, д, J=2,4 Гц), 8,68 (2H, д, J=6,1 Гц).
MS m/z: 398 (M++H).
Пример 121: 2-[[(3-Хлорпиридин-4-ил)(2,5-дифторфенил)-метил]сульфонил]пиримидин
[Химическая формула 1]
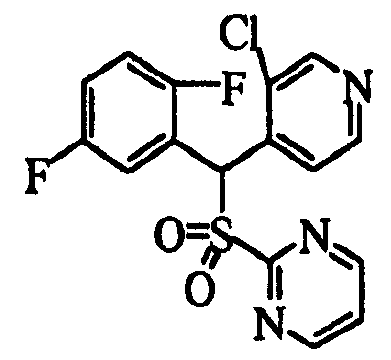
К раствору 3-хлор-4-[(2,5-дифторфенил)-гидроксиметил]пиридина (102 мг, 0,40 ммоль), полученного в ссылочном примере 23, в дихлорметане (4 мл) добавляли последовательно при 0°C триэтиламин (0,112 мл, 0,80 ммоль) и метансульфонилхлорид (0,046 мл, 0,60 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 17 часов. Реакционную смесь промывали насыщенным водным раствором бикарбоната натрия. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат затем концентрировали при пониженном давлении.
К раствору полученного остатка в N,N-диметилформамиде (4 мл) добавляли 2-пиримидинтиол (45 мг, 0,40 ммоль), а затем карбонат калия (83 мг, 0,60 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 23 часов. К реакционной смеси добавляли этилацетат. Полученную смесь промывали водой. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. К раствору полученного остатка в дихлорметане (4 мл) добавляли при 0°C 3-хлорпербензойную кислоту (чистота: 65% или выше) (212 мг, 0,80 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь промывали 1 н. водным раствором гидроксида натрия, затем органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=2:3, концентрировали при пониженном давлении с получением указанного в заголовке соединения (19 мг, 0,049 ммоль, 12%) в виде бесцветного пенистого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 6,26 (1H, с), 6,93-7,13 (3H, м), 7,50-7,56 (1H, м), 8,01-8,08 (1H, м), 8,13 (1H, д, J=5,1 Гц), 8,48 (1H, д, J=2,2 Гц), 8,60 (1H, с), 8,66 (1H, д, J=5,1 Гц).
MS m/z: 382 (M++H).
Пример 122: 6-(4-Хлорфенилтио) (2,5-дифторфенил)метил-5-фторникотинамид
[Химическая формула 2]
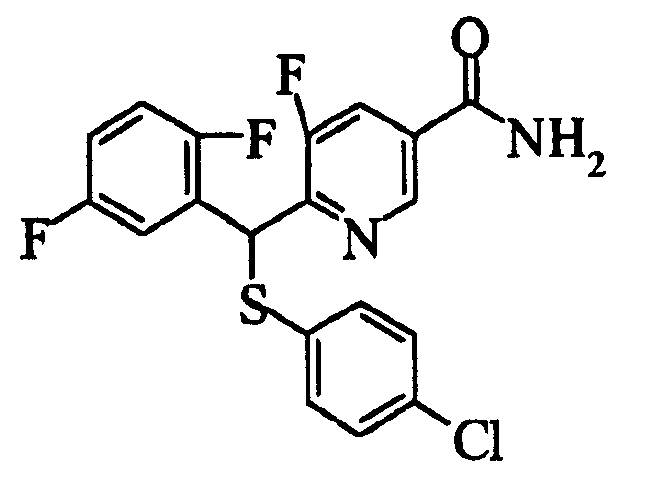
К раствору 6-(2,5-дифторфенил)гидроксиметил-5-фторникотинамида (114 мг, 0,40 ммоль), полученного в ссылочном примере 31, в дихлорметане (4 мл) добавляли последовательно при 0°C триэтиламин (0,113 мл, 0,81 ммоль) и метансульфонилхлорид (0,047 мл, 0,61 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь промывали насыщенным водным раствором бикарбоната натрия. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении.
К раствору полученного остатка в N,N-диметилформамиде (6 мл) добавляли 4-хлорбензолтиол (70 мг, 0,49 ммоль), а затем карбонат калия (67 мг, 0,49 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 15 часов. К реакционной смеси добавляли этилацетат. Полученную смесь промывали насыщенным водным раствором бикарбоната натрия. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=1:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (120 мг, 0,29 ммоль, 73%) в виде желтого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 6,14 (1H, с), 6,88-6,96 (2H, м), 7,21 (2H, д, J=8,5 Гц), 7,28 (2H, д, J=8,5 Гц), 7,58-7,74 (1H, м), 7,85 (1H, дд, J=9,4, 1,6 Гц), 8,80 (1H, с).
MS m/z: 409 (M++H).
Пример 123: 6-(4-Хлорфенилсульфонил)(2,5-дифторфенил)метил-5-фторникотинамид (Соединение A) и 6-(4-хлорфенилсульфинил) (2,5-дифторфенил)метил-5-фторникотинамид (Соединение B)
[Химическая формула 3]
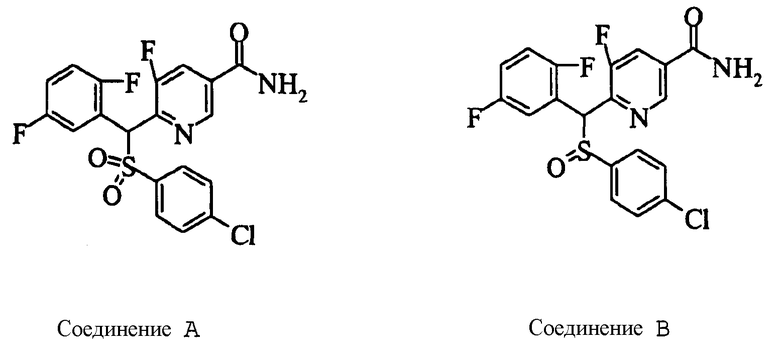
К раствору 6-(4-хлорфенилтио) (2,5-дифторфенил)метил-5-фторникотинамида (120 мг, 0,29 ммоль) в метаноле (3 мл) добавляли 30% водный раствор перекиси водорода (2 мл) и тетрагидрат гексааммонийгептамолибдата (73 мг). Полученную смесь перемешивали при комнатной температуре в течение 3 часов. К реакционной смеси добавляли дихлорметан. Полученную смесь промывали насыщенным водным раствором бикарбоната натрия. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=1:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения A (33 мг, 0,075 ммоль, 25%) в виде белого твердого вещества. Фракцию, полученную при элюировании смесью гексан:этилацетат=1:3, концентрировали при пониженном давлении с получением указанного в заголовке соединения B (39 мг, 0,092 ммоль, 31%) в виде белого твердого вещества.
Соединение A
1H-ЯМР (400 МГц, CDCl3)δ: 6,37 (1H, с), 6,90-6,97 (1H, м), 7,01-7,08 (1H, м), 7,43 (2H, д, J=8,5 Гц), 7,58 (2H, д, J=8,5 Гц), 7,94 (1H, дд, J=9,2, 1,8 Гц), 8,17-8,22 (1H, м), 8,91 (1H, с).
Т.пл.: 222-224°C.
MS m/z: 441 (M++H).
Соединение B
1H-ЯМР (400 МГц, CD3OD)δ: 5,86 (1H, с), 6,94-7,02 (1H, м), 7,06-7,14 (1H, м), 7,44 (2H, д, J=8,8 Гц), 7,48 (2H, д, J=8,8 Гц), 7,66-7,71 (1H, м), 8,07 (1H, дд, J=9,8, 1,7 Гц), 9,09 (1H, с).
Т.пл.: 171-173°C.
Элементный анализ для C19H12ClF3N2O2S. Рассчитано: C,53,72; H,2,85; Cl,8,35; F,13,42; N,6,59; S,7,55. Найдено: C,53,44; H,2,96; Cl,8,37; F,13,34; N,6,66; S,7,54.
Пример 124: [6-(4-Хлорфенилтио)(2,5-дифторфенил)метил-5-фторпиридин-3-ил]метанол
[Химическая формула 4]
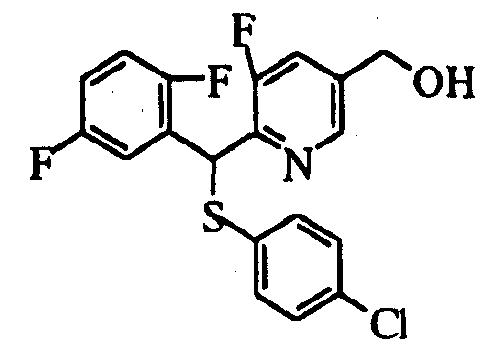
К раствору [5-(трет-бутилдифенилсилилоксиметил)-3-фторпиридин-2-ил] (2,5-дифторфенил)метанола (17,0 г, 33,5 ммоль), полученного в ссылочном примере 29, в дихлорметане (180 мл) добавляли при комнатной температуре триэтиламин (7,00 мл, 50,2 ммоль) и метансульфонилхлорид (3,11 мл, 40,2 ммоль). Полученную смесь перемешивали в течение 2 часов. Реакционную смесь промывали насыщенным водным раствором бикарбоната натрия. Органический слой затем сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении.
К раствору полученного остатка в N,N-диметилформамиде (300 мл) добавляли последовательно 4-хлорбензолтиол (5,33 г, 36,8 ммоль) и карбонат калия (5,55 г, 40,2 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 18 часов. К реакционной смеси добавляли этилацетат. Полученную смесь промывали насыщенным водным раствором бикарбоната натрия. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=30:1, концентрировали при пониженном давлении.
К раствору полученного остатка в тетрагидрофуране (200 мл) добавляли раствор (42,3 мл, 42,3 ммоль) тетрабутиламмонийфторида в тетрагидрофуране. Полученную смесь перемешивали при комнатной температуре в течение 4 часов. Реакционную смесь концентрировали при пониженном давлении и полученный остаток растворяли в этилацетате. Полученный раствор промывали насыщенным водным раствором бикарбоната натрия. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат затем концентрировали при пониженном давлении. Полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=3:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (9,80 г, 24,8 ммоль, 74%) в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3)δ: 4,76 (2H, с), 6,13 (1H, с), 6,84-6,96 (2H, м), 7,20 (2H, д, J=8,7 Гц), 7,27 (2H, д, J=8,7 Гц), 7,43 (1H, д, J=9,8 Гц), 7,57-7,64 (1H, м), 8,43 (1H, с).
Пример 125: [6-(4-Хлорфенилсульфонил)(2,5-дифторфенил)-метил-5-фторпиридин-3-ил]метанол
[Химическая формула 5]
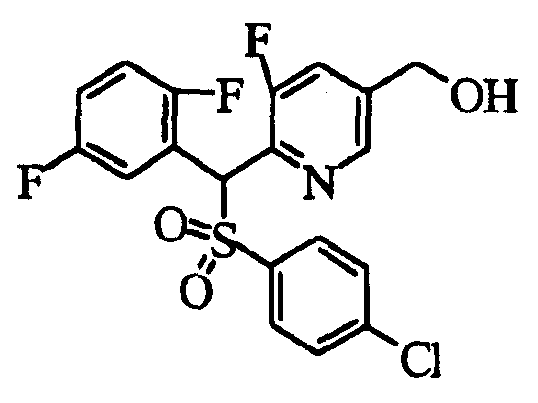
К раствору [6-(4-хлорфенилтио) (2,5-дифторфенил)метил-5-фторпиридин-3-ил]метанола (9,80 г, 24,8 ммоль) в метаноле (200 мл) добавляли 30% водный раствор перекиси водорода (14,0 мл) и тетрагидрат гексааммонийгептамолибдата (612 мг). Полученную смесь перемешивали при комнатной температуре в течение 18 часов. К реакционной смеси добавляли 30% водный раствор перекиси водорода (14,0 мл). Полученную смесь перемешивали при комнатной температуре в течение 3 дней. К реакционной смеси снова добавляли 30% водный раствор перекиси водорода (14,0 мл). Полученную смесь перемешивали при 50°C в течение 5 часов. К реакционной смеси добавляли воду и осажденное таким образом твердое вещество собирали фильтрованием. Полученное твердое вещество промывали водой и сушили при пониженном давлении. Твердое вещество растворяли в этилацетате. Полученный раствор промывали насыщенным водным раствором бикарбоната натрия. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток перекристаллизовывали из этанола с получением указанного в заголовке соединения (6,41 г, 15,0 ммоль, 61%) в виде белого твердого вещества. После концентрирования щелочного раствора при пониженном давлении, остаток перекристаллизовывали из этанола с получением указанного в заголовке соединения (2,14 г, 5,00 ммоль, 20%) в виде белого твердого вещества. После того как щелочной раствор снова концентрировали при пониженном давлении, остаток промывали диэтиловым эфиром и собирали фильтрованием с получением указанного в заголовке соединения (780 мг, 1,82 ммоль, 7%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 1,90 (1H, т, J=5,6 Гц), 4,80 (2H, д, J=5,6 Гц), 6,32 (1H, с), 6,89-6,97 (1H, м), 6,99-7,06 (1H, м), 7,41 (2H, д, J=8,8 Гц), 7,49 (1H, д, J=9,8 Гц), 7,57 (2H, д, J=8,8 Гц), 8,18-8,24 (1H, м), 8,52 (1H, с).
Т.пл.: 181-183°C.
MS m/z: 428 (M++H).
Пример 126: [6-[(4-Хлорфенилсульфонил)(2,5-дифторфенил)-метил]-5-фторпиридин-3-ил]карбальдегид
[Химическая формула 6]
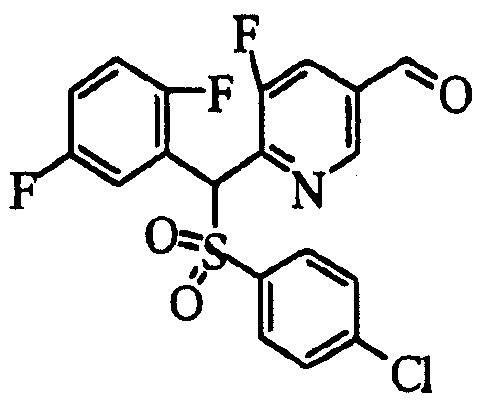
К раствору в дихлорметане (100 мл) [6-(4-хлорфенилсульфонил)(2,5-дифторфенил)метил-5-фторпиридин-3-ил]метанола (8,46 г, 19,8 ммоль), триэтиламина (13,8 мл, 98,9 ммоль) и диметилсульфоксида (7,02 мл, 98,9 мл) при комнатной температуре добавляли комплекс триоксид серы-пиридин (9,44 г, 59,3 ммоль). Полученную смесь перемешивали в течение 16 часов. Реакционную смесь промывали насыщенным солевым раствором, затем органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании дихлорметаном, концентрировали при пониженном давлении. Полученный остаток промывали диэтиловым эфиром и собирали фильтрованием с получением указанного в заголовке соединения (6,33 г, 14,9 ммоль, 75%) в виде желтого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 6,40 (1H, с), 6,91-6,98 (1H, м), 7,02-7,09 (1H, м), 7,43 (2H, д, J=8,6 Гц), 7,59 (2H, д, J=8,6 Гц), 7,89 (1H, дд, J=8,6, 1,7 Гц), 8,17-8,23 (1H, м), 9,02 (1H, с), 10,15 (1H, д, J=2,2 Гц).
Пример 127: 6-(4-Хлорфенилсульфонил)(2,5-дифторфенил)-метил-5-фторникотиновой кислоты
[Химическая формула 7]
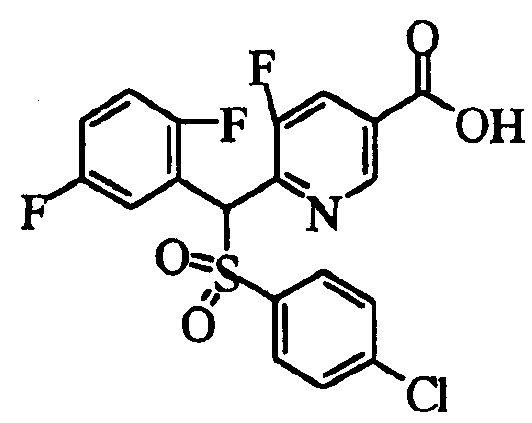
К раствору [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]-5-фторпиридин-3-ил]карбальдегида (1,28 г, 3,00 ммоль) в муравьиной кислоте (30 мл) добавляли при комнатной температуре 30% водный раствор перекиси водорода (1,02 мл, 9,00 мл). Полученную смесь перемешивали при комнатной температуре в течение 1 часа. Затем реакционную смесь перемешивали при 50°C в течение 1 часа. После охлаждения до комнатной температуры к смеси добавляли воду. Осажденное таким образом твердое вещество собирали фильтрованием, промывали водой и сушили при пониженном давлении. Полученное твердое вещество растворяли в этилацетате. Раствор промывали насыщенным водным раствором хлорида аммония. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток промывали этанолом и собирали фильтрованием с получением указанного в заголовке соединения (1,19 г, 2,69 ммоль, 89%) в виде белого твердого вещества.
1H-ЯМР (400 МГц,DMSO-d6)δ: 6,37 (1H, с), 7,27-7,42 (2H, м), 7,64 (2H, д, J=8,8 Гц), 7,67 (2H, д, J=8,8 Гц), 8,01-8,07 (1H, м), 8,17 (1H, дд, J=9,6, 1,7 Гц), 9,04 (1H, с).
Т.пл.: 249-251°C.
Элементный анализ для C19H11ClF3NO4S. Рассчитано: C,51,65; H,2,51; Cl,8,02; F,12,90; N,3,17; S,7,26. Найдено: C,51,70; H,2,73; Cl,7,96; F,12,81; N,3,36; S,7,39.
Пример 128: 6-(4-Хлорфенилсульфонил)(2,5-дифторфенил)-метил-5-фтор-N-тиазол-2-илникотинамид
[Химическая формула 8]
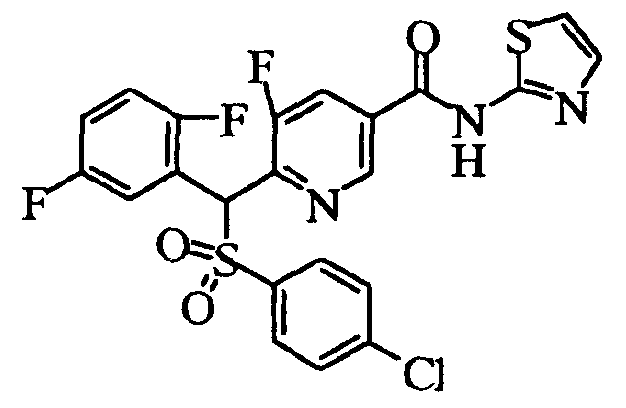
К раствору в дихлорметане (2 мл) добавляли 6-(4-хлорфенилсульфонил)(2,5-дифторфенил)метил-5-фторникотиновую кислоту (100 мг, 0,23 ммоль), добавляли при комнатной температуре тиазол-2-иламин (25 мг, 0,25 ммоль), бензотриазол-1-ол (34 мг, 0,25 ммоль), 4-метилморфолин (0,027 мл, 0,25 ммоль) и гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (48 мг, 0,25 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 14 часов. К реакционной смеси добавляли этилацетат. Полученную смесь промывали насыщенным водным раствором бикарбоната натрия. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=3:1, концентрировали при пониженном давлении. Остаток промывали этанолом и собирали фильтрованием с получением указанного в заголовке соединения (72 мг, 0,14 ммоль, 60%) в виде белого твердого вещества.
1H-ЯМР (400 МГц,DMSO-d6)δ: 6,38 (1H, с), 7,24-7,42 (2H, м), 7,60 (1H, д, J=3,7 Гц), 7,65 (2H, д, J=9,1 Гц), 7,68 (2H, д, J=9,1 Гц), 8,03-8,10 (1H, м), 8,38 (1H, д, J=9,6 Гц), 9,17 (1H, с), 13,00 (1H, с).
Т.пл.: 243-245°C.
Элементный анализ, рассчитано для C22H13ClF3N3O3S2. Рассчитано: C,50,43; H,2,50; Cl,6,77; F,10,88; N,8,02; S,12,24. Найдено: C,50,34; H,2,48; Cl,6,93; F,10,82; N,8,11; S,12,29.
Пример 129: 6-(4-Хлорфенилсульфонил)(2,5-дифторфенил)-метил-5-фтор-N-изоксазол-3-илникотинамид
[Химическая формула 9]
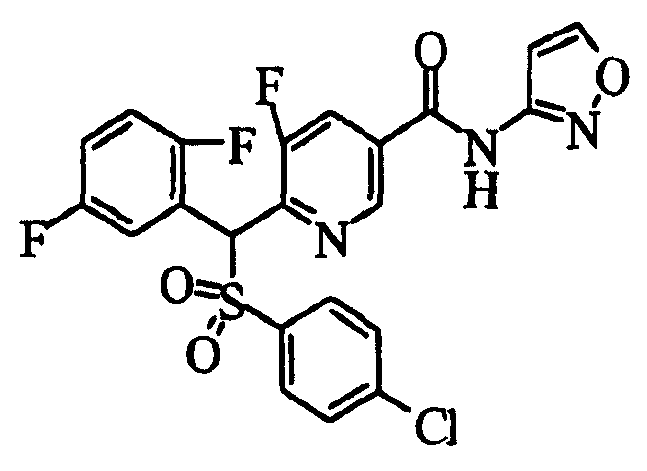
Таким же способом, как в примере 128, получали указанное в заголовке соединение (43 мг, 0,085 ммоль, 37%) в виде белого твердого вещества, используя 6-(4-хлорфенилсульфонил)(2,5-дифторфенил)метил-5-фторникотиновую кислоту (100 мг, 0,23 ммоль), полученную в примере 127, и изоксазол-3-иламин (0,018 мл, 0,25 ммоль).
1H-ЯМР (400 МГц, CDCl3)δ: 6,41 (1H, с), 6,92-7,00 (1H, м), 7,03-7,11 (1H, м), 7,25 (1H, д, J=1,7 Гц), 7,44 (2H, д, J=8,6 Гц), 7,60 (2H, д, J=8,6 Гц), 8,05 (1H, дд, J=9,1, 2,0 Гц), 8,20-8,26 (1H, м), 8,40 (1H, д, J=1,7 Гц), 9,14 (1H, д, J=1,5 Гц), 10,25 (1H, с).
Т.пл.: 200-202°C.
Элементный анализ, рассчитано для C22H13ClF3N3O4S. Рассчитано: C,52,03; H,2,58; Cl,6,98; F,11,22; N,8,27; S,6,31. Найдено: C,51,84; H,2,55; Cl,7,36; F,11,19; N,8,36; S,6,46.
Пример 130: 6-(4-Хлорфенилсульфонил)(2,5-дифторфенил)-метил-5-фтор-N-пиридин-2-илметилникотинамид
[Химическая формула 10]
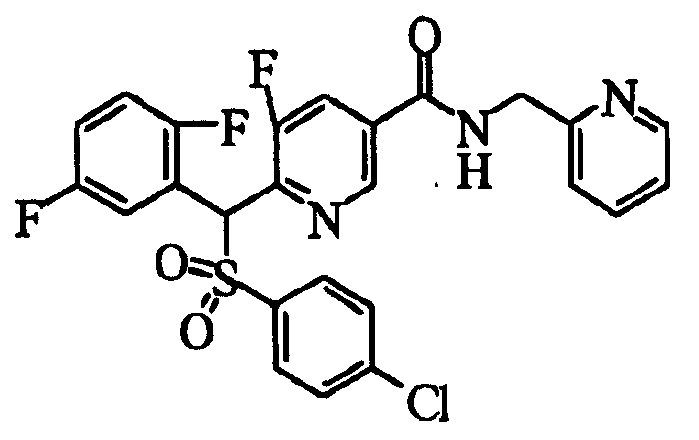
Таким же способом, как в примере 128, получали указанное в заголовке соединение (86 мг, 0,16 ммоль, 72%) в виде бесцветного аморфного вещества, используя 6-(4-хлорфенилсульфонил)(2,5-дифторфенил)метил-5-фторникотиновую кислоту (100 мг, 0,23 ммоль), полученную в примере 127, и пиридин-2-илметиламин (0,026 мл, 0,25 ммоль).
1H-ЯМР (400 МГц, CDCl3)δ: 4,77 (2H, д, J=4,4 Гц), 6,37 (1H, с), 6,91-7,09 (2H, м), 7,25-7,34 (2H, м), 7,43 (2H, д, J=8,8 Гц), 7,58 (2H, д, J=8,8 Гц), 7,72 (1H,тд, J=7,6, 1,7 Гц), 7,94 (1H, с), 7,96 (1H, дд, J=9,3, 2,0 Гц), 8,19-8,25 (1H, м), 8,59 (1H, д, J=4,4 Гц), 9,03 (1H, с).
Элементный анализ, рассчитано для C25H17ClF3N3O3S. Рассчитано: C,56,45; H,3,22; Cl,6,66; F,10,71; N,7,90; S,6,03. Найдено: C,56,32; H,3,30; Cl,6,63; F,10,61; N,7,88; S,6,14.
Пример 131: Метил (E)-3-[6-(4-хлорфенилсульфонил)(2,5-дифторфенил)метил-5-фторпиридин-3-ил]акрилат
[Химическая формула 11]
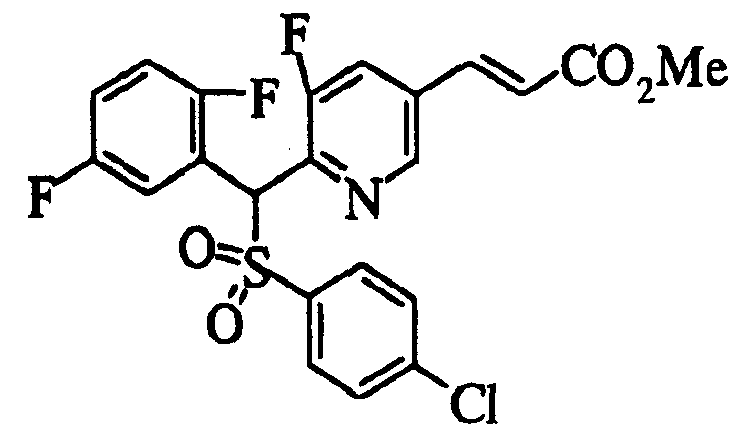
К раствору [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]-5-фторпиридин-3-ил]карбальдегида (1,70 г, 4,00 ммоль), полученного в примере 126, в тетрагидрофуране (15 мл) добавляли при комнатной температуре метил (трифенилфосфоранилиден)ацетат (1,47 г, 4,40 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 18 часов. Реакционную смесь концентрировали при пониженном давлении. Полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании дихлорметаном, концентрировали при пониженном давлении. Полученный остаток промывали смесью растворителей этанола и гексана и затем собирали фильтрованием с получением указанного в заголовке соединения (1,60 г, 3,31 ммоль, 83%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 3,84 (3H, с), 6,33 (1H, с), 6,53 (1H, д, J=16,7 Гц), 6,89-6,97 (1H, м), 6,99-7,08 (1H, м), 7,42 (2H, д, J=8,3 Гц), 7,55 (1H, д, J=9,6, 1,5 Гц), 7,58 (2H, д, J=8,3 Гц), 7,65 (1H, д, J=16,7 Гц), 8,18-8,24 (1H, м), 8,67 (1H, с).
MS m/z: 482 (M++H).
Пример 132: Метил 3-[6-(4-хлорфенилсульфонил)(2,5-дифторфенил)метил-5-фторпиридин-3-ил]пропионат
[Химическая формула 12]
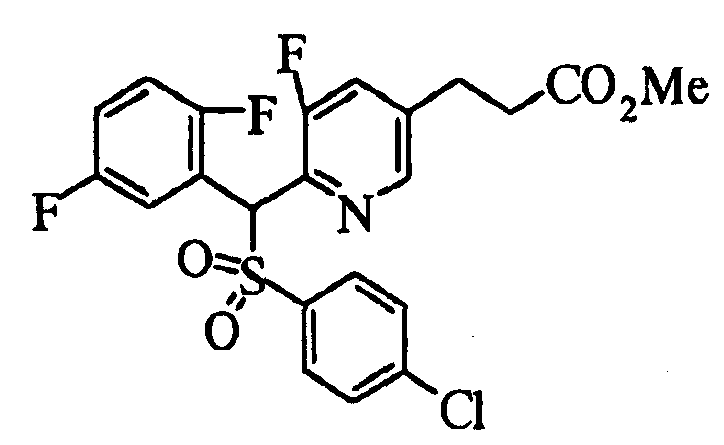
Суспензию никеля Ренея ("R-100", продукт от фирмы Nikko Rica Corporation) (1 мл) промывали последовательно водой и этанолом с получением суспензии в этаноле (10 мл). Полученную суспензию добавляли к раствору метил 3-[6-(4-хлорфенилсульфонил)(2,5-дифторфенил)метил-5-фторпиридин-3-ил]акрилата (1,38 г, 2,86 ммоль) в этаноле (40 мл). Полученную смесь перемешивали при комнатной температуре в атмосфере водорода в течение 1 часа. Реакционную смесь фильтровали через целит и фильтрат концентрировали при пониженном давлении. Полученный остаток растворяли в дихлорметане. Раствор сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении с получением указанного в заголовке соединения (1,37 г, 2,83 ммоль, 99%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 2,66 (2H, т, J=7,4 Гц), 3,00 (2H, т, J=7,4 Гц), 3,69 (3H, с), 6,29 (1H, с), 6,88-6,96 (1H, м), 6,98-7,06 (1H, м), 7,29 (1H, дд, J=10,1, 1,5 Гц), 7,40 (2H, д, J=8,3 Гц), 7,56 (2H, д, J=8,3 Гц), 8,20-8,26 (1H, м), 8,42 (1H, с).
MS m/z: 484 (M++H).
Пример 133: 3-[6-(4-Хлорфенилсульфонил)(2,5-дифторфенил)-метил-5-фторпиридин-3-ил]пропионовая кислота
[Химическая формула 13]
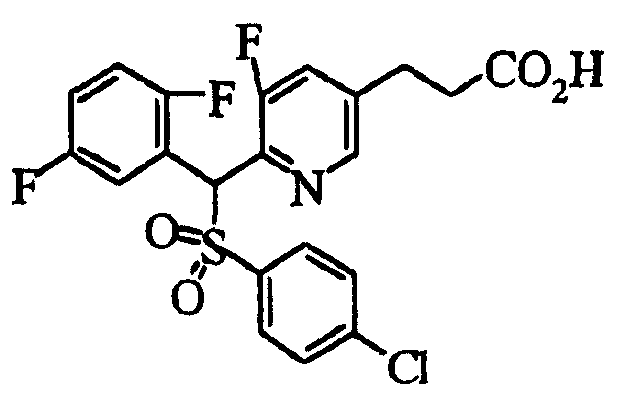
К раствору метил 3-[6-(4-хлорфенилсульфонил)(2,5-дифторфенил)метил-5-фторпиридин-3-ил]пропионата (387 мг, 0,80 ммоль) в этаноле (8 мл) добавляли 1 н. водный раствор гидроксида натрия (4 мл). Полученную смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь подкисляли 1 н. раствором хлористоводородной кислоты и затем экстрагировали дихлорметаном. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток промывали смесью растворителей диэтилового эфира и гексана и затем собирали фильтрованием с получением указанного в заголовке соединения (349 мг, 0,74 ммоль, 93%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 2,73 (2H, т, J=7,4 Гц), 3,01 (2H, т, J=7,4 Гц), 6,29 (1H, с), 6,89-6,96 (1H, м), 6,99-7,06 (1H, м), 7,30 (1H, дд, J=9,8, 1,7 Гц), 7,40 (2H, д, J=8,6 Гц), 7,56 (2H, д, J=8,6 Гц), 8,19-8,26 (1H, м), 8,44 (1H, с).
Т.пл.: 174-176°C.
MS m/z: 470 (M++H).
Элементный анализ для C21H15ClF3NO4S. Рассчитано: C,53,68; H,3,22; Cl,7,55; F,12,13; N,2,98; S,6,82. Найдено: C,53,68; H,3,35; Cl,7,42; F,12,09; N,3,16; S,6,92.
Пример 134: Гидрохлорид 3-[6-(4-Хлорфенилсульфонил)(2,5-дифторфенил)метил-5-фторпиридин-3-ил]-1-(4-метилпиперазин-1-ил)пропан-1-она
[Химическая формула 14]
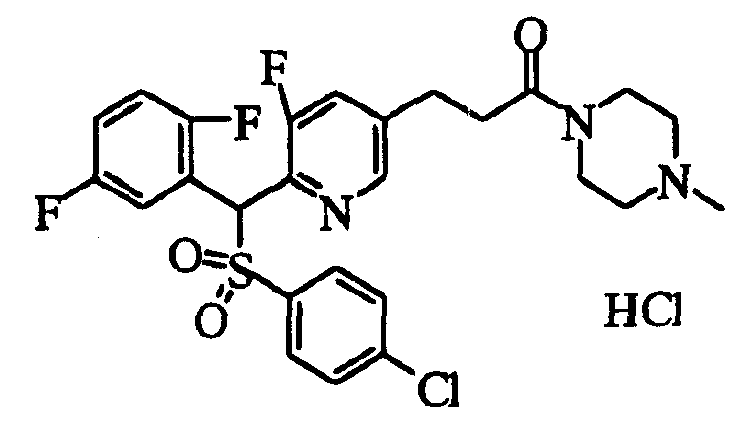
К раствору 3-[6-(4-хлорфенилсульфонил)(2,5-дифторфенил)метил-5-фторпиридин-3-ил]пропионовой кислоты (100 мг, 0,21 ммоль) в дихлорметане (3 мл) добавляли при комнатной температуре 1-метилпиперазин (0,026 мл, 0,23 ммоль), бензотриазол-1-ол (32 мг, 0,23 ммоль), 4-метилморфолин (0,026 мл, 0,23 ммоль) и гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (45 мг, 0,23 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 16 часов. Реакционную смесь промывали насыщенным водным раствором бикарбоната натрия, затем органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью дихлорметан:метанол=19:1, концентрировали при пониженном давлении. Остаток растворяли в этаноле (3 мл), а затем добавляли 1 н. раствор хлористоводородной кислоты (0,224 мл). После перемешивания при комнатной температуре в течение 30 минут реакционную смесь концентрировали при пониженном давлении. Полученный остаток промывали этанолом и собирали фильтрованием с получением указанного в заголовке соединения (111 мг, 0,19 ммоль, 89%) в виде белого твердого вещества.
1H-ЯМР (400 МГц,DMSO-d6)δ: 2,40-3,08 (6H, м), 2,75 (3H, с), 2,90 (2H, т, J=7,1 Гц), 3,19-3,50 (2H, м), 3,92-4,17 (1H, м), 4,29-4,52 (1H, м), 6,23 (1H, с), 7,24-7,39 (2H, м), 7,61 (2H, д, J=8,8 Гц), 7,66 (2H, д, J=8,8 Гц), 7,75 (1H, дд, J=10,8, 1,5 Гц), 8,10-8,16 (1H, м), 8,53 (1H, с), 10,70 (1H, с).
Т.пл.: 243-245°C.
Элементный анализ для C26H25ClF3N3O3S·HCl: Рассчитано: C,53,07; H,4,45; Cl,12,05; F,9,69; N,7,14; S,5,45. Найдено: C,52,81; H,4,51; Cl,11,74; F,9,48; N,7,09; S,5,50.
Пример 135: (E)-3-[6-[(4-Хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]акриловая кислота
[Химическая формула 15]
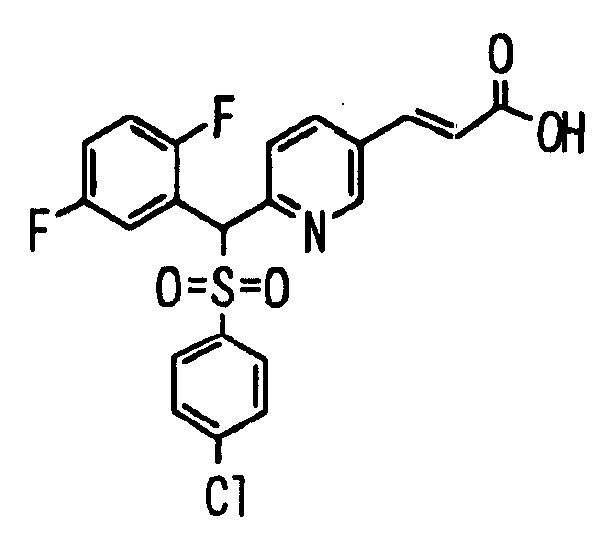
К раствору метил (E)-3-[6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]акрилата (460 мг, 0,991 ммоль), полученного в примере 44, в тетрагидрофуране (5 мл) добавляли 1 н. раствор гидроксида натрия (3,0 мл). Полученную смесь перемешивали при комнатной температуре в течение 4 часов. Реакционную смесь подкисляли 1 н. раствором хлористоводородной кислоты, а затем экстрагировали этилацетатом. Экстракт промывали водой и насыщенным солевым раствором, сушили над сульфатом магния и концентрировали. Неочищенное указанное в заголовке соединение получали в стехиометрическом количестве. Часть полученного твердого вещества перекристаллизовывали из этилацетата-гексана с получением указанного в заголовке соединения (29,4 мг, 0,0653 ммоль) в виде бесцветного твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 5,96 (1H, с), 6,52 (1H, д, J=16,1 Гц), 6,94 (1H,тд, J=9,0, 4,6 Гц), 6,99-7,06 (1H, м), 7,41 (2H, д, J=8,6 Гц), 7,56 (2H, д, J=8,6 Гц), 7,64 (1H, д, J=16,1 Гц), 7,64 (1H, д, J=8,1 Гц), 7,88 (1H, дд, J=8,1, 2,2 Гц), 8,01 (1H, ддд, J=9,0, 5,6, 3,4 Гц), 8,72 (1H, д, J=2,2 Гц).
Т.пл.: 236-238°C.
Элементный анализ для C21H14ClF2NO4S. Рассчитано: C,56,07; H,3,14; Cl,7,88; F,8,45; N,3,11; S,7,13. Найдено: C,55,98; H,3,21; Cl,7,90; F,8,45; N,3,21; S,7,12.
Пример 136: (E)-3-[6-[(4-Хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]акриламид
[Химическая формула 16]
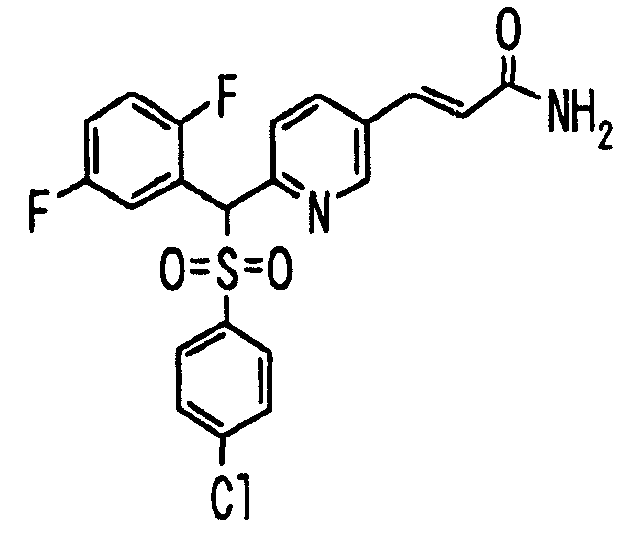
(E)-3-[6-[(4-Хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]акриловую кислоту (370 мг, 0,822 ммоль) растворяли в дихлорметане (6 мл). К полученному раствору добавляли тионилхлорид (2,00 мл) и N,N-диметилформамид (одну каплю). Полученную смесь перемешивали при комнатной температуре в течение 4 часов. Реакционную смесь концентрировали досуха. Полученный остаток растворяли в дихлорметане (6 мл), а затем добавляли концентрированный водный раствор аммиака (2,00 мл). После перемешивания при комнатной температуре в течение 2 часов реакционную смесь разбавляли дихлорметаном. Разбавленную смесь промывали водой, 0,1 н. раствором хлористоводородной кислоты и насыщенным солевым раствором, сушили над сульфатом магния и концентрировали. Полученное твердое вещество перекристаллизовывали из этанола с получением указанного в заголовке соединения (250 мг, 0,558 ммоль, 68%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3/DMSO-d6)δ: 5,79 (1H, шир. с), 5,95 (1H, с), 6,42 (1H, шир. с), 6,63 (1H, д, J=15,9 Гц), 6,94 (1H,t д, J=9,0, 4,4 Гц), 7,00-7,07 (1H, м), 7,41 (2H, д, J=8,5 Гц), 7,56 (2H, д, J=8,5 Гц), 7,62 (1H, д, J=15,9 Гц), 7,64 (1H, д, J=8,1 Гц), 7,85 (1H, дд, J=8,1, 2,2 Гц), 8,02 (1H, ддд, J=9,0, 5,4, 3,2 Гц), 8,74 (1H, д, J=2,2 Гц).
Т.пл.: 219-220°C.
Элементный анализ для C21H15ClF2N2O3S. Рассчитано: C,56,19; H,3,37; Cl,7,90; F,8,46; N,6,24; S,7,14. Найдено: C,55,98; H,3,34; Cl,8,03; F,8,45; N,6,39; S,7,23.
Пример 137: Этил N-[6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]никотиноил]глицин
[Химическая формула 17]
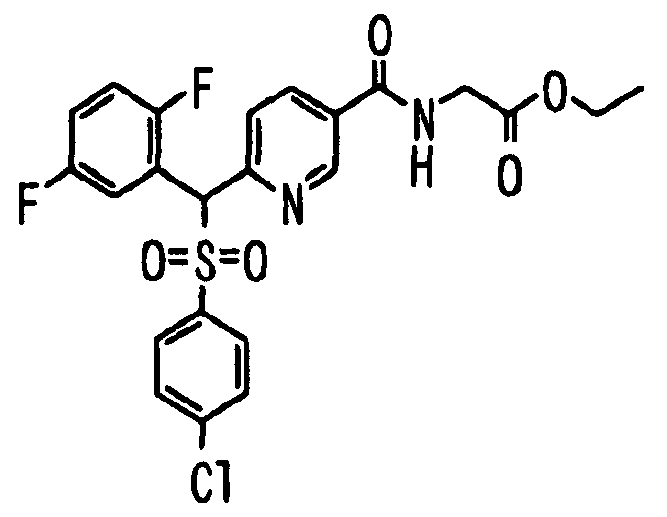
К раствору [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]карбоновой кислоты (100 мг, 0,236 ммоль), полученной в примере 50, в дихлорметане (5 мл) добавляли триэтиламин (80 мкл, 0,566 ммоль), 4-диметиламинопиридин (14 мг, 0,118 ммоль), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (54 мг, 0,283 ммоль) и этилглицингидрохлорид (40 мг, 0,283 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 7 часов. Реакционную смесь разбавляли дихлорметаном. Разбавленную смесь промывали последовательно водой, насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором. Полученный органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=2:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (95 мг, 0,187 ммоль, 79%) в виде бесцветного аморфного вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 1,33 (3H, т, J=7,1 Гц), 4,25 (2H, д, J=5,1 Гц), 4,28 (2H, кв, J=7,1 Гц), 6,00 (1H, с), 6,99 (1H, шир. с), 6,91-6,97 (1H, м), 7,00-7,06 (1H, м), 7,42 (2H, д, J=8,5 Гц), 7,56 (2H, д, J=8,5 Гц), 7,73 (1H, д, J=8,3 Гц), 7,96-8,00 (1H, м), 8,18 (1H, дд, J=8,3, 2,2 Гц), 9,01 (1H, д, J=2,2 Гц).
MS m/z: 509 (M++H).
Пример 138: трет-Бутил [2-[[6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-карбонил]амино]этил]карбамат
[Химическая формула 18]
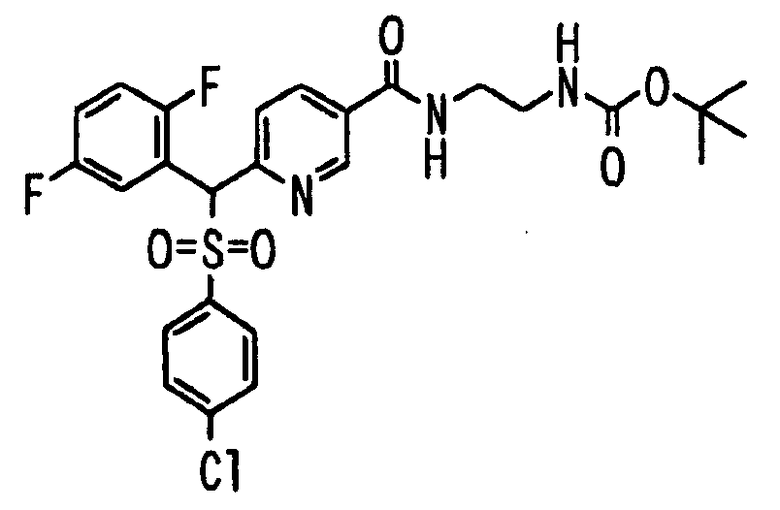
К раствору [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]карбоновой кислоты (100 мг, 0,236 ммоль), полученной в примере 50, в дихлорметане (5 мл) добавляли триэтиламин (40 мкл, 0,283 ммоль), 4-диметиламинопиридин (14 мг, 0,118 ммоль), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (54 мг, 0,283 ммоль) и трет-бутил N-(2-аминоэтил)карбамат (45 мкл, 0,283 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 6 часов. Реакционную смесь разбавляли дихлорметаном. Разбавленную смесь промывали последовательно водой, насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором. Полученный органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=1:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (57 мг, 0,101 ммоль, 43%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 1,44 (9H, с), 3,37-3,43 (2H, м), 3,55-3,59 (2H, м), 4,97 (1H, шир. с), 6,00 (1H, с), 6,92-7,05 (2H, м), 7,40 (2H, д, J=8,6 Гц), 7,55 (2H, д, J=8,6 Гц), 7,60 (1H, шир. с), 7,70 (1H, д, J=8,3 Гц), 7,92-7,97 (1H, м), 8,17 (1H, дд, J=8,3, 2,4 Гц), 9,03 (1H, д, J=2,4 Гц).
MS m/z: 566 (M++H).
Пример 139: N-(2-Аминоэтил)-6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]никотинамид
[Химическая формула 19]
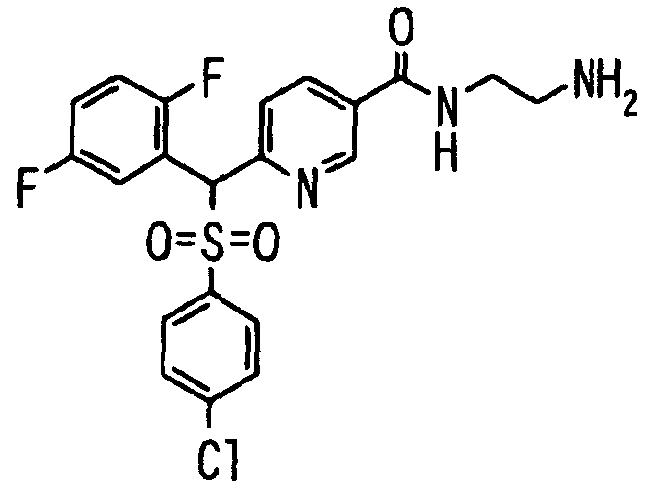
К раствору трет-бутил [2-[[6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-карбонил]амино]этил]карбамата (50 мг, 0,0880 ммоль) в этаноле (2 мл) добавляли концентрированную хлористоводородную кислоту (2 мл). Полученную смесь перемешивали при комнатной температуре в течение 20 минут. Реакционную смесь концентрировали при пониженном давлении. Полученное твердое вещество промывали диэтиловым эфиром с получением указанного в заголовке соединения (44 мг, 0,0880 ммоль, колич.) в виде 1,5 гидрохлорида (белый порошок).
1H-ЯМР (400 МГц, CD3OD)δ: 3,19 (2H, т, J=5,9 Гц), 3,69 (2H, д, J=5,9 Гц), 6,27 (1H, с), 7,03-7,09 (1H, м), 7,12-7,18 (1H, м), 7,54 (2H, д, J=8,6 Гц), 7,66 (2H, д, J=8,6 Гц), 7,83 (1H, д, J=8,3 Гц), 8,06-8,10 (1H, м), 8,27 (1H, дд, J=8,3, 2,4 Гц), 9,08 (1H, д, J=2,4 Гц).
Т.пл.: >250°C (разл.).
Элементный анализ для C21H18ClF2N3O3S·1,5H2O·1,5HCl. Рассчитано: C,46,06; H,4,14; Cl,16,18; F,6,94; N,7,67; S,5,86. Найдено: C,46,39; H,3,93; Cl,16,58; F,6,84; N,7,74; S,5,94.
Пример 140: 6-[(4-Хлорфенилсульфонил)(2,5-дифторфенил)-метил]-N-(2-гидроксиэтил)никотинамид
[Химическая формула 20]
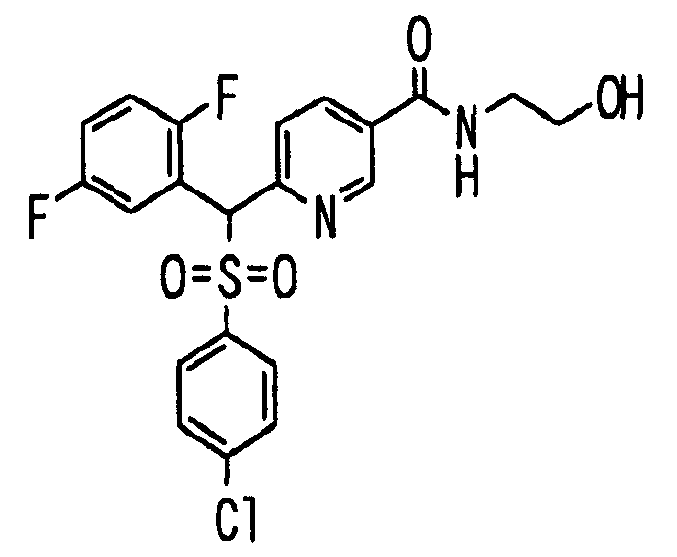
К раствору [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]карбоновой кислоты (100 мг, 0,236 ммоль), полученной в примере 50, в дихлорметане (5 мл) добавляли триэтиламин (80 мкл, 0,566 ммоль), 4-диметиламинопиридин (15 мг, 0,118 ммоль), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (54 мг, 0,283 ммоль) и этаноламиногидрохлорид (28 мг, 0,283 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 17,5 часов. Реакционную смесь разбавляли дихлорметаном. Разбавленную смесь промывали последовательно водой, насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором. Полученный органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью дихлорметан:метанол=30:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (69 мг, 0,148 ммоль, 63%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 2,38 (1H, т, J=4,9 Гц), 3,65 (2H, тд, J=5,4, 4,9 Гц), 3,85 (2H, кв, J=4,6 Гц), 5,99 (1H, с), 6,77 (1H, шир. с), 6,90-6,96 (1H, м), 7,00-7,06 (1H, м), 7,42 (2H, д, J=8,6 Гц), 7,56 (2H, д, J=8,6 Гц), 7,70 (1H, д, J=8,1 Гц), 7,97-8,01 (1H, м), 8,15 (1H, дд, J=8,1, 2,2 Гц), 8,99 (1H, д, J=2,2 Гц)H, м).
Т.пл.: 179-181°C.
Элементный анализ для C21H17ClF2N2O4S. Рассчитано: C,54,02; H,3,67; Cl,7,59; F,8,14; N,6,00; S,6,87. Найдено: C,53,83; H,3,63; Cl,7,72; F,8,14; N,6,06; S,7,02.
Пример 141: трет-Бутил [2-[[6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-карботиоил]амино]этил]карбамат
[Химическая формула 21]
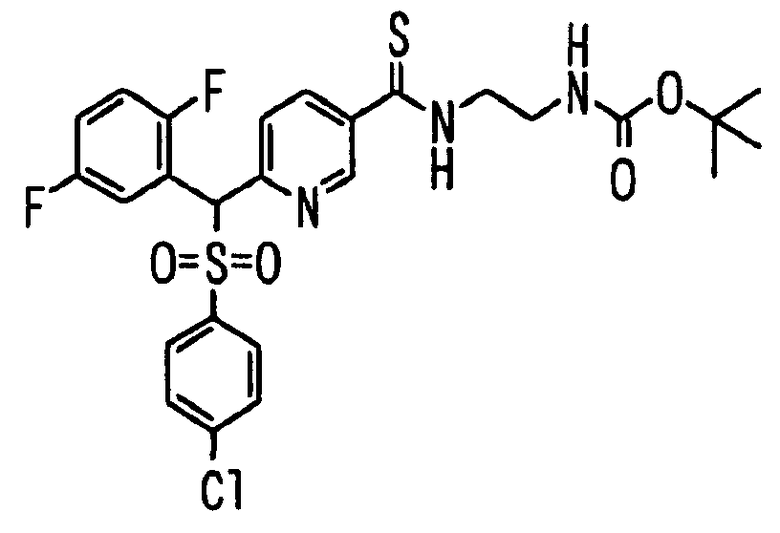
К раствору трет-бутил [2-[[6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-карбонил]амино]этил]карбамата (120 мг, 0,212 ммоль), полученного в примере 138, в толуоле (8 мл) добавляли в атмосфере аргона реагент Lawson (94 мг, 0,233 ммоль). Полученную смесь перемешивали в течение 1,5 часов при кипячении с обратным холодильником. После охлаждения растворитель концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=1:1, концентрировали с получением указанного в заголовке соединения (84 мг, 0,144 ммоль, 68%) в виде желтого аморфного вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 1,46 (9H, с), 3,52-3,57 (2H, м), 3,82-3,86 (2H, м), 5,09 (1H, шир. с), 5,99 (1H, с), 6,92-6,98 (1H, м), 6,99-7,05 (1H, м), 7,41 (2H, д, J=8,6 Гц), 7,55 (2H, д, J=8,6 Гц), 7,63 (1H, д, J=8,3 Гц), 7,89-7,94 (1H, м), 8,21 (1H, дд, J=8,3, 2,2 Гц), 9,06 (1H, д, J=2,2 Гц), 9,61 (1H, шир. с).
MS m/z: 582 (M++H).
Пример 142: N-(2-Аминоэтил)-6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]тионикотинамид
[Химическая формула 22]
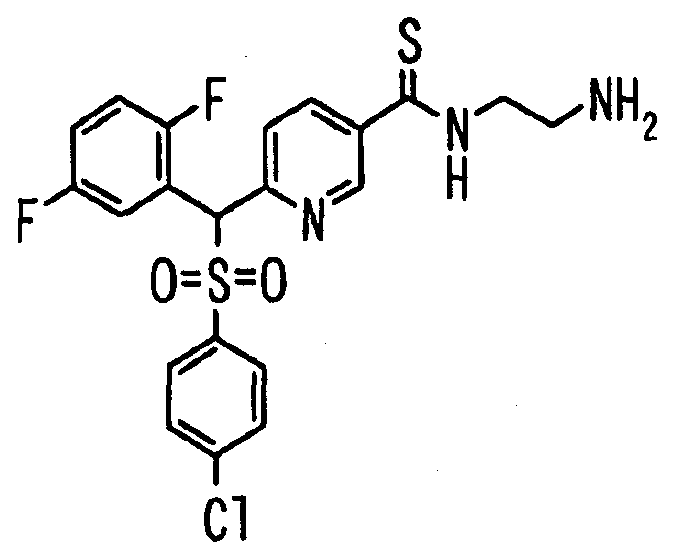
К раствору трет-бутил [2-[[6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-карботиоил]амино]этил]карбамата (80 мг, 0,137 ммоль) в этаноле (3 мл) добавляли концентрированную хлористоводородную кислоту (2 мл). Полученную смесь перемешивали при комнатной температуре в течение 20 минут. Реакционную смесь концентрировали при пониженном давлении. К полученному остатку добавляли этанол, а затем концентрировали. Эту процедуру повторяли три раза с получением указанного в заголовке соединения (76 мг, 0,137 ммоль, колич.) в виде 1,75 гидрохлорида (желтый порошок).
1H-ЯМР (400 МГц, DMSO-d6)δ: 3,07-3,12 (2H, м), 3,93-3,97 (2H, м), 6,46 (1H, с), 7,20-7,26 (1H, м), 7,28-7,34 (1H, м), 7,66 (2H, д, J=9,0 Гц), 7,69 (2H, д, J=9,0 Гц), 7,88 (1H, д, J=8,3 Гц), 8,05-8,12 (1H, м), 8,14 (2H, шир. с), 8,24 (1H, дд 8,3, 2,4), 9,05 (1H, д, J=2,4 Гц), 10,74 (1H, шир. с).
Т.пл.: 164-166°C.
Элементный анализ для C21H18ClF2N3O2S2·0,5H2O·1,75HCl: Рассчитано: C,45,46; H,3,77; Cl,17,57; F,6,85; N,7,57; S,11,56. Найдено: C,45,02; H,3,83; Cl,17,37; F,6,36; N,7,54; S,11,36.
Пример 143: 2-[(4-Хлорфенилтио) (2,5-дифторфенил)метил]-6-(1,3-диоксолан-2-ил)пиридин
[Химическая формула 23]
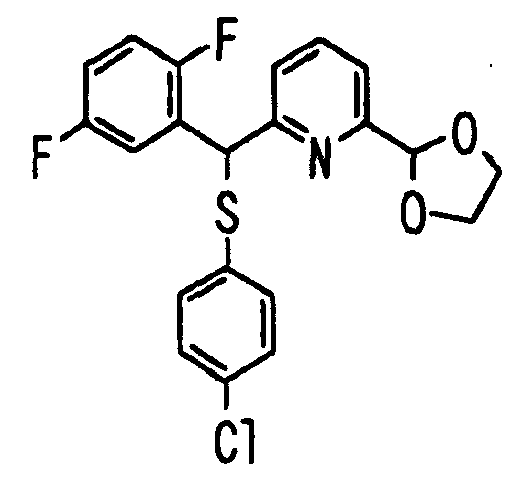
Триэтиламин (1,77 мл, 12,7 ммоль) и метансульфонилхлорид (851 мкл, 11,0 ммоль) добавляли в атмосфере аргона при охлаждении льдом к раствору 2-[(2,5-дифторфенил)гидроксиметил]-6-(1,3-диоксолан-2-ил)пиридина (2,48 г, 8,46 ммоль), полученного в ссылочном примере 32, в дихлорметане (30 мл). Полученную смесь перемешивали при комнатной температуре в течение 3,5 часов. К реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия, а затем экстрагировали диэтиловым эфиром. Экстракт промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении.
К раствору полученного остатка (2,14 г, 5,76 ммоль) в диметилформамиде (20 мл) добавляли 4-хлорбензолтиол (1,0 г, 6,91 ммоль) и карбонат калия (1,19 г, 8,64 ммоль). Полученную смесь перемешивали при 50°C в течение 2 часов. После охлаждения до комнатной температуры реакционную смесь разбавляли диэтиловым эфиром. Разбавленный раствор промывали последовательно водой и насыщенным солевым раствором. Полученный органический слой сушили над сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=5:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (2,12 г, 5,05 ммоль, 88%) в виде бледно-желтого масла.
1H-ЯМР (400 МГц, CDCl3)δ: 4,06-4,20 (4H, м), 5,84 (1H, с), 5,89 (1H, с), 6,86-6,96 (2H, м), 7,17 (2H, д, J=8,8 Гц), 7,23 (2H, д, J=8,8 Гц), 7,38 (1H, д, J=7,8 Гц), 7,43 (1H, д, J=7,8 Гц), 7,44-7,48 (1H, м), 7,69 (1H, т, J=7,8 Гц).
MS m/z: 420 (M++H).
Пример 144: 2-[(4-Хлорфенилсульфонил)(2,5-дифторфенил)метил]-6-(1,3-диоксолан-2-ил)пиридин
[Химическая формула 24]
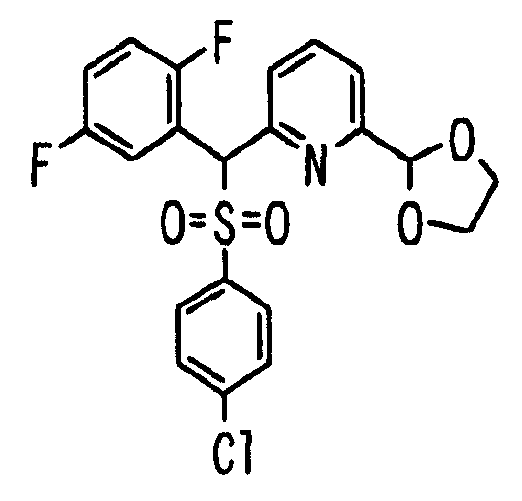
К раствору 2-[(4-хлорфенилтио) (2,5-дифторфенил)метил]-6-(1,3-диоксолан-2-ил)пиридина (2,40 г, 5,72 ммоль) в метаноле (40 мл) добавляли тетрагидрат гексааммонийгептамолибдата (200 мг) и 30% водный раствор перекиси водорода (20 мл). Полученную смесь перемешивали в течение 5 дней. К реакционной смеси добавляли воду и осажденное таким образом твердое вещество собирали фильтрованием. Остаток промывали водой. Остаток растворяли в этилацетате. Полученный раствор промывали последовательно водой и насыщенным солевым раствором. Органический слой концентрировали при пониженном давлении. Остаток промывали этилацетатом с получением указанного в заголовке соединения (2,09 г, 4,63 ммоль, 81%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 4,05-4,17 (4H, м), 5,73 (1H, с), 5,98 (1H, с), 6,93-7,05 (2H, м), 7,41 (2H, д, J=8,8 Гц), 7,52 (2H, д, J=8,8 Гц), 7,50-7,53 (1H, м), 7,64 (1H, дд, J=7,6, 1,0 Гц), 7,80 (1H, т, J=7,6 Гц), 7,91-7,95 (1H, м).
MS m/z: 452 (M++H).
Пример 145: [6-[(4-Хлорфенилсульфонил)(2,5-дифторфенил)-метил]пиридин-2-ил]карбальдегид
[Химическая формула 25]
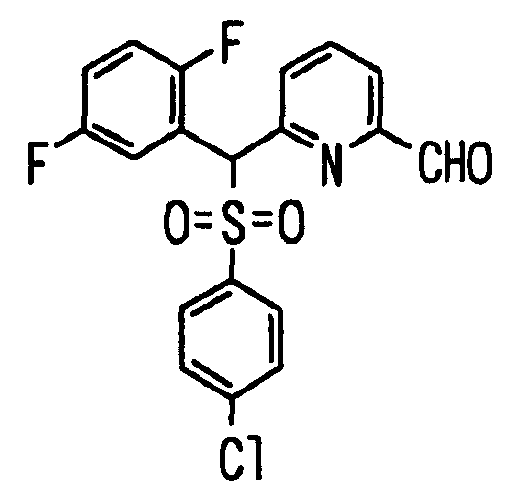
К раствору 2-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]-6-(1,3-диоксолан-2-ил)пиридина (2,05 г, 4,54 ммоль) в 1,4-диоксане (40 мл) добавляли концентрированную хлористоводородную кислоту (10 мл). Полученную смесь перемешивали при комнатной температуре в течение 20 часов. Растворитель концентрировали при пониженном давлении. К остатку добавляли этилацетат. Полученную смесь промывали последовательно водой, насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором. Полученный органический слой сушили над сульфатом магния и концентрировали при пониженном давлении с получением указанного в заголовке соединения (1,85 г, 4,54 ммоль, колич.) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 6,05 (1H, с), 6,92-6,98 (1H, м), 7,02-7,08 (1H, м), 7,43 (2H, д, J=8,8 Гц), 7,58 (2H, д, J=8,8 Гц), 7,90 (1H, дд, J=7,1, 2,0 Гц), 7,93-7,99 (2H, м), 8,04-8,09 (1H, м), 10,00 (1H, с).
MS m/z: 408 (M++H).
Пример 146: 6-[(4-Хлорфенилсульфонил)(2,5-дифторфенил)-метил]пиколиновая кислота
[Химическая формула 26]
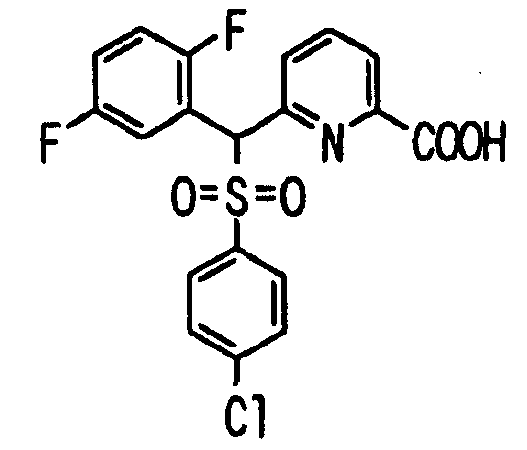
К раствору [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]карбальдегида (390 мг, 0,956 ммоль) в муравьиной кислоте (5 мл) добавляли 30% водный раствор перекиси водорода (325 мкл, 2,87 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 4 часов. К реакционной смеси добавляли воду, а затем смесь фильтровали. Остаток промывали водой. Полученный остаток растворяли в этилацетате. Полученный раствор промывали последовательно насыщенным водным раствором хлорида аммония, водой и насыщенным солевым раствором. Полученный органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток перекристаллизовывали из этанола с получением указанного в заголовке соединения (310 мг, 0,731 ммоль, 77%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 6,01 (1H, с), 6,93-6,99 (1H, м), 7,04-7,10 (1H, м), 7,44 (2H, д, J=8,6 Гц), 7,61 (2H, д, J=8,6 Гц), 7,78-7,82 (1H, м), 7,99 (1H, д, J=7,8 Гц), 8,06 (1H, т, J=7,8 Гц), 8,26 (1H, д, J=7,8 Гц).
Т.пл.: 200-201°C.
Элементный анализ для C19H12ClF2NO4S: Рассчитано: C,53,84; H,2,85; Cl,8,37; F,8,97; N,3,30; S,7,57. Найдено: C,53,55; H,2,80; Cl,8,23; F,9,00; N,3,55; S,7,68.
Пример 147: [6-[(4-Хлорфенилсульфонил)(2,5-дифторфенил)-метил]пиридин-2-ил] (4-метилпиперазин-1-ил)метанон
[Химическая формула 27]
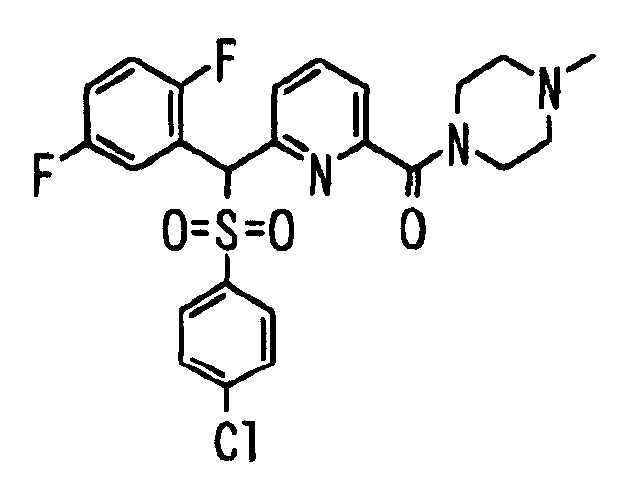
К раствору 6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)-метил]пиколиновой кислоты (130 мг, 0,307 ммоль) в дихлорметане (5 мл) добавляли N-метилморфолин (41 мкл, 0,368 ммоль), 1-гидроксибензотриазол (13 мг, 0,368 ммоль), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (71 мг, 0,368 ммоль) и 1-метилпиперазин (40 мкл, 0,368 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 15 часов. Реакционную смесь разбавляли дихлорметаном. Разбавленную смесь промывали последовательно водой, насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором. Полученный органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью дихлорметан:метанол=30:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (40 мг, 0,0791 ммоль, 26%) в виде белого аморфного вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 2,36 (3H, с), 2,44-2,65 (4H, м), 3,48-4,00 (4H, м), 5,91 (1H, с), 6,87-6,94 (1H, м), 6,98-7,05 (1H, м), 7,41 (2H, д, J=7,8 Гц), 7,55-7,60 (3H, м), 7,74 (1H, д, J=7,3 Гц), 7,85 (1H, т, J=7,6 Гц), 8,06-8,13 (1H, м).
FAB-MS: 506,1085 (Рассчитано для C24H23ClF2N3O3S: 506,1117).
Пример 148: трет-Бутил [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]карбамат
[Химическая формула 28]
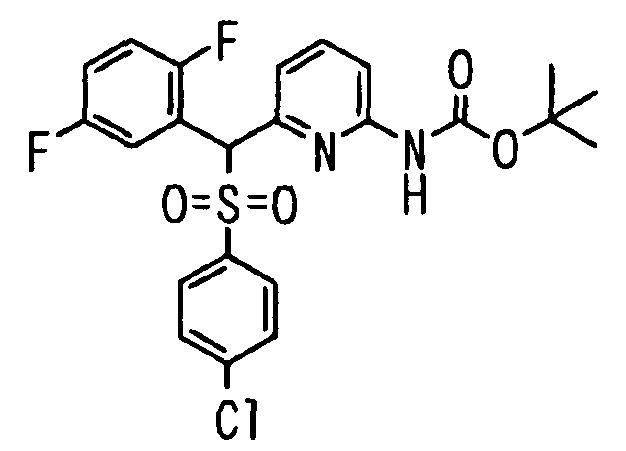
Дифенилфосфорилазид (428 мкл, 2,00 ммоль) и триэтиламин (394 мкл, 2,83 ммоль) добавляли в атмосфере аргона к раствору 6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиколиновой кислоты (600 мг, 1,42 ммоль), полученной в примере 146, в смеси бутанола (2 мл) и толуола (10 мл). Полученную смесь перемешивали в течение 23 часов при нагревании и кипячении с обратным холодильником. Реакционную смесь промывали насыщенным солевым раствором. Полученный органический слой сушили над сульфатом магния и затем концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=4:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (380 мг, 0,768 ммоль, 54%) в виде бледно-желтого аморфного вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 1,54 (9H, с), 5,76 (1H, с), 6,90-6,95 (1H, м), 6,99-7,05 (1H, м), 7,14 (1H, д, J=7,3 Гц), 7,19 (1H, шир. с), 7,40 (2H, д, J=8,8 Гц), 7,55 (2H, д, J=8,8 Гц), 7,65 (1H, дд, J=8,3, 7,3 Гц), 7,95 (1H, д, J=8,3 Гц), 8,01-8,05 (1H, м).
MS m/z: 495 (M++H).
Пример 149: 6-[(4-Хлорфенилсульфонил)(2,5-дифторфенил)-метил]пиридин-2-иламин
[Химическая формула 29]
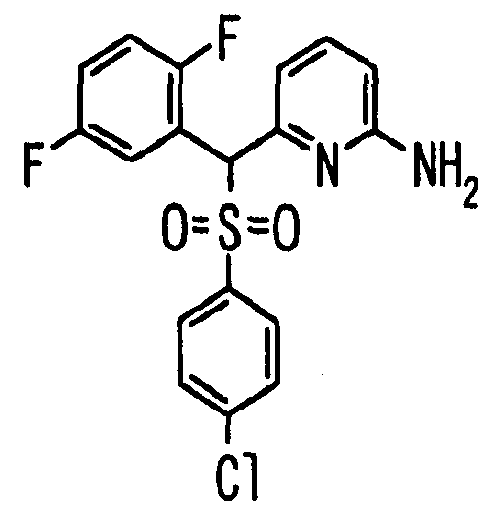
К раствору трет-бутил [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]карбамата (370 мг, 0,748 ммоль) в этаноле (5 мл) добавляли концентрированную хлористоводородную кислоту (5 мл). Полученную смесь перемешивали при комнатной температуре в течение 6 часов. Реакционную смесь концентрировали при пониженном давлении. К полученному остатку добавляли этилацетат. Полученную смесь промывали последовательно насыщенным раствором бикарбоната натрия и насыщенным солевым раствором. Полученный органический слой сушили над сульфатом магния и концентрировали при пониженном давлении с получением указанного в заголовке соединения (210 мг, 0,537 ммоль, 71%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 4,46 (2H, шир. с), 5,72 (1H, с), 6,45 (1H, д, J=8,1 Гц), 6,88 (1H, д, J=7,3 Гц), 6,91-7,03 (2H, м), 7,39 (2H, д, J=8,6 Гц), 7,39-7,43 (1H, м), 7,56 (2H, д, J=8,6 Гц), 7,98-8,03 (1H, м).
Т.пл.: 183-184°C.
Элементный анализ для C18H13ClF2N2O2S. Рассчитано: C,54,76; H,3,32; Cl,8,98; F,9,62; N,7,10; S,8,12. Найдено: C,54,46; H,3,22; Cl,8,82; F,9,55; N,7,07; S,8,11.
Пример 150: N-[6-[(4-Хлорфенилсульфонил)(2,5-дифторфенил)-метил]пиридин-2-ил]-2-(пиридин-2-ил)ацетамид
[Химическая формула 30]
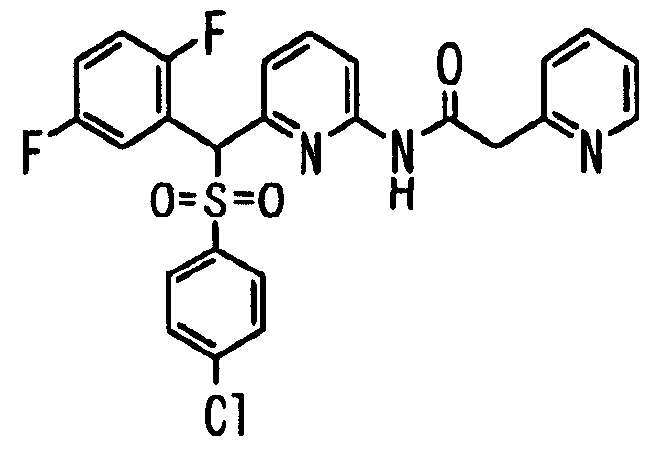
К раствору 6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-иламина (74 мг, 0,187 ммоль) в дихлорметане (5 мл) добавляли N-метилморфолин (90 мкл, 0,818 ммоль), 1-гидроксибензотриазол (11 мг, 0,313 ммоль), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (60 мг, 0,312 ммоль) и гидрохлорид 2-пиридилуксусной кислоты (54 мг, 0,312 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 24 часов. Реакционную смесь разбавляли дихлорметаном. Разбавленный раствор промывали последовательно водой, насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором. Полученный органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=4:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (48 мг, 0,0934 ммоль, 50%) в виде белого аморфного вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 3,86 (1H, д, J=15,9 Гц), 3,95 (1H, д, J=15,9 Гц), 5,82 (1H, с), 6,92-6,96 (1H, м), 6,98-7,08 (1H, м), 7,21 (1H, д, J=7,6 Гц), 7,25-7,33 (3H, м), 7,39 (2H, д, J=8,5 Гц), 7,54 (2H, д, J=8,5 Гц), 7,66-7,73 (2H, м), 8,07-8,11 (1H, м), 8,20 (1H, д, J=8,6 Гц), 8,69 (1H, д, J=4,4 Гц).
FAB-MS: 514,0800 (Рассчитано для C25H19ClF2N3O3S: 514,0804).
Пример 151: (E)-2-[(4-Хлорфенилсульфонил)(2,5-дифторфенил)метил]-6-(2-пиридин-2-илвинил)пиридин
[Химическая формула 31]
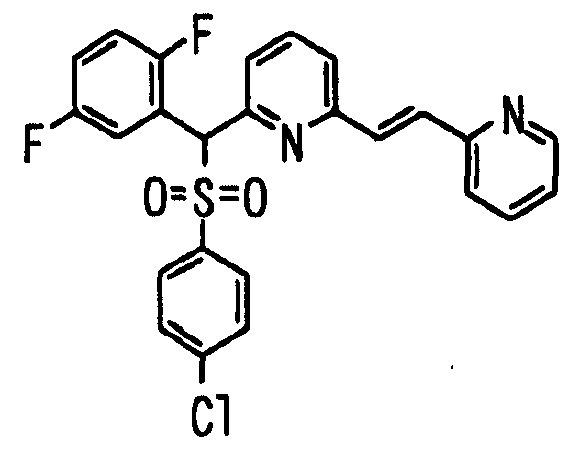
К раствору 6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]карбальдегида (100 мг, 0,245 ммоль), полученного в примере 145, в 1,4-диоксане (5 мл) добавляли гидрохлорид трифенил (2-пиридилметил)фосфонийхлорида (336 мг, 0,773 ммоль) и триэтиламин (215 мкл, 1,55 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 5 часов. Реакционную смесь концентрировали, а затем к полученному концентрату добавляли этилацетат. Полученную смесь промывали последовательно водой и насыщенным солевым раствором. Органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=4:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (202 мг, 0,418 ммоль, 81%) в виде бесцветного аморфного вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 5,99 (1H, с), 6,98-7,08 (2H, м), 7,21-7,25 (1H, м), 7,37-7,48 (6H, м), 7,54 (2H, д, J=8,1 Гц), 7,64 (1H, д, J=15,4 Гц), 7,69-7,75 (2H, м), 8,04-8,09 (1H, м), 8,65 (1H, д, J=4,4 Гц).
FAB-MS: 483,0739 (Рассчитано для C25H18ClF2N2O2S: 483,0746).
Пример 152: 2-[(4-Хлорфенилсульфонил)(2,5-дифторфенил)метил]-6-(2-пиридин-2-илэтил)пиридин
[Химическая формула 32]
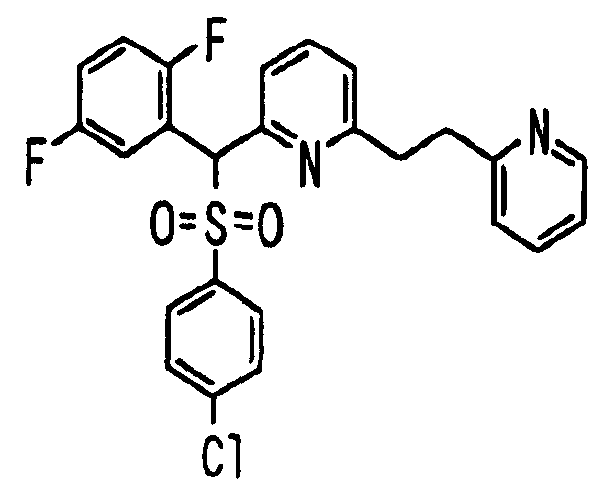
К раствору (E)-2-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]-6-(2-пиридин-2-илвинил)пиридина (180 мг, 0,373 ммоль) в смеси этанола (5 мл) и 1,4-диоксана (2 мл) добавляли суспензию (1 мл) никеля Ренея в этаноле. В атмосфере водорода при давлении 1 атмосфера, полученную смесь интенсивно перемешивали в течение 1,5 часов. После фильтрования реакционной смеси фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=3:2, концентрировали при пониженном давлении, а затем перекристаллизовывали из гексана:этилацетата с получением указанного в заголовке соединения (110 мг, 0,227 ммоль, 61%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 3,13-3,23 (4H, м), 5,92 (1H, с), 6,93-7,06 (2H, м), 7,07-7,12 (3H, м), 7,37-7,40 (3H, м), 7,52-7,60 (4H, м), 8,05-8,09 (1H, м), 8,52 (1H, д, J=3,7 Гц).
Т.пл.: 88-89°C.
Элементный анализ для C25H19ClF2N2O2S: Рассчитано: C,61,92; H,3,95; Cl,7,31; F,7,84; N,5,78; S,6,61. Найдено: C,61,84; H,4,08; Cl,7,26; F,7,69; N,5,90; S,6,75.
Пример 153: 3-[(4-Хлорфенилсульфонил)(2,5-дифторфенил)-метил]-1-(3-гидроксипропил)пиперидин-2-он
[Химическая формула 33]
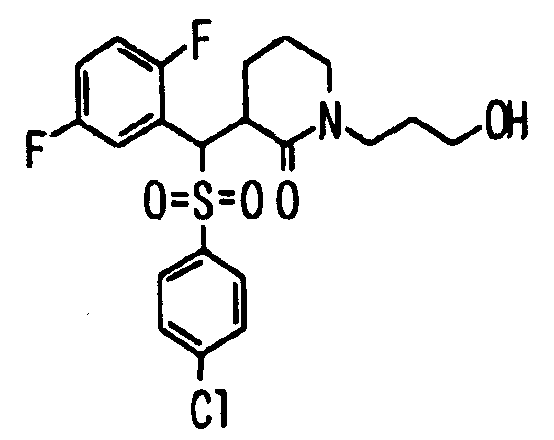
н-Бутиллитий (1,56M раствор в гексане, 0,140 мл, 0,218 ммоль) добавляли в атмосфере аргона при -78°C к раствору 2-[(4-хлорфенил)сульфонилметил]-1,4-дифторбензола (63,0 мг, 0,208 ммоль), полученного в ссылочном примере 1, в 1,2-диметоксиэтане (2 мл). Полученную смесь перемешивали при -78°C в течение 5 минут. После добавления 3-бром-1-[3-(трет-бутилдиметилсилилокси)пропил]пиперидин-2-она (72,8 мг, 0,208 ммоль), полученного в ссылочном примере 34, полученную смесь перемешивали при комнатной температуре в течение 15 часов. Реакционную смесь охлаждали до 0°C. После добавления воды полученную смесь экстрагировали этилацетатом. Экстракт промывали водой и насыщенным солевым раствором, сушили над сульфатом магния и концентрировали. Полученный остаток очищали колоночной флэш-хроматографией на силикагеле (гексан:этилацетат=4:1) с получением низкополярного силил-защищенного соединения (30,0 мг) и высокополярного силил-защищенного соединения (30,0 мг), оба соединения были получены в виде бесцветного масла. Полученное высокополярное силил-защищенное соединение (30,0 мг) растворяли в тетрагидрофуране (3 мл), а затем добавляли фтористый водород-пиридин (0,5 мл). Полученную смесь перемешивали при комнатной температуре в течение 3 часов. После разбавления этилацетатом разбавленную смесь промывали водой, насыщенным солевым раствором, сушили над сульфатом магния и концентрировали. Полученный остаток подвергали колоночной хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=2:3, концентрировали с получением белого твердого вещества. Полученное твердое вещество перекристаллизовывали из смеси этилацетат-гексан с получением указанного в заголовке соединения (11,8 мг, 0,0258 ммоль, 12%) в виде игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3)δ: 1,50-1,60 (2H, м), 1,88-2,08 (3H, м), 2,70-2,77 (1H, м), 2,86-2,93 (1H, м), 3,20-3,36 (5H, м), 3,62 (1H, ддд, J=13,7, 9,0, 4,6 Гц), 3,70-3,78 (1H, м), 5,71-5,73 (1H, м), 6,86 (1H, тд, J=9,0, 4,6 Гц), 6,96-7,02 (1H, м), 7,37 (2H, д, J=8,8 Гц), 7,55-7,62 (3H, м).
Т.пл.: 120-121°C.
FAB-MS: 458,0966 (Рассчитано для C21H23ClF2NO4S: 458,1004).
Пример 154: трет-Бутил 3-[[5-хлор-4-[(4-хлорфенилтио)-(2,5-дифторфенил)метил]пиридин-2-ил]амино]пропионат
[Химическая формула 34]
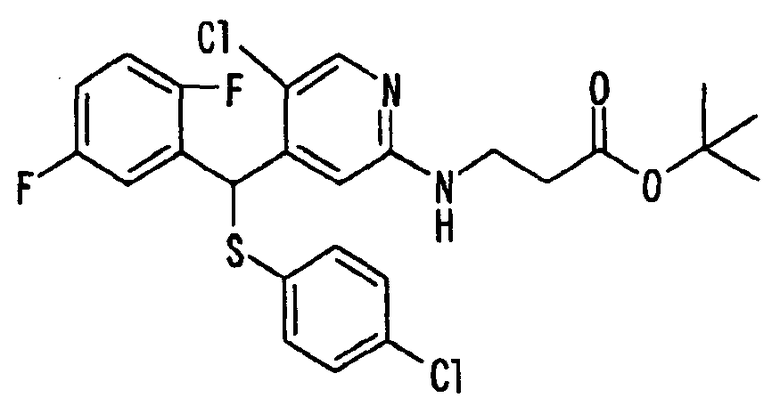
В небольшом количестве насыщенного водного раствора карбоната калия растворяли гидрохлорид трет-бутилового эфира β-аланина (1,5 г), а затем экстрагировали метиленхлоридом. Экстракт сушили и концентрировали с получением 720 мг трет-бутилового эфира β-аланина в свободной форме. Полученный сложный эфир и раствор 2,5-дихлор-4-[(4-хлорфенилтио)-(2,5-дифторфенил)метил]пиридина (300 мг, 0,72 ммоль), полученного в примере 54 в 1,4-диоксане (2,0 мл), перемешивали при 120°C в течение 4 дней в атмосфере аргона. После охлаждения до комнатной температуры реакционную смесь разбавляли этилацетатом. Разбавленную смесь промывали водой и насыщенным солевым раствором, сушили и затем концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат=5:1) с получением указанного в заголовке соединения (79 мг, 16%) в виде масла.
1H-ЯМР (400 МГц, CDCl3)δ: 1,46 (9H, с), 2,52 (2H, т, J=6,0 Гц), 3,58 (2H, кв, J=6,0 Гц), 4,95 (1H, шир.), 5,96 (1H, с), 6,68 (1H, с), 6,9-7,05 (2H, м), 7,11 (1H, м), 7,22 (2H, д, J=8,4 Гц), 7,23 (2H, д, J=8,4 Гц), 8,02 (1H, с).
MS: 525 (M++H).
Пример 155: 3-[[5-Хлор-4-[(4-хлорфенилсульфонил)-(2,5-дифторфенил)метил]пиридин-2-ил]амино]пропионовая кислота
[Химическая формула 35]
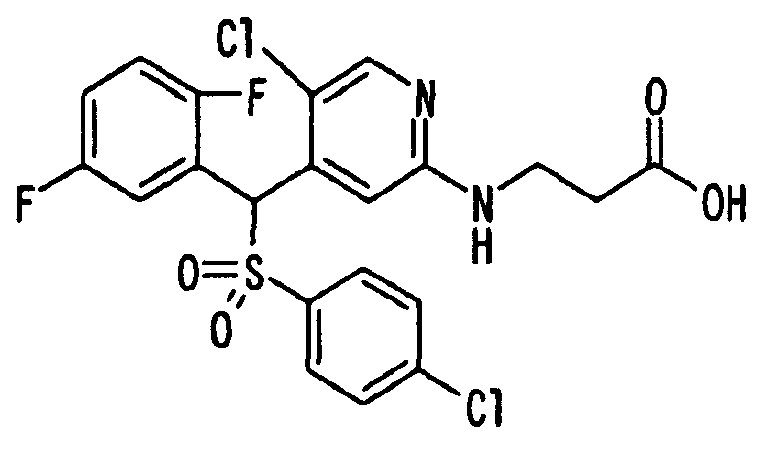
К раствору трет-бутил 3-[[5-хлор-4-[(4-хлорфенилтио)-(2,5-дифторфенил)метил]пиридин-2-ил]амино]пропионата (79 мг) в метаноле (6 мл) добавляли тетрагидрат гексааммонийгептамолибдата (30 мг). К полученной смеси добавляли 30% водный раствор перекиси водорода (3 мл) и смесь перемешивали в течение 16 часов. Реакционную смесь разбавляли этилацетатом (60 мл). Разбавленную смесь промывали водой и насыщенным солевым раствором и концентрировали при пониженном давлении. К полученному остатку добавляли трифторуксусную кислоту (1,0 мл). Полученную смесь перемешивали в течение 1 часа. Из реакционной смеси отгоняли трифторуксусную кислоту при пониженном давлении. Остаток растворяли в смеси вода-этанол (1:1). Полученный раствор подщелачивали добавлением к нему насыщенного водного раствора (0,2 мл) бикарбоната натрия. Добавляли водный раствор бисульфата натрия и полученную смесь экстрагировали этилацетатом (80 мл). Экстракт промывали насыщенным солевым раствором, сушили и концентрировали при пониженном давлении. Остаток кристаллизовали в простом эфире с получением указанного в заголовке соединения (61 мг, 81%) в виде 0,5 гидрата.
1H-ЯМР (400 МГц, CDCl3)δ: 2,76 (2H, м), 3,72 (2H, м), 6,11 (1H, с), 6,92 (1H, м), 7,04 (1H, м), 7,44 (2H, д, J=8,8 Гц), 7,46 (1H, с), 7,48 (1H, м), 7,61 (2H, д, J=8,8 Гц), 7,94 (1H, с).
Т.пл.: 200-205°C.
Элементный анализ для C21H16Cl2F2N2O4S·0,5H2O: Рассчитано: C,49,42; H,3,36; N,5,49; S,6,28; Cl,13,89; F,7,44. Найдено: C,49,51; H,3,28; N,5,52; S,6,35; Cl,13,75; F,7,77.
Пример 156: 2-[[5-Хлор-4-[(4-хлорфенилтио)-(2,5-дифторфенил)метил]пиридин-2-ил] (метил)амино]этанол
[Химическая формула 36]
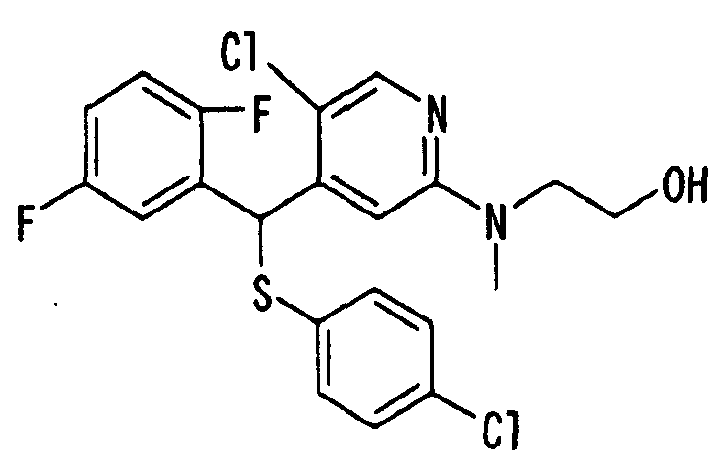
Раствор в 1,4-диоксане (2,0 мл) 2,5-дихлор-4-[(4-хлорфенилтио)-(2,5-дифторфенил)метил]пиридина (200 мг, 0,48 ммоль), полученного в примере 54, и метиламиноэтанола (200 мкл) перемешивали при 110°C в течение 3 дней в атмосфере аргона. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат=3:1) с получением указанного в заголовке соединения (164 мг, 75%) в виде масла.
1H-ЯМР (400 МГц, CDCl3)δ: 3,07 (3H, с), 3,73 (2H, д, J=4,8 Гц), 3,85 (2H, д, J=4,8 Гц), 5,99 (1H, с), 6,86 (1H, с), 6,91-7,12 (3H, м), 7,23 (2H, д, J=8,8 Гц), 7,25 (2H, д, J=8,8 Гц), 8,00 (1H, с).
MS m/z: 455 (M++H).
Пример 157: 5-Хлор-4-[(4-хлорфенилтио)-(2,5-дифторфенил)метил]-2-[2-(пиридин-2-ил)этиламино]пиридин
[Химическая формула 37]
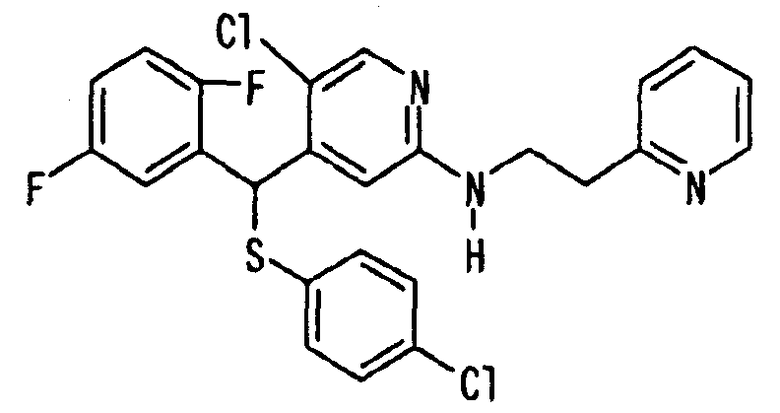
Раствор в 1,4-диоксане (1,5 мл) 2,5-дихлор-4-[(4-хлорфенилтио)-(2,5-дифторфенил)метил]пиридина (150 мг, 0,36 ммоль), полученного в примере 54, и 2-пиридин-2-илэтиламина (400 мкл) перемешивали при 120°C в течение 5 дней в атмосфере аргона. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат=1:1) с получением указанного в заголовке соединения (126 мг, 70%) в виде масла.
1H-ЯМР (400 МГц, CDCl3)δ: 3,07 (2H, д, J=6,4 Гц), 3,71 (2H, кв, J=6,4 Гц), 5,24 (1H, шир.), 5,96 (1H, с), 6,69 (1H, с), 6,93-7,30 (9H, м), 7,61 (1H, дт, J=2,0, 7,6 Гц), 8,01 (1H, с), 8,56 (1H, м).
MS m/z: 502 (M++H).
Пример 158: 5-Хлор-4-[(4-хлорфенилтио)-(2,5-дифторфенил)-метил]-2-[3-(имидазол-1-ил)пропиламино]пиридин
[Химическая формула 38]
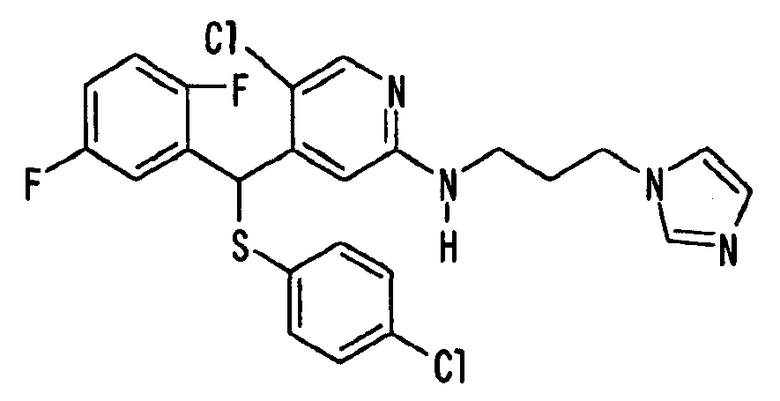
Раствор в 1,4-диоксане (1,5 мл) 2,5-дихлор-4-[(4-хлорфенилтио)-(2,5-дифторфенил)метил]пиридина (200 мг, 0,48 ммоль), полученного в примере 54, и 3-(имидазол-1-ил)пропиламина (400 мкл) перемешивали при 120°C в течение 5 дней в атмосфере аргона. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат=1:1) с получением указанного в заголовке соединения (94 мг, 39%) в виде масла.
1H-ЯМР (400 МГц, CDCl3)δ: 2,11 (2H, м), 3,35 (2H, м), 4,11 (2H, д, J=6,8 Гц), 4,86 (1H, м), 5,94 (1H, с), 6,69 (1H, с), 6,96 (1H, с), 6,95-7,26 (3H, м), 7,12 (1H, с), 7,21 (2H, д, J=8,8 Гц), 7,23 (2H, д, J=8,8 Гц), 7,92 (1H, м), 8,02 (1H, с).
MS m/z: 505 (M++H).
Пример 159: 2-[[5-Хлор-4-[(4-хлорфенилтио)-(2,5-дифторфенил)метил]пиридин-2-ил]амино]этанол
[Химическая формула 39]
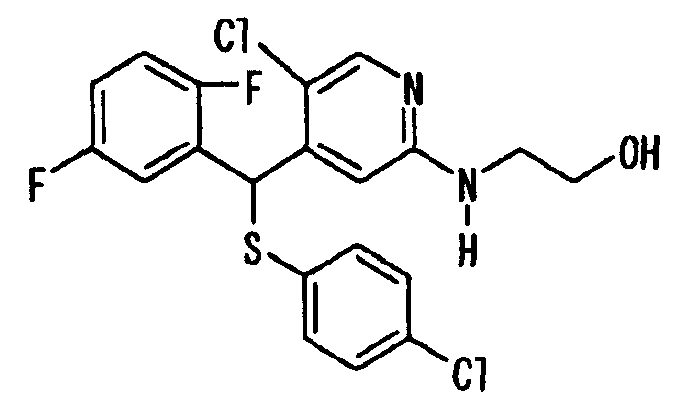
Раствор в 1,4-диоксане (1,5 мл) 2,5-дихлор-4-[(4-хлорфенилтио)-(2,5-дифторфенил)метил]пиридина (180 мг, 0,43 ммоль), полученного в примере 54, и 2-аминоэтанола (300 мкл) перемешивали при 120°C в течение 64 часов в атмосфере аргона. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат=1:1) с получением указанного в заголовке соединения (106 мг, 56%) в виде масла.
1H-ЯМР (400 МГц, CDCl3)δ: 3,00 (1H, шир.), 3,51 (2H, шир.), 3,81 (2H, д, J=4,8 Гц), 5,05 (1H, шир.), 5,95 (1H, с), 6,74 (1H, с), 6,92-7,06 (2H, м), 7,13 (1H, м), 7,23 (4H, с), 7,99 (1H, с).
MS m/z: 441 (M++H).
Пример 160: 1-[3-[[5-Хлор-4-[(4-хлорфенилтио)-(2,5-дифторфенил)метил]пиридин-2-ил]амино]пропил]пирролидин-2-он
[Химическая формула 40]
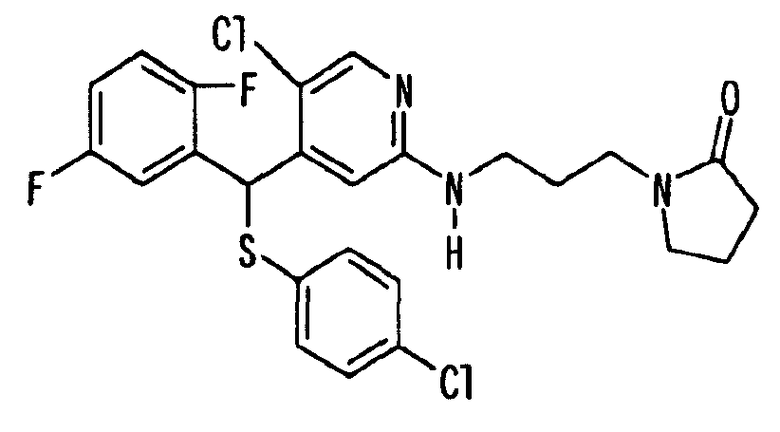
Раствор в 1,4-диоксане (1,5 мл) 2,5-дихлор-4-[(4-хлорфенилтио)-(2,5-дифторфенил)метил]пиридина (200 мг, 0,48 ммоль), полученного в примере 54, и 1-(3-аминопропил)пирролидин-2-она (400 мкл) перемешивали при 120°C в течение 17 часов в атмосфере аргона. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат=1:1) с получением указанного в заголовке соединения (68 мг, 27%) в виде масла.
1H-ЯМР (400 МГц, CDCl3)δ: 1,77 (2H, м), 2,04 (2H, м), 2,41 (2H, м), 3,30-3,40 (6H, м), 5,53 (1H, шир.), 5,94 (1H, с), 6,72 (1H, с), 6,90-7,03 (2H, м), 7,13 (1H, м), 7,22 (2H, д, J=8,0 Гц), 7,25 (2H, д, J=8,0 Гц), 7,99 (1H, с).
MS m/z: 522 (M++H).
Пример 161: трет-Бутил 4-[[5-хлор-4-[(4-хлорфенилтио)-(2,5-дифторфенил)метил]пиридин-2-ил]амино]пиперидин-1-карбоксилат
[Химическая формула 41]
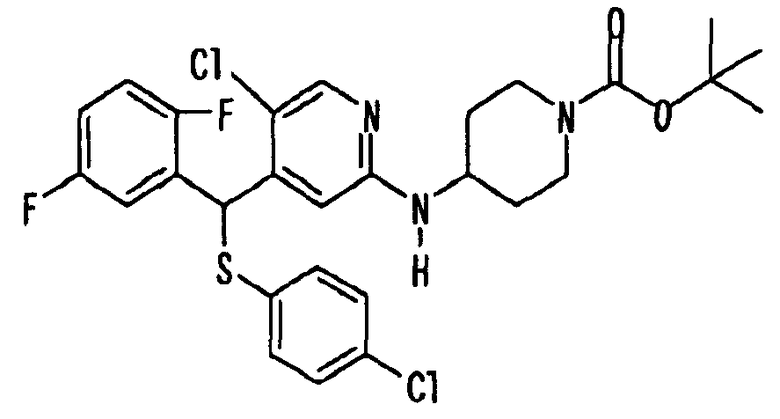
Раствор в 1,4-диоксане (2,2 мл) 2,5-дихлор-4-[(4-хлорфенилтио)-(2,5-дифторфенил)метил]пиридина (300 мг, 0,48 ммоль), полученного в примере 54, и трет-бутил 4-аминопиперидин-1-карбоксилата (600 мг) перемешивали при 120°C в течение 5 дней в атмосфере аргона. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат=3:1) с получением указанного в заголовке соединения (36 мг, 9%) в виде масла.
1H-ЯМР (400 МГц, CDCl3)δ: 1,34 (2H, м), 1,47 (9H, с), 1,98 (2H, м), 2,94 (2H, м), 3,79 (1H, м), 4,11 (2H, м), 4,58 (1H, шир.), 5,95 (1H, с), 6,63 (1H, с), 6,93-7,04 (2H, м), 7,12 (1H, м), 7,22 (4H, с), 8,01 (1H, с).
MS m/z: 580 (M++H).
Пример 162: трет-Бутил 3-[[5-хлор-4-[(4-хлорфенилтио)-(2,5-дифторфенил)метил]пиридин-2-ил]амино]пропилкарбамат
[Химическая формула 42]
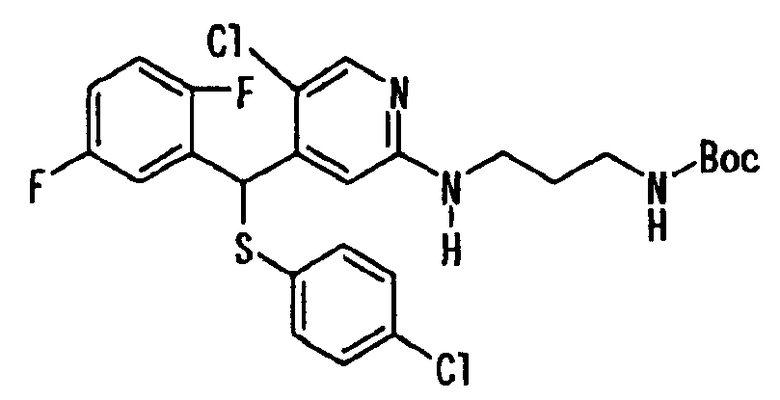
Раствор в 1,4-диоксане (1,5 мл) 2,5-дихлор-4-[(4-хлорфенилтио)-(2,5-дифторфенил)метил]пиридина (300 мг, 0,48 ммоль), полученного в примере 54, и трет-бутил (3-аминопропил)карбамата (400 мкл) перемешивали при 120°C в течение 2 дней в атмосфере аргона. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат=1:1) с получением указанного в заголовке соединения (71 мг, 27%) в виде масла.
1H-ЯМР (400 МГц, CDCl3)δ: 1,45 (9H, с), 1,73 (2H, м), 3,21 (2H, м), 3,38 (2H, м), 4,85 (1H, шир.), 5,10 (1H, шир.), 5,95 (1H, с), 6,96-7,04 (2H, м), 7,12 (1H, м), 7,22 (2H, д, J=8,8 Гц), 7,24 (2H, д, J=8,8 Гц), 8,00 (1H, с).
MS m/z: 554 (M++H).
Пример 163: 5-Хлор-4-[(4-хлорфенилтио)-(2,5-дифторфенил)-метил]-2-[(2-метилтиоэтил)амино]пиридин
[Химическая формула 43]
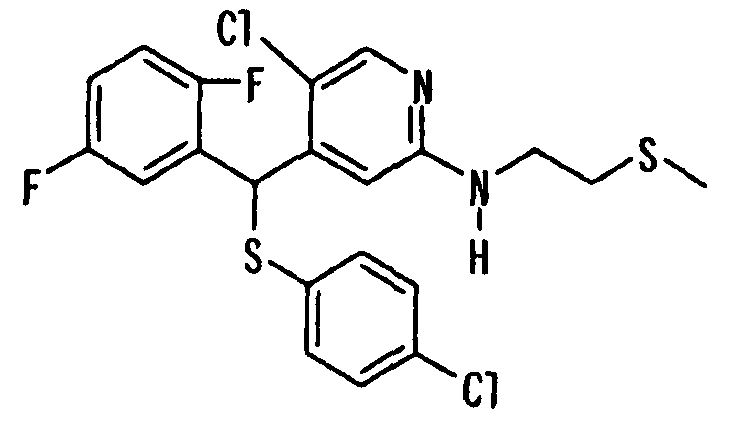
Раствор в 1,4-диоксане (1,5 мл) 2,5-дихлор-4-[(4-хлорфенилтио)-(2,5-дифторфенил)метил]пиридина (200 мг, 0,48 ммоль), полученного в примере 54, и 2-метилтиоэтиламина (200 мкл) перемешивали при 120°C в течение 2 дней в атмосфере аргона. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат=3:1) с получением указанного в заголовке соединения (29 мг, 13%) в виде масла.
1H-ЯМР (400 МГц, CDCl3)δ: 2,12 (3H, с), 2,74 (2H, д, J=6,4 Гц), 3,52 (2H, м), 4,98 (1H, шир.), 5,96 (1H, с), 6,69 (1H, с), 6,92-7,05 (2H, м), 7,13 (1H, м), 7,23 (4H, м), 8,02 (1H, с).
MS m/z: 471 (M++H).
Пример 164: 2-[[5-Хлор-4-[(4-хлорфенилсульфонил)-(2,5-дифторфенил)метил]пиридин-2-ил](метил)амино]этанол
[Химическая формула 44]
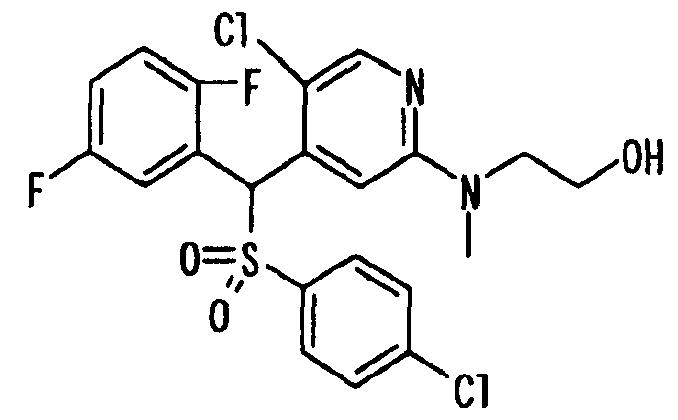
К раствору 2-[[5-хлор-4-[(4-хлорфенилтио)-(2,5-дифторфенил)метил]пиридин-2-ил](метил)амино]этанола (160 мг, 0,35 ммоль), полученного в примере 156, в метаноле (6 мл) добавляли тетрагидрат гексааммонийгептамолибдата (30 мг), а затем добавляли 30% водный раствор перекиси водорода (3 мл). Полученную смесь перемешивали в течение 17 часов. Реакционную смесь разбавляли этилацетатом (60 мл). Разбавленную смесь промывали водой и насыщенным солевым раствором и концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат=2:1) с последующей кристаллизацией из гексана-этанола с получением указанного в заголовке соединения (162 мг, 95%) в виде игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3)δ: 3,20 (3H, с), 3,7-3,85 (2H, м), 3,89 (2H, м), 6,14 (1H, с), 6,94 (1H, м), 7,04 (1H, м), 7,42 (1H, шир.), 7,44 (2H, д, J=8,8 Гц), 7,52 (1H, м), 7,62 (2H, д, J=8,8 Гц), 7,99 (1H, с).
Т.пл.: 88-89°C.
Элементный анализ для C21H18Cl2F2N2O3S·0,5H2O. Рассчитано: C,50,82; H,3,86; N,5,64; S,6,46; Cl,14,29; F,7,66. Найдено: C,51,16; H,3,66; N,5,78; S,6,62; Cl,14,32; F,7,73.
Пример 165: 2-[[5-Хлор-4-[(4-хлорфенилсульфонил)-(2,5-дифторфенил)метил]пиридин-2-ил](метил)амино]этил этилкарбамат
[Химическая формула 45]
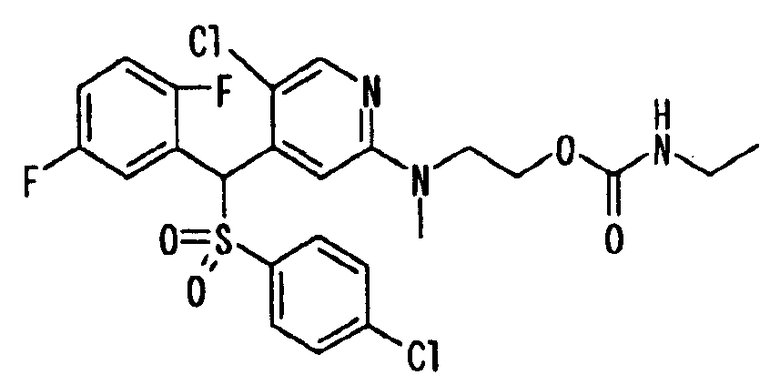
К раствору 2-[[5-хлор-4-[(4-хлорфенилсульфонил)-(2,5-дифторфенил)метил]пиридин-2-ил](метил)амино]этанола (73 мг, 0,15 ммоль) в метиленхлориде (1,0 мл) добавляли пиридин (0,5 мл), а затем добавляли этилизоцианат (100 мкл). Полученную смесь перемешивали в течение 19 часов. Смесь концентрировали при пониженном давлении и затем полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат=3:1) с получением указанного в заголовке соединения (65 мг, 74%) в виде масла.
1H-ЯМР (400 МГц, CDCl3)δ: 1,06 (3H, т, J=7,2 Гц), 3,19 (3H, с), 3,20 (2H, м), 3,68 (1H, м), 3,91 (1H, м), 4,25 (1H, м), 4,40 (1H, м), 5,15 (1H, шир.), 6,16 (1H, с), 6,92 (1H, м), 7,03 (1H, м), 7,45 (2H, д, J=8,4 Гц), 7,49 (1H, с), 7,55 (1H, м), 7,60 (2H, д, J=8,4 Гц), 8,03 (1H, с).
EI-MS: 557,0714 (Рассчитано для C24H23Cl2F2N3O4S: 557,0754).
Пример 166: 5-Хлор-4-[(4-хлорфенилсульфонил)-(2,5-дифторфенил)метил]-2-[2-(пиридин-2-ил)этиламино]пиридин
[Химическая формула 46]
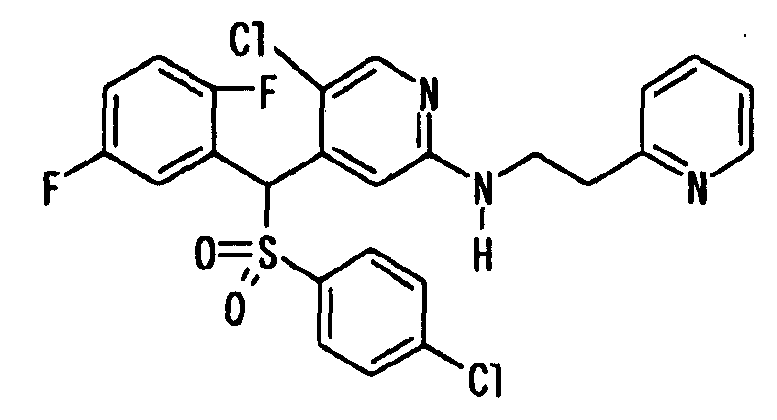
К раствору 5-хлор-4-[(4-хлорфенилтио)-(2,5-дифторфенил)метил]-2-[2-(пиридин-2-ил)этиламино]пиридина (120 мг, 0,35 ммоль), полученного в примере 157, в метаноле (6 мл) добавляли тетрагидрат гексааммонийгептамолибдата (30 мг), а затем добавляли 30% водный раствор перекиси водорода (3 мл). Полученную смесь перемешивали в течение 2 дней. Реакционную смесь разбавляли этилацетатом (80 мл). Разбавленную смесь промывали водой и насыщенным солевым раствором и концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат=3:1) с получением указанного в заголовке соединения (43 мг, 33%) в виде аморфного вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 3,19 (2H, т, J=5,2 Гц), 3,81 (2H, м), 5,51 (1H, шир.), 6,13 (1H, с), 6,91 (1H, м), 7,03 (1H, м), 7,20-7,30 (3H, м), 7,43 (2H, д, J=8,8 Гц), 7,50 (1H, м), 7,62 (2H, д, J=8,8 Гц), 7,68 (1H, с), 7,98 (1H, с), 8,60 (1H, м).
FAB-MS: 534,0651 (Рассчитано для C25H20Cl2F2N3O2S: 534,0621).
Пример 167: 5-Хлор-4-[(4-хлорфенилсульфонил)-(2,5-дифторфенил)метил]-2-[3-(имидазол-1-ил)пропиламино]пиридин
[Химическая формула 47]
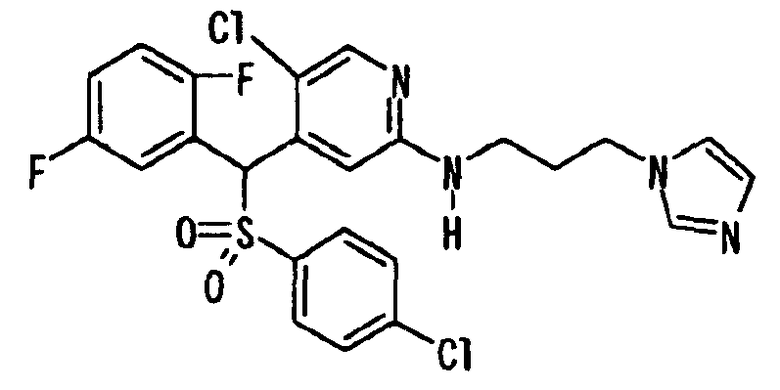
К раствору 5-хлор-4-[(4-хлорфенилтио)-(2,5-дифторфенил)метил]-2-[3-(имидазол-1-ил)пропиламино]пиридина (94 мг, 0,19 ммоль), полученного в примере 158, в метаноле (6 мл) добавляли тетрагидрат гексааммонийгептамолибдата (30 мг), а затем добавляли 30% водный раствор перекиси водорода (3 мл). Полученную смесь перемешивали в течение 17 часов. Реакционную смесь разбавляли этилацетатом (80 мл), затем разбавленную смесь промывали водой и насыщенным солевым раствором и концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (7% метанол-хлороформ) с получением указанного в заголовке соединения (5 мг, 5%) в виде масла.
1H-ЯМР (400 МГц, CDCl3)δ: 2,20 (2H, м), 3,44 (2H, м), 4,32 (2H, м), 5,77 (1H, шир.), 6,13 (1H, с), 6,91 (1H, м), 7,02 (1H, м), 7,10 (1H, с), 7,30 (1H, с), 7,40 (1H, с), 7,44 (2H, д, J=8,4 Гц), 7,54 (1H, м), 7,65 (2H, д, J=8,4 Гц), 7,97 (s,1H), 8,05 (1H, с), 8,89 (1H, с).
FAB-MS: 537,0737 (Рассчитано для C24H21Cl2F2N4O2S: 537,0730).
Пример 168: 2-[[5-Хлор-4-[(4-хлорфенилсульфонил)-(2,5-дифторфенил)метил]пиридин-2-ил]амино]этанол
[Химическая формула 48]
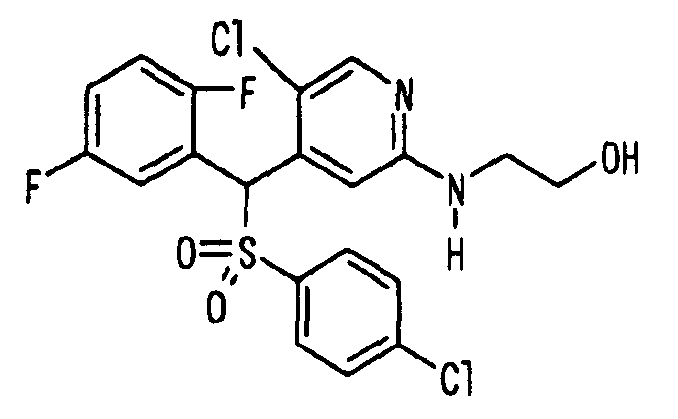
К раствору 2-[[5-хлор-4-[(4-хлорфенилтио)-(2,5-дифторфенил)метил]пиридин-2-ил]амино]этанола (143 мг, 0,33 ммоль), полученного в примере 159, в метаноле (6 мл) добавляли тетрагидрат гексааммонийгептамолибдата (30 мг), а затем добавляли 30% водный раствор перекиси водорода (3 мл). Полученную смесь перемешивали в течение 17 часов. Реакционную смесь разбавляли этилацетатом (60 мл), затем разбавленный раствор промывали водой и насыщенным солевым раствором и концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат=1:1) и кристаллизовали из этанола с получением указанного в заголовке соединения (98 мг, 63%) в виде игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3)δ: 3,60 (2H, м), 3,87 (2H, м), 5,53 (1H, шир.), 6,11 (1H, с), 6,92 (1H, м), 7,03 (1H, м), 7,40 (1H, с), 7,45 (2H, д, J=8,8 Гц), 7,48 (1H, м), 7,61 (2H, д, J=8,8 Гц), 7,96 (1H, с). Т.пл.: 168-169°C.
Элементный анализ для C20H16Cl2F2N2O3S. Рассчитано: C,50,75; H,3,41; N,5,92; S,6,77; Cl,14,98; F,8,03. Найдено: C,50,33; H,3,40; N,5,95; S,6,90; Cl,14,93; F,8,04.
Пример 169: 1-[3-[[5-Хлор-4-[(4-хлорфенилсульфонил)-(2,5-дифторфенил)метил]пиридин-2-ил]амино]пропил]пирролидин-2-он
[Химическая формула 49]
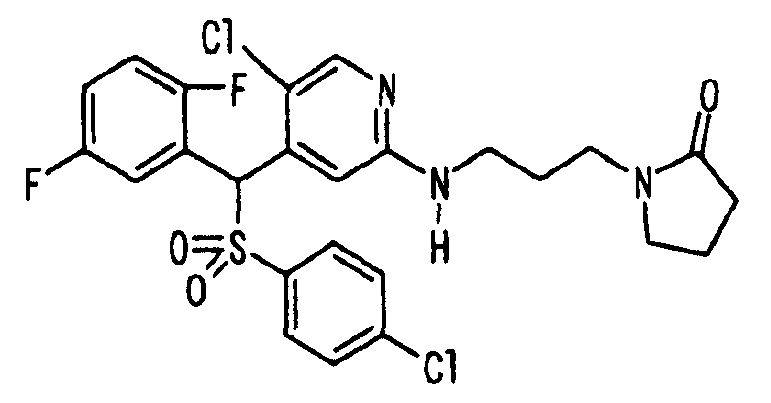
К раствору 1-[3-[[5-хлор-4-[(4-хлорфенилтио)-(2,5-дифторфенил)метил]пиридин-2-ил]амино]пропил]пирролидин-2-она (143 мг, 0,33 ммоль), полученного в примере 160, в метаноле (6 мл) добавляли тетрагидрат гексааммонийгептамолибдата (30 мг), а затем добавляли 30% водный раствор перекиси водорода (3 мл). Полученную смесь перемешивали в течение 17 часов. Реакционную смесь разбавляли этилацетатом (60 мл), затем разбавленную смесь промывали водой и насыщенным солевым раствором и концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (2% метанол-этилацетат) и кристаллизовали из простого эфира с получением указанного в заголовке соединения (42 мг, 60%) в виде игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3)δ: 1,82 (2H, м), 2,05 (2H, м), 2,43 (2H, м), 3,35-3,50 (6H, м), 5,53 (1H, шир.), 6,12 (1H, с), 6,92 (1H, м), 7,02 (1H, м), 7,23 (1H, с), 7,42 (2H, д, J=8,4 Гц), 7,53 (1H, м), 7,62 (2H, д, J=8,4 Гц), 7,96 (1H, с).
Т.пл.: 78-80°C.
Элементный анализ для C25H23Cl2F2N3O3S. Рассчитано: C,54,16; H,4,18; N,7,58; S,5,78; Cl,12,79; F,6,85. Найдено: C,54,15; H,4,37; N,7,39; S,5,60; Cl,12,20; F,6,64.
Пример 170: трет-Бутил 4-[[5-хлор-4-[(4-хлорфенилсульфонил)-(2,5-дифторфенил)метил]пиридин-2-ил]амино]пиперидин-1-карбоксилат
[Химическая формула 50]
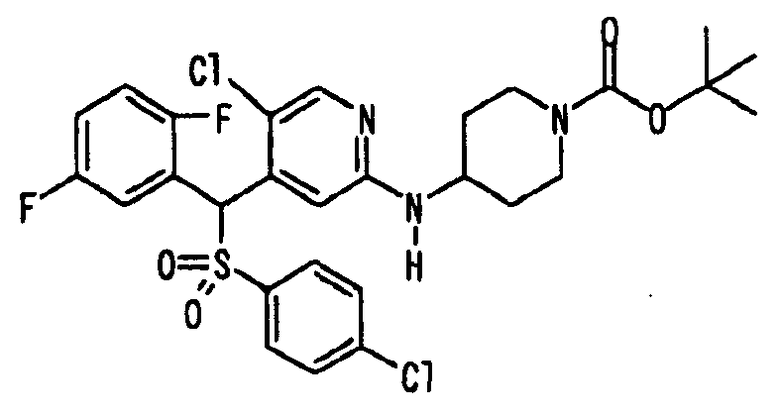
К раствору трет-бутил 4-[[5-хлор-4-[(4-хлорфенилтио)-(2,5-дифторфенил)метил]пиридин-2-ил]амино]пиперидин-1-карбоксилата (41 мг, 0,070 ммоль), полученного в примере 161, в метаноле (6 мл) добавляли тетрагидрат гексааммонийгептамолибдата (30 мг), а затем добавляли 30% водный раствор перекиси водорода (3 мл). Полученную смесь перемешивали в течение 20 часов. После разбавления этилацетатом (80 мл) разбавленную смесь промывали водой и насыщенным солевым раствором и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле (гексан:этилацетат=4:1) с получением указанного в заголовке соединения (41 мг, 95%) в виде масла.
1H-ЯМР (400 МГц, CDCl3)δ: 1,43 (2H, м), 1,47 (9H, с), 2,04 (2H, м), 2,97 (2H, м), 3,88 (1H, м), 4,08 (2H, м), 6,08 (1H, с), 6,89 (1H, м), 7,02 (1H, м), 7,25 (1H, с), 7,43 (2H, д, J=8,0 Гц), 7,46 (1H, м), 7,58 (2H, д, J=8,0 Гц), 7,96 (1H, с).
MS m/z: 612 (M++H).
Пример 171: Дигидрохлорид 4-[[5-Хлор-4-[(4-хлорфенилсульфонил)-(2,5-дифторфенил)метил]пиридин-2-ил]амино]пиперидина
[Химическая формула 51]
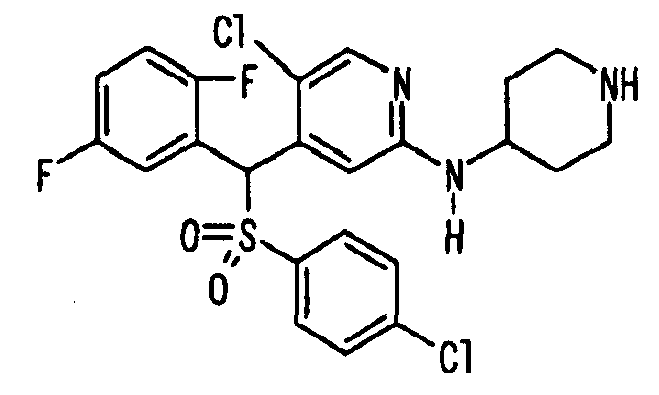
К трет-бутил 4-[[5-хлор-4-[(4-хлорфенилсульфонил)-(2,5-дифторфенил)метил]пиридин-2-ил]амино]пиперидин-1-карбоксилату (41 мг, 0,067 ммоль) добавляли 20% раствор хлористоводородной кислоты в метаноле. Полученную смесь перемешивали в течение 2 часов. Реакционную смесь концентрировали при пониженном давлении. Полученный остаток растворяли в хлороформе, а затем снова концентрировали. Полученное аморфное вещество сушили при пониженном давлении с получением указанного в заголовке соединения (34 мг, 84%).
1H-ЯМР (400 МГц, CD3OD)δ: 1,90 (2H, м), 2,33 (2H, м), 3,22 (2H, м), 3,52 (2H, м), 4,10 (1H, м), 6,28 (1H, с), 7,09 (1H, м), 7,23 (1H, м), 7,53 (1H, м), 7,61 (2H, д, J=6,4 Гц), 7,75 (2H, д, J=6,4 Гц), 7,89 (1H, с), 8,05 (1H, с).
Элементный анализ для C23H21Cl2F2N3O2S·2HCl·H2O. Рассчитано: C,45,79; H,4,18; N,6,96; S,5,31; Cl,23,50; F,6,30. Найдено: C,45,48; H,4,17; N,7,2; S,5,24; Cl,22,82; F,6,02.
Пример 172: трет-Бутил 3-[[5-хлор-4-[(4-хлорфенилсульфонил)-(2,5-дифторфенил)метил]пиридин-2-ил]амино]пропилкарбамат
[Химическая формула 52]
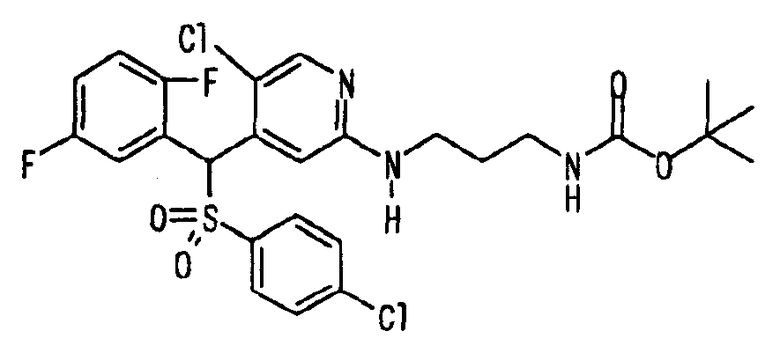
К раствору трет-бутил 3-[[5-хлор-4-[(4-хлорфенилтио)-(2,5-дифторфенил)метил]пиридин-2-ил]амино]пропилкарбамата (70 мг, 0,13 ммоль), полученного в примере 162, в метаноле (6 мл) добавляли тетрагидрат гексааммонийгептамолибдата (30 мг), а затем добавляли 30% водный раствор перекиси водорода (3 мл). Полученную смесь перемешивали в течение 20 часов. После разбавления этилацетатом (80 мл), разбавленную смесь промывали водой и насыщенным солевым раствором и концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат=2:1) с получением указанного в заголовке соединения (61 мг, 82%) в виде масла.
1H-ЯМР (400 МГц, CDCl3)δ: 1,45 (9H, с), 1,77 (2H, м), 3,23 (2H, м), 3,42 (2H, м), 4,89 (1H, шир.), 5,36 (1H, шир.), 6,10 (1H, с), 6,90 (1H, м), 7,02 (1H, м), 7,24 (1H, с), 7,42 (2H, д, J=8,8 Гц), 7,49 (1H, м), 7,59 (2H, д, J=8,8 Гц), 7,95 (1H, с).
MS m/z: 586 (M++H).
Пример 173: дигидрохлорид N-[5-хлор-4-[(4-хлорфенилсульфонил)-(2,5-дифторфенил)метил]пиридин-2-ил]пропан-1,3-диамина
[Химическая формула 53]
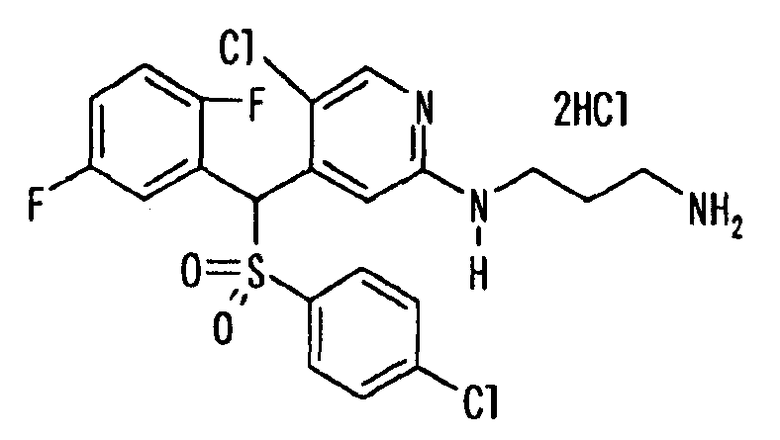
К трет-бутил 3-[[5-хлор-4-[(4-хлорфенилсульфонил)-(2,5-дифторфенил)метил]пиридин-2-ил]амино]пропилкарбамату (70 мг, 0,13 ммоль) добавляли 20% раствор хлористоводородной кислоты в метаноле (2 мл). Полученную смесь перемешивали в течение 2 часов. Остаток, полученный концентрацией реакционной смеси при пониженном давлении, кристаллизовали из этанола с получением указанного в заголовке соединения в виде белого твердого вещества (42 мг, 83%).
1H-ЯМР (400 МГц,DMSO-d6)δ: 1,83 (2H, м), 2,87 (2H, м), 3,33 (2H, м), 6,16 (1H, с), 7,28 (1H, м), 7,36 (1H, с), 7,38 (1H, м), 7,52 (1H, м), 7,69 (2H, д, J=8,4 Гц), 7,74 (2H, д, J=8,4 Гц), 8,05 (1H, с).
Т.пл.: 193-195°C.
Элементный анализ для C21H19Cl2F2N3O2S·2HCl. Рассчитано: C,45,10; H,3,78; N,7,51; S,5,73; Cl,25,36; F,6,79. Найдено: C,44,55; H,3,74; N,7,52; S,5,73; Cl,25,09; F,6,73.
Пример 174: N-[3-[[5-Хлор-4-[(4-хлорфенилсульфонил)-(2,5-дифторфенил)метил]пиридин-2-ил]амино]пропил]ацетамид
[Химическая формула 54]
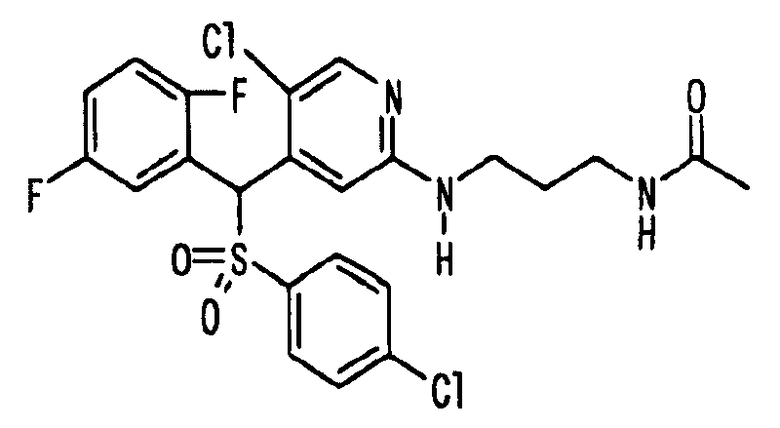
К раствору дигидрохлорида N-[5-хлор-4-[(4-хлорфенилсульфонил)-(2,5-дифторфенил)метил]пиридин-2-ил]пропан-1,3-диамина (47 мг, 0,084 ммоль) в метиленхлориде (5,0 мл) добавляли пиридин (17 мкл, 0,34 ммоль) и уксусный ангидрид (9,5 мкл, 0,10 ммоль). Полученную смесь перемешивали в течение 1 часа. Остаток, полученный концентрацией реакционной смеси, очищали хроматографией на силикагеле (этилацетат:метанол=10:1) с получением указанного в заголовке соединения (35 мг, 79%). Полученное соединение кристаллизовали в простом эфире с получением белого твердого вещества (27 мг).
1H-ЯМР (400 МГц, CDCl3)δ: 1,80 (2H, м), 2,02 (3H, с), 3,36 (2H, м), 3,45 (2H, м), 5,25 (1H, шир.), 6,12 (1H, с), 6,15 (1H, м), 6,93 (1H, м), 7,04 (1H, м), 7,44 (2H, д, J=8,8 Гц), 7,50 (1H, м), 7,62 (2H, д, J=8,8 Гц), 7,97 (1H, с).
Т.пл.: 103-105°C.
FAB-MS: 528,0740 (Рассчитано для C23H22Cl2F2N3O3S: 528,0727).
Пример 175: N-[5-Хлор-4-[(4-хлорфенилсульфонил)-(2,5-дифторфенил)метил]пиридин-2-ил]-N'-(пиримидин-2-ил)пропан-1,3-диамин
[Химическая формула 55]
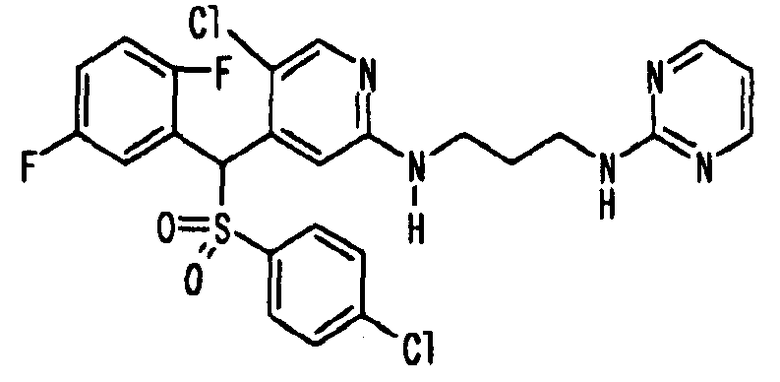
К раствору дигидрохлорида N-[5-хлор-4-[(4-хлорфенилсульфонил)-(2,5-дифторфенил)метил]пиридин-2-ил]пропан-1,3-диамина (76 мг, 0,136 ммоль), полученного в примере 173, в 1,4-диоксане (1,0 мл) добавляли триэтиламин (76 мкл, 0,54 ммоль) и 2-хлорпиримидин (23 мг, 0,20 ммоль). Полученную смесь перемешивали при 80°C в течение 19 часов. Реакционной смеси давали охладиться до комнатной температуры, а затем разбавляли этилацетатом. Разбавленную смесь промывали водой и насыщенным солевым раствором, сушили и концентрировали. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат=1: 2) с получением указанного в заголовке соединения (50 мг, 65%). Это соединение кристаллизовали в этаноле с получением белого твердого вещества (36 мг).
1H-ЯМР (400 МГц, CDCl3)δ: 1,94 (2H, м), 3,48 (2H, м), 3,59 (2H, м), 5,33 (1H, шир.), 5,60 (1H, шир.), 6,12 (1H, с), 6,56 (1H, т, J=4,8 Гц), 6,92 (1H, м), 7,03 (1H, м), 7,24 (1H, с), 7,44 (2H, д, J=8,0 Гц), 7,51 (1H, м), 7,61 (2H, д, J=8,0 Гц), 8,00 (1H, с), 8,32 (1H, д, J=4,8 Гц).
Т.пл.: 176-178°C.
FAB-MS: 564,0811 (Рассчитано для C25H22Cl2F2N5O2S: 564,0839).
Пример 176: 5-Хлор-4-[(4-хлорфенилсульфонил)-(2,5-дифторфенил)метил]-2-[(2-метилсульфонилэтил)амино]пиридин
[Химическая формула 56]
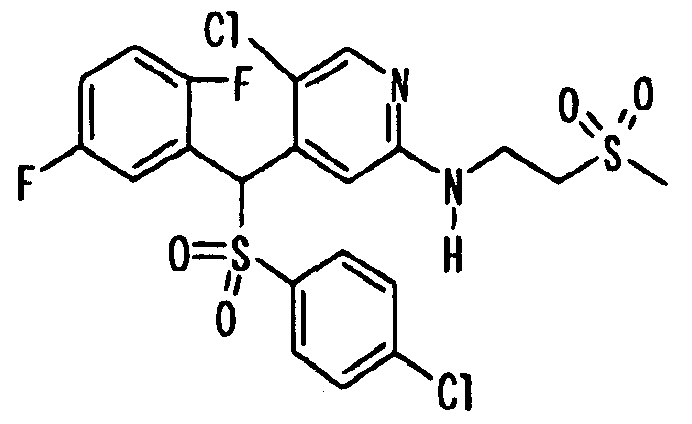
К раствору 5-хлор-4-[(4-хлорфенилтио)-(2,5-дифторфенил)метил]-2-[(2-метилтиоэтил)амино]пиридина (29 мг, 0,061 ммоль), полученного в примере 163, в метаноле (3 мл) добавляли тетрагидрат гексааммонийгептамолибдата (15 мг), а затем добавляли 30% водный раствор перекиси водорода (1,5 мл). Полученную смесь перемешивали в течение 20 часов. После разбавления этилацетатом (80 мл) разбавленную смесь промывали водой и насыщенным солевым раствором и концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат=1:1) с последующей кристаллизацией из простого эфира с получением указанного в заголовке соединения (24 мг, 73%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 2,98 (3H, с), 3,37 (2H, т, J=6,0 Гц), 3,94 (2H, м), 5,38 (1H, м), 6,10 (1H, с), 6,90 (1H, м), 7,01 (1H, м), 7,32 (1H, с), 7,42 (2H, д, J=8,8 Гц), 7,45 (1H, м), 7,59 (2H, д, J=8,8 Гц), 8,00 (1H, с).
Т.пл.: 134-136°C.
Элементный анализ для C21H18Cl2F2N2O4S. Рассчитано: C, 47,11; H, 3,39; N,5,23; S, 11,98. Найдено: C, 46,80; H, 3,35; N, 5,30; S, 11,84.
Пример 177: 2,5-Дихлор-4-[(2,5-дифторфенил)-(4-фторфенилтио)метил]пиридин
[Химическая формула 57]
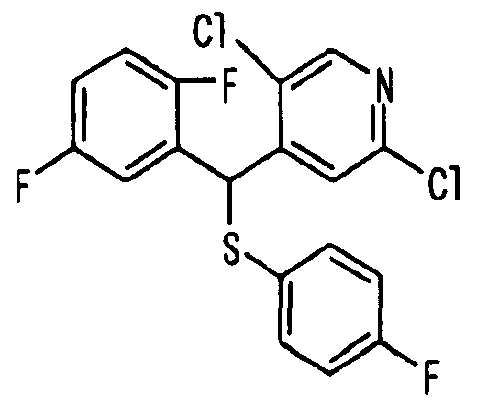
2,5-Дихлор-4-[(2,5-дифторфенил)-гидроксиметил]пиридин (1,22 г, 4,8 ммоль), полученный в ссылочном примере 24, растворяли в тионилхлориде (5,0 мл). К полученному раствору добавляли каталитическое количество диметилформамида. Полученную смесь перемешивали в течение 4 часов.
Реакционную смесь концентрировали при пониженном давлении. К полученному остатку добавляли 1,4-диоксан, а затем снова концентрировали. Остаток растворяли в диметилформамиде (10 мл). К полученному раствору добавляли 4-фторбензолтиол (730 мг, 5,7 ммоль) и карбонат калия (2,07 г, 15 ммоль). Полученный раствор перемешивали при комнатной температуре в течение 24 часов в атмосфере азота. К реакционной смеси добавляли диэтиловый эфир (120 мл). Полученную смесь промывали водой и насыщенным солевым раствором. Органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток кристаллизовали в этаноле с получением указанного в заголовке соединения (950 мг, 49%) в виде игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3)δ: 5,92 (1H, с), 6,94-7,04 (4H, м), 7,19 (1H, м), 7,33-7,4 (2H, м), 7,57 (1H, с), 8,33 (1H, с).
Т.пл.: 95-97°C.
MS m/z: 400 (M++1)
Пример 178: 2-[[5-Хлор-4-[(2,5-дифторфенил)-(4-фторфенилтио)метил]пиридин-2-ил]амино]этанол
[Химическая формула 58]
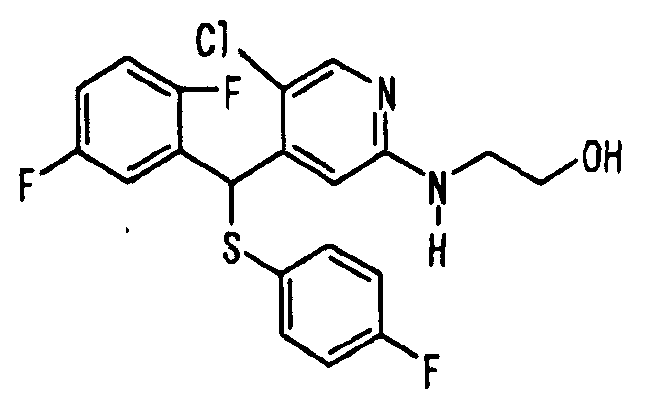
Раствор в 1,4-диоксане (1,5 мл) 2,5-дихлор-4-[(2,5-дифторфенил)-(4-фторфенилтио)метил]пиридина (200 мг, 0,50 ммоль) и 2-аминоэтанола (300 мкл) перемешивали при 120°C в течение 2 дней в атмосфере аргона. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле (гексан:этилацетат=1:1) с получением указанного в заголовке соединения (120 мг, 56%) в виде масла.
1H-ЯМР (400 МГц, CDCl3)δ: 3,53 (2H, м), 3,82 (2H, м), 4,95 (1H, шир.), 5,89 (1H, с), 6,74 (1H, с), 6,90-7,00 (4H, м), 7,16 (1H, м), 7,31-7,36 (2H, м), 7,99 (1H, с).
MS m/z: 425 (M++H).
Пример 179: 2-[[5-Хлор-4-[(2,5-дифторфенил)-(4-фторфенилсульфонил)метил]пиридин-2-ил]амино]этанол
[Химическая формула 59]
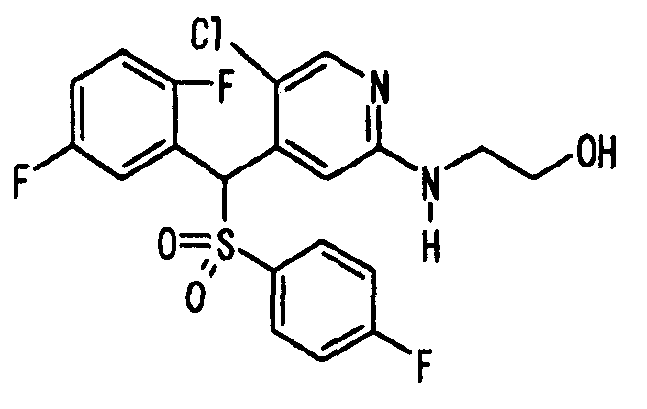
К раствору 2-[[5-хлор-4-[(2,5-дифторфенил)-(4-фторфенилтио)метил]пиридин-2-ил]амино]этанола (119 мг, 0,27 ммоль) в метаноле (6 мл) добавляли тетрагидрат гексааммонийгептамолибдата (30 мг), а затем добавляли 30% водный раствор перекиси водорода (3 мл). Полученную смесь перемешивали в течение 19 часов. После разбавления этилацетатом (80 мл) разбавленную смесь промывали водой и насыщенным солевым раствором и концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат=1:1) и кристаллизовали из этанола с получением указанного в заголовке соединения (65 мг, 56%) в виде игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3)δ: 3,61 (2H, м), 3,88 (2H, д, J=4,8 Гц), 6,09 (1H, с), 6,90 (1H, м), 7,04 (1H, м), 7,10-7,18 (2H, м), 7,42 (1H, с), 7,49 (1H, м), 7,66-7,71 (2H, м), 7,95 (1H, с).
Т.пл.: 157-158°C.
Элементный анализ для C20H16ClF3N2O3S. Рассчитано: C,52,58; H,3,53; N,6,13; S,7,02; Cl,7,76; F,12,48. Найдено: C,52,18; H,3,51; N,6,19; S,7,10; Cl,7,82; F,12,38.
Пример 180: 5-Хлор-4-[(4-хлорфенилтио)(2,5-дифторфенил)метил]-2-[2-(пиридин-4-ил)этиламино]пиридин
[Химическая формула 60]
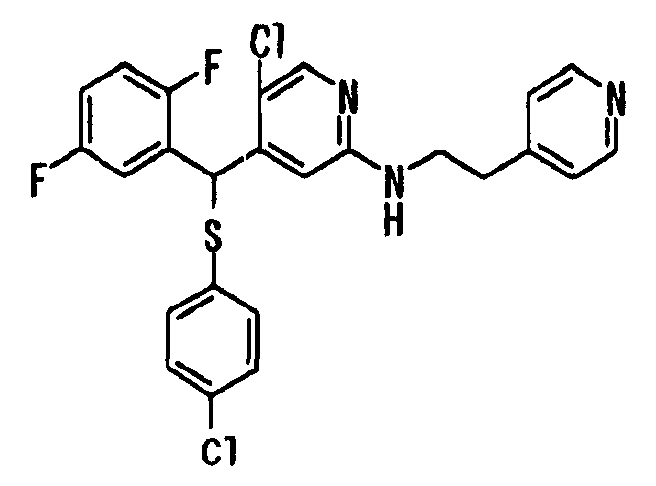
Раствор 2,5-дихлор-4-[(4-хлорфенилтио) (2,5-дифторфенил)-метил]пиридина (220 мг, 0,528 ммоль), полученного в примере 54, и 4-(2-аминоэтил)пиридина (400 мкл) в диоксане (1,5 мл) нагревали при 120°C в течение 3 дней в герметично закрытой пробирке. Реакционную смесь охлаждали до комнатной температуры и затем концентрировали при пониженном давлении. К полученному остатку добавляли воду, а затем экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали колоночной хроматографии на силикагеле. Фракцию, полученную при элюировании смесью метанол:метиленхлорид=1:30, концентрировали при пониженном давлении с получением указанного в заголовке соединения (114 мг, 0,227 ммоль, 43%) в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3)δ: 2,90 (2H, т, J=7,1 Гц), 3,54-3,65 (2H, м), 4,70-4,81 (1H, м), 5,96 (1H, с), 6,64 (1H, с), 6,90-7,03 (2H, м), 7,05-7,16 (3H, м), 7,22 (4H, с), 8,03 (1H, с), 8,53 (2H, д, J=6,1 Гц).
MS m/z: 501 (M+).
Пример 181: 5-Хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]-2-[2-(пиридин-4-ил)этиламино]пиридин
[Химическая формула 61]
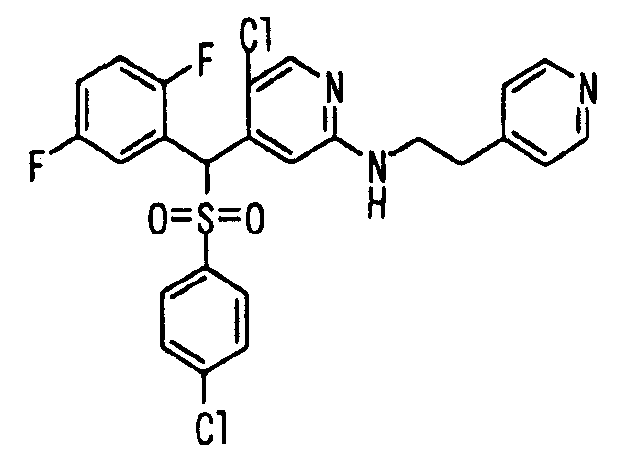
К раствору 5-хлор-4-[(4-хлорфенилтио) (2,5-дифторфенил)-метил]-2-[2-(пиридин-4-ил)этиламино]пиридина (110 мг, 0,219 ммоль) в метаноле (6 мл) добавляли при охлаждении льдом 30% водный раствор перекиси водорода (3 мл) и тетрагидрат гексааммонийгептамолибдата (34 мг). Реакционную смесь перемешивали при комнатной температуре в течение 22 часов, затем метанол отгоняли при пониженном давлении. К полученному остатку добавляли этилацетат. Полученную смесь промывали последовательно насыщенным раствором бикарбоната натрия, водным раствором тиосульфата натрия и насыщенным солевым раствором, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали колоночной хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=2:3, концентрировали при пониженном давлении с получением указанного в заголовке соединения (102 мг, 0,191 ммоль, 87%) в виде бледного желтовато-белого твердого вещества. Полученное твердое вещество промывали диизопропиловым эфиром-гексаном и собирали фильтрованием с получением указанного в заголовке соединения (87 мг) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 2,96 (2H, т, J=7,1 Гц), 3,68 (2H, кв, J=6,8 Гц), 4,72 (1H, т, J=6,1 Гц), 6,12 (1H, с), 6,89-6,96 (1H, м), 6,98-7,08 (1H, м), 7,20 (2H, д, J=5,9 Гц), 7,24 (1H, с), 7,40-7,50 (3H, м), 7,60 (2H, д, J=8,6 Гц), 8,03 (1H, с), 8,56 (2H, д, J=5,9 Гц).
Т.пл.: 148-150°C.
Элементный анализ для C25H19N3O2Cl2F2S. Рассчитано: C,56,19; H,3,58; N,7,86; Cl,13,27; F,7,11; S,6,00. Найдено: C,56,01; H,3,57; N,7,93; Cl,13,27; F,7,04; S,6,16.
Пример 182: 2-[2-[5-Хлор-4-[(4-хлорфенилтио)(2,5-дифторфенил)метил]пиридин-2-иламино]этокси]этанол
[Химическая формула 62]
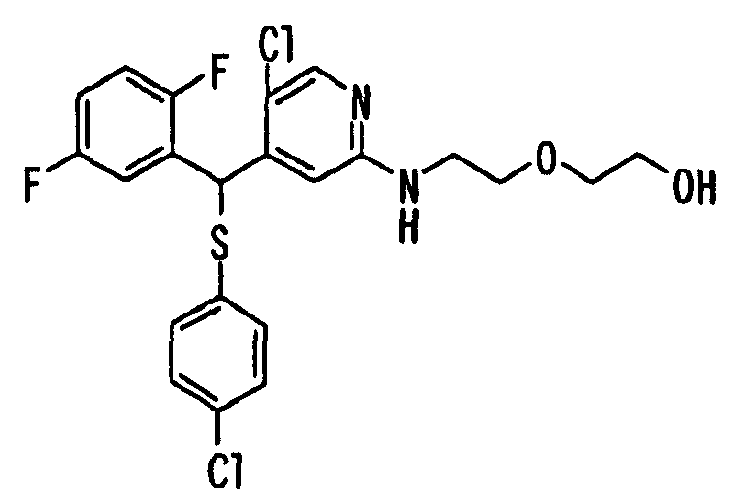
Раствор 2,5-дихлор-4-[(4-хлорфенилтио)(2,5-дифторфенил)метил]пиридина (210 мг, 0,504 ммоль), полученного в примере 54, и 2-(2-аминоэтокси)этанола (400 мкл) в диоксане (1,5 мл) нагревали при 120°C в течение 3 дней в герметично закрытой пробирке. Реакционную смесь охлаждали до комнатной температуры и затем концентрировали при пониженном давлении. К полученному остатку добавляли воду, а затем экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали колоночной хроматографии на силикагеле. Фракцию, полученную при элюировании смесью 30% метанол/метиленхлорид, концентрировали при пониженном давлении с получением указанного в заголовке соединения (85 мг, 0,175 ммоль, 35%) в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3)δ: 2,11 (1H, шир. с), 3,53 (2H, кв, J=5,3 Гц), 3,61 (2H, т, J=4,4 Гц), 3,70 (2H, т, J=5,1 Гц), 3,72-3,80 (2H, м), 4,95 (1H, т, J=5,6 Гц), 5,97 (1H, с), 6,71 (1H, с), 6,80-7,03 (2H, с), 7,08-7,17 (1H, м), 7,18-7,30 (4H, м), 8,03 (1H, с).
MS (m/z): 484 (M+).
Пример 183: 2-[2-[5-Хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-иламино]этокси]этанол
[Химическая формула 63]
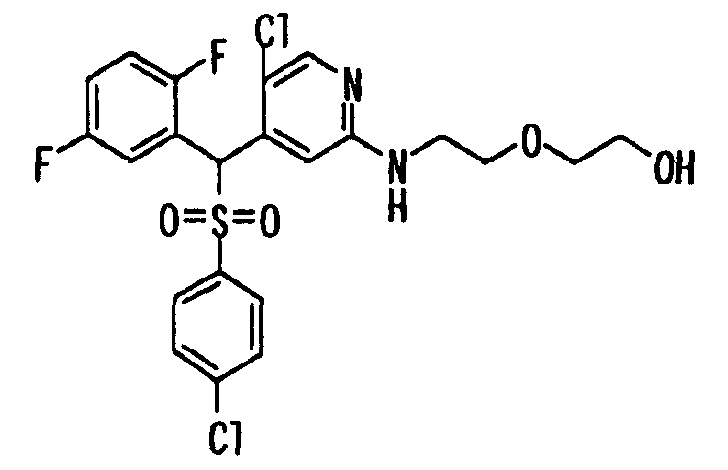
К раствору 2-[2-[5-хлор-4-[(4-хлорфенилтио)(2,5-дифторфенил)метил]пиридин-2-иламино]этокси]этанола (80 мг, 0,155 ммоль) в метаноле (6 мл) добавляли при охлаждении льдом 30% водный раствор перекиси водорода (3 мл) и тетрагидрат гексааммонийгептамолибдата (32 мг). Полученную смесь перемешивали при комнатной температуре в течение 24 часов, затем метанол отгоняли при пониженном давлении. К остатку добавляли этилацетат. Полученную смесь промывали последовательно насыщенным раствором бикарбоната натрия, водным раствором тиосульфата натрия и насыщенным солевым раствором, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали колоночной хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=2:3, концентрировали при пониженном давлении с получением указанного в заголовке соединения (70 мг, 0,135 ммоль, 87%) в виде аморфного вещества. Полученное аморфное вещество отверждали с использованием смеси простой эфир-гексан с последующим фильтрованием с получением указанного в заголовке соединения (55 мг) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 2,11 (1H, шир. с), 3,55-3,63 (2H, м), 3,66 (2H, т, J=4,5 Гц), 3,74 (2H, т, J=5,1 Гц), 3,78-3,85 (2H, м), 5,03-5,13 (1H, м), 6,13 (1H, с), 6,89-6,97 (1H, м), 6,98-7,08 (1H, м), 7,30 (1H, с), 7,45 (2H, д, J=8,5 Гц), 7,48-7,56 (1H, м), 7,62 (2H, д, J=8,5 Гц), 8,00 (1H, с). Т.пл.: 113-115°C.
Элементный анализ для C22H20N2O4Cl2F2S. Рассчитано: C,51,07; H,3,90; N,5,41; Cl,13,70; F,7,34; S,6,20. Найдено: C,50,81; H,3,83; N,5,49; Cl,13,64; F,7,46; S,6,34.
Пример 184: 5-Хлор-4-[(4-хлорфенилтио)(2,5-дифторфенил)метил]-2-[(3-метоксипропил)амино]пиридин
[Химическая формула 64]
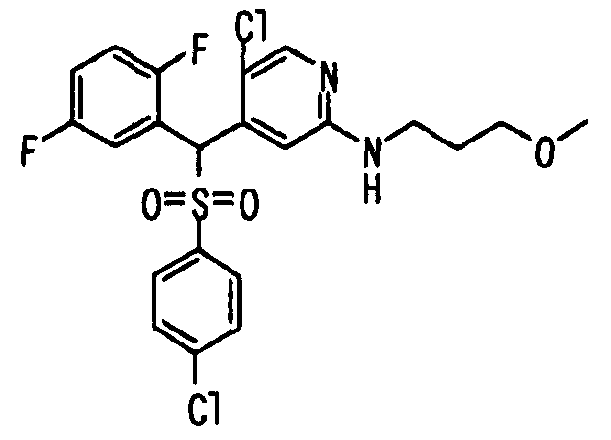
Раствор 2,5-дихлор-4-[(4-хлорфенилтио)(2,5-дифторфенил)метил]пиридина (216 мг, 0,518 ммоль), полученного в примере 54, и 3-метоксипропиламина (200 мкл) в диоксане (1,5 мл) нагревали при 120°C в течение 3 дней в герметично закрытой пробирке. Реакционную смесь охлаждали до комнатной температуры и затем концентрировали при пониженном давлении. Полученный остаток подвергали колоночной хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат (=3:1), концентрировали при пониженном давлении с получением бледно-желтого масла (101 мг).
К раствору полученного бледно-желтого масла (101 мг) в метаноле (6 мл) добавляли при охлаждении льдом 30% водный раствор перекиси водорода (3 мл) и тетрагидрат гексааммонийгептамолибдата (41 мг). Реакционную смесь перемешивали при комнатной температуре в течение 16 часов, затем метанол отгоняли при пониженном давлении. К полученному остатку добавляли этилацетат. Полученную смесь промывали последовательно насыщенным раствором бикарбоната натрия, водным раствором тиосульфата натрия и насыщенным солевым раствором, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали колоночной хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=3:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (90 мг, 0,180 ммоль, 35%) в виде белого твердого вещества. Полученное твердое вещество промывали простым эфиром-гексаном и собирали фильтрованием с получением указанного в заголовке соединения (64 мг) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 1,87-1,98 (2H, м), 3,39 (3H, с), 3,46 (2H, кв, J=6,1 Гц), 3,55 (2H, т, J=5,8 Гц), 5,09 (1H, шир. т, J=5,3 Гц), 6,13 (1H, с), 6,88-6,96 (1H, м), 6,98-7,08 (1H, м), 7,20 (1H, с), 7,43 (2H, д, J=8,7 Гц), 7,50-7,57 (1H, м), 7,62 (2H, д, J=8,7 Гц), 7,98 (1H, с).
Т.пл.: 146-148°C.
Элементный анализ для C22H20N2O3Cl2F2S. Рассчитано: C,52,70; H,4,02; N,5,59; Cl,14,14; F,7,58; S,6,40. Найдено: C,52,72; H,3,95; N,5,78; Cl,14,14; F,7,75; S,6,54.
Пример 185: 5-Хлор-4-[(4-хлорфенилтио)(2,5-дифторфенил)метил]-2-(3,4-диметоксибензиламино)пиридин
[Химическая формула 65]
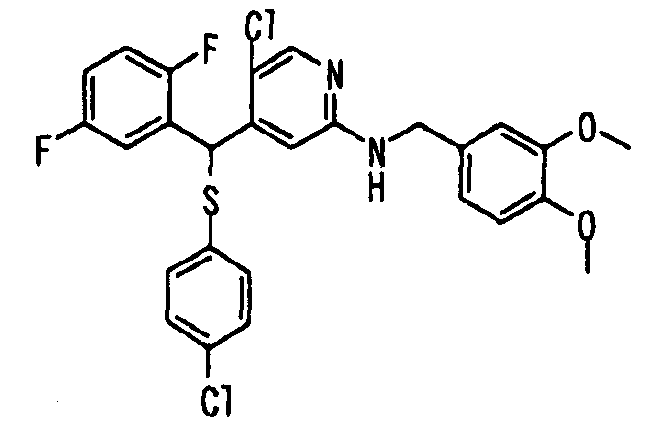
Раствор 2,5-дихлор-4-[(4-хлорфенилтио)(2,5-дифторфенил)-метил]пиридина (218 мг, 0,523 ммоль), полученного в примере 54, и 3,4-диметоксибензиламина (400 мкл) в диоксане (1,5 мл) нагревали при 120°C в течение 3 дней в герметично закрытой пробирке. Реакционную смесь охлаждали до комнатной температуры и затем концентрировали при пониженном давлении. Полученный остаток подвергали колоночной хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=4:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (140 мг, 0,256 ммоль, 49%) в виде аморфного вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 3,86 (3H, с), 3,88 (3H, с), 4,42 (2H, д, J=5,6 Гц), 4,99 (1H, т, J=5,6 Гц), 5,95 (1H, с), 6,68 (1H, с), 6,80-7,02 (6H, м), 7,12-7,21 (4H, м), 8,05 (1H, с).
MS m/z: 547 (M++H).
Пример 186: 5-Хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]-2-(3,4-диметоксибензиламино)пиридин
[Химическая формула 66]
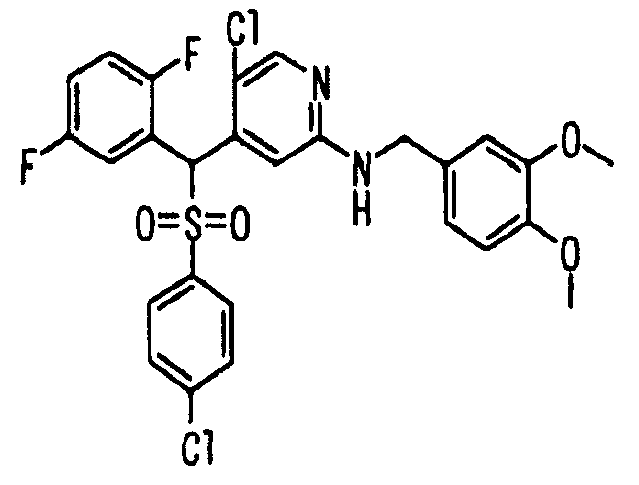
К раствору 5-хлор-4-[(4-хлорфенилтио) (2,5-дифторфенил)метил]-2-(3,4-диметоксибензиламино)пиридина (131 мг, 0,239 ммоль) в метаноле (6 мл) добавляли при охлаждении льдом 30% водный раствор перекиси водорода (3 мл) и тетрагидрат гексааммонийгептамолибдата (31 мг). Реакционную смесь перемешивали при комнатной температуре в течение 16 часов, затем метанол отгоняли при пониженном давлении. К полученному остатку добавляли этилацетат. Полученную смесь промывали последовательно насыщенным раствором бикарбоната натрия, водным раствором тиосульфата натрия и насыщенным солевым раствором, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью 35% этилацетата/гексан, концентрировали при пониженном давлении с получением указанного в заголовке соединения (75 мг, 0,129 ммоль, 54%) в виде белого твердого вещества. Полученное белое твердое вещество промывали простым эфиром-гексаном и фильтровали с получением указанного в заголовке соединения в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 3,89 (6H, с), 4,48-4,51 (2H, м), 5,08-5,15 (1H, м), 6,12 (1H, с), 6,85-7,05 (5H, м), 7,24 (1H, с), 7,28-7,35 (1H, м), 7,40 (2H, д, J=8,5 Гц), 7,55 (2H, д, J=8,5 Гц), 8,01 (1H, с).
Т.пл.: 204-206°C.
Элементный анализ для C27H22N2O4Cl2F2S. Рассчитано: C,55,97; H,3,83; N,4,83; Cl,12,24; F,6,56; S,5,53. Найдено: C,56,05; H,3,82; N,4,87; Cl,12,30; F,6,60; S,5,73.
Пример 187: 5-Хлор-4-[(4-хлорфенилтио)(2,5-дифторфенил)-метил]-2-[(пиридин-4-илметил)амино]пиридин
[Химическая формула 67]
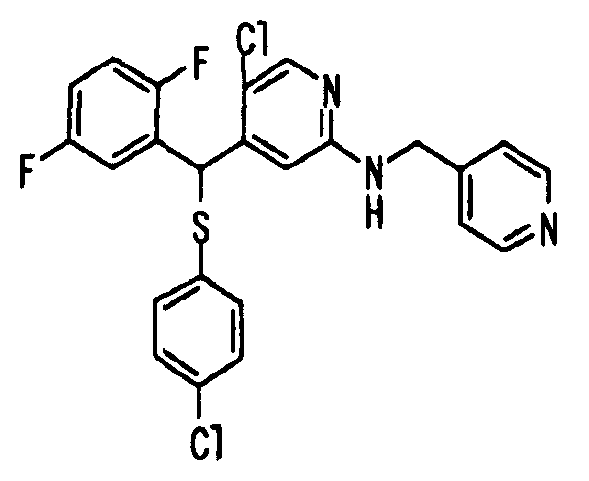
Раствор 2,5-дихлор-4-[(4-хлорфенилтио) (2,5-дифторфенил)метил]пиридина (229 мг, 0,550 ммоль), полученного в примере 54, и 4-аминометилпиридина (200 мкл) в диоксане (1,5 мл) нагревали при 120°C в течение 3 дней в герметично закрытой пробирке. Реакционную смесь охлаждали до комнатной температуры и затем концентрировали при пониженном давлении. Полученный остаток подвергали колоночной хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=1:3, концентрировали при пониженном давлении с получением указанного в заголовке соединения (37 мг, 0,076 ммоль, 14%) в виде аморфного вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 4,55 (2H, д, J=6,1 Гц), 5,06 (1H, т, J=6,0 Гц), 5,94 (1H, с), 6,61 (1H, с), 6,90-7,09 (3H, м), 7,13-7,30 (6H, м), 8,05 (1H, с), 8,55 (2H, д, J=6,1 Гц).
MS m/z: 488 (M++H).
Пример 188: 5-Хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]-2-[(пиридин-4-илметил)амино]пиридин
[Химическая формула 68]
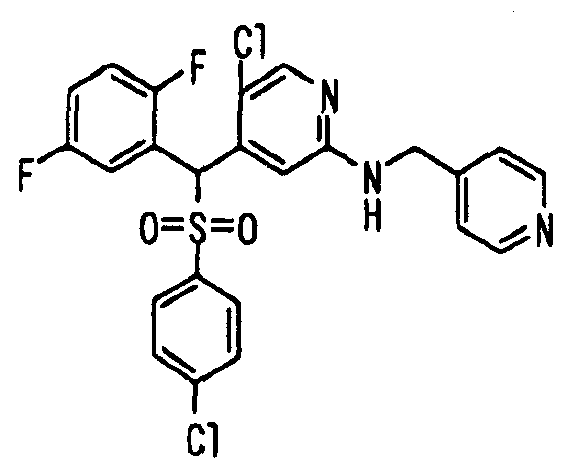
К раствору 5-хлор-4-[(4-хлорфенилтио)(2,5-дифторфенил)метил]-2-[(пиридин-4-илметил)амино]пиридина (35 мг, 0,072 ммоль) в метаноле (2 мл) добавляли при охлаждении льдом 30% водный раствор перекиси водорода (3 мл) и тетрагидрат гексааммонийгептамолибдата (23 мг). Реакционную смесь перемешивали при комнатной температуре в течение 22 часов, затем метанол отгоняли при пониженном давлении. К полученному остатку добавляли этилацетат. Полученную смесь промывали последовательно насыщенным раствором бикарбоната натрия, водным раствором тиосульфата натрия и насыщенным солевым раствором, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали колоночной хроматографии на силикагеле. Фракцию, полученную при элюировании смесью метанол:метиленхлорид=1:30, концентрировали при пониженном давлении с получением бледно-желтого твердого вещества. Полученное бледно-желтое твердое вещество промывали простым эфиром-гексаном и фильтровали с получением указанного в заголовке соединения (16 мг, 0,031 ммоль, 43%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 4,63 (2H, дд, J=6,1, 2,9 Гц), 5,20 (1H, т, J=6,4 Гц), 6,11 (1H, с), 6,87-6,95 (1H, м), 6,99-7,08 (1H, м), 7,25 (1H, с), 7,30 (2H, д, J=6,0 Гц), 7,35-7,40 (1H, м), 7,42 (2H, д, J=8,9 Гц), 7,56 (2H, д, J=8,9 Гц), 8,02 (1H, с), 8,59 (2H, д, J=6,0 Гц).
Т.пл.: 141-142°C.
FAB-MS: 520,0465 (Рассчитано для C24H18O2N3Cl2F2S: 520,0461).
Пример 189: N-[3-[[5-Хлор-4-[(4-хлорфенилсульфонил)-(2,5-дифторфенил)метил]пиридин-2-ил]амино]пропил]метансульфонамид
[Химическая формула 69]
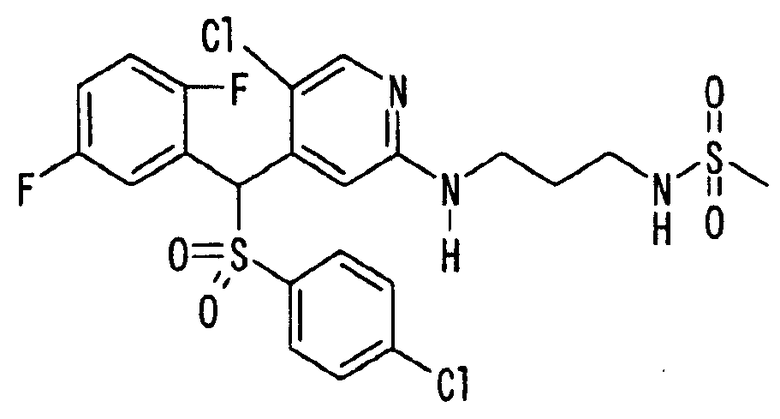
К раствору дигидрохлорида N-[5-хлор-4-[(4-хлорфенилсульфонил)-(2,5-дифторфенил)метил]пиридин-2-ил]пропан-1,3-диамина (60 мг, 0,107 ммоль), полученного в примере 173, в метиленхлориде (5,0 мл) добавляли триэтиламин (70 мкл, 0,05 ммоль) и метансульфонилхлорид (10 мкл, 0,13 ммоль). Полученную смесь перемешивали в течение 20 минут. К реакционной смеси добавляли эфир (50 мл). Полученную смесь промывали водой и насыщенным солевым раствором, сушили и концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат=2:1) с получением указанного в заголовке соединения (60 мг, 99%). Это соединение кристаллизовали в этаноле с получением белого твердого вещества (46 мг).
1H-ЯМР (400 МГц, CDCl3)δ: 1,86 (2H, квинтет, J=6,0 Гц), 2,95 (3H, с), 3,21 (2H, кв, J=6,0 Гц), 3,55 (2H, кв, J=6,0 Гц), 4,99 (1H, шир.), 5,65 (1H, шир.), 6,11 (1H, с), 6,91 (1H, м), 7,03 (1H, м), 7,29 (1H, с), 7,44 (2H, д, J=8,8 Гц), 7,49 (1H, м), 7,60 (2H, д, J=8,8 Гц), 8,00 (1H, с).
Т.пл.: 138-139°C.
Элементный анализ для C22H21Cl2F2N3O4S2. Рассчитано: C,46,81; H,3,75; N,7,44; S,11,36.; F,6,73; Cl,12,56; Найдено: C,46,81; H,3,72; N,7,43; S,11,39; F,6,80; Cl,12,41.
Пример 190: 1-[5-Хлор-4-[(4-хлорфенилсульфонил)-(2,5-дифторфенил)метил]пиридин-2-ил]тетрагидропиримидин-2-он
[Химическая формула 70]
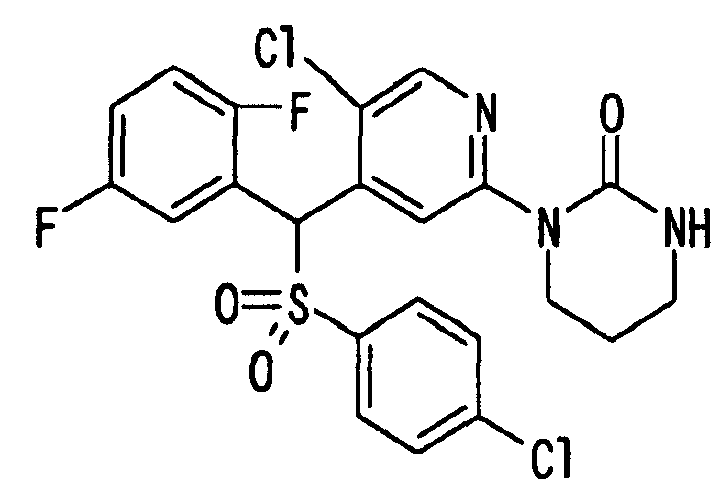
К раствору дигидрохлорида N-[5-хлор-4-[(4-хлорфенилсульфонил)-(2,5-дифторфенил)метил]пиридин-2-ил]пропан-1,3-диамина (51 мг, 0,091 ммоль), полученного в примере 173, в метиленхлориде (5,0 мл) добавляли триэтиламин (51 мкл, 0,36 ммоль) и 1,1'-карбонилдиимидазол (16,2 мг, 0,10 ммоль). Полученную смесь перемешивали в течение 17 часов. К реакционной смеси добавляли этилацетат (80 мл). Полученную смесь промывали водой и насыщенным солевым раствором, сушили и концентрировали при пониженном давлении. Полученный остаток растворяли в диметилформамиде (1,0 мл). К полученному раствору добавляли карбонат калия (27,2 мг, 0,2 моль) с последующим перемешиванием при нагревании при 50°C в течение 24 часов. После охлаждения до комнатной температуры к реакционной смеси добавляли воду. Полученную смесь разбавляли этилацетатом (60 мл). Органический слой, полученный путем отделения, промывали насыщенным солевым раствором, сушили и концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат=1:2) с получением указанного в заголовке соединения (15 мг, 99%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 2,12 (2H, м), 3,46 (2H, м), 3,99 (2H, м), 5,22 (1H, шир.), 6,26 (1H, с), 6,96 (1H, м), 7,03 (1H, м), 7,43 (2H, д, J=8,8 Гц), 7,68 (1H, м), 7,76 (2H, д, J=8,8 Гц), 8,23 (1H, с), 8,93 (1H, с).
MS m/z: 512 (M++H).
Т.пл.: >230°C.
Пример 191: трет-Бутил 2-[[5-хлор-4-[(4-хлорфенилтио)-(2,5-дифторфенил)метил]пиридин-2-ил]амино]этилкарбамат
[Химическая формула 71]
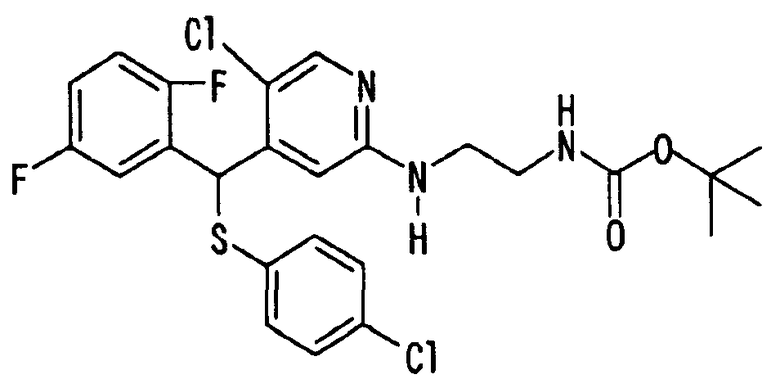
Раствор 2,5-дихлор-4-[(4-хлорфенилтио)-(2,5-дифторфенил)метил]пиридина (610 мг, 1,46 ммоль), полученного в примере 54, и трет-бутил (2-аминоэтил)карбамата (700 мг, 4,38 ммоль) в 1,4-диоксане (6,0 мл) перемешивали при 120°C в течение 4 дней в атмосфере аргона. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле (гексан:этилацетат=4:1) с получением указанного в заголовке соединения (176 мг, 22%) в виде масла.
1H-ЯМР (400 МГц, CDCl3)δ: 1,43 (9H, с), 3,36 (2H, м), 3,42 (2H, м), 5,01 (1H, шир.), 5,12 (1H, шир.), 5,95 (1H, с), 6,90-7,04 (2H, м), 7,13 (1H, м), 7,21 (2H, д, J=8,4 Гц), 7,23 (2H, д, J=8,4 Гц), 8,00 (1H, с).
MS m/z: 540 (M++H).
Пример 192: трет-Бутил 2-[[5-хлор-4-[(4-хлорфенилсульфонил)-(2,5-дифторфенил)метил]пиридин-2-ил]амино]этилкарбамат
[Химическая формула 72]
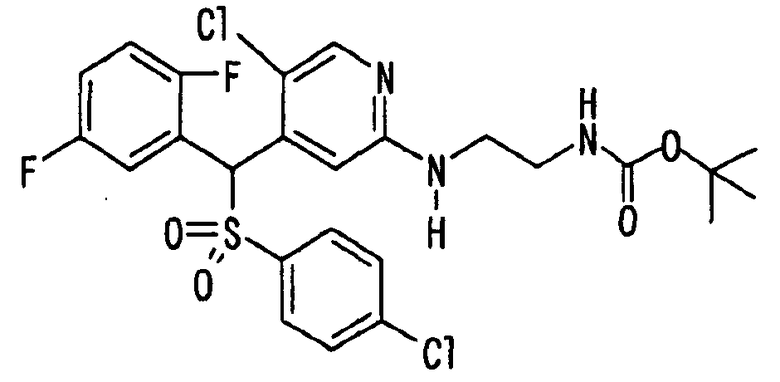
К раствору трет-бутил 2-[[5-хлор-4-[(4-хлорфенилтио)-(2,5-дифторфенил)метил]пиридин-2-ил]амино]этилкарбамата (176 мг, 0,32 ммоль) в метаноле (6 мл) добавляли тетрагидрат гексааммонийгептамолибдата (30 мг), а затем добавляли 30% водный раствор перекиси водорода (3 мл). Полученную смесь перемешивали в течение 20 часов. Реакционную смесь разбавляли этилацетатом (80 мл), затем разбавленную смесь промывали водой и насыщенным солевым раствором и концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат=3:1) с получением указанного в заголовке соединения (148 мг, 81%) в виде масла.
1H-ЯМР (400 МГц, CDCl3)δ: 1,45 (9H, с), 3,39 (2H, м), 3,49 (2H, м), 5,03 (1H, шир.), 5,29 (1H, шир.), 6,12 (1H, с), 6,91 (1H, м), 7,03 (1H, м), 7,24 (1H, с), 7,43 (2H, д, J=8,8 Гц), 7,52 (1H, м), 7,61 (2H, д, J=8,8 Гц), 7,98 (1H, с).
MS m/z: 572 (M++H).
Пример 193: Дигидрохлорид N-[5-хлор-4-[(4-хлорфенилсульфонил)-(2,5-дифторфенил)метил]пиридин-2-ил]этан-1,2-диамина
[Химическая формула 73]
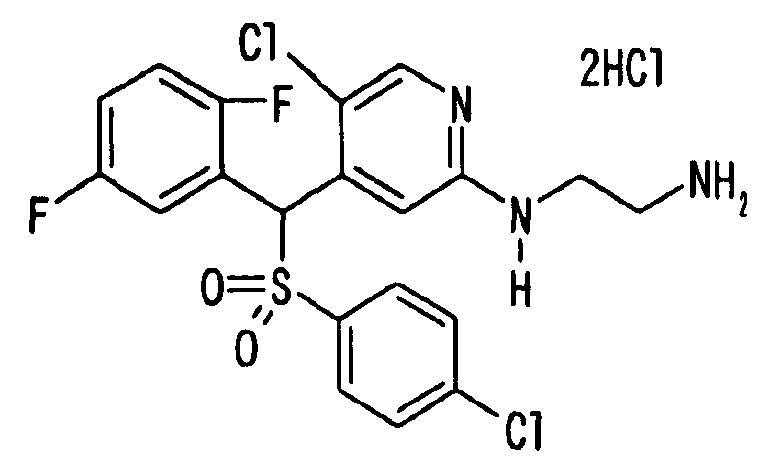
К трет-бутил 2-[[5-хлор-4-[(4-хлорфенилсульфонил)-(2,5-дифторфенил)метил]пиридин-2-ил]амино]этилкарбамату (146 мг, 0,25 ммоль) добавляли раствор 20% хлористоводородной кислоты в метаноле (1 мл). Полученную смесь перемешивали в течение 1 часа. Остаток, полученный концентрацией реакционной смеси при пониженном давлении, кристаллизовали из этанола с получением указанного в заголовке соединения (106 мг, 76%).
1H-ЯМР (400 МГц,DMSO-d6)δ: 2,99 (2H, м), 3,51 (2H, м), 6,17 (1H, с), 7,28 (1H, м), 7,38 (1H, м), 7,39 (1H, с), 7,52 (1H, м), 7,69 (2H, д, J=8,8 Гц), 7,75 (2H, д, J=8,8 Гц), 8,04 (1H, с).
Т.пл.: 163-166°C.
Элементный анализ для C20H17Cl2F2N3O2S·2HCl·0,5H2O. Рассчитано: C,43,34; H,3,64; N,7,58; S,5,78; Cl,25,59; F,6,86. Найдено: C,43,32; H,3,55; N,7,67; S,5,83; Cl,25,84; F,6,87.
Пример 194: 3-[5-Хлор-4-[(4-хлорфенилтио)(2,5-дифторфенил)метил]пиридин-2-иламино]-2,2-диметилпропан-1-ол
[Химическая формула 74]
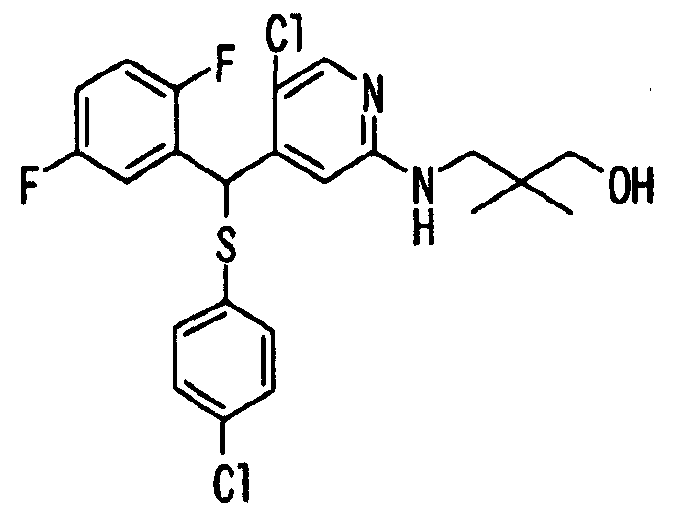
Раствор 2,5-дихлор-4-[(4-хлорфенилтио)(2,5-дифторфенил)метил]пиридина (191 мг, 0,458 ммоль), полученного в примере 54, и 3-амино-2,2-диметилпропан-1-ола (515 мг, 5,00 ммоль) в диоксане (1,5 мл) нагревали при 120°C в течение 3 дней в герметично закрытой пробирке. Реакционную смесь охлаждали до комнатной температуры и затем концентрировали при пониженном давлении. К полученному остатку добавляли этилацетат. Полученную смесь промывали последовательно водой и насыщенным солевым раствором, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали колоночной хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=3:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (199 мг, 0,412 ммоль, 90%) в виде аморфного вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 0,91 (6H, с), 3,12-3,28 (4H, м), 4,73 (1H, т, J=6,4 Гц), 4,87 (1H, шир. с), 5,92 (1H, с), 6,62 (1H, с), 6,92-7,07 (2H, м), 7,16-7,32 (5H, м), 7,96 (1H, м).
MS m/z: 483 (M++H).
Пример 195: 3-[5-Хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-иламино]-2,2-диметилпропан-1-ол
[Химическая формула 75]
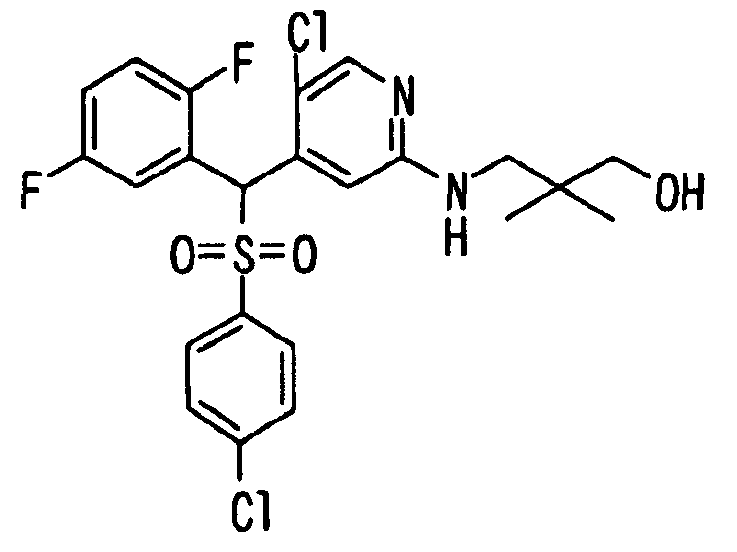
К раствору 3-[5-хлор-4-[(4-хлорфенилтио)(2,5-дифторфенил)метил]пиридин-2-иламино]-2,2-диметилпропан-1-ола (188 мг, 0,389 ммоль) в метаноле (6 мл) добавляли при охлаждении льдом 30% водный раствор перекиси водорода (3 мл) и тетрагидрат гексааммонийгептамолибдата (35 мг). Полученную смесь перемешивали при комнатной температуре в течение 13 часов, затем метанол отгоняли при пониженном давлении. К полученному остатку добавляли этилацетат. Полученную смесь промывали последовательно насыщенным раствором бикарбоната натрия, водным раствором тиосульфата натрия и насыщенным солевым раствором, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали колоночной хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=3:1, концентрировали при пониженном давлении с получением белого твердого вещества. Полученное белое твердое вещество отверждали при помощи простого эфира-гексана, промывали и собирали фильтрованием с получением указанного в заголовке соединения (156 мг, 0,303 ммоль, 78%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 0,94 (3H, с), 0,95 (3H, с), 3,20 (2H, д, J=6,6 Гц), 3,27 (2H, д, J=7,1 Гц), 4,68 (1H, шир. с), 4,94 (1H, т, J=6,9 Гц), 6,09 (1H, с), 6,86-6,95 (1H, м), 7,00-7,09 (1H, м), 7,29 (1H, с), 7,40-7,52 (3H, м), 7,60 (2H, д, J=8,6 Гц), 7,94 (1H, с).
Т.пл.: 176-178°C
Элементный Анализ для C23H22N2O3Cl2F2S. Рассчитано: C,53,60; H,4,30; N,5,44; Cl,13,76; F,7,37; S,6,22. Найдено: C,53,50; H,4,26; N,5,44; Cl,13,78; F,7,31; S,6,30.
Пример 196: [5-Хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]амин
[Химическая формула 76]
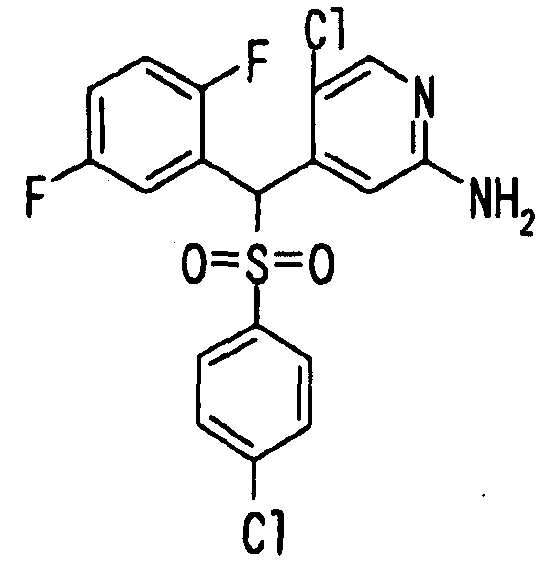
К раствору 5-хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]-2-(3,4-диметоксибензиламино)пиридина (43 мг, 0,074 ммоль), полученного в примере 186, в смеси ацетонитрил (4 мл)/вода (1 мл) добавляли при охлаждении льдом диаммонийнитрат (100 мг) церия (IV). Полученную смесь перемешивали в течение 1,5 часов. К реакционной смеси добавляли насыщенный раствор бикарбоната натрия, затем экстрагировали метиленхлоридом. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток очищали тонкослойной хроматографией на силикагеле (гексан:этилацетат=3:1) с получением указанного в заголовке соединения (12 мг, 0,028 ммоль, 38%) в виде бледного желтовато-белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 4,65 (2H, шир. с), 6,13 (1H, с), 6,89-6,98 (1H, м), 7,00-7,09 (1H, м), 7,33 (1H, с), 7,44 (2H, д, J=8,8 Гц), 7,49-7,57 (1H, м), 7,62 (2H, д, J=8,8 Гц), 7,99 (1H, с).
Т.пл.: 147-150°C.
MS m/z: 429 (M++H).
Элементный Анализ для C18H12N2O2Cl2F2S. Рассчитано: C,50,36; H,2,82; N,6,53; Cl,16,52; F,8,85; S,7,47. Найдено: C,50,46; H,2,68; N,6,63; Cl,16,42; F,9,00; S,7,66.
Пример 197: N-[5-Хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]метансульфонамид
[Химическая формула 77]
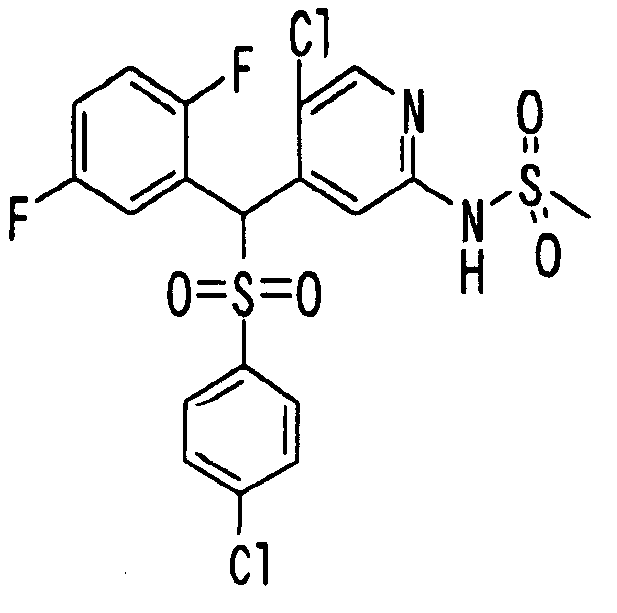
К раствору [5-хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]амина (106 мг, 0,247 ммоль), полученного в примере 196, в пиридине (2 мл) добавляли при охлаждении льдом метансульфонилхлорид (29 мкл, 0,370 ммоль). Смесь перемешивали при комнатной температуре в течение 3 дней и концентрировали при пониженном давлении. К полученному остатку добавляли этилацетат. Полученную смесь промывали последовательно насыщенным водным раствором бикарбоната натрия, водой и насыщенным солевым раствором, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=3:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (58 мг, 0,114 ммоль, 46%) в виде белого твердого вещества. Полученное белое твердое вещество промывали смесью гексан - простой эфир и собирали фильтрованием с получением указанного в заголовке соединения (28 мг) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 3,35 (3H, с), 6,19 (1H, с), 6,90-6,99 (1H, м), 7,01-7,10 (1H, м), 7,42-7,53 (3H, м), 7,60-7,70 (3H, м), 7,97 (1H, с), 8,32 (1H, с).
Т.пл.: 220-222°C.
MS m/z: 507 (M++H).
FAB-MS: 506,9824 (рассчитано для C19H15O4N2Cl2F2S2: 506,9818).
Элементный Анализ для C19H14N2O4Cl2F2S2. Рассчитано: C,44,98; H,2,78; N,5,52; Cl,13,98; F,7,49; S,12,64. Найдено: C,45,35; H,2,85; N,5,63; Cl,13,49; F,7,34; S,12,69.
Ссылочный Пример 35: 5-Фторпиридин-2-карбонитрил
[Химическая формула 78]
К смеси фтористый водород-пиридин (100 мл) добавляли при охлаждении льдом 5-амино-2-цианопиридин (24,5 г, 0,206 моль). Полученную смесь перемешивали в течение 10 минут. К реакционной смеси добавляли нитрит натрия (15,6 г, 0,226 моль). Полученную смесь перемешивали при комнатной температуре в течение 10 минут, а затем перемешивали при 50°C в течение 2 часов. К реакционной смеси добавляли 20% водный раствор гидроксида натрия. Смесь экстрагировали диэтиловым эфиром. Полученный органический слой сушили над сульфатом натрия и концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=3:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (16,0 г, 0,131 ммоль, 64%) в виде игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3)δ: 7,57 (1H, ддд, J=8,6, 8,6, 3,1 Гц), 7,77 (1H, дд, J=8,6, 4,4 Гц), 8,60 (1H, д, J=3,1 Гц).
ИК (ATR) см-1: 3095, 2237, 1577, 1467, 1409, 1375, 1272, 1240, 1197, 1120, 1010.
MS m/z: 122 (M+).
EI-MS: 122,0293 (Рассчитано для C6H3FN2: 122,0280).
Ссылочный Пример 36: 2-(1,3-диоксолан-2-ил)-5-фторпиридин
[Химическая формула 79]
Гидрид диизобутилалюминия (1,01M раствор в гексане, 58 мл, 58,9 ммоль) добавляли по каплям к раствору 5-фторпиридин-2-карбонитрила (6,54 г, 53,8 ммоль) в дихлорметане (150 мл) при -75°C в атмосфере аргона. Реакционную смесь перемешивали в течение 3 часов. При указанной температуре добавляли раствор хлористоводородной кислоты (80 мл) (концентрированная хлористоводородная кислота:вода=1:3), а затем смесь нагревали до комнатной температуры. Из реакционной смеси отделяли дихлорметановый слой. К водному слою затем добавляли бикарбонат натрия. Смесь экстрагировали диэтиловым эфиром. Полученный органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Дихлорметановый слой, полученный ранее, промывали водой, сушили над сульфатом магния и концентрировали при пониженном давлении.
К раствору объединенных остатков в бензоле (150 мл) добавляли моногидрат п-толуолсульфоновой кислоты (1,02 г, 5,36 ммоль) и этиленгликоль (30 мл, 0,536 моль). Полученную смесь перемешивали в течение 2 часов при нагревании и кипячении с обратным холодильником. После охлаждения добавляли насыщенный водный раствор бикарбоната натрия и смесь экстрагировали диэтиловым эфиром. Экстракт промывали насыщенным солевым раствором. Полученный органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=4:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (3,33 г, 19,7 ммоль, 37%) в виде красновато-коричневого масла.
1H-ЯМР (400 МГц, CDCl3)δ: 4,02-4,21 (4H, м), 5,85 (1H, с), 7,45 (1H, ддд, J=8,3,8,3,2,9 Гц), 7,57 (1H, дд, J=8,3,4,5 Гц), 8,48 (1H, д, J=2,9 Гц).
MS m/z: 170 (M++H).
Ссылочный Пример 37: 4-[(2,5-Дифторфенил)гидроксиметил]-2-(1,3-диоксолан-2-ил)-5-фторпиридин
[Химическая формула 80]
Диизопропиламид лития (1,8M раствор в гептане, 12 мл, 21,5 ммоль) добавляли при -75°C в атмосфере аргона к раствору 2-(1,3-диоксолан-2-ил)-5-фторпиридина (690 мг, 4,08 ммоль) в тетрагидрофуране (100 мл). Полученную смесь перемешивали в течение 2 часов. К реакционной смеси добавляли по каплям 2,5-дифторбензальдегид (2,1 мл, 19,5 ммоль) с последующим перемешиванием в течение 2,5 часов. К реакционной смеси добавляли воду и насыщенный водный раствор бикарбоната натрия. Полученную смесь экстрагировали диэтиловым эфиром. Экстракт промывали насыщенным солевым раствором. Полученный органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат (=3:1), концентрировали при пониженном давлении с получением указанного в заголовке соединения (2,53 г, 8,03 ммоль, 73%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 2,65 (1H, д, J=4,6 Гц), 4,05-4,21 (4H, м), 5,84 (1H, с), 6,35 (1H, д, J=4,6 Гц), 6,96-7,05 (2H, м), 7,09-7,26 (1H, м), 7,76 (1H, д, J=5,9 Гц), 8,40 (1H, д, J=1,5 Гц).
MS m/z: 312 (M++H).
Пример 198: 4-[(4-Хлорфенилтио)(2,5-дифторфенил)метил]-2-(1,3-диоксолан-2-ил)-5-фторпиридин
[Химическая формула 81]
Триэтиламин (1,7 мл, 12,0 ммоль) и метансульфонилхлорид (850 мкл, 10,4 ммоль) в атмосфере аргона добавляли при охлаждении льдом к раствору 4-[(2,5-дифторфенил)гидроксиметил]-2-(1,3-диоксолан-2-ил)-5-фторпиридина (2,5 г, 8,03 ммоль) в дихлорметане (30 мл). Полученную смесь перемешивали при комнатной температуре в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия, а затем экстрагировали диэтиловым эфиром. Экстракт промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении.
К раствору остатка в диметилформамиде (20 мл) добавляли 4-хлорбензолтиол (1,39 г, 9,64 ммоль) и карбонат калия (1,66 г, 12,0 ммоль). Полученную смесь перемешивали при 50°C в течение 3 часов. После охлаждения до комнатной температуры реакционную смесь разбавляли диэтиловым эфиром. Разбавленный раствор промывали последовательно водой и насыщенным солевым раствором. Полученный органический слой сушили над сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат (=4:1), концентрировали при пониженном давлении с получением указанного в заголовке соединения (2,86 г, 5,85 ммоль, 81%) в виде желтого масла.
1H-ЯМР (400 МГц, CDCl3)δ: 4,06-4,18 (4H, м), 5,82 (1H, с), 5,94 (1H, с), 6,96-7,03 (2H, м), 7,20-7,28 (5H, м), 7,71 (1H, д, J=5,9 Гц), 8,38 (1H, д, J=1,2 Гц).
MS m/z: 438 (M++H).
Пример 199: 4-[(4-Хлорфенилсульфонил)(2,5-дифторфенил)-метил]-2-(1,3-диоксолан-2-ил)-5-фторпиридин
[Химическая формула 82]
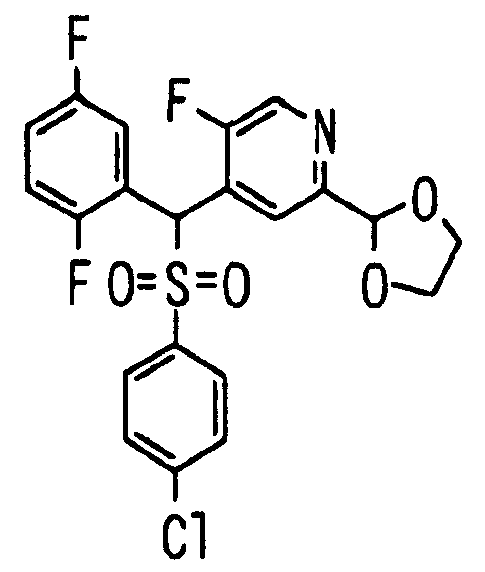
К раствору 4-[(4-хлорфенилтио)(2,5-дифторфенил)метил]-2-(1,3-диоксолан-2-ил)-5-фторпиридина (2,80 г, 6,39 ммоль) в метаноле (50 мл) добавляли тетрагидрат гексааммонийгептамолибдата (200 мг) и 30% водный раствор перекиси водорода (30 мл). Полученную смесь перемешивали в течение 3 часов. К реакционной смеси добавляли воду. Осажденное таким образом твердое вещество собирали фильтрованием и затем промывали водой. Полученное твердое вещество растворяли в этилацетате. Раствор промывали водой и насыщенным солевым раствором. Органический слой концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат (=3:1), концентрировали при пониженном давлении с получением указанного в заголовке соединения (1,39 г, 2,96 ммоль, 46%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 4,08-4,28 (4H, м), 4,08-4,28 (4H, м), 5,88 (1H, с), 6,10 (1H, с), 6,94-7,00 (1H, м), 7,03-7,10 (1H, м), 7,43 (2H, д, J=8,3 Гц), 7,62 (2H, д, J=8,3 Гц), 7,66-7,70 (1H, м), 8,17 (1H, д, J=5,9 Гц), 8,41 (1H, с).
MS m/z: 470 (M++H).
Пример 200: [4-[(4-Хлорфенилсульфонил)(2,5-дифторфенил)-метил]-5-фторпиридин-2-ил]карбальдегид
[Химическая формула 83]
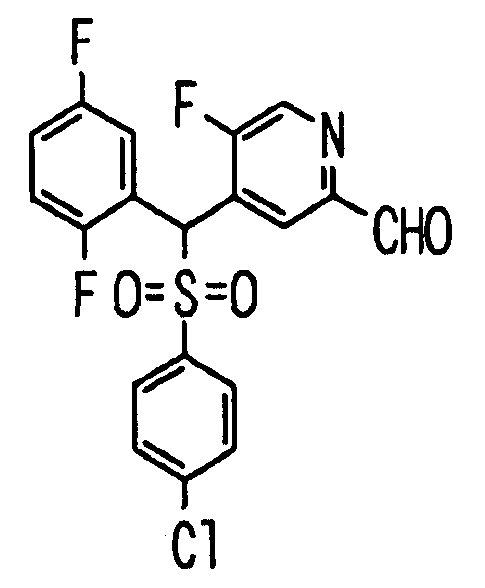
К раствору 4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]-2-(1,3-диоксолан-2-ил)-5-фторпиридина (2,60 г, 5,53 ммоль) в 1,4-диоксане (40 мл) добавляли концентрированную хлористоводородную кислоту (20 мл). Полученную смесь перемешивали при комнатной температуре в течение 5 часов. Растворитель концентрировали при пониженном давлении. К остатку добавляли этилацетат. Полученную смесь промывали последовательно водой, насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором. Полученный органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат (=3:1), концентрировали при пониженном давлении с получением указанного в заголовке соединения (1,86 г, 4,37 ммоль, 79%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 6,13 (1H, с), 6,93-6,99 (1H, м), 7,05-7,10 (1H, м), 7,45 (2H, д, J=7,8 Гц), 7,65 (2H, д, J=7,8 Гц), 7,70-7,75 (1H, м), 8,59 (1H, с), 8,60 (1H, с), 10,06 (1H, с).
MS m/z: 426 (M++H).
Пример 201: 4-[(4-Хлорфенилсульфонил)(2,5-дифторфенил)метил]-5-фторпиколиновая кислота
[Химическая формула 84]
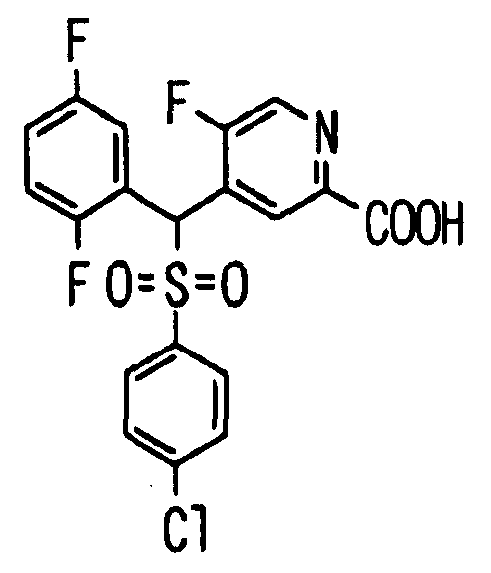
К раствору [4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]-5-фторпиридин-2-ил]карбальдегида (700 мг, 1,64 ммоль) в муравьиной кислоте (10 мл) добавляли 30% водный раствор перекиси водорода (562 мкл, 4,93 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 2,5 часов. К реакционной смеси добавляли воду. Осажденное таким образом твердое вещество собирали фильтрованием и промывали водой. Полученное твердое вещество растворяли в этилацетате. Раствор промывали последовательно насыщенным водным раствором хлорида аммония, водой и насыщенным солевым раствором. Полученный органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток перекристаллизовывали из этанола с получением указанного в заголовке соединения (656 мг, 1,48 ммоль, 91%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 6,14 (1H, с), 6,93-7,00 (1H, м), 7,05-7,11 (1H, м), 7,46 (2H, д, J=8,6 Гц), 7,67 (2H, д, J=8,6 Гц), 7,75-7,79 (1H, м), 8,47 (1H, с), 8,85 (1H, д, J=5,6 Гц).
ИК (ATR) см-1: 3288, 2942, 1751, 1722, 1693, 1608, 1575, 1492, 1398, 1326, 1290, 1241, 1182, 1147, 1089, 1043, 1014.
Т.пл.: 208-209°C.
MS m/z: 442 (M++H).
Элементный Анализ для C19H11ClF3NO4S·0,75H2O. Рассчитано: C,50,12; H,2,77; Cl,7,79; F,12,52; N,3,08; S,7,04. Найдено: C,50,49; H,2,97; Cl,7,53; F,12,02; N,3,11, S,6,89.
Пример 202: трет-Бутил [4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]-5-фторпиридин-2-ил]карбамат
[Химическая формула 85]
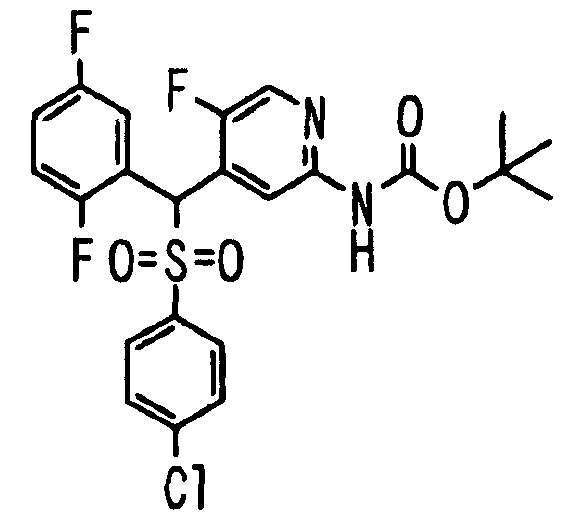
Дифенилфосфорилазид (162 мкл, 0,762 ммоль) и триэтиламин (151 мкл, 1,09 ммоль) в атмосфере аргона добавляли к раствору 4-[-хлорфенилсульфонил)(2,5-дифторфенил)метил]-5-фторпиколиновой кислоты (240 мг, 0,543 ммоль) в смеси трет-бутанола (2 мл) и толуола (5 мл). Реакционную смесь нагревали при кипячении с обратным холодильником в течение 15 часов. После охлаждения к реакционной смеси добавляли этилацетат. Полученную смесь промывали последовательно насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором. Полученный органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат (=4:1), концентрировали при пониженном давлении с получением указанного в заголовке соединения (181 мг, 0,353 ммоль, 65%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 1,57 (9H, с), 6,07 (1H, с), 6,93-6,99 (1H, м), 7,02-7,08 (1H, м), 7,43 (2H, д, J=8,6 Гц), 7,49 (1H, шир. с), 7,70 (2H, д, J=8,6 Гц), 7,71-7,75 (1H, м), 8,04 (1H, с), 8,65 (1H, д, J=4,9 Гц).
MS m/z: 442 (M+-tBu+2H).
Пример 203: [4-[(4-Хлорфенилсульфонил)(2,5-дифторфенил)метил]-5-фторпиридин-2-ил]амин
[Химическая формула 86]
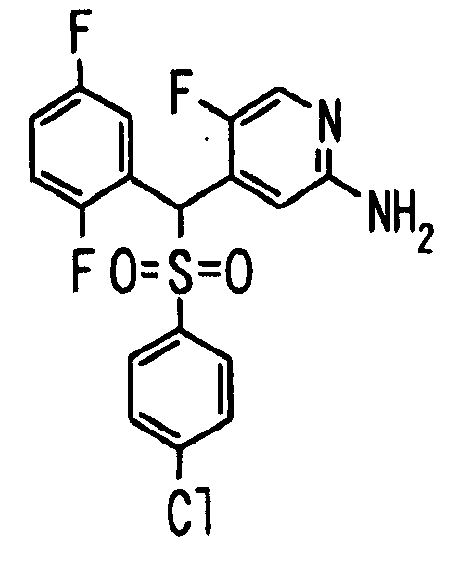
К раствору трет-бутил [4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]-5-фторпиридин-2-ил]карбамата (170 мг, 0,331 ммоль) в этаноле (5 мл) добавляли концентрированную хлористоводородную кислоту (5 мл). Полученную смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь концентрировали при пониженном давлении. К полученному остатку добавляли насыщенный водный раствор бикарбоната натрия и затем экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток перекристаллизовывали из гексана:этилацетата с получением указанного в заголовке соединения (110 мг, 0,266 ммоль, 81%) в виде светло-фиолетового порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 4,51 (2H, с), 5,99 (1H, с), 6,92-6,97 (1H, м), 7,02-7,08 (1H, м), 7,16 (1H, д, J=4,6 Гц), 7,44 (2H, д, J=8,6 Гц), 7,61-7,65 (1H, м), 7,63 (2H, д, J=8,6 Гц), 7,86 (1H, с).
ИК (ATR) см-1: 3645, 3174, 1631, 583, 1565, 1496, 1427, 1396, 1330, 1278, 1236, 1178, 1151, 1085, 1014.
Т.пл.: 181-183°C.
MS m/z: 413 (M++H).
Элементный Анализ для C18H12ClF3N2O2S. Рассчитано: C,52,37; H,2,93; Cl,8,59; F,13,81; N,6,79; S,7,77. Найдено: C,52,09; H,2,88; Cl,8,57; F,13,54; N,6,90; S,7,81.
Пример 204: N-[4-[(4-Хлорфенилсульфонил)(2,5-дифторфенил)-метил]-5-фторпиридин-2-ил]метансульфонамид
[Химическая формула 87]
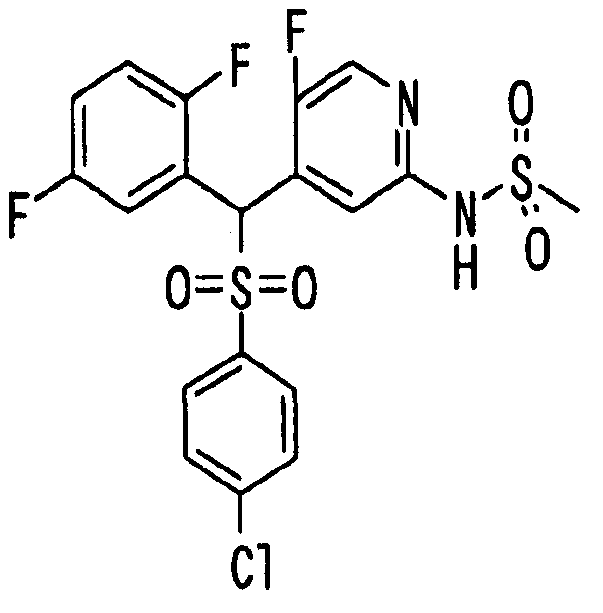
Метансульфонилхлорид (12 мкл, 0,157 ммоль) добавляли при охлаждении льдом к раствору [4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]-5-фторпиридин-2-ил]амина (54 мг, 0,131 ммоль) и пиридина (16 мкл, 0,197 ммоль) в метиленхлориде (5 мл). Полученную смесь перемешивали при комнатной температуре в течение 7 часов, а затем добавляли пиридин (16 мкл, 0,197 ммоль) и метансульфонилхлорид (12 мкл, 0,157 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 17 часов, затем к смеси добавляли пиридин (16 мкл, 0,197 ммоль) и метансульфонилхлорид (12 мкл, 0,157 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 2 часов и затем к смеси добавляли пиридин (16 мкл, 0,197 ммоль) и метансульфонилхлорид (12 мкл, 0,157 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 21 часов, затем к смеси добавляли пиридин (16 мкл, 0,197 ммоль) и метансульфонилхлорид (12 мкл, 0,157 ммоль). Смесь перемешивали при комнатной температуре в течение 2 часов и затем концентрировали при пониженном давлении. К полученному остатку добавляли этилацетат. Смесь промывали насыщенным водным раствором бикарбоната натрия, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат (=2:1), концентрировали при пониженном давлении с получением указанного в заголовке соединения (54 мг, 0,110 ммоль, 84%) в виде белого твердого вещества. Полученное белое твердое вещество промывали гексаном-простым эфиром и собирали фильтрованием с получением указанного в заголовке соединения в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 3,30 (3H, с), 6,06 (1H, с), 6,90-6,99 (1H, м), 7,02-7,10 (1H, м), 7,46 (2H, д,8,8 Гц), 7,58-7,69 (3H, м), 7,83-7,91 (2H, м), 8,21 (1H, с).
Т.пл.: 217-219°C.
MS m/z: 490 (M+).
EI-MS: 490,0008 (рассчитано для C19H14O4N2ClF3S2: 490,0036).
Элементный Анализ для C19H14N2O4ClF3S2. Рассчитано: C,46,49; H,2,87; N,5,71; Cl,7,22; F,11,61; S,13,06. Найдено: C,46,90; H,2,95; N,5,78; Cl,7,33; F,11,56; S,13,04.
Ссылочный Пример 38: (4-Бром-5-метилпиридин-2-ил)метанол
[Химическая формула 88]
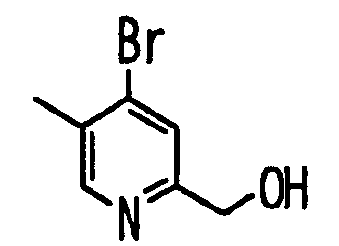
Трифторуксусный ангидрид (20,6 мл, 0,146 моль) добавляли в атмосфере аргона к раствору 4-бром-2,5-диметилпиридин 1-оксида (9,8 г, 48,5 ммоль) в дихлорметане (100 мл) при охлаждении льдом. Полученную смесь перемешивали в течение 20 минут, а затем перемешивали при комнатной температуре в течение 7,5 часов. Реакционную смесь концентрировали при пониженном давлении. К раствору остатка в дихлорметане (50 мл) добавляли насыщенный водный раствор (100 мл) бикарбоната натрия. Полученную смесь перемешивали в течение 14 часов. Реакционную смесь экстрагировали дихлорметаном. Экстракт сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток подвергали колоночной хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат (=1:1), концентрировали при пониженном давлении с получением указанного в заголовке соединения (8,17 г, 40,4 ммоль, 83%) в виде желтого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 2,38 (3H, с), 3,42 (1H, с), 4,71 (2H, с), 7,48 (1H, с), 8,35 (1H, с).
MS m/z: 202 (M++H).
Ссылочный Пример 39: 4-Бром-2-[(трет-бутилдиметилсилилокси)метил]-5-метилпиридин
[Химическая формула 89]
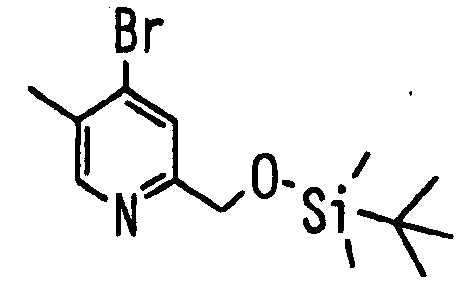
Имидазол (2,95 г, 43,3 ммоль), 4-диметиламинопиридин (481 мг, 3,94 ммоль) и трет-бутилхлордиметилсилан (6,53 г, 43,3 ммоль) в атмосфере азота добавляли к раствору (4-бром-5-метилпиридин-2-ил)метанола (7,96 г, 39,4 ммоль) в дихлорметане (100 мл) при охлаждении льдом. Полученную смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли воду, затем экстрагировали дихлорметаном. Экстракт сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток подвергали колоночной хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=4:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (12,4 г, 39,4 ммоль, колич.) в виде светло-желтого масла.
1H-ЯМР (400 МГц, CDCl3)δ: 0,12 (6H, с), 0,96 (9H, с), 2,36 (3H, с), 4,78 (2H, с), 7,67 (1H, с), 8,29 (1H, с).
MS m/z: 316 (M++H).
Ссылочный Пример 40: 2-[(трет-Бутилдиметилсилилокси)метил]-4-[(2,5-дифторфенил)-гидроксиметил]-5-метилпиридин
[Химическая формула 90]
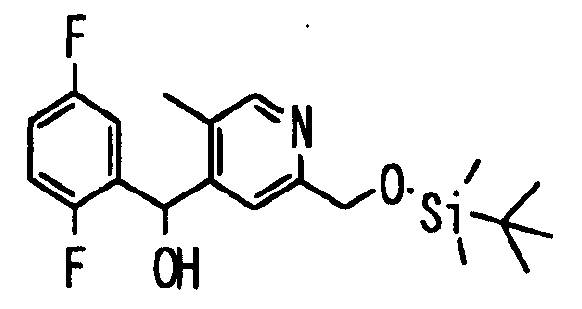
н-Бутиллитий (раствор 1,58M в гексане, 400 мкл, 0,632 ммоль) в атмосфере аргона добавляли к раствору 4-бром-2-[(трет-бутилдиметилсилилокси)метил]-5-метилпиридина (200 мг, 0,632 ммоль) в диэтиловом эфире (3 мл) при -78°C. Полученную смесь перемешивали в течение 1 часа. Добавляли по каплям 2,5-дифторбензальдегид (69 мкл, 0,632 ммоль), затем реакционную смесь перемешивали в течение 1 часа. К реакционной смеси добавляли воду и насыщенный водный раствор бикарбоната натрия, затем экстрагировали диэтиловым эфиром. Экстракт промывали насыщенным солевым раствором. Полученный органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=2:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (178 мг, 0,469 ммоль, 74%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 0,06 (3H, с), 0,09 (3H, с), 0,91 (9H, с), 2,26 (3H, с), 2,52 (1H, шир. с), 4,79 (2H, с), 6,24 (1H, с), 6,95-7,10 (3H, м), 7,58 (1H, с), 8,27 (1H, с).
MS m/z: 380 (M++H).
Пример 205: 2-[(трет-Бутилдиметилсилилокси)метил]-4-[(4-хлорфенилтио)(2,5-дифторфенил)метил]-5-метилпиридин
[Химическая формула 91]
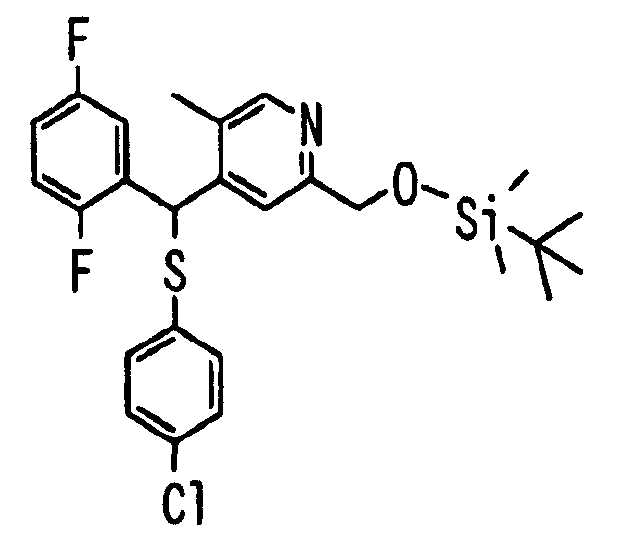
Триэтиламин (4,41 мл, 31,7 ммоль) и метансульфонилхлорид (2,2 мл, 27,4 ммоль) в атмосфере аргона добавляли при охлаждении льдом к раствору 2-[(трет-бутилдиметилсилилокси)метил]-4-[(2,5-дифторфенил)-гидроксиметил]-5-метилпиридина (8,0 г, 21,1 ммоль) в дихлорметане (100 мл). Полученную смесь перемешивали при комнатной температуре в течение 50 минут. К реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия, затем экстрагировали диэтиловым эфиром. Экстракт промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении.
К раствору остатка в диметилформамиде (100 мл) добавляли 4-хлорбензолтиол (3,66 г, 25,3 ммоль) и карбонат калия (4,38 г, 31,7 ммоль). Полученную смесь перемешивали при 50°C в течение 1,5 часов. После охлаждения до комнатной температуры реакционную смесь разбавляли диэтиловым эфиром. Разбавленный раствор промывали последовательно водой и насыщенным солевым раствором. Органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток подвергали колоночной хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=5:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (9,3 г, 18,4 ммоль, 87%) в виде светло-желтого масла.
1H-ЯМР (400 МГц, CDCl3)δ: 0,04 (3H, с), 0,08 (3H, с), 0,91 (9H, с), 2,33 (3H, с), 4,77 (2H, д, J=4,2 Гц), 5,83 (1H, с), 6,92-7,00 (2H, м), 7,20 (4H, с), 7,33-7,38 (1H, м), 7,56 (1H, с), 8,29 (1H, с).
MS m/z: 506 (M++H).
Пример 206: [4-[(4-Хлорфенилтио)(2,5-дифторфенил)метил]-5-метилпиридин-2-ил]метанол
[Химическая формула 92]
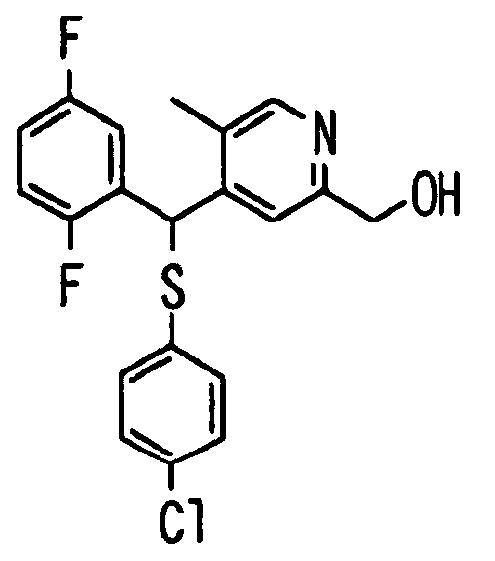
К раствору 2-[(трет-бутилдиметилсилилокси)метил]-4-[(4-хлорфенилтио)(2,5-дифторфенил)метил]-5-метилпиридина (200 мг, 0,395 ммоль) в тетрагидрофуране (3 мл) добавляли тетрабутиламмонийфторид (1,0 M раствор в тетрагидрофуране, 593 мкл, 0,593 ммоль). Полученную смесь перемешивали в течение 20 минут. К реакционной смеси добавляли воду, затем экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=3:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (150 мг, 0,384 ммоль, 97%) в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3)δ: 2,31 (3H, с), 3,54 (1H, шир. с), 4,72 (2H, с), 5,81 (1H, с), 6,94-7,03 (2H, м), 7,20 (4H, с), 7,22-7,28 (1H, м), 7,33 (1H, с), 8,35 (1H, с).
MS m/z: 392 (M++H).
Пример 207: [4-[(4-Хлорфенилсульфонил)(2,5-дифторфенил)метил]-5-метилпиридин-2-ил]метанол
[Химическая формула 93]
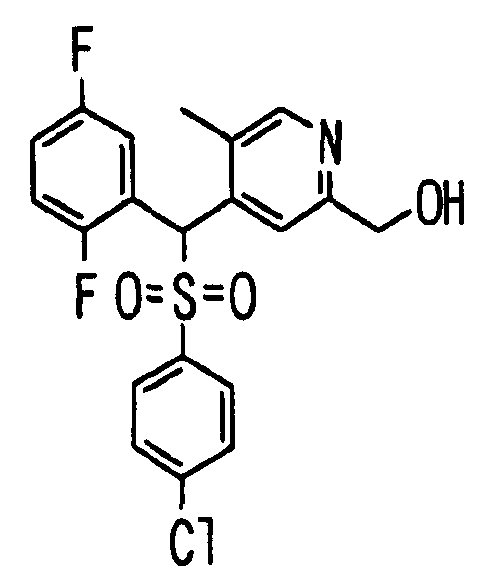
К раствору [4-[(4-хлорфенилтио)(2,5-дифторфенил)метил]-5-метилпиридин-2-ил]метанола (6,5 г, 16,6 ммоль) в метаноле (150 мл) добавляли тетрагидрат гексааммонийгептамолибдата (500 мг) и 30% водный раствор перекиси водорода (150 мл). Полученную смесь перемешивали в течение 23 часов. К реакционной смеси добавляли воду. Осажденное таким образом твердое вещество собирали фильтрованием и затем промывали водой. Твердое вещество растворяли в этилацетате. Полученный раствор промывали водой и насыщенным солевым раствором. Органический слой концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=1:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (4,0 г, 9,44 ммоль, 57%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 2,13 (3H, с), 3,53 (1H, шир. с), 4,80 (1H, д, J=14,4 Гц), 4,85 (1H, д, J=14,4 Гц), 5,88 (1H, с), 6,90-6,96 (1H, м), 7,01-7,07 (1H, м), 7,43 (2H, д, J=8,8 Гц), 7,60 (2H, д, J=8,8 Гц), 7,60 (2H, д, J=8,8 Гц), 7,63-7,67 (1H, м), 7,93 (1H, с), 8,36 (1H, с).
ИК (ATR) см-1: 3179, 1604, 1573, 1492, 1427, 1394, 1349, 1322, 1280, 1234, 1151, 1085, 039, 1010.
Т.пл.: 196-198°C.
MS m/z: 424 (M++H).
Элементный Анализ для C20H16ClF2NO3S. Рассчитано: C,56,67; H,3,80; Cl,8,36; F,8,96; N,3,30; S,7,56. Найдено: C,56,41; H,3,83; Cl,8,28; F,8,89; N,3,31; S,7,67.
Пример 208: [4-[(4-Хлорфенилсульфонил)(2,5-дифторфенил)-метил]-5-метилпиридин-2-ил]карбальдегид
[Химическая формула 94]
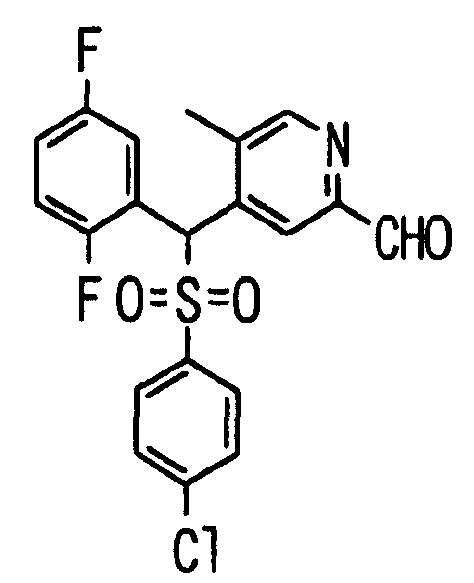
Диметилсульфоксид (164 мкл, 2,36 ммоль), триэтиламин (329 мкл, 2,36 ммоль) и комплекс триоксид серы-пиридин (255 мг, 1,42 ммоль) в атмосфере азота добавляли к раствору [4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]-5-метилпиридин-2-ил]метанола (200 мг, 0,472 ммоль) в дихлорметане (5 мл). Полученную смесь перемешивали при комнатной температуре в течение 16 часов. Реакционную смесь концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=3:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (160 мг, 0,379 ммоль, 80%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 2,29 (3H, с), 5,94 (1H, с), 6,92-6,97 (1H, м), 7,02-7,08 (1H, м), 7,43 (2H, д, J=8,8 Гц), 7,62 (2H, д, J=8,8 Гц), 7,70-7,75 (1H, м), 8,57 (1H, с), 8,59 (1H, с), 10,08 (1H, с).
MS m/z: 422 (M++H).
Пример 209: 4-[(4-Хлорфенилсульфонил)(2,5-дифторфенил)-метил]-5-метилпиколиновая кислота
[Химическая формула 95]
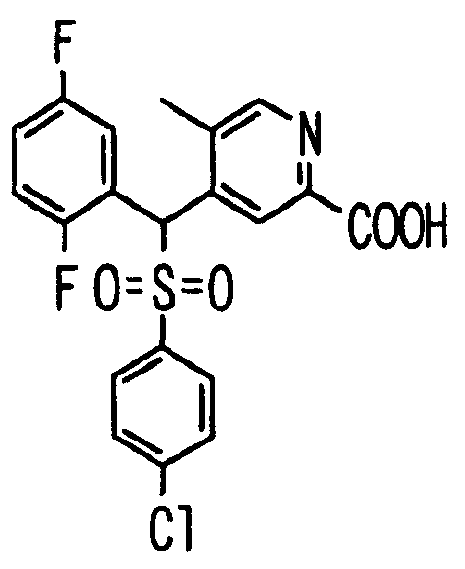
К раствору [4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]-5-метилпиридин-2-ил]карбальдегида (150 мг, 0,356 ммоль) в муравьиной кислоте (3 мл) добавляли 30% водный раствор перекиси водорода (121 мкл, 1,07 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 2 часов. К реакционной смеси добавляли воду. Осажденное таким образом твердое вещество собирали фильтрованием и промывали водой. Полученное твердое вещество растворяли в этилацетате. Раствор промывали последовательно водой и насыщенным солевым раствором. Органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток перекристаллизовывали из этанола с получением указанного в заголовке соединения (140 мг, 0,320 ммоль, 90%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 2,33 (3H, с), 5,96 (1H, с), 6,92-6,98 (1H, м), 7,02-7,08 (1H, с), 7,44 (2H, д, J=8,6 Гц), 7,64 (2H, д, J=8,6), 7,74-7,78 (1H, м), 8,45 (1H, с), 8,81 (1H, с).
ИК (ATR) см-1: 1922, 1683, 1598, 1488, 1450, 1428, 1396, 1375, 1326, 1290, 1236, 1174, 47, 1085, 1047, 1014.
Т.пл.: 105-107°C.
MS m/z: 438 (M++H).
Элементный Анализ для C20H14ClF2NO4S·0,75H2O. Рассчитано: C,53,22; H,3,46; Cl,7,85; F,8,42; N,3,10; S,7,10. Найдено: C,53,44; H,3,90; Cl,7,47; F,8,06; N,3,07; S,6,95.
Пример 210: трет-Бутил [4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]-5-метилпиридин-2-ил]карбамат
[Химическая формула 96]
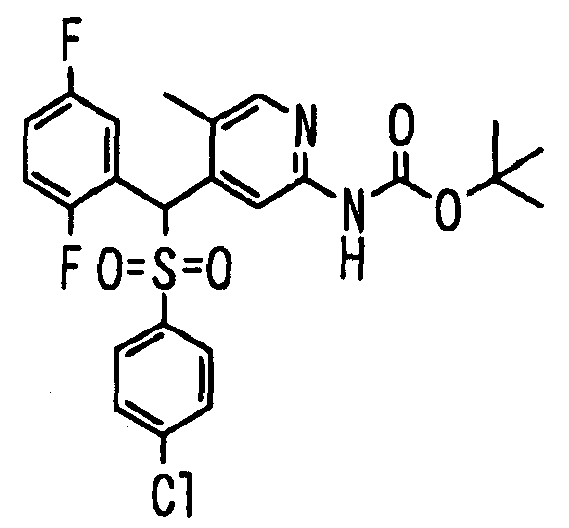
Дифенилфосфорилазид (2,9 мл, 13,6 ммоль) и триэтиламин (2,7 мл, 19,4 ммоль) в атмосфере аргона добавляли к раствору 4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]-5-метилпиколиновой кислоты (2,8 мг, 6,40 ммоль) в смеси трет-бутанола (20 мл) и толуола (40 мл). Полученную смесь перемешивали в течение 16 часов при нагревании и кипячении с обратным холодильником. После охлаждения к реакционной смеси добавляли этилацетат. Смесь промывали последовательно насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором. Органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток промывали последовательно гексаном и этилацетатом с получением указанного в заголовке соединения (2,60 г, 5,11 ммоль, 80%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 1,58 (9H, с), 2,07 (3H, с), 5,88 (1H, с), 6,92-6,98 (1H, м), 7,00-7,06 (1H, м), 7,42 (2H, д, J=8,8 Гц), 7,42 (2H, д, J=8,8 Гц), 7,57 (1H, шир. с), 7,67-7,72 (1H, м), 7,71 (2H, д, J=8,8 Гц), 8,02 (1H, с), 8,67 (1H, с).
MS m/z: 509 (M++H).
Пример 211: [4-[(4-Хлорфенилсульфонил)(2,5-дифторфенил)-метил]-5-метилпиридин-2-ил]амин
[Химическая формула 97]
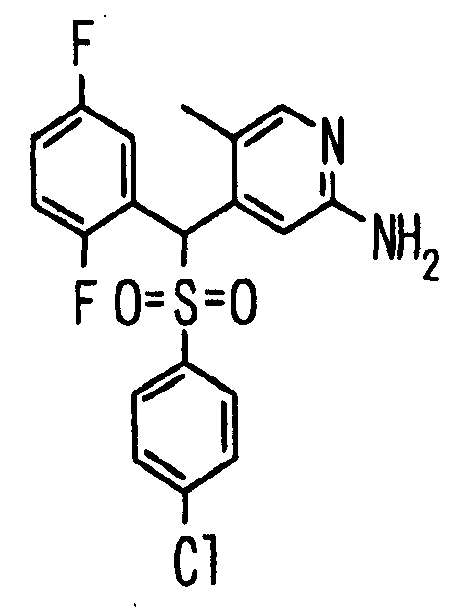
К раствору трет-бутил [4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]-5-метилпиридин-2-ил]карбамата (200 мг, 0,393 ммоль) в этаноле (5 мл) добавляли концентрированную хлористоводородную кислоту (6 мл). Полученную смесь перемешивали при комнатной температуре в течение 2,5 часов. Реакционную смесь концентрировали при пониженном давлении. К полученному остатку добавляли насыщенный водный раствор бикарбоната натрия, затем экстрагировали этилацетатом. Органический слой промывали последовательно водой и насыщенным солевым раствором, сушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток перекристаллизовывали из гексана:этилацетата с получением указанного в заголовке соединения (125 мг, 0,306 ммоль, 78%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 1,89 (3H, с), 5,95-5,96 (3H, м), 7,12 (1H, с), 7,22-7,34 (2H, м), 7,51-7,55 (1H, м), 7,65 (2H, д, J=8,8 Гц), 7,69 (1H, с), 7,78 (2H, д, J=8,8 Гц).
ИК (ATR) см-1: 3424, 1637, 1554, 1492, 1457, 1411, 1309, 1276, 1230, 1151, 1089, 1039, 1008.
Т.пл.: 188-189 °C.
Элементный Анализ для C19H15ClF2N2O2S. Рассчитано: C,55,82; H,3,70; Cl,8,67; F,9,29; N,6,85; S,7,84. Найдено: C,55,58; H,3,95; Cl,8,61; F,9,13; N,6,91; S,7,89.
Пример 212: N-[4-[(4-Хлорфенилсульфонил)(2,5-дифторфенил)-метил]-5-метилпиридин-2-ил]метансульфонамид
[Химическая формула 98]
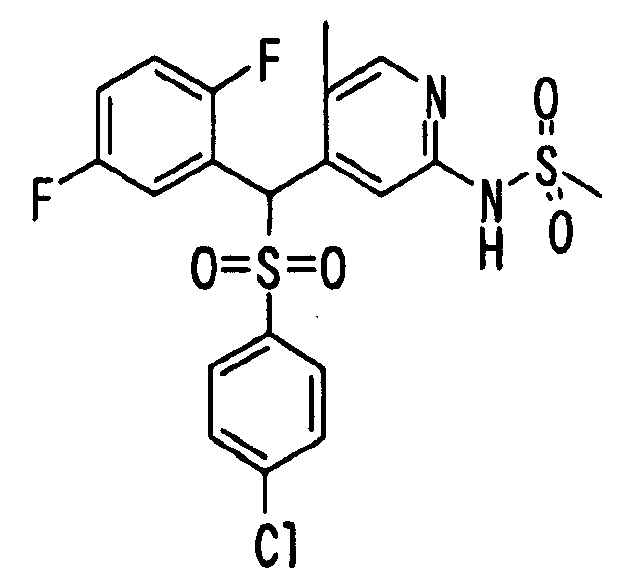
К раствору в метиленхлориде (5 мл) [4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]-5-метилпиридин-2-ил]амина (133 мг, 0,325 ммоль) и пиридина (39 мкл, 0,488 ммоль) добавляли при охлаждении льдом метансульфонилхлорид (28 мкл, 0,358 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2,5 часов. К реакционной смеси добавляли пиридин (26 мкл, 0,325 ммоль) и метансульфонилхлорид (25 мкл, 0,325 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 16 часов, затем к смеси добавляли пиридин (26 мкл, 0,325 ммоль) и метансульфонилхлорид (25 мкл, 0,325 ммоль). Смесь перемешивали при комнатной температуре в течение 1,5 часов. Реакционную смесь концентрировали при пониженном давлении. К полученному остатку добавляли этилацетат. Полученную смесь промывали последовательно водой и насыщенным солевым раствором, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=3:2, концентрировали при пониженном давлении с получением указанного в заголовке соединения (108 мг, 0,222 ммоль, 68%) в виде белого твердого вещества. Полученное белое твердое вещество промывали смесью гексан-простой эфир и собирали фильтрованием с получением указанного в заголовке соединения (67 мг) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 2,13 (3H, с), 3,29 (3H, с), 5,85 (1H, с), 6,89-6,99 (1H, м), 7,01-7,10 (1H, м), 7,45 (2H, д, J=8,3 Гц), 7,59-7,69 (3H, м), 7,90 (1H, с), 8,12 (1H, с).
Т.пл.: 214-217°C.
MS m/z: 486 (M+).
Элементный Анализ для C20H17N2O4ClF2S2. Рассчитано: C,49,33; H,3,52; N,5,75; Cl,7,28; F,7,80; S,13,17. Найдено: C,49,18; H,3,45; N,5,82; Cl,7,18; F,7,98; S,13,14.
Пример 213: 2,5-Дихлор-4-[(2,5-дифторфенил)-(4-фторфенилтио)метил]пиридин
[Химическая формула 99]
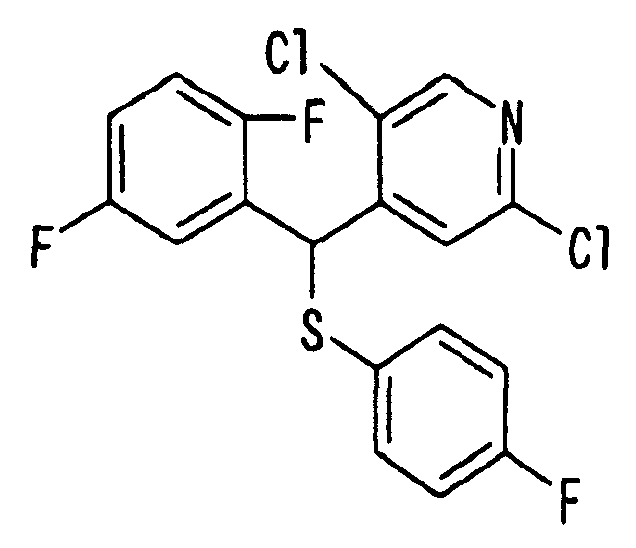
2,5-Дихлор-4-[(2,5-дифторфенил)-гидроксиметил]пиридин (1,22 г, 4,8 ммоль), полученный в ссылочном примере 24, растворяли в тионилхлориде (5,0 мл). К полученному раствору добавляли каталитическое количество диметилформамида и смесь перемешивали в течение 4 часов. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли 1,4-диоксан, а затем снова концентрировали.
Полученный остаток растворяли в диметилформамиде (10 мл). К полученному раствору в атмосфере азота добавляли 4-фторбензолтиол (730 мг, 5,7 ммоль) и карбонат калия (2,07 г, 15 ммоль). Смесь перемешивали при комнатной температуре в течение 24 часов. К реакционной смеси добавляли диэтиловый эфир (120 мл). Полученную смесь промывали водой и насыщенным солевым раствором. Органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток кристаллизовали в этаноле с получением указанного в заголовке соединения (95 мг, 49%) в виде игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3)δ: 5,92 (1H, с), 6,94-7,04 (4H, м), 7,19 (1H, м), 7,33-7,4 (2H, м), 7,57 (1H, с), 8,33 (1H, с).
ИК (ATR) см-1: 1571, 1489, 1329, 1222, 1157, 1109, 835.
Т.пл.: 95-97°C.
MS m/z: 400 (M++H).
Пример 214: [5-Хлор-4-[(2,5-дифторфенил)-(4-фторфенилсульфонил)метил]пиридин-2-ил] (3,4-диметоксибензил)амин
[Химическая формула 100]
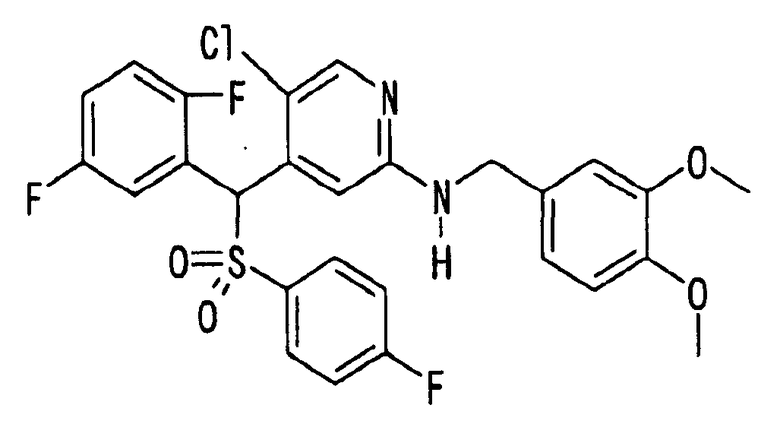
Раствор 2,5-дихлор-4-[(2,5-дифторфенил)-(4-фторфенилтио)метил]пиридина (740 мг, 1,85 ммоль) и 3,4-диметоксибензиламина (836 мкл, 5,55 ммоль) в 1,4-диоксане (3,0 мл) перемешивали при 120°C в течение 3 дней в атмосфере аргона в герметично закрытой пробирке. После охлаждения до комнатной температуры к реакционной смеси добавляли этилацетат (80 мл). Полученную смесь промывали насыщенным солевым раствором, сушили и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле (гексан:этилацетат=3:1) с получением соединения амина (235 мг) в виде масла.
Полученное соединение растворяли в метаноле (9,0 мл). К раствору добавляли тетрагидрат гексааммонийгептамолибдата (30 мг) и 30% водный раствор перекиси водорода (3,0 мл). Полученную смесь перемешивали при комнатной температуре в течение 20 часов. После разбавления этилацетатом (80 мл) разбавленный раствор промывали водой и насыщенным солевым раствором, сушили и концентрировали при пониженном давлении. К полученному остатку добавляли этанол и после кристаллизации получали указанное в заголовке соединение (159 мг, 15%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 3,89 (6H, с), 4,50 (2H, м), 6,10 (1H, с), 6,85-7,05 (5H, м), 7,11 (2H, т, J=8,4 Гц), 7,25-7,35 (1H, м), 7,29 (1H, с), 7,61 (2H, дд, J=5,2, 8,4), 7,99 (1H, с).
ИК (ATR) см-1: 3249, 1589, 1490, 1236, 1147, 817.
Т.пл.: 158-159°C.
MS m/z: 563 (M++H).
Пример 215: [5-Хлор-4-[(2,5-дифторфенил)-(4-фторфенилсульфонил)метил]пиридин-2-ил]амин
[Химическая формула 101]
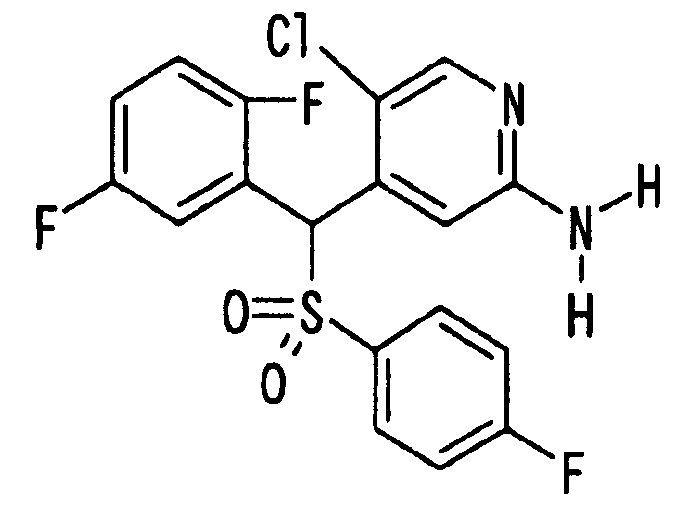
[5-Хлор-4-[(2,5-дифторфенил)-(4-фторфенилсульфонил)-метил]пиридин-2-ил] (3,4-диметоксибензил)амин (157 мг, 0,28 ммоль) растворяли в трифторуксусной кислоте (5,0 мл). Полученный раствор перемешивали при 65°C в течение 17 часов. После охлаждения реакционную смесь концентрировали при пониженном давлении. К полученному остатку добавляли насыщенный водный раствор бикарбоната натрия. Смесь экстрагировали этилацетатом. Экстракт промывали насыщенным солевым раствором, сушили и концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат=3:1) с получением указанного в заголовке соединения (114 мг, 99%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 4,76 (2H, шир.), 6,12 (1H, с), 6,91 (1H, м), 7,06 (1H, м), 7,14 (2H, т, J=8,4), 7,37 (1H, с), 7,53 (1H, м), 7,69 (2H, дд, J=4,8, 8,4 Гц), 7,98 (1H, с).
ИК (ATR) см-1: 3456, 3167, 1639, 1591, 1491, 1417, 1327, 1238, 1140, 1084.
Т.пл.: 157-159°C.
MS m/z: 413 (M++H).
Элементный Анализ для C18H12ClF3N2O2S. Рассчитано: C,52,37; H,2,93; Cl,8,59; F,13,81; N,6,79; S,7,77. Найдено: C,52,45; H,2,96; Cl,8,62; F,13,69; N,6,82; S,7,83.
Пример 216: N-[5-Хлор-4-[(2,5-дифторфенил)-(4-фторфенилсульфонил)метил]пиридин-2-ил]метансульфонамид
[Химическая формула 102]
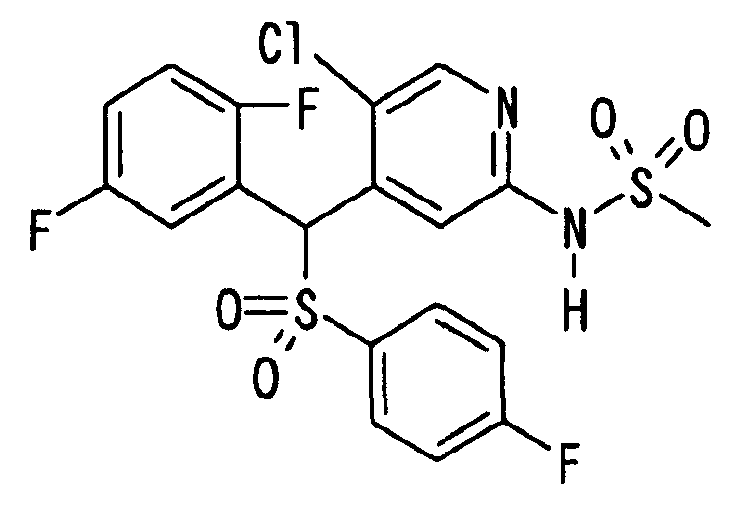
К раствору [5-хлор-4-[(2,5-дифторфенил)-(4-фторфенилсульфонил)метил]пиридин-2-ил]амина (114 мг, 0,276 ммоль) в метиленхлориде (10,0 мл) добавляли пиридин (440 мкл, 5,5 ммоль). К полученной смеси добавляли метансульфонилхлорид (добавление по 77 мкл раз в день в течение 3 дней, всего 230 мкл, 3,0 ммоль). Полученную смесь перемешивали в общей сложности в течение 4 дней. Реакционную смесь концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат=2:1) и после кристаллизации в простом эфире получали указанное в заголовке соединение (51 мг, 38%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 3,35 (3H, с), 6,19 (1H, с), 6,92 (1H, м), 7,08 (1H, м), 7,15 (2H, т, J=8,8 Гц), 7,50 (1H, м), 7,73 (2H, м), 8,00 (1H, с), 8,32 (1H, с).
MS m/z: 491 (M++H).
ИК (ATR) см-1: 1590, 1490, 1330, 1149, 968, 852. Т.пл.: 178-179°C.
Элементный Анализ для C19H14ClF3N2O4S2. Рассчитано: C,46,49; H,2,87; N,5,71; S,13,06; Cl,7,22; F,11,61. Найдено: C,46,55; H,2,96; N,5,73; S,13,02; Cl,7,13; F,11,39.
Пример 217: Оптическое разделение N-[5-хлор-4-[(2,5-дифторфенил)(4-фторфенилсульфонил)метил]пиридин-2-ил]метансульфонамида (оптический изомер A; оптический изомер B)
[Химическая формула 103]
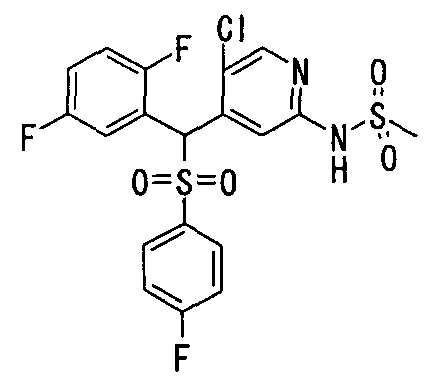
N-[5-Хлор-4-[(2,5-дифторфенил)(4-фторфенилсульфонил)-метил]пиридин-2-ил]метансульфонамид, полученный в примере 216, подвергали оптическому разделению в описанных ниже условиях, используя сверхкритическую хроматографию (продукт Gilson) на хиральной колонке.
Колонка: CHIRALPAK AD, 2,0 см × 25 см, продукт Daicel Chemical Industries, Ltd.
Подвижная фаза: 2-пропанол:диоксид углерода=1:99 → 50:50 (три минуты, а затем 50:50).
Скорость потока: 6,0 мл/мин.
Давление: 14 МПа.
Температура: 35°C.
Детекция: УФ (254 нм).
Время удерживания и полученные данные для каждого оптического изомера представлены ниже.
Оптический изомер A: 16,3 минут.
1H-ЯМР (400 МГц, CDCl3)δ: 3,35 (3H, с), 6,18 (1H, с), 6,89-6,97 (1H, м), 7,02-7,10 (1H, м), 7,12-7,20 (2H, м), 7,47-7,54 (1H, м), 7,69-7,76 (2H, м), 7,83 (1H, шир. с), 7,98 (1H, с), 8,32 (1H, с).
Оптический изомер B: 18,4 минут.
1H-ЯМР (400 МГц, CDCl3)δ: 3,36 (3H, с), 6,18 (1H, с), 6,89-6,96 (1H, м), 7,02-7,10 (1H, м), 7,12-7,20 (2H, м), 7,46-7,54 (1H, м), 7,69-7,76 (2H, м), 7,99 (1H, с), 8,32 (1H, с).
[α]D 25: +102,6 (c=0,5, CHCl3).
Пример 218: Натриевая соль N-[5-хлор-4-[(4-хлорфенилсульфинил)(2,5-дифторфенил)метил]пиридин-2-ил]метансульфонамида
[Химическая формула 104]
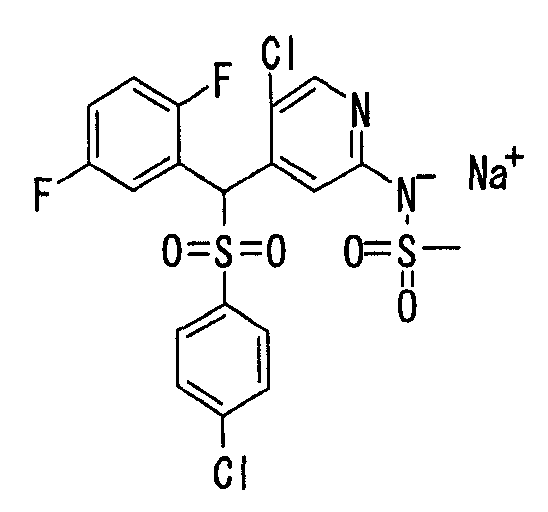
К раствору N-[5-хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]метансульфонамида (15,1 г, 29,8 ммоль), полученного в примере 197, в этаноле (100 мл) добавляли 1 н. водный раствор гидроксида натрия (32,8 мл). Полученную смесь концентрировали при пониженном давлении. К полученному остатку добавляли 2-пропанол для растворения в нем остатка при нагревании. Полученному раствору давали выстояться при комнатной температуре. Осажденное таким образом твердое вещество собирали фильтрованием с получением указанного в заголовке соединения (9,10 г, 16,6 ммоль, 56%).
1H-ЯМР (400 МГц,DMSO-d6)δ: 2,79 (3H, с), 6,10 (1H, с), 7,14 (1H, с), 7,23-7,40 (2H, м), 7,48-7,57 (1H, м), 7,68 (2H, д, J=8,8 Гц), 7,75 (2H, д, J=8,8 Гц), 7,89 (1H, с).
ИК (ATR) см-1: 1583, 1494, 1463, 1384, 1326, 1230, 1151, 1108, 1089, 1012, 813, 755.
Элементный Анализ для C19H13N2O4Cl2F2S2Na·1,0H2O. Рассчитано: C,41,69; H,2,76; N,5,12; Cl,12,95; F,6,94; S,11,72. Найдено: C,41,77; H,2,66; N,5,18; Cl,13,02; F,7,03; S,11,78.
Пример 219: [5-Хлор-4-[(4-хлорфенилтио)(2,5-дифторфенил)метил]пиридин-2-ил]амин
[Химическая формула 105]
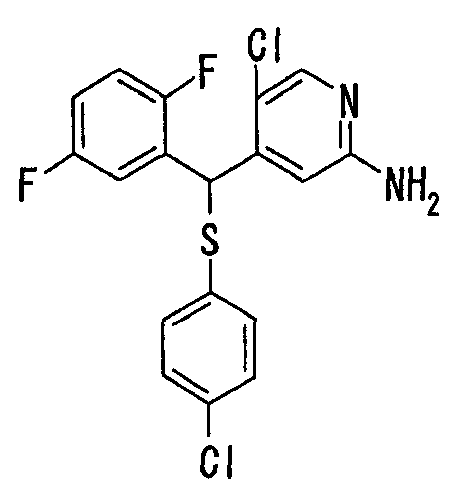
Раствор 5-хлор-4-[(4-хлорфенилтио)(2,5-дифторфенил)метил]-2-(3,4-диметоксибензиламино)пиридина (1,89 г, 3,45 ммоль), полученного в примере 185, в трифторуксусной кислоте (5 мл) перемешивали при 65°C в течение 2 часов. Реакционную смесь концентрировали при пониженном давлении. К полученному остатку добавляли насыщенный водный раствор бикарбоната натрия, затем экстрагировали метиленхлоридом. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали колоночной хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат (=2:1), концентрировали при пониженном давлении с получением белого твердого вещества. Полученное белое твердое вещество промывали гексаном - простым эфиром и собирали фильтрованием с получением указанного в заголовке соединения (1,06 г, 2,67 ммоль, 77%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 4,50 (2H, с), 5,96 (1H, с), 6,76 (1H, с), 6,90-7,10 (2H, м), 7,12-7,35 (5H, м), 8,02 (1H, с).
ИК (ATR)см-1: 3129, 1635, 1602, 1540, 1490, 1469, 1415, 1093, 1012, 819, 728.
MS m/z: 397 (M++H).
Пример 220: N-[5-Хлор-4-[(4-хлорфенилтио)(2,5-дифторфенил)метил]пиридин-2-ил]-N-(метилсульфонил)-метансульфонамид (Соединение A) и N-[5-хлор-4-[(4-хлорфенилтио)(2,5-дифторфенил)метил]пиридин-2-ил]метансульфонамид (Соединение B)
[Химическая формула 106]
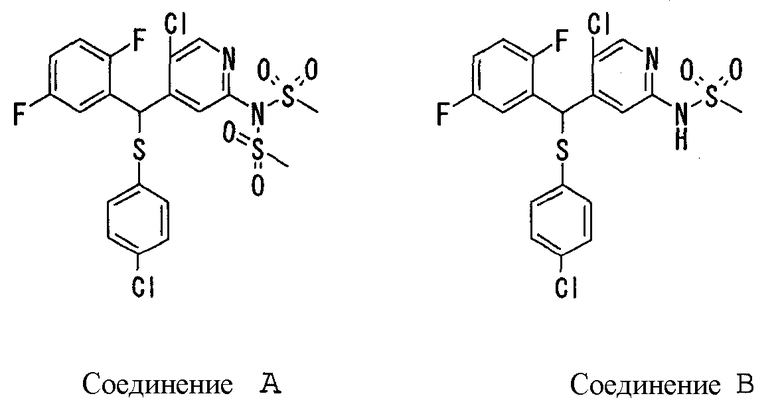
К раствору [5-хлор-4-[(4-хлорфенилтио)(2,5-дифторфенил)-метил]пиридин-2-ил]амина (575 мг, 1,45 ммоль) в пиридине (5 мл) добавляли при 0°C метансульфонилхлорид (0,123 мл, 1,59 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 16 часов. К реакционной смеси добавляли при 0°C метансульфонилхлорид (0,123 мл, 1,59 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 22 часов. К реакционной смеси добавляли пиридин (3 мл), а затем снова добавляли метансульфонилхлорид (0,123 мл, 1,59 ммоль) при 0°C. После перемешивания при комнатной температуре в течение 25 часов реакционную смесь концентрировали при пониженном давлении. Полученный остаток разбавляли этилацетатом. Разбавленный раствор промывали последовательно водой и насыщенным солевым раствором, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат (=4:1), концентрировали при пониженном давлении с получением указанного в заголовке соединения A (низкополярное соединение)(334 мг, 0,603 ммоль, 42%) в виде аморфного вещества и указанного в заголовке соединения B (высокополярное соединение)(269 мг, 0,566 ммоль, 39%) в виде белого твердого вещества.
Соединение A
1H-ЯМР (400 МГц, CDCl3)δ: 3,56 (6H, с), 5,97 (1H, с), 6,95-7,09 (3H, м), 7,20-7,31 (4H, м), 7,76 (1H, с), 8,45 (1H, с).
ИК (ATR) см-1: 1583, 1492, 1367, 1321, 1159, 1093, 1006, 962, 931, 821, 759.
MS m/z: 552 (M+).
Соединение B
1H-ЯМР (400 МГц, CDCl3)δ: 3,15 (3H, с), 6,02 (1H, с), 6,94-7,13 (3H, м), 7,20-7,35 (4H, м), 7,59 (1H, с), 8,07 (1H, шир. с), 8,30 (1H, с).
Т.пл.: 149-151°C
ИК (ATR) см-1: 1590, 1556, 1488, 1475, 1380, 1348, 1149, 993, 962, 831, 784.
MS m/z: 475 (M++H).
FAB-MS: 474,9925 (Рассчитано для C19H15O2N2Cl2F2S2: 474,9920).
Элементный Анализ для C19H14N2O2Cl2F2S2. Рассчитано: C,48,01; H,2,97; N,5,89; Cl,14,92; F,7,99; S,13,49. Найдено: C,48,27; H,2,95; N,5,91; Cl,14,79; F,7,96; S,13,61.
Пример 221: N-[5-Хлор-4-[(4-хлорфенилсульфинил)(2,5-дифторфенил)метил]пиридин-2-ил]метансульфонамид
[Химическая формула 107]
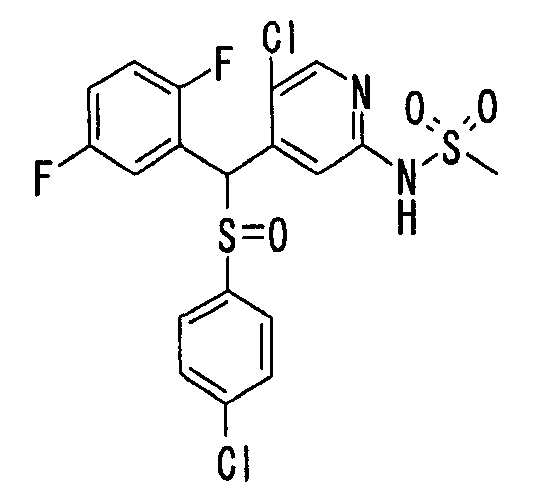
К раствору N-[5-хлор-4-[(4-хлорфенилтио)(2,5-дифторфенил)метил]пиридин-2-ил]метансульфонамида (331 мг, 0,696 ммоль) в метиленхлориде (10 мл) добавляли при 0°C 3-хлорпербензойную кислоту (120 мг, 0,696 ммоль). Полученную смесь перемешивали при 0°C в течение 50 минут. При указанной температуре к реакционной смеси добавляли 3-хлорпербензойную кислоту (60 мг, 0,348 ммоль). После перемешивания при 0°C в течение 10 минут к реакционной смеси добавляли насыщенный водный раствор тиосульфата натрия. Полученную смесь экстрагировали метиленхлоридом. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографией на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат (=2:1), концентрировали при пониженном давлении. К полученному остатку добавляли простой эфир и осажденное таким образом твердое вещество собирали фильтрованием с получением указанного в заголовке соединения (281 мг, 0,572 ммоль, 82%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 3,36 (3H, с), 5,48 (0,5H, с), 5,66 (0,5H, с), 6,79-6,88 (0,5H, м), 6,95-7,09 (1,5H, м), 7,18-7,44 (5H, м), 7,64 (0,5H, с), 7,83 (0,5H, с), 8,23 (0,5H, с), 8,36 (0,5H, с), 8,70 (1H, шир. с).
ИК (ATR) см-1: 3124, 3081, 1594, 1492, 1463, 1334, 1143, 964, 871, 821, 742.
MS m/z: 491 (M++H).
FAB-MS: 490,9853 (Рассчитано для C19H15O3N2Cl2F2S2: 490,9869).
Элементный Анализ для C19H14N2O3Cl2F2S2. Рассчитано: C,46,44; H,2,87; N,5,70; Cl,14,43; F,7,73; S,13,05. Найдено: C,46,64; H,3,02; N,5,64; Cl,14,31; F,7,74; S,13,02.
Пример 222: [5-Хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]гидразин
[Химическая формула 108]
К раствору 2,5-дихлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридина (524 мг, 1,17 ммоль), полученного в примере 57, в этаноле (10 мл) добавляли моногидрат гидразина (2 мл). Полученную смесь нагревали при кипячении с обратным холодильником в течение 3 часов. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Полученный остаток подвергали колоночной хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат (=1:1), концентрировали при пониженном давлении с получением светло-желтого масла. К полученному маслу добавляли гексан - простой эфир и осажденное таким образом твердое вещество собирали фильтрованием с получением указанного в заголовке соединения (95 мг, 0,214 ммоль, 18%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 3,89 (2H, с), 6,03 (1H, с), 6,16 (1H, с), 6,89-6,97 (1H, м), 7,00-7,09 (1H, м), 7,44 (2H, д, J=8,8 Гц), 7,50-7,58 (1H, м), 7,60-7,68 (3H, м), 8,03 (1H, с).
ИК (ATR) см-1: 3249, 1590, 1550, 1492, 1413, 1315, 1174, 1149, 1083, 811, 754.
MS m/z: 443 (M+).
Элементный Анализ для C18H13N3O2Cl2F2S. Рассчитано: C,48,66; H,2,95; N,9,46; Cl,15,96; F,8,55; S,7,22. Найдено: C,48,48; H,2,81; N,9,40; Cl,15,80; F,8,59; S,7,23.
Пример 223: трет-Бутил N'-[5-хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]гидразинкарбоксилат
[Химическая формула 109]
К раствору [5-хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]гидразина (166 мг, 0,374 ммоль) в метиленхлориде (5 мл) добавляли ди-трет-бутилдикарбонат (122 мг, 0,560 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 16 часов. Реакционную смесь концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат (=3:1), концентрировали при пониженном давлении с получением указанного в заголовке соединения (166 мг, 0,305 ммоль, 82%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 1,51 (9H, с), 6,19 (1H, с), 6,42 (1H, с), 6,59 (1H, шир. с), 6,91-7,09 (2H, м), 7,43 (2H, д, J=8,8 Гц), 7,50-7,56 (1H, м), 7,57 (1H, с), 7,63 (2H, д, J=8,8 Гц), 8,06 (1H, с).
ИК (ATR) см-1: 3336, 3295, 1681, 1596, 1558, 1496, 1477, 1321, 1151, 1091, 809.
MS m/z: 544 (M++H).
Пример 224: трет-Бутил N'-[5-хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]-N'-метилсульфонилгидразинкарбоксилат
[Химическая формула 110]
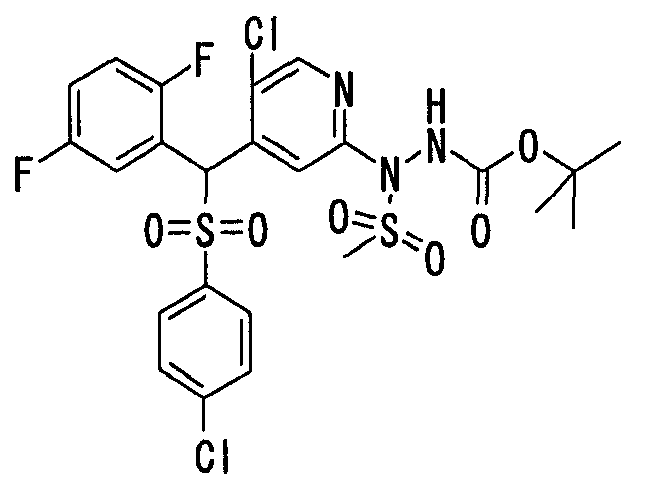
К раствору в метиленхлориде (5 мл) трет-бутил N'-[5-хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]гидразинкарбоксилата (178 мг, 0,327 ммоль) и триэтиламина (43 мкл, 0,392 ммоль) добавляли метансульфонилхлорид (30 мкл, 0,392 ммоль) при 0°C. Полученную смесь перемешивали при комнатной температуре в течение 16 часов. К реакционной смеси добавляли триэтиламин (43 мкл, 0,392 ммоль) и метансульфонилхлорид (30 мкл, 0,392 ммоль). После перемешивания при комнатной температуре в течение 3 часов реакционную смесь концентрировали при пониженном давлении. Полученный остаток разбавляли этилацетатом. Разбавленный раствор промывали последовательно насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат (=4:1), концентрировали при пониженном давлении с получением указанного в заголовке соединения (174 мг, 0,280 ммоль, 85%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 1,52 (9H, с), 3,56 (3H, с), 6,21 (1H, с), 6,92-7,10 (2H, м), 7,31 (1H, шир. с), 7,44 (2H, д, J=8,7 Гц), 7,47-7,54 (1H, м), 7,63 (2H, д, J=8,7 Гц), 8,05 (1H, с), 8,28 (1H, с).
ИК (ATR) см-1: 3320, 1731, 1583, 1494, 1353, 1326, 1236, 1149, 1091, 958, 754, 728.
MS m/z: 622 (M++H).
Пример 225: 1-[5-Хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]-1-метилсульфонилгидразин
[Химическая формула 111]
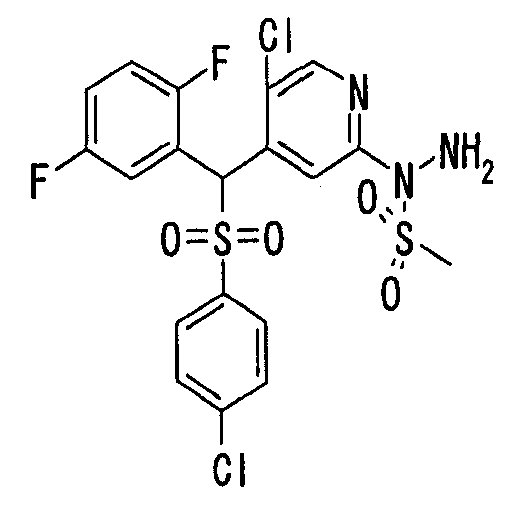
К раствору трет-бутил N'-[5-хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]-N'-метилсульфонилгидразинкарбоксилата (167 мг, 0,268 ммоль) в метиленхлориде (5 мл) добавляли трифторуксусную кислоту (2,5 мл). Полученную смесь перемешивали при комнатной температуре в течение 21 часа, затем концентрировали при пониженном давлении. К полученному остатку добавляли насыщенный водный раствор бикарбоната натрия. Полученную смесь экстрагировали метиленхлоридом. Органический слой, полученный в результате разделения, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат (=2:1), концентрировали при пониженном давлении с получением указанного в заголовке соединения (91 мг, 0,174 ммоль, 65%) в виде белого твердого вещества. Твердое вещество промывали простым эфиром и собирали фильтрованием с получением указанного в заголовке соединения (60 мг) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 3,25 (3H, с), 4,80 (2H, шир. с), 6,25 (1H, с), 6,90-7,10 (2H, м), 7,44 (2H, д, J=8,6 Гц), 7,53-7,61 (1H, м), 7,68 (2H, д, J=8,6 Гц), 8,32 (1H, с), 8,44 (1H, с).
Т.пл.: 152-154°C
ИК (ATR) см-1: 1583, 1490, 1361, 1319, 1149, 1079, 958, 833, 754.
MS m/z: 522 (M++H).
Элементный Анализ для C19H15N3O4Cl2F2S2. Рассчитано: C,43,69; H,2,89; N,8,04; Cl,13,57; F,7,27; S,12,28. Найдено: C,43,86; H,2,93; N,7,91; Cl,13,19; F,7,31; S,12,28.
Ссылочный Пример 41: 2,5-Дибром-4-[(2,5-дифторфенил)-гидроксиметил]пиридин
[Химическая формула 112]
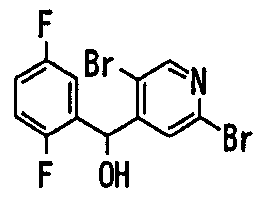
н-Бутиллитий (1,59M раствор в гексане, 76 мл, 121 ммоль) добавляли в атмосфере аргона при -70°C к раствору диизопропиламина (17 мл, 121 ммоль) в тетрагидрофуране (400 мл). Реакционную смесь перемешивали в течение 1 часа. К реакционной смеси добавляли по каплям раствор 2,5-дибромпиридина в тетрагидрофуране (100 мл) и полученную смесь перемешивали в течение 2 часов. К реакционной смеси добавляли по каплям 2,5-дифторбензальдегид (15 мл, 139 ммоль) и смесь перемешивали в течение 1 часа. После добавления воды полученную смесь концентрировали при пониженном давлении. Остаток экстрагировали дихлорметаном. Полученный органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток промывали дихлорметаном:гексаном с получением светло-желтого порошка. Фильтрат подвергали колоночной хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=6:1, концентрировали при пониженном давлении. Полученный остаток и указанный выше светло-желтый порошок объединяли с получением указанного в заголовке соединения (18,4 г, 48,6 ммоль, 52%) в виде светло-желтого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 2,62 (1H, с), 6,24 (1H, с), 6,85-6,89 (1H, м), 7,00-7,10 (2H, м), 7,79 (1H, с), 8,43 (1H, с).
MS m/z: 378 (M++H).
Пример 226: 2,5-Дибром-4-[(4-хлорфенилтио)(2,5-дифторфенил)метил]пиридин
[Химическая формула 113]
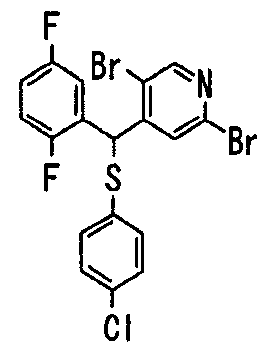
Триэтиламин (5,1 мл, 36,8 ммоль) и метансульфонилхлорид (2,6 мл, 31,9 ммоль) добавляли в атмосфере аргона при охлаждении льдом к раствору 2,5-дибром-4-[(2,5-дифторфенил)гидроксиметил]пиридина (9,3 г, 24,5 ммоль) в дихлорметане (200 мл). Реакционную смесь перемешивали при комнатной температуре в течение 30 минут. После добавления воды полученную смесь концентрировали при пониженном давлении. Полученный остаток экстрагировали диэтиловым эфиром. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении.
К раствору полученного остатка в диметилформамиде (200 мл) добавляли 4-хлорбензолтиол (4,3 г, 29,4 ммоль) и карбонат калия (5,1 г, 36,8 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 17 часов. После добавления воды полученную смесь экстрагировали диэтиловым эфиром. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток промывали гексаном с получением белого порошка. Фильтрат подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании дихлорметаном, концентрировали при пониженном давлении. Полученный остаток и указанный выше белый порошок объединяли с получением указанного в заголовке соединения (9,1 г, 18,0 ммоль, 73%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 5,94 (1H, с), 7,00-7,05 (2H, м), 7,15-7,20 (1H, м), 7,25 (2H, д, J=8,6 Гц), 7,29 (2H, д, J=8,6 Гц), 7,68 (1H, с), 8,45 (1H, с).
MS m/z: 504 (M++H).
Пример 227: [5-Бром-4-[(4-хлорфенилтио)(2,5-дифторфенил)метил]пиридин-2-ил]метанол
[Химическая формула 114]
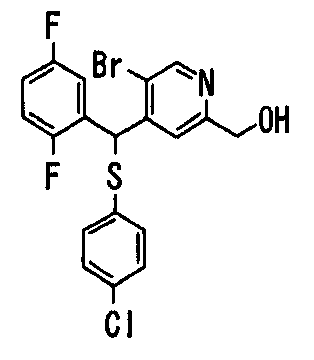
н-Бутиллитий (1,59M раствор в гексане, 0,27 мл, 0,435 ммоль) добавляли в атмосфере аргона к раствору 2,5-дибром-4-[(4-хлорфенилтио)(2,5-дифторфенил)метил]пиридина (200 мг, 0,396 ммоль) в толуоле (10 мл) при -78°C. Реакционную смесь перемешивали в течение 2 часов. К реакционной смеси добавляли по каплям диметилформамид (40 мкл, 0,514 ммоль) с последующим перемешиванием в течение 1 часа. К реакционной смеси добавляли метанол (10 мл) и борогидрид натрия (30 мг, 0,791 ммоль). Температуру полученной смеси повышали до комнатной температуры. Реакционную смесь перемешивали в течение 1 часа. После добавления воды полученную смесь экстрагировали этилацетатом. Экстракт промывали насыщенным солевым раствором. Органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=3:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (160 мг, 0,350 ммоль, 89%) в виде бесцветного аморфного вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 3,18 (1H, т, J=5,2 Гц), 4,72 (2H, д, J=5,2 Гц), 6,04 (1H, с), 6,95-7,05 (2H, м), 7,16-7,21 (1H, м), 7,22 (2H, д, J=7,8 Гц), 7,25 (2H, д, J=7,8 Гц), 7,51 (1H, с), 8,64 (1H, с).
MS m/z: 456 (M++H).
Пример 228: [5-Бром-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]метанол
[Химическая формула 115]
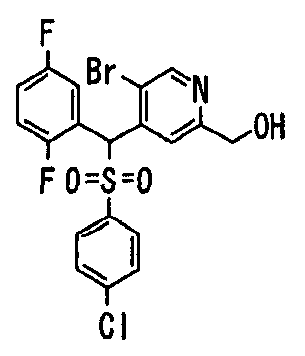
К раствору [5-бром-4-[(4-хлорфенилтио)(2,5-дифторфенил)метил]пиридин-2-ил]метанола (550 мг, 1,20 ммоль) в смеси метанола (10 мл) и этилацетата (10 мл) добавляли тетрагидрат гексааммонийгептамолибдата (100 мг) и 30% водный раствор перекиси водорода (10 мл). Полученную смесь перемешивали в течение 19 часов. После добавления воды полученную смесь экстрагировали этилацетатом. Экстракт промывали последовательно водой, насыщенным водным раствором бикарбоната натрия, насыщенным водным раствором тиосульфата натрия и насыщенным солевым раствором. Органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=2:1, концентрировали при пониженном давлении, а затем перекристаллизовывали из гексана:этилацетата с получением указанного в заголовке соединения (506 мг, 1,04 ммоль, 86%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 3,18 (1H, т, J=5,0 Гц), 4,79-4,88 (2H, м), 6,24 (1H, с), 6,92-6,97 (1H, м), 7,03-7,09 (1H, м), 7,45 (2H, д, J=8,6 Гц), 7,51-7,55 (1H, м), 7,61 (2H, д, J=8,6 Гц), 8,11 (1H, с), 8,65 (1H, с).
ИК (ATR) см-1: 3262, 1583, 1492, 1427, 1392, 1330, 1280, 1236, 1157, 1083, 1033.
Т.пл.: 172-173°C.
MS m/z: 488 (M++H).
Элементный Анализ для C19H13BrClF2NO3S. Рассчитано: C,46,69; H,2,68; Br,16,35; Cl,7,25; F,7,77; N,2,87; S,6,56. Найдено: C,46,59; H,2,55; Br,16,31; Cl,7,05; F,7,78; N,2,89; S,6,70.
Пример 229: [5-Бром-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]карбальдегид
[Химическая формула 116]
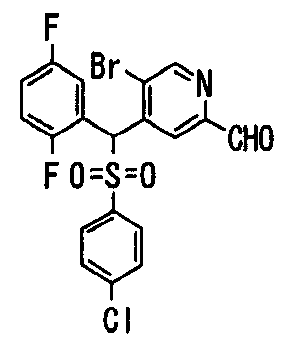
Диметилсульфоксид (218 мкл, 3,07 ммоль), триэтиламин (428 мкл, 3,07 ммоль) и комплекс триоксид серы-пиридин (293 мг, 1,84 ммоль) добавляли в атмосфере азота к раствору [5-бром-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]метанола (300 мг, 0,614 ммоль) в дихлорметане (10 мл). Реакционную смесь перемешивали при комнатной температуре в течение 4 часов. Реакционную смесь концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=3:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (227 мг, 0,466 ммоль, 76%) в виде бесцветного аморфного вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 6,29 (1H, с), 6,93-7,00 (1H, м), 7,04-7,10 (1H, м), 7,44 (2H, д, J=8,8 Гц), 7,57-7,62 (1H, м), 7,62 (2H, д, J=8,8 Гц), 8,68 (1H, с), 8,88 (1H, с), 10,09 (1H, с).
MS m/z: 486 (M++H).
Пример 230: 5-Бром-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиколиновая кислота
[Химическая формула 117]
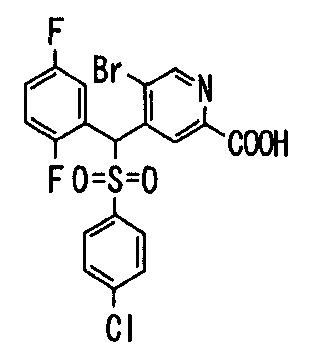
К раствору [5-бром-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]карбальдегида (225 мг, 0,462 ммоль) в муравьиной кислоте (5 мл) добавляли 30% водный раствор перекиси водорода (157 мкл, 1,39 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 3 часов. К реакционной смеси добавляли воду и осажденное таким образом твердое вещество фильтровали. Полученное твердое вещество промывали водой. Твердое вещество растворяли в этилацетате. Полученный раствор промывали последовательно водой и насыщенным солевым раствором. Органический слой сушили над сульфатом магния и концентрировали при пониженном давлении с получением указанного в заголовке соединения (226 мг, 0,461 ммоль, 97%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 6,30 (1H, с), 6,94-6,99 (1H, м), 7,05-7,11 (1H, м), 7,46 (2H, д, J=8,8 Гц), 7,61-7,66 (1H, м), 7,65 (2H, д, J=8,8 Гц), 8,75 (1H, с), 8,94 (1H, с).
MS m/z: 502 (M++H).
Пример 231: трет-Бутил [5-бром-4-[(4-хлорфенилсульфонил)-(2,5-дифторфенил)метил]пиридин-2-ил]карбамат
[Химическая формула 118]
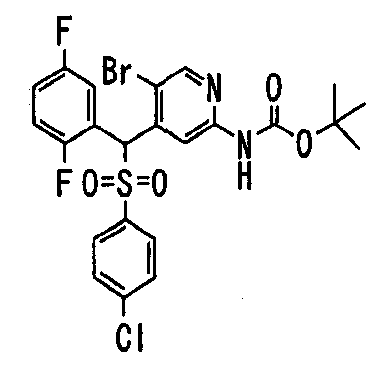
Дифенилфосфорилазид (131 мкл, 0,613 ммоль) и триэтиламин (122 мкл, 0,875 ммоль) добавляли в атмосфере аргона к раствору 5-бром-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиколиновой кислоты (220 мг, 0,438 ммоль) в смеси трет-бутанола (5 мл) и толуола (5 мл). Реакционную смесь перемешивали в течение 14 часов при нагревании и кипячении с обратным холодильником. После охлаждения к полученному остатку добавляли этилацетат. Полученную смесь промывали последовательно насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором. Органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=4:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (128 мг, 0,223 ммоль, 51%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 1,59 (9H, с), 6,23 (1H, с), 6,92-7,00 (1H, м), 7,02-7,08 (1H, м), 7,33 (1H, шир. с), 7,43 (2H, д, J=8,4 Гц), 7,57-7,62 (1H, м), 7,71 (2H, д, J=8,4 Гц), 8,28 (1H, с), 8,86 (1H, с).
MS m/z: 573 (M++H).
Пример 232: [5-Бром-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]амин
[Химическая формула 119]
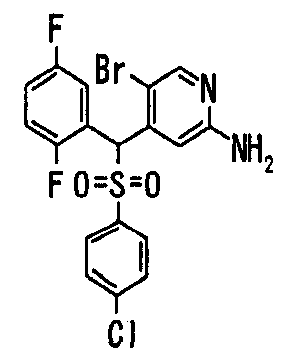
К раствору трет-бутил [5-бром-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]карбамата (130 мг, 0,227 ммоль) в этаноле (2 мл) добавляли концентрированную хлористоводородную кислоту (2 мл). Полученную смесь перемешивали при комнатной температуре в течение 63 часов. Реакционную смесь концентрировали при пониженном давлении. К полученному остатку добавляли насыщенный раствор бикарбоната натрия, затем экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток перекристаллизовывали из гексана:этилацетата с получением указанного в заголовке соединения (72 мг, 0,152 ммоль, 67%) в виде светло-желтого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 4,67 (2H, с), 6,12 (1H, с), 6,91-6,97 (1H, м), 7,02-7,08 (1H, м), 7,36 (1H, с), 7,45 (2H, д, J=8,6 Гц), 7,48-7,54 (1H, м), 7,62 (2H, д, J=8,6 Гц), 8,11 (1H, с).
ИК (ATR) см-1: 3467, 3372, 1617, 1585, 1540, 1492, 1475, 1413, 1330, 1311, 1280, 1238, 1178, 1151, 1081, 1033, 1012.
Т.пл.: 204-206°C.
MS m/z: 473 (M++H).
Элементный Анализ для C18H12BrClF2N2O2S. Рассчитано: C,45,64; H,2,55; Br,16,87; Cl,7,48; F,8,02; N,5,91; S,6,77. Найдено: C,45,87; H,2,58; Br,16,61; Cl,7,56; F,8,05; N,5,90; S,6,90.
Ссылочный Пример 42: 5-Циано-2-фторбензальдегид
[Химическая формула 120]
Диизопропиламин (2,80 мл, 19,8 ммоль) растворяли в тетрагидрофуране (20 мл). К полученному раствору добавляли по каплям при -78°C раствор н-бутиллития в гексане (1,60M, 11,4 мл, 18,2 ммоль). Реакционную смесь перемешивали при указанной температуре в течение 30 минут, а затем добавляли по каплям раствор 4-фторбензонитрила (2,00 г, 16,5 ммоль) в тетрагидрофуране (20 мл). После перемешивания при указанной температуре еще в течение 30 минут к реакционной смеси добавляли по каплям N,N-диметилформамид (1,7 мл, 21,5 ммоль). Реакционную смесь перемешивали при указанной температуре в течение 10 минут. К реакционной смеси добавляли уксусную кислоту и насыщенный водный раствор хлорида аммония, затем экстрагировали этилацетатом. Органические слои объединяли, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали хроматографии на силикагеле. Фракцию, полученную при элюировании смесью н-гексан:этилацетат=10:2, концентрировали при пониженном давлении с получением указанного в заголовке соединения (1,83 г, 12,3 ммоль, 74%) в виде светлого желтовато-коричневого масла.
1H-ЯМР (400 МГц, CD3OD)δ: 7,37 (1H, т, J=9,0 Гц), 7,92 (1H, ддд, J=9,0,6,4,2,2 Гц), 8,21 (1H, дд, J=6,4,2,2 Гц), 10,4 (1H, с).
ИК (ATR) см-1: 1953, 1695, 1600, 1482, 1236, 1105, 846, 624, 580.
MS m/z: 150 (M++H).
Ссылочный Пример 43: 3-[(2,5-Дихлорпиридин-4-ил)гидроксиметил]-4-фторбензонитрил
[Химическая формула 121]
Диизопропиламин (0,52 мл, 3,70 ммоль) растворяли в тетрагидрофуране (5 мл). К полученному раствору добавляли по каплям при -78°C раствор н-бутиллития в гексане (1,54M, 2,20 мл, 3,39 ммоль). Реакционную смесь перемешивали при указанной температуре в течение 30 минут. К реакционной смеси добавляли по каплям раствор 2,5-дихлорпиридина (0,46 г, 3,08 ммоль) в тетрагидрофуране (20 мл). После перемешивания при указанной температуре еще в течение 1 часа к реакционной смеси добавляли по каплям раствор 5-циано-2-фторбензальдегида (0,46 г, 3,08 ммоль) в тетрагидрофуране (5 мл). Полученную смесь перемешивали при указанной температуре в течение 30 минут. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония, затем экстрагировали этилацетатом. Органические слои объединяли, сушили над безводным сульфатом магния и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали хроматографии на силикагеле. Фракцию, полученную при элюировании смесью н-гексан:этилацетат=10:2, концентрировали при пониженном давлении с получением указанного в заголовке соединения (0,68 г, 2,28 ммоль, 74%) в виде светлого желтовато-коричневого масла.
1H-ЯМР (400 МГц, CDCl3)δ: 6,33 (1H, с), 7,22 (1H, т, J=8,3 Гц), 7,60 (1H, дд, J=6,6, 2,2 Гц), 7,66 (1H, с), 7,66-7,69 (1H, м), 8,34 (1H, с).
ИК (ATR) см-1: 3413, 1577, 1492, 1334, 1247, 1110, 829, 534.
MS m/z: 297 (M++H).
Пример 233: 3-[(4-Хлорфенилсульфонил)(2,5-дихлорпиридин-4-ил)метил]-4-фторбензонитрил
[Химическая формула 122]
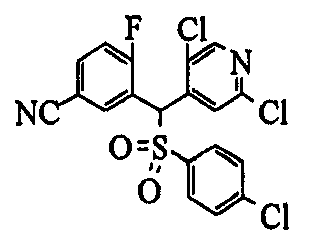
Тионилхлорид (3 мл) и каталитическое количество N,N-диметилформамида добавляли при охлаждении льдом к раствору 3-[(2,5-дихлорпиридин-4-ил)гидроксиметил]-4-фторбензонитрила (677 мг, 2,28 ммоль) в дихлорметане (5 мл). Полученную смесь перемешивали при комнатной температуре в течение 4 часов. К реакционной смеси добавляли воду, затем экстрагировали дихлорметаном. Органические слои объединяли, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении.
Полученный остаток растворяли в N,N-диметилформамиде (5 мл). К полученному раствору добавляли 4-хлорбензолсульфинат натрия (905 мг, 4,56 ммоль). Смесь перемешивали при комнатной температуре в течение 20 часов. К реакционной смеси добавляли воду, затем экстрагировали этилацетатом. Органические слои объединяли, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали хроматографии на силикагеле. Фракцию, полученную при элюировании смесью н-гексан:этилацетат=10:2, концентрировали при пониженном давлении с получением указанного в заголовке соединения (170 мг, 0,37 ммоль, 16%) в виде светлого желтовато-коричневого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 6,19 (1H, с), 7,15 (1H, т, J=8,5 Гц), 7,48 (2H, д, J=8,5 Гц), 7,62 (2H, д, J=8,5 Гц), 7,72 (1H, ддд, J=8,5, 5,4, 2,4 Гц), 8,12 (1H, дд, J=5,4, 2,4 Гц), 8,13 (1H, с), 8,36 (1H, с).
ИК (ATR) см-1: 1569, 1494, 1315, 1257, 1120, 1081, 752, 617, 570, 536.
MS m/z: 456 (M+).
Пример 234: 3-[(2-Амино-5-хлорпиридин-4-ил)(4-хлорфенилсульфонил)метил]-4-фторбензонитрил
[Химическая формула 123]
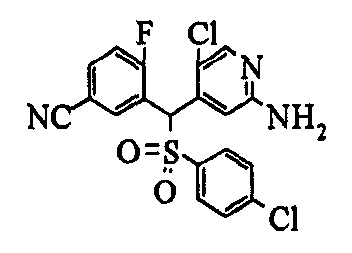
3-[(4-Хлорбензолсульфонил)(2,5-дихлорпиридин-4-ил)метил]-4-фторбензонитрил (559 мг, 1,23 ммоль) растворяли в N-метилпирролидоне (12 мл), а затем добавляли 3,4-диметоксибензиламин (0,91 мл, 6,13 ммоль). Полученную смесь перемешивали при нагревании при 140°C в течение 4 часов. К реакционной смеси добавляли воду, затем экстрагировали этилацетатом. Экстракт промывали насыщенным солевым раствором. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали хроматографии на силикагеле. Фракцию, полученную при элюировании смесью н-гексан:этилацетат=2:1, концентрировали при пониженном давлении.
Полученный остаток растворяли в трифторуксусной кислоте (5 мл) и полученный раствор перемешивали при нагревании при 70°C в течение 2 часов. Реакционную смесь концентрировали при пониженном давлении. Остаток подвергали хроматографии на силикагеле. Фракцию, полученную при элюировании смесью н-гексан:этилацетат=2:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (50 мг 0,11 ммоль, 9%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 4,74 (2H, с), 6,16 (1H, с), 7,12 (1H, т, J=8,8 Гц), 7,32 (1H, с), 7,48 (2H, д, J=8,5 Гц), 7,62 (2H, д, J=8,5 Гц), 7,98 (1H, с), 8,15 (1H, дд, J=8,8, 2,0 Гц), 8,55 (1H, д, J=2,0 Гц).
ИК (ATR) см-1: 1614, 1475, 1411, 1311, 1259, 1145, 1091, 755, 642, 620, 561, 543, 460.
Т.пл.: >220°C.
MS m/z: 436 (M++H).
Элементный Анализ для C19H12Cl2FN3O2S. Рассчитано: C,52,31; H,2,77; Cl,16,25; F,4,35; N,9,63; S,7,35. Найдено: C,52,17; H,2,85; Cl,16,50; F,4,32; N,9,40; S,7,30.
Пример 235: N-[5-Хлор-4-[(4-хлорфенилсульфонил)(5-циано-2-фторфенил)метил]пиридин-2-ил]-N-(метилсульфонил)-метансульфонамид
[Химическая формула 124]
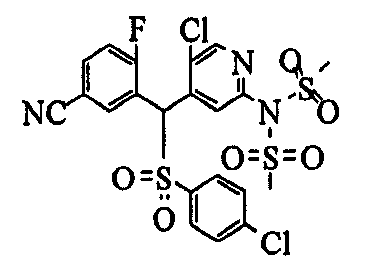
3-[(2-Амино-5-хлорпиридин-4-ил)(4-хлорфенилсульфонил)-метил]-4-фторбензонитрил (50 мг, 0,11 ммоль) растворяли в дихлорметане (5 мл), затем к полученному раствору добавляли при 0°C этансульфонилхлорид (27 мкл, 0,39 ммоль), триэтиламин (48 мкл, 0,39 ммоль) и каталитическое количество 4-диметиламинопиридина. Полученную смесь перемешивали при указанной температуре в течение 30 минут. Добавляли воду и полученную смесь экстрагировали дихлорметаном. Экстракт промывали насыщенным солевым раствором. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали хроматографии на силикагеле. Фракцию, полученную при элюировании смесью н-гексан:этилацетат=10:3, концентрировали при пониженном давлении с получением указанного в заголовке соединения (80 мг, 0,11 ммоль, 99%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl4)δ: 3,65 (6H, с), 6,25 (1H, с), 7,24 (1H, т, J=8,8 Гц), 7,45 (2H, д, J=8,5 Гц), 7,66 (2H, д, J=8,5 Гц), 7,75 (1H, ддд, J=8,8, 6,6, 2,0 Гц), 8,16 (1H, с), 8,19 (1H, дд, J=6,6, 2,0 Гц), 8,43 (1H, с).
ИК (ATR) см-1: 1725, 1583, 1492, 1369, 1326, 1164, 931, 835, 757, 628, 551, 505, 460.
MS m/z: 592 (M++H).
Пример 236: N-[5-Хлор-4-[(4-хлорфенилсульфонил)(5-циано-2-фторфенил)метил]пиридин-2-ил]метансульфонамид
[Химическая формула 125]
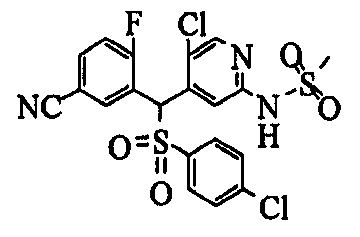
N-[5-Хлор-4-[(4-хлорфенилсульфонил)(5-циано-2-фторфенил)метил]пиридин-2-ил]-N-(метилсульфонил)-метансульфонамид (80 мг, 0,11 ммоль) растворяли в тетрагидрофуране (3 мл), затем к полученному раствору при 0°C добавляли раствор фторида тетрабутиламмония в тетрагидрофуране (1,0M, 0,15 мл, 0,15 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 1 часа. Остаток, полученный концентрацией реакционной смеси при пониженном давлении, подвергали хроматографии на силикагеле. Фракцию, полученную при элюировании смесью н-гексан:этилацетат=2:1, концентрировали при пониженном давлении с получением белого твердого вещества. Полученное белое твердое вещество промывали простым эфиром с получением указанного в заголовке соединения (32 мг, 0,06 ммоль, 46%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 3,37 (3H, с), 6,20 (1H, с), 7,14 (1H, д, J=8,8 Гц), 7,48 (2H, д, J=8,5 Гц), 7,62 (2H, д, J=8,5 Гц), 7,68-7,72 (1H, м), 7,92 (1H, с), 8,11 (1H, дд, J=6,6, 2,0 Гц), 8,34 (1H, с).
ИК (ATR) см-1: 1596, 1494, 1473, 1328, 1151, 1089, 755, 636, 541, 516.
Т.пл.: 118-120°C.
MS m/z: 514 (M++H).
Элементный Анализ для C20H14Cl2FN3O4S2. Рассчитано: C,46,70; H,2,74; Cl,13,78; F,3,69; N,8,17; S,12,47. Найдено: C,47,00; H,2,94; Cl,13,64; F,3,58; N,8,15; S,12,44.
Ссылочный Пример 44: 5-Хлор-2-(2,2,5,5-тетраметил-1,2,5-азадисилолидин-1-ил)пиридин
[Химическая формула 126]
К раствору 5-хлорпиридин-2-иламина (10,28 г, 80,0 ммоль) в тетрагидрофуране (350 мл) добавляли при -78°C раствор н-бутиллития в гексане (1,58M, 50,6 мл, 80,0 ммоль). Полученную смесь перемешивали в течение 1 часа. При указанной температуре к реакционной смеси добавляли раствор 1,2-бис(хлордиметилсилил)этана (17,22 г, 80,0 ммоль) в тетрагидрофуране (50 мл) с последующим перемешиванием в течение 1 часа. При указанной температуре добавляли раствор н-бутиллития в гексане (1,58M, 50,6 мл, 80,0 ммоль) и полученную смесь перемешивали в течение 30 минут. При комнатной температуре к реакционной смеси добавляли насыщенный водный раствор хлорида натрия. К смеси добавляли диэтиловый эфир для разделения смеси на слои. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали перегонке при пониженном давлении (120°C/3,0 ммHg) с получением указанного в заголовке соединения (12,97 г, 47,9 ммоль, 60%) в виде бесцветного вещества в форме игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3)δ: 0,29 (12H, с), 0,82 (4H, с), 6,50 (1H, д, J=8,8 Гц), 7,34 (1H, дд, J=8,8, 2,7 Гц), 8,05 (1H, д, J=2,7 Гц).
Ссылочный Пример 45: (2-Амино-5-хлорпиридин-4-ил)(2,5-дифторфенил)метанол
[Химическая формула 127]
К смеси раствора н-бутиллития в гексане (1,58M, 8,41 мл, 13,3 ммоль) и тетрагидрофурана (40 мл) добавляли диизопропиламин (1,86 мл, 13,3 ммоль) при -78°C. Полученную смесь перемешивали при 0°C в течение 1 часа, затем реакционную смесь охлаждали до -78°C. К реакционной смеси добавляли раствор 5-хлор-2-(2,2,5,5-тетраметил-1,2,5-азадисилолидин-1-ил)пиридина (3,27 г, 12,1 ммоль) в тетрагидрофуране (10 мл). Полученную смесь перемешивали при указанной температуре в течение 1 часа. Затем к реакционной смеси добавляли раствор 2,5-дифторбензальдегида (1,89 г, 13,3 ммоль) в тетрагидрофуране (10 мл). После перемешивания при указанной температуре в течение 30 минут добавляли при 0°C 1 н. раствор хлористоводородной кислоты (50 мл). К реакционной смеси добавляли 1 н. водный раствор (100 мл) гидроксида натрия. Полученный продукт экстрагировали диэтиловым эфиром. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток промывали смесью растворителей дихлорметан/гексан и собирали фильтрованием с получением указанного в заголовке соединения (1,76 г, 6,50 ммоль, 54%) в виде белого твердого вещества.
1H-ЯМР (400 МГц,DMSO-d6)δ: 5,96 (1H, д, J=4,9 Гц), 6,17 (2H, с), 6,31 (1H, д, J=4,9 Гц), 6,68 (1H, с), 6,97-7,04 (1H, м), 7,15-7,29 (2H, м), 7,82 (1H, с).
MS m/z: 271 (M++H).
Ссылочный Пример 46: (2-Амино-5-хлорпиридин-4-ил)(2,5-дифторфенил)метил трет-бутилкарбонат
[Химическая формула 128]
Ди-трет-Бутилдикарбонат (3,63 г, 16,6 ммоль) и 4-диметиламинопиридин (203 мг, 1,66 ммоль) добавляли в атмосфере азота при комнатной температуре к раствору (2-амино-5-хлорпиридин-4-ил)(2,5-дифторфенил)метанола (4,50 г, 16,6 ммоль) в дихлорметане (150 мл). Полученную смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь концентрировали при пониженном давлении. Полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью дихлорметан:метанол=50:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (5,70 г, 15,4 ммоль, 92%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 1,49 (9H, с), 4,53 (2H, с), 6,66 (1H, с), 6,89-6,95 (1H, м), 6,99-7,09 (2H, м), 7,00 (1H, с), 8,01 (1H, с).
MS m/z: 371 (M++H).
Ссылочный Пример 47: трет-Бутил [5-хлор-4-[(2,5-дифторфенил)(гидрокси)метил]пиридин-2-ил]карбамат
[Химическая формула 129]
Раствор бис(триметилсилил)амида натрия в тетрагидрофуране (1M, 33,8 мл, 33,8 ммоль) добавляли в атмосфере азота при 0°C к раствору (2-амино-5-хлорпиридин-4-ил)(2,5-дифторфенил)метил трет-бутилкарбоната (5,70 г, 15,4 ммоль) в тетрагидрофуране (80 мл) с последующим добавлением раствора ди-трет-бутилдикарбоната (3,69 г, 16,9 ммоль) в тетрагидрофуране (20 мл). После перемешивания при комнатной температуре в течение 30 минут к реакционной смеси добавляли насыщенный водный раствор хлорида аммония. Полученный продукт экстрагировали дихлорметаном. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении.
Полученный остаток растворяли в смеси растворителей тетрагидрофурана (50 мл) и метанола (50 мл). К полученному раствору добавляли при комнатной температуре 1 н. раствор гидроксида натрия (50 мл). Полученную смесь перемешивали при 50°C в течение 2 часов и концентрировали при пониженном давлении. Полученный продукт экстрагировали дихлорметаном. Остаток промывали смесью растворителей этанол/гексан и собирали фильтрованием с получением указанного в заголовке соединения (3,49 г, 9,41 ммоль, 61%) в виде белого твердого вещества. Фильтрат концентрировали при пониженном давлении. Полученный остаток промывали смесью растворителей этанол/диэтиловый эфир/гексан и собирали фильтрованием с получением указанного в заголовке соединения (828 мг, 2,23 ммоль, 15%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 1,54 (9H, с), 2,69 (1H, д, J=4,9 Гц), 6,32 (1H, д, J=4,9 Гц), 6,88-7,08 (3H, м), 7,81 (1H, с), 8,17 (1H, с), 8,33 (1H, с).
MS m/z: 371 (M++H).
Ссылочный Пример 48: O-Этил S-(4-хлор-3-метоксифенил) дитиокарбонат
[Химическая формула 130]
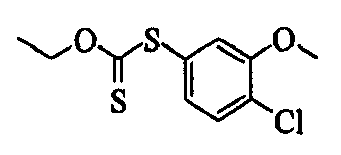
В 1 н. хлористоводородной кислоте(80 мл) растворяли 4-хлор-3-метоксианилин (2,77 г, 17,6 ммоль). К полученному раствору добавляли по каплям при 0°C водный раствор (10 мл) нитрита натрия (1,33 г, 19,3 ммоль), затем реакционную смесь перемешивали при указанной температуре в течение 30 минут. Температуру реакционной смеси повышали до 60°C. При указанной температуре к реакционной смеси добавляли по каплям водный раствор (30 мл) O-этилдитиокарбоната калия (3,10 г, 19,3 ммоль). Температуру реакционной смеси повышали до 90°C. После перемешивания в течение 1 часа реакционную смесь охлаждали до комнатной температуры. К реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия. Полученный продукт экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:дихлорметан=9:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (1,05 г, 4,00 ммоль, 23%) в виде желтого масла.
1H-ЯМР (400 МГц, CDCl3)δ: 1,35 (3H, т, J=7,1 Гц), 3,91 (3H, с), 4,62 (2H, кв., J=7,1 Гц), 7,03-7,08 (2H, м), 7,41 (1H, д, J=8,1 Гц).
MS m/z: 263 (M++H).
Пример 237: трет-Бутил [5-хлор-4-[(4-хлор-3-метоксифенилтио)(2,5-дифторфенил)метил]пиридин-2-ил]карбамат
[Химическая формула 131]
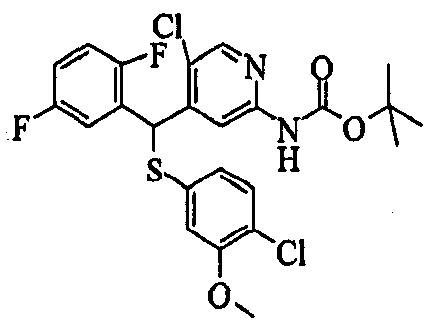
К раствору O-этил S-(4-хлор-3-метоксифенил)дитиокарбоната (394 мг, 1,50 ммоль) в этаноле (5 мл) добавляли 1 н. водный раствор гидроксида натрия (5 мл). Полученную смесь нагревали при кипячении с обратным холодильником в течение 1 часа. После охлаждения реакционной смеси до комнатной температуры этанол отгоняли при пониженном давлении. Остаток промывали дихлорметаном. Водный слой подкисляли уксусной кислотой. Полученный продукт экстрагировали дихлорметаном. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении с получением 4-хлор-3-метоксибензолтиола в виде бесцветного масла.
К раствору трет-бутил [5-хлор-4-[(2,5-дифторфенил)(гидрокси)метил]пиридин-2-ил]карбамата (371 мг, 1,00 ммоль), полученного в ссылочном примере 47, в дихлорметане добавляли при 0°C метансульфонилхлорид (0,155 мл, 2,00 ммоль), а затем триэтиламин (0,418 мл, 3,00 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь промывали насыщенным водным раствором бикарбоната натрия. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении.
К раствору остатка в N,N-диметилформамиде (10 мл) последовательно добавляли в атмосфере азота раствор в N,N-диметилформамиде (5 мл) 4-хлор-3-метоксибензолтиола, полученного, как указано выше, и карбонат калия (207 мг, 1,50 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 20 часов. К реакционной смеси добавляли этилацетат. Полученную смесь промывали насыщенным водным раствором бикарбоната натрия. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=19:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (354 мг, 0,67 ммоль, 67%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 1,55 (9H, с), 3,81 (3H, с), 6,07 (1H, с), 6,91-7,08 (3H, м), 6,97 (1H, дд, J=7,8, 2,0 Гц), 7,00 (1H, д, J=2,0 Гц), 7,23 (1H, д, J=7,8 Гц), 7,86 (1H, с), 8,18 (1H, с), 8,55 (1H, с).
MS m/z: 527 (M++H).
Пример 238: трет-Бутил [5-хлор-4-[(4-хлор-3-метоксифенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]карбамат
[Химическая формула 132]
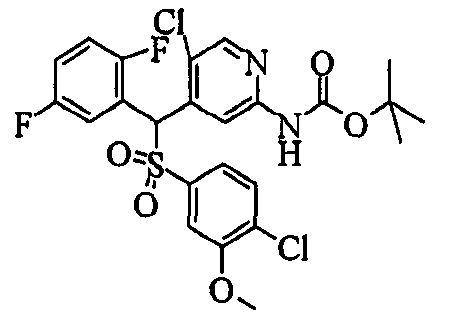
К раствору трет-бутил [5-хлор-4-[(4-хлор-3-метоксифенилтио)(2,5-дифторфенил)метил]пиридин-2-ил]карбамата (354 мг, 0,67 ммоль) в этилацетате (8 мл) добавляли метанол (8 мл), 31% водный раствор перекиси водорода (8 мл) и тетрагидрат гексааммонийгептамолибдата (166 мг, 0,13 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 20 часов. К реакционной смеси добавляли воду и этилацетат и метанол отгоняли при пониженном давлении. К остатку добавляли насыщенный водный раствор бикарбоната натрия. Полученный продукт экстрагировали дихлорметаном. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=9:1, концентрировали при пониженном давлении. Полученный остаток промывали смесью растворителей диэтиловый эфир/гексан и собирали фильтрованием с получением указанного в заголовке соединения (308 мг, 0,55 ммоль, 82%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 1,58 (9H, с), 3,82 (3H, с), 6,27 (1H, с), 6,94-7,09 (2H, м), 7,24 (1H, д, J=2,0 Гц), 7,36 (1H, дд, J=8,3, 2,0 Гц), 7,46 (1H, д, J=8,3 Гц), 7,56-7,62 (2H, с), 8,18 (1H, с), 8,89 (1H, с).
MS m/z: 559 (M++H).
Пример 239: [5-Хлор-4-[(4-хлор-3-метоксифенилсульфонил)-(2,5-дифторфенил)метил]пиридин-2-ил]амин
[Химическая формула 133]
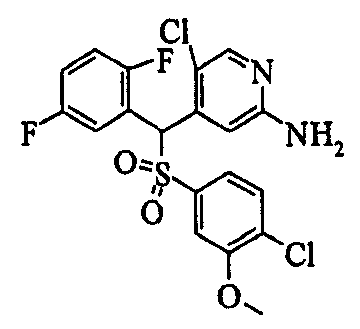
К раствору трет-бутил [5-хлор-4-[(4-хлор-3-метоксифенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]карбамата (300 мг, 0,54 ммоль) в дихлорметане (5 мл) добавляли при 0°C трифторуксусную кислоту (5 мл). Полученную смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь концентрировали при пониженном давлении. Остаток растворяли в дихлорметане. Полученный раствор промывали 1 н. водным раствором гидроксида натрия. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток промывали диэтиловым эфиром и затем собирали фильтрованием с получением указанного в заголовке соединения (208 мг, 0,45 ммоль, 84%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 3,82 (3H, с), 4,66 (2H, с), 6,14 (1H, с), 6,91-6,98 (1H, м), 7,02-7,09 (1H, м), 7,09 (1H, д, J=2,0 Гц), 7,25 (1H, дд, J=8,3, 2,0 Гц), 7,34 (1H, с), 7,46 (1H, д, J=8,3 Гц), 7,51-7,57 (1H, с), 7,99 (1H, с).
ИК (ATR) см-1: 3151, 1645, 1595, 1481, 1414, 1390, 1325, 1254, 1140, 1055, 1026.
Т.пл.: 198-200°C.
Элементный Анализ для C19H14Cl2F2N2O3S. Рассчитано: C,49,69; H,3,07; Cl,15,44; F,8,27; N,6,10; S,6,98. Найдено: C,49,56; H,3,03; Cl,15,29; F,8,58; N,6,08; S,7,07.
MS m/z: 459 (M++H).
Пример 240: [5-Хлор-4-[(2,5-дифторфенил)(4-метоксифенилсульфонил)метил]пиридин-2-ил]амин
[Химическая формула 134]
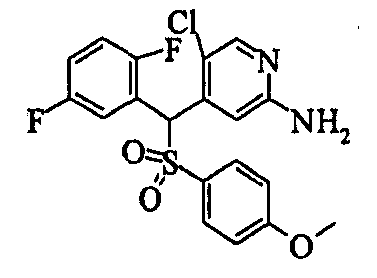
К раствору трет-бутил [5-хлор-4-[(2,5-дифторфенил)(гидрокси)метил]пиридин-2-ил]карбамата (148 мг, 0,40 ммоль), полученного в ссылочном примере 47, в дихлорметане добавляли метансульфонилхлорид (0,046 мл, 0,60 ммоль), а затем триэтиламин (0,167 мл, 1,20 ммоль) при 0°C. Полученную смесь перемешивали при комнатной температуре в течение 16 часов. Реакционную смесь промывали насыщенным водным раствором бикарбоната натрия. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении.
К раствору полученного остатка в N,N-диметилформамиде (4 мл) добавляли в атмосфере азота 4-метоксибензолтиол (56 мг, 0,40 ммоль), а затем карбонат калия (66 мг, 0,48 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 19 часов. К реакционной смеси добавляли этилацетат. Полученную смесь промывали насыщенным водным раствором бикарбоната натрия. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении.
К раствору полученного остатка в этилацетате (8 мл) добавляли метанол (8 мл), 31% водный раствор перекиси водорода (4 мл) и тетрагидрат гексааммонийгептамолибдата (99 мг, 0,08 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 20 часов. К реакционной смеси добавляли воду. Этилацетат и метанол отгоняли при пониженном давлении. К остатку добавляли насыщенный водный раствор бикарбоната натрия. Полученный продукт экстрагировали дихлорметаном. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении.
К раствору полученного остатка в дихлорметане (3 мл) добавляли при 0°C трифторуксусную кислоту (3 мл). Полученную смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь концентрировали при пониженном давлении. Остаток растворяли в дихлорметане. Полученный раствор промывали насыщенным водным раствором бикарбоната натрия. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=3:2, концентрировали при пониженном давлении. Остаток промывали смесью растворителей диэтиловый эфир/гексан и затем собирали фильтрованием с получением указанного в заголовке соединения (67 мг, 0,16 ммоль, 40%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 3,87 (3H, с), 4,63 (2H, с), 6,10 (1H, с), 6,87-6,94 (1H, м), 6,90 (2H, д, J=8,8 Гц), 6,98-7,06 (1H, м), 7,31 (1H, с), 7,51-7,57 (1H, м), 7,59 (2H, д, J=8,8 Гц), 7,97 (1H, с).
ИК (ATR) см-1: 3469, 3294, 3172, 1630, 1593, 1491, 1419, 1327, 1261, 1244, 1230, 1142, 1092.
Т.пл.: 153-155°C.
Элементный Анализ для C19H15ClF2N2O3S. Рассчитано: C,53,71; H,3,56; Cl,8,34; F,8,94; N,6,59; S,7,55. Найдено: C,53,53; H,3,55; Cl,8,34; F,9,06; N,6,31; S,7,79.
MS m/z: 425 (M++H).
Пример 241: [5-Хлор-4-[(5-хлорпиридин-2-илсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]амин
[Химическая формула 135]
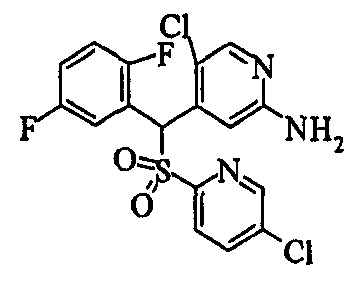
Таким же способом, как в примере 240, получали указанное в заголовке соединение (74 мг, 0,17 ммоль, 43%) в виде белого твердого вещества, используя трет-бутил [5-хлор-4-[(2,5-дифторфенил)(гидрокси)метил]пиридин-2-ил]карбамат (148 мг, 0,40 ммоль), полученный в ссылочном примере 47, и 5-хлор-2-пиридинтиол (58 мг, 0,40 ммоль), полученный в ссылочном примере 17.
1H-ЯМР (400 МГц, CDCl3)δ: 4,62 (2H, с), 6,77 (1H, с), 6,95-7,08 (2H, м), 7,28 (1H, с), 7,40-7,47 (1H, м), 7,82-7,84 (2H, м), 8,00 (1H, с), 8,68-8,70 (1H, м).
ИК (ATR) см-1: 3427, 3317, 3199, 1635, 1491, 1477, 1327, 1238, 1163, 1113, 1018.
Т.пл.: 187-189°C.
Элементный Анализ для C17H11Cl2F2N3O2S. Рассчитано: C,47,46; H,2,58; Cl,16,48; F,8,83; N,9,77; S,7,45. Найдено: C,47,43; H,2,64; Cl,16,52; F,8,98; N,9,69; S,7,71.
MS m/z: 430 (M++H).
Пример 242: N-[5-Хлор-4-[(5-хлорпиридин-2-илсульфонил)-(2,5-дифторфенил)метил]пиридин-2-ил]метансульфонамид
[Химическая формула 136]
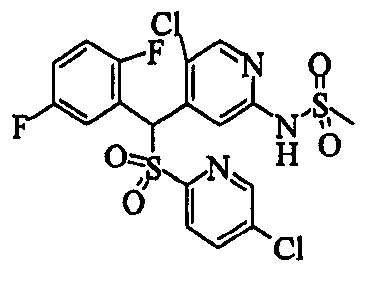
Раствор бис(триметилсилил)амида натрия (1M, 0,705 мл, 0,71 ммоль) в тетрагидрофуране добавляли в атмосфере аргона при 0°C к раствору [5-хлор-4-[(5-хлорпиридин-2-илсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]амина (92 мг, 0,21 ммоль) в тетрагидрофуране (4 мл). Полученную смесь перемешивали в течение 30 минут. К реакционной смеси добавляли метансульфонилхлорид (0,055 мл, 0,71 ммоль). Полученную смесь перемешивали при указанной температуре в течение 2 часов. Температуру реакционной смеси затем повышали до комнатной температуры. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония. Полученный продукт экстрагировали диэтиловым эфиром. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью дихлорметан:этилацетат=19:1, концентрировали при пониженном давлении. Полученный остаток промывали смесью растворителей этанол/гексан и затем собирали фильтрованием с получением указанного в заголовке соединения (27 мг, 0,053 ммоль, 25%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 3,32 (3H, с), 6,86 (1H, с), 6,98-7,09 (2H, м), 7,36-7,43 (1H, м), 7,75 (1H, с), 7,85 (1H, дд, J=8,3, 2,2 Гц), 7,90 (1H, д, J=8,3 Гц), 7,93 (1H, с), 8,32 (1H, с), 8,67 (1H, д, J=2,2 Гц).
ИК (ATR) см-1: 1603, 1568, 1493, 1389, 1329, 1240, 1144, 1109.
Т.пл.: 214-216°C.
Элементный Анализ для C18H13Cl2F2N3O4S2. Рассчитано: C,42,53; H,2,58; Cl,13,95; F,7,47; N,8,27; S,12,62. Найдено: C,42,56; H,2,56; Cl,14,03; F,7,54; N,8,23; S,12,58.
MS m/z: 508 (M++H).
Ссылочный Пример 49: 5-Хлортиофен-2-тиол
[Химическая формула 137]
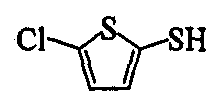
К раствору 5-хлортиофен-2-сульфонилхлорида (0,557 мл, 4,00 ммоль) в уксусной кислоте (15 мл) добавляли раствор хлорида олова (II) в 1 н. хлористоводородной кислоте (3 мл) (3,03 г, 16,0 ммоль) при 75°C. Реакционную смесь охлаждали до комнатной температуры, а затем к смеси добавляли воду. Полученный продукт экстрагировали дихлорметаном. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. К полученному остатку добавляли толуол, а затем снова концентрировали при пониженном давлении. Полученный остаток промывали диэтиловым эфиром и собирали фильтрованием с получением указанного в заголовке соединения (98 мг, 0,65 ммоль, 16%) в виде желтого твердого вещества. Фильтрат концентрировали при пониженном давлении. Полученный остаток промывали смесью растворителей диэтиловый эфир/гексан и собирали фильтрованием с получением указанного в заголовке соединения (118 мг, 0,78 ммоль, 20%) в виде желтого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 6,81 (1H, д, J=3,9 Гц), 6,85 (1H, д, J=3,9 Гц).
Пример 243: [5-Хлор-4-[(5-хлортиофен-2-илсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]амин
[Химическая формула 138]
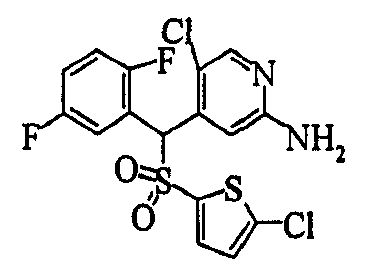
Таким же способом, как в примере 240, получали указанное в заголовке соединение (96 мг, 0,22 ммоль, 55%) в виде белого твердого вещества, используя трет-бутил [5-хлор-4-[(2,5-дифторфенил)(гидрокси)метил]пиридин-2-ил]карбамат (148 мг, 0,40 ммоль), полученный в ссылочном примере 47, и 5-хлортиофен-2-тиол (90 мг, 0,60 ммоль).
1H-ЯМР (400 МГц, CDCl3)δ: 4,66 (2H, с), 6,25 (1H, с), 6,93 (1H, д, J=4,2 Гц), 6,97-7,11 (2H, м), 7,28 (1H, с), 7,29 (1H, д, J=4,2 Гц), 7,47-7,53 (1H, м), 8,02 (1H, с).
ИК (ATR)см-1: 3438, 3180, 1643, 1595, 1543, 1485, 1404, 1315, 1242, 1138, 993.
Т.пл.: 170-171°C.
Элементный Анализ для C16H10Cl2F2N2O2S2. Рассчитано: C,44,15; H,2,32; Cl,16,29; F,8,73; N,6,44; S,14,73. Найдено: C,44,22; H,2,41; Cl,16,00; F,8,77; N,6,46; S,14,81.
MS m/z: 435 (M++H).
Пример 244: трет-Бутил [5-хлор-4-[(6-хлорпиридин-3-илтио)(2,5-дифторфенил)метил]пиридин-2-ил]карбамат
[Химическая формула 139]
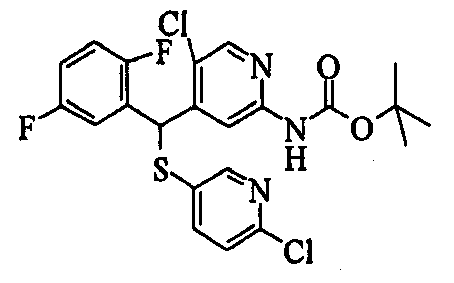
Таким же способом, как в примере 237, получали указанное в заголовке соединение (190 мг, 0,38 ммоль, 94%) в виде белого твердого вещества, используя O-этил S-(6-хлорпиридин-3-ил)дитиокарбонат (187 мг, 0,80 ммоль), полученный в ссылочном примере 26, и трет-бутил [5-хлор-4-[(2,5-дифторфенил)(гидрокси)метил]пиридин-2-ил]карбамат (151 мг, 0,41 ммоль), полученный в ссылочном примере 47.
1H-ЯМР (400 МГц, CDCl3)δ: 1,56 (9H, с), 6,01 (1H, с), 6,93-7,08 (3H, м), 7,22 (1H, д, J=8,3 Гц), 7,42 (1H, с), 7,71 (1H, дд, J=8,3, 2,5 Гц), 8,16 (1H, с), 8,37 (1H, д, J=2,5 Гц), 8,50 (1H, с).
MS m/z: 498 (M++H).
Пример 245: [5-Хлор-4-[(6-хлорпиридин-3-илсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]амин
[Химическая формула 140]
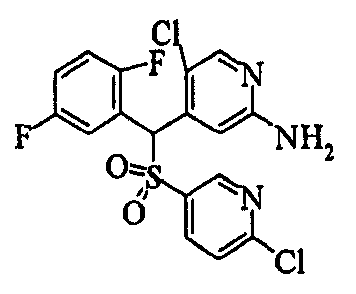
К раствору трет-бутил [5-хлор-4-[(6-хлорпиридин-3-илтио)(2,5-дифторфенил)метил]пиридин-2-ил]карбамата (187 мг, 0,38 ммоль) в дихлорметане (5 мл) добавляли при комнатной температуре 3-хлорпербензойную кислоту (199 мг, 0,75 ммоль). Полученную смесь перемешивали в течение 2 часов. Реакционную смесь промывали 1 н. водным раствором гидроксида натрия. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении.
Полученный остаток растворяли в дихлорметане (3 мл). При 0°C добавляли трифторуксусную кислоту (3 мл) и полученную смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении. Остаток растворяли в дихлорметане. Полученный раствор промывали 1 н. водным раствором гидроксида натрия. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=3:1, концентрировали при пониженном давлении. Полученный остаток промывали смесью растворителей этанол/гексан и собирали фильтрованием с получением указанного в заголовке соединения (90 мг, 0,21 ммоль, 55%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 4,68 (2H, с), 6,15 (1H, с), 6,93-7,00 (1H, м), 7,05-7,12 (1H, м), 7,29 (1H, с), 7,44 (1H, д, J=8,3 Гц), 7,48-7,54 (1H, м), 7,91 (1H, дд, J=8,3, 2,4 Гц), 8,01 (1H, с), 8,58 (1H, д, J=2,4 Гц).
ИК (ATR) см-1: 3342, 3167, 1495, 1479, 1331, 1240, 1161, 1115.
Т.пл.: 157-158°C.
Элементный Анализ для C17H11Cl2F2N3O2S. Рассчитано: C,47,46; H,2,58; Cl,16,48; F,8,83; N,9,77; S,7,45. Найдено: C,47,24; H,2,59; Cl,16,50; F,8,80; N,9,82; S,7,61.
MS m/z: 430 (M++H).
Пример 246: 4-[(2-Амино-5-хлорпиридин-4-ил)(2,5-дифторфенил)метилсульфонил]бензонитрил
[Химическая формула 141]
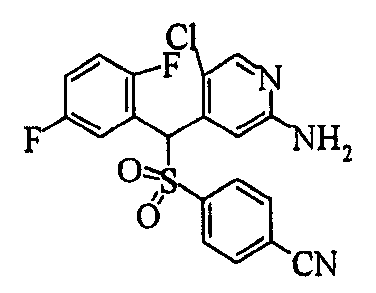
Таким же способом, как в примере 240, получали указанное в заголовке соединение (99 мг, 0,24 ммоль, 59%) в виде белого твердого вещества, используя трет-бутил [5-хлор-4-[(2,5-дифторфенил)(гидрокси)метил]пиридин-2-ил]карбамат (148 мг, 0,40 ммоль), полученный в ссылочном примере 47, и 4-меркаптобензонитрил (56 мг, 0,41 ммоль).
1H-ЯМР (400 МГц, CDCl3)δ: 4,68 (2H, с), 6,15 (1H, с), 6,89-6,96 (1H, м), 7,03-7,10 (1H, м), 7,31 (1H, с), 7,49-7,55 (1H, м), 7,76 (2H, д, J=8,5 Гц), 7,81 (2H, д, J=8,5 Гц), 7,99 (1H, с).
ИК (ATR) см-1: 3388, 1618, 1495, 1415, 1331, 1149.
Т.пл.: 233-235°C.
Элементный Анализ для C19H12ClF2N3O2S. Рассчитано: C,54,36; H,2,88; Cl,8,44; F,9,05; N,10,01; S,7,64. Найдено: C,54,41; H,2,93; Cl,8,41; F,8,92; N,9,92; S,7,69.
MS m/z: 420 (M++H).
Пример 247: [5-Хлор-4-[(2,5-дифторфенил)(3,4-дифторфенилсульфонил)метил]пиридин-2-ил]амин
[Химическая формула 142]
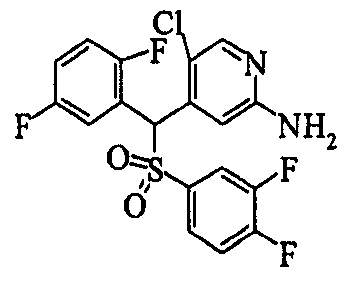
Таким же способом, как в примере 240, получали указанное в заголовке соединение (59 мг, 0,14 ммоль, 27%) в виде белого твердого вещества, используя трет-бутил [5-хлор-4-[(2,5-дифторфенил)(гидрокси)метил]пиридин-2-ил]карбамат (185 мг, 0,50 ммоль), полученный в ссылочном примере 47, и 3,4-дифторбензолтиол (84 мг, 0,55 ммоль).
1H-ЯМР (400 МГц, CDCl3)δ: 4,67 (2H, с), 6,13 (1H, с), 6,91-6,98 (1H, м), 7,03-7,10 (1H, м), 7,23-7,31 (1H, м), 7,31 (1H, с), 7,45-7,55 (3H, м), 8,00 (1H, с).
ИК (ATR) см-1: 3452, 3168, 1635, 1599, 1493, 1415, 1325, 1281, 1244, 1144, 1120.
Т.пл.: 140-141°C.
Элементный Анализ для C18H11ClF4N2O2S. Рассчитано: C,50,18; H,2,57; Cl,8,23; F,17,64; N,6,50; S,7,44. Найдено: C,50,12; H,2,60; Cl,8,25; F,17,35; N,6,51; S,7,58.
MS m/z: 431 (M++H).
Пример 248: N-[5-Хлор-4-[(2,5-дифторфенил)(3,4-дифторфенилсульфонил)метил]пиридин-2-ил]-N-(метилсульфонил)метансульфонамид
[Химическая формула 143]
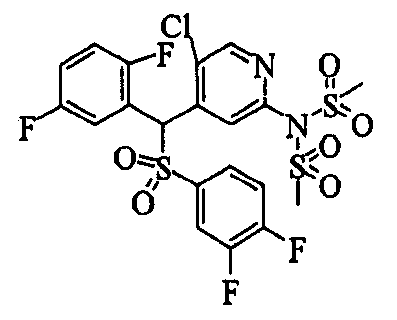
Метансульфонилхлорид (0,034 мл, 0,44 ммоль), триэтиламин (0,062 мл, 0,44 ммоль) и 4-диметиламинопиридин (4 мг, 0,03 ммоль) в атмосфере азота добавляли к раствору [5-хлор-4-[(2,5-дифторфенил)(3,4-дифторфенилсульфонил)метил]пиридин-2-ил]амина (63 мг, 0,15 ммоль) в дихлорметане (3 мл) при 0°C. Полученную смесь перемешивали при комнатной температуре в течение 17 часов. Реакционную смесь промывали 1 н. раствором хлористоводородной кислоты. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=3:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (73 мг, 0,12 ммоль, 85%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 3,63 (6H, с), 6,22 (1H, с), 7,02-7,16 (2H, м), 7,22-7,31 (1H, м), 7,45-7,51 (2H, м), 7,56-7,62 (1H, м), 8,17 (1H, с), 8,45 (1H, с).
MS m/z: 587 (M++H).
Пример 249: N-[5-Хлор-4-[(2,5-дифторфенил)(3,4-дифторфенилсульфонил)метил]пиридин-2-ил]метансульфонамид
[Химическая формула 144]
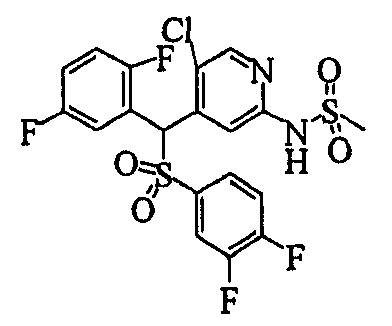
Раствор (1M, 0,147мл, 0,15 ммоль) тетрабутиламмонийфторида в тетрагидрофуране добавляли в атмосфере азота к раствору N-[5-хлор-4-[(2,5-дифторфенил)(3,4-дифторфенилсульфонил)метил]пиридин-2-ил]-N-(метилсульфонил)метансульфонамида (72 мг, 0,12 ммоль) в тетрагидрофуране (2 мл). Полученную смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь концентрировали при пониженном давлении, затем полученный остаток растворяли в этилацетате. Полученный раствор промывали последовательно 1 н. раствором хлористоводородной кислоты и насыщенным водным раствором хлорида аммония. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=3:1, концентрировали при пониженном давлении. Полученный остаток промывали смесью растворителей диэтиловый эфир/гексан и собирали фильтрованием с получением указанного в заголовке соединения (53 мг, 0,10 ммоль, 84%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 3,35 (3H, с), 6,19 (1H, с), 6,92-6,99 (1H, м), 7,04-7,12 (1H, м), 7,25-7,32 (1H, м), 7,44-7,60 (3H, м), 7,98 (1H, с), 7,99 (1H, с), 8,34 (1H, с).
ИК (ATR) см-1: 1599, 1495, 1468, 1333, 1281, 1146, 1003, 970.
Т.пл.: 118-120°C.
MS m/z: 509 (M++H).
FAB-MS: 509,0044 (Рассчитано для C19H14ClF4N2O4S2: 509,0020).
Ссылочный Пример 50: O-Этил S-(6-трифторметилпиридин-3-ил)дитиокарбонат
[Химическая формула 145]
После растворения 6-трифторметилпиридин-3-иламина (1,00 г, 6,02 ммоль) в 1 н. хлористоводородной кислоте (15 мл) и метаноле (3 мл) к полученному раствору добавляли по каплям при -10°C водный раствор (3 мл) нитрита натрия (506 мг, 7,22 ммоль). Реакционную смесь добавляли по каплям к водному раствору (15 мл) o-этилдитиокарбоната калия (1,93 г, 12,0 ммоль), нагретомудо 65°C. Реакционную смесь перемешивали при указанной температуре в течение 30 минут. После охлаждения реакционной смеси до комнатной температуры полученный продукт экстрагировали этилацетатом. Экстракт промывали насыщенным солевым раствором. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=100:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (895 мг, 3,35 ммоль, 56%) в виде желтого масла.
1H-ЯМР (400 МГц, CDCl3)δ: 1,38 (3H, т, J=7,1 Гц), 4,65 (2H,q, J=7,1 Гц), 7,76 (1H, д, J=8,1 Гц), 8,01 (1H, дд, J=8,1, 2,0 Гц), 8,79 (1H, д, J=2,0 Гц).
MS m/z: 268 (M++H).
Пример 250: [5-Хлор-4-[(2,5-дифторфенил)(6-трифторметилпиридин-3-илсульфонил)метил]пиридин-2-ил]амин
[Химическая формула 146]
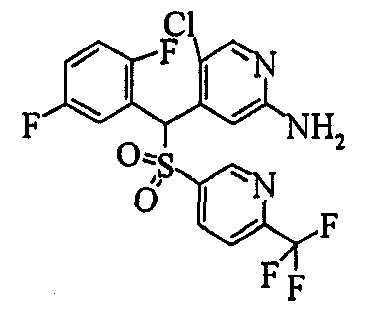
К раствору O-этил S-(6-трифторметилпиридин-3-ил) дитиокарбоната (160 мг, 0,60 ммоль) в этаноле (2 мл) добавляли 1 н. водный раствор гидроксида натрия (2 мл). Полученную смесь перемешивали при 65°C в течение 2 часов. После охлаждения реакционной смеси до комнатной температуры к смеси добавляли воду. Полученную смесь промывали дихлорметаном. Водный слой подкисляли 1 н. раствором хлористоводородной кислоты и продукт экстрагировали дихлорметаном. Органический слой сушили над безводным сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении с получением 6-трифторметилпиридин-3-тиола в виде бесцветного масла.
К раствору трет-бутил [5-хлор-4-[(2,5-дифторфенил)(гидрокси)метил]пиридин-2-ил]карбамата (185 мг, 0,50 ммоль), полученного в ссылочном примере 47, в дихлорметане при комнатной температуре последовательно добавляли метансульфонилхлорид (0,077 мл, 1,00 ммоль) и триэтиламин (0,279 мл, 2,00 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь промывали насыщенным водным раствором бикарбоната натрия. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении.
К раствору полученного остатка в N,N-диметилформамиде (5 мл) последовательно добавляли в атмосфере азота раствор 6-трифторметилпиридин-3-тиола, полученного, как указано выше, в N,N-диметилформамиде (5 мл) и карбонат калия (104 мг, 0,75 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 15 часов. К реакционной смеси добавляли этилацетат. Полученную смесь промывали последовательно насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении.
К раствору полученного остатка в этилацетате (10 мл) добавляли метанол (10 мл), 31% водный раствор перекиси водорода (5 мл) и тетрагидрат гексааммонийгептамолибдата (99 мг, 0,08 ммоль). Полученную смесь перемешивали при 50°C в течение 4 часов. К реакционной смеси добавляли воду и этилацетат и метанол отгоняли при пониженном давлении. К остатку добавляли насыщенный водный раствор бикарбоната натрия. Полученный продукт экстрагировали дихлорметаном. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=9:1, концентрировали при пониженном давлении.
К раствору полученного остатка в дихлорметане (5 мл) добавляли при 0°C трифторуксусную кислоту (5 мл). Полученную смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь концентрировали при пониженном давлении, затем остаток растворяли в дихлорметане. Полученный раствор промывали насыщенным водным раствором бикарбоната натрия. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=4:1, концентрировали при пониженном давлении. Полученный остаток промывали смесью растворителей этанол/гексан и собирали фильтрованием с получением указанного в заголовке соединения (75 мг, 0,16 ммоль, 32%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 4,71 (2H, с), 6,18 (1H, с), 6,91-6,99 (1H, м), 7,06-7,14 (1H, м), 7,30 (1H, с), 7,50-7,56 (1H, м), 7,81 (1H, д, J=8,1 Гц), 8,01 (1H, с), 8,20 (1H, дд, J=8,1, 2,0 Гц), 8,90 (1H, д, J=2,0 Гц).
ИК (ATR) см-1: 3446, 3157, 1649, 1601, 1485, 1419, 1325, 1147, 1101, 1076.
Т.пл.: 201-202°C.
Элементный Анализ для C18H11ClF5N3O2S·0,25H2O. Рассчитано: C,46,16; H,2,48; Cl,7,57; F,20,28; N,8,97; S,6,85. Найдено: C,46,30; H,2,36; Cl,7,61; F,19,96; N,8,93; S,7,12.
MS m/z: 464 (M++H).
Ссылочный Пример 51: O-Этил S-(4-хлор-3-фторфенил) дитиокарбонат
[Химическая формула 147]
Таким же способом, как в ссылочном примере 50, получали указанное в заголовке соединение (379 мг, 1,51 ммоль, 38%) в виде желтого масла, используя 4-хлор-3-фторанилин (582 мг, 4,00 ммоль).
1H-ЯМР (400 МГц, CDCl3)δ: 1,36 (3H, т, J=7,1 Гц), 4,63 (2H, кв., J=7,1 Гц), 7,22-7,25 (1H, м), 7,30-7,35 (1H, м), 7,43-7,49 (1H, м).
Пример 251: [5-Хлор-4-[(4-хлор-3-фторфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]амин
[Химическая формула 148]
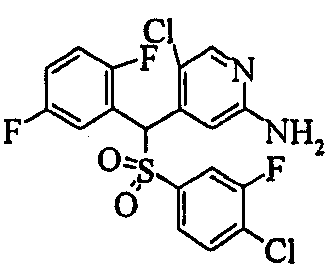
Таким же способом, как в примере 250, получали указанное в заголовке соединение (78 мг, 0,17 ммоль, 35%) в виде белого твердого вещества, используя O-этил S-(4-хлор-3-фторфенил)дитиокарбонат (150 мг, 0,60 ммоль) и трет-бутил [5-хлор-4-[(2,5-дифторфенил)(гидрокси)метил]пиридин-2-ил]карбамат (185 мг, 0,50 ммоль), полученный в ссылочном примере 47.
1H-ЯМР (400 МГц, CDCl3)δ: 4,68 (2H, с), 6,14 (1H, с), 6,92-6,99 (1H, м), 7,03-7,10 (1H, м), 7,31 (1H, с), 7,40-7,55 (4H, м), 8,00 (1H, с).
ИК (ATR) см-1: 3159, 1628, 1543, 1495, 1473, 1408, 1335, 1238, 1149, 1055.
Т.пл.: 159-160°C.
Элементный Анализ для C18H11Cl2F3N2O2S. Рассчитано: C,48,34; H,2,48; Cl,15,85; F,12,74; N,6,26; S,7,17. Найдено: C,48,22; H,2,47; Cl,15,89; F,12,75; N,6,24; S,7,34.
MS m/z: 447 (M++H).
Пример 252: Метил (E)-3-[4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]-5-фторпиридин-2-ил]акрилат
[Химическая формула 149]
Метил (трифенилфосфоранилиден)ацетат (259 мг, 0,775 ммоль) добавляли в атмосфере аргона к раствору [4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]-5-фторпиридин-2-ил]карбальдегида (300 мг, 0,705 ммоль), полученного в примере 200, в тетрагидрофуране (5 мл). Полученную смесь перемешивали при комнатной температуре в течение 6 часов. Реакционную смесь концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=4:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (303 мг, 0,629 ммоль, 89%) в виде бесцветного аморфного вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 3,84 (3H, с), 6,07 (1H, с), 6,92 (1H, д, J=15,6 Гц), 6,94-6,99 (1H, м), 7,05-7,11 (1H, м), 7,45 (2H, д, J=8,3 Гц), 7,63 (2H, д, J=8,3 Гц), 7,65-7,69 (1H, м), 7,73 (1H, д, J=15,6 Гц), 8,05 (1H, д, J=5,6 Гц), 8,44 (1H, с).
MS m/z: 482 (M++H).
Пример 253: Метил 3-[4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]-5-фторпиридин-2-ил]пропионат
[Химическая формула 150]
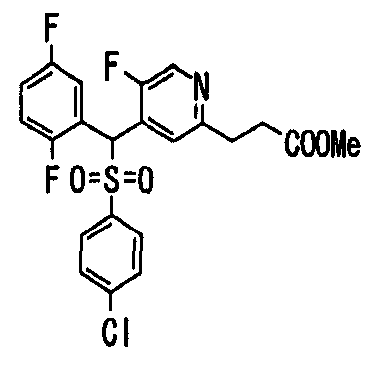
Суспензию никеля Ренея ("R-100", продукт от Nikko Rika Corporation) промывали последовательно водой и этанолом с получением, соответственно, суспензии в этаноле. Полученную суспензию в этаноле (1 мл) добавляли к раствору метил (E)-3-[4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]-5-фторпиридин-2-ил]акрилата (290 мг, 0,602 ммоль) в смеси этанола (6 мл) и 1,4-диоксана (4 мл). Полученную смесь интенсивно перемешивали в течение 30 минут в атмосфере водорода при давлении 1 атмосфера. Реакционную смесь фильтровали, затем концентрировали при пониженном давлении. Остаток растворяли в дихлорметане. Полученный раствор сушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток промывали гексаном с получением указанного в заголовке соединения (252 мг, 0,521 ммоль, 87%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 2,83 (2H, т, J=7,1 Гц), 3,19 (2H, т, J=7,1 Гц), 3,71 (3H, с), 6,06 (1H, с), 6,93-6,99 (1H, м), 7,03-7,09 (1H, м), 7,44 (2H, д, J=8,6 Гц), 7,63 (2H, д, J=8,6 Гц), 7,64-7,69 (1H, м), 7,88 (1H, д, J=5,4 Гц), 8,31 (1H, с).
MS m/z: 484 (M++H).
Пример 254: 3-[4-[(4-Хлорфенилсульфонил)(2,5-дифторфенил)метил]-5-фторпиридин-2-ил]пропионовая кислота
[Химическая формула 151]
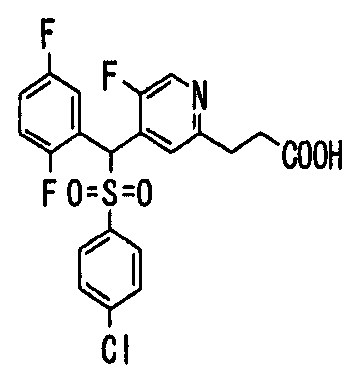
К раствору метил 3-[4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]-5-фторпиридин-2-ил]пропионата (150 мг, 0,310 ммоль) в смеси метанола (2 мл) и тетрагидрофурана (2 мл) добавляли 1 н. водный раствор гидроксида натрия. Полученную смесь перемешивали при комнатной температуре в течение 10 минут. Реакционную смесь слегка подкисляли 1 н. раствором хлористоводородной кислоты, затем экстрагировали дихлорметаном. Органический слой сушили над сульфатом магния и концентрировали при пониженном давлении с получением указанного в заголовке соединения (145 мг, 0,310 ммоль, колич.) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 2,88 (2H, т, J=6,6 Гц), 3,21-3,25 (2H, м), 6,07 (1H, с), 6,93-6,99 (1H, м), 7,04-7,10 (1H, м), 7,45 (2H, д, J=8,6 Гц), 7,62 (2H, д, J=8,6 Гц), 7,63-7,67 (1H, м), 7,92 (1H, д, J=5,4 Гц), 8,33 (1H, с).
ИК (ATR) см-1: 3453, 1716, 1664, 1614, 1571, 1496, 1430, 1394, 1330, 1284, 1238, 1187, 1151, 1089, 1010.
Т.пл.: 89-91°C.
MS m/z: 470 (M++H).
Элементный Анализ для C21H15ClF3NO4S·0,75H2O. Рассчитано: C,52,18; H,3,44; Cl,7,33; F,11,79; N,2,90; S,6,63. Найдено: C,52,20; H,3,65; Cl,7,11; F,11,43; N,2,99; S,6,58.
Ссылочный Пример 52: 2-Бром-5-хлор-4-[(2,5-дифторфенил)гидроксиметил]пиридин
[Химическая формула 152]
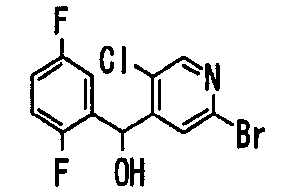
н-Бутиллитий (раствор 1,58M в гексане, 88 мл, 138 ммоль) добавляли в атмосфере аргона при -78°C к раствору диизопропиламина (21 мл, 150 ммоль) в тетрагидрофуране (200 мл). Полученную смесь перемешивали в течение 1 часа. К реакционной смеси добавляли по каплям раствор 2-бром-5-хлорпиридина (19 г, 98,7 ммоль) в тетрагидрофуране (100 мл). Полученную смесь перемешивали в течение 1,5 часа. К реакционной смеси добавляли по каплям 2,5-дифторбензальдегид (16 мл, 148 ммоль) с последующим перемешиванием в течение 2 часов. После добавления воды полученную смесь концентрировали при пониженном давлении. Остаток экстрагировали дихлорметаном. Полученный органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=6:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (24,8 г, 74,1 ммоль, 75%) в виде светло-желтого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 2,65 (1H, д, J=4,2 Гц), 6,20 (1H, д, J=4,2 Гц), 6,88-6,92 (1H, м), 7,01-7,27 (2H, м), 7,81 (1H, с), 8,30 (1H, с).
MS m/z: 334 (M++H).
Пример 255: 2-Бром-5-хлор-4-[(4-хлорфенилтио)(2,5-дифторфенил)метил]пиридин
[Химическая формула 153]
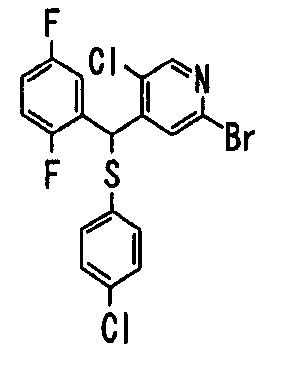
Триэтиламин (2,6 мл, 18,5 ммоль) и метансульфонилхлорид (1,3 мл, 16,0 ммоль) добавляли в атмосфере аргона при охлаждении льдом к раствору (80 мл) 2-бром-5-хлор-4-[(2,5-дифторфенил)гидроксиметил]-пиридина (4,12 г, 12,3 ммоль) в дихлорметане. Полученную смесь перемешивали при комнатной температуре в течение 1,5 часов. К реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия, затем экстрагировали диэтиловым эфиром. Экстракт промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении.
К раствору полученного остатка в диметилформамиде (40 мл) добавляли 4-хлорбензолтиол (2,1 г, 14,8 ммоль) и карбонат калия (2,6 г, 18,5 ммоль). Полученную смесь перемешивали при 50°C в течение 4 часов. После охлаждения до комнатной температуры реакционную смесь разбавляли диэтиловым эфиром. Разбавленную смесь промывали последовательно водой и насыщенным солевым раствором. Полученный органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=10:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (3,3 г, 7,16 ммоль, 58%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 5,96 (1H, с), 6,99-7,06 (2H, м), 7,15-7,20 (1H, м), 7,25 (2H, д, J=8,8 Гц), 7,28 (2H, д, J=8,8 Гц), 7,69 (1H, с), 8,32 (1H, с).
MS m/z: 460 (M++H).
Пример 256: [5-Хлор-4-[(4-хлорфенилтио)(2,5-дифторфенил)-метил]пиридин-2-ил]метанол
[Химическая формула 154]
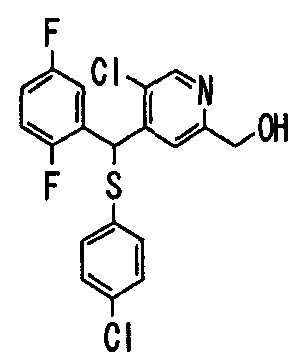
н-Бутиллитий (раствор 1,58M в гексане, 0,33 мл, 0,520 ммоль) добавляли в атмосфере аргона к раствору 2-бром-5-хлор-4-[(4-хлорфенилтио)(2,5-дифторфенил)метил]пиридина (200 мг, 0,434 ммоль) в толуоле (5 мл) при -78°C. Полученную смесь перемешивали в течение 2 часов. К реакционной смеси добавляли по каплям диметилформамид (44 мкл, 0,564 ммоль). Реакционную смесь перемешивали в течение 1 часа. К реакционной смеси добавляли метанол (5 мл) и борогидрид натрия (33 мг, 0,868 ммоль). Температуру полученной смеси повышали до комнатной температуры с последующим перемешиванием в течение 2 часов. К реакционной смеси добавляли воду и затем полученную смесь экстрагировали этилацетатом. Экстракт промывали насыщенным солевым раствором. Полученный органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=2:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (142 мг, 0,344 ммоль, 80%) в виде бесцветного аморфного вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 3,19 (1H, т, J=5,4 Гц), 4,75 (2H, д, J=5,4 Гц), 6,06 (1H, с), 6,96-7,04 (2H, м), 7,16-7,21 (1H, м), 7,22 (2H, д, J=8,8 Гц), 7,25 (2H, д, J=8,8 Гц), 7,52 (1H, с), 8,51 (1H, с).
MS m/z: 412 (M++H).
Пример 257: [5-Хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]метанол
[Химическая формула 155]
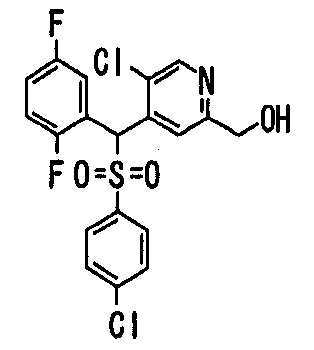
К раствору [5-хлор-4-[(4-хлорфенилтио)(2,5-дифторфенил)-метил]пиридин-2-ил]метанола (130 мг, 0,315 ммоль) в метаноле (5 мл) добавляли тетрагидрат гексааммонийгептамолибдата (20 мг) и 30% водный раствор перекиси водорода (3 мл). Полученную смесь перемешивали в течение 6 часов. К реакционной смеси добавляли воду, затем полученную смесь экстрагировали этилацетатом. Экстракт промывали последовательно водой, насыщенным водным раствором бикарбоната натрия, насыщенным водным раствором тиосульфата натрия и насыщенным солевым раствором. Полученный органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=2:1, концентрировали при пониженном давлении. Остаток перекристаллизовывали из гексана:этилацетата с получением указанного в заголовке соединения (101 мг, 0,227 ммоль, 72%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 3,22 (1H, т, J=5,4 Гц), 4,86 (2H, дд, J=5,4, 2,0 Гц), 6,24 (1H, с), 6,91-6,97 (1H, м), 7,02-7,09 (1H, м), 7,45 (2H, д, J=8,8 Гц), 7,52-7,57 (1H, м), 7,61 (2H, д, J=8,8 Гц), 8,10 (1H, с), 8,52 (1H, с).
ИК (ATR) см-1: 3255, 1583, 1492, 1428, 1394, 1330, 1280, 1236, 1159, 1085, 1035.
Т.пл.: 164-165°C.
MS m/z: 444 (M++H).
Элементный Анализ для C19H13Cl2F2NO3S. Рассчитано: C,51,36; H,2,95; Cl,15,96; F,8,55; N,3,15; S,7,22. Найдено: C,51,26; H,2,91; Cl,15,97; F,8,72; N,3,11; S,7,45.
Пример 258: [5-Хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]карбальдегид
[Химическая формула 156]
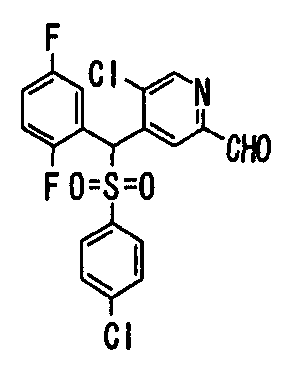
Диметилсульфоксид (880 мкл, 11,3 ммоль), триэтиламин (1,14 мл, 11,3 ммоль) и комплекс триоксид серы-пиридин (1,07 г, 6,75 ммоль) добавляли в атмосфере азота к раствору [5-хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]метанола (1,0 г, 2,25 ммоль) в дихлорметане (25 мл). Полученную смесь перемешивали при комнатной температуре в течение 18 часов. Реакционную смесь концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=2:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (770 мг, 1,74 ммоль, 77%) в виде бесцветного аморфного вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 6,23 (1H, с), 6,93-6,99 (1H, м), 7,04-7,10 (1H, м), 7,44 (2H, д, J=8,8 Гц), 7,59-7,64 (1H, м), 7,62 (2H, д, J=8,8 Гц), 8,69 (1H, с), 8,73 (1H, с), 10,09 (1H, с).
MS m/z: 442 (M++H).
Пример 259: Метил (E)-3-[5-Хлор-4-[(4-хлорфенилсульфонил)-(2,5-дифторфенил)метил]пиридин-2-ил]акрилат
[Химическая формула 157]
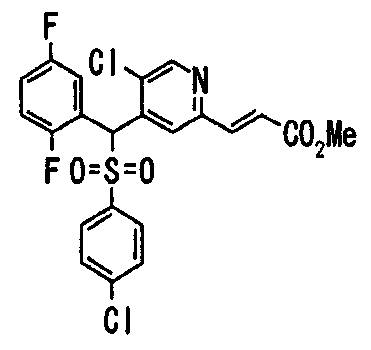
Метил (трифенилфосфоранилиден)ацетат (632 мг, 1,89 ммоль) добавляли в атмосфере аргона к раствору [5-хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]карбальдегида (760 мг, 1,72 ммоль) в тетрагидрофуране (15 мл). Полученную смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь концентрировали при пониженном давлении. Остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=4:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (776 мг, 1,56 ммоль, 91%) в виде бесцветного аморфного вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 3,85 (3H, с), 6,22 (1H, с), 6,93-6,98 (1H, м), 6,99 (1H, д, J=15,6 Гц), 7,03-7,10 (1H, м), 7,44 (2H, д, J=8,6 Гц), 7,54-7,58 (1H, м), 7,60 (2H, д, J=8,6 Гц), 7,73 (1H, д, J=15,6 Гц), 8,17 (1H, с), 8,56 (1H, с).
MS m/z: 498 (M++H).
Пример 260: Метил 3-[5-хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]пропионат
[Химическая формула 158]
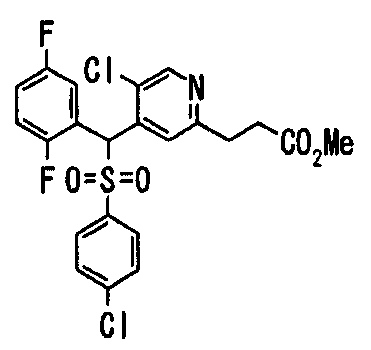
Суспензию никеля Ренея ("R-100", продукт от Nikko Rika Corporation) промывали последовательно водой и этанолом с получением, соответственно, суспензии в этаноле. Полученную суспензию в этаноле (2 мл) добавляли к раствору метил (E)-3-[5-хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]-пиридин-2-ил]акрилата (770 мг, 1,55 ммоль) в смеси этанола (10 мл) и 1,4-диоксана (5 мл). В атмосфере водорода при давлении 1 атмосфера полученную смесь интенсивно перемешивали в течение 30 минут. Реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении. Остаток растворяли в дихлорметане (15 мл). Полученный раствор сушили над сульфатом магния и концентрировали при пониженном давлении с получением указанного в заголовке соединения (720 мг, 1,44 ммоль, 93%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 2,84 (2H, т, J=7,1 Гц), 3,20 (2H, т, J=7,1 Гц), 3,70 (3H, с), 6,22 (1H, с), 6,92-6,97 (1H, м), 7,02-7,08 (1H, м), 7,43 (2H, д, J=8,6 Гц), 7,53-7,58 (1H, м), 7,61 (2H, д, J=8,6 Гц), 8,03 (1H, с), 8,44 (1H, с).
MS m/z: 500 (M++H).
Пример 261: 3-[5-Хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]пропионовая кислота
[Химическая формула 159]
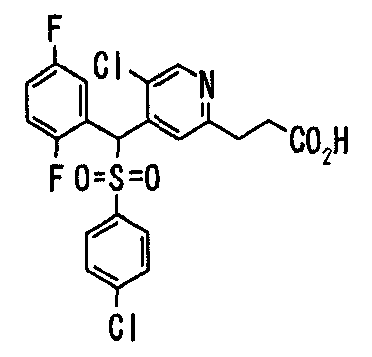
К раствору метил 3-[5-хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]пропионата (200 мг, 0,400 ммоль) в смеси метанола (2 мл) и тетрагидрофурана (2 мл) добавляли 1 н. водный раствор гидроксида натрия (2 мл). Полученную смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь слегка подкисляли добавлением 1 н. раствора хлористоводородной кислоты, затем экстрагировали дихлорметаном. Органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток перекристаллизовывали из гексана:этилацетата с получением указанного в заголовке соединения (161 мг, 0,331 ммоль, 83%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 2,90 (2H, т, J=6,7 Гц), 3,24 (2H, т, J=6,7 Гц), 6,21 (1H, с), 6,92-6,97 (1H, м), 7,03-7,08 (1H, м), 7,44 (2H, д, J=8,6 Гц), 7,51-7,56 (1H, м), 7,61 (2H, д, J=8,6 Гц), 8,06 (1H, с), 8,47 (1H, с).
ИК (ATR) см-1: 1718, 1587, 1496, 1423, 1396, 1365, 1321, 1280, 1240, 1205, 1174, 1083, 1054, 1014.
Т.пл.: 194-196°C.
MS m/z: 486 (M++H).
Элементный Анализ для C21H15Cl2F2NO4S. Рассчитано: C,51,86; H,3,11; Cl,14,58; F,7,81; N,2,88; S,6,59. Найдено: C,51,87; H,3,07; Cl,14,37; F,7,77; N,2,95; S,6,75.
Пример 262: 5-Хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиколиновая кислота
[Химическая формула 160]
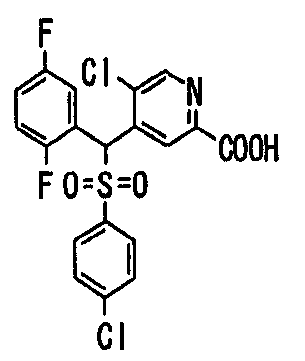
К раствору [5-хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]карбальдегида (150 мг, 0,339 ммоль), полученного в примере 258, в муравьиной кислоте (3 мл) добавляли 30% водный раствор перекиси водорода (115 мкл, 1,02 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 3 часов. К реакционной смеси добавляли воду и осажденное таким образом твердое вещество фильтровали. Твердое вещество промывали водой. Полученное твердое вещество растворяли в этилацетате. Полученный раствор промывали последовательно водой и насыщенным солевым раствором. Органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток перекристаллизовывали из гексана:этилацетата с получением указанного в заголовке соединения (88 мг, 0,192 ммоль, 57%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 6,30 (1H, с), 6,93-7,00 (1H, м), 7,05-7,11 (1H, м), 7,45 (2H, д, J=8,8 Гц), 7,62-7,66 (1H, м), 7,64 (2H, д, J=8,8 Гц), 8,95 (1H, с), 9,24 (1H, с).
ИК (ATR) см-1: 1758, 1712, 1583, 1542, 1494, 1425, 1396, 1328, 1280, 1228, 1153, 1085, 1054, 1014.
Т.пл.: 94-96°C.
MS m/z: 458 (M++H).
Элементный Анализ для C19H11Cl2F2NO4S. Рассчитано: C,49,80; H,2,42; Cl,15,47; F,8,29; N,3,06; S,7,00. Найдено: C,50,05; H,2,58; Cl,15,17; F,8,28; N,3,06; S,7,05.
Пример 263: 2-Бром-5-хлор-4-[(2,5-дифторфенил)(4-трифторметилфенилтио)метил]пиридин
[Химическая формула 161]
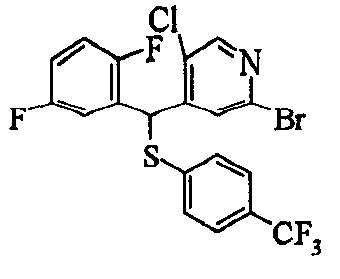
К раствору 2-бром-5-хлор-4-[(2,5-дифторфенил)-гидроксиметил]пиридина (1,34 г, 4,00 ммоль), полученного в ссылочном примере 52, в дихлорметане последовательно добавляли метансульфонилхлорид (0,619 мл, 8,00 ммоль) и триэтиламин (2,23 мл, 16,0 ммоль) в атмосфере азота. Полученную смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь промывали последовательно водой и насыщенным солевым раствором. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении.
К раствору полученного остатка в N,N-диметилформамиде (60 мл) в атмосфере азота последовательно добавляли 4-трифторбензолтиол (784 мг, 4,40 ммоль) и карбонат калия (663 мг, 4,80 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 17 часов. К реакционной смеси добавляли этилацетат и смесь промывали насыщенным водным раствором бикарбоната натрия. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=50:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (1,33 г, 2,69 ммоль, 67%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 6,10 (1H, с), 6,99-7,11 (2H, м), 7,14-7,20 (1H, м), 7,36 (2H, д, J=8,1 Гц), 7,52 (2H, д, J=8,1 Гц), 7,69 (1H, с), 8,36 (1H, с).
MS m/z: 494,496 (M++H).
Пример 264: Метил (E)-3-[5-хлор-4-[(2,5-дифторфенил)(4-трифторметилфенилтио)метил]пиридин-2-ил]акрилат
[Химическая формула 162]
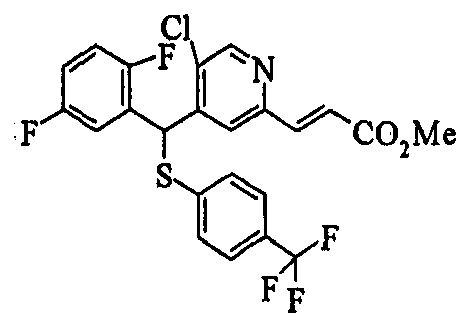
К раствору 2-бром-5-хлор-4-[(2,5-дифторфенил)(4-трифторметилфенилтио)метил]пиридина (396 мг, 0,80 ммоль) в толуоле (12 мл) при -78°C в атмосфере аргона добавляли раствор (1,59M, 0,604 мл, 0,96 ммоль) н-бутиллития в гексане. Полученную смесь перемешивали в течение 30 минут. При указанной температуре добавляли N,N-диметилформамид (0,081 мл, 1,04 ммоль) и полученную смесь перемешивали в течение 30 минут. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония, а затем воду. После того как температуру полученной смеси повышали до комнатной температуры, полученный продукт экстрагировали диэтиловым эфиром. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=9:1, концентрировали при пониженном давлении с получением альдегидного соединения (186 мг).
Соединение альдегида (133 мг) растворяли в тетрагидрофуране (2 мл). К полученному раствору при комнатной температуре добавляли метил (трифенилфосфоранилиден)ацетат (120 мг, 0,36 ммоль). Полученную смесь перемешивали при указанной температуре в течение 18 часов. Реакционную смесь концентрировали при пониженном давлении, затем полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=19:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (132 мг, 0,26 ммоль, 46%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 3,82 (3H, с), 6,17 (1H, с), 6,92 (1H, д, J=15,7 Гц), 6,99-7,09 (2H, м), 7,13-7,18 (1H, м), 7,35 (2H, д, J=8,1 Гц), 7,50 (2H, д, J=8,1 Гц), 7,61 (1H, с), 7,61 (1H, д, J=15,7 Гц), 8,59 (1H, с).
MS m/z: 500 (M++H).
Пример 265: Метил (E)-3-[5-хлор-4-[(2,5-дифторфенил)(4-трифторметилфенилсульфонил)метил]пиридин-2-ил]акрилат
[Химическая формула 163]
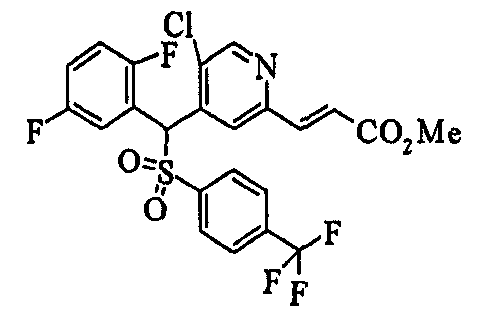
К раствору метил (E)-3-[5-хлор-4-[(2,5-дифторфенил)(4-трифторметилфенилтио)метил]пиридин-2-ил]акрилата (118 мг, 0,24 ммоль) в этилацетате (6 мл) добавляли метанол (6 мл), 31% водный раствор перекиси водорода (6 мл) и тетрагидрат гексааммонийгептамолибдата (58 мг, 0,05 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 11 часов. К реакционной смеси добавляли воду. Этилацетат и метанол отгоняли при пониженном давлении, затем к остатку добавляли насыщенный солевой раствор. Полученный продукт экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=9:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (111 мг, 0,21 ммоль, 88%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 3,86 (3H, с), 6,25 (1H, с), 6,91-6,98 (1H, м), 7,01 (1H, д, J=15,7 Гц), 7,04-7,11 (1H, м), 7,53-7,59 (1H, м), 7,74 (1H, д, J=15,7 Гц), 7,74 (2H, д, J=8,3 Гц), 7,83 (2H, д, J=8,3 Гц), 8,18 (1H, с), 8,56 (1H, с).
MS m/z: 532 (M++H).
Пример 266: Метил 3-[5-хлор-4-[(2,5-дифторфенил)(4-трифторметилфенилсульфонил)метил]пиридин-2-ил]пропионат
[Химическая формула 164]
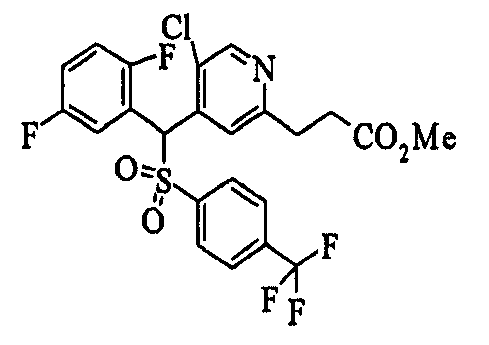
В смеси растворителей этилацетата (3 мл) и метанола (3 мл) растворяли метил (E)-3-[5-хлор-4-[(2,5-дифторфенил)(4-трифторметилфенилсульфонил)метил]пиридин-2-ил]акрилат (110 мг, 0,21 ммоль). К полученному раствору добавляли катализатор 10% палладий на углероде (60 мг). Полученную смесь перемешивали в атмосфере водорода при комнатной температуре в течение 2 часов. Катализатор удаляли фильтрованием через целит, фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=4:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (94 мг, 0,18 ммоль, 85%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 2,82-2,89 (2H, м), 3,21 (2H, т, J=7,1 Гц), 3,70 (3H, с), 6,25 (1H, с), 6,90-6,97 (1H, м), 7,03-7,10 (1H, м), 7,54-7,60 (1H, м), 7,73 (2H, д, J=8,3 Гц), 7,84 (2H, д, J=8,3 Гц), 8,04 (1H, с), 8,44 (1H, с).
MS m/z: 534 (M++H).
Пример 267: 3-[5-Хлор-4-[(2,5-дифторфенил)(4-трифторметилфенилсульфонил)метил]пиридин-2-ил]пропионовая кислота
[Химическая формула 165]
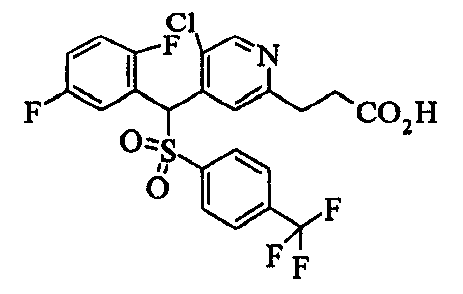
К раствору метил 3-[5-хлор-4-[(2,5-дифторфенил)(4-трифторметилфенилсульфонил)метил]пиридин-2-ил]пропионата (92 мг, 0,17 ммоль) в тетрагидрофуране (2 мл) добавляли при 0°C метанол (2 мл) и 1 н. водный раствор гидроксида натрия (2 мл). Полученную смесь перемешивали при комнатной температуре в течение 2 часов. К реакционной смеси добавляли 1 н. раствор хлористоводородной кислоты и полученный продукт экстрагировали дихлорметаном. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток промывали этанолом и собирали фильтрованием с получением указанного в заголовке соединения (61 мг, 0,12 ммоль, 68%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 2,90 (2H, т, J=6,7 Гц), 3,18-3,31 (2H, м), 6,25 (1H, с), 6,90-6,97 (1H, м), 7,03-7,10 (1H, м), 7,51-7,57 (1H, м), 7,74 (2H, д, J=8,3 Гц), 7,82 (2H, д, J=8,3 Гц), 8,07 (1H, с), 8,47 (1H, с).
ИК (ATR) см-1: 1707, 1495, 1408, 1321, 1244, 1174, 1159, 1124, 1063.
Т.пл.: 166-167°C.
Элементный Анализ для C22H15ClF5NO4S. Рассчитано: C,50,83; H,2,91; Cl,6,82; F,18,27; N,2,69; S,6,17. Найдено: C,50,66; H,2,93; Cl,6,87; F,17,83; N,2,75; S,6,28.
MS m/z: 520 (M++H).
Пример 268: N-[5-Хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]-1-метил-1H-имидазол-4-сульфонамид
[Химическая формула 166]
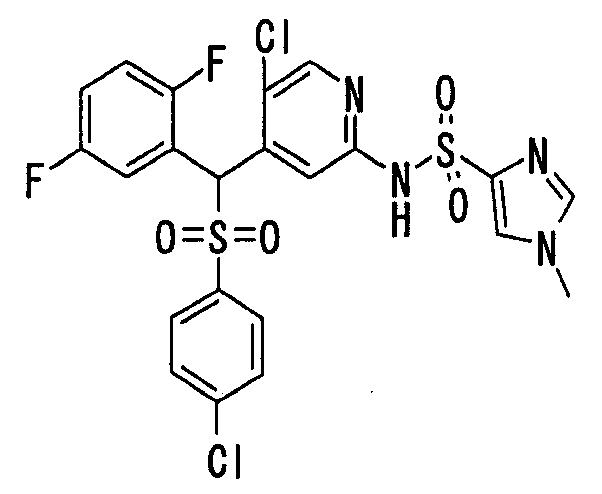
К раствору [5-хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]амина (93 мг, 0,217 ммоль), полученного в примере 196, и пиридина (21 мкл, 0,260 ммоль) в метиленхлориде (5 мл) добавляли 1-метил-1H-имидазол-4-сульфонилхлорид (47 мг, 0,260 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 18 часов. После добавления к реакционной смеси пиридина (1 мл) полученную смесь перемешивали при комнатной температуре в течение 7 часов и реакционную смесь концентрировали при пониженном давлении. К полученному остатку добавляли этилацетат. Полученную смесь промывали последовательно насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии на силикагеле. Фракцию, полученную при элюировании смесью метанол:метиленхлорид (=1:50), концентрировали при пониженном давлении с получением белого твердого вещества. Полученное белое твердое вещество промывали этанолом и собирали фильтрованием с получением указанного в заголовке соединения (68 мг, 0,119 ммоль, 55%) в виде белого порошка.
1H-ЯМР (400 МГц,DMSO-d6)δ: 3,69 (3H, с), 6,25 (1H, с), 7,29-7,45 (2H, м), 7,47-7,54 (1H, м), 7,68 (2H, д, J=8,8 Гц), 7,75 (2H, д, J=8,8 Гц), 7,77 (1H, с), 7,94 (1H, с), 8,10 (1H, с), 8,26 (1H, с), 11,40 (1H, шир. с).
Т.пл.: 294-296°C
ИК (ATR) см-1: 1594, 1562, 1494, 1382, 1332, 1159, 1118, 993, 817, 755, 723.
MS m/z: 572 (M+).
EI-MS: 571,9962 (Рассчитано для C22H16O4N4Cl2F2S2: 571,9958).
Элементный Анализ для C22H16N4O4Cl2F2S2. Рассчитано: C,46,08; H,2,81; N,9,77; Cl,12,37; F,6,63; S,11,18. Найдено: C,46,04; H,2,77; N,9,74; Cl,12,46; F,6,90; S,11,21.
Пример 269: N-[5-Хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]-1-пиридин-4-илметансульфонамид
[Химическая формула 167]
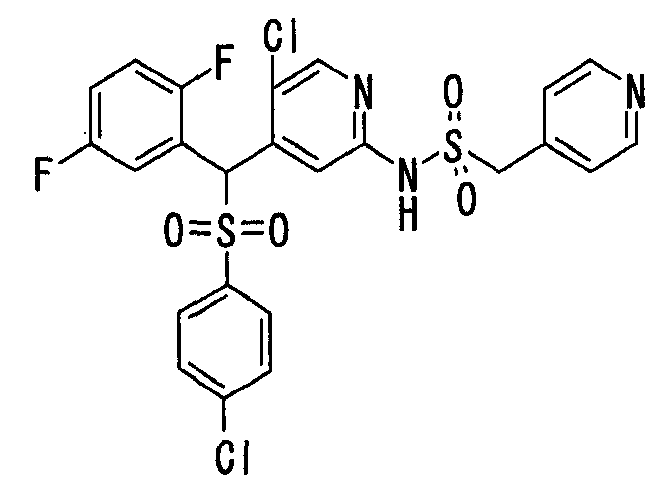
К раствору в метиленхлориде (2 мл) [5-хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]амина (104 мг, 0,242 ммоль), полученного в примере 196, и пиридина (74 мкл, 0,533 ммоль) добавляли (4-пиридилметил)сульфонилхлоридтрифлат (91 мг, 0,266 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 17 часов. К реакционной смеси добавляли пиридин (74 мкл, 0,533 ммоль) и (4-пиридилметил)сульфонилхлоридтрифлат (91 мг, 0,266 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 19 часов. Реакционную смесь разбавляли этилацетатом. Разбавленный раствор промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали колоночной хроматографии на силикагеле. Фракцию, полученную при элюировании смесью метанол:метиленхлорид (=1:40), концентрировали при пониженном давлении с получением указанного в заголовке соединения (66 мг, 0,113 ммоль, 47%) в виде белого твердого вещества.
1H-ЯМР (400 МГц,DMSO-d6)δ: 4,88 (2H, с), 6,30 (1H, с), 7,27 (2H, д, J=6,0 Гц), 7,29-7,49 (3H, м), 7,70 (2H, д, J=8,8 Гц), 7,74 (1H, с), 7,79 (2H, д, J=8,8 Гц), 8,45 (1H, с), 8,53 (2H, д, J=6,0 Гц), 11,00 (1H, шир. с).
Т.пл.: 257°C (разл.)
ИК (ATR) см-1: 1592, 1490, 1467, 1340, 1326, 1280, 1238, 1186, 1155, 1128, 1085, 1004, 966, 902, 869, 823.
MS m/z: 584 (M++H).
Элементный Анализ для C24H17N3O4Cl2F2S2. Рассчитано: C,49,32; H,2,93; N,7,19; Cl,12,13; F,6,50; S,10,97. Найдено: C,49,35; H,3,12; N,7,17; Cl,12,05; F,6,43; S,10,93.
Пример 270: N-[5-Хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]пиперидин-1-сульфонамид
[Химическая формула 168]
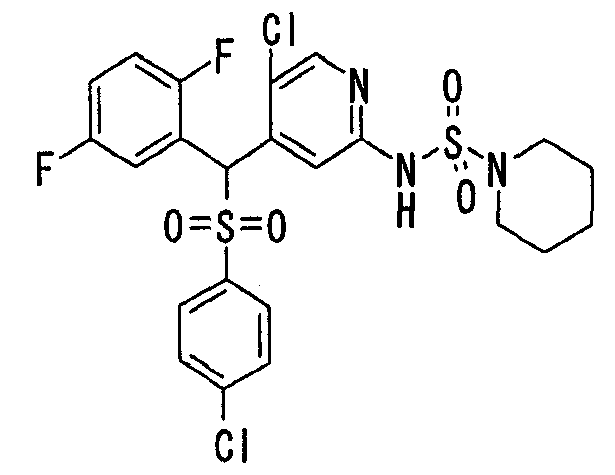
Раствор [5-хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]амина (101 мг, 0,235 ммоль), полученного в примере 196, и пиперидин-1-сульфонилхлорида (48 мг, 0,259 ммоль) в пиридине (2 мл) перемешивали при 70°C в течение 19 часов. К реакционной смеси добавляли пиперидин-1-сульфонилхлорид (48 мг, 0,259 ммоль) и полученную смесь перемешивали при 70°C в течение 4 дней. Реакционную смесь охлаждали до комнатной температуры и затем концентрировали при пониженном давлении. Полученный остаток разбавляли этилацетатом. Разбавленный раствор промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат (=4:1), концентрировали при пониженном давлении с получением белого твердого вещества. Полученное твердое вещество промывали смесью гексан-простой эфир и собирали фильтрованием с получением указанного в заголовке соединения (63 мг, 0,109 ммоль, 47%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 1,51-1,61 (2H, м), 1,65-1,75 (4H, м), 3,38 (4H, т, J=4,6 Гц), 6,21 (1H, с), 6,94-7,10 (2H, м), 7,41-7,52 (3H, м), 7,70 (2H, д, J=8,6 Гц), 8,24 (1H, с), 8,29 (1H, с), 8,71 (1H, шир. с).
Т.пл.: 192-194°C
ИК (ATR) см-1: 1598, 1563, 1492, 1396, 1346, 1322, 1234, 1145, 1083, 998, 923, 900, 833.
MS m/z: 576 (M++H).
Элементный Анализ для C23H21N3O4Cl2F2S2. Рассчитано: C,47,92; H,3,67; N,7,29; Cl,12,30; F,6,59; S,11,12. Найдено: C,47,87; H,3,66; N,7,33; Cl,12,12; F,6,66; S,11,25.
Пример 271: N-[5-Хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]-4-метилпиперидин-1-сульфонамид
[Химическая формула 169]
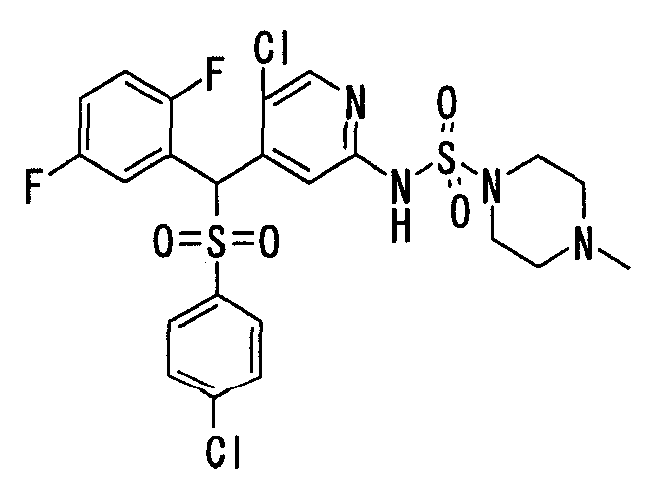
Раствор в ацетонитриле (5 мл) [5-хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]амина (101 мг, 0,235 ммоль), полученного в примере 196, гидрохлорида 4-метилпиперазин-1-сульфонилхлорида (126 мг, 0,534 ммоль) и триэтиламина (150 мкл, 1,07 ммоль) нагревали при кипячении с обратным холодильником в течение 23 часов. К реакционной смеси добавляли гидрохлорид 4-метилпиперазин-1-сульфонилхлорида (126 мг, 0,534 ммоль) и триэтиламин (150 мкл, 1,07 ммоль). Полученную смесь нагревали при кипячении с обратным холодильником в течение 22 часов. Реакционную смесь охлаждали до комнатной температуры и затем концентрировали при пониженном давлении. К остатку добавляли воду и полученную смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью метанол:метиленхлорид (=1:20), концентрировали при пониженном давлении с получением указанного в заголовке соединения (34 мг, 0,057 ммоль, 16%) в виде светло-желтого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 2,31 (3H, с), 2,45-2,60 (4H, м), 3,38-3,52 (4H, м), 6,20 (1H, с), 6,95-7,10 (2H, м), 7,41-7,50 (3H, м), 7,69 (2H, д, J=8,8 Гц), 8,24 (1H, с), 8,26 (1H, с).
Т.пл.: 215-218°C.
ИК (ATR) см-1: 1600, 1565, 1496, 1392, 1348, 1330, 1157, 1093, 935, 835, 819.
MS m/z: 591 (M++H).
Элементный Анализ для C23H22N4O4Cl2F2S2. Рассчитано: C,46,70; H,3,75; N,9,47; Cl,11,99; F,6,42; S,10,84. Найдено: C,46,89; H,3,76; N,9,40; Cl,11,78; F,6,42; S,10,72.
Пример 272: 3-Хлор-N-[5-хлор-4-[(4-хлорфенилсульфонил)-(2,5-дифторфенил)метил]пиридин-2-ил]-N-(3-хлорпропилсульфонил)пропан-1-сульфонамид
[Химическая формула 170]
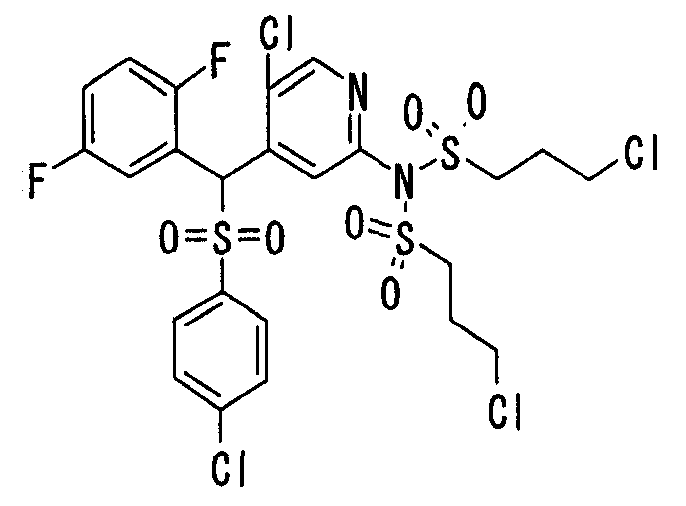
К раствору в метиленхлориде (5 мл) [5-хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]амина (130 мг, 0,303 ммоль), полученного в примере 196, и триэтиламина (42 мкл, 0,303 ммоль) при 0°C добавляли 3-хлорпропансульфонилхлорид (37 мкл, 0,303 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2,5 часов. При 0°C последовательно добавляли триэтиламин (42 мкл, 0,303 ммоль) и 3-хлорпропансульфонилхлорид (37 мкл, 0,303 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 7 часов. К реакционной смеси добавляли этилацетат. Полученную смесь промывали насыщенным водным раствором бикарбоната натрия, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат (=5:1), концентрировали при пониженном давлении. К полученному остатку добавляли эфир и осажденное таким образом твердое вещество собирали фильтрованием с получением указанного в заголовке соединения в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 2,47-2,57 (4H, м), 3,74 (4H, т, J=6,1 Гц), 3,96-4,05 (4H, м), 6,20 (1H, с), 6,98-7,15 (2H, м), 7,40-7,53 (3H, м), 7,62 (2H, д, J=8,3 Гц), 8,22 (1H, с), 8,64 (1H, с).
MS m/z: 709,711 (M++H).
Пример 273: 3-Хлор-N-[5-хлор-4-[(4-хлорфенилсульфонил)-(2,5-дифторфенил)метил]пиридин-2-ил]пропан-1-сульфонамид
[Химическая формула 171]
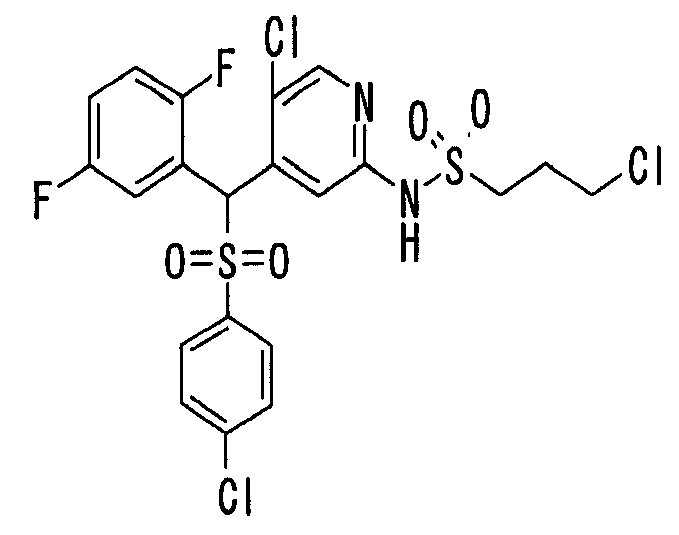
К раствору 3-хлор-N-[5-хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]-N-(3-хлорпропилсульфонил)пропан-1-сульфонамида (193 мг, 0,272 ммоль) в тетрагидрофуране (5 мл) добавляли раствор тетрабутиламмонийфторида (1,0M, 0,28 мл, 0,28 ммоль) в тетрагидрофуране. Полученную смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония, затем экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали колоночной хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат (=4:1), концентрировали при пониженном давлении с получением указанного в заголовке соединения (108 мг, 0,190 ммоль, 70%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 2,35-2,44 (2H, м), 3,61-3,67 (2H, м), 3,70 (2H, т, J=6,1 Гц), 6,19 (1H, с), 6,90-6,99 (1H, м), 7,02-7,10 (1H, м), 7,42-7,53 (3H, м), 7,64 (2H, д, J=8,3 Гц), 7,84 (1H, шир. с), 8,01 (1H, с), 8,31 (1H, с).
ИК (ATR) см-1: 1596, 1560, 1488, 1384, 1336, 1234, 1145, 1083, 997, 925, 844.
MS m/z: 568,570 (M+).
Пример 274: 5-Хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]-2-(1,1-диоксо-1λ6-изотиазолидин-2-ил)пиридин
[Химическая формула 172]
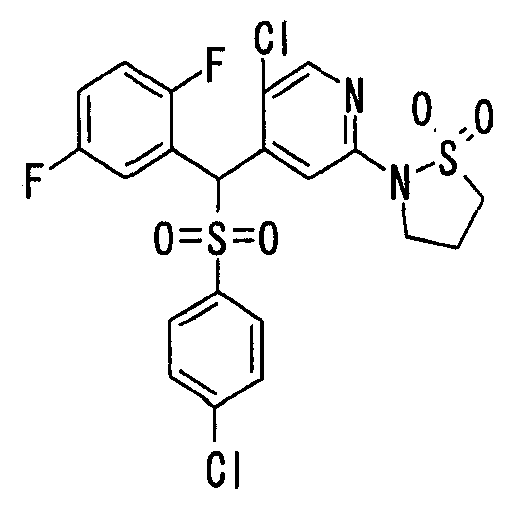
Раствор 3-хлор-N-[5-хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]пропан-1-сульфонамида (83 мг, 0,146 ммоль) и 1,8-диазабицикло[5,4,0]-7-ундецена (26 мкл, 0,175 ммоль) в ацетонитриле (5 мл) перемешивали при 70°C в течение 4,5 часов. Реакционную смесь охлаждали до комнатной температуры и затем концентрировали при пониженном давлении. Полученный остаток разбавляли этилацетатом. Разбавленный раствор промывали последовательно 1 н. раствором хлористоводородной кислоты, насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат (=1:1), концентрировали при пониженном давлении с получением указанного в заголовке соединения (75 мг, 0,141 ммоль, 96%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 2,52-2,62 (2H, м), 3,47 (2H, т, J=7,6 Гц), 4,02 (2H, т, J=6,6 Гц), 6,24 (1H, с), 6,95-7,10 (2H, м), 7,44 (2H, д, J=8,6 Гц), 7,49-7,56 (1H, м), 7,74 (2H, д, J=8,6 Гц), 8,13 (1H, с), 8,24 (1H, с).
Т.пл.: 219-221°C.
ИК (ATR) см-1: 1587, 1496, 1467, 1386, 1346, 1315, 1278, 1238, 1137, 1089, 998, 831.
MS m/z: 532 (M+).
Элементный Анализ для C21H16N2O4Cl2F2S2. Рассчитано: C,47,29; H,3,02; N,5,25; Cl,13,29; F,7,12; S,12,02. Найдено: C,47,39; H,3,02; N,5,37; Cl,13,32; F,7,24; S,11,95.
Пример 275: N-[5-Хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]-N-(трифторметилсульфонил)-трифторметансульфонамид
[Химическая формула 173]
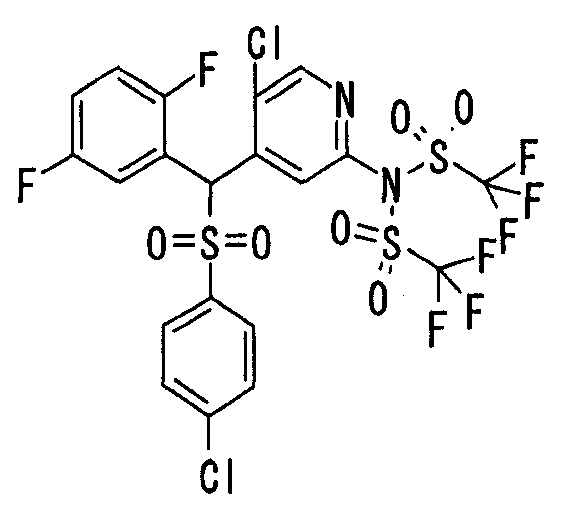
К раствору [5-хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]амина (103 мг, 0,240 ммоль), полученного в примере 196, и пиридина (19 мкл, 0,240 ммоль) в метиленхлориде (5 мл) при 0°C добавляли трифторметансульфоновый ангидрид (39 мкл, 0,240 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 3 часов, затем добавляли при 0°C пиридин (19 мкл, 0,240 ммоль) и трифторметансульфоновый ангидрид (39 мкл, 0,240 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 15 часов, затем концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат (=5:1), концентрировали при пониженном давлении с получением указанного в заголовке соединения (84 мг, 0,120 ммоль, 50%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 6,23 (1H, с), 6,99-7,15 (2H, м), 7,38-7,48 (3H, м), 7,62 (2H, д, J=8,8 Гц), 8,36 (1H, с), 8,53 (1H, с).
ИК (ATR) см-1: 1581, 1498, 1442, 1332, 1214, 1159, 1122, 1085, 997, 944, 923, 865, 755.
MS m/z: 693 (M++H).
Пример 276: N-[5-Хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]трифторметансульфонамид
[Химическая формула 174]
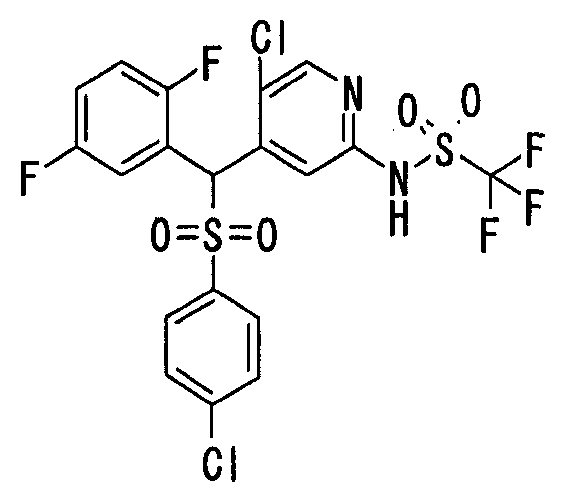
К раствору N-[5-хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]-N-(трифторметилсульфонил)трифторметансульфонамида (77 мг, 0,111 ммоль) в смеси тетрагидрофурана (5 мл) и воды (1 мл) добавляли моногидрат гидроксида лития (5,0 мг, 0,111 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 5 часов. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония, затем экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали колоночной хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан: этилацетат (=2:1) с содержанием 0,5% трифторуксусной кислоты, концентрировали при пониженном давлении. К полученному остатку добавляли эфир и осажденное таким образом твердое вещество собирали фильтрованием с получением указанного в заголовке соединения (39 мг, 0,069 ммоль, 63%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 6,21 (1H, с), 6,95-7,03 (1H м), 7,06-7,15 (1H, м), 7,42-7,52 (3H, м), 7,71 (2H, д, J=8,8 Гц), 8,23 (1H, с), 8,71 (1H, с).
Т.пл.: 221-223°C
ИК (ATR) см-1: 1637, 1496, 1382, 1336, 1195, 1157, 1130, 1085, 1010, 923, 779, 754.
MS m/z: 560 (M+).
Элементный Анализ для C19H11N2O4Cl2F5S2. Рассчитано: C,40,65; H,1,98; N,4,99; Cl,12,63; F,16,92; S,11,42. Найдено: C,40,68; H,1,94; N,5,06; Cl,12,46; F,16,91; S,11,47.
Пример 277: N-[5-Хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]этиленсульфонамид
[Химическая формула 175]
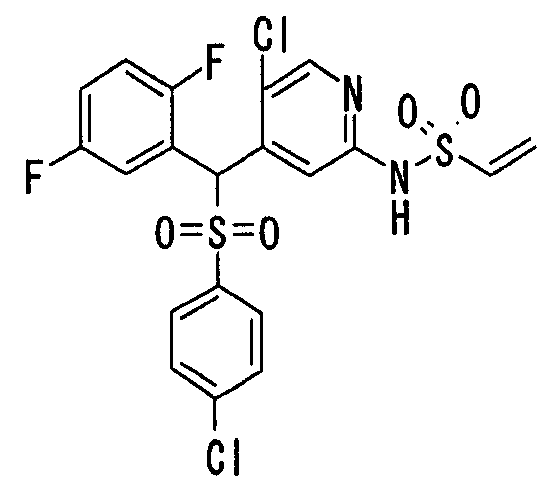
К раствору [5-хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]амина (982 мг, 2,29 ммоль), полученного в примере 196, и 2-хлорэтансульфонилхлорида (0,29 мл, 2,74 ммоль) в метиленхлориде (10 мл) добавляли пиридин (0,44 мл, 5,49 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 3,5 часов. К реакционной смеси добавляли 2-хлорэтансульфонилхлорид (143 мкл, 1,37 ммоль) и пиридин (222 мкл, 2,75 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли этилацетат. Полученную смесь промывали насыщенным водным раствором бикарбоната натрия, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат (=3:1), концентрировали при пониженном давлении с получением указанного в заголовке соединения (573 мг, 1,10 ммоль, 48%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 6,17-6,25 (2H, м), 6,65-6,70 (2H, м), 6,91-7,10 (2H, м), 7,41-7,49 (3H, м), 7,66 (2H, д, J=8,6 Гц), 8,16 (1H, с), 8,33 (1H, с).
ИК (ATR) см-1: 1600, 1565, 1492, 1388, 1349, 1322, 1147, 1081, 998, 916, 821, 757.
MS m/z: 519 (M++H).
Пример 278: N-[5-Хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]-2-пиперидин-1-илэтансульфонамид
[Химическая формула 176]
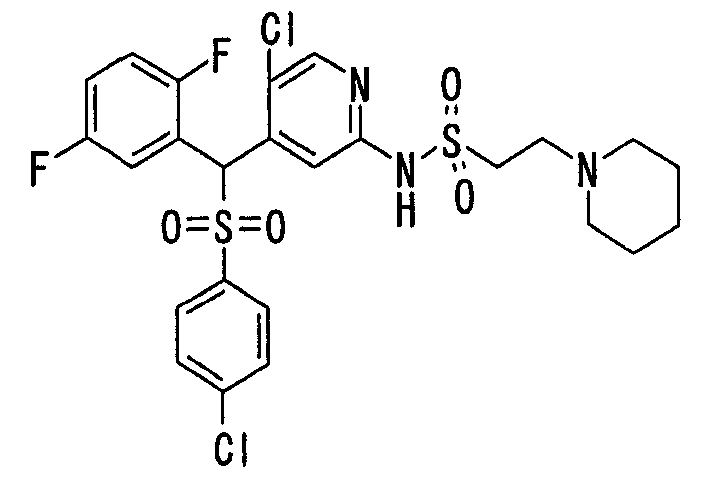
К раствору N-[5-хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]этиленсульфонамида (34 мг, 0,065 ммоль) в этаноле (5 мл) добавляли пиперидин (10 мкл, 0,098 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 3 дней. Реакционную смесь концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью метанол:метиленхлорид (=1:30), концентрировали при пониженном давлении с получением указанного в заголовке соединения (35 мг, 0,058 ммоль, 89%) в виде аморфного вещества. Полученное аморфное вещество отверждали добавлением к нему этанола и собирали фильтрованием с получением указанного в заголовке соединения в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 1,45-1,76 (6H, м), 2,50-2,65 (4H, м), 2,97 (2H, т, J=5,9 Гц), 3,30-3,38 (2H, м), 6,21 (1H, с), 6,92-7,10 (2H, м), 7,44 (2H, д, J=8,6 Гц), 7,52-7,59 (1H, м), 7,69 (2H, д, J=8,6 Гц), 8,06 (1H, с), 8,22 (1H, с).
Т.пл.: 200-203°C
ИК (ATR) см-1: 1600, 1571, 1492, 1390, 1332, 1141, 1083, 1002, 962, 919, 811, 754.
MS m/z: 604 (M++H).
Элементный Анализ для C25H25N3O4Cl2F2S2. Рассчитано: C,49,67; H,4,17; N,6,95; Cl,11,73; F,6,29; S,10,61. Найдено: C,49,90; H,4,13; N,6,88; Cl,11,64; F,6,17; S,10,52.
Пример 279: N-[5-Хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]-2-(диметиламино)этансульфонамид
[Химическая формула 177]
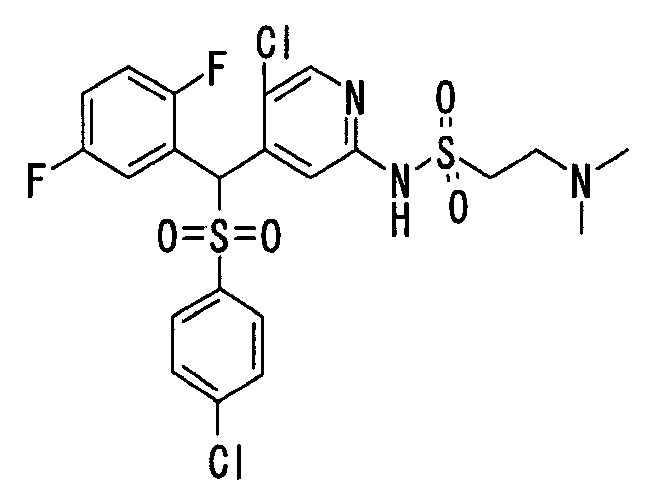
К раствору N-[5-хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]этиленсульфонамида (64 мг, 0,123 ммоль), полученного в примере 277, в тетрагидрофуране (3 мл) добавляли раствор тетрагидрофурана в диметиламине (2M, 0,18 мл, 0,36 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 3 дней, затем концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью метанол:метиленхлорид (=1:20), концентрировали при пониженном давлении с получением указанного в заголовке соединения (67 мг, 0,117 ммоль, 97%) в виде белого твердого вещества. Полученное твердое вещество промывали этанолом и собирали фильтрованием с получением указанного в заголовке соединения (43 мг) в виде белого порошка.
1H-ЯМР (400 МГц, CD3OD)δ: 2,73 (6H, с), 3,37 (2H, т, J=7,0 Гц), 3,82 (2H, т, J=7,0 Гц), 6,31 (1H, с), 7,16-7,26 (2H, м), 7,53-7,65 (3H, м), 7,75 (2H, д, J=8,8 Гц), 7,84 (1H, с), 8,24 (1H, с).
ИК (ATR) см-1: 1587, 1494, 1455, 1321, 1151, 1087, 998, 757.
MS m/z: 564 (M++H).
FAB-MS: 564,0399 (Рассчитано для C22H22O4N3Cl2F2S2: 564,0397).
Пример 280: N-[5-Хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]-2-морфолин-4-илэтансульфонамид
[Химическая формула 178]
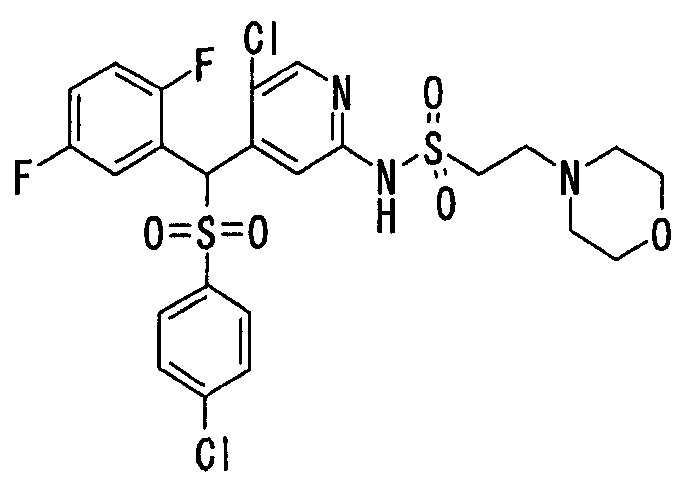
К раствору N-[5-хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]этиленсульфонамида (53 мг, 0,102 ммоль), полученного в примере 277, в этаноле (3 мл) добавляли морфолин (18 мкл, 0,204 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 3 дней, затем концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью метанол:метиленхлорид (=1:40), концентрировали при пониженном давлении. К полученному остатку добавляли простой эфир. Осажденное таким образом твердое вещество собирали фильтрованием с получением указанного в заголовке соединения (45 мг, 0,074 ммоль, 73%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 2,51-2,60 (4H, м), 2,96 (2H, т, J=6,1 Гц), 3,36-3,45 (2H, м), 3,70-3,80 (4H, м), 6,22 (1H, с), 6,90-7,10 (2H, м), 7,45 (2H, д, J=8,8 Гц), 7,50-7,59 (1H, м), 7,68 (2H, д, J=8,8 Гц), 8,19 (1H, с), 8,24 (1H, с).
Т.пл.: 219-221°C.
ИК (ATR) см-1: 1602, 1565, 1492, 1388, 1321, 1286, 1238, 1147, 1116, 1083, 998.
MS m/z: 606 (M++H).
FAB-MS: 606,0499 (Рассчитано для C24H24O5N3Cl2F2S2: 606,0503).
Элементный Анализ для C24H23N3O5Cl2F2S2. Рассчитано: C,47,53; H,3,82; N,6,93; Cl,11,69; F,6,27; S,10,57. Найдено: C,47,73; H,3,84; N,6,97; Cl,11,72; F,6,25; S,10,72.
Пример 281: трет-Бутил 4-[2-[[[5-хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]амино]сульфонил]этил]пиперазин-1-карбоксилат
[Химическая формула 179]
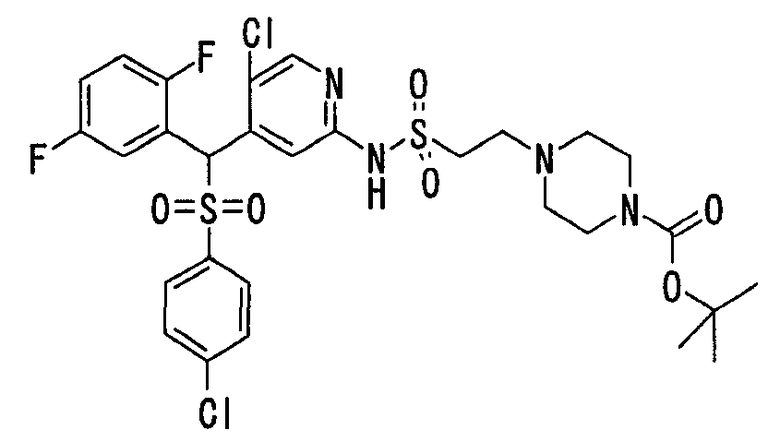
К раствору N-[5-хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]этиленсульфонамида (59 мг, 0,114 ммоль), полученного в примере 277, в этаноле (3 мл) добавляли 1-(трет-бутоксикарбонил)пиперазин (32 мг, 0,170 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 3 дней, затем концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью метанол:метиленхлорид (=1:40), концентрировали при пониженном давлении с получением указанного в заголовке соединения (75 мг, 0,106 ммоль, 93%) в виде аморфного вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 1,46 (9H, с), 2,50 (4H, т, J=5,0 Гц), 2,97 (2H, т, J=6,0 Гц), 3,35-3,42 (2H, м), 3,44-3,54 (4H, м), 6,22 (1H, с), 6,90-7,10 (2H, м), 7,45 (2H, д, J=8,8 Гц), 7,50-7,58 (1H, м), 7,68 (2H, д, J=8,8 Гц), 8,19 (1H, с), 8,24 (1H, с).
ИК (ATR) см-1: 1691, 1592, 1494, 1330, 1240, 1147, 1083, 998, 755.
MS m/z: 705 (M++H).
Пример 282: N-[5-Хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]-2-пиперазин-1-илэтансульфонамид
[Химическая формула 180]
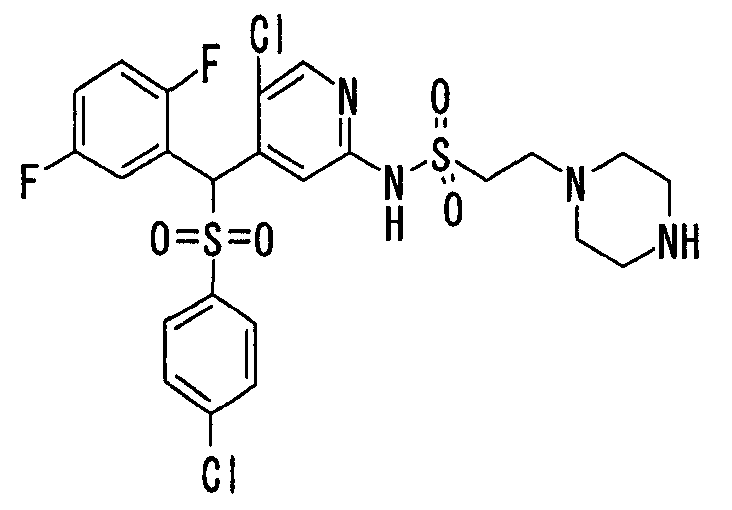
К раствору трет-бутил 4-[2-[[[5-хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]амино]сульфонил]этил]пиперазин-1-карбоксилата (72 мг, 0,102 ммоль) в этаноле (5 мл) добавляли концентрированную хлористоводородную кислоту (1 мл). Полученную смесь перемешивали при комнатной температуре в течение 2 дней, затем концентрировали при пониженном давлении. К полученному остатку добавляли насыщенный водный раствор бикарбоната натрия. Полученную смесь экстрагировали метиленхлоридом. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток промывали простым эфиром с получением указанного в заголовке соединения (23 мг, 0,038 ммоль, 37%) в виде белого порошка.
1H-ЯМР (400 МГц, DMSO-d6)δ: 2,40-2,47 (4H, м), 2,62-2,70 (2H, м), 2,83-2,90 (4H, м), 6,15 (1H, с), 7,25-7,42 (3H, м), 7,47-7,55 (1H, м), 7,68 (2H, д, J=8,7 Гц), 7,77 (2H, д, J=8,7 Гц), 8,03 (1H, с).
MS m/z: 605 (M++H).
Пример 283: Этил [[[5-Хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]амино]сульфонил]ацетат
[Химическая формула 181]
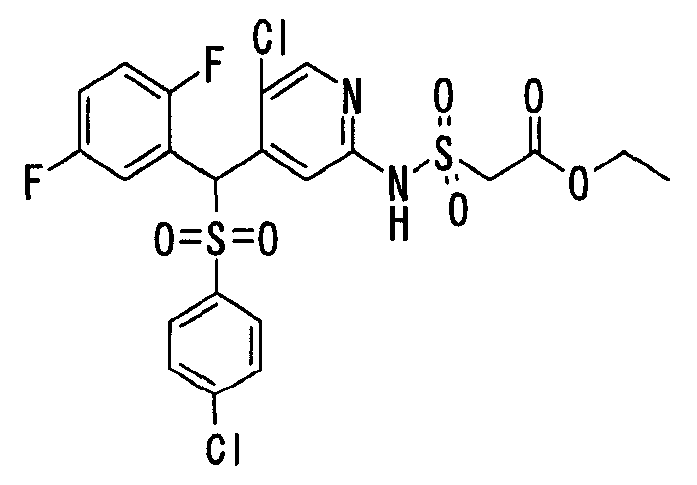
К раствору [5-хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]амина (331 мг, 0,771 ммоль), полученного в примере 196, и пиридина (94 мкл, 1,16 ммоль) в метиленхлориде (10 мл) при 0°C добавляли раствор этилхлорсульфонилацетата (216 мг, 1,16 ммоль) в метиленхлориде (2 мл). Полученную смесь перемешивали при комнатной температуре в течение 12 часов, затем добавляли последовательно при 0°C пиридин (94 мкл, 1,16 ммоль) и раствор этилхлорсульфонилацетата (216 мг, 1,16 ммоль) в метиленхлориде (2 мл). Полученную смесь перемешивали при комнатной температуре в течение 9 часов, затем реакционную смесь концентрировали при пониженном давлении. К остатку добавляли этилацетат. Полученную смесь промывали последовательно насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат (=3:1), концентрировали при пониженном давлении с получением указанного в заголовке соединения (239 мг, 0,412 ммоль, 53%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 1,29 (3H, т, J=7,2 Гц), 4,25 (2H, кв, J=7,2 Гц), 4,37 (2H, с), 6,21 (1H, с), 6,91-7,10 (2H, м), 7,45 (2H, д, J=8,6 Гц), 7,50-7,58 (1H, м), 7,66 (2H, д, J=8,6 Гц), 8,09 (1H, с), 8,30 (1H, с).
ИК (ATR) см-1: 1745, 1600, 1567, 1496, 1386, 1355, 1317, 1280, 1232, 1147, 1081.
MS m/z: 579 (M++H).
Пример 284: N-[5-Хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]-2-гидроксиэтансульфонамид
[Химическая формула 182]
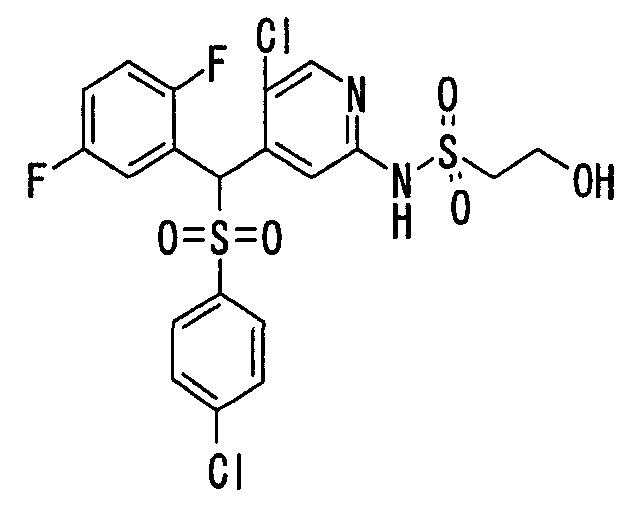
К раствору этил [[[5-хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]амино]сульфонил]ацетата (67 мг, 0,116 ммоль) в тетрагидрофуране (5 мл) при 0°C добавляли раствор 1M литийалюминийгидрида в простом эфире (0,18 мл). Полученную смесь перемешивали при 0°C. После того как завершение реакции было подтверждено анализом ТСХ, к реакционной смеси добавляли насыщенный водный раствор хлорида аммония. Полученную смесь фильтровали через целит. Фильтрат сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат (=2:1), концентрировали при пониженном давлении с получением указанного в заголовке соединения (39 мг, 0,073 ммоль, 63%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, DMSO-d6)δ: 3,63 (2H, т, J=6,3 Гц), 3,75-3,85 (2H, м), 4,94 (1H, шир. с), 6,28 (1H, с), 7,28-7,55 (3H, м), 7,70 (2H, д, J=8,7 Гц), 7,80 (2H, д, J=8,7 Гц), 7,81 (1H, с), 8,37 (1H, с), 10,91 (1H, шир. с).
Т.пл.: 155-158 °C
ИК (ATR) см-1: 3093, 2867, 1600, 1565, 1492, 1392, 1322, 1139, 1083, 813, 754.
MS m/z: 536 (M+).
EI-MS: 535,9835 (Рассчитано для C20H16O5N2Cl2F2S2: 535,9846).
Элементный Анализ для C20H16N2O5Cl2F2S2·0,5H2O. Рассчитано: C,43,96; H,3,14; N,5,13; Cl,12,98; F,6,95; S,11,74. Найдено: C,44,22; H,3,07; N,5,13; Cl,12,89; F,7,10; S,11,65.
Пример 285: 2-[[[5-Хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]амино]сульфонил]ацетамид
[Химическая формула 183]
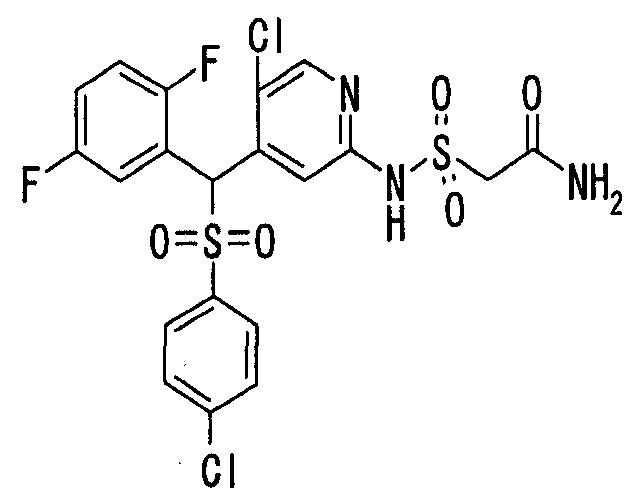
К 7 н. раствору аммиака в метаноле (5 мл) добавляли этил [[[5-хлор-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]амино]сульфонил]ацетат (78 мг, 0,135 ммоль), полученный в примере 283. Полученную смесь перемешивали при комнатной температуре в течение 3 дней, затем концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью метанол:метиленхлорид (=1:25), концентрировали при пониженном давлении с получением указанного в заголовке соединения (66 мг, 0,120 ммоль, 89%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, DMSO-d6)δ: 4,33 (2H, с), 6,29 (1H, с), 7,29-7,56 (4H, м), 7,64-7,72 (3H, м), 7,76-7,84 (3H, м), 8,35 (1H, с), 11,16 (1H, шир. с).
ИК (ATR) см-1: 1691, 1596, 1565, 1492, 1382, 1322, 1238, 1149, 1083, 995, 966, 811.
MS m/z: 550 (M++H).
Элементный Анализ для C20H15N3O5Cl2F2S2·0,5H2O. Рассчитано: C,42,94; H,2,88; N,7,51; Cl,12,68; F,6,79; S,11,46. Найдено: C,42,64; H,2,73; N,7,46; Cl,12,57; F,6,97; S,11,48.
Пример 286: [[[5-Хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]амино]сульфонил]уксусная кислота
[Химическая формула 184]
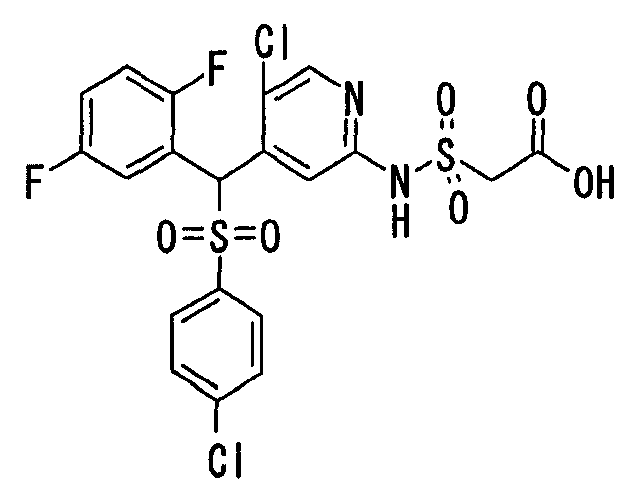
К раствору этил [[[5-хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]амино]сульфонил]ацетата (60 мг, 0,104 ммоль), полученного в примере 283, в смеси тетрагидрофурана (5 мл) и воды (1 мл) добавляли моногидрат гидроксида лития (9,1 мг, 0,218 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 2 часов. К реакционной смеси добавляли 1 н. раствор хлористоводородной кислоты. Полученную смесь экстрагировали метиленхлоридом. Экстракт сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали колоночной хроматографии на силикагеле. Фракцию, полученную при элюировании смесью метанол:метиленхлорид (=1:30) с содержанием 0,5% трифторуксусной кислоты, концентрировали при пониженном давлении с получением указанного в заголовке соединения (54 мг, 0,098 ммоль, 94%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, DMSO-d6)δ: 4,45-4,60 (2H, м), 6,29 (1H, с), 7,29-7,55 (3H, м), 7,69 (2H, д, J=8,9 Гц), 7,80 (2H, д, J=8,9 Гц), 7,81 (1H, с), 8,38 (1H, с).
MS m/z: 551 (M++H).
Пример 287: (Z)-5-Хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]-2-(3-[1,3]диоксолан-2-илпропенил)пиридин (Изомер 287-A) и (E)-5-хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]-2-(3-[1,3]диоксолан-2-илпропенил)пиридин (Изомер 287-B)
[Химическая формула 185]
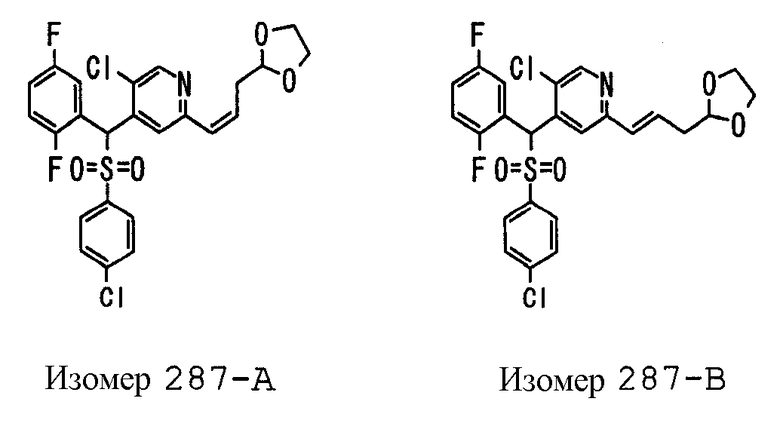
н-Бутиллитий (1,59M раствор в гексане, 1,3 мл, 1,99 ммоль) в атмосфере аргона при -78°C добавляли к раствору 2-(1,3-диоксолан-2-ил)этилтрифенилфосфонийбромида (738 мг, 1,99 ммоль) в тетрагидрофуране (30 мл). Полученную смесь перемешивали в течение 1 часа. К реакционной смеси добавляли [5-хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]карбальдегид (400 мг, 0,904 ммоль), полученный в примере 258. Температуру полученной смеси повышали до комнатной температуры с последующим перемешиванием в течение 4 часов. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония. Полученную смесь затем экстрагировали дихлорметаном. Органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=4:1, концентрировали при пониженном давлении с получением Изомера 287-A (низкополярное соединение)(140 мг, 0,266 ммоль, 29%) в виде бесцветного аморфного вещества и Изомера 287-B (высокополярное соединение)(170 мг, 0,323 ммоль, 36%) в виде бесцветного аморфного вещества.
Изомер 287-A
1H-ЯМР (400 МГц, CDCl3)δ: 3,03-3,17 (2H, м), 3,88-4,10 (4H, м), 5,11 (1H, т, J=4,3 Гц), 6,10 (1H,дт, J=12,0, 7,6 Гц), 6,25 (1H, с), 6,65 (1H, д, J=12,0 Гц), 6,93-6,99 (1H, м), 7,03-7,09 (1H, м), 7,44 (2H, д, J=8,6 Гц), 7,61 (2H, д, J=8,6 Гц), 7,67-7,71 (1H, м), 8,10 (1H, с), 8,49 (1H, с).
MS m/z: 526 (M++H).
Изомер 287-B
1H-ЯМР (400 МГц, CDCl3)δ: 2,67-2,71 (2H, м), 3,88-4,08 (4H, м), 5,07 (1H, т, J=4,6 Гц), 6,20 (1H, с), 6,68 (1H, д, J=15,9 Гц), 6,85-7,00 (2H, м), 7,02-7,08 (1H, м), 7,44 (2H, д, J=8,1 Гц), 7,55-7,62 (1H, м), 7,61 (2H, д, J=8,1 Гц), 7,96 (1H, с), 8,43 (1H, с).
MS m/z: 526 (M++H).
Пример 288: 4-[5-Хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]бутилальдегид
[Химическая формула 186]
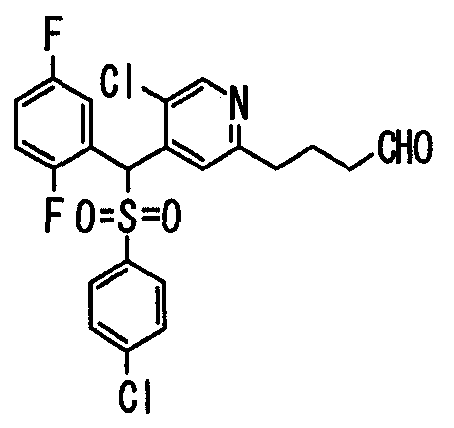
Водную суспензию никеля Ренея ("R-100", продукт от Nikko Rica Corporation) промывали последовательно водой и этанолом, затем к смеси добавляли этанол с получением, соответственно, суспензии в этаноле. Полученную этанольную суспензию (1 мл) добавляли к раствору (Z) и (E)-5-хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]-2-(3-[1,3]диоксолан-2-илпропенил)пиридина (80 мг, 0,152 ммоль) в смеси этанола (5 мл) и 1,4-диоксана (3 мл). В атмосфере водорода при давлении 1 атмосфера полученную смесь интенсивно перемешивали в течение 30 минут. Реакционную смесь фильтровали, затем фильтрат концентрировали при пониженном давлении.
К раствору полученного остатка в 1,4 диоксане (4 мл) добавляли концентрированную хлористоводородную кислоту (1 мл) и полученную смесь перемешивали при комнатной температуре в течение 1 часа. Растворитель затем концентрировали при пониженном давлении. К полученному остатку добавляли насыщенный водный раствор бикарбоната натрия, затем экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором. Полученный органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=4:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (44 мг, 0,0908 ммоль, 59%) в виде бесцветного аморфного вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 2,09-2,17 (2H, м), 2,56 (2H,тд, J=7,3, 1,5 Гц), 2,92 (2H, т, J=7,7 Гц), 6,21 (1H, с), 6,92-6,97 (1H, м), 7,03-7,08 (1H, м), 7,45 (2H, д, J=8,6 Гц), 7,51-7,55 (1H, м), 7,61 (2H, д, J=8,6 Гц), 7,95 (1H, с), 8,47 (1H, с), 9,81 (1H, т, J=1,5 Гц).
MS m/z: 484 (M++H).
Пример 289: 4-[5-Хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]масляная кислота
[Химическая формула 187]
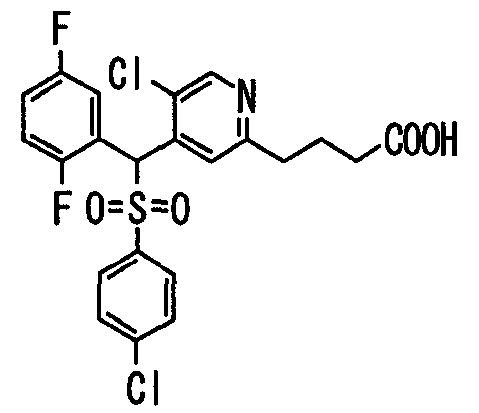
К раствору 4-[5-хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]бутилальдегида (40 мг, 0,0828 ммоль) в муравьиной кислоте (1 мл) добавляли 30% водный раствор перекиси водорода (84 мкл, 0,745 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 9 часов. К реакционной смеси добавляли воду, затем экстрагировали этилацетатом. Органический слой промывали последовательно водой и насыщенным солевым раствором. Органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Полученный остаток перекристаллизовывали из гексана:этилацетата с получением указанного в заголовке соединения (13 мг, 0,0260 ммоль, 32%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3)δ: 2,16-2,18 (2H, м), 2,46 (2H, т, J=7,2 Гц), 2,99 (2H, т, J=7,5 Гц), 6,22 (1H, с), 6,92-6,98 (1H, м), 7,03-7,08 (1H, м), 7,45 (2H, д, J=8,6 Гц), 7,51-7,56 (1H, м), 7,61 (2H, д, J=8,6 Гц), 8,00 (1H, с), 8,49 (1H, с).
Т.пл.: 147-148°C.
MS m/z: 500 (M++H).
Пример 290: 2-Бромметил-5-хлор-4-[(4-хлорфенилтио)(2,5-дифторфенил)метил]пиридин
[Химическая формула 188]
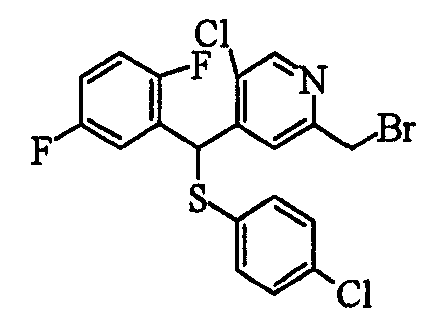
К раствору [5-хлор-4-[(4-хлорфенилтио)(2,5-дифторфенил)-метил]пиридин-2-ил]метанола (582 мг, 1,41 ммоль), полученного в примере 256, в дихлорметане (15 мл) при 0°C последовательно добавляли тетрабромид углерода (936 мг, 2,82 ммоль) и трифенилфосфин (407 мг, 1,55 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 15 часов. Реакционную смесь концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=20:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (518 мг, 1,09 ммоль, 77%) в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3)δ: 4,51 (1H, д, J=10,5 Гц), 4,54 (1H, д, J=10,5 Гц), 6,03 (1H, с), 6,94-7,06 (2H, м), 7,10-7,16 (1H, м), 7,23 (2H, д, J=8,5 Гц), 7,28 (2H, д, J=8,5 Гц), 7,73 (1H, с), 8,49 (1H, с).
MS m/z: 474,476 (M++H).
Пример 291: [5-Хлор-4-[(4-хлорфенилтио)(2,5-дифторфенил)метил]пиридин-2-ил]ацетонитрил
[Химическая формула 189]
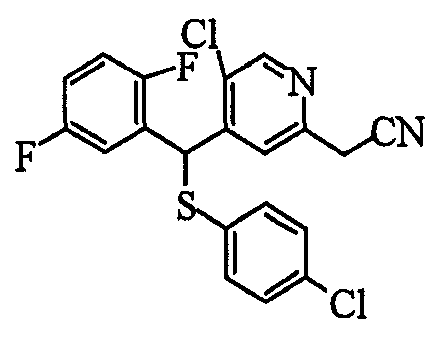
Триметилсилилнитрил (0,226 мл, 1,63 ммоль) и раствор тетрабутиламмонийфторида (1M, 1,63 мл, 1,63 ммоль) в тетрагидрофуране последовательно добавляли в атмосфере аргона при комнатной температуре к раствору 2-бромметил-5-хлор-4-[(4-хлорфенилтио)(2,5-дифторфенил)метил]пиридина (516 мг, 1,09 ммоль) в ацетонитриле (10 мл). Полученную смесь перемешивали в течение 30 минут. Реакционную смесь концентрировали при пониженном давлении. Остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=9:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (390 мг, 0,93 ммоль, 85%) в виде коричневого масла.
1H-ЯМР (400 МГц, CDCl3)δ: 3,90 (1H, д, J=19,0 Гц), 3,95 (1H, д, J=19,0 Гц), 6,04 (1H, с), 6,96-7,07 (2H, м), 7,12-7,18 (1H, м), 7,24 (2H, д, J=8,8 Гц), 7,29 (2H, д, J=8,8 Гц), 7,67 (1H, с), 8,52 (1H, с).
MS m/z: 421 (M++H).
Пример 292: [5-Хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]ацетонитрил
[Химическая формула 190]
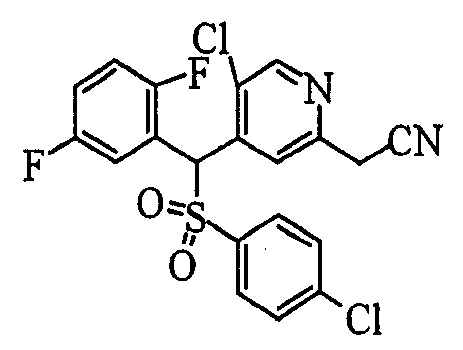
К раствору [5-хлор-4-[(4-хлорфенилтио)(2,5-дифторфенил)-метил]пиридин-2-ил]ацетонитрила (387 мг, 0,92 ммоль) в этилацетате (5 мл) добавляли метанол (5 мл), 31% водный раствор перекиси водорода (3 мл) и тетрагидрат гексааммонийгептамолибдата (227 мг, 0,18 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 2 часов. К реакционной смеси добавляли воду. Этилацетат и метанол отгоняли при пониженном давлении. К остатку добавляли насыщенный водный раствор бикарбоната натрия. Полученный продукт экстрагировали дихлорметаном. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=17:3, концентрировали при пониженном давлении с получением указанного в заголовке соединения (364 мг, 0,80 ммоль, 87%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 4,02 (2H, с), 6,22 (1H, с), 6,92-6,99 (1H, м), 7,04-7,11 (1H, м), 7,46 (2H, д, J=8,6 Гц), 7,48-7,54 (1H, м), 7,62 (2H, д, J=8,6 Гц), 8,15 (1H, с), 8,56 (1H, с).
MS m/z: 453 (M++H).
Пример 293: [5-Хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]уксусная кислота
[Химическая формула 191]
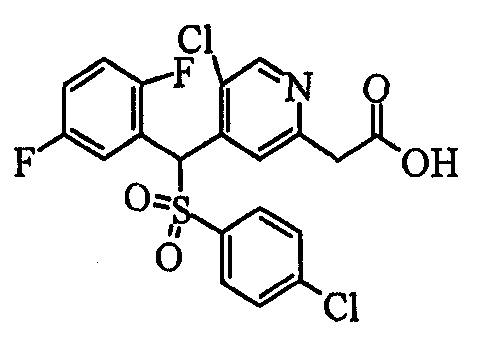
К раствору [5-хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]ацетонитрила (113 мг, 0,25 ммоль) в уксусной кислоте (2 мл) добавляли при комнатной температуре смесь воды (2 мл) и концентрированной серной кислоты (2 мл). Полученную смесь перемешивали при 100°C в течение 2 часов. После охлаждения реакционной смеси до комнатной температуры к смеси добавляли воду. Полученную смесь экстрагировали дихлорметаном. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный остаток промывали смесью растворителей диэтиловый эфир/гексан, затем собирали фильтрованием с получением указанного в заголовке соединения (101 мг, 0,21 ммоль, 86%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 1,74 (1H, шир. с), 4,00 (1H, д, J=17,9 Гц), 4,05 (1H, д, J=17,9 Гц), 6,23 (1H, с), 6,92-6,99 (1H, м), 7,04-7,11 (1H, м), 7,45 (2H, д, J=8,6 Гц), 7,48-7,54 (1H, м), 7,62 (2H, д, J=8,6 Гц), 8,12 (1H, с), 8,52 (1H, с).
MS m/z: 472 (M++H).
Ссылочный Пример 53: (2,5-Дихлор-4-пиридил)(2,6-дифторфенил)метанол
[Химическая формула 192]
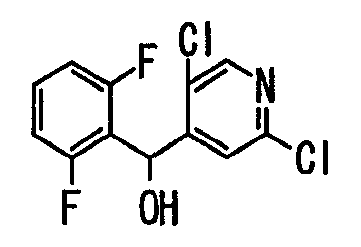
н-Бутиллитий (1,60M раствор в гексане, 2,33 мл, 3,72 ммоль) добавляли в атмосфере аргона при -78°C к раствору диизопропиламина (0,520 мл, 3,72 ммоль) в тетрагидрофуране (12 мл). Полученную смесь затем перемешивали при -78°C в течение 30 минут. К реакционной смеси добавляли раствор (2 мл) 2,5-дихлорпиридина (500 мг, 3,38 ммоль) в тетрагидрофуране. Полученную смесь перемешивали при -78°C в течение 1 часа. Затем к реакционной смеси добавляли раствор 2,6-дифторбензальдегида (395 мг, 3,72 ммоль) в тетрагидрофуране (2 мл) с последующим перемешиванием при -78°C в течение 2 часов. К реакционной смеси добавляли 1 н. раствор хлористоводородной кислоты (7 мл) и затем температуру реакционной смеси повышали до комнатной температуры. Реакционную смесь разбавляли этилацетатом. Разбавленную смесь промывали водой и насыщенным солевым раствором, сушили над сульфатом магния и концентрировали. Полученное твердое вещество промывали дихлорметаном с получением указанного в заголовке соединения (746 мг, 2,57 ммоль, 76%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 2,62 (1H, шир. д, J=3,7 Гц), 6,30 (1H, шир. с), 6,87-6,93 (2H, м), 7,28-7,37 (1H, м), 7,91 (1H, с), 8,25 (1H, с).
MS m/z: 290 (M++H).
Пример 294: 2,5-Дихлор-4-[(4-хлорфенилсульфонил)(2,6-дифторфенил)метил]пиридин
[Химическая формула 193]
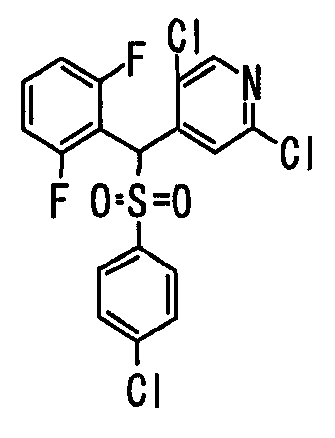
(2,5-Дихлор-4-пиридил)(2,6-дифторфенил)метанол (744 мг, 2,57 ммоль), полученный в ссылочном примере 53, суспендировали в дихлорметане (6 мл), затем добавляли тионилхлорид (0,5 мл) и диметилформамид (одну каплю). Полученную смесь перемешивали при комнатной температуре в течение 5 часов. К реакционной смеси снова добавляли тионилхлорид (1,0 мл). Полученную смесь перемешивали при комнатной температуре в течение 24 часов. Реакционную смесь концентрировали. Полученный остаток нейтрализовали насыщенным раствором бикарбоната натрия и затем экстрагировали дихлорметаном. Экстракт промывали водой и насыщенным солевым раствором, сушили над сульфатом магния и концентрировали. Полученный остаток растворяли в диметилформамиде (10 мл). После добавления 4-хлорбензолсульфината натрия (613 мг, 3,08 ммоль) полученную смесь нагревали при 50°C в течение 5 часов, а затем при 80°C в течение 3 часов. Реакционную смесь разбавляли этилацетатом. Разбавленный раствор промывали водой и насыщенным солевым раствором, сушили над сульфатом магния и концентрировали. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=4:1, концентрировали. Полученное твердое вещество перекристаллизовывали из смеси диэтиловый эфир-гексан с получением указанного в заголовке соединения (761 мг, 1,69 ммоль, 66%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 6,02 (1H, с), 6,84-6,90 (2H, м), 7,32-7,40 (1H, м), 7,46 (2H, д, J=8,5 Гц), 7,65 (2H, д, J=8,5 Гц), 8,35 (1H, с), 8,43-8,46 (1H, м).
MS m/z: 448 (M++H).
Пример 295: 5-Хлор-4-[(4-хлорфенилсульфонил)(2,6-дифторфенил)метил]-2-(3,4-диметоксибензиламино)пиридин
[Химическая формула 194]
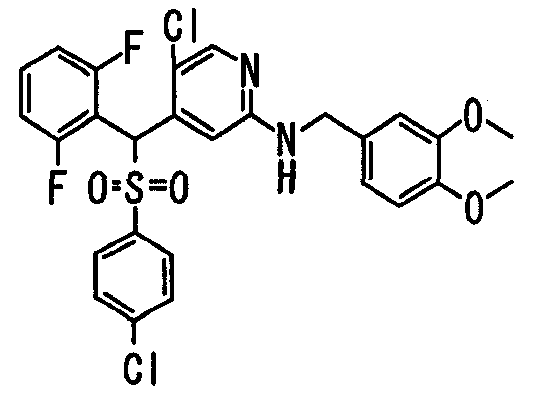
К раствору (20 мл) 2,5-дихлор-4-[(4-хлорфенилсульфонил)(2,6-дифторфенил)метил]пиридина (755 мг, 1,68 ммоль), полученного в примере 294, в N-метил-2-пирролидоне в атмосфере аргона добавляли 3,4-диметоксибензиламин (0,745 мл, 5,04 ммоль). Полученную смесь нагревали при 150°C в течение 5 часов. Реакционную смесь охлаждали до комнатной температуры и затем разбавляли этилацетатом. Разбавленный раствор промывали насыщенным водным раствором хлорида аммония, насыщенным водным раствором бикарбоната натрия, водой и насыщенным солевым раствором, сушили над сульфатом магния и концентрировали. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=2:1, концентрировали с получением указанного в заголовке соединения (295 мг, 0,509 ммоль, 30%) в виде белого аморфного вещества.
1H-ЯМР (400 МГц CDCl3)δ: 3,89 (3H, с), 3,90 (3H, с), 4,48 (2H, д, J=5,6 Гц), 5,06 (1H, т, J=5,6 Гц), 6,02 (1H, с), 6,81-6,88 (3H, м), 6,93-7,00 (2H, м), 7,28-7,36 (1H, м), 7,40 (2H, д, J=8,3 Гц), 7,51 (1H, с), 7,56 (2, д, J=8,3 Гц), 8,00 (1H, с).
MS m/z: 579 (M++H).
Пример 296: 5-Хлор-4-[(4-хлорфенилсульфонил)(2,6-дифторфенил)метил]пиридин-2-иламин
[Химическая формула 195]
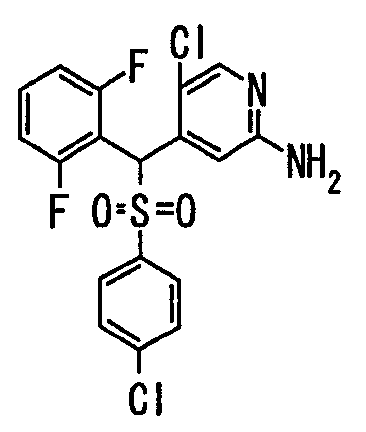
5-Хлор-4-[(4-хлорфенилсульфонил)(2,6-дифторфенил)метил]-2-(3,4-диметоксибензиламино)пиридин (293 мг, 0,506 ммоль), полученный в примере 295, растворяли в трифторуксусной кислоте (4 мл). Полученный раствор нагревали при 65°C в течение 2 часов. Реакционную смесь концентрировали. Остаток подщелачивали насыщенным водным раствором бикарбоната натрия, затем экстрагировали этилацетатом. Экстракт промывали водой и насыщенным солевым раствором, сушили над сульфатом магния и концентрировали. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=2:1, концентрировали. Полученное твердое вещество перекристаллизовывали из смеси этилацетат-гексан с получением указанного в заголовке соединения (147 мг, 0,343 ммоль, 68%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3)δ: 4,62 (2H, с), 6,01 (1H, с), 6,82-6,89 (2H, м), 7,29-7,38 (1H, м), 7,44 (2H, д, J=8,5 Гц), 7,59 (1H, шир. с), 7,65 (2H, д, J=8,5 Гц), 7,99 (1H, с).
ИК (ATR) см-1: 3502, 3400, 1620, 1603, 1545, 1471, 1412, 1333, 1279, 1230, 1151, 1084, 993, 928, 891, 829, 795, 756, 623, 559, 513, 459.
Т.пл.: 179-181°C.
MS m/z: 429 (M++H).
Элементный Анализ для C18H12Cl2F2N2O2S. Рассчитано: C,50,36; H,2,82; Cl,16,52; F,8,85; N,6,53; S,7,47. Найдено: C,50,36; H,2,83; Cl,16,39; F,8,88; N,6,48; S,7,56.
Пример испытания
Способ определения активности ингибитора продуцирования или секреции β-амилоидного белка
Ингибирующую активность соединений, полученных в примерах, направленную против образования β-амилоидного белка, испытывали способом, описанным ниже.
Клетки E35 получали путем трансфекции гена APP751, представляющего собой предшественник человеческого β-амилоидного белка дикого типа, в клетки глиомы человека (клетки H4).
Клетки E35 высевали в 96-луночные планшеты и культивировали в инкубаторе при 37°C, используя модифицированную Дульбекко среду Игла, содержащую 10% инактивированную фетальную бычью сыворотку (10% FBS-DMEM). Через двадцать четыре часа после высеивания испытываемое соединение, растворенное в DMSO таким образом, чтобы получить его концентрацию, в 2000 раз превышающую конечную концентрацию, добавляли к среде в количестве 1/2000 объема культуральной среды. Клетки культивировали еще в течение двадцати четырех часов и затем собирали надосадочную жидкость. Количество β-амилоидного белка (Aβ), секретированного в надосадочной жидкости, измеряли при помощи сэндвичевого твердофазного иммуноферментого анализа (ELISA). А именно, моноклональное антитело 25-1, распознающее Aβ25-35, иммобилизовали на 96-луночном планшете ELISA, а затем инкубировали при 4°C в течение 16-20 часов. После промывки фосфатным буфером (pH 7,4)(PBS) добавляли биотинилированное моноклональное антитело MA32-40, распознающее Aβ1-8, и планшет выдерживали при 4°C в течение 2 часов. Надосадочную жидкость удаляли и лунки тщательно промывали PBS, затем в планшет добавляли конъюгированный со щелочной фосфатазой стерптавидин. Абсорбцию измеряли в процессе добавления BlouPhos (изготовитель KPL) в качестве субстрата. Количество Aβ, содержащегося в надосадочной жидкости, подсчитывали, используя калибровочную кривую, построенную отдельно, используя известную концентрацию Aβ. ИК50 испытываемого соединения представляли как концентрацию, при которой наблюдали 50% ингибирование продукции Aβ по сравнению с количеством Aβ в контрольных клетках, к которым добавляли только DMSO.
С другой стороны, цитотоксичность испытываемого соединения определяли следующим способом. Испытываемое соединение, растворенное в DMSO, добавляли к клеткам H4, культивированным в 10% FBS-DMEM. После инкубации в течение 72 часов жизнеспособные клетки подсчитывали, используя для этого Alamar Blue (изготовитель BIOSOURCE). Концентрацию испытываемых соединений, при которой число жизнеспособных клеток составляло 80% или меньше от числа контрольных клеток, к которым добавляли только DMSO, определяли как концентрацию, при которой возникает цитотоксичность.
При разнице, по меньшей мере, в 10 раз между ИК50 и концентрацией, при которой возникает цитотоксичность, считалось, что соединение обладает ингибирующей активностью против продукции или секреции β-амилоидного белка.
Результаты оценки соединения по настоящему изобретению при помощи описанного выше анализа представлены в Таблице 1. Соединения, демонстрирующие ИК50 не выше 5 нМ, оценивали как +++, соединения, демонстрирующие ИК50 в пределах от 5 нМ до 50 нМ, оценивали как ++, и соединения, демонстрирующие ИК50 в пределах от 50 до 500 нМ, оценивали как +.
| название | год | авторы | номер документа |
|---|---|---|---|
| ИНГИБИТОРЫ ПРОДУЦИРОВАНИЯ / СЕКРЕЦИИ β-АМИЛОИДНОГО БЕЛКА | 2002 |
|
RU2304140C2 |
| ПИРИДИЛДИМЕТИЛСУЛЬФОНОВОЕ ПРОИЗВОДНОЕ | 2006 |
|
RU2404968C2 |
| ГАЛОГЕНЗАМЕЩЕННОЕ ГЕТЕРОЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ | 2013 |
|
RU2756506C2 |
| ГАЛОГЕНЗАМЕЩЕННОЕ ГЕТЕРОЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ | 2013 |
|
RU2649398C2 |
| СОЛЬ ГЕТЕРОЦИКЛИЧЕСКОГО СОЕДИНЕНИЯ, ЗАМЕЩЕННОГО ГАЛОГЕНОМ | 2015 |
|
RU2689315C2 |
| СОЕДИНЕНИЯ, ОБЛАДАЮЩИЕ ИНГИБИРУЮЩЕЙ АКТИВНОСТЬЮ ПО ОТНОШЕНИЮ К PDE9A, И ИХ ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2019 |
|
RU2788147C2 |
| НОВОЕ ПРОИЗВОДНОЕ ПИРИДИНА И ПРОИЗВОДНОЕ ПИРИМИДИНА (3) | 2006 |
|
RU2362771C1 |
| НОВОЕ ПРОИЗВОДНОЕ 3-АЗАБИЦИКЛО[3.1.0]ГЕКСАНА И ЕГО ПРИМЕНЕНИЕ В МЕДИЦИНСКИХ ЦЕЛЯХ | 2014 |
|
RU2701861C1 |
| 1-ГЕТЕРОЦИКЛИЛСУЛЬФОНИЛ, 2-АМИНОМЕТИЛ, 5-(ГЕТЕРО-)АРИЛ ЗАМЕЩЕННЫЕ 1-Н-ПИРРОЛ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ СЕКРЕЦИИ КИСЛОТЫ | 2006 |
|
RU2415838C2 |
| ПРОИЗВОДНОЕ ОЛИГОСАХАРИДОВ | 2004 |
|
RU2290408C2 |
Изобретение относится к новым соединениям общей формулы (1)
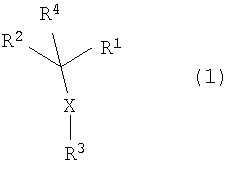
где R1 представляет собой фенильную группу, содержащую 1-3 заместителя, выбранных из галогена и цианогруппы; R2 представляет собой пиридильную группу, которая имеет 1-3 заместителей, выбранных из моноциклической или полициклической гетероциклической группы, которая может иметь 1-3 заместителя, выбранных из атомов галогенов, цианогруппы, а также другие значения радикала R2, указанные в формуле изобретения, R3 представляет собой фенильную группу или пиридильную группу, которая имеет 1-2 заместителя, выбранных из галогена и тригалогенметильной группы; R4 представляет собой атом водорода и X представляет собой -SO2-; его соль или его сольват. А также к лекарственному средству и фармацевтической композиции, ингибирующим продукцию или секрецию β-амилоидного белка и содержащим соединение формулы (1), и к применению соединению по п.1 для получения лекарственного средства. Технический результат: получены новые соединения, которые ингибируют продукцию или секрецию β-амилоидного белка, таким образом, данные соединения могут использованы в медицине. 4 н. и 10 з.п. ф-лы, 1 табл.
[Химическая формула 1]
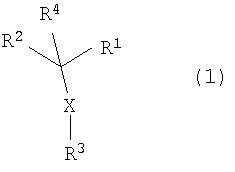
где R1 представляет собой фенильную группу, содержащую 1-3 заместителя, выбранных из галогена и цианогруппы;
R2 представляет собой пиридильную группу, которая имеет 1-3 заместителей, выбранных из моноциклической или полициклической гетероциклической группы, которая может иметь 1-3 заместителя, выбранных из атомов галогенов, цианогруппы, C1-6 алкильных групп, гидроксигруппы, C1-6 алкоксигрупп, С2-6 алкенилоксигрупп, карбокси алкильных групп, С2-6 алкоксикарбонил алкильных групп, гетероцикл-карбонил C1-6 алкильных групп, гидрокси C1-6 алкильных групп, С6-10 ароматический углеводород-сульфонил C1-6 алкильных групп, N,N-диалкиламиносульфонил C1-6 алкильных групп, гетероцикл-C1-6алкильных групп, С6-10 ароматический углеводород-С1-6 алкильных групп, С6-10 ароматический углеводород-тио C1-6 алкильных групп, азидо-C1-6алкильных групп, амино C1-6 алкильных групп, C1-6 алкиламино C1-6 алкильных групп, ди(C1-6алкил)амино C1-6алкильных групп, гидрокси C1-6алкиламино C1-8 алкильных групп, C1-6алкокси алкиламиноC1-6 алкильных групп, бис (C1-6алкокси C1-6алкил)амино C1-6алкильных групп, (гидрокси C1-6алкил) (C1-6алкокси C1-6алкил) амино C1-6 алкильных групп, C1-6алканоиламино алкильных групп, ди(C2-6 алканоил) амино алкильных групп, карбоксиамино C1-6 алкильных групп, ди(C1-6 алкилкарбониламино C1-6алкил) амино C1-6алкильных групп, C1-6алкоксикарбониламино C1-6алкильных групп, ди(C1-6алкоксикарбонил)амино C1-6алкильных групп, карбамоиламино C1-6 алкильных групп, N-C1-6алкилкарбамоиламино C1-6алкильных групп, (N,N-ди(C1-6 алкил)карбамоил)амино C1-6алкильных групп, аминосульфониламино C1-6 алкильных групп, N-C1-6алкилсульфониламино C1-6 алкильных групп, ди(С1-6 алкил) аминосульфониламино алкильных групп, C6-10 ароматический углеводород-сульфонил амино- C1-6 алканоиламино C1-6 алкильных групп, амино C1-6 алкилкарбониламино C1-6 алкильных групп, N-C1-6 алкиламино C1-6 алкилкарбониламино C1-6 алкильных групп, N,N-ди(C1-6 алкил) амино C1-6 алкилкарбониламино C1-6 алкильных групп, гетероцикл-C1-6 алкилкарбониламино C1-6 алкильных групп, гетероцикл-С2-6 алкенилкарбониламино C1-6 алкильных групп, С6-10 ароматический углеводород-алкенилкарбониламино C1-6 алкильных групп, С6-10 ароматический углеводород-карбониламино C1-6 алкильных групп, С6-10 ароматический углеводород-тиокарбониламино C1-6 алкильных групп, гетероцикл-карбониламино C1-6 алкильных групп, C1-6 алкоксиоксалиламино C1-6 алкильных групп, (С6-10 ароматический углеводород-сульфонил) (C1-6 алкил) амино C1-6 алкильных групп, C1-6 алкилсульфониламино C1-6 алкильных групп, карбамоилокси C1-6 алкильных групп, N-C1-6 алкилкарбамоилокси C1-6 алкильных групп, N,N-ди(C1-6 алкил) карбамоилокси C1-6 алкильных групп, С6-10 ароматический углеводород- C1-6алкилкарбамоилокси C1-6 алкильных групп, C1-6 алкоксикарбонилокси-C1-6 алкильных групп, С6-10 ароматический углеводород-оксикарбонилокси C1-6 алкильных групп, гетероциклических карбонилгидразонометильных групп, С6-10 ароматический углеводород-карбонилгидразонометильных групп, С2-6 алкенильных групп, карбокси-С2-6 алкенильных групп, C1-6 алкоксикарбонил-С2-6 алкенильных групп, карбамоил С2-6 алкенильных групп, гетероцикл-алкенильных групп, формильной группы, карбоксильной группы, гетероцикл-карбонильных групп, С6-10 ароматический углеводород-карбонильных групп, C1-6 алкоксикарбонильных групп, карбамоильной группы, N-C1-6 алкилкарбамоильных групп, N,N-ди(C1-6алкил)карбамоильных групп, С3-8 циклоалкил-C1-6 алкилкарбамоильных групп, алкилтио C1-6 алкилкарбамоильных групп, C1-6 алкилсульфинил C1-6 алкилкарбамоильных групп, C1-6 алкилсульфонил C1-6 алкилкарбамоильных групп, гидроксиаминокарбонильной группы, C1-6 алкоксикарбамоильных групп, гидрокси алкилкарбамоильных групп, C1-6алкокси C1-6 алкилкарбамоильных групп, амино C1-6 алкилкарбамоильных групп, амино C1-6 алкилтиокарбамоильных групп, гидрокси C1-6 алкилкарбамоильных групп, C1-6 алкоксикарбонил C1-6 алкилкарбамоильных групп, C1-6 алкоксикарбониламино C1-6 алкилкарбамоильных групп, C1-6 алкоксикарбониламино C1-6 алкилтиокарбамоильных групп, гетероцикл-карбамоильных групп, гетероцикл-C1-6 алкилкарбамоильных групп, С6-10 ароматический углеводород-карбамоильных групп, гидразинокарбонильной группы, N-C1-6 алкилгидразинокарбонильных групп, N'-C1-6 алкилгидразинокарбонильных групп, N',N'-ди(C1-6 алкил) гидразинокарбонильных групп, N,N'(C1-6алкил)гидразинокарбонильных групп, N,N',N'-три(C1-6 алкил)гидразинокарбонильных групп, N'-(гетероцикл-карбонил)-гидразинокарбонильных групп, аминогруппы, C1-6 алкокси C1-6 алкиламиногрупп, амино C1-6 алкиламиногрупп, C1-6 алкил амино алкиламиногрупп, (C1-6 алкиламино C1-6 алкил) (C1-6 алкил) аминогрупп, (C1-6 алкилкарбониламино C1-6 алкил) аминогрупп, (C1-6 алкилсульфониламино алкил) аминогрупп, C1-6 алкоксикарбониламино C1-6 алкиламиногрупп, ди(C1-6 алкил) амино C1-6 алкилами-ногрупп, гетероцикл-амино C1-6 алкиламиногрупп, карбоксил C1-6 алкиламиногрупп, (карбоксил C1-6 алкил) (C1-6 алкил) аминогрупп, гетероцикл-C1-6 алкиламиногрупп, (гетероцикл- C1-6 алкил) (C1-6 алкил) аминогрупп, гидрокси C1-6 алкиламиногрупп, (гидрокси C1-6 алкил) (C1-6 алкил) аминогрупп, C1-6 алкилтио C1-6 алкиламиногрупп, C1-6 алкиламинокарбонилокси C1-6 алкиламиногрупп, (C1-6 алкиламинокарбонилокси C1-6 алкил) (C1-6 алкил) аминогрупп, C1-6 алкилсульфинил C1-6 алкиламиногрупп, C1-6 алкилсульфонил C1-6 алкиламиногрупп, групп, представленных формулой: -N(R12)SO2R11 (где, R11 представляет собой C1-6 алкильную группу, гетероциклическую группу, C1-6 алкил-гетероциклическую группу, гетероцикл-C1-6 алкильную группу, гидрокси C1-6 алкильную группу, амино C1-6 алкильную группу, С1-6 алкиламино C1-6 алкильную группу, ди(C1-6 алкил) амино C1-6 алкильную группу, карбокси C1-6 алкильную группу, карбамоил C1-6 алкильную группу, трифторметильную группу, дифторметильную группу, фторметильную группу, аминогруппу, C1-6 алкиламиногруппу или ди(C1-6 алкил)аминогруппу, и R12 представляет собой атом водорода, C1-6 алкильную группу, гидроксигруппу или аминогруппу, гидрокси C1-6 алкокси C1-6 алкиламиногрупп, С6-10 ароматический углеводород-C1-6 алкиламиногрупп, гетероцикл-карбониламиногрупп, C1-6 алкоксикарбониламиногрупп, гетероцикл-C1-6 алкилкарбониламиногрупп, С6-10 ароматический углеводород-карбониламиногрупп, гетероцикл-аминогрупп, гидроксииминогруппы, C1-6 алкоксииминогрупп, оксогруппы, гидроксиимино C1-6 алкильных групп, C1-6 алкоксикарбонил C1-6 алкиламиногрупп, (С2-6 алканоиламино C1-6 алкил) аминогрупп, C1-6 ароматических углеводородных групп и гетероциклических групп (где С6-10 ароматическая углеводородная группа или гетероцикл или гетероциклическая группа может быть замещена 1-3 заместителями, выбранными из атомов галогенов, C1-6 алкильных групп, C1-6 алкоксигрупп, С2-6 алкенильных групп, формильной группы, С2-6 алканоильных групп, карбоксильной группы, карбоксиамино C1-6 алкильных групп, C1-6 алкоксикарбониламино C1-6 алкильных групп, оксогруппы, нитрогруппы, цианогруппы, амидиногруппы, С2-6 алкенилоксигрупп, гидроксигруппы, тиоксогруппы, аминогруппы, C1-6 алкиламиногрупп, ди(C1-6 алкил) аминогрупп, амино C1-6 алкильных групп, C1-6 алкоксикарбонильных групп, карбамоильной группы, C1-6 алкилкарбамоильных групп, ди(C1-6 алкил)карбамоильных групп, тиокарбамоильнои группы, C1-6 алкилтиокарбамоильных групп, ди(C1-6 алкил) тиокарбамоильных групп, С2-6 алканоиламиногрупп, С2-6 алканоил (C1-6 алкил) аминогрупп, тио С2-6 алканоиламиногрупп, тио С2-6 алканоил (C1-6 алкил) аминогрупп, формиламино-группы, формил (C1-6 алкил) аминогрупп, тиоформиламиногруппы, тиоформил (C1-6 алкил)аминогрупп, С2-6 алканоилоксигрупп, формилоксигруппы, меркаптогруппы, C1-6 алкилтиогрупп, C1-6 алкилсульфинильных групп, C1-6 алкил сульфонильных групп, аминосульфонильной группы, C1-6 алкиламиносульфонильных групп, ди(C1-6 алкил)аминосульфонильных групп, C1-6 алкилсульфониламиногрупп и C1-6 алкил сульфонил (C1-6 алкил)аминогрупп;
R3 представляет собой фенильную группу или пиридильную группу, которая имеет 1-2 заместителя, выбранных из галогена и тригалогенметильной группы;
R4 представляет собой атом водорода; и X представляет собой -SO2-;
его соль или его сольват.
[Химическая формула 2]
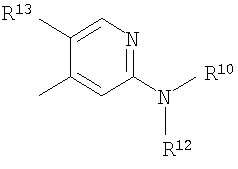
где R10 представляет собой атом водорода, C1-6 алкильную группу, гидрокси C1-6 алкильную группу, C1-6 алкил сульфинил C1-6 алкильную группу, C1-6 алкилсульфонил C1-6 алкильную группу, карбокси C1-6 алкильную группу, гетероцикл-C1-6 алкильную группу или группу, представленную формулой: -SO2-R11 (где R11 представляет собой С1-6 алкил, гетероциклическую группу, С1-6 алкил-гетероциклическую группу, гетероцикл-С1-6 алкил, гидрокси С1-6 алкил, амино С1-6 алкил, С1-6 алкиламино алкил, ди(С1-6 алкил) амино С1-6 алкил, карбокси С1-6 алкил, карбамоил С1-6 алкил, трифторметил, дифторметил, фторметил, амино, С1-6 алкиламино или ди(С1-6 алкил) амино), R12 представляет собой атом водорода, С1-6 алкильную группу, гидроксигруппу или аминогруппу, или R11 и R12, взятые вместе с атомом серы, с которым связан R11, и с атомом азота, с которым связан R12, могут образовывать 5- или 6-членный алифатический гетероцикл, и R13 представляет собой С1-6 алкильную группу, атом галогена или цианогруппу; его соль или его сольват.
[Химическая формула 3]

где R10 представляет собой группу формулы: -SO2-R11 (где R11 представляет собой С1-6 алкил, гетероциклическую группу, С1-6 алкил-гетероциклическую группу, гетероцикл-С1-6 алкил, гидрокси С1-6алкил, амино С1-6 алкил, С1-6алкиламино С1-6 алкил, ди(С1-6 алкил) амино С1-6 алкил, карбокси С1-6 алкил, карбамоил С1-6 алкил, трифторметил, дифторметил, фторметил, амино, С1-6 алкиламино или ди(С1-6 алкил) амино), R12 представляет собой атом водорода, С1-6 алкильную группу, гидроксигруппу или аминогруппу, или R11 и R12, взятые вместе с атомом серы, с которым связан R11, и с атомом азота, с которым связан R12, могут образовывать 5- или 6-членный алифатический гетероцикл, и R13 представляет собой С1-6 алкильную группу, атом галогена или цианогруппу;
его соль или его сольват.
[Химическая формула 4]
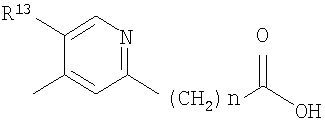
где R13 представляет собой С1-6 алкильную группу, атом галогена или цианогруппу, и n представляет собой целое число, имеющее значение 0-6; его соль или его сольват.
[Химическая формула 5]

где R10 представляет собой атом водорода, С1-6 алкильную группу, гидрокси С1-6 алкильную группу, алкилсульфинил С1-6 алкильную группу, С1-6 алкилсульфонил С1-6 алкильную группу, карбокси С1-6 алкильную группу, гетероцикл-С1-6 алкильную группу, или группу формулы: -SO2-R11 (где R11 представляет собой С1-6 алкил, гетероциклическую группу, С1-6 алкил-гетероциклическую группу, гетероцикл-С1-6 алкил, гидрокси С1-6 алкил, амино С1-6 алкил, С1-6 алкиламино С1-6 алкил, ди(С1-6 алкил) амино С1-6 алкил, карбокси С1-6 алкил, карбамоил С1-6 алкил, трифторметил, дифторметил, фторметил, амино, С1-6 алкиламино или ди(С1-6 алкил) амино), R12 представляет собой атом водорода, С1-6 алкильную группу, гидроксигруппу, или аминогруппу, или R11 и R12, взятые вместе с атомом серы, с которым связан R11, и с атомом азота, с которым связан R12, могут образовывать 5- или 6-членный алифатический гетероцикл, и R13 представляет собой С1-6 алкильную группу, атом галогена или цианогруппу; его соль; или его сольват.
R2 представляет собой группу формулы:
[Химическая формула 6]

где R10 представляет собой группу формулы: -SO2-R11 (где R11 представляет собой
С1-6 алкил, гетероциклическую группу, С1-6 алкил-гетероциклическую группу, гетероцикл-С1-6 алкил, гидрокси С1-6 алкил, амино С1-6 алкил, С1-6 алкиламино С1-6 алкил, ди(С1-6 алкил)амино С1-6 алкил, трифторметил, дифторметил, фтор-метил, амино, С1-6 алкил амино или ди(С1-6 алкил) амино), R12 представляет собой атом водорода, С1-6 алкильную группу, гидроксигруппу или аминогруппу, или R11 и R12, взятые вместе с атомом серы, с которым связан R11, и с атомом азота, с которым связан R12, могут образовывать 5- или 6-членный алифатический гетероцикл, и R13 представляет собой С1-6 алкильную группу, атом галогена или цианогруппу; его соль или его сольват.
4-хлорфенильную, 4-фторфенильную, 2,4-дифторфенильную, 3,4-дифторфенильную, 3-фтор-4-хлорфенильную, 4-трифторметилфенильную, 5-хлор-2-пиридильную, 6-хлор-3-пиридильную или 6-трифторметил-3-пиридильную группу;
R2 представляет собой группу формулы:
[Химическая формула 7]

где R13 представляет собой С1-6 алкильную группу, атом галогена или цианогруппу и n представляет собой целое число, имеющее значение 0-6; его соль или их сольват.
его соль; или его сольват.
| US 4257954 А, 24.03.1981 | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| US 4116665 А, 26.06.1978 | |||
| Приспособление в пере для письма с целью увеличения на нем запаса чернил и уменьшения скорости их высыхания | 1917 |
|
SU96A1 |
| RU 951120592 А, 10.11.1997. | |||
Авторы
Даты
2008-10-20—Публикация
2004-06-29—Подача