Настоящее изобретение относится к новому соединению, обладающему эффектом ингибирования продукции/секреции β-амилоидного белка, и к терапевтическому средству для лечения различных заболеваний, вызванных аномальной продукцией/секрецией β-амилоидного белка, например болезни Альцгеймера, синдрома Дауна и других заболеваний, связанных с амилоидными отложениями.
Болезнь Альцгеймера представляет собой нейродегенеративное заболевание, которое патологически характеризуется образованием сенильных бляшек и нейрофибриллярных сплетений вместе с дегенерацией нейронов и их гибелью. Болезнь Альцгеймера вызывает симптомы деменции, когда память, узнавание, мышление, суждение и т.п. прогрессивно утрачиваются, приводя, таким образом, к смерти. До настоящего времени не был известен какой-либо способ, который был бы эффективным для профилактики и лечения этого заболевания.
Белок, играющий основную роль в образовании сенильных бляшек, отлагающихся в головном мозге, представляет собой β-амилоидный белок (амилоидный β белок, Аβ), который состоит из 39-43 аминокислот. β-Амилоидный белок обладает цитотоксичностью, которая, как полагают, вызывает болезнь Альцгеймера (Непатентный документ 1). β-Амилоидный белок, секретируемый из клеток, представляет собой полипептид, в основном состоящий из 40-42 аминокислот, и, в частности, известно, что β-амилоидный белок, состоящий из 42 аминокислот, отлагается в головном мозге на ранней стадии с более высокой способностью к агрегации и обладает сильной цитотоксичностью (Непатентный документ 2). Несмотря на то что β-амилоидный белок повсеместно продуцируется в организме, его исходная функция до сих пор не выяснена.
β-Амилоидный белок продуцируется путем процессинга амилоидного белка-предшественника (АРР), который представляет собой трансмембранный белок. Среди пациентов, страдающих болезнью Альцгеймера, есть случаи распознавания мутации в АРР гене. Кроме того, известно, что в клетках, трансфицированных этим мутированным АРР геном, количество продукции/секреции β-амилоидного белка увеличивается. Исходя из этого считают, что лекарственное средство, ингибирующее продукцию/секрецию β-амилоидного белка, будет эффективным для профилактики или лечения болезни Альцгеймера.
Что касается способа расщепления АРР до β-амилоидного белка, были сообщения об аспарагинпротеазе, такой как ВАСЕ (фермент расщепления АРР по β-сайту) (Непатентный документ 3) или Asp1 (Непатентный документ 4), как β-секретазе, связанной с N-концевым расщеплением β-амилоидного белка. В то же время, что касается γ-секретазы, которая отвечает за С-концевое расщепление, имеются веские основания предполагать, что Пресенилин является ее частью (Непатентный документ 5). Сообщалось об ингибиторах указанных β-секретазы и γ-секретазы (Непатентный документ 6), и многие из них являются пептидными соединениями.
Smith et al. раскрывают соединение в Патентном документе 1, которое имеет сульфонамидный скелет и регулирует продукцию β-амилоидного белка. Belanger et al. также раскрывают соединение в Патентном документе 2, которое имеет бициклоалкилсульфонамидный скелет и ингибирует γ-секретазу. Кроме того, Патентные документы 3, 4 и 5 раскрывают соединения, обладающие активностью ингибирования продукции β-амилоидного белка. Патентные документы 6, 7 и 8 также раскрывают диарилсульфоновые соединения, которые ингибируют γ-секретазу. Кроме того, Патентные документы 9 и 10 также раскрывают соединения, ингибирующие продукцию β-амилоидного белка. В то же время Патентный документ 11 раскрывает тионафталиновое производное, которое ингибирует агрегацию амилоидных белков.
[Патентный документ 1] Международная Публикация No. WO 00/50391.
[Патентный документ 2] Международная Публикация No. WO 01/70677.
[Патентный документ 3] Международная Публикация No. WO 02/40451.
[Патентный документ 4] Международная Публикация No. WO 02/40508.
[Патентный документ 5] Международная Публикация No. WO 02/47671.
[Патентный документ 6] Международная Публикация No. WO 02/081433.
[Патентный документ 7] Международная Публикация No. WO 02/081435.
[Патентный документ 8] Международная Публикация No. WO 03/018543.
[Патентный документ 9] Международная Публикация No. WO 03/055850.
[Патентный документ 10] Международная Публикация No. WO 05/000798.
[Патентный документ 11] Выложенная Японская Патентная Заявка No. 9-95444.
[Непатентный документ 1] Science, Vol. 259, p. 514 (1993).
[Непатентный документ 2] Journal of Biological Chemistry, Vol. 270, p. 7013 (1995).
[Непатентный документ 3] Science, Vol. 286, p. 735 (1999).
[Непатентный документ 4] Molecular and Cellular Neuroscience, Vol. 16, p. 609 (2000).
[Непатентный документ 5] Journal of Medicinal Chemistry, Vol. 44, p. 2039 (2001).
Раскрытие изобретения
Задачи, решаемые настоящим изобретением
Задачей настоящего изобретения является обеспечение соединения, которое обладает сильным эффектом ингибирования продукции/секреции β-амилоидного белка и, таким образом, является эффективным для профилактики и/или лечения различных заболеваний, связанных с аномальной продукцией/секрецией β-амилоидного белка.
Средства решения задач
Авторами настоящего изобретения был выполнен большой объем исследований, и в результате было обнаружено, что пиридилметилтиосоединения, пиридилметилсульфиновые соединения и пиридилметилсульфоновые соединения, все представленные приведенной ниже общей формулой (1), ингибируют продукцию/секрецию β-амилоидного белка путем сильного ингибирования γ-секретазы и поэтому являются полезными в качестве терапевтических средств для лечения различных заболеваний, вызванных аномальной продукцией/секрецией β-амилоидного белка, таким образом, было создано настоящее изобретение.
Так, настоящее изобретение обеспечивает соединение, представленое следующей общей формулой (1):
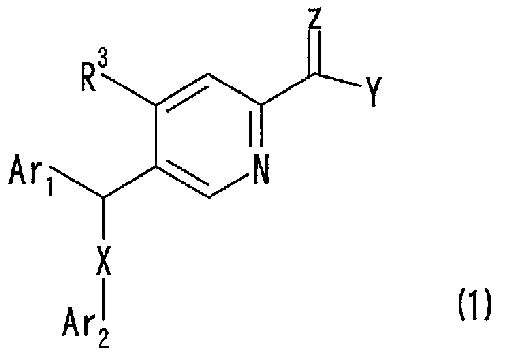
где Ar1 представляет собой замещенную фенильную группу;
Ar2 представляет собой фенильную группу, которая может быть замещена, или гетероциклическую группу, которая может быть замещена;
X представляет собой -S-, -SO- или -SO2-;
Y представляет собой атом водорода, -NR1R2 (где R1 представляет собой атом водорода, низшую алкильную группу или гидроксигруппу; и R2 представляет собой атом водорода, низшую алкильную группу, которая может быть замещена, низшую алканоильную группу, алкоксикарбонильную группу, которая может быть замещена, низшую алкоксигруппу, которая может быть замещена, аминогруппу, которая может быть замещена, фосфоногруппу, фенильную группу, которая может быть замещена, или ароматическую гетероциклическую группу, которая может быть замещена; или R1 и R2, вместе с атомом азота, с которым они связаны, образуют насыщенную гетероциклическую группу, при этом такая насыщенная гетероциклическая группа представляет собой группу, которая может быть замещена) или -OR1' (где R1' представляет собой атом водорода или низшую алкильную группу, которая может быть замещена);
Z представляет собой атом кислорода или атом серы; и
R3 представляет собой атом водорода, низшую алкильную группу или атом галогена;
или его соль, или сольват соединения или соли.
Кроме того, настоящее изобретение обеспечивает лекарственное средство, содержащее соединение, представленное общей формулой (1), его соль или сольват соединения или соли в качестве активного ингредиента.
Настоящее изобретение также направлено на обеспечение фармацевтической композиции, содержащей соединение, представленное общей формулой (1), его соль или сольват соединения или соли и фармацевтически приемлемый носитель.
Кроме того, настоящее изобретение направлено на обеспечение применения соединения, представленого общей формулой (1), его соли или сольвата соединения или соли для получения лекарственного средства.
Более того, настоящее изобретение направлено на обеспечение способа лечения заболевания, вызванного аномальной продукцией/секрецией β-амилоидного белка, при этом такой способ включает введение эффективного количества соединения, представленного общей формулой (1), его соли или сольвата соединения или соли.
Эффекты изобретения
Настоящее изобретение может обеспечивать средства для фармацевтической профилактики и/или лечения различных заболеваний, например болезни Альцгеймера, синдрома Дауна или других заболеваний, связанных с амилоидными отложениями.
Лучший способ осуществления изобретения
Далее будут описаны соединения, представленные общей формулой (1).
Ar1 представляет собой замещенную фенильную группу.
В данном случае указанная выше фенильная группа имеет в качестве заместителей 1 - 3 атома или группы, выбранных из группы, состоящей из атома галогена и низшей алкильной группы, которая может быть замещена атомом галогена, гидроксигруппой. Предпочтительно, количество заместителей составляет 2 или 3. В случае когда в качестве заместителей следует использовать несколько заместителей, эти заместители могут представлять собой одинаковые атомы или группы, или часть заместителей может представлять собой разные атомы и/или группы, или все заместители могут представлять собой разные атомы и/или группы.
Если имеется два заместителя, положения замещения предпочтительно представляют собой 2-положение и 5-положение; тогда как в случае трех заместителей положения замещения предпочтительно представляют собой 2-положение, 3-положение и 6-положение.
Кроме того, атом и заместитель, которые являются замещенными в фенильной группе, представленной Ar1, будут описаны ниже.
Термин “атом галогена” означает атом хлора, атом фтора, атом брома или атом иода. Из них атом хлора и атом фтора являются предпочтительными, и, в частности, атом фтора является предпочтительным.
Термин “низшая алкильная группа, которая может быть замещена атомом галогена или гидроксигруппой” означает незамещенную низшую алкильную группу, а также низшую алкильную группу, замещенную описанным выше атомом галогена или гидроксигруппой.
Термин “низшая алкильная группа” означает линейную, разветвленную или циклическую алкильную группу, содержащую 1-6 атомов углерода. Поэтому конкретные примеры низшей алкильной группы включают метильную группу, этильную группу, н-пропильную группу, изопропильную группу, н-бутильную группу, изобутильную группу, втор-бутильную группу, трет-бутильную группу, н-пентильную группу, 2-метилбутильную группу, 2,2-диметилбутильную группу, 2-метилпентильную группу, н-гексильную группу, циклопропильную группу, циклопропилметильную группу, циклобутилметильную группу, циклопропилэтильную группу, циклопентильную группу, циклогексильную группу и т.п.
Для низшей алкильной группы, замещенной атомом галогена или гидроксигруппой, количество замещений атомом галогена или гидроксигруппой не ограничено при условии, что замещение может иметь место, но это количество предпочтительно составляет от 1 до 3. Кроме того, в случае когда несколько атомов или групп нужно использовать в качестве заместителей, для замещений можно использовать одинаковые атомы или группы, или для замещений можно использовать разные атомы или группы, но предпочтительно, когда для замещений используют одинаковые атомы. Поэтому низшая алкильная группа, замещенная атомом галогена или гидроксигруппой, включает хлорметильную группу, дихлорметильную группу, трихлорметильную группу, фторметильную группу, дифторметильную группу, трифторметильную группу, 2-фторэтильную группу, 2-дифторэтильную группу, 2-трифторэтильную группу, 1-фторэтильную группу, 1-дифторэтильную группу, 1,2-дифторэтильную группу, гидроксиметильную группу, 2-гидроксиэтильную группу, 1-гидроксиэтильную группу и т.п.
Таким образом, конкретные примеры Ar1 включают 2-хлорфенильную группу, 3-хлорфенильную группу, 4-хлорфенильную группу, 2-фторфенильную группу, 3-фторфенильную группу, 4-фторфенильную группу, 2,5-дихлорфенильную группу, 2,6-дихлорфенильную группу, 2,3,6-трихлорфенильную группу, 2,3-дифторфенильную группу, 2,4-дифторфенильную группу, 2,5-дифторфенильную группу, 2,6-дифторфенильную группу, 3,5-дифторфенильную группу, 2,3,5-трифторфенильную группу, 2,3,6-трифторфенильную группу, 2-метилфенильную группу, 3-метилфенильную группу, 4-метилфенильную группу, 2,5-диметилфенильную группу, 3-хлор-2-метилфенильную группу, 3-фтор-2-метилфенильную группу, 5-хлор-2-метилфенильную группу, 5-фтор-2-метилфенильную группу, 2-хлор-5-метилфенильную группу, 2-фтор-3-метилфенильную группу, 2-хлор-5-метилфенильную группу, 2-фтор-5-метилфенильную группу, 2-хлорметилфенильную группу, 3-хлорметилфенильную группу, 2-дихлорметилфенильную группу, 3-дихлорметилфенильную группу, 2-трихлорметилфенильную группу, 3-трихлорметилфенильную группу, 2-фторметилфенильную группу, 3-фторметилфенильную группу, 4-фторметилфенильную группу, 2-дифторметилфенильную группу, 3-дифторметилфенильную группу, 2-трифторметилфенильную группу, 3-трифторметилфенильную группу, 2-хлор-5-хлорметилфенильную группу, 2-хлор-5-дихлорметилфенильную группу, 2-хлор-5-трихлорметилфенильную группу, 2-хлор-5-фторметилфенильную группу, 2-хлор-5-дифторметилфенильную группу, 2-хлор-5-трифторметилфенильную группу, 5-хлор-2-хлорметилфенильную группу, 5-хлор-2-фторметилфенильную группу, 5-хлор-2-дифторметилфенильную группу, 5-хлор-2-трифторметилфенильную группу, 2-фтор-5-хлорметилфенильную группу, 2-фтор-5-фторметилфенильную группу, 2-фтор-5-дифторметилфенильную группу, 2-фтор-5-трифторметилфенильную группу, 5-фтор-2-хлорметилфенильную группу, 5-фтор-2-фторметилфенильную группу, 5-фтор-2-дифторметилфенильную группу, 5-фтор-2-трифторметилфенильную группу, 2-метил-5-хлорметилфенильную группу, 2-метил-5-фторметилфенильную группу, 2-метил-5-дифторметилфенильную группу, 2-метил-5-трифторметилфенильную группу, 2-хлорметил-5-метилфенильную группу, 2-фторметил-5-метилфенильную группу, 2-дифторметил-5-метилфенильную группу, 2-трифторметил-5-метилфенильную группу, 5-хлор-2-фторфенильную группу, 2-хлор-5-фторфенильную группу, 5-хлор-2-гидроксиметилфенильную группу, 5-фтор-2-гидроксиметилфенильную группу, 2-хлор-5-гидроксиметилфенильную группу, 2-фтор-5-гидроксиметилфенильную группу, 2,3-дифтор-5-гидроксиметилфенильную группу, 2,6-дифтор-5-гидроксиметилфенильную группу и т.п. Из них 2,5-дифторфенильная группа и 2,3,6-трифторфенильная группа являются предпочтительными.
Далее будет описан Ar2.
Ar2 представляет собой фенильную группу, которая может быть замещена, или гетероциклическую группу, которая может быть замещена.
В данном описании термин “фенильная группа, которая может быть замещена” означает незамещенную фенильную группу, а также фенильную группу, которая является замещенной одним заместителем или двумя одинаковыми или разными заместителями, выбранными из группы, включающей низшую алкильную группу, которая может быть замещена атомом галогена, гидроксигруппу, низшую алкоксигруппу, которая может быть замещена, и атом галогена. В случае когда имеется один заместитель, положение замещения предпочтительно представляет собой 4-положениие, тогда как в случае, когда имеются два заместителя, замещения в 3-положении и 4-положении или замещения в 3-положении и 5-положении являются предпочтительными.
Низшая алкильная группа, которая может быть замещена атомом галогена, которая является заместителем для указанной выше фенильной группы, означает такую же группу, как низшая алкильная группа, которая может быть замещена атомом галогена, описанная выше в качестве заместителя для Ar1.
Для низшей алкоксигруппы, которая может быть замещена, которую используют в качестве заместителя для указанной выше фенильной группы, термин ”низшая алкоксигруппа” означает алкоксигруппу, содержащую описанную выше низшую алкильную группу в качестве составляющего фрагмента, и такие низшие алкоксигруппы могут быть дополнительно замещены атомом галогена. Таким образом, низшая алкоксигруппа, которая может быть замещена, может включать метоксигруппу, этоксигруппу, пропоксигруппу, изопропоксигруппу, бутоксигруппу, изобутоксигруппу, трет-бутоксигруппу, пентоксигруппу, гексильную группу, циклопропилоксигруппу, трифторметоксигруппу, трихлорметоксигруппу и т.п. Из них метоксигруппа и трифторметоксигруппа являются предпочтительными.
В качестве примера атома галогена в качестве заместителя для указанной выше фенильной группы можно привести те же атомы галогена, которые описаны выше в качестве заместителей для Ar1, и атом хлора и атом фтора являются предпочтительными, при этом атом фтора является особенно предпочтительным.
Гетероциклическая группа, такая как в гетероциклической группе, которая может быть замещена, означает моноциклическую или бициклическую гетероциклическую группу и конкретно означает пиридин-2-ильную группу, пиридин-3-ильную группу, тиофен-2-ильную группу, бензофуран-6-ильную группу, дигидробензофуран-6-ильную группу, пиримидин-5-ильную группу или т.п. Эти гетероциклические группы могут быть замещены одной группой или атомом или двумя одинаковыми или разными группами или атомами, выбранными из группы, включающей низшую алкильную группу, которая может быть замещена атомом галогена, гидроксигруппу, низшую алкоксигруппу, которая может быть замещена, и атом галогена, как описано в случае, когда Ar2 представляет собой фенильную группу, которая может быть замещена. То есть, когда в качестве заместителей присутствуют несколько групп или атомов, эти группы или атомы могут быть одинаковыми или могут быть отличными друг от друга.
Когда Ar2 представляет собой замещенную пиридин-2-ильную группу, замещенную пиридин-3-ильную группу или пиримидин-5-ильную группу, эти группы предпочтительно содержат заместитель в положении пара относительно связи с атомом серы. А именно, когда Ar2 представляет собой замещенную пиридин-2-ильную группу, предпочтительно, когда замещение группой или атомом имеет место в 5-положении, тогда как, когда Ar2 представляет собой замещенную пиридин-3-ильную группу, предпочтительно, когда замещение группой или атомом имеет место в 6-положении. Когда Ar2 представляет собой замещенную пиримидин-5-ильную группу, предпочтительно, когда замещение группой или атомом имеет место в 2-положении.
Поэтому конкретные примеры Ar2 включают фенильную группу, 2-метилфенильную группу, 3-метилфенильную группу, 4-метилфенильную группу, 2-этилфенильную группу, 3-этилфенильную группу, 4-этилфенильную группу, 4-пропилфенильную группу, 4-изопропилфенильную группу, 4-циклопропилфенильную группу, 4-бутилфенильную группу, 4-трет-бутилфенильную группу, 4-циклобутилфенильную группу, 4-циклопентилфенильную группу, 4-циклогексилфенильную группу, 2,3-диметилфенильную группу, 2,4-диметилфенильную группу, 3,4-диметилфенильную группу, 3,5-диметилфенильную группу, 2-метил-4-этилфенильную группу, 3-метил-4-этилфенильную группу, 3-этил-4-метилфенильную группу, 4-хлорметилфенильную группу, 4-дихлорметилфенильную группу, 4-трихлорметилфенильную группу, 2-фторметилфенильную группу, 2-дифторметилфенильную группу, 2-трифторметилфенильную группу, 3-фторметилфенильную группу, 3-дифторметилфенильную группу, 3-трифторметилфенильную группу, 4-фторметилфенильную группу, 4-дифторметилфенильную группу, 4-трифторметилфенильную группу, 4-трихлорметил-3-метилфенильную группу, 4-трифторметил-3-метилфенильную группу, 5-трихлорметил-3-метилфенильную группу, 5-трифторметил-3-метилфенильную группу, 2-гидроксифенильную группу, 3-гидроксифенильную группу, 4-гидроксифенильную группу, 2-метоксифенильную группу, 3-метоксифенильную группу, 4-метоксифенильную группу, 2-этоксифенильную группу, 3-этоксифенильную группу, 4-этоксифенильную группу, 4-(трифторметокси)фенильную группу, 2-хлорфенильную группу, 3-хлорфенильную группу, 4-хлорфенильную группу, 2,3-дихлорфенильную группу, 2,4-дихлорфенильную группу, 3,4-дихлорфенильную группу, 3,5-дихлорфенильную группу, 2-фторфенильную группу, 3-фторфенильную группу, 4-фторфенильную группу, 2,3-дифторфенильную группу, 2,4-дифторфенильную группу, 3,4-дифторфенильную группу, 3,5-дифторфенильную группу, 4-хлор-3-метилфенильную группу, 4-фтор-3-метилфенильную группу, 3-хлор-4-метилфенильную группу, 3-фтор-4-метилфенильную группу, 3-фтор-4-фторметилфенильную группу, 3-фтор-4-дифторметилфенильную группу, 5-хлор-3-метилфенильную группу, 5-фтор-3-метилфенильную группу, 3-фтор-4-трифторметилфенильную группу, 3-фтор-5-трифторметилфенильную группу, 3-фтор-4-метоксифенильную группу, 3-хлор-4-метоксифенильную группу, 3-фтор-4-этоксифенильную группу, 3-хлор-4-этоксифенильную группу, 4-фтор-3-метоксифенильную группу, 4-хлор-3-метоксифенильную группу, 4-фтор-3-этоксифенильную группу, 4-хлор-3-этоксифенильную группу; пиридин-2-ильную группу, 3-метилпиридин-2-ильную группу, 4-метилпиридин-2-ильную группу, 5-метилпиридин-2-ильную группу, 6-метилпиридин-2-ильную группу, 5-(хлорметил)пиридин-2-ильную группу, 5-(дихлорметил)пиридин-2-ильную группу, 5-(трихлорметил)пиридин-2-ильную группу, 5-(фторметил)пиридин-2-ильную группу, 5-(дифторметил)пиридин-2-ильную группу, 5-(трифторметил)пиридин-2-ильную группу, 5-гидроксипиридин-2-ильную группу, 5-метоксипиридин-2-ильную группу, 5-этоксипиридин-2-ильную группу, 3-хлорпиридин-2-ильную группу, 3-фторпиридин-2-ильную группу, 4-хлорпиридин-2-ильную группу, 4-фторпиридин-2-ильную группу, 5-хлорпиридин-2-ильную группу, 5-фторпиридин-2-ильную группу, 6-хлорпиридин-2-ильную группу, 6-фторпиридин-2-ильную группу, 5-хлор-3-метилпиридин-2-ильную группу, 5-фтор-3-метилпиридин-2-ильную группу, 5-хлор-4-метилпиридин-2-ильную группу, 5-фтор-4-метилпиридин-2-ильную группу, 5-хлор-6-метилпиридин-2-ильную группу, 5-фтор-6-метилпиридин-2-ильную группу, 5-трифторметил-4-метилпиридин-2-ильную группу; пиридин-3-ильную группу, 2-метилпиридин-3-ильную группу, 4-метилпиридин-3-ильную группу, 5-метилпиридин-3-ильную группу, 6-метилпиридин-3-ильную группу, 6-(хлорметил)пиридин-3-ильную группу, 6-(дихлорметил)пиридин-3-ильную группу, 6-(трихлорметил)пиридин-3-ильную группу, 2-(фторметил)пиридин-3-ильную группу, 2-(дифторметил)пиридин-3-ильную группу, 2-(трифторметил)пиридин-3-ильную группу, 4-(фторметил)пиридин-3-ильную группу, 4-(дифторметил)пиридин-3-ильную группу, 4-(трифторметил)пиридин-3-ильную группу, 5-(фторметил)пиридин-3-ильную группу, 5-(дифторметил)пиридин-3-ильную группу, 5-(трифторметил)пиридин-3-ильную группу, 6-(фторметил)пиридин-3-ильную группу, 6-(дифторметил)пиридин-3-ильную группу, 6-(трифторметил)пиридин-3-ильную группу, 6-метоксипиридин-3-ильную группу, 2-хлорпиридин-3-ильную группу, 2-фторпиридин-3-ильную группу, 4-хлорпиридин-3-ильную группу, 4-фторпиридин-3-ильную группу, 5-хлорпиридин-3-ильную группу, 5-фторпиридин-3-ильную группу, 6-хлорпиридин-3-ильную группу, 6-фторпиридин-3-ильную группу, 6-хлор-4-метилпиридин-3-ильную группу, 6-фтор-4-метилпиридин-3-ильную группу, 6-хлор-5-метилпиридин-3-ильную группу, 6-фтор-5-метилпиридин-3-ильную группу, 5-метил-6-трифторметилпиридин-3-ильную группу; тиофен-2-ильную группу, 3-метилтиофен-2-ильную группу, 4-метилтиофен-2-ильную группу, 5-метилтиофен-2-ильную группу, 5-трихлорметилтиофен-2-ильную группу, 5-трифторметилтиофен-2-ильную группу, 5-гидрокситиофен-2-ильную группу, 5-хлортиофен-2-ильную группу, 5-фтортиофен-2-ильную группу; бензофуран-6-ильную группу, 3-метилбензофуран-6-ильную группу, 5-метилбензофуран-6-ильную группу; 2,3-дигидробензофуран-6-ильную группу, 3-метил-2,3-дигидробензофуран-6-ильную группу, 5-метил-2,3-дигидробензофуран-6-ильную группу; пиримидин-5-ильную группу, 2-метилпиримидин-5-ильную группу, 2-хлорпиримидин-5-ильную группу, 2-фторпиримидин-5-ильную группу, 2-трихлорметилпиримидин-5-ильную группу, 2-трифторметилпиримидин-5-ильную группу и т.п.
Из них фенильная группа, 4-метилфенильная группа, 4-хлорфенильная группа, 4-фторфенильная группа, 4-трихлорметилфенильная группа, 4-трифторметилфенильная группа, 4-метоксифенильная группа, 4-(трифторметокси)фенильная группа, 3,4-дифторфенильная группа, 3,5-дифторфенильная группа, 4-хлор-3-метилфенильная группа, 4-фтор-3-метилфенильная группа, 5-хлорпиридин-2-ильная группа, 5-фторпиридин-2-ильная группа, 5-метилпиридин-2-ильная группа, 5-(фторметил)пиридин-2-ильная группа, 5-(дифторметил)пиридин-2-ильная группа, 5-(трифторметил)пиридин-2-ильная группа, 6-хлорпиридин-3-ильная группа, 6-фторпиридин-3-ильная группа, 6-метилпиридин-3-ильная группа, 6-(фторметил)пиридин-3-ильная группа, 6-(дифторметил)пиридин-3-ильная группа, 6-(трифторметил)пиридин-3-ильная группа, 2-(трифторметил)пиримидин-5-ильная группа, 5-хлортиофен-2-ильная группа, 5-фтортиофен-2-ильная группа, бензофуран-6-ильная группа, 2,3-дигидробензофуран-6-ильная группа и т.п. являются предпочтительными, и более предпочтительными являются фенильная группа, 4-метилфенильная группа, 4-трифторметилфенильная группа, 4-хлорфенильная группа, 4-фторфенильная группа, 4-метоксифенильная группа, 4-(трифторметокси)фенильная группа, 3,4-дифторфенильная группа, 4-хлор-3-метилфенильная группа, 4-фтор-3-метилфенильная группа, 3,5-дифторфенильная группа, 5-(трифторметил)пиридин-2-ильная группа, 6-(трифторметил)пиридин-3-ильная группа и бензофуран-6-ильная группа.
X представляет собой -S-, -SO- или -SO2-. Соединение, являющееся соединением, представленным общей формулой (1), и где X представляет собой -SO- или -SO2-, может демонстрировать желаемый эффект, в частности, в условиях in vivo.
Y представляет собой атом водорода, -NR1R2 или -OR1'.
Когда Y представляет собой -NR1R2, в качестве конкретного примера R1 и R2 можно привести группы, описанные ниже, но конкретно не ограниченные, при условии, что эти группы могут метаболизироваться в организме с образованием -NH2 в качестве Y.
R1 означает атом водорода, низшую алкильную группу или гидроксигруппу. Как описано выше, низшая алкильная группа означает линейную, разветвленную или циклическую алкильную группу, содержащую 1-6 атомов углерода, и метильная группа и этильная группа являются предпочтительными. Для R1 атом водорода или метильная группа являются особенно предпочтительными.
R2 представляет собой атом водорода, низшую алкильную группу, которая может быть замещена, низшую алканоильную группу, алкоксикарбонильную группу, которая может быть замещена, низшую алкоксигруппу, которая может быть замещена, аминогруппу, которая может быть замещена, фосфоногруппу, фенильную группу, которая может быть замещена, или ароматическую гетероциклическую группу, которая может быть замещена.
Термин “низшая алкильная группа, которая может быть замещена” в случае, когда R2 представляет собой низшую алкильную группу, которая может быть замещена, означает незамещенную низшую алкильную группу, а также низшую алкильную группу, содержащую в качестве заместителей 1-3 группы, выбранные из группы, включающей низшую алканоильную группу, карбоксильную группу, низшую алкоксикарбонильную группу, гидроксигруппу, низшую алкоксигруппу, которая может быть замещена, меркаптогруппу, низшую алкилтиогруппу, низшую алкилсульфинильную группу, низшую алкилсульфонильную группу, аминогруппу, которая может быть замещена, атом галогена, фенильную группу, которая может быть замещена, и ароматическую гетероциклическую группу, которая может быть замещена. Когда присутствует несколько групп в качестве заместителей, эти группы могут быть одинаковыми, часть групп могут быть одинаковыми или все группы могут быть разными.
В данном описании низшая алкильная группа, такая как в низшей алкильной группе, которая может быть замещена, включает те же группы, которые описаны выше, но метильная группа, этильная группа, пропильная группа и трет-бутильная группа являются предпочтительными, при этом метильная группа или этильная группа является более предпочтительной.
Далее будут описаны заместители для низшей алкильной группы в случае, когда R2 представляет собой низшую алкильную группу, которая может быть замещена.
Термин “низшая алканоильная группа” означает линейную и разветвленную алканоильную группу, содержащую 2 - 6 атомов углерода, и примеры такой группы включают ацетильную группу, пропионильную группу, бутирильную группу, валерильную группу, гексаноильную группу и т.п.
Термин “низшая алкоксикарбонильная группа” означает низшую алкоксикарбонильную группу, содержащую описанную выше низшую алкильную группу в качестве ее составляющего фрагмента, и означает метоксикарбонильную группу, этоксикарбонильную группу, пропоксикарбонильную группу или т.п.
Низшая алкоксигруппа, такая как в низшей алкоксигруппе, которая может быть замещена, означает такую же группу, как низшая алкоксигруппа, описанная в качестве заместителя для Ar1, и примеры такой группы включают метоксигруппу, этоксигруппу, пропоксигруппу, изопропоксигруппу, бутоксигруппу, изобутоксигруппу, пентоксигруппу, циклопропилоксигруппу, циклопентилоксигруппу, циклопропилметилоксигруппу и т.п. Из них метоксигруппа и этоксигруппа являются предпочтительными. Эти низшие алкоксигруппы могут быть дополнительно замещены карбоксильной группой, алкоксикарбонильной группой, гидроксигруппой или гетероциклической группой, такой как пиридильная группа. Поэтому предпочтительная низшая алкоксигруппа, которая может быть замещена, включает метоксигруппу, этоксигруппу, карбоксиметоксигруппу, метоксикарбонилметоксигруппу, этоксикарбонилметоксигруппу, 2-гидроксиэтоксигруппу, пиридин-3-илметоксигруппу и т.п., тогда как метоксигруппа, этоксигруппа, карбоксиметоксигруппа, этоксикарбонилметоксигруппа, 2-гидроксиэтоксигруппа, пиридин-3-илметоксигруппа и т.п. могут быть указаны как более предпочтительные группы.
Термин “низшая алкилтиогруппа” означает низшую алкилтиогруппу, содержащую описанную выше низшую алкильную группу в качестве ее составляющего фрагмента, и примеры такой группы включают метилтиогруппу, этилтиогруппу, пропилтиогруппу, трет-бутилтиогруппу, циклопропилтиогруппу и т.п.
Термин “низшая алкилсульфинильная группа” означает низшую алкилсульфинильную группу, содержащую описанную выше низшую алкильную группу в качестве ее составляющего фрагмента, и примеры такой группы включают метилсульфинильную группу, этилсульфинильную группу, пропилсульфинильную группу, трет-бутилсульфинильную группу, циклопропилсульфинильную группу и т.п.
Термин “низшая алкилсульфонильная группа” означает низшую алкилсульфонильную группу, содержащую описанную выше низшую алкильную группу в качестве ее составляющего фрагмента, и примеры такой группы включают метилсульфонильную группу, этилсульфонильную группу, пропилсульфонильную группу, трет-бутилсульфонильную группу, циклопропилсульфонильную группу и т.п.
Термин “аминогруппа, которая может быть замещена” означает незамещенную аминогруппу, а также аминогруппу, замещенную одним заместителем, выбранным из группы, включающей низшую алкильную группу, низшую алканоильную группу, низшую алкоксикарбонильную группу и азотсодержащую гетероциклическую группу, и примеры такой группы включают аминогруппу, метиламиногруппу, диметиламиногруппу, ацетиламиногруппу, пропиониламиногруппу, бутириламиногруппу, метоксикарбониламиногруппу, этоксикарбониламиногруппу, трет-бутоксикарбониламиногруппу и т.п. Из них диметиламиногруппа является предпочтительной.
Атом галогена означает, как описано выше, атом хлора, атом фтора, атом брома или атом иода.
Термин “фенильная группа, которая может быть замещена” означает незамещенную фенильную группу, а также фенильную группу, замещенную одной-тремя гидроксигруппами или низшими алкоксигруппами. Нет никакого ограничения положения замещения для заместителей. Кроме того, когда фенильная группа содержит несколько заместителей, эта фенильная группа может быть замещена одинаковыми заместителями, или часть заместителей могут быть одинаковыми, или все заместители могут представлять собой разные группы. Таким образом, конкретные примеры фенильной группы, которая может быть замещена, включают фенильную группу, 3-гидроксифенильную группу, 3,4-дигидроксифенильную группу, 3-гидрокси-4-метоксифенильную группу, 3,5-дигидроксифенильную группу, 3-метоксифенильную группу, 3,4-диметоксифенильную группу, 3,4,5-триметоксифенильную группу и т.п.
Термин “ароматическая гетероциклическая группа, которая может быть замещена” означает азотсодержащую ароматическую гетероциклическую группу, которая может быть замещена описанной выше низшей алкильной группой, и означает пиридильную группу, пиридазинильную группу, пиримидинильную группу, пиразинильную группу, пиразолильную группу, имидазолильную группу или триазолильную группу, каждая из которых является незамещенной, а также метилпиридильную группу, метилпиридазинильную группу, метилпиримидинильную группу, метилпиразинильную группу или т.п.
Более того, в случае когда R2 представляет собой низшую алкильную группу, замещенную гидроксигруппой, указанная выше гидроксигруппа может быть дополнительно замещена заместителем, который может гидролизоваться в организме с образованием указанной выше гидроксигруппы. Тип заместителя конкретно не ограничен, и можно использовать те заместители, которые известны как обладающие таким свойством. Например, можно указать заместитель, который обеспечивает образование сложноэфирной связи или т.п., такой как замещенная карбонильная группа или фосфоногруппа. В качестве конкретного примера замещенной карбонильной группы можно привести алканоильную группу, бензоильную группу, ароматическую гетероциклическую карбонильную группу или т.п. Эти группы могут быть дополнительно замещены гидроксигруппой, аминогруппой, карбоксигруппой или т.п. Поэтому заместитель для низшей алкильной группы, которая может быть замещена, может включать ацетоксигруппу, пропионилоксигруппу, бутирилоксигруппу, гидроксиацетоксигруппу, аминоацетоксигруппу, оксалилоксигруппу, карбоксиацетоксигруппу, карбоксипропионилоксигруппу, карбоксибутирилоксигруппу, бензоилоксигруппу, карбоксибензоилоксигруппу, пиридилкарбонилоксигруппу, карбоксипиридилкарбонилоксигруппу, фосфонооксигруппу и т.п.
Так, примеры низшей алкильной группы, которая может быть замещена, как в случае R2, включают метильную группу, этильную группу, н-пропильную группу, изопропильную группу, н-бутильную группу, изобутильную группу, втор-бутильную группу, трет-бутильную группу, н-пентильную группу, 2-метилпентильную группу, н-гексильную группу, циклопропильную группу, циклобутильную группу, циклопентильную группу, циклогексильную группу; ацетилметильную группу, 1-ацетилэтильную группу, 2-ацетилэтильную группу, 3-ацетилпропильную группу; карбоксиметильную группу, 2-карбоксиэтильную группу, 3-карбоксипропильную группу, 2-карбоксипропильную группу; метоксикарбонилметильную группу, этоксикарбонилметильную группу, пропоксикарбонилметильную группу, бутоксикарбонилметильную группу, трет-бутоксикарбонилметильную группу, 2-метоксикарбонилэтильную группу, 2-этоксикарбонилэтильную группу, 2-пропоксикарбонилэтильную группу, 2-бутоксикарбонилэтильную группу, 2-трет-бутоксикарбонилэтильную группу; гидроксиметильную группу, 2-гидроксиэтильную группу, 1-гидроксиэтильную группу, 1,2-дигидроксиэтильную группу, 1-гидроксиметил-2-гидроксиэтильную группу, 1-гидроксипропильную группу, 3-гидроксипропильную группу, 2-гидрокси-1-гидроксиметилэтильную группу, 1-гидроксибутильную группу, 2-гидроксибутильную группу, 3-гидроксибутильную группу, 2-гидроксициклопропильную группу, 2-гидроксициклобутильную группу, 4-гидроксициклогексильную группу; ацетоксиметильную группу, пропионилоксиметильную группу, бутирилоксиметильную группу, гидроксиацетоксиметильную группу, аминоацетоксиметильную группу, оксалилоксигруппу, карбоксилацетоксиметильную группу, карбоксипропионилоксиметильную группу, бензоилоксиметильную группу, карбоксибензоилоксиметильную группу, пиридилкарбонилоксиметильную группу, карбоксипиридилкарбонилоксиметильную группу, фосфонооксиметильную группу; метоксиметильную группу, этоксиметильную группу, карбоксиметоксиметильную группу, метоксикарбонилметоксиметильную группу, этоксикарбонилметоксиметильную группу, 2-гидроксиэтоксиметильную группу, (пиридин-3-илметокси)метильную группу, метоксиэтильную группу, этоксиэтильную группу, метоксипропильную группу, метоксиизопропильную группу, метоксибутильную группу; меркаптометильную группу; метилтиометильную группу, этилтиометильную группу, 2-метилтиоэтильную группу, 2-этилтиоэтильную группу, 3-метилтиопропильную группу, 2-метилтиопропильную группу, 3-этилтиопропильную группу; метилсульфинилметильную группу, этилсульфинилметильную группу, 2-метилсульфинилэтильную группу, 2-этилсульфинилэтильную группу, 3-метилсульфинилпропильную группу, 3-этилсульфинилпропильную группу; метилсульфонилметильную группу, этилсульфонилметильную группу, 2-метилсульфонилэтильную группу, 2-этилсульфонилэтильную группу, 3-метилсульфонилпропильную группу, 2-метилсульфонилпропильную группу, 3-этилсульфонилпропильную группу; аминометильную группу, диметиламинометильную группу, ацетиламинометильную группу, пропиониламинометильную группу, бутириламинометильную группу, 2-аминоэтильную группу, 2-ацетиламиноэтильную группу, 2-пропиониламиноэтильную группу, 2-бутириламиноэтильную группу, 1-ацетиламиноэтильную группу, 1-пропиониламиноэтильную группу, 1-бутириламиноэтильную группу, метоксикарбониламинометильную группу, этоксикарбониламинометильную группу, трет-бутоксикарбониламинометильную группу, 2-метоксикарбониламиноэтильную группу, 2-этоксикарбониламиноэтильную группу, 2-трет-бутоксикарбониламиноэтильную группу; хлорметильную группу, фторметильную группу, 2-хлорэтильную группу, 2-фторэтильную группу; фенилметильную группу, 3-гидроксифенилметильную группу, 3,4-дигидроксифенилметильную группу, 3-гидрокси-4-метоксифенилметильную группу, 3,5-дигидроксифенилметильную группу, 3-метоксифенилметильную группу, 3,4-диметоксифенилметильную группу, 3,4,5-триметоксифенилметильную группу; 2-пиридилметильную группу, 3-пиридилметильную группу, 4-пиридилметильную группу, 3-метил-4-пиридилметильную группу, 2-пиридазинилметильную группу, 2-пиримидинилметильную группу, 4-пиримидинилметильную группу, 2-пиразинилметильную группу, 1H-имидазол-2-илметильную группу, 1H-пиразол-5-илметильную группу, 1H-триазол-5-илметильную группу и т.п.
Термин “низшая алканоильная группа”, такая как в случае, когда R2 представляет собой низшую алканоильную группу, означает линейную или разветвленную алканоильную группу, содержащую 2 - 6 атомов углерода, и примеры такой группы включают ацетильную группу, пропионильную группу, бутирильную группу, валерильную группу, гексаноильную группу и т.п.
Термин “низшая алкоксикарбонильная группа, которая может быть замещена”, такая как в случае, когда R2 представляет собой низшую алкоксикарбонильную группу, которая может быть замещена, означает описанную выше низшую алкоксигруппу, которая может быть замещена гидроксигруппой или ароматической гетероциклической группой, и примеры такой группы включают карбоксильную группу, метоксикарбонильную группу, этоксикарбонильную группу, 2-гидроксиэтоксикарбонильную группу, пиридилоксикарбонильную группу и т.п.
Термин “низшая алкоксигруппа, которая может быть замещена”, такая как в случае, когда R2 представляет собой низшую алкоксигруппу, которая может быть замещена, означает описанную выше низшую алкоксигруппу, которая может быть замещена гидроксигруппой или ароматической гетероциклической группой, и примеры такой группы включают метоксигруппу, этоксигруппу, 2-гидроксиэтоксигруппу, 2-пиридилметоксигруппу и т.п.
Термин “аминогруппа, которая может быть замещена”, такая как в случае, когда R2 представляет собой аминогруппу, которая может быть замещена, означает незамещенную аминогруппу, а также метиламиногруппу, диметиламиногруппу, этиламиногруппу, 2-гидроксиэтиламиногруппу, 2-пиридиламиногруппу, ацетиламиногруппу и т.п. Кроме того, аминогруппа, которая может быть замещена, может представлять собой замещенную алифатическую гетероциклическую группу, содержащую в качестве ее составляющего фрагмента атом азота, который образует указанную выше аминогруппу, и примеры такой группы включают морфолин-4-ильную группу, пиперидиногруппу, пиперазиногруппу, 4-метилпиперазиногруппу и т.п.
Термин “фенильная группа, которая может быть замещена”, такая как в случае, когда R2 представляет собой фенильную группу, которая может быть замещена, означает незамещенную фенильную группу, а также фенильную группу, которая может быть замещена одним заместителем, выбранным из группы, включающей низшую алкильную группу, гидрокси-низшую алкильную группу, гидроксигруппу, аминокарбонильную группу, метиламинокарбонильную группу и диметиламинокарбонильную группу. Предпочтительно, когда такие заместители присутствуют в пара-положении относительно связи между указанной выше фенильной группой и аминогруппой. Так, примеры фенильной группы, которая может быть замещена, включают фенильную группу, 2-метилфенильную группу, 3-метилфенильную группу, 4-метилфенильную группу, 4-гидроксиметилфенильную группу, 4-гидроксифенильную группу, 4-аминокарбонилфенильную группу, 4-метиламинокарбонилфенильную группу, 4-диметиламинокарбонилфенильную группу и т.п.
Ароматическая гетероциклическая группа, такая как в случае, когда R2 представляет собой гетероциклическую группу, могут включать 5- или 6-членную азотсодержащую ароматическую гетероциклическую группу, например 2-пиридильную группу, 3-пиридильную группу, 2-пиримидинильную группу, 4-пиримидинильную группу, 2-пиридазинильную группу, 1H-имидазол-2-ильную группу, 1H-пиразол-5-ильную группу, 1H-триазол-5-ильную группу и т.п.
Из них, как для R2, в качестве предпочтительных групп могут быть включены атом водорода, метильная группа, этильная группа, трет-бутильная группа, циклопропильная группа, карбоксиметильная группа, 2-карбоксиэтильная группа, 2-(этоксикарбонил)этильная группа, гидроксиметильная группа, 2-гидроксиэтильная группа, 4-гидроксициклогексильная группа, 2-гидрокси-1-гидроксиметилэтильная группа, ацетоксиметильная группа, метилтиопропильная группа, метилсульфинилпропильная группа, метилсульфонилпропильная группа, метилкарбониламиноэтильная группа, метоксикарбониламиноэтильная группа, трет-бутоксикарбониламиноэтильная группа, 2-хлорэтильная группа, гидроксиацетоксиметильная группа, диметиламинометильная группа, карбоксиметоксиметильная группа, метоксикарбонилметоксиметильная группа, этоксикарбонилметоксиметильная группа, 2-гидроксиэтоксиметильная группа, (пиридин-3-илметокси)метильная группа, меркаптометильная группа, ацетильная группа и метоксигруппа; и в качестве более предпочтительных групп могут быть включены атом водорода, метильная группа, этильная группа, циклопропильная группа, карбоксиметильная группа, 2-карбоксиэтильная группа, гидроксиметильная группа, 2-гидроксиэтильная группа, ацетоксиметильная группа, метилсульфинилпропильная группа, метилсульфонилпропильная группа, метоксикарбониламиноэтильная группа, гидроксиацетоксиметильная группа, диметиламинометильная группа, карбоксиметоксиметильная группа, этоксикарбонилметоксиметильная группа, 2-гидроксиэтоксиметильная группа, (пиридин-3-илметокси)метильная группа, меркаптометильная группа, ацетильная группа и метоксигруппа. Еще более предпочтительными группами являются атом водорода, метильная группа, этильная группа, гидроксиметильная группа, 2-гидроксиэтильная группа, диметиламинометильная группа и метоксигруппа.
В качестве заместителя, представленого -NR1R2, в предпочтительные группы могут быть включены аминогруппа, метиламиногруппа, диметиламиногруппа, (гидроксиметил)аминогруппа, N-метил-N-(гидроксиметил)аминогруппа, (2-гидроксиэтил)аминогруппа и N-метил-N-(2-гидроксиэтил)аминогруппа.
Кроме того, R1 и R2, вместе с атомом азота, с которым эти группы связаны, могут образовывать насыщенную гетероциклическую группу. Насыщенная гетероциклическая группа в этом случае означает 4-7-членную насыщенную гетероциклическую группу, которая может содержать в качестве ее составляющих 1 - 3 одинаковых или разных атома, выбранных из атома азота, атома кислорода и атома серы, помимо указанного выше атома азота. Конкретные примеры такой группы включают азетидинильную группу, пирролидинильную группу, пиразолидинильную группу, имидазолидинильную группу, тиазолидинильную группу, изотиазолидинильную группу, оксазолидинильную группу, изооксазолидинильную группу, пиперидинильную группу, пиперазинильную группу, морфолинильную группу, тиоморфолинильную группу, гексагидропиримидинильную группу, тетрагидропиридазинильную группу, гомопиперазинильную группу, гомопиперидинильную группу, гомоморфолинильную группу и т.п.
Из них азетидинильная группа, пирролидинильная группа, пиразолидинильная группа, имидазолидинильная группа, пиперидинильная группа, пиперазинильная группа, гексагидропиридазинильная группа, гексагидропиримидинильная группа, морфолинильная группа, тиоморфолинильная группа и гомопиперазинильная группа являются предпочтительными, и более предпочтительными являются пиперидинильная группа, пиперазинильная группа, морфолинильная группа и тиоморфолинильная группа.
Такие 4-7-членные насыщенные гетероциклические группы могут быть замещены одной или двумя-тремя одинаковыми или разными группами, выбранными из группы, включающей низшую алкильную группу, гидрокси-низшую алкильную группу, гидроксигруппу, оксогруппу, аминогруппу и атом галогена. При условии, что замещение может иметь место, эти заместители могут быть замещены по одному и тому же атому или могут быть замещены по разным атомам. В качестве конкретного примера низшей алкильной группы и атома галогена, которые можно использовать для замещения указанной выше насыщенной гетероциклической группы, можно привести те же группы, которые описаны выше.
Когда 4-7-членная насыщенная гетероциклическая группа представляет собой тиоморфолинильную группу, предпочтительно, чтобы одна или две оксогруппы были замещены по атому серы.
Так, в случае когда R1 и R2, вместе с атомом азота, с которым они связаны, образуют 4-7-членную насыщенную гетероциклическую группу, которая может быть замещена, конкретные примеры такой группы включают азетидин-1-ильную группу, 3-метилазетидин-1-ильную группу, 2,2-диметилазетидин-1-ильную группу, 3,3-диметилазетидин-1-ильную группу, 3-гидроксиазетидин-1-ильную группу, 2-оксоазетидин-1-ильную группу, 3-оксоазетидин-1-ильную группу, 3-фторазетидин-1-ильную группу, 3,3-дифторазетидин-1-ильную группу; пирролидин-1-ильную группу, 2,2-диметилпирролидин-1-ильную группу, 3,3-диметилпирролидин-1-ильную группу, 2-гидроксипирролидин-1-ильную группу, 3-гидроксипирролидин-1-ильную группу, 3,4-дигидроксиметилпирролидин-1-ильную группу, 2-оксопирролидин-1-ильную группу, 3-оксопирролидин-1-ильную группу, 2,5-диоксопирролидин-1-ильную группу, 3-аминопирролидин-1-ильную группу; пиразолидин-1-ильную группу, 2-метилпиразолидин-1-ильную группу, 2-гидроксипиразолидин-1-ильную группу, 3-оксопиразолидин-1-ильную группу, 3,5-диоксопиразолидин-1-ильную группу; имидазолидин-1-ильную группу, 3-метилимидазолидин-1-ильную группу, 2-оксоимидазолидин-1-ильную группу, 4-оксоимидазолидин-1-ильную группу, 3-метил-2-оксоимидазолидин-1-ильную группу, 3-метил-4-оксоимидазолидин-1-ильную группу, 2,2-диметилимидазолин-1-ильную группу; пиперидин-1-ильную группу, 4-метилпиперидин-1-ильную группу, 2,2-диметилпиперидин-1-ильную группу, 3,3-диметилпиперидин-1-ильную группу, 4,4-диметилпиперидин-1-ильную группу, 4-гидроксиметилпиперидин-1-ильную группу, 4-гидроксипиперидин-1-ильную группу, 2-оксопиперидин-1-ильную группу, 3-оксопиперидин-1-ильную группу, 4-оксопиперидин-1-ильную группу, 4-аминопиперидин-1-ильную группу, 4-фторпиперидин-1-ильную группу, 4-хлорпиперидин-1-ильную группу, 3,3-дифторпиперидин-1-ильную группу, 4,4-дифторпиперидин-1-ильную группу, 3,3-дихлорпиперидин-1-ильную группу, 4,4-дихлорпиперидин-1-ильную группу; пиперазин-1-ильную группу, 4-метилпиперазин-1-ильную группу, 4-этилпиперазин-1-ильную группу, 4-изопропилпиперазин-1-ильную группу, 2-циклопропилпиперазин-1-ильную группу, 3-циклопропилпиперазин-1-ильную группу, 4-циклопропилпиперазин-1-ильную группу, 4-циклобутилпиперазин-1-ильную группу, 2,2-диметилпиперазин-1-ильную группу, 3,3-диметилпиперазин-1-ильную группу, 2,6-диметилпиперазин-1-ильную группу, 2-циклопропил-4-метилпиперазин-1-ильную группу, 3-циклопропил-4-метилпиперазин-1-ильную группу, 3,4,5-триметилпиперазин-1-ильную группу, 2,2,4-триметилпиперазин-1-ильную группу, 3,3,4-триметилпиперазин-1-ильную группу, 4-гидроксиметилпиперазин-1-ильную группу, 4-гидроксипиперазин-1-ильную группу, 2-оксопиперазин-1-ильную группу, 3-оксопиперазин-1-ильную группу, 2-оксо-4-метилпиперазин-1-ильную группу, 3-оксо-4-метилпиперазин-1-ильную группу, 2,3-диоксопиперазин-1-ильную группу, 3,5-диоксопиперазин-1-ильную группу, 2,6-диоксопиперазин-1-ильную группу, 2,3-диоксо-4-метилпиперазин-1-ильную группу, 3,5-диоксо-4-метилпиперазин-1-ильную группу, 3,3,4-триметил-5-оксопиперазин-1-ильную группу, 2,2,4-триметил-3-оксопиперазин-1-ильную группу; гексагидропиридазин-1-ильную группу, 2-метилгексагидропиридазин-1-ильную группу, 3,3-диметилгексагидропиридазин-1-ильную группу, 4,4-диметилгексагидропиридазин-1-ильную группу, 6-гидроксигексагидропиридазин-1-ильную группу, 3-оксогексагидропиридазин-1-ильную группу, 6-оксогексагидропиридазин-1-ильную группу; гексагидропиримидин-1-ильную группу, 2-метилгексагидропиримидин-1-ильную группу, 3-метилгексагидропиримидин-1-ильную группу, 2,2-диметилгексагидропиримидин-1-ильную группу, 4,4-диметилгексагидропиримидин-1-ильную группу, 5,5-диметилгексагидропиримидин-1-ильную группу, 6,6-диметилгексагидропиримидин-1-ильную группу, 2-оксогексагидропиримидин-1-ильную группу, 4-оксогексагидропиримидин-1-ильную группу, 5-оксогексагидропиримидин-1-ильную группу, 6-оксогексагидропиримидин-1-ильную группу; морфолин-4-ильную группу, 2,2-диметилморфолин-4-ильную группу, 3,3-диметилморфолин-4-ильную группу; тиоморфолин-4-ильную группу, 2,2-диметилтиоморфолин-4-ильную группу, 3,3-диметилтиоморфолин-4-ильную группу, 2-оксотиоморфолин-4-ильную группу, 1,1-диоксотиоморфолин-4-ильную группу; гомопиперазин-1-ильную группу, 2-метилгомопиперазин-1-ильную группу, 4-метилгомопиперазин-1-ильную группу, 4-циклопропилгомопиперазин-1-ильную группу, 2,2-диметилгомопиперазин-1-ильную группу, 3,3-диметилгомопиперазин-1-ильную группу, 5,5-диметилгомопиперазин-1-ильную группу, 6,6-диметилгомопиперазин-1-ильную группу, 7,7-диметилгомопиперазин-1-ильную группу, 3,4,5-триметилгомопиперазин-1-ильную группу, 2-оксогомопиперазин-1-ильную группу, 3-оксогомопиперазин-1-ильную группу, 5-оксогомопиперазин-1-ильную группу, 6-оксогомопиперазин-1-ильную группу, 7-оксогомопиперазин-1-ильную группу, 2-оксо-4-метилгомопиперазин-1-ильную группу, 3-оксо-4-метилгомопиперазин-1-ильную группу, 5-оксо-4-метилгомопиперазин-1-ильную группу, 6-оксо-4-метилгомопиперазин-1-ильную группу, 7-оксо-4-метилгомопиперазин-1-ильную группу, 2,3-диоксогомопиперазин-1-ильную группу, 2,3-диоксо-4-метилгомопиперазин-1-ильную группу и т.п. Из них 4-гидроксипиперидин-1-ильная группа, 3-оксопиперазин-1-ильная группа и морфолин-1-ильная группа являются предпочтительными.
Когда Y представляет собой -OR1', R1' представляет собой низшую алкильную группу, которая может быть замещена атомом водорода или гидроксигруппой. Низшая алкильная группа означает, как описано выше, линейную, разветвленную или циклическую алкильную группу, содержащую 1- 6 атомов углерода. Такие группы могут быть замещены одной или двумя гидроксигруппами. Положение замещения гидроксигруппы конкретно не ограничено, при условии что замещение может иметь место. Поэтому примеры R1' могут включать атом водорода, метильную группу, этильную группу, гидроксиметильную группу, гидроксиэтильную группу и т.п. Из них атом водорода, метильная группа и этильная группа являются предпочтительными.
Z представляет собой атом кислорода или атом серы.
R3 представляет собой атом водорода, низшую алкильную группу или атом галогена. Низшая алкильная группа означает, как описано выше, линейную, разветвленную или циклическую группу, содержащую 1-6 атомов углерода. Атом галогена также представляет собой те же группы, которые описаны выше. Из них атом водорода, метильная группа и атом хлора являются предпочтительными.
Сочетание соответствующих заместителей в общей формуле (1) конкретно не ограничено, но пример сочетания предпочтительных заместителей включает 2,5-дифторфенильную группу для Ar1; 4-фторфенильную группу для Ar2; -SO- для X; диметиламиногруппу для Y; атом кислорода для Z и метильную группу для R3.
Более того, другой пример сочетания предпочтительных заместителей включает 2,5-дифторфенильную группу или 2,3,6-трифторфенильную группу для Ar1; фенильную группу, 4-фторфенильную группу или 6-(трифторметил)пиридин-3-ильную группу для Ar2; -SO2- для X; (гидроксиметил)аминогруппу или аминогруппу для Y; атом кислорода для Z и метильную группу для R3.
В качестве такого примера сочетания предпочтительных заместителей можно указать, например, комбинацию из 2,5-дифторфенильной группы для Ar1, 4-фторфенильной группы для Ar2, -SO2- для X, (гидроксиметил)аминогруппы для Y, атома кислорода для Z и метильной группы для R3; или комбинацию из 2,3,6-трифторфенильной группы для Ar1, 4-фторфенильной группы для Ar2, -SO2- для X, (гидроксиметил)аминогруппы для Y, атома кислорода для Z и метильной группы для R3; комбинацию из 2,3,6-трифторфенильной группы для Ar1, фенильной группы для Ar2, -SO2- для X, (гидроксиметил)аминогруппы для Y, атома кислорода для Z и метильной группы для R3; комбинацию из 2,3,6-трифторфенильной группы для Ar1, 6-(трифторметил)пиридин-3-ильной группы для Ar2, -SO2- для X, (гидроксиметил)аминогруппы для Y, атома кислорода для Z и метильной группы для R3.
Соединение, представленное общей формулой (1) по настоящему изобретению, может существовать в форме стереоизомеров или оптических изомеров, полученных из асимметрических атомов углерода, и эти стереоизомеры, оптические изомеры и их смеси - все включены в настоящее изобретение.
Соль соединения, представленного общей формулой (1) по настоящему изобретению, конкретно не ограничена, при условии что она является фармацевтически приемлемой солью, и конкретные примеры такой соли включают соли минеральных кислот, такие как гидрохлориды, гидробромиды, гидроиодиды, фосфаты, нитраты и сульфаты; бензоаты; соли органических сульфоновых кислот, такие как метансульфонаты, 2-гидроксиэтансульфонаты и п-толуолсульфонаты; и соли органических карбоновых кислот, такие как ацетаты, пропаноаты, оксалаты, малонаты, сукцинаты, глутараты, адипаты, тартраты, малеинаты, малаты и манделаты.
Также, когда соединение, представленное общей формулой (1), содержит кислотную группу, соединение может представлять собой соль иона щелочного металла или иона щелочноземельного металла. Сольват таких соединений конкретно не ограничен, при условии что он является фармацевтически приемлемым, и, в частности, можно указать гидраты, этаноляты и т.п.
Далее будет описан способ получения соединения, представленного общей формулой (1) по настоящему изобретению.
Соединение, представленное общей формулой (1) по настоящему изобретению, его соль и сольват такого соединения или соли можно получить путем сочетаний известных способов получения, используемых в общей химии, и репрезентативные способы синтеза описаны ниже.
Далее будет описан репрезентативный способ получения пиридинового соединения общей формулы (1) по настоящему изобретению, где Z представляет собой атом кислорода (1: Z=O).
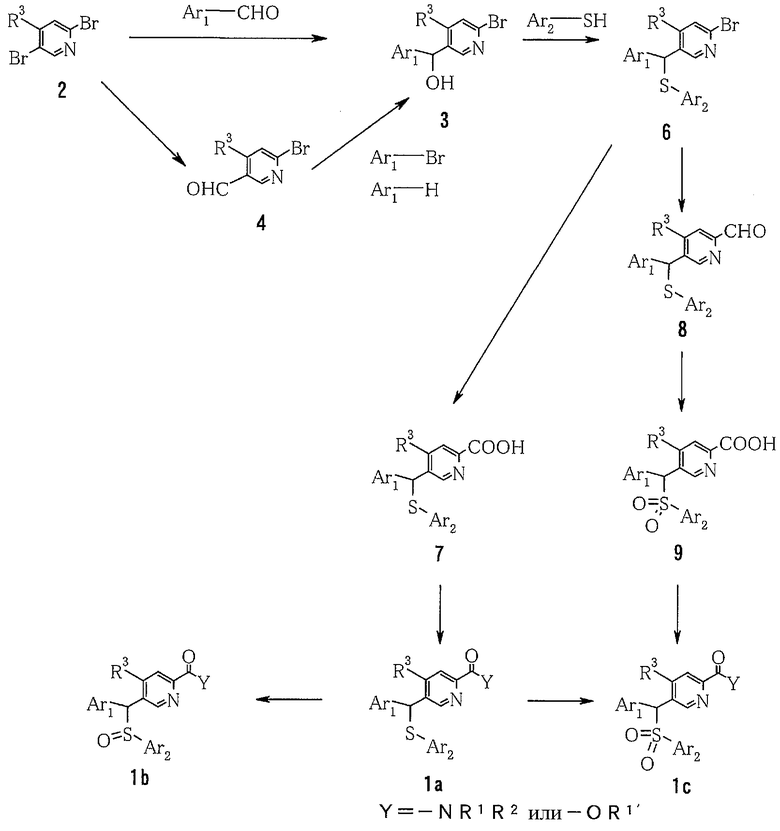
где Ar1, Ar2, R1, R2, R3, R1' и Y определены выше.
1) Способ получения спиртового производного (3)

где Ar1 и R3 определены выше.
В растворителе, таком как толуол или диэтиловый эфир, 2,5-дибромпиридиновое производное (2) можно подвергнуть взаимодействию с эквивалентом металлоорганического реагента (в качестве представителей можно указать литийорганический реагент или реагент Гриньяра), чтобы таким образом селективно литиировать 5-положение пиридина. Путем добавления альдегида, представленного Ar1-CHO, в качестве электрофильного реагента к полученному раствору можно получить спиртовое производное (3).
В другом способе, когда диметилформамид или этилформиат добавляют в качестве электрофильного реагента в описанной выше реакции, можно получить альдегидное производное (4). Спиртовое производное также можно синтезировать путем добавления Ar1-Li, который получают с Ar1-Br или Ar1-H, и одного-двух эквивалентов металлоорганического реагента (в качестве представителя можно указать литийорганический реагент) в растворителе, таком как тетрагидрофуран или диэтиловый эфир.
Кроме того, арилкарбальдегид (Ar1-CHO), арилбромид (Ar1-Br) или арил (Ar1-H), или 2,5-дибромпиридиновое производное (2), используемые в способе получения, описанном выше, могут быть известными соединениями, или их можно получить путем сочетания способов, которые хорошо известны специалистам в данной области со средней квалификацией.
2) Способ получения сульфидного производного (6)

где L представляет собой удаляемую группу; и Ar1, Ar2 и R3 определены выше.
Соединение (5) можно получить из спиртового производного (3). Сульфидное соединение (6) можно получить путем взаимодействия полученного соединения (5) с тиольным соединением (Ar2-SH) в присутствии основания. В этом случае тиольное соединение можно использовать в форме соли щелочного металла или соли щелочноземельного металла (например, лития, натрия, калия).
В реакции между соединением (5) и тиолом (Ar2-SH) температура обычно находится в пределах от -20 до 200°C и предпочтительно от комнатной температуры до 60°C. В зависимости от типа соединения (5) или тиольного соединения (Ar2-SH) может быть предпочтительной более высокая температура реакции, а также иногда может быть предпочтительным осуществление реакции в герметично закрытой пробирке. Время реакции обычно находится в пределах от 0,5 часа до 1 дня.
Примеры основания включают: неорганические основания, такие как гидриды щелочных металлов или щелочноземельных металлов (например, гидрид лития, гидрид натрия, гидрид калия, гидрид кальция); амиды щелочных металлов или щелочноземельных металлов (например, амид лития, амид натрия, диизопропиламид лития, дициклогексиламид лития, гексаметилдисилазид лития, гексаметилдисилазид натрия, гексаметилдисилазид калия); низшие алкоксиды щелочных металлов или щелочноземельных металлов (например, метоксид натрия, этоксид натрия, трет-бутоксид калия); гидроксиды щелочных металлов или щелочноземельных металлов (например, гидроксид натрия, гидроксид калия, гидроксид лития, гидроксид бария); карбонаты щелочных металлов или щелочноземельных металлов или серебра (например, карбонат натрия, карбонат калия, карбонат цезия, карбонат серебра); гидрокарбонаты щелочных металлов (например, гидрокарбонат натрия, гидрокарбонат калия); соединения алкиллития (например, н-бутиллития) или алкильный реагент Гриньяра (например, метилмагнийбромид); оксид серебра, и органические основания, такие как амины (например, триэтиламин, диизопропилэтиламин, N-метилморфолин); и основные гетероциклические соединения (например, диметиламинопиридин, пиридин, имидазол, 2,6-лутидин, коллидин, 1,8-диазабицикло[5,4,0]ундец-7-ен, 1,5-диазабицикло[4,3,0]нон-5-ен, 1,4-диазабицикло[2,2,2]октан).
Примеры растворителя включают спиртовые растворители, эфирные растворители, галогеновые растворители, ароматические растворители, нитрильные растворители, амидные растворители, кетоновые растворители, сульфоксидные растворители и воду, и смеси двух или более таких растворителей также можно использовать. Из них метиленхлорид, тетрагидрофуран, диэтиловый эфир и т.п. являются предпочтительными.
Соединение (5), содержащее удаляемую группу L, можно получить из спиртового производного (3) путем преобразования гидроксигруппы в удаляемую группу в соответствии с известным способом. Примеры удаляемой группы, представленной L, включают атом галогена (хлор, бром, иод и т.д.), C1-6 алкилсульфонилоксигруппу, которая может быть галогенированной (метансульфонилокси, этансульфонилокси, трифторметансульфонилокси и т.д.), C6-10 ароматический углеводород сульфонилокси, который может быть замещен, и т.п. Заместитель для группы ароматический углеводород сульфонилокси может включать один-три атома галогена, C1-6 алкильные группы, которые могут быть галогенированными, C6-10 алкоксигруппы и т.п. Предпочтительные примеры удаляемой группы включают бензолсульфонилоксигруппу, п-толуолсульфонилоксигруппу, 1-нафталинсульфонилоксигруппу, 2-нафталинсульфонилоксигруппу и т.п.
Кроме того, тиольное соединение (Ar2-SH), используемое в способе получения, описанном выше, может быть известным соединением, или его можно получить путем сочетания способов, которые хорошо известны специалистам в данной области со средней квалификацией.
3) Способ получения производного пиридин-2-карбоновой кислоты (7)

где Ar1, Ar2 и R3 определены выше.
Производное пиридин-2-карбоновой кислоты (7) можно получить путем добавления металлоорганического реагента к 2-бромпиридиновому производному (6) с последующим перемешиванием и затем добавлением диоксида углерода в качестве электрофильного реагента.
В качестве конкретного примера органического растворителя можно привести эфирный растворитель, такой как тетрагидрофуран или диэтиловый эфир, углеводородный растворитель, такой как толуол, или гексаметилфосфорамид (HMPA), или их сочетание. В качестве металлоорганического реагента в реакции используют от эквивалентного до избыточного количества, предпочтительно, эквивалентное количество алкиллития (например, н-бутиллития, втор-бутиллития, трет-бутиллития, фениллития и т.д.). Температура реакции обычно находится в пределах от -100 до 50°C и предпочтительно от -78 до 0°C. Время перемешивания обычно находится в пределах от 0,1 часа до 1 дня.
В этот реакционный раствор добавляют диоксид углерода в газообразной или твердой форме в качестве электрофильного реагента. Температура реакции обычно находится в пределах от -100 до 50°C и предпочтительно от -78 до 0°C. Время реакции обычно находится в пределах от 0,1 часа до 1 дня.
4) Способ получения производного пиридин-2-карбоновой кислоты (9)
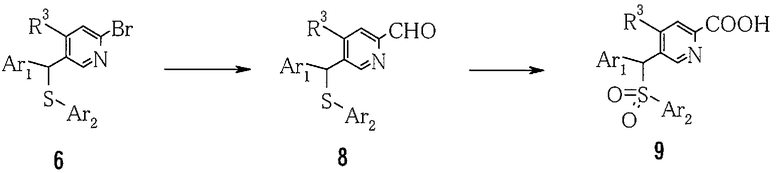
где Ar1, Ar2 и R3 определены выше.
Пиридин-2-карбальдегидное производное (8) можно получить путем добавления металлоорганического реагента к 2-бромпиридиновому производному (6) с последующим перемешиванием и затем добавлением диметилформамида или эфира муравьиной кислоты, такой как этилформиат, в качестве электрофильного реагента.
В качестве примера органического растворителя можно привести эфирный растворитель, такой как тетрагидрофуран или диэтиловый эфир, углеводородный растворитель, такой как толуол, или гексаметилфосфорамид (HMPA), или их сочетание. В качестве металлоорганического реагента в реакции используют от эквивалентного до избыточного количества, предпочтительно, эквивалентное количество алкиллития (например, н-бутиллития, втор-бутиллития, трет-бутиллития, фениллития и т.д.). Температура реакции обычно находится в пределах от -100 до 50°C и предпочтительно от -78 до 0°C. Время перемешивания обычно находится в пределах от 0,1 часа до 3 дней.
В этот реакционный раствор добавляют диметилформамид или эфир муравьиной кислоты, такой как этилформиат.
Температура реакции обычно находится в пределах от -100 до 50°C и предпочтительно от -78 до 0°C. Время реакции обычно находится в пределах от 0,1 часа до 3 дней. Полученное пиридин-2-карбальдегидное производное (8) может быть окислено путем использования окислителя в растворителе с получением производного пиридин-2-карбоновой кислоты (9).
Температура реакции обычно находится в пределах от -20 до 200°C и предпочтительно от 0 до 100°C, и время реакции составляет от 0,5 часа до 3 дней. В качестве примера растворителя можно привести органическую кислоту (например, муравьиную кислоту, уксусную кислоту), спиртовой растворитель, эфирный растворитель, галогеновый растворитель, ароматический растворитель, нитрильный растворитель, амидный растворитель, кетоновый растворитель, сульфоксидный растворитель или воду, и можно также использовать смесь двух или более таких растворителей. Из них муравьиная кислота, метиленхлорид, хлороформ, метанол, этанол и т.п. являются предпочтительными.
Примеры окислителя включают перекись водорода, органические перкислотные соединения (например, пермуравьиную кислоту, перуксусную кислоту, мета-хлорпербензойную кислоту), метапериодат (например, метапериодат натрия), ацилнитрат, диазот тетраоксид, галогены, N-галогеновые соединения (например, N-хлорсукцинимид, N-бромсукцинимид), гидропероксиды (например, трет-бутилгидропероксид), иодбензолдиацетат, иодбензолдихлорид, трет-бутилгипохлорит, сульфурилхлорид, кислород, озон, оксид селена, селеновую кислоту и т.п.
Что касается конкретных примеров реакционных условий, один-два эквивалентных количества перекиси водорода добавляют к пиридин-2-карбальдегидному производному (8) в растворителе, представляющем собой муравьиную кислоту, и смесь можно обрабатывать при комнатной температуре в течение времени примерно от 1 часа до 2 дней с получением, таким образом, производного пиридин-2-карбоновой кислоты (9).
5) Способ получения пиридин-2-карбоксамидных производных (1aN) и (1cN)
Что касается пиридиновых производных в настоящем изобретении, пиридин-2-карбоксамидное производное (1aN) или (1cN) можно получить путем объединения производного пиридин-2-карбоновой кислоты (7) или (9), первичного или вторичного амина (HNR1R2) или его соли и агента конденсации в растворителе следующим образом.

где Ar1, Ar2, R1, R2 и R3 определены выше.
Температура реакции обычно находится в пределах от -20 до 200°C и предпочтительно от 0 до 50°C. Время реакции обычно находится в пределах от 0,5 часа до 3 дней. В качестве примера растворителя можно привести эфирные растворители, галогенированные растворители, ароматические растворители, спиртовые растворители, нитрильные растворители, амидные растворители, кетоновые растворители, сульфоксидные растворители или воду, и можно также использовать смесь двух или более таких растворителей. Из них тетрагидрофуран, метиленхлорид, хлороформ и т.п. являются предпочтительными.
В качестве агента конденсации можно указать 1,3-дициклогексилкарбодиимид, 1-этил-3-(3'-диметиламинопропил)карбодиимид, гексафторфосфат (бензотриазол-1-илокси)трипирролидинoфосфония и т.п., и можно также добавлять третичный амин, такой как 1-гидроксибензотриазол и/или N-этилдиизопропиламин.
В другом способе пиридин-2-карбоксамидное производнное (1aN) или (1cN) также может быть получено путем преобразования производного пиридин-2-карбоновой кислоты (7) или (9) в хлорангидрид кислоты с добавлением затем первичного или вторичного амина в растворителе.
Что касается конкретного примера реакции, тионилхлорид добавляют в избыточном количестве к производному пиридин-2-карбоновой кислоты (7) или (9) при комнатной температуре. Предпочтительно, чтобы одновременно присутствовало очень небольшое количество диметилформамида, и, если используют растворитель, предпочтительно использовать метиленхлорид, хлороформ или т.п. Путем концентрирования этой смеси с последующим разбавлением растворителем и добавлением от эквивалентного до избыточного количества амина можно получить пиридин-2-карбоксамидное производное (1aN) или (1cN). Растворитель предпочтительно представляет собой тетрагидрофуран, метиленхлорид, хлороформ, диметилформамид или т.п., и в то же время в основании может присутствовать третичный амин, такой как триэтиламин, или ароматический амин, такой как пиридин.
Кроме того, амин (HNR1R2), используемый в способе получения, описанном выше, может быть известным соединением, или его можно получить путем сочетания способов, которые хорошо известны специалистам в данной области со средней квалификацией.
6) Способ получения пиридин-2-карбоксилатного производного (1aO) или (1cO)
Что касается пиридиновых производных в настоящем изобретении, пиридин-2-карбоксилатное производное (1aO) или (1cO) можно получить путем объединения производного пиридин-2-карбоновой кислоты (7) или (9), спирта и агента конденсации в растворителе.
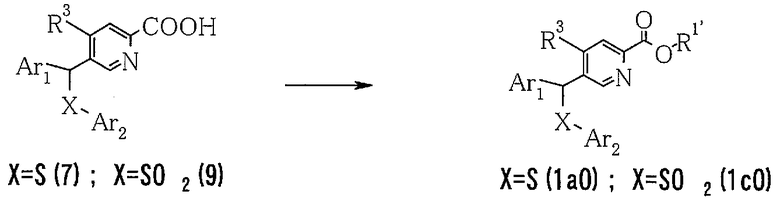
где Ar1, Ar2, R1' и R3 определены выше.
Температура реакции обычно находится в пределах от -20 до 200°C и предпочтительно от 0 до 50°C, и время реакции обычно находится в пределах от 0,5 часа до 3 дней. Примером растворителя является эфирный растворитель, галогеновый растворитель, ароматический растворитель, нитрильный растворитель, амидный растворитель, кетоновый растворитель или сульфоксидный растворитель, и можно также использовать смесь двух или более таких растворителей. Из них толуол, тетрагидрофуран, метиленхлорид и т.п. являются предпочтительными.
В качестве агента конденсации можно указать 1,3-дициклогексилкарбодиимид, 1-этил-3-(3'-диметиламинопропил)карбодиимид и т.п., и может одновременно присутствовать от 0,1 до 2 эквивалентных количеств амина, такого как 4-диметиламинопиридин.
В другом способе пиридин-2-карбоксилатное производное (1aO) или (1cO) также может быть получено путем преобразования производного пиридин-2-карбоновой кислоты (7) или (9) в хлорангидрид кислоты, а затем добавления спирта в растворителе, при одновременном присутствии основания.
Что касается конкретного примера реакции, тионилхлорид добавляют в избыточном количестве к производному пиридин-2-карбоновой кислоты (7) или (9) при комнатной температуре. Предпочтительно, когда одновременно присутствует очень небольшое количество диметилформамида, и, в случае использования растворителя, метиленхлорид, хлороформ или т.п. являются предпочтительными для использования. Путем концентрирования этой смеси с последующим разбавлением растворителем и добавлением от эквивалентного до избыточного количества спирта и основания можно получить пиридин-2-карбоксилатное производное (1aO) или (1cO). Растворитель, предпочтительно, представляет собой тетрагидрофуран, метиленхлорид, хлороформ, диметилформамид или т.п., и, в то же время, третичный амин или ароматический амин, такой как триэтиламин или пиридин, может присутствовать в качестве основания.
Кроме того, спирт (HOR1'), используемый в способе получения, описанном выше, может быть известным соединением или может быть получен путем сочетания способов, которые хорошо известны специалистам в данной области со средней квалификацией.
7) Способ получения пиридинового производного (1b) или (1c)
Что касается пиридиновых производных в настоящем изобретении, сульфинильное соединение (1b) или сульфонильное соединение (1c) можно получить путем окисления сульфидного соединения (1a) окислителем в растворителе следующим образом.
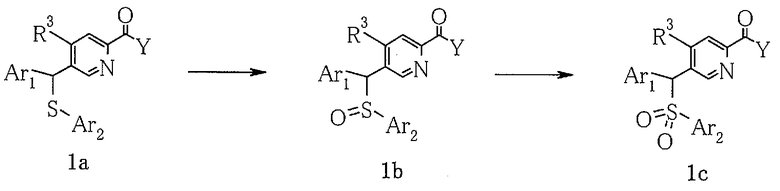
где Ar1, Ar2, R3 и Y определены выше.
Температура реакции обычно находится в пределах от -20 до 150°C и предпочтительно от 0 до 50°C, и время реакции обычно находится в пределах от 0,5 часа до 3 дней.
Растворитель может представлять собой спиртовой растворитель, эфирный растворитель, галогеновый растворитель, ароматический растворитель, карбоновокислотный растворитель, нитрильный растворитель, амидный растворитель, кетоновый растворитель, сульфоксидный растворитель или воду, можно также использовать смесь двух или более таких растворителей. Из них метиленхлорид, хлороформ, метанол, этанол, уксусная кислота и т.п. являются предпочтительными.
В качестве окислителя можно указать перекись водорода, органические перкислотные соединения (например, перуксусную кислоту, мета-хлорпербензойную кислоту), метапериодаты (например, метапериодат натрия), ацилнитраты, динитротетраоксид, галогены, N-галогеновые соединения (например, N-хлорсукцинимид, N-бромсукцинимид), гидропероксиды (например, трет-бутилгидропероксид), иодбензолдиацетат, иодбензолдихлорид, трет-бутилгипохлорит, сульфурилхлорид, кислород, озон, оксид селена, селеновую кислоту и т.п.
Что касается конкретного примера реакциии, сульфинильное соединение (1b) можно получить путем добавления сульфидного соединения (1a) и 1-2 эквивалентных количеств мета-хлорпербензойной кислоты или периодата натрия в растворителе, таком как метиленхлорид, тетрагидрофуран-вода или метанол, и обработки смеси при температуре от 0 до 100°C примерно в течение времени от 1 часа до 2 дней. Альтернативно, сульфонильное соединение (1c) можно получить путем взаимодействия сульфидного соединения (1a) с 2-5 эквивалентными количествами окислителя (например, мета-хлорпербензойной кислоты, периодата натрия, перекиси водорода, перекиси водорода-молибдата аммония и т.д.) в метиленхлориде, тетрагидрофуране-воде, муравьиной кислоте или метаноле, при температуре от 0 до 100°C, в течение времени примерно от 1 часа до 3 дней.
Кроме того, в случае получения оптически активного сульфоксида (1b), в качестве окислителя можно использовать тетраизопропоксид титана/оптически чистый диэтилтартрат/трет-бутилгидропероксид, тетраизопропоксид титана/оптически чистый диэтилтартрат/перуксусную кислоту или т.п.
Что касается соединения (1) по настоящему изобретению, в случае когда Z представляет собой атом серы, пиридиновое производное по настоящему изобретению можно получить следующим способом.
8) Способ получения пиридил-2-тиоамидного производного (1: Y=NR1R2, Z=S) или пиридил-2-тиокарбоксилатного производного (1: Y=OR1', Z=S)

где Ar1, Ar2, R3, X и Y определены выше.
Пиридил-2-карбоксамидное производное (1: Y=NR1R2, Z=O) или пиридил-2-карбоксилатное производное (1: Y=OR1', Z=O) может быть преобразовано в пиридил-2-тиоамидное производное (1: Y=NR1R2, Z=S) или пиридил-2-тиокарбоксилатное производное (1: Y=OR1', Z=S) известными способами. Например, 1 - 5 эквивалентных количеств реагента Лоуссона (2,4-бис(4-метоксифенил)-1,3-дитиа-2,4-дифосфетан-2,4-дисульфид) можно добавить к пиридил-2-карбоксамидному производному (1: Y=NR1R2, Z=O) или пиридил-2-карбоксилатному производному (1: Y=OR1', Z=O) в растворителе. В качестве растворителя предпочтительными являются толуол, ксилол, тетрагидрофуран, диоксан, метиленхлорид и т.п. Температура реакции составляет от 0°C до 200°C и предпочтительно от комнатной температуры до 130°C, и время реакции обычно находится в пределах от 0,5 часа до 3 дней.
Что касается способов получения пиридиновых производных (1) соединения по настоящему изобретению, проиллюстрированных выше, иногда необходима защита такого заместителя, как атом азота, гидроксигруппа или карбоксильная группа, и в этом случае можно использовать широко известные защитные группы, которые можно удалить подходящим способом. Такие защитные группы можно удалить, когда это необходимо, общим способом, известным в области химии органического синтеза.
Кроме того, что касается Y (-NR1R2) пиридинового производного (1) соединения по настоящему изобретению, в случае когда группа R1 и/или R2 представляет собой атом водорода, возможны дальнейшие структурные модификации. Например, в случае карбоксамида (R1, R2=H) он может быть преобразован в N-(гидроксиметил)карбоксамид (R1=H, R2=CH2OH) путем взаимодействия с водным раствором формальдегида и водным гидроксидом натрия в диметиловым эфире этиленгликоля.
Также, в случае когда имеется одна или несколько функциональных групп из групп для R1 и/или R2, также возможны дальнейшие структурные модификации. Например, соединение, содержащее гидроксигруппу из групп для R1 и/или R2, может быть преобразовано в такую группу, как сложный эфир, карбамат или галоген, с использованием известных способов. Кроме того, такие группы могут быть преобразованы в такие группы, как алкокси, амин, амид или сульфид. Такое преобразование также возможно для различных функциональных групп, отличных от гидроксигруппы, и такое преобразование можно осуществить с использованием известных способов. Реагенты, растворители и условия реакций, используемые в таких способах преобразования, могут быть такими, которые хорошо известны специалистам в данной области со средней квалификацией.
Соединение, представленное общей формулой (1) по настоящему изобретению, сильно ингибирует продукцию/секрецию β-амилоидного белка in vitro. Кроме того, соединение, представленное общей формулой (1) по настоящему изобретению, также сильно ингибирует продукцию/секрецию β-амилоидного белка in vivo при пероральном введении. На основании этих результатов считают, что соединение, представленное общей формулой (1) по настоящему изобретению, является чрезвычайно полезным в качестве профилактического и терапевтического лекарственногго средства при заболеваниях, вызванных аномальной продукцией/секрецией β-амилоидного белка, например болезни Альцгеймера, синдрома Дауна и других заболеваний, связанных с амилоидными отложениями.
В частности, было признано, что соединение, представленное следующей формулой (1-1), где для общей формулы (1) Ar1 представляет собой 2,5-дифторфенильную группу, Ar2 представляет собой 4-фторфенильную группу, X представляет собой -SO-, Y представляет собой диметиламиногруппу, Z представляет собой атом кислорода и R3 представляет собой метильную группу:

а именно 5-[(2,5-дифторфенил)[(4-фторфенил)сульфинил]метил]-N,N,4-триметилпиридин-2-карбоксамид, имеет достаточное отличие между дозой для проявления эффекта при пероральном введении и дозой для индукции иммуносупрессивного действия при повторяющемся введении, и его считают соединением, обладающим отличными качествами фармацевтического продукта.
Также эффект, подобный эффекту соединения (1-1), наблюдали при пероральном введении следующих соединений (1-2), (1-3), (1-4), (1-5), которые, как считают, обладают отличными качествами как фармацевтические продукты:
соединение, представленное следующей формулой (1-2), где для общей формулы (1) Ar1 представляет собой 2,5-дифторфенильную группу, Ar2 представляет собой 4-фторфенильную группу, X представляет собой -SO2-, Y представляет собой (гидроксиметил)аминогруппу, Z представляет собой атом кислорода и R3 представляет собой метильную группу:
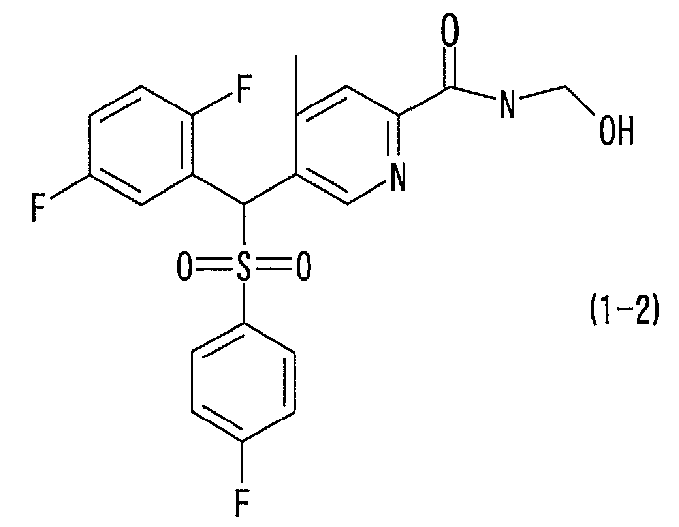
а именно 5-[(2,5-дифторфенил)[(4-фторфенил)сульфонил]метил]-N-(1-гидроксиметил)-4-метилпиридин-2-карбоксамид;
соединение, представленное следующей формулой (1-3), где для общей формулы (1) Ar1 представляет собой 2,3,6-трифторфенильную группу, Ar2 представляет собой 4-фторфенильную группу, X представляет собой -SO2-, Y представляет собой (гидроксиметил)аминогруппу, Z представляет собой атом кислорода и R3 представляет собой метильную группу:
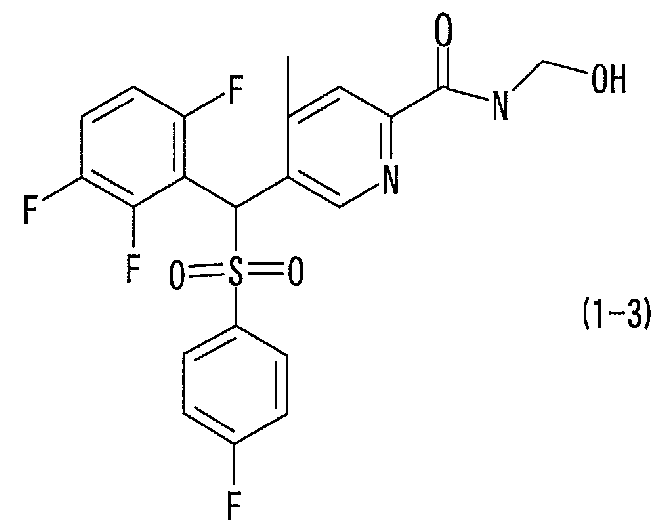
а именно 5-[[(4-фторфенил)сульфонил](2,3,6-трифторфенил)метил]-N-(1-гидроксиметил)-4-метилпиридин-2-карбоксамид;
соединение, представленное следующей формулой (1-4), где для общей формулы (1) Ar1 представляет собой 2,3,6-трифторфенильную группу, Ar2 представляет собой фенильную группу, X представляет собой -SO2-, Y представляет собой (гидроксиметил)аминогруппу, Z представляет собой атом кислорода и R3 представляет собой метильную группу:
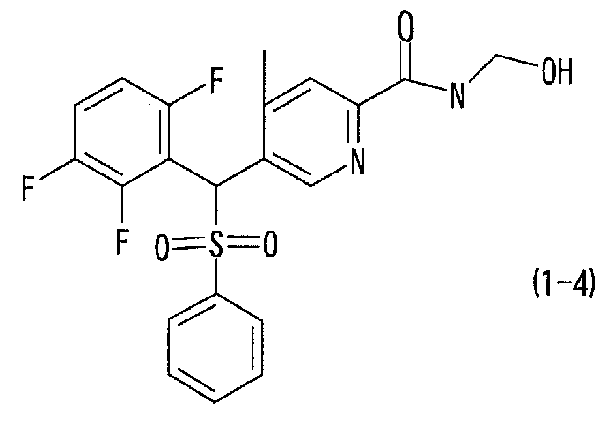
а именно N-(1-гидроксиметил)-4-метил-5-[(фенилсульфонил)(2,3,6-трифторфенил)метил]пиридин-2-карбоксамид; и
соединение, представленное следующей формулой (1-5), где для общей формулы (1) Ar1 представляет собой 2,3,6-трифторфенильную группу, Ar2 представляет собой 6-(трифторметил)пиридин-3-ильную группу, X представляет собой -SO2-, Y представляет собой (гидроксиметил)аминогруппу, Z представляет собой атом кислорода и R3 представляет собой метильную группу:

а именно N-(гидроксиметил)-4-метил-5-[[[6-(трифторметил)пиридин-3-ил]сульфонил](2,3,6-трифторфенил)метил]пиридин-2-карбоксамид.
В случае использования соединения по настоящему изобретению в качестве лекарственного средства для человека доза для взрослого находится в пределах от 1 мг до 1 г, предпочтительно от 10 мг до 300 мг, в день. Кроме того, доза при использовании для животного может варьировать в зависимости от цели введения (лечение или профилактика), типа и размера животного, подлежащего лечению, типа патогена, которым животное инфицировано, или тяжести состояния, но при этом суточная доза, как правило, находится в пределах от 0,1 мг до 200 мг, предпочтительно от 0,5 мг до 100 мг, на кг массы тела животного. Такую суточную дозу вводят раз в день или делят на 2 - 4 введения. Также суточная доза может превышать указанные выше количества, если это необходимо.
Фармацевтическую композицию, содержащую соединение по настоящему изобретению, можно получить путем выбора подходящего состава в соответствии со способом введения, используя способ получения композиций различных составов, которые традиционно используют. В качестве лекарственной формы для фармацевтической композиции, содержащей соединение по настоящему изобретению в качестве основного вещества, например, можно указать в качестве пероральных препаратов таблетки, порошки, гранулы, капсулы, жидкости, сиропы, эликсиры, масляные или водные суспензии и т.п.
В случае препаратов для инъекций в композиции, необязательно, можно использовать стабилизаторы, консерванты или средства, способствующие растворению, и раствор, который может содержать такие адъюванты, можно вводить в контейнер, а затем подвергнуть лиофилизационной сушке или т.п. с получением твердой композиции, которую будут использовать как "готовую к применению" композицию. Один контейнер может содержать одну дозу, или один контейнер может содержать несколько доз.
Можно указать в качестве композиций для наружного применения жидкости, суспензии, эмульсии, мази, гели, кремы, лосьоны, спреи, пластыри и т.п.
Твердые композиции могут быть получены путем объединения соединения по настоящему изобретению и необязательных выбранных фармацевтически приемлемых добавок, таких как наполнители, агенты сыпучести, связующие, разрыхлители, вещества, способствующие растворению, смачивающие вещества, смазывающие вещества и т.п.
В качестве жидких композиций можно указать растворы, суспензии, эмульсии и т.п., и они содержат в качестве добавок суспендирующие вещества, эмульгаторы и т.п.
ПРИМЕРЫ
Далее настоящее изобретение будет конкретно описано при помощи Примеров, но объем изобретения не ограничивается представленными ниже примерами. Более того, если в представленных ниже Примерах ничего не говорится о E-изомере или Z-изомере, полученное соединение является либо E-изомером, либо Z-изомером.
Ссылочный пример 1: (6-Бром-4-метилпиридин-3-ил)(2,5-дифторфенил)метанол
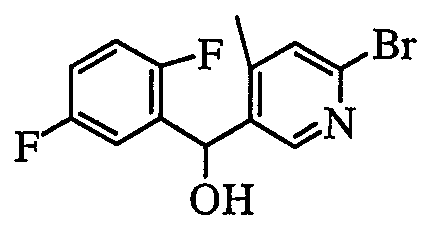
В атмосфере аргона раствор н-бутиллития в гексане (1,60 M, 8,22 мл, 13,2 ммоль) добавляли к раствору 2,5-дибром-4-метилпиридина (3,00 г, 12,0 ммоль) в диэтиловом эфире (120 мл) при -78°C. После перемешивания реакционной смеси в течение 30 минут добавляли 2,5-дифторбензальдегид (1,34 мл, 12,0 ммоль). После перемешивания в течение 1 часа при указанной температуре добавляли насыщенный водный раствор хлорида аммония при комнатной температуре. После отделения органического слоя органический слой сушили над безводным сульфатом натрия и фильтровали, а затем фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=4:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (1,26 г, 4,01 ммоль, 34%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,27 (3H, с), 2,53 (1H, д, J=4,2 Гц), 6,22 (1H, д, J=4,2 Гц), 6,95-7,06 (2H, м), 7,08-7,14 (1H, м), 7,29 (1H, с), 8,36 (1H, с).
МС m/z: 314, 316 (М++H).
Пример 1: 2-Бром-5-[[(4-хлорфенил)тио](2,5-дифторфенил)метил]-4-метилпиридин

В атмосфере азота тионилхлорид (2,90 мл, 39,8 ммоль) и N,N-диметилформамид (0,20 мл) добавляли к раствору (6-бром-4-метилпиридин-3-ил)(2,5-дифторфенил)метанола (1,25 г, 3,98 ммоль) в метиленхлориде (20 мл) при 0°C и полученную смесь перемешивали в течение 30 минут при комнатной температуре. Реакционную смесь концентрировали при пониженном давлении и к остатку добавляли метиленхлорид. Смесь промывали насыщенным водным раствором гидрокарбоната натрия, а затем насыщенным солевым раствором и органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении.
К раствору полученного остатка в N,N-диметилформамиде (45 мл) добавляли раствор 4-хлорбензолтиола (575 мг, 3,98 ммоль) в N,N-диметилформамиде (5 мл) и затем карбонат калия (550 мг, 3,98 ммоль) в атмосфере азота при 0°C и полученную смесь перемешивали в течение 30 минут при комнатной температуре. К реакционной смеси добавляли этилацетат и воду при 0°C, органический слой отделяли и затем органический слой промывали насыщенным солевым раствором. Органический слой сушили над безводным сульфатом натрия и фильтровали, фильтрат концентрировали при пониженном давлении и полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=20:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (1,48 г, 3,36 ммоль, 84%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,31 (3H, с), 5,77 (1H, с), 6,92-7,03 (2H, м), 7,19-7,25 (4H, м), 7,28-7,34 (1H, м), 7,29 (1H, с), 8,39 (1H, с).
МС m/z: 440, 442 (М++H).
Пример 2: 5-[[(4-Хлорфенил)тио](2,5-дифторфенил)метил]-4-метилпиридин-2-карбальдегид

В атмосфере аргона раствор н-бутиллития в гексане (1,60 M, 2,52 мл, 4,03 ммоль) добавляли к раствору 2-бром-5-[[(4-хлорфенил)тио](2,5-дифторфенил)метил]-4-метилпиридина (1,48 г, 3,36 ммоль) в толуоле (40 мл) при -78°C. Реакционную смесь перемешивали в течение 1 часа и затем добавляли N,N-диметилформамид (0,312 мл, 4,03 ммоль) при указанной температуре. После перемешивания реакционной смеси в течение 30 минут добавляли воду при указанной температуре и смеси давали нагреться до комнатной температуры. К реакционной смеси добавляли этилацетат и полученную смесь промывали насыщенным водным раствором хлорида аммония, а затем насыщенным солевым раствором. Органический слой сушили над безводным сульфатом натрия и фильтровали, фильтрат концентрировали при пониженном давлении и полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=10:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (419 мг, 1,07 ммоль, 32%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,43 (3H, с), 5,88 (1H, с), 6,94-7,05 (2H, м), 7,20-7,27 (4H, м), 7,36-7,42 (1H, м), 7,75 (1H, с), 8,79 (1H, с), 10,02 (1H, с).
МС m/z: 390 (М++H).
Пример 3: 5-[[(4-Хлорфенил)сульфонил](2,5-дифторфенил)метил]-4-метилпиридин-2-карбоновая кислота

31% водную перекись водорода (2 мл) добавляли к раствору 5-[[(4-хлорфенил)тио](2,5-дифторфенил)метил]-4-метилпиридин-2-карбальдегида (415 мг, 1,06 ммоль) в муравьиной кислоте (20 мл) и полученную смесь перемешивали в течение 2 часов при комнатной температуре. К реакционной смеси добавляли воду и осажденное таким образом твердое вещество собирали фильтрованием и промывали водой. Полученное твердое вещество растворяли в метиленхлориде и промывали 1н. раствором хлористоводородной кислоты. Органический слой сушили над безводным сульфатом натрия и фильтровали и фильтрат концентрировали при пониженном давлении. Полученный остаток промывали диэтиловым эфиром и собирали фильтрованием с получением указанного в заголовке соединения (347 мг, 0,79 ммоль, 74%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,31 (3H, с), 5,98 (1H, с), 6,93-7,01 (1H, м), 7,03-7,10 (1H, м), 7,44-7,48 (2H, м), 7,61-7,65 (2H, м), 7,72-7,78 (1H, м), 8,03 (1H, с), 9,22 (1H, с).
IR (ATR) cм-1: 1739, 1712, 1495, 1417, 1311, 1155, 1092, 727.
Т.пл.: 208-209°C.
Аналитически вычислено для C20H14ClF2NO4S: C, 54,86; H, 3,22; Cl, 8,10; F, 8,68; N, 3,20; S, 7,32. Найдено: C, 54,55; H, 3,15; Cl, 8,02; F, 8,60; N, 3,25; S, 7,44.
МС m/z: 438 (М++H).
Пример 4: 5-[[(4-Хлорфенил)сульфонил](2,5-дифторфенил)метил]-N,4-диметилпиридин-2-карбоксамид

К раствору 5-[[(4-хлорфенил)сульфонил](2,5-дифторфенил)метил]-4-метилпиридин-2-карбоновой кислоты (88 мг, 0,20 ммоль) в метиленхлориде (2 мл) добавляли при комнатной температуре гидрохлорид метиламина (15 мг, 0,22 ммоль), 1-гидроксибензотриазол (30 мг, 0,22 ммоль), 4-метилморфолин (0,048 мл, 0,44 ммоль) и гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (42 мг, 0,22 ммоль). После перемешивания в течение 5 часов при комнатной температуре реакционную смесь промывали насыщенным водным раствором гидрокарбоната натрия. Органический слой сушили над безводным сульфатом натрия и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=3:1, концентрировали при пониженном давлении и полученный остаток промывали смешанным растворителем, состоящим из диэтилового эфира и гексана, и затем собирали фильтрованием с получением указанного в заголовке соединения (73 мг, 0,16 ммоль, 81%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,21 (3H, с), 3,04 (3H, д, J=5,1 Гц), 5,96 (1H, с), 6,92-7,08 (2H, м), 7,43 (2H, д, J=8,6 Гц), 7,61 (2H, д, J=8,6 Гц), 7,74-7,81 (1H, м), 7,97 (1H, с), 8,00 (1H, ушир.д, J=5,1 Гц), 9,13 (1H, с).
ИК (ATR) cм-1: 1674, 1533, 1495, 1329, 1151.
Т.пл.: 200-201°C.
Аналитически вычислено для C21H17ClF2N2O3S: C, 55,94; H, 3,80; Cl, 7,86; F, 8,43; N, 6,21; S, 7,11. Найдено: C, 55,70; H, 3,72; Cl, 7,91; F, 8,51; N, 6,17; S, 7,26.
МС m/z: 451 (М++H).
Пример 5: 5-[[(4-Хлорфенил)сульфонил](2,5-дифторфенил)метил]-N,N,4-триметилпиридин-2-карбоксамид

К раствору 5-[[(4-хлорфенил)сульфонил](2,5-дифторфенил)метил]-4-метилпиридин-2-карбоновой кислоты (88 мг, 0,20 ммоль), полученнной в Примере 3, в метиленхлориде (2 мл), добавляли при комнатной температуре диметиламингидрохлорид (18 мг, 0,22 ммоль), 1-гидроксибензотриазол (30 мг, 0,22 ммоль), 4-метилморфолин (0,048 мл, 0,44 ммоль) и гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (42 мг, 0,22 ммоль). После перемешивания в течение 6 часов при комнатной температуре реакционную смесь промывали насыщенным водным раствором гидрокарбоната натрия. Органический слой сушили над безводным сульфатом натрия и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=1:1, концентрировали при пониженном давлении и полученный остаток промывали смешанным растворителем, состоящим из диэтилового эфира и гексана, и собирали фильтрованием с получением указанного в заголовке соединения (83 мг, 0,18 ммоль, 89%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,24 (3H, с), 3,14 (6H, с), 5,96 (1H, с), 6,91-6,98 (1H, м), 7,00-7,07 (1H, м), 7,44 (2H, д, J=8,6 Гц), 7,47 (1H, с), 7,65 (2H, д, J=8,6 Гц), 7,72-7,78 (1H, м), 9,16 (1H, с).
ИК (ATR) см-1: 1633, 1493, 1327, 1151, 1084.
Т.пл.: 207-208°C.
Аналитически вычислено для C22H19ClF2N2O3S: C, 56,84; H, 4,12; Cl, 7,63; F, 8,17; N, 6,03; S, 6,90. Найдено: C, 56,53; H, 4,08; Cl, 7,53; F, 8,25; N, 5,93; S, 7,00.
МС m/z: 465 (М++H).
Пример 6: 5-[[(4-Хлорфенил)тио](2,5-дифторфенил)метил]-4-метилпиридин-2-карбоновая кислота
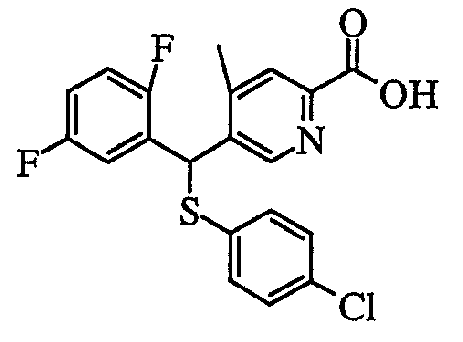
К раствору 2-бром-5-[[(4-хлорфенил)тио](2,5-дифторфенил)метил]-4-метилпиридина (5,04 г, 11,4 ммоль), полученного в Примере 1, в толуоле (100 мл), добавляли раствор н-бутиллития в гексане (1,54 M, 8,91 мл, 13,7 ммоль) в атмосфере аргона при -78°C. Реакционную смесь перемешивали в течение 30 минут при -40°C и затем снова охлаждали до -78°C и барботировали в смесь диоксид углерода. Реакционную смесь перемешивали в течение 30 минут и затем давали нагреться до комнатной температуры и к смеси добавляли насыщенный водный раствор хлорида аммония. Реакционную смесь концентрировали при пониженном давлении, затем добавляли к остатку хлороформ и смесь промывали 1н. раствором хлористоводородной кислоты. Органический слой сушили над безводным сульфатом натрия и фильтровали, фильтрат концентрировали при пониженном давлении и полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании метиленхлорид:метанол=10:1, концентрировали при пониженном давлении и полученный остаток промывали смешанным растворителем, состоящим из этанола и диэтилового эфира, и собирали фильтрованием с получением указанного в заголовке соединения (2,06 г, 5,08 ммоль, 44%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,46 (3H, с), 5,88 (1H, с), 6,95-7,05 (2H, м), 7,24 (4H, с), 7,36-7,42 (1H, м), 8,02 (1H, с), 8,61 (1H, с).
МС m/z: 406 (М++H).
Пример 7: 5-[[(4-Хлорфенил)тио](2,5-дифторфенил)метил]-4-метилпиридин-2-карбоксамид
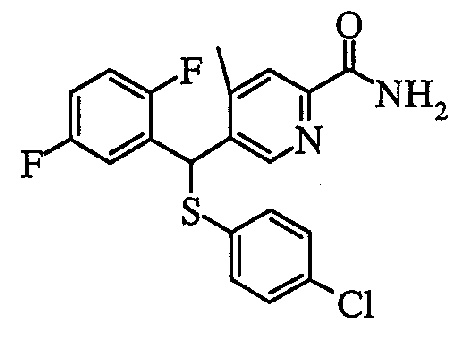
К раствору 5-[[(4-хлорфенил)тио](2,5-дифторфенил)метил]-4-метилпиридин-2-карбоновой кислоты (406 мг, 1,00 ммоль) в N,N-диметилформамиде (10 мл) добавляли (бензотриазол-1-илокси)трипирролидинoфосфония гексафторфосфат (781 мг, 1,50 ммоль), 1-гидроксибензотриазол (203 мг, 1,50 ммоль), хлорид аммония (107 мг, 2,00 ммоль) и N-этилдиизопропиламин (0,697 мл, 4,00 ммоль) в атмосфере аргона при комнатной температуре. После перемешивания в течение 12 часов при комнатной температуре к реакционной смеси добавляли этилацетат и смесь промывали 0,5н. раствором хлористоводородной кислоты. Органический слой сушили над безводным сульфатом натрия и фильтровали, фильтрат концентрировали при пониженном давлении и полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=2:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (398 мг, 0,98 ммоль, 98%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,42 (3H, с), 5,55 (1H, ушир.с), 5,88 (1H, с), 6,93-7,04 (2H, м), 7,22 (4H, с), 7,35-7,41 (1H, м), 7,77 (1H, ушир.с), 8,00 (1H, с), 8,58 (1H, с).
МС m/z: 405 (М++H).
Пример 8: 5-[[(4-Хлорфенил)сульфинил](2,5-дифторфенил)метил]-4-метилпиридин-2-карбоксамид

3-Хлорпербензойную кислоту (259 мг, 0,98 ммоль) добавляли к раствору 5-[[(4-хлорфенил)тио](2,5-дифторфенил)метил]-4-метилпиридин-2-карбоксамида (395 мг, 0,98 ммоль) в метиленхлориде (10 мл) при 0°C. После перемешивания в течение 14 дней при комнатной температуре реакционную смесь промывали 1н. водным раствором гидроксида натрия. Органический слой сушили над безводным сульфатом натрия и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=1:1, концентрировали при пониженном давлении и полученный остаток промывали смешанным растворителем, состоящим из этанола и диэтилового эфира, и собирали фильтрованием с получением, таким образом, указанного в заголовке соединения (243 мг, 0,58 ммоль, 59%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 1,95 (2,1H, с), 2,15 (0,9H, с), 5,35 (0,3H, с), 5,37 (0,7H, с), 5,51-5,62 (1H, м), 6,88-7,08 (2H, м), 7,23-7,55 (5H, м), 7,80-7,90 (1H, м), 7,94 (0,7H, с), 7,99 (0,3H, с), 8,87 (0,7H, м), 9,05 (0,3H, с).
ИК (ATR) см-1: 3126, 1695, 1595, 1493, 1421, 1053, 823.
Аналитически вычислено для C20H15ClF2N2O2С: C, 57,08; H, 3,59; Cl, 8,42; F, 9,03; N, 6,66; S, 7,62. Найдено: C, 56,75; H, 3,59; Cl, 8,35; F, 9,06; N, 6,65; S, 7,71.
МС m/z: 421 (М++H).
Пример 9: 5-[[(4-Хлорфенил)сульфонил](2,5-дифторфенил)метил]-4-метилпиридин-2-карбоксамид

3-Хлорпербензойную кислоту (66 мг, 0,25 ммоль) добавляли к раствору 5-[[(4-хлорфенил)сульфинил](2,5-дифторфенил)метил]-4-метилпиридин-2-карбоксамида (105 мг, 0,25 ммоль) в метиленхлориде (5 мл) при 0°C. После перемешивания в течение 5 дней при комнатной температуре реакционную смесь промывали 1н. водным раствором гидроксида натрия. Органический слой сушили над безводным сульфатом натрия и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали препаративной тонкослойной хроматографии (проявляли смесью метиленхлорид:метанол=40:1 и элюировали смесью метиленхлорид:метанол=4:1). Полученную фракцию концентрировали при пониженном давлении и полученный остаток промывали смешанным растворителем, состоящим из этанола и диэтилового эфира, и собирали фильтрованием с получением, таким образом, указанного в заголовке соединения (56 мг, 0,13 ммоль, 51%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,23 (3H, с), 5,57 (1H, ушир.с), 5,97 (1H, с), 6,92-7,00 (1H, м), 7,01-7,09 (1H, м), 7,44 (2H, д, J=8,5 Гц), 7,62 (2H, д, J=8,5 Гц), 7,75-7,81 (1H, м), 7,82 (1H, ушир.с), 7,99 (1H, с), 9,16 (1H, с).
ИК (ATR) см-1: 3442, 3288, 1701, 1493, 1315, 1153, 1088.
Т.пл.: 241-242°C.
МС m/z: 437 (М++H).
Ссылочный пример 2: 2-Бром-5-[хлор(2,5-дифторфенил)метил]-4-метилпиридин
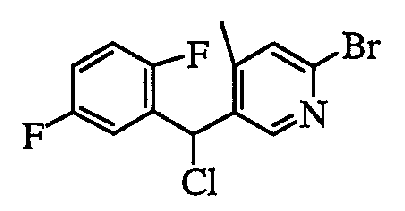
К раствору (6-бром-4-метилпиридин-3-ил)(2,5-дифторфенил)метанола (9,42 г, 30,0 ммоль), полученного в Ссылочном примере 1, в метиленхлориде (150 мл), добавляли тионилхлорид (21,9 мл, 300 ммоль) и N,N-диметилформамид (0,232 мл) при 0°C и смесь перемешивали в течение 2 часов при комнатной температуре. Реакционную смесь концентрировали при пониженном давлении, к остатку добавляли этилацетат и смесь промывали насыщенным водным раствором гидрокарбоната натрия. Органический слой сушили над безводным сульфатом натрия и фильтровали и фильтрат концентрировали при пониженном давлении с получением указанного в заголовке соединения (9,82 г, 29,5 ммоль, 98%) в виде коричневого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,36 (3H, с), 6,42 (1H, с), 7,01-7,07 (2H, м), 7,26-7,32 (1H, м), 7,33 (1H, с), 8,31 (1H, с).
МС m/z: 332, 334 (М++H).
Пример 10: 2-Бром-5-[(2,5-дифторфенил)[(4-фторфенил)тио]метил]-4-метилпиридин
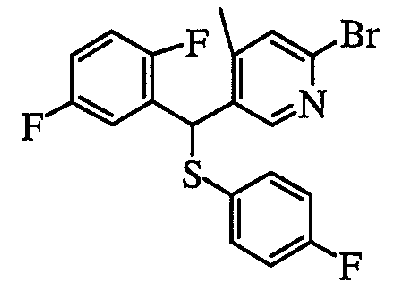
К раствору 2-бром-5-[хлор(2,5-дифторфенил)метил]-4-метилпиридина (6,44 г, 19,4 ммоль) в N,N-диметилформамиде (100 мл) добавляли 4-фторбензолтиол (2,06 мл, 19,4 ммоль) и затем карбонат калия (2,94 г, 21,3 ммоль) в атмосфере аргона при 0°C и смесь перемешивали в течение 1 часа при комнатной температуре. К реакционной смеси добавляли этилацетат и воду, органический слой отделяли и затем органический слой промывали насыщенным водным раствором гидрокарбоната натрия. Органический слой сушили над безводным сульфатом натрия и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=30:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (8,20 г, 19,3 ммоль, 100%) в виде светло-коричневого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,28 (3H, с), 5,72 (1H, с), 6,91-6,98 (4H, м), 7,27-7,34 (3H, м), 7,28 (1H, с), 8,43 (1H, с).
МС m/z: 424, 426 (М++H).
Пример 11: 5-[(2,5-дифторфенил)[(4-фторфенил)тио]метил]-4-метилпиридин-2-карбальдегид
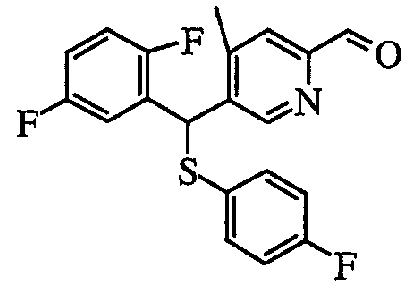
В атмосфере аргона раствор н-бутиллития в гексане (1,54 M, 22,3 мл, 34,4 ммоль) добавляли к раствору 2-бром-5-[(2,5-дифторфенил)[(4-фторфенил)тио]метил]-4-метилпиридина (8,10 г, 19,1 ммоль) в толуоле (200 мл) при -78°C. Реакционную смесь перемешивали в течение 30 минут и затем добавляли N,N-диметилформамид (1,63 мл, 21,0 ммоль) при указанной температуре. Реакционную смесь перемешивали в течение 30 минут, затем добавляли воду при указанной температуре и смеси давали нагреться до комнатной температуры. К реакционной смеси добавляли этилацетат и полученную смесь промывали насыщенным водным раствором хлорида аммония и затем насыщенным солевым раствором. Органический слой сушили над безводным сульфатом натрия и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=10:1, концентрировали при пониженном давлении и полученный остаток промывали смешанным растворителем, состоящим из диэтилового эфира и гексана, и затем собирали фильтрованием с получением, таким образом, указанного в заголовке соединения (4,27 г, 11,4 ммоль, 60%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,39 (3H, с), 5,83 (1H, с), 6,92-7,00 (4H, м), 7,30-7,36 (2H, м), 7,37-7,43 (1H, м), 7,73 (1H, с), 8,83 (1H, с), 10,03 (1H, с).
МС m/z: 374 (М++H).
Пример 12: 5-[(2,5-дифторфенил)[(4-фторфенил)сульфонил]метил]-4-метилпиридин-2-карбоновая кислота

31% водную перекись водорода (10 мл) добавляли к раствору 5-[(2,5-дифторфенил)[(4-фторфенил)тио]метил]-4-метилпиридин-2-карбальдегида (4,22 г, 11,3 ммоль) в муравьиной кислоте (100 мл) и полученную смесь перемешивали в течение 3 часов при комнатной температуре. К реакционной смеси добавляли воду, осажденное таким образом твердое вещество собирали фильтрованием и промывали 0,1н. раствором хлористоводородной кислоты. Полученное твердое вещество растворяли в метиленхлориде и раствор промывали 0,1н. раствором хлористоводородной кислоты. Затем органический слой сушили над безводным сульфатом натрия и фильтровали, а затем концентрировали при пониженном давлении. Полученный остаток промывали смешанным растворителем, состоящим из этанола и гексана, и собирали фильтрованием с получением указанного в заголовке соединения (4,34 г, 10,3 ммоль, 91%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,30 (3H, с), 5,97 (1H, с), 6,91-6,99 (1H, м), 7,03-7,10 (1H, м), 7,16 (2H, т, J=8,4 Гц), 7,68-7,78 (3H, м), 8,02 (1H, с), 9,23 (1H, с).
ИК (ATR) см-1: 3361, 1763, 1593, 1493, 1402, 1288, 1236, 1149.
Аналитически вычислено для C20H14F3NO4S: C, 57,01; H, 3,35; F, 13,53; N, 3,32; S, 7,61. Найдено: C, 56,87; H, 3,23; F, 13,54; N, 3,39; S, 7,86.
МС m/z: 422 (М++H).
Пример 13: 5-[(2,5-дифторфенил)[(4-фторфенил)сульфонил]метил]-N,4-диметилпиридин-2-карбоксамид
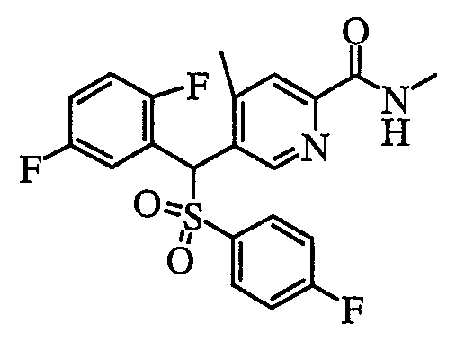
К раствору 5-[(2,5-дифторфенил)[(4-фторфенил)сульфонил]метил]-4-метилпиридин-2-карбоновой кислоты (105 мг, 0,25 ммоль) в метиленхлориде (3 мл) добавляли метиламингидрохлорид (19 мг, 0,28 ммоль), 1-гидроксибензотриазол (37 мг, 0,28 ммоль), 4-метилморфолин (0,061 мл, 0,55 ммоль) и гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (53 мг, 0,28 ммоль) при комнатной температуре. После перемешивания в течение 2 часов при комнатной температуре к реакционной смеси добавляли воду и смесь промывали насыщенным водным раствором гидрокарбоната натрия. Органический слой сушили над безводным сульфатом натрия и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=7:3, концентрировали при пониженном давлении и полученный остаток промывали смешанным растворителем, состоящим из этанола и гексана, и затем собирали фильтрованием с получением указанного в заголовке соединения (73 мг, 0,17 ммоль, 67%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,20 (3H, с), 3,04 (3H, д, J=5,1 Гц), 5,95 (1H, с), 6,92-6,99 (1H, м), 7,01-7,08 (1H, м), 7,10-7,17 (2H, м), 7,66-7,72 (2H, м), 7,75-7,80 (1H, м), 7,96 (1H, с), 8,01 (1H, ушир.д, J=5,1 Гц), 9,14 (1H, с).
ИК (ATR) см-1: 1672, 1591, 1533, 1493, 1327, 1294, 1236, 1146, 1082.
Т.пл.: 201-202°C.
Аналитически вычислено для C21H17F3N2O3S: C, 58,06; H, 3,94; F, 13,12; N, 6,45; S, 7,38. Найдено: C, 58,05; H, 3,83; F, 13,05; N, 6,47; S, 7,51.
МС m/z: 435 (М++H).
Пример 14: 5-[(2,5-Дифторфенил)[(4-фторфенил)сульфонил]метил]-N,N,4-триметилпиридин-2-карбоксамид
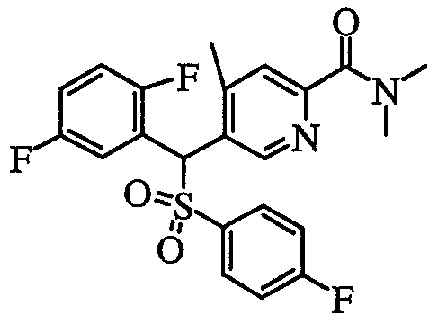
К раствору 5-[(2,5-дифторфенил)[(4-фторфенил)сульфонил]метил]-4-метилпиридин-2-карбоновой кислоты (105 мг, 0,25 ммоль), полученной в Примере 12, в метиленхлориде (3 мл), добавляли диметиламингидрохлорид (23 мг, 0,28 ммоль), 1-гидроксибензотриазол (37 мг, 0,28 ммоль), 4-метилморфолин (0,061 мл, 0,55 ммоль) и гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (53 мг, 0,28 ммоль) при комнатной температуре. После перемешивания в течение 3 часов при комнатной температуре к реакционной смеси добавляли воду и смесь промывали насыщенным водным раствором гидрокарбоната натрия. Органический слой сушили над безводным сульфатом натрия и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=3:2, концентрировали при пониженном давлении и полученный остаток промывали смешанным растворителем, состоящим из этанола и гексана, и собирали фильтрованием с получением указанного в заголовке соединения (77 мг, 0,17 ммоль, 69%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,23 (3H, с), 3,14 (6H, с), 5,95 (1H, с), 6,90-6,97 (1H, м), 7,00-7,07 (1H, м), 7,11-7,18 (2H, м), 7,47 (1H, с), 7,70-7,78 (3H, м), 9,18 (1H, с).
ИК (ATR) см-1: 1633, 1589, 1493, 1404, 1327, 1294, 1236, 1147, 1084.
Т.пл.: 176-177°C.
Аналитически вычислено для C22H19F3N2O3S: C, 58,92; H, 4,27; F, 12,71; N, 6,25; S, 7,15. Найдено: C, 58,74; H, 4,18; F, 12,68; N, 6,32; S, 7,26.
МС m/z: 449 (М++H).
Пример 15: 5-[(2,5-Дифторфенил)[(4-фторфенил)сульфонил]метил]-4-метилпиридин-2-карбоксамид
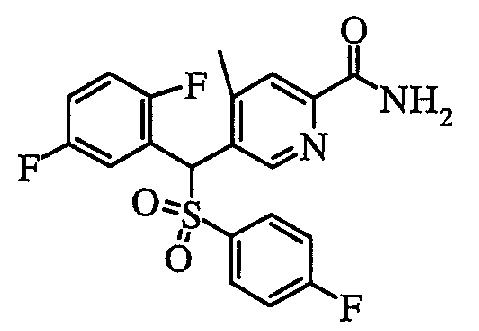
К раствору 5-[(2,5-дифторфенил)[(4-фторфенил)сульфонил]метил]-4-метилпиридин-2-карбоновой кислоты (211 мг, 0,50 ммоль), полученной в Примере 12, в N,N-диметилформамиде (5 мл) добавляли гексафторфосфат (бензотриазол-1-илокси)трипирролидинoфосфония (390 мг, 0,75 ммоль), 1-гидроксибензотриазол (101 мг, 0,75 ммоль), хлорид аммония (54 мг, 1,00 ммоль) и N-этилдиизопропиламин (0,348 мл, 2,00 ммоль) в атмосфере аргона при комнатной температуре. После перемешивания в течение 5 часов при комнатной температуре к реакционной смеси добавляли этилацетат и воду и полученную смесь промывали насыщенным водным раствором хлорида аммония. Органический слой сушили над безводным сульфатом натрия и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=7:3, концентрировали при пониженном давлении и полученный остаток промывали смешанным растворителем, состоящим из этанола и гексана, и собирали фильтрованием с получением указанного в заголовке соединения (154 мг, 0,37 ммоль, 73%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,22 (3H, с), 5,58 (1H, ушир.с), 5,96 (1H, с), 6,91-6,99 (1H, м), 7,01-7,08 (1H, м), 7,11-7,18 (2H, м), 7,67-7,73 (2H, м), 7,76-7,82 (1H, м), 7,83 (1H, ушир.с), 7,98 (1H, с), 9,17 (1H, с).
ИК (ATR) см-1: 3429, 3168, 1691, 1589, 1491, 1421, 1313, 1234, 1146, 1080.
Аналитически вычислено для C20H15F3N2O3S: C, 57,14; H, 3,60; F, 13,56; N, 6,66; S, 7,63. Найдено: C, 56,96; H, 3,55; F, 13,76; N, 6,67; S, 7,82.
МС m/z: 421 (М++H).
Пример 16: 5-[(2,5-Дифторфенил)[(4-фторфенил)сульфонил]метил]-N-этил-4-метилпиридин-2-карбоксамид

К раствору 5-[(2,5-дифторфенил)[(4-фторфенил)сульфонил]метил]-4-метилпиридин-2-карбоновой кислоты (126 мг, 0,30 ммоль), полученной в Примере 12, в метиленхлориде (3 мл), добавляли этиламингидрохлорид (27 мг, 0,33 ммоль), 1-гидроксибензотриазол (45 мг, 0,33 ммоль), 4-метилморфолин (0,073 мл, 0,66 ммоль) и гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (63 мг, 0,33 ммоль) при комнатной температуре. После перемешивания в течение 7 дней при комнатной температуре реакционную смесь промывали насыщенным водным раствором гидрокарбоната натрия. Органический слой сушили над безводным сульфатом натрия и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=7:3, концентрировали при пониженном давлении и полученный остаток промывали смешанным растворителем, состоящим из этанола и гексана, и собирали фильтрованием с получением указанного в заголовке соединения (120 мг, 0,27 ммоль, 89%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 1,27 (3H, т, J=7,4 Гц), 2,19 (3H, с), 3,51 (2H, дкв, J=7,4, 6,1 Гц), 5,95 (1H, с), 6,92-6,99 (1H, м), 7,01-7,08 (1H, м), 7,11-7,17 (2H, м), 7,66-7,73 (2H, м), 7,75-7,81 (1H, м), 7,96 (1H, с), 8,00 (1H, ушир.т, J=6,1 Гц), 9,14 (1H, с).
ИК (ATR) см-1: 1672, 1591, 1520, 1493, 1292, 1240, 1149.
Т.пл.: 191-193°C.
Аналитически вычислено для C22H19F3N2O3S: C, 58,92; H, 4,27; F, 12,71; N, 6,25; S, 7,15. Найдено: C, 58,64; H, 4,31; F, 12,84; N, 6,22; S, 7,20.
МС m/z: 449 (М++H).
Пример 17: 5-[(2,5-Дифторфенил)[(4-фторфенил)сульфонил]метил]-N-(2-гидроксиэтил)-4-метилпиридин-2-карбоксамид
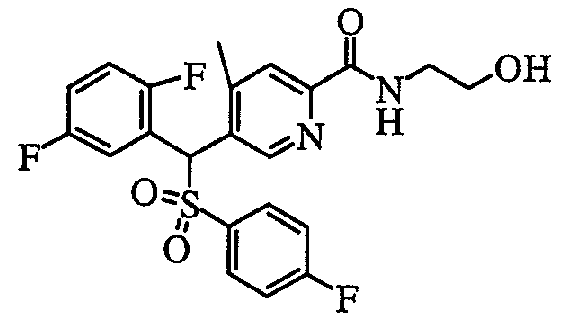
К раствору 5-[(2,5-дифторфенил)[(4-фторфенил)сульфонил]метил]-4-метилпиридин-2-карбоновой кислоты (421 мг, 1,00 ммоль), полученной в Примере 12, в метиленхлориде (10 мл) добавляли 2-аминоэтанол (0,067 мл, 1,10 ммоль), 1-гидроксибензотриазол (149 мг, 1,10 ммоль), 4-метилморфолин (0,12 мл, 1,10 ммоль) и гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (211 мг, 1,10 ммоль) при комнатной температуре. После перемешивания в течение 7 дней при комнатной температуре реакционную смесь промывали насыщенным водным раствором гидрокарбоната натрия. Органический слой сушили над безводным сульфатом натрия и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=2:3, концентрировали при пониженном давлении и полученный остаток промывали смешанным растворителем, состоящим из этанола и гексана, и собирали фильтрованием с получением указанного в заголовке соединения (427 мг, 0,92 ммоль, 92%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,21 (3H, с), 2,58 (1H, ушир.с), 3,63-3,68 (2H, м), 3,85 (2H, т, J=4,9 Гц), 5,95 (1H, с), 6,92-6,99 (1H, м), 7,01-7,08 (1H, м), 7,11-7,18 (2H, м), 7,67-7,73 (2H, м), 7,75-7,80 (1H, м), 7,96 (1H, с), 8,40 (1H, ушир.т, J=6,1 Гц), 9,16 (1H, с).
ИК (ATR) см-1: 3554, 3410, 1676, 1589, 1520, 1493, 1279, 1236, 1144.
Т.пл.: 153-154°C.
Аналитически вычислено для C22H19F3N2O4S: C, 56,89; H, 4,12; F, 12,27; N, 6,03; S, 6,90. Найдено: C, 56,85; H, 4,05; F, 12,56; N, 6,03; S, 6,97.
МС m/z: 465 (М++H).
Пример 18: 5-[(2,5-Дифторфенил)[(4-фторфенил)сульфонил]метил]-N-этил-N,4-диметилпиридин-2-карбоксамид

К раствору 5-[(2,5-дифторфенил)[(4-фторфенил)сульфонил]метил]-4-метилпиридин-2-карбоновой кислоты (126 мг, 0,30 ммоль), полученной в Примере 12, в метиленхлориде (3 мл) добавляли N-метилэтиламин (0,060 мл, 0,66 ммоль), 1-гидроксибензотриазол (45 мг, 0,33 ммоль) и гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (63 мг, 0,33 ммоль) при комнатной температуре. После перемешивания в течение 4 часов при комнатной температуре реакционную смесь промывали насыщенным водным раствором гидрокарбоната натрия. Органический слой сушили над безводным сульфатом натрия и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=1:1, концентрировали при пониженном давлении и полученный остаток промывали смешанным растворителем, состоящим из диэтилового эфира и гексана, и собирали фильтрованием с получением указанного в заголовке соединения (38 мг, 0,08 ммоль, 27%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 1,19-1,30 (3H, м), 2,23 (3H, с), 3,10 (3H, с), 3,47 (1,2H, кв, J=7,4 Гц), 3,60 (0,8H, кв, J=7,4 Гц), 5,95 (1H, с), 6,89-6,97 (1H, м), 6,99-7,07 (1H, м), 7,14 (2H, т, J=8,3 Гц), 7,44 (0,6H, с), 7,46 (0,4H, с), 7,69-7,79 (3H, м), 9,17 (0,6H, с), 9,18 (0,4H, с).
ИК (ATR) см-1: 1626, 1591, 1493, 1286, 1240, 1147, 1084.
Т.пл.: 165-167°C.
Аналитически вычислено для C23H21F3N2O3S: C, 59,73; H, 4,58; F, 12,32; N, 6,06; S, 6,93. Найдено: C, 59,31; H, 4,31; F, 12,59; N, 6,00; S, 7,05.
МС m/z: 463 (М++H).
Пример 19: 5-[(2,5-Дифторфенил)[(4-фторфенил)сульфонил]метил]-N-(2-гидроксиэтил)-N,4-диметилпиридин-2-карбоксамид
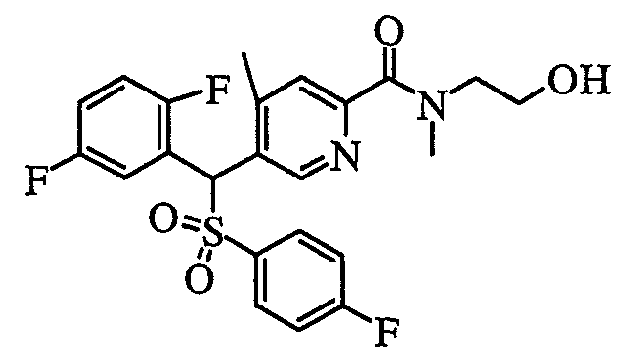
К раствору 5-[(2,5-дифторфенил)[(4-фторфенил)сульфонил]метил]-4-метилпиридин-2-карбоновой кислоты (337 мг, 0,80 ммоль), полученной в Примере 12, в метиленхлориде (8 мл) добавляли 2-(метиламино)этанол (0,077 мл, 0,96 ммоль), 1-гидроксибензотриазол (130 мг, 0,96 ммоль), 4-метилморфолин (0,194 мл, 1,76 ммоль) и гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (184 мг, 0,96 ммоль) при комнатной температуре. После перемешивания в течение 24 часов при комнатной температуре реакционную смесь промывали 1н. раствором хлористоводородной кислоты. Органический слой сушили над безводным сульфатом натрия и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании этилацетатом, концентрировали при пониженном давлении и полученный остаток промывали смешанным растворителем, состоящим из этанола и диэтилового эфира, и собирали фильтрованием с получением указанного в заголовке соединения (328 мг, 0,69 ммоль, 85%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,24 (0,3H, с), 2,29 (2,7H, с), 3,17 (2,7H, с), 3,21 (0,3H, с), 3,47-4,01 (4H, м), 5,95 (1H, с), 6,89-6,96 (1H, м), 7,01-7,08 (1H, м), 7,15 (2H, т, J=8,5 Гц), 7,52 (0,1H, с), 7,68 (0,9H, с), 7,70-7,78 (3H, м), 9,08 (0,9H, с), 9,19 (0,1H, с).
ИК (ATR) см-1: 3228, 1626, 1591, 1495, 1236, 1149, 833.
Т.пл.: 123-125°C.
Аналитически вычислено для C23H21F3N2O4S: 0,25H2O: C, 57,20; H, 4,49; F, 11,80; N, 5,80; S, 6,64. Найдено: C, 57,13; H, 4,34; F, 11,92; N, 5,86; S, S,84.
МС m/z: 479 (М++H).
Пример 20: 5-[(2,5-Дифторфенил)[(4-фторфенил)тио]метил]-4-метилпиридин-2-карбоновая кислота

К раствору 2-бром-5-[(2,5-дифторфенил)[(4-фторфенил)тио]метил]-4-метилпиридина (1,39 г, 3,28 ммоль), полученного в Примере 10, в толуоле (60 мл) добавляли раствор н-бутиллития в гексане (1,54 M, 2,55 мл, 3,93 ммоль) в атмосфере аргона при -78°C. После перемешивания в течение 1 часа при указанной температуре в смесь барботировали диоксид углерода. Реакционной смеси давали нагреться до комнатной температуры в течение 2 часов, затем к смеси добавляли 0,1н. раствор хлористоводородной кислоты и смесь экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом натрия и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью метиленхлорид:метанол=10:1, концентрировали при пониженном давлении и полученный остаток промывали смешанным растворителем, состоящим из этанола, диэтилового эфира и гексана, и собирали фильтрованием с получением указанного в заголовке соединения (815 мг, 2,09 ммоль, 64%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,41 (3H, с), 5,83 (1H, с), 6,89-7,03 (4H, м), 7,27-7,44 (3H, м), 8,00 (1H, с), 8,67 (1H, с).
МС m/z: 390 (М++H).
Пример 21: 5-[(2,5-Дифторфенил)[(4-фторфенил)сульфинил]метил]-N,4-диметилпиридин-2-карбоксамид
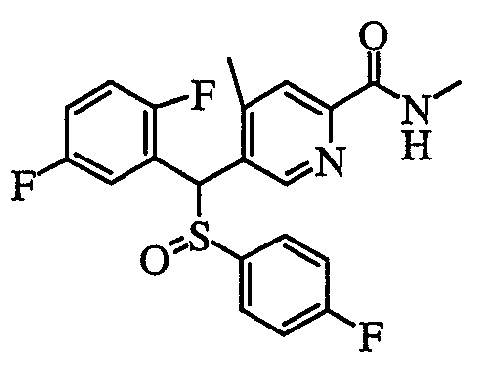
К раствору 5-[(2,5-дифторфенил)[(4-фторфенил)тио]метил]-4-метилпиридин-2-карбоновой кислоты (307 мг, 0,79 ммоль) в метиленхлориде (8 мл) добавляли метиламингидрохлорид (108 мг, 1,58 ммоль), 1-гидроксибензотриазол (213 мг, 1,58 ммоль), 4-метилморфолин (0,347 мл, 3,15 ммоль) и гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (302 мг, 1,58 ммоль) при комнатной температуре. После перемешивания в течение 16 часов при комнатной температуре реакционную смесь промывали насыщенным водным раствором гидрокарбоната натрия. Органический слой сушили над безводным сульфатом натрия и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=3:1, концентрировали при пониженном давлении. К раствору полученного остатка в метиленхлориде (5 мл) добавляли 3-хлорпербензойную кислоту (110 мг, 0,41 ммоль) при 0°C. После перемешивания в течение 1 часа при комнатной температуре реакционную смесь промывали 1н. водным раствором гидроксида натрия. Органический слой сушили над безводным сульфатом натрия и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали препаративной тонкослойной хроматографии (проявляли смесью гексан:этилацетат=2:1, элюировали смесью метиленхлорид:метанол=4:1). Полученную фракцию концентрировали при пониженном давлении и полученный остаток промывали смешанным растворителем, состоящим из этанола и гексана, и собирали фильтрованием с получением указанного в заголовке соединения (129 мг, 0,31 ммоль, 39%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 1,94 (1,95H, с), 2,13 (1,05H, с), 3,04 (1,95H, д, J=5,1 Гц), 3,05 (1,05H, д, J=5,1 Гц), 5,32 (0,35H, с), 5,35 (0,65H, с), 6,87-7,13 (4H, м), 7,27-7,35 (2,35H, м), 7,48-7,54 (0,65H, м), 7,92 (0,65H, с), 7,97 (0,35H, с), 8,00 (0,35H, ушир.д, J=5,1 Гц), 8,03 (0,65H, ушир.д, J=5,1 Гц), 8,84 (0,65H, с), 9,01 (0,35H, с).
ИК (ATR) см-1: 3359, 1664, 1591, 1529, 1491, 1228, 1086, 1051.
Аналитически вычислено для C21H17F3N2O2S: C, 60,28; H, 4,10; F, 13,62; N, 6,69; S, 7,66. Найдено: C, 59,86; H, 4,04; F, 13,65; N, 6,65; S, 7,67.
МС m/z: 419 (М++H).
Пример 22: 5-[(2,5-Дифторфенил)[(4-фторфенил)сульфинил]метил]-N,N,4-триметилпиридин-2-карбоксамид
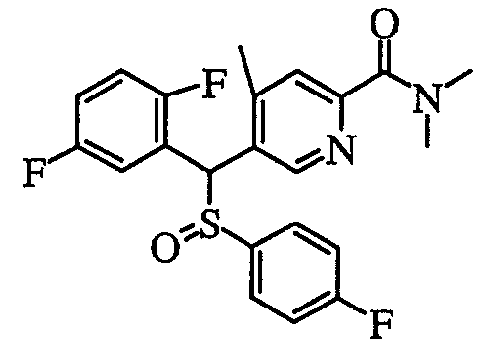
К раствору 5-[(2,5-дифторфенил)[(4-фторфенил)тио]метил]-4-метилпиридин-2-карбоновой кислоты (307 мг, 0,79 ммоль), полученной в Примере 20, в метиленхлориде (8 мл) добавляли диметиламингидрохлорид (130 мг, 1,58 ммоль), 1-гидроксибензотриазол (213 мг, 1,58 ммоль), 4-метилморфолин (0,347 мл, 3,15 ммоль) и гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (302 мг, 1,58 ммоль) при комнатной температуре. После перемешивания в течение 17 часов при комнатной температуре реакционную смесь промывали насыщенным водным раствором гидрокарбоната натрия. Органический слой сушили над безводным сульфатом натрия и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=1:1, концентрировали при пониженном давлении. К раствору полученного остатка в метиленхлориде (5 мл) добавляли 3-хлорпербензойную кислоту (112 мг, 0,42 ммоль) при 0°C. После перемешивания в течение 1 часа при комнатной температуре реакционную смесь промывали 1н. водным раствором гидроксида натрия. Органический слой сушили над безводным сульфатом натрия и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали препаративной тонкослойной хроматографии (проявляли смесью гексан:этилацетат=1:2, элюировали смесью метиленхлорид: метанол=4:1). Полученную фракцию концентрировали при пониженном давлении и полученный остаток промывали смешанным растворителем, состоящим из этанола и гексана, и собирали фильтрованием с получением указанного в заголовке соединения (78 мг, 0,18 ммоль, 23%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,03 (2H, с), 2,11 (1H, с), 3,14 (4H, с), 3,15 (2H, с), 5,31 (0,33H, с), 5,37 (0,67H, с), 6,87-7,13 (4H, м), 7,30-7,40 (3H, м), 7,43 (0,67H, с), 7,46 (0,33H, с), 8,96 (0,67H, с), 9,03 (0,33H, с).
ИК (ATR) см-1: 1631, 1587, 1493, 1408, 1217, 1049.
Аналитически вычислено для C22H19F3N2O2S: C, 61,10; H, 4,43; F, 13,18; N, 6,48; S, 7,41. Найдено: C, 60,83; H, 4,36; F, 13,43; N, 6,44; S, 7,42.
МС m/z: 433 (М++H).
Пример 23: 5-[(2,5-Дифторфенил)[(4-фторфенил)тио]метил]-4-метилпиридин-2-карбоксамид

К раствору 5-[(2,5-дифторфенил)[(4-фторфенил)тио]метил]-4-метилпиридин-2-карбоновой кислоты (178 мг, 0,46 ммоль), полученной в Примере 20, в N,N-диметилформамиде (5 мл) добавляли гексафторфосфат (бензотриазол-1-илокси)трипирролидинoфосфония (357 мг, 0,69 ммоль), 1-гидроксибензотриазол (93 мг, 0,69 ммоль), хлорид аммония (49 мг, 0,91 ммоль) и N-этилдиизопропиламин (0,319 мл, 1,83 ммоль) в атмосфере аргона при комнатной температуре. После перемешивания в течение 5 часов при комнатной температуре к реакционной смеси добавляли этилацетат и воду и полученную смесь промывали насыщенным водным раствором гидрокарбоната натрия и затем насыщенным солевым раствором. Органический слой сушили над безводным сульфатом натрия и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=4:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (156 мг, 0,40 ммоль, 88%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,38 (3H, с), 5,56 (1H, ушир.с), 5,83 (1H, с), 6,91-7,01 (4H, м), 7,28-7,34 (2H, м), 7,36-7,41 (1H, м), 7,77 (1H, ушир.с), 7,99 (1H, с), 8,61 (1H, с).
МС m/z: 389 (М++H).
Пример 24: 5-[(2,5-Дифторфенил)[(4-фторфенил)сульфинил]метил]-4-метилпиридин-2-карбоксамид

К раствору 5-[(2,5-дифторфенил)[(4-фторфенил)тио]метил]-4-метилпиридин-2-карбоксамида (152 мг, 0,39 ммоль) в метиленхлориде (5 мл) добавляли 3-хлорпербензойную кислоту (104 мг, 0,39 ммоль) при 0°C. После перемешивания в течение 2 часов при комнатной температуре реакционную смесь промывали 1н. водным раствором гидроксида натрия. Органический слой сушили над безводным сульфатом натрия и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=7:3, концентрировали при пониженном давлении и полученный остаток промывали смешанным растворителем, состоящим из этанола и гексана, и собирали фильтрованием с получением указанного в заголовке соединения (91 мг, 0,23 ммоль, 58%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 1,95 (1,9H, с), 2,14 (1,1H, с), 5,33 (0,37H, с), 5,36 (0,63H, с), 5,51-5,64 (1H, м), 6,87-7,14 (4H, м), 7,27-7,37 (2,37H, м), 7,49-7,56 (0,63H, м), 7,80-7,90 (1H, м), 7,94 (0,63H, с), 7,98 (0,37H, с), 8,87 (0,63H, с), 9,05 (0,37H, с).
ИК (ATR) см-1: 3458, 3377, 3155, 1697, 1491, 1421, 1348, 1227, 1082, 1043.
Аналитически вычислено для C20H15F3N2O2S: C, 59,40; H, 3,74; F, 14,09; N, 6,93; S, 7,93. Найдено: C, 59,29; H, 3,76; F, 13,88; N, 6,88; S, 7,93.
МС m/z: 405 (М++H).
Пример 25: 2-Бром-5-[(2,5-дифторфенил)[[6-(трифторметил)пиридин-3-ил]тио]метил]-4-метилпиридин
К раствору O-этил S-[6-(трифторметил)пиридин-3-ил] дитиокарбоната (2,67 г, 10,0 ммоль) в этаноле (30 мл) добавляли 1н. водный раствор гидроксида натрия (30 мл) и полученную смесь перемешивали в течение 2 часов при 50°C. Реакционную смесь охлаждали до комнатной температуры и промывали метиленхлоридом. Затем водный слой подкисляли 1н. раствором хлористоводородной кислоты и экстрагировали метиленхлоридом. Органический слой сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении с получением 6-(трифторметил)пиридин-3-тиола в виде неочищенного продукта.
К раствору (6-бром-4-метилпиридин-3-ил)(2,5-дифторфенил)метанола (3,14 г, 10,0 ммоль), полученного в Ссылочном примере 1, в метиленхлориде (50 мл) добавляли тионилхлорид (7,29 мл, 100 ммоль) и N,N-диметилформамид (0,50 мл) при 0°C и полученную смесь перемешивали в течение 2 часов при комнатной температуре. Реакционную смесь концентрировали при пониженном давлении, затем к остатку добавляли этилацетат и воду, а затем добавляли по каплям при 0°C насыщенный водный раствор гидрокарбоната натрия. После отделения органического слоя органический слой сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. К раствору полученного остатка в N,N-диметилформамиде (45 мл) добавляли раствор 6-(трифторметил)пиридин-3-тиола в N,N-диметилформамиде (5 мл) и затем карбонат калия (1,52 г, 11,0 ммоль) в атмосфере азота при 0°C и полученную смесь перемешивали в течение 16 часов при комнатной температуре. К реакционной смеси добавляли этилацетат и воду при 0°C, органический слой отделяли и затем органический слой промывали насыщенным солевым раствором. Органический слой сушили над безводным сульфатом натрия и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=19:1, концентрировали при пониженном давлении и полученный остаток промывали смешанным растворителем, состоящим из диэтилового эфира и гексана, и собирали фильтрованием с получением указанного в заголовке соединения (3,43 г, 7,22 ммоль, 72%) в виде бледно-желтого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,36 (3H, с), 5,93 (1H, с), 6,97-7,09 (2H, м), 7,25-7,32 (1H, м), 7,35 (1H, с), 7,55 (1H, д, J=8,3 Гц), 7,67 (1H, дд, J=8,3, 2,2 Гц), 8,39 (1H, с), 8,53 (1H, д, J=2,2 Гц).
МС m/z: 475, 477 (М++H).
Пример 26: 5-[(2,5-Дифторфенил)[[6-(трифторметил)пиридин-3-ил]тио]метил]-4-метилпиридин-2-карбоновая кислота
К раствору 2-бром-5-[(2,5-дифторфенил)[[6-(трифторметил)пиридин-3-ил]тио]метил]-4-метилпиридина (3,43 г, 7,22 ммоль) в толуоле (70 мл) добавляли раствор н-бутиллития в гексане (1,54 M, 5,62 мл, 8,66 ммоль) в атмосфере аргона при -78°C. Реакционную смесь перемешивали в течение 30 минут при -40°C и затем снова охлаждали до -78°C и смесь барботировали диоксидом углерода. После перемешивания в течение 1 часа при указанной температуре реакционной смеси давали нагреться до комнатной температуры и добавляли насыщенный водный раствор хлорида аммония. Реакционную смесь концентрировали при пониженном давлении и затем к остатку добавляли метиленхлорид и воду. После отделения органического слоя к водному слою добавляли 1н. раствор хлористоводородной кислоты, а затем его экстрагировали метиленхлоридом. Органические слои объединяли и сушили над безводным сульфатом натрия, фильтровали, фильтрат концентрировали при пониженном давлении и полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью метиленхлорид:метанол=100:1, концентрировали при пониженном давлении и полученный остаток промывали смешанным растворителем, состоящим из этанола и диэтилового эфира, и собирали фильтрованием с получением указанного в заголовке соединения (862 мг, 1,96 ммоль, 27%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,52 (3H, с), 6,04 (1H, с), 7,01-7,11 (2H, м), 7,33-7,39 (1H, м), 7,57 (1H, д, J=8,3 Гц), 7,70 (1H, дд, J=8,3, 2,2 Гц), 8,08 (1H, с), 8,55 (1H, д, J=2,2 Гц), 8,62 (1H, с).
МС m/z: 441 (М++H).
Пример 27: 5-[(2,5-Дифторфенил)[[6-(трифторметил)пиридин-3-ил]тио]метил]-N,N,4-триметилпиридин-2-карбоксамид
К раствору 5-[(2,5-дифторфенил)[[6-(трифторметил)пиридин-3-ил]тио]метил]-4-метилпиридин-2-карбоновой кислоты (352 мг, 0,80 ммоль) в метиленхлориде (10 мл) добавляли диметиламингидрохлорид (73 мг, 0,88 ммоль), 1-гидроксибензотриазол (119 мг, 0,88 ммоль), 4-метилморфолин (0,194 мл, 1,76 ммоль) и гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (169 мг, 0,88 ммоль) при комнатной температуре. После перемешивания в течение 13 часов при комнатной температуре реакционную смесь промывали 0,5н. раствором хлористоводородной кислоты. Органический слой сушили над безводным сульфатом натрия и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=1:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (370 мг, 0,79 ммоль, 99%) в виде бесцветного маслянистого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,43 (3H, с), 3,08 (3H, с), 3,12 (3H, с), 6,02 (1H, с), 6,97-7,08 (2H, м), 7,31-7,37 (1H, м), 7,49 (1H, с), 7,55 (1H, д, J=8,1 Гц), 7,68 (1H, дд, J=8,1, 2,0 Гц), 8,54 (1H, д, J=2,0 Гц), 8,57 (1H, с).
МС m/z: 468 (М++H).
Пример 28: 5-[(2,5-Дифторфенил)[[6-(трифторметил)пиридин-3-ил]сульфонил]метил]-N,N,4-триметилпиридин-2-карбоксамид (соединение A) и 5-[(2,5-дифторфенил)[[6-(трифторметил)пиридин-3-ил]сульфинил]метил]-N,N,4-триметилпиридин-2-карбоксамид (соединение B)
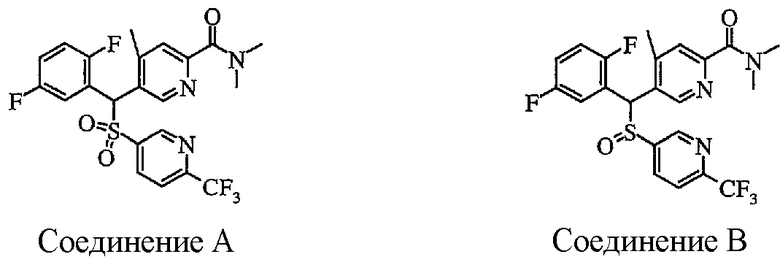
К раствору 5-[(2,5-дифторфенил)[[6-(трифторметил)пиридин-3-ил]тио]метил]-N,N,4-триметилпиридин-2-карбоксамида (365 мг, 0,78 ммоль) в метиленхлориде (10 мл) добавляли 3-хлорпербензойную кислоту (259 мг, 0,98 ммоль) при 0°C. После перемешивания в течение 6 часов при комнатной температуре реакционную смесь промывали 1н. водным раствором гидроксида натрия. Органический слой сушили над безводным сульфатом натрия и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=1:1, концентрировали при пониженном давлении и полученный остаток промывали смешанным растворителем, состоящим из этанола и диэтилового эфира, и собирали фильтрованием с получением указанного в заголовке соединения А (94 мг, 0,19 ммоль, 24%) в виде белого твердого вещества. Затем фракцию, полученную при элюировании смесью гексан:этилацетат=1:2, концентрировали при пониженном давлении и полученный остаток промывали смешанным растворителем, состоящим из этанола и диэтилового эфира, и собирали фильтрованием с получением указанного в заголовке соединения B (114 мг, 0,24 ммоль, 30%) в виде белого твердого вещества.
Соединение А
1H-ЯМР (400 МГц, CDCl3) δ: 2,30 (3H, с), 3,15 (6H, с), 6,01 (1H, с), 6,91-6,99 (1H, м), 7,05-7,12 (1H, м), 7,52 (1H, с), 7,65-7,71 (1H, м), 7,80 (1H, д, J=8,1 Гц), 8,20 (1H, дд, J=8,1, 2,2 Гц), 8,99 (1H, д, J=2,2 Гц), 9,22 (1H, с).
ИК (ATR) см-1: 1630, 1493, 1333, 1155, 1105, 1076, 723, 625.
Аналитически вычислено для C22H18F5N3O3S: C, 52,90; H, 3,63; F, 19,02; N, 8,41; S, 6,42. Найдено: C, 52,69; H, 3,58; F, 19,14; N, 8,42; S, 6,51.
МС m/z: 500 (М++H).
Соединение В
1H-ЯМР (400 МГц, CDCl3) δ: 2,10 (2,1H, с), 2,17 (0,9H, с), 3,14 (2,1H, с), 3,15 (2,1H, с), 3,16 (0,9H, с), 3,16 (0,9H, с), 5,38 (0,3H, с), 5,51 (0,7H, с), 6,84-7,11 (2H, м), 7,19-7,32 (1H, м), 7,47 (0,7H, с), 7,52 (0,3H, с), 7,72 (0,3H, дд, J=8,1, 0,7 Гц), 7,77 (0,7H, дд, J=8,1, 0,7 Гц), 7,84 (0,3H, дд, J=8,1, 2,0 Гц), 8,04 (0,7H, дд, J=8,1, 2,0 Гц), 8,50 (0,7H, д, J=2,0 Гц), 8,65 (0,3H, д, J=2,0 Гц), 9,02 (0,7H, с), 9,15 (0,3H, с).
ИК (ATR) см-1: 1631, 1493, 1331, 1169, 1132, 1068.
Аналитически вычислено для C22H18F5N3O2S: C, 54,66; H, 3,75; F, 19,65; N, 8,69; S, 6,63. Найдено: C, 54,38; H, 3,66; F, 19,94; N, 8,70; S, 6,68.
МС m/z: 484 (М++H).
Пример 29: 5-[(2,5-Дифторфенил)[[6-(трифторметил)пиридин-3-ил]тио]метил]-N-(2-гидроксиэтил)-4-метилпиридин-2-карбоксамид

К раствору 5-[(2,5-дифторфенил)[[6-(трифторметил)пиридин-3-ил]тио]метил]-4-метилпиридин-2-карбоновой кислоты (132 мг, 0,30 ммоль), полученной в Примере 26, в метиленхлориде (5 мл) добавляли 2-аминоэтанол (0,020 мл, 0,33 ммоль), 1-гидроксибензотриазол (45 мг, 0,33 ммоль), 4-метилморфолин (0,036 мл, 0,33 ммоль) и гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (63 мг, 0,33 ммоль) при комнатной температуре. После перемешивания в течение 6 часов при комнатной температуре реакционную смесь промывали 0,5н. раствором хлористоводородной кислоты. Органический слой сушили над безводным сульфатом натрия и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=1:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (143 мг, 0,30 ммоль, 99%) в виде бесцветного маслянистого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,46 (3H, с), 2,52 (1H, ушир.с), 3,61-3,67 (2H, м), 3,84 (2H, т, J=4,9 Гц), 6,03 (1H, с), 6,98-7,09 (2H, м), 7,29-7,35 (1H, м), 7,55 (1H, д, J=8,3 Гц), 7,67 (1H, дд, J=8,3, 2,2 Гц), 8,04 (1H, с), 8,33 (1H, ушир.т, J=6,1 Гц), 8,54 (1H, д, J=2,2 Гц), 8,59 (1H, с).
МС m/z: 484 (М++H).
Пример 30: 5-[(2,5-Дифторфенил)[[6-(трифторметил)пиридин-3-ил]сульфонил]метил]-N-(2-гидроксиэтил)-4-метилпиридин-2-карбоксамид

К раствору 5-[(2,5-дифторфенил)[[6-(трифторметил)пиридин-3-ил]тио]метил]-N-(2-гидроксиэтил)-4-метилпиридин-2-карбоксамид (195 мг, 0,40 ммоль) в метиленхлориде (8 мл) добавляли 3-хлорпербензойную кислоту (214 мг, 0,81 ммоль) при 0°C. После перемешивания в течение 10 часов при комнатной температуре реакционную смесь промывали 1н. водным раствором гидроксида натрия. Органический слой сушили над безводным сульфатом натрия и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=2:3, концентрировали при пониженном давлении и полученный остаток промывали смешанным растворителем, состоящим из этанола и диэтилового эфира, и собирали фильтрованием с получением указанного в заголовке соединения (118 мг, 0,23 ммоль, 57%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,30 (3H, с), 2,49 (1H, ушир.с), 3,64-3,70 (2H, м), 3,86 (2H, т, J=4,7 Гц), 6,02 (1H, с), 6,92-7,00 (1H, м), 7,05-7,13 (1H, м), 7,64-7,71 (1H, м), 7,80 (1H, д, J=8,3 Гц), 8,04 (1H, с), 8,18 (1H, дд, J=8,3, 2,0 Гц), 8,41 (1H, ушир.т, J=5,6 Гц), 8,97 (1H, д, J=2,0 Гц), 9,22 (1H, с).
ИК (ATR) см-1: 3373, 1662, 1533, 1493, 1327, 1238, 1184, 1155, 1138, 1074, 723.
Аналитически вычислено для C22H18F5N3O4S: C, 51,26; H, 3,52; F, 18,43; N, 8,15; S, 6,22. Найдено: C, 51,02; H, 3,46; F, 18,86; N, 8,14; S, 6,29.
МС m/z: 516 (М++H).
Пример 31: 5-[(2,5-Дифторфенил)[[6-(трифторметил)пиридин-3-ил]тио]метил]-4-метилпиридин-2-карбоксамид
К раствору 5-[(2,5-дифторфенил)[[6-(трифторметил)пиридин-3-ил]тио]метил]-4-метилпиридин-2-карбоновой кислоты (176 мг, 0,40 ммоль), полученной в Примере 26, в N,N-диметилформамиде (4 мл) добавляли гексафторфосфат (бензотриазол-1-илокси)трипирролидинoфосфония (312 мг, 0,60 ммоль), 1-гидроксибензотриазол (81 мг, 0,60 ммоль), хлорид аммония (43 мг, 0,80 ммоль) и N-этилдиизопропиламин (0,279 мл, 1,60 ммоль) в атмосфере аргона при комнатной температуре. После перемешивания в течение 5 часов при комнатной температуре к реакционной смеси добавляли этилацетат и воду и полученную смесь промывали насыщенным солевым раствором. Органический слой сушили над безводным сульфатом натрия и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=2:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (168 мг, 0,38 ммоль, 96%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,47 (3H, с), 5,56 (1H, ушир.с), 6,04 (1H, с), 6,98-7,09 (2H, м), 7,31-7,37 (1H, м), 7,56 (1H, д, J=8,3 Гц), 7,67 (1H, дд, J=8,3, 2,2 Гц), 7,75 (1H, ушир.с), 8,06 (1H, с), 8,54 (1H, д, J=2,2 Гц), 8,59 (1H, с).
МС m/z: 440 (М++H).
Пример 32: 5-[(2,5-Дифторфенил)[[6-(трифторметил)пиридин-3-ил]сульфонил]метил]-4-метилпиридин-2-карбоксамид
К раствору 5-[(2,5-дифторфенил)[[6-(трифторметил)пиридин-3-ил]тио]метил]-4-метилпиридин-2-карбоксамида (164 мг, 0,37 ммоль) в метиленхлориде (4 мл) добавляли 3-хлорпербензойную кислоту (215 мг, 0,81 ммоль) при 0°C. После перемешивания в течение 4 дней при комнатной температуре реакционную смесь промывали 1н. водным раствором гидроксида натрия. Органический слой сушили над безводным сульфатом натрия и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью метиленхлорид:метанол=100:1, концентрировали при пониженном давлении и полученный остаток промывали этанолом и собирали фильтрованием с получением указанного в заголовке соединения (109 мг, 0,23 ммоль, 62%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,31 (3H, с), 5,59 (1H, ушир.с), 6,03 (1H, с), 6,92-7,00 (1H, м), 7,06-7,13 (1H, м), 7,66-7,72 (1H, м), 7,80 (1H, д, J=8,3 Гц), 7,82 (1H, ушир.с), 8,05 (1H, с), 8,19 (1H, дд, J=8,3, 2,0 Гц), 8,98 (1H, д, J=2,0 Гц), 9,24 (1H, с).
ИК (ATR) см-1: 3410, 1685, 1495, 1331, 1157, 1136, 1103, 1076.
Аналитически вычислено для C20H14F5N3O3S: C, 50,96; H, 2,99; F, 20,15; N, 8,91; С, 6,80. Найдено: C, 51,06; H, 2,94; F, 20,25; N, 8,94; С, 6,96.
МС m/z: 472 (М++H).
Ссылочный пример 3: (6-Бром-4-метилпиридин-3-ил)(2,3,6-трифторфенил)метанол
Раствор н-бутиллития в гексане (1,54 M, 12,2 мл, 18,7 ммоль) добавляли к раствору 2,5-дибром-4-метилпиридина (4,27 г, 17,0 ммоль) в диэтиловом эфире (200 мл) в атмосфере аргона при -78°C. После перемешивания реакционной смеси в течение 30 минут к смеси добавляли 2,3,6-трифторбензальдегид (1,99 мл, 17,0 ммоль). После перемешивания в течение 30 минут при указанной температуре к смеси при комнатной температуре добавляли насыщенный водный раствор хлорида аммония. Органический слой сушили над безводным сульфатом натрия и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=4:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (4,60 г, 13,9 ммоль, 81%) в виде бледно-желтого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,25 (3H, с), 2,83 (1H, ушир.с), 6,29 (1H, с), 6,84-6,92 (1H, м), 7,11-7,21 (1H, м), 7,28 (1H, с), 8,53 (1H, с).
МС m/z: 332, 334 (М++H).
Ссылочный пример 4: 2-Бром-5-[хлор(2,3,6-трифторфенил)метил]-4-метилпиридин
К раствору (6-бром-4-метилпиридин-3-ил)(2,3,6-трифторфенил)метанола (4,60 г, 13,9 ммоль) в метиленхлориде (70 мл) добавляли тионилхлорид (10,1 мл, 139 ммоль) и N,N-диметилформамид (0,60 мл) при 0°C и полученную смесь перемешивали в течение 2 часов при комнатной температуре. Реакционную смесь концентрировали при пониженном давлении, к полученному остатку добавляли этилацетат, затем к смеси добавляли воду, а затем насыщенный водный раствор гидрокарбоната натрия при 0°C. После отделения органического слоя органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и фильтровали и фильтрат концентрировали при пониженном давлении с получением указанного в заголовке соединения (4,65 г, 13,3 ммоль, 96%) в виде светло-коричневого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,25 (3H, с), 6,45 (1H, с), 6,86-6,93 (1H, м), 7,14-7,23 (1H, м), 7,29 (1H, с), 8,80 (1H, с).
МС m/z: 350, 352 (М++H).
Пример 33: 2-Бром-5-[[(4-фторфенил)тио](2,3,6-трифторфенил)метил]-4-метилпиридин

К раствору 2-бром-5-[хлор(2,3,6-трифторфенил)метил]-4-метилпиридина (4,65 г, 13,3 ммоль) в N,N-диметилформамиде (70 мл) добавляли в атмосфере аргона при 0°C 4-фторбензолтиол (1,41 мл, 13,3 ммоль), а затем карбонат калия (2,02 г, 14,6 ммоль) и полученную смесь перемешивали в течение 4 часов при комнатной температуре. К реакционной смеси добавляли этилацетат и воду при 0°C, органический слой отделяли и затем органический слой промывали насыщенным солевым раствором. Органический слой сушили над безводным сульфатом натрия и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=19:1, концентрировали при пониженном давлении и полученный остаток промывали гексаном и затем собирали фильтрованием с получением указанного в заголовке соединения (5,17 г, 11,7 ммоль, 88%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,16 (3H, с), 5,67 (1H, с), 6,75-6,82 (1H, м), 6,91-6,99 (2H, м), 7,01-7,11 (1H, м), 7,24 (1H, с), 7,33-7,39 (2H, м), 8,88 (1H, с).
МС m/z: 442, 444 (М++H).
Пример 34: 5-[[(4-Фторфенил)тио](2,3,6-трифторфенил)метил]-4-метилпиридин-2-карбоновая кислота
К раствору 2-бром-5-[[(4-фторфенил)тио](2,3,6-трифторфенил)метил]-4-метилпиридина (2,65 г, 6,00 ммоль) в толуоле (60 мл) добавляли раствор н-бутиллития в гексане (1,54 M, 4,68 мл, 7,20 ммоль) в атмосфере аргона при -78°C. Реакционную смесь перемешивали в течение 30 минут при -40°C и снова охлаждали до -78°C и затем в смесь барботировали диоксид углерода. После перемешивания в течение 30 минут при указанной температуре реакционной смеси давали нагреться до 0°C и добавляли насыщенный водный раствор хлорида аммония. Реакционную смесь концентрировали при пониженном давлении и затем к остатку добавляли хлороформ и 1н. раствор хлористоводородной кислоты. После отделения органического слоя органический слой сушили над безводным сульфатом натрия и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью метиленхлорид:метанол=10:1, концентрировали при пониженном давлении и полученный остаток промывали смешанным растворителем, состоящим из диэтилового эфира и гексана, и собирали фильтрованием с получением указанного в заголовке соединения (981 мг, 2,41 ммоль, 40%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,21 (3H, с), 3,47 (1H, ушир.с), 5,74 (1H, с), 6,73-6,81 (1H, м), 6,90-6,98 (2H, м), 7,00-7,10 (1H, м), 7,29-7,35 (2H, м), 7,93 (1H, с), 9,12 (1H, с).
МС m/z: 408 (М++H).
Пример 35: 5-[[(4-Фторфенил)тио](2,3,6-трифторфенил)метил]-N,N,4-триметилпиридин-2-карбоксамид

К раствору 5-[[(4-фторфенил)тио](2,3,6-трифторфенил)метил]-4-метилпиридин-2-карбоновой кислоты (383 мг, 0,94 ммоль) в метиленхлориде (10 мл) добавляли диметиламингидрохлорид (85 мг, 1,03 ммоль), 1-гидроксибензотриазол (140 мг, 1,03 ммоль), 4-метилморфолин (0,227 мл, 2,07 ммоль) и гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (198 мг, 1,03 ммоль) добавляли при комнатной температуре. После перемешивания в течение 17 часов при комнатной температуре реакционную смесь промывали 0,5н. раствором хлористоводородной кислоты. Органический слой сушили над безводным сульфатом натрия и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=1:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (373 мг, 0,86 ммоль, 91%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,23 (3H, с), 3,12 (3H, с), 3,13 (3H, с), 5,77 (1H, с), 6,75-6,83 (1H, м), 6,91-6,99 (2H, м), 7,02-7,11 (1H, м), 7,33-7,39 (2H, м), 7,42 (1H, с), 9,07 (1H, с).
МС m/z: 435 (М++H).
Пример 36: 5-[[(4-Фторфенил)сульфонил](2,3,6-трифторфенил)метил]-N,N,4-триметилпиридин-2-карбоксамид (соединение A) и 5-[[(4-фторфенил)сульфинил](2,3,6-трифторфенил)метил]-N,N,4-триметилпиридин-2-карбоксамид (соединение B)
К раствору 5-[[(4-фторфенил)тио](2,3,6-трифторфенил)метил]-N,N,4-триметилпиридин-2-карбоксамида (370 мг, 0,85 ммоль) в метиленхлориде (10 мл) добавляли 3-хлорпербензойную кислоту (283 мг, 1,07 ммоль) при 0°C. После перемешивания в течение 18 часов при комнатной температуре реакционную смесь промывали 1н. водным раствором гидроксида натрия. Органический слой сушили над безводным сульфатом натрия и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=1:1, концентрировали при пониженном давлении и полученный остаток промывали смешанным растворителем, состоящим из этанола и диэтилового эфира, и собирали фильтрованием с получением указанного в заголовке соединения (110 мг, 0,24 ммоль, 28%) в виде белого твердого вещества. Затем фракцию, полученную при элюировании смесью гексан:этилацетат=1:4, концентрировали при пониженном давлении и полученный остаток промывали смешанным растворителем, состоящим из этанола и диэтилового эфира, и собирали фильтрованием с получением указанного в заголовке соединения B (157 мг, 0,35 ммоль, 41%) в виде белого твердого вещества.
Соединение A
1H-ЯМР (400 МГц, CDCl3) δ: 2,13 (3H, с), 3,13 (3H, с), 3,15 (3H, с), 5,90 (1H, с), 6,82-6,90 (1H, м), 7,13-7,24 (3H, м), 7,47 (1H, с), 7,75-7,82 (2H, м), 9,40 (1H, с).
ИК (ATR) см-1: 1631, 1587, 1491, 1406, 1329, 1234, 1146.
Аналитически вычислено для C22H18F4N2O3S: C, 56,65; H, 3,89; F, 16,29; N, 6,01; S, 6,87. Найдено: C, 56,63; H, 3,91; F, 16,54; N, 6,01; S, 7,04.
МС m/z: 467 (М++H).
Соединение B
1H-ЯМР (400 МГц, CDCl3) δ: 1,88 (0,9H, с), 2,36 (2,1H, с), 3,10 (0,9H, с), 3,13 (0,9H, с), 3,14 (2,1H, с), 3,15 (2,1H, с), 5,41 (0,3H, с), 5,44 (0,7H, с), 6,72-6,80 (0,7H, м), 6,91-6,98 (0,3H, м), 7,02-7,23 (3H, м), 7,36 (0,3H, с), 7,42-7,47 (0,6H, м), 7,51 (0,7H, с), 7,55-7,61 (1,4H, м), 9,00 (0,3H, с), 9,12 (0,7H, с).
ИК (ATR) см-1: 1637, 1589, 1491, 1223, 1086, 1066.
Аналитически вычислено для C22H18F4N2O2S: C, 58,66; H, 4,03; F, 16,87; N, 6,22; S, 7,12. Найдено: C, 58,51; H, 3,98; F, 16,84; N, 6,15; S, 7,22.
МС m/z: 451 (М++H).
Пример 37: 5-[[(4-Фторфенил)тио](2,3,6-трифторфенил)метил]-4-метилпиридин-2-карбоксамид
К раствору 5-[[(4-фторфенил)тио](2,3,6-трифторфенил)метил]-4-метилпиридин-2-карбоновой кислоты (407 мг, 1,00 ммоль), полученной в Примере 34, в N,N-диметилформамиде (10 мл) добавляли гексафторфосфат (бензотриазол-1-илокси)трипирролидинoфосфония (781 мг, 1,50 ммоль), 1-гидроксибензотриазол (203 мг, 1,50 ммоль), хлорид аммония (107 мг, 2,00 ммоль) и N-этилдиизопропиламин (0,697 мл, 4,00 ммоль) добавляли в атмосфере аргона при комнатной температуре. После перемешивания в течение 16 часов при комнатной температуре к реакционной смеси добавляли этилацетат и полученную смесь промывали 0,5н. раствором хлористоводородной кислоты. Органический слой сушили над безводным сульфатом натрия и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=2:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (392 мг, 0,96 ммоль, 96%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,25 (3H, с), 5,55 (1H, ушир.с), 5,78 (1H, с), 6,75-6,83 (1H, м), 6,92-6,99 (2H, м), 7,02-7,12 (1H, м), 7,32-7,38 (2H, м), 7,84 (1H, ушир.с), 7,96 (1H, с), 9,08 (1H, с).
МС m/z: 407 (М++H).
Пример 38: 5-[[(4-Фторфенил)сульфинил](2,3,6-трифторфенил)метил]-4-метилпиридин-2-карбоксамид

К раствору 5-[[(4-фторфенил)тио](2,3,6-трифторфенил)метил]-4-метилпиридин-2-карбоксамида (389 мг, 0,96 ммоль) в метиленхлориде (10 мл) добавляли 3-хлорпербензойную кислоту (254 мг, 0,96 ммоль) при 0°C. После перемешивания в течение 13 дней при комнатной температуре реакционную смесь промывали 1н. водным раствором гидроксида натрия. Органический слой сушили над безводным сульфатом натрия и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали препаративной тонкослойной хроматографии (проявляли смесью гексан:этилацетат=1:2, элюировали смесью метиленхлорид: метанол=4:1). Полученную фракцию концентрировали при пониженном давлении и полученный остаток промывали смешанным растворителем, состоящим из этанола и диэтилового эфира, и собирали фильтрованием с получением указанного в заголовке соединения (78 мг, 0,18 ммоль, 19%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,36 (3H, с), 5,46 (1H, с), 5,60 (1H, ушир.с), 6,74-6,82 (1H, м), 7,04-7,16 (3H, м), 7,52-7,59 (2H, м), 7,85 (1H, ушир.с), 8,05 (1H, с), 9,12 (1H, с).
ИК (ATR) см-1: 3446, 3209, 1689, 1587, 1495, 1412, 1342, 1230, 1043.
Аналитически вычислено для C20H14F4N2O2S: C, 56,87; H, 3,34; F, 17,99; N, 6,63; S, 7,59. Найдено: C, 56,66; H, 3,38; F, 18,12; N, 6,63; S, 7,65.
МС m/z: 423 (М++H).
Пример 39: 5-[[(4-Фторфенил)сульфонил](2,3,6-трифторфенил)метил]-4-метилпиридин-2-карбоксамид
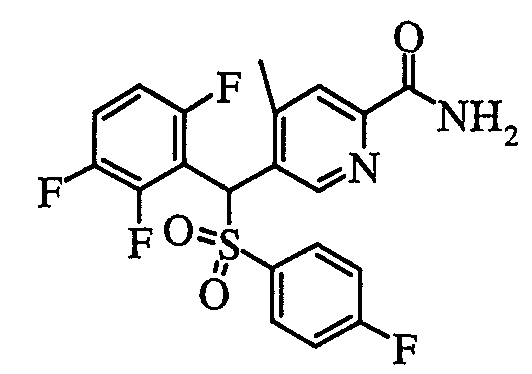
К раствору 5-[[(4-фторфенил)сульфинил](2,3,6-трифторфенил)метил]-4-метилпиридин-2-карбоксамида (106 мг, 0,25 ммоль) в метиленхлориде (5 мл) добавляли 3-хлорпербензойную кислоту (66 мг, 0,25 ммоль) при 0°C. После перемешивания в течение 5 дней при комнатной температуре реакционную смесь промывали 1н. водным раствором гидроксида натрия. Органический слой сушили над безводным сульфатом натрия и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали препаративной тонкослойной хроматографии (проявляли смесью гексан:этилацетат=2:3, элюировали смесью метиленхлорид: метанол=4:1). Полученную фракцию концентрировали при пониженном давлении и полученный остаток промывали смешанным растворителем, состоящим из этанола и диэтилового эфира, и собирали фильтрованием с получением указанного в заголовке соединения (67 мг, 0,15 ммоль, 61%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,14 (3H, с), 5,59 (1H, ушир.с), 5,90 (1H, с), 6,82-6,90 (1H, м), 7,14-7,25 (3H, м), 7,73-7,79 (2H, м), 7,87 (1H, ушир.с), 7,98 (1H, с), 9,43 (1H, с).
ИК (ATR) см-1: 3396, 3167, 1687, 1587, 1496, 1419, 1296, 1234, 1144, 1078, 845, 816.
Аналитически вычислено для C20H14F4N2O3S: C, 54,79; H, 3,22; F, 17,33; N, 6,39; S, 7,31. Найдено: C, 54,54; H, 3,26; F, 17,17; N, 6,37; S, 7,39.
МС m/z: 439 (М++H).
Пример 40: 2-Бром-5-[(2,5-дифторфенил)[(4-метоксифенил)тио]метил]-4-метилпиридин
К раствору 2-бром-5-[хлор(2,5-дифторфенил)метил]-4-метилпиридина (1,00 г, 3,01 ммоль), полученного в Ссылочном примере 2, в N,N-диметилформамиде (15 мл) добавляли 4-метоксибензолтиол (0,381 мл, 3,01 ммоль), а затем карбонат калия (457 мг, 3,31 ммоль), в атмосфере аргона при 0°C и полученную смесь перемешивали в течение 13 часов при комнатной температуре. К реакционной смеси добавляли этилацетат и воду при 0°C и после отделения органического слоя органический слой промывали насыщенным солевым раствором. Органический слой сушили над безводным сульфатом натрия и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=20:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (1,08 г, 2,48 ммоль, 82%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,26 (3H, с), 3,77 (3H, с), 5,66 (1H, с), 6,77 (2H, д, J=8,5 Гц), 6,89-6,98 (2H, м), 7,25 (1H, с), 7,29 (2H, д, J=8,5 Гц), 7,31-7,38 (1H, м), 8,43 (1H, с).
МС m/z: 436, 438 (М++H).
Пример 41: 5-[(2,5-Дифторфенил)[(4-метоксифенил)тио]метил]-4-метилпиридин-2-карбальдегид
К раствору 2-бром-5-[(2,5-дифторфенил)[(4-метоксифенил)тио]метил]-4-метилпиридина (1,08 г, 2,48 ммоль) в толуоле (30 мл) добавляли раствор н-бутиллития в гексане (1,54 M, 1,77 мл, 2,72 ммоль) в атмосфере аргона при -78°C. Реакционную смесь перемешивали в течение 30 минут при -40°C и затем снова охлаждали до -78°C и к смеси добавляли N,N-диметилформамид (0,221 мл, 2,72 ммоль). После перемешивания реакционной смеси в течение 2 часов добавляли воду при указанной температуре и смеси давали нагреться до комнатной температуры. К реакционной смеси добавляли этилацетат и полученную смесь промывали насыщенным солевым раствором. Органический слой сушили над безводным сульфатом натрия и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=10:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (597 мг, 1,55 ммоль, 63%) в виде желтого маслянистого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,36 (3H, с), 3,76 (3H, с), 5,77 (1H, с), 6,77 (2H, д, J=8,8 Гц), 6,93-6,98 (2H, м), 7,29 (2H, д, J=8,8 Гц), 7,42-7,47 (1H, м), 7,71 (1H, с), 8,82 (1H, с), 10,02 (1H, с).
МС m/z: 386 (М++H).
Пример 42: 5-[(2,5-Дифторфенил)[(4-метоксифенил)сульфонил]метил]-4-метилпиридин-2-карбоновая кислота

31% водную перекись водорода (1,50 мл) добавляли к раствору 5-[(2,5-дифторфенил)[(4-метоксифенил)тио]метил]-4-метилпиридин-2-карбальдегида (595 мг, 1,54 ммоль) в муравьиной кислоте (15 мл) и полученную смесь перемешивали в течение 3 часов при комнатной температуре. К реакционной смеси добавляли воду и осажденное таким образом твердое вещество собирали фильтрованием и промывали 0,01н. раствором хлористоводородной кислоты. Полученное твердое вещество растворяли в метиленхлориде и раствор промывали 0,1н. раствором хлористоводородной кислоты. Затем органический слой сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. Полученный остаток промывали смешанным растворителем, состоящим из этанола и гексана, и собирали фильтрованием с получением указанного в заголовке соединения (404 мг, 0,93 ммоль, 60%) в виде твердого вещества белого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 2,25 (3H, с), 3,87 (3H, с), 5,95 (1H, с), 6,91 (2H, д, J=8,8 Гц), 6,93-6,99 (1H, м), 7,01-7,08 (1H, м), 7,59 (2H, д, J=8,8 Гц), 7,80-7,86 (1H, м), 7,98 (1H, с), 9,18 (1H, с).
Т.пл.: 194-195°C.
МС m/z: 434 (М++H).
Пример 43: 5-[(2,5-Дифторфенил)[(4-метоксифенил)сульфонил]метил]-N-(2-гидроксиэтил)-4-метилпиридин-2-карбоксамид
К раствору 5-[(2,5-дифторфенил)[(4-метоксифенил)сульфонил]метил]-4-метилпиридин-2-карбоновой кислоты (108 мг, 0,25 ммоль) в метиленхлориде (3 мл) добавляли 2-аминоэтанол (0,017 мл, 0,28 ммоль), 1-гидроксибензотриазол (37 мг, 0,28 ммоль), 4-метилморфолин (0,030 мл, 0,28 ммоль) и гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (53 мг, 0,28 ммоль) при комнатной температуре. После перемешивания в течение 17 часов при комнатной температуре реакционную смесь промывали водой и затем насыщенным солевым раствором. Органический слой сушили над безводным сульфатом натрия и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=1:4, концентрировали при пониженном давлении и полученный остаток промывали смешанным растворителем, состоящим из этанола и диэтилового эфира, и затем собирали фильтрованием с получением указанного в заголовке соединения (96 мг, 0,20 ммоль, 81%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,15 (3H, с), 2,56 (1H, ушир.с), 3,62-3,68 (2H, м), 3,82-3,88 (2H, м), 3,86 (3H, с), 5,93 (1H, с), 6,90 (2H, д, J=8,8 Гц), 6,92-7,07 (2H, м), 7,57 (2H, д, J=8,8 Гц), 7,82-7,88 (1H, м), 7,93 (1H, с), 8,40 (1H, ушир.т, J=5,6 Гц), 9,11 (1H, с).
ИК (ATR) см-1: 3456, 3367, 1653, 1591, 1535, 1493, 1294, 1265, 1147.
Т.пл.: 134-135°C.
Аналитически вычислено для C23H22F2N2O5S: C, 57,97; H, 4,65; F, 7,97; N, 5,88; S, 6,73. Найдено: C, 57,93; H, 4,39; F, 8,18; N, 5,91; S, 6,79.
МС m/z: 477 (М++H).
Ссылочный пример 5: O-этил S-(3-фтор-4-метоксифенил) дитиокарбонат
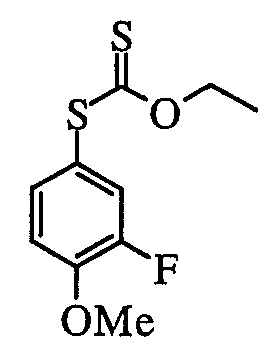
3-Фтор-4-метоксианилин (5,0 г, 35,4 ммоль) растворяли в метаноле (35 мл) и к смеси добавляли 1н. раствор хлористоводородной кислоты (106 мл) при -5°C. Затем к смеси добавляли по каплям раствор нитрита натрия (2,9 г, 42,5 ммоль) в воде (20 мл) и смесь перемешивали в течение 30 минут при указанной температуре. Полученный реакционный раствор добавляли по каплям к раствору О-этилдитиокарбоната калия (8,5 г, 53,1 ммоль) в воде (100 мл) при 65°C. Реакционную смесь нагревали до 90°C, перемешивали в течение 30 минут и затем охлаждали до комнатной температуры. Добавляли воду и смесь экстрагировали два раза этилацетатом. Объединенные органические слои промывали последовательно водой (2 раза), насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором. Органический слой сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=99:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (3,0 г, 12,2 ммоль, 34%) в виде желтого маслянистого вещества.
1H-ЯМР (400 МГц, CDCl3) д: 1,33-1,37 (3H, м), 3,93 (3H, с), 4,60-4,63 (2H, м), 6,98-7,00 (1H, м), 7,23-7,25 (2H, м).
Пример 44: 2-Бром-5-[(2,5-дифторфенил)[(3-фтор-4-метоксифенил)тио]метил]-4-метилпиридин
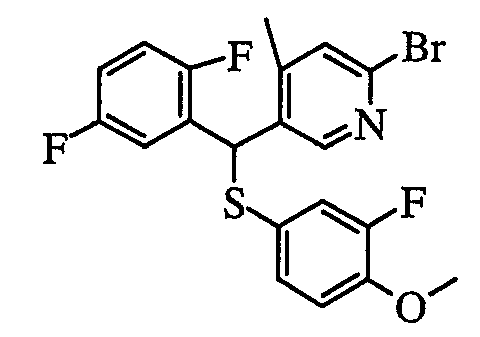
К раствору O-этил S-(3-фтор-4-метоксифенил) дитиокарбоната (1,23 г, 5,00 ммоль) в этаноле (15 мл) добавляли 1н. водный раствор гидроксида натрия (15 мл) и полученную смесь перемешивали в течение 2 часов при 50°C. Реакционную смесь охлаждали до комнатной температуры и промывали метиленхлоридом. Затем водный слой подкисляли 1н. раствором хлористоводородной кислоты и экстрагировали метиленхлоридом. Органический слой сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. К раствору полученного остатка и 2-бром-5-[хлор(2,5-дифторфенил)метил]-4-метилпиридина (1,66 г, 5,00 ммоль), полученного в Ссылочном примере 2, в N,N-диметилформамиде (25 мл) добавляли карбонат калия (760 мг, 5,50 ммоль) в атмосфере азота и полученную смесь перемешивали в течение 19 часов при комнатной температуре. К реакционной смеси добавляли этилацетат и воду при 0°C, органический слой отделяли и затем органический слой промывали насыщенным солевым раствором. Органический слой сушили над безводным сульфатом натрия и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=10:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (1,85 г, 4,07 ммоль, 81%) в виде маслянистого вещества зеленого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 2,29 (3H, с), 3,85 (3H, с), 5,69 (1H, с), 6,79-7,12 (5H, м), 7,28 (1H, с), 7,28-7,33 (1H, м), 8,42 (1H, м).
Пример 45: 5-[(2,5-Дифторфенил)[(3-фтор-4-метоксифенил)тио]метил]-4-метилпиридин-2-карбальдегид

К раствору 2-бром-5-[(2,5-дифторфенил)[(3-фтор-4-метоксифенил)тио]метил]-4-метилпиридина (1,85 г, 4,07 ммоль) в толуоле (40 мл) добавляли раствор н-бутиллития в гексане (1,54 M, 3,17 мл, 4,89 ммоль) в атмосфере аргона при -78°C. Реакционную смесь перемешивали в течение 30 минут при -40°C и затем снова охлаждали до -78°C и добавляли N,N-диметилформамид (0,378 мл, 4,89 ммоль). После завершения добавления по каплям реакционной смеси давали нагреться до 0°C и добавляли воду при указанной температуре. К реакционной смеси добавляли этилацетат, органический слой отделяли и органический слой промывали насыщенным солевым раствором. Органический слой сушили над безводным сульфатом натрия и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=12:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (1,20 г, 2,97 ммоль, 73%) в виде маслянистого вещества желтого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 2,40 (3H, с), 3,85 (3H, с), 5,80 (1H, с), 6,79-6,85 (1H, м), 6,94-7,01 (2H, м), 7,06-7,13 (2H, м), 7,36-7,42 (1H, м), 7,73 (1H, с), 8,82 (1H, м), 10,03 (1H, с).
Пример 46: 5-[(2,5-Дифторфенил)[(3-фтор-4-метоксифенил)сульфонил]метил]-4-метилпиридин-2-карбоновая кислота

31% водную перекись водорода (3 мл) добавляли к раствору 5-[(2,5-дифторфенил)[(3-фтор-4-метоксифенил)тио]метил]-4-метилпиридин-2-карбальдегида (1,20 г, 2,97 ммоль) в муравьиной кислоте (30 мл) и полученную смесь перемешивали в течение 2 часов при комнатной температуре. К реакционной смеси добавляли воду и осажденное таким образом твердое вещество собирали фильтрованием и промывали 0,01н. раствором хлористоводородной кислоты. Полученное твердое вещество растворяли в метиленхлориде и раствор промывали 0,1н. раствором хлористоводородной кислоты. Затем органический слой сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. Полученный остаток промывали смешанным растворителем, состоящим из этанола и гексана, и собирали фильтрованием с получением указанного в заголовке соединения (825 мг, 1,83 ммоль, 61%) в виде твердого вещества белого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 2,31 (3H, с), 3,96 (3H, с), 5,97 (1H, с), 6,91-7,10 (3H, м), 7,37-7,45 (2H, м), 7,72-7,78 (1H, м), 8,02 (1H, с), 9,21 (1H, с).
Т.пл.: 196-197°C.
МС m/z: 452 (М++H).
Пример 47: 5-[(2,5-Дифторфенил)[(3-фтор-4-метоксифенил)сульфонил]метил]-N-(2-гидроксиэтил)-4-метилпиридин-2-карбоксамид

К раствору 5-[(2,5-дифторфенил)[(3-фтор-4-метоксифенил)сульфонил]метил]-4-метилпиридин-2-карбоновой кислоты (113 мг, 0,25 ммоль) в метиленхлориде (3 мл) добавляли 2-аминоэтанол (0,017 мл, 0,28 ммоль), 1-гидроксибензотриазол (37 мг, 0,28 ммоль), 4-метилморфолин (0,030 мл, 0,28 ммоль) и гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (53 мг, 0,28 ммоль) при комнатной температуре. После перемешивания в течение 19 часов при комнатной температуре реакционную смесь промывали водой и затем насыщенным солевым раствором. Органический слой сушили над безводным сульфатом натрия и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании этилацетатом, концентрировали при пониженном давлении и полученный остаток промывали смешанным растворителем, состоящим из этанола и диэтилового эфира, и собирали фильтрованием с получением указанного в заголовке соединения (99 мг, 0,20 ммоль, 80%) в виде твердого вещества белого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 2,22 (3H, с), 2,55 (1H, ушир.с), 3,62-3,68 (2H, м), 3,85 (2H, т, J=4,9 Гц), 3,95 (3H, с), 5,95 (1H, с), 6,92-7,08 (3H, м), 7,37-7,45 (2H, м), 7,74-7,80 (1H, м), 7,96 (1H, с), 8,40 (1H, ушир.т, J=5,4 Гц), 9,14 (1H, с).
ИК (ATR) см-1: 3460, 3371, 1651, 1599, 1535, 1493, 1281, 1219, 1134.
Т.пл.: 137-138°C.
Аналитически вычислено для C23H21F3N2O5S: C, 55,87; H, 4,28; F, 11,53; N, 5,67; S, 6,48. Найдено: C, 55,73; H, 4,00; F, 11,77; N, 5,66; S, 6,58.
МС m/z: 495 (М++H).
Ссылочный пример 6: S-(4-этоксифенил) O-этилдитиокарбонат
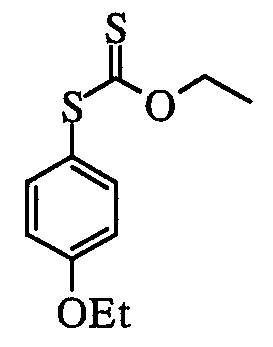
4-Этоксианилин (5,0 г, 36,4 ммоль) растворяли в метаноле (20 мл) и к смеси добавляли при -10°C 1н. раствор хлористоводородной кислоты (110 мл). Затем добавляли по каплям раствор нитрита натрия (3,0 г, 43,7 ммоль) в воде (20 мл) и полученную смесь перемешивали в течение 30 минут при указанной температуре. Полученный реакционный раствор добавляли по каплям к раствору О-этилдитиокарбоната калия (8,8 г, 54,6 ммоль) в воде (100 мл) при 65°C. Реакционную смесь нагревали до 90°C, перемешивали в течение 30 минут и затем охлаждали до комнатной температуры. К смеси добавляли воду и смесь экстрагировали два раза этилацетатом. Объединенные органические слои промывали последовательно водой (2 раза), насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором. Органический слой сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=99:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (2,08 г, 8,58 ммоль, 24%) в виде маслянистого вещества желтого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 1,24-1,43 (6H, м), 4,03-4,07 (2H, м), 4,60 (2H, кв, J=7,1 Гц), 6,92-6,93 (2H, м), 7,38-7,40 (2H, м).
Пример 48: 2-Бром-5-[(2,5-дифторфенил)[(4-этоксифенил)тио]метил]-4-метилпиридин

К раствору S-(4-этоксифенил) O-этилдитиокарбоната (1,45 г, 6,00 ммоль) в этаноле (15 мл) добавляли 1н. водный раствор гидроксида натрия (15 мл) и полученную смесь перемешивали в течение 2 часов при 50°C. Реакционную смесь охлаждали до комнатной температуры и промывали метиленхлоридом. Затем водный слой подкисляли 1н. раствором хлористоводородной кислоты и экстрагировали метиленхлоридом. Органический слой сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. К раствору полученного остатка и 2-бром-5-[хлор(2,5-дифторфенил)метил]-4-метилпиридина (1,66 г, 5,00 ммоль), полученного в Ссылочном примере 2, в N,N-диметилформамиде (25 мл) добавляли карбонат калия (760 мг, 5,50 ммоль) в атмосфере азота и полученную смесь перемешивали в течение 3 часов при комнатной температуре. К реакционной смеси добавляли этилацетат и воду при 0°C, органический слой отделяли и затем органический слой промывали насыщенным солевым раствором. Органический слой сушили над безводным сульфатом натрия и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=20:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (1,18 г, 2,62 ммоль, 52%) в виде твердого вещества светло-зеленого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 1,39 (3H, т, J=7,1 Гц), 2,25 (3H, с), 3,98 (2H, кв, J=7,1 Гц), 5,65 (1H, с), 6,75 (2H, д, J=8,8 Гц), 6,89-6,98 (2H, м), 7,25 (1H, м), 7,27 (2H, д, J=8,8 Гц), 7,31-7,37 (1H, м), 8,43 (1H, м).
Пример 49: 5-[(2,5-Дифторфенил)[(4-этоксифенил)тио]метил]-4-метилпиридин-2-карбальдегид
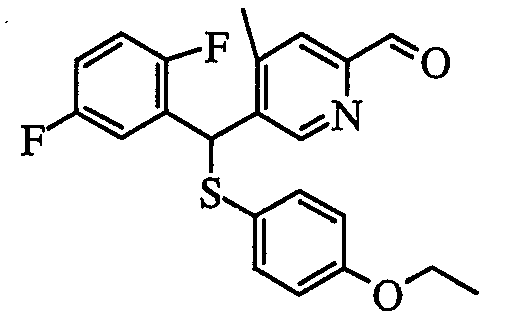
К раствору 2-бром-5-[(2,5-дифторфенил)[(4-этоксифенил)тио]метил]-4-метилпиридина (1,18 г, 2,62 ммоль) в толуоле (30 мл) добавляли раствор н-бутиллития в гексане (1,54 M, 2,04 мл, 3,14 ммоль) в атмосфере аргона при -78°C. Реакционную смесь перемешивали в течение 30 минут при -40°C и затем снова охлаждали до -78°C и к смеси добавляли N,N-диметилформамид (0,243 мл, 3,14 ммоль). После завершения добавления по каплям реакционной смеси давали нагреться до -40°C и добавляли воду при указанной температуре. К реакционной смеси добавляли этилацетат, органический слой отделяли и затем органический слой промывали насыщенным солевым раствором. Органический слой сушили над безводным сульфатом натрия и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=10:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (786 мг, 1,97 ммоль, 75%) в виде твердого вещества белого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 1,38 (3H, т, J=7,1 Гц), 2,36 (3H, с), 3,98 (2H, кв, J=7,1 Гц), 5,76 (1H, с), 6,75 (2H, д, J=8,6 Гц), 6,92-6,99 (2H, м), 7,27 (2H, д, J=8,6 Гц), 7,41-7,48 (1H, м), 7,71 (1H, с), 8,82 (1H, с), 10,02 (1H, с).
Пример 50: 5-[(2,5-Дифторфенил)[(4-этоксифенил)сульфонил]метил]-4-метилпиридин-2-карбоновая кислота

31% водную перекись водорода (2 мл) добавляли к раствору 5-[(2,5-дифторфенил)[(4-этоксифенил)тио]метил]-4-метилпиридин-2-карбальдегида (783 мг, 1,96 ммоль) в муравьиной кислоте (20 мл) и полученную смесь перемешивали в течение 2 часов при комнатной температуре. К реакционной смеси добавляли воду и осажденное таким образом твердое вещество собирали фильтрованием и промывали водой. Полученное твердое вещество растворяли в метиленхлориде и раствор промывали 0,1н. раствором хлористоводородной кислоты. Затем органический слой сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. Полученный остаток промывали смешанным растворителем, состоящим из этанола и гексана, и собирали фильтрованием с получением указанного в заголовке соединения (797 мг, 1,78 ммоль, 91%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 1,44 (3H, т, J=7,1 Гц), 2,24 (3H, с), 4,08 (2H, кв, J=7,1 Гц), 5,95 (1H, с), 6,89 (2H, д, J=8,8 Гц), 6,92-6,99 (1H, м), 7,01-7,08 (1H, м), 7,57 (2H, д, J=8,8 Гц), 7,80-7,86 (1H, м), 7,98 (1H, с), 9,17 (1H, с).
МС m/z: 448 (М++H).
Пример 51: 5-[(2,5-Дифторфенил)[(4-этоксифенил)сульфонил]метил]-N-(2-гидроксиэтил)-4-метилпиридин-2-карбоксамид

К раствору 5-[(2,5-дифторфенил)[(4-этоксифенил)сульфонил]метил]-4-метилпиридин-2-карбоновой кислоты (112 мг, 0,25 ммоль) в метиленхлориде (3 мл) добавляли 2-аминоэтанол (0,017 мл, 0,28 ммоль), 1-гидроксибензотриазол (37 мг, 0,28 ммоль), 4-метилморфолин (0,030 мл, 0,28 ммоль) и гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (53 мг, 0,28 ммоль) при комнатной температуре. После перемешивания в течение 3 часов при комнатной температуре реакционную смесь промывали водой и затем насыщенным солевым раствором. Органический слой сушили над безводным сульфатом натрия и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=1:2, концентрировали при пониженном давлении и полученный остаток промывали смешанным растворителем, состоящим из этанола и диэтилового эфира, и собирали фильтрованием с получением указанного в заголовке соединения (97 мг, 0,20 ммоль, 79%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 1,44 (3H, т, J=7,1 Гц), 2,15 (3H, с), 2,57 (1H, ушир.т, J=5,1 Гц), 3,62-3,68 (2H, м), 3,82-3,88 (2H, м), 4,07 (2H, кв, J=7,1 Гц), 5,93 (1H, с), 6,87 (2H, д, J=8,8 Гц), 6,92-7,06 (2H, м), 7,56 (2H, д, J=8,8 Гц), 7,82-7,89 (1H, м), 7,92 (1H, с), 8,40 (1H, ушир.т, J=5,6 Гц), 9,11 (1H, с).
ИК (ATR) см-1: 3381, 1668, 1593, 1527, 1493, 1321, 1269, 1140.
Аналитически вычислено для C24H24F2N2O5S: C, 58,77; H, 4,93; F, 7,75; N, 5,71; S, 6,54. Найдено: C, 58,41; H, 4,90; F, 7,91; N, 5,73; S, 6,66.
МС m/z: 491 (М++H).
Ссылочный пример 7: 5-(Трифторметил)пиридин-2-тиол
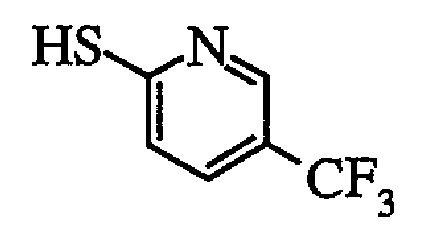
Тиомочевину (684 мг, 8,80 ммоль) добавляли к раствору 2-хлор-5-(трифторметил)пиридина (1,45 г, 8,00 ммоль) в этаноле (4 мл) и полученную смесь нагревали до температуры кипения с обратным холодильником в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры, затем к смеси добавляли раствор гидроксида калия (792 мг, 12,0 ммоль) в воде (4 мл) и полученную смесь нагревали до температуры кипения с обратным холодильником в течение 2 часов. Реакционную смесь охлаждали снова до комнатной температуры и к смеси добавляли 1н. раствор гидроксида натрия и метиленхлорид. После отделения водного слоя к водному слою добавляли уксусную кислоту и смесь экстрагировали метиленхлоридом. Органический слой сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. Полученный остаток промывали смешанным растворителем, состоящим из гексана и диэтилового эфира, и собирали фильтрованием с получением указанного в заголовке соединения (860 мг, 4,80 ммоль, 60%) в виде твердого вещества бледно-желтого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 7,45 (1H, дд, J=9,0, 2,2 Гц), 7,59 (1H, д, J=9,0 Гц), 7,81 (1H, м).
МС m/z: 180 (М++H).
Пример 52: 2-Бром-5-[(2,5-дифторфенил)[[5-(трифторметил)пиридин-2-ил]тио]метил]-4-метилпиридин

К раствору 2-бром-5-[хлор(2,5-дифторфенил)метил]-4-метилпиридина (1,59 г, 4,78 ммоль), полученного в Ссылочном примере 2, в N,N-диметилформамиде (25 мл) добавляли 5-(трифторметил)пиридин-2-тиол (857 мг, 4,78 ммоль), затем карбонат калия (992 мг, 7,18 ммоль) в атмосфере аргона при 0°C и полученную смесь перемешивали в течение 2 часов при комнатной температуре. К реакционной смеси добавляли этилацетат и воду при 0°C, органический слой отделяли и затем органический слой промывали насыщенным солевым раствором. Органический слой сушили над безводным сульфатом натрия и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=20:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (1,97 г, 4,15 ммоль, 87%) в виде маслянистого вещества светло-зеленого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 2,43 (3H, с), 6,72 (1H, с), 6,93-7,07 (2H, м), 7,19-7,25 (1H, м), 7,28 (1H, д, J=8,3 Гц), 7,32 (1H, с), 7,70 (1H, дд, J=8,3, 2,2 Гц), 8,35 (1H, м), 8,58-8,60 (1H, м).
МС m/z: 475, 477 (М++H).
Пример 53: 5-[(2,5-Дифторфенил)[[5-(трифторметил)пиридин-2-ил]тио]метил]-4-метилпиридин-2-карбальдегид
К раствору 2-бром-5-[(2,5-дифторфенил)[[5-(трифторметил)пиридин-2-ил]тио]метил]-4-метилпиридина (1,97 г, 4,15 ммоль) в толуоле (45 мл) добавляли раствор н-бутиллития в гексане (1,54 M, 3,23 мл, 4,97 ммоль) в атмосфере аргона при -78°C. Реакционную смесь перемешивали в течение 30 минут при -40°C и затем снова охлаждали до -78°C и к смеси добавляли N,N-диметилформамид (0,385 мл, 4,97 ммоль). После завершения добавления по каплям реакционной смеси давали нагреться до 0°C и добавляли воду при указанной температуре. К реакционной смеси добавляли этилацетат, органический слой отделяли и затем органический слой промывали насыщенным солевым раствором. Органический слой сушили над безводным сульфатом натрия и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=15:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (1,07, 2,52 ммоль, 61%) в виде маслянистого вещества желтого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 2,56 (3H, с), 6,85 (1H, с), 6,95-7,09 (2H, м), 7,23-7,29 (1H, м), 7,31 (1H, д, J=8,5 Гц), 7,71 (1H, дд, J=8,5, 2,0 Гц), 7,79 (1H, м), 8,58-8,60 (1H, м), 8,79 (1H, с), 10,02 (1H, с).
Пример 54: 5-[(2,5-Дифторфенил)[[5-(трифторметил)пиридин-2-ил]сульфонил]метил]-4-метилпиридин-2-карбоновая кислота

31% водную перекись водорода (2 мл) добавляли к раствору 5-[(2,5-дифторфенил)[[5-(трифторметил)пиридин-2-ил]тио]метил]-4-метилпиридин-2-карбальдегида (1,07 г, 2,52 ммоль) в муравьиной кислоте (20 мл) и полученную смесь перемешивали в течение 2 часов при комнатной температуре. К реакционной смеси добавляли воду и осажденное таким образом твердое вещество собирали фильтрованием и промывали водой. Полученное твердое вещество растворяли в метиленхлориде и раствор промывали 0,1н. раствором хлористоводородной кислоты. Затем органический слой сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. Полученный остаток промывали смешанным растворителем, состоящим из этанола и гексана, и собирали фильтрованием с получением указанного в заголовке соединения (604 мг, 1,28 ммоль, 51%) в виде твердого вещества белого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 2,63 (3H, с), 6,95 (1H, с), 6,97-7,07 (2H, м), 7,67-7,73 (1H, м), 8,09 (1H, с), 8,15-8,17 (2H, м), 8,96 (1H, с), 9,07 (1H, с).
МС m/z: 473 (М++H).
Пример 55: 5-[(2,5-Дифторфенил)[[5-(трифторметил)пиридин-2-ил]сульфонил]метил]-N-(2-гидроксиэтил)-4-метилпиридин-2-карбоксамид

К раствору 5-[(2,5-дифторфенил)[[5-(трифторметил)пиридин-2-ил]сульфонил]метил]-4-метилпиридин-2-карбоновой кислоты (118 мг, 0,25 ммоль) в метиленхлориде (3 мл) добавляли 2-аминоэтанол (0,017 мл, 0,28 ммоль), 1-гидроксибензотриазол (37 мг, 0,28 ммоль), 4-метилморфолин (0,030 мл, 0,28 ммоль) и гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (53 мг, 0,28 ммоль) при комнатной температуре. После перемешивания в течение 5 часов при комнатной температуре реакционную смесь промывали водой и затем насыщенным солевым раствором. Органический слой сушили над безводным сульфатом натрия и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=1:1, концентрировали при пониженном давлении и полученный остаток промывали гексаном и сушили при пониженном давлении с получением указанного в заголовке соединения (91 мг, 0,18 ммоль, 71%) в виде бесцветного пенистого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,46 (1H, ушир.с), 2,55 (3H, с), 3,61-3,66 (2H, м), 3,83 (2H, ушир.т, J=5,1 Гц), 6,90 (1H, с), 6,97-7,07 (2H, м), 7,66-7,72 (1H, м), 8,02 (1H, с), 8,12-8,15 (2H, м), 8,34 (1H, ушир.т, J=5,6 Гц), 8,96 (1H, с), 9,03 (1H, с).
ИК (ATR) см-1: 3377, 1664, 1529, 1495, 1325, 1165, 1138, 1099, 1072.
Аналитически вычислено для C22H18F5N3O4S: C, 51,26; H, 3,52; F, 18,43; N, 8,15; S, 6,22. Найдено: C, 51,39; H, 3,61; F, 18,36; N, 8,04; S, 6,31.
МС m/z: 516 (М++H).
Пример 56: 2-Бром-5-[(2,5-дифторфенил)(фенилтио)метил]-4-метилпиридин
2-Бром-5-[хлор(2,5-дифторфенил)метил]-4-метилпиридин (2,0 г, 6,0 ммоль), полученный в Ссылочном примере 2, и бензолтиол (618 мкл, 6,0 ммоль) растворяли в N,N-диметилформамиде (30 мл), к смеси добавляли при 0°C карбонат калия (996 мг, 7,2 ммоль) и затем полученную смесь перемешивали в течение ночи при комнатной температуре. К реакционной смеси добавляли воду и смесь экстрагировали два раза этилацетатом. Объединенные органические слои промывали насыщенным солевым раствором, затем сушили над безводным сульфатом натрия и фильтровали и фильтрат концентрировали при пониженном давлении. Полученное твердое вещество промывали смешанным раствором гексана и этилацетата и фильтровали с получением указанного в заголовке соединения (1,6 г, 3,9 ммоль, 66%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,31 (3H, с), 5,81 (1H, с), 6,93-7,00 (2H, м), 7,22-7,39 (7H, м), 8,37 (1H, с).
Пример 57: 5-[(2,5-Дифторфенил)(фенилтио)метил]-4-метилпиридин-2-карбальдегид
Раствор 2-бром-5-[(2,5-дифторфенил)(фенилтио)метил]-4-метилпиридина (1,2 г, 3,0 ммоль) в толуоле (30 мл) охлаждали до -78°C и добавляли н-бутиллитий (1,54 М раствор в гексане, 2,5 мл, 3,9 ммоль) в атмосфере аргона. После перемешивания в течение 10 минут при указанной температуре смеси давали нагреться до -40°C, перемешивали в течение 30 минут и снова охлаждали до -78°C и к смеси добавляли N,N-диметилформамид (302 мкл, 3,9 ммоль). После перемешивания в течение 30 минут при указанной температуре к смеси добавляли воду и смесь экстрагировали два раза этилацетатом. Объединенные органические слои промывали насыщенным солевым раствором, затем сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=93:7, концентрировали при пониженном давлении с получением указанного в заголовке соединения (250 мг, 0,70 ммоль, 25%) в виде бесцветного маслянистого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,42 (3H, с), 5,91 (1H, с), 6,95-7,01 (2H, м), 7,23-7,32 (5H, м), 7,44-7,47 (1H, м), 7,74 (1H, с), 8,78 (1H, с), 10,02 (1H, с).
Пример 58: 5-[(2,5-Дифторфенил)(фенилсульфонил)метил]-4-метилпиридин-2-карбоновая кислота
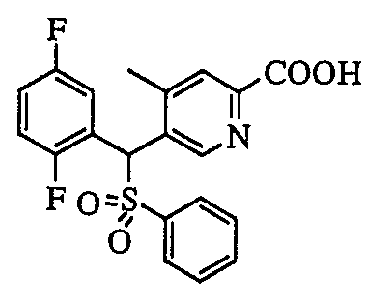
5-[(2,5-Дифторфенил)(фенилтио)метил]-4-метилпиридин-2-карбальдегид (250 мг, 0,70 ммоль) растворяли в муравьиной кислоте (7 мл) и к смеси добавляли 31% водную перекись водорода (0,7 мл) при 0°C. После перемешивания в течение 3 часов при комнатной температуре к реакционному раствору добавляли воду и осажденное таким образом твердое вещество собирали фильтрованием. Твердое вещество промывали достаточным количеством воды и затем сушили при пониженном давлении с получением указанного в заголовке соединения (90 мг, 0,22 ммоль, 32%) в виде твердого вещества белого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 2,23 (3H, с), 5,99 (1H, с), 6,91-7,08 (2H, м), 7,46-7,52 (2H, м), 7,64-7,70 (3H, м), 7,80-7,84 (1H, м), 7,98 (1H, с), 9,20 (1H, с).
МС m/z: 404 (М++H).
Пример 59: 5-[(2,5-Дифторфенил)(фенилсульфонил)метил]-N-(2-гидроксиэтил)-4-метилпиридин-2-карбоксамид

5-[(2,5-Дифторфенил)(фенилсульфонил)метил]-4-метилпиридин-2-карбоновую кислоту (90 мг, 0,22 ммоль), 2-аминоэтанол (27 мл, 0,45 ммоль), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (64 мг, 0,34 ммоль), 1-гидроксибензотриазол (30 мг, 0,22 ммоль) и триэтиламин (92 мл, 0,66 ммоль) растворяли в метиленхлориде (15 мл) и полученный раствор перемешивали в течение ночи при комнатной температуре. К реакционной смеси добавляли воду и полученную смесь экстрагировали два раза метиленхлоридом. Объединенные органические слои сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. Полученный остаток очищали препаративной тонкослойной хроматографией (проявляли 5% метанола/метиленхлорид, элюировали 30% метанола/метиленхлорид) с получением указанного в заголовке соединения (30 мг, 0,067 ммоль, 30%) в виде аморфного вещества белого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 2,14 (3H, с), 2,52-2,56 (1H, м), 3,62-3,68 (2H, м), 3,82-3,87 (2H, м), 5,97 (1H, с), 6,90-7,07 (2H, м), 7,43-7,49 (2H, м), 7,62-7,69 (3H, м), 7,81-7,87 (1H, м), 7,93 (1H, с), 8,39 (1H, ушир.с), 9,13 (1H, с).
ИК (ATR) см-1: 3413, 2940, 1662, 1650, 1529, 1496, 1307, 1143.
МС m/z: 447 (М++H).
FAB-МС: 447,1194 (вычислено для C22H21F2N2O4S: 447,1190).
Пример 60: 2-Бром-5-[(2,5-дифторфенил)[(4-метилфенил)тио]метил]-4-метилпиридин
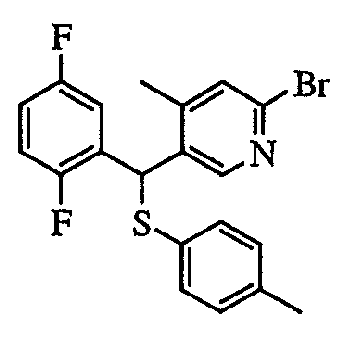
2-Бром-5-[хлор(2,5-дифторфенил)метил]-4-метилпиридин (2,0 г, 6,0 ммоль), полученный в Ссылочном примере 2, и 4-метилбензолтиол (746 мг, 6,0 ммоль) растворяли в N,N-диметилформамиде (30 мл) и к смеси добавляли карбонат калия (996 мг, 7,2 ммоль) при 0°C. Затем смесь перемешивали в течение ночи при комнатной температуре. К реакционной смеси добавляли воду, смесь экстрагировали два раза этилацетатом. Объединенные органические слои промывали насыщенным солевым раствором, затем сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=95:5, концентрировали при пониженном давлении с получением указанного в заголовке соединения (2,5 г, 6,0 ммоль, количественный) в виде маслянистого вещества светло-зеленого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 2,29 (3H, с), 2,30 (3H, с), 5,75 (1H, с), 6,90-6,99 (2H, м), 7,05 (2H, д, J=8,1 Гц), 7,21 (2H, д, J=7,8 Гц), 7,26 (1H, с), 7,33-7,39 (1H, м), 8,38 (1H, с).
Пример 61: 5-[(2,5-Дифторфенил)[(4-метилфенил)тио]метил]-4-метилпиридин-2-карбальдегид
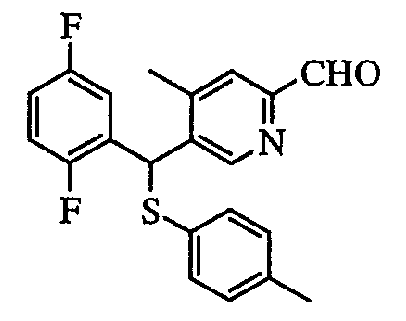
Раствор 2-бром-5-[(2,5-дифторфенил)[(4-метилфенил)тио]-метил]-4-метилпиридина (2,5 г, 6,0 ммоль) в толуоле (60 мл) охлаждали до -78°C и в атмосфере аргона к смеси добавляли н-бутиллитий (1,54 М раствор в гексане, 4,6 мл, 7,1 ммоль). После перемешивания в течение 10 минут при указанной температуре смеси давали нагреться до -40°C и перемешивали в течение 30 минут. Смесь снова охлаждали до -78°C и затем добавляли N,N-диметилформамид (720 мл, 7,1 ммоль). После перемешивания в течение 30 минут при указанной температуре добавляли воду и смесь экстрагировали два раза этилацетатом. Объединенные органические слои промывали насыщенным солевым раствором, затем сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=95:5, концентрировали при пониженном давлении с получением указанного в заголовке соединения (900 мг, 2,4 ммоль, 41%) в виде маслянистого вещества бледно-желтого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 2,29 (3H, с), 2,41 (3H, с), 5,85 (1H, с), 6,96-6,98 (2H, м), 7,05 (2H, д, J=8,1 Гц), 7,22 (2H, д, J=8,1 Гц), 7,45-7,47 (1H, м), 7,72 (1H, с), 8,78 (1H, с), 10,02 (1H, с).
Пример 62: 5-[(2,5-Дифторфенил)[(4-метилфенил)сульфонил]метил]-4-метилпиридин-2-карбоновая кислота

5-[(2,5-Дифторфенил)[(4-метилфенил)тио]метил]-4-метилпиридин-2-карбальдегид (900 мг, 2,4 ммоль) растворяли в муравьиной кислоте (20 мл) и добавляли 31% водную перекись водорода (2,5 мл) при 0°C. После перемешивания в течение 5 часов при комнатной температуре к реакционному раствору добавляли воду и осажденное таким образом твердое вещество собирали фильтрованием. Твердое вещество промывали достаточным количеством воды и затем сушили при пониженном давлении с получением указанного в заголовке соединения (520 мг, 1,2 ммоль, 51%) в виде твердого вещества белого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 2,23 (3H, с), 2,43 (3H, с), 5,97 (1H, с), 6,92-7,08 (2H, м), 7,26 (2H, д, J=8,3 Гц), 7,56 (2H, д, J=8,3 Гц), 7,81-7,86 (1H, м), 7,98 (1H, с), 9,17 (1H, с).
МС m/z: 418 (М++H).
Пример 63: 5-[(2,5-Дифторфенил)[(4-метилфенил)сульфонил]метил]-N-(2-гидроксиэтил)-4-метилпиридин-2-карбоксамид
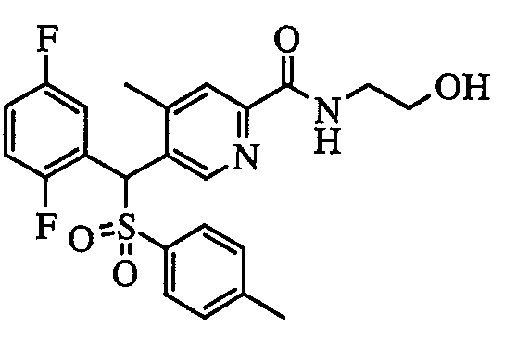
5-[(2,5-Дифторфенил)[(4-метилфенил)сульфонил]метил]-4-метилпиридин-2-карбоновую кислоту (208 мг, 0,5 ммоль), 2-аминоэтанол (46 мл, 0,75 ммоль), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (144 мг, 0,75 ммоль), 1-гидроксибензотриазол (68 мг, 0,5 ммоль) и триэтиламин (209 мл, 1,5 ммоль) растворяли в метиленхлориде (35 мл) и полученный раствор перемешивали в течение ночи при комнатной температуре. К реакционной смеси добавляли воду и полученную смесь экстрагировали два раза метиленхлоридом. Объединенные органические слои сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. Полученный остаток очищали препаративной тонкослойной хроматографией (проявляли 6% метанола/метиленхлорид, элюировали 30% метанола/метиленхлорид) с получением указанного в заголовке соединения (125 мг, 0,27 ммоль, 54%) в виде аморфного вещества белого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 2,14 (3H, с), 2,42 (3H, с), 2,58 (1H, т, J=5,2 Гц), 3,62-3,67 (2H, м), 3,85 (2H, кв, J=5,2 Гц), 5,95 (1H, с), 6,92-7,07 (2H, м), 7,24 (2H, д, J=8,3 Гц), 7,54 (2H, д, J=8,3 Гц), 7,83-7,88 (1H, м), 7,92 (1H, с), 8,40 (1H, ушир.с), 9,11 (1H, с).
ИК (ATR) см-1: 3388, 1664, 1594, 1527, 1492, 1145.
МС m/z: 461 (М++H).
Аналитически вычислено для C23H22F2N2O4S: C, 59,99; H, 4,82; F, 8,25; N, 6,08; S, 6,96. Найдено: C, 59,94; H, 4,81; F, 8,03; N, 5,94; S, 6,81.
Ссылочный пример 8: S-(4-хлор-3-метилфенил) O-этил дитиокарбонат
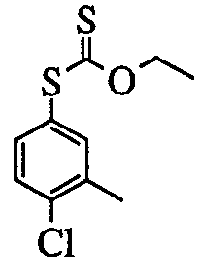
4-Хлор-3-метиланилин (4,5 г, 31,8 ммоль) растворяли в метаноле (20 мл) и добавляли 1н. раствор хлористоводородной кислоты (95 мл) при -5°C. Затем к смеси добавляли по каплям раствор нитрита натрия (2,6 г, 38,2 ммоль) в воде (20 мл) и смесь перемешивали в течение 30 минут при указанной температуре. Полученный реакционный раствор добавляли по каплям к раствору О-этилдитиокарбоната калия (7,6 г, 47,7 ммоль) в воде (100 мл) при 65°C. Реакционную смесь нагревали до 90°C, перемешивали в течение 30 минут и затем охлаждали до комнатной температуры. Добавляли воду и смесь экстрагировали два раза этилацетатом. Объединенные органические слои промывали последовательно водой (2 раза), насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором, сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=99:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (3,9 г, 15,8 ммоль, 50%) в виде маслянистого вещества светло-коричневого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 1,34 (3H, т, J=7,1 Гц), 2,39 (3H, с), 4,61 (2H, кв, J=7, 1 Гц), 7,25-7,40 (3H, м).
Пример 64: 2-Бром-5-[[(4-хлор-3-метилфенил)тио](2,5-дифторфенил)метил]-4-метилпиридин

К раствору S-(4-хлор-3-метилфенил) O-этилдитиокарбоната (3,9 г, 15,8 ммоль) в этаноле (50 мл) и тетрагидрофуране (20 мл) добавляли 1н. водный раствор гидроксида натрия (48 мл) и полученную смесь перемешивали в течение 3 часов при 60°C. Реакционную смесь охлаждали до комнатной температуры, добавляли воду и смесь промывали метиленхлоридом. Водный слой подкисляли 5н. раствором хлористоводородной кислоты и затем экстрагировали метиленхлоридом. Органический слой сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. Полученный остаток и 2-бром-5-[хлор(2,5-дифторфенил)метил]-4-метилпиридин (4,5 г, 13,8 ммоль), полученный в Ссылочном примере 2, растворяли в N,N-диметилформамиде (80 мл) и к смеси добавляли карбонат калия (2,4 г, 18 ммоль), затем перемешивали в течение ночи при комнатной температуре. К реакционной смеси добавляли воду и смесь экстрагировали два раза этилацетатом. Объединенные органические слои промывали насыщенным солевым раствором, затем сушили над безводным сульфатом натрия и фильтровали и фильтрат концентрировали при пониженном давлении. Полученное твердое вещество промывали смешанным раствором гексана и этилацетата и фильтровали с получением указанного в заголовке соединения (4,3 г, 9,5 ммоль, 60%) в виде светло-коричневого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,29 (3H, с), 2,31 (3H, с), 5,78 (1H, с), 6,93-7,33 (7H, м), 8,39 (1H, с).
МС m/z: 454, 456 (М++H).
Пример 65: 5-[[(4-Хлор-3-метилфенил)тио](2,5-дифторфенил)метил]-4-метилпиридин-2-карбальдегид
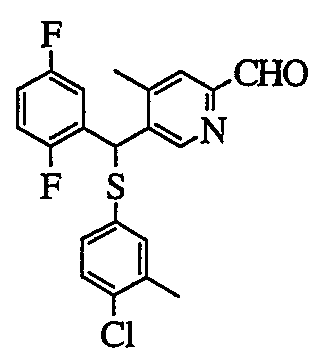
Раствор 2-бром-5-[[(4-хлор-3-метилфенил)тио](2,5-дифторфенил)метил]-4-метилпиридина (2,0 г, 4,4 ммоль) в толуоле (50 мл) охлаждали до -78°C и в атмосфере аргона к смеси добавляли н-бутиллитий (1,54 М раствор в гексане, 3,4 мл, 5,3 ммоль). После перемешивания в течение 10 минут при указанной температуре смеси давали нагреться до -40°C, перемешивали в течение 30 минут и снова охлаждали до -78°C и затем добавляли N,N-диметилформамид (409 мкл, 5,3 ммоль). После перемешивания в течение 30 минут при указанной температуре добавляли воду и смесь экстрагировали два раза этилацетатом. Объединенные органические слои промывали насыщенным солевым раствором, затем сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=95:5, концентрировали при пониженном давлении с получением указанного в заголовке соединения (700 мг, 1,7 ммоль, 40%) в виде бесцветного маслянистого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,29 (3H, с), 2,43 (3H, с), 5,88 (1H, с), 6,99-7,05 (3H, м), 7,19-7,21 (2H, м), 7,38-7,41 (1H, м), 7,75 (1H, с), 8,79 (1H, с), 10,02 (1H, с).
МС m/z: 404 (М++H).
Пример 66: 5-[[(4-Хлор-3-метилфенил)сульфонил](2,5-дифторфенил)метил]-4-метилпиридин-2-карбоновая кислота
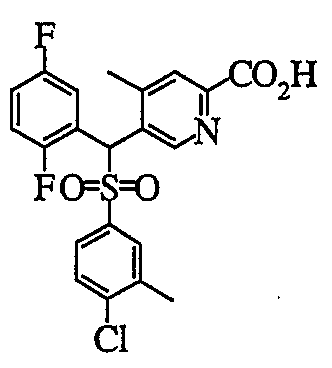
5-[[(4-Хлор-3-метилфенил)тио](2,5-дифторфенил)метил]-4-метилпиридин-2-карбальдегид (700 мг, 1,7 ммоль) растворяли в муравьиной кислоте (15 мл) и добавляли 31% водную перекись водорода (1,7 мл) при 0°C. После перемешивания в течение 2 часов при комнатной температуре к реакционной смеси добавляли воду и осажденное таким образом твердое вещество собирали фильтрованием. Твердое вещество промывали достаточным количеством воды и сушили при пониженном давлении с получением указанного в заголовке соединения (600 мг, 1,3 ммоль, 78%) в виде твердого вещества белого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 2,31 (3H, с), 2,38 (3H, с), 5,97 (1H, с), 6,93-7,09 (2H, м), 7,41-7,44 (2H, м), 7,56-7,57 (1H, м), 7,73-7,77 (1H, м), 8,03 (1H, с), 9,22 (1H, с).
МС m/z: 452 (М++H).
Пример 67: 5-[[(4-Хлор-3-метилфенил)сульфонил](2,5-дифторфенил)метил]-N-(2-гидроксиэтил)-4-метилпиридин-2-карбоксамид
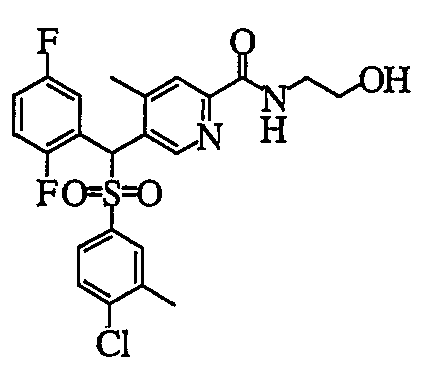
5-[[(4-Хлор-3-метилфенил)сульфонил](2,5-дифторфенил)метил]-4-метилпиридин-2-карбоновую кислоту (300 мг, 0,66 ммоль), 2-аминоэтанол (60 мкл, 0,99 ммоль), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (191 мг, 0,99 ммоль), 1-гидроксибензотриазол (89 мг, 0,66 ммоль) и триэтиламин (275 мкл, 1,98 ммоль) растворяли в метиленхлориде (60 мл) и полученную смесь перемешивали в течение ночи при комнатной температуре. К реакционной смеси добавляли воду и смесь экстрагировали два раза метиленхлоридом. Объединенные органические слои сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. Полученный остаток очищали препаративной тонкослойной хроматографией (проявляли 5% метанола/метиленхлорид, элюировали 30% метанола/метиленхлорид) с получением указанного в заголовке соединения (190 мг, 0,38 ммоль, 58%) в виде белого аморфного вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,22 (3H, с), 2,38 (3H, с), 2,58-2,59 (1H, м), 3,65-3,66 (2H, м), 3,84-3,86 (2H, м), 5,95 (1H, с), 6,92-7,07 (2H, м), 7,37-7,43 (2H, м), 7,55 (1H, с), 7,74-7,80 (1H, м), 7,97 (1H, с), 8,40 (1H, ушир.с), 9,14 (1H, с).
ИК (ATR) см-1: 3390, 1664, 1527, 1492, 1147, 1049,
МС m/z: 495 (М++H).
Аналитически вычислено для C23H21ClF2N2O4S·0,25H2O: C, 55,31; H, 4,34; Cl 7,10; F, 7,61; N, 5,61; S, 6,42. Найдено: C, 55,29; H, 4,24; Cl 7,50; F, 7,56; N, 5,64; S, 6,51.
Ссылочный пример 9: O-этил S-(4-фтор-3-метилфенил) дитиокарбонат
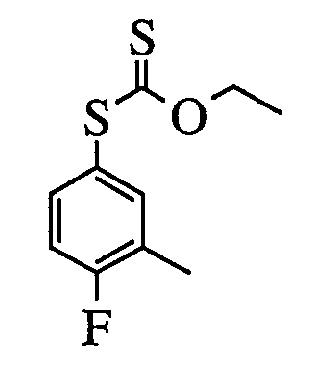
4-Фтор-3-метиланилин (5,0 г, 40 ммоль) растворяли в метаноле (20 мл) и к смеси добавляли 1н. раствор хлористоводородной кислоты (120 мл) при -5°C. Затем добавляли по каплям раствор нитрита натрия (3,3 г, 48 ммоль) в воде (20 мл) и затем полученную смесь перемешивали в течение 30 минут при указанной температуре. Полученный реакционный раствор добавляли по каплям к раствору О-этилдитиокарбоната калия (9,6 г, 60 ммоль) в воде (100 мл) при 65°C. Реакционную смесь нагревали до 90°C, перемешивали в течение 30 минут и затем охлаждали до комнатной температуры. Добавляли воду и смесь экстрагировали два раза этилацетатом. Объединенные слои промывали последовательно водой (2 раза), насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором, затем сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=99:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (4,0 г, 17,4 ммоль, 43%) в виде маслянистого вещества желтого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 1,30-1,35 (3H, м), 2,29 (3H, с), 4,59-4,63 (2H, м), 7,05 (1H, т, J=8,9 Гц), 7,26-7,37 (2H, м).
Пример 68: 2-Бром-5-[(2,5-дифторфенил)[(4-фтор-3-метилфенил)тио]метил]-4-метилпиридин

К раствору O-этил S-(4-фтор-3-метилфенил) дитиокарбоната (4,0 г, 17,4 ммоль) в этаноле (55 мл) и тетрагидрофуране (10 мл) добавляли 1н. водный раствор гидроксида натрия (48 мл) и смесь перемешивали в течение 3 часов при 60°C. Реакционную смесь охлаждали до комнатной температуры, добавляли воду и затем смесь промывали метиленхлоридом. Водный слой подкисляли 5н. раствором хлористоводородной кислоты и затем экстрагировали метиленхлоридом. Органический слой сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. Полученный остаток и 2-бром-5-[хлор(2,5-дифторфенил)метил]-4-метилпиридин (4,8 г, 14,7 ммоль), полученный в Ссылочном примере 2, растворяли в N,N-диметилформамиде (80 мл) и к смеси добавляли карбонат калия (2,6 г, 19,2 ммоль), затем перемешивали в течение ночи при комнатной температуре. К реакционной смеси добавляли воду и полученную смесь экстрагировали два раза этилацетатом. Объединенные органические слои промывали насыщенным солевым раствором, затем сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. Полученное твердое вещество промывали смешанным раствором гексана и этилацетата и затем фильтровали с получением указанного в заголовке соединения (3,1 г, 7,1 ммоль, 41%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,19 (3H, с), 2,28 (3H, с), 5,71 (1H, с), 6,85-7,33 (7H, м), 8,43 (1H, с).
МС m/z: 438, 440 (М++H).
Пример 69: 5-[(2,5-Дифторфенил)[(4-фтор-3-метилфенил)тио]метил]-4-метилпиридин-2-карбальдегид
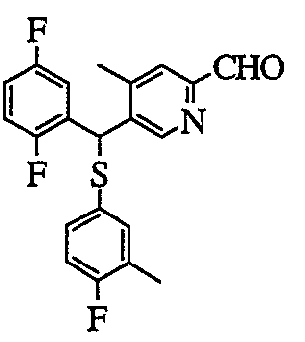
Раствор 2-бром-5-[(2,5-дифторфенил)[(4-фтор-3-метилфенил)тио]метил]-4-метилпиридина (2,0 г, 4,6 ммоль) в толуоле (50 мл) охлаждали до -78°C и в атмосфере аргона к смеси добавляли н-бутиллитий (1,54 М раствор в гексане, 3,6 мл, 5,5 ммоль). После перемешивания в течение 10 минут при указанной температуре смеси давали нагреться до -40°C, перемешивали в течение 30 минут и снова охлаждали до -78°C и затем добавляли N,N-диметилформамид (424 мл, 5,5 ммоль). После перемешивания в течение 30 минут при указанной температуре добавляли воду и смесь экстрагировали два раза этилацетатом. Объединенные органические слои промывали насыщенным солевым раствором, затем сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=95:5, концентрировали при пониженном давлении с получением указанного в заголовке соединения (1,1 г, 2,8 ммоль, 63%) в виде бесцветного маслянистого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,18 (3H, с), 2,39 (3H, с), 5,82 (1H, с), 6,85-6,99 (3H, м), 7,09-7,19 (2H, м), 7,37-7,41 (1H, м), 7,73 (1H, с), 8,82 (1H, с), 10,02 (1H, с).
МС m/z: 388 (М++H).
Пример 70: 5-[(2,5-Дифторфенил)[(4-фтор-3-метилфенил)сульфонил]метил]-4-метилпиридин-2-карбоновая кислота

5-[(2,5-Дифторфенил)[(4-фтор-3-метилфенил)тио]метил]-4-метилпиридин-2-карбальдегид (1,1 г, 2,8 ммоль) растворяли в муравьиной кислоте (20 мл) и к смеси добавляли 31% водную перекись водорода (2,8 мл) при 0°C. После перемешивания в течение 2 часов при комнатной температуре к реакционному раствору добавляли воду и осажденное таким образом твердое вещество собирали фильтрованием. Твердое вещество промывали достаточным количеством воды и сушили при пониженном давлении с получением указанного в заголовке соединения (1,0 г, 2,3 ммоль, 81%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,28 (3H, с), 2,30 (3H, с), 5,96 (1H, с), 6,93-7,10 (3H, м), 7,48-7,58 (2H, м), 7,73-7,77 (1H, м), 8,02 (1H, с), 9,23 (1H, с).
МС m/z: 436 (М++H).
Пример 71: 5-[(2,5-Дифторфенил)[(4-фтор-3-метилфенил)сульфонил]метил]-N-(2-гидроксиэтил)-4-метилпиридин-2-карбоксамид

5-[(2,5-Дифторфенил)[(4-фтор-3-метилфенил)сульфонил]метил]-4-метилпиридин-2-карбоновую кислоту (300 мг, 0,69 ммоль), 2-аминоэтанол (60 мл, 1,0 ммоль), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (193 мг, 1,0 ммоль), 1-гидроксибензотриазол (93 мг, 0,69 ммоль) и триэтиламин (292 мкл, 2,1 ммоль) растворяли в метиленхлориде (60 мл) и раствор перемешивали в течение ночи при комнатной температуре. К реакционной смеси добавляли воду и смесь экстрагировали два раза метиленхлоридом. Объединенные органические слои сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. Полученный остаток очищали препаративной тонкослойной хроматографией (проявляли 5% метанола/метиленхлорид, элюировали 30% метанола/метиленхлорид) с получением указанного в заголовке соединения (190 мг, 0,39 ммоль, 58%) в виде белого аморфного вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,21 (3H, с), 2,27 (3H, с), 2,57 (1H, т, J=5,2 Гц), 3,63-3,67 (2H, м), 3,85 (2H, кв, J=5,2 Гц), 5,94 (1H, с), 6,92-7,08 (3H, м), 7,44-7,49 (1H, м), 7,54-7,57 (1H, м), 7,74-7,78 (1H, м), 7,96 (1H, с), 8,40 (1H, ушир.с), 9,15 (1H, с).
ИК (ATR) см-1: 3388, 1664, 1527, 1490, 1240, 1141.
МС m/z: 479 (М++H).
Аналитически вычислено для C23H21F3N2O4S: C, 57,73; H, 4,42; F, 11,91; N, 5,85; S, 6,70. Найдено: C, 57,57; H, 4,63; F, 11,66; N, 5,60; S, 6,59.
Пример 72: 5-[(2,5-Дифторфенил)[(4-фторфенил)сульфонил]метил]-4-метил-N-[3-(метилтио)пропил]пиридин-2-карбоксамид

К раствору 5-[(2,5-дифторфенил)[(4-фторфенил)сульфонил]метил]-4-метилпиридин-2-карбоновой кислоты (222 мг, 0,527 ммоль), полученной в Примере 12, в метиленхлориде (5 мл) добавляли 3-метилтиопропиламин (66 мг, 0,632 ммоль), 1-гидроксибензотриазол (71 мг, 0,527 ммоль), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (121 мг, 0,632 ммоль) и 4-метилморфолин (69 мл, 0,632 ммоль). Реакционный раствор перемешивали в течение 3 дней при комнатной температуре и концентрировали при пониженном давлении. Полученный в результате концентрирования остаток подвергали колоночной хроматографии на силикагеле и фракцию, полученную при элюировании смесью этилацетат:метиленхлорид=1:20, концентрировали при пониженном давлении с получением указанного в заголовке соединения (253 мг, 0,497 ммоль, 94%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 1,90-2,00 (2H, м), 2,13 (3H, с), 2,20 (3H, с), 2,60 (2H, т, J=7,2 Гц), 3,55-3,65 (2H, м), 5,95 (1H, с), 6,90-7,20 (4H, м), 7,66-7,75 (2H, м), 7,75-7,84 (1H, м), 7,96 (1H, с), 8,13-8,20 (1H, м), 9,14 (1H, с).
ИК (ATR) см-1: 3421, 1679, 1589, 1525, 1494, 1295, 1278, 1234, 1143, 850, 825.
МС m/z: 509 (М++H).
Пример 73: 5-[(2,5-Дифторфенил)[(4-фторфенил)сульфонил]метил]-4-метил-N-[3-(метилсульфинил)пропил]пиридин-2-карбоксамид
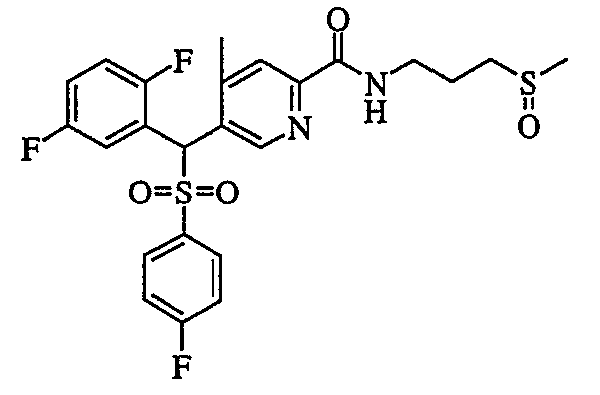
К раствору 5-[(2,5-дифторфенил)[(4-фторфенил)сульфонил]метил]-4-метил-N-[3-(метилтио)пропил]пиридин-2-карбоксамида (149 мг, 0,293 ммоль) в метиленхлориде (5 мл) добавляли 3-хлорпербензойную кислоту (51 мг, 0,293 ммоль) при охлаждении льдом и смесь перемешивали в течение 30 минут. При охлаждении льдом к реакционному раствору добавляли 3-хлорпербензойную кислоту (20 мг, 0,116 ммоль) и полученную смесь перемешивали в течение 15 минут. К реакционному раствору добавляли 1н. водный раствор гидроксида натрия и смесь экстрагировали метиленхлоридом. Органический слой сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. Полученный в результате концентрирования остаток подвергали колоночной хроматографии на силикагеле и фракцию, полученную при элюировании смесью метанол:метиленхлорид=1:30, концентрировали при пониженном давлении. К полученному в результате концентрирования остатку добавляли этилацетат-гексан и осажденное таким образом твердое вещество собирали фильтрованием с получением указанного в заголовке соединения (122 мг, 0,232 ммоль, 79%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 2,10-2,20 (2H, м), 2,23 (3H, с), 2,58-2,61 (3H, м), 2,76-2,83 (2H, м), 3,60-3,71 (2H, м), 5,96 (1H, с), 6,90-7,09 (2H, м), 7,11-7,19 (2H, м), 7,68-7,74 (2H, м), 7,75-7,82 (1H, м), 7,96 (1H, с), 8,21-8,29 (1H, м), 9,15 (1H, с).
ИК (ATR) см-1: 3394, 1670, 1590, 1525, 1492, 1319, 1288, 1236, 1149, 1049.
Т.пл.: 170-173°C.
МС m/z: 525 (М++H).
Аналитически вычислено для C24H23F3N2O4S2: C, 54,95; H, 4,42; F, 10,87; N, 5,34; S, 12,23. Найдено: C, 54,96; H, 4,34; F, 11,14; N, 5,42; S, 12,20.
Пример 74: 5-[(2,5-Дифторфенил)[(4-фторфенил)сульфонил]метил]-4-метил-N-[3-(метилсульфонил)пропил]пиридин-2-карбоксамид

К раствору 5-[(2,5-дифторфенил)[(4-фторфенил)сульфонил]метил]-4-метил-N-[3-(метилтио)пропил]пиридин-2-карбоксамида (100 мг, 0,197 ммоль), полученного в Примере 72, в метиленхлориде (5 мл) добавляли 3-хлорпербензойную кислоту (68 мг, 0,393 ммоль). Реакционный раствор перемешивали в течение 15 минут при комнатной температуре и затем добавляли 3-хлорпербензойную кислоту (30 мг, 0,174 ммоль). Реакционный раствор перемешивали в течение 15 минут при комнатной температуре. К реакционному раствору добавляли 1н. водный раствор гидроксида натрия и смесь экстрагировали метиленхлоридом. Органический слой сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. Полученный в результате концентрирования остаток подвергали колоночной хроматографии на силикагеле и фракцию, полученную при элюировании смесью метиленхлорид:этилацетат=3:2, концентрировали при пониженном давлении. К полученному в результате концентрирования остатку добавляли этилацетат-гексан и осажденное таким образом твердое вещество собирали фильтрованием с получением указанного в заголовке соединения (79 мг, 0,146 ммоль, 74%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 2,17-2,28 (2H, м), 2,23 (3H, с), 2,93 (3H, с), 3,09-3,17 (2H, м), 3,62-3,70 (2H, м), 5,96 (1H, с), 6,90-7,09 (2H, м), 7,10-7,20 (2H, м), 7,67-7,82 (3H, м), 7,95 (1H, с), 8,18-8,28 (1H, м), 9,15 (1H, с).
ИК (ATR) см-1: 3392, 1668, 1590, 1525, 1494, 1317, 1288, 1236, 1151, 1141, 1081.
Т.пл.: 182-185°C.
МС m/z: 541 (М++H).
Аналитически вычислено для C24H23F3N2O5S2: C, 53,32; H, 4,29; F, 10,54; N, 5,18; S, 11,86. Найдено: C, 53,38; H, 4,24; F, 10,54; N, 5,19; S, 12,01.
Пример 75: 5-[(2,5-Дифторфенил)[(4-фторфенил)сульфонил]метил]-N-[2-гидрокси-1-(гидроксиметил)этил]-4-метилпиридин-2-карбоксамид
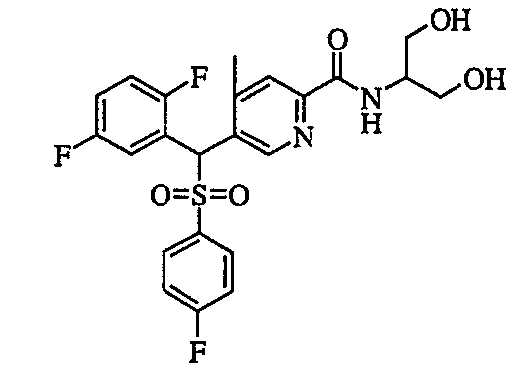
К раствору 5-[(2,5-дифторфенил)[(4-фторфенил)сульфонил]метил]-4-метилпиридин-2-карбоновой кислоты (93 мг, 0,221 ммоль), полученной в Примере 12, в метиленхлориде (3 мл) добавляли 2-амино-1,3-пропандиол (24 мг, 0,265 ммоль), 1-гидроксибензотриазол (30 мг, 0,221 ммоль), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (51 мг, 0,265 ммоль) и 4-метилморфолин (29 мкл, 0,265 ммоль) и полученную смесь перемешивали в течение 17 часов при комнатной температуре. К реакционному раствору добавляли этилацетат и смесь промывали последовательно насыщенным раствором гидрокарбоната натрия и насыщенным солевым раствором. Органический слой сушили над безводным сульфатом натрия и фильтровали и фильтрат концентрировали при пониженном давлении. Полученный в результате концентрирования остаток подвергали колоночной хроматографии на силикагеле и фракцию, полученную при элюировании смесью метанол:метиленхлорид=1:20, концентрировали при пониженном давлении. К полученному в результате концентрирования остатку добавляли этилацетат-гексан и осажденное таким образом твердое вещество собирали фильтрованием с получением указанного в заголовке соединения (81 мг, 0,164 ммоль, 74%) в виде порошка белого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 2,21 (3H, с), 2,46-2,57 (2H, м), 3,87-4,03 (4H, м), 4,10-4,19 (1H, м), 5,96 (1H, с), 6,90-7,09 (2H, м), 7,11-7,19 (2H, м), 7,67-7,74 (2H, м), 7,75-7,82 (1H, м), 7,96 (1H, с), 8,63 (1H, ушир.д, J=7,6 Гц), 9,17 (1H, с).
ИК (ATR) см-1: 3421, 3278, 1639, 1590, 1536, 1494, 1319, 1292, 1234, 1143, 1076, 1041.
Т.пл.: 150-152°C.
МС m/z: 495 (М++H).
Аналитически вычислено для C23H21F3N2O5S: C, 55,87; H, 4,28; F, 11,53; N, 5,67; S, 6,48. Найдено: C, 55,74; H, 4,13; F, 11,74; N, 5,68; S, 6,63.
Пример 76: 1-[[5-[(2,5-Дифторфенил)[(4-фторфенил)сульфонил]метил]-4-метилпиридин-2-ил]карбонил]пиперидин-4-ол
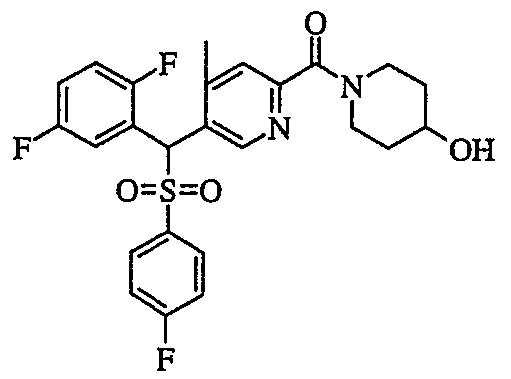
К раствору 5-[(2,5-дифторфенил)[(4-фторфенил)сульфонил]метил]-4-метилпиридин-2-карбоновой кислоты (94 мг, 0,223 ммоль), полученной в Примере 12, в метиленхлориде (3 мл) добавляли 4-гидроксипиперидин (27 мг, 0,268 ммоль), 1-гидроксибензотриазол (30 мг, 0,223 ммоль), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (51 мг, 0,268 ммоль) и 4-метилморфолин (29 мкл, 0,268 ммоль) и полученную смесь перемешивали в течение 18 часов при комнатной температуре. К реакционному раствору добавляли этилацетат и смесь промывали последовательно водным раствором гидрокарбоната натрия и насыщенным солевым раствором. Органический слой сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. Полученный в результате концентрирования остаток подвергали колоночной хроматографии на силикагеле и фракцию, полученную при элюировании смесью метанол:метиленхлорид=1:30, концентрировали при пониженном давлении. К полученному в результате концентрирования остатку добавляли этилацетат-гексан и осажденное таким образом твердое вещество собирали фильтрованием с получением указанного в заголовке соединения (76 мг, 0,151 ммоль, 68%) в виде порошка белого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 1,60-1,72 (2H, м), 1,90-2,09 (2H, м), 2,25 (3H, с), 3,30-3,50 (2H, м), 3,82-4,08 (2H, м), 4,12-4,28 (1H, м), 5,95 (1H, с), 6,89-6,98 (1H, м), 7,00-7,08 (1H, м), 7,10-7,20 (2H, м), 7,46 (1H, с), 7,70-7,80 (3H, м), 9,17 (1H, с).
ИК (ATR) см-1: 3463, 1606, 1589, 1492, 1444, 1326, 1282, 1238, 1147, 1081, 1027.
Т.пл.: 171-173°C.
МС m/z: 505 (М++H).
Аналитически вычислено для C25H23F3N2O4S: C, 59,52; H, 4,59; F, 11,30; N, 5,55; S, 6,36. Найдено: C, 59,43; H, 4,68; F, 11,41; N, 5,55; S, 6,53.
Пример 77: 4-[[5-[(2,5-Дифторфенил)[(4-фторфенил)сульфонил]метил]-4-метилпиридин-2-ил]карбонил]морфолин
К раствору 5-[(2,5-дифторфенил)[(4-фторфенил)сульфонил]метил]-4-метилпиридин-2-карбоновой кислоты (119 мг, 0,282 ммоль), полученной в Примере 12, в метиленхлориде (3 мл) добавляли морфолин (30 мкл, 0,339 ммоль), 1-гидроксибензотриазол (38 мг, 0,282 ммоль), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (65 мг, 0,339 ммоль) и 4-метилморфолин (37 мкл, 0,339 ммоль). Реакционный раствор перемешивали в течение 5 дней при комнатной температуре и концентрировали при пониженном давлении. Полученный в результате концентрирования остаток подвергали колоночной хроматографии на силикагеле и фракцию, полученную при элюировании смесью 65% этилацетата/гексан, концентрировали при пониженном давлении. К полученному в результате концентрирования остатку добавляли этилацетат-гексан и осажденное таким образом твердое вещество собирали фильтрованием с получением указанного в заголовке соединения (94 мг, 0,192 ммоль, 68%) в виде порошка белого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 2,26 (3H, с), 3,68-3,86 (8H, м), 5,95 (1H, с), 6,89-7,08 (2H, м), 7,10-7,20 (2H, м), 7,53 (1H, с), 7,70-7,80 (3H, м), 9,17 (1H, с).
ИК (ATR) см-1: 1629, 1590, 1492, 1461, 1324, 1280, 1226, 1147, 1114, 1083.
Т.пл.: 165-167°C.
МС m/z: 491 (М++H).
Аналитически вычислено для C24H21F3N2O4S: C, 58,77; H, 4,32; F, 11,62; N, 5,71; S, 6,54. Найдено: C, 58,81; H, 4,25; F, 11,94; N, 5,78; S, 6,71.
Пример 78: 5-[(2,5-Дифторфенил)[(4-фторфенил)сульфонил]метил]-N-метокси-4-метилпиридин-2-карбоксамид
К раствору 5-[(2,5-дифторфенил)[(4-фторфенил)сульфонил]метил]-4-метилпиридин-2-карбоновой кислоты (96 мг, 0,228 ммоль), полученной в Примере 12, в метиленхлориде (3 мл) добавляли гидрохлорид O-метилгидроксиамина (23 мг, 0,273 ммоль), 1-гидроксибензотриазол (31 мг, 0,228 ммоль), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (52 мг, 0,273 ммоль) и 4-метилморфолин (59 мл, 0,546 ммоль). Реакционный раствор перемешивали в течение 5 дней при комнатной температуре и концентрировали при пониженном давлении. Полученный в результате концентрирования остаток подвергали колоночной хроматографии на силикагеле и фракцию, полученную при элюировании смесью 65% этилацетата/гексан, концентрировали при пониженном давлении с получением белого твердого вещества. Полученное твердое вещество промывали смесью этилацетат-гексан и затем собирали фильтрованием с получением указанного в заголовке соединения (66 мг, 0,147 ммоль, 64%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 2,22 (3H, с), 3,91 (3H, с), 5,94 (1H, с), 6,90-7,10 (2H, м), 7,11-7,20 (2H, м), 7,65-7,80 (3H, м), 7,95 (1H, с), 9,11 (1H, с), 10,21 (1H, ушир.с).
ИК (ATR) см-1: 3343, 1689, 1587, 1475, 1295, 1238, 1207, 1172, 1141, 1112, 1079.
Т.пл.: 231-234°C.
МС m/z: 451 (М++H).
Аналитически вычислено для C21H17F3N2O4S: C, 56,00; H, 3,80; F, 12,65; N, 6,22; S, 7,12. Найдено: C, 56,00; H, 3,80; F, 12,85; N, 6,32; S, 7,23.
Пример 79: 5-[(2,5-Дифторфенил)[(4-фторфенил)сульфонил]метил]-N-метокси-N,4-диметилпиридин-2-карбоксамид
К раствору 5-[(2,5-дифторфенил)[(4-фторфенил)сульфонил]метил]-4-метилпиридин-2-карбоновой кислоты (99 мг, 0,235 ммоль), полученной в Примере 12, в метиленхлориде (3 мл) добавляли гидрохлорид N,O-диметилгидроксиамин (28 мг, 0,282 ммоль), 1-гидроксибензотриазол (32 мг, 0,235 ммоль), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (54 мг, 0,382 ммоль) и 4-метилморфолин (61 мл, 0,564 ммоль). Реакционный раствор перемешивали в течение 5 дней при комнатной температуре и концентрировали при пониженном давлении. Полученный в результате концентрирования остаток подвергали колоночной хроматографии на силикагеле и фракцию, полученную при элюировании смесью гексан:этилацетат=1:1, концентрировали при пониженном давлении. К полученному в результате концентрирования остатку добавляли этилацетат-гексан и осажденное таким образом твердое вещество собирали фильтрованием с получением указанного в заголовке соединения (73 мг, 0,157 ммоль, 67%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 2,21 (3H, с), 3,42 (3H, ушир.с), 3,81 (3H, с), 5,95 (1H, с), 6,90-7,09 (2H, м), 7,10-7,19 (2H, м), 7,48-7,59 (1H, м), 7,68-7,81 (3H, м), 9,20 (1H, с).
ИК (ATR) см-1: 1631, 1590, 1490, 1425, 1324, 1286, 1232, 1147, 1083, 987, 904.
Т.пл.: 156-158°C.
МС m/z: 465 (М++H).
Аналитически вычислено для C22H19F3N2O4S: C, 56,89; H, 4,12; F, 12,27; N, 6,03; S, 6,90. Найдено: C, 56,96; H, 4,11; F, 12,53; N, 6,08; S, 7,02.
Пример 80: этиловый эфир N-[[5-[(2,5-дифторфенил)[(4-фторфенил)сульфонил]метил]-4-метилпиридин-2-ил]карбонил]-β-аланина
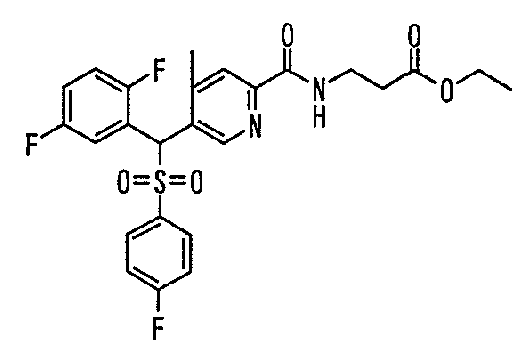
К раствору 5-[(2,5-дифторфенил)[(4-фторфенил)сульфонил]метил]-4-метилпиридин-2-карбоновой кислоты (106 мг, 0,252 ммоль), полученной в Примере 12, в метиленхлориде (3 мл) добавляли гидрохлорид этилового эфира β-аланина (46 мг, 0,302 ммоль), 1-гидроксибензотриазол (34 мг, 0,252 ммоль), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (58 мг, 0,302 ммоль) и 4-метилморфолин (66 мл, 0,604 ммоль). Реакционный раствор перемешивали в течение 15 часов при комнатной температуре и концентрировали при пониженном давлении. Полученный в результате концентрирования остаток подвергали колоночной хроматографии на силикагеле и фракцию, полученную при элюировании смесью гексан:этилацетат=1:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (126 мг, 0,242 ммоль, 96%) в виде аморфного вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 1,29 (3H, т, J=7,1 Гц), 2,20 (3H, с), 2,64 (2H, т, J=6,1 Гц), 3,70-3,79 (2H, м), 4,20 (2H, кв, J=7,1 Гц), 5,95 (1H, с), 6,90-7,09 (2H, м), 7,14 (2H, т, J=8,6 Гц), 7,65-7,73 (2H, м), 7,76-7,83 (1H, м), 7,95 (1H, с), 8,40-8,50 (1H, м), 9,14 (1H, с).
ИК (ATR) см-1: 3396, 1727, 1671, 1589, 1521, 1492, 1326, 1292, 1236, 1186, 1147, 1081.
МС m/z: 520 (М+).
Пример 81: N-[[5-[(2,5-дифторфенил)[(4-фторфенил)сульфонил]метил]-4-метилпиридин-2-ил]карбонил]-β-аланин

К раствору этилового эфира N-[[5-[(2,5-дифторфенил)[(4-фторфенил)сульфонил]метил]-4-метилпиридин-2-ил]карбонил]-β-аланина (120 мг, 0,231 ммоль) в тетрагидрофуране (5 мл) и воде (3 мл) добавляли моногидрат гидроксида лития (12 мг, 0,277 ммоль) и смесь перемешивали в течение 2,5 часов при комнатной температуре. К реакционному раствору добавляли 1н. раствор хлористоводородной кислоты (0,3 мл) и воду и смесь экстрагировали метиленхлоридом. Органический слой сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. К полученному в результате концентрирования остатку добавляли этилацетат-гексан и осажденное таким образом твердое вещество собирали фильтрованием с получением указанного в заголовке соединения (102 мг, 0,207 ммоль, 90%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 2,20 (3H, с), 2,74 (2H, т, J=6,3 Гц), 3,78 (2H, кв, J=6,3 Гц), 5,95 (1H, с), 6,90-7,09 (2H, м), 7,14 (2H, т, J=8,5 Гц), 7,65-7,75 (2H, м), 7,76-7,82 (1H, м), 7,96 (1H, с), 8,47 (1H, ушир.т, J=6,3 Гц), 9,17 (1H, с).
ИК (ATR) см-1: 3062, 2969, 1716, 1654, 1589, 1531, 1490, 1326, 1230, 1182, 1145, 1085.
Т.пл.: 223-226°C.
МС m/z: 493 (М++H).
Аналитически вычислено для C23H19F3N2O5S: C, 56,09; H, 3,89; F, 11,57; N, 5,69; S, 6,51. Найдено: C, 56,00; H, 3,91; F, 11,57; N, 5,67; S, 6,60.
Пример 82: Трет-бутил [2-[[[5-[(2,5-дифторфенил)[(4-фторфенил)сульфонил]метил]-4-метилпиридин-2-ил]карбонил]амино]этил]карбамат
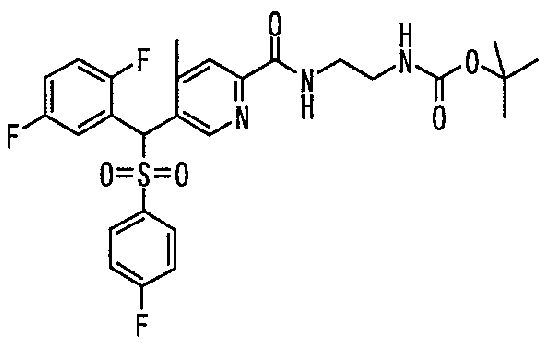
К раствору 5-[(2,5-дифторфенил)[(4-фторфенил)сульфонил]метил]-4-метилпиридин-2-карбоновой кислоты (374 мг, 0,888 ммоль), полученной в Примере 12, в метиленхлориде (10 мл) добавляли трет-бутил (2-аминоэтил)карбамат (170 мкл, 1,07 ммоль), 1-гидроксибензотриазол (120 мг, 0,888 ммоль), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (206 мг, 1,07 ммоль) и 4-метилморфолин (116 мкл, 1,07 ммоль) и смесь перемешивали в течение 19 часов при комнатной температуре. К реакционному раствору добавляли этилацетат и смесь промывали последовательно насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором. Органический слой сушили над безводным сульфатом натрия и фильтровали и фильтрат концентрировали при пониженном давлении. Полученный в результате концентрирования остаток подвергали колоночной хроматографии на силикагеле и фракцию, полученную при элюировании смесью гексан:этилацетат=1:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (491 мг, 0,871 ммоль, 98%) в виде аморфного вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 1,43 (9H, с), 2,20 (3H, с), 3,32-3,45 (2H, м), 3,53-3,65 (2H, м), 4,87-4,97 (1H, м), 5,95 (1H, с), 6,90-7,09 (2H, м), 7,14 (2H, т, J=8,4 Гц), 7,67-7,82 (3H, м), 7,95 (1H, с), 8,25-8,35 (1H, м), 9,15 (1H, с).
ИК (ATR) см-1: 3334, 1700, 1670, 1589, 1521, 1492, 1365, 1328, 1236, 1145, 1081.
МС m/z: 564 (М++H).
Пример 83: N-[2-(ацетиламино)этил]-5-[(2,5-дифторфенил)[(4-фторфенил)сульфонил]метил]-4-метилпиридин-2-карбоксамид
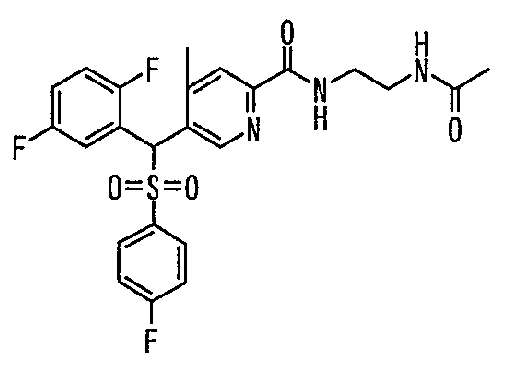
К раствору трет-бутил [2-[[[5-[(2,5-дифторфенил)[(4-фторфенил)сульфонил]метил]-4-метилпиридин-2-ил]карбонил]амино]этил]карбамата (90 мг, 0,160 ммоль) в метиленхлориде (5 мл) добавляли трифторуксусную кислоту (2 мл) и полученную смесь перемешивали в течение 2,5 часов при комнатной температуре. Реакционный раствор концентрировали при пониженном давлении и к смеси добавляли метиленхлорид и 0,5н. водный раствор гидроксида натрия. Органический слой отделяли, сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. Полученный в результате концентрирования остаток растворяли в метиленхлориде (5 мл) и к смеси добавляли уксусный ангидрид (23 мкл, 0,240 ммоль), триэтиламин (26 мкл, 0,240 ммоль) и каталитическое количество 4-диметиламинопиридина. Реакционный раствор перемешивали в течение 20 часов при комнатной температуре и концентрировали при пониженном давлении. Полученный в результате концентрирования остаток подвергали колоночной хроматографии на силикагеле и фракцию, полученную при элюировании смесью метанол:метиленхлорид=1:20, концентрировали при пониженном давлении с получением указанного в заголовке соединения (79 мг, 0,156 ммоль, 98%) в виде аморфного вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 1,99 (3H, с), 2,23 (3H, с), 3,46-3,54 (2H, м), 3,58-3,59 (2H, м), 5,96 (1H, с), 6,18-6,28 (1H, м), 6,90-7,09 (2H, м), 7,15 (2H, т, J=8,5 Гц), 7,77-7,92 (3H, м), 7,96 (1H, с), 8,33-8,43 (1H, м), 9,16 (1H, с).
ИК (ATR) см-1: 3392, 3361, 1587, 1536, 1490, 1454, 1317, 1276, 1232, 1147.
МС m/z: 505 (М+).
Аналитически вычислено для C24H22F3N3O4S: C, 57,02; H, 4,39; F, 11,27; N, 8,31; S, 6,34. Найдено: C, 56,88; H, 4,47; F, 11,45; N, 8,25; S, 6,44.
Пример 84: Метил [2-[[[5-[(2,5-дифторфенил)[(4-фторфенил)сульфонил]метил]-4-метилпиридин-2-ил]карбонил]амино]этил]карбамат
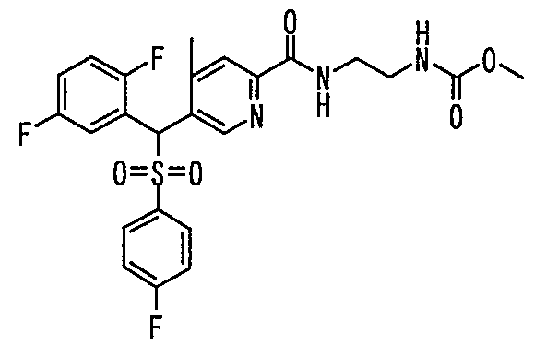
К раствору трет-бутил [2-[[[5-[(2,5-дифторфенил)[(4-фторфенил)сульфонил]метил]-4-метилпиридин-2-ил]карбонил]амино]этил]карбамата (90 мг, 0,160 ммоль), полученного в Примере 82, в метиленхлориде (5 мл) добавляли трифторуксусную кислоту (2 мл) и смесь перемешивали в течение 3 часов при комнатной температуре. Реакционный раствор концентрировали при пониженном давлении и к смеси добавляли метиленхлорид и 0,5н. водный раствор гидроксида натрия. Органический слой отделяли, затем сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. Полученный в результате концентрирования остаток растворяли в метиленхлориде (5 мл) и к смеси добавляли метилхлорформиат (19 мл, 0,240 ммоль) и триэтиламин (26 мл, 0,240 ммоль). Реакционный раствор перемешивали в течение 20 часов при комнатной температуре и концентрировали при пониженном давлении. Полученный в результате концентрирования остаток подвергали колоночной хроматографии на силикагеле и фракцию, полученную при элюировании смесью 60% этилацетата/гексан, концентрировали при пониженном давлении. К полученному в результате концентрирования остатку добавляли этилацетат-гексан и осажденное таким образом твердое вещество собирали фильтрованием с получением указанного в заголовке соединения (71 мг, 0,136 ммоль, 85%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 2,21 (3H, с), 3,40-3,48 (2H, м), 3,58-3,65 (2H, м), 3,68 (3H, с), 5,11-5,22 (1H, м), 5,96 (1H, с), 6,90-7,09 (2H, м), 7,15 (2H, т, J=8,5 Гц), 7,68-7,73 (2H, м), 7,75-7,82 (1H, м), 7,95 (1H, с), 8,28-8,35 (1H, м), 9,15 (1H, с).
ИК (ATR) см-1: 3396, 3340, 1718, 1670, 1589, 1533, 1490, 1452, 1315, 1270, 1234, 1145.
Т.пл.: 167-169°C.
МС m/z: 521 (М+).
Аналитически вычислено для C24H22F3N3O5S: C, 55,27; H, 4,25; F, 10,93; N, 8,06; S, 6,15. Найдено: C, 55,23; H, 4,21; F, 11,13; N, 7,96; S, 6,20.
Пример 85: 5-[(2,5-дифторфенил)[(4-фторфенил)сульфонил]метил]-N-(1-гидроксиметил)-4-метилпиридин-2-карбоксамид
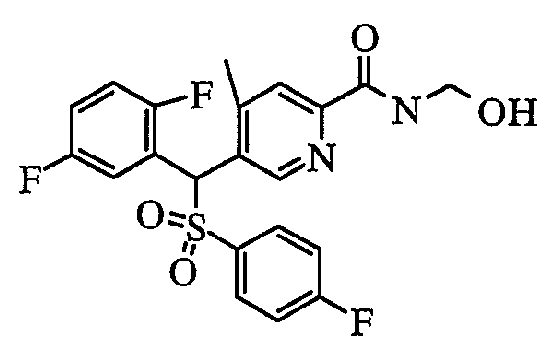
К раствору 5-[(2,5-дифторфенил)[(4-фторфенил)сульфонил]метил]-4-метилпиридин-2-карбоксамида (744 мг, 1,84 ммоль), полученного в Примере 15, в диметиловом эфире этиленгликоля (8 мл)добавляли водный раствор формальдегида (37%, 0,4 мл) и 5% водный раствор гидроксида натрия (1,6 мл) при 0°C и полученную смесь перемешивали в течение 3 часов при комнатной температуре. К реакционной смеси добавляли карбонат натрия (80 мг) и смесь перемешивали в течение 10 минут при комнатной температуре. Смесь концентрировали при пониженном давлении и затем остаток растворяли в хлороформе, сушили над сульфатом магния и фильтровали. Затем фильтрат концентрировали при пониженном давлении и полученный остаток промывали диэтиловым эфиром и затем собирали фильтрованием с получением указанного в заголовке соединения (524 мг, 1,16 ммоль, 63%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,22 (3H, с), 3,06 (1H, ушир.), 5,01 (2H, т, J=6,8 Гц), 5,96 (1H, с), 6,92-6,98 (1H, м), 7,01-7,08 (1H, м), 7,14 (2H, т, J=8,8 Гц), 7,67-7,73 (2H, м), 7,75-7,80 (1H, м), 7,96 (1H, с), 8,78-8,85 (1H, ушир.), 9,17 (1H, с).
ИК (ATR) см-1: 3405, 1683, 1589, 1511, 1492, 1236, 1147, 1035, 723, 593, 555, 522.
Т.пл.: 164-166°C.
МС m/z: 451 (М++H).
Аналитически вычислено для C21H17F3N2O4S: C, 56,00; H, 3,80; F, 12,65; N, 6,22; S, 7,12. Найдено: C, 55,97; H, 3,80; F, 12,83; N, 6,12; S, 7,18.
Пример 86: [[[5-[(2,5-Дифторфенил)(4-фторфенилсульфонил)метил]-4-метилпиридин-2-ил]карбонил]амино]метилацетат

К раствору 5-[(2,5-дифторфенил)[(4-фторфенил)сульфонил]метил]-N-(1-гидроксиметил)-4-метилпиридин-2-карбоксамида (200 мг, 0,44 ммоль), полученного в Примере 85, в пиридине (2 мл) добавляли уксусный ангидрид (2 мл) и смесь перемешивали в течение 3 часов при комнатной температуре. Реакционную смесь концентрировали при пониженном давлении и затем остаток растворяли в этилацетате и промывали водой. Раствор сушили над безводным сульфатом натрия и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали колоночной хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=10:3, концентрировали при пониженном давлении, промывали диэтиловым эфиром и собирали фильтрованием с получением указанного в заголовке соединения (86 мг, 0,17 ммоль, 39%) в виде твердого вещества белого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 2,08 (3H, с), 2,23 (3H, с), 5,47 (2H, д, J=7,3 Гц), 5,96 (1H, с), 6,91-6,97 (1H, м), 7,01-7,08 (1H, м), 7,14 (2H, т, J=8,8 Гц), 7,70 (2H, дд, J=8,8, 5,1 Гц), 7,74-7,80 (1H, м), 7,99 (1H, с), 8,96 (1H, т, J=7,3 Гц), 9,17 (1H, с).
ИК (ATR) см-1: 3280, 1735, 1677, 1519, 1492, 1234, 1147, 1018, 715, 568, 530.
Т.пл. 111-113°C.
МС m/z: 493 (М++H).
Аналитически вычислено для C23H19F3N2O5S: C, 56,09; H, 3,89; F, 11,57; N, 5,69; S, 6,51. Найдено: C, 55,91; H, 3,77; F, 11,68; N, 5,66; S, 6,67.
Пример 87: 5-[(2,5-Дифторфенил)[(4-фторфенил)сульфонил]метил]-N-(транс-4-гидроксициклогексил)-4-метилпиридин-2-карбоксамид
К раствору 5-[(2,5-дифторфенил)[(4-фторфенил)сульфонил]метил]-4-метилпиридин-2-карбоновой кислоты (114 мг, 0,271 ммоль), полученной в Примере 12, в метиленхлориде (3 мл)добавляли гидрохлорид транс-4-аминоциклогексанола (49 мг, 0,325 ммоль), 1-гидроксибензотриазол (37 мг, 0,271 ммоль), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (62 мг, 0,325 ммоль) и 4-метилморфолин (71 мкл, 0,650 ммоль) и смесь перемешивали в течение 17 часов при комнатной температуре. К реакционному раствору добавляли этилацетат и смесь промывали последовательно насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором. Органический слой сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. Полученный в результате концентрирования остаток подвергали колоночной хроматографии на силикагеле и фракцию, полученную при элюировании смесью метанол:метиленхлорид=1:40, концентрировали при пониженном давлении с получением указанного в заголовке соединения (129 мг, 0,249 ммоль, 92%) в виде аморфного вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 1,32-1,60 (4H, м), 1,98-2,18 (4H, м), 2,20 (3H, с), 3,64-3,75 (1H, м), 3,89-4,00 (1H, м), 5,95 (1H, с), 6,90-7,09 (2H, м), 7,11-7,19 (2H, м), 7,68-7,74 (2H, м), 7,75-7,82 (1H, м), 7,88 (1H, ушир.д, J=8,8 Гц), 7,96 (1H, с), 9,13 (1H, с).
ИК (ATR) см-1: 3380, 2933, 1664, 1589, 1521, 1492, 1326, 1292, 1236, 1145, 1081.
МС m/z: 518 (М+).
Аналитически вычислено для C26H25F3N2O4S: C, 60,22; H, 4,86; F, 10,99; N, 5,40; S, 6,18. Найдено: C, 60,15; H, 4,86; F, 10,82; N, 5,41; S, 6,21.
Пример 88: 1-[[5-[(2,5-Дифторфенил)[(4-фторфенил)сульфонил]метил]-4-метилпиридин-2-ил]карбонил]азетидин-3-ол
К раствору 1-(дифенилметил)азетидин-3-ола (230 мг, 0,961 ммоль) в этаноле (10 мл) добавляли палладий на углероде (50 мг) и смесь перемешивали в течение 1,5 часов в атмосфере водорода. Реакционную суспензию фильтровали и затем фильтрат концентрировали при пониженном давлении. Полученный в результате концентрирования остаток растворяли в метиленхлориде (10 мл) и добавляли 5-[(2,5-дифторфенил)[(4-фторфенил)сульфонил]метил]-4-метилпиридин-2-карбоновую кислоту (113 мг, 0,268 ммоль), полученную в Примере 12, 1-гидроксибензотриазол (36 мг, 0,268 ммоль), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (62 мг, 0,322 ммоль) и 4-метилморфолин (35 мл, 0,322 ммоль). Смесь перемешивали в течение 4 дней при комнатной температуре. Реакционный раствор концентрировали при пониженном давлении, добавляли этилацетат и смесь промывали последовательно насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором. Органический слой сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. Полученный в результате концентрирования остаток подвергали колоночной хроматографии на силикагеле и фракцию, полученную при элюировании смесью метанол:метиленхлорид =1:40, концентрировали при пониженном давлении с получением твердого вещества. Полученное твердое вещество промывали этанолом и затем собирали фильтрованием с получением указанного в заголовке соединения (72 мг, 0,151 ммоль, 56%) в виде порошка белого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 2,08-2,14 (1H, м), 2,17 (1,5H, с), 2,19 (1,5H, с), 4,02-4,12 (1H, м), 4,42-4,62 (2H, м), 4,70-4,80 (1H, м), 4,95-5,07 (1H, м), 5,94 (1H, с), 6,90-7,09 (2H, м), 7,11-7,19 (2H, м), 7,65-7,72 (2H, м), 7,75-7,82 (1H, м), 7,89 (0,5H, с), 7,91 (0,5H, с), 9,17 (1H, с).
ИК (ATR) см-1: 3409, 1612, 1587, 1546, 1494, 1461, 1419, 1359, 1324, 1294, 1234, 1216, 1143.
Т.пл.: 219-221°C.
МС m/z: 477 (М++H).
Аналитически вычислено для C23H19F3N2O4S: C, 57,98; H, 4,02; F, 11,96; N, 5,88; S, 6,73. Найдено: C, 57,70; H, 4,04; F, 12,21; N, 5,90; S, 6,79.
Пример 89: 4-[[5-[(2,5-Дифторфенил)[(4-фторфенил)сульфонил]метил]-4-метилпиридин-2-ил]карбонил]пиперазин-2-он

К раствору 5-[(2,5-дифторфенил)[(4-фторфенил)сульфонил]метил]-4-метилпиридин-2-карбоновой кислоты (114 мг, 0,271 ммоль), полученной в Примере 12, в метиленхлориде (3 мл) добавляли пиперазин-2-он (33 мг, 0,325 ммоль), 1-гидроксибензотриазол (37 мг, 0,271 ммоль), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (62 мг, 0,325 ммоль) и 4-метилморфолин (35 мл, 0,325 ммоль). Реакционную смесь перемешивали в течение 4 дней при комнатной температуре и концентрировали при пониженном давлении. К полученному в результате концентрирования остатку добавляли этилацетат и смесь промывали последовательно насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором. Органический слой сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. Полученный в результате концентрирования остаток подвергали колоночной хроматографии на силикагеле и фракцию, полученную при элюировании смесью метанол:метиленхлорид=1:30, концентрировали при пониженном давлении. Полученное твердое вещество промывали простым эфиром и затем собирали фильтрованием с получением указанного в заголовке соединения (116 мг, 0,230 ммоль, 85%) в виде порошка белого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 2,22 (1,5H, с), 2,27 (1,5H, с), 3,49-3,65 (2H, м), 3,92-4,15 (2H, м), 4,40-4,53 (2H, м), 5,96 (1H, с), 5,99-6,10 (1H, м), 6,89-7,10 (2H, м), 7,11-7,20 (2H, м), 7,58 (0,5H, с), 7,65 (0,5H, с), 7,70-7,83 (3H, м), 9,16 (0,5H, с), 9,18 (0,5H, с).
ИК (ATR) см-1: 1681, 1660, 1619, 1589, 1492, 1471, 1413, 1322, 1297, 1236, 1218.
МС m/z: 504 (М++H).
FAB-МС: 504,1189 (вычислено для C24H21O4N3F3S: 504,1205).
Пример 90: N-(2-хлорэтил)-5-[(2,5-дифторфенил)[(4-фторфенил)сульфонил]метил]-4-метилпиридин-2-карбоксамид
К раствору 5-[(2,5-дифторфенил)[(4-фторфенил)сульфонил]метил]-N-(2-гидроксиэтил)-4-метилпиридин-2-карбоксамида (120 мг, 0,258 ммоль), полученного в Примере 17, в метиленхлориде (5 мл) добавляли тионилхлорид (100 мкл) и смесь перемешивали в течение 4 часов при комнатной температуре. К реакционному раствору добавляли тионилхлорид (100 мкл) и смесь перемешивали в течение 1,5 часов при комнатной температуре. Реакционный раствор концентрировали при пониженном давлении, затем к смеси добавляли насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали метиленхлоридом. Органический слой сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. Полученный в результате концентрирования остаток подвергали колоночной хроматографии на силикагеле и фракцию, полученную при элюировании смесью 35% этилацетата/гексан, концентрировали при пониженном давлении с получением указанного в заголовке соединения (102 мг, 0,211 ммоль, 82%) в виде твердого вещества белого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 2,22 (3H, с), 3,69-3,90 (4H, м), 5,96 (1H, с), 6,90-7,09 (2H, м), 7,11-7,20 (2H, м), 7,67-7,74 (2H, м), 7,77-7,83 (1H, м), 7,96 (1H, с), 8,37-8,45 (1H, м), 9,17 (1H, с).
ИК (ATR) см-1: 3369, 1685, 1590, 1525, 1488, 1438, 1328, 1295, 1232, 1147, 1078.
МС m/z: 483 (М++H).
Пример 91: Диэтил 5-[(2,5-дифторфенил)[(4-фторфенил)сульфонил]метил]-4-метилпиридин-2-карбоновая кислота
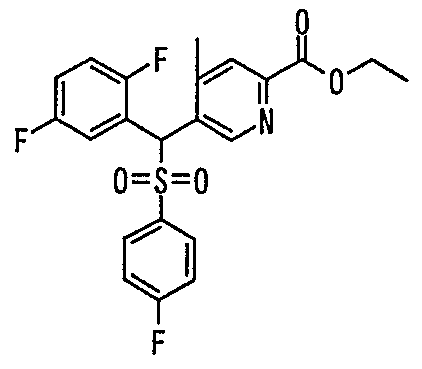
Этанольный раствор 5-[(2,5-дифторфенил)[(4-фторфенил)сульфонил]метил]-4-метилпиридин-2-карбоновой кислоты (104 мг, 0,247 ммоль), полученной в Примере 12, и концентрированную хлористоводородную кислоту (50 мкл) нагревали до температуры кипения с обратным холодильником в течение 21 часа. Реакционный раствор охлаждали до комнатной температуры и затем концентрировали при пониженном давлении. К полученному в результате концентрирования остатку добавляли насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и фильтровали и фильтрат концентрировали при пониженном давлении. Полученный в результате концентрирования остаток подвергали колоночной хроматографии на силикагеле и фракцию, полученную при элюировании смесью 30% этилацетата/гексан, концентрировали при пониженном давлении с получением твердого вещества. Полученное твердое вещество промывали этанолом и затем собирали фильтрованием с получением указанного в заголовке соединения (90 мг, 0,200 ммоль, 81%) в виде порошка белого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 1,45 (3H, т, J=7,1 Гц), 2,23 (3H, с), 4,47 (2H, кв, J=7,1 Гц), 5,97 (1H, с), 6,90-7,09 (2H, м), 7,10-7,18 (2H, м), 7,69-7,80 (3H, м), 7,90 (1H, с), 9,36 (1H, с).
ИК (ATR) см-1: 1739, 1589, 1556, 1332, 1317, 1278, 1232, 1216, 1145, 1101, 1081.
Т.пл.: 151-153°C.
МС m/z: 450 (М++H).
FAB-МS: 450,1008 (вычислено для C22H19O4NF3S: 450,0987).
Пример 92: 5-[(2,5-Дифторфенил)[(4-фторфенил)сульфонил]метил]-N,N,4-триметилпиридин-2-карботиоамид

Раствор 5-[(2,5-дифторфенил)[(4-фторфенил)сульфонил]метил]-N,N,4-триметилпиридин-2-карбоксамида (168 мг, 0,375 ммоль), полученного в Примере 14, и реагент Лоуссона (167 мг, 0,413 ммоль) в толуоле (10 мл) нагревали до температуры кипения с обратным холодильником в течение 3 часов. Реакционный раствор охлаждали до комнатной температуры и затем концентрировали при пониженном давлении. Полученный в результате концентрирования остаток подвергали колоночной хроматографии на силикагеле и фракцию, полученную при элюировании смесью 40% этилацетата/гексан, концентрировали при пониженном давлении. К полученному в результате концентрирования остатку добавляли простой эфир и осажденное таким образом твердое вещество собирали фильтрованием с получением указанного в заголовке соединения (119 мг, 0,256 ммоль, 68%) в виде порошка бледно-желтого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 2,26 (3H, с), 3,24 (3H, с), 3,60 (3H, с), 5,94 (1H, с), 6,88-7,08 (2H, м), 7,10-7,19 (2H, м), 7,43 (1H, с), 7,70-7,80 (3H, м), 9,09 (1H, с).
ИК (ATR) см-1: 1585, 1527, 1492, 1407, 1315, 1292, 1230, 1139, 1081.
Т.пл.: 161-164°C.
МС m/z: 465 (М++H).
Аналитически вычислено для C22H19F3N2O2S2: C, 56,88; H, 4,12; F, 12,27; N, 6,03; S, 13,81. Найдено: C, 56,60; H, 4,10; F, 12,27; N, 6,06; S, 13,64.
Пример 93: 5-[[(4-Фторфенил)тио](2,3,6-трифторфенил)метил]-N-(2-гидроксиэтил)-4-метилпиридин-2-карбоксамид

К раствору 5-[[(4-фторфенил)тио](2,3,6-трифторфенил)метил]-4-метилпиридин-2-карбоновой кислоты (163 мг, 0,40 ммоль), полученной в Примере 34, в метиленхлориде (5 мл) добавляли 2-аминоэтанол (0,027 мл, 0,44 ммоль), 1-гидроксибензотриазол (60 мг, 0,44 ммоль), 4-метилморфолин (0,048 мл, 0,44 ммоль) и гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (84 мг, 0,44 ммоль) при комнатной температуре. После перемешивания в течение 3 часов при комнатной температуре реакционную смесь промывали водой и затем насыщенным солевым раствором. Органический слой сушили над безводным сульфатом натрия и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=2:3, концентрировали при пониженном давлении с получением указанного в заголовке соединения (175 мг, 0,39 ммоль, 97%) в виде бесцветного маслянистого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,25 (3H, с), 2,68-2,75 (1H, м), 3,62-3,68 (2H, м), 3,82-3,89 (2H, м), 5,78 (1H, с), 6,75-6,84 (1H, м), 6,92-7,00 (2H, м), 7,02-7,12 (1H, м), 7,32-7,39 (2H, м), 7,94 (1H, с), 8,37-8,45 (1H, м), 9,07 (1H, с).
МС m/z: 451 (М++H).
Пример 94: 5-[[(4-Фторфенил)сульфонил](2,3,6-трифторфенил)метил]-N-(2-гидроксиэтил)-4-метилпиридин-2-карбоксамид
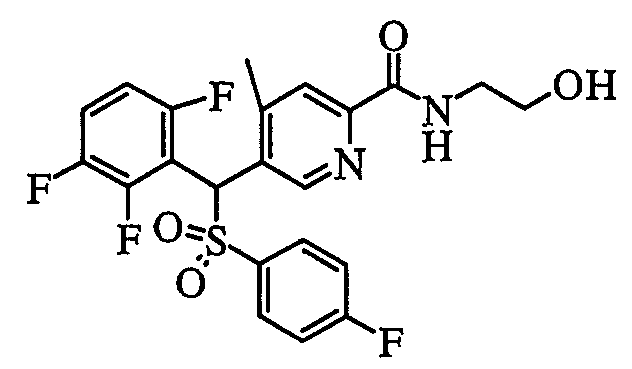
К раствору 5-[[(4-фторфенил)тио](2,3,6-трифторфенил)метил]-N-(2-гидроксиэтил)-4-метилпиридин-2-карбоксамида (173 мг, 0,38 ммоль) в метиленхлориде (5 мл) добавляли 3-хлорпербензойную кислоту (204 мг, 0,77 ммоль) при комнатной температуре. После перемешивания в течение 3 часов при комнатной температуре снова добавляли 3-хлорпербензойную кислоту (102 мг, 0,38 ммоль) и смесь перемешивали в течение 1 часа при указанной температуре. Реакционную смесь промывали 1н. водным раствором гидроксида натрия, органический слой сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали флэш-хроматографии на силикагеле и фракцию, полученную при элюировании смесью гексан:этилацетат=1:2, концентрировали при пониженном давлении. Полученный остаток промывали диэтиловым эфиром и затем собирали фильтрованием с получением указанного в заголовке соединения (126 мг, 0,26 ммоль, 68%) в виде твердого вещества белого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 2,14 (3H, с), 2,60 (1H, т, J=5,4 Гц), 3,63-3,69 (2H, м), 3,83-3,89 (2H, м), 5,89 (1H, с), 6,82-6,90 (1H, м), 7,14-7,25 (3H, м), 7,73-7,79 (2H, м), 7,97 (1H, с), 8,41-8,48 (1H, м), 9,42 (1H, с).
ИК (ATR) см-1: 3379, 1662, 1533, 1493, 1329, 1230, 1146, 1082, 820.
Т.пл.: 164-165°C.
Аналитически вычислено для C22H18F4N2O4S: C, 54,77; H, 3,76; F, 15,75; N, 5,81; S, 6,65. Найдено: C, 54,76; H, 3,69; F, 15,76; N, 5,84; S, 6,75.
МС m/z: 483 (М++H).
Пример 95: 5-[(2,5-Дифторфенил)[(4-фторфенил)тио]метил]-N-(2-гидроксиэтил)-4-метилпиридин-2-карбоксамид
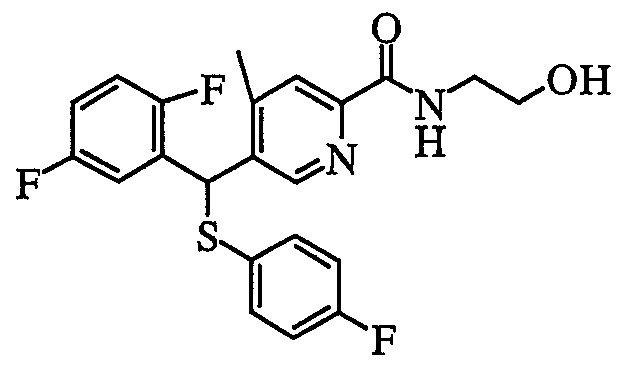
К раствору 5-[(2,5-дифторфенил)[(4-фторфенил)тио]метил]-4-метилпиридин-2-карбоновой кислоты (483 мг, 1,24 ммоль), полученной в Примере 20, в метиленхлориде (10 мл) добавляли 2-аминоэтанол (0,083 мл, 1,36 ммоль), 1-гидроксибензотриазол (184 мг, 1,36 ммоль), 4-метилморфолин (0,150 мл, 1,36 ммоль) и гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (262 мг, 1,36 ммоль) при комнатной температуре. После перемешивания в течение 4 часов при комнатной температуре к реакционной смеси добавляли воду и смесь промывали насыщенным водным раствором хлорида аммония. Органический слой сушили над безводным сульфатом натрия и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=1:3, концентрировали при пониженном давлении с получением указанного в заголовке соединения (481 мг, 1,11 ммоль, 90%) в виде бесцветного пенистого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,37 (3H, с), 2,57-2,65 (1H, м), 3,61-3,66 (2H, м), 3,80-3,87 (2H, м), 5,82 (1H, с), 6,91-7,00 (4H, м), 7,28-7,38 (3H, м), 8,00 (1H, с), 8,31-8,37 (1H, м), 8,61 (1H, с).
LC-МС m/z: 433 (М++H).
Пример 96: 5-[(2,5-Дифторфенил)[(4-фторфенил)сульфинил]метил]-N-(2-гидроксиэтил)-4-метилпиридин-2-карбоксамид
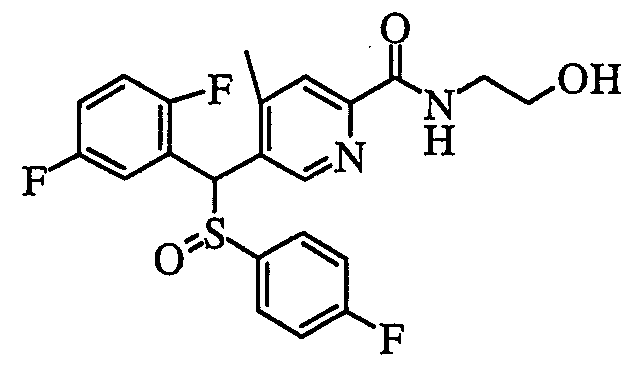
К раствору 5-[(2,5-дифторфенил)[(4-фторфенил)тио]метил]-N-(2-гидроксиэтил)-4-метилпиридин-2-карбоксамида (478 мг, 1,11 ммоль) в метиленхлориде (15 мл) добавляли 3-хлорпербензойную кислоту (293 мг, 1,11 ммоль) при 0°C. После перемешивания в течение 3 часов при указанной температуре реакционную смесь промывали 1н. водным раствором гидроксида натрия, органический слой сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали флэш-хроматографии на силикагеле и фракцию, полученную при элюировании смесью гексан:этилацетат=1:2, концентрировали при пониженном давлении. Полученный остаток промывали гексаном и затем остаток сушили при пониженном давлении с получением указанного в заголовке соединения (238 мг, 0,53 ммоль, 48%) в виде бесцветного пенистого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 1,94 (1,5H, с), 2,13 (1,5H, с), 2,51-2,65 (1H, м), 3,63-3,70 (2H, м), 3,83-3,90 (2H, м), 5,33 (0,5H, с), 5,35 (0,5H, с), 6,87-7,14 (4H, м), 7,28-7,37 (2,5H, м), 7,48-7,54 (0,5H, м), 7,92 (0,5H, с), 7,97 (0,5H, с), 8,36-8,46 (1H, м), 8,85 (0,5H, с), 9,03 (0,5H, с).
ИК (ATR) см-1: 3383, 1660, 1589, 1527, 1489, 1225, 1082, 1049.
Аналитически вычислено для C22H19F3N2O3S: C, 58,92; H, 4,27; F, 12,71; N, 6,25; S, 7,15. Найдено: C, 58,53; H, 4,30; F, 12,91; N, 6,16; S, 7,08.
МС m/z: 449 (М++H).
Ссылочный пример 10: O-этил S-(3,5-дифторфенил) дитиокарбонат
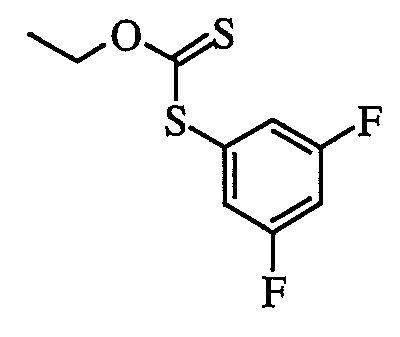
3,5-Дифторанилин (7,11 г, 54,0 ммоль) растворяли в метаноле (30 мл) и добавляли 1н. раствор хлористоводородной кислоты (150 мл) при -10°C. Затем при указанной температуре к смеси добавляли по каплям раствор нитрита натрия (4,54 г, 64,8 ммоль) в воде (30 мл) и затем смесь перемешивали в течение 30 минут при указанной температуре. Полученный реакционный раствор добавляли по каплям к раствору О-этилдитиокарбоната калия (коммерческий продукт) (13,0 г, 81,0 ммоль) в воде (150 мл) при 65°C. Реакционную смесь нагревали до 100°C, перемешивали в течение 30 минут и затем охлаждали до комнатной температуры и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором гидрокарбоната натрия, затем сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле и фракцию, полученную при элюировании гексаном, концентрировали при пониженном давлении с получением указанного в заголовке соединения (1,86 г, 7,94 ммоль, 15%) в виде маслянистого вещества желтого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 1,36 (3H, т, J=7,1 Гц), 4,63 (2H, кв, J=7,1 Гц), 6,87-6,94 (1H, м), 7,03-7,10 (2H, м).
Пример 97: 2-Бром-5-[(2,5-дифторфенил)[(3,5-дифторфенил)тио]метил]-4-метилпиридин

К раствору O-этил S-(3,5-дифторфенил) дитиокарбоната (1,86 г, 7,94 ммоль) в этаноле (20 мл) добавляли 1н. водный раствор гидроксида натрия (20 мл) и смесь перемешивали в течение 2 часов при 65°C. Реакционную смесь охлаждали до комнатной температуры и промывали метиленхлоридом. Затем водный слой подкисляли 1н. раствором хлористоводородной кислоты и экстрагировали метиленхлоридом. Органический слой сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. К раствору полученного остатка и 2-бром-5-[хлор(2,5-дифторфенил)метил]-4-метилпиридина (2,64 г, 7,94 ммоль), полученного в Ссылочном примере 2, в N,N-диметилформамиде (40 мл) добавляли карбонат калия (1,21 г, 8,73 ммоль) в атмосфере азота при 0°C и смесь перемешивали в течение 2 часов при комнатной температуре. К реакционной смеси добавляли этилацетат и воду при 0°C, органический слой отделяли и органический слой промывали насыщенным водным раствором гидрокарбоната натрия и затем насыщенным солевым раствором. Органический слой сушили над безводным сульфатом натрия и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=30:1, концентрировали при пониженном давлении и полученный остаток промывали гексаном и затем собирали фильтрованием с получением указанного в заголовке соединения (2,35 г, 5,31 ммоль, 67%) в виде твердого вещества белого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 2,37 (3H, с), 5,86 (1H, с), 6,62-6,69 (1H, м), 6,71-6,78 (2H, м), 6,96-7,07 (2H, м), 7,27-7,32 (1H, м), 7,33 (1H, с), 8,32 (1H, м).
МС m/z: 442, 444 (М++H).
Пример 98: 5-[(2,5-Дифторфенил)[(3,5-дифторфенил)тио]метил]-4-метилпиридин-2-карбальдегид
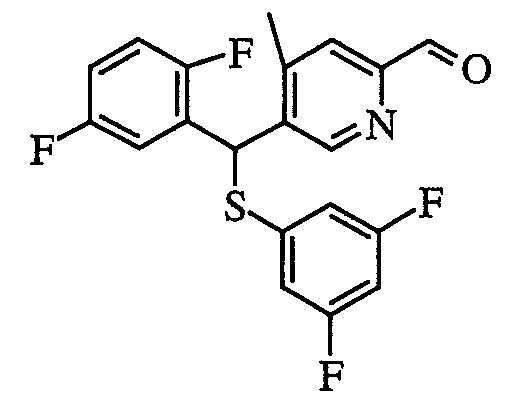
К раствору 2-бром-5-[(2,5-дифторфенил)[(3,5-дифторфенил)тио]метил]-4-метилпиридина (2,35 г, 5,31 ммоль) в толуоле (60 мл) добавляли раствор н-бутиллития в гексане (1,54 M, 4,14 мл, 6,38 ммоль) в атмосфере аргона при -78°C. Реакционную смесь перемешивали в течение 30 минут при -40°C и затем снова охлаждали до -78°C и добавляли N,N-диметилформамид (0,494 мл, 6,38 ммоль). После завершения добавления по каплям реакционной смеси давали нагреться до 0°C и добавляли воду при указанной температуре. К реакционной смеси добавляли этилацетат, органический слой отделяли и затем органический слой промывали насыщенным солевым раствором. Органический слой сушили над безводным сульфатом натрия и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=10:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (1,36 г, 3,47 ммоль, 65%) в виде твердого вещества белого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 2,49 (3H, с), 5,97 (1H, с), 6,63-6,70 (1H, м), 6,73-6,80 (2H, м), 6,98-7,09 (2H, м), 7,33-7,39 (1H, м), 7,79 (1H, с), 8,74 (1H, м), 10,03 (1H, с).
МС m/z: 392 (М++H).
Пример 99: 5-[(2,5-Дифторфенил)[(3,5-дифторфенил)сульфонил]метил]-4-метилпиридин-2-карбоновая кислота
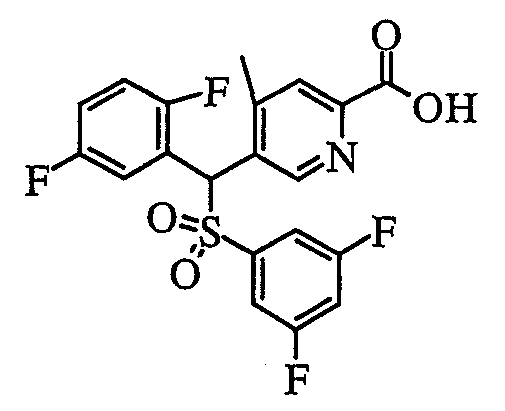
К раствору 5-[(2,5-дифторфенил)[(3,5-дифторфенил)тио]метил]-4-метилпиридин-2-карбальдегида (1,36 г, 3,47 ммоль) в муравьиной кислоте (40 мл) добавляли 31% водную перекись водорода (4 мл) и смесь перемешивали в течение 2 часов при 0°C. После перемешивания еще в течение 2 часов при комнатной температуре к реакционной смеси добавляли воду и осажденное таким образом твердое вещество собирали фильтрованием и промывали водой. Полученное твердое вещество растворяли в метиленхлориде и раствор промывали 0,1н. раствором хлористоводородной кислоты. Затем органический слой сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. Полученный остаток промывали диэтиловым эфиром и затем собирали фильтрованием с получением указанного в заголовке соединения (1,39 г, 3,16 ммоль, 91%) в виде твердого вещества белого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 2,38 (3H, с), 6,02 (1H, с), 6,95-7,02 (1H, м), 7,06-7,15 (2H, м), 7,23-7,30 (2H, м), 7,64-7,70 (1H, м), 8,07 (1H, с), 9,24 (1H, с).
МС m/z: 440 (М++H).
Пример 100: 5-[(2,5-Дифторфенил)[(3,5-дифторфенил)сульфонил]метил]-N-(2-гидроксиэтил)-4-метилпиридин-2-карбоксамид

К раствору 5-[(2,5-дифторфенил)[(3,5-дифторфенил)сульфонил]метил]-4-метилпиридин-2-карбоновой кислоты (105 мг, 0,24 ммоль) в метиленхлориде (5 мл) добавляли 2-аминоэтанол (0,016 мл, 0,26 ммоль), 1-гидроксибензотриазол (36 мг, 0,26 ммоль), 4-метилморфолин (0,029 мл, 0,26 ммоль) и гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (51 мг, 0,26 ммоль) при комнатной температуре. После перемешивания в течение 4 часов при комнатной температуре реакционную смесь промывали 1н. раствором хлористоводородной кислоты. Органический слой сушили над безводным сульфатом натрия и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=2:3, концентрировали при пониженном давлении и полученный остаток промывали смешанным растворителем, состоящим из этанола и диэтилового эфира, и собирали фильтрованием с получением указанного в заголовке соединения (36 мг, 0,07 ммоль, 31%) в виде твердого вещества белого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 2,30 (3H, с), 2,47-2,53 (1H, м), 3,63-3,69 (2H, м), 3,82-3,89 (2H, м), 6,00 (1H, с), 6,93-7,13 (3H, м), 7,22-7,30 (2H, м), 7,65-7,72 (1H, м), 8,01 (1H, с), 8,36-8,44 (1H, м), 9,17 (1H, с).
ИК (ATR) см-1: 3388, 1660, 1604, 1529, 1493, 1444, 1333, 1298, 1146, 1078, 989.
Т.пл.: 82-84°C.
Аналитически вычислено для C22H18F4N2O4S: C, 54,77; H, 3,76; F, 15,75; N, 5,81; S, 6,65. Найдено: C, 54,89; H, 3,95; F, 15,46; N, 5,76; S, 6,78.
МС m/z: 483 (М++H).
Пример 101: 5-[[(4-Фторфенил)сульфонил](2,3,6-трифторфенил)метил]-N-(1-гидроксиметил)-4-метилпиридин-2-карбоксамид
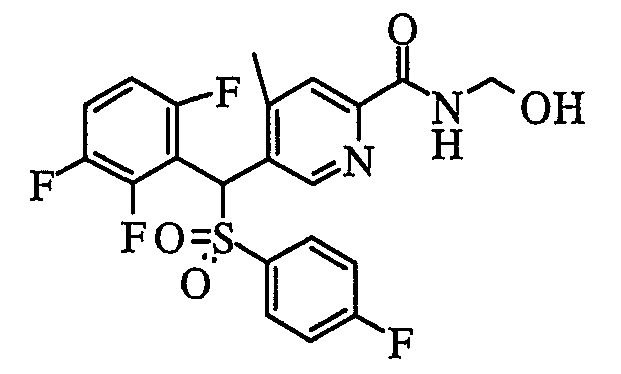
К раствору 5-[[(4-фторфенил)сульфонил](2,3,6-трифторфенил)метил]-4-метилпиридин-2-карбоксамида (150 мг, 0,34 ммоль), полученного в Примере 39, в диметиловом эфире этиленгликоля (3 мл) добавляли водный раствор формальдегида (37%, 0,1 мл) и 5% водный раствор гидроксида натрия (0,4 мл) при 0°C и смесь перемешивали в течение ночи при комнатной температуре. К реакционной смеси добавляли карбонат натрия (20 мг) и смесь перемешивали в течение 20 минут при комнатной температуре. Смесь концентрировали при пониженном давлении и затем остаток растворяли в хлороформе, сушили над сульфатом магния и фильтровали. Затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=1:1, концентрировали при пониженном давлении и полученный остаток промывали диэтиловым эфиром и затем собирали фильтрованием с получением указанного в заголовке соединения (93 мг, 0,20 ммоль, 58%) в виде твердого вещества белого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 2,15 (3H, с), 3,04-3,09 (1H, м), 5,01 (2H, т, J=7,2 Гц), 5,89 (1H, с), 6,85-6,88 (1H, м), 7,15-7,23 (3H, м), 7,74-7,78 (2H, м), 7,97 (1H, с), 8,84-8,88 (1H, br), 9,43 (1H, с).
ИК (ATR) см-1: 3332, 1650, 1592, 1521, 1496, 1145, 1054, 817, 582.
МС m/z: 469 (М++H).
Аналитически вычислено для C21H16F4N2O4SO·5H2O: C, 52,83; H, 3,59; F, 15,92; N, 5,87; S, 6,72. Найдено: C, 52,65; H, 3,56; F, 15,87; N, 5,81; S, 6,65.
Пример 102: 2-Бром-4-метил-5-[(фенилтио)(2,3,6-трифторфенил)метил]пиридин
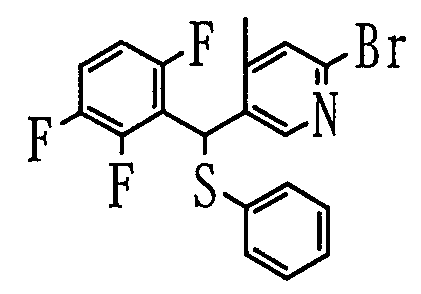
К раствору 2-бром-5-[хлор(2,3,6-трифторфенил)метил]-4-метилпиридина (1,80 г, 5,13 ммоль), полученного в Ссылочном примере 4, в N,N-диметилформамиде (25 мл) добавляли карбонат калия (1,21 г, 8,73 ммоль) и бензолтиол (0,58 мл, 5,65 ммоль) в атмосфере азота при 0°C и смесь перемешивали в течение 24 часов при комнатной температуре. К реакционной смеси добавляли этилацетат и воду при 0°C, органический слой отделяли и органический слой промывали водой и затем насыщенным солевым раствором. Органический слой сушили над безводным сульфатом магния и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат, концентрировали при пониженном давлении с получением указанного в заголовке соединения (2,05 г, 4,83 ммоль, 94%) в виде бесцветного маслянистого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,17 (3H, с), 5,76 (1H, с), 6,76-6,82 (1H, м), 7,02-7,10 (1H, м), 7,24-7,36 (6H, м), 8,90 (1H, с).
МС m/z: 424 (М++H).
Пример 103: 4-Метил-5-[(фенилтио)(2,3,6-трифторфенил)метил]пиридин-2-карбальдегид

К раствору 2-бром-4-метил-5-[(фенилтио)(2,3,6-трифторфенил)метил]пиридина (2,00 г, 4,40 ммоль) в толуоле (40 мл) добавляли раствор н-бутиллития в гексане (1,58 M, 3,3 мл, 5,28 ммоль) в атмосфере аргона при -75°C. Реакционную смесь перемешивали в течение 1 часа при -40°C и затем снова охлаждали до -75°C и добавляли N,N-диметилформамид (0,68 мл, 8,80 ммоль). После завершения добавления по каплям реакционной смеси давали нагреться до 0°C и добавляли воду при этой же температуре. К реакционной смеси добавляли этилацетат, органический слой отделяли и затем органический слой промывали насыщенным солевым раствором. Органический слой сушили над безводным сульфатом магния и фильтровали и затем фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат, концентрировали при пониженном давлении с получением указанного в заголовке соединения (1,03 г, 2,76 ммоль, 63%) в виде маслянистого вещества бледно-желтого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 2,28 (3H, с), 5,88 (1H, с), 6,78-6,84 (1H, м), 7,04-7,12 (1H, м), 7,24-7,38 (5H, м), 7,70 (1H, с), 9,34 (1H, с), 10,06 (1H, с).
МС m/z: 374 (М++H).
Пример 104: 4-Метил-5-[(фенилсульфонил)(2,3,6-трифторфенил)метил]пиридин-2-карбоновая кислота
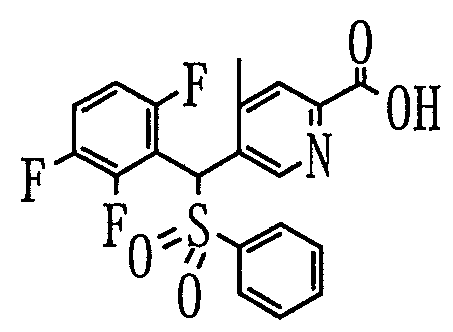
К раствору 4-метил-5-[(фенилтио)(2,3,6-трифторфенил)метил]пиридин-2-карбальдегида (1,00 г, 2,68 ммоль) в муравьиной кислоте (10 мл) добавляли 31% водную перекись водорода (3 мл) и смесь перемешивали в течение 4 часов при 0°C. К реакционной смеси добавляли воду и осажденное таким образом твердое вещество собирали фильтрованием и промывали водой. Полученное твердое вещество растворяли в этилацетате и промывали водой и затем насыщенным солевым раствором. Органический слой сушили над безводным сульфатом магния и фильтровали и затем фильтрат концентрировали при пониженном давлении. Полученный остаток промывали этанолом и затем собирали фильтрованием с получением указанного в заголовке соединения (0,99 г, 2,36 ммоль, 88%) в виде твердого вещества белого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 2,16 (3H, с), 5,91 (1H, с), 6,82-6,88 (1H, м), 7,17-7,25 (1H, м), 7,50-7,54 (2H, м), 7,68 (1H, т, J=7,5 Гц), 7,72 (2H, д, J=7,3 Гц), 7,99 (1H, с), 9,53 (1H, с).
МС m/z: 422 (М++H).
Пример 105: 4-Метил-5-[(фенилсульфонил)(2,3,6-трифторфенил)метил]пиридин-2-карбоксамид

К раствору 4-метил-5-[(фенилсульфонил)(2,3,6-трифторфенил)метил]пиридин-2-карбоновой кислоты (300 мг, 0,71 ммоль) в N,N-диметилформамиде (6 мл) добавляли гексафторфосфат (бензотриазол-1-илокси)трипирролидинoфосфония (556 мг, 1,07 ммоль), бензотриазол-1-ол (144 мг, 1,07 ммоль), хлорид аммония (76 мг, 1,42 ммоль) и N-этилдиизопропиламин (0,5 мл, 2,85 ммоль) в атмосфере аргона при комнатной температуре. После перемешивания в течение 3 часов при комнатной температуре к реакционной смеси добавляли этилацетат и воду и смесь экстрагировали этилацетатом и затем промывали насыщенным солевым раствором. Органический слой сушили над безводным сульфатом натрия и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток промывали диэтиловым эфиром и затем собирали фильтрованием с получением указанного в заголовке соединения (227 мг, 0,54 ммоль, 76%) в виде твердого вещества белого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 2,09 (3H, с), 5,67 (1H, ушир.с), 5,92 (1H, с), 6,82-6,88 (1H, м), 7,14-7,24 (1H, м), 7,50 (2H, т, J=7,5 Гц), 7,67 (1H, т, J=7,5 Гц), 7,74 (2H, д, J=7,5 Гц), 7,88 (1H, шир.с), 7,96 (1H, с), 9,45 (1H, с).
МС m/z: 421 (М++H).
Пример 106: N-(1-гидроксиметил)-4-метил-5-[(фенилсульфонил)(2,3,6-трифторфенил)метил]пиридин-2-карбоксамид
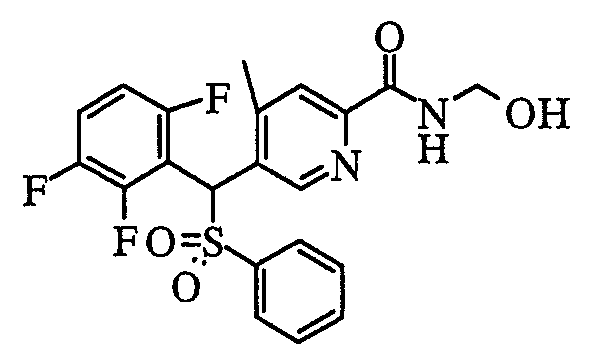
К раствору 4-метил-5-[(фенилсульфонил)(2,3,6-трифторфенил)метил]пиридин-2-карбоксамида (215 мг, 0,51 ммоль) в диметиловом эфире этиленгликоля (6 мл) добавляли водный раствор формальдегида (37%, 0,2 мл) и 5% водный раствор гидроксида натрия (0,8 мл) при 0°C и смесь перемешивали в течение 1 часа при комнатной температуре. К реакционной смеси добавляли карбонат натрия (40 мг) и смесь перемешивали в течение 20 минут при комнатной температуре. Смесь концентрировали при пониженном давлении и затем остаток растворяли в хлороформе, сушили над сульфатом магния и фильтровали. Затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=1:2, концентрировали при пониженном давлении и полученный остаток промывали диэтиловым эфиром и затем собирали фильтрованием с получением указанного в заголовке соединения (90 мг, 0,20 ммоль, 39%) в виде твердого вещества белого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 2,11 (3H, с), 3,14-3,18 (1H, м), 5,01 (2H, т, J=7,1 Гц), 5,91 (1H, с), 6,80-6,90 (1H, м), 7,12-7,24 (1H, м), 7,45-7,53 (2H, м), 7,61-7,78 (3H, м), 7,94 (1H, с), 8,88 (1H, ушир.), 9,45 (1H, с).
ИК (ATR) см-1: 3382, 3334, 1654, 1494, 1149, 1054, 987, 723, 595, 555.
МС m/z: 451 (М++H).
Пример 107: N-ацетил-5-[(2,5-дифторфенил)[(4-фторфенил)сульфонил]метил]-4-метилпиридин-2-карбоксамид
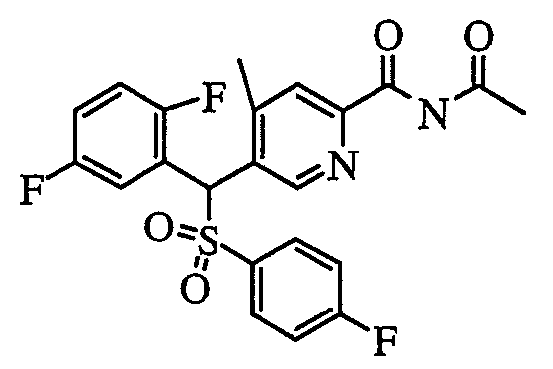
К раствору 5-[(2,5-дифторфенил)[(4-фторфенил)сульфонил]метил]-4-метилпиридин-2-карбоксамида (150 мг, 0,36 ммоль), полученного в Примере 15, в N,N-диметилформамиде (7 мл) добавляли гидрид натрия (60%, 34 мг, 0,79 ммоль) при 0°C и смесь перемешивали в течение 1 часа при комнатной температуре. Затем к реакционному раствору добавляли уксусный ангидрид (40 мл) при 0°C и смесь перемешивали в течение 1 часа при комнатной температуре. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом и сушили над безводным сульфатом магния. Растворитель концентрировали при пониженном давлении и полученный остаток подвергали хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=10:3, концентрировали при пониженном давлении и полученный остаток промывали диэтиловым эфиром и н-гексаном и затем собирали фильтрованием с получением указанного в заголовке соединения (80 мг, 0,17 ммоль, 48%) в виде твердого вещества белого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 2,29 (3H, с), 2,60 (2H, с), 5,96 (1H, с), 5,97 (1H, с), 6,92-6,98 (1H, м), 7,02-7,08 (1H, м), 7,15 (2H, т, J=8,8 Гц), 7,72 (2H, д, J=8,8 Гц), 7,74-7,79 (1H, м), 8,03 (1H, с), 9,20 (1H, с), 10,38 (1H, шир.с).
ИК (ATR) см-1: 1725, 1706, 1589, 1463, 1259, 1234, 1187, 1143, 1079, 970, 844, 717, 671, 593, 520, 487.
Т.пл.: 182-183°C.
МС m/z: 463 (М++H).
Аналитически вычислено для C22H17F3N2O4S: C, 57,14; H, 3,71; F, 12,32; N, 6,06; S, 6,93. Найдено: C, 57,33; H, 3,62; F, 12,64; N, 6,09; S, 7,00.
Ссылочный пример 11: (4-Метоксибензилокси)ацетат

К раствору 4-метоксибензилового спирта (1,00 г, 7,24 ммоль) в тетрагидрофуране (20 мл) добавляли гидрид натрия (695 мг, 17,4 ммоль) и бромуксусную кислоту (1,00 г, 7,24 ммоль) при 0°C и смесь перемешивали в течение ночи при комнатной температуре. К реакционному раствору добавляли воду и смесь экстрагировали этилацетатом и сушили над безводным сульфатом магния. Растворитель концентрировали при пониженном давлении и полученный остаток подвергали хроматографии на силикагеле. Фракцию, полученную при элюировании дихлорметан:метанол=10:1, концентрировали при пониженном давлении и полученный остаток промывали диэтиловым эфиром и н-гексаном и затем собирали фильтрованием с получением указанного в заголовке соединения (448 мг, 2,28 ммоль, 32%) в виде твердого вещества белого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 3,82 (3H, с), 4,11 (2H, с), 4,58 (2H, м), 6,89 (2H, д, J=8,5 Гц), 7,29 (2H, д, J=8,5 Гц), 9,50 (1H, шир.с).
Пример 108: [[[5-[(2,5-Дифторфенил)[(4-фторфенил)сульфонил]метил]-4-метилпиридин-2-ил]карбонил]амино]метил (4-метоксибензилокси)ацетат
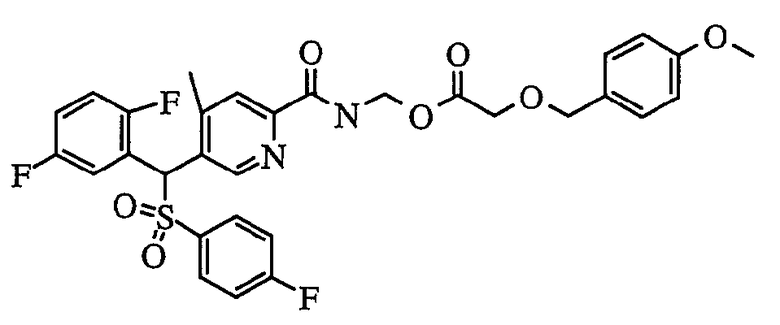
К раствору (78 мг, 0,40 ммоль) 5-[(2,5-дифторфенил)[(4-фторфенил)сульфонил]метил]-N-(1-гидроксиметил)-4-метилпиридин-2-карбоксамида (150 мг, 0,33 ммоль), полученного в Примере 85, в N,N-диметилформамиде (3 мл) добавляли гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (96 мг, 0,50 ммоль) и каталитическое количество диметиламинопиридина и смесь перемешивали в течение ночи при комнатной температуре. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом и сушили над безводным сульфатом натрия. Растворитель концентрировали при пониженном давлении и полученный остаток подвергали хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=2:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (205 мг, 0,33 ммоль, 99%) в виде твердого вещества белого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 2,23 (3H, с), 3,79 (3H, с), 4,56 (2H, с), 5,56 (2H, д, J=7,5 Гц), 5,96 (1H, с), 6,86 (2H, д, J=8,8 Гц), 6,91-6,98 (1H, м), 7,01-7,07 (1H, м), 7,14 (2H, т, J=8,8 Гц), 7,28 (2H, д, J=8,8 Гц), 7,70 (2H, д, J=8,8 Гц), 7,74-7,79 (1H, м), 7,98 (1H, с), 9,00 (1H, т, J=7,5 Гц), 9,17 (1H, с).
ИК (ATR) см-1: 3386, 1751, 1691, 1589, 1511, 1492, 1236, 1145, 1105, 1081, 817, 723, 590, 524.
Пример 109: [[[5-[(2,5-Дифторфенил)[(4-фторфенил)сульфонил]метил]-4-метилпиридин-2-ил]карбонил]амино]метил гидроксиацетат

К смешанному раствору [[[5-[(2,5-дифторфенил)[(4-фторфенил)сульфонил]метил]-4-метилпиридин-2-ил]карбонил]амино]метил (4-метоксибензилокси)ацетата (150 мг, 0,24 ммоль) в дихлорметане-воде (1:1, 10 мл) добавляли 2,3-дихлор-5,6-дициано-1,4-бензохинон (65 мг, 0,29 ммоль) и смесь перемешивали в течение ночи при комнатной температуре. К реакционному раствору добавляли воду и смесь экстрагировали дихлорметаном. Экстракт промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия, затем растворитель концентрировали при пониженном давлении и полученный остаток подвергали колоночной хроматографии на силикагеле. Фракцию, полученную при элюировании смесью дихлорметан:метанол=50:3, концентрировали при пониженном давлении, промывали диэтиловым эфиром и собирали фильтрованием с получением указанного в заголовке соединения (26 мг, 0,05 ммоль, 21%) в виде твердого вещества белого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 2,24 (3H, с), 4,19 (2H, с), 5,60 (2H, д, J=7,5 Гц), 5,96 (1H, с), 6,91-6,98 (1H, м), 7,01-7,08 (1H, м), 7,15 (2H, т, J=8,8 Гц), 7,70 (2H, д, J=8,8 Гц), 7,74-7,78 (1H, м), 7,99 (1H, с), 9,02 (1H, т, J=7,5 Гц), 9,18 (1H, с).
ИК (ATR) см-1: 3386, 1747, 1687, 1589, 1515, 1492, 1236, 1145, 1081, 590, 526.
Т.пл.: 84°C.
МС m/z: 509 (М++H).
Аналитически вычислено для C23H19F3N2O6S: C, 54,33; H, 3,77; F, 11,21; N, 5,51; S, 6,31. Найдено: C, 54,61; H, 3,93; F, 11,32; N, 5,59; S, 6,33.
Пример 110: 5-[(2,5-дифторфенил)[(4-фторфенил)сульфонил]метил]-N-(диметиламинометил)-4-метилпиридин-2-карбоксамид

К раствору 5-[(2,5-дифторфенил)[(4-фторфенил)сульфонил]метил]-4-метилпиридин-2-карбоксамида (150 мг, 0,33 ммоль), полученного в Примере 15, в N,N-диметилформамиде (3 мл) добавляли раствор формальдегида (37%, 54 мл) и диметиламингидрохлорид (136 мг, 1,67 ммоль) при 0°C и смесь перемешивали в течение 2 часов при комнатной температуре. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом и сушили над безводным сульфатом натрия. Растворитель концентрировали при пониженном давлении и полученный остаток подвергали хроматографии на силикагеле. Фракцию, полученную при элюировании смесью дихлорметан:метанол=10:1, концентрировали при пониженном давлении и полученный остаток промывали диэтиловым эфиром и дихлорметаном и сушили с получением указанного в заголовке соединения (99 мг, 0,21 ммоль, 63%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,22 (3H, с), 2,38 (6H, с), 4,33 (2H, д, J=5,6 Гц), 5,97 (1H, с), 6,91-6,98 (1H, м), 7,01-7,08 (1H, м), 7,15 (2H, т, J=8,8 Гц), 7,70 (2H, д, J=8,8 Гц), 7,75-7,81 (1H, м), 7,98 (1H, с), 8,43 (1H, т, J=5,6 Гц), 9,16 (1H, с).
ИК (ATR) см-1: 3340, 1670, 1592, 1521, 1494, 1238, 1145, 1039, 838, 817, 711, 657, 590, 530.
Аналитически вычислено для C23H22F3N3O3S·0,75H2O: C, 56,26; H, 4,82; F, 11,61; N, 8,56; S, 6,53. Найдено: C, 55,97; H, 4,56; F, 12,44; N, 8,46; S, 6,51.
Пример 111: N-[[2-(трет-бутилдифенилсилилокси)этокси]метил]-5-[(2,5-дифторфенил)[(4-фторфенил)сульфонил]метил]-4-метилпиридин-2-карбоксамид
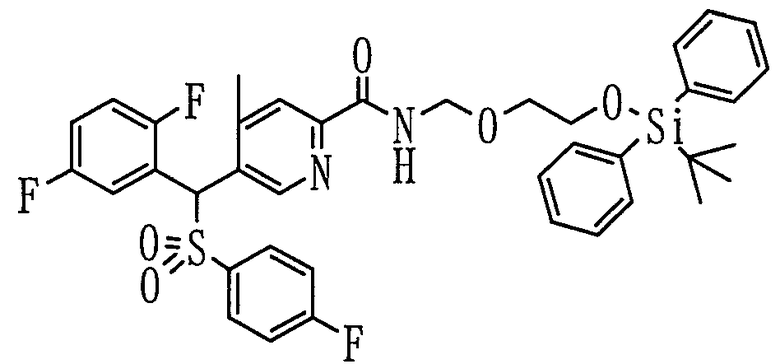
5-[(2,5-Дифторфенил)[(4-фторфенил)сульфонил]метил]-N-(1-гидроксиметил)-4-метилпиридин-2-карбоксамид (113 мг, 0,251 ммоль), полученный в Примере 85, и раствор 2-(трет-бутилдифенилсилилокси)этанола (136 мг, 0,453 ммоль) и п-толуолсульфоновой кислоты (10 мг) в бензоле (5 мл) перемешивали в течение 3 часов при нагревании до 60°C. Реакционный раствор охлаждали до комнатной температуры и затем концентрировали при пониженном давлении. К полученному в результате концентрирования остатку добавляли этилацетат и смесь промывали последовательно насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором. Органический слой сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. Полученный в результате концентрирования остаток подвергали колоночной флэш-хроматографии на силикагеле и фракцию, полученную при элюировании смесью 25% этилацетата/гексан, концентрировали при пониженном давлении с получением указанного в заголовке соединения (93 мг, 0,127 ммоль, 51%) в виде аморфного вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 1,04 (9H, с), 2,21 (3H, с), 3,65-3,85 (4H, м), 4,95-5,05 (2H, м), 5,96 (1H, с), 6,90-7,08 (4H, м), 7,30-7,43 (6H, м), 7,60-7,80 (7H, м), 7,98 (1H, с), 8,65-7,02 (1H, м), 9,14 (1H, с).
МС m/z: 733 (М++H).
Пример 112: 5-[(2,5-Дифторфенил)[(4-фторфенил)сульфонил]метил]-N-[(2-гидроксиэтокси)метил]-4-метилпиридин-2-карбоксамид

К раствору N-[[2-(трет-бутилдифенилсилилокси)-этокси]метил]-5-[(2,5-дифторфенил)[(4-фторфенил)сульфонил]метил]-4-метилпиридин-2-карбоксамида (56 мг, 0,076 ммоль) и уксусной кислоты (5 мл, 0,091 ммоль) в тетрагидрофуране (5 мл) добавляли фторид тетрабутиламмония (1 M раствор в тетрагидрофуране) (91 мкл, 0,091 ммоль) и смесь перемешивали в течение 6 часов при комнатной температуре. К реакционному раствору снова добавляли уксусную кислоту (5 мкл, 0,091 ммоль) и фторид тетрабутиламмония (1 M раствор в тетрагидрофуране) (91 мкл, 0,091 ммоль) и смесь перемешивали в течение 16 часов при комнатной температуре. Снова добавляли к реакционному раствору уксусную кислоту (5 мкл, 0,091 ммоль) и фторид тетрабутиламмония (1 M раствор в тетрагидрофуране) (91 мкл, 0,091 ммоль) и смесь перемешивали в течение 5 часов при комнатной температуре. К реакционному раствору добавляли насыщенный водный раствор хлорида аммония и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, затем сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. Полученный в результате концентрирования остаток подвергали колоночной флэш-хроматографии на силикагеле и фракцию, полученную при элюировании смесью 70% этилацетата/гексан, концентрировали при пониженном давлении. К полученному в результате концентрирования остатку добавляли простой эфир для осаждения твердого вещества и эфир отгоняли с получением указанного в заголовке соединения (35 мг, 0,071 ммоль, 93%) в виде твердого вещества белого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 2,22 (3H, с), 3,68-3,80 (4H, м), 4,95-5,05 (2H, м), 5,96 (1H, с), 6,90-7,08 (2H, м), 7,10-7,18 (2H, м), 7,60-7,80 (3H, м), 7,99 (1H, с), 8,75 (1H, ушир.т, J=7,0 Гц), 9,18 (1H, с).
ИК (ATR) см-1: 3347, 1668, 1589, 1513, 1494, 1309, 1282, 1230, 1147.
Т.пл.: 175-177°C.
МС m/z: 495 (М++H).
Аналитически вычислено для C23H21F3N2O5S: C, 55,87; H, 4,28; F, 11,53; N, 5,67; S, 6,48. Найдено: C, 55,63; H, 4,27; F, 11,40; N, 5,54; S, 6,43.
Пример 113: 5-[(2,5-Дифторфенил)[(4-фторфенил)сульфонил]метил]-4-метил-N-[(пиридин-3-илметокси)метил]пиридин-2-карбоксамид
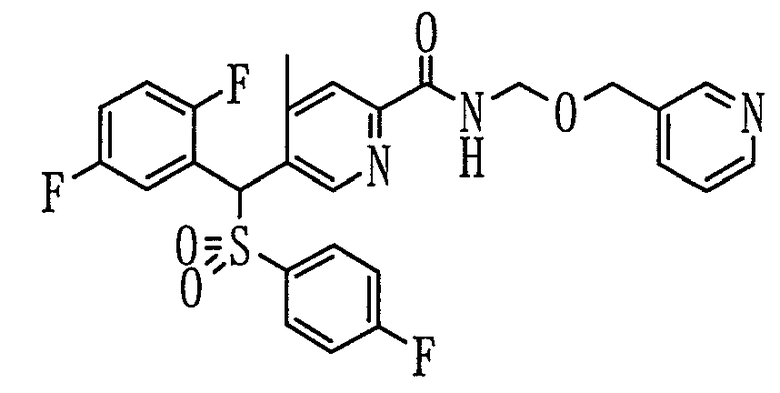
Бензольный раствор 5-[(2,5-дифторфенил)[(4-фторфенил)сульфонил]метил]-N-(1-гидроксиметил)-4-метилпиридин-2-карбоксамида (155 мг, 0,344 ммоль), полученного в Примере 85, 3-пиридинметанол (40 мкл, 0,413 ммоль) и дигидрат п-толуолсульфоновой кислоты (98 мг, 0,516 ммоль) нагревали до температуры кипения с обратным холодильником в течение 2 часов, отгоняя при этом воду. Реакционный раствор охлаждали до комнатной температуры, затем добавляли насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, затем сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. Полученный в результате концентрирования остаток подвергали колоночной флэш-хроматографии на силикагеле и фракцию, полученную при элюировании смесью 70% этилацетата/гексан, концентрировали при пониженном давлении. К полученному в результате концентрирования остатку добавляли простой эфир и осажденное таким образом твердое вещество собирали фильтрованием с получением указанного в заголовке соединения (46 мг, 0,085 ммоль, 25%) в виде порошка белого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 2,25 (3H, с), 4,66 (2H, с), 5,00-5,10 (2H, м), 5,97 (1H, с), 6,90-7,08 (2H, м), 7,10-7,18 (2H, м), 7,25-7,33 (1H, м), 7,67-7,80 (4H, м), 8,01 (1H, с), 8,50-8,55 (1H, м), 8,60 (1H, ушир.с), 8,74 (1H, ушир.т, J=7,1 Гц), 9,18 (1H, с).
ИК (ATR) см-1: 1675, 1590, 1523, 1492, 1309, 1295, 1236, 1147.
Т.пл.: 121-123°C.
МС m/z: 541 (М+).
Аналитически вычислено для C27H22F3N2O4S: C, 59,88; H, 4,09; F, 10,52; N, 7,79; S, 5,92. Найдено: C, 59,80; H, 4,07; F, 10,73; N, 7,70; S, 6,13.
Пример 114: 2-Бром-4-метил-5-[[[6-(трифторметил)пиридин-3-ил]тио](2,3,6-трифторфенил)метил]пиридин
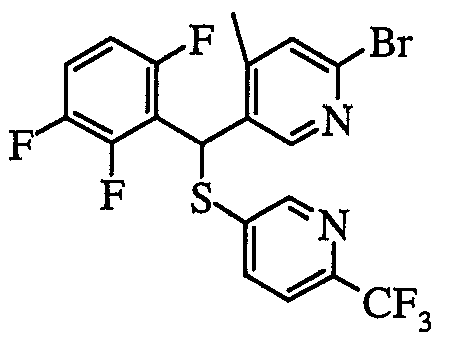
К раствору O-этил S-[6-(трифторметил)пиридин-3-ил] дитиокарбоната (3,09 г, 11,6 ммоль) в этаноле (30 мл) добавляли 1н. водный раствор гидроксида натрия (30 мл) и смесь перемешивали в атмосфере азота в течение 1 часа при 60°C. Реакционную смесь охлаждали до комнатной температуры, добавляли воду и смесь промывали дихлорметаном. Затем водный слой подкисляли 1н. раствором хлористоводородной кислоты и экстрагировали дихлорметаном. Органический слой сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. Полученный остаток растворяли в N,N-диметилформамиде (50 мл) и в атмосфере азота добавляли 2-бром-5-[хлор(2,3,6-трифторфенил)метил]-4-метилпиридин (3,94 г, 11,2 ммоль), полученный в Ссылочном примере 4, и затем карбонат калия (1,71 г, 12,4 ммоль) при 0°C. Смесь перемешивали в течение 16 часов при комнатной температуре. К реакционной смеси добавляли этилацетат и воду при 0°C, органический слой отделяли и затем органический слой промывали насыщенным солевым раствором. Органический слой сушили над безводным сульфатом натрия и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=9:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (4,76 г, 9,65 ммоль, 86%) в виде маслянистого вещества бледно-желтого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 2,24 (3H, с), 5,87 (1H, с), 6,81-6,90 (1H, м), 7,08-7,18 (1H, м), 7,30 (1H, с), 7,57 (1H, д, J=8,3 Гц), 7,76 (1H, дд, J=8,3, 2,0 Гц), 8,60 (1H, д, J=2,0 Гц), 8,85 (1H, с).
МС m/z: 493, 495 (М++H).
Пример 115: 4-Метил-5-[[[6-(трифторметил)пиридин-3-ил]тио](2,3,6-трифторфенил)метил]пиридин-2-карбальдегид
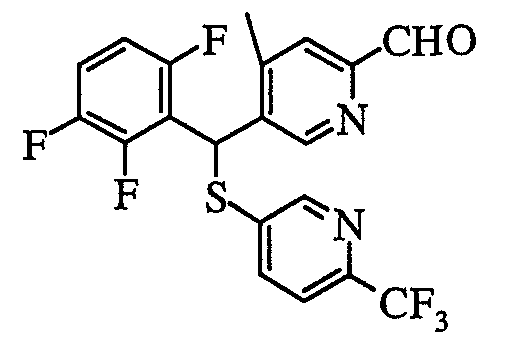
К раствору 2-бром-4-метил-5-[[[6-(трифторметил)пиридин-3-ил]тио](2,3,6-трифторфенил)метил]пиридина (4,76 г, 9,65 ммоль) в толуоле (100 мл) добавляли раствор н-бутиллития в гексане (1,58 M, 6,72 мл, 10,6 ммоль) в атмосфере аргона при -78°C. Реакционную смесь перемешивали в течение 30 минут при -40°C и затем снова охлаждали до -78°C и добавляли N,N-диметилформамид (0,897 мл, 11,6 ммоль). После завершения добавления по каплям реакционной смеси давали нагреться до 0°C и к смеси добавляли насыщенный водный раствор хлорида аммония при указанной температуре. К реакционной смеси добавляли дихлорметан и воду и органический слой отделяли. Затем органический слой сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали флэш-хроматографии на силикагеле и фракцию, полученную при элюировании смесью гексан:этилацетат=5:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (2,52 г, 5,70 ммоль, 59%) в виде маслянистого вещества желтого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 2,35 (3H, с), 5,99 (1H, с), 6,83-6,91 (1H, м), 7,10-7,20 (1H, м), 7,58 (1H, д, J=8,3 Гц), 7,76 (1H, с), 7,79 (1H, дд, J=8,3, 2,0 Гц), 8,60 (1H, д, J=2,0 Гц), 9,29 (1H, с), 10,06 (1H, с).
МС m/z: 443 (М++H).
Пример 116: 4-Метил-5-[[[6-(трифторметил)пиридин-3-ил]сульфонил](2,3,6-трифторфенил)метил]пиридин-2-карбоновая кислота

К раствору 4-метил-5-[[[6-(трифторметил)пиридин-3-ил]тио](2,3,6-трифторфенил)метил]пиридин-2-карбальдегида (2,52 г, 5,70 ммоль) в муравьиной кислоте (60 мл) добавляли 31% водную перекись водорода (6 мл) при 0°C. После перемешивания реакционной смеси в течение 5 часов при комнатной температуре к смеси добавляли воду и затем дихлорметан. После отделения органического слоя органический слой промывали насыщенным водным раствором хлорида аммония и затем 10% водным раствором тиосульфата натрия. Органический слой сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. Полученный остаток промывали этанолом и затем собирали фильтрованием с получением указанного в заголовке соединения (2,19 г, 4,47 ммоль, 78%) в виде твердого вещества белого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 2,26 (3H, с), 5,93 (1H, с), 6,85-6,93 (1H, м), 7,23-7,33 (1H, м), 7,86 (1H, д, J=8,3 Гц), 8,07 (1H, с), 8,26 (1H, дд, J=8,3, 2,2 Гц), 8,99 (1H, д, J=2,2 Гц), 9,50 (1H, с).
МС m/z: 491 (М++H).
Пример 117: 4-Метил-5-[[[6-(трифторметил)пиридин-3-ил]сульфонил](2,3,6-трифторфенил)метил]пиридин-2-карбоксамид
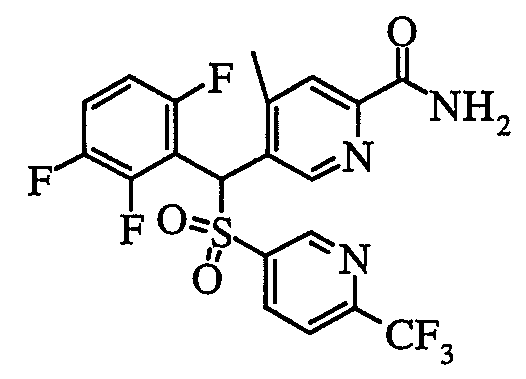
К раствору 4-метил-5-[[[6-(трифторметил)пиридин-3-ил]сульфонил](2,3,6-трифторфенил)метил]пиридин-2-карбоновой кислоты (392 мг, 0,800 ммоль) в N,N-диметилформамиде (10 мл) добавляли гексафторфосфат (бензотриазол-1-илокси)трипирролидинoфосфония (624 мг, 1,20 ммоль), бензотриазол-1-ол (162 мг, 1,20 ммоль), хлорид аммония (85,6 мг, 1,60 ммоль) и N-этилдиизопропиламин (0,557 мл, 3,20 ммоль) в атмосфере азота при комнатной температуре. После перемешивания в течение 2 часов при указанной температуре реакционную смесь растворяли в этилацетате и раствор промывали 1н. раствором хлористоводородной кислоты, 1н. водным раствором гидроксида натрия, насыщенным водный раствором хлорида аммония и затем насыщенным солевым раствором. Органический слой сушили над безводным сульфатом натрия и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=1:1, концентрировали при пониженном давлении и полученный остаток промывали смешанным растворителем, состоящим из этанола и диэтилового эфира, и затем собирали фильтрованием с получением указанного в заголовке соединения (229 мг, 0,468 ммоль, 58%) в виде твердого вещества белого цвета. Фильтрат концентрировали при пониженном давлении и полученный остаток промывали смешанным растворителем, состоящим из этанола и диэтилового эфира, и затем собирали фильтрованием с получением указанного в заголовке соединения (66 мг, 0,135 ммоль, 17%) в виде твердого вещества белого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 2,21 (3H, с), 5,61 (1H, ушир.с), 5,96 (1H, с), 6,85-6,93 (1H, м), 7,21-7,31 (1H, м), 7,84 (1H, д, J=8,3 Гц), 7,85 (1H, ушир.с), 8,04 (1H, с), 8,24 (1H, дд, J=8,3, 2,2 Гц), 8,99 (1H, д, J=2,2 Гц), 9,39 (1H, с).
ИК (ATR) см-1: 3462, 3159, 1701, 1595, 1495, 1329, 1192, 1163, 1140, 1107, 1078, 1018, 989.
Т.пл.: 237-238°C.
МС m/z: 490 (М++H).
Аналитически вычислено для C20H13F6N3O3S: C, 49,08; H, 2,68; F, 23,29; N, 8,59; S, 6,55. Найдено: C, 48,99; H, 2,70; F, 23,14; N, 8,60; S, 6,70.
Пример 118: N-(1-гидроксиметил)-4-метил-5-[[[6-(трифторметил)пиридин-3-ил]сульфонил](2,3,6-трифторфенил)метил]пиридин-2-карбоксамид
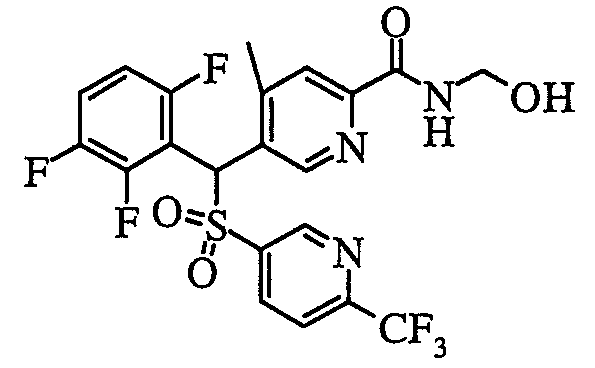
К раствору 4-метил-5-[[[6-(трифторметил)пиридин-3-ил]сульфонил](2,3,6-трифторфенил)метил]пиридин-2-карбоксамида (147 мг, 0,300 ммоль) в диметиловом эфире этиленгликоля (0,8 мл) добавляли водный раствор формальдегида (37%, 0,200 мл) и 1н. водный раствор гидроксида натрия (0,200 мл) при комнатной температуре и смесь перемешивали в течение 16 часов. К реакционной смеси добавляли этилацетат и смесь промывали насыщенным водным раствором гидрокарбоната натрия. Органический слой сушили над безводным сульфатом натрия и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=1:1, концентрировали при пониженном давлении и полученный остаток промывали смешанным растворителем, состоящим из этилацетата и диэтилового эфира, и затем собирали фильтрованием с получением указанного в заголовке соединения (113 мг, 0,218 ммоль, 73%) в виде твердого вещества белого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 2,22 (3H, с), 3,10 (1H, т, J=7,8 Гц), 5,02 (2H, дд, J=7,8, 6,4 Гц), 5,95 (1H, с), 6,84-6,93 (1H, м), 7,21-7,31 (1H, м), 7,84 (1H, д, J=8,3 Гц), 8,02 (1H, с), 8,24 (1H, дд, J=8,3, 2,2 Гц), 8,86 (1H, т, J=6,4 Гц), 8,99 (1H, д, J=2,2 Гц), 9,39 (1H, с).
ИК (ATR) см-1: 3249, 1655, 1541, 1496, 1333, 1186, 1161, 1105, 1078, 1043.
Т.пл.: 181-182°C.
МС m/z: 520 (М++H).
Аналитически вычислено для C21H15F6N3O4S: C, 48,56; H, 2,91; F, 21,95; N, 8,09; S, 6,17. Найдено: C, 48,48; H, 2,84; F, 21,67; N, 8,18; S, 6,39.
Ссылочный пример 12: 2-Бром-5-[[[трет-бутил(дифенил)силил]окси](2,3,6-трифторфенил)метил]-4-метилпиридин
К раствору (6-бром-4-метилпиридин-3-ил)(2,3,6-трифторфенил)метанола (51,3 г, 154 ммоль), полученного в Ссылочном примере 3, и трет-бутил хлор(дифенил)силана (43,0 мл, 162 ммоль) в N,N-диметилформамиде (350 мл) добавляли имидазол (22,1 г, 324 ммоль) при комнатной температуре и смесь перемешивали в течение 8 дней при комнатной температуре. К реакционной смеси добавляли воду и этилацетат, органический слой отделяли и органический слой промывали насыщенным водным раствором хлорида аммония и затем насыщенным солевым раствором. Органический слой сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали флэш-хроматографии на силикагеле и фракцию, полученную при элюировании смесью гексан:этилацетат=20:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (75,6 г, 133 ммоль, 86%) в виде бесцветного пенистого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 1,07 (9H, с), 1,85 (3H, с), 6,11 (1H, с), 6,58-6,65 (1H, м), 6,91-7,01 (1H, м), 7,12 (1H, с), 7,20-7,54 (10H, м), 9,12 (1H, с).
МС m/z: 570, 572 (М++H).
Ссылочный пример 13: 5-[[[Трет-бутил(дифенил)силил]окси](2,3,6-трифторфенил)метил]-4-метилпиридин-2-карбоксамид
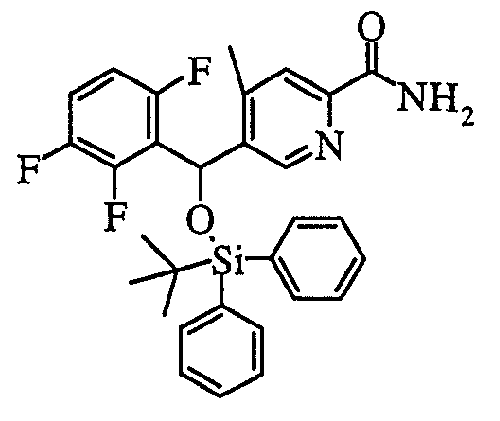
К раствору 2-бром-5-[[[трет-бутил(дифенил)силил]окси](2,3,6-трифторфенил)метил]-4-метилпиридина (75,6 г, 133 ммоль) в толуоле (1200 мл) добавляли раствор н-бутиллития в гексане (1,60 M, 99,4 мл, 159 ммоль) в атмосфере аргона при -78°C. Реакционную смесь перемешивали в течение 30 минут при -50°C и затем снова охлаждали до -78°C и в смесь барботировали диоксид углерода. После перемешивания в течение 30 минут при указанной температуре реакционной смеси давали нагреться до 0°C, к смеси добавляли воду и затем 1н. раствор хлористоводородной кислоты и смесь концентрировали при пониженном давлении. К полученному остатку добавляли этилацетат и органический слой промывали насыщенным солевым раствором. Органический слой сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. Полученный остаток растворяли в тетрагидрофуране (1000 мл) и к смеси добавляли изобутилхлоркарбонат (25,3 мл, 195 ммоль) и затем триэтиламин (36,2 мл, 260 ммоль) при -5°C. После перемешивания смеси в течение 30 минут при указанной температуре добавляли 7н. раствор аммиака в метаноле (100 мл, 700 ммоль) и смесь перемешивали в течение 1 часа при комнатной температуре. Реакционную смесь концентрировали при пониженном давлении и к полученному остатку добавляли этилацетат и воду. После отделения органического слоя органический слой промывали 1н. раствором хлористоводородной кислоты, насыщенным водным раствором гидрокарбоната натрия и затем насыщенным солевым раствором и органический слой сушили над безводным сульфатом натрия и фильтровали. Затем фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали флэш-хроматографии на силикагеле и фракцию, полученную при элюировании смесью гексан:этилацетат=1:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (50,0 г, 93,5 ммоль, 70%) в виде маслянистого вещества светло-коричневого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 1,09 (9H, с), 1,96 (3H, с), 5,56 (1H, ушир.с), 6,23 (1H, с), 6,58-6,65 (1H, м), 6,92-7,01 (1H, м), 7,20-7,54 (10H, м), 7,85 (1H, с), 7,88 (1H, ушир.с), 9,33 (1H, с).
МС m/z: 535 (М++H).
Ссылочный пример 14: 5-[Гидрокси(2,3,6-трифторфенил)метил]-4-метилпиридин-2-карбоксамид

К раствору 5-[[[трет-бутил(дифенил)силил]окси](2,3,6-трифторфенил)метил]-4-метилпиридин-2-карбоксамида (50,0 г, 93,5 ммоль) в тетрагидрофуране (500 мл) добавляли 1 н. раствор фторида тетрабутиламмония в тетрагидрофуране (100 мл, 100 ммоль) при 0°C. После перемешивания смеси в течение 2 часов при комнатной температуре добавляли насыщенный водный раствор хлорида аммония и смесь концентрировали при пониженном давлении. К полученному остатку добавляли этилацетат и воду. После отделения органического слоя органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. Остаток промывали смешанным растворителем, состоящим из этилацетата и диэтилового эфира, и затем диэтиловым эфиром и затем остаток сушили при пониженном давлении с получением указанного в заголовке соединения (20,8 г, 70,2 ммоль, 75%) в виде твердого вещества белого цвета.
1H-ЯМР (400 МГц, CD3OD) δ: 2,22 (3H, с), 6,35 (1H, с), 6,93-7,02 (1H, м), 7,24-7,34 (1H, м), 7,85 (1H, с), 8,99 (1H, с).
МС m/z: 297 (М++H).
Ссылочный пример 15: [6-Карбамоил-4-метилпиридин-3-ил](2,3,6-трифторфенил)метил метансульфонат
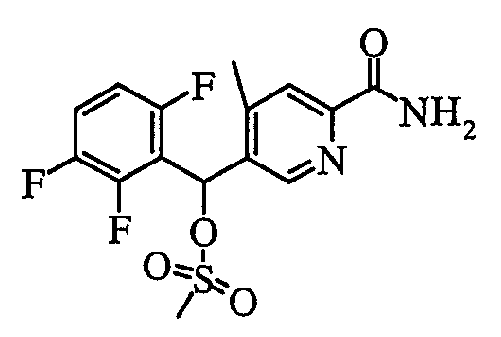
К раствору 5-[гидрокси(2,3,6-трифторфенил)метил]-4-метилпиридин-2-карбоксамида (7,11 г, 24,0 ммоль) в N,N-диметилформамиде (150 мл) добавляли метансульфонилхлорид (3,72 мл, 48,0 ммоль) и затем триэтиламин (13,4 мл, 96,0 ммоль) в атмосфере азота при 0°C и смесь перемешивали в течение 2 часов при комнатной температуре. К реакционной смеси добавляли воду и этилацетат при 0°C, органический слой отделяли и органический слой промывали последовательно 1н. раствором хлористоводородной кислоты, насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором. Органический слой сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали флэш-хроматографии на силикагеле и фракцию, полученную при элюировании смесью дихлорметан:метанол=49:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (4,71 г, 12,6 ммоль, 52%) в виде пенистого вещества светло-коричневого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 2,38 (3H, с), 3,04 (3H, с), 5,65 (1H, ушир.с), 6,91-6,98 (1H, м), 7,16 (1H, с), 7,21-7,30 (1H, м), 7,84 (1H, ушир.с), 8,02 (1H, с), 8,88 (1H, с).
Пример 119: 5-[[(4-Хлорфенил)сульфонил](2,3,6-трифторфенил)метил]-4-метилпиридин-2-карбоксамид

К раствору [6-карбамоил-4-метилпиридин-3-ил](2,3,6-трифторфенил)метилметансульфоната (187 мг, 0,500 ммоль), полученного в Ссылочном примере 15, в N,N-диметилформамиде (5 мл) добавляли 4-хлорбензолтиол (72,2 мг, 0,500 ммоль) и затем карбонат калия (82,9 мг, 0,600 ммоль) в атмосфере азота при 0°C и смесь перемешивали в течение 3 дней при комнатной температуре. К реакционной смеси добавляли этилацетат и воду, органический слой отделяли и органический слой промывали насыщенным водным раствором гидрокарбоната натрия и затем насыщенным солевым раствором. Органический слой сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. Полученный остаток растворяли в дихлорметане (5 мл) и к смеси добавляли 3-хлорпербензойную кислоту (318 мг, 1,20 ммоль) при 0°C. После перемешивания в течение 4 часов при комнатной температуре реакционную смесь промывали 1н. водным раствором гидроксида натрия. Органический слой сушили над безводным сульфатом натрия и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью дихлорметан:метанол=99:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (190 мг, 0,418 ммоль, 84%) в виде твердого вещества белого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 2,15 (3H, с), 5,62 (1H, ушир.с), 5,90 (1H, с), 6,83-6,91 (1H, м), 7,16-7,26 (1H, м), 7,45-7,50 (2H, м), 7,65-7,70 (2H, м), 7,87 (1H, ушир.с), 7,99 (1H, с), 9,42 (1H, с).
ИК (ATR) см-1: 3396, 3168, 1687, 1496, 1419, 1311, 1238, 1146, 1082.
МС m/z: 455 (М++H).
Пример 120: 5-[[(4-Хлорфенил)сульфонил](2,3,6-трифторфенил)метил]-N-(гидроксиметил)-4-метилпиридин-2-карбоксамид
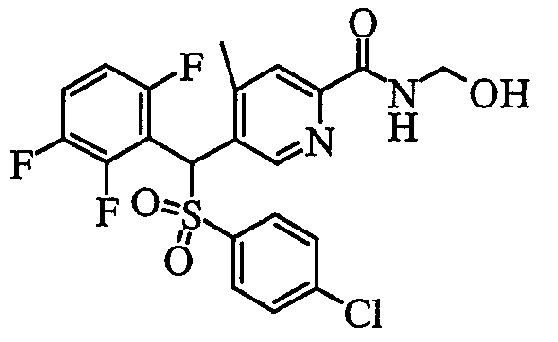
К раствору 5-[[(4-хлорфенил)сульфонил](2,3,6-трифторфенил)метил]-4-метилпиридин-2-карбоксамида (190 мг, 0,418 ммоль) в диметиловом эфире этиленгликоля (4 мл) добавляли водный раствор формальдегида (37%, 94,2 мкл) и 1н. водный раствор гидроксида натрия (21,0 мкл) при комнатной температуре и смесь перемешивали в течение 17 часов. К реакционной смеси добавляли этилацетат и смесь промывали насыщенным водным раствором хлорида аммония. Затем к органическому слою добавляли 1н. раствор хлористоводородной кислоты и смесь перемешивали в течение 1 часа. После отделения органического слоя органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали флэш-хроматографии на силикагеле и фракцию, полученную при элюировании смесью гексан:этилацетат=1:1, концентрировали при пониженном давлении. Полученный остаток промывали смешанным растворителем, состоящим из этилацетата и диэтилового эфира, и затем собирали фильтрованием с получением указанного в заголовке соединения (113 мг, 0,233 ммоль, 56%) в виде твердого вещества белого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 2,16 (3H, с), 3,06 (1H, т, J=7,8 Гц), 5,01 (2H, дд, J=7,8, 6,6 Гц), 5,90 (1H, с), 6,83-6,91 (1H, м), 7,16-7,26 (1H, м), 7,45-7,50 (2H, м), 7,65-7,70 (2H, м), 7,97 (1H, с), 8,88 (1H, т, J=6,6 Гц), 9,42 (1H, с).
ИК (ATR) см-1: 3251, 1657, 1537, 1493, 1335, 1232, 1149, 1088, 1047.
Т.пл.: 177-178°C.
МС m/z: 485 (М++H).
Аналитически вычислено для C21H16ClF3N2O4S: C, 52,02; H, 3,33; Cl, 7,31; F, 11,75; N, 5,78; S, 6,61. Найдено: C, 52,06; H, 3,31; Cl, 7,23; F, 11,46; N, 5,78; S, 6,69.
Пример 121: 5-[[(3,4-Дифторфенил)сульфонил](2,3,6-трифторфенил)метил]-4-метилпиридин-2-карбоксамид

К раствору [6-карбамоил-4-метилпиридин-3-ил](2,3,6-трифторфенил)метилметансульфоната (262 мг, 0,700 ммоль), полученного в Ссылочном примере 15, в N,N-диметилформамиде (7 мл) добавляли 3,4-дифторбензолтиол (80,6 мкл, 0,700 ммоль) и затем карбонат калия (116 мг, 0,840 ммоль) в атмосфере азота при 0°C и полученную смесь перемешивали в течение 3 дней при комнатной температуре. К реакционной смеси добавляли этилацетат и воду, органический слой отделяли и органический слой промывали насыщенным водным раствором гидрокарбоната натрия и затем насыщенным солевым раствором. Органический слой сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. Полученный остаток растворяли в дихлорметане (7 мл) и к смеси добавляли 3-хлорпербензойную кислоту (446 мг, 1,68 ммоль) при 0°C. После перемешивания в течение 5 часов при комнатной температуре реакционную смесь промывали 1н. водным раствором гидроксида натрия. Органический слой сушили над безводным сульфатом натрия и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную из дихлорметана:метанола=99:1, концентрировали при пониженном давлении и полученный остаток промывали 2-пропанолом и собирали фильтрованием с получением, таким образом, указанного в заголовке соединения (213 мг, 0,467 ммоль, 67%) в виде твердого вещества белого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 2,18 (3H, с), 5,59 (1H, ушир.с), 5,90 (1H, с), 6,84-6,92 (1H, м), 7,18-7,35 (2H, м), 7,49-7,56 (1H, м), 7,58-7,65 (1H, м), 7,87 (1H, ушир.с), 8,01 (1H, с), 9,42 (1H, с).
ИК (ATR) см-1: 3396, 3165, 1691, 1597, 1498, 1417, 1333, 1279, 1238, 1142.
Т.пл.: 200-201°C.
МС m/z: 457 (М++H).
Аналитически вычислено для C20H13F5N2O3S: C, 52,63; H, 2,87; F, 20,81; N, 6,14; S, 7,03. Найдено: C, 52,58; H, 2,77; F, 20,94; N, 6,18; S, 7,14.
Пример 122: 5-[[(3,4-Дифторфенил)сульфонил](2,3,6-трифторфенил)метил]-N-(гидроксиметил)-4-метилпиридин-2-карбоксамид

К раствору 5-[[(3,4-дифторфенил)сульфонил](2,3,6-трифторфенил)метил]-4-метилпиридин-2-карбоксамида (160 мг, 0,350 ммоль) в диметиловом эфире этиленгликоля (3 мл) добавляли водный раствор формальдегида (37%, 78,9 мкл) и 1н. водный раствор гидроксида натрия (17,5 мкл) при комнатной температуре и смесь перемешивали в течение 18 часов. К реакционной смеси добавляли этилацетат и полученную смесь промывали насыщенным водным раствором хлорида аммония. Затем к органическому слою добавляли 1н. раствор хлористоводородной кислоты и смесь перемешивали в течение 1 часа. После отделения органического слоя органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали флэш-хроматографии на силикагеле и фракцию, полученную при элюировании смесью гексан:этилацетат=1:1, концентрировали при пониженном давлении. Полученный остаток промывали смешанным растворителем, состоящим из этилацетата и диэтилового эфира, и затем собирали фильтрованием с получением указанного в заголовке соединения (100 мг, 0,206 ммоль, 59%) в виде твердого вещества белого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 2,19 (3H, с), 3,15 (1H, т, J=7,6 Гц), 5,01 (2H, дд, J=7,6, 6,8 Гц), 5,90 (1H, с), 6,84-6,92 (1H, м), 7,19-7,35 (2H, м), 7,50-7,56 (1H, м), 7,58-7,64 (1H, м), 7,99 (1H, с), 8,87 (1H, т, J=6,8 Гц), 9,42 (1H, с).
ИК (ATR) см-1: 3394, 3332, 1647, 1522, 1496, 1417, 1335, 1284, 1213, 1141, 1055.
Т.пл.: 119-120°C.
МС m/z: 487 (М++H).
Аналитически вычислено для C21H15F5N2O4S: C, 51,85; H, 3,11; F, 19,53; N, 5,76; S, 6,59. Найдено: C, 51,64; H, 3,01; F, 19,45; N, 5,81; S, 6,74.
Пример 123: 4-Метил-5-[[[4-(трифторметокси)фенил]сульфонил](2,3,6-трифторфенил)метил]пиридин-2-карбоксамид
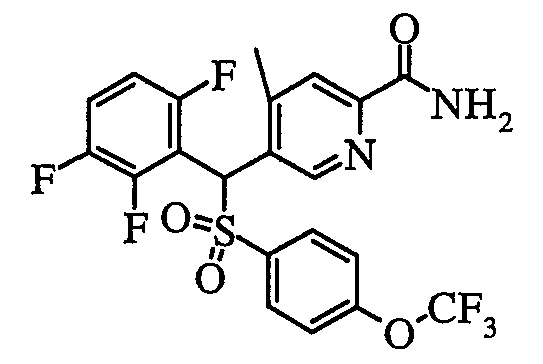
К раствору [6-карбамоил-4-метилпиридин-3-ил](2,3,6-трифторфенил)метилметансульфоната (262 мг, 0,700 ммоль), полученного в Ссылочном примере 15, в N,N-диметилформамиде (7 мл) добавляли 4-(трифторметокси)бензолтиол (136 мг, 0,700 ммоль) и затем карбонат калия (116 мг, 0,840 ммоль) в атмосфере азота при 0°C и смесь перемешивали в течение 3 дней при комнатной температуре. К реакционной смеси добавляли этилацетат и воду, органический слой отделяли и органический слой промывали насыщенным водным раствором гидрокарбоната натрия и затем насыщенным солевым раствором. Органический слой сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. Полученный остаток растворяли в дихлорметане (7 мл) и к смеси добавляли 3-хлорпербензойную кислоту (446 мг, 1,68 ммоль) при 0°C. После перемешивания в течение 3 часов при комнатной температуре реакционную смесь промывали 1н. водным раствором гидроксида натрия. Органический слой сушили над безводным сульфатом натрия и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании дихлорметан:метанол=99:1, концентрировали при пониженном давлении и полученный остаток промывали смешанным растворителем, состоящим из этилацетата и диэтилового эфира, и затем собирали фильтрованием с получением указанного в заголовке соединения (244 мг, 0,484 ммоль, 69%) в виде твердого вещества белого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 2,15 (3H, с), 5,62 (1H, ушир.с), 5,90 (1H, с), 6,83-6,91 (1H, м), 7,16-7,26 (1H, м), 7,45-7,50 (2H, м), 7,66-7,71 (2H, м), 7,88 (1H, ушир.с), 7,99 (1H, с), 9,42 (1H, с).
ИК (ATR) см-1: 3438, 3161, 1703, 1597, 1493, 1419, 1323, 1255, 1217, 1151.
Т.пл.: 219-220°C.
МС m/z: 505 (М++H).
Аналитически вычислено для C21H14F6N2O4S: C, 50,00; H, 2,80; F, 22,60; N, 5,55; S, 6,36. Найдено: C, 49,65; H, 2,74; F, 22,49; N, 5,52; S, 6,43.
Пример 124: N-(гидроксиметил)-4-метил-5-[[[4-(трифторметокси)фенил]сульфонил](2,3,6-трифторфенил)метил]пиридин-2-карбоксамид
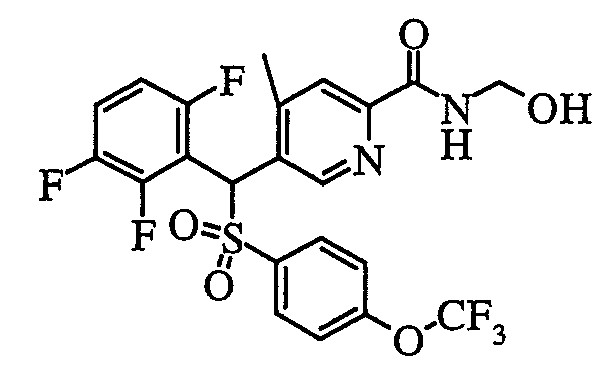
К раствору 4-метил-5-[[[4-(трифторметокси)фенил]сульфонил](2,3,6-трифторфенил)метил]пиридин-2-карбоксамида (177 мг, 0,350 ммоль) в диметиловом эфире этиленгликоля (3 мл) добавляли водный раствор формальдегида (37%, 78,9 мкл) и 1н. водный раствор гидроксида натрия (17,5 мкл) при комнатной температуре и смесь перемешивали в течение 2 дней. К реакционной смеси добавляли этилацетат и смесь промывали насыщенным водным раствором хлорида аммония. Затем к органическому слою добавляли 1н. раствор хлористоводородной кислоты и смесь перемешивали в течение 1 часа. После отделения органического слоя органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали флэш-хроматографии на силикагеле и фракцию, полученную при элюировании смесью гексан:этилацетат=1:1, концентрировали при пониженном давлении. Полученный остаток промывали смешанным растворителем, состоящим из этилацетата и диэтилового эфира, и затем собирали фильтрованием с получением указанного в заголовке соединения (59,4 мг, 0,111 ммоль, 32%) в виде твердого вещества белого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 2,15 (3H, с), 3,09 (1H, т, J=7,6 Гц), 5,01 (2H, дд, J=7,6, 6,6 Гц), 5,89 (1H, с), 6,82-6,90 (1H, м), 7,16-7,36 (3H, м), 7,77-7,83 (2H, м), 7,98 (1H, с), 8,88 (1H, т, J=6,6 Гц), 9,43 (1H, с).
ИК (ATR) см-1: 3236, 1657, 1541, 1495, 1252, 1227, 1151, 1043.
Т.пл.: 140-141°C.
МС m/z: 535 (М++H).
Аналитически вычислено для C22H16F6N2O5S: C, 49,44; H, 3,02; F, 21,33; N, 5,24; S, 6,00. Найдено: C, 49,44; H, 2,94; F, 21,42; N, 5,29; S, 6,15.
Ссылочный пример 16: S-(бензофуран-6-ил) O-этил дитиокарбонат
К раствору бензофуран-6-иламина (574 мг, 4,31 ммоль) в метаноле (2 мл) добавляли по каплям 1н. раствор хлористоводородной кислоты (10 мл) и затем раствор нитрита натрия (362 мг, 5,17 ммоль) в воде (2 мл) при 0°C и смесь перемешивали в течение 1 часа при указанной температуре. Реакционную смесь добавляли к раствору O-этилдитиокарбоната калия (1,38 г, 8,62 ммоль) в воде (2 мл), который был нагрет до 65°C. После перемешивания в течение 2 часов при указанной температуре реакционную смесь охлаждали до комнатной температуры, добавляли воду и продукт экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом натрия и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=50:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (351 мг, 1,47 ммоль, 34%) в виде маслянистого вещества желтого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 1,33 (3H, т, J=7,1 Гц), 4,62 (2H, кв, J=7,1 Гц), 6,80-6,84 (1H, м), 7,35-7,40 (1H, м), 7,64 (1H, д, J=8,1 Гц), 7,68-7,69 (1H, м), 7,71 (1H, д, J=2,2 Гц).
МС m/z: 239 (М++H).
Пример 125: 5-[(1-Бензофуран-6-илтио)(2,3,6-трифторфенил)метил]-4-метилпиридин-2-карбоксамид
S-(бензофуран-6-ил) O-этилдитиокарбонат (145 мг, 0,604 ммоль), полученный в Ссылочном примере 16, растворяли в этаноле (3 мл), добавляли 1н. водный раствор гидроксида натрия (3 мл) и смесь перемешивали в течение 2 часов при 60°C. Реакционную смесь охлаждали до комнатной температуры, добавляли воду и 1н. водный раствор гидроксида натрия (4 мл) и затем смесь промывали дихлорметаном. Водный слой подкисляли 1н. раствором хлористоводородной кислоты и затем экстрагировали этилацетатом. Экстракт промывали водой и насыщенным солевым раствором, затем сушили над сульфатом магния и концентрировали. К остатку в атмосфере аргона добавляли N,N-диметилформамид (4 мл). Добавляли [6-карбамоил-4-метилпиридин-3-ил](2,3,6-трифторфенил)метилметансульфонат (271 мг, 0,725 ммоль), полученный в Ссылочном примере 15, и затем карбонат калия (100 мг, 0,725 ммоль) при 0°C и затем смесь перемешивали в течение 4 часов при комнатной температуре. Реакционную смесь охлаждали до 0°C и затем последовательно добавляли этилацетат и воду. Органический слой отделяли и затем промывали водой и насыщенным солевым раствором. После сушки над сульфатом магния органический слой концентрировали и полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=1:1, концентрировали с получением указанного в заголовке соединения (226 мг, 0,528 ммоль, 87%) в виде твердого вещества белого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 2,26 (3H, с), 5,48-5,54 (1H, м), 5,88 (1H, с), 6,74 (1H, м), 6,76-6,83 (1H, м), 7,06 (1H, ддд, J=18,1, 9,0, 4,9 Гц), 7,26-7,28 (1H, м), 7,49 (1H, д, J=8,0 Гц), 7,54 (1H, с), 7,63 (1H, д, J=2,2 Гц), 7,84 (1H, с), 7,94 (1H, с), 9,14 (1H, с).
МС m/z: 429 (М++H).
Пример 126: 5-[(1-Бензофуран-6-илсульфонил)(2,3,6-трифторфенил)метил]-4-метилпиридин-2-карбоксамид
К раствору 5-[(1-бензофуран-6-илтио)(2,3,6-трифторфенил)метил]-4-метилпиридин-2-карбоксамида (93,0 мг, 0,217 ммоль) в этилацетате (5 мл) и метаноле (5 мл) добавляли 30% водную перекись водорода (2,5 мл) и гептамолибдат гексааммония тетрагидрат (10 мг, 0,00809 ммоль) и смесь перемешивали в течение 9 часов при комнатной температуре. К реакционной смеси добавляли гептамолибдат гексааммония тетрагидрат (10 мг, 0,00809 ммоль) и смесь перемешивали в течение 16 часов при комнатной температуре. Кроме того, к реакционной смеси добавляли 30% водную перекись водорода (1,0 мл) и полученную смесь перемешивали в течение 3 часов. К реакционной смеси добавляли воду и органический растворитель отгоняли при пониженном давлении. Полученный остаток экстрагировали этилацетатом и промывали последовательно водой, тиосульфатом натрия, водой и насыщенным солевым раствором. Остаток сушили над сульфатом магния и затем концентрировали. Полученный остаток подвергали колоночной флэш-хроматографии на силикагеле и фракцию, полученную при элюировании смесью гексан:этилацетат=2:3, концентрировали. Полученное твердое вещество перекристаллизовывали из этилацетата с получением указанного в заголовке соединения (35,8 мг, 0,0778 ммоль, 36%) в виде твердого вещества белого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 2,08 (3H, с), 5,55 (1H, с), 5,98 (1H, с), 6,80-6,87 (1H, м), 6,89 (1H, дд, J=2,2, 1,0 Гц), 7,19 (1H, ддд, J=18,0, 9,3, 4,9 Гц), 7,60 (1H, дд, J=8,1, 1,7 Гц), 7,69 (1H, д, J=8,1 Гц), 7,85 (1H, д, J=2,2 Гц), 7,86-7,90 (1H, ушир.с), 7,94 (2H, м), 9,48 (1H, с).
ИК (ATR) см-1: 3456, 3153, 1699, 1597, 1493, 1427, 1313, 1242, 1182, 1149, 1124, 1051, 989, 887, 829, 771, 727, 708, 633, 586, 563, 501, 420.
Т.пл.: 237-240°C.
МС m/z: 461 (М++H).
Аналитически вычислено для C22H15F3N2O4S: C, 57,39; H, 3,28; F, 12,38; N, 6,08; S, 6,96. Найдено: C, 57,25; H, 3,25; F, 12,37; N, 5,91; S, 6,97.
Пример 127: 5-[(1-Бензофуран-6-илсульфонил)(2,3,6-трифторфенил)метил]-N-(гидроксиметил)-4-метилпиридин-2-карбоксамид

К 1,2-диметоксиэтановому раствору (5 мл) 5-[(1-бензофуран-6-илсульфонил)(2,3,6-трифторфенил)метил]-4-метилпиридин-2-карбоксамида (210 мг, 0,457 ммоль) добавляли водный раствор формальдегида (37%, 0,111 мл) и 1н. водный раствор гидроксида натрия (0,023 мл) и смесь перемешивали в течение 4 часов при комнатной температуре. К реакционной смеси добавляли водный раствор формальдегида (37%, 0,111 мл) и 1н. водный раствор гидроксида натрия (0,023 мл) и смесь перемешивали в течение 5 часов при комнатной температуре. Снова добавляли водный раствор формальдегида (37%, 0,111 мл) и затем смесь перемешивали в течение 18 часов при комнатной температуре. К реакционному раствору добавляли воду и смесь экстрагировали этилацетатом и затем промывали водой и насыщенным солевым раствором. Смесь сушили над сульфатом магния и концентрировали и полученный остаток подвергали колоночной флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью гексан:этилацетат=2:3, концентрировали. Полученное твердое вещество перекристаллизовывали из 2-пропанола с получением указанного в заголовке соединения (138 мг, 0,273 ммоль, 60%) в виде твердого вещества белого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 2,09 (3H, с), 3,04 (1H, т, J=7,3 Гц), 5,01 (2H, т, J=7,3 Гц), 5,98 (1H, с), 6,80-6,87 (1H, м), 6,89 (1H, дд, J=2,2, 0,7 Гц), 7,19 (1H, ддд, J=17,8, 9,0, 4,9 Гц), 7,60 (1H, дд, J=8,0, 1,7 Гц), 7,69 (1H, д, J=8,0 Гц), 7,85 (1H, д, J=2,2 Гц), 7,93 (2H, м), 8,85-8,91 (1H, м), 9,48 (1H, с).
ИК (ATR) см-1: 3394, 1670, 1601, 1516, 1496, 1423, 1321, 1302, 1230, 1186, 1144, 1126, 1054, 1036, 822, 729, 714, 633, 586, 552, 532, 496.
Т.пл.: 185-186°C (дeк.).
МС m/z: 491 (М++H).
Аналитически вычислено для C23H17F3N2O5S·0,25C3H8O: C, 56, 43; H, 3,79; F, 11,28; N, 5,54; S, 6,34. Найдено: C, 56,38; H, 3,76; F, 11,51; N, 5,49; S, 6,43.
Пример 128: 4-Метил-5-[[[4-(трифторметил)фенил]сульфонил](2,3,6-трифторфенил)метил]пиридин-2-карбоксамид
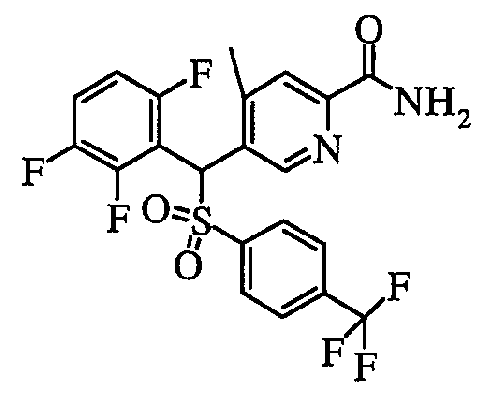
К раствору [6-(аминокарбонил)-4-метилпиридин-3-ил](2,3,6-трифторфенил)метилметансульфоната (262 мг, 0,700 ммоль), полученного в Ссылочном примере 15, и 4-(трифторметил)бензолтиола (129 мг, 0,700 ммоль) в N,N-диметилформамиде (10 мл) добавляли карбонат калия (116 мг, 0,840 ммоль) в атмосфере азота при 0°C и смесь перемешивали в течение 2 часов при комнатной температуре. К реакционной смеси добавляли этилацетат и воду, органический слой отделяли и затем органический слой промывали насыщенным солевым раствором. Органический слой сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. Полученный остаток растворяли в дихлорметане (10 мл) и добавляли 3-хлорпербензойную кислоту (465 мг, 1,75 ммоль) при 0°C. После перемешивания в течение 14 часов при комнатной температуре реакционную смесь промывали 1н. водным раствором гидроксида натрия. Органический слой сушили над безводным сульфатом натрия и фильтровали, затем фильтрат концентрировали при пониженном давлении и полученный остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную при элюировании смесью дихлорметан:метанол=99:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (260 мг, 0,532 ммоль, 76%) в виде твердого вещества белого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 2,14 (3H, с), 5,58 (1H, ушир.с), 5,93 (1H, с), 6,83-6,91 (1H, м), 7,17-7,26 (1H, м), 7,75-7,81 (2H, м), 7,84-7,94 (3H, м), 8,00 (1H, с), 9,43 (1H, с).
МС m/z: 489 (М++H).
Пример 129: N-(гидроксиметил)-4-метил-5-[[[4-(трифторметил)фенил]сульфонил](2,3,6-трифторфенил)метил]-пиридин-2-карбоксамид
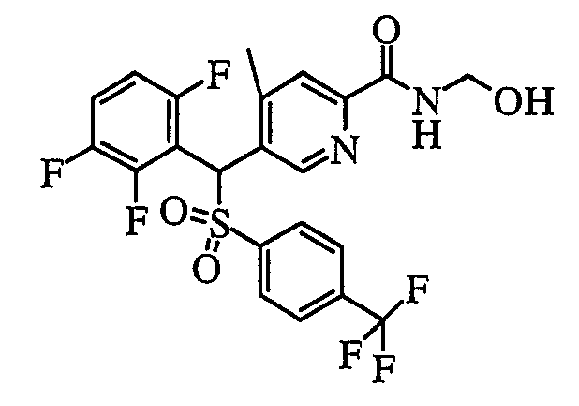
К раствору 4-метил-5-[[[4-(трифторметил)фенил]сульфонил](2,3,6-трифторфенил)метил]пиридин-2-карбоксамида (171 мг, 0,350 ммоль) в диметиловом эфире этиленгликоля (5 мл) добавляли водный раствор формальдегида (37%, 78,9 мкл) и водный раствор гидроксида натрия (17,5 мкл) при комнатной температуре и смесь перемешивали в течение 15 часов. К реакционной смеси добавляли этилацетат и смесь промывали насыщенным водным раствором хлорида аммония. Затем к органическому слою добавляли 1н. раствор хлористоводородной кислоты и смесь перемешивали в течение 1 часа. После отделения органического слоя органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали флэш-хроматографии на силикагеле и фракцию, полученную при элюировании смесью гексан:этилацетат=1:1, концентрировали при пониженном давлении. Полученный остаток промывали смешанным растворителем, состоящим из 2-пропанола и гексана, и затем собирали фильтрованием с получением указанного в заголовке соединения (139 мг, 0,268 ммоль, 77%) в виде твердого вещества белого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 2,15 (3H, с), 3,03-3,08 (1H, м), 4,98-5,05 (2H, м), 5,93 (1H, с), 6,83-6,91 (1H, м), 7,18-7,26 (1H, м), 7,77 (2H, д, J=8,5 Гц), 7,89 (2H, д, J=8,5 Гц), 7,98 (1H, с), 8,83-8,91 (1H, м), 9,43 (1H, с).
ИК (ATR) см-1: 3479, 3381, 1682, 1520, 1491, 1402, 1321, 1255, 1186, 1171, 1147, 1128, 1055, 1016.
Т.пл.: 190-192°C.
Аналитически вычислено для C22H16F6N2O4S: C, 50,97; H, 3,11; F, 21,99; N, 5,40; S, 6,19. Найдено: C, 50,95; H, 3,06; F, 22,24; N, 5,47; S, 6,31.
МС m/z: 519 (М++H).
Пример 130: этил [[[[5-[(2,5-дифторфенил)[(4-фторфенил)сульфонил]метил]-4-метилпиридин-2-ил]карбонил]амино]метокси]ацетат

Раствор 5-[(2,5-дифторфенил)[(4-фторфенил)сульфонил]метил]-N-(гидроксиметил)-4-метилпиридин-2-карбоксамида (421 мг, 0,935 ммоль), полученный в Примере 85, этилгидроксиацетата (106 мл, 1,12 ммоль), моногидрата п-толуолсульфоновой кислоты (18 мг, 0,094 ммоль) в бензоле (10 мл) нагревали до температуры кипения с обратным холодильником в течение 30 минут. Реакционный раствор охлаждали до комнатной температуры и затем концентрировали при пониженном давлении. К полученному в результате концентрирования остатку добавляли насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали из этилацетата. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. Полученный в результате концентрирования остаток подвергали колоночной флэш-хроматографии на силикагеле и фракцию, полученную при элюировании смесью 35% этилацетата/гексан, концентрировали при пониженном давлении с получением указанного в заголовке соединения (175 мг, 0,326 ммоль, 35%) в виде твердого вещества белого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 1,27 (3H, т, J=7,2 Гц), 2,22 (3H, с), 4,15-4,25 (4H, м), 5,08 (2H, д, J=7,2 Гц), 5,96 (1H, с), 6,90-7,20 (4H, м), 7,67-7,82 (3H, м), 7,98 (1H, с), 8,76 (1H, ушир.т, J=7,2 Гц), 9,18 (1H, с).
ИК (ATR) см-1: 1752, 1683, 1590, 1513, 1494, 1286, 1236, 1203, 1149, 1093.
МС (m/z): 537 (М++H).
Аналитически вычислено для C25H23F3N2O6S: C, 55,97; H, 4,32; F, 10,62; N, 5,22; S, 5,98. Найдено: C, 55,93; H, 4,24; F, 10,33; N, 5,28; S, 6,06.
Пример 131: [[[[5-[(2,5-Дифторфенил)[(4-фторфенил)сульфонил]метил]-4-метилпиридин-2-ил]карбонил]амино]метокси]уксусная кислота
К смешанному раствору этил [[[[5-[(2,5-дифторфенил)[(4-фторфенил)сульфонил]метил]-4-метилпиридин-2-ил]карбонил]амино]метокси]ацетата (167 мг, 0,311 ммоль) в тетрагидрофуране (6 мл) и воде (3 мл) добавляли моногидрат гидроксида лития (16 мг, 0,373 ммоль) и смесь перемешивали в течение 20 часов при комнатной температуре. К реакционному раствору добавляли 1н. раствор хлористоводородной кислоты (0,5 мл) и воду и смесь экстрагировали метиленхлоридом. Органический слой сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. Полученный в результате концентрирования остаток подвергали колоночной флэш-хроматографии на силикагеле и фракцию, полученную при элюировании смесью метанол:метиленхлорид =1:1,0, концентрировали при пониженном давлении. К полученному в результате концентрирования остатку добавляли смешанный раствор этилацетата-гексана и затем остаток собирали фильтрованием с получением указанного в заголовке соединения (38 мг, 0,075 ммоль, 24%) в виде порошка белого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 2,24 (3H, с), 4,24 (2H, с), 4,98-5,05 (2H, м), 5,96 (1H, с), 6,90-7,20 (4H, м), 7,67-7,80 (3H, м), 8,00 (1H, с), 8,85-8,95 (1H, м), 9,19 (1H, с).
ИК (ATR) см-1: 1762, 1682, 1589, 1521, 1492, 1321, 1292, 1236, 1147.
МС (m/z): 509 (М++H).
Аналитически вычислено для C23H19F3N2O6S·0,75H2O: C, 52,92; H, 3,96; F, 10,92; N, 5,37; S, 6,14. Найдено: C, 53,20; H, 3,90; F, 10,69; N, 5,19; S, 6,03.
Пример 132: 5-[(2,5-Дифторфенил)[(4-фторфенил)сульфонил]метил]-N-(меркаптометил)-4-метилпиридин-2-карбоксамид
Раствор 5-[(2,5-дифторфенил)[(4-фторфенил)сульфонил]метил]-N-(гидроксиметил)-4-метилпиридин-2-карбоксамида (170 мг, 0,377 ммоль), полученного в Примере 85, и реагента Лоуссона (76 мг, 0,377 ммоль) в толуоле (5 мл) нагревали до температуры кипения с обратным холодильником в течение 30 минут. Реакционный раствор охлаждали до комнатной температуры и концентрировали при пониженном давлении. Полученный в результате концентрирования остаток подвергали колоночной флэш-хроматографии на силикагеле и фракцию, полученную при элюировании смесью 30% этилацетата/гексан, концентрировали при пониженном давлении с получением твердого вещества. Полученное твердое вещество промывали этанолом и затем собирали фильтрованием с получением указанного в заголовке соединения (71 мг, 0,152 ммоль, 40%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 2,21 (3H, с), 2,49 (1H, т, J=8,8 Гц), 4,55-4,65 (2H, м), 5,95 (1H, с), 6,90-7,20 (4H, м), 7,67-7,80 (3H, м), 7,96 (1H, с), 8,45-8,55 (1H, м), 9,16 (1H, с).
ИК (ATR) см-1: 1673, 1589, 1508, 1492, 1315, 1286, 1238, 1211, 1147.
Т.пл.: 190-193°C.
EI-МС (m/z): 466 (М+).
Аналитически вычислено для C21H17F3N2O3S2: C, 54,07; H, 3,67; F, 12,22; N, 6,01; S, 13,75. Найдено: C, 54,05; H, 3,64; F, 12,13; N, 6,07; S, 13,78.
Пример 133: 5-[(2,5-Дифторфенил)((4-фторфенил)сульфонил)метил]-N-(гидроксиметил)-N,4-диметилпиридин-2-карбоксамид
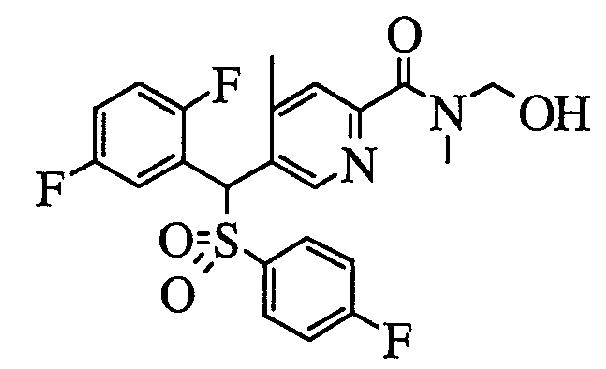
К раствору 5-[(2,5-дифторфенил)[(4-фторфенил)сульфонил]метил]-4-метилпиридин-2-карбоновой кислоты (405 мг, 0,961 ммоль), полученной в Примере 12, 1-гидроксибензотриазола (130 мг, 0,961 ммоль), гидрохлорида 1-этил-3-(3-диметиламинопропил)карбодиимида (277 мг, 1,44 ммоль), триэтиламина (158 мкл, 1,44 ммоль) и безводного сульфата натрия в тетрагидрофуране (5 мл) добавляли раствор, полученный перемешиванием метиламина (2 М раствор в тетрагидрофуране:1,4 мл) и 37% водного раствора формалина (467 мг, 5,76 ммоль) в течение 90 минут при комнатной температуре. Реакционный раствор перемешивали в течение 90 минут при комнатной температуре и затем подвергали фильтрованию с использованием силикагеля. Элюировали этилацетатом и элюат концентрировали при пониженном давлении. Полученный в результате концентрирования остаток подвергали колоночной хроматографии на силикагеле и фракцию, полученную из элюата гексана:этилацетата =1:2, концентрировали при пониженном давлении с получением твердого вещества (73 мг). Полученное твердое вещество промывали смесью гексан:этилацетат =1:2 и затем собирали фильтрованием с получением указанного в заголовке соединения (39 мг, 0,084 ммоль, 8,7%) в виде порошка белого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 2,27 (3H, с), 3,25 (3H, с), 4,70-4,84 (2H, м), 5,67 (1H, т, J=8,0 Гц), 5,95 (1H, с), 6,90-7,19 (4H, м), 7,69-7,78 (4H, м), 9,12 (1H, с).
ИК (ATR) см-1: 1635, 1589, 1490, 1326, 1295, 1230, 1149, 1039.
Т.пл.: 184-186°C.
МС m/z: 465 (М++H).
Аналитически вычислено для C22H19F3N2O4S: C, 56,89; H, 4,12; F, 12,27; N, 6,03; S, 6,90. Найдено: C, 56,83; H, 4,03; F, 12,18; N, 5,90; S, 6,90.
Ссылочный пример 17:
5-Бром-2-(дифторметил)пиридин
К раствору 5-бромпиридин-2-карбальдегида (372 мг, 2,00 ммоль) в дихлорметане (5 мл) добавляли бис(2-метоксиэтил)аминосеротрифторид (0,553 мл, 3,00 ммоль) в атмосфере азота при 0°C. Реакционную смесь перемешивали в течение 3 часов при комнатной температуре и к смеси добавляли насыщенный водный раствор гидрокарбоната натрия. Затем добавляли воду и дихлорметан для отделения органического слоя и органический слой сушили над безводным сульфатом натрия и фильтровали. Затем фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали флэш-хроматографии на силикагеле и фракцию, полученную при элюировании смесью гексан:этилацетат=49:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (301 мг, 1,45 ммоль, 72%) в виде твердого вещества белого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 6,61 (1H, т, J=55,2 Гц), 7,55 (1H, д, J=8,3 Гц), 7,98 (1H, дд, J=8,3, 2,2 Гц), 8,72 (1H, д, J=2,2 Гц).
МС m/z: 208, 210 (М++H).
Ссылочный пример 18: Трет-бутил [6-(дифторметил)пиридин-3-ил]карбамат
К раствору 5-бром-2-(дифторметил)пиридина (250 мг, 1,20 ммоль) в диэтиловом эфире (10 мл) добавляли раствор н-бутиллития в гексане (1,60 M, 0,825 мл, 1,32 ммоль) в атмосфере аргона при -78°C. После перемешивания смеси в течение 30 минут при указанной температуре добавляли диоксид углерода. Реакционной температуре давали повыситься до 0°C, затем к реакционной смеси добавляли воду, а затем 1н. водный раствор гидроксида натрия (5 мл) и органический слой отделяли. Органический слой экстрагировали два раза 1н. водным раствором гидроксида натрия (15 мл) и затем полученный водный слой объединяли и подкисляли 1н. раствором хлористоводородной кислоты и экстрагировали дихлорметаном. Полученный органический слой сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении с получением твердого вещества коричневого цвета (148 мг). Полученное твердое вещество (145 мг) растворяли в смешанном растворителе, состоящем из 2-метил-2-пропанола (4 мл) и толуола (4 мл) и в атмосфере азота добавляли триэтиламин (0,233 мл, 1,68 ммоль) и затем азид дифенилфосфорной кислоты (0,269 мл, 1,26 ммоль) при комнатной температуре. Реакционную смесь нагревали до температуры кипения с обратным холодильником в течение 18 часов, затем охлаждали до комнатной температуры и концентрировали при пониженном давлении. Полученный остаток подвергали флэш-хроматографии на силикагеле и фракцию, полученную при элюировании смесью гексан:этилацетат= 9:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (82,4 мг, 0,337 ммоль, 29%) в виде твердого вещества бледно-желтого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 1,53 (9H, с), 6,66 (1H, т, J=55,6 Гц), 6,62 (1H, ушир.с), 7,58 (1H, д, J=8,6 Гц), 8,09-8,16 (1H, м), 8,46 (1H, д, J=2,5 Гц).
МС m/z: 245 (М++H).
Ссылочный пример 19: 6-(Дифторметил)пиридин-3-амин
К раствору трет-бутил [6-(дифторметил)пиридин-3-ил]карбамата (1,11 г, 4,54 ммоль) в дихлорметане (8 мл) добавляли трифторуксусную кислоту (8 мл) при комнатной температуре. Реакционную смесь перемешивали в течение 5 часов при указанной температуре и затем концентрировали при пониженном давлении. К полученному остатку добавляли дихлорметан и насыщенный водный раствор гидрокарбоната натрия. Органический слой выделяли и органический слой сушили над безводным сульфатом натрия и фильтровали. Затем фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали флэш-хроматографии на силикагеле и фракцию, полученную при элюировании смесью гексан:этилацетат=2:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (540 мг, 3,75 ммоль, 82%) в виде маслянистого вещества светло-зеленого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 3,91 (2H, ушир.с), 6,56 (1H, т, J=55,9 Гц), 7,04 (1H, дд, J=8,5, 2,7 Гц), 7,41 (1H, д, J=8,5 Гц), 8,07 (1H, д, J=2,7 Гц).
МС m/z: 145 (М++H).
Ссылочный пример 20: S-[6-(дифторметил)пиридин-3-ил] O-этил дитиокарбонат
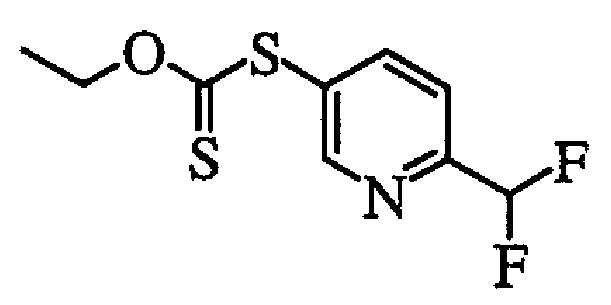
6-(Дифторметил)пиридин-3-амин (305 мг, 2,12 ммоль) растворяли в метаноле (4 мл) и добавляли 1н. раствор хлористоводородной кислоты (4 мл) при -5°C. Затем к смеси добавляли по каплям раствор нитрита натрия (222 мг, 3,17 ммоль) в воде (2 мл) и смесь перемешивали в течение 30 минут при указанной температуре. Полученную реакционную смесь добавляли по каплям к раствору O-этилдитиокарбоната калия (678 мг, 4,23 ммоль) в воде (4 мл) при 60°C, затем реакционную температуру повышали до 80°C и смесь перемешивали в течение 30 минут. Реакционную смесь охлаждали до комнатной температуры, затем добавляли этилацетат и воду и органический слой собирали путем разделения. Полученный органический слой промывали насыщенным солевым раствором, затем сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. Полученный остаток очищали препаративной тонкослойной хроматографией на силикагеле (проявляющий растворитель: гексан:этилацетат=19:1) с получением указанного в заголовке соединения (156 мг, 0,626 ммоль, 30%) в виде маслянистого вещества желтого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 1,37 (3H, т, J=7,1 Гц), 4,64 (2H, кв, J=7,1 Гц), 6,67 (1H, т, J=7,1 Гц), 7,72 (1H, д, J=8,1 Гц), 7,98 (1H, дд, J=8,1, 2,2 Гц), 8,71 (1H, д, J=2,2 Гц).
Пример 134: 5-[[[6-(Дифторметил)пиридин-3-ил]тио](2,3,6-трифторфенил)метил]-4-метилпиридин-2-карбоксамид

К раствору S-[6-(дифторметил)пиридин-3-ил] O-этил дитиокарбоната (206 мг, 0,826 ммоль) в этаноле (3 мл) добавляли 1н. водный раствор гидроксида натрия (3 мл) и смесь перемешивали в течение 1 часа при 60°C. Реакционную смесь охлаждали до комнатной температуры, добавляли дихлорметан и воду и водный слой отделяли. Полученный водный слой подкисляли 1н. раствором хлористоводородной кислоты и экстрагировали дихлорметаном. Полученный органический слой сушили над безводным сульфатом натрия, фильтровали и затем фильтрат концентрировали при пониженном давлении.
К раствору 5-[гидрокси(2,3,6-трифторфенил)метил]-4-метилпиридин-2-карбоксамида (355 мг, 1,20 ммоль), полученного в Ссылочном примере 14, в N,N-диметилформамиде (6 мл) добавляли метансульфонилхлорид (0,186 мл, 2,40 ммоль) и затем триэтиламин (0,502 мл, 3,60 ммоль) в атмосфере азота при комнатной температуре и смесь перемешивали в течение 1 часа. К реакционной смеси добавляли этилацетат, воду и затем насыщенный водный раствор хлорида аммония и органический слой отделяли. Полученный органический слой промывали насыщенным солевым раствором, затем сушили над безводным сульфатом натрия и фильтровали и фильтрат концентрировали при пониженном давлении. Полученный остаток растворяли в N,N-диметилформамиде (12 мл) и к смеси добавляли предварительно полученный тиол и карбонат калия (199 мг, 1,44 ммоль). Смесь перемешивали в течение 2 часов в атмосфере азота при комнатной температуре. К реакционной смеси добавляли этилацетат и воду и органический слой собирали путем отделения. Органический слой промывали насыщенным водным раствором хлорида аммония и затем насыщенным солевым раствором. Полученный органический слой сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали флэш-хроматографии на силикагеле и фракцию, полученную при элюировании смесью гексан:этилацетат=1:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (133 мг, 0,303 ммоль, 37%) в виде пенистого вещества светло-коричневого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 2,31 (3H, с), 5,55 (1H, ушир.с), 5,93 (1H, с), 6,59 (1H, т, J=55,4 Гц), 6,81-6,88 (1H, м), 7,07-7,17 (1H, м), 7,54 (1H, д, J=8,3 Гц), 7,77 (1H, дд, J=8,3, 2,2 Гц), 7,81 (1H, ушир.с), 8,00 (1H, с), 8,55 (1H, д, J=2,2 Гц), 9,08 (1H, с).
МС m/z: 440 (М++H).
Пример 135: 5-[[[6-(Дифторметил)пиридин-3-ил]сульфонил](2,3,6-трифторфенил)метил]-4-метилпиридин-2-карбоксамид

5-[[[6-(Дифторметил)пиридин-3-ил]тио](2,3,6-трифторфенил)метил]-4-метилпиридин-2-карбоксамид (132 мг, 0,300 ммоль) растворяли в этилацетате (3 мл) и метаноле (2 мл), к смеси добавляли 31% водную перекись водорода (3 мл) и гептамолибдат гексааммония тетрагидрат (37,1 мг, 0,030 ммоль). Смесь перемешивали в течение 17 часов при комнатной температуре. К реакционной смеси добавляли этилацетат, воду и затем насыщенный водный раствор гидрокарбоната натрия и органический слой отделяли. Полученный органический слой промывали 10% водным раствором тиосульфата натрия и затем насыщенным солевым раствором, сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали флэш-хроматографии на силикагеле и фракцию, полученную при элюировании смесью дихлорметан:метанол=100:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (118 мг, 0,250 ммоль, 83%) в виде твердого вещества белого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 2,20 (3H, с), 5,56 (1H, ушир.с), 5,94 (1H, с), 6,68 (1H, т, J=54,9 Гц), 6,84-6,91 (1H, м), 7,20-7,27 (1H, м), 7,79 (1H, д, J=8,3 Гц), 7,85 (1H, ушир.с), 8,03 (1H, с), 8,19 (1H, дд, J=8,3, 2,2 Гц), 8,93 (1H, д, J=2,2 Гц), 9,40 (1H, с).
МС m/z: 472 (М++H).
Пример 136: 5-[[[6-(Дифторметил)пиридин-3-ил]сульфонил](2,3,6-трифторфенил)метил]-N-(1-гидроксиметил)-4-метилпиридин-2-карбоксамид
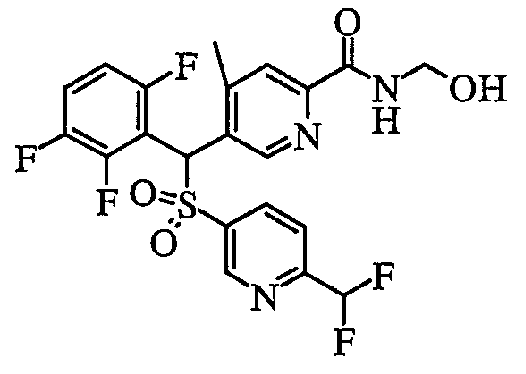
К раствору 5-[[[6-(дифторметил)пиридин-3-ил]сульфонил](2,3,6-трифторфенил)метил]-4-метилпиридин-2-карбоксамида (90,0 мг, 0,191 ммоль) в диметиловом эфире этиленгликоля (2 мл) добавляли водный раствор формальдегида (37%, 43,0 мкл, 0,573 ммоль) и 1н. водный раствор гидроксида натрия (9,5 мкл) при комнатной температуре и смесь перемешивали в течение 1 часа. К реакционной смеси добавляли этилацетат и смесь промывали насыщенным водным раствором хлорида аммония. Затем к органическому слою добавляли 1н. раствор хлористоводородной кислоты (5 мл) и смесь перемешивали в течение 1 часа. После отделения органического слоя органический слой промывали насыщенным водным раствором гидрокарбоната натрия и затем насыщенным солевым раствором, сушили над безводным сульфатом натрия и фильтровали и затем фильтрат концентрировали при пониженном давлении. Полученный остаток подвергали флэш-хроматографии на силикагеле и фракцию, полученную при элюировании смесью гексан:этилацетат=2:3, концентрировали при пониженном давлении. Полученный остаток промывали смешанным растворителем, состоящим из 2-пропанола и гексана, и затем собирали фильтрованием с получением указанного в заголовке соединения (77,0 мг, 0,154 ммоль, 80%) в виде твердого вещества белого цвета.
1H-ЯМР (400 МГц, CDCl3) δ: 2,21 (3H, с), 3,05 (1H, т, J=7,8 Гц), 4,98-5,05 (2H, м), 5,94 (1H, с), 6,68 (1H, т, J=54,9 Гц), 6,84-6,92 (1H, м), 7,20-7,27 (1H, м), 7,79 (1H, д, J=8,3 Гц), 8,01 (1H, с), 8,19 (1H, дд, J=8,3, 2,2 Гц), 8,86 (1H, т, J=6,9 Гц), 8,92 (1H, д, J=2,2 Гц), 9,40 (1H, с).
ИК (ATR) см-1: 3442, 3383, 1676, 1523, 1491, 1338, 1153, 1084, 1055, 1036, 1014.
Т.пл.: 181-183°C.
Аналитически вычислено для C21H16F5N3O4S: C, 50,30; H, 3,22; F, 18,94; N, 8,38; S, 6,39. Найдено: C, 50,07; H, 3,35; F, 19,03; N, 8,40; S, 6,50.
МС m/z: 502 (М++H).
(Пример испытания 1) Система скринирования с использованием клеток для идентификации вещества, которое ингибирует продукцию/секрецию β-амилоидного белка
Активность соединения, ингибирующего продукцию β-амилоидного белка, измеряли на клетках E35, полученных путем введения APP751 гена, гена белка-предшественника β-амилоидного белка дикого типа человека, в клетки глиомы человека (клетки H4), путем определения количества β-амилоидного белка (Aβ), секретируемого в культуральную среду, при помощи сэндвичего твердофазного иммуноферментного анализа (ELISA).
А именно, клетки E35, инокулированные в 96-луночные планшеты, культивировали в инкубаторе при 37°C, поддерживая равновесие при помощи 5% диоксида углерода, с использованием в качестве культуральной среды модифицированной Дульбекко среды Игла, содержащей инактивированную 10% фетальную бычью сыворотку. Через 24 часа после инокуляции добавляли испытываемое соединение, растворенное в растворе DMSO. Раствор в DMSO испытываемого соединения получали в концентрации 2000× от конечной концентрации, так чтобы концентрация DMSO в культуральной среде была 0,05%. После культивирования еще в течение 24 часов культуральный супернатант извлекали и добавляли в 96-луночные планшеты для ELISA, на которые наносили моноклональное антитело против Aβ, 25-1, в твердой фазе. Планшеты инкубировали при 4°C в течение 16 - 20 часов. Планшеты промывали фосфатно-буферным раствором (pH 7,4) и затем снова добавляли биотинилированное моноклональное антитело против Aβ, MA32-40. Планшеты оставляли выстаиваться при 4°C в течение 2 часов. Планшеты промывали снова фосфатно-буферным раствором и затем добавляли конъюгированный со щелочной фосфатазой стрептавидин для конъюгации стрептавидина с биотином. Затем планшеты промывали фосфатно-буферным раствором. Добавляли Blue Phos (Kirkegaard & Perry Laboratories, Inc.). После инкубации планшетов в течение соответствующего периода времени реакцию останавливали при помощи кислоты и измеряли абсорбцию в каждой лунке. Количество Aβ, содержащегося в культуральном супернатанте, определяли при помощи калибровочной кривой, которую получали отдельно, и это количество сравнивали с количеством в контрольных клетках, к которым не добавляли соединения. Таким образом, рассчитывали концентрацию, при которой ингибировалось 50% продукции Aβ (значение EC50). Кроме того, 25-1 антитело и MA32-40 антитело, используемые в ELISA, представляли собой мышиные моноклональные антитела, полученные из гибридомных клонированных клеточных линий, каждая из которых была получена и выбрана в соответствии со стандартным способом с использованием Aβ25-35 и Aβ-8 в качестве антигенов соответственно и которые специфически распознают их соответствующие антигены.
Цитотоксическую концентрацию определяли с помощью следующего анализа. Клетки H4 культивировали в 96-луночных планшетах до их полуконфлюентности, к смеси добавляли испытываемое соединение и продолжали культивирование. Через 72 часа определяли количество выживших клеток при помощи Alamar Blue (Biosource, Inc.), используемого для проявления цвета и определения концентрации красителя. Концентрацию, при которой количество выживших клеток достигало не более 80% от контрольных клеток, которые не содержали соединения, называли цитотоксической концентрацией. Любое соединение, демонстрирующее разницу в цитотоксической концентрации для EC50, определяли как соединение, обладающее активностью ингибирования продукции β-амилоидного белка.
Результаты оценки соединения (1) по настоящему изобретению в соответствии с описанным выше методом анализа представлены в Таблице 1. Использовали следующие оценки: ++++ для случая, когда EC50 составила 5 нМ или меньше; +++ для случая, когда EC50 составила 5 - 50 нМ; ++ для случая, когда EC50 составила 50 - 500 нМ; и + для случая, когда EC50 составила 500 нМ - 5 мкM.
Контрольное соединение, которое известно как обладающее активностью ингибирования секреции β-амилоидного белка, LY ((N)-((S)-2-гидрокси-3-метилбутирил)-1-(L-аланинил)-(S)-1-амино-3-метил-4,5,6,7-тетрагидро-2H-3-бензоазепин-2-он), синтезировали способами, описанными в патентных документах 3-5, указанных в настоящем описании.
(Пример испытания 2) Оценка ингибирующего действия в отношении продукции β-амилоидного белка и иммуносупрессивной активности in vivo
(Метод эксперимента)
В качестве примера соединения (1) соединения, описаные в Примере 22, Примере 85, Примере 101, Примере 106 или Примере 118 (соответственно соединения, представленные приведенными выше формулами (1-1), (1-2), (1-3), (1-4) или (1-5), которые далее будут указаны как соединения (1-1), (1-2), (1-3), (1-4) или (1-5)), или контрольное соединение LY суспендировали в 0,5% водном растворе метилцеллюлозы и суспензию перорально вводили в разовой дозе самцам крыс SD (возраст примерно 5 недель). Для контрольной группы, получавшей растворитель, вводили только 0,5% водный раствор метилцеллюлозы. Через 3 часа после введения головной мозг вырезали и собирали вещество головного мозга. Вещество головного мозга гомогенизировали с использованием 42% водного раствора муравьиной кислоты и центрифугировали при 100000×g в течение 60 минут. Полученный супернатант нейтрализовали при помощи 1 M Tris и концентрацию Aβ в этих образцах измеряли с использованием сэндвичевого анализа ELISA, описанного в Примере испытания 1. Кроме того, соединения (1-1) - (1-5) или контрольное соединение LY перорально вводили самцам крыс SD постоянно в течение 7 дней и крыс подвергали гистопатологическому и серологическому исследованию для определения иммуносупрессивного эффекта соединения.
(Результаты)
Что касается соединений (1-1), (1-2), (1-3), (1-4) и (1-5), наблюдали существенную разницу между дозами, показывающими статистически значимое снижение интрацеребрального количества Aβ, и дозами, демонстрирующими иммуносупрессивный эффект. С другой стороны, для контрольного соединения LY никакой существенной разницы между эффективной дозой и дозой, вызывающей токсичность, не наблюдалось.
| название | год | авторы | номер документа |
|---|---|---|---|
| ГЕТЕРОЦИКЛИЧЕСКИЕ МЕТИЛСУЛЬФОНОВЫЕ ПРОИЗВОДНЫЕ | 2004 |
|
RU2336270C2 |
| ИНГИБИТОРЫ ПРОДУЦИРОВАНИЯ / СЕКРЕЦИИ β-АМИЛОИДНОГО БЕЛКА | 2002 |
|
RU2304140C2 |
| 1-ГЕТЕРОЦИКЛИЛСУЛЬФОНИЛ, 2-АМИНОМЕТИЛ, 5-(ГЕТЕРО-)АРИЛ ЗАМЕЩЕННЫЕ 1-Н-ПИРРОЛ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ СЕКРЕЦИИ КИСЛОТЫ | 2006 |
|
RU2415838C2 |
| СОЕДИНЕНИЯ ТРИАЗОЛА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ИХ СОДЕРЖАЩАЯ, ПРИМЕНЕНИЕ СОЕДИНЕНИЙ ТРИАЗОЛА И СПОСОБ ЛЕЧЕНИЯ ГРИБКОВОЙ ИНФЕКЦИИ | 2002 |
|
RU2276670C2 |
| ПРОИЗВОДНОЕ БЕНЗИМИДАЗОЛА | 2006 |
|
RU2409573C2 |
| ПИРАНОДИПИРИДИНОВОЕ СОЕДИНЕНИЕ | 2016 |
|
RU2743998C2 |
| ПИРАЗОЛОХИНОЛИНОВОЕ ПРОИЗВОДНОЕ | 2012 |
|
RU2605096C2 |
| ГАЛОГЕНЗАМЕЩЕННОЕ ГЕТЕРОЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ | 2013 |
|
RU2756506C2 |
| ГАЛОГЕНЗАМЕЩЕННОЕ ГЕТЕРОЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ | 2013 |
|
RU2649398C2 |
| ПРОИЗВОДНЫЕ ПИПЕРИДИНОВ | 2011 |
|
RU2554353C2 |
Настоящее изобретение относится к новому соединению, представленному общей формулой (I):
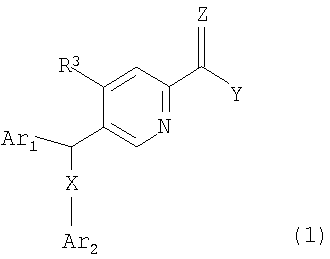
где Ar1 представляет собой фенильную группу, замещенную 1-3 атомами галогена; Ar2 представляет собой фенильную группу, которая может быть замещена галогеном, алкоксиалкилом, алкоксигалогеналкилом, или пиридильную группу, которая может быть замещена галогеналкилом; Х представляет собой -S-, -SO- или -SO2-; Y представляет собой атом водорода, -NR1R2 (где R1 представляет собой атом водорода, низшую алкильную группу или гидроксигруппу; и R2 представляет собой атом водорода, низшую алкильную группу, которая может быть замещена, низшую алканоильную группу, алкоксикарбонильную группу, которая может быть замещена, низшую алкоксигруппу, которая может быть замещена, аминогруппу, которая может быть замещена; или R1 и R2, вместе с атомом азота, с которым они связаны, образуют пиперидиновое, морфолиновое, азетидиновое или пиперазиновое кольцо, которые могут быть замещены гидроксигруппой) или -OR1' (где R1' представляет собой атом водорода); Z представляет собой атом кислорода или атом серы; и R представляет собой атом водорода или низшую алкильную группу; или к его соли. Также изобретение относится к лекарственному средству и фармацевтической композиции, обладающим эффектом ингибирования продукции/секреции β-амилоидного белка, к применению данных соединений для получения лекарственного средства и к способу лечения заболеваний, вызванных аномальной продукцией или секрецией β-амилоидного белка. Технический результат: получены и описаны новые соединения, которые обладают эффектом ингибирования продукции/секреции β-амилоидного белка и могут быть полезны в лечении болезни Альцгеймера или синдрома Дауна. 10 н. и 20 з.п. ф-лы, 1 табл.
1. Соединение, представленное следующей общей формулой (I):

где Ar1 представляет собой фенильную группу, замещенную 1-3 атомами галогена;
Ar2 представляет собой фенильную группу, которая может быть замещена галогеном, алкоксиалкилом, алкоксигалогеналкилом, или пиридильная группа, которая может быть замещена галогеналкилом;
Х представляет собой -S-, -SO- или -SO2-;
Y представляет собой атом водорода, -NR1R2 (где R1 представляет собой атом водорода, низшую алкильную группу или гидроксигруппу; и R2 представляет собой атом водорода, низшую алкильную группу, которая может быть замещена, низшую алканоильную группу, алкоксикарбонильную группу, которая может быть замещена, низшую алкоксигруппу, которая может быть замещена, аминогруппу, которая может быть замещена; или R1 и R2 вместе с атомом азота, с которым они связаны, образуют пиперидиновое, морфолиновое, азетидиновое или пиперазиновое кольцо, которые могут быть замещены гидроксигруппой), или -OR1' (где R1' представляет собой атом водорода);
Z представляет собой атом кислорода или атом серы; и
R представляет собой атом водорода или низшую алкильную группу;
или его соль.
2. Соединение или его соль по п.1, где Ar1 представляет собой 2,5-дифторфенильную группу или 2,3,6-трифторфенильную группу.
3. Соединение или его соль по п.1, где Ar2 представляет собой фенильную группу, 4-метилфенильную группу, 4-хлорфенильную группу, 4-фторфенильную группу, 4-метоксифенильную группу, 4-(трифторметокси)фенильную группу, 4-трифторметилфенильную группу, 4-хлор-3-метилфенильную группу, 4-фтор-3-метилфенильную группу, 3,4-дифторфенильную группу или 3,5-дифторфенильную группу.
4. Соединение или его соль по п.1, где Ar2 представляет собой соединение 5-(трифторметил)пиридин-2-ильную группу, 6-(трифторметил)пиридин-3-ильную группу.
5. Соединение или его соль по п.1, где R1 представляет собой атом водорода.
6. Соединение или его соль по п.1, где R1 представляет собой метильную группу.
7. Соединение или его соль по п.1, где R2 представляет собой атом водорода, метильную группу, этильную группу, трет-бутильную группу, циклопропильную группу, карбоксиметильную группу, 2-карбоксиэтильную группу, 2-(этоксикарбонил)этильную группу, гидроксиметильную группу, 2-гидроксиэтильную группу, 4-гидроксициклогексильную группу, 2-гидрокси-1-гидроксиметилэтильную группу, ацетоксиметильную группу, метилтиопропильную группу, метилсульфинилпропильную группу, метилсульфонилпропильную группу, метилкарбониламиноэтильную группу, метоксикарбониламиноэтильную группу, трет-бутоксикарбониламиноэтильную группу, 2-хлорэтильную группу, гидроксиацетоксиметильную группу, диметиламинометильную группу, карбоксиметоксиметильную группу, этоксикарбонилметоксиметильную группу, меркаптометильную группу, 2-гидроксиэтоксиметильную группу, (пиридин-3-илметокси)метильную группу, ацетильную группу или метоксигруппу.
8. Соединение или его соль по п.1, где R2 представляет собой атом водорода, метильную группу, этильную группу, гидроксиметильную группу, 2-гидроксиэтильную группу, диметиламинометильную группу или метоксигруппу.
9. Соединение или его соль по п.1, где -NR1R2 представляет собой аминогруппу, метиламиногруппу, диметиламиногруппу, (гидроксиметил)амино группу, N-метил-N-(гидроксиметил)аминогруппу, (2-гидроксиэтил)аминогруппу или N-этил-N-(2-гидроксиэтил)аминогруппу.
10. Соединение или его соль по п.1, где Y представляет собой 4-гидроксипиперидин-1-ил группу, 3-оксапиперазин-1-ил группу или морфолин-4-ил группу.
11. Соединение или его соль по п.1, где Z представляет собой атом кислорода.
12. Соединение или его соль по п.1, где R3 представляет собой метильную группу.
13. Соединение или его соль по п.1, где Ar1 представляет собой 2,5-дифторфенильную группу; Ar2 представляет собой 4-фторфенильную группу; Х представляет собой -SO-; Y представляет собой диметиламиногруппу; Z представляет собой атом кислорода; и R3 представляет собой метильную группу.
14. 5-[[2,5-Дифторфенил)[(4-фторфенил)сульфинил]метил]-N,N,4-триметилпиридин-2-карбоксамид или его соль.
15. Соединение или его соль по п.1, где Ar1 представляет собой 2,5-дифторфенильную группу или 2,3,6-трифторфенильную группу; Ar2 представляет собой фенильную группу, 4-фторфенильную группу или 6-(трифторметил)пиридин-3-ильную группу; Х представляет собой -SO2-; Y представляет собой (гидроксиметил)аминогруппу или аминогруппу; Z представляет собой атом кислорода; R3 представляет собой метильную группу.
16. Соединение, его соль по п.15, где Ar1 представляет собой 2,5-дифторфенильную группу; Аr2 представляет собой 4-фторфенильную группу; Х представляет собой -SO2-; Y представляет собой (гидроксиметил)аминогруппу; Z представляет собой атом кислорода; и R3 представляет собой метильную группу.
17. 5-[(2,5-Дифторфенил)[(4-фторфенил)сульфонил]метил]-N-(1-гидроксиметил)-4-метилпиридин-2-карбоксамид или его соль.
18. Соединение или его соль по п.15, где Ar1 представляет собой 2,3,6-трифторфенильную группу; Ar2 представляет собой 4-фторфенильную группу; Х представляет собой -SO2-; Y представляет собой (гидроксиметил)аминогруппу; Z представляет собой атом кислорода; и R3 представляет собой метильную группу.
19. 5-[[(4-Фторфенил)сульфонил](2,3,6-трифторфенил)метил]-N-(1-гидроксиметил)-4-метилпиридин-2-карбоксамид или его соль.
20. Соединение или его соль по п.15, где Ar1 представляет собой 2,3,6-трифторфенильную группу; Ar2 представляет собой фенильную группу; Х представляет собой -SO2-; Y представляет собой (гидроксиметил)аминогруппу; Z представляет собой атом кислорода; и R3 представляет собой метильную группу.
21. N-(1-гидроксиметил)-4-метил-5-[(фенилсульфонил)(2,3,6-трифторфенил)метил]пиридин-2-карбоксамид или его соль.
22. Соединение или его соль по п.15, где Ar1 представляет собой 2,3,6-трифторфенильную группу; Ar2 представляет собой 6-(трифторметил)пиридин-3-ильную группу; Х представляет собой -SO2-; Y представляет собой (гидроксиметил)аминогруппу; Z представляет собой атом кислорода; и R3 представляет собой метильную группу.
23. N-(1-гидроксиметил)-4-метил-5-[[[6-(трифторметил)пиридин-3-ил]сульфонил](2,3,6-трифторфенил)метил]пиридин-2-карбоксамид или его соль.
24. Лекарственное средство, применяемое для лечения или профилактики заболеваний, вызванных аномальной продукцией и/или секрецией β-амилоидного белка, включающее соединение или его соль по любому из пп.1-23 в качестве активного ингредиента.
25. Лекарственное средство по п.24, где заболевание, вызванное аномальной продукцией и/или секрецией β-амилоидного белка, представляет собой болезнь Альцгеймера или синдром Дауна.
26. Фармацевтическая композиция для лечения или профилактики заболеваний, вызванных аномальной продукцией и/или секрецией β-амилоидного белка, включающая соединение или его соль по любому из пп.1-23 и фармацевтически приемлемый носитель.
27. Применение соединения или его соли по любому из пп.1-23 для получения лекарственного средства, предназначенного для лечения или профилактики заболеваний, вызванных аномальной продукцией и/или секрецией β-амилоидного белка.
28. Применение по п.27, где заболевание, вызванное аномальной продукцией и/или секрецией β-амилоидного белка, представляет собой болезнь Альцгеймера или синдром Дауна.
29. Способ лечения заболеваний, вызванных аномальной продукцией и/или секрецией β-амилоидного белка, включающий введение эффективного количества соединения или его соли по любому из пп.1-23.
30. Способ по п.29, где заболевание, вызванное аномальной продукцией и/или секрецией β-амилоидного белка, представляет собой болезнь Альцгеймера или синдром Дауна.
| Тампонажный раствор | 1988 |
|
SU1640366A1 |
| Способ электродуговой сварки рабочих швов прямошовных труб большого диаметра | 1986 |
|
SU1466898A1 |
| Мяльно-трепальный станок для обработки тресты лубовых растений | 1922 |
|
SU200A1 |
| Перекатываемый затвор для водоемов | 1922 |
|
SU2001A1 |
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
| GRAVINA, S.A | |||
| et al | |||
| Amyloyd beta protein in Alzheimer's Disease Brain, The Journal of Biological Chemistry, 1995, vol.270, no.3, p.7013-7016 | |||
| RU 2004106540 A, 27.07.2005. | |||
Авторы
Даты
2010-11-27—Публикация
2006-04-07—Подача