Настоящая заявка относится к N-(3-метокси-5-метилпиразин-2-ил)-2-(4-[1,3,4-оксадиазол-2-ил]фенил)пиридин-3-сульфонамиду или его фармацевтически приемлемой соли, в дальнейшем "соединение (I)", и его применению для лечения злокачественного новообразования у теплокровного животного, такого как человек. Изобретение также относится к применению фармацевтических композиций, содержащих соединение (I) или его фармацевтически приемлемую соль, в способе лечения злокачественного новообразования у теплокровного животного, такого как человек, и к применению соединения (I) или его фармацевтически приемлемой соли для приготовления лекарственного средства для применения в способе лечения злокачественного новообразования у теплокровного животного, такого как человек. Изобретение также относится к применению фармацевтических композиций, содержащих соединение (I) или его фармацевтически приемлемую соль, в способе лечения боли у теплокровного животного, такого как человек, и к применению соединения (I) или его фармацевтически приемлемой соли для приготовления лекарственного средства для применения для лечения боли у теплокровного животного, такого как человек.
Злокачественными новообразования, по приблизительным подсчетам, страдают 10 млн. людей во всем мире. Эти данные включают заболеваемость, распространение и смертность. В Азии выявлено более 4,4 млн. случаев злокачественных опухолей, включая 2,5 млн. случаев в Восточной Азии, который является регионом мира с наивысшим коэффициентом заболеваемости. Для сравнения в Европе выявлено 2,8 млн. случаев, в Северной Америке 1,4 млн. случаев и в Африке - 627 тысяч случаев.
Например, в Великобритании и в США более чем у одного человека из трех развивается злокачественное новообразование на протяжении жизни. В США злокачественные новообразования вызывают смерть, согласно подсчетам, около 600 тысяч людей в год и являются причиной смертности в одном из четырех случаев, занимая второе место по уровню смертности после сердечных заболеваний, а также являются второй причиной смертности детей в возрасте от 1 до 14 лет. В настоящее время в США ежегодно выявляется около 1 млн. 380 тысяч новых случаев заболеваний, исключая около 900 тысяч случаев немеланомных новообразований кожи (базальных и сквамозных клеток).
Рак также является основной причиной заболеваемости в Великобритании, и в 1997 году было зарегистрировано около 260 тысяч новых случаев (исключая немеланомный рак кожи). Злокачественные опухоли являются заболеванием, которое поражает главным образом людей пожилого возраста, около 65% случаев заболевания выявляется у людей старше 65. Так как ожидается увеличение средней продолжительности жизни в Великобритании почти в два раза по сравнению с серединой девятнадцатого века, то риск заболевания раком населения возрастает. Коэффициент смертности от других заболеваний, вызывающих смерть, таких как заболевания сердца, в последние годы снижается, тогда как смертность от злокачественных новообразований остается относительно постоянной. Это приведет к тому, что у одного человека из трех в течение жизни будет диагностировано злокачественное новообразование и один из четырех людей умрет от рака. У людей до 75 лет смертность от злокачественных новообразований численно превосходит смертность от заболеваний сердечно-сосудистой системы, включая ишемическую болезнь сердца и удар. В 2000 году было зарегистрировано 151 тысяч 200 смертей от рака. Больше одной пятой (22%) этих смертей было вызвано раком легких и четвертая часть (26%) - раком ободочной кишки, молочной железы и предстательной железы.
Во всем мире заболеваемость и смертность вследствие определенных типов злокачественных новообразований (желудка, молочной железы, предстательной железы, кожи и т.д.) характеризуются значительными территориальными отличиями, которые приписывают расовым, культурным влияниям и, в особенности, влиянию окружающей среды. Выявлено свыше 200 различных типов злокачественных новообразований, но четыре основных типа, а именно легких, молочной железы, предстательной железы и прямой кишки, составляют больше половины всех диагностированных случаев рака в Великобритании и США. Рак предстательной железы занимает четвертое место по встречаемости среди злокачественных заболеваний у мужчин во всем мире и ежегодно диагностируется 400 тысяч новых случаев заболеваемости, что составляет 3,9% всех новых выявленных случаев рака.
В настоящее время для лечения злокачественных новообразований применяют хирургическое удаление, лучевую терапия с наружным облучением и/или системную химиотерапию. При одних видах рака они являются значительно эффективными, однако при других видах они не эффективны. Существует очевидная потребность в новом терапевтическом лечении.
Нестероидные противовоспалительные лекарственные средства (НПВС) и опиаты являются основными классами лекарственных средств для уменьшения боли. Однако оба эти класса обладают нежелательными побочными действиями. Известно, что НПВС вызывают раздражение желудочно-кишечного тракта, а опиаты вызывают зависимость. Таким образом, также существует очевидная потребность в новом лечении для устранения и лечения боли.
В последнее время антагонисты рецептора эндотелина А были идентифицированы в качестве эффективных средств при лечении злокачественных новообразований (Cancer Research, 56, 663-668, 15-е февраля, 1996 и Nature Medicine, том 1, №9, сентябрь 1999, 944-949).
Эндотелины представляют собой семейство эндогенных пептидов, состоящих из 21 аминокислоты, которое включает три изоформы: эндотелин-1 (ЕТ-1), эндотелин-2 и эндотелин-3. Эндотелины образуются путем расщепления эндотелинпревращающим ферментом связи Trp21-Val22 их соответствующих проэндотелинов. Эндотелины являются одними из наиболее известных эффективных сосудосуживающих средств и характеризуются значительной продолжительностью действия. Также они обладают множеством других действий, включая действие на пролиферацию клеток, митоз, транссудацию и хемотаксис, а также взаимодействуют со многими другими вазоактивными средствами.
Эндотелины секретируются многими тканями и клетками, включая эндотелий сосудов, сосуды гладких мышц, почки, печень, матку, дыхательные пути, кишечник и лейкоциты. Секреция может стимулироваться гипоксией, вибрационным стрессом, физической травмой и многими гормонами и цитокинами. Повышенные уровни эндотелина были обнаружены при многих болезненных состояниях у людей, включая злокачественные новообразования.
Настоящее изобретение относится к неожиданному выявлению того факта, что соединение (I) является чрезвычайно эффективным противораковым средством. Соединение (I) описано в качестве антагониста рецептора эндотелина в WO 96/40681, и хотя из WO 96/40681 известно, что повышенные уровни эндотелина обнаружены при многих болезненных состояниях у людей, включая определенные виды злокачественных новообразований, не было намека или предположения, что соединение может обладать значительной полезной эффективностью, метаболическими и токсикологическими профилями, что делает его эффективным противораковым средством. В WO 96/40681 заявляется, что описанные рецепторы эндотелина применимы только для сердечно-сосудистых заболеваний. Например, во вступлении указывается, что эти соединения пригодны для лечения заболеваний или медицинских состояний, включая "гипертонию, легочную гипертонию, сердечно-сосудистое заболевание или нарушение мозгового кровообращения и заболевание почек". Заявленный перечень включает следующие болезненные состояния: "гипертонию, легочную гипертонию, застойную сердечную недостаточность, дислипидемию, атеросклероз, рестеноз, острую и хроническую почечную недостаточность, ишемический удар, субарахноидальное кровоизлияние, перемежающуюся хромоту, угрожающую ишемию конечности, астму или недостаточность органа после общего хирургического вмешательства или трансплантации". Нет ни намека или предположения в WO 96/40681, что это соединение может обладать значительной полезной эффективностью, метаболическими и токсикологическими профилями, что делает его эффективным противораковым средством. В действительности, изобретатели настоящего изобретения неожиданно обнаружили, что соединение (I) является специфическим антагонистом эндотелина-А (ЕТA) и не обнаруживает измеримой активности по отношению к эндотелину-В (ЕТB).
Было показано, что рецептор ЕТA посредством различных механизмов является более важным патологическим рецептором из двух идентифицированных рецепторов эндотелина в онкологии: при снижении пролиферации атипичных клеток (Bagnato и др., (1995), Clin Cancer Res 1, 1059-1066); в качестве антиапоптотического средства (Wu Wang и др., (1997), Biochem J,. 328, 733-737); в качестве антиангиогенного средства (Spinella и др., (2002), J.Biol. Chem, 227(31), 27850-27855); и в качестве ингибитора метастаз в костях (Guise и др., ASCO (2000) реферат 331 и Nelson, и др., (1999), Urology 53,1063-1069), и кроме того, при опосредовании боли, которая обычно сопровождает злокачественное новообразование. Было показано (Dahlofn др., (1990), J Hypertens, 8, 811-817), что высокие дозы эндотелина-1 вызывают боль и болевую сенсибилизацию, но это действие может ингибироваться антагонистом ЕТA (напр., Davar и др., (1998), Neuroreport 9, 2279-2283 и De Mello и др., (1998), Pain, 77, 261-269). Следовательно, в другом варианте осуществления изобретения соединение (I) вводится для предотвращения или лечения боли, опосредованной эндотелиновой системой, в особенности связанной с повышенными уровнями эндотелина-1.
Наоборот, неожиданно выявлены данные (напр., Cattaruzza и др., (2002), FASEB J. 14(7), 991-998 и Okazawa и др., (1998), J Biol Chem, 273, 12581-12592), что рецептор ЕТB вовлечен в передачу апоптотического сигнала. Блокирование проапоптотических метаболических путей при лечении злокачественного новообразования может быть нежелательным, следовательно, соединение, которое специфически нацелено на рецептор ЕТA, в то время как не действует на рецептор ЕТB, является чрезвычайно полезным при лечении злокачественного новообразования. Соединение (I) является таким соединением.
Соединение (I), которое специфически действует на рецептор ЕТA, обладает многими преимуществами по сравнению с антагонистами эндотелина, которые имеют также измеряемое действие на ЕТB. Например, соединение (I) может вводиться пациенту без администратора или предписания лечащего врача, осуществляющего необходимое титрование дозы соединения (I) в зависимости от проявляемых симптомов активности ЕТB (например, отека). Более того, потенциально могут вводиться большие дозы, поскольку не проявляется побочных действий, связанных с ЕТB.
Другим недостатком ингибирования ЕТB является то, что оно вызывает повышение концентрации эндотелина в плазме. Потенциально в течение курса лечения для смешанного ЕТA/ЕТB ингибитора или соединения, которое селективно нацелено на рецептор ЕТA, однако все же обладает измеримой активностью по отношению к ЕТв, может возникать необходимость в увеличении больших доз ингибитора для достижения такого же полезного действия по отношению к ЕТA. Специфический ингибитор ЕТA позволяет избежать этой проблемы.
Таким образом, в соответствии с настоящим изобретением обеспечивается соединение (I) или его фармацевтически приемлемая соль для применения для лечения злокачественного новообразования у теплокровного животного, такого как человек.
В одном варианте осуществления ссылка на соединение (I) или его фармацевтически приемлемую соль относится только к одному соединению. В другом варианте осуществления эта ссылка относится к фармацевтически приемлемой соли соединения (I).
В соответствии с дальнейшим вариантом осуществления настоящего изобретения, обеспечивается соединение (I) или его фармацевтически приемлемая соль для приготовления лекарственного средства для применения для лечения злокачественного новообразования у теплокровного животного, такого как человек.
В соответствии с дальнейшим вариантом осуществления изобретения обеспечивается способ лечения злокачественного новообразования, который предусматривает введение эффективного количества соединения (I) или его фармацевтически приемлемой соли теплокровному животному, такому как человек.
В соответствии с дальнейшим вариантом осуществления изобретения обеспечивается фармацевтическая композиция, которая содержит соединение (I) или его фармацевтически приемлемую соль в сочетании с фармацевтически приемлемым разбавителем или носителем для применения для лечения злокачественного новообразования у теплокровного животного, такого как человек.
В другом варианте осуществления изобретения обеспечивается применение соединения (I) или его фармацевтически приемлемой соли для уменьшения атипичной пролиферации злокачественных клеток или индуцирования дифференциации злокачественных клеток у теплокровного животного, такого как человек.
В другом варианте осуществления изобретения обеспечивается применение соединения (I) или его фармацевтически приемлемой соли для приготовления лекарственного средства для применения для уменьшения атипичной пролиферации злокачественных клеток или индуцирования дифференциации злокачественных клеток у теплокровного животного, такого как человек.
В другом варианте осуществления изобретения обеспечивается способ уменьшения атипичной пролиферации злокачественных клеток или индуцирования дифференциации злокачественных клеток, который предусматривает введение эффективного количества соединения (I) или его фармацевтически приемлемой соли теплокровному животному, такому как человек.
В соответствии с дальнейшим вариантом осуществления изобретения обеспечивается фармацевтическая композиция, которая содержит соединение (I) или его фармацевтически приемлемую соль в сочетании с фармацевтически приемлемым разбавителем или носителем для применения для уменьшения атипичной пролиферации злокачественных клеток или индуцирования дифференциации злокачественных клеток у теплокровного животного, такого как человек.
В другом варианте осуществления изобретения обеспечивается применение соединения (I) или его фармацевтически приемлемой соли для индуцирования апоптоза в злокачественных клетках у теплокровного животного, такого как человек.
В другом варианте осуществления изобретения обеспечивается применение соединения (I) или его фармацевтически приемлемой соли для приготовления лекарственного средства для применения для индуцирования апоптоза в злокачественных клетках у теплокровного животного, такого как человек.
В другом варианте осуществления изобретения обеспечивается способ индуцирования апоптоза в злокачественных клетках, который предусматривает введение эффективного количества соединения (I) или его фармацевтически приемлемой соли теплокровному животному, такому как человек.
В соответствии с дальнейшим вариантом осуществления изобретения обеспечивается фармацевтическая композиция, которая содержит соединение (I) или его фармацевтически приемлемую соль в сочетании с фармацевтически приемлемым разбавителем или носителем для применения для индуцирования апоптоза в злокачественных клетках у теплокровного животного, такого как человек.
В другом варианте осуществления изобретения обеспечивается применение соединения (I) или его фармацевтически приемлемой соли в качестве антиангиогенного средства и средства, нацеленного на сосуды, в кровеносных сосудах, кровоснабжающих злокачественные клетки, у теплокровного животного, такого как человек.
В другом варианте осуществления изобретения обеспечивается применение соединения (I) или его фармацевтически приемлемой соли для приготовления лекарственного средства для применения в качестве антиангиогенного средства и средства, нацеленного на сосуды, в кровеносных сосудах, кровоснабжающих злокачественные клетки, у теплокровного животного, такого как человек.
В другом варианте осуществления изобретения обеспечивается способ антиангиогенного действия и средства, нацеленного на сосуды, в кровеносных сосудах, кровоснабжающих злокачественные клетки, который предусматривает введение эффективного количества соединения (I) или его фармацевтически приемлемой соли теплокровному животному, такому как человек.
В соответствии с дальнейшим вариантом осуществления изобретения обеспечивается фармацевтическая композиция, которая содержит соединение (I) или его фармацевтически приемлемую соль в сочетании с фармацевтически приемлемым разбавителем или носителем для применения в качестве антиангиогенного средства и средства, нацеленного на сосуды, в кровеносных сосудах, кровоснабжающих злокачественные клетки, у теплокровного животного, такого как человек.
Под термином "средство, нацеленное на сосуды", подразумевают, что место действия соединения (I) скорее будет находится в самой сосудистой сети, чем в опухоли.
В другом варианте осуществления изобретения обеспечивается применение соединения (I) или его фармацевтически приемлемой соли в качестве антиангиогенного средства у теплокровного животного, такого как человек.
В другом варианте осуществления изобретения обеспечивается применение соединения (I) или его фармацевтически приемлемой соли для приготовления лекарственного средства для применения в качестве антиангиогенного средства у теплокровного животного, такого как человек.
В другом варианте осуществления изобретения обеспечивается способ антиангиогенного действия, который предусматривает введение эффективного количества соединения (I) или его фармацевтически приемлемой соли теплокровному животному, такому как человек.
В соответствии с дальнейшим вариантом осуществления изобретения обеспечивается фармацевтическая композиция, которая содержит соединение (I) или его фармацевтически приемлемую соль в сочетании с фармацевтически приемлемым разбавителем или носителем для применения в качестве антиангиогенного средства у теплокровного животного, такого как человек.
В другом варианте осуществления изобретения обеспечивается применение соединения (I) или его фармацевтически приемлемой соли в качестве ингибитора метастаз в костях и ингибитора инвазии у теплокровного животного, такого как человек.
В другом варианте осуществления изобретения обеспечивается применение соединения (I) или его фармацевтически приемлемой соли для приготовления лекарственного средства для применения в качестве ингибитора метастаз в костях и ингибитора инвазии у теплокровного животного, такого как человек.
В другом варианте осуществления изобретения обеспечивается способ ингибирования метастаз в костях и ингибирования инвазии, который предусматривает введение эффективного количества соединения (I) или его фармацевтически приемлемой соли теплокровному животному, такому как человек.
В соответствии с дальнейшим вариантом осуществления изобретения обеспечивается фармацевтическая композиция, которая содержит соединение (I) или его фармацевтически приемлемую соль в сочетании с фармацевтически приемлемым разбавителем или носителем для применения в качестве ингибитора метастаз в костях и ингибитора инвазии у теплокровного животного, такого как человек.
В другом варианте осуществления изобретения обеспечивается применение соединения (I) или его фармацевтически приемлемой соли в качестве ингибитора метастаз в костях у теплокровного животного, такого как человек.
В другом варианте осуществления изобретения обеспечивается применение соединения (I) или его фармацевтически приемлемой соли для приготовления лекарственного средства для применения в качестве ингибитора метастаз в костях у теплокровного животного, такого как человек.
В другом варианте осуществления изобретения обеспечивается способ ингибирования метастаз в костях, который предусматривает введение эффективного количества соединения (I) или его фармацевтически приемлемой соли теплокровному животному, такому как человек.
В соответствии с дальнейшим вариантом осуществления изобретения обеспечивается фармацевтическая композиция, которая содержит соединение (I) или его фармацевтически приемлемую соль в сочетании с фармацевтически приемлемым разбавителем или носителем для применения в качестве ингибитора метастаз в костях у теплокровного животного, такого как человек.
В другом варианте осуществления изобретения обеспечивается применение соединения (I) или его фармацевтически приемлемой соли для предотвращения метастаз в костях у теплокровного животного, такого как человек.
В другом варианте осуществления изобретения обеспечивается применение соединения (I) или его фармацевтически приемлемой соли для приготовления лекарственного средства для применения для предотвращения метастаз в костях у теплокровного животного, такого как человек.
В другом варианте осуществления изобретения обеспечивается способ предотвращения метастаз в костях, который предусматривает введение эффективного количества соединения (I) или его фармацевтически приемлемой соли теплокровному животному, такому как человек.
В соответствии с дальнейшим вариантом осуществления изобретения обеспечивается фармацевтическая композиция, которая содержит соединение (I) или его фармацевтически приемлемую соль в сочетании с фармацевтически приемлемым разбавителем или носителем для применения для предотвращения метастаз в костях у теплокровного животного, такого как человек.
В другом варианте осуществления изобретения обеспечивается применение соединения (I) или его фармацевтически приемлемой соли для лечения метастаз в костях у теплокровного животного, такого как человек.
В другом варианте осуществления изобретения обеспечивается применение соединения (I) или его фармацевтически приемлемой соли для приготовления лекарственного средства для применения для лечения метастаз в костях у теплокровного животного, такого как человек.
В другом варианте осуществления изобретения обеспечивается способ лечения метастаз в костях, который предусматривает введение эффективного количества соединения (I) или его фармацевтически приемлемой соли теплокровному животному, такому как человек.
В соответствии с дальнейшим вариантом осуществления изобретения обеспечивается фармацевтическая композиция, которая содержит соединение (I) или его фармацевтически приемлемую соль в сочетании с фармацевтически приемлемым разбавителем или носителем для применения для лечения метастаз в костях у теплокровного животного, такого как человек.
В дальнейшем варианте осуществления изобретения обеспечивается ингибирование, лечение и/или предотвращение метастаз в костях, как описано в настоящем изобретении, где метастазы в костях возникают вследствие рака почки, щитовидной железы, легких, молочной железы или предстательной железы.
В другом варианте осуществления изобретения обеспечивается применение соединения (I) или его фармацевтически приемлемой соли для предотвращения или лечения боли, связанной с повышенной выработкой эндотелина-1 у теплокровного животного, такого как человек.
В другом варианте осуществления изобретения обеспечивается применение соединения (I) или его фармацевтически приемлемой соли для приготовления лекарственного средства для применения для предотвращения или лечения боли, связанной с повышенной выработкой эндотелина-1 у теплокровного животного, такого как человек.
В другом варианте осуществления изобретения обеспечивается способ лечения боли, связанной с повышенной выработкой эндотелина-1, который предусматривает введение эффективного количества соединения (I) или его фармацевтически приемлемой соли теплокровному животному, такому как человек.
В соответствии с дальнейшим вариантом осуществления изобретения обеспечивается фармацевтическая композиция, которая содержит соединение (I) или его фармацевтически приемлемую соль в сочетании с фармацевтически приемлемым разбавителем или носителем для применения для предотвращения или лечения боли, связанной с повышенной выработкой эндотелина-1 у теплокровного животного, такого как человек.
В другом варианте осуществления изобретения обеспечивается применение соединения (I) или его фармацевтически приемлемой соли для предотвращения или лечения боли у теплокровного животного, такого как человек.
В другом варианте осуществления изобретения обеспечивается применение соединения (I) или его фармацевтически приемлемой соли для приготовления лекарственного средства для применения для предотвращения или лечения боли у теплокровного животного, такого как человек.
В другом варианте осуществления изобретения обеспечивается способ лечения боли, который предусматривает введение эффективного количества соединения (I) или его фармацевтически приемлемой соли теплокровному животному, такому как человек.
В другом варианте осуществления изобретения обеспечивается применение соединения (I) или его фармацевтически приемлемой соли для предотвращения или лечения боли, связанной со стимуляцией рецептора ЕТA, у теплокровного животного, такого как человек.
В другом варианте осуществления изобретения обеспечивается применение соединения (I) или его фармацевтически приемлемой соли для приготовления лекарственного средства для применения для предотвращения или лечения боли, связанной со стимуляцией рецептора ЕТA, у теплокровного животного, такого как человек.
В другом варианте осуществления изобретения обеспечивается способ лечения боли, связанной со стимуляцией рецептора ЕТA, который предусматривает введение эффективного количества соединения (I) или его фармацевтически приемлемой соли теплокровному животному, такому как человек.
Ссылка на злокачественное новообразование предпочтительно относится к раку пищевода, миеломе, печеночно-клеточному раку, раку поджелудочной железы, раку шейки матки, диффузной эндотелиоме костей, нейробластоме, саркоме Капоши, раку яичников, раку молочной железы, раку прямой кишки, раку предстательной железы, раку мочевого пузыря, меланоме, раку легкого - немелкоклеточному раку легкого (NSCLC) и мелкоклеточному раку легкого (SCLC), раку желудка, раку головы и шеи, раку почки, лимфоме и лейкозу. Более предпочтительно она относится к раку предстательной железы. Кроме того, она предпочтительно относится к SCLC, NSCLC, раку прямой кишки, раку яичников и/или раку молочной железы. Кроме того, она более предпочтительно относится к SCLC. Кроме того, она более предпочтительно относится к NSCLC. Кроме того, она более предпочтительно относится к раку прямой кишки. Кроме того, она более предпочтительно относится к раку яичников. Кроме того, она предпочтительно относится к раку молочной железы. Также она более предпочтительно относится к раку мочевого пузыря, раку пищевода, раку желудка, меланоме, раку шейки матки и/или раку почки. Дополнительно она относится к раку эндометрия, печени, желудка, щитовидной железы, прямой кишки и/или головного мозга. В другом варианте осуществления изобретения злокачественное образование не представляет собой меланому. В другом варианте осуществления изобретения предпочтительно злокачественное новообразование находится на метастатической стадии и более предпочтительно рак образует метастазы в костях. В дальнейшем варианте осуществления изобретения предпочтительно злокачественное новообразование находится на метастатической стадии и более предпочтительно рак образует метастазы в коже. В дальнейшем варианте осуществления изобретения предпочтительно злокачественное новообразование находится на метастатической стадии и более предпочтительно рак образует метастазы в лимфатической системе. В дальнейшем варианте осуществления изобретения злокачественное новообразование находится на неметастатической стадии.
Подразумевается, что если злокачественное новообразование находится на метастатической стадии, то соединение (I) действует как на первичную опухоль, так и на метастазы. Соединение (I) как предотвращает метастазы, так и их лечит и ингибирует.
В одном варианте осуществления изобретения, если присутствует ссылка на боль, то эта боль связана с повышенными уровнями эндотелина-1. В другом варианте осуществления изобретения она представляет собой боль, связанную со стимуляцией рецептора ЕТA, которая является следствием того, что ингибирование ЕТB приводит к атипичной стимуляции ЕТA и/или повышению уровней эндотелина-1. Предпочтительно эта боль связана со злокачественным новообразованием. Более предпочтительно эта боль связана с раком предстательной железы.
В соответствии с дальнейшим вариантом осуществления изобретения обеспечивается фармацевтическая композиция, которая содержит соединение (I) или его фармацевтически приемлемую соль в сочетании с фармацевтически приемлемым разбавителем или носителем для применения для предотвращения или лечения боли, связанной со стимуляцией рецептора ЕТA, у теплокровного животного, такого как человек.
Дополнительно соединение (I), как полагают, является пригодным для лечения и/или профилактики боли разного происхождения и причин, включая острые, а также хронические болевые состояния. Примерами являются боли, вызванные химическими, механическими, лучевыми (включая солнечные), термическими (включая ожоги), инфекционными или воспалительными тканевыми повреждениями или злокачественным новообразованием, послеоперационные боли, послеродовые боли, боли, связанные с заболеваниями суставов (такими как ревматоидный артрит и остеоартрит), боли, связанные с заболеваниями зубов (такими как кариес зубов и гингивит), миофасциальные боли и боли в нижних участках спины, боли, связанные с заболеваниями костей (такими как остеопороз, злокачественная гиперкальциемия и деформирующая остеодистрофия), и боли, связанные со спортивными травмами и растяжениями.
Также неврологические болевые состояния центрального и периферического происхождения могут подвергаться лечению или предотвращению при помощи соединения (I). Примерами таких болевых состояний является боль, связанная с невралгией тройничного нерва, боль, связанная с постгерпетической невралгией (PHN), боль, связанная с диабетической моно/полиневропатией, боль, связанная с травмой нерва, боль, связанная с травмой спинного мозга, боль, связанная с повреждением центрального штифта, боль, связанная с рассеянным склерозом, и боль, связанная с болезнью Паркинсона.
Другие болевые состояния висцерального происхождения, такие как вызванные язвой, дисменореей, эндометриозом, синдромом раздраженной толстой кишки, диспепсией, болями в области таза и т.д. также могут подвергаться лечению или предотвращению с помощью соединения (I).
Дополнительно, соединение (I), как полагают, будет пригодным для лечения и/или профилактики дополнительных видов боли, например, комплексного регионарного болевого синдрома, болей при сужении сосудов/ишемических болей (например, синдром Раунауда) и боли в костях.
В дальнейшем варианте осуществления изобретения обеспечивается применение соединение (I) для перорального лечения невропатических болей или болевых состояний центрального происхождения.
Подходящие фармацевтически приемлемые соли включают, например, соли со щелочным металлом (таким как натрий, калий или литий), щелочноземельными металлами (такими как кальций или магний), соли аммония и соли с органическими основаниями, которые образуют физиологически приемлемые катионы, такие как соли с метиламином, диметиламином, триметиламином, пиперидином и морфолином. Кроме того, подходящие фармацевтически приемлемые соли включают фармацевтически приемлемые кислото-аддитивные соли с галогенидами водорода, серной кислотой, фосфорной кислотой и органическими кислотами, такими как лимонная кислота, малеиновая кислота, метансульфоновая кислота и п-толуолсульфоновая кислота.
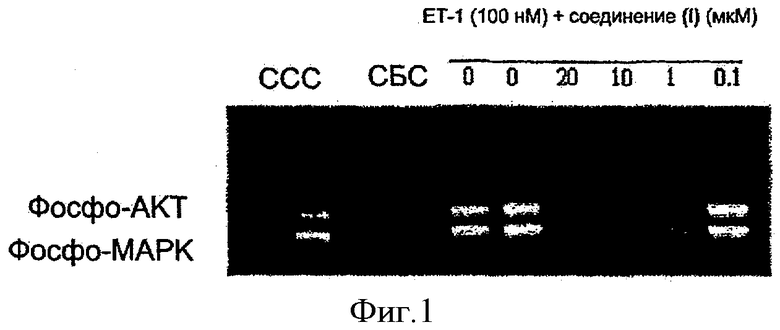
Подписи на фигурах
Фиг.1: Показано ингибирование соединением (I) индуцированного ЕТ-1 фосфорилирования МАРК в клеточной линии остеобластов MC3T3.E1/J1 из исследования 2, описанного ниже, при вестерн-блоттинге. Белки разгоняли в геле, затем переносили на нитроцеллюлозную мембрану, где их исследовали с первичными и вторичными антителами. Использованы следующие сокращения:
ССС: среда, содержащая сыворотку
СБС: среда без сыворотки
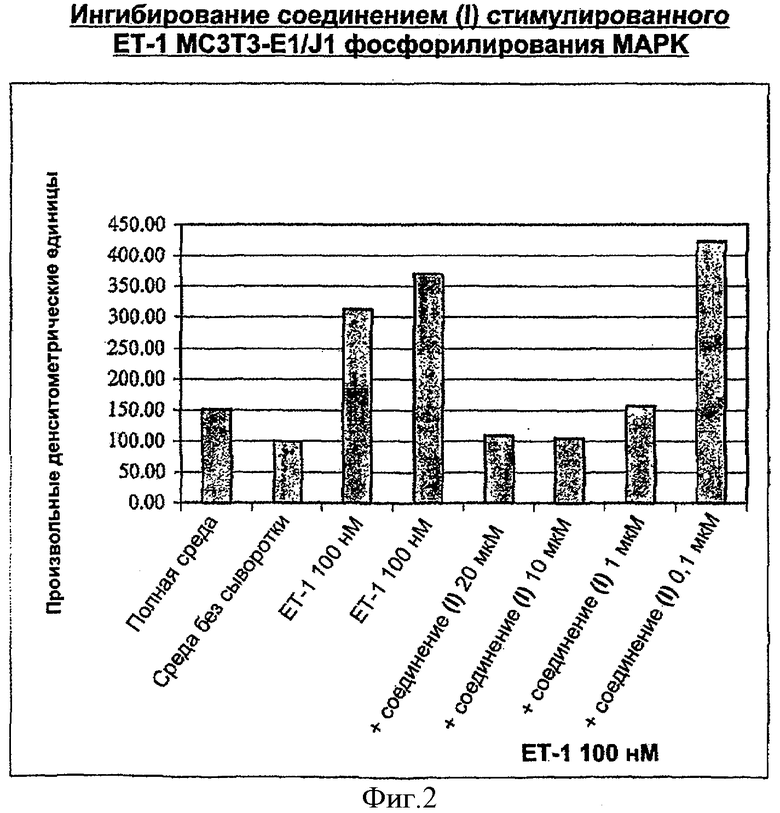
Фиг.2: На этой фигуре графически показано ингибирование соединением (I) индуцированного ЕТ-1 фосфорилирования МАРК в клеточной линии остеобластов MC3T3.E1/J1 также из исследования 2.
Следующие исследования в условиях in vivo и in vitro могут применяться для определения эффективности соединения (I) в онкологии.
1) Исследование связывания рецептора эндотелина человека
Рекомбинантные рецепторы ЕТA или ЕТB экспрессировали в клетках эритролейкоза мышей (MEL) и подготавливали мембраны для исследования конкурентного связывания, используя ЕТ-1, меченный 125I, в качестве радиоактивного лиганда. Инкубации осуществляли в трех повторах в присутствии соединения (I), 10-10-10-4М с увеличением концентрации с полулогарифмическим интервалом и ингибирование связывания ЕТ-1 выражали как среднее геометрическое значение pIC50 с 95% границами доверительного интервала.
Результаты
pIC50 (отрицательный логарифм концентрации соединения, необходимой для 50% вытеснения лиганда) для соединения (I) в рецепторе ЕТA составляет 8,27[8,23-8,32] (n=4). Кривые вытеснения являются стандартными с подобными углами наклона. Соединение (I) не обладает измеримым сродством к рецептору ЕТB при значениях вытеснения 1,2±0,7% (n=3) при концентрации 10-4М, как следует из фигуры в пределах чувствительности исследования.
Вывод
Соединение (I) является лигандом с сильным сродством для рецептора ЕТA человека и специфично к ЕТA, не обладая существенным сродством к рецептору ЕТB.
2) Соединение (I) для лечения метастатического рака: Исследования остеобластов - Ингибирование соединением (I) индуцированной ЕТ-1 стимуляции МАРК
Соединение (I) действительно может быть полезным для лечения не только первичных опухолей, но также и метастатических опухолей и патологического образования новых костей в метастазе и вокруг него. Далее описано экспериментальное доказательство полезности соединения (I) при лечении патологии остеобластов в костях.
Значительная клиническая патология наблюдается в метастатических участках в костях больных с прогрессирующим раком предстательной железы, которые представлены в виде несоответствующей стимуляции остеобластов, то есть присутствие метастаз опухоли предстательной железы в костях приводит к образованию сетчатой структуры новой кости и в итоге к повышению плотности кости вокруг метастаза (см. обзор в Cancer Metastasis Rev.2001; 20(3-4):333-49). Предположительный механизм, который лежит в основе этой патологии, состоит в высвобождении ЕТ-1 из метастатической клетки предстательной железы в начале образования вторичной опухоли в кости.
Стимуляция ЕТ-1 остеобластов описана в качестве ключевого этапа в патологическом образовании новой кости при метастазах рака предстательной железы в костях (Invest New Drugs. 2002; 20(2):173-82). Показано, что ЕТ-1 действует непосредственно, индуцируя пролиферацию и дифференциацию остеобласта, а также стимулирует остеобласт к выработке других факторов роста посредством стимуляции рецептора ЕТA и последующего фосфорилирования MAP киназы (Bone. 1999; 24(4):315-20 и J Bone Miner Res.2002; 17(10):1774-84). При таком пути стимуляции рецептора ЕТA вызывается как рост кости, так и выживание и рост метастатических опухолевых клеток путем высвобождения факторов роста в локальную окружающую среду. Следовательно, опухолевые клетки и клетки остеобластов в метастазе принимают участие в "дефектном цикле", при котором их пролиферативные ответы поддерживают друг друга, преодолевая при этом нормальные регуляторные механизмы, контролирующие и ограничивающие образование кости (Nat Rev Cancer. 2002; 2(8):584-93).
В экспериментах, описанных ниже, авторы настоящего изобретения, во-первых, подтверждают способность ЕТ-1 стимулировать MAP киназу в клетках остеобластов. Эта стимуляция содействует пролиферации клеток и активирует метаболические пути, которые, как известно, являются важными для высвобождения факторов роста из остеобластов.
Затем изобретатели подтверждают, что соединение (I), ЕТA антагонист, является эффективным антагонистом такой стимуляции ЕТ-1.
Способ
Клеточную линию МС3Т3. E1/J1 выделяли из родительской клеточной линии МС3Т3-Е1 (доступной из Invitrogen), которая, в свою очередь, была получена из C57BL/6 свода черепа новорожденных мышей. Линия МС3Т3 E1/J1 описана в качестве линии остеобластов. Для начала экспериментов, описанных ниже, клетки МС3Т3.E1/J1 помещали в планшеты при плотности 2,4×10 клеток/лунку (24 луночный планшет) в среду, содержащую сыворотку, и инкубировали в течение 48 часов. Клетки дважды промывали в PBS и повторно инкубировали приблизительно в течение 17 часов в среде, обедненной сывороткой.
На этой стадии затем клетки инкубировали с соединением (I) или без него в течение 30 минут и после этого стимулировали фактором роста (PDGF или ЕТ-1) в течение 3 минут. Затем всю среду удаляли и клетки лизировали и хранили при -20°С для электрофореза/вестерн-блоттинга, при которых локализировали пробы, фосфорилированные МАРК и фосфорилированные Akt с анти-фосфо-р44/42 МАРК (Thr 202/204) и анти-фосфо АКТ (Ser 473) антителами (оба коммерчески доступны от Cell Signalling Technology). Белковые полосы количественно определяли путем денситометрии и выражали в виде произвольных денситометрических единиц. Уровни фосфорилированной МАРК нормировали к общему уровню МАРК.
Результаты
Стимуляция клеток ЕТ-1 в течение 3 минут приводит к повышению фосфорилирования МАРК в клеточной линии остеобластов МС3Т3.E1/J1. Стимуляция клеток обычным фактором роста, PDGF, также приводит к повышению фосфорилирования МАРК. Соединение (I) ингибирует индуцированное ЕТ-1 фосфорилирование МАРК в остеобластах.
Ингибирование соединением (I) индуцированного ЕТ-1 фосфорилирования МАРК в клеточной линии остеобластов МС3Т3.E1/J1
Эти данные представлены на фиг.1 и 2.
Примечание: Вышеописанный эксперимент не зависит от применения, в частности, клеточной линии MC3T3.E1/J1, его можно осуществлять, например, используя коммерчески доступную родительскую линию МС3Т3-Е1.
3) Соединение (I) в качестве ингибитора ангиогенеза
Активация рецептора ЕТA посредством ЕТ-1 вносит вклад в рост опухоли и прогрессирование, опосредованные различными механизмами, и в литературе предполагается, что специфическое ингибирование ЕТA будет обеспечивать благоприятное воздействие на первичные опухоли, полностью отделяя его действие на метастазирование в костях. Эти механизмы включают антиапоптоз, прямое и непрямое стимулирование роста и стимулирование подвижности клеток (Nat Rev Cancer. 2003; 3(2):110-6).
В последнее время возрастает интерес к роли ЕТ-1, опосредованной рецептором ЕТA, в качестве основных участников ангиогенеза (развития кровеносных сосудов) опухоли (J Cardiovasc Pharmacol. 2000; 36: S1 35-9). В настоящее время при изучении этих механизмом было показано, что рецептор ЕТA является важным для выработки сильнодействующего ангиогенного фактора VEGF (Life Sci. 1998; 63(6):477-84) путем непосредственной индукции фактора HIF-1α, вызываемого гипоксией (J Biol Chem. 2002; 277:27850-5). Значительные литературные данные, подтверждающие роль эндотелина и ЕТА рецептора в ангиогенезе опухоли, обобщены в недавнем обзоре Bagnato и Spinella (Trends Endocrmol Metab. 2003; 14(1):44-50).
В исследовании, описанном ниже, нами было показано на животных моделях действие соединения (I) на ангиогенез, индуцированный новообразованными опухолями после прививания опухолевых клеток человека.
Способ
Опухолевые клетки прививали внутрикожно голым мышам, и им один раз в сутки перорально вводили 25 или 50 мг/кг соединения (I) или наполнитель, первую дозу вводили на следующий день после имплантации клеток и через 5 дней мышей убивали. Исследовали участок площадью 1 см2 в центре опухоли и подсчитывали количество кровеносных сосудов, которые разветвляются в этом участке, кровоснабжающих опухоль. Сравнивали количество сосудов, кровоснабжающих опухоль, у животных, которым вводили тестируемое лекарственное средство и наполнитель и действие соединения (I) рассчитывали в виде процента уменьшения подсчитанных кровеносных сосудов.
Результаты
Соединение (I) вызывает уменьшение плотности кровеносных сосудов вокруг опухолей у обработанных животных по сравнению с контрольными животными, которым вводили наполнитель. Уменьшение количества подсчитанных кровеносных сосудов соединением (I) наблюдается вокруг опухолей, индуцированных как клеточными линиями ободочной кишки, так и клеточными линиями предстательной железы, в пяти исследованиях в условиях in vivo.
Ингибирование ангиогенеза в первичных опухолях, вызванное соединением (I)
1статистический анализ осуществляли при помощи теста ANOVA по сравнению с контрольным наполнителем.
Вышеприведенные клеточные линии являются коммерчески доступными. Одним источником получения является АТСС (Американская коллекция типовых культур). LOVO имеет АТСС №=CCL-229. DU145 имеет АТСС №=НТВ-81.
Обсуждение
Нами было показано, что в условиях in vitro соединение (I) является эффективным ингибитором опосредованной ЕТ-1 активации MAP киназы в остеобластах, а также является эффективным ингибитором ангиогенеза в первичных опухолях в условиях in vivo. Это подтверждает возможности этого средства в качестве лечения метастатичного рака предстательной железы, так как оно может обладать благоприятными действиями относительно предотвращения патологического повышения плотности кости (путем ингибирования пролиферации остеобластов), опосредованного метаболическим путем МАРК, а также ингибирования высвобождения факторов роста, которые поддерживают выживание и рост опухолевых клеток в микросреде кости дополнительно к антиангиогенному действию на первичную опухоль.
4) Соединение (I) в качестве антагониста рецептора эндотелина в эндотелиновой системе человека
Кровоток в предплечье человека может быть оценен путем временной задержки венозного оттока из верхней конечности путем применения пневматической манжеты на плече, которую затем накачивали для немедленного повышения венозного давления. В результате артериальный кровоток в верхней конечности не соответствовал венозному оттоку, что приводит к переполнению кровью и набуханию верхней конечности, которые можно определить при помощи чувствительного тензиометрического датчика. Введение артериального сосудосуживающего средства ЕТ-1 в плечевую артерию приводит к уменьшению растяжения предплечья вследствие снижения артериального притока. Действие этого сосудосуживающего средства опосредуется рецепторами эндотелина в эндотелии сосудов и в сопутствующих гладких мышцах.
Способ
Исследование проводили для изучения способности соединения (I) противодействовать сосудосуживающему действию ЕТ-1 при помощи рецепторов эндотелина на этой модели у здоровых мужчин в возрасте от 18 до 65 лет. Восемь субъектов получали перорально однократную дозу 10 мг соединения (I), 30 мг соединения (I) и плацебо в рандомизированном двойном слепом исследовании по крайней мере в течение 7 дней отдельно. Сужение сосудов предплечья в ответ на действие ЕТ1 оценивали между 2 и 4 часами после введения соединения (I).
Результаты
В целом соединение (I) вызывает статистически значимое уменьшение кровотока в предплечье в ответ на введение ЕТ-1 по сравнению с плацебо (р=0,0210) в зависимости от дозы в пределах исследуемых доз. Это свидетельствует о том, что соединение (I) является антагонистом рецептора эндотелина в эндотелиновой системе человека.
5) Соединение (I) в исследовании повышения доз для определения переносимости и фармакокинетика соединения (I) при пероральном введении один раз в сутки пациентам с метастатическим раком предстательной железы.
Последующее исследование может быть предпринято для определения максимальной хорошо переносимой дозы (MWTD) соединения (I) у больных метастатическим раком предстательной железы. Это исследование позволяет наблюдать действие соединения (I) на специфический антиген предстательной железы (PSA), наблюдать действие соединения (I) на серологический биомаркер метастаза в костях и предоставляет возможность получить фармакокинетические характеристики соединения (I) у больных метастатическим раком предстательной железы.
Способ
Больные раком предстательной железы, у которых были задокументированы метастазы (подтвержденные сканированием костей в течение 3-х месяцев от начала исследования), могут использоваться для этого исследования. Соединение (I) может вводиться перорально один раз в сутки в виде таблеток. В качестве начальной дозы можно использовать 120 мг. Пациентов можно подвергать исследованию медикаментозного лечения в течение 28 дней или до тех пор, пока не появляются критерии, по которым нужно прекратить лечения. Каждый уровень доз может вводиться трем новым субъектам с метастатическим раком предстательной железы.
Формальную оценку переносимости можно осуществить у каждого субъекта через одну неделю введения соединения (I). Повышение дозы можно осуществить, если два субъекта из любой группы не испытывают токсичности, ограничивающей дозу (DLT), через одну неделю непрерывного введения соединения (I). Дозу можно увеличивать путем повышения ее в два раза на каждом этапе. Если у одного субъекта при конкретном уровне дозы обнаруживается DLT, тогда для того, чтобы осуществить повышение дозы на следующий уровень, у двух других субъектов при таком же уровне дозы не должно наблюдаться DLT.
Субъекты могут продолжать лечение в течение 28 дней, пока не появятся критерии, по которым нужно прекратить лечение. Если минимум у двух субъектов в любой группе при введении определенной дозы обнаруживается, что она плохо переносима в любое время после введения, то повышение дозы прекращают и окончательная доза перед этой считается максимальной хорошо переносимой дозой MWTD.
Могут наблюдаться следующие результаты:
- сфера распространения и тяжесть побочных действий;
- концентрация PSA (общая и соотношение свободного к общей) через 1, 2 и 4 недели у субъектов, подвергнутых лечению соединением (I);
- изменение концентрации PSA (общей и соотношения свободного к общем) перед введением соединения (I) и через 1, 2 и 4 недели после введения соединения (I);
- изменение концентрации в сыворотке маркера, вовлеченного в метастазирование в костях (щелочной фосфатазы кости), перед введением соединения (I) относительно значений через 1, 2 и 4 недели после введения соединения (I); и
- концентрации в плазме соединения (I) и ее изменение после введения в разовой дозе и многократных дозах в стабильном состоянии.
Исследование ослабления боли
Аналгезирующее действие соединения (I) может быть оценено, например, на мышиной модели боли при злокачественном новообразовании, описанной Wacnik и др.. Journal of Neuroscience (2001), 21, 9355.
В дальнейшем варианте осуществления настоящего изобретения соединение (I) или его фармацевтически приемлемую соль вводят в клетку или особе перед развитием злокачественного новообразования. Например, особь с риском развития злокачественного новообразования может подвергаться лечению соединением (I) или его фармацевтически приемлемой солью для предотвращения или ингибирования развития злокачественного новообразования и/или для предотвращения развития метастаз.
Соединение (I) или его фармацевтически приемлемая соль может вводиться с терапевтической или профилактической целью теплокровному животному, такому как человек, способами, известными в данной области. Введение можно осуществлять непосредственно в опухоль, или, предпочтительно, системным образом.
Соединение (I) или его фармацевтически приемлемая соль может вводиться с терапевтической или профилактической целью теплокровному животному, такому как человек, в виде обычных фармацевтических композиций. Композиция может находиться в форме, подходящей для перорального введения, например, в виде таблетки или капсулы, для парентерального введения (включая внутривенное, подкожное, внутримышечное, внутрисосудистое введение или инфузию) в виде стерильного раствора, суспензии или эмульсии, для местного введения в виде мази или пасты, или для ректального введения в виде суппозитория. В целом, вышеприведенные композиции могут быть приготовлены обычным способом при использовании обычных наполнителей. Например, лекарственная форма в виде таблетки может быть приготовлена на основе соединения (I), используя следующие наполнители:
соединение (I);
моногидрат лактозы (наполнитель);
кроскармеллоза натрия (распадающееся средство);
повидон (связующее);
стеарат магния (смазывающее вещество);
гипромеллоза (компонент пленочного покрытия);
полиэтиленгликоль 300 (компонент пленочного покрытия); и
диоксид титана (компонент пленочного покрытия).
Вводимое количество соединения (I) или его фармацевтически приемлемой соли должно быть достаточным для обеспечения желательного фармацевтического действия. Например, соединение (I) может вводиться теплокровному животному перорально в стандартной дозе меньше 1 г ежедневно. Предпочтительно соединение (I) может вводиться теплокровному животному в стандартной дозе меньше 250 мг в день. В другом варианте осуществления изобретения соединение (I) может вводиться теплокровному животному в стандартной дозе меньше 130 мг в день. В дальнейшем варианте осуществления изобретения соединение (I) может вводиться теплокровному животному в стандартной дозе меньше 50 мг в день.
Предложены способы воздействия М-(3-метокси-5-метилпиразин-2-ил)-2-(4-[1,3,4-оксадиазол-2-ил]фенил)пиридин-3-сульфонамидом или его фармацевтически приемлемой солью при лечении злокачественного новообразования, при уменьшении атипичной пролиферации злокачественных клеток, для индуцирования дифференциации злокачественных клеток, для индуцирования апоптоза в злокачественных клетках, способ антиангиогенного воздействия, нацеленный на сосуды, в кровеносных сосудах злокачественных клеток у теплокровного животного (варианты), такого как человек, способ подавления метастазов в костях и ингибирования инвазии, соответствующие способы лечения и профилактики метастазов и инвазии. Вещество ранее было известно как ингибитор эндотелина-1 (ЕТ-1). Показана его эффективность по всем заявленным назначениям в отношении рака яичника. 9 н. и 13 з.п. ф-лы, 2 ил., 2 табл.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Nelson J.B | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Jarvis M.F | |||
| ПНЕВМАТИЧЕСКИЙ ДВИГАТЕЛЬ | 1923 |
|
SU627A1 |
Авторы
Даты
2008-12-10—Публикация
2003-08-20—Подача