Изобретение относится к области получения пренилфенолов, которые широко используются в фармакологии в качестве перспективных физиологически активных веществ.
Известен способ аллилирования ароматических соединений, имеющих до 2-х ароматических ядер, с орто- и параориентирующими заместителями, выбранными из следующих: -N(СН3), -NH2, -ОН, алкокси, -NHCOCH3, алкил, -CH2СООН, -СН=СНСООН и т.п. Аллильное соединение имеет формулу R-O-R', где R выбран из группы радикалов, содержащих Н и ацил-, аллил- и алкил-замещенный аллильный радикалы. В частности, алкилирование фенолов проходит при температуре 40-125°С в контакте с твердой ионобменной смолой. Важным элементом этого исследования является использование кислотных ионобменных смол (Amberlite IR-120 и Dowex 50, Duolite C-3, Duolite C-25), имеющих сильные кислотные группы: сульфатные или метиленсульфатные. Также указанные катализаторы нерастворимы в реакционных растворителях и стабильны при 125°С. Недостатком этого способа является небольшой выход ортоаллилфенолов, который составил порядка 30% [Patent US 2915563. 1959. Fischer R.F. Allylation of aromatic compounds; Patent CA 677772. 1964. Fischer R.F. Allylation of aromatic compounds].
Известен способ аллилирования нуклеофильного реагента аллильным производным. В качестве нуклеофила для аллилирования предпочтительнее использовать реагент, который соответствует формуле:
(R)nAr-Y-Н
R представляет собой атом водорода, замещенный или незамещенный оптически активный линейный, циклический или разветвленный алкильный (включая арильный) радикал, эфир, оптически активный замещенный радикал, выбранный из алкокси-, арилокси-, амино-, гидроксил, карбоксилат-, амидо-, нитрил, кислотных радикалов. Аллильный спирт или одно из его аллильных производных соответствует формуле:
Z-O-C(R1)(R2)-C(R3)=C(R4)(R5)
где R1-R2=H - алкильный радикал - с содержанием атомов углерода 1-2; R3, R4, R5=H - алкильный радикал; Z - это атом водорода или ацильный радикал. Для этого процесса используется катализатор в водной фазе, содержащий, по крайней мере, один элемент из VIII группы ПС (Fe, Co, Ni, Ru, Rh, Pd, Os, Ir, Pt). В реагенте может присутствовать водорастворимый фосфин, а реагент может также содержать, по крайней мере, одну органическую фазу. Водорастворимые фосфины включают растворимые трифенилфосфинтрисульфонаты Р(С5Н4-SO3-)3, например щелочных металлов, а также формулы Р(С5Н4-СО2Н)3 предпочтительно в анионной форме. Был обеспечен процесс, в результате которого стало возможно образование аллилированных фенолов, даже если позднее происходила дезактивация электрофильными группами [Patent US 5986137. 1999. Grosselin J.-M., Kempf H. LeCouve J.-P. Allylation reagent and process for allylating a nucleophile]. Недостатком этого способа является сложная каталитическая система с участием металлов VIII и V групп, в том числе дорогостоящих металлов Pt и Pd. При этом конверсия исходного фенола небольшая, и в случае взаимодействия ароматических соединений с аллильными спиртами необходим большой (более чем 3-кратный) избыток спирта.
Известен метод аллилирования фенолов аллильными спиртами и их производными в водной среде в присутствии комплексов металла из VIII группы периодической системы и водорастворимых фосфинов [Patent WO 2005/051876 А2. Kuntz E., Amgoune A. Method for C- allylation of phenols]. Основная формула алкилирующего реагента может быть представлена следующим образом:
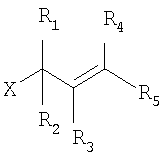
В качестве катализатора используют Pt (O) или Pd (O), их соли с минеральными (карбонаты, сульфаты, нитраты) или карбоксильными кислотами (ацетаты, пропионаты, бензоаты), галогениды (иодид, бромид, хлорид), гидроксиды, ацетилацетонаты, а также комплексы металлов Pt и Pd с органическими лигандами (олефины, диены, цианурины и др.). Однако при использовании в качестве алкилирующего реагента аллильных спиртов в указанных условиях общий выход продуктов алкилирования небольшой (24-64%). Этот метод не является ортоселективным, в результате образуются продукты пара- и ортоалкилирования в соотношении 1:1 или 2:1 соответственно.
В качестве прототипа выбран известный способ алкилирования фенолов аллильным третичным спиртом лабданового ряда в условиях катализа алюмосиликатами (в частности, глины асканит-бентонин) в кипящем дихлорэтане [Е.В.Кузаков, Э.Н.Шмидт. Взаимодействие (138)-6-оксолабд-7.14-диен-13-ола с фенолами на глине асканит-бентонит // Химия природных соединений. - 1998. - С.653-662]. Показано, что в ходе реакции промежуточные ортоаддукты замещения в ароматическое ядро циклизуются в хромановые производные, содержащие бициклический терпеновый остаток - 2-метил-2-(6'-оксо-Δ7'-тетранорлабд-12'-ил)хроманы. Недостатком этого способа являются существенные ограничения в стерическом контроле, которые вносит гетерогенный катализатор. Авторы показывают максимальное содержание хроманового производного при алкилированиии мета-крезола и резорцина (50 и 78% соответственно), но не уточняют общий выход продуктов реакции.
Задачей изобретения является селективное аллилирование фенолов аллильными алифатическими терпеновыми спиртами.
Предлагаемый способ позволяет проводить аллилирование фенолов терпеновыми аллильными алифатическими спиртами (количество атомов углерода 10-55) в присутствии органоалюминиевых соединений, кроме того, позволяет получать с 95% выходом пренилированные фенолы с содержанием ортопренилфенолов 40-70%. В этом и заключается технический результат изобретения.
Технический результат достигается тем, что в способе аллилирования фенолов, имеющих, по крайней мере, один атом водорода в ортоположении относительно гидроксильной группы терпеновым аллильным спиртом при нагревании в присутствии катализатора, согласно изобретению в качестве катализатора процесса алкилирования фенола терпеновыми аллильными спиртами выступают органоалюминиевые соединения, которые выбирают из группы алкоксидов алюминия несимметричного (смешанного) или симметричного (полного) типа, молярное соотношение фенола к спирту 1÷1. Кроме того, органоалюминиевые соединения используют в количестве 1-100 мас.% алюминия к массе исходного фенола, предпочтительно 20-100 мас.%; реакцию проводят при нагревании до 80-180°С в течение 3-21 часа.
Предложен способ аллилирования фенолов, содержащих, по крайней мере, один атом водорода в ортоположении относительно гидроксильной группы, терпеновыми аллильными алифатическими спиртами, содержащими 10-55 атомов углерода при нагревании от 80-180°С, предпочтительно 110-160°С, в присутствии органоалюминиевых соединений, которые выбирают из феноксидов или алкоксидов алюминия несимметричного (смешанного) или симметричного (полного) типа в количестве 1-100 мас.% алюминия к массе исходного фенола, при использовании растворителя из ряда бензол, толуол, гептан, октан или без растворителя. Отличительным признаком изобретения является алкилирование фенолов терпеновыми аллильными спиртами в присутствии органоалюминиевых соединений.
Предложенный способ осуществляется следующим образом.
Феноксиды алюминия получают in situ при нагревании алюминия в растворе соответствующего фенола. Используя взаимодействие фенола с алюминий-алкоксидными или алюминийорганическими соединениями (алкильный радикал от C2 до С20) in situ получают смешанные или полные феноксиды. К полученному феноксиду добавляется алкилант - терпеновый спирт в соотношении 0,1-1-1 соответственно. Реакцию проводят при нагревании до 80-180°С в течение 3-21 часа. Выполненные эксперименты показывают, что предлагаемый способ позволяет достичь конверсии исходных веществ до 95% и получить ортопренилированные фенолы с выходом 40-70%.
Способ поясняется следующими примерами.
Пример 1. Алкилирование проводили при использовании (PhO)3Al, полученного in situ. Реакцию вели при нагревании и перемешивании до полной конверсии гераниола (контроль по ГЖХ и ТСХ). По окончании взаимодействия реакционную смесь охладили, разбавили диэтиловым эфиром, прилили разбавленный раствор соляной кислоты для разложения оставшегося феноксида алюминия, затем промыли 5%-ным раствором NaOH и водой до нейтральной реакции. Органический слой сушили над безводным Na2SO4, растворитель упарили при пониженном давлении. Выход продуктов алкилирования составил 95%, содержание С-замещенных фенолов - 63%.
Пример 2. Процесс ведут аналогично примеру 1 при использовании изопропилата алюминия. Выход продуктов алкилирования составил 60-70%, содержание С-замещенных фенолов до 80%.
Пример 3. Алкилирование фенола гераниолом ведут аналогично примеру 1 в присутствии органоалюминиевого соединения с содержанием алюминия 1% к весу исходного фенола, при соотношении фенол:гераниол 1÷1. Выход продуктов алкилирования составил 60%, содержание С-замещенных фенолов - 64%.
Пример 4. Проводят алкилирование фенола аналогично примеру 1, в качестве алкилирующего реагента используют полипренолы (число атомов углерода - 30-55, преимущественно - 35-40). Выход продуктов алкилирования составил 98%, содержание С-замещенных фенолов - 52%.
Пример 5. Алкилирование фенола полипренолами в присутствии изо-пропилата алюминия проводят аналогично примеру 1. Общий выход продуктов алкилирования составил 80% при содержании С-замещенных фенолов 55%.
Контроль чистоты исходных веществ и анализ продуктов реакции осуществляли методом ГЖХ на хроматографе "Кристалл 2000М"; капиллярная колонка 60*0.25 mm*0.25 μm, фаза HP-5MS, температурный режим 70-230°С и 100-240°С через 6°С в минуту. Детектор пламенно-ионизационный, газ-носитель - гелий. ТСХ выполняли на пластинках "Sorbfil" (элюент гексан: диэтиловый эфир 3:1 и гексан). ИК спектры записывали на спектрометре "Specord M-80", твердые вещества в таблетках KBr или в тонком слое - жидкости. Спектры ЯМР 1Н и 13С полученных веществ записывали на спектрометре "Broker DRX-400" (400 МГц) в дейтерохлороформе, внутренний стандарт хлороформ, растворитель CDCl3.
Таким образом, предлагаемый способ позволяет проводить аллилирование фенолов аллильными алифатическими терпеновыми спиртами в присутствии органоалюминиевых соединений с 95%-ным выходом алкилированных продуктов и содержанием орто-замещенных фенолов 40-70%.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ АЛКИЛИРОВАНИЯ ФЕНОЛОВ ТЕРПЕНОВЫМИ СПИРТАМИ | 2007 |
|
RU2341511C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2,6-ДИИЗОБОРНИЛ-4-МЕТИЛФЕНОЛА | 2008 |
|
RU2394807C2 |
| СПОСОБ ПОЛУЧЕНИЯ ОРТО-ТЕРПЕНОФЕНОЛОВ | 2003 |
|
RU2233262C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2,6-ДИИЗОБОРНИЛ-4-МЕТИЛФЕНОЛА | 2012 |
|
RU2485090C1 |
| СПОСОБ ПОЛУЧЕНИЯ о-МЕТИЛЗА.(\\ЕЩЕКНЫХ ФЕНОЛОВ | 1967 |
|
SU200515A1 |
| 1-АЛКОКСИ-2,7-ДИМЕТИЛОКТА-2,7-ДИЕНЫ, ОБЛАДАЮЩИЕ АКАРИЦИДНОЙ АКТИВНОСТЬЮ, И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2012 |
|
RU2496763C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИМЕРА С ИСПОЛЬЗОВАНИЕМ КАТАЛИТИЧЕСКОЙ КОМПОЗИЦИИ И КАТАЛИТИЧЕСКАЯ КОМПОЗИЦИЯ НА ОСНОВЕ НИКЕЛЯ | 2008 |
|
RU2476451C2 |
| СПОСОБ ПОЛИМЕРИЗАЦИИ ОЛЕФИНОВ | 1995 |
|
RU2143439C1 |
| ПОЛУЧЕНИЕ ЭПОКСИЭТИЛОВЫХ ПРОСТЫХ ЭФИРОВ ИЛИ ГЛИЦИДИЛОВЫХ ПРОСТЫХ ЭФИРОВ | 2011 |
|
RU2532267C2 |
| Способ синтеза летучих перфторалкоксидов лантаноидов | 2016 |
|
RU2648362C2 |
Изобретение относится к способу аллилирования фенолов, имеющих, по крайней мере, один атом водорода в ортоположении относительно гидроксильной группы, терпеновым аллильным спиртом при нагревании в присутствии катализатора. При этом в качестве катализатора процесса алкилирования выступают органоалюминиевые соединения, которые выбирают из группы алкоксидов алюминия несимметричного (смешанного) или симметричного (полного) типа, молярное соотношение фенола к спирту 1:1. Полученные пренилфенолы широко используются в качестве физиологически активных веществ. Предлагаемый способ позволяет получать пренилированные фенолы с выходом 95% и содержанием ортопренилфенолов 40-70%. 2 з.п. ф-лы.
| Кузаков Е.В | |||
| и др | |||
| Насос | 1917 |
|
SU13A1 |
| Химия природных соединений, 1998, №5, стр.653-662 | |||
| Кучин А.В | |||
| Синтез новых терпеноидов - потенциальных лекарственных препаратов для лечения онкологических заболеваний | |||
| Новые лекарственные средства: успехи и перспективы, Уфа, 2005, стр.10, 11. | |||
Авторы
Даты
2008-12-10—Публикация
2007-07-16—Подача