Изобретение относится к способу электролиза Al2S3 с использованием ванны расплавленной соли, предпочтительно - ванны расплавленной хлоридной соли, в которой растворен Al2S3.
Обычно широко используемым способом производства алюминия из алюминиевой руды является способ Холла-Эру. Производство первичного алюминия электролизом согласно способу Холла-Эру потребляет примерно 13-15 МВт·ч электроэнергии на тонну алюминия. Во время процесса электролиза аноды расходуются, и их необходимо периодически менять. Кроме того, способ Холла-Эру приводит к выбросам парниковых газов, таких как CF4 и C2F6, которые должны быть удалены из отходящих газов согласно экологическому законодательству.
В альтернативном способе оксид алюминия превращают на стадии сульфидирования в сульфид алюминия Al2S3 посредством его реакции с сульфидом углерода CS2. Более подробное описание этого альтернативного способа, также называемого способом производства компактного алюминия или CAPP (от англ. «Compact Aluminium Production Process») или, в более общем случае, сульфидным способом, приведено в публикации заявки на патент WO/00/37691, содержание которой считают включенным в данное описание посредством этой ссылки. Металлический алюминий может быть извлечен из Al2S3 электролизом с образованием газообразной серы на аноде, предпочтительно - на графитовом аноде. Газообразная сера должна быть собрана и возвращена в цикл с получением CS2, который используют на стадии сульфидирования, которая имеет исключительное преимущество в сочетании со способом CAPP. Упрощенные реакции (не принимая во внимание комплексообразования) в процессе электролиза имеют вид:
катод: Al3++3e-→Al (1.)
анод: 2S2-→ S2(г)+4e- (2.)
В целом: Al2S3→2Al+1,5S2(г) (3.)
Побочные продукты в способе Холла-Эру, такие как фторидсодержащие отходящие газы, а также отработавшие футеровки электролизных ванн, производиться не будут, так как электролит в основном состоит из хлоридов.
На фиг.1 показан потенциал разложения различных соединений алюминия с получением алюминия электролизом, и там хорошо видно, что электролиз Al2S3 является очень выгодным с точки зрения потребления энергии, т.e. он имеет самый низкий потенциал разложения. Первый прямоугольник характеризует теоретическую величину, используемую для сравнения. Второй прямоугольник относится к способу, при котором Al2О3 преобразуют в AlCl3, который впоследующем разлагают. Четвертый прямоугольник характеризует альтернативный сульфидный способ, а третий прямоугольник относится к фактически существующему способу Холла-Эру. Теоретическое значение потенциала разложения определяют согласно формуле:
E0=-ΔG0/nF, где E0 = потенциал разложения;
ΔG0 = свободная энергия Гиббса;
n = валентность иона (3 для алюминия);
F = постоянная Фарадея.
Проблемой в сульфидном способе является низкая плотность тока, которая может быть достигнута в известной ванне расплавленных хлоридов.
Ранее был предложен эвтектический состав из смеси MgCl2-NaCl-KCl (50-30-20 мол.%) в качестве подходящего электролита для электролиза Al2S3 (см. N.Q. Minh, R.O. Loutfy, N.P. Yao, "The Electrolysis of Al2S3 in AlCl3-MgCl2-NaCl-KCl Melts", J. Appl. Electrochem., Vol.12, 1982, 653-658; R.O. Loutfy, N.Q. Ming, C. Hsu, N.P. Yao, "Potential Energy Savings in the Production of Aluminium: Aluminium Sulfide Route", Chemical Metallurgy - A Tribute To Carl Wagner, Proc. Of Symp. on Metallurgical Thermodynamics and Electrochemistry at the 110th AIME annual meeting, N.A. Gokcen, Ed., Chicago, Febr. 1981, The Metallurgical Society of AIME, New York, 1981; N.Q. Mingh, R.O. Loutfy, N.P. Yao, "The Electrochemical Behaviour of Al2S3 in Molten MgCl2-NaCl-KCl Eutectic", J. Electroanal. Chem., Vol.131, 198, 229-242).
Ранее полагали, что лимитирующим фактором достижимой плотности тока в ванне расплавленной хлоридной соли является растворимость Al2S3. Растворимость повышали путем использования MgCl2, который, как полагали, повышает растворимость согласно реакции:
MgCl2+Al2S3→2AlSCl+MgS(тв.) (5.)
Была измерена предельная плотность тока в 0,3 A/см2 при растворимости насыщения Al2S3 (≈ 3 мас.%) и 0,2 A/см2 - в эвтектическом составе MgCl2-NaCl-KCl, содержащем примерно 2 мас.% Al2S3.
Выход по току, т.е. тот процент тока, который действительно использован на электролиз, как было определено, составлял примерно 80% при плотности тока 0,2 A/см2, потенциал электролизера составлял примерно 1,5 В, и межполюсное расстояние (МПР) между анодом и катодом составляло 3 см.
В литературе сообщается о том, что электрохимические исследования электролиза Al2S3 вхлоридном расплаве показали, что восстановление Al-ионов на графитовом электроде является диффузионно-лимитируемым процессом и протекает посредством обратимого 3-электронного переноса заряда. Окисление S-ионов в хлоридном электролите должно быть обратимым диффузионно-лимитируемым процессом, протекающим по механизму, основанному на двух стадиях:
S2-→S+2e- (электрохимический 2-электронный процесс) (6.)
S+S→S2 (димеризация атомов серы до S2) (7.)
Обычная плотность тока, при которой осуществляют способ Холла-Эру, составляет примерно 0,8 A/см2. Достигаемая плотность тока при электролизе Al2S3 в эвтектической ванне MgCl2-NaCl-KCl составляет примерно 0,3 A/см2. Это означает, что при применении сульфидного способа площадь электролизера должна быть примерно в три раза больше, чем требуется в способе Холла-Эру. Это делает сульфидный способ непривлекательной альтернативой, несмотря на все недостатки, связанные со способом Холла-Эру.
Поскольку найденные предельные плотности тока являются слишком малыми для того, чтобы конкурировать со способом Холла-Эру, в котором используется примерно 0,8 A/см2, рассматривалось добавление флюсов к расплаву для повышения растворимости Al2S3 и повышения активности как Al, так и S в расплаве.
Известно, что возрастание кислотности ванны расплавленной соли оказывает положительное влияние на растворимость Al2S3. Добавление AlCl3 приводит к большей кислотности расплава и должно благоприятствовать растворимости. Однако вследствие высокого давления паров AlCl3 (температура кипения 447°C) добавки в расплав расплавленной соли ограничены вследствие улетучивания. Добавление 5-10 мас.% Al2S3 повышает растворимость AlCl3 максимум на 5-7 мас.% согласно следующей реакции:
AlCl3+Al2S3→3AlSCl.
Добавление AlCl3 обеспечивает плотности тока вплоть до 2 A/см2, но использование AlCl3 не является приемлемой альтернативой. Даже несмотря на то что температура эвтектики смеси MgCl2-NaCl-KCl остается относительно низкой, высокое давление паров AlCl3 вызывает улетучивание значительных количеств AlCl3.
В предшествующих публикациях AlCl3 использовали для способствования процессу электрохимического выделения. Так как AlCl3 легко испаряется из расплава и должен быть отделен от серы ниже по потоку с целью его рециркуляции в процесс электрохимического выделения, его рассматривали как практически непригодный.
Целью настоящего изобретения является разработка способа электролиза Al2S3, который обеспечивает высокую плотность тока, предпочтительно - сравнимую или большую, чем плотность тока, достигаемая в способе Холла-Эру.
Следующей целью настоящего изобретения является разработка способ электролиза Al2S3, который обеспечивает высокую плотность тока без использования AlCl3.
Еще одной целью изобретения является разработка способа электролиза Al2S3, при котором практически вся сера может быть рециркулирована с образованием нового Al2S3 из Al2О3.
Указанные и другие цели достигаются в способе электролиза Al2S3 с использованием ванны расплавленной соли, предпочтительно - ванны расплавленной хлоридной соли, в которой растворен Al2S3, который отличается тем, что принимают меры для улучшения электропроводности ванны, так что оказывается возможным повышение плотность тока в ванне.
В отличие от предложенного в предшествующем уровне техники авторы настоящего изобретатели установили, что растворимость Al2S3 в ванне расплавленной соли, имеющей подходящий состав, не является лимитирующим фактором достижимой плотности тока. Потенциал электролизера слагается из термодинамического, кинетического (потенциала активации и лимитированного массопереноса) и омического вкладов. Авторы изобретения предприняли другой подход и обнаружили почти линейную зависимость между плотностью тока и потенциалом электролизера, и это указывает на то, что процесс электролиза, по меньшей мере выше некоторой минимальной концентрации растворенного Al2S3, не является диффузионно-лимитируемым процессом, а имеет омические ограничения. К тому же, как наблюдали авторы настоящего изобретения, повышенная растворимость Al2S3 не приводит в результате к значительному повышению рабочих характеристик электролизера. Зависимость между потенциалом электролизера и плотностью тока является практически линейной, что означает, что эта связь определяется омической зависимостью. Следовательно, допустимая плотность тока может быть увеличена за счет улучшения электропроводности ванны.
Предпочтительно электропроводность улучшают в одном варианте осуществления изобретения, в котором предпринятые меры включают в себя введение добавки в ванну.
Добавки выбирают таким образом, чтобы увеличить общую электропроводность ванны расплавленной соли. В качестве дополнительного эффекта добавки могут повышать активность как алюминия, так и серы, а также растворимость Al2S3. Как описано выше, AlCl3 не является предпочтительной добавкой.
Предпочтительный вариант осуществления способа согласно данному изобретению отличается тем, что добавка содержит фторидное соединение, предпочтительно - главным образом состоит из фторидного соединения.
Этот вариант осуществления основывается на понимании того, что количество фторида оказывает положительное влияние на процесс электролиза, вытекающее из более высокой активности частиц AlFn m- , чем AlS+. К тому же, так как комплексообразование алюминия со фтором более предпочтительно по сравнению с комплексообразованием алюминия с серой, то концентрация ионов серы при добавлении фторида становится более высокой, благоприятствуя анодной реакции.
Другой предпочтительный вариант осуществления способа согласно изобретению отличается тем, что фторидное соединение представляет собой криолит.
Было установлено, что добавление криолита вызывает значительное улучшение электропроводности по сравнению с добавлением других фторидов, таких как NaF, хотя удельная электропроводность NaF намного выше.
Другие преимущества добавления криолита заключаются в том, что криолит имеет высокую температуру плавления (1012°C и, следовательно, намного более высокую, чем температура плавления AlCl3), и улетучивание криолита при обычной рабочей температуре электролизера, как считают, будет несущественным.
Можно возразить, что добавление фторида нежелательно, так как это приведет к выбросам фторида. Однако требуемое количество криолита является относительно небольшим, а рабочие температуры составляют лишь примерно 700°C по сравнению с примерно 950°C в случае традиционного способа Холла-Эру. Таким образом, давление паров фторидов будет очень низким. Анодного эффекта можно избежать, потому что на аноде реагирует сера. Ввиду того что могут использоваться нерасходуемые аноды, электрохимическое выделение может быть осуществлено в закрытой системе, обеспечивающей улучшенное улавливание отходящих газов.
Другой вариант осуществления способа согласно изобретению отличается тем, что концентрация криолита находится в диапазоне 5-30 мас.%, предпочтительно - 7-15 мас.%, а наиболее предпочтительно - составляет примерно 10 мас.%. Испытание показало, что относительно низкие концентрации криолита достаточны для того, чтобы получить необходимое увеличение электропроводности при оптимальной концентрации примерно 10 мас.%.
Из анализа зависимости между плотностью тока и потенциалом электролизера, содержащего ванну расплавленной соли, и исходя из влияния добавления криолита и NaF было сделано заключение, что положительный эффект от добавления фторидсодержащих добавок не может быть приписан исключительно увеличению удельной электропроводности расплава.
Было сделано заключение, что способ согласно изобретению также улучшается в том варианте его осуществления, который отличается тем, что предпринятые меры включают в себя увеличение эффективной площади поверхности анода, простирающегося в ванну, посредством уменьшения количества и/или размера покрывающих анод газовых пузырьков.
Были сделаны следующие наблюдения, которые подтверждают вывод о том, что благоприятный эффект от добавления фторидсодержащих флюсов не может быть приписан исключительно увеличению удельной электропроводности расплава:
- Зависимость наклона плотности тока от потенциала электролизера возрастает почти в 3 раза при добавлении криолита к эвтектике MgCl2-NaCl-KCl, что намного больше, чем можно было ожидать в результате повышения электропроводности.
- Добавление 10 мас.% криолита демонстрирует большее улучшение кажущейся электропроводности, чем добавление NaF, хотя удельная электропроводность NaF является намного большей.
- Представляется, что существует оптимальное количество фторида или соотношение фторида к алюминию в электролите.
Предложенное объяснение заключается в том, что значительная часть омического падения напряжения не связана с ванной расплавленной соли самой по себе, а является следствием газовых пузырьков на аноде, так как они имеют практически нулевую электропроводность и уменьшают доступную поверхность анода. В литературе было показано, что основной вклад в потенциал электролизера обусловлен анодной реакций. Что касается выделения хлора в хлоридном расплаве, то ранее было установлено, что кажущаяся электропроводность составляла лишь примерно 40% от удельной электропроводности электролита из-за газовых пузырьков. Пузырьки хлора имеют тенденцию расти и прилипать к аноду, и это перенапряжение могло быть интерпретировано как омическое падения потенциала в поверхностном слое на аноде. То же самое рассуждение можно применить по отношению к выделению газообразной серы в хлоридном расплаве.
Предполагается, что количество газообразной серы, образуемой на аноде, не изменяется при добавлении криолита, но что газовые пузыри прилипают менее сильно или легче удаляются с анода, так что слой из газовых пузырьков является менее плотным.
Поэтому может быть постулирована гипотеза о том, что при добавлении фторида образуется комплексный ион, изменяющий межфазное натяжение на аноде, что приводит к различным характеристикам слоя из пузырьков серы на площади поверхности анода, значительно уменьшая активное (омическое) падение напряжения, так же как и потребление энергии.
Предпочтительный вариант осуществления способа согласно изобретению отличается тем, что ванна расплавленной соли главным образом содержит хлориды щелочных металлов, предпочтительно - KCl и NaCl.
Из предшествующего уровня техники известно об использовании ванны расплавленных хлоридных солей, содержащей NaCl, KCl и MgCl2. В частности, последнее соединение добавляют для того, чтобы увеличить растворимость Al2S3, так как растворимость в ванне расплавленных NaCl и KCl является очень незначительной. Однако авторы настоящего изобретатели установили, что добавление подходящих добавок, подобных криолиту, увеличивает растворимость Al2S3 в ванне расплавленных хлоридов щелочных металлов до уровня, при котором растворимость больше не является лимитирующим фактором в процессах электролиза, а этим фактором является электропроводность. Это открыло путь к простой и более экологически благоприятной ванне.
Особенно выгодный вариант осуществления способа согласно изобретению отличается тем, что ванна расплавленного металла по существу не содержит хлоридов щелочноземельных металлов. Установлено, что достаточная растворимость в комбинации с высокой электропроводностью также может быть получена в ванне расплавленной соли, которая по существу не содержит хлоридов щелочноземельных металлов, в частности - не содержит MgCl2, в частности, когда делают вышеупомянутые добавки фторида. Это представляет особый интерес, так как щелочные земли, подобно Mg, взаимодействуют с серой в ванне и образуют твердый MgS, тем самым поглощая серу. Принципиально важным в сульфидном способе в виде способа CAPP является то, что сера не расходуется, так как вся сера может быть рециркулирована.
Из-за образования MgS значительное количество серы выводятся из цикла рециркуляции серы, что делает необходимой подачу серы, с дополнительными затратами. Кроме того, формирование MgS будет приводить к значительному потоку отходов экологически вредного материала, который нуждается в переработке. Наконец, формирование MgS будет затруднять работу электролизера и делать необходимым постоянную очистку электролизера, что находится в противоречии с концепцией закрытого электролизера и ведет к плохим условиям эксплуатации. Подобные проблемы должны ожидаться в том случае, если будут использованы другие хлориды щелочноземельных металлов, такие как CaCl2. Поэтому предпочтительно, чтобы ванна расплавленной соли по существу не содержала хлоридов щелочноземельных металлов.
В другом предпочтительном варианте осуществления способа согласно изобретению электролиз осуществляют при температуре ванны между 600°C и 850°C, предпочтительно - между 700°C и 800°C.
В известном способе MgCl2 добавляют к ванне расплавленной соли для увеличения растворимости Al2О3 и понижения температуры плавления ванны, так что для увеличения растворимости может быть добавлен AlCl3.
Удаляя MgCl2 и добавляя криолит, температуру плавления ванны увеличивают, но это является приемлемым, так как температура плавления криолита намного выше, чем предполагаемые температуры ванны. Кроме того, следует признать, что температура плавления эвтектики NaCl-KCl остается все еще существенно более низкой, чем предложенная температура ванны.
Еще один предпочтительный вариант осуществления способа согласно изобретению отличается тем, что электролиз осуществляют в многополюсном электролизере.
Вследствие работы с нерасходуемыми анодами межполюсное расстояние может быть уменьшено и может поддерживаться постоянным, и поэтому возможна эксплуатация многополюсного электролизера, что увеличит производительность, уменьшит потребление энергии и снизит капитальные затраты.
Теперь изобретение будет дополнительно объяснено и разъяснено со ссылкой на чертежи, на которых:
На Фиг.1 показан потенциал разложения соединений алюминия при производстве алюминия электролизом.
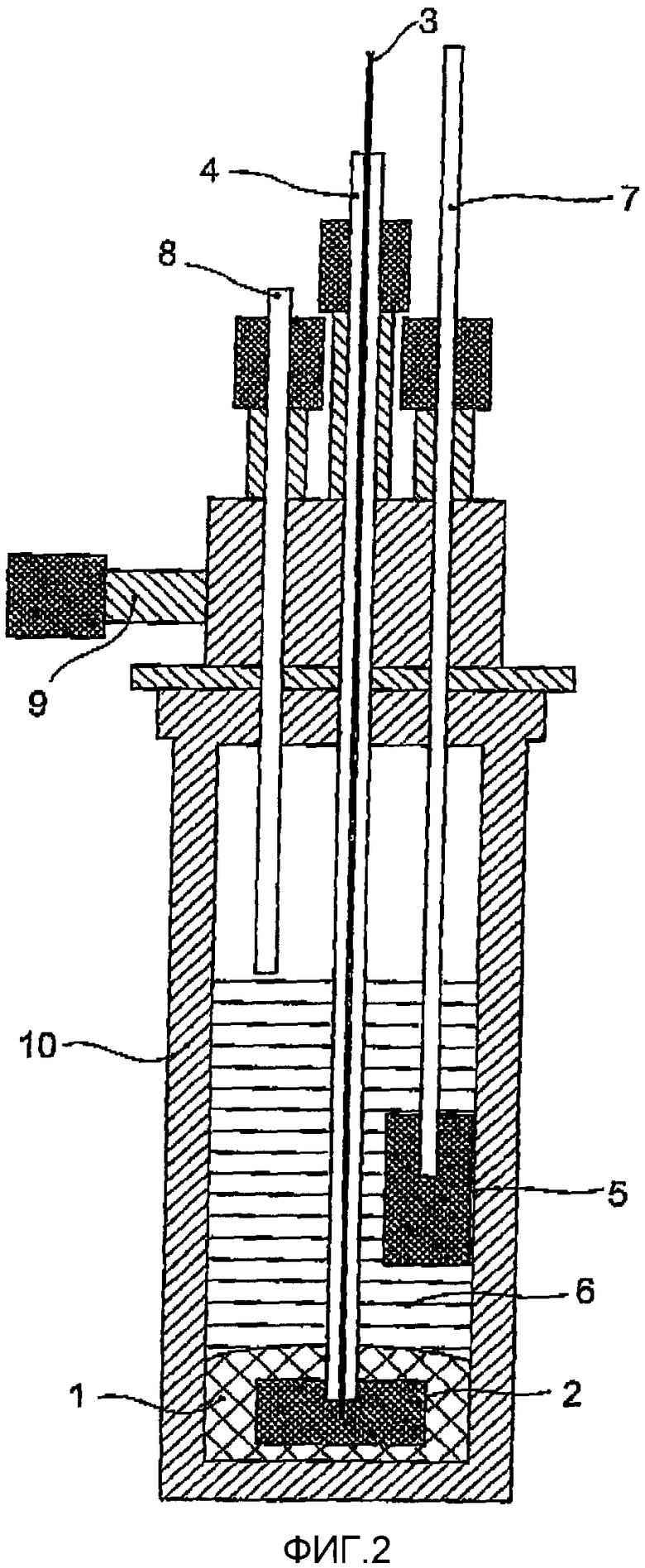
На Фиг.2 показано схематическое изображение экспериментального электролизера.
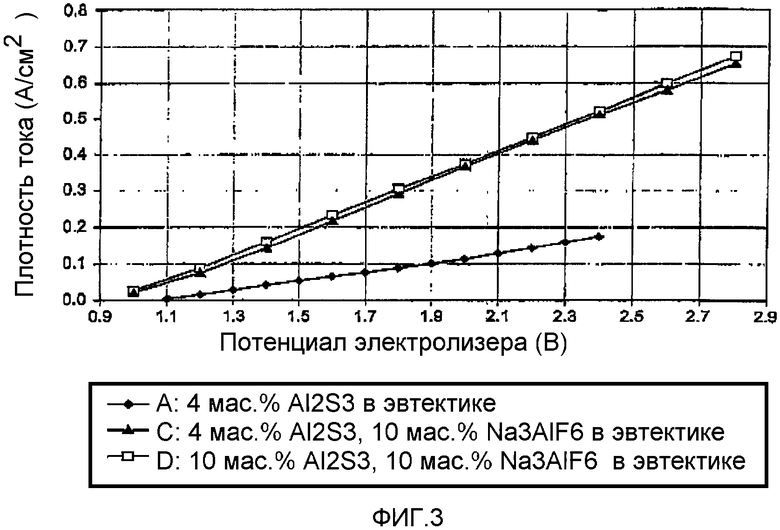
На Фиг.3 показан график зависимости катодной плотности тока как функции потенциала электролизера при электролизе алюминия из Al2S3 в электролите MgCl2-NaCl-KCl с соотношением 50-30-20 мол.% при 725°C с использованием криолита в качестве добавки (флюса).
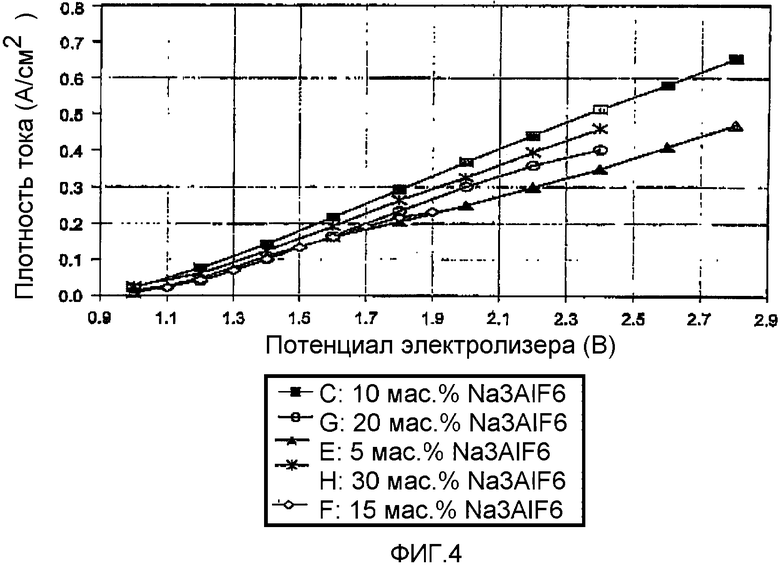
На Фиг.4 показан график зависимости катодной плотности тока как функции потенциала электролизера при электролизе алюминия с 4 мас.% Al2S3 в электролите MgCl2-NaCl-KCl с соотношением 50-30-20 мол.% при 725°C с использованием различных количеств криолита в качестве добавки (флюса).
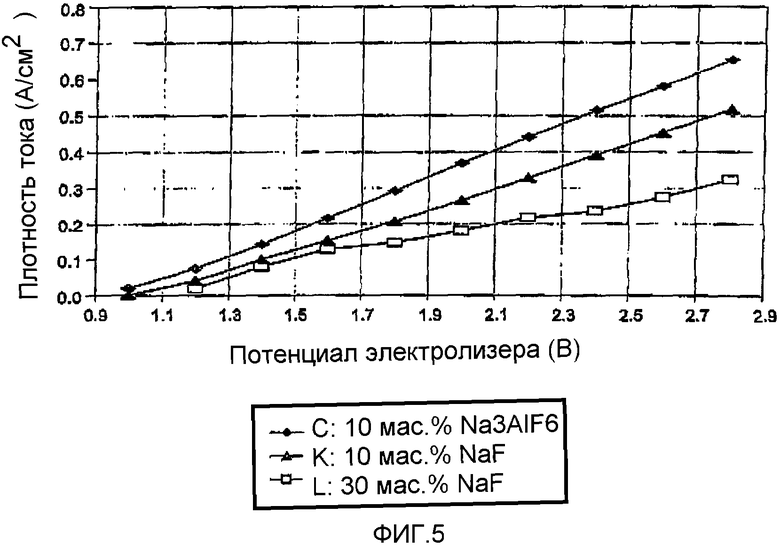
На Фиг.5 показан график зависимости катодной плотности тока как функции потенциала электролизера при электролизе алюминия с 4 мас.% Al2S3 в электролите MgCl2-NaCl-KCl с соотношением 50-30-20 мол.% при 725°C с использованием NaF в качестве добавки (флюса).
Фиг.1 была описана выше.
Электролиз алюминия из сульфида алюминия осуществляют в двух электродных системах. Схематическое изображение экспериментального электролизера приведено на Фиг.2. Катодом является ванна расплавленного алюминия (1) (с эффективной площадью поверхности 8,1 см2), который поляризуют с помощью графитового блока (2), соединенного со стержнем из нержавеющей стали (3), защищенным кварцевой трубкой (4). Анод сконструирован из графитового блока (5) с площадью 1 см2 и высотой 5 см, который погружен на 2 см в электролит и соединен со стержнем из нержавеющей стали (7). Межэлектродное расстояние составляет 2 см. Анод действует как электрод сравнения, таким образом измеряют потенциала электролизера в процессе электролиза. Электрохимическая ячейка сконструирована со стенками из спеченного Al2О3 (Alsint) (10). Расплав защищают инертной атмосферой Ar. Аргон вводят через входное отверстие (8), и он выходит из электролизера через выходное отверстие (9). Электролизер снаружи нагревают цилиндрической печью мощностью 2100 Вт, оборудованной нагревательными элементами (не показаны). Максимальная рабочая температура составляет 1400°C. Температуру измеряют и регулируют термопарами типа S и блоком управления (не показаны).
Потенциал измеряют потенциостатом/гальваностатом, который используют в комбинации с усилителем тока для обеспечения высокой производительности по току (в диапазоне 20 А). Система электрохимических измерений полностью управляется компьютером.
Испытания, описанные ниже, были осуществлены со смесью MgCl2-NaCl-KCl, но результаты также применимы к смеси NaCl-KCl.
Все химические реактивы хранили и обрабатывали в защитной камере с перчатками, заполненной атмосферой аргона (<1 ч/млн H2О, О2). KCl, NaCl и NaF имели качество для анализа. Безводные MgCl2 (98%), Al2S3 (98%) и Na3AlF6 (98%) были коммерчески получены от поставщика. Электролит в виде смеси хлоридов был приготовлен и помещен в контейнер защитной камере с перчатками. Затем этот контейнер доставали из защитной камеры с перчатками и нагревали до 450°C, в то время как продувочный газ HCl пропускали через сухие вещества и далее через расплав для удаления всей воды и оксидов. После охлаждения контейнер возвращали обратно в защитную камеру с перчатками. Al2S3 и добавки вводили в защитную камеру с перчатками при комнатной температуре. В защитной камере с перчатками собирали электролизер, закрывали его и затем транспортировали к печи, где поток Ar предохранял от контакта с воздухом. Ниже в таблице приведен перечень солевых смесей, используемых в программе экспериментов, обсужденных в данном описании.
Перечень солевых смесей, используемых в программе экспериментов по электролизу Al из Al2S3 в электролите MgCl2-NaCl-KCl с 50-30-20 мол.% при 725°C.
На фиг.3 показано основное улучшение рабочих характеристик электролиза вследствие добавления Na3AlF6. При добавлении 10 мас.% Na3AlF6 состав электролита принимает вид четырехкомпонентной смеси 48-29-19-4 мол.% для MgCl2-NaCl-KCl-Na3AlF6. Плотность тока более чем в 3 раза выше при данном потенциале электролизера. Используя линейную экстраполяцию, было определено, что E=0,98 В, что равно теоретическому потенциалу разложения. Это является другим указанием на то, что способ скорее имеет омические ограничения, чем является диффузионно-лимитируемым. Уравнение Нернста указывает, что активность Al2S3 в расплаве с добавкой криолита приближается к единице. Дальнейшее увеличение концентрации Al2S3 в расплаве не приводило к существенному эффекту (сравнение экспериментов C и D).
На Фиг.4 изображен график, характеризующий влияние количества добавленного в расплав криолита. Представляется, что оптимальным является добавление примерно 10 мас.% криолита.
Была выполнена экспериментальная работа по изучению того, было ли положительное влияние криолита на характеристики электрохимического выделения вызвано количеством добавленного фторида или это результат возрастания количества Al-ионов в электролите. Поэтому в качестве флюса использовали NaF. Добавление 10 мас.% NaF приводит в результате к составу расплава 42-25-17-16 мол.% для композиции MgCl2-NaCl-KCl-NaF. Расчет основных химических элементов показал, что количество F в электролите сравнимо с криолитсодержащим расплавом, т.е. 6,4 и 7,6 мол.% F соответственно. На фиг.5 приведены результаты указанных экспериментов. Увеличение количества NaF до 30 мас.% свидетельствует об ухудшении работы электролизера, что снова согласуется с результатами по введению добавок криолита.
Линейные зависимости плотности тока от потенциала электролизера, наблюдаемые с Фиг.3 по Фиг.5, указывают на то, что процесс электролиза с такими высокими концентрациями растворенного Al2S3 не является больше диффузионно-лимитируемым, а отражает омические ограничения. В таком случае повышение растворимости Al2S3 не будет приводить в результате к существенному улучшению работы электролизера. Это подтверждается экспериментальными результатами. Предполагается, что добавление Na3AlF6 к расплаву оказывает положительное влияние на растворимость Al2S3. Поэтому количество Al2S3, которое добавляют к четырехкомпонентной смеси, было повышено с 4% до 10% (эксперименты C и D на фиг.3). Однако это не приводило к значительному улучшению работы электролизера, показывая тем самым, что диффузия не является стадией, лимитирующей скорость реакции при таких относительно высоких концентрациях использованного Al2S3.
На первый взгляд, можно возразить, что из-за омического лимитирования процесса возрастание электропроводности расплава должно приводить в результате к повышению плотности тока. Поскольку криолит имеет более высокую электропроводность, чем эвтектика хлоридов, лучшая работа электролизера является, по крайней мере в некоторой степени, результатом повышенной электропроводности. При добавлении 10 мас.% Na3AlF6 состав электролита изменяется на четырехкомпонентную смесь 48-29-19-4 мол.% MgCl2-NaCl-KCl-Na3AlF6, которая может обладать существенно отличающимися свойствами. Однако наклон линейных зависимостей, возросший почти в 3 раза при добавлении криолита, не может быть приписан только повышенной электропроводности расплава. Кроме того, хотя удельная электропроводность NaF является наиболее высокой из всех компонентов, т.e. 4,2 Ом-1·см-1 при 725°C, эффект от добавления NaF явно менее выражен.
Так как добавки криолита и NaF дают подобные эффекты, то можно утверждать, что количество фторида вносит свой вклад в положительное влияние на процесс электролиза, что является результатом более высокой активности частиц AlFn m-, чем AlS+. К тому же, когда комплексообразование Al с F является преимущественным по сравнению с комплексообразованием с S, концентрация S-ионов становится выше при добавлении фторида, что приводит к благоприятствованию анодной реакции.
Как описано выше, было установлено, что основное преимущество от введения фторидных добавок связано с увеличением электропроводности расплава, что наиболее предпочтительно объяснить с точки зрения уменьшенного покрытия анода слоем пузырьков газообразной серы.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ АЛЮМИНИЯ ИЗ НЕФЕЛИНОВЫХ СИЕНИТОВ И СЫННЫРИТОВ | 1993 |
|
RU2074906C1 |
| СПОСОБ ПОЛУЧЕНИЯ АЛЮМИНИЯ И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 1999 |
|
RU2233897C2 |
| СПОСОБ ПОЛУЧЕНИЯ АЛЮМИНИЯ ИЗ АНОРТОЗИТОВ | 1992 |
|
RU2009273C1 |
| СПОСОБ ПРОИЗВОДСТВА АЛЮМИНИЯ ВЫСОКОЙ ЧИСТОТЫ ЭЛЕКТРОЛИЗОМ РАСПЛАВЛЕННЫХ СОЛЕЙ | 2018 |
|
RU2702672C1 |
| СПОСОБ ПОЛУЧЕНИЯ АЛЮМИНИЯ | 2013 |
|
RU2529264C1 |
| СПОСОБ ПОЛУЧЕНИЯ МЕТАЛЛОВ ЭЛЕКТРОЛИЗОМ РАСПЛАВЛЕННЫХ СОЛЕЙ | 2004 |
|
RU2274680C2 |
| СПОСОБ И УСТРОЙСТВО РАФИНИРОВАНИЯ АЛЮМИНИЯ | 2013 |
|
RU2558316C2 |
| СПОСОБ ПОЛУЧЕНИЯ ТИТАНО-АЛЮМИНИЕВОГО СПЛАВА | 2019 |
|
RU2772882C1 |
| Способ получения алюминия электролизом суспензии глинозема в расплаве алюминия | 2020 |
|
RU2745830C1 |
| СПОСОБ ЭКСПЛУАТАЦИИ ЭЛЕКТРОЛИЗЕРА ДЛЯ ПРОИЗВОДСТВА АЛЮМИНИЯ | 2007 |
|
RU2359071C2 |
Изобретение относится к способу производства первичного алюминия электролизом Al2S3. Способ включает использование ванны хлоридного солевого расплава, в которой растворен Al2S3, при этом ванна хлоридного солевого расплава содержит хлориды щелочных металлов, и в ванну расплава вводят добавку, содержащую фторидное соединение, для улучшения электропроводности ванны и увеличения плотности тока в ванне, добавка главным образом представляет собой фторидное соединение, в частности криолит. Концентрация криолита составляет от 5 до 30 мас.%,предпочтительнее от 7 до 15 мас.%, наиболее предпочтительно - примерно 10 мас.%. Кроме того, увеличивают эффективную площадь поверхности анода, простирающегося в ванну, посредством уменьшения количества и/или размера покрывающих анод газовых пузырьков. Обеспечивается повышение плотности тока в ванне, возможность рециркулирования практически всей серы с образованием нового Al2S3 и Al2О3. 10 з.п. ф-лы, 5 ил., 1 табл.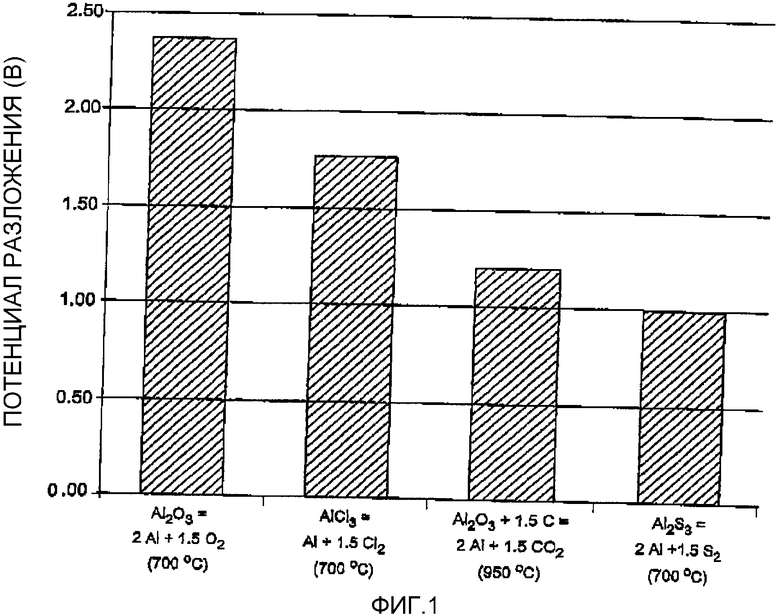
| Приспособление для формовки таблеток-фильтрод из порошка стекла | 1933 |
|
SU37691A1 |
| US 4464234 A, 07.08.1984 | |||
| US 4265716 A, 05.05.1981 | |||
| US 4133727 A, 09.01.1979 | |||
| Конденсаторный агрегат кондиционера | 1984 |
|
SU1483193A1 |
| RU 20011162 C1, 15.10.1993. | |||
Авторы
Даты
2008-12-20—Публикация
2004-03-31—Подача